Композиции и способы применения для лечения метаболических расстройств - RU2704285C2
Код документа: RU2704285C2
Чертежи






























































































































































































Описание
Перекрестные ссылки на родственные заявки
В настоящей заявке заявляется приоритет по предварительной заявке на патент США №61/758456, поданной 30 января 2013, и предварительной заявке на патент США №61/882542, поданной 25 сентября 2013, каждая из заявок включена в настоящий документ посредством ссылки.
Область изобретения
Настоящее изобретение относится к, в числе прочего, мутеинам фактора дифференцировки роста и их модификациям, которые являются полезными для лечения ожирения, диабета и других расстройств, связанных с метаболизмом.
Уровень техники
Ожирение чаще всего вызвано чрезмерным потреблением пищи в сочетании с ограниченным расходом энергии и/или отсутствия физических упражнений. Ожирение увеличивает вероятность развития различных заболеваний, таких как сахарный диабет, гипертония, атеросклероз, ишемическая болезнь сердца, апноэ сна, подагра, ревматизм и артрит. Кроме того, риск смертности напрямую коррелирует с ожирением, таким образом, что, например, индекс массы тела свыше 40 приводит к среднему снижению ожидаемой продолжительности жизни более чем на 10 лет.
Текущие фармакологические способы лечения включают в себя супрессоры аппетита, направленные на классы рецепторов (например, СВ1, 5-НТ2С и NPY); регуляторы систем аппетита в гипоталамусе и молекулярные действия грелина; и ингибиторы поглощения питательных веществ, нацеленные на липазы. К сожалению, ни один из существующих способов воздействия не был показан для эффективного лечения ожирения, не вызывая неблагоприятных эффектов, некоторые из которых могут быть очень серьезными.
Уровни глюкозы в крови стимулируют секрецию инсулина панкреатическими бета-клетками. Инсулин, в свою очередь, стимулирует проникновение глюкозы в мышцы и жировые клетки, что приводит к накоплению гликогена и триглицеридов, а также синтезу белков. Активация рецепторов инсулина в различных типах клеток уменьшает циркулирующие уровни глюкозы за счет увеличения усвоения глюкозы и утилизации, а также с помощью снижения выхода глюкозы в печени. Нарушения в пределах этой регулирующей сети может привести к диабету и связанным патологическим синдромам, которые затрагивают большую и растущую долю населения.
Пациенты, которые имеют расстройство метаболизма глюкозы, могут страдать от гипергликемии, гиперинсулинемии и/или нарушения толерантности к глюкозе. Пример расстройства, который часто ассоциируется с аномальными уровнями глюкозы и/или инсулина, представляет собой резистентность к инсулину, при котором печень, жир и мышечные клетки теряют их способность реагировать на нормальные уровни инсулина в крови.
Ввиду распространенности и тяжести ожирения, диабета и связанных метаболических и неметаболических расстройств, наряду с недостатками текущих вариантов лечения, альтернативные способы лечения, которые модулируют, например, аппетит, уровни глюкозы и/или инсулина и усиливают биологический ответ на изменяющиеся уровни глюкозы у пациента, все еще представляющие интерес.
Кроме того, в фармацевтических науках часто бывает полезным, а иногда и необходимым, улучшить одно из нескольких физических свойств представляющего интерес лечебного воздействия (например, белка, пептида или гидрофобной молекулы) и/или способа, которым его вводят. Улучшения физических свойств включают, например, способы повышения растворимости в воде, биодоступности, времени полужизни в сыворотке и/или времени полужизни терапевтического средства; модулирующей иммуногенности и/или биоактивности; и/или увеличения времени циркуляции. Такие улучшения должны быть внедрены без отрицательного воздействия на биологическую активность способа лечения. Таким образом, в случае альтернатив современных вариантов лечения ожирения, диабета и связанных с метаболическими и неметаболическими расстройствами, может быть предпочтительным иметь один или несколько улучшенных физических свойств.
Сущность изобретения
Настоящее изобретение предполагает применение средств, описанных в данном документе, и их композиций, для лечения и/или профилактики различных заболеваний, расстройств и состояний и/или их симптомов. В некоторых вариантах реализации изобретения заболевания, расстройства и состояния и/или их симптомы относятся к расстройствам метаболизма глюкозы и другим расстройствам, связанным с метаболизмом, в то время как в других вариантах они относятся к нарушениям массы тела. В качестве примера, но без ограничения, средства и их композиции, могут быть применены для лечения и/или профилактики сахарного диабета (например, диабета 2-го типа), резистентности к инсулину и заболеваний, расстройств и состояний, характеризующихся резистентностью к инсулину, снижением получения инсулина, гипергликемией, гипоинсулинемией и метаболическим синдромом. Средства и их композиции также могут быть применены для лечения и/или профилактики ожирения и других нарушений массы тела, например, с помощью влияния на подавление аппетита.
В некоторых вариантах реализации изобретения средства представляют собой фактор дифференцировки роста человека 15 (GDF15) - соответствующие полипептиды и их гомологи, варианты (например, мутеины), фрагменты и другие модифицированные формы. В конкретных вариантах реализации изобретения средства, рассматриваемые в настоящем описании, представляют собой модифицированные молекулы GDF15 человека, в то время как в других вариантах реализации изобретения средства представляют собой модифицированные мутеины GDF15. Данное описание также предполагает молекулы нуклеиновых кислот, кодирующие вышеуказанное. Для удобства, модифицированные молекулы GDF15 человека и модифицированные варианты GDF15 (например, мутеины), описанные с этого момента, вместе называются далее "полипептид(ы)". Следует отметить, что любая ссылка на "человека" в связи с полипептидами и молекулами нуклеиновых кислот по данному описанию не предназначена для того, чтобы быть ограничивающей по отношению к способу, которым получают полипептид или нуклеиновую кислоту, или источнику, а, скорее, только со ссылкой на последовательность, как это может соответствовать последовательности встречающегося в природе полипептида или молекулы нуклеиновой кислоты человека. В дополнение к полипептидам и молекулам нуклеиновых кислот человека, которые кодируют их, данное описание предполагает GDF15-связанные полипептиды и соответствующие молекулы нуклеиновых кислот других видов.
Данное описание также предполагает другие GDF15-связанные средства, способные вызывать биологический ответ, сопоставимый с (или больше чем) таковым в случае полипептидов и/или средств, способных усиливать активность полипептидов.
В некоторых вариантах реализации изобретения по данному описанию, субъекту, имеющему, или рискующему иметь, заболевание или расстройство, которое поддается лечению одним или более полипептидами, вводили в количестве, эффективном для лечения заболевания или расстройства. В некоторых вариантах реализации изобретения заболевание или расстройство представляет собой гипергликемическое состояние, резистентность к инсулину, гиперинсулинемию, нарушение толерантности к глюкозе или метаболический синдром. В иных вариантах реализации изобретения заболевание или расстройство представляет собой нарушение массы тела (например, ожирение), тогда как в других вариантах реализации изобретения полипептиды служат причиной, по меньшей мере в некоторой степени, подавления аппетита.
Другие аспекты по данному описанию включают системы экспрессии на основе клеток, векторы, сконструированные клеточные линии и способы и применения, связанные с вышеизложенным.
Как описано подробно ниже, один вариант реализации изобретения по данному описанию относится к полипептиду, содержащему а) полипептид, содержащий по меньшей мере одну модификацию последовательности, проиллюстрированной на Фигуре 1B (SEQ ID NO: 3); причем модификация не изменяет аминокислотную последовательность полипептида или b) полипептид-мутеин последовательности, проиллюстрированной на Фигуре 1B (SEQ ID NO: 3), причем полипептид-мутеин содержит по меньшей мере одну модификацию, которая не изменяет аминокислотную последовательность полипептида мутеина; и при этом набор модификаций, изложенный в a) и b) улучшает по меньшей мере одно физическое свойство полипептида или полипептида мутеина.
В некоторых вариантах реализации изобретения по данному описанию полипептид содержит полипептид-мутеин любой из последовательностей, проиллюстрированных на, например, Фигурах 3, 5, 6 и 13.
В некоторых вариантах реализации изобретения полипептид имеет длину от около 10 аминокислот до около 113 аминокислот. В иных вариантах реализации изобретения полипептид по данному описанию может иметь менее чем 100 аминокислотных остатков, менее чем 75 аминокислотных остатков, менее чем 50 аминокислотных остатков, менее чем 25 аминокислотных остатков или менее чем 20 аминокислотных остатков.
В других дополнительных вариантах реализации изобретения полипептид по данному описанию содержит аминокислотную последовательность, имеющую по меньшей мере 85% аминокислотной идентичности, по меньшей мере 90% аминокислотной идентичности, по меньшей мере 93% аминокислотной идентичности, по меньшей мере 95% аминокислотной идентичности, по меньшей мере 97% аминокислотной идентичности, по меньшей мере 98% аминокислотной идентичности или по меньшей мере 99% аминокислотной идентичности по отношению к аминокислотной последовательности, проиллюстрированной на Фигуре 1B (SEQ ID NO: 3).
В соответствии с данным описанием, полипептид может быть получен рекомбинантно.
В некоторых вариантах реализации изобретения по данному описанию модификация полипептида включает пегилирование, гликозилирование, полисиалилирование, конъюгацию с гидроксиэтилкрахмалом, слияние с альбумином, связывание альбумина посредством сопряженной цепи жирной кислоты, Fc-слияния или слияния с миметиком ПЭГ.
В конкретных вариантах реализации изобретения модификация полипептида содержит гликозилирование, а в некоторых подобных вариантах реализации изобретения гликозилирование представляет собой N-гликозилирование. N-гликозилирование может происходить в более чем одном аминокислотном остатке полипептида.
В иных вариантах реализации изобретения модификация полипептида включает слияние с альбумином, причем альбумин, вариант альбумина или фрагмент альбумина конъюгирован с полипептидом. В некоторых вариантах реализации изобретения альбумин, вариант альбумина или фрагмент альбумина представляет собой сывороточный альбумин человека (ЧСА), вариант сывороточного альбумина человека или фрагмента сывороточного альбумина человека, в то время как в других вариантах реализации изобретения альбумин, вариант альбумина или фрагмент альбумина представляет собой бычий сывороточный альбумин, вариант бычьего сывороточного альбумина или фрагмент бычьего сывороточного альбумина.
Полноразмерный ЧСА имеет сигнальный пептид из 18 аминокислот (MKWVTFISLLFLFSSAYS; SEQ ID NO: 164), с последующим про-доменом из 6 аминокислот (RGVFRR; SEQ ID NO: 165); этот пептид из 24 аминокислотных остатков может упоминаться как пре-продомен. Зрелый полипептид ЧСА охватывает остатки D25-L609 последовательности, проиллюстрированной на Фигуре 1С (SEQ ID NO: 5). В конструкции, применяемой для получения экспериментальных данных, представленных в данном документе, эндогенный сигнальный пептид был заменен человеческим сигнальным пептидом IgK, а эндогенный про-домен остался полностью.
В других дополнительных вариантах реализации изобретения альбумин, вариант альбумина или фрагмент альбумина конъюгирован с полипептидом на карбоксильном конце, N-конце, и на карбоксильном и N-конце, или между ними. Конкретные варианты реализации изобретения влекут за собой конъюгацию альбумина, варианта альбумина или фрагмента альбумина с полипептидом на N-конце.
В конкретных вариантах реализации изобретения альбумин, вариант альбумина или фрагмент альбумина конъюгирован с полипептидом, содержащим про-домен из 167 аминокислот и зрелый домен из 112 аминокислот полипептида прекурсора GDF15 из 308 аминокислот; таким образом, данное описание предполагает полипептид GDF15, который имеет длину от около аминокислотного остатка 30 до около аминокислотного остатка 308 последовательности, проиллюстрированной на Фигуре 1А (SEQ ID NO: 1).
Данное описание предполагает непосредственную экспрессию и получение зрелого домена GDF15 из 112 аминокислот, как проиллюстрировано на Фигуре IB (SEQ ID N0: 3), отсутствие про-домена из 167 аминокислот, с применением сигнального пептида соответствующей длины для обеспечения секреции из тканевой культуры млекопитающего. Пример подходящего сигнального пептида для облегчения экспрессии и секретирования включает IgK. Уровень техники предлагает механизмы, с помощью которых могут быть идентифицированы другие соответствующие сигнальные пептиды [См., например, Ng et al. (Jan. 2013) "Engineering Signal Peptides for Enhanced Protein Secretion from Lactococcus lactis.", Appl. Environ. Microbiol. 79 (1): 347-56; Chou (2001) "Using Subsite Coupling to Predict Signal Peptides", Protein Engineering 14 (2): 75-79; Leversen et al. (July 2009) "Evaluation of Signal Peptide Prediction Algorithms for Identification of Mycobacterial Signal Peptides Using Sequence Data from Proteomic Methods" Microbiology 155 (7): 2357-83; и Shen et al., (2007) "Signal-3L: a 3-layer Approach for Predicting Signal Peptides", Biochemical и Biophysical Res. Comm. 363: 297-303].
Данное описание предусматривает молекулы, слитые с альбумином, причем альбумин, вариант альбумина или фрагмент альбумина конъюгирован с полипептидом посредством линкера. Примеры подходящих линкеров описаны в данном документе. В качестве примера, линкер может представлять собой пептидный линкер из, например, четырех-шести аминокислот. В некоторых вариантах реализации изобретения линкер представляет собой нерасщепляемый линкер (например, линкер 3x(4Gly-Ser); SEQ ID NO: 64). В иных вариантах реализации изобретения линкер представляет собой расщепляемый линкер, а в дополнительных вариантах реализации изобретения расщепляемый линкер может быть расщеплен протеазой (например, 2x(4Gly-Ser) Factor Ха-расщепляемый линкер (GGGGSGGGGSIXGR, где X может представлять собой либо Е, либо D(SEQ ID NO: 221)).
В конкретных вариантах реализации изобретения альбумин, вариант альбумина или фрагмент альбумина молекулы, слитой с альбумином, вырезали перед тем, как молекула, полученная в результате слияния с альбумином, была секретирована из клетки, в то время как в других вариантах реализации изобретения молекулу, полученную в результате слияния с альбумином, вырезали после того, как молекула, полученная в результате слияния с альбумином, была секретирована из клетки.
Данное описание охватывает варианты реализации изобретения, в которых физическое свойство указанного полипептида выбрано из группы, состоящей из растворимости, биодоступности, времени полужизни терапевтического средства, времени циркуляции и иммуногенности. В конкретных вариантах реализации изобретения физическое свойство представляет собой растворимость.
Более того, данное описание предусматривает молекулы нуклеиновых кислот, кодирующие вышеприведенные полипептиды. В некоторых вариантах реализации изобретения молекула нуклеиновой кислоты функционально связана с элементом управления экспрессией, который обеспечивает экспрессию молекулы нуклеиновой кислоты, кодирующей полипептид in vitro, в клетке или in vivo.
В некоторых вариантах реализации изобретения вектор (например, вирусный вектор) содержит одну или более молекул нуклеиновых кислот.
Некоторые варианты реализации изобретения включают трансформированные клетки или клетки-хозяева, которые экспрессируют один или более из вышеприведенных полипептидов.
В конкретном варианте реализации изобретения по данному описанию один или более вышеприведенных полипептидов составлен для получения фармацевтической композиции, причем композиция также содержит один или более фармацевтически приемлемых разбавителей, носителей или вспомогательных веществ. В некоторых вариантах реализации изобретения фармацевтическая композиция также содержит по меньшей мере одно дополнительное профилактическое или терапевтическое средство.
Кроме того, дополнительные варианты реализации изобретения по данному описанию включают антитело, которое специфически связывается с одним из вышеприведенных полипептидов мутеина. В некоторых вариантах реализации изобретения антитело содержит вариабельную область легкой цепи и вариабельную область тяжелой цепи, присутствующие в различных полипептидах или в отдельном полипептиде. Антитело по данному описанию связывает полипептид с аффинностью от около 107 М-1 до около 1012 М-1 в некоторых вариантах реализации изобретения. В других вариантах осуществления антитело содержит константную область тяжелой цепи изотопа IgG1, IgG2, IgG3 или IgG4. В дополнительных вариантах реализации изобретения антитело является меченым детектируемой меткой, в то время как оно представляет собой Fv, scFv, Fab, F(ab')2 или Fab' в других вариантах реализации изобретения.
Данное описание также предусматривает антитела, которые содержат ковалентно связанный неполипептидный полимер (например, полимер поли(этиленгликоля)). В иных вариантах реализации изобретения антитело содержит ковалентно связанную функциональную группу, выбранную из липидной функциональной группы, функциональной группы жирной кислоты, полисахаридной функциональной группы и углеводородной функциональной группы.
Антитело представляет собой антитело к отдельной цепи Fv (scFv) в некоторых вариантах реализации изобретения, a scFv образует мультимеры с другими.
Антитела по данному описанию могут представлять собой, но не ограничиваясь этим, моноклональные антитела, поликлональные антитела или гуманизированные антитела.
Более того, данное описание предполагает фармацевтические композиции, содержащие антитело, как описано выше, составленные с по меньшей мере одним фармацевтически приемлемым вспомогательным веществом, носителем или разбавителем. Подобные фармацевтические композиции могут также содержать, по меньшей мере, одно дополнительное профилактическое или терапевтическое средство.
Некоторые варианты реализации изобретения по данному описанию предполагают стерильный контейнер, который содержит одну из вышеупомянутых фармацевтических композиций и, необязательно, один или более дополнительных компонентов. В качестве примера, но без ограничения, стерильный контейнер может представлять собой шприц. В других дополнительных вариантах реализации изобретения стерильный контейнер представляет собой отдельный компонент набора; набор может также содержать, например, второй стерильный контейнер, который содержит, по меньшей мере, одно профилактическое или терапевтическое средство.
Данное описание также предусматривает способ лечения или предотвращения расстройства метаболизма глюкозы у субъекта (например, человека) с помощью введения субъекту терапевтически эффективного количества полипептида. В некоторых способах, лечение или предотвращение приводит к снижению глюкозы в плазме у субъекта, снижению инсулина в плазме у субъекта, снижению массы тела и/или потреблению пищи или повышению толерантности к глюкозе у субъекта. В конкретных вариантах реализации изобретения расстройство метаболизма глюкозы представляет собой сахарный диабет. В некоторых вариантах реализации изобретения субъект страдает ожирением и/или имеет нарушение массы тела.
Хоть это и не ограничивается каким-либо конкретным способом введения или режимом дозирования, в некоторых вариантах реализации изобретения введение представляет собой парентеральную (например, подкожным) инъекцию.
Краткое описание графических материалов
Фигура 1А иллюстрирует нуклеотидную последовательность прекурсора GDF15 человека и соответствующую нуклеиновую кислоту, кодирующую нуклеотидную последовательность прекурсора GDF15 человека.
Фигура 1В иллюстрирует зрелую аминокислотную последовательность GDF15 человека и соответствующую нуклеотидную последовательность, кодирующую зрелый GDF15 человека.
Фигура 1С иллюстрирует последовательность прекурсора сывороточного альбумина человека, содержащую эндогенный сигнальный пептид и продомен, зрелый сывороточный альбумин человека (D25-L609) и соответствующую нуклеотидную последовательность; и последовательность прекурсора сывороточного альбумина человека, содержащую сигнальный пептид IgK, зрелый сывороточный альбумин человека (D25-L609), и соответствующую нуклеотидную последовательность.
Фигура 1D иллюстрирует аминокислотную последовательность зрелого сывороточного альбумина человека (подпоследовательность аминокислотной последовательности Фигуры 1С, за исключением сигнального пептида IgK, и соответствующая нуклеотидная последовательность).
Фигура 1Е иллюстрирует слитую молекулу, в которой аминокислотная последовательность сывороточного альбумина человека, имеющая сигнальную последовательность IgK, слита с N-концом аминокислотной последовательности зрелого GDF15 человека посредством протеазо-чувствительного Factor Ха-расщепляемого линкера 2x(4Gly-Ser) (SEQ ID NO: 56), и соответствующую нуклеиновую кислоту, кодирующую слитую молекулу.
Фигура 1F иллюстрирует слитую молекулу, в которой аминокислотная последовательность зрелого сывороточного альбумина человека слита с N-концом аминокислотной последовательности зрелого GDF15 человека посредством протеазо-чувствительного Factor Ха-расщепляемого линкера 2x(4Gly-Ser) (SEQ ID NO:56), и соответствующую нуклеиновую кислоту, кодирующую слитую молекулу.
Фигура 1G иллюстрирует слитую молекулу, в которой аминокислотная последовательность сывороточного альбумина человека, имеющая сигнальную последовательность IgK, слита с N-концом аминокислотной последовательности зрелого GDF15 человека посредством нерасщепляемого линкера 3x(4Gly-Ser) (SEQ ID NO: 64), и соответствующую нуклеиновую кислоту, кодирующую слитую молекулу.
Фигура 1Н иллюстрирует слитую молекулу, в которой аминокислотная последовательность зрелого сывороточного альбумина человека слита с N-концом аминокислотной последовательности зрелого GDF15 человека посредством нерасщепляемого линкера 3x(4Gly-Ser) (SEQ ID NO: 64), и соответствующую нуклеиновую кислоту, кодирующую слитую молекулу.
Фигуры 2А-2С иллюстрирует влияние на массу тела (Фигура 2А), прием пищи (Фигура 2В) и глюкозу в крови (Фигура 2С) у ob/ob мышей после введения слитой молекулы, приведенной на Фигуре 1Н, в виде однократной подкожной дозы в указанных концентрациях (PBS (растворитель), 0,04 мг/кг, 0,12 мг/кг, 0,4 мг/кг и 1,2 мг/кг). Как отмечалось на фигуре, указанные параметры определяли в разные дни в течение 22-дневного периода. В каждой группе мышей, n=7 и p-величины (*, p<0,05; **, p<0,01; ***, p<0,001) определяли с помощью двухвыборочного критерия Стьюдента для независимых выборок, сравнивая массы тела, потребление пищи и глюкозу в крови групп при различных концентрациях с контрольной группой, получающей растворитель, в каждой указанной точке времени.
Фигура 3 иллюстрирует аминокислотные последовательности мутеинов GDF15, полученные посредством мутагенеза предсказанных доступных для растворяющего вещества гидрофобных остатков в пределах зрелого GDF15 человека. Слитые молекулы, в которых каждая последовательность мутеина GDF15 была слита с ЧСА, получали посредством линкера, проиллюстрированного на Фигуре 1Н (нерасщепляемый линкер 3x(4Gly-Ser); (SEQ ID NO: 64)); последовательности, приведенные на Фигуре 3, не иллюстрируют ни компонент ЧСА, ни линкерный компонент слитых молекул.
Фигура 4 представляет собой таблицу, обобщающую, является ли каждый мутеин GDF15, приведенный на Фигуре 3, секретированным в виде связанного дисульфидом гомодимера.
Фигура 5 иллюстрирует аминокислотные последовательности мутеинов GDF15, которые имеют замены аланина для оценки улучшения их физических свойств, по сравнению с GDF15.
Фигура 6 иллюстрирует аминокислотные последовательности одноточечных гликозилированных мутеинов и дополнительных дигликозилированных мутеинов в случае введения N-связанных гликозилированных консенсусных сайтов (Asn-Xxx-Ser/Thr), для оценки улучшенных физических свойств, по сравнению с GDF15. Получали слитые молекулы, в которых каждая последовательность мутеина GDF15 была слита с ЧСА посредством линкера, проиллюстрированного на Фигуре IE (Factor Ха-расщепляемый линкер); последовательности, приведенные на Фигуре 6, не изображают ни компонент ЧСА, ни линкерный компонент слитых молекул.
Фигура 7 предлагает краткое описание секреции и данные образования димера, наряду с занятостью N-гликанового сайта, для каждого построенного N-гликозилированного мутеина GDF15 человека, приведенного на Фигуре 6.
Фигуры 8А и 8В отражает построенные мутеины GDF15 человека, после экспрессии и очистки, которые имеют улучшенные физические свойства, по сравнению со зрелым GDF 15 человека.
Фигура 9А иллюстрирует влияние на снижение потребления пищи в течение ночи у ob/ob мышей после однократного подкожного кратковременного введения 0,3 мг/кг зрелого GDF15 человека, N-гликозилированных мутеинов GDF15 человека и контроля растворителем (PBS). В каждой группе мышей, n=7 и p-величины (*, p<0,05; **, p<0,01; ***, p<0,001) определяли с помощью двухвыборочного критерия Стьюдента для независимых выборок, при сравнении с потреблением пищи обработанными мутеином GDF15 мышами, по сравнению с контрольной группой, получающей растворитель.
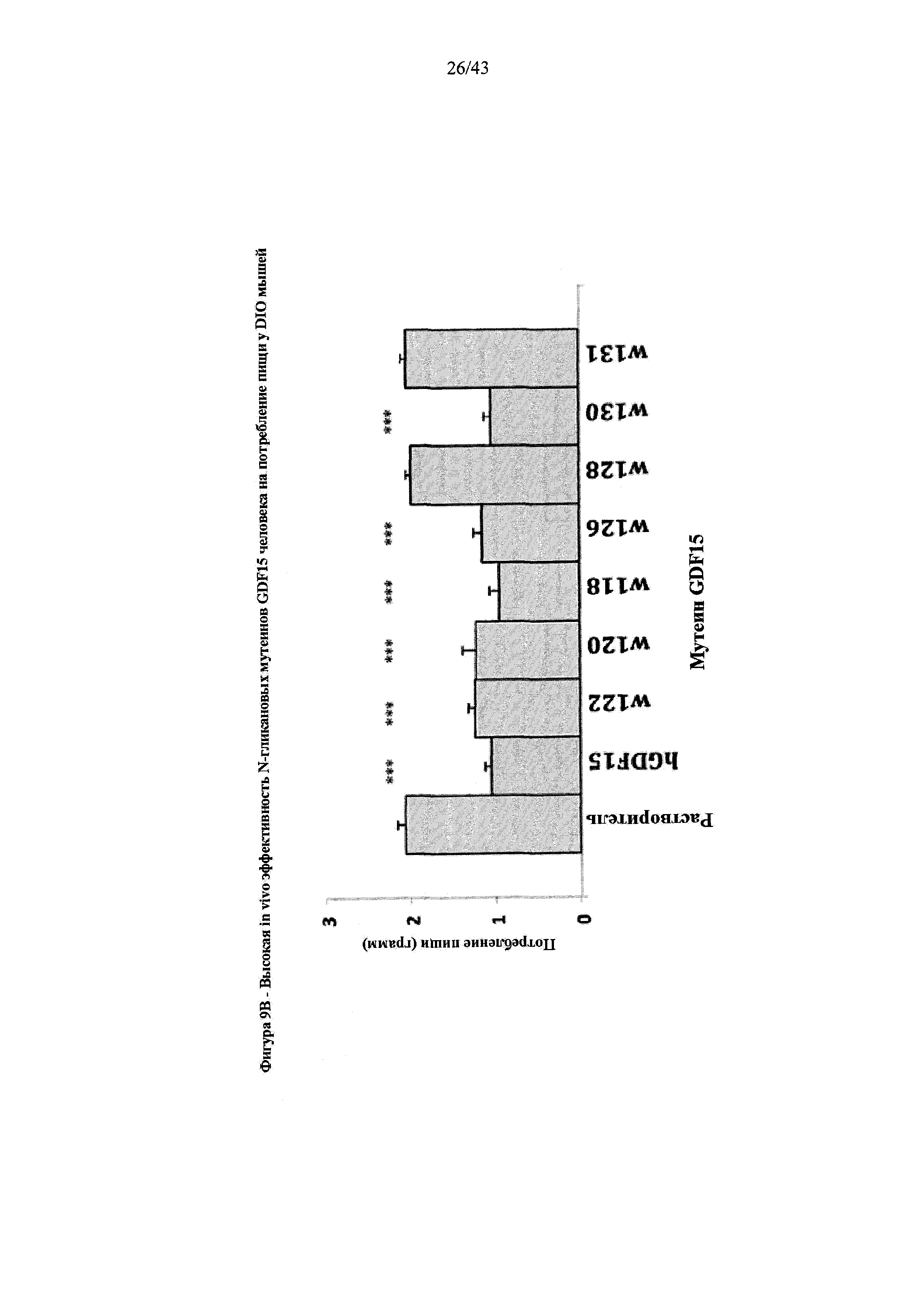
Фигура 9В иллюстрирует влияние на снижение потребления пищи в течение ночи у DIO мышей после однократного подкожного кратковременного введения 1,0 мг/кг зрелого GDF15 человека, N-гликозилированных мутеинов GDF15 человека и контроля растворителем (PBS). В каждой группе мышей, n=9 и p-величины (*, p<0,05; **, p<0,01; ***, p<0,001) определяли с помощью двухвыборочного критерия Стьюдента для независимых выборок, по сравнению с потреблением пищи обработанных мутеином GDF15 мышей, по сравнению с контрольной группой, получающей растворитель.
Фигура 10 демонстрирует, что гидродинамические радиусы N-гликановых мутеинов GDF15 являются повышенными, по сравнению со зрелым GDF15 человека, как определяли с помощью аналитической гель-фильтрационной хроматографии для измерения времени элюирования.
Фигура 11А иллюстрирует аминокислотные последовательности слитых молекул, содержащих ЧСА, которые имеют сигнальную последовательность IgK, слитую с N-концом ортологов видов зрелого GDF15 Mus museums и Масаса mulatta, посредством Factor Ха-расщепляемого линкера 2x(4Gly-Ser) (SEQ ID NO: 56).
Фигура 11В иллюстрирует аминокислотные последовательности слитых молекул, содержащие ЧСА, которые имеют сигнальную последовательность IgK, слитую с N-концом зрелого TGF-β1 человека и зрелого ВМР2 человека посредством Factor Ха-расщепляемого линкера 2x(4Gly-Ser) (SEQ ID NO: 56).
Фигура 12 краткое описание секреции и образование димера слитых молекул, содержащих ЧСА, слитый либо с N-концом ортологов видов зрелого GDF15, либо с N-концом зрелого человека TGF-B1 или ВМР2 человека посредством расщепляемого линкера.
Фигура 13 предлагает аминокислотные последовательности слитых молекул, содержащие ЧСА, которые имеют сигнальную последовательность IgK, слитую с N-концом зрелых мутеинов GDF15 человека, полученных с помощью сканирования на аланин, посредством нерасщепляемого линкера 3x(4Gly-Ser) (SEQ ID NO: 64).
Фигура 14 предлагает краткое описание секреции и образования димера в случае сканирования на аланин GDF15 с применением слитых молекул, содержащих аминокислотную последовательность ЧСА, слитую с N-концом аминокислотной последовательности зрелого GDF15 человека посредством нерасщепляемого линкер. Указанное краткое описание предлагает матрицу для сайтов, доступных для мутагенеза, которые не влияют на фолдинг GDF15 или параметры секреции.
Фигуры 15А-15Е предлагают несколько последовательностей молекул с повышенной растворимостью, увеличенным временем полужизни, содержащих слияние с N-концом аминокислотной последовательности зрелого GDF15 посредством различных линкеров. Фигура 15А): Схематическое изображение слитых молекул, содержащих сигнальную последовательность, слитую с Fc (IgG), ДСА и МСД; слитую с N-концом зрелого GDF15 посредством вариабельного линкера; Фигура 15В): FcGDF15, содержащий линкер 3X(Glu-3Gly-Ser); Фигура 15С): заряженная пара Fc(+)GDF15/Fc(-), содержащая Fc(+)-3X(Glu-3Gly-Ser)-GDF15 и hFc(-); Фигура 15D): Альбумин-связывающий домен (ДСА), содержащий линкер 5XGly (ДСА-GDF15); и Фигура 15Е): Мальтозо-связывающий домен (МСД), содержащий расщепляемый энтерокиназой линкер 5XGly (МСД-GDF15).
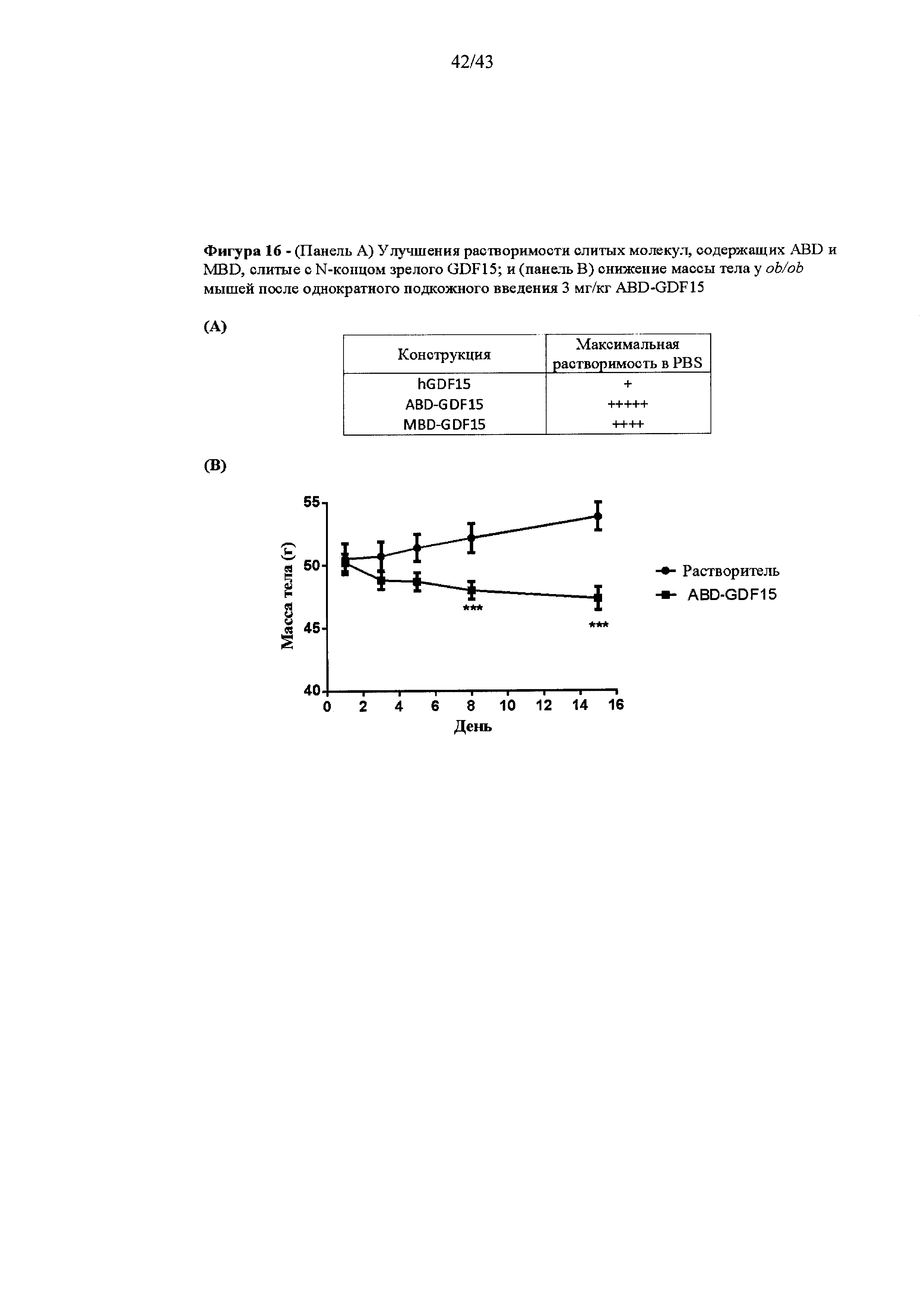
Фигура 16 предлагает краткое описание (А) улучшений растворимости в буфере PBS каждой из соответствующих слитых конструкций, приведенных на Фигуре 15, по сравнению со зрелым GDF15; и (В) снижение массы тела у мышиной модели ob/ob после одной подкожной инъекции 3 мг/кг альбумин-связывающего белка, слитого со зрелым GDF15 (ДСА-GDF15).
Фигура 17А иллюстрирует аминокислотную последовательность, применяемую для получения рекомбинантного (Оа) зрелого GDF15 утконоса (Оа).
Фигура 17В иллюстрирует влияние на потребление пищи в течение ночи и снижение массы тела у DIO мышей (n=8) после одной подкожной дозы 0,001, 0,003, 0,01, 0,03, 0,1, 0,3 и 1,0 мг/кг зрелого OaGDF15.
Подробное описание сущности изобретения
Перед тем, как будут дополнительно описаны способы и композиции по данному описанию, следует понимать, что изобретение не ограничивается конкретными вариантами реализации изобретения, приведенными в данном документе, а также следует понимать, что терминология, применимая в данном документе, применяется с целью описания конкретных вариантов реализации изобретения и не предназначена для ограничения.
Если предлагается диапазон значений, то следует понимать, что изобретением охватывается каждое промежуточное значение, до десятых долей единицы нижнего предела, если из контекста явным образом не следует иное, между верхним и нижним пределом этого диапазона и любое другое указанное или промежуточное значение в этом указанном диапазоне. Верхние и нижние пределы этих меньших диапазонов могут быть независимо включены в меньшие диапазоны и также охватываются настоящим изобретением, с учетом любого отдельно исключенного предела в указанном диапазоне. Если установленное значение содержит один или оба предела, диапазоны, исключающие любой или оба из этих включенных пределов, также включены в изобретение. Если не указано иное, все технические и научные термины, применяемые в данном документе, имеют то же значение, которое обычно понимается специалистом с обычной квалификацией в данной области техники, к которой это изобретение принадлежит.
Следует отметить, что, как применяется в данном документе и в прилагаемой формуле изобретения, формы единственного числа включают ссылки на множественное число, если из контекста явным образом не следует иное. Таким образом, например, ссылка на "полипептид человека" включает ссылку на один или более полипептидов человека, и так далее. Следует также отметить, что пункты формулы изобретения могут быть составлены таким образом, чтобы исключить любой необязательный элемент. Таким образом, это утверждение призвано служить основой для применения такой исчерпывающей терминологии, как "исключительно", "только" и тому подобной, в связи с перечислением элементов пункта, или применения "отрицательного" ограничения.
Публикации, обсуждаемые в данном документе, предлагаются исключительно для их раскрытия до даты подачи настоящей заявки. Ничего в данном документе не следует толковать как признание того, что настоящее изобретение в силу предшествующего изобретения не имеет права датировать подобную публикацию задним числом. Кроме того, предлагаемые даты публикации могут отличаться от фактических дат публикации, которые могут нуждаться в независимом подтверждении.
ОБЗОР
Настоящее изобретение предполагает применение средств, описанных в данном документе, и их композиций, для лечения и/или профилактики различных заболеваний, расстройств и состояний и/или их симптомов. В некоторых вариантах реализации изобретения заболевания, расстройства и состояния и/или их симптомы, относятся к расстройствам метаболизма глюкозы, в то время, как в других вариантах реализации изобретения они относятся к нарушениям массы тела. В качестве примера, но без ограничения, средства и их композиции могут быть применены для лечения и/или профилактики диабета 2го типа, резистентности к инсулину и заболеваний, расстройств и состояний, характеризующихся резистентностью к инсулину, сниженным получением инсулина, гипергликемией, метаболическим синдромом или ожирением.
В конкретных вариантах реализации изобретения средства, рассматриваемые в настоящем описании, представляют собой модифицированный фактор дифференцировки роста 15 человека (GDF15), в то время как в других вариантах реализации изобретения средства представляют собой модифицированные варианты GDF15 (например, мутеины). Модифицированный GDF15 человека и модифицированные варианты GDF15 (например, мутеины) имеют достаточную гомологию с GDF15 человека таким образом, что они имеют способность связывать рецептор(ы) GDF15 и инициировать сигнал трансдукции в результате, например, снижения масса тела и/или других физиологических эффектов, описанных в данном документе. Данное описание также предусматривает молекулы нуклеиновых кислот, кодирующие вышеуказанное. Как указано выше, модифицированные молекулы GDF15 человека и модифицированные варианты GDF15, описанные далее, в совокупности называют "полипептид(ы)".
Примеры различных мутеинов GDF15, которые могут быть модифицированными, описаны ниже. В некоторых вариантах реализации изобретения один или более аминокислотных остатков GDF15 заменены другой аминокислотой. В иных вариантах реализации изобретения один или более остатки нативного лизина GDF15 заменены другой аминокислотой (однако, изменения, связанные с K62Q, являются неактивными). В некоторых вариантах реализации изобретения по данному описанию, сканирование на аланин может применяться для получения мутеинов GDF15, а изменения в этих мутеинах могут быть оценены по их способности усиливать один или более желательных свойств самих мутеинов. Примеры модифицированных молекул GDF15 и модифицированных мутеинов GDF15 описаны ниже.
Данное описание предусматривает модификации GDF15 и мутеинов GDF15, в том числе, например, пегилирование, гликозилирование и конъюгаты с альбумином. В конкретных вариантах реализации изобретения стратегии применяют таким образом, что пегилирование осуществляют только на определенных остатках лизина (то есть, сайт-специфическое пегилирование). В иных вариантах реализации изобретения слияние с альбуминами может представлять собой полученный таким образом зрелый альбумин, или его измененную форму (например, фрагмент), конъюгированный непосредственно или опосредованно (например, посредством линкера) с GDF15 или мутеином GDF15. Как указано выше, модификации могут, например, улучшать время полужизни сыворотки и/или растворимость полипептидов. Примеры конкретных модифицированных молекул GDF15 и модифицированных мутеинов GDF15 описаны ниже.
ОПРЕДЕЛЕНИЯ
Термины "пациент" или "субъект" применяют взаимозаменяемо по отношению к человеку или отличному от человека животному (например, млекопитающему).
Термины "лечить", "лечение", "излечение" и подобные относятся к способу действия (например, введению полипептида или фармацевтической композиции, содержащей полипептид), инициируемых после того, как было диагностировано, замечено заболевание, расстройство или состояние или его симптом и подобное, таким образом, чтобы исключить, уменьшить, подавить, смягчить или улучшить, либо временно, либо постоянно, по меньшей мере, одну из основных причин заболевания, расстройства или состояния, от которого страдает субъект, или, по меньшей мере, один из симптомов, связанных с заболеванием, расстройством, состоянием, от которого страдает субъект. Таким образом, лечение включает ингибирование (то есть прекращение развития или дальнейшего развития заболевания, расстройства или состояния или клинических симптомов связанных с ним) активного заболевания (например, с тем, чтобы снизить уровень инсулина и/или глюкозы в кровотоке для того, чтобы повысить толерантность к глюкозе, с тем, чтобы свести к минимуму колебания уровней глюкозы и/или для того, чтобы защитить от заболеваний, вызванных нарушением гомеостаза глюкозы).
Термин "при необходимости лечения", как применяют в данном документе, соответствует решению, вынесенному врачом или другим опекуном, о том, что субъект требует лечения или получит положительный эффект от него. Это решение принимают на основе целого ряда факторов, которые находятся в сфере компетенции врача или компетентного опекуна.
Термины "предотвратить", "предотвращение", "профилактика" и подобное соответствуют способу действия (например, введению полипептида или фармацевтической композиции, содержащей полипептид), инициированном таким образом, (например, до начала заболевания, расстройства, состояния или его симптома), чтобы предотвратить, подавить, ингибировать или уменьшить, либо временно, либо постоянно, риск для субъекта развития заболевания, расстройства, состояния или подобного (как определено с помощью, например, отсутствия клинических симптомов) или задержки его наступления, как правило, в контексте субъекта, предрасположенного иметь конкретное заболевание, расстройство или состояние. В некоторых случаях, термины также соответствуют замедлению прогрессирования заболевания, расстройства или состояния или ингибирования их прогрессирования до опасного или другого нежелательного состояния.
Термин "при необходимости профилактики", как применяют в данном документе, соответствует решению, вынесенному врачом или другим опекуном, о том, что субъект требует его или получит положительный эффект от профилактического лечения. Это решение принимают на основе целого ряда факторов, которые находятся в сфере компетенции врача или компетентного опекуна.
Фраза "терапевтически эффективное количество" соответствует введению средства субъекту, либо отдельно, либо в виде части фармацевтической композиция и либо в отдельной дозе, либо в виде части серий доз, в количестве, которое способно иметь обнаруживаемый, положительный эффект на любой симптом, аспект или характеристики заболевания, расстройства или состояния при введении пациенту. Терапевтически эффективное количество может быть установлено с помощью измерения соответствующих физиологических эффектов. Например, в случае гипергликемического состояния, понижение или снижение глюкозы крови или улучшение пробы на толерантность к глюкозе может быть применено для определения, является ли количество средства эффективным для лечения гипергликемического состояния. Например, терапевтически эффективное количество представляет собой количество, достаточное для снижения или уменьшения любого уровня (например, базового уровня) уровня глюкозы натощак (УГН), причем, например, количество является достаточным для того, чтобы уменьшить уровень УГН более чем 200 мг/дл до менее чем 200 мг/дл, причем количество является достаточным для того, чтобы уменьшить уровень УГН между 175 мг/дл и 200 мг/дл до менее чем исходного уровня, причем, количество является достаточным для того, чтобы уменьшить уровень УГН между 150 мг/дл и 175 мг/дл до менее чем исходного уровня, причем, количество является достаточным для того, чтобы уменьшить уровень УГН между 125 мг/дл и 150 мг/дл до менее чем исходного уровня, и так далее (например, снижая уровни УГН до менее чем 125 мг/дл, до менее чем 120 мг/дл, до менее чем 115 мг/дл, до менее чем 110 мг/дл, и т.д.). В случае уровней HbAIc, эффективное количество представляет собой количество, достаточное для снижения или уменьшения уровней на более чем около 10%-9%, на более чем около 9%-8%, на более чем около 8%-7%, на более чем около 7%-6%, на более чем около 6%-5% и так далее. В частности, в соответствии с настоящим изобретением предполагается снижение или уменьшение уровней HbAIc на около 0,1%, 0,25%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 1,5%, 2%, 3%, 4%, 5%, 10%, 20%, 30%, 33%, 35%, 40%, 45%, 50% или более. Терапевтически эффективное количество может быть скорректировано в связи с режимом дозирования и диагностическим анализом состояния субъект и подобным.
Фраза "в достаточном количестве для того, чтобы осуществить изменения" означает, что существует обнаруживаемая разница между уровнем показателя, измеренным до (например, базовым уровнем) и после введения конкретной терапии. Показатели включают любой объективный параметр (например, уровень глюкозы или инсулина) или субъективный параметр (например, ощущение субъекта о здоровье).
Фраза "толерантность к глюкозе", как применяют в данном документе, соответствует способности субъекта контролировать уровень глюкозы в плазме и/или инсулина в плазме, при условии, что потребление глюкоза колеблется. Например, толерантность к глюкозе охватывает способность субъекта сокращать в течение около 120 минут уровень глюкозы в плазме обратно до уровня, определенного перед приемом глюкозы.
Вообще говоря, термины "сахарный диабет" и "диабетический" относятся к прогрессирующей болезни метаболизма углеводородов, в том числе неадекватному получению или расходованию инсулина, часто характеризуемому гипергликемией и глюкозурией. Термины "преддиабет" и "преддиабетический" относятся к состоянию, в котором субъект не имеет характеристик, симптомов и подобного, которые, как правило, наблюдаются у больных сахарным диабетом, но имеют характеристики, симптомы и подобное, которые, при условии, что его не лечат, могут перейти в сахарный диабет. Наличие этих состояния может быть определено с применением, например, либо уровня глюкозы натощак (УГН), либо перорального теста толерантности к глюкозе (ПТТГ). И, как правило, требуют, чтобы субъект воздерживался от пищи по меньшей мере 8 часов до начала испытания. В пробе УГН, глюкозу в крови субъекта измеряли после завершения голодания; как правило, субъект воздерживается от пищи в течение ночи, а глюкозу в крови измеряли утром, перед тем, как субъект ест. Здоровый субъект, как правило, имеет концентрацию УГН между около 90 и около 100 мг/дл, субъект с "преддиабетом", как правило, имеет концентрацию УГН между около 100 и около 125 мг/дл, а субъект с "диабетом", как правило, имеет уровень УГН выше около 126 мг/дл. В ПТТГ, глюкозу в крови субъекта измеряли после голодания и снова, через два часа после питья богатого глюкозой напитка. Через два часа после потребления богатого глюкозой напитка здоровый субъект обычно имеет концентрацию глюкозы в крови ниже около 140 мг/дл, преддиабетический субъект обычно имеет концентрацию глюкозы в крови от около 140 до около 199 мг/дл, а диабетический субъект обычно имеет концентрацию глюкозы в крови около 200 мг/дл или выше. В то время как вышеприведенные гликемические значения относятся к субъектам, относящимся к человеку, нормогликемия, умеренная гипергликемия и явная гипергликемия у субъекта, относящегося к мышам, масштабируются по-разному. Здоровый субъект, относящийся к мышам, после четырехчасового голодания, как правило, имеет концентрацию УГН между около 100 и около 150 мг/дл, субъект, относящийся к мышам, с "преддиабетом" будет иметь концентрацию УГН между около 175 и около 250 мг/дл, а субъект, относящийся к мышам, с "диабетом", как правило, имеет концентрацию УГН выше около 250 мг/дл.
Термин "резистентность к инсулину", как применяют в данном документе, соответствует состоянию, при котором нормальное количество инсулина не в состоянии получать нормальный физиологический или молекулярный ответ. В некоторых случаях, гиперфизиологическое количество инсулина, либо полученного эндогенно, либо введенного экзогенно, способно преодолеть резистентность к инсулину, в целом или частично, и вызвать биологическую реакцию.
Термин "метаболический синдром" соответствует связанному кластеру черт, который включает, но без ограничения этим, гиперинсулинемию, нарушение толерантности к глюкозе, ожирение, перераспределение жира в брюшной или верхний части корпуса, гипертонии, дисфибринолиз и дислипидемию, характеризующиеся высоким содержанием триглицеридов, липопротеинов низкой плотности (HDL) - холестерина, и крайне небольшими плотными частицами липопротеинов (LDL) низкой плотности. Субъекты, имеющие метаболический синдром, имеют риск развития диабета 2 го типа и/или других расстройств (например, атеросклероза).
Фраза "расстройство метаболизма глюкозы" охватывает любое расстройство, характеризующееся клиническим симптомом или комбинацией клинических симптомов, которые связаны с повышенным уровнем глюкозы и/или повышенным уровнем инсулина у субъекта, по сравнению со здоровым человеком. Повышенные уровни глюкозы и/или инсулина могут проявляться при следующих заболеваниях, расстройствах и состояниях: гипергликемии, диабете II типа, гестационном диабете, диабете I типа, резистентности к инсулину, ослабленной толерантности к глюкозе, гиперинсулинемии, ослабленном метаболизме глюкозы, преддиабете, других метаболических расстройствах (таких как метаболический синдром, который также называют синдром X) и ожирении среди прочих. Полипептиды по данному описанию и их композиции, могут быть применены, например, для достижения и/или поддержания гомеостаза глюкозы, например, для снижения уровня глюкозы в кровотоке и/или для снижения уровня инсулина в диапазоне, обнаруженном у здорового субъекта.
Термин "гипергликемия", как применяют в данном документе, соответствует состоянию, при котором в плазме крови субъекта циркулирует повышенное количество глюкозы, по сравнению со здоровыми людьми. Гипергликемия может быть диагностирована с применением способов, известных в данной области техники, в том числе измерения уровней глюкозы в крови натощак, как описано в данном документе.
Термин "гиперинсулинемия", как применяют в данном документе, соответствует состоянию, при котором наблюдаются повышенные уровни циркулирующего инсулина, при условии, что, одновременно с этим, уровни глюкозы в крови являются либо повышенными, либо нормальными. Гиперинсулинемия может быть вызвана резистентностью к инсулину, которая связана с дислипидемией, например, высоким уровнем триглицеридов, высоким уровнем холестерина, высоким уровнем липопротеина низкой плотности (LDL) и низким уровнем липопротеинов высокой плотности (HDL); высокими уровнями мочевой кислоты; синдромом поликистоза яичников; диабетом II типа и ожирением. Гиперинсулинемия может быть диагностирована, как имеющая уровень инсулина в плазме выше, чем около 2 мкЕд./мл.
Как применяют в данном документе, фраза "нарушение массы тела" соответствует состоянию, связанному с чрезмерной массой тела и/или повышенным аппетитом. Для определения, является ли субъект имеющим избыточный вес по сравнению с эталонным здоровым человеком, применяют различные параметры, в том числе возраст, рост, пол и состояние здоровья субъекта. Например, субъект может являться страдающим избыточным весом или ожирением по оценке индекса массы тела субъекта (ИМТ), который рассчитывают путем деления массы тела субъект в килограммах на высоту субъекта в метрах в квадрате. Взрослый, имеющий ИМТ в диапазоне от ~18,5 до ~24,9 кг/м2, считается имеющим нормальный вес; взрослый, имеющий ИМТ между ~25 и ~29,9 кг/м2, может считаться человеком с избыточным весом (предожирение); а взрослый, имеющий ИМТ в ~30 кг/м2 или выше, может считаться человеком с ожирением. Повышенный аппетит часто способствует чрезмерной массе тела. Существует несколько состояний, связанных с повышенным аппетитом, в том числе, например, синдром ночного питания, который часто характеризуется утренней анорексией и вечерней полифагией, связанными с бессонницей, но может быть связанным с повреждением гипоталамуса.
Термин "активаторы" соответствует средствам, которые, например, стимулируют, увеличивают, активируют, облегчают, повышают активацию, сенсибилизируют или повышающе регулируют функцию или активность одного или более полипептидов. В дополнение к этому, активаторы содержат средства, которые действуют посредством того же механизма действия, что и полипептиды (то есть средства, которые модулируют тот же сигнальный путь, что и полипептиды по способу, аналогичному таковому, что и в случае полипептидов) и способны вызывать биологический ответ, сопоставимый с (или более чем) таковым в случае полипептидов. Примеры активаторов включают агонисты, такие как низкомолекулярные соединения.
Термин "модуляторы", в совокупности, относится к полипептидам и активаторам.
Термины "модулировать", "модуляция" и подобные относятся к способности средства (например, активатора) повышать функцию или активность одного или более полипептидов (или молекул нуклеиновых кислот, кодирующей их), либо непосредственно, либо опосредованно; или к способности средства вызывать эффект, сопоставимый с таковым для одного или более полипептидов.
Термины "полипептид," "пептид" и "белок", применяемые в данном документе как взаимозаменяемые, относятся к полимерной форме аминокислот любой длины, которые могут содержать генетически закодированную и негенетически закодированные аминокислоты, химически или биохимически модифицированные или дериватизированные аминокислоты и полипептиды, имеющие модифицированные полипептидные остовы. Термины включают слитые белки, в том числе, но без ограничения этим, слитые белки с гетерологичной аминокислотной последовательностью, слитые белки с гетерологичными и гомологичными лидерными последовательностями, с или без N-концевых остатков метионина; иммунологически меченые белки; и подобное.
Следует иметь в виду, что на протяжении всего этого описания ссылку на аминокислоты делают в соответствии с однобуквенными или трехбуквенными кодами. Для удобства читателя, одно- и трехбуквенные коды аминокислот приведены ниже:
Как применяют в данном документе, термин "вариант" охватывает встречающиеся в природе варианты (например, гомологи и аллельные варианты) и не встречающиеся в природе варианты (например, мутеины). Встречающиеся в природе варианты включают гомологи, то есть нуклеиновые кислоты и полипептиды, которые отличаются нуклеотидной или аминокислотной последовательностью, соответственно, от одного вида к другому. Встречающиеся в природе варианты включают аллельные варианты, то есть нуклеиновые кислоты и полипептиды, которые отличаются нуклеотидной или аминокислотной последовательностью, соответственно, от одного варианта к другому в пределах вида. Не встречающиеся в природе варианты включают нуклеиновые кислоты и полипептиды, которые содержат в нуклеотидной или аминокислотной последовательности альтерацию, соответственно, где альтерация искусственно введена в последовательность, например альтерация получена в лаборатории или другим средством с помощью вмешательства человека ("руками человека").
Термин "нативный", по отношению к GDF15, соответствует биологически активному, встречающемуся в природе GDF15, в том числе биологически активным, встречающимся в природе вариантам GDF15. Термин включает последовательность зрелый GDF15 человека из 112 аминокислот.
Термин "мутеины", как применяют в данном документе, в широком смысле соответствует мутантным рекомбинантным белкам, то есть полипептиду, содержащему изменение, искусственно введенное в аминокислотную последовательность, например, изменение в аминокислотной последовательности, полученное в лаборатории или другим способом с помощью вмешательства человека ("руками человека"). Эти белки, как правило, несут одну или несколько аминокислотных замен и часто получены от клонированных генов, которые подвергались сайт-направленному или случайному мутагенезу, или от полностью синтетических генов. "Мутеины" по данному описанию, таким образом, охватывает, например, аминокислотные замены и/или делеции аминокислот (например, N-концевые усечения 1, 2, 3, 4, 5 или 6 или более аминокислот), по сравнению с соответствующим полипептидом, например, по сравнению со зрелым GDF15 человека.
Как применяют в данном документе по отношению к нативному GDF15 человека или мутеину GDF15, термины "модифицированные", "модификация" и подобные соответствуют одному или более изменениям, которые усиливают желаемое свойство GDF15 человека, встречающегося в природе варианта GDF15 или мутеина GDF15, где изменение не изменяет первичную аминокислотную последовательность GDF15. "Модификация" включает ковалентную химическую модификацию, которая не меняет первичную аминокислотную последовательность самого полипептида GDF15. Подобные желаемые свойства включают, например, повышение растворимости, продление время полужизни циркуляции, увеличение стабильности, уменьшение клиренса, изменение иммуногенности или аллергенности, улучшение аспектов технологичности (например, стоимости и эффективности) и делает возможным рост конкретных антител (например, с помощью введения уникальных эпитопов) для применения в анализах детектирования. Изменения GDF15 человека, встречающегося в природе варианта GDF15 или мутеина GDF15, которые могут быть осуществлены, включают, но не ограничиваясь этим, пегилирование (ковалентное присоединение одной или более молекул полиэтиленгликоля (ПЭГ) или его производных); гликозилирование (например, N-гликозилирование), полисиалилирование и конъюгацию с гидроксиэтилкрахмалом; связывающий мальтозу слитый белок; слияние с альбумином (например, слияние с ЧСА); связывание с альбумином, посредством, например, цепи конъюгированной жирной кислоты (ацилирование); Fc-слияние; и слияние с миметиком ПЭГ. Некоторые конкретные варианты реализации изобретения влекут за собой модификации с участием полиэтиленгликоля, другие конкретные варианты реализации изобретения влекут за собой модификации с участием альбумина, а дополнительные отличные конкретные модификации влекут за собой модификации с участием гликозилирования.
Термины "ДНК", "нуклеиновая кислота", "молекула нуклеиновой кислоты", "полинуклеотид" и подобное применяют взаимозаменяемо в данном документе по отношению к полимерной форме нуклеотидов любой длины, либо дезоксирибонуклеотидов, либо рибонуклеотидов, либо их аналогов. Неограничивающие примеры полинуклеотидов включают линейные и кольцевые нуклеиновые кислоты, матричную РНК (мРНК), комплементарную ДНК (мДНК), рекомбинантные полинуклеотиды, векторы, метки, праймеры и подобное.
Термин "метка" соответствует фрагменту ДНК или РНК, соответствующему гену или последовательности, представляющим интерес, в котором фрагмент был радиоактивно помечен (например, с помощью включения 32P или 35S) или с помощью другой обнаруживаемой молекулы, такой как биотин, дигоксигенин или флуоресцеин. Поскольку участки ДНК или РНК с комплементарными последовательностями будут гибридизованы, может быть применена метка, например, для того, чтобы пометить вирусные бляшки, бактериальные колонии или полосы на геле, которые содержат ген, представляющий интерес. Метка может представлять собой клонированную ДНК или она может представлять собой синтетическую цепь ДНК; последняя может быть применена для получения кДНК или геномного клона из изолированного белка с помощью, например, микросеквенирования части белка, с получением нуклеотидной последовательности, кодирующей белок, синтезирования олигонуклеотида, несущего эту последовательность, введения радиоактивной метки в последовательность и применение ее в качестве метки для скрининга библиотеки кДНК или геномной библиотеки.
Термин "гетерологичный" соответствует двум компонентам, которые определены с помощью структур, полученных из различных источников. Например, в контексте полипептида, "гетерологичный" полипептид может содержать функционально связанные аминокислотные последовательности, которые получали из различных полипептидов (например, первый компонент, содержащий рекомбинантный полипептид, а второй компонент получен из нативного полипептида GDF15). Точно так же, в контексте полинуклеотида, кодирующего химерный полипептид, "гетерологичный" полинуклеотид может содержать функционально связанные нуклеотидные последовательности, которые могут быть получены из различных генов (например, первый компонент из нуклеиновой кислоты, кодирующей полипептид согласно варианту реализации изобретения, раскрытого в данном документе, и второй компонент из нуклеиновой кислоты, кодирующей транспортный полипептид). Другие типовые "гетерологичные" нуклеиновые кислоты содержат экспрессирующие конструкции, в которых нуклеиновая кислота, содержащая кодирующую последовательность, является функционально связанной с регуляторным элементом (например, промотором), которые являются отличающимися от таковых в кодирующей последовательности по генетическому происхождению (например, для того, чтобы обеспечить экспрессию в клетке-хозяине, представляющей интерес, которая может иметь различное генетическое происхождение, отличное от промотора, кодирующего последовательность, или обеих). Например, промотор Т7 функционально связан с полинуклеотидом, кодирующим полипептид GDF15 или его домен, как указано, будет гетерологичной нуклеиновой кислотой. В контексте рекомбинантных клеток, "гетерологичный" может соответствовать присутствию нуклеиновой кислоты (или генного продукта, такого как полипептид), которая имеет иное генетическое происхождение, чем клетка-хозяин, в которой она присутствует.
Термин "функционально связанные" соответствует связи между молекулами, для того, чтобы обеспечить нужную функцию. Например, "функционально связанные" в контексте нуклеиновых кислот соответствуют функциональной связи между нуклеотидными последовательностями. В качестве примера, последовательность управления экспрессией нуклеиновой кислоты (например, промотор, сигнальная последовательность или повтор сайтов соединения фактора транскрипции) может быть функционально связанной со вторым полинуклеотидом, в котором последовательность управления экспрессией влияет на транскрипцию и/или трансляцию второго полинуклеотида. В контексте полипептида, "функционально связанные" соответствуют функциональной связи между аминокислотными последовательностями (например, различными доменами) для обеспечения описанной активности полипептида.
Как применяют в данном документе в контексте структуры полипептида, "N-конец" (или "аминный конец") и "С-конец" (или "карбоксильный конец") соответствуют крайним аминным и карбоксильным концам полипептида, соответственно, в то время как термины "N-концевой" и "С-концевой" соответствуют соответствующим позициям в аминокислотной последовательности полипептида по отношению к N-концу и С-концу, соответственно, и могут содержать остатки на N-конце и С-конце, соответственно. "Непосредственно N-концевой" или "непосредственно С-концевой" соответствует положению первого аминокислотного остатка, по сравнению со вторым аминокислотным остатком, где первый и второй аминокислотные остатки ковалентно связаны для обеспечения непрерывной аминокислотной последовательности.
"Полученный из", в контексте аминокислотной последовательности или полинуклеотидной последовательности (например, аминокислотная последовательность, "полученная из" полипептида GDF15), призвана подчеркнуть, что полипептид или нуклеиновая кислота имеют последовательность, основанную на таковой из соответствующего полипептида или нуклеиновой кислоты (например, встречающегося в природе полипептида GDF15 или кодирующей GDF15 нуклеиновой кислоты), и не предназначены для ограничения в качестве источника или способа, в котором получают белок или нуклеиновую кислоту. В качестве примера, термин "полученный из" включает гомологи или варианты соответствующей аминокислоты или последовательностей ДНК.
В контексте полипептида, термин "выделенный" соответствует полипептиду, представляющему интерес, который, при условии, что встречается в природе, находится в среде, отличной от той, в которой он может присутствовать естественным образом. "Выделенный" подразумевает включение полипептидов, которые находятся в пределах образцов, по существу, обогащенных полипептидом, представляющим интерес, и/или в которых полипептид, представляющий интерес, является частично или по существу очищенным. Если полипептид является не встречающимся в природе, "выделенный" означает полипептид, который был отделен от среды, в которой он был создан либо синтетическим, либо рекомбинантным способами.
"Обогащенный" означает, что образец не является регулируемым естественным образом (например, ученым или клиницистом), таким образом, что полипептид, представляющий интерес, присутствует в а) большей концентрации (например, по меньшей мере в 3 раза больше, по меньшей мере в 4 раза больше, по меньшей мере в 8 раз больше, по меньшей мере в 64 раз больше или более), чем концентрация полипептида в исходном образце, например, в биологическом образце (например, образце, в котором полипептид присутствует естественным образом или в котором он присутствует после введения), или б) концентрации, большей, чем в среде, в которой был создан полипептид (например, таким образом, как в бактериальной клетке).
"По существу чистый" указывает, что компонент (например, полипептид) составляет более чем около 50% от общего содержания композиции, и, как правило, более чем около 60% от общего содержания полипептида. Более конкретно, "по существу чистый" соответствует композициям, в которых, по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90% или более общего содержания композиции представляет собой компонент, представляющий интерес. В некоторых случаях, полипептид будет составлять более чем около 90% или более чем около 95% общего содержания композиции.
Термины "антитела" (Abs) и "иммуноглобулины" (Igs) соответствуют гликопротеинам, имеющим аналогичные структурные характеристики. В то время как антитела проявляют специфичность связывания с антигеном, иммуноглобулины содержат как антитела, так и другие подобные антителам молекулы, которые не имеют антигенную специфичность. Антитела описаны подробно ниже.
Термин "моноклональное антитело" соответствует антителу, полученному из популяции по существу гомогенных антител, то есть, индивидуальные антитела, содержащие популяцию, являются одинаковыми, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высоко специфичными, направленными против одного антигенного сайта. В отличие от препаратов поликлонального антитела, которые могут содержать различные антитела, направленных против различных сайтов связывания (эпитопов), каждое моноклональное антитело направлено против одного сайта связывания антигена.
В контексте антитела, термин "выделенный" соответствует антителу, который был отделен и/или выделен из загрязняющих компонентов его природной среды; такие загрязняющие компоненты содержат материалы, которые могли бы помешать диагностическим или терапевтическим применениям антитела и могут содержать ферменты, гормоны и другие белковые или небелковые растворенные вещества.
Фактор дифференцировки роста 15 (GDF15)
GDF15, также известный как MIC-1 (ингибирующий макрофаги цитокин-1), PDF, PLAB, NAG-1, TGF-PL и PTGFB, представляет собой член суперсемейства трансформирующего фактора роста β (TGF-β). GDF 15, который синтезируют в виде внутриклеточного прекурсора белка в 62 кДа, который затем расщепляется с помощью фуриноподобной протеазы, секретированный в виде связанного дисульфидом белка в 25 кДа. [См., например, Fairlie et al., J. Leukoc. Biol 65: 2-5 (1999)]. мРНК GDF 15 наблюдается в некоторых тканях, в том числе печени, почке, поджелудочной железе, толстой кишке и плаценте, а экспрессия GDF15 в печени может быть значительно повышена при травме органов, таких как печень, почек, сердца и легких.
Прекурсор GDF15 представляет собой полипептид из 308 аминокислот (NCBI Ref. Seq. NP_004855.2), содержащий сигнальный пептид из 29 аминокислот, про-домен из 167 аминокислот и зрелый домен из 112 аминокислот, который вырезали из про-домена с помощью фуриноподобных протеаз. Полипептид GDF15 из 308 аминокислот упоминается как "полноразмерный" полипептид GDF15; полипептид GDF15 из 112 аминокислот (например, аминокислот 197-308 аминокислотной последовательности, проиллюстрированной на Фигуре 1А) представляет собой "зрелый" полипептид GDF15. Если не указано иное, термин "GDF15" соответствует зрелой последовательности из 112 аминокислот. В дополнение к этому, многочисленные ссылки на конкретные остатки GDF15 соответствуют зрелой последовательности из 112 аминокислот (то есть, остаток 1 представляет собой Ala (А), а остаток 112 представляет собой I1e (I); См. Фигуру 1В). Следует отметить, что в то время, как нуклеотидная последовательность прекурсора GDF15 предсказывает три сайта вырезания, в результате чего получают три предполагаемые формы "зрелого" GDF15 человека (то есть из 110, 112 и 115 аминокислот), зрелая последовательность из 112 аминокислот принимается как такая, которая является правильной.
Объем настоящего описания включает ортологи GDF15 и их модифицированные формы, от других видов млекопитающих, и их применение, в том числе мыши (NP_035949), шимпанзе (ХР_524157), орангутана (ХР_002828972), макаки-резуса (ЕНН29815), большой панды (ХР_002912774), гиббона (ХР_003275874), морской свинки (ХР_003465238), хорька (AER98997), коровы (NP_001193227), свиньи (NP_001167527), собаки (ХР_541938) и утконоса (Ornithorhynchus anatinus; AFV61279). Зрелая форма GDF15 человека имеет приблизительно 67% аминокислотной идентичности с мышиным ортологом.
А. Модифированные мутеины GDF15, имеющие требуемые физические свойства
Данное описание предусматривает, в частности, модифицированные мутеины GDF15, причем один или более аминокислотных остатков зрелого полипептида GDF15 заменены на один или более других остатков. Например, компонент мутеина GDF15 модифицированного мутеина GDF15 может содержать одну или более замен нативных остатков лизина (то есть, остатков 62, 69, 91 и 107) на любую другую аминокислоту, за исключением того, что мутеины GDF15, содержащие K62Q, являются неактивными. Таким образом, модифицированный GDF15, содержащий K62Q, может быть специфически исключенным из мутеинов GDF15 по данному описанию. Мутеины GDF15, сохраняющие K62, но включающие любую комбинацию K69Q, K91R и/или K107R, являются активными в понижении массы тела до уровня, сравнимого со зрелым контролем GDF15 человека.
В других мутеинах GDF15, один или более остаток GDF15 замещен другой аминокислотой, в том числе, например, следующими заменами: H18Q, T19S или V20L. Подобные мутеины GDF15 являются кандидатами на модификацию для улучшения одного или более присущих физических свойств (например, стабильности, времени полужизни сыворотки и поколения конкретных антител для применения в анализах обнаружения и очистки белка).
Примеры других вероятных мутеинов GDF15 включают, но не ограничиваясь этим, следующие:
мутеин v1) K69Q, K91R, K107R (SEQ ID NO: 166);
мутеин v2) K62Q, K91R, K107R (SEQ ID NO: 167);
мутеин v3) K62Q, K69Q, K107R (SEQ ID NO: 168);
мутеин v4) K62Q, K69Q, K91R (SEQ ID NO: 169);
мутеин v5) K91R, K107R (SEQ ID NO: 170);
мутеин v6) K69Q, K107R (SEQ ID NO: 171);
мутеин v7) K69Q, K91R (SEQ ID NO: 172);
мутеин v8) H18Q, T19S, V20L, K62Q, K69Q, K91R, K107R (SEQ ID NO: 173);
мутеин v9) H18Q, T19S, V20L, K62Q, K91R, K107R (SEQ ID NO: 174);
мутеин v10) H18Q, T19S, V20L, K62Q, K69Q, K107R (SEQ ID NO: 175); и
мутеин v11) H18Q, T19S, V20L, K62Q, K69Q, K91R (SEQ ID NO: 176).
Дополнительные примеры мутеинов GDF15 включают, но не ограничиваясь этим, полипептид GDF15 человек, содержащий аминокислотную замену на одном, двух, трех, четырех или более из R2, N3, G4, D5, Н6, Р8, L9, G10, Р11, G12, R13, R16, L17, Н18, Т19, V20, R21, S23, L24, Е25, D26, L27, G28, W29, D31, W32, V33, L34, S35, R37, Е38, V39, Q40, V41, Т42, М43,145, Р49, S50, Q51, F52, R53, N56, М57, Н58, Q60,161, Т63, S64, Н66, R67, L68, К69, Р70, D71, Т72, V73, Р74, Р76, V79, Р80, S82, N84, Р85, М86, V87, L88,189, Q90, К91, Т92, D93, Т94, G95, V96, S97, L98, Q99, Т100, Y101, D102, D103, L104, L105, K107, D108, H110 и I112, причем аминокислотная замена может представлять собой консервативную аминокислотную замену или неконсервативную аминокислотную замену. В одном примере, мутеины GDF15 содержат аланин, замещенный на один, два, три, четыре или более из R2, N3, G4, D5, Н6, Р8, L9, G10, Р11, G12, R13, R16, L17, Н18, Т19, V20, R21, S23, L24, Е25, D26, L27, G28, W29, D31, W32, V33, L34, S35, R37, Е38, V39, Q40, V41, Т42, М43, 145, Р49, S50, Q51, F52, R53, N56, М57, Н58, Q60, 161, Т63, S64, Н66, R67, L68, К69, Р70, D71, Т72, V73, Р74, Р76, V79, Р80, S82, N84, Р85, М86, V87, L88,189, Q90, К91, Т92, D93, Т94, G95, V96, S97, L98, Q99, Т100, Y101, D102, D103, L104, L105, K107, D108, H110 и I112. В некоторых вариантах реализации изобретения мутеины GDF15 не имеют аминокислотную замену на Р36, G46, К62, L65 и/или Y83. В некоторых вариантах реализации изобретения мутеины GDF15 не имеют аминокислотную замену на С7, С14, С15, С44, С48, С77, С78, С109 и/или С111.
Как указано выше и как описано более детально ниже, нативный GDF15 и мутеины GDF15 могут представлять собой модифицированные, посредством, например, пегилирования (ковалентного присоединения одной или более молекул полиэтиленгликоля (ПЭГ) или его производных); гликозилирования (например, N-гликозилирования); полисиалилирования; слияния с альбумином молекул, содержащих сывороточный альбумин (например, сывороточный альбумин человека (ЧСА), сывороточный альбумин макаки или бычий сывороточный альбумин (БСА)); связывания альбумина посредством, например, конъюгированной цепи жирной кислоты (ацилирование); Fc-слияния; и слияния с миметиком ПЭГ. В некоторых вариантах реализации изобретения модификации вводят сайт-специфическим способом. В иных вариантах реализации изобретения модификации включают линкер.
В конкретных вариантах реализации изобретения данное описание предусматривает модификацию зрелого GDF15 человека и мутеинов GDF15 с помощью конъюгации с альбумином. В иных вариантах реализации изобретения данное описание предусматривает модификацию зрелого GDF15 человека и мутеинов GDF15 посредством N-гликозилирования. Характеристики альбуминов и их конъюгатов GDF15/мутеин GDF15 (например, слитых белков) и N-гликозилированных GDF15/мутеины GDF15 описаны дополнительно ниже.
Пример 1 указывает на влияние на массу тела, потребление пищи и глюкозу в крови натощак слитой молекулы, содержащей зрелый ЧСА, слитый с N-концом зрелого GDF15 человека посредством нерасщепляемого линкера 3x(4Gly-Ser) (SEQ ID NO: 64). Введение слитой молекулы (которая демонстрирует улучшенное время полужизни, экспрессию, секрецию и растворимость, по сравнению с неконъюгированным рекомбинантным GDF15 человека) приводит к значительному улучшению массы тела (Фигура 2А), потреблению пищи (Фигура 2В) и глюкозы в крови не натощак (Фигура 2С) по сравнению с контролем растворителем. Эти данные демонстрируют, что слияние ЧСА с GDF15 является активным, и что такие слитые молекулы представляют собой жизнеспособный метод для повышения некоторых полезных свойств мутеинов GDF15. Данные также показывают, что измерение указанных параметров может быть применимым в качестве платформы для высокопроизводительного скрининга мутеинов.
Пример 2 описывает методологию, применяемую для определения средств улучшения физических свойств (например, растворимости и стабильности) зрелого GDF15 человека. Набор из шести гидрофобных остатков, которые, как предполагают, являлись поверхностно доступными, мутировал в аланин в качестве средства повышения гидрофобности поверхности. Получали слитые молекулы, причем каждая из шести последовательностей мутеина GDF15 была слитой с ЧСА посредством линкера, проиллюстрированного на Фигуре 1Н (нерасщепляемый линкер 3x(4Gly-Ser) (SEQ ID NO: 64); последовательности, приведенные на Фигуре 3, не иллюстрируют ни компонент ЧСА, ни линкерный компонент слитых молекул.
Затем, слитые молекулы проверяли на экспрессию в качестве секретированных связанных дисульфидом гомодимеров (См. Фигуру 4). Данные, полученные таким образом, как описано в примерах, применяли для того, чтобы оценить растворимость, полученную от введения N-связанного гликозилированного консенсусного сайта(ов), наряду с последовательностью зрелого GDF15 человека, и для того, чтобы рассмотреть ограничения растворимости, связанные с поверхностными гидрофобностями и гидрофобностями, присущими зрелому GDF15 человека. Оценка влечет за собой конструирование GDF15/мутеины GDF15 - N-концевые слитые молекулы ЧСА, содержащие протеолитический Factor Ха-чувствительный, расщепляемый линкер. Каждый мутеин получали как слитый не с ЧСА с применением зрелой последовательности hGDF15 с сигнальным пептидом IgK. Снижение поверхностной гидрофобности пяти мутеинов GDF15 (w29, w32, w52, w68 и w89; См. Фигуру 3) оценивали посредством селективного мутагенеза гидрофобных остатков на аланин и получали либо в качестве ЧСА-слияний, содержащих протеолитический Factor Ха-чувствительный, расщепляемый линкер, либо в качестве бактериального рефолдинга, в том числе аминокислотной последовательности зрелых мутеинов hGDF15 из 112 аминокислот, содержащей N-концевой метионин. Сравнение растворимости указанных пяти мутеинов, по сравнению со зрелым GDF15 человека, свидетельствовало о том, что w52 и w89 представляли собой только мутеины, демонстрирующие улучшенную растворимость.
В дополнение к этому, поверхностную гидрофобность следующих пяти последовательностей мутеина GDF15 (См. Фигуру 5) оценивали посредством селективного мутагенеза кислотных остатков на аланин: w113, w114, w115, w116 и w117. Сравнение относительной растворимости указанных пяти мутеинов со зрелым GDF15 человека свидетельствовало о том, что w116 представлял собой только мутеин, который демонстрирует улучшенную растворимость.
Последовательность зрелого GDF15 человека затем оценивали на ее способность обеспечивать введение N-связанного гликозилированного консенсусного сайта(ов). В указанном контексте, отдельная аминокислотная замена может передавать требуемый консенсусный сайт в пределах последовательности зрелого GDF15 человека, консенсусный сайт в случае N-связанного гликозилирования был определен как "Asn-Xxx-Ser/Thr", где "Ххх" не может быть остатком пролина. Основываясь на сканировании последовательности зрелого GDF15 человека, для того, чтобы обеспечивать введение N-гликанового консенсусного сайта определяли 14 возможных одноточечных мутеинов. Фигура 6 иллюстрирует последовательности 14 моногликозилированных мутеинов, а также дополнительных комбинаторных дигликозилированных мутеинов. Каждый из указанных построенных N-гликановых мутеинов оценивали и на занятость сайта N-гликана, и на секрецию в гомодимере GDF15, который подвергали фолдингу, в питательной среде ткани млекопитающих. Как приведено на Фигуре 7, 10 из 14 моногликозилированных мутеинов были секретированы в виде гомодимеров GDF15, подвергнутых фолдингу, в то время как 4 (w123, w125, w127 и w129) не приводили к образованию димера. Из 10 моногликозилированных мутеинов, которые секретированы в виде гомодимеров, два (w121 и w124) проявляют низкую занятость и их растворимость в дальнейшем не оценивается (См. Фигуру 7).
Созданные моногликозидированные мутеины GDF15 человека, которые были и секретированными в качестве гомодимеров, и обладали высокой занятостью гликана в пределах консенсусного сайта, демонстрировали улучшенную растворимость, по сравнению со зрелым GDF15 человека (См. Пример 3; Фигура 8). Указанные мутеины GDF15 оценивали на их способность влиять на снижение потребления пищи, а данные приведены на Фигуре 9А.
В конце концов, гидродинамические радиусы построенных N-гликановых мутеинов GDF15, по сравнению со зрелым GDF15 человека оценивали с применением аналитической гель-фильтрационной хроматографии (См. Пример 4). Как указано на Фигуре 10, каждый из N-связанных гликановых мутеинов повышает гидродинамические радиусы связанного дисульфидом димера GDF15 человека. Таким образом, каждый мутеин может потенциально служить в качестве отправной точки для создания молекул, имеющих, например, предпочтительное in vivo время полужизни.
По отношению к зрелому GDF15 человека, многие из N-гликозилированных мутеинов демонстрируют наиболее существенные улучшения физических свойств (например, повышение растворимости и повышение гидродинамических радиусов) в то время как поддержание эффективного снижения потребления пищи, по-видимому, локализованы со специфическим эпитопом/областью GDF15 человека. В частности, мутагенез в результате введения N-гликозилированных консенсусных сайтов, казалось, будет перенесенным в эпитоп/область, охватывающую Gln90-Leu98. Таким образом, хотя понимание предпочтительных областей для мутагенеза не требуется для того, чтобы применять на практике данное описание, этот эпитоп/область считают выгодным для введения N-гликозилированных консенсусных сайтов.
Сывороточный альбумин (ЧСА) человека в качестве расщепляемого партнера слияния и экспрессии был, затем, дополнительно применен для получения и очистки самых различных ортологов GDF15 и членов семейства BMP/TGF, как приведено на Фигурах 11А, 11В и 12. Основываясь на профилировании экспрессии и определении характеристик секретированных конструкций, представляется такими, что сывороточный альбумин человека (согласно стандартизированному шаблону экспрессии IgK-ЧСА-2X(4Gly-Ser)-IEGR-GDF15 (SEQ ID NO: 12)) в качестве партнера слияния хорошо подходит для аминокислотной последовательности зрелого GDF15 человека. Шаблон экспрессии оптимизирован для GDF15 человека, а ортологи, которые сохраняют по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 60% по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95% или более идентичности последовательности с аминокислотной последовательностью зрелого GDF15 человека.
Специфические остатки, которые могут поддаваться аминокислотной замене, идентифицировали с помощью сканирующего аланином мутагенеза последовательности зрелого GDF15 человека из 112 аминокислот, с результатами, приведенными на Фигурах 7, 8, 9 и 10. Слияние экспрессированного сывороточного альбумина человека применяли для того, чтобы идентифицировать области, неустойчивые к мутагенезу. Остатки цистеина не были подвергнуты мутации для поддержания фолдинга цистеинового узла (С7, С14, С15, С44, С48, С77, С78, С109 и С111). Идентифицировали пять сайтов, которые могут быть неустойчивыми к мутагенезу на аланин: w36, w46, w62, w65 и w83 (P36, G46, K62, L65, и Y83, приведенные на Фигурах 13 и 14). Полученный в результате экспрессии и очистки каждого аланина мутеин оценивали на степень агрегированности и точность воспроизведения гомодимеризации, а в результате определяли остатки, которые поддаются мутагенезу без ущерба для фолдинга или биологической функции GDF15. Примеры остатков, которые поддаются аминокислотной замене, включают, но не ограничиваясь этим: N3A, N3Q, N3E, N3S, N3T, G4P, D5S, D5T, Q40A, Q40E, Q40D, Q40H, М43А, M43V, M43F, Q51A, Q51E, Q51L, Q51H, N56A, N56S, М57А, M57I, М57Т, Q60A, Q60L, N84A, N84E, N84Q, N84T, М86А, M86V, Q90A, Q90E, Q90E, Q90H, Q95A, Q95E, Q95D, Q95H, Q95T, Q95S.
В конкретных вариантах реализации изобретения модификации GDF15 были разработаны для того, чтобы рассмотреть различные нежелательные эффекты, например, дезамидирование остатка N3 и/или протеолиз остатка R2. В дополнение к этому, для того, чтобы рассмотреть дезамидирование на N3, модификации (например, замены) могут также быть осуществленными на других аспарагиновьгх остатков (например, N84) в пределах зрелого GDF15 для того, чтобы предотвратить дезамидирование.
Как обсуждается дополнительно в Примере 6, продемонстрировав, что N3 поддается мутагенезу без существенного ущерба для активности (как показано с помощью мутации N3A, описанной в данном документе), следует ожидать, что на этом сайте могут быть замещены другие аминокислоты, например, N3Q, N3E, N3T или N3S. Специалист в данной области техники знаком со способами (например, выравниванием зрелого человека GDF15 с ортологом GDF15 не принадлежащего к человеческому роду субъекта) идентификации аминокислотных остатков, которые претерпевают замену, и аминокислотных остатков, которые могут быть заменены на таковые в нативной последовательности.
В данном документе рассматриваются другие модификации полипептидов. Например, дезамидирование по N3 может создать не встречающийся в природе остаток аспартата, который может привести к изомеризации изоаспартата в связи с присутствием G4 непосредственно на С-конце по отношению к событию дезамидирования (то есть сайт Asp-Gly). Дезамидирование по N3 может быть предотвращено с помощью мутирования партнера изомеризации Gly в Pro (G4P), для того, чтобы нарушить образование пары Asp-Gly. Кроме того, дезамидирование может быть предотвращено посредством образования N-связанного гликозилированного сайта на N3 посредством мутагенеза D5, например, до D5T или D5S.
Другие варианты реализации изобретения по данному описанию предусматривают исключение дезамидирования по N3 зрелого GDF15 посредством усечения остатков на N-конце. В конкретном варианте реализации изобретения удаляют первые 3 остатка с N-конца, в дополнительном варианте реализации изобретения удаляют первые 4 остатка, в еще одном дополнительном варианте реализации изобретения удаляют первые 5 остатков, а в дополнительных вариантах реализации изобретения удаляют 6 или более остатков. Подобные усечения имеют дополнительное преимущество коррекции протеолиза по R2 (в виде остатка аргинина в положении, которое отщепляют).
Данное описание предусматривает комбинацию модификаций, описанных выше (например, усечение аминокислотных остатков на N-конце) с помощью одной или более других модификаций С-конца до третьего остатка.
В конце концов, Пример 7 описывает проектирование генетических слияний с N-концом аминокислотной последовательности зрелого GDF15 человека. Указанные конструкции содержат разработку и осуществление слияний, содержащие Fc-домены человека, домены связывания альбумина и домены связывания мальтозы (См. Фигуры 15 и 16). В каждом случае, экспрессированную конструкцию оценивали на точность воспроизведения секреции с помощью соответствующей переходной системы экспрессии и очищенной для оценки физических свойств. В случае альбумин связывающего домена (ДСА) и мальтозо связывающего домена (МСД), наблюдалось значительное повышение до максимальной растворимости, которая влияет непосредственно на определение состава этих молекул в виде фармацевтических средств (то есть, максимальная доза, которая может быть составлена). Кроме того, Фигура 16 В иллюстрирует 2-недельную эффективность (снижение массы тела) ДСА, слитой с GDF15 (ДСА-GDF15), после отдельной кратковременной дозы 3 мг/кг у мышиной ob/ob модели. РК профилирование ДСА-GDF15, которое демонстрировало время полужизни более 24 часов у ob/ob мышей, демонстрирует незначительное улучшение фармацевтических свойств GDF15.
В настоящем описании рассматривают молекулы нуклеиновой кислоты, кодирующие полипептиды, в том числе их встречающиеся в природе и не встречающиеся в природе изоформы, аллельные варианты и варианты сплайсинга. Как было указано ранее, полипептид также соответствует полипептидам, которые имеют одно или более изменений аминокислотных остатков (например, в положениях, которые не сохраняются для всех вариантов или видов), в то время как сохраняются консервативные домены и имеют такую же биологическую активность, как и встречающиеся в природе полипептиды. Настоящее описание также охватывает нуклеотидные последовательности, которые отличаются одним или более основаниями встречающейся в природе последовательности ДНК, но все еще транслирует в аминокислотную последовательность, которая соответствует полипептиду ввиду вырождения генетического кода. Например, GDF15 может соответствовать аминокислотным последовательностям, которые отличаются от встречающейся в природе последовательности на одну или более консервативных замен, меток или конъюгатов (например, полипептид).
Таким образом, в дополнение к любому встречающемуся в природе полипептиду GDF15, данное описание предусматривает такие, которые имеют 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, обычно не более 20, 10, или 5 аминокислотных замен, причем замена обычно представляет собой консервативную аминокислотную замену (например, полипептид).
С помощью "консервативной аминокислотной замены", как правило, соответствующей замене аминокислотных остатков в пределах нижеследующих групп: 1) L, I, М, V, F; 2) R, K; 3) F, Y, Н, W, R; 4) G, А, Т, S; 5) Q, N; и 6) D, Е. Консервативные аминокислотные замены сохраняют активность белка с помощью замены аминокислоты(аминокислот) в белке на аминокислоту с боковой цепью аналогичной кислотности, основности, заряда, полярности или размера боковой цепи. Правила замен, вставок или делеций могут быть основаны на выравниваниях аминокислотных последовательностей белков различных вариантов или белков различных видов.
Данное описание также рассматривает активные фрагменты (например, подпоследовательности) полипептидов, содержащие соседние аминокислотные остатки, полученные из зрелого полипептида GDF15 или мутеина GDF15. Длина соседних аминокислотных остатков пептида или полипептидной подпоследовательности изменяется в зависимости от специфической встречающейся в природе аминокислотной последовательности, из которой получают подпоследовательность. В общем, пептиды и полипептиды могут иметь от около 5 аминокислот до около 10 аминокислот, от около 10 аминокислот до около 15 аминокислот, от около 15 аминокислот до около 20 аминокислот, от около 20 аминокислот до около 25 аминокислот, от около 25 аминокислот до около 30 аминокислот, от около 30 аминокислот до около 40 аминокислот, от около 40 аминокислот до около 50 аминокислот, от около 50 аминокислот до около 75 аминокислот, от около 75 аминокислот до около 100 аминокислот или от около 100 аминокислот вплоть до полноразмерного пептида или полипептида.
Кроме того, полипептиды могут иметь определенную идентичность последовательности по сравнению со стандартной последовательностью на определенной длине соседних аминокислот (например, "окно сравнения"). Способы выравнивания последовательности для сравнения хорошо известны в данной области техники. Оптимальное выравнивание последовательности для сравнения может быть проведено, например, с помощью алгоритма локальной гомологии Smith & Waterman, Adv. Appl. Math. 2: 482 (1981), с помощью алгоритма выравнивания гомологии Needleman & Wunsch, J. Mol. Biol. 48:443 (1970), с помощью способа поиска подобия Pearson & Lipman, Proc. Nat'l. Acad. Sci. USA 85: 2444 (1988), с помощью компьютерных реализаций этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package, Madison, Wis.) или с помощью ручного выравнивания и визуального наблюдения (См., например, Current Protocols in Molecular Biology (Ausubel et al., eds. 1995 supplement)).
В качестве примера, подходящий полипептид может содержать аминокислотную последовательность, имеющую по меньшей мере около 75%, по меньшей мере около 80%, по меньшей мере около 85%, по меньшей мере около 90%, по меньшей мере около 95%, по меньшей мере около 98% или по меньшей мере около 99% идентичности аминокислотной последовательности по отношению к соседним участкам из от около 5 аминокислот до около 10 аминокислот, от около 10 аминокислот до около 12 аминокислот, от около 12 аминокислот до около 15 аминокислот, от около 15 аминокислот до около 20 аминокислот, от около 20 аминокислот до около 25 аминокислот, от около 25 аминокислот до около 30 аминокислот, от около 30 аминокислот до около 35 аминокислот, от около 35 аминокислот до около 40 аминокислот, от около 40 аминокислот до около 45 аминокислот, от около 45 аминокислот до около 50 аминокислот, от около 50 аминокислот до около 60 аминокислот, от около 60 аминокислот до около 70 аминокислот, от около 70 аминокислот до около 80 аминокислот, от около 80 аминокислот до около 90 аминокислот, от около 90 аминокислот до около 100 аминокислот или от около 100 аминокислот до 112 аминокислот или 113 аминокислот одной аминокислотной последовательности, проиллюстрированной на Фигурах 1, 3, 5, и 6.
Полипептиды могут представлять собой выделенные из природного источника (например, окружение, отличное от его встречающегося в природе окружения) и также могут быть полученными рекомбинантно (например, в генетически модифицированных клетках-хозяевах, таких как бактерии; дрожжах; Pichia; клетках насекомых; и подобном), где генетически модифицированные клетки-хозяева модифицированы с помощью нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую полипептид. Полипептиды также могут быть синтетически полученными (например, с помощью бесклеточного химического синтеза). Способы получений описаны более детально ниже.
Полипептид может быть полученным с применением рекомбинантных технологий для управления различными связанными с GDF15 нуклеиновыми кислотами, известными в данной области техники, для того, чтобы обеспечить конструкции, способные кодировать полипептид. Следует иметь в виду, что, если предлагается аминокислотная последовательность, обычному специалисту в данной области техники будет понятно, с точки зрения его образования и опыта в, например, молекулярной биологии, что такую аминокислотную последовательность кодирует множество различных молекул нуклеиновых кислот.
В. Модуляторы
Термин "модуляторы" соответствует и полипептидам, и активаторам. Как указано выше, активаторы представляют собой средства, которые, например, стимулируют, повышают, активируют, облегчают, повышают активацию, сенсибилизируют или повышающе регулируют функцию или активность одного или более полипептидов. В дополнение к этому, активаторы содержат средства, которые действуют посредством того же механизма действия, что и полипептиды (то есть средства, которые модулируют тот же сигнальный путь, что и полипептиды по способу, аналогичному таковому, что и в случае полипептидов) и способны вызывать биологический ответ, сопоставимый с (или более чем) таковым в случае полипептидов. Активатор может представлять собой, например, низкомолекулярное соединение-агонист или иную биоорганическую молекулу.
В некоторых вариантах реализации изобретения активатор представляет собой низкомолекулярное соединение-агонист. Многочисленные библиотеки низкомолекулярных соединений (например, комбинаторные библиотеки) являются коммерчески доступными и могут служить в качестве отправной точки для определения такого активатора. Специалист способен развивать один или более анализов (например, биохимические анализы или анализы на основе клеток), в котором такие библиотеки соединение могут быть подвергнуты скринингу, для того, чтобы идентифицировать одно или более соединений с желаемыми свойствами; после чего опытный химик со знанием медицины способен оптимизировать такие одно или более соединений с помощью, например, синтезирования и оценки аналогов и производных. При определении активатора также могут быть применены исследования синтеза и/или молекулярного моделирования.
В других дополнительных вариантах реализации изобретения активатор представляет собой агонистический полипептид, структурно отличимый от полипептидов, но имеющий сравнимую активность. Специалист способен определить такие полипептиды, которые имеют требуемые свойства.
Замены амидной связи
В некоторых случаях полипептид содержит одну или более связей, отличных от пептидных связей, например, по меньшей мере две смежные аминокислоты, соединенные посредством отличной от амидной связи. Например, для того, чтобы снизить или устранить нежелательный протеолиз или другие средства деградации и/или для повышения стабильности сыворотки и/или для того, чтобы ограничить или повысить конформационную гибкость, может быть замещена одна или более амидных связей в пределах остова полипептида.
В другом примере, одна или более амидных связей (-CO-NH-) в полипептиде может быть заменена связью, которая представляет собой изостеру амидной связи, такую как -CH2NH-, CH2S-, -СН2СН2-, -CH=CH-(cis и trans), -СОСН2-, -СН(ОН)СН2- или -CH2SO-. Одна или более амидных связей в полипептиде может быть также замещенной на, например, псевдопептидную связь со сниженной изостерой. См. Couder et al. (1993) Int. J. Peptide Protein Res. 41: 181-184. Подобные замены и то, как их осуществить, известны специалистам в данной области техники.
Аминокислотные замены
В полипептиде может быть осуществлена одна или более аминокислотных замен. Далее приведены неограничивающие примеры:
a) замены алкилзамещенных гидрофобных аминокислот, в том числе аланина, лейцина, изолейцина, валина, норлейцина, (S)-2-аминомасляной кислоты, (S)-циклогексилаланина или других простых альфа-аминокислот, замещенных алифатической боковой цепью из C1-С10 атомов углерода, в том числе разветвленной, циклической и неразветвленной цепи алкильных, алкенильных или алкинильных заместителей;
b) замены замещенных ароматическими фрагментами гидрофобных аминокислот, в том числе фенилаланина, триптофана, тирозина, сульфотирозина, бифенилаланина, 1-нафтилаланина, 2-нафтилаланина, 2-бензотиенилаланина, 3-бензотиенилаланина, гистидина, в том числе амино, алкиламино, диалкиламино, аза, галогенированных (фтор, хлор, бром или йод) или алкокси (от С1-С4)-замещенных форм вышеперечисленных ароматических аминокислот, иллюстративные примеры которых представляют собой: 2-, 3- или 4-аминофенилаланин, 2-, 3- или 4-хлорфенилаланин, 2-, 3- или 4-метилфенилаланин, 2-, 3- или 4-метоксифенилаланин, 5-амино-, 5-хлор-, 5-метил- или 5-метокситриптофан, 2'-, 3'- или 4'-амино-, 2'-, 3'- или 4'-хлор-, 2, 3 или 4-бифенилаланин, 2'-, 3'- или 4'-метил-, 2-, 3- или 4-бифенилаланин и 2- или 3-пиридилаланин;
c) замены аминокислот содержат основные боковые цепи, в том числе аргинин, лизин, гистидин, орнитин, 2,3-диаминопропионовую кислоту, гомоаргинин, в том числе алкил, алкенил или арил-замещенные (от C1-С10 разветвленные, линейные или циклические) производные предьщущих аминокислот, либо заместитель находится на гетероатомах (таком как альфа атом азота, дистальный атом азота или атомы азота, или на альфа атоме углерода, в про-R положении, например. Соединения, которые служат в качестве иллюстративных примеров, содержат: N-эпсилон-изопропил-лизин, 3-(4-тетрагидропиридил)-глицин, 3-(4-тетрагидропиридил)-аланин, N,N-гамма, гамма'-диэтил-гомоаргинин. Также включены соединения, такие как альфа-метил-аргинин, альфа-метил-2,3-диаминопропионовая кислота, альфа-метил-гистидин, альфа-метил-орнитин, где алкильная группа занимает про-R положение альфа атома углерода. Также включены амиды, образованные из алкил, ароматических, гетероароматических (где гетероароматическая группа имеет один или более атомов азота, кислорода или серы отдельно или в комбинации) карбоновых кислот или любого из многих хорошо известных активированных заместителей, таких как хлориды кислоты, активные сложные эфиры, активные азолиды и связанные производные) и лизина, орнитина или 2,3-диаминопропионовой кислоты;
d) замены кислых аминокислот, в том числе аспарагиновой кислоты, глютаминовой кислоты, гомоглютаминовой кислоты, тирозина, алкила, арила, арилалкила и гетероарила сульфонамидов 2,4-диаминопропионовой кислоты, орнитина или лизина и тетразол-замещенных алкил аминокислот;
e) замены боковой цепи амидного остатка, в том числе аспарагина, глутамина и алкила или замещенных ароматическими фрагментами заместителей аспарагина или глутамина; и
f) замены содержащих гидроксил аминокислот, в том числе серина, треонина, гомосерина, 2,3-диаминопропионовой кислоты и алкил или замещенных ароматическими фрагментами производных серина или треонина.
В некоторых случаях, полипептид содержит одну или более встречающиеся в природе негенетически кодированные L-аминокислоты, синтетические L-аминокислоты или D-энантиомеры аминокислоты. Например, полипептид может содержать только D-аминокислоты. Например, полипептид может содержать один или более из следующих остатков: гидроксипролина, β-аланина, о-аминобензойной кислоты, м-аминобензойной кислоты, n-аминобензойной кислоты, м-аминометилбензойной кислоты, 2,3-диаминопропионовой кислоты, α-аминоизомасляной кислоты, N-метилглицина (саркозина), орнитина, цитруллина, трет-бутилаланина, трет-бутилглицина, N-метилизолейцина, фенилглицина, циклогексилаланина, норлейцина, нафтилаланина, пиридилаланина, 3-бензотиенилаланина, 4-хлорфенилаланина, 2-фторфенилаланина, 3-фторфенилаланина, 4-фторфенилаланина, пеницилламина, 1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты, β-2-тиенилаланина, метионилсульфоксида, гомоаргинина, N-ацетиллизина, 2,4-диаминомасляной кислоты, ро-аминофенилаланина, N-метилвалина, гомоцистеина, гомосерина, ε-аминокапроновой кислоты, ω-аминокапроновой кислоты, ω-аминогептановой кислоты, ω-аминооктановой кислоты, ω-аминодекановой кислоты, ω-аминотетрадекановой кислоты, циклогексилаланина, α,γ-диаминомасляной кислоты, α,β-диаминопропионовой кислоты, δ-аминовалериановой кислоты и 2,3-диаминомасляной кислоты.
Дополнительные модификации
Остаток цистеина или аналог цистеина могут быть введены в полипептид с целью обеспечения связи с другим пептидом посредством дисульфидной связи или с целью обеспечения циклизации полипептида. Способы введения цистеина или аналог цистеина известны в данной области техники; См., например, патент США №8067532.
Полипептид может быть циклизированным. Один или более цистеин или аналоги цистеина могут быть введены в полипептид, где введенные цистеин или аналог цистеина могут образовать дисульфидную связь со вторым введенным цистеином или аналогом цистеина. Другие способы циклизации исключают введение линкера на основе оксима или линкера на основе лантионина; См., например, патент США №8044175. Может быть применена и/или введена любая комбинация аминокислот (или функциональной группы, отличной от аминокислоты), которые могут образовывать циклизированную связь. Циклизированная связь может быть получена с любой комбинацией аминокислот (или с аминокислотой и -(СН2)n-СО- или -(СН2)n-C6Н4-СО-) с функциональными группами, которые позволяют вводить мостик. Некоторые примеры представляют собой дисульфиды, миметики дисульфида, такие как -(СН2)n- "карбо" мостик, тиоацетальный, тиоэфирный мостики (цистатионин или лантионин) и мостики, содержащие сложные и простые эфиры. В этих примерах, n может представлять собой любое целое число, но часто менее десяти.
Другие модификации включают, например, N-алкильную (или арильную) замену (ψ[CONR]) или сшивание остова для образования лактамов и других циклических структур. Другие производные соединений-модуляторов по данному описанию содержат С-концевые гидроксиметильные производные, О-модифицированные производные (например, С-концевой гидроксиметилбензиловый эфир), N-концевые модифицированные производные, в том числе замещенные амиды, такие как алкиламиды и гидразиды.
В некоторых случаях, одна или более L-аминокислот в полипептиде заменены D-аминокислотой.
В некоторых случаях, полипептид представляет собой ретроинверсный аналог. Sela и Zisman (1997) FASEB J. 11: 449. Ретроинверсные аналоги пептидов представляют собой изомеры линейных полипептидов, в которых направление аминокислотной последовательности обращено (ретро), а хиральность, D- или L-, одной или более аминокислот в данном случае инвертирована (инверсо) например, с применением скорее D-аминокислот, чем L-аминокислот. См., например, Jameson et al. (1994) Nature 368: 744; и Brady et al. (1994) Nature 368: 692.
Полипептид может содержать "домен трансдукции белка" (PTD), который соответствует полипептиду, полинуклеотиду, углеводороду или органическому или неорганическому соединению, которое облегчает прохождение липидного бислоя, мицеллы, мембраны клеток, мембраны органелл или мембраны везикулы. PTD, присоединенный к другой молекуле, облегчает прохождение молекулой мембраны, например, переход из внеклеточного пространства во внутриклеточное пространство или из цитозоля в органеллу. В некоторых вариантах реализации изобретения PTD ковалентно связан с N-концом полипептида, в то время как в других вариантах реализации изобретения PTD ковалентно связан с карбоксильным концом полипептида. Иллюстративные домены трансдукции белка содержат, но не ограничиваясь этим, минимальный ундекапептидный домен трансдукции белка (соответствующий остаткам 47-57 HIV-1 ТАТ, содержащий YGRKKRRQRRR; SEQ ID NO: 177); полиаргининную последовательность, содержащую количество аргининов, достаточное для прямого входа в клетку (например, 3, 4, 5, 6, 7, 8, 9, 10, или 10-50 аргининов); домен VP22 (Zender et al. (2002) Cancer Gene Ther. 9 (6): 489-96); доментрансдукциибелка Drosophila Antennapedia (Noguchi et al. (2003) Diabetes 52(7):1732-1737); укороченный пептидкальцитонин человека (Trehin et al. (2004) Pharm. Research 21:1248-1256); полилизин (Wender et al. (2000) Proc. Natl. Acad. Sci. USA 97: 13003-13008); RRQRRTSKLMKR (SEQ ID NO: 178); Transportan GWTLNSAGYLLGKINLKALAALAKKIL (SEQ ID NO: 179); KALAWEAKLAKALAKALAKHLAKALAKALKCEA (SEQ ID NO: 180); и RQIKIWFQNRRMKWKK (SEQ ID NO: 181). Типовые PTD содержат, но не ограничиваясь этим, YGRKKRRQRRR (SEQ ID NO: 177), RKKRRQRRR (SEQ ID NO: 182); гомополимераргининаиз от 3 остатков аргинина до 50 остатков аргинина; Типовые аминокислотные последовательности домена PTD содержат, но не ограничиваясь этим, любую из следующих: YGRKKRRQRRR (SEQ ID NO: 177); RKKRRQRR (SEQ ID NO: 183); YARAAARQARA (SEQ ID NO: 184); THRLPRRRRRR (SEQ ID NO: 185); и GGRRARRRRRR (SEQ ID NO: 186).
Карбоксильная группа COR3 аминокислоты на С-конце полипептида может присутствовать в свободной форме (R3=ОН) или в форме физиологически переносимой соли щелочного или щелочноземельного металла, такой как, например, соль натрия, калия или кальция. Карбоксильная группа также может быть этерифицированной первичными, вторичными или третичными спиртами, такими как, например, метанол, разветвленные или неразветвленные C1-С6-алкильные спирты, например, этиловый спирт или трет-бутанол. Карбоксильная группа также может быть амидированной первичными или вторичными аминами, такими как аммоний, разветвленные или неразветвленные C1-С6-алкиламины или C1-С6 диалкиламины, например, метиламин или диметиламин.
Аминогруппа аминокислоты NR1R2 на N-конце полипептида может присутствовать в свободной форме (R1=Н и R2=Н) или в форме физиологически переносимой соли, такой как, например, хлорид или ацетат. Аминогруппа также может быть ацетилированной кислотами, такими, что R1=Н и R2 = ацетил, трифторацетил или адамантил. Аминогруппа может присутствовать в форме, защищенной амино-защищающими группами, обычно применяемыми в химии пептидов, такими, как, например, Fmoc, бензилоксикарбонил (Z), Boc или Alloc. Аминогруппа может быть N-алкилированной, в которой R1 и/или R2=C1-С6 алкил или С2-С8 алкенил или С7-С9 аралкил. Алкильные остатки могут быть прямоцепочечными, разветвленными или циклическими (например, этил, изопропил и циклогексил, соответственно).
Определенные модификации для повышения и/или симулирования функции GDF15
Полипептид может содержать одну или более модификаций, повышающих свойство, незначительное в случае белка, составленного для терапии (например, время полужизни сыворотки), которые делают возможным рост антител для применения в анализах обнаружения (например, метках эпитопа), которые обеспечивают легкость очистки белка, и т.д. Подобные модификации включают, но не ограничиваясь этим, в том числе пегилирование (ковалентное присоединение одной или более молекулы полиэтиленгликоля (ПЭГ) или его производных); гликозилирование (N- и О-связанный); полисиалилирование; слияние с альбумином; связывание альбумина, посредством конъюгированной цепи жирной кислоты (ацилирование); Fc-слитые белки; и слияние с миметиком ПЭГ.
Как отражено в данном документе, данное описание предусматривает слитые молекулы, содержащие зрелый полипептид GDF15 (например, зрелый GDF15 человека) или полипептид-мутеин GDF15 (например, мутеин зрелого GDF15 человека), причем зрелый полипептид GDF15 или полипептид-мутеин GDF15 содержит по меньшей мере одну модификацию, которая не изменяет его аминокислотной последовательности, и при этом модификация улучшает по меньшей мере одно физическое свойство полипептида или полипептида мутеина. В одном варианте реализации изобретения, полипептид GDF15 или модификация полипептид-мутеин GDF15 содержит конъюгацию с сывороточным альбумином (например, сывороточный альбумин человека (ЧСА), сывороточный альбумин макаки, или бычий сывороточный альбумин (БСА)). В некоторых вариантах реализации изобретения физическое свойство представляет собой растворимость.
В вариантах реализации изобретения, в которых слитая молекула содержит модифицированный полипептид GDF15 или полипептид-мутеин GDF15, любой из которых конъюгирован с альбумином, растворимость слитой молекулы является улучшенной по сравнению с неконъюгированным рекомбинантным GDF15 человека. В некоторых вариантах реализации изобретения слитая молекула имеет растворимость по меньшей мере 1 мг/мл в натрий-фосфатном буфере (PBS) при рН 7,0. В иных вариантах реализации изобретения слитая молекула имеет растворимость по меньшей мере 2 мг/мл, по меньшей мере 3 мг/мл, по меньшей мере 4 мг/мл или по меньшей мере 5 мг/мл. В иных вариантах реализации изобретения слитая молекула имеет растворимость по меньшей мере 6 мг/мл в натрий-фосфатном буфере (PBS) при рН 7,0, по меньшей мере 7 мг/мл, по меньшей мере 8 мг/мл, по меньшей мере 9 мг/мл или по меньшей мере 10 мг/мл. В конкретных вариантах реализации изобретения слитая молекула имеет растворимость более чем 10 мг/мл.
Пегилирование: Клиническая эффективность белковых терапевтических средств зачастую ограничена коротким временем полужизни в плазме и восприимчивостью к деградации протеазы. Исследования различных терапевтических белков (например, филграстима) показали, что такие трудности могут быть преодолены с помощью различных модификаций, в том числе конъюгирования или связывания полипептидной последовательности с любым из множества небелковых полимеров, например, полиэтиленгликолем (ПЭГ), полипропиленгликолем или полиоксиалкиленами (См., например, обычно посредством связующей функциональной группы, ковалентно связанной и с белком, и с небелковым полимером, например, ПЭГ). Подобные ПЭГ-конъюгированные биомолекулы, как было показано, обладают клинически полезными свойствами, в том числе улучшенной физической и тепловой стабильностью, защитой от восприимчивости к ферментной деградации, повышенной растворимостью, большим временем полужизни циркуляции in vivo и уменьшенным клиренсом, сниженной иммуногенностью и антигенностью и сниженной токсичностью.
ПЭГ, пригодные для конъюгации с полипептидной последовательности, как правило, растворимы в воде при комнатной температуре и имеют общую формулу R(O-CH2-CH2)nO-R, где R представляет собой водород или защитную группу, такую как алкильная или алканольная группы, и где n представляет собой целое число от 1 до 1000. Где R представляет собой защитную группу, которая, как правило, имеет от 1 до 8 атомов углерода. ПЭГ, конъюгированный с полипептидной последовательностью, может быть линейным или разветвленным. В настоящем описании рассматриваются разветвленные производные ПЭГ, "звездчатые ПЭГ" и многолучевые ПЭГ. Молекулярная масса ПЭГ, применяемого в данном описании, не ограничивается какой-либо конкретным диапазоном, но конкретные варианты реализации изобретения имеют молекулярную массу между 500 и 20000, в то время как другие варианты реализации изобретения имеют молекулярную массу между 4000 и 10000.
Данное описание также предусматривает композиции конъюгатов, в которых ПЭГ имеет различные величины n и, таким образом, различные отличающиеся ПЭГ присутствуют в специфических соотношениях. Например, некоторые композиции содержат смесь конъюгатов, где n=1, 2, 3 и 4. В некоторых композициях процентное содержание конъюгатов, где n=1, составляет 18-25%, процентное содержание конъюгатов, где n=2, составляет 50-66%, процентное содержание конъюгатов, где n=3, составляет 12-16%, а процентное содержание конъюгатов, где n=4, составляет вплоть до 5%. Подобные композиции может быть получен с помощью условий реакции и способов очистки, известных в данной области техники. Например, катионобменная хроматография может быть применена для разделения конъюгатов, а затем определяли фракцию, которая содержит конъюгат, имеющий, например, требуемое количество присоединенного очищенного ПЭГ, свободного от последовательностей немодифицированного белка и от конъюгатов, имеющих иные количества присоединенных ПЭГ.
ПЭГ может быть связанным с полипептидом по данному описанию посредством концевой функциональной группы ("спейсера"). Спейсер представляет собой, например, концевую функциональную группу, которая выступает посредником между свободными аминными или карбоксильными группы одной или более полипептидных последовательностей и полиэтиленгликоля. ПЭГ, имеющий спейсер, который может быть связанным со свободной аминогруппой, содержит N-гидроксисукцинилимидполиэтиленгликоль, который может представлять собой подготовленный с помощью активации сложный эфир янтарной кислоты полиэтиленгликоля с N-гидроксисукцинилимидом. Другой активированный полиэтиленгликоль, который может быть связанным со свободной аминогруппой, представляет собой 2,4-бис(O-метоксиполиэтиленгликоль)-6-хлор-с-триазин, который может быть получен с помощью взаимодействия простого монометилового эфира полиэтиленгликоля с хлорангидридом циануровой кислоты. Активированный полиэтиленгликоль, который связан со свободной карбоксильной группой, содержит полиоксиэтилендиамин.
Конъюгация одной или более полипептидных последовательностей по данному описанию с ПЭГ, имеющим спейсер, может быть выполнена с помощью различных стандартных способов. Например, реакция конъюгации может быть выполнена в растворе при рН от 5 до 10, при температуре от 4°С до комнатной температуры, в течение от 30 минут до 20 часов, используя молярное соотношение реагента к белку от 4:1 до 30:1. Условия реакции могут быть выбранными для направления реакции на получение преимущественно желаемой степени замены. В общем, низкая температура, низкий рН (например, рН=5) и короткое время реакции имеют тенденцию к снижению количества присоединенных ПЭГ, в то время как высокая температура, рН от нейтрального до высокого (например, рН≥7), и более продолжительное время реакции имеют тенденцию к повышению количества присоединенных ПЭГ. Для завершения реакции могут быть применимыми различные способы, известные в данной области техники. В некоторых вариантах реализации изобретения реакцию прекращали с помощью подкисления реакционной смеси и замораживания при, например, -20°С.
Данное описание также предусматривает применение миметиков ПЭГ. Были разработаны рекомбинантные миметики ПЭГ, которые сохраняют атрибуты ПЭГ (например, повышенное время полужизни сыворотки) и при этом обеспечивают несколько дополнительных полезных свойств. В качестве примера, простые полипептидные цепи (содержащие, например, Ala, Glu, Gly, Pro, Ser и Thr), способные образовывать развернутую конформацию, аналогичную ПЭГ, могут быть получены рекомбинантно уже слитыми с пептидным или белковым лекарственным средством, представляющим интерес (например, технология Amunix' XTEN; Маунтин-Вью, Калифорния). Это устраняет необходимость в дополнительном этапе конъюгацию во время процесса изготовления. Кроме того, было установлено, что технологии молекулярной биологии позволяют контролировать композицию боковой цепи цепей полипептида, что позволяет оптимизировать иммуногенность и производственные свойства.
Гликозилирование: Для целей настоящего изобретения, "гликозилирование" предусматривает широкое соответствие ферментативному процессу, который присоединяет гликаны к белкам, липидам или другим органическим молекулам. Применение термина "гликозилирование" в сочетании с данным описанием, как правило, означает, добавление или удаление одной или более углеводородных функциональных групп (либо с помощью удаления лежащего в основе сайта гликозилирования, либо с помощью удаления гликозилирования химическими и/или ферментными способами) и/или добавления одного или более сайтов гликозилирования, которые могут присутствовать, или могут не присутствовать в нативной последовательности. В дополнение к этому, фраза охватывает качественные изменения в гликозилировании нативных белков, в том числе изменение в природе и пропорции различных присутствующих углеводородных функциональных групп.
Гликозилирование может существенно повлиять на физические свойства белков, а также может быть важным в стабильности белка, секреции и внутриклеточной локализации. Действительно, гликозилирование связанных с GDF15 и связанных с мутеином GDF15 полипептидов, описанных в данном документе, придает выгодные улучшения их физическим свойствам. В качестве примера, но без ограничения, растворимость GDF15/мутеинов GDF15 может быть улучшена с помощью гликозилирования и подобное улучшение может быть существенным (См. Примеры). Улучшение растворимости, продемонстрированное подобными модифицированными GDF15/мутеинами GDF15 может, например, дать возможность генерирования составов, более подходящих для фармацевтического введения, чем негликозилированный GDF15/мутеины GDF15. Гликозилированные полипептиды GDF15/мутеина GDF15 также могут проявлять повышенную стабильность. Более того, полипептиды могут улучшать одно или более фармакинетических свойств, таких как время полужизни.
Правильное гликозилирование может быть существенным для биологической активности. К тому же, некоторые гены из организмов эукариотов, при условии, что являются экспрессированными бактерией (например, Е. coli), которым не хватает клеточных процессов для гликозилирования белков, производят белки, которые восстанавливаются с небольшой, или отсутствующей активностью, в силу отсутствия их гликозилирования.
Добавление сайтов гликозилирования может быть достигнуто с помощью изменения аминокислотной последовательности. Изменение в полипептиде может быть осуществлено, например, с помощью добавления, или замены на, один или более остатков серина или треонина (для О-связанных сайтов гликозилирования) или остатков аспарагина (для N-связанных сайтов гликозилирования). Структуры N-связанных и О-связанных олигосахаридов и остатков сахара, обнаруженных в каждом типе, могут быть различными. Один тип сахара, который обычно обнаружен в обоих, представляет собой N-ацетилнейраминовую кислоту (ниже упоминается как сиаловая кислота). Сиаловая кислота обычно представляет собой концевой остаток и N-связанных, и О-связанных олигосахаридов и, в силу ее отрицательного заряда, может обеспечивать кислотные свойства гликопротеина. Конкретный вариант реализации изобретения по данному описанию содержит генерирование и применение N-гликозилированных вариантов.
Полипептидные последовательности по данному описанию могут, необязательно, быть изменены посредством изменений на уровне ДНК, в частности, с помощью мутирования ДНК, кодирующей полипептид по предварительно выбранным основаниям таким образом, что полученные кодоны будут транслироваться в требуемые аминокислоты. Другие способы увеличения количества углеводородных функциональных групп на полипептиде представляют собой химическое или ферментативное соединение гликозидов с полипептидом. Удаление углеводородов может осуществляться химически или ферментативно, или с помощью замены кодонов кодирующих аминокислотных остатков, которые являются гликозилированными. Известны технологии химического дегликозилирования, а ферментативное расщепление углеводородных функциональных групп полипептидов может быть осуществлено с помощью применения разнообразных эндо- и экзогликозидаз.
Дигидрофолатредуктаза (DHFR) - для получения рекомбинантных гликопротеинов дефицитные клетки яичника китайского хомячка (СНО) представляли собой обычно применяемую клетку-хозяина. Указанные клетки не экспрессируют фермент бета-галактозид-альфа-2,6-сиалилтрансферазу и, следовательно, не добавляют сиаловую кислоту к альфа-2,6 связи с N-связанными олигосахаридами гликопротеинов, полученными в этих клетках.
Пол исиалилирование: Данное описание также предусматривает применение полисиалилирования, конъюгацию пептидов и белков с встречающейся в природе, биоразлагаемой α-(2→8)-связанной полисиаловой кислоты ("PSA"), для того, чтобы улучшить их стабильность и in vivo фармакокинетические свойства. PSA представляет собой биоразлагаемый, нетоксичный природный полимер, который является высокогидрофильным, давая ему высокую кажущуюся молекулярную массу в крови, что повышает его время полужизни в сыворотке. В дополнение к этому, полисиалилирование диапазона пептидных и белковых терапевтических свойств привело к заметно сниженному протеолизу, сохранению активности in vivo и снижению иммуногенности и антигенности (См., например, G. Gregoriadis et al., Int. J. Pharmaceutics 300 (1-2): 125-30). В качестве модификаций с другими конъюгатами (например, ПЭГ), доступны различные технологии сайт-специфического полисиалилирования (См., например, Т. Lindhout et al., PNAS 108 (18) 7397-7402 (2011)).
Слитые белки Данное описание предусматривает слитые белки зрелого GDF15 дикого типа (например, GDF15 человека), а также слитые белки полипептидов по данному описанию (например, модифицированные молекулы GDF15 человека, мутеинов GDF15 человека, модифицированных мутеинов GDF15 и подобное). Подобные слитые белки, как правило, содержат полипептид, не являющийся GDF15 (например, альбумин (например, ЧСА) или его фрагмент: ДСА; Fc-полипептид; МСД, который может упоминаться в данном документе как "партнер слияния", конъюгирован с полипептидом GDF15 дикого типа или полипептидом по данному описанию на его N-конце или С-конце. Необязательно, партнер слияния может быть конъюгированным с GDF15 дикого типа или полипептидом посредством линкерного полипептида. Линкерный полипептид может, необязательно, быть расщепляемым линкером, например, ферментативно расщепляемым линкером. Примеры партнеров слияния описаны ниже.
Слияние альбумина: Дополнительные подходящие для конъюгации компоненты и молекулы содержат альбумины, такие как сывороточный альбумин человека (ЧСА), сывороточный альбумин макаки и бычий сывороточный альбумин (БСА).
Зрелый ЧСА (См. Фигуру 1D), полипептид из 585 аминокислот (~67 кДа), имеющий время полужизни сыворотки ~20 дней, в первую очередь несет ответственность за содержание коллоидно-осмотического давления крови, рН крови, транспорт и распределение многочисленных эндогенных и экзогенных лигандов. Белок имеет три структурно гомологичные домены (домены I, II и III), почти полностью входит в альфа-спиральную конформацию и высокостабилизирован 17 дисульфидными мостиками. Три основные области связывания лекарственного средства у альбумина расположены на каждом из трех доменов в пределах суб-доменов IB, IIА и IIIA.
Синтез альбумина происходит в печени, которая получает короткоживущий, основной продукт препроальбумин. Таким образом, полноразмерный ЧСА имеет сигнальный пептид из 18 аминокислот (MKWVTFISLLFLFSSAYS; SEQ ID NO: 164) с последующим про-доменом из 6 аминокислот (RGVFRR; SEQ ID NO: 165); этот пептид из 24 аминокислотных остатков может упоминаться как пре-продомен. ЧСА может быть экспрессирован и секретирован с применением его эндогенного сигнального пептида в качестве пре-про-домена (См. Фигуру 1С). Альтернативно, ЧСА может быть экспрессирован и секретирован с применением сигнального пептида IgK (SEQ ID NO: 53), слитого со зрелой конструкцией (D25-L609; из SEQ ID NO: 5); в конструкции, применяемой для генерирования экспериментальных данных, представленных в данном документе, эндогенный сигнальный пептид заменяли на сигнальный пептид IgK человека, а эндогенный про-домен оставляли полностью. В свою очередь, пропроальбумин быстро котрансляционно расщепляется в просвете эндоплазматического ретикулума на его аминоконце для того, чтобы получить устойчивый полипептид прекурсора, проальбумина, из 609 аминокислот (См. Фигуру 1С). Проальбумин затем переходит в аппарат Гольджи, где он превращается в зрелый альбумин из 585 аминокислот с помощью фурин-зависимого амино-концевого расщепления. Если не указано иное, ссылка в данном документе на "альбумин" или на "зрелый альбумин" подразумевает под собой ссылку на ЧСА.
Первичные аминокислотные последовательности, структура и функция альбуминов являются высококонсервативными у разных видов, так же как и процессы синтеза и секреции альбумина. Белки альбумина сыворотки, сравнимые с ЧСА, обнаружены у, например, макак, коров, собак, кроликов и крыс. Бычий сывороточный альбумин (БСА) не принадлежащих человеческому роду видов является наиболее структурно подобным ЧСА. [См., например, Kosa et al, J Pharm Sci. 96 (11): 3117-24 (Nov 2007)]. Данное описание предусматривает применение альбумина не принадлежащих человеческому роду видов, в том числе, но без ограничения этим, тех, которые приведены выше, в, например, способе разработки лекарственного средства. В некоторых вариантах реализации изобретения не принадлежащий человеческому роду вид представляет собой корову. В иных вариантах реализации изобретения не принадлежащий человеческому роду вид представляет собой макаку.
В соответствии с данным описанием, альбумин может представлять собой конъюгированную с лекарственным средством молекулу (например, полипептид, описанный в данном документе) на карбоксильном конце, N-конце, и карбоксильном, и аминном концах, и между ними (См., например, USP 5876969 и USP 7056701). Более того, данное описание предусматривает слитые с альбумином белки, содержащие более чем одну гомологичные (например, несколько молекул мутеина GDF15) или гетерологичные (например, молекула мутеина GDF15 и отличающееся анти-диабетическое средство) молекулы лекарственного средства.
В конъюгатах ЧСА с молекулой лекарственного средства, рассматриваемых в настоящем описании, различные формы альбумина могут представлять собой, например, применимые в качестве предпоследовательностей секреции альбумина и их варианты, их фрагменты и варианты, и варианты ЧСА. Подобные формы, как правило, обладают одной или более желаемыми активностями альбумина. В дополнительных вариантах реализации изобретения данное описание включает слитые белки, содержащие молекулу полипептидного лекарственного средства, слитую непосредственно или опосредованно с альбумином, фрагментом альбумина и вариантом альбумина, и т.д., причем слитый белок имеет более высокую стабильность плазмы, по сравнению с неслитой молекулой лекарственного средства, и/или слитый белок сохраняет терапевтическую активность неслитой молекулы лекарственного средства. В некоторых вариантах реализации изобретения непрямое слияние осуществляют с помощью линкера, такого как пептидный линкер, или его модифицированной версией.
В конкретных вариантах реализации изобретения альбумин, вариант альбумина или фрагмент альбумина конъюгирован с полипептидом, содержащим про-домен из 167 аминокислот и зрелый домен из 112 аминокислот полипептида прекурсора GDF15 из 308 аминокислот; таким образом, данное описание предусматривает полипептид GDF15, который имеет длину от около аминокислотного остатка 30 до около аминокислотного остатка 308 последовательности, проиллюстрированной на Фигуре 1А (SEQ ID NO: 1).
Данное описание предусматривает прямую экспрессию и получение зрелого домена GDF15 из 112 аминокислот, как проиллюстрировано на Фигуре 1В, отсутствие про-домена из 167 аминокислот с применением сигнального пептида соответствующей длины обеспечивает секрецию от культуры тканей млекопитающего. Пример подходящего сигнального пептида для облегчения экспрессии и секретирования включает IgK. Как указано выше, в области техники описываются механизмы, с помощью которых другие соответствующие сигнальные пептиды могут быть идентифицированы.
В других вариантах реализации изобретения альбумин служит в качестве внутриклеточного шаперона для экспрессии молекулы лекарственного средства. Например, молекула нуклеиновой кислоты (например, вектор), кодирующая белок ЧСА, слитый с GDF15/мутеином GDF15, могут быть введены в клетку. Клеточное введение может быть осуществлено с помощью любых способов (например, трансфекции или электропорации), известных в данной области техники. Экспрессированный белок ЧСА, слитый с GDF15/мутеином GDF15, может, необязательно, быть конъюгированным посредством линкера(ов). Примеры подходящих линкеров описаны в данном документе. Некоторые варианты реализации изобретения предусматривает пептидный линкер из, например, четырех-шести аминокислот.
В вариантах реализации изобретения, в которых слитый белок содержит линкер, линкер может представлять собой нерасщепляемый линкер. Например, в одном варианте реализации изобретения данное описание предусматривает слитую молекулу, в которой аминокислотная последовательность прекурсора ЧСА слита с N-концом зрелого GDF15 человека или аминокислотной последовательности мутеина GDF15 посредством нерасщепляемого линкера 3x(4Gly-Ser) (SEQ ID NO: 64) (См., например, Фигура 1G), и в другом варианте реализации изобретения данное описание предусматривает слитую молекулу, в которой аминокислотная последовательность зрелого ЧСА слита с N-концом зрелого GDF15 человека или аминокислотной последовательности мутеина GDF15 посредством нерасщепляемого линкера 3x(4Gly-Ser) (SEQ ID NO: 64) (См., например, Фигура 1Н).
В иных вариантах реализации изобретения, в которых слитый белок содержит линкер, линкер представляет собой расщепляемый линкер. Например, описание предусматривает слитую молекулу, в которой аминокислотная последовательность прекурсора ЧСА слита с N-концом зрелого GDF15 человека или аминокислотной последовательностью мутеина GDF15 посредством протеазо-чувствительного Factor Ха-расщепляемого линкера 2x(4Gly-Ser) (SEQ ID NO: 56) (См., например, Фигура 1E). В иных вариантах реализации изобретения описание предусматривает слитую молекулу, в которой аминокислотная последовательность зрелого ЧСА слита с N-концом зрелого GDF15 человека или аминокислотной последовательности мутеина GDF15 посредством протеазо-чувствительного Factor Ха-расщепляемого линкера 2x(4Gly-Ser) (SEQ ID NO: 56) (См., например, Фигура 1F).
Конструированные молекулы ЧСА-расщепляемого линкер-зрелого рекомбинантного GDF15/мутеин GDF15, а также конструирование слитых молекул зрелого рекомбинантного GDF15/мутеин GDF15-расщепляемого линкер-ЧСА, могут быть применены для облегчения оценки, например, растворимости и определения in vivo эффективности GDF15/мутеина GDF 15. В таких вариантах реализации изобретения, GDF15/мутеин GDF 15 может представлять собой вырезанный из ЧСА посредством внутриклеточного расщепления или посредством in vitro ферментативного расщепления шаперон. В некоторых вариантах реализации изобретения вырезание осуществляли с помощью протеолитического расщепления расщепляемого линкера с применением любой жизнеспособной протеазы. В иных вариантах реализации изобретения мутеины GDF15 также могут быть получены в виде слияний не с ЧСА посредством конструирования сигнального пептида, слитого со зрелой последовательностью из 112 аминокислот, как указано на Фигуре 1В.
Внутриклеточное расщепление может быть выполнено ферментативно с помощью, например, фурина или каспазы. Клетки экспрессируют низкий уровень указанных эндогенных ферментов, способных расщеплять часть слитых молекул внутриклеточно; таким образом, некоторые из полипептидов секретированы из клетки, не будучи конъюгированными с ЧСА, в то время как некоторые из полипептидов секретированы в форме слитых молекул, содержащих ЧСА. Варианты реализации изобретения по данному описанию предусматривают применение различных конструкций слитого фурина. Например, конструкции могут быть сконструированы так, чтобы содержать последовательность RGRR (SEQ ID NO: 222), RKRKKR (SEQ ID NO: 223), RKKR (SEQ ID NO: 224) или RRRKKR (SEQ ID NO: 225). Подобные конструкции могут иметь следующую общую структуру: Igk-ЧСА(D25-L609 из SEQ ID NO: 5)-2Х(G4S)-последовательность фурина-hGDF15(А197-1308 из SEQ ID NO: 1).
Данное описание также предусматривает внеклеточное расщепление (то есть exvivo расщепление), посредством чего слитые молекулы секретировали из клетки, подвергали очистке, а затем расщепляли (например, с применением, например, протеолитического Factor Ха-чувствительного линкера или энтерокиназы). Понятно, что вырезание может отделить весь внутренний комплекс ЧСА-линкер от зрелого GDF15 или мутеина GDF15, или менее полного комплекса ЧСА-линкер.
Как упоминалось выше, слияние альбумина с одним или более полипептидами по данному описанию может, например, быть достигнуто с помощью генетической манипуляции, таким образом, что ДНК, кодирующая ЧСА или его фрагмент, присоединяется к ДНК, кодирующей одну или более полипептидных последовательностей. В дальнейшем, подходящий хозяин может быть трансформирован или трансфектирован слитыми нуклеотидными последовательностями в форме, например, подходящей плазмиды, таким образом, чтобы экспрессировать слитый полипептид. Экспрессия может быть осуществлена in vitro из, например, прокариотических или эукариотических клеток, или in vivo из, например, трансгенного организма. В некоторых вариантах реализации изобретения по данному описанию, экспрессию слитого белка осуществляли в клеточных линиях млекопитающего, например, клеточных линиях СНО. Трансформацию широко применяли в данном документе для обозначения генетического изменения клетки, получаемого в результате прямого поглощения, инкорпорирования и экспрессии экзогенного генетического материала (экзогенной ДНК) из окружающей среды и захватывания посредством клеточной мембраны(мембран). Трансформация происходит природным образом в некоторых видах бактерий, но она также может быть осуществлена с помощью синтетических способов в других клетках.
Более того, альбумин сам по себе может быть модифицирован для того, чтобы увеличить свой период полувыведения из крови. Слияние модифицированного альбумина с одним или более полипептидами может быть достигнуто с помощью технологий генной манипуляции, описанной выше, или с помощью химической конъюгацию; получаемая в результате слитая молекула имеет время полужизни, которое превышает таковое в случае слияний с немодифицированным альбумином. [См. WO 2011/051489].
Существуют общепризнанные технологические платформы для генетического слияния и химической конъюгации полипептидов (например, полипептидов, описанных в данном документе) и рекомбинантного альбумина. В качестве примера, платформа ALBUFUSE® flex (Novozymes Biopharma A/S; Дания) может быть применена для осуществления генетического слияния одного или нескольких рекомбинантных молекул альбумина с одним или несколькими полипептидами, тем самым получая соседние кДНК, кодирующие полипептид(ы) и альбумин(ы) для получения единого гомогенного белка. Платформа может быть применена с, например, дрожжами и системами экспрессии млекопитающих хозяев. В качестве еще одного примера, платформа RECOMBUMIN® Flex (Novozymes Biopharma A/S; Дания) может быть применена для осуществления химической конъюгации полипептидов по данному описанию с рекомбинантным альбумином, без какой-либо дополнительной дериватизации альбумина. Несмотря на то, что конъюгация может быть осуществлена на нескольких аминокислотных остатках (например, лизине и тирозине), свободный тиол на Cys34 представляет собой общую стратегию, ввиду специфичности сайта, что дает больше гомогенного конечного продукта.
Альтернативные стратегии связывания альбумина: Некоторые стратегии связывания альбумина были разработаны в качестве альтернатив прямого слияния, в том числе связывания альбумина посредством конъюгированной цепи жирной кислоты (ацилирования). Ввиду того, что сывороточный альбумин представляет собой транспортный белок для жирных кислот, эти природные лиганды с альбумин-связывающей активностью были применены для увеличения времени полужизни малых белковых терапевтических средств. Например, инсулин детемир (LEVEMIR), утвержденный продукт против диабета, содержит миристиловую цепь, конъюгированную с генетически-модифицированным инсулином, приводит к аналогу инсулина длительного действия.
Данное описание также предусматривает слитые белки, содержащие полипептидную последовательность домена связывания альбумина (ДСА) и последовательность одного или более полипептидов, описанных в данном документе. Любая полипептидная последовательность ДСА, описанная в данном документе или в литературе, может быть компонентом слитых белков. Компоненты слитых белков могут быть, необязательно, ковалентно связанными посредством линкера, такого как те линкеры, описанные в данном документе. В некоторых вариантах реализации изобретения по данному описанию слитые белки содержат полипептидную последовательность ДСА в качестве N-концевой функциональной группы и полипептиды, описанные в данном документе, в качестве С-концевой функциональной группы.
Данное описание также предусматривает слитые белки, содержащие фрагмент альбумин-связывающего полипептида, чей фрагмент существенно сохраняет связывание альбумина; или мультимер альбумин-связывающих полипептидов или их фрагменты, содержащие по меньшей мере два альбумин-связывающих полипептида или их фрагмента в виде мономерных звеньев.
Не желая быть связанными какой-либо теорией, предполагают, что полипептиды, описанные в данном документе, связываются с полипептидной последовательностью ДСА, тем самым изолируя полипептиды у субъекта, что приводит к повышенной продолжительности действия у субъекта.
Для общего обсуждения ДСА и связанных технологий, См. WO 2012/050923, WO 2012/050930, WO 2012/004384 и WO 2009/016043.
Слитые белки с мальтозо-связывающим белком или его фрагментами: Данное описание также предусматривает слитые белки, которые содержат мальтозо-связывающий белок (МСБ) или его фрагмент и аминокислотную последовательность одного или более полипептидов, описанных в данном документе. В некоторых вариантах реализации изобретения фрагмент МСБ содержит мальтозо-связывающий домен (МСД). Любой МСБ или его фрагмент, или полипептидная последовательность МСД, описанная в данном документе или известная в данной области техники, могут быть компонентом слитых белков по данному описанию. Компоненты слитых белков могут быть, необязательно, ковалентно связанными посредством линкера, такого как те линкеры, которые описаны в данном документе. В некоторых вариантах реализации изобретения по данному описанию, слитые белки в качестве С-концевой функциональной группы содержат МСБ или его фрагмент, или полипептидную последовательность МСД в качестве N-концевой функциональной группы и полипептиды, описанные в данном документе.
Данное описание также предусматривает слитые белки, содержащие фрагмент полипептида МСБ или МСД, чей фрагмент существенно сохраняет мальтозо-связывающую активность; или мультимер мальтозо-связывающих полипептидов или их фрагментов (например, мультимер МСД), содержащий по меньшей мере два мальтозо-связывающих полипептида или их фрагменты, в виде мономерных звеньев (например, двух или более полипептидов МСД).
Для общего обсуждения МСБ и МСД и связанных технологий, См., например, Kapust et al. (1999) Protein Sci 8 (8): 1668-74.
Слитые Fc-белки.
Данное описание также предусматривает слитые белки, которые содержат Fc-полипептид или его фрагмент, и аминокислотную последовательность одного или более полипептидов, описанных в данном документе (например, модифицированные молекулы GDF15 человека, мутеины GDF15 и модифицированные мутеины GDF15). Любая последовательность Fc-полипептида, описанная в данном документе или известная в данной области техники, может быть компонентом слитых белков по данному описанию. Компоненты слитых белков могут быть необязательно ковалентно связанными посредством линкера, такого как те линкеры, описанные в данном документе. В некоторых вариантах реализации изобретения по данному описанию, слитые белки содержат последовательность Fc-полипептида в качестве N-концевой функциональной группы и полипептиды, описанные в данном документе, в качестве С-концевой функциональной группы.
Данное описание также предусматривает партнеры слияния Fc-полипептида и слитые белки, содержащие такие, где партнер слияния Fc-полипептида модифицирован для того, чтобы быть одним партнером заряженной Fc-пары. "Партнер заряженной Fc-пары" соответствует (i) "отрицательно заряженной" Fc-последовательности (необязательно отсутствует шарнирная область) и содержит мутацию заряженной пары или (ii) "положительно заряженной" Fc-последовательности (необязательно отсутствует шарнирная область) и содержит мутацию заряженной пары. "Положительно заряженный" и "отрицательно заряженный" применяют в данном документе для удобства описания природы мутаций заряженной пары Fc-последовательностей, и не указывает на то, что, в целом, последовательность или конструкция обязательно имеет положительный или отрицательный заряд. Заряженные аминокислотные последовательности Fc, подходящие для применения в полипептидных конструкциях (например, мутеине GDF15, модифицированных мутеинах GDF15) по данному описанию, описаны в, например, WO 2013/113008.
Примеры положительно заряженной Fc ("Fc(+)") включают в себя Fc, содержащую мутацию аспарагиновой кислоты на лизин (Е356K) и мутацию глютаминовой кислоты на лизин (D399K) Fc-последовательности, за исключением шарнирной области. Примеры отрицательно заряженной Fc ("Fc(-)") включают в себя Fc, содержащую две мутации лизина на аспартат (K392D, K409D) в Fc-последовательности, за исключением шарнирной области. С-концевой лизин (K477) также может быть, необязательно, удален. При условии, что слитый белок Fс(+)полипептид (например, слитый белок Fс(+)мутеин GDF) и слитый белок Fс(-)полипептид (например, слитый белок мутеина Fc(-)GDF) мутеина GDF инкубируют вместе, остатки аспартата связываются с остатками лизина посредством электростатической силы, облегчая образование Fc-гетеродимеров между Fc(+) и Fc(-) последовательностями слитых белков полипептида.
Данное описание также предусматривает конструкции, обозначенные "геми" или "гемиFс" конструкциями, которые содержат две Fc-последовательности, присоединенные последовательно одна за другой с линкером, который соединяет N-конец первой Fc-последовательности с С-концом второй Fc-последовательности. В некоторых вариантах реализации изобретения мономер содержит полипептидную (например, зрелый модифицированный GDF15 или мутеин GDF15) последовательность, связанную с первой Fc-последовательностью с помощью первого линкера, который связывает N-конец последовательности GDF15 с С-концом первой Fc-последовательности, причем первая Fc-последовательность связана со второй Fc-последовательностью с помощью второго линкера, который связывает N-конец первой Fc-последовательности с С-концом второй Fc-последовательности. Первая и вторая Fc-последовательности также связаны с помощью шарнирной области Fc. Два таких мономера ассоциированы с образованием димера, в котором мономеры являются связанными посредством межцепочечной дисульфидной связи между двумя полипептидными последовательностями. Для примеров гемиFc-полипептидов, подходящих для применения с мутеинами GDF по данному описанию, См. WO 2013/113008.
Данное описание также предусматривает, что слитые белки имеют мультимер Fc-полипептидов или их фрагменты, в том числе партнер заряженной Fc-пары (например, мультимер Fc).
Конъюгация с другими молекулами: Дополнительные подходящие компоненты и молекулы для конъюгации содержат, например, тиреоглобулин; столбнячный анатоксин; дифтерийный анатоксин; полиаминокислоты, такие как поли(D-лизин : D-глютаминовая кислота); полипептиды VP6 ротавирусов; гемаглутинин вируса гриппа, нуклеопротеин вируса гриппа; гемоцианин лимфы улитки (KLH); и коровый белок вируса гепатита В и поверхностный антиген; или любую комбинацию вышеперечисленного.
Таким образом, данное описание предусматривает конъюгацию одного или более дополнительных компонентов или молекул на N- и/или С-конце полипептидной последовательности, такой как другой белок (например, белок, имеющий аминокислотную последовательность, гетерологичную белку субъекта) или молекулу носителя. Таким образом, иллюстративная полипептидная последовательность может быть предложена в виде конъюгата с другим компонентом или молекулой.
Сопряженная модификация может привести к полипептидной последовательности, которая сохраняет активность с дополнительной или комплементарной функцией или активностью второй молекулы. Например, полипептидная последовательность может быть конъюгированной с молекулой, например, для того, чтобы увеличить растворимость, хранение, срок годности in vivo или стабильности при хранении, снижение иммуногенности, отсроченное или контролируемое высвобождение in vivo и т.д. Другие функции или активности включают конъюгат, который снижает токсичность, по сравнению с неконъюгированной полипептидной последовательностью, конъюгат, который направлен на тип клетки или орган, более эффективный, чем неконъюгированная полипептидная последовательность или лекарственное средство, для того, чтобы дополнительно противостоять причинам или эффектам, связанным с расстройством или заболеванием, как изложено в данном документе (например, диабет).
Полипептид может также быть конъюгирован с большими, медленно поддающимися метаболизму макромолекулами, такими как белки; полисахариды, такие как сефароза, агароза, целлюлоза, целлюлозные волокна; полимерные аминокислоты, такие как полиглютаминовая кислота, полилизин; аминокислотные сополимеры; инактивированные вирусные частицы; инактивированные бактериальные токсины, такие как анатоксин дифтерии, столбняка, холеры, молекулы лейкотоксин; инактивированные бактерии; и дендритные клетки. Подобные конъюгированные формы, при желании, могут быть применены для получения антител против полипептида по данному описанию.
Дополнительные возможные компоненты и молекулы для конъюгацию содержат те, которые подходят для изоляции или очистки. Конкретные неограничивающие примеры включают связывание молекулы, такие как биотин (пара специфического связывания биотин-авидин), антитело, рецептор, лиганд, лектин или молекулы, которые содержат твердую подложку, в том числе, например, пластиковые или полистирольные волокна, пластины или шарики, магнитные шарики, тест-полоски и мембраны.
Способы очистки, такие как катионобменная хроматография, могут быть применены для разделения конъюгатов с помощью разницы в заряде, которая эффективно разделяет конъюгаты по их различным молекулярным массам. Например, катионобменная колонка может быть загружена, а затем промыта с помощью ~20 мМ ацетата натрия, рН ~4, а затем элюирована с помощью линейного градиента (от 0 М до 0,5 М) NaCl, забуференного при рН от около 3 до 5,5, например, при рН ~4,5. Содержание фракций, полученных с помощью катионобменной хроматографии, может быть определено с помощью молекулярной массы с применением обычных способов, например, масс-спектроскопии, SDS-PAGE или других известных способов разделения молекулярных частиц в соответствии с их молекулярной массой.
Слитые с Fc молекулы: В некоторых вариантах реализации изобретения амино- или карбоксильный конец полипептидной последовательности по данному описанию может быть слитым с Fc-областью иммуноглобулина (например, Fc человека) для образования слитого конъюгата (или слитой молекулы). Слитые с Fc конъюгаты, как было показано, повышают системное время полужизни биофармацевтических препаратов, и, таким образом, биофармацевтический продукт может требовать менее частое введение.
Fc связывается с неонатальным Fc-рецептором (FcRn) в эндотелиальных клетках, выстилающих кровеносные сосуды, и, при связывании, слитая с Fc молекула защищена от деградации и высвобождения заново в обращение, сохраняя молекула в обращении дольше. Указанное связывание Fc, как считают, представляет собой механизм, с помощью которого эндогенный IgG сохраняет свое длинное время полужизни в плазме. Более поздняя технология Fc-слияния связывает отдельную копию биофармацевтического средства с Fc-областью антитела для оптимизации фармакокинетических и фармакодинамических свойств биофармацевтического средства, по сравнению с традиционными Fc-слитыми конъюгатами.
Другие модификации: Данное описание предусматривает применение других модификаций полипептидов, в настоящее время известных или разработанных в будущем, для того, чтобы улучшить одно или более свойств. Один подобный способ продления циркуляционного времени полужизни, увеличивающий стабильность, уменьшающий клиренс или изменяющий иммуногенность или аллергенность полипептида по данному описанию, включает модификацию полипептидных последовательностей с помощью конъюгации с гидроксиэтилкрахмалом, который применяет производные гидроксиэтилкрахмала, связанные с другими молекулами, для того, чтобы изменить характеристики молекул. Различные аспекты конъюгации с гидроксиэтилкрахмалом описаны в, например, заявках на патент США №№2007/0134197 и 2006/0258607.
Данное описание также предусматривает слитые молекулы, содержащие SUMO в виде слитой метки (LifeSensors, Inc.; Малверн, Пенсильвания). Слияние полипептида, описанного в данном документе, с SUMO может передать несколько благоприятных влияний на полипептид, в том числе повышение экспрессии, улучшение растворимость и/или помощь в развитии способов очистки. Протеазы SUMO распознают четвертичную структуру SUMO и расщепляют слитый белок на С-конце SUMO, таким образом, высвобождая полипептид, описанный в данном документе, с желательной N-концевой аминокислотой.
Линкеры: Линкеры и их применение были описаны выше. Любой из вышеуказанных компонентов и молекул, применяемых для изменения полипептидных последовательностей по данному описанию, может, необязательно, быть конъюгированным посредством линкера. Подходящие линкеры содержат "гибкие линкеры", которые, как правило, имеют длину, достаточную для того, чтобы сделать возможным некоторое движение между модифицированными полипептидными последовательностями и связанными компонентами и молекулами. Линкерные молекулы имеют, как правило, около 6-50 атомов в длину. Линкерные молекулы могут также представлять собой, например, арилацетилен, олигомеры этиленгликоля, содержащие 2-10 мономерных звеньев, диамины, дикислоты, аминокислоты или их комбинации. Подходящие линкеры могут быть легко выбраны и могут иметь любую подходящую длину, например, 1 (например, Gly), 2, 3, 4, 5, 6, 7, 8, 9, 10, 10-20, 20-30, 30-50 аминокислот (например, Gly).
Иллюстративные гибкие линкеры содержат полимеры глицина (G)n, полимеры глицина-серина (например, (GS)n, GSGGSn и GGGSn, где n равен целому числу, по меньшей мере единице), полимеры глицина-аланина, полимеры аланина-серина и другие гибкие линкеры. Полимеры глицина и глицина-серина являются относительно неструктурированными и поэтому могут служить в качестве нейтральной связки между компонентами. Иллюстративные гибкие линкеры содержат, но не ограничиваясь этим, GGSG (SEQ ID NO: 226), GGSGG (SEQ ID NO: 227), GSGSG (SEQ ID NO: 228), GSGGG (SEQ ID NO: 229), GGGSG (SEQ ID NO: 230) и GSSSG (SEQ ID NO: 231).
В некоторых случаях, линкер представляет собой расщепляемый линкер, например, ферментативно расщепляемый линкер. В других случаях, линкер представляет собой нерасщепляемый линкер, например, линкер, которые не расщепляется ферментами при нормальном физиологическом состоянии in vivo.
Примеры подходящих линкеров содержат, например, (GGGGS)n, где n представляет собой целое число от 1 до около 10 (SEQ ID NO: 187) (например, n=3); GGGSGGGSIEGR (SEQ ID NO: 188); GGGGG (SEQ ID NO: 189); (EGGGS)n, где n представляет собой целое число от 1 до около 10 (SEQ ID NO: 190) (например, n=3).
Например, протеолитически расщепляемый кросслинкер может быть сайтом расщепления матричной металлопротеиназой, например, сайт расщепления в случае ММР выбран из коллагеназы-1, -2 и -3 (ММР-1, -8 и -13), гелатиназы А и В (ММР-2 и -9), стромелизина 1, 2 и 3 (ММР-3, -10 и -11), матрилизина (ММР-7) и металлопротеиназы мембраны (МТ1-ММР и МТ2-ММР). Например, последовательность расщепления ММР-9 представляет собой Pro-X-X-Ну (где, X представляет собой произвольный остаток; Ну, гидрофобный остаток) (SEQ ID NO: 191), например, Pro-X-X-Hy-(Ser/Thr) (SEQ ID NO: 192), например, Pro-Leu/Gln-Gly-Met-Thr-Ser (SEQ ID NO: 193) или Pro-Leu/Gln-Gly-Met-Thr (SEQ ID NO: 194). Другой пример сайта расщепления протеазой представляет собой сайт расщепления активатора плазминогена, например, uРА или сайт расщепления тканевого активатора плазминогена (tPA). Специфические примеры последовательностей расщепления uРА и tPA содержат последовательности, содержащие Val-Gly-Arg. Другой пример представляет собой сайт расщепления тромбина, например, CGLVPAGSGP (SEQ ID NO: 195). Дополнительные подходящие линкеры, содержащие сайты расщепления протеазой, содержат линкеры, содержащие одну или более из следующих аминокислотных последовательностей: 1) SLLKSRMVPNFN (SEQ ID NO: 196) или SLLIARRMPNFN (SEQ ID NO: 197), расщепляемые катепсином В; SKLVQASASGVN (SEQ ID NO: 198) или SSYLKASDAPDN (SEQ ID NO: 199), расщепляемые протеазой вируса Эпштейна-Барра; RPKPQQFFGLMN (SEQ ID NO: 200), расщепляемую ММР-3 (стромелизином); SLRPLALWRSFN (SEQ ID NO: 201), расщепляемую ММР-7 (матрилизином); SPQGIAGQRNFN (SEQ ID NO: 202), расщепляемую ММР-9; DVDERDVRGFASFL (SEQ ID NO: 203), расщепляемую термолизин-подобным ММР; SLPLGLWAPNFN (SEQ ID NO: 204), расщепляемую матричной металлопротеиназой 2(ММР-2); SLLIFRSWANFN (SEQ ID NO: 205), расщепляемую катепсином L; SGVVIATVIVIT (SEQ ID NO: 206), расщепляемую катепсином D; SLGPQGIWGQFN (SEQ ID NO: 207), расщепляемую матричной металлопротеиназой 1 (MMP-1); KKSPGRVVGGSV (SEQ ID NO: 208), расщепляемую активатором плазминогена урокиназного типа; PQGLLGAPGILG (SEQ ID NO: 209), расщепляемую матричной металлопротеиназой мембранного типа 1 (МТ-ММР); HGПЭГLRVGFYESDVMGRGHARLVHVEEPHT (SEQ ID NO: 210), расщепляемую стромелизином 3 (или ММР-11), термолизином, коллагеназой фибробласта и стромелизином-1; GPQGLAGQRGIV (SEQ ID NO: 211), расщепляемую матричной металлопротеиназой 13 (коллагеназой-3); GGSGQRGRKALE (SEQ ID NO: 212), расщепляемую тканевым активатором плазминогена (tPA); SLSALLSSDIFN (SEQ ID NO: 213), расщепляемую специфическим антигеном простаты человека; SLPRFKIIGGFN (SEQ ID NO: 214), расщепляемую калликреином (hK3); SLLGIAVPGNFN (SEQ ID NO: 215), расщепляемую нейтрофил-эластазой; и FFKNIVTPRTPP (SEQ ID NO: 216), расщепляемую кальпаином (кальций-активируемой нейтральной протеиназой).
Способы получения полипептидов
Полипептид по данному описанию может быть получен с помощью любого подходящего способа, в том числе рекомбинантных и нерекомбинантных способов (например, химического синтеза).
Химический синтез
Если полипептид синтезирован химически, синтез может происходить жидкофазным или твердофазным способом. Твердофазный синтез пептидов (SPPS) позволяет осуществлять инкорпорирование модификации остова не встречающихся в природе аминокислот и/или пептида/белка. Различные формы SPPS, такие как Fmoc и Boc, являются доступными для синтеза полипептидов по данному описанию. Детали химического синтеза известны в данной области техники (например, Ganesan А. 2006 Mini Rev. Med. Chem. 6: 3-10; и Camarero J.A. et al., 2005 Protein Pept Lett. 12: 723-8).
Твердофазный синтез белков может быть осуществлен таким образом, как описано ниже, α функции (Nα) и любые реакционноспособные боковые цепи являются защищенными кислотно-лабильной или осново-лабильной группами. Защитные группы являются стабильными при условиях для связывания амидных связей, но могут быть легко расщепляемыми без ущерба для пептидной цепи, которая формируется. Подходящие защитные группы для α-амино функциональной группы содержат, но не ограничиваясь этим, следующие: трет-бутилоксикарбонил (Boc), бензилоксикарбонил (Z), о-хлорбензилоксикарбонил, би-фенилизопропилоксикарбонил, трет-амилоксикарбонил (Amoc), α,α-диметил-3,5-диметокси-бензилоксикарбонил, о-нитросульфенил, 2-циано-трет-бутокси-карбонил, 9-флуоренилметоксикарбонил (Fmoc), 1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил (Dde) и подобное.
Подходящие защитные группы боковой цепи содержат, но не ограничиваясь этим: ацетил, аллил (Аll), аллилоксикарбонил (Alloc), бензил (Bzl), бензилоксикарбонил (Z), трет-бутилоксикарбонил (Boc), бензилоксиметил (Bom), о-бромбензилоксикарбонил, трет-бутил (tBu), трет-бутилдиметилсилил, 2-хлорбензил, 2-хлорбензилоксикарбонил (2-CIZ), 2,6-дихлорбензил, циклогексил, циклопентил, 1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил (Dde), изопропил, 4-метокси-2,3-6-триметилбензилсульфонил (Mtr), 2,3,5,7,8-пентаметилхроман-6-сульфонил (Pmc), пивалил, тетрагидропиран-2-ил, тозил (Tos), 2,4,6-триметоксибензил, триметилсилил и тритил (Trt).
В твердофазном синтезе С-концевая аминокислота соединена с подходящим материалом подложки. Подходящие материалы подложки являются инертными по отношению к реагентам и условиям реакции в случае ступенчатой конденсации и реакций расщепления способа синтеза и не растворяются в применяемой реакционной среде. Примеры коммерчески доступных материалов подложки включают сополимеры стирола/дивинилбензола, которые были модифицированы реакционно-способными группами и/или полиэтиленгликолем; хлорметилированные сополимеры стирола/дивинилбензола; гидроксиметилированные или аминометилированные сополимеры стирола/дивинилбензола и подобное. Полистирол (1%)-дивинилбензол или TentaGel®, дериватизированный с 4-бензилоксибензиловым спиртом (якорь Вэнга) или 2-хлортритилхлоридом, может быть применен при условии, что он предназначен для получения пептидной кислоты. В случае амида пептида, могут быть применены полистирол (1%) дивинилбензол или TentaGel®, дериватизированный с 5-(4'-аминометил)-3',5'-диметоксифенокси)валериановой кислотой (PAL-якорь) или n-(2,4-диметоксифенил-амино метил)-феноксильной группой (амидный якорь Ринка).
Связь с полимерной подложкой может быть образована с помощью приведения в контакт С-концевой Fmoc-защищенной аминокислоты с материалом подложки с добавлением активирующего реагента в этаноле, ацетонитриле, N,N-диметилформамиде (DMF), дихлорметане, тетрагидрофуране, N-метилпирролидоне или подобных растворяющих веществ при комнатной температуре или повышенных температурах (например, между 40°С и 60°С) и временем реакции, например, от 2 до 72 часа.
Соединение Nα-защищенной аминокислота (например, Fmoc аминокислоты) с якорем PAL, Вэнга или Ринка может, например, быть выполнено с помощью связывающих реагентов, таких как N,N'-дициклогексилкарбодиимид (DCC), N,N'-диизопропилкарбодиимид (DIC) или другие карбодиимиды, тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (TBTU) или другие урониевые соли, о-ацилмочевина, гексафторфосфат бензотриазол-1-ил-трис-пирролидино-фосфония (РуВОР) или другие соли фосфония, N-гидроксисукцинимиды, другие N-гидроксиимиды или оксимы в присутствие или в отсутствие 1-гидроксибензотриазола или 1-гидрокси-7-азабензотриазола, например, с помощью TBTU с добавлением HOBt, с или без добавления основания, такого как, например, диизопропилэтиламин (DIEA), триэтиламин или N-метилморфолин, например, диизопропилэтиламин с временем реакции от 2 до 72 часа (например, 3 часа с 1,5-3-кратным избытком аминокислоты и связывающих реагентов, например, с 2-кратным избытком и при температурах между около 10°С и 50°С, например, 25°С в растворяющем веществе, таком как диметилформамид, N-метилпирролидон или дихлорметан, например, диметилформамид).
Вместо связывающих реагентов, возможно также применять активные сложные эфиры (например, пентафторфенил, n-нитрофенил или подобное), симметричный ангидрид Nα-Fmoc-аминокислоты, его кислый хлорангидрид или кислый фторид в условиях, описанных выше.
Nα-защищенная аминокислота (например, Fmoc аминокислота) может быть связана с 2-хлортритиловой смолой в дихлорметане с добавлением DIEA со временем реакции от 10 до 120 минут, например, 20 минут, но без ограничения применением указанного растворяющего вещества и указанного основания.
Последовательное связывание защищенных аминокислот может быть выполнено в соответствии с обычными способами пептидного синтеза, как правило, в автоматическом синтезаторе белков. После расщепления Nα-Fmoc защитной группы связанной аминокислоты в твердой фазе с помощью обработки, например, пиперидином (10%-50%) в диметилформамиде в течение от 5 до 20 минут, например, 2×2 минут с 50% пиперидином в DMF и 1×15 минут с 20% пиперидином в DMF, следующей защищенной аминокислотой с 3-10-кратным избытком, например, с 10-кратным избытком, соединяли с предыдущей аминокислотой в инертном, безводном, полярном растворяющем веществе, таком как дихлорметан, DMF или смеси их обоих и при температурах между около 10°С и 50°С, например, при 25°С. Ранее упомянутые реагенты для связывания первой Nα-Fmoc аминокислоты с якорем PAL, Вэнга или Ринка являются подходящими в качестве связывающих реагентов. В качестве альтернативы также могут быть применены активные сложные эфиры защищенной аминокислоты, хлориды, фториды или их симметричные ангидриды.
В конце твердофазного синтеза, пептид отщепляется от материала подложки с одновременным отщеплением защитных групп боковой цепи. Расщепление может быть выполнено с помощью трифторуксусной кислоты или другой сильнокислой среды с добавлением 5%-20% об./об. поглотителей, таких как диметилсульфид, этилметилсульфид, тиоанизол, тиокрезол, м-крезол, этандитиол анизола, фенол или вода, например, 15% об./об. диметилсульфида/этандитиола/м-крезола 1:1:1, в пределах от 0,5 до 3 часа, например, 2 часа. Пептиды с полностью защищенной боковыми цепями получают с помощью расщепления 2-хлортритилового якоря ледяной уксусной кислотой/трифторэтанолом/дихлорметаном 2:2:6. Защищенной пептид может быть очищен с помощью хроматографии на силикагеле. При условии, что пептид связан с твердой фазой посредством якоря Вэнга и если он предназначен для получения пептида с С-концевым алкиламидированием, расщепление может быть выполнено с помощью аминолиза с помощью алкиламина или фторалкиламина. Аминолиз осуществляют при температурах между около -10°С и 50°С (например, около 25°С) и временем реакции между около 12 и 24 часов (например, около 18 часов). В дополнение к этому, пептид может быть отщеплен с подложки с помощью переэтерификации, например, с метанолом.
Получаемый кислый раствор может быть примешан с 3-20-кратным количеством холодного эфира или н-гексана, например, 10-кратным избытком диэтилового эфира, для того, чтобы осадить пептид и, следовательно, для разделения поглотителей и расщепленных защитных групп, которые остаются в эфире. Дополнительная очистка может быть выполнена с помощью повторного осаждения пептида несколько раз из ледяной уксусной кислоты. Получаемый осадок может быть собран в воде или трет-бутаноле или смеси двух растворяющих веществ, например, смеси 1:1 трет-бутанола/воды и подвергнут сублимационной сушке.
Полученный пептид может быть очищен с помощью различных хроматографических способов, в том числе ионного обмена на слабоосновной смоле в форме ацетата; хроматографии с помощью гидрофобной адсорбции на недериватизированных полисополимерах стирола/дивинилбензола (например, Amberlite® XAD); адсорбционной хроматографии на силикагеле; ионобменной хроматографии, например, на карбоксиметилцеллюлозе; распределительной хроматографии, например, на Sephadex® G-25; хроматографии на основе противоточного распределения; или жидкостной хроматографии высокого давления (ВЭЖХ) например, обращенно-фазовой ВЭЖХ на фазах октила или октадецилсиликагела (ODS).
Рекомбинантное получение
Если полипептид получают с применением рекомбинантных технологий, полипептид может быть получен в качестве внутриклеточного белка или в качестве секретированного белка, с применением любой подходящей конструкции и любой подходящей клетки-хозяина, которая может быть прокариотической или эукариотической клеткой, такой как бактериальная (например, E. coli) или дрожжевая клетка-хозяин, соответственно. Другие примеры эукариотических клеток, которые могут быть применимы в качестве клеток-хозяев, в том числе клеток насекомых, клеток млекопитающих и/или растительных клеток. Если применяют клетки-хозяева млекопитающего, они могут включать клетки человека (например, HeLa, 293, Н9 и клетки Jurkat); клетки мыши (например, NIH3T3, L клетки, и клетки С127); клетки примата (например, Cos 1, Cos 7 и CV1) и клетки хомячка (например, клетки яичника китайского хомячка (СНО)).
Множество систем вектор-хозяин, подходящих для экспрессии полипептида, может быть применено в соответствии со стандартными процедурами, известными в данной области техники. См., например, Sambrook et al., 1989 Current Protocols in Molecular Biology Cold Spring Harbor Press, New York; и Ausubel et al. 1995 Current Protocols in Molecular Biology, Eds. Wiley and Sons. Способы для введения генетического материала в клетки-хозяева включают, например, преобразование, электропорацию, конъюгацию, способы на основе фосфата кальция и подобное. Способ передачи может быть выбран, таким образом, с целью обеспечения стабильной экспрессии введенной полипептид-кодирующей нуклеиновой кислоты. Полипептид-кодирующая нуклеиновая кислота может быть предложена в виде наследуемого эписомного элемента (например, плазмиды) или может быть геномно интегрированной. Множество подходящих векторов для применения при получении полипептида, представляющего интерес, являются коммерчески доступными.
Векторы могут обеспечивать экстрахромосомальную стабилизацию в клетке-хозяине или могут обеспечивать интеграцию в геном клетки-хозяина. Вектор экспрессии обеспечивает последовательности регулирования транскрипции и трансляции и может обеспечить индуцируемую или конститутивную экспрессию, при которой кодирование область является функционально-связанным под контролем области инициации транскрипции и области терминации транскрипции и трансляции. В общем, последовательности регулирования транскрипции и трансляции могут содержать, но не ограничиваясь этим, промотор последовательности, рибосомальные сайты связывания, последовательности начала и конца транскрипции, последовательности начала и конца трансляции и активаторные и энхансерные последовательности. Промоутеры могут быть либо конститутивными, либо индуцируемыми, и могут быть сильным конститутивным промотором (например, Т7).
Экспрессирующие конструкции, как правило, имеют удобные сайты рестрикции, расположенные рядом с промоторной последовательности, для обеспечения вставок нуклеотидных последовательностей, кодирующих белки, представляющие интерес. Селективный маркер, действующий при экспрессии хозяина, может присутствовать для облегчения выбора клеток, содержащих вектор. Более того, экспрессирующая конструкция может содержать дополнительные элементы. Например, вектор экспрессии может иметь одну или две системы репликации, таким образом, позволяя ему поддерживаться в организме, например, в клетках млекопитающего или насекомого в случае экспрессии и в прокариотическом хозяине в случае клонирования и амплификации. В дополнение к этому, экспрессирующая конструкция может содержать селективный маркерный ген, чтобы сделать возможным выбор трансформированных клеток-хозяев. Выбираемые гены хорошо известны в данной области техники и будут изменяться в зависимости от применяемой клетки-хозяина.
Выделение и очистка белка могут быть осуществлены в соответствии со способами, известными в данной области техники. Например, белок может быть выделен из лизата клеток, которые являются генетически модифицированными, для того, чтобы экспрессировать белок конститутивно и/или при индукции, или из синтетической реакционной смеси с помощью иммуноаффинной очистки, которая, как правило, включает приведение в контакт образца с антибелковым антителом, промывание, для того, чтобы удалить неспецифически связанный материал, и элюирование специфически связанного белка. Выделенный белок может быть дополнительно очищен с помощью диализа и других способов, обычно применяемых в способах очистки белка. В одном варианте реализации изобретения белок может быть выделен с применением способов металл-хелатной хроматографии. Для облегчения выделения белки могут содержать модификации.
Полипептиды могут быть получены главным образом в чистой или изолированной форме (например, форме, свободной от других полипептидов). Полипептиды могут присутствовать в композиции, обогащенной полипептидом, по сравнению с другими компонентами, которые могут присутствовать (например, другие полипептиды или другие компоненты клетки-хазяина). Например, очищенный полипептид может быть предложен таким образом, что полипептид присутствует в композиции, которая по существу не содержит другие экспрессированные белки, например, менее чем 90%, менее чем 60%, менее чем 50%, менее чем 40%, менее чем 30%, менее чем 20%, менее чем 10%, менее чем 5% или менее чем 1% композиции состоит из других экспрессированных белков.
Антитела
В данном описании предложены антитела, в том числе выделенные антитела, которые специфически связывают полипептид GDF15, например, мутеин GDF15 по данному описанию. Термин "антитело" охватывает интактные моноклональные антитела, поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела), образованные из по меньшей мере двух интактных антител, и связывающие антитело фрагменты, в том числе Fab и F(ab)'2, при условии, что они проявляют требуемую биологическую активность. Основное структурное звено нормального антитела содержит тетрамер, а каждый тетрамер состоит из двух идентичных пар полипептида цепи, каждая пара имеет одну "легкую" цепь (около 25 кДа) и одну "тяжелую" цепь (около 50-70 кДа). Амино-концевая часть каждой цепи содержит вариабельную область из от около 100 до 110 или более аминокислот, в первую очередь, отвечающую за распознавание антигена. В противоположность этому, карбокси-концевая часть каждой цепи определяет константную область, ответственную, прежде всего, за эффекторную функцию. Легкие цепи человека классифицированы как каппа и лямбда, в то время как тяжелые цепи человека классифицированы как мю, дельта, гамма, альфа или эпсилон и определен изотип антител, таких как IgM, IgD, IgG, IgA, и IgE, соответственно. Связывающие фрагменты получены с помощью рекомбинантных технологий ДНК или с помощью ферментативного или химического расщепления интактных антител. Связывающие фрагменты содержат Fab, Fab', F(ab')2, Fv и одноцепочечные антитела.
Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH) с последующим рядом константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на его другом конце; константный домен легкой цепи выровнен с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи выровнен с вариабельным доменом тяжелой цепи. В пределах легких и тяжелых цепей, вариабельные и константные области присоединены с помощью области "J" из около 12 или более аминокислот с тяжелой цепью, также, в том числе, областью "D", из около 10 или более аминокислот. Все цепи антитела демонстрируют одинаковую общую структуру относительно консервативных каркасных областей (FR), соединенных тремя гипер-вариабельными областями, также называемыми "определяющими комплементарность областями" или "CDR". CDR двух цепей каждой пары выровнены с помощью каркасных областей, которые делают возможным связывание со специфическим эпитопом. От N-концевой до С-концевой, и легкие, и тяжелые цепи содержат домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4.
Интактное антитело имеет два сайта связывания и, за исключением бифункциональных или биспецифических антител, два сайты связывания являются одинаковыми. Биспецифическое или бифункциональное антитело представляет собой искусственное гибридное антитело, имеющее две различные пары тяжелая/легкая цепь и два различных сайта связывания. Биспецифическое антитело может быть получено с помощью различных способов, в том числе слиянием гибридом или связыванием фрагментов Fab'.
Как приведено выше, связывающие фрагменты могут быть получены с помощью ферментативного или химического расщепления интактных антител. Расщепление антител с помощью фермента папаина приводит к двум идентичным антиген-связывающим фрагментам, также известным как фрагменты "Fab" и фрагмент "Fc", не имеющий антиген-связывающей активности. Расщепление антител с помощью фермента пепсина приводит к фрагменту F(ab')2, в котором две плеча молекулы антитела остаются связанными и содержат связывающие два антигена сайты. Фрагмент F(ab')2 обладает способностью сшивать антиген.
Как применяют в данном документе, термин "Fab" соответствует фрагменту антитела, который содержит константный домен легкой цепи и домен СН1 тяжелой цепи.
При применении в данном документе, термин "Fv" соответствует минимальному фрагменту антитела, который сохраняет как сайты распознавания антигена, так и сайты связывания антигена. В двухцепочечных видах Fv, указанная область содержит димер одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи с нековалентной ассоциацией. В одноцепочечных видах Fv, один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи могут быть ковалентно связанными с помощью гибкого пептидного линкера, таким образом, что легкая и тяжелая цепи могут связываться в "димерную" структуру, аналогичную таковой в двухцепочечных видах Fv. Именно в указанной конфигурации три CDR другого вариабельного домена взаимодействуют для того, чтобы определить антиген-связывающий сайт на поверхности димера VH-VL. В то время как шесть CDR, коллективно обеспечивают антиген-связывающую специфичность к антителу, даже один вариабельный домен (или половина Fv, содержащего только три CDR, специфических к антигену) обладает способностью распознавать и связывать антиген.
При применении в данном документе, термин "определяющие комплементарность области" или "CDRs" соответствует частям иммунологических рецепторов, которые осуществляют контакт со специфическим лигандом и определяют его специфичность.
Термин "гипервариабельная область" соответствует аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельная область, как правило, содержит аминокислотные остатки из CDR и/или такие остатки из "гипервариабельной петли".
Как применяют в данном документе, термин "эпитоп" соответствует сайтам связывания с антителами на белковых антигенах. Эпитопные сайты связывания, как правило, содержат химически активные поверхностные группирования молекул, таких как аминокислоты или боковые цепи сахара, а также специфические трехмерные характеристики структуры и заряда. Антитело, как считают, связано с антигеном, где константа диссоциация составляет ≤1 мкМ, ≤100 нМ или ≤10 нМ. Повышенная константа равновесия ("KD") означает, что существует меньшее сродство между эпитопом и антителом, в то время как сниженная константа равновесия означает, что существует большее сродство между эпитопом и антителом. Антитело с KD, составляющей "не более чем" конкретное количество, означает, что антитело связывается с эпитопом с данной КD или сильнее. В то время как KD описывает характеристики связывания эпитопа и антитела, "специфическая активность" описывает эффективность самого антитела в зависимости от антитела. Не обязательно существует корреляция между константой равновесия и специфической активностью; таким образом, например, относительно низкая KD автоматически не означает высокой специфической активности.
Термин "селективно связывает" по отношению к антителу не означает, что антитело связывается только с одним веществом, а то, что KD антитела с первым веществом меньше, чем KD антитела со вторым веществом. Антитело, которое связывается исключительно с эпитопом, связывается только с этим единственным эпитопом.
При введении людям, антитела, которые содержат вариабельные и/или константные области грызунов (то есть, мыши или крысы), иногда связаны с, например, быстрым выведением из организма или генерированием иммунного ответа тела против антитела. Для того, чтобы избежать применения антител, полученных от грызунов, полностью антитела человека могут быть получены посредством введения функции антитела человека грызуну таким образом, что грызун получает полностью человеческое антитела. Если в данном документе конкретно не указано иное, "человеческие" и "полностью человеческие" антитела могут быть применены взаимозаменяемо. Термин "полностью человеческий" может быть применим при различении антител, которые являются только частично человеческими, от таких, которые являются целиком, или полностью, человеческими. Специалисту известны различные способы генерирования полностью человеческих антител.
Для того, чтобы рассмотреть возможные ответы антимышиного антитела человека, могут быть применены химерные или иным способом гуманизированные антитела. Химерные антитела имеют константную область человека и вариабельную область мыши, и, таким образом, у некоторых пациентов могут наблюдаться ответы анти-химерного антитела человека. Таким образом, является полезным обеспечить полностью человеческие антитела против мультимерных ферментов для того, чтобы избежать возможных ответов анти-мышиного антитела человека или анти-химерного антитела человека.
Полностью человеческие моноклональные антитела могут быть получены, например, с помощью генерирования клеточных линий гибридомы по технологиям, известным специалисту. Другие способы получения вовлекают применение последовательностей, кодирующих конкретные антитела, для трансформации подходящей клетки-хозяина млекопитающего, такой как клетка СНО. Трансформация может осуществляться любым известным способом введения полинуклеотидов в клетку-хозяина, в том числе, например, упаковкой полинуклеотида в вирусе (или в вирусный вектор) и трансдукцией клетки-хозяина с помощью вируса (или вектором) или с помощью процедур трансфекции, известных в данной области техники. Способы введения гетерологичных полинуклеотидов в клетки млекопитающего хорошо известны в данной области техники и включают декстран-опосредованную трансфекцию, осаждение фосфатом кальция, полибрен-опосредованную трансфекцию, слияние протопластов, электропорацию, инкапсуляцию полинуклеотида(ов) в липосомы и прямую микроинъекцию ДНК в ядра. Клеточные линии млекопитающих, в качестве хозяев экспрессии, хорошо известны в данной области техники и содержат, но, не ограничиваясь этим, клетки СНО, клетки HeLa и клетки гепатоцеллюлярной карциномы человека.
Антитела могут быть применены для того, чтобы обнаружить полипептид по данному описанию. Например, антитела могут быть применены в качестве диагностики путем обнаружения уровня одного или более полипептидов по данному описанию у субъекта и либо по сравнению обнаруженного уровня со стандартным уровнем контроля, либо по сравнению с базовым уровнем у субъекта, определенным ранее (например, перед любой болезнью).
Другой вариант реализации изобретения по данному описанию влечет за собой применение одного или более доменных антител (dAb) человека. dAb представляют собой наименьшие функциональные единицы связывания антител человека (IgG) и имеют предпочтительные характеристики стабильности и растворимости. Технология влечет за собой dAb, конъюгированный(е) с ЧСА (тем самым образуя "AlbudAb"; См., например, ЕР 1517921 В, WO 2005/118642 и WO 2006/051288) и молекулой, представляющей интерес (например, полипептидной последовательностью по данному описанию). AlbudAb часто представляют собой более мелкие и более простые для изготовления в микробных системах экспрессии, таких как бактерии или дрожжи, чем современных технологии, применяемые для увеличения времени полужизни полипептидов в сыворотке. ЧСА имеет время полужизни около трех недель, что приводит к тому, что конъюгированная молекула улучшает время полужизни молекулы, представляющей интерес. Применение технологии dAb может также повышает эффективность молекулы, представляющей интерес
Терапевтические и профилактические применения
Данное описание предлагает способы для лечения или предотвращения гипергликемии, гиперинсулинемии, непереносимости глюкозы, расстройства толерантности к глюкозе, ожирения и других нарушений массы тела, а также других метаболических и связанных с метаболизмом заболеваний, расстройств и состояний с помощью введения полипептидов, или их композиций, как описано в данном документе. Подобные способы могут также иметь благоприятное воздействие на один или более симптомов, связанных с заболеванием, расстройством или состоянием с помощью, например, уменьшения тяжести или частоты симптомов.
Для того чтобы определить, может ли субъект быть кандидатом для лечения или профилактики гипергликемии, гиперинсулинемии, непереносимости глюкозы и/или нарушения толерантности к глюкозе с помощью способов, предлагаемых в данном документе, могут быть применены различные диагностические способы, известные в данной области техники. Подобные способы содержат те, которые описаны где-нибудь в другом месте в данном документе (например, оценка уровня глюкозы натощак (УГН) и оральный тест на толерантность к глюкозе (ОГТТ)).
Для того чтобы определить, может ли субъект являться кандидатом для лечения или профилактики нарушения массы тела (например, ожирения) с помощью способов, предлагаемых в данном документе, должны быть оценены параметры, такие как, но без ограничения этим, этиология и степень состояния субъекта (например, насколько избыточный вес субъекта сравним с эталонным здоровым человеком). Например, взрослый, имеющий ИМТ между ~25 и ~29,9 кг/м2 может считаться человеком с избыточным весом (предожирение), в то время, как взрослый, имеющий ИМТ в ~30 кг/м2 или выше, может считаться человеком с ожирением. Для субъектов, которые имеют избыточный вес и/или которые имеют диеты низкого качества (например, диеты с высоким содержанием жира и калорий), он является общим для начального осуществления и оценки влияния измененных пищевых привычек и/или схем тренировок перед началом курса терапии, включающих один или более полипептидов по данному описанию. Как обсуждается в данном документе, полипептиды могут влиять на подавление аппетита.
Фармацевтические композиции
Модуляторы (например, полипептиды) по данному описанию могут существовать в форме композиций, подходящих для введения субъекту. В общем, подобные композиции представляют собой "фармацевтические композиции", содержащие один или более модуляторов и один или более фармацевтически приемлемых или физиологически приемлемых разбавителей, носителей или вспомогательных веществ. В некоторых вариантах реализации изобретения модуляторы присутствуют в терапевтически приемлемом количестве. Фармацевтические композиции могут быть применимы в способах по данному описанию; таким образом, например, фармацевтические композиции могут быть введены ex vivo или in vivo субъекту, для того, чтобы практиковать терапевтические и профилактические способы и применения, описанные в данном документе.
Фармацевтические композиции по данному описанию могут быть составлены для того, чтобы быть совместимыми с предписанным способом или путем введения; иллюстративные пути введения приведены в данном документе. Более того, фармацевтические композиции могут быть применимы в комбинации с другими терапевтически активными средствами или соединениями (например, глюкозопонижающими средствами), как описано в данном документе, для того, чтобы лечить или предотвращать заболевания, расстройства и состояния, таким образом, как это предусмотрено в настоящем описании.
Фармацевтические композиции обычно содержат терапевтически эффективное количество по меньшей мере одного из модуляторов (например, полипептидов), рассматриваемых в настоящем описании, и одного или более фармацевтически и физиологически приемлемых средств состава. Подходящие фармацевтически приемлемые или физиологически приемлемые разбавители, носители или вспомогательные вещества содержат, но не ограничиваясь этим, антиоксиданты (например, аскорбиновую кислоту и бисульфат натрия), консерванты (например, бензиловый спирт, метилпарабены, этил или н-пропил, n-гидроксибензоат), эмульгирующие средства, суспендирующие средства, диспергирующие средства, растворяющие вещества, наполнители, объемообразующие средства, детергенты, буферы, растворители, разбавители и/или адъюванты. Например, подходящий растворитель может представлять собой физиологический раствор или забуференный цитратом физиологический раствор, возможно, дополненный другими материалами, распространенными в фармацевтических композициях для парентерального введения. Нейтральный забуференный физиологический раствор или физиологический раствор, смешанный с сывороточным альбумином, представляет собой дополнительные иллюстративные растворители. Специалисту в данной области техники будет легко распознать различные буферы, которые могут быть применены в фармацевтических композициях и лекарственных формах. Обычные буферы содержат, но не ограничиваясь этим, фармацевтически приемлемое слабые кислоты, слабые основания или их смеси. В качестве примера, компоненты буфера может быть водорастворимыми материалами, такими как фосфорная кислота, винная кислота, молочная кислота, янтарная кислота, лимонная кислота, уксусная кислота, аскорбиновая кислота, аспарагиновая кислота, глютаминовая кислота и их соли. Подходящие буферные средства содержат, например, трис-буфер, N-(2-гидроксиэтил)пиперазин-N'-(2-этансульфоновую кислоту) (HEPES), 2-(N-морфолино)этансульфоновую кислоту (MES), натриевую соль 2-(N-морфолино)этансульфоновой кислоты (MES), 3-(N-морфолино)пропансульфоновую кислоту (MOPS) и N-трис[гидроксиметил]метил-3-аминопропансульфоновую кислоту (TAPS).
После того, как фармацевтическая композиция была составлена, она может храниться в стерильных флаконах в виде раствора, суспензии, геля, эмульсии, твердого вещества или дегидратированного или лиофилизированного порошка. Подобные составы могут храниться либо в виде готовой к применению, лиофилизированной формы, требующей восстановление перед применением, жидкой формы, требующей разбавление перед применением, либо другой приемлемой формой. В некоторых вариантах реализации изобретения фармацевтическая композиция предлагается в одноразовой емкости (например, одноразовом флаконе, ампуле, шприце или шприце для самоинъекции (аналогичного, например, EpiPen®)), в то время как многофункциональный контейнер (например, флакон для многократного применения) предлагается в других вариантах реализации изобретения. Любое устройство для доставки лекарственного средства может быть применимо для доставки полипептидов, в том числе имплантаты (например, имплантируемые насосы) и катетерные системы, все из которых являются хорошо известными специалистам. Инъекции веществ замедленного всасывания, которые, как правило, вводят подкожно или внутримышечно, могут также быть применены для того, чтобы высвободить полипептиды, предлагаемые в данном документе, в течение определенного периода времени. Инъекции веществ замедленного всасывания представляют собой, как правило, либо на основе твердого вещества, либо на масляной основе, и, как правило, содержат, по меньшей мере один из компонентов состава, приведенного в данном документе. Специалист в данной области техники знаком с возможными составами и применениями инъекций веществ замедленного всасывания.
Фармацевтические композиции могут находиться в форме стерильной инъецируемой водной или масляной суспензии. Указанная суспензия могут быть составлены в соответствии с известным уровнем техники с применением подходящих диспергирующих или смачивающих средств и суспендирующих средств, упоминавшихся в данном документе. Стерильный инъекционный препарат может также быть стерильным инъекционным раствором или суспензией в нетоксичном парентерально-приемлемом разбавителе или растворяющем веществе, например, в виде раствора в 1,3-бутандиоле. Подходящие разбавители, растворяющие вещества и дисперсионные среды, которые могут быть применены, содержат воду, раствор Рингера, изотонический раствор хлорида натрия, Cremophor EL™ (BASF, Парсиппани, Нью-Джерси) или натрий-фосфатный буфер (PBS), этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль) и их подходящие смеси. В дополнение к этому, в качестве растворяющего вещества или суспендирующей среды, обычно применяют стерильные, нелетучие масла. В этих целях может быть применимо любое мягкое нелетучее масло, в том числе синтетические моно- или диглицериды. Более того, при подготовке инъекций находят применение жирные кислоты, такие как олеиновая кислота. Длительное поглощение конкретных инъектируемых составов может быть достигнуто с помощью, в том числе, средства, которое задерживает поглощение (например, моностеарат алюминия или желатин).
Фармацевтические композиции, содержащие активный ингредиент, могут находиться в форме, подходящей для перорального применения, например, в виде таблеток, капсул, пастилок, леденцов, водных или масляных суспензий, дисперсных порошков, гранул, эмульсий, твердых или мягких капсул, сиропов, растворов, микрошариков или эликсиров. Фармацевтические композиции, предназначенные для перорального применения, могут быть получены в соответствии с любым известным способом производства фармацевтических композиций, известным в данной области техники, а подобные композиции могут содержать одно или более средств, таких как, например, подслащивающие средства, ароматизаторы, красящие средства и консерванты, для того, чтобы обеспечить фармацевтически элегантные и приятные на вкус препараты. Таблетки, капсулы и подобное содержат активный ингредиент в примеси с нетоксичными фармацевтически приемлемыми вспомогательными веществами, которые являются подходящими для производства таблеток. Указанные вспомогательные вещества могут представлять собой, например, разбавители, таких как карбонат кальция, карбонат натрия, лактозу, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие средства, например, кукурузный крахмал или альгиновую кислоту; связывающие средства, например, крахмал, желатин или камедь, и смазывающие средства, например, стеарат магния, стеариновую кислоту или тальк.
Таблетки, капсулы и подобное, подходящие для перорального введения, могут быть без покрытия или с покрытием по известной технологии, для того, чтобы задержать разложение и поглощение в желудочно-кишечном тракте и, тем самым, обеспечить пролонгированное действие. Например, может быть применим замедляющий материал, такой как глицерилмоностеарат или глицерилдистеарат. Они могут также быть покрыты с помощью технологий, известных в данной области техники, для образования осмотических терапевтических таблеток для контролируемого высвобождения. Дополнительные средства содержат биоразлагаемые или биосовместимые частицы или полимерное вещество, такое как полиэфиры, полиаминные кислоты, гидрогель, поливинилпирролидон, полиангидриды, полигликолевая кислота, этиленвинилацетат, метилцеллюлоза, карбоксиметилцеллюлоза, протаминсульфат или сополимеры лактида/гликолида, сополимеры полилактида/гликолида или сополимеры этиленвинилацетата, для того, чтобы контролировать доставку вводимой композиции. Например, пероральное средство может быть заключено в микрокапсулы, подготовленные с помощью технологий коацервации или межфазной полимеризации, с помощью применения гидроксиметилцеллюлозы, желатиновых микрокапсул или поли(метилметакролатных) микрокапсул, соответственно, или в коллоидной системе доставки лекарственного средства. Коллоидные дисперсные системы включают макромолекулярные комплексы, нанокапсулы, микросферы, микрошарики и системы на основе липидов, в том числе эмульсии типа "масло в воде", мицеллы, смешанные мицеллы и липосомы. Способы получения липосом описаны в, например, патентах США №№4235871, 4501728 и 4837028. Способы получения вышеупомянутых составов будут очевидны специалистам в данной области техники.
Составы для перорального применения также могут быть представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция, каолином или микрокристаллической целлюлозой, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой, например, арахисовым маслом, жидким парафином или оливковым маслом.
Водные суспензии содержат активные материалы в примеси со вспомогательными веществами, подходящими для их производства. Подобные вспомогательные вещества могут представлять собой суспендирующие средства, например, карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и аравийскую камедь; диспергирующие или смачивающие средства, например, встречающийся в природе фосфатид (например, лецитин), продукты конденсации алкиленоксида с жирными кислотами (например, полиоксиэтиленстеарат), продукты конденсации этиленоксида с длинноцепочечными алифатическими спирты (например, до гептадекаэтиленоксикетанола), продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и гекситола (например, полиоксиэтиленсорбитолмоноолеат) или продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и ангидридов гекситола (например, полиэтиленсорбитанмоноолеат). Водные суспензии могут также содержать один или более консервантов.
Масляные суспензии могут быть составлены с помощью суспендирования активного ингредиента в растительном масле, например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать средство для сгущения, например, пчелиный воск, твердый парафин или цетиловый спирт. Подслащивающие средства, такие как те, которые приведены выше, и ароматизаторы могут быть добавлены для того, чтобы обеспечить приятный на вкус пероральный препарат.
Диспергируемые порошки и гранулы, подходящие для приготовления водной суспензия путем добавления воды, обеспечивают активный ингредиент в примеси с диспергирующим или смачивающим средством, суспендирующим средством и одним или более консервантами. В данном документе проиллюстрированы подходящие диспергирующие или смачивающие средства и суспендирующие средства.
Фармацевтические композиции по данному описанию могут также находиться в форме эмульсий типа "масло в воде". Масляная фаза может представлять собой растительное масло, например, оливковое масло или арахисовое масло или минеральное масло, например, жидкий парафин, или смесь указанных. Подходящие эмульгирующие средства могут представлять собой встречающиеся в природе смолы, например, аравийскую камедь и трагакантовую камедь; встречающиеся в природе фосфатиды, например, сою, лецитин и сложные эфиры или частичные сложные эфиры, полученные из жирных кислот; ангидриды гекситола, например, сорбитанмоноолеат; и продукты конденсации частичных сложных эфиров с этиленоксидом, например, полиоксиэтиленсорбитанмоноолеатом.
Составы могут также содержать носители, для того, чтобы защитить композицию от быстрой деградации или исключения из тела, такие как состав с контролируемым высвобождением, в том числе имплантаты, липосомы, гидрогели, пролекарственные средства и микроинкапсулированные системы доставки. Например, может быть применим замедляющий материал, такой как глицеринмоностеарат, или отдельно глицеринстеарат, или в комбинации с воском.
Данное описание предусматривает введение модуляторов в форме суппозиториев для ректального введения лекарственного средства. Суппозитории может быть получены путем смешивания лекарственного средства с подходящим не раздражающим вспомогательным веществом, которое является твердым при обычных температурах, но жидким при ректальной температуре и будет таять в прямой кишке, высвобождая лекарственное средство. Подобные материалы содержат, но не ограничиваясь этим, кокосовое масло и полиэтиленгликоли.
Модуляторы, рассматриваемые в настоящем описании, могут находиться в форме любой другой подходящей фармацевтической композиции (например, спреев для назального или ингаляционного применения), известной в настоящее время или разработанной в будущем.
Концентрация полипептида или его фрагмента в составе может изменяться в широком диапазоне (например, от менее чем около 0,1%, обычно при или по меньшей мере около 2% вплоть до 20%-50% или более по массе) и, как правило, будет выбрана в первую очередь основываясь на объемах жидкости, вязкостях и факторов на основе субъекта, в соответствии с, например, конкретным способом введения выбранного.
Пути введения
Данное описание предусматривает введение раскрытых модуляторов (например, полипептидов) и их композиций любым подходящим способом. Подходящие пути введения включают парентеральный (например, внутримышечный, внутривенный, подкожный (например, инъекцию или имплантат), внутрибрюшинный, интрацистернальный, внутрисуставный, внутрибрюшинный, интрацеребральный (интрапаренхимальный) и интрацеребровентрикулярный), пероральный, назальный, вагинальный, сублингвальный, внутриглазной, ректальный, местный (например, трансдермальный), сублингвальный и ингаляцию.
Инъекции веществ замедленного всасывания, которые, как правило, введены подкожно или внутримышечно, могут также быть применены для того, чтобы высвободить модуляторы, раскрытые в данном документе, в течение определенного периода времени. Инъекции веществ замедленного всасывания представляют собой, как правило, либо на основе твердого вещества, либо на масляной основе, и, как правило, содержат, по меньшей мере один из компонентов состава, приведенного в данном документе. Специалист в данной области техники знаком с возможными составами и применениями инъекций веществ замедленного всасывания.
Что касается антитела, в иллюстративных вариантах реализации изобретения антитело или фрагмент антитело по данному описанию хранят при 10 мг/мл в стерильном изотоническом водном физиологическом раствора для инъекций при 4°С и разбавляют в 100 мл или 200 мл или 0,9% хлорида натрия для инъекций перед введением субъекту. Антитело вводили путем внутривенной инфузии в течение 1 часа в дозе между 0,2 и 10 мг/кг. В иных вариантах реализации изобретения антитело вводили путем внутривенной инфузии за период времени между 15 минут и 2 часа. В других вариантах осуществления введение процедуру осуществляют посредством подкожной болюсной инъекции.
Комбинированная терапия
Данное описание предусматривает применение модуляторов (например, полипептидов) в комбинации с одним или более активными терапевтическими средствами или другими профилактическими или терапевтическими способами воздействия. В подобной комбинированной терапии различные активные средства часто имеют разные механизмы действия. Подобная комбинированная терапия может быть особенно выгодной, позволяя снижать дозу одного или более средств, тем самым снижая или устраняя негативные последствия, связанные с одним или более средствами; кроме того, подобная комбинированная терапия может иметь синергический терапевтический или профилактический эффект на основное заболевание, расстройство или состояние.
Как применяют в данном документе, "комбинация" предназначена для того, чтобы включать лечения, которые могут быть введены отдельно, например, составлены отдельно для отдельного введения (например, как может быть предложено в наборе) и терапий, которые может быть введены вместе в одном составе (то есть "сосостав").
В некоторых вариантах реализации изобретения модуляторы вводят или применяют последовательно, например, когда одно средство вводят перед одним или более другими средствами. В иных вариантах реализации изобретения модуляторы вводят одновременно, например, где два или более средства вводят в одно и то же или около того же времени; два или более средства могут присутствовать в двух или более отдельных составах или объединены в один состав (то есть сосостав). Независимо от того, два или более средства вводят последовательно или одновременно, они считаются введенными в комбинации в соответствии с целями по данному описанию.
Модуляторы по данному описанию могут быть применены в комбинации с другими средства, применяемыми при лечении, профилактики, подавлении или облегчении заболевания, расстройства или состояния, изложенного в данном документе, в том числе теми, которые, как правило, введены субъектам, страдающим от гипергликемии, гиперинсулинемии, нарушения толерантности к глюкозе и других расстройств метаболизма глюкозы.
Данное описание предусматривает комбинированную терапию с множеством средств (и их классов), в том числе 1) инсулином, миметиками инсулина и средствами, которые влекут за собой стимулирование секреции инсулина, в том числе сульфонилмочевины (например, хлорпропамидом, толазамидом, ацетогексамидом, толбутамидом, глибуридом, глимепиридом, глипизидомм) и меглитинидами (например, гепаглидином (PRANDIN) и натеглидином (STARLIX)); 2) бигуанидами (например, метформином (GLUCOPHAGE)) и другими средствами, которые действуют посредством стимуляции применения глюкозы, уменьшая получение печеночной глюкозы и/или убавляя интрастинальный выход глюкозы; 3) ингибиторами альфа-глюкозидазы (например, акарбозой и миглитолом) и другими средствами, которые замедляют расщепление углеводорода и, следовательно, поглощение из кишечника и уменьшают постпрандиальную гипергликемию; 4) тиазолидиндионами (например, росиглитазоном (AVANDIA), троглитазоном (REZULIN), пиоглитазоном (ACTOS), глипизидом, балаглитазоном, ривоглитазоном, нетоглитазоном, троглитазоном, энглитазоном, циглитазоном, адаглитазоном, дарглитазоном, которые усиливают действие инсулина (например, с помощью сенсибилизации инсулина, таким образом стимулируя применение глюкозы в периферических тканях; 5) глюкагон-подобными пептидами, в том числе ингибиторами DPP-IV (например, вилдаглиптином (GALVUS) и ситаглиптином (JANUVIA)) и глюкагон-подобным пептидом-1 (GLP-1) и агонистами и аналогами GLP-1 (например, экзенатидом (BYETTA и ITCA 650 (осмотический насос вставляется подкожно, что доставляет аналог экзенатида в течение 12-месячного периода; Intarcia, Бостон, Массачусетс)); 6) и DPP-IV-устойчивыми аналогами (миметиками инкретина), гамма агонистами PPAR, агонистами PPAR двойного действия, агонистами PPAR общего действия, ингибиторами РТР1В, ингибиторами SGLT, усиливающими секрецию инсулина, агонистами RXR, ингибиторами гликогенсинтазы-киназы-3, иммуномодуляторами, агонистами адренергических рецепторов бета-3, ингибиторами 11beta-HSD1 и аналогами амиоина.
Более того, данное описание предусматривает комбинированную терапию со средствами и способами для стимуляции потери веса, такими как средства, которые стимулируют обмен веществ или уменьшают аппетит, и модифицированными диетами и/или схемами упражнений, чтобы способствовать потере веса.
Модуляторы по данному описанию могут быть применимы в комбинации с одним или более другими средствами любым способом, приемлемым при сложившихся обстоятельствах. В одном варианте реализации изобретения лечение по меньшей мере одним активным средством и по меньшей мере одним модулятором по данному описанию сохраняется в течение периода времени. В другом варианте реализации изобретения лечение по меньшей мере одним активным средством ограничено или прервано (например, когда субъект является стабильным), в то время, как лечение с помощью модулятора по данному описанию сохраняется при постоянном режиме дозирования. В дополнительном варианте реализации изобретения лечение по меньшей мере одним активным средством ограничено или прервано (например, когда субъект является стабильным), в то время, как лечение с помощью модулятора по данному описанию ограничено (например, более низкая доза, более редкое дозирование или более короткий режим лечения). В еще одном варианте реализации изобретения лечение по меньшей мере одним активным средством ограничено или прервано (например, когда субъект является стабильным) и лечение с помощью модулятора по данному описанию продолжено (например, более высокая доза, более частое дозирование или более продолжительный режим лечения). В еще одном варианте реализации изобретения лечение по меньшей мере одним активным средством сохраняется, а лечение с помощью модулятора по данному описанию ограничено или прервано (например, более низкая доза, более редкое дозирование или более короткий режим лечения). В еще одном варианте реализации изобретения лечение по меньшей мере одним активным средством и лечение с помощью модулятора по данному описанию ограничено или прервано (например, более низкая доза, более редкое дозирование или более короткий режим лечения).
Дозирование
Модуляторы (например, полипептиды) по данному описанию могут быть введены субъекту в количестве, которое зависит от, например, цели введения (например, степени желаемого разрешения); возраста, веса, пола и здоровья и физического состояния субъекта, которого лечат; природы модулятора и/или состава, который вводят; пути введения; и природы заболевания, расстройства, состояния или его симптома (например, тяжести нарушения регуляции глюкозы/инсулина и этапа расстройства). Режим дозирования может также принимать во внимание существование, природу и степень каких-либо неблагоприятных эффектов, связанных со средством(ами), которые вводят. Эффективные величины дозы и схемы приема лекарственных средств могут быть легко определены из, например, испытаний безопасности и повышения дозы, in vivo исследований (например, животных моделей) и других способов, известных специалистам в данной области техники.
В общем, параметры дозирования диктуют, что величина дозы является меньше количества, которое может быть необратимо токсичным для субъекта (то есть, максимально переносимой дозы, "МПД") и не менее чем количество, необходимое для получения заметного эффекта у субъекта. Подобные количества определяли с помощью, например, фармакокинетических и фармакодинамических параметров, связанных со всасыванием, распределением, метаболизмом и выведением ("ADME"), принимая во внимание путь введения и другие факторы.
Эффективная доза (ЭД) представляет собой дозу или количество средства, которое получает терапевтический ответ или требуемый эффект в какой-то фракции субъектов, принимающих его. "Средняя эффективная доза" или ЭД50 средства представляет собой дозу или количество средства, которое вызывает терапевтический ответ или требуемый эффект у 50% популяции, которой его вводили. Хотя ЭД50 обычно применяют в качестве измерения разумного ожидания влияния средства, не является обязательным, что доза, которую врач может рассчитать, принимает во внимание все соответствующие факторы. Таким образом, в некоторых случаях эффективное количество составляет больше, чем рассчитанная ЭД50, в других ситуациях эффективное количество составляет меньше, чем рассчитанная ЭД50, а в других ситуациях эффективное количество является таким же, как и рассчитанная ЭД50.
В дополнение к этому, эффективная доза модуляторов по данному описанию может представлять собой количество, которое, при введении в виде одной или более доз субъекту, вызывает требуемый результат, по сравнению со здоровым субъектом. Например, эффективная доза может представлять собой такую, которая при введении субъекту, имеющему повышенную глюкозу в плазме и/или инсулин в плазме, достигает требуемого снижения, по сравнению с таковой в случае здорового субъекта на по меньшей мере около 10%, по меньшей мере около 20%, по меньшей мере около 25%, по меньшей мере около 30%, по меньшей мере около 40%, по меньшей мере около 50%, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80% или более чем 80%.
Приемлемый уровень дозировки будет, как правило, составлять около 0,001-100 мг/кг массы тела пациента в день, который может быть введен в виде однократной или многократных доз. В некоторых вариантах реализации изобретения уровень дозирования будет составлять от около 0,01 до около 25 мг/кг в день, а в других вариантах реализации изобретения от около 0,05 до около 10 мг/кг в день. Подходящий уровень дозирования может представлять собой около 0,01-25 мг/кг в день, около 0,05-10 мг/кг в день или около 0,1-5 мг/кг в день. В пределах указанного диапазона, дозирование может представлять собой 0,005-0,05, 0,05-0,5 или 0,5-5,0 мг/кг в день.
В случае введения перорального средства, композиции могут быть предложены в форме таблеток, капсул и подобного, содержащих от 1,0 до 1000 миллиграмм активного ингредиента, в частности 1,0, 3,0, 5,0, 10,0, 15,0, 20,0, 25,0, 50,0, 75,0, 100,0, 150,0, 200,0, 250,0, 300,0, 400,0, 500,0, 600,0, 750,0, 800,0, 900,0, и 1000,0 миллиграмм активного ингредиента. Модуляторы могут быть введены в режиме, например, 1-4 раза в день и всего раз или два раза в день.
Дозирование модуляторов по данному описанию может быть повторено с соответствующей частотой, которая может быть в диапазоне от одного раза в день до одного раза каждые три месяца, в зависимости от фармакокинетических параметров модуляторов (например, периода полураспада) и фармакодинамического ответа (например, продолжительности терапевтического эффекта модулятора). В некоторых вариантах реализации изобретения, где модулятор представляет собой антитело или его фрагмент, его полипептид или варианты, дозирование часто повторяется между раз в неделю и раз в 3 месяца. В иных вариантах реализации изобретения подобные модуляторы вводят приблизительно один раз в месяц.
В некоторых вариантах реализации изобретения дозирование раскрытых модуляторов изложено в "единичной лекарственной форме". Фраза "единичная лекарственная форма" соответствует физически дискретным единицам, каждая единица содержит заранее определенное количество модулятора по данному описанию, либо отдельно, либо в комбинации с одним или более дополнительными средствами, достаточное для получения желаемого эффекта. Следует иметь в виду, что параметры единичной лекарственной формы будут зависеть от конкретного средства и эффекта, который должен быть достигнут.
Наборы
Данное описание также предусматривает наборы, содержащие раскрытые модуляторы (например, полипептиды) и их фармацевтические композиции. Наборы существуют, как правило, в форме физической структуры, вмещая различные компоненты, как описано ниже, и могут быть применимы, например, при осуществлении способов, описанных выше (например, введения модулятора субъекту при необходимости восстановления гомеостаза глюкозы).
Набор может содержать один или более модуляторов, раскрываемых в данном документе (предлагают в, например, стерильном контейнере), которые могут находиться в форме фармацевтической композиции, подходящей для введения субъекту. Модуляторы могут быть предложены в форме, которая готова к применению, или в форме, требующей, например, восстановления или разбавления перед введением. При условии, что модуляторы существуют в форме, которая должна быть восстановлена пользователем, набор может также содержать буферы, фармацевтически приемлемые вспомогательные вещества и подобное, в комплекте с или отдельно от модуляторов. При условии, что предполагается комбинированная терапия, набор может содержать несколько средства отдельно или они могут быть уже объединенными в набор. Каждый компонент набора может быть заключен в индивидуальный контейнер, а все различные контейнеры могут быть в одном пакете. Набор по данному описанию может быть предназначен для состояний, необходимых для надлежащего поддержания компонентов, размещенных в нем (например, охлаждения или замерзания).
Набор может содержать этикетки или упаковочный вкладыш, в том числе идентифицирующую информацию для компонентов в нем и инструкции по их применению (например, параметры дозирования, клиническую фармакологию активного ингредиента(ов), в том числе механизм действия, фармакокинетические и фармакодинамические параметры, побочные эффекты, противопоказания и т.д.). Этикетки или вкладыши могут содержать информацию производителя, такую как номера партии и даты истечения срока действия. Этикетка или упаковочный вкладыш могут быть, например, интегрированными в физическую структуру, вмещающую компоненты, содержащиеся отдельно в рамках физической структуры или прикрепленные к компоненту набора (например, ампуле, трубке или пробирке). Иллюстративные инструкции включают таковые для уменьшения или понижения глюкозы в крови, лечения гипергликемии, лечения диабета и т.д. с предлагаемыми модуляторами и их фармацевтическими композициями.
Этикетки или упаковочные вкладыши могут дополнительно содержать, или быть включенными в, машиночитаемый носитель, такой как диск (например, жесткий диск, карта, электронный диск), оптический диск, такой как CD- или DVD-ROM/RAM, DVD, МР3, магнитная лента или электронное запоминающее устройство, такое как RAM и ROM или гибриды указанных, такие как средства магнитного/оптического хранения информации, флэш-носители или карты памяти. В некоторых вариантах реализации изобретения фактические инструкции отсутствуют в наборе, но предполагается получение инструкций из удаленного источника, например, предлагают, посредством интернета.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Следующие примеры предлагали таким образом, чтобы предложить специалистам в данной области с полным раскрытием и описанием того, каким образом осуществлять и применять данное изобретение, и не предназначены ни для ограничения объема того, что авторы считают своим изобретением, ни для представления того, что эксперименты ниже представляют собой все или только проведенные эксперименты. Были предприняты усилия, чтобы обеспечить точность в отношении применяемых чисел (например, количеств, температуры и т.д.), но некоторые экспериментальные ошибки и отклонения должны учитываться.
Если не указано иное, части являются частями по массе, молекулярная масса представляет собой средневесовую молекулярную массу, температура представлена в градусах Цельсия (°С), а давление является равным, или близким к, атмосферному. Применяют стандартные сокращения, в том числе следующие: п.о. = пара(ы) оснований; т.н. = тысяча(и) нуклеотидов; пл = пиколитр(ы); с или сек = секунда(ы); мин = минута(ы); ч или чс = час(ы); а.к. = аминокислота(ы); т.н. = тысяча(и) нуклеотидов; нт = нуклеотид(ы); нг = нанограмм; мкг = микрограмм; мг = миллиграмм; г = грамм; кг = килограмм; дл или дЛ = децилитр; мкл или мкЛ = микролитр; мл или мЛ = миллилитр; л или Л = литр; мкМ = микромолярный; мМ = миллимолярный; М = молярный; кДа = килодальтон; в/м = внитримышечный(о); в/б = внутрибрюшинный(о); п/к = подкожный(о); двд = дважды в день; ВЭЖХ = высокоэффективная жидкостная хроматография; мт = масса тела; з = звено; сн = статистическинедостоверный; гн = уровень глюкозы натощак; ИПН = инсулин в плазме натощак; ТТИ = тест на толерантность к инсулину; ТТП = тест на толерантность к пирувату; ПТТГ = пероральный тест толерантности к глюкозе; GSIS = стимулированная глюкозой секреция инсулина; PBS = натрий-фосфатный буфер; ПЦР = полимеразная цепная реакция; NHS = N-гидроксисукцинимид; DMEM = модифицированная по способу Дульбекко среда Игла; кг = копия генома; ЭДТА = этилендиаминтетрауксусная кислота.
Материалы и способы
Следующие способы и материалы применяли в Примерах ниже:
Животные. В экспериментах, описанных выше, применяли самцов, 7-15 недель отроду, B6.V-LEPob/3 (лептин-дефицитных (ob/ob)) мышей (The Jackson Laboratory, Бар-Харбор, Мэн). Мыши имели свободный доступ к автоклавной дистиллированной воде и питались ad libitum коммерческой едой для мышей (Irradiated 2018 Teklad Global 18% protein Rodent Diet, Harlan Laboratories, Дублин, Виргиния). Самцов мышей C57BL/6J с ожирением, индуцированным диетой (DIO) (The Jackson Laboratory, Бар-Харбор, Мэн), поддерживали на диете с высоким содержанием жиров (D12492, Research Diets, Inc, Нью-Брансуик, Нью-Джерси), содержащей 60% ккал жиров, 20% ккал белков и 20% ккал углеводородов в течение 12-20 недель. Все исследования на животных были одобрены NGM Institutional Animal Care и Use Committee.
Нуклеотидная и аминокислотная последовательности. GenBank Accession No. ВС000529.2 предлагает кДНК вариантов GDF15 человека, кодирующих ORF, a GenBank Accession No. NP_004855.2 предлагает аминокислотную последовательность, кодированную кДНК. Сывороточный альбумин кДНК homo sapiens был приобретен у Origene (SC319937), GeneBank Accession No. NM_000477.3, NP_000468).
Слитые ПЦР фрагменты в случае ЧСА и GDF15 человека получали с помощью фермента Sapphire (Clontech), очищали в геле (набор Qiagen Gel Extraction) и собирали с Gibson Assembly Master Mix (NEB) в вектор pTT5, содержащий сигнальный пептид IgK человека, расщепляемый с помощью EcoRI и BamHI. Два ПЦР фрагмента получали для клонирования, первый, кодирующий ЧСА, и второй, кодирующий GDF15 человека. Следующие праймеры применяли для амплификации ЧСА: прямой праймер: 5'-tggctccgaggtgccagatgtgatgcacacaagagtgaggttgctcatcgg-3' (SEQ ID NO: 217); обратный праймер: 5'-gctaccgcctccacctaagcctaaggcagcttgacttgc-3' (SEQ ID NO: 218). Следующие праймеры применяли для амплификации GDF15: прямой праймер: 5'-gctgccttaggcttaggtggaggcggtagcggtggaggtgggagtggaggtggaggcagtgcgcgcaacggggaccactgtccgctcggg-3' (SEQ ID NO: 219); обратный праймер: 5'-cagaggtcgaggtcgggggatcctcatatgcagtggcagtctttggctaacaa-3' (SEQ ID NO: 220).
Колонии высевали и подтверждали последовательность. Праймеры разрабатывали для того, чтобы мутировать области, представляющие интерес, а мутагенез проводили с помощью Quikchange Lightning Site Directed Mutagenesis Kit (Agilent). Колонии с подтвержденной последовательностью амплифицировали, а плазмидную ДНК очищали с применением подготовительного набора Qiagen DNA-Maxi.
Экспрессия слитой молекулы мутеина ЧСА-GDF15. Все мутеины были временно трансфектированы в клетки Expi 293F (Invitrogen Corporation, Карлсбад, Калифорния). Клетки обычно пересевали в экспрессионную среду Expi (Invitrogen) и поддерживали в виде суспензионных культур во встряхиваемых колбах различных размеров. Обычно, клетки пересевали при плотности клеток в 5е5 жизнеспособных клеток/мл и выращивали в течение 3 дней перед повторным высеиванием. Колбы выдерживали в увлажненном СО2 инкубаторе (37°С и 5% СО2) на шейкере с платформой New Brunswick (New Brunswick Scientific Company, Эдисон, Нью-Джерси) при скорости перемешивания 110 оборотов в минуту.
Трансфекции выполняли, когда плотность клеток культуры достигала 2,5е6 жизнеспособных клеток/мл при более чем 95% жизнеспособности. Обычно, на 50 мл трансфекции, 2,5е6 клеток/мл x 50 мл, клетки высевали в 250 мл колбу для встряхивания в объем культуры 42,5 мл. Пятьдесят микрограмм (50 мкг) плазмидной ДНК, состоящей из вектора экспрессии, содержащего ген, представляющий интерес, сначала разводят в 2,5 мл среды OPTI-восстановленная MEM-сыворотка (Invitrogen). Одновременно, реагент трансфекции Expifectamine (Invitrogen), 2,67-кратный объем (количества плазмидной ДНК) также разбавляли в 2,5 мл среды OPTI-восстановленная MEM-сыворотка. После 5 мин инкубации при комнатной температуре, разбавленный реагент трансфекции медленно добавляли к разбавленной плазмидной ДНК для образования трансфекцие-компетентных комплексов. Спустя дополнительные 20 мин инкубационного периода при комнатной температуре, к 42,5 мл клеточной культуры добавляли 5 мл реагента трансфекции. Трансфектированные клетки затем помещали в увлажненный СО2 инкубатор на орбитальном шейкере, поддерживаемом при 110 оборотов в минуту. Спустя двадцать четыре час после трансфекции, в трансфектированную культуру вводили 250 мкл раствора энхансера 1 (Invitrogen) и 2,5 мл раствора энхансера 2 (Invitrogen). Культуру затем помещали в увлажненный СО2 инкубатор на орбитальном шейкере. Спустя шесть-семь дней после трансфекции культуры собирали с помощью центрифугирования при 3000 оборотов в минуту в течение 30 мин, после чего фильтровали сквозь 0,2 мкм фильтр (Nalgene). Затем образцы анализировали на геле с окрашиванием Кумасси на экспрессию.
Расщепление слитых молекул ЧСА-GDF15. Слитые конструкции hGDF15 альбумина сыворотки человека очищали до более чем 95% гомогенности. Мутеины вырезали посредством расщепления в течение ночи при комнатной температуре с применением Factor Ха, полученного от New England Biolabs (Р8010), с применением добавления 1:500 (м/м) (в 1Хнатрий-фосфатном буфере). После расщепления, мутеины GDF15 очищали до более чем 95% гомогенности.
Получение слитых молекул зрелого GDF15. Мутеины hGDF15 также конструировали и очищали, в качестве слияний не с ЧСА посредством применения сигнального пептида IgK, слитого со зрелой (из 112 аминокислот) последовательности GDF15 (Фигура 1B). Зрелые мутеины очищали непосредственно из среды до более чем 95% гомогенности.
Получение зрелых негликозилированных молекул, которые подвергали бактериальному рефолдингу. Мутеины hGDF15, приведенные на Фигуре 4 (w29, w32, w52, w68 и w89), также полученные как бактериальные, подвергнутые рефолдингу из телец включения и очищенные до более чем 95% гомогенности, содержат зрелую (из 112 аминокислот) последовательность GDF15 (Фигура 1В) c N-концевым метионином.
Оценка растворимости мутеинов GDF15 человека. Растворимость мутеинов GDF15 оценивали с применением двух комплементарных анализов, результаты которых целиком дублируют один другого. В одном формате анализа, мутеины подвергали диализу в 1X натрий-фосфатном буфере и концентрированию с применением Amicon Ultra Centrifugal Filter, состоящих из Regenerated Nitrocellulose 10000 NMWL (UFC901096). После концентрирования, оценки растворимости проводили на спектрофотометре NanoDrop ND-1000, погашенном в 1X натрий-фосфатном буфере с помощью оптической плотности при 280 нм длины волны и закону Бера (коэффициент экстинкции = 14400, молекулярная масса = 12287 Да).). Во втором формате анализа, мутеины подвергали диализу в 0,05% (об./об.) муравьиной кислоты (рН 2,0) и концентрировали с применением Amicon Ultra Centrifugal Filter, состоящих из Regenerated Nitrocellulose 10000 NMWL (UFC901096) вплоть до и более чем 20 мг/мл. Начальную концентрацию каждого мутеина определяли с помощью поглощения при длине волны 280 нм и закона Бера (коэффициент экстинкции = 14400, молекулярная масса = 12287 Да). Каждый мутеин затем последовательно снова 2-кратно разбавляли в 0,01% муравьиной кислоты, а 90 мкл каждого разведения добавляли в 96-луночный планшет.10 мкл 10Х PBS добавляли в каждую лунку и подтверждали рН равный 7,3. После инкубации при комнатной температуре в течение ночи при встряхивании, измеряли мутность при 370 нм. Точка перегиба кривой, в которой мутность начинает появляться, принимается в качестве максимальной растворимости для каждого мутеина.
Анализ глюкозы в крови. Уровень глюкозы в крови из надреза на хвосте мыши измеряли с помощью тест-полосок ACCU-CHEK Active, считываемых с помощью измерителя ACCU-CHEK Active (Roche Diagnostics, Индианаполис, Индиана), следуя инструкции изготовителей.
Анализ уровня экспозиции мутеинов GDF15 в сыворотке. Цельную кровь (~50 мл/мышь) из надреза на хвосте мыши собирали в капиллярные трубки без резьбы (BD Clay Adams SurePrep, Becton Dickenson, Спаркс, Мэриленд). Сыворотку и клетки крови разделяли с помощью центрифугования пробирок в Autocrit Ultra 3 (Becton Dickinson, Спаркс, Мэриленд). Уровни экспозиции GDF15 в сыворотке определяли с применением Human GDF-15 Quantikine ELISA Kit (R&D Systems, Миннеаполис, Миннесота), следуя инструкции производителя.
Аналитическая гель-фильтрация. Увеличение гидродинамических радиусов построенных мутеинов GDF15 человека контролировали посредством поглощения А280 при временах элюирования (мин) на Agilent 1200-серий ВЭЖХ с применением колонки TSKgelG3000SWXL TOSOH Biosciences (7,8 мм ID X 30 см, 5 мкм), предварительно уравновешенной 1х забуференным фосфатом физиологическим раствором с расходом 1 мл/мин.
Получение зрелой молекулы GDF15 утконоса (Оа). Ссылаясь на Фигуру 17А, зрелый OaGDF15 конструировали из аминокислотной последовательности прекурсора, содержащей сигнальную последовательность, про-домен (вырезанный фурином сайт подчеркнут), а затем MatureOaGDF15 (жирный шрифт) (См. Фигуру 17А).
Конструкцию OaGDF15 временно трансфектировали в клетки Expi 293F (Invitrogen; Карлсбад, Калифорния) способом, как описано в данном документе в случае слитых молекул ЧСА-мутеин GDF15. Секретированный OaGDF15 очищали до более чем 95% гомогенности из клеточной среды. N-конец зрелой формы OaGDF15 подтверждали посредством анализа LC/MS.
Пример 1: Влияния слитой молекулы ЧСА - GDF15 на массу тела, потребление пищи и кровь натощак
Влияния подкожно введенной слитой молекулы, имеющей рекомбинантную ЧСА, слитую с рекомбинантным GDF15 человека на массу тела, потребление пищи и глюкозу в крови натощак, оценивали на 22 день периода после доставки. Вкратце, слитую молекулу, проиллюстрированную на Фигуре 1H (зрелый ЧСА слит с N-концом зрелого GDF15 человека посредством нерасщепляемого линкера 3x(4Gly-Ser) (SEQ ID NO: 64) вводили, при различных дозах, в виде однократной подкожной болюсной инъекции 7-15 недельным самцам ob/ob мышей, которые весят приблизительно 44 г и имеют уровни глюкозы в сыворотке не натощак приблизительно 340 мг/дл. После введения контроля растворителем (PBS) или слитой молекулы в дозах 0,04 мг/кг, 0,12 мг/кг, 0,4 мг/кг и 1,2 мг/кг, указанные параметры определяли в течение 22-дневного периода в дни 0, 2, 3, 6, 8, 15 и 22. Экспозицию в сыворотке контролировали с помощью Human GDF-15 Quantikine ELISA Kit (R&D Systems, Миннеаполис, Миннесота) следуя инструкциям производителей.
Слитая молекула демонстрирует улучшенное время полужизни в 37 часов по сравнению с временем полужизни в 2 часа в случае неконъюгированного, рекомбинантного GDF15 человека. Кроме того, в то время как растворимость GDF15 человека составляет менее чем 0,2 мг/мл в буфере контроля растворителем (1xPBS), слитая молекула улучшала растворимость до более, чем 50 мг/мл в буфере контроля растворителем (1xРВS).
Как проиллюстрировано на Фигуре 2, введение слитой молекулы в дозах 0,04 мг/кг, 0,12 мг/кг, 0,4 мг/кг и 1,2 мг/кг приводит к значительному улучшению массы тела (Фигура 2А), потребления пищи (Фигура 2В) и глюкозы крови не натощак (Фигура 2С) по сравнению с контролем растворителем. В каждой группе мышей, n=7 и p-величины (*, p<0,05; **, p<0,01; ***, p<0,001) определяли с помощью двухвыборочного критерия Стьюдента для независимых выборок, сравнивая массы тела, потребление пищи и глюкозу в крови групп при различных концентрациях с контрольной группой, получающей растворитель, в каждой указанной точке времени.
Ссылаясь на Фигуру 2А, 22 дня после введения слитой молекулы при указанных дозах по сравнению с 22 днями после введения контроля растворителем (pb/ob мышам, которым вводили PBS (52,5 г)) приводит к следующим снижениям массы тела: уменьшение на 1,7 г, включающее процентное уменьшение на 3,2% (н/у) в случае группы дозы 0,04 мг/кг; уменьшение на 1,8 г, включающее процентное уменьшение на 3,5% (н/у) в случае группы дозы 0,12 мг/кг; уменьшение на 1,9 г, включающее процентное уменьшение на 3,6% (*, p<0,05) в случае группы дозы 0,40 мг/кг; и уменьшение на 3,2 г, включающее процентное уменьшение на 6,1% (**, p<0,01) в случае группы дозы 1,2 мг/кг.
Прием пищи (грамм/животное/день) у ob/ob мышей, которым вводили контроль растворителем или слитую молекулу при указанных дозах, оценивали в различные моменты времени на протяжении времени наблюдения 22 дней после введения. Ссылаясь на 9-15-дневный период времени на Фигуре 2В, среднее потребление пищи, по сравнению с ob/ob мышами, которым вводили контроль растворителем (PBS) (7,88 г/животное/день), было следующим: среднее потребление пищи уменьшалось на 0,24 г/животное/день, что включает процентное уменьшение на 3,0% (н/у) в случае группы дозы 0,04 мг/кг; уменьшалось на 0,92 г/животное/день, что включает процентное уменьшение на 11,7% (н/у) в случае группы дозы 0,12 мг/кг; уменьшалось на 1,70 г/животное/день, что включает процентное уменьшение на 21,5% (**, p<0,01) в случае группы дозы 0,40 мг/кг; и уменьшалось на 2,31 г/животное/день, что включает процентное уменьшение на 29,3% (**, p<0,01) в случае группы дозы 1,2 мг/кг.
Глюкоза в крови не натощак (мг/дл) у ob/ob мышей, которым вводили контроль растворителем или слитую молекулу при указанных дозах, оценивали в различные моменты времени на протяжении времени наблюдения 22 дней после введения. Ссылаясь на Фигуру 2С, по сравнению с ob/ob мышами, которым вводили контроль растворителем (PBS) (день 8=357,4 мг/дл), глюкоза крови не натощак уровни в день 8 демонстрирует уменьшение на 3,9 мг/дл, что включает процентное уменьшение на 1,1% (н/у) в случае группы дозы 0,04 мг/кга; уменьшение на 62,7 мг/дл, что включает процентное уменьшение на 17,5% (н/у) в случае группы дозы 0,12 мг/кг; уменьшение на 106,1 мг/дл, что включает процентное уменьшение на 29,7% (*, p<0,05) в случае группы дозы 0,40 мг/кг; и уменьшение на 191,1 мг/дл, что включает процентное уменьшение на 53,5% (**, p<0,01) в случае группы дозы 1,2 мг/кг.
Данные на Фигуре 2 демонстрируют, что слияние ЧСА с GDF15 является активным, и что подобные слитые молекулы представляют собой жизнеспособный подход для повышения некоторых полезных свойств мутеинов GDF15. Указанные данные также показывают, что измерение указанных параметров может быть применимым в качестве платформы для высокопроизводительного скрининга мутеинов.
Пример 2: Улучшение свойств GDF15 посредством снижения поверхностной гиброфобности
В попытке определения способов улучшения физических свойств (например, растворимости и стабильности) зрелого GDF15 человека, набор из шести гидрофобных остатков, которые, как предполагают, являлись поверхностно доступными, мутировали в аланин в качестве средства повышения гидрофобности поверхности.
Получали слитые молекулы, причем каждая из шести последовательностей мутеина GDF15 была слитой с ЧСА посредством линкера, проиллюстрированного на Фигуре 1Н (нерасщепляемый линкер 3x(4Gly-Ser) (SEQ ID NO: 64); последовательности, приведенные на Фигуре 3, не иллюстрируют ни компонент ЧСА, ни линкерный компонент слитых молекул.
Слитые молекулы проверяли на экспрессию в качестве секретированных связанных дисульфидом гомодимеров. На Фигуре 4 приведены данные для каждой слитой молекулы. Первые две колонки определяли остаток зрелого GDF15 человека, который мутировал, третья колонка определяла те нативные остатки, которые были замещенные по аланину, а четвертая колонка показывала, является ли каждая получаемая слитая молекула экспрессированной в виде секретированного димера. Пять из шести снижающих гидрофобность мутеинов экспрессировали и секретировали в виде связанных дисульфидом гомодимеров и дополнительно оценивали на улучшения физических свойств (w65 не экспрессировалась в виде гомодимера и не осуществляли дополнительно).
Пример 3: Мутеины GDF15 человека с улучшенными характеристиками растворимости
Данные, представленные в Примере 2, применяли для того, чтобы рассмотреть ограничения растворимости, связанные с поверхностными гидрофобностями, присущими зрелому GDF15 человека. В дополнение к этому, оценивали влияние на растворимость при введении N-связанного гликозилированного консенсусного сайта(ов), наряду с последовательностью зрелого GDF15 человека.
Для того чтобы облегчить оценку растворимости и определение in vivo эффективности, зрелый, рекомбинантный GDF15 человека и мутеины GDF15 конструировали в виде N-концевой слитой молекулы ЧСА, содержащей протеолитический Factor Ха-чувствительный линкер (2x(4Gly-Ser), Factor Ха-расщепляемый линкер (SEQ ID NO: 56); как приведено на Фигуре 1F), для того, чтобы обеспечить удаление GDF15 или мутеина GDF15 из шаперона ЧСА с применением расщепления Factor Ха. Зрелый, рекомбинантный GDF15 человека и мутеины GDF15 были также построены с применением IgK в качестве сигнального пептида напрямую слитого со зрелой последовательностью hGDF15 из 112 аминокислот (Фигура 1В) или последовательностью мутеина, представляющего интерес; или в качестве бактериального рефолдинга мутеинов с N-концевым метионином. Оценки растворимостей осуществляли в 1X PBS, жестком буфере, для которых улучшение растворимости мутеина может быть оценено по сравнению со зрелым GDF15 человека (который имеет максимальную наблюдаемую растворимость <0,2 мг/мл в 1X PBS).
Оценку растворимости определяли, основываясь на поглощении при длине волны 280 нм и законе Бера, рассчитывали с применением коэффициента экстинкции (зрелый GDF15 человека = 14400/мономер) и молекулярной массы (зрелый GDF15 человека = 12278 Да/мономер). Мутеины классифицировали в одну из пяти групп в зависимости от уровня их растворимости: 0,0-0,2 мг/мл = +; 0,2-0,5 мг/мл = ++; 0,5-1,0 мг/мл = +++; 1,0-5,0 мг/мл = ++++; и >5,0 мг/мл = +++++.
Снижение поверхностной гидрофобности пяти мутеинов GDF15 (w29, w32, w52, w68 и w89), приведенных на Фигуре 5, оценивали посредством селективного мутагенеза гидрофобных остатков на аланин. Сравнение относительной растворимости указанных пяти мутеинов со зрелым GDF15 человека свидетельствовало о том, что w52 и w89 представляли собой только мутеины в указанном классе, который демонстрирует улучшенную растворимость (++) по сравнению со зрелым GDF15 человека (+). Другие три мутеина демонстрировали растворимость в пределах того же диапазона, что и зрелый GDF15 человека.
Снижение поверхностной гидрофобности GDF15 человека оценивали посредством селективного мутагенеза кислотных остатков на аланин пятью последовательностями, обозначенными на Фигуре 5 и обобщенными ниже: w113, w114, w115, w116 и w117. Сравнение относительной растворимости указанных пяти мутеинов со зрелым GDF15 человека, обозначенным w116, представлял собой только мутеин в указанном классе, который демонстрирует улучшенную растворимость (++) по сравнению со зрелым GDF15 человека (+). Из других четырех мутеинов, w113 и w115 демонстрировали растворимость в том же диапазоне, что и зрелый GDF15 человека, в то время, как мутеины w114 и w117 были нерастворимыми при применяемых условиях.
Далее, последовательность зрелого GDF15 человека оценивали на его способность обеспечивать введение N-связанного гликозилированного консенсусного сайта(ов). В указанном контексте, отдельная аминокислотная замена может передавать требуемый консенсусный сайт в пределах последовательности зрелого GDF15 человека, консенсусный сайт в случае N-связанного гликозилирования был определен как "Asn-Xxx-Ser/Thr", где "Ххх" не может быть остатком пролина. Основываясь на сканировании последовательности зрелого GDF15 человека, для того, чтобы обеспечивать введение N-гликанового консенсусного сайта определяли 14 возможных одноточечных мутеинов. Фигура 6 иллюстрирует последовательности 14 моногликозилированных мутеинов, а также дополнительных комбинаторных дигликозилированных мутеинов.
Перед тем, как оценивать растворимость, каждый из сконструированных N-гликановых мутеинов, указанных на Фигуре 6, оценивали как на секрецию в виде гомодимера GDF15, подверженного фолдингу, в культуральной среде ткани млекопитающих, так и на размещение N-гликанового сайта. Как приведено на Фигуре 7, десять из четырнадцати моногликозидированных мутеинов секретировали в виде подверженных фолдингу гомодимеров GDF15, в то время как мутеины w123, w125, w127 и w129 не приводили к образованию димера. Десять моно-гликозилированных мутеинов, котрые секретировали в виде гомодимеров, затем оценивали по LC/MS и SDS-PAGE задержке электрофоретического сдвига в геле для определения занятости N-гликановых групп на консенсусном сайте; два указанные мутеина (w121 и w124) демонстрировали низкую занятость и их растворимость в дальнейшем не оценивали.
Созданные N-гликановые мутеины GDF15, которые были и секретированными в качестве гомодимеров, и обладали высокой занятостью гликана в пределах консенсусного сайта, проверяли на улучшения растворимости, по сравнению со зрелым GDF15 человека. Как приведено на Фигуре 8А, каждый из N-гликановых мутеинов GDF15, который оценивали с применением анализа центрифугированием, задает формат продемонстрированной улучшенной растворимость, по сравнению со зрелым GDF15 человека: w118: +++; w120: ++++; w122: ++; w126: ++++; w128: ++++; w130: ++++; w131: ++++; w132n: ++++; w133: ++++; w134: ++++; w135: +++++; w136: ++++; w137: ++++; w138: +++++; w139: +++++; и w140: +++++. +++++. Как приведено Фигура 8B, каждый из N-гликановых мутеинов GDF15, которые оценивали с применением анализа мутности, задает формат продемонстрированной улучшенной растворимость, по сравнению со зрелым GDF15 человека: w120: ++++; w122: ++; w126: ++++; w128: ++++; w130: +++++; w131: ++++.
Высокую in vivo эффективность подтверждали для тех моногликозилированных мутеинов GDF15 человека, которые демонстрировали улучшенную растворимость, по сравнению со зрелым GDF15 человека.
Ссылаясь на Фигуру 9А, после подкожного введения однократной 0,3 мг/кг дозы зрелого GDF15 человека или N-гликанового мутеина 7-15 недельным самцам ob/ob мышей (n=7), потребление пищи (грамм/животное) контролировали в течение 16 часов в течение ночи, по сравнению с группой контроля растворителем (PBS). Оценивали три когорты мышей, а p-величины определяли с помощью двухвыборочного критерия Стьюдента.
Как показано на Фигуре 9А, в первой когорте мышей потребление пищи уменьшалось на в среднем 0,82 г/животное (процентное уменьшение составляет 17,3% (***, p<0,001)), в случае группы дозы зрелого GDF15 человека; уменьшалось на 0,16 г/животное (процентное уменьшение составляет 3,4% (н/у)) в случае группы дозы w120; уменьшалось на 0,87 г/животное (процентное уменьшение составляет 18,3% (***, p<0,001)) в случае группы дозы w128; уменьшалось на 0,77 г/животное (процентное уменьшение составляет 16,2% (***, p<0,001)) в случае группы дозы w130; и уменьшалось на 0,45 г/животное (процентное уменьшение составляет 9,4% (*, p<0,05)) в случае группы дозы wl31. Среднее потребление пищи в группе дозы контроля растворителем составляло 4,76 г/животное.
В случае второй когорты мышей, приведенных на Фигуре 9А, потребление пищи уменьшалось на в среднем 0,77 г/животное (процентное уменьшение составляет 17,1% (*, p<0,05)) в случае группы дозы GDF15 человека дикого типа; уменьшалось на 0,35 г/животное (процентное уменьшение составляет 7,9% (н/у)) в случае группы дозы w118; и уменьшалось на 0,59 г/животное (процентное уменьшение составляет 13,0% (*, p<0,05)) в случае группы дозы w126. Среднее потребление пищи группы дозы контроля растворителем составляло 4,53 г/животное.
В случае третьей когорты мышей, приведенных на Фигуре 9А, потребление пищи уменьшалось на в среднем 1,10 г/животное (процентное уменьшение составляет 23,4% (***, p<0,001)) в случае группы дозы GDF15 человека дикого типа; и уменьшалось на 1,29 г/животное (процентное уменьшение составляет 27,4% (***, p<0,001)) в случае группы дозы w122. Среднее потребление пищи в группе дозы контроля растворителем составляло 4,70 г/животное.
Ссылаясь на Фигуру 9В, после 8-часового подкожного введение однократной 1,0 мг/кг дозы растворителя PBS на голодный желудок, зрелый GDF15 человека или N-гликановый мутеин давали 17-недельным DIO самцам мыши (n=9). Потребление пищи после возобновления питания (грамм/животное) за 16 часов в течение ночи контролировали по сравнению с группой контроля растворителем (PBS). Р-величины определяли с помощью двухвыборочного критерия Стьюдента. Ссылаясь на Фигуру 9В, проверяли уменьшения потребления пищи и сообщали о них, по сравнению с растворителем PBS. В случае группы дозы зрелого GDF15 человека (***; р=0,0000003), w122 (***; р=0,000006), w120 (***; р=0,00003), w118 (***; р=0,000001), w126 (***; р=0,000008), w128 (н/у; p>0,05), w130 (***; р=0,0000005) и w131 (н/у; p>0,05).
Пример 4: Аналитический анализ с помощью гель-фильтрации созданных N-гликановых мутеинов GDF15
Гидродинамические радиусы N-гликановых мутеинов GDF15 по сравнению со зрелым GDF15 человека оценивали с применением аналитической гель-фильтрационной хроматографии (См. Фигуру 10). Для оценки применяли аналитическую колонку TOSOH Biosciences TSKgelG3000SWXL (7,8 мм ID X 30 см, 5 мкм) для определения размеров, предварительно уравновешенную IX натрий-фосфатном буфере с расходом 1 мл/мин. Два мкг каждого мутеина GDF15 инъектировали в объеме 20 мкл (0,1 мг/мл), а времена элюирования записывали при максимальной оптической плотности во время извлечения колоколообразной кривой посредством измерения при 280 нм.
Аналитическая гель-фильтрационная хроматография зрелого GDF15 человека показала элюирование неаггрегированного, связанного дисульфидом гомодимера при 10,837 минут (Фигура 10). Каждый из N-связанных гликановых мутеинов повышал гидродинамические радиусы связанного дисульфидом димера GDF15 человека. Таким образом, каждый мутеин может потенциально служить в качестве отправной точки для создания молекул, имеющих, например, предпочтительное in vivo время полужизни.
Пример 5: Экспрессия ортологов GDF15 с применением ЧСА в качестве слитого партнера
Данные, представленные в Примере 5, подчеркивают применимость ЧСА в качестве слитого партнера для экспрессии и очистки ортологов GDF15 и других членов семейства BMP.
Фигура 11А иллюстрирует аминокислотные последовательности слитых молекул, содержащих ЧСА, имеющую сигнальную последовательность IgK (сигнальная последовательность подчеркнута; SEQ ID NO: 53), слитую с N-концом ортологов видов зрелого GDF15 Mus musculus (жирный шрифт; SEQ ID NO: 54) и Масаса mulatta (жирный шрифт; SEQ ID NO: 55), посредством расщепляемого линкера (жирный шрифт и подчеркнута; SEQ ID NO: 56). Фигура 11В иллюстрирует аминокислотные последовательности слитых молекул, содержащих ЧСА, имеющую сигнальную последовательность IgK (сигнальная последовательность подчеркнута; SEQ ID NO: 53), слитую с N-концом зрелого TGF-β1 человека (жирный шрифт; SEQ ID NO: 59) и зрелого ВМР2 человека (жирный шрифт; SEQ ID NO: 60), посредством расщепляемого линкера (жирный шрифт и подчеркнута; SEQ ID NO: 61).
Профили в случае GDF15 мыши (NP_035949.2) и GDF15 макаки (ЕНН29815.1) дублируют таковые в случае GDF15 человека в том, что они, в контексте слияния ЧСА, были экспрессированы и очищены как гомодимеры, подверженные фолдингу. Расщепление с помощью Factor Ха очищенных слитых конструкций ЧСА и высвобождение/очистка ортологов GDF15 выявили гомодимеры с физическими свойствами, эквивалентными таковым последовательности человека (данные не приведены). Гомология зрелых форм в случае каждой молекулы GDF15 мыши и макаки, по сравнению с последовательностью человека, составляет 67% и 95% соответственно, что указывает на то, что матрица слитой молекулы ЧСА может обеспечить разнообразие последовательности партнера слияния GDF15.
Свойства фолдинга и секреции, как кажется, будут изменены для более низкой гомологии последовательностей, по сравнению с GDF15 человека в случае членов семейства, таких как молекулы BMP класса и TGF-β класса. Действительно, при условии, что экспрессия была предпринята в матрице ЧСА в случае секреции, которая была устойчивой в случае GDF15 человека, мыши и макаки; ВМР2 человека (27% идентичности последовательности, по сравнению с GDF15 человека) и TGF-β1 человека (22% идентичности последовательности, по сравнению с GDF15 человека) проявляет плохие свойства фолдинга и секреции (Фигура 12).
Способность GDF15 человека экспрессироваться и секретироваться в качестве полнофункциональной и биологически активной молекулы может быть дополнена с применением полипептида, имеющего 45% идентичности аминокислотной последовательностис GDF15 человека (например, таких как GDF15 мыши и макаки). Способность экспрессировать и очищать HAS, слитую с N-концом GDF15 человека (или тесно связанными молекулами), содержащую линкер вариабельной длины и композицию, имеет прямое значение для полезных улучшений в фармацевтических свойствах GDF15, таких как растворимость, профиль экспрессии, состав и стабильности.
Пример 6: Идентификация остатков, поддающихся мутагенезу в пределах GDF15 человека, делающих возможным конструирование для улучшения физических свойств
Осуществляли полное сканирование на аланин, в котором каждая аминокислота в пределах зрелой последовательности GDF15 человека индивидуально мутировала в аланин (за исключением остатков цистеина таким образом, чтобы поддержать цистеин-узловую структуру/фолдинг GDF15). Последовательности каждого мутеина приведены на Фигуре 13, а результаты экспрессии детализированы на Фигуре 14. Каждый мутеин, приведенный на Фигуре 14, очищали и оценивали на физические свойства, в том числе гомо-димерный фолдинг и агрегатное состояние.
Результаты сканирования на аланин свидетельствовали о том, что GDF15 человека поддается мутагенезу по всем остаткам, за исключением пяти мутеинов; w36, w46, w62, w65 и w83 (или, дополнительно, введение нового гликозилированного консенсусного сайта(ов), как определено на Фигуре 7: w123, w125, w127 или w129). Все другие мутеины экспрессировались, подвергались фолдингу и секретировались аналогично тому, как и дикого типа GDF15 человека.
Идентификация специфических остатков в пределах GDF15, которая может обеспечивать мутагенез, как описано в данном документе, помогает в разработке и проектировании молекулы GDF15 с улучшенными физическими свойствами. Указанные свойства содержат, но не ограничиваясь этим, коррекцию нежелательных сайтов in vivo и/или in vitro протеолиза; и/или сайтов химических неоднородностей, таких как дезамидирование, дегидратация, формирования сукцинимида и/или сайтов окисления; что может привести к инактивации лекарственного средства и/или сниженной активности.
Экспериментально определенные химические неоднородности, вытекающие из ускоренных исследований стабильности (данные не приведены) зрелой последовательности GDF15 человека, демонстрируют доказательства случаев дезамидирования, происходящих на сайтах N3, Q40, Q51, N56, Q60, N84, Q90 и Q95; и случаев окисления, происходящих на сайтах W29, W32, М43, М57 и М86.
Результаты сканирования на аланин и идентификации сайтов, способных к мутагенезу, могут быть применены для получения сконструированных конструкций таким образом, чтобы улучшить и изменить проявленные химические неоднородности.
Например, идентификация сайтов, поддающихся мутагенезу, может быть применена для того, чтобы изменить событие дезамидирования, которое происходит на N3 в пределах зрелой последовательности GDF15. Показав, что N3 поддается мутагенезу без ущерба, как проиллюстрировано с помощью мутации N3A, описанной выше, разумно ожидать, что на указанном сайте, таком как N3Q, N3E, N3T или N3S, могут быть замещены другие аминокислоты. Аминокислоты, подходящие для замены, могут быть идентифицированы с помощью, например, выравнивания GDF15 человека с не принадлежащим человеческому роду ортологом (например, Otolemur garnettii (ХР_003796612.1; например, N3T) или Felis catus (ХР_003982125.1; например, N3S). В конце концов, событие дезамидирования по N3 создает не встречающийся в природе остаток аспартата в положении 3, что может привести к изомеризации изоаспартата в связи с присутствием G4 непосредственно на С-конце к событию дезамидирования (то есть, Asp-Gly сайт). Дезамидирование по N3 может быть предотвращено с помощью мутирования партнера изомеризации Gly в Pro (G4P), для того, чтобы нарушить образование пары Asp-Gly. Кроме того, дезамидирование может быть предотвращено посредством образования N-связанного гликозилированного сайта на N3 посредством мутагенеза D5, например, до D5T или D5S. Дополнительно, дезаминирование может быть осуществлено с помощью усечения N-конца зрелого GDF15 с помощью удаления первых 3 остатков (ΔA1-N3), 4 остатков (ΔA1-G4), 5 остатков (ΔA1-D5), 6 остатков (ΔА1-Н6) или более.
Основываясь на результатах мутагенеза сканирования на аланин, описанных выше, и применяя подобный анализ по отношению к сайту N3, корректирующие мутации других наблюдаемых сайтов в неоднородности в пределах зрелой последовательности GDF15 человека содержат, но не ограничиваясь этим: N3A, N3Q, N3E, N3S, N3T, G4P, D5S, D5T, Q40A, Q40E, Q40D, Q40H, М43А, M43V, M43F, Q51A, Q51E, Q51L, Q51H, N56A, N56S, М57А, M57I, М57Т, Q60A, Q60L, N84A, N84E, N84Q, N84T, М86А, M86V, Q90A, Q90E, Q90E, Q90H, Q95A, Q95E, Q95D, Q95H, Q95T, Q95S.
Данные отражают в Примере 6 выделенные остатки, которые поддаются мутагенезу таким образом, чтобы существенно не повлиять на фолдинг или секрецию GDF15, при условии, что экспрессирован в виде слитого белка, содержащего ЧСА, слитую с N-концом зрелого GDF15 с нерасщепляемым линкером.
Пример 7: Экспрессирование молекул, содержащих N-концевые, слитые с GDF15, с улучшенной растворимостью, увеличенным временем полужизни
Оценивали влияние на растворимость введения генетических слияний с N-концом зрелого GDF15 человека. Данные, отраженные в Примере 7, получали с применением некоторых слитых конструкций, схематически проиллюстрированных на Фигуре 15А и имеющие аминокислотные последовательности, приведенные на Фигурах 15В-15Е.
Фигура 15В представляет собой слитую молекулу, содержащую сигнальную последовательность (подчеркнута) - Fc, слитую с N-концом зрелого GDF15 (жирный шрифт) посредством линкера 3X(Glu-3Gly-Ser) (жирный шрифт и подчеркнута).
Фигура 15С представляет собой слитую молекулу, содержащую сигнальную последовательность [подчеркнута] заряженной пары -(Fc(+)GDF15/Fc(-), содержащей Fc(+)-3X(Glu-3Gly-Ser)-GDF15 и Fc(-), где заряженные пары Fc(+)GDF15/Fc(-) были разработаны в виде слияния Fc(+)GDF15, содержащего положительно заряженные мутации в домене Fc (D356K и D399K, подчеркнут и жирный шрифт на Фигуре 15С, который может быть сотрансфектирован с доменом Fc(-), содержащим отрицательно заряженные мутации в домене Fc (K392D и K409D), подчеркнут и жирный шрифт на Фигуре 15С.
Фигура 15D представляет собой слитую молекулу, содержащую связывающий альбумин домен (ДСА), слитый с N-концом GDF15 (жирный шрифт) посредством линкера 5XGly (жирный шрифт и подчеркнут); N-концевой метионин подчеркнут.
Фигура 15Е представляет собой слитую молекулу, содержащую сигнальную последовательность (подчеркнута) - мальтозосвязывающий домен (МСД), слитый с N-концом GDF15 (жирный шрифт) посредством расщепляемый энтерокиназой линкер 5XGly (жирный шрифт и подчеркнут).
Ссылаясь на слитые конструкции, описанные выше, те, которые содержат Fc и МСД, были непосредственно очищены от временно трансфектированной клеточной культуры 293. Слитый ДСА экспрессировали и очищали таким образом, что и зрелый GDF15 из бактериально экспрессированных телец включения.
В случае гомодимерной слитой конструкции Fc (FcGDF15), наблюдаемая секретированная форма была составлена из высокомолекулярных окисленных агрегатов в культуральной среде. Чтобы обойти эту наблюдаемую агрегацию, заряженные пары Fc(+)GDF15/Fc(-) были разработаны в виде слияния Fc(+)GDF15, положительно заряженные мутации в домене Fc (D356K и D399K), который может быть сотрансфектирован с доменом Fc(-), содержащим отрицательно заряженные мутации в домене Fc (K392D и K409D).
Оценку растворимостей ДСА-GDF15, МСД-GDF16 и GDF15 человека (контроль) осуществляли в 1X PBS, жестком буфере, в случае которого улучшения в растворимости мутеина могут быть оценены по сравнению со зрелым GDF15 человека (который имеет максимальную наблюдаемую растворимость <0,2 мг/мл). Оценку растворимости определяли, основываясь на поглощении при длине волны 280 нм и законе Бера, рассчитывали с применением коэффициента экстинкции и молекулярной массы для каждой соответствующей слитой молекулы. Концентрации А280 подтверждали количественным анализом белкаметодом Бредфорда при 595 нм, по сравнению с нормальным контроем БСА. Слитые молекулы классифицировали в одну из пяти групп в зависимости от уровня их растворимости: 0,0-0,2 мг/мл = +; 0,2-0,5 мг/мл = ++; 0,5-1,0 мг/мл = +++; 1,0-5,0 мг/мл = ++++; и >5,0 мг/мл = +++++. Каждая из экспрессированных и очищенных слитых молекул, которые оценивали, демонстрировали улучшенную, по сравнению со зрелым GDF15 человека, растворимость: hGDF15: +; ДСА-GDF15: +++++; МСД-GDF15: ++++ (См. Фигуру 16 (панель А)).
Снижение массы тела в течение 15 дней подтверждали in vivo в случае слияния ДСА, которое продемонстрировало улучшенную растворимость, по сравнению со зрелым GDF15 человека. После подкожного введения однократной 3 мг/кг дозы ДСА-GDF15 10-недельным самцам ob/ob мышей (n=6), массу тела (грамм/животное) в течение 15 дней контролировали по сравнению с контрольной группой, получающей растворитель, а p-величины определяли с помощью двухфакторного дисперсионного анализа (*=p<0,05; **=P<0,01; ***=p<0,001). В случае ДСА-GDF15, значительное снижение массы тела наблюдали на 15 день, что свидетельствует о молекуле с расширенной эффективностью. Последующее профилирование РK молекулы ДСА-GDF15 у ob/ob мышей при дозе 0,3 мг/кг и 3 мг/кг подкожно и контроль временных точек, взятых в течение двух недель (данные не приведены), демонстрируют Т1/2 в 54,2 часа (0,3 мг/кг) и 28,4 часа (3 мг/кг) (и См. Фигуру 16 (панель В)).
Пример 8: Экспрессия рекомбинантного белка ортолога GDF15 утконоса и влияния на потребление пищи и массу тела у DIO мышей
Данные, отраженные в Примере 8, иллюстрируют применимость конструирования и экспрессию биологически активных ортологов GDF15 с применением сигнального пептида и фурин-расщепляемого продомена.
Зрелый GDF15 утконоса (Ornithorhynchus anatinus (Оа); AFV61279) получали рекомбинантно, как описано в данном документе с применением конструкции, проиллюстрированной на Фигуре 17А. Зрелый полипептид GDF15 утконоса демонстрирует ~45% идентичности со зрелым полипептидом GDF15 человека.
Влияние на потребление пищи и снижение массы тела в течение ночи определяли у 17 недельных DIO мышей (n=8) после однократной подкожной дозы 0,001, 0,003, 0,01, 0,03, 0,1, 0,3 и 1,0 мг/кг зрелого OaGDF15. Помимо этого, зрелый полипептид GDF15 утконоса демонстрирует только 45% идентичности последовательности со зрелым полипептидом GDF15 человека, аналогичное in vivo влияние наблюдали на снижение потребления пищи (OaGDF15 = 0,03 мг/кг; hGDF15 = 0,04 мг/кг) и снижение массы тела (OaGDF15 = 0,04 мг/кг; hGDF15 = 0,01 мг/кг), основанные на разницах перед введением дозы по отношению к 24 часам после введения дозы, соответственно (См. Фигуру 17В (кривые связывания в случае GDF15 человека не показаны).
В данном документе описаны конкретные варианты реализации изобретения по изобретению, в том числе лучший режим, известный изобретателям для осуществления изобретения. После прочтения вышеизложенного, описание, вариации описанных вариантов реализации изобретения могут стать очевидными для лиц, работающих в данной области техники, и ожидается, что специалисты в данной области техники могут применять такие вариации в зависимости от обстоятельств. Соответственно, предполагается, что изобретение может быть осуществлено иначе, чем конкретно описано в данном документе, и что изобретение включает все модификации и эквиваленты объекта изобретения, изложенного в прилагаемой формуле изобретения, в соответствии с действующим законодательством. Кроме того, изобретением охватывается любая комбинация вышеописанных элементов во всех возможных вариантах, если иное не указано здесь или явно не противоречит контексту.
Все публикации, патентные заявки, инвентарные номера и другие ссылки, приведенные в данном описании, включены посредством ссылки таким образом, как если бы каждая отдельная публикация или патентная заявка были конкретно и индивидуально указаны как включенные посредством ссылки.
Реферат
Изобретение относится к области биотехнологии, конкретно к получению мутеинов фактора дифференцировки роста (GDF15) и их конъюгатов, и может быть использовано в медицине. Полученные мутеины GDF15 имеют повышенную растворимость по сравнению с природным GDF15 и используются для приготовления фармацевтических композиций для эффективного лечения ожирения и гипергликемии. 14 н. и 13 з.п. ф-лы, 34 ил., 8 пр.

Комментарии