Кодон-оптимизированная рекомбинантная плазмида, способ стимуляции регенерации периферического нерва, способ лечения поврежденного нерва человека - RU2558294C1
Код документа: RU2558294C1
Чертежи




Описание
Предшествующий уровень техники
По разным данным, частота встречаемости повреждений периферических нервов различной этиологии составляет 3-10% [1-3]. Актуальность разработки дополнительных методов лечения, способных повысить качество стандартных, обусловлена длительностью восстановительного периода (год и более) и значительным снижением качества жизни пациентов трудоспособного возраста и высокой частотой инвалидизации. Травма периферического нерва является частой причиной потери профессии. Выбор способа восстановления целостности периферического нерва обусловлен рядом особенностей повреждения в каждом конкретном случае: механизм травмы, время, прошедшее от момента получения травмы до выполнения хирургического пособия, протяженность дефекта периферического нерва и т.д. Одним из видов реконструктивного лечения является сшивание культей пересеченного нерва за счет создания анастомоза конец-в-конец. Однако часто травма периферического нерва сопровождается образованием дефекта различной протяженности, вследствие чего такой подход невозможен. В этой ситуации "золотым стандартом" восстановления целостности нерва является использование аутонервной вставки для устранения протяженного дефекта. В качестве аутовставки может быть использован функционально менее значимый нерв. В качестве альтернативы могут быть использованы различные кондуиты, которые представляют собой тубулированные структуры, предназначение которых заключается в устранении протяженного дефекта тканей и создании благоприятных условий для регенерации периферического нерва.
Степень восстановления функции иннервируемой конечности после хирургического восстановления целостности периферического нерва зависит от множества факторов: время, прошедшее с момента травмы до операции, протяженность дефекта, расстояние от места травмы периферического нерва до иннервируемой области и т.д. Однако, несмотря на развитие техники восстановления целостности нерва, даже при самых благоприятных условиях, как правило, происходит лишь частичное восстановление функции иннервируемой конечности. Это побуждает к поиску новых методов лечения, которые позволили бы улучшить результаты стандартного реконструктивного лечения и качество жизни пациентов в целом.
Одним из таких направлений является применение факторов роста с целью индукции регенерации периферического нерва. Данная концепция появилась в результате накопления данных о значимой роли факторов роста в естественном процессе регенерации периферических нервов [4].
Одним из наиболее хорошо изученных факторов роста, влияющих на восстановление периферических нервов, является сосудистый эндотелиальный фактор роста (VEGF). VEGF является одним из основных регуляторов ангиогенеза и васкулогенеза. VEGF - это димерный 34-42 кДа дисульфид-связанный гликопротеин. VEGF-A является специфичным митогеном для эндотелиальных клеток (ЭК). VEGF индуцирует пролиферацию ЭК, их активацию, дифференцировку и формирование ими капиллярных трубочек, ремоделирующихся в дальнейшем в зрелые сосуды. Он также является мощным фактором повышения выживаемости ЭК, так как индуцирует экспрессию антиапоптозных белков. Делеции генов, кодирующих VEGF, приводят к серьезным дефектам и неправильному развитию сердечно-сосудистой системы, что несовместимо с жизнью.
Ген VEGF человека расположен в хромосомном локусе 6р21.3. Кодирующая область охватывает около 14 т.п.н. VEGF существует в нескольких изоформах: VEGF 121, VEGF 145, VEGF 148, VEGF 165, VEGF 183, VEGF 189, VEGF 206, образуемых в результате альтернативного сплайсинга мРНК, которая состоит из 8-ми экзонов. Каждой изоформе VEGF соответствует определенная внеклеточная локализация, основанная на их биохимических различиях в способности связывать гепарин- и гепаран-сульфат. Так, все транскрипты гена VEGF-A у человека содержат экзоны 1-5 и 8, различия же обусловлены альтернативным сплайсингом экзонов 6 и 7.
Долгое время после открытия VEGF фактор рассматривался лишь как индуктор ангиогенеза и потенциальный терапевтический агент для лечения различных заболеваний, сопровождающихся ишемией тканей. Однако с течением времени были получены данные о его нейропротективных свойствах в отношении как нейронов периферической нервной системы, так и центральной [5, 6]. VEGF индуцирует пролиферацию Шванновских клеток, астроцитов, микроглии, нейронов коры головного мозга [7-10]. На модели травмы с пересечением седалищного нерва у крысы было показано значительное увеличение экспрессии VEGF и Flt-1 (рецептор VEGF II типа) в спинном мозге на уровне поясничного отдела позвоночника в ответ на повреждение [11]. Таким образом, появились предпосылки для применения данного фактора роста в качестве дополнительного терапевтического компонента реконструктивного лечения повреждений периферических нервов. Применение VEGF в составе матригеля, заполняющего кондуит, индуцирует спрутинг аксонов, что проявляется увеличением количества аксонов в кондуите на единицу площади поперечного среза [12]. Использование гранул полимолочной кислоты с VEGF в графте, выполненном из аутовены, на модели травмы с протяженным дефектом малоберцового и большеберцового нервов, достоверно улучшает функциональный индекс нервов и увеличение количества миелиновых волокон в графте [13]. VEGF в эксперименте индуцирует деление и миграцию Шванновских клеток в графте в дистальном направлении, что коррелирует с увеличением количества капилляров и миелиновых волокон [14]. Введение VEGF в комбинации с BDNF в кавернозные тела, на модели травмы кавернозного нерва крысы, приводило к восстановлению утраченной иннервации и эректильной функции [15].
Другим фактором, обладающим свойствами индуктора нейрогенеза, является FGF. FGF индуцирует деление, пролиферацию и миграцию Шванновских клеток при травме периферического нерва [16]. В эксперименте на животных было показано, что блокирование рецепторов к FGF, Fgfr1 и Fgfr2, приводит к нейропатии немиелиновых сенсорных волокон и значительному снижению температурной чувствительности [17]. Применение стволовых клеток костного мозга на модели травмы периферического нерва демонстрировало увеличение экспрессии FGF, что, по мнению авторов, индуцировало миграцию и пролиферацию Шванновских клеток [18]. На модели травмы спинного мозга на уровне грудного отдела, использование FGF в составе графта, выполненного из седалищного нерва, способствовало восстановлению двигательной функции верхних конечностей [19]. Таким образом, основываясь на экспериментальных данных, можно предполагать, что использование данных факторов роста в составе комплексной терапии при реконструкции повреждений периферических нервов может быть эффективно.
Однако, как известно, применение факторов роста с терапевтической целью имеет ряд ограничений. При их введении в область повреждения они подвергаются быстрому разрушению, ввиду чего нет возможности поддержания постоянной концентрации для достижения желаемого терапевтического эффекта [20]. В связи с этим вырос интерес к применению генной терапии. По механизму трансфера гена, кодирующего терапевтический агент, можно выделить два основных направления - использование вирусных векторов и невирусных. Однако использование вирусных векторов в клинике, несмотря на высокую трансфекционную активность, ограничено ввиду опасности развития инсерционного мутагенеза, воспалительного ответа и токсичности. Более безопасным методом осуществления генного трансфера является применение плазмидной ДНК. На модели реконструкции кожно-мышечного нерва путем создания анастомоза конец-в-конец и конец-в-бок интраоперационное введение плазмиды, содержащей последовательность гена VEGF, в дистальную культю приводило к достоверному увеличению количества миелиновых волокон на единицу площади поперечного среза участка дистальнее места анастомоза, что коррелировало со значительным увеличением концентрации VEGF в Шванновских клетках [21]. Геннотерапевтическая конструкция может также вводиться параневрально. На модели травмы седалищного нерва plVEGF вводилась внутримышечно и использовалась в комбинации с пленками гиалуроновой кислоты, которыми покрывался анастомоз с целью уменьшения выраженности рубцового процесса. Внутримышечное введение препарата сопровождалось достоверным увеличением амплитуды мышечного ответа и увеличения количества миелиновых волокон дистальнее анастомоза относительно использования их по отдельности [22]. В исследовании Wang F. et al. был показан дозозависимый эффект plVEGF при введении геннотерапевтической конструкции интраневарально после сшивания культей седалищного нерва конец-в-конец. При применении большей дозировки был получен наиболее выраженный прирост нейрофизиологических показателей, меньшее снижение индекса массы икроножной мышцы [23]. Был выявлен синергизм в действии некоторых факторов. Так комбинированное применение плазмиды, кодирующей ген VEGF, и плазмиды, кодирующей ген C-CSF, на модели травмы седалищного нерва продемонстрировало более выраженное увеличение количества миелиновых волокон и капилляров в участке дистальнее анастомоза конец-в-конец, сохранение большего количества нейронов в спинномозговом ганглии, а также раннее восстановление двигательной функции [24]. Однако при использовании геннотерапевтических препаратов in vivo только часть клеток трансфицируется плазмидной ДНК. Вследствие этого шанс того, что клетка будет одновременно трансфицированна двумя разными геннотерапевтическими конструкциями, снижается. Таким образом, является целесообразным объединение генетических последовательностей двух факторов, обладающих синергизмом действия, в составе одной плазмиды. Эффективность использования данного подхода уже была продемонстрирована на животных с моделью контузионной травмы спинного мозга. В ходе данного эксперимента было показано, что на фоне прямого введения в спинной мозг 40 мкг плазмиды, содержащей гены VEGF и FGF2, определяется достоверное увеличение количества капилляров на срезах, сделанных на расстоянии 1,5 см от эпицентра травмы. Также по данным поведенческого теста определялось достоверное улучшение восстановления двигательной функции относительно животных группы сравнения, которые не получали плазмиду с генами VEGF и FGF2. На основании полученных результатов исследователями был сделан вывод, что применение данной двухкассетной плазмиды улучшает васкуляризацию спинного мозга и уменьшает площадь деструкции серого и белого вещества спинного мозга [25]. Однако данные результаты не дают никакого представления о возможной эффективности применения двухкассетной плазмиды с генами VEGF и FGF2 при повреждениях периферических нервов. Это обусловлено тем, что механизм контузионной травмы значительно отличается по патогенезу, степени тяжести от травмы, сопровождающейся невротмезисом, которая наиболее характерна для периферических нервов и преобладает в общей структуре их повреждений. Но самое главное отличие заключается в разном регенеративном потенциале спинного мозга и периферических нервов. Таким образом, необходимо определить, возможно ли применение плазмид с генами факторов роста для эффективного улучшения регенерации периферических нервов.
Перечень иллюстраций
Рис. 1. Повторный доступ. Визуализируется целостный седалищный нерв с аутонервной вставкой.
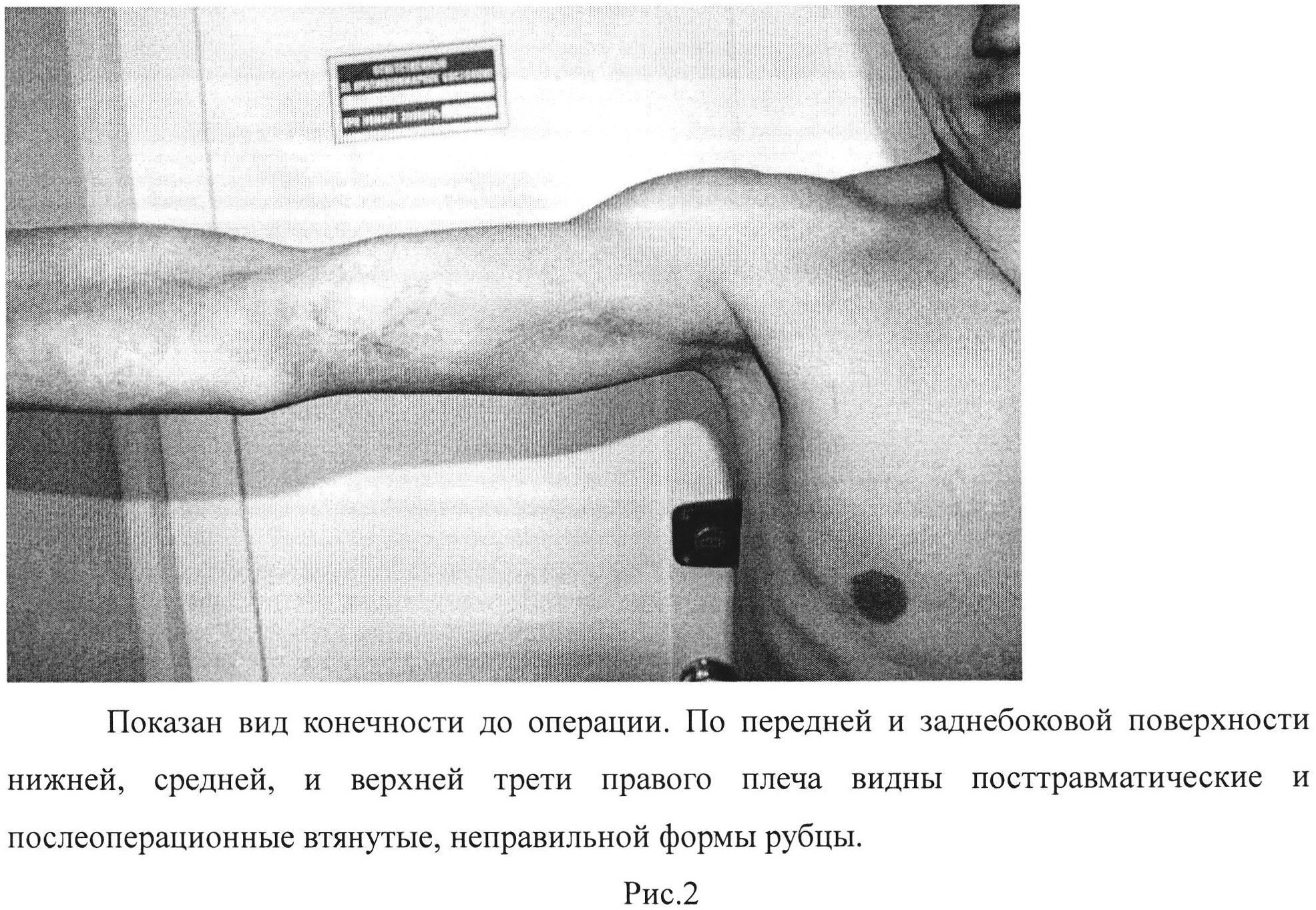
Рис. 2. Показан вид конечности до операции. По передней и заднебоковой поверхности нижней, средней и верхней трети правого плеча видны посттравматические и послеоперационные втянутые, неправильной формы рубцы.
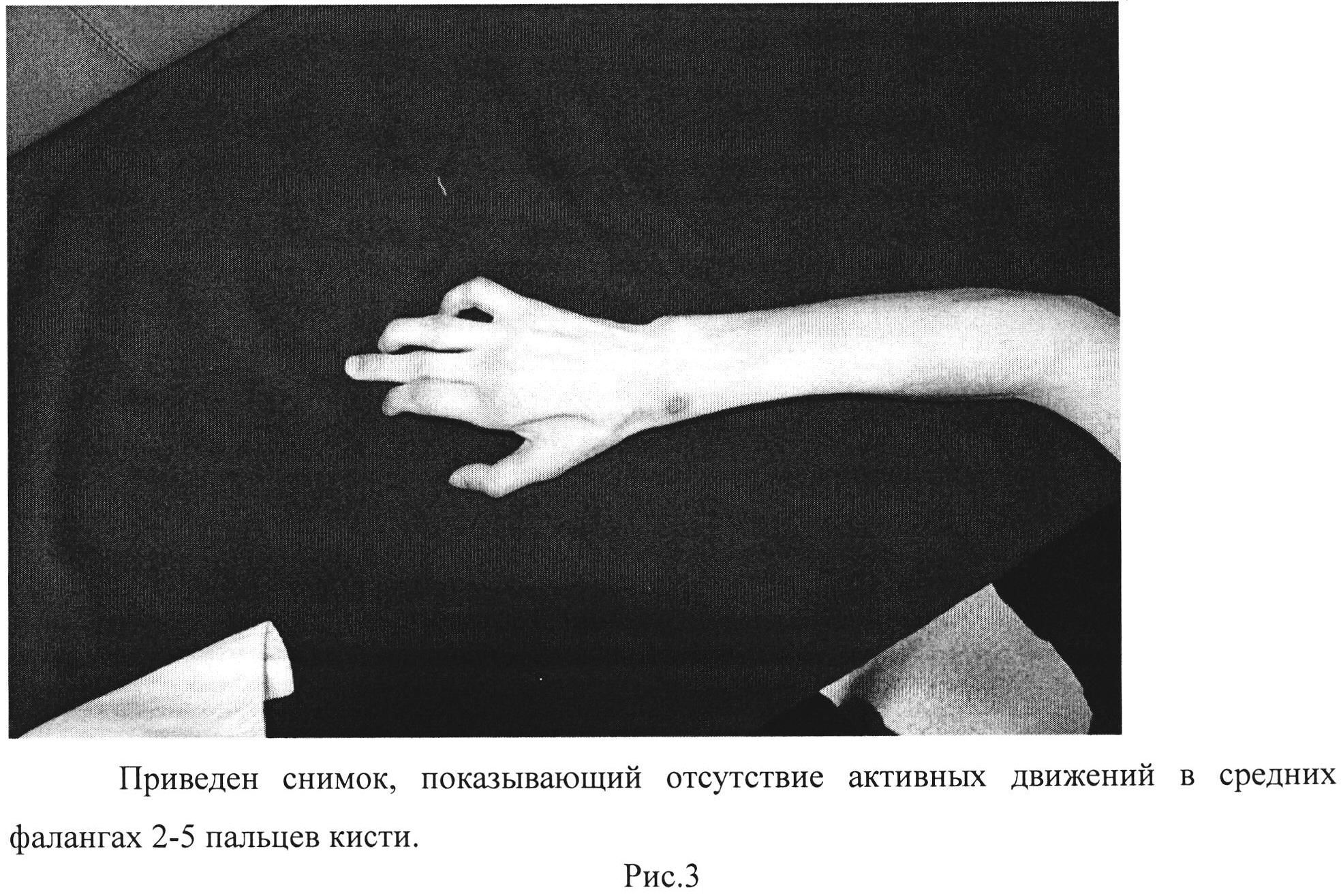
Рис. 3. Приведен снимок, показывающий отсутствие активных движений в средних фалангах 2-5 пальцев кисти.
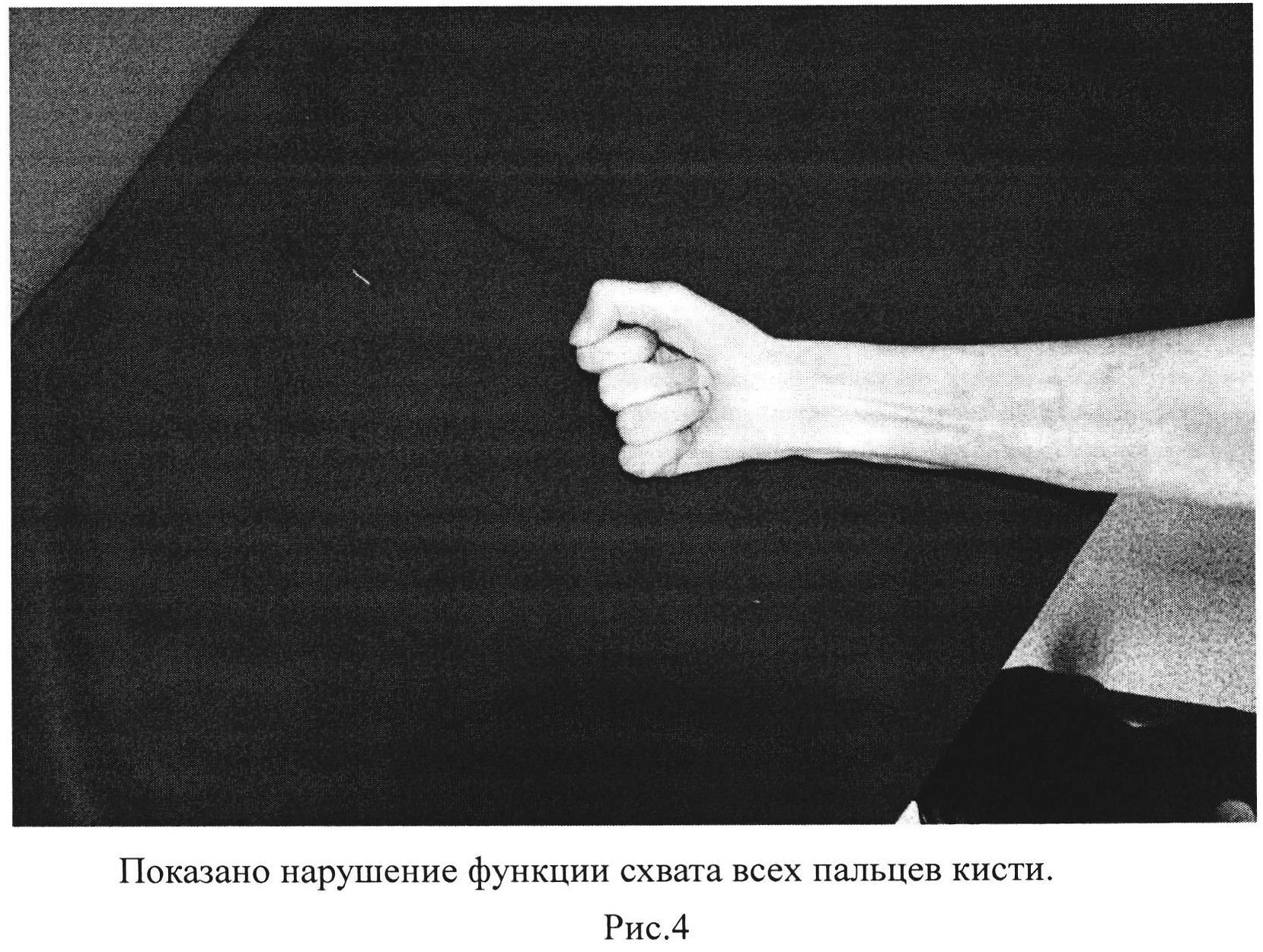
Рис. 4. Показано нарушение функции схвата всех пальцев кисти.
Рис. 5. Демонстрация выраженной гипотрофии мышц кисти в зоне иннервации срединного и локтевого нерва, возможность противопоставления 1 пальца только 2 пальцу.
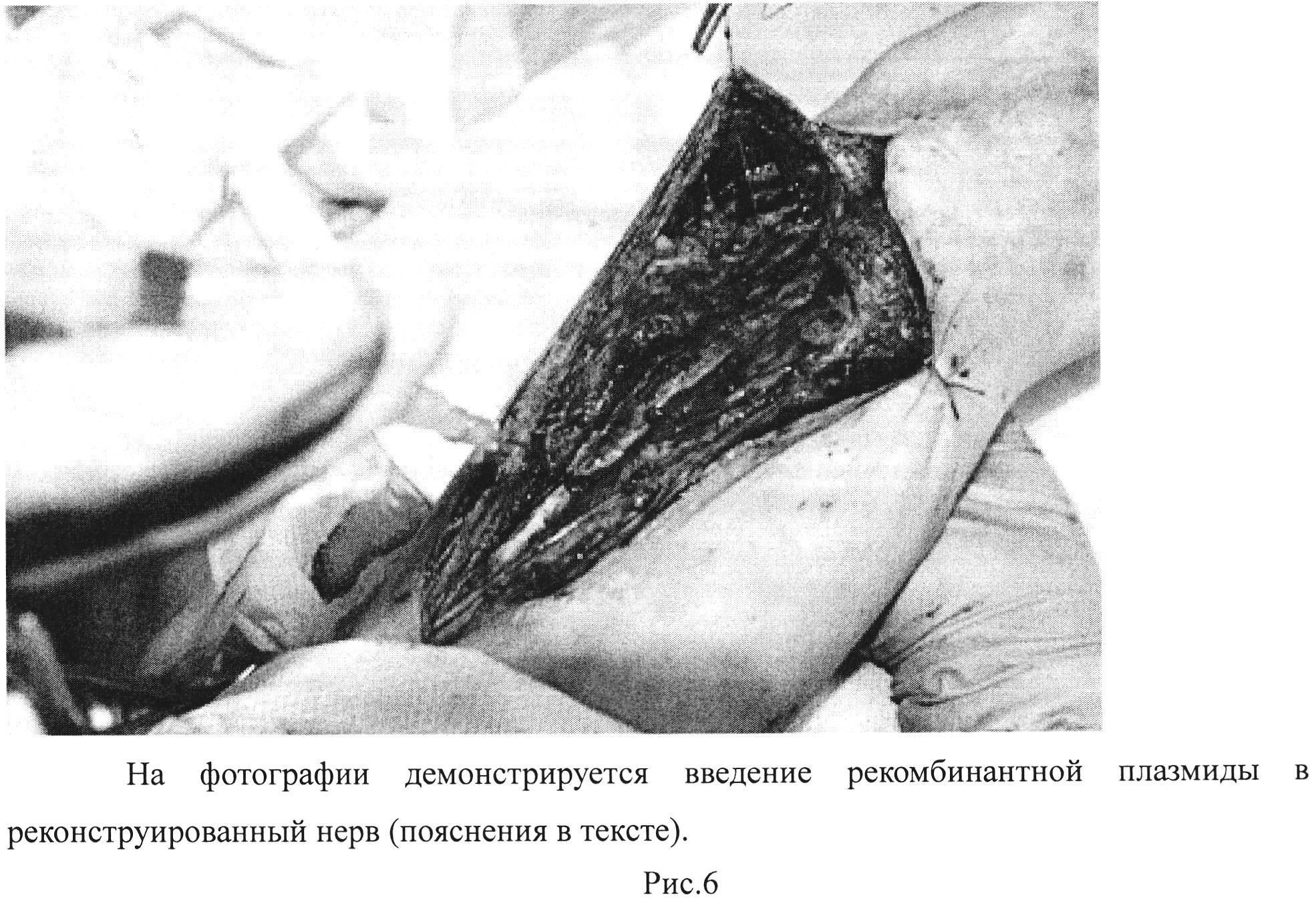
Рис. 6. На фотографии демонстрируется введение рекомбинантной плазмиды рBud(Kan)-coVEGF-coFGF2 в реконструированный нерв (пояснения в тексте).
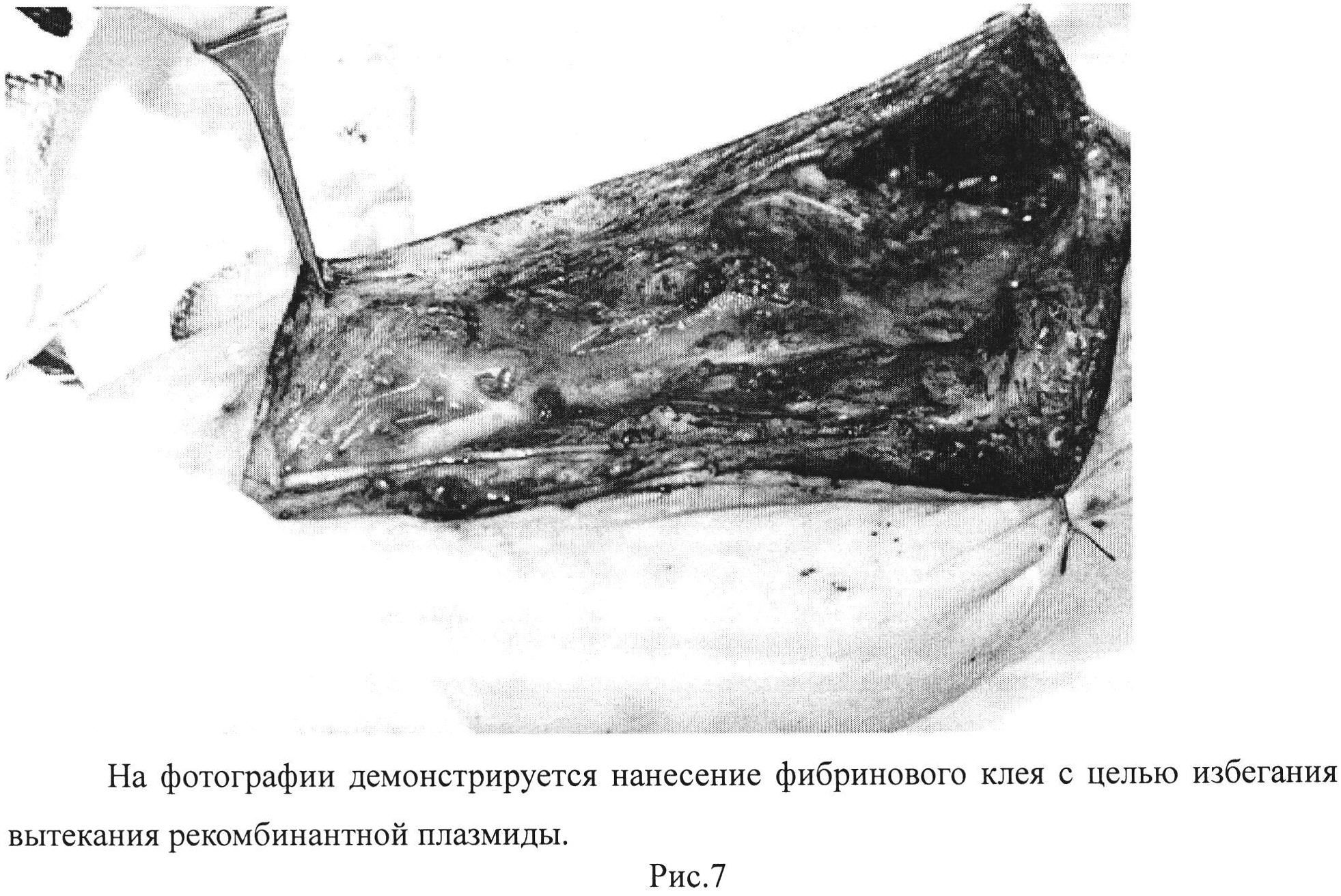
Рис. 7. На фотографии демонстрируется нанесение фибринового клея с целью избегания вытекания рекомбинантной плазмиды.
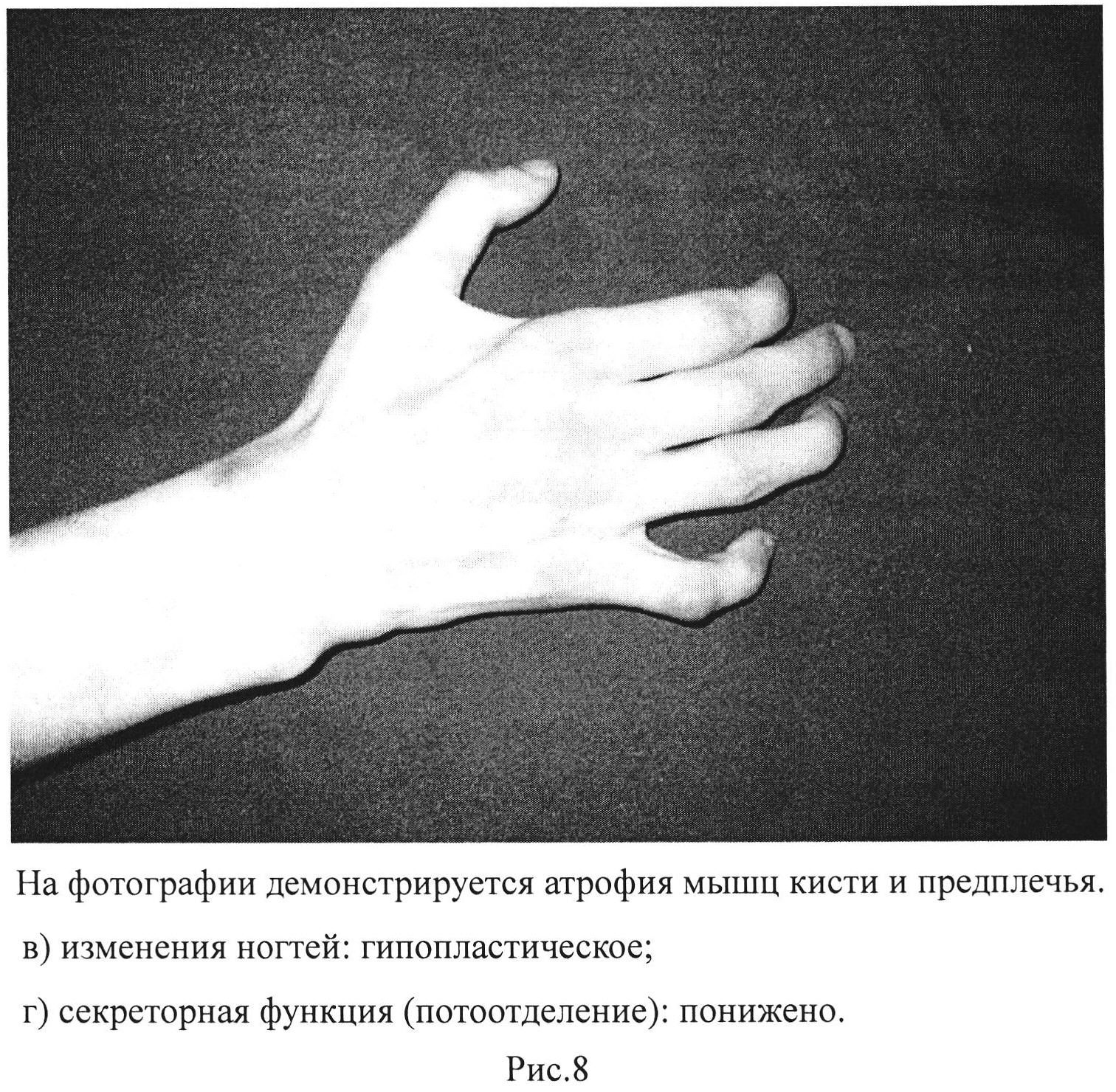
Рис. 8. На фотографии демонстрируется атрофия мышц кисти и предплечья.
в) изменения ногтей: гипопластическое;
г) секреторная функция (потоотделение): понижено.
Рис. 9. Захват крючок (ручка сумки).
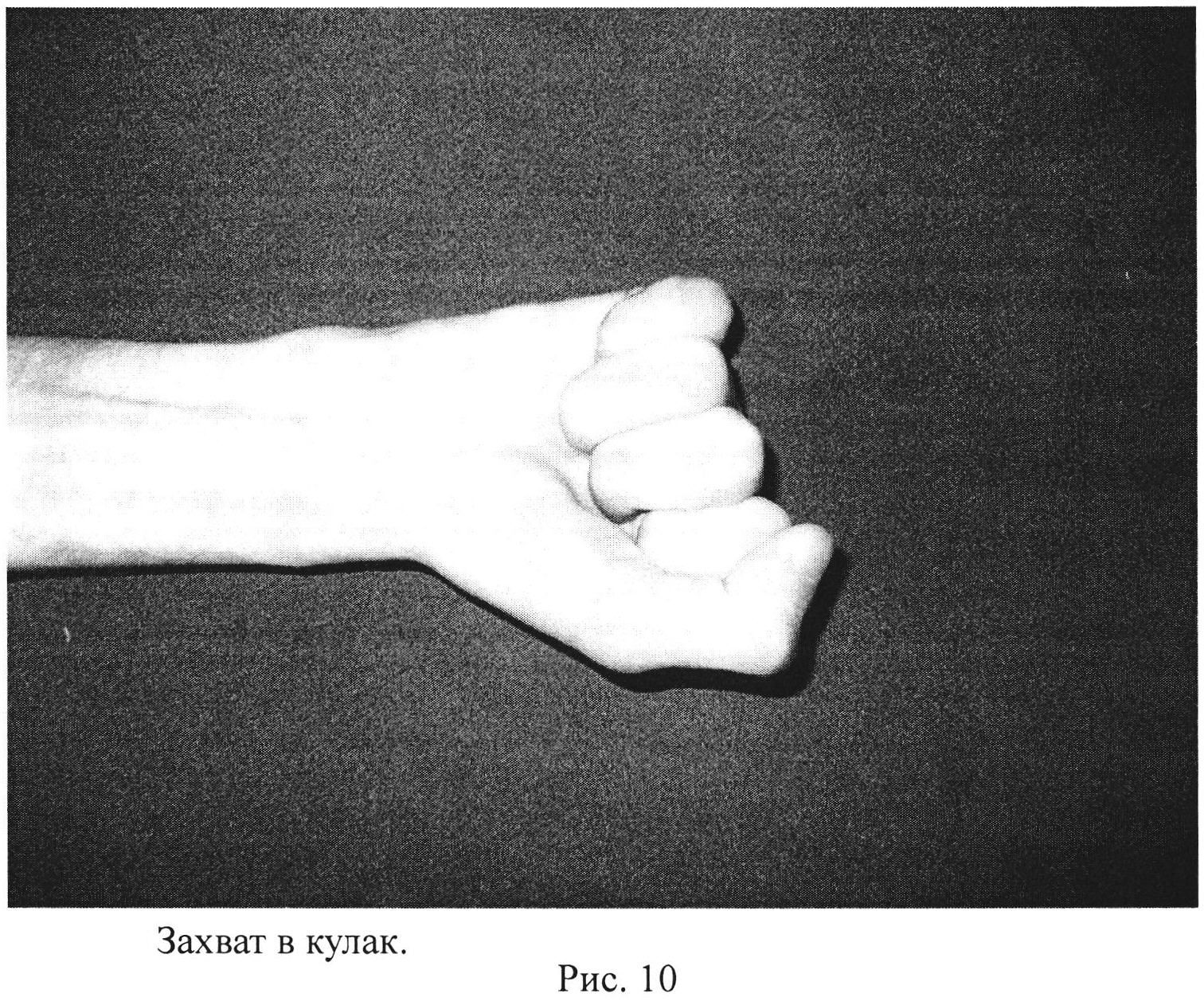
Рис. 10. Захват в кулак.
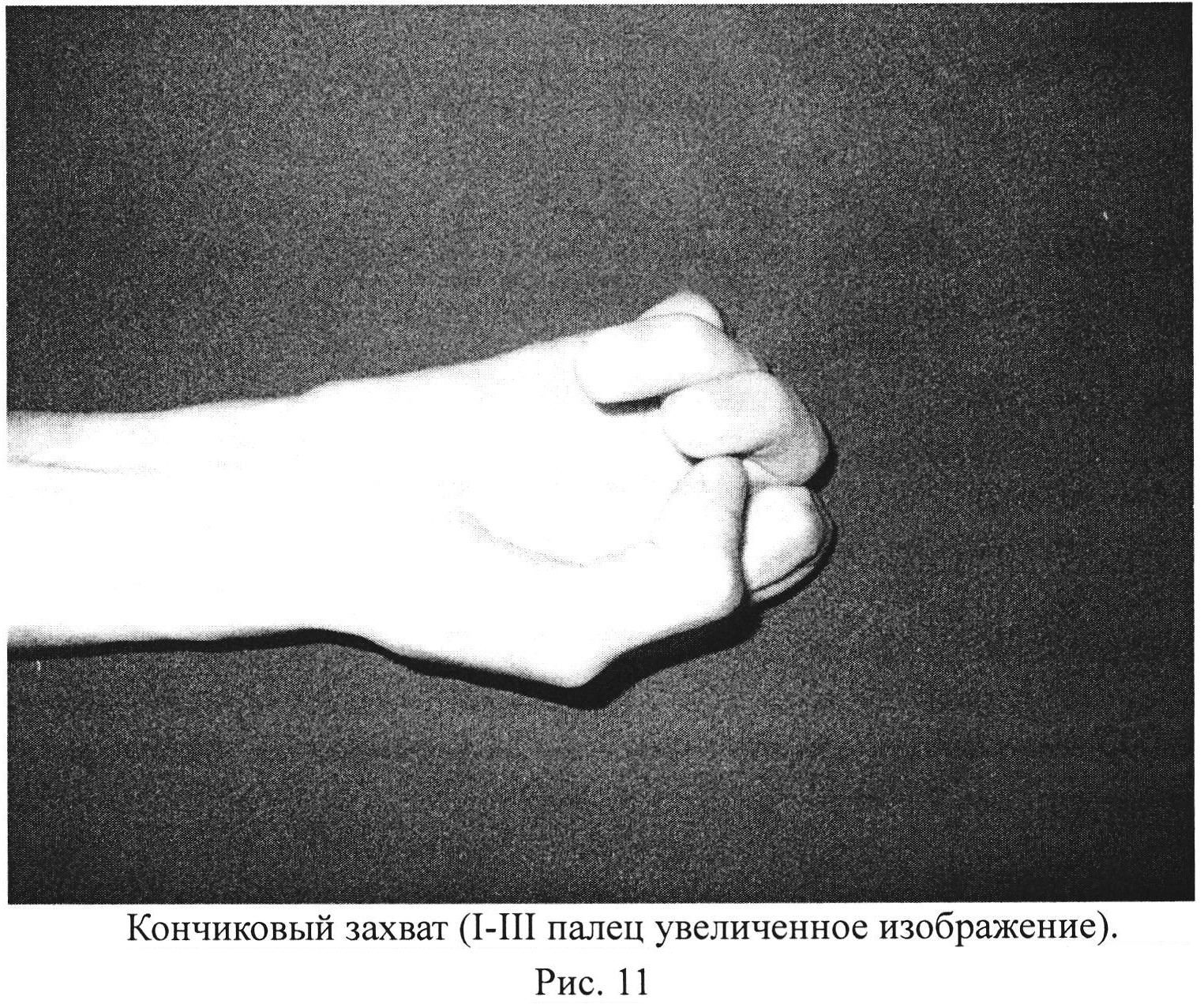
Рис. 11. Кончиковый захват (I-III палец).
Рис. 12. Кончиковый захват (I-III палец).
Рис. 13. Кончиковый захват (I-IV палец).
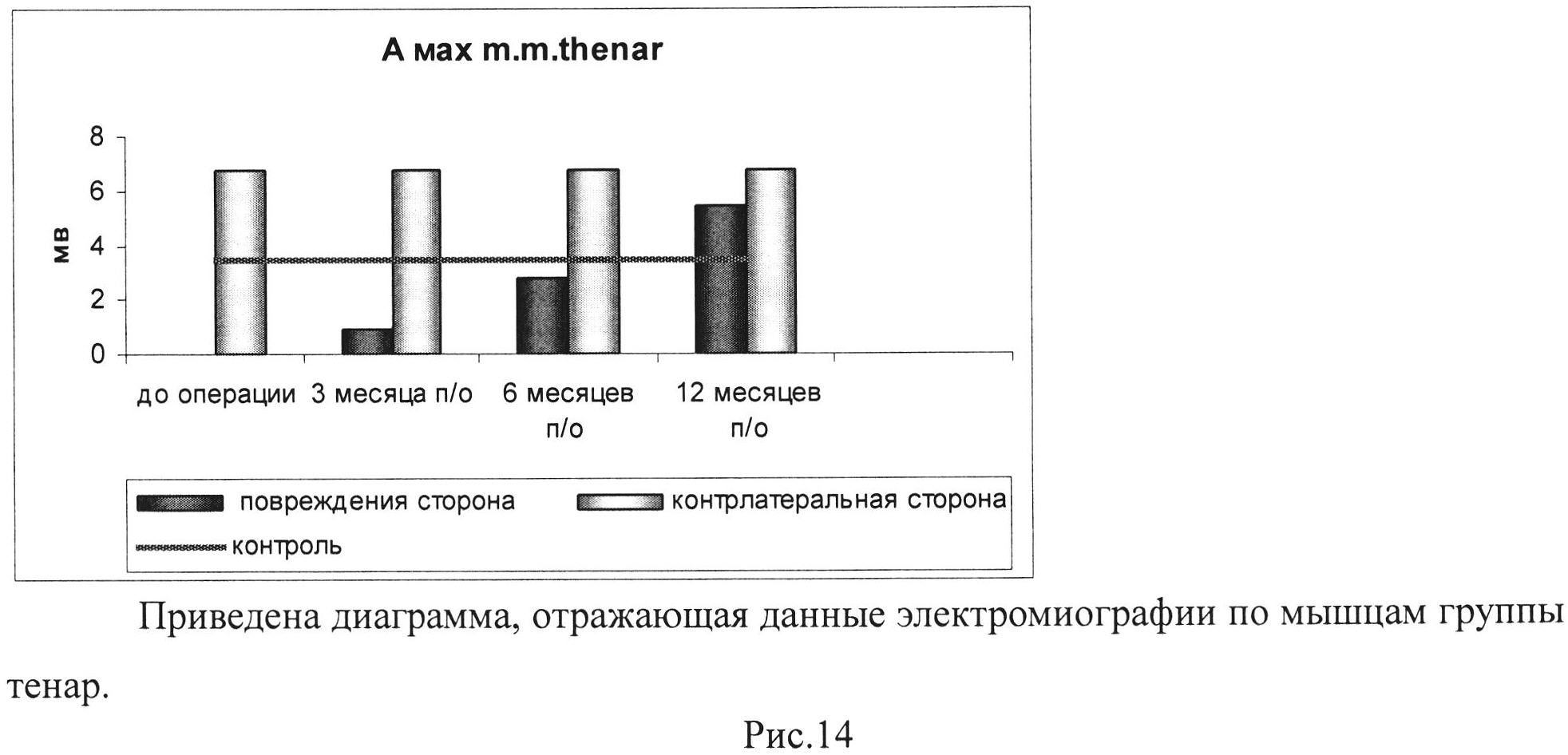
Рис. 14. Приведена диаграмма, отражающая данные электромиографии по мышцам группы тенар.
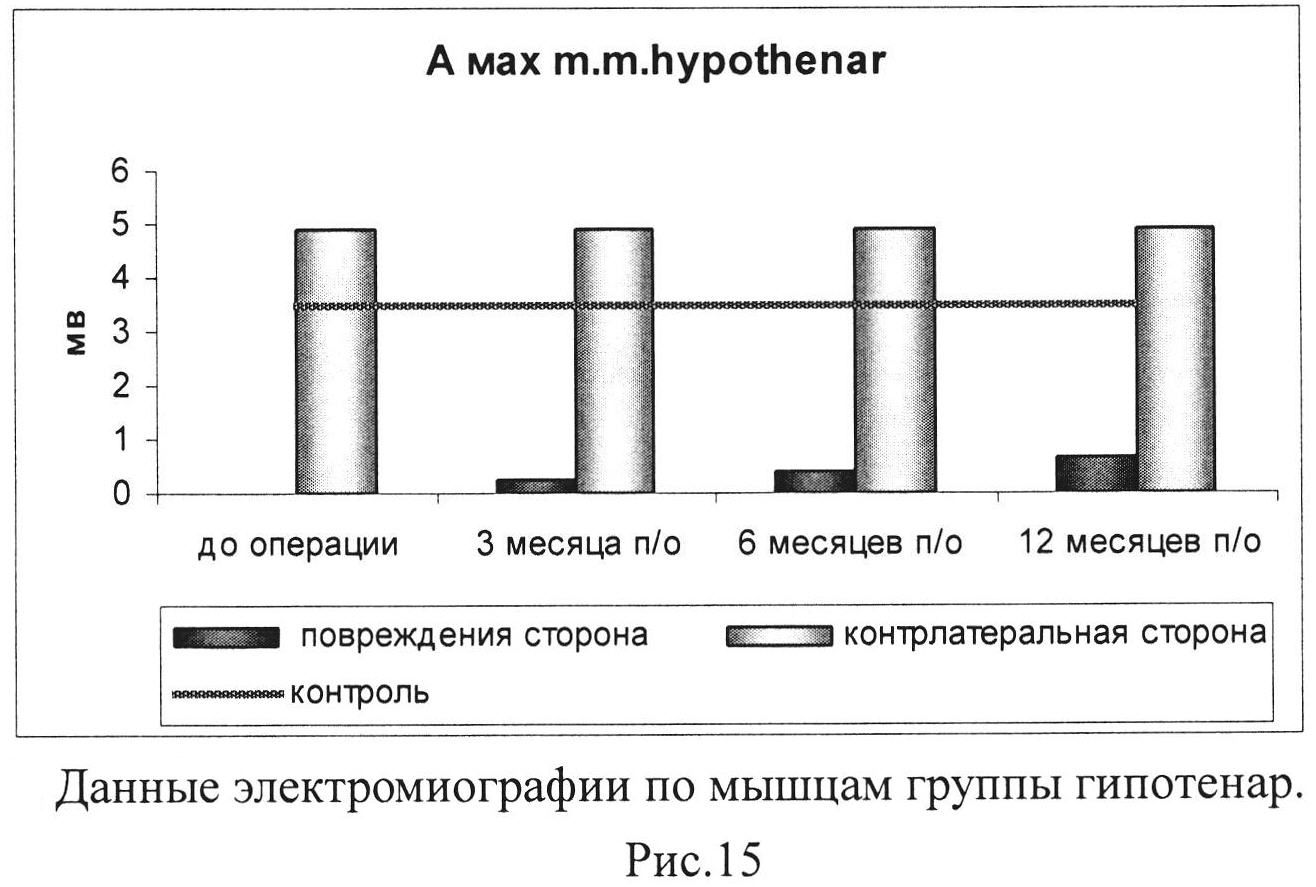
Рис. 15. Данные электромиографии по мышцам группы гипотенар.
Подробное описание настоящего изобретения
Изобретение относиться к медицине, преимущественная область его применения - нейрохирургия и травматология, лечение травм периферических нервов.
Задачей настоящего изобретения является улучшение результатов реконструктивного лечения при помощи геннотерапевтической конструкции. Основным компонентом двухкассетной оптимизированной рекомбинантной плазмиды pBud(Kan)-coVEGF-coFGF2 является генетическая последовательность генов VEGF и FGF-2.
Сущность изобретения заключается в достижении заявленного технического результата, заключающегося в восстановлении двигательной и чувствительной функции поврежденного нерва при значительном сокращении сроков лечения, в том числе и на отдаленных сроках после травмы, за счет использования с целью индукции регенерации периферического нерва препарата кодон-оптимизированной рекомбинантной плазмиды pBud(Kan)-coVEGF-coFGF2, представленной на SEQ №1.
В качестве ближайшего аналога принят патент RU 3459630 С1 «Способ стимулирования нейрогенерации с помощью генетических конструкций», который описывает способ посттравматической регенерации спинного мозга крысы путем введения двухкассетной плазмиды pBud(Kan)-VEGF-FGF2. Настоящее изобретение направлено на защиту следующих объектов.
Кодон-оптимизированная рекомбинантная плазмида pBud(Kan)-coVEGF-coFGF2, содержащая гены, кодирующие VEGF и FGF2, отличающаяся последовательностью нуклеотидов, представленной SEQ №1, для регенерации периферического нерва;
Способ стимуляции регенерации периферического нерва путем введения интра-, пери- и параневрально кодон-оптимизированной рекомбинантной плазмиды pBud(Kan)-coVEGF-coFGF2, представленной последовательностью SEQ №1, интраоперационно или в послеоперационном периоде;
Способ лечения поврежденного нерва человека путем введения в поврежденный участок эффективного количества плазмиды pBud(Kan)-coVEGF-coFGF2 по п. 1.
Наша исследовательская группа, основываясь на опыте разработок геннотерапевтических препаратов, была нацелена на создание эффективного средства для лечения пациентов с повреждениями периферических нервов у человека. Для этого нами были разработаны различные геннотерапевтические конструкции, различающиеся между собой по количеству кодируемых трансгенов, по самим трансгенам, а также нуклеотидным последовательностям одних и тех же трансгенов.
Опыт применения геннотерапевтичеких конструкций с целью улучшения восстановления периферических нервов уже был представлен нами ранее [26]. При оценке эффективности применения плазмиды, кодирующей одновременно гены VEGF и FGF2, на модели травмы периферического нерва с диастазом препарат вводился непосредственно в дистальный, проксимальный конец, а также в аутонервную вставку в равном объеме в суммарной дозе 45 мкг. В качестве экспериментальных животных использовались крысы, которые были разделены на три группы: интактная, исследуемая группа, в которой использовалась геннотерапевтическая конструкция, а также группа сравнения, где вместо исследуемого препарата вводился фосфатный буферный раствор. В качестве критериев оценки динамики регенерации периферического нерва использовались нейрофизиологические показатели, такие как скорость проведения импульса и амплитуда мышечного ответа, а также данные гистологического исследования - количество миелиновых волокон и плотность капиллярной сети. На 56 сутки после введения плазмидной конструкции нейрофизиологические показатели в исследуемой группе были лучше, чем в группе сравнения, однако значительно хуже, чем у животных интактной группы. По данным гистологического исследования количество миелиновых волокон на единицу площади поперечного среза было достоверно больше в исследуемой группе, по сравнению с группой сравнения, однако, несмотря на это, эффективного восстановления функции конечности не наблюдалось. Результаты эксперимента свидетельствуют о том, что применение плазмидных конструкций, содержащих генетические последовательности факторов роста, оказывает стимулирующее влияние на регенерацию периферического нерва, однако выраженность эффекта недостаточна. По нашему мнению, это связано, в первую очередь, с недостатками самой плазмиды, используемой в представленном исследовании. С целью улучшения свойств геннотерапевтической конструкции был выполнен ряд важных изменений ее структуры. Во-первых, вектор был модифицирован: были удалены последовательности тэгов и заменен ген антибиотикоустойчивости на канамицин. Во-вторых, с целью увеличения эффективности экспрессии были использованы кодон-оптимизированные последовательности кДНК генов VEGF и FGF2 (SEQ №1). После этого нами вновь был проведен ряд экспериментальных исследований на модели травмы периферического нерва с применением кодон-оптимизированной плазмиды. Геннотерапевтические конструкции вводились интраневрально непосредственно после восстановления целостности периферического нерва. Результаты оценивались спустя 60 суток после проведения оперативного вмешательства и введения препарата (Рис. 1).
Из всех плазмидных ДНК, используемых нами, наилучшие результаты показала кодон-оптимизированная двухкассетная плазмида, содержащая генетические последовательности FGF-2 и VEGF.
Основываясь на доклинических данных об эффективности применения геннотерапевтических конструкций pBud(Kan)-VEGF-FGF2 с целью улучшения регенерации периферического нерва, нами был инициировано клиническое исследование, результаты которого представлены ниже.
Пациент Б., 1985 г.р., поступил в травмцентр РКБ МЗ РТ 04.04.11 г. с диагнозом: последствия повреждения срединного и локтевого нерва в средней трети правого плеча (Рис. 2).
Из анамнеза: в 2009 году пациент порезал стеклом плечо на уровне средней трети, при этом были повреждены срединный и локтевой нервы. Незамедлительно был выполнен прямой шов срединного и локтевого нервов, однако в ближайший послеоперационный период как двигательная, так и чувствительная функции полностью отсутствовали. Курс реабилитационной терапии видимых результатов не дал. Далее, спустя 7 месяцев, в 2010 году, в связи с отсутствием положительной динамики восстановления двигательной и чувствительной функций, был выполнен невролиз срединного и локтевого нервов. Наблюдение в послеоперационном периоде показало слабую динамику регенерации, а именно полное отсутствие чувствительности, однако наблюдалось появление двигательной функции, которая характеризовалась незначительным сгибанием пальцев и кисти, в связи с чем было решено выполнить оперативное лечение.
До операции, 21.04.2011 г., пациенту было проведено обследование со следующими результатами:
Трофические нарушения:
а) состояние кожных покровов: окраска обычная, температура пальцев снижена, повышенная зябкость;
б) атрофия мышц кисти и предплечья по сравнению со здоровой рукой: выраженная степень - больше 2 см (рис. 2-3);
в) изменение ногтей: гипопластическое;
г) секреторная функция (потоотделение): понижено.
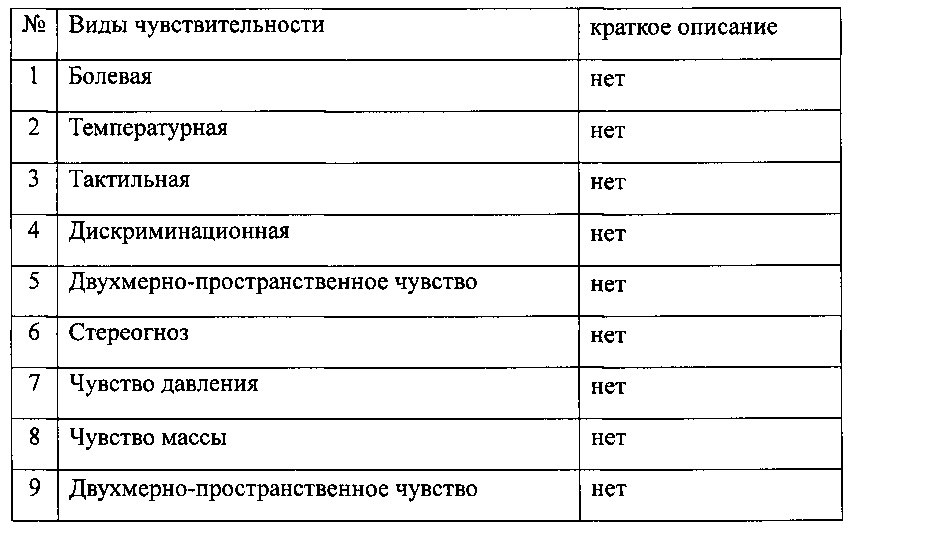
Исследование двигательной функции

Исследование чувствительности у пациента в автономной зоне иннервации нерва:
Виды захватов кисти: все виды захватов кисти отсутствуют (рис. 3-4).
Диагноз: Повреждение срединного и локтевого нервов в средней трети плеча 2-летней давности. Состояние после шва и невролиза срединного и локтевого нервов (Рис. 5).
26.04.11 произведена операция: невролиз срединного и локтевого нервов с интраневральным введением плазмидной ДНК, кодирующей сосудистый эндотелиальный фактор роста (VEGF) и фактор роста фибробластов-2 (FGF2).
Ход операции: Под проводниковой анестезией, после трехкратной обработки операционного поля, произведен дугообразный разрез по внутренней поверхности правого плеча. С техническими трудностями выделены срединный и локтевой нервы. Найдены линии швов. Признаков невромы не обнаружено, однако нервы вовлечены в рубцовый процесс и спаяны с окружающей тканью. Инсулиновой иглой произведено интраневральное введение рекомбинантной плазмиды, содержащей VEGF и FGF-2 по 250 микрограмм в каждый нерв в физиологическом растворе, объемом 2,5 мл. Инъекция осуществлена в зону швов, а также проксимально и дистально на протяжении 10 см (рис. 6). После чего на выделенные нервы нанесен двухкомпонентный фибриновый клей «Тиссукол» объемом 2 мл (Рис. 7). Гемостаз. Ушивание раны. Установлены резиновые выпускники. Асептическая повязка. Наложена гипсовая лонгета. Через месяц после операции пациенту проведено повторное обследование.
Данные объективного исследования 25.05.2011 г.:
Трофические нарушения:
а) состояние кожных покровов: окраска обычная;
б) атрофия мышц кисти и предплечья по сравнению со здоровой рукой в см - выраженная степень - больше 2 см (рис.8);
в) изменения ногтей: гипопластическое;
г) секреторная функция (потоотделение): понижено.
Исследование чувствительности пациента в автономной зоне инерции нерва:


Исследование двигательной функции

Виды захватов кисти: все виды захватов кисти отсутствуют.
Через 6 месяцев после операции пациенту проведено очередное обследование. Данные объективного исследования 15.11.2012 г.:
Трофические нарушения:
а) состояние кожных покровов: окраска обычная;
б) атрофия мышц кисти и предплечья по сравнению со здоровой рукой в см - средней степени 1-2 см выраженная степень - больше 2 см;
в) изменения ногтей: соответствует норме;
г) секреторная функция (потоотделение): нормальное.
Исследование чувствительности пациента в автономной зоне иннервации нерва:


Исследование двигательной функции

Виды захватов кисти:
1) цилиндрический захват - ДА
2) сферический захват - ДА
3) захват крючок (ручка сумки) - ДА
4) захват в кулак - ДА
5) кончиковый захват
а) терминальная оппозиция - ДА,
б) (субтерминальная опозиция - Нет)
6) боковой захват
а) ключевой захват - Нет,
б) (ножничный захват - «сигарета») - Нет.
Через 1 год после операции пациенту проведено очередное обследование. Данные объективного исследования 20.04.2012 г.:
Трофические нарушения:
а) состояние кожных покровов: окраска обычная;
б) атрофия мышц кисти и предплечья по сравнению со здоровой рукой в см - средняя степень 1-2 см;
в) изменения ногтей: соответствует норме;
г) секреторная функция: соответствует норме.
Исследование чувствительности пациента в автономной зоне иннервации нерва:


Исследование двигательной функции

Виды захватов кисти:
1) цилиндрический захват - ДА
2) сферический захват - ДА
3) захват крючок - ДА (рис. 9)
4) захват в кулак - ДА (рис. 10)
5) кончиковый захват: (рис. 11-13)
а) терминальная оппозиция - ДА,
б) субтерминальная опозиция - ДА
6) боковой захват
а) ключевой захват - ДА,
б) ножничный захват - ДА.
Таким образом, результаты клинического исследования свидетельствуют о том, что функция конечности значимо улучшилась спустя год после проведения процедуры интраневрального введения геннотерапевтической конструкции. Улучшение функционального состояния конечности выражалось в снижении выраженности трофических нарушений, появлении всех видов чувствительности в зоне иннервации срединного и локтевого нервов, а также достоверном улучшении двигательной функции. По представленным результатам электромиографии амплитуда мышечного ответа группы мышц тенара в течение 1 года возросла с 0 мВ до 5 мВ и практически достигла показателя на контрлатеральной конечности (рис. 14 и 15).
Эффективность применения двухкассетной плазмиды обусловлена возможностью проведения одновременного трансфера двух генов, VEGF и FGF2, что позволяет эффективнее индуцировать регенерацию периферического нерва. Изменения, внесенные в структуру кодон-оптимизированной плазмиды, позволяют значительно увеличить экспрессию кодируемых генов, благодаря чему создается необходимая терапевтическая концентрация данных факторов роста в эпицентре травмы, что позволяет увеличить эффективность восстановления периферического нерва. Таким образом, мы предполагаем, что достигнутый клинический эффект при применении плазмиды pBud(Kan)-coVEGF-coFGF2 был достигнут благодаря комбинации этих двух факторов и оптимизации их кодонной последовательности.
К сожалению, на данном этапе мы не можем достоверно определить механизм индуцирования регенерации периферического нерва посредством вышеописанной геннотерапевтической конструкции, для этого нам необходимо проведение дальнейших исследований. Однако эффективность применения их с целью улучшения результатов оперативного лечения травм периферических нервов была выявлена и продемонстрирована в условиях эксперимента и клинического наблюдения.
Список ссылочной литературы
1. Hudso, A.R. Timing of peripheral nerve repair: important local and neuropathological factors / A.R. Hudson // Clinical Neurosurgery. - 1977. - Vol. 24. - C. 391-405.
2. Deitch, E.A. Experience with 112 shotgun wounds of the extremities/ E.A. Deitch, W.R. Grimes // J Trauma. - 1984. - Vol. 24. - P. 600-603.
3. Analysis of upper and lower extremity peripheral nerve injuries in a population of patients with multiple injuries / C.A. Munro // J. Trauma. - 1998. - Vol. 45. - P. 116-122.
4. Terenghi, G. Peripheral nerve regeneration and neurotrophic factors / G. Terenghi // J. Anat. - 1999. - Vol. 194. - P.
5. Vascular endothelial growthfactor has neurotrophic activity and stimulates axonal outgrowth, enhancing cell survival and Schwann cell proliferation in the peripheral nervous system / M. Sondell, M. Kanje. G. Lundborg // J Neurosci. - 1999. - Vol. 19, №14 - P. 5731-40.
6. VEGF-A165b is an endogenous neuroprotective splice isoform of vascular endothelial growth factor A in vivo and in vitro / N. Beazley-Long [et al.] // J Pathol. - 2013. - Vol. 183, №3 - P. 918-29.
7. Sondell, M. Vascular endothelial growth factor stimulates Schwann cell invasion and neovascularisation of acelular nerve grafts / M. Sondell, G. Lundborg, M. Kanje // Brain Res. - 1999. - Vol. 846 - P. 219-228.
8. Vascular, glial and neuronal effects of vascular endothelial growth factor in mesencephalic expiants cultures / W.F. Silverman [et al.] // Neuroscience. - 1999. - Vol. 90 - P. 1529-1541.
9. Forstreuter, F. Vascular endothelial growth factor induces chemotaxis and proliferation of microglial cells / F. Forstreuter, R. Lucius, R. Mentlein // J. Neuroimmunol. - 2002. - Vol. 132 - P. 93-98.
10. Zhu, Y. Vascular endothelial growth factor promotes proliferation of cortical neuron precursors by regulating E2F expression / Y. Zhu [et al.] // J FASEB. - 2003. Vol. 17 - P. 186-193.
11. Induction of VEGF and its Flt-1 receptor after sciatic nerve crush injury / R.R. Islamov [et al.] // Neuroreport. - 2004. Vol. 15, №13 - P. 2117-21.
12. Effects of vascular endothelial growth factor on nerve regeneration in acellular nerve grafts / J.M. Rovak [et al.] // J Reconstr Microsurg. - 2004. Vol. 20, №1 - P. 53-58.
13. Vascular endothelial growth factor-loaded poly (lactic-co-glycolic acid) microspheres-induced lateral axonal sprouting into the vein graft bridging two healthy nerves: nerve graft préfabrication using controlled release system / H. Karagoz [et al.] // J Microsurgery. - 2012. Vol. 32, №8 - P. 635-41.
14. Sondell, M. Vascular endothelial growth factor stimulates Schwann cell invasion and neovascularization of acellular nerve grafts // M. Sondell, G. Lundborg, M. Kanje // Brain Res. - 1999. Vol. 846, №2 - P. 219-28.
15. The effect of vascular endothelial growth factor and brain-derived neurotrophic factor on cavernosal nerve regeneration in a nerve-crush rat model / PS. Hsieh [et al.] // BJU Int. - 2003. Vol. 92, №4 - P. 470-5.
16. Grothe, C. Physiological function and putative therapeutic impact of the FGF-2 system in peripheral nerve regeneration-lessons from in vivo studies in mice and rats / K. Haastert, J. Jungnickel, C. Grothe // Brain Res Rev. - 2006. Vol. 51 - P. 293-299.
17. Furushol, M. Disruption of Fibroblast growth factor receptor signaling in non-myelinating Schwann cells causes sensory axonal neuropathy and impairment of thermal pain sensitivity / М. Furushol [et al.] // J Neurosci. - 2009. Vol. 29, №6 - P. 1608-1614.
18. Tulio, V.R. Bone marrow-derived fibroblast growth factor-2 induces glial cell proliferation in the regenerating peripheral nervous system / V.R. Tulio [et al.] // Molecular Neurodegeneration. - 2012. Vol. 7, №34 - P. 1-17.
19. Sciatic nerve grafting and inoculation of FGF-2 promotes improvement of motor behavior and fiber regrowth in rats with spinal cord transaction / F.P. Guzen, [et al.] // Restorative Neurology and Neuroscience. - 2012. Vol. 30 - P. 265-275.
20. Zeng, W. Ionically cross-linked chitosan microspheres for controlled release of bioactive nerve growth factor / W. Zeng [et al.] // Int J Pharm. - 2011. Vol. 421 - P. 283-290.
21. Enhancement of musculocutaneous nerve reinnervation after vascular endothelial growthfactor (VEGF) gene therapy / P. Haninec [et al.] // BMC Neuroscience. - 2012. Vol. 13, № 57 - P.
22. Effect of VEGF gene therapy and hyaluronic acid film sheath on peripheral nerve regeneration / F. Zor [et al.] // - 2014. Vol. 34, №3 - P. 209-16.
23. Favorable effect of local VEGF gene injection on axonal regeneration in the rat sciatic nerve / C. Fu [et al.] // J Huazhong University Scince Technology. - 2007. Vol. 2 - P. 186-9.
24. Double gene therapy with granulocyte colony-stimulating factor and vascular endothelial growth factor acts synergistically to improve nerve regeneration and functional outcome after sciatic nerve injury in mice / F. Pereira Lopes [et al.] // Neuroscience. - 2013. Vol. 230 - P. 184-97.
25. Пат. 2459630 РФ, МПК A61K 48/00, A61P 25/28, C12N 15/79, C1. Способ стимулирования нейрогенерации с помощью генетических конструкций / Ю.А. Челышев; Федеральное государственное автономное образовательное Учреждение высшего профессионального образования "Казанский (Приволжский) Федеральный Университет". - №2011116853/10; 27.04.2011; опубл. 27.10.2009, Бюл. №30. - 11 с.
26. Стимуляция посттравматической регенерации седалищного нерва крысы с помощью плазмиды, экспрессирующей сосудистый эндотелиальный фактор роста и основной фактор роста фибробластов. / Р.Ф. Масгутов [и др.] // Клеточные технологии и тканевая инженерия. - 2011. - 6(3): 67-70.
Последовательность двухкассетной плазмиды pBud(Kan)-coVEGF165-coFGF2 SEQ №1:
<110> ООО «НекстГен», OOO «NextGen»
<120> Кодон-оптимизированная рекомбинантная плазмида, способ стимуляции регенерации периферического нерва, способ лечения поврежденного нерва человека
<160> 1
<170> PatentIn version 3.5
<211> 5701
<212> DNA
<213> Artificial Sequence
<223> expression plasmid
Основные элементы вектора:
Ген устойчивости к канамицину- 1469-2511
кДНК гена FGF2 (оптимизированная по кодонному составу) - 699-1166
кДНК гена VEGF165 (оптимизированная по кодонному составу) - 3723-4297
Последовательность Козак - 695-698 и 3719-3722.
Реферат
Изобретение относится к генной инженерии, а также к медицине, а именно к нейрохирургии и травматологии. Описана геннотерапевтическая конструкция, кодирующая эндотелиальный сосудистый фактор роста (VEGF) и фактор роста фибробластов (FGF-2). В основе геннотерапевтической конструкции, кодирующей оба фактора, используется кодон-оптимизированная рекомбинантная плазмида. Введение геннотерапевтической конструкции может осуществляться как непосредственно в поврежденный нерв, так и в параневральные ткани, как интраоперационно, так и в послеоперационном периоде. Изобретение может быть использовано для стимуляции регенерации нервов. Изобретение значительно улучшает результаты реконструктивного лечения повреждений периферических нервов. 3 н.п. ф-лы, 15 ил.

Комментарии