Ингибирование axl сигнализации в антиметастатической терапии - RU2556822C2
Код документа: RU2556822C2
Чертежи



















Описание
Изобретение заявляет о приоритете Предварительной заявки США №61/336478, поданной 22 января 2010 года, содержание которой включено здесь в качестве ссылки.
Область техники
Настоящее изобретение относится к опухолевой инвазии и метастазированию, например, лечению или диагностике опухолевой инвазии и метастазирования через пути, связанные с AXL и/или GAS6.
Уровень техники
Инвазия и метастазирование - наиболее коварные и опасные для жизни аспекты рака. В то время как опухоли с минимальной инвазией или вообще неинвазивные могут быть успешно удалены, после того, как опухоль становится инвазивной, она может распространяться через лимфатические и/или сосудистые каналы в несколько мест, и полное удаление становится очень трудным. Инвазия и метастазирование уничтожают хозяина через два процесса: локальную инвазию и удаленную колонизацию органов с их повреждением. Локальная инвазия может привести к нарушению функции тканей от локального сжатия, локального разрушения или затруднения нормальной функции органа. Наиболее важным поворотным пунктом в раке, однако, является развитие отдаленных метастазов. Пациент не может быть вылечен локальной терапией на этом этапе.
Процесс метастазирования является каскадом связанных последовательных шагов с участием нескольких взаимодействий хозяин-опухоль. Этот сложный процесс требует от клеток входа в кровеносную или лимфатическую систему, задержки на отдаленном участке сосудистого или лимфатического русла, активного проникновения из сосудов в интерстициальную ткань и паренхиму органа, а также разрастания в качестве вторичной колонии. Метастатический потенциал зависит от местной микросреды, ангиогенеза, взаимодействий строма - опухоль, выработки цитокинов локальными тканями, а также молекулярных фенотипов опухоли и клеток хозяина.
Местная начальная стадия инфильтрирующего роста опухоли может произойти рано, несмотря на то, что удаленное распространение еще не очевидно или, возможно, еще не началось. Опухолевые клетки проникают в эпителиальную базальную мембрану и входят в основную интерстициальную строму в течение перехода от in situ к инвазивной карциноме. Как только опухолевые клетки проникают в основную строму, они получают доступ к лимфатическим и кровеносным сосудам для удаленного распространения при высвобождении фрагментов матрикса и факторов роста. При переходе от доброкачественной опухоли к инвазивной карциноме происходят общие и широкомасштабные изменения в организации, распределении и количестве эпителиальных базальных мембран.
Терапевтические усилия по профилактике и лечению рака в настоящее время сосредоточены на уровне сигнальных путей или селективных модулирующих белков. Активность протеинкиназы, гомеостаз и активация онкобелка являются управляющими сигналами и, следовательно, могут играть ключевую роль регуляторных участков для терапевтического вмешательства. Киназы в сигнальных путях, регулирующих инвазию и ангиогенез, могут быть важным регулятором метастазирования. Одним из крупнейших классов биохимических молекулярных мишеней является семейство рецепторов тирозинкиназы (RTKs). Наиболее распространенными молекулярными мишенями, относящимися к рецепторам тирозинкиназы, на сегодняшний день являются рецепторы EGF и васкулярного эндотелиального фактора роста (VEGF). Новейшие киназные молекулярные мишени включают в себя тип III RTK семейства c-kit и abl. Ингибиторы этих молекул прописывались в сочетании с классической химиотерапией.
Метастазы в конечном счете ответственны за большую часть страданий и смертности от рака. Существует необходимость идентифицировать и молекулярные и функциональные маркеры, которые определяют метастатические клетки рака и нацеливаться на них, а также создавать реагенты для их специфического ингибирования.
Публикации в этой области включают, в частности, Li et al. Oncogene. (2009) 28(39):3442-55; Заявку на патент США, 20050186571 Ullrich et al.; Заявку на патент США 20080293733 Bearss et al.; Sun etal. Oncology. 2004; 66(6):450-7; Gustafsson et al. Clin Cancer Res. (2009) 15(14):4742-9; Wimmeletal. Eur J Cancer. 2001 37(17):2264-74; Koorstra et al. Cancer Biol Ther. 2009 8(7):618-26; Tai et al. Oncogene. (2008) 27(29):4044-55.
Рецептор тирозинкиназы AXL (также известный как Ufo и Tyro7) принадлежит к семейству тирозиновых рецепторов, которое включает в себя Tyro3 (Sky) и Mer (Tyrol 2). Общим лигандом для семейства AXL является GAS6 (Специфически задерживающий рост белок 6). AXL человека содержит открытую рамку считывания в 2682п.о. способную направлять синтез 894-аминокислотного полипептида. Два варианта мРНК были охарактеризованы, с вариантом 1 транскрипта можно ознакомиться в Genbank, по номеру доступа NM_021913.3, а с вариантом 2 транскрипта можно ознакомиться по номеру доступа NM_001699.4. Полипептидная последовательность нативного белка определяется как SEQ ID NO:1, а конкретная ссылка может быть сделана к последовательности с учетом аминокислотных модификаций. Важные функции клеточного GAS6/AXL включают клеточную адгезию, миграцию, фагоцитоз, и ингибирование апоптоза. Семейство рецепторов GAS6 и AXL строго регулируемо в тканях и определенным образом при болезни.
AXL характеризуется уникальной молекулярной структурой, заключающейся в том, что внутриклеточная область имеет типичную структуру рецептора тирозинкиназы, а внеклеточный домен содержит мотивы фибронектина III и Ig, похожие на молекулы адгезии кадгеринового типа. В течение развития, AXL экспрессируется в различных органах, включая мозг, что предполагает, что этот RTK участвует в развитии мезенхимы и нервной системы. У взрослых экспрессия AXL низка, но в различных опухолях экспрессия возвращается к высоким уровням. GAS6 является пока единственным активирующим лигандом для AXL.
Рецепторы тирозинкиназы (RTK), как правило, активируется лигандами, которые способствуют димеризации рецептора и, в свою очередь, аутофосфорилированию остатков тирозина в цитозольном домене. Связывание сигнальных белков в этих фосфорилированных остатках тирозина приводит к последующей передаче сигнала в сигнальном пути. Семейство AXL RTKs уникально тем, что его члены активируются GAS6, членом семейства витамин К-зависимых белков, которые напоминают факторы свертывания крови, а не типичные факторы роста.
Сущность изобретения
Настоящее изобретение основано частично на открытии того, что пути связанные с AXL и/или GAS6 связаны с инвазией опухоли и/или метастазированием. Соответственно, настоящее изобретение относится к композициям и способам, которые используются для лечения опухолевой инвазии и/или метастазирования, например, с помощью ингибирования путей связанных с AXL и/или GAS6. Кроме того, данное изобретение обеспечивает реагенты и способы, которые полезны для определения чувствительности или вероятности того, что опухоль станет инвазивной и/или метастатической, например, с помощью определения уровня активности AXL и/или GAS6.
В одном из вариантов воплощения настоящего изобретения предлагается растворимый вариант полипептида AXL, отличающийся тем, что полипептид не имеет трансмембранного домена AXL и, необязательно, внутриклеточного домена, и содержит, по меньшей мере, одну модификацию аминокислоты по сравнению с последовательностью AXL дикого типа, и где указанные изменения повышают сродство связывания полипептида AXL к GAS6. В некоторых вариантах воплощения растворимый вариант полипептида AXL содержит, по меньшей мере, одну модификацию аминокислоты в участке, выбранном из группы, состоящей из 1) между 15-50, 2) между 60-120 и 3) между 125-135 в последовательности AXL дикого типа (SEQ ID NO:1). В некоторых других вариантах воплощения, растворимый вариант полипептида AXL содержит, по меньшей мере, одну модификацию аминокислоты в положении 19, 23, 26, 27, 32, 33, 38, 44, 61, 65, 72, 74, 78, 79, 86, 87, 88, 90, 92, 97, 98, 105, 109, 112, 113, 116, 118, 127 или 129 последовательности AXL дикого типа (SEQ ID NO:1), или их сочетание. В некоторых других вариантах воплощения растворимый вариант полипептида AXL содержит, по меньшей мере, одну модификацию аминокислоты, которая выбрана из группы, состоящей из 1) А19Т, 2) Т23М, 3) E26G, 4) E27G или E27K, 5) G32S, 6) N33S, 7) T38I, 8) T44A, 9) H61Y, 10) D65N, 11) A72V, 12) S74N, 13) Q78E, 14) V79M, 15) Q86R, 16) D87G, 17) D88N, 18) I90M или I90V, 19) V92A, V92G или V92D, 20) I97R, 21) T98A или Т98Р, 22) T105M, 23) 0109R, 24) V112A, 25) F113L, 26) H116R, 27) T118A, 28) G127R или G127E и 29) E129K и их комбинации и консервативные эквиваленты.
В еще некоторых других вариантах воплощения растворимый вариант полипептида AXL содержит замены аминокислот по сравнению с последовательностью AXL дикого типа (SEQ ID NO:1) по следующим позициям: (а) глицин 32; (b) аспарагиновая кислота 87; (с) валин 92; и (d) глицин 127. В еще некоторых других вариантах воплощения растворимый вариант полипептида AXL содержит такие изменения: остаток глицина 32 заменен остатком серина, остаток аспарагиновой кислоты 87 заменен остатком глицина, остаток валина 92 заменен остатком аланина, или остаток глицина 127 заменен остатком аргинина или их комбинация, или консервативный эквивалент. В еще нескольких других вариантах воплощения растворимый вариант полипептида AXL содержит замены аминокислоты по сравнению с последовательностью AXL дикого типа (SEQ ID NO:1) по следующим позициям: (а) глутаминовая кислота 26; (b) валин 79; (с) валин 92; и (d) глицин 127. В еще нескольких других вариантах воплощения растворимый вариант полипептида AXL содержит такие изменения: остаток глутаминовой кислоты 26 заменен остатком глицина, остаток валина 79 заменен остатком метионина, остаток валина 92 заменен остатком аланина или остаток глицина 127 заменен остатком глутаминовой кислоты или их комбинацией или консервативным эквивалентом.
В некоторых других вариантах воплощения растворимый вариант полипептида AXL содержит, по меньшей мере, аминокислоты 1-437, 19-437, 130-437, 19-132, 1-132 полипептида AXL дикого типа (SEQ ID NO:1). В еще нескольких других вариантах воплощения растворимый вариант полипептида AXL является гибридным белком, содержащим область Fc.
В одном из вариантов воплощения растворимый вариант полипептида AXL имеет сродство по меньшей мере 1×10-5 М к GAS6. В другом варианте воплощения растворимый вариант полипептида AXL имеет сродство по меньшей мере 1×10-6 М, к GAS6. В еще одном варианте воплощения растворимый вариант полипептида AXL имеет сродство по меньшей мере 1×10-7 М к GAS6. В еще одном варианте растворимый вариант полипептида AXL имеет сродство по меньшей мере 1×10-8 М к GAS6. В еще одном варианте воплощения растворимый вариант полипептида AXL обладает сродством, по меньшей мере, около 1×10-9 М, 1×10-10 М, 1×10-11 М, или 1×10-12 М к GAS6. В различных вариантах воплощения, описанных здесь, растворимый вариант полипептида AXL показывает сродство к GAS6, что, по меньшей мере, примерно в 2 раза сильнее, чем сродство полипептида AXL дикого типа. В некоторых вариантах воплощения растворимый вариант полипептида AXL показывает сродство к GAS6, что составляет по меньшей мере в 3 раза, в 4 раза, в 5 раз, в 10 раз, в 15 раз, в 20 раз, в 25 раз, или в 30 раз сильнее, чем сродство полипептида AXL дикого типа.
В другом варианте воплощения настоящее изобретение обеспечивает выделенные антитела или их фрагменты, которые специфически связываются с GAS6 белком (SEQ ID NO:2). В некоторых вариантах воплощения выделенное антитело или его фрагмент представляет собой моноклональное антитело, гуманизированное антитело, химерное антитело, одноцепочечное антитело (ScFv) или их комбинации. В некоторых других вариантах воплощения выделенное антитело или его фрагмент связывает эпитоп, который состоит из одного или нескольких аминокислотных участков GAS6, которые выбраны из группы, состоящей из R299-T317, V364-P372, R389-N396, D398-A406, Е413-Н429, и W450-M468. Еще в нескольких других вариантах воплощения выделенное антитело или его фрагмент связывает эпитоп, который содержит аминокислотный участок, выбранный из группы, состоящей из RMFSGTPVIRLRFKRLQPT (SEQ ID NO:3), VGRVTSSGP (SEQ ID NO:4), RNLVIKVN (SEQ ID NO:5), DAVMKIAVA (SEQ ID NO:6), ERGLYHLNLTVGGIPFH (SEQ ID NO:7) и WLNGEDTTIQETVKVNTRM (SEQ ID NO:8).
В еще одном варианте воплощения настоящее изобретение относится к способам лечения, снижения или предотвращение метастазирования, или инвазии опухоли в организме пациента, относящегося к млекопитающим. В одном варианте воплощения способ включает введение указанному пациенту эффективной дозы растворимого варианта полипептида AXL или выделенного анти-GAS6 антитела, или его фрагмента.
В еще одном варианте воплощения настоящее изобретение относится к способам лечения, снижения или предотвращение метастазирования, или инвазии опухоли в организме пациента, относящегося к млекопитающим. В одном варианте воплощения способ включает введение одного или нескольких ингибиторов, выбранных из группы, состоящей из (а) ингибитора активности AXL, (b) ингибитора активности GAS6; и (с) ингибитора взаимодействия AXL-GAS6. В различных вариантах воплощения, описанных здесь, ингибитор представляет собой полипептид, полинуклеотид, небольшую молекулу, антитело, фрагмент антитела, или лекарственный конъюгат антитела.
Еще в одном варианте воплощения настоящее изобретение предлагает способы определения способности опухоли к инвазии или метастазированию в субъекте. В одном из вариантов воплощения способ включает в себя определение уровня активности AXL и/или активности GAS6 в биологическом образце от субъекта с опухолью; и сравнение уровня активности AXL и/или GAS6 в биологическом образце с заранее установленным уровнем, в котором увеличение по сравнению с заранее установленным уровнем, свидетельствует о предрасположенности опухоли к инвазии или метастазированию.
Краткое описание фигур
Фигура 1. Экспрессия AXL коррелирует с прогрессированием опухоли и метастазами рака молочной железы и рака яичников человека. А. Репрезентативные изображения иммуногистохимического окрашивания AXL в нормальной ткани молочной железы (нормальный), первичных инфильтратах протоковой карциномы (стадия 1, 2, и 3) и метастазах лимфатических узлов (лимфатические узлы). Следует отметить, что высокий уровень мембранного окрашивания AXL наблюдается на 2 стадии (стрелки), 3-й стадии, а также на метастазах в лимфоузлы. Отсутствие окрашивания AXL наблюдался в нормальной или опухолевой строме (*). В. Репрезентативные изображения иммуногистохимического окрашивания AXL в нормальном эпителии яичников (стрелка), стадия II, стадия III, и метастазах сальника, полученных от пациентов с серозной аденокарциномой. Обратите внимание, что нормальная и опухолевая стромы были отрицательными по окрашиванию AXL (*).
Фигура 2. Генетической инактивации AXL достаточно, чтобы заблокировать метастазы молочной железы и яичников. А. Иммуногистохимическое окрашивание Н & Е и AXL в легких мышей; через хвостовую вену мышам вводили клетки линии MDA-231 shscramble (малая шпилечная РНК случайной последовательности shSCRM) и shAXL (малая шпилечная РНК к последовательности AXL-shAXL). На фотографии представлены 5 мышей из группы. Графики показывают результаты ПЦР в реальном времени экспрессии человеческих GASPDH и AXL в здоровых легких мышей, которым вводили клетки линии MDA-231 shSCRM или shAXL (п=5). В. Фотографии мышей, сделанные через 28 дней после инъекции SKOV3ip.1 клеток shscramble (shSCRM) и shAXL (shAXL). Обратите внимание, что введение shSCRM мышам привело к развитию многочисленных метастазов в брюшной полости (отмечены кружком). Для shAXL группы показаны мыши с наибольшей опухолевой нагрузкой. Графики справа показывают среднее количество перитонеальных метастазов мыши >5 мм по размеру и средний вес крупных опухолей. На фотографии представлены пять мышей из группы. С. Фотографии мышей, сделанные через 34 дня после инъекции OVCAR-8 клеток shSCRM и shAXL. Обратите внимание, что введение shSCRM мышам приводило к развитию многочисленных метастазов в брюшной полости (отмечены кружком). Графики справа показывают среднее общее число перитонеальных метастазов на мышь и среднюю общую массу опухоли. На фотографии представлены восемь мышей из группы.
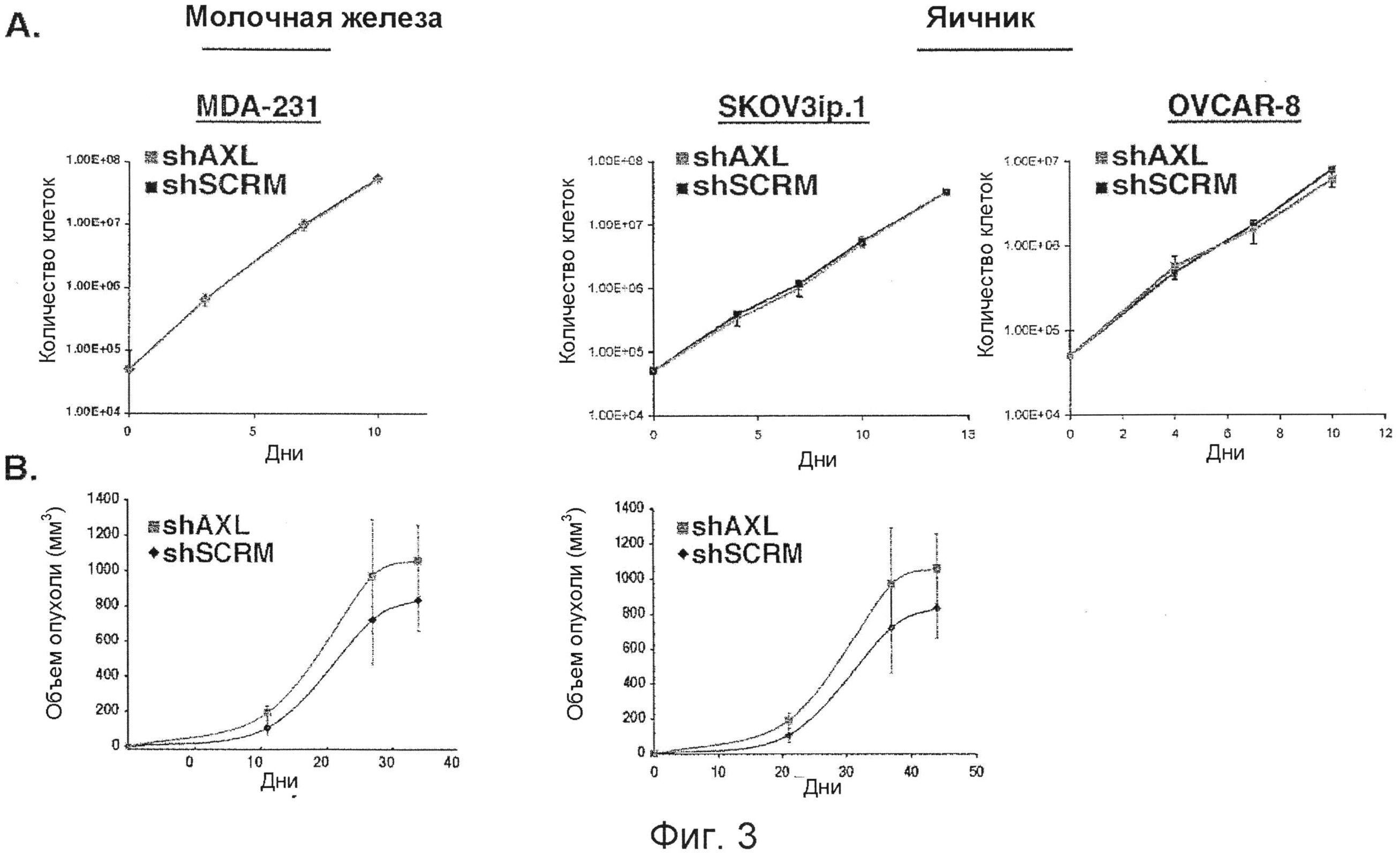
Фигура 3. Генетическая инактивация AXL не влияет на пролиферацию клеток опухоли молочной железы или яичников in vitro или рост in vivo. А. Кривые клеточного роста для MDA-231, SKOV3ip.1 и OVCAR-8 клеток стабильно экспрессирующих последовательности shPHK контроля scramble (shSCRM) или AXL (shAXL). Измерения проводились троекратно, и погрешность измерений представлена S.E.M. В. Средние объемы опухоли ортотопической MDA-231 (п=8 мышей в группе) и подкожной SKOV3ip.l опухоли (п=4 мыши в группе) выросли за время 48-дневного курса. Погрешность измерений представлена S.E.M.
Фигура 4. AXL регулирует инвазию клеток опухоли яичников и молочной железы in vitro. А. Анализ инвазии в коллаген под контролем (shSCRM) и с дефицитом AXL (shAXL) клеток MDA-231, SKOV3ip.1 и OVCAR-8. Фотографии были сделаны через 7 дней после внедрения клеток в коллаген и на них представлено по три образца из группы. Обратите внимание на инвазивный фенотип, наблюдаемый в AXL клетках дикого типа (ветвления) по сравнению с AXL дефицитными клетками (округлый). Графики показывают количественный анализ инвазии в коллаген. В. Анализ способом ПЦР в реальном времени экспрессии ММР-2 в shAXL и shSCRM SKOV3ip.1 клеток. Значения экспрессии нормированы на 18S; п=3. Погрешность определения представлена S.E.M.. Звездочки указывают на значительное увеличение или уменьшение экспрессии по сравнению с shSCRM, как это определено по t-критерию Стьюдента (**, p<0,001). С. ММР-2 значения из анализа shSCRM или shAXL SKOV3ip.1 клеток (п=6). D. Желатиновая зимография анализа активности про- и активного- ММР-2, в кондиционированной среде, собранной из сыворотки истощенных SKOV3ip.1 клеток. Е. Вестерн-блот анализ фосфо-AKT на Ser473 (P-AKT), общая AKT (AKT), и экспрессии AXL в SKOV3ip.1 клетках, экспрессирующих ShРНК целевые последовательности для контроля scramble (shSCRM) или AXL (shAXL) и истощенных SKOV3ip.1 клеток (strve), обработанных с GAS6 или ингибитором PI3K Ly294002 (Ly) с GAS6. ММР-2 значения из анализа истощенных SKOV3ip.1 клеток (strve), обработанных с GAS6 или GAS6 с ингибитором PI3K Ly294002 (Ly+GAS6).
Фигура 5. Эктодоменная терапия растворимыми AXL ингибирует AXL сигнализацию и инвазию in vitro. А. Схематическое изображение механизма терапии растворимыми AXL. Растворимые AXL (sAXL) функционируют в качестве рецепторов-ловушек для ингибирования эндогенной передачи сигнала AXL. В. Вестерн-блот анализ фосфо-AKT на Ser473 (P-AKT), общей AKT (AKT) и экспрессии AXL в клетках MDA231, SKOV3ip.1 и OVCAR-8, экспрессирующих последовательности ShPHK контроля scramble (shSCRM) или AXL (shAXL), и истощенных клеток SKOV3ip.1 (strve), обработанных GAS6 или ингибитором PI3K Ly294002 (Ly) с GAS6. С. Вестерн-блот анализ экспрессии фосфо-AKT Ser473a клетках, обработанных в одной из кондиционированных сред, содержащих растворимый AXL рецептор (sAXL) или контрольную среду (-). Все клетки культивировали в бессывороточной среде в течение 48 часов и обрабатывали GAS6 (+) или контрольной средой (-). D. Анализ инвазии в коллаген MDA-231 клеток, обработанных кондиционированной средой, содержащей контрольный вектор или sAXL.
Фигура 6. Лечение с помощью растворимых AXL рецепторов ингибирует метастатическую опухолевую нагрузку у мышей с установленными метастазами. А. Схематическое изображение исследования лечения растворимым AXL рецептором. Голым мышам и.п. (интраперитонеально) ввели 1×106 SKOV3ip.1 клеток. Через пять дней после имплантации проверяли наличие макроскопических поражений у мышей (на фотографии показана мышь с перитонеальным метастазом на 5-й день после инъекции, метастатические поражения отмечены кружком). На 7-й день мышам вводили аденовирус, экспрессирующий IgG2a-Fc контроль (Ad-Fc) или растворимый AXL рецептор (Ad-sAXL). Сывороточные уровни экспрессии sAXL оценивали по данным Вестерн-блоттинга каждые 3-4 дня после аденовирусной инъекции. В последующие 28 дней, после имплантации опухолевых клеток, оценивали опухолевую нагрузку у всех мышей. В. Представлены фотографии мышей, получавших путем экспрессии аденовируса Ad-sAXL или Ad-Fc через 28 дней после инъекции опухолевых клеток. Метастатические поражения отмечены кружком. Графики показывают среднее общее количество и вес опухоли для 7 мышей в группе. Погрешность измерений представлена S.E.M.. Отметим, что статистическая разница в количестве опухоли и весе (р=0,01, t-критерий Стьюдента) наблюдалась между мышами, обработанными Ad-Fc или shPHK Ad-sAXL (*). С.Анализ ПЦР в реальном времени экспрессии ММР-2 в опухоли мышей с Ad-Fc или Ad-AXL.
Фигура 7. Терапия растворимыми эктодоменами AXL не вызывает токсичность в нормальных тканях. А. Полное СВС и биохимический анализ сыворотки мышей, обработанными контролем (Fc) или растворимыми AXL (sAXL). В. Н & Е окрашивание тканей печени и почек, отобранных у мышей обработанных Fc или sAXL.
Фигура 8. Схема, иллюстрирующая молекулярные механизмы, связанные с торможением метастазирования растворимым рецептором AXL. Терапия растворимым рецептором AXL (sAXL) действует как рецептор-ловушка, который связывается с лигандом AXL GAS6. sAXL ингибирует путь эндогенной GAS6-AXL сигнализации, который стимулирует клеточную инвазию и метастазирование.
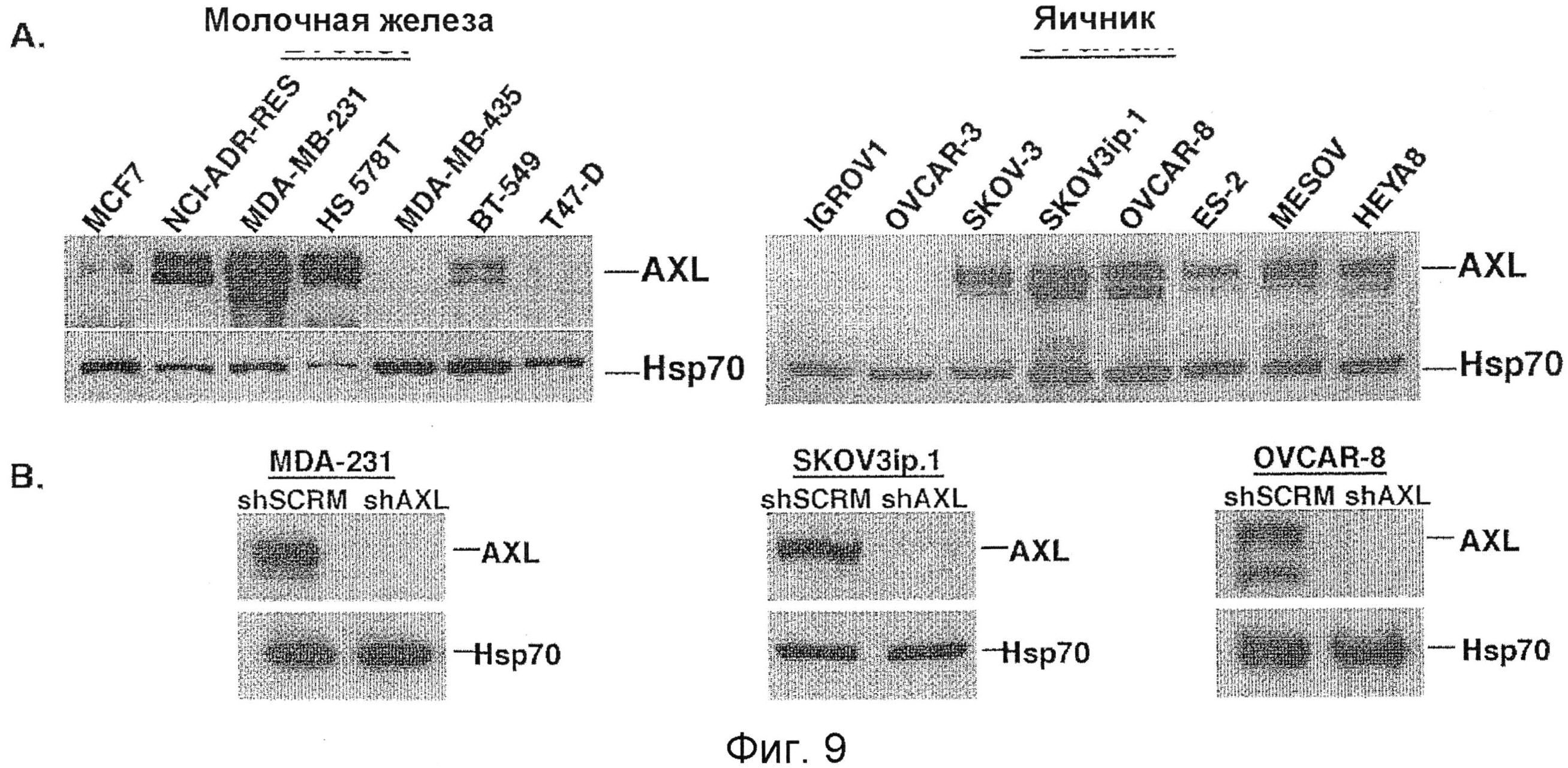
Фигура 9. Создание дефицитных по AXL линий раковых клеток молочной железы и яичников. А. Вестерн-блот анализ экспрессии AXL на панели человеческих линий раковых клеток молочной железы и яичников. Белок теплового шока 70 (Hsp70) был использован в качестве контроля загрузки белка. В. Вестерн-блот анализ экспрессии AXL в линиях раковых клеток метастатического рака молочной железы (MDA-231), яичников (SKOVSip.1 и OVCAR-8), стабильно трансфецированных мшРНК последовательностью контроля (scramble) (shSCRM) или AXL (shAXL). Обратите внимание, что shAXL клеточные линии имеют значительное уменьшение экспрессии AXL.
Фигура 10. AXL не влияет на клеточную адгезию или выживание клеток опухоли молочной железы и яичников. А-В. Процент миграции клеток MDA-231 (А) и SKOVSip.1 (В) миграции клеток к сыворотке, которая выступает как хемоаттрактант, при анализе в камере Бойдена. C-D. Анализы MDA-231 (A) SKOV3ip.1 (В) клеточной адгезии к белкам внеклеточного матрикса. Сокращения: бычий сывороточный альбумин (BSA), фибронектин (FN), коллаген типа I (Col I), коллаген типа IV (Col IV), ламинин (LN), фибриноген (FBN). Погрешности измерений представляют собой стандартную ошибку среднего. E-F. Анализ выживания AXL дикого типа и AXL дефицитных MDA-231 (Е) и SKOV3ip.1 (F) опухолевых клеток после удаления сыворотки, как это определено ХТТ анализом.
Фигура 11. Лечение с помощью растворимых AXL рецепторов ингибирует метастатическую опухолевую нагрузку у мышей с установленными OVCAR-8 метастазами. А. Схематическое изображение исследования лечения растворимым AXL рецептором. Голым мышам были интраперитонеально введены 5×106 OVCAR-8 клеток. Спустя четырнадцать дней после имплантации проверяли наличие макроскопических поражений у мышей (на фотографии показана мышь с перитонеальным метастазом на 14-й день после инъекции, метастатические поражения отмечены кружком). На 14-й день мышам вводили аденовирус, экспрессирующий IgG2a-Fc контроль (Ad-Fc) или растворимый AXL рецептор (Ad-sAXL). Сывороточные уровни экспрессии sAXL оценивали по данным Вестерн-блот анализа. В последующие 34 дня после имплантации опухолевых клеток, опухолевую нагрузку оценивали у всех мышей. В. Представлены фотографии мышей, получавших аденовирусы, экспрессирующие Ad-sAXL или Ad-Fc через 28 дней после инъекции опухолевых клеток. Метастатические поражения отмечены кружком. С. Графики показывают среднее общее количество и вес опухоли для 8 мышей в группе. Погрешности измерений представлены S.E.M.. Отметим, что статистическая разница в количество и весе опухоли (p<0,01, t-критерий Стьюдента) наблюдалась между мышами, которых лечили Ad-Fc и Ad-sAXL (*).
Фигура 12. Анализ связывания AXL библиотеки выявил 5 продуктов для GAS6. На точечном графике проточной цитометрии дрожжевых клеток экспрессирующих AXL дикого типа (А) или пул AXL, выделяется 5 продуктов полученных путем направленной эволюции (В). Представлены данные анализа связывания с последующей диссоциацией, описанного в примере 2. Уровень связывания с 2 нМ GAS6 показан в левой колонке, уровень связывания с GAS6 после 4 часов показан в средней колонке, и уровни связывания с GAS6 после 6 часов приведены в правой колонке. Для клеток, которые являются положительными по экспрессии конкретного белка на поверхности клетки (правый верхний квадрант каждой точки участка проточной цитометрии), уровни связывания с GAS6 (y-ось) количественно представлены на графике ниже. Выделенные пять продуктов показывают значительно лучшее связывание с GAS6 по сравнению с диким типом AXL.
Фигура 13. Связывание улучшенных вариантов AXL с GAS6. Левая панель показывает равновесие связывания GAS6 с мутантами AXL S6-1 (красный квадрат) и S6-2 (голубые ромбы) по сравнению с диким типом AXL (зеленые кружки). Мутанты S6-1 и S6-2 показывают значительно более высокие уровни связывания с низкими концентрациями GAS6, демонстрируя более сильное сродство связывания для этих мутантов по сравнению с диким типом AXL. В правой панели показана кинетика диссоциации Gas6-AXL взаимодействия для AXL дикого типа или сконструированного AXL. При взаимодействие Gas6 с диким типом AXL образуется Gas6-AXL «дикий тип», который распадается быстро, как функция от времени, в то время как при взаимодействии сконструированных S6-1 ("S6-1") или S6-2 ("S6-2") с Gas6 показано значительное увеличение сохранности связывания.
Фигура 14. Внутрибрюшинная доставка очищенного AXL S6-1-Fc показывает усиление терапевтического эффекта дикого типа AXL-Fc и AXL E59R/T77R-Fc. Представлено два изображения вскрытия мышей из трех групп лечения, AXL E59R/T77R-Fc, AXL-Fc дикого типа, и AXL S6-1-Fc. Черные кружки на снимках, указывают на видимое метастатическое поражение, но не обязательно показывают все метастазы. AXL-Fc дикого типа показывает умеренное ингибирование метастазирования, но превышающее отрицательный контроль, AXL E59R/T77R, a AXL S6-1 показывает почти полное подавление метастазирования.
Фигура 15. Ингибирование метастазирования в ксенографной модели SKOV3ip.1. На первых двух графиках один и тот же набор данных представлен двумя различными способами, чтобы показать, как среднее количество метастазов учитывается в каждой группе лечения. Кроме того, два нижних графика показывают тот же набор данных, который описывает общий вес всех метастазов, которые вырезали из мышей в каждой группе. AXL-Fc дикого типа препятствует распространению метастазов по сравнению с отрицательным E59R/T77R-Fc контролем, о чем свидетельствует снижение как количества повреждений (верхняя панель), так и общий вес (нижняя панель). AXL S6-1-Fc показывает значительное снижение опухолевой массы по сравнению с диким типом AXL-Fc и AXL E59R/T77R-Fc, как можно оценить по количеству поражений (верхняя панель), а также общему весу (нижняя панель). Эти данные показывают, что увеличенное сродство AXL S6-1 обеспечивает повышенную терапевтическую эффективность для дикого типа, и что AXL S6-1-Fc является эффективным способом лечения для борьбы с метастазированием.
Определения
В описании, представленном ниже, широко используется целый ряд терминов, обычно применяемых в области культуры клеток. В целях обеспечения четкого и последовательного понимания описания и формулы изобретения, а также объема, определяемого этими терминами, предусмотрены следующие определения.
"Ингибиторы", "активаторы" и "модуляторы" AXL на метастатических клетках или его лиганда GAS6 используются для обозначения ингибирующих, активирующих или модулирующих молекул соответственно, и определены с использованием in vitro и in vivo анализов связывания рецепторов или лигандов, и передачи сигналов, например, лигандов, рецепторов, агонистов, антагонистов и их гомологов и миметиков.
Термин «полипептид», «пептид» и «белок» используются здесь взаимозаменяемо для обозначения полимера, состоящего из аминокислотных остатков. Термин распространяются и на аминокислотные полимеры, в которых один или более аминокислотных остатков является искусственным химическим миметиком, соответствующим природной аминокислоте, а также на природные аминокислотные полимеры, и не встречающиеся в природе аминокислотные полимеры.
Термин "аминокислота" означает природные и синтетические аминокислоты, а также аналоги аминокислот и миметики аминокислот, которые функционируют подобно природным аминокислотам. Природные аминокислоты кодируются генетическим кодом, также как аминокислоты, которые затем модифицируются, например, гидроксипролин, гамма-карбоксиглутамат и O-фосфосерин. Аналоги аминокислот относятся к соединениям, которые имеют ту же основную химическую структуру природных аминокислот, то есть альфауглерод, который связан с водородом, карбоксильной группой, аминогруппой и R группой, например, гомосерин, норлейцин, метионинсульфоксид, S-метилметионин. Такие аналоги, имеют измененные R группы (например, норлейцин) или модифицированные боковые пептидные связи, но у них сохранена базовая химическая структура природных аминокислот. Миметики аминокислот относятся к химическим соединениям, которые имеют структуру, отличную от общей химической структуры аминокислот, но функции аналогичные природным аминокислотам. В настоящем изобретении используются отдельные буквы, для обозначения аминокислот, которые являются общепринятыми символами аминокислот, широко используемыми в этой области, например, А означает аланин, С означает цистеин и др. Когда аминокислота представлена одной буквой до и после соответствующей позиции, это означает замену первоначальной аминокислоты (до) в данной позиции на измененную аминокислоту (после). Например, А19Т означает, что аминокислота аланин в положении 19 меняется на треонин.
Термин "субъект", "индивид" и "пациент" используются здесь взаимозаменяемо для обозначения млекопитающих, которых анализируют в процессе лечения и/или которые проходят лечение. В одном варианте воплощения млекопитающее является человеком. Термины "субъект", "индивид" и "больной" таким образом, охватывают лиц, имеющих рак, в том числе, без ограничений, аденокарциномы яичников или простаты, рак молочной железы, глиобластомы и т.д., в том числе тех, кто подвергся или являются кандидатами на удаление злокачественной ткани (операцию). Субъекты могут быть человеком, но также включают и других млекопитающих, особенно млекопитающих, полезных в качестве лабораторных моделей для заболеваний человека, например, мышь, крысу и т.д.
Термин «опухоль», как он использован здесь, относится ко всем неопластическим клеточным образованиям, независимо от злокачественного или доброкачественного характера пролиферации, и всем предраковым и раковым клеткам и тканям.
Термины "рак", "новообразование" и "опухоль" используются здесь взаимозаменяемо для обозначения клеток, которые характеризуются автономным, нерегулируемым ростом так, что они обладают аномальным фенотипом роста, и характеризуются значительной потерей контроля над клеточной пролиферацией. В общем, клетки, представляющие интерес для обнаружения, анализа, классификации или лечения в настоящей заявке включают предраковые (например, доброкачественные), злокачественные, преметастатические, метастатические и неметастатические клетки. Примеры рака включают, но не ограничиваются ими, раком яичников, глиобластомой, раком молочной железы, раком толстой кишки, раком легких, раком простаты, гепатоцеллюлярным раком, раком желудка, раком поджелудочной железы, раком шейки матки, раком яичников, раком печени, раком мочевого пузыря, раком мочевыводящих путей, раком щитовидной железы, раком почки, карциномой, меланомой, раком головы и шеи, а также раком мозга.
"Патология" рака включает в себя все явления, которые ставят под угрозу благополучие пациента. Это включает в себя, но не ограничивается этим, нарушение или неконтролируемый рост клеток, метастазирование, вмешательство в нормальное функционирование соседних клеток, секреция цитокинов или других секреторных продуктов в аномальных количествах, подавление или обострение воспалительной или иммунологической реакции, неоплазию, предопухолевое состояние, злокачественные опухоли, инвазию в окружающие или отдаленные ткани или органы, такие как лимфатические узлы, и т.д.
Термины "раковый рецидив" и "опухолевый рецидив", как они используются здесь, и их грамматические варианты обозначают дальнейший рост опухолевых или раковых клеток после установления диагноза рак. В частности, рецидив может произойти, когда дальнейший рост раковой клетки происходит в раковой ткани. "Распространение опухоли" также происходит, когда клетки опухоли распространяются в местных или отдаленных тканях и органах, поэтому распространения опухоли включает в себя метастазирование опухоли. "Инвазия опухоли" возникает, когда рост опухоли распространился на местном уровне, нарушая функции участвующих тканей за счет сжатия, деструкции или предотвращения нормальной функции органа.
Термин "метастазирование", как он использован здесь, относится к росту раковой опухоли в органе или части тела, которые непосредственно не связаны с органом первоначальной раковой опухоли. Метастазирование также включает микрометастазирование - присутствие некоторого неопределяемого количества раковых клеток в органе или части тела, которые непосредственно не связаны с органом первоначальной раковой опухоли. Метастазирование может быть определено как несколько шагов процесса, таких как выход раковых клеток из места первоначальной опухоли, миграция и/или инвазия раковых клеток в другие части тела. Таким образом, настоящее изобретение предусматривает способ определения риска дальнейшего роста одной или нескольких раковых опухолей в органе или части тела, которые непосредственно не связаны с органом первоначальной раковой опухоли, и/или любые шаги в процессе подготовки для этого роста.
В зависимости от характера рака получается соответствующий образец пациента. Используемое здесь выражение "раковый образец ткани" относится к любым клеткам, полученным из раковой опухоли. В случае твердых опухолей, которые не метастазируют, образец ткани получают из опухоли удаленной хирургическим путем, и готовят к тестированию с помощью обычных методик.
Для определения используется кровь и другие жидкие образцы биологического происхождения, твердые образцы тканей, такие как биопсия или тканевые культуры, или клетки, полученные из нее и их потомство. При определении также используются образцы, которые были изменены после их получения каким либо образом, например, путем обработки реагентами; промыванием; или обогащением определенных клеточных популяций, таких как раковые клетки. Образец также может быть обогащен отдельными видами молекул, например, нуклеиновыми кислотами, полипептидами и т.д. Термин «биологический образец» включает в себя клинический образец, а также ткань, полученную при хирургической резекции, ткань, полученную при биопсии, клетки в культуре, супернатанты клеток, клеточные лизаты, образцы тканей, органов, костного мозга, крови, плазмы, сыворотки, и тому подобное. «Биологический образец» также включает в себя образец, полученный от раковых клеток пациента, например, образец, включающий полинуклеотиды и/или полипептиды, которые получаются из раковых клеток пациента (например, лизат клеток или других клеточных экстрактов, включающих полинуклеотиды и/или полипептиды); а также образец, включающий раковые клетки пациента. Биологический образец, содержащий раковые клетки от пациента, также может включать нераковые клетки.
Термин "диагностика" используется здесь для обозначения определения молекулярного или патологического состояния или болезни, таких как идентификация молекулярных подтипов рака молочной железы, рака предстательной железы или других видов рака.
Термин "прогноз" используется здесь для обозначения предсказания вероятности связанных с раком смерти или прогрессирования, в том числе рецидивов, метастазирования и лекарственной устойчивости опухолевых заболеваний, таких как рак яичников. Термин "предсказание" используется здесь для обозначения акта предсказания или оценки, основанного на наблюдениях, опыте и научных рассуждениях. В одном примере врач может предсказать вероятность того, что пациент выживет после хирургического удаления первичной опухоли и/или химиотерапии в течение определенного периода времени без рецидива рака.
Используемые здесь термины "лечение", "лечить" и тому подобные, относятся к введению агента или проведению процедуры (например, облучение, хирургическое вмешательство и т.д.) в целях получения эффекта. Эффект может быть профилактическим с точки зрения полного или частичного предотвращения болезни или ее симптома, и/или может быть терапевтическим с точки зрения осуществления частичного или полного излечения от болезни и/или симптомов заболевания. "Лечение", используемое здесь, включает в себя любое лечение любой метастатической опухоли у млекопитающих, в частности у человека, и включает: (а) предотвращение болезни или симптома заболевания, протекающего в субъекте, который может быть предрасположен к болезни, но до сих пор у него ее не диагностировали (например, при наличии у субъекта заболеваний, которые могут быть связаны с или вызваны основным заболеванием); (b) ингибирование заболевания, то есть задержка его развития; а также (с) облегчение болезни, т.е. регресс заболевания. При лечении опухоли (например, рака), терапевтический агент может непосредственно уменьшить метастазирование опухолевых клеток.
Лечение может относиться к любым признакам успеха в лечении или улучшения, или профилактики рака, в том числе объективным или субъективным параметрам, таким как прекращение, ремиссия; уменьшение симптомов или принятия болезнью состояния более терпимого для пациента; замедление скорости дегенерации или ухудшения; или делает конечную точку вырождения менее изнурительной. Лечение или облегчение симптомов может быть основано на объективных или субъективных параметрах, в том числе результатах исследований врача. Таким образом, термин «лечение» включает в себя введение соединения или агента настоящего изобретения, чтобы предотвратить или приостановить, чтобы облегчить либо задержать, или ингибировать развитие симптомов или состояния, связанного с неоплазией, например, опухолью или раком. Термин "терапевтический эффект" относится к сокращению, ликвидации или предотвращению болезни, симптомов болезни или побочных эффектов болезни у субъекта.
Термины "в сочетании с", "комбинированная терапия" и "комбинированные продукты" относятся, в некоторых вариантах воплощений, к одновременному введению пациенту первого терапевтического агента и соединений, которые используются здесь. При приеме внутрь в комбинации каждый компонент может быть введен одновременно или последовательно в любом порядке в различные моменты времени. Таким образом, каждый компонент может быть введен отдельно, но достаточно близко во времени таким образом, чтобы обеспечить необходимый терапевтический эффект.
В соответствии с настоящим изобретением первый терапевтический агент может быть любым подходящим терапевтическим агентом, например, цитотоксическими агентами. Один типичный класс цитотоксических агентов представляют химиотерапевтические агенты, например, которые могут быть объединены с лечением для ингибирования AXL или GAS6 сигнализации. Типичные химиотерапевтические агенты включают, но не ограничиваются этим, альдеслейкин, альтретамин, амифостин, аспарагиназу, блеомицин, капецитабин, карбоплатин, кармустин, кладрибин, цизаприд, цисплатин, циклофосфамид, цитарабин, дакарбазин (DTIC), дактиномицин, доцетаксел, доксорубицин, дронабинол, дуокармицин, эпоэтин альфа, этопозид, филграстим, флударабин, фторурацил, гемцитабин, гранисетрон, гидроксимочевину, идарубицин, ифосфамид, интерферон альфа, иринотекан, лансопразол, левамизол, лейковорин, мегестрол, месну, метотрексат, метоклопрамид, митомицин, митотан, митоксантрон, омепразол, ондансетрон, паклитаксел (Таксол™), пилокарпин, прохлороперазин, ритуксимаб, сапроин, тамоксифен, таксол, топотекана гидрохлорид, трастузумаб, винбластин, винкристин и винорельбина тартрат. Для лечения рака яичников предпочтительным химиотерапевтическим агентом, с которым могут быть объединены ингибиторы сигнализации AXL или GAS6, является паклитаксел (Таксол™).
Другие комбинированные терапии включают облучение, операции и гормональную депривацию (Kwon et al., Proc. Natl. Acad. Sci U.S.A., 96:15074-9, 1999). Ингибиторы ангиогенеза могут комбинироваться со способами изобретения.
"Одновременное введение" известного противоракового терапевтического препарата с фармацевтической композицией настоящего изобретения означает введение препарата и ингибитора AXL в такое время, когда известное лекарство и композиция настоящего изобретения будут иметь лечебный эффект. Такое одновременное введение может включать сопутствующее (то есть в то же время), предварительное или последующее введения препарата по отношению к применению соединения настоящего изобретения. Специалист в данной области не будет иметь затруднений с определением соответствующих сроков, последовательности и дозировки введения для конкретных препаратов и композиций настоящего изобретения.
Фраза "выживаемость без признаков заболевания", как используется здесь, относится к отсутствию рецидива опухоли и/или распространения, и судьбе пациента после постановки диагноза, в отношении влияния рака на продолжительность жизни пациента. Фраза "общая выживаемость" относится к судьбе пациентов после постановки диагноза, несмотря на возможность того, что причина смерти пациента напрямую не связана с последствиями рака. Фразы "вероятность выживаемости без признаков заболевания", "риск рецидива" и их варианты обращены к вероятности рецидива опухоли или ее распространения у пациента после постановки диагноза «рак», в котором вероятность определяется в соответствии со способом изобретения.
Термин "коррелирует" или "коррелирует с" и подобные термины, как они использованы здесь, относится к статистической связи между примерами двух событий, где события включают цифры, наборы данных, и тому подобное. Например, когда события связаны с числами, положительная корреляция (также называемая здесь "прямая связь") означает, что когда один растет, другой также увеличивается. Отрицательная корреляция (также называемая здесь "обратная корреляция") означает, что когда один растет, другой уменьшается.
"Единица дозирования" относится к физически дискретным единицам, соответствующим стандартным дозам для лечения конкретного индивидуума. Каждая единица может содержать заданное количество активного вещества(в), рассчитанное для получения желаемого терапевтического эффекта(ов) в сочетании с требуемым фармацевтическим носителем. Конкретная форма единицы дозирования может быть продиктована (а) уникальными характеристиками активного соединения(й) и, в частности, лечебного эффекта(ов), который должен быть достигнут, и (b) ограничениями, возникающими при смешивании такого активного соединения(й).
"Фармацевтически приемлемый наполнитель" означает наполнитель, который будет полезен при подготовке фармацевтической композиции, которые, как правило, безопасны, нетоксичны, и, желательно, включает в себя вспомогательные вещества, которые являются приемлемыми для использования в ветеринарии, а также для использования в фармацевтических целях для человека. Такие наполнители могут быть твердыми, жидкими, полутвердыми или, в случае аэрозольного состава, газообразными.
"Фармацевтически приемлемые соли и эфиры" означает соли и эфиры, которые фармацевтически приемлемы и имеют желаемые фармакологические свойства. Такие соли включают соли, которые могут быть образованы кислыми протонами, которые присутствуют в соединении и способны реагировать с неорганическими или органическими основаниями. Подходящие неорганические соли включают соли, формируемые со щелочными металлами, например, натрием и калием, магнием, кальцием и алюминием. Подходящие органические соли включают соли, образованные с органическими основаниями, такими как основные амины, например, этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и тому подобное. Такие соли включают также соли присоединения кислоты, образованные с неорганическими кислотами (например, соляной и бромистоводородной кислотами) и органическими кислотами (например, уксусной кислотой, лимонной кислотой, малеиновой кислотой, и алкан- и аренсульфокислотами, такими как метансульфокислота и бензолсульфокислота). Фармацевтически приемлемые сложные эфиры включают эфиры, образуемые из карбокси, сульфонилокси и фосфонокси групп, присутствующих в соединениях, например, C1-6 алкильных эфиров. При наличии двух кислотных групп фармацевтически приемлемая соль или эфир может быть монокислота-моносоль или эфир или дисоль или эфир; а также там, где присутствует более двух кислотных групп, некоторые или все эти группы участвуют в солеобразовании или этерификации. Соединения, указанные в настоящем изобретении, могут присутствовать в "несолевой" или неэтерифицированной форме или в форме соли, и/или этерифицированной форме и при упоминании таких соединений подразумевается как исходные (несолевые и неэтерифицированные) соединения, так и их фармацевтически приемлемые соли и эфиры. Кроме того, некоторые соединения, указанных в настоящем изобретении, могут быть представлены в нескольких стереоизомерных формах и упоминания таких соединений должны включать все индивидуальные стереоизомеры и все смеси (рацемические или иным образом организованные) таких стереоизомеров.
Термины "фармацевтически приемлемый", "физиологически приемлемый" и их грамматические варианты, относятся к композициям, носителям, разбавителям и реагентам, которые используются как синонимы, и заявляют, что материалы применимы к использованию на, или для человека, без проявления нежелательных физиологических эффектов до такой степени, чтобы запретить применение композиции.
"Терапевтически эффективное количество" означает количество, которое, при введении объекту с целью лечения заболеваний, достаточно, чтобы осуществить лечение этих болезней.
Подробное описание
В соответствии с настоящим изобретением, предлагаются растворимые варианты AXL, например, растворимый вариант полипептида AXL, у которого активность связывания с GAS6 по существу равна или лучше, чем активность связывания полипептида AXL дикого типа. В некоторых вариантах воплощения изобретения, растворимый вариант полипептида AXL используется в качестве терапевтических агентов.
Белок AXL, со ссылкой на нативную последовательность SEQ ID NO:1, состоит из иммуноглобулин(Ig)-подобного домена, образованного остатками 27-128, второго Ig-подобного домена, образованного остатками 139-222, доменов фибронектина типа 3, образованных остатками 225-332 и 333-427, внутриклеточного домена, образованного остатками 473-894, который включает домен тирозинкиназы. Остатки тирозина в 779, 821 и 866 положениях становятся аутофосфорилированными при димеризации рецептора и служат участками присоединения внутриклеточных сигнальных молекул. Нативный сайт расщепления, для высвобождения растворимой формы полипептида, находится на остатках 437-451.
Для целей изобретения растворимая форма AXL - это часть полипептида, которая является достаточной для связывания GAS6 с заметным сродством, например, с высоким сродством, которая обычно находится между сигнальной последовательностью и трансмембранным доменом, то есть обычно составляет от, примерно, остатка 19 до остатка 437 в SEQ ID NO:1, но которые могут включать или состоять в основном из усеченной версии примерно от остатка 19, 25, 30, 35, 40, 45, 50 до остатка 132, 450, 440, 430, 420, 410, 400, 375, 350 и 321, например, остатки 19-132. В некоторых вариантах воплощения растворимой форме AXL не хватает трансмембранного домена и, возможно, внутриклеточного домена.
Растворимый вариант Полипептидов AXL (варианты sAXL) в данном изобретении включает одну или несколько модификаций аминокислот в пределах растворимой форме дикого типа AXL, например, одну или несколько модификаций аминокислот, которые повышают его сродство к GAS6. В соответствии с настоящим изобретением модификации аминокислот включают естественные или искусственные модификации аминокислот, которые известны или позже будут обнаружены в этой области. В некоторых вариантах воплощения модификации аминокислот включают естественные мутации, например, замена, удаление, добавление, вставка и т.д. В некоторых других вариантах воплощения модификации аминокислот включают в себя замену существующей аминокислоты другой аминокислотой, например, консервативным ее эквивалентом. В некоторых других вариантах воплощения, модификация аминокислоты включают замену одной или нескольких существующих аминокислот неприродными аминокислотами, или вставку одной или нескольких неприродных аминокислот. В еще нескольких других вариантах воплощения, модификации аминокислоты включают, по меньшей мере, 1, 2, 3, 4, 5 или 6, или 10 аминокислотных мутаций или изменений.
В некоторых типичных вариантах воплощения одна или несколько модификаций аминокислоты может быть использована для изменения свойств растворимых форм AXL, например, влиять на стабильность, связывающую активность и/или специфичность, и т.д. Способы in vitro мутагенеза клонированных генов известны. Примеры протоколов для сканирования мутаций могут быть найдены в Gustin et al., Biotechniques 14:22 (1993); Barany, Gene 37:111-23 (1985); Colicelli et al., Mol Gen Genet 199:537-9 (1985); и Prentki et al., Gene 29:303-13 (1984). Способы сайтспецифического мутагенеза могут быть найдены в Sambrook et al., Molecular Cloning: A Laboratory Manual, CSH Press 1989, pp.15.3-15.108; Weiner et al., Gene 126:35-41 (1993); Sayers et al., Biotechniques 13:592-6 (1992); Jones and Winistorfer, Biotechniques 12:528-30(1992); Barton et al., Nucleic Acids Res 18:7349-55 (1990); Marotti and Tomich, Gene Anal Tech 6:67-70 (1989); и Zhu Anal Biochem 177:120-4 (1989).
В некоторых вариантах воплощения варианты sAXL настоящего изобретения включают одну или несколько модификаций аминокислот в одном или нескольких участках от 18 остатка до 130, от 10 остатка до 135, от 15 остатка до 45, от 60 остатка до 65, от 70 остатка до 80, от 85 остатка до 90, 91 остатка до 99, от 104 остатка до 110, 111 остатка до 120, от 125 остатка до 130, от 19 остатка до 437, от 130 остатка до 437, от 19 остатка до 132, от 21 остатка до 132, от 21 остатка до 121, от 26 остатка до 132 или от 26 остатка до 121 в последовательности AXL дикого типа (SEQ ID NO:1). В некоторых других вариантах воплощения варианты sAXL настоящего изобретения включают одну или несколько модификаций аминокислот в одном или нескольких участках от 20 остатка до 130, от 37 остатка до 124 или от 141 остатка до 212 в AXL дикого типа (SEQ ID NO:1). Еще в некоторых других вариантах воплощения варианты sAXL настоящего изобретения включают одну или несколько модификаций аминокислот, соответствующих положению 19, 23, 26, 27, 32, 33, 38, 44, 61, 65, 72, 74, 78, 79, 86, 87, 88, 90, 92, 97, 98, 105, 109, 112, 113, 116, 118, 127 или 129 в последовательности AXL дикого типа (SEQ ID NO:1).
В некоторых других вариантах воплощения варианты sAXL настоящего изобретения включают одну или несколько модификаций аминокислот, включая без всяких ограничений 1) А19Т, 2) Т23М, 3) E26G, 4) E27G или E27K, 5) G32S, 6) N33S, 7) T38I, 8) Т44А, 9) H61Y, 10) D65N, 11) A72V, 12) S74N, 13) Q78E, 14) V79M, 15) Q86R, 16) D87G, 17) D88N, 18) I90M или 190 V, 19) V92A, V92G или V92D, 20) I97R, 21) Т98А или Т98Р, 22) Т105М, 23) Q109R, 24) V112A, 25) F113L, 26) H116R, 27) T118A, 28) G127R или G127E и 29) E129K, и их комбинации.
В некоторых других вариантах воплощения варианты sAXL настоящего изобретения включают одну или более модификаций аминокислот в позиции 32, 87, 92 или 127 дикого типа AXL (SEQ ID NO:1), или их сочетание, например, G32S; D87G; V92A и/или G127R. Еще в некоторых других вариантах воплощения варианты sAXL настоящего изобретения включают одну или несколько модификаций аминокислот в положении 26, 79, 92, 127 дикого типа AXL (SEQ ID NO:1) или их сочетание, например, E26G, V79M; V92A и/или G127E.
В соответствии с настоящим изобретением варианты sAXL настоящего изобретения могут быть в дальнейшем изменены, например, присоединением к широкому кругу других олигопептидов или белков для различных целей. Например, различные посттрансляционные или постэкспрессионные модификации могут быть осуществлены в отношении вариантов sAXL настоящего изобретения. Например, при использовании соответствующих кодирующих последовательностей, можно обеспечить фарнезирование (процесс переноса групп ферментом фарнезилтрансферазой) или пренилирование (посттрансляционная модификация белка, заключающаяся в присоединении фарнезильных и геронилгеронильных групп к C-концевым остаткам цистеина). В некоторых вариантах воплощения варианты sAXL настоящего изобретения могут быть ПЭГилированными, где полиэтиленокси группы обеспечивают увеличение времени жизни в кровотоке. Варианты sAXL настоящего изобретения могут быть объединены с другими белками, например, Fc из изотипа IgG, который может комплементарно связываться с токсином, таким как рицин, абрин, дифтерийный токсин и т.п., либо со специфическими связывающими агентами, которые позволяют нацеливаться на конкретные фрагменты на клетках-мишенях.
В некоторых вариантах воплощений варианты sAXL настоящего изобретения являются гибридным белком, например, слитым со вторым полипептидом. В некоторых вариантах воплощений второй полипептид способен увеличить размер гибридного белка, например, таким образом, что гибридный белок не будет быстро выведен из циркуляции. В некоторых других вариантах воплощений второй полипептид является частью или всей областью Fc. В некоторых других вариантах воплощений второй полипептид является любым подходящим полипептидом, который является по существу сходным с Fc, например, обеспечивая увеличенный размер и/или дополнительное связывание или взаимодействие с молекулами Ig. Еще в некоторых других вариантах воплощений второй полипептид частично или полностью является белком альбумином, например, человеческим сывороточным альбумином.
В некоторых других вариантах воплощений второй полипептид полезен для совершенствования вариантов sAXL, например, очистки вариантов sAXL или для повышения их устойчивости in vitro или in vivo. Например, варианты sAXL настоящего изобретения могут быть объединены с частями константных доменов иммуноглобулина (IgG), в результате чего получаются химерные или гибридные полипептиды. Эти гибридные белки облегчают очистку и характеризуются повышенным временем полураспада in vivo. Один заявленный пример описывает химерные белки, состоящие из первых двух доменов человеческого CD4-полипептида и различных доменов константных областей тяжелых или легких цепей иммуноглобулинов млекопитающих. ЕР А 394827; Trauneckeretal., Nature, 331:84-86, 1988. Гибридные белки с дисульфидно-связанными димерными структурами (в связи с наличием IgG) также могут быть более эффективными в связывании и нейтрализации других молекул, чем мономерный секретируемый белок или один фрагмент белка. Fountoulakis et al., J. Biochem. 270:3958-3964, 1995.
В некоторых других вариантах воплощений второй полипептид является маркерной последовательностью, таким как пептид, который способствует очистке гибридного полипептида. Например, маркерная аминокислотная последовательности может быть пептидом гексагистидин, таким как представленная в векторе pQE (QIAGEN, Inc, 9259 Eton Avenue, Chatsworth, Calif., 91311), в частности, многие из которых доступны в продаже. Как описано в Gentz et al., Proc. Natl. Acad. Sci. USA 86:821-824, 1989, такой гексагистидин, например, обеспечивает удобную очистку гибридного белка. Другой пептидный маркер, полезный для очищения, "НА" маркер, соответствует эпитопу, полученному от белка гемагглютинина гриппа. Wilson et al., Cell 37:767, 1984.
В некоторых других вариантах воплощений второй полипептид полезен для улучшения характеристик вариантов sAXL настоящего изобретения. Например, в области дополнительных аминокислот, особенно заряженные аминокислоты, могут быть добавлены к N-концу полипептида для повышения стабильности и устойчивости во время очистки от клетки-хозяина или последующей обработки и хранения. Кроме того, пептидные группы могут быть добавлены в варианты sAXL изобретения для облегчения очистки и впоследствии удалены до окончательной подготовки полипептида. Кроме того, пептидные фрагменты для облегчения обработки полипептидов известны в обычных методиках исследований.
В еще некоторых вариантах воплощений варианты sAXL настоящего изобретения имеют активность связывания с GAS6, что, по меньшей мере, равна или лучше, чем у дикого типа AXL. В некоторых других вариантах воплощений варианты sAXL настоящего изобретения имеют активность связывания или сродство к GAS6, которая, по меньшей мере, в 1 раз, в 2 раза, в 3 раза, в 4 раза, в 5 раз или в 6 раз больше, чем у дикого типа AXL. В некоторых других вариантах воплощений варианты sAXL настоящего изобретения имеют активность связывания или сродство к GAS6, по меньшей мере, около 1×10-6, 1×10-7, 1×10-8 или 1×10-9 М. В некоторые других вариантах воплощений варианты sAXL изобретения способны ингибировать, подавлять или конкурировать с диким типом AXL за связывание с GAS6 in vivo, in vitro, или и так и так. Еще в некоторых других вариантах воплощений варианты sAXL настоящего изобретения ингибируют или конкурируют со связыванием AXL S6-1, AXL S6-2, и/или AXL S6-5, как это показано в примере 2 настоящего описания. В некоторых других вариантах воплощений варианты sAXL настоящего изобретения ингибируют или конкурируют со связыванием с любым вариантом sAXL, как это показано в примере 2 настоящего описания.
Способность молекулы связываться с GAS6 может быть определена, например, по оценке способности предполагаемого лиганда связываться с пластиной, покрытой GAS6. В одном из вариантов воплощений активность связывания вариантов sAXL настоящего изобретения с GAS6 может быть проанализирована по иммобилизации лигандов, например, GAS6 или варианта sAXL. Например, анализ может включать в себя иммобилизацию GAS6, смешанного с маркером His на Ni-активированных NTA полимерных (смоляных) шариках. Агенты могут быть добавлены в соответствующий буфер и шарики инкубируют в течение определенного периода времени при заданной температуре. После отмывки, предназначенной для удаления несвязанного материала, связанный белок может быть освобожден, например, SDS (додецилсульфатом натрия), буфером с высоким рН и подобными агентами, и проанализирован.
В других вариантах воплощений варианты sAXL настоящего изобретения имеют более высокую термическую стабильность, чем термическая стабильность дикого типа AXL. В некоторых вариантах воплощений температура плавления вариантов sAXL настоящего изобретения не менее, чем на 5°С, 10°С, 15°С или 20°С выше температуры плавления дикого типа AXL.
В соответствии с настоящим изобретением варианты sAXL настоящего изобретения также могут включать одну или несколько модификаций, которые не изменяют первичной последовательности вариантов sAXL настоящего изобретения. Например, такие модификации могут включать в себя химические преобразования полипептидов, например, ацетилирование, амидирования, карбоксилирование и т.д. Такие модификации могут также включать модификации гликозилирования, например, сделанные путем изменения паттерна гликозилирования полипептида в ходе синтеза и процессинга, или в ходе дальнейших шагов обработки; например, подвергая полипептид действию ферментов, которые влияют на гликозилирование, таких как гликозилирующие или дегликозилирующие ферменты млекопитающих. В некоторых вариантах воплощений варианты sAXL настоящего изобретения включают вариант sAXL с фосфорилированными аминокислотными остатками, например, фосфотирозином, фосфосерином или фосфотреонином.
В других вариантах воплощений варианты sAXL настоящего изобретения включают варианты sAXL дополнительно модифицированные для улучшения их устойчивости к протеолитической деградации или для оптимизации свойств растворимости, или чтобы сделать их более подходящими в качестве терапевтического средства. Например, варианты sAXL настоящего изобретения включают аналоги варианта sAXL, содержащего остатки, отличающиеся от природных L-аминокислот, например, D-аминокислоты или не встречающихся в природе синтетические аминокислоты. D-аминокислотами могут быть заменены некоторые или все из аминокислотных остатков.
В некоторых других вариантах воплощения варианты sAXL настоящего изобретения включают, по меньшей мере, два одинаковых или различных варианта sAXL, связанных ковалентно или нековалентно. Например, в некоторых вариантах воплощения варианты sAXL настоящего изобретения включают два, три, четыре, пять или шесть одинаковых, или различных вариантов sAXL, связанных ковалентно, например, так, что они будут иметь соответствующие размеры, чтобы избежать нежелательной агрегации.
В соответствии с настоящим изобретением варианты sAXL настоящего изобретения могут производиться любым подходящим способом из известных или позже обнаруженных в этой области, например, производится из эукариотических или прокариотических клеток, синтезироваться in vitro и т.д. Если белок производится из прокариотических клеток, он может быть дополнительно обработан для развертывания, например, тепловой денатурацией, восстановление DTT и т.д., и используя способы, известные в данной области, может быть вновь свернут.
Полипептиды могут быть получены в синтезе in vitro, используя обычные способы, известные в данной области. Имеются различные коммерческие аппараты для синтеза, например, автоматизированный синтезатор от Applied Biosystems, Inc., Foster City, CA, Beckman и т.д. С помощью синтезаторов природные аминокислоты могут быть заменены на неприродные аминокислоты. Определение последовательности и порядка подготовки будет зависеть от удобства, экономики, требуемой чистоты и тому подобного.
Полипептиды могут быть выделены и очищены в соответствии с традиционными способами рекомбинантного синтеза. Лизат может быть получен из экспрессирующего хозяина и очищен с использованием HPLC (высокоэффективной жидкостной хроматографии), эксклюзионной хроматографии (гель-фильтрации), гель-электрофореза, аффинной хроматографии или другой техники очищения. По большей части композиции, которые используются, содержат не менее 20% по массе целевого продукта, чаще всего по меньшей мере около 75% по массе, предпочтительно по меньшей мере около 95% по массе, а для терапевтических целей, как правило, по меньшей мере, около 99,5% по массе, в зависимости от загрязнения, связанного со способом приготовления продукта и его очисткой. Как правило, процент будет основан на общем белке.
Способы, которые хорошо известны специалистам в данной области, могут быть использованы для конструирования векторов экспрессии, содержащих кодирующие последовательности и соответствующие транскрипционные/трансляционные элементы контроля. Эти способы включают, например, технику рекомбинантных ДНК in vitro, синтетические способы и рекомбинацию/генетическую рекомбинацию in vivo. Альтернативно РНК, способная кодировать полипептиды, может быть химически синтезирована. Любой из специалистов в данной области может легко использовать известные таблицы кодонов и способы синтеза для создания приемлемой кодирующей последовательности для любого из полипептидов изобретения. Прямые способы химического синтеза, включают, например, фосфотриэфирный способ Narang et al. (1979) Meth. Enzymol. 68:90-99; фосфодиэфирный способ Brown et al. (1979) Meth. Enzymol. 68:109-151; диэтилфосфамидный способ Beaucage et al. (1981) Tetra. Lett, 22:1859-1862; a также синтез на твердой подложке из патента США №4458066. Химический синтез дает одноцепочечный олигонуклеотид. Он может быть преобразован в двухцепочечную ДНК путем гибридизации с комплементарной последовательностью, или полимеризации ДНК-полимеразой с использованием одной нити в качестве матрицы. В то время как химический синтез ДНК часто ограничен последовательностью около 100 оснований, большие последовательности могут быть получены путем лигирования коротких последовательностей. Кроме того, подпоследовательности можно клонировать и соответствующие подпоследовательности расщеплять с помощью соответствующих ферментов рестрикции.
Нуклеиновые кислоты могут быть выделены и получены в существенной степени чистоты. Как правило, нуклеиновые кислоты, такие как ДНК или РНК, могут быть получены в виде, который в значительной степени свободен от примесей других природных последовательностей нуклеиновых кислот, и обычно имеет не менее 50%, по меньшей мере, около 90% чистоты. Как правило, они также являются "рекомбинантными", например, фланкированы одним или несколькими нуклеотидами, которые обычно не связаны с существующими хромосомами. Нуклеиновые кислоты изобретения могут быть представлены как линейная молекула или как кольцевая молекула, и могут быть представлены в составе автономно реплицирующихся молекул (векторов), или в составе молекул без последовательности для репликации. Экспрессия нуклеиновых кислот может регулироваться самостоятельно, либо другими регуляторными последовательностями, известными в данной области. Нуклеиновые кислоты изобретения могут быть введены в подходящие клетки-хозяева, используя различные доступные в этой области способы, такие как трансферрин поликатион-опосредованный ДНК перенос, трансфекция с «голыми» или инкапсулированными нуклеиновыми кислотами, липосом-опосредованный перенос ДНК, внутриклеточный транспорт ДНК на покрытых латексом шариках, гибридизация протопластов, вирусная инфекция, электропорация, генная пушка, опосредованная фосфатом кальция трансфекция, и тому подобное.
В некоторых вариантах воплощения настоящего изобретения предлагаются экспрессирующие векторы для in vitro или in vivo экспрессии одного или нескольких вариантов sAXL настоящего изобретения, либо постоянно, или под контролем одного или нескольких регуляторных элементов. В некоторых вариантах воплощения настоящего изобретения предусматривается клеточная популяция, содержащая один или несколько векторов экспрессии для экспрессии вариантов sAXL по изобретению, либо постоянно, или под контролем одного или нескольких регуляторных элементов.
Согласно другому аспекту изобретения оно обеспечивает выделенные антитела или их фрагменты, которые специфически связываются с белком GAS6. GAS6 (рост, задерживающий специфический 6) принадлежит структурно к семейству витамин К-зависимых белков плазмы. GAS6 обладает высокой структурной гомологией с естественным антикоагулянтом белком S, разделяя те же модульные композиции, и имеет 40% идентичности между последовательностями. GAS6 имеет свойства подобные фактору роста посредством его взаимодействия с рецептором тирозинкиназы из семейства ТАМ; Tyro3, AXL и MerTK. Белок Gas6 человека содержит 678 аминокислот, и состоит из гамма-карбоксиглутамат (GLA) - богатого домена, который опосредует связывание фосфолипидов мембран, четырех доменов, подобных эпидермальному фактору роста и двух ламинин G-подобных (LG) доменов. С последовательностью транскрипционных вариантов человеческого GAS6 можно ознакомиться в Genbank под номерами доступа NM_001143946.1; NM_001143945.1; и NM_000820.2 соответственно.
GAS6 использует уникальный механизм действия, взаимодействуя через витамин K-зависимый GLA (гамма-карбоксиглутаминовая кислота) модуль с фосфатидилсерин-содержащими мембранами, и через карбокси-терминал LamG домены с рецепторами ТАМ мембраны.
В соответствии с настоящим изобретением выделенные антитела настоящего изобретения включают любые выделенные антитела с узнаваемой специфичностью связывания с GAS6. В некоторых вариантах воплощений выделенные антитела - частично или полностью человеческие антитела. В некоторых других вариантах воплощений выделенные антитела - моноклональные или поликлональные антитела. В некоторых других вариантах воплощений выделенные антитела представляют собой химерные антитела, например, с константными областями, вариабельными областями и/или CDR3, или их комбинации из различных источников. В некоторых других вариантах воплощений выделенные антитела содержат комбинацию различных признаков, описанных в настоящем документе.
В соответствии с настоящим изобретением фрагменты выделенных антител настоящего изобретения включают полипептид, содержащий участок антитела (или в пределах каркаса антитела, в пределах иного каркаса (не антитела)), который является достаточным и необходимым для распознавания и специфического связывания полипептида с GAS6. В некоторых вариантах воплощений фрагменты выделенных антител настоящего изобретения включают вариабельные легкие цепи, вариабельные тяжелые цепи, одну или несколько CDR тяжелых цепей или легких цепей, или их комбинации, например. Fab, Fv и т.д. В некоторых вариантах воплощений фрагменты выделенных антител настоящего изобретения включают полипептид, содержащий одноцепочечное антитело, например, ScFv. В некоторых вариантах воплощений фрагменты выделенных антител настоящего изобретения включают только вариабельные области или вариабельные области в сочетании с частью области Fc, например, СН1 участок. Еще в некоторых вариантах воплощений фрагменты выделенных антител настоящего изобретения включают миниантитела, например, VL-VH-CH3 или биантитела.
В некоторых вариантах воплощений выделенные антитела настоящего изобретения связываются с эпитопом содержащим, или представленным одним или несколькими аминокислотными участками, которые взаимодействуют с AXL. В некоторых других вариантах воплощений выделенные антитела настоящего изобретения связываются с эпитопом состоящим из, или представленным одним или несколькими аминокислотными участками GAS6, например, L295-T317, Е356-Р372, R389-N396, D398-A406, Е413-Н429 и W450, М468 из GAS6.
В некоторых других вариантах воплощений выделенные антитела настоящего изобретения связываются с эпитопом содержащим, или представленным одним или несколькими аминокислотными участками, например, LRMFSGTPVIRLRFKRLQPT (SEQ ID NO:3), EIVGRVTSSGP (SEQ ID NO:4), RNLVIKVN (SEQ ID NO:5), DAVMKIAVA (SEQ ID NO:6), ERGLYHLNLTVGIPFH (SEQ ID NO:7) и WLNGEDTTIQETVVNRM (SEQ ID NO:8).
В еще некоторых других вариантах воплощений выделенные антитела настоящего изобретения связываются с эпитопом, содержащим, или представленным, по меньшей мере, одной, двумя, тремя, четырьмя, пятью или шестью аминокислотами в области L295-T317, Е356-Р372, R389-N396, D398-A406, Е413-Н429 и W450-M468 из GAS6. В некоторых других вариантах воплощений выделенные антитела настоящего изобретения связываются с эпитопом, содержащим или представленным, по меньшей мере, одной, двумя, тремя, четырьмя, пятью или шестью аминокислотами в области LRMFSGTPVIRLRFKRLQPT (SEQ ID NO:3), EIVGRVTSSGP (SEQ ID NO:4), RNLVIKVN (SEQ ID NO:5), DAVMKIAVA (SEQ ID NO:6), ERGLYHLNLTVGIPFH (SEQ ID NO:7) и WLNGEDTTIQETVVNRM (SEQ ID NO:8).
В еще нескольких других вариантах воплощений выделенные антитела настоящего изобретения способны ингибировать, подавлять или конкуровать со связыванием между GAS6 и диким типом AXL или вариантами sAXL настоящего изобретения.
В соответствии с настоящим изобретением и варианты sAXL и выделенные антитела настоящего изобретения могут быть представлены в фармацевтической композиции, подходящей для терапевтического использования, например, для лечения человека. В некоторых вариантах воплощений фармацевтические композиции по настоящему изобретению включают один или несколько терапевтических субъектов настоящего изобретения, например, варианты sAXL и/или выделенные антитела против GAS6 или фармацевтически приемлемые соли, сложные эфиры или сольваты, или пролекарства. В некоторых других вариантах воплощений фармацевтические композиции по настоящему изобретению включают один или несколько терапевтических субъектов изобретения в сочетании с другим цитотоксическим агентом, например, другим противоопухолевым агентом. В еще некоторых других вариантах воплощений фармацевтические композиции по настоящему изобретению включают один или несколько терапевтических субъектов изобретения в сочетании с другим фармацевтически приемлемым наполнителем.
В некоторых других вариантах воплощений терапевтические субъекты изобретения часто вводят в виде фармацевтической композиции, содержащей, например, активное терапевтическое средство и целый ряд других фармацевтически приемлемых компонентов. (См. Remington's Pharmaceutical Science, 15.sup.th ed., Mack Publishing Company, Easton, Pa., 1980.) Предпочтительная форма зависит от предполагаемого способа введения и терапевтического применения. Композиции могут также включать, в зависимости от желаемой лекарственной формы, фармацевтически приемлемые нетоксичные носители или разбавители, которые определены в качестве средств, широко используемых в разработке фармацевтических композиций для лечения животных или человека. Разбавитель выбран так, чтобы не влиять на биологическую активность комбинации. Примерами таких разбавителей являются дистиллированная вода, физиологический фосфатный буферный раствор, раствор Рингера, раствор декстрозы и раствор Хэнка. Кроме того, фармацевтическая композиция или рецептура может также включать другие носители, адъюванты или нетоксичные, нетерапевтические, неиммуногенные стабилизаторы и тому подобное.
В некоторых других вариантах воплощений фармацевтические композиции по настоящему изобретению также могут включать большие, медленно метаболизирующиеся макромолекулы, например, белки, полисахариды, такие как хитозан, полимолочные кислоты, полигликолевые кислоты и сополимеры (как латекс функционализированная Sepharose™, агароза, целлюлоза и тому подобное), полимерные аминокислоты, сополимеры аминокислот, и липидные агрегаты (как масляные капли или липосомы). Кроме того, эти носители могут функционировать в качестве иммуностимулирующих агентов (например, адъюванты).
Согласно еще одному другому аспекту изобретения, оно предоставляет способы лечения, уменьшения или предотвращения метастазирования опухоли или инвазии опухоли путем ингибирования пути AXL сигнализации и/или GAS6 сигнального пути. В некоторых вариантах воплощений способы настоящего изобретения включают ингибирование активности AXL, активности GAS6 или взаимодействия между AXL и GAS6. Например, активность AXL или GAS6 может быть ингибирована на уровне экспрессии генов, на уровне процессинга мРНК, на уровне трансляции, на посттрансляционном уровне, на уровне активации белка и т.д. В некоторых других примерах активность AXL или GAS6 может быть ингибирована посредством малых молекул, биологических молекул, таких как полипептиды, полинуклеотиды, антитела, конъюгаты антител и лекарств и т.д. В некоторых других примерах активность AXL или GAS6 может быть ингибирована одним или несколькими вариантами sAXL, или выделенными антителами настоящего изобретения.
В других вариантах воплощений способы настоящего изобретения включают введение субъекту, нуждающемуся в лечении, терапевтически эффективного количества или эффективной дозы терапевтических объектов настоящего изобретения, например, ингибитора активности AXL или GAS6 активности, или ингибитора взаимодействия между AXL и GAS6. В некоторых вариантах воплощений эффективные дозы терапевтических объектов настоящего изобретения, например, для лечения метастатического рака, описанные здесь, меняются в зависимости от различных факторов, включая способ введения, целевой сайт, физиологическое состояние пациента, будь то больной человек или животное, применение других препаратов, и является ли лечение профилактическим или терапевтическим. Как правило, пациент является человеком, но также можно лечить млекопитающих, не являющихся человеком, включая трансгенных животных. Лечебную дозу необходимо титровать для оптимизации эффективности и безопасности.
В некоторых вариантах воплощений дозировка может варьироваться от примерно 0,0001 до 100 мг/кг, а чаще всего от 0,01 до 5 мг/кг веса тела хозяина. Например, доза может быть 1 мг/кг массы тела или 10 мг/кг массы тела, или в пределах 1-10 мг/кг. Образцовый режим лечения влечет за собой назначение один раз каждые две недели, или раз в месяц, или раз в 3 до 6 месяцев. Терапевтические субъекты настоящего изобретения обычно вводят по несколько раз. Интервалы между отдельными дозами могут быть недельными, месячными или годовыми. Интервалы могут быть нерегулярными, как показано путем измерения уровней в крови пациента терапевтического субъекта. Кроме того, терапевтические субъекты настоящего изобретения могут быть введены с замедленным высвобождением, в этом случае частота введения ниже. Дозировка и частота изменяются в зависимости от периода полураспада полипептида у пациента.
В профилактических приложениях относительно низкие дозы вводят в относительно редкие интервалы в течение длительного периода времени. Некоторые пациенты продолжают получать лечение до конца своей жизни. В терапевтических целях иногда требуется вводить относительно высокие дозы в сравнительно короткие промежутки времени до уменьшения или прекращения прогрессирования заболевания, и, желательно, пока пациент не показывает частичное или полное улучшение симптомов заболевания. После этого пациент может быть переведен в профилактический режим.
В других вариантах воплощений способы настоящего изобретения включают лечение, уменьшение или предотвращение метастазирования опухоли, или инвазию опухоли яичников, рака молочной железы, рака легкого, рака печени, рака толстой кишки, рака желчного пузыря, рак поджелудочной железы, рака простаты и/или глиобластомы.
В некоторых других вариантах воплощения для профилактического применения фармацевтические композиции или медикаменты вводятся пациенту, подверженному или находящемуся в группе риска развития заболевания или состояния, в количестве, достаточном для устранения или снижения риска, уменьшения тяжести, или для того, чтобы отсрочить начало заболевания, в том числе биохимические, гистологические и/или поведенческие симптомы болезни, ее осложнения и промежуточный патологический фенотип, возникающий в процессе развития болезни.
В некоторых других вариантах воплощения для терапевтического применения терапевтические объекты настоящего изобретения вводят пациенту, с подозрением на наличие или уже страдающему от такой болезни в количестве достаточном, чтобы вылечить, или, по меньшей мере, частично задержать симптомы заболевания (биохимические, гистологические и/или поведенческие), в том числе его осложнений и развитие промежуточного патологического фенотипа заболевания. Количество, адекватное для достижения лечебного или профилактического лечения определяется, как терапевтически или профилактически-эффективная доза. В обоих профилактических и терапевтических режимах агенты, как правило, вводятся в несколько доз, пока достаточный ответ будет достигнут.Как правило, ответ контролируется и даются повторяющиеся дозы, если есть рецидив рака.
В соответствии с настоящим изобретением композиции для лечения метастатического рака можно вводить парентерально, местно, внутривенно, внутриопухолево, орально, подкожно, внутриартериально, внутричерепно, внутрибрюшинно, интраназально или внутримышечно. Наиболее типичные пути введения - внутривенно или внутриопухолево, хотя другие пути могут быть одинаково эффективны.
Для парентерального введения композиции изобретения могут быть введены, как инъекционные дозы раствора или суспензии вещества в физиологически приемлемом разбавителе с фармацевтическим носителем, который может быть стерильной жидкостью, например, водой, маслом, физиологическим раствором, глицерином или этанолом. Кроме того, вспомогательные вещества, такие как увлажняющие или эмульгаторы, поверхностно-активные вещества, рН буферные субстанции и т.п. могут присутствовать в композиции. Другие компоненты фармацевтических композиций являются веществами нефтяного, животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло и нефтепродукты. В общем, гликоли, такие как пропиленгликоль или полиэтиленгликоль, являются предпочтительными жидкими носителями, в частности, для растворов для инъекций. Антитела могут быть введены в виде инъекции депо препарата или имплантата, который может быть образован таким образом, чтобы можно было обеспечить замедленное высвобождение действующего вещества. Типичная композиция содержит моноклональные антитела в дозе 5 мг/мл, помещенные в водный буфер, состоящий из 50 мМ L-гистидина, 150 мМ NaCl, доведенный до рН 6,0 с HCl.
Как правило, композиции готовят как инъекции, либо в виде жидких растворов или суспензий; также могут быть получены твердые формы, пригодные для растворения или суспендирования в жидких средствах, до инъекции. Препарат также может быть эмульгированным или инкапсулированным в липосомы, или микрочастицы, такие как полилактид, полигликолид или сополимер для улучшения адъювантного эффекта, как описано выше. Longer, Science 249:1527, 1990 and Hanes, Advanced Drug Delivery Reviews 28:97-119, 1997. Агенты этого изобретения можно вводить в виде инъекции депо препарата или имплантата, который может быть сформирован таким образом, чтобы можно было получить постоянное или пульсирующее высвобождение активного ингредиента.
Дополнительные формы, пригодные для других видов применения, включают оральные, интраназальные и легочные формы, свечи и трансдермальные приложения.
Для свечей связующие вещества и носители включают, например, полиалкиленгликоли или триглицериды; такие свечи могут быть образованы из смесей, содержащих активный ингредиент в диапазоне от 0,5 до 10%, предпочтительно 1-2%. Оральные формы включают наполнители, такие как фармацевтического качества маннитол, лактозу, крахмал, стеарат магния, натрия сахарин, целлюлозу и карбонат магния. Эти композиции употребляют в форме растворов, суспензий, таблеток, драже, капсул, форм с продолжительным высвобождением или порошков, и содержат 10%-95% активного ингредиента, предпочтительно 25-70%.
Местное применение может привести к трансдермальной или внутрикожной доставке. Местному введению может способствовать одновременное назначение агента с холерным токсином или обезвреженными производными, или их субъединицами или другими подобными бактериальными токсинами. Glenn et al., Nature 391:851, 1998. Совместное введение может быть достигнуто с помощью компонентов в смеси или в виде связанных молекул, полученных путем химической сшивки или экспрессированных в виде гибридного белка.
Кроме того, трансдермальная доставка может быть достигнута с помощью кожных пластырей или с помощью трансферосом Paul et al., Eur. J. Immunol. 25:3521-24, 1995; Cevcetal., Biochem. Biophys. Acta 1368: 201-15, 1998.
Фармацевтические композиции, как правило, составляются как стерильные, по существу изотонические и в полном соответствии со всеми правилами производства и контроля качества (GMP) администрации США по продовольствию и медикаментам.
Предпочтительно терапевтически эффективные дозы композиций антител, описанные здесь, будут обеспечивать терапевтический эффект, не вызывая существенной токсичности.
Токсичность белков, описанных здесь, может быть определена по стандартным фармацевтическим процедурам в клеточных культурах или на экспериментальных животных, например, путем определения LD50 (доза смертельная для 50% популяции) или LD100 (доза смертельная для 100% популяции). Соотношение доз между токсичным и лечебным эффектами является терапевтическим индексом. Данные, полученные в исследовании на этих клеточных культурах и животных, могут быть использованы в разработке интервала доз, которые не токсичны для использования у человека. Дозировка белков, описанных здесь, находится предпочтительно в диапазоне циркулирующих концентраций, которые включают эффективную дозу и практически или совсем не токсичны. Дозировка может варьироваться в пределах этого диапазона в зависимости от лекарственной формы и используемых путей введения. Точная пропись, способ применения и дозы могут быть выбраны лечащим врачом с учетом состояния пациента. (См., например, Fingl et al., 1975, In: The Pharmacological Basis of Therapeutics, Ch. 1).
Кроме того, в рамки данного изобретения входят наборы, содержащие композиции (например, растворимые варианты AXL и их препараты) изобретения и инструкции по применению. Наборы могут также содержать как минимум один дополнительный реагент. Наборы обычно включают в себя ярлык с указанием предполагаемого использования содержимого набора. Этот термин включает любые этикетки в письменной форме, или записанные сопровождающие материалы, или в наборе, или которые иным образом сопровождают набор.
Согласно еще одному аспекту изобретения, предлагаются способы для определения способности опухоли к опухолевой инвазии и/или метастазированию путем обнаружения и/или определения уровня активности AXL или активности GAS6 в биологических образах, представляющих интерес. В некотором варианте воплощения уровень активности AXL или активности GAS6 измеряется по уровню экспрессии мРНК, уровню экспрессии белка, уровню активации белка или любому подходящему индикатору соответствующей активности AXL или GAS6 прямо или косвенно. В некоторых вариантах воплощений уровень AXL активности или GAS6 активности в биологическом образце далее сравнивается с определенным уровнем, например, стандартным уровнем, полученным путем установления нормального уровня или диапазона активности AXL, или GAS6 активности, основанной на популяции образцов опухолей, где не развивается опухолевая инвазия или метастазирование опухоли, или от нормальных тканей. Например, увеличение активности AXL или активности GAS6 более, чем предопределенный уровень или стандартный уровень свидетельствует о предрасположенности опухоли к опухолевой инвазии или метастазированию опухоли.
Все публикации и патенты, приведенные в этом описании, включены здесь в качестве ссылки, как если бы каждая публикация или патент были специально и индивидуально указаны, должны быть включены по ссылке и включены сюда путем ссылки на выявление и описание способов и/или материалов, в связи с чем приводятся публикации. Цитирование из любой публикации раскрытой до даты подачи заявки не должно быть истолковано, как признание того, что настоящее изобретение не имеет приоритета задним числом на такие публикации до вступления в силу изобретения. Кроме того, даты публикаций условны, и могут отличаться от фактической даты публикации, для которой, возможно, потребуется независимое подтверждение.
Как будет ясно специалистам в данной области при чтении этого описания, каждое отдельное воплощение, описанное и проиллюстрированное здесь, имеет дискретные компоненты и функции, которые могут быть легко отделены от или в сочетании с особенностями любого другого или нескольких воплощений, не отходя от объема или духа настоящего изобретения. Любой цитируемый способ может быть осуществлен в порядке цитируемых событий или в любом другом порядке, логически возможном. В последующем будут описаны примеры для иллюстрации частей изобретения.
Экспериментальная часть
Пример 1.
Терапевтическая блокада AXL сигнализации угнетает метастатическое прогрессирование опухоли.
Ранее AXL, в качестве терапевтической мишени для лечения метастатического заболевания был практически не исследован, а главное в условиях in vivo не была продемонстрирована связь с нацеливанием на AXL. Мы показали, что AXL является маркером метастазирования у пациентов с раком молочной железы и у пациентов с раком яичников, и тяжесть заболевания у этих пациентов коррелирует с количеством белка AXL в первичной опухоли. Самое главное, мы показали, что метастазирование опухоли может успешно лечиться у мышей, у которых уже имеется метастазирование, путем введения растворимых эктодоменов AXL. Механистически, ингибирование AXL сигнализации у животных с метастатической болезнью приводит к снижению инвазии и активности ММР. Наши результаты показывают, что ингибирование сигнального каскада AXL в опухолевых клетках путем введения растворимых эктодоменов AXL достаточно для ингибирования метастатической прогрессии опухоли.
В этом исследовании мы изучали, является ли AXL критическим фактором метастазирования рака у человека, и может ли терапевтическая блокада AXL сигнализации быть эффективным средством для лечения метастатического заболевания. Мы использовали как генетические, так и терапевтические подходы, чтобы непосредственно оценить роль AXL в инициации и прогрессировании метастатического рака молочной железы и рака яичников.
AXL является маркером прогрессирования опухоли и метастазирования для рака человека. Мы впервые сравнили экспрессию AXL в нормальных тканях, первичной опухоли и метастазах у больных с раком молочной железы или раком яичников. В 100% нормальных эпителиальных клеток, прилегающих к клеткам рака молочной железы, присутствовало диффузное цитоплазматическое и ядерное окрашивание для AXL, что было принято за фоновую окраску с учетом того, что AXL это мембраносвязанные рецепторы (n=27, фигура 1). Однако в первичных опухолях молочной железы мембранное окрашивание AXL в опухоли эпителия присутствует в 25% (1/4) 1-й стадии, 76% (10/13) 2 стадии, и 100% (18/18) 3-й стадии образцов (фигура 1А и таблица 1). Кроме того, AXL была экспрессирована в 88% (8/9) метастазов в лимфатических узлах.
В серозных образцах рака яичников AXL экспрессия впервые была рассмотрена в нормальном эпителии поверхности яичников (OSE), так как большинство опухолей яичников, как полагают, возникают из этих клеток. В образцах пациентов с раком яичников, которые сохранили нормальный OSE, AXL была экспрессирована в 0% (0/5) образцов (фигура 1В). В контрасте с этим, окрашивание мембранных AXL в первичной опухоли эпителия присутствовало в 66% (6/9) стадии II и 83% (53/64) III стадии образцов пациентов (фигура 1В и таблица I). Кроме того, опухолевые образцы от общих метастатических сайтов, таких как сальник и брюшная полость, показали высокую экспрессию AXL в 75% (24/32) и 90% (27/30) образцов соответственно (фигура 1В и таблица I). Эти данные показывают, что AXL экспрессия в первичной опухоли коррелирует с метастазированием, как показано на поздних стадиях заболевания и в метастатических опухолях. Кроме того, эти данные показывают, что метастазы, полученные из человеческой молочной железы и рака яичников, экспрессируют высокий уровень AXL.
AXL является критическим фактором для метастазирования опухоли. Для изучения функциональной роли AXL в метастазировании, мы использовали генетический подход для подавления AXL в мышиных моделях метастазирования рака молочной железы и яичников. Для этой цели мы анализировали панель человеческих линий раковых клеток молочной железы и яичников на экспрессию белка AXL с целью выявления метастазирующих клеточных линий с высоким уровнем экспрессии AXL. Как и в наших клинических данных, AXL высоко экспрессирована в большинстве метастазирующих клеточных линий рака молочной железы (NCI-ADR-РЭС, MDA-231, HS 578T, ВТ-549) и яичников (SKOV3, OVCAR-8, ES-2, MESOV, HEYA8), в то время как в клеточных линиях с низким метастатическим потенциалом (MCF7, MDA-MB435, T47D, IGROV1, OVCAR-3; фигура 9) экспрессия AXL была на неопределяемом или низком уровне. AXL-дефицитные клеточные линии метастатического рака молочной железы (MDA-231) и яичников (SKOV3ip.1 и OVCAR-8) были получены с использованием описанных мшРНК, нацеленных на AXL. Вестерн-блот анализ подтвердил, что клетки, экспрессирующие последовательности shAXL, экспрессируют менее чем 5% белка AXL по сравнению с клетками, экспрессирующими контрольные scramble последовательности мшРНК (shSCRM, фигура 9В).
Чтобы непосредственно оценить роль AXL в поздних стадиях метастазирования опухоли молочной железы, мы вводили AXL-дикого типа (shSCRM) и AXL-дефицитные (shAXL) MDA-231 клетки в хвостовую вену голой мыши и оценивали опухолевую нагрузку в легких на двадцать восьмой день. Микроскопическая оценка легких показала, что у 5/5 мышей, которым вводили scramble мшРНК (shSCRM) MDA-231 клетки, развились метастатические очаги, окрашенные положительно по AXL (фигура 2А). С другой стороны, у 0/5 мышей, которым вводили мшРНК AXL (shAXL), развились метастазы в легких при гистологической оценке (фигура 2А). Для того, чтобы количественно оценить опухолевую нагрузку в легких этих животных, мы провели анализ ПЦР в реальном времени для человеческого GAPDH. Фигура 2А показывает, что в легких мышей, которым вводили shSCRM MDA-231 клетки, экспрессируется высокий уровень человеческого GAPDH, что указывает на наличие метастазов, полученных от MDA-231 клеток. Кроме того, shSCRM инъецированные мыши экспрессируют человеческий AXL в легких, что свидетельствует о наличии AXL положительных клеток опухоли (фигура 2А). В контрасте с этим, мыши, которым вводили shAXL опухолевые клетки, не экспрессируют человеческие GAPDH или AXL в легких. Эти результаты показывают, что генетической инактивации AXL достаточно, чтобы полностью подавить образование метастазов в легких этой модели.
Для определения того, влияет ли генетическая инактивация AXL на способность клеток рака яичников к метастазированию в условиях in vivo, мы сравнили способность shSCRM и shAXL SKOV3ip.1 клеток к образованию метастазов с помощью перитонеальной модели ксенотрансплантата рака яичников. Эта модель повторяет перитонеальное распространение человеческих метастазов яичников в мыши, в которой развивается быстро прогрессирующее заболевание, состоящее из асцита и более 100 небольших метастатических поражений, которые прикреплены к брыжейке, диафрагме, печени и другим перитонеальным поверхностям после перитонеальной инъекции SKOV3ip.1 клеток (фигура 3В). Иммуногистохимический анализ AXL экспрессии в SKOV3ip.1 перитонеальных метастазов показал, что они похожи на метастазы рака яичников человека, AXL высоко экспрессирован в SKOV3ip.1 метастатических поражениях, показывая, что это релевантная модельная система для исследования роли AXL в метастазировании яичников (данные не показаны). Двадцать восемь дней спустя после перитонеальной инъекции shSCRM и shAXL клеток, shSCRM мыши показывают признаки тяжелого асцита и заболеваемости, вследствие чего было необходимо скарифицировать мышей и исследовать изменения в опухолевой нагрузке между shSCRM и shAXL инъецированными мышами. Когда мыши вводили shSCRM клетки - развивается асцит и >100 перитонеальных метастазов, если мыши вводили shAXL клетки - развивались всего несколько метастазов (фигура 2В). Среднее число перитонеальных метастазов более 5 мм в размере было значительно уменьшено с 13,4 +/- 4.3 у shSCRM инъецированных мышей до 0,8 +/- 0,5 у shAXL инъецированных мышей (фигура 2В). Кроме того, средний вес этих опухолей был значительно уменьшен с 236 +/- 74 мг у shSCRM инъецированных мышей до 39,2 +/-18 мг у shAXL инъецированных мышей (фигура 2В). В подтверждение этих выводов, нокдаун AXL экспрессии в OVCAR-8 клетках существенно ингибирует общую массу опухоли и число перитонеальных опухолей яичников (фигура 2С). В совокупности эти результаты показывают, что AXL является критическим фактором для метастазирования рака молочной железы и опухоли яичников.
Принимая во внимание важную роль AXL в образовании метастазов в условиях in vivo, мы в последующем стремились определить, действительно ли AXL специфически регулирует метастазирование или AXL играет общую роль в регуляции пролиферации опухолевых клеток и росте. Чтобы ответить на эти вопросы, мы провели in vitro анализы пролиферации, в которых общее количество клеток между AXL дикого типа (shSCRM) и AXL-дефицитными (shAXL) клетками было подсчитано за 10-14 дней. Мы не обнаружили существенных различий в клеточных кривых роста между shSCRM и shAXL MDA-231, SKOV3ip.1 или OVCAR-8 клеток (фигура 3). Кроме того, никаких существенных различий не наблюдается между ортотопическим MDA-231 или подкожным SKOV3ip.1 ростом опухоли между shSCRM и shAXL клетками (фигура 3). Эти результаты показывают, что AXL не требуется для пролиферации опухолевых клеток или подкожного роста in vivo. В целом, наши результаты показывают, что AXL специфически регулирует метастазирование опухолей молочной железы и опухолей яичников.
AXL регулирует опухолевую инвазию клеток. Для определения возможных механизмов AXL-опосредованного метастазирования, мы избрали непредвзятый подход и напрямую сравнивали роль AXL в критических клеточных функциях, связанных с метастатическим каскадом, включая пролиферацию, инвазию, миграцию, адгезию и выживание. Мы обнаружили, что shAXL MDA-231, SKOV3ip.1 и OVCAR-8 клетки были значительно ослаблены в возможности инвазии через коллаген типа I (фигура 4А). Мы также наблюдали небольшое снижением клеточной миграции в shAXL клетках, но мы не смогли найти различия в адгезии к ЕСМ белкам или в выживании после введения сыворотки, что свидетельствует о том, что AXL преимущественно влияет на инвазию в метастатическом каскаде.
Недавно было определено, что на молекулярном уровне ММР-9 является эффектором AXL-опосредованной инвазии в клетках рака молочной железы. Таким образом, мы исследовали, была ли ММР-9 экспрессия или активность изменена в AXL-дефицитных клетках опухолей яичника. Хотя SKOV3ip.1 клетки не экспрессировали ММР-9, мы обнаружили, что ММР-2 был высоко экспрессирован в этих клетках, а в клетках shAXL мРНК ММР-2 значительно снизилась (фигура 4В). Анализы ММР-2 с репортерным геном люциферазы показали, что обнаруженная активность промотора ММР-2 значительно снизилась в shAXL клетках по сравнению с клетками shSCRM, что говорит о том, что AXL регулирует ММР-2 на уровне транскрипции (фигура 4С). Желатиновый зимографический анализ показал, что уровни секретируемых белков ММР-2 были значительно снижены в shAXL клетках по сравнению с shSCRM SKOV3ip.1 клетками (фигура 4D). В совокупности эти данные свидетельствуют о роли AXL, как повышающего регулятора экспрессии ММР-2 и его активности в клетках человеческого рака яичников.
Далее мы пытались определить сигнальные пути, участвующие в AXL-опосредованной ММР-2 экспрессии. Активация AXL от GAS6, как было сообщено, непосредственно индуцирует ряд внутриклеточных сигнальных путей, в том числе PI3K, PAS, МАРК, SRC и PLC. Среди этих путей, сигнальный путь PI3K был показан, как путь регулирования экспрессии ММР-2 и инвазии в клетках рака яичников. Для определения того, как PI3K сигнализация зависит от потери AXL в SKOV3ip.1 клетках, мы провели Вестерн-блот анализы фосфо-AKT на Ser473 (P-AKT) в AXL-дикого типа и AXL-дефицитных SKOV3ip.1 клетках. Мы увидели сильное торможение P-AKT экспрессии в shAXL клетках по сравнению с shSCRM SKOV3ip.1 клетками (фигура 4Е). Кроме того, GAS6 стимуляция истощенных SKOV3ip.1 клеток в результате PI3K зависимой индукции P-AKT, такой как обработка ингибитором PI3K Ly294002, полностью отменяет GAS6 индуцированную P-AKT экспрессию (фигура 4Е). Чтобы определить, является ли путь PI3K вовлеченным в AXL-опосредованную ММР-2 экспрессию, мы провели анализы ММР-2 с репортерным геном люциферазы в присутствии GAS6 и Ly294002. Индукция ММР-2 активности промотора после стимуляции GAS6 была полностью заблокирована Ly294002, что позволяет предположить, что GAS6/AXL сигнализация регулирует ММР-2 экспрессию через PI3K сигнальные события (фигура 4F).
Терапевтическое ингибирование AXL значительно подавляет метастатическую прогрессию опухоли у мышей. Наши результаты показывают, что AXL является критическим фактором для метастазирования и подтверждают гипотезу о том, что терапевтическая блокада может быть эффективным средством для лечения метастатического заболевания. Чтобы проверить эту гипотезу, мы использовали растворимые эктодомены AXL в терапевтической стратегии для ингибирования AXL сигнализации. Растворимый эктодомен AXL функционально действует как рецептор-ловушка и ранее было показано, что связывает GAS6 с наномолярным сродством in vitro и in vivo (фигура 5А). Сначала мы исследовали, является ли лечение растворимыми эктодоменами AXL достаточным для подавления AXL сигнализации и инвазии метастатических опухолевых клеток. PI3K/AKT сигнализация регулируется AXL в различных типах клеток. Мы обнаружили, что PI3K/AKT сигнализация регулируется GAS6/AXL сигнализацией в SKOV3ip.1 клетках, и лечением растворимыми эктодоменами AXL (sAXL) удалось уменьшить PI3K/AKT активацию в обработанных GAS6 клетках SKOV3ip.1 (фигуры 5В и С). Кроме того, введения MDA-231 клеток в коллаген с sAXL было достаточно, чтобы резко сократить клеточную инвазию, демонстрируя, что использование sAXL влияет на AXL сигнализацию и инвазию in vitro (фигура 5D).
Далее мы рассмотрели, как введение sAXL повлияет на метастатическое прогрессирование опухоли в высокометастатической модели рака яичников. Вначале мы индуцировали метастатическое поражение SKOV3ip.1 у голых мышей (день 1) и начали лечение sAXL на 7 день после проверки макроскопических поражений. sAXL терапия доставлялась с помощью аденовирусной системы, при которой печень осуществляет системное высвобождение sAXL белка в сыворотку крови мышей в течение 28 дней после инъекции (фигура 6А). Макроскопические анализы опухолевой массы на 28-й день показали, что у мышей, получавших терапию sAXL было достоверное (p<0,01) снижение опухолевой массы по сравнению с мышами, получавшими Fc контрольную терапию. В модели опухоли SKOV3ip.1, общая масса опухоли и число опухолей снизилось на 63% у мышей, получавших sAXL по сравнению с Fc мышами (фигура 6В). Точно так же в OVCAR-8 модели, общий вес опухоли и число опухолей значительно уменьшилось на 47% и 42% соответственно (фигура 11). Мы рассмотрели уровни экспрессии ММР2в опухолях SKOV3ip.l с помощью ПЦР анализа в реальном времени и обнаружили, что уровни ММР2 значительно снизились в опухолях sAXL мышей по сравнению с Fc контрольными мышами (фигура 6С). Эти результаты показывают, что монотерапия AXL достаточно существенно снизила метастатическую опухолевую нагрузку у мышей с выявленным заболеванием. Кроме того, наши результаты показывают, что терапевтический эффект AXL на рост опухолевых метастазов может привести к торможению инвазии, по меньшей мере, отчасти за счет регуляции активности ММР.
Учитывая, что для предыдущих антиметастатических ингибиторов, нацеленных на ММР, было показано, что они оказывают значительное влияние на нормальные ткани в плане токсичности, мы провели комплексный анализ токсичности для нормальной ткани у мышей, получавших терапию sAXL в течение 21 дня. Мы не наблюдали поведенческих, макроскопических или микроскопических отклонений у голых мышей, получавших sAXL или Fc терапии (фигура 7).
Инвазия и миграция являются важными внутриклеточными свойствами, которые способствуют патогенезу метастазирования опухоли. Было высказано предположение, что терапевтические агенты, нацеленные на эти процессы, могут быть полезной стратегией для подавления метастазирования и могут обеспечить клинический эффект у пациентов с метастатической болезнью. Нами было показано, что рецептор тирозинкиназы AXL является критическим фактором, определяющим способность клетки к опухолевой инвазии и метастазированию. Самое главное, мы показали, что терапевтическая блокада AXL сигнализации с использованием растворимых рецепторов AXL достаточно существенно ингибирует метастатическое прогрессирование опухоли у мышей, у которых уже есть метастатическое заболевание. Механистически наши исследования показывают, что терапия растворимым AXL подавляет метастазирование опухоли, по меньшей мере, отчасти за счет ингибирования активности ММР и инвазии. Наконец мы показали, что AXL сильно экспрессирован в метастазах на продвинутой стадии первичной опухоли пациентов с раком яичников и раком молочной железы, что подчеркивает клиническое значение наших выводов.
Здесь показано, что AXL является критическим фактором для метастазирования рака у человека, и что терапевтическая блокада AXL сигнализации является эффективной для лечения метастатического заболевания. Также мы показываем, что AXL сильно экспрессирован в метастазах и продвинутых образцах первичных опухолей молочной железы и больных раком яичников. Мы показываем, что генетически AXL имеет решающее значение для начала метастатического рака молочной железы и рака яичников с использованием данных полученных на модельных организмах - голых мышах. Самое главное, мы разработали весьма специфические и нетоксичные растворимые рецепторы AXL, в качестве анти-AXL терапии, и продемонстрировали, что терапия растворимым рецептором AXL достаточно существенно тормозит метастатическое прогрессирование опухоли у мышей с существующей метастатической болезнью. Наши результаты показывают, что ингибирование сигнального каскада AXL в опухолевых клетках может заблокировать как инициацию, так и прогрессированию метастатической болезни. Наши данные подразумевают AXL, как новую терапевтическую мишень для продвинутых стадий и метастатического рака молочной железы и рака яичников, и предполагают, что анти-AXL терапия может контролировать и инициацию, и прогрессирование метастатического заболевания.
ММР играют важную роль в регуляции инвазии клеток опухоли и метастазирования. Тем не менее, механизмы, посредством которых опухолевые клетки индуцируют активность ММР, остаются неясными. ММР экспрессия увеличивается при раке у человека и коррелирует с прогрессией опухоли и плохой выживаемостью пациентов. Амплификации гена и активирующие мутации в ММР редко встречаются при человеческом раке, что позволяет предполагать, что другие факторы ответственны за повышение экспрессии ММР при раке. Наши данные свидетельствуют, что 2 экспрессия ММР регулируется AXL на уровне транскрипции в клетках человеческого рака яичников. Хотя точный механизм, с помощью которого AXL регулирует экспрессию ММР-2, еще предстоит определить, показано, что фармакологическое ингибирование PI3K пути снижает активность промотора ММР-2 в GAS6 стимулированных клетках, указывает на роль PI3K пути (фигура 8). Важно отметить, что наши результаты показывают, что терапевтическая блокада AXL может быть эффективной и нетоксичной стратегией для подавления активности ММР в опухолях. Широкий спектр ингибиторов ММР оказался неудачным при испытаниях в лечении рака, в частности в связи с высоким уровнем токсичности для нормальной ткани. Наши результаты показывают, что предсказываемые побочные эффекты анти-AXL терапии являются минимальными. Мы не наблюдали токсичность для нормальных тканей, связанную с аденовирус-опосредованной доставкой растворимого AXL эктодомена при терапии у мышей. Кроме того, зародышевые линии клеток AXL и GAS6 мышей являются жизнеспособными и фенотипически нормальными, как и взрослые, что позволяет предположить, что AXL или GAS6 не требуется для развития и нормального функционирования тканей.
Мы показали, что монотерапия AXL достаточна для ингибирования метастатического прогрессирования опухоли в высокометастатических моделях метастатического рака яичников. Эти выводы имеют важное клиническое значение для лечения рака яичников. Примерно 14 600 человек умирают от рака яичников ежегодно в Соединенных Штатах. В настоящее время нет одобренных FDA биологических способов для лечения рака яичников, хотя Авастин (mAb нацеленный VEGF) и Тарцева (маленькая молекула ингибитор EGFR киназы) используются в клинических исследованиях для лечения распространенного и рецидивирующего рака яичников. Стандартная терапия рака яичников включает в себя операции с оптимальным удалением поражения и последующей цитотоксической комбинированной терапией платина-таксан. Несмотря на эти усилия, у восьмидесяти процентов пациентов с диагнозом рак яичников развивается рецидив заболевания и только 30% из этих пациентов выживают в течение 5 лет после постановки диагноза.
Наши данные показывают, что AXL терапия является эффективной адъювантной терапией для лечения распространенного и рецидивирующего рака яичников. Модель метастатической прогрессии опухоли яичников, используемая в наших исследованиях, напоминает развитие рецидива заболевания у пациентов после хирургического удаления. Мы обнаружили, что AXL терапии удалось снизить метастатическую опухолевую нагрузку у мышей с выявленным заболеванием на 63%. Создание новых метастатических поражений во время прогрессирования заболевания значительно снизилось. Это наблюдение согласуется с нашими выводами, демонстрируя, что AXL преимущественно поражает инвазию клетки опухоли, а не клеточную пролиферацию или рост. Взятые вместе, наши результаты показывают, что терапия AXL функционирует главным образом, как антиметастатический агент и может быть наиболее эффективен в комбинированной терапии с текущими цитотоксическими агентами.
Таким образом, AXL является критическим фактором для метастазирования, и блокада AXL сигнализации имеет положительное терапевтическое действие при метастазировании. Эти исследования являются важными доклиническими данными по анти-AXL терапии для метастатической болезни.
Способы
Клеточные линии. Клетки яичников SKOV3, SKOV3ip.1 и HEYA8 были получены в подарок от Dr. Gordon Mills (MD Anderson Cancer Center). Клетки яичников ES-2 и MESOV - в подарок от Dr. Branimir Sikic (Стэнфордский университет). MDA-231, OVCAR-3 и MCF-7 клетки были получены от АТСС. IGROV-1 и OVCAR-8 клетки были приобретены у NCI-Frederick DCTD хранилища клеточной линии опухолей. Клетки культивируют в соответствующих средах с добавлением 10% термоинактивированной эмбриональной телячьей сыворотки и 1% пенициллина и стрептомицина при 37°С в 5% CO2-инкубаторе. Клеточная масса из NCI60 панели линий раковых клеток молочной железы и яичников были предоставлены Dr. Giovani Melillo (NCI-Frederick).
Пациенты и ткани микрочипов. Микрочипы человеческой ткани молочной железы были приобретены в US Biomax (BR1002). Микрочипы ткани яичника человека были получены из отделения патологии Стэнфордского университета. В общей сложности 73 парафинированных образца опухолей были получены ранее от больных раком яичников Стэнфордской больницы с 1995 по 2001 год на тот момент еще не получавших лечение. Эти первичные образцы опухолей яичников были собраны в тканевой микрочип, содержащий по два образца от каждого пациента. Еще 30 образцов опухолей из брюшной полости были оценены в этом микрочипе. Все пациенты имели серозный рак яичников, информация была получена в соответствии со стандартами Международной федерацией гинекологии и акушерства. Все образцы и соответствующие клинические данные были собраны в соответствии с протоколами, утвержденными экспертным советом организации в Стэнфордском университете. Дополнительные коммерчески доступные микрочипы опухоли были использованы для изучения 32 метастатических поражений сальника (US Biomax).
AXL иммуногистохимия. С парафинированных тканей были сделаны срезы, которые депарафинировались в ксилоле, регидратировались и демаскировались следующими стандартными иммуногистохимическими способами. Первичное антитело AXL (RandD Systems) было использовано в разведении 1:500. Отрицательный контроль для всех образцов был выполнен с помощью только вторичных антител. Комплексы антиген-антитело были визуализированы с использованием Vectastain ABC системы (Vector Laboratories) и DAB Substrate Kit для пероксидазы (Vector Laboratories) в соответствии с протоколами производителя. Срезы были контрастно окрашены гематоксилином. AXL окрашивание на мембране клеток опухоли оценивали микроскопически в соответствии с процентом положительных клеток для AXL экспрессии (0 при отсутствии, 1 для плохих по качеству образцов, 2 для 5-60% и 3 для 61-100%).
Анализы с репортером. Репортерная плазмида ММР-2 под контролем промотора ММР-2 в 1659п.о. была получена в подарок. Активность люциферазы определялась с помощью Dual-Glo Luciferase Assay reagent (Promega) в shSCRM и shAXL SKOV3ip.1 клетках, и измерялась в Monolight 2010 люминометре (Лаборатория аналитической люминесценции). Активность люциферазы светлячка нормализовалась к активности Renilla. Анализы проводились в трех экземплярах и были повторены дважды.
Временные и ретровирусные трансфекции. Временные трансфекции DMA проводились липофектамином 2000 (Invitrogen) в соответствии с инструкциями производителя. 0,1 мкг ММР-2 кДНК (OpenBiosystems) был трансфецирован в 6 чашках.
миРНК (малые интерферирующие РНК): миРНК последовательности, нацеленные на AXL или контроль, были приобретены от Dharmacon. Все миРНК трансфекции проводились с использованием Dharmacon Smart Pools с Dharmafect 1 реагентом трансфекции в соответствии с протоколом производителя (Dharmacon, Lafayette, CO).
мшРНК: Олигонуклеотиды для специфической деградации РНК AXL 5'-GATTTGGAGAACACACTGA-3' были синтезированы, как описано выше. Случайная последовательность (Scramble) была использована в качестве контрольной МшРНК 5'-AATTGTACTACACAAAAGTAC-3'. Эти олигонуклеотиды были клонированы в RNAi-Ready pSiren RetroQ (BD Bioscience) векторы и SKOV3ip.1, MDA-231, и OVCAR-8 клетки через ретровирусную трансдукцию этих векторов. Инфицированные клетки были отобраны в пуромицин (Sigma), и поликлональные популяции были протестированы на снижение уровня экспрессии AXL Вестерн-блот анализом.
Плазмиды. Эктодомены AXL, соответствующие аминокислотам 1-451, были амплифицированы с кДНК человеческой AXL (Open Biosystems) и клонированы в CMV-управляемый pADD2 аденовирусный челночный вектор. Временные трансфекции ДНК с контрольным вектором или AXL 1-451 проводились липофектамином 2000 (Invitrogen) в соответствии с инструкцией производителя в НСТ116 клетках. Кондиционированная среда была собрана через 48-72 часов после трансфекции.
Анализы адгезии. SKOV3ip.1 shSCRM и shAXL клетки флуоресцентно мечены Sum CMFDA (Molecular Probes). Клетки промывали и отделяли с помощью неферментативного буфера клеточной диссоциации (Gibco). Клетки (5Х1Ое5) высевали в 96 ячейках, предварительно покрытых с 50 мкг/мкл коллагена типа I (BD Bioscience). После 60-минутной инкубации при 37°С, клетки тщательно промывали 5 раз. Флуоресцентная активность (возбуждение, 494 нм, эмиссия, 517 нм) была измерена с помощью флуоресцентного спектрофотометра.
SKOV3ip.1 Адгезия к Коллагену типа 1. SKOV3ip.1 shSCRM и shAXL клетки флуоресцентно мечены 5 мкм CMFDA (Molecular Probes). Клетки промывали и отделяли с помощью неферментативного буфера клеточной диссоциации (Gibco). Клетки (5Х1Ое5) помещали в трех экземплярах в 96 ячейках планшета, которые предварительно покрыты с 50 мкг/мкл коллагена типа I (BD Bioscience). После 60-минутной инкубации при 37°С, клетки тщательно промывали 5 раз. Флуоресцентная активность (возбуждение, 494 нм, эмиссия, 517 нм) была измерена с помощью флуоресцентного спектрофотометра.
MDA-231 Адгезия к ЕСМ белкам. MDA-231 shSCRM и shAXL (0.5×106) клетки помещали в трех экземплярах в лунки, содержащие панель белков ЕСМ, включая ламинин, коллаген I и IV, фибронектин и фибриноген. Клетки инкубировали при 37°С в течение 1 часа и промывали в PBS. Связанные клетки окрашивали и количественно определяли на OD 560 в соответствии с протоколом производителя (CellBiolabs).
Анализы миграции. Клеточная миграция была изучена in vitro, как описано выше. Короче говоря, клетки были лишены сыворотки в течение 24 часов и посеяны (2,5×104клеток) в трех экземплярах на непокрытые вставки (BD Biosciences), перенесены в камеру, содержащую FBS, как хемоаттрактант, и инкубированы в течение 24 часов. После удаления клеток, которые не проникли через мембрану, клетки в нижней части мембраны были зафиксированы, окрашены и подсчитаны. Пять полей считались для каждой мембраны. Процент миграции определяли следующим образом: (среднее кол-во клеток, которые мигрируют в shAXL клетках/среднее кол-во клеток, которые мигрируют в shSCRM клетках) Х 100. Эксперименты проводились в трех экземплярах и повторялись три раза.
Анализ инвазии в коллаген. Анализы инвазии в коллаген были проведены, как описано выше. Кратко, 533 клетки высевали на коллаген типа I на 48-луночном планшете. Клетки культивировали в стандартной среде или среде с добавлением условного контроля, или sAXL кондиционированной среде в течение 5-7 дней и были сделаны фотографии. Инвазия через коллаген количественно рассчитывалась путем определения процента опухолевых клеток, которые показывают фенотип ветвления в 20х поле. Три поля в образце были подсчитаны. Эксперименты проводились в трех экземплярах и повторялись 2 раза.
Зимография на желатиновом субстрате. SKOV3ip.1 shSCRM и shAXL клетки подвергали сывороточному голоданию в течение 48 часов. 25000 клеток высевали в 96 ячейках и кондиционированная среда была собрана через 24 часа. Равные объемы кондиционированной среды поместили при не восстанавливающих условиях на 10% зимограммный гель (Invitrogen). После электрофореза гель промывали в 2,5% (объем/объем) Тритон Х-100 для удаления SDS и промывали в 50 мМ Трис-HCl, 5 мМ CaCI2 и 0,1% Тритон Х-100 (рН 7,8), и инкубировали в течение ночи при температуре 37°С. Зимограммы окрашивали в течение 30 минут с 0,25% (вес/объем) Coomassie Brilliant Blue R250, растворенным в 40% метанола и 10% ледяной уксусной кислоты. Гели отмывали от красителя в 40% метанола и 10% ледяной уксусной кислоты. Эксперименты проводились в двух экземплярах и повторялись три раза.
Тесты клеточной пролиферации. Для однослойных кривых роста клетки (50000) высевали в 60 мм чашки в трех экземплярах. Каждые три дня клетки обрабатывали трипсином, подсчитывали с помощью клеточного счетчика Коултера и 50000 клеток вновь высевали и подсчитывали.
Анализ выживания ХТТ. Жизнеспособность клеток измеряется ХТТ анализом, как описано выше. Короче говоря, культивированные с или без подпитки клетки (0, 3, 6 и 7 дней) инкубировали с феноловым красным в среде по выбору с 0,3 мг/мл ХТТ и 2,65 мкг/мл N-метилдибензопиразинметил сульфатом. 96-луночные планшеты были возвращены в инкубатор при 37°С на время от 1 до 2 часов. Метаболизм ХТТ был количественно измерен по адсорбции при 450 им.
Выделение белка и Вестерн-блот анализ. Белки лизатов были собраны в 9 М мочевине, 0,075 М Трис буфером (рН 7,6). Белки лизатов количественно определяли, используя анализ по Брэдфорду, и проводили SDS-PAGE в восстанавливающих условиях по стандартной методике. Полученные блоты были исследованы с антителами против AXL (RandD Systems), альфа-тубулина (Fitzgerald Antibodies), AKT (Cell Signaling), фосфо-AKT (Cell Signaling).
Для GAS6 стимуляции клетки культивировали в бессывороточной среде в течение 24 часов. Клетки обрабатывали с 25 мкм PI3K ингибитора (Ly294002, Bio Bio Mol Research Laboratory) или 100 I кондиционированной среде, содержащей AXL эктодомены за 4 часа до лечения с 400 нг/мл GAS6 в течение 15 минут.
Для анализа sAXL экспрессии в сыворотке мышей, 1,5 I сыворотки от каждого образца было проанализировано с помощью гель-электрофореза.
Создание и производство аденовируса. Эктодомен AXL соответствующий аминокислотам 1-451 был амплифицирован из кДНК AXL (Open Biosystems) и клонирован в области Е1 из Е1 "Е3" Ad штамма 5 путем гомологичной рекомбинации с последующей продукцией аденовируса в 293 клетках и очисткой в градиенте CsCI, как ранее описано. Производство и очистку sAXL аденовируса проводили, как описано выше. Создание и производство отрицательного контроля вируса, экспрессирующего мышиный IgG2-Fc фрагмент иммуноглобулина, было описано выше.
Рост SKOV3ip.1 и OVCAR-8 клеток, как перитонеальных ксенотрансплантатов. Все процедуры, связанные с животными и уходом за ними, были утверждены Комитетом по уходу за животными и их использованию Стэнфордского университета в соответствии с институциональными и NIH принципами.
Контроль и AXL SKOV3ip.1 и OVCAR-8 клетки вводили интраперитонеально, 1×106 и 5×106 клеток, соответственно, в 0,5 мл PBS в голых мышей женского пола. После скарификации асцит был количественно определен, метастатические поражения были подсчитаны и все видимые повреждения были вскрыты и удалены для определения веса опухоли.
Родительские клетки SKOV3ip.1 и OVCAR-8 вводили интраперитонеально, 1×106 и 5×106 клеток, соответственно, в 0,5 мл PBS в голых мышей женского пола. Через семь (SKOV3ip.1) или 14 (OVCAR-8) дней после инъекции опухолевых клеток, мышам вводили sAXL или контроль 1,9×108 аденовирусных БОЕ в 0,1 мл PBS в хвостовую вену. После скарификации асцит был количественно определен, метастатические поражения были подсчитаны и все видимые повреждения были вскрыты и удалены для определения веса опухоли.
Изучение тканевой токсичности. Родительские клетки SKOV3ip.1 вводили интраперитонеально, 1×106 и 5×106 клеток, соответственно, в 0,5 мл PBS в голых мышей женского пола. Через семь дней после инъекции опухолевых клеток мышам вводили sAXL или контроль 1,9×108 аденовирусных БОЕ в 0,1 мл PBS в хвостовую вену. На 28-й день мышей скарифицировали. Кровь была собрана, и на кафедре сравнительной медицины Стэнфордского университета был проведен биохимический анализ крови и СВС анализ. Образцы тканей были собраны из всех основных органов, включая печень, почки, мозг, селезенку, которые фиксировали в 10% формалине, заливали в парафин, делали срезы, и контрастно окрашивали гематоксилином и эозином.
In vivo анализ метастазирования. Контроль и AXL МшРНК MDA-231 клетки вводили внутривенно 5×105 клеток в 0,1 мл PBS в хвостовую вену голой мыши. Спустя четыре недели после инъекции мышей скарифицировали. Микроскопическая оценка очагов в легких проводилось по репрезентативным поперечным сечениям (срезам) легких зафиксированным в формалине и парафинированным, которые окрашивали гематоксилином и эозином. Правильная идентификация очагов в легких с не менее четырьмя человеческими клетками с крупными ядрами и положительными для экспрессии AXL была подтверждена сертифицированным патологоанатомом. Опухолевая нагрузка в легких мышей количественно определялась анализом экспрессии человеческого GAPDH и AXL, оценивалась путем анализа РНК, выделенной из целого легкого, с помощью ПЦР в реальном времени.
Рост MDA-231 клеток как ортотопической опухоли. MDA-231 клетки были выращены, как подкожные ортотопические опухоли в шестинедельных голых (nu/nu) мышах при внутрикожных инъекциях 107 клеток в 0,1 мл PBS в жировую ткань. Опухоли были измерены штангенциркулем на 38-дневном курсе. Объем был рассчитан по следующей формуле: ширина2 × длина × 0.5.
Рост SKOV3ip.1 клеток, как подкожной опухоли. Пять миллионов клеток в 0,1 мл PBS были имплантированы подкожно в бока голых (nu/nu) шестинедельных самок мышей. Опухоли измерялись штангенциркулем на протяжении 45 дней. Объем был рассчитан по следующей формуле: ширина2 × длина × 0.5.
РНК и ПЦР анализ в реальном времени. РНК выделяли из клеток и тканей с использованием тризола по протоколам изготовителя (Invitrogen). кДНК синтезировали из 2 мкг РНК, обработанной ДНКазой (Invitrogen), с использованием Superscript first-strand synthesis system для обратной транскрипции-ПЦР (Invitrogen). Один мкл кДНК подвергали амплификации с использованием SYBR Green PCR Master Mix (Applied Biosystems). Следующие наборы праймеров были использованы для амплификации конкретных целевых генов: 18S FWD: 5-GCCCGAAGCGTTTACTTTGA-3 REV:5-TCCATTATTCCTAGCTGCGGTATC-3; AXL FWD: 5-GTGGGCAACCCAGGGAATATC-3 REV: 5-GTACTGTCCCGTGTCGGAAAG; GAPDH 5-ATGGGGAAGGTGAAGGTCG-3 REV: 5-GGGGTCATTGATGGCAACAATA-3, ММР-2 FWD: 5 GCCCCAGACAGGTGATCTTG-3 REV 5 - GCTTGCGAGGGAAGAAGTTGT-3. ПЦР амплификацию проводили на Prism 7900 Sequence Detection System (Applied Biosystems). Использовались следующие параметры цикла: денатурация при 50°С в течение 2 минут и при 95°С в течение 10 минут, после чего цикл денатурации при 95°С в течение 15 сек и при 60°С в течение 1 минуты. 18S была использована как стандарт мРНК. Относительный уровень экспрессии мРНК определяли с помощью способа относительной стандартной кривой в соответствии с инструкцией завода-изготовителя (Applied Biosystems).
Статистический анализ. Тесты для связи между AXL экспрессией и формированием опухоли и метастазированием проводили с использованием точного критерия Фишера. Все другие статистические тесты проводились с использованием t-критерия Стьюдента. Величины со значением p<0,05 считались статистически значимыми.
Сокращения: GAS6 - задержка роста специфического гена 6, ММР-2 - матриксные металлопротеиназы; ЕОС - эпителиальный рак яичников; ЕСМ - внеклеточный матрикс; AKT - V-акт гомолог вирусного онкогена мышиной тимомы.
Значения представлены как n (%). Для опухолевых клеток мембранные окрашивания оценивали как 0 - отсутствуют; 1 - невозможно подсчитать; 2 - от 5 до 60% положительные; 3 - от 61 до 100% положительные.
Пример 2
Мы показали, что ингибирование связывания GAS6 лиганда с клеточным AXL путем гиперэкспрессии растворимых AXL дикого типа в мышах с использованием аденовирусной системы экспрессии привело к снижению опухолевой нагрузки, оценка которой проводилась путем измерения количества и размеров опухоли, по сравнению с необработанным контролем, дополнительно подчеркивая важность GAS6 и AXL, как критических целей и эффективных стратегий для подавления прогрессирования метастазирования в доклинических мышиных моделях.
Разработаны растворимые варианты внеклеточного домена AXL, как указано в настоящем документе, которые имеют высокое сродство к лиганду GAS6, позволяя им поглощать лиганд и уменьшить эндогенную AXL сигнализацию. Разработанные варианты существенно улучшили сродство к GAS6 по сравнению с диким типом AXL.
Внеклеточный домен AXL состоит из двух IgG-подобных доменов и двух фибронектин-подобных доменов. Основной сайт связывания GAS6 находится в домене Ig1, и минорный GAS6 сайт связывания находится в Ig2 области.
В целях дальнейшего повышения сродства основного сайта связывания, мы спроектировали Ig1 домен с точками разрыва соответствующих положения 19-132 в AXL SwissProt P30530. Мутантная библиотека была создана путем выполнения ПЦР амплификации пониженной точности Ig1 домена рецептора AXL с использованием стандартных способов молекулярной биологии. Библиотека экспрессируется с помощью поверхностного дисплея на дрожжах и тщательно отбирается флуоресцентно-активированной сортировкой клеток (FACS), чтобы изолировать мутанты, обладающие улучшенным сродством связывания с растворимым GAS6. В нашем подходе скрининга библиотеки, библиотека мутантного белка была подвергнута нескольким раундам сортировки, в которых каждый последующий раунд уменьшает размер библиотеки, в то время как она одновременно обогащается по содержанию мутантных белков с желаемым свойством, в данном случае это высокое сродство связывания с GAS6.
Для того чтобы получить мутанты AXL со значительно большим сродством к GAS6, в более поздних раундах сортировки использовали сортировку по скорости диссоциации. Для сортировки по скорости диссоциации библиотеку мутантов белка сначала инкубируют с растворимыми GAS6, а затем промывают буфером для удаления несвязанных GAS6 из раствора. Далее, мутантную библиотеку инкубировали в присутствии избытка растворимого конкурента в течение 2, 4, 6, 12 или 24 часов при комнатной температуре. Избыток конкурента служит для улавливания GAS6, который отделяется от AXL находящегося на поверхности дрожжей, что делает шаг отделения необратимым. Мутантные AXL белки, которые сохраняют связывание с GAS6, собираются с использованием FACS. Анализ связывания с GAS6 на объединенной выборке 5 продуктов после диссоциирующих шагов через 0, 4 и 6 часов показывает, что эти продукты обладают значительным улучшением по сравнению с диким типом AXL в условиях стойкого связывания с GAS6 (см. фигуру 12). Гистограмма количественных данных с точечными участками демонстрирует значительное улучшение членов библиотеки. Секвенирование этих продуктов выявило несколько мутаций в домене Axl Ig1, которые придают усиленное сродство к GAS6, наблюдаемое для объединенного пула 5 продуктов (фигура 12 и таблица 2). Шестой раунд сортировки дает дальнейшее обогащение до 3 конкретных клонов из выделенных 5 продуктов. Таблица 2 показывает уникальные мутации аминокислот в последовательности AXL, которые содержатся в выбранных продуктах 5 и 6 раундов. В этой таблице номер остатка в верхней строке соответствует аминокислотному остатку в AXL дикого типа. Во второй строке указывается остаток, который находится в AXL дикого типа на данной позиции. В последующих строках указаны аминокислотные мутации, присутствующие в данном мутанте. Отсутствие аминокислоты для конкретного остатка в мутанте (например, пробел или пустая ячейка в таблице 2) означает, что этот аминокислотный остаток не мутировал в дикий тип остатка. Стандартное однобуквенное обозначение аминокислотных остатков используется, так как его хорошо понимают те, кто является специалистом в этой области.
Показаны уникальные последовательности из выбранных 5 и 6 продуктов, а также обязательные свойства объединенных клонов по сравнению с диким типом AXL, демонстрирующие существенное улучшение связывания с GAS6 для объединенной выборки 5 продуктов.
Мутанты, изолированные с помощью этого подхода направленной эволюции, включающей аминокислотные замены, приведены в таблице 3.
В соответствии с кристаллической структурой комплекса GAS6-AXL, как сообщил Sasaki et al. (EMBO J 2006), все мутации, которые были показаны выше, за исключением E26G, G32S, N33S и G127R/E, находятся на поверхности связывания между AXL и GAS6.
Индивидуальные мутанты AXL S6-1 и AXL S6-2, начиная с шестого раунда сортировки, были отобраны для дальнейшего исследования. Изучение равновесного связывания дикого типа AXL, AXL S6-1 и AXL S6-2 были проведены для сравнения сродства взаимодействия с GAS6 у дикого типа или мутантных белков AXL. Данные легли на четырехточечную сигмоидальную кривую, и средняя точка была взята в качестве равновесной константы связывания, KD. Мутанты AXL S6-1 и AXL S6-2 показывают значительное улучшение сродства связывания с GAS6 по сравнению с диким типом AXL (фигура 13 и таблица 4). Дикий тип AXL имеет сродство связывания (KD) с GAS6 2,4±1,2×10-9 М; AXL S6-2 имеет сродство связывания (KD) с GAS6 1,89±0,37×10-10 М с GAS6; и AXL S6-1 имеет сродство связывания (KD) 1,12±0,23×10-10 М с GAS6. Для AXL S6-1 и AXL S6-2 это в 22 раза и 12,8 раза сильнее GAS6 сродства связывания, соответственно, по сравнению с диким типом AXL (таблица 4).
Мы также исследовали термостабильность дикого типа и мутантных белков AXL с использованием сканирования кругового дихроизма при переменной температуре. Этот способ отслеживает разворачивания вторичных структурных элементов свернутого белка в зависимости от температуры. Эллиптичность каждого белка контролировали в зависимости от температуры, и данные соответствуют стандартной двузонной кривой разворачивания. Температура плавления (Tm) является серединной точкой кривой разворачивания. Для дикого типа AXL выставлена температура плавления 41,3±0,6°С; для AXL S6-1 выставлена температура плавления 54,0±0,9°С (примерно на 13°С выше термическая стабильность, чем у дикого типа AXL); для Axl S6-2 выставлена температура плавления 41,55±0,02°С (примерно одинаковая термическая стабильность с диким типом AXL) (таблица 5).

Пример 3
Растворимые варианты Axl ингибируют метастатическое прогрессирование опухоли в условиях in vivo.
GAS6-AXL сигнализация была вовлечена в прогрессирование многих агрессивных форм солидных опухолей, в том числе молочной железы, легких и толстой кишки, и, как было обнаружено в настоящей работе, яичников. В то время как четкая корреляция наблюдается между экспрессией AXL и стадией заболевания, а также прогнозом для пациента, возможность использования AXL в качестве терапевтической мишени для лечения метастазирования практически не исследована. В примере 1 показано, что AXL действительно является маркером метастазирования у больных раком молочной железы и яичников, уровни экспрессии AXL на первичных опухолях коррелируют с тяжестью заболевания. Эти результаты свидетельствуют о том, что антагонизм сигнального пути GAS6-AXL может предложить терапевтическое окно для лечения метастатического заболевания. Как указано в примере 1, для проверки потенциала AXL, как терапевтической мишени, растворимую форму дикого типа внеклеточного домена AXL вводили с использованием аденовирусной доставки в мышиной модели агрессивного рака яичников. Мы показали, что опухолевые метастазы были значительно уменьшены у мышей, которые получили лечение растворимым AXL по сравнению с контрольной группой. Эти данные показали, что антагонизм сигнализации GAS6-AXL в опухолевых клетках с помощью растворимого AXL может помешать метастатическому прогрессированию заболевания. Основываясь на этих результатах, мы показали, что инженерные мутанты AXL с более высоким сродством к GAS6 проявляют большую эффективность как антиметастатические агенты, и что более подходящий терапевтический режим доставки растворимых AXL дает еще более значительные результаты.
В этом исследовании мы использовали те же модели человеческого рака яичников, как и в эксперименте 1 и варианты интраперитонеального введение очищенного растворимого AXL (sAXL) мышам с существующей метастатической болезнью. Мы проверили AXL дикого типа и инженерно созданный мутант AXL S6-1, с высоким сродством, по сравнению с одной из форм AXL, E59R/T77R, который не связывается с GAS6. Наши результаты наглядно показывают, что увеличенное сродства AXL S6-1 приводит к большей терапевтической эффективности, так как было значительное снижение опухолевой нагрузки, которое оценивается по количеству и общему весу всех метастатических поражений, по сравнению с AXL дикого типа и отрицательным контролем AXL E59R/T77R. Эти данные далее проверены на AXL и GAS6, как терапевтических мишенях для ингибирования метастазирования, и подтверждают, что сконструированный мутант S6-1 с высоким сродством к AXL является мощным антагонистом сигнальной системы GAS6-AXL.
В то время как пример 1 показывает, что аденовирусная доставка sAXL дала терапевтическую эффективность, этот способ доставки не имеет клинического значения и, таким образом, мы подтвердили, что доставка очищенной sAXL даст аналогичные результаты. Дикого типа AXL, AXL S6-1 и AXL E59R/T77R были объединены во фрагмент кристаллизующейся области (Fc) мышиного IgG2a в целях улучшения фармакокинетики. Единственное различие между этими вариантами тройной AXL гибридизации (AXL-FC) заключается в обнаруженных мутациях в AXL Ig1 домене, которые приведены в таблице 6А. ДНК кодированные AXL-Fc белки клонировали в аденовирусном шаттл-векторе pADD2c под контролем CMV с использованием EcoRI и Sall сайтов рестрикции. pADD2 плазмида, кодирующая эти три AXL мутанта, была независимо трансфецирована в HEK 293 клетки с использованием набора Freestyle Expression kit от Life Technologies, как описано производителем. Белки были очищены от культуры супернатанта с использования Protein А аффинной хроматографии, а затем по размеру с использованием эксклюзионной хроматографии.
Чтобы оценить способность AXL-Fc мутантов к подавлению метастазирования in vivo, мы использовали ту же модель перитонеального ксенотрансплантата человеческого рака яичников, как описано в примере 1. Эта модель повторяет перитонеальное распространение метастазов человеческого рака яичников, так как у мыши быстро развивается очень инвазивное заболевание, включающее асцит и много (>100) небольших метастатических поражений, четыре недели спустя после введения SKOV3ip.1 клеток. Эта модель дает очень точное представление о человеческом раке яичника, поскольку большинство пациентов имеет значительные метастазы на момент установления диагноза. Мышам вводили SKOV3ip.1 клетки и опухоли было разрешено диссеминировать (метастазы) в течение семи дней. На седьмой день мы случайным образом разделили мышей на три изучаемые группы и начали вводное лечение или AXL-Fc дикого типа, S6-1-Fc или E59R/T77R-Fc. Очищенные белки растворяли в фосфатном буферном солевом растворе и вводили мышам два раза в неделю в течение трех недель в дозе 10 мг/кг, в общей сложности шесть доз. На двадцать восьмой день все мыши были скарифицированы, и вскрытие было проведено для оценки общей опухолевой нагрузки по измерению количества видимых метастазов, а также общему весу всех поражений. Существовали глубокие различия между группами лечения, чьи репрезентативные изображения показаны на фигуре 14. На мышей, получавших лечение отрицательным контролем E59R/T77R-Fc, приходилось в среднем 86,3±21,9 перитонеальных метастазов. Для мышей, получавших дикого типа AXL-Fc, это число сократилось до 48,1±6,9, а для мышей в инженерной AXL группе, S6-1-Fc, только 8,3±1,6 метастатического поражения наблюдалось в среднем (фигура 15 (верхняя панель)). Все видимые повреждения были вырезаны и коллективно взвешены для каждой мыши для оценки общей массы метастатической опухоли. Лечение группы инженерным AXL (S6-1-Fc) снова показало самый глубокий отклик, так в E59R/T77R-Fc, дикого типа Fc и S6-1-Fc группах определенная масса опухоли составила 567±92,430±36 и 188±55 мг соответственно, на фигуре 15 (нижняя панель).
В совокупности эти результаты в дальнейшем проверили AXL, как терапевтическую мишень при лечении метастазирования, и продемонстрировали, что нейтрализация лигандов AXL, GAS6 является эффективной антиметастатической стратегией лечения. Важно отметить, что белок, включающий гибрид AXL-Fc, который не проявляет обнаруживаемое связывание с GAS6 (AXL E59R/T77R-Fc), не препятствует метастазированию опухоли; белок, включающий гибрид AXL-Fc, который связывается с GAS6 с умеренным сродством (дикий тип AXL-FC), показывает небольшое торможение метастазирования опухоли; белок, включающий гибрид AXL-Fc, с очень большим сродством к GAS6 (AXL S6-1-Fc), показывает значительное подавление метастазирования опухоли. Все вместе это показывает, что эпитоп взаимодействия GAS6 и AXL имеет решающее значение в опухолевом метастазировании и мощный ингибитор этого эпитопа на GAS6 через AXL S6-1-Fc белок значительно ингибирует метастазирование опухолей. Таким образом, AXL S6-1-Fc белок или белок, который мощно блокирует GAS6-Axl взаимодействия, является перспективным терапевтическим кандидатом для метастатической болезни. Кроме того, мы также показали, что прямое введение очищенного растворимого белка AXL является успешным способом лечения, проверив этот подход клинически.
Способы для примера 3
Клеточные линии. Клетки яичников SKOV3ip.1 культивировали в подходящей среде с добавлением 10% эмбриональной телячьей сыворотки и 1% пенициллина и стрептомицина при 37°С в 5% CO2 инкубаторе.
AXL-Fc гибридизация. Полноразмерные AXL мутанты, аминокислоты 19-440 непосредственно слитый с областью мышиного IgG2a Fc был клонированы в аденовирусный шаттл-вектор pADD2 по контролем CMV. Временную трансфекцию ДНК эмбриональных клеток человеческих почек (HEK) 293 осуществляли с помощью набора Freestyle Expression kit от Life Technologies, как описано производителем. Fc-гибридные белки очищали из культуры супернатанта через пять дней с помощью Protein А аффинной хроматографии и размер эксклюзионной хроматографии (гель-фильтрации). Очищенные белки были помещены в фосфатный буферный солевой раствор без дополнительных добавок или носителей.
SKOV3ip.1 перитонеальные ксенографы. Все процедуры, связанные с животными и уходом за ними были утверждены Комитетом по уходу за животными и их использованию Стэнфордского университета в соответствии с институциональными и NIH принципами. Шестинедельным самкам голых мышей вводили 1×106 SKOV3ip.1 клеток интраперитонеально. Семь дней спустя после введения клеток, мыши были случайным образом разделены на три группы для лечения: S6-1-Fc, дикого типа AXL-Fc или E59R/T77R-Fc. Очищенный растворимый белок AXL-Fc вводили с помощью инъекции интраперитонеально два раза в неделю в дозе 10 мг/кг. Дозирование продолжалось в течение трех недель, после чего мыши были скарифицированы. Вскрытие было проведено, в котором метастатические поражения были подсчитаны, а затем вырезаны и коллективно взвешены. Опухолевая нагрузка определялась, как общее число поражений и общий вес всех больных тканей для каждой мыши.
Статистический анализ: t-критерий Стьюдента был использован и сообщения об ошибках являются стандартными ошибками среднего (SEM). Значения p со значением <0,01 считали значимыми.
Хотя выше изобретение было описано более подробно с помощью иллюстраций и примеров для ясности понимания, но это будет очевидно любому специалисту в данной области в свете учения этого изобретения, что некоторые изменения и модификации могут быть сделаны к нему без отступления от духа или объема прилагаемой формулы изобретения.
Реферат
Изобретение относится к области биотехнологии, конкретно к ингибиторам сигнального пути AXL, и может быть использовано в медицине. Получают растворимый вариант полипептида AXL без трансмембранного домена AXL, который содержит по меньшей мере одну модификацию аминокислоты в положении номер n, где n выбран из 32, 72, 87, 92 или 127 или их сочетание, где n+7 соответствует нумерации SEQ ID NO: 1 - последовательности AXL дикого типа, в котором указанная модификация повышает сродство связывания полипептида AXL со специфически задерживающим рост белком 6 (GAS6), которое, по меньшей мере, примерно в 2 раза сильнее, чем сродство полипептида AXL дикого типа. Полипептид может быть слит с Fc фрагментом и использован в способе лечения, снижения или предотвращения метастазирования или инвазии опухоли у пациента-млекопитающего. Изобретение позволяет эффективно ингибировать сигнальные пути AXL/GAS6. 6 н. и 2 з.п. ф-лы, 15 ил., 6 табл., 3 пр.
Формула
где указанная модификация находится в положении номер n, где n выбран из 32, 72, 87, 92 или 127 или их сочетание, где n+7 соответствует нумерации SEQ ID NO: 1;
где растворимый вариант полипептида AXL ингибирует взаимодействие между AXL и GAS 6.
где указанная модификация находится в положении номер n, где n+7 соответствует нумерации SEQ ID NO: 1,
где растворимый вариант полипептида AXL ингибирует взаимодействие между AXL и GAS6.
где указанный вариант AXL не имеет трансмембранного домена AXL и содержит по меньшей мере одну модификацию аминокислоты по сравнению с последовательностью AXL дикого типа (SEQ ID NO: 1), в котором указанная модификация повышает сродство связывания полипептида AXL со специфически задерживающим рост белком 6 (GAS6), которое по меньшей мере примерно в 2 раза сильнее, чем сродство полипептида AXL дикого типа,
где указанная модификация находится в положении номер n, где n выбран из 32, 72, 87, 92, 97 или 127, или их сочетание, где n+7 соответствует нумерации SEQ ID NO: 1;
где растворимый вариант полипептида AXL ингибирует взаимодействие между AXL и GAS 6.

Комментарии