Способ получения афлиберцепта - RU2732237C2
Код документа: RU2732237C2
Чертежи









Описание
[Область техники, к которой относится изобретение]
Настоящая заявка имеет приоритет и преимущество по корейским патентным заявкам №№ 10-2015-0144330 и 10-2016-0132633, поданным в Ведомство интеллектуальной собственности Республики Корея 15 октября 2015 года и 13 октября 2016 года, соответственно, раскрытие которых полностью включено в настоящее описание путем ссылки.
Настоящее изобретение относится к способу получения слитого белка, имеющего Fc-домен иммуноглобулина G человека (IgG), в частности, белка, в котором слиты растворимый внеклеточный домен рецептора фактора роста сосудистого эндотелия (VEGF) и Fc-домен иммуноглобулина G (IgG) человека (например, афлиберцепта).
[Уровень техники]
Фактор роста сосудистого эндотелия (VEGF) является важным фактором, который усиливает ангиогенез и проницаемость сосудов. В частности, VEGF сверхэкспрессируется в опухолевых клетках и, таким образом, способствует аномальному ангиогенезу и пролиферации опухолей (Oncogene, 2004, 23, 1745-1753). Кроме того, было опубликовано, что аномальный ангиогенез играет важную роль и в развитии других заболеваний, кроме опухолегенеза. В механизмах с участием VEGF аномальный ангиогенез связан с влажной макулярной дегенерацией, диабетической ретинопатией, макулярным отеком при окклюзии вен сетчатки и т. п., которые представляют собой офтальмологические заболевания (J. Korean Med. Assoc., 2014, 57,7, 614-623).
В качестве терапевтических агентов для этих офтальмологических заболеваний использовали пегаптаниб (РНК-аптамер), ранибизумаб (моноклональный фрагмент IgG-антитела (Fab)) и бевацизумаб (моноклональное IgG-антитело), а афлиберцепт (VEGFR1 и VEGFR2, слитые с IgG1-Fc) был одобрен в качестве терапевтического агента для лечения влажной макулярной дегенерации в США в 2011 году (Biol. Ther., 2012, 2, 3, 1-22; Drug Development Development Therapy, 2013, 3, 7, 711-722).
Поскольку спрос на эти терапевтические рекомбинантные белки увеличивается, то предпринимаются большие усилия для улучшения роста и жизнеспособности клеток, а также для улучшения продукции и качества белка, путем улучшения отбора клеток, оптимизации среды и контроля процессов культивирования. Многие белки и полипептиды, продуцируемые культурой клеток, получают культивированием клеток периодическим способом или периодическим способом с подпиткой при заданных температуре или рН в течение заданного времени и последующим выделением клеток. Поэтому, на количество и качество продукции могут влиять условия культивирования клеток. Существует потребность в способе, способном предотвращать проблемы безопасности, такие как иммуногенность, и осложнение процессов очистки в культуре животных клеток, путем увеличения количества продуцируемых белков, ингибирования образования неправильно свернутых/агрегированных белков или ингибирования образования деамидированных остовов белков или замещенных/удаленных производных аминокислот посредством корректировки и оптимизации условий культивирования клеток, связанных с продукцией белков.
[Описание изобретения]
[Техническая проблема]
Настоящее изобретение задумано для решения вышеуказанных проблем и обеспечивает способ получения слитого с Fc-IgG белка для увеличения уровня экспрессии белка.
Другой целью настоящего изобретения является создание способа получения целевого белка, включающего в себя: культивирование клеток, продуцирующих целевой белок, с помощью вышеописанного способа получения.
Еще одной целью настоящего изобретения является создание фармацевтической композиции, включающей терапевтический белок, полученный вышеописанным способом получения, и фармацевтически приемлемый носитель.
Однако технические проблемы, решаемые настоящим изобретением, не ограничиваются вышеуказанными проблемами, и другие проблемы, которые не указаны, могут быть очевидны для специалиста в данной области из нижеследующего описания.
[Техническое решение]
Для решения вышеописанных проблем было подтверждено, что настоящее изобретение улучшает продукцию и качество слитого белка, имеющего Fc-домен IgG, путем оптимизации условий культивирования клеток, которые продуцируют слитый белок. В частности, было подтверждено, что путем культивирования клеток при типичной температуре культивирования (от 35,0°С до 38,0°С) в течение заданного времени и последующего культивирования клеток при пониженной температуре культивирования от 28,0°С до 35,0°С, продукция слитого белок была увеличена, а образование агрегатов слитого белка было ингибировано, и настоящее изобретение было выполнено на основании этого факта.
Для достижения этих целей в настоящем изобретении предложен способ продукции белка, в котором растворимый внеклеточный домен рецептора фактора роста сосудистого эндотелия (VEGF) слит с Fc-доменом иммуноглобулина G (IgG) человека, причем клетки культивируют при пониженной температуре от 28,0°С или выше до температуры ниже 35,0°С для увеличения уровня экспрессии слитого белка.
Согласно предпочтительному примеру варианта осуществления настоящего изобретения слитый белок, полученный этим способом, может представлять собой слитый белок, в котором снижено содержание агрегатов.
Согласно предпочтительному примеру варианта осуществления настоящего изобретения культура клеток может представлять собой крупномасштабную культуру клеток.
Согласно другому предпочтительному примеру варианта осуществления настоящего изобретения культура клеток может представлять собой любую культуру, выбранную из группы, состоящей из периодической культуры, многократной периодической культуры, периодической культуры с подпиткой, многократной периодической культуры с подпиткой, непрерывной культуры и перфузионной культуры.
Согласно еще одному предпочтительному примеру варианта осуществления настоящего изобретения культура клеток может представлять собой периодическую культуру клеток с подпиткой.
Согласно еще одному предпочтительному примеру варианта осуществления настоящего изобретения клетка может представлять собой клетку млекопитающего.
Согласно еще одному предпочтительному примеру варианта осуществления настоящего изобретения клетка млекопитающего может представлять собой клетку СНО.
Согласно еще одному предпочтительному примеру варианта осуществления настоящего изобретения клетка СНО может принадлежать любой клеточной линии, выбранной из группы, состоящей из DG44, DXB-11, K-1 и CHO-S.
Согласно еще одному предпочтительному примеру варианта осуществления настоящего изобретения температура культивирования с момента начала культивирования до изменения температуры может представлять собой температуру в диапазоне температур от 33,0°С до менее 38,0°С.
Согласно еще одному предпочтительному примеру варианта осуществления настоящего изобретения температура может быть снижена до 30,0°С-34,0°С.
Согласно еще одному предпочтительному примеру варианта осуществления настоящего изобретения время культивирования с момента начала культивирования до изменения температуры может составлять от 1 до 5 дней.
Согласно еще одному предпочтительному примеру варианта осуществления настоящего изобретения время культивирования после снижения температуры может составлять от 2 до 15 дней.
Согласно еще одному предпочтительному примеру варианта осуществления настоящего изобретения по п.1 формулы изобретения суммарное время периода культивирования до изменения температуры и периода культивирования после изменения температуры может составлять 3 дня или большее число дней.
Согласно еще одному предпочтительному примеру варианта осуществления настоящего изобретения растворимый внеклеточный домен рецептора VEGF может включать иммуноглобулиноподобный домен 2 первого рецептора VEGF и иммуноглобулиноподобный домен 3 второго рецептора VEGF.
Согласно еще одному предпочтительному примеру варианта осуществления настоящего изобретения полученный белок может являться терапевтическим белком.
Настоящее изобретение также относится к способу получения целевого белка, включающему в себя: культивирование клеток, продуцирующих целевой белок, посредством вышеописанного способа получения.
Согласно предпочтительному примеру варианта осуществления настоящего изобретения способ может дополнительно включать в себя способ выделения целевого белка из культурального бульона, в котором культивируют клетки, продуцирующие целевой белок.
Согласно другому предпочтительному примеру варианта осуществления настоящего изобретения целевой белок может являться терапевтическим белком.
Настоящее изобретение также относится к фармацевтической композиции, включающей терапевтический белок, полученный вышеописанным способом получения, и фармацевтически приемлемый носитель.
Однако технические проблемы, решаемые настоящим изобретением, не ограничиваются вышеуказанными проблемами, и другие проблемы, которые не указаны, могут быть очевидны для специалиста в данной области из нижеследующего описания.
[Полезные эффекты]
Путем дополнительного включения стадии культивирования клеток, продуцирующих слитый белок, имеющий Fc-домен IgG, при пониженной температуре культивирования, настоящее изобретение повышает рост и жизнеспособность клеток, увеличивает уровень экспрессии слитого белка и ингибирует образование агрегатов, и в результате повышается продукция слитого белка и улучшается качество, так что становится возможным получать и поставлять слитый белок в больших количествах.
[Описание чертежей]
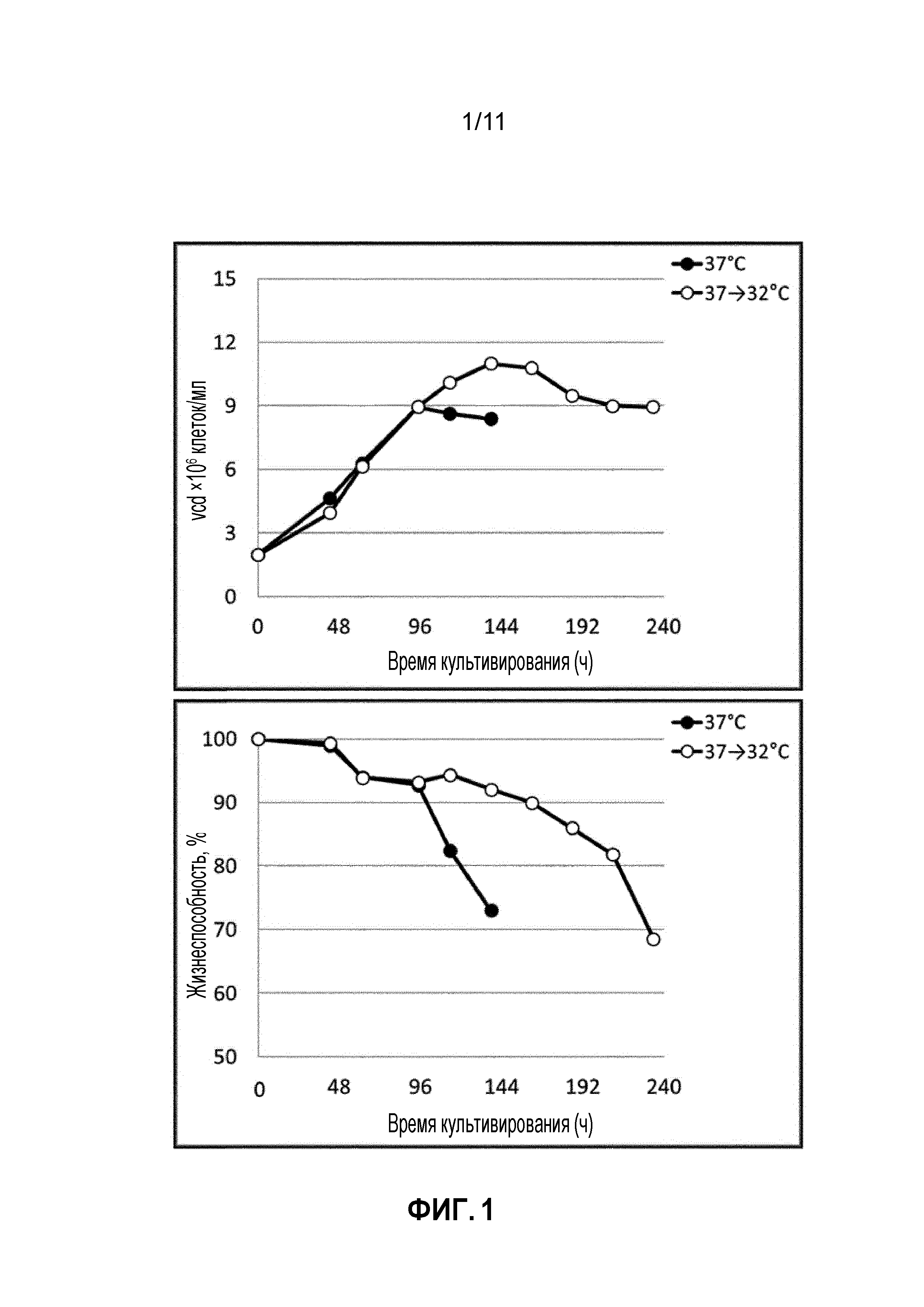
Фиг. 1 представляет собой график, анализирующий изменение роста клеток (vcd, плотность жизнеспособных клеток) и жизнеспособности клеток в соответствии с температурой культивирования клеток, продуцирующих афлиберцепт.
Фиг. 2 представляет собой график, показывающий интегрированное количество жизнеспособных клеток (ось Y, IVC [нормализовано на 109 клеток×день/л]), продуцирующий афлиберцепт, нормализованных на IVC, в динамике (ось X, время культивирования [дни]).
Фиг. 3 представляет собой график, показывающий изменение удельной скорости продукции в соответствии с температурой культивирования клеток, продуцирующих афлиберцепт.
Фиг. 4 представляет собой график, анализирующий изменение уровня экспрессии в соответствии с температурой культивирования клеток, которые продуцируют афлиберцепт, с помощью высокоэффективной жидкостной хроматографией (ВЭЖХ).
Фиг. 5 представляет собой график, анализирующий изменение роста клеток и жизнеспособности клеток при низкой температуре культивирования клеток, которые продуцируют афлиберцепт.
Фиг. 6 представляет собой график, анализирующий изменение уровня экспрессии при низкой температуре культивирования клеток, продуцирующих афлиберцепт, с помощью ВЭЖХ.
Фиг. 7 представляет собой график, анализирующий изменение роста клеток и жизнеспособности клеток в зависимости от температуры культивирования клеток, продуцирующих афлиберцепт в 2-литровом биореакторе.
Фиг.8 представляет собой график, показывающий интегрированное количество жизнеспособных клеток (ось Y, IVC [нормализовано на 109 клеток×день/л]), продуцирующих афлиберцепт в 2-литровом биореакторе, нормализованное на IVC, в динамике (ось X, время культивирования [дни]).
Фиг. 9 представляет собой график, показывающий изменение удельной скорости продукции в зависимости от температуры культивирования клеток, продуцирующих афлиберцепт в 2-литровом биореакторе.
Фиг. 10 представляет собой график, анализирующий изменение уровня экспрессии в зависимости от температуры культивирования клеток, продуцирующих афлиберцепт в 2-литровом биореакторе, с помощью ВЭЖХ на белке А.
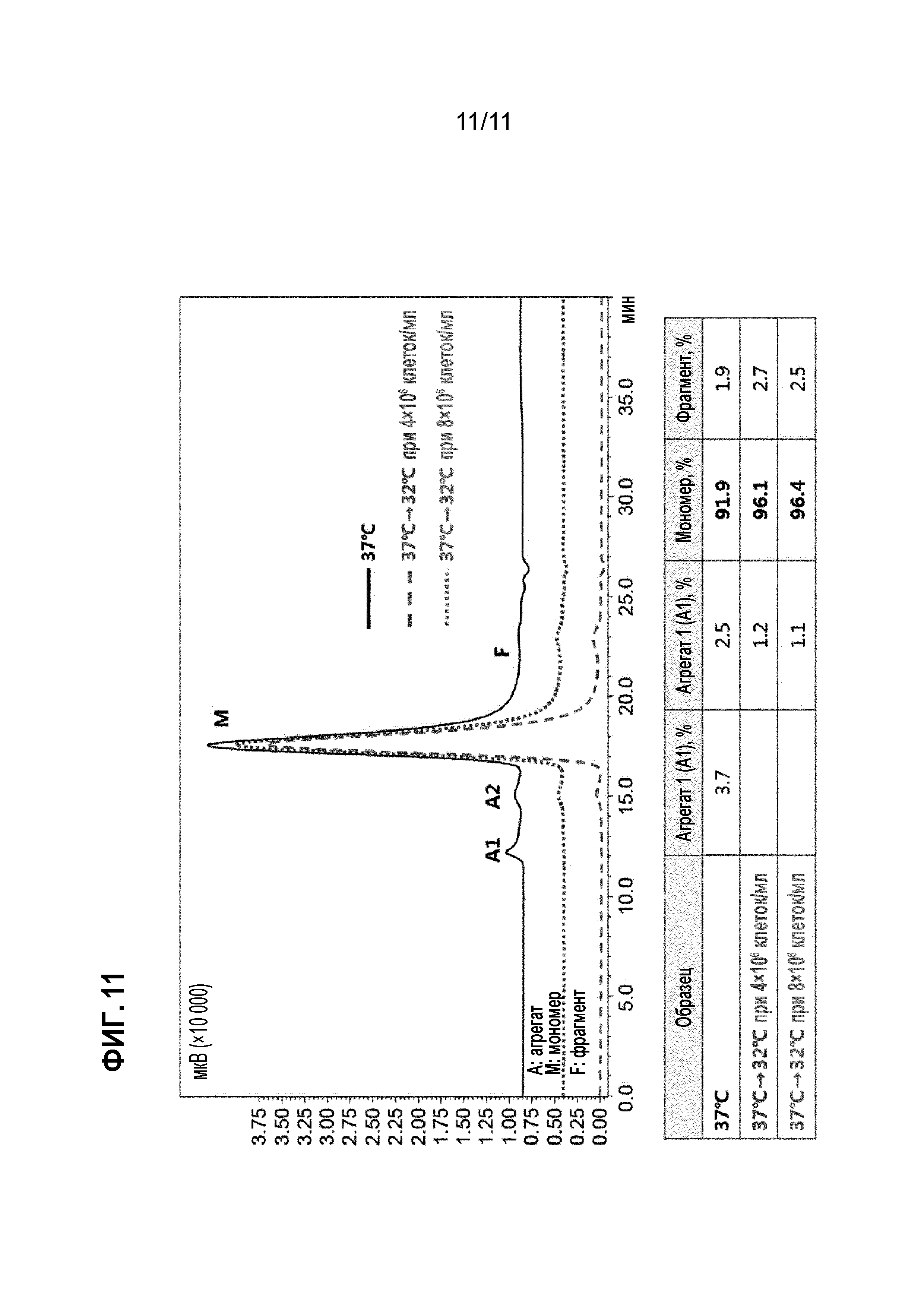
Фиг. 11 представляет собой график, анализирующий изменение содержания агрегированного белка в зависимости от температуры культивирования клеток, продуцирующих афлиберцепт в 2-литровом биореакторе, с помощью эксклюзионной высокоэффективной жидкостной хроматографии (SE-HPLC).
[Лучший вариант осуществления изобретения]
Далее настоящее изобретение будет описано более подробно.
Как описано выше, вследствие увеличения спроса на терапевтические рекомбинантные белки было осуществлено множество попыток улучшения роста и жизнеспособности клеток, а также продукции и качества белка, путем улучшения отбора клеток, оптимизации среды и контроля процессов культивирования, и существует потребность в способе, способном предотвращать проблемы безопасности, такие как иммуногенность, и осложнение процессов очистки в культуре животных клеток путем увеличения количества продуцируемых белков, ингибирования образования неправильно свернутых/агрегированных белков или ингибирования образования деамидированных остовов белков или замещенных/удаленных производных аминокислот посредством корректировки и оптимизации условий культивирования клеток, связанных с продукцией белков.
Таким образом, авторы настоящего изобретения нашли способ решения вышеописанных проблем путем подтверждения того, что продукция слитого белка, имеющего Fc-домен иммуноглобулина G (IgG), увеличивается, а образование агрегатов слитого белка ингибируется, когда клетки культивируют при стандартной температуре культивирования (35,0-38,0°С) в течение заданного времени, а затем при пониженной температуре культивирования от 28,0 до 35,0°С, и путем предложения способа получения слитого белка, имеющего Fc домен IgG, в котором повышается уровень экспрессии белка в клеточной культуре. За счет стадии культивирования клеток, продуцирующих слитый белок, имеющий Fc-домен IgG, при пониженной температуре культивирования, способ получения слитого белка, имеющего Fc-домен IgG, по настоящему изобретению повышает рост и жизнеспособность клеток, увеличивает уровень экспрессии слитого белка и ингибирует образование агрегатов, и в результате повышается продукция и улучшается качество слитого белка, так что становится возможным получать и поставлять слитый белок в больших количествах.
Все технические и научные термины, используемые в настоящем описании, имеют те же значения, что и значения, которые обычно понимаются специалистом в данной области техники, к которой относится настоящее изобретение.
В настоящем изобретении «слитый белок, имеющий Fc-домен IgG» означает белок, который связывается с Fc-областью, которая является невариабельной областью IgG человека. В этом случае в настоящем изобретении «белок» означает полимер из нескольких или большего числа аминокислот, связанных пептидными связями.
В настоящем изобретении в качестве «аминокислотного полимера» использованы рецепторы 1 и 2 VEGF человека и, предпочтительно, использованы внеклеточные домены рецепторов 1 и 2 VEGF.
В настоящем изобретении «Fc-область» является невариабельной областью антитела, причем могут быть использованы IgG1, IgG2, IgG3 и IgG4 человека, и, предпочтительно, использовать Fc-область IgG1.
Настоящее изобретение относится к способу получения белка, в котором растворимый внеклеточный домен рецептора фактора роста сосудистого эндотелия (VEGF) слит с Fc-доменом IgG человека, причем клетки культивируют при пониженной температуре от 28,0°C или выше до температуры ниже 35,0°С для увеличения уровня экспрессии слитого белка.
В способе получения слитого белка культура клеток может представлять собой крупномасштабную культуру клеток, а в качестве способа культивирования клеток может быть использован стандартно используемый способ культивирования клеток. Например, способ культивирования клеток может представлять собой, но не ограничивается ими, любой из одного или нескольких способов, выбранных из группы, состоящей из периодической культуры, многократной периодической культуры, периодической культуры с подпиткой, многократной периодической культуры с подпиткой, непрерывной культуры и перфузионной культуры.
«Периодическая культура» представляет собой способ культивирования, в котором небольшое количество затравочного культурального бульона добавляют к среде, и клетки размножаются в ней без добавления в нее свежей среды или выгрузки культурального бульона во время культивирования. «Непрерывная культура» представляет собой способ культивирования, в котором непрерывно добавляют среду, и культуральный бульон также непрерывно выгружается во время культивирования. Кроме того, перфузионная культура также является разновидностью непрерывной культуры. Так как «периодическая культура с подпиткой» является промежуточной стадией между периодической культурой и непрерывной культурой, периодическую культуру с подпиткой также называют полупериодической культурой, в которой среда непрерывно или последовательно добавляется во время культивирования, и периодическая культура с подпиткой представляет собой способ культивирования, при котором непрерывная выгрузка культурального бульона осуществляется как в непрерывной культуре, но клетки не выгружаются. В настоящем изобретении можно использовать любой из вышеописанных способов культивирования, предпочтительно использовать периодическое культивирование с подпиткой или непрерывное культивирование, и особенно предпочтительно использовать периодическое культивирование с подпиткой.
В настоящем изобретении для экспрессии слитого с Fc белка можно использовать без ограничения клетки любого типа, при условии, что клетки представляют собой стабильную клеточную линию, способную постоянно экспрессировать слитый белок, и, предпочтительно, чтобы клетка являлась клеткой млекопитающего. Более предпочтительно использовать обычно используемую животную культивируемую клетку, такую как клетка СНО, клетка НЕК, клетка COS, клетка 3T3, клетка миеломы, клетка BHK, клетка HeLa или клетка Vero, и, в частности, клетка CHO является предпочтительной, когда клетка используется для экспрессии слитого с Fc белка в большом количестве. Кроме того, для получения желаемого белка особенно предпочтительной является клетка, подходящая для введения желаемого гена, такая как клетка dhfr-CHO (Proc. Natl. Acad. Sci. USA, 1980, 77, 4216-4220), которая представляет собой клетку CHO, не содержащую гена DHFR, или клетку CHO K-1 (Proc.Natl. Acad. Sci. USA, 1968, 60, 1275). Поскольку клетка CHO, в частности, клеточная линия DG44, клеточная линия DXB-11, клеточная линия K-1 или клеточная линия CHO-S, является предпочтительной, клеточная линия K-1 является особенно предпочтительной, и введение вектора в клетку-хозяина может быть реализовано таким способом, как фосфатно-кальциевый способ, DEAE-декстранный способ, электропорация или липофекция.
В способе получения белка, в котором растворимый внеклеточный домен рецептора VEGF и Fc-домен IgG человека слиты по настоящему изобретению, в качестве температуры, при которой культивирование проводят от начала до изменения температуры, может быть выбрана температура, обычно используемая для культивирования в соответствии с типом клетки. Например, диапазон температур, обычно используемый для культивирования клеток млекопитающих, может составлять от 33,0°С до менее 38,0°С и, особенно предпочтительно, температура может составлять 37,0°С. В предпочтительном примере варианта осуществления настоящего изобретения, клетки, которые сверхэкспрессируют рекомбинантный афлиберцепт, культивировали при 37,0°С с момента начала культивирования до изменения температуры.
В настоящем изобретении время для изменения температуры определяется уровнем экспрессии целевого белка. В частности, оптимальное время для изменения температуры может быть определено путем проведения эксперимента, показанного в примере 3, но поскольку конечная плотность клеток отличается в зависимости от используемых типов клеток или условий культивирования, то конечная плотность клеток от примерно 1×106 клеток/мл до примерно 1×108 клеток/мл в общем является предпочтительной.
Настоящее изобретение относится к способу повышения продуктивности на клетку и ингибирования образования агрегатов, когда клетку СНО, в которую вводится ген, кодирующий белок, культивируют с целью получения слитого белка, где клетку культивируют при обычной температуре культивирования с момента начала культивирования в течение периода от 1 дня до 5 дней, а затем температуру культуры снижают. Период после изменения температуры до прекращения культивирования может составлять обычно от 1 дня до 30 дней и, предпочтительно, от 2 дней до 15 дней. Суммарное время периода культивирования до изменения температуры и периода культивирования после изменения температуры может составлять 3 дня или большее число дней. Конкретно, способ получения слитого белка путем культивирования клеток, продуцирующих слитый белок, отличается культивированием клеток при обычной температуре культивирования в течение заданного времени и последующим непрерывным культивированием клеток при пониженной температуре. В данном изобретении обычная температура культивирования обычно составляет от 33,0 до 38,0°С, что представляет собой температуру, подходящую для пролиферации клеток, полученных от гомотермического животного, и чаще всего составляет 37,0°С.
В способе получения белка, в котором растворимый внеклеточный домен рецептора VEGF и Fc-домен IgG человека слиты по настоящему изобретению, пониженная температура культивирования означает температурный диапазон ниже типичной температуры культивирования, и оптимальное снижение температуры культивирования определяют в соответствии с уровнем экспрессии целевого белка. Соответственно, в настоящем изобретении проводили эксперимент, как описано в примере 2, чтобы получить оптимальный диапазон снижения температур культивирования, при котором максимально экспрессируется белок-мишень. Хотя оптимальное изменение температуры может быть найдено в эксперименте, как в примере 2, вследствие того, что конечные плотности клеток отличаются в зависимости от типа клеток или условий культивирования клеток, оптимально пониженная температура культивирования может составлять, предпочтительно, от 28,0 до 35,0°С и, более предпочтительно, от 30,0 до 34,0°С.
В способе получения белка, в котором растворимый внеклеточный домен рецептора VEGF и Fc-домен IgG человека слиты по настоящему изобретению, растворимый внеклеточный домен рецептора VEGF может включать в себя иммуноглобулиноподобный домен 2 первого рецептора VEGF и иммуноглобулиноподобный домен 3 второго рецептора VEGF. Конкретно, белок, полученный способом получения по настоящему изобретению, может являться терапевтическим белком.
В предпочтительном примере варианта осуществления настоящего изобретения температура культивирования с момента начала культивирования до изменения температуры была установлена равной 37,0°C у культивируемых клеток, которые сверхэкспрессируют рекомбинантный афлиберцепт, в течение 3 дней, пока плотность клеток в колбе не достигала 8×106 клеток/мл. После этого клетки культивировали с подпиткой в соответствии с графиком подачи в таблице 1 при пониженной температуре культивирования 32,0°C.
Как показано на фиг. 1, клетки, выращиваемые в колбе при более низкой температуре, чем типичная температура культивирования, демонстрировали более высокую жизнеспособность, чем клетки, непрерывно культивируемые при 37,0°C (контроль), и соответственно период культивирования увеличивался, и в результате повышался уровень экспрессии белка, как показано на фиг. 4. Напротив, как показано на фиг. 2 и 3, клетки, выращиваемые в колбе при более низкой температуре, чем типичная температура культивирования, не влияют на число IVC и общее количество экспрессируемого белка (PV=уровень экспрессии × объем культуры), так что удельная скорость продукции не увеличивается.
В другом предпочтительном примере варианта осуществления настоящего изобретения клетки, сверхэкспрессирующие рекомбинантный афлиберцепт, культивировали при температуре 37,0°С с момента начала культивирования до изменения температуры в течение 2 дней, пока плотность клеток в колбе не достигала 8×106 клеток/мл. После этого клетки культивировали с подпиткой в соответствии с графиком подачи в таблице 1 при пониженной температуре культивирования 30,0°C, 32,0°C или 34,0°C.
Как показано на фиг. 5, концентрация клеток в культуре при температуре культивирования, пониженной до 34,0°С, в колбе была увеличена по сравнению с концентрацией при других температурах, но, как показано на фиг. 6, увеличение уровня экспрессии белка было самым высоким в культуре при температуре культивирования, пониженной до 32,0°С.
В еще одном предпочтительном примере варианта осуществления настоящего изобретения температура культивирования с момента начала культивирования до изменения температуры была установлена равной 37,0°C для культивирования клеток, сверхэкспрессирующих рекомбинантный афлиберцепт, в течение 1 дня или 2 дней до тех пор, пока плотность клеток в биореакторе не достигала 4×106 клеток/мл или 8×106 клеток/мл. После этого клетки культивировали с подпиткой в соответствии с графиком подачи в таблице 1 при пониженной температуре культивирования 32,0°C. Значения рН культурального бульона в биореакторе отличаются в зависимости от культивируемых клеток, но обычно рН может составлять от 6,8 до 7,6, предпочтительно, от 6,8 до 7,4. Кроме того, растворенный кислород (DO) в культуральном бульоне в биореакторе составляет обычно от 20 до 60%, предпочтительно, от 30 до 50% и, более предпочтительно, от 40%.
В отличие от культивирования в колбе (колбе Эрленмейера) культивирование клеток до достижения плотности клеток 8×106 клеток/мл при типичной температуре культивирования (37,0°С) с использованием биореактора, а затем при температуре культивирования ниже типичной температуры культивирования, не влияло на число IVC, как показано на фиг. 8. Однако, как показано на фиг. 9, удельная скорость продукции была увеличена за счет увеличения общего количества экспрессируемого белка (PV=уровень экспрессии × объем культуры) и, как показано на фиг. 7, период культивирования был увеличен, и в результате был увеличен уровень экспрессии белка, как показано на фиг. 10. Кроме того, как показано на фиг. 11, было подтверждено, что образовалось меньшее количество агрегатов, а чистота мономера увеличилась.
Соответственно, способ получения слитого белка, имеющего Fc-домен IgG, по настоящему изобретению может повысить продукцию слитого белка за счет увеличения роста и жизнеспособности клеток, продуцирующих слитый белок, имеющий Fc-домен IgG, путем оптимизации условий культивирования клеток.
Кроме того, способ получения слитого белка, имеющего Fc-домен IgG, по настоящему изобретению может обеспечить слитый белок лучшего качества путем улучшения способа культивирования клеток млекопитающих с целью повышения продукции слитого белка и ингибирования образования агрегатов, которые влияют на качество слитого белка.
Способ по настоящему изобретению отличается повышением продукции желаемого белка и ингибированием образования агрегированного компонента при получении слитого белка путем культивирования клеток, продуцирующих желаемый белок. Соответственно, способ может помочь повысить продукцию афлиберцепта, являющегося белком, в котором лигандсвязывающий участок анти-VEGF рецептора слит с Fc-областью IgG1, и может улучшить процессы очистки путем ингибирования образования агрегированных компонентов.
Настоящее изобретение также относится к способу получения целевого белка, включающему в себя: культивирование клеток, продуцирующих целевой белок, посредством вышеописанного способа получения.
Способ получения целевого белка по настоящему изобретению может дополнительно включать в себя способ выделения целевого белка из культурального бульона, в котором культивируют клетки, продуцирующие целевой белок.
Целевой белок, полученный способом получения целевого белка, может представлять собой терапевтический белок, и полученный терапевтический белок может быть предоставлен в виде фармацевтической композиции совместно с фармацевтически приемлемым носителем.
Фармацевтическая композиция по настоящему изобретению может быть получена с использованием фармацевтически приемлемого и физиологически приемлемого адъюванта в дополнение к действующему ингредиенту, а в качестве адъюванта может использоваться растворимый агент, такой как вспомогательное вещество, способствующее распадаемости вещество, подслащивающий агент, связующее вещество, покрывающий агент, способствующий набуханию агент, смазывающее вещество, модификатор скольжения или ароматизатор. Фармацевтическая композиция по настоящему изобретению может быть изготовлена путем добавления одного или нескольких фармацевтически приемлемых носителей в дополнение к действующему ингредиенту для введения. В композиции, изготовленной в виде жидкого раствора, в качестве фармацевтически приемлемого носителя, пригодного для стерилизации и живого организма, можно использовать солевой раствор, стерильную воду, раствор Рингера, забуференный солевой раствор, раствор альбумина для инъекций, раствор декстрозы, раствор мальтодекстрина, глицерин, этанол и смесь по меньшей мере из одного из них, а также при необходимости могут быть добавлены другие типичные добавки, такие как антиоксидант, буферный раствор и бактериостатический агент. Кроме того, композиция может быть изготовлена в виде инъекционной лекарственной формы, такой как водный раствор, суспензия и эмульсия, в виде пилюли, капсулы, гранулы или таблетки, дополнительно включающих разбавитель, способствующее распадаемости вещество, поверхностно-активное вещество, связующее вещество и смазывающее вещество.
Фармацевтическую композицию по настоящему изобретению можно вводить млекопитающему, включая человека, различными путями в соответствии с типом полученного терапевтического белка. Например, фармацевтическую композицию можно вводить перорально или любым другим способом (непероральным), и непероральный способ введения может представлять собой, но не ограничен этим, внутривенное, внутримышечное, внутриартериальное, интрамедуллярное, интрадуральное, внутрисердечное, чрескожное, подкожное, внутрибрюшинное, интраназальное, энтеральное, местное, сублингвальное, ректальное или интравитреальное введение.
Подходящее для введения количество фармацевтической композиции по настоящему изобретению может варьировать в зависимости от таких факторов, как способ изготовления, способ введения, возраст, вес, пол или состояние заболевания пациента, диета, время введения, путь введения, скорость экскреции и степень ответа, и обычный врач может легко определить и назначить вводимое количество, эффективное для желаемой терапии или профилактики.
Далее настоящее изобретение будет описано более подробно с помощью примеров настоящего изобретения. Однако примеры приведены для иллюстрации настоящего изобретения, и объем настоящего изобретения не ограничивается ими.
[Варианты осуществления изобретения изобретения]
[Примеры изготовления]
Получение вектора и клеточной линии, экспрессирующих рекомбинантный афлиберцепт
Рекомбинантный афлиберцепт клонировали в виде слитого белка с использованием модифицированного вектора, в котором сайты shGH, His-тег и TEV были удалены из pSGHV0 (Номер доступа в базе данных GenBank № AF285183), а рекомбинантный афлиберцепт секретируется из клетки с использованием собственной сигнальной последовательности белка.
Кроме того, GS-система была введена в качестве селективного маркера для создания клеточной линии (стабильной клеточной линии), постоянно экспрессирующей слитый белок, и для этой цели ген глутаминсинтетазы мыши был вставлен в вектор. Чтобы увеличить уровень экспрессии, в сигнальную последовательность была дополнительно вставлена последовательность Козака. После чего стабильную клеточную линию получали путем введения полученного таким образом клона в клеточную линию CHO-K1 (ATCC, кат. № CCL-61) и отбора на метионинсульфоксимине (MSX). Однако специалист в данной области техники может соответственно выбрать обычно используемые векторы и клеточные линии в соответствии с данными обстоятельствами и соответственно их использовать.
[Пример 1]
Подтверждение эффектов культивирования при пониженной температуре на состояние клеток и синтез слитого с Fc-IgG белка
Клетки, сверхэкспрессирующие рекомбинантный афлиберцепт, полученные в примере изготовления, высевали в среду, дополненную растительным белковым гидролизатом, при одинаковой концентрации и одинаковых условиях в две колбы Эрленмейера емкостью по 125 мл, и культивировали в CO2-инкубаторе с качанием при 37,0°С. Клетки выращивали способом периодического культивирования, а затем культивировали с подпиткой, снижая температуру до 32,0°С, когда концентрация клеток составляла около 8×106 клеток/мл. График подачи для условий эксперимента суммирован в нижеследующей таблице 1. Объем подпитки указан в процентах от исходного объема культуры в биореакторе. Количество жизнеспособных клеток, жизнеспособность клеток, экспрессию и удельную скорость продукции определяли путем ежедневного отбора клеток из культуры. «Интегрированное количество жизнеспособных клеток» или «Интегральная жизнеспособная клетка (IVC)» означает среднюю плотность жизнеспособных клеток за время культивирования, умноженную на время культивирования. Когда количество продуцируемого белка пропорционально количеству жизнеспособных клеток в ходе культивирования, для оценки количества белка, продуцируемого за время культивирования, использовалась интегрированная плотность жизнеспособных клеток. IVC рассчитывали путем измерения количества жизнеспособных клеток с использованием теста на плотность клеток, в котором жизнеспособные клетки окрашивали трипановым синим и подсчитывали под микроскопом и нормировали на IVC. IVC определяли путем вычисления среднего арифметического значения интегрированных на момент сбора плотностей жизнеспособных клеток для всех исследуемых экспериментальных условий. Уровень экспрессии измеряли с помощью ВЭЖХ на белке А и рассчитывали удельную скорость продукции.
[Таблица 1]
В результате удельная скорость продукции не увеличивалась, поскольку культивирование клеток при низкой температуре в колбе Эрленмейера емкостью 125 мл не влияло на число IVC и общее количество экспрессированного белка (PV=объем культуры × уровень экспрессии) (фиг. 2 и 3). Однако, когда клетки выращивали при низкой температуре, время культивирования и уровень экспрессии повышались (фиг.4) из-за более высокой жизнеспособности клеток (фиг.1).
[Пример 2]
Идентификация оптимального изменения температуры исходя уровня экспрессиислитого с Fc-IgG белка
Клетки, сверхэкспрессирующие рекомбинантный афлиберцепт, полученные в примере изготовления, высевали в среду, дополненную растительным белковым гидролизатом, при одинаковой концентрации и одинаковых условиях в три колбы Эрленмейера емкостью по 125 мл, и культивировали в CO2-инкубаторе с качанием при 37,0°С. Клетки выращивали путем периодического культивирования, а затем, когда концентрация клеток составляла около 8×106 клеток/мл, культивировали с подпиткой при пониженной температуре 30,0°C, 32,0°C или 34,0°C, соответственно. Графики подачи для экспериментальных условий были такими, как описано в таблице 1 примера 1. Различные показатели клеток измеряли, как описано в примере 1.
В результате для клеток, культивируемых при низкой температуре 34,0°C, увеличение концентрации клеток было самым высоким без какого-либо изменения жизнеспособности (фиг.5). Однако увеличение в уровне экспрессии для клеток, культивируемых при низкой температуре 32,0°С, было самым высоким по сравнению с наблюдаемым при других температурах (фиг.6).
[Пример 3]
Подтверждающий эксперимент в биореакторе
Клетки, сверхэкспрессирующие рекомбинантный афлиберцепт, полученные в примере получения, высевали в питательную среду, полученную из растений, в биореактор New Brunswick Scientific (NBS) и перемешивали при рН от 6,8 до 7,4 и скорости 80 об/мин. Когда плотность клеток в биореактора достигала 4×06 клеток/мл или 8×106 клеток/мл на 1-й или 2-й день, клетки культивировали, изменяя температуру с 37,0 до 32,0°С. Графики подачи для экспериментальных условий были такими, как описано в таблице 1 примера 1. Различные показатели клеток измеряли, как описано в примере 1.
В результате, в отличие от культивирования в 125-миллилитровых колбах Эрленмейера, когда температура культивирования снижалась при 8×106 клеток/мл, культивируемые клетки не влияли на число IVC, удельная скорость продукции повышалась из-за увеличения общего количества белка (PV=объем культуры × уровень экспрессии), а уровень экспрессии повышался из-за увеличения времени культивирования (фиг. 7-10). Белок выделяли на колонке с белком A из образца, культивируемого в вышеописанных температурных условиях, и анализировали с помощью SE-HPLC. Из результатов, полученных в результате SE-HPLC-анализа, рассчитывали соотношение мономеров, а также рассчитывали соотношения агрегатов, которые представляют собой полимерные примеси, и фрагментов, которые представляют собой низкомолекулярные примеси. В результате эксперимента было подтверждено, что в культуре при пониженной температуре формировалось меньше агрегатов, и в результате повышалась чистота мономера (фиг. 11).
Эти результаты подтверждают, что посредством способа получения белка, в котором растворимый внеклеточный домен рецептора VEGF и Fc-домен IgG человека слиты согласно настоящему изобретению, афлиберцепт, являющийся представителем слитого белка, может быть получен в высоком качестве благодаря подавлению образования агрегатов, а продукция также может быть увеличена благодаря значительному увеличению уровня экспрессии вследствие культивирования при пониженной температуре.
При получении слитого белка путем культивирования клеток, условия культивирования, одновременно удовлетворяющие качеству и уровню продукции белка, отличаются в зависимости от типа белка, поэтому для определения оптимальных условий необходимо проведение множества испытаний и исправление ошибок. Как показано в примерах, способ получения слитого белка согласно настоящему изобретению оптимизирован для получения белка, в котором слиты растворимый внеклеточный домен рецептора VEGF и Fc-домен IgG человека (например, афлиберцепта), и при изменении типа белка продукция и качество соответствующего белка могут значительно варьировать. Соответственно, при изменении типа целевого белка, который будет продуцироваться, по сути будет необходим процесс восстановления оптимальных условий для повышения качества и продукции и проверки оптимальных условий.
Приведенное выше описание настоящего изобретения представлено для иллюстративных целей, и специалист в данной области техники, к которой относится настоящее изобретение, поймет, что настоящее изобретение может быть легко модифицировано в другие конкретные формы без изменения технической идеи или существенных признаков настоящего изобретения. Поэтому следует понимать, что описанные выше примеры являются только иллюстративными во всех аспектах и не являются ограничительными.
[Промышленная применимость]
Способ получения белка, в котором слиты растворимый внеклеточный домен рецептора VEGF и Fc-домен IgG человека, как предусмотрено настоящим изобретением, дополнительно включает стадию культивирования клеток, продуцирующих слитый белок, при пониженной температуре культивирования, тем самым увеличивая продукцию слитого белка, повышая рост и жизнеспособность клеток, а также улучшая качество за счет ингибирования образования агрегатов слитого белка и, таким образом, обеспечивает возможность получения и поставки слитого белка в больших количествах.
Кроме того, белок, полученный способом получения по настоящему изобретению, представляет собой терапевтический белок и может быть использован для получения фармацевтической композиции, подходящей для терапевтической цели, и, поэтому, весьма подходит для промышленного применения.
Реферат
Изобретение относится к биотехнологии, в частности к способу получения афлиберцепта. Проводят культивирование клеток млекопитающего, экспрессирующих афлиберцепт, в диапазоне температур от 35,0 до 38,0°С. Когда конечная плотность клеток достигает от 1x10клеток/мл до 1x10клеток/мл, культивирование клеток без переноса в другой биореактор продолжают при пониженной температуре от 30,0 до 35,0°С. Изобретение позволяет достичь значительного повышения уровня экспрессии афлиберцепта с уменьшенным количеством агрегатов и повышает жизнеспособность клеток. 10 з.п. ф-лы, 11 ил., 1 табл., 3 пр.

Комментарии