Композиции и способы достижения иммунной супрессии - RU2270691C2
Код документа: RU2270691C2
Чертежи


Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Областью изобретения является иммунная супрессия.
ПРЕДПОСЫЛКА ИЗОБРЕТЕНИЯ
Эффективный иммунный ответ начинается в том случае, когда антиген или митоген инициирует активацию Т-клеток. В процессе активации Т-клеток происходят многочисленные клеточные изменения, которые включают в себя экспрессию цитокинов и рецепторов цитокинов. Одним из цитокинов, вовлеченных в иммунный ответ, является интерлейкин-15 (IL-15), который является фактором роста Т-клеток, который in vitro стимулирует пролиферацию и дифференцировку В-клеток, Т-клеток, клеток природных киллеров (NK) и клеток активируемых лимфоцитами киллеров (LAK). Пролиферация указанных типов клеток in vivo усиливает иммунный ответ.
Пациенты получают пользу в результате супрессии иммунного ответа в ряде случаев, например в случае трансплантации органов или иммунного заболевания, в частности аутоиммунной болезни. В других случаях, например, когда избранные иммунные клетки стали злокачественными или аутоагрессивными, полезным является их активное разрушение.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение основано на открытии новых способов супрессии иммунного ответа. В каждом случае супрессия достигается введением первого агента, мишенью которого является рецептор интерлейкина-15 (IL-15R), и второго агента, который блокирует костимулирующий сигнал, который в норме передается от антиген-презентирующих клеток (АПК) к Т-клеткам. Таким образом, существенным признаком изобретения являются способы лечения пациента, которому полезна иммунная супрессия (например, пациента, который получил, или которому назначено получение трансплантата, или у которого имеется иммунное заболевание, в частности аутоиммунная болезнь), путем введения одного или нескольких агентов, мишенью которых является IL-15R, и одного или нескольких агентов, которые блокируют костимулирующий сигнал. Существенным признаком изобретения также являются терапевтические композиции, которые содержат один или несколько описанных выше первых и вторых агентов. Хотя такие композиции обязательно должны содержать более одного агента, способы согласно изобретению не ограничены способами, в которых агенты обязательно вводят одновременно. Агенты согласно изобретению и способы их применения описаны далее.
Многие из агентов, используемых в контексте данного изобретения, обладают признаками, имеющими преимущества при терапии. Например, агенты, мишенью которых является IL-15R, могут представлять собой гибридные белки, которые содержат мутантный полипептид IL-15 (mIL-15). Указанные агенты, по-видимому, не являются иммуногенными, поскольку часть гибридного белка в виде мутантного IL-15 может отличаться от IL-15 дикого типа только несколькими замененными остатками. Кроме того, так как полипептиды mIL-15 могут связываться с IL-15α с такой же аффинностью, как и IL-15 дикого типа, они могут эффективно конкурировать за рецептор. Кроме того, агенты согласно изобретению могут активировать компоненты иммунной системы хозяина, такие как комплемент и фагоцитоз, которые в конечном итоге опосредуют элиминацию, т.е. истощение популяции клеток, несущих рецептор, с которым агент связывается (например, опосредуя лизис или фагоцитоз клеток-мишеней). Так как субъединица альфа рецептора IL-15 (IL-15Rα) экспрессируется активированными или злокачественными иммунными клетками, но не покоящимися иммунными клетками, агенты согласно изобретению можно использовать для того, чтобы специфично поражать указанные клетки-мишени, которые были активированы (например, активированные антигеном Т-клетки) или которые стали злокачественными. Следующее преимущество изобретения состоит в том, что когда агент, мишенью которого является IL-15R, вводят с агентом, который блокирует костимулирующий сигнал, индуцируется толерантность. В результате иммуносупрессия может быть прекращена без отторжения трансплантата или вторичные трансплантаты могут не отторгаться без дальнейшей иммуносупрессии.
Применение композиций согласно изобретению для того, чтобы супрессировать иммунный ответ, или при получении лекарственного средства для лечения иммунного заболевания, также является существенным признаком изобретения.
Другие признаки и преимущества изобретения будут очевидны из следующего подробного описания и из формулы изобретения. Хотя на практике или при тестировании изобретения можно использовать материалы и способы, сходные или эквивалентные описанным здесь, предпочтительные материалы и способы описаны ниже.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1 представлена последовательность нуклеиновой кислоты IL-15 дикого типа (SEQ ID NO:1) и рассчитанная аминокислотная последовательность (SEQ ID NO:2).
На фиг.2 представлена последовательность нуклеиновой кислоты мутантного IL-15 (SEQ ID NO:3) и рассчитанная аминокислотная последовательность (SEQ ID NO:4). Оба кодона, кодон дикого типа, кодирующий глутамин в положении 149, CAG, и кодон дикого типа, кодирующий глутамин в положении 156, CAA, изменили на GAC, который кодирует аспартат (Указанные положения (149 и 156) соответствуют положениям 101 и 108, соответственно, в зрелом полипептиде IL-15, в котором отсутствует сигнальная последовательность из 48 аминокислот).
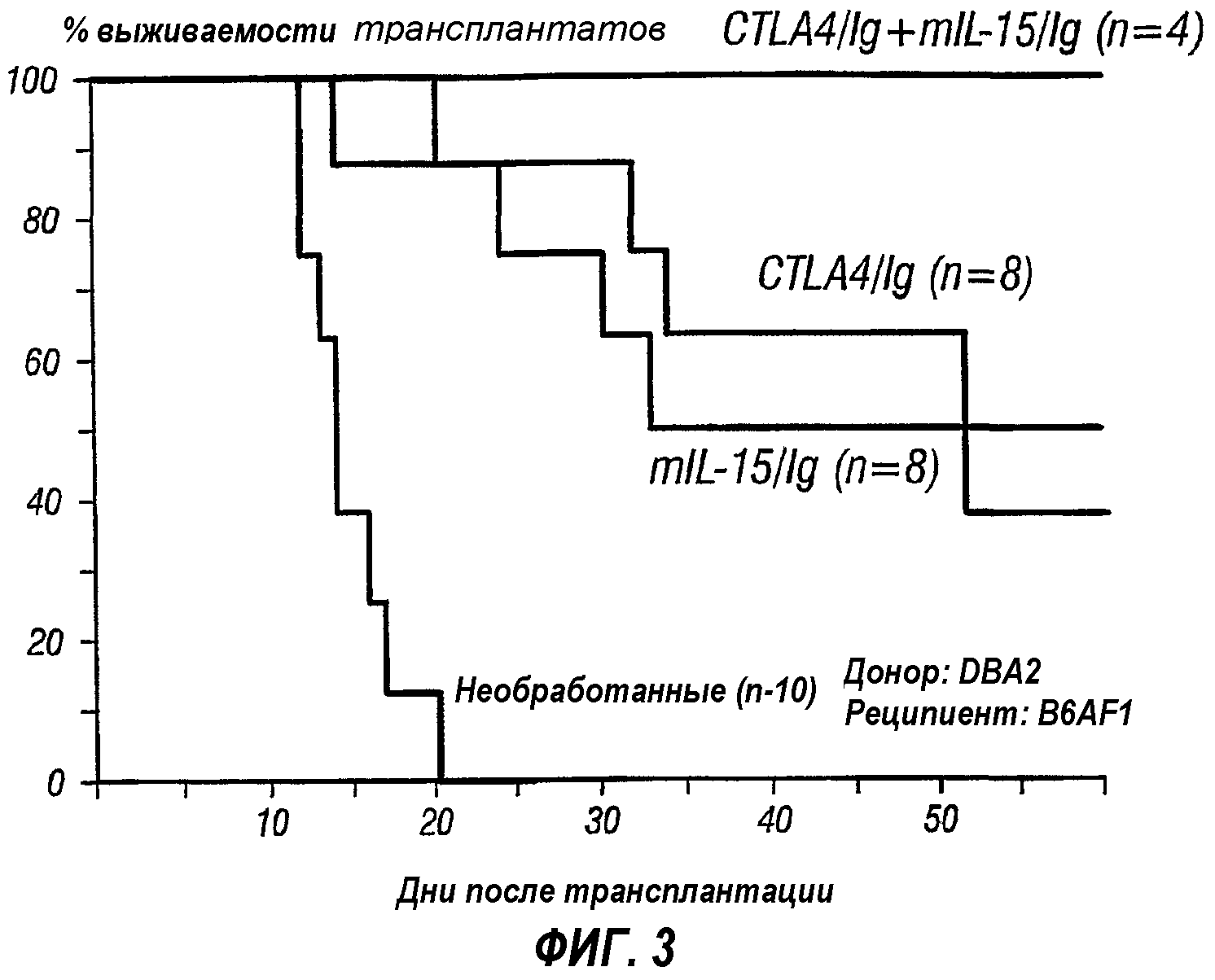
Фиг.3 представляет собой линейный график, изображающий процент выживания трансплантата после трансплантации клеток островков от донорных мышей DBA2 реципиентным мышам B6AF1. Реципиенты либо не подвергали, либо подвергали обработке mIL-15/Ig, CTLA4/Ig или комбинацией mIL-15/Ig и CTLA4/Ig.
ПОДРОБНОЕ ОПИСАНИЕ
Эффективный иммунный ответ начинается в том случае, когда антиген или митоген инициирует активацию Т-клеток. Фрагменты антигена находятся в ассоциации с молекулами главного комплекса гистосовместимости (МНС) на поверхности антиген-презентирующих клеток (АПК). АПК также доставляют костимулирующие сигналы, например сигналы, опосредованные CD40/CD154 и CD28/B7-1 или B7-2 ("костимулирующие сигналы Т-клеток" или "костимулирующие сигналы"). В процессе активации Т-клеток происходят многочисленные клеточные изменения, которые включают в себя экспрессию цитокинов и рецепторов цитокинов. Одним из цитокинов, принимающих участие в иммунном ответе, является интерлейкин-15 (IL-15). IL-15 связывает гетеротримерный рецептор, состоящий из β- и γ-субъединиц других рецепторов интерлейкинов и уникальной субъединицы IL-15Rα. Как описано выше, IL-15 охарактеризован как фактор роста Т-клеток, который in vitro стимулирует пролиферацию и дифференцировку В-клеток, Т-клеток, клеток природных киллеров (NK) и активированных лимфоцитами клеток киллеров (LAK). In vivo пролиферация указанных типов клеток усиливает иммунный ответ.
Данное изобретение основано на открытии новых способов ингибирования иммунного ответа. Ингибирования можно добиться введением комбинации агентов, мишенью одного из которых является IL-15R. Подразумевается, что термин "агент" охватывает по существу любой тип молекулы, которую можно использовать в качестве терапевтического средства. Белки, такие как антитела, гибридные белки и растворимые лиганды, любой из которых может быть либо идентичным белку дикого типа, либо содержит мутацию (т.е. делецию, присоединение или замену одного или нескольких аминокислотных остатков), и молекулы нуклеиновых кислот, которые их кодируют, - все являются "агентами". Агенты согласно изобретению можно вводить либо системно, либо локально, либо посредством терапии, основанной на клетках (т.е. агент согласно изобретению можно вводить пациенту путем введения клетки, которая экспрессирует агент у пациента). Клетка может представлять собой клетку, введенную пациенту исключительно в целях экспрессии терапевтического средства. Клетка также может представлять собой клетку клеточного, органного или тканевого трансплантата, при этом трансплантированный материал обрабатывают агентом или трансдуцируют нуклеиновой кислотой, кодирующей терапевтический агент до, ex vivo или после трансплантации. Таким образом трансплантированная клетка продуцирует свой собственный иммуносупрессирующий фактор(ры). Например, клетку, продуцирующую инсулин в качестве пригодного фенотипа, можно модифицировать так, чтобы она содержала ген, продуцирующий иммуносупрессирующий фактор(ры) согласно данному изобретению. Указанный и другие способы введения обычно используются специалистами в данной области и обсуждаются далее.
Агенты, мишенью которых является IL-15R
Агенты, мишенью которых является IL-15R, включают агенты, которые связываются с IL-15R, а также агенты, которые связываются и затем разрушают клетки, несущие IL-15R, такие как активированные Т-клетки. Таким образом, агенты, пригодные для достижения иммунной супрессии, могут содержать два функциональных компонента: направляющий к мишени компонент, который направляет агент к мишени - клетке, несущей IL-15R, и компонент, истощающий популяцию клеток-мишеней (т.е. лизирующий), который приводит к элиминации клеток, несущих IL-15R. В одном варианте направляющий к мишени компонент связывается с IL-15R без эффективной трансдукции сигнала через данный рецептор. Например, направляющий к мишени компонент может включать в себя мутантный полипептид IL-15, а компонент, истощающий популяцию клеток-мишеней, может содержать Fc-область молекулы иммуноглобулина, при этом указанную Fc-область получают из IgG, такого как IgG1, IgG2, IgG3, IgG4 человека, или аналогичные IgG млекопитающих, или из IgM, такого как IgM человека или аналогичные IgM млекопитающих. В предпочтительном варианте Fc-область содержит шарнирный домен, CH2 - и CH3-домены IgG1 человека или IgG2a мыши. Хотя изобретение не ограничено агентами, которые работают согласно какому-либо конкретному механизму, предполагается, что Fc-область опосредует управляемую комплементом или фагоцитами элиминацию клеток, несущих IL-15R.
Получены мутантные полипептиды IL-15, которые связываются с рецепторным комплексом IL-15 с аффинностью, сходной с аффинностью IL-15 дикого типа, но не могут полностью активировать сигнальную трансдукцию. Указанные мутантные полипептиды эффективно конкурируют с полипептидами IL-15 дикого типа и могут ингибировать одно или несколько событий, которые в норме происходят в ответ на передачу сигнала IL-15, таких как пролиферация клеток. Указанный здесь "полипептид IL-15 дикого типа" является полипептидом, который идентичен IL-15 природного происхождения (например, полипептид IL-15 дикого типа показан на фиг.1). Напротив, "мутантный полипептид IL-15" представляет собой полипептид, который имеет, по меньшей мере, одну мутацию по сравнению с IL-15 дикого типа, и который ингибирует, по меньшей мере, одну из активностей in vivo или in vitro, которые обычно стимулируются IL-15 дикого типа.
Мутантный полипептид IL-15, который можно использовать согласно данному изобретению, как правило, будет блокировать, по меньшей мере, 40%, более предпочтительно, по меньшей мере, 70% и наиболее предпочтительно, по меньшей мере, 90% одной или нескольких активностей молекулы IL-15 дикого типа. Способность мутантного полипептида IL-15 блокировать активность IL-15 дикого типа можно оценить множеством анализов, включая описанный здесь анализ пролиферации клеток BAF-BO3 (при котором клетки трансфицировали конструкцией, кодирующей IL-2Rβ). Кроме того, мутантные полипептиды согласно изобретению можно охарактеризовать в соответствии с конкретной идентичностью в процентах, которую они проявляют по отношению к IL-15 дикого типа. При определении процента идентичности между двумя полипептидами длина сравниваемых последовательностей, как правило, будет составлять, по меньшей мере, 16 аминокислот, предпочтительно, по меньшей мере, 20 аминокислот, более предпочтительно, по меньшей мере, 25 аминокислот и наиболее предпочтительно, по меньшей мере, 35 аминокислот.Термин "идентичность", используемый в отношении полипептидной последовательности или последовательности ДНК, относится к идентичности между субъединицами (аминокислотными остатками белков или нуклеотидами молекул ДНК) в пределах двух сравниваемых полипептидных последовательностей или последовательностей ДНК. Если положение субъединицы в обеих молекулах занято одной и той же мономерной субъединицей (т.е. одним и тем же аминокислотным остатком или нуклеотидом), в таком случае молекулы являются идентичными в данном положении. Сходство между двумя аминокислотными последовательностями или двумя нуклеотидными последовательностями является прямой функцией количества идентичных положений. Таким образом, полипептид, который на 50% идентичен эталонному полипептиду, который имеет длину, равную 100 аминокислотам, может представлять собой полипептид из 50 аминокислот, который полностью идентичен части эталонного полипептида, имеющей длину, равную 50 аминокислотам. Также может быть полипептид длиной 100 аминокислот, который на 50% идентичен эталонному полипептиду на протяжении всей его длины. Конечно, таким же критериям могут отвечать многие другие полипептиды. Обычно и наиболее удобно идентичность измеряют с использованием компьютерной программы анализа последовательностей, такой как пакет компьютерных программ для анализа последовательностей Genetics Computer Group в University of Wisconsin Biotechnology Center (1710 University Avenue, Madison, WI 53705), с параметрами, используемыми по умолчанию.
Мутантный полипептид IL-15 может быть, по меньшей мере, на 65%, предпочтительно, по меньшей мере, на 80%, более предпочтительно, по меньшей мере, на 90% и наиболее предпочтительно, по меньшей мере, на 95% (например, на 96%, 97%, 98% или 99%) идентичным IL-15 дикого типа. Мутация может состоять в изменении количества или содержания аминокислотных остатков. Например, мутантный IL-15 может иметь большее или меньшее количество аминокислотных остатков, чем IL-15 дикого типа. Альтернативно или дополнительно мутантный полипептид может содержать замену одного или нескольких аминокислотных остатков, которые присутствуют в IL-15 дикого типа. Мутантный полипептид IL-15 может отличаться от IL-15 дикого типа присоединением, делецией или заменой одного аминокислотного остатка, например присоединением, делецией или заменой остатка в положении 156. Подобным образом мутантный полипептид может отличаться от полипептида дикого типа присоединением, делецией или заменой двух аминокислотных остатков, например остатков в положениях 156 и 149. Например, мутантный полипептид IL-15 может отличаться от IL-15 дикого типа заменой глутамина на аспартат в остатках 156 и 149 (как показано на фиг.2). Мутантные полипептиды, пригодные в качестве направляющих к мишени агентов, подобно IL-15 дикого типа, узнают и связывают компонент IL-15R. В одном варианте мутация IL-15 находится в домене карбоксильного конца цитокина, который предположительно связывается с IL-2Rγ (субъединицей рецептора IL-2). Альтернативно или дополнительно мутантные полипептиды IL-15 могут содержать одну или несколько мутаций в домене, связывающем IL-2Rβ (β-субъединицу рецептора IL-2).
В том случае, когда мутантный полипептид IL-15 содержит замену одного аминокислотного остатка на другой, замена может, но необязательно, представлять собой консервативную замену, которая включает в себя замену в пределах следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота; аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин.
Вместо использования или дополнительно к использованию полипептида IL-15 (например, мутантного полипептида IL-15) направление к мишени IL-15R можно осуществлять с помощью антител, которые связываются с компонентом IL-15R (например, субъединицей IL-15Rα). Способы, посредством которых можно получать антитела, включая гуманизированные антитела, против компонента IL-15R, хорошо известны в данной области. Предпочтительно антитела должны обладать способностью активировать комплемент или фагоцитоз, например подклассы IgG3 и IgG1 человека (предпочтительно последний) или подкласс IgG2a мыши.
Как описано выше, агенты, пригодные для достижения иммунной супрессии, могут содержать два функциональных компонента: направляющий к мишени компонент, который направляет агент к мишени - клетке, несущей IL-15R (такой, как только что описанная мутантная молекула IL-15), и компонент, истощающий популяцию клеток-мишеней, который, например, лизирует или другим образом приводит к элиминации клетки, несущей IL-15R. Таким образом, агент может представлять собой химерный полипептид, который содержит мутантный полипептид IL-15 и гетерологичный полипептид, такой как Fc-область антител подклассов IgG и IgM. Fc-область может включать в себя мутацию, которая ингибирует фиксацию комплемента и связывание рецептора Fc или она может истощать популяцию клеток-мишеней (т.е. способна разрушать клетки посредством связывания комплемента или на основе другого механизма, такого как зависимый от антител лизис с участием комплемента).
Fc-область можно выделить из источника природного происхождения, получать рекомбинантным способом или синтезировать (подобно тому, как можно получить любой полипептид, охарактеризованный в данном изобретении). Например, Fc-область, которая гомологична С-концевому домену IgG, можно получить расщеплением IgG папином. Fc IgG имеет молекулярную массу, примерно равную 50 кДа. Полипептиды согласно изобретению могут включать в себя полную Fc-область или меньшую часть, которая сохраняет способность лизировать клетки. Кроме того, полноразмерные или фрагментированные Fc-области могут являться вариантами молекулы дикого типа. А именно они могут содержать мутации, которые могут влиять или не влиять на функцию полипептида.
Fc-область может быть "истощающей популяцию клеток-мишеней" или "не истощающей популяцию клеток-мишеней". В случае Fc-области, не истощающей популяцию клеток-мишеней, обычно отсутствует сайт связывания высоко аффинного Fc-рецептора и сайт связывания C'1q. Сайт связывания высоко аффинного Fc-рецептора Fc мышиного IgG содержит остаток Leu в положении 235 в Fc IgG. Таким образом, сайт связывания рецептора Fc мыши можно разрушить посредством мутации или делетирования Leu 235. Например, замена Leu 235 на Glu ингибирует способность Fc-области связывать высоко аффинный Fc-рецептор. Сайт связывания C'1q мыши можно функционально разрушить посредством мутации или делетирования остатков Glu 318, Lys 320 и Lys 322 в IgG. Например, замена Glu 318, Lys 320 и Lys 322 на Ala делает Fc IgG1 неспособной стимулировать зависимый от антител лизис с участием комплемента. Напротив, истощающая популяцию клеток-мишеней Fc-область IgG имеет сайт связывания высоко аффинного Fc-рецептора и сайт связывания C'1q. Сайт связывания высоко аффинного Fc-рецептора содержит остаток Leu в положении 235 Fc IgG, а сайт, связывающий C'1q, содержит остатки Glu 318, Lys 320 и Lys 322 IgG1. Истощающая популяцию клеток-мишеней Fc IgG имеет в указанных сайтах остатки дикого типа или консервативные аминокислотные замены. Истощающая популяцию клеток-мишеней Fc IgG может делать клетки мишенью для зависимой от антител клеточной цитотоксичности или вызываемого комплементом цитолиза (CDC). Соответствующие мутации IgG человека также известны (смотри, например, Morrison et al., The Immunologist 2: 119-124, 1994; и Brekke et al., The Immunologist 2: 125, 1994).
Агенты, мишенью которых является IL-15R, также могут представлять собой агенты, которые содержат мутантный полипептид IL-15 и полипептид, который функционирует как антигенная метка, такой как последовательность FLAG. Последовательности FLAG узнаются биотинилированными, высоко специфичными анти-FLAG антителами, как здесь описано (смотри также Blanar et al., Science 256: 1014, 1992; LeClair et al., Proc. Natl. Acad. Sci. USA 89: 8145, 1992).
Агенты, которые ингибируют костимулирующий сигнал
Чтобы ингибировать иммунный ответ, агенты, мишенью которых являются описанные выше клетки, несущие IL-15R, можно вводить вместе с агентом, который ингибирует костимулирующий сигнал, который в норме передается с АПК на Т-клетку. Агент, который вводят "вместе с" другим агентом, можно, но необязательно, вводить одновременно. Например, в контексте данного изобретения агент, мишенью которого является IL-15R, можно вводить до или после агента, который ингибирует костимулирующий сигнал. Для того чтобы ингибировать костимулирующий сигнал, можно вводить любой агент, который связывается и блокирует одну или несколько молекул либо на Т-клетке, либо на АПК, о которых известно, что они принимают участие в передаче костимулирующего сигнала между двумя указанными типами клеток. Например, можно вводить любой агент, который связывается с молекулой В7 (включая, но не ограничивая этим, B7-1 или B7-2) на АПК или с CD28, которая экспрессируется, например, Т-клетками и связывается В7. Указанные агенты включают антитела, которые связывают молекулы В7 (например, анти-В7-антитело), CTLA4/Ig и антитела, которые связывают CD28. Альтернативно или дополнительно можно вводить любой агент, который связывает CD40 на АПК или CD40L (также называемую CD154), которая экспрессируется, например, Т-клетками и связывается CD40. Указанные агенты включают антитела, которые связывают CD40 или CD40L.
Способы скрининга агентов, которые ингибируют иммунный ответ
Кроме тестирования исследуемого агента (например, мутантного полипептида IL-15) в анализах in vitro, описанных в примерах далее, можно использовать любой из следующих анализов in vivo, чтобы проверить, какие конкретные комбинации описанных здесь агентов наиболее эффективно вызывают иммунную супрессию. Например, можно тестировать один или несколько агентов, мишенью которых является IL-15R, в комбинации с одним или несколькими агентами, которые либо блокируют костимулирующий сигнал, который в норме передается от АПК к Т-клеткам, являются антагонистами TCR, ингибируют кальцинурин, ингибируют пролиферацию клеток или которые связываются и инактивируют активированные антигеном Т-клетки. Указанные анализы in vivo представляют собой только некоторые из обычных способов, с помощью которых специалист в данной области может далее тестировать эффективность агентов согласно изобретению. Выбранные указанные анализы включены здесь вследствие того, что они подходят для многих клинических состояний, поддающихся лечению агентами, мишенью которых является IL-15R. Например, анализы подходят для трансплантации органов, иммунного заболевания, в частности аутоиммунной болезни, и злокачественных опухолей иммунной системы (например, злокачественных опухолей, которые возникают в том случае, когда Т-клетки становятся злокачественными).
Принципы трансплантации
Чтобы определить, осуществляет ли агент согласно изобретению или комбинация таких агентов иммунную супрессию, их вводят (либо непосредственно с помощью основанной на генах терапии, либо посредством терапии, основанной на клетках) в контексте хорошо разработанных принципов трансплантации.
Агенты согласно изобретению или кодирующие их молекулы нуклеиновых кислот можно вводить системно или локально стандартными способами любому обычному лабораторному животному, такому как крыса, мышь, кролик, морская свинка или собака, перед тем, как животному проведена аллогенная или ксеногенная пересадка кожи, трансплантация органа или имплантация клеток. Линии мышей, такие как C57B1-10, B10.BR и B10.AKM (Jackson Laboratory, Bar Harbor, ME), которые имеют один и тот же генетический фон, но не соответствуют по локусу H-2, хорошо подходят для оценки различных пересадок органов.
Трансплантация сердца
Способ выполнения пересадок сердца посредством анастомоза сердца донора с магистральным сосудом брюшной полости хозяина впервые опубликован Ono et al. (J. Thorac. Cardiovasc. Surg. 57: 225, 1969; смотри также Corry et al., Transplantation 16: 343, 1973). С помощью указанной хирургической процедуры накладывают анастомоз между аортой сердца донора и аортой брюшной полости хозяина и накладывают анастомоз между легочной артерией сердца донора и близлежащей полой веной, используя стандартную технологию микрососудов. После того, как сердце будет пересажено на место и нагрето до 37°C раствором лактата Рингера, восстановится нормальный синусовый ритм. Функционирование трансплантированного сердца часто можно оценить посредством пальпации сокращений желудочков через брюшную стенку. Отторжение определяют как остановку сокращений миокарда. Агенты согласно изобретению (например, комбинация мутантного IL-15/Fc и CTLA4/Ig) будут считаться эффективными в снижении отторжения органа, если у хозяев, которые получали указанные агенты, наблюдается более длительный период приживления трансплантированного сердца донора, чем у необработанных хозяев.
Пересадка кожи
Эффективность различных комбинаций агентов согласно изобретению также можно оценить после пересадки кожи. Чтобы выполнить пересадки кожи на грызунах животное-донора анестезируют и с части хвоста удаляют кожу на всю толщину полностью. Животного-реципиента также анестезируют и готовят ложе для пересадки удалением лоскута кожи с обритого бока. Как правило, лоскут имеет размер примерно 0,5×0,5 см. Коже донора придают форму, соответствующую форме ложа для пересадки, укладывают на место, покрывают марлей и бинтуют. Трансплантаты можно обследовать ежедневно, начиная с шестого дня после операции, и трансплантат считается отторгнутым в том случае, когда более половины трансплантированного эпителия выглядит нежизнеспособным. Агенты согласно изобретению (например, комбинация мутантного IL-15/Fc и CTLA4/Ig) считаются эффективными в снижении отторжения при пересадке кожи в том случае, если у хозяев, которые получали указанные агенты, наблюдается более длительный период приживления кожи донора, чем у необработанных хозяев.
Модель аллотрансплантата островков
Аллотрансплантаты клеток островков DBA/2J можно трансплантировать грызунам, таким как мыши B6 AF1 6-8-недельного возраста, у которых диабет вызван однократной внутрибрюшинной инъекцией стрептозотоцина (225 мг/кг; Sigma Chemical Co., St. Louis, MO). В качестве контроля сингенные трансплантаты клеток островков можно трансплантировать мышам с диабетом. Трансплантацию островковых клеток можно выполнить с помощью следующих опубликованных протоколов (например, смотри Gotoh et al., Transplantation 42: 387, 1986). Коротко, поджелудочную железу донора перфузируют in situ коллагеназой типа IV (2 мг/мл; Worthington Biochemical Corp., Freehold, NJ). После 40-минутного периода расщепления при 37°C островки выделяют в ступенчатом градиенте фикола. Затем 300-400 островков трансплантируют под почечную капсулу каждого реципиента. За функционированием аллотрансплантата можно следить посредством серии измерений глюкозы в крови (Accu-Check IIITM; Boehringer, Mannheim, Germany). Первичное функционирование трансплантата определяют в виде уровня глюкозы в крови ниже 11,1 ммоль/л на 3 день после трансплантации, и отторжение трансплантата определяют в виде подъема концентрации глюкозы в крови, превышающем 16,5 ммоль/л (по меньшей мере, в каждый из 2 следующих друг за другом дней) после периода первичного функционирования трансплантата.
Модели аутоиммунного заболевания
Модели аутоиммунного заболевания обеспечивают другие способы оценки комбинаций агентов согласно изобретению in vivo. Указанные модели хорошо известны специалистам в данной области, и их можно использовать для определения того, будет ли данная комбинация агентов, которая включает в себя агент, мишенью которого является IL-15R, терапевтически пригодной для лечения конкретного аутоиммунного заболевания в случае непосредственной доставки в результате генетической терапии или посредством терапии, основанной на клетках.
Аутоиммунные заболевания, модели которых получены на животных, включают заболевания ревматизмом, такие как ревматоидный артрит и системная красная волчанка (СКВ), диабет типа I и аутоиммунные заболевания щитовидной железы, кишечника и центральной нервной системы. Например, модели СКВ на животных включают мышей MRL, мышей BXSB и мышей NZB и их гибриды F1. Указанных животных можно скрещивать для того, чтобы исследовать конкретные аспекты процесса заболевания ревматизмом; у потомства линии NZB развивается тяжелая форма волчаночного гломерулонефрита при скрещивании с мышами NZW (Bielschowsky et al., Proc. Univ. Otago Med. Sch. 37: 9, 1959; смотри также Fundamental Immunology, Paul, Ed., Raven Press, New York, NY, 1989). Подобным образом сдвиг к летальному нефриту наблюдается в потомстве от скрещивания NBZ X SWR (Data et al., Nature 263: 412, 1976). Гистологические проявления повреждений почек у мышей SNF1 хорошо охарактеризованы (Eastcott et al., J Immunol. 131: 2232, 1983; смотри также Fundamental Immunology, выше). Таким образом, общее состояние здоровья животного, а также гистологический вид почечной ткани можно использовать для того, чтобы определить, супрессируется ли эффективно иммунный ответ у животного в модели СКВ при введении агентов, мишенью которых является IL-15R, и которые, например, ингибируют костимуляцию.
У одной из линий мышей MRL, у которых развивается СКВ, MRL-lpr/lpr, также развивается форма артрита, которая похожа на ревматоидный артрит у человека (Theofilopoulos et al., Adv. Immunol. 37: 269, 1985). Альтернативно, экспериментальный артрит можно индуцировать у грызунов посредством инъекции коллагена типа II крыс (2 мг/мл), смешанного 1:1 с полным адъювантом Фрейнда (всего 100 мкл), в основание хвоста. Артрит развивается через 2-3 недели после иммунизации. Способность молекул нуклеиновой кислоты, кодирующих агенты согласно изобретению (например, агенты, мишенью которых является IL-15R, и агенты, которые ингибируют костимуляцию или которые связываются и инактивируют Т-клетки, активированные антигеном), супрессировать иммунный ответ можно оценить целенаправленной доставкой молекул нуклеиновой кислоты к Т-лимфоцитам. Один из способов целенаправленной доставки к Т-лимфоцитам представляет собой следующее. Суспензии клеток селезенки готовят через 2-3 дня после начала артрита и инкубируют с коллагеном (100 мкг/мл) в течение 48 часов, чтобы индуцировать пролиферацию активируемых коллагеном Т-клеток. В это время клетки трансдуцируют вектором, кодирующим представляющий интерес полипептидный агент. В качестве контроля выращивают параллельные культуры, но не трансдуцируют их, или трансдуцируют "пустым" вектором. Затем клетки инъецируют внутрибрюшинно (5×107 клеток/животное). Эффективность лечения оценивают, следя за симптомами заболевания в течение следующих 2 недель, как описано Chernajovsky et al. (Gene Therapy 2: 731-735, 1995). Менее выраженные симптомы по сравнению с контролем свидетельствуют о том, что комбинированные агенты согласно изобретению и молекулы нуклеиновых кислот, которые их кодируют, функционируют в качестве иммуносупрессоров и поэтому применимы для лечения иммунного заболевания, в частности аутоиммунной болезни.
Способность различных комбинаций агентов супрессировать иммунный ответ в случае диабета типа I можно тестировать на линии крыс BB, которая была получена из коммерческой колонии крыс Wistar в Bio-Breeding Laboratories в Оттаве. У указанных крыс спонтанно вырабатываются аутоантитела против островковых клеток и инсулина, точно так, как происходит в случае диабета типа I человека. Альтернативно в качестве модельной системы можно использовать мышей NOD (диабетические мыши без ожирения).
Аутоиммунные заболевания щитовидной железы моделировали у цыплят. У цыплят линии, в которой наблюдается ожирение (OS), единообразно развивается спонтанный аутоиммунный тиреоидит, аналогичный болезни Хашимото (Cole et al., Science 160: 1357, 1968).
Примерно 15% указанных птиц продуцируют аутоантитела к париетальным клеткам желудка, точно так же как при аутоиммунном тиреоидите человека. Манифестация заболевания у цыплят OS, которую можно прослеживать при любой схеме лечения, включает в себя размер тела, отложение жира, липиды в сыворотке, чувствительность к холоду и бесплодие.
Модели аутоиммунного заболевания в центральной нервной системе (ЦНС) также можно индуцировать экспериментально. Воспаление ЦНС, которое приводит к параличу, можно индуцировать однократной инъекцией адъюванта в ткань головного мозга или спинного мозга многих разных лабораторных животных, включая грызунов и приматов. Указанная модель, называемая экспериментальным аллергическим энцефаломиелитом (EAE), опосредована Т-клетками. Подобным образом можно получить экспериментально индуцированную миастению беременных путем однократной инъекции ацетилхолинового рецептора с адъювантом (Lennon et al., Ann. N.Y. Acad. Sci. 274: 283, 1976).
Аутоиммунные заболевания кишечника можно моделировать у "нокаутированных" мышей по IL-2 или IL-10, или у мышей, которые получали клизмы, содержащие бычий сывороточный альбумин.
Молекулы нуклеиновых кислот, которые кодируют агенты согласно изобретению
Полипептидные агенты согласно изобретению, включая агенты, которые являются гибридными белками (например, молекулы мутантного IL-15/Fc и CTLA4/Ig), можно получить не только посредством экспрессии молекулы нуклеиновой кислоты в подходящей эукариотической или прокариотической экспрессирующей системе in vitro и последующей очистки полипептидного агента, но также можно ввести пациенту с помощью подходящего генотерапевтического экспрессирующего вектора, кодирующего молекулу нуклеиновой кислоты. Кроме того, нуклеиновую кислоту можно ввести в клетку трансплантата перед трансплантацией трансплантата. Таким образом, молекулы нуклеиновой кислоты, кодирующие описанные выше агенты, входят в рамки изобретения. Точно так же, как полипептиды согласно изобретению (например, полипептиды мутантного IL-15/Fc) можно описать в соответствии с их идентичностью с полипептидами дикого типа (например, полипептидами IL-15 дикого типа), молекулы кодирующих их нуклеиновых кислот непременно будут обладать определенной идентичностью с молекулами, которые кодируют соответствующие полипептиды дикого типа. Например, молекула нуклеиновой кислоты, кодирующая мутантный полипептид IL-15, может быть, по меньшей мере, на 65%, предпочтительно, по меньшей мере, на 75%, более предпочтительно, по меньшей мере, на 85%, и наиболее предпочтительно, по меньшей мере, на 95% (например, 96%, 97%, 98% или 99%) идентична нуклеиновой кислоте, кодирующей IL-15 дикого типа. В случае нуклеиновых кислот длина сравниваемых последовательностей будет, как правило, составлять, по меньшей мере, 50 нуклеотидов, предпочтительно, по меньшей мере, 60 нуклеотидов, более предпочтительно, по меньшей мере, 75 нуклеотидов и наиболее предпочтительно 110 нуклеотидов.
Молекулы нуклеиновых кислот, которые кодируют агенты согласно изобретению, могут содержать последовательности природного происхождения или последовательности, которые отличаются от последовательностей природного происхождения, но вследствие вырожденности генетического кода кодируют тот же самый полипептид. Указанные молекулы нуклеиновых кислот могут состоять из РНК или ДНК (например, геномной ДНК, кДНК или синтетической ДНК, такой, которую получают посредством синтеза, основанного на фосфороамидитах) или комбинаций или модификаций нуклеотидов в пределах указанных типов нуклеиновых кислот. Кроме того, молекулы нуклеиновых кислот могут быть двунитевыми или однонитевыми (т.е. либо смысловая, либо антисмысловая нить).
Молекулы нуклеиновых кислот согласно изобретению называют "изолированными", так как они отделены от 5'- или 3'-кодирующей последовательности, с которой они непосредственно граничат в геноме организма природного происхождения. Таким образом, молекулы нуклеиновых кислот не ограничены последовательностями, которые кодируют полипептиды; также могут быть включены некоторые или все некодирующие последовательности, которые лежат "левее" или "правее" кодирующей последовательности. Специалисты в области молекулярной биологии знакомы со стандартными процедурами выделения молекул нуклеиновых кислот. Их, например, можно получить обработкой геномной ДНК эндонуклеазами рестрикции или посредством выполнения полимеразной цепной реакции (ПЦР). В том случае, когда молекула нуклеиновой кислоты представляет собой рибонуклеиновую кислоту (РНК), молекулы можно получить с помощью транскрипции in vitro.
Изолированные молекулы нуклеиновых кислот согласно изобретению могут содержать фрагменты, не выявляемые как таковые в природной форме. Таким образом, изобретение охватывает рекомбинантные молекулы, такие как молекулы, в которых последовательность нуклеиновой кислоты (например, последовательность, кодирующая мутантный IL-15) включена в вектор (например, плазмидный или вирусный вектор) или в геном гетерологичной клетки (или геном гомологичной клетки, в положении, отличном от естественного положения в хромосоме).
Как описано выше, агенты согласно изобретению могут являться гибридными белками. Дополнительно или вместо описанных выше гетерологичных полипептидов молекула нуклеиновой кислоты, кодирующая агент согласно изобретению, может содержать последовательности, кодирующие "маркер" или "репортер". Примеры маркерных или репортерных генов включают β-лактамазу, хлорамфениколацетилтрансферазу (ХАТ), аденозиндезаминазу (ADA), аминогликозидфосфотрансферазу (neor, G418r), дигидрофолатредуктазу (DHFR), гигромицин-B-фосфотрансферазу (HPH), тимидинкиназу (TK), lacZ (кодирующий β-галактозидазу) и ксантингуанинфосфорибозилтрансферазу (XGPRT). Как в случае многих стандартных способов, связанных с практическим применением изобретения, специалист в данной области будет знать дополнительные пригодные реагенты, например дополнительные последовательности, которые могут выполнять функцию маркера или репортера.
Молекулы нуклеиновых кислот согласно изобретению можно получить введением мутации в агент согласно изобретению (например, молекулу IL-15 или молекулу CTLA4), полученный из любой биологической клетки, такой как клетка млекопитающего, или полученный стандартными способами клонирования. Таким образом, нуклеиновые кислоты согласно изобретению могут представлять собой нуклеиновые кислоты мыши, крысы, морской свинки, коровы, овцы, лошади, свиньи, кролика, обезьяны, бабуина, собаки или кошки. Предпочтительно молекулы нуклеиновых кислот будут являться молекулами человека.
Описанные выше молекулы нуклеиновых кислот могут входить в состав вектора, который способен управлять их экспрессией, например, в клетке, которая была трансдуцирована вектором. Соответственно в дополнение к полипептидным агентам к числу предпочтительных вариантов относятся экспрессирующие векторы, содержащие молекулу нуклеиновой кислоты, кодирующую указанные агенты, и клетки, трансфицированные указанными векторами.
Подходящие для применения в данном изобретении векторы включают векторы на основе Т7 для применения в бактериях (смотри, например, Rosenberg et al., Gene 56: 125, 1987), экспрессирующий вектор pMSXND для применения в клетках млекопитающих (Lee and Nathans, J. Biol. Chem. 263: 3521, 1988), дрожжевые экспрессирующие системы, такие как системы Pichia pastoris (например, семейство экспрессирующих векторов PICZ от Invitrogen, Carlsbad, CA) и основанные на бакуловирусах векторы (например, экспрессирующий вектор pBacPAK9 от Clontech, Palo Alto, CA) для применения в клетках насекомых. В таких векторах вставки нуклеиновых кислот, которые кодируют представляющий интерес полипептид, можно оперативно связать с промотором, который выбран, например, на основе типа клеток, в которых пытаются получить экспрессию. Например, промотор Т7 можно использовать в бактериях, промотор полиэдрина можно использовать в клетках насекомых, а промотор цитомегаловируса или металлотионеина можно использовать в клетках млекопитающих. Также в случае высших эукариот широко используют тканеспецифичные и специфичные для типа клеток промоторы. Указанные промоторы называют так из-за их способности направлять экспрессию молекулы нуклеиновой кислоты в организме в ткани или клетке данного типа. Специалист в данной области хорошо знаком с многочисленными промоторами и другими регуляторными элементами, которые можно использовать для управления экспрессией нуклеиновых кислот.
Кроме последовательностей, которые способствуют транскрипции встроенной молекулы нуклеиновой кислоты, векторы могут содержать начала репликации и другие гены, кодирующие селектируемый маркер. Например, ген устойчивости к неомицину (neor) придает устойчивость к G418 клеткам, в которых он экспрессируется, и таким образом обеспечивает фенотипическую селекцию трансфицированных клеток. Другие подходящие гены селектируемых маркеров, позволяющие осуществлять фенотипическую селекцию клеток, включают различные флуоресцентные белки, например белок с зеленой флуоресценцией (GFP) и его варианты. Специалисты в данной области легко определят, подходит ли данный регуляторный элемент или селектируемый маркер для применения в конкретной экспериментальной ситуации.
Вирусные векторы, которые можно использовать в изобретении, включают, например, ретровирусные, аденовирусные векторы и векторы на основе аденоассоциированных вирусов, вируса герпеса, вируса обезьян 40 (SV40) и вируса папилломы быка (смотри, например, Gluzman (Ed.), Eukaryotic Viral Vectors, CSH Laboratory Press, Cold Spring Harbor, New York).
Прокариотические или эукариотические клетки, которые содержат молекулу нуклеиновой кислоты, которая кодирует агент согласно изобретению, и экспрессируют белок, кодируемый данной молекулой нуклеиновой кислоты, in vitro, являются существенным признаком изобретения. Клетка согласно изобретению представляет собой трансфицированную клетку, т.е. клетку, в которую посредством технологии рекомбинантной ДНК была введена молекула нуклеиновой кислоты, например молекула нуклеиновой кислоты, кодирующая мутантный полипептид IL-15. Потомство такой клетки также считается входящим в рамки данного изобретения. Точные компоненты системы экспрессии не являются критическими. Например, мутантный полипептид IL-15 можно получить в прокариотическом хозяине, таком как бактерия E.coli, или в эукариотическом хозяине, таком как клетка насекомого (например, клетки Sf21), или клетки млекопитающих (например, клетки COS, клетки СНО, клетки 293, клетки NIH 3T3 или клетки HeLa). Указанные клетки доступны из многих источников, включая Американскую коллекцию типовых культур (Manassas, VA). При выборе экспрессирующей системы значение имеет только то, чтобы компоненты были совместимы друг с другом. Специалист в данной области способен это определить. Кроме того, если необходимо руководство при выборе экспрессирующей системы, можно обратиться к Ausubel et al. (Current Protocols in Molecular Biology, John Wiley and Sons, New York, NY, 1993) и Pouwels et al. (Cloning Vectors: A Laboratory Manual, 1985 Suppl. 1987).
Эукариотические клетки, которые содержат молекулу нуклеиновой кислоты, которая кодирует агент согласно изобретению, и in vivo экспрессируют белок, кодируемый такой молекулой нуклеиновой кислоты, также являются существенным признаком изобретения.
Кроме того, эукариотическими клетками согласно изобретению могут быть клетки, которые являются частью клеточного трансплантата, трансплантата ткани или органа. Такие трансплантаты могут содержать либо первичные клетки, взятые из организма донора, или клетки, которые были культивированы, модифицированы и/или прошли селекцию in vitro до трансплантации в организм, реципиента, например, линии эукариотических клеток, включая стволовые клетки или клетки-предшественники. Так как после трансплантации в организме реципиента может иметь место пролиферация клеток, потомство такой клетки также рассматривается в рамках изобретения. Клетка, являющаяся частью клеточного трансплантата, трансплантата ткани или органа, может быть трансфицирована нуклеиновой кислотой, кодирующей мутантный полипептид IL-15, и затем трансплантирована в организм реципиента, где происходит экспрессия мутантного полипептида IL-15. Кроме того, такая клетка может содержать одну или несколько дополнительных конструкций нуклеиновых кислот, позволяющих применять процедуры селекции, например, специфичных линий дифференцировки клеток или типов клеток перед трансплантацией в организм реципиента.
Экспрессированные полипептиды можно очистить из экспрессирующей системы с использованием стандартных биохимических способов, и можно использовать в качестве диагностических средств или в качестве терапевтических агентов, как описано ниже (терапевтические композиции согласно изобретению можно понимать как фармацевтические препараты). Следовательно, существенным признаком изобретения также является способ получения терапевтической композиции, содержащей мутантный полипептид IL-15, который связывает субъединицу IL-15R, и полипептид, который связывает молекулу В7. Способ можно осуществить, например, посредством (а) очистки мутантного полипептида IL-15 из экспрессирующей системы; (b) очистки полипептида, который связывает В7, из экспрессирующей системы; и (c) объединением полипептида IL-15 и полипептида, который связывает В7. Терапевтическую композицию можно приготовить (как здесь описано и способами, известными специалистам в данной области) для того, чтобы лечить пациентов, имеющих любое описанное здесь иммунное заболевание (например, любое аутоиммунное заболевание).
Агенты, мишенью которых является IL-15R, пригодны для диагностирования
Агенты, мишенью которых является IL-15R, можно использовать для определения того, имеется ли у пациента заболевание (например, иммунное заболевание, в частности аутоиммунная болезнь), которое поддается лечению комбинацией описанных здесь агентов. Способ диагностики можно, например, осуществить, получая образец ткани от пациента, у которого предполагается наличие иммунного заболевания, в частности аутоиммунной болезни, или злокачественной опухоли, которую обнаруживают в виде злокачественных иммунных клеток, и подвергая данную ткань воздействию меченного антигеном полипептида, мишенью которого является IL-15R. Образец может представлять собой любой биологический образец, такой как образец крови, мочи, сыворотки или плазмы. Кроме того, образец может представлять собой образец ткани (например, ткани биопсии), или выпот, полученный из сустава (например, синовиальная жидкость), из брюшной полости (например, асцитная жидкость), из грудной клетки (например, плевральная жидкость) или из центральной нервной системы (например, спинномозговая жидкость). Образец также может состоять из культивируемых клеток, которые исходно были получены от пациента (например, мононуклеарные клетки периферической крови). Образец можно получить из организма млекопитающего, такого как пациент - человек. Если образец содержит клетки, которые связаны с агентом, воздействию которого их подвергали, то с высокой вероятностью они будут связываться с таким агентом (например, агентом, мишенью которого является IL-15R) in vivo, и таким образом, in vivo можно ингибировать их пролиферацию или разрушать их. Имеющиеся симптомы пациентов-кандидатов для такого тестирования и соответствующие ткани, которые необходимо исследовать в случае данного конкретного набора симптомов, хорошо известны специалисту в данной области.
Пациенты, подлежащие лечению
Комбинации агентов согласно изобретению можно использовать для лечения пациентов, которые страдают иммунным заболеванием, в частности аутоиммунным заболеванием, включая, но не ограничивая этим, следующие болезни: (1) ревматическое заболевание, такое как ревматоидный артрит, системная красная волчанка, синдром Шегрена, склеродермия, смешанное заболевание соединительной ткани, дерматомиозит, полимиозит, синдром Рейтера или болезнь Бекета; (2) диабет типа I или типа II; (3) аутоиммунное заболевание щитовидной железы, такое как тиреоидит Хашимото или болезнь Грейвса; (4) аутоиммунное заболевание центральной нервной системы, такое как множественный склероз, миастения беременных или энцефаломиелит; (5) различные формы пемфигуса, такие как пемфигус обыкновенный, пемфигус вегетирующий, пемфигус листовидный, синдром Синеара-Ушера или бразильский пемфигус, (6) заболевания кожи, такие как псориаз или нейродерматит, и (7) воспалительное заболевание кишечника (например, язвенный колит или болезнь Крона). Комбинации агентов согласно изобретению также можно использовать для лечения синдрома приобретенного иммунодефицита (СПИД). Подобным образом, способы, посредством которых вводят указанные агенты, можно использовать для лечения пациента, который получил трансплантат синтетического или биологического материала, или их комбинацию. Такие трансплантаты могут быть трансплантатами органов, тканей или клеток, или синтетическими трансплантатами, засеваемыми клетками, например синтетическими сосудистыми трансплантатами, засеваемыми клетками сосудов. Кроме того, такой способ полезен пациентам с повреждением сосудов.
Так как изобретение включает в себя введение формы агента, истощающего популяцию клеток-мишеней, мишенью которого является IL-15R, можно избирательно убивать аутореактивные или "разрушающие трансплантат" иммунные клетки без массивного уничтожения нормальных Т-клеток. Следовательно, существенным признаком изобретения является способ уничтожения клеток, которые экспрессируют IL-15R in vivo, которые включают активированные или аутореактивные или "разрушающие трансплантат" иммунные клетки или злокачественные клетки. Указанные способы можно выполнить введением пациенту комбинации агентов, которая включает в себя агент, мишенью которого является IL-15R и который активирует систему комплемента, лизирует клетки посредством механизма ADCC или другим образом убивает клетки, экспрессирующие рецепторный комплекс IL-15 дикого типа. Указанный способ можно использовать для лечения пациентов с IL-15R+-лейкозом, лимфомой или другими злокачественными заболеваниями IL-15R+, такими как рак толстого кишечника.
Композиции для применения и пути введения
Способы согласно данному изобретению и терапевтические композиции, используемые для их осуществления, включают в себя "в значительной степени очищенные" агенты. Например, в том случае, когда агентом является полипептид, полипептид, по меньшей мере, на 60% по массе (масса сухого вещества) состоит из представляющего интерес полипептида, например полипептида, который связывается и разрушает клетки, несущие IL-15R. Предпочтительно агенты (например, полипептиды), по меньшей мере, на 75%, более предпочтительно, по меньшей мере, на 90% и наиболее предпочтительно, по меньшей мере, на 99% по массе состоят из представляющего интерес агента. Чистоту можно измерить любым подходящим стандартным способом, например хроматографией на колонке, электрофорезом в полиакриламидном геле или анализом ВЭЖХ.
Хотя агенты, применимые в способах согласно данному изобретению, можно получить из источников природного происхождения, их также можно синтезировать или произвести другим способом (например, агенты, которые связывают и разрушают клетки, несущие IL-15R, можно получить в результате экспрессии рекомбинантной молекулы нуклеиновой кислоты). Полипептиды, которые получают из эукариотических организмов или синтезируют в E.coli или других прокариотах, или полипептиды, которые синтезируют химическим способом, будут в значительной степени освобождены от компонентов, связанных с ними в естественных условиях. В том случае, когда полипептид является химерой, он может кодироваться гибридной молекулой нуклеиновой кислоты, содержащей одну последовательность, которая кодирует весь или часть агента (например, последовательность, кодирующая мутантный полипептид IL-15, и последовательность, кодирующая Fc-область IgG). Агенты согласно изобретению (например, полипептиды) можно сливать с меткой гексагистидина, чтобы облегчить очистку экспрессированного в бактериях белка, или с гемагглютининовой меткой, чтобы облегчить очистку белка, экспрессированного в эукариотических клетках.
Способы, которые необходимы для получения агентов согласно изобретению, являются стандартными в данной области, и специалист в данной области может их выполнить, не прибегая к чрезмерному экспериментированию. Например, мутацию, которая заключается в замене одного или нескольких аминокислотных остатков в IL-15, можно создать, используя технологию мутагенеза с помощью ПЦР, описанную здесь для создания мутанта полипептида IL-15, в котором остаток глутамина в положениях 149 и 156 заменяли на остатки аспарагиновой кислоты. Мутации, которые состоят из делеций или присоединений аминокислотных остатков (к полипептиду IL-15 или к любым другим описанным здесь пригодным полипептидам, например полипептидам, которые ингибируют костимуляцию, или которые связывают активированные Т-клетки), можно также осуществить стандартными рекомбинантными способами. При терапевтических применениях агенты согласно изобретению можно вводить с физиологически приемлемым носителем, таким как физиологический раствор соли. Терапевтические композиции согласно изобретению также могут содержать носитель или наполнитель, многие из которых известны специалисту в данной области. Наполнители, которые можно использовать, включают буферы (например, цитратный буфер, фосфатный буфер, ацетатный буфер и бикарбонатный буфер), аминокислоты, мочевину, спирты, аскорбиновую кислоту, фосфолипиды, белки (например, сывороточный альбумин), EDTA, хлорид натрия, липосомы, маннит, сорбит и глицерин. Агенты согласно изобретению можно приготовить в композиции различными способами согласно соответствующему пути введения. Например, для приема вовнутрь или инъекции можно приготовить жидкие растворы; гели или порошки можно приготовить для приема вовнутрь, ингаляции или местного применения. Способы получения таких композиций хорошо известны, и их можно найти, например, в "Remington's Pharmaceutical Sciences".
Пути введения также хорошо известны опытным фармакологам и практикующим врачам и включают внутрибрюшинное, внутримышечное, подкожное и внутривенное введение. Дополнительные пути включают интракраниальное (например, внутрицистерновое или внутрижелудочковое), внутриглазничное, глазное, внутрикапсулярное, интраспинальное, внутрибрюшинное, через слизистую оболочку, местное, подкожное и пероральное введение. Предполагается, что предпочтительными будут являться внутривенный или внутриартериальный пути для введения агентов, мишенью которых является рецептор IL-15. Часто также можно использовать подкожный путь, так как подкожная ткань обеспечивает стабильную окружающую среду для полипептидов, из которой они могут медленно высвобождаться.
В случае основанной на клетках терапии (генотерапии) клетки/ткани/органы можно перед трансплантацией трансфицировать композицией нуклеиновой кислоты посредством инкубации, инфузии или перфузии, так, чтобы терапевтический белок экспрессировался и затем высвобождался трансплантированными клетками/тканями/органами в организме реципиента. А также клетки/ткани/органы можно подвергать предварительной обработке посредством перфузии или простой инкубации с терапевтическим белком перед трансплантацией, для того, чтобы удалить связанные с трансплантатом иммунные клетки, прилипшие к клеткам/тканям/органам донора (хотя это только побочный аспект, который возможно не будет иметь какой-либо клинической значимости). В случае клеточных трансплантатов клетки можно вводить либо способом имплантации, либо способом инъекции с помощью катетера через стенку кровеносного сосуда. В некоторых случаях клетки можно вводить высвобождением в сосудистую систему, из которой они затем распределяются потоком крови и/или мигрируют в окружающую ткань (это осуществляют при трансплантации островковых клеток, когда островковые клетки высвобождаются в воротную вену и затем мигрируют в ткань печени).
В области медицины хорошо известно, что дозы для какого-либо пациента зависят от многих факторов, включая общее состояние здоровья, пол, массу, площадь поверхности тела и возраст пациента, а также конкретного соединения, которое необходимо ввести, времени и пути введения и других лекарственных препаратов, вводимых одновременно. Дозы полипептида согласно изобретению будут варьировать, но при введении внутривенно могут даваться в дозах порядка от 1 микрограмма до 10 мг/кг массы тела или порядка от 0,01 мг/л до 100 мг/л объема крови. Дозу при необходимости можно вводить один или несколько раз в день, и лечение может продолжаться в течение длительных периодов времени. Определение соответствующей дозы для данного применения не составляет проблем для квалифицированного специалиста в данной области.
ПРИМЕРЫ
Реагенты
Для описанных здесь исследований использовали следующие реагенты: рекомбинантный IL-2 человека получали от Hoffman-La Roche (Nutley, NJ); рапамицин получали от Wyeth-Ayerst (Princeton, NJ); циклоспорин-А (CsA) получали от Sandoz (East Hanover, NJ); RPMI-1640 и фетальную сыворотку теленка (FCS) получали от BioWittaker (Walkersville, MD); пенициллин, стрептомицин, G418 и стрептавидин-RED670 получали от Gibco-BRL (Gaithersburg, MD); дексаметазон, ФГА, лизоцим, Nonidet P-40, NaCl, HEPES и PMSF получали от Sigma (St. Louis, MO); фикол-гипак получали от Pharmacia Biotech (Uppsala, Sweden); рекомбинантный IL-15 человека и Ат против IL-15 человека получали от PeproTech (Rocky Hill, NJ); анти-FLAG-Ат и анти-FLAG-аффинные шарики получали от International Biotechnologies, Inc. (Kodak, New Haven, CT); pRcCMV получали от InVitrogen Corporation (San Diego, CA); генистеин получали от ICN Biomedicals (Irvine, CA); дисукцинимидилсуберат (DSS) получали от Pierce (Rockford, IL); эндонуклеазы рестрикции получали от New England Biolabs (Beverly, MA); [3H]TdR получали от New England Nuclear (Boston, MA); и конъюгированные с флуоресцентным красителем антитела CD25-PE3, CD14-PE, CD16-PE, CD122-PE, CD4-ФИТЦ, CD8-ФИТЦ, IgG1-PE или IgG1-ФИТЦ получали от Beckton/Dickinson (San Jose, CA). FLAG-пептид синтезировали на оборудовании для синтеза пептидов в Harvard Medical School.
Получение гибридного белка FLAG-HMK-IL-15
Чтобы исследовать характер экспрессии рецептора IL-15 человека в клетках, сконструировали плазмиду, которую можно использовать для экспрессии гибридного белка IL-15. Плазмида кодирует полипептид IL-15, имеющий N-конец, ковалентно связанный с последовательностью FLAG-HMK из 18 аминокислот (FLAG-HMK-IL-15). FLAG-последовательности узнаются биотинилированными высоко специфичными анти-FLAG-антителами (Blanar et al., Science 256: 1014, 1992); LeClair et al., Proc. Natl. Acad. Sci. USA 89: 8145, 1992), тогда как последовательности HMK (сайт узнавания киназы сердечной мышцы) позволяют вводить в молекулу радиоактивную метку [32P] (Blanar et al., выше, LeClair et al., выше).
Для конструирования плазмиды FLAG-HMK-IL-15 фрагмент кДНК размером 322 п.н., кодирующий зрелый белок IL-15, амплифицировали посредством ПЦР, используя синтетические олигонуклеотиды [смысловой 5'-GGAATTCAACTGGGTGAATGTAATA-3' (SEQ ID NO:5; сайт EcoRI (подчеркнут) плюс основания 145-162); антисмысловой 5'-CGGGATCCTCAAGAAGTGTTGATGAA-3' (SEQ ID NO:5; сайт BamHI [подчеркнут] плюс основания 472-489)]. ДНК-матрицу получали из активированных ФГА PBMC человека. Продукт ПЦР очищали, расщепляли EcoRI и BamHI и клонировали в плазмиде pAR(DRI)59/60, расщепленной EcoRI-BamHI, как описано (Blanar et al., Science 256: 1014, 1992; LeClair et al., Proc. Natl. Acad. Sci. USA 89: 8145, 1992). Основная часть плазмиды pAR(DRI)59/60 содержит в рамке последовательности, кодирующие последовательности пептидов для узнавания FLAG и HMK (Blanar et al, Science 256: 1014, 1992; LeClair et al., Proc. Natl. Acad. Sci. USA 89: 8145, 1992).
Экспрессия и очистка гибридного белка FLAG-HMK-IL-15
Гибридную конструкцию FLAG-HMK-IL-15, родственную IL-15, экспрессировали в штамме BL-21 E.coli и аффинно очищали с помощью шариков, покрытых анти-FLAG, как описано (Blanar et al., Science 256: 1014, 1992; LeClair et al. Proc. Natl. Acad. Sci. USA 89: 8145, 1992). Гибридный белок элюировали с аффинных колонок после тщательной промывки 0,1 М глицином (pH 3,0). Элюат, содержащий FLAG-HMK-IL-15, диализовали против буфера, содержащего 50 мМ Трис (pH 7,4) и 0,1 М NaCl, в течение 18 часов при 4°C, фильтровали через мембрану с диаметром пор 0,2 мкм и хранили при -20°C.
FLAG-HMK-IL-15 связывает субъединицу IL-15Rα
Очищенный гибридный белок FLAG-HMK-IL-15 тестировали для того, чтобы определить, взаимодействует ли он с рецепторами IL-15 на поверхности клеток. Как описано выше, [32P]-FLAG-HMK-IL-15 добавляли к культурам PBMC, которые активировали митогеном ФГА. Для того чтобы связать взаимодействующие белки друг с другом, постоянно добавляли химический перекрестно сшивающий агент дисукцинимидилсуберат (DSS). Клетки промывали, лизировали, центрифугировали и растворимые в детергенте белки разделяли в SDS-ПААГ. Авторадиография разделенных в SDS-ПААГ белков выявила единственную полосу в области 75-80 кДа, соответствующую суммарной молекулярной массе FLAG-HMK-IL-15 (15 кДа) и субъединицы IL-15Rα человека (60-65 кДа). Идентичность указанной полосы субъединице IL-15Rα подтверждали экспериментами по перекрестному сшиванию, выполненными в присутствии молярного избытка hIL-15. В данных условиях авторы не могли обнаружить радиоактивно меченую полосу с М.м. 15 кДа. Таким образом, конформация гибридных белков [32P]-FLAG-HMK-IL-15 дает возможность для сайт-специфичного связывания с субъединицей IL-15Rα с М.м. 60-65 кДа, экспрессируемой на поверхности активированных митогеном PBMC.
FLAG-HMK-IL-15 является биологически активным фактором роста, который требует экспрессии IL-2Rβ
В следующей серии экспериментов гибридный белок FLAG-HMK-IL-15 тестировали для того, чтобы определить, может ли он функционировать в качестве биологически активного фактора роста. Активированные ФГА PBMC человека пролиферируют в ответ либо на FLAG-HMK-IL-15, либо на рекомбинантный IL-2 человека, что определяли посредством анализа включения [3H]-TdR. Пептид FLAG в отсутствие последовательности IL-15 не стимулирует пролиферацию клеток. Как и IL-2, гибридный белок FLAG-HMK-IL-15 стимулирует пролиферацию трансфектантов клеток IL-2Rγ+BAF-BO3, которые экспрессируют субъединицу IL-2Rβ. Однако гибридный белок FLAG-HMK-IL-15 не стимулирует пролиферацию родительских клеток BAF-BО3, которые были трансфицированы вектором, в котором отсутствуют последовательности цепи IL-2Rβ. Таким образом, FLAG-HMK-IL-15 является биологически активным фактором роста, который требует экспрессии цепей IL-2Rβ на клетках-мишенях для того, чтобы стимулировать клеточную пролиферацию.
Активированные митогеном, но не покоящиеся PBMC экспрессируют субъединицу IL-15Rα
Гибридный белок FLAG-HMK-IL-15, биотинилированное анти-FLAG-антитело и стрептавидин-RED670 использовали для того, чтобы выявить экспрессию сайтов связывания IL-15 на PBMC человека посредством цитофлуорометрического анализа. Тестированные PBMC были либо свежевыделенными, либо активированными ФГА. Указанные клетки промывали и инкубировали либо только в среде, либо с FLAG-HMK-IL-15, после чего с биотинилированными анти-FLAG-Ат и стрептавидином-RED670. Окрашенные клетки анализировали проточной цитометрией. PBMC, которые были активированы ФГА, экспрессировали белки IL-15Rα, а покоящиеся PBMC не экспрессировали. В соответствии с результатом описанных выше экспериментов по перекрестному сшиванию связывание FLAG-HMK-IL-15 с активированными ФГА PBMC блокируется молярным избытком rIL-15, свидетельствуя, таким образом, о специфичности связывания FLAG-HMK-IL-15 с сайтами связывания IL-15. Цепи IL-15Rα экспрессируют как активированные клетки CD4+, так и клетки CD8+. Индуцируемые при активации цепи IL-15Rα также выявляли на клетках CD14+(моноциты/макрофаги) и клетках CD16+(природные киллеры).
Субъединицы IL-2Rα и IL-2Rβ не требуются для связывания IL-15
FACS-анализ активированных ФГА PBMC, окрашенных белками FLAG-HMK-IL-15 и анти-CD25 Мат против субъединицы IL-2Rα, выявляет популяции клеток, экспрессирующих как IL-15Rα-, так и IL-2Rα-субъединицы, а также популяции клеток, которые экспрессируют одну из двух субъединиц, но не экспрессируют обе субъединицы. Имеются клетки IL-2Rα+, которые не связывают FLAG-HMK-IL-15. Почти все PBMC, которые были стимулированы ФГА в течение только одного дня, экспрессируют либо цепи IL-15Rα, либо цепи IL-2Rβ, но не экспрессируют оба белка. Напротив, через 3 дня после стимуляции ФГА отмечали намного большую популяцию клеток IL-15Rα+, IL-2Rβ+(дважды позитивных) и намного меньшую популяцию клеток IL-15Rα+, IL-2Rβ- (позитивных по одному маркеру). Интересно, что имеются клетки IL-2Rβ+, которые не связываются с IL-15. Таким образом, экспрессия цепей IL-2Rβ не достаточна для связывания IL-15.
Вместе взятые полученные данные свидетельствуют о том, что IL-15 может связываться с клетками IL-15Rα+, IL-2Rα- и IL-2Rβ-. Сходное заключение было сделано в ходе экспериментов, в которых исследовали взаимодействие IL-15 с клетками IL-2Rα-, β-, трансфицированными субъединицей IL-15Rα (Anderson et al., J. Biol. Chem. 270: 29862, 1995; Giri et al., EMBO J. 14: 3654, 1995). Кроме требования экспрессии субъединицы IL-15Rα, требуются субъединицы IL-2Rβ и IL-2Rγ для придания клеткам чувствительности к инициируемому IL-15 росту.
В заключение, представленные выше эксперименты показали, что: (i) субъединицы IL-15Rα быстро экспрессируются активированными макрофагами, Т-клетками и клетками NK и (ii) индукция субъединицы IL-15Rα блокируется дексаметазоном, но не CsA или рапамицином. Кроме того, эксперименты подтвердили, что субъединица IL-15Rα необходима и достаточна для связывания IL-15 и что гибридный белок FLAG-HMK-IL-15 является исключительно полезным средством для исследования рецепторов IL-15.
Набор фосфорилированных по тирозину белков, индуцированных IL-2, является таким же, как набор белков, индуцированных IL-15
Субъединица IL-2Rβ является необходимой для сигнальной трансдукции как IL-2, так и IL-15
Снижение жизнеспособности активированных Т-клеток и тем самым истощение популяции активированных Т-клеток дает способ снижения продукции лимфокинов и митогенов, которые способствуют ускоренному развитию атеросклероза, отторжения аллотрансплантата, некоторых лейкозов и других иммунологически опосредованных патологий. Кроме того, блокирование пути сигнальной трансдукции, активированной IL-15, также предоставляет способ снижения продукции лимфокинов и митогенов, которые способствуют ускоренному развитию атеросклероза, отторжения аллотрансплантата, некоторых лейкозов и других иммунологически опосредованных патологий. Когда Т-клетки активированы, они пролиферируют и экспрессируют на своей поверхности рецепторы интерлейкинов. Кроме того, активированные Т-клетки высвобождают, по меньшей мере, 3 лимфокина: гамма-интерферон, фактор дифференцировки В-клеток II и IL-3. Указанные лимфокины могут приводить к различным нежелательным событиям, таким как отторжение аллотрансплантата. Напротив, покоящиеся Т-клетки и Т-клетки долговременной памяти не экспрессируют рецепторы лимфокинов. Такое различие в экспрессии рецепторов дает средства для целенаправленного воздействия на активированные иммунные клетки, без воздействия на покоящиеся клетки. Молекулы, сконструированные для узнавания какой-либо субъединицы IL-15R, будут узнавать активированные моноциты/макрофаги, а также активированные Т-клетки, и их можно использовать для избирательного ингибирования или разрушения указанных клеток. Производные IL-15, которые связываются с субъединицей IL-15R, но у которых отсутствует активность IL-15, поскольку они либо блокируют связывание и/либо накопление настоящего IL-15, применимы в способе изобретения. Описанная ниже мутантная молекула IL-15 представляет рабочий пример такого производного.
Мутантный полипептид IL-15, мишенью которого является IL-15R
Генетическая конструкция мутантного IL-15
Белок IL-15 человека, несущий двойную мутацию (Q149D; Q156D), конструировали для того, чтобы целенаправленно воздействовать на предполагаемые сайты, важные для связывания с субъединицей IL-2Rγ. Осуществляли мутацию полярных, но незаряженных остатков глутамина в положениях 149 и 156 в кислые остатки аспарагиновой кислоты с помощью мутагенеза с применением ПЦР. кДНК, кодирующую двойной мутант IL-15, амплифицировали в ПЦР, используя синтетический смысловой олигонуклеотид [5'-GGAATTCAACTGGGTGAATGTAATA-3' сайт EcoRI (подчеркнутый гексамер) плюс основания 145-162] и синтетический антисмысловой олигонуклеотид (5'-CGGGATCCTC-AAGAAGTGTTGATGAACATGTCGACAATATGTACAAAACTGTCCAAAAAT-3'; сайт BamHI (подчеркнутый гексамер) плюс основания 438-489; мутантные основания отдельно подчеркнуты]. Матрицей была плазмида, содержащая кДНК, которая кодирует FLAG-HMK-IL-15 человека. Амплифицированный фрагмент расщепляли EcoRI/BamHI и клонировали в плазмиде pAR(DRI)59/60, расщепленной EcoRI/BamHI, как описано (LeClair et al., Proc. Natl. Acad. Sci. USA 89: 8145, 1989). Наличие мутации в остатке 156 подтверждали расщеплением SalI; мутация вводит новый сайт рестрикции SalI. Кроме того, мутации подтверждали секвенированием ДНК согласно стандартному способу. Белок FLAG-HMK-IL-15 с двойной мутацией (Q149D; Q156D) получали, очищали и подтверждали секвенированием, как описано выше, для белка FLAG-HMK-IL-15 дикого типа.
Используя ту же самую стратегию, получили мутанты, которые содержат единственную аминокислотную замену либо в положении 149, либо в положении 156. Как описано выше, указанные положения (149 и 156) соответствуют положениям 101 и 108 соответственно в зрелом полипептиде IL-15, в котором отсутствует сигнальная последовательность из 48 аминокислот.
Подобным образом указанную стратегию использовали для того, чтобы включить любую другую аминокислоту вместо остатков глутамина в положениях 149 или 156, или чтобы ввести аминокислотные замены в положения, отличные от положения 149 и/или 156.
Пролиферация клеток BAF-BO3 в присутствии белков, родственных IL-15
Двойной мутантный полипептид IL-15 может ингибировать пролиферацию BAF-BO3 дозо-зависимым образом: добавление 30 мкл (примерно 50 мкг/мл) двойного мутанта IL-15 ингибировало пролиферацию более полно, чем добавление 20 мкл двойного мутанта IL-15 такой же концентрации.
Пролиферация PBMC человека, стимулированных ФГА
Способность двойного мутантного полипептида FLAG-HMK-IL-15 связывать активированные ФГА PBMC человека показали следующим образом. Активированные ФГА PBMC промывали и инкубировали только в среде или в присутствии двойного мутанта FLAG-HMK-IL-15. Затем клетки инкубировали с биотинилированным анти-FLAG-антителом и красили стрептавидином, конъюгированным с RED670. Окрашенные клетки анализировали проточной цитометрией.
FACS-анализ линий лейкозных клеток, окрашенных с помощью FLAG-HMK-IL-15 дикого типа
В серии экспериментов, подобных описанным выше, показали способность полипептида FLAG-HMK-IL-15 дикого типа связываться с лейкозными клетками. Обработанные клетки получали из линий лейкозных клеток MOLT-14, YT, HuT-102 и из линий клеток, которые в настоящее время созданы в Beth Israel Hospital (Boston, MA) и названы 2A и 2B. Культивируемые клетки промывали и инкубировали либо только в среде, либо в среде, содержащей полипептид FLAG-HMK-IL-15 дикого типа. Затем клетки инкубировали с биотинилированным анти-FLAG-антителом и красили стрептавидином, конъюгированным с RED670. Окрашенные клетки анализировали проточной цитометрией.
Генетическая конструкция дополнительных мутантных химерных полипептидов IL-15
Кроме химеры FLAG-HMK-IL-15, в которой мутантный IL-15 снабжен антигенной меткой, с любым мутантом IL-15 можно связать множество других полипептидов. Например, мутантный IL-15 можно связать с Fc-фрагментом антител подкласса IgG в соответствии со следующим способом.
Генетическая конструкция мутантного IL-15/Fc
кДНК Fcγ2a можно получить на основе мРНК, экстрагированной из гибридомы, секретирующей IgG2a, используя стандартный способ с применением обратной транскриптазы (MMLV-RT; Gibco-BRL, Grand Island, NY) и синтетического олигонуклеотида олиго-dT (12-18) (Gibco BRL). кДНК мутантного IL-15 можно амплифицировать на плазмидной матрице в ПЦР, используя синтетические олигонуклеотиды, специфичные для IL-15.
Конструируют 5'-олигонуклеотид, чтобы встроить уникальный сайт рестрикции NotI на расстоянии 40 нуклеотидов с 5'-стороны от стартового кодона трансляции, тогда как 3'-олигонуклеотид удаляет кодон терминации и изменяет использование кодона для С-концевого остатка Ser с AGC на TCG, чтобы обеспечить создание уникального сайта BamHI в месте соединения мутантного IL-15/Fc. Синтетические олигонуклеотиды, используемые для амплификации кДНК домена Fcγ2a, изменяют первый кодон шарнира с Glu на Asp для того, чтобы создать уникальный сайт BamHI, охватывающий первый кодон шарнира, и вводят уникальный сайт XbaI с 3'-стороны от кодона терминации. Fc-фрагмент можно модифицировать так, чтобы он не истощал популяцию клеток-мишеней, т.е. был не способен активировать систему комплемента. Чтобы создать конструкцию мутантного IL-15, которая не истощает популяцию клеток-мишеней (mIL-15/Fc), используют сайт-специфичный мутагенез с применением олигонуклеотидов, чтобы заменить Glu 318, Lys 320, Lys 322 мотива, связывающего С'1q, остатками Ala. Подобным образом, Leu 235 заменяют Glu, чтобы инактивировать сайт связывания FcγRI. Лигирование компонентов цитокина и Fc в правильной трансляционной рамке считывания в уникальном сайте BamHI дает открытую рамку считывания длиной 1236 пар оснований, кодирующую один полипептид из 411 аминокислот (включая сигнальный пептид IL-15 из 18 аминокислот), в котором всего 13 остатков цистеина. Рассчитано, что зрелый секретируемый гомодимер IL-15/Fc имеет всего до восьми внутримолекулярных дисульфидных связи и три дисульфидных связи между тяжелыми цепями и молекулярную массу, примерно равную 85 кДа, не включая гликозилирование.
Экспрессия и очистка гибридных белков mIL-15/Fc
Правильную генетическую конструкцию mIL-15/Fc можно подтвердить анализом последовательности ДНК после клонирования гибридного гена в виде кассеты NotI-XbaI в эукариотической экспрессирующей плазмиде pRc/CMV (Invitrogen, San Diego, CA). Указанная плазмида несет промотор/энхансер CMV, сигнал полиаденилирования гормона роста быка и ген устойчивости к неомицину для селекции с помощью G418. Плазмидами, несущими гибридный ген mIL-15/Fc, трансфицируют клетки яичника китайского хомячка (CHO-K1, доступные для приобретения из Американской коллекции типов культур) путем электропорации (1,5 кВ/3 мкФ/0,4 см/PBS) и проводят селекцию в бессывороточной среде Ultra-CHO (BioWhittaker Inc., Walkerville, MD), содержащей 1,5 мг/мл G418 (Geneticin, Gibco BRL). После субклонирования клоны, которые на высоком уровне продуцируют гибридный белок, отбирают посредством скрининга надосадков в отношении IL-15 в ELISA (PharMingen, San Diego, CA). Гибридные белки mIL-15/Fc очищают из надосадков культур аффинной хроматографией на белок А-сефарозе, после чего диализуют против PBS и стерилизуют, используя 0,22 мкм-фильтр. Очищенные белки можно хранить при -20°C до применения.
Вестерн-блот-анализ после SDS-ПААГ в восстанавливающих (с ДТТ) и невосстанавливающих (без ДТТ) условиях можно осуществить, используя моноклональные или поликлональные анти-mIL-15 или анти-Fcγ первичные антитела, чтобы оценить размер и изотипическую специфичность гибридных белков. Функциональную активность мутантного IL-15/Fc можно оценить стандартным анализом пролиферации Т-клеток, как описано выше.
Введение mIL-15 и CTLA4/Ig
Следующая работа демонстрирует, что жизнеспособность аллотрансплантата поразительно повышается в том случае, когда реципиента аллотрансплантата обрабатывают агентом, мишенью которого является IL-15R, и агентом, который блокирует костимулирующий сигнал. Неочищенные аллотрансплантаты островков имплантировали мышам, у которых вызывали диабет инъекцией стрептозотоцина. Все аллотрансплантаты от доноров DBA/2J(H-2d) реципиентам B6AF1 (H-2b/d,k) постоянно приживались в том случае, когда мышей обрабатывали CTLA4/Ig и mIL-15/Fc. Постоянного приживления никогда не наблюдали у необработанных мышей или мышей, обработанных одним белком. Полностью несовпадающие по МНС аллотрансплантаты островков от Balb/c(Н2d) к C57B1/6(H2b) отторгались при среднем времени выживания, равном 15 дням у необработанных мышей, 30 дням у мышей, обработанных одним CTLA4/Ig и 30 дням у мышей, обработанных одним mIL-15Fc. В отличие от этого обработка CTLA4/Ig и mIL-15/Fc приводила к постоянной жизнеспособности трансплантата более чем у 70% обработанных мышей (смотри также фиг.3). Кроме того, наблюдали состояние стабильной толерантности к аллотрансплантату у двух реципиентов, которые не отторгали второй аллотрансплантат островков Balb/c без иммуносупрессирующей обработки. Количественный анализ ОТ-ПЦР тканей трансплантата и лимфатических узлов также выявил заметное снижение экспрессии транскриптов Т-клеточных рецепторов, а также многих генов лимфокинов после комбинированной обработки. Гистологический анализ подтвердил, что комбинированная обработка защищает трансплантат от лейкоцитарной инфильтрации.
Реферат
Изобретение относится к области иммунологии. Сущность его заключается в разработке композиций и способов достижения иммунной супрессии. Композиции содержат два основных агента: первый агент, мишенью которого является рецептор интерлейкина-15 (IL-15R), и второй агент, который ингибирует костимулирующий сигнал, передаваемый между Т-клеткой и антиген-презентирующей клеткой (АПК). Технический результат - повышение эффективности диагностики и терапии иммунных заболеваний, особенно аутоиммунных заболеваний. 5 н. и 40 з.п. ф-лы, 3 ил.

Комментарии