Полипептиды и полинуклеотиды и их применение для лечения иммунологических нарушений и рака - RU2623161C2
Код документа: RU2623161C2
Чертежи







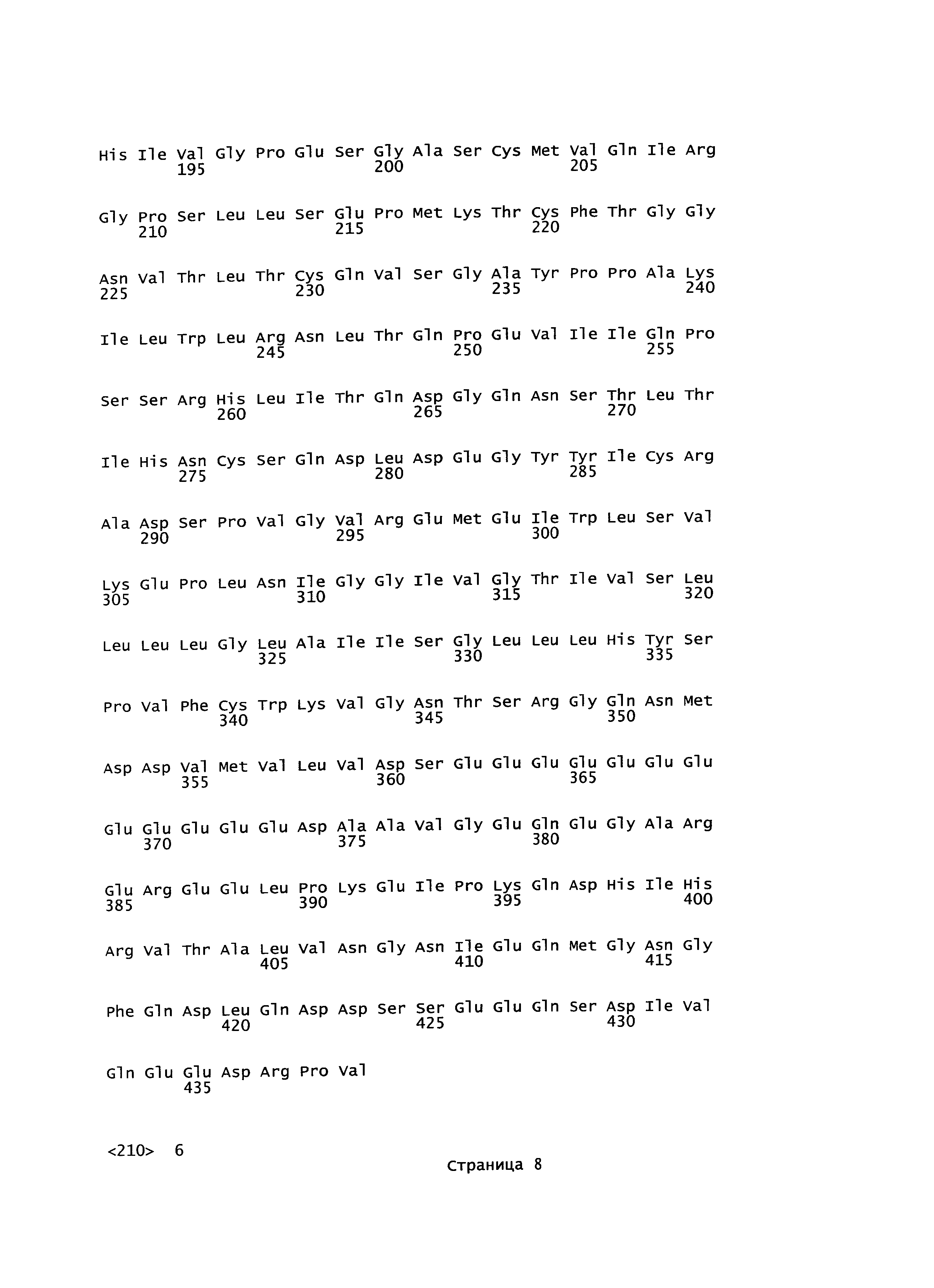



































































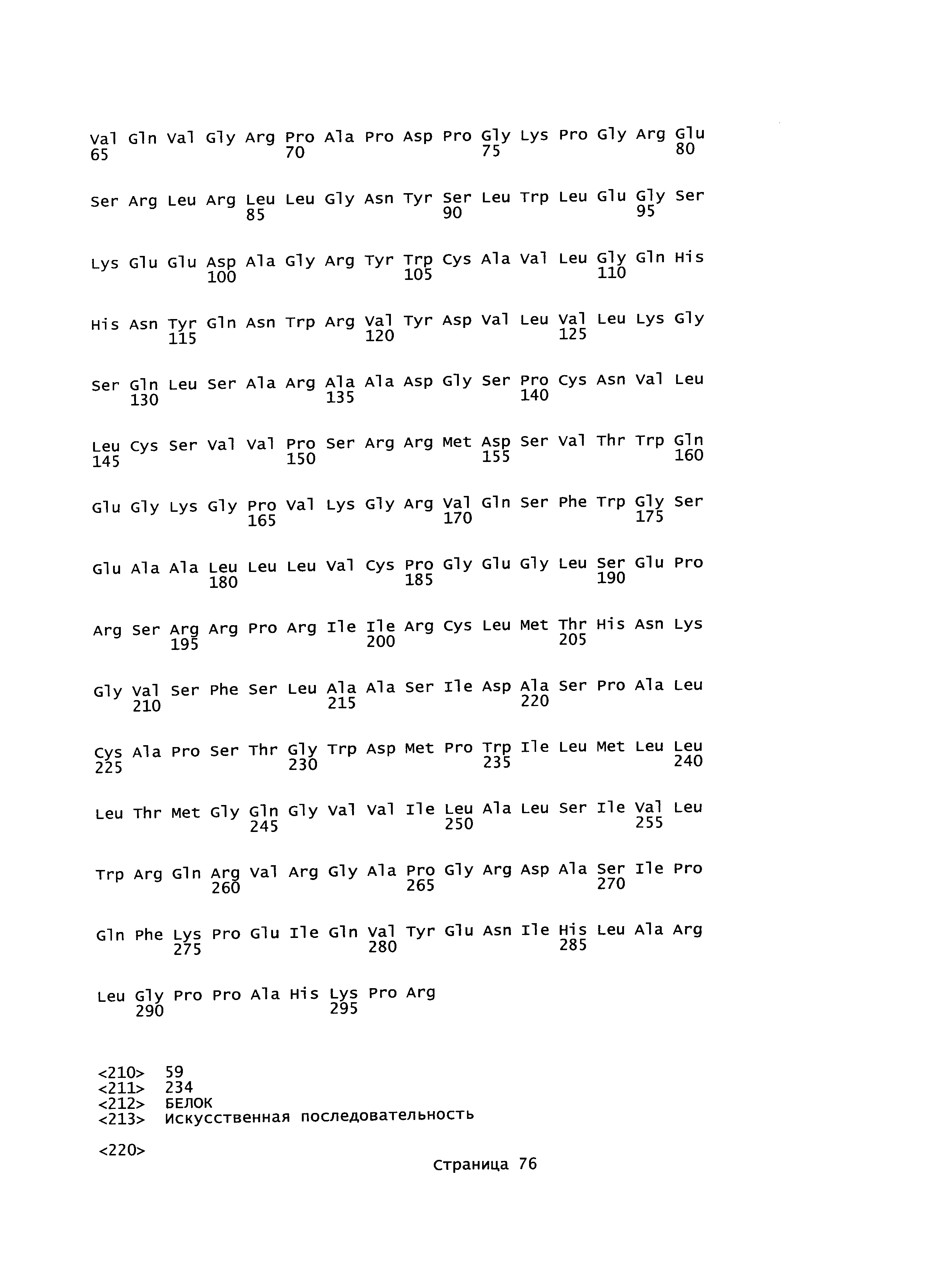






















































































































































































































































Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к белкам LY6G6F, VSIG10, ТМЕМ25 и LSR, которые являются подходящими мишенями для иммунотерапии, лечения рака, инфекционных нарушений и/или иммунологических нарушений и разработки лекарственных средств, а также к их растворимым молекулам, и конъюгатам, и антителам к ним.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Интактные Т-клетки должны получать два независимых сигнала от антиген-представляющих клеток (АРС) для того, чтобы эффективно активироваться. Первый, Сигнал 1, является антиген-специфическим и возникает, когда Т-клеточные рецепторы к антигену встречаются с соответствующим комплексом антиген-МНС на АРС. Судьбу иммунного ответа определяет второй, антиген-независимый сигнал (Сигнал 2), который передается через Т-клеточную костимулирующую молекулу, которая привлекает свой АРС-экспрессируемый лиганд. Этот второй сигнал может быть либо стимулирующим (положительная костимуляция), либо ингибирующим (отрицательная костимуляция или коингибирование). В отсутствие костимулирующего сигнала или в присутствии коингибирующего сигнала активация Т-клеток нарушается или прекращается, что может приводить к состоянию антиген-специфической нечувствительности (известному как Т-клеточная анэргия) или может приводить к апоптотической гибели Т-клеток.
Пары костимулирующих молекул обычно состоят из лигандов, экспрессируемых на АРС, и их родственных рецепторов, экспрессируемых на Т-клетках. Прототипами пар костимулирующих молекул лиганд/рецептор являются B7/CD28 и CD40/CD40L. Семейство В7 состоит из структурно родственных белковых лигандов клеточной поверхности, которые могут обеспечивать стимулирующее или ингибирующее влияние на иммунный ответ. Члены семейства B7 являются структурно родственными с внеклеточным доменом, содержащим, по меньшей мере один вариабельный или константный домен иммуноглобулина.
Как положительный, так и отрицательный костимулирующие сигналы играют чрезвычайно важную роль в регуляции клеточно-опосредованных иммунных ответов, и молекулы, которые опосредуют эти сигналы, являются, как доказано, эффективными мишенями для иммуномодуляции. На основе этих знаний разработаны определенные терапевтические подходы, которые включают нацеливание костимулирующих молекул и, как показано, являются пригодными для предупреждения и лечения рака посредством включения или предупреждения выключения иммунных ответов у больных раком пациентов и для предупреждения и лечения аутоиммунных заболеваний и воспалительных заболеваний, а также отторжения при аллогенной трансплантации, каждое - посредством выключения неконтролируемых иммунных ответов или с помощью индукции "отключающего сигнала" путем отрицательной костимуляции (или коингибирования) у субъектов с данными патологическими состояниями.
Манипулирование сигналами, передаваемыми лигандами B7, показало возможность лечения аутоиммунных реакций, воспалительных заболеваний и отторжения трансплантата. Терапевтические стратегии включают блокирование костимуляции с использованием моноклональных антител к лиганду или к рецептору из костимулирующей пары или использование растворимых слитых белков, составленных из костимулирующего рецептора, который может связывать и блокировать свой соответствующий лиганд. Другим подходом является индукция коингибирования с использованием растворимого слитого белка ингибиторного лиганда. Эти подходы зависят, по меньшей мере частично, от возможного удаления ауто- или аллореактивных Т-клеток (которые ответственны за патогенные процессы при аутоиммунных заболеваниях или трансплантации, соответственно), вероятно потому, что в отсутствие костимуляции (которая индуцирует гены выживания клеток) Т-клетки становятся чрезвычайно чувствительными к индукции апоптоза. Таким образом, новые средства, способные модулировать костимулирующие сигналы без угрозы для способности иммунной системы к защите от патогенов, являются чрезвычайно выгодными для лечения и предупреждения подобных патологических состояний.
Костимулирующие пути играют важную роль в развитии опухолей. Интересно, что опухоли, как показано, избегают иммунного повреждения, препятствуя активации Т-клеток посредством ингибирования костимулирующих факторов семейства B7-CD28 и TNF, а также привлекая регуляторные Т-клетки, которые ингибируют противоопухолевые Т-клеточные ответы (см. Wang (2006) Immune Suppression by Tumor Specific CD4+ Regulatory Т cells in Cancer. Semin. Cancer. Biol. 16:73-79; Greenwald et al. (2005) The B7 Family Revisited. Ann. Rev. Immunol. 23:515-48; Watts (2005) TNF/TNFR Family Members in Co-stimulation of Т Cell Responses Ann. Rev. Immunol. 23:23-68; Sadum et al. (2007) Immune Signatures of Murine and Human Cancers Reveal Unique Mechanisms of Tumor Escape and New Targets for Cancer Immunotherapy. Clin. Cane. Res. 13(13):4016-4025). Такие экспрессируемые опухолью костимулирующие молекулы становятся представляющими интерес биомаркерами злокачественных опухолей и могут служить в качестве опухолеспецифических антигенов (ТАА). Кроме того, костимулирующие пути идентифицированы как иммунологические контрольные точки, которые ослабляют зависимые от Т-клеток иммунные ответы одновременно на уровне инициирования и эффекторной функции в опухолевых метастазах. Поскольку разработанные противораковые вакцины продолжают совершенствоваться, становится ясно, что такие иммунологические контрольные точки являются главной преградой для способности вакцин индуцировать терапевтические противоопухолевые ответы. В связи с этим костимулирующие молекулы могут служить в качестве адъювантов для активной (вакцинации) и пассивной (антитело-опосредованной) иммунотерапии злокачественных опухолей, обеспечивая стратегии для противодействия иммунной толерантности и стимулирования иммунной системы.
Кроме того, подобные средства могут иметь применение при других типах иммунотерапии злокачественных опухолей, таких как адоптивная иммунотерапия, при которой увеличивают популяции опухолеспецифических Т-клеток и направляют для атаки и уничтожения клеток опухоли. Средства, способные увеличивать такой противоопухолевый ответ, имеют большой терапевтический потенциал и могут быть ценными в попытке преодоления препятствий противоопухолевой иммунотерапии. В последнее время новые средства, которые модулируют несколько костимулирующих путей, фактически были введены в клиническую практику в качестве иммунотерапии злокачественных опухолей.
Появляющиеся данные широкого ряда исследований острых и хронических инфекций подтверждают важную роль рецепторов отрицательной костимуляции также и в борьбе с инфекцией. CD8 Т-клетки памяти, произведенные после острой вирусной инфекции, являются высоко функциональным и составляют важный компонент защитного иммунитета. Доказано также, что модулирование костимулирующего пути является эффективным для оптимизации противовирусного иммунитета посредством ограничения ответа Т-клеток памяти в отношении защитных способностей (Teijaro et al., J Immunol. 2009: 182; 5430-5438). Это было продемонстрировано на моделях инфекции вируса гриппа, в которых ингибирование костимуляции CD28 с помощью CTLA4-Ig подавляло первичный иммунный ответ у не зараженных ранее мышей, инфицированных вирусом гриппа, но было отчетливо лечебным для вторичных ответов на вирус гриппа, опосредованных CD4 Т-клетками памяти, что приводило к улучшению клинического исхода и увеличению выживаемости при контрольном заражении вирусом гриппа.
Хронические инфекции часто характеризуются варьирующими степенями функционального нарушения вирусоспецифических T-клеточных ответов, и этот дефект является основной причиной неспособности хозяина удалить персистирующий патоген. Хотя функциональные эффекторные Т-клетки изначально производятся во время ранних стадий инфекции, они постепенно теряют функциональность в ходе хронической инфекции в результате постоянного представления чужеродного антигена, вызывая истощение Т-клеток. Истощенные Т-клетки экспрессируют высокие уровни множества коингибирующих рецепторов, таких как CTLA-4, PD-1 и LAG3 (Crawford et al., Curr. Opin. Immunol. 2009; 21:179-186; Kaufmann et al., J. Immunol. 2009; 182:5891-5897, Sharpe et al., Nat. Immunol. 2007; 8:239-245). Сверхэкспрессию PD-1 истощенными Т-клетками наблюдали в клинике у пациентов, страдающих от хронических вирусных инфекций, в том числе HIV, HCV и HBV (Crawford et al., Curr. Opin. Immunol. 2009; 21:179-186; Kaufmann et al., J. Immunol. 2009; 182:5891-5897, Sharpe et al., Nat. Immunol. 2007; 8:239-245). Было произведено некоторое исследование этого пути с дополнительными патогенами, в том числе другими вирусами, бактериями и паразитами (Hofmeyer et al., J. Biomed. Biotechnol. Vol 2011, Art. ID 451694, Bhadra et al., Proc. Natl. Acad. Sci. 2011; 108(22):9196-201). Например, путь PD-1 участвует в борьбе с бактериальной инфекцией, как показано с помощью модели сепсиса, индуцированной стандартным способом цекального дотирования и пункции. Отсутствие PD-1 у нокаутных мышей защищало от индуцированной сепсисом смерти в данной модели (Huang et al., PNAS 2009: 106; 6303-6308).
Истощение Т-клеток может быть обращено блокированием коингибирующих путей, таких как PD-1 и CTLA-4 (Rivas et al., J. Immunol. 2009; 183:4284-91; Golden-Mason et al., J. Virol. 2009; 83:9122-30; Hofmeyer et al., J. Biomed. Biotechnol. Vol 2011, Art. ID 451694), таким образом позволяя восстановиться противовирусной иммунной функции. Терапевтический потенциал блокады коингибирования для лечения вирусной инфекции интенсивно изучался при блокировании пути PD-1/PD-L1, которое, как было показано, является эффективным на нескольких животных моделях инфекции, в том числе острой и хронической инфекции вируса иммунодефицита обезьян (SIV) у макак резус (Valu et al., Nature 2009; 458:206-210) и на мышиных моделях хронической вирусной инфекции, такой как вирус лимфоцитарного хориоменингита (LCMV) (Barber et al., Nature. 2006; 439:682-7), и модель вируса мышиного энцефаломиелита Тайлера (TMEV) на мышах SJL/J (Duncan and Miller, PLoS One. 2011; 6:e18548). На этих моделях блокада PD-1/PD-L1 улучшала противовирусные ответы и способствовала очищению от оставшихся вирусов. Кроме того, блокада PD-1/PD-L1 повышала гуморальный иммунитет, проявлявшийся в повышенном производстве специфических противовирусных антител в плазме, что в комбинации с улучшенными клеточными ответами приводит к снижению в плазме вирусной нагрузки и увеличению выживаемости.
Блокирование отрицательных сигнальных путей, таких как PD-1 и CTLA-4, может восстановить иммунную систему хозяина, давая ей возможность отвечать на дальнейшую стимуляцию. Комбинация терапевтической вакцинации наряду с блокадой ингибирующих сигналов способна синергично повышать функциональные ответы CD8 Т-клеток и улучшать борьбу с вирусами индивидуумов с хронической инфекцией, предоставляя перспективную стратегию лечения хронических вирусных инфекций, таких как вирус иммунодефицита человека, вирус гепатита В и вирус гепатита С (На et al., Immunol. Rev. 2008 Jun; 223:317-33). Результаты недавнего исследования указывают, что блокирование пути PD-1 улучшает Т-клеточные ответы на вакцинацию против HBV у субъектов с инфекцией HCV и повышает возможность того, что блокирование этого пути может повысить частоту благоприятных исходов иммунизации на фоне хронической вирусной инфекции (Moorman et al., Vaccine. 2011 Apr 12; 29(17):3169-76). Антитела к PD-1 и CTLA-4 в настоящее время проходят клинические испытания при хроническом гепатите С как перспективные кандидаты для комбинации и с профилактическими, и с терапевтическими вакцинами (Diepolder and Obst, Expert. Rev. Vaccines. 2010 Mar; 9(3):243-7). Блокада PD-1 также повышает эффективность профилактической вакцинации, приводящей к увеличению эпитоп-специфических Т-клеток (Finnefrock et al., J. Immunol. 2009; 182; 980-987).
В дополнение к блокаде коингибирующих путей для лечения хронических инфекций недавние исследования с использованием моделей вирусной инфекции подчеркнули важность положительных костимулирующих сигналов во время вторичного иммунного ответа против вирусов. Костимулирующие молекулы, такие как CD28, 4-1ВВ и OХ40, также вовлечены в выживание, образование, поддержание и качество вирус-специфических CD8+ Т-клеток памяти. Передача костимулирующих сигналов может помочь усилить образование и функционирование вирус-специфических CD8+ Т-клеток памяти. Применение костимулирующих молекул в качестве адъювантов наряду с вирусными антигенами в вакцинах может способствовать образованию эффективных антиген-специфических ответов CD8+ Т-клеток памяти и может таким образом приводить к улучшению вакцин (Duttagupta et al., Crit. Rev. Immunol. 2009; 29(6):469-86).
В недавнем исследовании также оценили эффекты растворимого PD-1 (sPD-1) в качестве блокады PD-1 и PD-L1 на активированные вакциной антиген-специфические Т-клеточные ответы у мышей. Совместное введение sPD-1 с ДНК-вакциной или с вакциной на основе аденовируса увеличивало антиген-специфические ответы CD8(+) Т-клеток, указывая на независимый от типа вакцины адъювантный эффект sPD-1 (Song et al., J. Immunother. 2011 Арr; 34(3):297-306). Эти и дополнительные результаты данного исследования свидетельствуют, что стратегию иммунизации с использованием растворимого внеклеточного домена (ECD) отрицательно костимулирующего белка в качестве адъюванта можно использовать для повышения антиген-специфического Т-клеточного иммунитета, активированного вакцинацией.
В-клетки также долгое время рассматривались как имеющие ключевую роль в развитии и поддержании множества аутоиммунных заболеваний благодаря производству патогенных аутоантител, например, системная красная волчанка (SLE) и болезнь Шегрена. Однако ясно, что ряд других функций В-клеток также является крайне важным в патогенезе органоспецифических аутоиммунных заболеваний, которые ранее считались опосредованными в основном Т-клетками, например, ревматоидный артрит (RA) и сахарный диабет 1 типа (T1D) (Wong et al., 2010, Curr. Opin. Immunol. 22:723-731).
Хелперный сигнал Т-клеток В-клеткам является центральным процессом адаптивных иммунных ответов. Фолликулярные хелперные Т-клетки (Tfh) являются субпопуляцией CD4+ Т-клеток, специализирующиеся на хелперных сигналах В-клеткам (обзор Crotty, Annu. Rev. Immunol. 29:621-663, 2011). Tfh-клетки экспрессируют хемокиновый рецептор хоминга В-клеток CXCR5, который управляет миграцией Tfh-клеток в B-клеточные фолликулы лимфатических узлов CXCL13-зависимым способом. Tfh-клетки сначала взаимодействуют с родственными В-клетками на границе Т-клеток и В-клеток и в дальнейшем индуцируют дифференциацию В-клеток зародышевого центра и образование зародышевого центра в фолликуле (обзор Crotty, Annu. Rev. Immunol. 29:621-663, 2011). Необходимость в Tfh-клетках для хелперного сигнала В-клеткам и зависимого от Т-клеток образования антител указывает, что этот тип клеток чрезвычайно важен для защитного иммунитета против различных типов возбудителей инфекции, а также для рационального создания вакцин. Не является неожиданностью, что дисрегуляция и аберрантное накопление Tfh-клеток также связали с аутоиммунными заболеваниями, такими как болезнь Шегрена и аутоиммунный артрит (Yu and Vinuesa, 2010, Cell. Mol. Immunol. 7:198-203).
Tfh-клетки селективно экспрессируют множество поверхностных белков, которые участвуют в их селективной локализации (таких как CXCR5) и непосредственном физическом взаимодействии с В-клетками для подачи В-клеткам хелперного сигнала. Среди последней группы есть несколько членов семейства костимулирующих белков, которые интенсивно экспрессируются в Tfh-клетках, в том числе индуцируемый костимулирующий рецептор ICOS и отрицательные костимуляторы (ингибирующие рецепторы) PD-1 и BTLA (Crotty, Annu. Rev. Immunol. 29:621-663, 2011), таким образом, эта клеточная субпопуляция также может контролироваться путем модулирования костимулирующих и коингибирующих путей, способствующих влиянию на функцию В-клеток.
Регулирующая костимуляция с помощью агонистов и/или антагонистов различных костимулирующих белков интенсивно исследуется в качестве стратегии лечения аутоиммунных заболеваний, отторжения ткани, аллергии и рака. В этой области пионером в клинической практике стал CTLA4-Ig (абатацепт, Orencia®), который утвержден для лечения RA, мутированный CTLA4-Ig (белатацепт, Nulojix®) для предупреждения острого отторжения трансплантата почек, и антитело к CTLA4 (ипилимумаб, Yervoy®), ранее утвержденное для лечения меланомы. Другие костимулирующие регуляторы находятся в настоящее время на поздних стадиях клинической разработки, в том числе антитело к PD-1 (MDX-1106), которое находится в разработке для лечения позднего/метастатического светлоклеточного рака почки (RCC), и антитело к CD40L (BG9588, Antova®) для лечения при пересадке аллотрансплантата почки. Более того, подобные средства находятся в клинической разработке также для вирусных инфекций, например, антитело к PD-1, MDX-1106, которое испытывают для лечения гепатита С, и антитело к CTLA4, СР-675,206 (тремелимумаб), которое находятся на клинических испытаниях на пациентах, инфицированных вирусом гепатита С, с гепатоцеллюлярной карциномой; целями исследования является испытание его действия на карциному и на репликацию вируса.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет новые терапевтические и диагностические композиции, содержащие эктодомен или растворимую или секретируемую форму белков LY6G6F, VSIG10, ТМЕМ25, и/или LSR, и/или варианты и/или ортологи и/или фрагменты, и/или конъюгат, содержащий вышеуказанное, и/или последовательности нуклеиновых кислот, кодирующие вышеуказанное.
Аминокислотная последовательность известного (дикого типа) белка LY6G6F полной длины (белок G6f комплексного локуса 6 лимфоцитарного антигена, номер доступа в Genbank: NP_001003693, SEQ ID NO:1) показана на Фигуре 1А. Аминокислотная последовательность известного (дикого типа) белка VSIG10 полной длины (белок 10, содержащий V-set и домен иммуноглобулина, номер доступа в Genbank: NP_061959, SEQ ID NO:3) и аминокислотная последовательность нового варианта VSIG10 (SEQ ID NO:5) показаны на Фигуре 1B и 1C, соответственно. Выравнивание аминокислотной последовательности нового варианта VSIG10 (SEQ ID NO:5) и известного (дикого типа) белка VSIG10 (SEQ ID NO:3) показано на Фигуре 2А. Аминокислотная последовательность известного (дикого типа) белка ТМЕМ25 полной длины (трансмембранный белок 25, номер доступа в Swiss-Prot: Q86YD3, SEQ ID NO:7) показана на Фигуре 1D. Аминокислотная последовательность известного (дикого типа) белка LSR полной длины (изоформа 2 липолиз-стимулирующего липопротеинового рецептора, номер доступа Genbank: NP_991403) предоставлена в SEQ ID NO:62. Аминокислотные последовательности вариантов LSR с SEQ ID NO:11, 13, 15, 16, 17 и 18 показаны на Фигурах 1E, 1F, 1G, 1H, 1I и 1J, соответственно. Выравнивание аминокислотной последовательности вариантов LSR SEQ ID NO:11, 13, 15, 16, 17 и 18 с ранее известными последовательностями LSR (SEQ ID NO:62-67) продемонстрировано на Фигурах 2B, 2С, 2D, 2Е, 2F, 2G, соответственно.
Согласно по меньшей мере некоторым вариантам осуществления представлены выделенные полипептиды, содержащие по меньшей мере 98 аминокислот растворимого эктодомена с последовательностью, выбранной из группы, состоящей из SEQ ID NO:11, 13, 15-18, 67 и 143; по меньшей мере 62 аминокислоты растворимого эктодомена с последовательностью, выбранной из группы, состоящей из SEQ ID NO:1 и 58; по меньшей мере 36 аминокислот растворимого эктодомена с последовательностью, выбранной из группы, состоящей из SEQ ID NO:3 и 5; или по меньшей мере 46 аминокислот растворимого эктодомена с SEQ ID NO:7, или выделенный полипептид, состоящий, главным образом, из аминокислотной последовательности, изложенной в SEQ ID NO:5, или их варианты, которые обладают по меньшей мере 95% идентичности последовательности с ними; или их варианты или ортологи или фрагменты.
Выделенный полипептид необязательно содержит только от 98 до 180 аминокислот из последовательности, выбранной из группы, состоящей из SEQ ID NO:11, 13, 15-18, 67 и 143; от 62 до 228 аминокислот из последовательности, выбранной из группы, состоящей из SEQ ID NO:1 и 58; от 36 до 393 из последовательности, выбранной из группы, состоящей из SEQ ID NO:3 и 5; или от 46 до 216 аминокислот из SEQ ID NO:7.
Также необязательно выделенный полипептид выбран из группы, состоящей из полипептида, содержащего только от 98 до 118, от 135 до 155, и от 160 до 180 аминокислот из последовательности, выбранной из группы, состоящей из SEQ ID NO:11, 13, 15-18, 67 и 143; от 62 до 82, от 95 до 115, от 208 до 228 аминокислот из последовательности, выбранной из группы, состоящей из SEQ ID NO:1 и 58; от 36 до 70, от 80 до 100, от 170 до 200, от 265 до 290, от 365 до 393 аминокислот из последовательности, выбранной из группы, состоящей из SEQ ID NO:3 и 5; или от 46 до 66, от 84 до 104, от 196 до 216 аминокислот из SEQ ID NO:7.
Также необязательно выделенный полипептид содержит только приблизительно 72, 106 или 218 аминокислот из последовательности, выбранной из группы, состоящей из SEQ ID NO:1 и 58; приблизительно 108, 145 или 170 аминокислот из последовательности, выбранной из группы, состоящей из SEQ ID NO:11, 13, 15-18, 67 и 143; приблизительно 56, 94 или 206 аминокислот из SEQ ID NO:7; или приблизительно 46, 49, 58, 60, 87, 89, 93, 94, 178, 182, 185, 187, 273, 279, 282, 374 или 383 аминокислот из SEQ ID NO:3 и 5.
Также необязательно выделенный полипептид состоит, главным образом, из аминокислотной последовательности, имеющей по меньшей мере 95% идентичности последовательности с аминокислотными последовательностями, изложенными в любой из SEQ ID NO:12, 2, 4-6, 8, 14, 47-50, 10, 15-18, 22, 39, 59-61; 81-102. Необязательно и предпочтительно выделенный полипептид состоит, главным образом, из аминокислотной последовательности, изложенной в любой из SEQ ID NO:12, 2, 4-6, 8, 14, 47-50, 10, 15-18, 22, 39, 59-61, 81-102.
Необязательно выделенный полипептид блокирует или ингибирует взаимодействие LSR, TMEM25, VSIG10, LY6G6F, или их фрагмента, или варианта с подходящим функциональным соответствующим компонентом.
Необязательно выделенный полипептид восстанавливает или увеличивает взаимодействие LSR, TMEM25, VSIG10, LY6G6F или их фрагмента или варианта с подходящим функциональным соответствующим компонентом.
Необязательно выделенный ортолог является полипептидом мыши, выбранным из SEQ ID NO:9 и 19-21.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет выделенные полипептиды, содержащие отдельные участки (фрагменты) белков VSIG10, соответствующие:
А. Выделенному химерному полипептиду, содержащему первую аминокислотную последовательность, являющуюся по меньшей мере на 95% гомологичной MAAGGSAPEPRVLVCLGALLAGWVAVGLEAWIGEVHENVTLHCGNISGLRGQ VTWYRNNSEPVFLLSSNSSLRPAEPRFSLVDATSLHIESLSLGDEGIYTCQEILNVTQWFQVWLQVA, соответствующей аминокислотам 1-120 известного белка VSIG10 (SEQ ID NO:3), которая также соответствует аминокислотам 1-120 варианта VSIG10 (SEQ ID NO:5), вторую мостиковую аминокислотную последовательность, состоящую из N, и третью аминокислотную последовательность, являющуюся по меньшей мере на 95% гомологичной PPPSAPQCWAQMASGSFMLQLTCRWDGGYPDPDFLWIEEPGGVIVGKSKLGVE MLSESQLSDGKKFKCVTSHIVGPESGASCMVQIRGPSLLSEPMKTCFTGGNVTLT CQVSGAYPPAKILWLRNLTQPEVIIQPSSRHLITQDGQNSTLTIHNCSQDLDEGYYI CRADSPVGVREMEIWLSVKEPLNIGGIVGTIVSLLLLGLAIISGLLLHYSPVFCWK VGNTSRGQNMDDVMVLVDSEEEEEEEEEEEEDAAVGEQEGAREREELPKEIPKQ DHIHRVTALVNGNIEQMGNGFQDLQDDSSEEQSDIVQEEDRPV, соответствующей аминокислотам 223-540 известного белка VSIG10 (SEQ ID NO:3), которая также соответствует аминокислотам 122-439 варианта VSIG10 (SEQ ID NO:5), где указанная первая аминокислотная последовательность, вторая мостиковая аминокислотная последовательность и третья аминокислотная последовательность являются смежными и расположены в последовательном порядке.
В. Выделенному полипептиду краевого участка варианта VSIG10 (SEQ ID NO:5), содержащему полипептид, имеющий длину "n", где n составляет по меньшей мере приблизительно 10 аминокислот в длину, необязательно по меньшей мере приблизительно 20 аминокислот в длину, предпочтительно по меньшей мере приблизительно 30 аминокислот в длину, более предпочтительно по меньшей мере приблизительно 40 аминокислот в длину, и наиболее предпочтительно по меньшей мере приблизительно 50 аминокислот в длину, где по меньшей мере 3 аминокислоты содержат ANP, имеющий следующую структуру (нумерация согласно варианту VSIG10 (SEQ ID NO:5)): последовательность начинается с любой из аминокислот с номерами от 120-х до 120 и заканчивается любой из аминокислот с номерами 122+((n-3)-x), в которых x варьирует от 0 до n-3.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение, кроме того, предоставляет выделенные полипептиды, содержащие последовательность аминокислотных остатков, соответствующую отдельным участкам белков VSIG10, соответствующим новым участкам соединения и краевым участкам варианта VSIG10 (SEQ ID NO:5). Уникальная последовательность нового участка соединения варианта VSIG10 (SEQ ID NO:5) продемонстрирована при выравнивании белковой последовательности на Фигуре 2А.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет выделенные полипептиды, содержащие отдельные участки (фрагменты) белков LSR, соответствующие:
А. Выделенному химерному полипептиду, содержащему первую аминокислотную последовательность, являющуюся по меньшей мере на 95% гомологичной MALLAGGLSRGLGSHPAAAGRDAWFVWLLLSTWCTAPARAIQVTVSNPYHWILFQPVTLPCTYQMTSTPTQPIVIWKYKSFCRDRIADAFSPASVDNQLNAQLAAGNPGYNPYVECQDSVRTVRWATKQGNAVTLGDYYQGRRITITGNADLTFDQTAWGDSGVYYCSWSAQDLQGNNEAYAELIVLGRTSGVAELLPGFQAGPIE, соответствующей аминокислотам 49-258 известного белка LSR (SEQ ID NO:62), которая также соответствует аминокислотам 1-210 f-изоформы варианта LSR (SEQ ID NO:18), вторую мостиковую аминокислотную последовательность, состоящую из V, и третью аминокислотную последовательность, являющуюся по меньшей мере на 95% гомологичной
YAAGKAATSGVPSIYAPSTYAHLSPAKTPPPPAMIPMGPAYNGYPGGYPGDVDRSSSAGGQGSYVPLLRDTDSSVASEVRSGYRIQASQQDDSMRVLYYMEKELANFDPSRPGPPSGRVERAMSEVTSLHEDDWRSRPSRGPALTPIRDEEWGGHSPRSPRGWDQEPAREQAGGGWRARRPRARSVDALDDLTPPSTAESGSRSPTSNGGRSRAYMPPRSRSRDDLYDQDDSRDFPRSRDPHYDDFRSRERPPADPRSHHHRTRDPRDNGSRSGDLPYDGRLLEEAVRKKGSEERRRPHKEEEEEAYYPPAPPPYSETDSQASRERRLKKNLALSRESLW, соответствующей аминокислотам 309-649 известного белка LSR (SEQ ID NO:62), которая также соответствует аминокислотам 212-552 f-изоформы варианта LSR (SEQ ID NO:18), где указанная первая аминокислотная последовательность, вторая мостиковая аминокислота и третья аминокислотная последовательность являются смежными и расположены в последовательном порядке.
В. Выделенному полипептиду краевого участка f-изоформы варианта LSR (SEQ ID NO:18), содержащему полипептид, имеющий длину "n", где n составляет по меньшей мере приблизительно 10 аминокислот в длину, необязательно по меньшей мере приблизительно 20 аминокислот в длину, предпочтительно по меньшей мере приблизительно 30 аминокислот в длину, более предпочтительно по меньшей мере приблизительно 40 аминокислот в длину и наиболее предпочтительно по меньшей мере приблизительно 50 аминокислот в длину, где по меньшей мере 3 аминокислоты содержат EVY, имеющий следующую структуру (нумерация согласно SEQ ID NO:18): последовательность начинается с любой из аминокислот с номерами от 210-х до 210 и заканчивается любой из аминокислот с номерами 212+((n-3)-x), в которых x варьирует от 0 до n-3.
С. Выделенному химерному полипептиду, содержащему первую аминокислотную последовательность, являющуюся по меньшей мере на 95% гомологичной MALLAGGLSRGLGSHPAAAGRDAWFVWLLLSTWCTAPARAIQVTVSNPYHWILFQPVTLPCTYQMTSTPTQPIVIWKYKSFCRDRIADAFSPASVDNQLNAQLAAGNPGYNPYVECQDSVRTVRWATKQGNAVTLGDYYQGRRITITGNADLTFDQTAWGDSGVYYCSWSAQDLQGNNEAYAELIVL, соответствующей аминокислотам 49-239 известного белка LSR (SEQ ID NO:66), которая также соответствует аминокислотам 1-191 f-изоформы варианта LSR (SEQ ID NO:18), вторую аминокислотную последовательность, являющуюся по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, более предпочтительно по меньшей мере на 90% и наиболее предпочтительно по меньшей мере на 95% гомологичной полипептиду, имеющему последовательность GRTSGVAELLPGFQAGPIE, соответствующую аминокислотам 192-218 f-изоформы варианта LSR (SEQ ID NO:18), и третью аминокислотную последовательность, являющуюся по меньшей мере на 95% гомологичной
VYAAGKAATSGVPSIYAPSTYAHLSPAKTPPPPAMIPMGPAYNGYPGGYPGDVDRSSSAGGQGSYVPLLRDTDSSVASEVRSGYRIQASQQDDSMRVLYYMEKELANFDPSRPGPPSGRVERAMSEVTSLHEDDWRSRPSRGPALTPIRDEEWGGHSPRSPRGWDQEPAREQAGGGWRARRPRARSVDALDDLTPPSTAESGSRSPTSNGGRSRAYMPPRSRSRDDLYDQDDSRDFPRSRDPHYDDFRSRERPPADPRSHHHRTRDPRDNGSRSGDLPYDGRLLEEAVRKKGSEERRRPHKEEEEEAYYPPAPPPYSETDSQASR ERRLKKNLALSRESLW, соответствующей аминокислотам 240-581 известного белка LSR SEQ ID NO:66, которая также соответствует аминокислотам 211-552 f-изоформы варианта LSR (SEQ ID NO:18), где указанная первая аминокислотная последовательность, вторая аминокислотная последовательность и третья аминокислотная последовательность являются смежными и расположены в последовательном порядке.
D. Выделенному полипептиду краевого участка f-изоформы варианта LSR (SEQ ID NO:18), содержащему аминокислотную последовательность, являющуюся по меньшей мере приблизительно на 80%, предпочтительно по меньшей мере приблизительно на 85%, более предпочтительно по меньшей мере приблизительно на 90% и наиболее предпочтительно по меньшей мере приблизительно на 95% гомологичной последовательности GRTSGVAELLPGFQAGPIE f-изоформы варианта LSR (SEQ ID NO:18).
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение, кроме того, предоставляет выделенные полипептиды, содержащие последовательность аминокислотных остатков, соответствующую отдельным участкам LSR, соответствующим новым участкам соединения и краевым участкам LSR f-изоформы варианта LSR (SEQ ID NO:18). Уникальные последовательности нового участка соединения f-изоформы LSR (SEQ ID NO:18) продемонстрированы при выравнивании белковой последовательности на Фигуре 2G.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет полипептиды, содержащие последовательность аминокислотных остатков, соответствующую отдельным участкам белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, в том числе различным участкам внеклеточного домена, соответствующим остаткам 17-234 LY6G6F (SEQ ID NO:1), соответствующим аминокислотной последовательности, изображенной в SEQ ID NO:2; остаткам 31-413 VSIG10 (SEQ ID NO:3), соответствующим аминокислотной последовательности, изображенной в SEQ ID NO:4; остаткам 31-312 VSIG10 (SEQ ID NO:5), соответствующим аминокислотной последовательности, изображенной в SEQ ID NO:6; остаткам 27-232 ТМЕМ25 (SEQ ID NO:7), соответствующим аминокислотной последовательности, изображенной в SEQ ID NO:8; остаткам 42-211 LSR (SEQ ID NO:11 и/или SEQ ID NO:143), соответствующим аминокислотной последовательности, изображенной в SEQ ID NO:12; остаткам 42-192 LSR (SEQ ID NO:13), соответствующим аминокислотной последовательности, изображенной в SEQ ID NO:14, остаткам 42-533 LSR (SEQ ID NO:15), соответствующим аминокислотной последовательности, изображенной в SEQ ID NO:47, остаткам 42-532 LSR (SEQ ID NO:16), соответствующим аминокислотной последовательности, изображенной в SEQ ID NO:48, остаткам 42-493 LSR (SEQ ID NO:17), соответствующим аминокислотной последовательности, изображенной в SEQ ID NO:49, остаткам 42-552 LSR (SEQ ID NO:18), соответствующим аминокислотной последовательности, изображенной в SEQ ID NO:50, и/или их фрагменты и/или варианты, обладающими по меньшей мере 85%, 90%, 95, 96, 97, 98 или 99% гомологии последовательности с ними. Согласно другим вариантам осуществления фрагменты ECD LY6G6F выбраны из любой из SEQ ID NO 81, 96 и их вариантов, описанных в данном документе. Согласно другим вариантам осуществления фрагменты ECD VSIG10 выбраны из любой из SEQ ID NO 82-93, 97-100 и их вариантов, описанных в данном документе. Согласно другим вариантам осуществления фрагменты ECD LSR выбраны из любой из SEQ ID NO 95, 102 и их вариантов, описанных в данном документе. Согласно другим вариантам осуществления фрагменты ECD ТМЕМ25 выбраны из любой из SEQ ID NO 94, 101 и их вариантов, описанных в данном документе. Согласно другим вариантам осуществления отдельные участки белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR могут содержать или не включать последовательность сигнального (лидерного) пептида (SP) (Фигура 1). Согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения представлены примеры участков ECD, включающих последовательности SP белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR. Примером участка ECD, включающего последовательность SP белка LY6G6F (SEQ ID NO:1), является аминокислотная последовательность, изложенная в SEQ ID NO:59. Примером участка ECD, включающего последовательность SP белка VSIG10 (SEQ ID NO:3), является аминокислотная последовательность, изложенная в SEQ ID NO:60. Примером участка ECD, включающего последовательность SP белка VSIG10 (SEQ ID NO:5), является аминокислотная последовательность, изложенная в SEQ ID NO:61. Примером участка ECD, включающего последовательность SP белка ТМЕМ25 (SEQ ID NO:7), является аминокислотная последовательность, изложенная в SEQ ID NO:39. Примером участка ECD, включающего последовательность SP белка LSR (SEQ ID NO:11) является аминокислотная последовательность, изложенная в SEQ ID NO:10. Примером участка ECD, включающего последовательностью SP белка LSR (SEQ ID NO:14), является аминокислотная последовательность, изложенная в SEQ ID NO:22.
Согласно дополнительным вариантам осуществления настоящее изобретение предоставляет полипептиды, содержащие последовательность аминокислотных остатков, соответствующую растворимому белку LSR, изображенному в SEQ ID NO:18, включая различные их участки или их варианты, обладающие по меньшей мере 85%, 90%, 95, 96, 97, 98 или 99% гомологии последовательности с ними. Согласно дополнительным вариантам осуществления настоящее изобретение предоставляет полипептиды, содержащие последовательность аминокислотных остатков, соответствующую растворимым белкам LSR, изображенным в любой из SEQ ID NO:15-16, включая различные их участки или их варианты, обладающие по меньшей мере 95, 96, 97, 98 или 99% гомологии последовательности с ними. Согласно дополнительным вариантам осуществления настоящее изобретение предоставляет полипептиды, содержащие последовательность аминокислотных остатков, соответствующую растворимым белкам LSR, изображенным в любой из SEQ ID NO:15-18. Согласно другим вариантам осуществления растворимые белки LSR, изображенные в любой из SEQ ID NO:15-18, могут включать или не включать последовательность сигнального (лидерного) пептида (Фигура 1G, G, I и J).
Согласно другим вариантам осуществления настоящее изобретение предоставляет полипептиды, содержащие последовательность аминокислотных остатков, соответствующую внеклеточным доменам белков-ортологов ТМЕМ25, LY6G6F, VSIG10, варианта 1 LSR и/или варианта 2 LSR, в частности мышиных ортологов (SEQ ID NO:28, 29, 30, 31 и/или 32, соответственно), включая, без ограничения, внеклеточные домены мышиных ортологов, соответствующие аминокислотной последовательности, изображенной в SEQ ID NO:9, 19-21 или их участкам или их вариантам, обладающим по меньшей мере 85%, 90%, 95, 96, 97, 98 или 99% гомологии последовательности с ними.
Согласно другим вариантам осуществления настоящее изобретение предоставляет полипептиды, содержащие аминокислотную последовательность, соответствующую любому из новых вариантов VSIG10 (SEQ ID NO:5) и LSR (SEQ ID NO:11, 13, 15, 16 и 18).
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет слитый белок, содержащий любой из вышеупомянутых полипептидов, соединенных с гетерологичной последовательностью. Необязательно эта гетерологичная последовательность содержит по меньшей мере участок молекулы иммуноглобулина. Необязательно и предпочтительно участок молекулы иммуноглобулина является Fc-фрагментом константной области тяжелой цепи иммуноглобулина. Необязательно и более предпочтительно константная область тяжелой цепи иммуноглобулина получена из изотипа иммуноглобулина, выбранного из группы, состоящей из IgG1, IgG2, IgG3, IgG4, IgM, IgE, IgA и IgD. Необязательно и наиболее предпочтительно этот слитый белок имеет аминокислотную последовательность, изложенную в любой из SEQ ID NO:71-80, 172-181 или изложенную в любой из SEQ ID NO:23-26, а также необязательно модулирует ответ иммунных клеток in vitro или in vivo.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет выделенные последовательности нуклеиновых кислот, кодирующие любой из вышеприведенных новых вариантов ТМЕМ25, VSIG10 и/или LSR и/или любой из вышеприведенных полипептидов внеклеточного домена LY6G6F, VSIG10, ТМЕМ25 и/или LSR или их фрагменты, или гомологи или ортологи.
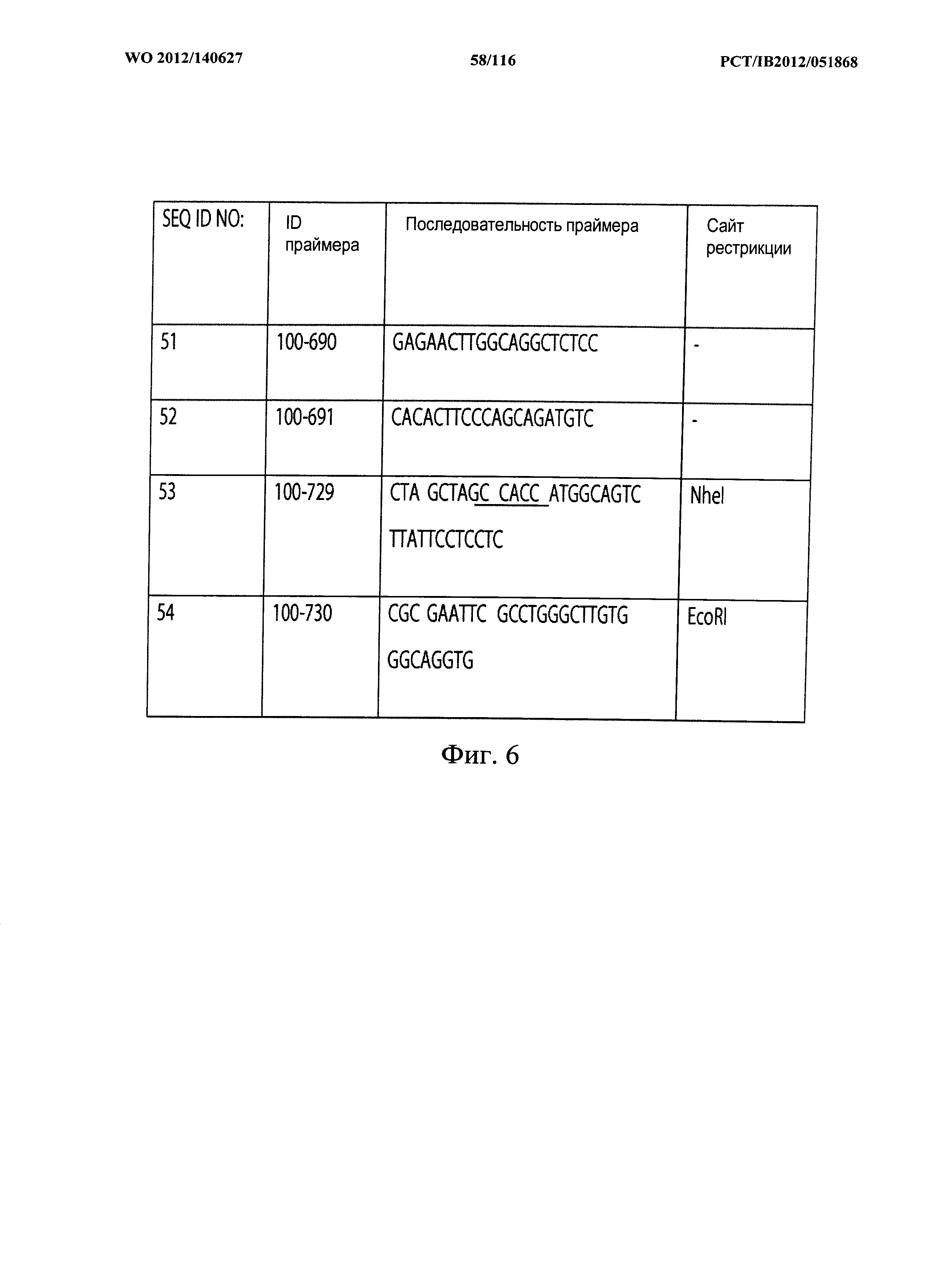
Согласно по меньшей мере некоторым вариантам осуществления предоставлена выделенная последовательность нуклеиновой кислоты, выбранная из группы, состоящей из SEQ ID NO:33-37, 40-46, 132, 155, 182-198, или ее вариант, который обладает по меньшей мере 95% идентичности последовательности с ними, или ее вырожденный вариант.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет выделенный полинуклеотид, кодирующий полипептид, содержащий любую из аминокислотных последовательностей, изложенных в SEQ ID NO:2, 4, 5, 6, 8-16, 18-22, 39, 47-50, 59-61, 143, или его фрагмент или вариант, который сохраняет по меньшей мере 85, 90, 95, 96, 97, 98 или 99% идентичности последовательности с ним, или его вырожденный вариант.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет выделенный полинуклеотид, содержащий нуклеиновую кислоту, изложенную в любой из SEQ ID NO:33-37, 40-46, 132, 145, 155, 182-188, или гомологичную ей последовательность, или ее вырожденные варианты. Согласно другому варианту осуществления выделенный полинуклеотид является по меньшей мере на 85, 90, 95, 96, 97, 98 или 99% гомологичным последовательности нуклеиновой кислоты, изложенной в любой из SEQ ID NO:33-37, 40-46, 145.
Согласно по меньшей мере некоторым вариантам осуществления предоставлен вектор экспрессии или вирус, содержащий по меньшей мере одну выделенную последовательность нуклеиновой кислоты, которая описана в данном документе. Согласно по меньшей мере некоторым вариантам осуществления в данном документе предоставлена рекомбинантная клетка, содержащая вектор экспрессии или вирус, содержащий выделенную последовательность нуклеиновой кислоты, которая описана в данном документе, где данная клетка конститутивно или индуцибельно экспрессирует полипептид, кодируемый этим сегментом ДНК. Согласно по меньшей мере некоторым вариантам осуществления предоставлен способ получения растворимого полипептида эктодомена LSR, TMEM25, VSIG10, LY6G6F или его фрагмента или слитого белка, включающий культивирование рекомбинантной клетки, которая описана в данном документе, в условиях, при которых клетка экспрессирует полипептид, кодируемый сегментом ДНК или нуклеиновой кислотой, и извлечение указанного полипептида.
Согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения предоставлена фармацевтическая композиция, содержащая выделенную аминокислотную последовательность эктодомена или растворимой или секретируемой формы любого из белков LY6G6F, VSIG10, TMEM25, LSR, или вариантов, или ортологов, или фрагментов, или конъюгатов, содержащих вышеуказанное.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет выделенную или очищенную аминокислотную последовательность растворимого и/или внеклеточного домена белка LY6G6F, VSIG10, TMEM25 и/или LSR или последовательность нуклеиновой кислоты, кодирующую ее, которую необязательно можно непосредственно или опосредованно присоединить к белку, не являющемуся LY6G6F, VSIG10, TMEM25 и/или LSR, или к последовательности нуклеиновой кислоты, такому как растворимый домен или фрагмент иммуноглобулина.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет векторы, такие как плазмиды и рекомбинантные вирусные векторы, и клетки-хозяева, содержащие их, которые экспрессируют секретируемую или растворимую форму и/или ECD белка LY6G6F, VSIG10, TMEM25 и/или LSR или их фрагменты или варианты или ортологи, или полипептидные конъюгаты, содержащие любое из вышеприведенного.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет применение этих векторов, таких как плазмиды и рекомбинантные вирусные векторы, и клеток-хозяев, содержащих их, которые экспрессируют любой из LY6G6F, VSIG10, TMEM25 и/или LSR, секретируемую и/или растворимую форму, и/или ECD, и/или их фрагменты и/или варианты и/или их ортологи, и/или полипептидные конъюгаты, содержащих любое из вышеприведенного для получения любого из указанных белков LY6G6F, VSIG10, TMEM25 и/или LSR.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет фармацевтические или диагностические композиции, содержащие любое из вышеприведенного.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет применение любого из соединений, содержащих по меньшей мере один из эктодоменов LY6G6F, VSIG10, ТМЕМ25 и/или LSR, его растворимую или секретируемую форму, или фрагменты, или ортологи, или варианты, или конъюгаты, или последовательности нуклеиновой кислоты, кодирующей вышеупомянутое, или фармацевтической композиции, содержащей вышеупомянутое, в качестве терапевтического средства для лечения или предупреждения рака, как указано в данном документе, инфекционного нарушения, как указано в данном документе, и/или иммунологического нарушения, включая, без ограничения, аутоиммунные заболевания, как указано в данном документе, отторжения трансплантата и реакции "трансплантат против хозяина" и/или для блокирования или активирования иммунной костимуляции, опосредованной любым из полипептидов LY6G6F, VSIG10, ТМЕМ25 и/или LSR, иммунологических заболеваний, как указано в данном документе, и/или для иммунотерапии (активации или ингибирования иммунной костимуляции). Согласно по меньшей мере некоторым вариантам осуществления аутоиммунное заболевание включает любое аутоиммунное заболевание и необязательно и предпочтительно включает, без ограничения, любой из типов и подтипов любого из рассеянного склероза, ревматоидного артрита, сахарного диабета 1 типа, псориаза, системной красной волчанки, воспалительного заболевания кишечника, увеита или синдрома Шегрена.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет применение любого из соединений, содержащих по меньшей мере один из эктодоменов LY6G6F, VSIG10, ТМЕМ25 и/или LSR, его растворимую или секретируемую форму, или фрагменты, или ортологи, или варианты, или конъюгаты, или последовательности нуклеиновой кислоты, кодирующей вышеупомянутое, или фармацевтической композиции, содержащей вышеупомянутое для введения в качестве противораковой вакцины, в качестве адъюванта для противораковой вакцины и/или для адоптивной иммунотерапии и/или иммунотерапии рака, как указано в данном документе.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет применение любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR и/или последовательностей нуклеиновых кислот в качестве мишеней для разработки лекарственных средств, которые специфически связываются с любым из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, и/или лекарственных средств, которые являются агонистами или антагонистами связывания других фрагментов с белками LY6G6F, VSIG10, ТМЕМ25 и/или LSR.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет лекарственные средства, которые модулируют (являются агонистами или антагонистами) по меньшей мере одной из биологических активностей, связанных с LY6G6F, VSIG10, ТМЕМ25 и/или LSR. Такие лекарственные средства включают в качестве примера антитела, малые молекулы, пептиды, рибозимы, аптамеры, антисмысловые молекулы, малые миРНК и тому подобное. Эти молекулы могут непосредственно связывать или модулировать активность, вызываемую с помощью любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, или ДНК LY6G6F, VSIG10, ТМЕМ25 и/или LSR, или их участков или вариантов, или могут опосредованно модулировать любую из связанных с LY6G6F, VSIG10, ТМЕМ25 и/или LSR активностей или связывание молекул с любым из LY6G6F, VSIG10, ТМЕМ25 и/или LSR и их участками и вариантами, например, модулируя связывание любого из LY6G6F, VSIG10, ТМЕМ25 и/или LSR с его контр-рецептором или эндогенным лигандом.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет новые моноклональные или поликлональные антитела, и антигенсвязывающие фрагменты, и конъюгаты, содержащие их, и/или альтернативные каркасные структуры, которые специфически связывают любой из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, которые описаны в данном документе, или полипептиды, имеющие по меньшей мере 95% гомологии с ними. Необязательно такие антитела связываются с белками, выбранными из группы, состоящей из любой из SEQ ID NO:1-8, 10-18, 22, 39, 47-50, 59-61, 9, 19-21 и/или аминокислотных последовательностей, соответствующих уникальным краевым зонам любой из SEQ ID NO:5 и 18, в частности, где эти антитела, антигенсвязывающие фрагменты и конъюгаты, содержащие вышеупомянутое, и/или альтернативные каркасные структуры пригодны для применения в качестве терапевтических и/или диагностических средств (как в способах диагностики in vitro, так и in vivo), в частности, для лечения и/или диагностики инфекционного нарушения, как указано в данном документе, и/или иммунологического нарушения, включая, без ограничения, аутоиммунные заболевания, как указано в данном документе, иммунологические заболевания, как указано в данном документе, отторжение трансплантата и реакцию "трансплантат против хозяина", а также форм рака и злокачественных опухолей, как указано в данном документе.
Согласно по меньшей мере некоторым вариантам осуществления предоставлены антитела, в которых участок связывания антигена содержит конформационный или линейный эпитоп, и где участок связывания антигена содержит приблизительно 3-7 смежных или несмежных аминокислот. Необязательно антитело является полностью человеческим антителом, химерным антителом, гуманизированным или приматизированным антителом.
Также необязательно антитело выбрано из группы, состоящей из фрагмента Fab, Fab', F(ab')2, F(ab'), F(ab), Fv или scFv и минимальной распознающей единицы.
Также необязательно антитело соединено с фрагментом, выбранным из лекарственного средства, радионуклида, флуорофора, фермента, токсина, терапевтического средства или химиотерапевтического средства; и где обнаруживаемый маркер является радиоизотопом, хелатором металла, ферментом, флуоресцентным соединением, биолюминесцентным соединением или хемилюминесцентным соединением.
Также необязательно антитело блокирует или ингибирует взаимодействие любого из полипептидов LSR, TMEM25, VSIG10, LY6G6F или его фрагмента или варианта с соответствующим элементом.
Также необязательно антитело восстанавливает или увеличивает взаимодействие полипептидов LSR, TMEM25, VSIG10, LY6G6F, или их фрагмента, или варианта с соответствующим элементом.
Также необязательно антитело вызывает апоптоз или лизис раковых клеток, которые экспрессируют любой из белков LSR, TMEM25, VSIG10, LY6G6F.
Также необязательно апоптоз или лизис включает CDC или ADCC активность антитела, где CDC (комплемент-зависимая цитотоксичность) или ADCC (антитело-зависимая клеточная цитотоксичность) активности используют для нацеливания иммунных клеток.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет антитела, и антиген-связывающие фрагменты, и конъюгаты, содержащие вышеупомянутое, и/или альтернативные каркасные структуры против отдельных участков белка LY6G6F, в том числе различных участков внеклеточного домена, соответствующих остаткам 17-234 LY6G6F (SEQ ID NO:1), изложенным в SEQ ID NO:2, и/или соответствующих аминокислотным последовательностям, изложенным в любой из SEQ ID NO:81, 96. Согласно дополнительным вариантам осуществления настоящее изобретение предоставляет антитела, антигенсвязывающие фрагменты и конъюгаты, содержащие вышеупомянутое, и/или альтернативные каркасные структуры против отдельных участков мышиного белка LY6G6F (SEQ ID NO:29), в том числе различных участков внеклеточного домена, соответствующих SEQ ID NO:20.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет антитела, и антигенсвязывающие фрагменты, и конъюгаты, содержащие вышеупомянутое, и/или альтернативные каркасные структуры против отдельных участков белка VSIG10, в том числе различных участков внеклеточного домена, соответствующих аминокислотным остаткам 31-413 VSIG10 (SEQ ID NO:3), изображенным в SEQ ID NO:4; аминокислотным остаткам 31-312 VSIG10 (SEQ ID NO:5), изображенным в SEQ ID NO:6, и/или соответствующих аминокислотным последовательностям, изложенным в любой из SEQ ID NO:82-93, 97-100. Согласно дополнительным вариантам осуществления настоящее изобретение предоставляет антитела, антигенсвязывающие фрагменты и конъюгаты, содержащие вышеупомянутое, и/или альтернативные каркасные структуры против отдельных участков мышиного белка VSIG10 (SEQ ID NO:30), в том числе различных участков внеклеточного домена, соответствующих SEQ ID NO:19. Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет антитела, антигенсвязывающие фрагменты и конъюгаты, содержащие вышеупомянутое, и/или альтернативные каркасные структуры против отдельных участков белка VSIG10, в том числе краевого участка варианта VSIG10 (SEQ ID NO:5), который описан в данном документе.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет антитела, антигенсвязывающие фрагменты и конъюгаты, содержащие вышеупомянутое, и/или альтернативные каркасные структуры против отдельных участков белков ТМЕМ25, в том числе различных участков внеклеточного домена, соответствующих аминокислотным остаткам 27-232 ТМЕМ25 (SEQ ID NO:7), изображенным в SEQ ID NO:8, и/или соответствующих аминокислотным последовательностям, изложенным в любой из SEQ ID NO:94, 101. Согласно дополнительным вариантам осуществления настоящее изобретение предоставляет антитела и антигенсвязывающие фрагменты и конъюгаты, содержащие вышеупомянутое, и/или альтернативные каркасные структуры против отдельных участков мышиного белка ТМЕМ25 (SEQ ID NO:28), в том числе различных участков внеклеточного домена, изложенных в SEQ ID NO:9.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет антитела и антигенсвязывающие фрагменты и конъюгаты, содержащие вышеупомянутое, и/или альтернативные каркасные структуры против отдельных участков белков LSR, в том числе различных участков внеклеточного домена, соответствующих аминокислотным остаткам 42-211 LSR (SEQ ID NO:11), изображенным в SEQ ID NO:12; аминокислотным остаткам 42-192 LSR (SEQ ID NO:13), изображенным в SEQ ID NO:14, аминокислотным остаткам 42-533 LSR (SEQ ID NO:15), изображенным в SEQ ID NO:47, аминокислотным остаткам 42-532 LSR (SEQ ID NO:16), изображенным в SEQ ID NO:48, аминокислотным остаткам 42-493 LSR (SEQ ID NO:17), изображенным в SEQ ID NO:49, аминокислотным остаткам 42-552 LSR (SEQ ID NO:18), изображенным в SEQ ID NO:50, и/или соответствующих аминокислотным последовательностям, изложенным в любой из SEQ ID NO:95, 102. Согласно дополнительным вариантам осуществления настоящее изобретение предоставляет антитела и антигенсвязывающие фрагменты и конъюгаты, содержащие вышеупомянутое, и/или альтернативные каркасные структуры против отдельных участков мышиных белков LY6G6F (SEQ ID NO:31-32), в том числе различных участков внеклеточного домена, соответствующих SEQ ID NO:21.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет антитела и антиген-связывающие фрагменты и конъюгаты, содержащие вышеупомянутое, и/или альтернативные каркасные структуры против отдельных участков белков LSR, в том числе уникального краевого участка f-изоформы варианта LSR (SEQ ID NO:18), который описан в данном документе.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет антитела и антигенсвязывающие фрагменты и конъюгаты, содержащие вышеупомянутое, и/или альтернативные каркасные структуры против отдельных участков растворимых белков LSR, в том числе различных участков белков LSR, изображенных в любой из SEQ ID NO:15-18, 47-50.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение относится к белковым каркасным структурам со специфичностью и сродством в диапазоне, соответствующем специфичным антителам. Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение относится к антигенсвязывающему конструкту, содержащему белковую каркасную структуру, которая соединена с одним или несколькими эпитоп-связывающими доменами. Такие разработанные белковые каркасные структуры обычно получают конструированием случайной библиотеки с мутагенезом, сфокусированным на области петли или на другой допустимой поверхности, и посредством отбора вариантов против данной мишени с помощью фагового дисплея или родственного метода. Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение относится к альтернативным каркасным структурам, включая, без ограничения, антикалины, DARPins, белки с повторами армадилло, белок А, липокалины, фибронектиновый домен, домен анкиринового консенсусного повтора, тиоредоксин, химически ограниченные пептиды и тому подобное. Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение относится к альтернативным каркасным структурам, которые применяют в качестве терапевтических средств для лечения рака, как указано в данном документе, иммунологических заболеваний, как указано в данном документе, аутоиммунного заболевания, как указано в данном документе, и инфекционных заболеваний, а также для диагностики in vivo.
Согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения предоставлена фармацевтическая композиция, содержащая выделенный полипептид, который описан в данном документе, или слитый белок, который описан в данном документе; нуклеотидную последовательность, которая описана в данном документе; вектор экспрессии, который описан в данном документе; клетку-хозяина, которая описана в данном документе, или антитело, которое описано в данном документе, и дополнительно содержащая фармацевтически приемлемый разбавитель или носитель.
Согласно по меньшей мере некоторым вариантам осуществления предоставлено применение любого из выделенного полипептида, который описан в данном документе, или слитого белка, который описан в данном документе; нуклеотидной последовательности, которая описана в данном документе; вектора экспрессии, который описан в данном документе; клетки-хозяина, которая описана в данном документе, или антитела, которое описано в данном документе, или фармацевтической композиции, которая описана в данном документе, где введение таковых субъекту ингибирует или уменьшает активацию Т-клеток.
Согласно по меньшей мере некоторым вариантам осуществления предоставлено применение любого из выделенного полипептида, который описан в данном документе, или слитого белка, который описан в данном документе; нуклеотидной последовательности, которая описана в данном документе; вектора экспрессии, который описан в данном документе; клетки-хозяина, которая описана в данном документе, или антитела, которое описано в данном документе, или фармацевтической композиции, которая описана в данном документе, для лечения рака.
Согласно по меньшей мере некоторым вариантам осуществления предоставлено применение выделенного полипептида, который описан в данном документе, или слитого белка, который описан в данном документе; нуклеотидной последовательности, которая описана в данном документе; вектора экспрессии, который описан в данном документе; клетки-хозяина, которая описана в данном документе, или антитела, которое описано в данном документе, или фармацевтической композиции, которая описана в данном документе, для лечения инфекционного нарушения.
Согласно по меньшей мере некоторым вариантам осуществления предоставлен способ осуществления одного или нескольких из следующего у субъекта:
а. повышающая регуляция цитокинов;
b. индуцирование увеличения количества Т-клеток;
с. стимуляция антиген-специфического Т-клеточного иммунитета;
d. стимуляция активации CD4+ и/или CD8+ Т-клеток;
включающий введение любого из выделенного полипептида, который описан в данном документе, или слитого белка, который описан в данном документе; нуклеотидной последовательности, которая описана в данном документе; вектора экспрессии, который описан в данном документе; клетки-хозяина, которая описана в данном документе, или антитела, которое описано в данном документе, или фармацевтической композиции, которая описана в данном документе, субъекту.
Согласно по меньшей мере некоторым вариантам осуществления предоставлен способ лечения или предупреждения связанного с иммунной системой состояния, включающий введение субъекту, нуждающемуся в этом, эффективного количества любого из выделенного полипептида, который описан в данном документе, или слитого белка, который описан в данном документе, нуклеотидной последовательности, которая описана в данном документе; вектора экспрессии, который описан в данном документе, клетки-хозяина, которая описана в данном документе, или антитела, которое описано в данном документе, или фармацевтической композиции.
Необязательно связанное с иммунной системой состояние включает связанное с иммунитетом состояние, аутоиммунные заболевания, как указано в данном документе, отторжение трансплантата и реакцию "трансплантат против хозяина" и/или состояния, нуждающиеся в блокировании или стимуляции иммунной костимуляции, опосредованной любым из полипептидов LSR, TMEM25, VSIG10 и/или LY6G6F, иммунологические заболевания, указанные в данном документе, и/или состояния, нуждающиеся в иммунотерапии (стимуляции или ингибировании иммунной костимуляции).
Необязательно данное лечение комбинируют с другим веществом, пригодным для лечения иммунологического состояния.
Необязательно вещество выбрано из группы, состоящей из иммуносупрессантов, таких как кортикостероиды, циклоспорин, циклофосфамид, преднизон, азатиоприн, метотрексат, рапамицин, такролимус, биологических средств, таких как блокаторы или антагонисты TNF-альфа, или любых других биологических средств, направленных на любой воспалительный цитокин, нестероидных противовоспалительных лекарственных средств/ингибиторов Сох-2, гидроксихлорохина, сульфасалазоприна, солей золота, этанерцепта, инфликсимаба, микофенолата мофетила, базиликсимаба, атацицепта, ритуксимаба, цитоксана, интерферона бета-1a, интерферона бета-1b, глатиромера ацетата, митоксантрона гидрохлорида, анакинры и/или других биопрепаратов и/или внутривенного иммуноглобулина (IVIG), интерферонов, таких как IFN-бета-1a (REBIF® и AVONEX®) и IFN-бета-1b (BETASERON®); глатирамера ацетата (COPAXONE®), полипептида; натализумаба (TYSABRI®), митоксантрона (NOVANTRONE®), цитотоксического средства, ингибитора кальциневрина, например, циклоспорина А или FK506; иммуносупрессивного макролида, например, рапамицина или его производного, например, 40-O-(2-гидрокси)этил-рапамицина; средства хоминга лимфоцитов, например FTY720 или его аналог, кортикостероидов, циклофосфамида; азатиопрена; метотрексата, лефлуномида или его аналога; мизорибина; микофенольной кислоты; микофенолата мофетила; 15-дезоксиспергуалина или его аналога; иммуносупрессивных моноклональных антител, например, моноклональных антител к рецепторам лейкоцитов, например, МНС, CD2, CD3, CD4, CD11a/CD18, CD7, CD25, CD27, B7, CD40, CD45, CD58, CD137, ICOS, CD150 (SLAM), OХ40, 4-1BB или их лигандам; или других иммуномодулирующих соединений, например, CTLA4-Ig (абатацепт, ORENCIA®), CD28-Ig, B7-H4-Ig или других костимулирующих средств, или ингибиторов молекул адгезии, например, mAb или низкомолекулярные ингибиторы, включая антагонистов LFA-1, антагонистов селектина и антагонистов VLA-4, или другого иммуномодулирующего средства.
Необязательно иммунное состояние выбрано из аутоиммунного заболевания, отторжения трансплантата или реакции "трансплантат против хозяина".
Необязательно аутоиммунное заболевание выбрано из группы, состоящей из рассеянного склероза, включая рецидивирующе-ремиттирующий рассеянный склероз, первично прогрессирующий рассеянный склероз и вторично прогрессирующий рассеянный склероз; псориаза; ревматоидного артрита; псориатического артрита, системной красной волчанки (SLE); язвенного колита; болезни Крона; доброкачественного лимфоцитарного васкулита, тромбоцитопенической пурпуры, идиопатической тромбоцитопении, идиопатической аутоиммунной гемолитической анемии, истинной эритроцитарной аплазии, синдрома Шегрена, ревматизма, заболевания соединительной ткани, ревматической атаки, дегенеративного ревматизма, внесуставного ревматизма, ювенильного ревматоидного артрита, подагрического артрита, фиброзита, хронического полиартрита, криоглобулинемического васкулита, ANCA-ассоциированного васкулита, антифосфолипидного синдрома, миастении, аутоиммунной гемолитической анемии, синдрома Гийена-Барре, хронической иммунной полинейропатии, аутоиммунного тиреоидита, инсулинзависимого сахарного диабета, сахарного диабета 1 типа, болезни Аддисона, мембранозной гломерулонефропатии, болезни Гудпасчера, аутоиммунного гастрита, аутоиммунного атрофического гастрита, злокачественной анемии, пузырчатки, пузырчатки обыкновенной, цирроза, первичного билиарного цирроза печени, дерматомиозита, полимиозита, фибромиозита, миогелеза, целиакии, иммуноглобулин А нефропатии, пурпуры Шенлейна-Геноха, синдрома Эванса, атопического дерматита, псориаза, артропатического псориаза, болезни Грейвса, офтальмопатии Грейвса, склеродермии, системной склеродермии, прогрессирующей системной склеродермии, астмы, аллергии, первичного билиарного цирроза печени, тиреоидита Хашимото, первичной микседемы, симпатической офтальмии, аутоиммунного увеита, гепатита, хронического гепатита, коллагенозов, анкилозирующего спондилита, плечелопаточного периартрита, узелкового панартериита, хондрокальциноза, гранулематоза Вегенера, микроскопического полиангиита, хронической крапивницы, буллезных кожных нарушений, пемфигоида, атопической экземы, болезни Девика, аутоиммунной гемолитической анемии у детей, рефрактерной или хронической аутоиммунной цитопении, предупреждения образования аутоиммунных антител к фактору VIII при приобретенной гемофилии А, болезни холодовых агглютининов, оптиконевромиелита, синдрома скованного человека, гингивита, периодонтита, панкреатита, миокардита, васкулита, гастрита, подагры, суставной подагры и воспалительных кожных нарушений, выбранных из группы, состоящей из псориаза, атопического дерматита, экземы, розовых угрей, крапивницы и угрей, нормокомплементарного уртикарного васкулита, перикардита, миозита, анти-синтетазного синдрома, склерита, синдрома активации макрофагов, синдрома Бехчета, синдрома PAPA, синдрома Блау, подагры, болезни Стилла у взрослых и детей, криопиринопатии, синдрома Макла-Уэльса, семейного холодового аутовоспалительного синдрома, мультисистемного воспалительного заболевания неонатального возраста, семейной средиземноморской лихорадки, хронического детского неврологического кожного и суставного синдрома, системного ювенильного идиопатического артрита, синдрома гипериммуноглобулинемии-D, синдрома Шницлера, аутоиммунной ретинопатии, возрастной макулярной дегенерации, атеросклероза, хронического простатита и периодического синдрома, связанного с TNF-рецепторами (TRAPS).
Необязательно аутоиммунное заболевание выбрано из группы, состоящей из любого из типов и подтипов любого из рассеянного склероза, ревматоидного артрита, сахарного диабета 1 типа, псориаза, системной красной волчанки, воспалительного заболевания кишечника, увеита и синдрома Шегрена.
Согласно по меньшей мере некоторым вариантам осуществления предоставлен способ лечения или предупреждения инфекционного заболевания, включающий введение субъекту, нуждающемуся в этом, эффективного количества любого из выделенного полипептида, который описан в данном документе, или слитого белка, который описан в данном документе; нуклеотидной последовательности, которая описана в данном документе; вектора экспрессии, который описан в данном документе; клетки-хозяина, которая описана в данном документе, или антитела, которое описано в данном документе, или фармацевтической композиции.
Необязательно, инфекционное заболевание выбрано из заболевания, вызываемого бактериальной инфекцией, вирусной инфекцией, грибковой инфекцией и/или другой паразитарной инфекцией.
Необязательно инфекционное заболевание выбрано из гепатита В, гепатита С, инфекционного мононуклеоза, инфекции EBV, цитомегаловируса, AIDS, инфекции HIV-1, HIV-2, туберкулеза, малярии и шистосомоза.
Согласно по меньшей мере некоторым вариантам осуществления предоставлен способ лечения или предупреждения рака, включающий введение субъекту, нуждающемуся в этом, эффективного количества любого из выделенного полипептида, который описан в данном документе, или слитого белка, который описан в данном документе; нуклеотидной последовательности, которая описана в данном документе; вектора экспрессии, который описан в данном документе; клетки-хозяина, которая описана в данном документе, или антитела, которое описано в данном документе, или фармацевтической композиции.
Необязательно, данное лечение комбинируют с другим веществом или терапией, пригодной для лечения рака.
Необязательно терапия представляет собой радиационную терапию, антителотерапию, химиотерапию, фотодинамическую терапию, адоптивную Т-клеточную терапию, деплецию Treg, хирургическое вмешательство или терапию в сочетании с традиционными лекарственными средствами.
Необязательно вещество выбрано из группы, состоящей из иммуносупрессантов, цитотоксических лекарственных средств, противоопухолевых вакцин, антител (например, бевацизумаба, эрбитукса), пептидов, пептидных антител, малых молекул, химиотерапевтических средств, таких как цитотоксические и цитостатические средства (например, паклитаксел, цисплатин, винорелбин, доцетаксел, гемцитабин, темозоломид, иринотекан, 5FU, карбоплатин), иммуномодуляторов, таких как интерфероны и интерлейкины, иммуностимулирующих антител, гормонов роста или других цитокинов, фолиевой кислоты, витаминов, минеральных веществ, ингибиторов ароматазы, молекул для RNAi, ингибиторов гистондеацетилазы и ингибиторов протеасом.
Необязательно, рак выбран из группы, состоящей из рака молочной железы, рака шейки матки, рака яичников, рака эндометрия, меланомы, рака мочевого пузыря, рака легких, рака поджелудочной железы, рака толстой кишки, рака предстательной железы, лейкоза, острого лимфоцитарного лейкоза, хронического лимфоцитарного лейкоза, B-клеточной лимфомы, лимфомы Беркитта, множественной миеломы, лимфомы Ходжкина, неходжкинской лимфомы, миелоидного лейкоза, острого миелолейкоза (AML), хронического миелолейкоза, рака щитовидной железы, фолликулярного рака щитовидной железы, миелодиспластического синдрома (MDS), фибросаркомы и рабдомиосаркомы, меланомы, увеальной меланомы, тератокарциномы, нейробластомы, глиомы, глиобластомы, доброкачественной опухоли кожи, кератоакантомы, рака почки, анапластической крупноклеточной лимфомы, плоскоклеточной карциномы пищевода, гепатоцеллюлярной карциномы, карциномы фолликулярных дендритных клеток, рака кишечника, инвазивного рака мышц, опухоли семенных пузырьков, эпидермальной карциномы, рака селезенки, рака мочевого пузыря, рака головы и шеи, рака желудка, рака печени, рака кости, рака головного мозга, рака сетчатки, билиарного рака, рака тонкого кишечника, рака слюнной железы, рака матки, рака яичек, рака соединительной ткани, гипертрофии предстательной железы, миелодисплазии, макроглобулинемии Вальденстрема, рака носоглотки, нейроэндокринного рака, миелодиспластического синдрома, мезотелиомы, ангиосаркомы, саркомы Капоши, карциноида, рака пищевода и желудка, рака фаллопиевой трубы, перитонеального рака, папиллярного серозного рака мюллерова протока, злокачественного асцита, гастроинтестинальной стромальной опухоли (GIST), синдрома Ли-Фраумени и фон Гиппеля-Линдау (VHL), и при этом рак является неметастатическим, инвазивным или метастатическим.
Необязательно рак представляет собой любой из меланомы, рака печени, почки, головного мозга, молочной железы, толстой кишки, легких, яичников, поджелудочной железы, простаты, желудка, множественной миеломы, лимфомы Ходжкина, неходжкинской лимфомы, острого и хронического лимфобластного лейкоза и острой и хронической миелоидной лейкемии.
Согласно по меньшей мере некоторым вариантам осуществления предоставлен способ потенцирования вторичного иммунного ответа на антиген у пациента, при этом способ включает введение эффективного количества любого из выделенного полипептида, который описан в данном документе, или слитого белка, который описан в данном документе; нуклеотидной последовательности, которая описана в данном документе; вектора экспрессии, который описан в данном документе; клетки-хозяина, которая описана в данном документе, или антитела, которое описано в данном документе, или фармацевтической композиции.
Необязательно антиген является раковым антигеном, вирусным антигеном или бактериальным антигеном, и пациент получил лечение с противораковой вакциной или вирусной вакциной.
Способ иммунотерапии у пациента, включающий:
in vivo или ex vivo индукцию толерантности, включающую введение эффективного количества любого из выделенного полипептида, который описан в данном документе, или слитого белка, который описан в данном документе; нуклеотидной последовательности, которая описана в данном документе; вектора экспрессии, который описан в данном документе; клетки-хозяина, которая описана в данном документе, или антитела, которое описано в данном документе, или фармацевтической композиции пациенту или в лейкоциты, выделенные от пациента для индуцирования дифференциации толерогенных регуляторных клеток;
ex-vivo обогащение и увеличение количества указанных клеток;
реинфузию толерогенных регуляторных клеток указанному пациенту.
Способ применения по меньшей мере одного из любого выделенного полипептида, который описан в данном документе, или слитого белка, который описан в данном документе; нуклеотидной последовательности, которая описана в данном документе; вектора экспрессии, который описан в данном документе; клетки-хозяина, которая описана в данном документе, или антитела, которое описано в данном документе, или фармацевтической композиции в качестве адъюванта противораковой вакцины, включающий введение пациенту иммуногенного количества представляющего интерес препарата ассоциированного с опухолью антигена; и адъювант противораковой вакцины в составе, подходящем для иммунизации, где иммунный ответ, против ассоциированного с опухолью антигена, в присутствии адъюванта противораковой вакцины сильнее, чем в отсутствие адъюванта противораковой вакцины.
Согласно по меньшей мере некоторым вариантам осуществления предоставлен способ комбинирования терапевтической вакцинации антигеном с введением любого из выделенного полипептида, который описан в данном документе, или слитого белка, который описан в данном документе; нуклеотидной последовательности, которая описана в данном документе; вектора экспрессии, который описан в данном документе; клетки-хозяина, которая описана в данном документе, или антитела, которое описано в данном документе, или фармацевтической композиции для лечения инфекции.
Согласно по меньшей мере некоторым вариантам осуществления предоставлен способ комбинирования любого из выделенного полипептида, который описан в данном документе, или слитого белка, который описан в данном документе; нуклеотидной последовательности, которая описана в данном документе; вектора экспрессии, который описан в данном документе; клетки-хозяина, которая описана в данном документе, или антитела, которое описано в данном документе, или фармацевтической композиции, адъюванта и антигена в вакцине для увеличения иммунного ответа.
Необязательно антиген является вирусным антигеном, бактериальным антигеном, грибковым антигеном, паразитарным антигеном и/или антигеном другого патогена.
Согласно по меньшей мере некоторым вариантам осуществления любое из вышеприведенных терапевтических средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, в том числе антитела и антигенсвязывающие фрагменты и конъюгаты, содержащие вышеупомянутое, и/или альтернативные каркасные структуры против любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR; секретируемой или растворимой формы LY6G6F, VSIG10, ТМЕМ25 и/или LSR или их ECD, и/или вариантов, и/или ортологов, и/или конъюгатов, можно применять для адоптивной иммунотерапии. Иммунная толерантность или иммунологическая толерантностть является процессом, при котором иммунная система не атакует антиген. Она может быть "естественной" или "аутотолерантностью", когда тело не запускает иммунный ответ на собственные антигены, или "индуцированной толерантностью", когда толерантность к внешним антигенам может быть создана путем манипулирования иммунной системой. Она встречается в трех формах: центральная толерантность, периферическая толерантность и приобретенная толерантность. Не желая быть связанными единой теорией, при толерантности используются регуляторные иммунные клетки - в том числе Treg - которые непосредственно подавляют аутореактивные клетки, а также некоторые другие клеточные субпопуляции с иммунорегуляторными свойствами, в том числе CD8+ Т-клетки и другие типы CD4+ Т-клеток (Tr1, Тh3), в дополнение к натуральным киллерам (NK), NKT-клеткам, дендритным клеткам (DC) и В-клеткам.
Толерантность можно индуцировать блокированием костимуляции или путем привлечения коингибирующего В7 с его контр-рецептором. Передача толерантности включает выделение клеток, у которых была индуцирована толерантность либо in vivo (т.е. до выделения клеток), либо ex-vivo, обогащение и увеличение количества этих клеток ех vivo, а затем реинфузию увеличенного количества клеток пациенту. Этот способ можно применять для лечения аутоиммунных заболеваний, которые указаны в данном документе, иммунных заболеваний, которые указаны в данном документе, трансплантации и отторжения трансплантата. Таким образом, согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет способы индукции толерантности, включающие in vivo или ех vivo лечебное введение эффективного количества любого из выделенных растворимых полипептидов LY6G6F, VSIG10, ТМЕМ25, LSR или полипептида, содержащего внеклеточный домен LY6G6F, VSIG10, ТМЕМ25, LSR, или их фрагмента, или их гибрида с гетерологичной последовательностью и/или поликлонального или моноклонального антитела или антигенсвязывающего фрагмента и конъюгатов, содержащих вышеупомянутое, и/или альтернативных каркасных структур, специфичных для любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, пациенту или в лейкоциты, выделенные от пациента, для того, чтобы индуцировать дифференцировку толерогенных регуляторных клеток, а затем ex-vivo обогащение и увеличение количества указанных клеток и реинфузию толерогенных регуляторных клеток указанному пациенту.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет анализы для обнаружения присутствия белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR in vitro или in vivo в биологическом образце или в организме индивидуума, включающие приведение в контакт образца с антителом, и/или антигенсвязывающими фрагментами, и/или конъюгатами, содержащими вышеупомянутое, и/или альтернативными каркасными структурами, имеющими специфичность относительно полипептидов LY6G6F, VSIG10, ТМЕМ25 и/или LSR, и обнаружение связывания белка LY6G6F, VSIG10, ТМЕМ25 и/или LSR в образце и/или в организме индивидуума.
Согласно по меньшей мере некоторым вариантам осуществления предоставлен анализ для обнаружения присутствия любого из полипептида с любой из SEQ ID NO:1-8, 11-18, 47-50, 58, 143, или его варианта, который по меньшей мере на 95% идентичен ему, в образце.
Согласно по меньшей мере некоторым вариантам осуществления предоставлен способ диагностики заболевания у субъекта, включающий обнаружение у субъекта или в образце, полученном от указанного субъекта, любого из полипептида с любой из SEQ ID NO:1-8, 11-18, 47-50, 58, 143, или его варианта, который по меньшей мере на 95% идентичен ему, или его фрагмента.
Необязательно обнаружение данного полипептида выполняют in vivo или in vitro.
Необязательно обнаружение проводят с помощью иммунологического анализа.
Необязательно обнаружение проводят с использованием антител или фрагментов, которые описаны в данном документе.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет способы обнаружения заболевания, диагностики заболевания, мониторинга прогрессирования заболевания или эффективности лечения или рецидива заболевания или выбора терапии заболевания, обнаружение клеток, пораженных вышеприведенным заболеванием, включающие обнаружение экспрессии LY6G6F, VSIG10, ТМЕМ25 и/или LSR, где заболевание выбрано из рака, инфекционного нарушения, которое указано в данном документе, и/или иммунологического нарушения.
Согласно одному варианту осуществления обнаружение присутствия данного полипептида указывает на наличие заболевания и/или его тяжесть и/или его прогрессирование. Согласно другому варианту осуществления изменение экспрессии и/или уровня данного полипептида по сравнению с его экспрессией и/или уровнем у здорового субъекта или в образце, полученном от него, указывает на наличие заболевания и/или его тяжесть и/или его прогрессирование. Согласно еще одному варианту осуществления изменение экспрессии и/или уровня данного полипептида по сравнению с его уровнем и/или экспрессией у указанного субъекта или в образце, полученном от него на более ранней стадии, указывает на прогрессирование заболевания. Согласно еще одному варианту осуществления обнаружение присутствия и/или относительного изменения экспрессии и/или уровня полипептида является пригодным для выбора лечения и/или мониторинга лечения заболевания.
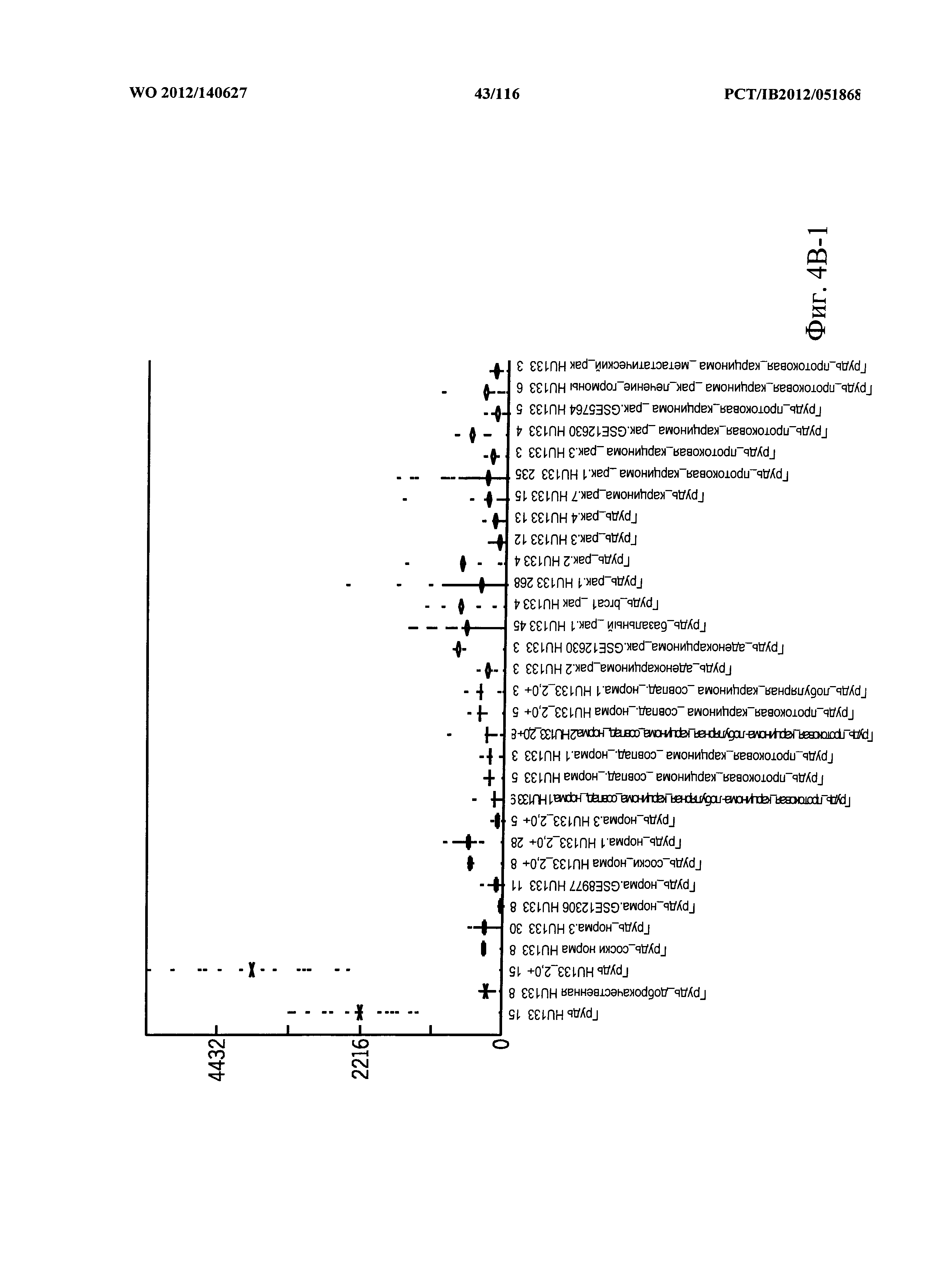
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фигуре 1 представлены аминокислотные последовательности белков LY6G6F (Фигура 1А, SEQ ID NO:1), VSIG10 (Фигуры 1B, SEQ ID NO:3 и 1C, SEQ ID NO:5), TMEM25 (Фигура 1D, SEQ ID NO:7), LSR (Фигуры 1E (SEQ ID NO:11), 1F (SEQ ID NO:13), 1G (SEQ ID NO:15), 1H (SEQ ID NO:16), 1I (SEQ ID NO:17) и 1J (SEQ ID NO:18)), фрагментов, ECD и соответствующие последовательности нуклеиновых кислот, кодирующие их. Аминокислотные остатки, соответствующие сигнальному пептиду (SP), показаны жирным курсивом. Домены Ig-V и/или Ig-C показаны в рамках. Аминокислотные остатки, соответствующие трансмембранному участку (ТМ), показаны жирным и подчеркнуты. Аминокислотные остатки, соответствующие альтернативным пропускам экзонов в некоторых из изоформ (на Фигурах 1B и 1Е), показаны курсивом и подчеркнуты. Последовательность нуклеиновой кислоты, соответствующая альтернативным вариантам с пропуском экзонов VSIG10 (пропуск экзона 3) и LSR (е-изоформа, пропуск экзонов 3, 4 и 5), показана жирным на Фигурах 1C и 1I, соответственно. Последовательность нуклеиновой кислоты, соответствующая трансмембранному участку (ТМ), показана жирным и подчеркнута на Фигуре 1C. Последовательность нуклеиновой кислоты, соответствующая сигнальному пептиду (SP), показана жирным курсивом на Фигурах 1C, 1Е, 1G, 1H, 1I и 1J. Стоп-код он TGA выделен на Фигурах 1C и 1I.
На Фигуре 2 представлено сравнение аминокислотных последовательностей между вариантом VSIG10 с SEQ ID NO:5 и известным белком VSIG10, SEQ ID NO:3 (номер доступа Genbank NP_061959.2) (Фигура 2А); а-изоформой LSR SEQ ID NO:11 и известным белком LSR, номер доступа Genbank NP_991403 SEQ ID NO:62 (Фигура 2B-1); а-изоформой LSR SEQ ID NO:11 и известным белком LSR, номер доступа Genbank ХР_002829104, SEQ ID NO:68 (Фигура 2B-2); b-изоформой LSR SEQ ID NO:13 и известным белком LSR, номер доступа Genbank NP_057009, SEQ ID NO:63 (Фигура 2С-1); b-изоформой LSR SEQ ID NO:13 и известным белком LSR, номер доступа Genbank ВАС11614, SEQ ID NO:65 (Фигура 2С-2); c-изоформой LSR SEQ ID NO:15 и известным белком LSR, номер доступа Genbank NP_991404, SEQ ID NO:66 (Фигура 2D-1); c-изоформой LSR SEQ ID NO:15 и известным белком LSR, номер доступа Genbank ХР_002829105.1, SEQ ID NO:69 (Фигура 2D-2); d-изоформой LSR SEQ ID NO:16 и известным белком LSR, номер доступа Genbank NP_991404, SEQ ID NO:66 (Фигура 2Е-1); d-изоформой LSR SEQ ID NO:16 и известным белком LSR, номер доступа Genbank ХР_002829105.1, SEQ ID NO:69 (Фигура 2Е-2); е-изоформой LSR SEQ ID NO:17 и известным белком LSR, номер доступа Genbank BAG59226.1, SEQ ID NO:67 (Фигура 2F); f-изоформой LSR SEQ ID NO:18 и известным белком LSR, номер доступа Genbank NP_991403, SEQ ID NO:62 (Фигура 2G-1); f-изоформой LSR SEQ ID NO:18 и известным белком LSR, номер доступа Genbank NP_991404, SEQ ID NO:66 (Фигура 2G-2). Последовательности уникальных краевых участков (уникальное соединение) варианта VSIG10 (SEQ ID NO:5) и варианта LSR (SEQ ID NO:18) показаны жирными и выделенными (Фигуры 2А и 2G, соответственно).
На Фигуре 3 показан график рассеяния, демонстрирующий экспрессию транс криптов VSIG10, которые кодируют белки VSIG10, на виртуальной панели всех тканей и условий с использованием средства обнаружения MED, демонстрирующий дифференциальную экспрессию транскриптов VSIG10 в нескольких группах клеток иммунной системы, в основном в лейкоцитах, и в условиях различных форм рака, таких как CD10 + лейкоциты из ALL и клетки BM-CD34 + из AML.
На Фигуре 4 показан график рассеяния, демонстрирующий экспрессию транскриптов LSR, которые кодируют белки LSR, на виртуальной панели всех тканей и условий с использованием средства обнаружения MED, демонстрирующий дифференциальную экспрессию транскриптов LSR в нескольких группах клеток иммунной системы, главным образом, в клетках костного мозга, и в условиях различных форм рака тканей, таких как рак молочной железы, легких, яичников, поджелудочной железы, простаты и кожи.
На Фигуре 5А представлено сравнение аминокислотных последовательностей LY6G6F человека (SEQ ID NO:1) и мыши (ref|NP_001156664.1, SEQ ID NO:29). На Фигуре 5B представлено сравнение аминокислотных последовательностей VSIG10 человека (SEQ ID NO:3) и мыши (sp1D3YX43.2, SEQ ID NO:30). На Фигуре 5С представлено сравнение аминокислотных последовательностей LSR человека (SEQ ID NO:11) и мыши (ref|NP_059101.1, SEQ ID NO:31) или мыши (ref|NP_001157656.1, SEQ ID NO:32). На Фигуре 5D представлено сравнение аминокислотных последовательностей ТМЕМ25 человека (SEQ ID NO:7) и мыши (ref: lcl|4109, SEQ ID NO:28).
На Фигуре 6 представлена сводная таблица праймеров, которые были использованы для клонирования транскрипта LY6G6F, соединенного с EGFP. Геноспецифические последовательности показаны жирным шрифтом; расширения сайта рестрикции, использованные в целях клонирования, показаны курсивом; последовательность Козак подчеркнута.
На Фигуре 7 представлена последовательность ДНК непроцессированного LY6G6F, соединенного с EGFP. Геноспецифическая последовательность, соответствующая непроцессированной последовательности LY6G6F, обозначена жирным шрифтом, последовательность EGFP - нежирным курсивом с подчеркиванием.
На Фигуре 8 представлена аминокислотная последовательность полученного непроцессированного LY6G6F, слитого с EGFP. Геноспецифическая последовательность, соответствующая непроцессированной последовательности LY6G6F, обозначена жирным шрифтом; последовательность EGFP - нежирным курсивом с подчеркиванием.
На Фигуре 9 представлена клеточная локализация слитого белка G6F_EGFP, временно экспрессируемого в клетках НЕK293Т. Изображение получено с использованием объектива конфокального микроскопа с 40-кратным увеличением.
На Фигуре 10 представлены ECD мыши, слитые с Fc IgG2a мыши следующим образом: слитые белки LY6G6F мыши (также упоминаемый в данном документе как LY6G6F-Ig, Фигура 10А), VSIG10 мыши (Фигура 10 В), ТМЕМ25 мыши (также упоминаемый в данном документе как TMEM25-Ig, Фигура 10С) или LSR мыши (также упоминаемый в данном документе как LSR-Ig, Фигура 10D) ECD-mIgG2aFc (SEQ ID NO:23, 24, 25 или 26, соответственно). Аминокислотные остатки, соответствующие сигнальному пептиду (SP), показаны курсивом. Аминокислотные остатки, соответствующие последовательности ECD, подчеркнуты. Аминокислотные остатки, соответствующие Fc IgG2a мыши, показаны жирным шрифтом (SEQ ID NO:27).
На Фигуре 11 представлены аминокислотные последовательности ECD человека, соединенных с Fc IgG1 человека с Cys в положении 220 (соответствующий непроцессированному IgG1 человека в положении 5 в SEQ ID NO:70), замененным на Ser (SEQ ID NO:156), следующим образом: ECD LY6G6F человека (Фигура 11А), VSIG10 человека (Фигура 11B), варианта VSIG10 человека с пропуском экзона 3 (Фигура 11С), ТМЕМ25 человека (Фигура 11D), a-изоформы LSR человека (Фигура НЕ), b-изоформы LSR человека (Фигура 11F), c-изоформы LSR человека (Фигура 11G), d-изоформы LSR человека (Фигура 11Н), e-изоформы LSR человека (Фигура 11I), f-изоформы LSR человека (Фигура 11J) слит с Fc IgG1 человека (SEQ ID NO:71-80, соответственно). Аминокислотные остатки, соответствующие сигнальному пептиду (SP), выделены жирным курсивом. Аминокислотные остатки, соответствующие последовательности ECD человека, подчеркнуты. Аминокислотные остатки, соответствующие Fc IgG1 человека с Cys в положении 220, замененным на Ser (SEQ ID NO:156), не отмечены.
Фигура 12 представляет собой гистограмму, показывающую экспрессию транскриптов LSR, обнаруживаемых с помощью или в соответствии с LSR_seg24-36_200-309/310_Amplicon (SEQ ID NO:140) в образцах рака яичников относительно нормальных образцов.
Фигура 13 представляет собой гистограмму, показывающую экспрессию транскриптов LSR, обнаруживаемых с помощью или в соответствии с LSR_seg24-36_200-309/310_Amplicon (SEQ ID NO:140) в образцах рака молочной железы относительно нормальных образцов.
Фигура 14 представляет собой гистограмму, показывающую экспрессию транскриптов LSR, обнаруживаемых с помощью или в соответствии с LSR_seg24-36_200-309/310_Amplicon (SEQ ID NO:140) в образцах рака легких относительно нормальных образцов.
Фигура 15 представляет собой гистограмму, показывающую экспрессию транскриптов LSR, обнаруживаемых с помощью или в соответствии с LSR_seg24-36_200-309/310_Amplicon (SEQ ID NO:140) в образцах нормальной ткани относительно образцов яичников.
Фигура 16 представляет собой гистограмму, показывающую экспрессию транскриптов LSR, обнаруживаемых с помощью или в соответствии с LSR_seg24-36_200-309/310_Amplicon (SEQ ID NO:140) в образцах рака почки относительно нормальных образцов.
Фигура 17 представляет собой гистограмму, показывающую экспрессию транскриптов LSR, обнаруживаемых с помощью или в соответствии с LSR_seg24-36_200-309/310_Amplicon (SEQ ID NO:140) в образцах рака печени относительно нормальных образцов.
На Фигуре 18 продемонстрирован вестерн-блот анализ экспрессии белка LSR_P5a_Flag_m (SEQ ID NO:144) в стабильно трансфицированных рекомбинантных клетках НЕK293Т, как обнаружено с антителами к Flag (каталожный номер Sigma A8592) (Фигура 18А) и к LSR следующим образом: Abnova, каталожный номер Н00051599-В01Р (Фигура 18B), Abeam, каталожный номер ab59646 (Фигура 18С) и Sigma, каталожный номер НРА007270 (Фигура 18D). Дорожка 1: HEK293T_pIRESpuro3; дорожка 2: HEK293T_pIRESpuro3_LSR_P5a_Flag.
На Фигуре 19 продемонстрирована субклеточная локализация LSR_P5a_Flag_m. LSR_P5a_Flag_m (SEQ ID NO:144) локализуется преимущественно в цитоплазме клетки, но также может быть обнаружен на поверхности клетки, как обнаружено с антителами к Flag (каталожный номер Sigma A9594) (Фигура 19А) и к LSR следующим образом: Abeam, каталожный номер ab59646 (Фигура 19B) Abnova, каталожный номер Н00051599-В01Р (Фигура 19С) и Sigma, каталожный номер НРА007270 (Фигура 19D).
На Фигуре 20 продемонстрирована эндогенная экспрессия LSR в различных клеточных линиях. Полоса 72 кДа, соответствующая LSR, обнаружена с помощью антител к LSR в экстрактах (1) Caov3, (2) ES2, (3) OV-90, (4) OVCAR3, (5) SK-OV3, (6) TOV112D, (7) CaCo2, (8) HeLa, (9) HepG2, (10) MCF-7, (11) SkBR3 и (12) 293T_LSR_P5a_Flag (Фигура 20А). Антитела к GAPDH (каталожный номер Abeam ab9484) служили в качестве нагрузочного контроля (Фигура 20B).
Фигура 21 является гистограммой, показывающей экспрессию транскриптов ТМЕМ25, обнаруживаемых с помощью или в соответствии с seg21-27-TMEM25_seg_21-27_200-344/346_Amplicon (SEQ ID NO:123) в нормальных и раковых тканях молочной железы.
Фигура 22 является гистограммой, показывающей экспрессию транскриптов ТМЕМ25, обнаруживаемых с помощью или в соответствии с seg21-27-TMEM25_seg_21-27_200-344/346_Amplicon (SEQ ID NO:123) в различных нормальных тканях.
На Фигуре 23 продемонстрированы результаты вестерн-блот анализа, показывающие (А) специфическое взаимодействие между антителами кролика к ТМЕМ25 и белком ТМЕМ25_Р5 (SEQ ID NO:7) и TMEM25_P5_Flag (SEQ ID NO:129), но не с HEK_293T_pRp3. (В) специфическое взаимодействие между белком TMEM25_P5_Flag (SEQ ID NO:129) и антителами к Flag. Дорожка 1: HEK293T_pIRESpuro3; дорожка 2: HEK293T_pIRESpuro3_TMEM25-P5, дорожка 3: HEK293T_pIRESpuro3_TMEM25-P5-Flag.
На Фигуре 24 представлена локализация на клеточной поверхности ТМЕМ25_Р5 (SEQ ID NO:132) (Фигура 24А) и TMEM25_P5_Flag (SEQ ID NO:129) (Фигура 24B) с использованием антител к ТМЕМ25. На Фигуре 24С продемонстрирована локализация TMEM25_P5_Flag (SEQ ID NO:129) с использованием антител к Flag (Sigma, каталожный номер: A9594).
На Фигуре 25 продемонстрировано, что антитела к ТМЕМ25 связываются с непроцессированным белком ТМЕМ25 в рекомбинантных клетках НЕK293Т, экспрессирующих белок TMEM25_P5_Flag (1:2250) (Фигура 25А), по сравнению с сывороткой крови мыши (1:2250) (Фигура 25B), использованной в качестве отрицательного контроля, указывая на мембранную локализацию белка ТМЕМ25.
На Фигуре 26 представлены результаты вестерн-блот анализа, показывающие экспрессию эндогенного белка ТМЕМ25 в различных клеточных линиях: (1): HEK293T_pIRESpuro3, (2) HEK293T_pIRESpuro3_TMEM25-P5-Flag, (3) KARPAS, (4) G-361, (5) RPMI8226, (6) DAUDI, (7) Jurkat.
На Фигуре 27 продемонстрирован специфический нокдаун белка TMEM25_P5_Flag (SEQ ID NO:129) в клетках HEK293Т, стабильно экспрессирующих TMEM25_P5_Flag (SEQ ID NO 129), трансфицированных миРНК ТМЕМ25_Р5 (L-018183-00-0005, Dharmacon) (Дорожка 2), по сравнению с клетками НЕK293Т, стабильно экспрессирующими TMEM25_P5_FLAG, трансфицированными рандомизированной миРНК (Дорожка 1) (Dharmacon, D-001810-10-05), с использованием антител к ТМЕМ25 (Sigma, каталожный номер НРА012163).
На Фигуре 28 продемонстрировано, что антитело к LSR (каталожный номер ab59646, Abeam) в секциях трансфицированных LSR_P5a_Flag_m клеток НЕK293Т клеточной линии положительного контроля (колонка 1, панели А, С и Е) показывает специфическую иммунореактивность в дозо-зависимых концентрациях 3, 1 и 0,3 мкг/мл, соответственно, по сравнению с клетками НЕK293Т клеточной линии отрицательного контроля с пустым вектором (колонка 2, панели В, D и F) в способе демаскирования антигена при рН 9.
На Фигуре 29 продемонстрировано, что антитело к ТМЕМ25 (каталожный номер НРА012163, Sigma) в секциях трансфицированных TMEM25_P5_Flag клеток HEK293Т (колонка 1, панели А, С и Е) показывает специфическую иммунореактивность в дозо-зависимых концентрациях 3, 1 и 0,3 мкг/мл, соответственно, по сравнению с клетками НЕK293Т клеточной линии отрицательного контроля с пустым вектором (колонка 2, панели В, D и F) в способе демаскирования антигена при рН 9.
На Фигуре 30A-F показан in vitro ингибирующий эффект растворимого LY6G6F-Ig (SEQ ID NO:23), TMEM25-Ig (SEQ ID NO:25) и LSR-Ig (SEQ ID NO:26) на активацию мышиных Т-клеток. Активацию Т-клеток, выделенных из селезенки мышей DO 11.10, индуцировали с помощью 20 мкг/мл (Фигуры 30А-С, Е) или 2 мкг/мл (Фигуры D и F) OVA323-339 в присутствии облученных спленоцитов мышей Balb/c, которые служили в качестве АРС. В этих исследованиях CTLA4-Ig или B7-H4-Ig использовали в качестве положительного контроля, тогда как мышиный IgG2a использовали в качестве контроля Ig.
На Фигуре 31 показан in vitro ингибирующий эффект гранул, связанных с LSR-Ig (SEQ ID NO:26), на пролиферацию Т-клеток, индуцированную гранулами, покрытыми антителами к CD3 и CD28.
На Фигуре 32 показан эффект слитых белков LY6G6F, VSIG10, ТМЕМ25 и LSR (SEQ ID NO:23-26, соответственно) на активацию Т-клеток CD4, которая манифестировала сниженной секрецией IFNγ (А) и сниженной экспрессией маркера активации CD69 (В). Каждый столбик представляет собой среднее из дублирующих культур, столбики ошибок указывают стандартное отклонение (t-тест Стьюдента, *P<0,05, **p<0,01, по сравнению с контрольным mIgG2a).
На Фигуре 33 показан эффект стимуляторных клеток (клеточная линия тимомы мышей, Bw5147, которую разработали для экспрессии мембрано-связанных фрагментов антитела к CD3 человека), экспрессирующих кДНК, кодирующие LY6G6F человека, ТМЕМ25 или LSR (SEQ ID NO:1, 7 или 11, соответственно) на пролиферацию (СРМ) основной части человеческих Т-клеток (Фигура 33А), человеческих Т-клеток CD4+ (Фигура 33B), Т-клеток CD8+ человека (Фигура 33С), или интактных Т-клеток CD4CD45RA+ человека (Фигура 33D). Результаты показаны как среднее +/- SEM из 6 (Фигура 337А) или из 3 (Фигура 33В, С, и D) экспериментов. *P<0,05, **p<0,01, ***p<0,001 и #p<0,0001 (Т-тест Стьюдента) представляет достоверно различные результаты по сравнению с пустым вектором.
На Фигуре 34 показан терапевтический эффект обработки LSR-Ig (SEQ ID NO:26) или TMEM25-Ig (SEQ ID NO:25) на PLP139-151-индуцированной модели R-EAE у мышей SJL. LSR-Ig (SEQ ID NO:26) или TMEM25-Ig (SEQ ID NO:25) вводили в терапевтической форме с начала ремиссии заболевания (день 18) в дозе 100 мкг/мышь i.p. 3 раза в неделю в течение двух недель. Терапевтические эффекты LSR-Ig и TMEM25-Ig на клинические симптомы продемонстрированы как снижение среднего клинического балла (Фигура 34А). Кроме того, при обработке LSR-Ig и TMEM25-Ig ингибировались ответы DTH на индуцирующий эпитоп (PLP139-151) или рассеянный эпитоп (PLP178-191) на 35 день после индукции с R-EAE (Фигура 34В). В данном исследовании эффект LSR-Ig или TMEM25-Ig изучили в сравнении с mIgG2a как отрицательным контролем Ig, и CTLA4-Ig как положительным контролем, которые вводили в аналогичном режиме, как и исследуемые белки.
На Фигуре 35 показана дозо-зависимость и способ действия эффекта TMEM25-Ig (SEQ ID NO:25) на модели R-EAE у мышей SJL. В данном исследовании обработку проводили с начала ремиссии заболевания (день 19) в дозе 100, 30 или 10 мкг/мышь i.p. 3 раза в неделю в течение двух недель, по сравнению с 100 мкг/мышь контрольного IgG2a, который давали по аналогичной схеме, показаны эффекты обработки TMEM25-Ig на течение заболевания (Фигура 35А), ответы DTH на рассеянные эпитопы PLP178-191 и МВР84-104 на 45 и 76 день после индукции с R-EAE (Фигура 35В), ex-vivo вторичные ответы спленоцитов, выделенных на 45 и 75 день после индуцирования заболевания (Фигура 35С), и клеток LN, выделенных на 45 день после индуцирования заболевания (Фигура 35D), которые манифестировали через эффект обработки TMEM25-Ig на пролиферацию клеток и секрецию цитокинов (IFNγ, IL-17, IL-10 и IL-4). Эффект TMEM25-Ig на количество клеток в селезенке, лимфатических узлах и CNS, а также различные линии, присутствующие в CNS при обработке TMEM25-Ig при 100 мкг/дозу показаны на Фигуре 35Е.
На Фигуре 36 показан терапевтический эффект обработки VSIG10-Ig (SEQ ID NO:24) на PLP139-151-индуцированной модели R-EAE у мышей SJL. VSIG10-Ig (SEQ ID NO:24) вводили в терапевтической форме с начала ремиссии заболевания (день 19) в дозе 100 мкг/мышь i.p. 3 раза в неделю в течение двух недель. Терапевтические эффекты VSIG10-Ig на клинические симптомы продемонстрированы как снижение среднего клинического балла (Фигура 36А). Кроме того, обработка VSIG10-Ig ингибировала ответы DTH на рассеянные эпитопы (PLP178-191 и МБР МВР84-104) на 45 и 76 день после индукции с R-EAE (Фигура 36B). Также показан эффект VSIG10-Ig на вторичные ответы спленоцитов ex-vivo, выделенных на 45 и 75 день после индуцирования заболевания (Фигура 36С), и клеток LN, выделенных на 45 день после индуцирования заболевания (Фигура 36D), которые манифестировали через эффект обработки VSIG10-Ig на пролиферацию клеток и секрецию цитокинов (IFNγ, IL-17, IL-10 и IL-4). Эффект VSIG10-Ig на количество клеток в селезенке, лимфатических узлах и CNS, а также различные линии, присутствующие в каждой из этих тканей после обработки VSIG10-Ig при 100 мкг/дозу показаны на Фигуре 36Е. В данном исследовании эффект VSIG10-Ig изучили в сравнении с mIgG2a в качестве контроля Ig, который вводили в аналогичной дозе и режиме, как и VSIG10-Ig.
На Фигуре 37 показан терапевтический эффект LSR-Ig (SEQ ID NO:26), введенного в дозе 100 мкг/мышь, i.p, 3 раза в неделю в течение 10 дней на модели ревматоидного артрита - индуцированного коллагеном артрита (CIA). Измеряли клинический балл (А), отек лапы (В) и гистологическое повреждение (С). CTLA4-Ig, (100 мкг/мышь) и TNFR-Ig (этанерцепт) использовали в качестве положительного контроля, тогда как контрольный Ig mIgG2a (100 мкг/мышь) использовали в качестве отрицательного контроля.
На Фигуре 38 показан терапевтический эффект LY6G6F-Ig (SEQ ID NO:23), введенного в дозе 25 мг/кг, i.p, 3 раза в неделю в течение 2 недель на модели ревматоидного артрита - индуцированного коллагеном артрита (CIA), с измерениями, данными согласно клиническим оценкам.
Для Фигур 12-17, 21, 22 выполнено разделение на отдельные части "А", "В" и т.д. только по причине экономии места, чтобы иметь возможность показать все результаты.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение в по меньшей мере некоторых вариантах осуществления относится к любому из белков, называемых LY6G6F, VSIG10, ТМЕМ25 и/или LSR, и их соответствующей последовательности нуклеиновой кислоты, и их участкам, и вариантам, и слитым белкам, и конъюгатам, содержащим, и/или поликлональным и моноклональным антителам, и/или антигенсвязывающим фрагментам, и/или конъюгатам, содержащим вышеупомянутое, и/или их альтернативным каркасным структурам, которые связывают LY6G6F, VSIG10, ТМЕМ25 и/или LSR и/или их участки и/или варианты, и их применению в качестве терапевтического и/или диагностического средства, а также к различным применениям, которые описаны в данном документе.
В заявках на патент США № US2009117566, US20090017473 и других документах семейства, переданных GENENTECH INC., раскрывается последовательность белка LY6G6F из 382 аминокислот (DNA234441, опухолеспецифическая антигенная мишень (TAT) TAT201, SEQ ID NO:92 в них), имеющего трансмембранный домен от остатков 234-254 до 354-374. В заявках '566, '473 и других заявках из этого семейства патентов раскрывается, что TAT201 сверхэкспрессируется при раке толстой и прямой кишки. В заявках РСТ № WO2003083074 и WO2004046342 раскрывается последовательность белка LY6G6F из 382 аминокислот, так как его ген является одним из многих генов, которые сверхэкспрессируются в клетках рака толстой кишки. Эти патентные заявки дополнительно предположительно относятся к способам применения LY6G6F для обнаружения и лечения рака толстой кишки. Однако в этих патентных заявках не сообщают или предлагают или предоставляют какой-либо стимул, который бы направил специалиста в данной области техники применять антитела, специфичные к LY6G6F и/или ECD LY6G6F, для лечения и/или диагностики рака помимо рака толстой кишки, и/или инфекционных нарушений и/или иммунологических нарушений. В этих заявках на патенты не описываются ECD LY6G6F и не сообщается, или не предлагается, или не предоставляется какой-либо стимул, который бы направил специалиста в данной области техники применять ECD LY6G6F для лечения рака, и/или инфекционных нарушений, и/или иммунологических нарушений.
ТМЕМ25 раскрыт в заявках РСТ № WO9958642 и WO2003087300 и в заявках на патент США № US2007041963 и US2005202526 как один из многих (от сотен до тысяч) белков, пригодных для диагностики, предупреждения и лечения нарушений, связанных с патологической экспрессией или активностью этих белков. Однако в этих заявках не сообщается или не предлагается или не предоставляется стимул, который направил бы специалиста в данной области техники применять антитела, специфичные к ТМЕМ25 и/или ECD ТМЕМ25, для лечения и/или диагностики рака, и/или инфекционных нарушений, и/или иммунологических нарушений. ТМЕМ25 также раскрыт в заявке на патент США №1782004010134, как один из сотен альбуминовых слитых белков, пригодных для диагностики, лечения, предупреждения или ослабления заболеваний или нарушений, например, рака, анемии, артрита, астмы, воспалительного заболевания кишечника или болезни Альцгеймера. Однако в этой заявке не сообщается или не предлагается или не предоставляется стимул, который направил бы специалиста в данной области техники применять антитела, специфичные к ТМЕМ25 и/или ECD ТМЕМ25, для лечения и/или диагностики рака, и/или инфекционных нарушений, и/или иммунологических нарушений. ТМЕМ25 также описан в Doolan P. et al., Tumour Biol. 2009, 30(4):200-9, как подходящий прогностический и предиктивный биомаркер для диагностики рака молочной железы. Однако в этой публикации не сообщается или не предлагается или предоставляется стимул, который направил бы специалиста применять антитела, специфичные к ТМЕМ25 и/или ECD ТМЕМ25, для лечения рака, и/или инфекционных нарушений, и/или иммунологических нарушений.
Для того, чтобы настоящее изобретение в различных вариантах осуществления могло быть более понятным, сначала определены некоторые выражения. Дополнительные определения представлены по всему подробному описанию.
Используемое в данном документе выражение "выделенный" обозначает соединение, представляющее интерес (например, полинуклеотид или полипептид), которое находится в окружении, отличном от того, в котором соединение встречается в природе, например, отделен от своей естественной среды, например, путем концентрирования пептида до концентрации, при которой он не встречается в природе. "Выделенный" включает соединения, которые находятся в образцах, которые значительно обогащены представляющим интерес соединением и/или в которых представляющее интерес соединение частично или значительно очищено.
"Иммунные клетки" относятся к любой клетке гемопоэтического происхождения, включая, без ограничения, Т-клетки, В-клетки, моноциты, дендритные клетки и макрофаги.
Используемое в данном документе выражение "полипептид" относится к цепи аминокислот любой длины независимо от модификации (например, фосфорилирования или гликозилирования).
Используемый в данном документе "костимулирующий полипептид" или "костимулирующая молекула" представляет собой полипептид, который при взаимодействии с молекулой клеточной поверхности на Т-клетках модулирует Т-клеточный ответ.
Используемый в данном документе "костимулирующий сигнал" представляет собой сигнальную активность в результате взаимодействия между костимулирующими полипептидами на антигенпредставляющих клетках и их рецепторами на Т-клетках во время антиген-специфического Т-клеточного ответа. Не желая быть ограниченными какой-либо одной гипотезой, антиген-специфический Т-клеточный ответ, как полагают, опосредован двумя сигналами: 1) контактированием рецептора Т-клетки (TCR) с антигенным пептидом, представленным в окружении МНС (сигнал 1) и 2) вторым антиген-независимым сигналом, передаваемым при контакте между различными парами костимулирующий рецептор/лиганд (сигнал 2). Не желая быть ограниченными какой-либо одной гипотезой, этот "второй сигнал" имеет решающее значение в определении типа Т-клеточного ответа (активация или ингибирование), а также силы и продолжительности этого ответа и регулируется как положительными, так и отрицательными сигналами от костимулирующих молекул, таких как белки семейства В7.
Используемое в данном документе выражение полипептид "В7" означает члена семейства белков В7, который костимулирует Т-клетки, включая, без ограничения, В7-1, В7-2, B7-DC, В7-Н5, В7-Н1, В7-Н2, В7-Н3, В7-Н4, В7-Н6, B7-S3 и их биологически активные фрагменты и/или варианты. Типичные биологически активные фрагменты включают внеклеточный домен или фрагменты внеклеточного домена, которые костимулируют Т-клетки.
Используемое в данном документе выражение "вариантный" полипептид включает по меньшей мере одно изменение аминокислотной последовательности по сравнению с аминокислотной последовательностью соответствующего полипептида дикого типа.
Используемые в данном документе "консервативные" аминокислотные замены являются заменами, где замещенная аминокислота имеет аналогичные структурные или химические свойства. Используемое в данном документе выражение "клетка-хозяин" относится к прокариотическим и эукариотическим клеткам, в которые может быть введен рекомбинантный вектор.
Используемое в данном документе выражение "краевой участок" или "новое соединение" относится к связи между двумя участками сплайс-варианта согласно настоящему изобретению, которые не были соединены в белке дикого типа или известном белке. Краевая зона может необязательно возникнуть из-за соединения между вышеуказанным участком "известного белка" варианта и хвостом, например, и/или может возникнуть, если внутренний участок последовательности дикого типа больше не присутствует, так что два участка последовательности теперь являются смежными в сплайс-варианте, которые не были смежными в известном белке. "Мостик" может необязательно быть краевым участком, как описано выше, но может также включать соединение между головкой и участком варианта "известного белка", или соединение между хвостом и участком "известного белка" варианта, или соединение между вставкой и участком "известного белка" варианта.
В некоторых вариантах осуществления мостик между хвостом или головкой или уникальной вставкой и участком "известного белка" варианта содержит по меньшей мере приблизительно 10 аминокислот, или в некоторых вариантах осуществления по меньшей мере приблизительно 20 аминокислот, или в некоторых вариантах осуществления по меньшей мере приблизительно 30 аминокислот, или в некоторых вариантах осуществления по меньшей мере приблизительно 40 аминокислот, в которых по меньшей мере одна аминокислота из хвоста/головки/вставки и по меньшей мере одна аминокислота из участка "известного белка" варианта. В некоторых вариантах осуществления мостик может содержать любое количество аминокислот от приблизительно 10 до приблизительно 40 аминокислот (например, 10, 11, 12, 13…37, 38, 39, 40 аминокислот в длину, или любое количество в этом промежутке).
Следует отметить, что мостик не может быть расширен за пределы длины последовательности в любом направлении, и следует считать, что каждое описание мостика следует интерпретировать таким образом, что длина мостика не выходит за пределы самой последовательности.
Кроме того, мостики описаны относительно скользящего окна в определенном контексте ниже. Например, некоторые описания мостиков имеют следующий формат: мостик между двумя краевыми зонами (в которых участок известного белка не представлен в варианте) необязательно может быть описан следующим образом: мостиковый участок CONTIG-NAME_P1 (представляющий название белка), содержащий полипептид, имеющий длину "n", где n составляет по меньшей мере приблизительно 10 аминокислот в длину, необязательно по меньшей мере приблизительно 20 аминокислот, по меньшей мере приблизительно 30 аминокислот, по меньшей мере приблизительно 40 аминокислот или по меньшей мере приблизительно 50 аминокислот в длину, где по меньшей мере две аминокислоты содержат XX (2 аминокислоты в центре мостика, по одной с каждого конца краевой зоны), имеющий следующую структуру (нумерация в соответствии с последовательностью CONTIG-NAME_P1): последовательность, начинающаяся с любой из аминокислот с номерами 49-х до 49 (например) и заканчивающаяся любой из аминокислот с номерами 50+((n-2)-x) (например), где x варьирует от 0 до n-2. В данном примере их также следует интерпретировать, как включающие мостики, в которых n представляет собой любое число аминокислот от 10 до 50 аминокислот в длину. Кроме того, мостиковый полипептид не может выходить за пределы последовательности, так что следует интерпретировать, что 49-х (например), составляет не менее 1, а 50+((n-2)-x) (например) не более, чем общая длина последовательности.
Выражение "рак", используемое в данном документе, следует понимать как охватывающее любое новообразование (как инвазивное, так и метастатическое), которое характеризуется патологическим и неконтролируемым делением клеток, вызывающим злокачественный рост или опухоль. Неограничивающими примерами рака, которые можно лечить с помощью соединения согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, являются солидные опухоли, саркомы и гематологические новообразования, включая, без ограничения, рак молочной железы (например, карциному молочной железы), рак шейки матки, рак яичников (карциному яичника), рак эндометрия, меланому, рак мочевого пузыря (карциному мочевого пузыря), рак легких (например, аденокарциному и немелкоклеточный рак легких), рак поджелудочной железы (например, карциному поджелудочной железы, такую как карцинома экзокринной части поджелудочной железы), рак толстой кишки (например, колоректальную карциному, такую как аденокарцинома толстой кишки и аденома толстой кишки), рак предстательной железы, в том числе запущенное заболевание, гемопоэтические опухоли лимфоидного ростка (например, лейкоз, острый лимфобластный лейкоз, хронический лимфобластный лейкоз, B-клеточная лимфома, лимфома Беркитта, множественная миелома, лимфома Ходжкина, неходжкинские лимфомы), миелоидный лейкоз (например, острый миелолейкоз (AML), хронический миелолейкоз), рак щитовидной железы, фолликулярный рак щитовидной железы, миелодиспластический синдром (MDS), опухоли мезенхимального происхождения (например, фибросаркомы и рабдомиосаркомы), меланому, увеальную меланому, тератокарциному, нейробластому, глиому, глиобластому, доброкачественную опухоль кожи (например, кератоакантомы), рак почки, анапластическую крупно-клеточную лимфому, плоскоклеточную карциному пищевода, гепатоцеллюлярную карциному, карциному фолликулярных дендритных клеток, рак кишечника, мышечно-инвазивный рак, опухоль семенных пузырьков, эпидермальная карцинома, рак селезенки, рак мочевого пузыря, рак головы и шеи, рак желудка, рак печени, рак кости, рак головного мозга, рак сетчатки, билиарный рак, рак тонкого кишечника, рак слюнной железы, рак матки, рак яичек, рак соединительной ткани, гипертрофию предстательной железы, миелодисплазию, макроглобулинемию Вальденстрема, носоглоточный, нейроэндокринный рак, миелодиспластический синдром, мезотелиому, ангиосаркому, саркому Капоши, карциноид, рак пищевода и желудка, рак фаллопиевой трубы, перитонеальный рак, папиллярный серозный рак мюллерова протока, злокачественный асцит, гастроинтестинальной стромальную опухоль (GIST) и наследственный раковый синдром, такой как синдром Ли-Фраумени и синдром фон Гиппеля-Линдау (VHL), и при этом рак может быть неметастатическим, инвазивным или метастатическим.
Согласно по меньшей мере некоторым предпочтительным вариантам осуществления настоящего изобретения рак выбран из группы, состоящей из меланомы, рака печени, почек, головного мозга, молочной железы, толстой кишки, легких, яичников, поджелудочной железы, простаты, желудка, множественной миеломы и рака кроветворной ткани, включая, без ограничения, лимфому (Ходжкина и неходжкинскую), острый и хронический лимфобластный лейкоз и острый и хронический миелолейкоз, и при этом рак может быть неметастатическим, инвазивным или метастатическим.
Выражение "аутоиммунное заболевание", используемое в данном документе, следует понимать как охватывающий любое аутоиммунное заболевание и хронические воспалительные состояния. Согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения аутоиммунные заболевания следует понимать как охватывающие любое болезненное нарушение или состояние, выбранное из группы, включающей, без ограничения, рассеянный склероз, в том числе рецидивируюше-ремиттирующий рассеянный склероз, первично прогрессирующий рассеянный склероз и вторично прогрессирующий рассеянный склероз, псориаз, ревматоидный артрит; псориатический артрит, системную красную волчанку (SLE); язвенный колит; болезнь Крона, доброкачественный лимфоцитарный васкулит, тромбоцитопеническую пурпуру, идиопатическую тромбоцитопению, идиопатическую аутоиммунную гемолитическую анемию, истинную эритроцитарную аплазию, синдром Шегрена, ревматизм, заболевание соединительной ткани, ревматической атаки, дегенеративный ревматизм, внесуставной ревматизм, ювенильный ревматоидный артрит, подагрический артрит, фиброзит, хронический полиартрит, криоглобулинемический васкулит, ANCA-ассоциированный васкулит, антифосфолипидный синдром, миастению, аутоиммунную гемолитическую анемию, синдром Гийена-Барре, хроническую иммунную полинейропатию, аутоиммунный тиреоидит, инсулинзависимый сахарный диабет, сахарный диабет 1 типа, болезнь Аддисона, мембранозную гломерулонефропатию, болезнь Гудпасчера, аутоиммунный гастрит, аутоиммунный атрофический гастрит, злокачественную анемию, пузырчатку, пузырчатку обыкновенную, цирроз, первичный билиарный цирроз печени, дерматомиозит, полимиозит, фибромиозит, миогелез, целиакию, иммуноглобулин А нефропатию, пурпуру Шенлейна-Геноха, синдром Эванса, атопический дерматит, псориаз, артропатический псориаз, болезнь Грейвса, офтальмопатию Грейвса, склеродермию, системную склеродермию, прогрессирующую системную склеродермию, астму, аллергию, первичный билиарный цирроз печени, тиреоидит Хашимото, первичную микседему, симпатическую офтальмию, аутоиммунный увеит, гепатит, хронический гепатит, коллагенозы, анкилозирующий спондилит, плечелопаточный периартрит, узелковый панартериит, хондрокальциноз, гранулематоз Вегенера, микроскопический полиангиит, хроническую крапивницу, буллезные кожные нарушения, пемфигоид, атопическую экзему, болезнь Девика, аутоиммунную гемолитическую анемию у детей, рефракторную или хроническую аутоиммунную цитопению, предупреждение образования аутоиммунных антител к фактору VIII при приобретенной гемофилии А, болезнь холодовых агглютининов, оптиконевромиелит, синдром скованного человека, гингивит, периодонтит, панкреатит, миокардит, васкулит, гастрит, подагру, суставную подагру и воспалительные кожные нарушения, выбранные из группы, состоящей из псориаза, атопического дерматита, экземы, розовых угрей, крапивницы и угрей, нормокомплементарного уртикарного васкулита, перикардита, миозита, анти-синтетазного синдрома, склерита, синдрома активации макрофагов, синдрома Бехчета, синдрома PAPA, синдрома Блау, подагры, болезни Стилла у взрослых и детей, криопиринопатии, синдрома Макла-Уэльса, семейного холодового аутовоспалительного синдрома, мультисистемного воспалительного заболевания неонатального возраста, семейной средиземноморской лихорадки, хронического детского неврологического кожного и суставного синдрома, системного ювенильного идиопатического артрита, синдрома гипериммуноглобулинемии-D, синдрома Шницлера, аутоиммунной ретинопатии, возрастной макулярной дегенерации, атеросклероза, хронического простатита и периодического синдрома, связанного с TNF-рецепторами (TRAPS).
Необязательно и предпочтительно аутоиммунное заболевание включает, без ограничения, любой из типов и подтипов любого из рассеянного склероза, ревматоидного артрита, сахарного диабета 1 типа, псориаза, системной красной волчанки, воспалительного заболевания кишечника, увеита и синдрома Шегрена.
Используемое в данном документе выражение "рассеянный склероз" включает одно или несколько из рассеянного склероза, доброкачественного рассеянного склероза, рецидивирующе-ремиттирующего рассеянного склероза, вторично прогрессирующего рассеянного склероза, первично прогрессирующего рассеянного склероза, прогрессирующего рецидивирующего рассеянного склероза, хронического прогрессирующего рассеянного склероза, транзиторного/прогрессирующего рассеянного склероза, быстро прогрессирующего рассеянного склероза, клинически определенного рассеянного склероза, злокачественного рассеянного склероза, также известного как вариант Марбурга, и острого рассеянного склероза. Необязательно "состояния, относящиеся к рассеянному склерозу" включают, например, болезнь Девика, также известную как оптиконевромиелит, острый рассеянный энцефаломиелит, острый демиелинизирующий неврит зрительного нерва, демиелинизирующий поперечный миелит, синдром Миллера-Фишера, энцефаломиелорадикулонейропатию, острую демиелинизирующую полинейропатию, опухолеподобный рассеянный склероз и концентрический склероз Бало.
Используемое в данном документе выражение "ревматоидный артрит" включает одно или несколько из ревматоидного артрита, подагры и псевдо-подагры, ювенильного идиопатического артрита, ювенильного ревматоидного артрита, болезни Стилла, анкилозирующего спондилоартрита, ревматоидного васкулита. Необязательно состояния, относящиеся к ревматоидному артриту, включают, например, остеоартрит, саркоидоз, пурпуру Шенлейна-Геноха, псориатический артрит, реактивный артрит, спондилоартропатию, септический артрит, гемохроматоз, гепатит, васкулит, гранулематоз Вегенера, болезнь Лайма, семейную средиземноморскую лихорадку, гипериммуноглобулинемию D с периодической лихорадкой, периодический синдром, связанный с TNF-рецепторами, и энтеропатический артрит, связанный с воспалительным заболеванием кишечника.
Используемое в данном документе выражение "увеит" включает одно или несколько из увеита, переднего увеита (или иридоциклита), промежуточного увеита (pars planitis), заднего увеита (или хориоретинита) и формы панувеита.
Используемое в данном документе выражение "воспалительное заболевание кишечника" включает одно или несколько из воспалительного заболевания кишечника, болезни Крона, язвенного колита (UC), коллагенового колита, лимфоцитарного колита, ишемического колита, колита, связанного с хирургическим изменением пассажа, болезни Бехчета, неопределенного колита.
Используемое в данном документе выражение "псориаз" включает одно или несколько из псориаза, непустулезного псориаза, в том числе псориаз обыкновенный и псориатическую эритродермию (эритродермический псориаз), пустулезного псориаза, в том числе генерализованный пустулезный псориаз (пустулезный псориаз фон Цумбуша), пальмарный и плантарный пустулез (персистирующий пальмоплантарный пустулез, пустулезный псориаз Барбера, пустулезный псориаз конечностей), кольцевидный пустулезный псориаз, акродерматит пустулезный, герпетиформное импетиго. Необязательно состояния, относящиеся к псориазу, включают, например, лекарственный псориаз, обратный псориаз, пеленочный псориаз, себорееподобный псориаз, каплевидный псориаз, псориаз ногтей, псориатический артрит.
Используемое в данном документе выражение "сахарный диабет 1 типа" включает одно или несколько из сахарного диабета 1 типа, инсулинозависимого сахарного диабета, идиопатического сахарного диабета, ювенильного сахарного диабета 1 типа, сахарного диабета зрелого возраста у молодых, латентного аутоиммунного сахарного диабета взрослых, гестационного сахарного диабета. Состояния, относящиеся к сахарному диабету 1 типа, включают нейропатии, в том числе полинейропатию, мононейропатию, периферическую нейропатию и автономную нейропатию; глазные осложнения: глаукому, катаракту, ретинопатию.
Используемое в данном документе выражение "синдром Шегрена" включает одно или несколько из синдрома Шегрена, первичного синдрома Шегрена и вторичного синдрома Шегрена, а также состояния, относящиеся к синдрому Шегрена, в том числе заболевание соединительной ткани, такое как ревматоидный артрит, системная красная волчанка или склеродермия. Другие осложнения включают пневмонию, фиброз легких, интерстициальный нефрит, воспаление тканей вокруг почечных фильтров, гломерулонефрит, ацидоз почечных канальцев, туннельный синдром кисти, периферическую нейропатию, краниальную нейропатию, первичный билиарный цирроз печени (РВС), цирроз, воспаление пищевода, желудка, поджелудочной железы и печени (в том числе гепатит), полимиозит, синдром Рейно, васкулит, аутоиммунные заболевания щитовидной железы, лимфому.
Используемое в данном документе выражение "системная красная волчанка" включает одно или несколько из системной красной волчанки, дискоидной красной волчанки, волчаночного артрита, волчаночного пневмонита, волчаночного нефрита. Состояния, относящиеся к системной красной волчанке, включают костно-суставной туберкулез, антифосфолипидный синдром, воспаление различных участков сердца, такое как перикардит, миокардит и эндокардит, воспаление легких и плевры, плеврит, плевральный выпот, хроническую диффузную интерстициальную болезнь легких, легочную гипертензию, эмболию легочной артерии, легочное кровотечение и синдром спавшегося легкого, головную боль при системной красной волчанке, синдром Гийена-Барре, асептический менингит, демиелинизирующий синдром, мононейропатию, множественный мононеврит, миастению, миелопатию, краниальную нейропатию, полинейропатию, васкулит.
Выражение "иммунологическое заболевание (или нарушение или состояние)", используемое в данном документе, следует понимать как охватывающий любое болезненное нарушение или состояние, выбранное из группы, включающей, без ограничения, аутоиммунные заболевания, воспалительные нарушения и иммунные нарушения, связанные с отторжением тканевого трансплантата, таким как острое и хроническое отторжение пересаженных органов, трансплантацией аллогенных стволовых клеток, трансплантацией аутологичных стволовых клеток, трансплантацией костного мозга и реакцией "трансплантат против хозяина".
Используемое в данном документе выражение "воспалительные нарушения" и/или "воспаление", используемые взаимозаменяемо, включают воспалительные нарушения, характеризующиеся нарушенным иммунным ответом на вредные стимулы, такие как патогенные микроорганизмы, поврежденные клетки или раздражающие вещества. Воспалительные нарушения лежат в основе огромного разнообразия заболеваний человека. Неиммунные заболевания, этиологически берущие начало в воспалительных процессах, включают рак, атеросклероз и ишемическую болезнь сердца. Примеры нарушений, связанных с воспалением, включают хронический простатит, гломерулонефрит, аллергии, воспалительные заболевания органов таза, реперфузионное повреждение, саркоидоз, васкулит, интерстициальный цистит, нормокомплементемический утрикарный васкулит, перикардит, миозит, анти-синтетазный синдром, склерит, синдром активации макрофагов, синдром Бехчета, синдром PAPA, синдром Блау, подагру, болезнь Стилла у взрослых и детей, криопиринопатию, синдром Макли-Уэллса, семейный холодовой аутовоспалительный синдром, мультисистемное воспалительное заболевание неонатального возраста, семейную средиземноморскую лихорадку, хронический детский неврологический кожный и суставной синдром, системный ювенильный идиопатический артрит, синдром гипериммуноглобулинемии-D, синдром Шницлера, периодический синдром, связанный с TNF-рецепторами (TRAPS), гингивит, периодонтит, гепатит, цирроз, панкреатит, миокардит, васкулит, гастрит, подагру, подагрический артрит и воспалительные кожные нарушения, выбранные из группы, состоящей из псориаза, атопического дерматита, экземы, розовых угрей, крапивницы и угрей.
Используемое в данном документе выражение "инфекционное нарушение и/или заболевание" и/или "инфекция", используемые взаимозаменяемо, включает любое нарушение, заболевание и/или состояние, вызванное присутствием и/или ростом патогенных биологических агентов в отдельном организме-хозяине. Используемое в данном документе выражение "инфекция" включает нарушение, заболевание и/или состояние, как указано выше, представляющее клинически явную болезнь (т.е. характерные медицинские признаки и/или симптомы заболевания), и/или которое является бессимптомным на протяжении большей части или на всем протяжении болезни. Используемое в данном документе выражение "инфекция" также включает нарушение, заболевание и/или состояние, вызванное персистенцией чужеродного антигена, что приводит к истощению Т-клеточного фенотипа, характеризующимся нарушением функции, которая проявляется как снижение пролиферации и продукции цитокинов. Используемое в данном документе выражение "инфекционное нарушение и/или болезнь" и/или "инфекция", кроме того, включает любое из перечисленных ниже инфекционных нарушений, заболеваний и/или состояний, вызванных бактериальной инфекцией, вирусной инфекцией, грибковой инфекцией и/или паразитарной инфекцией.
Используемое в данном документе выражение "вирусная инфекция" включает любую инфекцию, вызванную вирусом, необязательно включая, без ограничения, ретровирусы (например, вирус иммунодефицита человека, такой как HIV-1 или HIV-2, приобретенного иммунодефицита (AIDS), также называемый HTLV-III, LAV, или HTLV-III/LAV, или HIV-III, а также другие изоляты, такие как HIV-LP; пикорнавирусы (например, вирусы полиомиелита, вирус гепатита А, энтеровирусы, человеческий вирус коксаки, риновирусы, эховирусы); калицивирусы (например, штаммы, вызывающие гастроэнтерит); тогавирусы (например, вирусы лошадиного энцефалита, вирусы краснухи); флавивирусы (например, вирусы денге, вирусы энцефалита, вирусы желтой лихорадки); коронавирусы (например, коронавирусы); рабдовирусы (например, вирусы везикулярного стоматита, вирусы бешенства); филовирусы (например, вирусы Эбола); парамиксовирусы (например, вирусы парагриппа, вирус эпидемического паротита, вирус кори, респираторно-синцитиальный вирус); ортомиксовирусы (например, вирусы гриппа); буниавирусы (например, хантавирусы, буниавирусы, флебовирусы и наировирусы); аренавирусы (вирус геморрагической лихорадки); реовирусы (например, реовирусы, орбивирусы и ротавирусы); бирнавирусы; гепаднавирусы (вирус гепатита В); парвовирусы (парвовирусы); паповавирусы (вирусы папилломы, вирусы полиомы); аденовирусы (большинство аденовирусов); герпесвирусы (вирус простого герпеса (HSV) 1 и 2, вирус ветряной оспы, цитомегаловирус (CMV), вирусы герпеса); поксвирусы (вирусы натуральной оспы, вирусы коровьей оспы, вирусы оспы), и иридовирусы (например, вирус африканской чумы свиней), и неклассифицированные вирусы (например, возбудители губчатых энцефалопатий, возбудитель гепатитов дельта (считается дефектным сателлитом вируса гепатита В), возбудители ни-А, ни-В гепатита (класс 1 - вертикально передающиеся; класс 2 - парентерально передающиеся (т.е. гепатит С); Норуолк и родственные вирусы и астровирусы), а также вирус тяжелого острого респираторного синдрома и респираторно-синцитиальный вирус (RSV).
Используемое в данном документе выражение "грибковая инфекция" включает любую инфекцию, вызванную грибами, необязательно включая, без ограничения, Cryptococcus neoformans, Histoplasma capsulatum, Coccidioides immitis, Blastomyces dermatitidis, Chlamydia trachomatis, Candida albicans.
Используемое в данном документе выражение "паразитарная инфекция" включает любую инфекцию, вызванную паразитом, необязательно включая, без ограничения, простейших, таких как амебы, жгутиконосцы, малярийный плазмодий, токсоплазма, инфузории, кокцидии, микроспоридии, споровики; гельминтов, нематод (круглых червей), цестод (ленточных червей), трематод (сосальщиков), членистоногих и аберрантные белки, известные как прионы.
Инфекционное нарушение и/или заболевание, вызванное бактериями, может необязательно включать одно или более из сепсиса, септического шока, синусита, кожных инфекций, пневмонии, бронхита, менингита, бактериального вагиноза, инфекции мочевыводящих путей (UCI), бактериального гастроэнтерита, импетиго и рожистого воспаления, рожи, целлюлита, сибирской язвы, коклюша, болезни Лайма, бруцеллеза, энтерита, острого энтерита, столбняка, дифтерии, псевдомембранозного колита, газовой гангрены, острого пищевого отравления, анаэробного целлюлита, внутрибольничных инфекций, диареи, менингита у детей, диареи путешественника, геморрагического колита, гемолитико-уремического синдрома, туляремии, язвенной болезни, язвы желудка и двенадцатиперстной кишки, болезни легионеров, понтийской лихорадки, лептоспироза, листериоза, лепры (болезни Хансена), туберкулеза, гонореи, бленнореи новорожденных, септического артрита, менингококковой инфекции, в том числе менингита, синдрома Уотерхауса-Фридериксена, псевдомонадной инфекции, пятнистой лихорадки Скалистых гор, сальмонеллеза по типу брюшного тифа, сальмонеллеза с гастроэнтеритом и энтероколитом, бактериальной дизентерии/шигеллеза, коагулазо-позитивных стафилококковых инфекций: локализованных кожных инфекций, в том числе диффузных кожных инфекций (импетиго), подкожных инфекций, острого инфекционного эндокардита, септицемии, деструктивной пневмонии, заболеваний, вызванных токсином, таких как синдром токсического шока и стафилококковое пищевое отравление, цистита, эндометрита, среднего отита, стрептококкового фарингита, скарлатины, ревматической лихорадки, послеродового сепсиса, некротического фасциита, холеры, чумы (в том числе бубонной чумы и легочной чумы), а также любой инфекции, вызванной бактериями, выбранными из, без ограничения, Helicobacter pyloris, Boreliai Burgdorferi, Legionella pneumophilia, Mycobacteria sps (например, M. tuberculosis, M. avium, M. Intracellulare, M. kansaii, M. gordonae), Staphylococcus aureus, Neisseria gonorrhoeae, Neisseria meningitidis, Listeria monocytogenes, Streptococcus pyogenes (стрептококк группы A), Streptococcus agalactiae (стрептококк группы В), Streptococcus (группы viridans), Streptococcus faecalis, Streptococcus bovis, Streptococcus (анаэробных видов), Streptococcus pneumoniae, патогенный видов рода Campylobacter, Enterococcus, Haemophilus influenzae, Bacillus antracis, corynebacterium diphtheriae, видов рода corynebacterium, Erysipelothrix rhusiopathiae, Clostridium perfringers, Clostridium tetani, Enterobacter erogenes, Klebsiella pneuomiae, Pasturella multicoda, видов рода Bacteroides, Fusobacterium nucleatum, Sreptobacillus moniliformis, Treponema pallidium, Treponema pertenue, Leptospira и Actinomeyces israelli.
Неограничивающие примеры инфекционного нарушения и/или заболевания, вызванного вирусом, выбраны из группы, состоящей из, без ограничения, приобретенного иммунодефицита (AIDS), энцефалита Западного Нила, коронавирусной инфекции, риновирусной инфекции, гриппа, денге, геморрагической лихорадки; ушной инфекции; тяжелого острого респираторного синдрома (ТОРС), острого фебрильного фарингита, фарингоконъюнктивальной лихорадки, эпидемического кератоконъюнктивита, гастроэнтерита у детей, инфекционного мононуклеоза, лимфомы Беркитта, острого гепатита, хронического гепатита, цирроза печени, гепатоцеллюлярной карциномы, первичной инфекции HSV-1 (гингивостоматит у детей, тонзиллит и фарингит у взрослых, кератоконъюнктивит), латентной инфекции HSV-1 (лабиальный герпес, герпетическая лихорадка), асептического менингита, цитомегаловирусной инфекции, инклюзионной болезни, саркомы Капоши, болезни Кастлемена, первичной выпотной лимфомы, гриппа, кори, энцефалита, постинфекционного энцефаломиелита, свинки, гиперпластических эпителиальных повреждений (простых, плоских, подошвенных и аногенитальных бородавок, папиллом гортани, бородавчатой эпидермодисплазии), крупа, пневмонии, бронхиолита, полиомиелита, бешенства, бронхиолита, пневмонии, коревой краснухи, врожденной краснухи, геморрагической лихорадки, ветряной оспы, денге, инфекции Эбола, эховирусной инфекции, инфекции EBV, инфекционной эритемы, филовирусной, флавивирусной инфекции, везикулярного стоматита, вирусного опоясывающего лишая (опоясывающий герпес), эпидермальных поражений, связанных с вирусом папилломы человека, лихорадки Лаоса, лимфоцитарного хориоменингита, инфекции вируса парагриппа, парамиксовирусной инфекции, инфекции парвовируса В 19, пикорнавирусной, поксвирусной инфекции, ротавирусной диареи, краснухи, кори, ветряной оспы, инфекции натуральной оспы.
Инфекционное нарушение и/или заболевание, вызванное грибами, может необязательно включать, без ограничения, аллергический бронхолегочный аспергиллез, аспергиллому, аспергиллез, базидиоболомикоз, бластомикоз, кандидоз, хронический легочный аспергиллез, хитридиомикоз, кокцидиоидомикоз, конидиоболомикоз, твердую головню (ячмень), криптококкоз, дерматофит, микотический дерматит, дерматофитоз, вызванное эндотрикс, вызванное энтомопатогенным грибком, эпизоотический лимфангит, эпизоотический язвенный синдром, кандидоз пищевода, вызванное эктотрикс, фунгемию, гистоплазмоз, лобомикоз, вызванное Massospora Cicadina, микоз, вызванное Mycosphaerella fragariae, мирингомикоз, паракокцидиоидомикоз, вызванное патогенными грибками, пенициллез, болезнь тысячи язв, лишай, вызванное zeaspora, зигомикоз. Не ограничивающие примеры инфекционного нарушения и/или заболевания, вызванного паразитами, выбраны из группы, состоящей из, без ограничения, вызванное Acanthamoeba, амебиаза, аскаридоза, анкилостомидоза, анисакиаза, бабезиоза, балантидиаза, байлисаскаридоза, бластоцистоза, кандиру, болезни Шагаса, клонорхоза, кохлиомиаза, кокцидий, криптоспоридиоза китайского печеночного сосальщика, амебиаза Dientamoeba fragilis, дифиллоботриоза, инфекции Dioctophyme renalis, дракункулеза, эхинококкоза, слоновости, энтеробиоза, фасциолеза, фасциолопсиаза, филяриатоза, лямблиоза, гнатостомиаза, гименолепидоза, синдрома хальзун, изоспороза, лихорадки Катаяма, лейшманиоза, лимфатического филяриоза, малярии, метагонимоза, миаза, онхоцеркоза, педикулеза, первичного амебного менингоэнцефалита, паразитарной пневмонии, парагонимоза, чесотки, шистосомоза, сонной болезни, стронгилоидоза, спарганоза, риноспоридоза, речной слепоты, тениоза (причина цистицеркоза), токсокароза, токсоплазмоза, трихинеллеза, трихомониаза, трихиуриаза, трипаносомоза, тениидоза.
Предпочтительным примером инфекционного заболевания является заболевание, вызванной любым из возбудителя гепатита В, возбудителя гепатита С, возбудителя инфекционного мононуклеоза, EBV, цитомегаловируса, возбудителя AIDS, HIV-1, HIV-2, возбудителя туберкулеза, возбудителя малярии и возбудителя шистосомоза.
Используемое в данном документе выражение "вакцина" относится к биологическому препарату, который повышает иммунитет к конкретному заболеванию, где вакцина включает антиген, такой как ослабленные или убитые формы возбудителя, его токсины или один из его поверхностных белков, против которых вызывают иммунный ответ. Вакцина обычно включает адъювант в качестве иммунного потенциатора для стимуляции иммунной системы. Используемое в данном документе выражение "терапевтическая вакцина" и/или "терапевтическая вакцинация" относится к вакцине, используемой для лечения протекающих заболеваний, таких как инфекционное заболевание или рак.
Используемое в данном документе выражение "адъювант" относится к средству, используемому для стимуляции иммунной системы и повышения ответа на вакцину по сути без какого-либо специфического антигенного эффекта.
Используемое в данном документе выражение LY6G6F и/или белок (белки) LY6G6F относится к любому из белков, изложенных в SEQ ID NO:1, и/или их вариантам, и/или ортологам, и/или их фрагментам, и/или последовательностям нуклеиновых кислот, кодирующим их, которые по-разному экспрессируются при формах рака, которые указаны в данном документе, и/или инфекционных нарушениях, которые указаны в данном документе, и/или иммунологических нарушениях, которые указаны в данном документе, и/или которые играют роль в этиологии форм рака, и/или инфекционных нарушений, и/или иммунологических нарушений.
Согласно предпочтительным вариантами осуществления фрагмент LY6G6F содержит аминокислотную последовательность эктодомена LY6G6F, изложенную в любой из SEQ ID NO:2, 59, 81, 96, и/или ее варианты. Согласно предпочтительным вариантам осуществления ортолог LY6G6F содержит любую из SEQ ID NO:20, 29. Согласно предпочтительным вариантами осуществления последовательность нуклеиновой кислоты, кодирующая белок LY6G6F, содержит SEQ ID NO:33, 57 или 182.
Используемое в данном документе выражение VSIG10 и/или белок (белки) VSIG10 относится к любому из белков, изложенному в любой из SEQ ID NO:3, 5, и/или их вариантам, и/или ортологам, и/или их фрагментам, и/или последовательностям нуклеиновых кислот, кодирующим их, которые избирательно экспрессируются при формах рака, которые указаны в данном документе, и/или инфекционных нарушениях, которые указаны в данном документе, и/или иммунологических нарушениях, которые указаны в данном документе, и/или которые играют роль в этиологии форм рака и/или инфекционных нарушений и/или иммунологических нарушений.
Согласно предпочтительным вариантами осуществления фрагмент VSIG10 содержит аминокислотную последовательность эктодомена VSIG10, изложенную в любой из SEQ ID NO:4, 6, 60, 61, 82-93, 97-100, и/или ее варианты, и/или аминокислотную последовательность, содержащую уникальный краевой участок варианта VSIG10 (SEQ ID NO:5), продемонстрированный на Фигуре 2А. Согласно предпочтительным вариантами осуществления ортолог VSIG10 содержит любую из SEQ ID NO:19, 30. Согласно предпочтительным вариантами осуществления последовательность нуклеиновой кислоты, кодирующая белок VSIG10, содержит любую из SEQ ID NO:34, 35, 36, 183 или 184.
Используемое в данном документе выражение ТМЕМ25 и/или белок (белки) ТМЕМ25 относится к любому из белков, изложенному в любой из SEQ ID NO:7, 39, и/или их вариантам, и/или ортологам, и/или их фрагментам, и/или последовательностям нуклеиновых кислот, кодирующим их, которые избирательно экспрессируются при формах рака, которые указаны в данном документе, и/или инфекционных нарушениях, которые указаны в данном документе, и/или иммунологических нарушениях, которые указаны в данном документе, и/или которые играют роль в этиологии форм рака и/или инфекционных нарушений и/или иммунологических нарушений.
Согласно предпочтительным вариантам осуществления фрагмент ТМЕМ25 содержит аминокислотную последовательность эктодомена ТМЕМ25, изложенную в любой из SEQ ID NO:8, 39, 94, 101, и/или ее варианты. Согласно предпочтительным вариантами осуществления ортолог ТМЕМ25 содержит белок, имеющий последовательность согласно любой из SEQ ID NO:9 и/или 28. Согласно предпочтительным вариантами осуществления последовательность нуклеиновой кислоты, кодирующая белок ТМЕМ25, содержит любую из SEQ ID NO:37 или 185.
Используемое в данном документе выражение LSR и/или белок (белки) LSR относится к любому из белков, изложенных в любой из SEQ ID NO:11, 13, 15-18, 143, и/или их вариантам, и/или ортологам, и/или их фрагментам, и/или последовательностям нуклеиновых кислот, кодирующим их, которые избирательно экспрессируются при формах рака, которые указаны в данном документе, и/или инфекционных нарушениях, которые указаны в данном документе, и/или иммунологических нарушениях, которые указаны в данном документе, и/или которые играют роль в этиологии форм рака и/или инфекционных нарушений и/или иммунологических нарушений.
Согласно предпочтительным вариантам осуществления фрагмент LSR содержит аминокислотную последовательность эктодомена LSR, изложенную в любой из SEQ ID NO:10, 12, 14, 22, 47-50, 95, 102 и/или ее вариант, и/или аминокислотную последовательность, содержащую уникальный краевой участок варианта LSR (SEQ ID NO:18), продемонстрированный на фигуре 2G. Пример ортологов LSR представлен в любой из SEQ ID NO:21, 31, 32. Согласно предпочтительным вариантами осуществления последовательность нуклеиновой кислоты, кодирующая белок LSR, содержит любую из SEQ ID NO:40-46, 132, 155, 188, 186, 187, 145, 154.
Без ограничения какой-либо одной гипотезой, каждый из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения был предсказан, как иммунный костимулирующий белок, например, член семейства белков B7, который вовлекается в иммунную костимуляцию при помощи В7, в том числе, например, T-клеточных ответов, вызванных против раковых клеток, и которые вызывают воздействие на иммунитет, такое как запуск аутоиммунных эффектов.
Применяемое в данном документе выражение "растворимый эктодомен (ECD)" или "эктодомен" или "растворимый белок (белки)/молекула (молекулы) LY6G6F, VSIG10, ТМЕМ25 и/или LSR" из LY6G6F, VSIG10, ТМЕМ25 и/или LSR означает не связанные с клеточной поверхностью (т.е. циркулирующие) молекулы LY6G6F, VSIG10, ТМЕМ25 и/или LSR или любой их участок, включая, без ограничения: гибридные белки LY6G6F-Ig, VSIG10-Ig, TMEM25-Ig и/или LSR-Ig, где внеклеточный домен LY6G6F, VSIG10, ТМЕМ25 и/или LSR соединен с функциональной группой иммуноглобулина (Ig), делая гибридную молекулу растворимой, или их фрагменты и производные, белки с внеклеточным доменом LY6G6F, VSIG10, ТМЕМ25 и/или LSR, слитые или соединенные с участком биологически активного или химически активного белка, такого как продукт гена вируса папилломы Е7, связанный с меланомой антиген р97 или белок оболочки HIV, или их фрагменты и производные, гибридные (химерные) слитые белки, такие как LY6G6F-Ig, VSIG10-Ig, TMEM25-Ig и/или LSR-Ig, или их фрагменты и производные. Такие слитые белки описаны более подробно ниже.
"Растворимый белок (белки)/молекула (молекулы) LY6G6F, VSIG10, ТМЕМ25 и/или LSR" также включает молекулы LY6G6F, VSIG10, ТМЕМ25 и/или LSR с удаленным трансмембранным доменом для создания растворимого белка, или их фрагменты и производные; фрагменты, участки или их производные и мутантные молекулы растворимых LY6G6F, VSIG10, ТМЕМ25 и/или LSR. Растворимые молекулы LY6G6F, VSIG10, ТМЕМ25 и/или LSR, применяемые в способах согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения могут включать или не включать сигнальную (лидерную) пептидную последовательность.
Фрагменты полипептидов LY6G6F
Выражение "растворимый эктодомен (ECD)" или "эктодомен" или "растворимая" форма LY6G6F относится также к последовательности нуклеиновой кислоты, кодирующей соответствующие белки "растворимого эктодомена (ECD)" LY6G6F или "эктодомена" или "растворимых белков/молекул LY6G6F"). Необязательно ECD LY6G6F относится к любой из полипептидных последовательностей ниже и/или перечисленных в таблице А ниже, и/или их фрагментам или вариантам, сохраняющим по меньшей мере 80% идентичности последовательности, более предпочтительно по меньшей мере 90% идентичности последовательности с ними, и даже более предпочтительно по меньшей мере 95, 96, 97, 98 или 99% идентичности последовательности с ними, и/или их конъюгатам и/или полинуклеотидам, кодирующим вышеизложенное:
SEQ ID NO:2, аминокислотные остатки 17-234 (не включая сигнальный пептид, вплоть до трансмембранного) (фигура 1А):

и ее фрагментам и вариантам, сохраняющим по меньшей мере 80% идентичности последовательности, более предпочтительно по меньшей мере 90% идентичности последовательности с ней, и даже более предпочтительно по меньшей мере 95, 96, 97, 98 или 99% идентичности последовательности с ней. SEQ ID NO:59 представляет пример ECD LY6G6F, с сигнальным пептидом включительно.

Необязательно данный фрагмент составляет по меньшей мере приблизительно 62, 63, 64, 65 и т.д. аминокислот внеклеточного домена белка LY6G6F, изложенного в SEQ ID NO:1, вплоть до 228 аминокислот внеклеточного домена белка LY6G6F, необязательно включая любое целое значение от 62 до 228 аминокислот в длину. Предпочтительно данный фрагмент составляет по меньшей мере от приблизительно 62 и вплоть до 82 аминокислот внеклеточного домена белка LY6G6F, необязательно включая любое целое значение от 62 до 82 аминокислот в длину. Также предпочтительно данный фрагмент составляет по меньшей мере от приблизительно 95 и вплоть до 115 аминокислот внеклеточного домена белка LY6G6F, необязательно включая любое целое значение от 95 до 115 аминокислот в длину. Также предпочтительно данный фрагмент составляет по меньшей мере от приблизительно 208 и вплоть до 228 аминокислот внеклеточного домена белка LY6G6F, необязательно включая любое целое значение от 208 до 228 аминокислот в длину. Более предпочтительно, данный фрагмент составляет приблизительно 72 или 106, или 218 аминокислот. Белок фрагмента LY6G6F согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения может включать или не включать последовательность сигнального пептида, и может включать или не включать 1, 2, 3, 4 или 5 последовательных аминокислот из трансмембранного домена LY6G6F.
В частности, фрагменты внеклеточного домена LY6G6F могут включать любую последовательность, соответствующую любому участку из или содержащую домен IgV из внеклеточного домена LY6G6F, содержащего любую последовательность, соответствующую остаткам LY6G6F (SEQ ID NO:1), начиная с любого положения от 14 до 27 и заканчивая в любом положении от 112 до 132.
Белки LY6G6F содержат иммуноглобулиновый домен в пределах внеклеточного домена, домен IgV (или домен V), показанный на фигуре 1А в рамке, который относится к вариабельному домену антител. Домен IgV может отвечать за связывание с рецептором по аналогии с другими членами семейства В7. Домен Ig внеклеточного домена содержит одну дисульфидную связь, образованную между внутридоменными цистеиновыми остатками, которая является типичной для этой складки и может быть важной для структуры и функции. В SEQ ID NO:1 эти цистеины расположены при остатках 35 и 106.
В одном варианте осуществления предоставлен растворимый фрагмент LY6G6F, который более подробно описан ниже относительно раздела гибридных белков, такой растворимый фрагмент необязательно может быть описан, как первый партнер по слиянию. Применимыми фрагментами являются те, которые сохраняют способность связываться с их природными рецептором или рецепторами и/или сохраняют способность ингибировать активацию Т-клеток. Полипептид LY6G6F, который представляет собой фрагмент непроцессированного LY6G6F, как правило, характеризуется по меньшей мере 20 процентами, 30 процентами, 40 процентами, 50 процентами, 60 процентами, 70 процентами, 80 процентами, 90 процентами, 95 процентами, 98 процентами, 99 процентами, 100 процентами или даже более 100 процентами от способности связывать свой природный рецептор (рецепторы) и/или способности ингибировать активацию Т-клеток по сравнению с непроцессированным LY6G6F. Растворимые полипептидные фрагменты LY6G6F являются фрагментами полипептидов LY6G6F, которые могут быть выделены, секретированы или иным образом извлечены из продуцирующих клеток. В других вариантах осуществления растворимые фрагменты полипептидов LY6G6F включают фрагменты внеклеточного домена LY6G6F, которые сохраняют биологическую активность LY6G6F, такие как фрагменты, которые сохраняют способность связываться с их природным рецептором или рецепторами и/или сохраняют способность ингибировать активацию Т-клеток. Внеклеточный домен может включать 1, 2, 3, 4 или 5 последовательных аминокислот из трансмембранного домена и/или 1, 2, 3, 4 или 5 последовательных аминокислот из сигнальной последовательности. Альтернативно, во внеклеточном домене могут быть удалены 1, 2, 3, 4, 5 или более аминокислот с С-конца, N-конца или с обоих.
В некоторых вариантах осуществления полипептид внеклеточного домена LY6G6F содержит аминокислотную последовательность домена IgV, как изложено в любом одном из SEQ ID NO:81, или ее фрагменты или варианты или области между консервативными цистеинами домена IgV, расположенными при остатках 35 и 106 непроцессированного белка SEQ ID NO:1, соответствующей последовательности, изложенной в SEQ ID NO:96: CPSPPTLHGDEHLSWFCSPAAGSFTTLVAQVQVGRPAPDPGKPGRESRLRLLGNYSLWLEGSKEEDAGRYWC. В других вариантах осуществления полипептид внеклеточного домена LY6G6F состоит по сути из аминокислотной последовательности домена IgV, как изложено в любой из SEQ ID NO:81 и 96.
Как правило, полипептидные фрагменты LY6G6F экспрессируют из нуклеиновых кислот, которые включают последовательности, кодирующие сигнальную последовательность. Сигнальная последовательность, как правило, отщепляется от незрелого полипептида с получением зрелого полипептида, лишенного сигнальной последовательности. Сигнальная последовательность LY6G6F может быть заменена сигнальной последовательностью другого полипептида с использованием стандартных техник молекулярной биологии для воздействия на уровни экспрессии, секрецию, растворимость или другие свойства полипептида. Последовательность сигнального пептида, которую используют для замены последовательности сигнального пептида LY6G6F, может быть любой известной в данной области техники.
Необязательно ECD LY6G6F относится к любой из последовательностей нуклеиновых кислот, кодирующих полипептиды ECD LY6G6F, необязательно к последовательности нуклеиновой кислоты, изложенной в SEQ ID NO:33, или ее фрагментам и/или вырожденным вариантам, кодирующим полипептиды ECD LY6G6F, изложенные в SEQ ID NO:2.
Необязательно ECD LY6G6F относится к ортологичным полипептидам ECD. Необязательно ECD LY6G6F относится к полипептидам ECD LY6G6F мыши, изложенным в SEQ ID NO:20, и/или к гибридному полипептиду LY6G6F ECD-IgG2a-Fc мыши, изложенному в SEQ ID NO:23.
Фрагменты полипептидов VSIG10
Выражение "растворимый эктодомен (ECD)" или "эктодомен" или "растворимая" форма VSIG10 относится также к последовательности нуклеиновой кислоты, кодирующей соответствующие белки "растворимого эктодомена (ECD)" VSIG10 или "эктодомена" или "растворимых белков/молекул VSIG10"). Необязательно ECD VSIG10 относится к любой из полипептидных последовательностей ниже и/или перечисленным в таблице В ниже, и/или их фрагментам или вариантам, сохраняющим по меньшей мере 80% идентичности последовательности, более предпочтительно по меньшей мере 90% идентичности последовательности с ними, и даже более предпочтительно по меньшей мере 95, 96, 97, 98 или 99% идентичности последовательности с ними, и/или их конъюгатам и/или полинуклеотидам, кодирующим вышеизложенное: SEQ ID NO:4, аминокислотные остатки 31-413 (не включая сигнальный пептид, вплоть до трансмембранного) (фигура IВ):

SEQ ID NO:6, аминокислотные остатки 31-312 (вариант с пропуском экзона 3, не включая сигнальный пептид, вплоть до трансмембранного) (фигура 1С):

и ее вариантам, сохраняющим по меньшей мере 80% идентичности последовательности, более предпочтительно по меньшей мере 90% идентичности последовательности с ней, и даже более предпочтительно по меньшей мере 95, 96, 97, 98 или 99% идентичности последовательности с ней. SEQ ID NO:60-61 представляют примеры ECD VSIG10, в том числе сигнальный пептид.
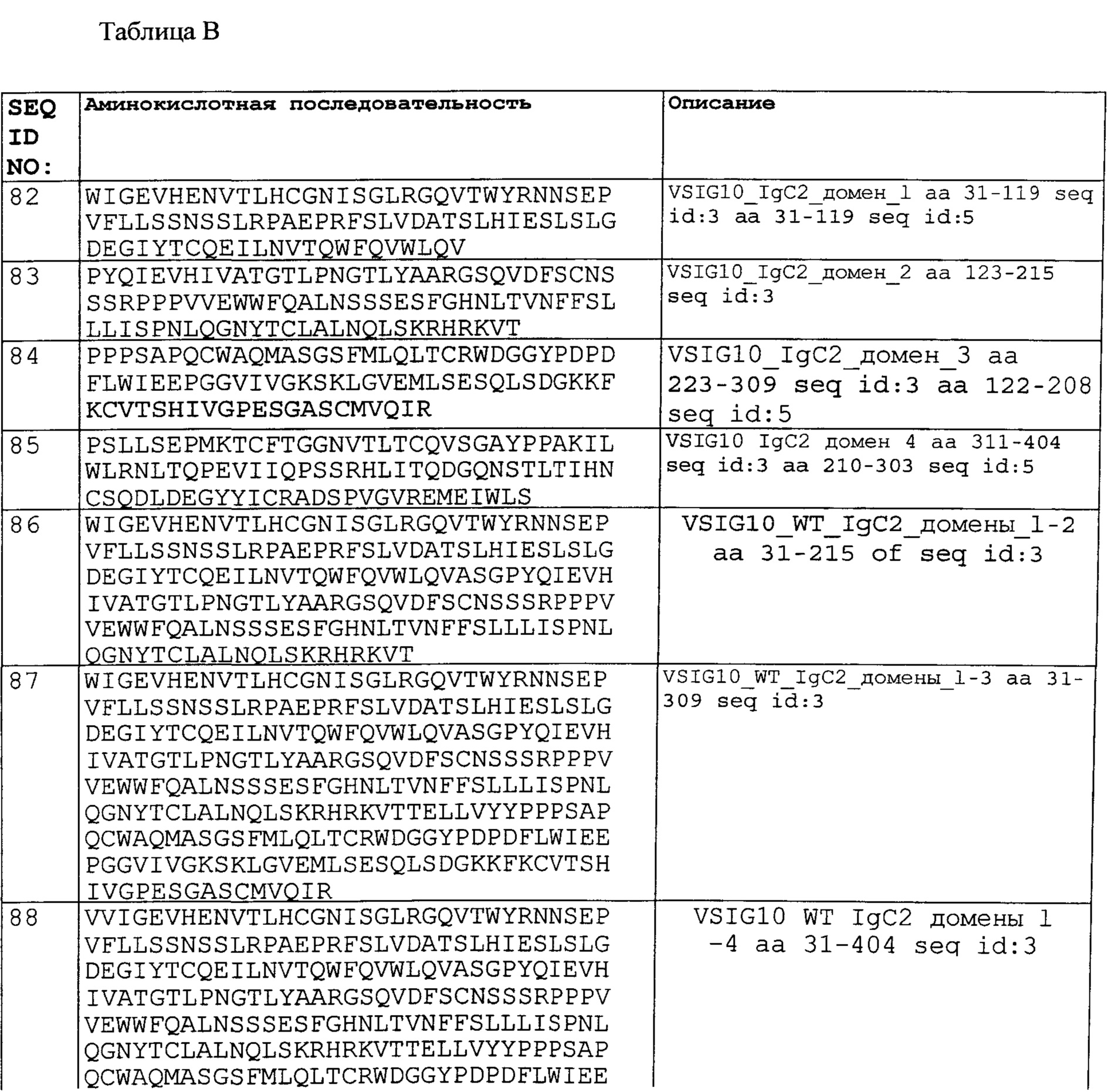

Необязательно данный фрагмент составляет по меньшей мере приблизительно 36, 37, 38, 39, 40, 41, 42, 43 и т.д. аминокислот внеклеточного домена белка VSIG10, изложенного в SEQ ID NO:3, вплоть до 393 аминокислот внеклеточного домена белка VSIG10, необязательно включая любое целое значение от 36 до 393 аминокислот в длину. Предпочтительно данный фрагмент составляет по меньшей мере от приблизительно 36 вплоть до 70 аминокислот внеклеточного домена белка VSIG10, необязательно включая любое целое значение от 36 до 70 аминокислот в длину. Также предпочтительно данный фрагмент составляет по меньшей мере от приблизительно 80 вплоть до 100 аминокислот внеклеточного домена белка VSIG10, необязательно включая любое целое значение от 80 до 100 аминокислот в длину. Также предпочтительно, данный фрагмент составляет по меньшей мере от приблизительно 170 вплоть до 200 аминокислот внеклеточного домена белка VSIG10, необязательно включая любое целое значение от 170 до 200 аминокислот в длину. Также предпочтительно, данный фрагмент составляет по меньшей мере от приблизительно 265 вплоть до 290 аминокислот внеклеточного домена белка VSIG10, необязательно включая любое целое значение от 265 до 290 аминокислот в длину. Также предпочтительно, данный фрагмент составляет по меньшей мере от приблизительно 365 вплоть до 393 аминокислот внеклеточного домена белка VSIG10, необязательно включая любое целое значение между 365 и 393 аминокислот в длину. Более предпочтительно данный фрагмент составляет приблизительно 46, 49, 58, 60, 87, 89, 93, 94, 178, 182, 185, 187, 273, 279, 282, 374, 383 аминокислот. Белок фрагмента VSIG10 согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения может включать или не включать последовательность сигнального пептида, и может включать или не включать 1, 2, 3, 4 или 5 последовательных аминокислот из трансмембранного домена VSIG10.
В частности, фрагменты внеклеточного домена VSIG10 могут включать любую последовательность, соответствующую любому участку из или содержащей один или несколько доменов IgC2 внеклеточного домена VSIG10, содержащего любую последовательность, соответствующую остаткам VSIG10 (SEQ ID NO:3), начиная с любого положения от 28 до 41 и заканчивая в любом положении от 109 до 122, или начиная с любого положения от 120 до 133 и заканчивая в любом положении от 205 до 222, или начиная с любого положения от 216 до 233 и заканчивая в любом положении от 299 до 310, или начиная с любого положения от 310 до 321 и заканчивая в любом положении от 394 до 414, или начиная с любого положения от 28 до 41 и заканчивая в любом положении от 205 до 222, или начиная с любого положения от 28 до 41 и заканчивая в любом положении от 299 до 310, или начиная с любого положения от 28 до 41 и заканчивая в любом положении от 394 до 414, или начиная с любого положения от 120 до 133 и заканчивая в любом положении от 299 до 310, или начиная с любого положения от 120 до 133 и заканчивая в любом положении от 394 до 414, или начиная с любого положения от 216 до 233 и заканчивается в любом положении от 394 до 414, или содержащего любую последовательность, соответствующую остаткам VSIG10_вариант_c пропуском_экзона_3_Т95617_Р6 (SEQ ID NO:5), начиная с любого положения от 28 до 41 и заканчивая в любом положении от 198 до 209, или начиная с любого положения от 28 до 41 и заканчивая в любом положении от 293 до 313.
Белки VSIG10 содержат иммуноглобулиновые домены в пределах внеклеточного домена, домен IgC2 (или Ig-подобный домен С2 или домен Ig популяции С2), который связан с константным доменом антител. Домены показаны на фигуре 1B (для SEQ ID NO:3) и на фигуре 1C (для SEQ ID NO:5). Домены Ig внеклеточного домена содержат одну дисульфидную связь, образованную между внутридоменными цистеиновыми остатками, которая является типичной для этой складки и может быть важной для структуры и функции. В SEQ ID NO:3 эти цистеины расположены при остатках 44 и 103, и при остатках 153 и 201, и при остатках 245 и 290, и при остатках 331 и 388. В SEQ ID NO:5 эти цистеины расположены при остатках 44 и 103, и 144 и 189, и при остатках 230 и 287.
В одном варианте осуществления предложен растворимый фрагмент VSIG10, который необязательно может быть описан как первый партнер по слиянию в приведенном ниже разделе гибридных белков. Применимыми фрагментами являются те, которые сохраняют способность связывать их природный рецептор или рецепторы и/или сохраняют способность ингибировать активацию Т-клеток. Полипептид VSIG10, который представляет собой фрагмент непроцессированного VSIG10, как правило, характеризуется по меньшей мере 20 процентами, 30 процентами, 40 процентами, 50 процентами, 60 процентами, 70 процентами, 80 процентами, 90 процентами, 95 процентами, 98 процентами, 99 процентами, 100 процентами или даже более 100 процентами от способности связывать свой природный рецептор (рецепторы) и/или способности ингибировать активацию Т-клеток по сравнению с непроцессированным VSIG10. Растворимые полипептидные фрагменты VSIG10 являются фрагментами полипептидов VSIG10, которые могут быть выделены, секретированы или иным образом извлечены из продуцирующих клеток. В других вариантах осуществления растворимые фрагменты полипептидов VSIG10 включают фрагменты внеклеточного домена VSIG10, которые сохраняют биологическую активность VSIG10, такие как фрагменты, которые сохраняют способность связываться с их природным рецептором или рецепторами и/или сохраняют способность ингибировать активацию Т-клеток. Внеклеточный домен может включать 1, 2, 3, 4 или 5 последовательных аминокислот из трансмембранного домена и/или 1, 2, 3, 4 или 5 последовательных аминокислот из сигнальной последовательности. Альтернативно, во внеклеточном домене могут быть удалены 1, 2, 3, 4, 5 или более аминокислот с С-конца, N-конца или с обоих.
В некоторых вариантах осуществления полипептид внеклеточного домена VSIG10 содержит аминокислотную последовательность по меньшей мере одного из доменов IgC2, как изложено в любом одном из SEQ ID NO:82, 83, 84 и 85, или его фрагменты или варианты или области между консервативными цистеинами доменов IgC2, расположенными при остатках 44 и 103 непроцессированного белка SEQ ID NO:3, соответствующей последовательности, изложенной в SEQ ID NO:97: CGNISGLRGQVTWYRNNSEPVFLLSSNSSLRPAEPRFSLVDATSLHIESLSLGDEGIYTC, или расположенной по остаткам 153 и 201 непроцессированного белка SEQ ID NO:3, соответствующей последовательности, изложенной в SEQ ID NO:98: CNSSSRPPPWEWWFQALNSSSESFGHNLTVNFFSLLLISPNLQGNYTC, или расположенной по остаткам 245 и 209 непроцессированного белка SEQ ID NO:3, соответствующей последовательности, изложенной в SEQ ID NO:99: CRWDGGYPDPDFLWIEEPGGVIVGKSKLGVEMLSESQLSDGKKFKC, или расположенной при остатках 331 и 388 непроцессированного белка SEQ ID NO:3, соответствующей последовательности, изложенной в SEQ ID NO:100: CQVSGAYPPAKILWLRNLTQPEVIIQPSSRHLITQDGQNSTLTIHNCSQDLDEGYYI С. В некоторых дополнительных вариантах осуществления полипептид внеклеточного домена VSIG10 состоит по сути из аминокислотной последовательности по меньшей мере одной из SEQ ID NO:82-93, 97-100.
Как правило, полипептидные фрагменты VSIG10 экспрессируют из нуклеиновых кислот, которые включают последовательности, кодирующие сигнальную последовательность. Сигнальная последовательность, как правило, отщепляется от незрелого полипептида с получением зрелого полипептида, лишенного сигнальной последовательности. Сигнальная последовательность VSIG10 может быть заменена сигнальной последовательностью другого полипептида с использованием стандартных техник молекулярной биологии для воздействия на уровни экспрессии, секрецию, растворимость или другие свойства полипептида. Последовательность сигнального пептида, которую используют для замены последовательности сигнального пептида VSIG10, может быть любой известной из уровня техники.
Необязательно ECD VSIG10 относится к любой из последовательностей нуклеиновых кислот, кодирующих полипептиды ECD VSIG10, необязательно к последовательностям нуклеиновых кислот, изложенным в SEQ ID NO:34, 36, или их фрагментам и/или вырожденным вариантам, кодирующим полипептиды ECD VSIG10, изложенные в SEQ ID NO:4, 6, соответственно.
Необязательно ECD VSIG10 относится к ортологичным полипептидам ECD. Необязательно ECD VSIG10 относится к полипептидам ECD VSIG10 мыши, изложенным в SEQ ID NO:19, и/или к гибридному полипептиду VSIG10 ECD-IgG2a-Fc мыши, изложенному в SEQ ID NO:24.
Фрагменты полипептидов TMEM25
Выражение "растворимый эктодомен (ECD)" или "эктодомен" или "растворимая" форма TMEM25 относится также к последовательности нуклеиновой кислоты, кодирующей соответствующие белки "растворимого эктодомена (ECD)" TMEM25 или "эктодомена" или "растворимых белков/молекул TMEM25"). Необязательно ECD TMEM25 относится к любой из полипептидных последовательностей ниже и/или перечисленным в таблице С ниже, и/или их фрагментам или вариантам, сохраняющим по меньшей мере 80% идентичности последовательности, более предпочтительно по меньшей мере 90% идентичности последовательности с ними, и даже более предпочтительно по меньшей мере 95, 96, 97, 98 или 99% идентичности последовательности с ними, и/или их конъюгатам и/или полинуклеотидам, кодирующим вышеизложенное: SEQ ID NO:8, аминокислотные остатки 27-232 (не включая сигнальный пептид, вплоть до трансмембранного) (фигура ID):
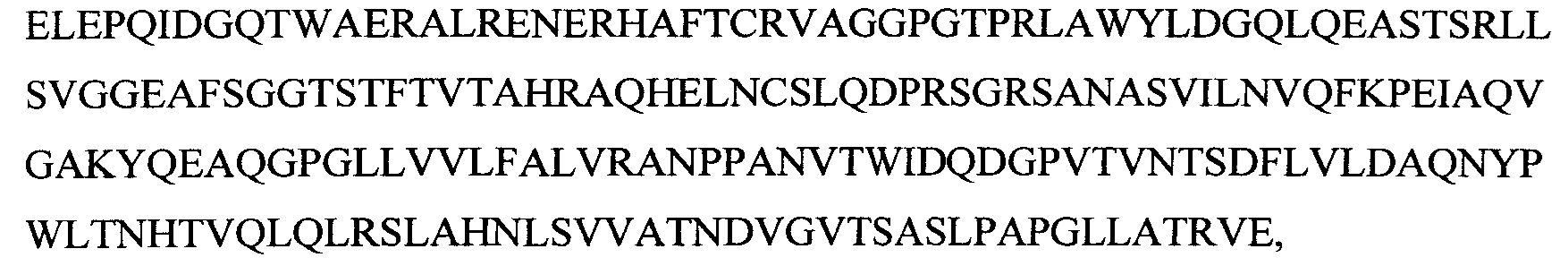
и ее вариантам, сохраняющим, по меньшей мере, 80% идентичности последовательности, более предпочтительно по меньшей мере 90% идентичности последовательности с ней, и даже более предпочтительно по меньшей мере 95, 96, 97, 98 или 99% идентичности последовательности с ней. SEQ ID NO:39 представляет пример ECD TMEM25 ECD, в том числе сигнальный пептид.

Необязательно данный фрагмент составляет по меньшей мере приблизительно 46, 47, 48, 49, 50, 51, 52 и т.д. аминокислот внеклеточного домена белка TMEM25, изложенного в SEQ ID NO:7, вплоть до 216 аминокислот внеклеточного домена белка TMEM25, необязательно включая любое целое значение от 46 до 216 аминокислот в длину. Предпочтительно, данный фрагмент составляет по меньшей мере от приблизительно 46 и вплоть до 66 аминокислот внеклеточного домена белка ТМЕМ25, необязательно включая любое целое значение от 46 до 66 аминокислот в длину. Также предпочтительно, данный фрагмент составляет по меньшей мере от приблизительно 84 и вплоть до 104 аминокислот внеклеточного домена белка ТМЕМ25, необязательно включая любое целое значение от 84 до 104 аминокислот в длину. Также предпочтительно, данный фрагмент составляет по меньшей мере от приблизительно 196 и вплоть до 216 аминокислот внеклеточного домена белка ТМЕМ25, необязательно включая любое целое значение от 196 и 216 аминокислот в длину. Более предпочтительно данный фрагмент составляет приблизительно 56 или 94, или 206 аминокислот. Белок фрагмента ТМЕМ25 согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения может включать или не включать последовательность сигнального пептида, и может включать или не включать 1, 2, 3, 4 или 5 последовательных аминокислот из трансмембранного домена ТМЕМ25.
В частности, фрагменты внеклеточного домена ТМЕМ25 могут включать любую последовательность, соответствующую любому участку из или содержащую домен IgC2 из внеклеточного домена ТМЕМ25, содержащего любую последовательность, соответствующую остаткам ТМЕМ25 (SEQ ID NO:7), начиная с любого положения от 27 до 40 и заканчивается при любом положении от 113 до 133.
Белки ТМЕМ25 содержат иммуноглобулиновый домен в пределах внеклеточного домена, домен IgC2 (или Ig-подобный домен С2, или домен Ig популяции С2), который связан с константным доменом антител. Домен показан на фигуре ID в рамке. Домен Ig внеклеточного домена содержит одну дисульфидную связь, образованную между внутридоменными цистеиновыми остатками, которая является типичной для этой складки и может быть важной для структуры и функции. В SEQ ID NO:7 эти цистеины расположены при остатках 52 и 107.
В одном варианте осуществления предоставлен растворимый фрагмент ТМЕМ25, который необязательно может быть описан, как первый партнер по слиянию, как, например, в подробном разделе гибридных белков ниже. Применимыми фрагментами являются те, которые сохраняют способность связывать их природный рецептор или рецепторы и/или сохраняют способность ингибировать активацию Т-клеток. Полипептид ТМЕМ25, который представляет собой фрагмент непроцессированного ТМЕМ25 как правило характеризуется по меньшей мере 20 процентами, 30 процентами, 40 процентами, 50 процентами, 60 процентами, 70 процентами, 80 процентами, 90 процентами, 95 процентами, 98 процентами, 99 процентами, 100 процентами или даже более 100 процентами от способности связывать свой природный рецептор (рецепторы) и/или способности ингибировать активацию Т-клеток по сравнению с непроцессированным ТМЕМ25. Растворимые полипептидные фрагменты ТМЕМ25 являются фрагментами полипептидов ТМЕМ25, которые могут быть выделены, секретированы или иным образом извлечены из продуцирующих клеток. В других вариантах осуществления растворимые фрагменты полипептидов ТМЕМ25 содержат фрагменты внеклеточного домена ТМЕМ25, которые сохраняют биологическую активность ТМЕМ25, такие как фрагменты, которые сохраняют способность связываться с их природным рецептором или рецепторами и/или сохраняют способность ингибировать активацию Т-клеток. Внеклеточный домен может включать 1, 2, 3, 4 или 5 последовательных аминокислот из трансмембранного домена и/или 1, 2, 3, 4 или 5 последовательных аминокислот из сигнальной последовательности. Альтернативно, во внеклеточном домене может быть удаление 1, 2, 3, 4, 5 или более аминокислот с С-конца, N-конца или с обоих.
В некоторых вариантах осуществления полипептид внеклеточного домена ТМЕМ25 содержит аминокислотную последовательность домена IgC2, как изложено в любом одном из SEQ ID NO:94, или ее фрагменты или варианты или области между консервативными цистеинами домена IgC2, расположенными при остатках 52 и 107 непроцессированного белка SEQ ID NO:7, соответствующей последовательности, изложенной в SEQ ID NO:101: CRVAGGPGTPRLAWYLDGQLQEASTSRLLSVGGEAFSGGTSTFTVTAHRAQHELNC. В других вариантах осуществления полипептид внеклеточного домена ТМЕМ25 состоит по сути из аминокислотной последовательности домена IgC2, как изложено в любой из SEQ ID NO:94 и 101.
Как правило, полипептидные фрагменты ТМЕМ25 экспрессируют из нуклеиновых кислот, которые включают последовательности, кодирующие сигнальную последовательность. Сигнальная последовательность, как правило, отщепляется от незрелого полипептида с получением зрелого полипептида, лишенного сигнальной последовательности. Сигнальная последовательность ТМЕМ25 может быть заменена сигнальной последовательностью другого полипептида с использованием стандартных техник молекулярной биологии для влияния на уровни экспрессии, секрецию, растворимость или другие свойства полипептида. Последовательность сигнального пептида, которую используют для замены последовательности сигнального пептида ТМЕМ25, может быть любой известной из уровня техники.
Необязательно ECD ТМЕМ25 относится также к любой из последовательностей нуклеиновых кислот, кодирующих полипептиды ECD ТМЕМ25, необязательно к последовательности нуклеиновой кислоты, изложенной в SEQ ID NO:37, или ее фрагментам и/или вырожденным вариантам, кодирующей полипептиды ECD ТМЕМ25, изложенные в SEQ ID NO:8.
Необязательно ECD ТМЕМ25 относится к ортологичным полипептидам ECD. Необязательно ECD ТМЕМ25 относится к полипептидам ECD ТМЕМ25 мыши, изложенным в SEQ ID NO:9, и/или к гибридному полипептиду ТМЕМ25 ECD-IgG2a-Fe мыши, изложенному в SEQ ID NO:25.
Фрагменты полипептидов LSR
Выражение "растворимый эктодомен (ECD)" или "эктодомен" или "растворимая" форма LSR относится также к последовательностям нуклеиновых кислот, кодирующим соответствующие белки "растворимого эктодомена (ECD)" LSR или "эктодомена" или "растворимых белков/молекул LSR"). Необязательно ECD LSR относится к любой из полипептидных последовательностей ниже и/или перечисленным в таблице D ниже, и/или их фрагментам или вариантам, сохраняющим по меньшей мере 80% идентичности последовательности, более предпочтительно по меньшей мере 90% идентичности последовательности с ними, и даже более предпочтительно по меньшей мере 95, 96, 97, 98 или 99% идентичности последовательности с ними, и/или их конъюгатам и/или полинуклеотидам, кодирующим вышеизложенное:
SEQ ID NO:12, аминокислотные остатки 42-211 ECD А-изоформы LSR (не включая сигнальный пептид, вплоть до трансмембранного) (фигура 1Е):

SEQ ID NO:14, аминокислотные остатки 42-192 ECD В-изоформы LSR (не включая сигнальный пептид, вплоть до трансмембранного) (фигура 1F):

SEQ ID NO:47, аминокислотные остатки 42-533 секретируемого варианта C-изоформы LSR (фигура 1G):

SEQ ID NO:48, аминокислотные остатки 42-532 секретируемого варианта D-изоформы LSR (фигура 1Н)

SEQ ID NO:49, аминокислотные остатки 42-493 секретируемого варианта E-изоформы LSR (фигура 1I):

SEQ ID NO:50, аминокислотные остатки 42-552 секретируемого варианта F-изоформы LSR (фигура 1J):

и их вариантам, сохраняющим по меньшей мере 80% идентичности последовательности, более предпочтительно по меньшей мере 90% идентичности последовательности с ними, и даже более предпочтительно по меньшей мере 95, 96, 97, 98 или 99% идентичности последовательности с ними. SEQ ID NO:10, 22 представляют пример ECD LSR, в том числе сигнальный пептид.
Необязательно данный фрагмент составляет по меньшей мере приблизительно 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110 и т.д., аминокислот внеклеточного домена белка LSR, изложенного в SEQ ID NO:11 и/или 143, вплоть до 198 аминокислот внеклеточного домена, необязательно включая любое целое значение от 100 до 198 аминокислот в длину. Белок фрагмента LSR согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения может включать или не включать последовательность сигнального пептида, и может включать или не включать 1, 2, 3, 4 или 5 последовательных аминокислот из трансмембранного домена LSR.

Необязательно данный фрагмент составляет по меньшей мере приблизительно 98, 99, 100, 101, 102 и т.д., аминокислот внеклеточного домена белка LSR изложенного в SEQ ID NO:11, вплоть до 180 аминокислот внеклеточного домена белка LY6G6F, необязательно включая любое целое значение от 98 до 180 аминокислот в длину. Предпочтительно данный фрагмент составляет по меньшей мере от приблизительно 98 вплоть до 118 аминокислот внеклеточного домена белка LSR, необязательно включая любое целое значение от 98 до 118 аминокислот в длину. Также предпочтительно, данный фрагмент составляет по меньшей мере от приблизительно 135 вплоть до 155 аминокислот внеклеточного домена белка LSR, необязательно включая любое целое значение от 135 до 155 аминокислот в длину. Также предпочтительно, данный фрагмент составляет по меньшей мере от приблизительно 160 вплоть до 180 аминокислот внеклеточного домена белка LSR, необязательно включая любое целое значение от 160 до 180 аминокислот в длину. Более предпочтительно, данный фрагмент составляет приблизительно 108 или 145, или 170 аминокислот. Белок фрагмента LSR согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения может включать или не включать с себя последовательность сигнального пептида, и может включать или не включать 1, 2, 3, 4 или 5 последовательных аминокислот из трансмембранного домена LSR.
Белки LSR содержат иммуноглобулиновый домен в пределах внеклеточного домена, домен IgV (или домен V), который относится к вариабельному домену антител. Домен Ig показан в рамке на фигурах 1E, 1F, 1G, 1Н и 1I для SEQ ID NO:11, 13, 15, 16 и 18, соответственно. Домен Ig внеклеточного домена содержит одну дисульфидную связь, образованную между внутридоменными цистеиновыми остатками, которая является типичной для этой складки и может быть важной для структуры и функции. В SEQ ID NO:11 эти цистеины расположены при остатках 63 и 170.
В одном варианте осуществления предоставлен растворимый фрагмент LSR, который необязательно может быть описан, как первый партнер по слиянию, как, например, в нижеприведенном разделе относительно гибридных белков. Применимыми фрагментами являются те, которые сохраняют способность связывать их природный рецептор или рецепторы и/или сохраняют способность ингибировать активацию Т-клеток. Полипептид LSR который представляет собой фрагмент непроцессированного LSR, как правило, характеризуется по меньшей мере 20 процентами, 30 процентами, 40 процентами, 50 процентами, 60 процентами, 70 процентами, 80 процентами, 90 процентами, 95 процентами, 98 процентами, 99 процентами, 100 процентами или даже более 100 процентами от способности связывать свой природный рецептор (рецепторы) и/или способности ингибировать активацию Т-клеток, по сравнению с непроцессированным LSR. Растворимые полипептидные фрагменты LSR являются фрагментами полипептидов LSR, которые могут быть выделены, секретированы или иным образом извлечены из продуцирующих клеток. В других вариантах осуществления растворимые фрагменты полипептидов LSR включают фрагменты внеклеточного домена LSR, которые сохраняют биологическую активность LSR, такие как фрагменты, которые сохраняют способность связываться с их природным рецептором или рецепторами и/или сохраняют способность ингибировать активацию Т-клеток. Внеклеточный домен может включать 1, 2, 3, 4 или 5 последовательных аминокислот из трансмембранного домена и/или 1, 2, 3, 4 или 5 последовательных аминокислот из сигнальной последовательности. Альтернативно, во внеклеточном домене может быть удаление 1, 2, 3, 4, 5 или более аминокислот с С-конца, N-конца или с обоих.
В некоторых вариантах осуществления полипептид внеклеточного домена LSR содержит аминокислотную последовательность домена IgV, как изложено в любом одном из SEQ ID NO:95, или ее фрагментах или вариантах или области между консервативными цистеинами домена IgV, расположенными по остаткам 63 и 170 непроцессированного белка SEQ ID NO:11, соответствующей последовательности, изложенной в SEQ ID NO:102: CTYQMTSTPTQPIVIWKYKSFCRDRIADAFSPASVDNQLNAQLAAGNPGYNPYVECQDSVRTVRWATKQGNAVTLGDYYQGRRITITGNADLTFDQTAWGDSGVYYC. В некоторых дополнительных вариантах осуществления полипептид внеклеточного домена LSR состоит по сути из аминокислотной последовательности домена IgV как изложено в любой из SEQ ID NO:95 и SEQ ID NO:102.
Как правило, полипептидные фрагменты LSR экспрессируют из нуклеиновых кислот, которые включают последовательности, кодирующие сигнальную последовательность. Сигнальная последовательность как правило отщепляется от незрелого полипептида с получением зрелого полипептида, лишенного сигнальной последовательности. Сигнальная последовательность LSR может быть заменена сигнальной последовательностью другого полипептида с использованием стандартных техник молекулярной биологии для воздействия на уровни экспрессии, секрецию, растворимость или другие свойства полипептида. Последовательность сигнального пептида, которую используют для замены последовательности сигнального пептида LSR, может быть любой известной из уровня техники.
Необязательно ECD LSR относится к любой из последовательностей нуклеиновых кислот, кодирующих полипептиды ECD LSR, необязательно к последовательностям нуклеиновых кислот, изложенным в SEQ ID NO:40, 41, 132, 44, 155, 188, или их фрагментам и/или вырожденным вариантам, кодирующим полипептиды ECD LSR, изложенные в любой из SEQ ID NO:12, 14, 47, 48, 49, 50, соответственно.
Необязательно ECD LSR относится к ортологичным полипептидам ECD. Необязательно ECD LSR относится к полипептидам ECD LSR мыши, изложенным в SEQ ID NO:21, и/или к гибридному полипептиду LSR ECD-IgG2a-Fc мыши, изложенному в SEQ ID NO:26.
Варианты полипептидов LY6G6F, VSIG10, ТМЕМ25 и/или LSR
Настоящее изобретение охватывает применяемые варианты полипептидов LY6G6F, VSIG10, ТМЕМ25 и/или LSR, в том числе те, которые повышают биологическую активность, как указано с помощью любого из анализов, описанных в данном документе, или которые увеличивают период полураспада или стабильность белка. Растворимые белки LY6G6F, VSIG10, ТМЕМ25 и/или LSR или их фрагменты, или их слитые формы, обладающие активностью белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, соответственно, могут быть сконструированы для повышения биологической активности. В дополнительном варианте осуществления белки LY6G6F, VSIG10, ТМЕМ25 и/или LSR или слитый белок модифицируют по меньшей мере с помощью одной аминокислотной замены, делеции или вставки, которая увеличивает связывание молекулы с иммунной клеткой, например, Т-клеткой, и передает ингибирующий сигнал в Т-клетку. Другими факультативными вариантами являются те белки LY6G6F, VSIG10, ТМЕМ25 и/или LSR, которые сконструированы для селективного связывания с одним типом Т-клеток в противовес другим иммунным клеткам. Например, полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR может быть сконструирован для необязательного связывания с клетками Treg, Th0, Тh1, Тh17 Th2 или Th22. Преимущественное связывание относится к связыванию, которое по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или более для одного типа клетки по сравнению с другим типом клетки. Другие варианты белка LY6G6F, VSIG10, ТМЕМ25 и/или LSR могут быть сконструированы для уменьшения связывания с иммунными клеткам по сравнению с диким типом белка LY6G6F, VSIG10, ТМЕМ25 и/или LSR, соответственно. Эти варианты могут быть использованы в комбинации с вариантами, обладающими сильными связывающими свойствами, для модулировании иммунного ответа с умеренным воздействием.
Также необязательно вариантный белок LY6G6F, VSIG10, ТМЕМ25 и/или LSR может быть сконструирован для увеличенного периода полураспада по сравнению с диким типом. Эти варианты обычно модифицируют для устойчивости к ферментативному расщеплению. Иллюстративные модификации включают модифицированные аминокислотные остатки и модифицированные пептидные связи, которые устойчивы к ферментативному расщеплению. Различные модификации для достижения этого известны из уровня техники.
Белок LY6G6F (SEQ ID NO:1) также содержит следующие SNP (однонуклеотидный полиморфизм), не относящиеся к "молчащим", которые перечислены в таблице Е, (даны согласно их положению (положениям) в аминокислотной последовательности с указанной альтернативной аминокислотой), причем наличие SNP в последовательности (SEQ ID NO:1) белка LY6G6F предоставляет основу для альтернативной последовательности (последовательностей) этого белка согласно настоящему изобретению. SEQ ID NO:58 является примером такой альтернативной последовательности с альтернативными аминокислотами, с использованием ряда SNP, указанных ниже
Белок LSR (SEQ ID NO:11) также содержит следующие SNP (однонуклеотидный полиморфизм), не относящиеся к "молчащим", которые перечислены в таблице F, (даны согласно их положению (положениям) в аминокислотной последовательности с указанной альтернативной аминокислотой; причем наличие SNP в последовательности (SEQ ID NO:11) белка LSR предоставляет основу для альтернативной последовательности (последовательностей) данного белка согласно настоящему изобретению. SEQ ID NO:143 является примером такой альтернативной последовательности с альтернативными аминокислотами, с использованием ряда SNP, указанных ниже
Белок VSIG10 (SEQ ID NO:3) также содержит следующие SNP (однонуклеотидный полиморфизм), не относящиеся к "молчащим", которые перечислены в таблице G, (даны согласно их положению (положениям) в аминокислотной последовательности с указанной альтернативной аминокислотой; причем наличие SNP в последовательности (SEQ ID NO:3) белка VSIG10 предоставляет основу для альтернативной последовательности (последовательностей) данного белка согласно настоящему изобретению.
Белок ТМЕМ25 (SEQ ID NO:7) также содержит следующие SNP (однонуклеотидный полиморфизм), не относящиеся к "молчащим", которые перечислены в таблице Н, (даны согласно их положению (положениям) в аминокислотной последовательности с указанной альтернативной аминокислотой; причем наличие SNP в последовательности (SEQ ID NO:7) белка ТМЕМ25 предоставляет основу для альтернативной последовательности (последовательностей) данного белка согласно настоящему изобретению.
Различные аспекты настоящего изобретения описаны более подробно в следующих подразделах.
НУКЛЕИНОВЫЕ КИСЛОТЫ
"Фрагмент нуклеиновой кислоты" или "олигонуклеотид" или "полинуклеотид" применяют в данном документе взаимозаменяемо для обозначения полимера остатков нуклеиновых кислот. Полинуклеотидная последовательность в соответствии с настоящим изобретением относится к одно- или двухцепочечным последовательностям нуклеиновых кислот, которые выделяют и представляют в форме последовательности РНК, комплементарной полинуклеотидной последовательности (кДНК), геномной полинуклеотидной последовательности и/или составных полинуклеотидных последовательностей (например, комбинации вышеуказанного).
Таким образом, настоящее изобретение охватывает последовательности нуклеиновых кислот, описанных в данном документе выше; их фрагменты, последовательности, гибридизируемые с ними, последовательности, гомологичные им [например, по меньшей мере на 90%, по меньшей мере на 95, 96, 97, 98 или 99% или более идентичные с последовательностям нуклеиновых кислот, изложенным в данном документе], последовательности, кодирующие аналогичные полипептиды с различной частотой использования кодонов, измененные последовательности, отличающиеся мутациями, такими как делеции, вставки или замены одного или нескольких нуклеотидов, встречающихся в природе или искусственных, случайным образом или целенаправленно. Настоящее изобретение также охватывает гомологичные последовательности нуклеиновых кислот (т.е. те, которые образуют часть полинуклеотидной последовательности в соответствии с настоящим изобретением), которые включают области последовательности, уникальные для полинуклеотидов в соответствии с настоящим изобретением.
Таким образом, настоящее изобретение также охватывает полипептиды, кодируемые полинуклеотидными последовательностями в соответствии с настоящим изобретением. Настоящее изобретение также охватывает гомологи этих полипептидов, такие гомологи могут быть по меньшей мере на 90%, по меньшей мере на 95, 96, 97, 98 или 99% или более гомологичными аминокислотной последовательности, изложенной ниже, как можно определить, используя программное обеспечение Blastp Национального центра биотехнологической информации (NCBI) с применением параметров по умолчанию. Как упоминалось выше, биомолекулярные последовательности в соответствии с настоящим изобретением могут быть эффективно использованы в качестве тканевых или патологических маркеров и как предполагаемые лекарственные средства или терапевтические мишени для лечения или профилактики заболевания.
Олигонуклеотиды, сконструированные для выполнения способов в соответствии с настоящим изобретением для любой из последовательностей, предоставленной в данном документе (сконструированной как описано выше), могут быть получены согласно любому способу синтеза олигонуклеотидов, известному из уровня техники, такому как ферментативный синтез или твердофазный синтез. Олигонуклеотиды, используемые согласно данному аспекту настоящего изобретения, имеют длину, выбранную из диапазона от приблизительно 10 до приблизительно 200 оснований, предпочтительно, от приблизительно 15 до приблизительно 150 оснований, более предпочтительно, от приблизительно 20 до приблизительно 100 оснований, наиболее предпочтительно, от приблизительно 20 до приблизительно 50 оснований.
Олигонуклеотиды в соответствии с настоящим изобретением могут включать гетероциклические нуклеозиды, состоящие из пуриновых и пиримидиновых оснований, связанных 3'-5'-фосфодиэфирной связью.
Предпочтительные олигонуклеотиды являются модифицированными в остове, либо по межнуклеозидным связям, либо по основаниям, как в общих чертах описано в данном документе ниже. Такие модификации часто могут способствовать поглощению олигонуклеотидов и устойчивости к внутриклеточным условиям.
Конкретные примеры предпочтительных олигонуклеотидов, используемых согласно данному аспекту настоящего изобретения, включают олигонуклеотиды, содержащие модифицированные остовы или неприродные межнуклеозидные связи. Олигонуклеотиды, имеющие модифицированные остовы, включают такие, которые сохраняют атом фосфора в остове, как описано в патентах США №4469863, 4476301, 5023243, 5177196, 5188897, 5264423, 5276019, 5278302, 5286717, 5321131, 5399676, 5405939, 5453496, 5455233, 5466677, 5476925, 5519126, 5536821, 5541306, 5550111, 5563253, 5571799, 5587361 и 5625050.
Предпочтительные модифицированные олигонуклеотидные остовы включают, например, фосфоротиоаты, хиральные фосфоротиоаты, фосфородитиоаты, сложные фосфотриэфиры, сложные аминоалкилфосфотриэфиры, метил- и другие алкилфосфонаты, в том числе 3'-алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, в том числе 3'-аминофосфорамидаты и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, сложные тионоалкилфосфотриэфиры и боранофосфаты с нормальными 3'-5'-связями, их 2'-5'-связанные аналоги, а также имеющие обратную полярность, где соседние пары нуклеозидных единиц соединены от 3'-5' к 5'-3' или от 2'-5' к 5'-2'. Различные соли, смешанные соли и свободные кислотные формы также могут быть использованы.
Альтернативно, модифицированные олигонуклеотидные остовы, которые не включают атом фосфора, имеют остовы, образованные короткоцепочечными алкильными или циклоалкильными межнуклеозидными связями, смешанными гетероатомными и алкильными или циклоалкильными межнуклеозидными связями, или одной или несколькими короткоцепочечными гетероатомными или гетероциклическими межнуклеозидными связями. Они включают такие, которые содержат морфолиновые связи (образованные частично из сахарного участка нуклеозида), силоксановые остовы; сульфидные, сульфоксидные и сульфоновые остовы; формацетильные и тиоформацетильные остовы; метиленформацетильные и тиоформацетильные остовы; алкенсодержащие остовы; сульфаматные остовы; метилениминовые и метиленгидразиновые остовы; сульфонатные и сульфонамидные остовы; амидные остовы; и другие, содержащие части смешанных компонентов N, О, S и СН2, как раскрыто в патентах США №5034506, 5166315, 5185444, 5214134, 5216141, 5235033, 5264562, 5264564, 5405938, 5434257, 5466677, 5470967, 5489677, 5541307, 5561225, 5596086, 5602240, 5610289, 5602240, 5608046, 5610289, 5618704, 5623070; 5663312, 5633360, 5677437 и 5677439.
Другие олигонуклеотиды, которые могут использоваться в соответствии с настоящим изобретением, являются такими, которые модифицированы одновременно по сахару и по межнуклеозидной связи, т.е. остов нуклеотидной единицы замещают новыми группами. Единицы азотистых оснований сохраняются для комплементации с соответствующими полинуклеотидными мишенями. Пример такого олигонуклеотида-миметика включает пептидную нуклеиновую кислоту (PNA). Олигонуклеотид PNA относится к олигонуклеотиду, где сахарный остов замещен амидсодержащим остовом, в частности, аминоэтилглициновым остовом. Основания сохранены и связаны непосредственно или посредством с аза-атомами азота амидного участка остова. Патенты США, которые сообщают о получении соединений PNA, включают, без ограничения, патенты США №5539082, 5714331 и 5719262, каждый из которых включен в данный документ с помощью ссылки. Другие модификации остовов, которые могут быть использованы в настоящем изобретении, раскрыты в патенте США №6303374.
Олигонуклеотиды в соответствии с настоящим изобретением могут также включать модификации или замены оснований. Применяемое в данном документе выражение "немодифицированные" или "природные" основания включает пуриновые основания аденин (А) и гуанин (G) и пиримидиновые основания тимин (Т), цитозин (С) и урацил (U). Модифицированные основания включают, без ограничения, другие синтетические и природные основания, такие как 5-метилцитозин (5-ме-С), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил и другие алкильные производные аденина и гуанина, 2-пропил и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галоурацил и 5-галоцитозин, 5-пропинилурацил и 5-пропинилцитозин, 6-азоурацил, 6-азоцитозин и 6-азотимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-галоген, в частности 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин и 3-деазагуанин и 3-деазааденин. Дополнительные основания включают раскрытые в патенте США №3687808, раскрытые в The Concise Encyclopedia Of Polymer Science and Engineering, p.858-859, Kroschwitz J. I., ed. John Wiley & Sons, 1990, раскрытые в Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613, и раскрытые Sanghvi Y. S., Chapter 15, Antisense Research and Applications, p.289-302, Crooke S. Т. и Lebleu В., ed., CRC Press, 1993. Такие основания особенно применимы для увеличения сродства связывания олигомерных соединений согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. Они включают 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и O-6 замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин. Показано, что 5-метилцитозиновые замены повышают стабильность двойной спирали нуклеиновой кислоты при 0,6-1,2°С [Sanghvi Y. S. et al. (1993) Antisense Research and Applications, CRC Press, Boca Raton 276-278] и в настоящее время являются предпочтительными заменами оснований, даже более предпочтительными в сочетании с 2'-O-метоксиэтильными модификациями сахара.
Другая модификация олигонуклеотидов согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения включает химическое связывание с олигонуклеотидом одного или нескольких фрагментов или конъюгатов, которые повышают активность, клеточное распределение или клеточное поглощение олигонуклеотида. Такие фрагменты включают, без ограничения, липидные фрагменты, такие как холестериновый фрагмент, холевую кислоту, простой тиоэфир, например, гексил-S-тритилтиол, тиохолестерол, алифатическую цепь, например додекандиол или ундецильные остатки, фосфолипид, например, ди-гексадецил-рац-глицерин или триэтиламмония 1,2-ди-О-гексадецил-рац-глицеро-3-Н-фосфонат, полиамин или полиэтиленгликолевую цепь, или адамантануксусную кислоту, пальмитильный фрагмент, или октадециламиновый или гексиламино-карбонил-оксихолестерольный фрагмент, как раскрыто в патенте США №6303374.
В отношении всех положений в данной олигонуклеотидной молекуле не является необходимым то, что молекула должна быть равномерно модифицированной, и фактически более чем одна из вышеуказанных модификаций может быть включена в одно соединение или даже в один нуклеозид в пределах олигонуклеотида.
ПЕПТИДЫ
Выражения "полипептид", "пептид" и "белок" применяют в данном документе взаимозаменяемо для обозначения полимера аминокислотных остатков. Выражения применяют к полимерам аминокислот, в которых один или несколько аминокислотных остатков являются аналогом или миметиком соответствующей природной аминокислоты, а также к природным полимерам аминокислот. Полипептиды могут быть модифицированы, например, путем добавления углеводных остатков с образованием гликопротеинов. Выражения "полипептид", "пептид" и "белок" включают гликопротеины, а также таковые, не являющиеся гликопротеинами.
Полипептидные продукты могут быть синтезированы биохимически, например, с использованием стандартных твердофазных техник. Такие способы включают разделительный твердофазный синтез, способы частичного твердофазного синтеза, конденсацию фрагментов, классический синтез в растворе. Эти способы предпочтительно применяют, когда пептид является относительно коротким (т.е., 10 кДа) и/или когда он не может быть получен рекомбинантными методами (то есть, не кодируемый нуклеиновой кислотой) и, следовательно, включает различные химические структуры.
Процедуры проведения твердофазного синтеза полипептидов хорошо известны из уровня техники и дополнительно описаны John Morrow Stewart и Janis Dillaha Young, Solid Phase Peptide Syntheses (2nd Ed., Pierce Chemical Company, 1984).
Синтетические полипептиды могут быть очищены с помощью препаративной высокоэффективной жидкостной хроматографии [Creighton Т. (1983) Proteins, structures and molecular principles. WH Freeman and Co., N.Y.], а их состав может быть подтвержден с помощью аминокислотного секвенирования.
В случаях, когда необходимы большие количества полипептида, он может быть произведен с использованием рекомбинантных методов, таких как описано в Bitter et al., (1987) Methods in Enzymol. 153:516-544, Studier et al., (1990) Methods in Enzymol. 185:60-89, Brisson et al., (1984) Nature 310:511-514, Takamatsu et al., (1987) EMBO J. 6:307-311, Coruzzi et al., (1984) EMBO J. 3:1671-1680 и Brogli et al., (1984) Science 224:838-843, Gurley et al., (1986) Mol. Cell. Biol. 6:559-565.
Следует иметь в виду, что пептиды, идентифицированные согласно принципам настоящего изобретения, могут быть продуктами расщепления, синтетическими пептидами или рекомбинантными пептидами, а также пептидомиметиками, как правило, синтетическими пептидами и пептоидами, а также полупептидоидами, являющимися пептидными аналогами, которые могут иметь, например, модификации, делающие пептиды более стабильными в организме или более способными к проникновению в клетки. Такие модификации включают, без ограничения, N-концевую модификацию, C-концевую модификацию, модификацию пептидной связи, включая, без ограничения, СН2-NH, CH2-S, CH2-S=O, O=C-NH, -СН2-O, СН2-СН2, S=C-NH, CH=CH или CF=CH, модификации остова и модификацию остатка. Способы получения пептидомиметических соединений хорошо известны из уровня техники и указаны, например, в Quantitative Drug Design, C.A. Ramsden Gd., Chapter 17.2, F. Choplin Pergamon Press (1992), которая включена в данный документ с помощью ссылки, как если бы была полностью изложена в данном документе. Дополнительное подробное описание в этом отношении предоставлено в данном документе ниже.
Пептидные связи (-CO-NH-) в пределах пептида могут быть замещены, например, N-метилированными связями (-N(СН3)-СО-), эфирными связями (-С(R)НС-О-О-С(R)-N-), кетометиленовыми связями (-СО-СН2-), α-аза-связями (-NH-N(R)-CO-), где R является любым алкилом, например, метилом, карбо-связями (-CH2-NH-), гидроксиэтиленовыми связями (-СН(ОН)-СН2-), тиоамидными связями (-CS-NH-), олефиновыми двойными связями (-СН=СН-), ретроамидными связями (-NH-CO-), пептидными производными (-N(R)-CH2-CO-), где R является "нормальной" боковой цепью, природно представленной на атоме углерода.
Эти модификации могут иметь место в любой из связей вдоль пептидной цепи и даже несколько (2-3) одновременно.
Природные ароматические аминокислоты Тrр, Тyr и Phe могут быть замещены синтетическими неприродными кислотами, такими как фенилглицин, TIC, нафтилаланин (Nol), метилированные по кольцу производные Phe, галогенированные производные Phe или O-метил-Тyr.
В дополнение к вышесказанному, пептиды в соответствии с настоящим изобретением могут также включать одну или несколько модифицированных аминокислот или один или несколько мономеров, не относящихся к аминокислотам (например, жирные кислоты, сложные углеводы и т.д.).
Применяемое в данном документе в описании и в формуле изобретения, приведенной ниже, выражение "аминокислота" или "аминокислоты" следует понимать, как включающий 20 природных аминокислот; те аминокислоты, которые часто модифицируются посттрансляционно in vivo, включая, например, гидроксипролин, фосфосерин и фосфотреонин; и другие необычные аминокислоты, включая, без ограничения, 2-аминоадипиновую кислоту, гидроксилизин, изодесмозин, норвалин, норлейцин и орнитин. Кроме того, выражение "аминокислота" включает как D-, так и L-аминокислоты.
Поскольку пептиды в соответствии с настоящим изобретением предпочтительно используют в терапии, при которой требуются пептиды в растворимой форме, пептиды в соответствии с настоящим изобретением предпочтительно включают одну или несколько неприродных или природных полярных аминокислот, включая, без ограничения, серии и треонин, которые способны повышать растворимость пептида из-за их содержащей гидроксил боковой цепи.
СИСТЕМЫ ЭКСПРЕССИИ
Чтобы обеспечить возможность экспрессии в клетке полинуклеотидов в соответствии с настоящим изобретением, может быть использован конструкт нуклеиновой кислоты согласно настоящему изобретению, который включает по меньшей мере кодирующий участок одной из вышеуказанных последовательностей нуклеиновых кислот и дополнительно включает по меньшей мере один цис-регуляторный элемент. Используемая в данном документе фраза "цис-регуляторный элемент" относится к полинуклеотидной последовательности, предпочтительно промоторной, которая связывает транс-регулятор и регулирует транскрипцию кодирующей последовательности, расположенной ниже по цепи.
Любая подходящая промоторная последовательность может быть использована в конструкции нуклеиновой кислоты в соответствии с настоящим изобретением.
Предпочтительно, промотор, применяемый в конструкте нуклеиновой кислоты в соответствии с настоящим изобретением, является активным в специфически трансформированной клеточной популяции. Примеры специфических относительно типа клеток и/или тканеспецифических промоторов включают промоторы, такие как альбуминовый, который является специфическим для печени [Pinkert et al., (1987) Genes Dev. 1:268-277], специфические для лимфоидной ткани промоторы [Calame et al., (1988) Adv. Immunol. 43:235-275]; в частности, промоторы рецепторов Т-клеток [Winoto et al., (1989) EMBO J. 8:729-733] и иммуноглобулинов [Banerji et al., (1983) Cell 33729-740], нейрон-специфические промоторы, такие как промотор нейрофиламентов [Вyrnе et al., (1989) Proc. Natl. Acad. Sci. USA 86:5473-5477], промоторы, специфические для поджелудочной железы [Edlunch et al., (1985) Science 230:912-916] или промоторы, специфические для молочной железы, такие как промотор молочной сыворотки (патент США №4873316 и заявка на европейский патент №264166). Конструкт нуклеиновой кислоты в соответствии с настоящим изобретением может дополнительно включать энхансер, который может быть примыкающим или отдаленным относительно промоторной последовательности и может выполнять активацию транскрипции оттуда.
Конструкт нуклеиновой кислоты в соответствии с настоящим изобретением предпочтительно дополнительно включает соответствующий селектируемый маркер и/или точку начала репликации. Предпочтительно, применяемый конструкт нуклеиновой кислоты представляет собой челночный вектор, который может размножаться в Е.coli (где конструкция содержит соответствующий селектируемый маркер и начало репликации) и быть совместимым для размножения в клетках, или интеграции в ген и ткань выбора. Конструкция согласно настоящему изобретению может быть, например, плазмидой, бакмидой, фагмидой, космидой, фагом, вирусом или искусственной хромосомой.
Примеры подходящих конструкций включают, без ограничения, pcDNA3, pcDNA3.1 (+/-), pGL3, PzeoSV2 (+/-), pDisplay, pEF/myc/cyto, pCMV/myc/cyto, каждая из которых является коммерчески доступной от Invitrogen Co. (www.invitrogen.com). Примерами ретровирусного вектора и систем упаковки являются поставляемые Clontech, Сан-Диего, Калифорния, включая Retro-X векторы pLNCX и pLXSN, которые обеспечивают клонирование в сайты множественного клонирования, и трансген, который транскрибируется с промотора CMV. Векторы, полученные из Mo-MuLV, также включают такие как pBabe, где трансген будет транскрибироваться с промотора 5'LTR.
В настоящее время предпочтительные техники in vivo переноса нуклеиновой кислоты включают трансфекцию вирусным или невирусным конструктами, такими как аденовирус, лентивирус, вирус простого герпеса I или адено-ассоциированный вирус (AAV) и основанные на липидах системы. Подходящие липиды для опосредованного липидами переноса гена являются, например, DOTMA, DOPE и DC-Chol [Tonkinson et al., Cancer Investigation, 14(1):54-65 (1996)]. Наиболее предпочтительными конструктами для применения в генной терапии являются вирусы, наиболее предпочтительно, аденовирусы, AAV, лентивирусы или ретровирусы. Вирусная конструкция, такая как ретровирусная конструкция, включает по меньшей мере один транскрипционный промотор/энхансер или локус-определяющие элементы, или другие элементы, которые контролируют экспрессию генов с помощью других средств, таких как альтернативный сплайсинг, экспорт ядерной РНК или пост-трансляционная модификация мессенджера. Такие векторные конструкты также включают сигнал упаковки, длинные концевые повторы (LTR) или их участки и сайты связывания праймеров положительной и отрицательной нитей, соответствующие применяемому вирусу, если это еще не присутствует в вирусном конструкте. Кроме того, такой конструкт обычно включает сигнальную последовательность для секреции пептида из клетки-хозяина, в которую он помещен. Предпочтительно, сигнальной последовательностью для этой цели является сигнальная последовательность млекопитающего или сигнальная последовательность полипептидов в соответствии с настоящим изобретением. Необязательно конструкт может также включать сигнал, который направляет полиаденилирование, а также один или несколько сайтов рестрикции и последовательность терминации трансляции. В качестве примера, такие конструкции, как правило, будут включать 5'-LTR, сайт связывания тРНК, сигнал упаковки, точку начала синтеза второй нити ДНК и 3'-LTR или его участок. Могут быть использованы другие векторы, которые являются невирусными, такие как катионные липиды, полилизин и дендримеры.
РЕКОМБИНАНТНЫЕ ВЕКТОРЫ ЭКСПРЕССИИ И КЛЕТКИ-ХОЗЯЕВА
Другой аспект настоящего изобретения относится к векторам, предпочтительно векторам экспрессии, содержащим нуклеиновую кислоту, кодирующую белок согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, или ее производные, фрагменты, аналоги или гомологи. Применяемое в данном документе выражение "вектор" относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она связана. Примерами типов векторов являются плазмиды и вирусные векторы. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальное начало репликации и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) интегрируются в геном клетки-хозяина при введении в клетку-хозяина, и тем самым реплицируются вместе с геномом хозяина. Кроме того, некоторые векторы способны направлять экспрессию генов, с которыми они функционально связаны. Такие векторы называют в данном документе "векторы экспрессии". Настоящее изобретение предназначено включать такие формы векторов экспрессии, как плазмиды, вирусные векторы (например, дефектные по репликации ретровирусы, аденовирусы и адено-ассоциированные вирусы), которые выполняют эквивалентные функции.
Рекомбинантные векторы экспрессии согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения содержат нуклеиновую кислоту согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения в форме, подходящей для экспрессии нуклеиновой кислоты в клетке-хозяине, которая означает, что рекомбинантные векторы экспрессии включают одну или несколько регуляторных последовательностей, выбранных на основе клеток-хозяев, которые будут использоваться для экспрессии, функционально связанных с последовательностью нуклеиновой кислоты, которая должна экспрессироваться. В рекомбинантном векторе экспрессии "функционально связанный" означает, что представляющая интерес нуклеотидная последовательность связана с регуляторными последовательностями таким образом, что обеспечивается экспрессия нуклеотидной последовательности (например, в системе транскрипции/трансляции in vitro или в клетке-хозяине, когда вектор вводят в клетку-хозяина).
Выражение "регуляторная последовательность" предназначен для охвата промоторов, энхансеров и других элементов контроля экспрессии (например, сигналов полиаденилирования). Такие регуляторные последовательности описаны, например, в Goeddel, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif. (1990). Регуляторные последовательности включают такие, которые управляют конститутивной экспрессией нуклеотидной последовательности во многих типах клетки-хозяина, и те, которые управляют экспрессией нуклеотидной последовательности только в определенных клетках-хозяевах (например, тканеспецифические регуляторные последовательности). Специалистам в данной области техники будет очевидно, что конструкция вектора экспрессии может зависеть от таких факторов, как выбор клетки-хозяина для трансформации, уровень экспрессии требуемого белка и т.д. Векторы экспрессии согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения могут быть введены в клетки-хозяева для получения таким образом белков или пептидов, в том числе гибридных белков или пептидов, кодируемых нуклеиновыми кислотами, которые описаны в данном документе.
Рекомбинантные векторы экспрессии согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения могут быть сконструированы для продуцирования вариантных белков в прокариотических или эукариотических клетках. Например, белки согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения могут быть экспрессированы в бактериальных клетках, таких как Escherichia coli, клетках насекомых (с использованием векторов экспрессии бакуловируса), дрожжевые клетках или клетках млекопитающих. Подходящие клетки-хозяева дополнительно обсуждаются в Goeddel, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif. (1990). Альтернативно, рекомбинантный вектор экспрессии можно транскрибировать и транслировать in vitro, например, с помощью регуляторных последовательностей промотора Т7 и полимеразы Т7.
Экспрессию белков в прокариотах чаще всего выполняют в Escherichia coli с векторами, содержащими конститутивные или индуцируемые промоторы, управляющие экспрессией слитых или неслитых белков. Гибридные векторы добавляют ряд аминокислот к белку, кодируемому в нем, к амино- или C-концу рекомбинантного белка. Такие гибридные векторы обычно служат для трех целей: (i) для повышения экспрессии рекомбинантного белка; (ii) для повышения растворимости рекомбинантного белка и (iii) для облегчения очистки рекомбинантного белка, действуя в качестве лиганда при аффинной очистке. Часто в гибридных векторах экспрессии сайт протеолитического расщепления вводится на стыке гибридного фрагмента и рекомбинантного белка, чтобы облегчить отделение рекомбинантного белка от гибридного фрагмента после очистки гибридного белка. Такие ферменты и их последовательности когнатного распознавания включают фактор Ха, тромбин, PreScission, TEV и энтерокиназу. Типичные гибридные векторы экспрессии включают pGEX (Pharmacia Biotech Inc; Smith and Johnson, 1988. Gene 67:31-40), pMAL (New England Biolabs, Беверли, Массачуссетс) и pRIT5 (Pharmacia, Пискатавей, Нью-Йорк), чтобы соединить глутатион S-трансферазу (GST), мальтозу Е-связывающий белок или белок А, соответственно, с целевым рекомбинантным белком.
В другом варианте осуществления вектор экспрессии, кодирующий белок в соответствии с настоящим изобретением, представляет собой дрожжевой вектор экспрессии. Примеры векторов для экспрессии в дрожжах Saccharomyces cerevisiae включают pYepSecl (Baldari, et al., 1987. EMBO J. 6: 229-234), pMFa (Kurjan and Herskowitz, 1982. Cell 30:933-943), pJRY88 (Schultz et al., 1987. Gene 54:113-123), pYES2 (Invitrogen Corporation, Сан Диего, Калифорния) и picZ (InVitrogen Corp, Сан Диего, Калифорния).
Альтернативно, полипептиды в соответствии с настоящим изобретением могут быть продуцированы в клетках насекомых с использованием бакуловирусных векторов экспрессии. Бакуловирусные векторы, доступные для экспрессии белков в культивируемых клетках насекомых (например, клеток SF9), включают серию рАс (Smith et al., 1983. Mol. Cell. Biol. 3:2156-2165) и серию pVL (Lucklow и Summers, 1989. Virology 170:31-39).
В еще одном варианте осуществления нуклеиновую кислоту в соответствии с настоящим изобретением экспрессируют в клетках млекопитающих с использованием вектора экспрессии млекопитающих. Примеры векторов экспрессии млекопитающих включают pCDM8 (Seed, 1987 Nature 329:. 840) и pMT2PC (Kaufman et al., 1987. EMBO J. 6:187-195), pIRESpuro (Clontech), pUB6 (Invitrogen), pCEP4 (Invitrogen), pREP4 (Invitrogen), pcDNA3 (Invitrogen). При использовании в клетках млекопитающих функции контроля вектора экспрессии часто обеспечиваются вирусными регуляторными элементами. Например, обычно используемыми промоторами являются полученные из вируса полиомы, аденовируса 2, цитомегаловируса, вируса саркомы Рауса и вакуолизирующего обезьяньего вируса 40. Для других подходящих систем экспрессии, как для прокариотических, так и эукариотических клеток, см., например, главы 16 и 17 из Sambrook et al., Molecular Cloning: A Laboratory Manual. 2nd ed., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989.
В другом варианте осуществления рекомбинантный вектор экспрессии млекопитающих способен управлять экспрессией нуклеиновой кислоты преимущественно в определенном типе клеток (например, используют тканеспецифические регуляторные элементы для экспрессии нуклеиновой кислоты). Тканеспецифические регуляторные элементы известны из уровня техники. Не ограничивающие примеры подходящих тканеспецифических промоторов включают альбуминовый промотор (специфический для печени; Pinkert et al., 1987. Genes Dev. 1:268-277), специфические для лимфоидной ткани промоторы (Calame and Baton, 1988. Adv. Immunol. 43:235-275), в частности, промоторы рецепторов Т-клеток (Winoto and Baltimore, 1989. EMBO J. 8:729-733) и иммуноглобулинов (Banerji et al., 1983. Cell 33:729-740; Queen and Baltimore, 1983. Cell 33:741-748), нейрон-специфические промоторы (например, промотор нейрофиламентов; Byrne and Ruddle, 1989. Proc. Natl. Acad. Sci. USA 86:5473-5477), промоторы, специфические для поджелудочной железы (Edlund et al., 1985. Science 230:912-916), и промоторы, специфические для молочной железы (например, промотор молочной сыворотки; патент США №4873316 и заявка на европейский патент №264166). Промоторы, регулируемые стадией развития, также охватывают, например, мышиные промоторы hox (Kessel and Gruss, 1990. Science 249:374-379) и промотор альфа-фетопротеина (Campes and Tilghman, 1989. Genes Dev. 3:537-546).
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение дополнительно предоставляет рекомбинантный вектор экспрессии, содержащий молекулу ДНК согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, клонированную в вектор экспрессии в антисмысловой ориентации. То есть, молекула ДНК функционально связана с регуляторной последовательностью таким образом, что возможна экспрессия (путем транскрипции молекулы ДНК) молекулы РНК, которая является антисмысловой к иРНК, кодирующей белок согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. Регуляторные последовательности, функционально связанные с нуклеиновой кислотой, клонированной в антисмысловой ориентации, могут быть выбраны для управления непрерывной экспрессией антисмысловой молекулы РНК в различных типах клеток, например, могут быть выбраны вирусные промоторы и/или энхансеры, или регуляторные последовательности для управления конститутивной, тканеспецифической или специфической для типа клеток экспрессией антисмысловой РНК. Антисмысловой вектор экспрессии может быть в форме рекомбинантной плазмиды, фагмиды или ослабленного вируса, в которых антисмысловая нуклеиновая кислота продуцируется под контролем высокоэффективного регуляторного участка, активность которого может быть определена типом клеток, в которые ввели вектор. Для обсуждения регуляции экспрессии генов с использованием антисмысловых генов см., например Weintraub et al., "Antisense RNA as a molecular tool for genetic analysis," Reviews-Trends in Genetics, Vol. 1(1) 1986.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение относится к клеткам-хозяевам, в которые вводят рекомбинантный вектор экспрессии согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. Выражение "клетка-хозяин" и "рекомбинантная клетка-хозяин" применяют в данном документе взаимозаменяемо. Понятно, что такие выражения относятся не только к отдельной клетке субъекта, но также и к потомству или потенциальному потомству такой клетки. Поскольку некоторые модификации могут иметь место в последующих поколениях вследствие мутации или воздействий окружающей среды, такое потомство может фактически не быть идентичным родительской клетке, но все еще включено в объем выражения, используемого в данном документе.
Клетка-хозяин может быть любой прокариотической или эукариотической клеткой. Например, белок согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения может продуцироваться в бактериальных клетках, таких как Е.coli, клетках насекомых, клетках дрожжей, растений или клетках млекопитающих (например, клетки яичника китайского хомячка (СНО) или COS, или клетки 293). Другие подходящие клетки-хозяева известны специалистам в данной области техники.
Векторная ДНК может быть введена в прокариотические или эукариотические клетки с помощью обычных методов трансформации или трансфекции. Используемые в данном документе выражения "трансформация" и "транефекция" предназначены для обозначения различных известных из уровня техники техник введения чужеродной нуклеиновой кислоты (например, ДНК) в клетку-хозяина, в том числе соосаждение фосфатом кальция или хлоридом кальция, опосредованную DEAE-декстраном трансфекцию, липофекцию или электропорацию. Подходящие способы трансформации или трансфекции клеток-хозяев можно найти в Sambrook et al. (Molecular Cloning: A Laboratory Manual. 2nd ed., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989) и других лабораторных руководствах.
Известно, что для стабильной трансфекции клеток млекопитающих в зависимости от вектора экспрессии и применяемой техники трансфекции только небольшая часть клеток может интегрировать чужеродную ДНК в свой геном. Для того чтобы идентифицировать и отобрать эти компоненты, ген, кодирующий селектируемый маркер (например, устойчивость к антибиотикам), обычно вводят в клетки-хозяева вместе с представляющим интерес геном. Различные селектируемые маркеры включают те, которые придают устойчивость лекарственным средствам, таким как G418, гигромицин, пуромицин, бластицидин и метотрексат. Нуклеиновые кислоты, кодирующие селектируемый маркер, могут быть введены в клетку-хозяина в том же векторе, который кодирует белок согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, или могут быть введены в отдельном векторе. Клетки, стабильно трансфицированные введенной нуклеиновой кислотой, могут быть идентифицированы селекции лекарственными средствами (например, клетки, которые включили ген селектируемого маркера, будут выживать, в то время как другие клетки погибают).
Клетка-хозяин согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, такая как прокариотическая или эукариотическая клетка-хозяин в культуре, может быть использована для продуцирования (т.е. экспрессии) белка согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. Соответственно, настоящее изобретение дополнительно предоставляет способы получения белков согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения с использованием клеток-хозяев согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. В одном варианте осуществления способ в соответствии с настоящим изобретением включает культивирование клетки-хозяина в соответствии с настоящим изобретением (в которую был введен рекомбинантный вектор экспрессии, кодирующий белок согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения) в подходящей среде, так что продуцируется белок согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. В другом варианте осуществления способ в соответствии с настоящим изобретением дополнительно включает выделение белка согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения из среды или клетки-хозяина.
Для эффективного продуцирования белка предпочтительно поместить нуклеотидные последовательности, кодирующие белок согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, под контролем последовательностей, контролирующих экспрессию, оптимизированных для экспрессии в требуемом хозяине. Например, последовательности могут включать оптимизированные регуляторные последовательности транскрипции и/или трансляции (такие как измененные последовательности Козак).
Следует отметить, что согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения белки LY6G6F, VSIG10, ТМЕМ25 и/или LSR согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно выделить в виде природных полипептидов, или из любого источника, будь он природным, синтетическим, полусинтетическим или рекомбинантным. Соответственно, белки LY6G6F, VSIG10, ТМЕМ25 и/или LSR можно выделить в виде природных белков из любых видов, в частности млекопитающих, в том числе крупного рогатого скота, овец, свиней, мышей, лошадей и предпочтительно человека. Альтернативно, белки LY6G6F, VSIG10, ТМЕМ25 и/или LSR можно выделить в виде рекомбинантных полипептидов, которые экспрессируются в прокариотических или эукариотических клетках-хозяевах, или выделить в виде химически синтезированного полипептида.
Специалист в данной области техники может легко использовать стандартные способы выделения для получения выделенных белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR. Характер и степень выделения будут зависеть от источника и предполагаемого применения выделенных молекул.
Трансгенные животные и растения
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение также предоставляет трансгенных животных, не являющихся человеком, и трансгенные растения, содержащие одну или несколько молекул нуклеиновой кислоты согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, которых можно применять для получения полипептидов согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. Полипептиды можно получить в ткани или жидкостях организма и извлекать из ткани или жидкостей организма, таких как молоко, кровь или моча коз, коров, лошадей, свиней, крыс, мышей, кроликов, хомяков или других млекопитающих. См., например, патент США №5827690, 5756687, 5750172 и 5741957.
Трансгенные животные, не являющиеся человеком, и трансгенные растения получают путем введения одной или нескольких молекул нуклеиновых кислот согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения в животное или растение с помощью стандартных трансгенных техник. Трансгенные клетки, используемые для создания трансгенного животного, могут быть эмбриональными стволовыми клетками, соматическими клетками или оплодотворенными яйцеклетками. Трансгенные организмы, не являющиеся человеком, могут быть химерными, нехимерными гетерозиготами и нехимерными гомозиготами. См., например, Hogan et al., Manipulating the Mouse Embryo: A Laboratory Manual 2ed. Cold Spring Harbor Press (1999); Jackson et al., Mouse Genetics and Transgenics: A Practical Approach, Oxford University Press (2000); и Pinkert, Transgenic Animal Technology: A Laboratory Handbook, Academic Press (1999).
ГЕННАЯ ТЕРАПИЯ
Согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения последовательности нуклеиновых кислот, кодирующие растворимые белки LY6G6F, VSIG10, ТМЕМ25 и/или LSR, можно применять в генной терапии для лечения инфекционных нарушений, и/или иммунологических нарушений, и/или рака.
Используемое в данном документе выражение "генная терапия" является процессом лечения заболевания путем генетической манипуляции таким образом, что последовательность нуклеиновой кислоты переносят в клетку, клетка затем экспрессирует любой генетический продукт, кодируемый нуклеиновой кислотой. Например, как хорошо известно специалистам в данной области техники, перенос нуклеиновой кислоты можно выполнить путем введения вектора экспрессии, содержащего представляющую интерес нуклеиновую кислоту в клетки ex vivo или in vitro различными способами, в том числе, например, осаждением фосфатом кальция, диэтиламиноэтилдекстраном, полиэтиленгликолем (PEG), электропорацией, прямым введением, липофекцией или вирусным инфицированием (Sambrook et al., Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Laboratory Press 1989); Kriegler M. Gene Transfer ad Expression: A Laboratory Manual (W. H. Freeman and Co, New York, N.Y., 1993) и Wu, Methods in Enzymology (Academic Press, New York, 1993). Альтернативно, представляющие интерес последовательности нуклеиновых кислот можно перенести в клетку in vivo в различных векторах и различными способами, в том числе, например, прямым введением нуклеиновой кислоты в субъект или вставкой нуклеиновой кислоты в вирусный вектор и инфицированием субъекта вирусом. Другие способы, используемые для переноса in vivo, включают инкапсулирование нуклеиновой кислоты в липосомы и прямой перенос липосом, или липосом в сочетании с гемагглютинирующим вирусом Сендай субъекту. Трансфицированные или инфицированные клетки экспрессируют белковые продукты, кодируемые нуклеиновой кислотой, для того, чтобы ослабить заболевание или симптомы заболевания.
АНТИТЕЛА И ОТВЕТ ИММУННОЙ СИСТЕМЫ
Используемые в данном документе выражения "иммунологический" или "иммунный" ответ представляют собой развитие полезного гуморального (опосредованного антителами) и/или клеточного (опосредованного антиген-специфическими Т-клетками или продуктами их секреции) ответа, направленного против пептида у пациента-рецепиента. Такой ответ может быть активным ответом, индуцируемым введением иммуногена, или пассивным ответом, индуцируемым введением антитела или примированных Т-клеток. Не желая быть ограниченными одной гипотезой, клеточный иммунный ответ вызывается представлением полипептидных эпитопов, связанных с молекулами класса I или класса II МНС, для активирования антиген-специфических CD4+ Т-хелперов и/или цитотоксических CD8+ Т-клеток. Ответ также может включать активацию моноцитов, макрофагов, NK-клеток, базофилов, дендритных клеток, астроцитов, клеток микроглии, эозинофилов, активацию или рекрутинг нейтрофилов или других компонентов врожденного иммунитета. Наличие клеточно-опосредованного иммунного ответа можно определить с помощью анализов пролиферации (CD4+ Т-клеток) или анализов CTL (цитотоксических Т-лимфоцитов). Относительный вклад гуморального и клеточного ответов в защитный или терапевтический эффект иммуногена можно различить при раздельном выделении антител и Т-клеток иммунизированного сингенного животного и измерении защитного или терапевтического эффекта у второго субъекта.
"Иммуногенный фактор" или "иммуноген" способен индуцировать иммунный ответ против себя при введении млекопитающему необязательно в сочетании с адъювантом.
"Путь сигнальной трансдукции" относится к биохимическому взаимоотношению между различными молекулами сигнальной трансдукции, которые играют важную роль в передаче сигнала из одной части клетки в другую часть клетки.
Используемая в данном документе фраза "рецептор клеточной поверхности" включает, например, молекулы и комплексы молекул, способные принимать сигнал и передавать такой сигнал через плазматическую мембрану клетки.
Выражение "антитело", упоминаемое в данном документе, включает полные поликлональные и моноклональные антитела и любой их антигенсвязывающий фрагмент (т.е. "антигенсвязывающий участок") или отдельные цепи. "Антитело" относится к гликопротеину, содержащему по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, соединенные между собой дисульфидными связями, или их антигенсвязывающий участок. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращено в данном документе как VH) и константную область тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, СН1, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращено в данном документе как VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена CL. Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, называемые областями, определяющими комплементарность (CDR), чередующиеся с областями, которые являются более консервативными и называются каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, в том числе различными клетками иммунной системы (например, эффекторными клетками) и первым компонентом (C1q) классической системы комплемента.
Выражение "антигенсвязывающий участок" антитела (или просто "участок антитела"), используемое в данном документе, относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном (например, молекулами LY6G6F, VSIG10, ТМЕМ25 и/или LSR и/или их фрагментом). Было показано, что антигенсвязывающая функция антитела может осуществляться фрагментами антитела полной длины. Примеры связывающих фрагментов, охватываемые выражением "антигенсвязывающий участок" антитела, включают (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов V легкой цепи, V тяжелой цепи, константного легкой цепи (CL) и СН1; (ii) F(ab').2 фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и СН1; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341:544-546), который состоит из домена VH; и (vi) выделенной области, определяющей комплементарность (CDR). Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, их можно соединить рекомбинантными способами с помощью синтетического линкера, который позволяет получить их в виде одной белковой цепи, в которой VL и VH области располагаются парами с образованием моновалентных молекул (известных как одноцепочечные Fv (scFv), см., например, Bird et al., (1988) Science 242:423-426; и Huston et al., (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Такие одноцепочечные антитела также, как предполагается, охвачены выражением "антигенсвязывающий участок" антитела. Данные фрагменты антитела получают с использованием обычных техник, известных специалистам в данной области техники, и эти фрагменты подвергают скринингу на полезность таким же образом, как и интактные антитела.
"Выделенное антитело", используемое в данном документе, как предполагается, относится к антителу, которое фактически не содержит других антител, имеющих другие антигенные специфичности (например, выделенное антитело, которое специфически связывает белки LY6G6F, VSIG10, ТМЕМ25 или LSR и/или их фрагменты и фактически не содержит антител, которые специфически связывают антигены, отличные от LY6G6F, VSIG10, ТМЕМ25 или LSR, соответственно. Выделенное антитело, которое специфически связывает белки LY6G6F, VSIG10, ТМЕМ25 или LSR, может, однако, иметь перекрестную реактивность с другими антигенами, такими как молекулы LY6G6F, VSIG10, ТМЕМ25 или LSR из других видов, соответственно. Более того, выделенное антитело может фактически не содержать другой клеточный материал и/или химические вещества.
Выражение "моноклональное антитело" или "композиция моноклонального антитела", используемое в данном документе, относится к препарату молекул антител одного молекулярного состава. Композиция моноклонального антитела проявляет одну специфичность связывания и сродство к конкретному эпитопу.
Выражение "человеческое антитело", используемое в данном документе, как предполагается, включает антитела, имеющие вариабельные области, в которых как каркасные, так и CDR-области получены из последовательностей иммуноглобулина зародышевого типа человека. Кроме того, если антитело содержит константную область, константная область также получена из последовательности иммуноглобулина зародышевого типа человека. Человеческие антитела согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулина зародышевого типа человека (например, мутации, введенные случайным или сайт-специфическим мутагенезом in vitro или путем соматической мутации in vivo). Однако, выражение "человеческое антитело", используемое в данном документе, как предполагается, не включает антитела, в которых последовательности CDR, полученные из последовательности зародышевого типа других видов млекопитающих, таких как мышь, были пересажены на человеческие каркасные последовательности.
Выражение "человеческое моноклональное антитело" относится к антителам, проявляющим единственную специфичность связывания, которые имеют вариабельные области, в которых как каркасные, так и CDR-области получены из последовательностей иммуноглобулина зародышевого типа человека. В одном варианте осуществления человеческие моноклональные антитела продуцируются гибридомой, которая содержит В-клетку, полученную из трансгенного животного, не являющегося человеком, например, трансгенной мыши, имеющего геном, содержащий трансген тяжелой цепи и трансген легкой цепи человека, слитую с иммортализованной клеткой.
Выражение "рекомбинантное человеческое антитело", используемое в данном документе, включает все человеческие антитела, которые получают, экспрессируют, создают или выделяют рекомбинантными способами, например, (а) антитела, выделенные из животного (например, мыши), которое является трансгенным или трансхромосомным по генам иммуноглобулина человека, или гибридомы, полученной из них (описано дополнительно ниже), (b) антитела, выделенные из клетки-хозяина, трансформированной для экспрессии человеческого антитела, например, из трансфектомы, (с) антитела, выделенные из рекомбинантной комбинаторной библиотеки человеческих антител, и (d) антитела, полученные, экспрессированные, созданные или выделенные любым другим способом, который включает сплайсинг последовательностей гена иммуноглобулина человека с другими последовательностями ДИК. Такие рекомбинантные человеческие антитела имеют вариабельные области, в которых каркасные и CDR-области получены из последовательностей иммуноглобулина зародышевого типа человека. В некоторых вариантах осуществления, однако, такие рекомбинантные человеческие антитела могут подвергаться мутагенезу in vitro (или, если используют животное, трансгенное по последовательностям Ig человека, соматическому мутагенезу in vivo) и, таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител представляют собой последовательности, которые, хотя и получены из и являются родственными последовательностям VH и VL зародышевого типа человека, не могут в естественных условиях существовать in vivo в наборе последовательностей зародышевого типа для человеческих антител.
Используемое в данном документе выражение "изотип" относится к классу антител (например, IgM или IgG1), который кодируется генами константной области тяжелой цепи.
Фразы "антитело, распознающее антиген" и "антитело, специфичное к антигену" используются в данном документе взаимозаменяемо с выражением "антитело, которое специфически связывается с антигеном".
Как используется в данном документе, антитело, которое "специфически связывается с человеческими белками LY6G6F, VSIG10, ТМЕМ25 или LSR", должно относиться к антителу, которое связывается с белками LY6G6F, VSIG10, ТМЕМ25 или LSR, соответственно, как, например, с KD 5×10 -8 М, 3×10 -8 М, 1×10 -9 М или менее.
Выражение "K-assoc" или "Kа", используемое в данном документе, предназначено для обозначения скорости ассоциации конкретного взаимодействия антитело-антиген, тогда как выражение "Kdiss" или "Kd", используемое в данном документе, предназначено для обозначения скорости диссоциации конкретного взаимодействия антиген-антитело. Выражение "KD", используемое в данном документе, предназначено для обозначения константы диссоциации, которую получают из отношения Kd к Kа (т.е., Kd/Ka) и выражают в виде молярной концентрации (М). Значения KD для антител можно определить с помощью способов, хорошо известных в данной области техники. Предпочтительным способом определения KD антитела является использование поверхностного плазменного резонанса предпочтительно с использованием биосенсорной системы, такой как система BiacoreRTM.
Используемое в данном документе выражение "с высоким сродством" для антитела IgG относится к антителу, имеющему KD 10-8 М или менее, более предпочтительно 10-9 М или менее и еще более предпочтительно 10-10 М или менее для мишеневого антигена. Однако связывание "с высоким сродством" может отличаться для других изотипов антител. Например, связывание "с высоким сродством" для изотипа IgM относится к антителу, имеющему KD 10-7 М или менее, более предпочтительно 10-8 М или менее.
Используемое в данном документе выражение "субъект" или "пациент" включает любого человека или животное, не являющееся человеком. Выражение "животное, не являющееся человеком" включает всех позвоночных, например, млекопитающих и немлекопитающих, таких как приматы, не являющиеся человеком, овцы, собаки, кошки, лошади, коровы, куры, амфибии, рептилии и т.д.
Антитела к LY6G6F, VSIG10, TMEM25 и LSR
Антитела согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, в том числе антитела, имеющие конкретные последовательности зародышевого типа, гомологичные антитела, антитела с консервативными модификациями, разработанные и модифицированные антитела, характеризуются конкретными функциональными особенностями или свойствами антител. Например, антитела специфически связываются с человеческим LY6G6F, VSIG10, TMEM25 или LSR. Предпочтительно антитело согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения связывается с соответствующим LY6G6F, VSIG10, TMEM25 или LSR с высоким сродством, например, с KD 10 -8 М или менее, или 10 -9 М или менее, или даже 10 -10 М или менее. Антитела к LY6G6F, к VSIG10, к TMEM25 и к LSR согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения предпочтительно проявляют одну или несколько из следующих характеристик:
(i) связываются с соответствующим человеческим LY6G6F, VSIG10, TMEM25 или LSR с KD 5×10-8 М;
(ii) модулируют (увеличивают или ингибируют) иммунную костимуляцию В7 и родственные активности и функции, такие как Т-клеточные ответы, участвующие в противоопухолевом иммунитете и аутоиммунитете, и/или
(iii) связываются с антигеном LY6G6F, VSIG10, TMEM25 или LSR, экспрессируемым раковыми клетками, в том числе, например, меланомой, раком печени, почек, головного мозга, молочной железы, толстой кишки, легких, яичников, поджелудочной железы, простаты, желудка, множественной миеломой и раком кроветворной ткани, включая, без ограничения, лимфому (Ходжкина и неходжкинскую), острый и хронический лимфобластный лейкоз и острый и хронический миелолейкоз, но фактически не связываются с нормальными клетками. Кроме того, предпочтительно эти антитела и их конъюгаты будут эффективно вызывать селективное уничтожение таких раковых клеток и модулировать иммунные ответы, участвующие в аутоиммунитете и при раке.
Более предпочтительно антитело связывается с соответствующим человеческим антигеном LY6G6F, VSIG10, ТМЕМ25 или LSR с KD 3×10 -8 М или менее, или с KD 1×10 -9 М или менее, или с KD 0,1×10 -9 М или менее, или с KD 0,05×10 -9 М или менее, или с KD от 1×10 -9 до 1×10 -11 М.
Стандартные анализы для оценки способности связывания антител с LY6G6F, VSIG10, ТМЕМ25 или LSR известны в данной области техники, в том числе, например, ELISA, вестерн-блот и RIA. Подходящие анализы подробно описаны в Примерах. Кинетику связывания (например, сродство связывания) антител также можно оценить с помощью стандартных анализов, известных в данной области техники, таких как анализ Biacore.
После продуцирования антител к LY6G6F, VSIG10, ТМЕМ25 и LSR последовательности из антител могут связываться с LY6G6F, VSIG10, ТМЕМ25 или LSR, последовательности VH и VL можно "комбинировать" для создания других молекул, связывающих LY6G6F, VSIG10, ТМЕМ25 и LSR, согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. Связывание с LY6G6F, VSIG10, ТМЕМ25 или LSR таких "комбинированных" антител можно испытать с помощью анализов связывания, описанных выше (например, ELISA). Предпочтительно, если цепи VH и VL комбинируют, последовательность VH из конкретной пары VH/VL заменяют структурно подобной последовательностью VH. Таким же образом, предпочтительно последовательность VL из конкретной пары VH/VL заменяют структурно подобной последовательностью VL. Например, последовательности VH и VL из гомологичных антител особенно подходят для комбинирования.
АНТИТЕЛА С КОНКРЕТНЫМИ ПОСЛЕДОВАТЕЛЬНОСТЯМИ ЗАРОДЫШЕВОГО ТИПА
В некоторых вариантах осуществления антитело по настоящему изобретению содержит вариабельную область тяжелой цепи из конкретного гена тяжелой цепи иммуноглобулина зародышевого типа и/или вариабельную область легкой цепи из конкретного гена легкой цепи иммуноглобулина зародышевого типа.
Как используется в данном документе, человеческое антитело содержит вариабельные области тяжелой или легкой цепи, то есть является "продуктом" или "получено из" конкретной последовательности зародышевого типа, если вариабельные области антитела получены из системы, в которой используются гены иммуноглобулина зародышевого типа человека. Такие системы включают иммунизацию трансгенной мыши, несущий гены иммуноглобулина человека, представляющим интерес антигеном или скрининг генетической библиотеки иммуноглобулинов человека на фаговом дисплее с представляющим интерес антигеном. Человеческое антитело, которое является "продуктом" или "получено из" последовательности иммуноглобулина зародышевого типа человека, можно идентифицировать как таковое путем сравнения аминокислотной последовательности человеческого антитела с аминокислотными последовательностями иммуноглобулинов зародышевого типа человека и выбора последовательности иммуноглобулина зародышевого типа человека, которая ближе всего по последовательности (т.е. с наибольшим % идентичности) к последовательности человеческого антитела.
Человеческое антитело, которое является "продуктом" или "получено из" конкретной последовательности иммуноглобулина зародышевого типа человека, может содержать аминокислотные различия по сравнению с последовательностью зародышевого типа за счет, например, природных соматических мутаций или преднамеренного введения сайт-направленной мутации. Однако выбранное человеческое антитело обычно является по меньшей мере на 90% идентичным по аминокислотной последовательности аминокислотной последовательности, кодируемой геном иммуноглобулина зародышевого типа человека и содержит аминокислотные остатки, которые идентифицируют человеческое антитело как человеческое по сравнению с аминокислотными последовательностями иммуноглобулина зародышевого типа других видов (например, мышиными последовательностями зародышевого типа). В некоторых случаях человеческое антитело может быть по меньшей мере на 95, 96, 97, 98 или 99% или даже по меньшей мере на 96%, 97%, 98% или 99% идентичным по аминокислотной последовательности аминокислотной последовательности, кодируемой геном иммуноглобулина зародышевого типа. Как правило, человеческое антитело, полученное из конкретной последовательности зародышевого типа человека, будет проявлять не более 10 аминокислотных отличий от аминокислотной последовательности, кодируемой геном иммуноглобулина зародышевого типа человека. В некоторых случаях человеческое антитело может проявлять не более 5 или даже не более 4, 3, 2 или 1 аминокислотного отличия от аминокислотной последовательности, кодируемой геном иммуноглобулина зародышевого типа.
ГОМОЛОГИЧНЫЕ АНТИТЕЛА
В еще одном варианте осуществления антитело по настоящему изобретению содержит вариабельные области тяжелой и легкой цепи, содержащие аминокислотные последовательности, которые являются гомологичными выделенным аминокислотным последовательностям против LY6G6F, VSIG10, ТМЕМ25 или LSR из предпочтительных антител к LY6G6F, VSIG10, ТМЕМ25 или LSR, соответственно, где антитела сохраняют желаемые функциональные свойства исходных антител к LY6G6F, VSIG10, ТМЕМ25 или LSR.
Как используется в данном документе, процент гомологии между двумя аминокислотными последовательностями эквивалентен проценту идентичности двух последовательностей. Процент идентичности двух последовательностей является функцией числа идентичных положений, общих для последовательностей (т.е., % гомологии = # идентичных положений/общее # положений × 100), принимая во внимание количество пробелов и длину каждого пробела, которые должны быть введены для оптимального выравнивания двух последовательностей. Сравнение последовательностей и определение процента идентичности двух последовательностей можно осуществить с использованием математического алгоритма, описанного в неограничивающих примерах ниже.
Процент идентичности двух аминокислотных последовательностей можно определить с использованием алгоритма Е. Meyers и W. Miller (Comput. Appl. Biosci., 4:11-17 (1988)), который был включен в программу ALIGN (версия 2.0), используя таблицу веса остатков РАМ 120, штраф за продолжение пробела 12 и штраф за внесение пробела 4. Кроме того, процент идентичности двух аминокислотных последовательностей можно определить с помощью алгоритма Needleman и Wunsch (J. Mol. Biol. 48:444-453 (1970)), который был включен в программу GAP в пакет программ GCG (коммерчески доступен), с помощью либо матрицы Blossum 62, либо матицы РАМ250 и весом пробела 16, 14, 12, 10, 8, 6 или 4 и весом удлинения 1, 2, 3, 4, 5 или 6.
Дополнительно или альтернативно белковые последовательности по настоящему изобретению можно дополнительно использовать в качестве «запрашиваемой последовательности» для выполнения поиска в общедоступных базах данных, например, для идентификации родственных последовательностей. Такие поиски можно выполнить с помощью программы XBLAST (версия 2.0) из Altschul et al. (1990) J Mol. Biol. 215:403-10. blast-поиски белков можно выполнить с помощью программы XBLAST, оценка=50, длина слова=3, для получения аминокислотных последовательностей, гомологичных молекулам антител согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. Для получения выравнивания с пробелами в целях сравнения можно использовать Gapped BLAST, описанную в Altschul et al., (1997) Nucleic Acids Res. 25(17):3389-3402. При использовании программ BLAST и Gapped BLAST можно использовать параметры по умолчанию соответствующих программ (например, XBLAST и NBLAST).
Антитела с консервативными модификациями
В некоторых вариантах осуществления антитело по настоящему изобретению содержит вариабельную область тяжелой цепи, содержащую последовательности CDR1, CDR2 и CDR3, и вариабельную область легкой цепи, содержащую последовательности CDR1, CDR2 и CDR3, где одна или несколько этих последовательностей CDR содержат указанные аминокислотные последовательности на основе предпочтительных антител к LY6G6F, VSIG10, ТМЕМ25 или LSR, выделенных и полученных с применением способов данного документа, или их консервативных модификаций, и где антитела сохраняют желаемые функциональные свойства антител к LY6G6F, VSIG10, ТМЕМ25-или LSR согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, соответственно.
В различных вариантах осуществления антитело к LY6G6F, VSIG10, ТМЕМ25 или LSR может быть, например, человеческим антителом, гуманизированным антителом или химерным антителом.
Используемое в данном документе выражение "консервативные модификации последовательности" предназначено для обозначения модификаций аминокислот, которые существенно не влияют или не изменяют характеристики связывания антитела, содержащего аминокислотную последовательность. Такие консервативные модификации включают аминокислотные замены, добавления и делеции. Модификации можно ввести в антитело согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения с помощью стандартных техник, известных в данной области техники, таких как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. Консервативными аминокислотными заменами являются замены, в которых аминокислотный остаток заменен на аминокислотный остаток, имеющий сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, определены в данной области техники. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серии, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин фенилаланин, триптофан, гистидин). Таким образом, один или несколько аминокислотных остатков в пределах CDR-областей антитела согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно заменить другими аминокислотными остатками из того же семейства боковых цепей, и измененное антитело можно проверить на сохраненность функции (т.е., функций, изложенных с (с) по (j) выше) с помощью функциональных анализов, описанных в данном документе.
Антитела, которые связываются с тем же эпитопом, что и антитела к LY6G6F, VSIG10, TMEM25 или LSR, согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения.
В другом варианте осуществления настоящее изобретение предоставляет антитела, которые связываются с предпочтительными эпитопами на человеческих LY6G6F, VSIG10, TMEM25 или LSR, которые обладают желаемыми функциональными свойствами, такими как модулирование костимуляции В7 и родственных функций. Можно выбрать другие антитела с желаемой эпитопной специфичностью, и они будут иметь способность к перекрестной конкуренции в отношении связывания антигена LY6G6F, VSIG10, TMEM25 или LSR с желаемыми антителами.
СПРОЕКТИРОВАННЫЕ И МОДИФИЦИРОВАННЫЕ АНТИТЕЛА
Антитело согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения дополнительно можно получить с использованием антитела, имеющего одну или несколько последовательностей VH и/или VL, полученных из исходного материала антител к LY6G6F, VSIG10, TMEM25 или LSR, для разработки модифицированного антитела, при этом модифицированное антитело может иметь измененные свойства относительно исходного антитела. Антитело можно разработать путем модификации одного или нескольких остатков в пределах одной или обеих вариабельных областей (т.е., VH и/или VL), например, в пределах одной или нескольких CDR-областей и/или в пределах одной или нескольких каркасных областей. Дополнительно или альтернативно, антитело можно разработать путем модификации остатков в пределах константных областей, например, для изменения эффекторных функций антитела.
Одним из типов разработки вариабельной области, которую можно осуществить, является пересадка CDR. Антитела взаимодействуют с мишеневыми антигенами преимущественно посредством аминокислотных остатков, которые расположены в шести областях, определяющих комплементарность (CDR), тяжелой и легкой цепи. По этой причине аминокислотные последовательности в пределах CDR сильнее различаются у отдельных антител, чем последовательности вне CDR. Поскольку последовательности CDR ответственны за большинство взаимодействий антиген-антитело, можно экспрессировать рекомбинантные антитела, которые имитируют свойства конкретных природных антител, путем конструирования векторов экспрессии, которые содержат последовательности CDR из конкретного природного антитела, пересаженные на каркасные последовательности из другого антитела с другими свойствами (см., например, Riechmann L. et al. (1998) Nature 332:323-327; Jones P. et al. (1986) Nature 321:522-525; Queen C. et al. (1989) Proc. Natl. Acad. See. U.S.A. 86:10029-10033; патент США №5225539 от Winter, и патенты США №5530101; 5585089; 5693762 и 6180370 от Queen и соавт.).
Подходящие каркасные последовательности можно получить из общедоступных баз данных ДНК или опубликованных источников, которые включают последовательности генов антител зародышевого типа. Например, последовательности ДНК зародышевого типа для генов вариабельной области тяжелой и легкой цепи человека можно найти в базе данных последовательностей зародышевого типа человека "VBase" (доступно в Интернете), а также в Kabat E. А. et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242; Tomlinson I. M. et al. (1992) "The Repertoire of Human Germline VH Sequences Reveals about Fifty Groups of VH Segments with Different Hyper-variable Loops" J. Mol. Biol. 227:776-798; и Сох J. P. L. et al. (1994) "A Directory of Human Germline VH Segments Reveals a Strong Bias in their Usage" Eur. J Immunol. 24:827-836; содержание каждого из которых специально включено в данный документ с помощью ссылки.
Другим типом модификации вариабельной области является мутирование аминокислотных остатков в пределах областей CDR1, CDR2 и/или CDR3 в VH и/или VL, чтобы таким образом улучшить одно или несколько свойств связывания (например, сродство) представляющего интерес антитела. Сайт-направленный мутагенез и ПЦР-опосредованный мутагенез можно выполнить для введения мутаций и влияния на связывание антитела или другие представляющие интерес функциональные свойства и можно оценить в соответствующих анализах in vitro или in vivo. Предпочтительно вводят консервативные модификации (как обсуждалось выше). Мутации могут быть аминокислотными заменами, добавлениями или делениями, но предпочтительно заменами. Кроме того, как правило, изменяют не более одного, двух, трех, четырех или пяти остатков в пределах CDR-области.
Разработанные антитела согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения включают антитела, в которых были произведены модификации в каркасных остатках в пределах VH и/или VL, например, для улучшения свойств антитела. Как правило, такие модификации каркасной области выполняют для уменьшения иммуногенности антитела. Например, один из подходов заключается в "мутировании к первоначальному виду" одного или нескольких каркасных остатков относительно соответствующей последовательности зародышевого типа. Более конкретно, антитело, которое подверглось соматической мутации, может содержать каркасные остатки, которые отличаются от последовательности зародышевого типа, из которой получено антитело. Такие остатки можно идентифицировать путем сравнения последовательностей каркасной области антител с последовательностями зародышевого типа, из которых получено антитело.
Кроме того или альтернативно, для модификаций, произведенных в пределах каркасных областей или CDR-областей, можно разработать антитела согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, включающие модификаций в Fc-области, как правило, чтобы изменить одно или несколько функциональных свойств антитела, таких как время полужизни в сыворотке крови, фиксация комплемента, связывание с Fc-рецептором и/или антиген-зависимая клеточная цитотоксичность. Кроме того, антитело согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно модифицировать химически (например, можно присоединить один или несколько фрагментов химических веществ к антителу) или модифицировать с изменением его гликозилирования, опять таки чтобы изменить одно или несколько функциональных свойств антитела. Такие варианты осуществления дополнительно описаны ниже. Нумерация остатков в Fc-области соответствует EU-индексу по Kabat.
В одном варианте осуществления шарнирную область СН1 модифицируют таким образом, что изменяется количество остатков цистеина в шарнирной области, например, увеличивается или уменьшается. Этот подход дополнительно описан в патенте США №5677425 Bodmer и соавт. Количество остатков цистеина в шарнирной области СН1 изменяют, например, для того, чтобы облегчить сборку легкой и тяжелой цепей или чтобы увеличить или уменьшить стабильность антитела.
В другом варианте осуществления осуществляется мутирование шарнирной Fc-область антитела с уменьшением биологического времени полужизни антитела. Более конкретно, одну или несколько аминокислотных мутаций вводят в область промежутка доменов СН2-СН3 шарнирного Fc-фрагмента таким образом, что связывание стафилококкового белка A (SpA) антителом слабее по сравнению со связыванием SpA нативным шарнирным Fc-доменом. Этот подход описан более подробно Ward и соавт. в патенте США №6165745.
В другом варианте осуществления антитело модифицируют для увеличения его биологического времени полужизни. Возможны различные подходы. Например, можно ввести одну или несколько из следующих мутаций: T252L, T254S, T256F, которые описаны Ward в патенте США №6277375. Альтернативно, для увеличения биологического времени полужизни антитело можно изменить в пределах области СН1 или CL так, что оно включает эпитоп связывания рецептора реутилизации, взятый из двух петель домена СН2 Fc-области IgG, как описано Presta и соавт. в патентах США №5869046 и 6121022.
В других вариантах осуществления Fc-область изменяют путем замены по меньшей мере одного аминокислотного остатка другим аминокислотным остатком с изменением эффекторной функции антитела. Например, одну или несколько аминокислот, выбранных из аминокислотных остатков 234, 235, 236, 237, 297, 318, 320 и 322, можно заменить другим аминокислотным остатком таким образом, что антитело имеет измененное сродство к эффекторному лиганду, но сохраняет антигенсвязывающую способность исходного антитела. Эффекторный лиганд, сродство к которому изменяется, может быть, например, Fc-рецептором или С1 компонентом комплемента. Этот подход описан более подробно в патентах США №5624821 и 5648260, оба от Winter и соавт.
В другом примере одна или несколько аминокислот, выбранных из аминокислотных остатков 329, 331 и 322, можно заменить другим аминокислотным остатком таким образом, что изменяется связывание C1q антителом и/или оно обладает сниженной комплемент-зависимую цитотоксичностью (CDC) или утрачивает ее. Этот подход описан более подробно в патенте США №6194551 от Idusogie и соавт.
В другом примере один или несколько аминокислотных остатков в положениях аминокислот 231 и 239 изменяют, чтобы тем самым изменить способность антитела фиксировать комплемент. Этот подход дополнительно описан в публикации РСТ WO 94/29351 от Bodmer и соавт.
В еще одном примере Fc-область модифицируют для увеличения способности антитела опосредовать антитело-зависимую клеточную цитотоксичность (ADCC) и/или для увеличения сродства антитела к Fey-рецептору путем модификации одной или нескольких аминокислот в следующих положениях: 238, 239, 248, 249, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 298, 301, 303, 305, 307, 309, 312, 315, 320, 322, 324, 326, 327, 329, 330, 331, 333, 334, 335, 337, 338, 340, 360, 373, 376, 378, 382, 388, 389, 398, 414, 416, 419, 430, 434, 435, 437, 438 или 439. Этот подход дополнительно описан в публикации РСТ WO 00/42072 от Presta. Кроме того, сайты связывания на человеческом IgG1 для Fc-гамма-RI, Fc-гамма-RII, Fc-гамма-RIII и FcRn были картированы, и были описаны варианты с улучшенным связыванием (см. Shields R. L. et al. (2001) J. Biol. Chem. 276:6591-6604). Конкретные мутации в положениях 256, 290, 298, 333, 334 и 339, как показано, улучшают связывание с FcyRIII. Кроме того, следующие комбинаторные мутанты, как показано, улучшают связывание с Fc-гамма-RIII: T256A/S298A, S298A/E333A, S298A/K224A и S298A/E333A/K334A. Кроме того, мутации, такие как M252Y/S254T/T256E или M428L/N434S, улучшают связывание с FcRn и увеличивают время полужизни в кровеносном русле антител (см. Chan С.A. and Carter P. J. (2010) Nature Rev. Immunol. 10:301-316).
В еще одном варианте осуществления модифицируют гликозилирование антитела. Например, можно создать агликозилированное антитело (т.е., недостаточно гликозилированное антитело). Гликозилирование можно изменить, например, для увеличения сродства антитела к антигену. Такие углеводные модификации можно осуществить, например, изменением одного или нескольких сайтов гликозилирования в последовательности антитела. Например, можно произвести одну или несколько аминокислотных замен, что приводит к устранению одного или нескольких каркасных сайтов гликозилирования вариабельных областей, чтобы тем самым устранить гликозилирование в этом сайте. Такое агликозилирование может увеличить сродство антитела к антигену. Такой подход описан более подробно в патентах США №5714350 и 6350861 от Со и соавт.
Дополнительно или альтернативно можно создать антитело, обладающее измененным типом гликозилирования, например, гипофукозилированное антитело, имеющее пониженное количество фукозильных остатков, или антитело, имеющее увеличенные разветвляющиеся GlcNac структуры. Было показано, что такие измененные паттерны гликозилирования увеличивают ADCC способность антител. Такие углеводные модификации можно осуществить, например, экспрессией антитела в клетке-хозяине с измененным механизмом гликозилирования. Клетки с измененным механизмом гликозилирования были описаны в данной области техники и могут быть использованы в качестве клеток-хозяев для экспрессии в них рекомбинантных антител согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения для получения таким образом антитела с измененным гликозилированием. Например, клеточные линии Ms704, Ms705 и Ms709 лишены гена фукозилтрансферазы, FUT8 (альфа-(1,6)-фукозилтрансфераза), так что у антител, экспрессируемых в клеточных линиях Ms704, Ms705 и Ms709, отсутствует фукоза на их углеводах. Клеточные линии Ms704, Ms705 и Ms709 FUT8.-/- создают целенаправленным повреждением гена FUT8 в клетках CHO/DG44 с использованием двух векторов замещения (см. публикацию патента США №20040110704 от Yamane и соавт. и Yamane-Ohnuki и соавт. (2004). Biotechnol. Bioeng. 87:614-22). В качестве другого примера, в ЕР 1176195 Hanai и соавт. описывают клеточную линию с геном FUT8 с нарушенной функцией, который кодирует фукозилтрансферазу, так что в антителах, экспрессируемых в такой клеточной линии, наблюдается гипофукозилирование из-за уменьшения количества или устранения фермента, способствующего образованию альфа-1,6-связи. Hanai и соавт. также описывают клеточные линии, которые характеризуются низкой ферментативной активностью в отношении присоединения фукозы к N-ацетилглюкозамину, который связывается с Fc-областью антитела, или не имеют этой ферментативной активности, например, клеточная линия миеломы крысы YB2/0 (АТСС CRL 1662). В публикации РСТ WO 03/035835 Presta описывает клеточную линию вариантного СНО, клетки Lee 13, со сниженной способностью к присоединению фукозы к Asn(297)-связанным углеводам, что также приводит к гипофукозилированию антител, экспрессируемых в этой клетке-хозяине (см. также Shields R. L. et al., (2002) J. Biol. Chem. 277:26733-26740). В публикации РСТ WO 99/54342 Umana и соавт. описывают клеточные линии, разработанные для экспрессии гликопротеин-модифицирующих гликозилтрансфераз (например, бета-(1,4)-N-ацетилглюкозаминил трансфераза III (GnTIII)), так что антитела, экспрессируемые в разработанных клеточных линиях, обнаруживают увеличенные разветвляющиеся структуры GlcNac, что приводит к повышенной ADCC-активности антител (см. также Umana et al. (1999) Nat. Biotech. 17:176-180). Альтернативно, остатки фукозы антитела могут быть отщеплены с помощью фермента фукозидазы. Например, фукозидаза, альфа-L-фукозидаза, удаляет фукозильные остатки антитела (Tarentino A. et al. (1975) Biochem. 14:5516-23).
Другой модификацией антител в данном документе, которая предполагается настоящим изобретением, является пегилирование. Антитело можно пегилировать, например, для повышения биологического (например, сывороточного) времени полужизни антитела. Для пегилирования антитела, как правило, осуществляют реакцию антитела или его фрагмента с полиэтиленгликолем (PEG), таким как реакционноспособный сложный эфир или альдегидное производное PEG, в условиях, при которых одна или несколько PEG-групп присоединяются к антителу или фрагменту антитела. Предпочтительно пегилирование осуществляют посредством реакции ацилирования или реакции алкилирования с реакционноспособной молекулой PEG (или водорастворимого полимера с аналогичной реакционноспособностью). Используемое в данном документе выражение "полиэтиленгликоль", как предполагается, охватывает любую форму PEG, которые использовались для дериватизации других белков, например, моно-(С1-С10)алкокси- или арилоксиполиэтиленгликоль или полиэтиленгликоль-малеимид. В некоторых вариантах осуществления пегилируемым антителом является агликозилированное антитело. Способы пегилирования белков известны в данной области техники и их можно применять к антителам согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. См., например, ЕР 0154316 от Nishimura и соавт. и ЕР 0401384 от Ishikawa и соавт.
СПОСОБЫ РАЗРАБОТКИ АНТИТЕЛ
Как обсуждалось выше, антитела к LY6G6F, VSIG10, ТМЕМ25 или LSR, имеющие последовательности VH и VK, раскрытые в данном документе, можно использовать для создания новых антител к LY6G6F, VSIG10, ТМЕМ25 или LSR, соответственно, путем модифицирования последовательностей VH и/или VL или константных областей, присоединенных к ним. Таким образом, в другом аспекте согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения структурные особенности антитела к LY6G6F, VSIG10, ТМЕМ25 или LSR согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения применяют для создания структурно родственных антител к LY6G6F, VSIG10, ТМЕМ25 или LSR, которые сохраняют по меньшей мере, одно функциональное свойство антител согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, такое как связывание с человеческим LY6G6F, VSIG10, ТМЕМ25 или LSR, соответственно. Например, одну или несколько CDR-областей из одного антитела к LY6G6F, VSIG10, ТМЕМ25 или LSR, или его мутации можно рекомбинантно объединить с известными каркасными областями и/или другими CDR для создания дополнительных рекомбинантно разработанных антител к LY6G6F, VSIG10, ТМЕМ25 или LSR согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, которые обсуждаются выше. Другие типы модификаций включают модификации, которые описаны в предыдущем разделе. Исходным материалом для способа разработки является одна или несколько последовательностей VH и/или VK, предоставленных в данном документе, или одна или несколько их CDR-областей. Для создания разработанного антитела не является необходимым фактическое получение (т.е., экспрессия в виде белка) антитела, имеющего одну или несколько из последовательностей VH и/или VK, предоставленных в данном документе, или одну или несколько их CDR-областей. Вместо этого, информацию, содержащуюся в последовательностях, используют в качестве исходного материала для создания последовательностей "второго поколения", полученных из оригинальных последовательностей, а затем последовательности "второго поколения" получают и экспрессируют в виде белка.
Стандартные методы молекулярной биологии могут быть использованы для получения и экспрессии измененной последовательности антитела.
Предпочтительно, антитело, кодируемое измененными последовательностями антитела, представляет собой антитело, которое сохраняет одно, несколько или все функциональные свойства антител к LY6G6F, VSIG10, ТМЕМ25 или LSR, соответственно, полученных с помощью способов и с последовательностями, предоставленными в данном документе, чьи функциональные свойства включают связывание с антигеном LY6G6F, VSIG10, ТМЕМ25 или LSR с конкретным уровнем KD или ниже, и/или модулирование костимуляции В7, и/или селективное связывание с желаемыми клетками-мишенями, такими как, например, меланомы, рака печени, почек, головного мозга, молочной железы, толстой кишки, легких, яичников, поджелудочной железы, простаты, желудка, множественной миеломы и рака кроветворной ткани, включая, без ограничения, лимфому (Ходжкина и неходжкинскую), острый и хронический лимфобластный лейкоз и острый и хронический миелолейкоз, которые экспрессируют антиген LY6G6F, VSIG10, ТМЕМ25 и/или LSR.
Функциональные свойства измененных антител можно оценить с использованием стандартных анализов, доступных в данной области техники и/или описанных в данном документе.
В некоторых вариантах осуществления способов разработки антител согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения мутации могут быть введены случайным образом или избирательно по всей или в части последовательности, кодирующей антитело к LY6G6F, VSIG10, ТМЕМ25 или LSR, и можно проводить скрининг полученных модифицированных антител к LY6G6F, VSIG10, ТМЕМ25 или LSR на активность связывания и/или другие желаемые функциональные свойства.
Мутационные способы были описаны в данной области техники. Например, в публикации РСТ WO 02/092780 Short описывает способы создания и скрининга мутаций антител с использованием насыщающего мутагенеза, сборки с синтетическим лигированием, или их комбинации. Альтернативно, в публикации РСТ WO 03/074679 Lazar и соавт. описывают способы применения вычислительных методов скрининга для оптимизации физико-химических свойств антител.
МОЛЕКУЛЫ НУКЛЕИНОВЫХ КИСЛОТ, КОДИРУЮЩИЕ АНТИТЕЛА
Другой аспект настоящего изобретения относится к молекулам нуклеиновых кислот, которые кодируют антитела согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. Нуклеиновые кислоты могут присутствовать в цельных клетках, в клеточном лизате или в частично очищенной или фактически чистой форме. Нуклеиновая кислота является "выделенной" или "представлена фактически чистой", когда она очищена от других клеточных компонентов или других примесей, например, других клеточных нуклеиновых кислот или белков, с помощью стандартных техник, в том числе обработки щелочью/SDS, CsCl-бэндинга, колоночной хроматографии, агарозного гель-электрофореза и других хорошо известных в данной области техники. См., Ausubel F. et al., ed. (1987) Current Protocols in Molecular Biology, Greene Publishing and Wiley Interscience, New York. Нуклеиновая кислота согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения может быть, например, ДНК или РНК и может содержать или не содержать интронные последовательности. В предпочтительном варианте осуществления нуклеиновая кислота представляет собой молекулу кДНК.
Нуклеиновые кислоты согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно получить с использованием стандартных методов молекулярной биологии. Для антител, экспрессируемых гибридомами (например, гибридомами, полученными из трансгенных мышей, несущих гены иммуноглобулина человека, которые описаны дополнительно ниже), кДНК, кодирующие легкую и тяжелую цепи антитела, произведенные гибридомой, можно получить с помощью стандартных техник ПЦР-амплификации или клонирования кДНК. Для антител, полученных с помощью генной библиотеки иммуноглобулинов (например, с использованием фагового дисплея), нуклеиновую кислоту, кодирующую антитело, можно выделить из библиотеки.
После получение фрагментов ДНК, кодирующих сегменты VH и VL, на эти фрагменты ДНК можно дополнительно воздействовать стандартными техниками рекомбинантной ДНК, например, для преобразования генов вариабельной области в гены цепи антитела полной длины, в гены Fab-фрагмента или в ген scFv. При таких воздействиях фрагмент ДНК, кодирующий VL или VH, функционально связывают с другим фрагментом ДНК, кодирующим другой белок, такой как константная область антитела или гибкий линкер.
Выражение "функционально связанный", используемое в данном контексте, как предполагается, означает, что два фрагмента ДНК соединены таким образом, что аминокислотные последовательности, кодируемые двумя фрагментами ДНК, остаются внутри рамки считывания.
Выделенную ДНК, кодирующую область VH, можно преобразовать в ген тяжелой цепи полной длины путем функционального связывания ДНК, кодирующей VH, с другой молекулой ДНК, кодирующей константные области тяжелой цепи (СН1, СН2 и СН3). Последовательности генов константной области тяжелой цепи человека известны в данной области техники (см., например, Kabat E.A. et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), а фрагменты ДНК, охватывающие эти области, можно получить с помощью стандартной ПЦР-амплификации. Константная область тяжелой цепи может быть константной областью IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, но наиболее предпочтительно константной областью IgG1 или IgG4. Для гена Fab-фрагмента тяжелой цепи ДНК, кодирующая VH, может быть функционально связанной с другой молекулой ДНК, кодирующей только константную область СН1 тяжелой цепи.
Выделенную ДНК, кодирующую область VL, можно преобразовать в ген легкой цепи полной длины (а также ген Fab легкой цепи) путем функционального связывания ДНК, кодирующей VL, с другой молекулой ДНК, кодирующей константную область легкой цепи, CL. Последовательности генов константной области легкой цепи человека известны в данной области техники (см., например, Kabat E. А. et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), а фрагменты ДНК, охватывающие эти области, можно получить с помощью стандартной ПЦР-амплификации. Константная область легкой цепи может быть константной областью каппа или лямбда, но наиболее предпочтительно константной областью каппа.
Для создания гена scFv фрагменты ДНК, кодирующие VH и VL, функционально связывают с другим фрагментом, кодирующим гибкий линкер, например, кодирующим аминокислотную последовательность (Gly4-Ser)3, так что последовательности VH и VL могут быть экспрессированы в виде непрерывного одноцепочечного белка с областями VL и VH, соединенными гибким линкером (см., например, Bird et al., (1988) Science 242:423-426; Huston et al., (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883; McCafferty et al., (1990) Nature 348:552-554).
Получение моноклональных антител к LY6G6F, VSIG10, ТМЕМ25 или LSR
Моноклональные антитела (mAb) по настоящему изобретению могут быть получены с помощью различных техник, в том числе по обычной методике моноклональных антител, например, с помощью стандартной техники гибридизации соматических клеток по Kohler и Milstein (1975) Nature 256:495. Хотя процедуры гибридизации соматических клеток являются предпочтительными, в принципе, могут быть использованы другие техники получения моноклональных антител, например, вирусная или онкогенная трансформация В-лимфоцитов.
Предпочтительной животной системой для получения гибридом является мышиная система. Производство гибридом в мыши является прочно установившейся процедурой. Протоколы иммунизации и техники выделения иммунизированных спленоцитов для слияния известны в данной области техники. Сливающиеся клетки (например, клетки мышиной миеломы) и процедуры слияния также известны.
Химерные или гуманизированные антитела по настоящему изобретению можно получить на основе последовательности мышиного моноклонального антитела, полученного, как описано выше. ДНК, кодирующую тяжелые и легкие цепи иммуноглобулина, можно получить из представляющей интерес мышиной гибридомы и разработать как содержащую не мышиные (например, человеческие) последовательности иммуноглобулина с использованием стандартных методов молекулярной биологии. Например, для создания химерного антитела мышиные вариабельные области могут быть связаны с человеческими константными областями с использованием способов, известных в данной области техники (см., например, патент США №4816567 от Cabilly и соавт.). Для создания гуманизированного антитела мышиные CDR-области можно вставить в человеческую каркасную область с использованием способов, известных в данной области техники (см., например, патент США №5225539 от Winter, и патенты США №5530101, 5585089, 5693762 и 6180370 от Queen и соавт.).
Согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения антитела представляют собой человеческие моноклональные антитела. Такие человеческие моноклональные антитела, направленные против LY6G6F, VSIG10, ТМЕМ25 и/или LSR, можно генерировать с использованием трансгенных или трансхромосомных мышей, несущих части иммунной системы человека, вместо системы мыши. Эти трансгенные и трансхромосомные мыши включают мышей, называемых в данном документе HuMAb Mouse RTM и KM Mouse RTM, соответственно, и обобщенно называемые в данном документе, как "мыши с человеческими Ig". HuMAb Mouse TM (Medarex. Inc.) содержит минилокусы гена иммуноглобулина человека, которые кодируют переаранжированные последовательности тяжелой (мю и гамма) и каппа легкой цепи иммуноглобулина человека, а также целевые мутации, которые инактивируют эндогенные локусы мю и каппа цепей (см., например, Lonberg et al. (1994) Nature 368 (6474):856-859). Соответственно, мыши характеризуются пониженной экспрессией мышиного IgM или каппа, и в ответ на иммунизацию в отношении введенных трансгенов человеческой тяжелой и легкой цепи осуществляется переключение класса и соматическая мутация с генерированием моноклональных человеческих IgG-каппа с высоким сродством (Lonberg N. et al. (1994), выше; обзор в Lonberg, N. (1994) Handbook of Experimental Pharmacology 113:49-101; Lonberg N. and Huszar D. (1995) Intern. Rev. Immunol. 13:65-93, и Harding F. and Lonberg N. (1995) Ann. N.Y. Acad. Sci. 764:536-546). Получение и применение HuMab Mouse RTM и геномные модификации, которые несут такие мыши, дополнительно описаны в Taylor L. et al. (1992) Nucleic Acids Research 20:6287-6295; Chen J. et al. (1993) International Immunology 5:647-656; Tuaillon et al. (1993) Proc. Natl. Acad. Sci. USA 90:3720-3724; Choi et al. (1993) Nature Genetics 4:117-123; Chen J. et al. (1993) EMBO J. 12:821-830; Tuaillon et al. (1994) J. Immunol. 152:2912-2920; Taylor L. et al. (1994) International Immunology 6:579-591; и Fishwild D. et al. (1996) Nature Biotechnology 14:845-851, содержание всех из которых таким образом специально включено в данный документ посредством ссылки во всей их полноте. См. дополнительно патенты США №5545806, 5569825, 5625126, 5633425, 5789650, 5877397, 5661016, 5814318, 5874299 и 5770429, все от Lonberg и Kаy; патент США №5545807 от Surani и соавт.; публикации РСТ № WO 92/03918, WO 93/12227, WO 94/25585, WO 97/13852, WO 98/24884 и WO 99/45962, все от Lonberg и Kаy, и публикация РСТ № WO 01/14424 от Korman и соавт.
В другом варианте осуществления человеческие антитела согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно получить с помощью мыши, которая несет последовательности человеческого иммуноглобулина на трансгенах и трансхромосомах, например, мыши, которая несет трансген человеческой тяжелой цепи и трансхромосому человеческой легкой цепи. Такие мыши, называемые в данном документе "KM mice TM", подробно описаны в публикации РСТ WO 02/43478 от Ishida и соавт.
Более того, альтернативные системы трансгенных животных, экспрессирующие гены иммуноглобулина человека, доступны в данной области техники, и их можно использовать для получения антител к LY6G6F, VSIG10, ТМЕМ25 и/или LSR согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. Например, можно использовать альтернативные трансгенные системы, называемые Xenomouse (Abgenix, Inc), такие мыши описаны, например, в патентах США №5939598, 6075181, 6114598, 6150584 и 6162963 от Kucherlapati и соавт.
Кроме того, альтернативные трансхромосомные животные системы, экспрессирующие гены иммуноглобулина человека, доступны в данной области техники, и их можно использовать для получения антител к LY6G6F, VSIG10, ТМЕМ25 и/или LSR согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. Например, можно использовать мышей, несущих одновременно трансхромосому человеческой тяжелой цепи и трансхромосому человеческой легкой цепи, называемых "мыши ТС", такие мыши описаны в Tomizuka et al. (2000) Proc. Natl. Acad Sci. USA 97:722-727. Кроме того, коровы несущие трансхромосомы тяжелой и легкой цепей человека, были описаны в данной области техники (Kuroiwa et al. (2002) Nature Biotechnology 20:889-894), и их можно использовать для получения антител к LY6G6F, VSIG10, ТМЕМ25 и/или LSR согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения.
Человеческие моноклональные антитела согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения также можно получить с использованием способов фагового дисплея для скрининга библиотек генов иммуноглобулинов человека. Такие способы фагового дисплея для выделения человеческих антител установлены в данной области техники. См., например, патенты США №5223409, 5403484 и 5571698 от Ladner и соавт., патенты США №5427908 и 5580717 от Dower и соавт., патенты США №5969108 и 6172197 от McCafferty и соавт., и патенты США №5885793, 6521404, 6544731, 6555313, 6582915 и 6593081 от Griffiths и соавт.
Человеческие моноклональные антитела согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения также можно получить с использованием мышей SCID, у которых человеческие иммунные клетки были реконструированы таким образом, что может быть получено образование человеческих антител в ответ на иммунизацию. Такие мыши описаны, например, в патентах США №5476996 и 5698767 от Wilson и соавт.
ИММУНИЗАЦИЯ МЫШЕЙ С ЧЕЛОВЕЧЕСКИМИ IG
Когда мышей с человеческими Ig используют для получения человеческих антител согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, таких мышей можно иммунизировать очищенным или обогащенным препаратом антигена LY6G6F, VSIG10, ТМЕМ25 и/или LSR и/или рекомбинантного LY6G6F, VSIG10, ТМЕМ25 и/или LSR или слитого белка LY6G6F, VSIG10, ТМЕМ25 и/или LSR, как описано в Lonberg N. et al. (1994) Nature 368 (6474):856-859; Fishwild D. et al. (1996) Nature Biotechnology 14:845-851, и в публикациях РСТ WO 98/24884 и WO 01/14424. Предпочтительно мыши будут 6-16 недельного возраста при первой инфузии. Например, можно использовать очищенный или рекомбинантный препарат (5-50 мкг) антигена LY6G6F, VSIG10, ТМЕМ25 и/или LSR для иммунизации мышей с человеческими Ig внутрибрюшинно.
Предыдущий опыт других исследователей с различными антигенами показал, что у транегенных мышей ответ получают при первоначальной внутрибрюшинной (IP) иммунизации антигеном в полном адъюванте Фрейнда с последующими IP иммунизациями раз в две недели (в общей сложности до 6) антигеном в неполном адъюванте Фрейнда. Однако другие адъюванты, помимо адъюванта Фрейнда, также оказались эффективными. Кроме того, цельные клетки в отсутствие адъюванта проявляют высокую иммуногенность. Иммунный ответ можно контролировать в ходе протокола иммунизации по образцам плазмы, получаемым ретроорбитально. Можно осуществлять скрининг плазмы с помощью ELISA (как описано ниже), и мышей с достаточными титрами человеческого иммуноглобулина к LY6G6F, VSIG10, ТМЕМ25 и/или LSR можно использовать для слияний. Мышей можно реиммунизировать внутривенно антигеном за 3 дня до умерщвления и удаления селезенки. Ожидается, что может понадобиться выполнить 2-3 слияния для каждой иммунизации. От 6 до 24 мышей, как правило, иммунизируют для каждого антигена. Обычно используют обе линии НСо7 и НСо12. Кроме того, оба трансгена НСо7 и НСо12 можно скрещивать в одной мыши, имеющей два различных трансгена человеческой тяжелой цепи (НСо7/НСо12). Альтернативно или дополнительно, можно использовать линию KМ Mouse RTM.
СОЗДАНИЕ ГИБРИДОМ, ПРОДУЦИРУЮЩИХ ЧЕЛОВЕЧЕСКИЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА
Для создания гибридом, продуцирующих человеческие моноклональные антитела согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, спленоциты и/или клетки лимфатических узлов из иммунизированной мыши можно выделить и слить с соответствующей иммортализованной клеточной линией, такой как линия клеток мышиной миеломы. Можно осуществлять скрининг полученных гибридом в отношении продуцирования антиген-специфических антител. Например, суспензии лимфоцитов селезенки одного клеточного типа от иммунизированных мышей можно слить с одной шестой количества P3X63-Ag8.653 несекретирующих клеток мышиной миеломы (АТСС, CRL 1580) с 50% PEG. Клетки высевают при приблизительно 2×10 -5 на плоскодонные микротитрационные планшеты, с последующей двухнедельной инкубацией в селективной среде, содержащей 20% фетальной клонирующей сыворотки, 18% кондиционированной среды "653", 5% оригена (IGEN), 4 мМ L-глутамина, 1 мМ пирувата натрия, 5 мМ HEPES, 0,055 мМ 2-меркаптоэтанола, 50 Ед/мл пенициллина, 50 мг/мл стрептомицина, 50 мг/мл гентамицина и IX HAT (Sigma; HAT добавляют через 24 часа после слияния). Примерно через две недели клетки можно культивировать в среде, в которой HAT заменена на НТ. Можно осуществлять скрининг отдельных лунок с помощью ELISA в отношении человеческих моноклональных антител IgM и IgG. После того, как происходит интенсивный рост гибридомы, среду можно исследовать обычно после 10-14 дней. Гибридомы, секретирующие антитела, можно пересеять, снова подвергнуть скринингу, и при сохранении положительного результата на человеческий IgG моноклональные антитела можно субклонировать по меньшей мере дважды путем серийных разведении. Стабильные субклоны затем можно культивировать in vitro для генерирования небольших количеств антитела в тканевой культуральной среде для определения характеристик.
Для очистки человеческих моноклональных антител выбранные гибридомы можно выращивать в двухлитровый колбах с перемешиванием для очистки моноклональных антител. Надосадочные жидкости можно отфильтровать и сконцентрировать перед аффинной хроматографией с белком А - сефарозой (Pharmacia, Пискатавей, Нью-Йорк). Элюированный IgG можно проверить путем гель-электрофореза и высокоэффективной жидкостной хроматографии для обеспечения чистоты. Буферный раствор можно заменить на PBS, а концентрацию можно определить посредством OD280 с использованием коэффициента экстинкции 1,43. Моноклональные антитела можно разделить на аликвоты и хранить при -80°С.
СОЗДАНИЕ ТРАНСФЕРТОМ, ПРОДУЦИРУЮЩИХ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА
Антитела согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения также можно продуцировать в трансфектоме клетки-хозяина посредством, например, сочетания техник рекомбинантной ДНК и способов генной трансфекции, хорошо известных в данной области техники (например, Morrison S. (1985) Science 229:1202).
Например, для экспрессии антител или фрагментов этих антител ДНК, кодирующие неполную легкую и тяжелую цепи или легкую и тяжелую цепи полной длины, можно получить с помощью стандартных методов молекулярной биологии (например, ПЦР-амплификации или клонирования кДНК с использованием гибридомы, которая экспрессирует представляющее интерес антитело) и ДНК можно вставить в векторы экспрессии таким образом, что гены функционально связаны с последовательностями, управляющими транскрипцией и трансляцией. В данном контексте выражение "функционально связанный", как предполагается, означает, что ген антитела лигируют в вектор таким образом, что последовательности, управляющие транскрипцией и трансляцией, в векторе выполняют предназначенную им функцию управления транскрипцией и трансляцией гена антитела. Вектор экспрессии и последовательности, управляющие экспрессией, выбирают так, чтобы они были совместимыми с используемой экспрессирующей клеткой-хозяином. Ген легкой цепи антитела и ген тяжелой цепи антитела можно вставить в отдельные векторы или, что более типично, оба гена вставляют в один и тот же вектор экспрессии. Гены антител вставляют в вектор экспрессии стандартными способами (например, лигированием комплементарных сайтов рестрикции на фрагменте гена антитела и вектора или лигированием тупых концов, если сайты рестрикции не присутствуют). Вариабельные области легкой и тяжелой цепи антител, описанных в данном документе, можно использовать для создания генов антитела полной длины любого изотипа антитела путем вставки их в векторы экспрессии, уже кодирующие константную область тяжелой цепи и константную область легкой цепи желаемого изотипа, таким образом, что VH-сегмент функционально связан с CH-сегментами в векторе, а VK-сегмент функционально связан с CL-сегментом в векторе. Дополнительно или альтернативно, рекомбинантный вектор экспрессии может кодировать сигнальный пептид, который облегчает секрецию цепи антитела из клетки-хозяина. Ген цепи антитела можно клонировать в вектор таким образом, что сигнальный пептид связан в рамке считывания с амино-концом гена цепи антитела. Сигнальный пептид может быть сигнальным пептидом иммуноглобулина или гетерологичным сигнальным пептидом (т.е., сигнальный пептид из белка, не являющегося иммуноглобулином).
В дополнение к генам цепи антитела, рекомбинантные векторы экспрессии согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения несут регуляторные последовательности, которые управляют экспрессией генов цепи антитела в клетке-хозяине. Выражение "регуляторная последовательность", как предполагается, включает промоторы, энхансеры и другие элементы, управляющие экспрессией (например, сигналы полиаденилирования), которые управляют транскрипцией или трансляцией генов цепи антитела. Такие регуляторные последовательности описаны, например, в Goeddel (Gene Expression Technology. Methods in Enzymology 185, Academic Press, San Diego, Calif. (1990)). Специалистам в данной области техники будет очевидно, что конструирование вектора экспрессии, включая выбор регуляторных последовательностей, может зависеть от таких факторов, как выбор клетки-хозяина для трансформации, уровня экспрессии желаемого белка и т.д. Предпочтительные регуляторные последовательности для экспрессии в клетках-хозяевах млекопитающих включают вирусные элементы, которые направляют высокие уровни экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры, полученные из цитомегаловируса (CMV), вакуолизирующего обезьяньего вируса 40 (SV40), аденовируса (например, основной поздний промотор аденовируса (AdMLP) и полиомы. Альтернативно, можно использовать невирусные регуляторные последовательности, например, промотор убиквитина или бета-глобина. Более того, регуляторные элементы, состоящие из последовательностей из различных источников, таких как промоторная система альфа-SR, которая содержит последовательности из раннего промотора SV40 и длинный концевой повтор человеческого вируса 1 типа Т-клеточного лейкоза (Takebe Y. et al. (1988) Mol. Cell. Biol. 8:466-472).
В дополнение к генам цепи антитела и регуляторным последовательностям рекомбинантные векторы экспрессии согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения могут нести дополнительные последовательности, такие как последовательности, которые управляют репликацией вектора в клетках-хозяевах (например, точки начала репликации) и селектируемые маркерные гены. Селектируемый маркерный ген облегчает отбор клеток-хозяев, в которые был введен вектор (см., например, патенты США №4399216, 4634665 и 5179017, все от Axel и соавт.). Например, как правило, селектируемый маркерный ген придает устойчивость к лекарственным средствам, таким как G418, гигромицин или метотрексат, клетке-хозяину, в которую был введен вектор. Предпочтительные селектируемые маркерные гены включают ген дигидрофолатредуктазы (DHFR) (для применения в dhfr-клетках-хозяевах с отбором/амплификацией метотрексатом) и ген nео (для выбора G418).
Для экспрессии легкой и тяжелой цепей векторы экспрессии, кодирующие тяжелую и легкую цепи, трансфицируют в клетку-хозяина с помощью стандартных техник. Различные формы выражения "трансфекция", как предполагается, охватывают большое разнообразие техник, обычно используемых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например, электропорацию, осаждение фосфатом кальция, трансфекцию DEAE-декстраном и тому подобное. Хотя теоретически возможно экспрессировать антитела согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения либо в прокариотических, либо в эукариотических клетках-хозяевах, экспрессия антител в эукариотических клетках, и наиболее предпочтительно в клетках-хозяевах млекопитающих является наиболее предпочтительной, поскольку такие эукариотические клетки и, в частности, клетки млекопитающих являются более подходящими, чем прокариотические клетки, для сборки и секреции правильно сложенного и иммунологически активного антитела. Прокариотическая экспрессия генов антител по сообщениям является неэффективной для продуцирования активных антител с большим выходом (Boss M. A. and Wood С R. (1985) Immunology Today 6:12-13).
Предпочтительные клетки-хозяева млекопитающих для экспрессии рекомбинантных антител согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения включают клетки яичника китайского хомячка (клетки СНО) (в том числе, dhfr-клетки СНО, описанные в Urlaub and Chasin, (1980) Proc. Natl. Acad. Sci. USA 77:4216-4220, используемые с DHFR-селектируемым маркером, например, как описано в R.J. Kaufman and Sharp P.A. (1982) Mol. Biol. 159:601-621), клетки миеломы NSO, клетки COS и клетки SP2. В частности, для применения с клетками миеломы NSO другой предпочтительной системой экспрессии является система экспрессии гена GS, раскрытая в WO 87/04462, WO 89/01036 и ЕР 338841. Когда рекомбинантные векторы экспрессии, кодирующие гены антител, вводят в клетки-хозяева млекопитающих, антитела получают путем культивирования клеток-хозяев в течение периода времени, достаточного для обеспечения экспрессии антитела в клетках-хозяевах, или, более предпочтительно, секреции антитела в культуральную среду, в которой выращивают клетки-хозяева. Антитела можно извлечь из культуральной среды с использованием стандартных способов очистки белков.
ХАРАКТЕРИСТИКА СВЯЗЫВАНИЯ АНТИТЕЛ С АНТИГЕНОМ
Антитела согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно проверить на связывание с LY6G6F, VSIG10, ТМЕМ25 и/или LSR с помощью, например, стандартного ELISA. Коротко, на планшеты для микротитрования наносят очищенные LY6G6F, VSIG10, ТМЕМ25 и/или LSR при 0,25 мкг/мл в PBS, а затем блокируют 5% альбумином бычьей сыворотки в PBS. Разведения антитела (например, разведения плазмы от иммунизированных мышей) добавляют в каждую лунку и инкубируют в течение 1-2 часов при 37°С. Планшеты промывают PBS/Tween, а затем инкубируют со вторичным реагентом (например, для человеческих антител это Fc-специфичный против человеческого IgG поликлональный реагент козы), конъюгированным со щелочной фосфатазой в течение 1 часа при 37°С. После промывки планшеты проявляют субстратом pNPP (1 мг/мл) и анализируют при OD 405-650. Предпочтительно мыши, у которых проявляются самые высокие титры, будут использованы для слияния.
Анализ ELISA, описанный выше, можно также использовать для скрининга гибридом, которые проявляют положительную реактивность с иммуногеном LY6G6F, VSIG10, ТМЕМ25 и/или LSR. Гибридомы, которые связываются с высокой авидностью с LY6G6F, VSIG10, ТМЕМ25 и/или LSR, субклонируют и дополнительно характеризуют. Один клон из каждой гибридомы, которая сохраняет реактивность родительских клеток (по ELISA), можно выбрать для изготовления 5-10 флаконов клеточного банка, сохраняемого при -140°С, и для очистки антител.
Для очистки антител к LY6G6F, VSIG10, ТМЕМ25 и/или LSR выбранные гибридомы можно выращивать в двухлитровый колбах с перемешиванием для очистки моноклональных антител. Надосадочные жидкости можно отфильтровать и сконцентрировать перед аффинной хроматографией с белком А - сефарозой (Pharmacia, Пискатавей, Нью-Йорк). Элюированный IgG можно проверить путем гель-электрофореза и высокоэффективной жидкостной хроматографии для обеспечения чистоты. Буферный раствор можно заменить на PBS, а концентрацию можно определить при OD280 с использованием коэффициента экстинкции 1,43. Моноклональные антитела можно разделить на аликвоты и хранить при -80°С.
Чтобы определить, связываются ли выбранные моноклональные антитела к LY6G6F, VSIG10, ТМЕМ25 и/или LSR с уникальными эпитопами, каждое антитело можно биотинилировать с использованием коммерчески доступных реагентов (Pierce, Rockford, I11.). Исследования конкуренции с использованием немеченых моноклональных антител и биотинилированных моноклональных антител можно выполнить с использованием описанных выше планшетов для ELISA с нанесенными LY6G6F, VSIG10, ТМЕМ25 и/или LSR. Связывание биотинилированных mAb можно обнаружить с помощью зонда стрептавидин-щелочная фосфатаза.
Для определения изотипа очищенных антител может быть выполнен ELISA изотипа с использованием реагентов, специфических для антител конкретного изотипа. Например, для определения изотипа человеческого моноклонального антитела на лунки планшетов для микротитрования можно нанести 1 мкг/мл антитела к иммуноглобулину человека в течение ночи при 4°С. После блокирования 1% BSA пластины подвергают взаимодействию с 1 мкг/мл или менее исследуемых моноклональных антител или контроля очищенного изотипа при температуре окружающей среды в течение одного-двух часов. Лунки затем можно подвергнуть взаимодействию либо с человеческим IgG1, либо со специфическим относительно человеческого IgM конъюгированным со щелочной фосфатазой зондом. Планшеты проявляют и анализируют, как описано выше.
Человеческие IgG к LY6G6F, VSIG10, ТМЕМ25 и/или LSR можно дополнительно проверить на реактивность относительно антигена LY6G6F, VSIG10, ТМЕМ25 и/или LSR, соответственно, с помощью вестерн-блоттинга. Коротко, антиген LY6G6F, VSIG10, ТМЕМ25 и/или LSR можно получить и подвергнуть электрофорезу в полиакриламидном геле в присутствии додецилсульфата натрия. После электрофореза разделенные антигены переносят на нитроцеллюлозные мембраны, блокируют 10% фетальной телячьей сывороткой и зондирую с использованием моноклональных антител, подлежащих проверке. Связывание человеческого IgG можно обнаружить с использованием конъюгированного со щелочной фосфатазой антитела к человеческому IgG и проявить с помощью субстратных пластинок BCIP/NBT (Sigma Chem. Co., Сент-Луис, Миссури).
АЛЬТЕРНАТИВНЫЕ КАРКАСНЫЕ СТРУКТУРЫ
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение относится к белковым каркасным структурам со специфичностью и сродством, находящимися в диапазоне, аналогичном таковому для специфических антител. Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение относится к антигенсвязывающему конструкту, содержащему белковую каркасную структуру, которая связана с одним или несколькими эпитоп-связывающими доменами. Такие разработанные белковые каркасные структуры обычно получают конструированием случайной библиотеки с мутагенезом, сфокусированным на области петли или на другой доступной поверхности, и посредством отбора вариантов против данной мишени с помощью фагового дисплея или родственных техник. Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение относится к альтернативным каркасным структурам включая, без ограничения, антикалины, DARPins, белки с повтором армадилло, белок А, липокалины, фибронектиновый домен, домен анкиринового консенсусного повтора, тиоредоксин, химически ограниченные пептиды и тому подобное. Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение относится к альтернативным каркасным структурам, которые используют в качестве терапевтических средств для лечения рака, аутоиммунных и инфекционных заболеваний, а также для диагностики in vivo.
Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение, кроме того, предоставляет фармацевтическую композицию, содержащую антигенсвязывающий конструкт, описанный в данном документе, и фармацевтически приемлемый носитель.
Выражение "белковая каркасная структура", используемое в данном документе, включает, без ограничения, каркасную структуру иммуноглобулина (Ig), например, каркасную структуру иммуноглобулина (Ig), которая может быть четырех- или двухцепочечным антителом, или которая может содержать только Fc-область антитела, или которая может содержать одну или несколько константных областей антитела, и эти константные области могут быть человеческими или приматов, или которые могут быть искусственными химерами константных областей человека и приматов. Такие белковые каркасные структуры могут содержать антиген-связывающие сайты в дополнение к одной или нескольким константным областям, например, когда белковая каркасная структура содержит полный IgG. Такие белковые каркасные структуры будут способны к связыванию с другими белковыми доменами, например, белковыми доменами, которые имеют антиген-связывающие сайты, например, эпитоп-связывающие домены или ScFv-домены.
"Домен" представляет собой складчатую структуру белка, который имеет третичную структуру независимо от остальной части белка. Как правило, домены отвечают за дискретные функциональные свойства белков и во многих случаях могут быть добавлены, удалены или перемещены в другие белки без потери функции оставшейся части белка и/или домена. "Единичный вариабельный домен антитела" является полипептидным доменом со складчатой структурой, содержащим последовательности, свойственные вариабельным доменам антител. Вследствие этого оно включает полные вариабельные домены антител и модифицированные вариабельные домены, например, в которых одна или несколько петель были заменены на последовательности, которые не свойственны вариабельным доменам антител, или вариабельные домены антител, которые были усечены или включают N- или C-концевые расширения, а также свернутые фрагменты вариабельных доменов, которые сохраняют по меньшей мере связывающую активность и специфичность домена полной длины.
Фраза "единичный вариабельный домен иммуноглобулина" относится к вариабельному домену антитела (VH, V НН, VL), который специфически связывает антиген или эпитоп независимо от другой V-области или домена. Единичный вариабельный домен иммуноглобулина может быть представлен в формате (например, гомо- или гетеро-мультимера) с другими, различными вариабельными областями или вариабельными доменами, где другие области или домены не требуются для связывания антигена единичным вариабельным доменом иммуноглобулина (т.е., где единичный вариабельный домен иммуноглобулина связывает антиген независимо от дополнительных вариабельных доменов). "Доменное антитело" или "dAb" представляет собой то же, что и "единичный вариабельный домен иммуноглобулина", который способен связываться с антигеном, как выражение используемое в данном документе. Единичный вариабельный домен иммуноглобулина может быть вариабельным доменом человеческого антитела, но также включает единичные вариабельные домены антител из других видов, таких как грызуны (например, как раскрыто в WO 00/29004), акулы-няньки и V НИ dAb верблюдовых. V НН верблюдовых являются полипептидами единичного вариабельного домена иммуноглобулинов, которые получены из видов, включая верблюда, ламу, альпаку, дромадера и гуанако, которые производят антитела с тяжелыми цепями, естественно лишенные легких цепей. Такие V НН-домены можно гуманизировать в соответствии со стандартными техниками, доступными в данной области техники, и такие домены по-прежнему рассматриваются как "доменные антитела" согласно настоящему изобретению. Используемый в данном документе "VH" включает V НН домены верблюдовых. NARV является еще одним типом единичного вариабельного домена иммуноглобулина, который был идентифицирован у хрящевых рыб, включая акулу-няньку. Эти домены также известны как новая вариабельная область рецептора к антигену (обычно сокращенно V(NAR) или NARV). Более подробную информацию см. в Mol. Immunol. 44, 656-665 (2006) и US20050043519A.
Выражение "эпитоп-связывающий домен" относится к домену, который специфически связывает антиген или эпитоп независимо от другой V-области или домена, это может быть доменное антитело (dAb), например, единичный вариабельный домен иммуноглобулина человека, верблюжьих или акулы, или это может быть домен, который является производным каркасной структуры, выбранной из группы, состоящей из CTLA-4 (Evibody); липокалина; молекул, полученных из белка А, таких как Z-домен белка A (Affibody, SpA), А-домен (Avimer/Maxibody); белков теплового шока, таких как GroEI и GroES; трансферрина (Trans-body); белка с анкириновыми повторами (DARPin); пептидного аптамера; лектинового домена C-типа (Tetranectin); человеческого γ-кристаллина и человеческого убиквитина (аффилины); PDZ-доменов; доменов ингибиторов протеазы человека токсина скорпиона Куница, белков с повтором армадилла, тиоредоксина и фибронектина (аднектин), которые были подвергнуты белковой инженерии для того, чтобы добиться связывания с лигандом помимо естественного лиганда.
Петли, соответствующие CDR антител, могут быть замещены гетерологичной последовательностью, чтобы придать различные свойства связывания, т.е. Evibodies. Более подробную информацию см. в Journal of Immunologieal Methods 248 (1-2), 31-45 (2001). Липокалины представляют собой семейство внеклеточных белков, которые транспортируют небольшие гидрофобные молекулы, такие как стероиды, билин, ретиноиды и липиды. Они имеют жесткую вторичную структуру с многочисленными петлями на открытом конце конической структуры, которые можно разработать как связывающиеся с различными антигенами-мишенями. Антикалины имеют размер 160-180 аминокислот и являются производными липокалинов. Более подробную информацию см. в Biochim Biophys Acta 1482:337-350 (2000), US7250297B1 и US20070224633. Affibody представляет собой каркасную структуру, полученную из белка А золотистого стафилококка, которую можно разработать как связывающуюся с антигеном. Домен состоит пучка из трех спиралей из приблизительно 58 аминокислот. Библиотеки были созданы путем рандомизации поверхностных остатков. Более подробную информацию см. в Protein Eng. Des. Sel. 17, 455-462 (2004) и ЕР1641818А1. Avimer являются мультидоменными белками, которые получают из семейства каркасных структур А-домена. Нативные домены из приблизительно 35 аминокислот принимают определенную структуру с дисульфидными связями. Разнообразие создают перетасовкой природных вариантов, представляемых семейством А-доменов. Более подробную информацию см. в Nature Biotechnology 23 (12), 1556-1561 (2005) и Expert Opinion on Investigational Drugs 16(6), 909-917 (June 2007). Трансферрин является мономерным транспортным гликопротеином сыворотки крови. Трансферрины можно разработать как связывающиеся с различными антигенами-мишенями путем вставки пептидных последовательностей в доступную поверхностную петлю. Примеры разработанных трансферриновых каркасных структур включают Trans-body. Более подробную информацию см. в J. Biol. Chem. 274, 24066-24073 (1999).
Сконструированные белки с анкириновыми повторами (DARPins) получают из анкирина, который представляет собой семейство белков, которые опосредуют присоединение интегральных мембранных белков к цитоскелету. Единичный анкириновый повтор представляет собой мотив из 33 остатков, состоящий из двух альфа-спиралей и бета-поворота. Они могут быть разработаны как связывающиеся с различными антигенами-мишенями посредством случайных остатками в первой альфа-спирали и бета-повороте каждого повтора. Их связывающая поверхность может быть увеличена за счет увеличения количества модулей (способ созревания сродства). Более подробную информацию см. в J. Моl. Biol. 332, 489-503 (2003), PNAS 100 (4), 1700-1705 (2003), и J. Моl. Biol. 369, 1015-1028 (2007), и US20040132028A1.
Фибронектин представляет собой каркасную структуру, которую можно разработать как связывающуюся с антигеном. Аднектины состоят из основы из природной аминокислотной последовательности 10-го домена из 15 повторяющихся единиц человеческого фибронектина типа III (FN3). Три петли на одном конце бета-сэндвича можно разработать таким образом, что они позволяют аднектину специфически распознавать представляющую интерес терапевтическую мишень. Более подробную информацию см. в Protein Eng. Des. Sel. 18, 435-444 (2005), 39791 US200801, WO2005056764 и US6818418В1.
Пептидные аптамеры являются комбинаторными распознающими молекулами, которые состоят из константного белка каркасной структуры, как правило, тиоредоксина (ТrхА), который содержит пептидную петлю с ограниченной вариабельностью, вставленную в активный сайт. Более подробную информацию см. в Expert Opin. Biol. Ther. 5. 783-797 (2005).
Микротельца получают из природных микробелков 25-50 аминокислот в длину, которые содержат 3-4 цистеиновых мостика - примеры микробелков включают KalataBI и конотоксин и ноттинсы. У микробелков есть петля, которую можно разработать как включающую до 25 аминокислот без нарушения общей укладки микробелка. Для получения дополнительной информации о разработанных ноттин-доменах см. WO2008098796.
Другие эпитоп-связывающие домены включают белки, которые были использованы в качестве каркасной структуры для разработки различных свойств связывания антигена-мишени, такие как человеческий γ бета-кристаллин и человеческий убиквитин (аффилины), домены ингибитора протеазы человека Куниц, PDZ-домены Ras-связывающий белок AF-6, токсины скорпиона (харибдотоксин), лектиновый домен С-типа (тетранектины), рассматриваются в Главе 7 - Non-Antibody Scaffolds from Handbook of Therapeutic Antibodies (2007, edited by Stefan Dubel) и Protein Science 15:14-27 (2006). Эпитоп-связывающие домены по настоящему изобретению можно получить из любого из этих альтернативных белковых доменов.
КОНЪЮГАТЫ ИЛИ ИММНОКОНЪЮГАТЫ
Настоящее изобретение охватывает конъюгаты для применения в иммунотерапии, содержащие антиген LY6G6F, VSIG10, ТМЕМ25 и/или LSR и их растворимые участки, в том числе эктодомен, или его участки, или варианты. Например, настоящее изобретение охватывает конъюгаты, где ECD антигена LY6G6F, VSIG10, ТМЕМ25 и/или LSR присоединен к иммуноглобулину или его фрагменту. Настоящее изобретение предполагает их применение для стимуляции или ингибирования активностей антигена LY6G6F, VSIG10, ТМЕМ25 и/или LSR, таких как иммунная костимуляция, и их применению в лечении при показаниях к применению, связанных с трансплантацией, аутоиммунными состояниями и раком, описанными в данном документе.
В другом своем аспекте настоящее изобретение описывает конъюгаты антитело-лекарственное средство (ADC), используемые, например, для лечения рака, состоящие из антитела (или фрагмента антитела, такого как одноцепочечный вариабельный фрагмент [ScFv]), связанного с полезным грузом лекарственного препарата (часто цитотоксического). Антитело обуславливает связывание ADC с раковыми клетками-мишенями. Часто ADC после этого поглощается клеткой, и лекарственное средство высвобождается в клетку. Из-за нацеливания побочные эффекты ниже, и обеспечивается более широкое терапевтическое окно. Гидрофильные линкеры (например, PEG4Mal) помогают предотвратить откачку лекарственного средства из резистентных раковых клеток через транспортеры MDR (множественная лекарственная резистентность). ADC на основе расщепляемых линкеров, как полагают, имеют менее благоприятное терапевтическое окно, но мишени (поверхностные антигены клеток опухоли), которые эффективно не поглощаются, представляются более подходящими для расщепляемых линкеров.
В другом аспекте настоящее изобретение описывает иммуноконъюгаты, содержащие антитело к LY6G6F, VSIG10, ТМЕМ25 и/или LSR или его фрагмент, конъюгированный с терапевтическим фрагментом, таким как цитотоксин, лекарственное средство (например, иммуносупрессор) или радиотоксин. Такие конъюгаты упоминаются в данном документе как "иммуноконъюгаты". Иммуноконъюгаты, которые содержат один или несколько цитотоксинов, называют "иммунотоксины". Цитотоксин или цитотоксическое средство включает любое средство, которое наносит повреждение (например, убивает) клеткам. Примеры включают таксол, цитохалазин В, грамицидин D, бромид этидия, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин и их аналоги или гомологи. Терапевтические средства также включают, например, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил декарбазин), алкилирующие средства (например, мехлорэтамин, тиоэпахлорамбуцил, мелфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромоманнитол, стрептозотоцин, митомицин С и цис-дихлородиамин платины (II) (DDP), цисплатин), антрациклины (например, даунорубицин (ранее дауномицин) и доксорубицин), антибиотики (например, дактиномицин (ранее актиномицин) блеомицин, митрамицин и антрамицин (АМС)) и антимитотические средства (например, винкристин и винбластин).
Другие предпочтительные примеры терапевтических цитотоксинов, которые можно конъюгировать с антителом согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, включают дуокармицины, калихеамицины, майтансины и ауристатины и их производные. Пример конъюгата антитело-калихеамицин является коммерчески доступным (Mylotarg.TM;. Wyeth).
Цитотоксины можно конъюгировать с антителами согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения с использованием линкерной технологии, доступной в данной области техники. Примеры типов линкеров, которые были использованы для конъюгирования цитотоксина с антителом, включают, без ограничения, гидразоны, тиоэфиры, сложные эфиры, дисульфиды и пептид-содержащие линкеры. Линкер можно выбрать так, например, чтобы он был чувствительным к расщеплению при низком рН в лизосомальном компартменте или чувствительным к расщеплению протеазами, такими как протеазы, предпочтительно экспрессирующиеся в опухолевой ткани, такие как катепсины (например, катепсины В, C, D).
Для дополнительного обсуждения типов цитотоксинов, линкеров и способов конъюгирования терапевтических средств с антителами см. также Saito G. et al. (2003) Adv. Drug Deliv. Rev. 55:199-215; Trail P. A. et al. (2003) Cancer Immunol. Immunother. 52:328-337; Payne G. (2003) Cancer Cell 3:207-212; Alien Т. М. (2002) Nat. Rev. Cancer 2:750-763; Pastan I. and Kreitman R. J. (2002) Curr. Opin. Investig. Drugs 3:1089-1091; Senter P. D. и Springer C. J. (2001) Adv. Drug Deliv. Rev. 53:247-264.
Антитела согласно настоящему изобретению также можно конъюгировать с радиоактивным изотопом для создания цитотоксических радиофармацевтических препаратов, также известных как радиоиммуноконъюгаты. Примеры радиоактивных изотопов, которые можно конъюгировать с антителами для применения в диагностике или терапии включают, без ограничения, йод-131, индий-111, иттрий-90 и лютеций-177. Способы получения радиоиммуноконъюгатов установлены в данной области техники. Примеры радиоиммуноконъюгатов являются коммерчески доступными, в том числе Zevalin (IDEC Pharmaceuticals) и Bexxar (Corixa Pharmaceuticals), и другие подобные способы можно использовать для получения радиоиммуноконъюгатов с помощью антител согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения.
Конъюгаты антител согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно применять для модификации данного биологического ответа, и фрагмент лекарственного средства не следует истолковывать как ограничивающийся классическими химическими терапевтическими средствами. Например, фрагмент лекарственного средства может быть белком или полипептидом, обладающим желаемой биологической активностью. Такие белки могут содержать, например, ферментативно активный токсин или его активный фрагмент, такой как абрин, рицин А, экзотоксин Pseudomonas или дифтерийный токсин; белок, такой как фактор некроза опухоли или интерферон-гамма, или модификаторы биологического ответа, такие как, например, лимфокины, интерлейкин-1 ("IL-1"), интерлейкин-2 ("IL-2"), интерлейкин-6 ("IL-6"), гранулоцитарно-макрофагальный колониестимулирующий фактор ("GM-CSF"), гранулоцитарный колониестимулирующий фактор ("G-CSF") или другие факторы роста.
Техники конъюгирования такого терапевтического фрагмента с антителами хорошо известны, см., например, Arnon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", in Monoclonal Antibodies And Cancer Therapy, Reisfeld et al. (eds.), pp.243-56 (Alan R. Liss, Inc. 1985); Heilstrom et al., "Antibodies For Drug Delivery", в Controlled Drug Delivery (2nd Ed.), Robinson et al. (eds.), pp.623-53 (Marcel Dekker, Inc. 1987); Thorpe "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", в Monoclonal Antibodies '84: Biological And Clinical Applications, Pinchera et al. (eds.), pp.475-506 (1985); "Analysis, Results, And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy", в Monoclonal Antibodies For Cancer Detection And Therapy, Baldwin et al. (eds.), pp.303-16 (Academic Press 1985), и Thorpe et al., "The Preparation And Cytotoxic Properties Of Antibody-Toxin Conjugates", Immunol. Rev., 62:119-58(1982).
БИСПЕЦИФИЧЕСКИЕ МОЛЕКУЛЫ
В другом аспекте настоящее изобретение описывает биспецифические молекулы, содержащие антитело к LY6G6F, VSIG10, ТМЕМ25 и/или LSR или его фрагмент согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. Антитело согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения или его антиген-связывающие участки можно дериватизировать или связать с другой функциональной молекулой, например, другим пептидом или белком (например, другим антителом или лигандом рецептора) для образования биспецифической молекулы, которая связывается с по меньшей мере двумя различными сайтами связывания или молекулами-мишенями. Антитело согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно фактически дериватизировать или связать с более чем одной иной функциональной молекулой для образования мультиспецифических молекул, которые связываются с более чем двумя различными сайтами связывания и/или молекулами-мишенями, такие мультиспецифические молекулы также, как предполагается, охвачены выражением "биспецифические молекулы", используемым в данном документе. Для создания биспецифической молекулы согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения антитело может быть функционально связано (например, путем химического связывания, генетического слияния, нековалентной связи или иным образом) с одной или несколькими другими связывающими молекулами, такими как другое антитело, фрагмент антитела, миметик пептида или связывания, так что результатом является биспецифическая молекула.
Соответственно, настоящее изобретение включает биспецифические молекулы, содержащие по меньшей мере одну первую специфичность связывания для LY6G6F, VSIG10, ТМЕМ25 и/или LSR и вторую специфичность связывания для второго эпитопа-мишени. Согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения второй эпитоп-мишень представляет собой Fc-рецептор, например, человеческий Fc-гамма RI (CD64) или человеческий Fc-альфа-рецептор (CD89). Таким образом, настоящее изобретение включает биспецифические молекулы, способные связываться эффекторными клетками, экспрессирующими и Fc-гамма R, и Fc-альфа R, и Fc-эпсилон R (например, моноцитами, макрофагами или полиморфно-ядерными клетками (PMN)), и с клетками-мишенями, экспрессирующими LY6G6F, VSIG10, ТМЕМ25 и/или LSR, соответственно. Эти биспецифические молекулы нацеливают клетки, экспрессирующие LY6G6F, VSIG10, ТМЕМ25 и/или LSR, для эффекторных клеток и инициируют Fc-рецептор-опосредованную активность эффекторных клеток, такую как фагоцитоз клеток, экспрессирующих LY6G6F, VSIG10, ТМЕМ25 и/или LSR, антитело-зависимую клеточно-опосредованную цитотоксичноеть (ADCC), высвобождение цитокинов или образование супероксид аниона.
Согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, в которых биспецифические молекулы являются мультиспецифическими, молекула может дополнительно включать третью специфичность связывания в дополнение к специфичности связывания с Fc и специфичности связывания с 6f. В одном варианте осуществления третьей специфичностью связывания является участком, связывающимся с фактором усиления (EF), например, молекула, которая связывается с поверхностным белком, участвующим в цитотоксической активности, и тем самым увеличивает иммунный ответ против клетки-мишени.
"Участок, связывающийся с фактором усиления" может представлять собой антитело, функциональный фрагмент антитела или лиганд, который связывается с данной молекулой, например, антигеном или рецептором, и тем самым приводит к усилению эффекта связывания детерминант для Fc-рецептора или антигена клетки-мишени. "Участок, связывающийся с фактором усиления" может связывать Fc-рецептор или антиген клетки-мишени. Альтернативно, участок, связывающийся с фактором усиления, может связываться с объектом, отличным от объекта, с которым связывает первая и вторая специфичности связывания. Например, участок, связывающийся с фактором усиления, может связывать цитотоксические Т-клетки (например, посредством CD2, CD3, CD8, CD28, CD4, CD40, ICAM-1, или другие иммунные клетки, что приводит к повышению иммунного ответа против клетки-мишени).
Согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения биспецифические молекулы содержат в качестве специфичности связывания по меньшей мере одно антитело или фрагмент такого антитела, в том числе, например, Fab, Fab', F(ab')2, Fv или одноцепочечный Fv. Антитело может быть также димером легкой цепи или тяжелой цепи или любым его минимальным фрагментом, таким как Fv или одноцепочечный конструкт, который описан в Ladner и соавт., патент США №4946778, содержание которого специально включено посредством ссылки.
В одном варианте осуществления специфичность связывания для Fcy-рецептора обеспечивает моноклональное антитело, связывание которого не блокируется человеческим иммуноглобулином G (IgG). Используемое в данном документе выражение "IgG-рецептор" относится к любому из восьми генов гамма-цепи, расположенных на хромосоме 1. Эти гены кодируют в общей сложности двенадцать трансмембранных или растворимых изоформ рецепторов, которые сгруппированы в три класса рецепторов Fc-гамма: Fc-гамма R1 (CD64), Fc-гамма RII (CD32) и Fc-гамма RIII (CD16). В одном предпочтительном варианте осуществления Fc-гамма-рецептор является человеческим с высоким сродством Fc-гамма RI. Человеческий Fc-гамма RI является 72 кДа молекулой, которая проявляет высокое сродство к мономерным IgG (10 8-10-9М.-1).
Производство и характеристика некоторых предпочтительных моноклональных антител к Fc-гамма описаны Fanger и соавт. в публикации РСТ WO 88/00052 и в патенте США №4954617, содержание которых полностью включено в данный документ посредством ссылки. Эти антитела связываются с эпитопом Fc-гамма R1, Fcy RII или Fcy RIII в сайте, который отличается от сайта связывания с Fc-гамма-рецептором и, следовательно, их связывание фактически не блокируется при физиологических уровнях IgG. Специфическими антителами к Fc-гамма RI, пригодными в настоящем изобретении, являются mAb 22, mAb 32, mAb 44, mAb 62 и mAb 197. Гибридому, продуцирующую mAb 32, можно получить в Американской коллекции типовых культур, номер доступа АТСС НВ9469. В других вариантах осуществления антитело к Fcy-рецептору представляет собой гуманизированную форму моноклонального антитела 22 (Н22). Продуцирование и характеристика антитела Н22 описаны в Graziano R.F. et al. (1995) J. Immunol. 155 (10):4996-5002 и в публикации РСТ WO 94/10332. Клеточная линия, продуцирующая антитело Н22, депонирована в Американской коллекции типовых культур под обозначением HAO22CLI и имеет номер доступа CRL 11177.
В других предпочтительных вариантах осуществления специфичность связывания для Fc-рецептора обеспечивает антитело, которое связывается с рецептором человеческого IgA, например, Fc-альфа-рецептором (Fc-альфа RI (CD89)), связывание которого предпочтительно не блокируется человеческим иммуноглобулином А (IgA). Выражение "IgA-рецептор", как предполагается, включает генный продукт одного альфа-гена (Fc-альфа RI), расположенного на хромосоме 19. Известно, что этот ген кодирует несколько трансмембранных изоформ альтернативного еплайсинга от 55 до 10 кДа.
Fc-альфа RI (CD89) конститутивно экспрессируется на моноцитах/макрофагах, эозинофильных и нейтрофильных гранулоцитах, но не на клеточных популяциях, не являющихся эффекторными. Fc-альфа RI имеет среднее сродство (примерно 5×10-7 М-1) как для IgA1, так и для IgA2, которое увеличивается под воздействием цитокинов, таких как G-CSF или GM-CSF (Morton H. С. et al. (1996) Critical Reviews in Immunology 16:423-440). Были описаны четыре FcaRI-специфических моноклональных антитела, идентифицированные как A3, А59, А62 и А77, которые связывают Fc-альфа RI вне лиганд-связывающего домена IgA (Monteiro R. С. et al. (1992) J. Immunol. 148:1764).
Fc-альфа RI и Fc-гамма RI являются предпочтительными триггерными рецепторами для применения в биспецифических молекулах согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, поскольку они (1) экспрессируются прежде всего на иммунных эффекторных клетках, например, моноцитах, PMN, макрофагах и дендритных клетках, (2) экспрессируются на высоком уровне (например, 5000-100000 на клетку), (3) являются медиаторами цитотоксической активности (например, ADCC, фагоцитоза), (4) опосредуют усиленное представление антигенов, в том числе аутоантигенов, направленных на них.
Хотя человеческие моноклональные антитела являются предпочтительными, другими антителами, которые можно использовать в биспецифических молекулах согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, являются мышиные, химерные и гуманизированные моноклональные антитела.
Биспецифические молекулы по настоящему изобретению можно получить путем конъюгирования составных специфичностей связывания, например, специфичностей связывания с FcR и с LY6G6F, VSIG10, ТМЕМ25 и/или LSR, с использованием способов, известных в данной области техники. Например, каждую специфичность связывания биспецифической молекулы можно создать отдельно, а затем конъюгировать друг с другом. Когда специфичностями связывания являются белки или пептиды, можно использовать различные соединяющие или сшивающие средства для ковалентного конъюгирования. Примеры сшивающих средств включают белок А, карбодиимид, N-сукцинимидил-3-ацетил-тиоацетат (SATA), 5,5'-дитиобис(2-нитробензойная кислота) (DTNB), о-фенилендималеимид (oPDM), N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) и сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (сульфо-SMCC) (см., например, Karpovsky et al. (1984) J. Exp. Med. 160:1686; Liu M. A. et al. (1985) Proc. Natl. Acad. Sci. USA 82:8648). Другие способы включают способы, описанные в Paulus (1985) Behring Ins. Mitt. No. 78, 118-132; Brennan et al. (1985) Science 229:81-83), и Glennie et al. (1987) J. Immunol. 139:2367-2375). Предпочтительными конъюгирующими средствами являются SATA и сульфо-SMCC, оба доступны от Pierce Chemical Co. (Rockford, III.).
Когда специфичностями связывания являются антитела, их можно конъюгировать посредством сульфгидрильного связывания C-концевых шарнирных областей двух тяжелых цепей. В особенно предпочтительном варианте осуществления шарнирная область модифицирована таким образом, чтобы она содержала нечетное число сульфгидрильных остатков, предпочтительно один, до конъюгирования.
Альтернативно, обе специфичности связывания могут кодироваться в одном и том же векторе и экспрессироваться и собираться в одной клетке-хозяине. Этот способ является особенно пригодным, когда биспецифической молекулой является слитый белок mAbXmAb, mAbXFab, FabXF(ab')2 или лиганд-XFab. Биспецифическая молекула согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения может быть одноцепочечной молекулой, содержащей одно одноцепочечное антитело и детерминанту связывания, или одноцепочечной биспецифической молекулой, включающей две детерминанты связывания. Биспецифические молекулы могут содержать по меньшей мере две одноцепочечные молекулы. Способы получения биспецифических молекул описаны, например, в патенте США №5260203; патенте США №5455030; патенте США №4881175; патенте США №5132405; патенте США №5091513, патенте США №5476786; патенте США №5013653; патенте США №5258498 и патенте США №5482858.
Связывание биспецифических молекул с их специфическими мишенями можно подтвердить, например, твердофазным иммуноферментным анализом (ELISA), радиоиммунологическим анализом (RIA), FACS-анализом, биологическим анализом (например, ингибирование роста) или вестерн-блоттингом. Каждый из этих анализов обычно обнаруживает присутствие комплекса белок-антитело, представляющего особый интерес, с использованием меченого реагента (например, антитела), специфического для представляющего интерес комплекса. Например, комплексы FcR-антитело можно обнаружить с использованием, например, связанного с ферментом антитела или фрагмента антитела, который распознает и специфически связывается с комплексами антитело-FcR. Альтернативно, комплексы можно обнаружить с использованием любого из множества других иммунологических анализов. Например, антитело можно радиоактивно пометить и использовать в радиоиммунологическом анализе (RIA) (см., например, Weintraub В., Principles of Radioimmunoassays, Seventh Training Course on Radioligand Assay Techniques, The Endocrine Society, March, 1986, который включен в данный документ посредством ссылки). Радиоактивный изотоп можно обнаружить с помощью таких средств, как применение гамма-счетчика, или сцинтилляционного счетчика, или посредством авторадиографии.
МОДИФИКАЦИИ БЕЛКОВ
СЛИТЫЕ БЕЛКИ
Согласно по меньшей мере некоторым вариантам осуществления в слитых полипептидах LY6G6F, VSIG10, ТМЕМ25 и/или LSR первый партнер слияния, содержащий весь или часть белка LY6G6F, VSIG10, ТМЕМ25 и/или LSR, слит со вторым полипептидом непосредственно или через линкерную пептидную последовательность или химический линкер, пригодный для соединения двух белков. Полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR можно необязательно слить со вторым полипептидом с образованием слитого белка, описанного в данном документе. Присутствие второго полипептида может изменить растворимость, стабильность, сродство и/или валентность слитого полипептида LY6G6F, VSIG10, ТМЕМ25 и/или LSR. Используемое в данном документе выражение "валентность" относится к количеству доступных сайтов связывания на молекулу. В одном варианте осуществления второй полипептид представляет собой полипептид из другого источника или другого белка.
Согласно по меньшей мере некоторым вариантам осуществления белок или фрагмент LY6G6F, VSIG10, ТМЕМ25 и/или LSR выбран по его активности в лечении иммунологического нарушения и/или инфекционного нарушения и/или рака, описанного в данном документе.
В одном варианте осуществления второй полипептид содержит один или несколько доменов константной области тяжелой цепи иммуноглобулина, предпочтительно, имеющий аминокислотную последовательность, соответствующую шарнирной, СН2 и СН3 областям цепи Сγ1, Сγ2, Сγ3 или Сγ4 иммуноглобулина человека или шарнирной, СH2 и СН3 областям цепи Сγ2а иммуноглобулина мыши. SEQ ID NO:70 предоставляет иллюстративную последовательность для шарнирной, СН2 и СН3 областей Сγ1 иммуноглобулина человека.
Согласно по меньшей мере некоторым вариантам осуществления слитый белок представляет собой димерный слитый белок. В произвольном димерном слитом белке димер является результатом ковалентного связывания остатка Cys в шарнирной области двух тяжелых цепей Ig, который является тем же остатком Cys, которые связаны дисульфидной связью в димеризованных тяжелых цепей нормального Ig. Такие белки называются полипептиды, фрагменты или слитые белки LY6G6F, VSIG10, ТМЕМ25 и/или LSR.
В одном варианте осуществления константный домен иммуноглобулина может содержать одну или несколько аминокислотных вставок, делеций или замен, которые усиливают связывание со специфическими типами клеток, увеличивают биодоступность или повышают стабильность полипептидов LY6G6F, VSIG10, ТМЕМ25 и/или LSR, их слитых белков или фрагментов. Подходящие аминокислотные замены включают консервативные и неконсервативные замены, описанные выше.
Слитые белки необязательно содержат домен, который функционирует с димеризацией или мультимеризацией двух или более слитых белков. Пептидный/полипептидный линкерный домен может быть либо отдельным доменом, или, альтернативно, может содержаться в одном из других доменов (полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR или второй полипептид) слитого белка. Подобным образом, домен, который функционирует с димеризацией или мультимеризацией слитых белков, может быть либо отдельным доменом, или, альтернативно, может содержаться в одном из других доменов (полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR, второй полипептид или пептидный/полипептидный линкерный домен) слитого белка. В одном варианте осуществления домен димеризации/мультимеризации и пептидный/полипептидный линкерный домен совпадают. Дополнительные специфические иллюстративные и неограничивающие примеры доменов димеризации/мультимеризации и линкеров приведены ниже.
Слитые белки, раскрытые в данном документе согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, имеют формулу I: N-R1-R2-R3-C, где "N" представляет N-конец слитого белка, "С" представляет С-конец слитого белка. В дополнительном варианте осуществления "R1" является полипептидом LY6G6F, VSIG10, ТМЕМ25 и/или LSR, "R2" является необязательным пептидным/полипептидным или химическим линкерным доменом и "R3" является вторым полипептидом. Альтернативно, R3 может быть полипептидом LY6G6F, VSIG10, ТМЕМ25 и/или LSR и R1 может быть вторым полипептидом. Различные неограничивающие примеры линкеров описаны более подробно ниже.
Необязательно, слитый белок содержит фрагменты полипептида LY6G6F, VSIG10, ТМЕМ25 и/или LSR, описанные в данном документе, слитые необязательно линкерным пептидом из одной или нескольких аминокислот (например, GS) с одним или несколькими "фрагментами, увеличивающими время полужизни". "Фрагментом, увеличивающим время полужизни" является любой фрагмент, например, полипептид, малая молекула или полимер, который при добавлении к белку увеличивает in vivo время полужизни данного белка в организме субъекта (например, в плазме субъекта). Например, фрагментом, увеличивающим время полужизни, является в варианте осуществления настоящего изобретения полиэтиленгликоль (PEG), монометокси PEG (mPEG) или иммуноглобулин (Ig). В одном варианте осуществления настоящего изобретения PEG представляет собой фрагмент 5, 10, 12, 20, 30, 40 или 50 кДа или больше или содержит приблизительно 12000 единиц этиленгликоля (PEG12000).
Слитый белок можно также необязательно получить способами химического синтеза, а «объединение» осуществляют химически либо в процессе синтеза, либо после синтеза. Сшивку и другие подобные способы можно необязательно использовать (необязательно также с описанными выше способами слияния на генном уровне), как описано, например, в патенте США №5547853 от Валлнер и соавт., который таким образом включен посредством ссылки, как если бы полностью был изложен в данном документе исключительно в качестве неограничивающего примера.
Согласно настоящему изобретению слитый белок можно получить из белка по настоящему изобретению путем слияния с участком иммуноглобулина, содержащим константную область иммуноглобулина. Более предпочтительно, участок иммуноглобулина содержит константную область тяжелой цепи, которая необязательно и более предпочтительно является человеческой константной областью тяжелой цепи. Константная область тяжелой цепи наиболее предпочтительно является константной областью тяжелой цепи IgG и необязательно и наиболее предпочтительно представляет собой Fc-цепь, наиболее предпочтительно Fc-фрагмент IgG, который содержит шарнирную область, СН2 и СН3 домены. Fc-цепь может необязательно быть Fc-цепью известного или "дикого типа" или, альтернативно, может быть мутированной или усеченной. Fc-участок слитого белка может быть необязательно измененным по изотипу или подклассу, может быть химерным или гибридным и/или может быть модифицированным, например, для улучшения эффекторных функций, регулирования времени полужизни, тканевой доступности, увеличения биофизических характеристик, таких как стабильность, и улучшения эффективности производства (и удешевления). Многие модификации пригодны в конструкции раскрытых слитых белков, а способы их изготовления известны в данной области техники, см., например, Mueller et al., Mol. Immun., 34(6):441-452 (1997), Swann et al., Cur. Opin. Immun., 20:493-499 (2008), и Presta, Cur. Opin. Immun. 20:460-470 (2008). В некоторых вариантах осуществления Fc-область является нативной Fc-областью IgG1, IgG2 или IgG4. В некоторых вариантах осуществления Fc-область является гибридной, например, химерной, состоящей из константных Fc-областей IgG2/IgG4.
Модификации Fc-области включают, без ограничения, IgG4, модифицированный таким образом, чтобы он предотвращал связывание с Fc-гамма-рецепторами и комплементом, IgG1, модифицированный таким образом, чтобы он улучшал связывание с одним или несколькими Fc-гамма-рецепторами, IgG1, модифицированный таким образом, чтобы он минимизировал эффекторную функцию (аминокислотные изменения), IgG1 с изменением/отсутствием гликанов (как правило, путем изменения экспрессирующего хозяина или замены Asn в положении 297) и IgG1 с измененным рН-зависимым связыванием с FcRn. Fc-область может включать всю шарнирную область или менее чем всю шарнирную область.
В другом варианте осуществления Fc-домен может содержать одну или несколько аминокислотных вставок, делеций или замен, которые уменьшают связывание с ингибирующим Fc-рецептором с низким сродством CD32B (FcγRIIB) и сохраняют уровень связывания дикого типа или усиливают связывание с активирующим Fc-рецептором с низким сродством CD16A (FcγRIIIA).
Другой вариант осуществления включает гибриды IgG2-4 и мутанты IgG4c уменьшенным связыванием с FcR (Fc-рецептором), что увеличивает их время полужизни. Типичные гибриды IgG2-4 и мутанты IgG4 описаны в Angal S. et al., Molecular Immunology, 30(1):105-108 (1993); Mueller J. et al., Molecular Immunology, 34(6):441-452 (1997) и в патенте США №6982323 от Wang и соавт. В некоторых вариантах осуществления домен IgG1 и/или IgG2 удален, например, Angal и соавт. описывают IgG1 и IgG2 с заменой серина 241 на пролин.
В дополнительном варианте осуществления Fc-домен содержит аминокислотные вставки, делеции или замены, которые улучшают связывание с CD16A. Большое количество замен в Fc-домене человеческого IgG1, которые увеличивают связывание с CD16A и уменьшают связывание с CD32B, известны в данной области техники и описаны в Stavenhagen et al., Cancer Res., 57(18):8882-90 (2007). Иллюстративные варианты Fc-доменов человеческого IgG1 с уменьшенным связыванием с CD32B и/или увеличенным связыванием с CD16A содержат замены F243L, R929P, Y300L, V305I или P296L. Эти аминокислотные замены могут присутствовать в Fc-домене человеческого IgGI в любой комбинации.
В одном варианте осуществления вариант Fc-домена человеческого IgG1 содержит замены F243L, R929P и Y300L. В другом варианте осуществления вариант Fc-домена человеческого IgG1 содержит замены F243L, R929P, Y300L, V305I и P296L. В другом варианте осуществления вариант Fc-домена человеческого IgG1 содержит замену N297A/Q, так как эти мутации прекращают связывание FcγR. He ограничивающие иллюстративные примерные типы мутаций описаны в заявке на патент США №20060034852, опубликованной 16 февраля 2006 года, включенной таким образом в данный документ посредством ссылки, как если бы полностью была изложена в данном документе. Выражение "Fc-цепь" также необязательно включает любой тип Fc-фрагмента.
Были идентифицированы некоторые из специфических аминокислотных остатков, являющиеся важными для опосредованной константной областью активности антитела подкласса IgG. Включение, замена или исключение этих специфических аминокислот, следовательно, позволяют включить или исключить специфическую активность иммуноглобулина, опосредованную константной областью. Кроме того, специфические изменения могут привести к агликозилированию, например, и/или другим необходимым изменениям в Fc-цепи. По меньшей мере некоторые изменения можно необязательно произвести для блокирования функции Fc, которая считается нежелательной, например, нежелательные эффекты иммунной системы, описанные более подробно ниже.
Не ограничивающие иллюстративные примеры мутаций в Fc, которые можно произвести для модулирования активности слитого белка, включают следующие изменения (представленные согласно номенклатуры последовательности Fc, предоставленной Kabat, из Kabat E.A. et al.: Sequences of Proteins of Immunological Interest. US Department of Health and Human Services, NIH, 1991); 220C -> S; 233-238 ELLGGP -> EAEGAP; 265D -> А, предпочтительно в комбинации с 434N -> A; 297N -> А (например, для блокирования N-гликозилирования); 318-322 EYKCK -> AYACA; 330-331АР -> SS или их комбинацию (см., например, М. Clark, "Chemical Immunol and Antibody Engineering", pp 1-31 для описания этих мутаций и их эффекта). Конструкт для Fc-цепи, который имеет указанные выше изменения, необязательно и предпочтительно содержит комбинацию шарнирной области с доменами СН2 и СН3.
Приведенные выше мутации можно необязательно осуществить для улучшения желаемых свойств или, альтернативно, для блокирования нежелательных свойств. Например, было показано, что агликозилирование антител сохраняет желаемую функциональность связывания, но при этом препятствует истощению Т-клеток или инициирует высвобождение цитокинов, что необязательно может быть нежелательными функциями (см. М. Clark, "Chemical Immunol and Antibody Engineering", pp 1-31). Замена пролина 331 на серин может блокировать способность к активации комплемента, которая необязательно может считаться нежелательной функцией (см. М. Clark, "Chemical Immunol and Antibody Engineering", pp 1-31). Изменение аланина 330 на серин в комбинации с этой заменой также может усилить желаемый эффект блокировки способности активировать комплемент.
Было показано, что остатки 235 и 237 участвуют в антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC), так что изменение блока остатков из 233-238, как описано, также может блокировать подобную активность, если ADCC считается нежелательной функцией.
Остаток 220, обычно, представляет собой цистеин для Fc из IgG1, который является сайтом, в котором тяжелая цепь образует ковалентную связь с легкой цепью. Необязательно, этот остаток можно заменить на другой аминокислотный остаток (например, серин), чтобы избежать ковалентной связи любого типа (см. М. Clark, "Chemical Immunol and Antibody Engineering", pp 1-31), или путем делеции или усечения.
Вышеупомянутые изменения в остатках 265 и 434 можно необязательно осуществить для уменьшения или блокирования связывания с Fc-рецептором, что может необязательно блокировать нежелательную функциональность Fc, связанную с его функциями в иммунной системе (см. "Binding site on Human IgG1 for Fc Receptors", Shieldset al., Vol.276, pp 6591-6604, 2001).
Вышеупомянутые изменения предназначены только в качестве иллюстраций необязательных изменений и, как подразумевается, не должны быть ограничивающими каким-либо образом. Кроме того, вышеупомянутое объяснение предоставляется только в описательных целях, не желая быть связанными одной гипотезой.
В дополнительном варианте осуществления слитый белок содержит внеклеточный домен LY6G6F или его фрагмент, слитый с Fc-областью Ig. Рекомбинантные полипептиды IgLY6G6F, фрагменты или слитые белки из этих слитых белков можно получить путем слияния кодирующей области внеклеточного домена LY6G6F или его фрагмента с Fc-областью человеческого IgG1 или мышиного IgG2a, как описано ранее (Chapoval et al., Methods Mol. Med., 45:247-255 (2000)).
Необязательно ECD LY6G6F относится также к слитому белку, содержащему аминокислотную последовательность человеческого ECD LY6G6F, слитую с Fc человеческого иммуноглобулина. Необязательно, указанный слитый белок содержит аминокислотную последовательность человеческого ECD LY6G6F, изложенную в SEQ ID NO:2, слитую с Fc человеческого IgG1, изложенным в любой из SEQ ID NO:70, 156. Необязательно аминокислотная последовательность указанного слитого белка изложена в SEQ ID NO:71 или SEQ ID NO:172.
В дополнительном варианте осуществления слитый белок содержит внеклеточный домен VSIG10 или его фрагмент, слитый с Fc-областью Ig. Рекомбинантные полипептиды Ig VSIG10, фрагменты или слитые белки из этих слитых белков можно получить путем слияния кодирующей области внеклеточного домена VSIG10 или его фрагмента с Fc-областью человеческого IgG1 или мышиного IgG2a, как описано ранее (Chapoval et al., Methods Mol. Med., 45:247-255 (2000)).
Необязательно ECD VSIG10 относится также к слитому белку, содержащему аминокислотную последовательность человеческого ECD VSIG10, соединенную с Fc человеческого иммуноглобулина. Необязательно указанный слитый белок содержит аминокислотную последовательность человеческого ECD VSIG10, выбранную из аминокислотных последовательностей, изложенных в любой из SEQ ID NO:4 и 6, слитую с Fc человеческого IgG1, изложенным в любой из SEQ ID NO:70, 156. Необязательно аминокислотная последовательность указанного слитого белка изложена в любой из SEQ ID NO:72, 73, 173 и 174.
В дополнительном варианте осуществления слитый белок содержит внеклеточный домен ТМЕМ25 или его фрагмент, слитый с Fc-областью Ig. Рекомбинантные полипептиды Ig TMEM25, фрагменты или слитые белки из этих слитых белков можно получить путем слияния кодирующей области внеклеточного домена ТМЕМ25 или его фрагмента с Fc-областью человеческого IgG1 или мышиного IgG2a, как описано ранее (Chapoval et al., Methods Mol. Med., 45:247-255 (2000)).
Необязательно ECD ТМЕМ25 относится также к слитому белку, содержащему аминокислотную последовательность человеческого ECD ТМЕМ25, соединенную с Fc человеческого иммуноглобулина. Необязательно указанный слитый белок содержит аминокислотную последовательность человеческого ECD ТМЕМ25, изложенную в SEQ ID NO:8, слитую с Fc человеческого IgG1, изложенным в любой из SEQ ID NO:70, 156. Необязательно аминокислотная последовательность указанного слитого белка изложена в любой из SEQ ID NO:74, 175.
В дополнительном варианте осуществления слитый белок содержит внеклеточный домен LSR или его фрагмент, слитый с Fc-областью Ig. Рекомбинантные полипептиды IgLSR, фрагменты или слитые белки из этих слитых белков можно получить путем слияния кодирующей области внеклеточного домена LSR или его фрагмента с Fc-областью человеческого IgG1 или мышиного IgG2a, как описано ранее (Chapoval, et al., Methods Mol. Med., 45:247-255 (2000)).
Необязательно ECD LSR относится также к слитому белку, содержащему аминокислотную последовательность человеческого ECD LSR, слитую с Fc человеческого иммуноглобулина. Необязательно указанный слитый белок содержит аминокислотную последовательность человеческого ECD LSR, выбранную из аминокислотных последовательностей, изложенных в любой из SEQ ID NO:12, 14, 15, 16, 17, 18, 47, 48, 49 и 50, слитую с Fc человеческого IgG1, изложенным в любой из SEQ ID NO:70, 156. Необязательно аминокислотная последовательность указанного слитого белка изложена в любой из SEQ ID NO:75, 76, 77, 78, 79, 80, 176, 177, 178, 179, 180 и 181.
Вышеупомянутые иллюстративные слитые белки могут включать любую комбинацию вариантов, описанных в данном документе. В другом варианте осуществления концевой лизин вышеупомянутых иллюстративных слитых белков удален.
Раскрытые слитые белки можно выделить с использованием стандартных техник молекулярной биологии. Например, вектор экспрессии, содержащий последовательность ДНК, кодирующую полипептиды LY6G6F, VSIG10, ТМЕМ25 и/или LSR, фрагменты или слитые белки из этого слитого белка, трансфицируют в клетки 293 путем осаждения фосфатом кальция и культивируют в бессывороточной DMEM. Надосадочную жидкость собирают через 72 часа и слитый белок очищают с помощью колонок с белком G или предпочтительно белком A SEPHAROSE® (Pharmacia, Уппсала, Швеция). Необязательно последовательность ДНК, кодирующая полипептиды LY6G6F, VSIG10, ТМЕМ25 и/или LSR, фрагменты или слитые белки из этого слитого белка трансфицируют в ретровекторы GPEx® и экспрессируют в клетках CHO-S после четырех циклов трансдукции ретровектора. Белок из надосадочной жидкости очищают с использованием хроматографии с белком А.
В другом варианте осуществления второй полипептид может иметь домен конъюгации, посредством которого дополнительные молекулы могут быть связаны со слитыми белками LY6G6F, VSIG10, ТМЕМ25 и/или LSR. В одном таком варианте осуществления конъюгированная молекула способна нацелить слитый белок на конкретный орган или ткань, дополнительные специфические иллюстративные неограничивающие примеры таких нацеливающих доменов и/или молекул приведены ниже.
В другом таком варианте осуществления конъюгированная молекула представляет собой другое иммуномодулирующее средство, которое может усиливать или повышать эффекты слитого белка LY6G6F, VSIG10, ТМЕМ25 и/или LSR. В другом варианте осуществления конъюгированная молекула является полиэтиленгликолем (PEG).
Пептидный или полипептидный линкерный домен
Раскрытые слитые белки LY6G6F, VSIG10, ТМЕМ25 и/или LSR необязательно содержат пептидный или полипептидный линкерный домен, который отделяет полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR от второго полипептида. В одном варианте осуществления линкерный домен содержит шарнирную область иммуноглобулина. В дополнительном варианте осуществления шарнирная область получена из человеческого иммуноглобулина. Пригодные человеческие иммуноглобулины, из которых можно получить шарнирную область, включают IgG, IgD и IgA. В дополнительном варианте осуществления шарнирную область получают из человеческого IgG. Аминокислотные последовательности шарнирных областей иммуноглобулина и других доменов хорошо известны в данной области техники. В одном варианте осуществления слитые полипептиды LY6G6F, VSIG10, ТМЕМ25 и/или LSR, содержат шарнирную, СН2 и СН3 области из Сγ1-цепи человеческого иммуноглобулина необязательно с Cys в положении 220 (согласно человеческому IgG1 полной длины в положении 5 в SEQ ID NO:70) замененным на Ser (SEQ ID NO:156), характеризующийся по меньшей мере 85%, 90%, 95%, 99% или 100% гомологии последовательности с аминокислотной последовательностью, изложенной в SEQ ID NO:70:

Шарнирную область можно дополнительно укоротить для удаления аминокислот 1, 2, 3, 4, 5 или их комбинации из любой из SEQ ID NO:70 или 156. В одном варианте осуществления аминокислоты 1-5 из любой из SEQ ID NO:70 или 156 удалены. Иллюстративные слитые полипептиды LY6G6F, VSIG10, ТМЕМ25 и/или LSR, содержащие шарнирную, СН2 и СН3 области из Сγ1-цепи человеческого иммуноглобулина с Cys в положении 220 замененным на Ser, приведены в SEQ ID NO:71, 72, 73, 74, 75, 76, 77, 78, 79, 80.
В другом варианте осуществления слитые полипептиды LY6G6F, VSIG10, ТМЕМ25 и/или LSR содержат СН2 и СН3 области из Сγ1-цепи человеческого иммуноглобулина, характеризующиеся по меньшей мере 85%, 90%, 95%, 99% или 100% гомологии последовательности с аминокислотной последовательностью, изложенной в SEQ ID NO:157:

В другом варианте осуществления слитые полипептиды LY6G6F, VSIG10, ТМЕМ25 и/или LSR содержат СН2 и СН3 области из Сγ2а-цепи мышиного иммуноглобулина с по меньшей мере 85%, 90%, 95%, 99% или 100% гомологии последовательности с аминокислотной последовательностью, изложенной в SEQ ID NO:158:


Другие подходящие пептидные/полипептидные линкерные домены включают природные или неприродные пептиды или полипептиды. Последовательности пептидных линкеров составляют по меньшей мере 2 аминокислоты в длину. Необязательно пептидные или полипептидные домены являются гибкими пептидами или полипептидами. "Гибкий линкер" в данном документе относится к пептиду или полипептиду, содержащему два или более аминокислотных остатка, соединенных пептидной связью (связями), что обеспечивает более высокую свободу вращения для двух полипептидов, связанных таким образом, чем для двух связанных полипептидов в отсутствие гибкого линкера. Такая свобода вращения позволяет двум или более антигенсвязывающим сайгам, соединенным гибким линкером, достигать антиген-мишень (антигены-мишени) более эффективно. Иллюстративные гибкие пептиды/полипептиды включают, без ограничения, аминокислотные последовательности Gly-Ser (SEQ ID NO:159), Gly-Ser-Gly-Ser (SEQ ID NO:160), Ala-Ser (SEQ ID NO:161), Gly-Gly-Gly-Ser (SEQ ID NO:162), Gly4-Ser (SEQ ID NO:163), (Gly4-Ser)2 (SEQ ID NO:164), (Gly4-Ser)3 (SEQ ID NO:165) и (Gly4-Ser)4 (SEQ ID NO:166). Дополнительные гибкие последовательности пептидов/полипептидов хорошо известны в данной области техники. Другие пригодные пептидные линкерные домены включают линкеры, формирующие спираль, такие как Ala-(Glu-Ala-Ala-Ala-Lys)n-Ala (n=1-5). Дополнительные формирующие спираль последовательности пептидов/полипептидов хорошо известны в данной области техники. Неограничивающие примеры таких линкеров изображены в SEQ ID NO:167-171.
Домены димеризации, мультимеризации и нацеливания
Слитые белки, раскрытые в данном документе, необязательно содержат домен димеризации или мультимеризации, который функционирует с димеризацией или мультимеризацией двух или более слитых белков. Домен, который функционирует с димеризацией или мультимеризацией слитых белков, может быть либо отдельным доменом, либо, альтернативно, может содержаться в одном из других доменов (полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR, второй полипептид или пептидный/полипептидный линкерный домен) слитого белка.
Димеризация или мультимеризация может происходить между или среди двух или более слитых белков посредством димеризации или мультимеризации доменов. Альтернативно, димеризация или мультимеризация слитых белков может происходить посредством химической сшивки. Димеры или мультимеры, которые образуются, могут быть гомодимерными/гомомультимерными или гетеродимерными/гетеромультимерными. Второй полипептидный "партнер" в слитых полипептидах LY6G6F, VSIG10, ТМЕМ25 и/или LSR может содержать один или несколько других белков, белковых фрагментов или пептидов, описанных в данном документе, включая, без ограничения, любой иммуноглобулиновый (Ig) белок или его участок, предпочтительно Fc-область, или участок биологически или химически активного белка, такого как генный продукт вируса папилломы Е7, меланома-ассоциированный антиген р97), и белок env HIV (gp120). "Партнер" необязательно выбран для обеспечения растворимого димера/мультимера и/или одной или нескольких других биологических активностей, описанных в данном документе.
"Домен димеризации" образован путем объединения по меньшей мере двух аминокислотных остатков или по меньшей мере двух пептидов или полипептидов (которые могут иметь одинаковые или различные аминокислотные последовательности). Пептиды или полипептиды могут взаимодействовать друг с другом посредством ковалентных и/или нековалентных связей). Необязательные домены димеризации содержат по меньшей мере один цистеин, который способен образовывать межмолекулярную дисульфидную связь с цистеином на слитом белке-партнере. Домен димеризации может содержать один или несколько остатков цистеина, благодаря чему дисульфидная связь (связи) может образовываться между слитыми белками-партнерами. В одном варианте осуществления домены димеризации содержат один, два или от трех до приблизительно десяти остатков цистеина. В еще одном варианте осуществления домен димеризации является шарнирной областью иммуноглобулина.
Дополнительные иллюстративные домены димеризации могут быть любыми известными в данной области техники и включают, без ограничения, биспирали, кислотные пэтчи, цинковые пальцы, кальциевые руки, пары CH1-CL "поверхность контакта" с разработанным "вздутием" и/или "протуберанцем", как описано в патенте США №5821333, лейциновые молнии (например, из jun и/или fos) (патент США №5932448), и/или активатор транскрипции дрожжей GCN4, SH2 (src-гомолог 2), SH3 (src-гомолог 3) (Vidal et al., Biochemistry, 43, 7336-44 ((2004)), связывание фосфотирозином (РТВ) (Zhou et al., Nature, 378:584-592 (1995)), WW (Sudol, Prog, Biochys. MoL Bio., 65:113-132 (1996)), PDZ (Kim et al., Nature, 378:85-88 (1995); Komau et al., Science, 269.1737-1740 (1995)) 14-3-3, WD40 (Hu5 et al., J Biol Chem., 273, 33489-33494 (1998)) EH, Lim, изолейциновую молнию, пары димера рецептора (например, рецептор интерлейкина-8 (IL-8R) и гетеродимеры интегрина, такие как LFA-I и GPIIIb/IIIа) или их область (области) димеризации, димерные лигандные полипептиды (например, фактор роста нервов (NGF), нейротрофин-3 (NT-3), интерлейкин-8 (IL-8), фактор роста эндотелия сосудов (VEGF), VEGF-C, VEGF-D, члены PDGF и нейротрофический фактор головного мозга (BDNF) (Arakawa et al., J Biol. Chem., 269(45):27833-27839 (1994) и Radziejewski et al., Biochem, 32(48):1350 (1993)), а также могут быть варианты этих доменов, в которых сродство изменено. Полипептидные пары можно идентифицировать способами, известными в данной области техники, в том числе дрожжевым двухгибридным скринингом. Дрожжевой двухгибридный скрининг описан в патентах ОПТА №5283173 и 6562576. Сродство между парой взаимодействующих доменов можно определить способами, известными в данной области техники, в том числе, описанными в Katahira et al., J. Biol Chem, 277, 9242-9246 (2002)). Альтернативно, библиотеку пептидных последовательностей можно подвергнуть скринингу на гетеродимеризацию, например, с помощью способов, описанных в WO 01/00814. Пригодные способы белок-белковых взаимодействий также описаны в патенте США №6790624.
"Домен мультимеризации" является доменом, который приводит три или более пептидов или полипептидов во взаимодействие друг с другом посредством ковалентной и/или нековалентной связи (связей). Подходящие домены мультимеризации включают, без ограничения, биспиральные домены. Биспиральной является пептидная последовательность с непрерывным узором преимущественно гидрофобных остатков, расположенных 3 и 4 остатка порознь, как правило, в последовательности из семи аминокислот (гептадный повтор) или одиннадцати аминокислот (ундекадный повтор), которая собирается (сворачивается) с образованием многомерного пучка спиралей. Биспирали с последовательностями, включающими некоторое неравномерное распределение расположения 3 и 4 остатков, также рассматриваются. Гидрофобными остатками являются, в частности, гидрофобные аминокислоты Val, Ile, Leu, Met, Тyr, Phe и Тrр. "В основном гидрофобный" означает, что по меньшей мере 50% остатков должны быть выбраны из указанных гидрофобных аминокислот.
Биспиральный домен можно получить из ламинина. Во внеклеточном пространстве гетеротримерный биспиральный белок ламинин играет важную роль в формировании базальных мембран. Видимо, многофункциональная олигомерная структура необходима для функции ламинина. Биспиральные домены также можно получить из тромбоспондинов, в которых соединены три (TSP-I и TSP-2) или пять (TSP-3, TSP-4 и TSP-5) цепей, или из СОМР (СОМРсс) (Guo et al., EMBO J, 1998, 17:5265-5272), который сворачивается в параллельную пятинитчатую биспираль (Malashkevich et al., Science, 274:761-765 (1996)). Дополнительные неограничивающие примеры биспиральных доменов, полученных из других белков и других доменов, которые опосредуют полипептидную мультимеризацию, известны в данной области техники, например, домен фосфопротеина, стимулированного вазодилататором (VASP), матрилин-1 (СМР), вирусные слитые пептиды, комплексы растворимого NSF (фактор, чувствительный к N-этилмалеимиду)-присоединяющего белкового рецептора (SNARE), богатые лейцином повторы, определенные тРНК-синтетазы, являются подходящими для применения в раскрытых слитых белках.
В другом варианте осуществления полипептиды LY6G6F, VSIG10, ТМЕМ25 и/или LSR, слитые белки или их фрагменты можно индуцировать с формированием мультимеров путем связывания со вторым поливалентным полипептидом, таким как антитело. Антитела, пригодные для применения в мультимеризации полипептидов LY6G6F, VSIG10, ТМЕМ25 и/или LSR, слитых белков или их фрагментов включают, без ограничения, антитела IgM и сшитые поливалентные комплексы IgG, IgA, IgD или IgE.
Димеризация или мультимеризация может происходить между или среди двух или более слитых белков с помощью доменов димеризации или мультимеризации, включая описанные выше. Альтернативно, димеризация или мультимеризация слитых белков может происходить посредством химической сшивки. Димеры слитых белков могут быть гомодимерами или гетеродимерами. Мультимеры слитых белков могут быть гомомультимерами или гетеромультимерами. Димеры слитых белков, раскрытых в данном документе, имеют формулу II:
N-R1-R2-R3-C
N-R4-R5-R6-C или, альтернативно, имеют формулу III:
N-R1-R2-R3-C
C-R4-R5-R6-N, где слитые белки димера, представленного формулой II, определяются как находящиеся в параллельной ориентации, а слитые белки димера, представленного формулой III, определяются как находящиеся в антипараллельной ориентации. Параллельные и антипараллельные димеры также называют цис- и транс-димерами, соответственно. "N" и "С" представляют собой N- и С-концы слитого белка, соответственно. Компоненты слитого белка "R1", "R2" и "R3" определены выше для формулы I. В отношении формулы II и формулы III "R4" представляет собой полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR или второй полипептид, "R5" представляет собой необязательный пептидный/полипептидный линкерный домен, a "R6" представляет собой полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR или второй полипептид, где "R6" представляет собой полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR, когда "R4" представляет собой второй полипептид, и "R6" представляет собой второй полипептид, когда "R4" представляет собой полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR. В одном варианте осуществления "R1" представляет собой полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR, "R4" также представляет собой полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR, а "R3" и "R6" представляют собой второй полипептид.
Димеры слитого белка формулы II определяют как гомодимеры, когда "R1"="R4", "R2"="R5" и "R3"="R6". Подобным образом, димеры слитого белка формулы III определяют как гомодимеры, когда "R1"="R6", "R2"="R5" и "R3"="R4". Димеры слитого белка определяют как гетеродимеры, когда эти условия не выполнены по любой причине. Например, гетеродимеры могут содержать ориентацию доменов, которая отвечает этим условиям (т.е. для димера в соответствии с формулой II "R1" и "R4" представляют собой полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR, "R2" и "R5" представляют собой пептидный/полипептидный линкерный домен и "R3" и "R6" представляют собой второй полипептид), однако вид одного или нескольких из этих димеров не идентичен. Например, хотя "R3" и "R6" оба могут представлять собой полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR, один полипептид может содержать аминокислотную последовательность LY6G6F, VSIG10, ТМЕМ25 и/или LSR дикого типа, тогда как другой полипептид может быть вариантным полипептидом LY6G6F, VSIG10, ТМЕМ25 и/или LSR. Иллюстративным вариантным полипептидом LY6G6F, VSIG10, ТМЕМ25 и/или LSR является полипептид LY6G6F, VSIG10, ТМЕМ25 и/или LSR, который был модифицирован таким образом, чтобы он характеризовался увеличенным или уменьшенным связыванием с клеткой-мишенью, повышенной активность относительно клеток иммунной системы, повышенным или сниженным временем полужизни или стабильность. Димеры слитых белков, которые содержат либо CHI, либо CL область иммуноглобулина как часть полипептидного линкерного домена, предпочтительно образуют гетеродимеры, где один слитый белок димера содержит CHI-область, а другой слитый белок из димера содержит CL-область.
Слитые белки можно также использовать для образования мультимеров. Как и димеры, мультимеры могут быть параллельными мультимерами, в которых все слитые белки мультимера выровнены в одной и той же ориентации по отношению к их N- и С-концам. Мультимеры могут быть антипараллельными мультимерами, в которых слитые белки мультимера альтернативно выровнены в противоположных ориентациях по отношению к их N- и C-концам. Мультимеры (параллельные или антипараллельные) могут быть либо гомомультимерами, либо гетеромультимерами. Слитый белок необязательно продуцируется в димерной форме, более предпочтительно слияние выполняют на генетическом уровне, как описано ниже, путем соединения полинуклеотидных последовательностей, соответствующих двум (или более) белкам, участкам белков и/или пептидов, так что соединенный или слитый белок продуцируется клеткой согласно соединенной полинуклеотидной последовательности. Описание получения для таких слитых белков приведено с учетом патента США №5851795 от Linsley и соавт., который таким образом включен посредством ссылки, как если бы был полностью изложен в данном документе исключительно в качестве неограничивающего примера.
Нацеливающие домены
Полипептиды LY6G6F, VSIG10, ТМЕМ25 и/или LSR и слитые белки могут содержать нацеливающий домен для нацеливания молекулы на специфические участки в организме. Необязательные нацеливающие домены нацеливают молекулы в зоны воспаления. Иллюстративными нацеливающими доменами являются антитела или их антигенсвязывающие фрагменты, которые являются специфическими для воспаленной ткани или провоспалительных цитокинов, включая, без ограничения, IL17, IL-4, IL-6, IL-12, IL-21, IL-22 и IL-23. В случае неврологических нарушений, таких как рассеянный склероз, нацеливающий домен может нацеливать молекулу в CNS или может связываться с VCAM-I на сосудистом эпителии. Дополнительными нацеливающими доменами могут быть пептидные аптамеры, специфические для провоспалительной молекулы. В других вариантах осуществления слитый белок LY6G6F, VSIG10, ТМЕМ25 и/или LSR может включать партнера связывания, специфического для полипептида, расположенного на поверхности иммунной клетки, например, Т-клетки. В других вариантах осуществления нацеливающий домен конкретно нацеливает активированные иммунные клетки. Произвольные иммунные клетки, которые являются нацеленными, включают Th0, Тh1, Th17, Th2 и Th22 Т-клетки, другие клетки, которые секретируют или стимулируют у других клеток секрецию воспалительных молекул, включая, без ограничения, IL-1бета, TNF-альфа, TGF-бета, IFN-гамма, IL-17, IL-6, IL-23, IL-22, IL-21, а также ММР и Treg. Например, нацеливающий домен для Treg может специфически связываться с CD25. Указанные выше изменения предназначены только в качестве иллюстраций необязательных изменений и, как предполагается, не являются ограничивающими каким-либо образом. Кроме того, вышеуказанное объяснение представлено только в описательных целях, не желая быть связанными одной гипотезой.
ДОБАВЛЕНИЕ ГРУПП
Если белок согласно настоящему изобретению представляет собой линейную молекулу, можно разместить различные функциональные группы в различных точках линейной молекулы, которые восприимчивы или подходят для химической модификации. Функциональные группы можно добавить к концам линейных форм белка согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. В некоторых вариантах осуществления функциональные группы улучшают активность белка в отношении одной или нескольких характеристик, включая, без ограничения, улучшение стабильности, проницаемость (через клеточные мембраны и/или тканевые барьеры), тканевую локализацию, эффективность, снижение клиренса, снижение токсичности, улучшение селективности, улучшение резистентности к выведению клеточными насосами и тому подобное. Для удобства и не желая ограничиваться, свободный N-конец одной из последовательностей, содержащихся в композиции, согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения будет рассматриваться в качестве N-конца композиции, а свободный С-конец последовательности будет рассматриваться как С-конец композиции. Либо С-конец, либо N-конец последовательности, либо оба могут быть связаны с функциональными группами карбоновой кислоты или с аминной функциональной группой, соответственно.
Неограничивающие примеры подходящих функциональных групп описаны в Green and Wuts, "Protecting Groups in Organic Synthesis", John Wiley and Sons, главы 5 и 7, 1991, содержание которой включено в данный документ посредством ссылки. Предпочтительными защитными группами являются группы, которые облегчают транспорт активного ингредиента, присоединенного к ним, в клетку, например, путем снижения гидрофильности и повышения липофильности активного ингредиента, это является примером "фрагмента для транспорта через клеточные мембраны".
Эти фрагменты могут необязательно и предпочтительно расщепляться in vivo либо путем гидролиза, либо ферментативно внутри клетки. (Ditter et al., J. Pharm. Sci. 57:783 (1968); Ditter et al., J. Pharm. Sci. 57:828 (1968); Ditter et al., J. Pharm. Sci. 58:557 (1969); King et al., Biochemistry 26:2294 (1987); Lindberg et al., Drug Metabolism and Disposition 17:311 (1989); и Tunek et al., Biochem. Pharm. 37:3867 (1988), Anderson et al., Arch. Biochem. Biophys. 239:538 (1985) и Singhal et al., FASEB J. 1:220 (1987)). Гидроксильные защитные группы включают сложные эфиры, карбонаты и карбаматные защитные группы. Аминные защитные группы включают алкокси и арилокси карбонильные группы, как описано выше для N-концевых защитных групп. Защитные группы карбоновой кислоты включают алифатические, бензильные и арильные эфиры, как описано выше для C-концевых защитных групп. В одном варианте осуществления группа карбоновой кислоты в боковой цепи одного или нескольких остатков глутаминовой кислоты или аспарагиновой кислоты в композиции по настоящему изобретению защищена, предпочтительно, метилом, этилом, бензилом или замещенным бензиловым сложным эфиром, более предпочтительно, бензиловым сложным эфиром.
Неограничивающие иллюстративные примеры N-концевых защитных групп включают ацильные группы (-CO-R1) и алкоксикарбонильные или арилоксикарбонильные группы (-CO-O-R1), в которых R1 является алифатической, замещенной алифатической, бензиловой, замещенной бензиловой, ароматической или замещенной ароматической группой. Специфические примеры ацильных групп включают, без ограничения, ацетил, (этил)-СО-, н-пропил-СО-, изо-пропил-СО-, н-бутил-СО-, втор-бутил-СО-, трет-бутил-СО-, гексил, лауроил, пальмитоил, миристоил, стеарил, олеоил фенил-СО-, замещенный фенил-СО-, бензил-СО- и (замещенный бензил)-СО-. Примеры алкоксикарбонильной и арилоксикарбонильной групп включают СН3-O-СО-, (этил)-О-СО-, н-пропил-O-СО-, изо-пропил-O-СО-, н-бутил-O-СО-, втор-бутил-O-СО-, трет-бутил-O-СО-, фенил-O-СО-, замещенный фенил-O-СО- и бензил-O-СО-, (замещенный бензил)-O-СО-, адамантан, нафталин, миристолеил, толуол, бифенил, циннамоил, нитробензоил, толуоил, фуроил, бензоил, циклогексан, норборнан или Z-капронат. Для облегчения N-ацилирования в N-концевой части молекулы могут присутствовать от одного до четырех остатков глицина.
Карбоксильную группу на С-конце соединения можно защитить, например, группой, включая, без ограничения, амид (т.е. гидроксильную группу на C-конце замещают на -NH2, -NHR2 и -NR2R3) или сложный эфир (т.е. гидроксильную группу на С-конце замещают на -OR2). R2 и R3 являются необязательно и независимо алифатической, замещенной алифатической, бензиловой, замещенной бензиловой, арильной или замещенной арильной группой. Кроме того, взятые вместе с атомом азота, R2 и R3 могут необязательно образовывать С4-С8 гетероциклическое кольцо с от приблизительно 0-2 дополнительных гетероатомов, таких как азот, кислород или сера. Неограничивающие подходящие примеры подходящих гетероциклических колец включают пиперидинил, пирролидинил, морфолино, тиоморфолино или пиперазинил. Примеры C-концевых защитных групп включают, без ограничения, -NH2, -NHCH3, -N(CH3)2, -NH(этил), -N(этил)2, -N(метил)(этил), -NН(бензил), -N(С1-С4алкил)(бензил), -NН(фенил), -N(С1-С4алкил)(фенил), -ОСН3, -О-(этил), -О-(н-пропил), -О-(н-бутил), -О-(изо-пропил), -О-(втор-бутил), -О-(трет-бутил), -O-бензил и -O-фенил.
ЗАМЕНА ПЕПТИДОМИМЕТИЧЕСКИМИ ФРАГМЕНТАМИ
"Пептидомиметический органический фрагмент" может быть необязательно замещен на аминокислотные остатки в композиции по настоящему изобретению как в виде консервативной, так и неконсервативной замены. Эти фрагменты также называются "неприродные аминокислоты" и необязательно могут заменять аминокислотные остатки, аминокислоты или действовать как спейсерная группа в пептидах вместо удаленных аминокислот. Пептидомиметические органические фрагменты необязательно и предпочтительно имеют стерические, электронные или конфигурационные свойства, аналогичные замененной аминокислоте, и такие пептидомиметики используются для замены аминокислот в основных положениях и считаются консервативными заменами. Однако такое сходство не обязательно необходимо. Согласно предпочтительным вариантам осуществления настоящего изобретения один или несколько пептидомиметиков выбирают таким образом, что композиция по меньшей мере по существу сохраняет свою физиологическую активность по сравнению с нативным белком согласно настоящему изобретению.
Пептидомиметики необязательно можно применять для ингибирования деградации пептидов посредством ферментативных или других деградационных процессов. Пептидомиметики можно необязательно и предпочтительно получить техниками органического синтеза. Неограничивающие примеры подходящих пептидомиметиков включают D-аминокислоты соответствующих L-аминокислот, тетразол (Zabrocki et al., J. Am. Chem. Soc. 110:5875-5880 (1988)); изостерические варианты амидных связей (Jones et al., Tetrahedron Lett. 29:3853-3856 (1988)); LL-3-амино-2-пропендион-6-карбоновую кислоту (LL-Acp) (Kemp et al., J. Org. Chem. 50:5834-5838 (1985)). Сходные аналоги показаны в Kemp et al., Tetrahedron Lett. 29:5081-5082 (1988), а также в Kemp et al., Tetrahedron Lett. 29:5057-5060 (1988), Kemp et al., Tetrahedron Lett. 29:4935-4938 (1988) и Kemp et al., J. Org. Chem. 54:109-115 (1987). Другие подходящие, но иллюстративные пептидомиметики показаны в Nagai and Sato, Tetrahedron Lett. 26:647-650 (1985); Di Maio et al., J. Chem. Soc. Perkin Trans., 1687 (1985); Kahn et al., Tetrahedron Lett. 30:2317 (1989); Olson et al., J. Am. Chem. Soc. 112:323-333 (1990); Garvey et al., J. Org. Chem. 56:436 (1990). Дополнительные подходящие иллюстративные пептидомиметики включают гидрокси-1,2,3,4-тетрагидроизохинолин-3-карбоксилат (Miyake et al., J. Takeda Res Labs 43:53-76 (1989)); 1,2,3,4-тетрагидроизохинолин-3-карбоксилат (Kazmierski et al., J. Am Chem Soc 133:2275-2283 (1991)); гистидинизохинолинкарбоновую кислоту (HIC) (Zechel et al., Int. J. Pep. Protein Res. 43 (1991)); (2S, 3S)-метилфенилаланин, (2S, 3R)-метилфенилаланин, (2R, 3S)-метилфенилаланин и (2R, 3R)-метилфенилаланин (Kazmierski and Hruby, Tetrahedron Lett. (1991)).
Примерные иллюстративные не ограничивающие неприродные аминокислоты включают бета-аминокислоты (бета3 и бета2), гомоаминокислоты, циклические аминокислоты, ароматические аминокислоты, производные Pro и Рyr, 3-замещенные производные аланина, производные глицина, замещенные по кольцу производные Phe и Тyr, аминокислоты с линейным ядром или диаминокислоты. Они доступны от различных поставщиков, таких как Sigma-Aldrich (США), например.
ХИМИЧЕСКИЕ МОДИФИКАЦИИ БЕЛКОВ
В настоящем изобретении любе. часть белка согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно необязательно химически модифицировать, т.е. изменить добавлением функциональных групп. Например, боковые аминокислотные остатки, входящие в нативную последовательность, необязательно можно изменить, хотя, как описано ниже альтернативно, другие части белка можно необязательно изменить в дополнение к боковым аминокислотным остаткам или вместо боковых аминокислотных остатков. Модификацию можно необязательно осуществить во время синтеза молекулы, если после процесса химического синтеза следует, например, добавление химически модифицированных аминокислот. Однако, химическая модификация аминокислоты, когда она уже присутствует в молекуле (модификация "in situ"), также возможна.
Аминокислоту любой из областей последовательности молекулы необязательно можно модифицировать согласно любому из следующих иллюстративных типов модификации (в пептиде, концептуально рассматриваемом как "химически модифицированный"). Неограничивающие иллюстративные типы модификации включают карбоксиметилирование, ацилирование, фосфорилирование, гликозилирование или ацилирование жирными кислотами. Эфирные связи могут необязательно использоваться для присоединения гидроксила серина или треонина к гидроксилу сахара. Амидные связи могут необязательно использоваться для присоединения карбоксильных групп глутамата или аспартата к аминогруппе на сахаре (Garg and Jeanloz, Advances in Carbohydrate Chemistry and Biochemistry, Vol.43, Academic Press (1985); Kunz, Ang. Chem. Int. Ed. English 26:294-308 (1987)). Ацетальная и кетальная связи также могут необязательно образоваться между аминокислотами и углеводами. Ацильные производные жирных кислоты можно необязательно получить, например, ацилированием свободной аминогруппы (например, лизина) (Toth et al., Peptides: Chemistry, Structure and Biology, Rivier and Marshal, eds., ESCOM Publ., Leiden, 1078-1079 (1990)).
Используемое в данном документе выражение "химическая модификация" в отношении белка или пептида согласно настоящему изобретению относится к белку или пептиду, где по меньшей мере один из его аминокислотных остатков модифицирован либо посредством естественных процессов, таких как процессинг или другие посттрансляционные модификации, либо с помощью техник химической модификации, которые хорошо известны в данной области техники. Примеры многочисленных известных модификаций обычно включают, без ограничения, ацетилирование, ацилирование, амидирование, ADP-рибозилирование, гликозилирование, образование GPI-анкера, ковалентное присоединение липида или липидного производного, метилирование, миристилирование, пэгирование, пренилирование, фосфорилирование, убиквитинирование или любой аналогичный процесс.
Другие типы модификаций необязательно включают добавление циклоалканового фрагмента к биологической молекуле, такой как белок, как описано в заявке РСТ № WO 2006/050262, таким образом включенной посредством ссылки, как если бы была полностью изложена в данном документе. Эти фрагменты конструируют для применения с биомолекулами и их необязательно можно использовать для придания различных свойств белкам.
Кроме того, необязательно любую точку на белке можно модифицировать. Например, пегилирование фрагмента гликозилирования белка необязательно можно выполнить, как описано в заявке РСТ № WO 2006/050247, таким образом включенной посредством ссылки, как если бы была полностью изложена в данном документе. Одну или несколько полиэтиленгликолевых (PEG) групп необязательно можно добавить к O-связанным и/или N-связанным фрагментам гликозилирования. Группа PEG может необязательно быть разветвленной или линейной. Необязательно водорастворимый полимер любого типа можно присоединить к сайту гликозилирования на белке посредством гликозильного линкера.
ИЗМЕНЕННОЕ ГЛИКОЗИЛИРОВАНИЕ
Белки согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно модифицировать для получения измененного паттерна гликозилирования (т.е. измененного по сравнению с исходным или нативным паттерном гликозилирования). Используемое в данном документе выражение "измененный" означает характеризующийся удалением одного или нескольких углеводных фрагментов, и/или характеризующийся добавлением по меньшей мере одного сайга гликозилирования к исходному белку.
Гликозилирование белков является, как правило, либо N-связанным, или O-связанным. N-связанное относится к присоединению углеводного фрагмента к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, где Х представляет собой любую аминокислоту, кроме пролина, являются распознаваемыми последовательностями для ферментативного присоединения углеводного фрагмента к боковой цепи аспарагина. Таким образом, присутствие любой из этих трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. 0-связанное гликозилирование относится к присоединению одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, чаще всего серину или треонину, хотя 5-гидроксипролин или 5-гидроксилизин также могут использоваться.
Добавление сайтов гликозилирования к белкам согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения удобно осуществлять путем изменения аминокислотной последовательности белка таким образом, что он содержит одну или несколько из описанных выше трипептидных последовательностей (для сайтов N-связанного гликозилирования). Изменение также можно осуществлять путем добавления или замещения одного или нескольких остатков серина или треонина в последовательности исходного белка (для сайтов O-связанного гликозилирования). Аминокислотная последовательность белка также может быть изменена путем внесения изменений на уровне ДНК.
Другим способом увеличения числа углеводных фрагментов в белках является химическое или ферментативное связывание гликозидов с аминокислотными остатками белка. В зависимости от используемого способа связывания сахара могут быть присоединены к (а) аргинину и гистидину, (b) свободным карбоксильным группам, (с) свободным сульфгидрильным группам, например, таким группам цистеина, (d) свободным гидроксильным группам, например, таким группам серина, треонина или гидроксипролина, (е) ароматическим остаткам, например, таким остаткам фенилаланина, тирозина или триптофана, или (f) амидной группе глутамина. Эти способы описаны в патентном документе WO 87/05330 и в Aplin and Wriston, CRC Crit. Rev. Biochem., 22:259-306 (1981).
Удаление любых углеводных фрагментов, присутствующих в белках согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно осуществлять химически или ферментативно. Для химического дегликозилирования необходимо воздействие на белок трифторметансульфоновой кислоты или эквивалентного соединения. Эта обработка приводит к расщеплению большинства или всех сахаров, за исключением связывающего сахара (N-ацетилглюкозамина или N-ацетилгалактозамина), при этом аминокислотная последовательность остается интактной.
Химическое дегликозилирование описано Hakimuddin et al., Arch. Biochem. Biophys, 259:52 (1987) и Edge et al., Anal. Biochem., 118:131 (1981). Ферментативного расщепления углеводных фрагментов в белках можно достигнуть посредством применения различных эндо- и экзогликозидаз, как описано Thotakura et al., Meth. Enzymol, 138:350 (1987).
СПОСОБЫ ПРИМЕНЕНИЯ
Используемое в данном документе выражение "терапевтическое средство" относится к любому из белков и полипептидов LY6G6F, VSIG10, ТМЕМ25 и/или LSR согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, или их ортологам или фрагментам, в особенности эктодомену, или секретируемым формам белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, и/или слитому белку, и/или мультимерному белку, содержащему вышеуказанное, или последовательности нуклеиновой кислоты LY6G6F, VSIG10, ТМЕМ25 и/или LSR или ее фрагментам, а также лекарственным средствам, которые специфически связываются с белками LY6G6F, VSIG10, ТМЕМ25 и/или LSR, и/или лекарственным средствам, которые способствуют или противодействуют связыванию других фрагментов с белками LY6G6F, VSIG10, ТМЕМ25 и/или LSR, и/или лекарственным средствам, которые модулируют (способствуют или противодействуют) по меньшей мере одной биологической активности, связанной с LY6G6F, VSIG10, ТМЕМ25 и/или LSR. Такие лекарственные средства включают моноклональные и/или поликлональные антитела, и/или антигенсвязывающие фрагменты, и/или конъюгаты, содержащие вышеуказанное, и/или их альтернативные каркасные структуры, содержащие антигенсвязывающий участок, который специфически связывается с любым из полипептидов LY6G6F, VSIG10, ТМЕМ25 и/или LSR или их эпитопом. Такие лекарственные средства, в качестве примера, также включают малые молекулы, пептиды, рибозимы, аптамеры, антисмысловые молекулы, миРНК и т.п.
Стимуляция активности LY6G6F, VSIG10, ТМЕМ25 и/или LSR является желательной в случаях, при которых происходит патологическое подавление LY6G6F, VSIG10, ТМЕМ25 и/или LSR, и/или в случаях, при которых повышенная активность LY6G6F, VSIG10, ТМЕМ25 и/или LSR, вероятно, будет оказывать положительный эффект. Таким же образом, ингибирование активности LY6G6F, VSIG10, ТМЕМ25 и/или LSR является желательным в случаях, при которых происходит патологическая активация LY6G6F, VSIG10, ТМЕМ25 и/или LSR, и/или в случаях, при которых снижение активности LY6G6F, VSIG10, ТМЕМ25 и/или LSR, вероятно, будет оказывать положительный эффект.
Как было упомянуто в данном документе выше, терапевтические средства можно применять для лечения иммунологических нарушений, которые указаны в данном документе, и/или аутоиммунных нарушений, которые указаны в данном документе, и/или инфекционных нарушений, которые указаны в данном документе, и/или рака, который указан в данном документе, и/или для блокирования, и/или способствования иммунной костимуляции, опосредованной любым из полипептидов LY6G6F, VSIG10, ТМЕМ25 и/или LSR.
Согласно дополнительному аспекту настоящего изобретения терапевтические средства можно применять для предупреждения патологического ингибирования Т-клеточной активности, например, такой, которая направлена против раковых клеток или хронических инфекций; и/или предупреждения патологической стимуляции Т-клеточной активности, например, такой, которая направлена против аутоантигенов при аутоиммунных заболеваниях. Например, эти молекулы можно применять по отношению к клеткам в культуре, in vitro или ex vivo, или к субъектам, являющимся людьми, например, in vivo, для лечения, предупреждения и диагностики различных нарушений. Предпочтительные субъекты включают пациентов-людей, имеющих нарушения, опосредованные клетками, экспрессирующими белки LY6G6F, VSIG10, ТМЕМ25 и/или LSR, и клетки, которые обладают активностью LY6G6F, VSIG10, ТМЕМ25 и/или LSR.
Согласно дополнительному аспекту настоящего изобретения терапевтические средства можно применять для ингибирования активации Т-клеток, которая может проявляться, например, пролиферацией Т-клеток и секрецией цитокинов.
Согласно дополнительному аспекту настоящего изобретения терапевтические средства можно применять, чтобы вызвать in vivo или in vitro одну или несколько из следующих биологических активностей: ингибирование роста и/или лизис клетки, экспрессирующей LY6G6F, VSIG10, ТМЕМ25 и/или LSR; опосредование фагоцитоза или ADCC клетки, экспрессирующей LY6G6F, VSIG10, ТМЕМ25 и/или LSR в присутствии человеческих эффекторных клеток, или блокирование связывания лиганда для LY6G6F, VSIG10, ТМЕМ25 и/или LSR с LY6G6F, VSIG10, ТМЕМ25 и/или LSR, соответственно.
Таким образом, согласно дополнительному аспекту настоящего изобретения предоставляется способ лечения иммунологических нарушений, которые указаны в данном документе, и/или аутоиммунных нарушений, которые указаны в данном документе, и/или инфекционных нарушений, которые указаны в данном документе, и/или рака, который указан в данном документе, и/или для блокирования и/или способствования иммунной стимуляции, опосредованной полипептидом LY6G6F, VSIG10, ТМЕМ25 и/или LSR, у субъекта путем введения субъекту, нуждающемуся в этом, эффективного количества любого из терапевтических средств и/или фармацевтической композиции, содержащей любое из терапевтических средств и дополнительно содержащей фармацевтически приемлемый разбавитель или носитель.
Субъект согласно настоящему изобретению представляет собой млекопитающее, предпочтительно человека, у которого диагностировано одно из заболеваний, нарушений или состояний, описанных в данном документе выше, или, в альтернативном случае, предрасположенного по меньшей мере к одному типу рака, и/или инфекционных нарушений, и/или иммунологического нарушения.
Используемое в данном документе выражение "лечение" относится к предупреждению, задержке начала, излечиванию, устранению, ослаблению, облегчению, сведению к минимуму, подавлению или прекращению вредных эффектов вышеописанных заболеваний, нарушений или состояний. Оно также включает в себя контролирование заболевания, которое описано выше. "Контролирование" означает снижение тяжести заболевания, снижение частоты эпизодов заболевания, снижение продолжительности таких эпизодов, снижение тяжести таких эпизодов и т.п.
Лечение согласно настоящему изобретению можно осуществлять путем специфической активации экспрессии по меньшей мере одного из полипептидов по настоящему изобретению у субъекта.
Следует принимать во внимание, что лечение указанных выше заболеваний согласно настоящему изобретению можно сочетать с другими способами лечения, известными в данной области техники (т.е. комбинированная терапия). Таким образом, терапевтические средства и/или фармацевтическую композицию, содержащую вышеупомянутое, как указано в данном документе, согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения также можно применять в комбинации с одним или несколькими из следующих средств для регуляции иммунного ответа: растворимый gp39 (также известный как лиганд CD40 (CD40L), CD154, Т-ВАМ, TRAP), растворимый CD29, растворимый CD40, растворимый CD80 (например, АТСС 68627), растворимый CD86, растворимый CD28 (например, 68628), растворимый CD56, растворимый Thy-1, растворимый CD3, растворимый TCR, растворимый VLA-4, растворимый VCAM-1, растворимый LECAM-1, растворимый ELAM-1, растворимый CD44, антитела, реагирующие с gp39 (например, АТСС НВ-10916, АТСС НВ-12055 и АТСС НВ-12056), антитела, реагирующие с CD40 (например, АТСС НВ-9110), антитела, реагирующие с В7 (например, АТСС НВ-253, АТСС CRL-2223, АТСС CRL-2226, АТСС НВ-301, АТСС НВ-11341 и т.д.), антитела, реагирующие с CD28 (например, АТСС НВ-11944 или mAb 9.3), антитела, реагирующие с LFA-1 (например, АТСС НВ-9579 и АТСС TIB-213), антитела, реагирующие с LFA-2, антитела, реагирующие с IL-2, антитела, реагирующие с IL-12, антитела, реагирующие с IFN-гамма, антитела, реагирующие с CD2, антитела, реагирующие с CD48, антитела, реагирующие с любым из ICAM (например, ICAM-1 (АТСС CRL-2252), ICAM-2 и ICAM-3), антитела, реагирующие с CTLA4 (например, АТСС НВ-304), антитела, реагирующие с Thy-1, антитела, реагирующие с CD56, антитела, реагирующие с CD3, антитела, реагирующие с CD29, антитела, реагирующие с TCR, антитела, реагирующие с VLA-4, антитела, реагирующие с VCAM-1, антитела, реагирующие с LECAM-1, антитела, реагирующие с ELAM-1, антитела, реагирующие с CD44; L104EA29YIg, моноклональные антитела (mAb) к CD80, mAb к CD86, mAb к gp39, mAb к CD40, mAb к CD28; mAb к LFA1, антитела или другие средства, нацеливающиеся на механизмы иммунной системы, например, CD52 (алемтузумаб), CD25 (даклизумаб), VLA-4 (натализумаб), CD20 (ритуксимаб), IL2R (даклизумаб) и MS4A1 (окрелизумаб); новые пероральные иммуномодулирующие средства, которые, как было показано, предотвращают рециркуляцию лимфоцитов из лимфоидных органов, например, финголимод (FTY720) или приводят к лимфопении, такие как милинакс (пероральный кладрибин) или терифлюномид; и средства, которые предотвращают иммуноактивацию, такие как панаклар (диметилфумарат BG-12) или лаквинимод (ABR216062). Другие комбинации будут легко оценены и понятны специалистам в данной области техники. В некоторых вариантах осуществления терапевтические средства можно применять для ослабления или устранения активности провоспалительного лекарственного средства и/или ограничения побочных эффектов таких лекарственных средств.
Как будет легко понятно специалистам в данной области техники, комбинация может включать в себя терапевтические средства и/или фармацевтическую композицию, содержащую вышеуказанное, согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения и одно другое иммуносупрессивное средство; терапевтические средства и/или фармацевтическую композицию, содержащую вышеуказанное, как указано в данном документе, с двумя другими иммуносупрессивными средствами; терапевтические средства и/или фармацевтическую композицию, содержащую вышеуказанное, как указано в данном документе, с тремя другими иммуносупрессивными средствами и т.д. Установление оптимальной комбинации и дозировки могут быть определены и оптимизированы с использованием способов, хорошо известных в данной области техники.
Терапевтическое средство по настоящему изобретению и одно или несколько других терапевтических средств можно вводить в любом порядке или одновременно. Другими терапевтическими средствами являются, например, цитотоксическое средство, радиотоксическое средство или иммуносупрессивное средство. Композиция может быть связана со средством (в виде иммунокомплекса), или может быть введена отдельно от средства. В последнем случае (раздельное введение) композицию можно вводить до, после или параллельно со средством или можно вводить совместно с другими известными видами терапии, например, с противораковой терапией, например, облучением. Такие терапевтические средства включают, среди прочих, противоопухолевые средства, такие как доксорубицин (адриамицин), цисплатин, блеомицинсульфат, кармустин, хлорамбуцил и циклофосфамид, гидроксимочевину, которые сами по себе эффективны только при уровнях, которые являются токсичными или субтоксичными для пациента. Цисплатин вводят внутривенно в виде 100 мг/доза один раз каждые четыре недели, и адриамицин вводят внутривенно в виде дозы 60-75 мг/мл один раз каждый 21 день.
Совместное введение человеческих антител к LY6G6F, VSIG10, ТМЕМ25 и/или LSR или их антигенсвязывающих фрагментов согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения с химиотерапевтическими средствами предоставляет два противораковых средства, которые действуют посредством различных механизмов, что приводит к цитотоксическому эффекту в отношении человеческих опухолевых клеток. Такое совместное введение может обеспечить решение проблем, возникающих вследствие развития резистентности к лекарственным средствам или изменения антигенности опухолевых клеток, что делает их не реагирующими с антителом. Мишень-специфические эффекторные клетки, например, эффекторные клетки, связанные с композициями (например, человеческие антитела, мультиспецифические и биспецифические молекулы) согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, также можно применять в качестве терапевтических средств. Эффекторными клетками для нацеливания могут быть лейкоциты человека, такие как макрофаги, нейтрофилы или моноциты. Другие клетки включают эозинофилы, естественные клетки-киллеры и другие клетки, несущие IgG- или IgA-рецепторы. При необходимости эффекторные клетки можно получить от субъекта, подлежащего лечению. Мишень-специфические эффекторные клетки можно вводить в виде суспензии клеток в физиологически приемлемом растворе. Количество вводимых клеток может быть порядка от 10 -8 до 10 -9, но будет варьировать в зависимости от терапевтической цели. В целом, количество будет достаточным для достижения локализации на клетке-мишени, например, опухолевой клетке, экспрессирующей белки LY6G6F, VSIG10, ТМЕМ25 и/или LSR, и осуществления уничтожения клетки, например, путем фагоцитоза. Пути введения также могут варьировать.
Терапию при помощи мишень-специфических эффекторных клеток можно осуществлять в сочетании с другими методиками удаления клеток-мишеней. Например, противоопухолевую терапию с использованием композиций (например, человеческие антитела, мультиспецифические и биспецифические молекулы) согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения и/или эффекторных клеток, усиленных этими композициями, можно применять в сочетании с химиотерапией. Кроме того, комбинированную иммунотерапию можно применять для направления двух различных цитотоксических эффекторных популяций на устранение опухолевых клеток. Например, антитела к LY6G6F, к VSIG10, к ТМЕМ25 и/или к LSR, присоединенные к антителу к Fc-гамма RI или антителу к CD3 можно применять в сочетании со средствами, специфически связывающими IgG- или IgA-рецептор.
Биспецифические и мультиспецифические молекулы согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения также можно применять для модулирования Fc-гамма R или уровней Fc-гамма R на эффекторных клетках, например, путем закрывания и устранения рецепторов на поверхности клетки. Смеси антител к Fc-рецепторам также можно применять для этой цели.
Настоящее изобретение также охватывает применение композиций согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения в комбинации с другими фармацевтическими средствами для лечения заболеваний иммунной системы. Например, аутоиммунное заболевание можно лечить с помощью молекул согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения в сочетании с, но без ограничения, иммуносупрессорами, такими как кортикостероиды, циклоспорин, циклофосфамид, преднизон, азатиоприн, метотрексат, рапамицин, такролимус, биологическими средствами, такими как TNF-альфа-блокаторы или антагонисты, или любое другое биологическое средство, нацеливающееся на любой воспалительный цитокин, нестероидными противовоспалительными лекарственными средствами/ингибиторами Сох-2, гидроксихлорохином, сульфасалазаприном, солями золота, этанерцептом, инфликсимабом, микофенолата мофетилом, базиликсимабом, атацицептом, ритуксимабом, цитоксаном, интерфероном бета-1a, интерфероном бета-1b, глатирамера ацетатом, митоксантрона гидрохлоридом, анакинрой, и/или другими биологическими препаратами, и/или внутривенным иммуноглобулином (IVIG). Неограничивающие примеры таких известных терапевтических средств включают интерфероны, такие как IFN-бета-1a (REBIF®, AVONEX® и CINNOVEX®) и IFN-бета-1b (BETASERON®, EXTAVIA®, BETAFERON®, ZIFERON®); глатирамера ацетат (COPAXONE®), полипептид; натализумаб (TYSABRI®) и митоксантрон (NOVANTRONE®), цитотоксическое средство.
Таким образом, лечение рассеянного склероза с использованием средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно сочетать, например, с любым известным терапевтическим средством или способом лечения рассеянного склероза. Неограничивающие примеры такого известного терапевтического средства или способа лечения рассеянного склероза включают интерферон класса IFN-бета-1a (REBIF®. AVONEX® и CINNOVEX®) и IFN-бета-1b (BETASERON®, EXTAVIA®, BETAFERON®, ZIFERON®); глатирамера ацетат (COPAXONE®), полипептид; натализумаб (TYSABRI®) и митоксантрон (NOVANTRONE®), цитотоксическое средство, фампридин (AMPYRA®). Другие лекарственные средства включают кортикостероиды, метотрексат, циклофосфамид, азатиоприн и внутривенный иммуноглобулин (IVIG), инозин, окрелизумаб (R1594), милинакс (калдрибин), алемтузумаб (кэмпас), даклизумаб (зенапакс), панаклар/диметилфумарат (BG-12), терифлуномид (HMR1726), финголимод (FTY720), лаквинимод (ABR216062), а также трансплантацию гемопоэтических стволовых клеток, нейровакс, ритуксимаб (ритуксан), вакцину BCG, низкие дозы налтрексона, гельминтотерапию, ангиопластику, венозные стенты и альтернативную терапию, такую как при помощи витамина D, полиненасыщенных жиров, медицинской марихуаны.
Таким образом, лечение ревматоидного артрита с использованием средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно сочетать, например, с любым известным терапевтическим средством или способом лечения ревматоидного артрита. Неограничивающие примеры таких известных терапевтических средств или способов лечения ревматоидного артрита включают глюкокортикоиды, нестероидные противовоспалительные лекарственные средства (NSAID), такие как салицилаты, или ингибиторы циклооксигеназы-2, ибупрофен и напроксен, диклофенак, индометацин, этодолак, противоревматические лекарственные средства, модифицирующие заболевание (DMARD) - пероральные DMARD: ауранофин (ридаура), азатиоприн (имуран), циклоспорин (сандиммун, генграф, неорал, генерики), D-пеницилламин (купримин), гидроксихлорохин (плаквенил), ауротиомалат натрия IM gold (миокризин), ауротиоглюкозу (солганал), лефлуномид (арава), метотрексат (ревматрекс), миноциклин (миноцин), иммуноадсорбцию стафилококкового белка А (колонка Prosorba), сульфасалазин (азульфидин). Биологические DMARD: TNF-α-блокаторы, в том числе адалимумаб (хумира), этанерцепт (энбрель), инфликсимаб (ремикад), голимумаб (симпони), цертолизумаб пегол (цимзия) и другие биологические DMARD, такие как анакинра (кинерет), ритуксимаб (ритуксан), тоцилизумаб (актемра), ингибитор CD28, в том числе абатацепт (оренция) и белатацепт.
Таким образом, лечение IBD с использованием средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно сочетать, например, с любым известным терапевтическим средством или способом лечения IBD. Неограничивающие примеры таких известных терапевтических средств или способов лечения IBD включают иммуносупрессию для контроля симптомов, например, преднизон, месалазин (в том числе асакол, пентаса, лиалда, аспиро), азатиоприн (имуран), метотрексат или 6-меркаптопурин, стероиды, ондансетрон, TNF-α-блокаторы (включая инфликсимаб, адалимумаб, голимумаб, цертолизумаб пегол), оренция (абатацепт), устекинумаб (Stelara®), бриакинумаб (АВТ-874), цертолизумаб пегол (Cimzia®), ITF2357 (гивиностат), натализумаб (тисабри), фиратеграст (SB-683699), ремикейд (инфликсимаб), ведолизумаб (MLN0002), другие лекарственные средства, в том числе GSK1605786 ССХ282-В (Traficet-EN), AJM300, стелара (устекинумаб), семапимод (CNI-1493), тасоцитиниб (СР-690550), низкомолекулярный (LMW) гепарин ММХ, будесонид ММХ, симпони (голимумаб), MultiStem®, вакцина против HPV гардасил, Epaxal Berna (виросомальная вакцина против гепатита А), хирургическая операция, такая как резекция кишки, стриктуропластика или временная или постоянная колостомия или илеостомия; противогрибковые лекарственные средства, такие как нистатин (кишечное противогрибковое средство широкого спектра) и либо итраконазол (споранокс), либо флуконазол (дифлюкан), альтернативный лекарственный препарат, пребиотики и пробиотики, каннабис, гельминтотерапия или яйцеклетки гельминта Trichuris suis.
Таким образом, лечение псориаза с использованием средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно сочетать, например, с любым известным терапевтическим средством или способом лечения псориаза. Неограничивающие примеры таких известных терапевтических средств для лечения псориаза включают местнодействующие средства, обычно применяемые при легкой форме заболевания, фототерапию при умеренной форме заболевания и системные средства при тяжелой форме заболевания. Неограничивающие примеры местнодействующих средств: омывающие жидкости и увлажняющие средства, минеральное масло и вазелин, мази и кремы, содержащие каменноугольный деготь, дитранол (антралин), кортикостероиды, такие как дезоксиметазон (топикорт), бетаметазон, флуоцинонид, аналоги витамина D3 (например, кальципотриол) и ретиноиды. Неограничивающие примеры фототерапии: солнечный свет, излучение с длинами волн 311-313 нм, псорален и фототерапия ультрафиолетом A (PUVA). Неограничивающие примеры системных средств: биологические средства, такие как антагонисты интерлейкина, TNF-α-блокаторы, в том числе антитела, такие как инфликсимаб (ремикад), адалимумаб (хумира), голимумаб, цертолизумаб пегол, и рекомбинантный рецептор-ловушка для TNF-α, этанерцепт (энбрел); лекарственные средства, которые нацеливаются на Т-клетки, например, эфализумаб (ксаннелим/раптива), алефацепт (амевив), на дендритные клетки, например, эфализумаб; моноклональные антитела (МАb), нацеливающиеся на цитокины, в том числе антитела к IL-12/IL-23 (устекинумаб (торговое название Stelara)) и антитело к интерлейкину-17; бриакинумаб (АВТ-874), малые молекулы, в том числе, но без ограничения, ISA247; иммуносупрессоры, такие как метотрексат, циклоспорин, витамин А и ретиноиды (синтетические формы витамина А); и альтернативная терапия, такая как изменения диеты и образа жизни, периоды голодания, низкокалорийные диеты и вегетарианские диеты, диеты, дополненные рыбьим жиром, богатым витамином А и витамином D (таким как жир печени трески), рыбий жир, богатый двумя омега-3 жирными кислотами, эйкозапентаеновой кислотой (ЕРА) и докозагексаеновой кислотой (DHA), и содержащий витамин Е. Ихтиотерапия, гипнотерапия, каннабис.
Таким образом, лечение сахарного диабета 1 типа с использованием средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно сочетать, например, с любым известным терапевтическим средством или способом лечения сахарного диабета 1 типа. Неограничивающие примеры таких известных терапевтических средств для лечения сахарного диабета 1 типа включают инсулин, аналоги инсулина, трансплантацию островков, терапию стволовыми клетками, в том числе PROCHYMAL®, неинсулиновые виды терапии, например, ингибиторы IL-1бета, в том числе анакинра (Kineret®), абатацепт (Orencia®), диамид, алефацепт (Ameviv®), отеликсизумаб, DiaPep277 (пептид, полученный из Hsp60), альфа-1-антитрипсин, преднизон, азатиоприн, циклоспорин, E1-INT (инъекционная терапия для неогенеза островков, которая включает аналог эпидермального фактора роста и аналог гастрина), статины, в том числе Zocor®, Simlup®, Simcard®, Simvacor®, ситаглиптин (ингибитор дипептидилпептидазы (DPP-4)), mAb к CD3 (например, теплизумаб); CTLA4-Ig (абатацепт), антитело к IL-1бета (канакинумаб), mAb к CD20 (например, ритуксимаб).
Таким образом, лечение увеита с использованием средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно сочетать, например, с любым известным терапевтическим средством или способом лечения увеита. Неограничивающие примеры таких известных терапевтических средств для лечения увеита включают кортикостероиды, местнодействующие мидриатики, такие как атропин или гоматропин, или инъекцию PSTTA (триамцинолона ацетат в заднее субтеноновое пространство), антиметаболические лекарственные препараты, такие как метотрексат, TNF-α-блокаторы (в том числе инфликсимаб, адалимумаб, этанерцепт, голимумаб, цетолизумаб пегол).
Таким образом, лечение синдрома Шегрена с использованием средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно сочетать, например, с любым известным терапевтическим средством или способом лечения синдрома Шегрена. Неограничивающие примеры таких известных терапевтических средств для лечения синдрома Шегрена включают циклоспорин, пилокарпин (салаген) и цевимелен (эвоксак), гидроксихлорохин (плаквенил), кортизон (преднизолон и др.), и/или азатиоприн (имуран), или циклофосфамид (цитоксан), дексаметазон, талидомид, дегидроэпиандростерон, NGX267, ребамипид, FID 114657, этанерцепт, раптива, белимумаб, мабтеру (ритуксимаб); анакинру, внутривенный иммуноглобулин (IVIG), аллогенные мезенхимальные стволовые клетки (AlloMSC), автоматическую нейроэлектростимуляцию с помощью "Saliwell Crown".
Таким образом, лечение системной красной волчанки с использованием средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно сочетать, например, с любым известным терапевтическим средством или способом лечения системной красной волчанки. Неограничивающие примеры таких известных терапевтических средств для лечения системной красной волчанки включают кортикостероиды и противоревматические лекарственные средства, модифицирующие заболевание (DMARD), обычные противомалярийные лекарственные средства, такие как плаквенил и иммуносупрессоры (например, метотрексат и азатиоприн), гидроксихлорохин, цитотоксические лекарственные средства (например, циклофосфамид и микофенолат), гидроксихлорохин (HCQ), бенлиста (белимумаб), нестероидные противовоспалительные лекарственные средства, преднизон, селлсепт, програф, атацицепт, лупузор, внутривенные иммуноглобулины (IVIG), селлсепт (микофенолата мофетил), оренция, CTLA4-IgG4m (RG2077), ритуксимаб, окрелизумаб, эпратузумаб, CNTO 136, сифалимумаб (MEDI-545), А-623 (ранее 623 AMG), AMG 557, ронтализумаб, паквинимод (ABR-215757), LY2127399, СЕР-33457, дегидроэпиандростерон, левотироксин, абетимус натрия (LJP 394), мемантин, опиаты, рапамицин, трансплантацию почки, трансплантацию стволовых клеток.
Терапевтические средства и/или фармацевтическую композицию, содержащую вышеупомянутое, как указано в данном документе, согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно вводить в виде единственного активного ингредиента или в сочетании с другими лекарственными средствами в иммуномодулирующих схемах, или с другими противовоспалительными средствами, например, для лечения или предупреждения острого или хронического отторжения алло- или ксенотрансплантата, или воспалительных или аутоиммунных нарушений, или для индуцирования толерантности.
Например, это можно применять в комбинации с ингибитором кальциневрина, например, циклоспорином А или FK506; иммуносупрессивными макролидами, например, рапамицином или его производным; например, 40-O-(2-гидрокси)этилрапамицином, средством для хоминга лимфоцитов, например FTY720 или его аналогом, кортикостероидами, циклофосфамидом; азатиопреном; метотрексатом, лефлуномидом или его аналогом; мизорибином; микофеноловой кислотой; микофенолата мофетилом; 15-дезоксиспергуалином или его аналогом; иммуносупрессивными моноклональными антителами, например моноклональными антителами к рецепторам лейкоцитов, например, МНС, CD2, CD3, CD4, CD11a/CD18, CD7, CD25, CD27, В7, CD40, CD45, CD58, CD137, ICOS, CD150 (SLAM), OХ40, 4-1BB или их лигандами; или другими иммуностимулирующими соединениями, например, CTLA4-Ig (абатацепт, ORENCIA® или белатацепт), CD28-Ig, B7-H4-Ig, или другими костимулирующими средствами, или ингибиторами адгезивных молекул, например, тАЬ или низкомолекулярными ингибиторами, в том числе антагонистами LFA-1, антагонистами селектина и антагонистами VLA-4.
Если терапевтические средства и/или фармацевтическую композицию, содержащую вышеупомянутое, как указано в данном документе, согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения вводят в сочетании с другой иммуносупрессивной/иммуномодулирующей или противовоспалительной терапией, например, как указано в данном документе выше, дозировки совместно вводимого иммуносупрессора, иммуномодулятора или противовоспалительного соединения будут, конечно, варьировать в зависимости от типа применяемого дополнительного лекарственного средства, например, является ли оно стероидом или циклоспорином, от конкретного применяемого лекарственного средства, от состояния, подлежащего лечению, и так далее.
Лечение злокачественных новообразований с использованием средств по настоящему изобретению можно сочетать с другими способами лечения, известными в данной области техники, одним или более из, например, лучевой терапии, терапии антителами, химиотерапии, фотодинамической терапии, хирургической операции или в терапии в сочетании с обычными лекарственными средствами, такими как иммуносупрессоры или цитотоксические лекарственные средства.
Терапевтическое средство или фармацевтическую композицию согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно также вводить в сочетании с другими соединениями или видами иммунотерапии. Например, комбинированная терапия может включать соединение по настоящему изобретению в сочетании по меньшей мере с одним терапевтическим или иммунномодулирующим средством или иммуностимулирующей стратегией, включая, но без ограничения, противоопухолевые вакцины, адоптивную Т-клеточную терапию, Treg-истощение, антитела (например, бевацизумаб, эрбитукс), пептиды, пептидные антитела, малые молекулы, химиотерапевтические средства, такие как цитотоксические и цитостатические средства (например, паклитаксел, цисплатин, винорелбин, доцетаксел, гемцитабин, темозоломид, иринотекан, 5-FU, карбоплатин), иммунологические модификаторы, такие как интерфероны и интерлейкины, иммуностимулирующие антитела, гормоны роста или другие цитокины, фолиевую кислоту, витамины, минеральные вещества, ингибиторы ароматазы, молекулы для RNAi, ингибиторы гистондеацетилазы, ингибиторы протеасом и так далее.
Согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения обеспечивается применение комбинации терапевтических средств и/или фармацевтической композиции, содержащей вышеупомянутое, как указано в данном документе, и известного терапевтического средства, эффективное для лечения инфекции.
Терапевтические средства и/или фармацевтическую композицию, содержащую вышеупомянутое, как указано в данном документе, можно вводить в сочетании с одним или несколькими дополнительными терапевтическими средствами, используемыми для лечения бактериальных инфекций, включая, но без ограничения, антибиотики, в том числе аминогликозиды, карбапенемы, цефалоспорины, макролиды, линкозамиды, нитрофураны, пенициллины, полипептиды, хинолоны, сульфонамиды, тетрациклины, лекарственные средства против микобактерий, включая, но без ограничения, клофазимин, циклосерин, циклосерин, рифабутин, рифапентин, стрептомицин и другие антибактериальные лекарственные средства, такие как хлорамфеникол, фосфомицин, метронидазол, мупироцин и тинидазол.
Терапевтические средства и/или фармацевтическую композицию, содержащая вышеупомянутое, как указано в данном документе, можно вводить в сочетании с одним или несколькими дополнительными терапевтическими средствами, используемыми для лечения вирусных инфекций, включая, но без ограничения, противовирусные лекарственные средства, такие как озельтамивир (торговое название тамифлю) и занамивир (торговое название реленза), арбидол - производные адамантана (амантадин, римантадин) - ингибиторы нейраминидазы (озельтамивир, ланинамивир, перамивир, занамивир), нуклеотидный аналог ингибитора обратной транскриптазы, в том числе пуриновый аналог гуанина (ацикловир#/валацикловир, ганцикловир/валганцикловир, пенцикловир/фамцикловир) и пиримидиновый аналог аденина (видарабин), уридин (идоксуридин, трифлюридин, эдоксудин), тимин (бривудин), цитозин (цитарабин); фоскарнет; аналоги нуклеозидов/NARTI: энтекавир, ламивудин, телбивудин, клевудин; аналоги нуклеотидов/NtRTI: адефовир, тенофовир; ингибиторы нуклеиновых кислот, такие как цидофовир; интерферон интерферон альфа-2b, пегинтерферон альфа-2а; рибавирин#/тарибавирин; антиретровирусные лекарственные средства, в том числе зидовудин, ламивудин, абакавир, лопинавир, ритонавир, тенофовир/эмтрицитабин эфавиренц, каждый из них по отдельности или в различных комбинациях, gp41 (энфувиртид), ралтегравир, ингибиторы протеаз, такие как фосампренавир, лопинавир и атазанавир, метисазон, докозанол, фомивирсен, тромантадин.
Терапевтические средства и/или фармацевтическую композицию, содержащую вышеупомянутое, как указано в данном документе, можно вводить в сочетании с одним или несколькими дополнительными терапевтическими средствами, используемыми для лечения грибковых инфекций, включая, но без ограничения, противогрибковые лекарственные средства из полиеновых противогрибковых средств, имидазоловые, триазоловые и тиазоловые противогрибковые средства, аллиламины, эхинокандины или другие противогрибковые лекарственные средства.
В альтернативном случае или дополнительно, способ активации необязательно можно осуществлять путем специфической активации определенного количества (необязательно, экспрессии) по меньшей мере одного из полипептидов по настоящему изобретению или его активных участков у субъекта.
Как упомянуто в данном документе выше и в разделе Примеры, который следует ниже, последовательности биомолекул согласно данному аспекту настоящего изобретения можно применять в качестве ценных терапевтических средств при лечении заболеваний, нарушений или состояний, при которых измененная активность или экспрессия продукта гена дикого типа (известного белка), как известно, способствует возникновению или прогрессированию заболевания, нарушения или состояния. Например, в случае, если заболевание вызвано сверхэкспрессией связанного с мембраной рецептора, его растворимый вариант можно применять в качестве антагониста, который конкурирует с рецептором за связывание лиганда, для того, чтобы таким образом прекратить передачу сигнала от рецептора.
Согласно по меньшей мере некоторым вариантам осуществления иммунные клетки, предпочтительно Т-клетки, можно приводить в контакт in vivo или ex vivo с терапевтическими средствами для модулирования иммунного ответа. Т-клетки, приведенные в контакт с терапевтическими средствами, могут являться любыми клетками, которые экспрессируют Т-клеточный рецептор, в том числе α/β и γ/δ Т-клеточные рецепторы. Т-клетки включают все клетки, которые экспрессируют CD3, в том числе субпопуляции Т-клеток, которые также экспрессируют CD4 и CDS. Т-клетки включают как наивные клетки и клетки памяти, так и эффекторные клетки, такие как CTL. Т-клетки также включают такие клетки, как клетки Тh1, Tc1, Th2, Tc2, Th3, Th17, Th22, Treg и Tr1. Т-клетки также включают NKT-клетки и аналогичные уникальные классы Т-клеточной линии дифференцировки.
Ингибирование рассеивания эпитопа
Рассеивание эпитопа относится к способности В- и Т-клеточного иммунного ответа диверсифицировать как на уровне специфичности, с одной детерминанты на множество сайтов аутоантигена, так и на уровне использования генов V (Monneaux, F. et al., Arthritis & Rheumatism, 46(6):1430-1438 (2002). Рассеивание эпитопа не ограничено системными аутоиммунными заболеваниями. Оно было описано при зависимых от Т-клеток органоспецифических заболеваниях, таких как сахарный диабет 1 типа и рассеянный склероз у людей и у ЕАЕ-индуцированных экспериментальных животных с различными миелиновыми белками.
Рассеивание эпитопа подразумевает приобретенное распознавание новых эпитопов в той же самой молекуле, а также эпитопов, присущих белкам, которые связаны в том же макромолекулярном комплексе. Рассеивание эпитопа можно оценить посредством измерения реакций гиперчувствительности замедленного типа (DTH), способы которого известны в данной области техники.
Один из вариантов осуществления предоставляет способ ингибирования или снижения рассеивания эпитопа у субъекта путем введения субъекту эффективного количества терапевтических средств. В дополнительном варианте осуществления любое из терапевтических средств ингибирует рассеивание эпитопа у индивидуумов с рассеянным склерозом. Предпочтительно терапевтические средства ингибируют или блокируют несколько точек воспалительного пути.
Еще один вариант осуществления предоставляет способ ингибирования или снижения рассеивания эпитопа у субъектов с рассеянным склерозом путем введения субъекту эффективного количества терапевтических средств для ингибирования или уменьшения дифференцировки, пролиферации, активности, и/или продукции цитокинов, и/или секреции, осуществляемой Th1, Th17, Th22 и/или другими клетками, которые секретируют или индуцируют секрецию другими клетками воспалительных молекул, в том числе, но без ограничения, IL-1бета, TNF-альфа, TGF-бета, IFN-гамма, IL-17, IL-6, IL-23, IL-22, IL-21 и ММР.
Применение терапевтических средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения в качестве адъюванта для противораковой вакцинации
Иммунизация против опухоль-ассоциированных антигенов (ТАА) является перспективным подходом для терапии и предупреждения рака, но он сталкивается с рядом проблем и ограничений, таких как механизмы толерантности, связанные с аутоантигенами, экспрессируемыми опухолевыми клетками. Костимулирующие молекулы, такие как В7.1 (CD80) и В7.2 (CD86), обеспечили улучшение эффективности генных вакцин и вакцин на основе клеток на животных моделях и исследуются в качестве адъюванта в клинических испытаниях. Такая адъювантная активность может быть достигнута либо путем повышения костимулирующего сигнала, либо путем блокирования ингибирующего сигнала, который передается негативными костимуляторами, экспрессируемыми опухолевыми клетками (Neighbors et al., 2008 J Immunother.; 31(7):644-55). Согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения любая из секретируемых или растворимых форм LY6G6F, VSIG10, ТМЕМ25 и/или LSR, или их ECD, и/или вариантов, и/или ортологов, и/или конъюгатов, и/или поликлональное или моноклональное антитело, и/или антигенсвязывающие фрагменты и/или конъюгаты, содержащие вышеупомянутое, и/или альтернативные каркасные структуры, специфические для любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, можно применять в качестве адъюванта для противораковой вакцинации. Согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение предоставляет способы улучшения иммунизации против ТАА, включающие введение пациенту эффективного количества любой из секретируемых или растворимых форм LY6G6F, VSIG10, ТМЕМ25 и/или LSR, или их ECD, и/или вариантов, и/или ортологов, и/или конъюгатов, и/или поликлонального или моноклонального антитела, и/или антигенсвязывающих фрагментов, и/или конъюгатов, содержащих вышеупомянутое, и/или альтернативных каркасных структур, специфических для любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR.
Применение терапевтических средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения для адоптивной иммунотерапии
Одной из основных особенностей некоторых моделей толерантности является то, что как только состояние толерантности устанавливается, оно может сохраняться у интактных реципиентов после адоптивного переноса донор-специфических регуляторных клеток. В исследованиях такого адоптивного переноса также рассматривали возможность переноса толерантности T-клеточными субпопуляциями и клетками, не относящимися к Т-клеткам. Такая толерантность может быть вызвана посредством блокирования костимуляции или при соединении коингибирующего В7 с его соответствующим рецептором. Этот подход, который был успешно применен на животных и подтвержден при клинических испытаниях по отношению к людям (Scalapino K.J. and Daikh D.I. PLoS One. 2009; 4(6):e6031; Riley et al., Immunity. 2009; 30(5):656-665), обеспечивает перспективный вариант для лечения аутоиммунных нарушений и трансплантации. Согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения секретируемую или растворимую форму LY6G6F, VSIG10, ТМЕМ25 и/или LSR, или их ECD, и/или варианты, и/или ортологи, и/или конъюгаты, и/или поликлональное или моноклональное антитело, и/или антигенсвязывающие фрагменты, и/или конъюгаты, содержащие вышеуказанное, и/или альтернативные каркасные структуры, специфические для любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, применяют для адоптивной иммунотерапии. Таким образом, согласно по меньшей мере некоторым вариантам осуществления настоящее изобретение обеспечивает способы индукции толерантности in vivo или ex vivo, включающие введение эффективного количества секретируемой или растворимой формы LY6G6F, VSIG10, ТМЕМ25 и/или LSR, или их ECD, и/или вариантов, и/или ортологов, и/или конъюгатов, и/или поликлонального или моноклонального антитела, и/или антигенсвязывающих фрагментов, и/или конъюгатов, содержащих вышеуказанное, и/или альтернативных каркасных структур, специфических для любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, пациенту или их применение по отношению к лейкоцитам, выделенным от пациента, для того, чтобы вызвать дифференцировку толерогенных регуляторных клеток, с последующим ex-vivo обогащением и увеличением количества указанных клеток и реинфузией толерогенных регуляторных клеток упомянутому пациенту.
В альтернативном случае, можно обеспечить повышение иммунных ответов у пациента путем выделения иммунных клеток от пациента, приведения в контакт иммунных клеток in vitro со средством, которое ингибирует активность LY6G6F, VSIG10, ТМЕМ25 и/или LSR, и/или которое ингибирует взаимодействие LY6G6F, VSIG10, ТМЕМ25 и/или LSR с их естественными партнерами по связыванию, и повторного введения стимулированных in vitro иммунных клеток пациенту. В другом варианте осуществления способ модулирования иммунного ответа предусматривает выделение иммунных клеток от пациента, их трансфекцию молекулой нуклеиновой кислоты, кодирующей форму LY6G6F, VSIG10, ТМЕМ25 и/или LSR, так что клетки экспрессируют весь или участок полипептида LY6G6F, VSIG10, ТМЕМ25 и/или LSR согласно различным вариантам осуществления настоящего изобретения на их поверхности, и повторное введение трансфицированных клеток пациенту. Трансфицированные клетки обладают способностью модулировать иммунные ответы у пациента.
Применение терапевтических средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения для иммунологической активации
1. Лечение рака
Терапевтические средства, обеспеченные в данном документе, как правило пригодны in vivo и ex vivo в качестве терапевтических средств, стимулирующих иммунный ответ. В целом, раскрытые композиции терапевтических средств являются пригодными для лечения субъекта, имеющего или предрасположенного к любому заболеванию или нарушению, по отношению к которому иммунная система субъекта повышает иммунный ответ. Способность терапевтических средств модулировать иммунные сигналы LY6G6F, VSIG10, ТМЕМ25 и/или LSR обеспечивает возможность более сильного иммунного ответа. Терапевтические средства согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения являются пригодными для стимуляции или усиления иммунных ответов с участием иммунных клеток, таких как Т-клетки.
Терапевтические средства согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения являются пригодными для стимулирования или усиления иммунного ответа у хозяина для лечения рака путем введения субъекту определенного количества терапевтического средства, эффективного для стимуляции Т-клеток у субъекта.
2. Применение терапевтических средств в вакцинах
Терапевтические средства согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения вводят отдельно или в комбинации с любым другим подходящим лечением. В одном варианте осуществления терапевтические средства можно вводить в сочетании с, или в качестве компонента вакцинной композиции, как описано выше. Терапевтические средства согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно вводить до, параллельно с или после введения вакцины. В одном варианте осуществления терапевтические средства вводят одновременно с введением вакцины.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
В другом аспекте настоящее изобретение предоставляет композицию, например, фармацевтическую композицию, содержащую одно или комбинацию терапевтических средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения.
Таким образом, настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество терапевтического средства согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения.
Фармацевтическую композицию согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения также предпочтительно применяют для лечения рака, где рак может быть неметастатическим, инвазивным или метастатическим, лечения иммунологического нарушения и/или инфекционного нарушения.
"Лечение" относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам. Те, кто нуждается в лечении, включают тех, у кого уже есть нарушение, а также тех, у кого нарушение должно быть предупреждено. Следовательно, у млекопитающего, подлежащего лечению согласно данному документу, может быть диагностировано нарушение, или оно может быть предрасположено или восприимчиво к этому нарушению. "Млекопитающее" для целей лечения относится к любому животному, классифицируемому как млекопитающее, включая человека, домашних и сельскохозяйственных животных, и животных, содержащихся в зоопарках, спортивных или комнатных животных, таких как собаки, лошади, кошки, крупный рогатый скот и т.д. Предпочтительно млекопитающее представляет собой человека.
Выражение "терапевтически эффективное количество" относится к количеству средства по настоящему изобретению, которое является эффективным для лечения заболевания или нарушения у млекопитающего.
Терапевтические средства по настоящему изобретению можно предоставить субъекту отдельно или как часть фармацевтической композиции, если их смешивают с фармацевтически приемлемым носителем.
Фармацевтическую композицию согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения также можно вводить в комбинированной терапии, т.е. в сочетании с другими средствами. Например, комбинированная терапия может предусматривать антитело к LY6G6F, к VSIG10, к ТМЕМ25 и/или к LSR или средство, модулирующее LY6G6F, VSIG10, ТМЕМ25 и/или LSR, согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, такое как растворимый полипептидный конъюгат, содержащий эктодомен антигена LY6G6F, VSIG10, ТМЕМ25 и/или LSR или малую молекулу, такую как пептид, рибозим, аптамер, миРНК, или другое лекарственное средство, которое связывается с LY6G6F, VSIG10, ТМЕМ25 и/или LSR, в сочетании по меньшей мере с одним другим терапевтическим или иммунномодулирующим средством.
Композиция считается "фармацевтически приемлемым носителем", если пациент, который ее получает, может переносить ее введение. Используемое в данном документе выражение "фармацевтически приемлемый носитель" охватывает любой и все растворители, дисперсионные среды, обволакивающие средства, антибактериальные и противогрибковые средства, изотонические и задерживающие абсорбцию средства и т.п., которые являются физиологически совместимыми. Предпочтительно носитель подходит для внутривенного, внутримышечного, подкожного, парентерального, спинального или эпидермального введения (например, путем инъекции или инфузии).
Такие композиции предусматривают стерильную воду, солевой буферный раствор (например, Tris-HCl, ацетатный, фосфатный), рН и ионную силу, и необязательно добавки, такие как детергенты и солюбилизирующие средства (например, полисорбат 20, полисорбат 80), антиоксиданты (например, аскорбиновую кислоту, метабисульфит натрия), консерванты (например, тимерсол, бензиловый спирт) и наполнители (например, лактоза, маннит). Неводные растворители или носители также можно применять, как описано ниже.
Примеры подходящих водных и неводных носителей, которые можно использовать в фармацевтических композициях согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения включают воду, этанол, полиолы (например, глицерин, пропиленгликоль, полиэтиленгликоль и т.п.) и их подходящие смеси, растительные масла, такие как оливковое масло, и органические сложные эфиры для инъекций, такие как этилолеат. Надлежащую текучесть можно поддерживать, например, посредством применения покрывающих материалов, таких как лецитин, при помощи поддержания требуемого размера частиц в случае дисперсий и посредством применения поверхностно-активных веществ. В зависимости от пути введения активное соединение, т.е. растворимый полипептидный конъюгат, содержащий эктодомен антигена LY6G6F, VSIG10, ТМЕМ25 и/или LSR, моноклональные или поликлональные антитела и антигенсвязывающие фрагменты и конъюгаты, содержащие вышеуказанное, и/или альтернативные каркасные структуры, которые специфически связываются с любым из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, или биспецифическая молекула может быть покрыта материалом для защиты соединения от действия кислот и других природных условий, которые могут привести к инактивации соединения. Фармацевтические соединения согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения могут включать одну или несколько фармацевтически приемлемых солей. "Фармацевтически приемлемая соль" относится к соли, которая сохраняет требуемую биологическую активность исходного соединения и не вызывает какие-либо нежелательные токсические эффекты (см., например, Berge S.М., et al. (1977) J. Pharm. Sci. 66:1-19). Примеры таких солей включают соли присоединения кислоты и соли присоединения основания. Соли присоединения кислоты включают соли, полученные из нетоксичных неорганических кислот, таких как соляная, азотная, фосфорная, серная, бромистоводородная, иодистоводородная, фосфористая и т.п., а также из нетоксичных органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, ароматические кислоты, алифатические и ароматические сульфокислоты и т.п. Соли присоединения основания включают соли, полученные из щелочно-земельных металлов, таких как натрий, калий, магний, кальций и т.п., а также из нетоксичных органических аминов, таких как N,N'-дибензилэтилендиамин, N-метилглюкамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, прокаин и т.п.
Фармацевтическая композиция согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения также может включать фармацевтически приемлемый антиоксидант. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, сульфит натрия и т.п.; (2) жирорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), лецитин, пропилгаллат, альфа-токоферол и т.п.; и (3) хелатирующие металл средства, такие как лимонная кислота, этилендиаминтетрауксусная кислота (ЭДТА), сорбит, винная кислота, фосфорная кислота и т.п.
Эти композиции могут также содержать адъюванты, такие как консерванты, смачивающие средства, эмульгаторы и диспергирующие средства. Предотвращение присутствия микроорганизмов можно обеспечить как процедурами стерилизации, см. выше, так и включением различных антибактериальных и противогрибковых средств, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и т.п. Также может быть желательно включить в композиции изотонические средства, такие как сахара, хлорид натрия и т.п. Кроме того, продолжительную абсорбцию фармацевтической формы для инъекций можно обеспечить при помощи включения средств, которые замедляют абсорбцию, таких как моностеарат алюминия и желатин.
Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки для немедленного получения стерильных растворов или дисперсий для инъекций. Применение таких сред и средств для фармацевтически активных веществ известно в данной области техники. За исключением тех случаев, когда обычная среда или средство является несовместимым с активным соединением, предусмотрено их применение в фармацевтических композициях согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения. Дополнительные активные соединения также можно включить в композиции.
Терапевтические композиции, как правило, должны быть стерильными и стабильными в условиях для получения и хранения. Композиция может быть составлена в виде раствора, микроэмульсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного средства. Носитель может быть растворителем или дисперсионной средой, содержащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и их подходящими смесями. Надлежащую текучесть можно поддерживать, например, посредством применения обволакивающего средства, такого как лецитин, при помощи поддержания требуемого размера частиц в случае дисперсии и посредством применения поверхностно-активных веществ. Во многих случаях будет предпочтительным включение изотонических средств, например, сахаров, многоатомных спиртов, таких как маннит, сорбит или хлорид натрия в композиции. Продолжительную абсорбцию композиций для инъекций можно обеспечить при помощи включения в композицию средства, которое задерживает абсорбцию, например солей моностеарата и желатина. Стерильные растворы для инъекций можно получить путем введения активного соединения в требуемом количестве в соответствующий растворитель с одним или комбинацией перечисленных выше ингредиентов, при необходимости, с последующей стерилизационной микрофильтрацией. Как правило, дисперсии получают при помощи включения активного соединения в стерильный носитель, который содержит основную дисперсионную среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных растворов для инъекций предпочтительными способами получения являются вакуумная сушка и сушка вымораживанием (лиофилизация), которые дают порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из его предварительно стерильно отфильтрованного раствора.
Стерильные растворы для инъекций можно получить путем введения активного соединения в требуемом количестве в соответствующий растворитель с одним или комбинацией перечисленных выше ингредиентов, при необходимости, с последующей стерилизационной микрофильтрацией. Как правило, дисперсии получают при помощи включения активного соединения в стерильный носитель, который содержит основную дисперсионную среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных растворов для инъекций предпочтительными способами получения являются вакуумная сушка и сушка вымораживанием (лиофилизация), которые дают порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из его предварительно стерильно отфильтрованного раствора.
Количество активного ингредиента, которое можно сочетать с материалом носителя для получения одной лекарственной формы, будет варьировать в зависимости от субъекта, лечение которого осуществляется, и конкретного способа введения. Количество активного ингредиента, которое можно сочетать с материалом носителя для получения одной лекарственной формы, как правило, будет тем количеством композиции, которое дает терапевтический эффект. Как правило, из ста процентов это количество будет находиться в диапазоне от приблизительно 0,01 процента до приблизительно девяносто девяти процентов активного ингредиента, предпочтительно, от приблизительно 0,1 процента до приблизительно 70 процентов, наиболее предпочтительно, от приблизительно 1 процента до приблизительно 30 процентов активного ингредиента в комбинации с фармацевтически приемлемым носителем.
Схемы дозирования приспособлены для обеспечения оптимального желаемого ответа (например, терапевтического ответа). Например, можно вводить один болюс, можно вводить несколько раздельных доз в течение определенного времени, или дозу можно пропорционально уменьшить или увеличить, как того требует терапевтическая ситуация. Особенно предпочтительным является составление парентеральных композиций в единичной лекарственной форме для простоты введения и однородности дозы. Единичная лекарственная форма, используемая в данном документе, относится к физически дискретным единицам, пригодным в качестве единичных доз для субъектов, подлежащих лечению; при этом каждая единица содержит предварительно определенное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта в сочетании с требуемым фармацевтическим носителем. Спецификация для единичных лекарственных форм согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения определяется и непосредственно зависит от (а) уникальных характеристик активного соединения и конкретного терапевтического эффекта, который должен быть достигнут, и (b) ограничений, присущих данной области техники относительно составления такого активного соединения для лечения чувствительности у индивидуумов.
Применительно к введению антитела доза находится в диапазоне от приблизительно 0,0001 до 100 мг/кг, а еще чаще от 0,01 до 5 мг/кг массы тела хозяина. Например, дозы могут составлять 0,3 мг/кг массы тела, 1 мг/кг массы тела, 3 мг/кг массы тела, 5 мг/кг массы тела или 10 мг/кг массы тела или находиться в диапазоне 1-10 мг/кг. Иллюстративный режим лечения предусматривает введение один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в месяц, один раз в 3 месяца или один раз каждые три - 6 месяцев. Предпочтительные схемы дозирования для антитела согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения предусматривают 1 мг/кг массы тела или 3 мг/кг массы тела посредством внутривенного введения, при этом антитело доставляют с использованием одного из следующих режимов дозирования: (i) один раз в четыре недели для шести доз, затем каждые три месяца; (ii) один раз в три недели; (iii) 3 мг/кг массы тела один раз, за которым следует по 1 мг/кг массы тела каждые три недели.
Применительно к слитым белкам, описанным в данном документе, необязательно придерживаются аналогичной схемы дозирования; в альтернативном случае, слитые белки необязательно можно вводить в количестве от 0,0001 до 100 мг/кг массы тела пациента в день, предпочтительно, от 0,001 до 10,0 мг/кг в день, в соответствии с любой подходящей схемой выбора времени. Терапевтическую композицию согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно вводить, например, три раза в день, два раза в день, один раз в день, три раза в неделю, два раза в неделю или один раз в неделю, один раз в две недели или 3, 4, 5, 6, 7 или 8 недель. Кроме того, композицию можно вводить в течение короткого или длительного периода времени (например, 1 неделя, 1 месяц, 1 год, 5 лет).
В некоторых способах два или более моноклональных антител с различной специфичностью связывания вводят одновременно, в этом случае доза каждого вводимого антитела находится в пределах указанных диапазонов. Антитело обычно вводят несколько раз. Интервалы между отдельными дозами могут быть, например, недельными, месячными, раз в три месяца или год. Интервалы также могут быть неравномерными, что определяется при помощи измерений в крови пациента уровней антитела к антигену-мишени. В некоторых способах дозу корректируют для достижения концентрации антитела в плазме приблизительно 1-1000 мкг/мл, а в некоторых способах приблизительно 25-300 мкг/мл.
В альтернативном случае, терапевтическое средство можно вводить в виде состава с замедленным высвобождением, в этом случае требуется менее частое введение. Доза и частота варьируют в зависимости от времени полужизни терапевтического средства в организме пациента. В целом, по отношению к человеческим антителам продемонстрировано самое длинное время полужизни, за которыми следуют гуманизированные антитела, химерные антитела и антитела, не относящиеся к человеческим. Время полужизни для слитых белков может варьировать в широких пределах. Доза и частота введения могут варьировать в зависимости от того, является лечение профилактическим или терапевтическим. При профилактическом применении относительно низкую дозу вводят при относительно нечастых интервалах в течение длительного периода времени. Некоторые пациенты продолжают получать лечение в течение всей своей жизни. При терапевтическом применении иногда требуются относительно высокие дозы при относительно коротких интервалах до тех пор, пока прогрессирование заболевания не уменьшится или не прекратится и, предпочтительно, пока у пациента не будет обнаружено частичное или полное облегчение симптомов заболевания. После этого к пациенту можно применять профилактическую схему.
Фактические уровни доз активных ингредиентов в фармацевтических композициях по настоящему изобретению можно варьировать так, чтобы получить количество активного ингредиента, которое является эффективным для достижения желаемого терапевтического ответа для конкретного пациента, композиции и способа введения, причем без токсичности для пациента. Выбранный уровень дозы будет зависеть от различных фармакокинетических факторов, в том числе активности конкретных применяемых композиций по настоящему изобретению, или их сложных эфиров, солей или амидов, пути введения, времени введения, скорости экскреции конкретного применяемого соединения, продолжительности лечения, других лекарственных средств, соединений и/или материалов, используемых в комбинации с конкретными применяемыми композициями, возраста, пола, массы тела, состояния, общего состояния здоровья и предшествующего анамнеза пациента, лечение которого осуществляется, и подобных факторов, хорошо известных в области медицины.
"Терапевтически эффективная доза" растворимого белка LY6G6F, VSIG10, ТМЕМ25 и/или LSR, или эктодомена LY6G6F, VSIG10, ТМЕМ25 и/или LSR, или слитого белка, содержащего вышеупомянутое, или антитела к LY6G6F, к VSIG10, к ТМЕМ25 и/или к LSR согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения предпочтительно приводит к уменьшению тяжести симптомов заболевания, увеличению частоты и продолжительности бессимптомных периодов заболевания, увеличению продолжительности жизни, ремиссии заболевания или предупреждению или уменьшению повреждения или нетрудоспособности в связи с физическим недостатком, к которому привело заболевание. Например, при лечении опухолей, положительных по LY6G6F, VSIG10, ТМЕМ25 и/или LSR, например, меланомы, форм рака печени, почек, головного мозга, молочной железы, толстой кишки, легких, яичников, поджелудочной железы, простаты, желудка, множественной миеломы и гемопоэтического рака, в том числе, но без ограничения, лимфомы (Ходжкина и неходжкинской), острого и хронического лимфобластного лейкоза и острого и хронического миелоидного лейкоза, "терапевтически эффективная доза" предпочтительно ингибирует рост клеток или рост опухоли по меньшей мере на приблизительно 20%, более предпочтительно по меньшей мере на приблизительно 40%, еще более предпочтительно по меньшей мере на приблизительно 60% и еще более предпочтительно по меньшей мере на приблизительно 80% по сравнению с субъектами, лечение которых не осуществлялось. Способность соединения ингибировать рост опухоли можно оценить при помощи системы на основе животной модели для прогнозирования эффективности в отношении опухолей у человека. В альтернативном случае, это свойство композиции можно оценить путем исследования способности соединения осуществлять ингибирование, причем анализы такого ингибирования in vitro известны специалисту в данной области техники. Терапевтически эффективное количество терапевтического соединения может обеспечить уменьшение размера опухоли или иным образом обеспечить облегчение симптомов у субъекта.
Специалист в данной области техники сможет определить терапевтически эффективное количество на основе таких факторов, как размер тела субъекта, тяжесть симптомов у субъекта и выбранные конкретная композиция или путь введения.
Композицию по настоящему изобретению можно вводить посредством одного или нескольких путей введения с использованием одного или нескольких из множества способов, известных в данной области техники. Как будет понятно специалисту в данной области техники, путь и/или способ введения будет варьировать в зависимости от желаемых результатов. Предпочтительные пути введения для терапевтических средств согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения предусматривают внутрисосудистую доставку (например, инъекция или инфузия), внутривенную, внутримышечную, внутрикожную, интраперитонеальную, подкожную, спинальную, пероральную, энтеральную, ректальную, легочную (например, ингаляция) назальную, местную (включая трансдермальную, трансбуккальную и сублингвальную), внутрипузырную, интравитреальную, интраперитонеальную, вагинальную доставку, доставку в мозг (например, интрацеребровентрикулярную, интрацеребральную и конвекционную диффузию), доставку в ЦНС (например, интратекальную, периспинальную и интраспинальную) или парентеральное введение (включая подкожное, внутримышечное, внутривенное и внутрикожное), черезслизистое (например, сублингвальное введение), или введение при помощи имплантата, или другие парентеральные пути введения, например, путем инъекции или инфузии, или другие пути доставки и/или формы введения, известные в данной области техники. Фраза "парентеральное введение", используемая в данном документе, означает способы введения, отличные от энтерального и местного введения, обычно путем инъекции, и включают без ограничения, внутривенную, внутримышечную, внутриартериальную, интратекальную, интракапсулярную, интраорбитальную, внутрисердечную, внутрикожную, интраперитонеальную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную, эпидуральную и интрастернальную инъекцию и инфузию. В специфическом варианте осуществления белок, терапевтическое средство или фармацевтическую композицию согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно вводить интраперитонеально или внутривенно.
В альтернативном случае, специфическое антитело к LY6G6F, VSIG10, ТМЕМ25 и/или LSR, или другое лекарственное средство на основе LY6G6F, VSIG10, ТМЕМ25 и/или LSR, или молекула, и их конъюгаты, и их комбинации, которые модулируют активность белка LY6G6F, VSIG10, ТМЕМ25 и/или LSR, можно вводить посредством пути, не относящегося к парентеральному, такого как местный, эпидермальный путь введения или путь введения через слизистую оболочку, например, интраназально, перорально, вагинально, ректально, сублингвально или местно.
Активные соединения можно получить с носителями, которые будут защищать соединение от быстрого высвобождения, например, состав с контролируемым высвобождением, включая имплантаты, трансдермальные пластыри и микроинкапсулированные системы доставки. Можно применять биоразлагаемые биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Многие способы получения таких составов запатентованы или в целом известны специалистам в данной области техники. См., например. Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
Терапевтические композиции можно вводить при помощи медицинских устройств, известными в данной области техники. Например, в предпочтительном варианте осуществления терапевтическую композицию согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно вводить с помощью игольного устройства для подкожных инъекций, такого как устройства, раскрытые в патентах США №5399163, 5383851, 5312335, 5064413, 4941880, 4790824 или 4596556. Примеры хорошо известных имплантатов и модулей, пригодных по настоящему изобретению, включают: патент США №4487603, в котором раскрывается имплантируемый микроинфузионный насос для дозирования лекарственного препарата с регулируемой скоростью, патент США №4486194, в котором раскрывается терапевтическое устройство для введения лекарственных препаратов через кожу, патент США №4447233, в котором раскрывается инфузионный насос для лекарственных препаратов для доставки лекарственных препаратов с точной скоростью инфузии; патент США №4447224, в котором раскрывается имплантируемое инфузионное устройство с переменной скоростью потока для непрерывной доставки лекарственных средств; патент США №4439196, в котором раскрывается осмотическая система доставки лекарственных средств, имеющая многокамерные компартменты, и патент США №4475196, в котором раскрывается осмотическая система доставки лекарственных средств. Эти патенты включены в данный документ при помощи ссылки. Многие другие такие имплантаты, системы доставки и модули известны специалистам в данной области техники.
В некоторых вариантах осуществления антитела, растворимые белки LY6G6F, VSIG10, ТМЕМ25 и/или LSR, эктодомены и/или слитые белки можно составить для обеспечения надлежащего распределения in vivo. Например, гематоэнцефалический барьер (ВВВ) исключает многие высокогидрофильные соединения. Для обеспечения того, что терапевтические соединения согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения проникнут через ВВВ (при необходимости), их можно составить, например, в липосомах. Что касается способов получения липосом, см., например, патенты США №№4522811, 5374548 и 5399331. Липосомы могут содержать один или несколько фрагментов, которые избирательно транспортируются в специфические клетки или органы, что таким образом повышает целевую доставку лекарственных средств (см., например, V.V. Ranade (1989) J. Clin. Pharmacol. 29:685). Иллюстративные нацеливающие фрагменты включают фолат или биотин (см., например, патент США №5416016, выданный Low и соавт.); маннозиды (Umezawa et al., (1988) Biochem. Biophys. Res. Commun. 153:1038); антитела (P.G. Bloeman et al. (1995) FEBS Lett. 357:140; M. Owais et al. (1995) Antimicrob. Agents Chemother. 39:180); рецептор поверхностно-активного белка A (Briscoe et al. (1995) Am. J Physiol. 1233:134); p120 (Schreier et al. (1994) J. Biol. Chem. 269:9090); см. также K. Keinanen; M.L. Laukkanen (1994) FEBS Lett. 346:123; J.J. Killion; I.J. Fidler (1994) Immunomethods 4:273.
Антитела к LY6G6F, к VSIG10, к ТМЕМ25 и к LSR согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения можно применять в качестве нейтрализующих антител. Нейтрализующее антитело (Nab) представляет собой антитело, которое способно связывать и нейтрализовать или ингибировать специфический антиген, что тем самым обеспечивает ингибирование его биологического эффекта, например, посредством блокирования рецепторов на клетке или вируса, ингибирования связывания вируса с клеткой-хозяином. NAb будет частично или полностью прекращать биологическое действие средства, либо при помощи блокирования важной поверхностной молекулы, необходимой для его активности, либо путем препятствования связыванию средства с его рецептором на клетке-мишени.
В еще одном варианте осуществления иммуноконъюгаты по настоящему изобретению можно применять для нацеливания соединений (например, терапевтических средств, меток, цитотоксинов, радиотоксинов, иммуносупрессоров и т.д.) на клетки, у которых есть рецепторы к LY6G6F, VSIG10, ТМЕМ25 и/или LSR на поверхности клетки, при помощи связывания таких соединений с антителом. Таким образом, настоящее изобретение также обеспечивает способ локализации ex vivo или in vivo клеток, экспрессирующих LY6G6F, VSIG10, ТМЕМ25 и/или LSR (например, с обнаруживаемой меткой, такой как радиоактивный изотоп, флуоресцентное соединение, фермент или кофактор фермента). В альтернативном случае, иммуноконъюгаты можно применять для уничтожения клеток, которые имеют рецепторы к LY6G6F, VSIG10, ТМЕМ25 и/или LSR на клеточной поверхности, путем нацеливания цитотоксинов или радиотоксинов на антиген LY6G6F, VSIG10, ТМЕМ25 и/или LSR.
ДИАГНОСТИЧЕСКОЕ ПРИМЕНЕНИЕ ПОЛИПЕПТИДОВ LY6G6F, VSIG10, ТМЕМ25 и/или LSR И СООТВЕТСТВУЮЩИХ ПОЛИНУКЛЕОТИДОВ
Согласно некоторым вариантам осуществления, образец, полученный от субъекта (пациента), для осуществления диагностического анализа согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения выбран из группы, состоящей из жидкости организма или секрета, включая, но без ограничения, кровь, сыворотку, мочу, плазму, секрет простаты, семенную жидкость, сперму, наружные секреты кожи, дыхательного, кишечного и мочеполового трактов, слезы, спинномозговую жидкость, синовиальную жидкость, мокроту, слюну, молоко, перитонеальную жидкость, плевральную жидкость, жидкость кисты, секреты системы протоков молочной железы (и/или их лаваж), бронхоальвеолярный лаваж, лаваж с репродуктивной системы и лаваж с любой другой части тела или системы организма; образцов любого органа, в том числе, выделенных клеток или тканей, причем клетка или ткань может быть получена из органа, выбранного из, но без ограничения, легких, толстой кишки, яичников и/или ткани молочной железы; стула, или образца ткани, или любой их комбинации. В некоторых вариантах осуществления выражение охватывает образцы in vivo компонентов клеточной культуры. До того, как подвергнуться диагностическому анализу, образец необязательно можно разбавить подходящим элюантом.
В некоторых вариантах осуществления фраза "маркер" в контексте настоящего изобретения относится к фрагменту нуклеиновой кислоты, пептиду или полипептиду, который неодинаково присутствует в образце, полученном от пациентов (субъектов), имеющих одно из описанных в данном документе заболеваний или состояний, по сравнению с сопоставимым образцом, полученным от субъектов, у которых нет одного из вышеописанных заболеваний или состояний.
В некоторых вариантах осуществления фраза "неодинаково присутствует" относится к различиям в количестве и качестве маркера, присутствующего в образце, полученном от пациентов с одним из описанных в данном документе заболеваний или состояний, по сравнению с сопоставимым образцом, полученным от пациентов, у которых нет одного из описанных в данном документе заболеваний или состояний. Например, фрагмент нуклеиновой кислоты необязательно может быть неодинаково присутствующим в двух образцах, если количество фрагмента нуклеиновой кислоты в одном образце значительно отличается от количества фрагмента нуклеиновой кислоты в другом образце, например, как измерено с помощью гибридизации и/или анализов на основе NAT. Полипептид неодинаково присутствует в двух образцах, если количество полипептида в одном образце значительно отличается от количества полипептида в другом образце. Следует отметить, что если маркер является обнаруживаемым в одном образце и не обнаруживаемым в другом, то такой маркер может рассматриваться в качестве неодинаково присутствующего. Необязательно, относительно небольшая степень активации может служить в качестве маркера, описанного в данном документе. Специалист в данной области техники сможет легко определить такие относительные уровни маркеров; дополнительное руководство предоставлено в описании каждого отдельного маркера ниже.
В некоторых вариантах осуществления фраза "диагностический" означает идентификацию присутствия или характера патологического состояния. Диагностические способы различаются по своей чувствительности и специфичности. "Чувствительность" диагностического анализа представляет собой процент больных индивидуумов с положительной реакцией (процент "истинно положительных"). Больные индивидуумы, не обнаруженные с помощью анализа, являются "ложноотрицательными." Субъектов, которые не являются больными и имеют отрицательную реакцию в анализе, называют "истинно отрицательными". "Специфичность" диагностического анализа составляет 1 минус доля ложноположительных, где долю "ложноположительных" определяют как относительное количество субъектов, не являющихся больными, с положительной реакцией. Хотя конкретный способ диагностики может не обеспечивать точный диагноз состояния, достаточно, если способ обеспечивает положительный признак, который способствует диагностике.
Используемое в данном документе выражение "диагностика" относится к способу выявления медицинского состояния или заболевания по его признакам, симптомам и в частности, исходя из результатов различных диагностических процедур, в том числе, например, обнаружения экспрессии нуклеиновых кислот или полипептидов согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения в биологическом образце (например, в клетках, ткани или сыворотке, как определено ниже), полученном от индивидуума. Кроме того, используемое в данном документе выражение "диагностика" охватывает скрининг на предмет заболевания, обнаружение присутствия или тяжести заболевания, обеспечения прогноза заболевания, мониторинг прогрессирования заболевания или рецидива, а также оценку эффективности лечения и/или рецидива заболевания, нарушения или состояния, а также выбор терапии и/или лечения заболевания, оптимизацию данной терапии по отношению к заболеванию, мониторинг лечения заболевания, и/или предсказание пригодности терапии для конкретного пациента или субпопуляций, или определение соответствующего дозирования терапевтических продуктов для пациентов или субпопуляций. Диагностическую процедуру можно выполнять in vivo или in vitro.
В некоторых вариантах осуществления фраза "качественный" по отношению к различиям по уровням экспрессии полинуклеотида или полипептида, описанного в данном документе, относится к присутствию экспрессии по сравнению с отсутствием таковой, или в некоторых вариантах осуществления к временной регуляции экспрессии, или в некоторых вариантах осуществления к временному паттерну экспрессии, или в некоторых вариантах осуществления к любым посттрансляционным модификациям экспрессированной молекулы и к другому, как будет понятно специалисту в данной области техники. В некоторых вариантах осуществления фраза "количественный" по отношению к различиям по уровням экспрессии полинуклеотида или полипептида, описанного в данном документе, относится к абсолютной разнице по величине экспрессии, определенной с помощью любых средств, известных в данной области техники, или в других вариантах осуществления к относительной разнице, которая может быть статистически значимой, или в некоторых вариантах осуществления, если рассмотрение в целом или в течение длительного периода времени и т.д. указывает на тенденцию с точки зрения различий по экспрессии.
В некоторых вариантах осуществления выражение "диагностирование" относится к классификации заболевания или симптома, определению тяжести заболевания, мониторингу прогрессирования заболевания, прогнозированию исхода заболевания и/или перспектив восстановления. Выражение "обнаружение" необязательно также может охватывать любое из вышеперечисленного.
В некоторых вариантах осуществления диагностика заболевания по настоящему изобретению может зависеть от определения уровня полинуклеотида или полипептида по настоящему изобретению в биологическом образце, полученном от субъекта, причем определенный уровень можно сопоставить с предрасположенностью к, или наличием или отсутствием заболевания. Следует отметить, что "биологический образец, полученный от субъекта" может также необязательно содержать образец, который не был физически извлечен из субъекта, как описано более подробно ниже.
В некоторых вариантах осуществления выражение "уровень" относится к уровням экспрессии РНК и/или белка или числу копий ДНК маркера по настоящему изобретению.
Как правило, уровень маркера в биологическом образце, полученном от субъекта, отличается (т.е., увеличен или уменьшен) от уровня того же маркера в аналогичном образце, полученном от здорового индивидуума (примеры биологических образцов описаны в данном документе).
Многочисленные хорошо известные способы сбора ткани или жидкости можно использовать для сбора биологического образца у субъекта для того, чтобы определить у субъекта уровень ДНК, РНК и/или полипептида маркера, представляющего интерес.
Примеры включают, но без ограничения, тонкоигольную биопсию, пункционную биопсию, толстоигольную биопсию и хирургическую биопсию (например, биопсию головного мозга) и лаваж. Независимо от используемой процедуры, если получают биопсию/образец, можно определить уровень маркера и, таким образом, можно поставить диагноз.
Определение уровня одного и того же маркера в нормальных тканях того же происхождения предпочтительно осуществляют параллельно с обнаружением повышенной экспрессии и/или амплификации, и/или сниженной экспрессии маркера по сравнению с таковыми в нормальных тканях.
В некоторых вариантах осуществления выражение "измеряемое количество" маркера относится к количеству маркера в образце от субъекта, которое согласуется с диагнозом конкретного заболевания или состояния. Измеряемое количество может представлять собой либо абсолютное количество (например, микрограмм/мл), либо относительное количество (например, относительная интенсивность сигналов).
В некоторых вариантах осуществления выражение "контрольное количество" маркера может быть любым количеством или диапазоном количеств по сравнению с измеряемым количеством маркера. Например, контрольное количество маркера может быть количеством маркера у пациента с конкретным заболеванием или состоянием или у лица без такого заболевания или состояния. Контрольное количество может представлять собой либо абсолютное количество (например, микрограмм/мл), либо относительное количество (например, относительная интенсивность сигналов).
В некоторых вариантах осуществления выражение "обнаружение" относится к идентификации присутствия, отсутствия или количества обнаруживаемого объекта.
В некоторых вариантах осуществления выражение "метка" предусматривает любой фрагмент или элемент, обнаруживаемый спектроскопическими, фотохимическими, биохимическими, иммунохимическими или химическими средствами. Например, пригодные метки включают 32Р, 35S, флуоресцентные красители, электроноплотные реагенты, ферменты (например, обычно используемые в ELISA), биотин-стрептавидин, дигоксигенин, гаптены и белки, для которых доступны антисыворотки или моноклональные антитела, или молекулы нуклеиновых кислот с последовательностью, комплементарной мишени. Метка часто служит источником измеримого сигнала, такого как радиоактивный, хромогенный или флуоресцентный сигнал, который можно использовать для определения количества связанной метки в образце. Метка может быть включена в, или прикреплена к праймеру или зонду либо ковалентно, либо посредством ионных, ван-дер-ваальсовских или водородных связей, например, включение радиоактивных нуклеотидов или биотинилированных нуклеотидов, которые распознаются стрептавидином. Метка может быть непосредственно или опосредованно обнаруживаемой. Опосредованное обнаружение может предусматривать связывание второй метки с первой меткой непосредственно или опосредованно. Например, метка может быть лигандом партнера связывания, такого как биотин, который является партнером связывания для стрептавидина, или нуклеотидной последовательностью, которая является партнером связывания для комплементарной последовательности, с которой она может специфически гибридизироваться. Сам партнер связывания может быть непосредственно обнаруживаемым, например, антитело само по себе может быть меченым флуоресцентной молекулой. Партнер связывания также может быть опосредованно обнаруживаемым, например, нуклеиновая кислота, имеющая комплементарную нуклеотидную последовательность, может быть частью разветвленной молекулы ДНК, которая, в свою очередь, обнаруживается при помощи гибридизации с другими мечеными молекулами нуклеиновых кислот (см., например, Р.D. Fahrlander and A. Klausner, Bio/Technology 6:1165 (1988)). Количественное определение сигнала осуществляют, например, с помощью сцинтилляционного измерения, денситометрии или проточной цитометрии.
Иллюстративные обнаруживаемые метки, необязательно и предпочтительно для применения в иммунологических анализах, включают, но без ограничения, магнитные гранулы, флуоресцентные красители, радиоактивные метки, ферменты (например, пероксидаза хрена, щелочная фосфатаза и другие, обычно используемые в ELISA), и калориметрические метки, такие как коллоидное золото или цветное стекло, или пластиковые гранулы. В альтернативном случае, маркер в образце можно обнаружить при помощи непрямого анализа, в котором, например, второе меченое антитело используют для обнаружения связанного маркер-специфического антитела, и/или в анализе конкурентного связывания или ингибирования, в котором, например, моноклональное антитело, которое связывается с отдельным эпитопом маркера, инкубируют одновременно со смесью.
"Иммунологический анализ" представляет собой анализ, в котором антитело используют для специфического связывания с антигеном. Иммунологический анализ характеризуется применением свойств специфического связывания конкретного антитела для выделения, нацеливания и/или определения количества антигена.
Фраза "специфически (или селективно) связывается" с антителом или "специфически (или селективно) иммунореактивный по отношению к" или "специфически взаимодействует или связывается" по отношению к белку или пептиду (или другого эпитопу) относится в некоторых вариантах осуществления к реакции связывания, при помощи которой определяют присутствие белка в гетерогенной популяции белков и других биологических компонентов. Таким образом, при указанных условиях иммунологического анализа определенные антитела связываются с конкретным белком по меньшей мере в два раза больше, чем фон (неспецифический сигнал) и практически не связываются в значительном количестве с другими белками, присутствующими в образце. Для специфического связывания с антителом при таких условиях может требоваться антитело, которое выбрано по его специфичности по отношению к конкретному белку. Например, поликлональные антитела, индуцированные по отношению к основному белку семенной жидкости конкретных видов, таких как крыса, мышь или человек, можно отобрать для получения только тех поликлональных антител, которые специфически иммунореактивны по отношению к основному белку семенной жидкости, но не к другим белкам, за исключением полиморфных вариантов и аллелей основного белка семенной жидкости. Этот отбор можно осуществлять путем изымания антител, которые перекрестно реагируют с молекулами основного белка семенной жидкости от других видов. Разнообразные форматы иммунологического анализа можно использовать для отбора антител, специфически иммунореактивных по отношению к конкретному белку. Например, обычно используют твердофазный иммунологический анализ ELISA для отбора антител, специфически иммунореактивных по отношению к белку (см., например, Harlow & Lane, Antibodies, A Laboratory Manual (1988) применительно к описанию форматов иммунологического анализа и условий, которые можно использовать для определения специфической иммунореактивности). Как правило, специфическая или селективная реакция будет по меньшей мере в два раза превышать фоновый сигнал или шум и, более типично, более чем в 10-100 раз по сравнению с фоном.
В другом варианте осуществления настоящее изобретение обеспечивает способ обнаружения полипептидов по настоящему изобретению в биологическом образце, включающий приведение в контакт биологического образца с антителом, специфически распознающим полипептид по настоящему изобретению, и обнаружение указанного взаимодействия, при этом присутствие взаимодействия коррелирует с присутствием полипептида в биологическом образце.
В некоторых вариантах осуществления настоящего изобретения полипептиды, описанные в данном документе, являются неограничивающими примерами маркеров для диагностики заболевания и/или характерного состояния. По отношению к различным применениям каждый маркер по настоящему изобретению можно применять отдельно или в комбинации, включая, но без ограничения, прогноз, предсказание, скрининг, раннюю диагностику, определение прогрессирования, выбор терапии и мониторинг лечения заболевания и/или характерного состояния.
По отношению к связанному объекту обнаруженные заболевания будут включать формы рака, такие как опухоли, не являющиеся солидными, и солидные опухоли, саркомы и гемобластозы.
По отношению к другому связанному объекту обнаруженные заболевания будут включать аутоиммунные нарушения, отторжение любого трансплантата органа и/или реакцию "трансплантат против хозяина".
По отношению к различным применениям каждый полипептид/полинуклеотид по настоящему изобретению можно применять отдельно или в комбинации, включая, но без ограничения, прогноз, предсказание, скрининг, раннюю диагностику, определение прогрессирования, выбор терапии и мониторинг лечения заболевания и/или характерного состояния, как подробно описано выше.
Такая комбинация может необязательно содержать любую субкомбинацию маркеров и/или комбинацию, характеризующуюся по меньшей мере одним другим маркером, например, известным маркером. Кроме того, такую комбинацию необязательно и предпочтительно можно применять, как описано выше, относительно определения соотношения между количественным или приближенным к количественному измерением любого маркера, описанного в данном документе, к таковому любого другого маркера, описанного в данном документе, и/или любого другого известного маркера, и/или любого другого маркера.
В некоторых вариантах осуществления настоящего изобретения обеспечиваются способы, применения, устройства и анализы для диагностики заболевания или состояния. Необязательно, множество маркеров можно применять в соответствии с настоящим изобретением. Данное множество маркеров необязательно может включать маркеры, описанные в данном документе, и/или один или несколько известных маркеров. Данное множество маркеров предпочтительно затем сопоставляют с заболеванием или состоянием. Например, такое сопоставление может необязательно включать определение концентрации каждого из множества маркеров и индивидуальное сравнение концентрации каждого маркера с пороговым уровнем. Необязательно, если концентрация маркера выше или ниже порогового уровня (в зависимости от маркера и/или осуществляемого диагностического анализа), концентрацию маркера сопоставляют с заболеванием или состоянием. Необязательно и предпочтительно, концентрации множества маркеров сопоставляют с заболеванием или состоянием.
В альтернативном случае, такое сопоставление может необязательно включать определение концентрации каждого из множества маркеров, вычисление одного значения показателя на основе концентрации каждого из множества маркеров и сравнение значения показателя с пороговым уровнем.
Также, в альтернативном случае, такое сопоставление может необязательно включать определение изменения по времени по меньшей мере одного из маркеров, и при этом изменение по времени используют на этапе сопоставления.
Также, в альтернативном случае, такое сопоставление может необязательно включать определение того, имеет ли по меньшей мере количество "X" из множества маркеров концентрацию за пределами заданного диапазона, и/или выше, или ниже порогового значения (как описано выше). Значение "X" необязательно может быть одним маркером, множеством маркеров или всеми из маркеров, в альтернативном случае или дополнительно, вместо включения любого маркера в подсчет "X", один или несколько специфических маркеров из множества маркеров необязательно могут требоваться для сопоставления с заболеванием или состоянием (в соответствии с диапазоном и/или пороговым значением).
Также в альтернативном случае, такое сопоставление может необязательно включать определение того, находится ли соотношение концентраций маркеров для двух маркеров за пределами диапазона и/или выше или ниже порогового значения. Необязательно, если данное соотношение выше или ниже порогового уровня и/или за пределами диапазона, данное соотношение сопоставляют с заболеванием или состоянием.
Необязательно, комбинацию из двух или более этих сопоставлений можно применять по отношению к одному набору и/или для сопоставления между множеством наборов.
Необязательно, способ обеспечивает различение заболевания или состояния с чувствительностью по меньшей мере 70% при специфичности по меньшей мере 85% при сравнении со здоровыми субъектами. Как используется в данном документе, чувствительность относится к количеству положительных (полученных от больных) образцов, обнаруженных из общего количества присутствующих положительных образцов; специфичность относится к числу истинно отрицательных (полученных не от больных) образцов, обнаруженных из общего количества присутствующих отрицательных образцов. Предпочтительно способ обеспечивает различение заболевания или состояния с чувствительностью по меньшей мере 80% при специфичности по меньшей мере 90% по сравнению со здоровыми субъектами. Более предпочтительно способ обеспечивает различение заболевания или состояния с чувствительностью по меньшей мере 90% при специфичности по меньшей мере 90% по сравнению со здоровыми субъектами. Кроме того, более предпочтительно, способ обеспечивает различение заболевания или состояния с чувствительностью по меньшей мере 70% при специфичности по меньшей мере 85% по сравнению с субъектами, характеризующимися симптомами, которые имитируют симптомы заболевания или состояния.
Набор маркеров можно анализировать при помощи ряда способов, хорошо известных специалистам в данной области техники. Например, каждый член набора можно сравнить с "нормальным" значением или значением, указывающим на конкретный результат. Конкретный диагноз/прогноз может зависеть от сравнения каждого маркера с этим значением, в альтернативном случае, если только подмножество маркеров находится за пределами нормального диапазона, то это подмножество может указывать на конкретный диагноз/прогноз. Специалисту в данной области техники также будет понятно, что диагностические маркеры, дифференциальные диагностические маркеры, прогностические маркеры, маркеры времени манифестации, маркеры, позволяющие различить заболевания или состояния и т.д., можно объединять в одном анализе или устройстве. Маркеры также можно широко применять для различных целей, например, путем применения разных пороговых значений или разных весовых коэффициентов к маркеру для различных целей.
В одном варианте осуществления наборы содержат маркеры для следующих целей: диагностика заболевания; диагностика заболевания и указание, находится ли заболевание в острой фазе и/или того, что имел место острый приступ заболевания; диагностика заболевания и указание находится ли заболевание в фазе, не являющейся острой и/или того, что имел место приступ заболевания, не являющийся острым; указание того, имело ли место сочетание острой фазы или приступа и фазы или приступа, не являющегося острым; диагностика заболевания и прогноз последующего неблагоприятного исхода; диагностика заболевания и прогноз последующей острой фазы или приступа или фазы или приступа, не являющегося острым; прогрессирование заболевания (например, для рака, такое прогрессирование может включать, например возникновение или рецидив метастазов).
Приведенные выше диагнозы могут также необязательно включать дифференциальную диагностику заболевания для того, чтобы отличить его от других заболеваний, в том числе заболеваний, которые могут характеризоваться одним или несколькими аналогичными или идентичными симптомами.
В некоторых вариантах осуществления один или несколько диагностических или прогностических показателей сопоставляют с состоянием или заболеванием только по наличию или отсутствию данных показателей. В других вариантах осуществления могут быть установлены пороговые уровни диагностических или прогностических показателей, и уровень показателей в образце от пациента можно просто сравнивать с пороговыми уровнями. Чувствительность и специфичность диагностического и/или прогностического анализа зависит не только от аналитического "качества" анализа, при этом они также зависят от определения того, что представляет собой аномальный результат. На практике рабочие характеристические кривые или "ROC"-кривые, как правило, рассчитывают путем построения графика значений переменной в зависимости от ее относительной частоты в "нормальной" и "больной" популяции и/или путем сравнения результатов от субъекта до, во время и/или после лечения.
Согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения белок LY6G6F, VSIG10, ТМЕМ25 и/или LSR, его полинуклеотид или фрагмент можно охарактеризовать в качестве биомаркера для обнаружения заболевания и/или характерного состояния, как подробно описано выше.
Согласно другим вариантам осуществления настоящее изобретение необязательно и предпочтительно охватывает любую аминокислотную последовательность или ее фрагмент, кодируемый последовательностью нуклеиновой кислоты, соответствующей LY6G6F, VSIG10, ТМЕМ25 и/или LSR, как описано в данном документе. Любой олигопептид или пептид, относящийся к такой аминокислотной последовательности или ее фрагменту, необязательно может также (дополнительно или в альтернативном случае) использоваться в качестве биомаркера.
В других вариантах осуществления настоящее изобретение обеспечивает способ обнаружения полинуклеотида по настоящему изобретению в биологическом образце с применением анализа на основе NAT, включающего гибридизацию выделенных молекул нуклеиновой кислоты или олигонуклеотидных фрагментов по меньшей мере минимальной длины с материалом на основе нуклеиновой кислоты из биологического образца и обнаружение комплекса гибридизации; при этом присутствие комплекса гибридизации сопоставляют с присутствием полинуклеотида в биологическом образце. Неограничивающие примеры способов или анализов описаны ниже.
Настоящее изобретение также относится к наборам, основанным на таких способах диагностики или анализа. Также объем настоящего изобретения охватывает наборы, содержащие белок LY6G6F, VSIG10, ТМЕМ25 и/или LSR или конъюгаты LY6G6F, VSIG10, ТМЕМ25 и/или LSR, или композиции антител по настоящему изобретению (например, человеческие антитела, биспецифические или мультиспецифические молекулы или иммуноконъюгаты) и инструкции для применения. Набор может дополнительно содержать один или несколько дополнительных реагентов, таких как иммуносупрессивный реагент, цитотоксическое средство или радиотоксическое средство, или одно или несколько дополнительных человеческих антител согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения (например, человеческое антитело, обладающее дополняющей активностью, которое связывается с эпитопом на антигене, отличным от такового для первого человеческого антитела).
АНАЛИЗЫ НА ОСНОВЕ ТЕХНОЛОГИИ НУКЛЕИНОВЫХ КИСЛОТ (NAT)
Обнаружение нуклеиновой кислоты, представляющей интерес, в биологическом образце необязательно можно осуществлять с помощью анализов на основе NAT, которые предусматривают технологии амплификации нуклеиновых кислот, такие как ПЦР, например (или ее варианты, такие как ПЦР в реальном времени, например). Используемое в данном документе выражение "праймер" определяет олигонуклеотид, способный комплементарно соединяться (гибридизироваться) с целевой последовательностью, что тем самым образует двухцепочечный участок, который может служить в качестве сайга инициации синтеза ДНК при подходящих условиях. Амплификацию выбранной или целевой последовательности нуклеиновой кислоты можно осуществлять с помощью ряда подходящих способов, известных в данной области техники. Неограничивающие примеры методик амплификации включают полимеразную цепную реакцию (ПЦР), лигазную цепную реакцию (LCR), амплификацию с замещением цепи (SDA), амплификацию на основе транскрипции, репликазную систему q3 и NASBA (Kwoh et al., 1989, Proc. Natl. Acad. Sci. USA 86, 1173-1177; Lizardi et al., 1988, BioTechnology 6:1197-1202; Malek et al., 1994, Methods Mol. Biol, 28:253-260 и Sambrook et al., 1989, выше). Неограничивающие примеры анализа на основе технологии нуклеиновых кислот выбраны из группы, состоящей из ПЦР, ПЦР в реальном времени, LCR, самоподдерживающейся синтетической реакции, Q-бета репликазы, реакции циклирующего зонда, разветвленной ДНК, RFLP-анализа, DGGE/TGGE, однонитевого конформационного полиморфизма, дидезоксифингерпринтинга, микроматриц, флуоресцентной in situ гибридизации и сравнительной геномной гибридизации. Выражение "амплификационная пара" (или "пара праймеров") относится в данном документе к паре олигонуклеотидов (олиго) по настоящему изобретению, которые выбраны для совместного использования при амплификации выбранной последовательности нуклеиновой кислоты посредством одного из нескольких типов процессов амплификации, предпочтительно полимеразной цепной реакции. Как известно в данной области техники, олиго предназначены для связывания с комплементарной последовательностью при выбранных условиях. В одном конкретном варианте осуществления амплификацию образца нуклеиновой кислоты от пациента осуществляют в условиях, которые способствуют амплификации наиболее распространенной неодинаково экспрессируемой нуклеиновой кислоты. В одном предпочтительном варианте осуществления осуществляют RT-PCR на образце мРНК от пациента при условиях, которые способствуют амплификации наиболее распространенной мРНК. В другом предпочтительном варианте осуществления амплификацию неодинаково экспрессируемых нуклеиновых кислот осуществляют одновременно. Специалисту в данной области техники будет понятно, что такие способы можно адаптировать для обнаружения неодинаково экспрессируемых белков вместо неодинаково экспрессируемых последовательностей нуклеиновых кислот. Нуклеиновую кислоту (т.е. ДНК или РНК) для осуществления настоящего изобретения можно получить согласно хорошо известным способам.
Олигонуклеотидные праймеры по настоящему изобретению могут иметь любую подходящую длину в зависимости от конкретного формата анализа и конкретных потребностей и применяемых целевых геномов. Необязательно олигонуклеотидные праймеры составляют по меньшей мере 12 нуклеотидов в длину, предпочтительно от 15 до 24 молекул, и их можно адаптировать так, чтобы они наилучшим образом подходили для выбранной системы амплификации нуклеиновой кислоты. Как известно в данной области техники, олигонуклеотидные праймеры можно сконструировать с учетом точки плавления их гибридизации с целевой последовательностью (Sambrook et al., 1989, Molecular Cloning -A Laboratory Manual, 2nd Edition, CSH Laboratories; Ausubel et al., 1989, в Current Protocols in Molecular Biology, John Wiley & Sons Inc., N.Y.).
ИММУНОЛОГИЧЕСКИЕ АНАЛИЗЫ
В другом варианте осуществления настоящего изобретения иммунологический анализ можно применять для качественного или количественного обнаружения и анализа маркеров в образце. Этот способ включает обеспечение антитела, которое специфически связывается с маркером; приведение в контакт образца с антителом и обнаружение присутствия комплекса антитела, связанного с маркером, в образце.
Для того чтобы получить антитело, которое специфически связывается с маркером, можно использовать очищенные белковые маркеры. Антитела, которые специфически связываются с белковым маркером, можно получить с использованием любых подходящих способов, известных в данной области техники.
После обеспечения антитела маркер можно обнаружить и/или оценить количественно с использованием любого из ряда общепризнанных иммунологических анализов связывания. Пригодные анализы включают, например, иммуноферментный анализ (EIA), такой как ферментный иммуносорбентный анализ (ELISA), радиоиммунный анализ (RIA), вестерн-блоттинг или слот-блоттинг, см., например, патенты США №№4366241, 4376110, 4517288 и 4837168. Как правило, образец, полученный от субъекта, можно привести в контакт с антителом, которое специфически связывается с маркером.
Необязательно антитело можно фиксировать на твердой подложке для облегчения отмывки и последующего выделения комплекса перед приведением в контакт антитела с образцом. Примеры твердых подложек включают, но без ограничения, стекло или пластик в форме, например, микротитровального планшета, стержня, гранулы или микрогранулы. Антитела также можно прикреплять к твердой подложке.
После инкубирования образца с антителами смесь промывают и можно обнаружить образованный комплекс антитело-маркер. Это можно осуществлять путем инкубирования промытой смеси с реагентом для обнаружения. В альтернативном случае, маркер в образце можно обнаружить с помощью непрямого анализа, в котором, например, используют второе меченое антитело для обнаружения связанного маркер-специфического антитела, и/или в анализе конкурентного связывания или ингибирования, в котором, например, моноклональное антитело, которое связывается с отличающимся эпитопом маркера, инкубируют одновременно со смесью.
Во время проведения анализов этапы инкубирования и/или промывки могут потребоваться после каждой комбинации реагентов. Этапы инкубирования могут варьировать от приблизительно 5 секунд до нескольких часов, предпочтительно от приблизительно 5 минут до приблизительно 24 часов. Однако время инкубирования будет зависеть от формата анализа, маркера, объема раствора, концентраций и т.п. Обычно анализы будут осуществляться при температуре окружающей среды, хотя они их можно проводить при широком диапазоне температур, таком как от 10°С до 40°С.
Иммунологический анализ можно применять для определения измеряемого количества маркера в образце от субъекта. Во-первых, измеряемое количество маркера в образце можно обнаружить с помощью способов иммунологического анализа, описанных выше. Если маркер присутствует в образце, он образует комплекс антитело-маркер с антителом, которое специфически связывается с маркером при подходящих условиях инкубирования, описанных выше. Количество комплекса антитело-маркер необязательно можно определить при помощи сравнения со стандартом. Как отмечалось выше, измеряемое количество маркера не нужно измерять в абсолютных единицах при условии, что единицу измерения можно сравнить с контрольным количеством и/или сигналом.
Радиоиммуноанализ (RIA). В одном из вариантов этот способ предусматривает осаждение желаемого субстрата, а также в способах, подробно описанных в данном документе ниже, со специфическим антителом и антитело-связывающим белком с радиоактивной меткой (например, белок А, меченый при помощи I125), иммобилизованным на осаждаемом носителе, таком как гранулы агарозы. Количество сигналов от осажденных гранул является пропорциональным количеству субстрата.
В альтернативном варианте RIA применяют меченый субстрат и немеченый антитело-связывающий белок. Образец, содержащий неизвестное количество субстрата, добавляют в различных количествах. Уменьшение сигналов от осадка из меченого субстрата пропорционально количеству субстрата в добавленном образце.
Ферментный иммуносорбентный анализ (ELISA). Этот способ предусматривает фиксацию образца (например, фиксированные клетки или белковый раствор), содержащего белковый субстрат, на поверхности, такой как лунки планшета для микротитрования. Применяют субстрат-специфическое антитело, связанное с ферментом, и позволяют ему связаться с субстратом. Затем присутствие антитела обнаруживают и количественно оценивают при помощи колориметрической реакции с использованием фермента, связанного с антителом. Ферменты, обычно используемые в данном способе, включают пероксидазу хрена и щелочную фосфатазу. При хорошей калибровке и в пределах линейного диапазона ответа количество субстрата, присутствующего в образце, пропорционально количеству полученного окрашивания. Стандарт субстрата обычно используют для улучшения количественной точности.
Вестерн-блоттинг. Этот способ предусматривает отделение субстрата от других белков при помощи акриламидного геля с последующим переносом субстрата на мембрану (например, найлон или PVDF). Присутствие субстрата затем обнаруживают при помощи антител, специфических к субстрату, которые, в свою очередь обнаруживают при помощи антитело-связывающих реагентов. Антитело-связывающие реагенты, например, могут представлять собой белок А или другие антителами. Антитело-связывающие реагенты могут быть с радиоактивной меткой или связанными с ферментом, как описано в данном документе выше. Обнаружение может быть с помощью авторадиографии, колориметрической реакции или хемилюминесценции. Этот способ обеспечивает как количественную оценку количества субстрата, так и определение его идентичности по относительному положению на мембране, которое является показателем расстояния миграции в акриламидном геле при электрофорезе.
Иммуногистохимический анализ. Этот способ предусматривает обнаружение субстрата in situ в фиксированных клетках с помощью субстрат-специфических антител. Субстрат-специфические антитела могут быть связанными с ферментом или связанными с флуорофорами. Обнаружение осуществляют посредством микроскопии и субъективной оценки. Если используют антитела, связанные с ферментом, может требоваться колориметрическая реакция.
Сортировка клеток с активированной флуоресценцией (FACS). Этот способ предусматривает обнаружение субстрата in situ в клетках с помощью субстрат-специфических антител. Субстрат-специфические антитела связаны с флуорофорами. Обнаружение осуществляют с помощью прибора для сортировки клеток, который считывает длину волны излучения, испускаемого каждой клеткой, когда она проходит через световой пучок. При этом способе можно использовать два или более антител одновременно.
РАДИОЛОГИЧЕСКИЕ СПОСОБЫ ВИЗУАЛИЗАЦИИ
Эти способы включают, но без ограничения, позитронно-эмиссионную томографию (PET), однофотонную эмиссионную компьютерную томографию (SPECT). Обе из этих методик являются неинвазивными и их можно применять для обнаружения и/или измерения разнообразных процессов в ткани и/или функций, таких как обнаружение раковых клеток, например. В отличие от PET, SPECT необязательно можно применять с двумя метками одновременно. SPECT имеет некоторые другие преимущества, например, что касается стоимости и типов меток, которые можно применять. Например, в патенте США №6696686 описывается применение SPECT для обнаружения рака молочной железы, и он включен в данный документ при помощи ссылки, как если бы он был полностью изложен в данном документе.
ТЕРАНОСТИКА
Выражение тераностика описывает применение диагностического тестирования для диагностики заболевания, выбора правильной схемы лечения в соответствии с результатами диагностического тестирования и/или контроля реакции пациента на терапию в соответствии с результатами диагностического тестирования. Тераностические тесты можно применять по отношению к пациентам для выбора лечения, которое вероятно будет для них благоприятным и маловероятно приведет к побочным эффектам. Они также могут обеспечить ранние и объективные показатели эффективности лечения у отдельных пациентов, так что (при необходимости) лечение можно изменить с минимальным промедлением. Например: DAKO и Genentech совместно создали HercepTest и герцептин (трастузумаб) для лечения рака молочной железы, причем первый тераностический тест был утвержден одновременно с новым терапевтическим лекарственным средством. В дополнение к HercepTest (который представляет собой иммуногистохимический тест), разрабатывают другие тераностические тесты, в которых применяют традиционные анализы клинической химии, иммунологические анализы, клеточные технологии и исследования нуклеиновых кислот. PPGx недавно разработала тест с использованием ТРМТ (тиопурин-S-метилтрансфераза), который позволяет врачам выявлять пациентов с риском развития потенциально летальных неблагоприятных реакций на 6-меркаптопурин, являющийся средством, используемым при лечении лейкоза. Кроме того, Nova Molecular впервые ввела SNP-генотипирование гена аполипопротеина Е для прогноза реакции пациентов с болезнью Альцгеймера на холиномиметическую терапию, и в настоящее время это широко используется в клинических испытаниях новых лекарственных средств по отношению к этому показанию. Таким образом, область тераностики представляет собой пересечение информации из диагностического тестирования, при помощи которой предсказывается реакция пациента на лечение, с выбором соответствующего лечения для конкретного пациента.
СУРРОГАТНЫЕ МАРКЕРЫ
Суррогатный маркер является маркером, который обнаруживают в лаборатории и/или по физическим признакам или симптомам у пациента, и который используют в испытаниях терапевтических средств в качестве замены клинически значимого ожидаемого результата. Суррогатным маркером является непосредственное измерение того, как пациент себя чувствует, его жизненно важные функции или выживание, что, как ожидается, будет предсказывать эффект терапии. Потребность в суррогатных маркерах, главным образом, возникает тогда, когда такие маркеры можно измерять раньше, с большим удобством или чаще, чем ожидаемые результаты, представляющие интерес в том, что касается эффекта лечения по отношению к пациенту, которые называют клиническими ожидаемыми результатами. В идеальном варианте, суррогатный маркер должен быть биологически приемлемым, предиктивным относительно прогрессирования заболевания и измеримым с помощью стандартизированных анализов (включая, но без ограничения, традиционную клиническую химию, иммунологический анализ, клеточные технологии, исследования нуклеиновых кислот и способы визуализации).
Терапевтические композиции (например, человеческие антитела, мультиспецифические и биспецифические молекулы и иммуноконъюгаты) согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, которые имеют сайты связывания комплемента, такие как участки из IgG1, -2 или -3, или IgM, которые связывают комплемент, также можно применять в присутствии комплемента. В одном варианте осуществления обработку ex vivo популяции клеток, содержащей клетки-мишени, средством для связывания согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения и соответствующими эффекторными клетками можно дополнить путем добавления комплемента или сыворотки, содержащей комплемент. Фагоцитоз клеток-мишеней, покрытых связывающим средством согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения, можно улучшить путем связывания белков комплемента. В другом варианте осуществления клетки-мишени, покрытые композициями (например, человеческие антитела, мультиспецифические и биспецифические молекулы) согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения также могут быть лизированы при помощи комплемента. В еще одном варианте осуществления композиции согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения не активируют комплемент.
Терапевтические композиции (например, человеческие антитела, мультиспецифические и биспецифические молекулы и иммуноконъюгаты) согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения также можно вводить вместе с комплементом. Таким образом, согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения обеспечиваются композиции, содержащие человеческие антитела, мультиспецифические или биспецифические молекулы и сыворотку или комплемент. Эти композиции обладают тем преимуществом, что комплемент расположен в непосредственной близости от человеческих антител, мультиспецифических или биспецифических молекул. В альтернативном случае, человеческие антитела, мультиспецифические или биспецифические молекулы согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения и комплемент или сыворотку можно вводить отдельно.
Настоящее изобретение дополнительно проиллюстрировано следующими примерами. Эта информация и примеры являются иллюстративными, и их не следует толковать как дополнительное ограничение. Содержимое всех фигур и всех ссылок, патентов и опубликованных патентных заявок, цитируемых в данной заявке, явным образом включено в данный документ при помощи ссылки.
ПРИМЕРЫ
ПРИМЕР 1:
Паттерн экспрессии белков согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения с использованием исследовательского движка MED:
MED является проприетарной программной платформой для сбора общедоступных данных о генной экспрессии, нормирования, аннотирования и выполнения различных запросов. Данные об экспрессии на основании наиболее широко используемых микроматриц Affymetrix загружают из Gene Expression Omnibus (GEO - www.ncbi.nlm.nih.gov/GEO). Данные мультипликативно нормируют путем установления постоянного значения для 95 процентили (нормированная экспрессия = 1200) и шум отфильтровывают путем установления значения 0 для нижних 30%. Эксперименты аннотируют, сначала автоматически, а затем вручную для идентификации ткани и состояния, и чипы группируют в соответствии с этой аннотацией, и проводят перекрестную проверку этой группировки путем сравнения общего паттерна экспрессии генов каждого чипа с общим средним паттерном экспрессии генов в этой группе. Каждому набору зондов в каждой группе присваивают значение экспрессии, которое является медианой значений экспрессии этого набора зондов во всех чипах, включенных в группу. Вектор экспрессии всех наборов зондов в пределах определенной группы образует виртуальный чип этой группы, а совокупность всех таких виртуальных чипов составляет виртуальную панель. Панели (или суб-панели) можно запрашивать для идентификации наборов зондов с требуемыми характеристиками (например, специфическая экспрессия в подгруппе тканей или дифференциальная экспрессия в больных и здоровых тканях). Эти наборы зондов связывают с контигами LEADS и с RefSeqs (http://www.ncbi.nlm.nih.gov/RefSeq/) посредством картирования на уровне зондов для дальнейшего анализа.
Загружаемые платформы Affymetrix представляют собой семейство HG-U95A и HG-U133 (А, В, А2.0 и PLUS 2.0). Были созданы три виртуальные панели: U95 и U133 Plus 2.0 на основе соответствующих платформ Affymetrix, а также U133, которая использует набор из общеизвестных наборов зондов для HG-U133A, HG-U133A2.0 и HG-U133 PLUS 2.0+.
Результаты, полученные с исследовательским движком MED, представлены на диаграммах рассеяния. Диаграмма рассеяния служит кратким представлением данной панели (совокупности групп). Ось у представляет собой (нормированную) экспрессию, и ось x описывает группы в панели. Для каждой группы медианная экспрессии представлена маркером в виде геометрической фигуры, а значения экспрессии для различных чипов в группе представлены небольшими черточками ("-"). Группы упорядочены и помечены следующим образом - группы "Другие" (например, доброкачественные, заболевания, не являющиеся раковыми и т.д.) помечены треугольником. Обработанные клетки помечены квадратом. Нормальные помечены кругом. Совпадающие помечены крестом, и Раковые помечены ромбом. Количество чипов в каждой группе также написано рядом с ее названием.
Исследовательский движок MED применяли для оценки экспрессии транскриптов VSIG10. Данные экспрессии для наборов зондов Affymetrix 220137_at, представляющие данные для гена VSIG10, показаны на Фигуре 3 (для всех фигур, связанных с исследовательским движком MED, проводили разделение на "А", "В" и т.д. только по причине места, чтобы иметь возможность показать результаты для всех зондов). Как очевидно из диаграммы рассеяния, представленной на Фигуре 3, экспрессию транскриптов VSIG10, обнаруживаемых с помощью указанных выше наборов зондов, наблюдали в нескольких группах клеток иммунной системы, в основном, в лейкоцитах. При различных состояниях, связанных с раком, наблюдали отличающуюся экспрессию, например, в лейкоцитах CD10+ из ALL (острого лимфобластного лейкоза) и клетках ВМ-CD34+ из клеток AML (острого миелоидного лейкоза).
На Фигуре 3 показана диаграмма рассеяния, демонстрирующая экспрессию транскриптов VSIG10, кодирующих белки VSIG10, на виртуальной панели всех тканей и состояний с использованием исследовательского движка MED.
Исследовательский движок MED применяли для оценки экспрессии транскриптов LSR. Данные экспрессии для наборов зондов Affymetrix 208190_s_at, представляющие данные гена LSR, показаны на Фигуре 4. Как очевидно из диаграммы рассеяния, представленной на Фигуре 4, экспрессию транскриптов LSR, обнаруживаемых с указанными выше наборами зондов, наблюдали в нескольких группах клеток иммунной системы, в основном, в клетках костного мозга. Высокая экспрессия транскриптов LSR наблюдалась также при состояниях, связанных с раком различных тканей, таких как формы рака молочной железы, легких, яичников, поджелудочной железы, простаты и кожи.
На Фигуре 4 показана диаграмма рассеяния, демонстрирующая экспрессию транскриптов LSR, которые кодируют белки LSR, на виртуальной панели всех тканей и состояний с использованием исследовательского движка MED.
ПРИМЕР 2
СПОСОБЫ, ПРИМЕНЯЕМЫЕ ДЛЯ АНАЛИЗА ЭКСПРЕССИИ РНК, КОДИРУЮЩЕЙ БЕЛКИ LY6G6F, VSIG10, ТМЕМ25 И/ИЛИ LSR
Мишени согласно по меньшей мере некоторым вариантам осуществления настоящего изобретения тестировали в отношении их экспрессии в различных образцах раковых тканей и тканей, не являющихся раковыми. Описание образцов, использованных в панели тестирования рака яичников, представлено в Таблице 1 ниже. Описание образцов, использованных в панели тестирования рака молочной железы, представлено в Таблице 2 ниже. Описание образцов, использованных в панели тестирования рака легких, представлено в Таблице 3. Описание образцов, использованных в панели тестирования здоровых тканей, представлено в Таблице 4. Описание образцов, использованных в панели тестирования рака почек, представлено в Таблице 5. Описание образцов, использованных в панели тестирования рака печени, представлено в Таблице 6. Затем проводили тесты, как описано в разделе Материалы и методы ниже.
Материалы и методы
Получение РНК - РНК получили от ABS (Вилмингтон, Делавэр 19801, США, http://www.absbioreagents.com), BioChain Inst. Inc. (Хейуорд, Калифорния 94545 США, www.biochain.com), GOG для образцов яичников - Педиатрического отделения Объединенной сети человеческих тканей (Pediatic Cooperative Human Tissue Network), Банка тканей гинекологической онкологической группы (Gynecologic Oncology Group Tissue Bank), Детского госпиталя Колумбуса (Children Hospital of Columbus) (Колумбус, Оклахома 43205 США), Ambion (Остин, Техас 78744 США, http://www.ambion.com), Analytical Biological Services Inc. (Уилмингтон, Делавэр 19801 США, www.absbioreagents.com), Asternad (Детройт, Мичиган 48202-3420, США, www.asterand.com), Genomics Collaborative Inc., подразделение Seracare (Кэмбридж, Массачуссетс, 02139, США, www.genomicsinc.com), медицинского центра Сураски больницы Ихилов Тель-Авива (The Tel Aviv Sourasky Medical Center Ichilov Hospital) (Тель-Авив, Израиль, www.tasmc.org.il/e/) и из медицинского центра им. Хаима Шиба (The Chaim Sheba Medical Center) (Тель-ха-Шомер, Израиль, eng.sheba.co.il). Образцы РНК получали от пациентов или посмертные. Все образцы общей РНК обрабатывали с помощью DNaseI (Ambion).
RT-PCR для панели яичников, почек и здоровых образцов - 10 мкг очищенной РНК смешивали со случайными гексамерными праймерами (Applied Biosystems, согласно инструкции производителя), 4 мМ dNTP, 12,5 мкл 10Х буфера MultiScribe™ (Applied Biosystems), 6 мкл (50 Ед/мкл) RNasin (Promega) и 6 мкл (50 Ед/мкл) MultiScribe (Applied Biosystems) в общем объеме 125 мкл. Реакционную смесь инкубировали в течение 10 минут при 25°C с последующим дополнительным инкубированием при 37°С в течение 2 часов. Затем смесь инактивировали при 85°С в течение 5 секунд. Полученную кДНК разбавляли 1:10-1:40 (в зависимости от калибровки панели) в буфере ТЕ (10 мМ Tris, рН 8; 1 мМ EDTA, рН 8).
Анализ RT-PCR в реальном времени проводили, как описано ниже - кДНК (5 мкл), полученной как описано выше, использовали в качестве матрицы для реакций ПЦР в реальном времени (конечный объем 20 мкл) с применением анализа SYBR Green I (РЕ Applied Biosystems) со специфическими праймерами и ферментом UNG (Eurogentech или ABI или Roche). Амплификацию осуществляли следующим образом: 50°С в течение 2 минут, 95°С в течение 10 минут, затем 40 циклов из 95°С в течение 15 секунд, затем 60°С в течение 30 секунд, с последующим этапом диссоциации. Обнаружение проводили с применением РЕ Applied Biosystem SDS 7000. Цикл, при котором реакционные смеси достигали порогового уровня флуоресценции (Ct = пороговый цикл, подробно описанный ниже), регистрировали и использовали для вычисления относительного количества транскриптов в реакциях RT. Относительное количество рассчитывали с помощью уравнения Q = эффективность^-Ct. Эффективность реакции ПЦР рассчитывали по стандартной кривой, созданной с использованием различных разведении из нескольких реакций обратной транскрипции (RT). Для минимизации внутренних различий в реакции RT полученные относительные количества нормировали с помощью нормировочного множителя, рассчитываемого следующим образом.
Экспрессию нескольких генов "домашнего хозяйства" (HSKP) проверяли в каждой панели. Относительное количество (Q) каждого гена "домашнего хозяйства" в каждом образце, рассчитанное, как описано выше, поделили на медианное количество этого гена в образцах всех панелей для получения "относительного Q относительно MED". Затем для каждого образца рассчитывали медиану "относительного Q относительно MED" выбранных генов "домашнего хозяйства" и использовали в качестве нормировочного множителя этого образца для дальнейших расчетов.
Для каждого образца RT экспрессию специфического ампликона нормировали по нормировочному множителю, рассчитанному на основании экспрессии различных генов "домашнего хозяйства". Гены "домашнего хозяйства" (HSKG), используемые для панелей для яичников, почек, легких, печени, молочной железы и здоровых тканей, приведены в Таблице 7.
HSKG, которые использовали для калибровки панелей яичников и здоровых образцов: HPRT1, SDHA и G6PD; гены HSKP, использованные для калибровки панелей почек и печени: G6PD, PBGD и SDHA; гены HSKP, использованные для калибровки панели легких: UBC, PBGD, HPRT и SDHA; гены HSKP, использованные для калибровки панели молочной железы: G6PD, PBGD, RPL19 и SDHA;

















Специфические праймеры и ампликоны, использованные для анализа экспрессии транскриптов LSR, представлены в Таблице 8.


Специфические праймеры и ампликоны, использованные для анализа экспрессии транскриптов ТМЕМ25, представлены в Таблице 9.

Данные об экспрессии ампликона LSR_seg24-36_200-309/310 (SEQ ID: 140) описаны в Примерах 3-9 ниже.
ПРИМЕР 3
ЭКСПРЕССИЯ ТРАНСКРИПТОВ LSR_, КОТОРЫЕ ОБНАРУЖИВАЮТСЯ С ПОМОЩЬЮ АМПЛИКОНА, ИЗОБРАЖЕННОГО В ПОСЛЕДОВАТЕЛЬНОСТИ С НАЗВАНИЕМ LSR_SEG24-36_200-309/310, В НОРМАЛЬНЫХ И РАКОВЫХ ТКАНЯХ ЯИЧНИКА
Экспрессию транскриптов LSR, обнаруживаемых с помощью или по LSR_seg24-36_200-309/310_ампликону (SEQ ID: 140) и праймерам LSR_seg24F_200-309 (SEQ ID: 141) и LSR_seg36R_200-310 (SEQ ID: 142), измеряли с помощью ПЦР в реальном времени. Необнаруженным образцам (образец(ы) №28) присвоили значение Ct равное 41 и рассчитывали соответствующим образом. Параллельно измеряли аналогичным образом экспрессию нескольких генов "домашнего хозяйства" - SDHA (SEQ ID: 103) (№ доступа GenBank NM_004168; ампликон - SDHA_ампликон (SEQ ID: 106)), HPRT1 (SEQ ID: 107) (№ доступа GenBank NM_000194; НРРТ1_ампликон (SEQ ID: 110)) и G6PD (SEQ ID: 111) (№ доступа GenBank NM_000402; G6PD_ампликон (SEQ ID: 1114)). Для каждого образца RT экспрессию вышеупомянутого ампликона нормировали по нормировочному множителю, рассчитанному по экспрессии этих генов "домашнего хозяйства", как описано в способе нормирования 2 в разделе "Материалы и методы". Нормированную количественную величину для каждого образца RT затем делили на медиану количественных величин нормальных образцов (номера образцов 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63 и 64, Таблица 1 выше), чтобы получить значение кратности активации для каждого образца относительно медианы нормальных образцов.
Фигура 12 представляет собой гистограмму, показывающую сверхэкспрессию указанных выше транскриптов LSR в образцах рака яичника по сравнению с нормальными образцами.
Как очевидно из Фигуры 12, экспрессия транскриптов LSR, обнаруживаемых с помощью вышеуказанного ампликона в образцах серозной карциномы, коллоидного рака и аденокарциномы, была значительно выше, чем в образцах тканей, не являющихся раковыми (номера образцов 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63 и 64, Таблица 1 выше). Примечательно, что по меньшей мере 5-кратную сверхэкспрессию обнаружили в 21 из 27 образцов серозной карциномы, в 7 из 9 образцов коллоидного рака и в 7 из 8 образцов эндометриоидной карциномы.
Для проверки значимости этих результатов применяли статистический анализ, описываемый ниже.
Р-значение для отличия в уровнях экспрессии транскриптов LSR, обнаруживаемых с помощью вышеупомянутого ампликона в образцах серозной карциномы яичника по сравнению с образцами нормальной ткани, определили с помощью Т-теста как 2,22е-002. Р-значение для отличия в уровнях экспрессии транскриптов LSR, обнаруживаемых с помощью вышеупомянутого ампликона в образцах коллоидного рака яичника по сравнению с образцами нормальной ткани, определили с помощью Т-теста как 6,84е-004. Р-значение для отличия в уровнях экспрессии транскриптов LSR, обнаруживаемых с помощью вышеупомянутого ампликона в образцах эндометриоидной карциномы яичника по сравнению с образцами нормальной ткани, определили с помощью Т-теста как 4,61е-003. Р-значение для отличия в уровнях экспрессии транскриптов LSR, обнаруживаемых с помощью вышеупомянутого ампликона в образцах аденокарциномы яичника по сравнению с образцами нормальной ткани, определили с помощью Т-теста как 5,68е-004.
Обнаружили, что порог 5-кратной сверхэкспрессии разграничивает образцы серозной карциномы и нормальные образцы с Р-значением 2,59Е-009, как установлено с помощью точного критерия Фишера. Обнаружили, что порог 5-кратной сверхэкспрессии разграничивает образцы коллоидного рака и нормальные образцы с Р-значением 8,43е-006, как установлено с помощью точного критерия Фишера. Обнаружили, что порог 5-кратной сверхэкспрессии разграничивает образцы эндометриоидной карциномы и нормальные образцы с Р-значением 2,38е-006, как установлено с помощью точного критерия Фишера. Обнаружили, что порог 5-кратной сверхэкспрессии разграничивает образцы аденокарциномы и нормальные образцы с Р-значением 7,28е-012, как установлено с помощью точного критерия Фишера.
Указанные значения демонстрируют статистическую значимость результатов.
Пары праймеров также необязательно и предпочтительно охватываются настоящим изобретением; например, в описанном выше эксперименте следующую пару праймеров использовали только в качестве неограничивающего иллюстративного примера подходящей пары праймеров: LSR_seg24F_200-309 (SEQ ID: 141) и LSR_seg36R_200-310 (SEQ ID: 142).
Настоящее изобретение также предпочтительно охватывает любой ампликон, полученный с применением любой подходящей пары праймеров, например, в описанном выше эксперименте получили следующий ампликон только в качестве неограничивающего иллюстративного примера подходящего ампликона: LSR_seg24-36_200-309/310_ампликон (SEQ ID: 140).
ПРИМЕР 4
ЭКСПРЕССИЯ ТРАНСКРИПТОВ LSR_, КОТОРЫЕ ОБНАРУЖИВАЮТСЯ С ПОМОЩЬЮ АМПЛИКОНА, ИЗОБРАЖЕННОГО В ПОСЛЕДОВАТЕЛЬНОСТИ С НАЗВАНИЕМ LSR_SEG24-36_200-309/310, В НОРМАЛЬНЫХ И РАКОВЫХ ТКАНЯХ МОЛОЧНОЙ ЖЕЛЕЗЫ
Экспрессию транскриптов LSR, обнаруживаемых с помощью или по seg24-36FR-LSR_seg24-36_200-309/310_ампликону (SEQ ID: 140) и праймерам LSR_seg24F_200-309 (SEQ ID: 141) и LSR_seg36R_200-310 (SEQ ID: 142), измеряли с помощью ПЦР в реальном времени. Необнаруженным образцам (образец(ы) №81) присвоили значение Ct равное 41 и рассчитывали соответствующим образом. Параллельно измеряли аналогичным образом экспрессию нескольких генов "домашнего хозяйства" - G6PD (SEQ ID: 111) (№ доступа GenBank NM_000402; G6PD_ампликон), PBGD (SEQ ID: 115) (№ доступа GenBank BC019323; PBGD_ампликон) RPL19 (SEQ ID: 119) (№ доступа GenBank NM_000981RPL19_ампликон) и SDHA (SEQ ID: 103) (№ доступа GenBank NM_004168SDHA_ампликон). Для каждого образца RT экспрессию вышеупомянутого ампликона нормировали по нормировочному множителю, рассчитанному по экспрессии этих генов "домашнего хозяйства", как описано в способе нормирования 2 в разделе "Материалы и методы". Нормированную количественную величину каждого образца RT затем делили на медиану количественных величин нормальных образцов (номера образцов 43, 45, 46, 47, 48, 49, 50, 51, 52, 54, 56, 58, 59, 60, 61, 62, 63, 64, 66, 67, 68 и 69, Таблица 2 выше), чтобы получить значение кратности активации для каждого образца относительно медианы нормальных образцов.
Фигура 13 представляет собой гистограмму, показывающую сверхэкспрессию указанных выше транскриптов LSR в образцах рака молочной железы по сравнению с нормальными образцами.
Как очевидно из Фигуры 13, экспрессия транскриптов LSR, обнаруживаемых с помощью вышеуказанного ампликона в образцах рака, была выше, чем образцах тканей, не являющихся раковыми (номера образцов 43, 45, 46, 47, 48, 49, 50, 51, 52, 54, 56, 58, 59, 60, 61, 62, 63, 64, 66, 67, 68 и 69, Таблица 2 выше). Примечательно, по меньшей мере 5-кратная сверхэкспрессию обнаружили в 9 из 53 образцов аденокарциномы.
Пары праймеров также необязательно и предпочтительно охватываются настоящим изобретением; например, в описанном выше эксперименте следующие пары праймеров использовали только в качестве неограничивающего иллюстративного примера подходящей пары праймеров: LSR_seg24F_200-309 (SEQ ID: 141) и LSR_seg36R_200-310 (SEQ ID: 142).
Настоящее изобретение также предпочтительно охватывает любой ампликон, полученный с применением любой подходящей пары праймеров, например, в описанном выше эксперименте получили следующий ампликон только в качестве неограничивающего иллюстративного примера подходящего ампликона: LSR_seg24-36 200-309/310 ампликон (SEQ ID: 140).
ПРИМЕР 5
ЭКСПРЕССИЯ ТРАНСКРИПТОВ LSR_, КОТОРЫЕ ОБНАРУЖИВАЮТСЯ С ПОМОЩЬЮ АМПЛИКОНА, ИЗОБРАЖЕННОГО В ПОСЛЕДОВАТЕЛЬНОСТИ С НАЗВАНИЕМ LSR_SEG24-36_200-309/310, В НОРМАЛЬНЫХ И РАКОВЫХ ТКАНЯХ ЛЕГКИХ
Экспрессию транскриптов LSR, обнаруживаемых с помощью или по seg24-36FR-LSR_seg24-36_200-309/310_ампликону (SEQ ID: 140) и праймерам LSR_seg24F_200-309 (SEQ ID: 141) и LSR_seg36R_200-310 (SEQ ID: 142), измеряли с помощью ПЦР в реальном времени. Параллельно измеряли аналогичным образом экспрессию нескольких генов "домашнего хозяйства" - HPRT1 (SEQ ID: 107) (№ доступа GenBank NM_000194 HPRT1_ампликон (SEQ ID: 110)), PBGD (SEQ ID: 115) (№ доступа GenBank BCO 19323; PBGD_ампликон (SEQ ID: 118)), SDHA (SEQ ID: 103) (№ доступа GenBank NM_004168; SDHA_ампликон (SEQ ID: 106)) и убиквитина (SEQ ID: 133) (№ доступа GenBank BC000449; убиквитин_ампликон (SEQ ID: 136)). Для каждого образца RT экспрессию вышеупомянутого ампликона нормировали по нормировочному множителю, рассчитанному по экспрессии этих генов "домашнего хозяйства", как описано в способе нормирования 2 в разделе "Материалы и методы". Нормированную количественную величину каждого образца RT затем делили на медиану количественных величин нормальных образцов (номера образцов 51, 52, 53, 54, 56, 57, 58, 59, 60, 61, 62, 63, 64, 69 и 70, Таблица 3 выше), чтобы получить значение кратности активации для каждого образца относительно медианы нормальных образцов.
Фигура 14 представляет собой гистограмму, показывающую сверхэкспрессию вышеуказанных транскриптов LSR в образцах рака легкого по сравнению с нормальными образцами.
Как очевидно из Фигуры 14, экспрессия транскриптов LSR, обнаруживаемых с помощью вышеуказанного ампликона в образцах аденокарциномы и немелкоклеточного рака, была значительно выше, чем в образцах тканей, не являющихся раковыми (номера образцов 51, 52, 53, 54, 56, 57, 58, 59, 60, 61, 62, 63, 64, 69 и 70, Таблица 3 выше), и в нескольких образцах плоскоклеточного рака была выше, чем в образцах тканей, не являющихся раковыми. Примечательно, что по меньшей мере 5-кратную сверхэкспрессия обнаружили в 7 из 15 образцов аденокарциномы, в 3 из 18 образцов плоскоклеточного рака ив 10 из 40 образцов немелкоклеточного рака.
Для проверки значимости этих результатов применяли статистический анализ, описываемый ниже.
Р-значение для отличия в уровнях экспрессии транскриптов рецепторов липопротеинов, стимулируемых липолизом, Homo sapiens, обнаруживаемых с помощью вышеупомянутого ампликона в образцах аденокарциномы легких по сравнению с образцами нормальной ткани, определили с помощью Т-теста как 2,98е-005. Р-значение для отличия в уровнях экспрессии транскриптов LSR, обнаруживаемых с помощью вышеупомянутого ампликона в образцах плоскоклеточной карциномы легких по сравнению с образцами нормальной ткани, определили с помощью Т-теста как 7,42е-003. Р-значение для отличия в уровнях экспрессии транскриптов рецепторов липопротеинов, стимулируемых липолизом. Homo sapiens, обнаруживаемых с помощью вышеупомянутого ампликона в образцах крупноклеточного рака легких по сравнению с образцами нормальной ткани, определили с помощью Т-теста как 1,76е-002. Р-значение для отличия в уровнях экспрессии транскриптов рецепторов липопротеинов, стимулируемых липолизом. Homo sapiens, обнаруживаемых с помощью вышеупомянутого ампликона в образцах мелкоклеточного рака легких по сравнению с образцами нормальной ткани, определили с помощью Т-теста как 4,35е-002. Р-значение для отличия в уровнях экспрессии транскриптов рецепторов липопротеинов, стимулируемых липолизом. Homo sapiens, обнаруживаемых с помощью вышеупомянутого ампликона в образцах немелкоклеточного рака легких по сравнению с образцами нормальной ткани, определили с помощью Т-теста как 4,31e-006.
Обнаружили, что порог 5-кратной сверхэкспрессии разграничивает образцы аденокарциномы и нормальные образцы со значением 3,16е-003, как установлено с помощью точного критерия Фишера. Обнаружили, что порог 5-кратной сверхэкспрессии разграничивает образцы немелкоклеточного рака и нормальные образцы со значением 2,90е-002, как установлено с помощью точного критерия Фишера.
Указанные значения демонстрируют статистическую значимость результатов.
Пары праймеров также необязательно и предпочтительно охватываются настоящим изобретением; например, в описанном выше эксперименте следующую пару праймеров использовали только в качестве неограничивающего иллюстративного примера подходящей пары праймеров: LSR_seg24F_200-309 (SEQ ID: 141) и LSR_seg36R_200-310 (SEQ ID: 142).
Настоящее изобретение также предпочтительно охватывает любой ампликон, полученный с применением любой подходящей пары праймеров, например, в описанном выше эксперименте получили следующий ампликон только в качестве неограничивающего иллюстративного примера подходящего ампликона: LSR_seg24-36_200-309/310_ампликон (SEQ ID: 140).
ПРИМЕР 6
ЭКСПРЕССИЯ ТРАНСКРИПТОВ LSR_, КОТОРЫЕ ОБНАРУЖИВАЮТСЯ С ПОМОЩЬЮ АМПЛИКОНА, ИЗОБРАЖЕННОГО В ПОСЛЕДОВАТЕЛЬНОСТИ С НАЗВАНИЕМ LSR_SEG24-36_200-309/310, В РАЗЛИЧНЫХ НОРМАЛЬНЫХ ТКАНЯХ
Экспрессию транскриптов LSR, обнаруживаемых с помощью или по seg24-36FR LSR_seg24-36_200-309/310_ампликону (SEQ ID: 140) и праймерам LSR_seg24F_200-309 (SEQ ID: 141) и LSR_seg36R_200-310 (SEQ ID: 142), измеряли с помощью ПНР в реальном времени. Параллельно измеряли аналогичным образом экспрессию нескольких генов "домашнего хозяйства" - SDHA (SEQ ID: 103) (№ доступа GenBank NM_004168; SDHA_ампликон (SEQ ID:106)), HPRT1 (SEQ ID:107) (№ доступа GenBank NM_000194; HPRT1 _ампликон (SEQ ID: 110)) и G6PD (SEQ ID: 111) (№ доступа GenBank NM_000402; G6PD_ампликон (SEQ ID: 114)). Для каждого образца RT экспрессию вышеупомянутого ампликона нормировали по нормировочному множителю, рассчитанному из экспрессии этих генов "домашнего хозяйства", как описано в способе нормирования 2 в разделе "Материалы и методы". Нормированную количественную величину каждого образца RT затем делили на медиану количественных величин для образцов яичника (номера образцов 20, 21, 22 и 23, Таблица 4 выше), чтобы получить значение относительной экспрессии каждого образца по отношению к медиане образцов яичника.
Фигура 15 представляет собой гистограмму, показывающую экспрессию вышеуказанных транскриптов LSR в образцах нормальной ткани по сравнению с образцами яичника.
ПРИМЕР 7
ЭКСПРЕССИЯ ТРАНСКРИПТОВ LSR_, КОТОРЫЕ ОБНАРУЖИВАЮТСЯ С ПОМОЩЬЮ АМПЛИКОНА, ИЗОБРАЖЕННОГО В ПОСЛЕДОВАТЕЛЬНОСТИ С НАЗВАНИЕМ LSR_SEG24-36_200-309/310, В НОРМАЛЬНЫХ ТКАНЯХ ПОЧЕК И ТКАНЯХ РАКА ПОЧЕК
Экспрессию транскриптов LSR, обнаруживаемых с помощью или по seg24-36FR-LSR_seg24-36_200-309/310_ампликону (SEQ ID: 140) и праймерам LSR_seg24F_200-309 (SEQ ID:141) и LSR_seg36R_200-310 (SEQ ID:142) измеряли с помощью ПЦР в реальном времени. Параллельно измеряли аналогичным образом экспрессию нескольких генов "домашнего хозяйства" - SDHA (SEQ ID: 103) (№ доступа GenBank NM_004168; SDHA_ампликон (SEQ ID: 106)), G6PD (SEQ ID: 111) (№ доступа GenBank NM_000402; G6PD_ампликон (SEQ ID: 114)) и PBGD (SEQ ID: 115) (№ доступа GenBank BC019323; PBGD_ампликон (SEQ ID: 118)). Для каждого образца RT экспрессию вышеупомянутого ампликона нормировали по нормировочному множителю, рассчитанному из экспрессии этих генов "домашнего хозяйства", как описано в способе нормирования 2 в разделе "Материалы и методы". Нормированную количественную величину для каждого образца RT затем делили на медиану количественных величин нормальных образцов (номера образцов 1, 2, 3, 4 и 19, Таблица 5 выше), чтобы получить значение кратности активации для каждого образца относительно медианы нормальных образцов.
Фигура 16 представляет собой гистограмму, показывающую ингибирование вышеуказанных транскриптов рецепторов липопротеинов, стимулируемых липолизом, Homo sapiens в образцах рака почек по сравнению с нормальными образцами.
Как очевидно из Фигуры 16, экспрессия транскриптов LSR, обнаруживаемых с помощью вышеуказанного ампликона в образцах рака почки была значительно ниже, чем в образцах тканей, на являющихся раковыми (номера образцов 1, 2, 3, 4 и 19, Таблица 5 выше).
Для проверки значимости этих результатов применяли статистический анализ, описываемый ниже.
Р-значение для отличия в уровнях экспрессии транскриптов LSR, обнаруживаемых с помощью вышеупомянутого ампликона в образцах рака почек по сравнению с образцами нормальной ткани, определили с помощью Т-теста как 1,25е-01.
Пары праймеров также необязательно и предпочтительно охватываются настоящим изобретением; например, в описанном выше эксперименте следующую пару праймеров использовали только в качестве неограничивающего иллюстративного примера подходящей пары праймеров: LSR_seg24F_200-309 (SEQ ID: 141) и LSR_seg36R_200-310 (SEQ ID: 142).
Настоящее изобретение также предпочтительно охватывает любой ампликон, полученный с применением любой подходящей пары праймеров, например, в описанном выше эксперименте получили следующий ампликон только в качестве неограничивающего иллюстративного примера подходящего ампликона: LSR_seg24-36_200-309/310_ампликон (SEQ ID: 140).
ПРИМЕР 8
ЭКСПРЕССИЯ ТРАНСКРИПТОВ LSR_, КОТОРЫЕ ОБНАРУЖИВАЮТСЯ С ПОМОЩЬЮ АМПЛИКОНА, ИЗОБРАЖЕННОГО В ПОСЛЕДОВАТЕЛЬНОСТИ С НАЗВАНИЕМ LSR_SEG24-36_200-309/310, В НОРМАЛЬНЫХ И РАКОВЫХ ТКАНЯХ ПЕЧЕНИ
Экспрессию транскриптов LSR, обнаруживаемых с помощью или по seg24-36FR_seg24-36_200-309/310_ампликону (SEQ ID: 140) и праймерам LSR_seg24F_200-309 (SEQ ID: 141) и LSR_seg36R_200-310 (SEQ ID: 142) измеряли с помощью ПЦР в реальном времени. Параллельно измеряли аналогичным образом экспрессию нескольких генов "домашнего хозяйства" - SDHA (SEQ ID: 103) (№ доступа GenBank NM_004168; SDHA_ампликон (SEQ ID: 106)), G6PD (SEQ ID: 111) (№ доступа GenBank NM_000402; G6PD_ампликон (SEQ ID: 114)) и PBGD (SEQ ID: 115) (№ доступа GenBank BC019323; -PBGD_ампликон (SEQ ID: 118)). Для каждого образца RT экспрессию вышеупомянутого ампликона нормировали по нормировочному множителю, рассчитанному из экспрессии этих генов "домашнего хозяйства", как описано в способе нормирования 2 в разделе "Материалы и методы". Нормированную количественную величину для каждого образца RT затем делили на медиану количественных величин нормальных образцов (номера образцов 41, 42, 43, 44 и 45, Таблица 6 выше), чтобы получить значение кратности активации для каждого образца относительно медианы нормальных образцов.
Фигура 17 представляет собой гистограмму, показывающую экспрессию вышеуказанных транскриптов LSR в образцах рака печени по сравнению с нормальными образцами.
Пары праймеров также необязательно и предпочтительно охватываются настоящим изобретением; например, в описанном выше эксперименте следующую пару праймеров использовали только в качестве неограничивающего иллюстративного примера подходящей пары праймеров: LSR_seg24F_200-309 (SEQ ID: 141) и обратный праймер LSR_seg36R_200-310 (SEQ ID: 142).
Настоящее изобретение также предпочтительно охватывает любой ампликон, полученный с применением любой подходящей пары праймеров, например, в описанном выше эксперименте получили следующий ампликон только в виде неограничивающего иллюстративного примера подходящего ампликона: LSR_seg24-36_200-309/310_ампликон (SEQ ID: 140).
ПРИМЕР 9
КЛОНИРОВАНИЕ ORF LSR_T1_P5a, СЛИТОЙ С МАРКЕРОМ FLAG
Клонирование открытой рамки считывания (ORF) LSR_T1_P5a (SEQ ID NO:154), слитой с FLAG (аминокислотная последовательность: DYKDDDDK, SEQ ID NO:153) для образования белка LSR_P5a (SEQ ID NO:11), слитого с flag, выполнили с помощью ПЦР, как описано ниже.
3-этапную ПЦР-реакцию выполняли с использованием ДНК-полимеразы PfuUltra II Fusion HS (Agilent, № по каталогу 600670) при следующих условиях: на первом этапе 1 мкл неразбавленного образца из яичников (ID PZQXH) из панели для яичников (Таблица 1) служил в качестве матрицы для ПЦР-реакции с 0,5 мкл каждого из праймеров 200_369_LSR_Kozak_NheI (SEQ ID NO:147) и 200_379_LSR_Rev (SEQ ID NO:148) в общем реакционном объеме 25 мкл. Условия реакции составляли 5 минут при 98°С; 35 циклов: 20 секунд при 98°С, 30 секунд при 55°С и 1,5 минуты при 72°С; затем 5 минут при 72°С. ПЦР-продукт разводили 1:20 в DDW и 1 мкл использовали в качестве матрицы для каждой ПЦР-реакции этапа 2.
На втором этапе 5'-часть LSR амплифицировали с 0,5 мкл каждого из праймеров 200_369_LSR_Kozak_NheI (10 мкМ) (SEQ ID NO:147) и 200_371_LSR_seg36R (10 мкМ) (SEQ ID NO:149) в общем реакционном объеме 25 мкл. 3'-часть LSR амплифицировали с 0,5 мкл каждого из праймеров 200_370_LSR_seg36F (10 мкМ) (SEQ ID NO:150) и 200-3 73_LSR_Flag_BamHI_Rev (10 мкМ) (SEQ ID NO:151) в общем реакционном объеме 25 мкл. Условия реакции для обеих реакций составляли 5 минут при 98°С; 35 циклов: 20 секунд при 98°С, 15 секунд при 60°С и 1,5 минуты при 72°С; затем 5 минут при 72°С. Продукты каждой из реакций разделяли на 1% агарозном геле и очищали от геля с использованием набора Qiaquick™ Gel Extraction Kit (Qiagene, № по каталогу 28706). 100 нг 5'-продукта и 100 нг 3'-продукта использовали в качестве матрицы для третьего этапа ПЦР-реакции, в которой амплифицировали полную последовательность LSR-Flag, с 0,5 мкл каждого из праймеров 200_369_LSR_Kozak_NheI (SEQ ID: 147) и 200-373_LSR_Flag_BamHI_Rev (SEQ ID: 151) в общем реакционном объеме 25 мкл. Условия реакции составляли 5 минут при 98°С; 35 циклов: 20 секунд при 98°С, 30 секунд при 55°С и 1,5 минуты при 72°С; затем 5 минут при 72°С. Все использованные праймеры содержали специфические последовательности гена, сайты для рестрикционных ферментов, последовательность Козак и последовательность маркера FLAG. ПЦР-продукт этапа 3 отделили на 1% агарозном геле. После проверки бэнда с ожидаемым размером бэнды ПЦР-продукт очищали с использованием набора QIAquick™ Gel Extraction Kit.
Очищенный ПЦР-продукт полной длины расщепляли с помощью ферментов рестрикции NheI и BamHI (New England Biolabs, Беверли, Массачусетс, США). После расщепления ДНК разделяли на 1% агарозном геле. Бэнды с ожидаемым размером вырезали и экстрагировали из геля, как описано выше. Затем ДНК, полученную в результате расщепления, лигировали в вектор pIRESpuro3, который расщепляли с помощью NheI и ВаmHI, как описано выше, обрабатывали фосфатазой Antarctic (New England Biolabs, Беверли, Масеачусетс,США, № по каталогу M0289L) в течение 30 минут при 37°С и очищали от 1% агарозного геля с использованием набора QIAquick™ Gel Extraction Kit, как описано выше. Реакцию лигирования выполняли с помощью ДНК-лигазы Т4 (Promega; № по каталогу М180А).
ПРИМЕР 10
КЛОНИРОВАНИЕ ORF LSR_T1_P5a
Клонирование открытой рамки считывания (ORF) LSR_T1_P5a (SEQ ID NO:154) выполняли с помощью ПЦР для образования белка LSR_P5a (SEQ ID NO:11), как описано ниже.
ПЦР-реакцию выполняли с использованием ДНК-полимеразы PfuUltra II Fusion HS (Agilent, № по каталогу 600670) при следующих условиях: 50 нг конструкта pIRES_puro3_LSR_T1_P5a_Flag, описанного выше, служили в качестве матрицы для ПЦР-реакции с 0,5 микролитра каждого из праймеров 200_369_LSR_Kozak_NheI (SEQ ID NO:147) и 200-3 72_LSR_BamHI_Rev (SEQ ID NO:152) в общем реакционном объеме 25 мкл. Условия реакции составляли 5 минут при 98°С; 35 циклов: 20 секунд при 98°С, 30 секунд при 55°С и 1,5 минуты при 72°С; затем 10 минут при 72°С. Все использованные праймеры содержали специфические последовательности гена, сайты для рестрикционных ферментов и последовательность Козак. ПЦР-продукт отделяли на 1% агарозном геле. После проверки бэнда с ожидаемым размером ПЦР-продукт очистили с использованием набора QIAquick™ Gel Extraction Kit, как описано выше.
Очищенный ПЦР-продукт расщепляли с помощью ферментов рестрикции NheI и ВаmHI (New England Biolabs, Беверли, Массачусетс, США). После расщепления ДНК разделяли на 1% агарозном геле. Бэнд с ожидаемым размером вырезали и экстрагировали из геля, как описано выше. Затем ДНК, полученную в результате расщепления, затем лигировали в вектор pIRESpuro3, который расщепляли с помощью NheI и ВаmHI, как описано выше, инкубировали с фосфатазой Antarctic (New England Biolabs, Беверли, Массачусетс, США, № по каталогу M0289L) в течение 30 минут при 37°С и очищали от 1% агарозного геля с использованием набора QIAquick™ Gel Extraction Kit, как описано выше. Реакцию лигирования выполняли с помощью ДНК-лигазы Т4 (Promega; № по каталогу М180А).
Выполняли проверку последовательности как маркированных, так и немаркированных конструктов, описанных выше (Hylabs, Реховот, Израиль). Выявили два следующих нуклеотидных несоответствия: G на А в положении 119 нуклеиновой кислоты из SEQ ID NO:154, и А на G в положении 626 нуклеиновой кислоты из SEQ ID NO:154, что приводит к нуклеиновой последовательности, изложенной в SEQ ID NO:145 для немаркированного конструкта и SEQ ID NO:146 для маркированного конструкта; что дает полипептид с аминокислотным несоответствием I на М в аминокислотном положении 209 в SEQ ID NO:301, что приводит к белку, имеющему аминокислотную последовательность, изложенную в SEQ ID NO:143 для немаркированного конструкта и SEQ ID NO:144 для маркированного конструкта.
Указанные выше рекомбинантные плазмиды обрабатывали с получением стабильного пула, как описано ниже.
ПРИМЕР 11
СОЗДАНИЕ СТАБИЛЬНОГО ПУЛА РЕКОМБИНАНТНЫХ КЛЕТОК НЕK293Т, ЭКСПРЕССИРУЮЩИХ БЕЛОК LSR_P5a_FLAG_M
Клетки НЕK-293Т стабильно трансфицировали LSR_T1_P5a_Flag_m (SEQ ID NO:146) и плазмидами pIRESpuro3 в качестве пустого вектора следующим образом.
Клетки НЕK-293Т (АТСС, CRL-11268) высевали в стерильный 6-луночный планшет, подходящий для тканевых культур, содержащий 2 мл предварительно нагретой полной среды DMEM [среда Игла, модифицированная по способу Дульбекко, Biological Industries (Бейт-ха-Емек, Израиль, № по каталогу: 01-055-1А)+10% FBS [фетальная бычья сыворотка. Biological Industries (Бейт-ха-Емек, Израиль, № по каталогу: 04-001-1А) + 4 мМ L-глутамина (Biological Industries (Бейт-ха-Емек, Израиль), №п о каталогу: 03-020-1А). 500000 клеток на лунку трансфицировали 2 мкг ДНК-конструкта с использованием 6 мкл реагента FuGENE 6 (Roche, № по каталогу: 11-814-443-001), разведенного в 94 мкл DMEM. Смесь инкубировали при комнатной температуре в течение 15 минут. Эту сложную смесь по каплям добавляли к клеткам. Клетки помещали в инкубатор, поддерживали при 37°С с 5% содержанием CO2. Через 48 часов после трансфекции клетки переносили в 75 см2 матрас для тканевой культуры, содержащую 15 мл селективной среды: полная среда с добавлением 5 мкг/мл пуромицина (Sigma, № по каталогу Р8833). Клетки поместили в инкубатор, и среду заменяли каждые 3-4 дня до тех пор, пока не наблюдали образования клона.
ПРИМЕР 12
АНАЛИЗ ЭКТОПИЧЕСКОЙ ЭКСПРЕССИИ LSR_P5a_FLAG_M В СТАБИЛЬНО ТРАНСФИЦИРОВАННЫХ КЛЕТКАХ НЕK293Т
Экспрессию LSR_P5a_Flag_m (SEQ ID NO:144) в стабильно трансфицированных клетках НЕK293Т определяли с помощью анализа Вестерн-блоттинга клеточных лизатов с использованием антител к LSR и антитела к flag, как указано в Таблице 9.
Клетки отделяли от планшета с использованием бесферментного буфера для диссоциации клеток на основе PBS (Gibco; 13151-014), промывали фосфатно-солевым буфером (PBS), модифицированным по способу Дульбекко (Biological Industries, 02*023-1А) и центрифугировали при 1200g в течение 5 минут. Экстракцию цельных клеток выполняли ресуспендированием клеток в 50 мМ Tris-HCl, pH 7,4, 150 мМ NaCl, 1 мМ EDTA, 1% Triton X-100 с добавлением 25х полной смеси ингибиторов протеаз без EDTA (Roche, 11 873 580 001) и перемешиванием на вортексе в течение 20 секунд. Клеточные экстракты собирали после центрифугирования при 20000 g в течение 20 минут при 4°С и определяли концентрацию белка с помощью анализа Bradford Biorad Protein (Biorad; № по каталогу 500-0006). Равные количества белка анализировали с помощью SDS-PAGE (Invitrogen NuPAGE 4-12%, NuPAGE Bis Tris, № по каталогу NP0335, NP0322) и переносили на нитроцеллюлозную мембрану (ВА83, 0,2 мкм, Schleicher & Schuell, № по каталогу 401385). Мембрану блокировали с помощью TTBS (Biolab, № по каталогу: 20892323)710% обезжиренного молока (Difco, № по каталогу 232100) и инкубировали с указанными первичными антителами (Фигура 18), разведенными в TTBS/5% BSA (Sigma-Aldrich, A4503) с указанными концентрациями (Таблица 9) в течение 16 часов при 4°С. После 3 промывок с помощью TTBS мембрану дополнительно инкубировали в течение 1 часа при комнатной температуре со вторичными конъюгированными антителами, как указано, разведенными в TTBS. Реакцию хемилюминесценции проводили с реагентами обнаружения для вестерн-блоттинга ECL (GE Healthcare, № по каталогу RPN2209) и мембраны экспонировали на пленке Super RX Fuji X-Ray (№ по каталогу 4741008389).
На Фигуре 18 показана экспрессия белка LSR_P5a_Flag_m (SEQ ID: 144) в рекомбинантных клетках НЕK293Т при бэнде с ожидаемым размером ~70 кДа, обнаруживаемом с помощью антитела к Flag (Sigma; № по каталогу А8592) (Фигура 18А) и антителами к LSR следующим образом: Abnova, № по каталогу Н00051599-В01Р (Фигура 18В), Abcam, № по каталогу ab59646 (Фигура 18С) и Sigma № по каталогу НРА007270 (Фигура 18D).
ПРИМЕР 13
ОПРЕДЕЛЕНИЕ СУБКЛЕТОЧНОЙ ЛОКАЛИЗАЦИИ ЭКТОПИЧЕСКОГО LSR_P5a_FLAG_M В КЛЕТКАХ НЕK293Т
Субклеточную локализацию белка LSR_P5a_Flag_m (SEQ ID NO:144) определяли в стабильно трансфицированных клетках с помощью конфокальной микроскопии.
Стабильно трансфицированные рекомбинантные клетки HEK293Т, экспрессирующие LSR_P5a_Flag_m (SEQ ID: 144), описанные выше, высевали на покровные стекла, предварительно покрытые поли-L-лизином (Sigma; № по каталогу Р4832). Через 24 часа клетки обрабатывали для обеспечения иммунного окрашивания и анализировали с помощью конфокальной микроскопии. Покровное стекло промывали фосфатно-солевым буфером (PBS), затем фиксировали в течение 15 минут в растворе PBS/3,7% параформальдегида (PFA) (EMS, № по каталогу: 15710)/3% глюкозы (Sigma, № по каталогу: G5767). Действие PFA прекращали с помощью PBS/3 мМ глицина (Sigma, № по каталогу: G7126) в течение 5 минут. После двух 5-минутных промывок в PBS клетки делали проницаемыми с помощью PBS/0,1% Triton-X100 в течение 5 минут при комнатной температуре и промывали два раза в PBS. Затем выполняли блокирование неспецифических участков с помощью PBS/5% альбумина бычьей сыворотки (BSA) (Sigma, № по каталогу: А4503) в течение 20 минут. Затем покровное стекло инкубировали во влажной камере в течение 1 часа с каждым из первичных антител, разведенных в PBS/5% BSA, как указано, с последующими тремя 5-минутными промывками PBS. Затем покровные стекла инкубировали в течение 30 минут с соответствующим вторичным антителом, разведенным в PBS/2,5% BSA при указанном разведении. Используемые антитела и разведения указаны в Таблице 9. После предварительной промывки сбалансированным солевым раствором Хэнкса без фенолового красного (HBSS) (Biological Industries, № по каталогу 02-016-1), покровное стекло инкубировали с WGA-Alexa 488 (Invitrogen, № по каталогу W11261), разбавленным 1:200 в HBSS, в течение 10 минут, промывали HBSS и инкубировали в бисбензимиде Н 33258 (Sigma, № по каталогу: 14530), разведенном 1:1000 в HBSS. Затем покровное стекло помещали на предметное стекло с водной средой Gel Mount (Sigma, № по каталогу: G0918) и клетки исследовали на присутствие флуоресцентного продукта с помощью конфокальной микроскопии.
Субклеточная локализация LSR_P5a_Flag_m показана на Фигуре 19, LSR_P5a_Flag_m (SEQ ID: 144) локализуется преимущественно в цитоплазме клетки, но также может обнаруживаться на поверхности клетки, как обнаружено с помощью следующих антител к Flag (Sigma, № по каталогу А9594) (Фигура 19А) и антител к LSR: Abcam, № по каталогу ab59646 (Фигура 19B), Abnova, № по каталогу Н00051599-В01Р (Фигура 19С) и Sigma, № по каталогу НРА007270 (Фигура 19D).
ПРИМЕР 14
АНАЛИЗ ЭКСПРЕССИИ ЭНДОГЕННОГО БЕЛКА LSR В РАЗЛИЧНЫХ КЛЕТОЧНЫХ ЛИНИЯХ
Экспрессию эндогенного белка LSR в различных клеточных линиях анализировали с помощью вестерн-блоттинга, как описано ниже.
Клеточные экстракты SK-OV3 (АТСС № НТВ-77), Caov3 (АТСС № НТВ-75), OVCAR3 (АТСС № НТВ-161), ES-2 (АТСС № CRL-1978), OV-90 (АТСС № CRL-11732), TOV112D (АТСС № CRL-11731) и Нер G2 (АТСС № НВ-8065) получали, как описано выше.
Клеточные экстракты HeLa (№ по каталогу sc-2200), MCF-7 (№ по каталогу sc-2206), СаСо2 (№ по каталогу sc-2262) и SkBR3 (№ по каталогу sc-2218) приобрели у SantaCruz Biotechnology.
Равные количества белка анализировали с помощью SDS-PAGE и переносили на нитроцеллюлозную мембрану, как описано выше. Мембрану блокировали с помощью TTBS (Biolab, № по каталогу: 20892323)/10% обезжиренного молока (Difco, № по каталогу 232100) и инкубировали с антителами к LSR (Abcam, № по каталогу ab59646), разведенными в TTBS/5% BSA (Sigma-Aldrich, A4503), при указанных концентрациях (Таблица 9) в течение 16 часов при 4°С. После 3 промывок с помощью TTBS мембрану дополнительно инкубировали в течение 1 часа при комнатной температуре с указанными вторичными конъюгированными антителами (Таблица 9), разведенными в TTBS. Реакцию хемилюминесценции проводили с реагентами обнаружения для вестерн-блоттинга ECL (GE Healthcare, № по каталогу RPN2209) и мембраны экспонировали на пленке Super RX Fuji X-Ray (№ по каталогу 4741008389).
На Фигуре 20 показана эндогенная экспрессия LSR в различных клеточных линиях. Бэнд 72 кДа, который соответствует LSR, обнаружили с помощью антител к LSR в экстрактах SK-OV3, Caov3, OVCAR3, OV-90, Нер G2, HeLa, Сасо2 и SKBR3 (Фигура 20А). Антитело к GAPDH (Abcam, № по каталогу ab9484) служило в качестве контроля загрузки (Фигура 20B).


ПРИМЕР 15
ЭКСПРЕССИЯ ТРАНСКРИПТОВ ТМЕМ25_, КОТОРЫЕ ОБНАРУЖИВАЮТСЯ С ПОМОЩЬЮ АМПЛИКОНА, ЗОБРАЖЕННОГО В ПОСЛЕДОВАТЕЛЬНОСТИ С НАЗВАНИЕМ TMEM25_SEG21-27, В НОРМАЛЬНЫХ И РАКОВЫХ ТКАНЯХ МОЛОЧНОЙ ЖЕЛЕЗЫ
Экспрессию транскриптов ТМЕМ25, обнаруживаемых с помощью или по seg21-27-TMEM25_seg_21-27_200-344/346_ампликону (SEQ ID NO:123) и праймерам TMEM25_seg21F_200-344 (SEQ ID NO:124) и TMEM25_seg27R_200-346 (SEQ ID NO:125), измеряли с помощью ПЦР в реальном времени. Параллельно измеряли аналогичным образом экспрессию нескольких генов "домашнего хозяйства" - G6PD (№ доступа GenBank NM_000402; (SEQ ID NO:111) G6PD_ампликон (SEQ ID NO:114)), RPL19 (№ доступа GenBank NM_000981; (SEQ ID NO:119)- RPL19_ампликон (SEQ ID NO:122)), PBGD (№ доступа GenBank BC019323; (SEQ ID NO:115) PBGD_ампликон (SEQ ID NO:118)) и SDHA (№ доступа GenBank NM_004168; (SEQ ID NO:103) SDHA_ампликон (SEQ ID: 106)). Для каждого образца RT экспрессию вышеупомянутого ампликона нормировали по нормировочному множителю, рассчитанному по экспрессии этих генов "домашнего хозяйства", как описано в способе нормирования в разделе "Материалы и методы". Нормированную количественную величину для каждого образца RT затем делили на медиану количественных величин нормальных образцов (номера образцов 43, 45, 46, 47, 48, 49, 50, 51, 52, 54, 56, 58, 59, 60, 61, 62, 63, 64, 66, 67, 68 и 69, Таблица 1 выше), чтобы получить значение кратности дифференциальной экспрессии для каждого образца относительно медианы нормальных образцов.
В двух выполненных экспериментах не наблюдали дифференциальную экспрессию в образцах раковых тканей относительно нормальных образцов (Фигура 21).
Пары праймеров также необязательно и предпочтительно охватываются настоящим изобретением; например, в описанном выше эксперименте следующую пару праймеров использовали только в качестве неограничивающего иллюстративного примера подходящей пары праймеров: прямой праймер TMEM25_seg21F_200-344 (SEQ ID NO:124) и обратный праймер TMEM25_seg27R_200-346 (SEQ ID NO:125).
Настоящее изобретение также предпочтительно охватывает любой ампликон, полученный с применением любой подходящей пары праймеров, например, в описанном выше эксперименте получили следующий ампликон только в качестве неограничивающего иллюстративного примера подходящего ампликона: TMEM25_seg_21-27_200-344/346_ампликон (SEQ ID: 123).
ПРИМЕР 16
ЭКСПРЕССИЯ ТРАНСКРИПТОВ ТМЕМ25_, КОТОРЫЕ ОБНАРУЖИВАЮТСЯ С ПОМОЩЬЮ АМПЛИКОНА, ИЗОБРАЖЕННОГО В ПОСЛЕДОВАТЕЛЬНОСТИ С НАЗВАНИЕМ TMEM25_SEG21-27, В РАЗЛИЧНЫХ НОРМАЛЬНЫХ ТКАНЯХ
Экспрессию транскриптов ТМЕМ25, обнаруживаемых с помощью или по seg21-27-TMEM25_seg_21-27_200-344/346_ампликону (SEQ ID: 123) и праймерам TMEM25_seg21F_200-344 (SEQ ID NO:124) и TMEM25_seg27R_200-346 (SEQ ID NO:125) измеряли с помощью ПЦР в реальном времени. Параллельно измеряли аналогичным образом экспрессию нескольких генов "домашнего хозяйства" - SDHA (№ доступа GenBank NM_004168; (SEQ ID NO:103) SDНА_ампликон (SEQ ID: 106)), G6PD (№ доступа GenBank NM_000402; (SEQ ID NO:111) G6PD_ампликон (SEQ ID NO:114)) и HPRT1 (№ доступа GenBank NM_000194; (SEQ ID NO:107) НРRТ1_ампликон (SEQ ID NO:110)). Для каждого образца RT экспрессию вышеупомянутого ампликона нормировали по нормировочному множителю, рассчитанному по экспрессии этих генов "домашнего хозяйства", как описано в способе нормирования 2 в разделе "Материалы и методы". Нормированную количественную величину для каждого образца RT затем делили на медиану количественных величин образцов молочной железы (номера образцов 30, 31, 32 и 33, Таблица 2 выше), чтобы получить значение относительной экспрессии каждого образца относительно медианы образцов молочной железы (Фигура 22).
ПРИМЕР 17
КЛОНИРОВАНИЕ БЕЛКОВ ТМЕМ25
КЛОНИРОВАНИЕ ORF ТМЕМ25_Т0_Р5, СЛИТОЙ С МАРКЕРОМ FLAG
Клонирование открытой рамки считывания (ORF) TMEM25_T0_P5 (SEQ ID NO:130), слитой с FLAG (SEQ ID NO:153), выполняли с помощью ПЦР в реальном времени, как описано ниже.
1 мкл неразбавленной объединенной ДНК из тканей рака ободочной кишки служили в качестве матрицы для ПЦР-реакции. ПЦР провели с использованием ДНК-полимеразы КАРА Hifi (KAPABIOSYSTEM, № по каталогу KK2101) при следующих условиях: 1 мкл - кДНК, описанной выше; по 1 мкл (25 мкМ) - каждого праймера 200-374_TMEM25_NheI_Kozak_seg5F (SEQ ID NO:127) и 200-375_TMEM25_Flag_STOP_EcoRI_seg43R (SEQ ID NO:128) в общем реакционном объеме 50 мкл; с программой для реакции 5 минут при 95°С, 40 циклов: 20 секунд при 98°С, 15 секунд при 55°С, 1 минута при 72°С; затем 5 минут при 72°С. Использованные праймеры содержали специфические последовательности гена, сайты для рестрикционных ферментов, последовательность Козак и маркер FLAG.
25 мкл ПЦР-продукта загружали в 1,5% агарозный гель, окрашивали бромистым этидием, подвергали электрофорезу в растворе 1xTAE при 100 В и визуализировали с помощью ультрафиолетового света. После проверки бэнда с ожидаемым размером 1 мкл ПЦР-продукта указанной выше матрицы служили в качестве матрицы для повторной амплификации. ПЦР провели с использованием ДНК-полимеразы КАРА Hifi (KAPABIOSYSTEM, № по каталогу KK2101) при таких же условиях, как описанные выше.
ПЦР-продукт очищали от геля с использованием набора QIAquick™ Gel Extraction Kit (Qiagen, № по каталогу: 28707).
Очищенный ПЦР-продукт расщепляли с помощью ферментов рестрикции NheI и EcoRI (New England Biolabs, Беверли, Массачусетс, США). Затем ДНК, полученную в результате расщепления, лигировали в вектор pIRESpuro3 (pRp) (Clontech, № по каталогу: 631619), предварительно расщепленный с помощью указанных выше ферментов рестрикции, с использованием ДНК-лигазы Т4 (Promega, № по каталогу: M1801). Полученную ДНК трансформировали в компетентные бактерии E. coli DH5α (RBC Bioscience, Тайбэй, Тайвань, № по каталогу: RH816) в соответствии с инструкциями производителя, а затем их высеивали на чашки с LB-агаром, содержащим ампициллин, для отбора рекомбинантных плазмид и инкубировали в течение ночи при 37°С. На следующий день положительные колонии подвергали скринингу с помощью ПЦР с использованием праймера, специфического для вектора pIRESpuro3, и ген-специфического праймера (данные не показаны). ПЦР-продукт анализировали с использованием 2% агарозного геля, как описано выше. После проверки бэнда с ожидаемым размером положительные колонии выращивали в 5 мл Terrific Broth с добавлением 100 мкг/мл ампициллина при встряхивании в течение ночи при 37°С. Плазмидную ДНК выделяли из бактериальных культур с использованием набора Qiaprep™ Spin Miniprep Kit (Qiagen, № по каталогу: 27106). Точность клонирования подтверждали секвенированием вставок (Нуlabs, Реховот, Израиль). После проверки в отношении отсутствия ошибок у колонии (т.е. без мутаций в ORF) рекомбинантные плазмиды обрабатывали для дальнейшего анализа.
КЛОНИРОВАНИЕ НЕМАРКИРОВАННОЙ ORF TMEM25_T0_P5
Клонирование немаркированной открытой рамки считывания (ORF) ТМЕМ25_Т0_Р5 (SEQ ID: 130) проводили с помощью ПЦР в реальном времени, как описано ниже.
1 мкл неразбавленной объединенной ДНК из тканей рака ободочной кишки служили в качестве матрицы для ПЦР-реакции. ПЦР проводили с использованием ДНК-полимеразы КАРА Hifi (KAPABIOSYSTEM, № по каталогу КК2101) при следующих условиях: 1 мкл - кДНК, описанной выше; по 1 мкл (25 мкМ) - каждого праймера 200-374_TMEM25_NheI_Kozak_seg5F (SEQ ID: 127) и 200 377_TMEM25_STOP_EcoRI_seg43R (SEQ ID: 131) в общем реакционном объеме 50 мкл; с программой для реакции 5 минут при 95°С, 40 циклов: 20 секунд при 98°С, 15 секунд при 55°С, 1 минута при 72°С; затем 5 минут при 72°С. Использованные праймеры содержали специфические последовательности гена, сайты для рестрикционных ферментов, последовательность Козак.
25 мкл ПЦР-продукта загружали на 1,5% агарозный гель, окрашивали бромистым этидием, подвергали электрофорезу в растворе 1xTAE при 100 В и визуализировали с помощью ультрафиолетового света. После проверки бэнда с ожидаемым размером 5 мкл ПЦР-продукта указанной выше матрицы служили в качестве матрицы для повторной амплификации. ПЦР провели с использованием ДНК-полимеразы КАРА Hifi (KAPABIOSYSTEM, № по каталогу KK2101) при таких же условиях, как описанные выше.
ПЦР-продукт очищали от геля с использованием набора QIAquick™ Gel Extraction Kit (Qiagen, № по каталогу: 28707).
Очищенный ПЦР-продукт расщепляли с помощью ферментов рестрикции NheI и EcoRI (New England Biolabs, Беверли, Массачусетс, США). Затем расщепленную ДНК лигировали в вектор pIRESpuro3 (pRp) (Clontech, № по каталогу: 631619), предварительно расщепленный с помощью указанных выше ферментов рестрикции, с использованием ДНК-лигазы Т4 (Promega, № по каталогу: M1801). Полученную ДНК трансформировали в компетентные бактерии E. coli DH5a (RBC Bioscience, Тайбэй, Тайвань, № по каталогу: RH816) в соответствии с инструкциями производителя, а затем их высеивали на чашки с LB-агаром, содержащим ампициллин, для отбора рекомбинантных плазмид и инкубировали в течение ночи при 37°С. На следующий день положительные колонии подвергали скринингу с помощью ПЦР с использованием праймера, специфического для вектора pIRESpuro3, и ген-специфического праймера (данные не показаны). ПЦР-продукт анализировали с использованием 2% агарозного геля, как описано выше. После проверки бэнда с ожидаемым размером положительные колонии выращивали в 5 мл Terrific Broth с добавлением 100 мкг/мл ампициллина при встряхивании в течение ночи при 37°С. Плазмидную ДНК выделяли из бактериальных культур с использованием набора Qiaprep™ Spin Miniprep Kit (Qiagen, № по каталогу: 27106). Точность клонирования подтверждали секвенированием вставок (Hylabs, Реховот, Израиль). После проверки в отношении отсутствия ошибок у колонии (т.е. без мутаций в ORF) рекомбинантные плазмиды обрабатывали для дальнейшего анализа.
ПРИМЕР 18
СОЗДАНИЕ СТАБИЛЬНОГО ПУЛА КЛЕТОК, ЭКСПРЕССИРУЮЩИХ БЕЛКИ ТМЕМ25_Р5 И TMEM25_P5_FLAG
Конструкты ТМЕМ25_Т0_Р5 (SEQ ID: 130) и TMEM25_T0_P5_FLAG (SEQ ID: 126) в pIRESpuro3 или пустой вектор pIRESpuro3 стабильно трансфицировали в клетки HEK-293Т следующим образом.
Клетки HEK-293Т (АТСС, CRL-11268) высевали в стерильный 6-луночный планшет подходящий для тканевых культур, содержащий 2 мл предварительно нагретой полной среды DMEM [среда Игла, модифицированная по способу Дульбекко, Biological Industries (Бейт-ха-Емек, Израиль, № по каталогу: 01-055-1А) + 10% FBS [фетальная бычья сыворотка. Biological Industries (Бейт-ха-Емек, Израиль, № по каталогу: 04-001-1А) + 4 мМ L-глутамина (Biological Industries (Бейт-ха-Емек, Израиль), № по каталогу: 03-020-1А). 350000 клеток на лунку трансфицировали 2 мкг ДНК-конструкта с использованием 6 мкл реагента FuGENE 6 (Roche, № по каталогу: 11-814-443-001), разведенного в 94 мкл DMEM. Смесь инкубировали при комнатной температуре в течение 15 минут. Сложную смесь по каплям добавляли к клеткам и проводили взбалтывание вращением. Клетки помещали в инкубатор, поддерживали при 37°С с 5% содержанием СО2. Через 48 часов после трансфекции трансфицированные клетки переносили в 75 см2 матрас для тканевой культуры, содержащую 15 мл селективной среды: полная среда с добавлением 5 мкг/мл пуромицина (Sigma, № по каталогу Р8833). Клетки помещали в инкубатор и среду заменяли каждые 3-4 дня до тех пор, пока не наблюдали образование клона.
Непосредственно после прохождения отбора достаточного количества клеток собирали 3-5 миллиона клеток. Клетки лизировали в 300 мкл буфера RIPA (50 мМ Tris-НСl рН 8, 150 мМ NaCl, 1% NP-40, 0,5% дезоксихолата натрия, 0,1% SDS) с добавлением ингибиторов протеаз (Roche, № по каталогу: 11873580001) в течение 20 минут при 4°С. После центрифугирования при 4°С в течение 10 минут при 14000 об./мин. прозрачные надосадочные жидкости переносили в чистые пробирки и использовали для процедуры WB: 30 мкг лизата смешивали с DTT, 1,4-дитиотреитолом (DTT; восстанавливающее средство), до конечной концентрации 100 мМ.
Кроме того, затем образцы инкубировали при 100°С в течение 10 минут, после чего в течение 1 минуты откручивали на центрифуге при 14000 об./мин. SDS-PAGE (Laemmli U.K., Nature 1970, 227, 680-685) выполняли при загрузке 30 мкл образца на дорожку в 4-12% гелях NuPAGE® Bis-Tris (Invitrogen, № по каталогу: NP0321), и гели разгоняли в подвижном буфере 1xMES SDS (Invitrogen, № по каталогу: NP0060) с использованием XCell SureLock™ Mini-Cell (Invitrogen, № по каталогу: E10001) в соответствии с инструкциями производителя. Выделенные белки переносили на нитроцеллюлозную мембрану (Schleicher & Schuell, № по каталогу: 401385) с использованием аппарата для блоттинга XCell™ II (Invitrogen, № по каталогу Е19051) в соответствии с инструкциями производителя.
Мембраны, содержащие белки, подвергнутые блоттингу, обрабатывали для обнаружения с помощью антител следующим образом.
Неспецифические участки мембраны блокировали с помощью инкубации в 5% обезжиренном молоке, разбавленном фосфатно-солевым буфером (PBS) с добавлением 0,05% Tween-20 (PBST), в течение 1 часа при комнатной температуре (все последующие инкубации проводили в течение 1 часа при комнатной температуре). Затем блокирующий раствор замещали первичным антителом кролика к ТМЕМ25 (Sigma, № по каталогу НРА012163), разведенными 1:500 в 5% альбумине бычьей сыворотки (BSA) (Sigma, № по каталогу: А4503) (разведенным в PBS). После инкубации в течение 1 часа и трех 5-минутных промывок применяли вторичное антитело: антитело козы к кролику, конъюгированное с пероксидазой, конъюгированное аффинно очищенное антитело козы к IgG кролика (Jackson, № по каталогу: 111-035-003), разведенное 1:20000 в блокирующем растворе. Также белки обнаруживали с помощью антитела мыши к Flag М2 с пероксидазой (Sigma, № по каталогу: А8592), разведенного 1:1000 в блокирующем растворе. После инкубации в течение 1 часа и трех 5-минутных промывок применяли субстрат ECL (PIERCE, № по каталогу: PIR-34080) в течение 1 минуты с последующим экспонированием на рентгеновской пленке (Fuji, № по каталогу: 100NIF). Результаты представлены на Фигуре 23.
На Фигуре 23А показано, что антитела кролика к ТМЕМ25, описанные выше, специфически распознавали белок ТМЕМ25_Р5 (SEQ ID NO:7) и TMEM25_P5_Flag (SEQ ID NO:129) в бэнде с ожидаемым размером - 40,2 кДа, но не HEK_293T_pRp3.
На Фигуре 23B показано, что белки TMEM25_P5_Flag (SEQ ID: 129) специфически распознавались антителом к Flag в бэнде с ожидаемым размером - 40,2 кДа.
ПРИМЕР 19
ОПРЕДЕЛЕНИЕ СУБКЛЕТОЧНОЙ ЛОКАЛИЗАЦИИ ЭКТОПИЧЕСКОГО ТМЕМ25_Р5 И TMEM25_P5_FLAG В КЛЕТКАХ HEK293Т С ПОМОЩЬЮ ИММУНОФЛУОРЕСЦЕНЦИИ
Локализацию белков ТМЕМ25_Р5 (SEQ ID NO:7) и TMEM25_P5_FLAG (SEQ ID NO:129) исследовали после стабильной трансфекции, описываемой выше, с использованием конфокальной микроскопии.
Стабильно трансфицированные рекомбинантные клетки HEK293Т, экспрессирующие ТМЕМ25_Р5 (SEQ ID NO:7) и TMEM25_P5_FLAG (SEQ ID NO:129), высевали на покровные стекла, предварительно покрытые поли-L-лизином (Sigma; № по каталогу Р4832). Через 24 часа клетки обрабатывали для обеспечения иммунного окрашивания и анализировали с помощью конфокальной микроскопии.
Покровное стекло промывали фосфатно-солевым буфером (PBS), затем фиксировали в течение 15 минут в растворе 3,7% параформальдегида (PFA) (Sigma, № по каталогу: Р-6148)/3% глюкозы (Sigma, № по каталогу: G5767) (разведенных в PBS). Действие PFA прекращали с помощью 5-минутной инкубации в 3 мМ глицине (Sigma, № по каталогу: G7126) (разведенном в PBS). После двух 5-минутных промывок в PBS выполняли блокирование неспецифических участков с помощью 5% альбумина бычьей сыворотки (BSA) (Sigma, № по каталогу: А4503) (разведенного в PBS) в течение 20 минут.
Затем покровное стекло инкубировали во влажной камере в течение 1 часа с антителами мыши к FLAG с Су3 (Sigma, № по каталогу: А9594), разведенными 1:200 в 5% BSA в PBS, или с антителом кролика к ТМЕМ25 (Sigma, № по каталогу НРА012163), разведенным 1:50 в 5% BSA в PBS, с последующими тремя 5-минутными промывками PBS. Для антитела к ТМЕМ25 требовалось вторичное антитело: антитело осла к кролику, конъюгированное с Су3 (Jackson, № по каталогу 711-165-152), разведенное 1:200 в 5% BSA в PBS, инкубировали во влажной камере в течение 1 часа с последующими тремя 5-минутными промывками PBS. После предварительной промывки бисбензимидом Н 33258 (HBSS) (Sigma, № по каталогу: 14530), покровное стекло инкубировали с WGA-Alexa 488 (Invitrogen, № по каталогу W11261), разведенным 1:200 в HBSS, в течение 10 минут с последующими двумя промывками в HBSS и инкубировали в бисбензимиде Н 33258 (Sigma, № по каталогу: 14530), разведенном 1:1000 в HBSS. Затем покровное стекло помещали на предметное стекло с водной средой Gel Mount (Sigma, № по каталогу: G0918) и клетки исследовали на присутствие флуоресцентного продукта с помощью конфокальной микроскопии.
Субклеточная локализация ТМЕМ25_Р5 (SEQ ID NO:132) и TMEM25_P5_Flag (SEQ ID NO:129) с использованием антител к ТМЕМ25 показана на Фигурах 24А и 24В, соответственно. На Фигуре 24С показана локализация TMEM25_P5_Flag (SEQ ID NO:129) с использованием антител к FLAG (Sigma, № по каталогу: А9594). Белок ТМЕМ25_Р5 локализован на поверхности клетки.
ПРИМЕР 20
ОПРЕДЕЛЕНИЕ КЛЕТОЧНОЙ ЛОКАЛИЗАЦИИ TMEM25_P5_FLAG С ПОМОЩЬЮ FACS
Мембранную локализацию белка TMEM25_P5_Flag (SEQ ID NO:129) исследовали после стабильной трансфекции, описываемой выше, с помощью анализа проточной цитометрии с использованием антител к ТМЕМ25 (Аb1628, Yomics) и нормальной мышиной сыворотки в качестве отрицательного контроля (015-000-120, Jackson). Рекомбинантные клетки HEK293Т, экспрессирующие TMEM25_P5_Flag, окрашивали антителами к ТМЕМ25 (А) или нормальной мышиной сывороткой (В) с последующей обработкой вторичным антителом осла к мыши, конъюгированного с DyLight 549 (Jackson 715-506-150), и исследовали в отношении присутствия флуоресцентного сигнала.
Рекомбинантные клетки HEK293T-TMEM25_P25_Flag отделяли от планшета с использованием бесферментного буфера для диссоциации клеток на основе PBS (Gibco; 13151-014), промывали буфером для FACS [фосфатно-солевой буфер (PBS), модифицированный по способу Дульбекко (Biological Industries, 02*023-1A)/1% бычьего альбумина (Sigma, A7030)] и подсчитывали. 0,5×106 клеток ресуспендировали в 100 мкл раствора антител при разведении 1:2250 мкл и инкубировали в течение 1 часа на льду. Клетки промывали ледяным буфером для FACS и инкубировали с указанным вторичным антителом в течение 1 часа на льду. Клетки промывали ледяным буфером для FACS и ресуспендировали в 500 мкл буфера для FACS, затем анализировали на установке для FACS (FACSCalibur, BD). Данные получали и анализировали с использованием Cellquest Pro, версия 5.2.
Результаты, представленные на Фигуре 25, показывают, что антитела к ТМЕМ25 (А) связываются с белком ТМЕМ25 полной длины в рекомбинантных клетках HEK293Т, экспрессирующих белок TMEM25_P5_Flag, по сравнению с мышиной сывороткой (В), использованной в качестве отрицательного контроля, что указывает на мембранную локализацию белка ТМЕМ25.
ПРИМЕР 21
АНАЛИЗ ЭКСПРЕССИИ ЭНДОГЕННОГО БЕЛКА ТМЕМ25 В РАЗЛИЧНЫХ КЛЕТОЧНЫХ ЛИНИЯХ
Экспрессию эндогенного белка ТМЕМ25 в различных клеточных линиях анализировали с помощью вестерн-блоттинга, как описано ниже.
Клеточные экстракты JURKAT (АТСС № TIB-152), Daudi (ATCC № CCL-213), RPMI8226 (АТСС № CCL-155), G-361 (АТСС № CRL-1424), KARPAS (АТСС № VR-702) получали, как описано выше (дорожки 3-7 на Фигуре 26 - см. легенду к фигуре в отношении соответствующих соотнесений дорожка/материал).
Цельноклеточные лизаты получали и анализировали с помощью вестерн-блоттинга, как описано выше. Равные количества белка анализировали с помощью SDS-PAGE и переносили на нитроцеллюлозную мембрану, как описано выше.
Мембрану блокировали с помощью 5% обезжиренного молока, разведенного в фосфатно-солевом буфере (PBS) с добавлением 0,05% Tween-20 (PBST), в течение 1 часа инкубации при комнатной температуре (все последующие инкубации проводили в течение 1 часа при комнатной температуре). Затем блокирующий раствор замещали первичным антителом кролика к ТМЕМ25 (Sigma, № по каталогу НРА012163), разведенным 1:500 в 5% альбумине бычьей сыворотки (BSA) (Sigma, № по каталогу: А4503) (разведенном в PBS). После инкубации в течение 1 часа и трех 5-минутных промывок применили вторичное антитело: антитело козы к кролику, конъюгированное с пероксидазой, конъюгированное аффинно очищенное антитело козы к IgG кролика (Jackson, № по каталогу: 111-035-003), разведенное 1:20000 в блокирующем растворе. Белки также обнаруживали с помощью антитела мыши к Flag M2, конъюгированного с пероксидазой (Sigma, № по каталогу: А8592), разведенного 1:1000 в блокирующем растворе. После инкубации в течение 1 часа и трех 5-минутных промывок применяли субстрат ECL (PIERCE, № по каталогу: PIR-34080) в течение 1 минуты с последующим экспонированием на рентгеновской пленке (Fuji, № по каталогу: 100NIF).
На Фигуре 26 показана эндогенная экспрессия ТМЕМ25 в различных клеточных линиях. Белок с 40,2 кДа, соответствующий ТМЕМ25, наблюдаемый в клетках HEK293Т, экспрессирующих TMEM25_P5_Flag (дорожка 2, на дорожке 1 показан контроль без Flag), обнаруживался с помощью антитела к ТМЕМ25 в экстрактах RPMI8226 (дорожка 5), Daudi (дорожка 6) и JURKAT (дорожка 7).
ПРИМЕР 22
ТРАНСФЕКЦИЯ СТАБИЛЬНЫХ HEK293Т_ТМЕМ25 миРНК К ТМЕМ25
Специфический нокдаун экспрессии белка TMEM25_P5_Flag (SEQ ID NO:129) наблюдали в ранее описанных клетках HEK293Т, стабильно экспрессирующих TMEM25_P5_Flag (SEQ ID NO 129), при трансфекции ТМЕМ25_Р5-миРНК.
Следующие миРНК приобрели у Dharmacon: ТМЕМ25 (L-018183-00-0005, Dharmacon, пул ON TARGET плюс SMART, человеческий ТМЕМ25 (84866), 5 нмоль) и скремблированная SiRNA в качестве отрицательного контроля (Dharmacon, D-001810-10-05).
Клетки высеивали при 50-70% конфлюэнтности за 24 часа перед трансфекцией. Комплексы миРНК из расчета 250 пмоль добавляли к 250 мкл Opti-MEM, позволяющей снизить количество сыворотки (GIBCO, № по каталогу 31985). Параллельно, смешивали реагент Lipofectamine 2000 (Invitrogen, № по каталогу 11668019); 5 мкл добавляли к 250 мкл Opti-MEM, позволяющей снизить количество сыворотки (GIBCO, № по каталогу 31985). Содержимое пробирок объединяли и их инкубировали в течение 15-30 минут при RT, чтобы образовалось достаточное количество комплексов; затем материал распределяли по поверхности клеток, и их инкубировали в течение 48 часов. Клетки собирали и получали клеточные лизаты, как описано выше, и обнаруживали с помощью антитела к ТМЕМ25 (Sigma, № по каталогу НРА012163) и затем вторичного антитела осла к кролику, конъюгированного с пероксидазой.
На Фигуре 27 показан специфический нокдаун белка TMEM25_P5_Flag (SEQ ID NO:129) в клетках HEK293Т, стабильно экспрессирующих TMEM25_P5_Flag (SEQ ID NO:129), трансфицированных миРНК к ТМЕМ25_Р5 (L-018183-00-0005, Dharmacon) (дорожка 2), по сравнению с клетками HEK293Т, стабильно экспрессирующими TMEM25_P5_FLAG, трансфицированными скремблированной миРНК (дорожка 1) (Dharmacon, D-001810-10-05) с использованием антител к ТМЕМ25 (Sigma, № по каталогу НРА012163).
ПРИМЕР 23
ИММУНОГИСТОХИМИЯ (IHC) С ИСПОЛЬЗОВАНИЕМ ПОЛИКЛОНАЛЬНЫХ АНТИТЕЛ К LSR И ТМЕМ25
Для оценки профилей связывания с тканями антитело к LSR (Abcam, № по каталогу: ab59646) и антитело к ТМЕМ25 (Sigma, № по каталогу НРА012163) применяли на панели микроматрицы опухолевых тканей (ТМА), как подробно описано в Таблице 10.
Клетки HEK-293, экспрессирующие LSR_P5a_Flag_m (SEQ ID NO:144) или TMEM25_P5_Flag (SEQ ID NO:129), использовали в качестве положительного контроля для калибровки рАb для окрашивания. Клетки HEK293Т, трансфицированные пустым вектором, использовали в качестве отрицательного контроля, также как и антитела к сывороточные IgG кролика.
Иммуногистохимическое обнаружение LSR_P5a_Flag_m (SEQ ID NO:144) или TMEM25_P5_Flag (SEQ ID NO:129) с помощью антител к LSR и антител к ТМЕМ25, соответственно, калибровали на срезах тканей, фиксированных формалином и залитых в парафин (FFPE). Использовали два способа демаскирования антигена: рН 6,1 и рН 9,0 при трех концентрациях антител (3; 1; 0,3 мкг/мл).
Способы демаскирования антигена выполняли следующим образом. Описанные выше срезы FFPE освобождали от парафина, демаскировали и регидратировали антиген с использованием буферов для демаскирования антигена Flex + 3-в-1 с рН 6,1 или рН 9,0 и автоматизированной системы для демаскирования антигена РТ Link при 95°С в течение 20 минут с помощью автоматического нагрева и охлаждения.
После демаскирования антигена срезы промывали дистиллированной водой в течение 2×5 минут, затем помещали в DAKO Autostainer Plus. Затем срезы инкубировали в течение 10 минут с реагентом Flex+, блокирующим пероксидазу, дважды промывали в 50 мМ Tris-HCl, 300 мМ NaCl, 0,1% Tween-20, рН 7,6 (TBST), с последующей инкубацией в течение 10 минут с блокирующим белок реагентом (DAKO X0909).
Срезы инкубировали в течение 30 минут с первичным антителом, разведенным в разбавителе для антитела DAKO Envision Flex (DAKO Cytomation, № по каталогу K8006). Затем, после инкубации с первичными антителами, срезы дважды промывали буфером FLEX, инкубировали с антителом к мыши/кролику Flex+, конъюгированному с HRP в течение 20 минут, дважды промывали буфером FLEX, а затем инкубировали с диаминобензидиновым (DAB) субстратом в течение 10 минут. Хромогенную реакцию останавливали с помощью промывки срезов дистиллированной водой.
Вслед за хромогенной реакцией срезы перекрашивали гематоксилином, обезводили в серии спиртов с возрастающей концентрацией (90-99-100%), просветляли в трех сменах ксилола и накрывали покровным стеклом под DePeX. Окрашенные срезы проанализировали с помощью микроскопа Olympus BX51 с камерой Leica DFC290.
На Фигуре 28 показано, что антитело к LSR (Abcam, № по каталогу Аb59646) на срезах клеточной линии положительного контроля (панели А, С и Е) демонстрировало специфическую дозозависимую иммунореактивность при концентрациях 3, 1 и 0,3 мкг/мл, соответственно, по сравнению с клеточной линей отрицательного контроля (панели В, D и F) при рН 9, в соответствии со способом демаскирования антигена, описанного ранее.
На Фигуре 29 показано, что антитело к ТМЕМ25 (Sigma, № по каталогу НРА012163) на срезах клеточной линии положительного контроля (панели А, С и Е) демонстрировало специфическую дозозависимую иммунореактивность при концентрациях 3, 1 и 0,3 мкг/мл, соответственно, по сравнению с клеточной линей отрицательного контроля (панели В, D и F) при рН 9, в соответствии со способом демаскирования антигена, описанного ранее.





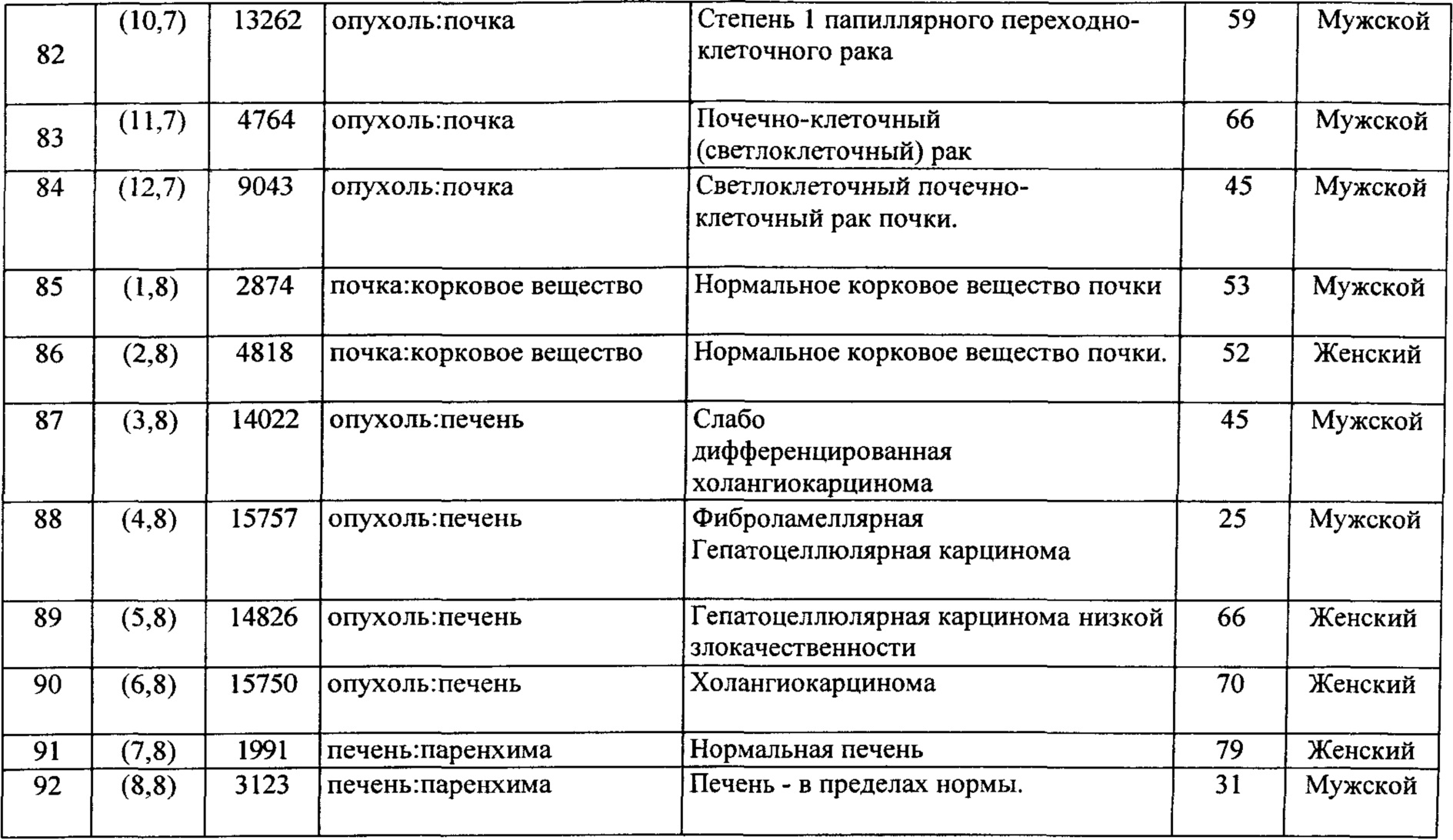
ПРИМЕР 24
ПОДТВЕРЖДЕНИЕ ПОЛНОЙ ДЛИНЫ ТРАНСКРИПТА, КОДИРУЮЩЕГО LY6G6F
Транскрипт полной длины, кодирующий LY6G6F (SEQ ID NO:1), подтверждали, как описано ниже.
1. Реакцию обратной транскрипции проводили следующим образом: 10 мкг очищенной РНК (нормальное легкое) смешивали с 150 нг случайных гексамерных праймеров (Invitrogen, Карлсбад, Калифорния, США, № по каталогу: 48190-011) и 500 мкМ dNTP в общем объеме 156 мкл. Смесь инкубировали в течение 5 минут при 65°С, а затем быстро охладили на льду. После этого добавили 50 мкл 5Х буфера для первой цепи Superscript II (Invitrogen, № по каталогу: 18064-014, номер партии: Y00146), 24 мкл 0,1 М DTT и 400 единиц RNasin (Promega, Милуоки, Висконсин, США, № по каталогу: N2511) и смесь инкубировали в течение 10 минут при 25°C с последующей дополнительной инкубацией при 42°С в течение 2 минут. Затем 10 мкл (2000 единиц) Superscript II (Invitrogen, № по каталогу: 18064-014) и реакционную смесь (конечный объем 250 мкл) инкубировали в течение 50 минут при 42°С, а затем инактивировали при 70°С в течение 15 минут. Полученную кДНК разводили 1:20 в буфере ТЕ (10 мМ Tris, 1 мМ EDTA, рН 8).
2. ПЦР проводили с использованием 2х GoTaq ReadyMix (Promega, № по каталогу: М7122) при следующих условиях: 12,5 мкл GoTaq ReadyMix; 5 мкл вышеуказанной кДНК; 1 мкл 10 мкМ прямого праймера 100-690 (SEQ ID NO:51); 1 мкл 10 мкМ обратного праймера 100-691 (SEQ ID NO:52) и 5,5 мкл Н2O в общем реакционном объеме 25 мкл; с программой реакции 5 минут при 95°С, 35 циклов: 30 секунд при 94°С, 30 секунд при 53°С, 50 секунд при 72°С, затем 10 минут при 72°С. Подробное описание праймеров представлено в Таблице 11 ниже.
ПЦР-продукт, описанный выше, загружали на 1,2% агарозный гель, окрашивали бромистым этидием, подвергали электрофорезу в растворе 1xTAE при 100 В и визуализировали с помощью ультрафиолетового света. Бэнд с ожидаемым размером вырезали и экстрагировали из геля с использованием набора Qiaquick™ Gel Extraction Kit (Qiagen, № по каталогу: 28707). Очищенную ДНК секвенировали (Тель-Авивский университет, Израиль) с использованием указанных выше праймеров и контролировали транскрипт полной длины, кодирующий LY6G6F (SEQ ID NO:1).
ПРИМЕР 25
КЛОНИРОВАНИЕ ТРАНСКРИПТА ПОЛНОЙ ДЛИНЫ, КОДИРУЮЩЕГО LY6G6F, СЛИТЫЙ С EGFP
Клонирование транскрипта полной длины, кодирующего LY6G6F, слитый с EGFP (усиленный зеленый флуоресцентный белок) выполняли, как описано ниже.
Во-первых, конструировали вектор экспрессии EGFP и затем клонировали открытую рамку считывания LY6G6F (SEQ ID NO:57), кодирующую аминокислотную последовательность, изложенную в SEQ ID NO:58. EGFP субклонировали в pIRESpuro3 (Clontech, № по каталогу: 631619) следующим образом: вектор EGFP-N1 (Clonteeh, № по каталогу: 6085-1) расщепляли с помощью NheI и NotI для вырезания гена EGFP. Вставку EGFP затем лигировали в pIRESpuro3 (Clontech, № по каталогу: 631619), который был предварительно расщеплен теми же ферментами, для того, чтобы получить вектор EGFP-pIRESpuro3.
ПЦР проводили с использованием Platinum PFX™ (Invitrogen, Карлсбад, Калифорния, США, № по каталогу: 1178-021) при следующих условиях: 5 мкл 10Х буфера Platinum PFX; 2 мкл - очищенной подтвержденной вышеуказанной ДНК; 1 мкл - 10 мМ dNTP (2,5 мМ каждого нуклеотида), 1 мкл - фермента Platinum PFX; 37 мкл - Н2O; 1 мкл 10 мкМ прямого праймера 100-729 (SEQ ID NO:53); 1 мкл 10 мкМ обратного праймера 100-730 (SEQ ID NO:54) (по 10 мкМ каждый) в общем реакционном объеме 50 мкл; с программой реакции 5 минут при 95°С, 35 циклов: 30 секунд при 94°С, 30 секунд при 55°С, 60 секунд при 68°С; затем 10 минут при 68°С. Использованные праймеры включали специфические последовательности гена, соответствующие необходимым координатам белка, а также сайты рестрикции и последовательность Козак, как перечислено в Таблице 11 ниже и в Фигуре 6. Жирным шрифтом в Таблице 11 представлена специфическая последовательность гена, тогда как липкие концы сайтов рестрикции, используемые для целей клонирования, выделены курсивом, а последовательность Козак подчеркнута.
5 мкл вышеуказанного ПЦР-продукта загружали на 1,2% агарозный гель, окрашивали бромистым этидием, подвергали электрофорезу в растворе 1xTAE при 100 В и визуализировали с помощью ультрафиолетового света. После проверки бэнда с ожидаемым размером оставшийся ПЦР-продукт обрабатывали с целью очистки ДНК с использованием набора для очистки ПЦР-реакций Qiaquick (Qiagen™, Валенсия, Калифорния, США, № по каталогу 28106). Экстрагированный ПЦР-продукт расщепляли с помощью ферментов рестрикции NheI и EcoRI (New England Biolabs, Беверли, Массачусетс, США), как указано в Таблице 11. После расщепления ДНК загружали на 1,2% агарозный гель, как описано выше. Бэнд с ожидаемым размером вырезали и экстрагировали из геля с использованием набора Qiaquick™ Gel Extraction Kit (Qiagen, № по каталогу: 28707).
ДНК, полученную в результате расщепления, дотировали в вектор EGFP_pIRESpuro3, предварительно расщепленный с помощью ферментов рестрикции NheI и EcoRI с использованием системы для быстрого лигирования ДНК LigaFast™ (Promega, № по каталогу: М8221). Полученную ДНК трансформировали в компетентные бактерии E. coli DH5a (RBC Bioscience, Тайбэй, Тайвань, № по каталогу: RH816) в соответствии с инструкциями производителя, а затем высевали на чашки с LB-агаром, содержащие ампициллин для отбора рекомбинантных плазмид, и инкубировали в течение ночи при 37°С.
Скрининг положительных клонов выполняли с помощью ПЦР с использованием GoTaq Ready Mix (Promega, № по каталогу: М7122). Положительные колонии выращивали в 5 мл Terrific Broth с добавлением 100 мкг/мл ампициллина при встряхивании в течение ночи при 37°С. Плазмидную ДНК выделяли из бактериальных культур с использованием набора Qiaprep™ Spin Miniprep Kit (Qiagen, № по каталогу: 27106). Точность клонирования подтверждали секвенированием вставок (Тель-Авивский университет, Израиль). После проверки в отношении отсутствия ошибок у колонии (т.е. без мутации в ORF) рекомбинантные плазмиды обработали для дальнейшего анализа.
Последовательность ДНК полученного LY6G6F полной длины, слитого с EGFP (SEQ ID NO:55), показана на Фигуре 7. На Фигуре 7 специфическая последовательность гена, соответствующая последовательности полной длины LY6G6F, помечена жирным шрифтом, тогда как последовательность EGFP помечена курсивом и подчеркнута. Аминокислотная последовательность полученного LY6G6F полной длины соединенного с EGFP (SEQ ID NO:56), показана на Фигуре 8; специфическая последовательность гена, соответствующая последовательности полной длины LY6G6F, помечена жирным шрифтом, тогда как последовательность EGFP помечена курсивом и подчеркнута.

ПРИМЕР 26
ОПРЕДЕЛЕНИЕ КЛЕТОЧНОЙ ЛОКАЛИЗАЦИИ LY6G6F
Для определения клеточной локализации белка LY6G6F использовали слитый белок LY6G6F-EGFP (SEQ ID NO:56). Локализацию белка LY6G6F исследовали при транзиентной трансфекции (Chen et al., Molecular vision 2002; 8; 372-388) с использованием конфокальной микроскопии. Клетки исследовали на присутствие флуоресцирующих продуктов через 48 часов после трансфекции.
Конструкт LY6G6F-EGFP pIRESpuro3, описанный выше, транзиентно трансфицировали в клетки HEK-293Т следующим образом.
Клетки HEK-293Т (АТСС, CRL-11268) высевали на стерильные стеклянные покровные стекла диаметром 13 мм (Marienfeld, № по каталогу: 01 115 30), которые помещали в 6-луночный планшет с использованием 2 мл предварительно нагретой DMEM [среда Игла, модифицированная по способу Дульбекко, Biological Industries (Бейт-ха-Емек, Израиль), № по каталогу: 01-055-1А] + 10% FBS (фетальная бычья сыворотка) + 4 мМ L-глутамина. 500000 клеток на лунку трансфицировали с помощью 2 мкг ДНК-конструкта с использованием 6 мкл реагента FuGENE 6 (Roche, № по каталогу: 11-814-443-001), разведенного в 94 мкл DMEM. Смесь инкубировали при комнатной температуре в течение 15 минут. Сложную смесь по каплям добавляли к клеткам и проводили взбалтывание вращением. Клетки помещали в инкубатор, поддерживали при 37°С с 5% содержанием СО2.
Через 48 часов после транзиентной трансфекции клетки дополнительно обрабатывали с целью анализа при помощи конфокальной микроскопии. Покровные стекла промывали 3 раза в фосфатно-солевом буфере (PBS) и фиксировали в течение 15 минут с помощью 3,7% параформальдегида (PFA) (Sigma, № по каталогу: Р-6148). После 2 промывок в PBS фиксированные покровные стекла приклеивали к предметному стеклу с помощью раствора для заключения (Sigma, № по каталогу: G0918), и исследовали клетки на присутствие флуоресцирующего продукта с помощью конфокальной микроскопии. Результаты представлены на Фигуре 9.
На Фигуре 9 показано, что при экспрессии в клетках HEK293Т слитый белок LY6G6F_EGFP (SEQ ID NO:56) локализуется в клеточной мембране. Изображение получено с помощью 40-кратного объектива конфокального микроскопа.
ПРИМЕР 27
КЛОНИРОВАНИЕ И ЭКСПРЕССИЯ СЛИТЫХ БЕЛКОВ FC IGg2A МЫШИ-ECD LY6G6F, VSIG10, ТМЕМ25 И LSR
Мышиные ортологи человеческих белков LY6G6F, VSIG10, ТМЕМ25 и LSR идентифицировали с использованием программного обеспечения BlastP Национального центра биотехнологической информации (NCBI) с использованием параметров по умолчанию и использовали для получения экспериментального доказательства представления, связанного с функциональностью слитых белков Ig-LY6G6F, -VSIG10, -ТМЕМ25 и/или -LSR на животной модели. Мышиные ортологи, соответствующие человеческим белкам LY6G6F, VSIG10, ТМЕМ25 и LSR, показаны в SEQ ID NO:20, 19, 9 и 21, соответственно. Аминокислотное выравнивание и сравнение человеческих белков LY6G6F, VSIG10, LSR и ТМЕМ25 с соответствующими мышиными ортологами показаны на Фигурах 5А, 5В, 5С и 5D, соответственно.
Каждая из кДНК-последовательностей мышиных белков ТМЕМ25 (SEQ ID NO:9), LY6G6F (SEQ ID NO:20), VSIG10 (SEQ ID NO:19) и LSR (SEQ ID NO:21) была слита с Fc-доменом мышиного IgG2aFc (SEQ ID NO:27). Во всех случаях для каждого ECD использовали соответствующий природный сигнальный пептид. Полученные слитые белки Ig mIgG2aFc- ECD LY6G6F, VSIG10, ТМЕМ25 или LSR (SEQ ID NO:23, 24, 25 или 26, соответственно) показаны на Фигурах 10A-D, соответственно.
Слитые белки mIgG2aFc-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR (SEQ ID NO:23, 24, 25, или 26, соответственно) клонировали в ретровирусные векторы GPEx® с последующей трансдукцией ретровирусных векторов в "собственную" клеточную линию CHO-S от Catalent. Получали объединенную популяцию и подтверждали ее продуктивность. Затем пул размножали и определяли относительную продуктивность и относительное число копий пула. Надосадочные жидкости клеточной культуры анализировали с помощью анализа ELISA на Fc от Catalent для подтверждения получения слитых белков mIgG2aFc-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR.
Растворы белков тестировали в отношении микробиологической нагрузки и эндотоксинов. Человеческие слитые белки, состоящие из человеческого ECD любого из ECD LY6G6F, VSIG10, ТМЕМ25 или LSR, слитого с IgG1 человека (как изображено на Фигуре 11), также экспрессировали с помощью аналогичной системы.
ОЦЕНКА ЭФФЕКТА СЛИТЫХ БЕЛКОВ Ig-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR НА АКТИВАЦИЮ МЫШИНЫХ И ЧЕЛОВЕЧЕСКИХ Т-КЛЕТОК IN VITRO:
ПРИМЕР 28:
ЭФФЕКТ СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR НА АКТИВАЦИЮ НАИВНЫХ CD4+ Т-КЛЕТОК DO11.10 С ПОМОЩЬЮ OVA-ПЕПТИДА
Наивные CD4+ Т-клетки выделяли из селезенки пяти мышей DO11.10 (Jackson) с помощью автоматического магнито-активированного клеточного сортинга: CD4-отрицательного сортинга (Miltenyi, № по каталогу 130-095-248), в том числе с антителом к CD25 (Miltenyi, № по каталогу 130-091-072) в коктейле отрицательного сортинга, с последующим CD62L-пoлoжитeльным сортингом (Miltenyi, № по каталогу 130-049-701). Также собирали общие спленоциты от одной мыши Balb/c и облучали дозой 3000 рад для того, чтобы они служили в качестве антигенпрезентирующих клеток (АРС) для CD4+ Т-клеток DO11.10. Наивные CD4+ Т-клетки культивировали при 5×105 клеток на лунку в плоскодонных 96-луночных планшетах с облученными АРС при соотношении 1:1 (АРС к Т-клеткам) в 200 мкл среды HL-1 и активировали с помощью 20 мкг/мл или 2 мкг/мл OVA323-339 в присутствии либо Ig-ECD ТМЕМ25 (SEQ ID NO:25), либо Ig-ECD LSR (SEQ ID NO:26), либо Ig-ECD LY6G6F (SEQ ID NO:23) в указанных концентрациях. В качестве положительных контролей использовали B7-H4-Ig (R&D Systems) или CTA4-Ig (мышиный ECD, слитый с mIgG2aFc). Изотипический контрольный Ig (mIgG2a, BioXCell, № по каталогу ВЕ0085) использовали в качестве отрицательного контроля. В клетки вводили радиоактивную метку с помощью 1 мкКи меченого тритием тимидина в 24 часа и собирали в 72 часа.
Как показано на Фигуре 30, Ig-ECD ТМЕМ25, Ig-ECD LSR и Ig-ECD LY6G6F вызывают дозозависимое ингибирование активации Т-клеток. Это было показано в качестве ингибирования пролиферации Т-клеток, индуцированной OVA323-339 при концентрации 20 мкг/мл (Фигуры 30 А-С, Е) или 2 мкг/мл (Фигура 30D).
Слитый белок Ig-ECD VSIG10 (SEQ ID NO:24) не проявлял активность в трех экспериментах, выполненных в аналогичном анализе.
ПРИМЕР 29:
ЭФФЕКТ СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR НА АКТИВАЦИЮ НАИВНЫХ CD4+ Т-КЛЕТОК С ПОМОЩЬЮ ГРАНУЛ, ПОКРЫТЫХ АНТИТЕЛАМИ К CD3/CD28
Наивные CD4+ Т-клетки выделяли из 5 мышей SJL (Harlan) с помощью автоматического магнито-активированного клеточного сортинга, как описано в предыдущем разделе. Гранулы покрывали антителом к CD3 (0,5 мкг/мл; клон 2С11) и антителом к CD28 (2 мкг/мл, клон 37.51 eBioscience) согласно протоколу производителя (Dynabeads М-450 Ероху, № по каталогу 140.11, Invitrogen), а также Ig-ECD LSR или изотипическим контролем mIgG2a (mIgG2a, BioXCell, № по каталогу ВЕ0085) с возрастающими концентрациями (0,1-10 мкг/мл). Общее количество белка, использованного для покрытия гранул Ig-ECD LSR, дополнили до 10 мкг/мл с помощью контрольного Ig. Наивные CD4+ Т-клетки (0,5×106/лунку) активировали покрытыми гранулами в соотношении 1:2 (гранулы к Т-клеткам). В клетки вводили радиоактивную метку с помощью 1 мкКи меченого тритием тимидина в 24 часа и собирали в 72 часа.
Ig-ECD LSR (SEQ ID NO:26) явно ингибирует пролиферацию Т-клеток и вызывает этот эффект дозозависимым образом (Фигура 31).
Слитые белки Ig-ECD ТМЕМ25, LY6G6F и VSIG10, показанные на Фигурах 10 и 11, тестировали в аналогичном анализе с аналогичными результатами.
ПРИМЕР 30
ДОЗОЗАВИСИМЫЙ ЭФФЕКТ СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 ИЛИ LSR НА АКТИВАЦИЮ МЫШИНЫХ CD4+ Т-КЛЕТОК С ПОМОЩЬЮ СВЯЗАННЫХ С ПЛАНШЕТОМ АНТИТЕЛ К CD3, ПРОЯВЛЯЕМЫЙ В ПРОДУКЦИИ ЦИТОКИНОВ И ЭКСПРЕССИИ МАРКЕРА АКТИВАЦИИ CD69.
Интактные CD4+CD25- Т-клетки выделяли из пулов клеток селезенки и лимфоузлов из мышей линии BALB/C путем негативной селекции с использованием набора для выделения CD4+CD62L+ Т клеток (Miltenyi, № по каталогу 130-093-227) в соответствии с инструкциями производителя. Чистота полученных клеток составила >95%.
96-луночные планшеты для тканевых культур покрывали в течение ночи при 4°С с помощью 2 мкг/мл mAb к CD3 (клон 145-2С11) в присутствии слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR (SEQ ID NO:23, 24, 25 и 26, соответственно) из расчета 1, 5 и 10 мкг/мл. Контрольный mIgG2a (клон С1.18.4 от BioXCell, № по каталогу ВЕ0085) добавляли в каждую лунку для того, чтобы дополнить общую концентрацию белка до 12 мкг/мл на лунку. В лунки высевали 1×105 CD4+CD25- Т-клеток на лунку. Через 48 часов после стимуляции культуральные над осадочные жидкости собирали и анализировали с помощью набора ELISA для мышиного IFNγ, и клетки анализировали в отношении экспрессии маркера активации CD69 методом проточной цитометрии.
Результаты, показанные на Фигуре 32, демонстрируют ингибирующие эффекты слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR на активацию CD4 Т-клеток, что проявляется снижением секреции IFNγ (Фигура 32А) и снижением экспрессии CD69 (Фигура 32В) после стимуляции TCR в сравнении с контрольными mIgG2a и CTLA4-Ig.
ПРИМЕР 31
ЭФФЕКТ СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR НА ДИФФЕРЕНЦИРОВКУ CD4+ Т-КЛЕТОК IN VITRO.
Для тестирования способности слитых белков Ig-LY6G6F, -VSIG10, -ТМЕМ25 и -LSR ингибировать дифференцировку CD4+ Т-клеток, наивные CD4+ Т-клетки выделяли у мышей DO11.10, которые были трансгенными по Т-клеточному рецептору (TCR), который специфичен к пептиду OVA323-339. Использование Т-клеток DO11.10 дает возможность изучать как поликлональные (mAb к CD3/CD28), так и пептид-специфические ответы на одной популяции CD4+ Т-клеток. Наивные CD4+ Т-клетки выделяли у мышей DO11.10 и активировали в культуре в присутствии гранул, покрытых антителами к CD3/CD28, или пептида OVA323-339 плюс облученные спленоциты мышей BALB/c в присутствии слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR, контрольного Ig или В7-Н4 Ig. Клетки активировали в присутствии следующих условий, стимулирующих Th: клетка Th0 - (IL-2), клетка Тh1 - (IL-2+IL-12), клетка Th2 - (IL-2+IL-4) или клетка Тh17 - (TGF-β+IL-6+IL-23+антитело к IL-2). Эффекты на дифференциацию Т-клеток и Th-специфических ответов оценивали путем измерения пролиферации клеток и подтип-специфической продукции цитокинов: IL-4, IL-5, IL-10, IL-17, IFN-γ.
ПРИМЕР 32
ОЦЕНКА ЭФФЕКТА СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR НА АКТИВАЦИЮ ЧЕЛОВЕЧЕСКИХ Т-КЛЕТОК.
Эффект слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR на ответ человеческих Т-клеток тестировали с помощью двух различных анализов in vitro с использованием очищенных человеческих Т-клеток. В первом анализе человеческие Т-клетки активировали с помощью гранул, покрытых антителами к CD3 и CD28, а в другом анализе активацию выполняли с использованием антител к CD3 и CD28 в присутствии аутологичных, облученных РВМС. Регулирующую активность слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR на активацию человеческих Т-клеток оценивали путем измерения пролиферации клеток и высвобождения цитокинов.
Исследование I - Активация человеческих Т-клеток с помощью гранул, покрытых антителами к CD3 и CD28, ингибируется слитыми белками
Наивные CD4+ Т-клетки выделяли у 4 здоровых доноров-людей и активировали с помощью гранул, покрытых mAb к CD3/mAb к CD28, в присутствии контрольного mIgG2a, или любого из слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR. Получали два параллельных набора культур; в одну культуру вводили радиоактивную метку в 24 часа с помощью меченого тритием тимидина и собирали ее в 72 часа, а во втором планшете сбор проводили в 96 часов для оценки продукции цитокинов с помощью LiquiChip.
Исследование II - Активация человеческих Т-клеток с помощью облученных аутологичных РВМС ингибируется слитыми белками
Общие РВМС выделяли из свежей крови здоровых доноров-людей с использованием градиента фиколла. 10×1016 общих РВМС ресуспендировали в среде Ex-Vivo 20 и облучали дозой 3000 рад. Эти клетки использовали для активации выделенных Т-клеток in vitro в присутствии антитела к CD3, антитела к CD28 и какого-либо из исследуемых белков. Остаток РВМС использовали для выделения Т-клеток с помощью набора для выделения CD4+ Т клеток II от Miltenyi.
Для активации 5×105 выделенных Т-клеток культивировали в присутствии 5×105 аутологичных облученных РВМС. Антитело к CD3 (0,5 мкг/мл), антитело к CD28 (2 мкг/мл) и либо слитые белки Ig-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR, либо контрольный Ig (mIgG2a) добавляли в растворенной форме. В культуры вводили радиоактивную метку с помощью 1 мкКи меченого тритием тимидина в 24 часа и измеряли пролиферацию в 72 часа.
ПРИМЕР 33
ЭФФЕКТ БЕЛКОВ LY6G6F, ТМЕМ25 И LSR ПРИ ЭКТОПИЧЕСКОЙ ЭКСПРЕССИИ В АРС-ПОДОБНЫХ КЛЕТКАХ НА ОТВЕТЫ ЧЕЛОВЕЧЕСКИХ Т-КЛЕТОК
Эффекты LY6G6F, ТМЕМ25 и LSR на ответы человеческих Т-клеток оценивали после их эктопической экспрессии в "клетках, стимулирующих Т-клетки": клеточной линии тимомы мышей, Bw5147, разработанной для экспрессии мембрано-связанных фрагментов антител против CD3 человека, индуцирующих TCR-комплекс на человеческих Т-клетках, с совместной экспрессией предполагаемых костимулирующих или коингибирующих лигандов или без такой совместной экспрессии.
Кодон-оптимизированные кДНК, кодирующие LY6G6F (SEQ ID NO:1), ТМЕМ25 (SEQ ID NO:7) и LSR (SEQ ID NO:11), синтезировали с помощью химического синтеза и напрямую клонировали в ретровирусный вектор pCJK2 посредством сайтов Sfi-I. Получали моноцистронные конструкты экспрессии. Конструкты подтверждали с помощью электрофореза в агарозном геле и экспрессировали в клетках Bw5147, демонстрирующих высокие уровни антитела к CD3, связанного с мембраной, (Bw-3/2) (Leitner et al., 2010). В качестве отрицательного контроля использовали клетки Bw5147, трансдуцированные "пустым" вектором (pCJK2). Кроме того, в качестве контролей также использовали Bw-3/2-клетки, экспрессирующие костимулирующие молекулы (ICOSL и CD70), и Bw-3/2-клетки, экспрессирующие коингибирующие молекулы (В7-Н3 и В7-H1/PD-L1). Однородно высокую экспрессию стимулирующего связанного с мембраной антитела к CD3 подтверждали методом FACS с использованием антитела к IgG мыши (H+L), конъюгированного с DyLight-649, которое реагирует с мышиным одноцепочечным антителом, экспрессируемым на стимулирующих клетках. Присутствие и высокий уровень транскрипции моноцистронных конструктов экспрессии в соответствующих стимулирующих клетках подтверждали с помощью qPCR.
Т-клетки очищали из лейкоцитарных пленок или гепаринизированной крови, полученной от здоровых доноров-добровольцев, и мононуклеарную фракцию получали стандартным центрифугированием в градиенте плотности с использованием Ficoll-Paque (GE-Healthcare). Основной объем интактных человеческих Т-клеток получили с помощью MACS-истощения CD11b, CD14, CD16, CD19, CD33 и клеток, несущих МНС класса II, с помощью соответствующего биотинилированного mAb вместе со стрептавидиновыми парамагнитными гранулами (Leitner et al., 2009). Очищенные CD8 Т-клетки и CD4 Т-клетки получали путем добавления биотинилированного mAb к CD4 и CD8 к пулам. Наивные CD4 Т-клетки выделяли с использованием набора Naive CD4+T cell Isolation Kit II (Miltenyi Biotec). После выделения клетки проанализировали в отношении чистоты с помощью FACS, и образцы с достаточной чистотой (>90%) использовали для экспериментов.
Стимулирующие клетки собирали, подсчитывали, облучали (2×3000 рад) и высевали в плоскодонные 96-луночные планшеты (20000 клеток/лунку). Т-клетки, очищенные с помощью MACS и хранившиеся в жидком азоте, оттаивали, подсчитывали и добавляли в лунки из расчета 100000 клеток на лунку; общий объем составлял 200 мкл/лунку. Для каждого состояния подготовили лунки в трех повторностях. Через 48 часов совместного культивирования в лунки добавляли3H-тимидин (конечная концентрация 0,025 мКи; PerkinElmer/NewEngland Nuclear Corporation, Уэлсли, Массачуссетс). После дополнительного культивирования в течение 18 часов планшеты собирали на фильтровальных планшетах и определяли включение3H-тимидина, как описано в Pfistershammer et al., 2004. Кроме того, выполняли серию экспериментов с субпопуляциями Т-клеток (CD8 Т-клетки, СD4Т-клетки и наивные СD45RA-позитивные CD4 Т-клетки), очищенными с помощью MACS. Дополнительные контроли во всех экспериментах включали лунки исключительно со стимулирующими клетками для микроскопической оценки клеток, а также для определения основного уровня включения3H-тимидина в стимулирующие клетки в отсутствие Т-клеток. Результаты со стимулирующими клетками, которые быстро дезинтегрировали после облучения, исключали из анализа.
Результаты, показанные на Фигуре 33, представляют собой среднее по нескольким экспериментам и показывают эффект стимулирующих клеток, экспрессирующих LY6G6F, ТМЕМ25 или LSR, на пролиферацию основного объема человеческих Т-клеток (Фигура 33А), CD4+ Т-клеток (Фигура 33B), CD8+ Т-клеток (Фигура 33С) или наивных CD4 CD45RA+ Т-клеток (Фигура 33D). Экспрессия контрольных костимулирующих молекул (ICOSL и CD70) приводила к устойчивой и выраженной стимуляции пролиферации всех подтипов клеток. Аналогично экспрессии контрольных коингибирующих молекул (В7-Н3 и B7-H1/PD-L1), которая приводила к умеренному ингибированию пролиферации различных подтипов Т-клеток, экспрессия LY6G6F, ТМЕМ25 и LSR также приводила к умеренному ингибированию пролиферации Т-клеток с наиболее выраженными ингибирующими эффектами, проявляющимися на CD8+ Т-клетках.
ПРИМЕР 34
ХАРАКТЕРИСТИКА КЛЕТОК-МИШЕНЕЙ ДЛЯ БЕЛКОВ LY6G6F, VSIG10, ТМЕМ25 И/ИЛИ LSR ПУТЕМ ОПРЕДЕЛЕНИЯ ИХ ПРОФИЛЕЙ СВЯЗЫВАНИЯ С ИММУННЫМИ КЛЕТКАМИ
Спленоциты от мышей DO11.10 (трансгенные мышей, у которых все CD4+ Т-клетки экспрессируют Т-клеточный рецептор, специфический к пептиду OVA323-339) активировали в присутствии пептида OVA323-339, и клетки собирали в t=0, 6, 12, 24 и 48 часов после начальной активации для определения того, какой тип клеток экспрессирует рецептор к LY6G6F, VSIG10, ТМЕМ25 и/или LSR с течением времени. Затем клетки совместно окрашивали на CD3, CD4, CD8, В220, CD19, CD11b и CD11c.
ПРИМЕР 35
ОЦЕНКА ЭФФЕКТА СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR НА СПОСОБНОСТЬ В-КЛЕТОК К ПЕРЕКЛЮЧЕНИЮ КЛАССА И СЕКРЕЦИИ АНТИТЕЛ
Непростимулированные В-клетки выделяли из непримированных мышей C57BL/6 и активировали in vitro в присутствии антитела к CD40 плюс (i) в отсутствие экзогенного цитокина, (ii) IL-4 или (iii) IFN-γ. Во время постановки культуры клеточные культуры получали контрольный Ig (mIgG2a), mAb к CD86 (в качестве положительного контроля в отношении увеличенной выработки Ig) или любой из слитых белков ECD LY6G6F, VSIG10, ТМЕМ25 и LSR, описанных в Примере 5 в данном документе, и их культивировали в течение 5 дней. Каждый из слитых белков ECD LY6G6F, VSIG10, ТМЕМ25 и LSR тестировали при трех концентрациях. В конце культивирования надосадочные жидкости тестировали на наличие IgM, IgG1 и IgG2a с помощью ELISA. Если оказывалось, что имеется изменение в способности В-клеток к переключению класса на один изотип антитела в противовес другого, тогда ряд В-клеток, характеризующихся переключенным классом, определяли с помощью ELISPOT. Если имелось изменение числа антитело-продуцирующих клеток, тогда определяли, есть ли изменение в уровне γ1- и γ2а-стерильных транскриптов по сравнению со зрелыми транскриптами для IgG1 и IgG2a.
ОЦЕНКА ТЕРАПЕВТИЧЕСКОГО ЭФФЕКТА СЛИТЫХ БЕЛКОВ Ig-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR НА ЛЕЧЕНИЕ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ
ПРИМЕР 36:
ЭФФЕКТИВНОСТЬ СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR НА МЫШИНОЙ R-EAE-МОДЕЛИ РАССЕЯННОГО СКЛЕРОЗА
Терапевтический эффект слитых белков Ig-ECD ТМЕМ25, Ig-ECD LSR и Ig-ECD VSIG10 (SEQ ID NO:25, 26 и 24, соответственно) на лечение аутоиммунных заболеваний испытывали на мышиной модели рассеянного склероза; рецидивирующе-ремиттирующего экспериментального аутоиммунного энцефаломиелита (R-EAE):
Самок мышей SJL в возрасте 6 недель приобрели у Harlan и содержали в лаборатории ССМ в течение 1 недели до начала эксперимента. Мышей случайным образом распределяли на группы по 10 животных и примировали с помощью 50 мкг PLP139-151/CFA в день 0. Мыши получили 6 i.p. инъекций по 100 мкг/дозу Ig-ECD ТМЕМ25 (SEQ ID NO:25), Ig-ECD LSR (SEQ ID NO:26), изотипического контрольного mIgG2a или CTLA4-Ig (мышиный ECD, слитый с Fc IgG2a мыши) в качестве положительного контроля. Лечение начали во время наступления ремиссии заболевания и давали 3 раза в неделю в течение 2 недель. Мышей наблюдали в отношении симптомов заболевания. На день 35 (во время пика рецидива заболевания) 5 мышей из каждой группы анализировали в отношении DTH-ответа (гиперчувствительности замедленного типа) на вызывающий болезнь эпитоп (PLP139-151) и на ассоциированный с рецидивом эпитоп миелина (PLP178-191) с помощью инъекции 10 мкг PLP139-151 в одно ухо и PLP178-191 в противоположное ухо. Степень отека уха анализировали через 24 часа после введения вещества.
В настоящем Примере показано выраженное снижение тяжести заболевания у мышей с индуцированным R-EAE после лечения с помощью Ig-ECD ТМЕМ25 (SEQ ID NO:25) или Ig-ECD LSR (SEQ ID NO:26) в терапевтическом режиме с 100 мкг/дозу 3 раза в неделю, как показано на Фигуре 34А. Степень ингибирования был аналогична CTLA4-Ig.
Кроме того, лечение мышей с R-EAE с использованием Ig-ECD ТМЕМ25 (SEQ ID NO:25) или Ig-ECD LSR (SEQ ID NO:26) значительно ингибирует DTH-ответы на вызывающий заболевание эпитоп (PLP139-151), а также ассоциированный с рецидивом эпитоп (PLP178-191) на день 35 (Фигура 34B).
Для проверки дозовой зависимости эффективности Ig-ECD ТМЕМ25 (SEQ ID NO:25), а также способа его действия на PLP-индуцированной модели R-EAE, болезнь индуцировали, как описано выше, и мышей лечили с начала ремиссии заболевания с помощью 100, 30 или 10 мкг/дозу Ig-ECD ТМЕМ25 3 раза в неделю в течение двух недель. Ig-ECD ТМЕМ25 снижал степень тяжести заболевания дозозависимым образом, как показано с помощью более умеренного эффекта, наблюдаемого при самой низкой протестированной дозе (10 мкг/дозу), что значительно отличалось от эффекта высокой дозы (100 мкг/дозу) (Фигура 35А). Ig-ECD ТМЕМ25 также ингибировал DTH-ответы на рассеянные эпитопы PLP178-191 и на МВР84-104 в дни 45 и 76 (Фигура 35B). Кроме того, Ig-ECD ТМЕМ25 ингибировал вторичные ответы спленоцитов в день 45 и день 76 и клеток шейных лимфоузлов в день 45 на PLP139-151, PLP178-191 и МВР84-104 (Фигуры 35С и 35D). Это, в основном, проявлялось в ингибировании пролиферации, а также снижении высвобождения IFNγ и IL-17. Ig-ECD TMEM25 также ингибировал высвобождение IL-4 и IL-10 из клеток шейных лимфоузлов мышей, обработанных Ig-ECD TMEM25 при 30 мкг/дозу. При этих условиях не наблюдали стабильного эффекта на высвобождение IL-4 и IL-10 из спленоцитов.
Благоприятный эффект Ig-ECD TMEM25 (SEQ ID NO:25) в R-EAE-модели также сопровождался значительным снижением инфильтрации иммунных клеток в CNS (Фигура 35Е). Хотя ни одна из протестированных в CNS линий не характеризовалась значимыми изменениями, наблюдалась явная тенденция к снижению CD4+ Т-клеток и Dc (CD11C+) и некоторое увеличение популяции В-клеток (CD19+), хотя они не достигали статистической значимости (Фигура 35Е).
Ig-ECD VSIG10 (SEQ ID NO:24) также тестировали на PLP-индуцированной модели R-EAE, описанной выше. Лечение начали в день наступления ремиссии и давали 100 мкг/дозу 3 раза в неделю в течение 2 недель. Ig-ECD VSIG10 значительно снижал тяжесть заболевания, что проявлялось в снижение оценки заболевания (Фигура 36А). Благоприятный эффект Ig-ECD VSIG10 в этой модели также сопровождался ингибированием в день 45 и день 76 DTH-ответов на рассеянные эпитопы PLP178-191 и на МВР84-104 (Фигура 36В). Кроме того, Ig-ECD VSIG10 (SEQ ID NO:24) ингибировал вторичные ответы спленоцитов и клеток дренирующего (шейного) лимфоузла, взятых в день 45 в ответ на активацию индуцирующим эпитопом PLP139-151 или рассеянными эпитопами PLP178-191 и МВР84-104 (Фигуры 36С и 36D). Это проявлялось в ингибировании клеточной пролиферации, а также секреции IFNγ, IL-17, IL-4 и IL-10.
Примечательно, что на день 76 Ig-ECD VSIG10 (SEQ ID NO:24) ингибировал только индуцированную МВР84-104 пролиферацию спленоцитов, но не пролиферацию, индуцированную ранними эпитопами миелина (Фигура 36С). Лечение с помощью Ig-ECD VSIG10 на модели R-EAE также значительно снижало инфильтрацию иммунных клеток в CNS, что сопровождалось очевидным, но не значительным повышением количества клеток в лимфоузлах (Фигура 36Е). Основным клеточным подтипом, который снижался в CNS, были CD4+ Т-клетки, однако наблюдалась также явная тенденция к снижению CD19+ В-клеток и CD11c+Dc в CNS. Все эти подтипы иммунных клеток были значительно повышены в лимфоузлах, что свидетельствует о том, что Ig-ECD VSIG10 может ингибировать направленное перемещение иммунных клеток из лимфоузлов в CNS.
Слитый белок Ig-ECD LY6G6F изучали на аналогичной модели рассеянного склероза.
ПРИМЕР 37:
ЭФФЕКТИВНОСТЬ СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR НА МЫШИНЫХ СIА-МОДЕЛЯХ РЕВМАТОИДНОГО АРТРИТА
Исследование I: Ig-ECD LSR (SEQ ID NO:26) тестировали на мышиной модели индуцированного коллагеном артрита (CIA), который представляет собой модель ревматоидного артрита. Самцов мышей DBA/I размещали в группах по 8-10 и содержали при 21°С±2°С, 12-часовом цикле свет/темнота, с пищей и водой ad libitum. Артрит индуцировали посредством иммунизации коллагеном типа II, эмульгированным в полном адъюванте Фрейнда. Мышей ежедневно контролировали в отношении признаков артрита. С появлением артрита (день 1) начинали лечение с помощью Ig-ECD LSR (SEQ ID NO:26), изотипического контрольного mIgG2a или CTLA4-Ig (мышиный ECD, слитый с Fc IgG2a мыши) в качестве положительного контроля (100 мкг/дозу каждый) и давали 3 раза в неделю в течение 10 дней. Измеряли отек подушечки задней лапы (с помощью микрометра), а также количество и степень поражения суставов на всех четырех конечностей. Это давало два измерения, клиническую оценку и толщину подушечки, которые можно использовать для статистической оценки.
В конце периода лечения у мышей брали кровь и их забивали. Для гистологического анализа лапы удаляли post mortem, фиксировали в забуференном формалине (10% объем/объем), затем декальцинировали в EDTA в забуференном формалине (5,5% вес/объем). Затем ткани заливали в парафин, изготовляли срезы и окрашивали гематоксилином и эозином. Использовали следующую систему оценки: 0 = норма, 1 = синовит, при этом отсутствует потеря хрящевой ткани и костные эрозии или они ограничены дискретными очагами, 2 = присутствуют синовит и значительная эрозия, но нормальная архитектура сустава интактна; 3 = синовит, обширные эрозии, архитектура сустава нарушена.
В настоящем Примере показано, что лечение мышей с развившимся CIA с помощью Ig-ECD LSR при 100 мкг/дозу 3 раза в неделю в течение 10 дней приводило к сильному снижению клинической оценки (Фигура 37А), отека лапы (Фигура 37B) и гистологического повреждения (Фигура 37С). Эффективность Ig-ECD LSR (SEQ ID NO:26) была аналогичной эффективности CTLA4-Ig.
Эффективность Ig-ECD ТМЕМ25, Ig-ECD VSIG10 и Ig-ECD LY6G6F оценивали в этой модели CIA.
Лечение с помощью Ig-ECD ТМЕМ25 (SEQ ID NO:25) или с Ig-ECD LSR (SEQ ID NO:26) не показало эффективности на более тяжелой модели CIA, в которой давали бустерную дозу коллагена типа II, эмульгированного в полном адъюванте Фрейнда, на день 21. При этом тяжелом CIA Enbrel, положительный контроль, который давали по такой же схеме и дозировке, характеризовался очень слабой эффективностью. Лечение с помощью Ig-ECD TMEM25 также не показывало терапевтического эффекта на модели CIA с бустерной дозой коллагена типа II без адъюванта на день 21.
Исследование II: Эффективность слитого белка Ig-ECD LY6G6F на модели CIA изучали с использованием модифицированной модели CIA следующим образом: самок мышей DBA/1 (Taconic Farms, возраст 9-11 недель) акклиматизировали в течение 7 дней. В день 0 мышей иммунизировали куриным коллагеном/CFA, 0,05 мл эмульсии ЕK-0210/мышь (Hooke Laboratories, Inc.) и в день 20 ввели бустерную дозу куриного коллагена/IFA, 0,05 мл эмульсии ЕK-0211/мышь (Hooke Laboratories, Inc.). Мышей ежедневно оценивали и зачислили в одну из следующих групп лечения в день появления артрита:
Группа 1: Ig-ECD LY6G6F (SEQ ID NO:23), i.p., Q2D, 30 мг/кг в течение 2 недель, 10 мл/кг.
Группа 2: Среда (PBS) Q2D, в течение 2 недель, 10 мл/кг (отрицательный контроль).
С момента зачисления мышей оценивали через день в отношении клинических признаков и анкилоза в соответствии со следующей системой оценки:
Клиническая оценка:
Оценка анкилоза:
В настоящем Примере показано, что лечение мышей с развившимся CIA с помощью 30 мг/кг Ig-ECD LY6G6F Q2D в течение 2 недель с начала артрита приводило к облегчению заболевания, что проявлялось в снижении оценки заболевания (Фигура 38).
Эффективность Ig-ECD VSIG10 (SEQ ID NO:24) и Ig-ECD TMEM25 (SEQ ID NO:25) оценивали на аналогичной модели.
Исследование III: эффект слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR на индукцию толерантности на модели переноса CIA. Для дальнейшего понимания эффекта слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR на иммунную регуляцию анализировали способность этих белков индуцировать толерантность на модели переноса артрита.
Коротко, клетки селезенки и LN мышей DBA/1 с артритом, которых лечили в течение 10 дней слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR (SEQ ID NO:23, 24, 25 и 26, соответственно) или контрольным Ig2a, извлекали и вводили i.p. реципиентам С.В-17 SCID с дефицитом по Т-клеткам. Затем мышам инъецировали 100 мкг коллагена типа II (без CFA), что было необходимо для успешного переноса артрита. Затем артрит контролировали у мышей SCID. Выполняли гистологическое исследование и измеряли уровни антител к коллагену, чтобы определить, предоставляют ли слитые белки Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR долгосрочную защиту от болезни.
ПРИМЕР 38
ОЦЕНКА ЭФФЕКТА СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 И LSR НА МОДЕЛИ ВИРУСНОЙ ИНФЕКЦИИ TMEV
Вирус мышиного энцефаломиелита Тайлера (TMEV) является природным эндемичным патогеном мышей, вызывающим индуцированное демиелинизирующее заболевание (TMEV-IDD) у восприимчивых линий мышей (SJL/J, H-2KS), которое напоминает первичную прогрессирующую форму MS (Munz et al., Nat. Rev. Immunol. 2009; 9:246-58). Заражение TMEV вызывает пожизненную хроническую вирусную инфекцию CNS, ведущую к развитию хронического опосредованного Т-клетками аутоиммунного демиелинизирующего заболевания, инициируемого активацией de novo ответов CD4 Т-клеток на эндогенные эпитопы миелина в воспаленной CNS (т.е. на рассеяние эпитопа) (Miller et al., Nat. Med. 1997; 3:1133-6; Katz-Levy et al., J. Clin. Invest. 1999; 104:599-610).
Мыши SJL выводят большую часть вирусов в течение 21 дня после заражения, однако скрытая вирусная инфекция сохраняется и инфицирует микроглию, астроциты и нейроны. Симптомы заболевания проявляются приблизительно на день 25-30 после заражения.
Эффект лечения с помощью слитых белков Ig LY6G6F, VSIG10, ТМЕМ25 или LSR (SEQ ID NO:23, 24, 25 и 26, соответственно) острой и хронической фаз вирусной инфекции изучали на модели TMEV-IDD с помощью оценки клиренса вируса и тяжести заболевания.
Способ:
Самок мышей SJL/J (5-6 недель) инфицировали TMEV путем внутричерепной инокуляции в правое полушарие большого мозга 3×107 бляшкообразующих единиц (PFU) TMEV штамма ВеАn 8386 в 30 мкл бессывороточной среды. Начиная от дня 2 после заражения мышей лечили контрольным Ig, слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR по 100 мкг/дозу каждого; 3 дозы в неделю в течение 2 недель.
Мышей наблюдали в отношении клинической оценки. В день 7 и день 14 после заражения (после 3 и 6 обработок, соответственно) у 5 мышей в каждой группе лечения собирали головной мозг и спинной мозг для анализа бляшкообразования. Ткани взвешивали для того, чтобы можно было рассчитать отношение PFU/мг ткани CNS после завершения анализа бляшкообразования.
Анализ бляшкообразования TMEV:
Головной мозг и спинной мозг мышей, обработанных контрольным Ig (мышиный IgG2a) или каждым из слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR (SEQ ID NO:23, 24, 25 и 26, соответственно), собирали в дни 7 и 14 после заражения у неперфузированных анестезированных мышей. Головной мозг и спинной мозг взвешивали и гомогенизировали. Гомогенаты CNS серийно разводили в DMEM и добавляли в чашки с обработанной тканевой культурой из конфлюэнтных клеток ВНК-21 для инкубации в течение 1 часа при комнатной температуре с периодическими легким встряхиванием.
Раствор среда/агар смешивали 1:1 (объем:объем), добавляли к клеткам и давали возможность застыть при комнатной температуре. Затем чашки культивировали при 34°С в течение 5 дней. В конце культивирования добавляли 1 мл формалина и инкубировали при комнатной температуре в течение 1 часа, чтобы зафиксировать монослой ВНК. Формалин сливали в контейнер для отходов, а агар с чашек удаляли. Бляшки визуализировали посредством окрашивания кристаллическим фиолетовым в течение 5 минут, и чашки осторожно промывали diH2O. Для определения PFU/мл гомогената количество бляшек в каждой чашке умножали на коэффициент разбавления гомогената и делили на количество гомогената, добавленного на планшет. PFU/мл делят на массу ткани для вычисления PFU/мг ткани.
ПРИМЕР 39
ОЦЕНКА ЭФФЕКТА СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 И LSR НА ПЕРВИЧНЫЙ И ВТОРИЧНЫЙ ИММУННЫЙ ОТВЕТ НА ВИРУСНУЮ ИНФЕКЦИЮ НА МЫШИНОЙ МОДЕЛИ ГРИППА
Для тестирования эффекта слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR (SEQ ID NO:23, 24, 25 и 26, соответственно) на первичный и вторичный иммунный ответ на вирусную инфекцию использовали наивных мышей BALB/c (для первичного иммунного ответа) и "мышей с памятью в отношении НА", а также "мышей с поликлональной памятью в отношении гриппа" (для оценки вторичных ответов, опосредованных CD4 Т-клетками памяти), которых получали, как описано в Teijaro et al., J. Immunol. 2009:182; 5430-5438, и описано ниже.
Для получения "мышей с памятью в отношении НА" сначала получали НА-специфические CD4 Т-клетки памяти, наивные CD4 Т-клетки очищали из селезенки мышей HA-TCR [мыши BALB/c-HA, которые экспрессируют трансгенный Т-клеточный рецептор (TCR), специфический к пептиду (110-119) гемагглютинина (НА) гриппа] и примировали in vitro с помощью культивирования с 5,0 мкг/мл пептида НА и обработанными митомицином С, Т-обедненными спленоцитами BALB/c в качестве АРС в течение 3 дней при 37°С. Полученные активированные НА-специфические эффекторные клетки переносили в конгенных хозяев BALB/c (Thy 1.1) (5×106клеток/мышь) с получением "мышей с памятью в отношении НА" со стабильной популяцией НА-специфических CD4 Т-клеток памяти.
Для получения "мышей с поликлональной памятью" сначала создавали поликлональные специфические в отношении гриппа CD4 Т-клетки памяти путем интраназального заражения мышей BALB/c с помощью сублетальной дозы вируса гриппа PR8, CD4 Т-клетки выделяли через 2-4 месяца после заражения, и частоту специфичных в отношении гриппа CD4 Т-клеток памяти определяли с помощью ELISPOT. CD4 Т-клетки от предварительно примированных мышей переносили в хозяев BALB/c для создания мышей "с поликлональной памятью в отношении гриппа" с полным комплектом эндогенных Т-клеток.
Первичный и вторичный ответы в отношении вируса гриппа тестировали посредством заражения наивных мышей BALB/c или мышей BALB/c с памятью в отношении НА и мышей BALB/c "с поликлональной памятью в отношении грипп" сублетальными или летальными дозами вируса гриппа PR8 путем интраназального введения.
Мышей обрабатывали слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR или контрольным mIgG2a до и после контрольного заражения гриппом. Потерю веса и смертность контролировали ежедневно. Через шесть дней после контрольного заражения содержание вируса в бронхоальвеолярном лаваже (BAL) анализировали путем сбора промывной жидкости и тестирования надосадочной жидкости на содержание вирусов путем определения 50% инфекционной дозы для тканевой культуры (TCID50) в клетках MDCK. Кроме того, выполняли гистопатологическое исследование легочной ткани.
Для тестирования эффекта слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR на размножение Т-клеток мышей BALB/c или мышей BALB/C с памятью в отношении НА или мышей BALB/c "с поликлональной памятью в отношении гриппа" заражали, как указано выше, и вводили BrdU (1 мг/дозу) в дни 3, 4 и 5 после заражения. В день 6 селезенку и легкие собирали и оценивали включение BrdU. Продукцию цитокинов CD4 Т-клетками памяти легких во время контрольного заражения гриппом также изучали на НА-специфических CD4 Т-клетках памяти, стимулированных in vitro с помощью пептида НА в присутствии слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR или IgG2a в течение 18 часов.
ПРИМЕР 40
ОЦЕНКА ЭФФЕКТА СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 И LSR НА ПЕРВИЧНЫЙ И ВТОРИЧНЫЙ ОТВЕТ CD8 Т-КЛЕТОК НА ВИРУСНУЮ ИНФЕКЦИЮ В МЫШИНОЙ МОДЕЛИ ГРИППА
Эффект слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR (SEQ ID NO:23, 24, 25 и 26, соответственно) на первичный ответ CD8 Т-клеток на вирус гриппа исследуют в соответствии со способами, описанными в литературе (Hendriks et al., J. Immunol 2005; 175, 1665-1676; Bertram et al., J. Immunol 2004; 172:981-8) с использованием мышей C57BL/6, инфицированных вирусом гриппа А НKx31 путем интраназального или внутрибрюшинного введения. Слитые белки Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR или контрольный mIgG2a вводят во время примирования. Потерю веса и смертность животных контролируют ежедневно. Для отслеживания вирус-специфических CD8+ Т-клеток используют тетрамеры МНС H-2Db, нагруженные основным эпитопом Т-клеток CD8, пептидом NP366-374. Количество вирус-специфических CD8+ Т-клеток H-2Db/NP366-374+ в легких, дренирующих лимфоузлах и селезенке, как ожидается, достигнет пика приблизительно на 8-10 день после инфицирования и в дальнейшем уменьшится до только 1,5% вирус-специфических CD8 Т-клеток (Hendriks et al., J. Immunol. 2005, 175; 1665-1676; Bertram et al., J. Immunol. 2002; 168:3777-85; Bertram et al., J. Immunol. 2004; 172:981-8). Таким образом, мышей умерщвляют на дни 8 и 21 после инфицирования и количество вирус-специфических CD8 Т-клеток оценивают в легких, дренирующих лимфатических узлах и селезенке. Оценивают клиренс вируса. Ответы CD8 Т-клеток оценивают в суспензии клеток селезенки, что включает внесение внутриклеточной метки в IFN-γ и СТL-активность, как описано ранее (Bertram et al., J. Immunol. 2004; 172:981-8) и подробно описано ниже.
Клетки поверхностно помечают FITC-конъюгированным антителом к мышиному CD62L, РЕ-конъюгированным антителом к мышиному CD8 для измерения активированных CD8+ Т-клеток (или антителом к мышиному CD4 для отслеживания клеток CD4+). В дополнение к этим Аb меченые аллофикоцианином тетрамеры, состоящие из мышиных молекул H-2Db класса I МНС, β2-микроглобулина, и NP-пептид гриппа, NP366-374, используют для измерения гриппо-специфических CD8 Т-клеток. Для внесения внутриклеточной метки в IFN-γ клеточные суспензии повторно стимулируют в культуральной среде в течение 6 ч при 37°C с 1 мкМ пептида NP366-374 и GolgiStop (BD PharMingen, Сан Диего, Калифорния). Затем клетки собирают, ресуспендируют в PBS/2% FCS/азид и вносят поверхностную метку при помощи РЕ-антитела к CD8 и FITC-антитела к CD62L, как описано выше. После внесения поверхностной метки клетки фиксируют в растворе Cytofix/Cytoperm (BD Pharmingen), а затем помечают с помощью конъюгированного с аллофикоцианином антителом к мышиному IFN-γ, разведенного в 1X растворе проницаемости/промывки (BD PharMingen). Образцы анализируют с помощью проточной цитометрии.
Для анализов цитотоксичности (CTL ответы) спленоциты из инфицированных гриппом мышей инкубируют в течение 2 ч при 37°С, чтобы удалить адгезивные клетки. Серийные 3-кратные разведения эффекторов анализируют на противогриппозную NP366-374-специфическую CTL-активность против51Cr-меченых клеток EL4, активированных 50 мкМ пептида NP366-374 в течение 6 часов, как описано Bertram и соавт. в 2002, и Bertram и соавт. в 2004.
Через 3 недели после инфицирования некоторым мышам проводят повторную антигенную стимуляцию серологически отличающимся вирусом гриппа A/PR8/34 (PR8), имеющим общий ген NP с вирусом гриппа НKx31, но с отличающимся гемагглютинином и нейраминидазой, так что нейтрализующие Аb не ограничивают вторичный СТL-ответ. Мышей умерщвляют на дни 5 и 7 после повторной антигенной вирусной стимуляции и оценивают количество вирус-специфических CD8 Т-клеток в легких, дренирующих лимфатических узлах и селезенке, как описано Hendriks и соавт. и Bertram и соавт. (Hendriks et al., 2005, J. Immunol., 175, 1665-1676; Bertram et al, J. Immunol. 2004; 172:981-8) и подробно описано выше. Вторичные ответы CD8 Т-клеток, в том числе наличие внутриклеточной метки IFN-γ и CTL-активность, оценивают в суспензии клеток селезенки мышей на дни 5 и 7 после повторной антигенной вирусной стимуляции, как описано выше.
Чтобы определить эффект слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR на увеличение количества и накопление CD8+ Т-клеток памяти в процессе вторичного ответа, выполняют эксперимент с адоптивным переносом согласно ранее описанным способам (Hendriks et al., J. Immunol. 2005, 175, 1665-1676; Bertram et al., J. Immunol. 2004; 172:981-8): мышей иммунизуют вирусом гриппа А НKх31. Двадцать один день спустя Т-клетки очищают от клеток селезенки на иммуноколонках для обогащения мышиных Т-клеток (Cedarlane Laboratories, Хорнсби, Онтарио, Канада) и метят CFSE (альтернативно, конгенных мышей Thy 1.1 используют в качестве реципиентов). Равные количества тетрамер-положительных Т-клеток вводят через хвостовую вену мышей-реципиентов. Мышам проводят повторную антигенную стимуляцию вирусом гриппа, как описано выше, и через 7 дней оценивают спленоциты на донорские вирус-специфические CD8+ Т-клетки, как описано выше.
ПРИМЕР 41
ОЦЕНКА ЭКСПРЕССИИ БЕЛКА В ИСТОЩЕННЫХ Т-КЛЕТКАХ, А ТАКЖЕ СВЯЗЫВАНИЕ И ЭФФЕКТ СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 И LSR НА ВОССТАНОВЛЕНИЕ ИСТОЩЕННОГО ФЕНОТИПА Т-КЛЕТОК
Дифференцировка CD8 Т-клеток памяти идет по определенным путям после острой вирусной инфекции по сравнению с хронической (Klenerman and Hill, Nat. Immunol. 6, 873-879, 2005). CD8 Т-клетки памяти, образованные после острой вирусной инфекции, высоко функциональны и являются важным компонентом защитного иммунитета. В отличие от этого, хронические инфекции часто характеризуются различной степенью функциональной недостаточности вирус-специфических Т-клеточных ответов, и этот недостаток является основной причиной неспособности хозяина устранить персистирующий патоген. Хотя функциональные эффекторные Т-клетки первоначально образуются на ранних стадиях инфекции, они постепенно теряют функцию в ходе хронической инфекции, что приводит к истощенному фенотипу, характеризующемуся недостаточной функциональностью Т-клеток.
Исследование I. Эффект слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR на клиренс вирусной инфекции и на функции Т-клеток при острой и хронической вирусной инфекции.
Эффект слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR (SEQ ID NO:23, 24, 25 и 26, соответственно) на острую и хроническую вирусную инфекцию оценивают на мышиной модели инфекции LCMV (вирус лимфоцитарного хориоменингита) согласно методике, описанной в Wherry et al., J. Virol. 77:4911-4927, 2003 и Barber et al., Nature, 2006, и подробно описанной ниже.
Используют два штамма LCMV, которые могут вызвать либо острую, либо хроническую инфекцию у взрослых мышей; штамм Armstrong, который устраняется в течение недели, и штамм клона 13, создающий персистирующую инфекцию, которая может длиться несколько месяцев. Поскольку два этих штамма отличаются только двумя аминокислотами, сохраняя все известные эпитопы Т-клеток, можно отслеживать одни и те же ответы CD8 Т-клеток после острой или хронической вирусной инфекции. В отличие от высокоустойчивых CD8 Т-клеток памяти, образованных после острой инфекции Armstrong, LCMV-специфические CD8 Т-клетки истощаются во время персистирующей инфекции клона 13 (Wherry et al. J. Virol 77:4911-4927, 2003; Barber et al., Nature 2006; 439:682-7).
Мышей инфицируют 2×105 PFU штамма Armstrong LCMV внутрибрюшинно для инициации острой инфекции или 2×106 PFU С 1-13 внутривенно для инициации хронической инфекции. Мышей внутрибрюшинно обрабатывают слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR или контрольным mIgG2a и специфическим антителом к LY6G6F, VSIG10, ТМЕМ25, LSR или изотипическим контролем.
Мышей контролируют в отношении количества вирус-специфических CD8 Т-клеток в селезенке, используя вирус-специфические эпитопы тетрамера МНС, такие, как Db NP396-404 и DbGP33-41, которые отличаются при острой или хронической инфекции. Функциональные анализы CD8 Т-клеток, такие как внутриклеточные уровни цитокинов и CTL-активность, выполняют, как описано в Wherry et al., J. Virol. 77:4911-4927, 2003, и аналогично описанному в Примере 40. Дополнительные анализы включают продуцирование спленоцитами после стимуляции вирус-специфическими эпитопами и оценку вирусных титров в сыворотке крови и в селезенке, печени, легких и почках (Wherry et al., J. Virol 77:4911-4927, 2003; Barber et al., Nature 2006; 439:682-7).
Исследование II. Оценка экспрессии LY6G6F, VSIG10, ТМЕМ25 и LSR на истощенных Т-клетках и связывание слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR с истощенными Т-клетками для оценки регуляции этих белков или их соответствующих рецепторов во время истощения Т-клеток:
Т-клетки выделяют из мышей с хронической инфекцией LCMV, индуцированной штаммом Сl-13. Клетки совместно помечают с флуоресцентно меченым Аb к PD-1 в качестве положительного контроля (PD-1 экспрессируется на высоком уровне истощенными Т-клетками) и биотинилированными слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR или биотинилированными антителами к слитым белкам LY6G6F, VSIG10, ТМЕМ25 и LSR и соответствующим изотипическим контролем. Связывание обнаруживают с помощью анализа FACS с использованием флуоресцентно меченого стрептавидина.
ПРИМЕР 42
ОЦЕНКА ЭКСПРЕССИИ БЕЛКА LY6G6F, VSIG10, ТМЕМ25 и/или LSR В ФОЛЛИКУЛЯРНЫХ Т-ХЕЛПЕРАХ (TFH) И СВЯЗЫВАНИЯ IG-СЛИТЫХ БЕЛКОВ С TFH-КЛЕТКАМИ
Фолликулярные Т-хелперы (Tfh) представляют собой субпопуляцию CD4+ Т-клеток, специализирующихся на хелперном сигнале В-клеткам (обзор Crotty, Annu. Rev. Immunol. 29:621-663, 2011). Tfh-клетки мигрируют в фолликулы В-клеток в лимфатических узлах и взаимодействуют с родственными В-клетками на границе Т-клетки-В-клетки и впоследствии индуцируют дифференцировку В-клеток в герминативном центре и формирование герминативного центра внутри фолликула (обзор Crotty, Annu. Rev. Immunol. 29:621-663, 2011). Необходимость в Tfh-клетках для хелперного сигнала В-клеткам и зависимого от Т-клеток образования антител указывает, что этот тип клеток имеет большое значение для защитного иммунитета против различных типов возбудителей инфекции, а также для рациональной разработки вакцин.
Tfh-клетки легко идентифицировать на пике ответа CD4+ Т-клеток на острую инфекцию вируса лимфоцитарного хориоменингита (LCMV) как СХСR5hiSLAMloВТLAhiPD1hiВс16 вирус-специфические CD4+ Т-клетки (Choi et al., 2011, Immunity 34:932-946). Т-клетки выделяют из мышей с острой инфекцией LCMV, индуцированной 2×105 PFU LCMV штамма Armstrong, введенного внутрибрюшинно. Клетки совместно помечают с флуоресцентно мечеными антителами в отношении маркеров Tfh (CXCR5, PD1, BTLA, Вс16), которые экспрессируются на высоком уровне Tfh-клетками и биотинилированными слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR или биотинилированными антителами, специфичными относительно LY6G6F, VSIG10, ТМЕМ25 и LSR и соответствующими изотипическими контролями. Связывание Fc-слитого белка или антитела обнаруживают с помощью анализа FACS с использованием флуоресцентно меченого стрептавидина.
ПРИМЕР 43
ОЦЕНКА ЭФФЕКТА СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR НА ОБРАЗОВАНИЕ И АКТИВНОСТЬ ФОЛЛИКУЛЯРНЫХ Т-ХЕЛПЕРОВ (TFH)
Для того, чтобы исследовать эффект слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR на дифференцировку Tfh и развитие B-клеточного иммунитета in vivo, C57BL/6 обрабатывают слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR и изотипическим контролем в ходе острой вирусной инфекции штамма Armstrong LCMV (вирус лимфоцитарного хориоменингита). Дифференцировку Tfh и экспрессию белка Вс16 оценивают с помощью анализа FACS, как описано в Eto et al., 2011 (PLoS One 6:e17739). Спленоциты анализируют 8 дней после инфицирования LCMV, образование Tfh (CD44hiCXCR5hiSLAMlo) и экспрессию Вс16 оценивают с помощью анализа FACS. Кроме того, эффект слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR (SEQ ID NO:23, 24, 25 и 26, соответственно) на антиген-специфические ответы В-клеток оценивают, как описано в Eto et al., 2011 (PLoS One 6:e17739), включая титры IgG против LCMV в сыворотке крови на 8 день после инфицирования LCMV и количественное определение с помощью анализа FACS развития плазматических клеток (CD138+ IgD-) на 8 день после инфицирования, запускаемое на CD19+ спленоцитах.
ПРИМЕР 44
ЭФФЕКТ СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR НА МОДУЛИРОВАНИЕ САХАРНОГО ДИАБЕТА 1 ТИПА У МЫШЕЙ NOD, CD28-KO NOD И В7-2-KО NOD
Эффект слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR изучают на широко используемой мышиной модели сахарного диабета 1 типа: диабетические мыши без ожирения (NOD), которые спонтанно развиваются в мышей NOD; спонтанный инсулит, являющийся признаком патологического поражения, развивается через несколько характерных этапов, которые начинаются с пери-инсулита и заканчиваются инвазивным и деструктивным инсулитом и явным сахарным диабетом. Пери-инсулит впервые обнаруживают в возрасте 3-4 недель, инвазивный инсулит в 8-10 недель, а деструктивный инсулит появляется как раз перед началом клинического диабета в самых ранних случаях в 10-12 недель. В возрасте 20 недель 70-80% самок мышей NOD становятся диабетическими (Ansari et al., 2003 J. Exp. Med. 198:63-69).
Также используют две линии мышей КО: мыши CD-28-KO NOD и мыши В7-1/В7-2 двойные КО NOD, у которых развивается ускоренный диабет (Lenschow et al., 1996 Immunity 5:285-293; Salomon et al., 2000 Immunity 12:431-440).
Исследование I: мышей NOD обрабатывают слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR (SEQ ID NO:23, 24, 25 и 26, соответственно) в раннюю и позднюю фазы эволюции сахарного диабета, до или после начала заболевания для изучения эффектов этих соединений на патогенез заболевания и для демонстрации того, что такая обработка смягчает начало заболевания и оказывает положительное влияние на патогенез. Для изучения эффекта на инсулит уровень глюкозы в крови измеряют 3 раза в неделю вплоть до 25 недель (Ansari et al., 2003 J. Exp Med 198:63-69).
Механизм модифицирования заболевания и способ действия изучают посредством экспериментальной оценки отдельных типов иммунных клеток: поджелудочной железы, панкреатических LN и селезенки, их берут для получения Treg, подтипов Th и CD8 Т-клеток, DC и В-клеток. Эффект на секрецию цитокинов клетками, выделенными из поджелудочной железы, панкреатических LN и селезенки, анализируют, сосредоточившись на IFNγ, IL-17, IL-4, IL-10 и TGFb. При эффекте тестируемых соединений механизм модификации заболевания изучают путем исследования отдельных типов иммунных клеток (в том числе, Treg, подтипы Th и Т-клетки CD8, DC и В-клетки); цитокинов (IFNγ, IL-17, IL-4, IL-10 и TGFb) и гистологии. Гистологический анализ поджелудочной железы выполняют для сопоставления начала инсулита и лимфоцитарной инфильтрации.
ИССЛЕДОВАНИЕ II: эффект СЛИТЫХ БЕЛКОВ LY6G6F-IG на модулирование сахарного диабета 1 типа на модели адоптивного переноса
Для дополнительного исследования способа действия Ig-слитых белков используют модель адоптивного переноса диабета. Т-клетки от диабетических или пред-диабетических доноров NOD переносят мышам-реципиентам SCID NOD. Осуществляют контроль этих мышей в отношении развития диабета. Глюкозу мочи и глюкозу крови, гистологическую оценку поджелудочной железы и Т-клеточные ответы контролируют как описано в предыдущем Примере.
Исследование III: диабет также индуцируют переносом активированных CD4+CD62L+CD25-BDC2.5 Т-клеток (трансгенных по TCR-распознающему специфическому для островков пептиду 1040-Р31, активированных путем инкубации с 1040-Р31) реципиентам NOD. Мышей обрабатывают слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 или LSR, контрольным mIgG2a или положительным контролем. Обработки начинают в 1 день после переноса. У мышей исследуют уровни глюкозы через 10-28 дней после переноса (Bour-Jordan et al., J. Clin. Invest. 2004; 114(7):979-87).
Через семь дней после обработки извлекают клетки поджелудочной железы, селезенки, панкреатических LN и периферических лимфатических узлов и исследуют в отношении различных популяций иммунных клеток. Кроме того, вторичные ответы измеряют путем проверки ex-vivo пролиферации и секреции цитокинов в ответ на пептид р31.
Слитые белки Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR предотвращают или смягчают начало заболевания или его тяжесть в вышеупомянутых исследованиях.
ПРИМЕР 45
ЭФФЕКТ СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR НА МЫШИНЫХ МОДЕЛЯХ ВОЛЧАНКИ
Исследование I: используют мышиную модель предрасположенности к волчанке, (NZB × NZW)F1 (B/W). Циклофосфамид (СТХ) является основным лекарственным средством, используемым при диффузном пролиферативном гломерулонефрите у пациентов с волчаночным поражением почек, Daikh и Wofsy сообщили, что комбинированное лечение СТХ и CTLA4-Ig было более эффективным, чем каждое средство по отдельности, для уменьшения заболевания почек и увеличения выживаемости мышей NZB/NZW F1 с волчанкой с запущенным нефритом (Daikh and Wofsy, J. Immunol., 166(5):2913-6 (2001)). Для исследования обоснованности концепции испытывают лечение слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR и СТХ либо самостоятельно, либо в комбинации.
Образцы крови отбирают за 3 дня до лечения при помощи белка, а затем каждые две недели во время и после лечения для анализа в плазме аутоантител к дцДНК с помощью ELISA. Гломерулонефрит оценивают путем гистологического анализа почек. Протеинурию измеряют в ходе исследования свежих образцов мочи с применением тест-полосок для анализа мочи.
Слитые белки Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR (SEQ ID NO:23, 24, 25 и 26, соответственно) имеют положительный эффект по меньшей мере относительно облегчения волчаночного нефрита.
Исследование II: используют модель SLE на полученных от NZM2410 мышах B6.Sle1.Sle2.Sle3. NZM2410 является рекомбинантный инбредной линией, получаемой от NZB и NZW, у который развивается высоко пенетрантное волчаночно-подобное заболевание с ранним началом заболевания (Blenman et al., 2006 Lab. Invest. 86:1136-1148). Эффект слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR изучают на этой модели путем оценки протеинурии и аутоантител, как описано выше.
Исследование III: используют индуцированную модель волчанки. Эта модель основана на хронической реакции "трансплантат против хозяина" (cGVH), индуцированной путем переноса Ia-несовместимых клеток селезенки от одной нормальной линии мышей (например, В6.С-Н2 (bm12)/KhEg (bm12)) другой (такой как C57BL/6), что вызывает аутоиммунный синдром, напоминающий системную красную волчанку (SLE), включая аутоантитела к двухцепочечной ДНК (анти-днДНК) и пролиферативный гломерулонефрит с иммунными комплексами (Appleby et al., Clin. Exp. Immunol. 1989, 78:449-453); Eisenberg and Choudhury, 2004, Methods Mol. Med. 102:273-284).
Волчанку индуцируют в этой модели после введения клеток селезенки от мышей bm12 реципиентам C57BL/6. Эффект слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR изучают на этой модели путем оценки протеинурии и аутоантител, как описано выше. Т-клеточные ответы и ответы В-клеток также оценивают.
Исследование IV: используют модель мышей MRL/lpr, предрасположенных к волчанке. Эффект слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR изучают на этой модели путем оценки протеинурии и аутоантител, как описано выше.
ПРИМЕР 46
ЭФФЕКТ СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR НА КОНТРОЛЬ КИШЕЧНОГО ВОСПАЛЕНИЯ.
Используют мышиную модель адоптивного переноса колита у мышей, при которой перенос интактных CD45RBhigh-CD4+ Т-клеток от мышей BALB/c сингенным мышам SCID приводит к развитию IBD-подобного синдрома через 6-10 недель после восстановления популяции Т-клеток, похожего на болезнь Крона у человека.
Восстановление популяции у мышей SCID осуществляют путем внутрибрюшинной инъекции сингенных CD45RBhigh-CD4+ Т-клеток либо отдельно, либо путем совместного переноса с сингенными клетками CD45RBlow-CD4+ или CD25+CD4+ (4×105/мышь каждой клеточной популяции) (Liu et al., J. Immunol. 2001; 167(3) 1830-8). Мышей SCID с колитом, с популяцией, восстановленной сингенными CD45RBhigh-CD4+ Т-клетками из селезенки здоровых мышей, обрабатывают внутрибрюшинно слитым белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR или изотипическим контрольным Ig дважды в неделю, начиная от начала переноса Т-клеток вплоть до 8 недель. Осуществляют еженедельный контроль всех мышей в отношении веса, мягкого стула или диареи и пролапса прямой кишки. Всех мышей умерщвляют через 8 недель после переноса Т клеток или, когда у них происходит потеря 20% от первоначального веса тела. Ткани толстого кишечника собирают для гистологического и цитологического обследования. Слитые белки Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR имеют положительный эффект, по меньшей мере, относительно облегчения воспалительного заболевания кишечника.
ПРИМЕР 47
ЭФФЕКТ СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 И LSR НА МЫШИНОЙ МОДЕЛИ ПСОРИАЗА
Исследование I: Создание ксенотрансплантатной модели псориаза у SCID
Человеческие псориатические бляшки пересаживают мышам SCID. Бритвенные биопсии (2,5_2,5 см) берут у пациентов с генерализованным бляшковидным псориазом с вовлечением 5-10% общей поверхности кожи, которые не получали никакого системного лечения псориаза или фототерапии в течение 6 месяцев и не получали каких-либо препаратов для местного применения, кроме смягчающих, в течение 6 недель. Биопсии получают из активных бляшек, расположенных на бедре или руке. Каждый кусочек биопсии разделяют на четыре равные части размером приблизительно 1 см2. Каждый кусочек пересаживают отдельной мыши.
Под общим наркозом создают основание для трансплантата приблизительно 1 см2 на бритой области спины 7-8-недельной мыши SCID СВ17, удаляя полнослойный образец кожи, сохраняя нетронутым сосудистое сплетение на фасции, покрывающей подлежащие мышцы спины. Затем частичный слой кожи человека, полученный бритвенной биопсией, ортотопически переносят на основание для трансплантата. Жидкий ветеринарный бандаж Nexaband (Veterinary Products Laboratories, Феникс, Аризона) используют для крепления человеческой кожи на кожу мыши и применяют мазь с антибиотиком (бацитрацин). Мышей обрабатывают внутрибрюшинно три раза в неделю в течение 4 недель слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR, изотипическим контролем или CTLA4-Ig (положительный контроль).
Пункционные биопсии (2 мм) получают в день 0 (до обработки) и день 28 (после обработки) периода исследования. Биопсии замораживают и изготавливают криосрезы для гистопатологического и иммуногистохимического исследования. Терапевтическую эффективность определяют путем сравнения данных до и после обработки: (i) длины эпидермальных гребней для определения влияния на толщину эпидермиса и (ii) уровня лимфомононуклеарных клеточных инфильтратов для определения эффекта на воспалительные клеточные инфильтраты. (Raychaudhuri et al., 2008, J. Invest Dermatol.; 128(8):1969-76; Boehncke et al., 1999, Arch. Dermatol. Res. 291:104-6).
Слитые белки Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR (SEQ ID NO:23, 24, 25 и 26, соответственно) имеют положительный эффект, по меньшей мере, относительно облегчения псориаза.
ИССЛЕДОВАНИЕ II: ЭФФЕКТ LY6G6F, VSIG10, ТМЕМ25 и LSR НА МОДЕЛЯХ ПСОРИАЗА И КОЛИТА С АДОПТИВНЫМ ПЕРЕНОСОМ CD45RBHI CD4+ Т-КЛЕТОК МЫШАМ SCID
Мышам с иммунодефицитом вводят внутривенно (i.v.) 0,3_106 CD45RBhi CD4+ клеток. На следующий день после адоптивного переноса клеток мышам вводят внутрибрюшинно (i.p.) 10 мкг стафилококкового энтеротоксина В (Davenport et al., Int. Immunopharmacol. 2002 Apr; 2(5):653-72). Мышей-реципиентов обрабатывают слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR (SEQ ID NO:23, 24, 25 и 26, соответственно), изотипическим контролем или CTLA4-Ig (положительный контроль). Мышей оценивают один раз в неделю в течение 8 недель в отношение потери веса и наличия повреждений кожи.
Полученные результаты аналогичны тем, которые описаны выше.
ПРИМЕР 48
ЭФФЕКТ СЛИТЫХ БЕЛКОВ IG-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR НА МОДУЛИРОВАНИЕ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА
Исследование I: ЭФФЕКТ LY6G6F, VSIG10, ТМЕМ25 И LSR НА МОДЕЛИ АЛЛОГЕННОЙ ТРАНСПЛАНТАЦИИ ОСТРОВКОВ У МЫШЕЙ С ДИАБЕТОМ. Чтобы исследовать эффект слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR (SEQ ID NO:23, 24, 25 и 26, соответственно) на отторжение трансплантата используют модель аллогенной трансплантации островков. Диабет индуцируют у мышей C57BL/6 с помощью обработки стрептозотоцином. Через семь дней мышам трансплантируют под капсулу почки панкреатические островки, выделенные у мышей-доноров BALB/c. Мышей-реципиентов обрабатывают слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR или mIgG2a в качестве отрицательного контроля. Толерантность к ECDI-фиксированным спленоцитам донора используют в качестве положительного контроля успешного модулирования отторжения трансплантата островка. Мышей-реципиентов контролируют в отношении уровня глюкозы крови как меры принятия/отторжения трансплантата (Luo et al., PNAS, September 23, 2008, 105(38):14527-14532).
Исследование II: ЭФФЕКТ LY6G6F, VSIG10, ТМЕМ25 и LSR НА HYA-МОДЕЛИ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА КОЖИ
В организме человека и некоторых линий лабораторных мышей мужские ткани распознаются как "не свой" и уничтожаются женской иммунной системой посредством распознавания антигенов гистосовместимости, кодируемых Y-хромосомой (Нyа). Разрушение мужской ткани, как полагают, осуществляется цитотоксическими Т-лимфоцитами хелпер-зависимым образом.
Для исследования эффекта слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR (SEQ ID NO:23, 24, 25 и 26, соответственно) на трансплантацию используют модельную систему Нyа, в которой самки мышей C57BL/6 получают трансплантаты кожи хвоста от самцов-доноров C57BL/6.
В этом исследовании самкам мышей C57BL/6 прививают ортотопический расщепленный кожный лоскут хвоста от самца мыши C57BL/6 соответствующего возраста. Мышей обрабатывают слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR, изотипическим контрольным mIgG2a. Иммунодоминантный кодируемый Нyа эпитоп CD4 (DBy), прикрепленный к лейкоцитам селезенки (DBy-SP) самок, служит в качестве положительного контроля для успешного модулирования отторжения трансплантата (Martin et al., 2010, J. Immunol. 2010 September 15; 185(6):3326-3336). Кожные трансплантаты ежедневно оценивают на наличие отека, потерю пигмента и выпадение шерсти. Отторжение определяют как полное выпадение шерсти и более чем 80% потери пигмента.
Кроме того, вторичные T-клеточные ответы клеток, выделенных из селезенки и дренирующих лимфоузлов, в различные моменты времени изучают в ответ на CD4-специфический эпитоп (DBy), эпитопы CD8 (Uty и Smcy) или посторонний пептид (OVA 323-339), тогда как стимуляцию антителом к CD3 используют в качестве положительного контроля пролиферации и секреции цитокинов.
Исследование III: эффект слитых белков Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR на отторжение трансплантата изучают на мышиной модели трансплантации сингенных клеток костного мозга с использованием модельной системы Нyа, описанной выше. Гемопоэтические клетки самцов, экспрессирующие маркер CD45.1, пересаживают мышиным самкам-хозяевам, которые экспрессируют родственный маркер CD45.2. Самок-хозяев обрабатывают слитыми белками Ig-ECD LY6G6F, VSIG10, ТМЕМ25 и LSR или изотипическим контрольным mIgG2a. Самок-хозяев исследуют с течением времени и контролируют наличие клеток CD45.1+.
ПРИМЕР 49
УСТАНОВЛЕНИЕ РОЛИ БЕЛКОВ LY6G6F, VSIG10, ТМЕМ25 И/ИЛИ LSR СОГЛАСНО ПО МЕНЬШЕЙ МЕРЕ НЕКОТОРЫМ ВАРИАНТАМ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ИММУНОЛОГИЧЕСКОГО КОНТРОЛЯ РАКА:
1) Доказательство концепции in vivo
а) Сингенная модель рака мыши:
(i) Опухолевые клетки, сверх-экспрессирующие любой из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, или нерелевантный контрольный белок, пересаживают генетически подходящим мышам. Затем объем опухоли (и вес опухоли после умерщвления животных) и ех vivo анализ иммунных клеток из дренирующих опухоль лимфатических узлов или селезенки исследуют, чтобы продемонстрировать задержку отторжения опухоли (т.е. опухоль, сверх-экспрессирующая LY6G6F, VSIG10, ТМЕМ25 и/или LSR, растет быстрее, чем опухоли, сверх-экспрессирующие нерелевантный контрольный белок). Анализ ех vivo иммунных клеток из дренирующих опухоль лимфатических узлов, как ожидается, должно показывать увеличение частоты регуляторных Т-клеток и снижение чувствительности эффекторных Т-клеток к стимуляции (J. Exp. Med. 2011 том 208 №3 577-592).
(ii) Сингенную in vivo модель с использованием внеклеточного домена мышиных ортологов любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, слитого с Fc-фрагментом антитела (мышиный ECD-Fc) (SEQ ID NO:23, 24, 25 и 26, соответственно) испытывают следующим образом. Мышиный ECD-FC вводят IV мышам C57BL/6 с интервалами 3-4 дня после создания опухоли, как описано в J. Immunol, 2010, 185, 2747-2753. Затем исследуют объем опухоли (и вес опухоли после умерщвления животных) и осуществляют ex vivo анализ иммунных клеток из дренирующих опухоль лимфатических узлов или селезенки. В результате IV обработки мышиным ECD-FC LY6G6F, VSIG10, ТМЕМ25 и/или LSR отторжение опухоли задерживается (т.е. у мышей, обработанных мышиным ECD-FC LY6G6F, VSIG10, ТМЕМ25 и/или LSR, опухоли растут быстрее, чем опухоли у мышей, обработанных нерелевантным контрольный белком). Анализ ех vivo иммунных клеток из дренирующих опухоль лимфатических узлов показывает увеличение частоты регуляторных Т-клеток и снижение чувствительности эффекторных Т-клеток к стимуляции.
(iii) Создание сингенной опухоли и обработка нейтрализующими антителами, направленными против одного из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR (1, 3, 5, 7, 11, 143, 13, 15-17, 18, 28, 29-32). Опухолевые клетки пересаживают генетически идентичным мышам. После образования опухолей мышам IV вводят различные дозы нейтрализующих антител, направленных против любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR. В результате IV обработки нейтрализующими антителами, специфичными для любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, отторжение опухоли повышается (т.е. у мышей, обработанных нейтрализующими антитела против любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, опухоли растут медленнее, чем опухоли у мышей, обработанных нерелевантным антителом). Анализ ех vivo иммунных клеток из дренирующих опухоль лимфатических узлов показывает снижение частоты регуляторных Т-клеток и увеличение чувствительности эффекторных Т-клеток к стимуляции.
b) Ксенотрансплантатная модель человеческого рака:
(i) Восстановление противоопухолевого иммунного ответа на модели иммунодефицитных мышей NOD.Cg-Prkdcscid I12rgtmlWjl/SzJ (Jackson lab), мышей "NSG". Человеческую опухоль создают на модели NSG, и АРС, предварительно нагруженные опухолевыми антигенами, и/или Т-клетки (CD8 Т-клетки, предварительно активированные раковыми клетками-мишенями) переносят в мышей NSG с опухолями (все пересаживаемые/вводимые клетки получены от пациентов, страдающих раком). Эта модель состоит из четырех ответвлений: 1. АРС, сверх-экспрессирующие любой из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR; 2. "глушение" любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR (миРНК или РНК-шпилька) на АРС; 3. раковые клетки, сверх-экспрессирующие любой из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR; и 4. "глушение" любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR (миРНК или РНК-шпилька) на раковых клетках. Положительные (например, В7-Н1, PD-L1) и отрицательные (например, вектор и клетки по отдельности) контроли также входят. Изучают объем опухоли или метастазирование опухоли и выживаемость мышей (J. Ехр. Med.; 2006; том 203; стр. 871-881). Сверх-экспрессия любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR либо на АРС, либо на опухолевых клетках, приводит к задержке отторжения опухоли (т.е. у мышей, обработанных АРС или опухолевыми клетками, сверх-экспрессирующими любой из LY6G6F, VSIG10, ТМЕМ25 и/или LSR, опухоли растут быстрее, чем опухоли у мышей, обработанных нерелевантным контрольным белком). "Глушение" (с помощью миРНК или РНК-шпильки) любого из LY6G6F, VSIG10, ТМЕМ25 и/или LSR либо на АРС, либо на опухолевых клетках, приводит к повышенному отторжению опухоли.
(II) Создание ксенотрансплантатной модели рака NSG, как описано выше (без генетических манипуляций с АРС и/или раковыми клетками) и обработка нейтрализующими антителами, направленными против любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR. Обработка в ксенотрансплантатной модели NSG нейтрализующими антителами, направленными против любого из LY6G6F, VSIG10, ТМЕМ25 и/или LSR вызывает повышенное отторжение опухоли.
2) In vitro подтверждение клеточной активности натуральных киллеров (NK)
a) Анализ связывания:
(i) Анализ связывания с человеческими белками FC-ECD LY6G6F, VSIG10, ТМЕМ25 и/или LSR выполняют на активированной первичной культуре NK-клеток, как описано в J. Immunol. 2005, 174; 6692-6701. Если соответствующий рецептор LY6G6F, VSIG10, ТМЕМ25 и/или LSR экспрессируется на NK-клетках, наблюдают связывание Fc-ECD LY6G6F, VSIG10, ТМЕМ25 и/или LSR.
(ii) Анализ связывания со специфическим антителом, направленным против любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, выполняют на активированной первичной культуре NK-клеток, как описано в PNAS, 2009, том 109; 17858-17863. Если любой из LY6G6F, VSIG10, ТМЕМ25 и/или LSR экспрессируется на NK-клетках, наблюдают связывание специфического антитела к LY6G6F, VSIG10, ТМЕМ25 и/или LSR, соответственно.
(iii) Анализ связывания с человеческими белками FC-ECD LY6G6F, VSIG10, ТМЕМ25 и/или LSR на различных человеческих клеточных линиях рака, которые могут служить в качестве клеток-мишеней для NK-опосредованного цитолиза, выполняют, как описано в J. Immunol. 2006, 176; 6762-6769. Если соответствующий рецептор любого из LY6G6F, VSIG10, ТМЕМ25 и/или LSR экспрессируется на раковых клетках-мишенях, наблюдают связывание Fc-ECD LY6G6F, VSIG10, ТМЕМ25 и/или LSR, соответственно.
b) Анализ функционального цитолиза:
(i) Анализы цитолиза выполняют с помощью системы сверх-экспрессии (либо NK-клеток, либо раковых клеток-мишеней, сверх-экспрессирующих любой из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR). NK-клетки (эффекторные; е) совместно инкубируют с радиоактивно (S35) мечеными раковыми клетками-мишенями (мишень; t) в различных соотношениях е:t, как описано в PNAS, 2009, том 109; 17858-17863. Затем лизис клеток-мишеней путем NK-опосредованной активности цитолиза оценивают путем измерения радиоактивного излучения. Сверх-экспрессия любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR на раковых клетках-мишенях и/или в линиях NK-клеток ведет к подавлению NK-опосредованной активности цитолиза.
(ii) Анализы цитолиза выполняют в присутствии человеческих белков FC-ECD LY6G6F, VSIG10, ТМЕМ25 и/или LSR, как описано в PLoS ONE, 2010, том 5, стр. 1-10. Обработка с ECD-Fc любого из LY6G6F, VSIG10, ТМЕМ25 и/или LSR мешает взаимодействию LY6G6F, VSIG10, ТМЕМ25 и/или LSR с их соответствующими рецепторами и, следовательно, уменьшает их ингибирующую активность, что вызывает повышенную активность цитолиза.
(iii) Анализы цитолиза выполняют в присутствии нейтрализующего антитела, направленного против любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, как описано в PNAS, 2009, том 109; 17858-17863. Обработка нейтрализующими антителами, направленными против любого из LY6G6F, VSIG10, ТМЕМ25 и/или LSR, вызывает повышенную NK-опосредованную активность цитолиза.
(iv) "Анализ перенаправленного цитолиза" выполняют следующим образом: раковые клетки-мишени, с высокой плотностью экспрессирующие Fc-рецепторы, нагружают активирующими антителами, направленными против любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, и подвергают воздействию NK-клеток (экспрессирующих указанный белок LY6G6F, VSIG10, ТМЕМ25 и/или LSR), как описано в PNAS, 2009, том 109; 17858-17863. Перекрестное связывание любого из LY6G6F, VSIG10, ТМЕМ25 и/или LSR с активирующим антителом вызывает снижение NK-опосредованной активности цитолиза.
3) Анализ экспрессии
а) Экспрессия белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR на клетках, выделенных из биопсии опухолей человека
i) Проверку экспрессии любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR с использованием специфических антител, направленных против любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, соответственно, выполняют на отдельных клеточных популяциях из опухоли. Различные клеточные популяции недавно выделены из биопсии опухолей (например, опухолевые клетки, эндотелий, ассоциированные с опухолью макрофаги (ТАМ) и DC, В-клетки и различные Т-клетки (CD4, CD8 и Treg), как описано в J. Med Exp; 2006; том 203; стр.871-881 и Cancer Res 2007; 67; 8900-8905, для демонстрации экспрессии любого из LY6G6F, VSIG10, ТМЕМ25 и/или LSR в опухолевых клетках, и опухолевой строме, и иммунном инфильтрате.
ii) Анализ связывания выполняют с человеческими белками FC-ECD LY6G6F, VSIG10, ТМЕМ25 и/или LSR на отдельных клеточных популяциях из опухоли. Изолят различных клеточных популяций из биопсии опухоли (например, опухолевые клетки, эндотелий, ассоциированные с опухолью макрофаги (ТАМ) и DC, В-клетки и различные Т-клетки (CD4, CD8 и Treg), недавно выделенные из опухолей, как описано в J. Med Exp; 2006; том. 203; стр. 871-881 и Cancer Res 2007; 67; 8900-8905, чтобы показать экспрессию соответствующего рецептора для любого из LY6G6F, VSIG10, ТМЕМ25 и/или LSR на опухолевых клетках и опухолевой строме и иммунных клетках.
b) Экспрессия белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR на клетках, выделенных из дренирующих лимфатических узлов и селезенки мышей с опухолью
i) Проверку экспрессии любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR с использованием специфических антител, направленных против любого из белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, соответственно, выполняют на эпителиальных раковых клетках, а также на иммунных клетках из дренирующих опухоль лимфатических узлов в сравнении с селезенкой мышей С57 с опухолью, как описано в Clinical Cancer Research 1996 том 2, 811-820. Исследуют три различных типа рака: В16 (меланома), ID8 (рак яичника) и МС38 (рак толстой кишки), чтобы показать экспрессию любого из LY6G6F, VSIG10, ТМЕМ25 и/или LSR в опухолевых клетках и в иммунных клетках дренирующего опухоль лимфатического узла.
ii) Анализ связывания с мышиными белками FC-ECD LY6G6F, VSIG10, ТМЕМ25 и/или LSR на клетках, выделенных из эпителиального рака, а также на иммунных клетках из дренирующих опухоль лимфатических узлов в сравнении с селезенкой мышей С57 с опухолью выполняют, как описано выше, чтобы показать экспрессию соответствующих рецепторов для любого из LY6G6F, VSIG10, ТМЕМ25 и/или LSR в опухолевых клетках и в иммунных клетках дренирующих опухоль лимфатических узлов.
с) Экспрессия белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR на поляризованных макрофагах М2
(i) Проверку экспрессии белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR с использованием специфических антител, направленных против белков LY6G6F, VSIG10, ТМЕМ25 и/или LSR, соответственно, выполняют на первичных моноцитах, выделенных из периферической крови, дифференцированных в макрофаги и подвергнутых "управляющему стимулу М2" (например, IL-4, IL-10, глюкокортикоиды, TGF-бета), как описано в Nat. Immunol. 2010; том 11; стр. 889-896, чтобы показать экспрессию любого из LY6G6F, VSIG10, ТМЕМ25 и/или LSR в дифференцированных макрофагах М2.
ii) Анализ связывания с человеческими ECD-FC белками LY6G6F, VSIG10, ТМЕМ25 и/или LSR на первичных моноцитах, выделенных из периферической крови, дифференцированных в макрофаги и подвергнутых "управляющему стимулу М2" (например, IL-4, IL-10, глюкокортикоиды, TGF-бета), выполняют, как описано выше, чтобы показать экспрессию соответствующих рецепторов для любого из LY6G6F, VSIG10, ТМЕМ25 и/или LSR в дифференцированных макрофагах М2.
ПРИМЕР 50
РАЗРАБОТКА ПОЛНОСТЬЮ ЧЕЛОВЕЧЕСКИХ АНТИТЕЛ К LY6G6F, VSIG10, ТМЕМ25 и/или LSR
Создание человеческих моноклональных антител против антигена LY6G6F, VSIG10, ТМЕМ25 и/или LSR
Слитые белки, состоящие из внеклеточного домена LY6G6F, VSIG10, ТМЕМ25 и/или LSR, связанного с мышиным полипептидом IgG2-Fc, создают стандартными рекомбинантными способами и используют в качестве антигена для иммунизации.
Трансгенные мыши HuMab Mouse
Полностью человеческие моноклональные антитела к LY6G6F, VSIG10, ТМЕМ25 и/или LSR получают с использованием мышей из линии НСо7 трансгенных мышей HuMab Mouse RTM, экспрессирующих гены человеческих антител. В этой мышиной линии эндогенный ген мышиной легкой каппа-цепи был гомозиготно разрушен, как описано в Chen et al. (1993) EMBO J. 12:811-820, и эндогенный ген мышиной тяжелой цепи был гомозиготно разрушен, как описано в Примере 1 из публикации РСТ WO 01/09187. Кроме того, эта мышиная линия несет трансген человеческой легкой каппа-цепи, КСо5, как описано в Fishwild et al., (1996) Nature Biotechnology 14:845-851, и трансген человеческой тяжелой цепи, НСо7, как описано в патентах США №5545806, 5625825 и 5545807.
Иммунизация HuMab
Для создания полностью человеческих моноклональных антител к LY6G6F VSIG10, ТМЕМ25 и/или LSR мыши линии НСо7 HuMab Mouse можно иммунизировать очищенным рекомбинантным слитым белком LY6G6F, VSIG10, ТМЕМ25 и/или LSR, полученным из клеток млекопитающих, которые трансфицированы вектором экспрессии, содержащим ген, кодирующий слитый белок. Общие схемы иммунизации HuMab Mouse описаны в Lonberg H. et al., (1994) Nature 368(6474):856-859; Fishwild D. et al., (1996) Nature Biotechnology 14:845-851 и публикации РСТ WO 98/24884. Мыши имеют возраст 6-16 недель после первой инфузии антигена. Очищенный рекомбинантный антигенный препарат LY6G6F, VSIG10, ТМЕМ25 и/или LSR (5-50 мкг, очищенный из трансфицированных клеток млекопитающих, экспрессирующих слитый белок LY6G6F, VSIG10, ТМЕМ25 и/или LSR) используют для иммунизации мышей HuMab внутрибрюшинно.
Трансгенных мышей иммунизируют дважды антигеном в полном адъюванте Фрейнда или адъюванте Райби IP с последующими 3-21 днем IP (в общей сложности до 11 иммунизации) антигеном в неполном адъюванте Фрейнда или Райби. Иммунный ответ контролируют в ретроорбитальных образцах крови. Плазму подвергают скринингу с помощью ELISA (как описано ниже), а мышей с достаточными титрами человеческого иммуноглобулина к LY6G6F, VSIG10, ТМЕМ25 и/или LSR используют для слияния. Мышам вводят внутривенно бустер-дозу с антигеном за 3 дня до умерщвления и удаления селезенки.
Отбор мышей HuMab, производящих антитела к LY6G6F, VSIG10, ТМЕМ25 и/или LSR
Для отбора мышей HuMab, производящих антитела, которые связывают LY6G6F, VSIG10, ТМЕМ25 и/или LSR, сыворотку крови от иммунизированных мышей исследуют с помощью модифицированного ELISA, как было впервые описано Fishwild D. et al., (1996). Коротко, на планшеты для микротитрования наносят очищенный рекомбинантный слитый белок LY6G6F, VSIG10, ТМЕМ25 и/или LSR при 1-2 мкг/мл в PBS, 50 мкл/лунку, инкубируют при 4°С в течение ночи, затем блокируют с 200 мкл/лунку 5% BSA в PBS. Разведения плазмы от LY6G6F-, VSIG10-, ТМЕМ25- и/или LSR-иммунизированных мышей добавляют в каждую лунку и инкубируют в течение 1-2 часов при температуре окружающей среды. Планшеты промывают PBS/Tween и затем инкубируют с козьим поликлональным антителом против человеческой легкой каппа-цепи, конъюгированным со щелочной фосфатазой, в течение 1 часа при комнатной температуре. После промывки планшеты проявляют с субстратом pNPP и анализируют с помощью спектрофотометра при OD 415-650. Мышей, которые проявили самые высокие титры антител к LY6G6F, VSIG10, ТМЕМ25 и/или LSR, используют для слияний. Слияния выполняют, как описано ниже, и надосадочные жидкости гибридом исследуют на активность против LY6G6F, VSIG10, ТМЕМ25 и/или LSR с помощью ELISA.
Образование гибридом, продуцирующих человеческие моноклональные антитела к LY6G6F, VSIG10, TMEM25 и/или LSR
Мышиные спленоциты, выделенные от мышей HuMab, сливают с помощью PEG с клеточной линией мышиной миеломы на основе стандартных протоколов. Полученные гибридомы подвергают скринингу на производство антиген-специфических антител. Суспензии одного типа клеток лимфоцитов селезенки иммунизированных мышей сливают с одной четвертой количества Р3Х63 Ag8.6.53 (ATCC CRL 1580) несекретирующих клеток мышиной миеломы с 50% PEG (Sigma). Клетки высевают при приблизительно 1×10 -5/лунку в плоскодонный микротитровальный планшет с последующей инкубацией около двух недель в селективной среде, содержащей 10% фетальной телячьей сыворотки с добавлением Origen (IGEN) в RPMI, L-глутамине, пирувате натрия, HEPES, пенициллине, стрептамицине, гентамицине, 1х ПАТ и бета-меркаптоэтаноле. Через 1-2 недели клетки культивируют в среде, в которой HAT заменен на НТ. Затем отдельные лунки подвергают скринингу с помощью ELISA (описано выше) на человеческие моноклональные IgG-антитела к LY6G6F, VSIG10, TMEM25 и/или LSR. После того, как произошел интенсивный рост гибридомы, среду контролируют, как правило, через 10-14 дней. Гибридомы, секретирующие антитела, пересевают, снова подвергают скринингу и, если они все еще положительные на человеческий IgG, моноклональные антитела к LY6G6F, VSIG10, TMEM25 и/или LSR субклонируют по меньшей мере дважды путем серийных разведении. Затем стабильные субклоны культивируют in vitro для получения небольших количеств антитела в среде тканевой культуры для дополнительной характеристики.
Клоны гибридомы отбирают для дополнительных анализов.
Структурная характеристика требуемых человеческих моноклональных антител к LY6G6F, VSIG10, TMEM25 и/или LSR
Последовательности кДНК, кодирующие вариабельные области тяжелой и легкой цепи полученных моноклональных антител к LY6G6F, VSIG10, TMEM25 и/или LSR, получают из результирующих гибридом, соответственно, с использованием стандартных техник ПЦР и секвенируют с использованием стандартных техник секвенирования ДНК.
Определяют нуклеотидные и аминокислотные последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи. Эти последовательности можно сравнить с известными последовательностями легкой и тяжелой цепи человеческого иммуноглобулина зародышевой линии и идентифицировать CDR каждой из тяжелой и легкой цепей полученных последовательностей антител к LY6G6F, VSIG10, TMEM25 и/или LSR.
Характеристика специфичности связывания и кинетики связывания человеческих моноклональных антител к LY6G6F, VSIG10, TMEM25 и/или LSR
Сродство связывания, кинетику связывания, специфичность связывания и перекрестную конкуренцию антител к LY6G6F, VSIG10, ТМЕМ25 и/или LSR исследуют с помощью анализа Biacore. Кроме того, специфичность связывания исследуют методом проточной цитометрии.
Сродство и кинетика связывания
Антитела к LY6G6F, VSIG10, ТМЕМ25 и/или LSR, полученные согласно настоящему изобретению, характеризуют относительно сродства и кинетики связывания с помощью анализа Biacore (Biacore АВ, Уппсала, Швеция). Очищенный рекомбинантный человеческий гибридный белок LY6G6F, VSIG10, ТМЕМ25 и/или LSR ковалентно связывается с чипом СМ5 (чип, покрытый карбоксиметил декстраном) через первичные амины с использованием стандартной химии связывания аминов и набора, предоставляемого Biacore. Связывание измеряют в потоке антител в буфере HBS ЕР (предоставлен BIAcore АВ) в концентрации 267 нМ при скорости потока 50 мкл/мин. Кинетику ассоциации антиген-ассоциациированных антител исследуют в течение 3 минут и кинетику диссоциации исследуют в течение 7 минут. Кривые ассоциации и диссоциации выравнивают по модели связывания Ленгмюра 1:1 с использованием программного обеспечения BIAevaluation (Biacore АВ). Для минимизации эффектов авидности при оценке констант связывания только начальный сегмент данных, соответствующий фазам ассоциации и диссоциации, используют для выравнивания.
Картирование эпитопов полученных антител к LY6G6F, VSIG10, ТМЕМ25 и/или LSR
Biacore используют для определения группирования эпитопов HuMAb к LY6G6F, VSIG10, ТМЕМ25 и/или LSR. Полученные антитела к LY6G6F, VSIG10, ТМЕМ25 и/или LSR используют для картирования их эпитопов на антигене LY6G6F, VSIG10, ТМЕМ25 и/или LSR, соответственно. Эти различные антитела наносят на три различные поверхности на одном и том же чипе по 8000 RU каждый. Выполняют разведения каждого из mAb, начиная с 10 мкг/мл, и инкубируют с Fc-слитыми LY6G6F, VSIG10, ТМЕМ25 и/или LSR (50 нМ) в течение одного часа. Инкубированный комплекс вводят на все три поверхности (и пустую поверхность) одновременно в течение 1,5 минут при скорости потока 20 мкл/мин. Изобразили зависимость сигнала от каждой поверхности по окончании 1,5 минут после удаления соответствующих пустых участков от концентрации mAb в комплексе. После анализа данных антитела к LY6G6F, VSIG10, ТМЕМ25 и/или LSR разделили на различные эпитопные группы в зависимости от результатов картирования эпитопов. Также сравнили их функциональные свойства.
Клеточные линии яичника китайского хомячка (СНО), которые экспрессируют белок LY6G6F, VSIG10, ТМЕМ25 и/или LSR на поверхности клетки, разработаны и используются для определения специфичности HuMAb LY6G6F, VSIG10, ТМЕМ25 и/или LSR с помощью проточной цитометрии. Клетки СНО трансфицировали плазмидами экспрессии, содержащими кДНК полной длины, кодирующую трансмембранные формы антигена LY6G6F, VSIG10, ТМЕМ25 и/или LSR или их варианта. Трансфицированные белки, содержащие эпитопную метку на N-конце, используют для обнаружения антитела, специфического для данного эпитопа. Связывание МАЬ к LY6G6F, VSIG10, ТМЕМ25 и/или LSR оценивают путем инкубации трансфицированных клеток с каждым из Аb к LY6G6F, VSIG10, ТМЕМ25 и/или LSR в концентрации 10 мкг/мл. Клетки промывают и определяют связывание с помощью FITC-меченого антитела против человеческого IgG. Мышиное АЬ против эпитопной метки, а затем меченое антитело к мышиному IgG используют в качестве положительного контроля. Неспецифические человеческие и мышиные Аb используют в качестве отрицательного контроля. Полученные данные используют для оценки специфичности HuMAb в отношении антигена-мишени LY6G6F, VSIG10, ТМЕМ25 и/или LSR.
Эти антитела и другие антитела, специфические в отношении LY6G6F, VSIG10, ТМЕМ25 и/или LSR, можно использовать в типах вышеописанной связанной с антителами к LY6G6F, VSIG10, ТМЕМ25 и/или LSR терапии, такой как лечение форм рака, где антиген LY6G6F, VSIG10, ТМЕМ25 и/или LSR неодинаково экспрессирован, и/или для модулирования (усиления или ингибирования) иммунной костимуляции В7 с участием антигена LY6G6F, VSIG10, ТМЕМ25 и/или LSR, например, для лечение форм рака и аутоиммунных заболеваний, где такие антитела будут, например, предотвращать отрицательную стимуляцию Т-клеточной активности против требуемых раковых клеток-мишеней или предотвращать положительное стимулирование активности Т-клеток, тем самым вызывая требуемый противоаутоиммунный эффект.
Настоящее изобретение было описано и были предоставлены различные варианты осуществления, связанные с производством и отбором требуемых антител к LY6G6F, VSIG10, ТМЕМ25 и/или LSR для применения в качестве терапевтических и диагностических способов, где заболевание или состояние связано с антигеном LY6G6F, VSIG10, ТМЕМ25 и/или LSR. Различные варианты осуществления можно необязательно комбинировать в данном документе любым подходящим способом помимо подробных комбинаций и подкомбинаций, показанных в данном документе. Настоящее изобретение дополнительно описано с помощью нижеследующей формулы изобретения.
Реферат
Изобретение относится к области биотехнологии, конкретно к выделенным нейтрализующим антителам, специфичным к внеклеточным доменам белка LSR, и может быть использовано в медицине. Путем иммунизации млекопитающего белком LSR с SEQ ID NO: 11, 13, 15-17 или 18 с последующим выделением получают антитела и фармацевтическую композицию, обладающую нейтрализующей активностью. Изобретение позволяет получать лекарственные средства для иммунотерапии, эффективные для лечения заболеваний, связанных со снижением активации Т-клеток, опосредованных белком LSR. 6 н. и 21 з.п. ф-лы, 38 ил., 20 табл., 50 пр.
Формула
Документы, цитированные в отчёте о поиске
Анализы и способы, использующие биомаркеры

Комментарии