Блокада воспалительных протеаз тета-дефензинами - RU2652605C2
Код документа: RU2652605C2
Чертежи











Описание
[0001] Данная заявка испрашивает приоритет на основании предварительной заявки на патент США номер 61/492753, поданной 2 июня 2011.
Область техники
[0002] Настоящее изобретение относится к применению циклических пептидов для модулирования активности цитокинов, включая передачу сигналов и пути воспаления, при различных заболеваниях. В частности, циклические пептиды согласно настоящей заявке обладают ранее неизвестной биологической активностью, такой как ингибирование шеддаз и других родственных протеаз (металлопротеиназ и цистеиновых протеаз), что можно применять при заболеваниях, в случае, когда активность этих протеаз связана с патогенезом такого заболевания.
Предпосылки создания изобретения
[0003] Все публикации включены в настоящую заявку посредством ссылки в равной мере, как если бы каждая отдельная публикация или заявка на патент была бы конкретно и отдельно обозначена как включенная в виде ссылки. Нижеследующее описание содержит сведения, которые могут быть полезны в понимании предмета настоящего изобретения. Это не является признанием того, что любые сведения, предоставленные в настоящей заявке, представляют собой известный уровень техники или имеют отношение к заявленным в настоящее время изобретениям, или что любая публикация, на которую ссылаются непосредственно или неявно, представляет собой известный уровень техники.
[0004] Циклические пептиды, описанные в настоящей заявке, представляют собой недавно обнаруженные терапевтические агенты, направленные на ферменты провоспалительных путе с известным клиническим значением, такие как фермент, конвертирующий фактор некроза опухоли альфа ФНОα («ТАСЕ», также известный как ADAM17), и другие металлоферменты (например, шеддазы и матриксные металлопротеиназы («ММП»), которые вовлечены в патологическое воспаление, деградацию ткани и мобилизацию факторов роста, стимулирующих пролиферацию раковых клеток.
[0005] Металлопротеиназы регулируют множество биологических процессов, от эволюционного программирования, до ответа на повреждение или инфекцию такни, ремоделирования шрамов и стимуляции деления клеток (3). Регуляция активности металлопротеиназ является ключевой для поддержания клеточного и тканевого гомеостаза. Множество болезненных состояний связано со сверхэкспрессией активности металлоферментов. Например, суставы, страдающие от ревматоидного и других форм артрита, характеризуются повышенным уровнем ММП, а также ФНОα, который высвобождается с поверхности клеток, экспрессирующих про- ФНОα под действием ТАСЕ (7, 8, 13, 16). Доказано, что блокада ФНОа с помощью моноклональных антител является эффективной для лечения ревматоидного артрита (РА) у значительной части пациентов с РА, невосприимчивым к препаратам первой линии, таким как низкие дозы метотрексата. Поскольку блокада ФНОα для РА не является эффективной во всех случаях и поскольку существуют серьезные побочные эффекты, связанные с блокаторами ФНОα у некоторых, пациентов, продолжаются попытки разработать альтернативные противовоспалительные стратегии. В этой связи многочисленные фармацевтические компании сфокусировали программы разработки лекарственных препаратов на изучении ингибиторов ТАСЕ (17), но ни один из них не был одобрен FDA.
[0006] Тета дефензины (θ-дефензины) представляют собой природные циклические пептиды, экспрессируемые в тканях макаков-резус, павианов и других мартышковых. Они не экспрессируются у людей или других гоминид. Существующие в природе θ-дефензины состоят из кольца из 18 аминокислот, стабилизированных тремя дисульфидными связями, которые являются консервативными среди всех известных θ-дефензинов (9, 21-23, 25). Как и другие дефензины, θ-дефензины изначально были обнаружены на основании противомикробных свойств этих пептидов. Однако авторы настоящего изобретения обнаружили второе, неизвестное до настоящей заявки свойство θ-дефензинов как потенциальных противовоспалительных факторов. Как описано более подробно в настоящей заявке, природные и модифицированные структуры θ-дефензинов способны к подавлению воспаления как ex vivo, так и in vivo. Что наиболее важно, было обнаружено то, что θ-дефензины и пептиды, производные от структуры θ-дефензинов (т.е., циклические пептиды), способны ингибировать ТАСЕ, ключевой фактор в воспалении, опосредованном ФНОα. Это абсолютно новое открытие того, что θ-дефензины являются природными ингибиторами ТАСЕ, обеспечивает важный источник молекул, способных регулировать воспаление посредством эндогенных цитокин-опосредованных путей передачи сигнала, существующих у субъекта. Эти пептиды являются единственным известным природным продуктом, экспрессируемым у животных, который является растворимым регулятором ТАСЕ. Таким образом, циклические пептиды могут быть полезными терапевтическими агентами в отношении разнообразных стадий или состояний болезни, таких как аутоиммунные и другие воспалительные заболевания, которые являются следствием нарушения активности цитокинов, и разнообразные воспалительные заболевания и/или состояния человека могут возникать в результате потери экспрессии θ-дефензинов в ходе эволюции приматов.
[0097] Более того, факторы, такие как ТАСЕ, являются членами более широкого класса молекул, известных как шеддазы, которые обладают биологической активностью по расщеплению внеклеточных доменов белков. Такая активность по расщеплению обеспечила терапевтический путь для увеличения эффективности определенных вариантов лечения, таких как лечение трастузумабом (Герцептином), путем ингибирования шеддазы ADAM10, для применения при лечении рака молочной железы. Обычно расщепление Her2 шеддазой ADAM10 приводит к образованию фрагмента Her2, обладающего конститутивной киназной активностью с лиганд-независимой передачей сигналов к росту и выживанию пролиферирующих клеток. Однако вредные эффекты этого процесса могут быть нивелированы посредством ингибирования шеддазы. Таким образом, циклические пептиды, обладающие способностью ингибировать шеддазы, обеспечивают терапевтические подходы для еще более широкого репертуара заболеваний и/или состояний, включая те, при которых изменения в структуре, экспрессии и/или функции металлопротеиназ связаны с патогенезом заболевания и/или состояния.
[0008] На протяжении более десятка лет фармацевтические компании пытались разработать ингибиторы ТАСЕ (14, 17). Хотя было показано, что некоторые небольшие молекулы (в основном, гидроксаматы) являются эффективными на экспериментальных моделях РА, ни одно из этих соединений не было одобрено из-за неприемлемой токсичности у людей (14, 17). Более того, все существующие антагонисты ФНО имеют предостережение в черной рамке, наиболее суровый тип предупреждения Управления по контролю продуктов питания и лекарственных средств США (FDA) которое лекарственный препарат может иметь и при этом остается на рынке Соединенных Штатов.
[0009] Вследствие этого, появление нетоксичного ингибитора ТАСЕ, который был бы эффективным в лечении таких заболеваний как РА, станет ценным дополнением к терапевтическим подходам к лечению РА, связанных аутоиммунных и воспалительных заболеваний, а также других заболеваний, в которые вовлечена активность металлопротеиназ, таких как рак. В более общих словах, все еще существует потребность в лекарственных средствах, которые лечили бы воспалительные и связанные с воспалением состояния, особенно хронические воспалительные состояния, а также в способах производства, предложения на рынке и введения таких лекарственных средств.
Краткое описание изобретения
[0010] Предмет настоящего изобретения предусматривает аппараты, системы и способы, с помощью которых лекарственная композиция, которая содержит θ-дефензин, его аналог или производное, исследуется и поставляется на рынок для лечения воспалительного состояния.
[0011] В свете данного представления, предпочтительные лекарственные композиции содержат по меньшей мере одно из RTD-1-27, RTD-1-28 и RTD-1-29.
[0012] Рассматриваемыми в исследовательском аспекте предмета настоящего изобретения являются исследования токсичности, эффективности и исследование зависимости «доза-эффект». Любое из таких исследований может быть проведено непосредственно фармацевтической или другой компанией в ее собственных лабораториях или опосредованно - через дочернюю компанию или несвязанную компанию, каждая из которых должна пониматься в настоящей заявке как включенная в концепцию определения эффективности указанной лекарственной композиции.
[0013] Противовоспалительный эффект/противовоспалительные эффекты, рассматриваемые в настоящей заявке, следует интерпретировать как широким образом включающие все варианты клинически значимого ингибирования связанных с воспалением соединений, включая, например, ингибирование фермента, конвертирующего фактор некроза опухоли альфа ФНОα (ТАСЕ), катепсина C или других провоспалительных протеаз, семейства металлопротеиназ ADAM или других шеддаз.
[0014] Этап обеспечения лекарственной композиции на рынке следует интерпретировать в настоящей заявке как осуществляемое или уже осуществленное производство, или руководство, контроль или осуществляющееся любым другим способом влияние на производство коммерческого количества лекарственной композиции. Рассматриваемые минимальные коммерческие количества включают в общей сложности 1 килограмм, 10 килограмм, 100 килограмм, 1000 килограмм, произведенные в течение любого данного периода длительностью в один год на одной или более производственных площадках.
[0015] Один интересный аспект рассматриваемого θ-дефензина, его аналога или производных состоит в том, что любое из этих соединений является высокостабильным по отношению к кислотам и протеазам и может быть введено в лекарственной форме для орального приема.
[0016] По меньшей мере частично, поскольку рассматриваемые терапевтические композиции могут воздействовать на ТАСЕ и/или шеддазы, предполагается, что можно лечить многие различные воспалительные состояния, включая, например, ревматоидный артрит, воспалительное заболевание кишечника и другие хронические воспалительные заболевания, аутоиммунные заболевания, острую бактериемию, сепсис, муковисцедоз, рак, болезнь Альцгеймера, остеоартрит, связанные с воспалением нейродегенеративные заболевания и другие заболевания, связанные с воспалением. В частности предполагается, что способы и композиции, рассматриваемые в настоящей заявке, можно успешно реализовать на рынке для лечения лиц, невосприимчивых к лечению агентами против ФНОα.
[0017] Также рассматриваются лекарственные средства и способы производства лекарственных средств для введения человеку или животному, отличному от человека, где лекарственное средство включает по меньшей мере один из новых θ-дефензинов, его аналог или производное, раскрытые в настоящей заявке или в приоритетной заявке, которые предлагаются на рынке для лечения воспалительного состояния. Особенный интерес вызывают RTD-1-27, RTD-1-28 и RTD-1-29.
[0018] Различные объекты, черты, аспекты и преимущества предмета настоящего изобретения станут более понятными из следующего детального описания предпочтительных вариантов реализации.
Краткое описание чертежей
[0019] Фиг.1. Биосинтез θ-дефензина и его структура. При образовании зрелого пептида RTD-1 происходит вырезание нонапептидов-заместителей (обозначены цветовым кодированием) и сплайсинг (из (21)).
[0020] Фиг.2. Выравнивание препро-θ-дефензинов. А. Аминокислотные последовательности от BTDa до -d, спрогнозированные на основании кДНК, выравнивали вручную с RTD1a до -с, и с превдогеном θ-дефензина человека (HTDp). Точки в выровненных последовательностях обозначают аминокислоты, идентичные аминокислотам в BTD-a, знак звездочки обозначает положение терминирующего кодона, знак # обозначает стоп-кодон, досрочно терминирующий трансляцию. В. Циклические структуры 10 расшифрованных пептидов BTD, происходящих из последовательностей кДНК.
[0021] Фиг.3. RTD-1 снижает смертность при полимикробном сепсисе мыши. Взрослые мыши Balb/c подвергались лигатуре слепой кишки и пункции (ЛСКП) в Т=0. Мыши получали единичную инъекцию (150 мкл) физиологического раствора (•, n=10) через 4 ч после ЛСКП или физиологического раствора, содержащего 5 мг/мг RTD-1 через 4 ч (▲, n=11) или через 24 ч (■, n=5) после операции ЛСКП.
[0022] Фиг.4. Активность θ-дефензинов, направленная против ФНОα. А. Ковалентные структуры RTD 1-6 (23) с цветовым кодированием, демонстрирующим получение элементов нонапептидов (23). В. Цельную кровь человека (в разведении 1:10) инкубировали с 100 КОЭ/мл живых E. coli в течение 4 ч в присутствии 0-10 мг/мл θ-дефензина RTD-1 и двух α-дефензинов человека (HNP-2 и HNP-4) и количественно определяли ФНОα с помощью метода ELISA. С. Изучали влияние RTD 1-5 на высвобождение ФНОα из цельной крови человека, как в секции В; ФНОα количественно определяли с помощью метода ELISA. RTD-6, присутствующий только в следовых количествах в полиморфно-ядерных лейкоцитах, не анализировали.
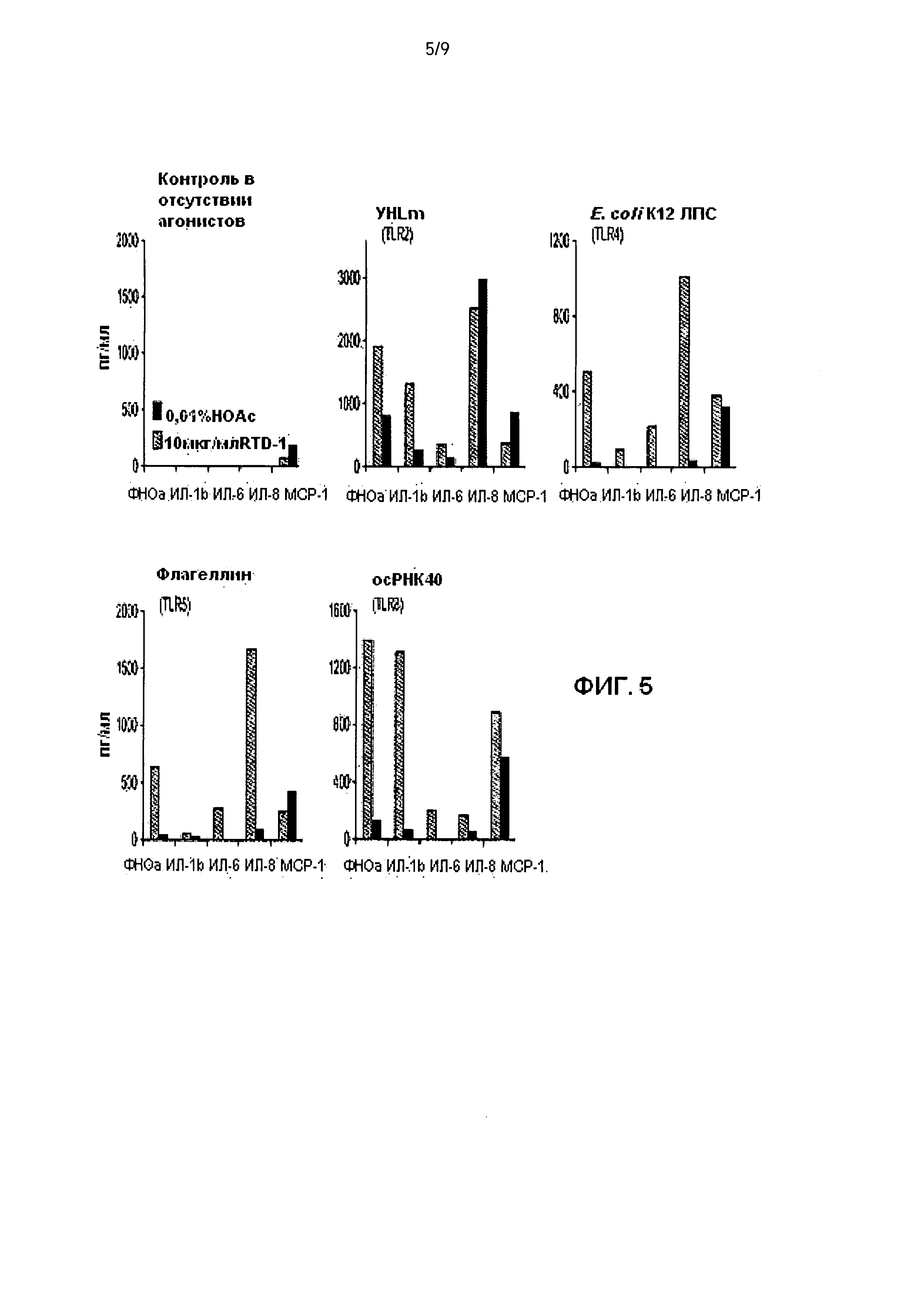
[0023] Фиг.5. θ-дефензины ингибируют провоспалительные цитокины/хемокины, индуцированные многочисленными агонистами TLR. Клетки периферической крови человека (5×105 клеток/мл) в RPMI 1640 и 5% плазму человека инкубировали с 10 мкг/мл RTD-1 (контроль в отсутствии агонистов) или с растворителем пептидов (0,01% НОАс), или одновременно с агонистами TLR в течение 4 ч при 37°С в 5% CO2 с легким перемешиванием. Супернатанты собирали с помощью центрифугирования и количественно определяли уровень цитокинов/хемокинов с помощью анализа Luminex xMAP, используя панель цитокинов/хемокинов Milliplex. Агонисты: TLR2 - 1×108 убитых нагреванием L. monocytogenes (УHLm); TLR4 - 3,3 нг/мл E. coli K12 LPS; TLR5 - 30 нг/мл флагеллина S. typhimurium; TLR8 - 0,9 мкг/мл осРНК40.
[0024] Фиг.6. θ-дефензины являются конкурентными ингибиторами ТАСЕ. А. Рекомбинантный ТАСЕ (рТАСЕ) инкубировали с указанными концентрациями пептидов и ТАСЕ-специфичным субстратом (Mca-PLAQAV-Dpa-RSSSR-NH2) и флуориметрически измеряли ферментативную активность. В. Анализировали способность RTD 1-5 ингибировать ТАСЕ, как в секции А. С. Анализ Лайнуивера-Берка ингибирования RTD-1 рТАСЕ при концентрации пептидов 0, 50, 100 и 150 нг/мл. D. Сравнение структур RTD-1 и «природного» ациклического аналога (S-7). Е. Сравнительное ингибирование рТАСЕ RTD-1 и RTD-1-S7 аналогом. F. Ингибирование рТАСЕ RTD-1 в покоящихся или LPS-стимулированных (2 ч) клеток ТНР-1 (1).
[0025] Фиг.7. θ-дефензины являются потенциальными ингибиторами ADAM 10. Рекомбинантный ADAM10 и субстрат (Mca-PLAQAV-Dpa-RSSSR-NH2; 0,05 мкг/мл) инкубировали с RTD 1-3 в течение 60 мин при 37°С, и флуориметрически измеряли ферментативную активность.
[0026] Фиг.8. Эффективность in vivo, а также активность против ФНОα. и блокирующее ТАСЕ действие мини-θ-дефензинов. А. Ковалентные структуры мини-θ-дефензинов. В. Эффективность мини-θ-дефензинов при сепсисе ЛСКП. Операцию ЛСКП проводили у BALB/c мышей в Т=0. Через 4 ч после операции мыши получали в.в. ФБР (контроль плацебо) или 5 мг/кг указанного мини-θ-дефензина в ФБР. Эффективность лечения оценивали как выживание до включительно 15 дней. С. Оценивали действие мини-θ-дефензинов на высвобождение ФНОα из цельной крови человека. EDTA-антикоагулированную цельную кровь разводили в соотношении 1:10 в RPMI 1640 и инкубировали с живыми клетками E. coli в течение 4 ч с 0-10 мкг/мл RTD-1 (природный θ-дефензин) или с тремя указанными мини-θ-дефензинами. D. Влияние RTD-1 и трех мини-θ-дефензинов на активность ТАСЕ определяли, как описано для Фиг.5.
[0027] Фиг.9. Влияние RTD-1 на пристан-индуцированный артрит крыс (ПИА). У крыс DA индуцировали ПИА, как описано в тексте, и разбивали животных на группы, которые получали ежедневные в.в. инъекции солевого раствора (N=10) или 5 мг/кг RTD-1 (N=11). Оценивали и рассчитывали степень макропатологии (20). Каждый символ представляет собой степень макропатологии у отдельного животного. Во всех случаях обработка RTD-1 вызывала прекращение болезни суставов, которое сопровождалось восстановлением нормальной способности передвигаться.
Подробное описание изобретения
[0028] Содержание всех ссылок, приведенных в настоящей заявке, включены в нее посредством ссылки во всей своей полноте, как если бы они были полностью изложены. Если не указано обратное, технические и научные термины, используемые в настоящей заявке, имеют то же значение, как обычно понимается средним специалистом в той области техники, к которой принадлежит предмет настоящего изобретения. Singleton et al., Dictionary of Microbiology and Molecular Biology 3rd ed., J. Wiley & Sons (New York, NY 2001); March, Advanced Organic Chemistry Reactions, Mechanisms and Structure 5th ed, Wiley & Sons (New York, NY 2001); и Sambrook and Russel, Molecular Cloning: A Laboratory Manual 3nd ed., Cold Spring Harbor Laboratory Press (Cold Spring Harbor, NY 2001); обеспечат специалисту в данной области техники общее указание ко многим терминам, используемым в настоящей заявке.
[0029] Специалисту в данной области техники известно множество способов и материалов, подобных или эквивалентных тем, которые раскрыты в настоящей заявке, которые можно использовать при практическом применении заявленных изобретений. Более того, предмет настоящего изобретения не следует интерпретировать как ограниченный описанными способами и материалами. Для настоящих целей следующие термины определены ниже.
[0030] Если контекст не предписывает обратного, все диапазоны, изложенные в настоящей заявке, следует интерпретировать как включающие их предельные точки, и неограниченные диапазоны следует интерпретировать как включающие коммерчески реальные объемы. Аналогично все списки значений следует рассматривать как охватывающие промежуточные значения, если контекст не свидетельствует об обратном.
[0031] Используемый в настоящей заявке термин «тета-дефензины» или «θ-дефензины» включают членов семейства θ-дефензинов из белков дефензинов, которые обнаружены у многих видов обезьян, таких как мартышковые и приматы (примерами служат макака-резус, павиан анубис, сиаманг и орангутанг), при этом предшественники θ-дефензинов транскрипционно экспрессируются и процессируются посредством пост-трансляционных модификаций в θ-дефензин. Они также включают псевдогены, найденные у человекообразных приматов (примерами служат человек, шимпанзе, бонобо и горилла), где генетические модификации псевдогенов θ-дефензина могут быть изменены в соответствии с методиками, широко известными в данной области техники, для обеспечения экспрессии белков θ-дефензинов в клетках млекопитающих. Они также включают белки θ-дефензины, которые могут быть идентифицированы в одном и том же или в различных видах, в соответствии с методиками, известными в данной области техники, такими как методики компьютерного моделирования, описывающие гомологичность последовательностей или консервативную структуру в окне сравнения последовательностей нуклеиновой кислоты и/или аминокислоты, или методики селективной гибридизации с использованием проб нуклеиновой кислоты для идентификации гомологичных θ-дефензинов. θ-дефензины можно выделить из эндогенных источников, наработать в автологичных или гетерологичных клеточных линиях, получить посредством пептидного синтеза или в соответствии с любым доступным способом, известным специалисту в данной области техники. Примеры θ-дефензинов включают RTD-1, RTD-2, RTD-3, RTD-4, RTD-5, RTD-6, BTD-1, BTD-2, BTD-3, BTD-4, BTD-5, BTD-6, BTD-7, BTD-8, BTD-9, BTD-19 или HTDp.
[0032] Термин «шеддазы», используемый в настоящей заявке, охватывает белки ферментов, которые расщепляют внеклеточные части трансмембранных белков. Примеры включают, среди прочих, членов семейств белков дезинтегринов и металлопротеиназ (ADAM), семейства белков аспарагиновых протеаз (ВАСЕ). Примеры белков ADAM, которые являются шеддазами, включают ADAM2, ADAM7, ADAM8, ADAM9, ADAM10, ADAM11, ADAM12, ADAM15, ADAM17, ADAM18 (также известный как ADAM27), ADAM19, ADAM29, ADAM21 (также известный как ADAM31), ADAM22, ADAM23, ADAM28, ADAM29, ADAM39 и ADAM33.
[0033] Термин «аналог», применяемый в настоящей заявке по отношению к θ-дефензинам, относится к полипептидам и пептидам, которые содержат коровую структуру, происходящую от дефензина, такого как θ-дефензин, которые способны модулировать активность цитокинов, ингибировать активность протеолитических шеддаз, изменять функцию ферментов, связанных с рецепторами клеточной поверхности, и/или обладают противомикробным действием. Примеры включают циклические пептиды, содержащие одну, две, три, четыре или более дисульфидных связей между множеством остатков цистеина или существенно подобных заместителей, причем указанный аналог может иметь длину, варьирующую от 8 до 24 аминокислот, и содержит суммарный положительный заряд.
[0034] Дефензины представляют собой небольшие богатые цистеином катионные белки, которые являются эволюционно высоко консервативными и которые обнаружены у позвоночных, беспозвоночных, а также у растений. Эти белки обладают биологической активностью, направленной против широкого спектра организмов, таких как бактерии, грибы и многие оболочечные и безоболочечные вирусы. Обычно дефензины состоят из 18-45 аминокислот, включая от 6 (у позвоночных) до 8 консервативных остатков цистеина. Различные иммунные клетки, такие как нейтрофильные гранулоциты и почти все эпителиальные клетки, содержат эти пептиды с ключевой функцией уничтожения фагоцитированных или внеклеточных микроорганизмов. Многие дефензины функционируют посредством связывания с мембраной микробиальной клетки и, однажды внедрившись в нее, образуют пороподобные дефекты мембраны, которые обеспечивают выход важных ионов и питательных веществ с разрушением целостности микроба. Однако, как будет далее описано в настоящей заявке, некоторые члены белков дефензинов, включая θ-дефензины, также функционируют посредством модулирования иммунной функции клетки-хозяина. Это включает пути воспаления, связанные с цитокинами, такими как ФНОα.
[0035] Дефензины, в общем смысле. Дефензины представляют собой катионные, тридисульфид-содержащие противомикробные пептиды, которые продуцируются лейкоцитами и различными эпителиальными клетками. Они подразделяются на подсемейства α, β, θ-дефензинов, которые отличаются размером пептида и различными дисульфидными мотивами. У человека четыре α-дефензина (от HNP-1 до HNP-4) были выделены из нейтрофилов, а два кишечных α-дефензина (HD-5 и HD-6) экспрессируются клетками Панета в криптах тонкой кишки. Экспрессия HD-5 была также обнаружена в мочеполовых путях женщин. Три β-дефензина человека (от hBD-1 до hBD-3) были выделены из эпителиальных и неэпителиальных типов клеток различных органов, и экспрессия некоторых других была выявлена с помощью анализа кДНК или благодаря анализу генома человека. Многочисленные данные свидетельствуют, что дефензины обеспечивают противомикробную эффекторную функцию в коже, респираторном эпителии, мочеполовых путях и в различных лейкоцитах (т.е., нейтрофилах, моноцитах и клетках NK). Более того, дефензины активируют клетки, вовлеченные как во врожденный, так и в приобретенный иммунный ответ, свидетельствуя, что они действуют в рамках двух ветвей иммунитета и объединяют их.
[0036] Макроциклические θ-дефензины. θ-дефензины представляют собой циклические октадекапептиды, образованные посредством посттрансляционного сплайсинга из двух нонапептидов, происходящих от родственного θ-дефензину предшественника, состоящего из 76 аминокислот. У людей не экспрессируются пептиды θ-дефензина, поскольку экспрессия θ-дефензина прекратилась приблизительно в то время, когда в ходе эволюции возникли орангутанги в результате мутации, которая ввела преждевременный стоп-кодон в предшественник пептида.
[0037] θ-дефензины можно получить путем биосинтеза, используя сплайсинг по типу «голова-к-хвосту», последовательностей, состоящих из 9 аминокислот, происходящих от предшественника θ-дефензина. θ-дефензины впервые идентифицировали в нейтрофилах и моноцитах макаков-резусов. Последовательное филогенетическое исследование обнаружило существование генов θ-дефензина у других человекообразных обезьян и у двух приматов (сиаманга и орангутанга), но о существовании θ-дефензинов у капуцинообразных обезьян или полуобезьян не сообщалось. У людей, шимпанзе, бонобо и горилл экспрессируются псевдогены θ-дефензина, в которых мРНК предшественника содержит мутацию, которая образует стоп-кодон в сигнальной последовательности, и тем самым предотвращает трансляцию предшественника θ-дефензина. θ-дефензин-1 резуса (RTD-1) продуцируется в результате гетеродимерного сплайсинга двух предшественников θ-дефензина, proRTD1a и proRTD1b. Гомодимерные реакции отщепления/лигирования, в которые вовлечены proRTD1a и proRTD1b, обнаружили путем изолирования RTD-2 и RTD-3. RTD-1, -2, и -3 оказывают сильное микробиологическое действие против бактерий и грибов; известно, что они обладают противовирусной активностью против вируса иммунодефицита человека типа 1 (HTV-1) и вируса простого герпеса (HSV).
[0038] Нами была разработана структура синтетических θ-дефензинов на основании последовательности природного θ-дефензина, которые обладают противобактериальным и противовирусным действием. В дополнение обнаружено, что θ-дефензины связывают летальные токсины Bacillus anthracis и инактивируют их. θ-дефензины проявляют бактерицидные свойства в присутствии физиологических концентраций соли, двухвалентных катионов и сыворотки. Напротив, противомикробные свойства α- и β-дефензинов значительно снижаются в присутствии соли и двухвалентных катионов. Ациклический RTD-1 является неактивным против Staphylococcus aureus в физиологическом растворе, тогда как природная циклическая форма пептида сохраняет в этих условиях потенциальную лизирующую активность. Эти данные свидетельствуют, что циклическая структура остова θ-дефензинов предоставляет соединению нечувствительность к соли, обеспечивая стабильность молекулы и способность поддерживать потенциальную ее биологическую активность в физиологических соответствующих условиях.
[0039] Противомикробная активность θ-дефензинов. Архетипический пептид θ-дефензина представляет собой θ-дефензин-1 (RTD-1) резуса, макроциклический пептид, состоящий из 18 аминокислот (22). Как было описано, зрелый пептид продуцируется в результате уникального процесса, в ходе которого два пептида, состоящие из 9 аминокислот, происходящие из усеченного θ-дефензин-подобного предшественника, подвергаются сплайсингу по принципу «голова-к-хвосту» для образования макроциклической молекулы, стабилизированной тремя дисульфидами (Фиг.1). Путь биосинтеза, который приводит к образованию зрелого макроцикличеекого θ-дефензина, является новым. Макак-резус (22, 23, 25) и павиан анубис (9) экспрессируют 3 и 4 предшественников θ-дефензина соответственно. Каждый предшественник является донором уникального нонапептида, который образует пару с идентичным (гомодимерный сплайсинг) или отличным от него (гетеродимерный сплайсинг) нонапептидом во всех бинарных комбинациях. Это делает возможным получение 6 уникальных θ-дефензинов макака и 10 θ-дефензинов павиана. Авторы настоящего изобретения выделили все шесть из предсказанных пептидов макак (23) и выделили семь из предсказанных пептидов павиана (9).
[0040] Подобно другим θ-дефензинам, таким как α-дефензины, θ-дефензины упакованы в первичные гранулы нейтрофилов макак и павиана, а также экспрессируются в моноцитах (23). Поскольку микробы фагоцитируются нейтрофилами, моноцитами и макрофагами, дефензины мобилизуются в фагосоме, где они участвуют во внутриклеточном уничтожении в качестве бактерицидного вещества. θ-дефензины в субмикромолярных концентрациях являются бактерицидным веществом в отношении грамм-положительных бактерий, грибов (9, 22, 25) и ингибируют захват клетками HIV-1 (5, 6, 27, 28). Используя специфические нейтрализующие антитела, авторы настоящего изобретения продемонстрировали, что θ-дефензины отвечают за большинство опосредованных гранулами противомикробных активностей нейтрофилов макак против S. aureus, E. coli и С. albicans in vitro (23). Более того, было показано, что θ-дефензины отвечают за наивысшую лизирующую способность экстракта гранул полиморфно-ядерных лейкоцитов макака в сравнении с экстрактом гранул нейтрофилов человека (23). Во время системного воспаления (например, сепсиса) у людей θ-дефензины высвобождаются направленным и/или случайным способом во внеклеточное пространство (2, 18). θ-дефензины павиана (22) подобным образом высвобождаются в сыворотку бактериемийных животных. Также внеклеточные θ-дефензины появляются для осуществления способности модулировать воспаление посредством противовоспалительных механизмов, которые являются агентами в диапазоне видов от грызунов до человека, что также описано в настоящей заявке. Таким образом, θ-дефензины и пептиды, происходящие от структуры θ-дефензинов, представляют собой важный класс модуляторов иммунной функции.
[0041] ФНОα и воспаление. Фактор некроза опухоли альфа («ФНОα», также известный как катексин или кахектин) представляет собой цитокин, вовлеченный в системное воспаление, и является членом группы цитокинов, которые стимулируют реакции острой фазы.
[0042] ФНОα играет ключевую роль в регуляции иммунных клеток, включая индукцию апоптотической гибели клетки, стимулирование воспаления, ингибирование онкогенеза и репликации вируса. Принимая во внимание широкое варьирование эффектов активности ФНОα, неудивительно открытие того, что нарушение регуляции экспрессии ФНОα, его продукции и передачи сигналов связано с разнообразием болезней человека, включая, среди многих прочих, ревматоидный артрит, болезнь Альцгеймера, туберкулез, болезнь Крона.
[0043] Сигнальный белок ФНОα первоначально синтезируется как трансмембранный белок типа II массой 26 кДа длиной 212 аминокислот, который затем встраивается в клеточную мембрану в процессе созревания. На поверхности клетки мембраносвязанный ФНОα («про-ФНОα») является биологически активным и способен индуцировать иммунные ответы посредством юкстакринной межклеточной передачи сигналов. Однако про-ФНОα может подвергаться протеолитическому расщеплению по амидной связи Ala76-Val77 металлопротеиназой - ферментом, конвертирующим ФНОα («ТАСЕ», также известным как ADAM17). Из этой мембраносвязанной формы высвобождается растворимый внеклеточный домен массой 17 кДа (эктодомен), обычно известный как ФНОα, что имеет важнейшее значение в паракринной передаче сигналов.
[0044] Как правило, существующие терапевтические стратегии, направленные на активность ФНОα, сфокусированы на разработке антител против растворимой и/или трансмембранной связанной формы ФНОα для предотвращения связывания рецептора, или на создании растворимых гибридных слитых рецепторов для нейтрализации уровня циркулирующего ФНОα. Несмотря на важные преимущества этих терапевтических подходов, около 1/3 пациентов не реагируют ни на какую форму терапии против ФНОα, тогда как было сообщено о некоторых побочных эффектах, включая иммуногенность, инфекции, реакции отложенной гиперчувствительности и аутоиммунные заболевания, такие как синдром лекарственной волчанки и димиелинизация.
[0045] ТАСЕ и активность шеддаз. Как было описано, ключевым этапом в активности по передаче сигналов от ФНОα является высвобождение мембраносвязанной формы белка в растворимую форму циркулирующего ФНОα, что катализируется ТАСЕ. Этот процесс известен как «шеддинг». ТАСЕ, белок массой 70 кДа, состоящий из 824 аминокислот, принадлежит к семейству белков ADAM - дезинтегринов и металлопротеиназ (A Disintegrin And Metalloproteinase). Члены семейства белков ADAM обладают как эволюционно консервативными структурами, так и функциональной способностью отщепления и высвобождения растворимого эктодомена из мембраносвязанных пробелков. Принимая во внимание роль ФНОα как потенциального и центрального медиатора в процессе воспаления, циклические пептиды, которые функционируют как ингибиторы ТАСЕ, могут предложить жизненную альтернативу существующим агентам против ФНОα, таким как композиции на основании антител или растворимых рецепторов.
[0046] Также ФНОα и ТАСЕ представляют только две из нескольких потенциальных мишеней терапевтической активности циклических пептидов, принимая во внимание широту и разнообразие шеддинговых активностей нескольких различных белков, вовлеченных во многие различные стадии и/или состояния заболевания. ТАСЕ и другие молекулы из семейства ADAM представляют собой большинство членов большего семейства «шеддаз». Однако другие шеддазы включают членов белкового семейства аспарагиновых протеаз (ВАСЕ). В пределах различных типов шеддаз, функция шеддазной активности варьирует от активности по передаче сигналов посредством отщепления трансмембранного белкового рецепторного эктодомена (например, Her2), или последующего связывания агониста с рецептором для обеспечения способности высвобожденного агониста затем стимулировать другой рецептор (например, EGFR). Благодаря этой жизненно важной роли в осуществлении и расширении функции передачи сигналов, ингибирование активности шеддаз обеспечивает важную терапевтическую стратегию для открытия новых терапевтических путей, и также к потенцированию эффективности существующих лекарственных препаратов. Например, расщепление шеддазой ADAM10 Her2 приводит к образованию фрагмента Her2, обладающего конститутивной киназной активностью с лиганд-независимыми сигналами к росту и выживанию пролиферирующих клеток. Вредные эффекты этого процесса могут быть сведены на нет посредством введения трастузумаба (герцептина) и ингибирования шеддазной активности ADAM10 (30, 31). В результате, циклические пептиды можно использовать для ограничения вредной активности цитокинов по отношению к иммунной функции, открывая даже более широкие терапевтические возможности для лечения заболеваний, таких как рак, или других заболеваний и/или состояний, включающих дисфункцию шеддаз. С помощью этого аспекта θ-дефензинов как осуществляющих эндогенную активность по ингибированию шеддаз можно объяснить многочисленные аутоиммунные, воспалительные заболевания и другие болезненные состояния у пациентов людей, возникающие в результате утраты экспрессии θ-дефензинов в процессе эволюции приматов. Таким образом, θ-дефензины и циклические пептиды, происходящие от структуры различных θ-дефензинов, можно использовать в качестве совместимых терапевтических агентов у пациентов людей, имеющих заболевания, или состояния, связанные с нарушением регуляции металлопротеиназ.
[0047] В различных вариантах реализации, предмет настоящего изобретения предусматривает циклические пептиды. В одном классе вариантов реализации, циклический пептид представляет собой дефензин, его аналог или производное. В другом классе вариантов реализации, циклический пептид представляет собой α-дефензин, β-дефензин, θ-дефензин, их аналог или производное. В другом классе вариантов реализации, циклический пептид представляет собой θ-дефензин, его аналог или производное.
[0048] В другом классе вариантов реализации, θ-дефензин эндогенно экспрессируется у примата. В другом классе вариантов реализации, θ-дефензин эндогенно экспрессируется у макак-резуса. В другом классе вариантов реализации, θ-дефензин представляет собой RTD-1, RTD-2, RTD-3, RTD-4, RTD-5 или RTD-6. В другом классе вариантов реализации, θ-дефензин эндогенно экспрессируется у павиана анубиса. В другом классе вариантов реализации, θ-дефензин представляет собой BTD-1, BTD-2, BTD-3, BTD-4, BTD-5, BTD-6, BTD-7, BTD-8, BTD-9 или BTD-10. В другом классе вариантов реализации, θ-дефензин эндогенно экспрессируется у человека. В другом классе вариантов реализации, θ-дефензин представляет собой псевдоген θ-дефензина человека (HTDp). В другом классе вариантов реализации, θ-дефензин экспрессируется у сиаманга или орангутанга.
[0049] В другом классе вариантов реализации, θ-дефензин выделяют из млекопитающего. В другом классе вариантов реализации, θ-дефензин выделяют из приматов. В другом классе вариантов реализации, θ-дефензин выделяют из человека. В другом классе вариантов реализации, θ-дефензин является очищенным из биологического образца, полученного от млекопитающего. В другом классе вариантов реализации, θ-дефензин является очищенным из биологического образца, полученного от примата. В другом классе вариантов реализации, θ-дефензин является очищенным из биологического образца, полученного от человека.
[0050] В другом классе вариантов реализации, циклический пептид составляет в длину 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 аминокислот. В другом классе вариантов реализации, циклический пептид составляет в длину более 24 аминокислот. В конкретном варианте реализации циклический пептид составляет в длину 14 аминокислот. В другом классе вариантов реализации, циклический пептид содержит по меньшей мере 2 остатка цистеина, образующих одну дисульфидную связь. В другом классе вариантов реализации, циклический пептид содержит 4 остатка цистеина, образующих 2 дисульфидные связи. В другом классе вариантов реализации, циклический пептид содержит 6 остатков цистеина, образующих 3 дисульфидные связи. В другом классе вариантов реализации, циклический пептид содержит синтетическую аминокислоту. В другом классе вариантов реализации, циклический пептид имеет суммарный положительный заряд. В другом классе вариантов реализации, циклический пептид может кодироваться полинуклеотидом, обладающим менее чем приблизительно 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% или более процентов идентичности SEQ. NO. 1, SEQ. NO. 2, SEQ. NO. 3, SEQ. NO. 4, SEQ. NO. 5, SEQ. NO. 6 и/или SEQ. NO. 7. Средний специалист в данной области техники может установить процент идентичности в соответствии со способами, известными в данной области техники, включая создание окна сравнения между последовательностью сравнения и второй полинуклеотидной последовательностью для установления степени процентной идентичности.
[0051] В другом классе вариантов реализации, циклический пептид модулирует воспаление. В другом классе вариантов реализации, циклический пептид модулирует активность цитокинов и/или хемокинов. В другом классе вариантов реализации, циклический пептид модулирует активность ФНОα. В другом классе вариантов реализации, циклический пептид модулирует активность ФНОα посредством конкурентного ингибирования члена семейства дезинтегринов и металлопротеиназ. В другом классе вариантов реализации, член семейства дезинтегринов и металлопротеиназ представляет собой шеддазу. В другом классе вариантов реализации, шеддаза представляет собой ТАСЕ. В другом классе вариантов реализации, шеддаза представляет собой ADAM10. В другом классе вариантов реализации, циклический пептид способен к модулированию активности протеолитического фермента. В другом классе вариантов реализации, циклический пептид способен к противомикробному лизису.
[0052] В различных вариантах реализации, предмет настоящего изобретения предусматривает способы лечения воспалительного заболевания и/или состояния, используя циклический пептид, включающие этапы обеспечения количества циклического пептида, вводимого субъекту, который нуждается в лечении воспалительного заболевания и/или состояния, где циклический пептид способен модулировать воспаление, тем самым излечивая субъекта. В другом классе вариантов реализации, циклический пептид представляет собой θ-дефензин, его аналог или производное. В другом классе вариантов реализации, θ-дефензин представляет собой RTD-1, RTD-2, RTD-3, RTD-4, RTD-5, RTD-6, BTD-1, BTD-2, BTD-3, BTD-4, BTD-5, BTD-6, BTD-7, BTD-8, BTD-9 или BTD-10. В другом классе вариантов реализации, циклический пептид составляет в длину 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 аминокислот. В другом классе вариантов реализации, циклический пептид составляет в длину более 24 аминокислот. В другом классе вариантов реализации, циклический пептид составляет в длину 14 аминокислот. В другом классе вариантов реализации, циклический пептид содержит по меньшей мере 2 остатка цистеина, образующих одну дисульфидную связь. В другом классе вариантов реализации, циклический пептид содержит по меньшей мере 4 остатка цистеина, образующих две или более дисульфидных связей. В другом классе вариантов реализации, количество вводимого циклического пептида представляет собой терапевтически эффективное количество циклического пептида. В другом классе вариантов реализации, субъект представляет собой млекопитающее. В другом классе вариантов реализации, субъект представляет собой человека.
[0053] В различных вариантах реализации, воспалительное заболевание и/или состояние представляет собой острое или хроническое воспаление или аутоиммунное заболевание. В другом классе вариантов реализации, воспалительное заболевание и/или состояние относится к активности цитокина или хемокина. В другом классе вариантов реализации, воспалительное заболевание и/или состояние относится к активности ФНОα. В другом классе вариантов реализации, воспалительное заболевание и/или состояние представляет собой ревматоидный артрит, анкилозирующий спондилоартрит, воспалительное заболевание кишечника, неспецифический язвенный колит, аутистический энтероколит, псориаз, псориатический артрит, болезнь Крона, болезнь Бехчета, волчанку, гнойный гидраденит, тяжелую астму, колит, дерматит, дивертикулит, гепатит, нефрит, болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона, застойное заболевание сердца, атеросклероз, увеит и аллергию.
[0054] В различных вариантах реализации, предмет настоящего изобретения также предусматривает способ повышения эффективности лечения воспалительного заболевания и/или состояния, используя циклический пептид, который включает этап обеспечения количества циклического пептида, введение количества циклического пептида субъекту, получающему лечение воспалительного заболевания и/или состояния, где циклический пептид способен повысить эффективность лечения воспалительного заболевания и/или состояния и тем самым повысить эффективность лечения. В другом классе вариантов реализации, циклический пептид вводят одновременно с композицией, способной лечить воспалительное заболевание и/или состояние. В другом классе вариантов реализации, циклический пептид вводят последовательно, до или после введения с композицией, способной лечить воспалительное заболевание и/или состояние. В другом классе вариантов реализации, субъект представляет собой млекопитающее. В другом классе вариантов реализации, субъект представляет собой человека.
[0055] В различных вариантах реализации, предмет настоящего изобретения также предусматривает способ лечения заболевания и/или состояния у субъекта, с применением циклического пептида. В другом классе вариантов реализации, заболевание и/или состояние представляет собой рак или нейродегенеративное заболевание. В различных вариантах реализации, предмет настоящего изобретения также предусматривает способ повышения эффективности лечения воспалительного заболевания и/или состояния, используя циклический пептид. В другом классе вариантов реализации, циклический пептид вводят одновременно с композицией, способной лечить воспалительное заболевание и/или состояние. В другом классе вариантов реализации, циклический пептид вводят последовательно, до или после введения композиции, способной лечить воспалительное заболевание и/или состояние. В предпочтительных вариантах реализации субъект представляет собой млекопитающее, и в особенно предпочтительных вариантах реализации, субъект представляет собой человека.
[0056] В различных вариантах реализации, предмет настоящего изобретения также предусматривает фармацевтическую композицию. В другом классе вариантов реализации, указанная фармацевтическая композиция содержит циклический пептид и фармацевтически приемлемый носитель. В другом классе вариантов реализации, циклический пептид представляет собой θ-дефензин, его аналог или производное. В другом классе вариантов реализации, θ-дефензин представляет собой RTD-1, RTD-2, RTD-3, RTD-4, RTD-5, RTD-6, BTD-1, BTD-2, BTD-3, BTD-4, BTD-5, BTD-6, BTD-7, BTD-8, BTD-9 или BTD-10. В другом классе вариантов реализации, циклический пептид составляет в длину 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 аминокислот. В другом классе вариантов реализации, циклический пептид составляет в длину 14 аминокислот. В другом классе вариантов реализации, циклический пептид составляет в длину более 24 аминокислот. В другом классе вариантов реализации, циклический пептид содержит по меньшей мере 2 остатка цистеина, образующих одну дисульфидную связь. В другом классе вариантов реализации, циклический пептид содержит по меньшей мере 4 остатка цистеина, образующих две или более дисульфидных связей. В другом классе вариантов реализации, циклический пептид в фармацевтической композиции включает терапевтически эффективное количество циклического пептида. В другом классе вариантов реализации, фармацевтическая композиция включает один или более циклических пептидов и фармацевтически приемлемый носитель.
[0057] В различных вариантах реализации, предмет настоящего изобретения также предусматривает способ производства циклического пептида. В другом классе вариантов реализации, способ производства включает этапы обеспечения одного или более полинуклеотидов, кодирующих циклический пептид, экспрессию одного или более полинуклеотидов в клетке хозяина и выделение циклического пептида из клетки хозяина. В другом классе вариантов реализации, способ производства включает этапы экспрессии одного или более полинуклеотидов в клетке хозяина и выделение циклического пептида из клетки хозяина. В другом классе вариантов реализации, один или более полинуклеотидов включают SEQ. NO. 1, SEQ. NO. 2 и/или SEQ. NO. 3. В другом классе вариантов реализации, один или более полинуклеотидов включают SEQ. NO. 4, SEQ. NO. 5, SEQ. NO. 6 и/или SEQ. NO. 7.
[0058] В другом классе вариантов реализации, циклический пептид представляет собой θ-дефензин, его аналог или производное. В другом классе вариантов реализации, θ-дефензин представляет собой RTD-1, RTD-2, RTD-3, RTD-4, RTD-5, RTD-6, BTD-1, BTD-2, BTD-3, BTD-4, BTD-5, BTD-6, BTD-7, BTD-8, BTD-9 или BTD-10. В другом классе вариантов реализации, циклический пептид составляет в длину 8, 9, 10, 1112, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 аминокислот. В другом классе вариантов реализации, циклический пептид составляет в длину 14 аминокислот. В другом классе вариантов реализации, циклический пептид содержит по меньшей мере 2 остатка цистеина, образующих одну дисульфидную связь. В другом классе вариантов реализации, циклический пептид содержит по меньшей мере 4 остатков цистеина, образующих две или более дисульфидных связей. В другом варианте реализации, способ производства включает этапы синтеза пептидов, используя жидкофазный синтез или твердофазный синтез. В цругом классе вариантов реализации, твердофазный синтез представляет собой Fmoc или ВОС-синтез.
[0059] Производство композиций, рассматриваемых в настоящей заявке, можно осуществить в любой подходящей форме, включая, например, использование экспрессирующих векторов. Средний специалист в данной области техники способен выбрать подходящий вектор экспрессии и должен понимать, что существует огромное количество вариантов выбора. Многие из этих векторов используют вирусные промоторы. Множество вариантов выбора клеточных линий подходят для клеток хозяина, включая, например, бактерии, дрожжи, клетки насекомых и растений.
Примеры
Пример 1 - Уникальные свойства плейотропных θ-дефензинов и противовоспалительные свойства
[0060] θ-дефензины лизируют клетки Е. coil посредством образования небольших пор в клеточной стенке, что опосредует захват дефензинов (24). В данном исследовании, авторы настоящего изобретения сделали значительное открытие, заключающееся в том, что, в отличие от многих α- и β-дефензинов, θ-дефензины являются нетоксичными по отношению к клеткам хозяина (24) и могут быть введены мышам с помощью различных путей (29). В этом отношении мыши являются полностью толерантными к в.в. введению по меньшей мере дозы 80 мг/кг трех различных θ-дефензинов. Авторы настоящего изобретения также вводили RTD-1 в возрастающих в.в. дозах (максимум 3 мг/мг) двум взрослым шимпанзе. Клиническую токсичность не наблюдали ни в одной точке, и все клинические химические и гематологические лабораторные показатели после всех инъекций находились в норме. Ни одно животное не продуцировало антитела против RTD-1, тем самым демонстрируя значительное отсутствие токсичности и иммуногенности между различными видами млекопитающих. Основываясь на этих и других данных, изучали эффективность RTD-1 на мышиной модели тяжелого сепсиса, вызванного лигатурой слепой кишки и пункцией (ЛСКП) (12). Как показано на Фиг.2, единичная инъекция RTD-1 (5 мг/кг) значительно уменьшала смертность мышей BALB/c при введении пептида через 4 или 24 ч после операции ЛСКП (Р<0,01 для дней 4 и 7). Выжившие на день 7 были клинически нормальными до дня 15, когда животных умерщвляли. Этот терапевтический эффект θ-дефензинов в отношении сепсиса ЛСКП был высоко воспроизводимым (N=5 экспериментов). Однако высокий уровень эффективности θ-дефензинов свидетельствует, что эффективность RTD-1 в этой модели была не первично опосредована антибиотическим эффектом, поскольку микробном при полимикробиальном сепсисе является огромным. Можно предположить, что скорее активность продемонстрированного терапевтического действия была опосредована противовоспалительным механизмом. Для исследования этой возможности авторы настоящего изобретения провели дополнительные эксперименты, в которых лечение с помощью RTD-1 мышей после ЛСКП приводило к значительным уменьшениям широкого разнообразия сывороточных провоспалительных цитокинов, включая ФНОα, ИЛ-6 и фактора подавления макрофагов.
[0061] Другие исследования продемонстрировали, что природные (10, 15) или сконструированные (11) АМФ являются эффективными в моделях сепсиса на грызунах. В каждом случае очевидным защитным механизмом выступало связывание бактериальных липополисахаридов (ЛПС) пептидом и тем самым препятствование взаимодействию с белками клетки хозяина (белками, связывающими ЛПС) или с рецепторами (TLR-4, CD14). В этом отношении было показано, что почти все проанализированные АМФ связываются и нейтрализуют ЛПС, поддерживая вывод о том, что это является главным механизмом, опосредующим их активность, направленную против сепсиса (19).
[0062] Однако θ-дефензины являются менее эффективными при прямой нейтрализации ЛПС, являясь в 100 раз менее активными, чем полимиксин В, в нейтрализации эндотоксинов. Чаще, как обсуждается ниже, исследования демонстрируют, что θ-дефензины обладают определенными функциональными свойствами, включая первичное модулирование воспаления путем взаимодействия с клетками хозяина. Это открытие соотносится с ранними исследованиями, в которых оценивали эффективность RTD-1 на мышиных моделях пневмоний, вызванных SARS-коронавирусом (SARS-CoV) (29). В этом исследовании, авторы настоящего изобретения обнаружили, что интраназальное введение RTD-1 было на 100% более эффективным в предотвращении смерти мышей, инфицированных вирусом. Примечательно, что RTD-1 не был вирулицидным по отношению к SARS-CoV. Однако введение пептида уменьшало легочное воспаление и экспрессию некоторых провоспалительных цитокинов, тем самым подтверждая, что терапевтический эффект был опосредован противовоспалительными свойствами RTD-1. Не желая связывать себя с конкретными теориями, авторы настоящего изобретения предполагают, что θ-дефензины модулируют ответы хозяина на провоспалительные стимулы, что было подтверждено дальнейшими экспериментами, продемонстрировавшими, что RTD-1 является терапевтически эффективным при пристан-индуцированном артрите у крыс (Фиг.9; обсуждение ниже) и при коллаген-индуцированном артрите.
Пример 2. Активность RTD-1 в основном опосредована взаимодействием с клеткой хозяина, а не противомикробным действием
[0063] Некоторые данные демонстрируют, что архетипичный θ-дефензин, RTD-1, чаще проявляет противовоспалительное действие путем взаимодействия с клетками хозяина, чем посредством своего противомикробного действия (29). Эти данные привели к проведению дальнейших экспериментов, в которых оценивали действие RTD на продукцию ФНОα цельной кровью человека, стимулированной Е. coli или S. aureus. Типичные результаты экспериментов, представленные на Фиг. 4 (В и С), демонстрируют, что RTD 1-5 (Фиг.4А) ингибирует индуцированное Е. coli высвобождение ФНОα; отметим, что даже среди различных θ-дефензинов наблюдается заметно различающаяся ингибиторная активность. Подобные результаты получили и в экспериментах с S. aureus. В контрольных экспериментах авторы настоящего изобретения обнаружили, что, в отличие от многих других дефензинов, θ-дефензины не взаимодействуют непосредственно с белком ФНОα; этот вывод сделали на основании результатов, демонстрирующих, что пептиды не приводят к изменению стандартных кривых ELISA, и в результате иммунного анализа выявляется только активный тримерный ФНОα. Результаты этих и других экспериментов свидетельствуют, что протекторные эффекты RTD-1 при сепсисе ЛСКП (Фиг.3) были обусловлены скорее иммуномодуляторной активностью, чем противомикробным эффектом. Исходя из этих результатов, авторы настоящего изобретения стимулировали лейкоциты периферической крови человека (ЛПК) агонистами TLR 1-9 в течение 4 ч с или без одновременного добавления 10 мкг/мл RTD-1. Как показано на Фиг.5, совместная инкубация ЛПК с RTD-1 значительно снижала уровень высвобождения ФНОα, индуцированного агонистами TLR 2, 4, 5 и 8. Более того, RTD-1 также ингибировал высвобождение ИЛ-1β и ИЛ-6, стимулированных каждым агонистом, и высвобождение ИЛ-8 было существенно заингибировано при всех вариантах индукции, за исключением наличия агониста TLR2. RTD-1 не оказывал существенного влияния на нестимулированные клетки (Фиг.5, верхняя левая секция). Влияние обработки RTD-1 на уровень МСР-1 варьировало. Авторы настоящего изобретения включили этот хемокин в анализ, поскольку при мышиной пневмонии, вызванной SARS, RTD-1 значительно уменьшал уровень легочного МСР-1 (29). Это согласуется с действием RTD-1 на ЛПК, стимулированные вирусной осРНК (Фиг.5). Наконец, авторы настоящего изобретения также обнаружили, что RTD-1 супрессирует экспрессию (>85% уменьшения) ИЛ-17А мононуклеарными клетками периферической крови человека, стимулированными ex vivo энтеротоксин-продуцирующими S. aureus в зависимости от дозы.
Пример 3. Ингибирование θ-дефензинами ТАСЕ
[0064] Поскольку данные результаты демонстрируют опосредованное θ-дефензином ингибирование ФНОα, индуцированного бактериями (Фиг.4) и различными агонистами TLR (Фиг.5), уровень которого измеряли у животных (см. выше), одним из возможных механизмов действия θ-дефензинов может являться антагонизм со стороны последних активности конвертирующего фермента, конвертирующего ФНОα. Фермент, конвертирующий ФНОα («ТАСЕ», также известный как ADAM17, член семейства ADAM (дезинтергинов и металлопротеиназ)), представляет собой шеддазу, ответственную за высвобождение мембраносвязанного ФНОα. Неожиданно авторы настоящего изобретения обнаружили, что RTD-1 представляет собой потенциальный ингибитор рекомбинантного ТАСЕ (рТАСЕ) с IC50 ≈0,1 мкг/мл (48 нМ). Примечательно, что ни один из θ-дефензинов человека (HNP-2, HNP-4) не ингибирует рТАСЕ (Фиг.6А), что делает активность θ-дефензинов уникальной среди дефензинов. При исследовании относительной ингибиторной активности природных θ-дефензинов (RTD 1-5 структуры на Фиг.4А) было обнаружено, что она варьирует более чем в 10-кратном диапазоне значений IC50 (Фиг.6В). Примечательно, что механизм ингибирования ТАСЕ RTD 1-5 коррелирует с ингибированием ФНОα пептидами в крови человека (Фиг.4С). Степень ингибирования ТАСЕ RTD-1 не увеличивалась после 15 мин прединкубации с ТАСЕ; это открытие позволяет сделать вывод о быстром связывании и конкурентном ингибировании. Это предположение было подтверждено с помощью двойного реципрокиного анализа графика данных ферментативной кинетики (Фиг.6С), который свидетельствует, что RTD-1 выступает в качестве псевдосубстрата ТАСЕ. Также исследовали возможность ингибирования ТАСЕ со стороны аналога RTD-1 с открытой цепью (S-7; Фиг.6D) и обнаружили, что он обладает менее, чем 29% от активности RTD-1. Это свидетельствует, что циклическая конформация является необходимой для эффективного ингибирования ТАСЕ (Фиг.6Е).
[0065] Ингибирование ТАСЕ также подтвердили в анализе на клетках. Было показано, что RTD-1 ингибирует ТАСЕ, экспрессированный на находящихся в покое и стимулированных ЛПС клетках ТНР-1 (Фиг.6F), используя вариант анализа, описанного Alvarez-Iglesias с соавт. (1). Значение IC50, полученные для RTD-1 в анализе на клетках, составляло ≈15 мкг/мл (7,4 мкМ). Это выгодно отличается от IC50 низкомолекулярного ингибитора ТАСЕ GM6001 (5,5±3 мкМ) в исследовании блокады ТАСЕ на клетках ТНР-1 (1).
Пример 4. θ-дефензины ингибируют ADAM10
[0066] Различные ADAM рассматриваются в качестве регуляторных шеддаз, которые высвобождают заякоренные в мембране факторы роста, цитокины и рецепторы (3). Поскольку ADAM вовлечены во множество ключевых биологических процессов, включая регуляцию воспаления и рака, идентификация ингибиторов ADAM является областью интенсивных исследований. Авторы настоящего изобретения установили, что природные θ-дефензины RTD 1-3 ингибируют ADAM10 (Фиг.7) с приблизительно такой же IC50, какая наблюдалась при ингибировании ТАСЕ (см. Фиг.6). Таким образом, θ-дефензины являются ингибиторами металлопротеиназ, по меньшей мере двух ADAM.
Пример 5. Ингибирование мини-θ-дефензинами ФНОα и ТАСЕ
[0067] Анализ структуры и активности природных и модифицированных θ-дефензинов позволяет выявить определенные свойства последовательности, которые, как прогнозируют, опосредуют противовоспалительные эффекты этих пептидов. Например, были разработаны три тетрадекапептида (мини-θ-дефензины), обладающие свойствами, которые считаются важными для всех противовоспалительных действий природных θ-дефензинов. Они были встроены в последовательности пептидов, показанных на Фиг.8А. Затем оценивали эффективность каждого пептида при сепсисе ЛСКП мыши. Как показано на Фиг.8В, все три мини-θ-дефензина снижали летальность у мышей в сравнении с обработкой плацебо ФБР. Авторы настоящего изобретения также оценивали влияние каждого мини-θ-дефензина на высвобождение ФНОα из стимулированной крови человека (Фиг.8С) и их ингибиторную активность по отношению к ТАСЕ (Фиг.8D). Как показывают данные на Фиг. 8, мини-θ-дефензин имеет подобную RTD-1 или превышающую активность в анализе ЛСКП (ср.: с Фиг.3), в анализе ингибирования ФНОα (Фиг.8С), или в анализе ингибирования ТАСЕ (Фиг.8D).
[0068] Зрелый пептид θ-дефензина RTD-1 представляет собой двуспиральный бета-слой, который, подобно α- и β-дефензинам, стабилизируется тремя дисульфидами. Однако параллельная ориентация расположения дисульфидов в RTD-1 позволяет осуществлять значительную подвижность вокруг его короткой оси. В отличие от α- и β-дефензинов, RTD-1 лишен амфифильной топологии, и, не желая связывать себя какой-либо теорией, эти и другие подобные структурные отличия можно рассматривать как свойства, уникальные для иммуномодуляторной способности θ-дефензинов.
Пример 6. Эффективность θ-дефензина при пристан-индуцированном артрите (ПИА) у мышей
[0069] Блокада ФНОα θ-дефензином in vivo или ex vivo является центральным звеном противовоспалительного действия пептида; авторы настоящего изобретения считают, что она должна модулировать течение заболевания, о котором известно, что оно опосредуется ФНОα. Авторы настоящего изобретения провели исследование влияния RTD-1 на крыс с вызванным ПИА. В типичных экспериментах (N=3) взрослым крысам Dark Agouti (DA; линия OlaHsd) (N=21) инъецировали подкожно 0,3 мл пристана в день 0, как описано Vingsbo с соавт. (26). С первыми симптомами клинического заболевания (дни 14-21; определяли на основе степени макропатологии по Brand с соавт., ссылка (4)), животных альтернативно разделяли на группы, которые получали солевой раствор (N=10) или лечение RTD (N=11). Заслепленное введение солевого раствора (0,2-0,25 мл) или RTD-1 (5 мг/кг в 0,2-0,25 мл солевого раствора) осуществляли путем инъекции в хвостовую вену ежедневно в течение более 14 дней до тех пор, пока тяжесть артрита (которую оценивали вслепую ежедневно в течение более чем 36 дней трое наблюдателей) не возвращалась к исходной точке (N=1 в группе солевого раствора; N=8 в группе RTD-1). У животных, получавших RTD-1, наблюдалось статистически значимое (*=p≤0,05, определяли с помощью непарного Т-теста Стьюдента с двухсторонним критерием) уменьшение патологии суставов, начиная с дня 7; Фиг.9. В этой модели было также продемонстрировано эффективность подкожной инъекции RTD-1 в той же дозе и лекарственной форме. После прекращения лечения не наблюдалось свидетельств повторного проявления заболевания в течение по меньшей мере 45 дней.
Пример 7 - θ-дефензины являются высокостабильными
[0070] θ-дефензин RTD-1 инкубировали в концентрации 50 м кг/мл в плазме человека, сыворотке человека или в 50 мг/мл альбумине сыворотки человека в течение 72 ч при комнатной температуре. Проводили количественный анализ ВЭЖХ, который продемонстрировал, что более 95% пептида оставалось неизменным в каждых из исследованных условиях. Более того, θ-дефензины являются стабильными к пролонгированному хранению при низких (рН 2,5) или нейтральных (рН 7,4) условиях.
[0071] Таким образом, θ-дефензины обладают противовоспалительными свойствами, которые опосредованы блокадой провоспалительных протеаз, таких как ТАСЕ и другие металлоферменты. Они эффективны в экспериментальных моделях инфекционных и неинфекционных воспалительных заболеваний, хорошо устойчивы при системном введении и не иммуногенны. В дополнение, в отличие от других противовоспалительных агентов, θ-дефензины не являются иммуносупрессорными.
Лекарственные композиции. Дозировки, дозированные формы и пути введения
[0072] Композиции в соответствии с предметом настоящего изобретения можно вводить, используя различные пути, включая оральный, парентеральный, ингаляцию, местное введение, ректальный, назальный пути или посредством имплантированного резервуара, где термин «парентеральный», используемый в настоящей заявке, включает подкожное, внутривенное, внутримышечное, внутрисуставное, внутрисиновиальное, внутриоболочечное, внутрипеченочное, внутриочаговое и внутричерепное введение (обычно инъекцию или инфузию). Предпочтительно, композиции вводят орально, подкожно, внутрибрюшинно или внутривенно.
[0073] Например, стерильные инъекционные формы рассматриваемых соединений могут представлять собой водные растворы или маслянистые суспензии. Такие суспензии можно приготовить в соответствии с методиками, известными в данной области техники, используя приемлемые диспергирующие или увлажняющие агенты и суспендирующие агенты. Стерильные инъекционные препараты можно также приготовить в форме стерильного инъекционного раствора или суспензии в нетоксичном, приемлемом для парентерального введения растворителе, например в форме раствора в 1,3-бутандиоле. Среди других приемлемых наполнителей и растворителей в особенности рассматриваются жидкости, включающие воду, раствор Рингера и изотонический раствор натрия хлорида. В дополнение, стерильные нелетучие масла можно применять в качестве со-растворителей или суспендирующей среды (например, природные или синтетические моно- или диглицериды). Можно также использовать жирные кислоты; подходящие жирные кислоты включают олеиновую кислоту и ее глицеридные производные, оливковое масло, касторовое масло, особенно в их полиоксиэтилированных формах. Такие масляные растворы или суспензии могут также содержать длинноцепочечные спирты-растворители или дисперсанты.
[0074] В другом примере рассматриваемые соединения можно вводить орально в любой приемлемой для орального введения дозированной форме, включая капсулы, таблетки, водные суспензии или растворы. В случае таблеток для орального применения все фармацевтически приемлемые носители (например, лактоза, кукурузный крахмал и т.д.) считаются подходящими. Аналогично можно добавлять различные смазывающие вещества (например, стеарат магния). Растворители, полезные для орального введения в форме капсул, включают лактозу и сухой кукурузный крахмал. Когда водные суспензии требуются для орального применения, действующее вещество объединяют с эмульгирующими и суспендирующими веществами. Если требуется, можно также добавлять определенные подсластители, ароматизирующие вещества или красители.
[0075] Предполагают, что фармацевтическую композицию согласно предмету настоящего изобретения можно вводить местно, особенно в случае если мишень лечения включает участки или органы, легко доступные для местного нанесения, включая заболевания глаз, кожи, нижнего кишечника, или области, открытые во время хирургического вмешательства. Существует множество составов для местного применения, известных в данной области техники, и все эти составы считаются подходящими для применения в рамках настоящей заявки.
[0076] Для местного применения рассматриваемые композиции можно приготовить в подходящие мази, содержащие действующее вещество, суспендированное или растворенное в одном или более носителях. Носители для местного введения соединений согласно предмету настоящего изобретения включают минеральные масла, вазелиновое масло, белый вазелин, соединения пропиленгликоля, полиоксиэтилена, полиоксипропилена, эмульгированный воск и воду. В качестве альтернативы, фармацевтические композиции можно приготовить в подходящий лосьон или крем, содержащий действующие вещества, суспендированные или растворенные в одном или более фармацевтически приемлемых носителях. Подходящие носители включают минеральное масло, сорбитан моностеарат, полисорбат 60, воск цетиловых эфиров, цетеариловых спирт, 2-октилдодеканол, бензиловый спирт и воду.
[0077] Фармацевтические композиции в соответствии с предметом настоящего изобретения можно также вводить в виде назального аэрозоля или путем ингаляции. Такие композиции готовят в соответствии с методиками, хорошо известными в области техники фармацевтических составов; их можно приготовить в виде растворов в солевом растворе, бензиловом спирте или других приемлемых консервантах, в веществе, способствующем абсорбции для увеличения биодоступности, фторуглеродах и/или в других подходящих растворителях или диспергирующих веществах.
[0078] В отношении количества рассматриваемых соединений в композиции, нужно понимать, что конкретное количество будет обычно зависеть от конкретной лекарственной формы, действующего вещества и желаемой цели. Исходя из этого, необходимо понимать, что количество рассматриваемых соединений будет существенно варьировать. Однако обычно предпочтительно, чтобы соединения присутствовали в минимальном количестве, эффективном для достижения терапевтического эффекта и/или для визуализации in vitro и/или in vivo.
[0079] Таким образом, в наиболее предпочтительных жидких лекарственных формах рассматриваемые соединения присутствуют в количестве между приблизительно 20 мг/мл и приблизительно 30 мг/мл, более часто в количестве между приблизительно 24 мг/мл и приблизительно 26 мг/мл и наиболее часто приблизительно 25 мг/мл. В случае если лекарственная форма является твердой лекарственной формой или гелем, рассматриваемые соединения будут присутствовать в количестве между приблизительно 5 мг/г до приблизительно 100 мг/г. В отношении единицы дозирования обычно предполагается, что рассматриваемые соединения вводят в дозе, эффективной для достижения желаемого терапевтического эффекта, или в дозе, эффективной для обеспечения визуализации in vitro и/или in vivo.
[0080] Как для человека, так и для млекопитающих, отличных от человека, подходящие дозы рассматриваемых соединений должны варьировать в диапазоне приблизительно 1-10 мг/кг.
[0081] При лечении и/или профилактике воспалительных заболеваний обычно предпочитают, чтобы соединения или композиции в соответствии с предметом настоящего изобретения были приготовлены в лекарственную форму фармацевтически приемлемым образом. Подходящие лекарственные формы предпочтительно включают жидкие препараты для инъекции в переднюю и/или заднюю камеру глаза или для инъекции в полукружные каналы, улитку и/или в костный лабиринт височной кости. В качестве альтернативы или дополнительно можно приготовить имплантируемые носители (например, биодеградируемые/растворяющиеся) так, чтобы носитель включал терапевтически эффективное количество соединения или композиции и так, чтобы носитель обеспечивал высвобождение соединения или композиции контролируемым и предопределенным образом. Среди других подходящих носителей, высвобождение может зависеть от времени и/или инициироваться с помощью облучения светом с одной или несколькими длинами волны.
[0082] Предполагается, что фармацевтическая композиция в соответствии с предметом настоящего изобретения содержит по меньшей мере одно из рассматриваемых соединений (например, одно или более из RTD-1-27, RTD-1-28 и RTD-1-29) вместе с фармацевтически приемлемым носителем. В зависимости от конкретного использования, нужно понимать, что лекарственная форма, путь и/или расписание введения могут значительно варьировать и вообще предполагается, что конкретная лекарственная форма, путь и/или введение не ограничиваются предметом настоящего изобретения.
[0083] Следует учесть, однако, что вводимая доза фармацевтической композиции будет значительно варьировать, и конкретная доза будет по меньшей мере частично зависеть от: (а) количества действующего вещества, которое является эффективным для достижения желаемого терапевтического ответа; (b) лекарственной формы рассматриваемых соединений; (с) пути введения; (d) фармакокинетических и фармакодинамических свойств конкретного соединения и (е) других факторов, включая возраст, пол, вес, общее состояние здоровья и предшествующую медицинскую историю пациента, которого подвергают лечению. Средний специалист в данной области техники может легко определить и прописать требуемое эффективное количество фармацевтической композиции. Например, терапевт может начать введение доз пациенту с уровня, меньшего, чем обычно необходимый для достижения желаемого терапевтического эффекта, и затем повышать дозу до тех пор, пока не будет достигнут желаемый эффект.
[0084] Обычно полагают, что соединения в соответствии с предметом настоящего изобретения можно приготовить в лекарственную форму для парентерального применения, и особенно рассматриваемыми парентеральными лекарственными формами являются жидкие лекарственные формы для инъекций. Таким образом, приемлемые лекарственные формы будут, как правило, содержать фармацевтически приемлемый растворитель (например, стерильный изотонический водный или неводный раствор) и могут быть приготовленными в виде дисперсии, суспензии или эмульсии. В качестве альтернативы, парентеральные лекарственные формы можно также предоставлять в виде набора, который включает рассматриваемые соединения и другие компоненты, которые можно восстановить в жидкий продукт перед применением. В других рассматриваемых аспектах, соединения в соответствии с предметом настоящего изобретения можно также вводить в виде рекомбинантной нуклеиновой кислоты способом, позволяющим экспрессию соединения в клетке хозяина. Например, рекомбинантные нуклеиновые кислоты можно доставлять в ткани-мишени с помощью аденовирусных векторов, трансфекции с использованием липидов или липосом, электропорации или других способов, хорошо известных в данной области техники.
[0085] Примеры подходящих водных и неводных носителей, которые можно применять в фармацевтических композициях, включают воду, этанол, полиолы (например, глицерин, пропиленгликоль, полиэтиленгликоль и т.д.) и их подходящие смеси, растительные масла и инъекционные органические эфиры, такие как этилолеат. Надлежащую текучесть можно поддержать, например, с помощью применения материалов для покрытия, таких как лецитин, поддержанием требуемого размера частиц в случае дисперсий и с помощью применения поверхностно-активных веществ. Наиболее часто подходящие жидкости являются стерильными и забуференными для поддержания соответствующего значения рН для стабилизации действующего вещества и места инъекции или для других целей.
[0086] Рассматриваемые соединения можно приготовить в виде фармацевтически приемлемой соли или солей, которые в особенности включают соли кислотных или основных групп, которые могут присутствовать в рассматриваемых соединениях. Например, рассматриваемые соединения, которые являются основными по природе, могут образовывать широкое разнообразие солей с различными неорганическими и органическими кислотами. Подходящие кислоты будут обеспечивать фармацевтически приемлемые анионы, включая анионы хлорида, бромида, иодида, нитрата, сульфата, бисульфата, фосфата, кислого фосфата, изоникотината, ацетата, лактата, салицилата, цитрата, кислого цитрата, тартрата, пантотената, битартрата, аскорбата, сукцината, малеината, гентисината, фумарата, глюконата, глюкароната, сахарата, формата, бензоата, глутамата, метансульфоната, этансульфоната, бензенсульфоната, p-толуенсульфоната и памоата [1,1'-метилен-бис-(2-гидрокси-3-нафтоата)]. Аналогично соединения, имеющие кислотную природу, могут образовывать основные соли с различными фармакологически приемлемыми катионами, и особенно подходящие катионы включают ионы щелочных металлов или щелочноземельных металлов (например, катионы натрия и калия).
[0087] Также предполагается, что соединения в соответствии с предметом настоящего изобретения можно также приготовить в форме пролекарства, и все известные способы и типы пролекарств рассматриваются подходящими для применения в рамках настоящей заявки при условии, что эти пролекарства повысят концентрацию препарата (или метаболита пролекарства) в органе-мишени или клетке-мишени.
[0088] Например, если соединения имеют свободную амино-, амидную, гидрокси-, тио- или карбоксильную группу, предполагается, что такие группы можно применить для ковалентного и высвобождаемого связывания группы, которая преобразует препарат в пролекарство. Вследствие этого пролекарства, в частности, включают те. в которых рассматриваемые соединения образуют эфирную, амидную или дисульфидную связь с другой расщепляемой группой. Такие группы могут содействовать органо- или клеточно-специфичной доставке препарата. Например, можно получить производное карбоксильной группы для образования амидного или алкилового эфира, который может включать эфирную, амино и/или карбоксильную группу. Получить производные свободных гидроксигрупп можно, используя гемисукцинаты, фосфатные эфиры, диметиламиноацетаты и фосфорилоксиметилоксикарбонилы, как изложено в D. Fleisher, R. Bong, В. R Stewart, Advanced Drug Delivery 40 Reviews (1996) 19, 115. Также включаются карбаматные пролекарства на основании гидрокси- и аминогрупп, которые являются карбонатными пролекарствами и сульфатными эфирами гидроксильных групп. Также рассматривается получение производных гидроксигрупп как (ацилокси)метил и (ацилокси)этилэфиров, где ацильная группа может представлять собой алкильный эфир (в некоторых случаях замещенный), или где ацильная группа представляет собой эфир аминокислоты (пролекарства этого типа описаны в R P. Robinson et al., J. Medicinal Chemistry (1996) 39: p.10).
[0089] Более того, необходимо понимать, что рассматриваемые соединения могут подвергаться метаболизму в клетке или внеклеточном пространстве, и образовавшиеся метаболиты могут демонстрировать такой же или отличный фармакологический эффект. Например, рассматриваемые соединения могут подвергаться фосфорилированию и тем самым становиться более активными, чем родительское соединение. С другой стороны, восстановление или гликозилирование может повлиять на биодоступность рассматриваемых соединений. Следовательно, рассматриваемые соединения будут не только включать описанные выше, но также включать и их метаболиты.
Прочие положения
[0090] Различные способы и методики, описанные выше, предоставляют некоторое количество путей для осуществления способов, относящихся к предмету настоящего изобретения. Разумеется, необходимо понимать, что необязательно все описанные цели или преимущества можно достигнуть в соответствии с любым конкретным вариантом реализации, описанным в настоящей заявке. Таким образом, например, специалист в данной области техники понимает, что способы можно осуществить таким образом, чтобы достичь или оптимизировать одно преимущество или группу преимуществ, указанных в настоящей заявке, без обязательного достижения других целей или преимуществ, которые могут быть указаны или рекомендованы в настоящей заявке. В настоящей заявке упомянуто разнообразие альтернатив, которые имеют преимущества и недостатки. Необходимо понимать, что некоторые предпочтительные варианты реализации включают конкретно одно, другое или несколько свойств, обеспечивающих преимущества, тогда как другие конкретно исключают одно, другое или несколько свойств недостатков при включении одного, другого или нескольких свойств, обеспечивающих преимущества.
[0091] Более того, специалист в данной области техники понимает применимость различных свойств из различных вариантов реализации Аналогичным образом, различные элементы, свойства и этапы, которые обсуждали выше, а также другие известные эквиваленты каждого такого элемента, свойства или этапа, могут быть объединены и подобраны средним специалистом в данной области техники для осуществления способа в соответствии с принципами, описанными в настоящей заявке. Среди различных элементов, свойств и этапов некоторые будут конкретно включены и другие конкретно исключены из разнообразных вариантов реализации.
[0092] Также предмет настоящего изобретения был раскрыт в контексте некоторых вариантов реализации и примеров, и специалисту в данной области техники будет понятно, что варианты реализации предмета настоящего изобретения распространяются за пределы конкретно раскрытых вариантов реализации к другим альтернативным вариантам реализации и/или применения и их модификациям и эквивалентам.
[0093] В вариантах реализации предмета настоящего изобретения было раскрыто множество видоизменений и альтернативных вариантов. Более того, видоизменения и альтернативные элементы будут возникать у специалиста в данной области техники. К этим разновидностям, без ограничений, относятся источники циклических пептидов, включая θ-дефензины, способы приготовления, выделения или очистки θ-дефензинов, их аналогов или производных, способы лечения различных заболеваний и/или состояний, используя θ-дефензины, их аналоги и производные, методики и композиции и применение растворов, используемых в настоящей заявке, и конкретное использование продуктов, созданных с помощью указаний из настоящей заявки. Различные варианты реализации могут специфически включать или исключать любую из этих видоизменений или элементов.
[0094] В некоторых вариантах реализации, цифры, выражающие количества компонентов, свойства, такие как концентрации, условия реакции и тому подобное, применяемые для описания и заявления определенных вариантов реализации, отмеченные термином «приблизительно», должны пониматься как те, которые могут быть в отдельных случаях изменены. Соответственно, в некоторых вариантах реализации, числовые параметры, изложенные в приведенном описании и приложенной формуле изобретения, являются приблизительными значениями, которые могут варьировать в зависимости от желаемых свойств, которые хотят получить в конкретном варианте реализации. В некоторых вариантах реализации, числовые параметры следует интерпретировать в свете числа сообщенных значащих цифр и путем приложения стандартных методик. Несмотря на то, что численные диапазоны и изложенные параметры широкого объема некоторых вариантов реализации являются приближением, численные значения, изложенные в конкретных примерах, сообщены настолько точно, насколько это возможно. Численные значения, представленные в некоторых вариантах реализации, могут содержать некоторые ошибки, неизбежно возникающие из стандартного отклонения, найденного в их соответствующих экспериментальных измерениях.
[0095] Используемое в настоящей заявке и везде на протяжении приложенной формулы изобретения значение единственного числа включает ссылку на множественное число, если контекст не подразумевает обратное. Также, используемое в описании настоящей заявки значение «в» включает «в» и «на», если контекст строго не подразумевает обратное.
[0096] Перечисление диапазонов значений в настоящей заявке предназначено исключительно для условного обозначения способа относительно каждого отдельного значения, попадающего в диапазон. Если в настоящей заявке не указано обратное, каждое отдельное значение включается в описание так, как если бы оно отдельно было изложено в настоящей заявке. Все способы, описанные в настоящей заявке, можно осуществить в любом подходящем порядке, если в настоящей заявке не указано обратное или если обратное строго противоречит контексту. Применение любого и всех примеров или символа, означающего пример (например, «такие как»), приведенное по отношению к определенным вариантам реализации в настоящей заявке, призвано исключительно лучше осветить предмет настоящего изобретения, а не ограничить весь объем заявленных изобретений. Ни одно обозначение в спецификации не должно быть истолковано как обозначающее любой не заявленный элемент, существенный для применения на практике заявленного изобретения.
[0097] Группирование альтернативных элементов или вариантов реализации предмета настоящего изобретения, раскрытых в настоящей заявке, не следует рассматривать в качестве ограничения. Каждого члена группы можно отнести и заявить индивидуально или в комбинации с другими членами группы или другими элементами, найденным в настоящей заявке. Один или более членов группы можно включить в, или исключить из группы по соображениям приемлемости и/или патентоспособности. Когда происходит любое такое включение или исключение, настоящая спецификация, как предполагается, содержит группу, которая модифицирована таким образом, что осуществление приведенного описания всех групп Маркуша используется в прилагаемой формуле изобретения.
[0098] Предпочтительные варианты реализации данного предмета настоящего изобретения описаны в настоящей заявке, включая наилучший вариант, известный авторам настоящего изобретения, для осуществления заявленных изобретений. Изменения этих предпочтительных вариантов реализации будут понятны среднему специалисту в данной области техники после прочтения следующего описания. Предполагается, что специалисты в данной области техники могут применить такие изменения как соответствующие, и заявленные изобретения можно реализовать на практике другим способом, отличным от конкретно описанного в настоящей заявке. Соответственно заявленные изобретения являются интегрированными как включающие все изменения и эквиваленты перечисленных предметов настоящего изобретения, которые разрешены действующим законодательством. Более того, любые комбинации вышеописанных элементов во всех их возможных вариантах охватываются соответствующими заявленными изобретениями, если только обратное не указано в настоящей заявке или если обратное строго диктуется контекстом.
[0099] Более того, были сделаны различные ссылки на патенты и печатные публикации по всему объему настоящей заявки. Каждая из вышеприведенных ссылок и печатных публикаций включена в настоящую заявку отдельно посредством ссылки во всей своей полноте.
[00100] Необходимо понимать, что варианты реализации, раскрытые в настоящей заявке, являются иллюстрациями принципов предмета настоящего изобретения. Таким образом, в качестве примера, но не ограничения, можно применять альтернативные конфигурации предмета настоящего изобретения в соответствии с указаниями, изложенными в настоящей заявке. Соответственно варианты реализации предмета настоящего изобретения не ограничиваются исключительно теми, которые приведены и описаны.
Реферат
Группа изобретений относится к медицине, а именно к терапии воспалительных заболеваний, опосредованных ФНО-альфа, и касается блокады воспалительных протеаз тета-дефензинами. Для этого вводят эффективное количество тета-дефензина, выбранного из группы, состоящей из RTD-1, RTD-2, RTD-3, RTD-4, RTD-5, RTD-1-27, RTD-1-28 и RTD-1-29. Это обеспечивает эффективное лечение за счет конкурентного ингибирования указанными соединениями активности ФНО-альфа конвертирующего фермента (ТАСЕ). 2 н. и 4 з.п. ф-лы, 9 ил.,7 пр.

Комментарии