Способы лечения состояний, связанных с masp-2 зависимой активацией комплемента - RU2662563C2
Код документа: RU2662563C2
Чертежи
































































































































Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА СООТВЕТСТВУЮЩИЕ ПРИЛОЖЕНИЯ
Эта заявка заявляет приоритет предварительной заявки № 61/473698, поданной 8 апреля 2011 года, которая включена в настоящий документ посредством ссылки в полном объеме.
ЗАЯВЛЕНИЕ, КАСАЮЩЕЕСЯ ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Перечень последовательностей, связанный с этой заявкой, предоставляется в текстовом формате вместо бумажной копии и настоящим включен посредством ссылки в эту спецификацию. Имя текстового файла, содержащего перечень последовательностей, представляет собой MP_1_0126_US2_SequenceListingasFiled.txt. Текстовый файл представляет собой файл размером 110 КB; был создан 30 марта 2012 года; и представляется с помощью EFS-Web с подачей спецификации.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Система комплемента обеспечивает механизм раннего действия для инициирования, усиления и регулирования иммунного ответа на микробную инфекцию и другие острые поражения (M.К. Liszewski and J.P. Atkinson, 1993, в Fundamental Immunology, Third Edition, edited by W.E. Paul, Raven Press, Ltd., Нью-Йорк) в организме человека и других позвоночных. Несмотря на то, что активация комплемента обеспечивает чрезвычайно важную первую линию обороны против возможных возбудителей заболеваний, активности комплемента, которые стимулируют защитный иммунный ответ, также могут представлять потенциальную угрозу для хозяина (K.R. Kalli, et al., Springer Semin. Imrnunopathol. 15:417-431, 1994; B.P. Morgan, Eur. J. Clinical Investig. 24: 219-228, 1994). Например, протеолитические продукты C3 и C5 привлекают и активируют нейтрофилы. Активированные нейтрофилы, несмотря на то, что являются совершенно необходимыми для защиты организма, действуют неизбирательно при своем высвобождении деструктивных ферментов, и могут вызывать повреждения органов. Кроме того, активация комплемента может привести к депозиции литических компонентов комплемента на близлежащих клетках-хозяевах, как и на микробных мишенях, приводя в результате к лизису клеток-хозяев.
Система комплемента также вовлечена в патогенез многих острых и хронических заболеваний, в том числе: инфаркт миокарда, инсульт, синдром острой дыхательной недостаточности (ARDS), реперфузионное повреждение, септический шок, подтекание капилляров, следующее за термическими ожогами, послекардиопульмональное обходное воспаление, отторжение трансплантата, ревматоидный артрит, рассеянный склероз, миастения gravis и болезнь Альцгеймера. Почти при всех этих состояниях комплемент является не причиной, а одним из нескольких факторов, вовлеченных в патогенез. Тем не менее, активация комплемента может являться основным патологическим механизмом и представляет эффективный пункт для клинического управления при многих из этих болезненных состояний. Растущее понимание важности комплемент-опосредованного повреждения тканей при различных болезненных состояниях подчеркивает необходимость в эффективных комплемент-ингибирующих лекарственных препаратах. На сегодняшний день, экулизумаб (Solaris®), антитело против C5, является единственным комплемент-направленным лекарственным препаратом, который был одобрен для применения на людях. Кроме того, C5 представляет собой одну из нескольких эффекторных молекул, расположенных «ниже по течению» в системе комплемента, и блокада C5 не ингибирует активацию системы комплемента. Поэтому, ингибитор начальных стадий инициации активации комплемента мог бы иметь существенные преимущества по сравнению с ингибитором комплемента, действующим «ниже по течению».
В настоящее время общепризнано, что система комплемента может быть активирована при помощи трех различных путей: классического пути, лектинового пути и альтернативного пути. Классический путь обычно инициируется комплексом, который состоит из антител организма-хозяина, связанных с инородной частицей (т.е., антигеном) и, таким образом, требует предварительного воздействия антигена для формирования специфического гуморального ответа. Поскольку активация классического пути зависит от предварительного адаптивного иммунного ответа организма-хозяина, классический путь представляет собой часть приобретенной иммунной системы. В противоположность этому, как лектиновый, так и альтернативные пути являются независимыми от адаптивного иммунитета и являются частью естественной иммунной системы.
Активация системы комплемента приводит к последовательной активации зимогенов сериновой протеазы. Первой стадией при активации классического пути является связывание специфической узнающей молекулы, C1q, с антигенсвязывающими молекулами IgG и IgM. C1q связывается с проферментами сериновой протеазы C1r и C1s в виде комплекса, называемого C1. После связывания C1q с иммунным комплексом, происходит автопротеолитическое расщепление участка Arg-Ile в C1r, а затем C1r-опосредованное расщепление и активация С1s, который, таким образом, приобретает способность расщеплять C4 и C2. C4 расщепляется на два фрагмента, обозначенные как C4a и C4b, и, аналогично, C2 расщепляется на C2a и C2b. Фрагменты C4b способны образовывать ковалентные связи с соседними гидроксильными или аминными группами и образовывать C3-конвертазу (C4b2a) через нековалентное взаимодействие с C2a-фрагментом активированного C2. Конвертаза C3 (C4b2a) активирует С3 путем протеолитического расщепления на субкомпоненты C3a и C3b, приводя к образованию С5-конвертазы (C4b2a3b), который, путем расщепления C5, приводит к образованию мембраноатакующего комплекса (C5b в сочетании с С6, С7, С8 и C-9, также известного как «MAC»), который может нарушать клеточные мембраны, приводя к клеточному лизису. Активированные формы C3 и C4 (C3b и C4b) ковалентно размещаются на внешних поверхностях мишеней, которые распознаются рецепторами комплемента на многочисленных фагоцитах.
Независимо, первая стадия в активации системы комплемента через лектиновый путь также представляет собой связывание специфических распознающих молекул, которое следует за активацией ассоциированных проферментов сериновой протеазы. Однако, вместо связывания иммунных комплексов при помощи C1q, узнающие молекулы в лектиновом пути включают группу углевод-связывающих белков (маннан-связывающий лектин (MBL), H-фиколин, М-фиколин, L-фиколин и C-типа лектин CL-11), в совокупности именуемые лектинами. Смотри J. Lu et al., Biochim. Biophys. Acta 1572:387-400, (2002); Holmskov et al., Annu. Rev. Immunol. 21:547-578 (2003); Teh et al,. Immunology 101:225-232 (2000)). Смотри также J. Luеt et al., Biochim Biophys Acta 1572:387-400 (2002); Holmskov et al., Annu Rev Immunol 21:547-578 (2003); Teh et al., Immunology 101:225-232 (2000); Hansen et al, J. Immunol 185(10):6096-6104 (2010).
Ikeda et al. впервые продемонстрировали, что MBL, подобно C1q, может активировать систему комплемента через связывание с эритроцитами, покрытыми маннаном дрожжей, C4-зависимым образом (Ikeda et al., J. Biol. Chem. 2.52:7451-7454, (3987)). MBL, член белкового семейства коллектинов, является кальций-зависимым лектином, который связывает углеводы с 3- и 4-гидроксильными группами, ориентированными в экваториальной плоскости пиранозного кольца. Выступающими лигандами для MBL, таким образом, являются D-манноза и N-ацетил-D-глюкозамин, в то время как углеводы, не удовлетворяющие этому стерическому требованию, обладают недетектируемой для MBL аффинностью (Wets et al., Nature 360: 127-134, (1992)). Взаимодействие между MBL и моновалентными сахарами является крайне слабым, с константами диссоциации, как правило, в одноразрядном миллимолярном диапазоне. MBL достигает плотного, специфического связывания с гликановыми лигандами за счет авидности, т.е., за счет одновременного взаимодействия с несколькими моносахаридными остатками, расположенными в непосредственной близости друг от друга (Lee et al., Archiv. Biochem. Biophys. 299: 129-136, (3992)). MBL распознает углеводные структуры, которые обычно декорируют микроорганизмы, такие как бактерии, дрожжи, паразиты и некоторые вирусы. И наоборот, MBL не узнает D-галактозу и сиаловую кислоту, предпоследние и последние сахара, которые обычно декорируют «зрелые» сложные гликоконъюгаты, присутствующие на гликопротеинах плазматических и клеточных поверхностей клеток млекопитающих. Считается, что эта специфичность связывания стимулирует узнавание «чужеродных» поверхностей и помогает в защите от «самоактивации». Однако, MBL не связывается с высокой аффинностью с кластерами высокоманнозных «прекурсорных» гликанов на N-связанных гликопротеинах и гликолипидах, изолированных в эндоплазматическом ретикулуме и комплексе Гольджи клеток млекопитающих (Maynard et al., J. Biol. Chem 257:3788-3794, (1982)). Поэтому, поврежденные клетки являются потенциальными мишенями для лектинового пути активации через MBL-связывание.
Фиколины обладают типом лектинового домена, отличного от такового для MBL, который называется фибриноген-подобный домен. Фиколины связывают сахарные остатки Ca++-независимым образом. В организме человека было выявлено три вида фиколинов (L-фиколин, М-фиколини и H-фиколин). Два сывороточных фиколина, L-фиколин и H-фиколин, совместно обладают специфичностью к N-ацетил-D-глюкозамину; при этом, H-фиколин также связывает N-ацетил-D-галактозамин. Различие в сахароспецифичности L-фиколина, H-фиколина, CL-11 и MBL означает, что разные лектины могут быть комплементарны и ориентированы на разные, хотя и перекрывающиеся, гликоконъюгаты. Эта концепция поддерживается недавним сообщением о том, что из известных лектинов лектинового пути лишь L-фиколин специфически связывается с липотейхоевой кислотой, глюкоконьюгатом клеточной стенки, обнаруженным во всех грамположительных бактериях (Lynch et al., J. Immunol. 172: 1198-1202, (2004)). Коллектины (т.е., MBL) и фиколины не обладают значительным сходством аминокислотных последовательностей. Однако, две группы белков обладают похожей доменной организацией и, подобно C1q, собраны в олигомерные структуры, которые максимально увеличивают возможности многосайтного связывания.
Концентрации MBL в сыворотке сильно варьируется в популяции здоровых людей, и это генетически контролируется полиморфизмом/мутациями как в промоторной, так и в кодирующей областях гена MBL. Как для белка острой фазы, экспрессия MBL также увеличивается во время воспаления. L-фиколин присутствует в сыворотке в концентрациях, аналогичных таковым для MBL. Таким образом, L-фиколиновая ветвь лектинового пути по силе сопоставима с плечом MBL. MBL и фиколины также могут функционировать в качестве опсонинов, которые позволяют фагоцитам нацеливаться на поверхности, декорированные MBL и фиколином (смотри Jack et al., J Leukoc Biol., 77(3):328-36 (2004), Matsushita and Fujita, Immunohiology, 205(4-5):490-7 (2002), Aoyagi et al., J. Immunol, 174(1):418-25 (2005). Эта опсонизация требует взаимодействия этих белков с фагоцитарными рецепторами (Kuhlman et al., J. Exp. Med. 169: 1733, (1989); Matsushita et al., J. Biol. Chem. 271:2448-54, (1996)), тождественность которых не была установлена.
MBL человека формирует специфическое и высокоаффинное взаимодействие через свой коллагено-подобный домен с уникальными C1r/C1s-подобными сериновыми протеиназами, называемыми MBL-связанными сериновыми протеазами (MASP). На сегодняшний день, было описано три MASP. Во-первых, один фермент «MASP» был выделен и охарактеризован в качестве фермента, ответственного за инициирование каскада комплемента (т.е., расщепление C2 и C4) (Matsushita et al., J. Exp. Med. 176(6): 1497-1502 (1992); Ji et al., J. Immunol 750:571-578, (1993)). Впоследствии было установлено, что активность МASP представляет собой, по сути, смесь двух протеаз: MASP-1 и MASP-2 (Tiel et al., Nature 386:506-510, (1997)). Однако было показано, что комплекс MBL-MASP-2 сам по себе достаточен для активации комплемента (Vorup-Jensen et al., J. Immunol 165:2093-2100, (2000)). Кроме того, только MASP-2 расщеплял C2 и C4 с высокой эффективностью (Ambrus et al., J. Immunol, 770: 1374-1382, (2003)). Поэтому, MASP-2 представляет собой протеазу, ответственную за активирование C2 и C4 для образования C3-конвертазы, C4b2a. В этом заключается существенное отличие от C1-комплекса классического пути, где скоординированное действие двух специфических сериновых протеаз (C1r и C1s) приводит к активации системы комплемента. Кроме того, была изолирована третья новая протеаза, MASP-3 (Dahl, М.Р., et al., Immunity 75: 127-35, 2001). MASP-1 и MASP-3 представляют собой продукты альтернативного сплайсинга одного и того же гена.
MASP разделяет идентичные доменные организации с таковыми C1r и C1s, ферментативными компонентами C1-комплекса (Sim et al., Biochem. Soc. Trans. 28:545, (2000)). Эти домены включают N-концевой домен C1r/C1s/VEGF морского ежа/морфогенетического белка костей (CUB), домен, подобный эпидермальному фактору роста, второй CUB-домен, домены тандема комплемент-контролирующих белков и домен сериновой протеазы. Как и в случае C1-протеазы, активация MASP-2 происходит через расщепление связи Arg-Ile, прилегающей к домену сериновой протеазы, которая расщепляет фермент на дисульфидсвязанные цепи A и B, последняя состоит из домена сериновой протеазы.
MBL также может связываться с альтернативно-сплайсированной формой MASP-2, известной как MBL-ассоциированный белок массой 19 кДа (MAp19) или небольшой MBL-ассоциированный белок (sMAP), в которой отсутствует каталитическая активность MASP-2 (Stover, J. Immunol, 752:3481-90, (1999); Takahashi et al., Int. Immunol. 11:859-863, (1999)). Map19 включает в себя первые два домена MASP-2, следующие после дополнительной последовательности из четырех уникальных аминокислот. Функция Map 19 непонятна (Degn et al, J. Immunol. Methods, 2011). Гены MASP-1 и MASP-2 расположены на 3 и 1 хромосомах человека, соответственно (Schwaeble et al., Immunobiology 205:455-466, (2002)).
Несколько линий доказательства свидетельствуют о том, что существуют различные комплексы MBL-MASP, и большая часть MASP в сыворотке крови не образует комплексы с MBL (Thiel, et al., J. Immunol. 165:878-887, (2000)). Как H-, так и L-фиколин связывается со всеми MASP и активирует лектиновый путь комплемента, как это делает MBL (Dahl et al., Immunity 15:127-35, (2001); Matsushita et al., J. Immunol 168: 3502-3506, (2002)). Как лектиновый, так и классический пути образуют общую C3-конвертазу (C4b2a), и два пути сходятся на этой стадии.
Лектиновый путь, по общему мнению, играет большую роль в защите организма от инфекции в наивном организме-хозяине. Убедительные доказательства причастности MBL к защите организма исходят из анализа пациентов со сниженными сывороточными уровнями функциональных MBL (Kilpatrick, Biochim. Biophys. Acta 1572:401-413, (2002)). Такие пациенты проявляют восприимчивость к рецидивирующим бактериальным и грибковым инфекциям. Эти симптомы, как правило, являются выраженными в начале жизни, во время наблюдаемого окна восприимчивости, поскольку титр производимых по материнской линии антител убывает, но развивается до полного спектра реакций антител. Этот синдром часто является результатом мутаций в нескольких сайтах в коллагеновой части MBL, которые препятствуют правильному формированию MBL-олигомеров. Однако, поскольку MBL может функционировать в качестве опсонина, независимого от комплемента, неизвестно, в какой степени повышенная восприимчивость к инфекции обусловлена нарушением активации комплемента.
В отличие от классического и лектинового путей, никаких инициаторов альтернативного пути не было обнаружено для осуществления функций распознавания, которые в двух других путях выполняют C1q и лектины. В настоящее время общепризнано, что альтернативный путь спонтанно подвергается низкому уровню оборотной активации, которая может легко усиливаться на чужеродных или других аномальных поверхностях (бактериях, дрожжах, клетках, зараженных вирусом, или поврежденной ткани), у которых отсутствуют надлежащие молекулярные элементы, которые удерживают спонтанную активацию комплемента под контролем. Существует четыре белка плазмы, непосредственно участвующих в активации альтернативного пути: C3, факторы B и D и пропердин.
Несмотря на то, что существуют многочисленные свидетельства причастности классического и альтернативного путей комплемента к патогенезу неинфекционных заболеваний человека, роль лектинового пути только начинают оценивать. Недавние исследования предоставляют доказательства того, что активация лектинового пути может быть ответственна за активацию комплемента и связанного с этим воспаления при ишемии/реперфузионном повреждении. Collard et al., (2000) сообщили, что культивируемые клетки эндотелия, подвергнутые окислительному стрессу, связывают MBL и демонстрируют депозицию C3 при экспозиции с человеческой сывороткой (Collard et al., Am. J. Pathol 156: 1549-1556, (2000)). Кроме того, обработка человеческой сыворотки блокирующими моноклональными антителами против MBL подавляла MBL-связывание и активацию комплемента. Это обнаружение было распространено на крысиной модели ишемии миокарда-реперфузии, в которой крысы, подвергнутые лечению блокирующим антителом, направленным против MBL крысы, показали значительно меньше повреждения миокарда при окклюзии коронарных артерий, чем у крыс, подвергнутых лечению контрольным антителом (Jordan et al., Circulation 104: 1413-1418, (2001)). Молекулярный механизм связывания MBL с васкулярным эндотелием после окислительного стресса неясен; недавние исследования позволили предположить, что активация лектинового пути после окислительного стресса может быть опосредована связыванием MBL с васкулярными эндотелиальными цитокератинами, а не с гликоконьюгатами (Collard et al., Am. J. Pathol, 159: 1045-1054, (2001)). Другие исследования непосредственно связали классический и альтернативный пути с патогенезом ишемии/реперфузионного повреждения, и роль лектинового пути в этой болезни остается спорной (Riedermann, N.C., et al., Am. J. Pathol. 162:363-367, 2003).
Недавнее исследование показало, что MASP-1 (и, возможно, MASP-3) требуется для преобразования фактора D, фермента активациии альтернативного пути, из его зимогенной формы в его ферментативно активную форму (смотри Takahashi M. et al., J. Exp. Med 207(1):29-37 (2010)). Физиологическое значение этого процесса подчеркивается отсутствием функциональной активности альтернативного пути в плазме мышей с недостатком MASP-1/3. Протеолитическая генерация C3b из натавного C3 требуется для функционирования альтернативного пути. Поскольку C3-конвертаза (C3bBb) альтернативного пути содержит C3b в качестве неотъемлемой субъединицы, вопрос о происхождении первых C3b через альтернативный путь представлялся головоломной проблемой и стимулировал значительное количество исследований.
C3 принадлежит к семейству белков (наряду с C4 и α-2 макроглобулином), которые содержат редкую посттрансляционную модификацию, известную как тиоэфирная связь. Тиоэфирная группа состоит из глутамина, чья концевая карбонильная группа образует ковалентную тиоэфирную связь с сульфгидрильной группой цистеина, расположенного на расстоянии трех аминокислот. Эта связь является нестабильной, и электрофильный глутамилтиоэфир может реагировать с нуклеофильными частями, такими как гидрокси- или амино- группы и, таким образом, образовывать ковалентную связь с другими молекулами. Тиоэфирная связь является достаточно стабильной при изоляции в гидрофобном кармане интактного C3. При этом, протеолитическое расщепление С3 до C3a и C3b приводит в результате к экспозиции высокоактивной тиоэфирной связи на C3b и, после нуклеофильной атаки соседних частей, содержащих гидрокси- или амино- группы, C3b становится ковалентно связанным с мишенью. В дополнение к хорошо задокументированной роли в ковалентном присоединении C3b к мишеням комплемента, также полагают, что тиоэфир C3 играет ключевую роль в инициировании альтернативного пути. Согласно общепринятой «теории топтания на месте», альтернативный путь инициируется формированием конвертазы жидкой фазы, iC3Bb, которая образуется из C3 с гидролизованным тиоэфиром (iC3; C3(H2O)) и фактором B (Lachmann, P.J., et al., Springer Semin. Immunopatol. 7: 143-162, (1984)). C3b-подобный C3(H2O) образуется из нативного C3 путем медленного спонтанного гидролиза внутреннего тиоэфира в белке (Pangburn, M.K., et al., J. Exp, Med. 154:856-867, 1981). Благодаря активности конвертазы C3(H2O)Bb, молекулы C3b депонируются на поверхности мишени, инициируя тем самым альтернативный путь.
Об инициаторах активизации альтернативного пути известно очень мало. Считается, что активаторы включают клеточные стенки дрожжей (зимозан), много очищенных полисахаридов, эритроциты кролика, некоторые иммуноглобулины, вирусы, грибки, бактерии, опухолевые клетки животных, паразиты и поврежденные клетки. Единственное свойство, общее у этих активаторов, является наличие углеводов, однако сложность и разнообразие углеводных структур затрудняет установление общих молекулярных детерминант, которые распознаются. Общепризнано, что активация альтернативного пути контролируется с помощью тонкого баланса между ингибирующими регуляторными компонентами этого пути, такими как Фактор Н, Фактор I, DAF, и CR1 и пропердин, который представляет собой единственный положительный регулятор альтернативного пути (см. Schwaebie W.J. and Reid K.B., Immunol Today 20(1): 17-21 (1999)).
В добавление к явно нерегулируемому механизму активации, описанному выше, альтернативный путь также может обеспечить эффективное усиление петли для C3-конвертазы (C4b2a) лектинового/классического пути, поскольку любой образованный C3b может принимать участие вместе с фактором B в формировании C3-конвертазы (C3bBb) дополнительного альтернативного пути. C3-конвертаза альтернативного пути стабилизируется за счет связывания с пропердином. Пропердин увеличивает время полужизни C3-конвертазы альтернативного пути в шесть-десять раз. Добавление C3b к C3-конвертазе альтернативного пути приводит к формированию C5-конвертазы альтернативного пути.
Все три пути (т.е., классический, лектиновый и альтернативный), как полагают, сходятся в C5, который расщепляется с образованием продуктов с несколькими провоспалительными действиями. Конвергентный путь был назван как терминальным путем комплемента. C5a представляет собой самый эффективный анафилатоксин, вызывающий изменения в гладких мышцах и сосудистом тонусе, а также сосудистой проницаемости, он также является эффективным хемотаксином и активатором как нейтрофилов, так и моноцитов. С5а-опосредованная клеточная активация может значительно усиливать воспалительные реакции путем индуцирования высвобождения нескольких дополнительных воспалительных медиаторов, включая цитокины, гидролитические ферменты, метаболиты арахидоновой кислоты и активные формы кислорода. Расщепление C5 приводит к образованию C5b-9, также известному как мембраноатакующий комплекс (MAC). Сейчас имеются убедительные доказательства того, что сублитическое депонирование MAC может играть важную роль в воспалении, в дополнение к своей роли в качестве литического порообразующего комплекса.
В дополнение к своей важной роли в иммунной защите, система комплемента способствует повреждению тканей при многих клинических состояниях. Таким образом, существует настоятельная необходимость разработки терапевтически эффективных ингибиторов комплемента для предотвращения этих неблагоприятных эффектов.
КРАТКОЕ СОДЕРЖАНИЕ
Это краткое изложение приводится для введения набора понятий в упрощенной форме, которые также приводятся ниже в Подробном описании. Это краткое изложение не предназначено для определения ключевых характеристик заявленного предмета рассмотрения, как не предназначено и для использования в качестве вспомогательного средства при определении объема заявленного предмета рассмотрения.
В одном аспекте, настоящее изобретение предоставляет способ ингибирования неблагоприятных эффектов MASP-2-зависимой активации комплемента у живого субъекта. Способ включает в себя стадию введения субъекту, который в этом нуждается, количества MASP-2 ингибирующего агента, эффективного для ингибирования MASP-2-зависимой активации комплемента. В другом аспекте изобретения, MASP-2-ингибирующий агент ингибирует активацию комплемента через лектин-зависимую MASP-2-систему без значительного ингибирования активации комплемента через классическую или C1q-зависимую систему, так, что C1q-зависимая система остается функциональной.
В некоторых вариантах осуществления этих аспектов изобретения, MASP-2-ингибирующий агент представляет собой антитело анти-MASP-2 или его фрагмент. В дополнительных вариантах осуществления, антитело анти-MASP-2 обладает ослабленными эффекторными функциями. В некоторых вариантах осуществления, MASP-2-ингибирующий агент представляет собой MASP-2-ингибирующий пептид или непептидный MASP-2-ингибитор.
В другом аспекте, настоящее изобретение предоставляет композиции для ингибирования неблагоприятных эффектов MASP-2-зависимой активации комплемента, содержащие терапевтически эффективное количество MASP-2-ингибирующего агента и фармацевтически приемлемый носитель. Также предоставляются способы изготовления лекарственного средства для применения при ингибировании неблагоприятных эффектов MASP-2-зависимой активации комплемента у живых субъектов, которые в этом нуждаются, содержащего терапевтически эффективное количество MASP-2-ингибирующего агента в фармацевтически приемлемом носителе. Также предоставляются способы изготовления лекарственных препаратов для применения при ингибировании MASP-2-зависимой активации комплемента для лечения каждого из состояний, болезней и расстройств, описанных в настоящем документе ниже.
Способы, композиции и лекарственные препараты по изобретению полезны для ингибирования неблагоприятных эффектов MASP-2-зависимой активации комплемента in vivo у субъектов-млекопитающих, включая людей, страдающих от острого или хронического патологического состояния или травмы, как изложено далее в настоящем документе.
В другом аспекте изобретения представляются способы ингибирования MASP-2-зависимой активации комплемента у субъекта, страдающего от или подверженного риску пароксизмальной ночной гемоглобинурии, включающие введение субъекту композиции, содержащей количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2 зависимой активации комплемента.
В другом аспекте, изобретение предоставляет способ ингибирования MASP-2-зависимой активации комплемента у субъекта, страдающего от или подверженного риску развития фактор H-независимого атипичного гемолитического уремического синдрома (aHUS), включающий введение субъекту композиции, содержащей количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2 зависимой активации комплемента.
В другом аспекте, изобретение предоставляет способ снижения вероятности того, что субъект с риском развития атипичного гемолитического уремического синдрома (aHUS) будет страдать от клинических симптомов, связанных с aHUS, включающий: (a) определение наличия у субъекта генетического маркера, как известно, связанного с aHUS; (b) периодический мониторинг субъекта на наличие или отсутствие по крайней мере одного симптома, выбранного из группы, включающей анемию, тромбоцитопению, почечную недостаточность и повышение уровня креатинина; и (c) введение субъекту композиции, содержащей количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2-зависимой активации комплемента при определении наличия по крайней мере одного из анемии, тромбоцитопении, почечной недостаточности или повышения уровня креатинина, где композицию вводят в эффективном количестве и в течение достаточного периода времени для улучшения указанного одного или более симптомов.
В другом аспекте, изобретение предоставляет способ ингибирования MASP-2-зависимой активации комплемента у субъекта, страдающего от или подверженного риску развития атипичного гемолитического уремического синдрома (aHUS), на фоне инфекции, включающий введение субъекту композиции, содержащей количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2-активации комплемента.
В другом аспекте, изобретение предоставляет способ лечения субъекта, страдающего от атипичного гемолитическиого уремического синдрома (aHUS), включающий введение субъекту композиции, содержащей количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2-зависимой активации комплемента, где введение MASP-2-ингибирующего агента осуществляется через внутривенный катетер или другим способом доставки при помощи катетера.
В другом аспекте, изобретение предоставляет способ уменьшения вероятности развития нарушения функции почек у субъекта с риском развития гемолитического уремического синдрома (HUS), включающий введение субъекту композиции, содержащей количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2-зависимой активации комплемента.
В другом аспекте, изобретение предоставляет способ лечения субъекта, страдающего от гемолитического уремического синдрома (HUS), включающий введение субъекту композиции, содержащей количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2-зависимой активации комплемента, где введение MASP-2-ингибирующего агента субъекту осуществляется через внутривенный катетер или при помощи другого способа доставки с использованием катетера.
В другом аспекте, изобретение предоставляет способ лечения субъекта, страдающего от тромботической тромбоцитопенической пурпуры (ТТР), или демонстрирует симптомы, согласующиеся с диагнозом ТТР, включающий введение субъекту композиции, содержащей количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2-зависимой активации комплемента, где введение MASP-2-ингибирующего агента субъекту осуществляется через внутривенный катетер или при помощи другого способа доставки с использованием катетера.
В другом аспекте, изобретение предоставляет способ лечения субъекта, страдающего от рефракторной тромботической тромбоцитопенической пурпуры (ТТР), включающий введение субъекту композиции, содержащей количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2-зависимой активации комплемента.
В другом аспекте изобретения, представлены способы ингибирования MASP-2-зависимой активации комплемента у субъекта, страдающего криоглобулинемией, включающий введение субъекту композиции, содержащей количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2-зависимой активации комплемента.
В другом аспекте изобретения, представлены способы ингибирования MASP-2-зависимой активации комплемента у субъекта, страдающего от синдрома холодовой агглютинации, включающий введение субъекту композиции, содержащей количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2-зависимой активации комплемента.
В другом аспекте изобретения, представлены способы ингибирования MASP-2-зависимой активации комплемента у субъекта, страдающего глаукомой, включающие введение субъекту композиции, содержащей количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2-зависимой активации комплемента.
В другом аспекте изобретения, представлены способы ингибирования MASP-2-зависимой активации комплемента у субъекта с риском развития или страдающего от острого лучевого синдрома, включающие введение субъекту композиции, содержащей количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2-зависимой активации комплемента. В некоторых вариантах осуществления, анти-MASP-2-ингибирующий агент представляет собой антитело анти-MASP-2. В некоторых вариантах осуществления, MASP-2-ингибирующий агент вводят профилактически субъекту перед воздействием облучения (например, перед началом лечения радиацией, или перед ожидаемым воздействием облучения). В некоторых вариантах осуществления, MASP-2-ингибирующий агент вводят в течение от 24 до 48 часов после облучения. В некоторых вариантах осуществления, MASP-2-ингибирующий агент вводят перед и/или после облучения в количестве, достаточном для улучшения одного или более симптомов, связанных с острым лучевым синдромом.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеупомянутые аспекты и многие присутствующие достоинства данного изобретения станут более легкими для оценки, так как становятся более понятными путем отсылки к нижеприведенному подробному описанию, когда рассматриваются вместе с сопровождающими чертежами, где:
ФИГУРА 1 представляет собой диаграмму, иллюстрирующую геномную структуру МASP-2 человека;
ФИГУРА 2А представляет собой принципиальную схему, иллюстрирующую доменную структуру белка MASP-2 человека;
ФИГУРА 2В представляет собой принципиальную схему, иллюстрирующую доменную структуру белка Мар19 человека;
ФИГУРА 3 представляет собой диаграмму, иллюстрирующую стратегию нокаута MASP-2 мыши;
ФИГУРА 4 представляет собой диаграмму, иллюстрирующую конструирование минигена MASP-2 человека;
ФИГУРА 5A представляет результаты, которые демонстрируют, что MASP-2-недостаточность приводит к потере лектиновый-путь-опосредованной C4-активации, измеряемой по отсутствию C4b-депозиции на маннане, как описано в Примере 2;
ФИГУРА 5B представляет результаты, которые демонстрируют, что MASP-2-недостаточность приводит к потере лектиновый-путь-опосредованной C4-активации, измеряемой по отсутствию C4b-депозиции на зимозане, как описано в Примере 2;
ФИГУРА 5С представляет результаты, которые демонстрируют относительные уровни C4-активации образцов сыворотки, полученных от штаммов MASP-2+/-; MASP-2-/- и дикого типа, как определено по C4b-депозиции на маннане и на зимозане, как описано в Примере 2;
ФИГУРА 6 представляет результаты, которые демонстрируют, что добавление мышиного рекомбинантного MASP-2 к образцам сыворотки MASP-2-/- восстанавливает лектиновый-путь-опосредованную C4-активацию зависимым от концентрации белка образом, как определяют по C4b-депозиции на маннане, как описано в Примере 2;
ФИГУРА 7 представляет результаты, которые демонстрируют, что классический путь является функциональным в штамме MASP-2-/-, как описано в Примере 8;
ФИГУРА 8А представляет результаты, которые демонстрируют, что Fab2-антитело анти-MASP2 # 11 ингибирует образование С3-конвертазы, как описано в Примере 10;
ФИГУРА 8B представляет результаты, которые демонстрируют, что Fab2-антитело анти-MASP2 # 11 связывается к нативным MASP-2 крысы, как описано в Примере 10;
ФИГУРА 8С представляет результаты, которые демонстрируют, что Fab2-антитело анти-MASP-2 # 41 ингибирует расщепление C4, как описано в Примере 10;
ФИГУРА 9 представляет результаты, которые демонстрируют, что каждое из протестированных Fab2-антител анти-MASP-2, которые ингибировали образование C3-конвертазы, также, как было обнаружено, ингибируют расщепление C4, как описано в Примере 10;
На ФИГУРЕ 10 приведена диаграмма, иллюстрирующая рекомбинантные полипептиды, полученные из MASP-2 крысы, которые использовались для эпитопного картирования блокирующих Fab2-антител анти-MASP-2, как описано в Примере 11;
ФИГУРА 11 представляет результаты, которые демонстрируют связывание Fab2 анти-MASP-2 № 40 и № 60 с полипептидами MASP-2 крысы, как описано в Примере 11;
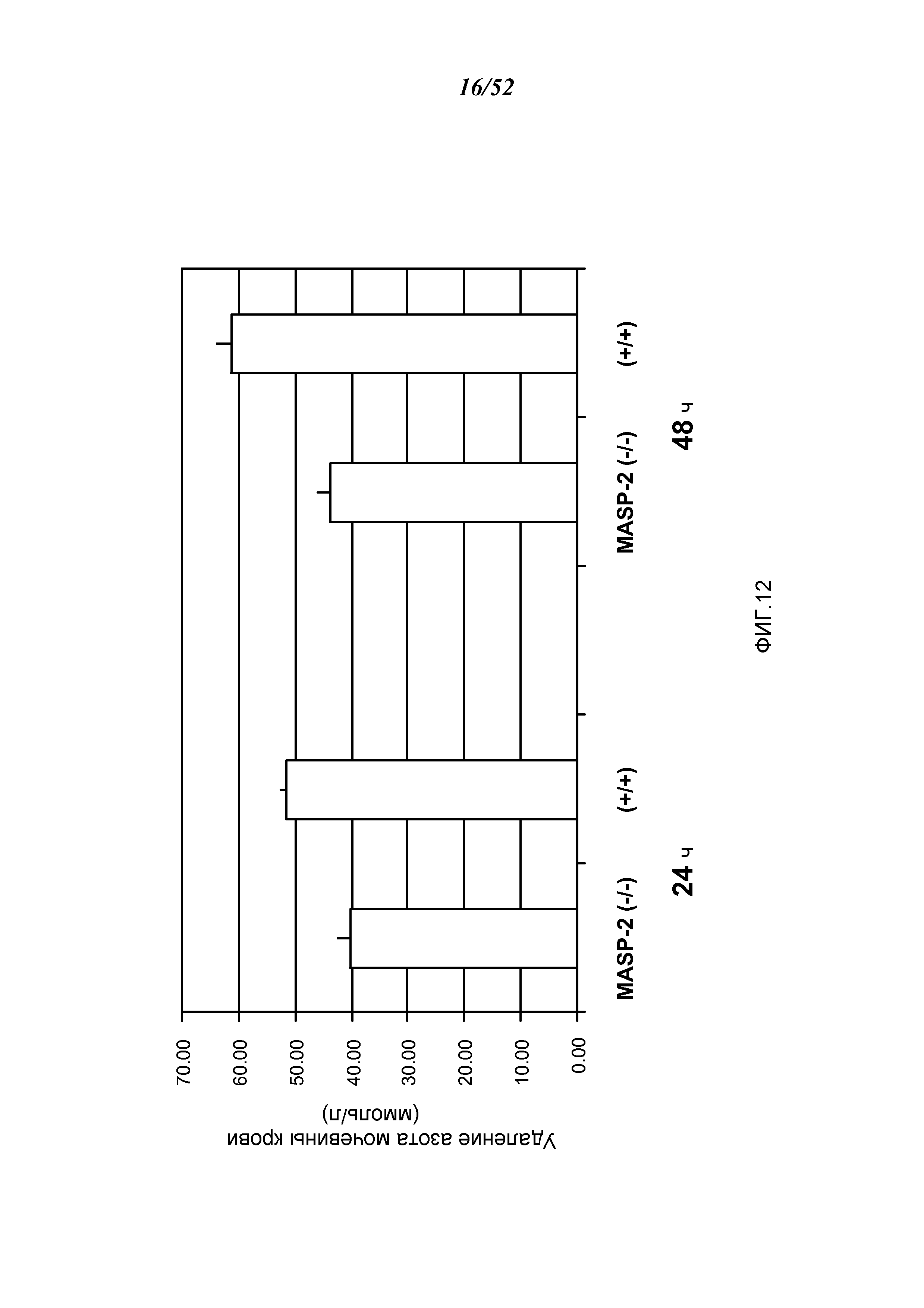
ФИГУРА 12 представляет результаты, которые демонстрируют освобождение от азота мочевины крови у мышей дикого типа (+/+) и MASP-2 (-/-) через 24 и 48 часов после реперфузии в модели ишемии почек/реперфузионного повреждения, как описано в Примере 12;
ФИГУРА 13А представляет результаты, показывающие базовые уровни белка VEGF в RPE-хороидальном комплексе, изолированном из мышей дикого типа (+/+) и MASP-2 (-/-), как описано в Примере 13;
ФИГУРА 13B представляет результаты, показывающие базовые уровни белка VEGF в RPE-хороидальном комплексе у мышей дикого типа (+/+) и MASP-2 (-/-) на 3 день после лазерно- индуцированного повреждения в модели макулярной дегенерации, как описано в Примере 13;
ФИГУРА 14 представляет результаты, показывающие средний объем хориоидальной неоваскуляризации (CNV) на седьмой день после лазерно-индуцированного повреждения у мышей дикого типа (+/+) и MASP-2 (-/-), как описано в Примере 13;
ФИГУРЫ 15A и 15B представляют кривые дозового эффекта для ингибирования C4b-депозиции (ФИГУРА 15А) и ингибирования активации тромбина (ФИГУРА 15В) после введения Fab2-антитела MASP-2 в нормальной сыворотке крови крыс, как описано в Примере 14;
ФИГУРЫ 16A и 16B представляют измеренную агрегацию тромбоцитов (выраженную в виде суммарной площади) у мышей MASP-2 (-/-) (ФИГУРА 16В) по сравнению с агрегацией тромбоцитов у мышей дикого типа, не получавших лечения, и мышей дикого типа, у которых путь комплемента ингибируется при помощи истощающего агента фактора яда кобры (CVF) и ингибитора терминального пути (C5aR-антагонист) (ФИГУРА 16А) в модели локализованной реакции Шварцмана диссеминированного внутрисосудистого свертывания, как описано в Примере 15;
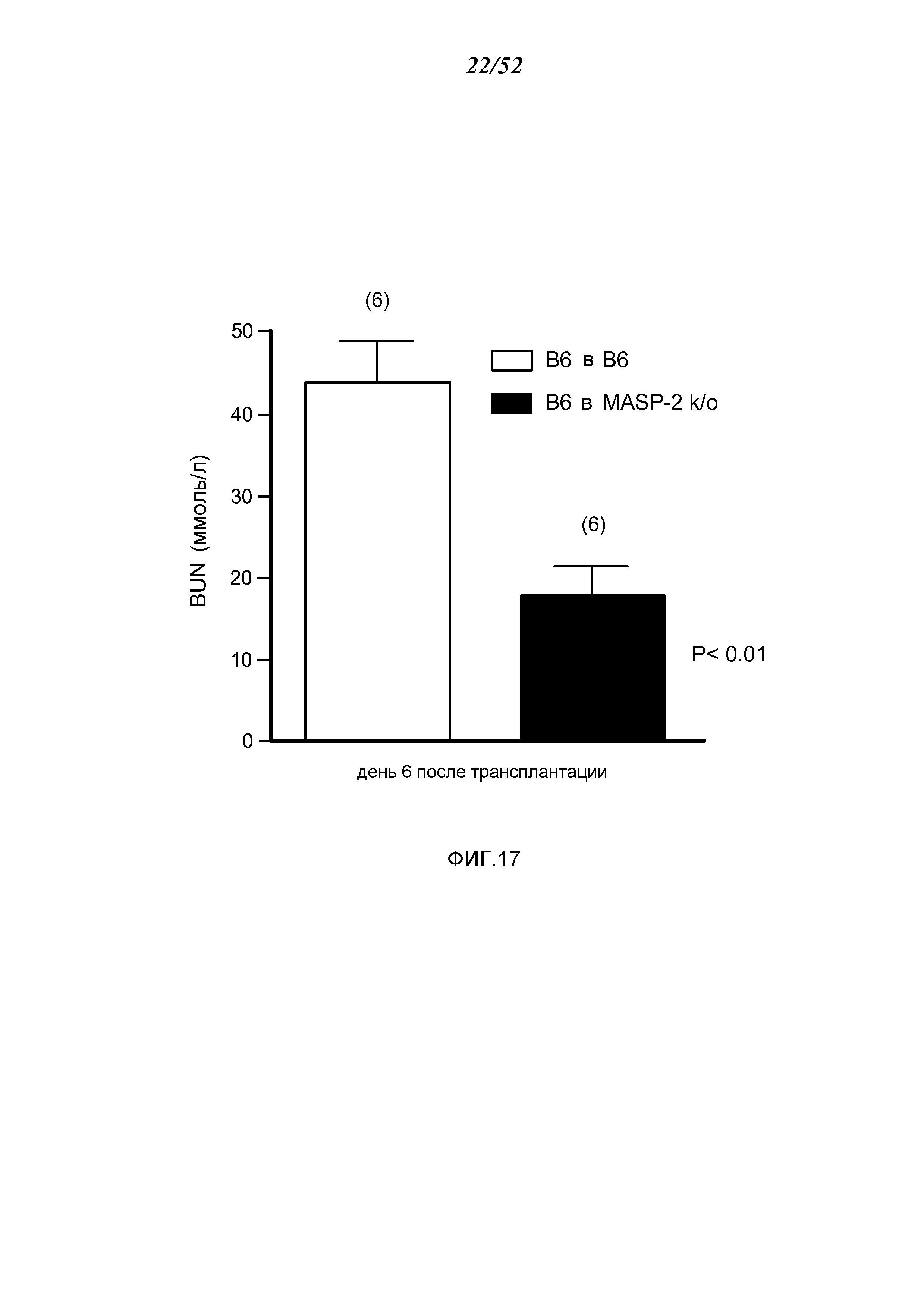
ФИГУРА 17 графически иллюстрирует уровни азота мочевины крови (BUN), определенные у трансплантат-реципиентных WT-мышей (+/+) (B6) или трансплантат-реципиентных мышей MASP-2 (-/-), с почками от WT(+/+) доноров, как описано в Примере 16;
ФИГУРА 18 графически иллюстрирует процент выживания WT-мышей (+/+) и мышей MASP-2 (-/-) как функцию числа дней после микробной инфекции в модели перевязки слепой кишки и пункции (CLP), как описано в Примере 17;
ФИГУРА 19 графически иллюстрирует количество бактерий, определенных в WT-мышах (+/+) и мышах MASP-2 (-/-) после микробной инфекции в модели перевязки слепой кишки и пункции (CLP), как описано в Примере 17;
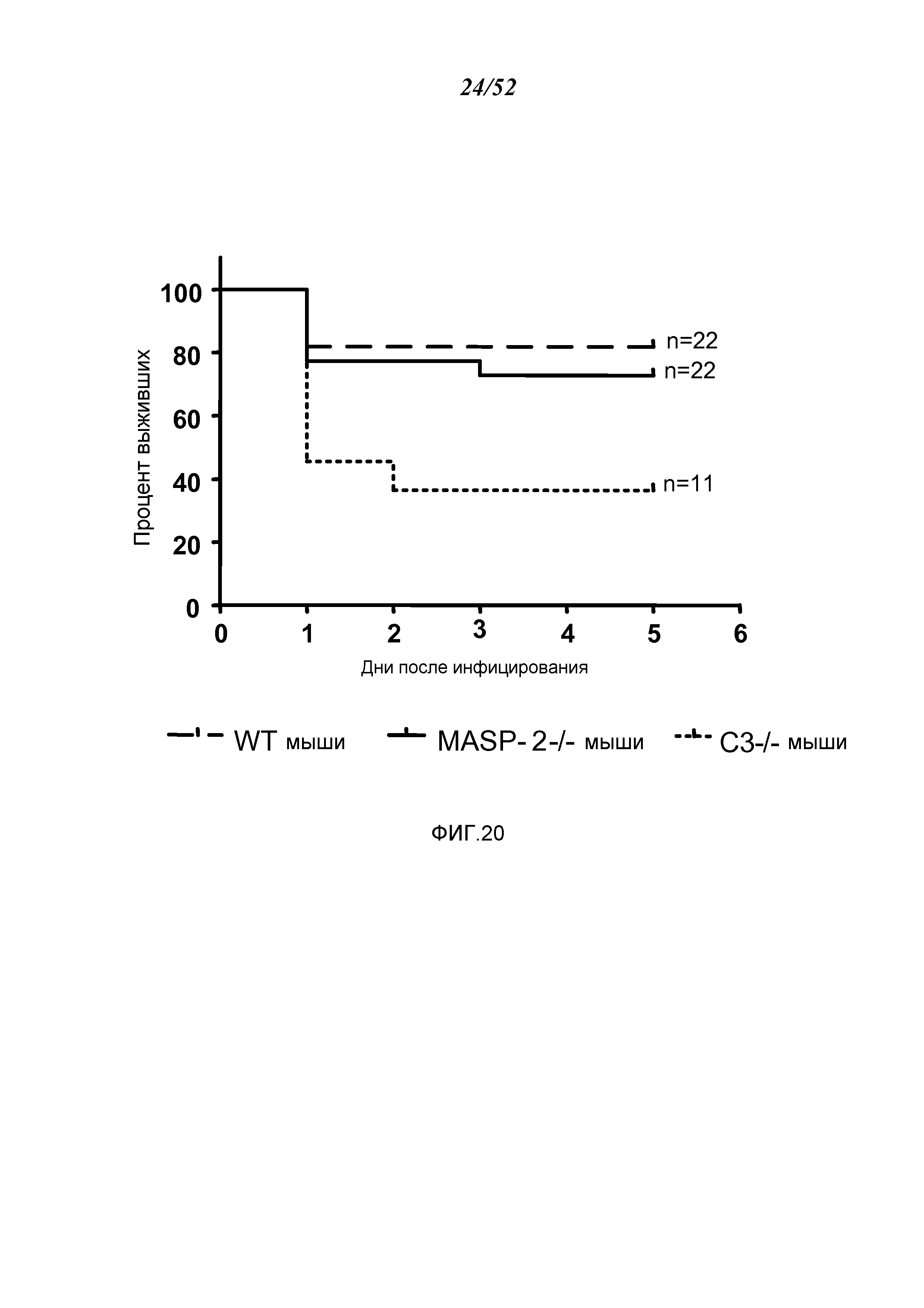
ФИГУРА 20 представляет собой график Каплана-Майера, иллюстрирующий процент выживания мышей WT (+/+), MASP-2 (-/-) и C3 (-/-) через шесть дней после интраназального введения Pseudomonas aeruginosa, как описано в Примере 18;
ФИГУРА 21 графически иллюстрирует уровень C4b-депозиции, определенный в % от контроля, в пробах, взятых в разные моменты времени после подкожного введения WT-мышам либо 0,3 мг/кг или 1,0 мг/кг мышиных моноклональных антител анти-MASP-2, как описано в Примере 19;
ФИГУРА 22 графически иллюстрирует уровень C4b-депозиции, определенный в % от контроля, в пробах, взятых в разные моменты времени после ip-дозирования WT-мышам 0,6 мг/кг мышиного моноклонального антитела анти-MASP-2, как описано в Примере 19;
ФИГУРА 23 графически иллюстрирует средний объем хороидальной неоваскуляризации (CNV) в день семь после лазер-индуцированного повреждения WT-мышей (+/+), предварительно получавших однократную ip-инъекцию 0,3 мг/кг или 1,0 мг/кг мышиного моноклонального антитела анти-MASP-2, как описано в Примере 20;
ФИГУРА 24А графически иллюстрирует процент выживания мышей MASP-2 (-/-) и WT (+/+) после заражения с 5×108кое/100 мкл N. meningitidis, как описано в Примере 21;
ФИГУРА 24В графически иллюстрирует log кое/мл N. meningitides, полученных в разные моменты времени в пробах крови, взятых от мышей MASP-2 КО (-/-) и WT (+/+), инфицированных 5×108 кое/100 мкл N. meningitidis, как описано в Примере 21;
ФИГУРА 25А графически иллюстрирует процент выживания MASP-2 КО (-/-) и WT (+/+) после заражения мышей с 2×108 кое/100 мкл N. meningitidis, как описано в Примере 21;
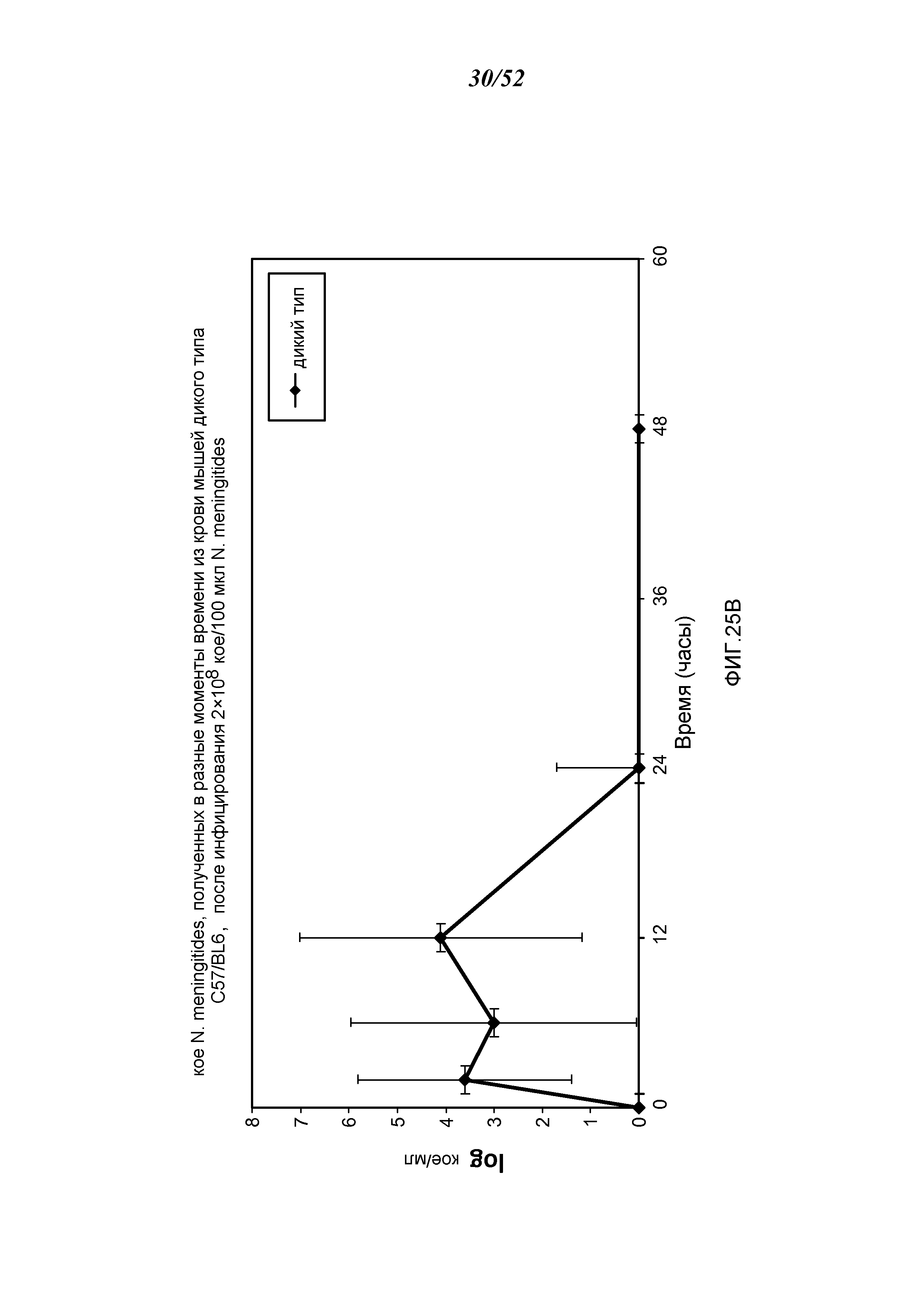
ФИГУРА 25B графически иллюстрирует log кое/мл N. meningitides, полученных в разные моменты времени из образцов крови, взятых из мышей WT (+/+), инфицированных 2×108 кое/100 мкл N. meningitidis, как описано в Примере 21;
ФИГУРА 25C графически иллюстрирует log кое/мл N. meningitides, полученных в разные моменты времени из образцов крови, взятых из мышей MASP-2 (-/-), инфицированных 2×108 кое/100 мкл N. meningitidis, как описано в Примере 21;
ФИГУРА 26А графически иллюстрирует результаты анализа C3b-депозиции, демонстрирующие, что у мышей MASP-2 (-/-) сохранен функциональный классический путь, как описано в Примере 22;
ФИГУРА 26В графически иллюстрирует результаты анализа C3b-депозиции на покрытых зимозаном планшетах, демонстрирующие, что у мышей MASP-2 (-/-) сохранен функциональный альтернативный путь, как описано в Примере 22;
ФИГУРА 27А графически иллюстрирует миокардиальную ишемию/реперфузионное повреждение (MIRI)-индуцированную потерю ткани после перевязки левой передней нисходящей ветви коронарной артерии (LAD) и реперфузии у мышей C4 (-/-) (n=6) и соответствующих однопометных WT-контролей (n=7), показывая зону риска (AAR) и размер инфаркта (INF), как описано в Примере 22;
ФИГУРА 27В графически иллюстрирует определение размера инфаркта (INF) как функцию зоны риска (AAR) у мышей C4 (-/-) и WT, как указано на ФИГУРА 42, демонстрируя, что мыши C4 (-/-) настолько же восприимчивы к MIRI, как и WT контроли (прерывистая линия), как описано в Примере 22;
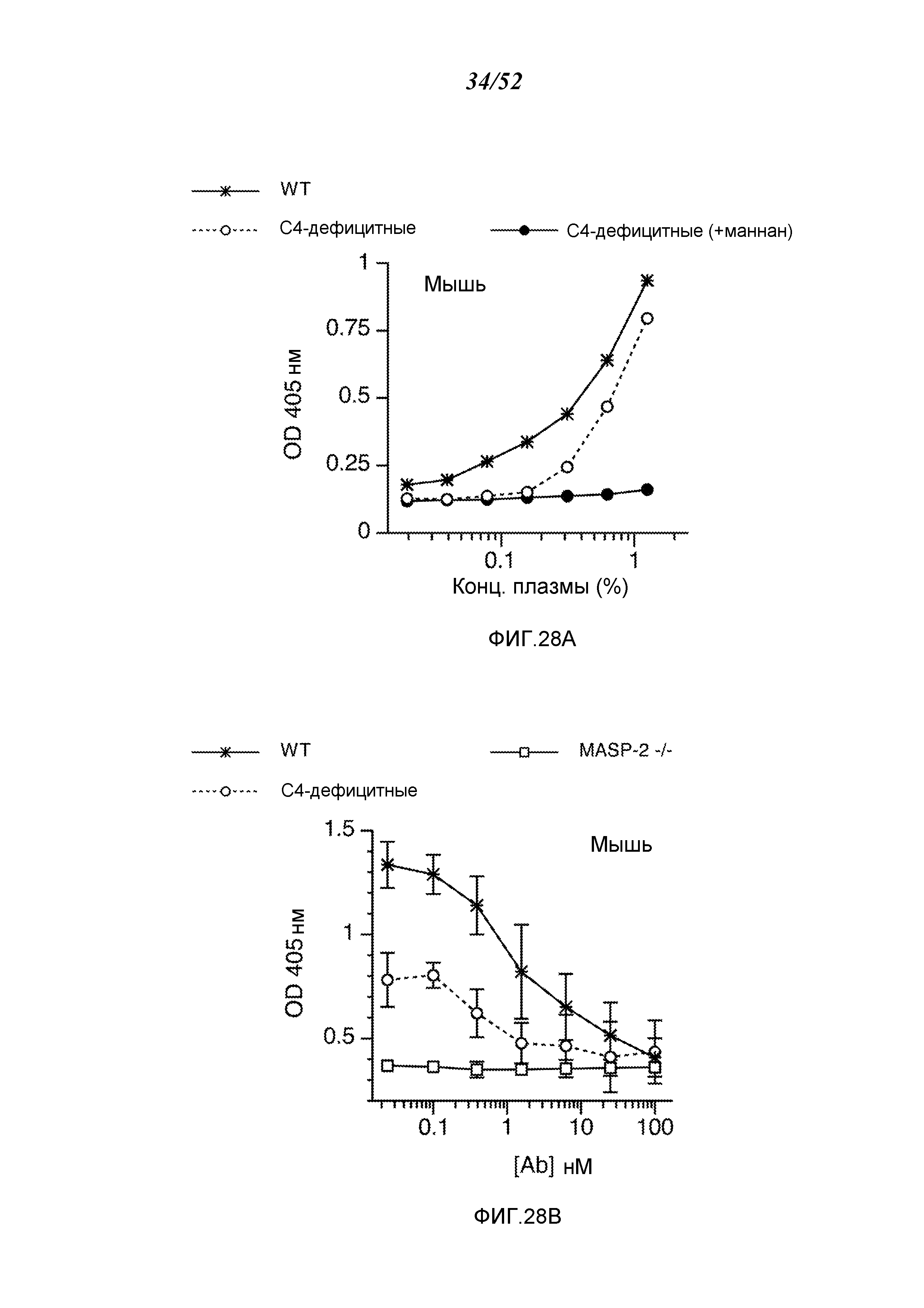
ФИГУРА 28А графически иллюстрирует результаты теста на C3b-депозицию с помощью сыворотки от мышей WT, сыворотки от мышей C4 (-/-) и сыворотки от мышей C4 (-/-), предварительно инкубированной с маннаном, как описано в Примере 22;
ФИГУРА 28В графически иллюстрирует результаты анализа C3b-депозиции в сыворотках от мышей WT, C4 (-/-) и MASP-2 (-/-), смешанных с различными концентрациями mAb против MASP-2 мыши (mAbM11), как описано в Пример 22;
ФИГУРА 28С графически иллюстрирует результаты анализа C3b-депозиции на сыворотке человека из WT (C4-достаточной) и C4-дефектной сыворотки и сыворотки от C4-дефектных субъектов, предварительно инкубированных с маннаном, как описано в Примере 22;
ФИГУРА 28D графически иллюстрирует результаты анализа C3b-депозиции на сыворотке человека от WT (C4-достаточных) и C4 дефектных субъектов, смешанной с mAb против MASP-2 человека (mAbH3), как описано в Примере 22;
ФИГУРА 29А графически иллюстрирует сравнительный анализ активности C3-конвертазы в плазме крови от протестированных штаммов мышей с различными дефектами комплемента, либо при условиях тестирования, специфических для лектинового пути активации, или при условиях тестирования, специфических для классического пути активации, как описано в Примере 22;
ФИГУРА 29В графически иллюстрирует кинетику временного разрешения активности C3-конвертазы в плазме крови штаммов мышей с различными дефектами комплемента, при условиях тестирования, специфических для лектинового пути активации, как описано в Примере 22;
ФИГУРА 30 иллюстрирует результаты Вестерн-блот анализа, демонстрирующие активизацию C3 человека, показанные при помощи наличия а’-цепи, при помощи субстратов тромбина FXIa и FXa, как описано в Примере 23;
ФИГУРА 31 показывает результаты анализа C3-депозиции на образцах сыворотки, полученных от WT, MASP-2 (-/-), F11 (-/-), F11(-/-)/C4(-/-) и C4 (-/-), как описано в Примере 23;
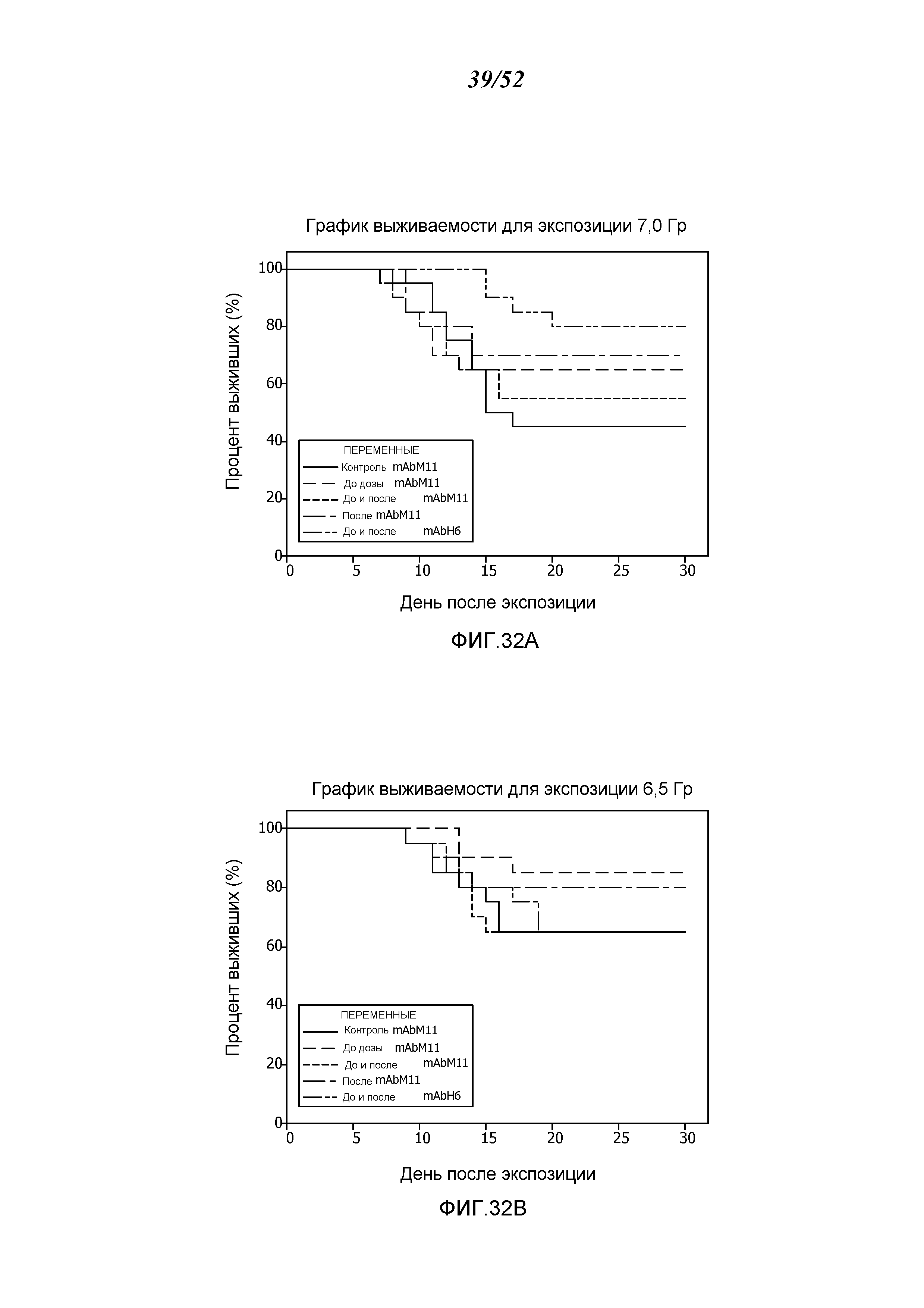
ФИГУРА 32А представляет собой график выживания Каплана-Мейера, показывающий процент выживания с течением времени после воздействия 7,0 Гр-излучения для контрольных мышей и мышей, получавших антитело против MASP-2 мыши (mAbM11) или антитело против MASP-2 человека (mAbH6), как описано в Примере 29;
ФИГУРА 32В представляет собой график выживания Каплана-Мейера, показывающий процент выживания с течением времени после воздействия 6,5 Гр-излучения для контрольных мышей и мышей, получавших антитело против MASP-2 мыши (mAbM11) или антитело против MASP-2 человека (mAbH6), как описано в Примере 29;
ФИГУРА 33 представляет собой график Каплана-Мейера, графически иллюстрирующий процент выживания мышей MASP-2 КО и WT после приема инфицирующий дозы 2,6×107 кое N. meningitidis серогруппы А Z2491, демонстрируя, что MASP-2-дефектные мыши защищены от N. meningitides-индуцированной смертности, как описано в Примере 30;
ФИГУРА 34 представляет собой график Каплана-Мейера, графически иллюстрирующий процент выживания мышей MASP-2 КО и WT после приема инфицирующей дозы 6×106 кое N. meningitidis серогруппы B штамма MC58, демонстрируя, что MASP-2-дефектные мыши защищены от смертности, индуцированной N. meningitides серогруппы B штамма MC58, как это описано в Примере 30;
ФИГУРА 35 графически иллюстрирует log кое/мл N. meningitidis серогруппы B штамма MC58, полученные в разные моменты времени из проб крови, которые берутся из мышей MASP-2 КО и WT после i.p.-инфицирования 6×106 кое N. meningitidis серогруппы B штамма MC58 (n=3 в разные моменты времени, для обеих групп мышей, результаты выражены в виде среднего ± SEM), демонстрируя, что хотя мыши MASP-2 КО были заражены той же дозой N. meningitidis серогруппы B штамма C58, что и мыши WT, мыши MASP-2 КО имеют повышенное освобождение от бактериемии по сравнению с WT, как описано в Примере 30;
ФИГУРА 36 графически иллюстрирует среднюю балльную оценку заболеваемости мышей MASP-2 и WT через 3, 6, 12 и 24 часа после заражения 6×106 кое/100 мкл N. meningitidis серогруппы B штамма MC58, демонстрируя, что MASP-2 дефектные мыши показали высокую устойчивость к инфекции, со значительно более низкой балльной оценкой заболеваемости через 6 часов, как описано в Примере 30;
ФИГУРА 37 представляет собой график Каплана-Мейера, графически иллюстрирующий процент выживания мышей после введения инфицирующей дозы 4×106 кое/100 мкл N. meningitidis серогруппы B штамма MC58, после введении через 3 часа после заражения либо ингибирующего антитела анти-MASP-2 (1 мг/кг), или контрольного изотипического антитела, демонстрируя, что антитело анти-MASP-2 является эффективным для лечения и улучшения выживаемости у субъектов, инфицированных N. meningitidis, как описано в Примере 31;
ФИГУРА 38 графически иллюстрирует log кое/мл жизнеспособных счетов N. meningitidis серогруппы B-MC58, полученных в разные моменты времени при 20% концентрации сыворотки человека после i.p. инфицирования 6,5×106 кое/100 мкл N. meningitidis серогруппы B штамма MC58, через 0, 30, 60 и 90 минут после инкубации в присутствии: (A) нормальной сыворотки человека (NHS) плюс антитела анти-MASP-2 человека: (В) нормальной сыворотки человека (NHS) плюс изотипического контрольного антитела; (C) MBL-/- сыворотка человека; (D) нормальной сыворотки человека (NHS) и (E) инактивированной прогреванием нормальной сыворотки человека (NHS), показывая, что комплемент-зависимое уничтожение N. meningitidis в сыворотке крови человека значительно усилилось за счет добавления антитела анти-MASP-2 человека, как описано в Примере 32.
ФИГУРА 39 графически иллюстрирует log кое/мл жизнеспособных счетов N. meningitidis серогруппы B-MC58, полученных в разные моменты времени из образцов мышиной сыворотки, демонстрируя, что сыворотки мышей MASP-2 -/- обладают более высокой бактерицидной активностью в отношении N. meningitidis, чем сыворотки WT-мышей, как описано в Примере 32;
ФИГУРА 40 графически иллюстрирует гемолиз (определенный по высвобождению гемоглобина лизированными мышиными эритроцитами (Crry/C3-/-) в надосадочной жидкости, измеряемому при помощи фотометрии) покрытых маннаном мышиных эритроцитов при помощи сыворотки человека в диапазоне сывороточных концентраций. Тестируемые сыворотки включали инактивированную прогреванием (HI) NHS, MBL-/-, NHS + антитело анти-MASP-2 и контрольный NHS, как описано в Примере 33;
ФИГУРА 41 графически иллюстрирует гемолиз (определенный по высвобождению гемоглобина лизированными эритроцитами WT-мышей в надосадочной жидкости, измеряемому при помощи фотометрии) непокрытых мышиных эритроцитов при помощи сыворотки человека в диапазоне сывороточных концентраций. Тестируемые сыворотки включали инактивированную прогреванием (HI) NHS, MBL-/-, NHS + антитело анти-MASP-2 и контрольный NHS, демонстрируя, что ингибирующее анти-MASP-2 ингибирует комплемент-опосредованный лизис эритроцитов несенсибилизированных WT-мышей, как описано в Примере 33;
ФИГУРА 42 графически иллюстрирует гемолиз (определенный по высвобождению гемоглобина лизированными эритроцитами мышей (CDS 55/59-/-) в надосадочной жидкости, измеряемому при помощи фотометрии) непокрытых мышиных эритроцитов при помощи сыворотки человека в диапазоне сывороточных концентраций. Тестируемые сыворотки включали инактивированную прогреванием (HI) NHS, MBL-/-, NHS + антитело анти-MASP-2 и контрольную NHS, как описано в Примере 33;
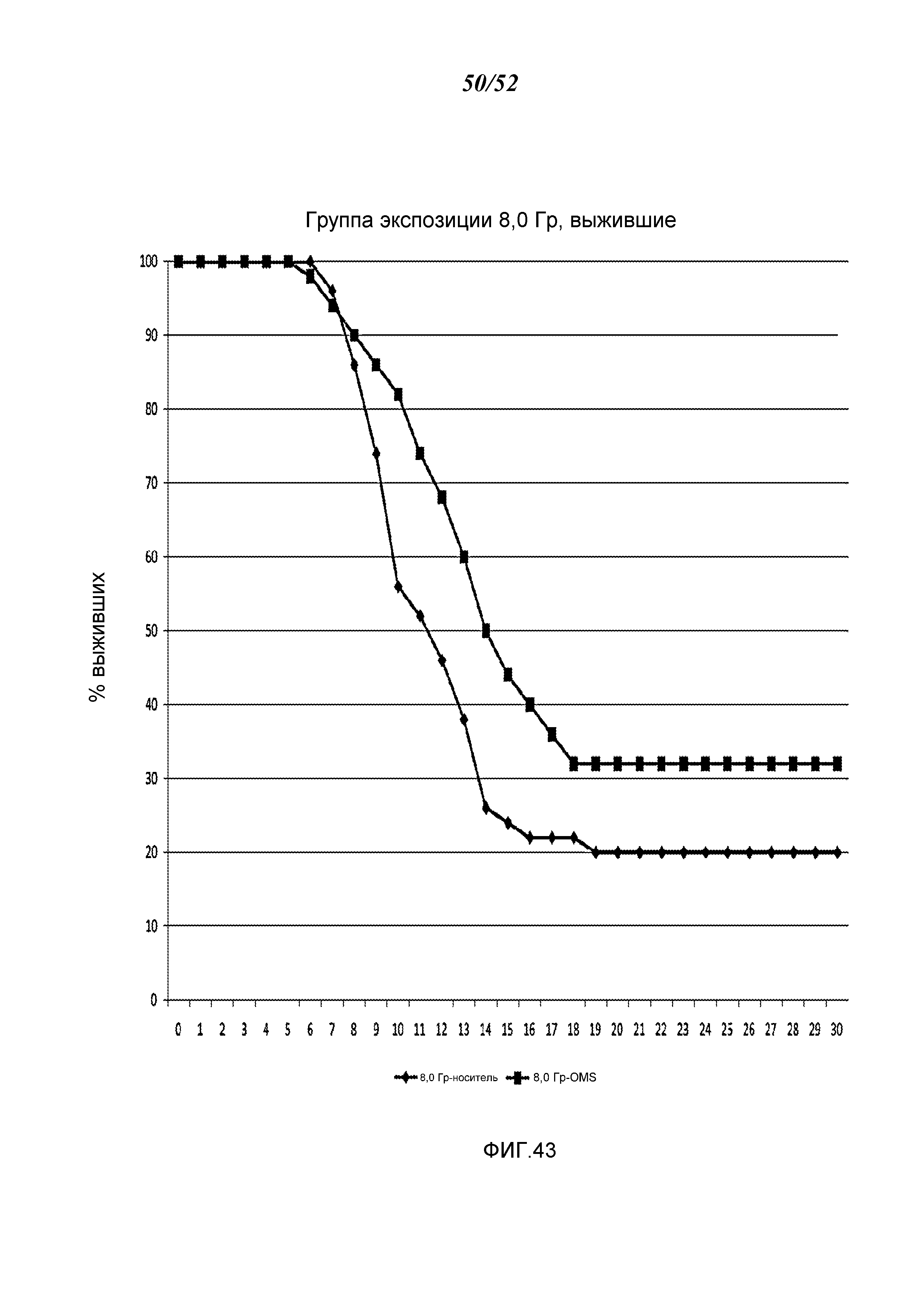
ФИГУРА 43 графически иллюстрирует процент выживания с течением времени (дни) после воздействия 8,0 Гр-облучения в контрольных мышах и мышах, получавших антитело против MASP-2 человека (mAbH6), как описано в Примере 34;
ФИГУРА 44 графически иллюстрирует время начала микрососудистой окклюзии после LPS инъекции мышам MASP-2-/- и WT, показывающей процент мышей с тромбообразованием, измеренным в течение 60 минут, демонстрируя, что тромбообразование детектируется через 15 минут у WT-мышей, при этом до 80% WT-мышей демонстрировали тромбообразование в течение 60 минут; в отличие от этого, ни одна из мышей MASP-2 -/- не показала какое-либо тромбообразование в течение 60-минутного периода (логарифмический ранговый критерий: p=0,0005), как описано в Примере 35; и
ФИГУРА 45 графически иллюстрирует процент выживания контрольных мышей, получавших физиологический раствор, (n=5) и мышей, получавших антитело анти-MASP-2, (n=5) в STX/LPS-индуцированной модели HUS с течением временем (в часах), демонстрируя, что все контрольные мыши погибли в течение 42 часов, тогда как, напротив, 100% мышей, получавших антитело анти-MASP-2, выживали на протяжении времени в ходе эксперимента, как это описано в Примере 36.
ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1, кДНК Map19 человека
SEQ ID NO:2 белок Map19 человека (с лидерной областью)
SEQ ID NO:3 белок Map19 человека (зрелый)
SEQ ID NO:4 кДНК MASP-2 человека
SEQ ID NO:5 белок MASP-2 человека (с лидерной областью)
SEQ ID NO:6 белок MASP-2 человека (зрелый)
SEQ ID NO:7 геномная ДНК MASP-2 человека (экзоны 1-6)
АНТИГЕНЫ (В ОТНОШЕНИИ ЗРЕЛОГО БЕЛКА MASP-2)
SEQ ID NO:8 последовательность CUBI (a.к. 1-121)
SEQ ID NO:9 последовательность CUBEGF (а.к. 1-166)
SEQ ID NO:10 CUBEGFCUBII (а.к. 1-293)
SEQ ID NO:11 EGF-область (а.к. 122-166)
SEQ ID NO:12 домен сериновой протеазы (а.к. 429-671)
SEQ ID NO:13 неактивный домен сериновой протеазы (а.к. 610-625 с мутацией Ser618 Ala)
SEQ ID NO:34 TPLGPKWPEРVFGRL (пептида CUBI)
SEQ ID NO:15
TAPPGYRLRLYFTHFDLELSHLCEYDFVKLSSGAKVLATLCGQ (пептид CUBI)
SEQ ID NO:16 TFRSDYSN (ядро МВL-области связывания)
SEQ ID NO:17 FYSLGSSLDITFRSDYSNEPFTGF (MBL-область связывания)
SEQ ID NO:18 IDECQVAPG (ПЕПТИД EGF)
SEQ ID NO:19 ANMLCAGLESGGDSCRGDSGGALV (ядро связывания сериновой протеазы) Подробное Описание
ПЕПТИДНЫЕ ИНГИБИТОРЫ:
SEQ ID NO:20 полноразмерная кДНК MBL
SEQ ID NO:21 полноразмерный белок MBL
SEQ ID NO:22 OGК-Х-GP (консенсус связывания)
SEQ ID NO:23 OGКLG
SEQ ID NO:24 GLR GLQ GPO GKL GPO G
SEQ ID NO:25 GPO GPO GLR GLQ GPO GKL GPO GPO GPO
SEQ ID NO:26 GKDGRDGTKGEKGEPGQGLRGLQGPOGKLGPOG
SEQ ID NO:27 GAOGSOGEKGAOGPQGPOGPOGKMGPKGEOGDO
(h-фиколин человека)
SEQ ID NO:28
GCOGLOGAOGDKGEAGTNGKRGERGPOGPOGKAGPOGPN
GAOGEO (фиколин p35 человека)
SEQ ID NO:29 LQRALEILPNRVTIKANRPFLVFI (участок C4-расщепления)
ЭКСПРЕССИОННЫЕ ИНГИБИТОРЫ:
SEQ ID NO:30 кДНК домена CUBI-EGF (нуклеотиды 22-680 SEQ ID NO:4)
SEQ ID NO:31
5' CGGGCACACCATGAGGCTGCTGACCCTCCTGGGC 3'
Нуклеотиды 12-45 SEQ ID NO:4, в том числе сайт начала трансляции MASP-2 (смысловые)
SEQ ID NO:32
5' GACATTACCTTCCGCTCCGACTCCAACGAGAAG 3'
Нуклеотиды 361-396 SEQ ID NO:4, кодирующие область, включающую сайт связывания MBL на MASP-2 (смысловые)
SEQ ID NO:33
5' AGCAGCCCTGAATACCCACGGCCGTATCCCAAA 3'
Нуклеотиды 610-642 SEQ ID NO:4, кодирующие область, включающую домена CUBII
ПРАЙМЕРЫ ДЛЯ КЛОНИРОВАНИЯ:
SEQ ID NO:34 CGGGATCCATGAGGCTGCTGACCCTC (5'-PCR для CUB)
SEQ ID NO:35 GGAATTCCTAGGCTGCATA (3'-PCR ДЛЯ CUB)
SEQ ID NO:36 GGAATTCCTACAGGGCGCT (3'-PCR ДЛЯ CUBIEGF)
SEQ ID NO:37 GGAATTCCTAGTAGTGGAT (3'-PCR ДЛЯ CUBIEGFCUBII)
SEQ ID NO:38-47 представляют собой праймеры для клонирования для гуманизированного антитела
SEQ ID NO:48 представляет собой 9 a.к.-пептидную связь
ВЕКТОР ЭКСПРЕССИИ:
SEQ ID NO:49 представляет собой вставку минигена MASP-2
SEQ ID NO:50 представляет собой кДНК MASP-2 мыши
SEQ ID NO:51 представляет собой белок MASP-2 мыши (с лидером)
SEQ ID NO:52 представляет собой зрелый белок MASP-2 мыши
SEQ ID NO:53 представляет собой кДНК MASP-2 крысы
SEQ ID NO:54 представляет собой белок MASP-2 крысы (с лидером)
SEQ ID NO:55 представляет собой зрелый белок MASP-2 крысы
SEQ ID NO:56-59 представляют собой олигонуклеотиды для сайт-направленного мутагенеза MASP-2 человека, используемые для создания MASP-2А человека
SEQ ID NO:60-63 представляют собой олигонуклеотиды для сайт-направленного мутагенеза MASP-2 мыши, используемые для создания MASP-2А мыши
SEQ ID NO:64-65 представляют собой олигонуклеотиды для сайт-направленного мутагенеза MASP-2 крысы, используемые для создания MASP-2А крысы
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение основывается на удивительном открытии авторов настоящего изобретения, что ингибирование лектинового пути, опосредованного MASP-2, возможно при сохранени классического пути интактным. Настоящее изобретение также описывает использование MASP-2 в качестве терапевтической мишени для ингибирования клеточного повреждения, связанного с лектин-опосредованной активацией комплемента, при сохранении компоненты классического (C1q-зависимого) пути иммунной системы интактной.
I. ОПРЕДЕЛЕНИЯ
Если специально не определено в настоящем документе, все термины, используемые в настоящем документе, имеют тот же смысл, чтобы быть понятыми специалистами в области настоящего изобретения. Следующие определения приводятся для того, чтобы обеспечить ясность в отношении терминов, как они используются в спецификации и пунктах формулы изобретения для описания настоящего изобретения.
В настоящем документе термин «MASP-2-зависимая активация комплемента» включает в себя MASP-2-зависимую активацию лектинового пути, которая возникает при физиологических состояниях (т.е., в присутствии Ca++), приводя к формированию C3-конвертазы C4b2a лектинового пути, и после накопления продукта С3-расщепления C3b, затем к C5-конвертазе C4b2a(C3b)n, которая, как было определено, первоначально вызывает опсонизацию.
В настоящем документе термин «альтернативный путь» относится к активации комплемента, которая инициируется, например, при помощи зимозана из клеточных стенок грибков и дрожжей, липополисахарида (LPS) из наружной оболочки грамотрицательных микроорганизмов и эритроцитов кролика, а также из многих очищенных полисахаридов, эритроцитов кролика, вирусов, бактерий, опухолевых клеток животных, паразитов и поврежденных клеток, и которая, как традиционно считалось, возникает от спонтанного протеолитического генерирования C3b из фактора комплемента С3.
В настоящем документе термин «лектиновый путь» относится к активации комплемента, которая происходит вследствие специфического связывания сывороточных и несывороточных углевод-связывающих белков, в том числе маннан-связывающий лектин (MBL), CL-11 и фиколины (H-фиколин, М-фиколин или L-фиколин).
В настоящем документе термин «классический путь» относится к активации комплемента, которая инициируется антителом, связанным с инородной частицей и требует связывания узнающей молекулы C1q.
В настоящем документе термин «MASP-2-ингибирующий агент» относится к любому агенту, который связывается с или непосредственно взаимодействует с MASP-2 и эффективно ингибирует MASP-2-зависимую активацию комплемента, в том числе антитела анти-MASP-2 и их MASP-2-связывающие фрагменты, природные и синтетические пептиды, малые молекулы, растворимые MASP-2-рецепторы, ингибиторы экспрессиии и изолированные природные ингибиторы, и также включает в себя пептиды, которые конкурируют с MASP-2 за связывание с другими узнающими молекулами (например, MBL, H-фиколин, М-фиколин или L-фиколин) в лектиновом пути, но не охватывает антитела, которые связываются с другими распознающими молекулами. MASP-2-ингибирующие агенты, пригодные в способе по изобретению, могут снижать MASP-2-зависимую активацию комплемента более чем на 20%, как например, более чем на 50%, как например, более чем на 90%. В одном варианте осуществления, MASP-2-ингибирующий агент снижает MASP-2-зависимую активацию комплемента более чем на 90% (т.е., приводит в результате только к 10%-ой или менее MASP-2-активации комплемента).
В настоящем документе термин «антитело» охватывает антитела и их фрагменты антител, полученные от любого антитело-продуцирующего млекопитающего (например, мыши, крысы, кролика и примата, включая человека), или из гибридомы, фаговой селекции, рекомбинантной экспрессии или трансгенных животных (или других способов получения антител или фрагментов антител), которые специфически связываются с полипептидом-мишенью, таким как, например, MASP-2, полипептидами или их частями. Не предполагается, что термин «антитело» ограничен в отношении источника антитела или способа, с помощью которого оно изготовлено (например, при помощи гибридомы, фаговой селекции, рекомбинантной экспрессии, трансгенного животного, пептидного синтеза и т.д.). Типичные антитела включают поликлональные, моноклональные и рекомбинантные антитела; панспецифические, мультиспецифические антитела (например, биспецифические антитела, триспецифические антитела); гуманизированные антитела; мышиные антитела; химерные антитела, моноклональные антитела мышь-человек, мышь-примат, примат-человек; и антиидиотипические антитела, и, может быть, любое интактное антитело или его фрагмент. Как используется в настоящем документе, термин «антитело» включает в себя не только интактные поликлональные и моноклональные антитела, но также и фрагменты этого (например, dAb, Fab, Fab', F(ab')2, Fv), одноцепочечные (ScFv), их синтетические варианты, варианты, встречающиеся в природе, слитые белки, содержащие часть антитела с антиген-связывающим фрагментом требуемой специфичности, гуманизированные антитела, химерные антитела, и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит антиген-связывающий участок или фрагмент (эпитоп-узнающий участок) требуемой специфичности.
«Моноклональное антитело» относится к популяции однородных антител, где моноклональное антитело содержит аминокислоты (встречающиеся в природе и не встречающиеся в природе), которые участвуют в избирательном связывании эпитопа. Моноклональные антитела являются весьма специфическими для антигена-мишени. Термин «моноклональное антитело» включает не только интактные моноклональные антитела и полноразмерные моноклональные антитела, но и их фрагменты (например, Fab, Fab', F(ab')2, Fv), одноцепочечные (ScFv), их варианты, слитые белки, содержащие антиген-связывающую часть, гуманизированные моноклональные антитела, химерные моноклональные антитела и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит антиген-связывающий фрагмент (эпитоп-узнающий участок) требуемой специфичности и с возможностью связывания с эпитопом. Не подразумевается ограничение в отношении источника антитела или способ, с помощью которого оно изготовлено (например, при помощи гибридомы, фаговой селекции, рекомбинантной экспрессии, трансгенного животного и др.). Этот термин включает в себя все иммуноглобулины, а также фрагменты и др., описанные выше под определением «антитело».
В настоящем документе термин «фрагмент антитела» относится к части, полученной из или относящейся к полноразмерному антителу, такому как, например, антитело анти-MASP-2, как правило, включающей антиген-связывающую или вариабельную область этого. Иллюстративные примеры фрагментов антител включают фрагменты Fab, Fab', F(ab)2, F(ab')2 и Fv, фрагменты scFv, диатела, линейные антитела, молекулы одноцепочечных антител и мультиспецифические антитела, образованные из фрагментов антител.
Как используется в настоящем документе, фрагмент «одноцепочечного Fv» или «scFv» антитела включает в себя VН и VL домены антитела, где эти домены присутствуют в единой полипептидной цепи. Как правило, полипептид Fv дополнительно содержит полипептидный линкер между доменами VН и VL, который позволяет scFv формировать нужную структуру для связывания антигена.
Как используется в настоящем документе, «химерное антитело» представляет собой рекомбинантный белок, который содержит вариабельные домены и гипервариабельные участки, полученные из антитела биологических видов, отличных от человека (например, грызун), тогда как остаток молекулы антитела является производным от антитела человека.
Как используется в настоящем документе, «гуманизированное антитело» представляет собой химерное антитело, которое включает в себя минимальную последовательность, соответствующую определенным гипервариабельным участкам, полученным из иммуноглобулина, отличного от иммуноглобулина человека, которую трансплантируют в рамке антитела человека. Гуманизированные антитела обычно представляют собой рекомбинантные белки, в которых только гипервариабельные участки антитела не имеют происхождения от человека.
Как используется в настоящем документе, термин «маннан-связывающий лектин» («MBL») эквивалентен маннан-связывающему белку («MBP»).
Как используется в настоящем документе, «мембраноатакующий комплекс» («MAC») относится к комплексу терминальных пяти компонентов комплемента (C5b в сочетании с С6, С7, С8 и C-9), который встраивается в мембраны и нарушает их (также называется C5b-9).
Как используется в настоящем документе, «субъект» включает в себя всех млекопитающих, включая, в качестве неограничивающих примеров, людей, отличных от человека приматов, собак, кошек, лошадей, овец, коз, коров, кроликов, свиней и грызунов.
Как используется в настоящем документе, аминокислотные остатки сокращены следующим образом: аланин (Ala;А), аспарагин (Asn;N), аспарагиноваякислота (Asр;D), аргинин (Arg;R), цистеин (Cys;C), глутаминовая кислота (Glu;E), глутамин (Gln;Q), глицин (Gly;G), гистидин (His;H), изолейцин (Ile;I), лейцин (Leu;L), лизин (Lys;K), метионин (Мет;M), фенилаланин (Phe;E), пролин (Pro;P), Серин (Ser;S), треонин (Thr;T), триптофан (Trp;W), тирозин (Tyr;Y) и валин (Val;V).
В широком смысле, встречающиеся в природе аминокислоты могут быть разделены на группы в зависимости от химической характеристики боковой цепи соответствующих аминокислот. Под «гидрофобной» аминокислотой подразумевается Ile, Leu, Мет, Phe, Trp, Tyr, Val, Ala, Cys или Pro. Под «гидрофильной» аминокислотой подразумевается Gly, Asn, Gln, Ser, Thr, Asp, Glu, Lys, Arg или His. Это группирование аминокислот может быть далее разделено на подклассы следующим образом. Под «незаряженной гидрофильной» аминокислотой подразумевается Ser, Thr, Asn или Gln. Под «кислой» аминокислотой подразумевается Glu или Asp. Под «основной» аминокислотой подразумевается Lys, Arg или His.
Как используется в настоящем документе, термин «консервативная аминокислотная замена» иллюстрируется замещением между аминокислотами в каждой из следующих групп: (1) глицин, аланин, валин, лейцин, изолейцин, (2) фенилаланин, тирозин и триптофан, (3) серин и треонин, (4) аспартат и глутамат, (5) глутамин и аспарагин, и (6) лизин, аргинин и гистидин.
Термин «олигонуклеотид», используемый в настоящем документе, относится к олигомеру или полимеру рибонуклеиновой кислоты (РНК) или дезоксирибонуклеиновой кислоты (ДНК), или их миметикам. Этот термин также охватывает те олигонуклеиновые основания, которые состоят из природных нуклеотидов, сахаров и ковалентных межнуклеозидных (главная цепь) связей, а также олигонуклеотидов с модификациями, отсутствующими в природе.
Как используется в настоящем документе, «эпитоп» относится к участку на белке (например, белок MASP-2 человека), который связывается с антителом. «Перекрывающиеся эпитопы» включают по крайней мере один (например, два, три, четыре, пять или шесть) общих аминокислотных остатков, в том числе неразветвленные и разветвленные эпитопы.
Как используется в настоящем документе, термин «полипептид», «пептид» и «белок» используются взаимозаменяемо и означают любые цепочки аминокислот с пептидными связями, независимо от их длины или посттрансляционной модификации. Белок MASP-2, описанный в настоящем документе, может содержать или представлять собой белки дикого типа или может представлять собой варианты, которые содержат не более чем 50 (например, не более чем один, два, три, четыре, пять, шесть, семь, восемь, девять, десять, 12, 15, 20, 25, 30, 35, 40 или 50) консервативных аминокислотных замен. Консервативные замены, как правило, включают замены в пределах следующих групп: глицин и аланин; валин, изолейцин и лейцин; аспарагиновая и глутаминовая кислота, аспарагин, глютамин, серин и треонин; лизин, гистидин и аргинин; и фенилаланин и тирозин.
В некоторых вариантах осуществления, белок MASP-2 человека может иметь последовательность аминокислот, которая на, или больше, чем на 70 (например, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100)% идентична белку MASP-2 человека, имеющего аминокислотную последовательность, изложенную в SEQ ID NO:5.
В некоторых вариантах осуществления, пептидные фрагменты могут составлять не менее 6 (например, по крайней мере 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 250, 300, 350, 400, 450, 500 или 600 или более) аминокислотных остатков в длину (например, по крайней мере 6 смежных аминокислотных остатков SEQ ID NO:5). В некоторых вариантах осуществления, антигенный пептидый фрагмент белка MASP-2 человека составляет менее 500 (например, меньше, чем 450, 400, 350, 325, 300, 275, 250, 225, 200, 190, 180, 170, 160, 150, 140, 130, 120, 110, 100, 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7 или 6) аминокислотных остатков в длину (например, меньше, чем 500 смежных аминокислотных остатков в любой из SEQ ID NO:5).
Процент (%) идентичности аминокислотной последовательности определяется как процентное соотношение аминокислот в кандидатной последовательности, которая является идентичной по аминокислотам референсной последовательности, после выравнивания последовательностей и внедрения пробелов, в случае необходимости, для достижения максимального процента идентичности последовательностей. Выравнивание для целей определения процента идентичности последовательностей может быть достигнуто различными способами, известными специалистам в рассматриваемой области, например, с помощью общедоступных компьютерных программ, таких как программное обеспечение BLAST, BLAST-2, ALIGN, ALIGN-2 или Megalign (DNASTAR). Соответствующие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей, могут быть определены по известным методикам.
II. Обзор изобретения
Лектины (MBL, M-фиколин, H-фиколин, L-фиколин и CL-11) представляют собой специфические распознающие молекулы, которые инициируют природную систему комплемента, и система включает в себя инициацию лектинового пути и связанного цикла усиления терминального пути, который усиливает лектин-инициированную активизацию эффекторных молекул терминального комплемента. C1q представляют собой специфическую узнающую молекулу, которая инициирует нужную систему комплемента, и система индуцирует классический путь инициации и связанный цикл усиления терминального пути, который усиливает C1q-инициированную активацию эффекторных молекул терминального комплемента. Мы называем эти две основных системы активации комплемента как лектин-зависимая система комплемента и C1q-зависимая система комплемента, соответственно.
В дополнение к ее важной роли в иммунной защите, система комплемента принимает участие в повреждении тканей при многих клинических состояниях. Таким образом, существует насущная необходимость разработки терапевтически эффективных ингибиторов комплемента для предотвращения этих неблагоприятных эффектов. С признанием того, что можно заблокировать лектин-опосредованный MASP-2 путь при сохранении классического пути интактным, приходит осознание того, что было бы весьма желательно специфически ингибировать только систему активации комплемента, вызывающую конкретную патологию, без полного выключения возможностей иммунной защиты комплемента. Например, при болезненных состояниях, при которых активация комплемента опосредуется преимущественно лектин-зависимой системой комплемента, было бы выгодно специфически ингибировать только эту систему. Это сохранило бы C1q-зависимую систему активации комплемента интактной для оперирования подготовкой иммунного комплекса и помощи в защите организма-хозяина от инфекции.
Предпочтительным белковым компонентом в качестве цели при разработке терапевтических агентов для специфического ингибирования лектин-зависимой системы комплемента является MASP-2. Из всех известных белковых компонентов лектин-зависимой системы комплемента (MBL, H-фиколин, М-фиколин, L-фиколин, MASP-2, C2-C9, Фактор B, Фактор D и пропердин), только MASP-2 является как уникальным для лектин-зависимой системы комплемента, так и необходимым для функционирования системы. Лектины (MBL, H-фиколин, М-фиколин, L-фиколин и CL-11) также представляют собой уникальные компоненты в лектин-зависимой системе комплемента. Тем не менее, потеря любого из лектиновых компонентов не обязательно должна ингибировать активацию системы из-за лектиновой избыточности. Было бы необходимо ингибировать все пять лектинов, чтобы гарантированно ингибировать лектин-зависимую систему активации комплемента. Кроме того, поскольку также известно, что MBL и фиколины обладают опсонической активностью, независимой oт комплемента, ингибирование лектиновой функции могло бы привести к потере этого благотворного механизм защиты организма-хозяина от инфекции. В отличие от этого, такая комплемент-независимая лектиновая опсоническая активность оставалась бы интактной, если бы MASP-2 представлял собой мишень для ингибирования. Дополнительным преимуществом MASP-2 в качестве терапевтической мишени для ингибирования лектин-зависимой системы активации комплемента является то, что концентрация MASP-2 в плазме крови является одной из самых низких из каких-либо белков комплемента (≈500 нг/мл), поэтому, соответственно, низкие концентрации высокоаффинных ингибиторов MASP-2 могут быть достаточны для получения полного ингибирования (Moller-Kristensen, M., et al., J. Immunol Methods 282: 159-167, 2003).
III. РОЛЬ MASP-2 В РАЗЛИЧНЫХ ЗАБОЛЕВАНИЯХ И СОСТОЯНИЯХ И ТЕРАПЕВТИЧЕСКИЕ СПОСОБЫ, ИСПОЛЬЗУЮЩИЕ MASP-2-ИНГИБИРУЮЩИЕ АГЕНТЫ
ПОЧЕЧНЫЕ СОСТОЯНИЯ
Активация системы комплемента вовлечена в патогенез различных заболеваний почек, включая мезангиопролиферативный гломерулонефрит (IgA-нефропатия, болезнь Берже) (Endo, M., et al., Clin. Nephrology 55: 185-191, 2001), мембранный гломерулонефрит (Kerjashki, D., Arch B Cell Pathol. 58:253-71, 1990; Brenchlcy, P.E., et al., Kidney Int., 41:933-7, 1992; Salant, D.J., et al., Kidney Int. 55:976-84, 1989), мембранозно-пролиферативный гломерулонефрит (мезангиокапиллярный гломерулонефрит) (Bartlow, B.G., et al., Kidney Int. 15:294-300, 1979; Meri, S., et al., J. Exp. Med. 175:939-50, 1992), острый послеинфекционный гломерулонефрит (постстрептококковый гломерулонефрит), криоглобулинемический гломерулонефрит (Ohsawa, I., et al., Clin Immunol, 101:59-66, 2001), волчаночный нефрит (Gatenby, P.A., Autoimmunity 11:61-6, 1991) и пурпурный нефрит Henoch-Schonlein (Endo, M., et al., Am. J. Kidney Dis. 35:401-407, 2000). Участие комплемента в болезни почек оценивали на протяжении нескольких десятилетий, но по-прежнему существует значительное обсуждение его точной роли в возникновении, развитии и стадии разрешения почечной болезни. При нормальных состояниях вклад комплемента выгоден организму-хозяину, но неадекватная активация и депозиция комплемента может способствовать повреждению тканей.
Существует значительное доказательство того, что гломерулонефрит, воспаление почечных клубочков, часто начинается с депозиции иммунных комплексов на гломерулярных или трубчатых структурах, что затем инициирует активацию комплемента, воспаление и повреждение тканей. Kahn и Sinniah продемонстрировали увеличение депозиции C5b-9 в тубулярных базальных мембранах в биопсиях, взятых у пациентов с различными формами гломерулонефрита (Kahn. T.N., et al., Histopath. 26:351-6, 1995). При исследовании пациентов с IgA нефрологии (Alexopouios, A., et al., Nephrol. Dial. Transplant 10: 1166-1172, 1995), депозиция C5b-9 в трубчатых эпителиальных/базальных мембранных структурах коррелировала с уровнями креатинина в плазме. Другое исследование мембранной нефропатии продемонстрировало наличие связи между клиническим результатом и уринарными уровнями C5b-9 (Кon, S.P., et al., Kidney Int. 48: 1953-58, 1995). Повышенные уровни C5b-9 положительно коррелировали с плохим прогнозом. Lehto et al, измеряли повышенные уровни CD59, комплемент-регулирующего фактора, который ингибирует мембраноатакующий комплекс в плазматических мембранах, а также C5b-9 в моче у пациентов с пленчатым гломерулонефритом (Lehto, T., et al., Kidney Int. 47; 1403-11, 1995). Патологогистологический анализ образцов биопсии, взятых у этих же пациентов, продемонстрировал депозицию белков C3 и С9 в почечных клубочках, в то время как экспрессия CD59 в этих тканях была снижена по сравнению с нормальной почечной тканью. Эти различные исследования показывают, что постоянный комплемент-опосредованный гломерулонефрит приводит к уринарной экскреции белков комплемента, что коррелирует со степенью повреждения тканей и прогнозом заболевания.
Ингибирование активации комплемента в различных животных моделях гломерулонефрита также продемонстрировало важность активации комплемента в этиологии заболевания. В модели мембранозно-пролиферативного гломерулонефрита (MPGN), инфузия антисыворотки анти-Thy1 в C6-дефектных крыс (которые не могут образовывать C5b-9), привела к 90%-ому уменьшению клубочковой клеточной пролиферации, 80%-ому снижению инфильтрации тромбоцитов и макрофагов, сниженному синтезу коллагена IV типа (маркер расширения мезангиального матрикса) и к 50%-ому уменьшению протеинурии, по сравнению с нормальными крысами C6+ (Brandt, J., et al, Kidney Int. 49:335-343, 1996). Эти результаты позволяют полагать C5b-9 в качестве основного медиатора повреждения тканей при помощи комплемента в этой анти-тимоцитарной сывороточной модели на крысах. В другой модели гломерулонефрита, инфузия градуированных доз кроличьего антитела против клубочковой базальной мембраны крысы продуцировала дозо-зависимый приток полиморфоядерных лейкоцитов (PMN), который ослаблялся предварительным лечением при помощи фактора яда кобры (чтобы израсходовать комплемент) (Scandrett, A.L., et al., Am. J. Physiol 268: F256-F265, 1995). Крысы, получавшие фактор яда кобры, также показали ослабление гистопаталогии, снижение долговременной протеинурии и более низкие уровни креатинина, чем контрольные крысы. Применяя три модели GN на крысах (анти-тимоцитная сыворотка, Con А анти-Con А и пассивный нефрит Хейманна), Couser et al. продемонстрировали потенциалую терапевтическую эффективность подходов по ингибированию комплемента с помощью рекомбинантного белка sCR1 (Couser, W.G., et al., J. Am. Soc. Nephwi. 5: 1888-94, 1995). Крысы, получавшие sCR1, показали значительное уменьшение притока полиморфоядерных нейтрофилов, тромбоцитов и макрофагов, снижение месангиолизиса и протеинурии по сравнению с контрольной группой животных. Дальнейшие доказательства необходимости активации комплемента при гломерулонефрите было предоставлено при использовании анти-C5 МоAb в модели NZB/W F1 на мышах. Анти-C5 МоAb ингибирует расщепление C5, блокируя таким образом образование C5a и C5b-9. Непрерывная терапия с анти-C5 МоAb в течение 6 месяцев привела к значительному улучшению ходагломерулонефрита. Гуманизированное моноклональное антитело анти-C5 МоAb (5G1.1), которое предотвращает расщепление компоненты C5 комплемента человека в его провоспалительные компоненты, находится в стадии разработки Alexion Pharmaceuticals, Inc., Нью-Хейвен, штат Коннектикут, в качестве потенциального лечения гломерулонефрита.
Прямое доказательство патологической роли комплемента в почечном повреждении предоставлено при исследованиях пациентов с генетическими дефектами в специфических компонентах комплемента. В ряде сообщений задокументирована связь почечной недостаточности с нехваткой регуляторного фактора H комплемента (Ault, B.H., Nephrol. 14: 1045-1053, 2000; Levy, M.L., et al., Kidney Int. 30:949-56, 1986; Pickering, M.C., el al., Nat. Genet, 31:424-8, 2002). Нехватка фактора H приводит к низким уровням фактора B и C3 в плазме и потреблению C5b-9. Как атипичный мембранозно-пролиферативный гломерулонефрит (MPGN), так и идиопатический гемолитический уремический синдром (HUS) связаны с нехваткой фактора H. Свиньи с нехваткой фактора H (Jansen, J.H., et al., Kidney Int. 55:331-49, 1998) и мыши с нокаутом фактора H (Pickering, М.С., 2002) демонстрировали MPGN-подобные симптомы, подтверждающие важность фактора H в регулировании комплемента. Нехватки других компонентов комплемента связаны с заболеванием почек на фоне развития системной красной волчанки (SLE) (Walport, M.J., Davies, et al., Ann. N. Y, Acad, Sci. 815:267-81, 1997). Нехватка C1q, C4 и C2 сильно предрасполагает к развитию SLE через механизмы, связанные с дефектным освобождением иммунных комплексов и апоптотического материала. У многих из этих больных SLE имеет место волчаночный нефрит, характеризующийся депозицией иммунных комплексов по всему клубочку.
Дополнительное доказательство, связывающее активацию комплемента с почечным заболеванием, было предоставлено при помощи идентификации у пациентов аутоантител, направленных против компонентов комплемента, некоторые из которых были непосредственно связаны с почечной недостаточностью (Trouw, L.A., et al., Mol. Immunol. 38: 199-206, 2001). Ряд этих аутоантител показывает такую высокую степень корреляции с заболеваниями почек, что для обозначения этой активности был введен термин почечной фактор (NeF). В клинических исследованиях у около 50% больных, положительных по почечному фактору, развивался MPGN (Spitzer, R.E. et al., Clin. Immunol. Immunopathol. 64: 177-83, 1992). C3NeF представляет собой аутоантитело, направленное против C3-конвертазы альтернативного пути (C3bBb), и оно стабилизирует эту конвертазу, способствуя, таким образом, альтернативному пути активации (Daha, M.R., et al., J. Immunol. 116: 1-7, 1976). Аналогичным образом, аутоантитело со специфичностью к C3-конвертазе (C4b2a) классического пути, называемое C4NeF, стабилизирует эту конвертазу и тем самым способствует активации классического пути (Daha М.Р. et al., J. Immunol. 725:2051-2054, 1980; Halhwachs, L., et al., J. Clin. Invest. 65: 1249-56, 1980). Было описано, что аутоантитела анти-C1q связаны с нефритом у пациентов с SLE (Hovath, L., et al., Clin. Exp. Rheumatol, 19:667-72, 2001; Siegert, C, et al., J. Rheumatol 75:230-34, 1993; Siegert, C., et al., Clin. Exp. Rheumatol. 70: 19-23, 1992), и повышение титра этих аутоантител анти-C1q, как сообщалось, прогнозировало вспышку нефрита (Coremans, I.E., et al, Am. J. Kidney Dis. 26:595-601, 1995). Иммунные депозиты, элюированные из посмертных почек SLE-пациентов, показали накопление этих аутоантител анти-C1q (Marmiek, M, et al., Arthritis Rheumatol. 40: 1504-11, 1997). Все эти факты подтверждают патологическую роль этих аутоантител. Однако, не у всех пациентов с аутоантителами анти-C1q развивалась почечная недостаточность, а также некоторые здоровые люди имеют низкий титр аутоантител анти-C1q (Siegert, C.E., et al., Clin. Immunol. Immunopathol. 67:204-9, 1993).
В дополнение к альтернативному и классическому пути активации комплемента, лектиновый путь может также играть важную патологическую роль в почечном заболевании. Повышенные уровни MBL, МBL-связанной сериновой протеазы и продуктов активации комплемента были обнаружены с помощью иммуногистохимических способов на материале биопсии почек, полученном от пациентов, диагностированных с различными заболеваниями почек, включая пурпурный нефрит Henoch-Schonlein (Endo, M., et al., Am. J. Kidney Dis. 35:401-407, 2000), криоглобулинемический гломерулонефрит (Ohsawa, I., et al, Clin. Immunol. 101:59-66, 2001) и IgA-нейропатию (Endo, M., et al., Clin. Nephrology 55: 185-191, 2001). Поэтому, несмотря на то, что связь между комплементом и болезнями почек известна на протяжении нескольких десятилетий, данные о том, как именно комплемент влияет на эти заболевания почек, являются далеко не полными.
Один аспект изобретения, таким образом, направлен на лечение почечного состояния, включая, в качестве неограничивающих примеров, мезангиопролиферативный гломерулонефрит, мембранный гломерулонефрит, мембранозно-пролиферативный гломерулонефрит (мезангиокапиллярный гломерулонефрит), острый постинфекционный гломерулонефрит (постстрептококковый гломерулонефрит), криоглобулинемийный гломерулонефрит, волчаночный нефрит, пурпурный нефрит Henoch-Schonlein или IgA-нефропатию, путем введения композиции, содержащей терапевтически эффективное количество MASP-2-ингибирующего агента в фармацевтическом носителе субъекту, страдающему от такого расстройства. MASP-2-ингибирующий агент может быть введен субъекту системно, как например, при помощи внутриартериального, внутривенного, внутримышечного, подкожного или другого парентерального введения или потенциально путем приема внутрь для непептидергических агентов. MASP-2-ингибирующий агент можно вводить периодически в течение длительного периода времени, для лечения или контроля хронического состояния, или может представлять собой одно- или многократное введение в период до, во время или после острого повреждения или увечья.
ЗАБОЛЕВАНИЯ КРОВИ
Сепсис вызывается подавляющей реакцией пациента на вторгшиеся микроорганизмы. Важнейшей функцией системы комплемента является организация воспалительной реакции на вторжение бактерий и других болезнетворных микроорганизмов. В соответствии с этой физиологической ролью, активация комплемента, как было показано в многочисленных исследованиях, играет важную роль в патогенезе сепсиса (Bone, R.C., Annals. Internal, Med. 175:457-469, 1991). Определение клинических проявлений сепсиса постоянно развивается. Сепсис обычно определяется как системный иммунный ответ на инфекцию. Однако, во многих случаях отсутствуют клинические данные для инфекции (например, положительные бактериальные культуры крови) у больных с септическими симптомами. Это противоречие было впервые рассмотрено на Консенсус-конференции в 1992 году, когда был создан термин «синдром системного воспалительного ответа» (SIRS), и для которого не требовалось наличие поддающейся определению бактериальной инфекции (Bone. R.C., et al., Crit. Care Med. 20:724-726, 1992). Теперь существует общее согласие, что сепсис и SIRS сопровождаются неспособностью регулировать воспалительную реакцию. Для целей данного краткого обзора авторы рассмотрят клиническое определение сепсиса, также включающего тяжелый сепсис, септический шок и SIRS.
Преобладающим источником инфекции у больных сепсисом до конца 1980-х годов были грамотрицательные бактерии. Липополисахарид (LPS), основной компонент клеточной стенки грамотрицательных бактерий, как было известно, стимулирует высвобождение медиаторов воспаления из различных типов клеток и вызывает острые инфекционные симптомы при попадании в животных (Haeney, M.R., et al., Antimicrobial Chemotherapy 41 (Suppl. A):41-6, 1998). Интересно, что спектр ответственных за это микроорганизмов, как оказалось, переместился из преимущественно грамотрицательных бактерий в конце 1970-х и в 1980-е годы в преимущественно грамположительные бактерии в настоящее время, по причинам, которые в настоящее время неясны (Martin, G.S., et al., N. Eng. J. Med, 348: 1546-54, 2003).
Многие исследования показали важность активации комплемента в опосредовании воспаления и содействии особенностей шока, особенно септического и геморрагического шока. Как грамположительные, так и грамотрицательные организмы обычно преципитируют септический шок. LPS представляет собой эффективный активатор комплемента, преимущественно через альтернативный путь, хотя классический путь активации, опосредуемый антителами, также имеет место (Fearon, D.T., et al., N. Engl. J. Med. 292:937-400, 1975). Основными компонентами клеточной стенки грамположительных бактерий являются пептидогликан и липотехоевая кислота, оба компонента являются мощными активаторами альтернативного пути комплемента, хотя при наличии специфических антител они также могут активировать классический путь комплемента (Joiner, К.A., et al, Ann. Rev. Immunol. 2:461-2, 1984).
Систему комплемента изначально считали вовлеченной в патогенез сепсиса, когда исследователями отмечалось, что анафилатоксины C3a и C5a опосредуют множество воспалительных реакций, которые могут возникнуть во время сепсиса. Эти анафилатоксины вызывают расширение сосудов и повышение проницаемости микрососудов, события, которые играют центральную роль в септическом шоке (Schumacher, W.A., et al., Agents Actions 34:345-349, 1991). Кроме того, анафилатоксины вызывают бронхоспазм, выделение гистамина из тучных клеток и агрегацию тромбоцитов. Более того, они оказывают многочисленные эффекты на гранулоциты, такие как хемотаксис, агрегация, адгезия, высвобождение лизосомальных ферментов, образование токсичного супероксиданиона и формирование лейкотриенов (Shin, H.S., et al., Science 162:361-363, 1968; Vogt, W., Complement 3: 177-86, 1986). Эти биологические эффекты, как полагают, играют определенную роль в развитии осложнений, таких как септический шок или синдром острой дыхательной недостаточности (ARDS) (Hammerschmidt, D.E., et al, Lancet 1:947-949, 1980; Slotman, G.T., et al, Surgery 99:744-50, 1986). Кроме того, повышенные уровни анафилатоксина C3a связаны со смертельным исходом при сепсисе (Hack, C.E., et al, Am. J. Med. 86:20-26, 1989). В некоторых животных моделях шока, определенные комплемент-дефектные штаммы (например, C5-дефектные) являются более устойчивыми к воздействию LPS-инфузий (Hseuh, W, et al., Immunol. 70:309-14, 1990).
Блокада образования C5a антителами во время начала сепсиса у грызунов, как было показано, значительно улучшала выживаемость (Czermak, B.J., et al., Nat. Med. 5:788-792, 1999). Аналогичные выводы были сделаны, когда C5a-рецептор (C5aR) был блокирован либо антителами, либо ингибитором-малой молекулой (Huber-Lang, M.S., et al., FASEB J, 16: 1567-74, 2002; Riedemann, N.C., et al, J. Clin. Invest. 110: 101-8, 2002). Ранее экспериментальные исследования на обезьянах показали, что блокада антителами C5a ослабляет септический шок, индуцированный E. coli, и респираторный дистресс-синдром у взрослых (Hangen, DTI, et al., J. Surg. Res. 46: 195-9, 1989; Stevens, J.H., et al., J. Clin. Invest. 77: 1812-16, 1986). У людей с сепсисом, C5a был увеличен и связан с существенно сниженными показателями выживаемости вместе с полиорганной недостаточностью, при сравнении с таковыми у септических больных с меньшей степенью тяжести и выживших (Nakae, H., et al., Res. Commun. Chem. Pathol. Pharmacol. 54: 189-95, 1994; Nakae, et al., Surg. Today 26:225-29, 1996; Bengtson, A., et al., Arch. Surg. 123:645-649, 1988). Механизмы, с помощью которых C5a оказывает вредные воздействия во время сепсиса, еще предстоит изучить более подробно, но недавние данные, свидетельствующие об образовании C5a во время сепсиса, значительно компрометируют врожденную иммунную функцию нейтрофилов крови (Huber-Lang, М.С., et al., J. Immunol. 169: 3223-31, 2002), их способность экспрессировать дыхательный всплеск и их способность генерировать цитокины (Riedernann, N.C., et al., Immunity 19: 193-202, 2003). Кроме того, образование С5а во время сепсиса, как оказалось, оказывает прокоагулянтое действие (Laudes, I.J., et al., Am. J. Pathol. 160: 1867-75, 2002). Комплемент-модулирующий белок CI INH также показал эффективность в животных моделях сепсиса и ARDS (Dickneite, G., Behring Ins. Mitt. 93:299-305, 1993).
Лектиновый путь также может играть определенную роль в патогенезе сепсиса. Было показано, что MBL связывается с рядом клинически значимых микроорганизмов, в том числе как грамотрицательных, так и грамположительных бактерий, и активирует лектиновый путь (Neth, О., et al., Infect. Immun, 68:688, 2000). Липотехоевая кислота (LTA) все чаще рассматривается в качестве грамположительного партнера LPS. Она является мощным иммуностимулятором, который вызывает высвобождение цитокинов из мононуклеарных фагоцитов и цельной крови (Morath, S., et al., J. Exp. Med. 195: 1635, 2002: Morath, S., et al., Infect. Immun, 70:938, 2002). Недавно было показано, что L-фиколин специфически связывается с LTA, выделенной из многочисленных грамположительных бактерий, в том числе Staphylococcus aureus, и активизирует лектиновый путь (Lynch, N.J., et al, J. Immunol. 172: 1198-02, 2004). Также было показано, что MBL связывается с LTA из Enterococcus spp, в котором полиглицерофосфатная цепь замещается гликозильными группами), но не с LTA из девяти других видов, в том числе S. Aureus (Polotsky, V.Y., et al., Infect. Immun. 64:380, 1996).
Аспект изобретения, таким образом, предоставляет способ лечения сепсиса или состояния, возникающего в результате сепсиса, путем введения композиции, содержащей терапевтически эффективное количество MASP-2-ингибирующего агента в фармацевтическом носителе субъекту, страдающему от сепсиса или состояния, возникающего в результате сепсиса, включая, в качестве неограничивающих примеров, тяжелый сепсис, септический шок, синдром острой дыхательной недостаточности, возникающий в результате сепсиса, и синдром системного воспалительного ответа. Связанные способы предоставлены для лечения других заболеваний крови, включая геморрагический шок, гемолитическую анемию, аутоиммунную тромботическую тромбоцитопеническую пурпуру (ТТР), гемолитический уремический синдром (HUS), атипичный гемолитический уремический синдром (aHUS) или другие состояния, разрушительные для костного мозга/крови, путем введения композиции, содержащей терапевтически эффективное количество MASP-2-ингибирующего агента в фармацевтическом носителе субъекту, страдающему от такого состояния. MASP-2-ингибирующий агент вводят субъекту системно, как например, внутриартериально, внутривенно, внутримышечно, ингаляционно (особенно в случае с ARDS), подкожно или другим парентеральным введением, или потенциально путем перорального введения для непептидергических агентов. Композиция с MASP-2-ингибирующим агентом может быть в сочетании с одним или несколькими дополнительными терапевтическими агентами для борьбы с последствиями сепсиса и/или шока. Для развитого сепсиса или шока или вытекающего из этого мучительного состояния, композицию с MASP-2-ингибитором можно соответствующим образом вводить в быстродействующей лекарственной форме, такой, как путем внутривенной или внутриартериальной доставки болюса раствора, содержащего композицию с MASP-2-ингибирующим агентом. Повторное введение может осуществляться, как определено врачом, пока состояние не будет разрешено.
РОЛЬ MASP-2 В ПАРОКСИЗМАЛЬНОЙ НОЧНОЙ ГЕМОГЛОБУЛИНУРИИ И ТЕРАПЕВТИЧЕСКИЕ СПОСОБЫ, ИСПОЛЬЗУЮЩИЕ MASP-2-ИНГИБИРУЮЩИЕ АГЕНТЫ
Обзор PNH
Пароксизмальная ночная гемоглобинурия (PNH), которую иногда также называют болезнью Маркиафавы-Микели, представляет собой приобретенное, потенциально угрожающее жизни заболевание крови. PNH может развиваться самостоятельно, называемое «первичная PNH», или в контексте других расстройств костного мозга, таких как апластическая анемия, называемое «вторичная PNH». Большинство случаев представляют собой первичную PNH. PNH характеризуется комплемент-индуцированным разрушением эритроцитов (гемолиз), низким уровнем красных кровяных телец (анемия), тромбозом и поражением костного мозга. Результаты лабораторных исследований по PNH демонстрируют изменения в соответствии с внутрисосудистой гемолитической анемией: низкий гемоглобин, увеличенная лактатдегидрогеназа, увеличенное количество ретикулоцитов (незрелые красные клетки, высвобождаемые костным мозгом для замены разрушенных клеток), увеличенный билирубин (продукт распада гемоглобина), в отсутствие аутореактивных RBC-связывающих антител в качестве возможной причины.
Отличительной чертой PNH является хронический комплемент-опосредованный гемолиз, вызванный нерегулируемой активацией терминальных компонентов комплемента, в том числе мембранатакующего комплекса, на поверхности циркулирующих RBC (эритроцитов). RBC при PNH являются предметом неконтролируемой активации комплемента и гемолиза из-за отсутствия регуляторов комплемента CD55 и CD59 на их поверхности (Lindorfer, M.A., et al., Blood 115(11):2283-91 (2010), Risitano, et al., Mini-Reviews in Medicinal Chemistry, 11:528-535 (2011)). CD55 и CD59 обильно экспрессируются на нормальных RBC и контролируют активацию комплемента. CD55 действует как негативный регулятор альтернативного пути, ингибируя сборку комплекса C3-конвертазы (C3bBb) альтернативного пути и ускоряя распад преформированной конвертазы, блокируя, таким образом, образование мембраноатакующего комплекса (МАС). CD59 ингибирует мембраноатакующий комплекс комплемента, непосредственно путем связывания C5b678-комплекса и предохраняя C9 от связывания и полимеризации.
Несмотря на то, что гемолиз и анемия являются доминирующими клиническими особенностями PNH, болезнь представляет собой сложное гематологическое заболевание, которое также включает тромбоз и нарушение костного мозга, как часть клинических данных (Risitano et al, Mini Reviews in Med Chem 11:528-535 (2011)). На молекулярном уровне, PNH обусловлена аномальной клональной экспансией гемопоэтических стволовых клеток, утративших функциональный ген PIG A. PIG A представляет собой Х-связанный ген, кодирующий гликозилфосфатидилинозитол (GPI) трансферазу, необходимую для стабильной поверхностной экспрессии GPI-заякоренных гликопротеинов класса А, включая CD55 и CD59. По причинам, которые в настоящее время исследуются, кроветворные стволовые клетки с нефункциональным геном PIG A, который возникает как результат спонтанных соматических мутаций, могут подвергаться клональной экспансии в точке, где их потомки составляют значительную часть пула периферийных гемопоэтических клеток. Несмотря на то, что как эритроцитарное, так и лимфоцитарное потомство клона мутантной стволовой клетки не содержит CDS5 и CD59, только RBC подвергаются явному лизису после того, как они поступают в кровообращение.
В настоящее время лечение PNH включает переливания крови при анемии, антикоагулянтную терапию при тромбозах и использование моноклонального антитела экулизумаб (Soliris®), которое защищает клетки крови от разрушения иммунной системой путем ингибирования системы комплемента (Hillmen P. et al., N. Engl. J Med. 350(6):552-559 (2004)). Экулизумаб (Soliris®) представляет собой гуманизированное моноклональное антитело, которое направлено на компонент C5 системы комплемента, блокирующий его расщепление C5-конвертазами, предотвращая, тем самым, продуцирование C5a и сборку MAC. Лечение PNH-пациентов экулизумабом привело к снижению внутрисосудистого гемолиза, что определялось по лактатдегидрогеназе (ЛДГ), что приводило к стабилизации гемоглобина и независимости от переливания примерно у половины больных (Risitano et al, Mini-Reviews in Medicinal Chemistry, 11(6) (2011)). В то время как почти для всех пациентов, проходящих терапию экулизумабом, добивались нормального или почти нормального уровня LDH (из-за контроля внутрисосудистого гемолиза), лишь у около одной трети пациентов был достигнут уровень гемоглобина около 11 г/дл, а остальные пациенты с экулизумабом продолжают демонстрировать анемию от умеренной до тяжелой степени (то есть, зависимость от переливаний крови), примерно в равной пропорции (Risitano A.M. et al., Blood 113:4094-100 (2009)). Как описано в Risitano et al., Mini-Reviews in Medicinal Chemistry 11:528-335 (2011), было показано, что PNH-пациенты на экулизумабе содержали в больших количествах C3-фрагменты, связанные с их PNH эритроцитами (хотя не получавших лечение пациентов не было). Это открытие привело к признанию того, что у PNH-пациентов, получавших лечение экулизумабом, RBС при PNH, которые больше не гемолизируются из-за C5-блокады, теперь могут накапливать большое количество мембранных C3-фрагментов, которые действуют как опсонины, что в результате приводит к их попаданию в ретикулоэндотелиальные клетки через специфические C3-рецепторы и последующему экстравазальному гемолизу. Таким образом, несмотря на предотвращение внутрисосудистого гемолиза и вытекающие последствия, терапия экулизумабом просто отвлекает депозицию этих RBС от внутрисосудистого к экстравазального гемолиза, приводя в результате к значительной остаточной нелеченой анемии у многих пациентов (Risitano A.M. et al., Blood 113:4094-100 (2009)). Таким образом, терапевтические стратегии, в добавление к использованию экулизумаба, необходимы для тех больных, у которых развивается C3-фрагмент опосредованный экстравазальный гемолиз, поскольку им по-прежнему требуются переливания красных клеток. Такие подходы, связанные с направленностью на C3-фрагмент, продемонстрировали полезность экспериментальных систем (Lindorfer et al., Blood 115:2283-91, 2010).
Механизм инициации комплемента при PNH
Причинно-следственная связь между нарушенной экспрессией негативных регуляторов комплемента CD55 и CD59 в PNH, в сочетании с эффективностью экулизумаба в предотвращении внутрисосудистого гемолиза, четко определяет PNH как состояние, вызванное системой комплемента. Несмотря на то, что эта парадигма является общепринятой, природа события, инициирующего активацию комплемента, и вовлеченный путь(пути) активации комплемента остаются неразрешенными. Поскольку CD55 и CO59 негативно регулируют терминальные стадии амплификации в каскаде комплемента, общего для всех путей инициации комплемента, нехватка этих молекул приведет к увеличенной терминальной активации комплемента независимо от того, инициируется ли активация комплемента при помощи лектинового пути, классического пути или спонтанного оборота альтернативного пути. Таким образом, у PNH-пациентов, любые события активации комплемента, которые ведут к депозиции C3b на поверхности RBC, могут инициировать последующию амплификацию и патологический гемолиз (внутрисосудистый и/или экстравазальный) и ускорять гемолитический криз. Ясное механистическое понимание молекулярных событий, вызывающих гемолитический криз у PNH-пациентов, остается труднодостижимым. Из-за того, что у PNH-больных, перенесших гемолитический криз, явно не наблюдается комплемент-инициирующих событий, преобладает мнение, что активация комплемента при PNH может возникнуть спонтанно, благодаря остаточной активации альтернативного пути на низком уровне, которая впоследствии будет усилена в результате ненадлежащего контроля терминальной активации комплемента из-за отсутствия CD55 и CD59.
Однако важно отметить, что в своей естественной динамике PNH обычно развивается или усугубляется после определенных событий, таких как инфекции или травмы (Risitano, Biologies 2:205-222 (2008)), которые, как было показано, инициируют активацию комплемента. Этот ответ активации комплемента не зависит от предшествующего иммунитета хозяина по отношению к патогену-возбудителю, и, следовательно, классический путь, скорее всего, не вовлечен. Скорее, похоже на то, что этот ответ активации комплемента инициируется путем связывания лектинов с чужеродными углеводными структурами или углеводными структурами «измененное свое», экспрессированных на поверхности микробных агентов или поврежденных тканей организма-хозяина. Таким образом, события, ускоряющие гемолитический криз при PNH, тесно связаны с активацией комплемента, инициированной через лектины. Это делает очень вероятным, что лектиновые пути активации обеспечивают сигнал, инициирующий инициацию, что, в конечном счете, приводит к гемолизу у PNH-пациентов.
MASP-2-ингибиторы для блокирования опсонизации и экстравазального гемолиза PNH-эритроцитов через ретикулоэндотелиальную систему
В этом разделе описывается ингибирующее действие MASP-2-ингибирующих агентов на гемолиз в in vitro-модели PNH. Факты подтверждают полезность MASP-2-блокаторов (включая, в качестве неограничивающих примеров, антитела, которые связываются с и блокируют функцию MASP-2) для лечения субъектов, страдающих от аспектов PNH, а также использования ингибиторов MASP-2 для смягчения последствий C3-фрагмент-опосредованного экстравазального гемолиза у PNH-пациентов, проходящих курс терапии с C5-ингибитором, таким как экулизумаб.
Как подробно описано выше, PNH-пациенты становятся анемичными вследствие двух различных механизмов исключения RBC из циркуляции: внутрисосудистого гемолиза с помощью активации мембраноатакующего комплекса (МАС), и экстравазального гемолиза с последующей опсонизацией с C3b и последующим исключением после связывания с рецептором комплемента и поглощением ретикулоэндотелиальной системой. От внутрисосудистого гемолиза в значительной степени предохраняются, если пациент лечится экулизумабом. Из-за того, что экулизумаб блокирует терминальный литический эффекторный механизм, который имеет место вниз по течению как по отношению к событиям, инициирующим активацию комплемента, так и последующей опсонизации, экулизумаб не блокирует экстравазальный гемолиз (Risitano A.M. et. al., Blood 113:4094-100 (2009)). Вместо этого, RBC, которые подвергались бы гемолизу в не подвергавшихся лечению PNH-пациентах, теперь могут накапливать активированные белки C3b на своей поверхности, что увеличивает поглощение ретикулоэндотелиальной системой и усиливает их экстравазальный гемолиз. Таким образом, лечение экулизумабом эффективно отводит депозицию RBC от внутрисосудистого гемолиза к экстравазальному гемолизу. Как результат, некоторые PNH-пациенты, получавшие лечение экулизумабом, оставались с анемией. Отсюда следует, что агенты, которые блокируют активацию комплемента вверх по течению и предотвращают опсонизацию RBC при PNH, могут быть особенно подходящими для блокирования экстравазального гемолиза, не предотвращенного экулизумабом.
Данные, представленные здесь, показывают, что MASP-2 зависимая активация комплемента является доминирующим маршрутом для лектин-зависимой опсонизации. Поэтому MASP-2-ингибирующие агенты, как ожидается, будут эффективными при ограничении опсонизации и ингибировании экстравазального гемолиза при PNH.
С помощью in vitro-модели PNH, авторы продемонстрировали, что активация комплемента и полученный в результате гемолиз при PNH действительно инициируется по крайней мере частично путем MASP-2-зависимой активации комплемента, и что она не является самостоятельной функцией альтернативного пути. В этих исследованиях использовали маннан-сенсибилизированные RBC разных линий мышей, в том числе RBC от Crry-дефектных мышей (важный негативный регулятор терминального пути комплемента у мышей), а также RBC от CD55/CD59-дефектных мышей, у которых недостает таких же регуляторов комплемента, которые отсутствуют у PNH-пациентов). Когда маннан-сенсибилизированные Crry-дефектные RBC подвергали действию комплемент-достаточной сыворотки крови человека, RBC эффективно гемолизировали при концентрации сыворотки 3% (ФИГУРА 40), тогда как комплемент-дефектная сыворотка (HI: инактивированная теплом) не была гемолитической. Замечательно, что комплемент-достаточная сыворотка крови в присутствии антитела анти-MASP-2 обладала ослабленной гемолитической активностью, а 6%-я сыворотка была необходима для эффективного гемолиза (ФИГУРА 40). Аналогичные наблюдения были сделаны, когда были протестированы CD55/CD59-дефектные RBC (ФИГУРА 42). Комплемент-достаточная сыворотка крови человека с добавлением моноклонального антитела анти-MASP-2 была примерно в два раза менее эффективной, чем непроцессированная сыворотка при поддерживающем гемолизе. Кроме того, более высокие концентрации сыворотки, обработанной моноклональным антителом анти-MASP-2, были необходимы для вызывания эффективного гемолиза непроцессированных WT RBC по сравнению с непроцессированной сывороткой крови (ФИГУРА 40). В совокупности, эти данные указывают на то, что MASP-2-зависимая активация комплемента вносит значительный вклад в гемолизный ответ. Данные, представленные в настоящем документе, свидетельствуют о следующих патогенетических механизмах анемии при PNH: внутрисосудистый гемолиз из-за нерегулируемой активации терминальных компонентов комплемента и лизиса RBC путем формирования MAC, и экстравазальный гемолиз, вызванный опсонизацией RBC при помощи C3b, который инициируется преимущественно MASP-2-зависимой активацией комплемента. Таким образом, MASP-2-ингибирующие агенты, как ожидается, существенно снижают внутрисосудистый гемолиз у PNH-пациентов.
Экстравазальный гемолиз, менее драматичный, но не менее важный механизм разрушения RBC, который приводит к анемии при PNH, является, в первую очередь, следствием опсонизации при помощи C3b, что, главным образом, опосредуется MASP-2-зависимой активацией комплемента. Таким образом, MASP-2-ингибирующие агенты должны предпочтительно блокировать опсонизацию RBC и C3b и последующий экстравазальный гемолиз при PNH. Эта уникальная терапевтическая активность MASP-2-ингибирующих агентов, как ожидается, обеспечит значительную лечебную пользу для всех PNH-пациентов, поскольку в настоящее время не существует лечения этого патогенного процесса.
Ингибиторы MASP-2 в качестве вспомогательного лечения к блокирующим агентам терминального комплемента:
Данные, представленные в настоящем документе, подробно описывают два патогенных механизма исключения RBC и анемии при PNH: внутрисосудистый гемолиз, инициированный, по крайней мере частично, путем MASP-2-зависимой активации комплемента, и который поэтому, как ожидается, будет эффективно ингибироваться MASP-2-ингибирующим агентом, и экстравазальный гемолиз вследствие C3b-опсонизации, обусловленной MASP-2, и поэтому эффективно предупреждаемый при помощи MASP-2-ингибирующего агента.
Документально подтверждено, что как внутрисосудистый, так и экстравазальный механизмы гемолиза приводят к анемии у PNH-пациентов (Risitano et al., Blood 113:4094-4100 (2009)). Поэтому, в параметрах PNH, ингибирование MASP-2, как ожидается, будет направлено как на внутрисосудистый, так и экстравазальный гемолиз, что обеспечивает значительное преимущество по сравнению с C5-ингибитором экулизумабом. Соответственно, ожидается, что MASP-2-блокатор, который ингибирует внутрисосудистый гемолиз и предотвращает экстравазальный гемолиз, как ожидается, будет эффективным в предотвращении степени анемии, развивающейся у PNH-пациентов.
Известно также, что C5-блокаторы (такие как экулизумаб) эффективно блокируют внутрисосудистый гемолиз, но не препятствуют опсонизации. Это оставляет PNH-пациентов, подвергшихся лечению с анти-C5, со значительной остаточной анемией вследствие экстравазального гемолиза, обусловленного MASP-2-зависимой активацией комплемента, которая остается без терапии. Таким образом, ожидается, что C5-блокатор (например, экулизумаб), который предотвращает внутрисосудистый гемолиз, в сочетании с MASP-2-ингибирующим агентом, который предотвращает экстравазальный гемолиз, будет более эффективным, чем любой из агентов по-отдельности в предотвращении анемии, развивающейся у PNH-пациентов. В самом деле, комбинация анти-C5 и MASP-2-ингибирующего агента, как ожидается, будет предотвращать все соответствующие механизмы разрушения RBC при PNH и, таким образом, ослаблять или блокировать все симптомы анемии у PNH.
Другие агенты, которые блокируют терминальный амплификационный шунт системы комплемента, приводящие к C5-активации и MAC-депозиции (включая, в качестве неограничивающих примеров, агенты, которые блокируют пропердин, фактор B или фактор D или повышают ингибирующую активность фактора I, фактора H или других факторов, ингибирующих комплемент), также должны, как ожидается, ингибировать внутрисосудистый гемолиз. Однако, эти агенты, как ожидается, не должны препятствовать MASP-2-опосредованной опсонизации у PNH-пациентов. Это оставляет PNH-пациентов, получавших такие агенты, со значительной остаточной анемией вследствие экстравазального гемолиза, опосредованного MASP-2-зависимой активацией комплемента, которая остается без терапии. Таким образом, ожидается, что лечение такими препаратами, которые предотвращают внутрисосудистый гемолиз в сочетании с MASP-2-ингибирующим агентом, который предотвращает экстравазальный гемолиз, будет более эффективным, чем лечение любым из агентов по-отдельности в предотвращении анемии, которая развивается у PNH-пациентов. В самом деле, комбинация таких агентов и MASP-2-ингибирующего агента, как ожидается, будет предотвращать все или подавляющее большинство соответствующих механизмов разрушения RBC у PNH и, тем самым, блокировать все или подавляющее большинство симптомов анемии у PNH.
Ингибирование MASP-2 повышает выживаемость у субъектов, инфицированных Neisseria meningitidis
Как описано в Примерах 30-32 и показано на ФИГУРАХ 33-37, ингибирование MASP-2 не снижает выживаемость после инфицирования Neisseria meningitides. Наоборот, с удивлением было обнаружено, что MASP-2-ингибирование значительно улучшало выживание (ФИГУРА 33 и 34), а также балльную оценку заболевания (ФИГУРА 36) в этих исследованиях. Введение антитела анти-MASP2 приводило к тому же результату (ФИГУРА 37), устраняя вторичные или компенсационные эффекты у линий нокаутных мышей в качестве возможной причины. Эти благоприятные результаты на животных с удаленным MASP-2 были связаны с более быстрой ликвидацией Neisseria из крови (ФИГУРА 35). Также, как описано в настоящем документе, инкубация Neisseria с человеческой сывороткой убивала Neisseria (ФИГУРА 38). Кроме того, добавление функционального моноклонального антитела, специфичного для MASP-2 человека, которое блокирует MASP-2-зависимый лектиновый путь активации комплемента, а не введение изотипического контрольного моноклонального антитела, усиливало эту реакцию убийства. В контексте лектин-зависимой активации комплемента при помощи Neisseria, находится блокада MASP-2-усиленного литического разрушения организма in vitro (ФИГУРА 38). Поскольку лизис Neisseria является основным защитным механизмом у наивного хозяина, блокада MASP-2 in vivo увеличивает устранение Neisseria и приводит к усилению уничтожения. Эти результаты удивительны и обеспечивают значительное преимущество по сравнению с лечением экулизумабом, который, как было показано, увеличивает восприимчивость к опасным для жизни и плода менингококковым инфекциям (Dmytrijuk А., et al., The Оncologist 13:993-1000 (2008)).
В соответствии с вышесказанным, в одном аспекте, изобретение предоставляет способ лечения пароксизмальной ночной гемоглобинурии (PNH) путем введения композиции, содержащей терапевтически эффективное количество MASP-2-ингибирующего агента в фармацевтическом носителе субъекту, страдающему от PNH или состояния, возникающего в результате PNH (например, анемия, гемоглобин в моче и тромбоз). MASP-2-ингибирующий агент вводится системно субъекту, страдающему от PNH или состояния, возникающего в результате PNH, как например, путем внутриартериального, внутривенного, внутримышечного, ингаляционного, подкожного или другого парентерального введения, или потенциально путем перорального введения для непептидергических агентов.
РОЛЬ MASP-2 В ТРОМБОТИЧЕСКИХ МИКРОАНГИОПАТИЯХ, ВКЛЮЧАЯ ГЕМОЛИТИЧЕСКИЙ УРЕМИЧЕСКИЙ СИНДРОМ (HUS), АТИПИЧНЫЙ ГЕМОЛИТИЧЕСКИЙ УРЕМИЧЕСКИЙ СИНДРОМ (AHUS) И ТРОМБОТИЧЕСКУЮ ТРОМБОЦИТОПЕНИЧЕСКУЮ ПУРПУРУ (ТТР), И ТЕРАПЕВТИЧЕСКИЕ СПОСОБЫ, ИСПОЛЬЗУЮЩИЕ MASP-2-ИНГИБИРУЮЩИЕ АГЕНТЫ
Обзор
Тромботическая микроангиопатия (ТМА) представляет собой патологию, характеризующуюся сгустками крови в мелких кровеносных сосудах (Benz, К.; et al, Curr Opin Nephrol Hyperiens 19(3):242-7 (2010)). Стресс или повреждение эндотелия сосудистой стенки, лежащие в основе, по-видимому, является основным фактором. Клинические и лабораторные обнаружения ТМА включают тромбоцитопению, анемию, пурпуру и почечную недостаточность. Классическими ТМА являются гемолитический уремический синдром (HUS) и тромботическая тромбоцитопеническая пурпура (TТP). Характеристики, лежащие в основе патологических особенностей ТМА, представляют собой активацию тромбоцитов и образование микротромбов в мелких артериолах и венулах.
Прямое доказательство патологической роли комплемента в нефритах организма-хозяина предоставлено в исследованиях пациентов с генетическими дефектами в специфических компонентах комплемента. Ряд сообщений документировали связь почечного повреждения с недостатком регуляторного фактора H комплемента (Ault, B.H., Nephrol. 74: 1045-1053, 2000; Levy, M., et al., Kidney Int. 30:949-56, 1986; Pickering, M.C., et al., Nat. Genet, 31:424-8, 2002). Нехватка фактора H приводит к низким уровням фактора B и C3 в плазме крови из-за связанного с активацией потребления этих компонентов. Уровни циркулирующего C5b-9 также повышены в сыворотке крови этих пациентов, что подразумевает активацию комплемента. Мембранозно-пролиферативный гломерулонефрит (MPGN) и идиопатический гемолитический уремический синдром (HUS) связаны с нехваткой фактора H или мутациями фактора Н. Свиньи с нехваткой фактора H (Jansen, J.H., et al., Kidney Int. 53:331-49, 1998) и мыши с нокаутом фактора H (Pickering, М.C., 2002) демонстрировали симптомы наподобие MPGN, подтверждающие важность фактора H в регулировании комплемента. Недостаточность других компонентов комплемента связаны с заболеваниями почек на фоне развития системной красной волчанки (SLE) (Walport, M.J., Davies, et al., Am. N. Y. Acad Sci. 815:267-81, 1997). Недостаток C1q, C4 и C2 сильно предрасполагает к развитию SLE через механизмы, относящиеся к дефектному исключению иммунных комплексов и апоптотического материала. У многих из этих SLE-пациентов имеет место волчаночный нефрит, характеризующийся депозицией иммунных комплексов по всему клубочку.
aHUS
Атипичный гемолитический уремический синдром (aHUS) является частью группы состояний, называемых «Тромботические микроангиопатии». В атипичной форме HUS (aHUS) болезнь связана с дефектной регуляцией комплемента и может быть либо спорадической, или семейной. Семейные случаи aHUS связаны с мутациями в генах, кодирующих белки активации комплемента или регуляции комплемента, в том числе фактор комплемента H, фактор I, фактор B, мембранный кофактор CD46, а также фактор комплемента H-родственный белок 1 (CFHR1) и фактор комплемента H-родственный белок 3 (CFHR3). (Zipfel, P.F., et al., PloS Genetics 3(3):e41 (2007)). Объединяющей особенностью этого многообразия генетических мутаций, связанных с aHUS, является предрасположенность к усиленной активации комплемента на поверхностях клеток или тканей. Поэтому один аспект данного изобретения включает лечение пациента, страдающего от aHUS, связанного с нехваткой фактора H, с помощью введения эффективного количества MASP-2-ингибирующего агента. Другой аспект изобретения включает в себя лечение пациента, страдающего от HUS, связанного с нехваткой фактора I, фактора B, мембранного кофактора CD46, CFHR1 или CFHR3, с помощью введения эффективного количества MASP-2-ингибирующего агента.
В последнее время был достигнут значительный прогресс в отношении понимания молекулярной патофизиологии, лежащей в основе повышенной активации комплемента при aHUS, вызванной разнообразием мутантных факторов комплемента. Этот механизм лучше всего осознан для мутаций фактора H. Фактор H представляет собой имеющийся в изобилии сывороточный белок, состоящий из 20 коротких консенсусных повторяющихся (SCR) доменов, который действует в качестве негативного регулятора активации комплемента, как в растворе, так и на клеточных поверхностях хозяина. Он нацелен на активную форму C3 и, вместе с фактором I и другими кофакторами, вызывает его инактивацию, предотвращая дальнейшую активацию комплемента. Для эффективного контроля активации комплемента на поверхности клетки-хозяина, требуется взаимодействие фактора H с клетками организма-хозяина, которое опосредуется SCR-доменами 16-20. Все мутации фактора H, связанные с aHUS, описанные на сегодняшний день, сгруппированы в C-концевой области, включающей (SCR) домены 16-20. Эти белки мутантного фактора H являются полностью функциональными при контролировании C3-активации в растворе, но не в состоянии взаимодействовать с клеточными поверхностями организма-хозяина и, следовательно, не могут контролировать C3-активацию на клеточной поверхности (Exp Med 204(6): 1249-56 (2007)). Таким образом, определенные мутации фактора H связаны с aHUS, потому что белок мутантного фактора H не взаимодействует с клеточными поверхностями организма-хозяина и, таким образом, не может эффективно подавлять активацию комплемента на клеточных поверхностях организма-хозяина, в том числе эндотелия микрососудов. В результате, как только произошла начальная активация C3, последующая активация комплемента на эндотелиальных поверхностях микрососудов продолжается без ослабления у пациентов с мутациями фактора H. Эта контролируемая активация комплемента, в конечном счете, ведет к прогрессирующему повреждению эндотелия сосудов, последующей агрегации тромбоцитов и микрососудистой коагуляции, и гемолизу, вызванному легким стрессом прохождения RBC через частично закупоренные микрососуды. Таким образом, проявления болезни aHUS и клинические и лабораторные показатели напрямую связаны с дефектом в негативном регулировании комплемента на поверхности эндотелия микрососудов.
Аналогично мутации фактора Н, мутации потери функции в негативных модуляторах комплемента - факторе I и мембранном кофакторном белке (CD46) - также связаны с aHUS. Обратное наблюдали для фактора B и белка C3 в том, что aHUS, как было обнаружено, связан с мутациями усиления функции в этих белках (Pediatr Nephrol 25(12):2431-42 (2010)). Таким образом, множество сходящихся данных подразумевает активацию комплемента в патогенезе HUS. Это представление наиболее убедительно поддерживается терапевтической эффективностью офекулизумаба, моноклонального антитела, которое блокирует терминальный белок C5 комплемента при лечении aHUS.
В то время как центральная роль комплемента в качестве эффекторного механизма при aHUS широко распространена, пусковые сигналы, инициирующие активацию комплемента, и вовлеченные молекулярные пути являются невыясненными. Не у всех индивидуумов, несущих вышеописанные мутации, развивается aHUS. В самом деле, семейные исследования показали, что пенетрантность aHUS составляет только ~50% (Ann Hum Genet 74(1): 17-26 (2010)). Естественное развитие болезни предполагает, что aHUS наиболее часто развивается после инициирующего события, такого как инфекционный эпизод или травма. Инфекционные агенты, как известно, активируют систему комплемента. В отсутствие предсуществующего адаптивного иммунитета, активация комплемента инфекционными агентами может первоначально инициироваться через лектиновый путь. Таким образом, лектиновый путь активации, вызванной инфекцией, может представлять инициирующий пусковой сигнал для последующей патологической амплификации активации комплемента у индивидуумов, предрасположенных к aHUS, которая может, в конечном итоге, привести к прогрессированию заболевания. Соответственно, еще один аспект изобретения включает в себя лечение пациента, страдающего от aHUS, на фоне инфекции, с помощью введения эффективного количества MASP-2-ингибирующего агента.
Другие формы повреждения ткани организма-хозяина активируют комплемент через лектиновый путь, в частности, повреждение эндотелия сосудов. Клетки сосудистого эндотелия человека, подвергнутые, например, окислительному стрессу, реагируют путем экспрессирования молекул на поверхности, которые связывают лектины и активируют лектиновый путь комплемента (Am J. Pathol 156(6): 1549-56 (2000)). Повреждение сосудов после ишемии/реперфузии также активирует комплемент через лектиновый путь in vivo (Scand J Immunol 61(5):426-34 (2005)). Лектиновый путь активации этого параметра имеет патологические последствия для организма-хозяина, и ингибирование лектинового пути путем блокирования MASP-2 предотвращает дальнейшее повреждение тканей организма-хозяина и неблагоприятные исходы (Sehwaebie PNAS 2011).
Таким образом, другие процессы, которые преципитируют aHUS, как известно, также активируют лектиновый путь комплемента. Поэтому вполне вероятно, что лектиновый путь может представлять первичный механизм активации комплемента, который несоответствующим образом усиливается разрегулированным способом у индивидуумов, генетически предрасположенных к aHUS, инициируя тем самым патогенез aHUS. Можно сделать вывод, что агенты, которые блокируют активацию комплемента через лектиновый путь, в том числе антитела анти-MASP-2, как ожидается, будут предотвращать прогрессирование заболевания или ослаблять обострения у индивидуумов, подверженных aHUS.
В дополнительную поддержку этой концепции, недавние исследования выявили S. pneumonia в качестве важного этиологического агента в педиатрических случаях aHUS. (Nephrology (Carlton), 17:48-52 (2012): Pediar Infect Dis J. 30(9):736-9 (2011)). Эта конкретная этиология, по-видимому, имеет неблагоприятный прогноз, со значительным уровнем смертности и долговременную заболеваемость. В частности, эти случаи включали некишечные инфекции, приводящие к проявлениям микроангиопатии, уремии и гемолиза без свидетельства одновременного наличия мутаций в генах комплемента, которые, как известно, предрасполагают к aHUS. Важно отметить, что S. pneumonia особенно эффективны при активации комплемента, и осуществляет это преимущественно через лектиновый путь. Таким образом, в случае некишечного HUS, связанного с пневмококковой инфекцией, проявления микроангиопатии, уремии и гемолиза, как ожидается, будет обусловлено, в основном, через активацию лектинового пути, и агенты, которые блокируют лектиновый путь, в том числе антитела анти-MASP-2, как ожидается, будут препятствовать прогрессированию aHUS или уменьшать тяжесть заболевания у этих пациентов. Соответственно, еще один аспект изобретения включает в себя лечение пациентов, страдающих от некишечного aHUS, связанного с инфекцией S. рneumonia, с помощью введения эффективного количества MASP-2-ингибирующего агента.
В соответствии с вышесказанным, в некоторых вариантах осуществления, при определении субъекта с риском развития почечной недостаточности, связанной с aHUS, предоставляется способ уменьшения вероятности развития aHUS, или развития почечной недостаточности, связанной с aHUS, включающий введение количества MASP-2-ингибирующего агента в течение периода времени, эффективного для ослабления или предотвращения почечной недостаточности у субъекта. В некоторых вариантах осуществления способ дополнительно включает стадию определении того, существует ли риск развития aHUS у субъекта до появления каких-либо симптомов, связанных с aHUS. В других вариантах осуществления, способа включает определение того, существует ли риск развития aHUS у субъекта до появления по крайней мере одного или более симптомов, указывающих на aHUS (например, наличие анемии, тромбоцитопении и/или почечной недостаточности), и/или наличие тромботической микроангиопатии в биопсии, полученной от субъекта. Определение того, существует ли риск развития aHUS у субъекта, включает в себя определение того, имеет ли субъект генетическую предрасположенность развития aHUS, которое может быть проведено путем оценки генетической информации (например, из базы данных, содержащих генотип субъекта) или выполнения у субъекта по крайней мере одного генетического скрининг-теста, для определения наличия или отсутствия генетического маркера, связанного с aHUS (т.е., определение наличия или отсутствия генетической мутации, связанной с aHUS, в генах, кодирующих фактор комплемента H (CFH), фактор I (CFI), фактор B (CFB), мембранный кофактор CD46, C3, родственный фактору комплемента H белок 1 (CFHR1), или THBD (кодирующий антикоагулянтный белок тромбодулин) или родственный фактору комплемента H белок 3 (CFHR3), или родственный фактору комплемента H белок 4 (CFFIR4)), либо с помощью геномов или геномного секвенирования или ген-специфического анализа (например, ПЦР-анализа), и/или определения того, имеет ли субъект семейную историю aHUS. Способы генетического скрининга на наличие или отсутствие генетической мутации, связанной с aHUS, хорошо известны, например, смотри Moris M. et al. «Atypical Hemolytic-Uremic Syndrome», 2007 Nov 16 [Updated 2011 Mar 10]. В: Pagon RA, Bird TD, Dolan CR, et al, editors. GeneReviews™, Сиэтл (WA): Университет штата Вашингтон, Сиэтл
Например, в целом пенетрантность заболевания у лиц с мутациями фактора комплемента H (CFH) составляет 48%, а пенетрантность для мутаций в CD46 составляет 53%, для мутаций в CFI составляет 50%, для мутаций в С3 составляет 56%, а для мутаций в THBD составляет 64% (Caprioli J. et al., Blood, 108: 1267-79 (2006); Noris et al., Clin J Am Soc Nephrol 5: 1844-59 (2010)). Как описано в Caprioli et al., (2006), выше, у значительного числа индивидуумов, имеющих мутации в Факторе комплемента H (CFH), может никогда не развиться aHUS, и постулируется, что недостаточная активность CFH в этих индивидуумах достаточна, чтобы защитить хозяина от последствий активации комплемента в физиологических состояниях, однако, недостаточной активности CFH не достаточно, чтобы предотвратить C3b от депозиции на клетки сосудистого эндотелия при воздействии агента, который активирует комплемент, продуцирует большее, чем в норме, количество C3b. Соответственно, в одном варианте осуществления, предоставляется способ ингибирования MASP-2-зависимой активации комплемента у субъекта, страдающего от, или подверженного риску развития Фактор H-независимого атипичного гемолитического уремического синдрома, включающий введение субъекту композиции, содержащей количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2-зависимой активации комплемента. В другом варианте осуществления предоставляется способ ингибирования MASP-2-зависимой активации комплемента у субъекта с риском развития Фактор H-зависимого атипичного гемолитического уремического синдрома, включающий периодический мониторинг субъекта на определение наличия или отсутствия анемии, тромбоцитопении или повышение креатинина, и лечение MASP-2-ингибирующим агентом при определении наличия анемии, тромбоцитопении или повышения креатинина. В другом варианте осуществления предоставляется способ уменьшения вероятности того, что субъект с риском развития Фактор Н-независимого aHUS будет страдать от клинических симптомов, связанных с aHUS, включающий введение MASP-2-ингибирующего агента до или во время, или после события, как известно, связанного с запуском клинических симптомов aHUS, например, воздействие лекарственного препарата (например, химиотерапия), инфекции (например, бактериальная инфекция), злокачественное новообразование, травма, трансплантат органа или ткани или беременность.
В одном варианте осуществления, предоставляется способ уменьшения вероятности того, что субъект с риском развития aHUS будет страдать от клинических симптомов, связанных с aHUS, включающий периодический мониторинг субъекта на субъект наличия или отсутствия анемии, тромбоцитопении или повышения креатинина, а также лечение MASP-2-ингибирующим агентом при определении наличия анемии, тромбоцитопении или повышения уровня креатинина.
В другом варианте осуществления, предоставляется способ уменьшения вероятности того, что субъект с риском развития aHUS будет страдать от клинических симптомов, связанных с aHUS, включающий введение MASP-2-ингибирующего агента до или во время, или после события, как известно, связанного с включением клинических симптомов aHUS, например, воздействие лекарственного препарата (например, химиотерапия), инфекция (например, бактериальная инфекция), злокачественное новообразование, травма, трансплантат органа или ткани или беременность.
В некоторых вариантах осуществления, MASP-2-ингибирующий агент вводят в течение периода по крайней мере одного, двух, трех, четырех или более дней до, в ходе или после события, связанного с включением клинических симптомов aHUS, и может быть повторено, как определяется врачом, до тех пор, пока состояние не будет разрешено или контролироваться. В обстановке, предшествующей aHUS, MASP-2-ингибирующий агент может вводиться субъекту системно, как например, путем внутриартериального, внутривенного, внутримышечного, ингаляционного, назального, подкожного или другого парентерального введения.
В некоторых вариантах осуществления, в обстановке первичной диагностики aHUS, или у субъекта, проявляющего один или несколько симптомов, совместимых с диагнозом aHUS (например, наличие анемии, тромбоцитопении и/или почечной недостаточности), субъект получает эффективное количество MASP-2-ингибирующего агента (например, антитело анти-MASP-2) в качестве терапии первой линии, при отсутствии плазмафереза или в комбинации с плазмаферезом. В качестве терапии первой линии, MASP-2-ингибирующий агент может вводиться субъекту системно, как например, путем внутриартериального, внутривенного, внутримышечного, ингаляционного, назального, подкожного или другого парентерального введения. В некоторых вариантах осуществления, MASP-2-ингибирующий агент вводят субъекту в качестве терапии первой линии в отсутствие плазмафереза, чтобы избежать возможных осложнений от плазмафереза, включая кровотечения, инфекцию и воздействия от расстройств и/или аллергий, присущих плазме донора, или у субъекта, которому противопоказан плазмаферез, или в обстановке, где плазмаферез недоступен.
В некоторых вариантах осуществления, способ включает в себя введение MASP-2-ингибирующего агента субъекту, страдающему от aHUS, через катетер (например, внутривенно) в течение первого периода времени (например, по крайней мере один день в неделю или в две недели), с последующим введением MASP-2-ингибирующего агента субъекту подкожно в течение второго периода (например, в хронической фазе по крайней мере две недели или дольше). В некоторых вариантах осуществления, введение в первый и/или второй период времени происходит в отсутствие плазмафереза. В некоторых вариантах осуществления, способ дополнительно включает определение уровня по крайней мере одного фактора комплемента (например, C3, C5) у субъекта до начала лечения, и, при необходимости, во время лечения, где определение уменьшенного уровня по крайней мере одного фактора комплемента по сравнению со стандартным значением или здоровым контрольным субъектом, свидетельствует о необходимости продолжения лечения MASP-2-ингибирующим агентом.
В некоторых вариантах осуществления, способ включает в себя введение MASP-2-ингибирующего агента, такого как антитело анти-MASP-2, субъекту, страдающему от или подверженному риску развития aHUS, либо внутривенно, внутримышечно или, предпочтительно, подкожно. Лечение может стать постоянным, и введение может представлять собой от ежедневного до ежемесячного, но желательно каждые две недели. Антитело анти-MASP-2 можно вводить по-отдельности или в сочетании с C5-ингибитором, таким как экулизамаб.
HUS
Подобно атипичной HUS, типичная форма HUS отображает все клинические и лабораторные результаты TМА. Типичная HUS, однако, часто является детской болезнью, и, как правило, не имеет родственного компонента или прямой ассоциации с мутациями в генах комплемента. Этиология типичной HUS тесно связана с инфицированием определенными патогенными кишечными микроорганизмами. Пациенты обычно присутствуют с острой почечной недостаточностью, гемоглобинурией, и тромбоцитопенией, которая обычно следует за случаем кровавого поноса. Состояние вызывается кишечной инфекцией Shigella dissenteria, Salmonella или энтерогеморрагическими штаммами E. сoli, продуцирующими Шига-подобный токсин, такими как E. coli 0157:H7. Патогенные микроорганизмы приобретаются через загрязненную пищу или воду. HUS требует неотложной медицинской помощи и приводит к 5-10%-ой летальности. У значительной части выживших развиваются хронические заболевания почек (Corrigan and Boineau, Pediatr Rev 22 (11): 365-9 (2011)) и может потребоваться трансплантация почки.
Микрососудистая коагуляция при типичном HUS происходит, преимущественно, если не исключительно, в ренальном микроциркуляторном русле. Базовая патофизиология опосредуется токсином Шига (STX). Экскретируемый энтеропатическим микробом в просвет кишечника, STX пересекает кишечный барьер, проникает в кровоток и связывается с клетками сосудистого эндотелия, через блоботриаозильный керамидный рецептор CD77 (Boyd and Lingwood Nephron 51:207 (1989)), который, преимущественно, экспрессируется на клубочковом эндотелии и опосредует токсический эффект STX. После связывания с эндотелием, STX индуцирует ряд событий, которые повреждают эндотелий сосудов, активируют лейкоциты и вызывают vWF-зависимое тромбообразование (Forsyth et al., Lancet 2: 411-414 (1989); Zoja et al., Kidney Int. 62: 846-856 (2002); Zanchi et aL J. Immunol 181: 1460-1469 (2008); Morigi et al., Blood 98: 1828-1835 (2001); Guessou et al., Infect. Immun., 73: 8306-8316 (2005)). Эти микротромбы заслоняют или закупоривают артериолы и капилляры почек и других органов. Обтурация кровотока в артериолах и капиллярах при помощи микротромбов увеличивает силу трения, прикладываемую к RBC, поскольку они стискиваются при прохождении через суженные сосуды. Это может привести к разрушению RBC за счет силы трения и формированию фрагментов RBC, называемых шизоцитами. Наличие шизоцитов является характерным обнаружением HUS. Этот механизм известен как микроангиопатический гемолиз. Кроме того, нарушение кровотока приводит к ишемии, инициируя комплемент-опосредованную воспалительную реакцию, что наносит дополнительный ущерб пораженному органу.
Лектиновый путь комплемента способствует патогенезу HUS через два основных механизма: 1) MASP-2-обусловленная непосредственная активация каскада свертывания, вызванная повреждением эндотелия, и 2) лектин-опосредованная последующая активация комплемента, вызванная ишемией, образующейся в результате первичной окклюзии микрососудистого кровообращения.
STX повреждает эндотелиальные клетки микрососудов человека, а поврежденные эндотелиальные клетки, как известно, активируют систему комплемента. Как описано выше, активация комплемента, следующая за повреждением эндотелиальных клеток, обусловлена преимущественно лектиновым путем. Клетки сосудистого эндотелия, подвергнутые окислительному стрессу, реагируют экспрессированием молекул на поверхности, которые связывают лектины и активируют лектиновый путь комплемента (Collard et al., Am J Pathol. 156(5): 1549-56 (2000)). Сосудистые поражения, следующие за ишемической реперфузией, также активируют комплемент через лектиновый путь in vivo (Sсand J Immunol 61(5):426-34 (2005)). Лектиновый путь активации в этой обстановке имеет патологические последствия для организма-хозяина, и ингибирование лектинового пути блокадой MASP-2 предотвращает дальнейшее повреждение тканей организма-хозяина и неблагоприятные исходы (Schwaeble et al, PNAS (2011)). В дополнение к активации комплемента, лектин-зависимая активация MASP-2, как было показано, приводит в результате к расщеплению протромбина с образованием тромбина и способствует свертыванию крови. Таким образом, активация лектинового пути комплемента с помощью поврежденных эндотелиальных клеток может непосредственно активировать систему свертывания крови. Лектиновый путь комплемента, благодаря MASP-2-опосредованной активации протромбина, вследствие этого является, по-видимому, доминирующим молекулярным путем, связывающим первоначальное повреждение эндотелия STX с коагуляцией и микрососудистым тромбозом, что происходит при HUS. Поэтому ожидается, что ингибиторы лектинового пути, в том числе, но без ограничения, антитела, которые блокируют функцию MASP-2, будут предотвращать или смягчать микрососудистую коагуляцию, тромбоз и гемолиз у пациентов, страдающих HUS. Действительно, введение антитела анти-MASP-2 основательно защищает мышей в модели типичной HUS. Как описано в Примере 36 и показано на ФИГУРЕ 45, у всех контрольных мышей, подвергавшихся воздействию STX и LPS, развилась HUS в тяжелой степени, и они становились умирающими или умерали в течение 48 часов. С другой стороны, как далее показано на ФИГУРЕ 45, все мыши, получавшие антитело анти-MASP-2, а затем подвергшиеся действию STX и LPS, выжили (точность по Фишеру p<0,01; N=5). Таким образом, анти-MASP-2 терапия основательно защищает мышей в этой модели HUS. Ожидается, что введение MASP-2-ингибирующего агента, такого как антитело к MASP-2, будет эффективным при лечении пациентов с HUS и обеспечит защиту от микрососудистой коагуляции, тромбоза и гемолиза, вызванного инфекцией энтеропатичных E. coli или других STX-продуцирующих патогенных микроорганизмов.
Несмотря на то, что было показано в настоящем документе для HUS, вызванного STX, ожидается, что терапия с анти-MASP-2 будет выгодной для HUS-подобных синдромов вследствие повреждения эндотелия, вызванного другими токсическими агентами. Это включает агенты, такие как митомицин, тиклопидин, цикплатин, хинин, циклоспорин, блеомицин, а также другие химиотерапевтические препараты и иммунодепрессивные средства. Таким образом, ожидается, что терапия с антителом анти-MASP-2, или другими средствами, которые препятствуют активности MASP-2, будет эффективно предотвращать или ограничивать свертывание крови, образование тромбов и разрушение RBC и предотвращать почечную недостаточность при HUS и других связанных с ТМА заболеваниях (т.е., aHUS и ТТР).
Пациенты, страдающих от HUS, часто представлены с диареей и рвотой, у них обычно уменьшенное количество тромбоцитов (тромбоцитопения) и RBC (анемия). Предшествующая HUS фаза поноса обычно длится около четырех дней, в течение которой субъекты с риском развития HUS обычно проявляют один или более из следующих симптомов в добавление к тяжелой диарее: уровень гематокрита ниже 30% с положительным результатом микроскопии мокроты, доказывающим внутрисосудистое разрушение эритроцитов, тромбоцитопении (число тромбоцитов <150×103/мМ3), и/или наличие нарушения функции почек (концентрация сывороточного креатинина больше, чем верхний предел диапазона для данного возраста). Наличие олигоанурии (диурез ≤0,5 мл/кг/час в течение >1 дня) может быть использовано в качестве меры для продвижения в направлении развития HUS (смотри C. Hickey et al., Arch Pediatr Adolesc Med 165(10):884-889 (2011)). Тестирование, как правило, осуществляется на наличие инфекции бактериями E. coli (E.coli 0157:Н7), или видами Shigella или Salmonella. У субъекта, положительного при тестировании на инфекцию энтерогенной E. coli (например, E. coli 0157:H7), применение антибактериальных препаратов противопоказано, так как использование антибиотиков может увеличить риск развития HUS за счет увеличения производства STX (Смотри Wong C. et al., N Engl J. Med 342: 1930-1936 (2000)). Для субъектов, положительных при тестировании на Shigella или Salmonella, антибиотики, как правило, вводят для освобождения от инфекции. Другая хорошо обоснованная терапия первой линии для HUS включает в себя объемное расширение, гемодиализ и плазмаферез.
В соответствии с вышесказанным, в некоторых вариантах осуществления, в окружении субъекта, страдающего от одного или более симптомов, связанных с фазой, предшествующей HUS, и риском развития HUS (т.е., субъект проявляет один или более из следующего: диарея, уровень гематокрита менее 30% с положительным результатом микроскопии мокроты, доказывающим внутрисосудистое разрушение эритроцитов, тромбоцитопения (число тромбоцитов <150×103/мМ3), и/или наличие нарушения функции почек (концентрация сывороточного креатинина больше, чем верхний предел диапазона для данного возраста), предоставляется способ снижения риска развития HUS, или снижения вероятности возникновения почечной недостаточности у субъекта, включающий введение количества МASP-2-ингибирующего агента за период времени, эффективно ослабляющего или предотвращающего нарушение функции почек. В некоторых вариантах осуществления, MASP-2-ингибирующий агент вводят в течение периода времени не менее одного, двух, трех, четырех или более дней, и введение может быть повторено, что определяется врачом, до тех пор, пока состояние не будет разрешено или контролироваться. В предшествующей HUS установке, MASP-2-ингибирующий агент может быть введен субъекту системно, как, например, при помощи внутриартериального, внутривенного, внутримышечного, ингаляционного, назального, перорального, подкожного введения или других парентеральных введений.
Лечение инфекции E. coli 0157:Н7 бактерицидными антибиотиками, в частности, β-лактамами, ассоциируется с повышенным риском развития HUS (Smith et al., Pediatr Infect Dis J 31(1):37-41 (2012). В некоторых вариантах осуществления, в окружении субъекта, страдающего от симптомов, связанных с фазой, предшествующей HUS, где субъект, как известно, инфицирован энтерогенными E. coli, для которых применение антибиотиков противопоказано (например, E. Coli 0157:H7), предоставляется способ снижения риска развития HUS, или снижения вероятности возникновения почечной недостаточности у субъекта, включающий введение количества MASP-2-ингибирующего агента в течение первого периода времени, эффективного для ингибирования или предотвращения наличия олигоанурии у субъекта (например, по крайней мере один, два, три или четыре дня), где введение MASP-2-ингибирующего агента в течение первого периода времени имеет место в отсутствие антибиотика. В некоторых вариантах осуществления, способ дополнительно включает в себя введение MASP-2-ингибирующего агента субъекту, в комбинации с антибиотиком в течение второго периода времени (например, по крайней мере одной-двух недель).
В других вариантах осуществления, в окружении субъекта, страдающего от симптомов, связанных с фазой, предшествующей HUS, где субъект, как известно, имеет инфекцию Shigella или Salmonella, предоставляется способ снижения риска развития HUS, или снижения вероятности почечной недостаточности у субъекта, включающий введение количества MASP-2-ингибирующего агента и в течение периода времени, эффективного для ингибирования или предотвращения присутствия олигоанурии у субъекта, где введение MASP-2-ингибирующего агента происходит либо в присутствии, или в отсутствие подходящего антибиотика.
В некоторых вариантах осуществления, в состоянии первоначального диагноза HUS, или у субъекта, проявляющего один или несколько симптомов, совместимых с диагнозом: HUS (например, наличие почечной недостаточности, или микроангиопатической гемолитической анемией при отсутствии низкого фибриногена, или тромбоцитопении) субъект получает эффективное количество MASP-2-ингибирующего агента (например, антитело анти-MASP-2) в качестве терапии первой линии, в отсутствие плазмафереза или в сочетании с плазмаферезом. В качестве терапии первой линии, MASP-2-ингибирующий агент может быть введен субъекту системно, как например, путем внутриартериального, внутривенного, внутримышечного, ингаляционного, назального, подкожного введения или другого парентерального введения. В некоторых вариантах осуществления, MASP-2-ингибирующий агент вводят субъекту в качестве терапии первой линии в отсутствие плазмафереза, чтобы избежать осложнений плазмафереза, таких как кровотечение, инфекция, и воздействия расстройства и/или аллергий, присущих плазме доноров, или субъекту, отвергающему плазмаферез по другим причинам, или в обстановке, где плазмаферез является недоступным.
В некоторых вариантах осуществления, способ включает в себя введение MASP-2-ингибирующего агента субъекту, страдающему от HUS, через катетер (например, внутривенно) в течение первого периода времени (например, острая фаза, длящаяся по крайней мере от одного дня до недели или двух недель), затем следует введение MASP-2-ингибирующего агента субъекту подкожно в течение второго периода (например, в хронической фазе по крайней мере две недели или дольше). В некоторых вариантах осуществления, введение во время первого и/или второго периода происходит в отсутствие плазмафереза. В некоторых вариантах осуществления, способ дополнительно включает определение уровня по крайней мере одного фактора комплемента (например, C3, C5) у субъекта до начала лечения, и, при необходимости, во время лечения, где определение уменьшенного уровня по крайней мере одного фактора комплемента в сравнении со стандартным значением или со здоровым контрольным субъектом является указанием на необходимость лечения, и где определение нормального уровня является показателем улучшения.
В некоторых вариантах осуществления, способ включает в себя введение MASP-2-ингибирующего агент, такого как антитело анти-MASP-2, субъекту, страдающему от, или подверженного риску развития HUS, либо подкожно, или внутривенно. Предпочтительно ежедневное лечение, но может быть и нечасто случающимся, как например, еженедельным или ежемесячным. Лечение следует продолжать в течение по крайней мере одной недели и до 3 месяцев. Антитела анти-MASP-2 можно применять самостоятельно или в сочетании с C5-ингибитором, таким как экулизамаб.
TTP:
Тромботическая тромбоцитопеническая пурпура (ТТР) является угрожающим для жизни расстройством системы свертываемости крови, обусловленным аутоиммунными или наследственными нарушениями, которые активируют коагуляционный каскад или систему комплемента (George, JN, N Engl J Med; 354: 1927-35 (2006)). Это приводит к многочисленным микроскопическим сгусткам, или томбозам, в мелких кровеносных сосудах по всему организму. Красные кровяные клетки подвергаются напряжению сдвига, которое наносит ущерб их мембране, приводя к внутрисосудистому гемолизу. Получающееся снижение кровотока и повреждения эндотелия приводят к повреждению органов, включая мозг, сердце и почки. ТТР клинически характеризуется тромбоцитопенией, микроангиопатической гемолитической анемией, неврологическими изменениями, почечной недостаточностью и лихорадкой. В эпоху до появления плазмафереза частота фатальных исходов составляла 90% во время острых эпизодов. Даже с плазмаферезом выживание за шесть месяцев составляет около 80%.
ТТР может возникать в результате генетически обусловленного или приобретенного ингибирования фермента ADAMTS-13, металлопротеиназы, ответственной за расщепление больших мультимеров фактора von Willebrand (vWF) на более мелкие единицы. Ингибирование или недостаток ADAMTS-13, в конечном итоге, приводит в повышенной свертываемости (Tsai, Н. J Am Soc Nephrol 14: 1072-1081, (2003)). ADAMTS-13 регулирует активность vWF; в его отсутствие vWF образует крупные мультимеры, которые склонны связывать тромбоциты и создает предрасположенность пациентов к агрегации тромбоцитов и тромбообразованию в микроциркуляторном русле.
Многочисленные мутации в ADAMTS 13 были выявлены у индивидуумов с ТТР. Болезнь может также развиваться за счет ауто-антител против ADAMTS-13. Кроме того, ТТP может развиться во время рака молочной железы, желудочно-кишечного тракта или предстательной железы (George I.N., Oncology (Williston Park). 25:908-14 (2011)), беременности (во втором триместре беременности или после родов), George JN., Curr Opin Hematol 10:339-344 (2003)), или связана с заболеваниями, такими как ВИЧ, или аутоиммунными заболеваниями, такими как системная красная волчанка (Hamasaki K, et al., Clin Rheumatol. 22:355-8 (2003)). ТТP также могут быть следствием некоторых способов лекарственной терапии, в том числе гепарина, хинина, аутоиммунного ингредиента, противораковых химиотерапевтических агентов (блеомицин, цисплатин, цитозин-арабинозид, дауномицина гемцитабин, митомицин С и тамоксифен), циклоспорина А, оральных контрацептивов, пенициллина, рифампина и антитромбоцитных препаратов, в том числе тиклопидина и клопидогрела (Azarm, T. et al., J Res Med Sci, 16: 353-357 (2011)). Другие факторы или состояния, связанные с ТТР, представляют собой токсины, такие, как пчелиный яд, сепсис, секвестрация селезенки, трансплантацию, васкулит, сосудистую хирургию и инфекции, такие как Streptococcus pneumoniae и цитомегаловирус (Moake X.L., N Engl J Med., 347:589-600 (2002)). ТТР из-за временной функциональной недостаточности ADAMTS-13 может возникать как следствие повреждения эндотелиальных клеток, связанного с инфекцией S. pneumonia (Pediair Nephrol., 26:631-5 (2011)).
Плазмаферез представляет собой стандартное лечение ТТР (Rock GA, et al., N Engl J Med 325:393-397 (1991)). Плазмаферез заменяет активность ADAMTS-13 у пациентов с генетическими дефектами и удаляет аутоантитела к ADAMTS-13 у больных с приобретенной аутоиммунной ТТР (Tsai, H-M, Hematol Oncol Clin North Am., 21(4): 609-v (2007)). К терапии обычно добавляются дополнительные агенты, такие как иммуносупрессивные препараты (George, JM, N Engl J Med, 354: 1927-35 (2006)). Однако плазмаферез не является успешным для около 20% пациентов, рецидивы встречаются более чем у трети пациентов, и плазмаферез является дорогостоящим и технически сложным. Кроме того, многие пациенты не в состоянии терпеть плазмаферез. Следовательно, остается острая необходимость в дополнительных и более эффективных способах лечения ТТР.
Поскольку ТТР представляет собой расстройство каскада свертывания крови, лечение антагонистами системы комплемента может оказывать помощь в стабилизации и коррекции заболевания. Несмотря на то, что патологическая активация альтернативного пути комплемента связана с aHUS, роль активации комплемента в ТТР менее ясна. Функциональный дефицит ADAMTS 13 важен для восприимчивости к ТТР, однако это не является достаточной причиной острых эпизодов. Факторы окружающей среды и/или другие генетические вариации могут способствовать проявлению ТТР. Например, гены, кодирующие белки, участвующие в регуляции каскада свертывания, vWF, функции тромбоцитов, компоненты эндотелиальной поверхности сосудов или системы комплемент могут быть вовлечены в развитие острой тромботической микроангиопатии (Galbusera, M. et al., Haematologica, 94: 166-170 (2009)). В частности, активация комплемента, как было показано, играет решающую роль; сыворотка от тромботической микроангиопатии, связанной с дефицитом ADAMTS-13, как было показано, вызывает депозицию C3 и MAC и последующую активацию нейтрофилов, которую можно отменить инактивацией комплемента (Ruiz-Torres MP, et al, Thromb Haemost, 93:443-52 (2005)). Кроме того, недавно было показано, что во время острых эпизодов ТТР наблюдаются повышенные уровни C4d, C3bBbP и C3a (M. Reti et al., J Thromb Haemost. Feb 28, (2012) doi: 10.1111/j.1538-7836.2012.04674.x. [Препринт]), в соответствии с активацией классического/лектинового и альтернативного пути. Это увеличенная степень активации комплемента в острых эпизодах может инициировать терминальный путь активации и нести ответственность за дальнейшее обострение ТТР.
Роль ADAMTS-13 и vWF в ТТР четко отвечает за активацию и агрегацию тромбоцитов и их последующую роль в сдвиговом напряжении и депозиции при микроангиопатиях. Активированные тромбоциты взаимодействуют с и инициируют как классический, так и альтернативный пути комплемента. Тромбоцит-опосредованная активация комплемента увеличивает медиаторы воспаления C3a и C5a (Peerschke E et al, Mol Immunol, 47:2170-5 (2010)). Тромбоциты, таким образом, могут служить мишенями классической активации комплемента при наследственной или аутоиммунной ТТР.
Как описано выше, лектиновый путь комплемента, в силу MASP-2-опосредованной активации протромбина, представляет собой доминантный молекулярный путь, связывающий повреждение эндотелия с коагуляцией и микрососудистым тромбозом, которые происходят при HUS. Аналогичным образом, активация лектинового пути комплемента может непосредственно управлять системой свертываемости крови при ТТР. Лектиновый путь активации может быть инициирован в ответ на первоначальное повреждение эндотелия, вызванное нехваткой ADAMTS-13 при ТТР. Поэтому ожидается, что ингибиторы лектинового пути, включающие, в качестве неограничивающего примера, антитела, которые блокируют функцию MASP-2, позволят смягчить микроангиопатии, связанные с микрососудистой коагуляцией, тромбозом и гемолизом у пациентов, страдающих от ТТР.
Пациенты, страдающие от ТТР, как правило, находятся в реанимационном отделении с одним или более из следующего: пурпура, почечная недостаточность, низкий уровень тромбоцитов, анемия и/или тромбоз, в т.ч. инсульт. Современный стандарт медицинской помощи при ТТР предполагает внутрикатетерную доставку (например, внутривенный катетер или катетер иной формы) замещающего плазмафереза в течение двух недель или дольше, как правило, три раза в неделю, но вплоть до ежедневной. В случае если субъект показывает положительный результат на наличие ингибитора ADAMTS 13 (т.е., эндогенные антитела против ADAMTS13), то плазмаферез может быть проведен в сочетании с иммуносупрессивной терапией (например, кортикостероиды, ритуксан или циклоспорин). Субъекты с рефракторной ТТР (около 20% от ТТР-пациентов) не реагируют в течение по крайней мере двух недель терапии с плазмаферезом.
В соответствии с вышесказанным, в одном варианте осуществления, в обстановке первичного диагноза ТТР, или у субъекта, проявляющего один или несколько симптомов, согласующихся с диагнозом ТТР (например, участие центральной нервной системы, тяжелая тромбоцитопения (число тромбоцитов менее или равно 5000/мкл, при отсутствии назначения аспирина, менее чем или равным 20000/мкл, при назначении аспирина), тяжелое поражение сердечной деятельности, тяжелое поражение легких, желудочно-кишечный инфаркт или гангрена), предоставляется способ лечения субъекта эффективным количеством MASP-2-ингибирующего агента (например, антитело анти-MASP-2) в качестве терапии первой линии, в отсутствие плазмафереза или в сочетании с плазмаферезом. В качестве терапии первой линии, MASP-2-ингибирующий агент можно вводить субъекту системно, как, например, при помощи внутриартериального, внутривенного, внутримышечного, ингаляционного, назального, подкожного или другого парентерального введения. В некоторых вариантах осуществления, MASP-2 ингибирующий агент вводят субъекту в качестве терапии первой линии в отсутствие плазмафереза, чтобы избежать осложнений плазмафереза, таких как кровотечение, инфекция, и воздействия расстройства и/или аллергий, присущих плазме доноров, или субъекту, отвергающему плазмаферез по другим причинам, или в обстановке, где плазмаферез является недоступным. В некоторых вариантах осуществления, MASP-2-ингибирующий агент вводят субъекту, страдающему от ТТР, в комбинации (в том числе совместное введение) с иммунодепрессивным средством (например, кортикостероиды, ритуксан или циклоспорин) и/или в сочетании с концентрированным ADAMTS-13.
В некоторых вариантах осуществления, способ включает в себя введение MASP-2-ингибирующего агента субъекту, страдающему от ТТР, через катетер (например, внутривенно) в течение первого периода времени (например, острая фаза, длящаяся по крайней мере от одного дня до недели или двух недель), затем следует введение MASP-2-ингибирующего агента субъекту подкожно в течение второго периода времени (например, в хронической фазе по крайней мере две недели или дольше). В некоторых вариантах осуществления, введении во время первого и/или второго периода происходит в отсутствие плазмафереза. В некоторых вариантах осуществления, применяется способ для поддержания субъекта, чтобы предохранить субъекта от страдания одним или более симптомов, связанных с ТТР.
В другом варианте осуществления, предоставляется способ лечения субъекта, страдающего от рефракторной ТТР (т.е., субъект, который не реагирует на по крайней мере двухнедельную терапию с использованием плазмафереза), путем введения количества ингибитора MASP-2, эффективного для снижения одного или более симптомов ТТР. В одном варианте осуществления, ингибитор MASP-2 (например, антитело анти-MASP-2) вводят субъекту с рефракторной ТТР на постоянной основе, в течение по крайней мере двух недель или дольше, посредством подкожного или другого парентерального введения. Введение можно повторять, что определяется врачом, до тех пор, пока состояние не будет разрешено или контролироваться.
В некоторых вариантах осуществления, способ дополнительно включает определение уровня по крайней мере одного фактора комплемента (например, C3, C5) у субъекта до начала лечения, и, при необходимости, во время лечения, где определение уменьшенного уровня по крайней мере одного фактора комплемента, в сравнении со стандартным значением или здоровым контрольным субъектом, свидетельствует о необходимости продолжения лечения MASP-2-ингибирующим агентом.
В некоторых вариантах осуществления, способ включает в себя введение MASP-2-ингибирующего агента, такого как антитела анти-MASP-2, субъекту, страдающему от, или подверженному риску развития ТТР, либо подкожно, или внутривенно. Лечение желательно ежедневное, но может быть редким, как например, раз в две недели. Лечение продолжается до тех пор, пока число тромбоцитов субъекта составляет больше, чем 150000/мл в течение не менее двух дней подряд. Антитело анти-MASP-2 можно применять самостоятельно или в сочетании с C5-ингибитором, таким как экулизамаб.
Другой аспект изобретения предоставляет способы лечения криоглобулинемии путем введения композиции, содержащей терапевтически эффективное количество MASP-2-ингибирующего агента в фармацевтическом носителе субъекту, страдающему от криоглобулинемии или состояния, возникающего в результате криоглобулинемии. Криоглобулинемия характеризуется наличием криоглобулинов в сыворотке крови, которые являются единственным иммуноглобулином или смешанными иммуноглобулинами (обычно, IgM-антитела), которые подвергаются обратимой агрегации при низких температурах. Состояния, сложившиеся в результате криоглобулинемии, включают васкулит, гломерулонефрит и системное воспаление. МASP-2-ингибирующий агент вводят системно субъекту, страдающему от криоглобулинемии или состояния, возникающего в результате криоглобулинемии, как, например, путем внутриартериального, внутривенного, внутримышечного, ингаляционного, подкожного или другого парентерального введения или потенциально путем перорального введения не пептидергических агентов.
В другом аспекте, изобретение предоставляет способы лечения синдрома холодовой агглютинации (CAD) путем введения композиции, содержащей терапевтически эффективное количество MASP-2-ингибирующего агент в фармацевтическом носителе субъекту, страдающему от CAD или состояния, возникающего в результате CAD. Заболевание CAD проявляется как анемия, и может быть вызвано заболеванием или расстройством, называемым «вторичный CAD», таким, как инфекционное заболевание, лимфопролиферативная болезнь или расстройство соединительной ткани. У этих пациентов обнаруживаются IgM-антитела против своих красных кровяных клеток, которые вызывают реакцию агглютинации при низких температурах. MASP-2-ингибирующий агент вводят системно субъекту, страдающему от CAD или состояния, возникающего в результате CAD, как, например, путем внутриартериального, внутривенного, внутримышечного, ингаляционного, подкожного или другого парентерального введения или потенциально путем перорального введения не пептидергических агентов.
КОАГУЛОПАТИИ
Были обнаружены доказательства роли системы комплемента в синдроме диссеминированной внутрисосудистой коагуляции («DIС»), такого как DIС на фоне значительной телесной травмы.
Предыдущие исследования показали, что мыши C4-/- не защищены от почечного реперфузионного повреждения (Zhou, W., et al, «Predominant role for C5b-9 in renal ischemia/reperfusion injury,» J Clin Invest 105: 1363-1371 (2000)). Для того, чтобы выяснить, могут ли мыши C4-/- по-прежнему активировать комплемент посредством классического или лектинового пути, оборот C3 в плазме мышей C4-/- определяли в тестах, специфических для маршрута классического или лектинового пути активации. Несмотря на то, что расщепление С3 не может наблюдаться при запуске активации через классический путь, наблюдалась высокоэффективная, зависимая от лектинового пути активация C3 в C4-дефектной сыворотке крови (ФИГУРА 30). Видно, что депозиция C3b на маннане и зимозане серьезно снижена у мышей MASP-2-/-, даже в экспериментальных условиях, что, в соответствии с многими ранее опубликованными работами по альтернативному пути активации, должно быть разрешительным для всех трех путей. При использовании той же сыворотки в лунках, покрытых иммуноглобулиновыми комплексами вместо маннана или зимозана, депозиция C3b и расщепление Фактора B наблюдается в сыворотке мышей MASP-2+/+ и в сыворотке MASP-2-/-, но не в C1q-обедненной сыворотке. Это означает, что альтернативный путь активации облегчен в сыворотке MASP-2-/-, когда исходный C3b предоставляется через классическую активность. ФИГУРА 30С демонстрирует удивительное открытие, что C3 может быть эффективно активирован способом, зависящим от лектинового пути, в C4-дефектной плазме.
Этот «C4-обход» устраняется за счет ингибирования активации лектинового пути через прединкубацию плазмы с растворимым маннаном или маннозой.
Аберрантная, неиммунная активация системы комплемента является потенциально опасной для человека и может также играть важную роль в гематологическом пути активации, особенно в ситуациях с тяжелой травмой, где активируются как воспалительный, так и гематологический пути. У нормальных здоровых людей, C3-конверсия составляет <5% от общего плазменного белка C3. При угрожающей инфекции, включая септицемию и болезнь иммунного комплекса, C3-конверсия сама заново устанавливает на уровне около 30%, с уровнями комплемента, часто более низкими, чем обычно, из-за увеличенного использования и изменений в распределение пула. Непосредственная активация C3-пути более чем на 30%, как правило, производит явное клиническое доказательство вазодилатации и потери жидкости в тканях. При C3-конверсии выше 30%, инициирующие механизмы являются, преимущественно, неиммунными, и получающиеся в результате клинические проявления опасны для пациента. Уровни C5 комплемента у здоровых и при контрольной болезни оказываются гораздо более стабильными, чем C3. Значительное понижение и/или конверсия уровней C5 связаны с реакцией пациента на аномальные множественные травмы (например, дорожно-транспортные происшествия) и вероятное развитие шоковых синдромов легких. Таким образом, какие-либо свидетельства либо C3-активации комплемента, превышающей 30% васкулярного пула, или какого-либо участия C5, или и то, и другое, могут рассматриваться, скорее всего, как предвестники вредных патологических изменений в организме больного.
Как C3, так и C5 освобождают анафилатоксины (C3a и C5a), которые действуют на тучные клетки и базофилы, высвобождая сосудорасширяющие химические вещества. Они создают хемотаксические градиенты, чтобы направлять полиморфоядерные клетки (PMN) к центру иммунологических нарушений (благоприятный ответ), но здесь они отличаются тем, что C5a оказывает специфический комкующий (агрегирующий) эффект на эти фагоцитарные клетки, предотвращая их случайное движение прочь от участка реакции. При нормальном контроле инфекции, C3 активирует C5. Однако при множественной травме, C5, по-видимому, в значительной степени активирован, системно генерируя анафилатоксины C5a. Эта неконтролируемая активность вызывает полиморфы, с образованием скоплений в сосудистой системе, и эти скопления затем смываются в капилляры легких, которые их поглощают и создают локальные разрушающие эффекты в результате освобождения супероксидов. Кроме того, не желая ограничиваться теорией, механизм, вероятно, играет важную роль в патогенезе синдрома острой дыхательной недостаточности (ARDS), хотя эта точка зрения была недавно оспорена. Может быть показано, что анафилатоксины C3a in vitro являются мощными агрегаторами тромбоцитов, но их участие in vivo является менее определенным, и высвобождение веществ тромбоцитов и плазмина при заживлении раны может только во вторую очередь связано с комплементом С3. Возможно, что длительное повышение C3-активации необходимо для создания DIC.
В дополнение к клеточным и сосудистым эффектам активированных компонентов системы комплемента, описанным выше, которые могли бы объяснить связь между травматическим повреждением и DIC, новые научные открытия позволили определить прямые молекулярные связи и функциональное взаимное влияние между комплементом и системой свертываемости крови. Дополнительные данные были получены в результате исследований на C3-дефектных мышах. Из-за того, что C3 является общим компонентом для каждого из путей комплемента, у C3-дефектных мышей, как прогнозируется, должны отсутствовать все функции комплемента. Удивительно, однако, что C3-дефектные мыши вполне способны активировать терминальные компоненты комплемента. (Huber-Lang, M., et al., «Generation of C5a in the absence of C3: a new complement activation pathway,» Nat. Med 12:682-687 (2006)). Углубленные исследования показали, что C3-независимая активация терминальных компонентов комплемента опосредуется тромбином, ферментом, огранивающим скорость коагуляционного каскада (Huber et al., 2006). Молекулярные компоненты, опосредующие активацию тромбина, следующую за первоначальной активацией комплемента, оставались неясными.
Авторы настоящего изобретения выявили, что является, как полагают, молекулярной основой взаимного влияния между комплементом и каскадами свертывания, и идентифицировали MASP-2 в качестве центральной контрольной точки, связывающей эти две системы. Биохимические исследования субстратной специфичности MASP-2 определили протромбин в качестве возможного субстрата, в дополнение к хорошо известным белкам комплемента, C2 и C4. MASP-2 специфически расщепляет протромбин в функционально значимых участках, образуя тромбин, фермент, ограничивающий скорость коагуляционного каскада. (Krarup, A., et al., «Simultaneous Activation of Complement and Coagulation by MBL-Associated Serine Protease 2,» PLoS. ONE. 2; e623 (2007)). MASP-2-порожденный тромбин способен вызывать депозицию фибрина в определенных реконструированных in vitro-системах, демонстрирующих функциональную актуальность расщепления MASP-2. (Krarup et al., 2007). Как описано в примерах ниже в настоящем документе, авторы изобретения также подтвердили физиологическое значение этого открытия путем документирования активации тромбина в нормальной сыворотке грызунов после активации лектинового пути, и показали, что этот процесс блокируется нейтрализующими MASP-2 моноклональными антителами.
MASP-2 может представлять центральную точку разветвления лектинового пути, способную вызывать активизацию как комплемента, так и системы свертывания крови. Поскольку лектиновый путь активации представляет собой физиологический ответ на многие виды травматических повреждений, авторы настоящего изобретения считают, что системное воспаление (опосредуемое компонентами комплемента) одновременно с диссеминированным свертыванием (опосредованное через путь свертывания) могут быть объяснены способностью MASP-2 активировать оба пути. Эти данные наглядно показывают роль MASP-2 в образовании DIC и терапевтическую пользу ингибирования MASP-2 в лечении или профилактике DIC. MASP-2 может обеспечивать молекулярную связь между комплементом и системой свертывания крови, и активация лектинового пути, как это происходит в окружении повреждения, может непосредственно инициировать активацию системы свертывания крови через ось MASP-2 - тромбин, обеспечивая механистическую связь между травматическим повреждением и DIC. В соответствии с аспектом настоящего изобретения, ингибирование MASP-2 могло бы ингибировать лектиновый путь активации и уменьшать образование как анафилатоксина C3a, так и анафилатоксина C5a. Считается, что длительное повышение C3-активации необходимо для формирования DIC.
Таким образом, аспект изобретения поэтому предоставляет способ ингибирования MASP-2-зависимой активации комплемента для лечения диссеминированного внутрисосудистого свертывания крови или другое комплемент-опосредованное нарушение свертываемости крови путем введения композиции, содержащей терапевтически эффективное количество MASP-2-ингибирующего агента (например, антитело анти-MASP-2 или его фрагмент, пептидные ингибиторы или малые молекулы-ингибиторы) в фармацевтическом носителе субъекту, страдающему от или подверженного риску развития такого состояния. В некоторых вариантах осуществления, MASP-2-ингибирующие агенты могут блокировать MASP-2, который уже был активирован. MASP-2-ингибирующую композицию, соответственно, вводят субъекту системно, как, например, путем внутриартериального, внутривенного, внутримышечного, ингаляционного, подкожного или другого не парентерального введения или потенциально путем перорального введения пептидергических агентов. Введение можно повторять, что определяется врачом, до тех пор, пока состояние не будет разрешено или будет контролироваться. Способы данного аспекта настоящего изобретения могут быть использованы для лечения DIC на фоне сепсиса, тяжелой травмы, в том числе неврологической травмы (например, острая черепно-мозговая травма, смотри Kumura, E., et al. Acta Neurochirurgica 85:23-28 (1987), инфекции (бактериальной, вирусной, грибковой, паразитарной), рака, послеродового осложнения, заболевания печени, тяжелой токсической реакции (например, укус змеи, укус насекомого, трансфузионная реакция), шока, теплового удара, отторжения трансплантата, аневризмы сосудов, печеночной недостаточности, лечения рака химиотерапией или лучевой терапией, ожога, случайного радиационного облучения и других причин. Смотри, например, Becker J.U. and Wira C.R. "Disseminated Intravascular Coagulation" emedicine.medscape.com/9/10/2009. Для DIC на фоне травмы или других острых событий, MASP-2-ингибирующую композицию можно применять сразу после травматического повреждения или профилактически перед этим, во время, сразу после или в течение одного-семи дней или дольше, как, например, в течение от 24 часов до 72 часов, после повреждения, вызванного травмой, или ситуациями, такими, как операции у больных, подверженных риску развития DIC. В некоторых вариантах осуществления, MASP-2-ингибирующую композицию можно соответствующим образом вводить в быстродействующую лекарственную форму, такую, как внутривенная или внутриартериальная доставка болюсного раствора, содержащего композицию с MASP-2-ингибирующим агентом.
В другом аспекте, изобретение предоставляет способы лечения субъекта, страдающего от или подверженного риску развития тромбоза, микроциркуляторной коагуляции или полиорганной недостаточности после микроциркуляторной коагуляции. Физиологический тромб (сгусток крови) формируется в ответ на повреждение сосуда для предотвращения утечки крови из поврежденного сосуда.
Лектиновый путь может играть роль в патологическом тромбозе, вызванном исходным сосудистым воспалением, связанным с различными этиологиями. Например, тромб может образоваться вокруг атеросклеротических бляшек, что, как известно, является активатором лектинового пути. Таким образом, лечение ингибитором MASP-2 может быть использовано для блокирования тромбообразования у пациентов с сопутствующим атеросклерозом.
Микроциркуляторная коагуляция (кляксообразные тромбы в капиллярах и мелких сосудах) возникает при состояниях, таких как септический шок. Роль лектинового пути в септическом шоке установлена, что подтверждено при помощи защищенного фенотипа в модели сепсиса на мышах MASP-2 (-/-), описанной в Примере 17 и ФИГУРАХ 18 и 19. Кроме того, как показано в Примере 15 и ФИГУРАХ 16А и 16B, мыши MASP-2 (-/-) защищены в модели локализованной реакции Шварцмана диссеминированного внутрисосудистого свертывания (DIC), модели локализованной коагуляции в микрососудах.
ПЕРИХЕМОТЕРАПЕВТИЧЕСКОЕ ВВЕДЕНИЕ И ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Активация системы комплемента также может быть вовлечена в патогенез злокачественных новообразований. Недавно неоантигены из C5b-9-комплекса комплемента IgG, C3, C4, S-протеин/витронектин, фибронектин и макрофаги были локализованы в 17 образцах молочной железы и 6 образцах доброкачественных опухолей молочной железы с использованием поликлональных или моноклональных антител и стрептавидин-биотин-пероксидазной методики. Все образцы тканей с карциномой в каждой из TNM-стадий, представляли C5b-9-депозиты на мембранах опухолевых клеток, тонких гранулах на остатках клеток, и диффузные депозиты в некротических участках (Niculescu, F. et al., Am. J. Palhol. 140: 1039-1043, 1992).
Кроме того, активация комплемента может быть следствием химиотерапии или лучевой терапии, и, таким образом, ингибирование активации комплемента было бы полезно как вспомогательное средство при лечении злокачественных новообразований, чтобы уменьшить интрогенное воспаление. В случае, когда химио- и лучевой терапии предшествует хирургическая операция, депозиты C5b-9 были более интенсивными и распространенными. Депозиты C5b-9 отсутствовали во всех пробах с доброкачественными поражениями. S-белок/витронектин присутствовал в качестве фибриллярных депозитов в матриксе соединительной ткани и в качестве диффузных депозитов вокруг опухолевых клеток, менее интенсивных и распространенных, чем фибронектин. Депозиты IgG, C3 и C4 присутствовали только в образцах карциномы. Наличие депозитов C5b-9 свидетельствует об активации комплемента и его последующем патогенетическом воздействии на заболеваемость раком молочной железы (Niculescu, F., et al, Am. J. Pathol. 140: 1039-1043, 1992).
Терапия с использованием импульсного перестраиваемого жидкостного лазера (577 нм) (PTDL) вызывает коагуляцию гемоглобина и некроз тканей, который в основном ограничивается кровеносными сосудами. При исследовании PTDL-облученной нормальной кожи основными выводами были следующие: 1) C3-фрагменты, C8, C9 и MAC осаждались на стенках сосудов; 2) эти депозиты были не из-за денатурации белков, так как они стали очевидными только через 7 мин после облучения, в отличие от непосредственной депозиции трансферрина на участки эритроцитных коагулятов; 3) C3-депозиты, как было показано, усиливают активацию комплемента по альтернативному пути, реакция, которая была специфической, поскольку некроз тканей сам по себе не приводил к такому усилению; и 4) этим реакциям предшествовало местное накопление полиморфноядерных лейкоцитов. Некроз тканей был более выраженным в гемангиомах. Более крупные ангиоматозные сосуды в центре некроза не фиксировали существенно комплемент. Наоборот, депозиция комплемента в сосудах, расположенных на периферии, была подобна той, которая наблюдается в нормальной коже, с одним исключением: C8, C9 и МАС были обнаружены в некоторых кровеносных сосудах сразу после лазерного лечения, обнаружение, согласующееся со сборкой MAC, происходящей непосредственно без образования C5-конвертазы. Эти результаты показывают, что комплемент активируется в PTDL-индуцированном сосудистом некрозе и может быть ответственным за возникающий воспалительный ответ.
Фотодинамическая терапия (PDT) опухоли вызывает сильный иммунный ответ, и одним из ее проявлений является выраженная нейтрофилия. В дополнение к фрагментам комплемента (непосредственные медиаторы), высвобождаемые как следствие PDT-индуцированной активации комплемента, существует, по меньшей мере, десяток вторичных медиаторов, каждый из которых возникает в результате активности комплемента. К последним относятся цитокины IL-1 бета, TNF-альфа, IL-6, IL-10, G-CSF и KC, тромбоксан, простагландины, лейкотриены, гистамин и факторы свертывания крови (Cecic, I. et al., Сancer Lett. 183:43-51, 2002).
И, наконец, использование ингибиторов MASP-2-зависимой активации комплемента может быть предусмотрено в сочетании со стандартной терапевтической схемой лечения рака. Например, лечение ритуксимабом, химерным моноклональным антителом анти-CD20, может быть связано с умеренными и тяжелыми побочными эффектами от первой дозы, особенно у пациентов с высоким числом циркулирующих опухолевых клеток. В недавних исследованиях во время первой инъекции ритуксимаба определяли продукты активации комплемента (C3b/c и C4b/c) и цитокины (фактор некроза опухоли альфа (TNF-альфа), интерлейкин 6 (IL-6) и IL-8) у пяти пациентов с рецидивирующей низкосортной неходжкинской лимфомой (NHL). Инфузия ритуксимаба индуцировала быструю активацию комплемента, предшествующую высвобождению TNF-альфа, IL-6 и IL-8. Несмотря на то, что обследованная группа была небольшой, уровень активации комплемента, по-видимому, коррелировал как с числом циркулирующих B-клеток до инфузии (r=0,85; P=0,07), так и со степенью тяжести неблагоприятных эффектов. Результаты показали, что комплемент играет ключевую роль в патогенезе неблагоприятных эффектов лечения ритуксимабом. Поскольку активация комплемента не может быть предотвращена с помощью кортикостероидов, может быть актуальным изучение возможной роли ингибиторов комплемента во время первого введения ритуксимаба (van der Kolk, L.E. et al., Br. J. Haematol. 115:807-811, 2001).
В другом аспекте изобретения, представлены способы ингибирования MASP-2-зависимой активации комплемента у субъекта, подвергающегося лечению химиотерапией и/или лучевой терапией, в том числе, в качестве неограничивающего примера, лечению раковых состояний. Этот способ включает в себя введение композиции, содержащей терапевтически эффективное количество ингибитора MASP-2 в фармацевтическом носителе, пациенту перихемотерапевтически, т.е., до и/или во время, и/или после введения химиотерапевтического средства(средств) и/или лучевой терапии. Например, введение композиции с ингибитором MASP-2 по настоящему изобретению может быть начато раньше или одновременно с введением химио- или лучевой терапии, и продолжаться на протяжении всего курса терапии, для уменьшения отрицательных последствий химио- и/или лучевой терапии в непредназначенных для лечения здоровых тканях. Кроме того, композицию с ингибитором MASP-2 можно вводить после химио- и/или лучевой терапии. Следует понимать, что схемы химио- и лучевой терапии часто влекут за собой повторные курсы лечения и, таким образом, возможно, что введение композиции с ингибитором MASP-2 также могло бы быть повторяющимся и относительно совпадающим с химиотерапевтической и лучевой терапиями. Кроме того, считается, что MASP-2-ингибирующие агенты, которые могут быть использованы в качестве химиотерапевтических агентов, самостоятельно или в комбинации с другими химиотерапевтическими препаратами и/или лучевой терапией, для лечения пациентов, страдающих от злокачественных опухолей. Введение можно осуществлять соответственно с помощью перорального (для непептидергических), внутривенного, внутримышечного или другого парентерального способа.
В другом варианте осуществления, MASP-2-ингибирующие агенты могут быть использованы для лечения субъекта с острым лучевым синдромом (также известным как лучевая болезнь или отравление радиацией), чтобы уменьшить вредное воздействие ионизирующего излучения (случайного или нет). К симптомам, связанным с острым лучевым синдромом, относятся тошнота, рвота, диарея, повреждения кожи, выпадение волос, утомляемость, лихорадка, судороги и кома. Для лечения острого лучевого синдрома композицию, ингибирующую MASP-2, можно вводить сразу же после облучения или профилактически до, во время, сразу после или в течение одного-семи дней или дольше, как, например, в течение от 24 часов до 72 часов после облучения. В некоторых вариантах осуществления, способы можно применять для лечения субъекта до или после облучения в дозе ионизирующего излучения, достаточной, чтобы вызвать острый лучевой синдром (т.е., доза ионизирующего излучения всего тела по крайней мере 1 Гр или по крайней мере 2 Гр, или по крайней мере 3 Гр, или по крайней мере 4 Гр, или по крайней мере 5 Гр, или по крайней мере 6 Гр, или по крайней мере 7 Гр и выше). В некоторых вариантах осуществления, композицию, ингибирующую MASP-2, можно соответствующим образом вводить в быстродействующую лекарственную форму, такую как внутривенная или внутриартериальная доставка болюсного раствора, содержащего композицию с MASP-2-ингибирующим агентом.
ОФТАЛЬМОЛОГИЧЕСКИЕ СОСТОЯНИЯ
Возрастная макулярная дегенерация (AMD) представляет собой болезнь ослепления, которая поражает миллионы взрослых, но последствия биохимических, клеточных и/или молекулярных событий, ведущих к развитию AMD, плохо изучены. AMD приводит к постепенному разрушению макулы, которое коррелировало с образованием внеклеточных депозитов, называемых друзой, расположенных в районе макулы, позади сетчатки и между пигментным эпителием сетчатки (RPE) и сосудистой оболочкой. Недавние исследования показали, что белки, связанные с воспалением и аутоиммунными процессами, являются наиболее распространенными среди составляющих, связанных с друзой. Транскрипты, которые кодируют число этих молекул, были обнаружены в ретинальных, RPE- и хориоидальных клетках. Эти данные также показывают, что дендритные клетки, которые являются эффективными антиген-представляющими клетками, тесно связаны с развитием друзы, и что активация комплемента является ключевым путем, который активен как внутри друзы, так и вдоль RPE-хориоидной границы (Hageman, G.S. et al., Prog. Retin. Eye Res. 20:705-732, 2001).
Несколько независимых исследований показали тесную связь между AMD и генетическим полиморфизмом в гене фактора комплемента H (CFH), в которых вероятность AMD увеличена в 7,4 раза у индивидуумов, гомозиготных по аллели риска (Klein, R.J. et al., Science 305:362-364, 2005; Haines et al., Science 305:362-364, 2005; Edwards et al., Science 308:263-264, 2005). Ген CFH был картирован на хромосоме в районе lq31, который был вовлечен в AMD при помощи шести независимых связывающих сканирований (смотри, например, Schultz, D.W., et al., Hum. Mol. Genet. 12:3315, 2003). CFH, как известно, является ключевым регулятором системы комплемента. Было показано, что CFH на клетках и в кровообращении регулирует активность комплемента путем ингибирования активации C3 в C3a и C3b, и за счет инактивации существующего C3b. Депозицию C5b-9 наблюдали в мембране Браша, интеркапиллярных пиллерах и в друзах у пациентов с AMD (Klein et al). Эксперименты по иммунофлюоресценции показывают, что при AMD, полиморфизм CFH может привести к депозиции комплемента в хориоидальных капиллярах и хориоидальных сосудах (Klein et al).
Мембранно-связанный ингибитор комплемента, рецептор 1 комплемента, также локализован в друзах, но не детектируется в RPE-клетках иммуногистохимически. В отличие от этого, второй мембранно-связанный ингибитор комплемента, мембранный кофакторный белок, присутствует в связанных с друзами RPE-клетках, а также в мелких, шаровидных подструктурных элементах в пределах друзы. Эти ранее неизвестные элементы также показывают сильную иммунореактивность для протеолитических фрагментов C3-компонентов комплемента, которые характерно размещаются на участках активации комплемента. Предполагается, что эти структуры представляют остаточный дебрис из вырождающихся RPE-клеток, которые являются мишенями атаки комплемента (Johnson, L.V., et al., Exp. Eye Res. 73:887-896, 2001).
Идентификация и локализация этих многочисленных регуляторов комплемента, а также продуктов активации комплемента (C3a, C5a, C3b, C5b-9) привели исследователей к выводу, что хроническая активация комплемента играет важную роль в процессе биогенеза друзы и этиологии AMD (Hageman et al, Progress Retinal Eye Res. 20:705-32, 2001). Идентификация продуктов активации C3 и C5 в друзе не дает понимания того, активируется ли комплемент по классическому пути, лектиновому пути или альтернативному амплификационному шунту, как это понимается в соответствии с настоящим изобретением, поскольку C3 и C5 являются общими для всех трех путей. При этом в ходе двух исследований определяли иммуно-меченые друзы с помощью антител, специфичных к C1q, важнейшему компоненту для распознавания активации классического пути (Mullins et al., FASEB J. 14: 835-846, 2000; Johnson et al., Exp. Eye Res. 70:441-449, 2000). Оба исследования позволили сделать вывод, что иммуно-меченый C1q в друзах, как правило, не наблюдается. Эти отрицательные результаты с C1q позволили предположить, что активации комплемента в друзах не происходит по классическому пути. Кроме того, иммуно-мечение друз для составляющих иммунного комплекса (легкие цепи IgG, IgM) описано в исследовании Мullins et al., 2000, как представляющее собой от слабого до неустойчивого, что дополнительно указывает на то, что классический путь играет незначительную роль в активации комплемента, которая происходит в процессе этого заболевания.
Два недавно опубликованных исследования оценивали роль комплемента в развитии лазер-индуцированной хориоидальной неоваскуляризации (CNV) на мышах, модели CNV человека. С помощью иммуногистологических способов Bora c коллегами (2005) обнаружили значительную депозицию продуктов активации комплемента C3b и C5b-9 (MAC) в неоваскулярном комплексе после лазерного лечения (Bora et al., J. Immunol. 174:491-7, 2005). Важно, что CNV не развивается у мышей, генетически дефектных по C3 (мыши C3-/-), существенному компоненту, необходимому во всех путях активации комплемента. Уровни информационной РНК для VEGF, TGF-β2 и β-FGF, трех ангиогенных факторов, задействованных в CNV, были повышены в ткани глаза от мышей после лазерно-индуцированной CNV. Существенно, что истощение комплемента приводит к значительному снижению концентрации РНК этих ангиогенных факторов.
С помощью иммуноферментного анализа (ELISA) Nozaki и коллеги показали, что эффективные анафилатоксины C3a и C5a формируются на ранних стадиях лазерно-индуцированной CNV (Nozaki et al., Proc. Natl. Acad Sci. USA 103:2328-33, 2006). Более того, эти два биологически активных фрагмента C3 и C5 индуцировали экспрессии VEGF после инъекции в стекловидное тело мышей дикого типа. В соответствии с этими результатами Nozaki и коллеги показали, что генетическое удаление рецепторов для C3a и C5a снижает экспрессию VEGF и формирование CNV после лазерного повреждения, и что антитело-опосредованная нейтрализация C3a или C5a или фармакологическая блокада их рецепторов также снижает CNV. В предыдущих исследованиях было установлено, что привлечение лейкоцитов и макрофагов, в частности, играет ключевую роль в лазерно-индуцированной CNV (Sakurai et al., Invest. Opthomoi. Vis. Sci. 44:3578-85, 2003; Espinosa-Heidmann, et al., Invest. Opthomol Vis. Sci. 44:3586-92, 2003). В своей статье 2006 года, Nozaki и его коллеги сообщают о том, что привлечение лейкоцитов заметно снижается в мышах C3aR(-/-) и C5aR(-/-) после лазерного повреждения.
Аспект изобретения, таким образом, предоставляет способ ингибирования MASP-2-зависимой активации комплемента для лечения возрастной макулярной дегенерации или других комплемент-опосредованных офтальмологических состояний путем введения композиции, содержащей терапевтически эффективное количество MASP-2-ингибирующего агента в фармацевтическом носителе субъекту, страдающему от такого состояния или другого комплемент-опосредованного офтальмологического состоянии. MASP-2 ингибирующую композицию можно вводить локально в глаз, как например, при помощи опрыскивания или применения композиции в виде геля, мази или капель. Кроме того, MASP-2-ингибирующий агент можно вводить субъекту системно, как, например, путем внутриартериального, внутривенного, внутримышечного, ингаляционного, подкожного или другого парентерального введения или потенциально путем перорального введения не пептидергических агентов. Композиция с MASP-2-ингибирующим агентом может быть в сочетании с одним или более дополнительными терапевтическими агентами, такими, как раскрыто в Патентной публикации США № 2004-0072809-A1. Введение можно повторять, как определяется врачом, до тех пор, пока состояние не будет разрешено или будет контролироваться.
В другом аспекте, изобретение предоставляет способ ингибирования MASP-2-зависимой активации комплемента для лечения субъекта, страдающего от или подверженного риску развития глаукомы. Было показано, что неконтролируемая активация комплемента способствует прогрессированию дегенеративных повреждений ретинальных ганглиозных клеток (RGS), их синапсов и аксонов при глаукоме. Смотри Tezel G. et al., Invest Ophthalmol Vis Sci 51: 5071-5082 (2010). Например, гистопатологические исследования человеческих тканей и in vivo исследования с использованием различных моделей на животных показали, что компоненты комплемента, включая C1q и С3, синтезируются, и терминальный комплекс комплемента формируется в глаукоматозной сетчатке (смотри Stasi К. et al., Invest Ophthalmol Vis Sci 47: 1024-1029 (2006), Кuehn M.H. et al., Exp Eye Res 83:620-628 (2006)). Как описано в Tezel G. et al., было установлено, что, в дополнение к классическому пути, лектиновый путь, вероятно, вовлечен в активацию комплемента при глаукоматозной нейродегенерации, способствуя, таким образом, развитию нейродегенеративных повреждений путем коллатерального клеточного лизиса, воспаления и аутоиммунности. Как описано в Tezel G. et al., протеомный анализ образцов человеческой сетчатки, полученных из глаза доноров с наличием или отсутствием глаукомы, детектировал экспрессию и дифференцированное регулирование нескольких компонентов комплемента. В частности, уровни экспрессии компонентов комплемента лектинового пути были выше, или только детектировались, в глаукоматозных образцах, чем в контролях, включая MASP-1 и MASP-2 и лектин C-типа. Как более подробно описано в Kuehn M.H. et al., Experimental Eye Research 87:89-95 (2008), синтез комплемента и депозиция индуцируется ретинальным I/R, и нарушение каскада комплемента замедляет скорость дегенерации RGC. В этом исследовании мыши, несущие направленное нарушение компоненты С3 комплемента, как было обнаружено, проявляли замедление скорости дегенерации RGC после временного ретинального I/R, по сравнению с нормальными животными.
Результаты этих исследований свидетельствуют о том, что изменения в физиологическом балансе между активацией комплемента и внутренней регуляцией при состояниях глаукоматозного стресса может оказать серьезное влияние на развитие нейродегенеративных повреждений, что свидетельствует о том, что ингибирование активации комплемента, например, посредством введения антитела анти-MASP-2 может быть использовано в качестве терапевтического средства для пациентов с глаукомой.
Аспект изобретения, таким образом, предоставляет способ ингибирования MASP-2-зависимой активации комплемента для лечения глаукомы с помощью введения композиции, содержащей терапевтически эффективное количество MASP-2-ингибирующего агента в фармацевтическом носителе субъекту, страдающему глаукомой. MASP-2-ингибирующую композицию можно вводить локально в глаз, например, путем спринцевания или применения композиции в виде геля, мази или капель. Кроме того, MASP-2-ингибирующий агент может быть введен субъекту системно, как, например, путем внутриартериального, внутривенного, внутримышечного, ингаляционного, подкожного или другого парентерального введения или потенциально путем перорального введения не пептидергических агентов. Введение можно повторять, как определяется врачом, до тех пор, пока состояние не будет разрешено или будет контролироваться.
IV. MASP-2-ИНГИБИРУЮЩИЕ АГЕНТЫ
В одном аспекте, настоящее изобретение предоставляет способы ингибирования негативных последствий MASP-2-зависимой активации комплемента. MASP-2-ингибирующие агенты вводят в количестве, эффективном для ингибирования MASP-2-зависимой активации комплемента у живого субъекта. В практике этого аспекта изобретения, типичные MASP-2-ингибирующие агенты включают: молекулы, которые подавляют биологическую активность MASP-2 (например, малые молекулы-ингибиторы, антитела анти-MASP-2 или блокирующие пептиды, которые взаимодействуют с MASP-2 или мешают белок-белковому взаимодействию), и молекулы, которые снижают экспрессию MASP-2 (например, MASP-2-антисмысловые молекулы нуклеиновой кислоты, MASP-2-специфические молекулы РНК-интерференции и рибозимы MASP-2), тем самым предохраняя MASP-2 от активации лектинового пути комплемента. MASP-2-ингибирующие агенты могут использоваться по-отдельности, в качестве первичной терапии или в комбинации с другими терапевтическими средствами в качестве адъювантной терапии для усиления терапевтического эффекта других медицинских процедур.
Ингибирование MASP-2-зависимой активации комплемента характеризуется по крайней мере одним из следующих изменений в компоненте системы комплемента, которое возникает в результате введения MASP-2-ингибирующего агента в соответствии со способами по изобретению: ингибирование образования или производства продуктов MASP-2-зависимой активации системы комплемента C4b, C3a, C5a и/или С5b-9 (MAC) (определяется, например, как это описано в Примере 2), снижение активации комплемента оценивается в гемолитическом тесте с использованием красных кровяных клеток несенсибилизированного кролика или морской свинки (определяется, например, как описано в Примере 33), снижение С4-расщепления и C4b-депозиции (определяется, например, как описано в Примере 2), или снижение С3-расщепления и C3b-депозиции (определяется, например, как описано в Примере 2).
В соответствии с настоящим изобретением, используются MASP-2-ингибирующие агенты, которые эффективны при ингибировании MASP-2-зависимой активации системы комплемента. MASP-2-ингибирующие агенты, полезные в практике этого аспекта изобретения, включают, например, антитела анти-MASP-2 и их фрагменты, MASP-2-ингибирующие пептиды, малые молекулы, растворимые рецепторы MASP-2 и ингибиторы экспрессии. MASP-2-ингибирующие агенты могут препятствовать MASP-2-зависимой активации системы комплемента, блокируя биологическую функцию MASP-2. Например, ингибирующий агент может эффективно блокировать MASP-2 белок-белковые взаимодействия, препятствовать димеризации или сборке MASP-2, блокировать связывание Ca++, быть помехой MASP-2 активному сайту сериновой протеазы или может снижать экспрессию белка MASP-2.
В некоторых вариантах осуществления, MASP-2-ингибирующие агенты избирательно подавляют MASP-2 активацию комплемента, оставляя C1q-зависимую активацию системы комплемента функционально интактной.
В одном варианте осуществления, MASP-2 ингибирующий агент, пригодный в способах по изобретению, представляет собой специфический MASP-2-ингибирующий агент, который специфически связывается с полипептидом, содержащим SEQ ID NO:6, с аффинностью по крайней мере в десять раз большей, чем для других антигенов системы комплемента. В другом варианте осуществления, MASP-2-ингибирующий агент специфически связывается с полипептидом, содержащим SEQ ID NO:6, с аффинностью по крайней мере в 100 раз большей, чем для других антигенов системы комплемента. Аффинность связывания MASP-2-ингибирующего агента может быть определена, используя подходящий тест связывания.
Полипептид MASP-2 проявляет молекулярную структуру, аналогичную MASP-1, MASP-3, и С1r и С1s, протеазам C1-системы комплемента. Молекула кДНК, приведенная в SEQ ID NO:4, кодирует типичный пример MASP-2 (состоящий из последовательности аминокислот, приведенных в SEQ ID NO:5) и предоставляет полипептид MASP-2 человека с лидерной последовательностью (а.к. 1-15), которая отщепляется после секреции, образуя в результате зрелую форму MASP-2 человека (SEQ ID NO:6). Как показано на ФИГУРЕ 2, ген MASP-2 человека включает в себя двенадцать экзонов. кДНК MASP-2 человека кодируется экзононами B, C, D, F, G, H, 1, J, К и L. Альтернативный сплайсинг приводит к образованию 20 кДа белка, называемого MBL-связанный белок 19 («MApl9», также называемый «sMAP») (SEQ ID NO:2), кодируемый (SEQ ID NO:1), вытекающей из экзонов B, C, D и E, как показано на ФИГУРЕ 2. Молекула кДНК, приведенная в SEQ ID NO:50, кодирует MASP-2 мыши (состоящий из последовательности аминокислот, изложенной в SEQ ID NO:51) и предоставляет полипептид MASP-2 мыши с лидерной последовательностью, которая отщепляется после секреции, образуя в результате зрелый MASP-2 мыши (SEQ ID NO:52). Молекула кДНК, изложенная в SEQ ID NO:53, кодирует MASP-2 крысы (состоящий из последовательности аминокислот, изложенных в SEQ ID NO:54) и предоставляет полипептид MASP-2 крысы с лидерной последовательностью, которая отщепляется после секреции, образуя в результате зрелую форму MASP-2 крысы (SEQ ID NO:55).
Специалисты в рассматриваемой области поймут, что последовательности, раскрытые в SEQ ID NO:4, SEQ ID NO:50 и SEQ ID NO:53, представляют отдельные аллели MASP-2 человека, мыши и крысы, соответственно, и что, как ожидается, произойдет аллельная вариация и альтернативный сплайсинг. Аллельные варианты нуклеотидных последовательностей, показанных в SEQ ID NO:4, SEQ ID NO:50 и SEQ ID NO:53, в том числе такие, которые содержат молчащие мутации и такие, в которых мутации приводят к заменам в аминокислотной последовательности, входят в сферу применения настоящего изобретения. Аллельные варианты последовательности MASP-2 могут быть клонированы путем зондирования кДНК или геномных библиотек различных индивидуумов в соответствии со стандартными процедурами.
Домены белка MASP-2 человека (SEQ ID NO:6) показаны на ФИГУРЕ 1 и 2А и включают N-концевой домен C1r/C1s/VEGF морского ежа/морфогенетического белка костей (CUBI) (а.к. 1-123 последовательности SEQ ID NO:6), домен, подобный эпидермальному фактору роста (а.к. 122-166), второй CUBI домен (а.к. 167-293), а также тандем доменов контролирующего белка комплемента и домена сериновой протеазы. Альтернативный сплайсинг гена MASP 2 приводит к образованию MАp19, показанного на ФИГУРЕ 1. Map19 представляет собой неферментный белок, содержащий N-концевую CUB1-EGF область MASP-2 с четырьмя дополнительными остатками (EQSL), полученными из экзона E, как показано на ФИГУРЕ 1.
Некоторые белки, как было показано, связываются или взаимодействуют с MASP-2 через белок-белковые взаимодействия. Например, MASP-2, как известно, связывается с и формирует Ca2+-зависимые комплексы с лектиновыми белками MBL, H-фиколином и L-фиколином. Каждый MASP-2/лектиновый комплекс, как было показано, активирует комплемент через MASP-2-зависимое расщепление белков C2 и C4 (Ikeda, K., et al., J. Biol Chem. 262:7451-7454, 1987; Matsushita, M., et al, J. Exp. Med 176: 1497-2284, 2000; Matsushita, M., et al., J. Immunol 165:3502-3506, 2002). Исследования показали, что CUB1-EGF домены MASP-2 необходимы для ассоциации MASP-2 с MBL (Thieiens, N.M., et al., J. Immunol, 166:5068, 2001). Кроме того, было показано, что домены CUBIEGFCUII опосредуют димеризацию MASP-2, которая необходима для формирования активного MBL-комплекса (Wallis, R., et al, J. Biol. Chem. 275:30962-30969. 2000). Поэтому могут быть идентифицированы MASP-2-ингибирующие агенты, которые связываются с или препятствуют областям-мишеням MASP-2, как известно, важным для MASP-2-зависимой активации комплемента.
АНТИТЕЛА АНТИ-MASP-2
В некоторых вариантах осуществления этого аспекта изобретения, MASP-2-ингибирующий агент содержит анти-MASP-2 антитело, которое ингибирует MASP-2-зависимую активацию системы комплемента. Антитела анти-MASP-2, полезные в этом аспекте изобретения, включают поликлональные, моноклональные или рекомбинантные антитела, полученные из любого антитела, продуцируемого млекопитающим, и могут быть мультиспецифическими, химерными, гуманизированными, анти-идиотипическими и фрагментами антител. Фрагменты антител включают фрагменты Fab, Fab', F(ab)2, F(ab')2, Fv, фрагменты scFv и одноцепочечные антитела, как изложено далее в настоящем документе.
Некоторые антитела анти-MASP-2 были описаны в литературе, некоторые из которых перечислены ниже в ТАБЛИЦЕ 1. Эти ранее описанные антитела анти-MASP-2 могут быть проверены на способность ингибировать MASP-2-зависимую активацию системы комплемента с помощью тестов, описанных в настоящем документе. Например, были выявлены Fab2-антитела против MASP-2 крысы, которые блокировали MASP-2 зависимую активацию комплемента, как более подробно описано в Примерах 10 и 11 настоящего документа. Как только устанавливается, что антитело анти-MASP-2 функционирует как MASP-2-ингибирующий агент, оно может быть использовано для производства анти-идиотипических антител, и использовано для идентификации других MASP-2-связывающих молекул, как дополнительно описано ниже.
АНТИТЕЛА АНТИ-MASP-2 С УМЕНЬШЕННОЙ ЭФФЕКТОРНОЙ ФУНКЦИЕЙ
В некоторых вариантах осуществления этого аспекта изобретения, антитело анти-MASP-2 обладает уменьшенной эффекторной функцией для уменьшения воспаления, которое может возникнуть в результате активации классического пути комплемента. Способность молекул IgG инициировать классический путь комплемента, как было показано, находится в пределах Fc-части молекулы (Duncan, A.R., et al., Nature 332:738-740 1988). Молекулы IgG, в которых Fc-часть молекулы была удалена путем ферментативного расщепления, лишены этой эффекторной функции (смотри: Harlow, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, New York, 1988). Соответственно, антитела с уменьшенной эффекторной функцией могут быть получены как результат утраты Fc-части молекул путем получения генноинженерно модифицированной последовательности Fc, которая сводит к минимуму эффекторную функцию, или являются изотипом либо IgG2, или IgG4 человека.
Антитела с уменьшенной эффекторной функцией могут быть произведены с помощью стандартных молекулярно-биологических манипуляций с Fc-частью тяжелой цепи IgG, как описано в Примере 9 настоящего документа, и также описано в Jolliffe et al., Int'l Rev. Immunol, 10:241-250, 1993, и Rodrigues et al., J. Immunol 151:6954-6961, 1998. Антитела с уменьшенной эффекторной функцией также включают в себя изотипы IgG2 и IgG4 человека, которые имеют пониженную способность к активации комплемента и/или взаимодействию с Fc-рецепторами (Ravetch, J.V., et al., Annu. Rev. Immunol. 9:457-492, 1991 ; Isaacs, J.D., et al., J. Immunol 148:3062-3071 , 1992; van de Winkel, J.G., et al., Immunol Today 14:215-221, 1993). Гуманизированные или полностью человеческие антитела, специфические к MASP-2 человека, состоящие из изотипов IgG2 или IgG4, можно производить на основе одного из нескольких способов, известных любому специалисту в данной области, как описано в Vaughan, T.J., et al, Nature Bioiechnical 16:535-539, 1998.
ПРОИЗВОДСТВО АНТИТЕЛ АНТИ-MASP-2
Антитела анти-MASP-2 могут быть получены с использованием полипептидов MASP-2 (например, полноразмерного MASP-2) или с помощью антигенных пептидов, несущих эпитоп MASP-2 (например, часть полипептида MASP-2). Иммуногенные пептиды могут быть в пределах пяти аминокислотных остатков. Например, полипептид MASP-2, включащий всю аминокислотную последовательность SEQ ID NO:6, можно использовать, чтобы индуцировать антитела анти-MASP-2, пригодные в способе по изобретению. Специфические домены MASP-2, вовлеченные, как известно, в белок-белковые взаимодействия, как, например, CUBI и домены CUBIEGF, а также, область, охватывающую активный участок сериновой протеазы, можно экспрессировать в виде рекомбинантных полипептидов, как описано в Примере 3, и использовать в качестве антигенов. Кроме того, пептиды, содержащие часть по крайней мере из 6 аминокислот полипептида MASP-2 (SEQ ID NO:6), также пригодны, чтобы индуцировать MASP-2-антитела. Дополнительные примеры антигенов-производных MASP-2, пригодных для индуцирования MASP-2-антител, приводятся ниже в ТАБЛИЦЕ 2. Пептиды и полипептиды MASP-2, используемые для увеличения антител, могут быть выделены в качестве природных полипептидов, или рекомбинантных или синтетических пептидов и каталитически неактивных рекомбинантных полипептидов, таких как MASP-2A, как это описано далее в Примерах 5-7. В некоторых вариантах осуществления этого аспекта изобретения, антитела анти-MASP-2 получают с помощью линии трансгенных мышей, как описано в Примерах 8 и 9 и более подробно описано ниже.
Антигены, пригодные для производства антител анти-MASP-2, также включают в себя слитые полипептиды, таких как слияние MASP-2 или его части с полипептидом иммуноглобулина или с мальтозо-связывающим белком. Полипептидный иммуноген может быть полноразмерной молекулой или ее частью. Если полипептидная часть является гаптеноподобной, то такую часть можно успешно объединять с или присоединять к макромолекулярному носителю (например, гемоцианин лимфы улитки (KLH), бычий сывороточный альбумин (БСА) или анатоксин столбняка) для иммунизации.
ПОЛИКЛОНАЛЬНЫЕ АНТИТЕЛА
Поликлональные антитела против MASP-2 можно подготовить при помощи иммунизации животного полипептидом MASP-2 или иммуногенной его частью с помощью способов, которые хорошо известны любому специалисту в рассматриваемой области. Смотри, например, Green et al., "Production of Polyclonal Antisera," in Immunochemical Protocols (Мanson, ed.), page 105, и также, как описано в Примере 6. Иммуногенность полипептида MASP-2 может быть увеличена за счет использования адъювантов, в том числе минеральных гелей, таких, как гидроокись алюминия или адъювант Фрейнда (полный или неполный), поверхностно-активные вещества, такие как лизолецитин, полиолы плуроника, полианионы, масляные эмульсии, гемоцианин лимфы улитки и динитрофенол. Поликлональные антитела обычно индуцируются в животных, таких как лошади, коровы, собаки, курицы, крысы, мыши, кролики, морские свинки, козы или овцы. Кроме того, антитело анти-MASP-2, пригодное в настоящем изобретении, также можно получать от приматов, отличных от человека. Общие способы индуцирования диагностически и терапевтически полезных антител в бабуинах можно найти, например, в Goldenberg et аl., международная патентная заявка № WO 91/11465, и в Losman, M.J., et al., Int. J, Cancer 46:310, 1990. Сыворотки, содержащие иммунологически активные антитела, получают из крови таких иммунизированных животных с использованием стандартных процедур, известных в рассматриваемой области.
МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА
В некоторых вариантах осуществления, MASP-2-ингибирующий агент представляет собой моноклональное антитело анти-MASP-2. Моноклональные антитела анти-MASP-2 являются весьма специфическими, будучи направлены против одного эпитопа MASP-2. Как используется здесь, модификатор «моноклональное» указывает на характер антитела как полученное из существенно однородной популяции антител, и не может толковаться как требующее производства антитела каким-либо специфическим способом. Моноклональные антитела можно получать, используя любой способ, который обеспечивает производства молекул антитела при помощи непрерывной клеточной линии в культуре, например, гибридомный способ, описанный в Kohler, G., et al., Nature 256:495, 1975, или их можно получить при помощи способов рекомбинантной ДНК (смотри, например, Патент США No 4,816,567 к Cabilly), Моноклональные антитела можно изолировать из фаговых библиотек антител, используя способы, описанные в Clackson, T., et al., Nature 352:624-628, 1991, и Marks, J.D., et al., J. Mol Biol. 222:581-597, 1991. Такие антитела могут представлять собой иммуноглобулины любого иммуноглобулинового класса, включая IgG, IgM, IgE, IgA, IgD и любой их подкласс.
Например, моноклональные антитела могут быть получены при помощи инъецирования подходящему млекопитающему (например, в мыши BALB/c) композиции, содержащей полипептид MASP-2 или его части. По истечении заданного периода времени, спленоциты отбирают у мыши и суспендируют в среде для клеточного культивирования. Спленоциты затем сливают с бессмертной клеточной линией, чтобы образовать гибридому. Образовавшиеся гибриды выращивают в культуре клеток и проверяют на их способность производить моноклональное антитело против MASP-2. Пример, в котором подробно описывается производство моноклональных антител анти-MASP-2, приводится в Примере 7. (Смотри также Current Protocols in Immunology, Vol. 1., John Wiley & Sons, pages 2.5.1-2.6.7, 1991.)
Моноклональные антитела человека могут быть получены в результате использования трансгенных мышей, которые были разработаны для производства специфических антител человека в ответ на антигенную провокационную пробу. В этой методике, элементы локуса тяжелой и легкой цепи человеческого иммуноглобулина вводят в линии мышей, полученных из линии эмбриональных стволовых клеток, которые содержат направленное нарушение эндогенного локуса тяжелой цепи и легкой цепи иммуноглобулина. Трансгенные мыши могут синтезировать человеческие антитела, специфические для антигенов человека, таких как антигены MASP-2, описанные в настоящем документе, и мыши могут быть использованы для производства гибридом, секретирующих антитело к MASP-2 человека путем слияния B-клеток таких животных с подходящими миеломными клеточными линиями с использованием обычных технологий Кохлера-Мильштейна, как описано в Примере 7. Трансгенные мыши с геномом иммуноглобулинов человека имеются в продаже (например, от Abgenix, inc., Fremont, CA и Medarex, Inc., Annandale, N.J.). Способы получения антител человека от трансгенных мышей описаны, например, Green, L.L., et al., Nature Genet. 7: 13, 1994; Lonberg, N., et al, Nature 368:856, 1994; и Taylor, L.D., et al., Int. Immun. 6:579, 3994.
Моноклональные антитела могут быть выделены и очищены из гибридомных культур при помощи множества хорошо зарекомендовавших себя способов. Такие способы выделения включают аффинную хроматографию с Protein A-Sepharose, эксклюзионную хроматографию и ионообменную хроматографию (смотри, например, Coligan at pages 2.7.1-2.7.12 and pages 2.9.1-2.9.3; Baines et al., "Purification of immunoglobulin G (IgG)," в Methods in Molecular Biology, The Humana Press, Inc., Vol, 10, pages 79-104, 1992).
После получения поликлональные, моноклональные или фаго-производные антитела сначала тестируют на специфичность связывания с MASP-2. Различные анализы, известные специалистам в рассматриваемой области, могут быть использованы для обнаружения антител, которые специфически связываются с MASP-2. Типичные тесты включают: Вестерн-блоттинг или иммунопреципитационный анализ с помощью стандартных способов (например, как описано в Ausubel et al.), иммуноэлектрофорез, фермент-связанный иммуно-сорбентный анализ, дот-блоттинг, тесты по ингибированию или конкурентные анализы и сэндвич-анализы (как описано в Harlow and Land, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1988). После выявления того, что антитела специфически связываются с MASP-2, антитела анти-MASP-2 тестируют на способность функционировать в качестве MASP-2-ингибирующего агента в одном из нескольких анализов, таких как, например, тест на лектин-специфическое C4-расщепление (описан в Примере 2), анализ C3b-депозиции (описан в Примере 2) или анализ C4b-депозиции (описан в Примере 2).
Аффинность моноклональных антител анти-MASP-2 может без труда определить любой специалист в рассматриваемой области (смотри, например, Scatchard, А., NY Acad. Sci. 51:660-672, 1949). В одном варианте осуществления моноклональные антитела анти-MASP-2, пригодные в способах по изобретению, связывают MASP-2 с аффинностью связывания <100 нМ, предпочтительно <10 нМ и наиболее предпочтительно <2 нМ.
ХИМЕРНЫЕ/ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА
Моноклональные антитела, пригодные в способе по изобретению, включают химерные антитела, в которых часть тяжелой и/или легкой цепи идентичны или гомологичны соответствующим последовательностям в антителах, полученных из определенных видов или принадлежащих к определенному классу или подклассу антител, в то время как остаток цепи(ей) идентичен или гомологичен соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих к другому классу или подклассу антител, а также фрагментам таких антител (Патент США No 4816567, к Cabilly; и Morrison, S.L., et al., Proc. Natl Acad Sci. USA 81:-6851-6855, 1984).
Одной из форм химерного антитела, полезного в изобретении, является гуманизированное моноклональное антитело анти-MASP-2. Гуманизированные формы антител, отличных от антител человека (например, мышиные), представляют собой химерные антитела, которые содержат минимальную последовательность, полученных из иммуноглобулина, отличного от иммуноглобулина человека. Гуманизированные моноклональные антитела получают путем передачи отличных от человеческих (например, мышиных) гипервариабельных участков (CDR) из тяжелых и легких вариабельных цепей иммуноглобулина мыши в вариабельную область человека. Как правило, остатки антител человека затем замещают в каркасных областях аналогов, отличных от таковых человека. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются в реципиентном антителе или в донорском антителе. Эти изменения вносятся в целях дальнейшего усовершенствования эффективности антитела. В общем, гуманизированное антитело будет включать практически все из по крайней мере одной, и, как правило, двух вариабельных областей, в которых все или практически все гипервариабельные петли соответствуют таковым иммуноглобулина, отличного от иммуноглобулина человека, и все или практически все Fv каркасные области являются таковыми последовательности иммуноглобулина человека. Гуманизированное антитело также, при необходимости, будет включать по крайней мере часть константной области (Fc) иммуноглобулина, как правило, иммуноглобулина человека. Для получения дополнительной информации смотри Jones, P.T, et al., Nature 321:522-525, 1986; Reicbmann, L., et al., Nature 332:323-329, 1988; и Presta, Curr. Op. Struct. Biol. 2:593-596, 1992.
Гуманизированные антитела, полезные для изобретения, включают в себя моноклональные антитела человека, включая по крайней мере MASP-2-связывающую CDR3-область. Кроме того, Fc-части могут быть заменены таким образом, чтобы произвести IgA или IgM, а также IgG-антитела человека. Такие гуманизированные антитела будут иметь особую клиническую полезность, поскольку они должны специфически узнавать MASP-2 человека, но сами по себе не вызывают иммунную реакцию на антитело в организме человека. Следовательно, они лучше подходят для in vivo введения в организмы людей, особенно когда необходимо повторное или длительное применение.
Пример образования гуманизированного антитела анти-MASP-2 из мышиного моноклонального антитела анти-MASP-2 предоставлен в Примере 6 настоящего документа. Технологии производства гуманизированных моноклональных антител также описаны, например, Jones, P.T, et al., Nature 321:522, 1986; Carter, P., et al., Proc. Natl Acad Sci. USA 89:4285, 1992; Sandhu, J.S., Crit. Rev. Biotech. 12:437, 1992; Singer, I.I., et al., J. Immun. 150:2844, 1993; Sudhir (ed.), Antibody Engineering Protocols, Humana Press, inc., 1995; Kelley, "Engineering Therapeutic Antibodies," in Protein Engineering: Principles and Practice, Cleland et al. (eds.), John Wiley & Sons, Inc., pages 399-434, 1996; и патентом США № 5,693,762, к Queen, 1997. Кроме того, существуют коммерческие организации, которые синтезируют гуманизированные антитела от специфических участков мышиных антител, такие как Protein Design Labs (Mountain View, CA).
РЕКОМБИНАНТНЫЕ АНТИТЕЛА
Антитела анти-MASP-2 можно также создавать с использованием рекомбинантных способов. Например, человеческие антитела можно сделать с помощью экспрессионных библиотек иммуноглобулинов человека (доступно, например, от Stratagene, Corp., La Jolla, CA), чтобы произвести фрагменты антител человека (VН, VL, Fv, Fd, Fab или F(ab')2). Эти фрагменты затем используются для конструирования целых антител человека при помощи способов, аналогичных способам для получения химерных антител.
АНТИ-ИДИОТИПИЧЕСКИЕ АНТИТЕЛА
После того, как у антитела анти-MASP-2 выявляется желаемая ингибирующая активность, такие антитела могут быть использованы для создания анти-идиотипических антител, которые напоминают часть MASP-2 с помощью способов, которые хорошо известны в рассматриваемой области. Смотри, например, Greenspan, N.S., et al., FASEB J. 7:437, 1993. Например, антитела, которые связываются с MASP-2 и конкурентно ингибируют MASP-2-белковое взаимодействие, необходимое для активации комплемента, могут быть использованы для создания анти-идиотипов, которые напоминают сайт связывания MBL на белке MASP-2 и, следовательно, связывают и нейтрализуют связывающий лиганд из MASP-2, такой как, например, MBL.
ФРАГМЕНТЫ ИММУНОГЛОБУЛИНОВ
MASP-2-ингибирующие агенты, полезные в способе по изобретению, включают в себя не только целые молекулы иммуноглобулинов, но также хорошо известные фрагменты, в том числе фрагменты Fab, Fab', F(ab)2, F(ab')2 и Fv, фрагменты scFv, диатела, линейные антитела, молекулы одноцепочечных антител и мультиспецифические антитела, образованные из фрагментов антител.
В рассматриваемой области хорошо известно, что только малая часть молекулы антитела, паратоп, участвует в связывании антитела со своим эпитопом (смотри, например, Clark, W.R., The Experimental Foundations of Modern Immunology, Wiley & Sons, Inc., NY, 1986). Области pFc' и Fc антитела представляют собой эффекторы классического пути комплемента, но не участвуют в связывании антигена. Антитело, из которого ферментативно вырезали область pFc', или которое было произведено без области pFc', обозначается как фрагмент F(ab')2 и сохраняет оба сайта связывания антигена интактного антитела. Изолированный фрагмент F(ab')2 называется бивалентным моноклональным фрагментом из двух его сайтов связывания антигена. Аналогично, антитело, из которого ферментативно вырезали область Fc, или который был произведен без области Fc, обозначают Fab-фрагментом, и сохраняет один из сайтов связывания антигена интактной молекулы антитела.
Фрагменты антител могут быть получены путем протеолитического гидролиза, такого как расщепление пепсином или папаином целых антител с помощью традиционных способов. Например, фрагменты антител можно производить путем ферментативного расщепления антител пепсином, чтобы предоставить 5S фрагмент, обозначаемый как F(ab')2. Данный фрагмент можно в дальнейшем расщеплять с помощью тиол-восстанавливающего агента для производства 3,5S Fab' моновалентных фрагментов. При необходимости, реакцию расщепления можно выполнять с помощью блокирующей группы для сульфгидрильных групп, которые получаются в результате разрыва дисульфидных связей. В качестве альтернативы, ферментативное расщепление с помощью пепсина производит два моновалентных Fab-фрагмента и Fc-фрагмент непосредственно. Эти способы описаны, например, в патенте США № 4,331,647 к Goldenberg; Nisonoff, A., et al., Arch. Biochem. Biophys. 89:230, 1960; Porter, R.R., Biochem. J. 73:119, 1959; Edelman, et al., в Methods in Enzymology 1:422, Academic Press, 1967; и в Coligan на страницах 2.8.1-2.8.10 и 2.10.-2.10.4.
В некоторых вариантах осуществления, использование фрагментов антител с отсутствием Fc-области предпочтительно для того, чтобы избежать активации классического пути комплемента, которая инициируется при связывании Fс с Fcγ-рецептором. Существует несколько способов, с помощью которых можно производить MoАb, что позволяет избежать взаимодействий с Fcγ-рецептором. Например, Fc-область моноклонального антитела может быть удалена частичным перевариванием с помощью протеолитических ферментов (например, расщепление фицином), тем самым образуя, например, фрагменты антигенсвязывающего антитела, такие как Fab или F(ab)2-фрагменты (Mariani, M., et al., Mol. Immunol. 28:69-71, 1991). Кроме того, изотип γ4 IgG человека, который не связывается с Fcγ-рецепторами, может использоваться при конструировании гуманизированных антител, как это описано в настоящем документе. Антитела, одноцепочечные антитела и антиген-связывающие домены, у которых отсутствует Fc-домен, также могут быть сконструированы с использованием рекомбинантных технологий, описанных в настоящем документе.
ФРАГМЕНТЫ ОДНОЦЕПОЧЕЧНЫХ АНТИТЕЛ
Альтернативно, можно создать связывающие молекулы с единой пептидной цепью, специфичные к МASP-2, в которой Fv-области тяжелой и легкой цепи связаны. Fv-фрагменты могут быть соединены пептидным линкером с образованием одноцепочечного антиген-связывающего белка (scFv). Эти одноцепочечные антиген-связывающие белки готовят путем конструирования структурного гена, включающего последовательности ДНК, кодирующие Vн и VL домены, которые соединены олигонуклеотидом. Структурный ген встраивают в вектор экспрессии, который впоследствии вводят в хозяйскую клетку, такую как E. сoli. Рекомбинантные клетки-хозяева синтезируют единую полипептидную цепь с линкерным пептидом, соединяющим два V-домена. Способы получения scFvs описаны, например, Whitlow, et al., "Methods: A Companion to Methods in Enzyrnology" 2:97, 1991; Bird, et al., Science 242:423, 1988; Патент США № 4946778, к Ladner; Pack, P., et al., Bio/Technology 11: 1271, 1993.
В качестве иллюстративного примера, MASP-2-специфический scFv может быть получен путем воздействия лимфоцитов на полипептид MASP-2 in vitro и селектирования дисплейных библиотек антител в фаговых векторах или векторах, аналогичных этому (например, посредством использования иммобилизованного или меченого белка или пептида MASP-2). Гены, кодирующие полипептиды, имеющие потенциальные MASP-2-полипептид связывающие домены, могут быть получены путем скринирования случайных пептидных библиотек, отображенных на фаге или на бактериях, таких как E. coli. Эти дисплейные библиотеки случайных пептидов могут быть использованы для скринирования пептидов, которые взаимодействуют с MASP-2. Способы создания и скрининга таких дисплейных библиотек случайных пептидов известны в рассматриваемой области (Патент США № 5223409, к Ladner; Патент США № 4946778, к Ladner; Патент США № 5403484, к Ladner; Патент США № 5571698, к Ladner; и Kay et al., Phage Display of Peptides and Proteins, Academic Press, Inc., 1996) и дисплейные библиотеки случайных пептидов и наборы для проверки таких библиотек имеются в продаже, например, от CLONTECH Laboratories, Inc. (Пало-Альто, Калифорния), Invitrogen Inc. (Сан-Диего, Калифорния), New England Biolabs, Inc. (Беверли, Массачусетс), и Pharmacia LKB Biotechnology Inc. (Piscataway, штат Нью-Джерси).
Другая форма фрагмента антитела анти-MASP-2, пригодного в этом аспекте изобретения, представляет собой пептид, кодирующий отдельный гипервариабельный участок (CDR), который связывается с эпитопом на антигене MASP-2 и ингибирует MASP-2-зависимую активацию комплемента. CDR-пептиды («минимальные узнающие единицы») могут быть получены путем конструирования генов, кодирующих CDR представляющего интерес антитела. Такие гены подготавливают, например, с помощью полимеразной цепной реакции для синтеза вариабельной области от РНК антитело-продуцирующих клеток (смотри, например, Larrick et al., Methods: A Companion to Methods in Enzymology 2: 106, 1991; Courtenay-Luck, "Genetic Manipulation of Monoclonal Antibodies," в Monoclonal Antibodies: Production, Engineering and Clinical Application, Ritter et al. (eds.), page 166, Cambridge University Press, 1995; и Ward et al, "Genetic Manipulation and Expression of Antibodies," в Monoclonal Antibodies: Principles and Applications, Birch et al, (eds,), page 137, Wiley-Liss, Inc., 1995).
MASP-2 антитела, описанные в данном документе, вводят субъекту, которые в этом нуждаются, чтобы ингибировать MASP-2-зависимую активацию комплемента. В некоторых вариантах осуществления, MASP-2-ингибирующий агент является высокоаффинным человеческим или гуманизированным моноклональным антителом анти-MASP-2 с уменьшенной эффекторной функцией.
ПЕПТИДНЫЕ ИНГИБИТОРЫ
В некоторых вариантах осуществления этого аспекта изобретения, MASP-2-ингибирующий агент содержит изолированные пептидные ингибиторы MASP-2, в том числе изолированные природные пептидные ингибиторы и синтетические пептидные ингибиторы, которые ингибируют MASP-2-зависимую активацию системы комплемента. В настоящем документе термин «изолированные пептидные ингибиторы MASP-2» относится к пептидам, которые ингибируют MASP-2-зависимую активацию комплемента путем связывания с, конкурируя с MASP-2 за связывание с другой узнающей молекулой (например, MBL, H-фиколин, М-фиколин, или L-фиколин) в лектиновом пути, и/или непосредственно взаимодействующих с MASP-2 для ингибирования MASP-2-зависимой активации комплемента, которые в существенной степени очищены и по существу свободны от других веществ, с которыми они могут находиться в природе, до степени, целесообразной и соответствующей их использованию по назначению.
Пептидные ингибиторы успешно используются in vivo для создания препятствия белок-белковым взаимодействиям и каталитическим участкам. Например, пептидные ингибиторы для молекул адгезии, структурно родственных LFA-1, недавно были одобрены для применения в клинической практике при коагулопатиях (Ohman, Е.М., et al, European Heart J. 16:50-55, 1995). Были описаны короткие линейные пептиды (<30 аминокислот), которые препятствуют или мешают интегрин-зависимой адгезии (Murayama, O. Et al., J. Biochem. 120:445-51, 1996). Более длинные пептиды, длиной от 25 до 200 аминокислотных остатков, успешно применяются для блокирования интегрин-зависимой адгезии (Zhang, L., et al., J. Biol. Chem. 271 (47):29953-57, 1996). В общем, более длинные пептидные ингибиторы имеют большие аффинности и/или более низкие скорости диссоциации, чем короткие пептиды, и могут представлять собой, следовательно, более эффективные ингибиторы. Циклические пептидные ингибиторы, как было показано, также являются эффективными ингибиторами интегринов in vivo для лечения воспалительного заболевания человека (Jackson, D.Y., et al., J. Med. Chem. 40:3359-68, 1997). Один из способов получения циклических пептидов предполагает синтез пептидов, у которых концевыми аминокислотами пептида являются цистеины, позволяющие тем самым пептиду существовать в циклической форме за счет дисульфидных связей между концевыми аминокислотами, которые, как было показано, улучшают аффинность и время полужизни in vivo для лечения гемопоэтических новообразований (например, патент США № 6649592, к Larson).
СИНТЕТИЧЕСКИЕ ПЕПТИДНЫЕ ИНГИБИТОРЫ MASP-2
MASP-2-ингибирующие пептиды, пригодные в способах этого аспекта изобретения, иллюстрируются последовательностями аминокислот, которые имитируют области-мишени, важные для функции MASP-2. Ингибирующие пептиды, полезные в практике способов по изобретению, варьируют по размеру от около 5 аминокислот до около 300 аминокислот. В ТАБЛИЦЕ 3 приводится список типичных ингибирующих пептидов, которые могут быть полезны в практике этого аспекта изобретения. Кандидатный MASP-2-ингибирующий пептид может быть проверен на способность функционировать в качестве MASP-2-ингибирующего агента в одном из нескольких анализов, в том числе, например, анализа лектин-специфического C4-расщепления (описан в Примере 2), и анализа C3b-депозиции (описан в Примере 2).
В некоторых вариантах осуществления, MASP-2-ингибирующие пептиды получают из полипептидов MASP-2 и селектируют из полноразмерного зрелого белка MASP-2 (SEQ ID NO:6), или из специфического домена белка MASP-2, такого как, например, домена CUBI (SEQ ID NO:8), домена CUBIEGF (SEQ ID NO:9), домена EGF (SEQ ID NO:11) и домена сериновой протеазы (SEQ ID NO:12). Как описано ранее, области CUBEGFCUBII, как было показано, необходимы для димеризации и связывания с MBL (Thielens et al. выше). В частности, пептидная последовательность TFRSDYN (SEQ ID NO:16) в CUBI-домене MASP-2, как было показано, вовлечена в связывание с MBL в исследовании, которое позволило выявить человека, несущего гомозиготную мутацию замены Asp-105 на Gly-105, что приводит к потере MASP-2 из MBL-комплекса (Stengaard-Pedersen, K., et at. New England J. Med. 349:554-560, 2003).
В некоторых вариантах осуществления, MASP-2 ингибирующие пептиды являются производными от лектиновых белков, которые связываются с MASP-2 и участвуют в лектиновом пути комплемента. Было идентифицировано несколько различных лектинов, которые принимают участие в этом пути, в том числе маннан-связываний лектин (MBL), L-фиколин, М-фиколин и H-фиколин, (Ikeda, K., et al., J. Biol. Chem. 262:7451-7454, 1987; Matsushita, M. et al., J. Exp. Med. 176: 1497-2284, 2000; Matsushita, M. et al., J. Immunol, 168: 3502-3506, 2002). Эти лектины присутствуют в сыворотке крови в качестве олигомеров гомотримерных субъединиц, каждая из которых имеет N-концевые коллаген-подобные волокна с углеводными узнающими доменами. Эти различные лектины, как было показано, связываются с MASP-2, и комплекс лектин/MASP-2 активирует комплемент через расщепление белков C2 и C4. H-фиколин имеет амино-концевую область в 24 аминокислоты, коллаген-подобный домен с 11 повторами Gly-Хаа-Yaa, перешеечный домен в 12 аминокислот и фибриноген-подобный домен в 207 аминокислот (Matsushita, M., et al., J. Immunol 168:3502-3506, 2002). H-фиколин связывается с GlcNAc и агглютинирует эритроциты человека, покрытые LPS, полученным из S. typhimurium, S. minnesota и E. coli. H-фиколин, как было показано, связан с MASP-2 и Map19 и активирует лектиновый путь. Id, L-фиколин/P35 также связывается с GlcNAc и, как было показано, связан с MASP-2 и MAp19 в сыворотке крови человека, и данный комплекс, как было показано, активирует лектиновый путь (Matsushita, М., et al., J. Immunol. 164:2281, 2000). Соответственно, MASP-2 ингибирующие пептиды, полезные в данном изобретении, могут содержать область не менее 5 аминокислот, выбранных из белка MBL (SEQ ID NO:21), белка H-фиколина (Инвентаризационный номер Genbank NM_173452), белка М-фиколина (Инвентаризационный номер Genbank O00602) и белка L-фиколина (Инвентаризационный номер Genbank NM_015838).
Конкретнее, ученые определили, что MASP-2-связывающий сайт MBL находится в пределах 12 триплетов Gly-X-Y «GKD GRD GTK GЕК GEP GQG LRG LQG POG KLG POG NOG PSG SOG PKG QKG DOG КS» (SEQ ID NO:26), который лежит между шарниром и перешейком в C-концевой части коллаген-подобного домена MBP (Wallis, R. et al., J. BiolChem, 279: 14065, 2004). Эта область MASP-2-связывающего сайта также очень консервативна в H-фиколине человека и L-фиколине человека. Был описан консенсусный сайта связывания, который присутствует во всех трех лектиновых белках, содержащий аминокислотную последовательность «ОGК-Х-GP» (SEQ ID NO:22), где буква «O» представляет гидроксипролин, а буква «X» представляет собой гидрофобный остаток (Wallis et al., 2004 г., см. выше). Соответственно, в некоторых вариантах осуществления MASP-2-ингибирующие пептиды, полезные в этом аспекте изобретения, составляют в длину по крайней мере 6 аминокислот и включают SEQ ID NO:22. Пептиды, полученные из MBL, которые включают последовательность аминокислот «GLR GLQ GPO GKL GPO G» (SEQ ID NO:24), как было показано, связывают MASP-2 in vitro (Wallis, et al., 2004, см. выше). Для повышения связывания с MASP-2 могут быть синтезированы пептиды, которые фланкированы двумя триплетами GPO на каждом конце («GPO GPO GLR GLQ GPO GKL GPO GGP OGP O» SEQ ID NO:25) для усиления образования тройной спирали, как обнаруживается в нативном белке MBL (как описано далее в Wallis, R., et al., J. Biol. Chem. 279: 14065, 2004).
MASP-2-ингибирующие пептиды могут быть также получены из H-фиколина человека, который включает последовательность «GAO GSO GEK GAO GPQ GPO GPO GKM GPK GEO GDO» (SEQ ID NO:27) из консенсуса MASP-2-связывающей области в H-фиколине. Также включены пептиды, полученные из L-фиколина человека, которые включают последовательность «GCO GLO GAO GDK GEA GTN GKR GER GPO GPO GKA GPO GPN GAO GEO» (SEQ ID NO:28) из консенсуса MASP-2-связывающей области в L-фиколине.
MASP-2-ингибирующие пептиды могут быть также получены из сайта расщепления C4, такого как «LQRALEILPNRVTIKANRPFLVFI» (SEQ ID NO:29), который представляет собой сайт расщепления C4, связанный с C-концевой частью антитромбина III (Glover, G.I., et al., Mol. Immunol. 25: 1261 (1988)).
Пептиды, полученные из сайта расщепления С4, а также другие пептиды, которые ингибируют MASP-2-сайт сериновой протеазы, могут быть химически модифицированы, так что они становятся необратимыми протеазными ингибиторами. Например, соответствующие модификации могут включать, в качестве неограничивающих примеров, галометилкетоны (Br, Cl, I, F) на C-конце, Asp или Glu, или прилагаемы к функциональной боковой цепи; галоацетильные (или другие α-галоацетильные) группы на аминогруппах или других функциональных боковых цепях; эпоксидные или имин-содержащие группы на амино- или карбокси-конце или на функциональных боковых цепях; или имидированные эфиры на амино- или карбокси-конце или на функциональных боковых цепях. Такие модификации давали бы преимущество постоянного ингибирования фермента путем ковалентного присоединения пептида. Это могло бы привести к снижению эффективных доз и/или к необходимости в менее частом введении пептидного ингибитора.
Помимо ингибирующих пептидов, описанных выше, MASP-2-ингибирующие пептиды, полезные в способе по изобретению, включают пептиды, содержащие MASP-2-связывающую CDR3-область MoAb анти-MASP-2, полученного, как описано в настоящем документе. Последовательность CDR3-областей для использования в синтезе пептидов может быть определена способами, известными в рассматриваемой области. Вариабельная область тяжелой цепи представляет собой пептид, который, как правило, варьирует от 100 до 150 аминокислоты в длину. Вариабельная область легкой цепи представляет собой пептид, который, как правило, варьирует от 80 до 130 аминокислот в длину. CDR-последовательности в вариабельных областях тяжелой и легкой цепи включают только последовательности приблизительно в 3-25 аминокислот, которые могут быть легко секвенированы любым специалистом в рассматриваемой области.
Специалисты в рассматриваемой области должны признать, что в существенной степени гомологичные вариации MASP-2 ингибирующих пептидов, описанных выше, будут также проявлять MASP-2-ингибирующую активность. Типичные варианты включают, в качестве неограничивающих примеров, пептиды, имеющие вставки, делеции, замены и/или дополнительные аминокислоты на карбокси-концевых или амино-концевых частях рассматриваемых пептидов и их смесей. Соответственно, те гомологичные пептиды, которые обладают MASP-2-ингибирующей активностью, считаются пригодными в способах этого изобретения. Описанные пептиды могут также включать в себя мотивы дублирования и другие модификации с консервативными заменами. Консервативные варианты описаны в других местах настоящего документа и включают замену аминокислоты на другую с таким же зарядом, размером или гидрофобностью и т.п.
MASP-2 ингибирующие пептиды могут быть модифицированы с целью увеличения растворимости, и/или чтобы максимизировать положительный или отрицательный заряд для того, чтобы больше напоминать сегмент в интактном белке. Производная может иметь или не иметь точную первичную аминокислотную структуру пептида, описанного в настоящем документе, при условии, что производная функционально сохраняет нужную характерную особенность MASP-2- ингибирования. Модификации могут включать в себя аминокислотную замену одной из широко известных двадцати аминокислот или другой аминокислотой, производной или замещающей аминокислотой с вспомогательными желательными характеристиками, такими как устойчивость к ферментативной деградации, или D-аминокислотой или заменой на другую молекулу или соединение, такое как углевод, который имитирует природное подтверждение и функцию аминокислоты, аминокислот или пептида; аминокислотную делецию; аминокислотную вставку одной из широко известных двадцати аминокислот или другой аминокислоты, производной или замещающей аминокислотой с вспомогательными желательными характеристиками, такими как устойчивость к ферментативной деградации, или D-аминокислотой или заменой на другую молекулу или соединение, такое как углевод, который имитирует природное подтверждение и функцию аминокислоты, аминокислот или пептида; или замена на другую молекулу или соединение, такое как мономер углевода и нуклеиновой кислоты, который имитирует природную конформацию, распределение заряда и функцию родительского пептида. Пептиды также могут быть модифицированы путем ацетилирования или амидирования.
Синтез производных ингибирующих пептидов может основываться на известных способах пептидного биосинтеза, биосинтеза углеводов и тому подобное. В качестве отправной точки, специалист может опираться на подходящую компьютерную программу для определения конформации представляющего интерес пептида. После установления конформации пептида, описанного в настоящем документе, специалист может определить способом рационального дизайна, какой вид замен может быть произведен в одном или нескольких участках, чтобы смоделировать производное, которое сохраняет основную конформацию и распределение зарядов родительского пептида, но которое может обладать характеристиками, которые не присутствуют или усилены по сравнению с теми, которые обнаруживаются у родительского пептида. Как только кандидатная молекула-производное будет определена, производные могут быть проверены, чтобы определить, функционируют ли они в качестве MASP-2-ингибирующих агентов с использованием способов, описанных в настоящем документе.
СКРИНИНГ MASP-2-ИНГИБИРУЮЩИХ ПЕПТИДОВ
Можно также использовать молекулярное моделирование и рациональный молекулярный дизайн для создания и скрининга пептидов, которые имитируют молекулярные структуры ключевых областей связывания MASP-2 и подавляют MASP-2-активности комплемента. Молекулярные структуры, используемые для моделирования, включают в себя CDR-области моноклональных антител анти-MASP-2, а также области-мишени, как известно, важные для функции MASP-2, в том числе область, необходимую для димеризации, область, участвующую в связывании с MBL, и активный сайт сериновой протеазы, как описано ранее. Способы идентификации пептидов, которые связываются со специфической мишенью, хорошо известны в рассматриваемой области. Например, молекулярный импринтинг может быть использован для конструирования de novo макромолекулярных структур, таких как пептиды, которые связываются со специфической молекулой. Смотри, например, Shea, K.J., "Molecular Imprinting of Synthetic Network Polymers: The De Novo synthesis of Macromolecular Binding and Catalytic Sties," TRIP 2(5) 1994.
В качестве наглядного примера, один способ подготовки имитаторов MASP-2-связывающих пептидов представляет собой следующее. Полимеризуют функциональные мономеры известного MASP-2-связывающего пептида или области связывания антитела анти-MASP-2, которое демонстрирует ингибирование MASP-2 (матрица). Матрицу затем удаляют, после чего следует полимеризация второго класса мономеров в пробел, оставленный матрицей, чтобы предоставить новую молекулу, которая проявляет одно или более необходимых свойств, сходных с таковыми матрицы. В дополнение к подготавливаемым таким образом пептидам, можно также подготовить другие MASP-2-связывающие молекулы, которые представляют собой MASP-2-ингибирующие агенты, такие, как полисахариды, нуклеозиды, лекарственные препараты, нуклеопротеиды, липопротеины, углеводы, гликопротеины, стероиды, липиды и другие биологически активные вещества. Этот способ полезен для проектирования широкого спектра биологических имитаторов, которые более устойчивы, чем их природные аналоги, поскольку они, как правило, подготовлены путем свободно-радикальной полимеризации функциональных мономеров, в результате чего образуется соединение с не поддающейся биохимическому разложению основой.
СИНТЕЗ ПЕПТИДОВ
MASP-2-ингибирующие пептиды можно подготовить с использованием способов, известных в рассматриваемой области, как, например, твердофазный способ синтеза, первоначально описанный Merrifield в J. Amer. Chem. Soc. 85:2149-2154, 1963. Автоматизированного синтеза можно достичь, например, с помощью пептидного синтезатора Applied Biosystems 431А (Фостер-Сити, Калифорния), в соответствии с инструкциями производителя. Другие способы могут быть найдены, например, в Bodanszky, M., et al., Peptide Synthesis, second edition, John Wiley & Sons, 1976, а также в других ссылочных работах, известных специалистам в данной области.
Пептиды могут быть подготовлены с использованием стандартных способов генной инженерии, известных специалистам в рассматриваемой области. Например, пептид может быть произведен ферментативно путем встраивания нуклеиновой кислоты, кодирующей пептид, в вектор экспрессии, экспрессирующий ДНК, и трансляции ДНК в пептид в присутствии необходимых аминокислот. Пептид затем очищают с помощью хроматографических или электрофоретических способов, или с помощью белка-носителя, который может быть слит с, а впоследствии отщеплен от пептида, путем встраивания в вектор экспрессии в рамке с пептид- кодирующей последовательностью нуклеотидной последовательности, кодирующей белок-носитель. Слитый белок-пептид можно изолировать с помощью хроматографических, электрофоретических или иммунологических способов (таких как связывание со смолой с помощью антител к белку-носителю). Пептид может быть отщеплен с использованием химической методологии или ферментативно, как, например, при помощи гидролазы.
MASP-2-ингибирующие пептиды, которые являются полезными в способе по изобретению, могут быть произведены в рекомбинантных клетках-хозяевах, следуя традиционным способам. Чтобы экспрессировать последовательность, кодирующую MASP-2-ингибирующий пептид, молекула нуклеиновой кислоты, кодирующей пептид, должна быть функционально связана с регуляторными последовательностями, которые контролируют транскрипционную экспрессию, в экспрессионном векторе и затем вводится в клетку-хозяина. В дополнение к транскрипционным регуляторным последовательностям, таким как промоторы и энхансеры, векторы экспрессии могут включать транскрипционные регуляторные последовательности и маркерный ген, которые подходят для селекции клеток, которые несут экспрессионный вектор.
Молекулы нуклеиновых кислот, которые кодируют MASP-2 ингибирующий пептид, можно синтезировать при помощи «генных машин» с использованием протоколов, таких как фосфорамидитный способ. Если химически синтезированная двуцепочечная ДНК требуется для приложения, такого как синтез гена или фрагмента гена, то каждая комплементарная цепь производится отдельно. Производство коротких генов (от 60 до 80 пар оснований) технически просто, и может быть выполнено путем синтеза комплементарных цепей, а затем их отжига. Для производства более длинных генов, синтетические гены (двухцепочечные) собираются в модульной форме из одноцепочечных фрагментов, которые составляют от 20 до 100 нуклеотидов в длину. В качестве обзоров по полинуклеотидному синтезу, смотри, например, Glick and Pasternak, "Molecular Biotechnology, Principles and Applications of Recombinant DNA", ASM Press, 1994; Itakura, K., et al., Annu. Rev. Biochem. 53:323, 1984; и Climie, S., et al., Proc. Natl Acad. Sci. USA 87:633, 1990,
МАЛЫЕ МОЛЕКУЛЫ - ИНГИБИТОРЫ
В некоторых вариантах осуществления, MASP-2-ингибирующие агенты представляют собой малые молекулы-ингибиторы, в том числе природные и синтетические вещества, которые обладают низкой молекулярной массой, такие как, например, пептиды, пептидомиметики и непептидные ингибиторы (в том числе олигонуклеотиды и органические соединения). Малые молекулы-ингибиторы MASP-2 могут быть созданы на основе молекулярной структуры вариабельных областей антитела анти-MASP-2.
Небольшие молекулы ингибиторов можно также разрабатывать и создавать на основе кристаллической структуры MASP-2, используя компьютерное проектирование лекарственных препаратов (Kuntz I.D., et al., Science 257: 1078, 1992). Кристаллическая структура MASP-2 крысы была описана (Feinberg, H., et al., EMBO J. 22:2348-2359, 2003). Используя способ, описанный Kuntz et al., координаты кристаллической структуры MASP-2 используются в качестве входных данных для компьютерной программы, такой как DOCK, которая выводит список структур малых молекул, которые, как ожидается, связываются с MASP-2. Использование таких компьютерных программ хорошо известно специалистам в рассматриваемой области. Например, кристаллическая структура ингибитора протеазы ВИЧ-1 была использована для выявления уникальных непептидных лигандов, которые представляли собой ингибиторы протеазы ВИЧ-1 по оценке соответствия соединений, которые содержатся в Cambridge Crystallographic database для сайта связывания фермента при помощи программы DOCK (Kuntz, I.D., et al., J. Mol. Biol. 161:269-288, 1982; DesJariais, R.L., et al., PNAS 87:6644-6648, 1990).
Список структур малых молекул, которые идентифицируются вычислительным способом в качестве потенциальных MASP-2 ингибиторов, проверяется с помощью анализа MASP-2-связывания, такого, как описано в Примере 10. Малые молекулы, которые, как обнаружено, связываются с MASP-2, затем анализируют в функциональном тесте, таком как описано в Примере 2, чтобы определить, ингибируют ли они MASP-2-зависимую активацию комплемента.
РАСТВОРИМЫЕ MASP-2-РЕЦЕПТОРЫ
Другие подходящие MASP-2-ингибирующие агенты, как полагают, включают растворимые MASP-2-рецепторы, которые могут быть получены с использованием способов, известных любому специалисту в рассматриваемой области.
ИНГИБИТОРЫ ЭКСПРЕССИИ MASP-2
В другом варианте осуществления этого аспекта изобретения, MASP-2-ингибирующий агент представляет собой ингибитор экспрессии MASP-2, способный ингибировать MASP-2-зависимую активацию комплемента. В практике этого аспекта изобретения, типичные ингибиторы экспрессии включают антисмысловые к MASP-2 молекулы нуклеиновых кислот (например, антисмысловые мРНК, антисмысловые ДНК или антисмысловые олигонуклеотиды), рибозимы MASP-2 и молекулы РНК-интерференции MASP-2.
Антисмысловые молекулы РНК и ДНК действуют, чтобы непосредственно блокировать трансляцию мРНК MASP-2 при помощи гибридизации с мРНК MASP-2 и предотвратить трансляцию белка MASP-2. Антисмысловая молекула нуклеиновой кислоты может быть сконструирована различными способами, при условии, что она может подавлять экспрессию MASP-2. Например, антисмысловая молекула нуклеиновой кислоты может быть построена путем инвертирования кодирующей области (или части этого) кДНК MASP-2 (SEQ ID NO:4) относительно ее нормальной ориентации для транскрипции для того, чтобы разрешить транскрипцию ее комплементарной цепи.
Молекула антисмысловой нуклеиновой кислоты, как правило, практически идентична по крайней мере части гена-мишени или генов-мишеней. Нуклеиновая кислота, однако, не должна быть совершенно идентична для ингибирования экспрессии. Обычно, более высокая гомология может быть использована для компенсации для использования более короткой молекулы антисмысловой нуклеиновой кислоты. Минимальный процент идентичности, как правило, составляет больше, чем приблизительно на 65%, но более высокий процент идентичности может оказать более эффективное подавление экспрессии эндогенной последовательности. Значительно больший процент идентичности в более чем около 80%, как правило, является предпочтительным, хотя идентичность от около 95% до абсолютной является, как правило, наиболее предпочтительной.
Молекула антисмысловой нуклеиновой кислоты не обязательно должна иметь тот же профиль интронов или экзонов, что и ген-мишень, и некодирующие сегменты целевого гена-мишени могут быть одинаково эффективны в достижении антисмыслового подавления экспрессии гена-мишени, что и кодирующие сегменты. Последовательность ДНК по крайней мере из 8 или около этого нуклеотидов может быть использована в качестве молекулы антисмысловой нуклеиновой кислоты, несмотря на то, что более длинная последовательность является предпочтительной. В настоящем изобретении, репрезентативный пример полезного MASP-2-ингибирующего агента представляет собой молекулу MASP-2-антисмысловой нуклеиновой кислоты, которая по крайней мере на девяносто процентов идентична комплементарной к кДНК MASP-2, состоящей из нуклеотидной последовательности, изложенной в SEQ ID NO:4. Нуклеотидная последовательность, изложенная в SEQ ID NO:4, кодирует белок MASP-2, состоящий из последовательности аминокислот, изложенной в SEQ ID NO:5.
Нацеливание антисмысловых олигонуклеотидов для связывания с мРНК MASP-2 является еще одним механизмом, который может быть использован для снижения уровня синтеза белка MASP-2. Например, синтез полигалактуроназы и ацетилхолинового рецептора мускарина 2-го типа ингибируется антисмысловыми олигонуклеотидами, направленными на их соответствующие последовательности мРНК (Патент США № 5739119 к Cheng и Патент США № 5759829 к Shewmaker). Кроме того, примеры антисмыслового ингибирования были продемонстрированы с ядерным белком циклином, геном множественной лекарственной устойчивости (MDG1), ICAM-1, E-селектином, STK-1, стриарному GABAA рецептору и EGF человека (смотри, например, Патент США № 5,801,154 к Baracchini; Патент США № 5,789,573 к Baker; Патент США № 5,718,709 к Considine; и Патент США № 5,610,288 к Reubenstein).
Была описана система, которая позволяет любому специалисту определить, какие олигонуклеотиды являются полезными по изобретению, которое включает в себя поиск подходящих участков в мРНК-мишени с помощью расщепления РНКазой H в качестве индикатора доступности в пределах последовательностей внутри транскрипта. Scherr, M., et al., Nucleic Acids Res. 25:5079-5085, 1998; Lloyd, et al., Nucleic Acids Res. 29:3665-3673, 2001. Смесь антисмысловых олигонуклеотидов, которые являются комплементарными к определенным областям транскриптов MASP-2, добавляют к экстрактам клеток, экспрессирующих MASP-2, таких как гепатоциты, и гибридизуют для того, чтобы создать сайт, чувствительный к действию RNAseH. Этот способ можно сочетать с выбором последовательности при помощи компьютера, что позволяет прогнозировать оптимальную последовательность выбора для антисмысловых композиций на основе их относительной способности образовывать димеры, шпильки или другие вторичные структуры, которые могут снизить или запретить специфическое связывание с мРНК-мишенью в клетке-хозяине. Анализ этих вторичных структур и оценки выбора сайта-мишени может быть выполнен при помощи программного обеспечения для анализа праймеров OLIGO (Rychlik, I., 1997) и программного обеспечения алгоритма BLASTN 2.0.5 (Altschul, S.F., et al., Nucl Acids Res. 25:3389-3402, 1997). Антисмысловые соединения, направленные на последовательности-мишени, желательно, составляют примерно от 8 до 50 нуклеотидов в длину. Антисмысловые олигонуклеотиды, содержащие от около 9 до 35 или около этого нуклеотидов, являются особенно предпочтительными. Изобретатели рассматривают, что все олигонуклеотидные композиции в диапазоне от 9 до 35 нуклеотидов (т.е., таковые из 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или 35, или около этого пар в длину) являются в высокой степени предпочтительными для практики способов по изобретению, основанных на антисмысловых олигонуклеотидах. Весьма предпочтительными областями-мишенями мРНК MASP-2 являются те, которые находятся на уровне или вблизи от инициирующего кодона трансляции AUG, и те последовательности, которые в существенной степени комплементарны 5ʹ-областям мРНК, например, областям от -10 до +10 нуклеотидной последовательности гена MASP-2 (SEQ ID NO:4). Типичные ингибиторы экспрессии MASP-2 представлены в ТАБЛИЦЕ 4.
Как отмечалось выше, термин «олигонуклеотид», используемый в настоящем документе, относится к олигомеру или полимеру рибонуклеиновой кислоты (РНК) или дезоксирибонуклеиновой кислоты (ДНК) или миметиков этого. Этот термин распространяется также и на те олигонуклеиновые основания, которые состоят из встречающихся в природе нуклеотидов, сахаров и ковалентных межнуклеозидных (основных) связей, а также олигонуклеотидов с модификациями, не встречающимися в природе. Эти модификации позволяют вводить некоторые желательные свойства, которые не предлагаются в природных олигонуклеотидах, такие как сниженные токсичные свойства, повышенная устойчивость к нуклеазной деградации и усиленное поглощение клетками. В иллюстративных вариантах осуществления, антисмысловые соединения по изобретению отличаются от нативной ДНК модификацией фосфодиэфирного остова, чтобы продлить жизнь антисмыслового олигонуклеотида, в котором фосфатные заместители заменяются фосфоротиоатными. Аналогичным образом, один или оба конца олигонуклеотида могут быть заменены одним или более производных акридина, которые встраиваются между соседними парами оснований в цепи нуклеиновой кислоты.
Другой альтернативой антисмысловым РНК является использование «РНК-интерференции» (RNAi). Двухцепочечная РНК (dsRNA) может спровоцировать сайленсинг генов у млекопитающих in vivo. Природная функция RNAi и coвместное подавление представляется защитой генома от инвазии мобильных генетических элементов, таких как ретротранспозоны и вирусы, которые производят аномальными РНК или dsRNA в клетке-хозяине, когда они становятся активными (см., например, Jensen, J., et al., Nat, Genet. 27:209-12, 1999). Двуцепочечная молекула РНК может быть подготовлена путем синтеза двух нитей РНК, способных образовывать двуцепочечную молекулу РНК, каждая из которых составляет в длину примерно от 19 до 25 (например, 19-23 нуклеотидов). Например, молекула dsRNA, полезная в способах по изобретению, может содержать РНК, соответствующую последовательности и комплементарной ей, указанные в ТАБЛИЦЕ 4. Желательно, чтобы по крайней мере одна цепь РНК имела 3’-выступание в 1-5 нуклеотидов. Синтезированные нити РНК объединяют при условиях, которые формируют двуцепочечную молекулу. Последовательность РНК может включать часть в, как минимум, 8 нуклеотидов последовательности SEQ ID NO:4 общей протяженностью 25 нуклеотидов или менее. Проектирование последовательностей siRNA для данной мишени находится в компетенции специалистов в рассматриваемой области. Доступны коммерческие услуги, которые позволяют проектировать последовательности siRNA и гарантирующие по крайней мере 70%-ое падение экспрессии (Qiagen, Валенсия, штат Калифорния).
dsRNA можно вводить в качестве фармацевтической композиции и проводить известными способами, где нуклеиновая кислота вводится в требуемую клетку-мишень. Часто используемые способы переноса генов включают кальцийфосфатный, DEAE-декстрановый, электропорационный, микроинъекционный и вирусный способы. Такие способы изложены в Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., 1993.
Рибозимы также могут быть использованы для сокращения количества и/или биологической активности MASP-2, такие как рибозимы, которые нацелены на мРНК MASP-2. Рибозимы являются каталитическими молекулами РНК, которые могут расщеплять молекулы нуклеиновых кислот, имеющие последовательности, полностью или частично гомологичные последовательности рибозима. Возможно проектирование рибозимных трансгенов, которые кодируют РНК-рибозимы, которые специфически соединяются попарно с РНК-мишенью и расщепляют фосфодиэфирный остов в определенном месте, тем самым функционально инактивируя РНК-мишень. В проведении этого расщепления, рибозим сам по себе не изменяется, и, таким образом, способен к рециклингу и расщеплению других молекул. Включение последовательностей рибозимов в антисмысловые РНК наделяет их РНК-расщепляющей активностью, тем самым увеличивая активность антисмысловых конструкций.
Рибозимы, полезные в практике изобретения, обычно содержат область гибридизации в по крайней мере около девяти нуклеотидов, которая комплементарна нуклеотидной последовательности по крайней мере части мРНК-мишени МASP-2, и каталитическую область, которая адаптирована для расщепления мРНК-мишени MASP-2 (смотри, в частности, EPA № 0 321 201; WO88/04300; Haseloff, J., et al., Nature 534:585-591, 1988; Fedor, M.J., el al., Proc. Natl. Acad. Sci. USA 87: 1668-1672, 1990; Cech, T.R., et al., Ann. Rev. Biochem. 55:599-629, 1986).
Рибозимы могут либо быть непосредственно направлены на клетки в виде РНК-олигонуклеотидов, включающих последовательности рибозимов, или вводиться в клетку в качестве экспрессионного вектора, кодирующего нужную рибозимную РНК. Рибозимы могут использоваться и применяться в значительной степени таким же образом, как описано для антисмысловых полинуклеотидов.
Молекулы антисмысловых РНК и ДНК, рибозимов и RNAi, полезные в способах по изобретению, могут быть подготовлены с помощью любого способа, известного в рассматриваемой области для синтеза ДНК и РНК. Они включают в себя способы химического синтеза олигодезоксирибонуклеотидов и олигорибонуклеотидов, известных в рассматриваемой области, такие как, например, твердофазный фосфорамидитный химический синтез. Кроме того, молекулы РНК можно создавать путем транскрипции in vitro и in vivo последовательностей ДНК, кодирующих антисмысловые молекулы РНК. Такие последовательности ДНК могут быть встроены в различные векторы, которые включают подходящие РНК-полимеразные промоторы, такие как промоторы полимераз T7 или SP6. Кроме того, конструкции антисмысловых кДНК, которые синтезируют антисмысловую РНК конститутивно или индуцибельно, в зависимости от использованного промотора, можно стабильно вводить в клеточные линии.
Различные хорошо известные модификации молекул ДНК могут вводиться как средство повышения стабильности и времени полужизни. Полезные модификации включают, в качестве неограничивающих примеров, добавление фланкирующей последовательности рибонуклеотидов или дезоксирибонуклеотидов к 5'- и/или 3'- концам молекулы или использование фосфоротиоатных или 2' O-метильных, а не фосфодиэстеразных связей в пределах олигодезоксирибонуклеотидного остова.
V. ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ДОСТАВКИ
ДОЗИРОВАНИЕ
В другом аспекте, изобретение предоставляет композиции для ингибирования неблагоприятных эффектов MASP-2-зависимой активации комплемента у субъекта, страдающего заболеванием или от состояния, как указано в настоящем документе, включающий введение субъекту композиции, содержащей терапевтически эффективное количество MASP-2-ингибирующего агента и фармацевтически приемлемый носитель. MASP-2-ингибирующие агенты могут вводиться субъекту, который в этом нуждается, в терапевтически эффективных дозах для лечения или улучшения состояния, связанного с MASP-2-зависимой активацией комплемента. Терапевтически эффективная доза относится к количеству MASP-2-ингибирующего агента, достаточному для улучшения симптомов, связанных с заболеванием или состоянием.
Токсичность и терапевтическая эффективность MASP-2 ингибирующих агентов могут быть определены с помощью стандартных фармацевтических процедур, используя экспериментальные модели на животных, таких как мышиная модель на мышах MASP-2 -/-, экспрессирующих трансген MASP-2 человека, описанная в Примере 1. С помощью таких животных моделей можно определить NOAEL (уровень ненаблюдаемого вредного воздействия) и MED (минимально эффективная доза) с использованием стандартных способов. Дозовое соотношение между NOAEL и MED представляет собой терапевтическое соотношение, которое экспрессируется как отношение NOAEL/MED. MASP-2-ингибирующие агенты, которые обладают большими терапевтическими отношениями и индексами, являются наиболее предпочтительными. Данные, полученные в результате анализов клеточных культур и исследованиях на животных, могут быть использованы при составлении диапазона дозировок для применения на людях. Дозировка MASP-2-ингибирующего агента, предпочтительно, находится в диапазоне концентраций в кровотоке, которые включают MED с небольшой токсичностью или ее отсутствием. Дозировка может варьироваться в пределах этого диапазона, в зависимости от применяемой лекарственной формы и используемых способов введения.
Для любого состава соединений, терапевтически эффективную дозу можно оценить с помощью моделей на животных. Например, доза может быть сформулирована в животной модели, чтобы достичь диапазоне концентраций в циркулирующей плазме, которые включает в себя MED. Количественный уровень MASP-2-ингибирующего агент в плазме крови также может быть измерен, например, способом высокоэффективной жидкостной хроматографии.
В дополнение к исследованиям токсичности, эффективная доза препарата также может быть рассчитана на основе количества белка MASP-2, присутствующего в живом субъекте, и аффинности связывания MASP-2-ингибирующего агента. Показано, что уровни MASP-2, в нормальных субъектах-людях присутствуют в сыворотке крови на низких уровнях в районе от 500 нг/мл, и уровни MASP-2 в отдельном субъекте могут быть определены с помощью количественного анализа для MASP-2, описанного в Moller- Kristensen M., et al., J. Immunol Methods 282: 159-167, 2003.
Как правило, доза вводимых композиций, содержащих MASP-2-ингибирующие агенты, варьирует в зависимости от таких факторов, как возраст субъекта, вес, рост, пол, общее состояние здоровья и история болезни. В качестве иллюстрации, MASP-2-ингибирующие агенты, такие как антитела анти-MASP-2, можно вводить в диапазонах дозировок от около 0,010 до 10,0 мг/кг, желательно от 0,010 до 1,0 мг/кг, более предпочтительно, от 0,010 до 0,1 мг/кг массы тела субъекта. В некоторых вариантах осуществления, композиция включает в себя сочетание антитела анти-MASP-2 и MASP-2-ингибирующих пептидов.
Терапевтическая эффективность MASP-2 ингибирующих композиций и способы по настоящему изобретению в данном субъекте, и соответствующие дозировки, могут быть определены в соответствии с анализами на комплемент, хорошо известными специалистам в рассматриваемой области. Комплемент порождает многочисленные специфические продукты. В течение последнего десятилетия были разработаны чувствительные и специфические тесты, которые коммерчески доступны для большинства этих продуктов активации, в том числе малые фрагменты активации C3, C4a и C5a и большие фрагменты активации iC3b, C4d, Bb и sC5b-9. Большинство этих способов используют моноклональные антитела, которые реагируют с новыми антигенами (неоантигенами), экспонированными на фрагменте, а не на нативных белках, из которых они формируются, что делает эти способы очень простыми и специфическими. Большинство полагается на технологии ELISA (иммуноферментный анализ), хотя радиоиммунный анализ до сих пор иногда используется для C3a и C5a. В этих последних тестах определяются как непроцессированные фрагменты, так и их «desArg» фрагменты, которые являются основными формами, обнаруживаемыми в кровообращении. Непроцессированные фрагменты и C5adеsArg быстро удаляются за счет связывания с рецепторами клеточной поверхности, и, следовательно, присутствуют в очень низких концентрациях, в то время как C3adеsArg не связывается с клетками и накапливается в плазме крови. Измерение C3a обеспечивает чувствительный путь-независимый индикатор активации комплемента. Активация альтернативного пути может быть оценена путем определения фрагмента Bb. Обнаружение жидкофазного продукта активации пути мембранной атаки, sC5b-9, служит доказательством того, что комплемент активизируется в завершение. Поскольку как лектиновый, так и классический пути создают одинаковые продукты активации, C4a и C4d, измерение этих двух фрагментов не предоставляет никакой информации о том, какой из этих двух путей породил продукты активации.
Ингибирование MASP-2-зависимой активации комплемента характеризуется по крайней мере одним из следующих изменений в компоненте системы комплемента, который возникает в результате введения MASP-2-ингибирующего агент в соответствии со способами по изобретению: ингибирование генерации или продуцирования продуктов MASP-2-зависимой активации системы комплемента C4b, C3a, C5a и/или C5b-9 (MAC) (определенные, например, как описано в Примере 2), снижение расщепления C4 и C4b-депозиции (определенные, например, как описано в Примере 10), или снижение расщепления С3 и C3b-депозиции (определенные, например, как описано в Примере 10).
ДОПОЛНИТЕЛЬНЫЕ АГЕНТЫ
Композиции и способы, включающие MASP-2-ингибирующие агенты, могут дополнительно содержать один или более дополнительных терапевтических агентов, которые могут увеличить активность MASP-2-ингибирующего агента или обеспечивать соответствующие терапевтические функции аддитивным или синергическим образом. Например, в контексте лечения субъекта, страдающего от ТТР, где субъект является положительным на ингибирование ADAМTS-13, один или более MASP-2-ингибирующих агентов можно вводить в комбинации (в том числе и совместное введение) с одним или несколькими иммуносупрессивными препаратами. К подходящим иммуносупрессивным препаратам относятся: кортикостероиды, ритуксан, циклоспорин и тому подобное. В контексте лечения субъекта, страдающего от, или подверженного риску развития HUS или аHUS, один или более MASP-2-ингибирующих агентов можно вводить в комбинации (в том числе и совместное введение) с соответствующим антибиотиком. В контексте лечения субъекта, страдающего от, или подверженного риску развития aHUS, один или более MASP-2-ингибирующих агентов можно вводить в комбинации (в том числе и совместное введение) с другими комплемент-ингибирующими веществами, такими как экулизумаб (Soliris), TT-30, антитело к фактору B или другие вещества, которые ингибируют компоненты терминального комплемента или амплификацию альтернативного пути.
Включение и выбор дополнительного агента(ов) должны определяться для достижения желаемого терапевтического результата. В некоторых вариантах осуществления, MASP-2-ингибирующий агент может назначаться в комбинации с одним или более противовоспалительным и/или болеутоляющим средствами. Подходящие противовоспалительные и/или болеутоляющие средства включают: антагонисты серотониновых рецепторов; агонисты серотониновых рецепторов; антагонисты гистаминового рецептора; антагонисты брадикининового рецептора; ингибиторы калликреина; антагонисты тахикининового рецептора, в том числе антагонисты подтипных рецепторов гонадолиберина1 и гонадолиберина2; антагонисты рецептора ген кальцитонина-родственного пептида (CGRP); антагонисты рецептора интерлейкина; ингибиторы ферментов, активных в пути синтеза метаболитов арахидоновой кислоты, в том числе ингибиторы фосфолипазы, в том числе ингибиторы изоформы PLA2 и ингибиторы изоформы PLCγ, ингибиторы циклооксигеназы (СОХ), (которые могут представлять собой либо СОХ-1, СОХ-2 или неселективные СОХ-1 и СОХ-2-ингибиторы), ингибиторы липоксигеназы; антагонисты простаноидного рецептора, в том числе антагонисты подтиповых эйкозаноидных рецепторов ЕР-1 и ЕP-4 и антагонисты подтипового рецептора тромбоксана; антагонисты лейкотриенового рецептора, в том числе антагонисты подтипового рецептора лейкотриена B и подтипового рецептора лейкотриена D4; агонисты опиоидных рецепторов, в том числе агонисты μ-опиоидных, δ-опиоидных и κ-опиоидных подтипных рецепторов; агонистов и антагонистов пуринергического рецептора, в том числе антагонисты Р2Х-рецептора и агонисты P2Y-рецептора; открыватели аденозинтрифосфат (АТФ)-чувствительных калиевых каналов; ингибиторы МАР-киназ; никотиновые ацетилхолиновые ингибиторы; и агонисты альфа-адренергических рецепторов (в том числе альфа -1, альфа-2 и неселективные альфа-1 и 2-агонисты).
MASP-2-ингибирующие агенты по изобретению могут также назначаться в комбинации с одним или несколькими другими ингибиторами комплемента, такими как ингибитор C5. На сегодняшний день экулизумаб (Solaris®), антитело против C5, является единственным комплемент-направленным препаратом, который был одобрен для применения на людях. Однако, некоторые фармакологические препараты, как было показано, блокируют комплемент in vivo. К76COOH и нафамстатмесилат представляют собой два препарата, которые показали определенную эффективность в животных моделях трансплантации (Miyagawa, S. et al., Transplant Proc, 24:483-484, 1992). Низкомолекулярные гепарины, как было показано, также являются эффективными в регулировании активности комплемента (Edens, R.E., et al., Complement Today, pp. 96-120, Basel: Karger, 1993). Считается, что эти малые молекулы-ингибиторы могут быть полезным в качестве агентов для использования в сочетании с MASP-2-ингибирующими агентами по изобретению.
Другие встречающиеся в природе ингибиторы комплемента могут быть полезны в сочетании с MASP-2-ингибирующими агентами по изобретению. Биологические ингибиторы комплемента включают в себя растворимый фактор комплемента 1 (sCR1). Он представляет собой природный ингибитор, который может обнаруживаться на наружной мембране клеток человека. Другие мембранные ингибиторы включают DAF, MCP и CD59. Рекомбинантные формы были проверены на их анти-комплементную активность in vitro и in vivo. Как было показано, sCR1 является эффективным при ксенотрансплантации, где система комплемента (как альтернативный, так и классический) обеспечивает запуск гиперактивного синдрома отторжения, в течение нескольких минут перфузии крови через недавно пересаженный орган (Piatt, J.L., et al, Immunol. Today 11 :450-6, 1990; Marino, I.R., et al, Transplant Proc. 1071:6, 1990; Johnstone, P.S., et al, Transplantation 54:573-6, 1992). Использование sCRl защищает и продлевает время выживания пересаженного органа, означая путь комплемента в патогенезе выживания органа (Leventhal, J.R., et al., Transplantation 55:857-66, 1993; Pruitt, S.K., et al., Transplantation 57:363-70, 1994).
Соответствующие дополнительные ингибиторы комплемента для использования в сочетании с композициями по настоящему изобретению также включают, например, MoAb, такие как антитело анти-C5 (например, экулизумаб), которые разрабатываются Alexion Pharmaceuticals, Inc., Нью-Хейвен, штат Коннектикут, и MoAb анти-пропердин.
ФАРМАЦЕВТИЧЕСКИЕ НОСИТЕЛИ И СРЕДСТВА ДОСТАВКИ
В общем, композиции с MASP-2-ингибирующим агентом, по изобретению, в сочетании с любыми другими выбранными терапевтическими агентами, соответственно, содержатся в фармацевтически приемлемом носителе. Носитель не токсичен, биосовместим и выбирается так, чтобы не оказывать неблагоприятного воздействия на биологическую активность MASP-2-ингибирующего агента (и любых других терапевтических агентов в сочетании с этим). Типичные фармацевтически приемлемые носители для пептидов описаны в патенте США № 5,211,657, к Yamada. Антитела анти-MASP-2 и ингибиторные пептиды, полезные в изобретении, могут быть сформулированы в препаратах в твердых, полутвердых, гелевых, жидких или газообразной формах, таких как таблетки, капсулы, порошки, гранулы, мази, растворы, депозитории, ингалянты и инъекции, предполагающих пероральное, парентеральное или операционное введение. Изобретение также предусматривает местное введение композиций путем покрытия медицинских приборов и т.п.
Подходящие носители для парентеральной доставки посредством инъекционных, инфузионной или промывающей и местной доставки включают дистиллированную воду, физиологический забуферизованный фосфатом солевой раствор, нормальный или лактированный растворы Рингера, раствор декстрозы, раствор Хэнкса или пропандиол. Кроме того, стерильные нелетучие масла могут быть использованы в качестве растворителя или суспендирующей среды. Для этой цели любое биосовместимое масло может быть использовано, в том числе синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, находят применение для приготовления инъекций. Носители и агенты могут быть составлены в качестве жидкости, суспензии, полимеризующегося или неполимеризующегося геля, пасты или мази.
Носитель может также включать в себя средство доставки для поддержания (т.е., продления, задержки или регулирования) агента (ов) доставки или, чтобы увеличить доставку, поглощение, стабильность или фармакокинетику терапевтического агента(ов). Такое средство доставки может включать в себя, в качестве неограничивающих примеров, микрочастицы, микросферы, наносферы или наночастицы, состоящие из белков, липосом, углеводов, синтетических органических соединений, неорганических соединений, полимерных или сополимерных гидрогелей и полимерных мицелл. Подходящие гидрогельные и мицеллярные системы доставки включают сополимеры PEO:PHB:PEO и комплексы сополимер/циклодекстрин, раскрытые в WO 2004/009664 A2, и PEO и комплексы PEO/циклодекстрин, раскрытые в Патентной публикации США № 2002/0019369 А1. Такие гидрогели можно вводить локально в участок предполагаемого действия, или подкожно или внутримышечно, чтобы сформировать продолжительное высвобождение запаса.
Для внутрисуставной доставки, МASP-2-ингибирующий агент может переноситься в описанных выше жидких или гелевых носителях, которые являются инъекционными, вышеописанными средствами доставки с продолжительным высвобождением, которые являются инъекционными, или в гиалуроновой кислоте или производном гиалуроновой кислоты.
Для перорального введения непептидергических агентов, MASP-2-ингибирующий агент может переноситься в качестве инертного наполнителя или разбавителя, таких, как сахароза, кукурузный крахмал или целлюлоза.
Для местного введения, MASP-2-ингибирующий агент может переноситься в мази, лосьоне, креме, геле, каплях, суппозитории, спрее, жидкости или порошке, или в гелевой или микрокапсульной системе доставки через трансдермальный пластырь.
Различные назальные и пульмональные системы доставки, в том числе аэрозоли, дозированные ингаляторы, сухие порошковые ингаляторы и небулайзеры разрабатываются и могут быть соответствующим образом адаптированы для доставки настоящего изобретения в аэрозольном, ингалянтном или распыляемом средстве доставки, соответственно.
Для интратекальной (IT) или интрацеребровентрикулярной (IСV) доставки, соответственные стерильные системы доставки (например, жидкости; гели, суспензии и др.) могут использоваться для введения данного изобретения.
Композиции по настоящему изобретению могут также включать биосовместимые наполнители, такие как диспергирующие или смачивающие агенты, суспендирующие агенты, разбавители, буферы, способствующие всасыванию вещества, эмульгаторы, связующие вещества, загустители, ароматизаторы (для перорального применения).
ФАРМАЦЕВТИЧЕСКИЕ НОСИТЕЛИ ДЛЯ АНТИТЕЛ И ПЕПТИДОВ
Конкретнее, в отношении антител анти-MASP-2 и ингибиторных пептидов, типичные составы можно парентерально вводить в виде инъецируемых дозировок раствора или суспензии соединения в физиологически приемлемых разбавителях с фармацевтическим носителем, которые могут представлять собой стерильную жидкость, такую как вода, масла, солевой раствор, глицерин или этанол. Кроме того, вспомогательные вещества, такие как смачивающие или эмульсирующие агенты, поверхностно-активные вещества, забуферивающие вещества для поддержания pH и т.д., могут присутствовать в композициях, содержащих антитела анти-MASP-2 и ингибиторные пептиды. Дополнительные компоненты фармацевтических композиций включают смазочный материал (такой, как например, растительного, животного или синтетического происхождения), например, соевое масло и минеральное масло. В целом, гликоли, например, пропиленгликоль или полиэтиленгликоль, являются предпочтительными жидкими носителями для растворов для инъекций.
Антитела анти-MASP-2 и ингибиторные пептиды можно также вводить в виде инъекции вещества замедленного всасывания или имплантатного препарата, которые могут быть составлены таким образом, чтобы дать возможность устойчивому или пульсирующему высвобождению активного вещества.
ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ НОСИТЕЛИ ДЛЯ ИНГИБИТОРОВ ЭКСПРЕССИИ
Конкретнее, в отношении ингибиторов экспрессии, полезных для способов по изобретению, предоставляются композиции, которые включают в себя ингибиторы экспрессии, как описано выше, и фармацевтически приемлемый носитель или растворитель. Композиция может дополнительно содержать коллоидно-дисперсную систему.
Фармацевтические композиции, которые включают в себя ингибиторы экспрессии, могут включать, в качестве неограничивающих примеров, растворы, эмульсии и липосомо-содержащие составы. Эти композиции могут быть созданы из различных компонентов, которые включают, в качестве неограничивающих примеров, заранее сформированные жидкости, самоэмульгирующие сухие вещества и самоэмульгирующие полутвердые вещества. Подготовка таких композиций, как правило, включает в себя сочетание ингибитора экспрессии с одним или несколькими из следующего: буферы, антиоксиданты, низкомолекулярные полипептиды, белки, аминокислоты, углеводы, в том числе глюкоза, сахароза или декстрины, хелатирующие агенты, такие как ЭДТА, глутатион и другие стабилизаторы и наполнители. Нейтральный буферизованный солевой раствор или солевой раствор, смешанный с неспецифическим сывороточным альбумином, являются примерами подходящих разбавителей.
В некоторых вариантах осуществления, композиции могут быть подготовлены и составлены в виде эмульсий, которые, как правило, представляют собой гетерогенные системы одной жидкости, диспергированной в другой в виде капель (смотри, Idson, в Pharmaceutical Dosage Forms, Vol, 1, Rieger and Banker (eds.), Marcek Dekker, inc., N.Y., 1988). Примеры встречающихся в природе эмульсификаторов, используемых в эмульсионных составах, включают акацию, пчелиный воск, ланолин, лецитин и фосфатиды.
В одном варианте осуществления, композиции, включающие нуклеиновые кислоты, могут быть составлены в виде микроэмульсий. Микроэмульсия, как используется в настоящем документе, относится к системе воды, масла и амфифильного вещества, которая является единым оптически изотропным и термодинамически стабильным жидким раствором (смотри Rosoff в Pharmaceutical Dosage Forms, Vol. 1). В способе по изобретению могут также использоваться липосомы для передачи и доставки антисмысловых олигонуклеотидов в нужный участок.
Фармацевтические композиции и составы ингибиторов экспрессии для местного введения могут включать трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Традиционные фармацевтические носители, а также водные, порошковые или жирные основы и загустители и т.д. могут быть использованы.
РЕЖИМЫ ВВЕДЕНИЯ
Фармацевтические композиции, содержащие MASP-2-ингибирующие агенты, можно вводить несколькими способами в зависимости от того, местный или системный режим введения является наиболее соответствующим для состояния, подвергаемого лечению. Кроме того, как описано выше в настоящем документе в отношении процедур экстракорпоральной реперфузии, MASP-2 ингибирующие агенты можно назначать через введение композиций по настоящему изобретению для рециркуляции крови или плазмы. Кроме того, композиции по настоящему изобретению можно доставлять путем покрытия композициями имплантируемых медицинских устройств или включения композиций в имплантируемые медицинские устройства.
СИСТЕМНАЯ ДОСТАВКА
Как используемый здесь термин «системная доставка» и «системное введение» включает, в качестве неограничивающих примеров, пероральные и парентеральные способы, включая внутримышечные (IM), подкожные, внутривенные (IV), внутриартериальные, ингаляционные, подъязычные, трансбуккальные, местные, трансдермальные, назальные, ректальные, вагинальные и другие пути введения, которые эффективно приводят к диспергированию доставленного агента в один или несколько участков, предназначенных для терапевтического воздействия. Предпочтительные способы системной доставки для настоящего изобретения включают внутривенные, внутримышечные, подкожные и ингаляционные. Следует учесть, что точный способ системного введения отдельных агентов, используемых в конкретных композициях по изобретению, будет определен в части учета чувствительности веществ к трансформации в метаболических путях, связанной с данным способом введения. Например, пептидергические агенты могут быть приятнее при ведении при помощи способов, отличных от перорального.
MASP-2-ингибиторующие антитела и полипептиды могут доставляться в субъекта, нуждающегося в этом, при помощи любых подходящих способов. Способы доставки антител MASP-2 и полипептидов включают введение при помощи перорального, пульмонального, парентерального (например, внутримышечная, внутрибрюшинная, внутривенная (IV) или подкожная инъекция), ингаляционного (например, посредством состава мелкодисперсного порошка), трансдермального, назального, вагинального, ректального или сублингвального способов введения, и могут быть сформулированы в лекарственных формах, соответствующих каждому способу введения.
Путем репрезентативных примеров, MASP-2-ингибирующие антитела и пептиды могут быть введены в живой организм с применением телесной мембраны, способной абсорбировать полипептиды, например, назальная, гастроинтестинальная и ректальная мембраны. Полипептиды, как правило, применяют к абсорбирующей мембране в сочетании с усилителем проникновения (См., например, Lee, V.H.L., Crit. Rev. Ther. Drug Carrier Sys. 5:69, 1988; Lee, V.H.L., J. Controlled Release 13:213, 1990; Lee, V.H.L., Ed., Peptide and Protein Drug Delivery, Marcel Dekker, New York (1991); DeBoer, A.G., et al., J. Controlled Release 13:241, 1990.) Например, STDHF является синтетическим производным фузидовой кислоты, стероидным поверхностно активным веществом, которое аналогично по структуре желчным солям, и было использовано в качестве усилителя проникновения при назальной доставке. (Lee, W.A., Biopharm. 22, Nov./Dec. 1990).
MASP-2 ингибиторные антитела и полипептиды могут быть введены вместе с другой молекулой, такой как липид, чтобы защитить полипептиды от ферментативного расщепления. Например, ковалентное присоединение полимеров, особенно полиэтиленгликоля (ПЭГ), был использовано для защиты определенных белков от ферментативного гидролиза в организме и, таким образом, продлить время полужизни (Fuertges, P., et al., J. Controlled Release 11: 139, 1990). Сообщалось о многих полимерных системах для доставки белков (Bae, Y.H., et al., J. Controlled Release 9:271, 1989; Hori R., et al., Pharm. Res. 6:813, 1989: Yamakawa, L. et al., J. Pharm. Sci. 79:505, 1990; Yoshihiro, I., et al, J. Controlled Release 10: 195, 1989; Asano, M., et al., J. Controlled Release 9: 111, 1989; Rosenblatt, J., et al., J. Controlled Release 9: 195, 1989; Makino, K., J. Controlled Release 12:235, 1990; Takakura, Y., et al., J. Pharm. Sci. 78: 117, 1989; Takakura, Y., et al., J. Pharm. Sci. 78:219, 1989).
Недавно были разработаны липосомы с улучшенной стабильностью в сыворотке и увеличенным временем полужизни в кровотоке (смотри, например, Патент США № 5,741,516, к Webb). Кроме того, были рассмотрены различные способы применения липосомных и липосомо-подобных препаратов в качестве потенциальных носителей лекарственных средств (см., например, Патент США № 5567434, к Szoka; Патент США № 5552 157, к Yagi; Патент США № 5,565,213, к Nakamori; Патент США № 5738868, к Шинкаренко; и Патент США № 5795587, к Gao).
Для трансдермальных применений, MASP-2 ингибиторные антитела и полипептиды могут быть объединены с другими соответствующими компонентами, такими как носители и/или адъюванты. Нет никаких ограничений на природу таких других ингредиентов, за исключением того, что они должны быть фармацевтически приемлемыми для их целевого введения, и не могут приводить к деградации активности активных ингредиентов композиции. Примеры подходящих средств доставки включают мази, кремы, гели или суспензии, с очищенным коллагеном или без него. MASP-2 ингибиторные антитела и полипептиды могут также пропитывать трансдермальные пластыри, пластыри и бинты, предпочтительно, в жидком или полужидком виде.
Композиции по настоящему изобретению можно системно вводить на регулярной основе, проводимой с периодичностью, установленной для поддержания желаемого уровня терапевтического эффекта. Например, композицию можно вводить, например, путем подкожной инъекции каждые две-четыре недели или реже. Режим дозирования определяется врачом с учетом различных факторов, которые могут влиять на действие комбинации активных веществ. Эти факторы включают степень прогрессирования состояния, подвергаемого лечению, возраст пациента, пол и массу, и другие клинические факторы. Дозировка для каждого отдельного агента будет изменяться как функция MASP-2-ингибирующего агента, который входит в композицию, а также от наличия и характера любого лекарственного средства доставки лекарственного средства (например, средство доставки с продолжительным высвобождением). Кроме того, дозовое количество может быть скорректировано, чтобы учесть различия в частоте введения и фармакокинетическом поведении доставляемого агента(ов).
МЕСТНАЯ ДОСТАВКА
В настоящем документе термин «местный» включает применение препарата в или вокруг участка, предназначенного для локализованного действия, и может включать, например, местное введение на коже или других пораженных тканях, офтальмологическая доставка, интратекальное (IT), интрацеребральновентрикулярное (ICV), внутрисуставное, внутреннеполостное, внутричерепное или внутривестибулярное введение, размещение или промывание. Местное введении может быть предпочтительным для создания возможности введения пониженной дозы, чтобы избежать системных неблагоприятных эффектов, и для более точного контроля сроков доставки и концентрации активных веществ на участке местной доставки. Местное введение обеспечивает известную концентрацию на участке-мишени, независимо от индивидуальной вариабельности у пациентов в обмене веществ, кровообращении, и т.д. Улучшение контроля дозировки также предоставляется режимом прямой доставки.
Местная доставка MASP-2-ингибирующего агента может быть достигнута в контексте хирургических способов лечения заболевания или состояния, такого как, например, во время процедуры, такой как артериальное шунтирование, атерэктомия, лазерные процедуры, ультразвуковые процедуры, баллонная ангиопластика и установка стента. Например, MASP-2 ингибитор может вводиться субъекту в сочетании с баллонной ангиопластической процедурой. Баллонная ангиопластическая процедура предусматривает введение катетера, имеющего сдувшийся надувной баллон, в артерию. Сдувшийся надувной баллон располагается в непосредственной близости от атеросклеротической бляшки и надувается, так что бляшка сплющивается сосудистой стенкой. В результате, поверхность баллона находится в контакте со слоем эндотелиальных сосудистых клеток на поверхности кровеносных сосудов. MASP-2-ингибирующий агент может быть присоединен к баллонному ангиопластическому катетеру таким способом, который позволяет освободить агент в участке атеросклеротической бляшки. Агент может быть прикреплен к балонному катетеру в соответствии со стандартными процедурами, известными в рассматриваемой области. Например, агент может храниться в отсеке баллонного катетера до тех пор, пока баллон надувается, и в этот момент он высвобождается в окружающую среду. Кроме того, агент может пропитывать поверхность баллона, так что он контактирует с клетками артериальной стенки, когда баллон надувается. Агент может также доставляться в перфорированном баллонном катетере, таком, как таковые, раскрытые в Flugelman, M.Y., et al., Circulation 85: 1110-1117, 1992. Смотри также опубликованную Заявку РСТ WO 95/23161 для типичной процедуры присоединения терапевтического белка к баллонному ангиопластическому катетеру. Аналогичным образом, MASP-2-ингибирующий агент может быть включен в гель или полимерное покрытие, нанесенное на стент, или может быть включен в материал стента, так, что стент элюирует MASP-2-ингибирующий агент после сосудистого размещения.
MASP-2 ингибирующие композиции, используемые при лечении артритов и других заболеваний опорно-двигательного аппарата, могут доставляться локально при помощи внутрисуставных инъекций. Такие композиции могут соответственно включать средство доставки для продолжительного высвобождения. В качестве дополнительного примера случаев, при которых местная доставка может быть желаема, MASP-2 ингибирующие композиции, используемые при лечении урогенитальных состояний, могут надлежащим образом вводиться малыми дозами внутрипузырно или в другую мочеполовую структуру.
ПОКРЫТИЯ НА МЕДИЦИНСКОМ УСТРОЙСТВЕ
MASP-2 ингибирующие вещества, такие как антитела и ингибиторные пептиды, могут быть иммобилизованы на (или в) поверхности имплантируемого или присоединяемого медицинского устройства. Модифицированная поверхность, как правило, будет находиться в контакте с живой тканью после имплантации в тело животного. Под «имплантируемым или присоединяемым медицинским устройством» подразумевается любое устройство, которое вживляется в, или присоединяется к ткани тела животного, в ходе нормальной эксплуатации устройства (например, стенты и имплантируемые устройства для доставки лекарственных препаратов). Такие имплантируемые или присоединяемые устройства медицинского назначения могут быть изготовлены, например, из нитроцеллюлозы, диазоцеллюлозы, стекла, полистирола, поливинилхлорида, полипропилена, полиэтилена, декстрана, Сефарозы, агара, крахмала, нейлона, нержавеющей стали, титана и биоразлагаемых и/или биосовместимых полимеров. Присоединение белка к устройству можно выполнять в любой технике, которая не уничтожает биологическую активность присоединенного белка, например, путем присоединения одного или обоих из N- и C-концевых остатков белка к устройству. Присоединение также может быть осуществлено по одному или нескольким внутренним сайтам в белке. Также можно использовать несколько присоединений (как внутренних, так и на концах белка). Поверхность имплантируемого или присоединяемого медицинского прибора может быть модифицирована для включения функциональных групп (например, карбоксильной, амидной, аминной, эфирной, гидроксильной, циановой, нитридной, сульфаниламидной, ацетиленовой, эпоксидной, силановой, ангидридной, сукцинимидной, азидной) для иммобилизации белка на этом. Химические реактивы для соединения включают, в качестве неограничивающих примеров, формирование сложных эфиров, простых эфиров, амидов, азидных и сульфаниламидных производных, цианата и других связей с функциональными группами, доступными на MASP-2-антителах или ингибирующих пептидах. MASP-2-антитела или ингибирующие фрагменты также могут прикрепляться нековалентно путем добавления аффинной тег-последовательности к белку, такой как GST (D.B. Smith and K.S. Johnson, Gene 67:31, 1988), полигистидина (E. Hochuli et al., J. Chromayog. 411:77, 1987) или биотина. Такие аффинные теги могут быть использованы для обратимого присоединения белка к устройству.
Белки также могут ковалентно присоединяться к поверхности корпуса устройства, например, при помощи ковалентной активации поверхности медицинского устройства. Путем репрезентативного примера, матриклеточный белок(ки) может присоединяться к корпусу устройства при помощи любой из следующих пар реакционноспособных групп (один из членов пары, присутствующий на поверхности корпуса устройства, а другой член пары, присутствующий на матриклеточном белке(ах)): гидроксила/карбоновой кислоты с образованием эфирной связи; гидроксила/ангидрида с образованием эфирной связи; гидроксила/изоцианата с образованием уретановой связи. Поверхность корпуса устройства, которая не обладает полезными реакционноспособными группами, можно обрабатывать с помощью травления плазмой радиочастотного разряда (RFGD) для создания реактивной группы, чтобы дать возможность депозиции матриклеточного белка(ов) (например, обработка кислородной плазмой для введения кислородсодержащих групп; обработка с пропиламино плазмой для введения аминных групп).
MASP-2-ингибирующие агенты, содержащие молекулы нуклеиновых кислот, такие как антисмысловые, RNAi- или ДНК-кодируемые пептидные ингибиторы, могут быть встроены в пористые матрицы, присоединенные к корпусу устройства. Образцовые пористые матрицы, применимые для образования поверхностного слоя, представляют собой таковые, подготовленные из сухожильного или кожного коллагена, и могут быть получены из множества коммерческих источников (например, Sigma и Сollagen Corporation), или коллагеновые матрицы подготавливают, как описано в патентах США № 4394370 к Jefferies и № 4975527, к Кoezuka. Один коллагеновый материал называется UltraFiber™, и его можно получить от Norian Corp. (Mountain View, Калифорния).
При желании могут быть также использованы некоторые полимерные матрицы, которые включают полимеры эфиров акриловой кислоты и полимеры молочной кислоты, как описано, например, в патентах США № 4526909 и 4563489 к Urist. Конкретные примеры полезных полимеров представляют собой таковые ортоэфиров, ангидридов, пропилен-кофумаратов или полимера одного или более мономеров α-гидроксикарбоновой кислоты (например, α-гидроксиуксусной кислоты (гликолевой кислоты) и/или α-гидроксипропионовой кислоты (молочной кислоты)).
СХЕМЫ ЛЕЧЕНИЯ
В профилактических приложениях, фармацевтические композиции вводят субъекту, подверженному, или, в ином случае, подверженному риску состояния, связанного с MASP-2-зависимой активацией комплемента в количестве, достаточном, чтобы исключить или уменьшить риск развития симптомов заболевания. В терапевтических применениях, фармацевтические композиции вводят субъекту, подозреваемому в или уже страдающему от состояния, связанного с MASP-2-зависимой активацией комплемента, в терапевтически эффективном количестве, достаточном, чтобы снять или по крайней мере частично уменьшить симптомы заболевания. Как при профилактических, так и при терапевтических схемах, композиции, содержащие MASP-2-ингибирующие агенты, можно вводить в нескольких дозах до тех пор, пока у субъекта не будет достигнут достаточный терапевтическоий результат. Применение MASP-2 ингибирующих композиций по настоящему изобретению может проводиться с помощью однократного введения композиции, или ограниченной последовательности введений, для лечения острого состояния, например, реперфузионного повреждения или другого травматического повреждения. Кроме того, композицию можно вводить через определенные интервалы времени в течение продолжительного периода времени для лечения хронических заболеваний, например, артритов или псориаза.
Способы и композиции по настоящему изобретению могут быть использованы для подавления воспаления и сопутствующих процессов, как правило, возникающих в результате диагностических и терапевтических медицинских и хирургических процедур. Для подавления таких процессв, MASP-2 ингибирующая композиция по настоящему изобретению может применяться перипроцедурально. В настоящем документе «перипроцедурально» относится к введению ингибирующей композиции препроцедурально и/или интрапроцедурально, и/или постпроцедурально, т.е., перед процедурой, перед и во время процедуры, перед и после процедуры, до, во время и после процедуры, в ходе процедуры, во время и после процедуры, или после процедуры. Перипроцедуральное применение может осуществляться с помощью местного введения композиции в хирургический или процессуальный участок, например, путем инъекции или непрерывного или периодического промывания участка, или при помощи системного введения. Подходящие способы для местной периоперационной доставки раствора MASP-2-ингибирующего агента раскрыты в Патентах США № 6420432 к Dernopulos и 6645168, к Demopulos. Подходящие способы локальной доставки хондропротекторных композиций, содержащих MASP-2-ингибирующий агент(ы) раскрыты в Международной патентной заявке PCT WO 01/07067 A2. Подходящие способы и композиции для направленной системной доставки хондропротекторных композиций, содержащих MASP-2-ингибирующий агент(ы), раскрыты в Международной патентной заявке PCT WO 03/063799 A2.
В одном аспекте изобретения, фармацевтические композиции вводят субъекту, подверженному PNH, или, в ином случае, подверженному риску PNH, в количестве, достаточном, чтобы исключить или уменьшить риск развития симптомов заболевания. В терапевтических применениях, фармацевтические композиции вводят субъекту, подверженному PNH, или уже от страдающему от PNH, в терапевтически эффективном количестве, достаточном, чтобы снять или, по крайней мере частично, уменьшить симптомы заболевания.
В одном варианте осуществления красные кровяные клетки субъекта опсонизируют фрагментами C3 в отсутствие композиции, и введение композиции, содержащей MASP-2-ингибирующий агент, субъекту повышает выживаемость клеток крови у субъекта. В одном варианте осуществления, у субъекта проявляется один или более симптомов, в отсутствие композиции, выбранных из группы, состоящей из: (i) уровни гемоглобина ниже нормальных, (ii) уровни тромбоцитов ниже нормальных; (iii) уровни ретикулоцитов выше нормальных и (iv) уровни билирубина выше нормальных, и введение композиции субъекту улучшает по крайней мере один или более симптомов, приводя в результате к (i) повышенным, нормальным или почти нормальным уровням гемоглобина, (ii) повышенным, нормальным или почти нормальным уровням тромбоцитов, (iii) сниженным, нормальным или почти нормальным уровням ретикулоцитов, и/или (iv) сниженным, нормальным или почти нормальным уровням билирубина.
Как в профилактических, так и в терапевтических схемах, композиции, содержащие MASP-2-ингибирующего агенты, можно вводить в нескольких дозы до тех пор, пока у субъекта не будет достигнут достаточный терапевтический результат. В одном из вариантов осуществления изобретения, MASP-2-ингибирующий агент включает в себя антитело анти-MASP-2, которое соответствующим образом можно вводить взрослому пациенту (например, среднестатистическому взрослому человеку массой 70 кг) в дозе от 0,1 мг до 10000 мг, более соответственно, от 1,0 мг до 5000 мг, более соответственно, от 30,0 мг до 2000 мг, более соответственно, от 10,0 мг до 1 000 мг, и еще более соответственно, от 50,0 мг до 500 мг. Для пациентов детского возраста, дозировка может быть скорректирована в пропорции к массе пациента. Применение MASP-2 ингибирующих композиций по настоящему изобретению можно проводить при помощи однократного введения композиции или ограниченной последовательности введений, для лечения PNH. Кроме того, композицию можно вводить через периодические интервалы времени, например, ежедневно, два раз в неделю, еженедельно, раз в две недели, ежемесячно или раз в два месяца в течение длительного периода времени для лечения PNH.
В некоторых вариантах осуществления, субъект, страдающий от PNH, ранее перенес, или в настоящее время проходит лечение ингибитором терминального комплемента, который ингибирует расщепление белка комплемента C5. В некоторых вариантах осуществления, способ включает в себя введение субъекту композиции по изобретению, содержащей MASP-2-ингибитор, и дополнительное введение к субъекту ингибитора терминального комплемента, который ингибирует расщепление белка комплемента C5. В некоторых вариантах осуществления, ингибитор терминального комплемента представляет собой гуманизированное антитело анти-C5 или антигенсвязывающий его фрагмент. В некоторых вариантах осуществления, ингибитором терминального комплемента является экулизумаб.
В одном аспекте изобретения, фармацевтические композиции вводят субъекту, подверженному aHUS, или, в ином случае, подверженному риску aHUS, в количестве, достаточной для снятия или снижения риска развития симптомов заболевания. В терапевтических применений, фармацевтические композиции вводят субъекту, подозреваемому в или уже страдающему от aHUS, в терапевтически эффективном количестве, достаточном, чтобы снять или, по крайней мере частично, уменьшить симптомы заболевания. В одном аспекте изобретения, перед введением, субъект может быть изучен, чтобы определить, проявляет ли субъект один или более симптомов aHUS, в том числе (i) анемию, (ii), тромбоцитопению (iii) почечную недостаточность и (iv) повышение креатинина, и композицию по настоящему изобретению затем вводят в эффективном количестве и в течение достаточного периода времени для улучшения этих симптомов(а).
В другом аспекте изобретения, MASP-2 ингибирующие композиции по настоящему изобретению могут быть использованы для профилактического лечения субъекта, который имеет повышенный риск развития aHUS, и тем самым уменьшать вероятность того, что субъекту будет поставлен aHUS. Наличие у субъекта генетического маркера, связанного, как известно, с aHUS, сначала определяют путем проведения генетического скрининг-тест по образцу, полученному от субъекта, и выявления наличия хотя бы одного из генетических маркеров, связанных с aHUS: фактора комплемента H (CFH), фактора 1 (CFI), фактора B (CFB), мембранного кофактора CD46, C3, фактор H комплемента-родственного белка 1 (CFHR1), антикоагулянтного белка тромбодулина (THBD), фактор H комплемента-родственного белка 3 (CFHR3) или фактор H комплемента-родственного белка 4 (CFHR4). Субъекта затем периодически контролируют (например, ежемесячно, поквартально, два раза в год или ежегодно), чтобы определить наличие или отсутствие хотя бы одного симптома aHUS, такого, как анемия, тромбоцитопения, почечная недостаточность и повышенный уровень креатинина. При определении наличия хотя бы одного из этих симптомов, субъекту можно вводить количество MASP-2-ингибирующего агента, эффективно ингибирующего MASP-2-зависимую активацию комплемента, в эффективном количестве и в течение достаточного периода времени для улучшения указанного одного или более симптомов. В еще одном аспекте настоящего изобретения, субъект с повышенным риском развития aHUS вследствие того, что он был проверен и у него был выявлен один из генетических маркеров, связанных с aHUS, может быть проверен на предмет наступления события, связанного с клиническими симптомами инициирования aHUS, в том числе медикаментозное воздействие, инфекция (например, бактериальная инфекция), злокачественное новообразование, травматическое повреждение, трансплантация органов и тканей и беременность.
В еще одном аспекте настоящего изобретения, композиция, содержащая количество MASP-2-ингибирующего агента, эффективное для ингибирования MASP-2-зависимой активации комплемента, может вводиться субъекту, страдающему от или подверженного риску развития атипичного гемолитического уремического синдрома (aHUS) на фоне инфекции. Например, пациента, страдающего от или подверженного риску развития некишечного aHUS, связанного с инфекцией S. pneumonia, можно лечить композициями по настоящему изобретению.
В еще одном аспекте настоящего изобретения, субъекта, страдающего от aHUS, можно первоначально лечить MASP-2 ингибирующей композицией по настоящему изобретению, которую вводят через катетерную линию, такую как внутривенная катетерная линия или подкожная катетерная линия, в течение первого периода времени (например, один час, двенадцать часов, один день, два дня или три дня. Субъекта затем можно лечить в течение второго периода времени MASP-2 ингибирующей композицией, вводимой посредством регулярных подкожных инъекций, например, инъекций, проводимых ежедневно, два раза в неделю, еженедельно, раз в две недели, ежемесячно или раз в два месяца.
В еще одном аспекте изобретения, MASP-2 ингибирующую композицию по настоящему изобретению можно вводить субъекту, страдающему от aHUS, в отсутствие плазмафереза (т.е. субъекту, чьи aHUS-симптомы еще не подвергались лечению плазмаферезом и они не подвергаются лечению плазмаферезом во время лечения MASP-2 ингибирующей композицией), для предотвращения потенциальных осложнений плазмафереза, включая кровотечения, инфекции и воздействие расстройств и/или аллергий, присущих плазме доноров, или субъекту, отвергающему плазмаферез по другим причинам, или в обстановке, где плазмаферез является недоступным.
В еще одном аспекте настоящего изобретения, MASP-2 ингибирующую композицию по настоящему изобретению можно вводить субъекту, страдающему от aHUS, совместно с лечением пациента плазмаферезом. Например, субъекту, получающему лечение плазмаферезом, затем можно вводить MASP-2-ингибирующую композицию после плазмафереза или попеременно с ним.
В еще одном аспекте настоящего изобретения, субъект, страдающий от или подверженный риску развития aHUS и подвергаемый лечению MASP-2 ингибирующей композицией по настоящему изобретению, может контролироваться путем периодического определения, например, каждые двенадцать часов или ежедневно, уровня по крайней мере одного фактора комплемента, где определение уменьшенного уровня по крайней мере одного фактора комплемента по сравнению со стандартным значением или здоровым субъектом свидетельствует о необходимости продолжения лечения композицией.
Как при профилактической, так и терапевтической схеме, композиции, содержащие MASP-2-ингибирующие агенты, можно вводить в нескольких дозах до тех пор, пока у субъекта не будет достигнут достаточный терапевтический результат. В одном из вариантов осуществления изобретения, MASP-2-ингибирующий агент включает в себя антитела анти-MASP-2, которые соответствующим образом можно вводить взрослому пациенту (например, среднестатистическому взрослому человеку массой 70 кг) в дозе от 0,1 мг до 10000 мг, более соответственно, от 1,0 мг до 5000 мг, более соответственно, от 10,0 мг до 2000 мг, более соответственно, от 10,0 мг до 1000 мг, и еще более соответственно, от 50,0 мг до 500 мг. Для пациентов детского возраста, дозировка может быть скорректирована в пропорции к массе пациента. Применение MASP-2-ингибирующих композиций по изобретению может проводиться путем однократного введения композиции, или ограниченной последовательности введений, для лечения aHUS. Кроме того, композицию можно вводить через периодические интервалы времени (например, ежедневно, два раза в недели, еженедельно, раз в две недели, ежемесячно или раз в два месяца, в течение длительного периода времени для лечения aHUS.
В некоторых вариантах осуществления, субъект, страдающий от aHUS, ранее подвергался или в настоящее время проходит лечение ингибитором комплемента, который ингибирует расщепление белка комплемента C5. В некоторых вариантах осуществления, способ включает в себя введение субъекту композиции по изобретению, содержащей MASP-2-ингибитор, и дальнейшее введение субъекту ингибитора терминального комплемента, который ингибирует расщепление белка комплемента C5. В некоторых вариантах осуществления, ингибитор терминального комплемента представляет собой гуманизированное антитело анти-C5 или антигенсвязывающий его фрагмент. В некоторых вариантах осуществления, ингибитор терминального комплемента представляет собой экулизумаб.
В одном аспекте изобретения, фармацевтические композиции вводят субъекту, подверженному, или, в ином случае, подверженному риску AHUS, в количестве, достаточном, чтобы исключить или уменьшить риск развития симптомов заболевания. В терапевтических применениях, фармацевтические композиции вводят субъекту, подверженному или уже страдающему от AHUS, в терапевтически эффективном количестве, достаточном, чтобы снять или по крайней мере частично уменьшить симптомы состояния.
В другом аспекте настоящего изобретения, вероятность развития нарушения функции почек у субъекта с риском развития AHUS может быть уменьшена путем введения субъекту MASP-2 ингибирующей композиции по настоящему изобретению в количестве, эффективно ингибирующем MASP-2 зависимую активацию комплемента. Например, субъект с риском развития HUS и подвергаемый лечению MASP-2 ингибирующей композицией по изобретению, может проявлять один или более симптомов, связанных с HUS, в том числе диарею, гематокрит на уровне менее 30% с положительным результатом микроскопии мокроты, доказывающим внутрисосудистое разрушение эритроцитов, тромбоцитопению и повышение уровня креатинина. В качестве еще одного примера, субъект с риском развития HUS и подвергаемый лечению MASP-2 ингибирующими композициями по изобретению, может быть заражен E. coli, shigella или salmonella. Такие субъекты, зараженные E. coli, shigella или salmonella, могут подвергаться лечению MASP-2 ингибирующей композицией по настоящему изобретению одновременно с лечением антибиотиками, или попеременно могут подвергаться лечению MASP-2 ингибирующей композицией без одновременного лечения антибиотиками, особенно для энтерогенных E. coli, для которых лечение антибиотиками противопоказано. Субъект, инфицированный энтерогенными E. coli, который подвергался лечению антибиотиками, может быть подвержен повышенному риску развития HUS, и может соответствующим образом подвергаться лечению MASP-2 ингибирующей композиции по настоящему изобретению, чтобы уменьшить риск. Субъект, инфицированный энтерогенными E. coli, может подвергаться лечению в первый промежуток времени MASP-2 ингибирующей композицией по настоящему изобретению в отсутствие антибиотика, и затем, для второго промежутка времени, - MASP-2 ингибирующей композицией по настоящему изобретению и антибиотиком.
В еще одном аспекте настоящего изобретения, субъект, страдающий от HUS, изначально может подвергаться лечению MASP-2 ингибирующей композицией по настоящему изобретению, которую вводят через катетерную линии, такую как линию через внутривенный катетер или катетерную линию подкожного введения, в течение первого периода времени, как например, один час, двенадцать часов, один день, два дня или три дня. Субъекта может принимать лечение в течение второго периода времени MASP-2 ингибирующей композицией, вводимой посредством регулярных подкожных инъекций, например, инъекций, проводимых ежедневно, два раза в неделю, еженедельно, раз в две недели, ежемесячно или раз в два месяца.
В еще одном аспект изобретения, MASP-2 ингибирующую композицию по изобретению могут вводить субъекту, страдающему от HUS, в отсутствие плазмафереза (т.е., субъект, симптомы HUS которого не подвергались лечению плазмаферезом и они не подвергается лечению плазмаферезом во время лечения MASP-2 ингибирующей композицией), для предотвращения потенциальных осложнений от плазмафереза, включая кровотечения, инфекцию и воздействия расстройств и/или аллергий, присущих плазме доноров, или субъекту, отвергающему плазмаферез по другим причинам, или в обстановке, где плазмаферез является недоступным.
В еще одном аспекте изобретения, MASP-2 ингибирующую композицию по настоящему изобретению можно вводить субъекту, страдающему от HUS, одновременно с лечением пациента плазмаферезом. Например, субъекту, получающему лечение плазмаферезом, затем можно вводить MASP-2 ингибирующую композицию после плазмафереза или попеременно с ним.
В еще одном аспекте настоящего изобретения, субъект, страдающий от или подверженный риску развития HUS и подвергаемый лечению MASP-2 ингибирующей композицией по настоящему изобретению, может контролироваться периодическим определением, таким, как каждые двенадцать часов или ежедневно, уровня, как минимум, одного фактора комплемента, где определение уменьшенного уровня по крайней мере одного фактора комплемента в сравнении со стандартным значением или со здоровым субъектом свидетельствует о необходимости продолжения лечения композицией.
Как в профилактических, так и терапевтических схемах, композиции, содержащие MASP-2-ингибирующие агенты, можно вводить в нескольких дозах до тех пор, пока у субъекта не будет достигнут достаточный терапевтический результат. В одном варианте осуществления изобретения, MASP-2-ингибирующий агент включает в себя антитела анти-MASP-2, которые соответствующим образом можно вводить взрослому пациенту (например, среднестатистическому взрослому человеку массой 70 кг) в дозе от 0,1 мг до 10000 мг, более соответственно, от 1,0 мг до 5000 мг, более соответственно, от 10,0 мг до 2000 мг, более соответственно, от 10,0 мг до 1000 мг и еще более соответственно, от 50,0 мг до 500 мг. Для пациентов детского возраста, дозировка может быть скорректирована в пропорции к массе пациента. Применение MASP-2 ингибирующих композиций изобретения можно проводить гут однократным введением композиции, или ограниченной последовательностью введений, для лечения HUS. Кроме того, композицию можно осуществляться через периодические интервалы времени (например, ежедневно, два раза в неделю, еженедельно, раз в две недели, ежемесячно или раз в два месяца, в течение длительного периода времени для лечения HUS.
В некоторых вариантах осуществления, субъект, страдающий от HUS, ранее проходил, или в настоящее время проходит лечение ингибитором комплемента, который ингибирует расщепление белка комплемента С5. В некоторых вариантах осуществления, способ включает в себя введение субъекту композиции по изобретению, содержащей ингибитор MASP-2, и дальнейшее введение субъекту ингибитора терминального комплемента, который ингибирует расщепление белка комплемента С5. В некоторых вариантах осуществления, ингибитор терминального комплемента представляет собой гуманизированное антитело анти-C5 или антигенсвязывающий его фрагмент. В некоторых вариантах осуществления, ингибитор терминального комплемента представляет собой экулизумаб.
В одном аспекте изобретения, фармацевтическую композицию вводят субъекту, подверженному ТТР или, в ином случае, подверженного риску ТТР в количестве, достаточном, чтобы исключить или уменьшить риск развития симптомов заболевания. В терапевтических применениях, фармацевтические композиции вводят субъекту, подверженному или уже от страдающему от ТТР, в терапевтически эффективное количестве, достаточном, чтобы снять или, по крайней мере частично, уменьшить симптомы заболевания.
В другом аспекте настоящего изобретения, субъект, проявляющий один или более симптомов ТТР, в том числе поражение центральной нервной системы, тромбоцитопению, сильное поражение сердца, тяжелое поражение легких, желудочно-кишечного инфаркт и гангрена, может быть подвергнут лечению MASP-2 ингибирующей композицией по настоящему изобретению. В другом аспекте настоящего изобретения, субъект с установленным снижением уровня ADAMTS13, а также давший положительный результат при тестировании на наличие ингибитора ADAMTS 13 (т.е., антитела), может подвергаться лечению MASP-2 ингибирующей композицией по настоящему изобретению. В еще одном аспекте изобретения, субъектом, давший положительный результат при тестировании на наличие ингибитора ADAMTS13, может подвергаться лечению иммунодепрессантом (например, кортикостероиды, ритуксан или циклоспорины) одновременно с лечением MASP-2 ингибирующей композицией по настоящему изобретению. В еще одном аспекте изобретения, субъект с установленным снижением уровня ADAMTS13 и давший положительный результат при тестировании на наличие ингибитора ADAMTS13, может подвергаться лечению ADATS13 одновременно с лечением MASP-2 ингибирующей композицией по настоящему изобретению.
В еще одном аспекте изобретения, субъект, страдающий от ТТР, может изначально подвергаться лечению MASP-2 ингибирующей композицией по настоящему изобретению, которую вводят через катетерную линию, такую как внутривенная катетерная линия или катетерная линия для подкожного введения, в течение первого промежутка времени, такого как один час, двенадцать часов, один день, два дня или три дня. Субъект может принимать лечение в течение второго периода времени MASP-2 ингибирующей композицией, вводимой посредством регулярных подкожных инъекций, например, инъекций, проводимых ежедневно, два раза в неделю, еженедельно, раз в две недели, ежемесячно или раз в два месяца.
В еще одном аспекте изобретения, MASP-2-ингибирующая композиция по изобретению может вводиться субъекту, страдающему от HUS, в отсутствие плазмафереза (т.е., субъекту, чьи симптомы ТТР не подвергались лечению плазмаферезом и не подвергаются лечению плазмаферезом во время лечения MASP-2-ингибирующей композицией), для предотвращения потенциальных осложнений плазмафереза, включая кровотечения, инфекции и воздействия расстройств и/или аллергий, присущих плазме доноров, или субъекту, отвергающему плазмаферез по другим причинам, или в обстановке, где плазмаферез является недоступным.
В еще одном аспекте изобретения, МАSP-2 ингибирующую композицию по изобретению можно вводить субъекту, страдающему от ТТР, одновременно с лечением пациента плазмаферезом. Например, субъекту, получающему лечение плазмаферезом, затем можно вводить MASP-2-ингибирующую композицию после плазмафереза или попеременно с ним.
В еще одном аспекте изобретения, субъект, страдающий от рефракторного ТТР, т.е., симптомов ТТР, не реагировали адекватно на другие лечебные процедуры, такие, как плазмаферез, может подвергаться лечению MASP-2 ингибирующей композицией по настоящему изобретению, с дополнительным плазмаферезом или без него.
В еще одном аспекте изобретения, у субъекта, страдающего от или подверженного риску развития ТТР, и подвергаемого лечению MASP-2 ингибирующей композицией по изобретению, можно контролировать периодическим определением, например, каждые двенадцать часов или ежедневно, уровня, как минимум, одного фактора комплемента, где определение уменьшенного уровня по крайней мере одного фактора комплемента по сравнению со стандартным значением или со здоровым субъектом свидетельствует о необходимости продолжения лечения композицией.
Как в профилактических, так и терапевтических схемах, композиции, содержащие MASP-2-ингибирующие агенты, можно вводить в нескольких дозах до тех пор, пока у субъекта не будет достигнут достаточный терапевтический результат. В одном из вариантов изобретения, MASP-2-ингибирующий агент включает в себя антитела анти-MASP-2, которые соответствующим образом могут вводиться взрослому пациенту (например, среднестатистическому взрослому человеку массой 70 кг) в дозе от 0,1 мг до 10000 мг, более соответственно, от 1,0 мг до 5000 мг, более соответственно, от 10,0 мг до 2000 мг, более соответственно, от 10,0 мг до 1000 мг, и еще более соответственно, от 50,0 мг до 500 мг. Для пациентов детского возраста, дозировка может быть скорректирована пропорционально массе пациента. Применение MASP-2 ингибирующих композиций по настоящему изобретению можно проводить при помощи однократного введения композиции, или ограниченной последовательности введений, для лечения ТТР. Кроме того, композицию может осуществляться через периодические интервалы времени (например, ежедневно, два раза в неделю, еженедельно, раз в две недели, ежемесячно или раз в два месяца, в течение длительного периода времени для лечения ТТР.
В некоторых вариантах осуществления, субъект, страдающий от ТТР, ранее проходил, или в настоящее время проходит лечение ингибитором комплемента, который ингибирует расщепление белка С5 комплемента. В некоторых вариантах осуществления способ включает в себя введение субъекту композиции по изобретению, содержащей MASP-2 ингибитор, и дополнительное введение субъекту ингибитора терминального комплемента, который ингибирует расщепление белка С5 комплемента. В некоторых вариантах осуществления, ингибитор терминального комплемента представляет собой гуманизированное антитело анти-C5 или антигенсвязывающий его фрагмент. В некоторых вариантах осуществления, ингибитор терминального комплемента представляет собой экулизумаб.
В одном аспекте изобретения, фармацевтические композиции вводят субъекту, подверженному или, в ином случае, подверженному риску синдрома холодовой агглютинации или криоглобулинемии в количестве, достаточном, чтобы исключить или уменьшить риск развития симптомов заболевания. В терапевтических применениях, фармацевтические композиции вводят субъекту, подозреваемому в или уже страдающему от синдрома холодовой агглютинации или криоглобулинемии, в терапевтически эффективном количестве, достаточном, чтобы снять или, по крайней мере частично, уменьшить симптомы заболевания.
В еще одном аспекте изобретения, субъект, страдающий от или подверженный риску развития синдрома холодовой агглютинации или криоглобулинемии и подвергаемый лечению MASP-2 ингибирующей композицией по настоящему изобретению, может контролироваться путем периодического определения, например, каждые двенадцать часов или ежедневно, уровня по крайней мере одного фактора комплемента, где определение уменьшенного уровня по крайней мере одного фактора комплемента по сравнению со стандартным значением или здоровым субъектом свидетельствует о необходимости продолжения лечения композицией.
Как в профилактических, так и терапевтических схемах, композиции, содержащие MASP-2-ингибирующие агенты, могут проводиться в несколько доз до тех пор, пока у субъекта не будет достигнут достаточный терапевтический результат. В одном из вариантов изобретения, MASP-2-ингибирующий агент включает в себя антитела анти-MASP-2, которые соответствующим образом можно вводить взрослому пациенту (например, среднестатистическому взрослому человеку массой 70 кг) в дозе от 0,1 до 10000 мг, более соответственно, от 1,0 мг до 5000 мг, более соответственно, от 10,0 мг до 2000 мг, более соответственно, от 10,0 мг до 1000 мг, и еще более соответственно, от 50,0 мг до 500 мг. Для пациентов детского возраста, дозировка может быть скорректирована в пропорции к массе пациента. Применение MASP-2 ингибирующих композиций по настоящему изобретению можно проводить при помощи однократного введения композиции, или ограниченной последовательности введений, для лечения синдром холодовой агглютинации или криоглобулинемии. Альтернативно, композицию может вводить через периодические интервалы времени (например, ежедневно, два раза в неделю, еженедельно, раз в две недели, ежемесячно или раз в два месяца, в течение длительного периода времени для лечения синдрома холодовой агглютинации или криоглобулинемии.
В некоторых вариантах осуществления, субъект, страдающий от синдрома холодовой агглютинации или криоглобулинемии, ранее проходил, или в настоящее время проходит лечение ингибитором комплемента, который ингибирует расщепление белка С5 комплемента. В некоторых вариантах осуществления, способ включает в себя введение субъекту композиции по изобретению, содержащей MASP-2-ингибитор, и дальнейшее введение субъекту ингибитора терминального комплемента, который ингибирует расщепление белка комплемента С5. В некоторых вариантах осуществления, ингибитор терминального комплемента представляет собой гуманизированное антитело анти-C5 или антигенсвязывающий его фрагмент. В некоторых вариантах осуществления, ингибитор терминального комплемента представляет собой экулизумаб.
В одном аспекте изобретения, фармацевтические композиции вводят субъекту, подверженному глаукоме или, в ином случае, подверженному риску глаукомы, в количестве, достаточном, чтобы исключить или уменьшить риск развития симптомов заболевания. В терапевтических применениях, фармацевтические композиции вводят субъекту, подозреваемому в или уже страдающему от глаукомы, в терапевтически эффективном количестве, достаточном, чтобы снять или, по крайней мере частично, уменьшить симптомы заболевания.
В еще одном аспекте изобретения, субъект, страдающий от или подверженный риску развития глаукомы, и подвергаемый лечению MASP-2 ингибирующей композицией по настоящему изобретению, может контролироваться путем периодического определения, например, каждые двенадцать часов или ежедневно, уровня по крайней мере одного фактора комплемента, где определение уменьшенного уровня по крайней мере одного фактора комплемента по сравнению со стандартным значением или здоровым субъектом свидетельствует о необходимости продолжения лечения композицией.
Как в профилактических, так и терапевтических схемах, композиции, содержащие MASP-2-ингибирующие агенты, могут проводиться в несколько доз до тех пор, пока достаточный терапевтический результат был достигнут у субъекта. В одном из вариантов изобретения, MASP-2-ингибирующий агент включает антитело анти-MASP-2, которое соответствующим образом можно вводить взрослому пациенту (например, среднестатистическому взрослому человеку массой 70 кг) в дозе от 0,1 мг до 10000 мг, более соответственно, от 1,0 мг до 5000 мг, более соответственно, от 10,0 мг до 2000 мг, более соответственно, от 10,0 мг до 1000 мг, а еще более соответственно, от 50,0 мг до 500 мг. Для пациентов детского возраста, дозировка может быть скорректирована в пропорции к массе пациента. Применение MASP-2 ингибирующих композиций по настоящему изобретению можно проводить при помощи однократного введения композиции, или ограниченной последовательности введений, для лечения глаукомы. Кроме того, композицию можно вводить через периодические интервалы времени, например, ежедневно, два раза в неделю, еженедельно, раз в две недели, ежемесячно или раз в два месяца, в течение длительного периода времени для лечения синдрома холодовой агглютинации.
В некоторых вариантах осуществления, субъект, страдающий глаукомой, ранее проходил, или в настоящее время проходит лечение ингибитором комплемента, который ингибирует расщепление белка комплемента С5. В некоторых вариантах осуществления, способ включает в себя введение субъекту композиции по изобретению, содержащей ингибитор MASP-2, и дополнительное введение субъекту ингибитора терминального комплемента, который ингибирует расщепление белка С5 комплемент. В некоторых вариантах осуществления, ингибитор терминального комплемента представляет собой гуманизированное антитело анти-C5 или антигенсвязывающий его фрагмент. В некоторых вариантах осуществления, ингибитор терминального комплемента представляет собой экулизумаб.
В одном аспекте изобретения, фармацевтические композиции вводят субъекту, страдающему от или подверженного риску развития острого лучевого синдрома, в количестве, достаточном, чтобы исключить или уменьшить риск развития симптомов состояния. В терапевтических применениях, фармацевтические композиции вводят субъекту, подозреваемому в или уже страдающему от острого лучевого синдрома в терапевтически эффективном количестве, достаточном, чтобы снять или, по крайней мере частично, уменьшить симптомы заболевания. Субъект может быть подвергнут лечению MASP-2-ингибирующей композицией по настоящему изобретению до или после воздействия радиоактивного облучения, такого как радиоактивное облучение для лечения раковых состояния, при очистке территории радиоактивного загрязнения, при работе с радиоактивными материалами на атомной электростанции или в лаборатории, или из-за воздействия радиации в результате аварии ядерного реактора, террористического акта или военных действий. В одном из вариантов осуществления настоящего изобретения, MASP-2-ингибирующую композицию вводят в течение от 24 до 48 часов после облучения.
В еще одном аспекте изобретения, субъект, страдающий от или подверженный риску развития острой лучевой болезни и проходящий лечение MASP-2-ингибирующей композицией по изобретению, может контролироваться путем периодического определения, например, каждые двенадцать часов или ежедневно, уровня, как минимум, одного фактора комплемента, где определение и уменьшение уровня по крайней мере одного фактора комплемента в сравнении со стандартным значением или со здоровым субъектом свидетельствует о необходимости продолжения лечения композицией.
Как в профилактических, так и терапевтических режимах, композиции, содержащие MASP-2-ингибирующие агенты, можно вводить в нескольких дозах до тех пор, пока у субъекта не будет достигнут достаточный терапевтический результат. В одном варианте осуществления изобретения, MASP-2-ингибирующий агент содержит антитело анти-MASP-2, которое соответствующим образом можно вводить взрослому пациенту (например среднестатистическому взрослому человеку массой 70 кг) в дозе от 0,1 мг до 10000 мг мг, более соответственно, от 1,0 мг до 5000 мг, более соответственно, от 10,0 мг до 2000 мг, более соответственно, от 10,0 мг 1000 мг, и еще более соответственно, от 50,0 мг до 500 мг. Для пациентов детского возраста, дозировка может быть скорректирована в пропорции к массе пациента. Применение MASP-2 ингибирующих композиций по изобретению может осуществляться при помощи однократного введения композиции, или ограниченной последовательности введений, для лечения глаукомы. Кроме того, композицию можно вводить через периодические интервалы времени (например, ежедневно, два раза в неделю, еженедельно, раз в две недели, ежемесячно или раз в два месяца, в течение длительного периода времени для лечения острого лучевого синдрома.
В некоторых вариантах осуществления, субъект, страдающий от острого лучевого синдрома, ранее проходил, или в настоящее время проходит лечение ингибитором комплемента, который ингибирует расщепление белка С5 комплемента. В некоторых вариантах осуществления, способ включает в себя введение субъекту композиции по изобретение, содержащей ингибитор MASP-2, и дополнительное введение субъекту ингибитора терминального комплемента, который ингибирует расщепление белка С5 комплемента. В некоторых вариантах осуществления, ингибитор терминального комплемента представляет собой гуманизированное антитело анти-C5 или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления, ингибитор терминального комплемента представляет собой экулизумаб.
VI. ПРИМЕРЫ
Следующие примеры просто демонстрируют лучший режим, предусмотренный в настоящее время для осуществления изобретения, но не должны быть истолкованы как ограничивающие данное изобретение. Все литературные цитирования настоящим документом в явной форме включены посредством ссылки.
ПРИМЕР 1
В этом примере описывается создание штамма мышей, дефектных по MASP-2 (MASP-2 -/-), но достаточных по Map19 (Map19+/+).
Материалы и способы: был разработан адресный вектор pКO-NTKV 1901 году для дизрупции трех экзонов, кодирующих C-конец MASP-2 мыши, в том числе экзон, который кодирует домена сериновой протеазы, как показано на ФИГУРЕ 3. PKO-NTKV 1901 был использован для трансфекции мышиной ES клеточной линии E14.1а (SV 129 O1a). Были отобраны неомицин-устойчивые и тимидин киназа-устойчивые клоны. 600 ES-клонов были скринированы, и из них четыре различных клона были выявлены и подтверждены саузерн-блотом на содержание ожидаемого направленного и рекомбинантого события, как показано на ФИГУРЕ 3. Химеры были получены из этих четырех положительных клонов путем трансплантации эмбрионов. Химеры были затем обратно скрещены с генетическим фоном C57/BL6 для создания трансгенных самцов. Трансгенных самцов скрещивали с самками для генерирования F1-поколения с 50% потомства, показывающих гетерозиготность по дизруптированному гену MASP-2. Гетерозиготные мыши были перекрестно скрещены для создания гомозиготного MASP-2 дефектного потомства, в результате чего были образованы гетерозиготные мыши и мыши дикого типа в соотношении 1:2:1, соответственно.
Результаты и фенотип: полученные в результате гомозиготные MASP-2-/- дефектные мыши оказались жизнеспособными и фертильными, и были проверены на MASP-2-дефектность по саузерн-блоттингу, чтобы подтвердить правильность направленного события, нозерн-блоттингом, чтобы подтвердить отсутствие мРНК MASP-2, и с помощью Вестерн-блоттинга, чтобы подтвердить отсутствие белка MASP-2 (данные не представлены). Наличие мРНК MAр19 и отсутствие мРНК MASP-2 также было подтверждено с помощью RT-PCR с временным разрешением на приборе LightCyсler. Мыши MASP-2-/- продолжали экспрессировать мРНК и белок Map19, MASP-1 и MASP-3, как и ожидалось (данные не представлены). Наличие и обилие мРНК у мышей MASP-2-/- для пропердина, Фактора B, Фактора D, C4, C2 и C3 оценивали при помощи LightCyeier-анализа, которые, как оказалось, идентичны таковым у однопометных контролей дикого типа (данные не представлены). Плазма от гомозиготных мышей MASP-2-/- совершенно отлична от таковой при опосредованной лектиновым путем активации комплемента, как описано в Примере 2.
Генерация штамма MASP-2-/- напряжение на чистом фоне C57BL6: мышей MASP-2-/- возвратно скрещивали с чистой линией C57BL6 в течение девяти поколений до использования штамма MASP-2-/- в качестве экспериментальной животной модели.
Трансгенный мышиный штамм, который представляет собой мышей MASP-2-/-, Map19+/+ и который экспрессирует MASP-2-трансген человека (нокаут мышиного MASP-2 и встройка MASP-2 человека), был также генерирован следующим образом:
Материалы и способы: Был сконструирован миниген, кодирующий MASP-2 человека, названный «мини hMASP-2» (SEQ ID NO:49), как показано на ФИГУРЕ 4, в который входит промоторная область гена MASP 2 человека, в том числе первые 3 экзона (с экзона 1 по экзон 3), за которым следует последовательность кДНК, которая представляет кодирующую последовательность следующих 8 экзонов, таким образом, кодирующий полноразмерный белок MASP 2 под своим эндогенным промотором. Конструкцию мини hMASP-2 ввели в оплодотворенные яйца MASP-2 -/-, чтобы заменить недостающий мышиный ген MASP 2 трансгенно экспрессируемым MASP-2 человека.
ПРИМЕР 2
Этот пример показывает, что MASP-2 необходим для активации комплемента через лектиновый путь.
Материалы и способы:
Анализ специфического для лектинового пути С4-расщепления: Анализ C4-расщепления был описан в Petersen, et al., J. Immunol. Methods 257: 107 (2001), который определяет активацию лектинового пути как результат действия липотехоевой кислоты (LTA) из S. aureus, которая связывает L-фиколин. Анализ, описанный в Petersen et al., (2001), был адаптирован для измерения активации лектинового пути через MBL путем покрытия планшета LPS и маннаном или зимозаном перед добавлением сыворотки от мышей MASP-2 -/-, как описано ниже. Тест был также модифицирован, чтобы исключить возможность C4-расщепления через классический путь. Это было достигнуто с помощью буфера для разбавления образцов, содержащего 1М NaCl, который дает возможность высокоаффинного связывания распознающих компонентов лектинового пути со своими лигандами, но и предотвращает активацию эндогенного C4, тем самым исключая участие классического пути путем диссоциации C1-комплекса. Вкратце, в модифицированном тесте тестируемые образцы сыворотки (разведенный в высокое содержание соли в воде (1 М NaCl) буфер) добавляют к покрытым лигандом планшетам, с последующим добавлением постоянного количества очищенного C4 в буфере с физиологической концентрацией соли. Связывающие узнающие комплексы, содержащие MASP-2, расщепляют C4, что в результате приводит к C4b-депозиции.
Способы анализа:
1) Планшеты для микротитрования NuncMaxisorb (Maxisorb, Nunc, кат. № 442404, Fisher Scientific) были покрыты 1 мкг/мл маннана (M7504 Sigma) или любым другим лигандом (как, например, перечислено ниже), растворенным в буфере для покрытия (15 мМ Na2CО3, 35 мМ NaHCO3, рН 9,6).
Следующие реагенты были использованы в тесте:
a. маннан (1 мкг/лунку маннана (M750 Sigma) в 100 мкл буфера для покрытия);
b. зимозан (1 мкг/лунку зимозана (Sigma) в 100 мкл буфера для покрытия);
c. LTA (1 мкг/лунку 100 мкл буфера для покрытия или 2 мкг/лунку в 20 мкл метанола)
d. 1 мкг H-фиколинспецифических Мab 4H5 в буфере для покрытия
e. PSA из Aerococcus viridans (2 мкг/лунку в 100 мкл буфера для покрытия)
f. 100 мкл/лунку фиксированных в формалине S. aureus DSM20233 (OD550=0,5) в буфере для покрытия.
2) Планшеты инкубировали ночь при 4°С.
3) После ночной инкубации, остаточных сайты связывания белка были насыщены путем инкубирования планшетов с 0,1% HSA-TBS блокировочным буфером (0,1% (масс./об.) HSA в 10 мМ Трис-НCl, 140 мМ NaCl, 1,5 мМ NaN3, рН 7,4) в течение 1-3 часов, затем 3X промывка планшетов TBS/tween/Ca2+ (TBS с 0,05%, Tween 20 и 5 мМ CaCl2, 1 мМ MgCl2, рН 7,4).
4) Образцы сыворотки для тестирования разводили в MBL-связывающем буфер (1 М NaCl), и разбавленные образцы были добавлены к планшетам и инкубировали в ночь при 4°С. Лунки, содержавшие только буфер, использовались в качестве отрицательного контроля.
5) После инкубации в течение ночи при 4°С, планшеты промывали 3 раза TBS/tween/Са2+. C4 человека (100 мкл/лунку 1 мкг/мл, разбавленной в BBS (4 мМ барбитал, 145 мМ NaCl, 2 мМ CaСl2, 1 мМ MgСl2, рН 7,4)) затем добавляли к планшетам и инкубировали в течение 90 минут при 37°С. Планшеты промывали снова 3 раза TBS/tween/Са2+.
6) C4b-депозицию детектировали с помощью конъюгированных с щелочной фосфатазой куриных против C4c человека (в соотношении 1:1000 в ТBS/teen/Са2+), которые добавляли к планшетам и инкубировали в течение 90 минут при комнатной температуре. Планшеты затем снова промывали 3 раза TBS/tween/Са2+.
7) Щелочную фосфатазу детектировали путем добавления 100 мкл субстратного раствора п-нитрофенилфосфата, инкубации при комнатной температуре в течение 20 минут и считывания OD405 в ридере для планшетов для микротитрования.
Результаты: ФИГУРЫ 5A-B показывают количество C4b-депозиции на маннан (ФИГУРА 5) и зимозан (ФИГУРА 5B) в разведениях сыворотки от MASP-2+/+ (крестики), MASP-2+/- (темные кружки) и MASP-2-/- (темные треугольники). ФИГУРА 5C показывает относительную активность C4-конвертазы на планшетах, покрытых зимозаном («белые столбцы») или маннаном (затененные столбцы) от мышей MASP-2-/+ (n=5) и мышей MASP-2-/- (n=4) относительно мышей дикого типа (n=5), основанную на определении количества C4b-депозиции, нормированную на сыворотку дикого типа. Интервалы ошибки представляют собой стандартное отклонение. Как показано на ФИГУРЕ 5A-C, плазма от мышей MASP-2-/- является полностью дефектной по опосредованной лектиновым путем активации комплемента на планшетах, покрытых маннаном и зимозаном. Эти результаты наглядно демонстрируют, что MASP-2 является эффекторным компонентом лектинового пути.
Рекомбинантный MASP-2 восстанавливает зависящую от лектинового пути C4-активацию в сыворотке мышей MASP-2 -/-
Для того, чтобы установить, что отсутствие MASP-2 является непосредственной причиной потери зависимой от лектинового пути C4-активации у мышей MASP-2-/-, проверяли эффект добавления рекомбинантного белка MASP-2 к образцам сыворотки в анализе C4-расщепления, который был описан выше. Рекомбинантные белки функционально активного мышиного MASP-2 и каталитически неактивного мышиного MASP-2А (в котором остаток серина активного центра в домене сериновой протеазы был заменен на остаток аланина) были продуцированы и очищены, как описано ниже в Примере 3. Объединенную сыворотку от 4 мышей MASP-2 -/- предварительно инкубировали с увеличенными концентрациями белков рекомбинантного мышиного MASP-2 или неактивного рекомбинантного мышиного MASP-2A, и активность C4-конвертазы анализировали, как описано выше.
Результаты: Как показано на ФИГУРЕ 6, добавление белка функционально активного мышиного рекомбинантного MASP-2 (показано, как открытые треугольники) к сыворотке, полученной от мышей MASP-2 -/-, восстанавливало зависимую от лектинового пути C4-активацию, зависимым от концентрации белка образом, тогда как белок каталитически неактивного мышиного MASP-2A (отображается в виде звездочек) не восстанавливал C4-активацию. Результаты, показанные на ФИГУРЕ 6, нормализованы на C4-активацию, наблюдаемую с объединенной сывороткой от мышей дикого типа (показано пунктиром).
ПРИМЕР 3
В этом примере описывается рекомбинантная экспрессии и белковая продукция рекомбинантных полноразмерных MASP-2 человека, крысы и мыши, полипептидов MASP-2-производных и каталитически инактивированных мутантных форм MASP-2.
Экспрессия полноразмерных MASP-2 человека, крысы и мыши:
Последовательность кДНК полноразмерного MASP-2 человека (SEQ ID NO:4) была также субклонирована в экспрессионный вектор млекопитающих pCI-Nео (Promega), который управляет эукариотической экспрессией под контролем энхансерной/промоторной области CMV (описано в Kaufman R.J. et al., Nucleic Acids Research 9:4485-90, 1991; Kaufman, Methods in Emymology, 185:537-66 (1991)). Каждую из кДНК полноразмерных MASP-2 мыши (SEQ ID NO:50) и крысы (SEQ ID NO:53) субклонировали в вектор экспрессии pED. Векторы MASP-2-экспрессии затем трансфицировали в линию присоединенных клеток яичника китайского хомячка DXB1 с помощью стандартной процедуры трансфекции на основе фосфата кальция, описанной в Maniatis et al., 1989. Клетки, трансфицированные этими конструкциями, росли очень медленно, свидетельствуя о том, что кодированная протеаза является цитостатической.
В другом подходе, конструкцию минигена (SEQ ID NO:49), содержащую кДНК MASP-2 человека, управляемую своим эндогенным промотором, транзиентно трансфицировали в клетки яичников китайского хомячка (CHO). Белок MASP-2 человека секретировался в культуральную среду, и его выделяли, как это описано ниже.
Экспрессия полноразмерного каталитически неактивного MASP-2:
Обоснование: MASP-2 активируется автокаталитическим расщеплением после узнавания субкомпонентов MBL или фиколинов (L-фиколин, H-фиколин или М-фиколин), связанных с их соответствующим углеводным паттерном. Автокаталитическое расщепление, приводящее в результате к активации MASP-2, часто происходит во время процедуры выделения MASP-2 из сыворотки крови, или при очистке, следующей за рекомбинантной экспрессией. Чтобы получить более стабильный белковый препарат для использования в качестве антигена, каталитически неактивная форма MASP-2, обозначенная как MASP-2A, была создана путем замены остатка серина, который присутствует в каталитической триаде протеазного домена, остатком аланина в MASP-2 крысы (SEQ ID NO:55 Ser617 на Ala617); в MASP-2 мыши (SEQ ID NO:52 Ser617 на Ala617); или в MASP-2 человека (SEQ ID NO:3 Ser618 на Ala618).
В целях создания каталитически неактивных белков MASP-2A человека и мыши, осуществляли сайт-направленный мутагенез с помощью олигонуклеотидов, показанных в ТАБЛИЦЕ 5. Олигонуклеотиды в ТАБЛИЦЕ 5 были спроектированы для отжига на область кДНК человека и мыши, кодирующую ферментативно активный серин, и олигонуклеотиды содержат несоответствия для того, чтобы заменить кодон серина на кодон аланина. Например, ПЦР-олигонуклеотиды SEQ ID NO:56-59 были использованы в сочетании с кДНК MASP-2 человека (SEQ ID NO:4), чтобы амплифицировать область от стартового кодона до ферментативно активного серина и от серина до стоп-кодона для создания полной открытой рамки считывания из мутантного MASP-2A, содержащего мутантную замену Ser618 на Ala618. ПЦР-продукты очищали после агарозного гель-электрофореза и подготовки полос, и перекрывание единичного аденозина было создано с помощью стандартной тейлинг-процедуры. MASP-2A с тейлом аденозина затем клонировали в pGEM-T легкий вектор, трансформированный в E. coli.
Каталитически неактивный белок MASP-2A крысы создали путем обработки киназой и отжига SEQ ID NO:64 и SEQ ID NO:65 путем объединения этих двух олигонуклеотидов в эквимолярных количествах, нагревания при 100°С в течение 2 минут и медленного охлаждения до комнатной температуры. Образующийся в результате отожженный фрагмент имеет РstI- и XbaI-совместимые концы и был встроен вместо фрагмента PstI-XbaI кДНК MASP-2 крысы дикого типа (SEQ ID NO:53) для создания MASP-2A крысы.
5 'GAGGTGACGCAGGAGGGGCAITAGTGTTT 3' (SEQ ID NO:64)
5' CTAGAAACACTAATGCCCCTCCTGCGTCACCTCTGCA 3' (SEQ ID NO:65)
Каждая из MASP-2А человека, мыши и крысы были затем субклонированы в один из векторов экспрессии для млекопитающих pED или pCI-Nео и трансфицированы в клетки яичника китайского хомячка линии DXB1, как описано ниже.
В другом подходе, каталитически неактивную форму MASP-2 конструируют с использованием способа, описанного в Chen et al., J. Biol. Chem, 276(28):25894-25902, 2001. Вкратце, плазмиду, содержащую кДНК полноразмерного MASP-2 человека (описано в Thiel et al., Nature 386:506, 1997), переваривают XhoI и EcoRI, и кДНК MASP-2 (описанная в настоящем документе как SEQ ID NО:4) клонируют в соответствующие рестрикционные сайты бакуловирусного передающего вектора pFastBac1 (Life Technologies, NY). Активный участок сериновой протеазы MASP-2 по Ser618 затем меняют на Ala618 путем замены двуцепочечных олигонуклеотидов, кодирующих аминокислот 610-625 (SEQ ID NO:13) пептида области, на аминокислоты с 610 по 625 нативной области, чтобы создать полноразмерный полипептид MASP-2 с неактивным протеазным доменом.
Конструирование экспрессионных плазмид, содержащих полипептидные области, полученных от MASP-2 человека.
Следующие конструкции были произведены с использованием сигнального пептида MASP-2 (остатки 1-15 SEQ ID NO:5) для секретирования различных доменов MASP-2. Конструкции, экспрессирующие домен CUBI MASP-2 человека (SEQ ID NO:8), производятся ПЦР-амплификацией области, кодирующей остатки 1-121 из MASP-2 (SEQ ID NO:6) (соответствующие N-концевому домену CUBI). Конструкцию, экспрессирующая домен CUBIEGF MASP-2 человека (SEQ ID NO:9), получают ПЦР-амплификацией области, кодирующей остатки 1-166 из MASP-2 (SEQ ID NO:6) (соответствующего N-концевому домену CUBIEGF). Конструкцию, экспрессирующую домен CUBIEGFCUBII MASP-2 человека (SEQ ID NO:10), получают ПЦР-амплификацией области, кодирующей остатки 1-293 из MASP-2 (SEQ ID NO:6) (соответствующего N-концевому домену CUBIEGFCUBII). Вышеуказанные домены амплифицируют при помощи ПЦР с использованием полимеразы VentR и pBS-MASP-2 в качестве матрица, в соответствии с установленными способами ПЦР. 5'-праймерная последовательность смыслового праймера (5'-CGGGATCCATGAGGCTGCTGACCCTC-3' SEQ ID NO:34) вводит сайт рестрикции BamHI (подчеркнуто) в 5'-конец ПЦР-продуктов. Антисмысловые праймеры для каждого из MASP-2-доменов, как показано ниже в ТАБЛИЦЕ 5, предназначены для введения стоп-кодона (шрифт жирный), за которыми следует сайт EcoRI (подчеркнуто), в конце каждого ПЦР-продукта. После амплификации фрагменты ДНК переваривают BamHI и EcoRI и клонируют в соответствующие сайты вектор pFastBae1. Получившиеся конструкции характеризуют рестрикционным картированием и подтверждают дцДНК-секвенированием.
Рекомбинантная эукариотическая экспрессия MASP-2 и продуцирование ферментативно неактивных белков MASP-2А мыши, крысы и человека.
Конструкции для экспрессии MASP-2 и MASP-2A, описанные выше, трансфицировали в клетки DXB1 с помощью стандартной процедуры трансфекции с использованием фосфата кальция (Maniatis et al., 1989). MASP-2A продуцировали в бессывороточной среде, для гарантии того, что препараты не загрязнены другими белками сыворотки крови. Среду отбирали от сливающихся клеток каждый второй день (четыре раза в общей сложности). Уровень рекомбинантного MASP-2A в среднем составлял около 1,5 мг /литр питательной среды для каждого из трех видов.
Очистка белка MASP-2A: MASP-2A (мутант Ser-Ala, описанный выше) очищали аффинной хроматографией на колонках с МВР-агарозой. Эта стратегия позволяла проводить быструю очистку без использования чужеродных тегов. MASP-2A (100-200 мл среды, разбавленной равным объемом нагружающего буфера (50 мМ Tris-Cl, pH 7,5, содержащий 150 мМ NaCl и 25 мМ СaСl2) нагружали на аффинную колонку с MBP-агарозой (4 мл), предварительно уравновешенной 10 мл нагружающего буфера. После промывки дополнительными 10 мл нагружающего буфера, белки элюировали фракциями по 1 мл с 50 мМ Tris-Cl, pH 7,5, содержащего 1,25 М NaCl и 10 мМ ЭДТК. Фракции, содержащие MASP-2А, определяли при помощи электрофореза в полиакриламидном геле в присутствии SDS. В случае необходимости, MASP-2A дополнительно очищали при помощи ионообменной хроматографии на колонке MonoQ (HR 5/5). Белок диализовали против 50 мМ Tris-Cl рН 7,5, содержащего 50 мM NaCl, и нагружали на колонку, уравновешенную тем же буфером. После промывки, связанный MASP-2A элюировали градиентом NaCl (0,05-1 М) более 10 мл.
Результаты: Выход 0,25-0,5 мг белка MASP-2A были получены с 200 мл среды. Молекулярная масса 77,5 кДа, определенная при помощи MALDI-MS, превышает расчетное значение немодифицированного полипептида (73,5 кДа) из-за гликозилирования. Присоединение гликанов к каждому из участков N-гликозилирования объясняет наблюдаемую массу. MASP-2A перемещается отдельной полосой в SDS-полиакриламидном геле, демонстрируя, что она не подверглась протеолизу в процессе биосинтеза. Усредненная молекулярная масса, определенная равновесным центрифугированием, соответствует расчетному значению для гомодимеров гликозилированных полипептидов.
ПРОИЗВОДСТВО РЕКОМБИНАНТЫХ ПОЛИПЕПТИДОВ MASP-2 ЧЕЛОВЕКА
Другой способ получения рекомбинантных полипептидов MASP-2 и производного MASP2A описано в Thieiens, Н.М., et al., J. Immunol 166:5068-5077, 2001. Вкратце, клетки насекомого Spadopiera frugiperda (клетки Ready-Plaque Sf9, полученные от Novagen, Мэдисон, WI) выращивают и поддерживают в бессывороточной среде Sf900II (Life Technologies) с добавлением 50 ед./мк пенициллина и 50 мг/мл стрептомицина (Life Technologies). Клетки насекомого Trichoplusia ni (High Five) (предоставленные Jadwiga Chroboczek, Институт биологических структур, Гренобль, Франция) поддерживают в среде ТС100 (Life Technologies), содержащей 10% FCS (Dominique Dutscher, Брюмат, Франция) с добавлением 50 ед./мл пенициллина и 50 мг/мл стрептомицина. Рекомбинантные бакуловирусы создают с помощью системы Baс-to-Bac (Life Technologies). Бакмидную ДНК очищают с помощью система очистки Qiagen midiprep (Qiagen) и используют для трансфекции клеток насекомого Sf9 с помощью целфектина в среде Sf900 II SFM (Life Technologies), как описано в инструкции производителя. Рекомбинантные вирусные частицы собирают спустя 4 дня, титруют при помощи теста на вирусные бляшки, и размножают, как описано в King and Possee, in The Baculovims Expression System: A Laboratory Guide, Chapman and Hall Ltd., London, pp. 111 -114, 1992.
Клетки High Five (1,75×107клеток/175 см2-флакон для культуры тканей) инфицировали рекомбинантными вирусами, содержащими полипептиды MASP-2, при множественности заражения 2 в среде Sf900 II SFM при 28°С в течение 96 ч. Супернатант собирали путем центрифугирования, и добавляли диизопропилфосфорофторидат до конечной концентрации 1 мМ.
Полипептиды MASP-2 секретируются в культурную среду. Культурные супернатанты диализуют против 50 мМ NaCl, 1 мМ CaCl2, 50 мМ триэтаноламингидрохлорид, pH 8,1, и нагружают при 1,5 мл/мин на колонку Q-Sepharose Fast Flow (Amersham Pharmacia Biotech) (2,8×12 см), уравновешенную в том же буфере. Элюция проводится применением 1,2-литрового линейного градиента до 350 мМ NaCl в том же буфере. Фракции, содержащие рекомбинантные полипептиды MASP-2, определяют Вестерн-блот-анализом, преципитируют добавлением (NH4)2SO4 до 60% (масс./об.), и оставляют на ночь при 4°С. Осадок ресуспендировали в 145 мМ NaCl, 1 мМ CaCl2, 50 мМ триэтаноламингидрохлориде, рН 7,4, и наносили на колонку TSG3000 SWG (7,5×600 мм) (Tosohaas, Montgomeryville, PA), уравновешенную тем же буфером. Очищенные полипептиды затем концентрируют до 0,3 мг/мл при помощи ультрафильтрации на микроконцентраторах Microsep (молекулярная масса исключения составляет 10,000) (Filtron, Karistein, Германия).
ПРИМЕР 4
Этот пример описывает способ получения поликлональных антител против полипептидов MASP-2.
Материалы и способы:
Антигены MASP-2: Антисыворотку поликлональных антител против MASP-2 человека производит путем иммунизации кроликов следующими изолированными полипептидами MASP-2: MASP-2 человека (SEQ ID NO:6), изолированный из сыворотки крови; рекомбинантный MASP-2 человека (SEQ ID NO:6), MASP-2A, содержащий неактивный протеазный домен (SEQ ID NO:13), как описано в Примере 3; и рекомбинантные CUBI (SEQ ID NO:8), CUBEGFT (SEQ ID NO:9) и CUBEGFCUBII (SEQ ID NO:10), экспрессированные, как описано выше в Примере 3.
Поликлональные антитела: Шестинедельные кролики, подвергнутые первичному воздействию БЦЖ (вакцина бациллы Кальметта-Герена) иммунизировали путем инъекции 100 мкг полипептида MASP-2 в 100 мкг/мл стерильного физиологического раствора. Инъекции проводятся каждые 4 недели, с титром антител, контролируемым при помощи ИФА, как описано в Примере 5. Культуральные супернатанты собирают для очистки антител при помощи белок А-аффинной хроматографии.
ПРИМЕР 5
Этот пример описывает способ получения мышиных моноклональных антител против полипептидов MASP-2 крысы и человека.
Материалы и способы:
Самцам мышей А/j (Harlan, Хьюстон, штат Техас) с возрастом 8-12 недель, вводят подкожно по 100 мкг полипептидов rMASP-2 или rMASP-2А человека или крысы (подготовленных, как описано в Примере 3) в полном адъюванте Фрейда (Difco Laboratories, Detroit, штат Мичиган) в 200 мкл буферизованного фосфатом солевого раствора (PBS) с pH 7,4. С двухнедельными интервалами мышам дважды вводят подкожно 50 мкг полипептидов rMASP-2 или rМASP-2A человека или крыса в неполном адъюванте Фрейда. На четвертой неделе мышам вводят 50 мкг полипептидов rMASP-2 или rMASP-2 человека или крыс в PBS и сливали спустя 4 дня.
Для каждого слияния, подготавливали отдельные клеточные суспензии из селезенки в иммунизированной мыши и использовали для слияния с миеломными клетками Sp2/0. 5×108 из Sp2/0 и 5×108 клеток селезенки сливают в среде, содержащей 50% полиэтиленгликоля (мол. масса 1450) (Kodak, Рочестер, Нью-Йорк) и 5% диметилсульфоксида (Sigma Chemical Co., Сент-Луис, Mo). Клетки затем доводят до концентрации 1,5×105 клеток селезенки в 200 мкл суспензии в среде Iscove (Gibco, Гранд-Айленд, N.Y.), с добавлением 10% эмбриональной сыворотки крупного рогатого скота, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина, 0,1 мМ гипоксантина, 0,4 мкМ аминоптерина и 16 мкМ тимидина. Двести микролитров суспензии клеток добавляют в каждую лунку около двадцати 96-луночных планшетов для микротитрования. Примерно через десять дней культуральные супернатанты отбирают для скрининга на реакционноспособность с очищенным фактором MASP-2 в иммуноферментном анализе.
Иммуноферментный анализ (ИФА): Лунки планшетов для микротестов Immulon 2 (Dynatech Laboratories, Chantilly, Va.) покрывают путем добавления 50 мкл очищенного hMASP-2 при 50 нг/мл или rMASP-2 (или rMSP-2А) крысы в течение ночи при комнатной температуре. Низкая концентрация MASP-2 для покрытия дает возможность отбора высокоаффинных антител. После удаления покрывающего раствора путем стряхивания планшетов, 200 мкл BLOTTO (обезжиренное сухое молоко) в PBS добавляют в каждую лунку на один час, чтобы блокировать неспецифические участки. Час спустя, лунки промывают буфером PBST (PBS, содержащие 0,05% Tween 20). Пятьдесят микролитров культурального супернатанта для каждой лунки со слиянием собирают и смешивают с 50 мкл BLOTTO, а затем добавляют к отдельным лункам планшетов для микротитрования. После одного часа инкубации лунки промывают PBST. Связанные мышиные антитела затем детектируют при помощи реакции с пероксидазой хрена (HRP), конъюгированной с козлиными анти-мышиными IgG (Fc специфические) (Jackson ImmunoResearch Laboratories, West Grove, штат Пенсильвания), и разводят в 1:2000 в BLOTTO. Раствор субстрата пероксидазы, содержащий 0,1% 3,3,5,5 тетраметилбензидин (Sigma, St. Louis, Mo.) и 0,0003% пероксида водорода (Sigma), добавляют к лункам для развития окраски в течение 30 минут. Реакция прекращается при добавлении 50 мкл 2М H2SO4 на лунку. Оптическую плотность при 450 нм реакционной смеси считывают при помощи ридера BioTek ELISA (BioTek instruments, Winooski, Vt).
Тест на MASP-2-связывание
Культуральные супернатанты, которые дают положительный результат в MASP-2 ИФА-тесте, описанном выше, могут быть протестированы в анализе связывания для определения аффинности связывания, которой обладают MASP-2-ингибирующие агенты по отношению к MASP-2. Подобный анализ может также использоваться, чтобы определить, связываются ли ингибирующие агенты с другими антигенам в системе комплемента.
Лунки полистиролового планшета для микротитрования (96-луночные планшеты со средним связыванием, Corning Costar, Cambridge, MA) покрывают MASP-2 (20 нг/100 мкл/лунку, Advanced Research Technology, San Diego, CA) в буферизованном фосфатом солевом растворе (PBS) с рН 7,4 в течение ночи при 4°С. После аспирации раствора MASP-2, лунки блокируют PBS, содержащим 1% бычьего сывороточного альбумина (БСА; Sigma Chemical) в течение 2 ч при комнатной температуре. Лунки без MASP-2-покрытия служат в качестве фонового контроля. Аликвоты гибридомных супернатантов или очищенных анти-MASP-2 MoAb, при различных концентрациях в блокирующем растворе, добавляют в лунки. После 2 ч инкубации при комнатной температуре лунки тщательно промывали PBS. MASP-2-связанные анти-MASP-2 MoAb определяют добавлением коньюгированных с пероксидазой козлиных анти-мышиных IgG (Sigma Chemical) в блокирующем растворе, что позволяет инкубировать 1 час при комнатной температуре. Планшет тщательно промывают еще раз с PBS, и добавляют 100 мкл субстрата 3,3',5,5-тетраметилбензидина (ТМВ) (Kirkegaard and Perry Laboratories, Gaithersburg, MD). Реакцию ТМВ гасится добавлением 100 мкл 1 М ортофосфорной кислоты, и планшет считывается при 450 нм в ридере для микропланшетов (SPECTRA MAX 250, Molecular Devices, Sunnyvale, CA).
Культуральные супернатанты из положительных лунок затем проверяют на способность ингибировать активацию комплемента в функциональном анализе, таком как анализ C4-расщепления, как описано в Примере 2. Клетки в положительных лунках затем клонируют последовательным разведением. MoAb тестируются снова на реактивность с hMASP-2 с помощью ИФА-теста, как описано выше. Отобранные гибриды выращивают в покачивающихся флаконах, и использованный культуральный супернатант собирают для очистки антитела при помощи протеин А-аффинной хроматографии.
ПРИМЕР 6
Этот пример описывает создание и продуцирование гуманизированных мышиных антител анти-MASP-2 и фрагменты антител.
Мышиное моноклональное антитело анти-MASP-2 получают в самцах мышей A/J, как описано в Примере 5. Мышиное антитело затем гуманизируют, как описано ниже, чтобы уменьшить его иммуногенность путем замены константных областей мыши на их человеческие аналоги для создания химерного IgG и Fab-фрагмента антитела, который пригоден для ингибирования неблагоприятных эффектов MASP-2-зависимой активации комплемента у субъекта-человека в соответствии с настоящим изобретением.
1. Клонирование генов переменной области анти-MASP-2 из мышиных гибридомных клеток. Тотальную РНК выделяют из гибридомных клеток, секретирующих анти-MASP-2 MoAb (полученных, как описано в Примере 7) с помощью RNAzol, следуя протоколу производителя (Biotech, Хьюстон, штат Техас.). Первую цепь кДНК синтезируют из тотальной РНК с помощью олиго dT в качестве праймера. ПЦР осуществляется с помощью 3'-праймеров, полученных к константной C-области иммуноглобулина, и генерированных наборов праймеров, производных от лидерного пептида или первой рамочной области мышиных генов Vн или Vk, в качестве 5'-праймеров. Заякоренный ПЦР осуществляется, как описано Chen и Platsucas (Chen, P.F., Scand. J. Immunol. 35:539-549, 1992). Для клонирования Vk-генов, двухцепочечную кДНК подготавливают с использованием праймера NotI-MAK1 (5'-TGCGGCCGCTGTAGGTOCTGTC-3' SEQ ID NO:38). Отожженные адапторы AD1 (5'-GGAAТTCACTCGTTArCTCGGA-3' SEQ ID NO:39) и AD2 (5-TCCGAGAATACGAGTG-3' SEQ ID NO:40) лигировали как с 5'-, так и с 3'-концом двухцепочечной кДНК. Адапторы на 3'- концах удаляют при помощи расщепления NotI. Расщепленный продукт затем используются в качестве матрица при ПЦР с олигонуклеотидом AD1 в качестве 5'-праймера и MAK2 (5'-CATTGAAAGCTTTGGGGTAGAAGТTGTTC-3' SEQ ID NO:41) в качестве 3'-праймера. Фрагменты ДНК примерно в 500 п.н. клонируют в pUC19. Несколько клонов отбирают для анализа последовательности, чтобы убедиться, что клонированная последовательность включает в себя ожидаемую константную область иммуноглобулина мыши. Олигонуклеотиды NotI-MAK1 и MAK2 являются производными от Vk-области и составляют 182 и 84 п.н., соответственно, ниже по течению от первой пары оснований гена C каппа. Выбирают клоны, которые включают полную Vk и лидерный пептид.
Для клонирования VН генов, двухцепочечную кДНК подготавливают с использованием праймера NotI-MAK1 (5'-CGCGGCCGCAGCTGCTCAGAGTGTAGA-3' SEQ ID NO:42). Отожженные адапторы AD1 и AD2 лигируют как с 5'-, так и с 3'-концом двухцепочечной кДНК. Адаптеры на 3'-концах удаляют путем расщепления NotI. Расщепленный продукт используется в качестве матрицы при ПЦР с олигонуклеотидом AD1 и MAG2 (5'- CGGTAAGCTTCACTGGCTCAGGGAAATA-3' SEQ ID NO:43) в качестве праймеров. Фрагменты ДНК от 500 до 600 п.н. в длину клонируют в pUC19. Олигонуклеотиды NotI-MAG1 и MAG2 являются производными от области Cγ.7.1 мыши, и составляют 180 и 93 п.н., соответственно, ниже по течению от первой пары нуклеотидов гена Cγ.7.1 мыши. Выбирают клоны, которые охватывают полную VН и лидерный пептид.
2. Конструирование векторов экспрессии для химерных MASP-2 IgG и Fab. Клонированные гены VН и VК, описанные выше, используются в качестве матриц в ПЦР-реакции для добавления консенсусной последовательности Kozak на 5' -конец и сплайс-донора на 3' -конце нуклеотидной последовательности. После того, как последовательности проанализируют с целью подтверждения отсутствия ПЦР-ошибок, гены VН и VК встраивают в кассеты вектора экспрессии, содержащие Cγ.1 и C. каппа человека, соответственно, чтобы дать pSV2neoVН-huCγ1 и pSV2neoV-huCγ. Плазмидные ДНК векторов тяжелой и легкой цепи, очищенные в градиенте CsCl, используются для трансфекции COS-клеток с помощью электропорации. После 48 часов, культуральный супернатант проверяют способом ИФА с целью подтвердить присутствие около 200 нг/мл химерного IgG. Клетки собирают и подготавливают тотальную РНК. Первую цепь кДНК синтезируют на тотальной РНК с помощью олиго-dT праймера. Эту кДНК используют в качестве матрица при ПЦР для создания фрагментов ДНК Fd и каппа. Для гена Fd, ПЦР проводится с использованием 5'-AAGAAGCTTGCCGCCACCATGGATTGGCTGTGGAACT-3' (SEQ ID NO:44) в качестве 5'-праймера и CH1-производного 3'-праймера (5'-CGGGATCCTCAAACTTTCTTGTCCACCTTGG-3' SEQ ID NO:45). В последовательности ДНК подтверждают содержание полного VН и CH1-домена IgG1 человека. После расщепления нужными ферментами, Fd-фрагменты ДНК встраивают в сайты рестрикции HindIII и BamHI кассеты вектора экспрессии pSV2dhfr-TUS c образованием pSV2dhfrFd. Плазмида pSV2 является коммерчески доступной и состоит из сегментов ДНК из различных источников: ДНК pBR322 (тонкая линия) содержит ориджин репликации ДНК pBR322 (pBR ori) и лактамазный ген устойчивости к ампициллину (Amp); ДНК SV40, представленная более широкой штриховкой и помеченная, содержит ориджин репликации ДНК SV40 (SV40 ori), ранний промотор (5ʹ к dhfr, и гены nео), и сигнал полиаденилирования (3' к dhfr, и гены nео). Полученный от SV40 сигнал полиаденилирования (рА) также размещается на 3' конце Fd-гена.
Для гена каппа, ПЦР осуществляется с помощью 5ʹ-AAGAAAGCTTGCCGCCACCATGTTCTCACTAOCTCT-3' (SEQ ID NO:46), в качестве 5'-праймера, и CK-производного 3'-праймера (5'-CGGGATCCTTCTCCCTCTAACACTCT-3' SEQ ID NO;47). Секвенирование ДНК подтверждает содержание полных областей Vk и Ckчеловека. После расщепления нужными ферментами рестрикции, ДНК-фрагменты каппа встраивают в сайты рестрикции HindIII и BamHI кассеты экспрессионного вектора pSV2neo-TUS c образованием pSV2neoK. Экспрессия как гена Fd, так и гена kappa управляется полученными от HCMV энхансерными и промоторными элементами. Поскольку ген Fd не включает аминокислотный остаток цистеина, участвующий в образовании дисульфидных связей между цепями, этот рекомбинантный химерный Fab содержит нековалентно связанные тяжелые и легкие цепи. Это химерный Fab обозначается как cFab.
Для получения рекомбинантного Fab с дисульфидной связью между тяжелой и легкой цепями, вышеописанный ген Fd может быть расширен и включать кодирующую последовательность для дополнительных 9 аминокислот (EPKSCDKTH SEQ ID NO:48) от области петли IgG1 человека. Сегмент ДНК BstEII-BamHI, кодирующий 30 аминокислот на 3' конце гена Fd, может быть заменен участками ДНК, кодирующими продленный Fd, с образованием в результате pSV2dhfrFd/9aa.
3. Экспрессия и очистка химерного IgG анти-MASP-2
Для создания линии клеток, секретирующих химерный IgG анти-MASP-2, клетки NSО трансфицировали очищенными плазмидными ДНК pSV2neoVН-huC.γ1 и pSV2neoVН-huC.kappa при помощи электропорации. Трансфицированные клетки отбирали в присутствии 0,7 мг/мл G418. Клетки выращивали в роллерной колбе на 250 мл с помощью среды, содержащей сыворотку.
Культуральный супернатант от 100 мл роллерной культуры нагружают на 10-мл колонку PROSEP-А (Bioprocessing, Inc., Princeton, NJ). Колонку промывают 10 объемами колонки PBS. Связанное антитело элюируют 50 мM цитратного буфера, pH 3,0. Равный объем 1 М Hepes, рН 8,0 добавляют к фракции, содержащей очищенное антитело, для доведения рН до 7,0. Остаточные соли удаляют с помощью замены буфера на PBS при помощи мембранной ультрафильтрации Millipore (мол. масса исключения составляет 3000). Концентрацию белка очищенных антител определяют способом ВСА (Pierce).
4. Экспрессия и очистка химерного Fab анти-MASP-2
Для создания линий клеток, секретирующих химерный Fab анти-MASP-2, клетки СНО трансфицируют очищенными плазмидными ДНК pSV2dhfrFd (или pSV2dhfrFd/9aa) и pSV2neokappa при помощи электропорации. Трансфицированные клетки отбирают в присутствии G418 и метотрексата. Отобранные линии клеток размножают при повышенных концентрациях метотрексата. Клетки представляют собой отдельную клетку, субклонированную при помощи последовательных разведений. Высокопродуктивные клеточные линии, субклонированные из одной клетки, затем выращивают в 100 мл роллерной культуры, используя бессывороточную среду.
Химерный Fab анти-MASP-2 очищают при помощи аффинной хроматографией с помощью мышиного антиидиотипического MoAb к MASP-2 MoAb. Антиидиотипическое MASP-2 MoAb может быть получено путем иммунизации мышей мышиным MoAb анти-MASP-2, конъюгированным с гемоцианином лимфы улитки (KLH) и скринирования специфического MoAb-связывания, которое может конкурировать с MASP-2 человека. Для очистки, 100 мл супернатанта роллерной культуры CHО клеток, продуцирующих cFab или cFab/9aa, загружают на аффинную колонку, в сочетании с антиидиотипическим MASP-2 MoAb. Колонку затем тщательно промывают PBS перед тем, как связанный Fab элюируют 50 мМ диэтиламином, pH 11,5. Остаточные соли удаляют с использованием замены буфера, как описано выше. Концентрацию белка очищенного Fab определяют способом ВСА (Pierce).
Способность химерных MASP-2 IgG, cFab, и eFAb/9aa подавлять MASP-2-зависимый путь комплемента можно определить с помощью ингибиторных тестов, описанных в Примере 2 или Примере 7.
ПРИМЕР 7
Этот пример описывает in vitro анализ C4-расщепления, используемого в качестве функционального скрининга, чтобы определить MASP-2-ингибирующие агенты, способные блокировать MASP-2-зависимую активацию комплемента через L-фиколин/P35, H-фиколин, М-фиколин или маннан.
Анализ C4-расщепления: анализ C4-расщепления был описан в Petersen, S.V., et al., J. Immunol Methods 257: 107, 2001, который определяет активацию лектинового пути, обусловленного липотехоевой кислотой (LTA) из S. Aureus, которая связывает L-фиколин.
Реагенты: Зафиксированные в формалине S. aureous (DSM20233) готовятся следующим образом: бактерии выращивают в течение ночи при 37°С в триптической соевой среде с добавлением крови, промывают три раза PBS, затем фиксируют в течение 1 ч при комнатной температуре в PBS/0,5%-растворе формалина, и промывают еще три раза PBS, прежде чем ресуспендировать в буфере для покрытия (15 мМ Na2CО3, 35 мМ NaHCО3, pH 9,6).
Анализ: Лунки планшета для микротитрования Nunc MaxiSorb (Nalgene Nunc International, Рочестер, Нью-Йорк) покрывают: 100 мкл зафиксированных в формалине S. aureous DSM20233 (0D550 = 0,5) в буфере для покрытия и 1 мкг L-фиколина в буфере для покрытия. После инкубации в течение ночи лунки блокируют 0,1% сывороточным альбумином человека (HSA) в TBS (10 мМ трис-HCl, 140 мМ NaCl, рН 7,4), затем промывают TBS, содержащим 0,05%, Tween 20 и 5 мМ CaCl2 (промывочный буфер). Образцы сыворотки человека разводят в 20 мМ Tris-HCl, 1 M NaCl, 10 мМ CaCl2, 0,05% Triton X-100, 0,1% HSA, pH 7,4, что предотвращает активацию эндогенного C4 и диссоциирует C1-комплекс (состоящий из C1q, Clr и C1s). MASP-2 ингибирующие агенты, в том числе MoAb анти-MASP-2 и ингибирующие пептиды, добавляют к образцам сыворотки в различных концентрациях. Разбавленные образцы добавляют к планшету и инкубируют в течение ночи при 4°C. Через 24 часа, планшеты тщательно промывают промывочным буфером, потом 0,1 мкг очищенного C4 человека (полученного, как описано в Dodds, A.W., Methods Enzymol. 223:46, 1993) в 100 мкл 4 мМ барбитала, 145 мМ NaCl, 2 мМ CaCl2,1 мМ MgCl2, pH 7,4, добавляют в каждую лунку. Через 1,5 ч при 37°С, планшеты промывают снова и C4b-депозицию детектируют с помощью конъюгированных с щелочной фосфатазой куриных антител против C4c человека (полученные от Immunsystem, Уппсала, Швеция) и измеряют с помощью колориметрического субстрата p-нитрофенилфосфата.
Анализ C4 на маннане: Описанный выше анализ адаптируют для измерения активации лектинового пути через MBL путем покрытия планшета LSP и маннаном перед добавлением сыворотки крови, смешанной с различными MASP-2-ингибирующими агентами.
Анализ C4 на Н-фиколин (Hakata Ag): Описанный выше анализ адаптируют для измерения активации лектинового пути через Н-фиколин путем покрытия планшета LSP и Н-фиколин перед добавлением сыворотки крови, смешанной с различными MASP-2-ингибирующими агентами.
ПРИМЕР 8
Следующий анализ свидетельствует о наличии классического пути активации у мышей дикого типа и мышей MASP-2-/-.
Способы: Иммунные комплексы были созданы in situ путем покрытия планшетов для микротитрования (Maxisorb, Nunc, Кат. № 442404, Fisher Scientific) 0,1% сывороточным альбумином человека в 10 мМ трис, 140 мМ NaCl, pH 7,4 в течение 1 часа при комнатной температуре, затем инкубации в течение ночи при температуре 4°С с овечьей антисывороткой против цельной сыворотки (Scottish Antibody Production Unit, Карлюк, Шотландия), разведенной 1:1000 в TBS/tween/Ca2+. Образцы сыворотки получали от мышей дикого типа и мышей MASP-2-/-, и добавляли к планшетам с покрытием. Подготавливали контрольные образцы, в которых С1q был исчерпан в образцах сыворотки дикого типа и MASP-2-/-. C1q-обедненная мышиная сыворотка была подготовлена с использованием Dynabead, связанных с протеином А (Dynal Biotech, Осло, Норвегия), покрытых кроличьими IgG против C1q человека (Dako, Glostrup, Дания) в соответствии с инструкциям поставщика. Планшеты инкубировали в течение 90 минут при 37°С. Связанный C3b детектировали поликлональным антителом против C3c человека (Dako В 062), разведенным в TBS/tw/Ca2+ 1:1000. Вторичное антитело представляет собой козлиный IgG против кроличьих.
Результаты: ФИГУРА 7 показывает относительные уровни C3b-депозиции на планшетах, покрытых IgG, в сыворотке дикого типа, сыворотке MASP-2 -/-, C1q-обедненной сыворотке дикого типа и C1q -обедненной сыворотке MASP-2-/-. Эти результаты показывают, что классический путь является интактным в штамме мыши MASP-2-/-.
ПРИМЕР 9
Следующий анализ используется для проверки того, блокирует ли MASP-2-ингибирующий агент классический путь, путем анализа эффекта MASP-2-ингибирующего агент при состояниях, когда классический путь инициируется иммунными комплексами.
Способы: Для тестирования эффекта MASP-2-ингибирующего агента на состояния активации комплемента, где классический путь инициируется иммунными комплексами, три повторности по 50 мкл образцов, содержащих 90% NHS, инкубируют при 37°С в присутствии 10 мкг/мл иммунных комплексов (IC) или PBS, и параллельно включены образцы в трех повторностях (+/-IC), которые содержат 200 нМ моноклонального антитела к пропердину в течение инкубации при 37°С. После двух часов инкубации при 37°С, 13 мМ ЭДТК добавляют ко всем образцам, чтобы остановить дальнейшую активацию комплемента, и образцы немедленно охлаждают до 5°С. Образцы хранятся при температуре -70°С до того, как будут проанализированы на продукты активации комплемента (C3a и sC5b-9) с помощью ИФА-наборов (Quidel, Кат. № А015 и A009), следуя инструкциям производителя.
ПРИМЕР 10
В этом примере описывается идентификация высокоаффинных Fab2-фрагментов антитела анти-MASP-2, блокирующих активность MASP-2.
Предпосылки и обоснование: MASP-2 представляет собой сложный белок с множеством отдельных функциональных доменов, в том числе: сайт(ы) связывания для MBL и фиколинов, каталитический сайт сериновой протеазы, сайт связывания для протеолитического субстрата C2, сайт связывания для протеолитического субстрата C4, сайт расщепления MASP-2 для аутоактивации MASP-2-зимогена и две сайта связывания Ca2+. Были выявлены Fab2-фрагменты антитела, которые связываются с высокой аффинностью с MASP-2, и выявленные Fab2-фрагменты были протестированы в функциональном анализе, чтобы определить, способны ли они блокировать функциональную активность MASP-2.
Для блокирования функциональной активности MASP-2, антитело или Fab2-фрагмент антитела должны связываться с и служить препятствием структурному эпитопу на MASP-2, который необходим для функциональной активности MASP-2. Поэтому многие, если не все высокоаффинные связывающие Fab2 анти-MASP-2 могут не препятствовать функциональной активности MASP-2, если они связываются со структурными эпитопами на MASP-2, которые принимают непосредственное участие в функциональной активности MASP-2.
Функциональный анализ, в котором определяется ингибирование формирования C3-конвертазы лектинового пути, был использован для оценки «блокирования активности» Fab2 анти-MASP-2. Известно, что основная физиологическая роль MASP-2 в лектиновом пути представляет собой образование следующего функционального компонента лектин-опосредованного пути комплемента, а именно: C3-конвертаза лектинового пути. C3-конвертаза лектинового пути является критическим ферментативным комплексом (C4bC2a), который протеолитически расщепляет C3 на C3a и C3b. MASP-2 не является структурным компонентом C3-конвертазы лектинового пути (C4bC2a); однако, функциональная активность MASP-2 необходима для образования двух белковых компонентов (C4b, C2a), которые содержат C3-конвертазу лектинового пути. Кроме того, каждая из отдельных функциональных активностей MASP-2, перечисленных выше, по-видимому, необходима для того, чтобы MASP-2 образовывала C3-конвертазу лектинового пути. По этим причинам, предпочтительным для использования анализом при оценке «блокирующей активности» Fab2 анти-MASP-2 считается функциональный анализ, который позволяет определять ингибирование образования C3-конвертазы лектинового пути.
Создание высокоаффинных Fab2: Библиотека фагового дисплея последовательностей вариабельных легких и тяжелых цепей антител человека и технология автоматизированного отбора антител для идентификации Fab2, которые реагируют с выбранными лигандами, представляющими интерес, была использована для создания высокоаффинных Fab2 к белку MASP-2 крысы (SEQ ID NO:55). Известное количество белка MASP-2 крысы (около 1 мг, степень очистки >85%) используют для скрининга антител. Три раунда амплификация были использованы для отбора антител с наилучшей аффинностью. Примерно 250 различных хитов, экспрессирующих фрагменты антител, были выбраны для ИФА-скрининга. Высокоаффинные хиты впоследствии были секвенированы для определения уникальности различных антител.
Пятьдесят уникальных антител анти-MASP-2 были очищены, и 250 мкл каждого очищенного Fab2 антитела было использовано для характеристики аффинности связывания MASP-2 и функционального тестирования пути комплемента, как описано более подробно ниже.
Тесты, используемые для оценки ингибирующей (блокирующей) активности Fab2 анти-MASP-2
1. Анализа для определения ингибирования образования C3-конвертазы лектинового пути:
Предпосылки: C3-конвертаза лектинового пути представляет собой ферментативный комплекс (C4bC2a), который протеолитически расщепляет C3 в два эффективных провоспалительных фрагмента, анафилатоксин C3a и опсонический C3b. Формирование C3-конвертазы, по-видимому, является ключевой стадией в лектиновом пути в плане опосредования воспаления. MASP-2 не является структурным компонентом C3-конвертазы лектинового пути (C4bC2a); поэтому антитела анти-MASP-2 (или Fab2) не должны напрямую ингибировать активность уже существующей C3-конвертазы. При этом активность сериновой протеазы у MASP-2 необходима для создания двух белковых компонентов (C4b, C2a), которые составляют C3-конвертазу лектинового пути. Таким образом, Fab2 анти-MASP-2, который ингибирует функциональную активность MASP-2 (т.е., блокирующий Fab2 анти-MASP-2) будет препятствовать формированию de novo C3-конвертазы лектинового пути. C3 содержит необычную и очень реактивную тиоэфирную группу как часть своей структуры. После расщепления C3 при помощи C3-конвертазы в этом анализе, тиоэфирная группа на C3b может образовывать ковалентную связь с гидроксильными или аминными группами макромолекул, иммобилизованных на дне пластиковых лунок, через эфирные или амидные связи, способствуя, таким образом, детектированию C3b в ИФА.
Маннан дрожжей является известным активатором лектинового пути. В следующем способе измерения формирования C3-конвертазы, пластиковые лунки, покрытые маннаном, инкубировали в течение 30 мин при 37°С с разбавленной сывороткой крови крысы, чтобы активировать лектиновый путь. Лунки затем промывали и анализировали на C3b, иммобилизованном на лунках, используя стандартные способы твердофазного иммуноферментного анализа. Количество C3b, образующееся в этом анализе, является прямым отражением формирования de novo C3-конвертазы лектинового пути, Fab2 анти-MASP-2 в выбранных концентрациях были протестированы в этом анализе на их способность подавлять формирование C3-конвертазы и последующее образование C3b.
Способы:
96-луночные планшеты Costar Medium Binding инкубировали в течение ночи при 5°С с маннаном, разведенным в 50 мМ карбонатном буфере, pH 9,5 с 1 мкг/50 TI/лунку. После инкубации течение ночи каждую лунку промывали три раза 200 TI PBS. Лунки затем блокировали 100 TI/лунку 1% бычьим сывороточным альбумином в PBS и инкубировали в течение одного часа при комнатной температуре с осторожным перемешиванием. Каждую лунку затем промывали три раза 200 TI PBS, образцы Fab2 анти-MASP-2 разбавляли до выбранной концентрации в буфере CFP, содержащем Ca2+ и Mg++, (4,0 мМ барбитал, 141 мМ NaCl, 1,0 мМ Mg Cl2, 2,0 мМ CaCl2, 0,1% желатина, рН 7,4) при 5°C. 0,5% сыворотку крысы добавляли в вышеописанные образцы при 5°C, и 100 TI переносили в каждую лунку. Планшеты покрывали и инкубировали 30 минут в 37°C-водной бане, чтобы позволить активировать комплемент. Реакцию останавливали путем перестановки планшетов из 37°C-водной бани в контейнер, содержащий смесь льда с водой. Каждую лунку промывали пять раз 200 TI с PBS-Tween 20 (0,05% Tween 20 в PBS), затем промывали два раза 200 TI PBS. 100 TI /лунку первичного антитела в разведении 1:10000 (кроличьи против C3c человека, DAKOA0062) добавляли в PBS, содержащих 2,0 мг/мл бычьего сывороточного альбумина и инкубировали 1 час при комнатной температуре с осторожным смешиванием. Каждую лунку промывали 5×200 TI PBS. 100 TI/лунку вторичного антитела в разведении 1:10000 (конъюгированные с пероксидазой козлиные анти-кроличьи IgG, American Qualex A102PU) добавляли в PBS, содержащим 2,0 мг/мл бычьего сывороточного альбумина и инкубировали в течение одного часа при комнатной температуре на шейкере с осторожным перемешиванием. Каждую лунку промывали в пять раз 200 TI с PBS. 100 TI/лунку субстрата пероксидазы ТМВ (Кirkegaard & Perry Laboratories) добавляли и инкубировали при комнатной температуре в течение 10 мин. Пероксидазная реакция была остановлена путем добавления 100 TI/лунку 1,0 М H3PO4, и определяли OD450.
2. Тест на определение ингибирования MASP-2-зависимого C4-расщепления
Предпосылки: активность сериновой протеазы MASP-2 является высокоспецифичной, и только два белковых субстратов для MASP-2 были выявлены: C2 и C4. Расщепление С4 генерирует C4a и C4b. Fab2 анти-MASP-2 может связываться со структурными эпитопами на MASP-2, которые напрямую участвуют в C4-расщеплении (например, сайт связывания MASP-2 для C4; каталитический сайт сериновой протеазы MASP-2), и тем самым ингибировать функциональную активность MASP-2 по C4-расщеплению.
Маннан дрожжей, как известно, является активатором лектинового пути. В следующем способе для измерения C4-расщепляющей активности MASP-2, пластиковые лунки, покрытые маннаном, инкубировали в течение 30 минут при 37°C с разбавленной сывороткой крови крысы, чтобы активировать лектиновый путь. Поскольку первичное антитело, используемое в этом ИФА-анализе, узнает только C4 человека, к разбавленной сыворотке крови крысы также был добавлен C4 человека (1,0 Tг/мл). Лунки затем промывали и анализировали на C4b человека, иммобилизованного на лунках, с использованием стандартных способов твердофазного иммуноферментного анализа. Количество C4b, образующихся в этом анализе, представляет собой меру MASP-2-зависимой C4-расщепляющей активности. Fab2 анти-MASP-2 в выбранных концентрациях были протестированы в этом анализе на их способность ингибировать C4-расщепление.
Способы: 96-луночные планшеты Costar Medium Binding инкубировали в течение ночи при 5°С с маннаном, разведенным в 50 мМ карбонатном буфере, pH 9,5 с 1,0 Tг /50 TI/лунку. Каждую лунку промывают 3× с 200 TI PBS. Лунки затем блокировали 100 TI/лунку 1% бычьим сывороточным альбумином в PBS и инкубировали в течение одного часа при комнатной температуре с осторожным перемешиванием. Каждую лунку промывают 3 раза с 200 TI PBS. Образцы Fab2 анти-MASP-2 разбавляли до выбранной концентрации в Ca++ и Mg++-содержащем CFP-буфере (4,0 мМ барбитал, 141 мМ NaCl, 1,0 мМ MgCl2, 2,0 мМ CaCl2, 0,1% желатин, рН 7,4) при 5°C. 1,0 Tg/мл C4 человека (Quidel) также был включен в эти образцы. 0,5% сыворотку крысы добавляли к вышеописанным образцам при 5°C и 100 TI переносили в каждую лунку. Планшеты покрывали и инкубировали 30 минут в 37°C-водной бане, чтобы позволить активации комплемента. Реакцию останавливали перенесением планшетов из 37°C-водной бани в контейнер, содержащий смесь воды со льдом. Каждую лунку промывали 5 × TI 200 с PBS-Tween 20 (0,05% Tween 20 в PBS), затем каждую лунку промывали 2× с 200 TI PBS. 100 TI/лунку в разбавлении 1:700 биотин-конъюгированных куриных антител против C4c человека (Immunsystem AB, Уппсала, Швеция) добавляли в PBS, содержащем 2,0 мг/мл бычьего сывороточного альбумина (БСА), и инкубировали один час при комнатной температуре с осторожным перемешиванием. Каждую лунку промывали 5 × TI 200 PBS. 100 TI/лунку 0,1 Tг/мл коньюгированного с пероксидазой стрептавидина (Pierce Сhemicals #21126) добавляли в PBS, содержащий 2,0 мг/мл BSA и инкубируют в течение одного часа при комнатной температуре на шейкере с осторожным перемешиванием. Каждую лунку промывали 5 × TI 200 с PBS. 100 TI/лунку субстрата пероксидазы ТМВ (Кirkegaard & Perry Laboratories) добавляли и инкубировали при комнатной температуре в течение 16 минут. Пероксидазную реакцию останавливали путем добавления 100 TI/лунку 1,0 М H3PO4 и определяли OD450.
3. Анализ связывания Fab2 анти-MASP-2 крысы с «нативным» MASP-2 крысы
Предпосылки: MASP-2, как правило, присутствует в плазме крови в качестве MASP-2-димерного комплекса, который также включает в себя специфические лектиновые молекулы (маннозо-связывающий белок (MBL) и фиколины). Поэтому, если существует заинтересованность в изучении связывания Fab2 анти-MASP-2 с физиологически значимой формой MASP-2, то важно разработать анализ связывания, в котором используется взаимодействие между Fab2 и «нативным» MASP-2 в плазме, а не с очищенным рекомбинантным MASP-2. В этом анализе связывания, комплекс «нативного» MASP-2-MBL из 10% сыворотке крови крысы сначала иммобилизовали на покрытых маннаном лунках. Аффинность связывания различных Fab2 анти-MASP-2 с иммобилизованным «нативным» MASP-2 затем изучали, используя стандартную методологию ИФА.
Способы: 96-луночные планшеты Costar Medium Binding инкубировали в течение ночи при 5°С с маннаном, разведенным в 50 мМ карбонатном буфере, pH 9,5 с 1 Тг/50 TI/лунку. Каждую лунку промывали 3 раза 200 TI PBS. Лунки блокировали 100 TI/лунку 0,5% обезжиренным сухим молоком в PBSТ (PBS с 0,05% Tween 20) и инкубировали в течение одного часа при комнатной температуре с осторожным перемешиванием. Каждую лунку промывали 3 раза 200 TI TBS/Tween/Ca++. Промывочный буфер (Трис-буферизованный солевой раствор, 0,05% Tween 20, содержащий 5,0 мМ CaCl2, pH 7,4, 10% сыворотку крови крысы в высокосолевом буфере для связывания (20 мМ Трис, 1,0 М NaCl, 10 мМ CaCl2, 0,05% Тритон-X100, 0,1% (масс./об.) бычий сывороточный альбумин, рН 7,4) был подготовлен на льду. 100 TI/лунку добавляют и инкубируют в течение ночи при 5°С. Лунки промывали с 3 раза 200 TI TBS/Tween/C++-промывочным буфером. Лунки промывали 2 раза 200 TI TBS. 100 TI/лунку выбранной концентрации Fab2 анти-MASP-2, разводненные в Ca++ и Mg++-содержащем CFP-буфере (4,0 мМ барбитал, 141 мМ NaCl, 1,0 мМ Mg Cl2, 2,0 мМ CaCl2, 0,1% желатина, рН 7,4), добавляли и инкубировали в течение одного часа при комнатной температуре с осторожным перемешиванием. Каждую лунку промывают 5×200 TI PBS. 100 TI/лунку HRP-конъюгированных козлиных анти-Fab2 (Вiogenesis Кат. № 0500-0099), разведенного 1:5000 в 2,0 мг/мл бычьего сывороточного альбумина в PBS, добавляли и инкубировали в течение одного часа при комнатной температуре с осторожным перемешиванием. Каждую лунку промывали 5×200 TI PBS. 100 TI/лунку субстрата пероксидазы ТМВ (Кirkegaard & Perry Laboratories) добавляли и инкубировали при комнатной температуре в течение 70 мин. Пероксидазную реакцию останавливали путем добавления 100 TI/лунку 1,0 М H3P04 и определяли OD450.
РЕЗУЛЬТАТЫ:
Около 250 различных Fab2, которые с высокой аффинностью реагировали с белком MASP-2 крысы, выбрали для ИФА-скрининга. Эти высокоаффинные Fab2 были секвенированы для определения уникальности различных антител, и 50 уникальных антител анти-MASP-2 были очищены для дальнейшего анализа. 250 мкг каждого очищенного Fab2-антитела было использовано для характеристики аффинности связывания MASP-2 и функционального тестирования пути комплемента. Результаты этого анализа показаны ниже, в ТАБЛИЦЕ 6.
Как показано выше, в ТАБЛИЦЕ 6, из 50 проверенных Fab2 анти-MASP-2, семнадцать Fab2 были определены как Fab2, блокирующие MASP-2, которые эффективно ингибируют образование C3-конвертазы с IC50, равным или меньшим, чем 10 нМ Fab2 (коэффициент эффективности поиска - 34% положительных). Восемь из семнадцати идентифицированных Fab2 имеют IC50 в субнаномолярном диапазоне. Кроме того, все семнадцать MASP-2-блокирующих Fab2, показанных в ТАБЛИЦЕ 6, дали, по сути, полное ингибирование формирования C3-конвертазы в лектиновый путь C3 конвертаза анализа. ФИГУРА 8A графически иллюстрирует результаты анализа формирования C3-конвертазы для Fab2-антитела #11, который является характерным для другого тестирования Fab2-антител, результаты которого приведены в ТАБЛИЦЕ 6. Это является важным фактором, поскольку теоретически возможно, что «блокирующий» Fab2 может только незначительно ингибировать функцию MASP-2 даже тогда, когда каждая молекула MASP-2 связана при помощи Fab2.
Несмотря на то, что маннан, как известно, является активатором лектинового пути, теоретически возможно, что присутствие антител против маннана в сыворотке крови крысы может также активировать классический путь и генерировать C3b через C3-конвертазу классического пути. Однако, каждый из семнадцати блокирующих Fab2 анти-MASP-2, перечисленных в данном примере, эффективно ингибирует образование C3b (>95%), демонстрируя, таким образом, специфичность этого анализа для C3-конвертазы лектинового пути.
Анализы связывания также были выполнены для всех семнадцати блокирующих Fab2 в целях вычисления наблюдаемой Kd для каждого. Результаты анализов связывания Fab2 против MASP-2 крысы с нативным MASP-2 крыса для шести из блокирующих Fab2 также показано в ТАБЛИЦЕ 6. ФИГУРА 8B графически иллюстрирует результаты анализа связывания с Fab2-антителом # 11. Подобные анализы связывания были проведены и для других Fab2, результаты которых приведены в ТАБЛИЦЕ 6. Как правило, наблюдаемые Kd, полученные для связывания каждого из шести Fab2 с «нативным» MASP-2, соответствуют достаточно хорошо с IC50 для Fab2 в функциональном анализе для C3-конвертазы. Имеются свидетельства того, что MASP-2 подвергается конформационному переходу от «неактивной» к «активной» форме по активизации его протеазной активности (Feinberg et al., EMBO J 22:2348-59 (2003); Gal et al., J. Biol. Chem. 250:33435-44 (2005)). В нормальной плазме крови крысы, используемой в анализа формирования C3-конвертазы, MASP-2 присутствует в основном в «неактивной» зимогенной конформации. В отличие от этого, в анализе связывания MASP-2 присутствует как часть комплекса с MBL, связанного с иммобилизованным маннаном, поэтому, MASP-2 мог бы быть в активной конформации (Petersen et al., J. Immunol Methods 257: 107-16, 2001). Следовательно, не обязательно ожидать точного соответствия между IC50 и Kd для каждого из семнадцати блокирующих Fab2, протестированных в этих двух функциональных анализах, поскольку в каждом анализе Fab2 будет связываться с различной конформационной формой MASP-2. Тем не менее, за исключением Fab2 #88, существует, по-видимому, достаточно близкое соответствие между IC50 и наблюдаемой Kd для каждого из шестнадцати Fab2, протестированных в двух тестах (см. ТАБЛИЦУ 6).
Несколько блокирующих Fab2 оценивались по ингибированию MASP-2-опосредованного C4-расщепления. ФИГУРА 8В графически иллюстрирует результаты анализа C4-расщепления, демонстрируя ингибирование Fab2 #41, с IC50 = 0,81 нм (смотри ТАБЛИЦУ 6). Как показано на ФИГУРЕ 9, каждый из протестированных Fab2, как было обнаружено, ингибировал C4-расщепление с IC50, сходным с таковым, полученным в анализе на C3-конвертазу (смотри ТАБЛИЦУ 6).
Несмотря на то, что маннан, как известно, является активатором лектинового пути, теоретически возможно, что присутствие антител против маннана в сыворотке крови крысы может также активировать классический путь и тем самым генерировать C4b путем C1s-опосредованного расщепления C4. Однако, было идентифицировано несколько Fab2 анти-MASP-2, которые эффективно ингибируют образование C4b (>95%), что свидетельствует о специфичности этого анализа для MASP-2-опосредованного C4-расщепления. C4, как и C3, содержит необычную и очень реактивную тиоэфирную группу как часть своей структуры. После расщепления C4 при помощи MASP-2 в этом анализе, тиоэфирная группа на C4b может образовывать ковалентную связь с гидроксильными или аминными группами на макромолекулах, иммобилизованных на дне пластиковых лунок через эфирные или амидные связи, способствуя, таким образом, обнаружению C4b в ИФА-анализе.
Эти исследования наглядно демонстрируют создание высокоаффинных FAB2 к белку MASP-2 крысы, которые функционально блокируют конвертазную активность как С4, так и С3, предотвращая тем самым активацию лектинового пути.
ПРИМЕР 11
В этом Примере описывается эпитопное картирование для некоторых из блокирующих Fab2-антител против MASP-2 крысы, которые были созданы, как описано в Примере 10.
Способы:
Как показано на ФИГУРЕ 10, следующие белки, все с N-концевыми 6X His тегами, были экспрессированы в СНО-клетках с помощью вектора pED4:
MASP-2A крысы, полноразмерный белок MASP-2, инактивированный при помощи изменения серина в активном центре на аланин (S613A);
MASP-2K крысы, полноразмерный белок MASP-2, измененный для уменьшения автоактивации (R424К);
CUBI-II, N-концевой фрагмент MASP-2s, который содержит только домены CUBI, EGF-подобный и CUBII; и
CUBI/EGF-подобный, N-концевой фрагмент MASP-2 крысы, который содержит только домены CUBI и EGF-подобный.
Эти белки были очищены из культуральных супернатантов активированных клеток при помощи никель-аффинной хроматографии, как описано ранее (Chen, et al., J. Biol. Chem. 276:25894-02 (2001)).
C-концевой полипептид (CCPII-SP), содержащий CCPII и домен сериновой протеазы MASP-2 крысы, был экспрессирован в E. coli в виде слитого с тиоредоксином белка с помощью pTrxFus (Invitrogen). Белок был очищен из клеточных лизатов помощью аффинной смолы Thiobond. Тиоредоксин - партнер для слияния - экспрессировали с пустого pTrxFus в качестве отрицательного контроля.
Все рекомбинантные белки диализовали в буфере TBS, и их концентрации определяли путем измерения ОD при 280 нм.
ДОТ-БЛОТ-АНАЛИЗ:
Серийные разведения пяти рекомбинантных полипептидов MASP-2, описанных выше и показанных на ФИГУРЕ 10 (и полипептид тиоредоксина в качестве отрицательного контроля для полипептида CCPII-сериновая протеаза), были раскапаны на нитроцеллюлозную мембрану. Количество белка в пятнах колебалось от 100нг до 6,4, с пятикратным шагом разведения. В последующих экспериментах количество белка в пятнах колебалось от 50 нг до 16 пг, снова с пятикратным шагом разведения. Мембраны блокировали 5%-ым сухим обезжиренным молоком в TBS (блокирующий буфер), затем инкубировали с 1,0 мкг/мл Fab2 анти-MASP-2 в блокирующем буфере (содержащем 5,0 мМ Ca2+). Связанные Fab2s детектировали с помощью HRP-коньюгированного анти-человеческого Fab (AbD/Serotec; в разведении 1 к 10 000) и детектирующего набора ECL (Amersham). Одну мембрану инкубировали с поликлональными кроличьими Ab анти-MASP-2 человека (описано в Stover et al., J. Immunol 76:6848-59 (1999)) в качестве положительного контроля. В этом случае связанные Ab детектировали с помощью HRP-конъюгированного козлиные антитела против кроличьих IgG (Dako; в разведении 1/2,000).
Анализ связывания MASP-2
ИФА-планшеты покрывали 1,0 мкг/лунку рекомбинантного MASP-2А или полипептида CUBI-II в карбонатном буфере (рН 9,0) в течение ночи при 4 °C. Лунки блокировали 1% BSА в TBS, затем серийные разведения Fab2 анти-MASP-2 были добавлены в TBS, содержащий 5,0 мМ Ca2+, планшеты инкубировали в течение одного часа при комнатной температуре. После промывки три раза с TBS/tween/Ca2+, HRP-коньюгированный анти-человеческий Fab (AbD/Serotec) в разведении 1 к 10000 в TBS/Ca2+ добавляли, и планшеты инкубировали в течение еще одного часа при комнатной температуре. Связанные антитела детектировали с помощью набора с субстратом пероксидазы ТМВ (Biorad).
РЕЗУЛЬТАТЫ:
Результаты дот-блот-анализа, демонстрирующие реактивность Fab2 с различными полипептидами MASP-2, приводятся ниже в ТАБЛИЦЕ 7. Числовые значения, представленные в ТАБЛИЦЕ 7, показывают количество раскапанного белка, необходимого для проявления примерно половины от максимальной силы сигнала. Как показано, каждый из полипептидов (за исключением тиоредоксина самого по себе, являющегося партнером по сливанию) узнавался положительным контрольным Ab (поликлональной сывороткой против MASP-2 человека, индуцированной в кроликах).
Все Fab2 реагировали с MASP-2, а также с MASP-2K (данные не приведены). Большинство Fab2 узнавали полипептид CCPII-SP, но не N-концевые фрагменты. Исключениями являются Fab2 № 60 и Fab2 #57. Fab2 #60 распознает MASP-2A и фрагмент CUBI-II, но не полипептид CUBI/EGF-подобный или полипептид CCPII-SP, из чего предполагается, что он связывается с эпитопом в CUBII, или, охватывая CUBII и EGF-подобный домен. Fab2 # 57 распознает MASP-2, но не какой-либо из проверенных фрагментов MASP-2, что указывает на то, что это Fab2 распознает эпитоп в CCP1. Fab2 #40 и # 49 связывались только с полным MASP-2А. В анализе связывания ИФА, показанном на ФИГУРЕ 11, Fab2 #60 также связывается с полипептидом CUBI-II, хотя и с чуть пониженной наблюдаемой аффинностью.
Это обнаружение демонстрирует идентификацию уникальных блокирующих Fab2 к нескольким областям белка MASP-2
ПРИМЕР 12
В этом Примере описывается анализ мышей MASP-2-/- в мышиной почечной модели ишемии/реперфузии.
Предпосылки/Обоснование: Ишемическое-реперфузионное (I/R) поражение почек при температуре тела имеет актуальность при ряде клинических состояний, в том числе гиповолемическом шоке, почечной артериальной окклюзии и процедурах пережатия.
Почечная ишемия-реперфузия (I/R) является важной причиной острой почечной недостаточности, связанной с процентом смертности до 50% (Levy et al., JAMA 275: 1489-94, 1996; Thadhani et al., N. Engl. J, Med. 334: 1448-60, 1996). Посттрансплантационная ренальная недостаточность является распространенным и угрожающим осложнением после трансплантации почки (Николсон et al., Kidney Int. 55:2585-91, 2000). Эффективное средство для лечения почечного I/R повреждения в настоящее время недоступно, и гемодиализ является единственным способом лечения. Патофизиология почечного I/R повреждения сложная. Недавние исследования показали, что лектиновый путь активации комплемента может играть важную роль в патогенезе почечного I/R повреждения (deVries et al., Am. J. Path. 165: 1677-88, 2004).
Способы:
Мышь MASP-2(-/-) была генерирована, как описано в Примере 1, и было проведено не менее 10 поколений возвратных скрещиваний с C57BS/6. Шести самцам MASP-2(-/-) и шести мышам дикого типа (+/+) с массой 22-25 г вводили внутрибрюшинные инъекции Hypnovel (6,64 мг/кг; Roche products Ltd., Weiwyn Garden City, Великобритания), а затем давали наркоз путем ингаляции изофлюрана (Abbott Laboratories Ltd., Кент, Великобритания). Изофлуран был выбран потому, что он представляет собой мягкий ингаляционный анестетик с минимальной токсичностью для печени: концентрации производятся точно, и животное быстро восстанавливается даже после длительного наркоза. Hypnovel вводили, поскольку он производит состояние нейролептаналгезии у животного, и это означает, что нужно вводить меньше изофлурана. Под животное помещали теплый коврик, чтобы поддерживать постоянную температуру тела. Далее, был выполнен разрез брюшной полости по средней линии, и полость тела держали открытой с помощью пары ранорасширителей. Соединительная ткань была очищена выше и ниже почечных вены и артерии, как у правой, так и у левой почки, и почечная ножка была зажата при помощи микроаневризмальных зажимов в течение периода времени 55 минут. Этот период ишемии изначально был основан на предыдущем исследовании, выполненном в этой лаборатории (Zhou et al., J. Clin. Invest. 105: 1363-71 (2000)). Кроме того, стандартное ишемическое время в 55 минут было выбрано после ишемического титрования, и было обнаружено, что 55 минут давали последовательное повреждение, которое было также обратимым, с низкой смертностью, менее чем 5%. После окклюзии, 0,4 мл теплого физиологического раствора (37°С) помещали в брюшную полость, а затем живот был закрыт на период ишемии. После удаления микроаневризмальных зажимов, за почками наблюдали до изменения цвета, что является признаком возобновлением тока крови в почках. Дополнительные 0,4 мл теплого физиологического раствора помещали в брюшной полости, и открытие было зашито, после чего животные были возвращены в свои клетки. Хвостовые пробы крови были взяты через 24 часа после снятия зажимов, и через 48 часов мыши были забиты, и были собраны дополнительные образцы крови.
Оценка почечного повреждения: Функцию почек оценивали через 24 и 48 часов после реперфузии у шести самцов MASP-2(-/-) и шести WT-мышей(+/+). Измерение креатинина в крови определяли способом масс-спектрометрии, которая предоставляет индекс воспроизводимости функции почек (чувствительность <1,0 (мкмоль/л). ФИГУРА 12 графически иллюстрирует удаление азота мочевины крови для контролей дикого типа C57BI/6 и MASP-2 (-/-) через 24 часа и 48 часов после реперфузии. Как показано на ФИГУРЕ 12, мыши MASP-2(-/-) показали значительное снижение количества мочевины крови через 24 и 48 ч, по сравнению с контрольными мышами дикого типа, что указывает на защитный функциональный эффект от повреждения почек в модели ишемического реперфузионного повреждения.
В общем, повышение мочевины крови наблюдалось как у WT-мышей (+/+), так и у MASP-2(-/-) через 24 и 48 часов после хирургического вмешательства и ишемического инсульта. Уровни мочевины в крови у неишемического WT (+/+) оперированного животного, как было отдельно определено, составляют 5,8 ммоль/л. В дополнение к данным, представленным в таблице 12, одно MASP-2 (-/-) животное показало почти полную защиту от ишемического инсульта, со значениями 6,8 до 9,6 ммоль/л через 24 и 48 ч, соответственно. Это животное было исключено из анализируемой группы как потенциальный выброс, при котором не может присутствовать никакого ишемического повреждения. Поэтому, конечный анализ, показанный на ФИГУРЕ 12, включал 5 мышей MASP-2(-/-) и 6 WТ-мышей(+/+), и статистически значимое снижение концентрации мочевины в крови был замечено через 24 и 48 часов у мышей MASP-2 (-/-) (t-критерий Стьюдента, p<0,05). Эти результаты указывают на то, что ингибирование активности MASP-2, как ожидается, будет иметь защитный или терапевтический эффект от повреждения почек вследствие ишемического повреждения.
ПРИМЕР 13
Этот Пример описывает результаты MASP-2-/- в мышиной модели макулярной дегенерации.
Предпосылки/Обоснование: Возрастная макулярная дегенерация (AMD) является основной причиной слепоты после 55 лет в промышленно развитых странах. AMD возникает в двух основных формах: неоваскулярная (влажная) AMD и атрофическая (сухая) AMD. Неоваскулярная (влажная) форма составляет 90% тяжелых потерь зрения, связанных с AMD, несмотря на то, что только у 20% людей с AMD развивается влажная форма. Клинические признаки AMD включают множественные друзы, географическую атрофию и хориоидальную неоваскуляризацию (CNV). В декабре 2004 года FDA одобрила Macugen (пегаптаниб), новый класс офтальмологических препаратов для специфической направленности и блокирования действия фактора роста эндотелия сосудов (VEGF), для лечения влажной (неоваскулярной) формы AMD (Ng et al., Nat Rev. Drug Discov 5: 123-32 (2006)). Хотя Macugen представляет собой перспективный новый терапевтический выбор для подгруппы AMD-пациентов, остается насущная необходимость разработки дополнительных процедур для этого сложного заболевания. Многочисленные независимые направления исследований означают центральную роль активации комплемента в патогенезе AMD. Патогенез хороидальной неоваскуляризации (CNV), наиболее серьезная форма AMD, может включать активацию путей комплемента.
Более двадцати пяти лет назад, Райан описал модель CNV на основе лазерно-индуцированного повреждения на животных (Ryan, S.J., Tr. Am. Opth. Soc. LXXVII: 707-745, 1979). Модель была первоначально разработана с использованием макак-резусов, однако та же технология с тех пор была использована для разработки аналогичных моделей CNV у множества экспериментальных животных, включая мышь (Tobe et al., Am. J. Pathol. 153: 1641-46, 1998). В этой модели, лазерная фотокоагуляция применяется для разрушения мембраны Бруха, действие, которое приводит к образованию CNV-подобных мембран. Лазерно-индуцированная модель захватывает многие важные черты человеческого состояния (в качестве недавнего обзора, смотри Ambati et al., Survey Ophthalmology 48:251-293, 2003). Модель на лазерно-индуцированных мышах в настоящее время хорошо разработана и используются в качестве экспериментальной основы в большом и постоянно растущем ряду исследовательских проектов. Общепринято, что лазерно-индуцированная модель имеет достаточное биологическое сходство с CNV у людей, и доклинические исследования патогенеза и лекарственного ингибирования с помощью этой модели имеют отношение к CNV у людей.
Способы:
Мышь MASP-2-/- генерировали, как описано в Примере 1, и возвратно скрещивали на протяжении 10 поколений с С57В1/6. В текущем исследовании сравнивали результаты оценки самцов мышей MASP-2 (-/-) и MASP-2 (+/+) в ходе лазерно-индуцированной CNV, ускоренной модели неоваскулярной AMD, ориентируясь на объем лазерно-индуцированной CNV, при помощи способа сканирующей лазерной конфокальной микроскопии в качестве меры повреждения тканей, и определение уровня VEGF, мощного ангиогенного фактора, вовлеченного в CNV, в ретинальном пигментном эпителии (RPE)/хориоидах при помощи ИФА после лазерного повреждения.
Индукция хороидальной неоваскуларизации (CNV): Лазерную фотокоагуляцию (532 нм, 200 мВт, 100 мс, 75 мкм; Oculight GL, Iridex, Mountain View, CA) выполняли на обоих глазах каждого животного в день ноль при помощи одного человека в маске для группы препаратов по назначению. Лазерные пятна применяли в стандартизованном виде вокруг зрительного нерва, с помощью системы доставки на основе щелевой лампы и покровного стекла в качестве контактной линзы. Морфологическая конечная точка лазерного повреждения представляла собой появление кавитационного пузырька, знак, как полагают, корреляции с нарушением мембраны Бруха. Подробные способы и конечные точки, которые были оценены, представляют собой следующее.
Флюоресцентная ангиография: Флюоресцентную ангиографию выполняли с камеры и системы визуализации (камера TRC 50 1А; система ImageNet 2,01; Topcon, Paramus, NJ) через 1 неделю после лазерной коагуляции. Фотографии были получены с объективом 20-D в контакте с объективом фундус-камеры после внутрибрюшинной инъекции 0,1 мл 2,5% флуоресцеина натрия. Эксперт по сетчатке, не участвующий в лазерной фотокоагуляции или ангиографии, оценивал ангиограммы флуоресцеина в отдельной обстановке с надетой маской.
Объем хороидальной неоваскуларизации (CNV): Через одну неделю после лазерного повреждения, глаза были энуклеированы и фиксировались в 4% параформальдегиде в течение 30 минут при 4°С. Глазные чашки были получены путем снятия передних сегментов и промывали три раза PBS, с последующим обезвоживанием и регидратацией через серии обработки метанолом. После блокирования дважды буфером (PBS, содержащий 1% бычий сывороточный альбумин и 0,5% Triton X-100) в течение 30 минут при комнатной температуре, глазные чашки инкубировали в ночь при 4°С с 0,5% FITC-изолектином B4 (Vector laboratories, Burlingame, CA), разбавленным PBS, содержащим 0,2% BSA и 0,1% Triton X-100, который связывает концевые остатки β-D-галактозы на поверхности эндотелиальных клеток и выборочно маркирует сосудистую систему мыши. После двух промывок PBS, содержащего 0,1% Triton X-100, нейросенсорную сетчатку осторожно отделяли и отрывали от зрительного нерва. Четыре ослабляющих радиальных надреза было сделано, и оставшийся комплекс RPE-хороид-склеры был подготовлен для микроскопического исследования в среде против обесцвечивания (Immu-Mount Veсtashield Mounting Medium; Vector Laboratories) и помещен под покровное стекло.
Подготовленные образцы обследовали с помощью сканирующего лазерного конфокального микроскопа (TCS SP; Leica, Гейдельберг, Германия). Сосуды были визуализированы с помощью возбуждения голубого аргонового света с длиной волны (488 нм) и улавливающей эмиссии от 545 до 515 нм. 40X масло-иммерсионный объектив использовали для всех визуализационных исследований. Горизонтальные оптические срезы (с шагом 1 мкл) были получены с поверхности комплекса RPE-хороид-склера. Самая глубокая фокальной плоскости, в которой окружающая хориоидальная сосудистая сеть, соединенная с подключением, может быть идентифицирована, был признана в качестве дна поражения. Любой сосуд, находящийся в лазерно-целевые области и внешний по отношению к этой референсной плоскости, оценивался как CNV. Изображения каждого среза хранили в цифровом виде. Площадь CNV-связанной флуоресценции измеряли с помощью компьютеризированного анализа изображений с программным обеспечением для микроскопа (TCS SP; Leica). Суммирование всей люминесцентной площади каждого горизонтального участка использовали в качестве индекса объема CNV. Съемки выполняются оператором в масках для обработки группы назначения.
Поскольку вероятность каждого лазерного поражения, приводящего к развитию CNV, находится под влиянием группы, к которой оно относится (мышь, глаз и лазерное пятно), усредненные объемы поражения сравнивали с использованием линейной смешанной модели по схеме повторно-измеряемых расщепленных делянок. Фактор полной площади представлял собой генетическую группу, к которой животное принадлежит, где фактором разделенного участка являлся глаз. Статистическая значимость была определена на уровне 0,05. Post hoc-сравнения средних были построены с настройками Bonferroni для множественных сравнений.
ИФА VEGF. В течение трех дней после получения повреждения при помощи 12 лазерных пятен, RPE-хороидальный комплекс озвучивали в лизис-буфере (20 мМ имидазол HCl, 10 мM КCl, 1 мМ MgCl2, 10 мМ EGTA, 1% Triton X-100, 10 мМ NaF, 1 мМ молибдат Na, и 1 мМ ЭДТК и с ингибитором протеазы) на льду в течение 15 мин. Уровни белка VEGF в надосадочной жидкости определяли при помощи набора ELISA (R&D Systems, Minneapolis, MN), который распознает все соединенные варианты, при длине волны от 450 до 570 нм (Emax; Molecular Devices, Sunnyvale, CA), и нормировали на общий белок. Повторяющиеся измерения проводили помощи оператора в маске, не участвующего в фотокоагуляции, получении изображений или ангиографии. Значения VEGF были представлены в виде среднего +/- стандартная погрешность среднего от не менее трех независимых экспериментов и сравнивали с использованием теста Mann-Whitney U. Нулевая гипотеза была отвергнута на уровне P<0,05.
РЕЗУЛЬТАТЫ:
Оценка уровней VEGF:
ФИГУРА 13A графически иллюстрирует уровни белка VEGF в RPE-хороидном комплексе, изолированном из мышей дикого типа C57b1 и MASP-2(-/-) в день ноль. Как показано на ФИГУРЕ 13А, оценка уровней VEGF указывает на снижение базовых уровней VEGF у мышей MASP-2 (-/-) по сравнению с контрольными мышами дикого типа C57b1. ФИГУРА 13B графически иллюстрирует уровни белка VEGF, измеренные на третий день после лазер-индуцированного повреждения. Как показано на ФИГУРЕ 13B, уровни VEGF были значительно увеличены у мышей дикого типа (+/+) через три дня после лазер-индуцированного повреждения, в соответствии с опубликованными исследованиями (Nozaki et al., Proc. Natl. Acad. ScL USA 103:2328-33 (2006)). Однако, на удивление, очень низкие уровни VEGF были отмечены для мышей MASP-2 (-/-).
Оценка хориоидальной неоваскуляризации (CNV):
В дополнение к снижению уровней VEGF после лазерно-индуцированной макулярной дегенерации, область CNV определяли до и после лазерного повреждения. ФИГУРА 14 графически иллюстрирует объем CNV, определенный у мышей дикого типа C57b1 и мышей MASP-2(-/-) на седьмой день после лазерно-индуцированного повреждения. Как показано на ФИГУРА 14, мыши MASP-2 (-/-) проявляли около 30%-ое уменьшение CNV области после лазерно-индуцированного повреждения на день седьмой, по сравнению с контрольными мышами дикого типа.
Эти выводы указывают на снижение VEGF и CNV, как это видно у мышей MASP-2(-/-) против контрольных мышей дикого типа (+/+), и что блокада MASP-2 ингибитором могла бы иметь профилактический и терапевтический эффект при лечении макулярной дегенерации.
ПРИМЕР 14
Этот Пример показывает, что активация тромбина может иметь место после активации лектинового пути при физиологических состояниях, и демонстрирует степень участия MASP-2. В нормальной сыворотке крови крысы, активация лектинового пути приводит к активации тромбина (оценивается как депозиция тромбина) одновременно с активации комплемента (оценивается как C4 депозиция). Как видно из рисунков 15A и 15B, активация тромбин в этой системе ингибируется при помощи MASP-2-блокирующих антител (в формате Fab2), демонстрируя кривую ингибирующая концентрация-реакция (ФИГУРА 15В), что соответствует таковому для активации комплемента (ФИГУРА 15а). Эти данные позволяют предположить, что активация лектинового пути, как это происходит при травматическом повреждении, приведет к активации как системы комплемента, так и системы свертывания крови в процесс, который целиком зависит от MASP-2. Путем умозаключений, MASP2-блокирующие антитела могут оказаться эффективными в смягченных случаях чрезмерной системной коагуляции, например, диссеминированное внутрисосудистое свертывание крови, которое является одним из признаков, ведущих к смертности в случаях серьезных травм.
ПРИМЕР 15
В этом Примере приведены результаты, полученные с использованием локализованной модели реакции Schwartzman диссеминированного внутрисосудистого свертывания («DIC») в MASP-2-дефектных и MASP-2-+/+-достаточных мышах для оценки роли лектинового пути в DIC.
Предпосылки/обоснование:
Как описано выше, блокада MASP-2 ингибирует активацию лектинового пути и снижает образование как анафилатоксина C3a, так и анафилатоксина C5a. C3a-анафилатоксин, как можно показать, является эффективным агрегатором тромбоцитов in vitro, но их вовлеченность при состояниях in vivo недостаточно четко определена, и высвобождение веществ тромбоцитов и плазмина при заживлении ран может только во вторую очередь включать комплемента С3. В этом Примере, роль лектинового пути была проанализирована у мышей MASP-2 (-/-) и WТ (+/+) в целях изучения того, необходимо ли длительное повышение активации C3 для порождения диссеминированного внутрисосудистого свертывания крови.
Способы:
Мыши MASP-2 (-/-), использованные в данном исследовании, были созданы, как описано в Примере 1, и их возвратно скрещивали не менее 10 поколений с С57В1/6.
Модель локализованной реакции Шварцмана была использована в этом эксперименте. Локализованная реакция Шварцмана (LSR) представляет собой липосахарид (LPS)-индуцированный ответ с хорошо изученными вкладами клеточных и гуморальных элементов врожденной иммунной системы. Зависимость LSR от комплемента является твердо установленной (Polak, L., et al., Nature 225:738-739 (1969); Fong IS, et al., J Exp Med 134:642-655 (1971)). В LSR-модели мышей в течение 4 часов подвергали первичному воздействию TNF-альфа (500 нг, внутримошоночно), затем мышей анестезировали и подготавливали для прижизненной микроскопии кремастерной мышцы. Сети пост-капиллярных венул (15-60 мкл в диаметре) с хорошим кровотоком (1-4 мм/сек) были выбраны для наблюдения. Животным вводили флюоресцирующие антитела для избирательного мечения нейтрофилов, или тромбоцитов. Сеть сосудов последовательно сканировали, и изображения всех сосудов из последующего анализа были оцифрованы. После записи базального состояния микроциркуляции, мыши получали однократную внутривенную инъекцию LPS (100 мкг), либо самого по себе, либо с веществами, перечисленными ниже. Ту же сеть сосудов затем сканировали каждые 10 минут в течение 1 часа. Специфическое накопление флуорофоров идентифицировали путем вычитания фоновой флуоресценции и усиливали за счет обработки пороговых значений изображения. Величину реакции определяли по полученным изображениям. Первичное определение реакций Шварцмана представляло собой статистически обработанные данные.
В исследованиях сравнивали MASP-2+/+ достаточных мышей, или мышей дикого типа, подвергавшихся воздействию любого из известных комплемент-ослабляющих агентов, фактора яда кобры (CVF) или ингибитора терминального пути (C5aR-антагониста). Результаты (ФИГУРА 16А) показывают, что как CVF, так и C5aR-антагонист предотвращали появление агрегатов в сосудистой системе. Кроме того, MASP-2 -/- дефектные мыши (ФИГУРА 16В) также продемонстрировали полное подавление локализованной реакции Шварцмана, подтверждая участие лектинового пути. Эти результаты явно демонстрируют роль MASP-2 в появлении DIC и поддерживают использование MASP-2-ингибиторов для профилактики и лечения DIC-синдрома.
ПРИМЕР 16
В этом Примере описывается анализ мышей MASP-2 (-/-) в мышиной модели почечной трансплантации.
Предпосылки/обоснование:
Роль MASP-2 в функциональном исходе трансплантации почки оценивали с помощью мышиной модели.
Способы:
Функциональный исход трансплантации почки оценивали с помощью единственного почечного изотрансплантата в uninephrecomized реципиентных мышах, у шести WТ (+/+)-реципиентов трансплантанта (B6), и шести MASP-2 (-/-)-реципиентов трансплантанта. Для оценки функции трансплантированной почки, оставшуюся нативную почку удаляли у реципиента через 5 дней после трансплантации, и функцию почки оценивали через 24 часа при помощи измерения уровней азота мочевины в крови (BUN).
Результаты:
ФИГУРА 17 графически иллюстрирует уровни азота мочевины в крови (BUN) почки на 6 день после операции по пересадке почки в WТ (+/+)-реципиентах и MASP-2 (-/-)-реципиентах. Как показано на ФИГУРЕ 17, сильно повышенные уровни BUN наблюдались у WТ (+/+) (B6) реципиентов (нормальные уровни BUN у мышей составляют <5 мМ), что указывает на почечную недостаточность. В отличие от этого, MASP-2 (-/-)-изотрансплантатные реципиентные мыши показали значительно более низкие уровни BUN, что предполагает улучшенную функцию почки. Следует отметить, что эти результаты были получены с помощью трансплантатов от WT (+/+)-доноров почек, что предполагает, что отсутствие функционального лектинового пути у реципиента трансплантата само по себе достаточно для достижения терапевтического эффекта.
Взятые вместе, эти результаты указывают на то, что транзиентное ингибирование лектинового пути через MASP-2-ингибирование предоставляет способ снижения заболеваемости и задержки функции трансплантата при трансплантации почки, и что этот подход может оказаться полезным и при других состояниях транспланта.
ПРИМЕР 17
Этот Пример показывает, что мыши MASP-2 (-/-) устойчивы к септическому шоку в мышиной модели полимикробного септического перитонита
Предпосылки/обоснование:
Для оценки потенциального воздействия MASP-2 (-/-) на инфекции, оценивали модель перевязки слепой кишки и пункции (CLP), модель полимикробного септического перитонита. Эта модель, как считается, наиболее точно имитирует ход септического перитонита у людей. Модель перевязки и пункции слепой кишки (CLP) представляет собой модель, в которой слепую кишку перевязывают и протыкают иглой, что приводит к постоянной утечке бактерий в брюшную полость, которые попадают в кровь через дренаж лимфы и затем распределяются во все органы брюшной полости, что приводит к полиорганной недостаточности и септическому шоку (Eskandari et al., J. Immunol 148(9):2724-2730 (1992)). Модель CLP имитирует течение сепсиса, наблюдаемое у больных, и приводит к ранней гипервоспалительной реакции с последующей выраженной гиповоспалительной фазой. Во время этой фазы, животные очень чувствительны к бактериальным воздействиям (Wichterman et al., J. Surg. Res. 29(2): 189-201 (1980)).
Способы:
Мортальность от полимикробной инфекции, используемой в модели перевязки и пункции слепой кишки (CLP), определяли у WТ-мышей (+/+) (n= 8) и мышей MASP-2 (-/-) (n 16). Вкратце, MASP-2-дефектные мыши и их однопометные животные дикого типа были анестезированы, и слепую кишку экстериоризировали и перетягивали на 30% выше дистального конца. После этого, слепую кишку прокалывали иглой диаметром 0,4 мм. Слепую кишку затем возвращали в брюшную полость, и кожу закрывали с помощью зажимов. Выживаемость мышей, подвергшихся CLP, контролировалась в течение 14 дней после CLP. Перитонеальный лаваж собирали у мышей 16 часов после CLP для измерения бактериальной нагрузки. Серийные разведения перитонеального лаважа подготавливали в PBS и инокулировали в планшеты Мюллер-Хинтона с последующей инкубацией при 37°С в анаэробных условиях в течение 24 часов, после чего определяли бактериальную нагрузку.
TNF-альфа цитокиновый ответ на бактериальную инфекцию также определяли у мышей WТ (+/+) и MASP-2 (-/-) через 16 часов после CLP в легких и селезенки посредством количественной полимеразной цепной реакции в режиме реального времени (qRT-PC). Сывороточный уровень TNF-альфа через 16 часов после CLP у мышей WТ (+/+) и MASP-2 (-/-) также количественно оценивали при помощи многослойного ИФА.
Результаты
ФИГУРА 18 графически иллюстрирует процент выживания животных, подвергнутых CLP, как функцию дней после процедуры CLP. Как показано на ФИГУРА 18, дефектность лектинового пути у мышей MASP-2 (-/-) не увеличивает смертность мышей после полимикробной инфекции, с использованием модели перевязки и пункции слепой кишки, по сравнению с мышами WТ (+/+). Однако, как показано на ФИГУРЕ 19, мыши MASP-2 (-/-) показали существенно более высокую бактериальную нагрузку (примерно 1000-кратное увеличение числа бактерий) в перитонеальном лаваже после CLP, по сравнению с их однопометными WТ (+/+). Эти результаты показывают, что MASP-2 (-/-) дефектные мыши устойчивы к септическому шоку. Снижение удаления бактерий у MASP-2-дефектных мышей в этой модели может быть обусловлено нарушенным C3b-опосредованным фагоцитозом, поскольку было продемонстрировано, что C3-депозиция является MASP-2-зависимой.
Было установлено, что TNF-альфа цитокиновый ответ на бактериальные инфекции не был увеличен у мышей MASP-2 (-/-) по сравнению с WТ (+/+) контролями (данные не приведены). Было также установлено, что существует значительно более высокий уровень концентрации TNF-альфа у мышей WТ (+/+) через 16 часов после CLP, в отличие от мышей MASP-2 (-/-), где сывороточный уровень TNF-альфа остался почти без изменений. Эти результаты позволяют предположить, что интенсивная воспалительная реакция на септическое состояние была смягченной у мышей MASP-2 (-/-), и животным удалось выжить в присутствии более высокого количества бактерий.
Взятые вместе, эти результаты свидетельствуют о потенциальных вредных последствиях активации лектинового пути комплемента в случае сепсиса и повышенной смертности у больных с подавляющим сепсисом. Эти результаты также показывают, что MASP-2 дефицит модулирует воспалительный иммунный ответ и снижает уровни экспрессии медиаторов воспаления во время сепсиса. Поэтому считается, что ингибирование MASP-2 (-/-) путем введения ингибирующих моноклональных антител против MASP-2 будет эффективным для уменьшения воспалительного ответа у субъекта, страдания от септического шока.
ПРИМЕР 18
В этом Примере описывается анализ MASP-2 (-/-) мышей в мышиной модели интраназальной инфекции.
Предпосылки/обоснование:
Pseudomonas aeruginosa является грамотрицательным условно-патогенным для человека бактериальным микроорганизмом, который вызывает широкий спектр инфекций, особенно у индивидуумов с ослабленным иммунитетом. Он является основным источником приобретенных внутрибольничных инфекций, в частности госпитальной пневмонии. Он также ответственен за значительную заболеваемость и смертность пациентов c муковисцидозом (CF). Легочная инфекция P. aeruginosa характеризуется сильным привлечением нейтрофилов и значительным воспалением легких, приводящим в результате к обширному повреждению тканей (Palanki M.S, et al., J. Med. Chem 51: 1546- 1559 (2008)).
В этом Примере было проведено исследование, чтобы определить, увеличивает ли удаление лектинового пути у мышей MASP-2 (-/-) восприимчивость мышей к бактериальным инфекциям.
Способы:
Двадцать две мыши WT (+/+), двадцать две мыши MASP-2 (-/-)и одиннадцать мышей C3 (-/-) стимулировали интраназальным введением бактериального штамма P. aeruginosa. Мышей контролировали в течение шести дней после инфицирования, и были построены графики Каплана-Майера, показывающие процент выживания.
Результаты:
ФИГУРА 20 представляет собой график Каплана-Майера процента выживания мышей WT (+/+), MASP -2 (-/-) или C3 (-/-) через шесть дней после инфицирования. Как показано на ФИГУРЕ 20, различия наблюдались при сравнении мышей MASP-2 (-/-) и мышей WT (+/+). Однако, удаление классического (Clq) пути у мышей C3 (-/-) приводило к серьезной восприимчивости к бактериальной инфекции. Эти результаты показывают, что MASP-2-ингибирование не увеличивает восприимчивость к бактериальной инфекции, указывая, что у пациентов, перенесших травмы, возможно уменьшение нежелательных воспалительных осложнений при помощи ингибирования MASP-2 без ущерба способности пациента бороться с инфекциями при помощи классического пути комплемента.
ПРИМЕР 19
В этом Примере описывается анализ фармакодинамики типичных высокоаффинных анти-MASP-2 Fab2-антител, которые были идентифицированы, как описано в Примере 10.
Предпосылки/обоснование:
Как описано в Примере 10, в целях идентификации высокоаффинных антител, которые блокируют лектиновый путь у крысы, был использован белок MASP-2 крысы, используемых для панорамирования библиотеки фагового дисплея. Данная библиотека была разработана для обеспечения высокого иммунологического разнообразия и была сконструирована с использованием полностью человеческих последовательностей генов иммуноглобулинов. Как описано в Примере 10, было идентифицировано примерно 250 индивидуальных фаговых клонов, которые с высокой аффинностью связывались с белком MASP-2 крысы в скрининге ELISA. Секвенирование этих клонов позволило идентифицировать 50 уникальных фагов, кодирующих MASP-2-антитело. Белок Fab2 экспрессировали в этих клонах, очищали и анализировали аффинность связывания с MASP-2 и функциональное ингибирование лектинового пути комплемента.
Как показано в ТАБЛИЦЕ 6 Примера 10, 17 Fab2 анти-MASP-2 с функциональной блокирующей активностью было идентифицировано в результате этого анализа (34% попаданий для блокирующих антител). Функциональное ингибирование лектинового пути комплемента при помощи Fab2 было очевидно на уровне С4-депозиции, которая является прямой мерой C4-расщепления при помощи MASP-2. Важно, что ингибирование было столь же очевидным, когда была оценена C3-конвертазная активность, что демонстрирует функциональную блокаду лектинового пути комплемента. 17 MASP-2-блокирующих Fab2, определенных, как описано в Примере 10, эффективно ингибируют образование C3-конвертазы со значением IC50, равным или меньшим, чем 10 нМ. Восемь из 17 выявленных Fab2 имеют значения IC50 в субнаномолярном диапазоне. Кроме того, все 17 MASP-2-блокирующих Fab2 дали, по существу, полное ингибирование формирование C3-конвертазы при анализе на C3-конвертазу лектинового пути, как показано на ФИГУРАХ 8A-C и обобщено в ТАБЛИЦЕ 6 Примера 10. Кроме того, каждое из 17 анти-MASP-2-блокирующих Fab2, показанное в ТАБЛИЦЕ 6, эффективно ингибирует образование C3b (>95%), что свидетельствует о специфичности этого анализа для C3-конвертазы лектинового пути.
Изотипные варианты полноразмерных антител IgG2c крысы и IgG2a мыши представляли собой производное от Fab2 # 11. В этом Примере описывается характеризация in vivo этих изотипов для фармакодинамических параметров.
Способы:
Как описано в Примере 10, белок MASP-2 крысы, используемых для панорамирования Fab библиотеки фагового дисплея, из которой был идентифицирован Fab2# 11. Изотипные варианты полноразмерных антител IgG2c крысы и IgG2a мыши представляли собой производное от Fab2 # 11. Изотипы полноразмерных антител как IgG2c крысы, так и IgG2a мыши характеризовали in vivo для фармакодинамических параметров следующим образом.
In vivo исследование на мышах:
Фармакодинамическое исследование проводились на мышах, чтобы исследовать эффект дозирования антитела анти-MASP-2 на плазматическую активность лектинового пути in vivo. В этом исследовании, C4-депозиция измерялась ex vivo в анализе лектинового пути в различные моменты времени после подкожного (sс) и внутрибрюшинного (ip) введения 0,3 мг /кг или 1,0 мг/кг мышиного MoAb анти-MASP-2 (изотип полноразмерного антитела IgG2a мыши, полученный из Fab2 # 11).
ФИГУРА 21 графически иллюстрирует специфическую для лектинового пути C4b-депозицию, измеренную ex vivo в неразбавленных образцах сыворотки, взятых у мышей (n=3 мыши/группу) в различные моменты времени после подкожного введения либо 0,3 мг/кг, или 1,0 мг/кг мышиного MoAb анти-MASP-2. Образцы сыворотки от мышей, собранные до дозирования антитела, служили в качестве отрицательного контроля (100% активности), в то время как добавление in vitro 100 нм того же блокирующего антитела анти-MASP-2 было использовано в качестве положительного контроля (0% активности).
Результаты, приведенные на ФИГУРЕ 21, демонстрируют быстрое и полное ингибирование C4b-депозиции после подкожного введения дозы 1,0 мг/кг мышиного MoAb анти-MASP-2. Частичное ингибирование C4b-депозиция был отмечено после подкожного введения дозы 0,3 мг/кг мышиного MoAb анти-MASP-2.
Временной курс восстановления лектинового пути последовал через три недели после однократного ip-введения мыши 0,6 мг /кг мышиного MoAb анти-MASP-2. Как показано на ФИГУРЕ 22, резкое падение активности лектинового путь произошло после дозирования антитела, за которым последовало полное ингибирование лектинового путь, которое продолжалось в течение 7 дней после ip-введения. Медленное восстановление активности лектинового пути наблюдалось в течение второй и третьей недели с полным восстановлением лектинового пути у мышей на 17 день после введения MoAb анти-MASP-2.
Эти результаты показывают, что мышиные MoAb анти-MASP-2, полученные из Fab2 # 11, ингибирует лектиновый путь у мышей дозо-чувствительным образом, при системной доставке.
ПРИМЕР 20
В этом Примере описывается анализ мышиного MoAb анти-MASP-2, полученного из Fab2 #11 на эффективность в мышиной модели возрастной макулярной дегенерации.
Предпосылки/обоснование:
Как описано в Примере 10, белок MASP-2 крысы был использован для панорамирования Fab-библиотеки фагового дисплея, из которой Fab2 # 11 был идентифицирован как функционально активное антитело. Изотипы полноразмерных антител IgG2c крысы и IgG2a мыши были получены из Fab2 # 11. Полноразмерное мышиное антитело анти-MASP-2 мышиного IgG2a-изотипа характеризовали для фармакодинамических параметров, как описано в Примере 19. В этом Примере мышиное полноразмерное антитело анти-MASP-2, полученное из Fab2 #11, анализировали в мышиной модели возрастной макулярной дегенерации (AMD), описанной в Bora P.S. et al., J Immunol, 174:491-497 (2005).
Способы:
Изотип мышиного полноразмерного антитела анти-MASP-2, полученный из Fab2 # 11, как описано в Примере 19, протестировали в мышиной модели возрастной макулярной дегенерации (AMD), как описано в Примере 13, со следующими модификациями.
Введение мышиных MoAb анти-MASP-2
Две разные дозы (0,3 мг/кг и 1,0 мг /кг) мышиного MoAb анти-MASP-2 самого по себе с лечением изотипным контрольным MoAb инъецировали ip в мышей WT (+/+) (n=8 мышей в каждой группе) за 16 часов до индукции CNV.
Индукция хориоидальной неоваскуляризации (CNV)
Индукция хориоидальной неоваскуляризации (CNV) и измерение объема CNV осуществлялись с помощью лазерной фотокоагуляции, как описано в Примере 13.
Результаты:
ФИГУРА 23 графически иллюстрирует площадь CNV, измеренную через 7 дней после лазерного травматического повреждения у мышей, получавших либо изотипное контрольное MoAb, или мышиное MoAb анти-MASP-2 (0,3 мг /кг и 1,0 мг/кг). Как показано на ФИГУРЕ 23, у мышей, предварительно получавших 1,0 мг/кг MoAb анти-MASP-2, статистически значимое (p<0,01) примерно 50%-ное снижение CNV было отмечено через семь дней после лазерного лечения. Как показано далее на ФИГУРЕ 23, было отмечено, что доза 0,3 мг/кг MoAb анти-MASP-2 была неэффективна для снижения CNV. Было отмечено, что доза 0,3 мг/кг MoAb анти-MASP-2, как было показано, обладает частичным и временным ингибированием C4b-депозиции после подкожного введения, как описано в Примере 19 и ФИГУРЕ 21.
Результаты, описанные в данном Примере, продемонстрируют, что блокада MASP-2 ингибитором, таким как MoAb анти-MASP-2, имеет профилактический и/или терапевтический эффект при лечении макулярной дегенерации. Следует отметить, что эти результаты согласуются с результатами, наблюдаемыми в исследовании, проведенном на мышах MASP-2 (-/-), описанном в Примере 13, в котором 30%-ное снижение CNV через 7 дней после лазерной обработки наблюдалось у мышей MASP-2 (-/-), по сравнению с контрольными мышами дикого типа. Кроме того, результаты в этом Примере дополнительно показывают, что системно доставленное антитело анти-MASP-2 обеспечивает местный терапевтический эффект в глазе, тем самым подчеркивая потенциал для системного способа введения при лечении AMD-пациентов. В целом, эти результаты представляют доказательства, поддерживающие применение MoAb MASP-2 при лечении AMD.
ПРИМЕР 21
Этот Пример показывает, что MASP-2 дефектные мыши защищены от смертности, индуцированной Neisseria meningitidis, после инфицирования N. meningitidis и обладают увеличенным освобождением от бактериемии, по сравнению с контрольными мышами дикого типа.
Обоснование: Neisseria meningitidis представляет собой гетеротрофную грамотрицательную диплококковую бактерию, известную по своей роли в менингите и других формах менингококковой инфекции, такой как менингококкемия. N. meningitidis является основной причиной заболеваемости и смертности в детском возрасте. Серьезные осложнения включают в себя септицемию, синдром Уотерхауза-Фридериксена, недостаточности надпочечников и диссеминированное внутрисосудистое свертывание (DIC). Смотри, например, Rintala E, et al., Critical Care Medicine 28(7):2373-2378 (2000). В этом Примере, роль лектинового пути анализировали у мышей MASP-2 (-/-) и WT (+/+), чтобы установить, будут ли MASP-2 дефектные мыши подвержены N. Meningitidis-индуцированной смертности.
Способы:
MASP-2-нокаутные мыши были созданы, как описано в Примере 1, и возвратно скрещивали не менее 10 поколений с C57B1/6. 10-недельные мыши MASP-2 KO (n=10) и мыши дикого типа C57B1/6 (n=10) были инокулированы путем внутривенной инъекции одной из дозировок 5×108 кое/100 мкл, 2×108 кое/100 мкл или 3×107 кое/100 мкл Neisseria meningitidis серогруппы А Z2491 в 400 мг/кг декстрана железа. Выживаемость мышей после заражения контролировали в течение 72-часового периода времени. Пробы крови брали от мышей с интервалами в 1 час после заражения и анализировали, чтобы определить уровень N. meningitidis в сыворотке крови (log кое/мл), чтобы проверить инфекцию и определить скорость исчезновения бактерий из сыворотки.
Результаты:
ФИГУРА 24а графически иллюстрирует процент выживания мышей MASP-2 KO и WT-мышей после введения инфицирующей дозы 5×108 кое/100 мкл N. meningitidis. Как показано на ФИГУРЕ 24А, после инфекции самой высокой 5×108 кое/100 мкл N. meningitidis, 100% MASP-2 KO мышей выживали на протяжении периода в 72 часа после заражения. В отличие от этого, только 20% WT-мышей были еще живы через 24 часа после заражения. Эти результаты показывают, что MASP-2 дефектные мыши защищены от N. Meningitidis-индуцированной смертности.
ФИГУРА 24В графически иллюстрирует log кое/мл N. Meningitidis, полученных из образцов крови, взятых в разные моменты времени из мышей MASP-2 2 и WT-мышей, инфицированных 5×108 кое/100 мкл N. meningitidis. Как показано на ФИГУРЕ 24В, WT-мышей уровень N. meningitidis в крови достиг пика около 6,5 log кое/мл через 24 часа после заражения и упал до нуля через 48 часов после заражения. В отличие от этого, у мышей MASP-2 KO, уровень N. meningitidis достиг пика примерно в 3,5 log кое/мл через 6 часов после заражения и упал до нуля через 36 часов после заражения.
ФИГУРА 25A графически иллюстрирует процент выживших мышей MASP-2 КО и WT-мышей после инфицирования 2×108 кое/100 мкл N. meningitidis. Как показано на ФИГУРЕ 25А, после инфекции в дозе 2×108 кое/100 мкл N. meningitidis, 100% MASP-2 КО мышей выжили на протяжении 72 часов после заражения, напротив, только 80% МАС мышей были еще живы через 24 часа после заражения. В соответствии с результатами, показанными на ФИГУРЕ 24А, эти результаты демонстрируют, что MASP-2-дефектные мыши защищены от N. Meningitidis-индуцированной смертности.
ФИГУРА 25B графически иллюстрирует log кое/мл N. Meningitidis, полученных из образцов крови, взятых в разные моменты времени из WT-мышей, инфицированных 2×108 кое/100 мкл N. meningitidis. Как показано на ФИГУРЕ 25B, уровень N. meningitidis в крови WT-мышей, инфицированных 2×108 кое, достигал пика в около 4 log кое/мл через 12 часов после заражения и падал до нуля через 24 часа после заражения. ФИГУРА 25С графически иллюстрирует log кое/мл N. meningitides, полученных из образцов крови, взятых в разные моменты времени из мышей MASP-2 КО, инфицированных 2×108 кое/100 мкл N. meningitidis. Как показано на ФИГУРЕ 25С, уровень N. meningitidis в крови мышей MASP-2 КО, инфицированных 2×108 кое, достигал пика на уровне около 3,5 log кое/мл через 2 часа после заражения и падал до нуля в течение 3 часов после заражения. В соответствии с результатами, показанными на ФИГУРЕ 24В, эти результаты показывают, что, хотя мыши MASP-2 КО были заражены той же дозой N. meningitidis, что и WT-мыши, мыши MASP-2 КО обладают повышенным освобождением от бактериемии по сравнению с WT-мышами.
Процент выживания мышей MASP-2 КО и WT-мышей после заражения наименьшей дозой 3×107 кое/100 мкл N. meningitidis составлял 100% в течение 72-часового периода времени (данные не приведены).
Обсуждение
Эти результаты показывают, что MASP-2-дефектные мыши защищены от N. meningitidis-индуцированной смертности и имеют повышенное освобождение от бактериемии по сравнению с WT-мышами. Поэтому, с учетом этих результатов, ожидается, что терапевтическое применение MASP-2-ингибиторов, таких как MoAb MASP-2, как ожидается, будет эффективным для лечения и предотвращения или смягчения последствий заражения бактериями N. meningitidis (т.е., сепсис и DiC). Кроме того, эти результаты указывают на то, что терапевтическое применение MASP-2-ингибиторов, таких как MoAb MASP-2, не будет провоцировать субъекта к повышенному риску приобретения инфекций N. meningitidis.
ПРИМЕР 22
В этом Примере описывается открытие новой лектиновый путь-опосредованной и MASP-2-зависимой C4-обходной активации комплемента С3.
Обоснование:
Основной терапевтический эффект использования ингибиторов активации комплемента по ограничению миокардиальной ишемии/реперфузионного повреждения (MIRI) был убедительно продемонстрирован в экспериментах на крысиной модели инфаркта миокарда два десятилетия назад: Рекомбинантный sCR1, растворимая укороченная производная рецептора комплемента типа-1 клеточной поверхности (CR1), давали внутривенно, и его эффект оценивали в крысиной in vivo модели MIRI. Лечение sCR1 снижало объем инфаркта более чем при на 40% (Weisman, H.F., et al., Science 249: 146-151 (1990)). Терапевтический потенциал этого рекомбинантного ингибитора впоследствии было показано в клиническом исследовании, показывающем, что введение sCR1 больным с MI препятствовало сократительному отказу при пост-ишемической болезни сердца (Shandelya, S. et al., Circulation 87:536-546 (1993)). Основной механизм, приводящий к активации системы комплемента в ишемизированных тканях, однако, не был, в конечном счете, определен, в основном из-за отсутствия соответствующих экспериментальных моделей, ограниченного понимания молекулярных процессов, которые приводят к активации комплемента в лишенных кислорода клетках, и взаимное влияние и синергизмы между различными путями активации комплемента.
В качестве основного компонента иммунного ответа, система комплемента обеспечивает защиту от вторжения микроорганизмов как через антитело-зависимый, так и антитело-независимый механизмы. Она организует многие клеточные и гуморальные взаимодействия в рамках иммунного ответа, в том числе хемотаксис, фагоцитоз, клеточная адгезия и B-клеточная дифференциация. Три различных пути инициируют каскад комплемента: классический путь, альтернативный путь и лектиновый путь. Узнающий подкомпонент классического путь C1q связывается с различными мишенями - наиболее заметными иммунными комплексами - для начала постадийной активации связанных сериновых протеиназ, C1r и C1s, обеспечивая основной механизм удаления патогена и иммунного комплекса после захвата адаптивной иммунной системой. Связывание C1q c иммунными комплексами преобразует димер зимогена C1r в его активную форму для расщепления и, тем самым, активирования C1s. C1s транслирует C1q связывание в активацию комплемента в две стадии расщепления: на первой C4 преобразуется в C4a и C4b, а затем расщепляется C4b-связанный С2 с образованием C3-конвертазы C4b2a. Этот комплекс преобразует присутствующий в изобилии компонент плазмы С3 в C3a и C3b. Накопление C3b в непосредственной близости от C4b2a-комплекса сдвигает субстратную специфичность для C3 к C5, с образованием C5-конвертазы C4b2a(C3b)n. Конвертазные комплексы C3 и C5, сформированные с помощью классического пути активации, идентичны таковым, полученным с помощью способа активации лектинового пути. В альтернативном пути, спонтанный низкого уровня гидролиз компонента C3 приводит к депозиции белковых фрагментов на поверхностях клеток, вызывая активацию комплемента на инородные клетки, а связанные с клетками регуляторные белки в тканях хозяина предотвращают активацию, предотвращая, таким образом, самоповреждение. Подобно альтернативному пути, лектиновый путь может быть активирован в отсутствие иммунных комплексов. Активация инициируется путем связывания мультимолекулярного комплекса активации лектинового пути с патоген-связанными молекулярными структурами (PAMP), в основном углеводными структурами, присутствующими на бактериальных, грибковых или вирусных патогенах, или аномальными гликозилированными структурами на апоптотических, некротических, злокачественных или лишенных кислорода клетках, (Collard, C.D., et al., Am. J. Pathol. 156: 1549-1556 (2000); Walport, M.J., N. Engl. J. Med. 344: 1058-1066 (2001); Schwaeble, W. et al., Immunobiology 205:455-466 (2002); and Fujita, T., Nat. Rev. Immunol 2:346-353 (2002)).
Маннан-связыванный лектин (MBL) был первым углевод-узнающим подкомпонентом, образующим, как было показано, комплексы с группой новых сериновых протеиназ, названных MBL-связанных сериновых протеаз (MASP) и нумеруются по порядку их открытия (т.е., MASP-1, MASP-2 и MASP-3). У человека, комплексы активации лектинового пути могут быть образованы с четырьмя альтернативными углевод-узнающими субкомпонентами с разных специфичностями связывания углеводов, т.е., MBL 2, и три разных членов семейства фиколинов, а именно L-фиколин, H-фиколин и М-фиколин и MASP. Две формы MBL, MBL А и MBL C, и фиколин-А форма комплексов лектинового пути активации с MASP в плазмы мыши и крысы. Авторы ранее клонировали и характеризовали MASP-2 и дополнительный сеченный продукт гена MASP-2 размером 19 кДа, названный MAp19 или sMAP, у человека, мыши и крысы (Thiel, S., et al., Nature 556:506-510 (1997); Stover, C.M. et al., J. Immunol 162:3481-3490 (1999); Takahashi, M., et al., Int. Immunol 77:859-863 (1999): и Stover, C.M., et al., J. Immunol 763:6848-6859 (1999)). MAp19/sMAP лишен протеазной активности, но может регулировать активацию лектинового пути конкурирования за связывание MASP с углевод-узнающими комплексами (Jwaki, D. et al., J. Immunol 77:8626-8632 (2006)).
Имеются данные, указывающие на то, что из трех MASP, требуется только MASP-2, чтобы транслировать связывание комплексов, узнающих лектиновый путь, в активацию комплемента (Thiel, S., et al. (1997); Vorup-Jensen, T., et al., J. Immunol. 765:2093-2100 (2000); Thiel, S., et al., J. Immunol. 765:878-887 (2000); Rossi, V., et al., J. Biol Chem. 276:40880-40887 (2001)). Этот вывод подтверждается и фенотипом недавно описанного штамма мыши, дефектного по MASP-1 и MASP-3. За исключением задержки в наступлении активации комплемента, опосредованной лектиновым путем, in vitro-MASР-1/3 дефектные мыши сохраняют функциональную активность лектинового пути. Воссоздание MASP-1 и MASP-3-дефектной сыворотки рекомбинантным MASP-1 преодолевает эту задержку активации лектинового пути, подразумевая, что MASP-1 может способствовать активации MASP-2 (Takahashi, М., et al., J. Immunol 750:6132-6138 (2008)). Самое последние исследование показало, что MASP-1 (а также, вероятно, MASP-3) необходим для преобразования активационного ферментного Фактора D альтернативного пути из его зимогенной формы в ферментативно активную форму (Takahashi, M. et al., J. Exp. Med. 207:29-37 (2010)). О физиологическом значении этого процесса свидетельствует и отсутствие функциональной активности альтернативного пути в плазме MASP - 1/3 дефектных мышей.
Недавно созданные штаммы мышей с комбинированной направленной недостаточностью углевод-узнающих субкомпонентов лектинового пути MBL А и MBL C по-прежнему могут активировать активацию лектинового пути через оставшийся узнающий подкомпонент лектинового пути у мыши - фиколин А (Takahashi, K. et al., Microbes Infect. 4:773-784 (2002)). Отсутствие каких-либо остаточной функциональной активности лектинового пути у MASP-2 дефектных мышей обеспечивает окончательную модель для изучения роли этого эффекторного плеча врожденного гуморального иммунитета в норме и патологии.
Наличие штаммов мышей, дефектных по C4 и MASP-2, позволило нам определить новый лектиновый путь-специфический, но MASP-2-зависимый, C4-обходной маршрут активации комплемента С3. Существенный вклад этого нового лектиновый путь-опосредованного C4-обходного маршрута активации в отношении пост-ишемической потери тканей подчеркивается заметным защитным фенотипом MASP-2 -недостаточности в МIRI, несмотря на то, что C4-дефектные мыши, проверенные в той же модели, демонстрируют отсутствие защиты.
В этом Примере авторы описывают новую лектиновый путь-опосредованную и MASP-2-зависимую C4-обходную активацию комплемента С3. Физиологическое значение этого нового способа активации устанавливается при помощи защитного фенотипа недостатка MASP-2 в экспериментальной модели ишемии миокарда/реперфузионного поражения (MIRI), где C4-дефектные животные не были защищены.
Способы:
MASP-2-дефектные мыши демонстрируют отсутствие грубых нарушений. MASP-2 дефектные мыши были созданы, как описано в Примере 1. Как гетерозиготные(+/-), так и гомозиготные (-/-) MASP-2 дефектные мыши являются здоровыми и фертильными, и демонстрируют отсутствие грубых нарушений. Продолжительность их жизни сходна с таковой у их однопометных WT (более 18 месяцев). Перед изучением фенотипа этих мышей в экспериментальных моделях заболевания, нашу линию MASP-2-/- возвратно скрещивали одиннадцать поколений с линией C57BL/6. Полное отсутствие MASP-2 мРНК было подтверждено Нозерн-блоттингом поли А+-селектированных препаратов РНК печени, в то время как 1,2 т.п.н.-мРНК, кодирующая Map19 или sMAP (усеченный продукт альтернативного сплайсинга гена MASP2), обильно экспрессировалась.
qRT-ПЦР-анализа с использованием пар праймеров, специфичных либо для последовательности, кодирующей домен сериновой протеазы MASP-2 (B-цепь), или для оставшейся части, кодирующей последовательность A-цепи, показал, что мРНК, кодирующая B-цепь, не обнаруживается у мышей MASP-2-/-, хотя обилие мРНК-транскрипта дизруптированной А-цепи было значительно увеличено. Аналогично, обилие мРНК, кодирующей МАр19/sMAP, увеличено у мышей MASP-2+/- и MASP-2-/-. Уровни MASP-2 в плазме, определеннные способом ИФА у 5 животных каждого генотипа, составляли 300 нг/мл для WT-контролей (диапазон 260-33 нг /мл), 360 нг/мл для гетерозиготных мышей (в диапазоне 330-395 нг/мл) и неопределяемый у MASP-2-/--мышей. Используя qRT-ПЦР-анализ, были получены профили экспрессии мРНК, демонстрирующие, что MASP-2 -/--мыши экспрессируют мРНК для MBL А, MBL C, фиколина А, MASP-1, MASP-3, C1q, C1rА, C1sA, Фактора B, Факторa D, С4 и С3 в количестве, сходном с таковым для их MASP-2 достаточных однопометных животных (данные не приведены).
C3-уровни в плазме MASP-2-/- (n=8) и MASP-2+/+ (n=7) однопометных животных были измерены с использованием коммерчески доступного набора mouse C3 ELISA (Kamiya, Biomedical, Seattle, WA). C3-уровни MASP-2 дефектных мышей (в среднем 0,84 мг/мл, +/- 0,34) были сходны с таковыми для WT-контролей (в среднем 0,92, +/- 0,37).
Результаты:
MASP-2 необходим для функциональной активности лектинового пути.
Как описано в Примере 2 и показано на ФИГУРЕ 5, in vitro -анализ плазмы MASP-2-/- показал полное отсутствие функциональной активности лектинового пути на активированных маннан- и зимозан-покрытых поверхностях для активации C4. Аналогичным образом, ни лектиновый путь-зависимое C4-расщепление, ни С3-расщепление не были обнаружены в MASP-2-/--плазме на поверхностях, покрытых N-ацетилглюкозамином, которая связывает и инициирует активацию через MBL А, MBL C и фиколин (данные не приведены).
Анализ сыворотки и плазмы MASP-2-/-мышей наглядно показал, что MASP-2, в существенной степени, необходим для активации комплемента через лектиновый путь. Общая нехватка функциональной активности лектинового пути, однако, оставляет другие пути активации комплемента интактными: в MASP-2-/-плазме все еще можно активировать комплемент по классическому (ФИГУРА 26А) и альтернативному пути (ФИГУРА 26В). На ФИГУРАХ 26А и 26В, символ «*» указывает сыворотку от WT (MASP-2 (+ /+)), символ «•» обозначает сыворотку от WT (C1q обедненную): символ «□» указывает на сыворотку от MASP-2 (-/-); и символ «▲» указывает на сыворотку от MASP-2 (-/-) (C1q обедненную).
ФИГУРА 26А наглядно демонстрирует, что мыши MASP-2-/- сохраняют функциональный классический путь: C3b-депозицию анализировали в планшетах для микротитрования, покрытых иммунными комплексами (созданных in situ путем покрытия BSA, затем добавляя козлиный IgG анти-BSA). ФИГУРА 26В графически иллюстрирует, что у MASP-2 дефектных мышей сохраняется функциональный альтернативный путь: C3b-депозицию анализировали на покрытых Зимозаном планшетах для микротитрования при состояниях, которые разрешают активации только альтернативного пути (буфер, содержащий Мg2+ и EGTA). Результаты, показанные на ФИГУРЕ 26А и ФИГУРЕ 26В, представляют собой средние от дубликатов и являются типичными для трех независимых экспериментов. Для источников плазмы использовались те же символы. Эти результаты показывают, что функциональный альтернативный путь присутствует в MASP-2 дефектных мышах, как об этом свидетельствуют результаты, приведенные на ФИГУРЕ 26В, по экспериментальным состояниям, спланированным для непосредственного инициирования альтернативного пути, при инактивации классического пути и лектинового пути.
Лектиновый путь активации комплемента критически способствует потере воспаления тканей при ишемии миокарда/реперфузионном повреждении (MIRI).
В целях изучения вклада функциональной активности лектинового пути в MIRI, авторы сравнивали мышей MASP-2-/- и однопометные WT-контроли в модели MIRI после транзиентной перевязки и реперфузии левой передней нисходящей ветви коронарной артерии (LAD). Наличие или отсутствие комплемента С4 не имеет никакого влияния на степень потери ишемизированной ткани при MIRI. Авторы провели оценку воздействия недостатка C4 на размеры инфаркта после экспериментальной MIRI. Как показано на ФИГУРЕ 27А и ФИГУРЕ 27В, идентичные размеры инфаркта наблюдались как у C4-дефектных мышей, так и их однопометных WT-животных. ФИГУРА 27А графически иллюстрирует MIRI-индуцированную потерю ткани после LAD-перевязки и реперфузии у мышей C4-/- (n=6) и соответствующих однопометных WT-контролей (n=7). ФИГУРА 27В графически иллюстрирует INF как функция AAR, ясно демонстрируя, что мыши C4-/- настолько же восприимчивы к MIRI, как их WT-контроли (прерывистая линия).
Эти результаты показывают, что C4-дефектные мыши не защищены от MIRL. Этот результат оказался неожиданным, так как он вступает в противоречие с общепринятой точки зрения, что основной фрагмент C4-активации, C4b, является неотъемлемой частью C3-конвертазы классического и лектинового пути C4b2a. Поэтому авторы оценивали, можно ли обнаружить остаточную лектиновый путь-специфическую активацию комплемента С3 у C4-дефектных мышей и плазме человека.
Лектиновый путь может активировать комплемент С3 при отсутствии С4 через новый MASP-2-зависимых C4-обходной маршрут активации.
Ободренные исторические сообщениями, свидетельствующими о существовании C4-обходного маршрута активации в C4-дефектной сыворотке крови морской свинки (May, J.E. and M Frank, J. Immunol 111:1671-1677 (1973)), авторы анализировали, могут ли C4-дефектные мыши иметь остаточную функциональную активность классического или лектинового пути, и контролировали активизацию C3 при пути-специфических условиях тестирования, исключающих вклад альтернативного пути.
C3b-депозицию анализировали в покрытых маннаном планшетах для микротитрования с использованием повторно кальцинированной плазмы при плазменных концентрациях, запретительных для альтернативного пути активации (1, 25% и ниже). Несмотря на то, что расщепления С3 не было обнаружено в C4-дефектной плазме, протестированной на классический путь активации (данные не приведены), сильная остаточная активность расщепления С3 наблюдалась в плазме C4-дефектной мыши при инициировании активации комплемента через лектиновый путь. Зависимость от лектинового пути демонстрируется путем конкурентного ингибирования расщепления С3 с последующей преинкубацией C4-дефектных разведений плазмы с растворимым маннаном (смотри ФИГУРУ 28). Как показано на ФИГУРЕ 28А-D, MASP-2-зависимая активация C3 наблюдалось в отсутствие C4. ФИГУРА 28А графически иллюстрирует C3b-депозицию мышиной плазмой C4+/+ (кресты) и С4-/- (белые кружки). Прединкубации C4-плазмы с избытком (1 мкг/мл) маннана в жидкой фазе перед анализом полностью подавляет C3-депозицию (заполненные кружки). Результаты являются типичными из 3 независимых экспериментов. ФИГУРА 28В графически иллюстрирует результаты эксперимента, в котором плазмы мыши дикого типа, MASP-2-дефектной (открытые квадраты) и C4-/- (1%) смешивали с различными концентрациями mAbM11 анти-MASP-2 крысы (абсцисса) и C3b-депозицию анализировали в покрытых маннаном планшетах. Результаты представляют собой среднее (±SD) 4 анализов (дубликаты 2 из каждого типа плазмы). ФИГУРА 28С графически иллюстрирует результаты эксперимента, в котором плазму человека: объединяли с NHS (кресты), плазмой C4-/- (открытые кружки) и плазмой С4-/-, предварительно инкубированной с 1 мкг/мл маннана (заполненные кружки). Результаты являются характерными для трех независимых экспериментов. ФИГУРА 28D графически показывает такое ингибирование C3b-депозиции в C4-достаточно и C4-дефицитной человеческой плазме (1%) при помощи mAbН3 анти-MASP-2 человека (Средние ± SD троекратных повторностей). Как показано на ФИГУРЕ 28В, не было обнаружено никакой лектиновый путь-зависимой C3-активации в MASP-2-/-плазме, проанализированной параллельно, что подразумевает, что этот C4-обходной маршрут активации C3 является MASP-2-зависимым.
Для дополнительного подтверждения этих выводов, авторы создали серии рекомбинантных ингибирующих mAb, изолированных из антительных библиотек фагового дисплея при помощи аффинного скрининга против рекомбинантных MASP-2A человека и крысы (где остаток серина активного протеазного домена был заменен на остаток аланина при помощи сайт-направленного мутагенеза, чтобы предотвратить аутолитическую деградацию антигена). Рекомбинантные антитела против MASP-2 (AbH3 и AbM11) были изолированы от комбинаторных библиотек Антител (Knappik, A., et al., J. Mol. Biol. 296:57-86 (2000)), с использованием рекомбинантного MASP-2А человека и крысы в качестве антигена (Chen, C.B. and Wallis, J. Biol. Chem. 276:25894-25902 (2001)). Анти-крысиный Fab2-фрагмент, который эффективно подавлял лектиновый путь-опосредованную активацию С4 и С3 в плазме мыши (IC50 ≈ 1 нМ), был преобразован в полноразмерное антитело IgG2a. Поликлональная антисыворотка против MASP-2A мыши была поднята в крысе. Эти инструменты позволили нам подтвердить MASP-2-зависимость этого нового лектиновый путь-специфического C4-обходного маршрут активации C3, как описано ниже.
Как показано на ФИГУРЕ 28B, М211, ингибирующее моноклональное антитело, которые избирательно связывается с MASP-2 мыши и крысы, подавляло C4-обходную активацию C3 у C4-дефектной мыши, а также C3-активацию плазмы WT-мыши через лектиновый путь концентрационно-зависимым образом со сходным значением IC50. Все анализы были проведены при высоких разведениях плазмы, что делало нефункциональным маршрут альтернативного пути активации (с максимальной концентрацией плазмы в 1,25%).
Для того чтобы исследовать наличие аналогичной лектиновый путь-специфической C4-обходной активации C3 у людей, авторы проанализировали плазму донора с наследственным дефектом обоих C4-генов человека (т.е., C4A и C4B), что привело к полному отсутствию C4 (Yang, Y., et al., J. Immunol, 173:2803-2814 (2004)). На ФИГУРЕ 28С показано, что плазма этого пациента эффективно активирует C3 в высоких плазменных разведениях (что делает нефункциональным маршрут альтернативного пути активации). Лектиновый путь-специфический режим C3-активации на покрытых маннаном планшетах демонстрируется в C4-дефектной плазме мыши (ФИГУРА 28А) и C4-дефектной плазме человека (ФИГУРА 28С) при помощи добавления избыточной концентрации маннана в жидкой фазе. MASP-2 зависимость этого механизма активации С3 в C4-дефектной плазме человека оценивали с помощью AbH3, моноклонального антитела, которое специфически связывается с MASP-2 человека и снимает функциональную активность MASP-2. Как показано на ФИГУРЕ 28D, AbH3 подавляет депозицию C3b (и C3dg) как в C4-достаточной, так и в C4-дефектной плазме человека с сопоставимой эффективностью.
Для оценки возможной роли других компонентов комплемента в C4-обходной активации C3, авторы протестировали плазму мышей MASP-1/3-/-и Bf/C2-/- наряду с плазмой MASP-2-/-, С4- и C1q-/- (в качестве контроля) как при условиях тестирования, специфических для лектинового пути, так и при условиях, специфических для классического пути. Относительное количество C3-расщеплени было отложено против количества депонированного C3 при использовании WT-плазмы.
ФИГУРА 29А графически иллюстрирует сравнительный анализ активности C3-конвертазы в протестированной плазме крови штаммов мышей с различными дефектами комплемента как при условиях тестирования, специфических для лектинового пути активации, так и при условиях, специфических для классического пути активации. Разбавленные образцы плазмы (1%) WT-мышей (n=6), мышей MASP-2-/- (n=4), мышей MASP-1/3-/- (n=2), мышей C4-/- (n=8), мышей C4/MASР-1/3-/- (11=8), мыши Bf/C2-/- (n=2) и C1q-/- (n=2), были протестированы в параллелях. Реконституция плазмы Bf/C2 -/- с 2,5 мкг/мл рекомбинантного крысиного C2 (Bf/C2-/- +C2) восстанавливала C3b-депозицию. Результаты представляют собой среднее (±SD), **p<0,01 (по сравнению с WT-плазмой). Как показано на ФИГУРЕ 29А, существенная C3-депозиция наблюдается в C4-/- плазме, тестированной при условиях, специфических для лектинового пути, но не при условиях, специфических для классического пути. Опять же, C3-депозицию не наблюдали в MASP-2-дефектной плазме по маршруту активации через лектиновый путь, в то же время как та же плазма осаждала C3 через классический путь. В плазме MASP-1/3-/-, C3-депозиция наблюдается при анализируемых состояниях, специфических как для лектинового, так и для классического пути. C3-депозиция не наблюдалась в плазме крови в сочетании с дефектом С4 и MASP-1/3, с использованием состояний, специфических либо для лектинового пути, или классического пути. C3-депозиция не детектировалась в плазмы C2/Bf-/-, либо через лектиновый путь, или посредством классического пути. Реконституция плазмы C2/Bf-/-мыши плазмы рекомбинантным C2, однако, восстанавливала расщепление С3, опосредованное как лектиновым путем, так и классическим путем. Тестируемые состояния были проверены с использованием плазмы C1q-/-.
ФИГУРА 29В графически иллюстрирует кинетику с временным разрешением C3-конвертазной активности в плазме крови штаммов мышей с различными дефектами комплемента WT, fB-/-, С4-/-, MASP-1/3-/- и MASP-2 -/-плазмы, проверенных при состояниях тестирования, специфических для лектинового пути активации (1%-я плазма, результаты являются типичными из трех независимых экспериментов). Как показано на ФИГУРЕ 29В, хотя C3-расщепление не наблюдали в плазме MASP-2-/-, плазма fB-/- расщепляла C3 с кинетикой, аналогичной таковой для WT-плазмы. Значительная задержка в лектиновый путь-зависимом преобразовании С3 в C3b (и C3dg) наблюдали в C4-/-, а также в MASP -1/3 дефектной плазме. Эта задержка С3-активации в MASP-1/3-/- плазме, как было недавно показано, является зависимой от MASP-1, а не от MASP-3 (Takahashi, М., et al., J. Immunol. 730:6132-6138 (2008)).
Обсуждение:
Результаты, описанные в данном Примере, убедительно свидетельствуют о том, что функциональная активность MASP-2 является существенной для активации C3 через лектиновый путь, как при наличии, так и отсутствии C4. Кроме того, C2 и MASP-1 требуются для работы этого нового лектиновый путь-специфического C4-обходного маршрута активации C3. Сравнительный анализ функциональной активности лектинового пути в плазме MASP-2 -/-, а также C4-/- обнаружил существование ранее нераспознанного C4-независимого, но MASP-2-зависимого маршрута активации комплемента С3 и показал, что С3 может быть активирован лектиновый путь-зависимым образом при полном отсутствии C4. Хотя детальная молекулярная композиция и последовательность событий активации этой новой MASP-2-зависимой C3-конвертазы остаются до конца не изученными, наши результаты предполагают, что этот C4-обходной маршрут активации дополнительно требует наличие комплемента C2, а также MASP-1. Потеря лектиновый путь-опосредованной активности расщепления С3 в плазме крови мышей с комбинированной дефектом C4 и MASP-1/3 может быть объяснена недавно описанной ролью MASP-1 в усилении MASP-2 зависимой активации комплемента через прямое расщепление и активацию MASP-2 (Takahashi, M. et al. J. Immunol. 180:6132-6138 (2008)). Аналогичным образом, MASP-1 может помогать функциональной активности MASP-2 через его способность расщеплять C2 (Moiler-Kristensen, et al., Int. Immunol. 19: 141-149 (2007)). Обе активности могут объяснить пониженную скорость, с которой MASP-1/3 дефектная плазма расщепляет C3 через лектиновый путь активации и почему MASP-1 может потребоваться для поддержания преобразования С3 через C4-обходной маршрут активации.
Неспособность плазмы C2/fB-/- активировать C3 через лектиновый путь является, как было показано, C2-зависимымой, поскольку добавление рекомбинантного C2 крысы к плазме C2/fB-/- восстанавливает способность реконституированной плазмы активировать C3 на покрытых маннаном планшетах.
Обнаружение, что недостаток C4 специфически нарушает классический путь активации комплемента, несмотря на то, что лектиновый путь сохраняет физиологически критический уровень активности C3-конвертазы через MASP-2-зависимый C4-обходной маршрут активации, требует переоценки роли лектинового пути в моделях разных заболеваний, в том числе экспериментальной инфекции S. pneumoniae (Brown, J. S., et al., Proc. Natl. Acad. Sci. U. S. A. PP: 16969-16974 (2002); экспериментальный аллергический энцефаломиелит (Boos, L.A., et al., Glia 49: 158-160 (2005); а также модели C3-зависимых регенерации печени на мышах (Clark A., et al., Mol Immunol. 45:3125-3132 (2008)). Последняя группа продемонстрировала, что C4 - дефектные мыши могут активировать C3 в альтернативный путь-независимым образом, поскольку ингибирование in vivo альтернативного пути при помощи антитело-опосредованного истощения функциональной активности фактора B не оказывает эффекта на зависимую от С3-расщепления регенерацию печени у мышей C4-/- (Clark, A. еt al. (2008)). Этот лектиновый путь-опосредованный C4-обходной маршрут активации C3 может также объяснить и отсутствие защитного фенотипа C4-недостаточности в нашей модели MIRI, а также в ранее описанной модели отторжения почечного аллотрансплантата (Lin, T. et al, Am. J. Pathol. 168: 1241-1248 (2006)). В отличие от этого, последние результаты авторов независимо продемонстрировали значительный защитный фенотип мышей MASP-2-/- в модели трансплантации почки (Farrar, C.A., et al., Mol. Immunol. 40:2832 (2009)).
В целом, результаты данного Примера поддерживают мнение, что MASP-2 зависимая C4-обходная активация C3 представляет собой физиологически соответствующий механизм, который может быть важен при состояниях, когда наличие C4 ограничивает C3-активацию.
ПРИМЕР 23
В этом Примере описывается активация С3 при помощи субстратов тромбина и C3-депозиция на маннане у мышей WT (+/+), MASP-2 (-/-), F11 (-/-), F11/C4 (-/-) и C4 (-/-).
Обоснование:
Как описано в Примере 14, было установлено, что активация тромбина может возникать после активации лектинового пути при физиологических состояниях, и демонстрирует степень участия MАSP-2. C3 играет центральную роль в активации системы комплемента. C3-активация требуется как для классического, так и для альтернативного пути активации комплемента. Эксперимент был проведен с целью определить, активируется ли C3 субстратами тромбина.
Способы:
Активация С3 субстратами тромбина
Активацию C3 измерялась в присутствии следующих активированных форм субстратов тромбина; FCXIa человека, FVIIa человека, бычьего FXa, FXa человека, активированного белка С человека и тромбина человека. C3 инкубировали с различными субстратами тромбина, затем разделяли при восстановительных условиях в 10%-ом SDS-полиакриламидном геле. После электрофоретического переноса с использованием целлюлозной мембраны, мембрану инкубировали с моноклональными биотин-связанными крысиными антителами против C3 мыши, детектировали при помощи набора стрептавидин-HRP и проявляли с использованием ECL-реагента.
Результаты:
Активация C3 предполагает расщепление интактной цепи на усеченную цепь и растворимый C3a (не показано на ФИГУРА 30). ФИГУРА 30 показывает результаты Вестерн-блот анализа активизации С3 человека при помощи субстратов тромбина, где нерасщепленная альфа-цепь C3 и цепь продукта активации показаны стрелками. Как показано на ФИГУРЕ 30, инкубация C3 с активированными формами фактора и свертывания крови XI и фактора X человека, а также c активированным бычьим фактором свертывания крови X, может приводить к расщеплению C3 in vitro в отсутствие каких-либо протеаз комплемента.
C3-депозиция на маннане
Анализы C3-депозиции проводились на образцах сыворотки крови, полученных от WT, MASP-2 (-/-), F11 (-/-), F11(-/-)/C4(-/-) и C4(-/-). F11 представляет собой ген, кодирующий фактор свертывания крови XI. Для измерения C3-активации, планшеты для микротитрования покрывали маннаном (1 мкг/лунку), затем добавляли овечью сыворотку анти-HSA (2 мкг/мл) в TBS/tween/Ca2+. Планшеты блокировали 0,1% HSA в TBS и промывали, как описано выше. Образцы плазмы разводили в 4 мМ барбитале, 145 мМ NaCl, 2 мМ CaCl2, 1 мМ MgCl2, pН 7,4, добавляли в планшеты и инкубировали 1,5 ч при 37°С. После промывки, связывание C3b детектировали с помощью кроличьих антител против C3c человека (Dako), а затем - с помощью конъюгированных с щелочной фосфатазой козлиных антител против IgG кролика и pNPP.
Результаты:
ФИГУРА 31 демонстрирует результаты анализа C3-депозиция на образцах сыворотки, полученной от WT, MASP-2 (-/-), F11 (-/-), F11(-/-)/C4 (-/-) и C4 (-/-). Как показано на ФИГУРЕ 31, существует функциональный лектиновый путь, даже при полном отсутствии C4. Как далее показано на ФИГУРЕ 31, эта новая лектиновый путь-зависимая активация комплемента требует фактора свертывания крови XI.
Обсуждение:
До получения результатов этого эксперимента у специалистов в рассматриваемой области считалось, что для лектинового пути комплемента требуется активность C4. Поэтому данные, полученные на C4-нокаутных мышах (и людях с недостатком C4), были интерпретированы с предположением, что такие организмы были дефектными по лектиновому пути (в дополнение к недостаточности классического пути). Настоящие результаты показывают, что эта идея является ложной. Таким образом, выводы последних исследований, предполагающие, на основании фенотипа C4-дефектных животные, что лектиновый путь не является важным при некоторых состояниях заболеваний, могут быть ложными. Данных, описанных в данном Примере, также показывают, что в физиологическом контексте цельной сыворотки лектиновый путь может активировать компоненты коагуляционного каскада. Таким образом, показано, что существует перекрестное взаимодействие между комплементом и коагуляцией с участием MASP-2.
ПРИМЕР 24
В этом Примере дается описание способов оценки влияния антитела анти-MASP-2 на лизис красных кровяных клеток из образцов крови, полученные от пациентов с пароксизмальной ночной гемоглобинурией (PNH).
Предпосылки/обоснование
Пароксизмальная ночная гемоглобинурия (PNH), также известный как синдром Маркиафава-Микели, представляет собой приобретенное, потенциально опасное для жизни заболевание крови, характеризующееся комплемент-индуцированной внутрисосудистой гемолитической анемией. Отличительной чертой PNH является хронический внутрисосудистый гемолиз, который является следствием нерегулируемой активации альтернативного пути комплемента, Lindorfеr, М.А., et al., Blood 115(11) (2010). Анемия при PNH возникает из-за разрушения красных кровяных клеток крови. Симптомы PNH включают покраснение мочи, из-за появления гемоглобина в моче, и тромбоз. PNH может развиваться самостоятельно, так называемый «первичной PNH», или в контексте других расстройств костного мозга, таких как апластическая анемия, так называемый «вторичный PNH». Лечение PNH включает переливание крови при анемии, антикоагулянтную терапию при тромбозах и использование моноклонального антитела экулизумаб (Soliris), которое защищает клетки крови против иммунного разрушения путем ингибирования системы комплемента (Hillmen P. et al., N. Engl. J. Med. 350(6): 552-9 (2004)). Однако, значительная часть PNH-пациентов, получавших экулизумаб, остается с клинически значимой аутоиммунной гемолитической анемией, потому что антитело не блокирует активацию альтернативного пути комплемента.
В этом Примере дается описание способов оценки влияния антитела анти-MASP-2 на лизис красных кровяных клеток в образцах крови, полученных от PNH-больных (не получавших Soliris), которые инкубируют с АВО-соответствующей подкисленной нормальной сывороткой человека.
Способы:
Реагенты:
Эритроциты от здоровых доноров и от пациентов, страдающих PNH (не получавших Soliris), получают способом венепункции, и подготавливают, как описано в Wilcox, L.A., et al, Blood 75:820-829 (1991), включенном в настоящий документ посредством ссылки. Антитела анти -MASP-2 с функциональной блокирующей активностью лектинового пути, могут быть созданы, как описано в Примере 10.
Анализ гемолиза:
Способ определения эффекта антител анти-MASP-2 на способность блокировать гемолиз эритроцитов от PNH-больных осуществляется с использованием способов, описанных в Lindorfer, M.A., et al., Blood 15(11):2283-91 (2010) и Wilcox, L.A., et al., Blood 78:820-829 (1991), обе ссылки включены в настоящий документ посредством ссылки. Как описано в Lindorfer et al., эритроциты из образцов PNH -пациентов центрифугировали, лейкоцитарную пленку аспирировали и клетки промывали в желатиновом верональном буфере (CFP) перед каждым экспериментом. Эритроциты тестируют на предрасположенность к APC-опосредованному лизису следующим образом. АВО-соответствующую нормальную сыворотку человека разбавляют GVB, содержащим 0,15 мМ CaCl2 и 0,5 мМ MgCl2 (GVB+2) и обрабатывают кислотой до pH 6,4 (подкисленной NHS, aNHS) и используют для восстановления эритроцитов до гематокрита 1,6% в 50% aNHS. Смеси затем инкубируют при 37°С, и через 1 час эритроциты осаждают путем центрифугирования. Оптическую плотность аликвоты восстановленного отстоявшегося слоя жидкости измеряют при 405 нм и используют для расчета процента лизиса. Образцы, восстановленные в подкисленной сыворотке крови-ЭДТК, обрабатываются аналогично и используются для определения фона некомплемент-опосредованного лизиса (как правило, менее 3%). Полный лизис (100%) определяется после инкубации эритроцитов в дистиллированной воде.
Для того, чтобы определить влияние антител анти-MASP-2 на гемолиз PNH-эритроцитов, эритроциты от PNH-пациентов инкубируют в aNHS в присутствии добавочной концентрации антител анти-MASP-2, и наличие/количество гемолиза впоследствии количественно определяется.
Ввиду того, что антитела анти-MASP-2, как было показано, блокируют дальнейшую активизацию альтернативного пути комплемента, ожидается, что антитела анти-MASP-2 будут эффективно блокировать альтернативный путь-опосредованный гемолиз PNH-эритроцитов, и будет полезен в качестве терапевтического препарата для лечения пациентов, страдающих от PNH.
ПРИМЕР 25
В этом Примере дается описание способов оценки влияния блокирующих антител анти-MASP-2 на активацию комплемента при помощи криоглобулинов образцов крови, полученных от пациентов, страдающих криоглобулинемией.
Предпосылки/обоснование:
Криоглобулинемия характеризуется наличием криоглобулинов в сыворотке крови. Криоглобулины представляют собой одиночные или смешанные иммуноглобулины (обычно IgM-антитела), которые подвергаются обратимой агрегации при низких температурах. Агрегация приводит к классическому пути активации комплемента и воспалению в сосудистом русле, особенно на периферии. Клинические проявления криоглобулинемии включают васкулит и гломерулонефрит.
Криоглобулинемия может быть классифицирована следующим образом на основе композиции криоглобулинов: криоглобулинемия Типа I, или простая криоглобулинемия, является результатом моноклонального иммуноглобулина, как правило, иммуноглобулина М (IgM); криоглобулинемия Типов II и III (смешанная криоглобулинемия) содержит ревматоидные факторы (RF), которые обычно представляют собой IgM в комплексах с Fc-частью поликлонального IgG.
Состояния, связанные с криоглобулинемией, включают инфекцию гепатита С, лимфопролиферативные расстройства и другие аутоиммунные заболевания. Криоглобулин-содержащие иммунные комплексы приводят к клиническому синдрому системного воспаления, возможно, из-за их способности к активации комплемента. Несмотря на то, что IgG-иммунные комплексы, как правило, активируют классический путь комплемента, IgM-содержащие комплексы могут также активировать комплемент через лектиновый путь (Zhang, M. et al., Mol Immunol 44(1-3): 103-110 (2007) и Zhang. M., et al., J. Immunol. 777(7):4727-34 (2006)).
Иммуногистохимические исследования также продемонстрировали, что криоглобулиновые иммунные комплексы содержат компоненты лектинового пути, и биопсии от пациентов с криоглобулинемическим гломерулонефритом продемонстрировали иммуногистохимические доказательства активации лектинового пути in situ (Ohsawa, I. еt al., Clin Immunol 101(1):59-66 (2001)). Эти результаты позволяют предположить, что лектиновый путь может способствовать воспалению и неблагоприятным исходам при криоглобулинемических заболеваниях.
Способы:
Способ определения эффекта антител анти-MASP-2 на способность блокировать нежелательные эффекты криоглобулинемии проводится с помощью анализа C3-преобразования в жидкой фазе, как описано в Ng Y.C. et al., Arthritis and Rheumatism 31(l):99- 107 (1988), включенными в настоящий документ посредством ссылки. Как описано в Ng et al., в существенной смешанной криоглобулинемии (EMC), моноклональный ревматоидный фактор (mRF), как правило, IgM, образует комплекс с поликлональным IgG с образованием характерных криопреципитатных иммунных комплексов (IC) (криоглобул типа II). Иммуноглобулины и C3 были продемонстрированы в стенках сосудов в пораженных тканях, таких как кожная, нервная и почечная. Как описано в Ng et al.,125-I-меченый mRF добавляют к сыворотке (нормальной человеческой сыворотке крови и сыворотки крови, полученной от больных, страдающих криоглобулинемией), инкубировали при 37°С и измеряли связывание с эритроцитами.
Жидкофазное C3-преобразование определяется в сыворотке крови (нормальной человеческой сыворотке крови и сыворотке крови, полученной от больных, страдающих криоглобулинемией) в присутствии или отсутствие следующих IC: BSA-анти BSA, mRF, mRF плюс IgG, или криоглобулинов, в присутствие или отсутствие антител анти-MASP-2. Фиксация C3 и C4 с IC измеряют с помощью копреципитационного анализа с F(ab')2 анти-C3 и F(ab')2 анти-C4.
В виду того, что антитела анти-MASP-2, как было показано, блокируют активацию лектинового пути, ожидается, что антитела анти-MASP-2 будут эффективно блокировать опосредованные комплементом неблагоприятные последствия, связанные с криоглобулинемией, и будут полезны в качестве терапевтического препарата для лечения пациентов, страдающих от криоглобулинемии.
ПРИМЕР 26
В этом Примере дается описание способов оценки влияния антитела анти-MASP-2 на образцы крови, полученные от пациентов с синдромом холодовой агглютинации, который проявляется в виде анемии.
Предпосылки/обоснование:
Синдром холодовой агглютинации (CAD) представляет собой тип аутоиммунной гемолитической анемии. Антитела холодовой агглютинации (как правило, IgM) активируются низкими температурами и связываются с агрегатами красных кровяных клеток. Антитела холодовой агглютинации объединяются с комплементом и атакуют антиген на поверхности красных кровяных клеток. Это приводит к опсонизации эритроцитов (гемолиз), которая вызывает их клиренс при помощи ретикулоэндотелиальной системы. Температура, при которой происходит агглютинация, варьируется от пациента к пациенту.
CAD проявляется как анемия. Когда скорость разрушения красных кровяных клеток превышает способность костного мозга вырабатывать достаточное количество кислород-переносящих клеток, то возникает анемия. CAD может быть вызвана основным заболеванием или расстройством, так называемое «Вторичный CAD», таким как инфекционное заболевание (микоплазменная пневмония, эпидемический паротит, мононуклеоз), лимфопролиферативное заболевание (лимфома, хронический лимфоцитарный лейкоз) или расстройство соединительной ткани. Больные с первичным CAD, как считается, имеют слабо выраженное лимфопролиферативное расстройство костного мозга. Как первичный, так и вторичный CAD являются приобретенными состояниями.
Способы:
Реагенты:
Эритроциты от здоровых доноров и пациентов, страдающих CAD, получали при помощи венепункции. Антитела анти-MASP-2 с функциональной блокирующей активностью лектинового пути, могут быть созданы, как описано в Примере 10.
Эффект антител анти-MASP-2 на блокирование холодовой агглютинин-опосредованной активации лектинового пути можно определить следующим образом. Эритроциты крови положительных пациентов первой группы сенсибилизировали холодовыми агглютининами (т.е., антителами IgM), в присутствие или отсутствие антител анти-MASP-2. Эритроциты затем проверяются на возможность активировать лектинового пути при помощи измерения C3-связывания.
В виду того, что антитела анти-MASP-2, как было показано, блокируют активацию лектинового пути, ожидается, что антитела анти-MASP-2 будут эффективно блокировать опосредованные комплементом неблагоприятные последствия, связанные с синдромом холодовой агглютинации, и будут полезны в качестве терапевтического препарата для лечения пациентов, страдающих синдрома холодовой агглютинации.
ПРИМЕР 27
В этом Примере дается описание способов оценки влияния антитела анти-MASP-2 на лизис красных кровяных клеток в образцах крови, полученных от мышей с атипичным гемолитическим уремическим синдромом (aHUS).
Предпосылки/обоснование:
Атипичный гемолитический уремический синдром (aHUS) характеризуется гемолитической анемией, тромбоцитопенией и почечной недостаточностью, вызванной тромбоцитными тромбами в микроциркуляции почек и других органов. aHUS связан с нарушением регуляции комплемента и может быть либо спорадическим, или наследственным. aHUS связан с мутациями в генах, ответственных за активацию комплемента, в том числе фактор Н комплемента, мембранный кофактор B и фактор I, а также фактор H комплемента-родственный белок 1 (CFHR1) и фактор H комплемента-родственный белок 3 (CFHR3). Zipfel, P.F., et al, PloS Genetics 3(3):e41 (2007). В этом Примере дается описание способов оценки влияния антитела анти-MASP-2 на лизис красных кровяных клеток из образцов крови, полученных от aHUS-мышей.
Способы:
Эффект антител анти-MASP-2 на лечение aHUS можно определить в мышиной модели этого заболевания, в которой эндогенный ген fH мыши был заменен на гомолог человека, кодирующий мутантную форму fH, часто встречающуюся у aHUS-пациентов. Смотри Pickering M.C. et al., J. Exp. Med. 204(6): 1249-1256 (2007), включенную в настоящий документ посредством ссылки. Как описано в Pickering et al., такие мыши проявляют aHUS-подобную патологию. Для того, чтобы оценить эффект антитела анти-MASP-2 для лечения aHUS, антитела анти-MASP-2 вводят мутантным aHUS-мышам, и сравнивают лизис красных кровяных клеток, полученные от мышей, получавших ab анти-MASP-2, и от неполучавших контролей. В виду того, что антитела анти-MASP-2, как было показано, блокируют активацию лектинового пути, ожидается, что антитела анти-MASP-2 будет эффективно блокировать лизис красных кровяных клеток у субъектов-млекопитающих, страдающих aHUS.
ПРИМЕР 28
В этом Примере дается описание способов оценки влияния анти-MASP-2 антитела для лечения глаукомы.
Предпосылки/обоснование:
Было показано, что неконтролируемая активация комплемента способствует прогрессированию дегенеративного повреждения ганглиозных клеток сетчатки (RGC), их синапсов и аксонов в глаукоме. Смотри Tezel G. et al., Invest Ophthalmol Vis Sci 57:5071-5082 (2010). Например, гистопатологические исследования человеческих тканей и исследования in vivo с использованием различных моделей на животных показали, что компоненты комплемента, в том числе C1q и C3, синтезируются и терминальный комплекс комплемента формируется в глаукоматозной сетчатке (см. Stasi K. et al., Invest Ophthalmol Vis Sci 47: 1024-1029 (2006), Kuehn M.H. et al., Exp Eye Res 83:620-628 (2006)). Как более подробно описано в Kuehn M.H. et al., Experimental Eye Research 87:89-95 (2008), синтез комплемента и депозиция индуцируется ретинальным I/R, и нарушение каскада комплемента задерживает RGC-дегенерацию. В этом исследовании мыши, несущие направленное нарушение компонента С3 комплемента, как было обнаружено, проявляют задержку RGC-дегенерации после транзиентного ретинального I/R, по сравнению с нормальными животными.
Способы:
Способ определения эффекта антитела анти - ASP-2 на RGC-дегенерацию осуществляется в животной модели ретинальным I/R, как описано в Kuehn M.H. et al., Experimental Eye Research 57:89-95 (2008), включенной в настоящий документ посредством ссылки. Как описано в Kuehn et al., ретинальная ишемия индуцируется анестезированием животных, затем вставкой иглы 30-го размера, соединенной с емкостью, содержащей буферизованный фосфатом солевой раствор, через роговицу в переднюю камеру глаза. Сосуд с физраствором затем поднимают, чтобы получить внутриглазное давление 104 мм.рт.ст, достаточное, чтобы полностью предотвратить циркуляцию через сосудистую систему сетчатки. Повышенная внутриглазная ишемия подтверждается побледнением радужной оболочки и сетчатки глаза, и ишемию поддерживают в течение 45 минут в левом глазе только, правый глаз служит в качестве контроля и не принимает катетеризации. Мышей потом усыпляют, либо через 1 или 3 недели после ишемического инсульта. Антитела анти-MASP-2 вводят мышам либо локально в глаз, или системно для оценки эффекта антитела анти-MASP, введенного до ишемического инсульта.
Иммуногистохимия глаз осуществляется с использованием антител против qCl и C3, чтобы детектировать депозицию комплемента. Повреждение оптического нерва также можно оценить, используя стандартные способы электронной микроскопии. Определение количества сохранившихся ретинальных RGC осуществляется с помощью мечения гамма-синкулеина.
Результаты:
Как описано в Kuehn et al., у нормальных контрольных мышей транзиентная ретинальная ишемия приводит к дегенеративным изменениям зрительного нерва и ретинальным депозициям C1q и C3, детектируемым иммуногистохимически. В отличие от этого, C3-дефектные мыши показали заметное снижение дегенерации аксонов, демонстрируя лишь незначительные уровни повреждения зрительного нерва через 1 неделю после индукции. Основываясь на этих результатах, ожидается, что аналогичные результаты можно было бы наблюдать, при проведении этого анализа в MASP-2-нокаутной мыши, и, когда антитела анти -MASP-2 вводят нормальной мыши до ишемического инсульта.
ПРИМЕР 29
Этот Пример демонстрирует, что MASP-2-ингибитор, такой как анти-MASP-2 антитело, является эффективным для лечения радиационного облучения и/или для лечения, улучшения или профилактика острого лучевого синдрома.
Обоснование:
Воздействие высоких доз ионизирующей радиации вызывает смертность при помощи двух основных механизмов: токсичность костного мозга и желудочно-кишечный синдром. Токсичность костного мозга приводит в результате к падению количества всех гематологических клеток, предрасполагая организм к смерти от инфекции и кровотечения. Желудочно-кишечный синдром является более тяжелым и направляется потерей барьерной функции кишечника вследствие распада эпителиального слоя кишечника и потери эндокринной функции кишечника. Это приводит к сепсису и связанному синдрому системного воспалительного ответа, который может привести к смерти.
Лектиновый путь комплемента представляет собой врожденный иммунный механизм, который инициирует воспаление в ответ на повреждение тканей, травмы и воздействия на внешние поверхности (т.е., бактерии). Блокада этого пути приводит к улучшению показателей в мышиных моделях ишемического повреждения ткани кишечника или септического шока. Было высказано предположение, что лектиновый путь может вызвать чрезмерное и вредное воспаление в ответ на радиационно-индуцированное повреждение тканей. Блокада лектинового пути, таким образом, может уменьшить вторичное повреждение и увеличить выживаемость при остром радиационном облучении.
Целью исследования, проведенного, как описано, в этом Примере было оценить влияние блокады лектинового пути на выживание в мышиной модели радиационного поражения путем введения антитела против MASP-2 мыши.
Способы и материалы:
Материалы. Тестируемые продукты, которые использовались в этом исследовании, представляли собой (i) высокоаффинное антитело против MASP-2 мыши (mAbM11) и (ii) высокоаффинное антитело против MASP-2 человека (mAbH6), которые блокируют MASP-2-белковый компонент лектинового пути комплемента, которые были произведены в трансфицированных клетках млекопитающих. Дозовые концентрации составляли 1 мг/кг антитела против MASP-2 мыши (mAbM11), 5мг/кг антитела против MASP-2 человека (mAbH6) или стерильный физиологический раствор. Для каждого сессии дозирования, были подготовлены адекватные объемы свежего раствора для дозирования.
Животные. Молодые взрослые самцы мышей Swiss-Webster были получены от Harlan Laboratories (Хьюстон, Техас). Животные находились в твердодонных клетках с подстилкой Alpha-Dri, и им предоставлялись сертифицированный рацион для грызунов PM1 5002 (Animal Specialties, Inc., Hubbard OR) и вода в неограниченном количестве. Температуру контролировали, и в комнате содержания животных поддерживали цикл освещения: 12 часов - свет/12 часов - ночной свет.
Облучение. После 2-недельной акклиматизации в лаборатории, мышей облучали 6,5 и 7,0 Гр путем облучения всего тела в группах по 10 в дозировке 0.78 Гр/мин с помощью системы TherapaxX-RAD 320, оснащенной 320 кВ высокостабильным рентгеновским генератором, металлокерамической рентгеновской трубкой, коллиматором переменного пучка рентгеновского излучения и фильтром (Precision X-ray Incorporated, East Haven, CT). Дозовые уровни были подобраны на основании предварительных исследований, проведенных с одним и тем же штаммом мышей с указанием, что LD50/30 было между 6,5 и 7,0 Гр (данные не приведены).
Составление препарата и введение. Соответствующий объем концентрированного стокового раствора был разбавлен физиологическим раствором изо льда для подготовки дозирующих растворов 0,2 мг/мл антитела против MASP-2 мыши (mAbM11) или 0,5 мг/мл антитела против MASP-2 человека (mAbH6) в соответствии с протоколом. Введение антитела анти-MASP-2 mAbM11 и mAbH6 производили посредством IP-инъекции с помощью иглы 25-го размера, исходя из массы животного, чтобы доставить 1 мг/кг mAbM11, 5 мг/кг mAbH6 или солевой носитель.
Схема исследования. Мыши были случайным образом распределены в группы, как указано в Таблице 8. Массу тела и температуру измеряли и регистрировали ежедневно. Мыши в Группах 7, 11 и 13 были умерщвлены на 7 день после облучения, и кровь собирали при помощи сердечной пункции под глубоким наркозом. Выжившие животные на 30 день после облучения были умерщвлены таким же образом, и кровь собирали. Плазму подготавливали из собранных образцов крови в соответствии с протоколом и возвращали спонсору для анализа.
Статистический анализ. Кривые выживания Kaplan-Meier были построены и использованы для сравнения среднего времени выживания между группами лечения, используя способы log-Rank и Вилкоксона. Средние со стандартными отклонениями, или средние со стандартной ошибкой среднего представлены. Статистические сравнения были сделаны с помощью двусторонний непарного t-теста между контрольными облученными животными и отдельными лечебными группами.
Результаты
Графики выживания Kaplan-Meier для групп с экспозициями 7,0 и 6,5 Гр предоставлены на ФИГУРАХ 32A и 32В, соответственно, и обобщены ниже в Таблице 9. В целом лечение антителом против MASP-2 мыши (mAbM11) перед облучением увеличивало выживаемость облученных мышей, по сравнению с облученными контрольными животными, получавшими наполнитель, при уровнях экспозиции как в 6,5 (20% прироста), так и в 7,0 Гр (прирост на 30%). При уровне экспозиции 6,5 Гр, лечение после облучения антителом против MASP-2 мыши приводило к незначительному росту выживания (15%) по сравнению с контрольными облученными животными, получавшими наполнитель.
В сравнении, все получавшие лечение животные с уровнем экспозиции 7,0 Гр излучения показали повышение выживаемости по сравнению с облученными контрольными животными, получавшими наполнитель. Наибольшие изменения в выживания произошло у животных, получающих mAbH6, с 45%-ым увеличением, по сравнению с контрольными животными. Кроме того, при уровне экспозиции 7,0 Гр, смертельные исходы в mAbH6-получающей группе впервые произошли на 15 день после облучения, по сравнению с 8 днем после облучения для облученных контрольных животных, получавшими наполнитель, увеличившись на 7 дней по сравнению с контрольными животными. Среднее время смертности для мышей, получавших mAbH6 (27,3±1,3 дней) была значительно увеличена (р=0,0087) по сравнению с контрольными животными (20,7±2,0 дней) при уровне экспозиции 7,0 Гр.
Процентное изменение массы тела по сравнению с массой в день перед облучением (день -1) регистрировали в течение всего исследования. Транзиентная потеря массы происходила у всех облученных животных, с отсутствием свидетельств дифференциальных изменений из-за лечения mAbM11 или mAbH6, по сравнению с контрольной группой (данные не приведены). В окончания исследования, все выжившие животные показали увеличение массы тела, по сравнению с начальной массой тела (в день -1).
Обсуждение
Острый лучевой синдром состоит из трех определенных подсидромов: гемопоэтического, гастроинтестинального и цереброваскулярного. Наблюдаемый синдром зависит от дозы облучения, с гемопоэтическими эффектами, наблюдаемыми у людей со значительными радиационным облучением части или всего тела, превышающем 1 Гр. Гемопоэтический синдром характеризуется сильным подавлением функции костного мозга, приводящим к панцитопении с изменениями в формуле крови, красных и белых кровяных тельцах и тромбоцитах, происходящими одновременно с повреждением иммунной системы. При наступлении надира, с несколькими нейтрофилами и тромбоцитами, присутствующими в периферической крови, нейтропения, лихорадка, септические осложнения и неконтролируемое кровотечение приводят к смерти.
В настоящем исследовании, введение mAbH6, как было обнаружено, увеличивает выживаемость при рентгеновском облучении всего организма самцов мышей Swiss-Webster, облученных в 7,0 Гр. Примечательно, что при уровне экспозиции 7,0 Гр 80% животных, получавших mAbH6, дожили до 30 дней, по сравнению с 35% для контрольных облученных животных, получавших наполнитель. Важно, что первый день смерти в этой группе, получавшей лечение, не наступал до 15-го дня после облучения, 7-дневный рост по сравнению с таковым, который наблюдается для контрольных облученных животных, получавших наполнитель. Любопытно, что при пониженном рентгеновском облучении (6,5 Гр), введение mAbH6, по всей видимости, не влияет на выживаемость или задержку смертности, по сравнению контрольными облученными животными, получавшими наполнитель. Может существовать несколько причин этой разницы в реакции между уровнями воздействия, хотя для проверки любой гипотезы могут потребоваться дополнительные исследования, в том числе промежуточный сбор проб на микробиологические культуры и гематологические показатели. Одним из объяснений может быть просто то, что число животных, отнесенных к группам, может нарушаться в связи с какими-либо тонкими отличиями, связанными с лечением. Например, при размерах групп n=20, разница в выживаемости между 65% (mAbH6 при экспозиции 6,5 Гр) и 80% (mAbH6 при экспозиции 7,0 Гр) составляет 3 животных. С другой стороны, разница между 35% (контроль с носителем при уровне экспозиции 7,0 Гр) и 80% (mAbH6 при экспозиции 7,0 Гр) составляет 9 животных, и предоставляет обоснованное доказательство отличия, связанного с лечением.
Эти результаты показывают, что антитела анти-MASP-2 являются эффективными в лечении субъектов-млекопитающих, подверженных риску или страдающего от вредного воздействия острого лучевого синдрома.
ПРИМЕР 30
Этот Пример показывает, что MASP-2 дефектные мыши защищены от смертности, индуцированной Neisseria meningitides, после заражения либо N. meningitidis серогруппы A, или Neisseria meningitidis серогруппы В.
Способы:
MASP-2-нокаутные мыши (мыши MASP-2 КО) были созданы, как описано в Примере 1. 10 недельные мыши MASP-2 КО (n=10) и мыши дикого типа (WT) C57/BL6 (n=10) были инокулированы путем внутрибрюшинной (i.p.) инъекции дозы 2,6×107 кое Neisseria meningitidis серогруппы А Z2491 в объеме 100 мкл. Инфицирующие дозы вводили мышам в сочетании с декстраном железа с конечной концентрацией 400 мг/кг. Выживаемость мышей после инфицирования контролировали в течение 72-часового периода времени.
В отдельном эксперименте, 10 недельные мыши MASP-2 КО (n=10) и мыши дикого типа (WT) C57/BL6 (n=10) были инокулированы путем внутрибрюшинной (i.p.) инъекции дозы 6×106 кое Neisseria meningitidis серогруппы B штамма MC58 в объеме 100 мкл. Инфицирующие дозы вводили мышам в сочетании с декстраном железа с конечной концентрацией 400 мг/кг. Выживаемость мышей после инфицирования контролировали в течение 72-часового периода времени. Балльную оценку заболевания также определяли для мышей WT и MASP-2 КO в течение 72-часового периода времени после инфицирования, на основе оценочных параметров заболевания, приведенных ниже в ТАБЛИЦЕ 10, которая основывается на схеме Fransen et al., (2010), но с небольшими изменениями.
Брали пробы крови от мышей с интервалами в 1 час после заражения и анализировали для определения уровня в сыворотке крови (log кое/мл) N. meningitidis, чтобы проверить инфекции и определить скорость оформления бактерий из сыворотки.
Результаты:
ФИГУРА 33 представляет собой график Каплана-Мейера, графически иллюстрирующий процент выживания мышей MASP-2 КО и WT после введения инфицирующей дозы 2,6×107кое N. meningitidis серогруппы А Z2491. Как показано на ФИГУРЕ 33, 100% мышей MASP-2 КО выживали на протяжении 72 часов после заражения. В отличие от этого, только 80% WT-мышей (р=0,012) были еще живы через 24 часа после заражения, и только 50% WT-мышей были живы через 72 часа после заражения. Эти результаты показывают, что MASP-2 - дефектные мыши защищены от смертности, индуцированной N. meningitidis серогруппы А Z2491.
ФИГУРА 34 представляет собой график Каплана-Мейера, графически иллюстрирующий процент выживания мышей MASP-2 КО и WT после введения инфицирующей дозы 6×106 кое N. meningitidis серогруппы B штамма MC58. Как показано на ФИГУРЕ 34, 90% мышей MASP-2 KO выживали на протяжении 72 часов после заражения. В отличие от этого, только 20% WT-мышей (p=0,0022) были еще живы через 24 часов после заражения. Эти результаты показывают, что MASP-2-дефектные мыши защищены от смертности, индуцированной N. meningitidis серогруппы B штамма MC58.
ФИГУРА 35 графически иллюстрирует log кое/мл N. meningitidis серогруппы B штамма MC58, полученные в разные моменты времени из проб крови, взятых от МASP-2 нокаутных мышей и WT-мышей после i.p. инфецирования с 6×106 кое N. meningitidis серогруппы B штамм MC58 (n=3 в разные моменты времени, для обеих групп мышей). Результаты выражены как средние ± SEM. Как показано на ФИГУРЕ 35, у WT-мышей уровень N. meningitidis в крови достигал пика в примерно 6,0 log кое/мл через 24 часа после заражения и падал примерно до 4,0 log кое/мл через 36 часов после заражения. В отличие от этого, у мышей MASP-2 КО уровень N. meningitidis достигал пика в примерно 4,0 log кое/мл через 12 часов после заражения и падал примерно до 1,0 log кое/мл через 36 часов после заражения (символ «*» указывает p < 0,05; символ «**» указывает p=0,0043). Эти результаты показывают, что хотя мыши MASP-2 КО были заражены той же дозой N. meningitidis серогруппы B штамма MC58, что и WT-мыши, мыши MASP-2 КО имеют повышенное освобождение от бактериемии по сравнению с WT-мышами.
ФИГУРА 36 графически иллюстрирует среднюю балльную оценку заболевания мышей MASP-2 КО и WT через 3, 6, 12 и 24 часа после заражения 6×105 кое N. meningitidis серогруппы B штамма MC58. Как показано на ФИГУРЕ 36, MASP-2-дефектные мыши показали высокую устойчивость к инфекции, со значительно более низкой балльной оценки заболевания через 6 часов (символ «*» указывает p=0,0411), 12 часов (символ «**» указывает p=0,0049) и 24 часа (символ указывает p=0,0049) после заражения, по сравнению с WT-мышами. Результаты на ФИГУРЕ 36 выражены в виде среднего ± SEM.
В целом, результаты в этом Примере демонстрируют, что MASP-2-дефектные мыши защищены от смертности, индуцированной N. meningitides, после заражения либо N. meningitidis серогруппы A, или N. meningitidis серогруппы В.
ПРИМЕР 31
Этот Пример показывает, что введение антитела анти-MASP-2 после инфицирования N. meningitidis увеличивает выживаемость мышей, инфицированных N. meningitidis.
Предпосылки/обоснование:
Как описано в Примере 10, белок MASP-2 крысы был использован для панорамирования Fab-библиотеки фагового дисплея, из которой Fab2 # 11 был идентифицирован как функционально активное антитело. Полноразмерные антитела изотипов IgG2c крысы и IgG2а мыши были генерированы из Fab2 # 11. Полноразмерное антитело анти - ASP-2 изотипа IgG2a мыши было охарактеризовано по фармакодинамическим параметрам (как описано в Примере 19).
В этом Примере мышиное полноразмерное антитело анти-MASP-2, полученное из Fab2 # 11, анализировали в мышиной модели инфекции N. meningitides.
Способы:
Изотип IgG2a мышиного полноразмерного антитела анти-MASP-2, полученный из Fab2 #11, созданный, как описано выше, анализировали в мышиной модели инфекции N. meningitides следующим образом.
Введение мышиных моноклональных антител анти-MASP-2 (MoAb) после инфицирования
9-недельные мыши Charles River C57/BL6 получали ингибирующее мышиное антитело анти-MASP-2 (1,0 мг/кг) (n=l2) или контрольное изотипическое антитело (n=10) через 3 ч после i.p. инъекции высокой дозы (4×106 кое) N. meningitidis серогруппы B штамма MC58.
Результаты:
ФИГУРА 37 представляет собой график Каплана-Мейера, графически иллюстрирующий процент выживаемости мышей после введения инфицирующей дозы 4×106 кое N. meningitidis серогруппы B штамма MC58, с последующим введением через 3 часа после заражения либо ингибирующего антитела анти-MASP-2 (1,0 мг/кг) или контрольного изотипического антитела. Как показано на ФИГУРЕ 37, 90% мышей, получавших антитело анти-MASP-2, выживали на протяжении 72 часов после заражения. В отличие от этого, только 50% мышей, получавших контрольное изотипическое антитело, выживали на протяжении 72 часов после заражения. Символ «*» указывает p-0,0301, как определено путем сравнения двух кривых выживания.
Эти результаты свидетельствуют о том, что введение антитела анти-MASP-2 является эффективным для лечения и улучшения выживания субъектов, инфицированных N. meningitidis.
Как показано в настоящем документе, использование антитела анти-MASP-2 при лечении субъекта, инфицированного N. meningitides, эффективно при введении внутрь в течение 3 часов после инфицирования, и, как ожидается, будет действовать в течение от 24 часов до 48 часов после заражения. Менингококковое заболевание (либо менингококкемия, или менингит) требует неотложной медицинской помощи, и терапии, как правило, должна начинаться немедленно, если есть подозрение на менингококковую инфекцию (т.е., до того, как N. meningitidis положительно определены в качестве этиологического агента).
В свете результатов на мышах MASP-2 КO, продемонстрированных в ПРИМЕРЕ 30, считается, что введение антитела анти-MASP-2 до заражения N. meningitidis также будет эффективным для предотвращения или смягчения тяжести инфекции.
ПРИМЕР 32
Этот Пример показывает, что введение антитела анти-MASP-2 является эффективным для лечения инфекции N. meningitidis в сыворотке крови человека.
Обоснование:
Больным со сниженными сывороточными уровнями функциональных MBL проявляли повышенную восприимчивость к рецидивирующим бактериальным и грибковым инфекциям (Kilpatrick et al., Biochim Biophys Acta 1572:401-413 (2002)). Известно, что N. meningitidis узнается MBL, и показано, что MBL-недостаточная сыворотка не лизирует Neisseria.
Учитывая результаты, описанные в Примерах 30 и 31, была проведена серия экспериментов с целью определения эффективности введения антитела анти-MASP-2 для лечения инфекции N. meningitidis в комплемент-дефектной и контрольной сыворотке человека.
Эксперименты проводили при высокой концентрации сыворотки (20%) в целях сохранения пути комплемента.
Способы:
1. Сывороточная бактериоцидная активность в различных комплемент-дефектных сыворотках человека и в сыворотках человека, обработанных человеческим антителом анти-MASP-2
Следующие комплемент-дефектные сыворотки человека и контрольные сыворотки человека были использованы в этом эксперименте:
Рекомбинантное антитело против MASP-2 человека было изолировано из комбинаторной библиотеки антител (Knappik, А., et al., J. Mol Biol. 296:57-86 (2000)), с использованием рекомбинантного MASP-2A человека в качестве антигена (Chen, C.B. and Wallis, J. Biol. Chem. 276:25894-25902 (2001)). Анти-человеческий scFv-фрагмент, который эффективно подавлял лектиновый путь-опосредованную активацию С4 и С3 в плазме человека (IC50 около 20 нМ), был идентифицирован и преобразован в полноразмерное антитело IgG4 человека.
N. meningitidis серогруппы B-MC58 инкубировали с разными сыворотками, представленными в ТАБЛИЦЕ 11, каждая концентрацией сыворотки 20%, с добавлением или без добавлением ингибирующего антитела анти-MASP-2 человека (3 мкг в 100 мкл общего объема) при 37°C со встряхиванием. Пробы были взяты в следующие моменты времени: 0-, 30-, 60 - и 90-минутные интервалы, высевались, и затем было определено количество жизнеспособных. Инактивированная нагреванием сыворотка человека была использована в качестве отрицательного контроля.
Результаты:
ФИГУРА 38 графически иллюстрирует log кое/мл жизнеспособных cчетов N. meningitidis серогруппы B-MC58, полученных в разные моменты времени в образцах сыворотки человека, как показано в ТАБЛИЦЕ 11. В ТАБЛИЦЕ 12 представлены результаты t-критерия Стьюдента для ФИГУРЫ 38.
Как показано на ФИГУРЕ 38 и в ТАБЛИЦЕ 12, комплемент-зависимое уничтожение N. meningitidis в 20%-ой сыворотке человека было значительно усилено за счет добавления ингибиторного антитела анти-MASP-2 человека.
2. Комплемент-зависимое уничтожение N. meningitidis в 20%-ой (об/об) сыворотке мыши, дефектной по MASP-2.
Следующие комплемент-дефектные сыворотки мыши и контрольные сыворотки мыши были использованы в этом эксперименте:
N. meningitides серогруппы B -МC58 инкубировали с различными комплемент-дефектными сыворотками мыши, каждая с концентрацией сыворотки крови 20%, при 37°С со встряхиванием. Пробы были взяты в следующие моменты времени: 0-, 30-, 60- и 90-минутные интервалы, высевались, и затем было определено количество жизнеспособных. Инактивированная нагреванием сыворотка человека была использована в качестве отрицательного контроля.
Результаты:
ФИГУРА 39 графически иллюстрирует log кое/мл жизнеспособных cчетов N. meningitidis серогруппы B-MC58, полученных в разные моменты времени в образцах мышиной сыворотки, показанных в ТАБЛИЦЕ 13. Как показано на ФИГУРЕ 39, сыворотка мыши MASP-2 -/- имеют более высокий уровень бактерицидной активности против N. meningitidis, чем сыворотка WT-мыши. Cимвол «**» указывает p-0,0058, символ «***» указывает p=0,001. ТАБЛИЦА 14 предоставляет результаты t-критерия Стьюдента на ФИГУРЕ 39.
В целом, результаты в этом Примере демонстрируют, что сыворотка MASP-2 -/- имеет более высокий уровень бактерицидной активности против N. meningitidis, чем WT-сыворотка.
ПРИМЕР 33
Этот Пример демонстрирует ингибирующий эффект MASP-2-недостаточности на лизис красных кровяных клеток из образцы крови, полученных из мышиной модели пароксизмальной ночной гемоглобинурии (PNH).
Предпосылки/обоснование
Пароксизмальная ночная гемоглобинурия (PNH), также известная как синдром Маркиафава-Микели, представляет собой приобретенное, потенциально угрожающее жизни заболевание крови, характеризующееся комплемент-индуцированной внутрисосудистой гемолитической анемией. Отличительной чертой PNH является хронической комплемент-опосредованной внутрисосудистый гемолиз, который является следствием неурегулированности активации альтернативного путь комплемента из-за отсутствия регуляторов комплемента CD55 и CD59 на PNH-эритроцитах, с последующей гемоглобинурией и анемией. Lindorfer, M.A., et al., Blood 115(11) (2010), Risitano, A.M, Mini-Reviews in Medicinal Chemistry, 11:528-535 (2011). Анемия при PNH происходит из-за разрушения красных кровяных клеток крови. Симптомы PNH включают покраснение мочи, из-за появления гемоглобина в моче, боль в спине, усталость, одышку и тромбоз. PNH может развиваться самостоятельно, так называемая «первичная PNH», или в контексте других расстройств костного мозга, таких как апластическая анемия, так называемая «вторичная PNH». Лечение PNH включает переливания крови при анемии, антикоагулянтную терапию при тромбозах и использование моноклонального антитела экулизумаб (Soliris®), которое защищает клетки крови от иммунного разрушения путем ингибирования системы комплемента (Hillmen P. et al., N. Engl, J. Med. 350(6) 552-9 (2004)). Экулизумаб (Soliris®) представляет собой гуманизированные моноклональные антитело, которое направлено на компонент C5 системы комплемента, блокируя его расщепление C5-конвертазами, тем самым, предотвращения производство С5а и сборку MAC. Лечение PNH-пациентов экулизумабом привело к уменьшению внутрисосудистого гемолиза, как измеряется по лактатдегидрогеназе (LDH), приводя к стабилизации гемоглобина и независимости от переливания примерно у половины больных (Hillmen P. et al., N. Engl, J. Med. 350(6) 552-9 (2004)). В то время как почти у всех пациентов, проходящих терапию с экулизумабом, достигаются нормальные или почти нормальные уровни LDH (из-за контроля внутрисосудистого гемолиза), лишь у около одной трети пациентов достигается уровень гемоглобина выше 11 г/дл, а остальные больные на экулизумабе продолжают демонстрировать умеренную и тяжелую (т.е., зависящую от переливаний крови) анемию, примерно в равной пропорции (Risitano A.M. et al., Blood 113:4094-100 (2009)). Как описано в Risitano et al, Mini- Reviews in Medicinal Chemistry 11:528-535 (2011), было показано, что PNH-пациенты на экулизумабе содержали C3- фрагменты, связанные со значительной частью своих PNH-эритроцитов (хотя в случае неполучавших пациентов связывания не было), что приводит к выводу, что связанные с мембраной C3-фрагменты работают как опсонины на PNH-эритроцитах, что приводит к их захвату в ретикулоэндотелиальных клетках через специфические C3-рецепторы и последующий экстравазальный гемолиз. Таким образом, терапевтические стратегии в дополнение к использованию экулизумаба необходимы для тех пациентов, у которых развивается C3 фрагмент-опосредованный экстравазальный гемолиз, поскольку они по-прежнему нуждаются в переливаниях эритроцитарных клеток.
Этот Пример описывает способы оценки эффекта MASP-2 - дефектной сыворотки и сыворотки от получавших MASP-2-ингибирующий агент на лизис красных кровяных клеток образцов крови, полученные из мышиной модели PNH, и демонстрирует эффективность MASP-2-ингибирования при лечении субъектов, страдающих от PNH, а также поддерживает использование ингибиторов MASP-2 для смягчения последствий C3-фрагмент-опосредованного экстравазального гемолиза у PNH-субъектов, проходящих курс лечения C5-ингибитором, таким как экулизумаб.
Способы:
Модель PNH на животных:
Были собраны образцы крови, полученные от ген-направленных мышей с недостатками Crry и C3 (Crry/C3-/-) и CD55/CD59-дефектных мышей. У этих мышей отсутствуют соответствующие поверхностные регуляторы комплемента, и их эритроциты, следовательно, подвержены спонтанному комплементному автолизу, поскольку представляют собой клетки крови человека с PNH.
Для того чтобы даже больше сенсибилизировать эти эритроциты, эти клетки использовали с покрытием маннана и без него, а затем проверяли на гемолиз в WT-плазме C56/BL6, плазме MBL ноль, плазме MASP-2 -/-, NHS человека, плазме MBL-/- человека, и NHS после обработке антителом анти-MASP-2 человека.
1. Проверка мышиных эритроцитов с двойным дефектом Crry/C3 и CD55/CD59 на гемолиз в MASP-2-дефектных/обедненных сыворотках и контролях
День 1. Подготовка мышиных RBC (покрытие и непокрытие маннаном)
Включенные материалы: свежая кровь мыши, BBS/Mg2+/Ca2+ (4,4 мМ барбитуровой кислоты, 1,8 мМ барбитал натрия, 145 мМ NaCl, pH 7,4, 5 мМ Мg2+, 5мМ Ca2+), хлорид хрома, CrCl3·6H2O (0,5 мг/мл в BBS/Mg2+/Са2+) и маннан, 100 мкг/мл в BBS/Mg2+, Ca2+.
Цельную кровь (2 мл) откручивали в течение 1-2 минуты при 2000×g в охлажденной центрифуге при 4°C. Плазма и лейкоцитная пленка были аспирированы. Затем образец промывали три раза путем повторного ресуспендирования осадка RBC в 2 мл ледяного BBS/желатин/Mg2+/Са2+ и повторной стадия центрифугирования. После третьей промывки, осадок ресуспендировали в 4мл BBS/Mg2+/Са2+. 2 мл-аликвота RBC была отобрана в качестве контроля без покрытия. К оставшимся 2 мл добавляли 2 мл CrCl3 и 2 мл маннана, и пробы инкубировали с осторожным перемешиванием при комнатной температуре в течение 5 минут. Реакцию прекращали путем добавления 7,5 мл BBS/желатин/Mg2+/Са2++. Образец осаждали, как описано выше, ресуспендировали в 2 мл BBS/желатин/Mg2+/Са2+ и промывали еще два раза, как описано выше, а затем хранили при 4°C.
День 2. Анализ гемолиза
Материалы включали BBS/желатин/Mg2+/Са2+ (смотри выше), анализируемые сыворотки, 96-луночные планшеты с круглым дном и плоским дном и спектрофотометр, который считывает 96-луночные планшеты при 410-414 нм.
Сначала определяли концентрацию RBC, и клетки доводили до 109/мл и хранили при данной концентрации. Перед использованием, буфер для тестирования разбавляли до 108/мл, а затем использовали с 100 мкл на лунку. Гемолиз оценивали при 430-414 нм (принимая во внимание большую чувствительность, чем 541 нм). Разведения тестируемых сывороток были подготовлены в ледяном BBS/желатин/Mg2+/Са2+. 100 мкл каждого разбавления сыворотки отбирали пипеткой в планшет с круглодонными лунками (смотри план расположения в планшете). 100 мкл соответствующим образом разбавленного RBC-препарата добавляли (т.е., 108/мл) (смотри план расположения в планшете), инкубировали при 37°С в течение около 1 часа и наблюдали за лизисом. (Планшеты можно фотографировать в этой точке.) Планшеты затем откручивали на максимальной скорости в течение 5 минут. 100 мкл аспирировали из жидкой фазы, переносили в планшеты с плоским дном и записывали ОD при 410-414 нм. Осадки RBC сохраняли (они могут быть впоследствии лизированы в воде, чтобы получить обратный результат).
Эксперимент #1: Свежую кровь получали от дважды дефектных мышей CD55/CD59 и кровь от дважды дефектных мышей Crry/C3, и эритроцитов подготавливали, как это подробно описано выше в протоколе. Клетки были разделены, и половина клеток была покрыта маннаном, а другая половина остались необработанной, с доведением конечной концентрации до 1×108 /мл, из которых 100 мкл использовали в анализе гемолиза, который был проведен, как описано выше.
Результаты эксперимента #1: Лектиновый путь принимает участие в лизисе эритроцитов в животной модели PNH
В начальном эксперименте было установлено, что непокрытые эритроциты WT-мыши не лизировались в любой сыворотке мыши. Было также установлено, что покрытые маннаном эритроциты мыши Crry-/- медленно лизировались (более 3 часов при 37 градусов) в сыворотке крови WT-мыши, но они не лизировались в сыворотке MBL ноль. (Данные не приведены).
Было установлено, что покрытые маннаном эритроциты мыши Crry-/- быстро лизировались в сыворотке крови человека, но не в инактивированной теплом NHS. Важно, что покрытые маннаном эритроциты мыши Crry-/- лизировались в NHS, разбавленной до 1/640 (т.е., лизировались в каждом из разведений 1/40, 3/80, 1/160, 1/320 и 1/640). (Данные не приведены). В таком разведении, альтернативный путь не работает (Функциональная активность AP значительно снижается при концентрации сыворотки ниже 8%).
Заключение из эксперимента #1
Покрытые маннаном эритроциты мыши Crry-/- мыши хорошо лизировались в сильно разбавленной сыворотке крови человека с MBL, но не в таковой, не содержащей MBL. Эффективный лизис при каждой тестируемой концентрации сыворотке подразумевает, что альтернативный путь не участвует или не является необходимым для этого лизиса. Неспособность сыворотки MBL-дефектной мыши и сыворотки крови человека лизировать покрытые маннаном эритроциты мыши Crry-/- показывает, что классический путь также не имеет ничего общего с наблюдаемым лизисом. Поскольку необходимы узнающие молекулы лектинового пути (т.е., MBL), это лизис опосредуется лектиновым путем.
Эксперимент № 2:
Свежую кровь получали от дважды дефектных мышей Crry/C3 и CD55/CD59, и покрытые маннаном эритроциты мыши Crry-/- анализировали в тесте на гемолиз, как описано выше, в присутствии сыворотки крови человека: MBL ноль; WT; NHS, предварительно обработанные антителом анти-MASP-2 человека; и инактивированный прогреванием NHS в качестве контроля.
Результаты эксперимента #2: MASP-2-ингибиторы предотвращают лизис эритроцитов в животной модели РNH
С покрытыми маннаном эритроцитами мыши Crry-/- NHS инкубировали в разведениях вплоть до 1/640 (т.е., 1/40, 1/80, 1/160, 1/320 и 1/640) сыворотки MBL-/- человека, NHS, предварительно обработанного mAb анти-MASP-2 и инактивированного прогреванием NHS в качестве контроля.
Микротитровальный планшет для ELISA откручивали, и нелизировавшиеся эритроциты собирали на дне планшета с круглодонными лунками. Супернатант из каждой лунки собирали, и количество гемоглобина, высвобожденного из лизированных эритроцитов, определяли путем прочтения при OD415 нм в ридере ELISA.
В контрольном инактивированном прогреванием NHS (отрицательный контроль), как и ожидалось, лизис не наблюдали. MBL-/- сыворотка человека лизировала покрытые маннаном эритроциты мыши в разведениях 1/8 и 1/16. NHS, предварительно обработанный антителом анти-МАSP-2, лизировал покрытые маннаном эритроциты мыши в разведениях 1/8 и 1/16, тогда как WT-сыворотка человека лизировала покрытые маннаном эритроциты мыши в разведениях вплоть до разведения 1/32.
ФИГУРА 40 графически иллюстрирует гемолиз (измеряемый по высвобождению гемоглобина лизированными эритроцитами мыши (Cryy/C3-/-) в надосадочную жидкость, измеряемый по фотометрии) покрытых маннаном эритроцитов мыши сывороткой человека в диапазоне сывороточных концентраций в сыворотке от инактивированного прогреванием (HI) NHS, MBL-/-, NHS, предварительно обработанного антителом анти-MASP-2 и NHS-контроля.
Результаты, показанных на ФИГУРА 40, демонстрируют, что MASP-2-ингибирование антителом анти-MASP-2 значительно смещало CH50 и подавляло комплемент-опосредованный лизис сенсибилизированных эритроцитов с недостаточной защитой от аутогенной активации комплемента.
Эксперимент № 3
Свежую кровь, полученную от дважды дефектных мышей Crry/C3 и CD55/CD59 в непокрытых эритроцитах мыши Crry-/-, анализировали в тесте на гемолиз, как описано выше, в присутствии следующих сывороток: MBL -/-; WT-сыворотки; NHS, предварительно обработанного антителом анти-MASP-2 и инактивированного прогреванием NHS в качестве контроля.
Результаты:
ФИГУРА 41 графически иллюстрирует гемолиз (измеряемый по высвобождению гемоглобина лизированными эритроцитами WT-мыши в надосадочную жидкость, измеряемый по фотометрии) непокрытых эритроцитов мыши при помощи сыворотки человека в диапазоне сывороточной концентрации в сыворотке от инактивированного прогреванием (HI) NHS, MBL-/-, NHS, предварительно обработанного антителом анти-MASP-2 и контрольным NHS. Как показано на ФИГУРЕ 41, продемонстрировано, что ингибирование MASP-2 ингибирует комплемент-опосредованный лизис несенсибилизированных эритроцитов WT-мыши.
ФИГУРА 42 графически иллюстрирует гемолиз (измеряемый по высвобождению гемоглобина лизированными эритроцитами мыши (CD55/59) в надосадочную жидкость, измеряемый по фотометрии) непокрытых эритроцитов мыши при помощи сыворотки человека в диапазоне сывороточной концентрации в сыворотке от инактивированного прогреванием (HI) NHS, MBL-/-, NHS, предварительно обработанного антителом анти-MASP-2 и контрольным NHS.
В целом, результаты в этом Примере демонстрируют, что ингибирование MASP-2 ингибирует комплемент-опосредованный лизис сенсибилизированных и несенсибилизированных эритроцитов с недостаточной защитой от аутогенной активации комплемента. Поэтому, MASP-2 ингибиторы могут быть использованы для лечения субъектов, страдающих PNH, а также могут быть использованы для улучшения (т.е., ингибирования, предотвращения или уменьшения тяжести) экстравазального гемолиза у PNH-пациентов, проходящих курс лечения C5-ингибитором, таким как экулизумаб (Soliris®).
ПРИМЕР 34
Этот Пример описывает следовать по результатам исследования, исследования, описанные выше в Примере 29, предоставляющее дополнительные доказательства, подтверждающие, что MASP-2-ингибитор, такой как MASP-2-антитело, эффективен для лечения радиационного воздействия и/или для лечения, облегчения или профилактики острого лучевого синдрома.
Обоснование: В первоначальном исследовании, описанном в Примере 29, было показано, что получение антитела анти-MASP-2 перед облучения у мышей увеличивала выживаемость облученных мышей по сравнению с получавшими наполнитель облученными контрольными животными, как для 6,5 Гр, так и для 7,0 Гр- уровнем экспозиции. Далее в Примере 29 было продемонстрировано, что при уровне экспозиции 6,5 Гр, получение антитела анти-MASP-2 после облучения приводило к незначительному росту выживания по сравнению с получавшими наполнитель облученными контрольными животными. Этот Пример описывает второе исследование по облучению, которое было проведено, чтобы подтвердить результаты первого исследования.
Способы:
Схема исследования А:
Мыши Swiss Webster (n=50) подверглись воздействию ионизирующего излучения (8,0 Гр). Оценивался эффект антитела анти-MASP-2 (mAbH6 5мг/кг), которое вводили за 18 часов до и через 2 часа после облучения, и еженедельно в дальнейшем, на смертность.
Результаты исследования А:
Как показано на ФИГУРЕ 43, было установлено, что введение антитела анти-MASP-2 mAbH6 увеличивало выживаемость мышей, подвергавшихся воздействию 8,0 Гр, с увеличением скорректированной усредненной степени выживаемости с 4 до 6 дней, по сравнению с мышами, которые получали контроль с наполнителем, и смертность снизилась на 12% по сравнению с мышами, которые получали контроль с наполнителем (логарифмический ранговый критерий, p=0,040).
Схема исследования B:
Мыши Swiss Webster (n=50) подверглись воздействию ионизирующего излучения (8,0 Гр) в следующих группах: (I: наполнитель) контроль с физраствором; (II: низкая) антитело анти-MASP-2 mAbH6 (5 мг/кг), введенное за 18 часов до и через 2 часа после облучения; (III; высокая) mAbH6 (10 мг/кг) вводят за 18 часов до и через 2 часа после облучения; и (IV: высокая после) mAbH6 (10 мг/кг) вводят только через 2 часа после облучения.
Результаты исследования B:
Введение антитела анти-MASP-2 до и после облучения корректировало среднюю выживаемость с 4 до 5 дней, по сравнению с животными, которые получали контроль с наполнителем. Смертность у мышей, получавших антитело анти-MASP-2, была снижена на 6-12% по сравнению с контрольными мышами, получавшими наполнитель. Следует также отметить, что значительные вредные эффекты лечения не наблюдалось (данные не приведены).
В целом, результаты, приведенные в этом Примере, согласуются с результатами, приведенными в Примере 29, дополнительно демонстрируют, что антитела анти-MASP-2 являются эффективными при лечении субъекта-млекопитающего, подверженного риску или страдающего от отрицательных последствий острого лучевого синдрома.
ПРИМЕР 35
Данное исследование изучает влияние недостатка MASP-2 в мышиной модели LPS (липополисахарид)-индуцированного тромбоза.
Обоснование:
Гемолитический уремический синдром (HUS), который вызывается инфекцией E. coli, продуцирующими Шига-токсин, является основной причиной острой почечной недостаточности у детей. В этом Примере модель Шварцмана LPS-индуцированного тромбоза (микрососудистой коагуляции) была выполнена на мышах MASP-2-/- (КО), чтобы определить, является ли MASP-2-ингибирование эффективным для ограничения или препятствия образованию внутрисосудистых тромбов.
Способы:
Мыши MASP-2-/- (n=9) и WT-мыши (n=10) были проанализированы в модели Шварцмана LPS-индуцированного тромбоза (микрососудистой коагуляции). Мышам вводили LPS Serratia, и проводили мониторинг образования тромбов с течением времени. Проводилось сравнение частоты возникновения микротромбов и LPS-индуцированной микрососудистой коагуляции.
Результаты:
Примечательно, что все проверенные мыши MASP-2 -/- (9/9) не образовывали внутрисосудистых тромбов после введения LPS Serratia. В отличие от этого, микротромбы были выявлены у 7 из 10 WT-мышей, протестированы параллельно (p=0,0031, точность Фишера). Как показано на ФИГУРЕ 44, время начала микрососудистой окклюзии после LPS-инфекции измеряли у мышей MASP-2-/- и WT-мышей, что показывает процент WT-мышей с тромбообразованием, измеренным в течение 60 минут, с тромбообразованием, детектированным еще в районе 15 минут. До 80% WT-мышей показали тромбообразование за 60 минут. В отличие от этого, как показано на ФИГУРЕ 44, ни у одной из мышей MASP-2 -/- не было тромбообразования за 60 минут (логарифмический ранговый критерий: p=0,0005).
Эти результаты показывают, что MASP-2 ингибирование защищает от развития внутрисосудистых тромбов в модели HUS.
ПРИМЕР 36
Этот Пример описывает эффект антител анти-MASP-2 в мышиной модели HUS, с использованием совместной инъекции очищенного Шига-токсина 2 (STX2) плюс LPS в брюшную полость.
Предпосылки:
Была разработана мышиная модель HUS с использованием coвместной внутрибрюшинной инъекции очищенного Шига-токсина 2 (STX2) плюс LPS. Биохимический анализа и анализа при помощи микрочипов почек мыши выявлено, что STX2 плюс LPS-провокация отличается от эффектов обоих агентов по-отдельности. Анализ крови и сыворотки этих мышах показал нейтрофилез, тромбоцитопению, гемолиз эритроцитов и повышенный сывороточный уровень креатинина и азота мочевины крови. Кроме того, гистологический анализ и электронная микроскопия почек мыши продемонстрировали депозицию клубочковой фибрина, скопление красных клеток, образование микротромбов и клубочковые ультраструктурные изменения. Было установлено, что в этой модели HUS индуцируются все клинические симптомы HUS-патологии человека у мышей линии C57BL/6, в том числе тромбоцитопения, гемолитическая анемия и почечная недостаточность, что определяет болезнь у человека. (J. Immunol 187(1): 172-80 (2011))
Способы:
Cамки мыши C57BL/6, которые весили от 18 до 20 г, были приобретены у Charles River Laboratories и разделены на 2 группы (по 5 мышей в каждой группе). Одна группа мышей была предварительно обработана путем внутрибрюшинной (i.p.) инъекции рекомбинантного антитела анти-MASP-2 mAbM11 (100 мкг на мышь; с соответствующей конечной концентрацией 5 мг/кг массы тела), разведенного в общем объеме 150 мкл физиологического раствора. Контрольная группа получала физиологический раствор без антитела. Через шесть часов после i.p.-инъекции антитела анти-MASP-2 mAbM11, все мыши получали комбинированную i.p.-инъекцию сублетальной дозы (3 мкг/животное; соответствующие 150 мкг/кг массы тела) LPS Serratia marcescens (L6136; Sigma-Aldrich, St. Louis, MO) и дозе 4,5 нг/животное (соответствующее 225 нг/кг) STX2 (два раза дозу LD50) в общем объеме 150 мкл. Инъекцию физиологического раствора использовали в качестве контроля.
Выживаемость мышей контролировали каждые 6 ч после приема препарата. Мышей забивали, как только они достигали летаргической стадии HUS-патологии. Через 36 часов все мыши были забиты, и обе почки были удалены для иммуногистохимии и сканирующей электронной микроскопии. Образцы крови были взяты в конце эксперимента при помощи сердечной пункции. Сыворотку отделяли и держали замороженной при -80°С для измерения уровней содержания мочевины и креатинина в сыворотке крови как для получавшей лечение, так и для контрольной групп.
Иммуногистохимия
Одну треть от каждой почки мыши фиксировали в 4% параформальдегиде в течение 24 ч, обрабатывали и помещали в парафин. Срезы трехмикронной толщины срезали и помещали на заряженные стекла для последующего окрашивания с красителем H&Е.
Электронная микроскопия
Среднюю часть почек нарезали на кусочки примерно от 1 до 2 мм3, и фиксированной ночь при 4°С в 2,5%-ом глутаровом альдегиде в 1×PBS. Фиксированную ткань впоследствии обрабатывали в комплексе электронной микроскопии университета Лестера.
Криостатные срезы
Оставшуюся треть почек нарезали на кусочки примерно от 1 до 2 мм3, и быстро замораживали в жидком азоте и хранили при -80°С для криостатных срезов и анализа мРНК.
Результаты:
ФИГУРА 45 графически иллюстрирует процент выживания получавших физиологический раствор контрольных мышей (n=5) и мышей, получавших антитело анти-MASP-2 (n=5) в STX/LPS-индуцированной модели с течением времени (часы). Примечательно, как показано на ФИГУРЕ 45, что все контрольные мыши погибли в течение 42 часов. В резком контрасте, 100% мышей, получавших антитело анти-MASP-2, выжили на протяжении всего времени проведения эксперимента. В соответствии с результатами, показанными на ФИГУРЕ 45, было отмечено, что все не получавшие лечение мыши, которые либо погибли, либо были забиты по признакам тяжелого заболевания, имели значительные клубочковые повреждения, в то время как клубочки всех мышей, получавших антитело анти-MASP-2, выглядели нормальными (данные не приведены). Эти результаты показывают, что MASP-2-ингибиторы, такие как антитела анти-MASP-2, могут быть использованы для лечения субъектов, страдающих от или подверженных риску развития тромботической микроангиопатии (ТМА), такой как гемолитический уремический синдром (HUS), атипичныый HUS (aHUS) или тромботическая тромбоцитопеническая пурпура (ТТР).
Несмотря на то, что были проиллюстрированы и описаны типичные варианты осуществления изобретения, следует понимать, что различные изменения могут быть сделаны в нем без отступления от объема и сущности данного изобретения.
Реферат
Изобретение относится к медицине, а именно к иммунологии, и может быть использовано для применения MASP-2-ингибирующего агента, который ингибирует MASP-2-зависимую активацию комплемента, для изготовления лекарственного средства для лечения субъекта, страдающего от пароксизмальной ночной гемоглобинурии (PNH), где MASP-2-ингибирующий агент содержит моноклональное антитело против MASP-2 или его антигенсвязывающий фрагмент, которые специфически связываются с частью SEQ ID NO: 6 и селективно ингибируют MASP-2-зависимую активацию комплемента без по существу ингибирования C1q-зависимого пути комплемента. Это позволяет ингибировать, предотвратить или уменьшить тяжесть экстравазального гемолиза у PNH-пациентов, проходящих курс лечения С5-ингибитором, таким как экулизумаб. 9 з.п. ф-лы, 63 ил., 15 табл., 36 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ лечения заболеваний, связанных с masp-2-зависимой активацией комплемента (варианты)

Комментарии