Антитела к бета-амилоиду - RU2651486C2
Код документа: RU2651486C2
Чертежи

















































































































































Описание
Область изобретения
Настоящее изобретение относится к антителам, которые связываются с человеческим бета-амилоидным 1-42 пептидом и его N-терминальными усечениями, совместно называемыми Аβn-42 пептиды, где n равно 1-29. Оно относится к антителам, которые являются селективными в отношении связывания с бета-амилоидным n-42 пептидом по сравнению с бета-амилоидным 1-40 пептидом. Настоящее изобретение также относится к применению антител к Аβn-42 для лечения состояний, ассоциированных с амилоидозом, в том числе болезни Альцгеймера.
Предпосылки изобретения
Болезнь Альцгеймера (AD) характеризуется нарастанием когнитивных нарушений, поражением памяти, что наносит ущерб социальной активности и профессиональной деятельности пациента. Дегенеративное заболевание вызывает утрату нервных клеток в головном мозге, что обуславливает когнитивные затруднения, связанные с речью и высшими функциями, такими как способность к логическому рассуждению, планированию, организации и мышлению, что, в конечном итоге, может приводить к изменениям личности. Конечные стадии заболевания характеризуются полной утратой способности к независимой деятельности.
Гистологически, AD (спорадическая и семейная) определяют по присутствию внутриклеточных нейрофибриллярных клубков (NFT) и внеклеточных бляшек. Бляшки представляют собой скопления β-амилоидного пептида (Аβ), образованного в результате неправильного расщепления белка-предшественника амилоида (АРР), трансмембранного белка, обнаруженного в нейронах и астроцитах в головном мозге. Отложения Аβ также обнаруживают в кровеносных сосудах пациентов, страдающих AD.
При AD особенно уязвимы холинергические нейроны, и последующее снижение количества нейромедиаторов негативно воздействует на другие нейромедиаторные системы. Другие симптомы заболевания включают оксидативный стресс, воспаление и апоптоз нейронов (запрограммированную клеточную смерть). У пациента, страдающего AD, широкомасштабная гибель нейронов приводит к снижению когнитивных способностей и, в конечном итоге, к смерти пациента. (Younkin, 1995; Borchelt et al., 1996; Selkoe, 1999).
Современные способы лечения являются только симптоматическими и представляются минимально эффективными с незначительными облегчениями симптомов на протяжении ограниченного периода времени. Однако, как полагают, сверхвыработка или изменения в уровнях Аβ являются ключевыми событиями в патогенезе спорадической и ранней AD. По этой причине, Аβ стал главной мишенью для разработки лекарственных средств, предназначенных для снижения его образования (Vassar et al., 1999) или для активации механизмов, которые ускоряют его клиренс из головного мозга.
Гипотеза амилоидного каскада предполагает, что выработка Аβ пептида негативно воздействует на функцию нейронов, тем самым, приводя к гибели нейронов и деменции при AD. Аβ вырабатывается из белка-предшественника амилоида (АРР), который расщепляется последовательно секретазами с образованием молекул с разными длинами. Основным компонентом бляшек является изоформа из 42 аминокислот, Аβ1-42, которая вовлечена в формирование нейротоксических олигомеров и формирование бляшек при патогенезе AD. Ряд изоформ Аβ, в том числе Аβ1-42, pGluAβ3-42, Аβ3-42 и 4-42, преобладает при AD головного мозга, из которых Аβ1-42 и Аβ4-42 являются основными формами в гиппокампе и коре при семейной и спорадической AD (Portelius et al., 2010).
Аβ, заканчивающийся остатком 42, является немногочисленным компонентом молекул Аβ, образуемых при процессинге АРР. Другие формы включают Аβ1-40 и N-терминальные усечения Аβn-40. Однако Аβ, заканчивающийся остатком 42, наиболее склонен к агрегации и приводит к отложению в амилоидных бляшках. В дополнение к наибольшей склонности к агрегации, Аβ1-42 пептид формирует растворимые полимеры с небольшим числом звеньев (или олигомеры), которые, как было показано, являются токсическими для нейронов в культуре. В отличие от крупных видимых отложений фибрилл, олигомеры не выявляются при типичных анализах на патологию. Олигомеры, характеризующиеся аналогичными свойствами, были выделены из головной мозга, больных AD, и они более тесно ассоциированы с прогрессированием заболевания, чем бляшки (Younkin, 1998; Walsh et al., 2005a; Walsh et al., 2005b).
Экспериментально полученные олигомеры, применяемые к срезам головного мозга или инъецируемые in vivo, вызывают прекращение долговременной потенциации (LTP) в гиппокампе, которая представляет собой форму хранения синаптической информации, хорошо известной как парадигма механизмов памяти (Lambert et al., 1998; Walsh et al., 2002; Wang et al., 2002). Растворимые олигомеры были вовлечены в физическую дегенерацию синапсов (Mucke et al., 2000). Реверсия нарушения памяти при помощи антител на мышиных моделях подтвердила развивающуюся концепцию, что олигомеры играют главную роль в синаптической недостаточности.
Генетические доказательства позволяют предположить, что повышенные количества Аβ1-42 и его N-терминальных усечений (Аβn-42) вырабатываются при многих, или даже при всех, генетических состояниях, которые вызывают семейную AD (Borchelt et al., 1996; Duff et al., 1996; Scheuner et al., 1996; Citron et al., 1998), что указывает на вероятность, что формирование амилоида может быть вызвано либо повышенным образованием Аβn-42, либо уменьшенным распадом или обоими процессами (Glabe, 2000). В частности, при семейной AD, вызывающей генетические мутации в гене АРР и/или в гене, кодирующем компонент комплекса γ-секретазы, пресенилин, повышается выработка Аβ1-42 относительно Аβ1-40. Также было высказано предположение, что абсолютное количество пептидов, вырабатываемых в головном мозге, может быть менее важным, чем соотношение Аβ пептидов (отраженное в изменении соотношения Аβ1-42 к Аβ1-40), в отношении образования токсических молекул Аβ (De Strooper, 2007; Kuperstein et al., 2010). В дополнение, при помощи животных моделей отложения амилоида, как на мышах, так и на Drosophila, можно предположить, что для образования отложений амилоида требуется Аβ1-42 (Greeve et al., 2004; Iijima et al., 2004; McGowan et al., 2005).
Результаты исследования вакцинации в 2000 подсказали возможные новые стратегии лечения AD. У трансгенной мыши PDAPP, в которой происходит сверхэкспрессия мутантного человеческого АРР (в котором аминокислота в положении 717 представляет собой фенилаланин вместо валина, встречающегося в норме), постепенно развивается множество нейропатологических признаков AD в зависимости от возраста и области головного мозга. Трансгенных животных иммунизировали пептидом Аβ1-42 либо перед появлением нейропатологий по типу AD (в возрасте 6 недель) или в старом возрасте (11 месяцев), когда отложение Аβ и некоторые последующие нейропатологические изменения хорошо сформировались. Иммунизация молодых животных фактически предупреждала развитие образования бляшек, дистрофии нейритов и астроглиоза. Лечение более старых животных также заметно снижало степень и прогрессирование этих AD-подобных нейропатологий. Было показано, что иммунизация Аβ1-42 приводила к образованию антител к Аβ и что Аβ-иммунореактивные моноцитные/микроглиальные клетки появлялись в области оставшихся бляшек (Schenk et al., 1999; Schenk et al., 2000). Однако, при применении на людях метод активной иммунизации привел к нескольким случаям менингоэнцефалита, наиболее вероятно, вследствие Т-клеточного ответа, и был прерван, хотя первоначальные результаты по эффективности действия были перспективными (Orgogozo et al., 2003; Gilman et al., 2005; Pride et al., 2008).
Вследствие этого, было исследовано несколько стратегий пассивной вакцинации. Периферического введения антител против Аβ было достаточно для снижения амилоидных бляшек (Bard et al., 2000). Несмотря на относительно небольшие сывороточные уровни антител, достигнутые в этих экспериментах, пассивно введенные антитела были способны проходить через гематоэнцефалический барьер и попадать в центральную нервную систему, покрывать бляшки и индуцировать клиренс уже существующего амилоида. При сравнении Aβ1-40-специфичного антитела, Aβ1-42-специфичного антитела и антитела, направленного против остатков 1-16 Аβ было показано, что все антитела снижали накопление Аβ в головном мозге мыши (Levites et al., 2006).
Позднее, было высказано предположение, что прохождение в ЦНС является наиболее вероятным путем проникновения для эффективного клиренса Аβ для пассивно вводимых антител (Golde et al., 2009). Однако, в дополнение к антителам, способным проходить через гематоэнцефалический барьер, в качестве возможного механизма действия была предложена гипотеза стока.
Гипотеза стока утверждает, что Аβ может удаляться из ЦНС непрямым образом, при помощи снижения концентрации пептида в плазме. В экспериментах, описывающих это, применяли антитело, которое связывает Аβ в плазме и, тем самым, удаляет Аβ из ЦНС. Это достигалось, поскольку антитело предупреждает приток Аβ из плазмы в ЦНС и/или меняет равновесие между плазмой и ЦНС вследствие снижения концентрации свободного Аβ в плазме (DeMattos et al., 2001). Также было показано, что средства связывания амилоида, не родственные антителам, являются эффективными в удалении Аβ из ЦНС в результате связывания в плазме. Было показано, что два средства связывания Аβ, гельзолин и GM1, которые удаляют Аβ плазмы, снижают или предупреждают амилоидоз головного мозга (Matsuoka et al., 2003).
Что касается безопасности, одним из признаков патогенеза при AD является церебральная амилоидная ангиопатия (САА), при этом происходит замещение гладкомышечных клеток сосудов на Аβ, главным образом Аβ1-40, в стенках мозговых артерий (Weller et al., 2003). Как было показано, лечение пациентов, страдающих AD, при помощи антител ко всем Аβ приводит к микрокровоизлияниям, отражающим удаление Аβ из стенки сосуда (Wilcock et al., 2009), что может неблагоприятно влиять на пациентов. Одним путем для избежания этого была разработка дегликозилированных антител, которые могут снижать механизмы клиренса, приводящие к микрокровоизлияниям и/или снижать скорость, с которой Аβ выводится из отложений в сосудах, предупреждая насыщение путей оттока (Wilcock et al., 2006).
Нацеленное воздействие на молекулы n-42β пептида при помощи Аβ42-специфичного антитела будет нацеливать на молекулу, которая представляет собой ключевую пептидную составляющую при AD головного мозга и является движущей силой образования бляшек. Антитело с первичной специфичностью в отношении молекул n-42-мономера и олигомера с небольшим числом звеньев, будет не только истощать эти молекулы, но также может предупреждать накопление других олигомерных молекул, которые, как было показано, токсичны для нейронов.
Краткое описание изобретения
Настоящее изобретение относится к полностью человеческим антителам, которые являются специфичными в отношении Аβ1-42 и его N-терминальных усечений и связываются с эпитопом между аминокислотами 29-42 Аβ42 пептида. Антитела по настоящему изобретению можно применять для профилактического и/или терапевтического лечения состояний, ассоциированных с бета-амилоидом, таких как AD, в том числе умеренных когнитивных нарушений (MCI) вследствие AD и синдрома Дауна.
Настоящее изобретение касается применения полностью человеческих антител для подавления изоформ Аβ пептида (n-42) в плазме, головном мозге и спинномозговой жидкости (CSF) для предупреждения накопления или способствовать устранению отложения Аβ n-42 изоформ в головном мозге и сосудистой системе головного мозга и для улучшения когнитивной деятельности.
В данном документе описано получение полностью человеческих антител к Аβ n-42 пептидам, которые распознают мономерные формы и олигомерные формы с небольшим числом звеньев (вплоть до и включая пентамер) Аβ n-42 и которые эпитопно картированы к области, охватывающей аминокислоты 17-42 на Аβ42 пептиде, более конкретно, к области, охватывающей аминокислоты 29-42 на Аβ42 пептиде.
Антитела согласно настоящему изобретению являются специфичными в отношении молекулы Аβ n-42 (где n является целым числом в диапазоне от 1 до 29) и, таким образом, можно ожидать селективно снижают ключевую движущую силу прогрессирования AD. Антитела согласно настоящему изобретению являются эффективными в связывании Аβ42 (а не Аβ40) в плазме, головном мозге и спинномозговой жидкости (CSF) человека, что приводит к повышенному клиренсу Аβ n-42 изоформ из головного мозга. Антитела согласно настоящему изобретению также эффективны в снижении связывания растворимых агрегатов Аβ42 с нейронами и, таким образом, часть антител, которая попадает в головной мозг, будет оказывать воздействие на здоровье нейронов.
В данном документе описаны сильные, высокоаффинные антитела, в том числе антитело с KD 320 пМ в отношении мономера. Такая высокая аффинность может обеспечивать эффективное подавление Аβ n-42 до уровней, обеспечивая профилактику и модификацию заболевания AD.
Уровни растворимых молекул Аβ42 и Аβ40 можно выявлять в головном мозге, CSF и крови при помощи стандартизированных анализов с применением антител, направленных против эпитопов на Аβ пептиде. Как показано на PK:PD крысы, описанной в данном документе, дозозависимое подавление свободного Аβ42 наблюдали в CSF крыс после периферического введения антитела. Также показано дозозависимое повышение общего Аβ42 в головном мозге крыс с несущественным воздействием на Аβ40 пептид.
Таким образом, в данном документе описаны антитела, которые характеризуются способностью проникать в головной мозг (0,1% общего периферического введения в CSF) и специфично подавлять ключевую токсическую молекулу Аβ42 (а не Аβ40) в CSF.
Специфичность и механизм действия антител согласно настоящему изобретению могут обеспечивать как профилактическое, так и терапевтическое лечение ряда заболеваний, связанных с накоплением амилоида, который накапливается в органах тела, в том числе различных стадий патогенеза заболевания AD: продромальной, легкой и умеренной AD, синдрома Дауна, а также макулярной дегенерации.
Антитела согласно настоящему изобретению могут обладать способностью обращать снижение когнитивных способностей, лечить снижение когнитивных способностей и предупреждать снижение когнитивных способностей у субъектов с диагнозом продромальная AD, от легкой до умеренной AD и синдром Дауна.
Соответственно, первый аспект настоящего изобретения относится к связывающим элементам в отношении человеческого Аβ1-42, особенно молекул антител.
Связывающие элементы, например молекулы антител, согласно настоящему изобретению могут характеризоваться каким-либо или всеми из следующих свойств.
Связывание с растворимым мономерным человеческим Аβ1-42 и/или олигомерным Аβ1-42.
Селективность в связывании Аβ1-42 по сравнению с Аβ1-40. Они могут не проявлять связывания с Аβ1-40 или связывание может быть несущественным. К примеру, молекулы антител согласно настоящему изобретению могут связывать мономерный Аβ1-42 с константой диссоциации (Kd), составляющей 500 пМ или меньше. Они могут не связывать Аβ1-40, или могут связывать Аβ1-40 с Kd больше 1 мМ.
Связывание с человеческим Аβ17-42. Соответственно, молекула антитела может распознавать эпитоп между аминокислотами 17-42 Аβ1-42 пептида, более конкретно, молекула антитела может распознавать эпитоп между аминокислотами 29-42 Аβ1-42 пептида.
Связывание с растворимым мономерным человеческим 3-пиро-42 (пироглутамат 3) и 11-пиро-42 (пироглутамат 11).
Связывание с человеческим Аβ1-43. И
Перекрестная реактивность с мышиным Аβ1-42.
Связывающий элемент может содержать набор HCDR и/или набор LCDR молекулы антитела, которая описана в данном документе. Примеры молекул антител согласно настоящему изобретению содержат VH-домен, содержащий набор HCDR (HCDR1, HCDR2 и HCDR3), и VL-домен, содержащий набор LCDR (LCDR1, LCDR2 и LCDR3), где HCDR и LCDR представляют собой HCDR и LCDR, соответственно, любого из антител Abet0380, Abet0007, Abet0144, Abet0319, Abet0321b, Abet0322b, Abet0323b, Abet0328, Abet0329, Abet0332, Abet0342, Abet0343, Abet0344, Abet0368, Abet0369, Abet0370, Abet0371, Abet0372, Abet0373, Abet0374, Abet0377, Abet0378, Abet0379, Abet0381, Abet0382 и Abet0383 или их GL-версии, последовательности которых показаны в прилагаемом перечне последовательностей. Соответствие между молекулами антител и идентификаторами последовательностей в перечне последовательностей обозначено в таблице 16.
Молекула антитела для человеческого Аβ1-42 может содержать
(i) VH-домен, содержащий набор HCDR: HCDR1, HCDR2 и HCDR3, расположенные между каркасными областями, где аминокислотные последовательности набора HCDR являются такими, которые показаны в таблице 16 для любого из антител Abet0380, Abet0007, Abet0144, Abet0319, Abet0321b, Abet0322b, Abet0323b, Abet0328, Abet0329, Abet0332, Abet0342, Abet0343, Abet0344, Abet0368, Abet0369, Abet0370, Abet0371, Abet0372, Abet0373, Abet0374, Abet0377, Abet0378, Abet0379, Abet0381, Abet0382 и Abet0383 или их GL-версии,
или может содержать такой набор HCDR с одной или двумя аминокислотными мутациями; и
(ii) VL-домен, содержащий набор LCDR: LCDR1, LCDR2 и LCDR3, расположенные между каркасными областями, где аминокислотные последовательности набора LCDR являются такими, которые показаны в таблице 16 для любого из антител Abet0380, Abet0007, Abet0144, Abet0319, Abet0321b, Abet0322b, Abet0323b, Abet0328, Abet0329, Abet0332, Abet0342, Abet0343, Abet0344, Abet0368, Abet0369, Abet0370, Abet0371, Abet0372, Abet0373, Abet0374, Abet0377, Abet0378, Abet0379, Abet0381, Abet0382 и Abet0383 или их GL-версии,
или может содержать такой набор LCDR с одной или двумя аминокислотными мутациями.
Молекула антитела согласно настоящему изобретению может содержать
(i) VH-домен, содержащий набор HCDR из Abet0380 или Abet0380 GL, где аминокислотные последовательности HCDR Abet0380 представляют собой
или может содержать набор HCDR из Abet0380 или Abet0380 GL с одной или двумя аминокислотными мутациями и
(ii) VL-домен, содержащий набор LCDR из Abet0380 или Abet0380 GL, где аминокислотные последовательности LCDR Abet0380 представляют собой
или может содержать набор LCDR из Abet0380 или Abet0380 GL с одной или двумя аминокислотными мутациями.
Молекула антитела может содержать
(i) VH-домен, содержащий набор HCDR: HCDR1, HCDR2 и HCDR3, расположенные между каркасными областями, где аминокислотные последовательности HCDR представляют собой
или может содержать такой набор HCDR с одной или несколькими аминокислотными заменами, где одна или несколько замен выбраны из показанных в таблице 12 или таблице 14;
и
(ii) VL-домен, содержащий набор LCDR: LCDR1, LCDR2 и LCDR3, расположенные между каркасными областями, где аминокислотные последовательности LCDR представляют собой
или может содержать такой набор LCDR с одной или несколькими аминокислотными заменами, где одна или несколько замен выбраны из показанных в таблице 13 или таблице 15;
VH-домен молекулы антитела может содержать область FW1, в которой аминокислотные остатки в положениях 26-30 по Kabat выбраны из показанных в таблице 14.
VH-домен молекулы антитела может содержать каркасные области тяжелой цепи FW1, FW2, FW3 и FW4, где аминокислотные последовательности каркасных областей тяжелой цепи представляют собой
или где FW1 включает SEQ ID NO: 528 с одной или несколькими аминокислотными заменами, где одна или несколько замен в FW1 выбраны из показанных в таблице 12 или таблице 14.
VL-домен молекулы антитела может содержать каркасные области легкой цепи FW1, FW2, FW3 и FW4, где аминокислотные последовательности каркасных областей легкой цепи представляют собой
Молекула антитела согласно настоящему изобретению может содержать
(i) аминокислотную последовательность VH-домена, показанную в таблице 16 для любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их GL-версии,
или может содержать аминокислотную последовательность с одной или двумя аминокислотными мутациями; и
(ii) аминокислотную последовательность VL-домена, показанную в таблице 16 для любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их GL-версии,
или может содержать такую аминокислотную последовательность с одной или двумя аминокислотными мутациями.
Молекула антитела согласно настоящему изобретению может содержать VH-домен с аминокислотной последовательностью, которая по меньшей мере на 85% идентична SEQ ID NO: 524, и VL-домен с аминокислотной последовательностью, которая по меньшей мере на 85% идентична SEQ ID NO: 533, где в VH-домене:
аминокислота 26 представляет собой М, G или S;
аминокислота 27 представляет собой G, F или D;
аминокислота 28 представляет собой N, Т, D или Н;
аминокислота 29 представляет собой F;
аминокислота 30 представляет собой N, S, K или Р;
аминокислота 31 представляет собой Y, V, R, Е или Т;
аминокислота 32 представляет собой Q, Y, D, S или Е;
аминокислота 33 представляет собой Т, Р, I или V;
аминокислота 34 представляет собой М;
аминокислота 35 представляет собой W;
аминокислота 50 представляет собой V;
аминокислота 51 представляет собой I;
аминокислота 52 представляет собой G;
аминокислота 52а представляет собой K, S или А;
аминокислота 53 представляет собой Т, S, N, D, G или Q;
аминокислота 54 представляет собой N, G, Т или Р;
аминокислота 55 представляет собой Е, G, N, K или Т;
аминокислота 56 представляет собой N, Т, R или K;
аминокислота 57 представляет собой I, Т, K или V;
аминокислота 58 представляет собой А, V или Т;
аминокислота 59 представляет собой Y;
аминокислота 60 представляет собой А;
аминокислота 61 представляет собой D;
аминокислота 62 представляет собой S;
аминокислота 63 представляет собой V;
аминокислота 64 представляет собой K;
аминокислота 65 представляет собой G;
аминокислота 95 представляет собой Е;
аминокислота 96 представляет собой W;
аминокислота 97 представляет собой М;
аминокислота 98 представляет собой D;
аминокислота 99 представляет собой Н;
аминокислота 100 представляет собой S;
аминокислота 100а представляет собой R;
аминокислота 100b представляет собой Р;
аминокислота 100с представляет собой Y;
аминокислота 100d представляет собой Y;
аминокислота 100е представляет собой Y;
аминокислота 100f представляет собой Y;
аминокислота 100g представляет собой G;
аминокислота 100h представляет собой М;
аминокислота 101 представляет собой D;
аминокислота 102 представляет собой V;
и где в VL-домене:
аминокислота 24 представляет собой S;
аминокислота 25 представляет собой G;
аминокислота 26 представляет собой Н;
аминокислота 27 представляет собой N;
аминокислота 28 представляет собой L или I;
аминокислота 29 представляет собой Е или G;
аминокислота 30 представляет собой D;
аминокислота 31 представляет собой K;
аминокислота 32 представляет собой F или W;
аминокислота 33 представляет собой А или V;
аминокислота 34 представляет собой S;
аминокислота 50 представляет собой R;
аминокислота 51 представляет собой D;
аминокислота 52 представляет собой D;
аминокислота 53 представляет собой K;
аминокислота 54 представляет собой R;
аминокислота 55 представляет собой Р;
аминокислота 56 представляет собой S;
аминокислота 89 представляет собой S или Q;
аминокислота 90 представляет собой S или А;
аминокислота 91 представляет собой Q;
аминокислота 92 представляет собой D;
аминокислота 93 представляет собой Т или S;
аминокислота 94 представляет собой V или Т;
аминокислота 95 представляет собой Т;
аминокислота 96 представляет собой R;
аминокислота 97 представляет собой V.
Молекула антитела согласно настоящему изобретению может содержать VH-домен с аминокислотной последовательностью, которая по меньшей мере на 85% идентична SEQ ID NO: 524, и VL-домен с аминокислотной последовательностью, которая по меньшей мере на 85% идентична SEQ ID NO: 533, где в YH-домене:
аминокислота 26 представляет собой М, G, S, V, A, N, Т или Н;
аминокислота 27 представляет собой G, F, S, Y, Е, D или Р;
аминокислота 28 представляет собой N, Q, Н, V, Е, Т, A, S, D, М или Р;
аминокислота 29 представляет собой F, I, Y, S, L или W;
аминокислота 30 представляет собой N, S, Т, Q, K, Н, R, G, Р, Е, K, А или D;
аминокислота 31 представляет собой Y, Н, K, Е, N, Т, R, V, Р, М, F, I, D или W;
аминокислота 32 представляет собой Q, Y, D, N, S, Е или Т;
аминокислота 33 представляет собой Т, Р, I или V;
аминокислота 34 представляет собой М или L;
аминокислота 35 представляет собой W;
аминокислота 50 представляет собой V;
аминокислота 51 представляет собой I;
аминокислота 52 представляет собой G;
аминокислота 52а представляет собой K, S, Р, A, N, G, Е, D, V или Т;
аминокислота 53 представляет собой Т, S, N, Н, Q, D, G или Е;
аминокислота 54 представляет собой N, G, Р, Т, Q, Е, М, K или А;
аминокислота 55 представляет собой Е, G, K, N, Q, Т, Н, D или А;
аминокислота 56 представляет собой N, Т, A, R или K;
аминокислота 57 представляет собой I, Т, N, S, K, F, Q, V или L;
аминокислота 58 представляет собой А, V, S, Т или N;
аминокислота 59 представляет собой Y;
аминокислота 60 представляет собой А;
аминокислота 61 представляет собой D;
аминокислота 62 представляет собой S, А или Т;
аминокислота 63 представляет собой V;
аминокислота 64 представляет собой K;
аминокислота 65 представляет собой G;
аминокислота 95 представляет собой Е;
аминокислота 96 представляет собой W;
аминокислота 97 представляет собой М;
аминокислота 98 представляет собой D или G;
аминокислота 99 представляет собой Н или R;
аминокислота 100 представляет собой S;
аминокислота 100а представляет собой R;
аминокислота 100b представляет собой Р;
аминокислота 100с представляет собой Y;
аминокислота 100d представляет собой Y;
аминокислота 100е представляет собой Y;
аминокислота 100f представляет собой Y;
аминокислота 100g представляет собой G;
аминокислота 100h представляет собой М или I;
аминокислота 101 представляет собой D;
аминокислота 102 представляет собой V или А;
и где в VL-домене:
аминокислота 24 представляет собой S или Т;
аминокислота 25 представляет собой G или Т;
аминокислота 26 представляет собой Н, R или Р;
аминокислота 27 представляет собой N или Н;
аминокислота 28 представляет собой L, I, V, F или Т;
аминокислота 29 представляет собой Е, М, G, S или N;
аминокислота 30 представляет собой D, A, S, G или Н;
аминокислота 31 представляет собой K или S;
аминокислота 32 представляет собой F или W;
аминокислота 33 представляет собой А, V, М, Т или I;
аминокислота 34 представляет собой S, Т или А;
аминокислота 50 представляет собой R;
аминокислота 51 представляет собой D;
аминокислота 52 представляет собой D;
аминокислота 53 представляет собой K;
аминокислота 54 представляет собой R;
аминокислота 55 представляет собой Р;
аминокислота 56 представляет собой S;
аминокислота 89 представляет собой S, Q или А;
аминокислота 90 представляет собой S, А или Т;
аминокислота 91 представляет собой Q;
аминокислота 92 представляет собой D или G;
аминокислота 93 представляет собой Т, Q, S, N или K;
аминокислота 94 представляет собой V, Т или F;
аминокислота 95 представляет собой Т;
аминокислота 96 представляет собой R;
аминокислота 97 представляет собой V, S или А.
Молекула антитела согласно настоящему изобретению может содержать:
(i) VH-домен с аминокислотной последовательностью, которая по меньшей мере на 90% идентична аминокислотной последовательности VH-домена, показанной в таблице 16 для любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их GL-версии; и
(ii) VL-домен с аминокислотной последовательностью, которая по меньшей мере на 90% идентична аминокислотной последовательности VL-домена, показанной в таблице 16 для любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их GL-версии.
Молекула антитела может содержать VH-домен и VL-домен, которые по меньшей мере на 90% идентичны VH-домену и VL-домену, соответственно, любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их GL-версии.
Указанная процентная доля идентичности VH- и/или VL-домена может составлять по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99%.
Молекула антитела может содержать VH-домен и VL-домен любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их GL-версии.
К примеру, молекула антитела может содержать аминокислотную последовательность VH-домена Abet0380-GL под SEQ ID NO: 524 и аминокислотную последовательность VL-домена Abet0380-GL под SEQ ID NO: 533.
Молекула антитела согласно настоящему изобретению может представлять собой антитело, которое конкурирует за связывание с Аβ1-42 с:
(i) молекулой антитела, содержащей аминокислотную последовательность VH-домена под SEQ ID NO: 524 и аминокислотную последовательность VL-домена под SEQ ID NO: 533,
(ii) молекулой антитела, кодируемой нуклеиновой кислотой, депонированной под номером доступа NCIMB 41890, 41891 или 41892.
Молекула антитела может содержать VH-домен и VL-домен, кодируемые:
(i) последовательностью нуклеиновой кислоты Abet0380-GL, депонированной под номером доступа 41890;
(ii) последовательностью нуклеиновой кислоты Abet0144-GL, депонированной под номером доступа 41891; или
(iii) последовательностью нуклеиновой кислоты Abet0377-GL, депонированной под номером доступа 41892.
Молекула антитела может содержать VH-домен и VL-домен, содержащие HCDR и LCDR, соответственно, депонированного антитела, указанного выше. Молекула антитела может представлять собой антитело, кодируемое депонированной нуклеиновой кислотой, указанной выше.
Также в данном документе описаны молекулы нуклеиновой кислоты, кодирующие связывающие элементы согласно настоящему изобретению, клетки-хозяева, содержащие нуклеиновую кислоту, и способы получения связывающих элементов при помощи экспрессии нуклеиновой кислоты и выделения связывающего элемента.
Дополнительные аспекты настоящего изобретения связаны с композициями, включающими молекулу антитела по любому из предыдущих пунктов, и один или несколько дополнительных компонентов, таких как фармацевтически приемлемый наполнитель, и с такими композициями для медицинского применения. Композиции, включающие связывающие элементы по настоящему изобретению, могут предусматриваться для применения в способе лечения организма человека или животного.
Связывающиеся элементы, которые описаны в данном документе, могут применяться в способах диагностики или лечения субъектов-людей или животных, например людей. Связывающие элементы по настоящему изобретению могут применяться для понижения уровней Аβ1-42 у индивидуума и/или для снижения амилоидоза. Связывающие элементы могут применяться для снижения амилоидоза и для лечения, снижения или предупреждения состояния, ассоциированного с амилоидозом. Состояния и заболевания, которые можно лечить, включают болезнь Альцгеймера, такую как продромальная, легкая или умеренная AD. AD, подвергаемая лечению при помощи настоящего изобретения, может представлять собой семейную или спорадическую AD. Настоящее изобретение можно применять для предупреждения, снижения или обращения умеренных когнитивных нарушений (MCI), ассоциированных с AD. Когнитивную деятельность можно улучшать и/или снижение когнитивных способностей можно ослаблять у пациентов, страдающих AD, или пациентов, страдающих синдромом Дауна. Настоящее изобретение также можно применять для лечения или предупреждения макулярной дегенерации, которая связана с бета-амилоидом (Ding et al. PNAS 108(28): Е279-287 2011).
Соответственно, в дополнительном аспекте настоящее изобретение предусматривает способ снижения амилоидоза, лечения болезни Альцгеймера, улучшения когнитивной деятельности или замедление снижения когнитивных способностей при болезни Альцгеймера или синдроме Дауна и/или лечения макулярной дегенерации у индивидуума, включающий введение индивидууму связывающего элемента по настоящему изобретению.
Эти и другие аспекты настоящего изобретения описаны более подробно ниже.
Краткое описание графических материалов
На фигуре 1 показаны результаты HTRF™-анализа прямого связывания очищенного Fab Abet0007 и серии бета-амилоидных пептидов. Клон Abet0007



На фигуре 2 показано ингибирование образования комплекса из биотинилированного человеческого бета-амилоидного 1-42 пептида и IgG2 Abet0007 при повышении концентраций конкурирующих пептидов. Образование комплекса ингибируют человеческие бета-амилоидные 1-42






На фигуре 3 показаны кривые поверхностного плазмонного резонанса (BIAcore) для связывания человеческого бета-амилоидного 1-42 пептида с иммобилизованным IgG2 Abet0007 при концентрации пептида, составляющей 100 нМ (верхняя кривая), 50 нМ, 25 нМ, 12,5 нМ, 6,2 нМ и 3,1 нМ (нижняя кривая). Каждую кривую подгоняют к модели Ленгмюра 1:1.
На фигуре 4 показаны фотографии образца in vitro иммуногистохимического окрашивания IgG2 Abet0007. (А) Антитело положительного контроля проявляет сильное распознавание бляшек (балл = 4) на срезах головного мозга человека, страдающего AD (генотип АроЕ 3/3; стадия по Braak 6; концентрация антитела 20 мкг/мл). (В) Лидерный клон IgG2 Abet0007 проявляет отсутствие распознавания бляшек (балл = 0) на смежном срезе головного мозга (20 мкг/мл). (С) То же самое антитело положительного контроля проявляет сильное распознавание бляшек (балл = 4) на срезах головного мозга мыши Tg2576 (мыши возрастом 18 месяцев; концентрация антитела 20 мкг/мл). (D) Лидерный клон IgG2 Abet0007 проявляет отсутствие распознавания бляшек (балл = 0) на смежном срезе головного мозга мыши (20 мкг/мл).
На фигуре 5 показано ингибирование образования комплекса из человеческого бета-амилоидного 1-42 пептида и IgG Abet0042 при повышении концентрации scFv Abet0007



На фигуре 6 показаны кривые поверхностного плазмонного резонанса (BIAcore) для связывания очищенного scFv Abet0144 с иммобилизованным человеческим бета-амилоидным 1-42 пептидом при концентрации scFv, составляющей 400 нМ (верхняя кривая), 200 нМ, 100 нМ, 50 нМ и 12,5 нМ (нижняя кривая). Каждую кривую подгоняют к модели Ленгмюра 1:1.
На фигуре 7 показаны кривые поверхностного плазмонного резонанса (BIAcore) для связывания человеческого бета-амилоидного 1-42 пептида с иммобилизованным антителом IgG1-TM Abet0144-GL при концентрации пептида, составляющей 50 нМ (верхняя кривая), 25 нМ, 12,5 нМ, 6,25 нМ, 3,13 нМ и 1,56 нМ (нижняя кривая). Каждую кривую подгоняют к модели Ленгмюра 1:1.
На фигуре 8 показаны кривые поверхностного плазмонного резонанса (BIAcore) для связывании серии бета-амилоидных пептидов при концентрации 400 нМ с иммобилизованным антителом IgG1-TM Abet0144-GL. Отмечается явное связывание с биотинилированным человеческим бета-амилоидным 1-42 пептидом (верхняя кривая) и немеченным человеческим бета-амилоидным 1-42 пептидом (вторая кривая). Отсутствует заметное связывание со скремблированным биотинилированным человеческим бета-амилоидным 1-42 пептидом, биотинилированным человеческим бета-амилоидным 1-40 пептидом, немеченным человеческим бета-амилоидным 1-40 пептидом или биотинилированным-инсулином (плоские линии).
На фигуре 9 показано определение профиля специфичности IgG1-TM Abet0144-GL с применением биохимического анализа конкуренции за эпитоп, в котором измеряют ингибирование образования комплекса между биотинилированным человеческим бета-амилоидным 1-42 пептидом и IgG1-TM Abet0144-GL при повышении концентрации конкурирующих пептидов. Образование комплекса ингибировали человеческий бета-амилоидный 1-42 пептид







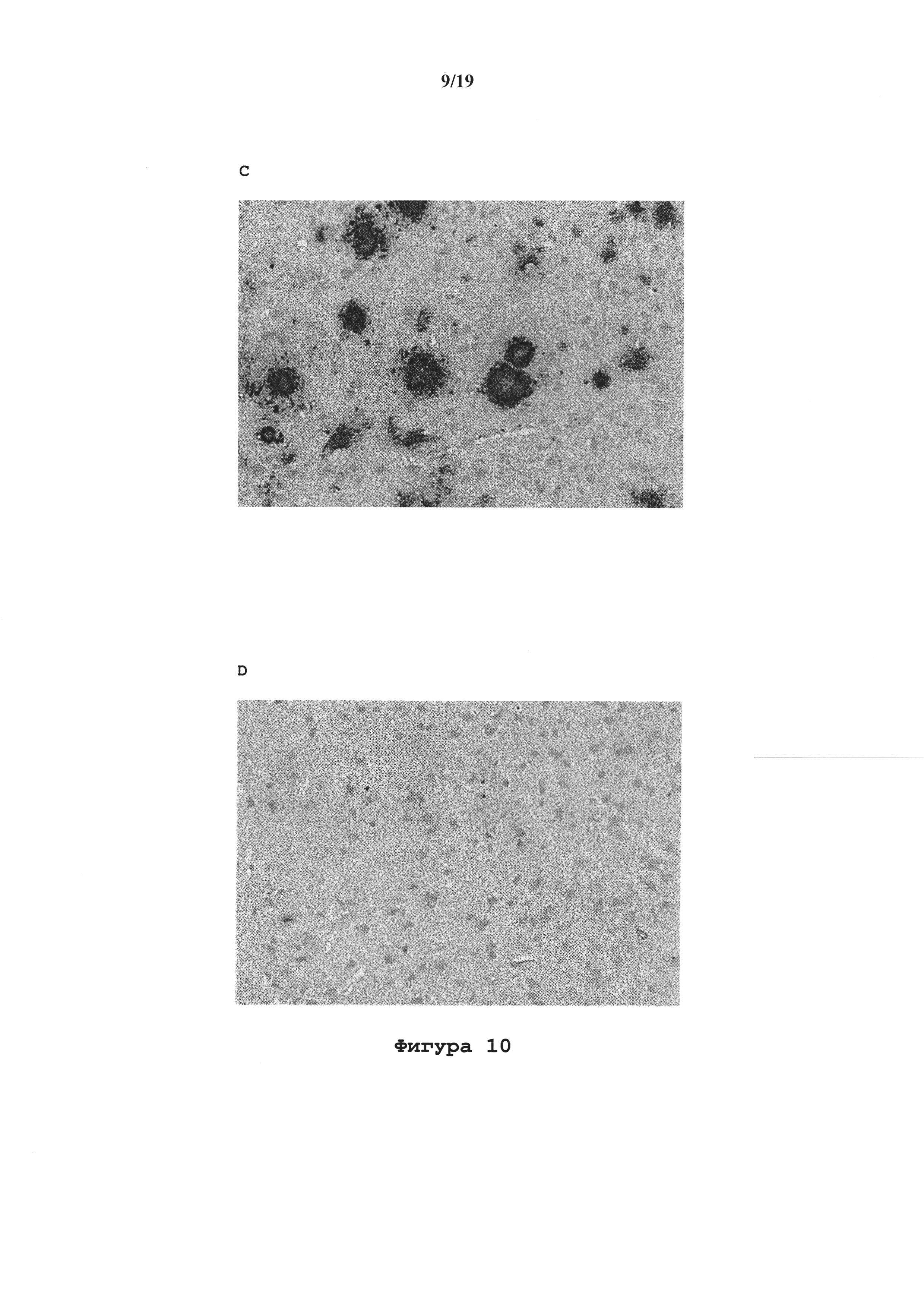
На фигуре 10 показаны фотографии образца in vitro иммуногистохимического окрашивания IgG1-TM Abet0144-GL. (А) Антитело положительного контроля проявляет сильное распознавание бляшек (балл = 4) на срезах головного мозга человека, страдающего AD (генотип АроЕ 3/3; концентрация антитела 20 мкг/мл). (В) Лидерный клон IgG1-TM Abet0144-GL проявляет некоторое распознавание бляшек (балл = 1,5) на смежном срезе головного мозга (20 мкг/мл). (С) То же самое антитело положительного контроля проявляет сильное распознавание бляшек (балл = 4) на срезах головного мозга мыши Tg2576 (мыши возрастом 18 месяцев; концентрация антитела 20 мкг/мл). (D) Лидерный клон IgG1-TM Abet0144-GL проявляет некоторое распознавание бляшек (балл = 1) на смежном срезе головного мозга мыши (20 мкг/мл).
На фигуре 11 показано ингибирование образования комплекса из человеческого бета-амилоидного 1-42 пептида и IgG1-TM Abet0144-GL при повышении концентрации очищенного конкурирующего scFv


На фигуре 12 показаны кривые поверхностного плазмонного резонанса (BIAcore) для связывания человеческого бета-амилоидного 1-42 пептида с иммобилизованным антителом IgG1-TM Abet0380-GL при концентрации пептида от 1024 нМ (верхняя кривая) до 63 пМ (нижняя кривая). Каждую кривую подгоняют к модели Ленгмюра 1:1.
На фигуре 13 показаны кривые поверхностного плазмонного резонанса (BIAcore) для связывании серии бета-амилоидных пептидов с иммобилизованным антителом IgG1-TM Abet0380-GL. Отмечается явное связывание с биотинилированным человеческим бета-амилоидным 1-42 пептидом (верхняя кривая) и немеченным мышиным бета-амилоидным 1-42 пептидом (вторая кривая). Отсутствует заметное связывание с биотинилированным человеческим бета-амилоидным 1-40 пептидом или немеченным мышиным бета-амилоидным 1-40 пептидом (плоские линии).
На фигуре 14 показаны фотографии образца in vitro иммуногистохимического окрашивания IgG1-TM Abet0380-GL. (А) Антитело положительного контроля проявляет сильное распознавание бляшек (балл = 4) на срезах головного мозга человека, страдающего AD (генотип АроЕ 3/3, стадия по Braak 6; концентрация антитела 5 мкг/мл). (В) Лидерный клон IgG1-TM Abet0380-GL проявляет сильное распознавание бляшек (балл = 3) на смежном срезе головного мозга (10 мкг/мл). (С) The same positive control antibody shows strong plaque recognition (score = 4) on Tg2576 mouse brain sections (22 month old mice; 20 μg/ml antibody). (D) Лидерный клон IgG1-TM Abet0380-GL проявляет сильное распознавание бляшек (балл = 4) на смежном срезе головного мозга мыши (20 мкг/мл).
Figure 15 shows Western Blot analysis of Abeta 42 aggregate preparation and detection using the Abet0380-GL IgG1TM. (А) Выявление с помощью IgG1TM Abet0380-GL агрегата Aβ42, не подвергнутого фотосшиванию (не-PICUP). (В) Выявление с помощью IgG1TM Abet0380-GL агрегата Аβ42, подвергнутого фотосшиванию (PICUP). Здесь нами показано, что IgG1TM Abet0380-GL специфично распознает молекулы мономера Аβ1-42 и олигомера с небольшим числом звеньев вплоть до и в том числе пентамера.
На фигуре 16 показано дозозависимое снижение уровня свободного бета-амилоидного 1-42 пептида в CSF (А), повышение общего бета-амилоидного 1-42 пептида в ткани головного мозга (В) и неизменные уровни общего бета-амилоидного 1-40 пептида в ткани головного мозга (С) при повышении доз антитела IgG1-TM Abet0380-GL у крыс Sprague-Dawley, получавших повторные еженедельные дозы в течение 14 дней.
На фигуре 17 показаны фотографии образца иммуногистохимического анализа связывания IgG1-TM Abet0380-GL с бета-амилоидными бляшками in vivo через 168 часов после введения дозы в периферический сосуд пожилым мышам Tg2576. Антитело положительного контроля, вводимое из расчета 30 мг/кг, проявляет сильное in vivo распознавание бляшек (А), тогда как IgG1-TM Abet0380-GL, вводимое из расчета 30 (В) или 10 (С) мг/кг, не проявляет какого-либо in vivo присоединения к бляшкам.
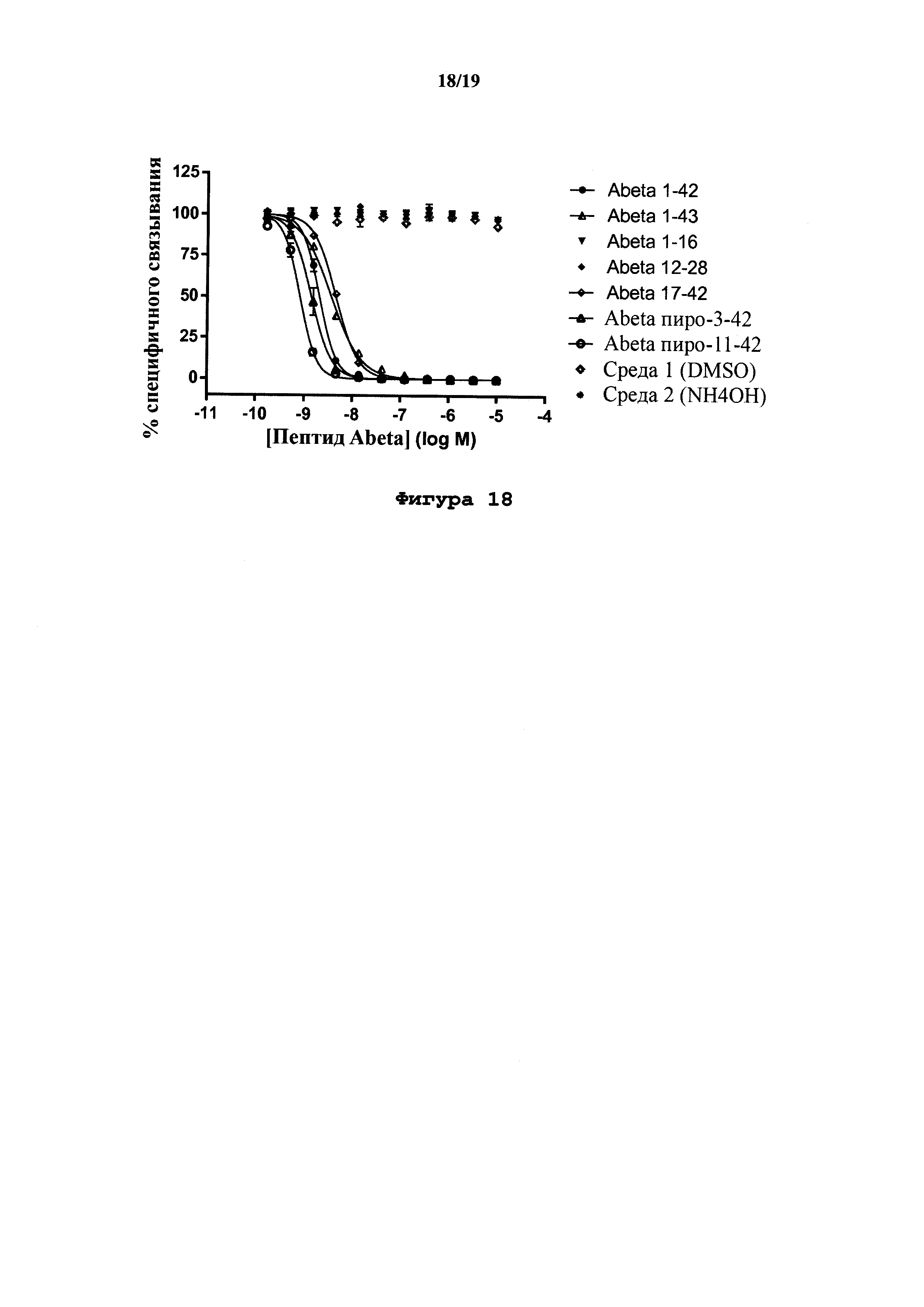
На фигуре 18 показана специфичность IgG1-TM Abet0380-GL в экспериментах по конкурентному связыванию с панелью из человеческих Abeta пептидов полной длины, усечений и пиро-пептидов (Abeta 1-42, Abeta 1-43, Abeta 1-16, Abeta 12-28, Abeta 17-42, Abeta пиро-3-42 или Abeta пиро-11-42), имеющих диапазон различных концентраций (от 10 мкМ с понижением до 0,17 нМ). Пояснение:







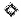

На оси х показана концентрация пептида Abeta в виде log М, на оси у показан % специфичного связывания. Ингибирование IgG1-TM Abet0380-GL: связывание Abeta 1-42 с N-концевым биотином наблюдали в случае Abeta 1-42, Abeta 1-43, Abeta 17-42, Abeta пиро-3-42 и Abeta пиро-11-42 со значениями IC50, варьирующими в диапазоне от 10-8 до 10-9 М для этой группы. Отсутствие ингибирования IgG1-TM Abet0380-GL: связывание с Abeta 1-42 с N-концевым биотином наблюдали в случае Abeta 1-16 или Abeta 12-28.
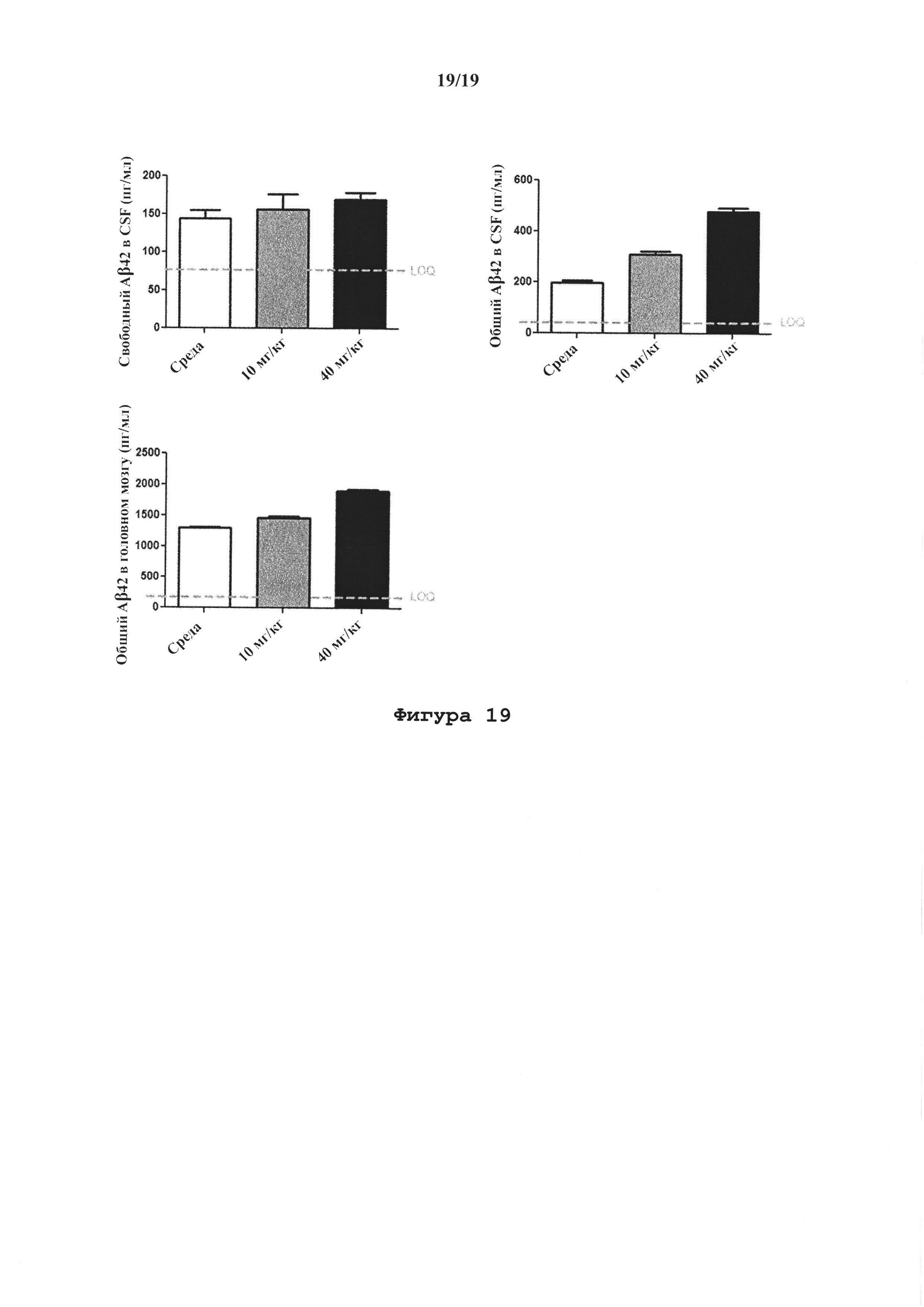
На фигуре 19 показана способность антитела Abet0144-GL удалять бета-амилоид 1-42 в PK-PD исследовании на нормальных крысах. На оси x показана среда или концентрация Abet0144-GL (10 мг/кг или 40 мг/кг), на оси у показана концентрация общего бета-амилоида 1-42 в CSF в пг/мл. Уровень свободного бета-амилоида 1-42 в CSF незначительно изменялся под действием либо 10, либо 40 мг/кг Abet0144-GL (повышение на 5 и 18%, соответственно, при сравнении со средой). Уровень общего бета-амилоида 1-42 в CSF значительно повышался на 38% при 10 мг/кг, и на 139% при 40 мг/кг. Уровень общего бета-амилоида 1-42 в ткани головного мозга также значительно повышался, на 16% и 50% при 10 и 40 мг/кг, соответственно. Данные из этого исследования на нормальных крысах демонстрируют, что Abet0144-GL не оказывал значительного влияния на уровни свободного бета-амилоида 1-42 в CSF, и в то же время повышал уровни общего бета-амилоида 1-42 как в CSF, так и в головном мозге.
Подробное описание
При помощи связывания изоформ Аβ 1-42 пептида и его N-терминальных усечений (n-42) в плазме, головном мозге и спинномозговой жидкости (CSF) связывающий элемент по настоящему изобретению может предупреждать накопление или способствовать устранению отложения изоформ Аβ n-42 в головном мозге и сосудистой системе головного мозга. Связывающие элементы по настоящему изобретению могут связывать и осаждать растворимый Аβ1-42 в сыворотке крови и/или в спинномозговой жидкости (CSF), тем самым, снижая концентрацию Аβ1-42 в плазме и/или CSF, соответственно. Они представляют собой тактику лечения болезни Альцгеймера и других состояний, ассоциированных с амилоидозом.
Связывающие элементы являются специфичными в отношении эпитопа-мишени в Аβ17-42, более конкретно в Аβ29-42, и связывают этот эпитоп-мишень с высокой аффинностью по сравнению с эпитопами, не являющимися мишенями, к примеру, эпитопами из Аβ1-40, тем самым, нацеливаясь на основные токсические молекулы, связанные с образованием амилоидных бляшек. К примеру, связывающий элемент может проявлять аффинность связывания с Аβ1-42, которая по меньшей мере в 10 раз, по меньшей мере в 100 раз, по меньшей мере в 1000 раз или по меньшей мере в 10000 раз больше аффинности связывания с Аβ1-40. Таким образом, связывающий элемент является селективным по преимущественному связыванию с Аβ1-42, а не с Аβ1-40. Как отмечено выше, связывающий элемент может связывать Аβ1-42 с константой диссоциации (Kd) 500 пМ или менее. Предпочтительно, он не проявляет значительного связывания с Аβ1-40. Аффинность и связывание можно определять с применением поверхностного плазмонного резонанса при помощи мономерного Аβ пептида, как описано в примерах.
Связывание с Аβ также можно измерять в анализе гомогенной флуоресценции с временным разрешением (HTRF™) для определения того, способно ли антитело конкурировать за связывание с Аβ с эталонной молекулой антитела к Аβ пептиду, как описано в примерах.
HTRF™-анализ представляет собой метод гомогенного анализа, который использует резонансный перенос энергии флуоресценции между донорным и акцепторным флуорофором, которые находятся в непосредственной близости. Такие анализы можно применять для измерения взаимодействия макромолекул при помощи прямого или непрямого присоединения одной из молекул, представляющих интерес, к донорному флуорофору, криптату европия (Eu3+), и присоединение другой молекулы, представляющей интерес, к акцепторному флуорофору XL665 (стабильный сшитый аллофикоцианин). Возбуждение молекулы криптата (при 337 нм) приводит к испусканию флуоресценции при 620 нм. Энергия, полученная в результате этого испускания, может переноситься к XL665, находящемуся в непосредственной близости от криптата, что приводит к испусканию специфичной долгоживущей флуоресценции (при 665 нм) от XL665. Измеряют специфичные сигналы как донора (при 620 нм), так и акцептора (при 665 нм), что делает возможным расчет соотношения 665/620 нм, что компенсирует присутствие окрашенных соединений в анализе.
Связывающий элемент согласно настоящему изобретению может конкурировать за связывание с Аβ1-42 и, таким образом, ингибировать связывание эталонного антитела в конкурентном HTFR™-анализе с Аβ1-42, но не с Аβ1-40. Связывающий элемент может проявлять по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85% или по меньшей мере 90% ингибирование связывания Abet0144GL с Аβ1-42 в HTRF™-анализе.
Активность ингибирования связывания может выражаться в виде значения IC50, в нМ, если не заявлено иное. В функциональных анализах IC50 представляет собой концентрацию молекулы антитела, которая уменьшает биологический ответ на 50% от своего максимального. В исследованиях по связыванию лиганда IC50 представляет собой концентрацию, которая уменьшает уровень связывания рецептора на 50% от уровня максимального специфичного связывания. IC50 можно рассчитать путем нанесения на график % максимального биологического ответа как зависимость от логарифма концентрации связывающегося элемента, а также при помощи программного обеспечения, такого как Prism (GraphPad) или Origin (Origin Labs), для подгонки сигмоидальной функции к данным с получением значения IC50. Подходящие анализы для измерения или определения активности хорошо известны в данной области техники.
Связывающий элемент может характеризоваться IC50, составляющей 5 нМ или меньше, например, 2 нМ или меньше, например, 1 нМ или меньше, в HTRF™-анализе конкуренции за эпитоп с Abet0144-GL и Aβ1-42. Abet0144-GL представляет собой молекулу антитела с VH-доменом под SEQ ID NO: 20 VH-домена и SEQ ID NO: 29. Его можно использовать в анализе в таком же формате, что и молекулу антитела, подлежащую тестированию, например в формате scFv или IgG, например IgG1. Таким образом, IgG молекулы антитела согласно настоящему изобретению могут конкурировать с IgG Abet0144-GL за связывание с человеческим Аβ1-42 в HTRF-анализе конкуренции за эпитоп. Активность в таком анализе может составлять менее 1 нМ.
Связывающий элемент согласно настоящему изобретению может проявлять специфичное связывание с Аβ1-42, превышающее связывание с Аβ1-40, как определено при помощи конкурентного HTRF™-анализа. В таком анализе Аβ1-40 может проявлять отсутствие значительного ингибирования связывания связывающего элемента с Аβ1-42 пептидом, например, он может проявлять менее 20%, например, менее 10% или менее 5% ингибирования в таком анализе, и предпочтительно не проявляет значительного ингибирования в таком анализе.
Связывающие элементы согласно настоящему изобретению распознают эпитоп в человеческом Аβ17-42, более конкретно в человеческом Аβ29-42, и могут также распознавать свой эпитоп-мишень в Аβ от другого вида, например мыши или крысы. Активность связывающего элемента, рассчитываемую в конкурентном HTRF™-анализе с применением Аβ1-42 от первого вида (например, человека), можно сравнивать с активностью связывающего элемента в таком же анализе с применением Аβ1-42 от второго вида (например, Аβ1-42 мыши), чтобы оценить степень перекрестной реактивности связывающего элемента в отношении Аβ1-42 этих двух видов. Активность, определяемая путем измерений IC50, может находиться в пределах 10-кратной или в пределах 100-кратной. Как отмечено выше, Abet0144GL можно применять как эталонное антитело в конкурентном HTRF™-анализе. Связывающие элементы, описанные в данном документе, могут характеризоваться большей активностью в анализе с применением человеческого Аβ1-42, чем в анализе с применением Аβ1-42, не являющегося человеческим.
Связывающий элемент может включать молекулу антитела с одним или несколькими CDR, например набором CDR, в каркасной области антитела (т.е. антиген-связывающий домен антитела). Например, молекула антитела может содержать VH- и/или VL-домены антитела. VH и VL домены молекул антитела также предусмотрены как часть настоящего изобретения. Как хорошо известно, VH и VL-домены содержат области, определяющие комплементарность ("CDR"), и каркасные области ("FW"). VH-домен содержит ряд HCDR, и VL-домен содержит ряд LCDR. Молекула антитела может содержать VH-домен антитела, содержащий CDR1, CDR2 и CDR3 VH, и/или VL-домен антитела, содержащий CDR1, CDR2 и CDR3 VL. VH- или VL-домены могут дополнительно включать каркасные области. Каркасные области VH- или VL-домена, как правило, включают четыре каркасных области, FW1, FW2, FW3 и FW4, которые расположены между CDR в следующей структуре: FW1-CDR1-FW2-CDR2-FW3-CDR3-FW4.
Примеры VH- и VL-доменов антител, FW и CDR согласно аспектам настоящего изобретения перечислены в таблицах 5 и 6 и прилагаемом перечне последовательностей, который является частью настоящего раскрытия. Все последовательности VH и VL, последовательности CDR, наборы CDR, наборы HCDR и наборы LCDR, раскрытые в данном документе, а также комбинации данных элементов, представляют аспекты настоящего изобретения. Как описано в данном документе, "набор CDR" включает CDR1, CDR2 и CDR3. Таким образом, набор HCDR относится к HCDR1, HCDR2 и HCDR3, а набор LCDR относится к LCDR1, LCDR2 и LCDR3. Если не указано иное, "ряд CDR" включает HCDR и LCDR. Как правило, молекулы антитела по настоящему изобретению являются моноклональными антителами.
В других вариантах осуществления связывающий элемент может содержать антигенсвязывающий участок в молекуле, не являющейся антителом, обычно образованный одной или несколькими CDR, например, набором CDR, в белковом каркасе, не являющимся антителом, как дополнительно обсуждается ниже.
Выделение исходной молекулы антитела, обозначенного Abet0007, с последующим осуществлением направленного мутагенеза CDR3 и отбором оптимизованного антитела Abet0144, осуществление модификации на уровне генов зародышевого типа до Abet0144-GL с набором последовательностей CDR и последовательностей каркасных областей, которые показаны в таблице 5, 6 и в перечне последовательностей, описано в данном документе. Благодаря масштабному процессу дальнейшей оптимизации и рекомбинации нескольких библиотек, как описано в примерах, из Abet0144GL получили панель клонов антител. Эти дополнительно оптимизированные клоны обозначены как Abet0380, Abet0319, Abet0321b, Abet0322b, Abet0323b, Abet0328, Abet0329, Abet0332, Abet0342, Abet0343, Abet0369, Abet0370, Abet0371, Abet0372, Abet0373, Abet0374, Abet0377, Abet0378, Abet0379, Abet0381, Abet0382 и Abet0383. Последовательности их CDR и последовательности их вариабельных доменов приведены в таблицах 5 и 6 и изложены в перечне последовательностей. Модифицированные на уровне генов зародышевого типа последовательности VH- и VL-доменов Abet0380GL, Abet0377GL, Abet0343GL, Abet0369GL и Abet0382GL показаны в таблице 8 и таблице 9.
К примеру, в таблицах 5 и 6 показано, что Abet0380 характеризуется набором CDR, в котором HCDR1 представляет собой SEQ ID NO: 525 (остатки 31-35 по Kabat), HCDR2 представляет собой SEQ ID NO: 526 (остатки 50-65 по Kabat), HCDR3 представляет собой SEQ ID NO: 527 (остатки 95-102 по Kabat), LCDR1 представляет собой SEQ ID NO: 534 (остатки 24-34 по Kabat), LCDR2 представляет собой SEQ ID NO: 535 (остатки 50-56 по Kabat), и LCDR3 представляет собой SEQ ID NO: 536 (остатки 89-97 по Kabat). Другие оптимизированные клоны антител аналогичным образом показаны в таблицах 5 и 6, и они также предусмотрены в качестве аспектов настоящего изобретения.
Связывающий элемент для человеческого Аβ1-42 в соответствии с настоящим изобретением может содержать один или несколько CDR, как описано в данном документе, например набор CDR. CDR или набор CDR могут представлять собой набор CDR из Abet0380, Abet0319, Abet0321b, Abet0322b, Abet0323b, Abet0328, Abet0329, Abet0332, Abet0342, Abet0343, Abet0369, Abet0370, Abet0371, Abet0372, Abet0373, Abet0374, Abet0377, Abet0378, Abet0379, Abet0381, Abet0382 и Abet0383 или их версии, модифицированной на уровне генов зародышевого типа, или могут представлять собой их вариант, как описано в данном документе.
В некоторых вариантах осуществления
HCDR1 может иметь длину 5 аминокислот, при этом состоять из остатков 31-35 по Kabat;
HCDR2 может иметь длину 17 аминокислот, при этом состоять из остатков 50-65 по Kabat;
HCDR3 может иметь длину 16 аминокислот, при этом состоять из остатков 95-102 по Kabat;
LCDR1 может иметь длину 11 аминокислот, при этом состоять из остатков 24-34 по Kabat;
LCDR2 может иметь длину 7 аминокислот, при этом состоять из остатков 50-56 по Kabat; и/или
LCDR3 может иметь длину 9 аминокислот, при этом состоять из остатков 89-97 по Kabat.
Связывающие элементы могут содержать HCDR1, HCDR2 и/или HCDR3 и/или LCDR1, LCDR2 и/или LCDR3 из любого из антител, перечисленных в таблицах 5 и 6, например набор CDR любого из антител, перечисленных в таблице 5 или 6. Связывающий элемент может содержать набор CDR VH из любого из этих антител. Необязательно он может также включать набор CDR VL из одного из этих антител. CDR VL могут быть из того же антитела, что и CDR VH, или из другого антитела. VH-домен, содержащий набор HCDR из любого из антител, перечисленных в таблице 5, и/или VL-домен, содержащий набор LCDR любого из антител, перечисленных в таблице 6, также предусмотрены в данном документе.
Связывающий элемент может содержать набор Н и/или L CDR любого из антител, перечисленных в таблицах 5 и 6, с одной или несколькими аминокислотными мутациями, например до 5, 10 или 15 мутаций, в раскрытом наборе Н и/или L CDR. Мутация может представлять собой аминокислотную замену, делению или вставку. К примеру, молекула антитела по настоящему изобретению может содержать набор Н и/или L CDR из любого из Abet0380, Abet0319, Abet0321b, Abet0322b, Abet0323b, Abet0328, Abet0329, Abet0332, Abet0342, Abet0343, Abet0369, Abet0370, Abet0371, Abet0372, Abet0373, Abet0374, Abet0377, Abet0378, Abet0379, Abet0381, Abet0382 и Abet0383 или их модифицированной на уровне генов зародышевого типа версии, с одной или двумя аминокислотными мутациями, например заменами.
К примеру, связывающий элемент может содержать
VH-домен, содержащий набор HCDR из Abet0380 или Abet0380GL, где аминокислотные последовательности HCDR из Abet0380 или Abet0380GL представляют собой
или содержащий набор HCDR из Abet0380 с одной или двумя аминокислотными мутациями, и
(ii) VL-домен, содержащий набор LCDR из Abet0380 или Abet0380GL, где аминокислотные последовательности LCDR из Abet0380 или Abet0380GL представляют собой
или содержащий набор LCDR из Abet0380 или Abet0380GL с одной или двумя аминокислотными мутациями.
Теоретически, мутации можно осуществлять в любом остатке в наборе CDR. В некоторых вариантах осуществления замены можно осуществлять в положениях, замещенных в любом из Abet0380, Abet0319, Abet0321b, Abet0322b, Abet0323b, Abet0328, Abet0329, Abet0332, Abet0342, Abet0343, Abet0369, Abet0370, Abet0371, Abet0372, Abet0373, Abet0374, Abet0377, Abet0378, Abet0379, Abet0381, Abet0382 и Abet0383 по сравнению с Abet0144GL, или в положениях, замещенных в любом из Abet0319, Abet0321b, Abet0322b, Abet0323b, Abet0328, Abet0329, Abet0332, Abet0342, Abet0343, Abet0369, Abet0370, Abet0371, Abet0372, Abet0373, Abet0374, Abet0377, Abet0378, Abet0379, Abet0381, Abet0382 и Abet0383 по сравнению с Abet0380 или в их модифицированных на уровне генов зародышевого типа версиях, которые показаны в таблицах 5 и 6.
К примеру, одна или несколько замен могут находиться в одном или нескольких из следующих остатков по Kabat:
26, 27, 28, 29 или 30 в FW1 VH;
31, 32, 33, 34 или 35 в CDR1 VH;
52а, 53, 54, 55, 56, 57, 58 или 62 в CDR2 VH;
98, 99, 100h или 102 в CDR3 VH;
24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 в CDR1 VL;
89, 90, 92, 93, 94 или 97 в CDR3 VL.
Примеры возможных аминокислотных замен в конкретных положениях остатков по Kabat показаны в таблицах 12 и 14 для VH-домена и таблицах 13 и 15 для VL-домена.
Как описано выше, связывающий элемент может включать молекулу антитела с одним или несколькими CDR, например набором CDR, в каркасной области антитела. Например, один или несколько CDR или набор CDR антитела могут быть перевиты в каркасную область (например, каркасную область человека) с получением молекулы антитела. Каркасные области могут относиться к последовательностям сегментов гена зародышевого типа человека. Таким образом, каркасная область может быть модифицирована на уровне генов зародышевого типа, в котором один или несколько остатков в пределах каркасной области изменены, чтобы соответствовать остаткам в эквивалентном положении в наиболее сходной каркасной области зародышевого типа человека. Специалист в данной области может выбрать сегмент зародышевого типа, который по последовательности наиболее близок к последовательности каркасной области антитела до модифицирования на уровне генов зародышевого типа, и протестировать аффинность или активность антител для подтверждения того, что модифицирование на уровне генов зародышевого типа существенно не уменьшает связывание антигена или активность в анализах, описываемых в данном документе. Последовательности сегментов гена зародышевого типа человека известны специалистам в данной области и к ним можно получить доступ, например, из компиляции VBASE (VBASE, Центр белковой инженерии совета медицинских исследований (MRC Centre of Protein Engineering), Великобритания, 1997, http//mrc-cpe.cam.ac.uk).
Связывающий элемент, как описано в данном документе, может представлять собой выделенную молекулу антитела человека с VH-доменом, содержащим набор HCDR в каркасной области зародышевого типа человека, например Vh3-23 DP-47. Таким образом, каркасные области FW1, FW2 и/или FW3 VH-домена могут включать каркасные области сегмента гена зародышевого типа человека Vh3-23 DP-47 и/или могут быть модифицированы на уровне генов зародышевого типа путем мутирования остатков каркасных областей, чтобы они совпадали с остатками каркасных областей этого сегмента гена зародышевого типа человека. FW4 может включать каркасную область сегмента j зародышевого типа человека.
Аминокислотная последовательность FW1 VH может представлять собой SEQ ID NO: 528. FW1 VH содержит серию остатков в положениях 26-30 по Kabat, которые, как полагают, участвуют в связывании антигена и/или важны для структурной конформации CDR1-петли. Замены можно включать в SEQ ID NO: 528, например, для синергического действия в отношении выбранной последовательности HCDR1. Одна или несколько замен необязательно могут быть выбраны из показанных в таблице 12 или таблице 14.
Аминокислотная последовательность FW2 VH может представлять собой SEQ ID NO: 529. Аминокислотная последовательность FW3 VH может представлять собой SEQ ID NO: 530. Аминокислотная последовательность FW4 VH может представлять собой SEQ ID NO: 531.
Обычно связывающий элемент также содержит VL-домен, содержащий набор LCDR, например, в каркасной области зародышевого типа человека, например V лямбда 23-3 DPL-23. Таким образом, каркасные области VL-домена могут включать каркасные области FW1, FW2 и/или FW3 сегмента гена зародышевого типа человека V лямбда 23-3 DPL-23 и/или могут быть модифицированы на уровне генов зародышевого типа путем мутирования остатков каркасных областей, чтобы они совпадали с остатками каркасных областей данного сегмента гена зародышевого типа человека. FW4 может включать каркасную область сегмента j зародышевого типа человека. Аминокислотная последовательность FW1 VL может представлять собой SEQ ID NO: 537. Аминокислотная последовательность FW2 VL может представлять собой SEQ ID NO: 538. Аминокислотная последовательность FW3 VL может представлять собой SEQ ID NO: 539. Аминокислотная последовательность FW4 VL может представлять собой SEQ ID NO: 540.
Модифицированный на уровне генов зародышевого типа VH- или VL-домен может быть модифицирован на уровне генов зародышевого типа в одном или нескольких остатках Вернье или может не быть модифицирован в них, но, как правило, не модифицирован.
Например, молекула антитела или VH-домен, описываемые в данном документе, могут содержать следующий набор каркасных областей тяжелой цепи:
FW1 SEQ ID NO: 528;
FW2 SEQ ID NO: 529;
FW3 SEQ ID NO: 530;
FW4 SEQ ID NO: 531;
или может содержать указанный набор каркасных областей тяжелой цепи с 1, 2, 3, 4, 5, 6 или 7 аминокислотными мутациями, например заменами.
Молекула антитела или VL-домен, описываемые в данном документе, могут включать следующий набор каркасных областей легкой цепи:
FW1 SEQ ID NO: 537;
FW2 SEQ ID NO: 538;
FW3 SEQ ID NO: 539;
FW4 SEQ ID NO: 540;
или может содержать указанный набор каркасных областей легкой цепи с 1, 2, 3, 4, 5 или 6 аминокислотными мутациями, например заменами.
Немодифицированная на уровне генов зародышевого типа молекула антитела имеет такие же CDR, но отличающиеся каркасные области по сравнению с модифицированной на уровне генов зародышевого типа молекулой антитела. Из последовательностей антител, показанных в данном документе в прилагаемом перечне последовательностей, последовательности Abet0144-GL, Abet0380-GL, Abet0377-GL, Abet0343-GL, Abet0369-GL и Abet0382-GL являются модифицированными на уровне генов зародышевого типа. Модифицированные на уровне генов зародышевого типа антитела из других молекул антител, последовательности которых раскрыты в данном документе, можно получить при помощи модифицирования на уровне генов зародышевого типа каркасных областей последовательностей их VH- и VL-домена, необязательно, в Vh3-23 DP-47 у VH-домена и V лямбда 23-3 DPL-23 у VL-домена.
Как правило, VH-домен составляет пару с VL-доменом для обеспечения антигенсвязывающего участка антитела, хотя, как обсуждается выше, VH- или VL-домен отдельно могут применяться для связывания антигена. К примеру, VH-домен Abet0380-GL (SEQ ID NO: 524) можно составлять в пару с VL-доменом Abet0380-GL (SEQ ID NO: 533), так что образуется антигенсвязывающий участок антитела, содержащий как VH-, так и VL-домены Abet0380-GL. Аналогичные варианты осуществления предусмотрены для VH- и VL-доменов других антител, описываемых в данном документе. В других вариантах осуществления VH Abet0380-GL составляют в пару с VL-доменом, не являющимся VL Abet0380-GL. Разнородность легкой цепи хорошо известна в данной области. Опять же, аналогичные варианты осуществления предусмотрены в настоящем изобретении для других VH- и VL-доменов, описываемых в данном документе. Таким образом, VH-домен, содержащий CDR VH или модифицированную на уровне генов зародышевого типа последовательность VH-домена из любого из Abet0319, Abet0321b, Abet0322b, Abet0323b, Abet0328, Abet0329, Abet0332, Abet0342, Abet0343, Abet0369, Abet0370, Abet0371, Abet0372, Abet0373, Abet0374, Abet0377, Abet0378, Abet0379, Abet0380, Abet0381, Abet0382 и Abet0383, может быть составлен в пару с VL-доменом, содержащем CDR VL или модифицированный на уровне генов зародышевого типа VL-домен из другого антитела, например VH- и VL-домены могут быть получены из различных антител, выбранных из Abet0319, Abet0321b, Abet0322b, Abet0323b, Abet0328, Abet0329, Abet0332, Abet0342, Abet0343, Abet0369, Abet0370, Abet0371, Abet0372, Abet0373, Abet0374, Abet0377, Abet0378, Abet0379, Abet0380, Abet0381, Abet0382 и Abet0383.
Связывающий элемент может содержать
(i) аминокислотную последовательность VH-домена, показанную в таблице 16 или в прилагаемом перечне последовательностей для любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их модифицированной на уровне генов зародышевого типа версии,
или содержать такую аминокислотную последовательность с одной или двумя аминокислотными мутациями; и
(ii) аминокислотную последовательность VL-домена, показанную в таблице 16 или в прилагаемом перечне последовательностей для любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их модифицированной на уровне генов зародышевого типа версии,
или содержать такую аминокислотную последовательность с одной или двумя аминокислотными мутациями.
Молекула антитела может содержать:
(i) VH-домен с аминокислотной последовательностью, которая по меньшей мере на 90%, 95% или 98% идентична аминокислотной последовательности VH-домена, показанной в таблице 16 для любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их модифицированной на уровне генов зародышевого типа версии; и
(ii) VL-домен с аминокислотной последовательностью, которая по меньшей мере на 90%, 95% или 98% идентична аминокислотной последовательности VL-домена, показанной в таблице 16 для любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382 или их модифицированной на уровне генов зародышевого типа версии.
Она может содержать VH-домен и VL-домен, которые по меньшей мере на 90%, 95% или 98% идентичны VH-домену и VL-домену, соответственно, из любого из Abet0380, Abet0343, Abet0369, Abet0377 и Abet0382, или их модифицированной на уровне генов зародышевого типа версии.
Связывающий элемент может содержать VH-домен и VL-домен, в которых
(i) аминокислотная последовательность VH-домена показана в SEQ ID NO: 524, а аминокислотная последовательность VL-домена показана в SEQ ID NO: 533.
(ii) аминокислотная последовательность VH-домена имеет 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных замен по сравнению с SEQ ID NO: 524, а аминокислотная последовательность VL-домена имеет 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных замен по сравнению с SEQ ID NO: 533 VL-домена, или
(iii) аминокислотная последовательность VH-домена характеризуется по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 524, а аминокислотная последовательность VL-домена характеризуется по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% идентичностью последовательности с SEQ ID NO: 533.
В некоторых вариантах осуществления молекула антитела может не иметь константных областей антитела, например scFv.
В других вариантах осуществления молекула антитела может содержать константную область антитела. Молекула антитела может представлять собой целое антитело, такое как IgG, т.е. IgG1, IgG2 или IgG4, или может представлять собой фрагмент или производное антитела, как описано ниже. Молекулы антитела также могут иметь другие форматы, например IgG1 с YTE (Dall'Acqua et al. (2002) J. Immunology, 169: 5171-5180; Dall'Acqua et al. (2006) J Biol. Chem. 281(33): 23514-24) и/или мутациями TM (Oganesyan et al. (2008) Acta Cryst D64: 700-4) в Fc-области.
Настоящее изобретение предусматривает связывающий элемент по настоящему изобретению с вариантной Fc-областью, где вариант содержит остаток фенилаланина (F) в положении 234, остаток фенилаланина (F) или остаток глутаминовой кислоты (Е) в положении 235 и остаток серина (S) в положении 331, пронумерованные посредством индекса EU, как приведено в Kabat. Такая комбинация мутаций далее в данном документе упоминается как тройной мутант (ТМ).
Связывающий элемент, как описано в данном документе, может включать CDR, VH-домен, VL-домен, антитело-антиген связывающий участок или молекулу антитела, которая кодируется последовательностью нуклеиновой кислоты, и/или вектор из любого из:
(i) номера доступа депонирования NCIMB 41889 (Abet0007);
(ii) номера доступа депонирования NCIMB 41890 (Abet0380-GL);
(iii) номера доступа депонирования NCIMB 41891 (Abet0144-GL);
(iv) номера доступа депонирования NCIMB 41892 (Abet0377-GL).
Связывающий элемент, как описано в данном документе, можно получать или иметь возможность получать из нуклеиновой кислоты, вектора или клеточной линии с номером доступа депонирования NCIMB 41889, 41890, 41891 или 41892. Например, связывающий элемент можно получать путем экспрессии нуклеиновой кислоты или вектора клеточной линии с номером доступа депонирования NCIMB 41890. Нуклеиновую кислоту или вектор можно экспрессировать при помощи любой удобной системы экспрессии. Альтернативно, связывающий элемент можно экспрессировать при помощи клеточной линии с номером доступа депонирования NCIMB 41889, 41890, 41891 или 41892.
В аспектах настоящего изобретения также предусмотрена нуклеиновая кислота, кодирующая VH- и/или VL-домены, которую содержит клеточная линия с номером доступа 41889, 41890, 41891 или 41892; вектор, содержащий указанную нуклеиновую кислоту, который содержит клеточная линия с номером доступа 41889, 41890, 41891 или 41892; и клетки или клеточная линия с номером доступа 41889, 41890, 41891 или 41892.
Связывающий элемент по настоящему изобретению может включать антигенсвязывающий участок антитела или молекулу антитела, которые конкурируют за связывание с человеческим Аβ1-42 с любой молекулой антитела, кодируемой нуклеиновой кислотой, депонированной под номером доступа 41889, 41890, 41891 или 41892, или с молекулой антитела, которая содержит аминокислотные последовательности VH-домена и VL-домена из Abet007, Abet0380-GL, Abet0144-GL или Abet0377-GL, как изложено в прилагаемом перечне последовательностей.
Связывающий элемент
Термин "связывающий элемент" описывает один элемент из пары молекул, которые связываются друг с другом. Элементы из пары связывания могут представлять собой полученные естественным путем или полученные полностью или частично синтетическим путем. Один элемент пары молекул содержит область на своей поверхности, или полость, которая связывается с и, следовательно, является комплементарной определенной пространственной и полярной организации другого элемента пары молекул. Примерами типов пар связывания являются антиген-антитело, биотин-авидин, гормон-рецептор гормона, рецептор-лиганд, фермент-субстрат. Настоящее изобретение касается реакций типа антиген-антитело.
Связывающий элемент обычно включает молекулу, имеющую антигенсвязывающий центр. Например, связывающий элемент может представлять собой молекулу антитела или белок, не являющийся антителом, которые содержат антигенсвязывающий центр.
Антигенсвязывающий участок можно получить при помощи расположения CDR на белковом каркасе, не являющимся антителом, таком как фибронектин или цитохром В и т.д. [Haan & Maggos (2004) BioCentury, 12(5): A1-A6; Koide et al. (1998) Journal of Molecular Biology, 284: 1141-1151; Nygren et al. (1997) Current Opinion in Structural Biology, 7: 463-469], или путем рандомизации или мутирования аминокислотных остатков петли в белковом каркаса для придания специфичности связывание с требуемой мишенью. Каркасы для конструирования новых участков связывания в белках подробно рассмотрены Nygren и соавт. [выше]. Каркасные белки для миметиков антител раскрыты в WO 00/34784, включенном в данном документе посредством ссылки во всей своей полноте, где авторы изобретения описывают белки (миметики антител), которые включают домен фибронектина типа III, содержащий по меньшей мере одну рандомизированную петлю. Подходящий каркас, на который перевивают один или несколько CDR, например набор HCDR или HCDR3 и/или LCDR3, можно получить из любого доменного элемента суперсемейства генов иммуноглобулинов. Остов может представлять собой человеческий белок или белок, не являющийся человеческим. Преимущество белкового каркасной структуры, не являющейся антителом, состоит в тот, что с помощью нее может быть получен антигенсвязывающий центр в молекуле каркасной структуры, меньшей, чем по меньшей мере некоторые молекулы антител, и/или которую легче производить. Малый размер связывающегося элемента может придавать полезные физиологические свойства, такие как способность попадать в клетки, проникать глубоко в ткани, или достигать мишеней в других структурах, или связываться в белковых полостях антигена-мишени. Применение антигенсвязывающих участков в белковых каркасах, не являющихся антителом, рассмотрено в Wess, 2004 [Wess, L.В: BioCentury, The Bernstein Report on BioBusiness, 12(42), A1-A7, 2004]. Типичными являются белки, обладающие стабильным остовом и одной или несколькими вариабельными петлями, в которых аминокислотная последовательность петли или петель является специфично или случайно мутированной для создания антигенсвязывающего участка, который связывается с антигеном-мишенью. Такие белки включают IgG-связывающие домены белка А из S.aureus, трансферрин, тетранектин, фибронектин (например, десятый домен фибронектина III типа), липокалины, а также гамма-кристаллин и другие каркасы Affilin™ (Scil Proteins). Примеры других подходов включают синтетические "микротела" на основе циклотидов - маленьких белков с внутримолекулярными дисульфидными связями, микропротеины (Versabodies™, Amunix) и белки с анкириновым повтором (DARPins, Molecular Partners).
В дополнение к последовательностям антител и/или антигенсвязывающему участку, связывающий элемент может включать другие аминокислоты, например, образующие пептид или полипептид, такой как свернутый домен, или придающие молекуле другую функциональную характеристику в дополнение к способности связывать антиген. Связывающиеся элементы могут нести детектируемую метку или могут быть конъюгированы с токсином или нацеливающим компонентом или ферментом (например, посредством пептидильной связи или линкера). Например, связывающий элемент может содержать каталитический центр (например, в ферментном домене), а также антигенсвязывающий центр, где антигенсвязывающий центр связывается с антигеном и, таким образом, нацеливает каталитический центр на антиген. Каталитический центр может ингибировать биологическую функцию антигена, например, путем расщепления.
Хотя, как отмечается, CDR могут удерживаться на каркасах, не являющихся антителами, структура для переноса CDR, например CDR3 или набора CDR по данному изобретению, будет, как правило, представлять собой последовательность тяжелой или легкой цепи антитела или ее существенную часть, в которой CDR или набор CDR расположен в месте, соответствующем CDR или набору CDR из природных VH- и VL-вариабельных доменов антител, кодируемых перегруппированными генами иммуноглобулинов. The structures and locations of immunoglobulin variable domains may be determined by reference to Kabat, et al., 1987 [Kabat, E.A. et al., Sequences of Proteins of Immunological Interest. 4th Edition. US Department of Health and Human Services. 1987] и их исправленные и дополненные издания. Ряд научных и коммерческих интерактивных ресурсов доступны для запросов в этой базе данных. Например, см. Martin, A.C.R. Accessing the Kabat Antibody Sequence Database by Computer PROTEINS: Structure, Function and Genetics, 25 (1996), 130-133 и ассоциированный интерактивный ресурс, доступный в настоящее время по веб-адресу http://www.bioinf.org.uk/abs/simkab.html.
Как предполагается, область CDR или CDR обозначают гипервариабельные области тяжелой и легкой цепей иммуноглобулина, как определено у Kabat и соавт. 1991 [Kabat, E.A. et al. (1991) Sequences of Proteins of Immunological Interest, 5th Edition. US Department of Health and Human Services, Public Service, NIH, Washington], и более поздние издания. Антитело, как правило, содержит 3 CDR тяжелой цепи и 3 CDR легкой цепи. Термин CDR или области CDR применяют в данном документе для обозначения, в зависимости от случая, одного или нескольких из данных областей, или даже данных областей в целом, которые содержат большинство аминокислотных остатков, ответственных за связывание посредством аффинности антитела к антигену или эпитопу, который оно распознает.
Среди шести коротких последовательностей CDR, третий CDR тяжелой цепи (HCDR3) характеризуется большей вариабельностью размера (большим разнообразием, главным образом, из-за механизмов распределения генов, которые приводят к его возрастанию). Он может состоять всего из 2 аминокислот, при этом самый длинный размер составляет 26. Длина CDR также может варьировать в зависимости от длины, которую может предоставлять конкретный лежащий в основе каркасной области. Функционально, HCDR3 частично играет роль в определении специфичности антитела (Segal et al., PNAS, 71:4298-4302, 1974; Amit et al., Science, 233:747-753, 1986; Chothia et al., J. Mol. Biol., 196:901-917, 1987; Chothia et al., Nature, 342:877-883, 1989; Caton et al., J. Immunol., 144:1965-1968, 199; Sharon et al., PNAS, 87:4814-4817, 1990; Sharon et al., J. Immunol., 144:4863-4869, 1990; и Kabat et al., J. Immunol., 147:1709-1719, 1991).
Молекула антитела
В данном разделе описан иммуноглобулин, полученный либо естественным, либо частично или полностью синтетическим путем. Выражение также охватывает любой полипептид или белок, содержащий антигенсвязывающий центр антитела. В данной ситуации следует понимать, что настоящее изобретение не относится к антителам в естественной форме, иными словами, что они не находятся в их природном окружении, но они могли были быть выделены или получены из природных источников путем очистки, либо, иначе, получены путем генетической рекомбинации или путем химического синтеза, и, следовательно, что они могут содержать неприродные аминокислоты, как будет описано ниже. Фрагменты антитела, которые содержат антигенсвязывающий участок антитела, включают без ограничений молекулы, такие как Fab, Fab', Fab'-SH, scFv, Fv, dAb и Fd. Были сконструированы различные другие молекулы антител, включающие один или несколько антигенсвязывающих участков антитела, в том числе, например Fab2, Fab3, диатела, тритела, тетратела и миниантитела. Молекулы антител и способы их конструирования и применения описаны в Holliger & Hudson, Nature Biotechnology 23(9):1126-1136 2005.
Возможно получать моноклональные и другие антитела и применять методики технологии рекомбинантных ДНК для получения других антител или химерных молекул, которые связывают антиген-мишень. Такие методики могут включать введение ДНК, кодирующей вариабельную область иммуноглобулина или CDR антитела, в гены константных областей или константных областей плюс каркасных участков различных иммуноглобулинов. См., например, ЕР-А-184187, GB 2188638А или ЕР-А-239400 и большое количество последующей литературы. Гибридому или другую клетку, вырабатывающую антитело, можно подвергать генетическому мутированию или другим изменениям, которые могут или не могут изменять специфичность связывания вырабатываемых антител.
Поскольку антитела можно модифицировать различными способами, термин "молекула антитела" следует рассматривать как охватывающий любой связывающий элемент или вещество, обладающие антигенсвязывающим участком антитела с требуемой специфичностью и/или связывающиеся с антигеном. Таким образом, данное выражение охватывает фрагменты и производные антитела, в том числе любой либо природный, либо полностью или частично синтетический полипептид, содержащий антигенсвязывающий центр антитела. Следовательно, охвачены химерные молекулы, содержащие антигенсвязывающий участок антитела или эквивалент, слитые с другим полипептидом (например, полученным от другого вида или принадлежащим к другому классу или подклассу антител). Клонирование и экспрессия химерных антител описаны в ЕР-А-0120694 и ЕР-А-0125023 и в большом количестве последующей литературы.
Дополнительные методики, доступные в области техники, связанной с разработкой антител, сделали возможным выделение человеческих и гуманизированных антител. Например, можно получать гибридомы человека, как описано в Kontermann & Dubel [Kontermann, R & Dubel, S, Antibody Engineering, Springer-Verlag New York, LLC; 2001, ISBN: 3540413545]. Фаговый дисплей, другая признанная методика получения связывающих элементов, была подробно описана во многих публикациях, таких как Kontermann & Dubel [выше] и WO 92/01047 (дополнительно обсуждают ниже), а также патенты США №№ US 5969108, US 5565332, US 5733743, US 5858657, US 5871907, US 5872215, US 5885793, US 5962255, US 6140471, US 6172197, US 6225447, US 6291650, US 6492160, US 6521404.
Трансгенных мышей, у которых гены мышиного антитела инактивированы и функционально заменены генами антитела человека, при этом оставлены интактными другие компоненты иммунной системы мыши, можно применять для выделения антител человека [Mendez, М. et al. (1997) Nature Genet, 15(2): 146-156]. Гуманизированные антитела могут быть получены с помощью методик, известных в уровне техники, таких как методики, раскрытые, например, в WO 91/09967, US 5585089, ЕР 592106, US 565332 и WO 93/17105. Кроме того, в WO 2004/006955 описаны способы гуманизирования антител, основанные на выборе последовательностей каркаса вариабельных областей из генов антител человека путем сравнения канонических типов структур CDR последовательностей CDR вариабельной области антитела, не являющегося человеческим, с каноническими типами структур CDR соответствующих CDR из библиотеки последовательностей антител человека, например, генных сегментов антитела зародышевого типа. Вариабельные области антитела человека, имеющие канонические типы структур CDR, сходные с CDR, не являющимися человеческими, образуют подмножество представителей последовательностей антитела человека, из которых можно выбирать последовательности каркаса человека. Представители подмножества могут быть дополнительно выстроены в ряд по сходству аминокислот между последовательностями CDR человека и не являющимися человеческими. В способе по WO 2004/006955, последовательности высокого ранга человека выбирают так, чтобы обеспечить последовательности каркасных областей для создания химерного антитела, которое функционально заменяет последовательности CDR человека аналогами CDR не принадлежащих человеку, с применением выбранных каркасных областей подгруппы элементов человека, получая, тем самым, гуманизированное антитело с высокой аффинностью и низкой иммуногенностью без необходимости сравнивать последовательности каркасных областей между антителами человека и не принадлежащими человеку. Также раскрыты химерные антитела, созданные согласно способу.
Синтетические молекулы антител можно создавать путем экспрессии генов, полученных при помощи олигонуклеотидов, синтезированных и собранных в пределах подходящих векторов экспрессии, например, как описано Knappik и соавт. [Knappik et al. J. Mol. Biol. (2000) 296, 57-86] или Krebs и соавт. [Krebs et al. Journal of Immunological Methods 254 2001 67-84].
Было показано, что фрагменты полного антитела могут выполнять функцию связывания антигенов. Примеры связывающих фрагментов представляют собой (i) Fab-фрагмент, состоящий из VL-, VH-, CL- и СН1-доменов; (ii) Fd-фрагмент, состоящий из VH- и CH1-доменов; (iii) Fv-фрагмент, состоящий из VL- и VH-доменов одного антитела; (iv) dAb-фрагмент [Ward, E.S. et al., Nature 341, 544-546 (1989); McCafferty et al. (1990) Nature, 348, 552-554; Holt et al. (2003) Trends in Biotechnology 21, 484-490], который состоит из VH- или VL-домена; (v) выделенные CDR-области; (vi) Р(ab’)2-фрагменты, бивалентный фрагмент, содержащий два соединенных Fab-фрагмента, (vii) одноцепочечные Fv-молекулы (scFv), где VH-домен и VL-домен связаны пептидным линкером, который обеспечивает возможность двум доменам связываться с образованием антигенсвязывающего участка [Bird et al., Science, 242, 423-426, 1988; Huston et al., PNAS USA, 85, 5879-5883, 1988]; (viii) биспецифичные одноцепочечные Fv-димеры (PCT/US 92/09965) и (ix) "диатела", мультивалентные или мультиспецифичные фрагменты, сконструированные посредством слияния генов (WO 94/13804; Holliger, P. et al., Proc. Natl. Acad. Sci. USA 90 6444-6448, 1993). Молекулы Fv, scFv или диатела можно стабилизировать путем встраивания дисульфидных мостиков, соединяющих VH- и VL-домены [Reiter, Y. et al., Nature Biotech, 14, 1239-1245, 1996]. Также можно создавать миниантитела, содержащие scFv, присоединенный к СН3-домену [Hu, S. et al., Cancer Res., 56, 3055-3061, 1996]. Другие примеры связывающих фрагментов представляют собой Fab', который отличается от Fab-фрагментов добавлением нескольких остатков на карбоксильном конце СН1-домена тяжелой цепи, в том числе одного или нескольких цистеинов из шарнирной области антитела, и Fab'-SH, который представляет собой Fab'-фрагмент, в котором цистеиновый(е) остаток(и) константных доменов несет(несут) свободную тиоловую группу.
Qui и соавт. [Qui et al., Nat. Biotechnol 25: 921-929 2007] описали молекулы антител, содержащие всего два CDR, связанные каркасной областью. CDR3 из VH или VL-домена соединяли с петлей CDR1 или CDR2 другого домена. Связь осуществлялась через С-конец выбранной CDR1 или CDR2 к N-концу CDR3 посредством FR-области. Qui и соавт. выбрали FR-область, обладающую наименьшим количеством гидрофобных отрезков. Установили, что наилучшей комбинацией для протестированного антитела является CDR1 VL, связанный посредством FR2 VH с CDR3 VH (CDR1VH-FR2VH-CDR3VL). При молекулярном весе приблизительно 3 кДа, эти молекулы антитела дают преимущества с точки зрения улучшения проникновения в ткани по сравнению с полноценными иммуноглобулинами (около 150 кДа) или scFv (около 28 кДа).
Фрагменты антитела по настоящему изобретению можно получать, начиная с любого из антител, перечисленных в данном документе, такими способами, как расщепление ферментами, например пепсином или папаином, и/или путем расщепления дисульфидных мостиков химическим восстановлением. В еще одном способе фрагменты антитела, включенные в настоящее изобретение, можно получать с помощью методик генетической рекомбинации, также хорошо известных специалисту в данной области, или же путем пептидного синтеза, например при помощи автоматических синтезаторов пептидов, таких как поставляемые компанией Applied Biosystems и т.д., или путем синтеза и экспрессии нуклеиновых кислот.
Функциональные фрагменты антитела, согласно настоящему изобретению, включают любой функциональный фрагмент, время полужизни которого увеличено путем химического модифицирования, особенно ПЕГилированием, либо путем введения в липосому.
dAb (доменное антитело) представляет собой небольшой мономерный антигенсвязывающий фрагмент антитела, а именно вариабельную область тяжелой или легкой цепи антитела. VH dAb встречаются в природе у верблюдовых (например, верблюда, ламы) и их можно получить посредством иммунизации представителя верблюдовых антигеном-мишенью, выделения антиген-специфичных В-клеток и прямого клонирования генов dAb из отдельных В-клеток. dAb также может вырабатываться в культуре клеток. Их малый размер, хорошая растворимость и температурная устойчивость делает их особенно пригодными в физиологическом отношении и подходящими для отбора и созревания аффинности. VH dAb верблюдовых находятся в разработке для терапевтического применения под названием "nanobodies™". Связывающий элемент по настоящему изобретению может представлять собой dAb, содержащее VH- или VL-домен, по сути приведенный в данном документе, или VH- или VL-домен, содержащий ряд CDR, по сути приведенных в данном документе.
Биспецифические или бифункциональные антитела образуют второе поколение моноклональных антител, в которых две различные вариабельные области объединены в одной молекуле [Holliger and Bohlen 1999 Cancer and Metastasis Rev. 18. 411-419]. Их применение было продемонстрировано как в области диагностики, так и в области терапии благодаря их способности выполнять новые эффекторные функции или нацеливаться на несколько молекул на поверхности опухолевых клеток. При необходимости применять биспецифичные антитела, они могут представлять собой традиционные биспецифичные антитела, которые можно получать различными способами [Holliger, P. and Winter G. Current Opinion Biotechnol 4, 446-449. 1993], например, полученные химическим способом или при помощи гибридных гибридом, или они могут представлять собой любой из фрагментов биспецифичных антител, указанных выше. Эти антитела можно получить при помощи химических способов [Glennie М J et al., 1987 J. Immunol. 139, 2367-2375; Repp R. et al., 1995 J. Hemat. 377-382] или соматических способов [Staerz U.D. and Bevan M.J. 1986 PNAS 83; Suresh M.R. et al., 1986 Methods Enzymol. 121: 210-228], но, кроме того и преимущественно, при помощи методик генной инженерии, которые обеспечивают возможность усиления гетеродимеризации и, таким образом, облегчают процесс очистки искомых антител [Merchand et al., 1998 Nature Biotech. 16: 677-681]. Примеры биспецифических антител включают биспецифические антитела технологии BiTE™, в которых могут быть использованы связывающие домены двух антител с различной специфичностью и могут быть напрямую связаны посредством коротких гибких пептидов. Таким образом комбинируют два антитела на одной короткой полипептидной цепи. Диатела и scFv могут быть сконструированы без Fc-области с использованием только вариабельных доменов, потенциально снижающих эффекты антиидиотипической реакции.
Биспецифичные антитела можно сконструировать в виде полного IgG, в виде биспецифичного Fab'2, в виде Fab'PEG, в виде диател или в виде биспецифичного scFv. Дополнительно, два биспецифичных антитела можно связать с использованием стандартных способов, известных в данной области, с образованием четырехвалентных антител.
Биспецифичные диатела, в отличие от биспецифичных полных антител, могут также быть особенно пригодными, поскольку их можно легко конструировать и экспрессировать в Е. coli. Диатела (и многие другие полипептиды, такие как фрагменты антитела) с подходящей специфичностью связывания можно легко выбрать с применением фагового дисплея (WO 94/13804) из библиотек. Если одно плечо диатела следует сохранить константным, например со специфичностью, направленной против бета-амилоида, как описано в данном документе, то можно создать библиотеку, в которой варьирует другое плечо, и выбирать антитело с подходящей специфичностью. Биспецифичные целые антитела можно создавать при помощи альтернативных способов генной инженерии, как описано у Ridgeway и соавт., 1996 [Ridgeway, J.В.В. et al., Protein Eng., 9, 616-621, 1996].
В области техники доступны различные способы получения антител. Антитела могут представлять собой моноклональные антитела, особенно, человеческого, мышиного, химерного или гуманизированного происхождения, которые можно получить в соответствии со стандартными способами, хорошо известными специалисту в данной области.
В целом, для получения моноклональных антител или их функциональных фрагментов, особенно мышиного происхождения, можно обращаться к методикам, которые описаны, в частности, в руководстве "Antibodies" [Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor N.Y., pp. 726, 1988], или к методике получения с помощью гибридом, описанной у
Моноклональные антитела можно получить, например, с помощью животной клетки, иммунизированной человеческим Аβ1-42 или одним из его фрагментов, содержащих эпитоп, распознаваемый указанными моноклональными антителами, например Аβ17-42. Подходящие фрагменты и пептиды или полипептиды, содержащие их, описаны в данном документе, и их можно применять для иммунизации животных с получением антител против Аβ1-42. Указанный антиген или один из его фрагментов можно, в частности, получить в соответствии с обычными рабочими способами, при помощи генетической рекомбинации, начиная с последовательности нуклеиновой кислоты, содержащейся в последовательности кДНК, кодирующей Аβ1-42 или его фрагмент, при помощи пептидного синтеза, начиная с последовательности аминокислот, содержащейся в пептидной последовательности Аβ1-42 и/или его фрагмента.
Моноклональные антитела, например, можно очищать на колонке для аффинной хроматографии, на которой предварительно был иммибилизован человеческий Аβ1-42 или один из его фрагментов, содержащий эпитоп, распознаваемый указанными моноклональными антителами, например Аβ17-42. Более конкретно, моноклональные антитела можно очистить с помощью хроматографии с применением белка А и/или G, за которой следует или не следует ионообменная хроматография, направленная на устранение остаточных белковых примесей, а также ДНК и LPS, за которой следует или не следует гель-хроматография на сефарозном геле для устранения возможных агрегатов из-за присутствия димеров или других мультимеров. В одном варианте осуществления можно применять все данные методики одновременно или последовательно.
Антигенсвязывающий центр
В данном разделе описана часть молекулы, которая связывается со всем или частью антигена-мишени и комплементарна таковым. В молекуле антитела ее называют антигенсвязывающим участком антитела, и она составляет часть антитела, которая связывается со всем или частью антигена-мишени и комплементарна таковым. В случае, когда антиген большой, антитело может связываться только с конкретной частью антигена, данная часть которого называется эпитоп. Антигенсвязывающий центр антитела может быть представлен одним или несколькими вариабельными доменами антитела. Антигенсвязывающий участок антитела может содержать вариабельную область легкой цепи антитела (VL) и вариабельную область тяжелой цепи антитела (VH).
В WO 2006/072620 описано конструирование антигенсвязывающих участков в структурных (не CDR) петлях, расположенных между бета-цепями доменов иммуноглобулина. Антигенсвязывающий участок может быть сконструирован в области молекулы антитела, отделенной от естественного расположения CDR, например в каркасной области VH- или VL-домена или в константном домене антитела, например СН1 и/или СН3. Антигенсвязывающий участок, сконструированный в структурной области, может дополнять или заменять антигенсвязывающий участок, образованный наборами CDR из VH- и VL-домена. Если в молекуле антитела присутствуют множественные антигенсвязывающие участки, они могут связывать один и тот же антиген (антиген-мишень), тем самым увеличивая валентность связывающего элемента. Альтернативно, множественные антигенсвязывающие участки могут связывать различные антигены (антиген-мишень и один или несколько других антигенов), что может быть использовано для добавления эффекторных функций, продления времени полужизни или улучшения доставки молекулы антитела in vivo.
Выделенные
Это означает состояние, в котором связывающие элементы по настоящему изобретению или нуклеиновая кислота, кодирующая такие связывающие элементы, как правило, будут в целом соответствовать настоящему изобретению. Таким образом, связывающие элементы, VH- и/или VL-домены, а также кодирующие молекулы нуклеиновых кислот и векторы согласно настоящему изобретению можно получать выделенными и/или очищенными, например, из их природного окружения, фактически в чистой или гомогенной форме, или, в случае нуклеиновой кислоты, не содержащими или фактически не содержащими нуклеиновую кислоту или гены с иным происхождением, чем последовательность, кодирующая полипептид с требуемой функцией. Выделенные элементы и выделенная нуклеиновая кислота не будут содержать или фактически не будут содержать материал, с которым они связаны в естественных условиях, например другие полипептиды или нуклеиновые кислоты, с которыми их обнаруживают в их природном окружении или среде, в которой их получают (например, клеточной культуре), если такое получение осуществляют при помощи технологии рекомбинантной ДНК, применяемой на практике in vitro или in vivo. Элементы и нуклеиновую кислоту можно составлять с разбавителями или вспомогательными веществами, и оставлять, для практических целей, выделенными - например элементы, как правило, будут смешивать с желатином или другими носителями, в случае применения для покрытия микротитрационных планшетов для применения в иммунологических анализах, или будут смешивать с фармацевтически приемлемыми носителями или разбавителями при применении в диагностике или терапии. Связывающие элементы могут быть гликозилированными либо естественным путем, либо с помощью систем гетерологичных эукариотических клеток (например, клетки СНО или NS0 (ЕСАСС 85110503)), или они могут быть негликозилированными (например, при получении путем экспрессии в прокариотической клетке).
Гетерогенные препараты, содержащие молекулы антитела, также образуют часть настоящего изобретения. Например, такие препараты могут представлять собой смеси антител с тяжелыми цепями полной длины и тяжелыми цепями с отсутствием лизина на С-конце, с различной степенью гликозилирования и/или с дериватизированными аминокислотами, как, например, циклизация N-концевой глутаминовой кислоты с образованием остатка пироглутаминовой кислоты.
Применяемое в данном документе выражение "фактически, как изложено" относят к характеристике(ам) соответствующих областей CDR из VH- или VL-домена связывающих элементов, описываемых в данном документе, которые являются либо идентичными, либо в высокой степени подобны указанным областям, последовательность которых изложена в данном документе. Как описано в данном документе, выражение "в высокой степени подобные" по отношению к указанной(ым) области(ям) одного или нескольких вариабельных доменов, предполагает, что в CDR и/или VH- или VL-домене можно осуществить 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислотных замен.
Как отмечено выше, связывающий элемент согласно настоящему изобретению связывает человеческий Аβ1-42. Как описано в данном документе, связывающие элементы по настоящему изобретению можно оптимизировать в отношении аффинности и/или в отношении активности ингибирования в конкурентном HTRF™-анализе. В целом, оптимизация активности подразумевает мутирование последовательности выбранного связывающего элемента (обычно последовательности вариабельного домена антитела) для создания библиотеки связывающих элементов, которые затем анализируют на активность и выбирают более активные связывающие элементы. Таким образом, выбранные "оптимизированные в отношении активности" связывающие элементы, как правило, обладают более высокой активностью, чем связывающий элемент, из которого создали библиотеку. Тем не менее, связывающие элементы с высокой активностью можно также получать без оптимизации, например связывающий элемент с высокой активностью можно получить непосредственно при предварительном отборе. Анализы и активности более подробно описаны в другом месте в данном документе. Специалист в данной области, таким образом, может получать связывающие элементы с высокой активностью.
В дополнительном аспекте настоящее изобретение предусматривает способ получения одного или нескольких связывающих элементов, способных связывать антиген, при этом способ включает приведение библиотеки связывающих элементов согласно настоящему изобретению в контакт с указанным антигеном и выбор одного или нескольких связывающих элементов библиотеки, способных связывать указанный антиген.
Библиотека может быть представлена на частицах или молекулярных комплексах, например реплицируемых генетических пакетах, таких как дрожжи, бактериальные частицы или частицы бактериофага (например, Т7), вирусы, клетки или ковалентные, рибосомные или другие in vitro системы дисплея, при этом каждая частица или молекулярный комплекс содержит нуклеиновую кислоту, кодирующую VH-вариабельный домен антитела, представленный на ней, и необязательно также представленный VL-домен, в случае его присутствия. Фаговый дисплей описан в WO 92/01047 и, например, патентах США №№ US 5969108, US 5565332, US 5733743, US 5858657, US 5871907, US 5872215, US 5885793, US 5962255, US 6140471, US 6172197, US 6225447, US 6291650, US 6492160 и US 6521404, каждый из которых включен в данный документ посредством ссылки во всей своей полноте. Рибосомный дисплей описан в Hanes J and

После выбора связывающих элементов, способных связывать антиген и представленных на бактериофаге или других частицах или молекулярных комплексах библиотеки, нуклеиновую кислоту можно извлекать из бактериофага, или другой частицы, или молекулярного комплекса, представляющих указанный выбранный связывающий элемент. Такую нуклеиновую кислоту можно применять в последующем получении связывающего элемента или VH- или VL-вариабельного домена антитела путем экспрессии на основании нуклеиновой кислоты, при этом последовательность нуклеиновой кислоты извлечена из бактериофага, или другой частицы, или молекулярного комплекса, представляющих указанный выбранный связывающий элемент.
VH-вариабельный домен антитела с аминокислотной последовательностью VH-вариабельного домена антитела указанного выбранного связывающего элемента может быть получен в выделенной форме, как и связывающий элемент, содержащий такой VH-домен.
Способность связывать человеческий Аβ1-42 и Аβ1-40 можно дополнительно тестировать, а также способность конкурировать, например, с любым из антител, перечисленных в данном документе (например, формате scFv и/или формате IgG, например IgG2 или IgG1) за связывание с человеческим Аβ1-42. Можно тестировать способность нейтрализовать Aβ1-42, как дополнительно обсуждается в другом месте в данном документе.
Связывающий элемент может связывать человеческий Аβ1-42 с аффинностью, свойственной любому из антител, перечисленных в таблицах 5 и 6, например scFv, IgG2, IgG1TM или IgG1, или с аффинностью, которая является лучшей. Аффинности связывания антител показаны в таблице 7. Аффинность связывания и активность нейтрализации различных связывающих элементов можно сравнивать при соответствующих условиях.
Варианты VH- и VL-доменов и CDR, описанных в данном документе, в том числе те, аминокислотные последовательности которых изложены в данном документе, и которые можно использовать в связывающих элементах для Аβ1-42, можно получать при помощи способов изменения или мутирования последовательности и скрининга в отношении антигенсвязывающих элементов с требуемыми характеристиками. Примеры требуемых характеристик включают без ограничений: повышенную аффинность связывания антигена по сравнению с известными антителами, которые являются специфичными для антигена, усиленную нейтрализацию активности антигена по сравнению с известными антителами, которые являются специфичными для антигена, если активность известна, указанную способность конкурировать с известным антителом или лигандом антигена при определенном молярном соотношении, способность к иммунопреципитации комплекса, способность связываться с указанным эпитопом: линейным эпитопом, например пептидной последовательностью, выявленной с применением сканирования связывания пептидов, как описано в данном документе, например, с применением пептидов, подвергнутых скринингу в линейной и/или затрудненной конформации, или конформационным эпитопом, образованным при помощи несмежных остатков; и способность к модуляции новой биологической активности человеческого Аβ1-42. В данном документе также предложены такие способы.
Варианты молекул антитела, раскрытых в данном документе, можно получать и применять в настоящем изобретении. Следуя примеру вычислительной химии в применении методик многофакторного анализа данных к соотношениям структура/свойство - активность [см., например, Wold, et al. Multivariate data analysis in chemistry. Chemometrics-Mathematics and Statistics in Chemistry (Ed.: B. Kowalski); D. Reidel Publishing Company, Dordrecht, Holland, 1984 (ISBN 90-277-1846-6], количественные соотношения активность-свойство антител можно получить с применением хорошо известных математических методик, таких как статистическая регрессия, распознавание образов и классификация [см., например, Norman et al. Applied Regression Analysis. Wiley-Interscience; 3rd edition (April 1998) ISBN: 0471170828; Kandel, Abraham et al. Computer-Assisted Reasoning in Cluster Analysis. Prentice Hall PTR, (May 11, 1995), ISBN: 0133418847; Krzanowski, Wojtek. Principles of Multivariate Analysis: A User's Perspective (Oxford Statistical Science Series, No 22 (Paper)). Oxford University Press; (December 2000), ISBN:.0.198507089; Witten, Ian H. et al Data Mining: Practical Machine Learning Tools and Techniques with Java Implementations. Morgan Kaufmann; (October 11, 1999), ISBN: 1558605525; Denison David G. T. (Editor) et al Bayesian Methods for Nonlinear Classification and Regression (Wiley Series in Probability and Statistics). John Wiley & Sons; (July 2002), ISBN: 0471490369; Ghose, Amp K. et al. Combinatorial Library Design and Evaluation Principles, Software, Tools, and Applications in Drug Discovery. ISBN: 0-8247-0487-8]. Свойства антител можно вывести на основании эмпирических и теоретических моделей (например, анализа вероятных соприкасающихся остатков или расчетных физико-химические свойств) последовательности антитела, функциональных и трехмерных структур, и данные свойства можно рассматривать индивидуально и в комбинации.
Антигенсвязывающий участок антитела, состоящий из VH-домена и VL-домена, как правило, образован шестью петлями полипептида: тремя, образованными вариабельным доменом легкой цепи (VL), и тремя, Образованными вариабельным доменом тяжелой цепи (VH). Анализ антител с известной атомной структурой выявил взаимосвязи между последовательностью и трехмерной структурой паратопов антитела [Chothia С. et al. Journal Molecular Biology (1992) 227, 799-817; Al-Lazikani, et al. Journal Molecular Biology (1997) 273(4), 927-948]. Данные взаимосвязи подразумевают, что за исключением третьего участка (петли) в VH-доменах, петли центра связывания имеют одну из небольшого количества конформаций основной цепи - канонические структуры. Как было показано, каноническая структура, имеющая форму специфической петли, определяется ее размером и присутствием определенных остатков в ключевых участках, как в петле, так и в каркасных областях.
Данное исследование взаимосвязи последовательность-структура можно применять для прогнозирования остатков в антителе с известной последовательностью, но с неизвестной трехмерной структурой, которые важны для поддержания трехмерной структуры его петель CDR и, следовательно, поддерживают специфичность связывания. Эти прогнозы можно подкреплять путем сравнения прогнозов с выходными данными предварительных оптимизационных экспериментов. При структурном подходе можно создать модель молекулы антитела [Chothia, et al. Science, 223, 755-758 (1986)] с применением любого свободно доступного или коммерческого пакета, такого как WAM [Whitelegg, N.R.u. and Rees, A.R (2000). Prot. Eng., 12, 815-824]. Пакет программного обеспечения для визуализации и анализа белков, такой как Insight II (Accelrys, Inc.) или Deep View [Guex, N. and Peitsch, M.C. Electrophoresis (1997) 18, 2714-2723] можно затем применять для оценки возможных замен в каждом положении в CDR. Данную информацию можно затем использовать для того, чтобы сделать так, что замены вероятно будут оказывать минимальный или благоприятный эффект на активность.
Методики, необходимые для осуществления замен в аминокислотных последовательностях CDR VH- или VL-доменов антитела, и связывающие элементы, как правило, доступны в уровне техники. Можно создавать вариантные последовательности с заменами, которые, как прогнозируют, могут оказывать или могут не оказывать минимальное или благоприятное влияние на активность, и тестировать их в отношении способности связывать Аβ1-42 и/или в отношении любого другого требуемого свойства.
Варианты аминокислотных последовательностей вариабельных доменов любого из VH- и VL-доменов, чьи последовательности, в частности, раскрыты в данном документе, как рассматривалось, можно использовать согласно настоящему изобретению.
Как описано выше, аспекты настоящего изобретения предусматривают связывающий элемент, такой как молекула антитела, содержащая VH-домен, аминокислотная последовательность которого по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична аминокислотной последовательности VH-домена любого из антител, перечисленных в данном документе, для которых последовательности VH-домена показаны в прилагаемом ниже перечне последовательностей; и/или содержащая VL-домен, аминокислотная последовательность которого по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична аминокислотной последовательности VL-домена любого из антител, перечисленных в таблице 11, для которых последовательности VL-домена показаны в прилагаемом перечне последовательностей.
Аспекты настоящего изобретения предусматривают связывающий элемент, такой как молекула антитела, содержащая VH-домен с набором CDR VH, аминокислотные последовательности которых по меньшей мере на 75%, по меньшей мере на 80%), по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичны аминокислотным последовательностям набора CDR VH любого из антител, перечисленных в данном документе, для которых последовательности CDR VH показаны в данном документе, и/или содержащая VL-домен с набором CDR VL, аминокислотные последовательности которых по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичны аминокислотным последовательностям набора CDR VL любого из антител, перечисленных в данном документе, для которых последовательности CDR VL показаны в данном документе.
Алгоритмы, которые можно применять для расчета % идентичности двух аминокислотных последовательностей, включают, например, BLAST [Altschul et al. (1990) J. Mol. Biol. 215: 405-410], FASTA [Pearson and Lipman (1988) PNAS USA 85: 2444-2448] или алгоритм Смита-Ватермана [Smith and Waterman (1981) J. Mol Biol. 147: 195-197], например, при использовании параметров по умолчанию.
Конкретные вариабельные домены могут включать одну или несколько мутаций аминокислотных последовательностей (замену, делецию и/или вставку аминокислотного остатка) и менее чем приблизительно 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2.
Мутации можно выполнять в одной или нескольких каркасных областях и/или в одном или нескольких CDR. Мутации обычно не приводят к потере функции, поэтому связывающий элемент, содержащий измененную таким образом аминокислотную последовательность, может сохранять способность связывать человеческий Аβ1-42. Он может сохранять такие же количественные характеристики способности к связыванию и/или нейтрализации, как у связывающего элемента, в котором изменение не выполняли, например, как измерено в анализе, описанном в данном документе. Связывающий элемент, содержащий измененную таким образом аминокислотную последовательность может характеризоваться улучшенной способностью связывать человеческий Аβ1-42.
Мутация может включать замену одного или нескольких аминокислотных остатков на не встречающуюся в природе или нестандартную аминокислоту, модифицируя один или несколько аминокислотных остатков с получением не встречающейся в природе или нестандартной формы, или вставку одной или нескольких не встречающихся в природе или нестандартных аминокислот в последовательность. Примеры числа и местоположений изменений в последовательностях по настоящему изобретению описаны в других частях данного документа. Встречающиеся в природе аминокислоты включают 20 "стандартных" L-аминокислот, обозначаемых как G, А, V, L, I, М, Р, F, W, S, Т, N, Q, Y, С, K, R, Н, D, Е их стандартным однобуквенным кодом. Нестандартные аминокислоты включают любой другой остаток, который может быть внедрен в полипептидный скелет или который получен в результате модификации существующего аминокислотного остатка. Нестандартные аминокислоты могут быть встречающимися в природе или не встречающимися в природе. В данной области известен ряд встречающихся в природе нестандартных аминокислот, таких как 4-гидроксипролин, 5-гидроксилизин, 3-метилгистидин, N-ацетилсерин и др. [Voet & Voet, Biochemistry, 2nd Edition, (Wiley) 1995]. Аминокислотные остатки, дериватизированные по их N-альфа-положению, будут расположены только на N-конце аминокислотной последовательности. Как правило, в настоящем изобретении аминокислота представляет собой L-аминокислоту, однако она может представлять собой D-аминокислоту. Изменение может, таким образом, включать модификацию L-аминокислоты с получением D-аминокислоты или замену ее таковой. Метилированные, ацетилированные и/или фосфорилированные формы аминокислот также известны, и аминокислоты в настоящем изобретении могут быть подвергнуты таким модификациям.
Аминокислотные последовательности в доменах антитела и связывающие элементы по настоящему изобретению могут содержать неприродные или нестандартные аминокислоты, описанные выше. Нестандартные аминокислоты (например, D-аминокислоты) могут быть внедрены в аминокислотную последовательность во время синтеза или с помощью модификации или замены "первоначальных" стандартных аминокислот после синтеза аминокислотной последовательности.
Применение нестандартных и/или не встречающихся в природе аминокислот увеличивает структурное и функциональное разнообразие и может, таким образом, увеличивать возможность получения требуемых свойств связывания и нейтрализации у связывающего элемента по настоящему изобретению. Также было показано, что D-аминокислоты и аналоги имеют отличающиеся фармакокинетические профили по сравнению со стандартными L-аминокислотами, в силу in vivo разложения полипептидов с L-аминокислотами после введения животному, например человеку, что означает, что D-аминокислоты являются предпочтительными для некоторых способов применения in vivo.
Новые VH- или VL-области, несущие полученные из CDR последовательности по настоящему изобретению, можно получать с применением случайного мутагенеза одного или несколько выбранных VH- и/или VL-генов с созданием мутаций в пределах всего вариабельного домена. Такая методика описана Gram et al. [Gram et al., 1992, Proc. Natl. Acad. Set, USA, 89: 3576-3580], которые применяли ПЦР сниженной точности. В некоторых вариантах осуществления одну или две аминокислотные замены осуществляют в пределах всего вариабельного домена или набора CDR.
Другой способ, который можно применять, представляет собой направление мутагенеза на CDR-области VH- или VL-генов. Такие методики раскрыты у Barbas и соавт. [Barbas et al., 1994, Proc. Natl. Acad. Scl, USA, 91:3809-3813] и Schier и соавт. [Schier et al., 1996, J. Mol Biol. 263: 551-567].
Все вышеописанные методики известны как таковые в данной области, и специалист сможет применить такие методики для получения связывающих элементов по настоящему изобретению с применением стандартной методологии в данной области.
Дополнительный аспект настоящего изобретения предусматривает способ получения антигенсвязывающего участка антитела против человеческого Аβ1-42, при этом способ включает получение путем замены, делеции или вставки одной или нескольких аминокислот в аминокислотной последовательности VH-домена, изложенного в данном документе, VH-домена, который представляет собой вариант аминокислотной последовательности VH-домена, необязательно комбинирование VH-домен, полученного таким образом, с одним или несколькими VL-доменами и тестирование VH-домена или комбинации или комбинаций VH/VL для выявления связывающего элемента или антигенсвязывающего участка антитела против Аβ1-42, которые, необязательно, обладают одним или несколькими требуемыми свойствами. Указанный VL-домен может иметь аминокислотную последовательность, по сути приведенную в данном документе. Можно использовать аналогичный способ, в котором один или несколько вариантов последовательности VL-домена, раскрытых в данном документе, комбинируют с одним или несколькими VH-доменами.
Как отмечалось выше, аминокислотная последовательность CDR фактически такая, как изложено в данном документе, может быть встроена в качестве CDR в вариабельный домен антитела человека или его существенную часть. Последовательности HCDR3, фактически такие, как изложено в данном документе, представляют варианты осуществления настоящего изобретения, и каждая из них может быть встроена в качестве HCDR3 в вариабельный домен тяжелой цепи человека или его существенную часть.
Вариабельные домены, используемые в настоящем изобретении, могут быть образованы или получены из любого вариабельного домена зародышевого типа или преобразованного вариабельного домена человека или могут представлять собой синтетический вариабельный домен, основанный на консенсусных или реально существующих последовательностях известных вариабельных доменов человека. Вариабельный домен можно получать из антитела, не являющегося человеческим. Последовательность CDR по настоящему изобретению (например, CDR3) может быть введена в репертуар вариабельных доменов, в которых отсутствует CDR (например, CDR3), с помощью технологии рекомбинантных ДНК. Например, Marks et al. [Marks et al Bio/Technology, 1992, 10: 779-783] описывают способы получения спектров вариабельных доменов антител, в которых консенсусные праймеры, направленные на 5'-конец области вариабельного домена или смежные с ним, применяются в сочетании с консенсусными праймерами к третьей каркасной области генов VH человека для получения спектра вариабельных доменов VH с недостатком CDR3. Marks и соавт. дополнительно описывают, как этот спектр можно комбинировать с CDR3 конкретного антитела. С помощью аналогичных методик полученные на основе CDR3 последовательности по настоящему изобретению, могут быть перетасованы с репертуарами VH- или VL-доменов, в которых отсутствует CDR3, и полные VH- или VL-домены после перетасовки комбинируют с родственным VL- или VH-доменом с получением связывающих элементов по настоящему изобретению. Затем спектр можно представлять на подходящей системе хозяина, такой как система фагового дисплея из WO 92/01047, который включен в данный документ посредством ссылки во всей своей полноте, или в любой из последующей многочисленной литературы, в том числе Kay, Winter и McCafferty [Kay, B.K., Winter, J., and McCafferty, J. (1996) Phage Display of Peptides and Proteins: A Laboratory Manual, San Diego: Academic Press], так что можно выбрать подходящий связывающий элемент. Спектр может состоять всего из 104 отдельных элементов и более, например по меньшей мере 105, по меньшей мере 106, по меньшей мере 107, по меньшей мере 108, по меньшей мере 109 или по меньшей мере 1010 элементов или более. Другие подходящие системы хозяев включают без ограничений дрожжевой дисплей, бактериальный дисплей, Т7 дисплей, вирусный дисплей, клеточный дисплей, рибосомный дисплей и ковалентный дисплей.
Предусмотрен способ получения связывающего элемента для человеческого Аβ1-42, причем способ включает:
(a) получение исходного спектра нуклеиновых кислот, кодирующих VH-домен, который либо включают CDR3, подлежащий замене, или не содержат область, кодирующую CDR3;
(b) объединение указанного спектра с донорной нуклеиновой кислотой, кодирующей аминокислотную последовательность, фактически такую, как изложено в данном документе для CDR3 VH, например CDR3 VH, показанного в таблице 11, так что указанную донорную нуклеиновую кислоту вводят в CDR3-область в спектр, так, чтобы получить получаемый в результате спектр нуклеиновых кислот, кодирующих VH-домен;
(c) экспрессию нуклеиновых кислот указанного получаемого в результате спектра;
(d) отбор связывающего элемента для человеческого Аβ1-42; и
(e) выделение указанного связывающего элемента или нуклеиновой кислоты, кодирующей его.
И в этом случае, можно применять аналогичный способ, в котором CDR3 VL по настоящему изобретению комбинируют со спектром нуклеиновых кислот, кодирующих VL-домен, которые либо включают CDR3, подлежащий замене, либо не содержат область, кодирующую CDR3.
Аналогично, один, или несколько, или все три CDR можно прививать в спектр VH- или VL-доменов, которые затем подвергают скринингу в отношении связывающего элемента или связывающих элементов для человеческого Аβ1-42.
К примеру, можно использовать HCDR1, HCDR2 и/или HCDR3, например набор HCDR, из одного или нескольких антител, перечисленных в таблице 5 или таблице 6, и/или можно использовать LCDR1, LCDR2 и/или LCDR3, например набор LCDR, из одного или нескольких антител, перечисленных в данном документе.
Аналогично, можно использовать другие VH и VL-домены, наборы CDR и наборы HCDR и/или наборы LCDR, раскрытые в данном документе.
Существенная часть вариабельного домена иммуноглобулина может включать по меньшей мере три области CDR вместе с их промежуточными каркасными областями. Данная часть может также состоять по меньшей мере приблизительно на 50% из одной или обоих из первой и четвертой каркасных областей, при этом 50% представляют собой C-терминальные 50% первой каркасной области и N-терминальные 50% четвертой каркасной области. Дополнительные остатки на N-терминальном или C-терминальном конце значительной части вариабельного домена могут представлять собой остатки, которые обычно не связаны с встречающимися в природе областями вариабельных доменов. Например, конструирование связывающих элементов по настоящему изобретению, осуществляемое с помощью методик рекомбинантных ДНК, может привести в результате к введению N- или С-терминальных остатков, кодируемых линкерами, вводимыми для обеспечения клонирования или других этапов манипуляций. Другие стадии манипуляции включают введение линкеров для присоединения вариабельных доменов по настоящему изобретению к дополнительным белковым последовательностям, в том числе константным областям антитела, другим вариабельным доменам (например, при получении диател) или детектируемым/функциональным меткам, которые обсуждаются более подробно в других местах в данном документе.
Хотя в некоторых аспектах настоящего изобретения, связывающие элементы содержат пару VH- и VL-доменов, одиночные связывающие домены на основе последовательностей либо VH-, либо VL-доменов образуют дополнительные аспекты настоящего изобретения. Известно, что одиночные домены иммуноглобулинов, особенно VH-домены, способны связывать антигены-мишени специфичным способом. Например, см. обсуждение dAb выше.
В случае любого из одиночных связывающих доменов, эти домены можно применять для скрининга комплементарных доменов, способных образовывать двухдоменный связывающий элемент, способный связывать Аβ1-42. Этого можно достичь посредством способов скрининга фагового дисплея с применением так называемого иерархического двойного комбинаторного подхода, раскрытого в WO 92/01047, который включен в данный документ посредством ссылки во всей своей полноте, в котором применяют отдельные колонии, содержащие клон либо Н, либо L цепи, для заражения полной библиотеки клонов, кодирующих другую цепь (L или Н), а полученный двухцепочечный связывающий элемент выбирают в соответствии с методиками фагового дисплея, как, например, описанными в данной ссылке. Эта методика также раскрыта в Marks et al., Bio/Technology, 1992, 10:779-783.
Связывающие элементы по настоящему изобретению могут дополнительно включать константные области антител или их части, например константные области антител человека или их части. Например, VL-домен можно присоединять на его C-терминальном конце к константным доменам легкой цепи антитела, в том числе цепей Сκ или Сλ человека. Аналогично, связывающий элемент на основе VH-домена можно присоединять на его C-терминальном конце ко всему или части (например, СН1-домену) тяжелой цепи иммуноглобулина, полученной из любого изотипа антитела, например IgG, IgA, IgE и IgM и любого из подклассов изотипов, в частности, IgG2, IgG1 и IgG4. В некоторых вариантах осуществления предпочтительным может быть IgG2, вследствие отсутствия у него эффекторных функций. В других вариантах осуществления предпочтительным может быть IgG1, в связи с его эффекторной функцией и простотой получения. Любой синтетический или другой вариант константной области, который обладает этими свойствами и стабилизирует вариабельные области, может также применяться в настоящем изобретении.
Связывающие элементы можно метить детектируемой или функциональной меткой. Таким образом, связывающий элемент или молекула антитела могут присутствовать в виде иммуноконъюгата, для получения детектируемого и/или количественно измеряемого сигнала. Иммуноконъюгат может содержать молекулу антитела по настоящему изобретению, конъюгированную с детектируемой или функциональной меткой. Детектируемая метка, как указано в данном документе, может представлять собой любую метку, которая вырабатывает или которую можно индуцировать к выработке сигнала, в том числе без ограничений люминофоры, хемилюминесцеры (например, пероксидаза хрена), окрашенные метки (например, латекс [синий] или коллоидное золото [красный]), радиоактивные метки, ферменты, фотосенсибилизаторы и магнитные метки. Количество метки, связанной на поверхности, например поверхности капиллярного отверстия, следовательно, можно выявлять и/или измерять посредством выявления флуоресценции или люминесценции, цвета, радиоактивности, активности фермента, поглощения света или изменений в магнитном поле. Детектируемые метки можно присоединять к связывающим элементам с применением традиционных методов химии. Предпочтительно, детектируемая метка представляет собой метку, которую можно выявлять при помощи оптических считываний, например, с помощью цифровой камеры или планшетного сканера. Метки, которые можно выявлять посредством оптических считываний, включают люминофоры, хемилюминесцеры и окрашенные метки. Механизм, при помощи которого сигнал может вырабатываться для оптического выявления, включает (но не обязательно ограничиваться): поглощение света, рассеивание света, дифракцию света, отражение света, флуоресценцию или люминесценцию.
Подходящие метки включают в качестве иллюстрации, а не ограничения
ферменты, такие как щелочная фосфатаза, глюкозо-6-фосфатдегидрогеназа ("G6PDH"), альфа-D-галактозидаза, глюкооксидаза, глюкоамилаза, карбоангидраза, ацетилхолинэстераза, лизоцим, малатдегидрогеназа и пероксидаза, например пероксидаза хрена;
красители;
флуоресцентные метки или люминофоры, такие как флуоресцеин и его производные, флуорохром, соединения и производные родамина, GFP (GFP - "зеленый флуоресцентный белок"), дансил, умбеллиферон, фикоэритрин, фикоцианин, аллофикоцианин, о-фталевый альдегид и флуорескамин; флуорофоры, такие как криптаты и хелаты лантаноидов, например европия, и т.д. (Perkin Elmer and Cis Biointernational),
хемолюминесцентные метки или хемилюминесцеры, такие как изолюминол, люминолом и диоксетаны;
биолюминесцентные метки, такие как люцифераза и люциферин;
сенсибилизаторы;
коферменты;
субстраты ферментов;
радиоактивные метки, в том числе без ограничений бром77, углерод14, кобальт57, фтор8, галлий67, галлий68, водород3 (тритий), индий111, индий113m, йод123m, йод125, йод126, йод131, йод133, ртуть107, ртуть203, фосфор32, рений99m, рений101, рений105, рутений95, рутений97, рутений103, рутений105, скандий47, селен75, сера35, технеций99, технеций99m, теллур121m, теллур122m, теллур125m, тулий165, тулий167, тулий168, иттрий199 и другие радиоактивные метки, упомянутые в данном документе;
частицы, такие как латексные частицы или частицы углерода; золь металла; кристаллит; липосомы; клетки и т.д., которые можно дополнительно метить красителем, катализатором или другой детектируемой группой;
молекулы, такие как биотин, дигоксигенин или 5-бромдезоксиуридин;
компоненты токсинов, такие как, например, компонент токсина, выбранный из группы экзотоксина Pseudomonas (РЕ или его цитотоксический фрагмент или мутант), дифтерийный токсин или его цитотоксический фрагмент или мутант, ботулинический токсин типов А, В, С, D Е или F, рицин или его цитотоксический фрагмент, например рицин А, абрин или его цитотоксический фрагмент, сапорин или его цитотоксический фрагмент, антивирусный токсин лаконоса или его цитотоксический фрагмент и бриодин 1 или его цитотоксический фрагмент.
Примеры подходящих ферментов и коферментов раскрыты в US 4275149 и US 4318980. Подходящие люминофоры и хемилюминесцеры также раскрыты в US 4275149. Метки дополнительно включают химические компоненты, такие как биотин, который можно выявлять посредством связывания со специфическим когнатным детектируемым компонентом, например меченым авидином или стрептавидином. Детектируемые метки можно прикреплять к антителам по настоящему изобретению с применением традиционных методов химии, известных в данной области.
Иммуноконъюгаты или их функциональные фрагменты можно получать способами, известными специалистам в данной области. Их можно присоединять к ферментам или к флуоресцентным меткам напрямую или посредством спейсерной группы или связывающей группы, такой как полиальдегид, например глутаральдегид, этилендиаминтетрауксусная кислота (EDTA), диэтилентриаминпентауксусная кислота (DPTA), либо в присутствии связывающих средств, таких как упомянутые выше, для терапевтических конъюгатов. Конъюгаты, содержащие метки типа флуоресцеина можно получать путем реакции с изотиоцианатом.
Способы, известные в данной области для присоединения терапевтических радиоизотопов к антителам либо напрямую, либо при помощи хелатирующего средства, такого как EDTA, DTPA, которые упоминаются выше, также можно применять для радиоактивных элементов, которые можно применять в диагностике. Кроме того, возможно выполнять мечение натрием125 с помощью методики с хлорамином Т [Hunter W.М. and Greenwood F.С. (1962) Nature 194: 495], либо технецием99m с помощью методики по US 4424200 или присоединенным посредством DTP А, как описано в US 4479930.
Существуют многочисленные способы, посредством которых метка может создавать сигнал, детектируемый с помощью внешних средств, например с помощью визуального осмотра, электромагнитного излучения, тепла и химических реагентов. Метку можно также связывать с другим связывающим элементом, который связывает антитело по настоящему изобретению, или с подложкой.
Метка может непосредственно вырабатывать сигнал и, следовательно, для выработки сигнала не требуются дополнительные компоненты. Многочисленные органические молекулы, например люминофоры, способны поглощать ультрафиолетовый и видимый свет, при этом поглощение света передает энергию этим молекулам и приводит их в возбужденное энергетическое состояние. Эта поглощенная энергия затем рассеивается путем излучения света на второй длине волны. Это излучение на второй длине волны может также передавать энергию меченой акцепторной молекуле, и получаемая в результате энергия рассеивается от акцепторной молекулы путем излучения света, например резонансного переноса энергии флуоресценции (FRET). Другие метки, которые непосредственно вырабатывают сигнал, включают радиоактивные изотопы и красители.
Альтернативно, метке могут требоваться другие компоненты для выработки сигнала, а система, вырабатывающая сигнал, будет тогда включать все компоненты, требуемые для выработки поддающегося измерению сигнала, которые могут включать субстраты, коферменты, энхансеры, дополнительные ферменты, вещества, которые вступают в реакцию с ферментативными продуктами, катализаторы, активаторы, кофакторы, ингибиторы, акцепторы, ионы металлов, а также специфическое связывающее вещество, требуемое для связывания веществ, генерирующих сигнал. Подробное обсуждение подходящих систем, создающих сигнал, можно найти в US 5185243.
Аспект настоящего изобретения предлагает способ, включающий обеспечение или разрешение связывания связывающего элемента, как предусмотрено в данном документе, с человеческим Аβ1-42. Как отмечалось, такое связывание может происходить in vivo, например, после введения связывающего элемента или нуклеиновой кислоты, кодирующей связывающий элемент, или оно может происходить in vitro, например, при ELISA, Вестерн-блоттинге, иммуноцитохимии, иммунопреципитации, аффинной хроматографии и биохимических или клеточных анализах.
Настоящее изобретение также предусматривает непосредственное измерение уровней антигена, например, в плазме или CSF, путем использования связывающего элемента по настоящему изобретению, например в системе биосенсора. Например, способ выявления и/или измерения связывания с человеческим Аβ1-42 может включать, (i) воздействие на указанный связывающий элемент Аβ1-42 и (ii) выявление связывания указанного связывающего элемента с Аβ1-42, где связывание выявляют с применением любого способа или детектируемой метки, описанной в данном документе. Аβ1-42 может представлять собой мономерный или олигомерний Аβ1-42, предпочтительно мономерный Аβ1-42. Данный, а также любой другой способ выявления связывания, как описано в данном документе, могут интерпретироваться непосредственно лицом, осуществляющим способ, например путем визуального наблюдения детектируемой метки. Альтернативно, данный способ или любой другой способ выявления связывания, описываемый в данном документе, может предоставлять отчет в виде авторадиограммы, фотографии, компьютерной распечатки, отчета проточной цитометрии, графика, диаграммы, тестовой пробирки, или контейнера, или лунки, которые содержат результат, или любого другого визуального или физического представления результата способа.
Можно определять количественный показатель связывания связывающего элемента с Аβ1-42. Количественное определение может быть связано с количеством антигена в тестируемом образце, который может представлять диагностический интерес. Скрининг в отношении связывания Аβ1-42 и/или его количественное определение могут быть применимыми, например, в скрининге пациентов на заболевания или нарушения, упоминаемые в данном документе, и/или любое другое заболевание или нарушение, связанное с аберрантными уровнями и/или активностью Аβ1-42.
Диагностический способ может включать (i) получение образца ткани или жидкости от субъекта, например пациента, у которого предполагают состояние или заболевание, упомянутое в данном документе, или уверены в них; (ii) воздействие на указанный образец ткани или жидкости одним или несколькими связывающими элементами по настоящему изобретению; и (iii) выявление связанного Аβ1-42 по сравнению с контрольным образцом, где увеличение величины связывания Аβ1-42 по сравнению с контролем может указывать на аберрантный уровень Аβ1-42. Образцы ткани или жидкости для тестирования включают кровь, сыворотку крови, плазму, CSF, мочу, биоптат, опухоли или любую ткань, которая предположительно содержит аберрантные уровни Аβ1-42. Субъекты с положительным результатом теста на аберрантные уровни и активность Аβ1-42 также могут получать пользу от способов лечения, раскрытых далее в данном документе.
Специалисты в данной области способны выбрать подходящий способ определения связывания связывающего элемента с антигеном в соответствии с их предпочтениями и общими сведениями в свете способов, раскрытых в данном документе.
Реакционную способность связывающих элементов в образце можно определить с помощью любых подходящих способов. Радиоиммуноанализ (RIA) является одной из возможностей. Антиген с радиоактивной меткой смешивают с немеченным антигеном (тестируемый образец) и оставляют для связывания со связывающим элементом. Связанный антиген физически отделяют от несвязанного антигена и определяют количество радиоактивного антигена, связанного со связывающим элементом. Чем больше антигена присутствует в тестируемом образце, тем меньше радиоактивного антигена свяжется со связывающим элементом. Также можно применять анализ конкурентного связывания с нерадиоактивным антигеном с применением антигена или его аналога, связанного с репортерной молекулой. Репортерной молекулой может являться флуорохромом, фосфор или лазерный краситель со спектрально изолированными характеристиками поглощения или излучения. Подходящие флуорохромы включают флуоресцеин, родамин, фикоэритрин и техасский красный, а также хелаты или криптаты лантаноидов. Подходящие хромогенные красители включают диаминобензидин.
Другие репортеры включают макромолекулярные коллоидные частицы или материал на основе частиц, такие как латексные гранулы, которые окрашены, магнетики или парамагнетики и биологически или химически активные средства, которые могут прямо или непрямо вызывать детектируемые сигналы, которые наблюдают визуально, обнаруживают электронными средствами или регистрируют иным образом. Такие молекулы могут представлять собой ферменты, катализирующие реакции, в которых, например, проявляется окрашивание, или меняется цвет, или изменяются электрические свойства. Они могут вызывать возбуждение на молекулярном уровне, так что электронные переходы между энергетическими состояниями приводят к характерному спектральному поглощению или эмиссии. Они могут включать химические соединения, используемые в сочетании с биосенсорами. Можно использовать системы выявления на основе биотина/авидина или биотина/стрептавидина и щелочной фосфатазы.
Сигналы, генерируемые отдельными конъюгатами связывающий элемент-репортер, можно применять для получения количественно определяемых абсолютных или относительных данных связывания соответствующего связывающего элемента в образцах (нормальные и тестируемые).
Набор, содержащий связывающий элемент, описываемый в данном документе, также предусмотрен как один из аспектов настоящего изобретения. В наборе связывающий элемент можно пометить, чтобы обеспечить его реакционную способность в образце, например, как дополнительно описано ниже. Дополнительно, связывающий элемент можно прикреплять или не прикреплять к твердой подложке. Компоненты набора обычно стерильны и находятся в герметичных флаконах или других контейнерах. Наборы можно использовать в диагностическом анализе или других способах, для которых пригодны связывающие элементы. Набор можно применять в способе, описываемом выше. Набор может содержать инструкции по использованию компонентов в способе, например способе в соответствии с настоящим изобретением. Вспомогательные материалы, способствующие или обеспечивающие возможность осуществления такого способа могут включаться в набор по настоящему изобретению. Вспомогательные материалы включают второй, отличающийся связывающий элемент, который связывается с первым связывающим элементом и конъюгирован с детектируемой меткой (например, флуоресцентной меткой, радиоактивным изотопом или ферментом). Наборы на основе антител могут также содержать микрогранулы для проведения иммунопреципитации. Каждый компонент наборов, как правило, находится в собственном подходящем контейнере. Таким образом, эти наборы, как правило, содержат различные контейнеры, подходящие для каждого связывающего элемента. Дополнительно, наборы могут содержать инструкции для выполнения анализа и способов для интерпретации и анализа данных, полученных в результате выполнения анализа.
Настоящее изобретение также предусматривает применение связывающего элемента, описанного выше, для измерения уровней антигена в конкурентном анализе, то есть способ измерения уровня антигена в образце с использованием связывающего элемента, предусматриваемого в настоящем изобретении, в конкурентном анализе. Его проводят, если физическое разделение связанного и несвязанного антигена не требуется. Одной из возможностей является связывание репортерной молекулы со связывающим элементом, в силу чего при связывании происходит физическое или оптическое изменение. Репортерная молекула может прямо или опосредованно генерировать детектируемые сигналы, которые можно измерять количественно. Связывание репортерных молекул может быть прямым или опосредованным, ковалентным, например через пептидную связь, или нековалентным. Связывание через пептидную связь может представлять собой результат рекомбинантной экспрессии слияния генов, кодирующих антитело и репортерную молекулу.
Конкуренцию между связывающими элементами можно легко проанализировать in vitro, например, при помощи ELISA и/или биохимического анализа конкуренции, такого как маркирования специфической репортерной молекулой одного связывающего элемента, который можно выявить в присутствии одного или нескольких других связывающих элементов без маркера, с возможностью идентификации связывающих элементов, которые связываются с тем же эпитопом или перекрывающимся эпитопом. Такие способы хорошо известны обычному специалисту в данной области, и описаны более подробно в данном документе.
Настоящее изобретение распространяется на связывающий элемент, который конкурирует за связывание с человеческим Аβ1-42 с любым связывающим элементом, определенным в данном документе, например любым из антител, перечисленных в таблицах 5 и 6, например в формате IgG2, IgG1 или тройной мутации IgG1 ("ТМ"; Oganesyan et al. (2008) Acta Crystallogr D Biol Crystallogr. 64(Pt 6):700-4). Конкуренцию между связывающими элементами можно легко проанализировать in vitro, например, путем маркирования специфической репортерной молекулой одного связывающего элемента, который можно выявлять в присутствии другого связывающего(их) элемента(ов) без маркера, с возможностью идентификации связывающих элементов, которые связываются с тем же эпитопом или перекрывающимся эпитопом. Конкуренцию можно определять, например, с применением анализа ELISA, при котором Аβ1-42 иммобилизуют на планшете и к планшету добавляют первый меченный или маркированный связывающий элемент, вместе с одним или несколькими другими немаркированными или немеченными связывающими элементами. Присутствие немаркированного связывающего элемента, который конкурирует с маркированным связывающим элементом, наблюдали по уменьшению сигнала, испускаемого маркированным связывающим элементом.
Конкурентные анализы также можно применять в картировании эпитопов. В одном случае картирование эпитопов можно применять для идентификации эпитопа, связанного при помощи связывающего элемента, который необязательно может обладать оптимизированными нейтрализующими и/или модулирующими характеристиками. Такой эпитоп может быть линейным или конформационным. Конформационный эпитоп может содержать по меньшей мере два различных фрагмента Аβ, где указанные фрагменты расположены вблизи друг к другу, когда Аβ пептид сворачивается в свою третичную или четвертичную структуру с образованием конформационного эпитопа, который распознается ингибитором Аβ, таким как Аβ-связывающий элемент. При тестировании конкуренции можно использовать пептидный фрагмент антигена, в частности, пептид, включающий или состоящий фактически из эпитопа, представляющего интерес. Можно применять пептид, состоящий из последовательности эпитопа плюс одна или несколько аминокислот на любом конце. Связывающие элементы согласно настоящему изобретению могут быть таковыми, что их связывание с антигеном ингибируется пептидом с данной последовательностью или содержащим ее.
В дополнительных аспектах настоящее изобретение предусматривает выделенную нуклеиновую кислоту, которая содержит последовательность, кодирующую связывающий элемент, VH-домен и/или VL-домен согласно настоящему изобретению, и способы получения связывающего элемента, VH- домена и/или VL-домена по настоящему изобретению, которые включают экспрессию указанной нуклеиновой кислоты в условиях осуществления выработки указанного связывающего элемента, VH-домена и/или VL-домена и его выделения. Примеры кодирующих последовательностей нуклеиновой кислоты изложены в таблицах и прилагаемом перечне последовательностей. Последовательности нуклеиновых кислот согласно настоящему изобретению могут включать ДНК или РНК и могут быть полностью или частично синтетическими. Ссылка на нуклеотидную последовательность, изложенную в данном документе, охватывает молекулу ДНК с указанной последовательностью, и охватывает молекулу РНК с указанной последовательностью, в которой U замещен на Т, если контекст не требует иного.
Настоящее изобретение также предусматривает конструкции в форме плазмид, векторов, таких как плазмидный или фаговый вектор, кассет транскрипции или экпрессии, которые содержат по меньшей мере один полинуклеотид, описываемый выше, например функционально связанный с регуляторным элементом.
Дополнительный аспект предусматривает клетку-хозяина, содержащую или трансформированную нуклеиновыми кислотами и/или векторами по настоящему изобретению. Настоящее изобретение также предусматривает рекомбинантную линию клеток-хозяев, которая содержит одну или несколько конструкций, описанных выше. Последовательность нуклеиновой кислоты, кодирующая любой CDR, или набор CDR, или VH-домен, или VL-домен, или антигенсвязывающий участок антитела, или молекулу антитела, например scFv или IgG (например, IgG2, IgG1 или IgG1TM), как предусмотрено, образует аспект настоящего изобретения, вместе со способом получения закодированного продукта, при этом способ включает экспрессию из кодирующих его последовательностей нуклеиновой кислоты. Экспрессии можно легко достичь путем культивирования рекомбинантных клеток-хозяев, содержащих нуклеиновую кислоту, при соответствующих условиях. После получения путем экспрессии VH- или VL-домен или связывающий элемент можно выделить и/или очистить с применением любой подходящей методики для последующего использования соответствующим образом.
Соответственно, другой аспект настоящего изобретения представляет собой способ получения VH-вариабельного домена антитела, причем способ включает обеспечение экспрессии из кодирующих последовательностей нуклеиновых кислот. Такой способ может включать культивирование клеток-хозяев в условиях для получения указанного VH-вариабельного домена антитела.
Аналогичные способы получения VL-вариабельных доменов и связывающих элементов, содержащих VH- и/или VL-домен, предусмотрены как дополнительные аспекты настоящего изобретения.
Способ получения может включать этап выделения и/или очистки продукта. Способ получения может включать составление продукта в композицию, включающую по меньшей мере один дополнительный компонент, такой как фармацевтически приемлемый наполнитель.
Системы для клонирования и экспрессии полипептида в ряде различных клеток-хозяев хорошо известны. Подходящие клетки-хозяева включают бактерий, клетки млекопитающих, клетки растений, мицелиальные грибы, дрожжи и бакуловирусные системы, а также трансгенные растения и животные. Экспрессия антител и фрагментов антител в прокариотических клетках хорошо известна в данной области. Обзор, см., например, у Pliickthun [Pliickthun, A. Bio/Technology 9: 545-551 (1991)]. Распространенным бактериальным хозяином является Е. coli.
Экспрессия в эукариотических клетках в культуре также доступна специалистам в данной области в качестве варианта для получения связывающего элемента [Chadd НЕ and Chamow SM (2001) Current Opinion in Biotechnology 12: 188-194; Andersen DC and Krummen L (2002) Current Opinion in Biotechnology 13: 117; Larrick JW and Thomas DW (2001) Current Opinion in Biotechnology 12: 411-418].
Линии клеток млекопитающих, доступные в данной области для экспрессии гетерологичного полипептида, включают клетки яичника китайского хомячка (СНО), клетки HeLa, клетки почки новорожденного хомяка, клетки меланомы мыши NS0, клетки миеломы крысы YB2/0, эмбриональные клетки почки человека, эмбриональные клетки сетчатки человека и многие другие.
Можно выбрать или сконструировать подходящие векторы, содержащие, при необходимости, подходящие регуляторные последовательности, в том числе промоторные последовательности, терминаторные последовательности, последовательности полиаденилирования, энхансерные последовательности, маркерные гены и другие последовательности. При необходимости, векторы могут представлять собой плазмиды, например фагмиду, или вирусы, например 'фаг, [Sambrook and Russell, Molecular Cloning: a Laboratory Manual: 3rd edition, 2001, Cold Spring Harbor Laboratory Press]. Многие известные методики и протоколы для манипуляций с нуклеиновой кислотой, например для получения конструкций нуклеиновой кислоты, мутагенеза, секвенирования, введения ДНК в клетки и экспрессии генов, а также анализа белков, подробно описаны в Ausubel и соавт: [Ausubel et al. eds., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, John Wiley & Sons, 4th edition 1999].
Дополнительный аспект настоящего изобретения предусматривает клетку-хозяина, содержащую нуклеиновую кислоту, раскрытую в данном документе. Такая клетка-хозяин может находиться in vitro, и может находиться в культуре. Такая клетка-хозяин может находиться in vivo. Присутствие клетки-хозяина in vivo может обеспечивать внутриклеточную экспрессию связывающих элементов по настоящему изобретению в виде "интраантител" или внутриклеточных антител. Интраантитела можно применять для генной терапии.
Другой аспект предусматривает способ, включающий введение нуклеиновой кислоты по настоящему изобретению в клетку-хозяина. Для введения можно использовать любую доступную методику. Для эукариотических клеток подходящие методики могут включать трансфекцию с использованием фосфата кальция, DEAE-декстран, электропорацию, трансфекцию, опосредованную липосомами, и трансдукцию с применением ретровируса или другого вируса, например, вируса оспы, или бакуловируса, в случае клеток насекомых. Введение нуклеиновой кислоты в клетку-хозяина, в частности эукариотическую клетку, можно применять вирусные или плазмидные системы. Плазмидную систему можно поддерживать эписомально или можно вводить в клетку-хозяина или в искусственную хромосому. Введение можно осуществлять путем либо случайной, либо направленной интеграции одной или нескольких копий в один или несколько локусов. Для бактериальных клеток подходящие методики могут включать трансформацию с хлористым кальцием, электропорацию и трансфекцию с применением бактериофага.
После введения может следовать индукция или обеспечение экспрессии из нуклеиновой кислоты, например, путем культивирования клеток-хозяев в условиях для экспрессии гена. Очистки экспрессированного продукта можно достичь способами, известными специалисту в данной области.
Нуклеиновые кислоты по настоящему изобретению можно интегрировать в геном (например, хромосому) клетки-хозяина. Интеграцию можно стимулировать путем включения последовательностей, которые стимулируют рекомбинацию с геномом, в соответствии со стандартными методиками.
Настоящее изобретение также предусматривает способ, который включает применение конструкции, указываемой выше, в системе экспрессии с целью экспрессии связывающего элемента или полипептида, описываемых выше.
Связывающие элементы согласно настоящему изобретению можно применять в лечении (которое может включать профилактическое лечение) заболевания или нарушения в организме человека или животного (например, у пациента-человека), которое предусматривает введение пациенту связывающего элемента. Состояния, которые можно лечить в соответствии с настоящим изобретением, описаны в другом месте в данном документе, в том числе профилактическое лечение и снижение тяжести состояния или одного, или нескольких его симптомов или отсрочки или снижения риска начала заболевания.
Соответственно, настоящее изобретение предусматривает способ лечения или снижения тяжести по меньшей мере одного симптома любого из состояний, упомянутых в данном документе, включающий введение пациенту, нуждающемуся в этом, эффективного количества одного или нескольких связывающих элементов по настоящему изобретению отдельно или в схеме комбинированного лечения с другим подходящим лекарственным препаратом, известным из уровня техники или описанным в данном документе, так что снижается тяжесть по меньшей мере одного симптома любого из упомянутых выше нарушений.
Выражение "эффективная доза" определяется как количество, достаточное для излечения или по меньшей мере частичной остановки заболевания и его осложнений у пациента, уже страдающего от заболевания.
Настоящее изобретение направлено среди прочего на лечение болезни Альцгеймера и других амилоидогенных заболеваний при помощи введения пациенту терапевтического антитела по настоящему изобретению при условиях, которые приводя к благоприятному терапевтическому ответу у пациента (например, снижению Аβ1-42 в CSF, уменьшению объема бляшек, ингибированию образования бляшек, снижению дистрофии нейритов, улучшению когнитивной функции и/или реверсии, уменьшению или предупреждению снижения когнитивных способностей) у пациента, например, для профилактики или лечения амилоидогенного заболевания.
Применяемое в данном документе "лечение" определяется как применение или введение терапевтического средства пациенту, у которого имеется заболевание или состояние, ассоциированное с амилоидозом; или симптом, или предрасположенность к такому заболеванию или состоянию, ассоциированному с амилоидозом, с целью излечить, вылечить, облегчить, ослаблять, видоизменить, лечить, уменьшить, нормализовать или воздействовать на заболевание, состояние, его симптомы или предрасположенность к нему.
Настоящее изобретение предусматривает способы предупреждения или лечения заболевания, ассоциированного с отложениями амилоида из Аβ в головном мозге пациента. Такие заболевания включают болезнь Альцгеймера, синдром Дауна и когнитивные нарушения. Когнитивные нарушения встречаться вместе с другими характерными признаками амилоидогенного заболевания или без них. Настоящее изобретение предусматривает способы лечения макулярной дегенерации, состояния, которое связано с Аβ. Способы по настоящему изобретению могут включать введение пациенту эффективной дозы антитела, которое специфично связывается с 1-42 Аβ и его N-терминальными усечениями. Такие способы особенно применимы для предупреждения или лечения болезни Альцгеймера у пациентов-людей.
Антитела по настоящему изобретению можно применять в схеме лечения для предупреждения или уменьшения нейропатологии и, у некоторых пациентов, когнитивного нарушения, ассоциированного с болезнью Альцгеймера.
Пациенты, подлежащие лечению, включают пациентов, у которых проявляются симптомы, а также индивидуумов с риском заболевания, но у которых симптомы не проявляются. В случае болезни Альцгеймера, потенциально каждый имеет риск заболевания, если он или она живет в течение достаточно длительного времени. Антитела по настоящему изобретению можно вводить профилактически субъекту без какой-либо оценки риска у пациента-субъекта. Пациенты, подлежащие лечению, включают индивидуумов, для которых известен генетический риск болезни Альцгеймера, например индивидуумов, кровные родственники которых имеют данное заболевание, и тех, у которых риск определен посредством анализа генетических или биохимических маркеров. Генетические маркеры предрасположенности к болезни Альцгеймера включают мутации в гене АРР, в частности, мутации в положении 717 и положениях 670 и 671, называемые мутациями Харди и шведскими мутациями, соответственно. Другие маркеры риска представляют собой мутации в генах пресенилина, PS1 и PS2, и АроЕ4, семейный анамнез AD, гиперхолестеринемия или атеросклероз. Индивидуумы, страдающие от болезни Альцгеймера, могут диагностироваться по характерной деменции, ассоциированной с заболеванием, а также по присутствию факторов риска, описанных выше. Доступен ряд диагностических тестов для содействия идентификации болезни Альцгеймера у индивидуума. Они включают измерение уровней белка-тау и Аβ1-42 в CSF. Повышенный уровень белка-тау и сниженный уровень Аβ1-42 могут сигнализировать о наличии AD. Индивидуумов, страдающих от болезни Альцгеймера, также можно диагностировать по критериям NINCDS-ADRDA или DSM-IV-TR.
У бессимптомных пациентов лечение можно начинать в любом возрасте (например, 10, 20, 30). В целом, лечение начинают в старческом возрасте, например, когда пациент достигает своих 40, 50, 60 или 70 лет. Лечение может включать множественные дозы в течение периода времени, который может иметь продолжительность, составляющую всю оставшуюся жизнь пациента. Необходимость введения повторных доз можно отслеживать при помощи измерения уровней антител с течением времени.
Для профилактики фармацевтические композиции или лекарственные препараты вводят пациенту, подверженному болезни Альцгеймера, или, иначе, имеющему риск ее развития, в количестве, достаточном для устранения или снижения риска, ослабления тяжести или отсрочки начала заболевания, в том числе биохимических, гистологических, связанных с когнитивными нарушениями, и/или поведенческих симптомов заболевания, его осложнений и промежуточных фенотипов патологии, присутствующих во время развития заболевания. Для терапевтических применений композиции или лекарственные препараты вводят пациенту, у которого подозревают или который уже страдает от такого заболевания, в количестве, достаточном для излечения или по меньшей мере частичной остановки симптомов заболевания (биохимических, гистологических, связанных с когнитивными нарушениями и/или поведенческих), в том числе его осложнений и промежуточных фенотипов патологии, присутствующих во время развития заболевания.
Настоящее изобретение предусматривает способ лечения индивидуума, включающий введение индивидууму, нуждающемуся в этом, эффективного количества одного или нескольких связывающих элементов по настоящему изобретению отдельно или в схеме комбинированного лечения с другим подходящим лекарственным препаратом, известным из уровня техники или описанным в данном документе. Способ лечения может включать введение эффективного количества связывающего элемента, описанного в данном документе, пациенту, нуждающемуся в этом, где уровни Аβ1-42 снижаются в плазме крови и/или в CSF.
Способ лечения может включать (i) идентификацию пациента, имеющего состояние, ассоциированное с амилоидозом, как упомянуто в данном документе, и (ii) введение пациенту эффективного количества связывающего элемента, описанного в данном документе, где уровни Аβ1-42 снижаются в плазме крови и/или в CSF, а амилоидоз уменьшается. Эффективное количество представляет собой количество, которое снижает уровни Аβ1-42 так, чтобы снизить или уменьшить тяжесть по меньшей мере одного симптома конкретного заболевания или нарушения, подлежащего лечению, но не обязательно излечить заболевание или нарушение.
Настоящее изобретение также предусматривает способ противодействия по меньшей мере одному эффекту Аβ1-42, включающий обеспечение контакта или введение эффективного количества одного или нескольких связывающих элементов по настоящему изобретению, так что указанный по меньшей мере один эффект Аβ1-42 испытывает противодействие.
Соответственно, дополнительные аспекты данного изобретения предусматривают способы лечения, включающие введение связывающего элемента, как предусмотрено, фармацевтических композиций, содержащих такой связывающий элемент, и применение такого связывающего элемента в получении лекарственного препарата для введения, например, в способе создания лекарственного препарата или фармацевтической композиции, включающего составление связывающего элемента с фармацевтически приемлемым наполнителем. Фармацевтически приемлемый наполнитель может представлять собой соединение или комбинацию соединений, входящих в фармацевтическую композицию, не провоцирующих вторичные реакции, и которые обеспечивают, например, облегчение введения связывающего элемента, увеличение его срока жизни и/или его эффективности в организме, повышение его растворимости в растворе или улучшение его сохранности. Такие фармацевтически приемлемые носители хорошо известны и будут адаптированы специалистом в данной области, в зависимости от природы и способа введения выбранного(ых) активного(ых) соединения(й).
Связывающие элементы, как описано в данном документе, обычно будут вводиться в форме фармацевтической композиции, которая может содержать по меньшей мере один компонент в дополнение к связывающему элементу. Таким образом, фармацевтические композиции согласно настоящему изобретению и для применения в соответствии с настоящим изобретением могут содержать, в дополнение к связывающему элементу, фармацевтически приемлемый наполнитель, носитель, буфер, стабилизатор или другие материалы, хорошо известные специалистам в данной области. Такие вещества должны быть нетоксичными и не должны оказывать противодействие эффективности активного ингредиента. Точная природа носителя или другого материала будет зависеть от пути введения.
Для инъецируемых составов, например, для внутривенной или подкожной инъекции, активный ингредиент будет находиться в форме водного раствора, приемлемого для парентерального введения, который не содержит пирогены и имеет подходящий рН, изотоничность и стабильность. Связывающие элементы, которые описаны в данном документе, можно составлять в жидкой, полутвердой или твердой формах, в зависимости от физико-химических свойств молекулы и пути доставки. Составы могут содержать наполнители или комбинации наполнителей, например, сахара, аминокислоты и поверхностно-активные вещества. Жидкие составы могут содержать антитела с широким спектром концентраций и рН. Твердые составы могут быть получены, например, путем лиофилизации, сушки распылением или сушки с помощью технологии с применением сверхкритического флюида. Средство для лечения можно вводить посредством инъекции, например, подкожно или внутривенно. Средство для лечения можно вводить путем импульсной инфузии, в частности, со снижением дозы связывающего элемента. Путь введения может определяться физико-химическими характеристиками средства для лечения, особенностями заболевания или необходимостью оптимизации эффективности и минимизации побочных эффектов. Одним конкретным путем введения является внутривенное введение. Другим способом введения фармацевтических композиций по настоящему изобретению является подкожное введение. Подкожная инъекция с применением безыгольного устройства также является предпочтительной.
Композицию можно вводить саму по себе или в комбинации с другими средствами для лечения либо одновременно, либо последовательно в зависимости от состояния, подлежащего лечению.
Связывающий элемент может применяться как часть комбинированной терапии в сочетании с дополнительным лекарственным компонентом. Комбинированное лечение можно применять для обеспечения значительных синергических эффектов, в частности, комбинацию связывающего элемента с одним или несколькими другими лекарственными средствами. Связывающий элемент можно вводить одновременно или последовательно или в виде комбинированного препарата с другим терапевтическим средством или средствами, для лечения одного или нескольких состояний, перечисленных в данном документе.
Связывающий элемент и одно или несколько указанных выше дополнительных лекарственных компонентов можно применять при производстве лекарственного препарата. Лекарственное средство может предназначаться для отдельного или комбинированного введения индивидууму, и, соответственно, может содержать связывающий элемент и дополнительный компонент в виде комбинированного препарата или в виде отдельных препаратов. Отдельные препараты могут применяться для облегчения отдельного и последовательного или одновременного введения, и позволяют вводить компоненты различными путями, например, с помощью перорального и парентерального введения.
Предусматриваемые композиции можно вводить млекопитающим. Введение, как правило, проводится с "терапевтически эффективным количеством", что является достаточным, чтобы продемонстрировать пользу у пациента. Такая эффективность может представлять собой по меньшей мере уменьшение интенсивности по меньшей мере одного симптома. Фактическое вводимое количество, а также частота и динамика введения будут зависеть от природы и тяжести того, что подлежит лечению, конкретного млекопитающего, подлежащего лечению, клинического состояния отдельного пациента, причины нарушения, местоположения доставки композиции, типа связывающего элемента, способа введения, режима введения и других факторов, известных практикующим врачам. Назначение лечения, например, принятие решения о дозировке и т.д., входит в ответственность врачей общей практики и других врачей, и может зависеть от тяжести симптомов и/или прогрессирования заболевания, подлежащего лечению. Терапевтически эффективное количество или подходящую дозу связывающего элемента по настоящему изобретению можно определить путем сравнения его активности in vitro и активности in vivo на животных моделях. Известны способы экстраполяции эффективных дозировок для других подопытных животных на людей. Точная доза будет зависеть от ряда факторов, в том числе от того, предназначено ли антитело для диагностики, предупреждения или для лечения, размера и локализации области, которая подлежит лечению, конкретной природы антитела (например, полное антитело, фрагмент или диатело) и природы любой детектируемой метки или другой молекулы, прикрепленной к антителу. Типичная доза антитела будет находиться в диапазоне от 100 мкг до 1 г для системного применения. Может вводиться изначально более высокая ударная доза, за которой следует одна или несколько более низких доз. Как правило, антитело будет представлять собой целое антитело, например изотипа IgG1 или IgG1-TM. Средства для лечения можно вводить повторно с интервалами один раз в день, два раза в неделю, один раз в неделю или один раз в месяц по решению врача. Лечение можно проводить каждые две - четыре недели с подкожным введением, и каждые четыре-восемь недель с внутривенным введением. Лечение может быть периодическим, и период между введениями составляет примерно две недели или больше, например, примерно три недели или больше, примерно четыре недели или больше или примерно раз в месяц.
Различные дополнительные аспекты и варианты осуществления настоящего изобретения будут очевидны специалистам в данной области в свете настоящего раскрытия.
Все документы, в том числе ссылки на базы данных и номера доступа, патенты, заявки на патент и публикации, упоминающиеся в данном описании, включены в данный документ посредством ссылки во всей своей полноте для всех целей.
Применяемое в данном документе "и/или" следует понимать как конкретное раскрытие каждого из данных двух указанных свойств или компонентов с другим или без другого. Например, "А и/или В" следует рассматривать как конкретное раскрытие каждого из (i) A, (ii) В, (iii) А и В, как если бы каждый из них был изложен в данном документе по отдельности.
Если контекст не диктует иное, описания и определения деталей, изложенных выше, не ограничены каким-либо конкретным аспектом или вариантом осуществления настоящего изобретения и в равной степени применимы ко всем описанным аспектам и вариантам осуществления.
Определенные аспекты и варианты осуществления настоящего изобретения далее будут проиллюстрированы посредством примеров и со ссылками на прилагаемые фигуры и таблицы.
Примеры
Следующие последовательности были депонированы в NCIMB, Ferguson Building, Craibstone Estate, Баксберн, Абердин, AB21 9YA. Шотландия, Великобритания.
Клетки Е. coli ТОР10 Abet0007 = NCIMB 41889
Клетки Е. coli ТОР10 Abet0380-GL = NCIMB 41890
Клетки Е. coli ТОР10 Abet0144-GL = NCIMB 41891
Клетки Е. coli ТОР10 Abet0377-GL = NCIMB 41892
Дата депонирования = 2 ноября 2011 г.
Пример 1. Получение антитела, специфичного к бета-амилоиду 1-42, и отбор лидерного антитела
1.1 Состав бета-амилоидных пептидов
Биотинилированный человеческий бета-амилоидный 1-42 пептид (rPeptide, США; № по кат.: A1117 или Bachem AG, Швейцария; № по кат.: Н-5642) ресуспендировали до 1 мг/мл в 1% растворе гидроксида аммония (объем/объем) и хранили в аликвотах при -80°C, до того как они потребуются. Идентичной процедуре следовали в случае немеченого человеческого бета-амилоидного 1-42 пептида (Anaspec, США; № по кат.: 64129), немеченого человеческого бета-амилоидного 1-40 пептида (rPeptide, США; № по кат.: А1155), биотинилированного человеческого бета-амилоидного 1-40 пептида (rPeptide, США; № по кат.: А111 или Bachem AG, Швейцария; № по кат.: Н-5914), биотинилированного мышиного бета-амилоидного 1-42 пептида (Anaspec, США; № по кат.: 61718-01) и биотинилированного мышиного бета-амилоидного 1-40 пептида (Anaspec, США; № по кат.: 61717).
1.2 Отбор
Библиотеку фагового дисплея на основе фага Fab310-лямба (Dyax, США), клонированную в фагмидный вектор на основе нитчатого фага М13, применяли для отбора (Hoet et al., 2005). Fab-антитела, специфичные к бета-амилоиду 1-42, выделяли из библиотек фагового дисплея с применением серии циклов отбора на синтетическом человеческом биотинилированном бета-амилоиде 1-42 (rPeptide, США), фактически как описано ранее (Hawkins et al., 1992; Vaughan et al., 1996). Кратко, для первого раунда отбора в фазе раствора, биотинилированный амилоид-бета 1-42 в фосфатно-солевом буфере Дульбекко (DPBS, рН 7,4) добавляли к очищенным фаговым частицам, которые предварительно инкубировали в течение 1 часа в Marvel-PBS (3% вес/объем), содержащем 100-кратный избыток немеченого человеческого бета-амилоидного 1-40 пептида (Anaspec, США). Фаговые частицы, которые связались с биотинилированным бета-амилоидным 1-42 пептидом, захватывали с применением парамагнитных гранул, соединенных со стрептавидином (Invitrogen Life Technologies, Великобритания), и слабосвязанные фаговые частицы удаляли при помощи серии циклов отмывки с применением PBS-Tween (0,1% объем/объем). Связанные фаговые частицы отмывали от гранул, инфицировали в бактерии Е. coli TG1 и спасали для раунда отбора (Vaughan et al., 1996). Два последующих раунда отбора проводили как ранее описано, но со сниженной концентрацией биотинилированного бета-амилоидного 1-42 антигена.
1.3 Идентификация клонов, специфичных к бета-амилоиду 1-42, с применением анализа прямого связывания с неочищенными Fab-фрагментами
Для получения растворимых одноцепочечных Fab-фрагментов (sFab) ген III tether удаляли из кассеты для дисплея на основе Fab310-лямбда с применением стандартных методик расщепления и лигирования. Вкратце, фагмидные векторы выделяли из продукта раунда 3 с применением стандартных наборов для очистки ДНК (QIAgen, Великобритания) и последовательность гена III tether удаляли из вектора с применением рестриктазы MluI (Hoet et al., 2005). Повторно лигированные векторы трансформировали обратно в клетки TG1 и отдельные колонии отбирали для анализа.
Неочищенные sFab из периплазматических препаратов подвергали скринингу посредством анализа связывания с помощью гомогенной флуоресценции с временным разрешением (HTRF™, CisBio International, Франция) с применением планшет-ридера En Vision (PerkinElmer, США). В этом анализе связывание неочищенных sFab с человеческим бета-амилоидным 1-42 пептидом оценивали посредством измерения резонансного переноса энергии флуоресценции (FRET) между sFab с гистидиновой меткой и биотинилированным пептидом с применением детекторных реагентов криптата стрептавидина и антитела к 6his-XL665 (CisBio International, Франция; № по кат.: 610SAKLB и 61HISXLB, соответственно). Продукты отбора подвергали скринингу в виде неочищенных бактериальных периплазматических экстрактов, содержащих sFab, приготовленных в 50 мМ буфера MOPS рН 7,4, 0,5 мМ EDTA и 0,5 М сахарозы. Десять микролитров неочищенных образцов sFab вносили в 384-луночный планшет для анализа Costar® (Corning, США; № по кат.: 3676). После этого следовало добавление 5 мкл 20 нМ синтетического человеческого бета-амилоида 1-42 и 5 мкл объединенного раствора 6 нМ криптата стрептавидина и 20 нМ анитела к his-XL665. Лунки с неспецифичным связыванием (отрицательные контроли) определяли для каждого планшета с применением неочищенных sFab отрицательного контроля вместо тестируемого образца sFab. Перекрестно-реагирующие клоны sFab идентифицировали с применением одновременного анализа с человеческим бета-амилоидным 1-40 пептидом. Все разведения осуществляли в 50 мМ MOPS рН 7,4 (Sigma, Великобритания; № по кат.: М9381), содержащем 0,4 М KF (BDH Chemicals, США; № по кат.: 103444Т), 0,1% бычий сывороточный альбумин, не содержащий жирных кислот (Sigma, Великобритания; № по кат.: А6003), и 0,1% Tween 20 (объем/объем) (Sigma, Великобритания; № по кат.: Р2287) (буфер для анализа). Планшеты для анализа инкубировали в течение 4 часов при комнатной температуре перед считыванием посредством флуоресценции с временным разрешением на планшет-ридере EnVision (PerkinElmer, США) с применением длины волны возбуждения 320 нм и измерения испускание при 620 нм и 665 нм (100 вспышек).
Данные анализировали путем расчета значений % дельта F для каждого образца. % дельта F определяли согласно уравнению 1.
Уравнение 1:

1.4 Анализ прямого связывания очищенных sFab-фрагментов
Периплазматические экстракты с неочищенными sFab, которые показали специфичное связывание с человеческим бета-амилоидным 1-42 пептидом в HTRF™-анализе, подвергали ДНК-секвенированию (Osbourn et al., 1996; Vaughan et al., 1996). sFab с уникальными белковыми последовательностями экспрессировали в Е. coli и очищали посредством аффинной хроматографии (фактически как описано (Bannister et al., 2006)). Профиль связывания бета-амилоида для каждого очищенного sFab определяли путем тестирования серии разведений очищенных sFab в HTRF™-анализе, описанном в разделе 1.3, заменяя периплазматические препараты с неочищенными sFab на очищенные sFab. Очищенные sFab тестировали одновременно на связывание с биотинилированным человеческим бета-амилоидным 1-42 пептидом, биотинилированным мышиным бета-амилоидным 1-42 пептидом и биотинилированным человеческим бета-амилоидным 1-40 пептидом. Кроме того, sFab тестировали на связывание со скремблированным человеческим бета-амилоидным 1-42 пептидом (Anaspec, синтез под заказ) в отдельном HTRF™-эксперименте, чтобы проконтролировать какое-либо неспецифичное связывание пептида. Данные анализировали путем расчета значений % дельта F, как описано в разделе 1.3.
Типовые результаты для очищенного sFab Abet0007 показаны на фигуре 1. Эти результаты демонстрируют, что Abet0007 специфично связывается с человеческим бета-амилоидным 1-42 пептидом, а не с человеческим бета-амилоидным 1-40 пептидом и скремблированным человеческим бета-амилоидным 1-42 пептидом. Кроме того, sFab Abet0007 перекрестно реагирует с мышиным бета-амилоидным 1-42 пептидом.
1.5 Переформатирование Fab-антител, специфичных к бета-амилоиду 1-42, в формат IgG2
Тринадцать клонов, специфичных к бета-амилоиду 1-42, переводили из Fab в IgG2 посредством субклонирования вариабельных доменов тяжелой цепи (VH) и вариабельных доменов легкой цепи (VL) в векторы, экспрессирующие целые тяжелые и легкие цепи человеческого антитела, соответственно. VH-домены подвергали оптимизиации кодонов в лаборатории перед субклонированием, поскольку VH-домены из библиотеки Dyax FAB310 являются полусинтетическими и не могут экспрессироваться в достаточных количествах в клетках млекопитающих, описанных в данном документе. Совпадающий с геном зародышевого типа VH, полученный в лаборатории, который, как известно, хорошо экспрессируется в виде человеческого IgG полной длины в клетках млекопитающих, применяли в качестве матрицы для изменения частоты использования кодонов ДНК в VH-доменах из Dyax, при этом с сохранением оригинальной аминокислотной последовательности. Кодон-оптимизированные вариабельные домены тяжелых цепей клонировали в вектор экспрессии для млекопитающих (pEU 9.2), содержащий константные домены тяжелой цепи человека и регуляторные элементы для экспрессии целой тяжелой цепи IgG2 в клетках млекопитающих. Аналогично, вариабельный домен легкой цепи клонировали в вектор экспрессии для млекопитающих (pEU4.4) для экспрессии константных доменов легкой лямбда-цепи человека и регуляторных элементов для экспрессии целой легкой цепи IgG в клетках млекопитающих. Векторы для экспрессии тяжелых цепей и легких цепей первоначально описаны в Persic и соавт. (Persic et al., 1997). Для получения клонов в виде IgG2 векторы экспрессии для тяжелой и легкой цепи IgG временно трансфицировали в клетки млекопитающих HEK293-EBNA (Invitrogen, Великобритания; № по кат.: R620-07) или СЕР6-СНО (полученные в лаборатории), в которых антитело экспрессировалось и секретировалось в среду. Собранную среду отфильтровывали перед очисткой. IgG очищали с применением хроматографии с белком A (Biosepra™, Pall, США или MabSelect SuRe, GE Healthcare, Великобритания). Культуральные супернатанты загружали на подходящую колонку с белком А, предварительно уравновешенную 50 мМ Tris рН 8,0, 250 мМ NaCl. Связавшийся IgG элюировали из колонки с применением 0,1 М цитрата натрия, рН 3,0, и элюат нейтрализовали добавлением 1 М Tris-буфера (рН 10,0). Для IgG проводили замену буфера на PBS в модификации Дульбекко с применением колонок для замены буфера NAP-10 (GE Healthcare, Великобритания; № по кат.: 17-0854-02). Очищенные IgG пропускали через фильтр с диаметром пор 0,2 микрометра и концентрацию IgG определяли по поглощению при 280 нм с применением коэффициента экстинкции на основе аминокислотной последовательности IgG. Очищенные IgG анализировали в отношении агрегирования или разложения с применением методик SEC-HPLC и SDS-PAGE.
1.6 Определение специфичности лидерного антитела в конкурентном HTRF™-анализе с применением бета-амилоидного пептида
Как описано выше, очищенные sFab-фрагменты, которые специфично связывались с бета-амилоидным 1-42 пептидом, превращали в рекомбинантные IgG. Для тестирования специфичности связывания этих IgG с другими человеческими бета-амилоидными пептидами разрабатывали конкурентный анализ. В этом анализе немеченные человеческие бета- амилоидные пептиды 1-42 (rPeptide, США; № по кат.: А1165), 1-40 (rPeptide, США; № по кат.: А1155), 11-42 (rPeptide, США; № по кат.: А1063), 17-42 (rPeptide, США; № по кат.: А1058) и 1-43 (Anaspec, США; № по кат.: 25356) инкубировали с лидерным IgG и биотинилированным человеческим бета-амилоидным 1-42 пептидом (rPeptide, США; № по кат.: АН 17). Вкратце, серию разведений каждого тестируемого пептида объединяли с 0,3 нМ тестируемого IgG и 5 нМ биотинилированного человеческого бета-амилоидного 1-42 пептида. Конкуренцию каждого пептида оценивали путем выявления утраты связывания лидерного IgG с биотинилированным 1-42 пептидом посредством измерения резонансного переноса энергии флуоресценции (FRET) между IgG и биотинилированным 1-42 бета-амилоидом с применением детекторных реагентов криптата стрептавидина (CisBio International, Франция; № по кат.: 610SAKLB) и антитела к Fc IgG XL665 человека (CisBio International, Франция; № по кат.: 61HFCXLB).
Криптат стрептавидина и антитело к Fc IgG XL665 человека объединяли из расчета 7 нМ и 5 нМ, соответственно, в буфере для анализа, содержащем 50 мМ MOPS рН 7,4 (Sigma, Великобритания; № по кат.: М9381), 0,4 М KF (BDH Chemicals, США; № по кат.: 103444Т), 0.1% fatty acid free bovine serum albumin (Sigma, UK; cat: A6003) and 0.1% Tween 20 (v/v) (Sigma, UK; cat: P2287). 5 мкл этого раствора вносили в планшет для анализа (Costar® 384-луночный с черными мелкими лунками, Corning Life Sciences; № по кат.: 3676). Бета-амилоидные пептиды серийно разводили в буфере для анализа с применением 96-луночного планшета с лунками с U-образным дном Greiner (Greiner BioOne, Германия; № по кат.: 650201). По 5 мкл каждого разведения пептида переносили в двойной повторности в планшет для анализа с применением роботизированной станции дозирования жидкостей MiniTrak™ (PerkinElmer, США). Тестируемый IgG разбавляли до 1,2 нМ в буфере для анализа и 5 мкл вносили в планшет для анализа. 20 нМ раствор биотинилированного человеческого бета-амилоидного 1-42 пептида приготовили в буфере для анализа и 5 мкл этого раствора вносили в планшеты для анализа. Лунки с неспецифичным связыванием (отрицательные контроли) определяли для каждого планшета путем замещения тестируемого IgG 5 мкл буфера для анализа. Планшеты для анализа инкубировали в течение 4 часов при комнатной температуре перед считыванием флуоресценции с временным разрешением при длинах волны испускания 620 нм и 665 нм с применением планшет-ридера En Vision (PerkinElmer, США).
Данные анализировали путем расчета значений % дельта F для каждого образца. % дельта F определяли согласно уравнению 1. Значения % дельта F затем использовали для расчета % специфичного связывания, как описано в уравнении 2.
Уравнение 2:

Типовые результаты для IgG Abet0007 показаны на фигуре 2. Эти результаты демонстрируют, что IgG Abet0007 связывается с человеческим бета-амилоидным 1-42 пептидом, но не с человеческим бета-амилоидным 1-40 пептидом. Это антитело также связывается с усеченными пептидами 11-42 и 17-42 и с человеческим бета-амилоидным 1-43 пептидом.
1.7 Определение аффинностей связывания лидерных антител с человеческим бета-амилоидом 1-42 с применением поверхностного плазмонного резонанса
Биосенсорный инструмент BIAcore Т-100 (GE Healthcare, Великобритания) применяли для оценки кинетических параметров взаимодействия между каждым лидерным антителом и синтетически полученным человеческим бета-амилоидным 1-42 пептидом. Эти эксперименты осуществляли, фактически, как описано у Karlsson и соавт. (Karlsson et al., 1991).
В биосенсоре используются оптические эффекты поверхностного плазмонного резонанса (SPR) для изучения изменений поверхностной концентрации, происходящих в результате взаимодействия молекулы аналита, которую пропускают поверх молекулы лиганда, иммобилизованного на слое декстрана биосенсорного чипа. Как правило, определенную концентрацию частиц аналита пропускают поверх соответствующего лиганда и любое связывание определяется как увеличение местного SPR сигнала (фаза ассоциации). За этим следует период с пропусканием потока буфера, в течение которого диссоциацию частиц аналита с иммобилизованным на поверхности лигандом можно наблюдать в виде снижения сигнала (фаза диссоциации). Оставшийся аналит затем можно отделить от связанного с чипом лиганда, и процедура повторяется с несколькими различными концентрациями аналита. Эксперимент разрабатывали, так что ни абсолютная связывающая способность, ни кинетический профиль связанного лиганда существенно не изменяются в течение всего эксперимента и могут отслеживаться с применением серии контролей, используемых в ходе всего эксперимента. Проприетарный физиологический раствор, забуференный при помощи HEPES, содержащий EDTA (HBS-EP+, GE Healthcare), обычно применяют в качестве разбавляющего буфера для образцов аналитов и в качестве проточного буфера во время фазы диссоциации. Экспериментальные данные записываются в виде «резонансных единиц» (RU), которые являются условными единицами, прямо соответствующими SPR сигналу. RU прямо пропорциональны изменениям показателя преломления на поверхности чипа, который, в свою очередь, является приближенным показателем массы связанного аналита. Проприетарный пакет программного обеспечения BIAevaluation можно затем применять для обработки данных и подбора моделей связывания для наборов данных. Обратные константы скорости ассоциации (ka; М-1 с-1) и диссоциации (kd; с-1) позволяют рассчитать аффинные константы диссоциации (KD; М).
Аффинность связывания между каждым тестируемым IgG и человеческим бета-амилоидным 1-42 пептидом оценивали с применением анализов, в которых антитело ковалентно связывали посредством аминного мостика с поверхностью проприетарного чипа СМ5 с конечной поверхностной плотностью приблизительно 2000 RU. Поверхность чипа регенерировали между циклами при помощи однократной 40 секундной инъекции 10 мМ глицина, рН 2.0, для удаления лиганда, связавшегося с антителом. Регенерация не приводила к значительной потере активности связывания пептида.
Серию разведений синтетического человеческого бета-амилоидного 1-42 пептида (1,6-100 нМ) последовательно пропускали поверх поверхности с антителом в течение достаточного количества времени для наблюдения сенсограмм, которые можно было с достоверностью согласовать с подходящей моделью связывания. Данные от холостой пробы для эталонной проточной кюветы вычитали из каждого набора данных для IgG и проводили двойное контрольное вычитание данных холостой пробы с буфером с нулевой концентрацией из основного набора данных для снижения влияния любых артефактов от буфера или эффектов неспецифичного связывания. Затем подбирали подходящую модель связывания одновременно для данных от каждого титрования аналита с применением программного обеспечения BIAevaluation.
Правильность данных оценивали с применением рассчитанного значения хи2 при допустимом значении ниже 2 RU2. Общую успешность подбора оценивали с применением остатков при допустимом отклонении менее 2 RU.
Типовые результаты для IgG2 Abet0007 показаны на фигуре 3. Средняя константа скорости ассоциации (ka), константа скорости диссоциации (kd) и константа диссоциации (KD) составляют 1,6×105 М-1 с-1, 7,4×10-2 с-1 и 473 нМ, соответственно. Эти параметры получены на основании подбора модели Langmuir 1:1 к данным.
1.8 Определение функциональных характеристик лидерных антител при помощи деплеции бета-амилоидных пептидов из человеческой плазмы
Лидерные антитела тестировали в анализе деплеции в плазме для изучения их способности к иммунопреципитации человеческого бета-амилоидного 1-42 пептида из плазмы крови человека. Этот анализ применяли для получения доказательства функциональной эффективности каждого антитела. Вкратце, образцы плазмы человека инкубировали с каждым тестируемым IgG в течение 3 часов, после чего антитела и любые связанные лиганды удаляли. Содержание бета-амилоидного 1-42 пептида в образцах плазмы человека анализировали с применением стандартных методик до и после иммунопреципитации, и эти значения применяли для определения эффективности антитела. Образцы плазмы также анализировали в отношении какой-либо деплеции бета-амилоидного 1-40 пептида для оценки специфичности лидерного антитела
Каждое тестируемое антитело отдельно ковалентно связывали с магнитными гранулами с карбоновой кислотой Dynabeads® М-270 (Invitrogen Life Technologies, Великобритания; № по кат.: 143-05D) согласно инструкциям производителя. Для каждого тестируемого IgG 100 мкл Dynabeads промывали дважды с помощью 100 мкл 25 мМ MES, рН 5 (Sigma, Великобритания; № по кат.: М5287), с применением магнита для отделения гранул от суспензии. Непосредственно перед использованием EDC (Pierce, Thermo Scientific, США; № по кат.: 22981) растворяли в холодном 25 мМ MES, рН 5, до конечной концентрации 50 мг/мл. 50 мг/мл раствор NHS (Pierce, Thermo Scientific; № по кат.: 24500) готовили аналогично в 25 мМ MES, рН 5. 50 мкл раствора NHS и 50 мкл раствора EDC добавляли к промытым Dynabeads, которые хорошо перемешивали и инкубировали при вращении с небольшим наклоном при комнатной температуре в течение 30 минут. Магнит применяли для осаждения гранул и супернатант удаляли. Гранулы дважды промывали с помощью 100 мкл 25 мМ MES, рН 5. Каждый тестируемый IgG разводили до 0,6 мг/мл в общем объеме 100 мкл 25 мМ MES, рН 5. Промытые гранулы ресуспендировали в растворе лиганда и инкубировали в течение по меньшей мере 30 минут при комнатной температуре при вращении с небольшим наклоном. Впоследствии гранулы осаждали с применением магнита и однократно промывали с помощью 100 мкл 50 мМ буфера Tris, рН 7,4 (Sigma, Великобритания). Затем гранулы ресуспендировали в 100 мкл Marvel-PBS (3% вес/объем) и инкубировали на протяжении ночи при 4°C. Гранулы промывали дважды при помощи PBS в модификации Дульбекко (100 мкл) и ресуспендировали в PBS (100 мкл).
Образцы плазмы с EDTA отбирали у анонимных доноров в медицинской клинике AstraZeneca в Седертелье, Швеция. Приблизительно 100 мл крови собирали от каждого донора, и их собирали в две 50 мл пробирки. EDTA добавляли до конечной концентрации 5 мМ для предотвращения свертывания, и пробирки центрифугировали при 4000 × g в течение 10 минут при 4°C. Супернатант (плазму) собирали, делили на аликвоты в 1 мл пробирки и хранили при -80°С, до того как они потребуются. Образцы анализировали на содержание как бета-амилоидного 1-42 пептида, так и бета-амилоидного 1-40 пептида, как описано ниже.
Каждый набор покрытых антителом гранул отдельно инкубировали с 1 мл аликвотой плазмы с EDTA в течение 3 часов при 4°C при вращении с небольшим наклоном, и затем гранулы осаждали с применением магнита. Супернатант осторожно удаляли от гранул и анализировали на как бета- амилоидный 1-42 пептид, так и бета-амилоидный 1-40 пептид, как описано ниже.
Анализ содержания бета-амилоидного 1-40 пептида в образцах плазмы осуществляли с применением набора для ELISA на человеческий Аβ 40 от Invitrogen (Великобритания; № по кат.: KHB3482) согласно инструкциям производителя. Вкратце, стандарт человеческого бета-амилоидного 1-40 пептида применяли для создания серии разведений от 1 нг/мл вниз до 7,81 пг/мл. Разведения производили с применением стандартного буфера для разведений, содержащего 1 таблетку ингибитора протеазы (Roche, Великобритания; № по кат.: 11697498001) на 50 мл разбавителя. Затем по 50 мкл каждого разведения вносили в различные лунки планшета для микротитрования, предварительно покрытые проприетарным моноклональным антителом, специфичным по отношению к N-концу бета-амилоидного пептида. Образцы плазмы с EDTA центрифугировали в течение 10 минут при 4°C и 2000 × g и по 50 мкл супернатанта каждого образца вносили в отдельную лунку в тот же планшет для микротитрования, что и стандарты. Затем в каждую лунку планшета для микротитрования добавляли по 50 мкл проприетарного антитела для выявления человеческого Аβ, которое специфично распознает С-конец бета-амилоидного 1-40 пептида. Планшет накрывали при помощи пленки для планшетов и инкубировали в течение 3 часов при комнатной температуре при встряхивании. Планшет промывали четыре раза при помощи 400 мкл промывочного буфера, позволяя планшету пропитаться в течение 15-30 секунд во время каждой промывки. Затем планшет переворачивали и постукивали для высушивания. По 100 мкл проприетарного антитела против IgG кролика, конъюгированного с HRP, добавляли в каждую лунку, планшет накрывали при помощи пленки для планшетов и образцы инкубировали в течение 30 минут при комнатной температуре. Снова планшет промывали четыре раза при помощи 400 мкл промывочного буфера, позволяя планшету пропитаться в течение 15-30 секунд во время каждой промывки. Затем планшет переворачивали и постукивали для высушивания. По 100 мкл проприетарного стабилизированного хромогена добавляли в каждую лунку и планшет инкубировали в темноте в течение 20 минут при комнатной температуре. После этого в каждую лунку добавляли по 100 мкл проприетарного стоп-раствора. Поглощение каждой лунки считывали при 450 нм в течение 2 часов после добавления стоп-раствора. Стандартную кривую получали на основании серии разведений человеческого бета-амилоидного 1-40 пептида и ее применяли для определения концентрации человеческого бета-амилоидного 1-40 пептида в тестируемых образцах плазмы с EDTA.
Анализ содержания бета-амилоидного 1-42 пептида в образцах плазмы осуществляли с применением набора для β-амилоида(1-42) INNOTEST® от Innogenetics (Бельгия; № по кат.: 80177), фактически согласно инструкциям производителя. Вкратце, стандарт человеческого бета-амилоидного 1-42 пептида применяли для создания серии разведений от 1 нг/мл вниз до 7,81 пг/мл. Затем по 100 мкл каждого разведения вносили в различные лунки планшета для микротитрования, предварительно покрытые проприетарным моноклональным антителом, специфичным по отношению к С-концу бета- амилоидного 1-42 пептида. Образцы плазмы с EDTA центрифугировали в течение 10 минут при 4°С и 2000 × g и по 100 мкл супернатанта каждого образца вносили в отдельную лунку в тот же планшет для микротитрования, что и стандарты. Планшет накрывали при помощи пленки для планшетов и инкубировали в течение 3 часов при комнатной температуре при встряхивании. Планшет промывали пять раз с помощью 400 мкл промывочного буфера и затем переворачивали и постукивали до сухости. По 100 мкл проприетарного конъюгата 1 (C1HS), который распознает N-конец бета-амилоидного пептида, добавляли в каждую лунку. Планшет накрывали при помощи пленки для планшетов, и образцы инкубировали в течение 1 часа при комнатной температуре. Снова планшет промывали пять раз с помощью 400 мкл промывочного буфера и затем переворачивали и постукивали до сухости. Затем в каждую лунку добавляли по 100 мкл конъюгата 2 (С2), конъюгата стрептавидина с HRP, который связывается с биотинилированным антителом C1HS. Планшет накрывали при помощи пленки для планшетов и инкубировали в течение 30 минут при комнатной температуре. Планшет промывали пять раз с помощью 400 мкл промывочного буфера и затем переворачивали и постукивали до сухости. В каждую лунку добавляли по 100 мкл проприетарного раствора субстрата, планшет инкубировали в течение 30 минут при комнатной температуре, и затем в каждую лунку добавляли по 100 мкл стоп-раствора. Поглощение каждой лунки считывали при 450 нм в течение 15 минут после добавления стоп-раствора. Стандартную кривую получали на основании серии разведений человеческого бета-амилоидного 1-42 пептида и ее применяли для определения концентрации человеческого бета-амилоидного 1-42 пептида в тестируемых образцах плазмы с EDTA.
В одном эксперименте антитело IgG2 Abet0007 снижало уровни человеческого бета-амилоидного 1-42 пептида в плазме от 80,47 пг мл-1 до 60,56 пг мл-1 (снижение на 25%). Во втором эксперименте уровни снижались от 197,43 пг мл-1 до 154,45 пг мл-1 (снижение на 22%).
1.9 Идентификация лидерных клонов с низкой аффинностью в отношении нативного бета-амилоида с применением in vitro иммуногистохимии
Лидерные антитела тестировали в отношении их способности связываться с бета-амилоидом для того, чтобы идентифицировать лидерные клоны с низкой аффинностью в отношении нативных форм бета-амилоидного пептида. Вкратце, лидерные антитела подвергали скринингу на срезах головного мозга людей с болезнью Альцгеймера и срезах головного мозга мышей Tg2576 для идентификации антител к бета-амилоиду 1-42, которые связывались с нативным амилоидом in vitro.
Мыши Tg2576 представляют собой трансгенных мышей, которые сверхэкспрессируют ген для человеческого белка-предшественника амилоида (АРР). Этот ген несет две точковые мутации в сайте расщепления гамма-секретазой (Lys670Asn и Met671Leu), что ведет к образованию бета-амилоидных бляшек в коре и гиппокампе мышей, начиная с возраста приблизительно 9 месяцев.
Ткань головного мозга человека получали из лобной коры (нижняя лобная извилина) двух индивидуумов с тяжелой болезнью Альцгеймера (генотип ApoE 3/3, стадия по Braak 6 и генотип ApoE 4/3, стадия по Braak 5, соответственно). В качестве контроля, эквивалентную ткань получали от одного индивидуума без деменции (генотип ApoE 3/3, стадия по Braak 1). Все три ткани были получены из Банка головных мозгов Нидерландов (Netherlands Brain Bank) (NBB). Качество срезов проверяли при помощи окрашивания гематоксилином/эозином перед использованием. Ткань головного мозга мыши вырезали из мышей Tg2576 в возрасте 15 месяцев (2 мыши), 18 месяцев (6 мышей) и 22 месяца (2 мыши).
Срезы головного мозга, залитого в парафин, толщиной 4-6 мкм, подготавливали для иммуногистохимии вначале путем удаления парафиновой несущей матрицы. Срезы промывали ксилолом (5 минут ×2), абсолютным этанолом (3 минуты ×2), 95% этанолом (3 минуты ×2), 70% этанолом (3 минуты ×2), 90% муравьиной кислотой (Sigma Aldrich, Великобритания; № по кат.: 06440; 10 минут), водопроводной водой (20 минут ×3) и PBS (5 минут ×2). Затем срезы прокипятили в растворе Diva Decloaker (Biocare Medical, США; № по кат.: DV2004 G1) в микроволновой печи в течение 20 минут при 100°С. Образцы впоследствии охлаждали до 40°С в водяной бане и затем промывали дистиллированной водой (5 минут) и PBS (5 минут ×3).
Лидерные антитела IgG2 тестировали при концентрациях 2, 5 и 20 мкг мл-1. Связывание этих IgG выявляли с применением вторичного антитела кролика против человеческого Ig (Dako, Дания; № по кат.: А0482) при разведении 1 к 400, а впоследствии с применением антитела OmniMap против Ig кролика, конъюгированного с HRP (Ventana Medical Systems, США; № по кат.: 760-4311). Сигнал выявляли с применением набора ChromoMap DAB (Ventana Medical Systems, США; № по кат.: 760-159). Эти стадии окрашивания осуществляли с применением системы для автоматического приготовления препаратов BenchMark (Ventana Medical Systems, США) согласно стандартным протоколам.
Количественную оценку окрашивания проводили слепым методом при помощи по меньшей мере двух различных людей под оптическим увеличением 20-40x. In vitro связывание бляшек определяли с применением шкалы от 0 (отсутствует окрашивание бляшек) до 4 (интенсивное окрашивание бляшек).
IgG2 Abet0007 не демонстрировало окрашивания бляшек как в головном мозге людей с болезнью Альцгеймера, так и в головном мозге мышей Tg2576 (балл = 0). В отличие от этого, антитело положительного контроля давало балл 4 на смежных срезах при таких же состояниях. Типичные фотографии представлены на фигуре 4.
Пример 2. Оптимизация антитела Abet0007 посредством направленного мутагенеза определяющей комплементарность области 3 (CDR3)
2.1 Превращение исходного клона Abet0007 в формат scFv
Исходный клон превращали из формата IgG2 в формат одноцепочечного вариабельного фрагмента (scFv) при подготовке для аффинной оптимизации. Кодон-оптимизированные вариабельные домены тяжелой цепи (VH) и вариабельные домены легкой цепи (VL) амплифицировали отдельно от их соответствующих векторов IgG с добавлением специфичных сайтов клонирования и гибкой линкерной области. Затем осуществляли рекомбинаторную ПЦР для получения полной scFv-конструкции, которую клонировали в фагмидный вектор pCantab10.5, фактически как описано в Vaughan и соавт. (Vaughan et al., 1996). Вектор pCantab10.5 представляет собой модифицированную версию вектора pCantab6, который содержит дополнительные сайты рестрикции для облегчения добавления меток, кроме стандартных меток His и myc.
2.2 Оптимизация Abet0007 посредством нацеленного мутагенеза
Лидерное антитело (Abet0007) оптимизировали для улучшения аффинности к человеческому бета-амилоидному 1-42 пептиду с применением подхода нацеленного мутагенеза и отборов с фаговым дисплеем на основе аффинности. Большие scFv-фаговые библиотеки, полученные из Abet0007, создавали путем олигонуклеотид-направленного мутагенеза определяющих комплементарность областей 3 (CDR3) вариабельных доменов тяжелой цепи (VH) и вариабельных доменов легкой цепи (VL) с применением стандартных методик молекулярной биологии, как описано у Clackson and Lowman ((2004) A Practical Approach, Oxford University Press).
Библиотеки подвергали процедурам отбора с помощью фагового дисплея на основе аффинности, чтобы обогатить вариантами с более высокой аффинностью к человеческому бета-амилоидному 1-42 пептиду. Процедуру отбора осуществляли, фактически, как описано ранее (Hawkins et al., 1992; Schier et al., 1996; Thompson et al., 1996). Вкратце, фаговые частицы с scFv инкубировали с биотинилированным человеческим бета-амилоидным 1-42 пептидом (rPeptide, США; № по кат.: A1117) в растворе. Фаг с ScFv, который связался с антигеном, затем захватывали на покрытых стрептавидином парамагнитных гранулах (Dynabeads® М280, Invitrogen Life Sciences, Великобритания) согласно рекомендациям производителя. Затем отобранные фаговые частицы с scFv спасали, как описано ранее (Osbourn et al., 1996), и процесс отбора повторяли в присутствии понижающихся концентраций биотинилированного человеческого бета-амилоидного 1-42 антигена (от 200 нМ до 2 нМ за 3 раунда).
2.3 Идентификация улучшенных клонов с применением анализа прямого связывания
Тысячу семьсот шестьдесят scFv случайным образом отобрали из раундов отбора 2 и 3 из подхода с нацеленным мутагенезом, описанного в разделе 2.2. Эти клоны подвергали скринингу с применением анализа прямого связывания, фактически, как описано в разделе 1.3. Вкратце, неочищенные scFv из периплазматических препаратов тестировали на повышенное связывание с биотинилированным человеческим бета-амилоидным 1-42 пептидом и выявляли с применением HTRF™-технологии с детекторными реагентами криптатом стрептавидина и антителом к 6his-XL665.
Неочищенные scFv из периплазматических препаратов готовили в 50 мМ буфере MOPS, рН 7,4, содержащем 0,5 мМ EDTA и 0,5 М сахарозы, и впоследствии разводили до 1% в буфере для анализа, содержащем 50 мМ MOPS, рН 7,4 (Sigma, Великобритания; № по кат.: М9381), 0,4 М фторида калия (BDH Chemicals, США; № по кат.: 103444Т), 0,1% бычьего сывороточного альбумина, не содержащего жирных кислот (Sigma, Великобритания; № по кат.: А6003) и 0,1% Tween 20 (объем/объем) (Sigma, Великобритания; № по кат.: Р2287), с применением 384-луночного планшета с лунками с V-образным дном Greiner (Greiner BioOne, Германия; № по кат.: 781280). 5 мкл разведенного образца scFv переносили в планшет для анализа (Costar® 384-луночный с черными мелкими лунками, Corning Life Sciences; № по кат.: 3676) с применением роботизированной станции дозирования жидкостей MiniTrak™ (PerkinElmer, США). Затем в каждую лунку добавляли по 5 мкл буфера для анализа. 20 нМ раствор биотинилированного человеческого бета-амилоидного 1-42 пептида (rPeptide, США; № по кат.: АН 17) готовили в буфере для анализа и 5 мкл этого раствора добавляли в планшеты для анализа. Детекторные реагенты криптат стрептавидина (Cisbio International, Франция; № по кат.: 610SAKLB) и антитело к His6-XL665 (Cisbio International, Франция; № по кат.: 61HISXLB) объединяли в буфере для анализа с получением концентраций 7 нМ криптата стрептавидина и 60 нМ антитела к His6-XL665 и затем по 5 мкл этой детекторной смеси добавляли во все лунки планшетов для анализа. Лунки с неспецифичным связыванием (отрицательные контроли) определяли для каждого планшета путем замещения образца scFv 5 мкл буфера для анализа. Планшеты для анализа закрывали и инкубировали в течение 2,5 часа при комнатной температуре перед считыванием флуоресценции с временным разрешением при длинах волны испускания 620 нм и 665 нм с применением планшет-ридера EnVision (PerkinElmer, США). Анализ данных осуществляли, как описано ранее (раздел 1.3), и значения % дельта F применяли для сравнения сигналов анализа в соседних лунках. "Попадание" определяли как образец scFv, который дает % дельта F больше, чем сигнал, наблюдаемый для scFv Abet0007.
2.4 Подтверждение улучшенных клонов с применением анализа конкуренции за эпитоп
Клоны, которые показали более высокое связывание с человеческим бета-амилоидным 1-42 пептидом, чем исходный клон Abet0007, подвергали ДНК-секвенированию (Osbourn et al., 1996; Vaughan et al., 1996). scFv с уникальными белковыми последовательностями экспрессировали в Е. coli и очищали посредством аффинной хроматографии с последующей заменой буфера. Затем аффинности связывания этих scFv тестировали в анализе конкуренции за эпитоп против эталонного антитела, называемого Abet0042, которое имеет аналогичную аффинность в отношении человеческого бета-амилоидного 1-42 пептида, что и Abet0007. В этом конкурентном анализе определяли конкуренцию связывания IgG Abet0042 с биотинилированным человеческим бета-амилоидным 1-42 пептидом по сравнению с тестируемыми образцами scFv. Связывание IgG Abet0042 с биотинилированным человеческим бета-амилоидным 1-42 пептидом выявляли с применением HTRF™-технологии, как описано ранее (раздел 1.6). Вкратце, серию разведений очищенных scFv добавляли в смесь IgG Abet0042, биотинилированного бета-амилоидного 1-42 пептида, криптата стрептавидина и антитела к Fc IgG XL665 человека. Флуоресценцию с временным разрешением считывали после двух часов инкубации при комнатной температуре.
Очищенные scFv серийно разводили в буфере для анализа, содержащем 50 мМ буфера MOPS, рН 7,4 (Sigma, Великобритания; № по кат.: М9381), 0,4 М фторида калия (BDH Chemicals, США; № по кат.: 103444Т), 0,1% бычьего сывороточного альбумина, не содержащего жирных кислот (Sigma, Великобритания; № по кат.: А6003) и 0,1%) Tween 20 (Sigma, Великобритания; № по кат.: Р2287), с применением 96-луночного планшета с лунками с U-образным дном Greiner (Greiner BioOne, Германия; № по кат.: 650201). 5 мкл каждого разведения scFv переносили в двойной повторности в планшет для анализа (Costar® 384-луночный с черными мелкими лунками, Corning Life Sciences; № по кат.: 3676) с применением роботизированной станции дозирования жидкостей MiniTrak™ (PerkinElmer, США). 20 нМ раствор биотинилированного бета-амилоидного 1-42 пептида (rPeptide, США; № по кат.: А1117) предварительно готовили в буфере для анализа и 5 мкл раствора биотинилированного пептида вносили в планшеты для анализа с получением конечной концентрации 5 нМ пептида при конечном объеме анализа 20 мкл. Планшеты для анализа герметизировали и инкубировали при комнатной температуре в течение 1 часа. Криптат стрептавидина и антитело к Fc IgG XL665 человека объединяли при 7 нМ и 20 нМ, соответственно, в буфере для анализа и 5 мкл этого раствора вносили в планшет для анализа. IgG Abet0042 разводили до 2,4 нМ в буфере для анализа и 5 мкл вносили в планшет для анализа с получением конечной концентрации IgG 0,6 нМ. Лунки с неспецифичным связыванием (отрицательные контроли) определяли для каждого планшета путем замещения образца IgG Abet0042 5 мкл буфера для анализа. Assay plates were sealed and incubated for 2 hours at room temperature prior to reading time resolved fluorescence at 620 nm and 665 nm emission wavelengths using an En Vision plate reader (PerkinElmer, USA).
Данные анализировали путем расчета значения % дельта F и % специфичного связывания для каждого образца. % дельта F определяли согласно уравнению 1 и % специфичного связывания рассчитывали с применением уравнения 2. Значения IC50 определяли с применением Prism (Graphpad Software, США) путем подбора кривой с применением логистического уравнения с четырьмя параметрами, как описано в уравнении 3.
Уравнение 3:

где Y представляет собой специфичное связывание и X представляет собой логарифм концентрации.
Типовые результаты показаны на фигуре 5. Оригинальное лидерное антитело, Abet0007, характеризуется IC50 159 нМ, тогда как наиболее улучшенный клон, Abet0144, характеризуется значением IC50 5,5 нМ.
2.5 Определение кинетического профиля аффинности улучшенных клонов в формате очищенных scFv при помощи поверхностного плазмонного резонанса
Поверхностный плазменный резонанс применяли для анализа очищенных клонов scFv, которые продемонстрировали значительное улучшение аффинности связывания в отношении человеческого бета-амилоидного 1-42 пептида в сравнении с исходной последовательностью, Abet0007, в HTRF™-анализе конкуренции за эпитоп (раздел 2.4). Вкратце, биосенсорный инструмент BIAcore Т-100 (GE Healthcare, Великобритания) применяли для оценки кинетических параметров взаимодействия между каждым очищенным scFv и синтетически полученным человеческим бета-амилоидным 1-42 пептидом. Эти эксперименты осуществляли, фактически, как описано у Karlsson и соавт.(Karlsson et al., 1991). Подробнее см. раздел 1.7.
Аффинность связывания между каждым тестируемым scFv и человеческим бета-амилоидным пептидом 1-42 оценивали с применением анализов, в которых биотинилированный синтетический человеческий бета-амилоидный 1-42 пептид (rPeptide, США; № по кат.: A1117) был нековалентно связан через взаимодействие биотин/стрептавидин с проприетарным сенсорным чипом SA с конечной поверхностной плотностью приблизительно 700 RU. Поверхность чипа регенерировали между циклами при помощи однократной 20 секундной инъекции 10 мМ глицина, рН 2.0, для удаления scFv, связавшегося с пептидом. Регенерация не приводила к значительной потере способности связывания пептида.
Серию разведений каждого очищенного scFv (12,5-400 нМ) последовательно пропускали поверх поверхности с пептидом в течение достаточного количества времени для наблюдения сенсограмм, которые можно было с достоверностью согласовать с подходящей моделью связывания. Данные холостой пробы с буфером с нулевой концентрацией вычитали из основного набора данных для снижения влияния любых артефактов от буфера или эффектов неспецифичного связывания. Затем подбирали подходящую модель связывания одновременно для данных от каждого титрования аналита с применением программного обеспечения BIAevaluation.
Правильность данных оценивали с применением рассчитанного значения хи2 при допустимом значении ниже 4 RU2. Общую успешность подбора оценивали с применением остатков при допустимом отклонении менее 20 RU.
Типовые результаты для scFv Abet0144 показаны на фигуре 6. Константа скорости ассоциации (ка), константа скорости диссоциации (kd) и константа диссоциации (KD) составляют 2,01×105 М-1 с-1, 6,66×10-3 с-1 и 33,2 нМ, соответственно. Эти параметры получены на основании подбора модели Langmuir 1:1 к данным.
2.6 Переформатирование scFv с улучшенной аффинностью в IgG1-TM человека
Формат антитела IgG1-TM представляет собой изотип IgG1 антитела человека, содержащий три замены одиночных аминокислот (тройной мутант: ТМ) в пределах нижней части шарнирного участка и константного СН2-домена (Oganesyan et al., 2008). При введении в нижнюю часть шарнирного участка и CH2-домен молекул IgG1 человека тройная мутация L234F7L235E/P331S ('ТМ') обуславливает значительное снижение его связывания с человеческими CD64, CD32A, CD16 и C1q. Эти ТМ мутации применяют для создания человеческого изотипа с очень низкой эффекторной функцией. ScFv переформатировали в IgG1-TM путем субклонирования вариабельных доменов тяжелой цепи (VH) и вариабельных доменов легкой цепи (VL) в векторы, экспрессирующие целые тяжелые и легкие цепи человеческих антител, соответственно. Вариабельный домен тяжелой цепи клонировали в вектор экспрессии для млекопитающих (pEU 1.4), содержащий константные домены тяжелой цепи человека и регуляторные элементы для экспрессии целой тяжелой цепи IgG1-TM в клетках млекопитающих. Аналогично, вариабельный домен легкой цепи клонировали в вектор экспрессии для млекопитающих (pEU 4.4) для экспрессии константных доменов легкой лямбда-цепи человека и регуляторных элементов для экспрессии целой легкой цепи IgG в клетках млекопитающих. IgG антитела экспрессировали и очищали, фактически, как описано в разделе 1.5.
2.7 Модифицирование на уровне генов зародышевого типа
Аминокислотные последовательности VH- и VL-доменов специфичных антител к бета-амилоидному 1-42 пептиду, оптимизированных в отношении аффинности, выравнивали с известными последовательностями генов зародышевого типа человека из базы данных VBASE (Tomlinson et al., 1992) и самый близкий ген зародышевого типа идентифицировали при помощи анализа на сходство последовательностей. Для VH-доменов оптимизированной линии антител это был Vh3-23 (DP-47), а для VL-доменов это был Vλ3-3r (DPL-23).
Процесс модифицирования на уровне генов зародышевого типа состоял из восстановления остатков каркасных участков в VH- и VL-доменах согласно самой близкой последовательности гена зародышевого типа для идентичного соответствия антителам человека. В случае Abet0144, в VH-домене не требовались изменения ни одного остатка (таблица 1), однако всего 5 изменений провели в каркасном участке VL-домена. Эти изменения находились в положениях по Kabat 1, 2, 3, 40 и 81 (таблица 2). Остатки Вернье (Foote et al., 1992) не модифицировали на уровне генов зародышевого типа, кроме остатка 2 в последовательности легкой цепи, который был модифицирован на уровне генов зародышевого типа в то же самое время, что и фланкирующие остатки 1 и 3. Модифицирование на уровне генов зародышевого типа этих аминокислотных остатков проводили с применением стандартных методик сайт-направленного мутагенеза с соответствующими мутагенными праймерами, как описано у Clackson and Lowman (Clackson et al., 2004).


2.8 Определение показателей кинетики связывания IgG, оптимизированных в отношении аффинности, с применением поверхностного плазмонного резонанса
Поверхностный плазмонный резонанс применяли для анализа показателей кинетики связывания IgG, оптимизированных в отношении аффинности (раздел 2.6), и их модифицированных на уровне генов зародышевого типа аналогов (раздел 2.7). Вкратце, биосенсорный инструмент BIAcore Т-100 (GE Healthcare, Великобритания) применяли для оценки кинетических параметров взаимодействия между каждым тестируемым IgG и синтетически полученным человеческим бета-амилоидным 1-42 пептидом. These experiments were performed essentially as described by Karlsson et al. (Karlsson et al., 1991). Подробнее см. раздел 1.7.
Аффинность связывания между каждым тестируемым IgG и человеческим бета-амилоидным 1-42 пептидом оценивали с применением анализов, в которых антитело ковалентно связывали посредством аминного мостика с поверхностью проприетарного чипа СМ3 с конечной поверхностной плотностью приблизительно 2000 RU. Поверхность чипа регенерировали между циклами при помощи однократной 40 секундной инъекции 10 мМ глицина, рН 2.0, для удаления лиганда, связавшегося с антителом. Регенерация не приводила к значительной потере способности связывания пептида.
Серию разведений синтетического человеческого бета-амилоидного 1-42 пептида (1,6-50 нМ) последовательно пропускали поверх поверхности с антителом в течение достаточного количества времени для наблюдения сенсограмм, которые можно было с достоверностью согласовать с подходящей моделью связывания. Данные от холостой пробы для эталонной проточной кюветы вычитали из каждого набора данных для IgG и проводили двойное контрольное вычитание данных холостой пробы с буфером с нулевой концентрацией из основного набора данных для снижения влияния любых артефактов от буфера или эффектов неспецифичного связывания. Затем подбирали подходящую модель связывания одновременно для данных от каждого титрования аналита с применением программного обеспечения BIAevaluation.
Правильность данных оценивали с применением рассчитанного значения хи2 при допустимом значении ниже 2 RU2. Общую успешность подбора оценивали с применением остатков при допустимом отклонении менее 2 RU.
Типовые результаты для IgG1-TM Abet0144-GL (модифицированного на уровне генов зародышевого типа) показаны на фигуре 7. Константа скорости ассоциации (ka), константа скорости диссоциации (kd) и константа диссоциации (KD) составляют 2,08×105 М-1 с-1, 1,97×10-3 с-1 и 9,50 нМ, соответственно. Эти параметры получены на основании подбора модели Langmuir 1:1 к данным.
2.9 Определение профиля специфичности IgG, оптимизированных в отношении аффинности, с применением поверхностного плазмонного резонанса
Поверхностный плазменный резонанс применяли для проверки надежности специфичности оптимизированных в отношении аффинности IgG против человеческих бета-амилоидных 1-42 пептидов. Вкратце, биосенсорный инструмент BIAcore Т-100 (GE Healthcare, Великобритания) применяли для оценки кинетических параметров взаимодействия между каждым тестируемым IgG и рядом малых пептидов, в том числе синтетически полученными человеческим бета-амилоидным 1-42 пептидом и человеческим бета-амилоидным 1-40 пептидом. Эти эксперименты осуществляли, фактически, как описано у Karlsson и соавт. (Karlsson et al., 1991). Подробнее см. раздел 1.7.
Аффинность связывания между каждым тестируемым IgG и каждым пептидом оценивали с применением анализов, в которых антитело ковалентно связывали посредством аминного мостика с поверхностью проприетарного чипа СМ3 с конечной поверхностной плотностью приблизительно 2000 RU. Поверхность чипа регенерировали между циклами при помощи однократной 40 секундной инъекции 10 мМ глицина, рН 2.0, для удаления лиганда, связавшегося с антителом. Регенерация не приводила к значительной потере способности связывания пептида.
Каждый тестируемый пептид при 400 нМ последовательно пропускали поверх поверхности с антителом в течение достаточного количества времени для наблюдения сенсограмм, на которых либо не показано связывание, либо которые можно было с достоверностью согласовать с подходящей моделью связывания. Данные от холостой пробы для эталонной проточной кюветы вычитали из каждого набора данных для IgG и проводили двойное контрольное вычитание данных холостой пробы с буфером с нулевой концентрацией из основного набора данных для снижения влияния любых артефактов от буфера или эффектов неспецифичного связывания.
Типовые результаты для IgG1-TM Abet0144-GL (модифицированного на уровне генов зародышевого типа) показаны на фигуре 8. Два пептида (биотинилированный человеческий бета-амилоидный 1-42 (rPeptide, США; № по кат.: А1117) и немеченный человеческий бета-амилоидный 1-42 (rPeptide, США; № по кат.: А1165)) демонстрировали сильное связывание с антителом, тогда как три пептида (биотинилированный скремблированный человеческий бета-амилоидный 1-42 (Anaspec, США; синтез под заказ), биотинилированный человеческий бета-амилоидный 1-40 (rPeptide, США; № по кат.: А1111) и немеченный человеческий бета-амилоидный 1-40 (Anaspec, США; № по кат.: 24236)) демонстрировали отсутствие связывания с антителом.
2.10 Определение профиля специфичности IgG1-TM Abet0144-GL в формате биохимического анализа конкуренции за эпитоп
Для тестирования специфичности связывания этих IgG1-TM Abet0144- GL с другими человеческими бета-амилоидными пептидами разрабатывали конкурентный анализ. В этом анализе фиксированную концентрацию (1,5 нМ) биотинилированного человеческого бета-амилоидного 1-42 пептида (rPeptide, США; № по кат.: А1117) инкубировали с диапазоном различных концентраций немеченных человеческих бета-амилоидных пептидов, в том числе 1-42, 1-40, 1-16, 12-28, pyro 3-42, pyro 11-42 и скремблированным 1-42 (Anaspec № по кат.: 20276, 24236, 24226, 24230, 29907, 29903 и 25383, соответственно), в присутствии фиксированной концентрации (0,28 нМ) IgG1-TM Abet0144-GL. Конкуренцию пептидов оценивали посредством выявления ингибирования связывания IgG1-TM Abet0144-GL с биотинилированным человеческим бета-амилоидным 1-42 пептидом с применением резонансного переноса энергии флуоресценции с временным разрешением (TR-FRET). Это включало применение детекторных реагентов для TR-FRET антитела к Fc IgG человека, меченного криптатом европия (CisBio International, Франция; № по кат.: 61HFCKLB), и стрептавидина, меченного XL665 (CisBio International, Франция; № по кат.: 611SAXLB).
Эксперименты проводили в 384-луночных планшетах для микротитрования с лунками с мелким дном Costar. По 5 мкл/лунка биотинилированного человеческого бета-амилоидного 1-42 пептида (6 нМ) вносили во все лунки планшета для анализа (за исключением лунок для отрицательного контроля анализа связывания), чтобы получить конечную концентрацию при анализе 1,5 нМ. 5 мкл буфера для анализа вносили только в лунки для отрицательного контроля анализа связывания. Готовили серийную 1:3 титрацию из 11 точек в двух повторностях, или применение каждого тестируемого пептида начинали с наибольшей концентрации 40 мкМ, чтобы получить наибольшую конечную концентрацию пептида в анализе 10 мкМ. Затем по 5 мкл на лунку серийного разведения каждого тестируемого пептида переносили на 384-луночный планшет для анализа. 5 мкл буфера для анализа вносили только в лунки для общего и отрицательного контроля анализа связывания. IgG1-TM Abet0144-GL разводили с получением рабочего раствора из расчета 1,12 нМ. По 5 мкл на лунку этого раствора добавляли во все лунки 384-луночного планшета для анализа, чтобы привести к конечной концентрации Abet0144-GL-IgG1-TM в анализе 0,28 нМ. Наконец, готовили объединенный раствор, содержащий антитело к Fc человека, меченное криптатом европия (2,4 нМ), и стрептавидин, меченный XL665 (60 нМ). По 5 мкл на лунку этого раствора добавляли во все лунки 384-луночного планшета для анализа, так что конечные концентрации антитела к Fc человека, меченного криптатом европия, и стрептавидина, меченного XL665, составляли 0,6 нМ и 15 нМ, соответственно. Обратите внимание, что конечный объем анализа составлял 20 мкл, и что каждый отдельный компонент анализа вносили в виде добавления 5 мкл, причем с концентрацией в четыре раза большей, чем требуемая конечная концентрация для анализа. Все реагенты разводили в буфере для анализа, содержащем 50 мМ MOPS, рН 7.4 (Sigma, Великобритания; № по кат.: М9381), 0,4 М KF (BDH Chemicals, США; № по кат.: 103444Т), 0,1% бычьего сывороточного альбумина, не содержащего жирных кислот (Sigma, Великобритания; № по кат.: А6003) и 0,1% Tween 20 (объем/объем) (Sigma, Великобритания; № по кат.: Р2287).
Планшеты для анализа инкубировали в течение 2 часов при комнатной температуре перед считыванием флуоресценции с временным разрешением при длинах волны испускания 620 нм и 665 нм с применением планшет-ридера En Vision (PerkinElmer, США). Данные анализировали путем расчета значений % дельта F для каждого образца. % дельта F определяли согласно уравнению 1.
Уравнение 1:

Значения % дельта F использовали для расчета % специфичного связывания, как описано в уравнении 2.
Уравнение 2:

Типовые результаты для IgG1-TM Abet0144-GL показаны на фигуре 9. Эти результаты демонстрируют, что IgG1-TM Abet0144-GL связывается с человеческим бета-амилоидным 1-42, pyro 3-42 и pyro 11-42 пептидами, но не связывается с человеческим бета-амилоидным 1-40 пептидом или усечениями пептида 1-16 и 12-28.
2.11 Определение функциональных характеристик лидерных антител при помощи деплеции бета-амилоидных пептидов из человеческой плазмы
Лидерные антитела тестировали в анализе деплеции в плазме для изучения их способности к иммунопреципитации человеческого бета- амилоидного 1-42 пептида из плазмы крови человека. Этот анализ применяли для получения доказательства функциональной эффективности каждого антитела. Анализы осуществляли точно, как описано в разделе 1.8.
В одном эксперименте антитело IgG1-TM Abet0144-GL снижало уровни человеческого бета-амилоидного 1-42 пептида в плазме от 13,54 пг мл-1 до 9,86 пг мл-1 (снижение на 27%). Во втором эксперименте уровни снижались от 40,06 пг мл-1 до 34,65 пг мл-1 (снижение на 14%).
2.12 Идентификация улучшенных клонов с нативным связыванием в отношении бета-амилоида с применением in vitro иммуногистохимии
IgG, оптимизированные в отношении аффинности, тестировали в отношении их способности связываться с бета-амилоидом для того, чтобы идентифицировать лидерные клоны, которые распознают нативный бета-амилоидный пептид. Вкратце, лидерные антитела подвергали скринингу на срезах головного мозга людей с болезнью Альцгеймера и срезах головного мозга мышей Tg2576 для идентификации антител к бета-амилоиду 1-42, которые связывались с нативным амилоидом in vitro. Эксперименты осуществляли, фактически, как описано в разделе 1.9.
В этих экспериментах ткань головного мозга человека получали из лобной коры и гиппокампа от двух индивидуумов с тяжелой болезнью Альцгеймера (женщина, ApoE 4/3, 86 лет; женщина, ApoE 3/3, 67 лет). Ткань головного мозга мыши получали от мышей Tg2576 в возрасте 18 месяцев (6 мышей). Антитела тестировали при концентрациях 2, 5 и 20 мкг мл-1.
В одном эксперименте антитело IgG1-TM Abet0144-GL не окрашивало диффузные бляшки (DP) или бляшки при церебральной амилоидной ангиопатии (САА) (балл = 0). Оно, однако, окрашивало плотные бляшки (CP) с баллом 1 на срезах головного мозга у мышей Tg2576, и баллом 1,5 на срезах головного мозга людей с AD. Напротив, антитело положительного контроля давало балл 3-4 на всех бляшках (CP, DP, САА) на смежных срезах при таких же состояниях. Типичные фотографии показаны на фигуре 10.
Пример 3. Оптимизация антитела Abet0144-GL посредством мутирования всех шести CDR, в том числе фланкирующих остатков Вернье
3.1 Превращение исходного клона Abet0144-GL в формат scFv, совместимый с рибосомным дисплеем
Исходный клон превращали из формата IgG1-TM в формат одноцепочечного вариабельного фрагмента (scFv) при подготовке для оптимизации аффинности. Кодон-оптимизированные вариабельные домены тяжелой цепи (VH) и вариабельные домены легкой цепи (VL) амплифицировали отдельно от их соответствующих векторов IgG с добавлением специфичных сайтов клонирования и гибкой линкерной области. Затем осуществляли рекомбинаторную ПЦР для получения полной scFv-конструкции, которую клонировали в модифицированный pUC-вектор (pUC-PJD), содержащий структурные особенности, необходимые для рибосомного дисплея. Эти особенности включают 5'-и 3'-структуру стебель-петля для предотвращения разрушения мРНК-тарнскрипта экзонуклеазами, последовательность Shine-Dalgarno для содействия связыванию рибосомы с мРНК-транскриптом, и ген III-спейсер, который позволяет транслированной молекуле scFv сворачиваться, при этом она остается прикрепленной к рибосоме (Groves et al., 2005).
3.2 Оптимизация Abet0144-GL посредством нацеленного мутагенеза
Лидерное антитело (Abet0144-GL) дополнительно оптимизировали для улучшения аффинности к человеческому бета-амилоидному 1-42 пептиду с применением подхода нацеленного мутагенеза и отборов с рибосомным дисплеем на основе аффинности. Большие scFv-рибосомные библиотеки, полученные из Abet0144-GL, создавали путем олигонуклеотид-направленного мутагенеза всех шести определяющих комплементарность областей (CDR) вариабельных доменов тяжелой цепи (VH) и вариабельных доменов легкой цепи (VL) с применением стандартных методик молекулярной биологии, как описано у Clackson and Lowman (Clackson et al., 2004). Мутированные последовательности из каждого CDR подвергали оптимизации в отношении аффинности в виде отдельной библиотеки. Пять остатков Вернье, предшествующих VHCDR1 (остатки по Kabat 26-30), также рандомизировали с применением нацеленного мутагенеза и эти последовательности объединяли и подвергали созреванию с остальной библиотекой VHCDR1. Все библиотеки подвергали процедурам отбора с помощью рибосомного дисплея на основе аффинности, чтобы обогатить вариантами с более высокой аффинностью к человеческому бета-амилоидному 1-42 пептиду. Процедуры отбора проводили, фактически, как описано ранее (Hanes et al., 2000).
Вкратце, шесть библиотек нацеленного мутагенеза лидерного клона Abet0144-GL, каждая из которых охватывает один CDR, отдельно транскрибировали в мРНК. С использованием способа прерванной трансляции получали трехчленные комплексы мРНК-рибосома-scFv (Hanes et al., 1997). Затем эти комплексы подвергали четырем раундам отбора, инкубировали в присутствии понижающихся концентраций синтетического биотинилированного человеческого бета-амилоидного 1-42 пептида (Bachem, Германия; № по кат.: Н-5642) (от 100 нМ до 10 нМ) для отбора на варианты с более высокой аффинностью в отношении человеческого бета-амилоидного 1-42 пептида. Комплексы, которые связались с антигеном, затем захватывали на покрытых стрептавидином парамагнитных гранулах (Dynabeads™, Invitrogen, Великобритания, № по кат.: 112-05D), а неспецифичные рибосомные комплексы смывали. Затем мРНК выделяли из связавшихся рибосомных комплексов, подвергали обратной транскрипции в кДНК и их амплифицировали при помощи ПЦР. Эту ДНК применяли в следующем раунде отбора.
После четырех раундов созревания аффинности, каждый результат отбора клонировали с целью скрининга. ScFv, выделенные с помощью рибосомного дисплея, клонировали в фагмидный вектор pCANTAB6 при помощи разрезания рестрикционной эндонуклеазой NotI/NcoI конструкции рибосомного дисплея (New England BioLabs, США; № по кат.: R0189L, R0193L), с последующим лигированием в pCANTAB6, разрезанный при помощи NotI/NcoI, с применением Т4 ДНК-лигазы (New England BioLabs, США; № по кат.: M0202L), фактически, как описано у McCafferty и соавт. (McCafferty et al., 1994).
3.3 Идентификация улучшенных клонов с применением анализа конкуренции за эпитоп
Две тысячи двести четыре scFv, выбранных случайным образом из раундов отбора 3 и 4 подхода с нацеленным мутагенезом, описанным в разделе 3.2, экспрессировали в бактериях с получением неочищенных периплазматических scFv. scFv, способные к связыванию синтетического человеческого бета-амилоидного 1-42 пептида посредством того же эпитопа, что и IgG1-TM Abet0144-GL, выявляли в анализе в формате конкуренции, с применением платформы HTRF™. А именно, резонансный перенос энергии флуоресценции (FRET) измеряли между криптатом стрептавидина (ассоциирует с биотинилированным бета-амилоидным 1-42 пептидом) и антителом к Fc XL665 (ассоциирует с IgG1-TM Abet0144-GL) в присутствии одной концентрации каждого неочищенного периплазматического тестируемого scFv. Успешная оккупация эпитопа для IgG1-TM Abet0144-GL на пептиде при помощи scFv приводила к снижению в FRET, как измеряли на флуоресцентном планшет-ридере.
'Общий' сигнал связывания определяли посредством анализа связывания IgG1-TM Abet0144-GL с синтетическим человеческим бета-амилоидным 1-42 пептидом в отсутствие конкурирующего пептида. Сигналы 'образца' получали на основании анализа связывания IgG1-TM Abet0144-GL с синтетическим человеческим бета-амилоидным 1-42 пептидом в присутствии образца тестируемого scFv. Наконец, сигнал 'холостой с криптатом' определяли посредством анализа флуоресценции, опосредованной только смесью детекторных реагентов.
Неочищенные периплазматические scFv получали в буфере для образцов, состоящем из 50 мМ MOPS, рН 7,4, 0,5 мМ EDTA и 0,5 М сахарозы. Для определения профиля образцы scFv разводили в 384-луночном планшете с лунками с V-образным дном до 50% исходной концентрации в буфере для анализа, состоящем из 50 мМ MOPS, рН 7,4, 0,4 М фторида калия, 0,1% альбумина бычьей сыворотки, не содержащей жирных кислот, и 0,1% Tween 20 (объем/объем). По 5 мкл каждого из вновь разведенных scFv переносили в лунки 'образец' с черным, мелким, твердым дном несвязывающего 384-луночного планшета для анализа с применением роботизированной станции дозирования жидкостей. Оставшиеся реагенты (приготовленные в буфере для анализа) вносили в планшет для анализа при помощи многоканальной пипетки в следующем порядке: 5 мкл буфера для образцов (в лунки 'общий' и 'холостой с криптатом'), 10 мкл буфера для анализа (в лунки 'холостой с криптатом'), 5 мкл 2 нМ IgG1-TM Abet0144-GL (в лунки 'образец' и 'общий'), 5 мкл 5 нМ биотинилированного человеческого бета-амилоидного 1-42 пептида (в лунки 'образец' и 'общий') и 5 мкл детекторной смеси, состоящей из 6 нМ криптата стрептавидина и 60 нМ антитела к His6-XL665 (во все лунки). Планшеты для анализа закрывали и затем инкубировали в течение 3 часов при комнатной температуре в темноте, перед измерением флуоресценции с временным разрешением при длине волны испускания 620 и 665 нм на флуоресцентном планшет-ридере.
Данные анализировали путем расчета значений % дельта F для каждого образца. % дельта F определяли согласно уравнению 4.
Уравнение 4:

Значения дельта F затем использовали для расчета нормализованных значений связывания, как описано в уравнении 5.
Уравнение 5:

Неочищенные периплазматические scFv, демонстрирующие значительное ингибирование связывания IgG1-TM Abet0144-GL с бета-амилоидным 1-42 пептидом, подвергали ДНК-секвенированию (Osbourn et al., 1996; Vaughan et al., 1996). scFv, у которых обнаружили уникальные белковые последовательности, экспрессировали в Е. coli и очищали посредством аффинной хроматографии с последующей заменой буфера.
Активность каждого очищенного scFv определяли посредством тестирования серий разведений scFv (как правило, 4 пМ - 1200 нМ) в анализе конкуренции за эпитоп, описанном выше. Данные вновь анализировали путем расчета значений % дельта F и % общего связывания для каждого образца. Кроме того, также рассчитывали значение % ингибирования для каждой концентрации очищенных scFv, как описано в уравнении 6:
Уравнение 6:
% ингибирования = 100 - % общего связывания
Концентрацию образца ScFv помещали на график в сравнении с % ингибирования с применением научного программного обеспечения для построения графиков и для каждого из зависимых от концентраций ответов подбирали кривые нелинейной регрессии. Значения IC50 получали на основании этих анализов с углами наклона, ограниченными значением -1. Наиболее сильный клон из этого раунда отборов, Abet0286, характеризовался IC501,8 нМ и брал начало из библиотеки нацеленного мутагенеза VLCDR1.
Источники реагентов/оборудования: MOPS (Sigma, Великобритания; № по кат.: М9381), фторид калия (BDH chemicals, США; № по кат.: А6003), бычий сывороточный альбумин, не содержащий жирных кислот (Sigma, Великобритания; № по кат.: А6003), Tween 20 (Sigma, Великобритания; № по кат.: Р2287), IgG1-TM Abet0144-GL (получен в лаборатории), биотинилированный человеческий бета-амилоидный 1-42 пептид (rPeptide, США; № по кат.: A1117), криптат стрептавидина (Cisbio, Франция; № по кат.: 610SAKLB), антитело к His6-XL665 (Cisbio, Франция; № по кат.: 61HISXLB), 384-луночные планшеты для анализа (Corning, Costar Life Sciences; № по кат.: 3676), 384-луночные планшеты для разведений (Greiner BioOne, Германия; № по кат.: 781280), роботизированная станция дозирования жидкостей (MiniTrak™, Perkin Elmer, США), флуоресцентный планшет-ридер (Envision™, Perkin Elmer, США), HTRF-технология (Cisbio International, Франция), программное обеспечение для построения графиков/проведения статистических анализов (Prism, Graphpad США).
3.4 Рекомбинация успешных результатов отбора для получения "двухкомпонентных" библиотек и последующая оптимизация их аффинности
Анализ конкуренции за эпитоп, описанный в разделе 3.3, применяли для составления мнения о том, подверглась ли конкретная scFv-рибосомная библиотека созреванию аффинности за первые четыре раунда отбора. Две из данных библиотек, библиотеки нацеленного мутагенеза VHCDR3 и VLCDR2, не проявили улучшения по сравнению с исходным клоном Abet0144-GL и в дальнейшем их не совершенствовали.
Оставшиеся четыре библиотеки нацеленного мутагенеза (охватывающие VHCDR1, VHCDR2, VLCDR1 и VLCDR3) проявили улучшения аффинности и их рекомбинировали попарно для получения шести "двухкомпонентных" рекомбинационных библиотек, в которых два из шести CDR были мутированы. Например, библиотеку с созревшей аффинностью, охватывающую VHCDR1, случайным образом рекомбинировали с библиотекой с созревшей аффинностью VHCDR2 с получением библиотеки VH1:VH2. Остальные библиотеки получали следующим образом: VH1:VL1, VH1:VL3, VH2:VL1, VH2:VL3 и VL1:VL3. Подгруппу из каждой рекомбинационной библиотеки клонировали, как описано ранее (раздел 3.2), и посылали на секвенирование для проверки надежности каждой библиотеки.
Затем продолжали отборы, как описано ранее (раздел 3.2), в присутствии понижающихся концентраций биотинилированного синтетического человеческого бета-амилоидного 1-42 пептида (5 нМ и 2 нМ для раундов 5 и 6, соответственно). Как и ранее, каждый результат отбора клонировали для целей скрининга (раздел 3.2).
Одну тысячу девятьсот тридцать шесть scFv, случайным образом выбранных из раундов отбора 5 и 6, подвергали скринингу в анализе конкуренции за эпитоп, как описано в разделе 3.3. Из-за повышения активности этих клонов неочищенные scFv вначале разводили до 25% перед внесением в планшеты для анализа. Как и ранее, клоны, которые показали значительные ингибиторные свойства, посылали на ДНК-секвенирование, и получали уникальные клоны и анализировали их в виде очищенных scFv (раздел 3.3). Наиболее сильный клон из этих отборов, Abet0303, характеризовался активностью 0,84 нМ и брал начало от рекомбинационной библиотеки VH1:VH2.
3.5 Рекомбинация результатов двухкомпонентного отбора для получения "трехкомпонентных" библиотек и последующая оптимизация их аффинности
Анализ конкуренции за эпитоп, описанный в разделе 3.3, применяли для составления мнения о том, подверглась ли каждая двухкомпонентная библиотека созреванию аффинности за предыдущие два раунда отбора (5 и 6). Все библиотеки проявили улучшения аффинности и, следовательно, их посчитали пригодными для дальнейшего созревания аффинности.
Шесть двухкомпонентных библиотек (раздел 3.4) попарно рекомбинировали с успешными результатами раунда 4 (раздел 3.2) с образованием четырех "трехкомпонентных" рекомбинационных библиотек, в которых три из шести CDR были мутированы. Например, двухкомпонентную библиотеку VH2:VL3 (результат раунда 6) рекомбинировали с библиотекой нацеленного мутагенеза VHCDR1 (результат раунда 4) с получением библиотеки VH1:VH2:VL3. Аналогичные конструкции также создавали посредством объединения двухкомпонентной библиотеки VH1:VH2 (результат раунда 6) с библиотекой нацеленного мутагенеза VLCDR3 (результат раунда 4). Эти две отдельные библиотеки объединяли для создания трехкомпонентной библиотеки VH1:VH2:VL3.
Уделялось внимание тому, чтобы не разрушить синергию между CDR, которые были совместно оптимизированы. Например, двухкомпонентную библиотеку VH1:VL3 не рекомбинировали с библиотекой нацеленного мутагенеза VHCDR2, поскольку данная манипуляция могла разрушить синергию между совместно оптимизированными последовательностями VHCDR1 и VLCDR3. Полный перечень всех трехкомпонентных библиотек и их производных приведен в таблице 3. Подгруппу из каждой рекомбинационной библиотеки клонировали, как описано ранее (раздел 3.2), и посылали на секвенирование для проверки надежности каждой библиотеки.


Затем продолжали отборы, как описано ранее (раздел 3.2), в присутствии понижающихся концентраций биотинилированного синтетического человеческого бета-амилоидного 1-42 пептида (500 нМ и 200 пМ для раундов 7 и 8, соответственно). Как и ранее, каждый результат отбора клонировали для целей скрининга (раздел 3.2).
Одну тысячу четыреста восемь scFv, случайным образом выбранных из раундов отбора 7 и 8, подвергали скринингу в анализе конкуренции за эпитоп, как описано в разделе 3.3. Как и в случае "двухкомпонентного" скрининга, неочищенные scFv вначале разводили до 25% перед внесением в планшеты для анализа. Как и ранее, клоны, которые показали значительные ингибиторные свойства, посылали на ДНК-секвенирование, и получали уникальные клоны и анализировали их в виде очищенных scFv (раздел 3.3). Наиболее сильный клон из этих отборов, Abet0343, характеризовался активностью 0,48 нМ и брал начало от рекомбинационной библиотеки VH1:VH2:VL3.
3.6 Рекомбинация результатов трехкомпонентного отбора для получения "четырехкомпонентных" библиотек и последующая оптимизация их аффинности
Анализ конкуренции за эпитоп, описанный в разделе 3.3, применяли для составления мнения о том, подверглась ли каждая трехкомпонентная библиотека созреванию аффинности за предыдущие два раунда отбора (7 и 8). Все библиотеки проявили улучшения аффинности и, следовательно, их посчитали пригодными для дальнейшего созревания аффинности.
Трехкомпонентную библиотеку VH1:VH2:VL1 (результат раунда 8) рекомбинировали с библиотекой нацеленного мутагенеза VLCDR3 (результат раунда 4), а трехкомпонентную библиотеку VH2:VL1:VL3 (результат раунда 8) рекомбинировали с библиотекой нацеленного мутагенеза VHCDR1 (результат раунда 4). Дополнительно, двухкомпонентную библиотеку VH1:VH2 (результат раунда 6) рекомбинировали с двухкомпонентной библиотекой VL1:VL3 (результат раунда 6). Эти три отдельные библиотеки затем объединяли для создания одной "четырехкомпонентной" библиотеки, VH1:VH2:VL1:VL3, в которой четыре из шести CDR были мутированы.
Уделялось внимание тому, чтобы не разрушить синергию между CDR, которые были совместно оптимизированы. Например, трехкомпонентную библиотеку VH1:VL2:VL3 не рекомбинировали с библиотекой нацеленного мутагенеза VLCDR1, поскольку данная манипуляция могла бы разрушить синергию между совместно оптимизированными последовательностями VHCDR1/VHCDR2 и VLCDR3. Подгруппу из каждой рекомбинационной библиотеки клонировали, как описано ранее (раздел 3.2), и посылали на секвенирование для проверки надежности каждой библиотеки.
Затем продолжали отборы, как описано ранее (раздел 3.2), в присутствии понижающихся концентраций биотинилированного синтетического человеческого бета-амилоидного 1-42 пептида (от 50 нМ до 10 пМ для раундов 9-11). Как и ранее, каждый результат отбора клонировали для целей скрининга (раздел 3.2).
Одну тысячу шестьсот семьдесят два scFv, случайным образом выбранных из раундов отбора 9-11, подвергали скринингу в анализе конкуренции за эпитоп, как описано в разделе 3.3. Из-за повышения активности этих клонов неочищенные scFv вначале разводили до 3,13% перед внесением в планшеты для анализа. Как и ранее, клоны, которые показали значительные ингибиторные свойства, посылали на ДНК-секвенирование, и получали уникальные клоны и анализировали их в виде очищенных scFv (раздел 3.3). Наиболее сильный клон из этих отборов, Abet0377, характеризовался активностью 0,32 нМ (данные n=2). Кривые ингибирования для образца показаны на фигуре 11, и данные для 24 клонов с самой высокой активностью показаны в таблице 4. Соответствующие белковые последовательности перечислены в таблицах 5 и 6.

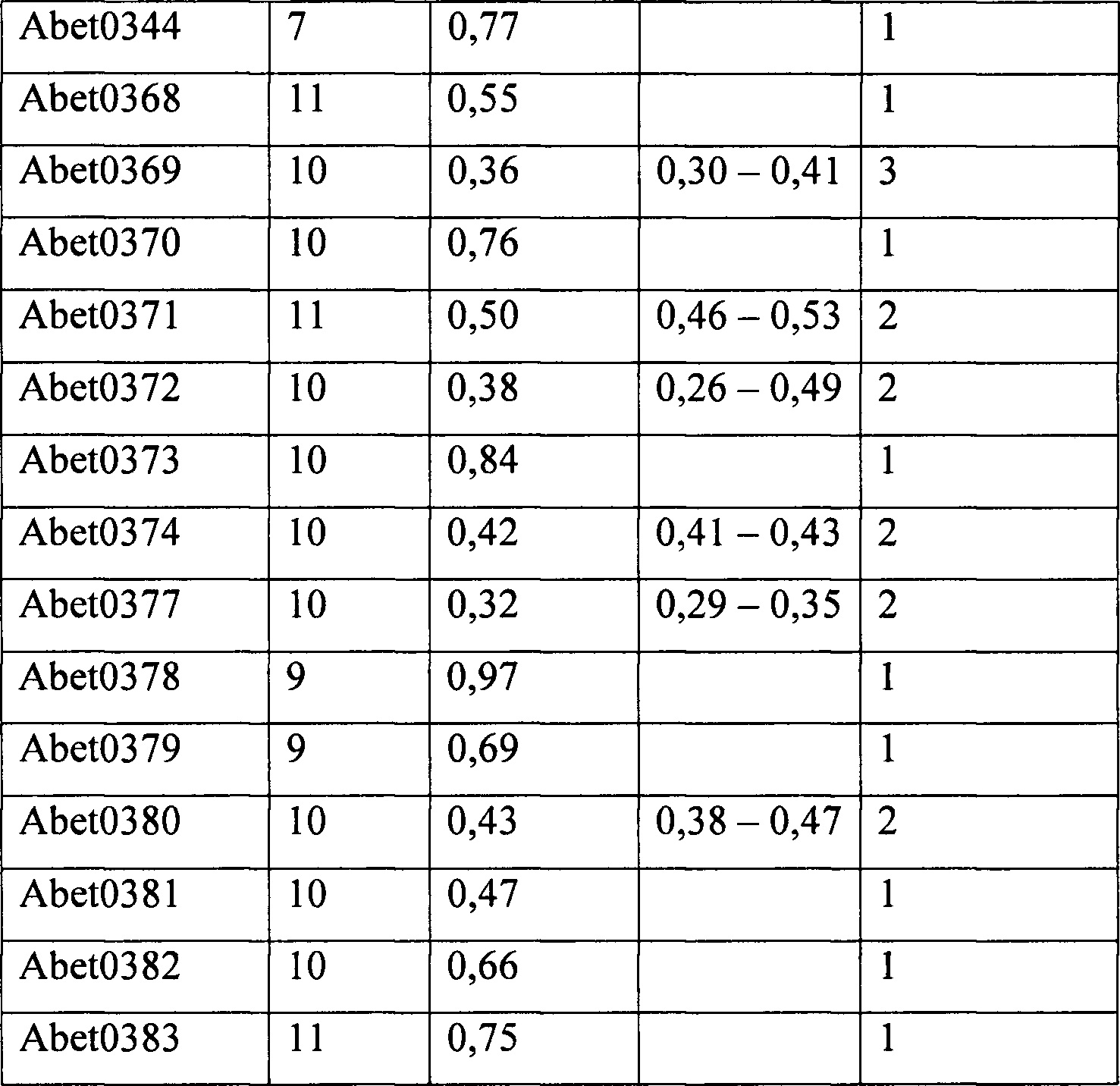






3.7 Определение кинетического профиля аффинности улучшенных клонов в формате очищенных scFv при помощи поверхностного плазмонного резонанса
Поверхностный плазмонный резонанс применяли для анализа очищенных клонов scFv, которые показали значительное улучшение аффинности связывания в отношении человеческого бета-амилоидного 1-42 пептида в сравнении с исходной последовательностью, Abet0144-GL, в HTRF™-анализе конкуренции за эпитоп (разделы 3.3-3.6). Вкратце, систему анализа взаимодействия белков ProteOn (BioRad, США) применяли для оценки кинетических параметров взаимодействия между каждым очищенным scFv и синтетически полученным человеческим бета-амилоидным 1-42 пептидом. Эти эксперименты осуществляли, фактически, как описано у Karlsson и соавт. (Karlsson et al., 1991). Подробнее см. раздел 1.7.
Аффинность связывания между каждым тестируемым scFv и человеческим бета-амилоидным пептидом 1-42 оценивали с применением анализов, в которых биотинилированный синтетический человеческий бета-амилоидный 1-42 пептид (rPeptide, США; № по кат.: A1117) был нековалентно связан через взаимодействие биотин/стрептавидин с проприетарным чипом со стрептавидином (NTA 176-5021) при пяти различных поверхностных плотностях. Поверхность чипа регенерировали между циклами при помощи однократной 60 секундной инъекции 10 мМ глицина, рН 2.0, для удаления scFv, связавшегося с пептидом. Регенерация не приводила к значительной потере способности связывания scFv.
Каждый scFv из расчета 100-200 нМ последовательно пропускали поверх поверхности с пептидом в течение достаточного количества времени для наблюдения сенсограмм, которые можно было с достоверностью согласовать с подходящей моделью связывания. Данные несущественной холостой пробы с scFv вычитали из основного набора данных для снижения влияния любых артефактов от буфера или эффектов неспецифичного связывания. Затем к данным подбирали подходящую модель связывания.
Для scFv Abet0380, константа скорости ассоциации (ка), константа скорости диссоциации (kd) и константа диссоциации (KD) составляют 1,93×105 М-1 с-1, 2,85×10-5 с-1 и 148 пМ, соответственно. Эти параметры получены на основании подбора модели Langmuir 1:1 к данным.

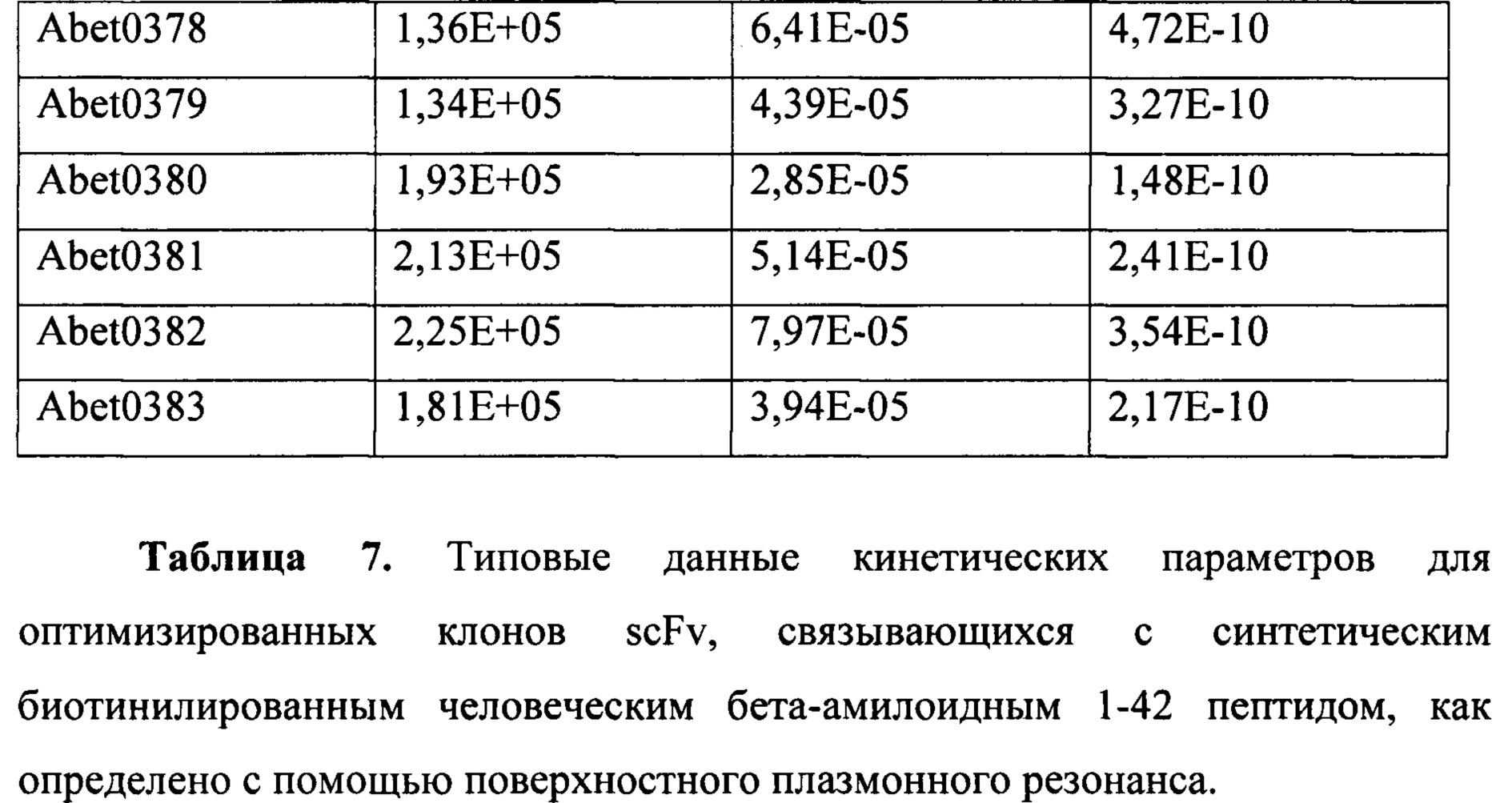
3.8 Переформатирование scFv с улучшенной аффинностью в IgG1-TM человека
Формат антитела IgG1-TM обсуждается в разделе 2.6. ScFv переформатировали в IgG1-TM путем субклонирования вариабельных доменов тяжелой цепи (VH) и вариабельных доменов легкой цепи (VL) в векторы, экспрессирующие целые тяжелые и легкие цепи человеческих антител, соответственно. Вариабельный домен тяжелой цепи клонировали в вектор экспрессии для млекопитающих (pEU 1.4), содержащий константные домены тяжелой цепи человека и регуляторные элементы для экспрессии целой тяжелой цепи IgG1-TM в клетках млекопитающих. Аналогично, вариабельный домен легкой цепи клонировали в вектор экспрессии для млекопитающих (pEU 4.4) для экспрессии константных доменов легкой лямбда-цепи человека и регуляторных элементов для экспрессии целой легкой цепи IgG в клетках млекопитающих.
Для получения антител в виде IgG векторы экспрессии для тяжелой и легкой цепи IgG временно трансфицировали в клетки млекопитающих HEK293-EBNA (Invitrogen, Великобритания; № по кат.: R620-07), в которых IgG экспрессировались и секретировались в среду. Собранные среды объединяли и фильтровали перед очисткой. IgG очищали с применением хроматографии с белком А. Культуральные супернатанты загружали на подходящую керамическую колонку с белком A (BioSepra - Pall, США) и промывали при помощи 50 мМ Tris-HCl, рН 8,0, 250 мМ NaCl. Связанный IgG элюировали из колонки с помощью 0,1 М цитрата натрия (рН 3,0) и нейтрализовали добавлением Tris-HCl (рН 9,0). Для элюированного материала проводили замену буфера на PBS с применением колонки для замены буфера NAP-10 (GE Healthcare, Великобритания; № по кат.: 17-0854-02) и очищенные IgG пропускали через 0,2 мкм фильтр. Концентрацию IgG определяли спектрофотометрическим способом с применением коэффициента экстинкции на основании аминокислотной последовательности IgG. Очищенные IgG анализировали в отношении агрегирования или разложения с применением SEC-HPLC и при помощи SDS-PAGE.
3.9 Модифицирование на уровне генов зародышевого типа
Пять наиболее сильных IgG отбирали для модифицирования на уровне генов зародышевого типа на основании экспериментальных характеристик их соответствующих scFv. Очищенные scFv всех клонов Abet0343, Abet0369, Abet0377, Abet0380 и Abet0382 проявляли значения IC50 меньше 750 пМ, как определяли при помощи анализа конкуренции за эпитоп (таблица 4), и все характеризовались экспериментальной константой диссоциации меньше 250 пМ, как определяли при помощи поверхностного плазмонного резонанса, таблица 7.
Процесс модифицирования на уровне генов зародышевого типа состоял из восстановления остатков каркасных участков в VH- и VL-доменах согласно самой близкой последовательности гена зародышевого типа для идентичного соответствия антителам человека. Для VH-доменов оптимизированной линии антител это был Vh3-23 (DP-47), а для VL-доменов это был Vλ3-3r (DPL-23). Для Abet0380 требовалось изменение 1 остатка в VH-домене в положении по Kabat 43 (таблица 8) и требовалось изменение 1 остатка в VL-домене в положении по Kabat 81 (таблица 9). В остальных четырех последовательностях требовалось от двух до пяти изменений (таблицы 8 и 9). Остатки Вернье (Foote et al., 1992) не модифицировали на уровне генов зародышевого типа, кроме остатка 2 в последовательности легкой цепи Abet0343, который был модифицирован на уровне генов зародышевого типа в то же самое время, что и фланкирующие остатки 1 и 3. Модифицирование на уровне генов зародышевого типа этих аминокислотных остатков проводили с применением стандартных методик сайт-направленного мутагенеза с соответствующими мутагенными праймерами, как описано у Clackson and Lowman (Clackson et al., 2004).
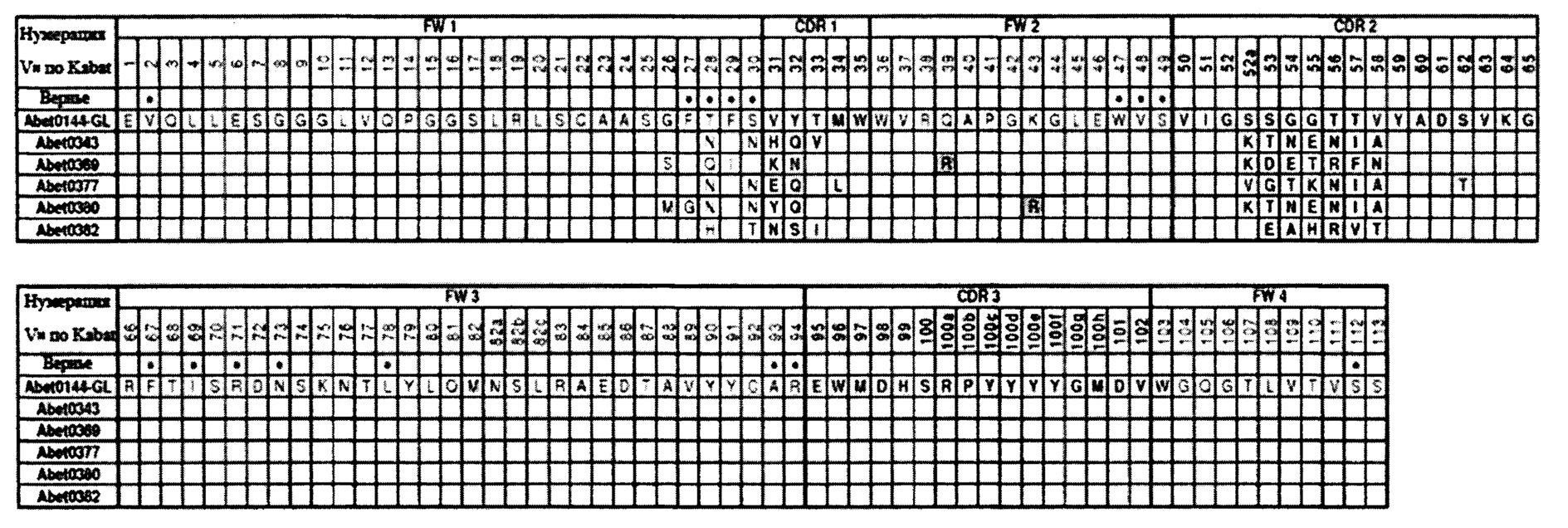



3.10 Определение показателей кинетики связывания IgG, оптимизированных в отношении аффинности, с применением поверхностного плазмонного резонанса
Поверхностный плазмонный резонанс применяли для анализа показателей кинетики связывания IgG, оптимизированных в отношении аффинности (раздел 3.8), и их модифицированных на уровне генов зародышевого типа аналогов (раздел 3.9). Вкратце, биосенсорный инструмент BIAcore Т-100 (GE Healthcare, Великобритания) применяли для оценки кинетических параметров взаимодействия между каждым тестируемым IgG и синтетически полученным человеческим бета-амилоидным 1-42 пептидом. Эти эксперименты осуществляли, фактически, как описано у Karlsson и соавт. (Karlsson et al., 1991). Подробнее см. раздел 1.7.
Аффинность связывания между каждым тестируемым IgG и человеческим бета-амилоидным 1-42 пептидом оценивали с применением анализов, в которых каждое антитело нековалентно захватывали с помощью поверхности с белком G, который сам по себе был связан аминным мостиком с проприетарным чипом СМ5. Поверхность чипа регенерировали между циклами при помощи парных 40 секундных инъекций 10 мМ глицина, рН 2.0, для удаления лиганда и связавшегося антитела. Затем тестируемое антитело вновь применяли для каждого введения пептида.
Серию разведений синтетического человеческого бета-амилоидного 1-42 пептида (0,063-1024 нМ) последовательно пропускали поверх поверхности с антителом в течение достаточного количества времени для наблюдения сенсограмм, которые можно было с достоверностью согласовать с подходящей моделью связывания. Данные от холостой пробы для эталонной проточной кюветы вычитали из каждого набора данных для IgG и проводили двойное контрольное вычитание данных холостой пробы с буфером с нулевой концентрацией из основного набора данных. Затем подбирали подходящую модель связывания одновременно для данных от каждого титрования аналита с применением программного обеспечения BIAevaluation.
Правильность данных оценивали с применением рассчитанного значения хи2 при допустимом значении ниже 2 RU2. Общую успешность подбора оценивали с применением остатков при допустимом отклонении менее 2 RU.
Типовые результаты для IgG1-TM Abet0380-GL (модифицированного на уровне генов зародышевого типа) показаны на фигуре 12. Константа скорости ассоциации (ka), константа скорости диссоциации (kd) и константа диссоциации (KD) составляют 9,52×105 М-1 с-1, 3,07×10-4 с-1 и 322 пМ, соответственно. Эти параметры получены на основании подбора модели Langmuir 1:1 к данным.
3.11 Определение профиля специфичности IgG, оптимизированных в отношении аффинности, с применением поверхностного плазмонного резонанса
Поверхностный плазмонный резонанс применяли для проверки надежности специфичности оптимизированных в отношении аффинности IgG против человеческих бета-амилоидных 1-42 пептидов. Вкратце, биосенсорный инструмент BIAcore2000 (GE Healthcare, Великобритания) применяли для оценки кинетических параметров взаимодействия между каждым тестируемым IgG и рядом малых пептидов, в том числе синтетически полученными человеческим бета-амилоидным 1-42 пептидом и человеческим бета-амилоидным 1-40 пептидом. Эти эксперименты осуществляли, фактически, как описано у Karlsson и соавт.(Karlsson et al., 1991). Подробнее см. раздел 1.7.
Взаимодействие между каждым тестируемым IgG и каждым пептидом оценивали с применением анализов, в которых антитело нековалентно захватывали с помощью поверхности с белком G, который сам по себе был связан аминным мостиком с проприетарным чипом СМ5. Взаимодействие между антителом и пептидом наблюдали с применением подхода с 5 применениями в одном цикле. Поверхность чипа регенерировали между циклами при помощи парных 40 секундных инъекций 10 мМ глицина, рН 2.0, для удаления лиганда и связавшегося антитела. Затем тестируемое антитело вновь применяли для каждого цикла введения пептида.
Каждый тестируемый пептид (от 64 до 1024 нМ) последовательно пропускали поверх поверхности с антителом в течение достаточного количества времени для наблюдения сенсограмм, на которых либо не показано связывание, либо которые можно было с достоверностью согласовать с подходящей моделью связывания. Данные от холостой пробы для эталонной проточной кюветы вычитали из каждого набора данных для IgG и проводили двойное контрольное вычитание данных холостой пробы с буфером с нулевой концентрацией из основного набора данных.
Типовые результаты для IgG1-TM Abet0380-GL (модифицированного на уровне генов зародышевого типа) показаны на фигуре 13. Два пептида (биотинилированный человеческий бета-амилоидный 1-42 (rPeptide, США; № по кат.: А1117) и немеченный мышиный бета-амилоидный 1-42 (rPeptide, США; № по кат.: А1008) демонстрировали сильное связывание с антителом, тогда как два пептида, биотинилированный человеческий бета-амилоидный 1-40 (rPeptide, США; № по кат.: А1111) и немеченный мышиный бета-амилоидный 1-40 (rPeptide, США; № по кат.: А1007) демонстрировали отсутствие связывания с антителом.
3.12 Аффинность самых сильных IgG в отношении нативного бета-амилоида с применением in vitro иммуногистохимии
Самые сильные IgG тестировали в отношении их способности связываться с бета-амилоидом, чтобы оценить аффинность этих клонов в отношении нативных форм бета-амилоидного пептида. Вкратце, лидерные антитела подвергали скринингу на срезах головного мозга людей с болезнью Альцгеймера и срезах головного мозга мышей Tg2576 для идентификации антител к бета-амилоиду 1-42, которые связывались с амилоидными бляшками in vitro. Эксперименты осуществляли, фактически, как описано в разделе 1.9.
В этих экспериментах, ткань головного мозга человека получали из лобной коры двух индивидуумов с тяжелой болезнью Альцгеймера (генотип ApoE 3/3, стадия по Braak 6 и генотип ApoE 4/3, стадия по Braak 5). В качестве контроля, эквивалентную ткань получали от одного индивидуума без деменции (генотип ApoE 3/3, стадия по Braak 1). Ткань головного мозга мыши вырезали из мышей Tg2576 в возрасте 15 месяцев (2 мыши) и 22 месяца (2 мыши). Антитела тестировали при концентрациях 2, 5, 10 и 20 мкг мл-1.
В одном эксперименте антитело IgG1-TM Abet0380-GL окрашивало плотные бляшки (CP) с баллом 4 на срезах головного мозга мышей Tg2576 и с баллом 3 на срезах головного мозга людей с AD. Оно также окрашивало диффузные бляшки (DP) и бляшки при церебральной амилоидной ангиопатии (САА), но в меньшей степени. Напротив, антитело положительного контроля давало балл 3-4 на всех бляшках (CP, DP, САА) на смежных срезах при таких же состояниях. Типичные фотографии показаны на фигуре 14.
3.13 Демонстрация профиля распознавания Abeta42 антителом IgG1-TM Abet0380-GL при помощи вестерн-блоттинга
Чтобы сшить Аβ42-олигомеры перед SDS-PAGE, PICUP (фотоиндуцированная сшивка пептидов) проводили следующим образом. 1 мМ раствор Ru(Bpy) получали добавлением 2 мкл исходного раствора (с концентрацией 10 мМ) к 18 мкл 1×PBS. Кроме того, 20 мМ раствор персульфата аммония (APS) получали добавлением 2 мкл исходного раствора (с концентрацией 200 мМ) к 18 мкл 1×PBS. Неиспользуемый исходный раствор сразу же замораживали на сухом льду и возвращали в морозилку при -80°C. В темной комнате 5 мкл Ru(Bpy) добавляли к 80 мкл агрегата (чистый 10 мкМ образец), а затем 5 мкл APS. Образцы облучали с помощью лампы в темной комнате в течение 10 секунд. Сразу же добавляли 30 мкл (4×) LDS буфера для образцов.
Затем осуществляли SDS-PAGE для сшитых (PICUP) и несшитых агрегатов Аβ1-42. Растворы инкубировали на водяной бане Hot Block при 70°С в течение 10 минут. Тем временем, получали маркер путем комбинирования 5 мкл белкового стандарта для вестерн-блоттинга Magic Mark ХР, 5 мкл предварительно окрашенного белкового стандарта Novex Sharp. После инкубации в течение десяти минут, образцы вместе с маркером загружали на гели NuPAGE Novex с 4-12% буфером Bis-Tris (1,0 мм, 15 лунок, 15 мкл на лунку) с буфером подвижной фазы MES. Хроматографию гелей проводили при 200 В в течение 35 минут.
Затем осуществляли блоттинг геля на PVDF-мембрану с применением аппарата iBlot от Invitrogen в течение 7 минут при 20 В (программа Р3).
После окончания блоттинга слой геля убирали и PVDF-мембрану затем блокировали в 50 мл 4% MPBST (4% Marvel в PBST) в течение одного часа при комнатной температуре при легком вращении. Затем пятна вырезали скальпелем для исследования с помощью отдельных антител. Это исследование представляло собой инкубацию в течение 1 часа с раствором первичного антитела (2 мкг/мл в 10 мл 3% MPBST).
После этого мембрану промывали 5х с помощью PBST, по 5 минут каждый раз, и затем инкубировали в растворе вторичного антитела (1 мкл HRP-конъюгата антитела, специфичного к Fc человека, в 10 мл PBST) в течение 1 часа при комнатной температуре. Мембрану промывали 3× с помощью PBST и 2× с помощью PBS, по 5 минут каждый раз.
Во время последних промывок хемилюминисцентный субстрат SuperSignal West Dura (Thermo Scientific; 34075) оставляли нагреваться до комнатной температуры. Объединяли по 600 мкл каждого из 2 растворов. PBS декантировали от PVDF-мембраны, а затем для покрытия мембраны смешанными регентами Dura применяли пипетку. Обеспечивали осуществление реакции в течение ~5 минут (в это время настраивали систему визуализации VerscDoc) и затем получали фотографии с экспонированием 30 секунд (с усовершенствованием при применении трансформирующего фильтра). Типичная фотография показана на фигуре 15.
Пример 4. Исследования, демонстрирующие специфичную функциональную реакцию антитела IgG1-TM Abet0380-GL in vivo
4.1 Определение функциональных характеристик IgG1-TM Abet0380-GL в отношении снижения свободного бета-амилоидного 1-42 пептида in vivo
Самцам крыс-альбиносов Harlan Sprague-Dawley возрастом восемь недель (n=8-12) вводили однократную дозу антитела IgG1-TM Abet0380-GL при помощи внутривенной инъекции со средой для введения дозы из 25 мМ гистидина, 7% сахарозы, 0,02% поверхностно-активного вещества р80, рН 6,0, из расчета 5 мл/кг. Растворы для введения дозы готовили непосредственно перед введением дозы. В указанное время животным вводили анестезию и спинномозговую жидкость (CSF) аспирировали из задней мозжечково-мозговой цистерны. Образцы CSF центрифугировали в течение 10 минут при приблизительно 3000 × g при 4°C не позже, чем через 20 минут после взятия образца, для удаления клеток или дебриса. Затем образцы замораживали на сухом льду и хранили при -70°C для последующего анализа.
Животных умерщвляли декапитацией, ткань головного мозга иссекали и бета-амилоидные пептиды экстрагировали из ткани головного мозга в диэтиламине (DEA; Fluka, Sigma, Великобритания; № по кат.: 31729). Вкратце, замороженную ткань головного мозга гомогенизировали в 0,2% DEA и 50 мМ NaCl (Merck, США; № по кат.: 1.06404.1000). Гомогенаты головного мозга ультрацентрифугировали при 133000 × g в течение 1 часа. Полученные супернатанты нейтрализовали до рН 8,0 с помощью 2 М Tris-HCl (TRIZMA® - гидрохлорид; Sigma, Великобритания; № по кат.: 93363) и хранили при -70°C до проведения анализа. Эксперименты на животных осуществляли согласно соответствующим руководствам и инструкциям, предусмотренным Министерством сельского хозяйства Швеции. Разрешение согласно нормам этики было получено от совета по этике, специализирующегося на экспериментах на животных: Комитет по этике при исследованиях на животных Южного Стокгольма (Stockholm

Измерения свободного бета-амилоидного 1-42 пептида в CSF крыс проводили с применением иммунопреципитации для удаления бета- амилоидного 1-42 пептида, связанного с Abet0380-GL, с последующим анализом при помощи коммерческого набора для ELISA, полученного от Invitrogen. Вкратце, раствор гранул с белком A (Dynabeads® Protein А; Invitrogen, Великобритания; № по кат.: 100-02D) вносили в 96-луночный неокаймленный планшет (полипропилен 0,2 мл; VWR International, Великобритания; № по кат.: 10732-4828) и дважды промывали с помощью TBST (50 мМ TBS; Sigma, Великобритания; № по кат.: Т6664 вместе с 0,1% Tween20), причем применяли магнит (DynaMag™ 96 секций; Invitrogen, Великобритания; № по кат.: 123.31D) для отделения гранул от раствора. Оттаявшие образцы CSF крысы (40 мкл) добавляли в каждую лунку и инкубировали при 40°С при вращении с наклоном в течение 1 часа. Затем гранулы осаждали при помощи магнита и по 30 мкл иммунопреципитированных образцов CSF переносили в 96-луночный планшет из набора для ELISA (набор для колориметического ELISA мышиного бета-амилоидного (1-42) пептида; Invitrogen, Великобритания; № по кат.: КМВ3441) с 70 мкл уже внесенного стандартного буфера для разведений (дополненный ингибитором протеазы; Roche, Великобритания; № по кат.: 11836153001). Стандартные образцы для калибровки вносили в планшет в двух повторностях и планшет инкубировали в течение 2 часов при комнатной температуре при покачивании. Планшет промывали 4 раза с помощью 400 мкл промывочного буфера, по 100 мкл раствора детекторного антитела добавляли в каждую лунку и планшет инкубировали в течение 1 часа при комнатной температуре при покачивании. Снова планшет промывали 4 раза с помощью 400 мкл промывочного буфера, по 100 мкл рабочего раствора вторичного антитела добавляли в каждую лунку и планшет инкубировали в течение 30 минут при комнатной температуре при покачивании. Наконец, планшет промывали 4 раза с помощью 400 мкл промывочного буфера, по 100 мкл стабилизированного хромогена добавляли в каждую лунку и планшет инкубировали в течение 30 минут при комнатной температуре в темноте. Для остановки реакции по 100 мкл стоп-раствора добавляли в каждую лунку и планшет считывали не позднее чем через 2 часа при поглощении 450 нм. Анализировали одиночные образцы CSF и анализ данных осуществляли с применением Prism 4 (GraphPad, США) при помощи однофакторного ANOVA на log-трансформированных данных без поправки на множественные сравнения.
Измерения общего (свободный и связанный с Abet0380-GL) бета- амилоидного 1-42 пептида в гомогенатах головного мозга крысы осуществляли с применением модификаций набора для колориметического ELISA мышиного бета-амилоидного (1-42) пептида (Invitrogen, Великобритания; № по кат.: KMB3441). Детекторное антитело набора заменяли избытком антитела IgG1-TM Abet0380-GL, а вторичное антитело антилелом к IgG человека, конъюгированным с HRP (Jackson ImmunoResearch, Великобритания; № по кат.: 109-035-098). Вкратце, оттаявшие гомогенаты головного мозга по 50 мкл, разведенные 1:2 в разбавителе для образцов (дополненном ингибитором протеазы; Roche, Великобритания; № по кат.: 11836153001), и стандартные образцы вносили в двух повторностях в 96-луночный планшет для ELISA. Избыток антитела IgG1-TM Abet0380-GL (50 мкл, 4 мкг/мл) добавляли в каждую лунку и планшет затем инкубировали в течение 3 часов при комнатной температуре. Планшет промывали 4 раза с помощью 400 мкл промывочного буфера, по 100 мкл рабочего раствора вторичного антитела добавляли в каждую лунку и планшет инкубировали в течение 30 минут при комнатной температуре. Наконец, планшет промывали 4 раза с помощью 400 мкл промывочного буфера, по 100 мкл стабилизированного хромогена добавляли в каждую лунку и планшет инкубировали в течение 15 минут при комнатной температуре в темноте. Для остановки реакции по 100 мкл стоп-раствора добавляли в каждую лунку и планшет считывали не позднее чем через 2 часа при поглощении 450 нм. Анализ данных осуществляли с применением Prism 4 (GraphPad, США) при помощи однофакторного ANOVA на log-трансформированных данных без поправки на множественные сравнения.
Измерения общего бета-амилоидного 1-40 пептида в гомогенатах головного мозга крысы осуществляли с применением набора для колориметического ELISA мышиного бета-амилоидного (1-40) пептида (Invitrogen, Великобритания; № по кат.: KMB3481). Вкратце, оттаявшие гомогенаты головного мозга по 50 мкл и стандартные образцы, разведенные 1:2 в разбавителе для образцов (дополненном ингибитором протеазы; Roche, Великобритания; № по кат.: 11836153001), вносили в двух повторностях в 96-луночный планшет для ELISA. По 50 мкл раствора детекторного антитела добавляли в каждую лунку и планшет инкубировали в течение 3 часов при комнатной температуре. Планшет промывали 4 раза с помощью 400 мкл промывочного буфера, по 100 мкл рабочего раствора вторичного антитела добавляли в каждую лунку и планшет инкубировали в течение 30 минут при комнатной температуре. Наконец, планшет промывали 4 раза с помощью 400 мкл промывочного буфера, по 100 мкл стабилизированного хромогена добавляли в каждую лунку и планшет инкубировали в течение 30 минут при комнатной температуре в темноте. Для остановки реакции по 100 мкл стоп-раствора добавляли в каждую лунку и планшет считывали не позднее чем через 2 часа при поглощении 450 нм. Анализ данных осуществляли с применением Prism 4 (GraphPad, США) при помощи однофакторного ANOVA на log-трансформированных данных без поправки на множественные сравнения.
4.2 Определение функциональных характеристик IgG1-TM Abet0380-GL в отношении снижения свободного бета-амилоидного 1-42 пептида in vivo
Однократная доза антитела IgG1-TM Abet0380-GL из расчета 20 мг/кг снижала уровни свободного бета-амилоидного 1-42 пептида в CSF у крыс до предела количественного определения через 72 или 168 часов после введения дозы в анализе, описанном в разделе 4.1 (данные не показаны). Для дальнейшего исследования эффекта антитела IgG1-TM Abet0380-GL in vivo, крысам вводили еженедельные дозы по 0,25, 0,5, 1, 5 или 10 мг/кг на протяжении 14 дней. Животных умерщвляли через 168 часов после второй дозы для измерения уровней свободного бета-амилоидного 1-42 пептида в CSF, а также общих бета-амилоидного 1-42 или 1-40 пептидов в ткани головного мозга.
В CSF было показано дозозависимое снижение свободного бета- амилоидного 1-42 пептида (фигура 16А). Две самые большие дозы, 5 и 10 мг/кг, снижали бета-амилоидный 1-42 пептид до предела количественного определения в применяемом анализе, тогда как дозы 0,5 и 1 мг/кг значительно снижали содержание бета-амилоидного 1-42 пептида на 47% и 61%, соответственно, при сравнении с контролем-средой. Самая низкая доза, 0,25 мг/кг, приводила к 14% снижению свободного бета-амилоидного 1-42 пептида в CSF, но не достигла статистической значимости. Вследствие удаления бета-амилоидного 1-42 пептида при помощи антитела IgG1-TM Abet0380-GL в ткани головного мозга было показано дозозависимое повышение общего бета- амилоидного 1-42 пептида (фигура 16 В). Однако, уровень общего бета- амилоидного 1-40 пептида в ткани головного мозга не подвергался влиянию (фигура 16С), что, таким образом, демонстрирует специфичность IgG1-TM Abet0380-GL в отношении бета-амилоидного 1-42 пептида. Подводя итог, приведенные выше результаты исследований на крысах показали, что антитело IgG1-TM Abet0380-GL снижало уровень свободного бета-амилоидного 1-42 пептида в CSF с ED50 от 0,5 до 1 мг/кг.
4.3 Определение функциональных характеристик IgG1TM Abet0380-GL - демонстрация связывания не с бляшками in vivo - отсутствие связывания IgG1-TM Abet0380-GL с бета-амилоидными бляшками in vivo через 168 часов после введения дозы в периферический сосуд пожилым мышам Tg2576
IgG1-TM Abet0380-GL тестировали в отношении его способности связываться с бета-амилоидными бляшками у пожилых мышей Tg2576 после однократного введения дозы в периферический сосуд. Эксперименты на животных осуществляли согласно соответствующим руководствам и инструкциям, предусмотренным Министерством сельского хозяйства Швеции. Разрешение согласно нормам этики было получено от совета по этике, специализирующегося на экспериментах на животных: Комитет по этике при исследованиях на животных Южного Стокгольма (Stockholm

Самкам мышей Tg2576 возрастом семнадцать месяцев (n=5) вводили однократную дозу среды, антитело положительного контроля из расчета 30 мг/кг или антитело IgG1-TM Abet0380-GL из расчета 10 или 30 мг/кг путем внутривенной инъекции со средой для введения дозы из 25 мМ гистидина, 7% сахарозы, 0,02% поверхностно-активного вещества р80, рН 6,0, из расчета 5 мл/кг. Через 168 часов после введения дозы животным вводили сильную анестезию и выполняли перфузию при помощи PBS комнатной температуры, с последующим холодным (4°С) 4% параформальдегидом, забуференным фосфатным буфером (PFA). Затем животных умерщвляли декапитацией и головной мозг иссекали и фиксировали погружением в PFA при 4°С в течение 72 часов. Фиксатор заменяли на PBS, содержащий 0,1% азид натрия, и ткани хранили при 4°С до последующей обработки.
Иммуногистохимию проводили на срезах головного мозга для оценки степени связывания IgG1-TM Abet0380-GL с бета-амилоидными бляшками in vivo. Вкратце, срезы головного мозга, залитого в парафин, готовили для иммуногистохимии, как описано в разделе 1.9. Выявление IgG1-TM Abet0380-GL или антитела положительного контроля, отложенных в паренхиме головного мозга, проводили с применением антитела кролика к IgG1 мыши и вторичного антитела, специфичного к IgG2, от Epitomics. Окраску осуществляли на роботизированной системе Ventana с применением системы выявления OmniMap (Ventana Medical Systems, США). Для введения ex vivo смежные срезы ткани окрашивали in vitro с помощью инъецированного антитела IgG1-TM Abet0380-GL или антитела положительного контроля до излишества. Вторичные антитела и хромогены были такими же, как упомянутые выше.
Количественную оценку окрашивания проводили слепым методом под оптическим увеличением 10×. Отмечали распределение покрытых бляшек. Интенсивность мечения бляшек оценивали количественно согласно шкале относительной интенсивности от 0 (отсутствует окрашивание бляшек) до 4 (интенсивное покрытие бляшек).
IgG1-TM Abet0380-GL не покрывало бета-амилоидные бляшки или бляшки при церебральной амилоидной ангиопатии (САА) in vivo через 168 часов после введения дозы 10 или 30 мг/кг в периферический сосуд. Антитело положительного контроля демонстрировало от сильного до низкого покрытия бляшек in vivo. Паттерн частичного и очагового распределения был различим, в случае плотных бляшек, диффузных бляшек и САА у всех животных. Типичные фотографии показаны на фигуре 17. Введение ex vivo в ткани головного мозга от тех же животных IgG1-TM Abet0380-GL и антитела положительного контроля подтвердило ранее продемонстрированную способность к связыванию бляшек ex vivo у инъецированных антител (не показано).
Пример 5. Последовательности антител к Аβ1-42
Примеры последовательностей молекул антител перечислены в прилагаемом перечне последовательностей, в том числе типовые VH-домены, VL-домены, отдельные CDR-последовательности, наборы HCDR, наборы LCDR и каркасные области антител.
Сравнивали последовательности 24 оптимизированных клонов, перечисленных в таблице 7. В таблицах 10 и 11 показан % идентичности последовательности у VH- и VL-доменов, соответственно.




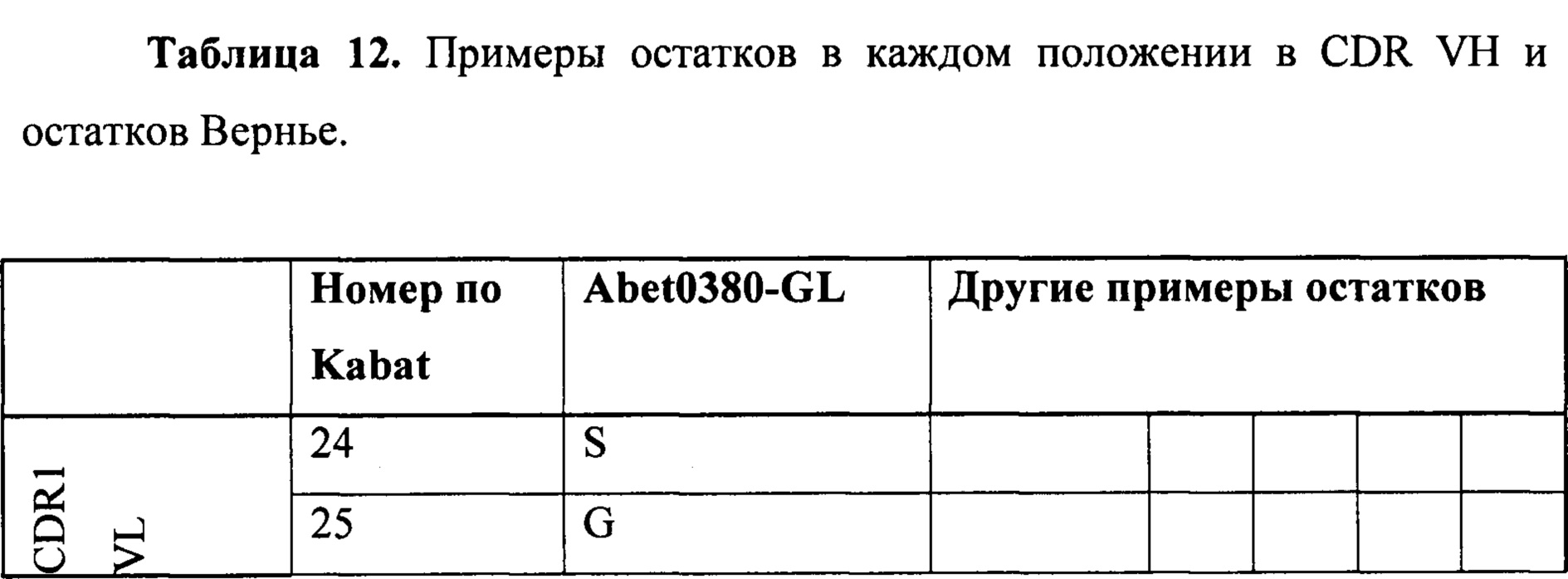






























Пример 6. Специфичность IgG1-TM Abet0380-GL в экспериментах по конкурентному связыванию
Специфичность IgG1-TM Abet0380-GL проверяли в экспериментах по конкурентному связыванию. Вкратце, IgG1-TM Abet0380-GL (0,5 нМ) инкубировали (в течение 1 часа при комнатной температуре) с панелью из человеческих Abeta пептидов полной длины, усечений и пиро-пептидов (Abeta 1-42, Abeta 1-43, Abeta 1-16, Abeta 12-28, Abeta 17-42, Abeta пиро-3-42 или Abeta пиро-11-42), имеющих диапазон различных концентраций (от 10 мкМ с понижением до 0,17 нМ).
После инкубации между IgG1-TM Abet0380-GL и Abeta пептидами, добавляли Abeta 1-42 (1,5 нМ) с биотином N-конце, а затем антитело к Fc человека, меченное криптатом европия (0,8 нМ) (CisBio № по кат. 61HFCKLB) и стрептавидин-XLent! (5 нМ) (CisBio № по кат. 611SAXLB). Затем анализ инкубировали в течение дополнительных 2 часов при комнатной температуре перед считыванием на планшет-ридере EnVision (PerkinElmer) с применением стандартного протокола считывания гомогенной флуоресценции с временным разрешением (HTRF). В отсутствие конкуренции взаимодействие Abeta 1-42 с биотином N-конце с IgG1-TM Abet0380-GL (в комплексе со стрептавидином-XLent! и антителом к Fc человека, меченным криптатом европия, соответственно) можно было затем измерять посредством резонансного переноса энергии флуоресценции с временным разрешением (TR-FRET) из-за непосредственной близости донора криптата европия и акцепторных флуорофоров XL665. Конкуренция IgG1-TM Abet0380-GL: взаимодействие Abeta 1-42 с биотином N-конце с тестируемыми пептидам, следовательно, приводило к снижению сигнала анализа. Результаты выражали как % специфичного связывания, где 100% специфичного связывания получали на основании лунок, содержащих стрептавидин-XLent! (5 нМ), Abeta 1-42 с биотином N-конце (1,5 нМ), IgG1-TM Abet0380-GL (0,5 нМ) и антитело к Fc человека, меченное криптатом европия (0,8 нМ). 0% специфичного связывания получали на основании лунок, в которых IgG1-TM Abet0380-GL не вносили.
Конечный объем анализа составлял 20 мкл и все реагенты готовили в буфере для анализа, содержащем MOPS, рН 7,4 (50 мМ), фторид калия (0,4 М), tween 20 (0,1%) и BSA, не содержащий жирных кислот (0,1%). Анализ осуществляли в 384-луночных планшетах для анализа с черными лунками малого объема (Costar 3676).
И наконец, ингибирование IgG1-TM Abet0380-GL: связывание Abeta 1- 42 с N-концевым биотином наблюдали в случае Abeta 1-42, Abeta 1-43, Abeta 17-42, Abeta пиро-3-42 и Abeta пиро-11-42 со значениями IC50, варьирующими в диапазоне от 10-8 до 10-9 М для этой группы. Отсутствие ингибирования IgG1-TM Abet0380-GL: связывание с Abeta 1-42 с N-концевым биотином наблюдали в случае Abeta 1-16 или Abeta 12-28 (фигура 18).
Пример 7. Способность антитела Abet0144-GL удалять бета-амилоид 1-42 в PK-PD исследовании на нормальных крысах
Способность антитела Abet0144-GL к удалению бета-амилоида 1-42 изучали в PK-PD исследовании на нормальных крысах. Крысам внутривенно вводили Abet0144-GL (10 или 40 мг/кг) или среду еженедельно в течение 2 недель (в дни 0 и 7), и умерщвляли через неделю после 2 дозы. Отбирали образцы CSF для измерения свободного и общего бета-амилоида 1-42 и отбирали образцы головного мозга для измерения общего бета-амилоида 1-42. Уровни свободного и общего бета-амилоида 1-42 измеряли с применением анализов, описанных выше.
Как показано на фигуре 19, уровень свободного бета-амилоида 1-42 в CSF незначительно изменялся под действием либо 10, либо 40 мг/кг Abet0144-GL (повышение на 5 и 18%, соответственно, при сравнении со средой). Уровень общего бета-амилоида 1-42 в CSF значительно повышался на 38% при 10 мг/кг, и на 139% при 40 мг/кг. Уровень общего бета-амилоида 1-42 в ткани головного мозга также значительно повышался, на 16% и 50% при 10 и 40 мг/кг, соответственно. Подводя итог, данные из этого исследования на нормальных крысах продемонстрировали, что Abet0144-GL не оказывал значительного влияния на уровни свободного бета-амилоида 1-42 в CSF, и в то же время повышал уровни общего бета-амилоида 1-42 как в CSF, так и в головном мозге. Это был профиль, который, как можно было ожидать, характерен для антитела с аффинностью в отношении мишени в диапазоне десятков нМ.
Список литературы
Bannister, D., Wilson, A., Prowse, L., Walsh, M., Holgate, R., Jermutus, L. and Wilkinson, T. (2006). Parallel, high-throughput purification of recombinant antibodies for in vivo cell assays. Biotechnol. Bioeng. 94, 931-937.
Bard, F., Cannon, C, Barbour, R., Burke, R.L., Games, D., Grajeda, H., Guido, Т., Hu, K., Huang, J., Johnson-Wood, K., Khan, K., Kholodenko, D., Lee, M., Lieberburg, I., Motter, R., Nguyen, M., Soriano, F., Vasquez, N., Weiss, K., Welch, В., Seubert, P., Schenk, D. and Yednock, T. (2000). Peripherally administered antibodies against amyloid beta-peptide enter the central nervous system and reduce pathology in a mouse model of Alzheimer disease. Nat. Med. 6, 916-919.
Borchelt, D.R., Thinakaran, G., Eckman, С.В., Lee, M.K., Davenport, F., Ratovitsky, Т., Prada, С.M., Kim, G., Seekins, S., Yager, D., Slunt, H.H., Wang, R., Seeger, M., Levey, A.I., Gandy, S.E., Copeland, N.G., Jenkins, N.A., Price, D.L., Younkin, S. G. and Sisodia, S. S. (1996). Familial Alzheimer's disease-linked presenilin 1 variants elevate Abeta 1-42/1-40 ratio in vitro and in vivo. Neuron 17, 1005-1013.
Citron, M., Eckman, С.В., Diehl, T.S., Corcoran, C, Ostaszewski, B.L., Xia, W., Levesque, G., St George Hyslop, P., Younkin, S.G. and Selkoe, D.J. (1998). Additive effects of PS1 and APP mutations on secretion of the 42-residue amyloid beta-protein. Neurobiol. Dis. 5, 107-116.
Clackson, T. and Lowman, H.B. (2004). Phage display: a practical approach, Oxford University Press.
De Strooper, B. (2007). Loss-of-function presenilin mutations in Alzheimer disease. Talking Point on the role of presenilin mutations in Alzheimer disease. EMBORep.8, 141-146.
DeMattos, R.В., Bales, K.R., Cummins, D.J., Dodart, J.C, Paul, S.M. and Holtzman, D.M. (2001). Peripheral anti-A beta antibody alters CNS and plasma A beta clearance and decreases brain A beta burden in a mouse model of Alzheimer's disease. Proc. Natl. Acad. Sci. USA 98, 8850-8855.
Duff, K., Eckman, C, Zehr, C, Yu, X., Prada, С.M., Perez-tur, J., Hutton, M., Buee, L., Harigaya, Y., Yager, D., Morgan, D., Gordon, M. N., Holcomb, L., Refolo, L., Zenk, В., Hardy, J. and Younkin, S. (1996). Increased amyloid- beta42(43) in brains of mice expressing mutant presenilin 1. Nature 383, 710-713.
Foote, J. and Winter, G. (1992). Antibody framework residues affecting the conformation of the hypervariable loops. J. Mol. Biol. 224, 487-499.
Gilman, S., Koller, M., Black, R.S., Jenkins, L., Griffith, S.G., Fox, N.C, Eisner, L., Kirby, L., Rovira, M.В., Forette, F. and Orgogozo, J.M. (2005). Clinical effects of Abeta immunization (AN1792) in patients with AD in an interrupted trial. Neurology 64, 1553-1562.
Glabe, C. (2000). Does Alzheimer disease tilt the scales of amyloid degradation versus accumulation? Nat. Med. 6, 133-134.
Golde, Т.E., Das, P. and Levites, Y. (2009). Quantitativeand Mechanistic Studies of Ab Immunotherapy. CNS & Neuro. Dis. - Drug Targets 8, 31-49
Greeve, I., Kretzschmar, D., Tschape, J.A., Beyn, A., Brellinger, C, Schweizer, M., Nitsch, R.M. and Reifegerste, R. (2004). Age-dependent neurodegeneration and Alzheimer-amyloid plaque formation in transgenic Drosophila. J. Neurosci. 24, 3899-3906.
Groves, M.A. and Osbourn, J.K. (2005). Applications of ribosome display to antibody drug discovery. Expert Opin. Biol. Ther. 5, 125-135.
Hanes, J., Jermutus, L. and Pluckthun, A. (2000). Selecting and evolving functional proteins in vitro by ribosome display. Methods Enzymol. 328, 404-430.
Hanes, J. and Pluckthun, A. (1997). In vitro selection and evolution of functional proteins by using ribosome display. Proc. Natl. Acad. Sci. USA 94, 4937-4942.
Hawkins, R.E., Russell, S.J. and Winter, G. (1992). Selection of phage antibodies by binding affinity. Mimicking affinity maturation. J. Mol. Biol. 226, 889-896.
Hoet, R.M., Cohen, E.H., Kent, R.В., Rookey, K., Schoonbroodt, S., Hogan, S., Rem, L., Frans, N., Daukandt, M., Pieters, H., van Hegelsom, R., Neer, N.C, Nastri, H.G., Rondon, I.J., Leeds, J.A., Hufton, S.E., Huang, L., Kashin, I., Devlin, M., Kuang, G., Steukers, M., Viswanathan, M., Nixon, A.E., Sexton, D.J., Hoogenboom, H.R. and Ladner, R.C. (2005). Generation of high-affinity human antibodies by combining donor-derived and synthetic complementarity- determining-region diversity. Nat. Biotechnol. 23, 344-348.
Iijima, K., Liu, H.P., Chiang, A.S., Hearn, S.A., Konsolaki, M. and Zhong, Y. (2004). Dissecting the pathological effects of human Abeta40 and Abeta42 in Drosophila: a potential model for Alzheimer's disease. Proc. Natl. Acad. Sci. USA 101, 6623-6628.
Karlsson, R., Michaelsson, A. and Mattsson, L. (1991). Kinetic analysis of monoclonal antibody-antigen interactions with a new biosensor based analytical system. J. Immunol Methods 145, 229-240.
Kuperstein, I., Broersen, K., Benilova, I., Rozenski, J., Jonckheere, W., Debulpaep, M., Vandersteen, A., Segers-Nolten, I., Van Der Werf, K., Subramaniam, V., Braeken, D., Callewaert, G., Bartic, C, D'Hooge, R., Martins, I.C, Rousseau, F., Schymkowitz, J. and De Strooper, B. (2010). Neurotoxicity of Alzheimer's disease Abeta peptides is induced by small changes in the Abeta42 to Abeta40 ratio. EMBO J. 29, 3408-3420.
Lambert, M.P., Barlow, A.K., Chromy, B.A., Edwards, C, Freed, R., Liosatos, M., Morgan, Т.E., Rozovsky, I., Trommer, В., Viola, K.L., Wals, P., Zhang, C, Finch, С.E., Krafft, G.A. and Klein, W.L. (1998). Diffusible, nonfibrillar ligands derived from Abetal-42 are potent central nervous system neurotoxins. Proc. Natl. Acad. Sci. USA 95, 6448-6453.
Levites, Y., Das, P., Price, R.W., Rochette, M.J., Kostura, L.A., McGowan, E.M., Murphy, M.P. and Golde, Т.E. (2006). Anti-Abeta42- and anti-Abeta40-specific mAbs attenuate amyloid deposition in an Alzheimer disease mouse model. J. Clin. Invest. 116, 193-201.
Matsuoka, Y., Saito, M., LaFrancois, J., Saito, M., Gaynor, K., Olm, V., Wang, L., Casey, E., Lu, Y., Shiratori, C, Lemere, C. and Duff, K. (2003). Novel therapeutic approach for the treatment of Alzheimer's disease by peripheral administration of agents with an affinity to beta-amyloid. J. Neurosci. 23, 29-33.
McCafferty, J., Fitzgerald, K.J., Earnshaw, J., Chiswell, D.J., Link, J., Smith, R. and Kenten, J. (1994). Selection and rapid purification of murine antibody fragments that bind a transition-state analog by phage display, на патент США Biochem. Biotechnol. 47, 157-171; discussion 171-153.
McGowan, E., Pickford, F., Kim, J., Onstead, L., Eriksen, J., Yu, C, Skipper, L., Murphy, M.P., Beard, J., Das, P., Jansen, K., Delucia, M., Lin, W.L., Dolios, G., Wang, R., Eckman, С.В., Dickson, D.W., Hutton, M., Hardy, J. and Golde, T. (2005). Abeta42 is essential for parenchymal and vascular amyloid deposition in mice. Neuron 47, 191-199.
Mucke, L., Masliah, E., Yu, G.Q., Mallory, M., Rockenstein, E.M., Tatsuno, G., Hu, K., Kholodenko, D., Johnson-Wood, K. and McConlogue, L. (2000). High-level neuronal expression of abeta 1-42 in wild-type human amyloid protein precursor transgenic mice: synaptotoxicity without plaque formation. J. Neurosci. 20, 4050-4058.
Oganesyan, V., Gao, C, Shirinian, L., Wu, H. and Dall'Acqua, W.F. (2008). Structural characterization of a human Fc fragment engineered for lack of effector functions. Acta Crystallogr. D Biol. Crystallogr. 64, 700-704.
Orgogozo, J.M., Gilman, S., Dartigues, J.F., Laurent, В., Puel, M., Kirby, L.C, Jouanny, P., Dubois, В., Eisner, L., Flitman, S., Michel, B.F., Boada, M., Frank, A. and Hock, C. (2003). Subacute meningoencephalitis in a subset of patients with AD after Abeta42 immunization. Neurology 61, 46-54.
Osbourn, J.K., Field, A., Wilton, J., Derbyshire, E., Earnshaw, J.C, Jones, P.Т., Allen, D. and McCafferty, J. (1996). Generation of a panel of related human scFv antibodies with high affinities for human CEA. Immunotechnology 2, 181-196.
Persic, L., Roberts, A., Wilton, J., Cattaneo, A., Bradbury, A. and Hoogenboom, H.R. (1997). An integrated vector system for the eukaryotic expression of antibodies or their fragments after selection from phage display libraries. Gene 187, 9-18.
Portelius, E., Bogdanovic, N., Gustavsson, M.K., Volkmann, I., Brinkmalm, G., Zetterberg, H., Winblad, B. and Blennow, K. (2010). Mass spectrometric characterization of brain amyloid beta isoform signatures in familial and sporadic Alzheimer's disease. Acta Neuropathol. 120, 185-193.
Pride, M., Seubert, P., Grundman, M., Hagen, M., Eldridge, J. and Black, R.S. (2008). Progress in the active immunotherapeutic approach to Alzheimer's disease: clinical investigations into AN1792-associated meningoencephalitis. Neurodegener. Dis. 5, 194-196.
Schenk, D., Barbour, R., Dunn, W., Gordon, G., Grajeda, H., Guido, Т., Hu, K., Huang, J., Johnson-Wood, K., Khan, K., Kholodenko, D., Lee, M., Liao, Z., Lieberburg, I., Motter, R., Mutter, L., Soriano, F., Shopp, G., Vasquez, N., Vandevert, C, Walker, S., Wogulis, M., Yednock, Т., Games, D. and Seubert, P. (1999). Immunization with amyloid-beta attenuates Alzheimer-disease-like pathology in the PDAPP mouse. Nature 400, 173-177.
Schenk, D. В., Seubert, P., Lieberburg, I. and Wallace, J. (2000). beta-peptide immunization: a possible new treatment for Alzheimer disease. Arch. Neurol. 57, 934-936.
Scheuner, D., Eckman, C, Jensen, M., Song, X., Citron, M., Suzuki, N., Bird, T.D., Hardy, J., Hutton, M., Kukull, W., Larson, E., Levy-Lahad, E., Viitanen, M., Peskind, E., Poorkaj, P., Schellenberg, G., Tanzi, R., Wasco, W., Lannfelt, L., Selkoe, D. and Younkin, S. (1996). Secreted amyloid beta-protein similar to that in the senile plaques of Alzheimer's disease is increased in vivo by the presenilin 1 and 2 and APP mutations linked to familial Alzheimer's disease. Nat. Med. 2, 864-870.
Schier, R., Bye, J., Apell, G., McCall, A., Adams, G.P., Malmqvist, M, Weiner, L.M. and Marks, J.D. (1996). Isolation of high-affinity monomeric human anti-c-erbB-2 single chain Fv using affinity-driven selection. J. Mol. Biol. 255, 28-43.
Selkoe, D.J. (1999). Translating cell biology into therapeutic advances in Alzheimer's disease. Nature 399, A23-31.
Thompson, J., Pope, Т., Tung, J. S., Chan, C, Hollis, G., Mark, G. and Johnson, K.S. (1996). Affinity maturation of a high-affinity human monoclonal antibody against the third hypervariable loop of human immunodeficiency virus: use of phage display to improve affinity and broaden strain reactivity. J. Mol. Biol. 256, 77-88.
Tomlinson, I.M., Walter, G., Marks, J.D., Llewelyn, M.B. and Winter, G. (1992). The repertoire of human germline VH sequences reveals about fifty groups of VH segments with different hypervariable loops. J. Mol. Biol. 227, 776-798.
Vassar, R., Bennett, B.D., Babu-Khan, S., Kahn, S., Mendiaz, E.A., Denis, P., Teplow, D.В., Ross, S., Amarante, P., Loeloff, R., Luo, Y., Fisher, S., Fuller, J., Edenson, S., Lile, J., Jarosinski, M.A., Biere, A.L., Curran, E., Burgess, Т., Louis, J.C, Collins, F., Treanor, J., Rogers, G. and Citron, M. (1999). Beta-secretase cleavage of Alzheimer's amyloid precursor protein by the transmembrane aspartic protease BACE. Science 286, 735-741.
Vaughan, T.J., Williams, A.J., Pritchard, K., Osbourn, J.K., Pope, A.R., Earnshaw, J.C, McCafferty, J., Hodits, R.A., Wilton, J. and Johnson, K.S. (1996). Human antibodies with sub-nanomolar affinities isolated from a large non-immunized phage display library. Nat. Biotechnol. 14, 309-314.
Walsh, D.M., Klyubin, I., Fadeeva, J.V, Cullen, W.K., Anwyl, R., Wolfe, M.S., Rowan, M.J. and Selkoe, D.J. (2002). Naturally secreted oligomers of amyloid beta protein potently inhibit hippocampal long-term potentiation in vivo. Nature 416, 535-539.
Walsh, D.M., Klyubin, I., Shankar, G.M., Townsend, M., Fadeeva, J.V., Betts, V., Podlisny, M.В., Cleary, J.P., Ashe, K.H., Rowan, M. J. and Selkoe, D.J. (2005a). The role of cell-derived oligomers of Abeta in Alzheimer's disease and avenues for therapeutic intervention. Biochem. Soc. Trans. 33, 1087-1090.
Walsh, D.M., Townsend, M., Podlisny, M.В., Shankar, G.M., Fadeeva, J.V., El Agnaf, O., Hartley, D.M. and Selkoe, D.J. (2005b). Certain inhibitors of synthetic amyloid beta-peptide (Abeta) fibrillogenesis block oligomerization of natural Abeta and thereby rescue long-term potentiation. J. Neurosci. 25, 2455-2462.
Wang, H.W., Pasternak, J.F., Kuo, H., Ristic, H., Lambert, M.P., Chromy, В., Viola, K.L., Klein, W.L., Stine, W.В., Krafft, G.A. and Trommer, B.L. (2002). Soluble oligomers of beta amyloid (1-42) inhibit long-term potentiation but not long-term depression in rat dentate gyrus. Brain Res. 924, 133-140.
Weller, R.O. and Nicoll, J.A. (2003). Cerebral amyloid angiopathy: pathogenesis and effects on the ageing and Alzheimer brain. Neurol. Res. 25, 611-616.
Wilcock, D.M., Alamed, J., Gottschall, P.E., Grimm, J., Rosenthal, A., Pons, J., Ronan, V., Symmonds, K., Gordon, M.N. and Morgan, D. (2006). Deglycosylated anti-amyloid-beta antibodies eliminate cognitive deficits and reduce parenchymal amyloid with minimal vascular consequences in aged amyloid precursor protein transgenic mice. J. Neurosci. 26, 5340-5346.
Wilcock, D.M. and Colton, C.A. (2009). Immunotherapy, vascular pathology, and microhemorrhages in transgenic mice. CNS Neurol. Disord. Drug. Targets. 8, 50-64.
Younkin, S.G. (1995). Evidence that A beta 42 is the real culprit in Alzheimer's disease. Ann. Neurol. 37, 287-288.
Younkin, S.G. (1998). The role of A beta 42 in Alzheimer's disease. J. Physiol. Paris 92, 289-292.
Остальные литературные источники включены в текст.
Реферат
Данное изобретение относится к иммунологии. Предложена выделенная молекула антитела, которая является селективной в отношении связывания человеческого бета-амилоидного 1-42 пептида (Aβ1-42), а не человеческого бета-амилоидного 1-40 пептида (Aβ1-40). Также рассмотрена композиция, содержащая молекулу антитела, применение композиции при лечении болезни Альцгеймера, в улучшении когнитивной деятельности или замедлении снижения когнитивных способностей у пациента; способ снижения амилоидоза, лечения болезни Альцгеймера, улучшения когнитивной деятельности или замедления снижения когнитивных способностей у пациента, страдающего болезнью Альцгеймера или синдромом Дауна, и/или лечения макулярной дегенерации у индивидуума; выделенная нуклеиновая кислота, клетка-хозяин и способ получения молекулы антитела. Настоящее изобретение может найти дальнейшее применение в лечении состояний, ассоциированных с амилоидозом. 7 н. и 12 з.п. ф-лы, 19 ил., 16 табл., 7 пр.

Комментарии