Способы получения косметической композиции, содержащей лейколектин, и ее применение - RU2595823C2
Код документа: RU2595823C2
Чертежи












Описание
Настоящее изобретение относится к применению полипептида, который может быть получен из среды, получаемой после выклева Salmonidae (т.е. массы, получаемой после выклева личинок рыб семейства лососевых), для оказания различных типов воздействия на кожные покровы (также называемые кожей) индивидуума. В частности, полипептид согласно настоящему изобретению и композиции, содержащие этот полипептид, пригодны для изменения, предпочтительно улучшения, косметического состояния кожи.
Кожа является одним из наиболее уязвимых органов тела. Кожа, непосредственно или опосредованно, постоянно находится в постоянном взаимодействии с внешними раздражителями и часто подвергается воздействию и влиянию факторов окружающей среды. Действительно, кожа может рассматриваться как первый рубеж, контактирующий с внешним миром. Такое постоянное воздействие может приводить к неприятным и/или нежелательным физическим и видимым изменениям кожи, в частности, изменениям косметического состояния кожных покровов. Несмотря на то, что такие изменения могут и не угрожать здоровью индивидуума, они могут вызывать физический дискомфорт или приводить к образованию видимых дефектов. Действительно, поскольку кожные покровы часто находятся на виду, изменение их внешнего вида может вызывать психологический стресс. Таким образом, существует постоянная необходимость и спрос на эффективные средства ухода, предназначенные для поддержания, восстановления или улучшения состояния кожных покровов и, в частности, для восстановления молодого внешнего вида кожи.
Кожа представляет собой самый крупный орган тела, составляя приблизительно 12-16 процентов его массы. Она имеет ряд жизненно необходимых функций, одновременно являясь барьером и регулятором баланса между воздействиями внешней среды и контролируемым состоянием среды внутри организма.
Кожный покров состоит из 3 слоев: эпидермиса, дермы и подкожного слоя (субкутиса). Эпидермис является самым верхним, эпителиальным слоем кожи. Он действует как физический барьер, предотвращающий потерю организмом воды, а также предотвращающий поступление веществ и организмов внутрь тела. Его толщина различна на разных участках тела.
Эпидермис состоит из многослойного плоского эпителия, т.е. он состоит из слоев уплощенных клеток. Кожа, волосы и ногти подвергаются кератинизации (ороговению), что означает, что они имеют омертвевшую, затвердевшую гидрофобную поверхность, образуемую белком, называемым кератином. Благодаря содержанию внеклеточных липидов, связанных с кератиноцитами, в особенности, в среднем слое эпидермиса (stratum lucidum, т.е. блестящем слое) эпидермис непроницаем. Слизистые оболочки (например, пищевода, ротовой и глоточной полостей, репродуктивных органов и другие) в основном не подвергаются кератинизации и остаются влажными. Эпидермис включает три основных типа клеток: кератиноциты (клетки кожи), меланоциты (клетки, вырабатывающие пигмент) и клетки Лангерганса (иммунные клетки). Четвертым, менее преобладающим типом клеток эпидермиса являются клетки Меркеля.
По мере продвижения к внешнему слою, кератиноциты становятся зрелыми и накапливают кератин. В конечном итоге они отваливаются или отшелушиваются. Они образуют четыре или пять отчетливо различимых слоев, среди которых, начиная от самого внешнего и заканчивая самым глубоким, можно выделить следующие слои: (i) Stratum corneum (роговой слой), содержащий отмершие высохшие отвердевшие клетки, не имеющие ядер, (ii) Stratum granulosum (зернистый слой), включающий клетки, содержащие базофильные гранулы (зерна) и отделенный снаружи от Stratum corneum тонким слоем Stratum lucidum, (iii) Stratum spinulosum (шиповатый слой или слой шиповатых клеток), в котором клетки постепенно уплощаются по мере их продвижения вверх, и (iv) Stratum basale (базальный слой), содержащий цилиндрические (призматические, столбчатые) регенеративный клетки.
Непосредственно под эпидермисом находится базальная мембрана, т.е. специальная структура, расположенная между эпидермисом и дермой.
Дерма представляет собой волокнистую соединительную ткань или поддерживающий слой кожи. Основными волокнами являются переплетающиеся между собой коллагеновые волокна и эластин.
Подкожный слой представляет собой слой жира, расположенный непосредственно под дермой и эпидермисом. Он также называется подкожной тканью, гиподермой или поверхностным слоем ткани. Подкожный слой в основном состоит из жировых клеток (адипоцитов), нервов и кровеносных сосудов.
Новые эпителиальные клетки кожи образуются в более глубоко лежащем слое кожи, Stratum granulosum. С течением времени клетки перемещаются к поверхности кожи, и их кислотность повышается. В течение 30-суточного периода своего перемещения они отмирают и насыщаются кератином. Кератин и связанные с ним липиды являются важными веществами, поскольку они защищают кожу от внешних воздействий.
На косметическое состояние кожи может отрицательно влиять множество факторов, которые включают заболевания, повреждения, влияние окружающей среды, возраст, уровни гормонов, прием медикаментов, наносимые наружно или принимаемые вовнутрь материалы, генетические факторы или комбинация этих и других факторов. Универсальным фактором является возрастное ухудшение косметического состояния кожных покровов, в частности, фотостарение (старение кожи от воздействия ультрафиолетовых лучей), т.е. дерматогелиоз. Это ухудшение может проявляться в неровностях или аномалиях кожи, которые могут представлять собой, например, сухость кожи, морщины, мимические морщинки, повышенную вялость (отвисание) или измененную пигментацию.
Фотостарение - это термин, принятый для обозначения характерных изменений, вызываемых хроническим воздействием УФА (ультрафиолетовых лучей спектра А) и УФВ (ультрафиолетовых лучей спектра В). Ухудшение биологического функционирования и способности справляться с метаболическим стрессом является одним из основных результатов процесса старения. Старение представляет собой сложный, постепенный процесс, который также приводит к функциональным и эстетическим изменениям кожи.
Фотостарение представляет собой процесс старения кожи в результате долговременного непрерывного воздействия на кожные покровы ультрафиолетового (УФ) излучения с длиной волны приблизительно 245-290 нм, которое может представлять собой как естественный, так и искусственный свет.Фотостарение также известно как старение кожи, в частности, кожи лица, ушей, шеи и рук под действием УФА- и УФВ-излучения.
Наиболее часто встречающимися признаками старения кожи является сухость и/или шелушение кожи. Несмотря на то, что некоторые индивидуумы больше предрасположены к сухости и/или шелушению кожи, сухая и/или шелушащаяся кожа может появляться у любого индивидуума независимо от его возраста, пола или типа кожи.
Кожа становится сухой, когда в наружном слое кожи (роговой и блестящий слои вместе) имеется недостаток воды, вызываемый потерями влаги испарением через кожу (трансэпидермальной потерей влаги, англ. transepidermal water loss, сокращенно TEWL). Если этот слой хорошо увлажнен, то это уменьшает потери влаги через кожные покровы и позволяет противостоять воздействию раздражителей, аллергенов и микробов. Однако, при высыхании рогового слоя, его защитная способность понижается. Это приводит к еще большим потерям влаги, что делает кожу уязвимой к воздействиям окружающей среды.
В идеале содержание воды в роговом слое составляет от 10 до 30%. Содержащаяся вода придает коже мягкую, гладкую и гибкую структуру, т.е. характеристики, ассоциирующиеся с молодым внешним видом кожи. Вода поступает из атмосферы, нижележащих слоев кожи и пота. Сало, вырабатываемое кожными железами, и жирные вещества, вырабатываемые клетками кожи, действуют как натуральные увлажняющие средства, что позволяет роговому слою удерживать воду.
Организм непрерывно теряет воду за счет испарения с поверхности кожи (TEWL). В обычных условиях скорость испарения невелика, и происходит адекватное восполнение воды. Характерные признаки и симптомы сухости кожи возникают, когда скорость потери влаги превышает скорость восполнение воды, и содержание воды в роговом слое становится менее 10%.
Чрезвычайно желательно создать увлажняющие средства, улучшающие или устраняющие сухость и/или шелушение кожи, то есть улучшающие косметическое состояние кожных покровов. Несмотря на то, что в данной области техники известно множество увлажняющих средств, все еще имеется необходимость использования натуральных продуктов, обладающих эффективным, но мягким действием.
Клетки эпидермиса, имеющие нежелательную или избыточную пигментацию, т.е. гиперпигментацию, например, печеночные пятна, являются другим обычным признаком старения кожи. Традиционно для удаления клеток эпидермиса, ухудшающих косметическое состояние кожных покровов, может быть применено принудительное отшелушивание.
При отшелушивании удаляют наружный слой эпидермиса, обнажая более молодые клетки кожи, находящиеся под ним. Отшелушивание может быть выполнено физическими средствами (т.е. шлифовкой кожных покровов) или химическими средствами. Химические эксфолианты (отшелушивающие средства) включают скрабы, содержащие салициловую кислоту, гликолевую кислоту, фруктовые ферменты, лимонную кислоту или яблочную кислоту, и могут быть использованы в высоких концентрациях дерматологом или в более низких концентрациях в изделиях, поступающих в розничную торговлю. Химическое отшелушивание может включать применение средств, содержащих альфа-гидроксикислоты (англ. alpha hydroxy acid, сокращенно AHA) или бета-гидроксикислоты (англ. beta hydroxy acid, сокращенно ВНА) или ферменты, разжижающие клееподобные вещества, удерживающие клетки на месте в местах соединения клеток, что позволяет отделять такие клетки. Такой тип отшелушивания рекомендован людям, проходящим лечение от угревой сыпи (акне).
Самым серьезным недостатком отшелушивания является высокая стоимость некоторых средств и способов, применяемых для проведения отшелушивания. Отшелушивание может вызывать начальное покраснение кожи. Ближе к окончанию химического пилинга кожа становится "перламутровой", и цвет поверхности кожи варьируется от очень белого до серого.
Таким образом, желательно создание эффективных способов уменьшения гиперпигментации кожных покровов, но более мягких, чем отшелушивание.
Помимо старения, косметический/эстетический внешний вид кожных покровов может пострадать из-за физического повреждения. Например, поверхностное повреждение верхних (поверхностных) слоев кожи, т.е. эпидермиса и/или дермы, например, при небольших ссадинах, царапинах и т.д. может вызывать появление на коже нежелательных пятен. Физическое повреждение кожи, например, вызываемое ранами, порезами, инфекцией, угревой сыпью и т.д., может приводить к рубцеванию (появлению шрамов).
Раны представляют собой наружные или внутренние повреждения, вызываемые, например, механическими, химическими, термическими или патогенными факторами, которые приводят к физическому нарушению целостности структурной ткани.
Шрамы (рубцы) представляют собой участки волокнистой ткани (фиброзной ткани), которые замещают нормальную кожу после повреждения. Шрам возникает в результате биологического процесса заживления раны в кожных и других тканях организма. Таким образом, рубцевание представляет собой естественную часть процесса заживления. За исключением очень мелких ссадин, каждая рана (например, полученная в результате несчастного случая, заболевания или хирургической операции) приводит к выраженному в определенной степени рубцеванию.
Рубцовая ткань, как функционально, так и в косметическом плане, менее полноценна, чем нормальная неповрежденная кожа. Полагают, что эта неполноценность обусловлена типом размещения пучков коллагена внутри дермы, создающимся во время нового образования ткани. В нормальной коже пучки коллагена расположены в виде сложного трехмерного переплетения (часто называемого "шахматным переплетением"), которое придает коже высокую эластичность и устойчивость к повреждениям. Пучки коллагена в рубцовой ткани расположены в виде более плоскостной структуры и ориентированы параллельно поверхности кожи. Полагают, что утрата трехмерного переплетения и его замена параллельным расположением пучков коллагена обусловливают ухудшение косметического результата на участках рубцевания ткани.
Рубцевание также может происходить при разрыве индивидуальных слоев кожи. Например, растяжки (также известные как полосы или стрии, лат.striae) вызываются разрывом дермы. Растяжки часто являются результатом быстрого растяжения кожных покровов в результате быстрого роста (обычного в подростковом возрасте) или набора массы (например, при беременности, наращивании мускулов или быстром наборе жировых тканей) или в некоторых случаях в результате приложения к коже очень большой растягивающей силы, превышающей эластичность дермы. Растяжки также могут быть вызваны гормональными изменениями, связанными с подростковым возрастом, беременностью, наращиванием мускулов, заместительной гормональной терапией у транссексуалов и т.д. Отметины, получаемые при растяжении кожи, известны как striae atrophicae (атррфические полосы кожи), striae vergetures, striae distensae, striae cutis distensae (полосы растяжения кожи), striae gravidarum (вызванные беременностью), lineae atrophicae (линейная атрофия), linea albicante или просто striae.
Таким образом, имеется необходимость создания терапии, подходящей для улучшения эстетического внешнего вида кожных покровов. Другими словами, желательно нахождение способов улучшения косметического состояния кожных покровов. В частности, имеется необходимость создания способов восстановления молодого вида возрастной кожи и/или способов борьбы с признаками старения кожи. Также имеется необходимость создания способов улучшения, восстановления или внешнего устранения поверхностных повреждений кожи, например, зарубцевавшейся кожи или поверхностных дефектов, полученных в результате незначительных повреждений эпидермиса и/или дермы.
Неожиданно было обнаружено, что воздействие определенных молекул, находящихся в среде, получаемой после выклева Salmonidae, а именно, полипептида, который известен как лейколектин (англ. leukolectin), чрезвычайно эффективно улучшает косметическое состояние кожных покровов, в частности, уменьшает физические признаки, связанные со старением кожи и восстанавливает внешний вид кожи, поверхность которой была повреждена.
Изначально этот белок был идентифицирован у рыб, выделен из организма рыб и описан в патентной публикации WO 2010/049688, содержание которой полностью включено в настоящее описание посредством ссылки. Белок лосося содержит 255 аминокислот (последовательность SEQ ID NO:1). Это пропептидная форма полипептида, которая содержит 19-ый аминокислотный N-терминальный пептид, что означает, что для дальнейшей секреции молекула должна попасть в лизосому (т.е. в перивителлиновое (околожелтковое) пространство).
Идентификация аминокислотной последовательности полипептида позволила создать эпитоп-специфические антитела, что, в свою очередь, позволило в зависимости от анализируемой ткани идентифицировать множество (2-8) кажущихся изоформ белка. Из организма лосося было выделено по меньшей мере две мРНК (информационных или матричных РНК), последовательности которых содержат небольшие отличия, проявляющиеся только в виде 7 изменений на уровне полипептида. В лейкоцитах лосося также были идентифицированы усеченные формы белка (см. последовательность SEQ ID NO:2).
Полученный белок мало похож на известные белки; сходство с любым из известных белков прослеживается менее чем на 50%. У небольших доменов имеется некоторое сходство с тахилолектинами (англ. tachylolectin).
Неожиданно обнаружили, что эти белки оказывают выраженное воздействие на косметическое состояние кожи. Не прибегая к какой-либо теории, можно отметить, что в приведенных Примерах показано, что лейколектин может замедлять высвобождение матриксных металлопротеиназ (англ. matrix metalloproteinase, сокращенно ММР), которые представляют собой цинкозависимые эндопептидазы фибробластов дермы. Эти ферменты могут разрушать множество различных типов белков, присутствующих во внеклеточной матрице кожных покровов, например, коллаген, и полагают, что ингибирование высвобождения этих ферментов по меньшей мере частично обусловливает воздействие этих белков на косметический/эстетический внешний вид кожи.
Соответственно, в наиболее широком понимании изобретение может рассматриваться как относящееся к полипептидам, рассматриваемым в настоящем описании, которые применяют для или в способах улучшения эстетического состояния внешнего вида кожи. Другими словами, рассматриваемые в настоящем описании полипептиды применяют для или в способах улучшения косметического состояния кожных покровов. В одном из особенно предпочтительных аспектов изобретение может рассматриваться как относящееся к полипептидам, рассматриваемым в настоящем описании, которые применяют для или в способах восстановления молодого вида состарившейся кожи и/или борьбы с признаками старения кожи. Согласно другому предпочтительному аспекту, изобретение может рассматриваться как относящееся к полипептидам, рассматриваемым в настоящем описании, которые применяют для или в способах улучшения, уменьшения или устранения внешних поверхностных повреждений кожи, например, зарубцевавшейся кожи или поверхностных дефектов, полученных в результате небольших повреждений эпидермиса и/или дермы.
Из приведенного ниже описания должно быть понятно, что рассматриваемые в настоящем описании полипептиды могут быть включены в косметические композиции, которые содержат одно или более физиологически или фармацевтически приемлемых эксципиентов и/или разбавителей.
Таким образом, один из аспектов настоящего изобретения относится к:
(i) полипептиду, содержащему последовательность аминокислот, приведенную в любой из последовательностей SEQ ID No.1-4, или последовательность, которая по меньшей мере на 90% идентична упомянутой последовательности, или часть любой из упомянутых последовательностей; или
(ii) косметической композиции, содержащей (i) и одно или несколько физиологически или фармацевтически приемлемых эксципиентов и/или разбавителей,
применяемых с целью улучшения косметического состояния кожных покровов млекопитающего.
Изобретение также относится к способу улучшения косметического состояния кожных покровов млекопитающего, согласно которому в организм млекопитающего вводят полипептид или косметическую композицию, рассмотренные выше.
Дополнительный аспект изобретения относится к применению полипептида или косметической композиции, рассмотренных выше, для получения медикамента, улучшающего косметическое состояние кожных покровов млекопитающего.
Согласно настоящему изобретению, термином "полипептиды" названы молекулы, содержащие предпочтительно более 50, 100, 150, 200 или 250 остатков и/или менее 500, 400, 300, 200 или 100 остатков, или количество остатков, выбранное из приведенных выше диапазонов. Согласно настоящему изобретению, термин "часть" предпочтительно включает по меньшей мере 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240 или более аминокислот последовательности, из которой получена эта часть. Такая часть может быть получена из центральной или N-терминальной или С-терминальной частей последовательности. Предпочтительно упомянутую часть получают из N-терминальной части, например, из первых 50, 100 или 150 остатков полипептида. В альтернативном варианте предпочтительными являются части, полученные из С-терминальной части, например, из последних 50, 100 или 150 остатков полипептида. Особенно предпочтительные аспекты включают отсечение полипептидов, например, для удаления сигнального пептида или части, отсутствующей в вариантах, встречающихся в природе. Предпочтительное отсечение проводят в N-терминальной части, и длина отсечения составляет от 1 до 50, например, от 1 до 10, 20, 30 или 40, или от 5 до 40, например, от 10 до 35 остатков.
Предпочтительно последовательность по меньшей мере на 95, 96, 97, 98 или 99% идентична последовательности, с которой ее сравнивают.
Идентичность последовательности может быть определена, например, с помощью банка данных SWISS-PROT белковых последовательностей с использованием программного обеспечения FASTA pep-cmp с вариабельным PAN-факгором (PAMfactor), штрафом за создание пропуска в последовательности, установленным на значении 12,0, штрафом за продление пропуска в последовательности, установленным на значении 4,0, и с окном в 2 аминокислоты. Предпочтительно сравнение выполняют по всей длине последовательности, но, тем не менее, окно сравнения может быть меньше, например, составлять менее 200, 100 или 50 последовательных аминокислот.
Предпочтительно полипептиды, связанные идентичностью последовательности, функционально эквивалентны полипептидам, представленным в перечисленных ниже Последовательностях No.Функционально эквивалентные полипептиды могут принимать форму производных, описанную ниже. Соответственно, полипептиды, имеющие последовательности, приведенные в последовательностях No., могут быть модифицированы без изменения последовательности полипептида, как описано ниже.
Кроме того, рассматриваемые в настоящем описании "части" могут быть функционально эквивалентными. Предпочтительно эти части удовлетворяют рассмотренным в настоящем описании условиям идентичности (в отношении сравнимого участка).
Согласно настоящему изобретению, для достижения "функциональной эквивалентности" полипептид может проявлять несколько пониженную эффективность при выполнении косметической функции по сравнению с исходной молекулой (т.е. молекулой, из которой он был получен, например, замещением аминокислоты), но предпочтительно он имеет равную или более высокую эффективность. Таким образом, функциональная эквивалентность относится к полипептиду, эффективно улучшающему косметическое состояние кожных покровов, как описано ниже в настоящем описании. Это может быть определено по результатам качественного или количественного сравнения воздействия производного полипептида и воздействия полипептида, из которого он был получен, например, с помощью анализов, проводимых in vivo, описанных в Примерах. Если возможно получение количественных результатов, то производное должно обладать эффективностью, составляющей по меньшей мере 30, 50, 70 или 90% от эффективности исходного полипептида. В альтернативном варианте может быть выполнено испытание in vitro, например, с помощью анализа ингибирования высвобождения ММР в клеточных культурах in vitro.
Функционально эквивалентные белки, родственные или полученные из встречающегося в природе белка, могут быть получены модификацией встречающейся в природе последовательности аминокислот с помощью единичного или множественного замещения аминокислот, их добавления и/или делеции (при условии, что они удовлетворяют описанным выше требованиям идентичности последовательности), при которых не происходит нарушения функционирования молекулы. Предпочтительно при таких модификациях природная последовательность имеет менее 20 замещений, добавлений или делеции, например, менее 10, 5, 4, 3, 2 или 1. Получаемые белки называют "молекулами функционально эквивалентных нуклеиновых кислот", которые получены соответствующим замещением, добавлением и/или делецией одного или более оснований.
Предпочтительные функциональные эквиваленты представляют собой варианты "добавления", в которых получают белки или полипептиды со слиянием (гибридизацией) по терминальному амино- и/или карбокси-участку, содержащие дополнительный белок или полипептид, присоединенный к исходному полипептиду.
Особенно предпочтительными функционально эквивалентными вариантами являются натуральные биологические вариации, в частности аллельные варианты или географические внутривидовые вариации, или в альтернативном варианте в различных родах семейства Salmonidae, в частности, подсемейств Salrno и Oncorhynchus, и производные, полученные известными способами. Особенно предпочтительные виды семейства Salmonidae включают виды лосось атлантический (Saimo salar) и лосось тихоокеанский (Oncorhynchus masou).
Рассмотренные выше полипептиды включают полипептиды, модифицированные без нарушения последовательности полипептида, например, с помощью химической модификации, включающей дегликозилирование или гликозилирование. Такие полипептиды могут быть получены после выделения полипептида и проведения его модификации без нарушения функциональности, например, с помощью гликозилирования, метилирования и т.д. определенных остатков.
Полипептиды, подходящие для осуществления изобретения или в композициях согласно изобретению, также могут иметь форму пептидомиметиков, которые могут рассматриваться как производные, в которых функциональные признаки полипептида остаются, но существуют в контексте другой, например, непептидной структуры. Подобные пептидомиметики были с успехом получены и используются в других, в частности, медицинских, областях.
Пептидомиметики, в частности, непептидные молекулы могут быть получены различными способами, которые включают дизайн молекул на основе конформационных признаков, массовое исследование, создание направленных библиотек и классическую медицинскую химию. Для этих целей возможно использование не только олигомеров неприродных аминокислот или других органических строительных блоков, но также применение углеводов, гетероциклических или макроциклических соединений или любых органических молекул, которые содержат структурные элементы и имеют конформации, обеспечивающие наличие электростатической поверхности молекулы, которая имитирует свойства трехмерной конформации пептида, в соответствии со способами, известными в данной области техники.
Таким образом, пептидомиметики могут иметь лишь небольшое сходство с пептидной основной цепью или вовсе не иметь сходства с ней. Пептидомиметики могут включать полностью синтетическую непептидную форму (например, полученную на основе углеводной основной цепи с соответствующими заместителями) или могут сохранять один или более элементов пептида, на основе которого они получены, например, путем образования производных одной или более аминокислот или заменой одной или более аминокислот альтернативными непептидными компонентами. Пептидоподобные темплеты включают псевдопептиды и циклические пептиды. Структурные элементы, которые, как полагают, могут ухудшать функцию пептида, могут быть уменьшены, так чтобы они сохраняли лишь скелетную функцию, или могут быть уделены, если это целесообразно.
Если пептидомиметики сохраняют один или более элементов пептида, т.е. более одной аминокислоты, то такие аминокислоты могут быть замещены своими нестандартными или структурными аналогами. Из аминокислот, остающихся в последовательностях, также могут быть образованы производные, или они могут быть модифицированы (например, помечены или подвергнуты гликозилированию или метилированию), при условии, что полипептид сохраняет функциональные свойства согласно изобретению. Пептидомиметики рассматриваются как вещества, которые "могут быть образованы из" определенной полипептидной последовательности. Это означает, что пептидомиметик создан с использованием определенной полипептидной последовательности в качестве модели, то есть он сохраняет структурные признаки пептида, необходимые для его функционирования. Это могут быть конкретные боковые цепи полипептида или потенциал водородных связей структуры. Эти признаки могут обеспечиваться непептидными компонентами или одним или более аминокислотными остатками, или связи, соединяющие эти аминокислотные остатки полипептида, могут быть модифицированы с целью улучшения определенных функций полипептида, таких как стабильность или стойкость к воздействию протеаз, при сохранении структурных признаков полипептида, необходимых для его функционирования.
Примеры нестандартных аминокислот или структурных аналогов аминокислот, которые могут быть применены, включают D аминокислоты, амидные изостерные аналоги (например, N-метиламид, ретро-инвертированный (retro-inverse) амид, тиоамид, сложный тиоэфир, фосфонат, кетометилен, гидроксиметилен, фторвинил, (Е)-винил, метиленамино, метилентио или алкан), L-N-метиламинокислоты, D-α-метиламинокислоты, D-N-метиламинокислоты. Примеры нетрадиционных аминокислот перечислены в Таблице 1.
Нестандартные аминокислоты, которые могут быть использованы, включают конформационно затрудненные аналоги, такие как, например, Tic (замещающий F), Aib (замещающий А) или пипеколиновую кислоту (замещающую Pro).
Рассмотренные выше полипептиды также включают производные, которые были модифицированы, например, для облегчения их использования в косметических целях (рассматриваемых в настоящем описании), например, посредством добавления направляющих или функциональных групп, например, для повышения липофильности, улучшения клеточного транспорта, растворимости и/или стабильности. Таким образом, к упомянутым выше молекулам полипептидов или нуклеиновых кислот могут быть присоединены олигосахариды, жирные кислоты, жирные спирты, аминокислоты, пептиды или полипептиды.
Полипептиды также включают производные в форме "пролекарств" или "пропептидов", в которых добавочный компонент может быть отщеплен после введения в организм, например, за счет отщепления заместителя, добавляемого посредством этерификации, который может быть отщеплен под действием эстераз. Такие пролекарства включают природные предшественники встречающихся в природе белков, которые расщепляются, например, в результате протеолиза, образуя целевой полипептид. Такие предшественники могут быть неактивны в виде предшественника, но могут быть активированы в результате протеолитического расщепления. Описанные выше модифицированные полипептиды могут быть подвергнуты испытаниям для определения сохранения ими функциональной активности по сравнению с немодифицированной молекулой, в которых определяют, имеет ли полученное соединение идентичное или аналогичное медицинское действие.
Рассматриваемые в настоящем описании полипептиды, используемые в композициях согласно изобретению и применяемые согласно изобретению, получают или производят из встречающихся в природе источников.
Полипептиды удобно выделять в соответствии с протоколами, описанными в Примерах. Способы и продукты, получаемые этими способами, составляют дополнительные аспекты изобретения.
Таким образом, дополнительный аспект настоящего изобретения относится к способу (i) выделения полипептида или (ii) получения косметической композиции, рассматриваемой в настоящем описании, из среды, получаемой после выклева Salmonidae (например, среды, получаемой после выклева лосося), который включает по меньшей мере следующие этапы:
a) суспендирование икры Salmonidae в минимальном объеме воды (например, эквивалентном объему икры или менее);
b) инициирование синхронизированного, быстрого выклева икры (предпочтительно так, чтобы в течение менее 2 часов завершался выклев более 95% эмбрионов);
c) необязательно фильтрование икорной массы после выклева с целью получения среды, получаемой после выкпева; и
d) фильтрование среды, получаемой после выклева, с целью получения полипептида и/или композиции.
Необязательно, перед использованием в способах и применении согласно изобретению продукт, полученный или получаемый при проведении рассмотренного выше способа, может быть разбавлен или сконцентрирован до соответствующей концентрации.
В первом примере осуществления этап фильтрования среды, получаемой после выклева, может включать множество этапов, включающих:
(i) фильтрование среды, получаемой после выклева, с помощью фильтра, размер пор которого составляет по меньшей мере 5 мкм, предпочтительнее от 5 до 15 мкм, и особенно предпочтительно с размером пор, составляющим 7 мкм, и сбор фильтрата;
(ii) фильтрование фильтрата, полученного при проведении этапа (i), с помощью фильтра, размер пор которого составляет от 0,30 до 0,60 мкм, предпочтительно с размером пор от 0,35 до 0,55, более предпочтительно от 0,40 до 0,50 мкм, наиболее предпочтительно 0,45 мкм, и сбор фильтрата;
(iii) замену воды в фильтрате, полученном при проведении этапа (ii), фармацевтически приемлемым буфером;
(iv) фильтрование раствора, полученного при проведении этапа (iii), с помощью фильтра, имеющего эксклюзионный размер, составляющий по меньшей мере 80 кДа, предпочтительно от 80 до 120 кДа, наиболее предпочтительно имеющего эксклюзионный размер, составляющий 100 кДа, и сбор фильтрата; и
(v) фильтрование фильтрата, полученного в этапе (iv), с помощью фильтра, размер пор которого составляет от 0,15 до 0,30 мкм, предпочтительно с размером пор, составляющим 0,22 мкм, и сбор фильтрата, причем полученный фильтрат составляет композицию, содержащую целевой полипептид. Продукт, полученный этим способом, представляет собой дополнительный аспект изобретения.
В альтернативном варианте, во втором примере осуществления этап фильтрования среды, получаемой после выклева, может включать множество этапов, включающих:
(i) фильтрование среды, получаемой после выклева, с помощью фильтра, размер пор которого составляет по меньшей мере 5 мкм, предпочтительно от 5 до 15 мкм, и более предпочтительно с размером пор, составляющим 7 мкм, и сбор фильтрата;
(ii) обработку фильтрата, полученного при проведении этапа (i), с помощью ионообменной хроматографии, и сбор элюата;
(iii) замену воды в элюате, полученном при проведении этапа (ii), фармацевтически приемлемым буфером; и
(iv) фильтрование раствора, полученного при проведении этапа (iii), с помощью фильтра, размер пор которого составляет от 0,15 до 0,30 мкм, предпочтительно с размером пор, составляющим 0,22 мкм, и сбор фильтрата, причем полученный фильтрат составляет композицию, содержащую целевой полипептид или его часть. Продукт, полученный этим способом, представляет собой дополнительный аспект изобретения.
В некоторых примерах осуществления может быть предпочтительно вводить фильтрат, полученный при проведении этапа (i), в дополнительный этап фильтрования с помощью фильтра, размер пор которого меньше размера пор фильтра, применяемого в первом этапе фильтрования. Это может предотвратить агломерацию материала, полученного из среды после выклева, в ионообменной колонке (что приводит к замедлению течения жидкости через ионообменную колонку). Таким образом, этап фильтрования среды, получаемой после выклева, может включать следующий необязательный этап:
(i′) фильтрование фильтрата, полученного в этапе (i), с помощью фильтра, размер пор которого составляет от 0,30 до 0,60 мкм, предпочтительно с размером пор от 0,35 до 0,55, более предпочтительно от 0,40 до 0,50 мкм, наиболее предпочтительно 0,45 мкм, и сбор фильтрата.
Предпочтительно необязательный этап фильтрования проводят до этапа проведения ионообменной хроматографии фильтрата, полученного в этапе (i). Таким образом, фильтрат, подвергаемый ионообменной хроматографии, может быть получен при проведении этапа (i) или этапа (i′).
В одном из примеров осуществления этап (ii) включает:
(a) загрузку фильтрата (полученного в этапе (i) или этапе (i′)) в ионообменную колонку, например, колонку, содержащую ДЭАЭ (диэтиламиноэтил);
(b) промывку колонки подходящим буфером, например, промывным раствором, содержащим 20 мМ Tris-HCl, и имеющим рН 8.5;
(c) элюирование полипептида из колонки с помощью буфера или растворителя элюирования, например, промывного раствора, дополнительно содержащего соль, например, 50 мМ NaCl; и
(d) сбор элюата, полученного при проведении этапа (с).
Таким образом, общий способ фильтрования среды, получаемой после выклева, может включать этапы (i) из описанных выше способов; этап (ii) из описанного выше первого способа с использованием фильтра, размер пор которого составляет от 0,30 до 0,60 мкм, и/или этап (ii) из описанного выше второго способа с применением ионообменной хроматографии; этап (iii) из описанных выше способов; необязательный этап (iv) из описанного выше первого способа с использованием фильтра, имеющего эксклюзионный размер, составляющий по меньшей мере 80 кДа, и этап (v) из описанного выше первого способа (эквивалентный этапу (iv) описанного выше второго способа) с использованием фильтра, размер пор которого составляет от 0,15 до 0,30 мкм.
Несмотря на то, что сам фильтрат может представлять собой косметическую композицию, продукт (фильтрат этапа (v) первого примера осуществления или этапа (iv) второго примера осуществления), полученный или получаемый описанными выше способами, необязательно может быть разбавлен (или сконцентрирован) до соответствующей концентрации перед использованием в способах и в целях изобретения. Таким образом, способы могут включать дополнительный этап разбавления (или концентрирования) композиции. Предпочтительно коэффициент разбавления (или концентрации) фильтрата может составлять по меньшей мере 1,5, 2, 3, 4, 5, 10, 15, 20, 50, 100, 1000, 5000 или 10000.
К продукту, полученному или получаемому описанными выше способами, необязательно могут быть добавлены один или более фармацевтически приемлемых эксципиентов и/или разбавителей. Таким образом, способы могут включать дополнительный этап добавления к композиции одного или более фармацевтически приемлемых эксципиентов и/или разбавителей или смешивания композиции с одним или несколькими фармацевтически приемлемыми эксципиентами и/или разбавителями. Альтернативные или дополнительные этапы способа получения включают изменение или модификацию растворителя, например, изменение рН, ионных концентраций и т.д.
К продукту, полученному или получаемому описанными выше способами, могут быть добавлены другие фармацевтически приемлемые компоненты или ингредиенты. Один или более из других компонентов могут представлять собой активные компоненты, т.е. компоненты, воздействующие на кожу, которые также предпочтительно улучшают эстетичность внешнего вида кожи или улучшают косметическое состояние кожных покровов, например, согласно косметическим указаниям, рассматриваемым в настоящем описании. Таким образом, в альтернативном варианте или дополнительно способы могут включать дополнительный этап добавления к композиции одного или более фармацевтически приемлемых активных компонентов или смешивание композиции с одним или более фармацевтически приемлемыми активными компонентами. Фармацевтически приемлемые активные компоненты могут включать минералы, витамины, ферменты, белки, пептиды, аминокислоты, липиды, антиоксиданты, полисахариды, вещества, подходящие в качестве фильтров солнечного излучения, химические эксфолианты, экстракты и их смеси, более подробно описанные ниже.
Выделенный полипептид и/или косметическая композиция, полученная или получаемая описанными выше способами, подходит для использования в способах согласно изобретению, рассмотренных в настоящем описании. В частности, косметическую композицию применяют с целью улучшения косметического состояния кожных покровов млекопитающего.
Этап проведения ионообменной хроматографии фильтрата может быть выполнен любым подходящим способом, который позволяет получить фильтрат, обогащенный полипептидами согласно изобретению (включая их части, рассмотренные выше), по сравнению с содержанием по меньшей мере одного из других полипептидов, находящихся в экстракте среды, получаемой после выклева, перед ее очисткой (т.е. перед проведением ионообменной хроматографии). Например, в результате ионообменной хроматографии может быть получен элюат, обогащенный полипептидами согласно изобретению на по меньшей мере 5% по сравнению с по меньшей мере одним из других полипептидов, предпочтительно всеми другими полипептидами, находящимися в экстракте среды, получаемой после выклева, перед проведением этого этапа очистки. Другими полипептидами могут считаться полипептиды, не соответствующие структурным и/или функциональным определениям рассмотренного выше полипептида, подходящего для использования в способах согласно изобретению (т.е. лейколектина). Предпочтительно в этом этапе обогащение полипептидами составляет по меньшей мере 10, 20, 30, 40 или 50%. Особенно предпочтительная степень чистоты полипептида после очистки составляет более 50 или 60%, например, более 70, 80 или 90%, предпочтительно более 95 или 99% чистоты по сравнению с по меньшей мере одним из других полипептидов, находящихся до очистки в экстракте среды, получаемой после выклева. Таким образом, элюат может содержать только следовые количества других полипептидов, присутствующих в среде, получаемой после выклева, перед проведением ионообменной хроматографии, например, менее 0,1%, 0,01%, 0,001%, 0,0001% или 0,00001% мас.
Ионообменная хроматография хорошо известна в данной области техники, и подходящие ионообменные колонки коммерчески доступны. В одном из примеров осуществления ионообменная колонка представляет собой колонку, содержащую ДЭАЭ (диэтиламиноэтил), т.е. колонку с инертной матрицей, например, из целлюлозы, оксида кремния, сефарозы и т.д., на которой иммобилизован ДЭАЭ. Однако для применения в описанных выше способах могут быть подходящими другие ионообменные колонки.
Этап загрузки профильтрованной среды, получаемой после выклева, в ионообменную колонку включает нанесение среды, получаемой после выклева, на ионообменную колонку, подготовленную или активированную таким образом, что с материалом колонки могут связываться полипептиды согласно изобретению. Подготовка или активация ионообменной колонки обычно включает промывку колонки буфером, например, промывным буфером, описанным ниже. Этап предварительной промывки позволяет получать ионообменную колонку, в которой в оптимальных условиях, например, при определенном рН, происходит связывание полипептидов с материалом колонки. Таким образом, этап загрузки можно рассматривать как этап связывания полипептидов согласно изобретению с ионообменной колонкой.
После этапа загрузки профильтрованной среды, получаемой после выклева, в ионообменную колонку в соответствии со стандартными протоколами, колонка может быть промыта подходящим буфером для удаления нежелательных компонентов, присутствующих в среде, получаемой после выклева, которые не связаны с материалом колонки. Промывка включает нанесение объема промывного буфера на колонку, и обычно объем промывного буфера, наносимого на колонку, по меньшей мере равен объему ионообменной колонки и может превышать его, например, по меньшей мере в 1,5, 2, 3, 4 или 5 раз. В некоторых примерах осуществления этап промывки может быть повторен, например, 2, 3, 4, 5 или более раз. Для осуществления способа согласно изобретению может быть использован любой подходящий промывной буфер. Подходящим промывным буфером является буфер, который не оказывает значительного негативного влияния на взаимодействие между целевыми полипептидами и ионообменной колонкой, так что в каждом этапе промывки из ионообменной колонки вымывается менее 10%, например, менее 5, 4, 3, 2 или 1% полипептидов согласно изобретению. В предпочтительном примере осуществления промывной буфер представляет собой раствор Tris-HCl, имеющий концентрацию от 10 до 100 мМ, предпочтительно от 10 до 50 мМ, например, от 20 до 30 мМ, и рН в диапазоне от 6 до 10, предпочтительно от 7 до 9, например, 8.5. Промывные воды, получаемые в этапе промывки, могут быть собраны, например, для определения необходимости проведения дополнительных этапов промывки (например, для проведения определений полипептидов, полисахаридов, солей и т.д., которые представляют собой нежелательные компоненты, присутствующие в среде, получаемой после выклева, до очистки) и/или отброшены.
Этап элюирования полипептида из ионообменной колонки может быть проведен любым подходящим образом и обычно включает промывку колонки растворителем или раствором, способствующим нарушению взаимодействия между целевым полипептидом и материалом ионообменной колонки. Обычно объем буфера или растворителя элюирования, вводимый в колонку, по меньшей мере равен объему ионообменной колонки и может превышать последний, например, в по меньшей мере 1,5, 2, 3, 4 или 5 раз. В некоторых примерах осуществления этап элюирования может быть повторен, например, 2, 3, 4, 5 или более раз. Элюат (элюат этапа элюирования) может быть собран в каждом этапе элюирования, и один или более элюатов могут быть объединены перед проведением этапа замены воды в элюате. Подходящий буфер или растворитель элюирования представляет собой среду, которая нарушает взаимодействие между полипептидами согласно изобретению и материалом ионообменной колонки, так что в каждом этапе элюирования по меньшей мере 70%, предпочтительно по меньшей мере 75, 80, 85, 90, 95 или 99%, полипептидов согласно изобретению, связанных с колонкой, вымываются из колонки.
В одном из предпочтительных примеров осуществления буфер элюирования совпадает с промывным буфером и также содержит вещество, способное нарушать взаимодействие между полипептидами и ионообменной колонкой, например, соль. Таким образом, в некоторых примерах осуществления буфер элюирования представляет собой раствор Tris-HCl, имеющий концентрацию от 10 до 100 мМ, предпочтительно от 10 до 50 мМ, например, от 20 до 30 мМ, и рН в диапазоне от 6 до 10, предпочтительно от 7 до 9, например, 8.5, также содержащий соль, например, NaCl, KCl и т.д. в концентрации от 10 до 500 мМ, предпочтительно от 20 до 400 мМ, от 30 до 300 мМ, от 40 до 200 мМ или от 50 до 100 мМ, например 50 мМ NaCl.
Этап замены воды в фильтрате или элюате может быть выполнен любым подходящим способом, известным в данной области техники, например, диафильтрацией или диализом. В особенно предпочтительном примере осуществления этот этап выполняют диафильтрацией через фильтр, имеющий эксклюзионный размер, составляющий менее 15 кДа, предпочтительно 10 кДа или менее, например, 9, 8, 7, 6, 5, 4, 3 кДа или менее.
В диафильтрации применяют ультрафильтрационные мембраны для удаления из раствора, например, солей или других ненужных или нежелательных растворенных микропримесей или, в случае обмена растворителя, например, буфера раствора. Небольшие молекулы отделяют от раствора, оставляя более крупные молекулы в ретентате (материале, который не проходит через фильтр). Растворенные микропримеси и растворители, например, вода, обычно легко вымываются через мембрану. Обычно промывка приблизительно 3 объемами растворителя диафильтрации удаляет 95% растворенных микропримесей. Таким образом, фильтрат, полученный при проведении вышеописанного этапа (ii), первого способа, или элюат, полученный при проведении этапа (ii) второго способа, сначала подвергают диафильтрации, что приводит к концентрированию ретентата в результате прохождения части раствора (который содержит растворимые загрязнения/нежелательную фракцию среды, получаемой после выклева) через мембрану. Затем ретентат разбавляют фармацевтически приемлемым буфером, например, раствором, содержащим 0,5 мМ фосфата натрия и 1 мМ хлорида натрия, солевым раствором, содержащим фосфатный буфер, и т.д. При необходимости разбавленный ретентат может быть многократно подвергнут диафильтрации.
Синхронизация выклева может быть осуществлена любым подходящим способом, известным в данной области техники. Например, развитие икры может быть синхронизовано с помощью манипуляций с освещением, например, переносом икры со света (который замедляет выклев) в условия, где отсутствует освещение. Для синхронизации выклева также могут быть использованы манипуляции с температурой раствора, деоксигенация (Oppen-Berntsen et al. 1990, Aquaculture, 86, стр.417-430) и стимуляция электричеством. Как было отмечено выше, минимальный объем воды может быть равен объему икры или менее; например, на каждый 1 мл икры может быть взято ≤1, 0,75, 0,5, 0,25 мл суспендирующей жидкости, например, от 0,5 до 1 мл.
Таким образом, изобретение дополнительно включает применение полипептидов и/или композиций, полученных описанными выше способами.
Если рассматриваемый в настоящем описании полипептид получен из лейкоцитов, то он получается в немодифицированной форме. Полипептиды, выделенные из среды, получаемой после выклева Salmonidae, например, лосося, модифицируют (подвергая гликозилированию и/или фосфорилированию), но обе формы имеют равную эффективность при использовании в способах, рассматриваемых в настоящем описании.
Полипептиды, рассматриваемые в настоящем описании, предпочтительно по существу не содержат загрязняющих компонентов, поступающих из источника материала или материалов, используемых в процедуре выделения или в процессе их получения. Особенно предпочтительно, если при очистке соединения достигается степень чистоты, составляющая более 50 или 60%, например, более 70, 80 или 90%, предпочтительно более 95 или 99% чистоты, определенной в массовых процентах (масса сухого вещества). Эти уровни чистоты относятся к конкретной целевой молекуле, но также включают продукты ее разложения. В тех случаях, в которых это возможно, могут быть использованы обогащенные препараты, имеющие более низкие уровни чистоты, например, содержащие более 1, 2, 5 или 10% целевой молекулы, например, более 20, 30 или 40% чистоты, определенной в массовых процентах (масса сухого вещества). Описанный выше способ "выделения" полипептида относится к очистке до значений чистоты, указанных выше. Очистка рассматриваемых в настоящем описании полипептидов может быть произведена, например, с помощью хроматографии (например, жидкостной хроматографии высокого давления (ЖХВД), гель-проникающей, ионообменной, аффинной хроматографии, гидрофобной хроматографии, хроматографии с обращенной фазой) или капиллярного электрофореза.
Полипептиды или композиции, рассматриваемые в настоящем описании, могут быть применены in vitro, например, добавлены в культуры клеток или органов для изменения свойств этих клеток, например, замедления высвобождения ММР с целью изменения структуры и/или состава белков внеклеточной матрицы.
Однако полипептиды и композиции предпочтительно предназначены для применения in vivo, как рассмотрено в настоящем описании.
Термин "фармацевтически приемлемый" или "физиологически приемлемый" означает, что ингредиент должен быть подходящим для применения в косметических целях и в косметических композициях. Ингредиент также должен быть совместим с другими ингредиентами композиции, а также физиологически приемлем для реципиента.
Активный ингредиент для введения в организм может быть соответствующим образом модифицирован для его включения в косметическую композицию. Например, соединения, используемые согласно изобретению, могут быть стабилизированы для придания им устойчивости к разложению посредством получения описанных выше производных.
Активный ингредиент также может быть стабилизирован в композициях, например, посредством применения соответствующих добавок, например, солей или неэлектролитов, ацетата, SDS (додецилсульфата натрия; англ. sodium dodecyi sulphate), EDTA (этилендиаминтетрауксусной кислоты, ЭТДУ; англ. ethylenediaminotetraacetic acid), цитратных или ацетатных буферов, маннита, глицина, HSA (гексансульфоновой кислоты; hexane sulfonic acid) или полисорбата.
Полипептид или композиция, рассматриваемые в настоящем описании, могут быть включены в композиции в виде единственного активного ингредиента, или они могут быть смешаны с другими ингредиентами, в частности, с другими активными ингредиентами, например, для усиления косметического эффекта (обсужденного выше) или для придания композиции свойств, делающие ее более привлекательной для потребителя.
Как было отмечено выше, полипептиды и композиции, рассматриваемые в настоящем описании, обладают свойствами, оказывающими улучшающее действие на косметическое состояние кожи, в частности, на состарившуюся кожу, например, на кожу, состарившуюся в результате фотостарения, или кожу, зарубцевавшуюся, например, в результате повреждения по меньшей мере одного из слоев кожных покровов, например, в результате образования раны или поверхностных дефектов или ссадин, полученных в результате небольших повреждений эпидермиса и/или дермы.
Композиция, содержащая один или более полипептидов, рассматриваемых в настоящем описании, также может содержать загрязнения, например, после выделения одного или более полипептидов согласно изобретению из природных источников. Содержание одного или более полипептидов согласно изобретению в рассматриваемых в настоящем описании композициях может составлять от 0,0001 до 50% мас. от массы косметической композиции, полученной согласно описанному выше способу. Предпочтительно содержание целевого полипептида (полипептидов) в композиции, полученной согласно описанному выше способу или как указано ниже в настоящем описании, например, после дополнительного разбавления, составляет от 0,01 до 40% мас. от массы косметической композиции. Например, содержание полипептида (полипептидов) может составлять от 0,0001 до 5%, от 0,0001 до 3%, 0,0001 до 2%, от 0,0001 до 1%, от 0,0001 до 0,5%, от 0,0001 до 0,1% мас. от массы косметической композиции.
В косметических композициях может быть определена доля полипептида (полипептидов) или частей полипептида (полипептидов) относительно других растворенных в композиции веществ (например, солей), т.е. за вычетом растворителей, например, воды. Так, содержание полипептида (полипептидов) или частей полипептида (полипептидов) может составлять от 10 до 100% мас. от массы сухого вещества композиции. В некоторых примерах осуществления полипептиды или части полипептидов в комбинации могут составлять от 10 до 90% масс.от массы сухого вещества композиции, например, от 10 до 80%, от 15 до 70%, от 20 до 60%, от 30 до 50% мас. от массы сухого вещества композиции. В других примерах осуществления полипептиды или части полипептидов в комбинации могут составлять от 10 до 40%, от 20 до 39%, от 25 до 38%, от 30 до 37% и т.д. мас. от массы сухого вещества композиции. Как было отмечено в настоящем описании, для применения согласно изобретению композиция может быть разбавлена.
Несмотря на то, что изобретение относится к способам улучшения косметического состояния кожных покровов, оно также может относиться к лечению нарушения, аномалии или состояния, но в любом случае, лечение предполагает косметическую терапию.
Согласно настоящему изобретению, термин "косметический" относится к терапии, которая не излечивает, не лечит или не предотвращает заболевание или нарушение, но применяется в качестве продукта для ухода за кожей или для изменения или улучшения внешнего вида кожи, например, цвета, структуры или содержания влаги в кожных покровах.
В основе терапии, рассматриваемой в настоящем описании, лежит антивозрастное, устраняющее рубцы и поверхностные дефекты/ссадины воздействие на кожу полипептидов согласно изобретению. Это воздействие описано в приведенных ниже Примерах.
Таким образом, изобретение относится к терапии, основанной антивозрастном, устраняющем рубцы и поверхностные дефекты/ссадины, воздействии на кожу полипептидов, рассматриваемых в настоящем описании.
Таким образом, изобретение относится к косметическому способу улучшения внешнего вида кожных покровов млекопитающего, в котором в организм млекопитающего вводят полипептид или косметическую композицию, рассмотренные выше в настоящем описании.
В особенно предпочтительном примере осуществления кожа представляет собой состарившуюся, имеющую поверхностные дефекты или зарубцевавшуюся кожу.
Под "состарившейся кожей" понимают кожу, имеющую один или более признаков или симптомов старения, т.е. имеющую морщины, мимические морщинки, гиперпигментацию, вялость (отвисание), сухость, шелушение, или образующуюся в результате потери влаги испарением через кожные покровы (TEWL). В частности, "состарившуюся кожу" определяют в сравнении с нормальной обычной кожей, т.е. здоровой, содержащей достаточное количество воды, нормально пигментированной и не состарившейся кожей. В этом отношении старение кожи не обязательно связано с возрастом субъекта, поскольку старение может быть преждевременным, например, в результате хронического воздействия солнечного света (фотоповреждения). Таким образом, относительные параметры "нормальной обычной кожи" могут быть определены как средние показатели перечисленных выше признаков старения у множества субъектов возраста, совпадающего или близкого возрасту рассматриваемого субъекта, например, субъектов, которые не подвергались хроническому воздействию солнечного света. В альтернативном варианте относительные параметры "нормальной обычной кожи" могут представлять собой показатели субъектов, более молодых, чем рассматриваемый субъект. Другими словами, полипептиды, их применение и композиции, рассматриваемые в настоящем описании, могут быть использованы для восстановления молодого внешнего вида кожи, сравнимой с кожей субъекта, отличающегося от рассматриваемого субъекта более молодым возрастом.
Таким образом, изобретение относится к косметическому способу терапии дерматогелиоза у млекопитающего, в котором в организм млекопитающего вводят полипептид или косметическую композицию, рассмотренную выше в настоящем описании, и предпочтительно полипептид или композицию наносят топическим (местным) образом.
В альтернативном варианте изобретение относится к полипептиду или косметической композиции, рассмотренным выше в настоящем описании, которые применяют в терапии дерматогелиоза у млекопитающего, предпочтительно терапии, включающей нанесение полипептида или композиции на кожу млекопитающего. В конкретном примере осуществления полипептид или композиция предназначены для местного применения.
В особенно предпочтительном примере осуществления улучшение косметического состояния кожных покровов (например, состарившейся или фотоповрежденной кожи) включает улучшение косметического состояния посредством уменьшения или предотвращения появления или распространения морщин, мимических морщинок, гиперпигментации, вялости, сухости кожи, шелушения и/или потери влаги испарением через кожные покровы. Может быть улучшен один или более из указанных параметров. Предпочтительно снижают интенсивность мимических морщинок и/или морщин.
Улучшение косметического состояния посредством уменьшения или предотвращения появления или распространения признаков или симптомов, например, старения кожи или дерматогелиоза, может означать, что наблюдается снижение количества и/или интенсивности признака или симптома. Например, может быть снижено количество мимических морщинок и морщин и/или их размер, например, может быть снижена или уменьшена глубина морщин или мимических морщинок. Кроме того, уменьшение или предотвращение может включать остановку или снижение скорости появления новых признаков или симптомов.
Согласно настоящему изобретению, термин "сухость кожи (сухая кожа)" относится к эпидермису, в котором имеется недостаток влаги или кожного сала, что часто характеризуется появлением множества мимических морщинок, шелушением и ощущением зуда и/или жжения. Сухость кожи может проявляться как состояние самой кожи (например, в результате возрастных изменений) или может быть симптомом нарушения или повреждения кожи, например, в результате обгорания на солнце.
В этом отношении снижение сухости кожи, уменьшение шелушения, мимических морщинок или потери влаги испарением через кожу может быть обусловлено увлажняющим действием полипептида и композиции, описанных выше.
Таким образом, изобретение также относится к косметическому или некосметическому способу увлажнения кожи млекопитающего, в котором в организм млекопитающего вводят полипептид или косметическую композицию согласно настоящему изобретению.
В альтернативном варианте настоящее изобретение относится к полипептиду или косметической композиции, рассматриваемым в настоящем описании, применяемым для увлажнения кожи млекопитающего. (В альтернативном варианте соединение или композиция могут быть использованы для получения косметического лекарственного средства, предназначенного для этой цели).
Согласно настоящему изобретению, термин "увлажнение" относится к увлажняющим средствам, которые предотвращают удаление из кожных покровов воды (например, посредством TEWL), а также к увлажняющим средствам (влагоудерживающим средствам), которые при нанесении на кожу притягивают и удерживают воду, и к смягчающим средствам (которые снимают дефектное отшелушивание).
Как было отмечено выше, подобные увлажняющие свойства полезны для улучшения косметического состояния кожных покровов. В особенно предпочтительном примере осуществления кожный покров представляет собой кожу лица, ушей, шеи, рук или скальпа.
"Морщины" представляют собой складки, выступы или борозды в коже. Морщины обычно появляются на коже как результат протекания процессов старения. В этом отношении дерма содержит множество структурных элементов кожи, которые включают коллаген, придающий коже прочность, гликозаминогликаны, придающие коже тургор, и волокна эластина, придающие коже эластичность или упругость.
По мере старения кожи слой дермы истончается, и кожа вырабатывает меньшее количество коллагена. Кроме того, изнашиваются эластичные волокна, обеспечивающие эластичность. Эти изменения в структурах, поддерживающих кожные покровы, вызывают сморщивание и провисание кожи. Эпидермальные выросты в местах соединения дермы и эпидермиса уплощаются, что делает кожу более хрупкой и податливой для смещений. В результате этого процесса из-за уменьшения площади контакта с дермой также снижается количество питательных веществ, поступающих в эпидермис, что также замедляет нормальный процесс восстановления кожи.
С возрастом жировые клетки подкожного слоя уменьшаются. Это приводит к образованию более заметных морщин и отвисания (вялости), поскольку жировые клетки не могут "заполнить" повреждения в других слоях.
Воздействие УФА- и УФВ-излучения, т.е. солнечного света, приводит к более ускоренному разрушению коллагена по сравнению с возрастным старением. Солнечный свет повреждает волокна коллагена и вызывает накопление аномального эластина. Накопление такого образующегося под действием солнечного света эластина приводит к образованию больших количеств матриксных металлопротеиназ (ММР). В нормальном состоянии металлопротеиназы реконструируют поврежденную солнцем кожу за счет генерации и повторного образования коллагена. Однако, этот процесс не всегда проходит гладко, и некоторые металлопротеиназы, напротив, разрушают коллаген. Это приводит к образованию участков из неупорядоченных волокон коллагена, называемых солнечными рубцами. Многократное протекание такого неполного процесса повторного образования/регенерации вызывает появление морщин и вялости кожи.
Однако, как было отмечено выше, было показано, что рассматриваемые в настоящем описании полипептиды замедляют высвобождение ММР и, таким образом, полипептиды и композиции согласно изобретению способствуют уменьшению или предотвращению образования морщин и вялости кожи.
В дополнительном предпочтительном аспекте подвергаемое косметической терапии или предотвращаемое состояние кожи представляет собой пигментацию, ее нарушение или аномалию.
Нарушения пигментации или аномальная пигментация кожи, т.е. гиперпигментация, могут появляться из-за возраста или в результате преждевременного старения, например, в результате воздействия солнечных лучей. Измененная пигментация может быть результатом локального избытка меланоцитов или повышения их активности или под воздействием обоих этих факторов. Нарушения пигментации включают печеночные пятна, солнечные или возрастные пятна (солнечное лентиго) и другие дефекты поверхности, например, веснушки.
"Зарубцевавшаяся кожа" - это кожа функционально и косметически боле низкого качества, чем нормальная неповрежденная кожа. Как было отмечено выше, полагают, что рубцевание происходит из-за иного расположения пучков коллагена, которые образуются в заживающей коже.
Таким образом, один из аспектов настоящего изобретения относится к косметическому способу уменьшения или сведения к минимуму рубцовой ткани или улучшения косметического состояния шрама (рубца) у млекопитающего, согласно которому в организм млекопитающего вводят полипептид или косметическую композицию, рассмотренные выше в настоящем описании, и предпочтительно полипептид или композицию наносят местно на рубцовую ткань.
В альтернативном варианте изобретение относится к полипептиду или косметической композиции, рассмотренным выше в настоящем описании, применяемым для уменьшения или сведения к минимуму рубцовой ткани или улучшения косметического состояния шрама у млекопитающего, и предпочтительно полипептид или композицию наносят на рубцовую ткань такого млекопитающего. В одном из конкретных примеров осуществления полипептид или композиция предназначены для местного применения. Косметическая композиция также может быть использована для терапии поверхностного повреждения кожи.
Процесс заживления кожи, например, ран, включает различные этапы (описанные в патентной публикации WO 2007/059584, содержание которой включено в настоящее описание посредством ссылки), и в результате образуется шрам или рубцовая ткань. Для поверхностных повреждений кожи, т.е. небольших повреждений эпидермиса и/или дермы, вызванных, например, царапинами или ссадинами, особенно важны последние этапы заживления кожных покровов.
Первый этап представляет собой стадию "воспаления" (0-6 суток), которая наступает непосредственно после получения раны, например, кожной раны. Он называется гемостазом, в результате которого происходит сужение сосудов и свертывание крови, опосредуемое фибрином и тромбоцитами, останавливающее кровотечение. Сгусток крови дополнительно служит временной матрицей для подходящих к ране фибробластов и клеток воспаления, а также резервуаром для цитокинов и факторов роста.
После гемостаза в рану поступают клетки воспаления, которые инициируют процесс воспаления (проявляющийся в покраснении, повышении температуры, опухании и боли). Первыми поступающими клетками являются полиморфноядерные клетки (англ. polymorphonuclear cell, сокращенно PMN), которые привлекаются факторами роста и цитокинами, например, тромбоцитным фактором роста (англ. platelet derived growth factor, сокращенно PDGF) и IL-8. IL-8 является основным хемоатрактантом для PMN, и его быстрая и переходная экспрессия необходима для протекания воспалительного процесса. PMN начинают очищать рану, удаляя осколки клеток, чужеродные частицы и бактерии, и остаются в ране в течение относительно небольшого периода времени (1-2 суток). Приблизительно на третьи сутки после повреждения, PMN заменяются моноцитами, которые трансформируются в макрофаги, также очищающие рану. Важную роль в процессе воспаления играют фиброциты, которые специфически вовлечены в выработку коллагена и цитокинов.
Второй этап представляет собой этап "пролиферации" (начинающийся спустя 3 суток - несколько недель после повреждения кожи). Мигрирующие фибробласты образуют постоянную внеклеточную матрицу (англ. extracellular matrix, сокращенно ЕСМ) на основе коллагена, а макрофаги вырабатывают множество факторов роста и цитокинов, которые, в свою очередь, стимулируют выработку факторов роста. Матриксные металлопротеиназы и сериновые протеиназы играют важную роль в регулировании клеточной миграции и реконструкции ЕСМ после повреждения; было показано, что ухудшение реорганизации ЕСМ связано со снижением выработки и активации фибробластной ММР.
Следующим ключевым событием процесса заживления кожи является восстановление эпителия, который в основном начинают мигрирующие кератиноциты. Восстановление эпителия происходит в результате пролиферации кератиноцитов под действием факторов роста и цитокинов при миграции кератиноцитов через грануляционную ткань. Во время миграции эти клетки претерпевают множество фенотипических изменений, экспрессируя белки, связанные с дифференциацией клеточного фенотипа. По мере протекания миграции, кератиноциты приобретают протеолитический фенотип, вырабатывая сериновые протеиназы и ММР. Кератиноциты продолжают мигрировать в пространство раны до завершения процесса, когда митотически активные кератиноциты претерпевают дополнительное фенотипическое изменение, в результате которого происходит дифференциация и стратификация эпителия и повторное образование базальной мембраны, завершающее процесс восстановления эпителия.
Другими ключевыми признаками реконструкции и заживления кожных покровов являются клеточное связывание ЕСМ, разложение ЕСМ под действием протеиназ и общее регулирование этих процессов цитокинами и факторами роста, которые координируют функции клеток, например, миграцию клеток и сокращение раны, посредством взаимодействии клеточного интегрина с ЕСМ. Эти взаимодействия регулируют реорганизацию цитосклета и протекание новых взаимодействий клеточного интегрина с ЕСМ, в то время как протеиназы прекращают существующие взаимодействия интегрина, способствуя протеканию деадгезии тыльных частей клеток и миграции клеток. Сократительная способность клеток в Отсутствии деадгезии тыльных частей приводит к реорганизации дермы, которая была количественно оценена в экспериментах по реорганизации/сокращению коллагеновой матрицы.
Заключительным этапом процесса заживления кожных покровов (и, таким образом, образования рубца) является "созревание" (которое начинается, спустя период времени, составляющий от 4 суток до недель или месяцев после повреждения). Созревание (или реконструкция) может занимать лишь несколько суток или недель, в особенности, для поверхностных повреждений кожи, но завершающий процесс может длиться несколько лет. Во время этой фазы наблюдается сокращение, уменьшение покраснения, уменьшение толщины, уменьшение твердости и повышение прочности кожных покровов. Кожа или рубцовая ткань сокращается под влиянием миофибробластов, выработка коллагена в грануляционной ткани снижается, и уменьшаются кровеносные сосуды. Заживление кожи завершается последующим восстановлением эпителия.
Таким образом, на основании вышеизложенного должно быть понятно, что нанесение полипептида или композиции, рассматриваемых в настоящем описании, на кожу во время заживления кожных покровов, в частности, на этапах пролиферации или созревания, может способствовать уменьшению или сведению к минимуму рубцовой ткани или улучшению косметического состояния шрама. Таким образом, описанные выше продукты могут быть нанесены на участки поврежденной кожи или шрамы, причем шрам (рубец) может рассматриваться как частично или полностью зажившая кожа. В одном из предпочтительных примеров осуществления рассматриваемый в настоящем описании полипептид или композиция предназначены для нанесения на этапе созревания.
В особенно предпочтительном примере осуществления появление рубцовой ткани вызвано акне.
В другом предпочтительном примере осуществления рубцовая ткань представляет собой полосу растяжки или sfriae. Предпочтительно striae выбраны из любого из следующих образований: sfriae atrophicae, striae vergetures, striae distensae, striae cutis distensae, striae gravidarum, lineae atrophicae или linea albicante.
Согласно настоящему изобретению, "улучшение" косметического состояния кожных покровов определяют по сравнению с нормальной обычной кожей, т.е. здоровой, содержащей, достаточное количество воды, нормально пигментированной и не состарившейся кожей. В отношении состарившейся кожи, один или более признаков или симптомов старения могут быть оценены, как описано в Примерах, и произведено сравнение с теми же признаками кожи у хронологически или физиологически более молодых индивидуумов, и предпочтительно улучшение состоит в уменьшении одного или более признаков или симптомов старения.
В отношении зарубцевавшейся кожи или кожи с поверхностными дефектами уменьшение или сведение к минимуму рубцовой ткани или улучшение косметического состояния шрама или поверхностного дефекта означает, что на участке шрама или поверхностного дефекта может наблюдаться снижение интенсивности или размера рубцовой ткани, участка покраснения, пятен кожи или пигментации (гипер- или гипопигментации), которые могут быть обусловлены процессом заживления кожных покровов, и при этом указанные параметры сравнивают с нормальной, не имеющей рубцов кожей. Также может быть определено сопротивление кожных покровов разрыву на и вблизи участка зажившей кожи или рубца, причем повышение сопротивление разрыву указывает на улучшение косметического состояния кожных покровов или уменьшение рубцовой ткани.
В предпочтительном аспекте косметический эффект получают при местном нанесении на кожу.
Используемый в настоящем описании термин "терапия" означает снижение, улучшение или устранение, предпочтительно до достижения нормального состояния, одного или более косметических симптомов или эффектов косметического состояния или нарушения, например, наличия или величины области сухой кожи, наличия или величины области пигментации или рубцевания и т.д., в сравнении с симптомами или эффектами, имеющимися на других частях тела рассматриваемого индивидуума, на которых кожа не имеет названных состояний или нарушений и не подвергается упомянутой терапии, или в сравнении с кожей нормального индивидуума, не подвергающегося названной терапии.
"Предотвращение (профилактика)" или "уменьшение" означает абсолютное предотвращение или уменьшение или снижение степени или отсутствие наступления (например, отсрочку момента наступления) симптома или эффекта. Например, состояние, характеризующееся наличием сухой, аномально пигментированной, морщинистой или зарубцевавшейся кожей, может быть предотвращено при регулярном применении композиций, рассматриваемых в настоящем описании, до наступления подобного состояния.
Предпочтительно терапию проводят с использованием полипептидов, рассматриваемых в настоящем описании. Особенно предпочтительным является применение косметических композиций, содержащих такие полипептиды.
Косметические способы терапевтического лечения или профилактики согласно изобретению могут быть успешно объединены с воздействием одного или более активных ингредиентов, которые способствуют лечению или профилактике нарушений или состояний и/или способствуют, например, увлажнению. Таким образом, рассматриваемые в настоящем описании косметические композиции могут дополнительно содержать один или более таких активных ингредиентов.
Согласно дополнительному аспекту изобретения, предложены продукты, содержащие один или более полипептидов согласно изобретению и необязательно один или более дополнительных активных ингредиентов в виде комбинированного препарата для одновременного, раздельного или последовательного использования в терапии человека или млекопитающего, проводимой согласно настоящему изобретению.
Композиции согласно изобретению могут быть приготовлены традиционными способами с использованием одного или более физиологически приемлемых носителей, эксципиентов и/или разбавителей, в соответствии с методиками, хорошо известными в данной области техники, с использованием легко доступных ингредиентов.
Таким образом, активный ингредиент может быть включен, необязательно вместе с другими активными веществами, в комбинированный препарат, содержащий один или более традиционных носителей, разбавителей и/или эксципиентов, в традиционные галеновы (медицинские) препараты, например, порошки, саше, капсулы, эликсиры, суспензии (в виде инфузионных сред), эмульсии, растворы, сиропы, аэрозоли (в виде твердого вещества или в жидкой среде), мази, стерильные упакованные порошки и подобные им продукты. Композиции могут быть стабилизированы лиофилизацией, суперохлаждением или с помощью фермента пермазайм (Permazyme).
Подходящие эксципиенты, носители или разбавители включают лактозу, декстрозу, сахарозу, сорбит, маннит, крахмалы, аравийскую камедь, фосфат кальция, карбонат кальция, кальций-лактозу, кукурузный крахмал, альгинаты, трагакантовую камедь, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, водный сироп, воду, воду/этанол, воду/гликоль, воду/полиэтилен, гликоль, пропиленгликоль, метилцеллюлозу, метилгидроксибензоаты, пропилгидроксибензоаты, тальк, стеарат магния, минеральное масло или жировые вещества, например, твердый жир или подходящие смеси перечисленных веществ. Также могут быть использованы агенты для получения композиций с замедленным высвобождением, например, карбоксиполиметилен, карбоксиметилцеллюлоза, целлюлоз ацетатфталаты или поливинилацетат.
Композиции могут дополнительно включать скользящие агенты, смачивающие агенты, эмульгаторы, агенты, повышающие вязкость, гранулирующие агенты, вещества для улучшения распадаемости лекарственной формы, связующие агенты, осмотически активные агенты, суспендирующие агенты, консерванты, подсластители, вкусовые добавки, усилители адсорбции (например, поверхностно-проникающие агенты, например, желчные соли, лецитины, поверхностно-активные вещества, жирные кислоты, хелатирующие агенты), окрашивающие в коричневый цвет агенты, органический растворитель, антиоксидант, стабилизирующие агенты, смягчающие средства, кремнийорганический полимер (силикон), альфа-гидроксикислоту, средство, уменьшающее раздражение, антивспениватель, увлажняющий агент, витамин, отдушку, ионные или неионные загустители, поверхностно-активные вещества, наполнители, отшелушивающее вещество, полимер, газ-вытеснитель, подщелачивающий или подкисляющий агент, агент, сообщающий непрозрачность, окрашивающие вещества, жирные соединения и подобные соединения. Некоторые из этих компонентов более подробно описаны ниже.
Другие активные ингредиенты или компоненты косметической композиции могут быть выбраны из любого одного или более следующих веществ: минералов, витаминов, ферментов, белков, пептидов, аминокислот, липидов, полисахаридов, веществ, подходящих в качестве фильтров солнечного излучения, химических эксфолиантов, экстрактов, кондиционеров для кожи, антиоксидантов и смесей таких веществ.
Примеры белков, которые могут быть смешаны с композицией согласно изобретению, включают коллаген и/или его производное (например, его части, рассмотренные выше), белок или пептид, улучшающий рост клеток, гликопротеин 1, гликопротеин 2 и ламинин.
Композиции согласно изобретению могут быть смешаны с ферментами, неограничивающие примеры которых включают один или более фруктовых ферментов (например, бромелайн), супероксиддисмутазу (пероксиддисмутазу), пероксидазу, гиалуронидазу и мукополисахаридазу.
Неограничивающие примеры пептидов включают одно или более из следующих веществ: D,L-карнозин, D-карнозин, L-карнозин, ансерин и Матриксил (пентапептидное производное).
Неограничивающие примеры аминокислот могут включать одно или более из следующих веществ: L-аланин, L-аргинин, L- аспарагин, L-аспарагиновую кислоту, L-цистеин, L-цистин, глицин, L-глютамин, L-глютаминовую кислоту, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин и L-валин и их производные, включающие не встречающиеся в природе аминокислоты, указанные в Таблице 1. Особенно предпочтительно используемые в качестве антиоксидантов аминокислоты могут быть выбраны из одного или более следующих веществ: глицина, лизина, аргинина, цистеина, цистина, гистидина, тирозина и триптофана.
Косметическая композиция может содержать один или более липидов, которые включают жиры, масла, воски и подобные им вещества. Подходящие полярные масла представляют собой, например, масла, выбранные из группы, включающей лецитины и триглицериды жирных кислот, а именно: сложные эфиры триглицерола и насыщенных и/или ненасыщенных, разветвленных и/или неразветвленных алканкарбоновых кислот с длиной цепи от 8 до 24, в частности от 12 до 18 атомов углерода. Триглицериды жирных кислот могут быть, например, предпочтительно выбраны из группы, включающей синтетические, полусинтетические и натуральные масла, например, оливковое масло, подсолнечное масло, соевое масло, арахисовое масло, рапсовое масло, миндальное масло, пальмовое масло, кокосовое масло, касторовое масло, масло зародышей пшеницы, масло из виноградных косточек, репейное масло, масло энотеры; масло австралийского ореха и подобные масла.
В альтернативном варианте или дополнительно масло может быть выбрано из летучих масел, нелетучих масел или их смесей. Нелетучие масла включают масла, отвечающие по меньшей мере одному из следующих требований: (а) давление паров масла составляет не более 0,2 мм рт.ст. (что приблизительно составляет 26,7 Па) при 25°С и давлении, равном одной атмосфере (приблизительно 1,013·105 Па); (b) температура кипения масла при давлении, равном одной атмосфере, составляет по меньшей мере 300°С. Летучие масла включают материалы, не относящиеся к "нелетучим" согласно приведенному выше определению.
Нелетучие масла могут быть выбраны из нелетучих кремнийорганических масел, нелетучих углеводородных масел и их смесей. Подходящие нелетучие кремнийорганические масла включают линейные полиметилсилоксаны, и, предпочтительно, нелетучие кремнийорганические масла представляет собой высокомолекулярные диметиконы. Примеры коммерчески доступных линейных полиметилсилоксанов включают DC 200 Fluid 20Cst, DC 200 Fluid 100Cst, DC 200 Fluid 350Cst, поставляемые Dow Corning Corporation.
Подходящие нелетучие углеводородные масла включают разветвленные сложные эфиры диглицерина или триглицерина или сложные эфиры 1,2,3,4-бутантриола или эритрита, диэритрита или триэритрита. Предпочтительно, нелетучие углеводородные масла содержат эритритилтриэтилгексаноат (поставляемый Nisshin Oilio под наименованием Salacos E-38) и Полиглицерил-2-триизостеарат (поставляемый Nisshin Oilio под наименованием Cosmol 43V), диэтилгексилкарбонат (поставляемый Degussa под наименованием Tegosoft DEC), простой дикаприловый эфир (поставляемый Cognis AG под наименованием Cetiol ОЕ), дикаприлкарбонат (поставляемый Cognis AG под наименованием Cetiol CC), изононилизононаноат (поставляемый Seppic под наименованием Lanol 99), тридецилнеопентаноат (поставляемый International Speciality Products под наименованием Ceraphyl 55) или смесь перечисленных веществ.
Летучие масла могут быть выбраны из летучих кремнийорганических масел, как функционализированных, так и нефункционализированных, летучих углеводородных масел и их смесей. Летучие масла, подходящие для использования согласно настоящему изобретению, могут быть насыщенными или ненасыщенными, иметь неразветвленную или разветвленную цепочку или циклическую структуру, или иметь комбинацию из одного или более указанных признаков.
Примеры летучих углеводородных масел включают полидеканы, например, изододекан и изодекан (например, Permethyl-99A, поставляемый Presperse Inc.) и С7-С15 изопарафины (например, серии Isopar, поставляемые Еххоп Chemicals).
Летучие кремнийорганические масла могут быть выбраны из циклопентасилоксана, циклогексасилоксана или их смеси. Примеры коммерчески доступных летучих циклических кремнийорганических масел включают DC 244, DC 245, DC 344 и DC 345, поставляемые Dow Corning Corp.; SF-1204 и SF-1202 Silicone Fluids, поставляемые Momentive Performance Materials; GE 7207 и 7158, поставляемые General Electric Co.); и SWS-03314, поставляемые SWS Silicones Corp.
Линейное летучее кремнийорганическое масло может представлять собой линейный полиметилсилоксан. Примеры коммерчески доступных линейных полиметилсилоксанов включают DC 200 Fluid, 5Cst, поставляемый Dow Corning Corp.
Косметическая композиция согласно изобретению может дополнительно содержать один или более полисахаридов, неограничивающие примеры которых включают одно или более из следующих веществ: анионные полисахариды (например, альгиновую кислоту, пектин, ксантановую камедь, гилауроновую кислоту, хондроитинсульфат, аравийскую камедь, камедь карайи, трагакантовую камедь, карбоксиметилхитин, камедь целлюлозы, гликозаминогликаны), катионные полисахариды (например, хитозан, ацетилированный хитозан, катионную гуаровую камедь, катионную гидроксиэтилцеллюлозу (ГЭЦ)), неионные полисахариды (например, крахмал, декстрины, гуаровую камедь, простые эфиры целлюлозы, например, гидроксиэтилцеллюлозу, метилцеллюлозу и нитроцеллюлозу), амфотерные полисахариды (например, карбоксиметилхитозан, N-гидрокси-дикарбоксиэтилхитозан, модифицированный картофельный крахмал) и гидрофобные полисахариды (например, цетилгидроксиэтилцеллюлозу, поликватерниум 24 (англ. polyquaternium 24)).
Косметическая композиция может дополнительно содержать вещество, подходящее для применения в качестве фильтра солнечного излучения, например, органический солнцезащитный фильтр, например, производное коричной кислоты. Активные органические солнцезащитные фильтры могут быть выбраны из гидрофильных органических солнцезащитных фильтров, гидрофобных органических солнцезащитных фильтров или их смесей. Подходящие примеры солнцезащитных фильтров содержатся в публикации CTFA International Cosmetic Ingredient Dictionary and Handbook, 7-е издание, том 2, стр.1672, под ред. Wenning, Me Ewen (The Cosmetic, Toiletry, and Fragrance Association, Inc., Washington, D.C. 1997).
Органический солнцезащитный фильтр может быть выбран из производных алкил-β, (-дифенилакрилатов, производных α-циано-β, (-дифенилакрилата, производных антранилата, производных бензофенона, производных камфары, производных дибензоилметана, производных пара-аминобензойной кислоты, производных салициловой кислоты, производных триазина или их смесей. Например, гидрофобный органический солнцезащитный фильтр может быть выбран из 4-(1,1-диметилэтил)-4′-метоксидибензоилметана, 4-изопропилдибензоилметана, 4-(1,1-диметилэтил)-4′-метоксидибензоилметана, 2-этилгексил-2-циано-3,3-дифенилакрилата или их смеси.
Примером коммерчески доступного 4-(1,1-диметилэтил)-4′-метоксидибензоилметана, также называемого бутилметоксидибензоилметаном или Avobenzone, является Parsol TM 1789, поставляемый Givaudan Roure S.А., и Eusolex TM 9020, поставляемый Merck & Co., Inc. Примером коммерчески доступного 4-изопропилдибензоилметана, также называемого изопропилдибензоилметаном, является Eusolex TM 8020, поставляемый Merck & Co., Inc. Примеры коммерчески доступного 2-этилгексил-2-циано-3,3-дифенилакрилата, также называемого Octocrylene, включают Uvinul N539 SG, поставляемый BASF; и Eusolex OCR, поставляемый Rona/Merck.
В некоторых примерах осуществления гидрофильный органический солнцезащитный фильтр может представлять собой 2-фенилбензимидазол-5-сульфоновую кислоту. Примером коммерчески доступной 2-фенилбензимидазол-5-сульфоновой кислоты, также называемой PBSA (англ. 2-phenylbenzilimazole-5-sulfonic acid), является Eusolex 232, поставляемый Rona/Merck.
Подходящие примеры солнцезащитных фильтров на основе производных коричной кислоты содержатся в публикации CTFA International Cosmetic Ingredient Dictionary and Handbook, 7-е издание, том 2, стр.1672, под ред. Wenning, Me Ewen (The Cosmetic, Toiletry and Fragrance Association, Inc., Washington, D.C. 1997). Производное коричной кислоты может быть выбрано из 2-этилгексил-пара-метоксициннамата, диэтаноламинметоксициннамата, 2-этоксиэтил-пара-метоксициннамата или их смеси. Например, производным коричной кислоты может являться 2-этилгексил-пара-метоксициннамат.
Косметическая композиция может быть смешана с химическим эксфолиантом, неограничивающие примеры которого включают одну или более из альфа-гидроксикислот (AHA), бета-гидроксикислот (ВНА) или полигидроксикислот, например, салициловую кислоту, гликолевую кислоту, лимонную кислоту и яблочную кислоту.
Неограничивающие примеры экстрактов, которые могут быть включены в косметическую композицию, включают растительные экстракты, которые могут содержать фенольные соединения, например, флавоноиды (например, гликозилрутин, феруловую кислоту, кофеиновую кислоту), фурфурилиденглицитол, бутилированный гидрокситолуол, бутилированный гидроксианизол, нордигидрогуайаретовую полимерную кислоту, нордигидрогуайаретовую кислоту, тригидроксибутирофенон и производные перечисленных веществ. Специальные растительные экстракты, подходящие для включения в композицию согласно изобретению, включают экстракт алоэ вера, экстракт женьшеня и экстракт хвоща.
Экстракт женьшеня получают экстракцией корня Panax ginseng гидрофильным растворителем (в частности, водой, этанолом, гликолем или любой их смесью). Полученный экстракт содержит сапонины, стероидные спирты, углеводы, пектин, витамины, минералы и липиды.
Экстракт хвоща получают экстракцией всех частей травы Equisetum arvense гидрофильным растворителем (например, водой, этанолом, гликолем или любой их смесью). Полученный экстракт содержит силикаты, флавиноиды, сапонозиды, кофеиновую кислоту и феруловую кислоту.
Косметическая композиция может дополнительно содержать кондиционер для кожи. Кондиционер для кожи может быть выбран из влагоудерживающих средств, эксфолиантов, смягчающих средств или их смесей. Влагоудерживающие средства включают многоосновные спирты, например, глицерин, пропиленгликоль, дипропиленгликоль, полипропиленгликоль, полиэтиленгликоль, сорбит, гидроксипропилсорбит, гексиленгликоль, 1,3-бутиленгликоль, 1,2,6-гексантриол, этоксилированный глицерин, пропоксилированный глицерин или их смеси.
Неограничивающие примеры антиоксидантов, которые могут быть смешаны с композицией согласно изобретению, включают аминокислоты, витамины, минералы, каротиноиды, пептиды, тиолы, сульфоксиминные соединения, хелатирущие соединения, ненасыщенные жирные кислоты, фенольные соединения, растительные экстракты, стильбены, мочевую кислоту, маннозу, хлорогеновую кислоту, имидазолы (например, урокановую (3-1 Н-имидазол-4-ил-2-пропеновую) кислоту), фурфурилиденсорбит, убихинон (кофермент Q окисленный), убихинол (кофермент Q восстановленный), пластохинон, фитостерины и производные перечисленных веществ (например, соли, сложные эфиры, простые эфиры, сахара, нуклеотиды, нуклеозиды, пептиды и/или липидные производные), часть которых описана выше.
Неограничивающие примеры витаминов могут включать одно или более из следующих веществ: витамин А и его производные (например, ретиноид или ретинол или их производные, например, ретинилпальмитат или ретинилпропионат), биотин, фолиевую кислоту, пантотенат кальция, никотинамид, пиридоксина гидрохлорид, пиридоксаля гидрохлорид, рибовлавин, тиамина гидрохлорид, тимидин, витамин В12, витамин В3 (например, ниацинамид), витамин В5 (например, пантенол), витамин С и его производные (например, аскорбилпальмитат, Mg-аскорбилфосфат, аскорбилацетат), токоферол и его производные (например, ацетат витамина Е).
Неограничивающие примеры минералов могут включать одну или более солей молибдата (например, (NH4)OMo7O24) алюминия (например, AlCl3), кальция (например, CaCl2), кобальта (например, CoCl2), хрома (например, CrK(SO4)), меди (например, CuSO4), железа (например, Fe(NO3)3, FeSO4), калия (например, KCl), магния (например, MgCl2), марганца (например, MnCl2, MnSO4), фосфата (например, Na2HPO4, NaH2PO4), карбоната (например, NaHCO3), силиката (например, Na2SiO3), натрия (например, NaCl), ванадата (например, NH4VO3), никеля (например, NiCl2), олова (например, SnCb), цинка (например, ZnO, ZnSO4), селена (например, селенометионин, ebselen (2-фенил-1,2-бензизоселеназол-3(2Н)-он), H2SeO3, Na2SeO3), сульфата и нитрата.
Неограничивающие примеры каротиноидов могут включать одно или более из следующих веществ: каротины, например, α-каротин, β-каротин, ψ-ликопен, фитоен и т.д., и производные перечисленных веществ.
Неограничивающие примеры тиолов могут включать одно или более из следующих веществ: ауротиоглюкозу, пропилтиоурацил, тиоредоксин, липоевую кислоту, глютатион, цистеин, цистин, цистамин и их сложные эфиры и соли, содержащие следующие радикалы: гликозил, N-ацетил, метил, этил, пропил, амил, бутил, лаурил, пальмитоил, олеил, γ-линолеил, холестерил и глицерил; дилаурилтиодипропионат, дистеарилтиодипропионат, тиопропионовую кислоту и производные перечисленных веществ.
Неограничивающие примеры сульфоксиминных соединений могут включать одно или более из следующих веществ: гомоцистеинсульфоксимин, бутионинсульфоны, пента-, гекса-, гептатионинсульфоксимины, которые могут быть включены в композицию таким образом, чтобы их дозировки были очень низкими (например, от пикомоль до мкмоль/кг).
Неограничивающие примеры хелатирущих соединений могут включать одно или более из следующих веществ: апоферритин, десферал, лактоферрин, жирные а-гидроксикислоты, пальмитиновую кислоту, фитиновую кислоту, а-гидроксикислоты (например, лимонную кислоту, молочную кислоту, яблочную кислоту), гуминовую кислоту, желчную кислоту, желчные экстракты, билирубин, биливердин, ЭДТА (этилендиаминтетрауксусную кислоту), ЭГТК (этиленгликольтетрауксусную кислоту) и производные перечисленных веществ.
Неограничивающие примеры ненасыщенных жирных кислот могут включать одно или более из следующих веществ: γ-линоленовую кислоту, линолевую кислоту, олеиновую кислоту и их производные.
Стильбены и их производные включают, например, стильбеноксид и транс-стильбеноксид.
В косметические композиции согласно настоящему изобретению может быть включено множество дополнительных необязательных активных ингредиентов. Неограничивающие примеры дополнительных ингредиентов включают дополнительные активные средства для ухода за кожей, например, фарнезол, бисаболол, фитантриол, мочевину, гуанидин (например, аминогуанидин); соединения гексаминидина, соли или производные перечисленных веществ; сахароамины; средства для искусственного загара (например, дегидроксиацетон); структурирующие агенты; гидрофильные гелеобразующие агенты; лекарственные средства от угревой сыпи (резорцин, салициловая кислота и подобные им средства); средства для смягчения и заживления кожи, например, аллантоин и подобные ему средства; и агенты, подходящие для эстетических целей, например, эфирные масла, отдушки, агенты, улучшающие чувствительность кожи, агенты, сообщающие непрозрачность, ароматические соединения (например, гвоздичное масло, ментол, камфара, эвкалиптовое масло и эвгенол).
Рассматриваемые в настоящем описании композиции могут быть приготовлены образом, который обеспечивает быстрое, замедленное или отсроченное высвобождение активного ингредиента после нанесения на тело/введения в организм, с помощью методик, хорошо известных в данной области техники.
Композиции могут быть сформованы в виде любой соответствующей лекарственной формы, которая обеспечивает доставку в конкретные клетки или ткани или нацеливание на конкретные клетки или ткани, например, в виде эмульсии или в виде липосом, ниосом, микросфер, наночастиц или подобных образований, которые могут абсорбировать, адсорбировать, включать в себя или связывать активный ингредиент. Это может эффективно переводить продукт в нерастворимую форму. Получаемые порошковые формы могут придавать композиции стабильность (например, устойчивость к разложению) и устранять проблемы доставки.
Предпочтительно использование растворов, суспензий, гелей и эмульсий; например, активный ингредиент может переноситься в воде, газе, жидкости на водной основе, в масле, геле, эмульсии, эмульсии типа "масло в воде" или "вода в масле", дисперсии или их смеси.
Эмульгатор может быть выбран из неионных эмульгаторов, анионных эмульгаторов, катирнных эмульгаторов, цвиттер-ионных эмульгаторов, амфотерных эмульгаторов или их смесей. Эмульгаторы известны в данной области техники. См., например, публикацию McCutcheon, Detergents and Emulsifiers, North American Edition (1986), опубликованную- Allured Publishing Corporation.
Если косметически приемлемый носитель представляет собой эмульсию типа "вода в кремнийорганическом масле", то эмульгаторы предпочтительно выбирают из полиоксиалкиленовых сополимеров, полиглицериловых сополимеров или их смесей. Полиоксиалкиленовые сополимеры, также называемые кремнийорганическими простыми полиэфирами, подробно описаны в патентной публикации US 4268499. Пример коммерчески доступных полиоксиалкиленовых сополимеров включает DC5225C или DC2-5185C (ПЭГ7ППГ-18/18 диметикон, доступный в виде смеси с циклопентасилоксаном), поставляемый Dow Corning Corp.; и KF6017 или KF6028 (ПЭГ-9 диметикон), поставляемый Shin-Etsu Inc. Примеры коммерчески доступных полиглицериловых эмульгаторов включают KF6100 и KF6104, поставляемые Shin-Etsu Inc.
Композиции предпочтительно предназначены для местного (т.е. накожного) применения.
Композиции для местного нанесения включают гели, кремы, мази, спреи, лосьоны, бальзамы, стикеры, мыла, порошки, пленки, аэрозоли, капли, пены, растворы, эмульсии, суспензии, дисперсии, например, неионные пузырьковые дисперсии, молочко и любые другие традиционные косметические формы, известные в данной области техники.
Мази, гели и кремы могут быть, например, получены на водной или масляной основе с добавлением подходящих загустителей и/или гелеобразующих агентов. Лосьоны могут быть получены на водной или масляной основе, и в общем случае они также содержат одно или более эмульгирующих, диспергирующих, суспендирующих, загущающих или окрашивающих веществ. Порошки могут быть получены с использованием любой подходящей порошковой основы. Капли и растворы могут быть получены на водной или неводной основе и также содержать один или более диспергирующих, солюбилизирующих или суспендирующих агентов. Аэрозольные спреи предпочтительно дозируют из упаковок, находящихся под давлением, с применением подходящего газа-вытеснителя.
В некоторых примерах осуществления полипептид и косметические композиции, рассматриваемые в настоящем описании, могут быть нанесены на кожу местно с помощью изделия (продукта), устройства или материала, на который были нанесены, введены пропитыванием или связаны химическими связями полипептид или композиция. Для этого полипептид или композиция, рассматриваемые в настоящем описании, могут быть нанесены в виде покрытия, введены пропитыванием или связаны химическими связями с перевязочными материалами, пластырями (например, накладками из клейкого пластыря), марлей, медицинской клейкой лентой, хлопковыми тампонами или другими абсорбирующими материалами, например, пуховым материалом, ворсистым полотном или губкой, или поддерживающими матрицами. Например, множество композиций может быть нанесено на кожу с помощью накожных пластырей, хорошо известных в данной области техники и описанных, например, в патентных публикациях US 2008/0038300, US 2009/0043236, WO 2005/067499 и WO 2009/085302, содержания которых включены в настоящее описание посредством ссылки. В некоторых примерах осуществления материал, содержащий полипептид или композицию, рассматриваемую в настоящем описании, может находиться в форме устройства, которое может, например, носить субъект, подвергаемый терапии. Например, полипептид или композиция, рассматриваемые в настоящем описании, могут быть нанесены, введены пропитыванием или связаны химическими связями с материалом или поддерживающей матрицей, которая образует целое изделие, представляющее собой подгузник, перчатку, носок и т.д., или составляет часть такого изделия.
Косметические композиции могут быть заключены в контейнер, упаковку или дозирующее устройство вместе с инструкциями по применению.
Таким образом, дополнительный аспект изобретения относится к изделию (продукту), материалу или устройству, на которое нанесены, введены пропитыванием или связаны химическими связями полипептид или композиция, рассматриваемые в настоящем описании. Изобретение также включает использование таких изделий (продуктов), материалов или устройств как указано в настоящем описании; Предпочтительно изделие (продукт) представляет собой перевязочный материал, пластырь (например, накладку из клейкого пластыря), марлю, медицинскую клейкую ленту или хлопковый тампон, или устройство представляет собой подгузник, перчатку или носок.
Концентрация активного ингредиента в композициях согласно изобретению зависит от типа нанесения/введения, терапевтического курса, возраста и массы пациента, косметических показаний, особенностей тела или области тела, подвергаемой терапии, и эта концентрация может быть изменена или уточнена выбранным образом. Однако, в целом, концентрации соединения, рассматриваемого в настоящем описании, составляют 0,0001, 0,0005, 0,001 или от 0,01 до 50%, например, от 0,0005 до 40%, например, от 0,01 до 25%, например, от 0,1 или 0,5 до 5, например, от 1 до 5% (массовых или объемных процентов от массы или объема готового препарата для нанесения/введения, в частности для местного применения), например, применяют 1%-ный раствор упомянутой выше композиции, полученный в соответствии со способом согласно изобретению.
Если присутствует более одного соединения, например, присутствуют дополнительные увлажняющие агенты, рассматриваемые в настоящем описании, то количество каждого соединения может находиться в диапазонах, упомянутых выше. Концентрации определяют на основании количества самого соединения, и, таким образом, необходимо сделать соответствующие поправки на чистоту композиции. Эффективные однократные дозы полипептидов при однократном местном нанесении могут находиться в диапазоне от 0,001 до 100 мг/см2/сутки, например, от 0,1 до 100 мг/см2/сутки, предпочтительно от 0,001 до 10 мг/см2/сутки, например, от 0,1 до 10 мг/см2/сутки в зависимости от типа млекопитающего, подвергаемого терапии.
Предпочтительно для местного нанесения полипептидов или композиций, рассматриваемых в настоящем описании, применяют жидкие растворы, кремы или суспензии.
Тип животных, которым могут быть нанесены или введены композиции, ограничен млекопитающими. Предпочтительно млекопитающими являются приматы, домашние животные, домашний скот и лабораторные животные. Таким образом, предпочтительные млекопитающие включают мышей, крыс, кроликов, морских свинок, кошек, собак, обезьян, свиней, коров, коз, овец и лошадей. Особенно предпочтительно нанесение или введение композиций людям.
Приведенные ниже Примеры служат для иллюстрации и сопровождаются графическими материалами, в которых:
На Фиг.1 представлены фотографии участницы испытания, которой наносили композицию, содержащую полипептид согласно изобретению, до начала терапии (начальное состояние), после 2 недель и после 12 недель терапии. Уменьшение различных признаков старения кожи очевидны как после 2, так и после 12 недель терапии. Приведенные величины показывают среднее для величин изменений у 35 участниц.
На Фиг.2 крупным планом представлена фотография участницы испытания, изображенной на Фиг.1, для лучшего рассмотрения уменьшения мимических морщинок и морщин, которое заметно как после 2, так и после 12 недель терапии с использованием композиции, содержащей полипептид согласно изобретению.
На Фиг.3 крупным планом представлена фотография участницы испытания, которой наносили композицию, содержащую полипептид согласно изобретению, до начала терапии (начальное состояние) и после 12 недель терапии. На обведенном участке ясно видно уменьшение морщин после 12 недель терапии.
На Фиг.4 представлена гистограмма, на которой показана процентная доля участниц испытания, у которых по оценкам в соответствии с клинической шкалой тактильной/визуальной оценки обеих сторон лица, наблюдалось уменьшение различных признаков старения.
На Фиг.5 представлена гистограмма, на которой показано среднее повышение насыщения кожи влагой, составившее приблизительно 23% для 4 участниц испытания, кожу которых в течение 3 недель дважды в сутки обрабатывали композицией, содержащей полипептид согласно изобретению, по сравнению с состоянием кожи в отсутствии терапии.
На Фиг.6 представлена гистограмма, на которой показано среднее снижение потери влаги испарением через кожные покровы (улучшение барьерной функции кожи), составившее приблизительно 14,5% для 4 участниц испытания, кожу которых в течение 3 недель дважды в сутки обрабатывали композицией, содержащей полипептид согласно изобретению, по сравнению с состоянием кожи в отсутствии терапии.
На Фиг.7 представлена гистограмма, на которой показано среднее снижение объема морщин вокруг глаз, составившее приблизительно 23% для 4 участниц испытания, кожу которых в течение 3 недель дважды в сутки обрабатывали композицией, содержащей полипептид согласно изобретению, по сравнению с состоянием кожи в отсутствии терапии.
На Фиг.8 представлена гистограмма, на которой показано среднее снижение содержания меланина, составившее приблизительно 10% для 4 участниц испытания, кожу которых в течение 3 недель дважды в сутки обрабатывали композицией, содержащей полипептид согласно изобретению, по сравнению с состоянием кожи в отсутствии терапии.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1
Выделение лейколектина и получение препаратов, содержащих лейколектин
Лейколектиновые белки (описанные ниже) и способы их получения были подробно описаны в патентной публикации WO 2010/049688, содержание которой полностью включено в настоящее описание посредством ссылки. Однако, для полноты описания и в качестве примера способа, описанного выше, ниже описан предпочтительный способ получения композиции, содержащей лейколектин.
Способ получения частично очищенной зоназы (zonase), которая может быть использована в качестве исходного материала для выделения полипептида согласно изобретению, описан в патентной публикации WO 99/29836, содержание которой включено в настоящее описание посредством ссылки (в частности, Пример 1 описанного способа, но необязательно без этапа, проводимого в присутствии мочевины).
Лейколектин выделяли из среды, получаемой после выклева лосося. Для повышения концентрации белка в среде, получаемой после выклева, икру лосося перед выклевом помещают в минимальные объемы воды. Высоко синхронизованный выклев может быть вызван повышенными (комнатными) температурами или деоксигенацией (Oppen-Berntsen et al. 1990, Aquaculture, 86, с.417-430), в результате чего получают небольшой объем высококонцентрированного препарата неочищенного лейколектина и соответствующих белков. Выклев должен быть завершен в течение 2 часов для более 95% эмбрионов.
Среду, получаемую после выклева, фильтруют через стандартный фильтр с размером пор 7 мкм для удаления материала, который с большой долей вероятности будет закупоривать фильтры в последующих этапах фильтрования. Полученный фильтрат, т.е. обработанная среда, получаемая после выкпева, может быть заморожена и может храниться в замороженном состоянии в течение нескольких лет без значительного разложения, после чего она может быть разморожена и использована для последующего выделения белка. Это очень упрощает получение исходного материала для выделения из него лейколектина лосося.
Обработанную среду, получаемую после выклева, фильтруют с помощью фильтра с размером пор 0,45 мкм, и собирают фильтрат.Затем для замены среды, получаемой после выклева, буферм фильтрат подвергают диафильтрации на фильтре, имеющем эксклюзионный размер, составляющий 8 кДа. В данном случае буфер содержал 0,5 мМ фосфата и 1 мМ NaCl; тем не менее, подходящими являются другие буферы. Например, для целей изобретения подходит фосфатный буферный солевой раствор или буферы, содержащие миллимолярные количества Tris (например, 10 мМ) при приблизительно нейтральном или слегка щелочном рН (рН 7.5-8.5), содержащие 5 мМ NaCl. Ретентат, получаемый в этапе диафильтрации, собирали и разбавляли буфером.
Диафильтрат подвергали ультрафильтрации через ультрафильтры, имеющие эксклюзионный размер, составляющий 100 кДа, и собирали фильтрат, содержащий лейколектин. Наконец, фильтрат фильтровали через фильтр с размером пор, составляющим 0,22 мкм, и собирали готовый фильтрат.Полученный фильтрат представляет собой препарат, обогащенный лейколектином.
Пример 2
Воздействие лейколектина на фибробласты in vitro
Материалы и способы
Композиции, полученные способом, описанным в Примере 1, наносили на стареющие (дряхлые) фибробласты (фибробласты человеческой дермы, в соответствии с моделью старения по Hayflick, опубликованной в Hayflick, L, Moorhead, P. S. (1961). "The serial cultivation of human diploid cell strains." Exp.Cell Res. 25:585-621). Следует отметить, что стареющие фибробласты высвобождают больше ММР, чем молодые фибробласты и, как было отмечено выше, активность ММР связана с признаками и симптомами старения и рубцевания. В частности ММР-1, известная как интерстициальная коллагеназа или коллагеназа фибробластов, участвует в разрушении внеклеточной матрицы, поскольку она расщепляет интерстициальный коллаген типов I, II и III.
Для обработки стареющих фибробластов использовали три разных концентрации композиции лейколектина, 0,015%, 0,050% и 0,150% (объемн). Композиция представляла собой препарат, обогащенный лейколектином, и объемные проценты были рассчитаны, исходя из общего объема обогащенного препарата (включая компоненты, отличные от лейколектина) в пересчете на единичный объем. Концентрацию ММР-1 определяли способом ИФА (ELISA). Одновременно выполняли два контрольных эксперимента. Первый контрольный эксперимент проводили с использованием нормальных фибробластов человеческой дермы (англ. Normal Human Dermal Fibroblasts, сокращенно NHDF), которые были выделены из дермы ювенильной кожи крайней плоти или взрослой кожи различных участков, например, лица, и, таким образом, имели нормальные "несостарившиеся" уровни ММР-1 (P7-NHDF). Второй контрольный эксперимент проводили с использованием стареющих клеток, которые вместо лейколектина обрабатывали TGF-((10 нг/мл). TGF-((бета-трансформирующий фактор роста) представляет собой полифункциональный цитокин, регулирующий пролиферацию и дифференциацию клеток, а также моделирование и восстановление тканей. Известно, что он замедляет высвобождение ММР-1. Результаты, представленные в Таблице 2, показывают, что обработка композициями, содержащими лейколектин в концентрациях 0,050% и 0,150%, приводит к почти полному ингибированию высвобождения ММР-1 из стареющих фибробластов, в результате чего их уровни становятся даже ниже, чем в ювенильных фибробластах. Эти результаты показывают, что потенциально лейколектин может способствовать улучшению косметического состояния кожных покровов, в частности, состояния зрелой и зарубцевавшейся кожи, в которой наблюдаются повышенные уровни ММР и/или аномальная активность ММР. Действительно, представленные ниже результаты, которые демонстрируют эффективность композиции, содержащей лейколектин, подтверждают воздействие таких композиций на состарившуюся кожу.
В Таблице имеются следующие обозначения:
(1): Пороговое значение статистической значимости
ns:>0,05, незначительное
*: 0,01 до 0,05, значительное
**: 0,001 до 0,01, очень значительное
***:<0,001, чрезвычайно значительное
<или>: ниже или выше предела обнаружения
Пример 3
Воздействие лейколектина in vivo на состарившуюся кожу
Композицию, содержащую лейколектин, получали, как описано в Примере 1, но предпоследний этап ультрафильтрования через фильтр с эксклюзионным размером 100 кДа не выполняли. Композиция была приготовлена в виде лосьонов для нанесения на кожу, имеющих концентрации 1% и 3% (об.) (общий объем композиции на единицу объема лосьона), которые в этом испытании представляли собой два активных лосьона для кожи; их действие сравнивали с действием контрольного лосьона для кожи, не содержащего активного компонента композиции, т.е. среды, получаемой после выклева. Лосьон для кожи представлял собой эмульсию типа "масло в воде" (англ. обозначение O/W, т.е. oil-in-water). Масляная фаза составляла 9% от общего количества композиции; эмульгатор представлял собой гидрированный лецитин.
Для оценки эффективности и переносимости местной терапии кожи было проведено двойное слепое плацебо-контролируемое клиническое исследование кожи субъектов женского пола (участниц испытания), имевших фото повреждения кожи от небольших до умеренных, т.е. имевших состарившуюся кожу лица. Продолжительность этого испытания составляла 12 недель; проводили осмотры участниц до начала терапии, на 2 неделе, на 6 неделе и на 12 неделе. Эффективность оценивали визуально, с помощью оборудования, цифровых фотографий VISIA CR и анкет самостоятельной оценки своего состояния участницами.
Количество участниц
Все этапы исследования были пройдены сто одной (101) участницей испытания (N>30 для трех видов терапии, т.е. одной, включающей плацебо, и двух с использованием композиций, содержащих активный компонент, т.е. лейколектин, в разных концентрациях).
Выбор участниц и их идентификация
Участницами были здоровые женщины в возрасте от 40 до 65, каждой из которых присваивали трехзначный номер, который при использовании в комбинации с номером клинического исследования образовывал уникальный идентификационный номер каждой участницы исследования. Этот номер закрепляли за участницей в течение всего исследования для сохранения анонимности эксперимента.
Критерии пригодности
Критерии включения
1. Индивидуумы женского пола в возрасте от 40 до 65 включительно, имеющие общее хорошее состояние здоровья, определяемое при заполнении анкет по состоянию здоровья и пригодности.
2. Изъявление согласия на сотрудничество и участие с выполнением всех требований исследования в течение всей продолжительности исследования с условием немедленного уведомления о любых неблагоприятных симптомах.
3. Клинически установленное фотоповреждение кожи лица от небольшого до умеренного (мимические морщинки, морщины, гиперпигментация, вялость и шероховатость), соответствующее оценке от 3 до 7 по модифицированной шкале Гриффита.
4. Отсутствие заболеваний или физических повреждений кожи лица (например, атопического дерматита, экземы, псориаза, себорейного дерматита), которые могут повлиять на оценку состояния испытуемых участков или создавать риск здоровью индивидуума при участии в исследовании.
5. Изъявление согласия на то, что участница не будет находиться на солнечном свету в течение продолжительных периодов времени и полностью исключит визиты в солярий в течение всей продолжительности исследования. Особое внимание следует уделить ношению защитной одежды, а также солнечных очков, и избегать воздействия солнечного света с 10 часов утра до 4 часов вечера.
6. Изъявление согласия на то, что участница будет продолжать использование всех привычных наименований декоративной косметики, очищающих средств, тонизирующего средства (если их применяет) и средства для удаления макияжа в течение всей продолжительности исследования. Индивидуумы должны воздержаться от использования каких-либо средств против старения или для осветления кожи за исключением назначенного испытуемого материала.
7. Изъявление согласия на то, что по меньшей мере за 20 минут перед каждым запланированным визитом в клинику участница полностью удаляет макияж. До завершения диагностического визита участница не должна наносить на лицо или область вокруг глаз никаких других средств местного нанесения. Если участница приходит с макияжем, удаленным не полностью, то такая участница должна удалить оставшийся макияж в клинике и не приступать к процедурам в течение еще по меньшей мере 20 минут.
8. Индивидуумы, принимающие гормонозаместительную терапию или противозачаточные гормоны, должны находиться в стадии стабильного режима в течение по меньшей мере одного месяца до начала исследования, и они должны изъявить согласие продолжать принимать предписанные медикаменты в течение всей продолжительности исследования. Индивидуумы, не принимающие гормонозаместительную терапию или гормоны до начала исследования, должны изъявить согласие не начинать подобную терапию в течение всей продолжительности исследования.
9. Изъявление согласия на сотрудничество и участие с выполнением всех требований исследования в течение всей продолжительности исследования с условием немедленного уведомления о любых неблагоприятных симптомах.
Критерии исключения
1. Индивидуумы, анамнез которых содержит упоминание о непереносимости или аллергии на какое-либо средство личной гигиены.
2. Индивидуумы, которые использовали прописанные или безрецептурные средства для осветления кожи в течение менее чем 30 суток до начала исследования.
3. Индивидуумы, имеющие состояние и/или заболевание кожных покровов, которые проверяющий Исследователь считает неприемлемыми для участия.
4. Кормящие, беременные или планирующие наступление беременности во время исследования.
5. Индивидуумы, которые постоянно использовали средства против старения, против образования морщин, местные антиоксиданты в течение менее чем 30 суток перед началом исследования.
6. Индивидуумы, которые использовали ферментативную терапию кожи лица в течение 6 месяцев до начала исследования.
7. Использование Retin-A®, Retin-A Micro®, Renova®, Avita®, Tazorac®, Avage® или Differin® или других ретиноидов местного нанесения в течение 3 месяцев до начала исследования или прием Accutane или ретиноида для перорального введения в течение последних 6 месяцев.
8. Регулярное нанесение на кожу лица средств, содержащих альфа-, бета-или поли-гидроксикислоты (включая салициловую кислоту и Lachydrin), ретинол или производные ретинола, или других средств, предотвращающих старение, в течение 30 суток до начала исследования.
9. Индивидуумы, прошедшие процедуры абразивной шлифовки дермы лица или химического пилинга в течение 3 месяцев до терапии или во время исследования.
10. Индивидуумы, получавшие радиочастотную лифтинг-терапию (RF-light терапию) или других устройств на участках, подвергаемых испытанию, в течение 6 месяцев до начала терапии или во время исследования.
11. Индивидуумы, которым вводили инъекции Ботокса (англ. Botox), коллагена, жиров или подвергали другим способам наполнения тканей с помощью инъекционного или имплантированного материала на участках, подвергаемых испытанию, в течение 9 месяцев до начала терапии или во время исследования.
12. Индивидуумы, подвергавшиеся процедуре омоложения, подтяжки лица или хирургическим операциям в области глаз или глазных век в течение 12 месяцев до начала настоящего испытания.
13. Индивидуумы, у которых ранее наблюдали и/или которые имеют латентные дерматологические состояния лица (например, витилиго, атопический дерматит, псориаз, красные угри, экзема, себорейный дерматит, серьезные ссадины и т.д.) или медицинские состояния/заболевания, которые, по мнению Исследователя, могут влиять на результаты исследования.
14. Индивидуумы, в анамнезе которых имеются иммунодепрессивные/иммунодефицитные нарушения (включая ВИЧ инфекцию или СПИД), или которые принимают иммунодепрессанты.
15. Индивидуумы, которые участвовали в других клинических исследованиях (аппликационные пробы допускаются).
16. Индивидуумы, имеющие неконтролируемые заболевания, например, диабет, гипертонию, гипертиреоз или гипотиреоз. Некоторые индивидуумы, имеющие множественные нарушения здоровья, исключались из участия, даже если их состояния могли контролироваться диетой, применением медикаментов и т.д.
17. Индивидуумы, которые участвовали в любых клинических исследованиях в течение 28 суток до начала участия в настоящем исследовании.
Индивидуумы были допущены к исследованию на усмотрение Исследователя или его заключения, сделанного на основании медицинского анамнеза и результатов предварительного собеседования и обследования.
План исследования
Для оценки эффективности местной терапии кожи у участниц исследования, имеющих фотоповреждение от небольшого до умеренного, т.е. состарившуюся кожу лица, было проведено двойное слепое плацебо-контролируемое клиническое испытание. Продолжительность этого испытания составляла 12 недель; осмотры проводили до начала терапии, на 2 неделе, на 6 неделе и на 12 неделе. Эффективность оценивали визуально, с помощью оборудования, цифровых фотографий VISIA CR и анкет самостоятельной оценки своего состояния участницами.
Полностью прошли исследование три группы с N>30 человек в группе. Участницам в течение двенадцати недель обрабатывали лицо активным средством, воздействующим на кожу, а именно лейколектиновой композицией, описанной выше, или контролем в виде носителя (вода). Разделение участниц на 3 группы производили согласно предварительно заданному способу рандомизации.
Оценка эффективности и переносимости
Перечисленные ниже параметры правой и левой сторон лица определялись экспертом по клинической оценке. Использовали модифицированную шкалу Гриффита со следующими градациями: 0=нет, 1-3=небольшое, 4-6=умеренное и 7-9=сильное. При необходимости, для лучшего описания состояния кожи, использовали половинные значения баллов.
- Мимические морщинки
- Морщины
- Гиперпигментация
- Вялость
- Отсутствие блеска/матирование (яркость)
- Шероховатость на ощупь
Перечисленные ниже параметры правой и левой сторон лица определялись экспертом по клинической оценке. Использовали четырехбалльную шкалу со следующими градациями: 0=нет, 2=небольшое, 3=умеренное и 4=сильное. При необходимости, для лучшего описания состояния кожи, использовали половинные значения баллов.
- Покраснение
- Сухость/шелушение
- Ощущение жжения/острого жжения
- Зуд
- Тянущее ощущение/сухость
Получение цифровых VISIA CR фотографий
Получали VISIA-CR изображения правой и левой сторон лица. Участниц фотографировали с убранными назад с лица волосами, без украшений, с закрытыми глазами, при расположении участницы в центре кадра и так, чтобы выражение лица участницы было нейтральным.
Потери влаги испарением через кожные покровы (TEWL)
Перед проведением измерений с помощью оборудования организм участницы уравновешивали до условий окружающей среды в клинике в течение по меньшей мере 20 минут. Во время диагностических визитов состояние окружающей среды записывали каждый час. В это время состояние участниц оценивали в соответствии со шкалами, участницы заполняли анкеты и/или их фотографировали с использованием VISIA CR.
Во время всех визитов для определения потерь влаги испарением через кожные покровы (TEWL) использовали датчик для определения потерь влаги (Tewameter). Измерения выполняли на правой и левой щеках на пересечении линии, проходящей вниз от угла глаза, и линии, проходящей горизонтально через основание носа.
Для определения TEWL в датчике потерь влаги используют систему с открытой камерой. Ручной зонд, помещаемый на поверхность кожи, определяет относительную влажность в двух точках над поверхностью, что позволяет вычислить скорость потери влаги на основании измеренного градиента влажности.
Кутометр МРА 580
Во время всех визитов всем участницам проводили измерения с помощью Кутометра. Кутометр применяли для оценки вязкоэластичных свойств (т.е. растяжимости и эластичности) кожных покровов. Устройство создает вакуум на небольшом участке кожи и измеряет упругую ответную реакцию кожи (по перемещению кожи внутрь и наружу из отверстия) оптическим способом.
Для этого исследования применяли 2-мм зонд, вакуум, составляющий 300 мбар (102 Па), и два цикла втягивания и высвобождения. Продолжительность воздействий в цикле была следующей: 5 секунд - включено, и 10 секунд -выключено.
Измерения выполняли на правой и левой щеках на пересечении линии, проходящей вниз от угла глаза, и линии, проходящей горизонтально через основание носа, или на другом участке вблизи челюсти.
Оценка состояния кожи и анкеты самостоятельной оценки своего состояния
Участницы заполняли анкеты самостоятельной оценки состояния своей кожи, содержащие вопросы о том, как участница ощущает состояние и оценивает внешний вид кожи лица на правой и левой сторонах лица.
Результаты
Мимические морщинки
К неделе 2 у участниц, которым наносили лосьон для кожи, содержащий одну из активных композиций, наблюдали уменьшение мимических морщинок (например, процентное изменение, составляющее 5,59% (1% раствор) и 5,65% (3% раствор)) по сравнению с применением плацебо (4,58%). Уменьшение мимических морщинок продолжалось в течение недели 6 (например, 14,34% (1% раствор), 14,86% (3% раствор) и 8,98% (плацебо)) и недели 12 (например, 23,43% (1% раствор), 25,99% (3% раствор) и 14,68% (плацебо)). На Фиг.1 и 2 представлена участница, для которой уменьшение мимических морщинок составило 28%.
Морщины
К неделе 2 у участниц, которым наносили лосьон для кожи, содержащий одну из активных композиций, наблюдали уменьшение морщин (например, процентное изменение, составляющее 2,15% (1% раствор) и 1,75% (3% раствор)) по сравнению с применением плацебо (0,70%). Уменьшение морщин продолжалось в течение недели 6 (например, 6,13% (1% раствор), 7,32% (3% раствор) и 3,70% (плацебо)) и недели 12 (например, 14,72% (1% раствор), 15,15% (3% раствор) и 9,57% (плацебо)). На Фиг.1 представлена участница, для которой уменьшение морщин составило 12,5%. На Фиг.3 представлена участница, для которой уменьшение морщин составило 26,32%.
Гиперпигментация
К неделе 2 у участниц, которым наносили лосьон для кожи, содержащий одну из активных композиций, наблюдали снижение гиперпигментации (например, процентное изменение, составляющее 2,11% (1% раствор) и 2,68% (3% раствор)) по сравнению с применением плацебо (0,40%). Снижение гиперпигментации продолжалось в течение недели 6 (например, 5,61% (1% раствор), 7,91% (3% раствор) и 3,16% (плацебо)) и недели 12 (например, 10,53% (1% раствор), 15,35% (3% раствор) и 5,73% (плацебо)). На Фиг.1 представлена участница, для которой снижение пигментации возрастного пятна спустя 12 недель составило 15%.
Вялость
К неделе 2 у участниц, которым наносили лосьон для кожи, содержащий одну из активных композиций, наблюдали снижение вялости (например, процентное изменение, составляющее 2,64% (1% раствор) и 1,62% (3% раствор)) по сравнению с применением плацебо (0,87%). Снижение вялости продолжалось в течение недели 6 (например, 6,33% (1% раствор) и 6,61% (3% раствор), 2,51% (плацебо)) и недели 12 (например, 10,55% (1% раствор) и 11,33% (3% раствор), 5,18% (плацебо)). На Фиг.1 представлена участница, для которой снижению вялости (отвисания) спустя 12 недель составило 7,69%.
Отсутствие блеска/матирование (яркость)
К неделе 2 у участниц, которым наносили лосьон для кожи, содержащий одну из активных композиций, наблюдали улучшение яркости кожи (например, процентное изменение, составляющее 12,95% (1% раствор) и 16,00% (3% раствор)) по сравнению с применением плацебо (10,67%). Улучшение продолжалось в течение недели 6 (например, 29,26% (1% раствор), 28,50% (3% раствор) и 19,07% (плацебо)) и недели 12 (например, 37,17% (1% раствор), 39,18% (3% раствор) и 26,72% (плацебо)). На Фиг.1 представлена участница, для которой снижение тусклости кожи составило 33,33%.
Шероховатость на ощупь
К неделе 2 у участниц, которым наносили лосьон для кожи, содержащий одну из активных композиций, наблюдали уменьшение ощущаемой шероховатости кожных покровов (например, процентное изменение, составляющее 16,51% (1% раствор) и 20,24% (3% раствор)) по сравнению с применением плацебо (13,38%). Улучшение продолжалось в течение недели 6 (например, 24,77% (1% раствор), 26,65% (3% раствор) и 16,79% (плацебо)), но в течение недели 12 не наблюдали дополнительного снижения (например, 26,61% (1% раствор), 29,19% (3% раствор), и 15,79% (плацебо)). На Фиг.1 представлена участница, для которой снижение ощущаемой шероховатости составило 12,5%.
Сухость/шелушение
К неделе 2 у участниц, которым наносили лосьон для кожи, содержащий одну из активных композиций, наблюдали уменьшение в сухости/шелушения кожных покровов (например, процентное изменение, составляющее 72,09% (1% раствор) и 100,00% (3% раствор)) по сравнению с применением плацебо (64,71%). Однако, в течение недели 6 (например, 86,05% (1% раствор), 84,62% (3% раствор) и 100,00% (плацебо)) и недели 12 дополнительного снижения по сравнению с плацебо (например, 90,70% (1% раствор), 100,00% (3% раствор) и 89,47% (плацебо)) не наблюдали.
TEWL
Несмотря на то, что у участниц, которым наносили лосьон для кожи, содержащий одну из активных композиций, наблюдали снижение TEWL в течение недели 2, это снижение не слишком отличалось от действия плацебо (например, процентное изменение составляло 15,35% (1% раствор) и 14,53% (3% раствор) по сравнению с применением плацебо (17,26%)). Однако, к неделе 6 было заметно дополнительное снижение, превышающее снижение под действием плацебо (например, 29,46% (1% раствор), 26,66% (3% раствор) и 22,96% (плацебо)), и к неделе 12 наблюдали снижение, превышающее снижение, получаемое при действии плацебо (например, 37,46% (1% раствор), 40,04% (3% раствор) и 34,21% (плацебо)).
Растяжимость
Несмотря на то, что у участниц, которым наносили лосьон для кожи, содержащий одну из активных композиций, наблюдали улучшение растяжимости кожных покровов в течение недели 2, его величина лишь слегка отличалась от улучшения под действием плацебо (например, процентное изменение составляло 16,18% (1% раствор) и 17,21% (3% раствор) по сравнению с применением плацебо (10,82%)). К неделе 6 явного различия между результатами трех терапий не наблюдали (например, 18,04% (1% раствор), 17,18% (3% раствор) и 19,90% (плацебо)), но к неделе 12 наблюдали дополнительное улучшение при обработке кожи композициями, содержащими активный компонент, которое было более выраженным, чем эффект плацебо (например, 31,84% (1% раствор), 33,57% (3% раствор) и 16,48% (плацебо)).
Сравнение тактильных оценок/оценок по визуальной клинической шкале обеих сторон лица, выполненное в начале исследования (начальное состояние) и спустя 12 недель терапии, показывает, что у всех участниц наблюдали снижение тусклости и шероховатости кожи после обработки композицией, содержащей полипептид согласно изобретению, и у большинства участниц наблюдали уменьшение мимических морщинок (97% участниц), морщин (91% участниц), гиперпигментации (87% участниц) и отвисания (80% участниц) (Фиг.4).
Содержание анкет показывает, что после шести недель терапии в количестве утверждений, касающихся общего внешнего вида, ощущений в целом, гладкости, мягкости, яркости и эластичности кожи, полученных в результате применения косметической композиции, содержащей полипептид согласно изобретению, и в результате применения плацебо, имеются статистически значимые различия.
Таким образом, приведенные выше результаты показывают, что композиция, содержащая лейколектин, более эффективна в отношении каждого аспекта состарившейся кожи, чем плацебо.
Пример 4
Альтернативный способ получения композиции, содержащей лейколектин
Начальные этапы альтернативного способа получения композиции, содержащей лейколектин, совпадают с этапами, описанными в Примере 1. Однако, после проведения этапа фильтрования среды, получаемой после выклева, через стандартный фильтр с размером пор 7 мкм с целью удаления материала, который с большой степенью вероятности будет забивать фильтры последующих этапов фильтрования, альтернативный способ получения начинает отличаться от способа Примера 1. В альтернативном способе полученный фильтрат, т.е. обработанную среду, получаемую после выклева, загружают в ионообменную колонку, содержащую диэтиламиноэтил (ДЭАЭ), согласно инструкции производителя, и промывают раствором Tris HCl концентрацией 20 мМ (рН 8.50). Элюат отбрасывают. Лейколектиновый белок элюируют из колонки промывным раствором, содержащим 50 мМ NaCl. Элюат собирают и затем подвергают диафильтрации через фильтр, имеющий эксклюзионный размер, составляющий 8 кДа, для замены буфером воды в среде, получаемой после выклева. В этом случае буфер представляет собой фосфатный буферный солевой раствор, но подходящими для данной цели могут быть и другие буферные растворы. Например, подходящими являются буфер, содержащий 0,5 мМ фосфата и 1 мМ NaCI, или буферы, содержащие миллимолярные количества Tris (например, 10 мМ) при приблизительно нейтральном или слабощелочном рН (рН 7.5-8.5), содержащие 5 мМ NaCl. Ретентат, полученный в этапе диафильтрации, собирают и разбавляют, добавляя буфер.
Наконец, фильтрат фильтруют через фильтр с размером пор, составляющим 0,22 мкм, и полученный фильтрат собирают. Этот фильтрат представляет собой препарат, сильно обогащенный лейколектином, не содержащий или содержащий лишь следовые количества пептидов, поступающих из среды, получаемой после выклева.
Пример 5
Воздействие композиции, содержащей лейколектин, на состарившуюся кожу in vivo
Задачи исследования
Задача этого двойного слепого исследования воздействия на кожу состояла в оценке изменений, касающихся насыщения кожи влагой и потерь влаги испарением через кожные покровы (TEWL) на предплечьях, после трехнедельной терапии с использованием геля, содержащего 3% лейколектинового препарата, полученного в Примере 4, и сравнением результатов с состоянием в отсутствии терапии. Дополнительно анализировали влияние лейколектина на пигментацию возрастных пятен на руках (содержание меланина) и объем выбранных морщин вокруг глаз по сравнению с состоянием в отсутствии терапии.
Материалы и способы
Исследование проводили в соответствии с протоколом SOP "Hautpflege-Prufung Standard", версия 4 от 29 января 2003 г., с внесением изменений в моменты проведения измерений.
Двойное слепое исследование проводили на 4 субъектах женского пола. Критерием отбора участниц для этого испытания являлась сухая кожа на предплечьях (результаты корнеометрии до начала терапии <20), морщины вблизи внешнего угла глазной щели и возрастные пятна на обеих руках. Все 4 участницы правильно и полностью завершили участие в исследовании. Результаты всех 4 участниц были включены в анализ данных. Возраст 4 участниц составлял от 56,3 до 70,9 лет (в среднем 64,3±6,3 года).
Анализ насыщения кожи влагой и потерь влаги испарением через кожные покровы (TEWL) проводили на участках обоих предплечий. На предплечьях выбирали четыре испытуемых участка, по два на внутренней стороне каждого предплечья. На два участка наносили гель, содержащий лейколектиновый препарат, на один наносили глицерин (контроль), и четвертый оставляли без терапии. Распределение обработок по испытуемым участкам чередовали.
Испытуемыми участками для анализа морщин вокруг глаз были морщинки вокруг правого и левого глаза (внешний угол глазной щели). На одну сторону, в соответствии со случайным выбором, наносили гель, содержащий лейколектиновый препарат, а другую сторону оставляли без терапии.
Действие геля, содержащего лейколектиновый препарат, на пигментацию исследовали на одном выбранном возрастном пятне на каждой руке. Также, на тыльную сторону одной руки в соответствии со случайным выбором наносили гель, а другую руку оставляли без терапии.
Период предварительной выдержки перед началом исследований и терапии составлял 7 суток. В течение этого периода и в течение всего периода исследования на предплечья, внешние углы глазной щели обоих глаз и тыльные стороны обеих рук было запрещено наносить средства для ухода за кожей, солнцезащитные средства, маслянистые или увлажняющие средства для очистки кожи и дерматологические терапевтические средства. Кроме того, было запрещено подвергать испытуемые участки интенсивному воздействию УФ излучения (как солнечного света, так и солярия). В день исследования в институте было запрещено наносить макияж.
В течение трех недель участницы дома дважды в сутки производили назначенную обработку. Средства наносили в количестве, приблизительно составляющем 2 мг/см2, на соответствующий участок предплечья (в соответствии со случайным выбором, один испытуемый участок оставляли без терапии, а другой обрабатывали в качестве контроля глицерином). Кроме того, гель, содержащий лейколектиновый препарат, наносили на внешний угол глазной щели на одной стороне лица и тыльную сторону одной кисти руки (левой или правой - в соответствии со случайным выбором), а другую сторону оставляли без терапии.
Перед началом применения первого продукта (t0) и спустя три недели терапии (t1) определяли следующие параметры: насыщение кожи предплечья влагой (Корнеометр СМ825®, 10 измерений); потери влаги испарением через кожу предплечья (TEWL, DermaLab®, 3 измерения); пигментация возрастных пятен на тыльной поверхности кистей рук (Siascope®, 1 измерение, содержание меланина); и in vivo измерение объема одной выбранной морщины у внешнего угла глазной щели с помощью 3D системы для анализа кожи in vivo PRIMOS® Pico (3 измерения, объем морщин в мм3 рассчитывали на основании смоделированного изображения перепада высот).
Соответствие действий участницы с заданным режимом нанесения продукта проверяли, спустя одну неделю после начала использования продукта.
Все измерения были проведены в комнате с климатическим контролем при 21,5°С (±1°С) и 50% (±5%) относительной влажности после адаптации незакрытых испытуемых участков кожи участниц к внутренним климатическим условиям в течение по меньшей мере 30 минут. Измерения и обработку в момент времени t1 проводили, спустя 10-20 часов после последнего нанесения продукта.
Исключения
Исключений не было.
Дискомфорт и негативные кожные реакции
Дискомфорта и негативных кожных реакций не наблюдали.
Результаты
После 3 недель нанесения геля, содержащего 3% об. препарата лейколектина, дважды в сутки на кожу, наблюдали повышение в насыщения кожи влагой, составляющее в среднем для 4 участниц приблизительно 23%, по сравнению с состоянием в отсутствии терапии (Фиг.5).
После обработки кожи гелем в течение 3 недель дважды в сутки среднее для 4 участниц снижение потери влаги испарением через кожные покровы (улучшение барьерной функции кожи) составило приблизительно 14,5% по сравнению с испытуемым участком, не подвергавшимся терапии (Фиг.6).
После обработки кожи гелем в течение 3 недель дважды в сутки снижение объема морщин вокруг глаз составило приблизительно 23% по сравнению с испытуемым участком, не подвергавшимся терапии (Фиг.7).
После обработки кожи гелем в течение 3 недель дважды в сутки среднее для 4 участниц снижение пигментации возрастных пятен (содержание меланина) составило приблизительно 10,0% по сравнению с испытуемым участком, не подвергавшимся терапии (Фиг.8).
Последовательности:
1. Лейколектиновый полипептид эмбриона лосося:

2. Лейколектиновый полипептид из лейкоцитов лосося:

3. Лейколектин-2 полипептид лосося:
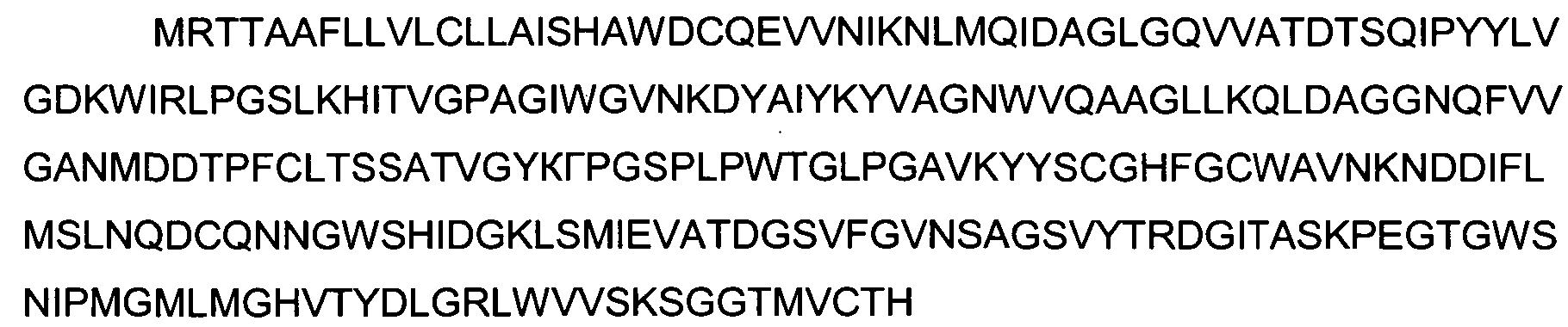
4. Лейколектин-3 полипептид лосося:

Реферат
Группа изобретений относится к косметическим композициям улучшения косметического состояния состарившейся или зарубцевавшейся кожи млекопитающего, содержащим полипептид, содержащий последовательность аминокислот, приведенную в любой из последовательностей SEQ ID No. 1-4, или последовательность, которая по меньшей мере на 90% идентична упомянутой последовательности, или часть любой из упомянутых последовательностей, полученный или получаемый из среды, получаемой после выклева Salmonidae, способам получения таких композиций и их применению для улучшения косметического состояния кожи млекопитающего. Группа изобретений эффективна в улучшении эстетического внешнего вида кожных покровов. 4 н. и 33 з.п. ф-лы, 8 ил., 3 табл., 5 пр.
Формула
(i) полипептид, содержащий последовательность аминокислот, приведенную в любой из последовательностей SEQ ID No. 1-4, или последовательность, которая по меньшей мере на 90% идентична упомянутой последовательности, или часть любой из упомянутых последовательностей; или
(ii) косметическую композицию, содержащую (i) и один или несколько фармацевтически приемлемых эксципиентов и/или разбавителей.
a) суспендирование рыбьей икры, предпочтительно икры лосося, в минимальном объеме воды;
b) инициирование синхронизированного, быстрого выклева икры, предпочтительно так, чтобы в течение менее 2 часов завершался выклев более 95% эмбрионов;
c) фильтрование икорной массы после выклева с целью получения среды, получаемой после выклева; и
d) фильтрование среды, получаемой после выклева, с целью получения полипептида и/или композиции, причем этап фильтрования среды, получаемой после выклева, включает по меньшей мере следующие этапы:
(i) фильтрование среды, получаемой после выклева, с помощью фильтра, размер пор которого составляет по меньшей мере 5 мкм, и сбор фильтрата;
(ii) фильтрование фильтрата, полученного на этапе (i), с помощью фильтра, размер пор которого составляет от 0,30 до 0,60 мкм, и сбор фильтрата;
(iii) замену воды в фильтрате, полученном при проведении этапа (ii), фармацевтически приемлемым буфером;
(iv) фильтрование раствора, полученного при проведении этапа (iii), с помощью фильтра, имеющего эксклюзионный размер, составляющий по меньшей мере 80 кДа, и сбор фильтрата; и
(v) фильтрование фильтрата, полученного на этапе (iv), с помощью фильтра, размер пор которого составляет от 0,15 до 0,30 мкм, и сбор фильтрата, причем полученный фильтрат обеспечивает композицию, содержащую указанный полипептид или его часть.
а′) суспендирование рыбьей икры, предпочтительно икры лосося, в минимальном объеме воды;
b′) инициирование синхронизированного, быстрого выклева икры, предпочтительно так, чтобы в течение менее 2 часов завершался выклев более 95% эмбрионов;
с′) фильтрование икорной массы после выклева с целью получения среды, получаемой после выклева; и
d′) фильтрование среды, получаемой после выклева, с целью получения полипептида и/или композиции, причем этап фильтрования среды, получаемой после выклева, включает по меньшей мере следующие этапы:
(i′) фильтрование среды, получаемой после выклева, с помощью фильтра, размер пор которого составляет по меньшей мере 5 мкм, и сбор фильтрата;
(ii′) обработку фильтрата, полученного при проведении этапа (i′), ионообменной хроматографией, и сбор элюата;
(iii′) замену воды в элюате, полученном при проведении этапа (ii′), фармацевтически приемлемым буфером; и
(iv′) фильтрование раствора, полученного при проведении этапа (iii′), с помощью фильтра, размер пор которого составляет от 0,15 до 0,30 мкм, и сбор фильтрата, причем указанный фильтрат обеспечивает композицию, содержащую указанный полипептид или его часть.
(a) загрузку фильтрата в ионообменную колонку, предпочтительно колонку, содержащую диэтиламиноэтил (ДЭАЭ);
(b) промывку колонки подходящим буфером, предпочтительно промывным раствором, содержащим 20 мМ Tris-HCl и имеющим pH 8,5;
(c) элюирование полипептида из колонки с помощью буфера или растворителя элюирования, причем буфер элюирования предпочтительно содержит промывной раствор, дополнительно содержащий 50 мМ NaCl; и
(d) сбор элюата, полученного при проведении этапа (с).
a) размер пор фильтра, применяемого на этапе (i), составляет от 5 до 15 мкм, предпочтительно размер пор составляет 7 мкм;
b) размер пор фильтра, применяемого на этапе (ii), составляет от 0,35 до 0,55 мкм, и предпочтительно размер пор составляет 0,45 мкм;
c) эксклюзионный размер фильтра, применяемого на этапе (iv), составляет от 80 до 120 кДа, и предпочтительно эксклюзионный размер составляет 100 кДа; и/или
d) размер пор фильтра, применяемого на этапе (v), составляет 0,22 мкм.
a) размер пор фильтра, применяемого на этапе (i′), составляет от 5 до 15 мкм, и предпочтительно размер пор составляет 7 мкм;
b) размер пор фильтра составляет от 0,35 до 0,55 мкм и предпочтительно размер пор составляет 0,45 мкм; и/или
c) размер пор фильтра, применяемого на этапе (iv′), составляет 0,22 мкм.
a) суспендирования рыбьей икры в минимальном объеме воды;
b) инициирования синхронизированного, быстрого выклева икры;
c) фильтрования икорной массы после выклева с целью получения среды, получаемой после выклева, и
d) фильтрования среды, получаемой после выклева, с целью получения композиции, где стадия фильтрования среды, получаемой после выклева, включает по меньшей мере следующие стадии:
(i) фильтрования среды, получаемой после выклева, с помощью фильтра, размер пор которого составляет по меньшей мере 5 мкм, и сбора фильтрата;
(ii) обработки фильтрата, полученного при проведении этапа (i), с помощью ионообменной хроматографии, включающей:
(A) загрузку фильтрата в колонку, содержащую ДЭАЭ (диэтиламиноэтил);
(B) промывку колонки промывным раствором, содержащим 10-50 мМ Tris-HCl и имеющим pH 7-9;
(C) элюирование полипептида из колонки с помощью буфера элюирования, содержащего промывный раствор, дополнительно содержащего 10-500 мМ NaCl или KCl; и
(D) сбор элюата, полученного при проведении этапа (С),
(iii) замены воды в элюате, полученном при проведении этапа (ii), фармацевтически приемлемым буфером; и
(iv) фильтрования раствора, полученного при проведении этапа (iii), с помощью фильтра, размер пор которого составляет от 0,15 до 0,30 мкм, и сбор фильтрата, причем полученный фильтрат составляет композицию, содержащую указанный полипептид или его часть.
a) размер пор фильтра на стадии (i) составляет от 5 до 15 мкм, где предпочтительно размер пор составляет 7 мкм;
b) размер пор фильтра, указанного в п. 35, составляет от 0,35 до 0,55 мкм, где предпочтительно размер пор составляет 0,45 мкм; и/или
c) размер пор фильтра на стадии (iv) составляет 0,22 мкм.

Комментарии