Новые проникающие в клетку пептиды - RU2670488C2
Код документа: RU2670488C2
Чертежи













Описание
Область техники
Настоящее изобретение имеет отношение к новым проникающим в клетку пептидам, предназначенным для практического использования в биологии и медицине в качестве средства для клеточной доставки.
Уровень техники
Цитоплазматическая мембрана эукариотических клеток представляет собой строго контролируемый барьер, защищающий клетку от нерегулируемого вхождения биоактивных молекул. Для перемещения через плазматическую мембрану не являющихся эндогенными для клетки низкомолекулярных, белковых или других лекарственных средств на основе макромолекул может использоваться естественная система транспортировки или прямая диффузия через липидный бислой. Однако, во многих случаях, оба способа вхождения являются неэффективными для экзогенных молекул.
За последнее десятилетие проникающие в клетку пептиды (СРР) превратились в перспективные векторы для доставки различных терапевтических средств, включая белки, до их мишеней. СРР представляют собой пептидные последовательности, облегчающие эффективное перемещение белков через биологические мембраны независимо от транспортеров или специфических рецепторов. Кроме того, СРР дают преимущество экономически эффективного производства. После открытия 20 лет назад свойства перемещения через мембрану трансактивирующего регуляторного белка вируса иммунодефицита человека (HIV ТАТ) было идентифицировано несколько СРР, включая пенетратин (гомеодомен Antennapedia), VP22 (вирус простого герпеса) и синтетический полиаргинин (polyR). Перспектива создания новых вакцин связана с карго-молекулами, соединенными с СРР.
Недавно было показано, что основная лейциновая молния транскрипционного активатора ZEBRA вируса Эпштейна-Барр проникает через внешнюю мембрану живых клеток и накапливается в ядрах лимфоцитов. Конкретнее, было продемонстрировано, что минимальный участок ZEBRA, необходимый для проникающей способности трансактиватора ZEBRA вируса Эпштейна-Барр, охватывает участок от остатка 170 до 220 остатка ZEBRA и что оба, и ДНК-связывающий домен и домен димеризации, содержащиеся в этой области, необходимы для проникающей способности (Rothe et al. 2010, J. Biological Chemistry 285(26): 20224-20232).
Считается, что у многих СРР имеются недостатки, в случае их использования в качестве носителей для доставки карго-молекул в клетку. Например, они могут вызывать некоторые серьезные побочные эффекты в клетке, такие как цитоплазматическая «утечка» вследствие разрушения мембраны или нарушения нормального функционирования мембранных белков, или могут вызывать токсические эффекты в клетках и/или иммуногенные эффекты. Кроме того, некоторые СРР могут быстро разрушаться в цитоплазме или остаются заключенными в эндосомах, чтобы затем подвергнуться расщеплению в лизосомах. Более того, некоторые СРР не могут высвобождать карго-молекулу или не имеют широкого спектра для адресации или высвобождения карго-молекулы.
Поэтому, по-прежнему существует необходимость в усовершенствованном носителе, способном доставлять самые разные карго-молекулы в клетку, который демонстрирует высокую эффективность поглощения карго-молекулы, а также низкую токсичность. Применительно к вакцинам, также было бы целесообразно, чтобы носитель (средство доставки) не ограничивался только одним путем интернализации карго-молекулы и мог бы доставляться и в цитозоль и эндосомы для презентации антигена. Настоящее изобретение решает эту проблему, предоставляя СРР, которые обеспечивают эффективную доставку и презентацию, например, антигенных детерминант на клеточной поверхности антиген-презентирующих клеток. Таким образом, СРР изобретения используются в качестве носителей для доставки самых разных карго-молекул, таких как полипептиды и белки, полисахариды, липиды или их комбинации, а также нуклеиновых кислот, низкомолекулярных лекарственных препаратов и визуализирующих средств.
Раскрытие изобретения
Первый аспект изобретения представлен проникающим в клетку пептидом, характеризующимся тем, что:
a) длина аминокислотной последовательности указанного пептида составляет в целом от 15 до 30 аминокислот; и
b) указанный пептид имеет аминокислотную последовательность, содержащую фрагмент участка, продолжающегося от 170 остатка до 220 остатка ZEBRA, в которой необязательно 1, 2, 3, 4 или 5 аминокислот может быть заменено, удалено и/или добавлено, при условии сохранения проникающей способности указанного пептида;
или вариант указанного пептида, содержащий аминокислотную последовательность, имеющую, по меньшей мере, одну консервативно замещенную аминокислоту по сравнению с указанной аминокислотной последовательностью пептида.
Второй аспект изобретения имеет отношение к комплексу, содержащему указанный проникающий в клетку пептид и карго-молекулу.
Третий аспект изобретения имеет отношение к полинуклеотидам, кодирующим указанный проникающий в клетку пептид или указанный комплекс, а также векторам, содержащим такие полинуклеотиды.
Четвертый аспект изобретения относится к клеткам-хозяевам, экспрессирующим проникающий в клетку пептид или комплекс, описанный выше, а также способам получения таких клеток.
Пятый аспект изобретения имеет отношение к клеткам, нагруженным комплексом, описанным выше.
Шестой аспект изобретения касается композиций, содержащих: (i) проникающий в клетку пептид изобретения, (ii) комплекс изобретения, (iii) нуклеиновую кислоту изобретения, (iv) вектор изобретения, (v) клетку-хозяина изобретения или (vi) клетки, нагруженные комплексом согласно изобретению.
Седьмой аспект изобретения, касается упомянутых выше композиций, предназначенных для использования в качестве медикаментов или в качестве визуализирующих или диагностических композиций.
Восьмой аспект изобретения представляет собой состоящий из частей набор, содержащий, по меньшей мере, одно из следующего:
(a) проникающий в клетку пептид согласно изобретению;
(b) комплекс согласно изобретению;
(c) нуклеиновую кислоту согласно изобретению;
(d) вектор согласно изобретению;
(e) клетку-хозяина согласно изобретению;
(f) клетку, нагруженную комплексом согласно изобретению.
Девятый аспект изобретения предоставляет способ доставки карго-молекулы в клетку in vitro, включающий стадию установления контакта указанной клетки с проникающим в клетку пептидом согласно изобретению и указанной карго-молекулой.
Другие признаки и преимущества изобретения станут понятны из следующего далее подробного описания.
Описание чертежей
Фигура 1 показывает результаты ограниченного МНС класса I представления после загрузки в дендритные клетки гибридных полипептидов CPP1-OVA и CPP2-OVA. Дендритные клетки, происходящие из костного мозга, в течение 4 часов нагружали 0.3 мкМ соответствующих CPPs-OVA гибридных полипептидов и выдерживали в течение ночи с LPS. После 5 дневной совместной инкубации со спленоцитами, полученными от TCR трансгенных мышей ОТ1, соответствующее ограниченное МНС представление эпитопа класса I OVA было оценено посредством CFSE разбавления пролиферирующих OVA-специфических Т-клеток. Отрицательные контроли или только с Т-клетками (А) или с Т-клетками, совместно инкубированными со зрелыми дендритными клетками костного мозга, которые не были активированы гибридными полипептидами (В); положительные контроли с Т-клетками инкубированными или с пептидами (С) или с пептидами, активированными дендритными клетками полученными из зрелого костного мозга (D); CPP1-OVA (Е); CPP2-OVA (F).
Фигура 2 показывает поликлональный иммунный ответ после вакцинации мышей гибридными полипептидами, содержащими СРР1 или СРР2 и карго в виде пептида овальбумина. Мышей вакцинировали два раза подкожно с интервалом 14 дней 20 мкг каждого CPPs-OVA гибридного полипептида и 100 мкг анти-CD40, 50 мкг поли-IC вводили внутримышечно через 10 дней после буст-инъекции, мышей забивали, а спленоциты окрашивали мультимером и анти-CD8. Отрицательный контроль PBS (А); CPP1-OVA (В); CPP2-OVA (С).
Подробное описание изобретения
Термин "проникающие в клетку пептиды (проникающие пептиды)" ("СРР") в большинстве случаев используется для обозначения коротких пептидов, которые способны транспортировать различные типы карго-молекул через плазматическую мембрану, и, таким образом, способствовать поглощению клеткой различных молекулярных «грузов» (от наноразмерных частиц до небольших химических молекул, макромолекул и больших фрагментов ДНК). "Карго-молекула" (молекула-груз) связана с проникающим пептидом или посредством химических ковалентных связей или посредством нековалентных взаимодействий. Проникающие пептиды, как правило, имеют аминокислотный состав с высоким относительным количеством положительно заряженных аминокислот, таких как лизин или аргинин, или имеют последовательность, которая содержит изменяющийся набор полярных/заряженных аминокислот и неполярных, гидрофобных аминокислот. Эти два типа структур известны под названием поликатионные или амфипатические, соответственно. Проникающие пептиды имеют разные размеры, последовательности и заряды аминокислот, однако все СРР имеют общее свойство, заключающееся в способности «проходить» через плазматическую мембрану и способствовать доставке различных молекулярных «грузов» в цитоплазму или органеллы клетки. В настоящее время, теории СРР-транслокации различают три основных механизма входа: прямое проникновение в мембрану, вход, опосредованный эндоцитозом, и перемещение за счет образования временной структуры. Трансдукция (перенос) СРР - это область происходящих в настоящее время исследований. Проникающие пептиды находят много вариантов применения в медицине в качестве средств доставки лекарств для лечения различных болезней, включая ингибирование рака и вирусных болезней, а также в качестве контрастных веществ для мечения и визуализации клетки.
В данном документе "карго-молекула" обозначает молекулу, связанную с проникающим пептидом путем ковалентного или нековалентного связывания, клеточная интернализация которой облегчается или обеспечивается наличием указанного проникающего пептида. В настоящем изобретении "карго-молекулы" включают пептиды, белки, полисахариды, липиды, их комбинации, включая липопротеины и гликолипиды, нуклеиновые кислоты (например, ДНК, миРНК, кшРНК, антисмысловые олигонуклеотиды, ловушки ДНК, плазмиды), низкомолекулярные лекарственные средства (например, циклоспорин А, паклитаксел, доксорубицин, метотрексат, 5-аминолевулиновая кислота), визуализирующие вещества (например, флюорофор, квантовые точки (QDs), радиоактивные индикаторы, хелаты металлов, такие как низкомолекулярные хелатные соединения гадолиния (Gd3+), суперпарамагнитная окись железа (SPIO)). Следует понимать, что в том случае, когда карго-молекула является пептидом, полипептидом или белком, она может содержать один или более пептидов, полипептидов или белков, связанных вместе. Кроме того, когда карго-молекула является нуклеиновой кислотой, указанная нуклеиновая кислота может содержать одну или более нуклеиновых кислот, причем каждая кодирует один пептид или полипептид. Также карго-молекула может быть комбинацией белка, липида и/или полисахарида, включая липопротеины и гликолипиды.
Термины "пептид", "полипептид", "белок (протеин)" и варианты этих терминов относятся к пептиду, олигопептиду, олигомеру или белку, включая гибридный белок, соответственно, содержащему, по меньшей мере, две аминокислоты, соединенные друг с другом нормальной или модифицированной пептидной связью, такой как, например, в случаях изостерических пептидов. Эти термины в данном документе также включают "пептидомиметики", которые определяются как аналоги пептидов, содержащие непептидные структурные элементы и способные подражать биологическому действию(ям) природного исходного пептида или противодействовать биологическому действию(ям) природного исходного пептида. Пептидомиметик утрачивает классические свойства пептида, такие как ферментативно неустойчивые пептидные связи. Пептид или полипептид может состоять из аминокислот, отличных от 20 аминокислот, определенных генетическим кодом. Он может состоять из L-аминокислот и/или D-аминокислот. Пептид или полипептид может в равной мере состоять из аминокислот, модифицированных в результате естественных процессов, таких как процессы пост-трансляционного созревания, или в результате химических процессов, которые хорошо известны специалистам в данной области техники. Такие модификации подробно изложены в литературе. Эти модификации могут содержаться в любом месте в полипептиде: в остове пептида, в аминокислотной цепи или даже на карбокси-конце или амино-конце. Пептид или полипептид может быть разветвленным после убиквитинирования или может быть циклическим с разветвлением или без него. Этот тип модификации может являться результатом естественных или искусственных пост-трансляционных процессов, которые хорошо известны специалисту в данной области техники. Например, модификации пептида или полипептида могут включать ацетилирование, ацилирование, ADP-рибозилирование, амидирование, ковалентное связывание нуклеотида или производного нуклеотида, ковалентное связывание липида или липидного производного, ковалентное связывание фосфатидилинозитола, ковалентное или нековалентное перекрестное связывание, циклизацию, образование дисульфидной связи, деметилирование, гликозилирование, включая пегилирование, гидроксилирование, йодирование, метилирование, миристиорилирование, окисление, протеолитические процессы, фосфорилирование, пренилирование, рацемизацию, сенелоилирование, сульфатацию, добавление аминокислоты, например, аргинина, или убиквитинирование. Такие модификации подробно описаны в литературе (Proteins Structure and Molecular Properties (1993) 2nd Ed., T. Ε. Creighton, New York; Post-translational Covalent Modifications of Proteins (1983) В. C. Johnson, Ed., Academic Press, New York; Seifter et al. (1990) Analysis for protein modifications and nonprotein cofactors, Meth. Enzymol. 182: 626-646 and Rattan et al., (1992) Protein Synthesis: Post-translational Modifications and Aging, Ann NY Acad Sci, 663: 48-62).
Термины "клеточная интернализация" карго-молекулы, связанной с проникающим пептидом, в большинстве случаев означает транспорт карго-молекулы через плазматическую мембрану и таким образом вход карго-молекулы в клетку. В зависимости от конкретного случая карго-молекула может затем высвобождаться в цитоплазму, направляться во внутриклеточную органеллу или впоследствии презентироваться на клеточной поверхности.
Термин "ZEBRA" (также известный как Zta, Ζ, ЕВ1 или BZLF1), как правило, означает лейциновую «молнию» (bZIP) активатора транскрипции вируса Эпштейна-Барр (EBV). Минимальный домен ZEBRA, который демонстрирует свойства проникания, был идентифицирован, как участок, охватывающий от 170 остатка до 220 остатка ZEBRA. Аминокислотная последовательность ZEBRA раскрывается под учетным номером NCBI YP_401673 и содержит 245 аминокислот, представленных в SEQ ID NO: 23.
Термин "эпитоп", также известный как "антигенная детерминанта", представляет собой часть антигена, которая распознается иммунной системой, в частности, антителами, В-клетками или Т-клетками. В настоящей заявке термин "эпитоп" главным образом используется для обозначения Т-клеточных эпитопов, которые представлены на поверхности антиген-презентирующей клетки, где они связываются с главным комплексом гистосовместимости (МНС). Т-клеточные эпитопы, презентируемые молекулами МНС класса I, как правило, но не исключительно, представляют собой пептиды, длиной 8-11 аминокислот, тогда как молекулы МНС класса II представляют более длинные пептиды, обычно, но не исключительно, длиной 12-25 аминокислот.
Термин "CD4+ эпитоп" или "CD4+-ограниченный эпитоп" в данном описании обозначает эпитоп, распознаваемый CD4+ Т-клеткой, при этом указанный эпитоп состоит из антигенного фрагмента, находящегося (лежащего) в бороздке молекулы МНС класса II.
Термин "CD8+ эпитоп" или "CD8+-ограниченный эпитоп" в данном описании обозначает эпитоп, распознаваемый CD8+ Т-клеткой, при этом указанный эпитоп состоит из антигенного фрагмента, лежащего в бороздке молекулы МНС класса I.
Термин "презентация эпитопа в отношении МНС класса I" относится к CD8+ эпитопу, лежащему в бороздке молекулы МНС класса I на поверхности клетки.
Термины "презентация эпитопа в отношении МНС класса II" относится к CD8+ эпитопу, лежащему в бороздке молекулы МНС класса II на поверхности клетки.
Термины "презентация эпитопа в отношении CDI" относится к липидному эпитопу, лежащему в бороздке молекулы кластера дифференцировки 1 на поверхности клетки.
"МНС класса I" означает один из двух основных классов молекул главного комплекса гистосовместимости. Молекулы МНС класса I (также называемые "МНС I") обнаруживаются в организме на каждой клетке с ядром. Функция МНС класса I состоит в том, чтобы показывать эпитоп цитотоксическим клеткам (CTL). У людей молекулы МНС класса I состоят из двух полипептидных цепей, α- и β2-микроглобулина (b2m). Только α цепь является полиморфной и кодируется HLA геном, тогда как b2m субъединица не является полиморфной и кодируется геном Beta-2 микроглобулина.
"МНС класса II" означает другой основной класс молекул главного комплекса гистосовместимости. Молекулы МНС класса II (также известные как "МНС II") обнаруживаются только на некоторых специализированных типах клеток, включая, макрофаги, дендритные клетки и В-клетки, которые все относятся к антиген-презентирующим клеткам (APC).
"Опухолевый эпитоп" в данном документе означает эпитоп опухоль-ассоциированного антигена или опухоль-специфического антигена. Например, опухолевые эпитопы включают эпитопы глиомы.
"Эпитоп патогена" в данном документе означает эпитоп антигенного белка, антигенного полисахарида, антигенного липида, антигенного липопротеина или антигенного гликолипида патогена, включая вирусы, бактерии, грибы, простейших и многоклеточных паразитов. Антигенные протеины, полисахариды, липиды, липопротеины или гликолипиды патогенов включают в данном описании белки, полисахариды, липиды, липопротеины и гликолипиды, соответственно, патогенов, отвечающих за болезни, которые могут быть мишенью вакцинации, включая, например, амебиаз, сибирскую язву, язву Бурули (Mycobacterium ulcerans), диарею, связанную с Caliciviruses, диарею, вызванную Campylobacter, рак шейки матки (Human papillomavirus), генитальные заболевания, вызванные Chlamydia trachomatis, холеру, конго-крымскую геморрагическую лихорадку, лихорадку Денге, дифтерию, геморрагическую лихорадку Эбола, энтеротоксигенную диарею, вызванную Escherichia coli (ЕТЕС), рак желудка (Helicobacter pylori), гонорею, болезни, связанные со стрептококком группы А, болезни, связанные со стрептококком группы В, пневмонию и инвазивную болезнь, вызванную Haemophilus influenzae В, гепатит А, гепатит В, гепатит С, диарею при гепатите Е, генитальные язвы, вызванные вирусом Herpes simplex 2 типа, ВИЧ/СПИД, анкилостомидоз, грипп, японский энцефалит, лихорадку Ласса, лейшманиоз, лептоспироз, рак печени (Гепатит В), рак печени (Гепатит С), болезнь Лайма, малярию, геморрагическую лихорадку Марбург, краснуху, свинку, назофаренгиальный рак (вирус Эпштейна-Барр), менингит, вызванный менингококком Neisseria meningitidis, пневмонию, связанную с парагриппом, коклюш, чуму, полиомиелит, бешенство, пневмонию, вызванную респираторным синцитиальным вирусом (RSV), лихорадку долины Рифт, диарею, вызванную ротавирусом, коревую краснуху, шистосомоз, тяжелый острый респираторный синдром (SARS), шигеллез (бактериальная дизентерия), оспу, болезни, связанные с золотистым стафилококком, рак желудка (Helicobacter pylori), пневмонию и инвазионные болезни, вызванные стрептококком, столбняк, клещевой энцефалит, трахому, туберкулез, туляремию, брюшной тиф, болезнь, связанную с вирусом Западного Нила, желтую лихорадку.
Термин "малые ингибирующие нуклеиновые кислоты" (миНК) относится к коротким нуклеиновым кислотам, которые используются при распознавании целевых мРНК, причем их понижающая регуляция основывается на антисмысловом действии. Этот термин включает антисмысловые нуклеотиды, каталитические нуклеиновые кислоты, такие как рибозимы и дезоксирибозимы, а также малые интерферирующие РНК (миРНК).
Термин "миРНК" относится к малым интерферирующим РНК, которые представляют собой одноцепочечные или двухцепочечные РНК (около 19-23 нуклеотидов), способные «выключить» или подавить желаемую мРНК из гена-мишени. Искусственные миРНК могут быть синтезированы химическим путем, как олигонуклеотиды, или могут быть клонированы в плазмидный или вирусный вектор (аденовирус, ретровирус или лентивирус) в виде коротких шпилечных РНК (кшРНК) с целью получения временной или стабильной трансфекции в любом типе клеток (Martin et al., 2007, Ann. Rev. Genomics Hum. Genet., 8: 81-108; Kolfschoten et al, 2007, Nat. Clin. Pract. Endocrinol. Metab., 3(12): 827-34; Huang et al, 2008, Expert. Opin. Ther. Targets, 12(5), 637-645).
При использовании в описании "лечение" и тому подобное, как правило, означает получение желательного фармакологического и физиологического эффекта. Эффект может быть профилактическим, если иметь в виду предотвращение или частичное предотвращение болезни, симптома или состояния, и/или может быть терапевтическим, если иметь в виду частичное или полное излечение болезни, состояния, симптома или неблагоприятного воздействия, приписываемого болезни. Термин "лечение" при использовании в описании включает любое лечение болезни у млекопитающего, в частности, человека, и включает: (а) предотвращение появления болезни у субъекта, который может быть предрасположен к болезни, но у которого болезнь еще не была диагностирована, такое как раннее профилактическое бессимптомное вмешательство; (b) ингибирование болезни, т.е., задержку развития болезни; или облегчение болезни, т.е. вызывание регрессии болезни и/или ее симптомов или таких состояний, как улучшение или восстановление повреждения. В частности, способы, варианты использования, составы и композиции согласно изобретению являются пригодными для лечения рака или инфекционных болезней и/или для предотвращения прогрессирования рака до запущенной или метастатической стадии у пациентов с раком на ранней стадии, таким образом, улучшение стадии рака. В случаях применительно к раку, предотвращение болезни или нарушения включает предотвращение появления или развития рака у индивидуума, находящегося в группе риска относительно развития указанного рака, например, в связи с прошлым случаем возникновения указанного рака в круге родственников индивидуума, и предотвращение инфицирования патогенами, способствующими развитию опухолей, такими как, например, вирус Эпштейна-Барр (EBV), вирус папилломы человека (HPV), вирус гепатита В (HBV), вирус гепатита С (HCV), вирус герпеса человека 8 (HHV8), вирус Т-клеточного лейкоза человека типа 1 (HTLV-1), полиомавирус осязательной клетки Меркеля (MCV) и Helicobacter pylori. Кроме того, термины "предотвращение/лечение" рака включают стабилизацию уже диагностированного рака у индивидуума. "Стабилизация" означает предотвращение прогрессирования рака до запущенной или метастатической стадии у пациентов с раком на ранней стадии.
Использованный в описании термин "субъект" относится к млекопитающим. Например, млекопитающие, рассматриваемые настоящим изобретением, включают человека, приматов, домашних животных, таких как крупный рогатый скот, овцы, свиньи, лошади, лабораторные грызуны и тому подобные.
Использованный в описании термин "эффективное количество" относится к количеству, по меньшей мере, одного проникающего в клетку пептида, комплекса, содержащего указанный проникающий в клетку пептид и карго-молекулу, клеток, нагруженных указанным комплексом, состава или фармацевтической композиции согласно изобретению, которое вызывает биологический или медицинский ответ в ткани, системе, у нужного животного или человека. В одном варианте осуществления эффективное количество является "терапевтически эффективным количеством", т.е. количеством, необходимым для облегчения симптомов болезни или состояния, которое подвергается лечению. В другом варианте осуществления эффективное количество является "профилактически эффективным количеством", т.е. количеством, необходимым для профилактики симптомов болезни или состояния, которое подвергается лечению. Термин также включает количество активного полипептида, достаточное для уменьшения прогрессирования болезни, а именно, для уменьшения или ингибирования роста опухоли или инфекции, и вследствие этого получения нужного ответа, в частности, такой ответ может быть иммунным ответом, направленным против эпитопов, содержащихся в карго-молекуле (т.е. "ингибирующим эффективным количеством").
"Эффективность" лечения согласно изобретению поддается измерению на основании изменений в ходе болезни в ответ на применение способа согласно изобретению. Например, эффективность лечения рака может быть измерена по уменьшению объема опухоли, и/или увеличению времени выживаемости без прогрессирования, и/или уменьшению риска рецидива после удаления первичного рака. Конкретнее, что касается лечения рака с помощью иммунотерапии, оценкой эффективности может служить спектр клинических примеров противоопухолевого ответа в отношении иммунотерапевтических средств за счет использования нового критерия, связанного с иммунным ответом (irRC), который основан на Критерии оценки ответа солидных опухолей (RECIST) и критериях Всемирной организации здравоохранения (ВОЗ) (J. Natl. Cancer Inst. 2010, 102(18): 1388-1397). Эффективность предотвращения инфекционной болезни в конечном итоге оценивается эпидемиологическими исследованиями в человеческих популяциях, которая часто коррелирует с титрами нейтрализующих антител в сыворотке и индукцией многофункциональных патоген-специфических Т-клеточных ответов. Доклиническая оценка может включать устойчивость к инфекции после заражения инфекционным патогеном. Лечение инфекционной болезни измеряется ингибированием роста патогена или уничтожением патогена (и, таким образом, невозможностью обнаружения патогена), коррелируя с патоген-специфическими антителам и/или Т-клеточными иммунными ответами.
Термин "фармацевтическая композиция" относится к препаратам, которые находятся в форме, обеспечивающей несомненную эффективность активного ингредиента(ов), обладающего биологической активностью, и не содержащей дополнительный компонент, который может быть токсичным для субъектов, которым вводится указанная композиция. А.
Проникающие в клетку пептиды и комплексы согласно изобретению
Первый аспект изобретения имеет отношение к проникающему в клетку пептиду, характеризующемуся тем, что:
a) длина аминокислотной последовательности указанного пептида составляет в целом 15-30 аминокислот, например, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот всего; и
b) указанный пептид имеет аминокислотную последовательность, содержащую фрагмент минимального домена ZEBRA, при этом указанный минимальный домен продолжается от остатка 170 до остатка 220 ZEBRA (SEQ ID NO: 23), в которой необязательно 1, 2, 3, 4 или 5 аминокислот может быть заменено, удалено и/или добавлено, при условии сохранения проникающей способности указанного пептида;
или вариант указанного пептида, содержащий аминокислотную последовательность, имеющую, по меньшей мере, одну консервативно замещенную аминокислоту по сравнению с указанной аминокислотной последовательностью пептида.
Способность проникать в клетку или интернализация проникающего в клетку пептида или комплекса, содержащего указанный проникающий в клетку пептид согласно изобретению, может быть проверена с помощью стандартных способов, известных специалистам в данной области техники, включая проточную цитометрию или флуоресцентную микроскопию живых или фиксированных клеток, иммуногистохимический анализ клеток, трансфектированных указанным пептидом или комплексом, и вестерн-блоттинга.
В предпочтительном варианте осуществления варианты или фрагменты проникающего пептида согласно изобретению дополнительно сохраняют способность указанного пептида презентировать белковую карго-молекулу, такую как эпитоп, на поверхности клетки, такой как антиген-презентирующая клетка, в контексте молекул МНС класса I и/или МНС класса II.
Способность проникающего в клетку пептида или комплекса, содержащего проникающий в клетку пептид, презентировать белковую карго-молекулу, такую как эпитоп, на поверхности клетки в контексте молекул МНС класса I и/или МНС класса II может быть проверена с помощью стандартных способов, известных специалистам в данной области техники, включая способность стимулировать пролиферацию и/или функцию МНС-ограниченных CD4+ или CD8+ Τ клеток, обладающих специфичностью в отношении этих эпитопов.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению не является SEQ ID NO: 13.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению не является SEQ ID NO: 14.
В другом отдельном варианте осуществления проникающий в клетку пептид согласно изобретению содержит Cys (С), замещенный Ser (S), в эквивалентном положении 189 относительно ZEBRA аминокислотной последовательности SEQ ID NO: 23.
В одном варианте осуществления изобретение имеет отношение к проникающему в клетку пептиду, отличающемуся тем, что:
a) указанный пептид имеет аминокислотную последовательность, имеющую, по меньшей мере, 15 и не более, чем 30 аминокислот в длину; и
b) указанный пептид, имеет аминокислотную последовательность, содержащую:
(i) SEQ ID NO: 1, или
(ii) аминокислотную последовательность, идентичную SEQ ID NO: 1, за исключением того, что 1, 2, 3, 4 или 5 аминокислот заменяется, удаляется и/или добавляется, при условии сохранения проникающей способности указанного пептида;
или варианту указанного пептида, содержащему аминокислотную последовательность, имеющую, по меньшей мере, одну консервативно замещенную аминокислоту по сравнению с указанной аминокислотной последовательностью пептида.
Согласно одному аспекту изобретения проникающий в клетку пептид содержит аминокислотную последовательность, имеющую, по меньшей мере, одну консервативно замещенную аминокислоту по сравнению с исходной последовательностью, означая, что данный остаток аминокислоты замещается остатком, имеющим сходные физиохимические характеристики.
Как правило, замена одной или более аминокислот, присутствующих в исходной аминокислотной последовательности должна быть сделана консервативно. Примеры консервативных замен включают замены одного алифатического остатка на другой, такого как Ile, VaI, Leu или Ala на другой, или замену одного полярного остатка на другой, такую как между Lys и Arg; Glu и Asp; или Gln и Asn. Хорошо известны другие подобные консервативные замены, например, замены целых участков, имеющих сходные гидрофобные свойства (Kyte and Doolittle, 1982, J. Mol. Biol. 157(1): 105-132). Замены одной или более L-аминокислот одной или более D-аминокислотами следует рассматривать как консервативные замены в контексте настоящего изобретения. Примеры аминокислотных замен представлены в таблице 1 ниже:

Таким образом, в другом аспекте проникающий в клетку пептид согласно изобретению отличается тем, что:
a) указанный пептид имеет аминокислотную последовательность, длиной, по меньшей мере, 15, и не более чем 30 аминокислот; и
b) указанный пептид имеет аминокислотную последовательность, содержащую SEQ ID NO: 6, причем 0, 1, 2, 3, 4 или 5 аминокислот заменяется, удаляется и/или добавляется, при условии сохранения способности проникать в клетку у указанного пептида, в которой
Χ1 представляет собой K, R или Η
Х2 представляет собой R, K или Η
Х3 представляет собой Y, W или F
Х4 представляет собой K, R или H
Х5 представляет собой N или Q
Х6 представляет собой R, K или H
Х7 представляет собой V, I, M, L, F или А
Х8 представляет собой А, V, L, I или G
Х9 представляет собой S или Τ
Х10 представляет собой R, K или Η
Х11 представляет собой K, R или H
Х13 представляет собой R, K или H
X14 представляет собой А, V, L, I или G
Х15 представляет собой K, R или H
X16 представляет собой F, L, V, I, Y, W или M
Х17 представляет собой K, R или Н.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Χ1 представляет собой K.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Х2 представляет собой R.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Х3 представляет собой Υ.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Х4 представляет собой K.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Х5 представляет собой N.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Х6 представляет собой R.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Х7 представляет собой V.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Х8 представляет собой А.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Х9 представляет собой S.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Х10 представляет собой R.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Х11 представляет собой K.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Х13 представляет собой R.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Х14 представляет собой А.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Χ15 представляет собой K.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой X16 представляет собой F.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, в которой Х17 представляет собой K.
В отдельном варианте осуществления проникающий в клетку пептид согласно изобретению представляет собой определенную выше последовательность SEQ ID NO: 6, при этом аминокислота в положении, эквивалентном положению 12 относительно SEQ ID NO: 6, является Ser (S).
В более конкретном аспекте указанный проникающий в клетку пептид содержит аминокислотную последовательность, содержащую SEQ ID NO: 7, в которой
Χ1 представляет собой K или R
Х2 представляет собой R или K
Х3 представляет собой Y, W, или F
Х4 представляет собой K или R
Х5 представляет собой N или Q
Х6 представляет собой R или K
Х7 представляет собой V, I, M или L
X8 представляет собой А или G
Х9 представляет собой S или Τ
Х10 представляет собой R или K
Х11 представляет собой K или R
Х13 представляет собой R или K
Х14 представляет собой А или G
Χ15 представляет собой K или R
X16 представляет собой F, Y или W
Х17 представляет собой K или R.
В частности, проникающий в клетку пептид согласно изобретению имеет аминокислотную последовательность, содержащую или состоящую из SEQ ID NO: 1 или SEQ ID NO: 2.
В другом варианте осуществления проникающий в клетку пептид согласно изобретению имеет аминокислотную последовательность, содержащую или состоящую из SEQ ID NO: 1.
В другом варианте осуществления изобретение имеет отношение к проникающему в клетку пептиду, содержащему или состоящему из аминокислотной последовательности SEQ ID NO: 8.
В другом отдельном варианте осуществления указанный проникающий в клетку пептид содержит или состоит из аминокислотной последовательности SEQ ID NO: 9.
В другом варианте осуществления изобретение имеет отношение к проникающему в клетку пептиду, содержащему или состоящему из аминокислотной последовательности SEQ ID NO: 10.
Специалисту ясно, что первичная аминокислотная последовательность проникающего в клетку пептида изобретения может быть дополнительно пост-трансляционно модифицирована, например, путем гликозилирования или фосфорилирования, без отклонения от сущности изобретения.
В дополнительном варианте осуществления проникающий в клетку пептид согласно изобретению необязательно дополнительно содержит, в дополнение к его аминокислотной последовательности, как описано выше, что-либо из числа или любую комбинацию из:
(i) клеточного сигнала внутриядерной локализации (NLS). Такие сигналы хорошо известны специалисту и описаны в Nair et al. (2003, Nucleic Acids Res. 31(1): 397-399)
(ii) направленный (нацеленный) пептид, включая опухолевые хоминг-пептиды, например, такие, которые описаны в Kapoor et al. (2012, PLoS ONE 7(4): e35187) и перечисленные в-http://crdd.osdd.net/raghava/tumorhope/general.php?
В другом варианте осуществления проникающий в клетку пептид согласно изобретению связан с карго-молекулой и способствует клеточной интернализации указанной карго-молекулы.
Таким образом, другой аспект изобретения имеет отношение к комплексу, содержащему проникающий в клетку пептид согласно изобретению и карго-молекулу.
Карго-молекула может быть связана или с С-концевой частью или с N-концевой частью проникающего пептида согласно изобретению.
В отдельном варианте осуществления карго-молекула, которая связана с проникающим пептидом согласно изобретению или которая содержится в комплексе согласно изобретению может быть выбрана из группы, состоящей из: (i) пептида, полипептида или протеина, (ii) полисахарида, (iii) липида, (iv) липопротеина, (v) гликолипида, (vi) нуклеиновой кислоты, (vii) низкомолекулярного лекарственного средства или токсина и (viii) визуализирующего или контрастного вещества.
Понятно, что карго-молекула может содержать более чем один пептид, полипептид или протеин, более чем один полисахарид, более чем один липид, более чем один липопротеин, более чем один гликолипид, более чем одну нуклеиновую кислоту, более чем одно низкомолекулярное лекарственное средство или токсин, более чем одно визуализирующее или контрастное вещество или их комбинацию.
В дополнительном варианте осуществления карго-молекулу, которая связана с проникающим пептидом согласно изобретению или которая содержится в комплексе согласно изобретению выбирают из числа эпитопов патогенов и/или опухолевых эпитопов.
Один вариант осуществления касается комплекса, содержащего проникающий в клетку пептид согласно изобретению и карго-молекулу, при этом указанная карго-молекула является пептидом, полипептидом или белком.
Примеры карго-молекул пептидного, полипептидного или белкового происхождения, пригодные в изобретении, включают эпитопы, антитела, фрагменты антител, терапевтические белки, факторы транскрипции, трансактиваторы и пептиды-ловушки. Например, карго-молекула может содержать CD4+ эпитоп(ы) и/или CD8+ эпитопы, соответствующие антигенной детерминанте(ам) опухоль-ассоциированного антигена, опухоль-специфического антигена или антигенного белка патогена. CD4+ эпитопы, содержащиеся в полипептиде изобретения, в большинстве случаев и предпочтительно состоят примерно из 12-25 аминокислот. Они могут также состоять примерно из 8-25 аминокислот или примерно из 6-100 аминокислот. CD8+ эпитопы, содержащиеся в полипептиде изобретения, как правило, и предпочтительно, состоят примерно из 8-11 аминокислот. Они также могут состоять примерно из 8-15 аминокислот или примерно из 6-100 аминокислот.
В отдельном варианте осуществления комплекс согласно изобретению содержит карго-молекулу, выбранную из эпитопов, антител, фрагментов антител, терапевтических белков, факторов транскрипции, трансактиваторов и пептидов-ловушек.
В более конкретном варианте осуществления комплекс согласно изобретению включает карго-молекулу, содержащую один или более эпитопов, которые могут быть опухолевыми эпитопами и/или эпитопами патогенов, как определено в описании.
В отдельном варианте осуществления комплекс согласно изобретению включает карго-молекулу, содержащую эпитоп(ы) опухоль-ассоциированного антигена, опухоль-специфический антиген и/или антигенный белок патогена, включая антигенный белок вируса, бактерии, грибка, простейшего и многоклеточного паразита.
В отдельной иллюстрации изобретения указанные эпитопы презентируются на клеточной поверхности в контексте МНС класса I и/или МНС класса II.
Примеры карго-молекул в пределах категории пептида, полипептида или протеина включают комбинацию нескольких эпитопов глиомы, таких как, эпитопы, описанные в Novellino et al. (2005, Cancer Immunol Immunother, 54(3): 187-207), Vigneron et al. (2013, Cancer Immun. 13:15).
В другом аспекте изобретения все указанные эпитопы глиомы не являются связанными с тем же самым проникающим пептидом, который мог бы образовать единый комплекс согласно изобретению, но являются связанными, или по отдельности или группами, по меньшей мере, из 2 эпитопов, с независимыми проникающими пептидами согласно изобретению, образуя, по меньшей мере, 2 отдельных комплекса согласно изобретению.
В предпочтительном варианте осуществления комплекс согласно изобретению содержит проникающий в клетку пептид и эпитопы и обеспечивает транспорт и презентирование указанных эпитопов на клеточной поверхности антиген-презентирующих клеток в контексте МНС класса I и МНС класса II, и, таким образом, может использоваться для вакцинации и иммунотерапии.
В отдельном аспекте комплекс согласно изобретению содержит спейсер или линкер, который является неиммунологической расщепляемой молекулой, связывающей проникающий в клетку пептид и карго-молекулу, и/или связывающей последовательные эпитопы, содержащиеся в пептидной, полипептидной или белковой карго-молекуле, и/или связывающей последовательные карго-молекулы, и/или располагается на С-концевой части карго-молекулы.
Указанный спейсер может быть пептидным или непептидным, связь между двумя компонентами комплекса согласно изобретению может быть ковалентной связью или нековалентной связью.
Пептидный спейсер, например, может состоять примерно из 1, 2, 3, 4,·5, 6, 7, 8, 9 или 10 аминокислот. Аминокислотная последовательность пептидного спейсера может быть идентичной последовательности N-концевой или С-концевой фланкирующей области карго-молекулы или эпитопа указанной карго-молекулы. Альтернативно, пептидный спейсер может состоять из искусственных аминокислотных последовательностей, таких как аминокислотная последовательность, возникающая в результате консервативных аминокислотных замен указанных природных фланкирующих областей, или последовательностей известных сайтов расщепления протеазами, таких как сайт-мишень энтерокиназы (аминокислотная последовательность DDDK, SEQ ID NO: 15), сайт-мишень фактора Ха (аминокислотная последовательность IEDGR, SEQ ID NO: 16), сайт-мишень тромбина (аминокислотная последовательность LVPRGS, SEQ ID NO: 17), сайт-мишень протеазы TEV (аминокислотная последовательность ENLYFQG, SEQ ID NO: 18), сайт-мишень PreScission протеазы (аминокислотная последовательность LEVLFQGP, SEQ ID NO: 19), поликатионные аминокислоты, например, поли K, сайт-мишень фурина (аминокислотная последовательность RX(R/K)R, SEQ ID NO: 20). В отдельном варианте осуществления пептидный спейсер не содержит остатков Cys (С).
Непептидный спейсер может включать сложные эфиры, сложные тиоэфиры или дисульфиды.
В отдельном аспекте комплекс согласно изобретению содержит спейсер или линкер, в частности, пептидный спейсер, размещенный между последовательностью проникающего пептида и пептидной, полипептидной или белковой карго-молекулой. Этот пептидный спейсер может быть выбран специалистом в данной области так, чтобы он мог быть «отрезан» клеточным аппаратом сразу после того, как комплекс, содержащий проникающий в клетку пептид и карго-молекулу, интернализуется, таким образом, освобождая карго-молекулу от проникающего пептида в клетке, органелле или на клеточной поверхности.
В более конкретном аспекте указанный спейсер, соединяющий проникающий в клетку пептид и пептидную, полипептидную или белковую карго-молекулу, или смежный эпитоп пептидной, полипептидной или белковой карго-молекулы, может состоять примерно из 1, 2, 3, 4 или 5 аминокислот, которые соответствуют примерно 1, 2, 3, 4 или 5 аминокислотам фланкирующей области указанной карго-молекулы или смежного эпитопа.
В том случае, когда карго-молекула содержит несколько эпитопов, специалисту в данной области техники понятно, что каждый из эпитопов, содержащихся в комплексе изобретения может быть или непосредственно связан с другим или связан через спейсеры или линкеры, такие как пептидный спейсер, состоящий из нескольких аминокислот. Альтернативно, в том случае, когда карго-молекула содержит несколько эпитопов, также возможно, что некоторые эпитопы, содержащиеся в комплексе изобретения, являются непосредственно связанными друг с другом, или некоторые другие эпитопы связываются через спейсеры или линкеры, такие как пептидный спейсер, состоящий из нескольких аминокислот.
В отдельном аспекте изобретения два последовательных эпитопа, содержащиеся в пептидной, полипептидной или белковой карго-молекуле изобретения, являются связанными друг с другом спейсерами, состоящими из природных фланкирующих областей указанных эпитопов. Согласно одному варианту осуществления спейсер, использованный для соединения первого эпитопа со вторым эпитопом, состоит примерно из 8 аминокислот, соответствующих примерно 4 аминокислотам N-концевой или С-концевой фланкирующей области первого эпитопа, за которыми следует примерно 4 аминокислоты N-концевой или С-концевой фланкирующей области второго эпитопа. В примере настоящего изобретения спейсер, использованный для соединения первого эпитопа ("эпитоп 1") со вторым эпитопом ("эпитоп 2"), состоит примерно из 8 аминокислот в соответствии с любой возможной комбинацией в пределах: от 0 фланкирующих аминокислот эпитопа 1 и 8 фланкирующих аминокислот эпитопа 2 до 8 фланкирующих аминокислот эпитопа 1 и 0 фланкирующих аминокислот эпитопа 2, т.е. включая 1 фланкирующую аминокислоту эпитопа 1 и 7 фланкирующих аминокислот эпитопа 2, 2 фланкирующих аминокислоты эпитопа 1 и 6 фланкирующих аминокислот эпитопа 2, 3 фланкирующих аминокислоты эпитопа 1 и 5 фланкирующих аминокислот эпитопа 2, 4 фланкирующих аминокислоты эпитопа 1 и 4 фланкирующих аминокислоты эпитопа 2, 5 фланкирующих аминокислот эпитопа 1 и 3 фланкирующих аминокислоты эпитопа 2, 6 фланкирующих аминокислот эпитопа 1 и 2 фланкирующих аминокислоты эпитопа 2, 7 фланкирующих аминокислот эпитопа 1 и 1 фланкирующую аминокислоту эпитопа 2, 8 фланкирующих аминокислот эпитопа 1 и 0 фланкирующих аминокислот эпитопа 2. Следует понимать, что общее количество 8 аминокислот, составляющих спейсер, соединяющий два последовательных эпитопа, не является абсолютным значением, и спейсер также может состоять в целом, например, из 3 аминокислот, 4 аминокислот, 5 аминокислот, 6 аминокислот, 7 аминокислот, 9 аминокислот или 10 аминокислот. Аналогично, равноценные комбинации, как упомянуто выше, также являются иллюстрацией изобретения в ситуации, когда спейсер имеет меньше или больше, чем 8 аминокислот.
В другой конкретной иллюстрации настоящего изобретения спейсер, использованный для соединения первого эпитопа ("эпитоп 1") со вторым эпитопом ("эпитоп 2"), состоит примерно из 4 аминокислот, например, 1, 2, 3, 4 или 5 аминокислот. Конкретнее, указанная аминокислотная последовательность спейсера может соответствовать 4 аминокислотам N-концевой или С-концевой фланкирующей области эпитопа 1 или эпитопа 2.
Описанный выше спейсер может также располагаться на С-концевой части последнего эпитопа, содержащегося в карго-молекуле.
Примеры пептидного спейсера включают, например, аминокислотные последовательности EQLE (SEQ ID NO: 11) или TEWT (SEQ ID NO: 12), или любые их консервативные замены.
Другой вариант осуществления касается комплекса, содержащего проникающий в клетку пептид согласно изобретению и карго-молекулу, при этом указанная карго-молекула представляет собой полисахарид, липид, липопротеин и/или гликолипид, в частности, эпитоп полисахарида, липида, липопротеина и/или гликолипид а, который может быть эпитопом патогена, как определено в описании.
В отдельном примере, комплекс согласно изобретению содержит карго-молекулу, содержащую эпитоп(ы) полисахарида, липида, липопротеина и/или гликолипида антигена патогена, включая вирусные, бактериальные, грибковые антигены и антигены простейших и многоклеточных паразитов.
В отдельном примере изобретения указанные эпитопы будут презентироваться на клеточной поверхности в контексте МНС класса I и/или МНС класса II.
В другом примере изобретения указанные липидные эпитопы будут презентироваться на клеточной поверхности в контексте CD1 (кластер дифференцировки 1).
Другой вариант осуществления предоставляет комплекс, содержащий проникающий в клетку пептид согласно изобретению и карго-молекулу, при этом указанная карго-молекула представляет собой низкомолекулярное лекарственное средство или токсин.
Примеры карго-молекул в пределах категории низкомолекулярных лекарственных средств или токсинов, пригодных в изобретении, включают циклоспорин А, паклитаксел, доксорубицин, метотрексат, 5-аминолевулиновую кислоту, дифтерийный токсин, сунитиниб и молекулы, рассмотренные в De wit Amer (2010, Neuro Oncol, 12(3): 304-16).
Другой вариант осуществления предоставляет комплекс, содержащий проникающий в клетку пептид согласно изобретению и карго-молекулу, при этом указанная карго-молекула представляет собой визуализирующее или контрастное вещество.
Примеры карго-молекул в пределах категории визуализирующих или контрастных веществ, пригодных в изобретении, включают флюорофоры, квантовые точки (QDs), хелаты металлов, такие как низкомолекулярные хелатные соединения гадолиния (Gd3+), суперпарамагнитную окись железа (SPIO), радиоактивные индикаторы.
Другой вариант осуществления предоставляет комплекс, содержащий проникающий в клетку пептид согласно изобретению и карго-молекулу, при этом карго-молекула является нуклеиновой кислотой.
Примеры нуклеиновокислотных карго-молекул, пригодных в изобретении включают ДНК, РНК, миРНК, кшРНК, антисмысловые олигонуклеотиды, ДНК-ловушку, плазмиды, микроРНК.
Другой вариант осуществления предоставляет комплекс, содержащий проникающий в клетку пептид согласно изобретению и карго-молекулу, при этом карго-молекула является нуклеиновой кислотой, кодирующей пептид, полипептид или протеин, в частности, кодирующей пептид, полипептид или протеин, содержащий эпитопы.
Примеры карго-молекул в пределах категории нуклеиновых кислот включают нуклеиновую кислоту, кодирующую пептидную, полипептидную или белковую карго-молекулу согласно изобретению. Конкретным примером является нуклеиновая кислота, кодирующая эпитопы, содержащиеся в пептидной, полипептидной или белковой карго-молекуле согласно изобретению. Другим примером является нуклеиновая кислота, кодирующая комбинацию нескольких эпитопов глиомы, например, описанных в Reardon et al (2013, Expert Rev Vaccines, 12(6): 597-615).
В другом предпочтительном варианте осуществления комплекс согласно изобретению содержит проникающий в клетку пептид и нуклеиновую кислоту, кодирующую эпитопы, и обеспечивает возможность транспорта указанной нуклеиновой кислоты в клетку. Затем внедренная (трансдуцированная) нуклеиновая кислота может транскрибироваться и транслироваться с целью продуцирования указанных эпитопов в клетке, которые в свою очередь презентируются на клеточной поверхности антиген-презентирующих клеток в контексте МНС класса I и МНС класса II. Поэтому такой комплекс полезен для вакцинации и иммунотерапии.
В одном варианте осуществления изобретения карго-молекула может быть ковалентно или нековалентно связана с проникающим пептидом согласно изобретению, включая связь посредством пептидного спейсера, описанного выше.
Методы соединения проникающего пептида согласно изобретению и карго-молекулы широко освещены в литературе и могут зависеть от природы карго-молекулы. Например, связывание карго-молекулы и проникающего пептида может обеспечиваться расщепляемыми дисульфидными связями, полученными с помощью полного ступенчатого твердофазного синтеза или путем жидкофазного или твердофазного соединения фрагментов, устойчивой амидной, тиазолидиновой, оксимовой и гидразиновой связью, дисульфидной связью, устойчивой тиомалеимидной связью, пептидной связью (включая пептидные связи между аминокислотами гибридного белка), или электростатическими или гидрофобными взаимодействиями.
Полинуклеотиды, кодирующие пептидные и белковые комплексы согласно изобретению
Другой аспект изобретения имеет отношение к полинуклеотидам, кодирующим проникающий в клетку пептид или комплекс, содержащий пептидную, полипептидную или белковую карго-молекулу согласно изобретению.
В одном варианте осуществления изобретение имеет отношение к нуклеиновой кислоте, кодирующей проникающий в клетку пептид согласно изобретению или кодирующей комплекс, содержащий указанный проникающий в клетку пептид, ковалентно связанный с пептидной, полипептидной или белковой карго-молекулой, возможно посредством пептидного спейсера(ов), как описано в данном документе.
В дополнительном варианте осуществления изобретение имеет отношение к нуклеиновой кислоте, кодирующей проникающий в клетку пептид согласно изобретению или комплекс, кодирующий указанный проникающий в клетку пептид, ковалентно связанный с пептидом, полипептидом или белковой карго-молекулой, содержащей по меньшей мере, один эпитоп, возможно посредством пептидного спейсера(ов), как описано в данном документе.
В еще одном дополнительном варианте осуществления изобретение имеет отношение к нуклеиновой кислоте, кодирующей пептидную, полипептидную или белковую карго-молекулу согласно изобретению, содержащую, по меньшей мере, один эпитоп.
Получение и очистка проникающего пептида или комплексов согласно изобретению
Другой аспект изобретения предоставляет рекомбинантный вектор, содержащий полинуклеотид согласно изобретению.
Могут быть использованы многочисленные системы экспрессии, включая без ограничения, хромосомы, эписомы и полученные из вирусов. Конкретнее, используемые рекомбинантные векторы могут быть получены из бактериальных плазмид, транспозонов, эписом дрожжей, перемещающихся встроенных элементов, элементов хромосом дрожжей, вирусов, таких как бакуловирус, папиллома вирус, такой как V40, вирусы осповакцины, аденовирусы, лисьи поксвирусы, вирусы псевдобешенства, ретровирусы.
Эти рекомбинантные векторы в равной степени могут быть производными космиды или фагмиды. Нуклеотидная последовательность может быть вставлена в рекомбинантный вектор экспрессии с помощью хорошо известных специалистам в данной области техники методов, например, таких, которые описаны в MOLECULAR CLONING: A LABORATORY MANUAL, Sambrook et al., 4th Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 2001.
Рекомбинантный вектор может включать нуклеотидные последовательности, которые контролируют регуляцию экспрессии полинуклеотида, а также нуклеотидные последовательности, обеспечивающие экспрессию и транскрипцию полинуклеотида изобретения и трансляцию полипептида изобретения, эти последовательности выбирают в соответствии с используемыми клетками-хозяевами.
Таким образом, например, соответствующий сигнал секреции может быть интегрирован в рекомбинантный вектор так, что полипептид, кодированный полинуклеотидом изобретения, будет направляться к просвету эндоплазматического ретикулума, по направлению к периплазматическому пространству, на мембрану или по направлению к внеклеточному пространству. Выбор соответствующего сигнала секреции может облегчить последующую очистку белка.
В дополнительном варианте осуществления предоставляется клетка-хозяин, содержащая рекомбинантный вектор согласно изобретению.
Введение рекомбинантного вектора в клетку-хозяина может осуществляться с помощью хорошо известных специалистам в данной области методов, например, описанных в BASIC METHODS IN MOLECULAR BIOLOGY, Davis et al., 2nd ed., McGraw-Hill Professional Publishing, 1995, and MOLECULAR CLONING: A LABORATORY MANUAL, выше, таких как кальций-фосфатная трансфекция, трансфекция DEAE декстраном, трансфекция, микроинъекция, трансфекция посредством катионных липидов, электропорация, трансдукция или инфекция.
Клетка-хозяин может представлять собой, например, бактериальную клетку, такую как Е.coli, клетки грибов, такие как дрожжевые клетки и клетки Aspergillus, Streptomyces, клетки насекомых, клетки яичника китайского хомячка (СНО), линия мышиных клеток С127, линия клеток ВНК сирийского хомяка, клетки первичной почки человека 293 (HEK 293).
Клетка-хозяин может использоваться, например, для экспрессии полипептида изобретения. После очистки стандартными способами полипептид изобретения может использоваться в способе, описанном далее.
Дополнительным вариантом осуществления изобретения является предоставление способа получения проникающего пептида согласно изобретению или комплекса, содержащего указанный проникающий в клетку пептид, ковалентно связанный с пептидной, полипептидной или белковой карго-молекулой согласно изобретению, включающего культивирование упомянутой выше клетки-хозяина в культуральной среде и отделение указанного проникающего пептида или комплекса из культуральной среды или отделение указанного проникающего пептида или комплекса из лизата клеток-хозяев после лизиса клеток-хозяев.
В другом варианте осуществления проникающие пептиды и комплексы согласно изобретению могут быть получены методами синтетической химии, такими как твердофазный синтез пептидов. Очистка этих пептидов может осуществляться любыми методами, известными в данной области техники, предназначенными для очистки протеина/пептида. Типичные методы включают ионообменную хроматографию, хроматографию гидрофобного взаимодействия и иммуноаффинный метод.
Дополнительным вариантом осуществления изобретения является предоставление способа получения проникающего пептида согласно изобретению, содержащего химически синтезированный и очищенный указанный пептид.
Другим дополнительным вариантом осуществления изобретения является предоставление способа получения комплекса согласно изобретению, содержащего проникающий в клетку пептид, ковалентно связанный с пептидной, полипептидной или белковой карго-молекулой, как определено в данном документе, при этом способ включает химический синтез и очистку полипептида, аминокислотная последовательность которого содержит аминокислотную последовательность указанного проникающего пептида и аминокислотную последовательность указанной пептидной, полипептидной или белковой карго-молекулы.
В другом варианте осуществления способ согласно изобретению включает синтез проникающего пептида и карго-молекулы по отдельности, и или смешивание очищенных пептида и карго-молекулы или ковалентное связывание указанного пептида и карго-молекулы.
Клетки, нагруженные комплексами согласно изобретению
Другой аспект изобретения имеет отношение к клеткам, нагруженным комплексом согласно изобретению. В отдельном варианте осуществления клетки являются клетками, полученными от пациента, которого предполагается лечить.
В дополнительном варианте осуществления клетки являются клетками иммунной системы, такими как антиген-презентирующие клетки или стволовые клетки, такие как нейтральные стволовые клетки.
В одном варианте осуществления предоставляются антиген-презентирующие клетки, нагруженные комплексом согласно изобретению.
В отдельном варианте осуществления антиген-презентирующие клетки выбирают из числа дендритных клеток, макрофагов и В-клеток. Предпочтительными являются дендритные клетки, в частности дендритные клетки (обычные и плазмоцитоидные), полученные от пациента, которого предполагается лечить.
Методы получения антиген-презентирующих клеток, в частности, дендритных клеток пациента, хорошо известны специалистам. Они включают сбор моноцитов или гематопоэтических стволовых клеток из костного мозга, пуповинной крови или периферической крови. Они также включают использование эмбриональных стволовых клеток (ES) и индуцированных плюрипотентных стволовых клеток (iPS). Антиген-презентирующие клетки, в частности дендритные клетки или их предшественники, могут быть обогащены методами, включающими элютриацию и отделение с использованием магнитного микроносителя, которые могут затрагивать накопление CD14+ клеток-предшественников.
Методы «загрузки» комплекса изобретения в клетки, в частности в упомянутые выше антиген-презентирующие клетки, и дальнейшая подготовка таких клеток до введения пациенту известны специалисту в данной области техники. Получение дендритных клеток может включать их культивирование или дифференцировку с использованием цитокинов, которые могут включать GM-CSF и IL-4. Также могут использоваться линии дендритных клеток. Загрузка комплекса изобретения в клетки, в частности в дендритные клетки, может включать совместную инкубацию культуры клеток с комплексом изобретения, пользуясь присущими свойствами проникающего пептида изобретения (т.е. его способностью к интернализации). Дальнейшее культивирование загруженных таким образом дендритных клеток с целью индуцировать эффективное созревание может включать добавление цитокинов, включая IL-1β, IL-6, TNFα, PGE2, IFNα, и адьювантов, которые могут включать поли-IC, поли-ICLC (т.е. комплекс синтеза карбоксиметилцеллюлозы, полиинозиновой-полицитидиловой кислоты и поли-L-лизиновой двухцепочечной РНК), и других агонистов TLR (toll-подобные рецепторы) и NLR (рецепторы, подобные нуклеотид-связывающему олигомеризационному домену).
Следующий аспект касается визуализации клеток, служащих для клеточной терапии, таких как стволовые клетки, дендритные клетки, Т-клетки или натуральные киллеры, нагруженных комплексом согласно изобретению, при этом карго-молекула является визуализирующим веществом.
Кроме того, целью изобретения является предоставление способа получения клеток, в частности, антиген-презентирующих клеток, нагруженных упомянутым выше комплексом согласно изобретению, включающего трансдукцию указанных клеток комплексом изобретения, культивирование указанных клеток в культуральной среде и отделение указанных клеток от культуральной среды.
В отдельном варианте осуществления клетки нагружаются комплексом(ами), содержащим карго-молекулу, при этом указанную карго-молекулу выбирают из числа (i) пептида, полипептида или протеина или (ii) нуклеиновой кислоты.
В другом варианте осуществления изобретения клетки нагружаются комплексом(ами), содержащим эпитопы согласно изобретению, причем указанные эпитопы презентируются на клеточной поверхности в контекстах МНС класса I и МНС класса II.
Композиции и наборы согласно изобретению
Изобретение предоставляет композиции, содержащие, по меньшей мере, один компонент, выбранный из числа:
(i) проникающего в клетку пептида изобретения,
(ii) комплекса изобретения,
(iii) нуклеиновой кислоты изобретения,
(iv) вектора изобретения,
(v) клеток-хозяев изобретения, и
(vi) клеток, нагруженных комплексом согласно изобретению.
В отдельном варианте осуществления композиция изобретения содержит более чем один из компонентов по пунктам (i)-(vi).
В одном примере изобретения композиция содержит, по меньшей мере, два разных пептида по пункту (i), по меньшей мере, два разных комплекса по пункту (ii), по меньшей мере, две разных нуклеиновых кислоты по пункту (iii), по меньшей мере, два разных вектора по пункту (iv), по меньшей мере, две разных клетки-хозяина по пункту (v) и/или по меньшей мере, две разные клетки по пункту (vi).
В другом примере композиция изобретения содержит, по меньшей мере, два разных комплекса и/или, по меньшей мере, две разные нуклеиновые кислоты согласно изобретению.
В частности, композиция изобретения может содержать более, чем один комплекс согласно изобретению, например, по меньшей мере, два комплекса, при этом каждый комплекс содержит одну или более карго-молекул, и при этом указанные карго-молекулы различаются между комплексами.
В одном примере композиция изобретения содержит, по меньшей мере, 2 комплекса, при этом каждый комплекс содержит один или более эпитопов, и при этом указанные эпитопы различаются между комплексами.
В другом примере композиция изобретения содержит, по меньшей мере, 2 комплекса, при этом каждый комплекс содержит одну или более нуклеиновую кислоту, кодирующую один или более эпитопов, и при этом указанные нуклеиновые кислоты различаются между комплексами.
Настоящее изобретение также предоставляет комплекс или клетки, нагруженные указанным комплексом, как описано в документе, предназначенные для использования в качестве медикамента, в частности, в качестве вакцины.
В отдельном варианте осуществления настоящее изобретение предоставляет комплекс или клетки, нагруженные указанным комплексом, как описано в документе, предназначенные для использования при лечении болезней или нарушений, включая рак, инфекционные болезни, аутоиммунные нарушения и отторжение трансплантата.
В другом варианте осуществления настоящее изобретение предоставляет комплекс или клетки, нагруженные указанным комплексом, как описано в документе, предназначенные для использования в качестве визуализирующей или диагностической композиции.
Изобретение также предоставляет визуализирующую композицию или диагностическую композицию, содержащую комплекс согласно изобретению или клетки, нагруженные указанным комплексом, как описано в документе.
Изобретение предоставляет фармацевтические композиции, в частности, вакцинные композиции, и способы лечения субъекта, предпочтительно, млекопитающего, и наиболее предпочтительно человека, который подвержен действию или страдает от болезни, и в частности, нарушения, которое можно лечить с помощью иммунотерапии, такого как рак, инфекционные болезни, аутоиммунные нарушения и отторжение трансплантата.
Фармацевтические композиции, в частности, вакцинные композиции, согласно изобретению могут быть введены в виде фармацевтического состава, содержащего проникающий в клетку пептид или комплекс согласно изобретению в любой описанной здесь форме.
Фармацевтические композиции, в частности вакцинные композиции, согласно изобретению также могут быть введены в виде фармацевтического состава, содержащего антиген-презентирующие клетки, нагруженные комплексом согласно изобретению, в любой форме, описанной в данном документе.
Композиции согласно изобретению в сочетании с обычно используемым адьювантом (вспомогательным веществом), иммуномодулирующим веществом, носителем, разбавителем или эксципиентом могут быть заключены в стандартную лекарственную форму и могут использоваться в виде твердых лекарственных форм, предназначенных для перорального применения, таких как таблетки или наполненные капсулы, или в виде жидкостей, таких как растворы, суспензии, эмульсии, эликсиры или капсулы, наполненные теми же самыми компонентами, или в форме стерильных растворов для инъекций, предназначенных для парентерального введения (включая подкожное и внутрикожное введение) с помощью инъекций или длительных вливаний. Составы для инъекций, как правило, изготавливаются на основе стерильного солевого раствора для инъекций или фосфатно-буферного солевого раствора или других инъецируемых носителей, известных в данной области. Такие фармацевтические композиции и их стандартные лекарственные формы могут содержать ингредиенты в обычных соотношениях, с добавлением или без добавления дополнительных активных соединений или компонентов, при этом такие стандартные лекарственные формы могут содержать любое подходящее эффективное количество активного ингредиента в соответствии с предполагаемым ежедневным диапазоном доз.
Примеры подходящих адъювантов и/или иммуномодулирующих веществ включают MPL® (Corixa), минералы на основе алюминия, включая соединения алюминия (в общем называемые квасцами), ASO1-4, MF59, фосфат кальция, липосомы, иском, полиинозиновую:полицитидиловую кислоту (поли-IC), включая ее стабилизированную форму поли-ICLC (Hiltonol), CpG олигодезоксинуклеотиды, гранулоцитарно-макрофагально колониестимулирующий фактор (GM-CSF), липополисахарид (LPS), монтанид, полилактид-ко-гликолид (PLG), флагеллин, сапонины мыльного дерева (QS21), амино-алкильные глюкозамидные соединения (например, RC529), двухкомпонентные антибактериальные пептиды с синтетическими олигодезоксинуклеотидами (например, IC31), имиквимод, резиквимод, иммуностимулирующие последовательности (ISS), монофосфорил-липид A (MPLA), липопептид, стимулирующий фибробласты (FSL1), и анти-CD40 антитела.
Композиции изобретения могут быть жидкими композициями, включая, но не ограничиваясь этим, водные или масляные суспензии, растворы, эмульсии, сиропы и эликсиры. Композиции также могут быть созданы в виде сухого продукта, предназначенного для восстановления водой или другим подходящим разбавителем перед применением. Подобные жидкие препараты могут содержать вспомогательные вещества, включая, но не ограничиваясь этим, суспендирующие вещества, эмульгирующие вещества, неводные наполнители и консервирующие вещества. Суспендирующие вещества включают, но не ограничиваются этим, сорбитовый сироп, метилцеллюлозу, глюкозу/сахарный сироп, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, алюминиево-стеариновый гель и гидрогенезированные пищевые жиры. Эмульгирующие вещества включают, но не ограничиваются этим, лецитин, сорбитанмоноолеат и гуммиарабик. Консервирующие вещества включают, но не ограничиваются этим, метил или пропил р-гидроксибензоат и сорбиновую кислоту. Диспергирующие или увлажняющие вещества включают, но не ограничиваются этим, поли(этиленгликоль), глицерин, бычий сывороточный альбумин, Твин ®, Span®.
Композиции изобретения также могут быть созданы в виде депо-препарата, который может быть введен посредством имплантации или внутримышечной инъекции.
Твердые композиции этого изобретения могут иметь форму таблеток или пастилок, созданных обычным образом. Например, таблетки и капсулы, предназначенные для перорального приема, могут содержать общепринятые эксципиенты, включая, но не ограничиваясь этим, связывающие вещества, наполнители, смазывающие вещества, дезинтегрирующие вещества и увлажняющие вещества. Связывающие вещества включают, но не ограничиваются этим, сироп, гуммиарабик, желатин, сорбитол, трагакантовую камедь, крахмальную слизь и поливинилпирролидон. Наполнители включают, но не ограничиваются этим, лактозу, сахар, микрокристаллическую целлюлозу, кукурузный крахмал, фосфат кальция и сорбитол. Смазывающие вещества включают, но не ограничиваются этим, стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль и двуокись кремния. Дезинтегрирующие вещества включают, но не ограничиваются этим, картофельный крахмал и натрия крахмал гликолят. Увлажняющие вещества включают, но не ограничиваются этим, натрий лаурил сульфат. Таблетки могут быть покрыты в соответствии с известными в данной области техники способами.
Соединения этого изобретения также могут быть введены в формах с замедленным высвобождением или в виде систем доставки лекарств с замедленным высвобождением.
Согласно отдельному варианту осуществления композиции согласно изобретению предназначаются для подкожного применения.
В другом отдельном аспекте композиции согласно изобретению приспособлены для доставки путем повторяющегося введения.
Дополнительные материалы, а также методы изготовления композиции и тому подобное изложены в 5 части работы Remington's "The Science and Practice of Pharmacy", 22nd Edition, 2012, University of the Sciences in Philadelphia, Lippincott Williams & Wilkins, включенной в данное описание путем отсылки.
Другим аспектом изобретения является предоставление способа приготовления фармацевтической композиции согласно изобретению, включающего стадию смешивания проникающего пептида или комплекса согласно изобретению или клеток, в частности антиген-презентирующих клеток, нагруженных комплексом согласно изобретению, и фармацевтически приемлемого носителя.
Комплекс согласно изобретению, клетки, в частности, антиген-презентирующие клетки, нагруженные комплексом согласно изобретению, композиции согласно изобретению или способ согласно изобретению используются для предотвращения и/или лечения болезни или нарушения, в частности тех, которые можно лечить или предотвратить, используя иммунотерапию, таких как рак и инфекционные болезни.
В другом аспекте изобретение предоставляет визуализирующие или диагностические композиции. Еще один аспект касается способов доставки визуализирующего вещества и способов диагностирования болезни или нарушения у субъекта, предпочтительно млекопитающего, и наиболее предпочтительно человека, предположительно страдающего от болезни, и в частности, рака, инфекционной болезни, аутоиммунного нарушения и отторжения трансплантата.
Описанные в данном документе композиции и способы введения фармацевтических композиций также подходят для визуализирующих или диагностических композиций согласно изобретению.
В дополнительном аспекте настоящее изобретение также имеет отношение к состоящему из частей набору, содержащему, по меньшей мере, что-либо из числа:
(a) проникающий в клетку пептид согласно изобретению;
(b) комплекс согласно изобретению;
(c) нуклеиновая кислота согласно изобретению;
(d) вектор согласно изобретению;
(e) клетка-хозяин согласно изобретению;
(f) клетка, нагруженная комплексом согласно изобретению.
В отдельном варианте осуществления состоящий из частей набор изобретения содержит более чем один компонент по пунктам (а)-(f).
В одном примере изобретения состоящий из частей набор содержит, по меньшей мере, два разных пептида по пункту (а), по меньшей мере, два разных комплекса по пункту (b), по меньшей мере, две разных нуклеиновых кислоты по пункту (с), по меньшей мере, два разных вектора по пункту (d), по меньшей мере, две разных клетки-хозяина по пункту (е), и/или, по меньшей мере, две разных клетки по пункту (f).
В другом примере; состоящий из частей набор изобретения содержит, по меньшей мере, два разных комплекса и/или, по меньшей мере, две разные нуклеиновые кислоты согласно изобретению.
В частности, состоящий из частей набор изобретения может содержать более, чем один комплекс согласно изобретению, например, по меньшей мере, два комплекса, при этом каждый комплекс содержит одну или более карго-молекул, и при этом указанные карго-молекулы различаются между комплексами.
В одном примере, состоящий из частей набор изобретения содержит, по меньшей мере, 2 комплекса, при этом каждый комплекс содержит один или более эпитопов, и при этом указанные эпитопы различаются между комплексами.
В другом примере состоящий из частей набор изобретения содержит, по меньшей мере, 2 комплекса, при этом каждый комплекс содержит одну или более нуклеиновых кислот, кодирующих один или более эпитопов, и при этом указанные нуклеиновые кислоты различаются между комплексами.
Различные компоненты состоящего из частей набора могут быть упакованы в один или более контейнеров. Вышеупомянутые компоненты могут предоставляться в лиофилизированной или сухой форме или растворенными в подходящем буфере. Набор также может содержать дополнительные реагенты, включая, например, консервирующие вещества, ростовые среды и/или буферы для хранения и/или восстановления вышеуказанных компонентов, промывающие растворы и тому подобное. В другом варианте осуществления состоящий из частей набор согласно изобретению также содержит инструкции по применению.
Другим аспектом изобретения является прививочный набор, предназначенный для лечения, предотвращения или стабилизации рака или инфекционных болезней, содержащий фармацевтическую композицию согласно изобретению и инструкции в отношении применения указанной фармацевтической композиции.
В отдельном варианте осуществления композиции и/или состоящий из частей набор согласно изобретению предназначаются для применения в методах визуализации.
В другом варианте осуществления композиции и/или состоящий из частей набор согласно изобретению предназначаются для диагностирования болезни или нарушения, как упоминается по ходу настоящей заявки.
Применение и способы согласно изобретению
Один аспект изобретения обеспечивает способ доставки карго-молекулы в клетку in vitro, включающий стадию установления контакта указанной клетки с проникающим пептидом согласно изобретению и указанной карго-молекулой.
В - отдельном аспекте способ изобретения, направленный на доставку карго-молекулы в клетку in vitro, включает стадии:
a) образования комплекса между проникающим пептидом согласно изобретению и карго-молекулой, которая должна быть доставлена в клетку, и
b) установления контакта указанной клетки с комплексом, образованным на стадии а).
Другой аспект изобретения предоставляет in vitro способ доставки и презентирования эпитопов карго-молекулы на поверхности клетки в контексте МНС класса I и/или МНС класса II, включающий стадию установления контакта указанной клетки с проникающим пептидом согласно изобретению и указанной карго-молекулой.
В другом аспекте изобретение обеспечивает применение любого из числа: (i) комплекса изобретения, (ii) клеток, таких как антиген-презентирующие клетки, нагруженные комплексом изобретения, для приготовления медикамента, предназначенного для предотвращения, лечения или стабилизации таких болезней или нарушений, которые можно лечить с помощью иммунотерапии, включая рак, инфекционные болезни, аутоиммунные нарушения и отторжение трансплантата.
В предпочтительном варианте осуществления изобретения предоставляется комплекс согласно изобретению, содержащий проникающий в клетку пептид и эпитопы, обеспечивающий возможность транспорта и презентирования указанных эпитопов на клеточной поверхности антиген-презентирующих клеток в контексте МНС класса I и/или МНС класса II, предназначенный для использования при вакцинации и/или иммунотерапии.
Согласно другому аспекту изобретение предоставляет способ предотвращения, лечения или подавления таких болезней или нарушений, которые можно лечить с помощью иммунотерапии, включая рак, инфекционные болезни, аутоиммунные нарушения и отторжение трансплантата, при этом указанный способ включает введение чего-либо из числа: (i) комплекса изобретения, (ii) клеток, таких как антиген-презентирующие клетки, нагруженные комплексом изобретения, или (iii) фармацевтической композиции по пункту (i)-(ii) указанному субъекту.
Согласно другому варианту осуществления предоставляется способ индуцирования или улучшения иммунного ответа у субъекта против одного или нескольких эпитопов, зависящего от CD4+ хелперных Т-клеток и/или CD8+ цитотоксических Т-клеток, при этом указанный способ включает введение указанному субъекту чего-либо из числа: (i) комплекса изобретения, включающего карго-молекулу, содержащую один или несколько эпитопов, (ii) клеток, таких как антиген-презентирующие клетки, нагруженные комплексом изобретения, или (iii) фармацевтической композиции по пункту (i)-(ii).
Иммунный ответ, зависящий от CD4+ и/или CD8+ ответа, может быть оценен по воспалительному ответу, ответу провоспалительных цитокинов, включая увеличение экспрессии одного или более из числа мРНК IFN-γ, TNF-α и IL-2, или белка относительно уровня до введения соединений изобретения. Ответ также может быть определен по увеличению частоты или абсолютного количества антиген-специфических Т-клеток после введения соединений изобретения, измерен посредством окрашивания мультимера HLA-пептида, с помощью метода иммуноферментных пятен ELISPOT и реакций гиперчувствительности замедленного типа. Кроме того, ответ может быть опосредованно измерен по увеличению антиген-специфических антител в сыворотке, которые зависят от антиген-специфических Т-хелперных клеток.
Согласно другому варианту осуществления предоставляется способ индуцирования или улучшения иммунного ответа у субъекта против одного или нескольких эпитопов, ограниченных многочисленными молекулами МНС класса I и/или многочисленными молекулами МНС класса II, при этом указанный способ включает введение указанному субъекту чего-либо из числа: (i) комплекса изобретения, включающего карго-молекулу, содержащую один или несколько эпитопов, (ii) клеток, таких как антиген-презентирующие клетки, нагруженные комплексом изобретения, или (iii) фармацевтической композиции по пункту (i)-(ii).
Способ индуцирования или улучшения иммунного ответа у субъекта против нескольких эпитопов, ограниченных многочисленными молекулами МНС класса I и/или многочисленными молекулами МНС класса II, может быть оценен по ответу цитокинов, включая увеличение экспрессии одного или более из числа мРНК IFN-γ, TNF-α и IL-2, или белка относительно уровня до введения соединений изобретения после in vitro стимуляции Т-клеток специальными пептидами, связанными с отдельными молекулами МНС класса I и класса II на антиген-презентирующих клетках. Ограничение различными молекулами МНС также может быть подтверждено путем использования антиген-презентирующих клеток, экспрессирующих различные МНС молекулы, или использования МНС блокирующих антител. Также может быть проведена оценка по увеличению частоты или абсолютного количества антиген-специфических Т-клеток после введения соединений изобретения путем окрашивания мультимеров HLA-пептид, собранных с отдельными МНС молекулами.
В предпочтительном аспекте способов индуцирования или улучшения иммунного ответа против одного или нескольких эпитопов согласно изобретению иммунный ответ направлен против одного или нескольких эпитопов опухоль-ассоциированного антигена, например, такой комбинации эпитопов глиомы, которая описана в Novellino et al. (2005, Cancer Immunol Immunother, 54(3): 187-207) and Vigneron et al. (2013, Cancer Immun. 13:15).
В другом предпочтительном аспекте иммунный ответ направлен против нескольких эпитопов антигенного белка патогена.
В отдельном аспекте способов согласно изобретению указанные способы являются способами индуцирования или улучшения иммунного ответа у субъекта против одного или нескольких эпитопов, ограниченных молекулами МНС класса I и/или молекулами МНС класса II.
В другом аспекте изобретение обеспечивает применение чего-либо из числа: (i) комплекса изобретения, (ii) клеток, таких как антиген-презентируюшие клетки, нагруженные комплексом изобретения, для приготовления визуализирующей композиции, предназначенной для методов визуализации, или для приготовления диагностической композиции, предназначенной для постановки диагноза болезни или нарушения, соответственно. Болезни или нарушения, которые могут быть диагностированы с помощью изобретения, включают такие, которые можно лечить с помощью иммунотерапии, например, рак, инфекционные болезни, аутоиммунные нарушения и отторжение трансплантата.
Согласно другому аспекту изобретение предоставляет способ визуализии, при этом указанный способ включает использование, in vitro, ex vivo или in vivo, любого из числа: (i) комплекса изобретения, (ii) клеток, таких как антиген-презентирующие клетки, нагруженные комплексом изобретения, или (iii) фармацевтической композиции по пунктам (i)-(ii).
Согласно следующему аспекту изобретение предоставляет способ диагностирования болезни или нарушения у субъекта, при этом указанный способ включает введение любого из числа: (i) комплекса изобретения, (ii) клеток, таких как антиген-презентирующие клетки, нагруженные комплексом изобретения, или (iii) фармацевтической композиции по пунктам (i)-(ii), указанному субъекту или в образец указанного субъекта ex vivo.
В отдельном варианте осуществления способы применения изобретения включают введение комплекса согласно изобретению.
В другом варианте осуществления способы применения изобретения включают введение более чем одного комплекса, клеток или фармацевтической композиции согласно изобретению.
В одном примере применения способов изобретения, по меньшей мере, 2 комплекса используются или вводятся, при этом каждый комплекс содержит одну или более карго-молекул, а указанные карго-молекулы различаются между комплексами.
В другом примере применения способов изобретения, по меньшей мере, 2 комплекса используются или вводятся, при этом каждый комплекс содержит один или более эпитопов, и при этом указанные эпитопы различаются между комплексами.
В еще одном примере применения способов изобретения, по меньшей мере, 2 комплекса используются или вводятся, при этом каждый комплекс содержит одну или более нуклеиновых кислот, кодирующих один или более эпитопов, и при этом указанные нуклеиновые кислоты различаются между комплексами.
Примеры видов рака, подходящих для применения способов изобретения, включают рак мозга, рак предстательной железы, рак молочной железы, рак яичника, рак пищевода, рак легких, рак печени, рак почки, меланому, карциному кишечника, карциному легких, плоскоклеточную карциному головы и шеи, хронический миелоидный лейкоз, колоректальную карциному, карциному желудка, карциному эндометрия, миелоидный лейкоз, плоскоклеточную карциному легких, острый лимфобластный лейкоз, острый миелоцитарный лейкоз, рак мочевого пузыря, промиелоцитарный лейкоз, немелкоклеточную карциному легких, саркому.
Рак может представлять собой солидную опухоль, рак крови или рак лимфатической системы. Рак может быть доброкачественным или метастатическим.
Примеры инфекционных болезней, подходящих для применения способов изобретения включают болезни, вызванные вирусами, бактериями, грибами, простейшими и многоклеточными паразитами. Эти болезни включают, например, амебиаз, сибирскую язву, язву Бурули (Mycobacterium ulcerans), диарею, связанную с Caliciviruses, диарея, вызванную Campylobacter, рак шейки матки (Human papillomavirus), генитальные заболевания, вызванные Chlamydia trachomatis, холеру, конго-крымская геморрагическую лихорадку, лихорадку Денге, дифтерию, геморрагическую лихорадку Эбола, энтеротоксигенную диарею, вызванную Escherichia coli (ЕТЕС), рак желудка (Helicobacter pylori), гонорею, болезни, связанные со стрептококком группы А, болезни, связанные со стрептококком группы В, пневмонию и инвазивную болезнь, вызванную Haemophilus influenzae В, гепатит А, гепатит В, гепатит С, диарею при гепатите Е, генитальные язвы, вызванные вирусом Herpes simplex 2 типа, ВИЧ/СПИД, анкилостомидоз, грипп, японский энцефалит, лихорадку Ласса, лейшманиоз, лептоспироз, рак печени (Гепатит В), рак печени (Гепатит С), болезнь Лайма, малярию, геморрагическую лихорадку Марбург, краснуху, свинку, назофаренгиальный рак (вирус Эпштейна-Барр), менингит, вызванный менингококком Neisseria meningitidis, пневмонию, связанную с парагриппом, коклюш, чуму, полиомиелит, бешенство, пневмонию, вызванную респираторным синцитиальным вирусом (RSV), лихорадку долины Рифт, диарею, вызванную ротавирусом, коревую краснуху, шистосомоз, тяжелый острый респираторный синдром (SARS), шигеллез (бактериальная дизентерия), оспу, болезни, связанные с золотистым стафилококком, рак желудка (Helicobacter pylori), пневмонии и инвазионные болезни, вызванные стрептококком, столбняк, клещевой энцефалит, трахому, туберкулез, туляремию, брюшной тиф, болезнь, связанную с вирусом Западного Нила, желтую лихорадку.
В другом варианте осуществления способа изобретения клетки согласно изобретению являются антиген-презентирующими клетками, в частности, дендритными клетками, конкретнее дендритными клетками, полученными от субъекта, которого предполагается лечить.
Как правило, при лечении рака терапевтически эффективная доза полипептида согласно изобретению составляет примерно от 0.1 мг до 2 мг на инъекцию или примерно от мкмоль до 1 ммоль на инъекцию.
Как правило, при лечении рака терапевтически эффективная доза антиген-презентирующих клеток, нагруженных полипептидом согласно изобретению, составляет примерно от 0.2 миллионов клеток до 2 миллионов клеток на инъекцию.
Вводимая индивидууму дозировка, как в виде одной, так и в виде нескольких доз, будет варьировать в зависимости от целого ряда факторов, включая фармакокинетические свойства, состояние и характеристики пациента (пол, возраст, вес тела, состояние здоровья, размер), выраженности симптомов, сопутствующих видов лечения, периодичности лечения и желательного эффекта.
Способ введения
Соединения, составы, в частности вакцинные составы, и их композиции согласно этому изобретению могут вводиться любым способом, включая пероральное, парентеральное, внутривенное, ректальное введение или их сочетание. Парентеральное введение включает, но не ограничивается этим, внутривенное, внутриартериальное, внутрибрюшинное, подкожное, внутрикожное и внутримышечное. Композиции этого изобретения также могут быть введены местно, внутрь опухоли, интраназально или интранодально. Композиции этого изобретения также могут быть введены в виде имплантата, который обеспечивает медленное высвобождение композиций, а также медленное контролируемое внутривенное вливание.
Предпочтительно, соединения, композиции, в частности, вакцинные композиции, и их сочетания согласно изобретению вводятся подкожно.
В одном варианте осуществления введение комплекса, антиген-презентирующих клеток и композиций изобретения требует несколько последовательных инъекций. Таким образом, введение может повторяться, по меньшей мере, два раза, один раз в качестве первичной иммунизации и позже в качестве бустер-инъекции.
В отдельном варианте осуществления изобретения вакцинная композиция может вводиться повторно или в течение длительного времени. Вакцинная композиция может вводиться повторно или в течение периода, по меньшей мере, 1, 2, 3 или 4 недель; 2, 3, 4, 5, 6, 8, 10 или 12 месяцев; или 2, 3, 4 или 5 лет.
В другом варианте осуществления проникающий в клетку пептид и карго-молекула, образующие комплекс согласно изобретению, содержатся в отдельных композициях, которые смешиваются непосредственно перед введением или которые одновременно вводятся нуждающемуся в этом субъекту.
Комбинация
Согласно дополнительному варианту осуществления введение фармацевтических композиций при использовании способов согласно изобретению осуществляется отдельно или в сочетании с сопутствующим средством, подходящим для лечения и/или стабилизации болезни или нарушения, которое предполагается лечить или подавить.
Например, в случае лечения, предотвращения или стабилизации рака введение фармацевтических композиций при использовании способов согласно изобретению осуществляется в сочетании с химиотерапевтическими средствами, обычно применяемыми при борьбе с солидными опухолями, и средствами контроля за формированием метастазов или какой-либо другой молекулой, запускающей запрограммированную гибель клетки, например, средство для совместного применения выбирают из членов семейства некроза опухоли, включая, но без ограничения, Fas-лиганд и индуцирующий апоптоз лиганд (TRAIL), связанный с фактором некроза опухоли (TNF). Согласно дополнительному варианту осуществления введение фармацевтических композиций при использовании способов согласно изобретению может проводиться одновременно с рентгенотерапией.
Изобретение включает введение комплекса изобретения, клетки, нагруженной комплексом изобретения, или фармацевтической композиции согласно изобретению, при этом введение субъекту осуществляется до, одновременно или последовательно с другими терапевтическими режимами или совместными средствами, подходящими для лечения и/или стабилизации рака и/или предотвращения рецидива рака (например, несколько схем лекарственного лечения), в терапевтически эффективном количестве. Указанный комплекс, клетка или фармацевтическая композиция, которая вводится одновременно с сопутствующим средством, может быть введена в той же самой или другой композиции(ях) и тем же самым или другим способом(ами) введения.
Указанные иные терапевтические режимы или совместные средства могут быть выбраны из группы, состоящей из рентгенотерапии, химиотерапии, хирургического вмешательства, таргетной терапии (включая небольшие молекулы, пептиды и моноклональные антитела) и анти-ангиогенной терапии. Анти-ангиогенная терапия определяется в описании, как введение средства, которое прямо или опосредованно нацеливается на сосудистую систему опухоли.
Согласно одному варианту осуществления предоставляется фармацевтическая композиция, содержащая комплекс изобретения или клетку изобретения, в частности антиген-презентирующую клетку изобретения, в комбинации, по меньшей мере, с одним совместным средством, подходящим для лечения и/или стабилизации рака и/или предотвращения рецидива рака, и, по меньшей мере, один фармацевтически приемлемый носитель.
Согласно другому варианту осуществления изобретения соединения согласно изобретению и их фармацевтические композиции могут вводиться после хирургического вмешательства, связанного с удалением солидных опухолей, в качестве профилактики рецидива и/или метастазирования.
Согласно следующему варианту введение визуализирующей или диагностической композиции при применении способов согласно изобретению может проводиться отдельно или в комбинации со средством, пригодным для визуализации и/или диагностирования предполагаемой болезни или нарушения.
Пациенты
В зависимости от терапевтического эффекта карго-молекулы изобретение может применяться в отношении любого пациента, восприимчивого к или страдающего от какой-либо болезни или нарушения, которое может быть предотвращено, вылечено или уменьшено действием указанной карго-молекулы. В том случае, когда карго-молекула содержит эпитопы, терапевтическим эффектом указанной карго-молекулы может быть возбуждение иммунного ответа, направленного против указанных эпитопов, в частности, ответ, который зависит от CD4+ хелперных Т-клеток и/или CD8+ цитотоксических Т-клеток, и/или который ограничивается молекулами МНС класса I и/или молекулами МНС класса П.
В одном варианте осуществления пациенты согласно изобретению являются пациентами, восприимчивыми к или страдающими от рака, например, рака мозга, толстой кишки, рака головы и шеи или от рака шейки матки.
В отдельном варианте осуществления пациенты согласно изобретению являются пациентами, страдающими от рака мозга, включая глиому.
В отдельном варианте осуществления пациенты согласно изобретению подвергаются хирургическому удалению опухоли.
В другом варианте осуществления пациенты согласно изобретению являются пациентами, восприимчивыми к или страдающими от инфекционной болезни.
Приведенные в тексте ссылки полностью включаются в описание путем отсылки, объем настоящего изобретения не ограничиваются описанными в документе отдельными вариантами осуществления, которые предоставляются в качестве иллюстраций конкретных аспектов изобретения, причем функционально равноценные способы и компоненты включаются в объем изобретения. Безусловно, различные модификации изобретения, дополнительные относительно показанных и описанных в этом документе, станут понятны специалистам в данной области на основании вышеизложенного описания и прилагаемых чертежей. Такие модификации подпадают под действие прилагаемых пунктов формулы изобретения.
Следующие примеры описанного изобретения представлены для наглядности, но не для ограничения.
Примеры
Следующие примеры были выполнены с целью подтверждения эффективности некоторых фрагментов ZEBRA в качестве проникающих в клетку пептидов для доставки пептидов и белков в клетку и индуцирования иммунного ответа in vivo.
Следующие аббревиатуры соответственно обозначают:
ак (аминокислота), ч (час), мкл (микролитр), мкМ (микромолярный), мМ (миллимолярный), мг (миллиграмм), мин (минут), CFSE (карбоксифлуоресцеин сукцинимидил сложный эфир), ДК (дендритные клетки)
Пример 1: Получение гибридных полипептидов, содержащих СРР1 или СРР2 настоящего изобретения и карго-пептид овальбумин
Путем химического синтеза были получены два СРР и два гибридных полипептида, соответствующих конструкциям 1 и 2, которые включали, соответственно, один из СРР, происходящих от ZEBRA, и иммунодоминантный CD8+ Т-клеточный эпитоп овальбумина.
Аминокислотная последовательность этих СРР и гибридные полипептиды имели следующий вид:
СРР1: (всего 17 аминокислот)

СРР2: (всего 30 аминокислот)

Эпитоп овальбумина CD8 (всего 8 аминокислот)

Комплекс 1: Конструкция 1: содержащая СРР1, соединенный с эпитопом овальбумина CD8 (всего 33 аминокислоты)

Комплекс 2: Конструкция 2: содержащая СРР2, соединенный с эпитопом овальбумина CD8 (всего 46 аминокислот)
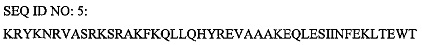
Пример 2: Доставка и ограниченное МНС класса I презентирование после загрузки CPP1-OVA или CPP2-OVA гибридных полипептидов согласно изобретению в дендритные клетки
Сначала возможность поглощения СРР1 и СРР2 антиген-презентирующими клетками вместе с процессированием и презентированием эпитопа овальбумина была протестирована in vitro. Каждая из конструкций 1 и 2 была добавлена в культуры дендритных клеток, полученных из костного мозга, которые потом «дозревали» в течение ночи в присутствии липополисахарида (LPS). Затем процессирование и презентирование эпитопа овальбумина на молекулах МНС класса I устанавливали в функциональном исследовании путем совместного культивирования дендритных клеток с овальбумин-специфическими CD8+ Т-клетками, полученными из селезенок ОТ1 трансгенных мышей.
ΟΤΙ CD8+ Т-клетки предварительно метили флуоресцентным красителем CFSE, который служит в качестве индикатора антиген-специфической пролиферации, поскольку он разбавляется при каждом клеточном делении. Через 5 дней совместной инкубации CD8+ ΟΤ1 Т-клеток и дендритных клеток, нагруженных каждой из конструкций 1 и 2, пролиферацию оценивали с помощью проточной цитометрии (Фигура 1).
Полипептиды, соответствующие конструкциям 1 и 2 были способны индуцировать сравнимую пролиферацию ОТ1 Т-клеток (93-96% Т-клеток пролиферировали, исходя из CFSE разбавления). Более того, жизнеспособность клеток в культурах также была сходной (69-75%). Наблюдалась сходная пролиферация, а жизнеспособность превосходила положительные контрольные культуры, в которые был добавлен синтетический пептид, соответствующий минимальному Т-клеточному эпитопу (SIINFEKL) (Фигуры 1С, 1D). Пролиферация также была овальбумин-специфической, так как незначительное количество жизнеспособных ОТ1 Т-клеток было обнаружено после отдельного культивирования или совместного культивирования с дендритными клетками без антигена (Фигуры 1А, 1В).
Пример 3: Вакцинация мышей гибридными полипептидами CPP1-OVA или CPP2-OVA настоящего изобретения
Способность полипептидов, соответствующих конструкциям 1 и 2, стимулировать антиген-специфические CD8+ Т-клетки в более строгих условиях была протестирована in vivo по протоколу вакцинации (Фигура 2). Для того, чтобы вызвать ответ in vivo, полипептид вакцины должен поглощаться естественным образом присутствующими у инъецируемого животного антиген-презентирующими клетками, а стимуляция поликлональных Т-клеток должна быть высокоэффективной в том случае, если овальбумин-специфические Т-клетки подлежат обнаружению ex vivo. В этих экспериментах результаты получали с помощью проточной цитометрии спленоцитов, используя мультимеры МНС-пептид для обнаружения овальбумин-специфических CD8+ Т-клеток.
После всего лишь 2 вакцинаций повышенная доля овальбумин-специфических CD8+ Т-клеток была обнаружена у двух вакцинированных групп (0.37-1.14% CD8+ Т-клеток были мультимер-положительными по сравнению с 0.18% у мышей, вакцинированных PBS (отрицательный контроль)). Пептид, соответствующий конструкции 2, был особенно эффективным in vivo, так как он активировал свыше 1% овальбумин-специфических CD8+ Т-клеток.
Заключение: В общем, эти данные подтверждают функциональные возможности СРР 1 и 2 в качестве проникающих в клетку пептидов. Данные также подтверждают, что полипептиды, соответствующие конструкциям 1 и конструкциям 2, которые содержат каждый из этих двух СРР, соответственно, и Т-клеточный эпитоп овальбумина, могут поглощаться дендритными клетками, и что карго-молекула (т.е. Т-клеточный эпитоп, содержащийся в конструкции) перекрестно презентируется CD8+ Т-клеткам in vitro и в контексте in vivo вакцинации.
Пример 4: Эксперимент по трансдукции IN VITRO разных CPP-OVA гибридных полипептидов изобретения
Была исследована трансдукция (перенос) в клетки при использовании различных CPP-OVA гибридных полипептидов, содержащих СРР1, СРР2, СРР8 или СРР 10. Каждый из этих СРР, соединенный с иммунодоминантным CD8+ Т-клеточным эпитопом овальбумина, был получен путем химического синтеза и помечен флуоресцеином. 5.105 клеток инкубировали в течение 2 час при 37°С с 0.9 мкМ различных гибридных полипептидов. Тестируемыми клетками были человеческие лимфоидные клетки K562, мышиные лимфоидные клетки EL4, клетки астроцитомы человека U251 и клетки астроцитомы мыши GL261. Клетки промыли в кислотном буфере для удаления всех мембран-связанных пептидов, для оценки жизнеспособности клеток использовали окрашивание Live-Dead Yellow. Анализ проводили с помощью проточной цитометрии. Индекс флуоресценции показывает уровень флуоресценции выше природной аутофлуоресценции клеток. Индекс флуоресценции - это отношение среднего значения индекса флуоресценции, измеренного с помощью проточной цитометрии между клетками как таковыми и клетками, нагруженными CPP-OVA гибридными полипептидами.
Результаты представлены в таблице 2.

В общем, не наблюдалось токсического эффекта CPP-OVA гибридных полипептидов. Кроме того, эти результаты продемонстрировали, что все протестированные СРР могут проникать в клетки человеческого или мышиного происхождения со сходной эффективностью.
Пример 5: IN VIVO вакцинация мышей различными CPP-OVA гибридными полипептидами изобретения
Эксперимент был проведен, как описано в Примере 3.
От четырех до восьми мышей на группу дважды подкожно вакцинировали с 14-дневным интервалом гибридными полипептидами (10 нмоль), содержащими один из СРР, указанных в таблице 2, соединенный с эпитопом овальбумина CD8+ (SEQ ID NO: 3), фланкированным спейсерами SEQ ID NO: 11 и SEQ ID NO: 12 на N-концевой и С-концевой части CD8+ эпитопа, соответственно. Каждый CPP-OVA гибридный полипептид вводили в PBS с 100 мкг анти-CD40. 50 мкг поли-IC вводили внутримышечно через 7 дней после второй вакцинации. Иммунный ответ контролировали по крови с использованием окрашивания Pentamer, а затем проточной цитометрии.
Результаты представлены в таблице 3 в виде кратного увеличения CPP-OVA гибридного полипептида относительно исходного, содержащего СРР 14 SEQ ID NO: 22. Как видно из таблицы 2, все исследованные CPP-OVA гибридные полипептиды имели более высокий иммуногенный потенциал. по, сравнению с исходным гибридным полипептидом, содержащим СРР 14, за исключением другого исходного гибридного полипептида, содержащего СРР7 SEQ ID NO: 21, который принимается в качестве отрицательного контроля и который имеет более низкий иммуногенный потенциал по сравнению с исходным гибридным полипептидом, содержащим СРР 14.

СРР7 представляет собой фрагмент Zebra длиной 8 аминокислот, продолжающийся от положения 178 до 185 Zebra.
СРР14 представляет собой фрагмент Zebra длиной 42 аминокислоты, продолжающийся от положения 178 до 219 Zebra.
Заключение: Взятые вместе, результаты Примеров 4 и 5 показывают, что различные СРР изобретения могут проникать в клетки человеческого и мышиного происхождения, и что карго-молекула, которую несут такие СРР, перекрестно-презентируется CD8+ Т-клеткам, т.е. индуцирует иммунный ответ, специфический в отношении транспортируемой карго-молекулы и, таким образом, может применяться для вакцинации и иммунотерапии.
Список последовательностей
СРР1: (всего 17 аминокислот)

СРР2: (всего 30 аминокислот)

Эпитоп овальбумина CD8 (всего 8 аминокислот)

CPPs-OVA гибридные полипептиды:
Конструкция 1: содержащая СРР1, соединенный с эпитопом овальбумина CD8 (всего 33 аминокислоты)

Конструкция 2: содержащая СРР2, соединенный с эпитопом овальбумина CD8 (всего 46 аминокислот)

Искусственная последовательность

X1 представляет собой K, R или Н
Х2 представляет собой R, K или Н
Х3 представляет собой Y, W или F
Х4 представляет собой K, R или Н
Х5 представляет собой N или Q
Х6 представляет собой R, K или Н
Х7 представляет собой V, I, М, L, F или А
Х8 представляет собой А, V, L, I или G
Х9 представляет собой S или Т
Х10 представляет собой R, K или Н
Х11 представляет собой K, R или Н
Х13 представляет собой R, K или Н
Х14 представляет собой А, V, L, I или G
Х15 представляет собой K, R или Н
X16 представляет собой F, L, V, I, Y, W или М
Х17 представляет собой K, R или Н
Искусственная последовательность

X1 представляет собой K или R
Х2 представляет собой R или K
Х3 представляет собой Y, W или F
Х4 представляет собой K или R
Х5 представляет собой N или Q
Х6 представляет собой R или K
Х7 представляет собой V, I, М или L
X8 представляет собой А или G
Х9 представляет собой S или Т
Х10 представляет собой R или K
Х11 представляет собой K или R
Х13 представляет собой R или K
Х14 представляет собой А или G
Х15 представляет собой K или R
X16 представляет собой F, Y или W
Х17 представляет собой K или R
СРР8: (всего 15 аминокислот)

СРР10: (всего 19 аминокислот)

СРР11: (всего 25 аминокислот)

Спейсеры (Искусственные последовательности)

Искусственная последовательность (всего 21 аминокислот)

Искусственная последовательность (всего 21 аминокислот)
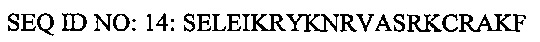
Сайт-мишень энтерокиназы

Сайт-мишень фактора Ха
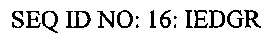
Сайт-мишень тромбина

Сайт-мишень протеазы TEV

Сайт-мишень протеазы PreScission

Сайт-мишень фурина

Х2 представляет собой любую аминокислоту
Х3 представляет собой R или K
СРР7 (8 всего аминокислот)

СРР14 (всего 42 аминокислоты)

ZEBRA аминокислотная последовательность (природная последовательность вируса Эпштейна-Барр (EBV)) (YP_401673)

Реферат
Настоящее изобретение относится к области биотехнологии, конкретно к проникающим в клетку пептидам, и может быть использовано в медицине путем доставки терапевтической карго-молекулы в клетку млекопитающего. Пептид состоит из фрагмента в 15-30 аминокислот участка, продолжающегося от остатка 170 до остатка 220 SEQ ID NO: 23, и содержит Ser (S) в положении, эквивалентном положению 189 SEQ ID NO: 23. Изобретение обеспечивает эффективную доставку терапевтических пептидных эпитопов патогена или опухоли в клетки млекопитающих. 21 н. и 3 з.п. ф-лы, 2 ил., 3 табл., 5 пр.

Комментарии