Лизины ацинетобактеров - RU2725809C2
Код документа: RU2725809C2
Чертежи










































































































Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка PCT заявляет приоритет по предварительной заявке США № 62/017618, поданной 26 июня 2014 года, полное содержание которой включено в настоящий документ посредством ссылки.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Настоящая заявка содержит ссылку в полном объеме на перечень последовательностей в виде файла под названием ʺ235932-373399_Sequence_Listing_ST25ʺ, (57 Кбайт) созданного 24 июня 2015 года, и поданного в электронном виде вместе с ней.
ОБЛАСТЬ ТЕХНИКИ
[0003] Композиции, содержащей бактериофаговый литический фермент специфичный к видам рода Acinetobacter и способ лечения инфекций, вызванных видами рода Acinetobacter.
УРОВЕНЬ ТЕХНИКИ
[0004] Комплекс Acinetobacterbaumannii-calcoaceticus и другие представители этого вида часто колонизирует кожу человека не причиняя вреда. Однако, повреждения кожи от ссадин, ран или хирургической операции, могут привести к инфекциям (вызванным бактериями рода Acinetobacter) раны, крови, мягких тканей и центральной нервной системы. Учитывая, что более 80% инфекций, вызванных видами рода Acinetobacter также являются устойчивыми к множеству лекарственных препаратов (МЛУ) (по меньшей мере к трем классам антибиотиков), эти инфекции могут привести к неблагоприятным клиническим исходам, включая высокие показатели заболеваемости и смертности, длительное пребывание в стационаре и значительные расходы здравоохранения. Военнослужащие и спортсмены имеют повышенный риск получения травм (от ссадин до тяжелых ранений), подвергаясь риску заражения инфекциями, вызванными видами рода Acinetobacter. таким образом, способы, быстрого и эффективного их удаления уменьшат или устранят последующие осложнения. Вспышки заболеваний, вызванные МЛУ Acinetobacter, были зарегистрированы в больницах по всему миру; в последнее время, они стали серьезной проблемой в военно-медицинских учреждениях. Из-за своей МЛУ, инфекции, вызванные бактериями рода Acinetobacter трудно лечить, так что заражение вызванное данными организмами, как правило, приводит к неблагоприятному исходу. Таким образом, необходимы новые и более эффективные способы контроля данного возбудителя.
[0005] Уже сообщалось о штаммах Acinetobacterbaumannii устойчивых ко всем известным антибиотикам. Действие совместно с этим новым профилем сопротивления является удивительной способностью А. baumannii, выживать в течение длительных периодов в условиях стационара, тем самым усиливая его способность к нозокомиальному распространению. Организм обычно поражает госпитализированных субъектов, которые находятся в критическом состоянии с нарушениями целостности кожи и защиты дыхательных путей. Как таковая, госпитальная пневмония является по-прежнему самой распространенной инфекцией, вызываемой А. baumannii. Однако, в последнее время, инфекции, связанные с центральной нервной системой, кожи и мягких тканей, и кости стали проблемой для некоторых организаций. Из-за данной проблемы резистентности, должны быть разработаны новые способы борьбы с данными патогенами.
[0006] Были определены антимикробные агенты, известные как бактериофаг-кодируемые лизины. Бактериофаги представляют собой вирусы, которые заражают бактерии и предполагается, что существует 106 различных видов бактериофагов. Лизины бактериофагов, как правило, являются родо- или видоспецифичными, т. е. фаговый лизин Staphylococcus aureus проявляет активность только против Staphylococcus aureus обеспечивая целевой терапевтический подход. В некоторых случаях, лизины могут проявлять активность в отношении нескольких родов или видов.
[0007] Бактериофаг заражает бактерию-хозяина для воспроизведения вирусных частиц. В конце репродуктивного цикла они сталкиваются с проблемой, освобождения фагового потомства, заключенного внутри бактерии. Они решают эту проблему, производя фермент, называемый ʺлизинʺ, разрушающий клеточные стенки зараженных бактерий для освобождения фагового потомства. Литическая система состоит из холина и по меньшей мере одной пептидогликангидролазы, или лизина, способных к разрушению клеточной стенки бактерий. Как правило, холин экспрессируется на поздних стадиях развития фаговой инфекции, образуя поры в клеточной мембране, что позволяет лизину(ам), получить доступ к пептидогликану клеточной стенки, что приводит высвобождению фагового потомства. Важно отметить, что экзогенный лизин, при отсутствии холина, способен лизировать клеточные стенки здоровых, неинфицированных клеток, вызывая явление, известное как ʺлизис извнеʺ.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0008] Недавно мы определили, очистили и охарактеризовали несколько фаговых лизинов, специфические поражающих бактерии рода Acinetobacter. Это прорыв, так как большинство лизинов обладают антибактериальной активностью только против грамположительных бактерий. Очищенные фаговые лизины согласно настоящему изобретения хорошо подходят для различных применений, таких как лечение бактериальных инфекций и дезинфекция.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0009] Фигура 1A. Негативно окрашенная электронная микрофотография демонстрирующая фаг, индуцированный из А. baumannii штамм 1790.
[0010] Фигура 1B. Негативно окрашенная электронная микрофотография демонстрирующая фаг, индуцированный из А. baumannii штамм 1794.
[0011] Фигура 1C. Негативно окрашенная электронная микрофотография демонстрирующая фаг, индуцированный из А. baumannii штамм 1796.
[0012] Фигура 2. Репрезентативное изображение литической активности клона в просветлении живого A. baumannii заключенного в агар.
[0013] Фигура 3. Схемы аминокислотных последовательностей клонированных лизинов демонстрирующие четыре класса литической активности: i) семейство гликозилгидролаз, ii) лизоцимы базальной пластинки фага, iii) лизоцимные автолизины и iv) лизины.
[0014] Фигура 4. Выравнивание нуклеотидных последовательностей для клонированных лизинов.
[0015] Фигура 5. Выравнивание аминокислотных последовательностей клонированных лизинов.
[0016] Фигура 6. Представляет собой график, демонстрирующий литическую активность 21 клонированного конструкта против тринадцати различных клинических изолятов А. baumannii.
[0017] Фигуры 7A и 7B. Пузырение цитоплазматической мембраны, содержащей цитозольное содержимое клеток A. baumannii, наблюдаемое после обработки F307 (стрелки).
[0018] Фигура 8. Сканирующая электронная микрофотография 3-суточных биопленок штамма 1791 А. baumannii до и после обработки полипептидом F307.
[0019] Фигура 9. Представляет собой график, демонстрирующий уменьшение количества бактерий на всех отрезках катетеров с биопленкой Acinetobacter после обработки полипептидом F307.
[0020] Фигура 10. Представляет собой график, демонстрирующий выживаемость мышей, зараженных A. baumannii и обработанных полипептидом F307 по сравнению с контролем.
[0021] Фигура 11. Последовательность полипептида F307, P307 без короткого удлиняющего сегмента и с коротким удлиняющим сегментом (P307Ex).
[0022] Фигура 12. Фигура 12A представляет собой график сравнения in vitro бактерицидных активностей P307, P307SQ-8C и P307AE-8 против штаммов A. baumannii № 1791, S5 и ATCC17978. На Фигуре 12B представлена сравнительная in vivo бактерицидная активность P307, P307SQ-8C и P307CS-8 против штаммов A. baumannii № 1791 и S5. На Фигуре 12C представлено сравнение сравнительной in vivo бактерицидной активности P307SQ-8C и P307CS-8 против штаммов A. baumannii № 1791, S5 и ATCC17978.
[0023] Фигура 13.in vitro бактерицидная активность P307 и P307SQ-8C против штамма A. baumannii № 1791 для исследования оптимального pH (13A) и оптимальной концентрации NaCl (13B). Те же условия, за исключением переменных, были использованы с 50 мМ Трис-HCl, pH 7,5 для определения концентрационного оптимума (13C) и лизисной кинетики (13D). Планки погрешностей показывают стандартное отклонение, а черная горизонтальная линия обозначает предел обнаружения.
[0024] Фигура 14. Представляет собой график, демонстрирующий чувствительность различных бактерий к P307 и P307SQ-8С. Планки погрешностей показывают стандартное отклонение, а черная горизонтальная линия обозначает предел обнаружения.
[0025] Фигура 15. Фигуры 15А и 15В представляют собой графики, которые демонстрируют бактерицидную активность P307 и P307SQ-8С на логарифмической и стационарной фазе A. baumannii штамм 1791 (15A) и фазе биопленки (15B).
[0026] Фигура 16. На фигуре 16 представлены цитотоксические эффекты P307 и P307SQ-8С, измеренные на основании выживаемости (16A) и гемолиза (16B) B клеток.
[0027] Фигура 17. На фигуре 17A представлено влияние ДТТ, при концентрации 0, 0,1 и 1 мМ, на активность P307 и P307SQ-8C.На фигуре 17B представлено влияние замены концевого остатка цистеина у P307SQ-8С на аланин (P307SQ-8А).
[0028] Фигура 18. Сдвиг ДНК в геле демонстрирующий сдвиг для контрольного пептида и P307.
[0029] Фигура 19. На фигурах 7 A-C представлены репрезентативные изображения полученные при помощи трансмиссионной электронной микроскопии A. baumanii штамм № 1791: необработанный контроль (19A), обработанный 300 мкг/мл P307SQ-8C в течение 5 минут (19B) и 2-х часов (19C). Увеличение, ×2600 (левая, масштабная полоска=2 мкм) и ×5000 (правая верхняя и нижняя, масштабная полоска=0,5 мкм). На фигуре 7D представлена бактерицидная активность P307SQ-8C на грамотрицательные бактерии K. pneumoniae и E. coli при pH 7,5 и 8,8.
[0030] Фигура 20. Продемонстрирована проницаемость мембраны A. baumannii штаммы № 1791 и S5 обработанные P307 и P307SQ-8C.
[0031] Фигура 21. Представлено ингибирование бактерицидной активности P307 или P307SQ-8С с помощью утилизации гидроксильного радикала, тиомочевины и анаэробных условий.
[0032] Фигура 22. Представлен эффект лечения кожной инфекции полимиксином B и P307SQ-8С.
ПОДРОБНОЕ ОПИСАНИЕ
[0033] В настоящем изобретении предложены полипептиды, имеющие антибактериальную активность и способы применения предложенных полипептидов. Как используют в данном документе формы единственного числа включают ссылки на множественное число, если из контекста явно не следует иное.
[0034] Такие термины, как ʺсодержитʺ, ʺсодержащийʺ и т. п. имеют значение, приписываемое в патентном законодательстве Соединенных Штатов; они являются охватывающими или открытыми и не исключают дополнительные, не перечисленные элементы или стадии способа. Такие термины, как ʺсостоящий по существу изʺ и ʺсостоит по существу изʺ имеют значение, приписываемое в патентном законодательстве Соединенных Штатов; они позволяют включение дополнительных ингредиентов или действий, которые существенно не влияют на основные и новые характеристики изобретения. Термины ʺсостоит изʺ и ʺсостоящий изʺ имеют значение, приписываемое в патентном законодательстве Соединенных Штатов; а именно, что эти термины являются закрытыми.
[0035] В первом аспекте, в настоящем изобретении предложены полипептиды, содержащие аминокислотную последовательность, имеющую по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 93%, или по меньшей мере 94% или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99% или 100% идентичности с SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20 или SEQ ID NO:21, или фрагмент полипептида, причем полипептид или фрагмент обладает антибактериальной активностью.
[0036] В другом варианте реализации первого аспекта, полипептиды содержат аминокислотную последовательность, имеющую по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99% или 100% идентичности с SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20 или SEQ ID NO:21, или фрагмент полипептида, причем полипептид или фрагмент обладает антибактериальной активностью.
[0037] В другом варианте реализации первого аспекта, полипептиды содержат аминокислотную последовательность, имеющую 100% идентичности с SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20 или SEQ ID NO:21, или фрагмент полипептида, причем полипептид или фрагмент обладает антибактериальной активностью.
[0038] Во втором аспекте, в настоящем изобретении предложены полипептиды, состоящие из аминокислотной последовательности, имеющей по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 93%, или по меньшей мере 94% или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99% или 100% идентичности с SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20 или SEQ ID NO:21, или фрагмента полипептида, причем полипептид или фрагмент обладает антибактериальной активностью.
[0039] В другом варианте реализации второго аспекта, полипептиды состоят из аминокислотной последовательности, имеющей по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99% или 100% идентичности с SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20 или SEQ ID NO:21, или фрагмента полипептида, причем полипептид или фрагмент обладает антибактериальной активностью.
[0040] В еще одном другом варианте реализации второго аспекта, полипептиды состоят из аминокислотной последовательности, имеющей 100% идентичности с SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20 или SEQ ID NO:21, или фрагмента полипептида, причем полипептид или фрагмент обладает антибактериальной активностью.
[0041] В третьем аспекте, в настоящем изобретении предложены полипептиды, содержащие аминокислотную последовательность, имеющую по меньшей мере 80%, или по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 93%, или по меньшей мере 94% или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99% или 100% идентичности с SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20 или SEQ ID NO:21, или фрагмент полипептида, причем полипептид или фрагмент конъюгирован с антимикробным пептидом для получения конъюгированного полипептида, и конъюгированный полипептид обладает антибактериальной активностью.
[0042] В одном варианте реализации третьего аспекта полипептид содержит аминокислотную последовательность, имеющую по меньшей мере 90%, или по меньшей мере 92%, или по меньшей мере 94% или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99% или 100% идентичности с SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20 или SEQ ID NO:21, или фрагмент полипептида, причем полипептид или фрагмент конъюгирован с антимикробным пептидом для получения конъюгированного полипептида, и конъюгированный полипептид обладает антибактериальной активностью.
[0043] В четвертом аспекте, в настоящем изобретении предложены полипептиды, состоящие из аминокислотной последовательности, имеющей по меньшей мере 80%, или по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 93%, или по меньшей мере 94% или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99% или 100% идентичности с SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20 или SEQ ID NO:21, или фрагмента полипептида, причем полипептид или фрагмент конъюгирован с антимикробным пептидом для получения конъюгированного полипептида, и конъюгированный полипептид обладает антибактериальной активностью.
[0044] В одном варианте реализации четвертого аспекта полипептид состоит из аминокислотной последовательности, имеющей по меньшей мере 90%, или по меньшей мере 92%, или по меньшей мере 94% или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99% или 100% идентичности с SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20 или SEQ ID NO:21, или фрагмента полипептида, причем полипептид или фрагмент конъюгирован с антимикробным пептидом для получения конъюгированного полипептида, и конъюгированный полипептид обладает антибактериальной активностью.
[0045] В некоторых вариантах реализации третьего или четвертого аспекта, антимикробный пептид содержит аминокислотную последовательность SQSRESQC (SEQ ID NO:44), причем по меньшей мере одна аминокислота представляет собой цистеин и 0, 1, 2, 3, 4, 5, 6 или 7 аминокислот антимикробного пептида являются консервативно замененными. 0, 1, 2, 3, 4, 5, 6 или 7 аминокислот антимикробного пептида являются консервативно замененными. В других вариантах третьего или четвертого аспекта, антимикробный пептид содержит аминокислотную последовательность SQSRESQC (SEQ ID NO:44). В еще одних других вариантах третьего или четвертого аспекта, антимикробный пептид содержит аминокислотную последовательность SQSRESQC (SEQ ID NO:44), причем 0, 1, 2, 3, 4, 5, 6 или 7 аминокислот антимикробного пептида являются консервативно замененными, и антимикробный пептид состоит из 8 аминокислот. В еще одних других вариантах третьего или четвертого аспекта, антимикробный пептид состроит из аминокислотной последовательности SQSRESQC (SEQ ID NO:44).
[0046] В некоторых вариантах реализации третьего или четвертого аспекта, антимикробный пептид содержит аминокислотную последовательность CSQRQSES (SEQ ID NO:50), причем по меньшей мере одна аминокислота представляет собой цистеин и 0, 1, 2, 3, 4, 5, 6 или 7 аминокислот антимикробного пептида являются консервативно замененными. В других вариантах реализации третьего или четвертого аспекта, антимикробный пептид содержит аминокислотную последовательность CSQRQSES (SEQ ID NO:50). В еще одних других вариантах реализации третьего или четвертого аспекта, антимикробный пептид содержит аминокислотную последовательность CSQRQSES (SEQ ID NO:50), причем 0, 1, 2, 3, 4, 5, 6 или 7 аминокислот антимикробного пептида являются консервативно замененными, и антимикробный пептид состоит из 8 аминокислот. В еще одних других вариантах реализации третьего или четвертого аспекта, антимикробный пептид состроит из аминокислотной последовательности CSQRQSES (SEQ ID NO:50).
[0047] В некоторых вариантах реализации третьего или четвертого аспекта, C-конец полипептида или фрагмента конъюгирован с противомикробным пептидом. В других вариантах реализации третьего или четвертого аспекта, C-конец полипептида или фрагмента конъюгирован с N-концом антимикробного пептида. В еще одних других вариантах реализации третьего или четвертого аспекта, N-конец полипептида или фрагмента конъюгирован с антимикробным пептидом. В еще одних других вариантах реализации третьего или четвертого аспекта, N-конец полипептида или фрагмента конъюгирован с C-концом антимикробного пептида. Для любого из вариантов третьего или четвертого аспекта антимикробный пептид может быть, конъюгирован с полипептидом или фрагментом через пептидную связь.
[0048] Еще один вариант реализации пептидов настоящего раскрытия представляет собой пептид, имеющий аминокислотную последовательность NAKDYKGAAAEFPKWNKAGGRVLAGLVKRRKSQSRESQA (SEQ ID NO: 53). Другой вариант реализации представляет собой пептид, имеющий аминокислотную последовательность NAKDYKGAAAEFPKWNKAGGRVLAGLVKRRKCSQRQSES (SEQ ID NO:51).
[0049] В некоторых вариантах реализации изобретения полипептид или фрагмент полипептида или конъюгированные полипептиды обладают антибактериальной активностью против грамотрицательной бактерии. В некоторых вариантах реализации изобретения грамотрицательные бактерии представляют собой бактерию рода Acinetobacter.
[0050] В некоторых вариантах реализации изобретения полипептид или фрагмент полипептида или конъюгированные полипептиды обладают антибактериальной активностью против E. coli, P. aeruginosa или A. baumannii.
[0051] В некоторых вариантах реализации изобретения полипептид или фрагмент полипептида или конъюгированные полипептиды обладают антибактериальной активностью против грамположительной бактерии. В некоторых вариантах реализации изобретения грамположительная бактерия представляют собой S. aureus или B. anthracis.
[0052] В некоторых вариантах реализации изобретения полипептид является лиофилизированным.
[0053] Конкретные варианты реализации полипептидов по изобретению представлены в Таблице 1.
Таблица 1
[0054] P307SQ-8C и P307Ex используются взаимозаменяемо в данном документе.
[0055] В настоящем изобретении также предложены фармацевтические композиции, содержащие полипептиды, фрагменты полипептида или конъюгированные полипептиды по изобретению. В некоторых вариантах реализации изобретения композиции представляют собой фармацевтические композиции, содержащие фармацевтически приемлемый носитель, буферный агент или консервант.
[0056] В некоторых вариантах реализации изобретения фармацевтическая композиция создана для местного применения. В других вариантах реализации изобретения фармацевтическая композиция создана для подкожной доставки. В еще одних других вариантах реализации изобретения фармацевтическая композиция создана для внутривенной доставки. В еще одних других вариантах реализации, фармацевтическая композиция создана для пероральной доставки.
[0057] В некоторых вариантах реализации изобретения композиция дополнительно содержит антибиотик. Примеры пригодных антибиотиков включают, без ограничения, амоксициллин, аугментин, амоксициллин, ампициллин, азлоциллин, флюклоксациллин, мезлоциллин, метициллин, пенициллин G, пенициллин V, цефалексин, цефазедон, цефуроксим, лорацарбеф, цеметазол, цефотетан, цефокситин, ципрофлоксацин, левакин и флоксацин, тетрациклин, доксициклин или миноциклин, гентамицин, амикацин, и тобрамицин, кларитромицин, азитромицин, эритромицин, даптомицин, неомицин, канамицин или стрептомицин.
[0058] В некоторых вариантах реализации изобретения фармацевтическая композиция дополнительно содержит коагулирующий агент.
[0059] В некоторых вариантах реализации изобретения фармацевтическая композиция является лиофилизированной.
[0060] В настоящем изобретении также предложены способы лечения субъекта, нуждающегося в этом, включающие введение субъекту фармацевтической композиции, содержащей полипептид, фрагмент полипептида или конъюгированный полипептид согласно изобретению и фармацевтически приемлемый носитель, буферный агент или консервант.
[0061] В одном варианте реализации изобретения способ представляет собой способ лечения субъекта, нуждающегося в этом, включающий введение субъекту фармацевтической композиции, содержащей полипептид согласно изобретению и фармацевтически приемлемый носитель, буферный агент или консервант.
[0062] В другом варианте реализации изобретения способ представляет собой способ лечения субъекта, нуждающегося в этом, включающий введение субъекту фармацевтической композиции, содержащей фрагмент полипептида согласно изобретению и фармацевтически приемлемый носитель, буферный агент или консервант.
[0063] В одном варианте реализации изобретения способ представляет собой способ лечения субъекта, нуждающегося в этом, включающий введение субъекту фармацевтической композиции, содержащей конъюгированный полипептид согласно изобретению и фармацевтически приемлемый носитель, буферный агент или консервант.
[0064] В одном варианте реализации изобретения способ представляет собой способ лечения субъекта, имеющего бактериальную инфекцию, а лечение представляет собой терапевтическое лечение, включающее введение субъекту фармацевтической композиции, содержащей конъюгированный полипептид согласно изобретению, и фармацевтически приемлемый носитель, буферный агент или консервант. В некоторых вариантах реализации субъект имеет бактериальную инфекцию, резистентную к другим способам лечения. Например, бактериальная инфекция может быть устойчивой к одному или более антибиотикам. В одном варианте реализации изобретения, бактериальная инфекция представляет собой раневую инфекцию.
[0065] В одном варианте реализации изобретения способ представляет собой способ профилактического лечения субъекта, нуждающегося в этом, включающий введение субъекту фармацевтической композиции, содержащей конъюгированный полипептид согласно изобретению и фармацевтически приемлемый носитель, буферный агент или консервант. В некоторых вариантах реализации изобретения субъект претерпел или претерпевает оперативное вмешательство, а операционная рана контактирует с фармацевтической композиции согласно изобретению. В некоторых вариантах реализации изобретения хирургическую рану орошают фармацевтической композицией до закрытия раны. В других вариантах реализации изобретения фармацевтическую композицию наносят на рану, после закрытия, например, фармацевтическую композицию наносят на зашитую или скрепленную степлером область раны.
[0066] В некоторых вариантах реализации изобретения способ включает введение фармацевтической композиции согласно изобретению в сочетании с антибиотиком. В некоторых вариантах реализации изобретения способ включает местное применение фармацевтической композиции по изобретению. В других вариантах реализации изобретения способ включает введение фармацевтической композиции согласно изобретению подкожно. В еще одних других вариантах реализации изобретения способ включает введение фармацевтической композиции согласно изобретению путем внутривенной инъекции. В еще одних других вариантах реализации изобретения способ включает введение фармацевтической композиции согласно изобретению в перорально.
[0067] В некоторых вариантах реализации изобретения фармацевтическая композиция представлена в виде единичной дозы. В других вариантах реализации изобретения фармацевтическая композиция представлена в форме крема, мази, бальзама, геля, пастилки, спрея или аэрозоля.
[0068] Также представлены способы лечения бактериальной инфекции, включающий ингибирование формирования или нарушение бактериальной биопленки, включающий введение субъекту, нуждающемуся в этом, композиции, содержащей полипептид, фрагмент полипептида или конъюгированный полипептид согласно изобретению в количестве, эффективном для уничтожения бактерий в биопленке.
[0069] Дополнительно представлены способы дезинфекции предмета включающие приведение в контакт предмета с композицией, содержащей полипептид, фрагмент полипептида или конъюгированный полипептид согласно изобретению с предметом в течение времени, достаточного для дезинфекции предмета. В некоторых вариантах реализации изобретения предмет представляет собой твердую поверхность. В некоторых вариантах реализации изобретения предмет представляет собой рабочую поверхность, клавиатуру, хирургический инструмент или медицинское устройство.
[0070] Дополнительно, представлены способы ингибирования образования или разрушения бактериальной биопленки на предмете включающие приведение в контакт предмета с полипептидом, фрагментом полипептида или конъюгированным полипептидом согласно изобретению, в количестве, эффективном для уничтожения бактерий в биопленке.
[0071] Также представлены изделия, содержащие композиции, содержащие полипептид, фрагмент полипептида или конъюгированный полипептид согласно изобретению. В некоторых вариантах реализации изобретения изделие представляет собой аэрозольный баллончик, содержащий полипептид, фрагмент полипептида или конъюгированный полипептид согласно изобретению.
[0072] В некоторых вариантах реализации изобретения изделие содержит фармацевтическую композицию, содержащую полипептид, фрагмент полипептида или конъюгированный полипептид согласно изобретению и носитель, буферный агент или консервант. В некоторых вариантах реализации изобретения изделие представляет собой флакон. В некоторых вариантах реализации изобретения изделие представляет собой устройство доставки. В некоторых вариантах реализации изобретения композиция, содержащаяся в изделии является лиофилизированной.
[0073] Модификации и изменения могут быть произведены в структуре полипептидов данного раскрытия и получатся молекулы, имеющие сходные характеристики, как у полипептида (например, консервативная аминокислотная замена). Например, некоторые аминокислоты могут быть заменены другими аминокислотами в последовательности без заметной потери активности. Потому как интерактивная возможность и природа полипептида определяют биологическую функциональную активность полипептида некоторые замены в аминокислотной последовательности замены могут быть проведены в последовательности полипептида и тем не менее получится полипептид с желаемыми свойствами.
[0074] Такие аминокислотные замены, как правило, основаны на относительном сходстве заместителей аминокислотных боковых цепей, например, их гидрофобности, гидрофильности, заряде, размере и тому подобном. Типичные замен, которые принимают различные из вышеприведенных характеристик во внимание, хорошо известны специалистам в данной области и включают (оригинальный остаток: типичная замена): (Ala: Gly, Ser), (Arg: Lys), (Asn: Gln, His), (Asp: Glu, Cys, Ser), (Gln: Asn), (Glu: Asp), (Gly: Ala), (His: Asn, Gln), (Ile: Leu, Val), (Leu: Ile, Val), (Lys: Arg), (Met: Leu, Tyr), (Ser: Thr), (Thr: Ser), (Tip: Tyr), (Tyr: Trp, Phe) и (Val: Ile, Leu). Варианты реализации настоящего раскрытия, таким образом, рассматривают функциональные или биологические эквиваленты полипептида, как описано выше. В частности, варианты реализации полипептидов могут включать варианты имеющие около 50%, 60%, 70%, 80%, 90% и 95% идентичности последовательности с интересующим полипептидом.
[0075] "Идентичность" как известно в данной области техники, представляет собой связь между двумя или более полипептидными последовательностями, как это определено путем сравнения последовательностей. "Идентичность" может быть легко рассчитана с помощью известных алгоритмов, хорошо известных в данной области техники. Предпочтительные способы определения идентичности разработаны с целью обеспечения наилучшего совпадения между исследуемыми последовательностями. Способы определения идентичности кодируются в общедоступных компьютерных программах. Процент идентичности между двумя последовательностями может быть определен с помощью программного обеспечения для анализа (например, Sequence Analysis Software Package от Genetics Computer Group, Мадисон, штат Висконсин) который включает алгоритм Needelman and Wunsch, (J. Mol. Biol., 48: 443-453, 1970) (например, NBLAST и XBLAST).
[0076] Идентичность можно определить, как ʺлокальную идентичностьʺ или ʺглобальную идентичностьʺ. Под локальной идентичностью понимается степень родства последовательностей между полипептидами, как определено соответствием между цепочками таких последовательностей. Под глобальной идентичностью понимается степень родства последовательность полипептида по сравнению с полной длиной эталонного полипептида. Если не указано другое, используемая в настоящем документе идентичность, означает глобальную идентичность. Проценты глобальной идентичности в данном документе рассчитываются с использованием алгоритма ClustalW при помощи программы MacVector, используя параметры по умолчанию, как для локальной, так и глобальной идентичности.
Получение полипептидов
[0077] Полипептиды согласно настоящему изобретению могут быть получены любым известным способом. Например, полипептиды могут быть получены в бактерии, включая, без ограничения, E. coli, или в другой существующей системе для полипептида (например, Bacillus subtilis, бакуловирусной экспрессионной системе с использованием клеток дрозофилы Sf9, экспрессионных системах дрожжей или мицелиальных грибов, экспрессионной системе млекопитающих), или они могут быть химически синтезированы.
[0078] Если полипептид должен быть получен в бактерии, например, E. coli, молекула нуклеиновой кислоты, кодирующая пептид может также кодировать лидерную последовательность, позволяющую секрецию зрелого пептида из клетки. Таким образом, последовательность кодирующая пептид может содержать препоследовательность и пропоследовательность, к примеру, естественный бактериальный пептид ST. Секретированный, зрелый пептид может быть очищен от культуральной среды.
[0079] Последовательность, кодирующая пептид, описанный в настоящем документе, может быть вставлена в вектор, способный доставить и обеспечить функционирование молекулы нуклеиновой кислоты в бактериальной клетке. Молекула ДНК может быть вставлена в самовоспроизводящийся вектор (подходящие векторы включают, например, pGEM3Z и pcDNA3, и их производные). Вектор может представлять собой бактериальный ДНК вектор или ДНК вектор бактериофага, например бактериофага лямбда или М13, и их производные. Конструирование вектора, содержащего нуклеиновую кислоту, описанную в настоящем документе, может сопровождаться трансформацией клетки-хозяина, такой как бактерия. Подходящие бактерии-хозяева включают, без ограничения, E. coli, B subtilis, Pseudomonas, Salmonella. Генетический конструкт также содержит, в дополнение к кодирующей молекуле нуклеиновой кислоты, элементы, которые обеспечивают экспрессию, такие как промотор и регуляторные последовательности. Экспрессионные векторы могут содержать последовательности контроля транскрипции, которые контролируют инициацию транскрипции, такие как последовательности промотора, энхансера, оператора и репрессора. Разнообразные последовательности контроля транскрипции хорошо известны в данной области техники. Экспрессионные вектор может также содержать последовательности контроля трансляции (например, нетранслируемую 5'-последовательность, нетранслируемую 3'-последовательность или участок внутренней посадки рибосомы). Вектор может быть способен к автономному воспроизведению или он может интегрироваться в ДНК хозяина, чтобы обеспечить стабильность во время продуцирования пептида.
[0080] Один вариант реализации нуклеиновой кислоты согласно настоящему изобретению представляет собой нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая имеет по меньшей мере 90% идентичность последовательности с аминокислотной последовательностью из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 или SEQ ID NO:45, или фрагмент полипептида, причем полипептид или фрагмент обладает антибактериальной активностью.
[0081] В другом варианте реализации изобретения нуклеиновая кислота кодирует полипептид, содержащий аминокислотную последовательность из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 или SEQ ID NO:45, или фрагмент полипептида, причем полипептид или фрагмент обладает антибактериальной активностью.
[0082] В еще одном другом варианте реализации изобретения нуклеиновая кислота кодирует полипептид, состоящий из аминокислотной последовательности из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 или SEQ ID NO:45, или фрагмент полипептида, причем полипептид или фрагмент обладает антибактериальной активностью.
[0083] В еще одном варианте реализации изобретения нуклеиновая кислота содержит нуклеотидную последовательность SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41 или SEQ ID NO:42.
[0084] В еще одном варианте реализации изобретения нуклеиновая кислота состоит из нуклеотидной последовательности SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41 или SEQ ID NO:42.
[0085] Другой вариант реализации изобретения представляет собой экспрессионный вектор, содержащий нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая имеет по меньшей мере 90% идентичность последовательности с аминокислотной последовательностью из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 или SEQ ID NO:45, или фрагмент полипептида, причем полипептид или фрагмент обладает антибактериальной активностью.
[0086] В другом варианте реализации изобретения экспрессионный вектор содержит нуклеиновую кислоту кодирующую полипептид, содержащий аминокислотную последовательность из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 или SEQ ID NO:45, или фрагмент полипептида, причем полипептид или фрагмент обладает антибактериальной активностью.
[0087] В еще одном другом варианте реализации изобретения экспрессионный вектор содержит нуклеиновую кислоту кодирующую полипептид, состоящий из аминокислотной последовательности из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 или SEQ ID NO:45, или фрагмент полипептида, причем полипептид или фрагмент обладает антибактериальной активностью.
[0088] В еще одном варианте реализации изобретения экспрессионный вектор содержит нуклеиновую кислоту, содержащую нуклеотидную последовательность SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41 или SEQ ID NO:42.
[0089] В еще одном варианте реализации изобретения экспрессионный вектор содержит нуклеиновую кислоту, состоящую из нуклеотидной последовательности SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41 или SEQ ID NO:42.
[0090] В таблице 2 приведены конкретные варианты реализации нуклеиновых кислот согласно изобретению демонстрирующие нуклеотидные SEQ ID NO:, которые соответствуют полипептидам, которые они кодируют.
Таблица 2
[0091] Нуклеиновая кислота, которая кодирует полипептид, описанная в настоящем документе, может также быть слита с нуклеиновой кислотой, кодирующей пептидный аффинный маркер, например, глутатион S-трансферазу (ГСТ), мальтозо-связывающий белок E, белок A, FLAG-маркер, гекса-гистидин, myc-маркер или маркер HA гриппа, для облегчения очистки. Аффинный маркер или репортерная склейка соединяет рамку считывания пептида, представляющего интерес, с рамкой считывания гена, кодирующего аффинный маркер, таким образом, что создается трансляционное слияние. Экспрессия слитого гена приводит к трансляции одного пептида, содержащего и интересующий пептид, и аффинную метку. В некоторых случаях, когда метки аффинности используются, последовательность ДНК, кодирующая сайт узнавания протеазы будут слита между рамками считывания для аффинной метки и пептида, представляющего интерес.
[0092] Генетические конструкты и способы, подходящие для производства незрелых и зрелых форм полипептидов и вариантов, описанных в настоящем документе в системах экспрессии белка, отличных от бактерий, и хорошо известных специалистам в данной области техники, могут также быть использованы для получения полипептидов в биологической системе.
[0093] Полипептиды и их варианты могут быть синтезированы твердофазным методом, с использованием автоматического пептидного синтезатора. Например, пептид может быть синтезирован на Cyc(4-CH2 Bxl)-OCH2-4-(оксиметил)-фенилацетамидометиловой смоле с использованием программы двойного сцепления. Пептиды также могут быть синтезированы с помощью многих других способов, включая твердофазный синтез с использованием традиционной защиты FMOC (т.е. соединение с DCC-HOBt и снятие защиты при помощи пиперидина в ДМФА).
Терапевтические и профилактические композиции, и их применение
[0094] В настоящем изобретении предложены способы лечения, включающие введение субъекту, нуждающемуся в этом, эффективного количества полипептида согласно изобретению. Субъект представляет собой человека или другое животное, включая, без ограничения, приматов, таких как обезьяны и шимпанзе; сельскохозяйственных животных, таких как коровы, свиньи, лошади или куры; и животных-компаньонов, таких как собаки, кошки и грызуны. В конкретном варианте реализации изобретения субъект представляет собой человека. В другом конкретном варианте реализации изобретения субъект представляет собой млекопитающее, не являющееся человеком. В одном варианте реализации изобретения полипептиды вводят в качестве единственного антибактериального агента. В другом варианте реализации изобретения полипептиды вводят в комбинации с одним или более другим антибактериальным агентом.
[0095] Способы введения описанных фармацевтических композиций могут быть следующими: пероральный или парентеральный и включать, без ограничений, внутрикожный, внутримышечный, внутрибрюшинный, внутривенный, внутрисуставной, интрасиновиальный, подкожный, интраназальный, эпидуральный, местный и пероральные пути. Соединения могут вводиться любым удобным путем, например путем инфузии или болюсной инъекции, путем всасывания через эпителиальные или кожно-слизистые оболочки (например, слизистую оболочку полости рта, прямой кишки и слизистую оболочку кишечника и т.д.) и могут вводиться вместе с другими биологически активными веществами. Введение может быть системным или местным. Кроме того, может быть желательным введение фармацевтических композиций по изобретению в центральную нервную систему любым подходящим вариантом, включая внутрижелудочковое и интратекальное введение; внутрижелудочковая инъекция может быть облегчена с помощью внутрижелудочкового катетера, например, присоединенного к резервуару, такому как резервуар Оммайя. Также может быть использовано ингаляционное введение, например, с помощью ингалятора или небулайзера и смешивание с аэрозольным агентом. В конкретном варианте реализации изобретения может быть желательным применение фармацевтической композиции согласно изобретению локально на зоны, нуждающиеся в лечении, такое как местное применение на коже; при этом может быть использован любой подходящий способ, известный в данной области техники.
[0096] В одном аспекте настоящего изобретения предложены фармацевтические композиции, содержащие полипептиды согласно настоящему раскрытию для терапевтического или профилактического лечения бактериальных инфекций. Вариант реализации изобретения представляет собой фармацевтическую композицию, разработанную для местного лечения. Другой вариант реализации изобретения представляет собой фармацевтическую композицию, разработанную для системных инфекций.
[0097] Такие композиции содержат терапевтически эффективное количество полипептида согласно изобретению и фармацевтически приемлемый носитель, буферный агент или консервант. Термин ʺфармацевтически приемлемый носительʺ, используемый в настоящем документе, включает, без ограничения, растворители, разбавители или другие жидкие средства, дисперсионные или суспензионные вспомогательные вещества, поверхностно-активные агенты, изотонические агенты, загустители или эмульгаторы, твердые связующие вещества, лубриканты и тому подобное, пригодные для желаемой конкретной лекарственной формы. Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода и масла, включая нефтяные масла, масла животного, растительного или синтетического происхождения, такие как ореховое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Солевые растворы и водные растворы декстрозы и глицерина также могут быть использованы в качестве жидких носителей, особенно для инъекционных препаратов. Подходящие фармацевтические вспомогательные вещества включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикатный гель, стеарат натрия, глицеролмоностеарат, тальк, хлорид натрия, сухое обезжиренное молоко, глицерол, пропилен, гликоль, воду, этанол и тому подобное. Композиция может также содержать смачивающие или эмульгирующие агенты, консерванты или рН-буферные агенты. Данные композиции могут иметь форму раствора, суспензии, эмульсии, таблетки, пилюли, пастилки, капсулы, порошка, пластырей для местного применения и тому подобного. Для местного применения, фармацевтически приемлемые композиции могут быть приготовлены в виде соответствующей мази, лосьона или крема, содержащих активный компонент взвешенный или растворенный в одном или более носителей. Носители для местного применения включают, без ограничения, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, соединения полиоксиэтилен-полиоксипропилена, эмульгированный воск, полисорбат 60, воск цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду. Композиция может быть приготовлена в виде суппозитория с традиционными связующими веществами и носителями, такими как триглецириды. Состав для перорального применения может содержать стандартные носители, такие как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлозу, карбонат магния и т.д., фармацевтической степени чистоты. Специалист в данной области техники хорошо разбирается в разработке терапевтических агентов. См. например Remington The Science and Practice of Pharmacy, 20th Edition, Lippincott Williams & White, Baltimore, Md. (2000); Remingtonʹs Pharmaceutical Sciences,19th Edition (Mack Publishing Company, 1995).
[0098] В настоящем изобретении предложены также фармацевтические комплект или набор, содержащий один или более контейнер, заполненный одним или более ингредиентами фармацевтической композиции согласно изобретению. При необходимости, могут предоставляться связанные с таким контейнером(ами) уведомление в форме, предписанной правительственным агентством, регулирующим производство, использование или продажу фармацевтических препаратов или биологических продуктов, которое отражает (а) утвержденное агентством по производству, применение или продажу для введения человеку, (б) рекомендации по применению, или оба пункта.
ПРИМЕРЫ
[0099] Следующие примеры используются, чтобы предоставить дополнительную информацию для специалиста в данной области техники, о приготовлении и использовании полипептидов, описанных в настоящем документе, и не предназначены для ограничения объема того, что изобретатели рассматривают как свое изобретение. Были предприняты усилия для обеспечения точности в отношении используемых чисел (например, количества, температуры и т.д.), но следует учесть некоторые экспериментальные ошибки и отклонения. Если не указано иное, молекулярная масса представляет собой среднюю молекулярную массу, а температура указана в градусах Цельсия.
Пример 1
[00100] Идентификация полипептидов, имеющих антибактериальную активность.
[00101] Пятнадцать клинических изолятов A. baumannii были получены в Нью-Йоркской больнице. Штаммы А. baumannii были изолированы и обработаны митомицином C, для инициации индукции профага. Были собраны супернатанты, и фаг был осажден при помощи полиэтиленгликоля (ПЭГ). Супернатанты из трех изолятов A. baumannii изучались при помощи электронной микроскопии (ЭМ) с негативным контрастированием, и были сделаны снимки фагов (Фигуры 1A, 1B и 1C).
[00102] Фаговая ДНК была выделена из совместно осажденных соединений при помощи электрофореза на агарозном геле и экстракции высокомолекулярных ДНК. Из этой ДНК, была создана, как описано выше, экспрессионная шот-ган библиотека, амплифицированная с помощью линкеров (E-LASL). (Schmitz JE. et al., 2008, Appl. Environ. Microbiol. 74:1649-1652.) Кратко, для всех образцов, 100 нг ДНК были фрагментированы при помощи рестрикционного фермента TSP509I (консенсусная последовательность AATT). Затем следовала экстракция фенол-хлороформом и осаждение этанолом, ДНК лигировали с 40 нг линкерной последовательности, с комплементарными 5ʹ липким концом (AATTCGGCTCGAG, где липкий конец подчеркнут (SEQ ID NO:46). Смесь для лигирования использовали в качестве шаблона для Taq ПЦР, используя нацеленный на линкер праймер CCATGACTCGAGCCGAATT (SEQ ID NO:47).
[00103] Амплифицированные вставки были лигированы в арабинозо-индуцибельную pBAD плазмиду, используя набор для экспрессии pBAD TOPO® TA; Invitrogen, в соответствии с инструкциями производителя. Рекомбинантные векторы были трансформированы в компетентные E. coli TOP10 (Invitrogen). Для определения, какой клон обладает литической активностью, E. coli поместили на агар LB дополненный 100 мкг/мл ампициллина и 5% дефибринированной овечьей крови. После роста в течение ночи при 37°C, чашки были помещены в герметичный контейнер, который был прикреплен к выходному отверстию коммерческого небулайзера. Небулизированная арабиноза непрерывно закачивалась в контейнер в течение 1 часа. Чашки были возвращены на 37°C и колонии определяли по образованию зоны гемолиза в окружающем кровяном агаре. Выбранные клоны были высеяны штрихом на разные чашки с LB-ампициллином (без арабинозы) и оставили размножаться без индуцированной экспрессии. (Schmitz JE, et al., 2010 Appl. Environ. Microbiol.76:7181-7187).
[00104] Для определения лизисной активности A. baumannii, вторичный скрининг был осуществлен по существу как у Schmitz JE, et al., 2010 Appl. Environ. Microbiol.76:7181-7187. Колонии были высеяны штрихом с очагами примерно 1 см на 2 см на чашки с LB-ампициллином дополненные 0,2% арабинозы. После инкубирования в течение ночи при 37°C, чашки обрабатывали парами хлороформа для уничтожения и пермеабилизирования любых живых E. coli. Затем очаги были покрыты расплавленным мягким агаром, содержащим А. baumannii и наблюдали для выявления зон просветления. Был выявлен двадцать один положительный клон, проявлявшие четкие зоны вокруг клона. На Фигуре 2 представлено репрезентативное наблюдение литической активности клона в просветлении живого A. baumannii заключенного в агар.
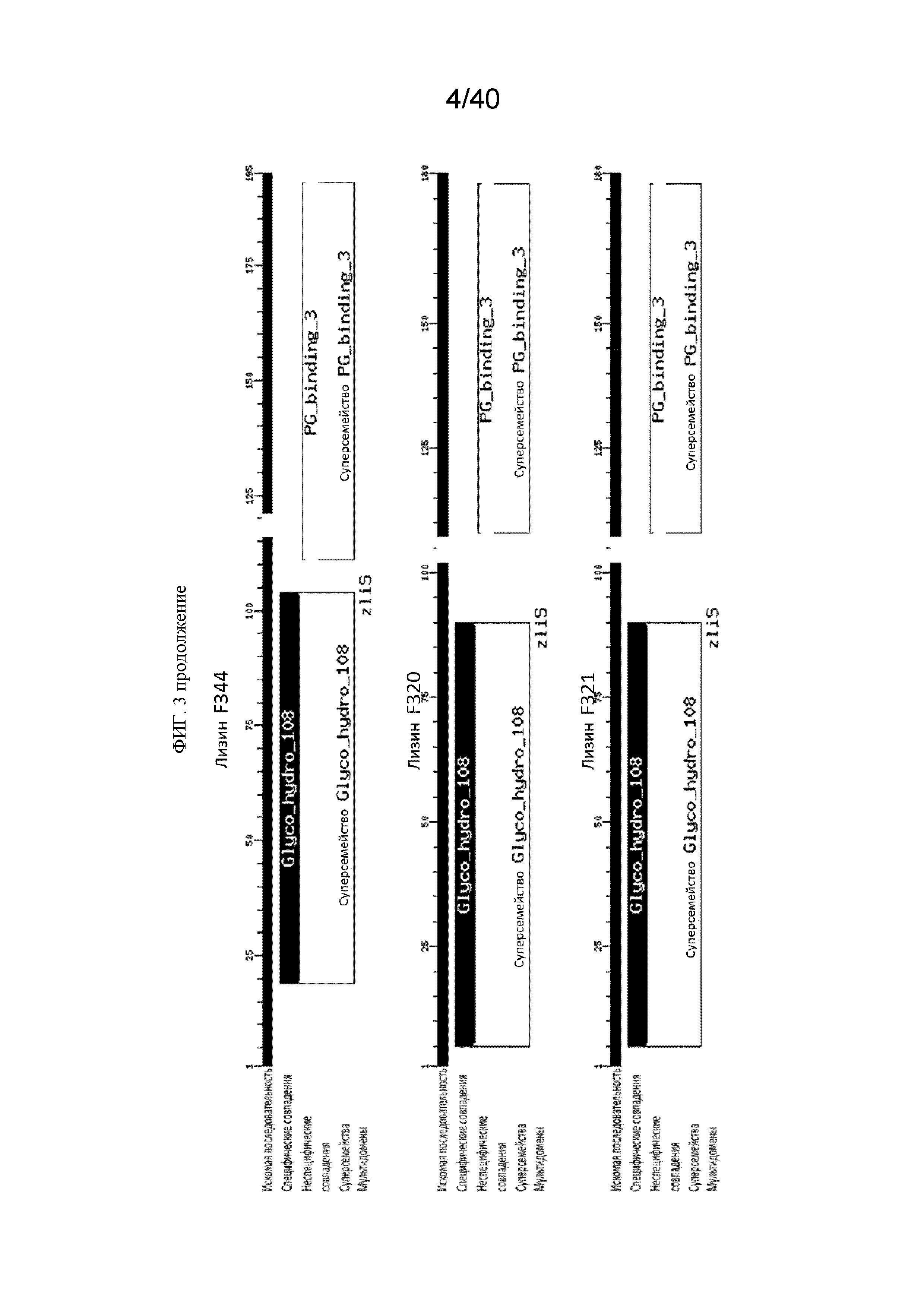
[00105] Вставки положительных клонов были подвергнуты секвенированию и сравнены с последовательностями из базы данных белков NCBI. Участки выравнивания продемонстрировали, что среди 21 клона имеется четыре класса литической активности: i) девять принадлежало к семейству гликозилгидролаз, ii) семь принадлежало к лизоцимам базальной пластинки фага, iii) два являлись лизоцимными автолизинами и iv) три являлись лизинами. (Фиг. 3). Для удобства пользования в настоящем документе, независимо от класса, полипептиды, кодируемые этими последовательностями называются ʺлизиныʺ. На Фигуре 4 показано выравнивание последовательностей на основе сходства нуклеотидных последовательностей, кодирующих 21 клон. На Фигуре 5 показано выравнивание последовательностей на основе схожести полипептидных последовательностей 21 клона.
Пример 2
[00106] Активность положительных клонов.
[00107] Был исследован двадцать один различный конструкт для выяснения активности против клинических изолятов A. baumannii. Конструкты были рекомбинантно экспрессированы в E. coli. Клетки выращивали при 30°C 200 об/мин, а при достижении середины логарифмической фазы роста они были индуцированы путем добавления 0,2% арабинозы. Индукция продолжалась всю ночь. Утром, клетки осаждали центрифугированием, промывали 3 раза 50 мМ натрий-фосфатным буфером рН 7,0, прежде чем гомогенизировать в гомогенизаторе Emulsiflex. Клеточный дебрис удаляли путем центрифугирования (16000 g, 45 мин), а лизат пропускали через стерильный фильтр 0,22 мкм для создания сырых лизатов.
[00108] А. baumannii, выращенный в течение ночи на TSB (триптон-соевый бульон), были смешаны при 50°С с мягким агаром TSB и залиты на агаровые пластины TSB в качестве верхнего слоя агара. Пластины оставили затвердевать при комнатной температуре. Сырые лизаты (10 мкл) добавляли в мягкую агаровую пластину с A. baumannii, и инкубировали 2 часа при комнатной температуре каждый день, в то же время хранили при 4°C в течение оставшегося времени. Пластины инкубировали до тех пор, пока не становились видны зоны просветления (4-5 суток). Подсчитывались зоны просветления, которые были больше, чем исходное пятно сырого лизата. Число над каждым лизином отображает, сколько существует штаммов, против которых лизин был наиболее эффективен.
[00109] Результаты представлены на Фигуре 6. Лизирующие конструкты приведены по оси X, а процент лизированных штаммов Acinetobacter, приведен по оси Y. Цифры над каждой шкалой указывают на количество штаммов, против которых данный лизин был наиболее эффективен, отсутствие цифр означает один штамм. Как можно видеть, Лизин F307 лизирует около 90% протестированных штаммов и является наиболее активным против семи штаммов.
Пример 3
[00110] Лизис A. baumannii вызываемый F307.
[00111] На Фиг. 7 показаны репрезентативные трансмиссионные электронные микрофотографии клеток A. baumannii штамм 1791 после обработки полипептидом F307. На микрофотографии показано, что F307 вызывает лизис посредством экструзии цитоплазматической мембраны наружу клетки. (См. Фиг. 7, стрелки). Две 100 мл культуры A. baumannii штамм 1791 созданы на среде в BHI (ʺBrain Heart Infusionʺ - бульон с сердечно-мозговым экстрактом) и выращивались в 500 мл колбе в течение 1,5 ч при 37 °C, 200 об./мин. Затем клетки центрифугировали и промывали один раз буфером 1х PBS. Затем они были ресуспендированы в 1,2 мл 1х PBS. ЭДТК в конечной концентрации 250 мкМ была добавлена в каждый образец. Для экспериментального образца 300 мкл лизина (конечная концентрация ~1,2 мг), и инкубировали контроль (только ЭДТК) и экспериментальный образец (ЭДТК+F307 лизина) при 25 °C. Временные точки составляли 0,5, 1, 5, 10, 15 и 30 минут. Реакции останавливали и клетки фиксировали с помощью 2,5% глютарового альдегида в CAC буфере (10 мМ какодилата натрия, 0,1 М СаСl2, рН 6,5).
Пример 4
[00112] Влияние полипептида F307 на биопленки A. baumannii на катетерах in vitro и in vivo.
[00113] Обработка in vitro катетера облепленного A. baumannii 1791 при помощи лизина F307
[00114] Трубка катетера (CareFusion Ref № 72023E) была разрезана при помощи стерильного скальпеля на 3-дюймовые (7,62 см) отрезки. Ночная культура A. baumannii 1791 использовалась для инокулирования 1:1000 50 мл TSB 0,2% глюкозы (~1X105 КОЕ/мл). Каждый 3-дюймовый отрезок трубки катетера был засеян 300-350 мкл 1:1000 разведенной культуры. Затем катетеры были зажаты и помещены в пластиковые контейнеры в инкубатор на 37 °С на 3 суток для образования биопленки. После 3 суток катетеры были дважды промыты с помощью PBS или натрий-фосфатного буфера рН 7,5, а затем 300-350 мкл F307 добавляли в трубку (конечная концентрация ~1 мг). Затем катетеры были зажаты. Катетеры изымали во временные точки 0, 15 минут, 30 минут и 1 час. Катетеры были дважды промыты 50 мМ фосфатом натрия рН 7,5 и нарезаны небольшими кусочками. Их помещали в 1,5 мл пробирки эпендорф и добавляли 500 мкл 50 мМ буфера NaP pH 7,5. Пробирки обрабатывали ультразвуком в течение 20 минут, и перемешивали на вортексе в течение 1 минуты. Затем образцы были серийно разбавлены и 20 мкл высеивали на сектор BHI-агаровой пластинки, и инкубировали при 37°C в течение ночи. КОЕ рассчитывали на следующее утро.
[00115] Приблизительное 4-х кратное логарифмическое уменьшение числа колониеобразующих единиц (КОЕ A. baumannii наблюдалось после 30 минут обработки. В таблице 3 представлено число КОЕ. На Фигуре 8 представлены сканирующие электронные микрофотографии 3-суточных биопленок A. baumannii штамм 1791 до и после обработки 250 мкг полипептида F307.
Таблица 3. Обработка биопленок A. baumannii на катетерах.
Пример 5
[00116] Мышиная модель катетера: Несколько 3-дюймовых отрезков трубки катетера был засеяны (1:1000) штаммом 1791 A. baumannii. Биопленки A. baumannii формировались как описано выше. Спины двадцати белых мышей (BALB/C) были выбриты, их спины были стерилизованы, а затем был сделан надрез и помещен под дерму спины 1-дюймовый (2,54 см) катетер с уже образованной биопленкой. Разрезы затем были сшиты скобами. Через 24 часа, 250 мкл F307 (1 мг) (n=10) или 250 мкл контрольной несущей среды (n=10) вводили непосредственно в катетер, расположенный под дермой мыши. Обработку повторяли спустя 4 часа. Через 3 часа катетеры были удалены из мышей и проанализированы, как описано в эксперименте 4. На Фигуре 9 показано приблизительно 2-х кратное логарифмическое уменьшение количества бактерий у мышей, обработанных полипептидом F307 по сравнению с контролем.
Пример 6
[00117] Полипептид F307 предотвращает смерть мышей после летальной инъекции A. baumannii.
[00118] Двадцати двум мышам C57BL/6 ввели108 КОЕ штамма A. baumannii интраперитонеально (IP). Спустя два часа, две мыши были умерщвлены и органы, изучены, как описано ниже, десяти мышам вводили IP 1 мг F307 и десяти мышам вводили IP несущую среду. Обработанные животные продемонстрировали 50% выживаемость при данной дозе лизина, в то время, как контрольные мыши продемонстрировали только 10% выживаемость после 14 суток инфицирования (Фигура 10).
[00119] Органы у двух мышей, которые были усыплены после инфицирования, были обследованы для подтверждения того, что органы были инфицированы А. baumannii на момент обработки полипептидом F307. Печень, селезенка, почка и сердце были извлечены из мышей. Органы затем гомогенизировали в 500 мкл 1x PBS. Растворы были изготовлены и высеяны на чашки Петри с бульоном с сердечно-мозговым экстрактом (BHI). Чашки инкубировали в течение ночи при температуре 37 °С. Количество колониеобразующих единиц было подсчитано. Контрольные мыши были умерщвлены в точке времени, равной двум часам и продемонстрировали наличие Acinetobacter во всех осмотренных органах, что указывает на то, что органы были инфицированы А. baumannii во время обработки.
Пример 7
[00120] Полипептид P307 (SEQ ID NO:43) был протестирован в двух повторностях против 18 клинических изолятов штаммов A. baumannii. Штаммы A. baumannii культивировали в течение ночи до достижения стационарной фазы. Клетки были промыты 3 раза в 20 мМ Трис рН 7,5 и ресуспендированы в том же буфере до ОП (595 нм) около 0,7. К этим клеткам был добавлен P307 (250 мкг/мл) или соответствующий объем буфера, и смесь инкубировали 60 минут при комнатной температуре. Были проведены и высеяны на агаровые пластины TSB разведения смесей для последующего подсчета колониеобразующих единиц.
[00121] Обработка полипептидом P307 привела к 1-8 кратному логарифмическому уменьшению жизнеспособности бактерий по сравнению с контролем после инкубации в течение 60 минут с 250 мкг P307. Результаты приведены в Таблице 4. При сравнении P307 с полноразмерным полипептидом F307 (SEQ ID NO:1), полипептид P307 имел более высокую активность.
Таблица 4. Активность P307 против 18 штаммов A. baumannii.
Пример 8
[00122] Добавление пептида с коротким удлинением приводит к усилению антибактериальной активности P307.
[00123] Пептид SQSRESQC (SEQ ID NO:44) получен от вируса гепатита С и было показано, что он обладает антибактериальной активностью в отношении грамположительных и грамотрицательных бактерий. Мы конъюгировали данную последовательность с P307 (P307Ex), чтобы определить ее влияние на активность. Последовательность F307, p307 и P307Ex (SEQ ID NO: 1, 43 и 45 соответственно) представлены на Фиг. 11, в которых часть последовательности F307 подчеркнута, чтобы показать расположение P307, а часть последовательности P307 отмечена двойным подчеркиванием, чтобы показать расположение противомикробной последовательности.
[00124] P307 и P307Ex были исследованы в двух повторностях против шести штаммов бактерий. Антибактериальные активность измеряли, как описано в Примере 5. Обработка P307Ex привела к логарифмическому уменьшению А. baumannii 1791 в 3,2 раза, в то время как обработка P307 привела к логарифмическому уменьшению в 2,9 раз, продемонстрировав, что добавление антибактериального пептида увеличило активность P307. Результаты представлены в Таблице 5.
Таблица 5
[00125] P307 и P307Ex были протестированы на активность против A. baumannii штамм 1791, E. coli, P. aeruginosa штамм PAO1, S. aureus штамм RN4220, S. aureus штамм 8325 и B. anthracis. Как представлено в Таблице 6, P307 и P307 являлись наиболее активными против A. baumannii и B. anthracis.
Таблица 6. P307 и P307Ex против других видов бактерий.
Пример 9
[00126] P307 не является токсичным для B-лимфоцитов или эритроцитов.
[00127] P307 был смешан с эритроцитами, чтобы определить, будет ли он вызывать лизис. Лизис не наблюдался при концентрации P307 равной 200 мкг. При тестировании влияния P307 на лизис B-лимфоцитов было выявлено только незначительное влияние на количество клеток после 24 часов. Результаты представлены в Таблице 7.
Таблица 7 (% жизнеспособных)
[00128] Пептиды, использованные в Примерах 10-20 были химически синтезированы.
[00129] Пептиды были созданы с помощью установки для синтеза пептидов Protein Technologies Symphony™ peptide synthesizer (PTI Tucson, штат Аризона, США) на предварительно связанной смоле Ванга (П-алкокси-бензиловый спирт) (Bachem, Торранс, штат Калифорния, США). Реакционные емкости были загружены в концентрации 25 мкМ, и пептиды были удлинены, с использованием защищенных аминокислот Fmoc (Anaspec, Сан-Хосе, штат Калифорния, США) (1997.StandardFmocprotocols.289:44-67). Снятие защиты с амина было выполнено с помощью 20% пиперидина (Sigma-Aldrich) в NMP (Н-метилпирролидиноне). Повторяющиеся реакции связывания были проведены с использованием 0,6 М HATU/Cl-HOBT (азабензотриазол тетраметилурониум гексафторфосфата/6-хлор-1-гидроксибензотриазола) (P3 Biosystems, Шелбивилл, штат Кентукки, США) и 0,4 М НММ (н-метилморфолина) с помощью NMP (EMD) в качестве основного растворителя (1989.NewCouplingReagentsinPeptideChemistry30:1927-1930.). Расщепление смолы и снятие защиты с боковых цепей было достигнуто за счет переноса в 100 мл круглодонную колбу и реагирования с 4,0 мл концентрированной, трифторуксусной кислоты, с классом чистоты для секвенирования (Fisher) с триизопропилсиланом (Fluka), дегазированной водой и 3,6-диокса-1,8-октанедитиолом (DODT, Sigma-Aldrich) в соотношении 95:2:2:1 в течение 6 часов. Затем проводили фильтрацию на колонке в 50 мл круглодонную колбу и объем TFA уменьшали до 2 мл с помощью роторного испарителя. Была проведено стандартное осаждение эфиром для индивидуальных пептидов путем переноса в 50 мл пробирки фирмы Falcon, содержащие 40 мл холодного трет-бутилового метилового эфира (TBME, Sigma-Aldrich). Образцы были помещены на ледяную баню на 2 часа, для осуществления осаждения с последующим формированием осадка с помощью центрифугирования (3300 об/мин, 5 мин). Избыток эфира был удален при помощи вакуумной-аспирации, а пептидный осадок оставляли сушиться в течение ночи в вытяжном шкафу. Высушенные осадки пептидов были растворены в 20% ацетонитриле и 10 мл воды для ВЭЖХ, аликвотированы для ЖХ/МС и лиофилизированы. Все сырые продукты были впоследствии проанализированы с помощью обращенно-фазовой СВЭЖХ (сверхэффективной жидкостной хроматографии) Aquity™ (Waters Chromatography, Милфорд, штат Массачусетс, США) с использованием колонки Waters BEH C18. Целостности отдельных пептидов была проверена тандемной масс-спектрометрией с электрораспылением с использованием спектрометрической системы ThermoFinnigan LTQ™ (Thermo Fisher, Уолтем, штат Массачусетс, США). Препаративная хроматография была выполнена на препаративной колонке Vydac C18 RP с использованием ВЭЖХ Waters 600 Prep. Отдельные фракции были собраны с 30-ти секундными интервалами, охарактеризованные с использованием ЖХ/МС и фракции, содержащие желаемый продукт был лиофилизированы. Их поместили на хранение при температуре -20°C до ресуспендирования в автоклавированной воде Milli-Q для различных анализов. Затем исходные растворы хранили при 4 °C. Пептиды кратко изложены с учетом их аминокислотных последовательностей, изоэлектрической точки (pI) и молекулярной массы (MW) в таблице 8.
Таблица 8
Пример 10
[00130] Сравнение in vitro бактерицидной активности пептидов настоящего раскрытия.
[00131] Для определения in vitro бактерицидной активности пептидов, P307, P307AE-8, P307SQ-8C и P307CS-8, бактерии обрабатывали пептидами в течение 2 часов при комнатной температуре. Выжившие клетки серийно разводили и высевали на чашки с TSB агаром для определения активности.
[00132] Бактерицидную активность 50 мкг/мл пептидов P307, P307AE-8 и P307SQ-8C сравнивали путем обработки A. baumannii, штаммы № 1791, S5 и ATCC17978. P307SQ-8C являлся самым активным, снижая около 106 кое/мл бактерий до уровня ниже предела обнаружения (<10 кое/мл). P307 был чуть более активен, чем P307AE-8, однако оба пептида вызывали снижение жизнеспособности бактерий равное около 3,8 логарифмических единиц (Фиг. 2A). Чтобы выяснить, как восемь аминокислот, SQSRESQC, способствовали увеличению активности P307SQ-8C, одинакова молярная концентрация пептида SQSRESQC эквивалентная 50 мкг/мл P307 была добавлена отдельно или в комбинации с P307 к A. baumannii, штаммы № 1791 и S5. Активность сравнивали с 50 мкг/мл P307 и P307SQ-8C. Комбинация была так же активна, как P307 в то время, как пептид SQSRESQC, взятый отдельно не проявлял активности (Фиг. 2B). Следовательно, связь имеет важное значение для высокой бактерицидной активности P307SQ-8С. Далее мы исследовали важность последовательности и состава. Путем перестановки последних восьми аминокислот P307SQ-8C мы синтезировали P307CS-8 с C-концевым добавлением CSQRQSES к P307. Активности P307SQ-8C и P307CS-8 были сопоставимы (Фиг. 2C). Планки погрешностей показывают стандартное отклонение, а черная горизонтальная линия обозначает предел обнаружения. Таким образом, мы пришли к выводу, что превосходящая активность P307SQ-8С зависит от состава последних восьми аминокислот, вне зависимости от последовательности последних восьми аминокислот. Для дальнейших исследований мы использовали P307SQ-8С потому что он обладал наибольшей активностью, и сравнивали его активность с P307.
Пример 11
[00133] Бактерицидная активность P307 и P307SQ-8C
[00134] Было исследовано влияние pH и NaCl на in vitro активность P307 и P307SQ-8C. A. baumannii штамм № 1791 обрабатывали 50 мкг/мл пептидов для проверки каждого условия. Две буферные системы (фосфат натрия и Трис-HCl) использовали для тестирования pH равного 6,8, 7,5, 8,0 и 8,8. Пептиды были более активны в Трис-HCl, а более высокий pH вызывал улучшенный лизис (Фиг. 13A). Таким образом, мы решили продолжить наши in vitro эксперименты с 50 мм Трис-HCl, рН 7,5, что соответствует физиологическому рН. Активность обоих пептидов была обратно пропорциональна концентрации NaCl (Фиг. 13B). Далее титрование P307 и лизисная кинетика P307 и P307SQ-8С были исследованы путем обработки A. baumannii, штамм № 1791. Активность P307 находилась в зависимости от концентрации, начиная с 4-х мкг/мл (Фиг. 13C). P307SQ-8С действовал быстрее, чем P307, в результате чего наблюдалось уменьшение равное около 3,2 логарифмических единиц уже в 5-минутный момент времени (Фиг. 13D). Не было никакой разницы в активности любого пептида при комнатной температуре или 37 °С (данные не представлены). Из этих in vitro характеризующих экспериментов, мы решили, что наши оптимальные экспериментальные условия должны быть следующими: 50 мм Трис-HCl, рН 7,5, 50 мкг/мл пептидов и 2 часа при комнатной температуре (22-25 °С), если не указано иное.
Пример 12
[00135] Далее мы исследовали in vitro бактерицидные спектры P307 и P307SQ-8С против различных видов бактерий - А. baumannii (штаммы № 1775, 1776, 1777, 1788, 1789, 1790, 1791, 1792, 1793, 1794, 1796, 1797, 1798, 1799, ATCC 17978 и S1, S3, D5), Bacillusanthracis (ΔSterne), Escherichia coli (DH5α), Pseudomonas aeruginosa (PA01), Staphylococcus aureus (RN4220) и двух штаммов Klebsiella pneumonia (ATCC 700603 и ATCC10031). Эти виды бактерий обрабатывали 50 мкг/мл P307 или P307SQ-8С в 50 мм Трис-HCl, рН 7,5 в течение 2 часов при комнатной температуре для исследования специфичности пептидов. Среди исследованных бактерий, штаммы А. baumannii были последовательно наиболее чувствительны к пептидам, демонстрируя среднее уменьшение равное 2,7 и 6,2 логарифмических единиц с P307 и P307SQ-8С соответственно. Bacillus anthracis, Pseudomonas aeruginosa и Staphylococcus aureus являются умеренно чувствительными. P307 и P307SQ-8C вызвали среднее уменьшение равное около 1,3 и 2,9 логарифмических единиц, соответственно, для данных бактерий. Однако Escherichia coli и Klebsiella pneumoniae являются устойчивыми к обоим пептидам (Фиг. 14).
Пример 13.
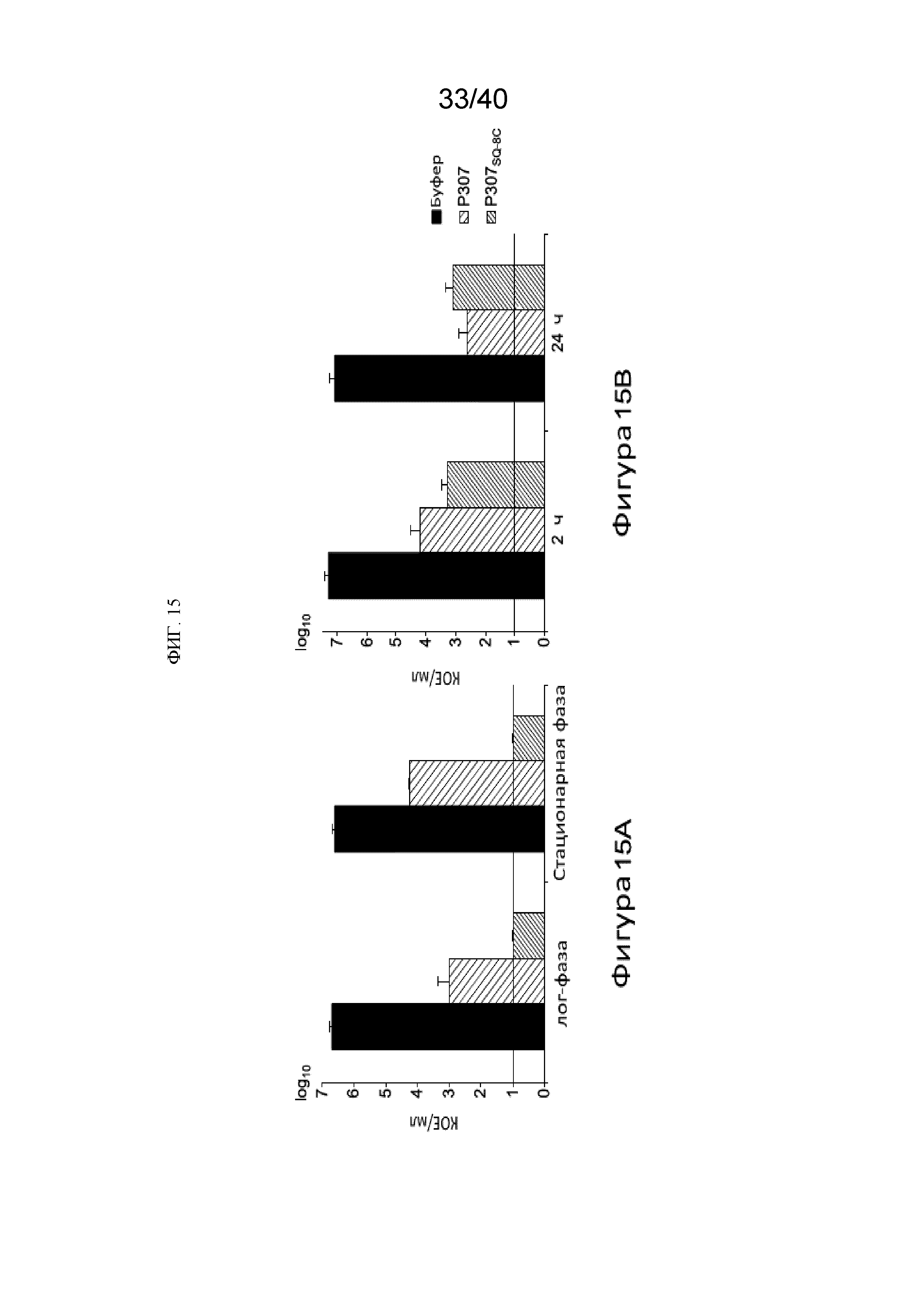
[00136] Кроме того, чтобы исследовать активность пептидов против A. baumannii на разных фазах роста, мы сравнили чувствительность штамма № 1791 в лог фазу, стационарную фазу и при состоянии биопленки. Бактерии в лог фазе (3 часа после инокуляции 1:100 ночной культуры на свежей среде) и стационарной фазе (ночная культура) обрабатывали 50 мкг/мл P307 или P307SQ-8С в течение 2 часов при комнатной температуре. Выжившие клетки серийно разводили и высевали на чашки с TSB агаром для определения соотношения кое/мл. (Фигура 15A). Биопленки A. baumannii были созданы путем инкубации около 105 кое/мл штамм № 1791 в TSB с 0,2% глюкозы внутрь катетеров длиной около 2,5 см в течение 72 часов при 37 °С. Затем катетеры промывали для удаления планктонных клеток и обрабатывали 250 мкг/мл P307 или P307SQ-8С. Спустя 2 часа и 24 часа при комнатной температуре, биопленки был полностью разрушены, а выжившие клетки ресуспендировали для посева и подсчета, с целью определения лизисной эффективности пептидов против in vitro биопленки. (Фиг. 15B) Организмы, находящиеся в лог фазе были несколько более чувствительны к P307, чем те, что находились в стационарной фазе (около 3,7 против 2,4 логарифмических единиц снижения). Похоже, что не существовало такой разницы в случае P307SQ-8С (Фиг. 15А). Биопленки являлись наиболее устойчивыми из всех фаз роста. Биопленки обрабатывали 250 мкг/мл P307 или P307SQ-8C в течение 2 или 24 ч. Через 2 часа наблюдалось снижение, равное около 3 и 4 логарифмических единиц кое/мл с P307 и P307SQ-8С соответственно. После 24 часов, P307 производил дополнительно снижение, равное около 1,3 логарифмических единиц, а P307SQ-8С не вызывал такого эффекта. (Фиг. 15Б).
Пример 14
[00137] Для того, чтобы сравнить эффективность пептидов P307 и P307SQ-8С с клинически используемым антибиотиками, мы провели исследование минимальный ингибирующее концентрации для двух штаммов А. baumannii № 1791 и ATCC17978. Способ микротитровального разведения был использован для определения МИК (максимальных ингибирующих концентраций) левофлоксацина, цефтазидима, полимиксина B, P307 и P307SQ-8C на А. baumanni штаммы № 1791, № 1798, S5 и ATCC17978. Для антибиотиков были включены 1,5-2 кратные серийные разведения (три нижних и три верхних) МИК, определенные при помощи системы EtestLoodR,etal.,2015Antimicrob.AgentsChemother.59:1983-1991.). Для пептидов были протестированы 2-х кратные серийные разведения (500-31,25 мкг/мл). Ночную культуру ресуспендировали до OD600 равной 0,001 (около 105 КОЕ/мл) в бульоне Мюллера-Хинтона (pH 7,9). Антибиотики или пептиды были добавлены для достижения разведения, равного 100 мкл. Бактерии оставляли расти в течение 24 часов при 37°C и 220 об/мин. Поглощение при длине волны равной 595 нм затем регистрировали при помощи SpectraMax Plus Reader (Molecular Devices). МИК были определены как самые низкие концентрации антимикробных препаратов, которые полностью подавляют рост бактерий. Для подтверждения данных, полученных при измерении OD595 был использован Alamar®Blue. Эксперименты проводились как минимум дважды с двумя повторностями.
[00138] Штаммы продемонстрировали различную степень чувствительности ко всем антибактериальным препаратам (таблица 9).
Таблица 9
[00139] P307SQ-8C имел более низкую МИК по сравнению с P307, который соответствовал in vitro лизирующей активности (Фиг. 2 и 3).
Пример 15
[00140] Цитотоксические эффекты P307 и P307SQ-8C измеренная на основании выживаемости и гемолиза B клеток.
[00141] B-клетки человека, полученные от пациента, больного ревматической лихорадкой в больнице университета Рокфеллера были выращены на среде RPMI с добавлением 10% бычьей сыворотки, пенициллина и стрептомицина. Клетки собирали при помощи низкоскоростного центрифугирования, промывали один раз в среде, и ресуспендировали в предварительно прогретой среде в концентрации 107 клеток/мл, как определено при помощи теста на вытеснение трипанового синего. Пептиды (P307, P307SQ-8C и мелиттин) серийно разводили (80-0,3125 мкМ) в культуральной среде, и добавляли к 5×104 живым клеткам. Клетки инкубировали 1 час при 37 °С В увлажненной атмосфере с 5% CO2, после чего их окрашивали в соответствии с инструкциями производителя (нерадиоактивный анализ пролиферации клеток CellTiter 96; Promega). Образцы инкубировали дополнительно 4 часа, прежде чем добавляли солюбилизирующий/стоп раствор и инкубировали в течение ночи. Поглощение при 570 нм измеряли при помощи SpectraMax Plus Reader (Molecular Devices). Реакции проводили дважды с тремя повторностями, а репрезентативные данные представлены как среднее ± стандартное отклонение.
[00142] Человеческую кровь от здорового человека собирали в ЭДТК-вакутейнеры, и красные кровяные клетки (RBC), собирали при помощи центрифугирования на низкой скорости. Клетки промывали в PBS, и ресуспендировали до получения до 10% раствора RBC. P307 и P307SQ-8C последовательно разводили в PBS (80-0,3125 мкM). PBS и 1% Тритон X-100 использовали в качестве отрицательного и положительного контроля, соответственно. Образцы смешивали, и инкубировали 1 час при 37 °С. Супернатант собирали, и поглощение при 405 нм записывали с помощью SpectraMax Plus Reader (Molecular Devices). Реакции проводили дважды с тремя повторностями, а репрезентативные данные представлены как среднее ± стандартное отклонение.
[00143] Серийные разведения пептидов инкубировали с около 5×104 живых B-клеток в течение 1 ч при 37 °С в увлажненной атмосфере содержащей 5% CO2, и мелиттин был использован в качестве положительного контроля. Нерадиоактивный анализ пролиферации клеток CellTiter 96 ® (Promega) проводили согласно протоколу производителя для количественной оценки выживаемости B-клеток. Красные клетки крови (RBC) инкубировали с серийными разведениями пептидов, а высвобождение гемоглобина в супернатант измеряли при OD405 для определения гемолиза. Тритон X-100 использовали в качестве положительного контроля. Планки погрешностей показывают стандартное отклонение.
[00144] Пептиды были протестированы на цитотоксичность с использованием человеческих B-клеток и красных клеток крови (эритроцитов) (RBC). В отличие от положительного контроля с мелиттином, мембраны B-клеток не поражались ни P307, ни P307SQ-8С. Даже при самой высокой протестированной концентрации (80 мкM), жизнеспособность клеток оставалась такой же, как в контроле с буфером (Фигура 16A). Аналогично, на целостность эритроцитов также не влиял пептид в сравнении с положительным контролем с Тритоном X-100 (рис. 16Б).
Пример 16
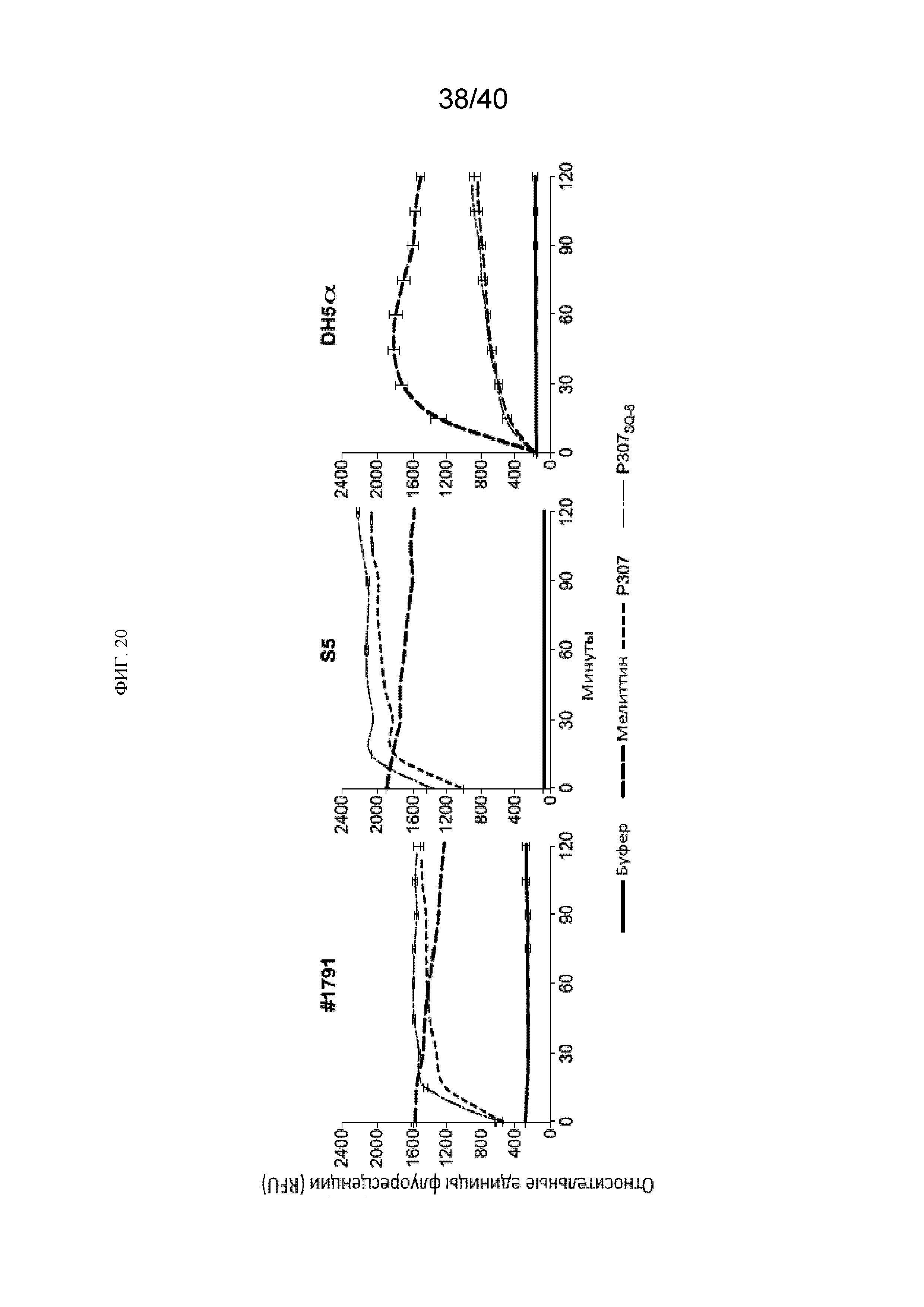
[00145] Часть P307SQ-8C (около 25%) имеет подвижность в геле характерную для двойной теоретической молекулярной массы в сравнении с P307SQ-8A, который имеет подвижность характерную для 4,3 кДа (данные не представлены). Для определения важности образования дисульфидной связи для высокой активности P307SQ-8С бактерицидная активность P307 и P307SQ-8С, была сравнена в присутствии 0, 0,1 и 1 мМ дитиотреитола (ДТТ). A. baumannii штамм № 1791 обрабатывали 50 мкг/мл P307 или 10 мкг/мл P307SQ-8C в 50 мМ Трис-HCl, pH 7,5 в течение 2 часов при комнатной температуре. Выжившие клетки серийно разводили и высевали на TSB агар. P307SQ-8С становился менее активным при более высокой концентрации ДТТ, тогда как активность P307 незначительно увеличивалась (Фиг. 17А). Для дальнейшего подтверждение важности формирования дисульфидных связей для активности P307SQ-8С, мы синтезировали P307SQ-8А с заменой последнего цистеина на аланин. Штаммы A. baumannii №. 1791 и ATCC17978 обрабатывали 10 мкг/мл каждого пептида. Бактерицидные анализ P307SQ-8C и P307SQ-8А показал, что первый был немного более активным, чем второй (Фиг. 17Б). Данные результаты в целом указывают, что часть повышенной активности P307SQ-8С возникает из-за образования дисульфидной связи между двумя молекулами.
Пример 17
[00146] Далее мы исследовали, может ли P307 связывается с ДНК, учитывая положительные заряды на пептидах (суммарный заряд +7). Пептид P307 смешивали с ДНК на разных соотношениях пептид:ДНК (0:1-15:1) и инкубировали в течение 1 часа, после чего анализировали на агарозном геле. В сравнении с положительным пептидным контролем, не наблюдалось никаких сдвигов молекулярной массы для P307 в любом из протестированных соотношений пептида к ДНК (Фиг. 18).
Пример 18
[00147] Так как пептиды, по-видимому, не лизируют бактерии, взаимодействуя с ДНК, мы исследовали, могут ли они повлиять на бактериальную мембрану с помощью трансмиссионной электронной микроскопии (TEM). A. baumannii штамм № 1791 обрабатывали буфером (контроль) или 300 мкг/мл P307SQ-8C в течение 5 минут или 2 часов. Сравнение микрофотографий TEM образцов продемонстрировало разрушение внутренней мембраны и изменение плотности межклеточной среды (Фиг. 19А, B и C). Кроме того мы обнаружили, что бактерии устойчивые при pH 7,5 (Фиг 3) были чувствительны к P307 при pH 8,8, включая E. coli и K. pneumoniae (Фиг. 19D). Поскольку заряды на пептиде не изменяются при изменении рН от 7,5 до 8,8, мы полагали, что изменения происходят на бактериальной мембране. При повышенном рН, бактериальная мембрана становится более отрицательно заряженной, что позволяет положительно заряженным пептидам устанавливать более прочные ионные взаимодействия.
Пример 19
[00148] Не желая быть связанными теорией, мы предполагаем следующий механизм действий: P307SQ-8С взаимодействует с бактериальной мембраной, чтобы попасть в клетку, и в этом процессе разрушает цитоплазматическую мембрану. Пермеабилизация мембраны является более эффективной, когда пептид является димеризованым. Нарушение индуцирует образование активных форм кислорода, таких как гидроксильные радикалы, которые разрушают внутриклеточное содержимое. Чтобы исследовать данную гипотезу, мы определили разрушение мембраны с помощью анализа поглощения SYTOX® зеленого.
[00149] Ночные культуры бактерий промывали в 50 мМ Трис-HCl pH 7,5, и ресуспендировали до OD600 равной 0,3 (около 107 КОЕ/мл). Бензоназ® нуклеазу (25 Ед/мл)(Novagen) и SYTOX® зеленый (1 мкМ)(Invitrogen) добавляли к клеткам бактерий и инкубировали в течение 15 минут при комнатной температуре в темноте. Добавляли пептиды (50 мкг/мл; 14,7 мкM P307 и 11,6 мкM P307SQ-8C), а мелиттин (14,7 мкM)(Sigma) использовали в качестве контроля. Относительные единицы флуоресценции (RFU) были измерены с помощью SpectraMax Plus reader (Molecular Devices) при комнатной температуре (возбуждение, 485 нм, эмиссия: 520 нм) в течение 2 часов. Реакции проводили дважды с двумя повторностями, а репрезентативные данные представлены как среднее ± стандартное отклонение.
[00150] Оба пептида пермабилизируют мембраны чувствительных бактерий, что приводит к увеличению флуоресцентного сигнала красителя SYTOX® зеленый когда он связывается с внутриклеточной ДНК (Фиг. 20). Образование гидроксильных радикалов исследовали путем обработки бактерий P307 и P307SQ-8С в присутствии акцептора гидроксильного радикала, тиомочевины. Полимиксин B был включен в качестве контроля, поскольку сообщалось, что его бактерицидная активность частично связана с путем деструкции гидроксильным радикалом. Тиомочевина (300 мМ) ингибирует активность P307 и P307SQ-8С полностью (Фиг. 21A). Однако, нельзя забывать, что тиомочевина влияет на активность другими путями. Поэтому, бактерицидную активность также сравнивали в аэробных и анаэробных условиях. Так как A. baumannii представляет собой облигатно аэробный вид бактерий, для бактерицидных анализов использовали E. coli с 50 мМ Трис-HCl, pH 8,8. Обе пептидных активности были полностью ингибированы в анаэробных условиях (Фиг. 21B). Хотя мы не можем исключать другие возможности, такие как влияние на кислород-зависимый транспортный механизм, текущие результаты подтверждают нашу гипотезу об образовании гидроксильных радикалов.
Пример 20
[00151] Мы исследовали in vivo активность P307SQ-8C с использованием модели кожи мыши, потому что кожная инфекция является широко распространенным путем заболевания A. baumannii. Спины 40 CD-1 самок мышей (возрастом 6-8 недель; Charles River Laboratories) были побриты при помощи электробритвы. NairTM (лосьон для удаления волос для тела и ног, алоэ и ланолин) наносили на побритые участки для удаления оставшихся волос. Затем эти участки были продезинфицированы спиртовыми салфетками, и ссадины на коже были созданы при помощи соскоба липкой лентой. Область кожи размером ~ 1 см2 на которой проводили соскоб липкой лентой затем отмечали и инфицировали 10 мкл с около 108 КОЕ/мл A. baumannii штамм № 1791. Бактерии оставляли для образования колоний в течение 16-18 часов, после чего инфицированные участки оставляли необработанными или обрабатывали 200 мкг P307SQ-8C или 2 мкг полимиксина B в течение 2 часов. Для сбора оставшихся бактерии с поверхности кожи, мышей умерщвляли и инфицированную кожу обрабатывали в 500 мкл PBS в течение 1 минуты в Stomacher® 80 Biomaster с применением микросумки (Seward Ltd., Великобритания). Раствор последовательно разбавляли и высеивали на LB агар, содержащий 4 мкг/мл левофлоксацина и 12 мкг/мл ампициллина для селекции. Итоговые значения КОЕ/мл от каждого животного изображены как точка, а горизонтальные черта представляют собой среднее значение. Обе обработки значительно снизили бактериальную нагрузку (p-значение=0,0023, обычный однофакторный дисперсионный анализ (ANOVA)) (Фиг. 22).
Реферат
Изобретение относится к области биохимии, в частности к полипептиду, который обладает антибактериальной активностью против каждой инфекционной бактерии, выбранной изи. Также раскрыты конъюгат, композиция и набор, содержащие указанный полипептид. Раскрыты способы лечения субъекта, дезинфекции предмета, ингибирования образования или разрушения бактериальной биопленки. Изобретение обладает эффективной антибактериальной активностью против каждой инфекционной бактерии, выбранной изи. 9 н. и 27 з.п. ф-лы, 22 ил, 9 табл., 20 пр.
Формула
Документы, цитированные в отчёте о поиске
Антибактериальные пептиды

Комментарии