Микровезикулы, происходящие из протопластов клеток, и их применение - RU2570636C2
Код документа: RU2570636C2
Чертежи





Описание
Область техники
Настоящее изобретение относится к микровезикулам, происходящим из протопластов клеток, таких как бактерии, археи, грибы, клетки растений и т.п., и к их применению для доставки терапевтических, диагностических и/или вакцинных веществ в клетки-мишени и ткани-мишени.
Уровень техники
В целях применения в фармакотерапии, система для доставки лекарственных средств (DDS) предназначена для способствования доставке лекарственного средства в область-мишень в организме для обеспечения терапевтического эффекта. Если лекарственное средство экскретируется слишком быстро из организма вследствие его низких уровней всасывания или биодоступности, DDS можно использовать для модификации профиля высвобождения лекарственного средства. Лекарственные средства с тяжелыми побочными эффектами должны доставляться только в ткани-мишени клетки-мишени. Например, множество доступных в настоящее время средств против злокачественной опухоли проявляют цитотоксичность в отношении нормальных клеток помимо злокачественных клеток. Доставка средств против злокачественной опухоли в основном в злокачественные клетки или ткани должна снизить страдание и неудобство пациентов со злокачественной опухолью в ходе лечения.
С первого применения в 1960 годах липосомы широко исследовали в отношении их применения в DDS. Достижения в исследованиях липосом привели к конструированию, путем конъюгации с полимерами, такими как полиэтиленгликоль (PEG), закрепленными снаружи мембраны, так называемых липосом-невидимок, которые могут избегать обнаружения иммунной системой организма. Покрытие PEG обеспечивает более длительное время полужизни в кровотоке механизма доставки лекарственных средств. На практике был разработан DOXIL, пегилированная инкапсулированная в липосомы форма доксорубицина. Однако сами по себе липосомы и липосомы-невидимки не могут доставлять лекарственные средства в клетки-мишени или ткани-мишени, поскольку они лишены способности распознавать клетки-мишени или ткани-мишени. Чтобы обеспечить связывание липосом с конкретной мишенью, недавно проводили исследования, направленные на включение нацеливающих лигандов, таких как моноклональные антитела, в липосомы, однако ни одно из них еще не прошло клинические испытания и не было успешно запущено в серийное производство.
Вместо искусственно синтезированных липосом, состоящих из липидов, в целях разработки систем для доставки используют существующие в природе клеточные мембраны. Описан способ доставки лекарственных средств с использованием мини-клеток, секретируемых из микроорганизмов, выращенных в среде, содержащей лекарственное средство [WO 2005/079854, “Compositions and methods for targeted in vitro and in vivo drug delivery to mammalian cells via bacterially derived intact minicells”]. Миниклетки, обычно состоящие из бактериальной клеточной мембраны, склонны содержать токсические материалы, например, эндотоксины (липополисахариды), присутствующие на внешней мембране, если они происходят из грамотрицательных бактерий, или пептидогликаны, присутствующие в клеточной стенке, если они происходят из грамположительных бактерий, так что они могут вызывать различные побочные эффекты, такие как системное воспаление, сепсис и т.д.
Протопласт представляет собой клетку бактерий, архей, грибов, растений, из которой полностью удалена ее клеточная стенка. Удаление клеточной стенки можно осуществить с помощью ферментов, таких как лизоцим для клеток бактерий и архей, хитиназа для клеток грибов и целлюлаза, пектиназа и/или ксиланаза для клеток растений. Протопласты можно использовать для исследования биологии мембран, включая захват макромолекул и вирусов. Кроме того, протопласты применяют для трансформации ДНК, чтобы создавать генетически модифицированные организмы. Протопласты можно использовать для выведения растений с использованием способа, называемого слиянием протопластов. Однако до настоящего времени еще не были описаны происходящие из протопластов микровезикулы, также как и их применение.
Описание
Техническая проблема
К настоящему изобретению привело глубокое и тщательное исследование DDS, проведенное авторами настоящего изобретения, нацеленное на преодоление проблем, имеющихся на уровне техники, что привело к открытию того, что микровезикулы, происходящие из клеток бактерий, архей, грибов или растений, у которых удалены их клеточные стенки, можно использовать для эффективной доставки терапевтических и диагностических веществ или вакцин, в конкретные клетки или ткани.
Таким образом, задачей настоящего изобретения является предоставление композиции, содержащей микровезикулы, происходящие из протопластов клеток. Другой задачей настоящего изобретения является предоставление фармацевтической композиции, содержащей микровезикулы, нагруженные веществом, необходимым для диагностики, терапии, вакцинации, нацеливания или слияния клеточной мембраны с клеткой мишенью, и обладающей сниженными побочными эффектами и улучшенной стабильностью in vivo и in vitro. Следующей задачей настоящего изобретения является предоставление композиции для доставки терапевтического, диагностического и/или вакцинного вещества, содержащего микровезикулы, происходящие из протопластов клеток. Следующей задачей настоящего изобретения является предоставление способа доставки вещества к конкретной мишени с использованием микровезикул, системы для доставки вещества, содержащей микровезикулы, и набора для диагностики заболевания, содержащего микровезикулы.
Однако технические задачи, решаемые с помощью настоящего изобретения, не ограничиваются задачами, указанными выше, и другие задачи могут быть хорошо понятны специалистам в данной области из представленного ниже описания.
Техническое решение
В соответствии с его аспектами, настоящее изобретение относится к композиции, содержащей микровезикулы, происходящие из протопластов клетки. Клетка, пригодная для настоящего изобретения, может быть выбрана из группы, состоящей из клетки бактерий, клетки архей, клетки грибов и клетки растений.
В соответствии с другим аспектом, настоящее изобретение относится к фармацевтической композиции, содержащей происходящие из протопластов микровезикулы, нагруженные терапевтическим или диагностическим веществом.
В соответствии с другим аспектом, настоящее изобретение относится к фармацевтической композиции, содержащей микровезикулы протопластов, нагруженные вакцинным веществом.
Благодаря наличию способности к транспорту терапевтического, диагностического и/или вакцинного вещества в конкретную ткань или клетку, микровезикулы по настоящему изобретению можно использовать для предупреждения, лечения и/или диагностики представляющего интерес заболевания. Вещество, предназначенное для нагрузки микровезикул, конкретно не ограничено. Терапевтическое, диагностическое и/или вакцинное вещество для нагрузки может быть экспрессировано естественным образом или путем трансформации клетки, используемой в качестве источника микровезикул, или оно может быть внесено извне клетки.
В соответствии со следующим аспектом, настоящее изобретение относится к композиции для доставки диагностического, терапевтического и/или вакцинного вещества от заболевания, включающего происходящие из протопластов микровезикулы.
В соответствии с другим аспектом, настоящее изобретение относится к системе для доставки диагностического, терапевтического и/или вакцинного вещества от заболевания, содержащего происходящие из протопластов микровезикулы.
В соответствии с другим аспектом настоящее изобретение относится к способу получения происходящих из протопластов микровезикул, включающему: удаление клеточных стенок из клеток с получением протопластов; конструирование микровезикул в суспензии клеток; и выделение микровезикул из суспензии.
В соответствии с другим аспектом настоящее изобретение относится к способу получения происходящих из протопластов микровезикул, нагруженных терапевтическим, диагностическим или вакцинным веществом от заболевания, включающему: нагрузку клеток терапевтическим, диагностическим или вакцинным веществом извне, а затем удаление клеточной стенки из клеток с получением протопластов; конструирование микровезикул в суспензии протопластов; и выделение микровезикул из суспензии.
В соответствии с другим аспектом, настоящее изобретение относится к способу получения происходящих из протопластов микровезикул, нагруженных терапевтическим, диагностическим или вакцинным веществом от заболевания, включающему: удаление клеточной стенки из клеток с получением протопластов; нагрузку клеток терапевтическим, диагностическим или вакцинным веществом извне; конструирование микровезикул в суспензии протопластов, нагруженных веществом; и выделение микровезикул из суспензии.
В соответствии с другим аспектом, настоящее изобретение относится к способу получения происходящих из протопластов микровезикул, нагруженных терапевтическим, диагностическим или вакцинным веществом от заболевания, включающему: удаление клеточной стенки из клеток с получением протопластов; добавление терапевтического, диагностического или вакцинного вещества к суспензии протопластов для конструирования микровезикул; и выделение микровезикул из суспензии.
В соответствии с дополнительным аспектом, настоящее изобретение относится к способу получения происходящих из протопластов микровезикул, нагруженных терапевтическим, диагностическим или вакцинным веществом от заболевания, включающему: удаление клеточной стенки из клеток с получением протопластов; конструирование микровезикул в суспензии протопластов; добавление терапевтического, диагностического или вакцинного вещества к суспензии, содержащей микровезикулы, и обеспечения нагрузки микровезикул терапевтическим, диагностическим или вакцинным веществом; и выделение микровезикул, нагруженных терапевтическим, диагностическим или вакцинным веществом, из суспензии.
В соответствии со следующим дополнительным аспектом, настоящее изобретение относится к способу получения происходящих из протопластов микровезикул, нагруженных терапевтическим, диагностическим или вакцинным веществом от заболевания, включающему: удаление клеточной стенки из клеток с получением протопластов; конструирование микровезикул в суспензии протопластов; выделение микровезикул из суспензии; и добавление терапевтического, диагностического или вакцинного вещества к суспензии, содержащей микровезикулы, и обеспечение нагрузки микровезикул терапевтическим, диагностическим или вакцинным веществом.
В соответствии с другим дополнительным аспектом, настоящее изобретение относится к способу доставки диагностического, терапевтического или вакцинного вещества в конкретную клетку или ткань, включающему использование происходящих из протопластов микровезикул, нагруженных диагностическим, терапевтическим или вакцинным веществом.
В соответствии со следующим дополнительным аспектом, настоящее изобретение относится к способу лечения и/или диагностики заболевания, включающему доставку диагностического или терапевтического вещества в конкретную клетку или ткань с использованием происходящих из протопластов микровезикул, нагруженных терапевтическим или диагностическим веществом.
В соответствии с другим дополнительным аспектом, настоящее изобретение относится к способу профилактики и/или лечения заболевания, включающему доставку вакцинного вещества в конкретную клетку или ткань с использованием происходящих из протопластов микровезикул, нагруженных вакцинным веществом.
В соответствии со следующим дополнительным аспектом, настоящее изобретение относится к набору для диагностики заболевания, содержащему происходящие из протопластов микровезикулы субпротопластного размера, нагруженные праймером, зондом, антисмысловой нуклеиновой кислотой или антителом, необходимыми для диагностики заболевания.
Преимущественные эффекты
Патогенная способность клеток микробов или клеток высших организмов часто ассоциирована с определенными компонентами оболочек и мембран клеток, включая эндотоксины, расположенные в наружной мембране клетки, и пептидогликаны и липопротеины, расположенные в клеточной стенке грамотрицательных бактерий, псевдопептидогликан у архей, и хитин и целлюлозу, расположенные в клеточной стенке клеток грибов и растений. Эти компоненты могут запускать иммунные ответы, одновременно вызывая тяжелые симптомы. Будучи происходящими из протопластов, сконструированных удалением клеточной стенки из бактерий, архей, грибов или клеток растений, микровезикулы по настоящему изобретению не запускают иммунный ответ сами по себе. Кроме того, происходящие из протопластов микровезикулы являются преимущественными в том, что их можно легко нагрузить терапевтическим и/или диагностическим веществом или вакцинным веществом, и можно получить в крупном масштабе.
Терапевтические, диагностические и/или вакцинные вещества, когда ими нагружены происходящие из протопластов микровезикулы по настоящему изобретению, можно доставлять в клетки-мишени или ткани-мишени без направления их на не являющиеся мишенями клетки или ткани. Таким образом, происходящие из протопластов микровезикулы по настоящему изобретению могут селективно доставлять терапевтическое средство, такое как лекарственное средство, в представляющие интерес клетки или ткани со значительным снижением побочных эффектов, таким образом, смягчая неудобство и боль у пациента. Кроме того, благодаря способности к точному нацеливанию, происходящие из протопластов микровезикулы по настоящему изобретению можно использовать для точной диагностики заболеваний, когда они нагружены диагностическим веществом, и для эффективной вакцинации индивидуума, когда они нагружены вакцинным веществом, без возникновения побочных эффектов.
Более того, если микровезикулы получены из протопласта клетки, экспрессирующей терапевтическое, диагностическое и/или вакцинное вещество, они имеют промышленные и экономические преимущества, поскольку их можно получить без очистки вещества.
Также микровезикулы или терапевтические и/или диагностические вещества, которыми их нагружают, и способ их получения в соответствии с настоящим изобретением можно использовать для лечения, диагностики или экспериментов in vitro и/или in vivo.
Описание чертежей
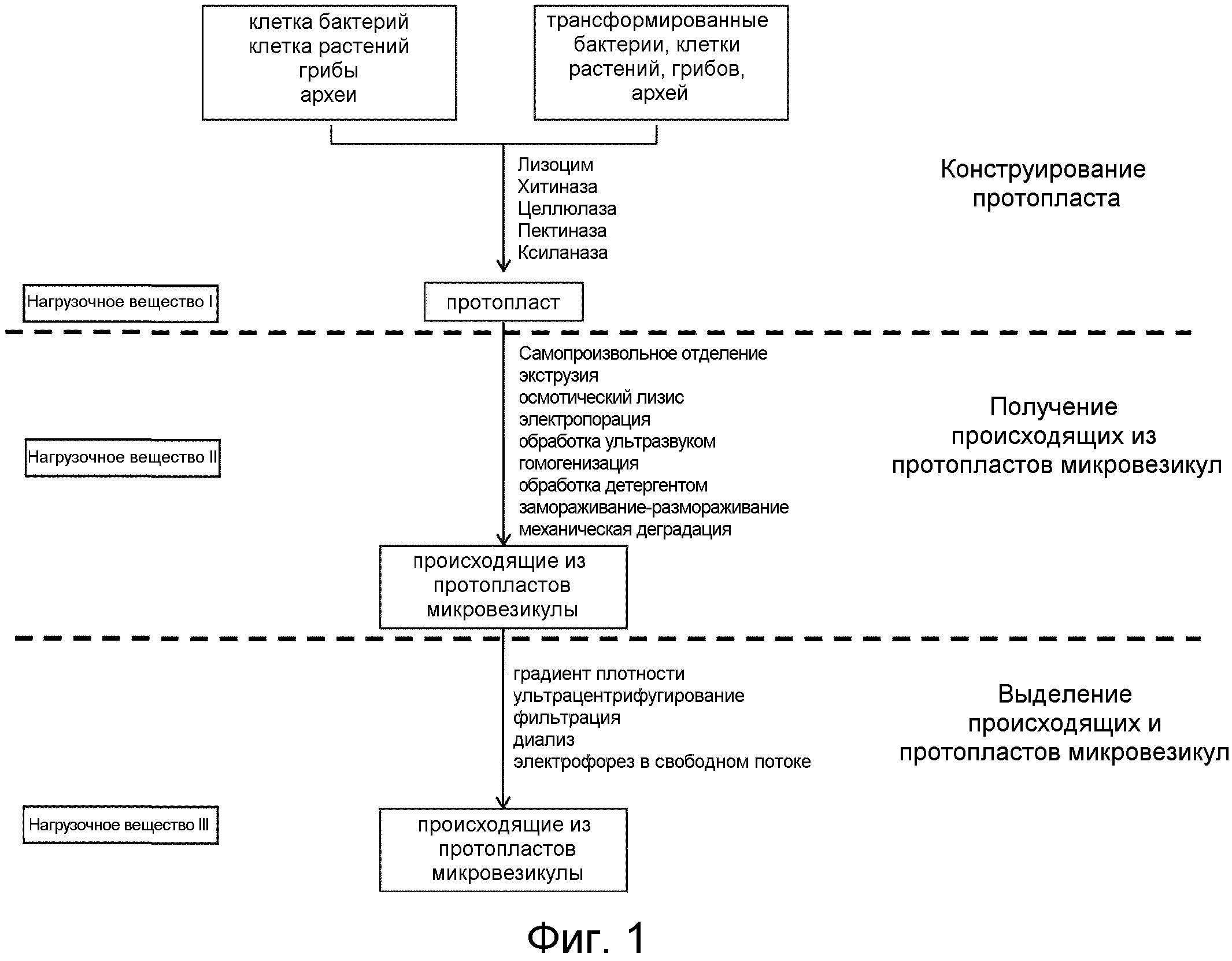
На ФИГ.1 представлено схематическое изображение, иллюстрирующее процессы получения происходящих из протопластов микровезикул.
На ФИГ.2 проиллюстрирована точная конструкция протопластов из бактериальных клеток.
На ФИГ.3 представлено изображение TEM, демонстрирующее микровезикулы, происходящие из протопластов грамотрицательных бактерий.
На ФИГ.4 представлено изображение TEM, демонстрирующее микровезикулы, происходящие из протопластов грамположительных бактерий.
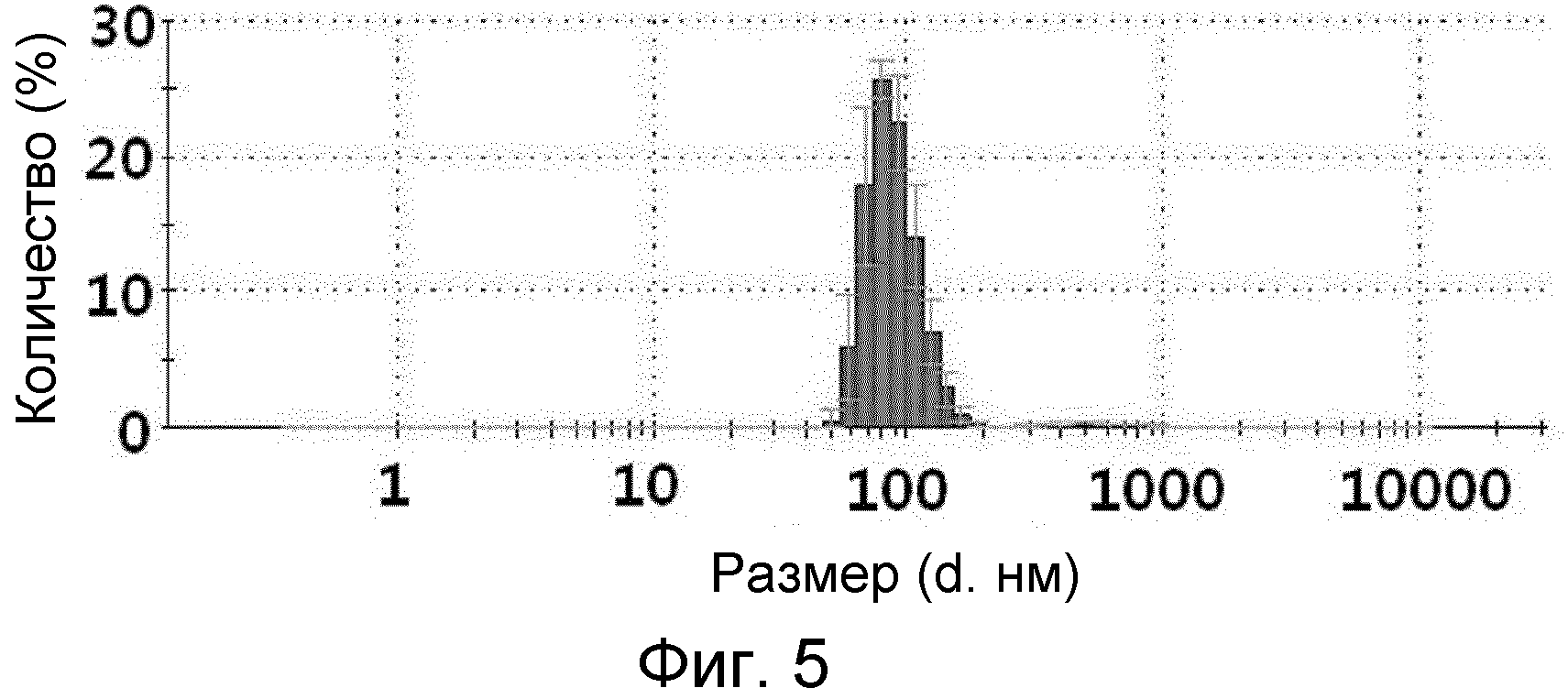
На ФИГ.5 представлен график, демонстрирующий размеры частиц микровезикул, происходящих из протопластов грамотрицательных бактерий.
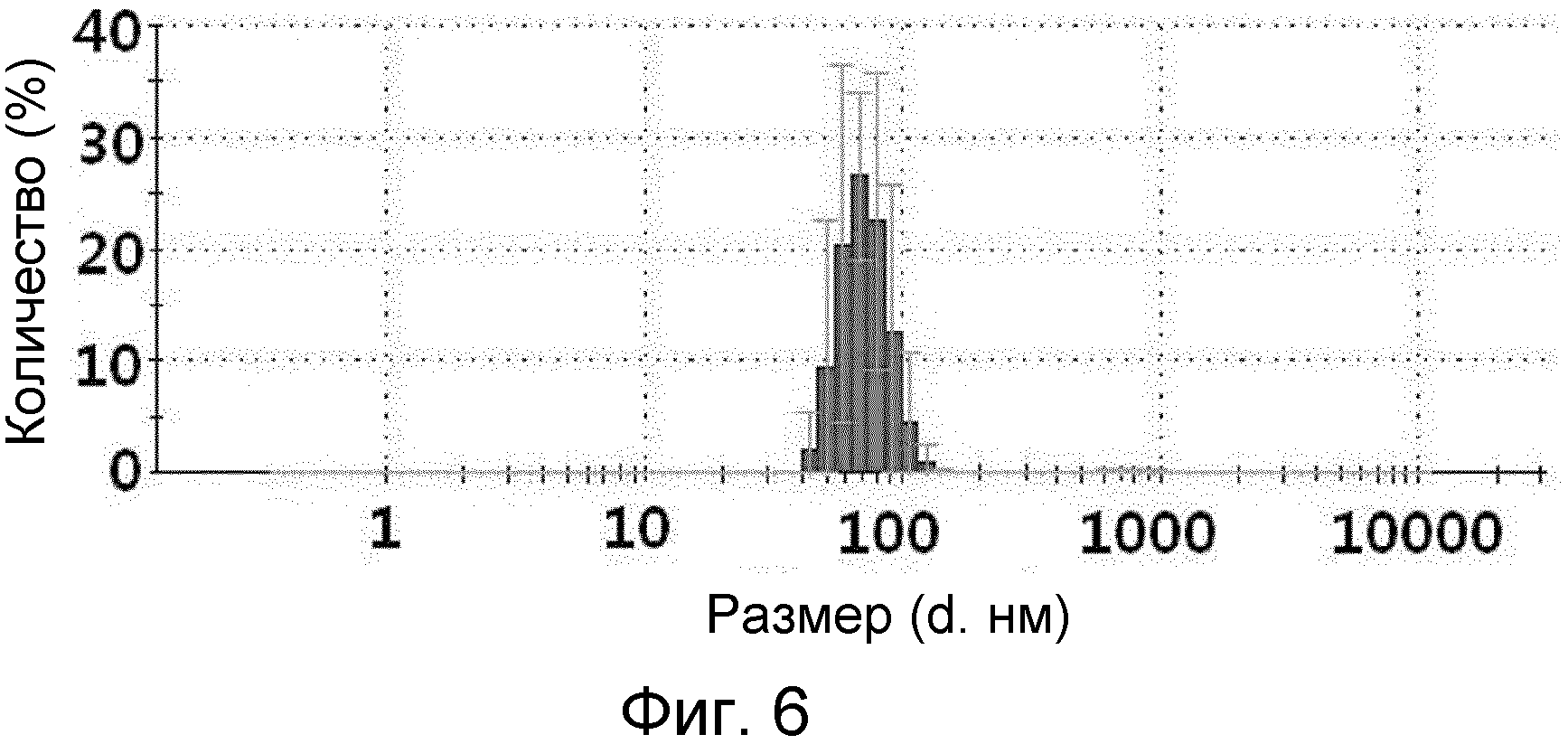
На ФИГ.6 представлен график, демонстрирующий размеры частиц микровезикул, происходящих из протопластов грамположительных бактерий.
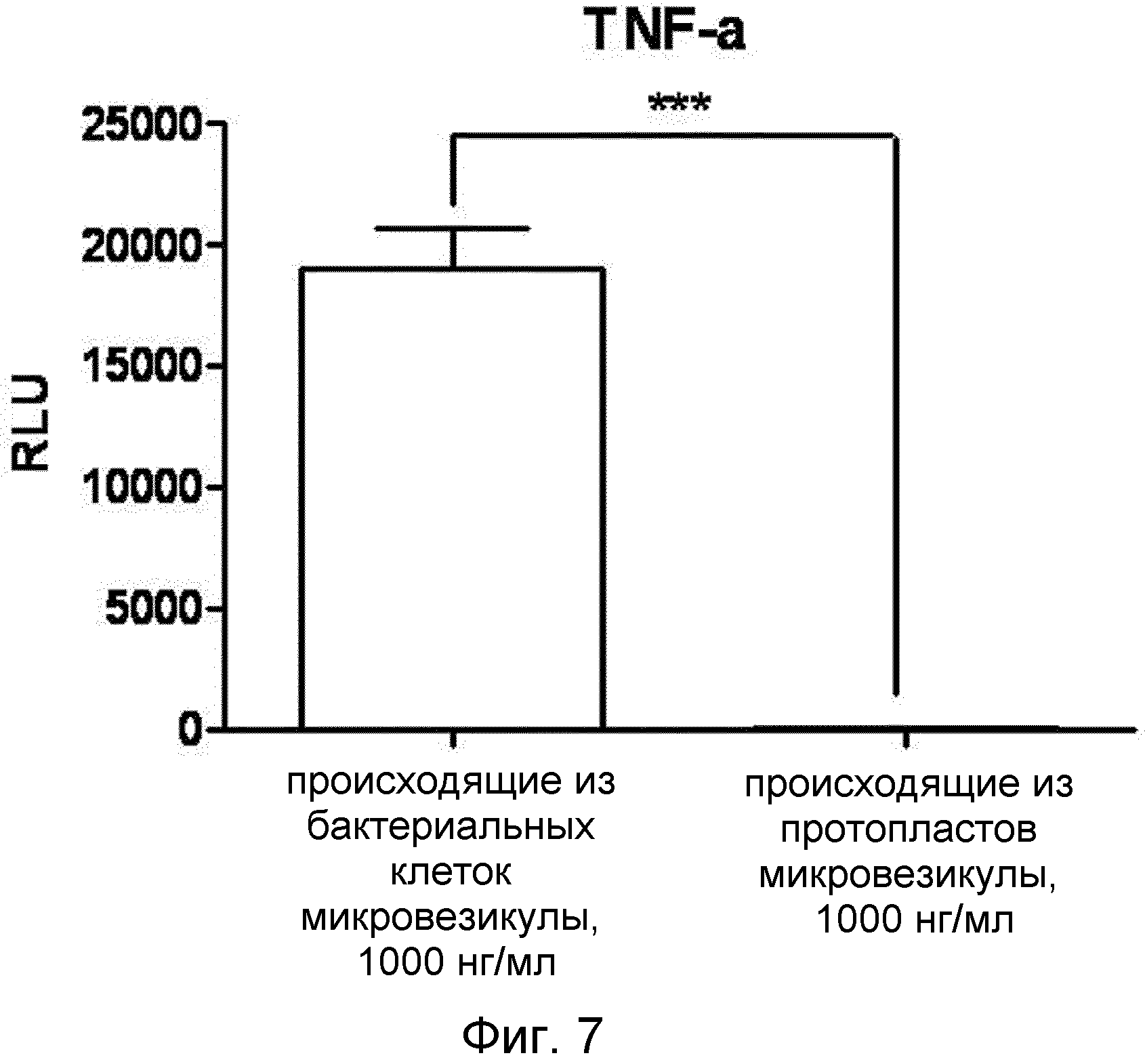
На ФИГ.7 представлен график, демонстрирующий, что микровезикулы, происходящие из протопластов грамотрицательных бактерий, не вызывают побочных эффектов.
На ФИГ.8 представлен график, демонстрирующий, что микровезикулы, происходящие из протопластов грамположительных бактерий, не вызывают побочных эффектов.
На ФИГ.9 представлен график, демонстрирующий, что микровезикулы, происходящие из протопластов грамотрицательных бактерий, не вызывают побочных эффектов у мышей.
На ФИГ.10 представлен график, демонстрирующий, что микровезикулы, происходящие из протопластов грамположительных бактерий, не индуцируют продуцирование IL-6 у мышей.
На ФИГ.11 представлено изображение, демонстрирующее способность происходящих из протопластов микровезикул быть нагруженными плазмидой.
На ФИГ.12 представлено изображение, демонстрирующее целостность плазмиды, которой нагрузили происходящие из протопластов микровезикулы.
На ФИГ.13 представлено изображение, демонстрирующее опосредуемую происходящими из протопластов микровезикулами доставку плазмиды в бактерии.
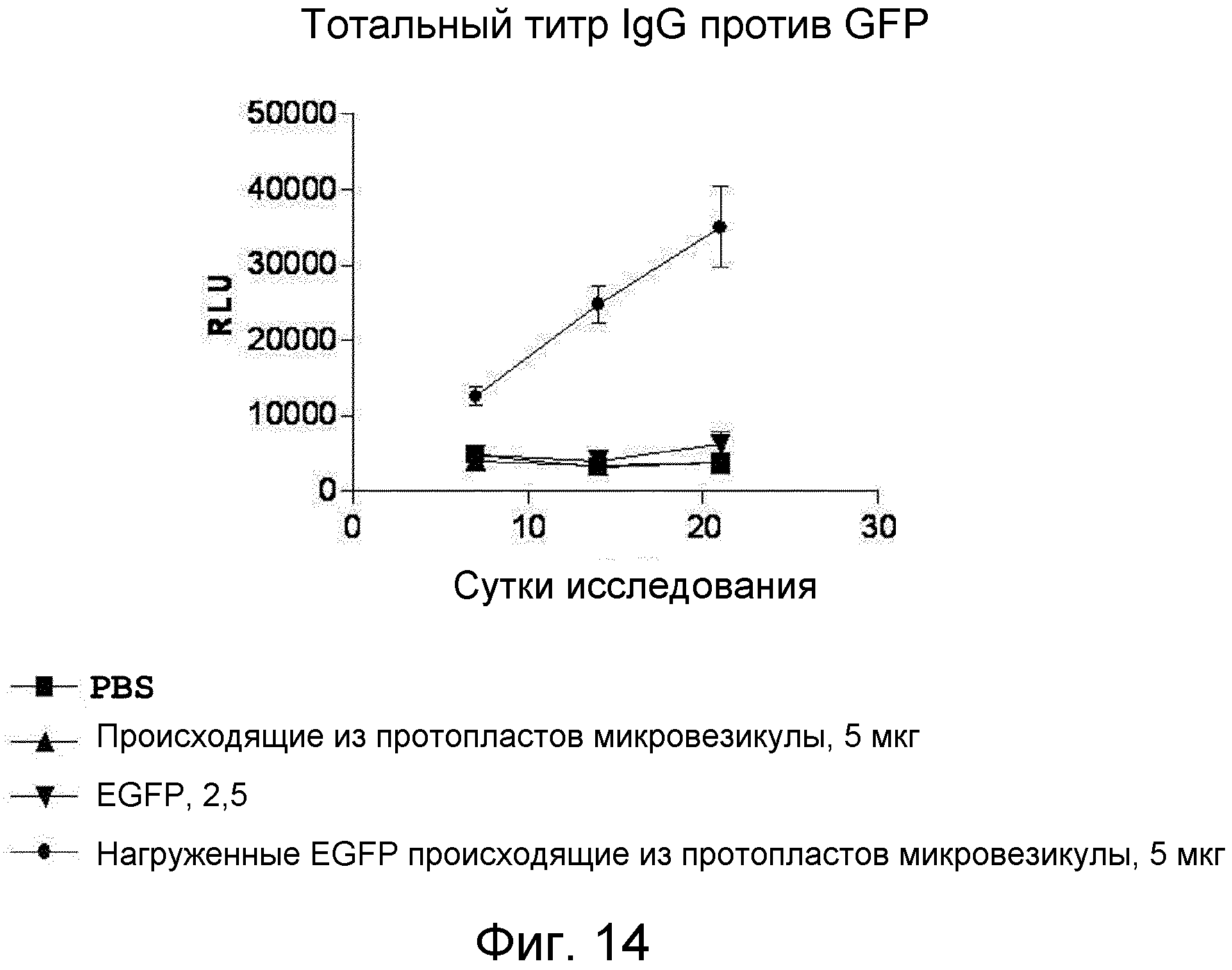
На ФИГ.14 представлен график, демонстрирующий способность нагруженных антигеном происходящих из протопластов микровезикул индуцировать продуцирование IgG-антитела, специфичного к антигену, у мышей.
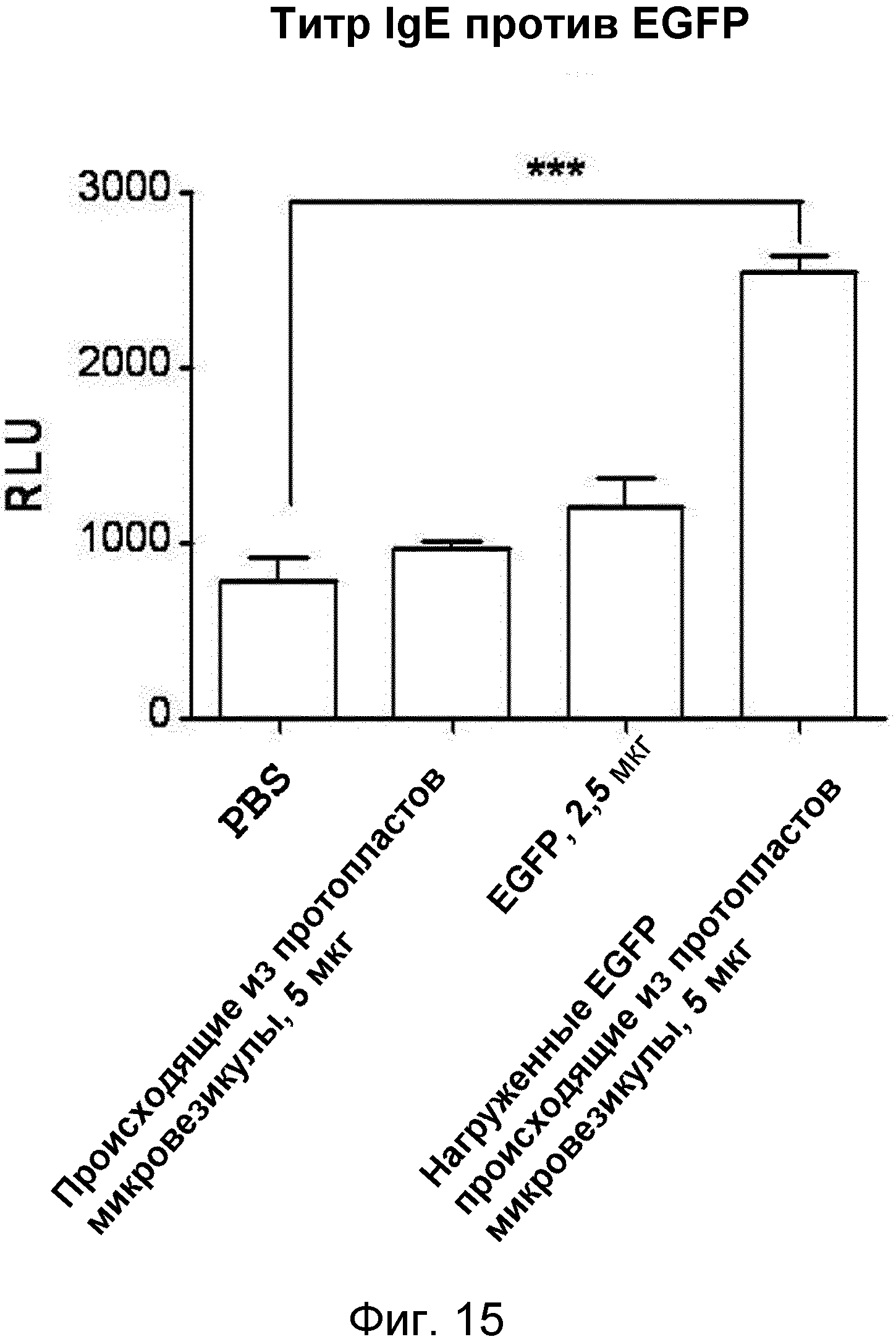
На ФИГ.15 представлен график, демонстрирующий способность нагруженных антигеном происходящих из протопластов микровезикул индуцировать продуцирование IgE-антитела, специфичного к антигену, у мышей.
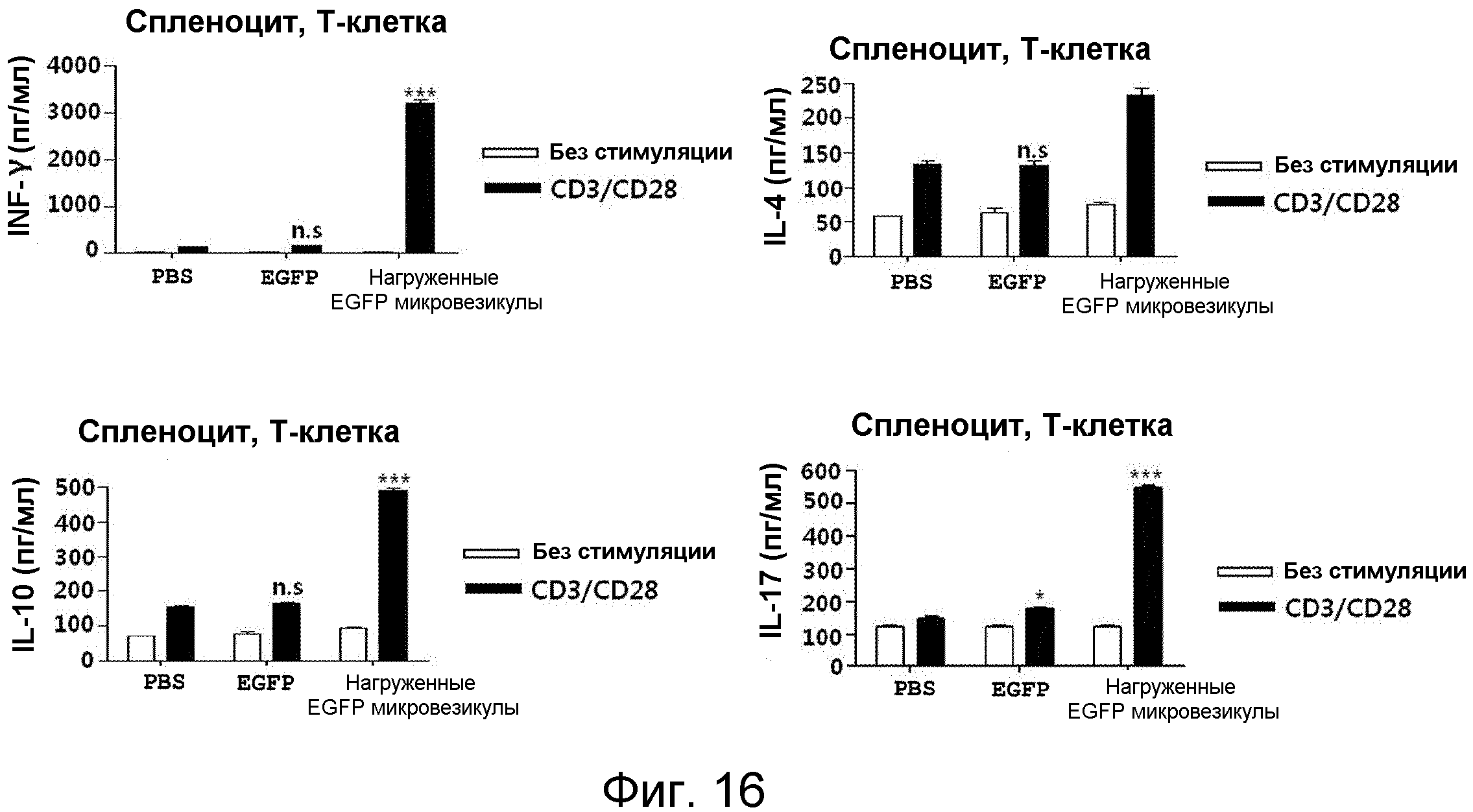
На ФИГ.16 представлены графики, иллюстрирующие способность нагруженных антигеном происходящих из протопластов микровезикул индуцировать образование T-клеток памяти, специфичных к антигену, у мышей.
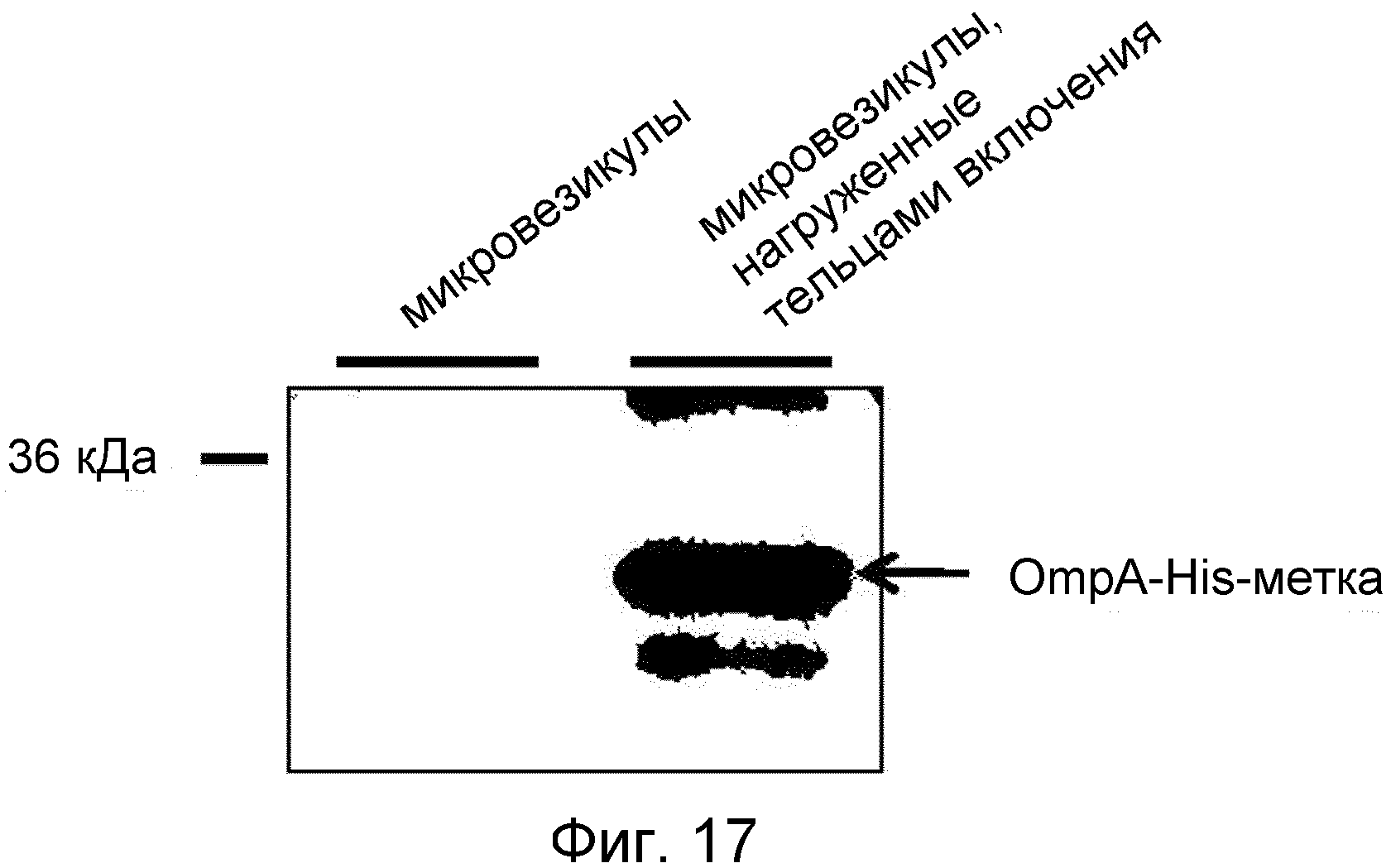
На ФИГ.17 представлено изображение, демонстрирующее способность происходящих из протопластов микровезикул быть нагруженными тельцами включения.
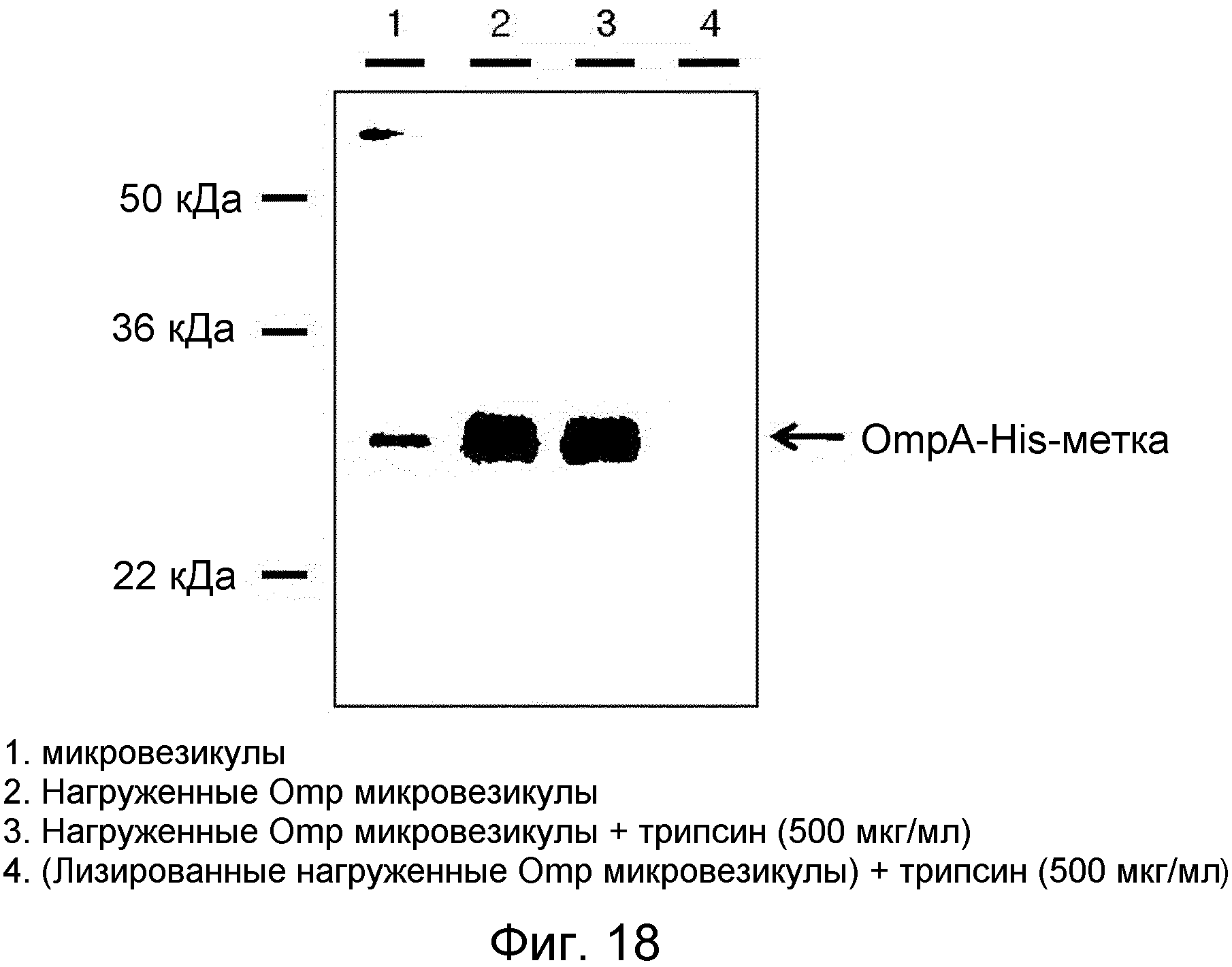
На ФИГ.18 представлено изображение, демонстрирующее способность происходящих из протопластов микровезикул быть нагруженными белком Omp.
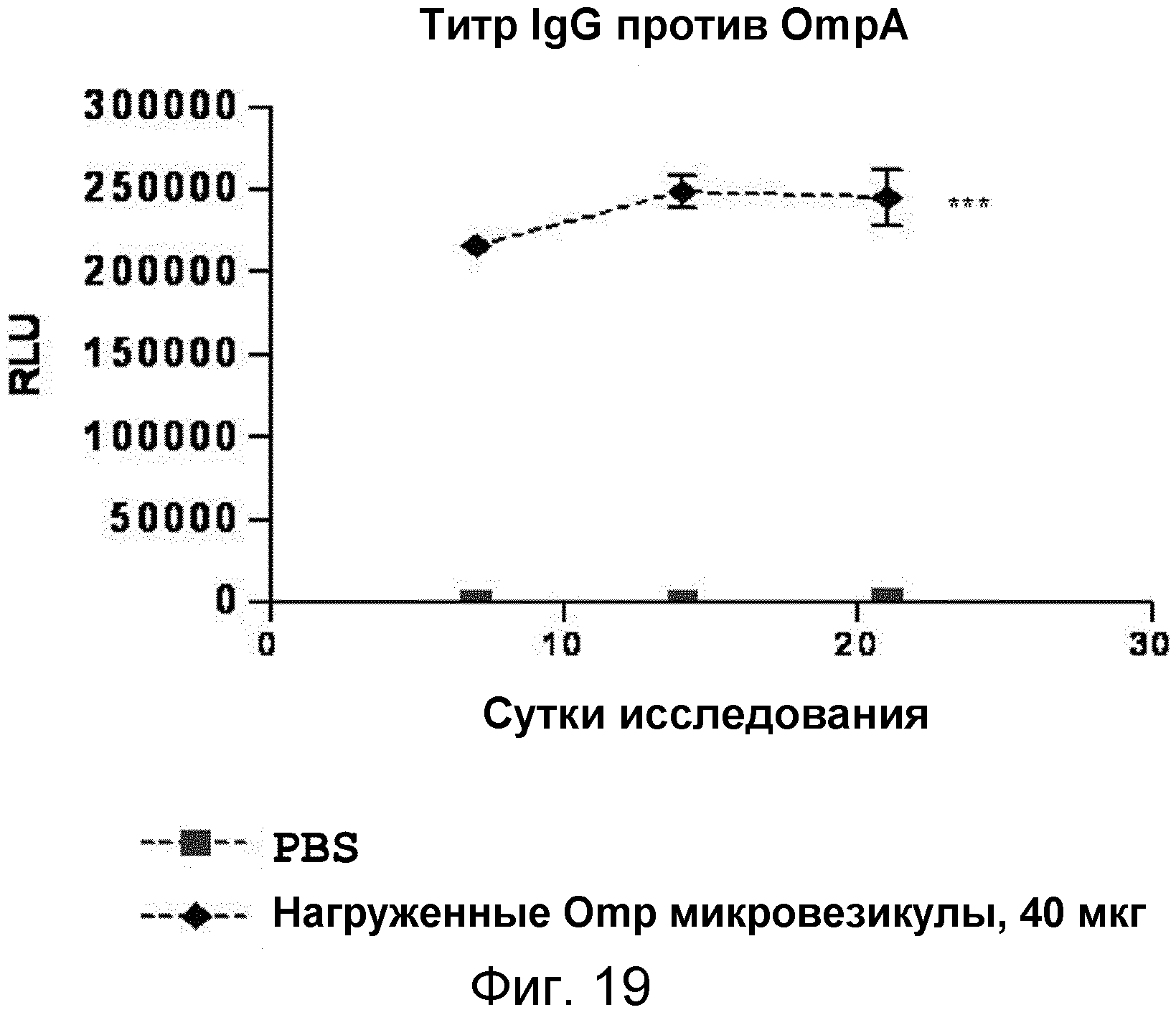
На ФИГ.19 представлен график, демонстрирующий, что нагруженные антигеном OmpA происходящие из протопластов микровезикулы индуцируют продуцирование специфичного к OmpA IgG-антитела у мышей.
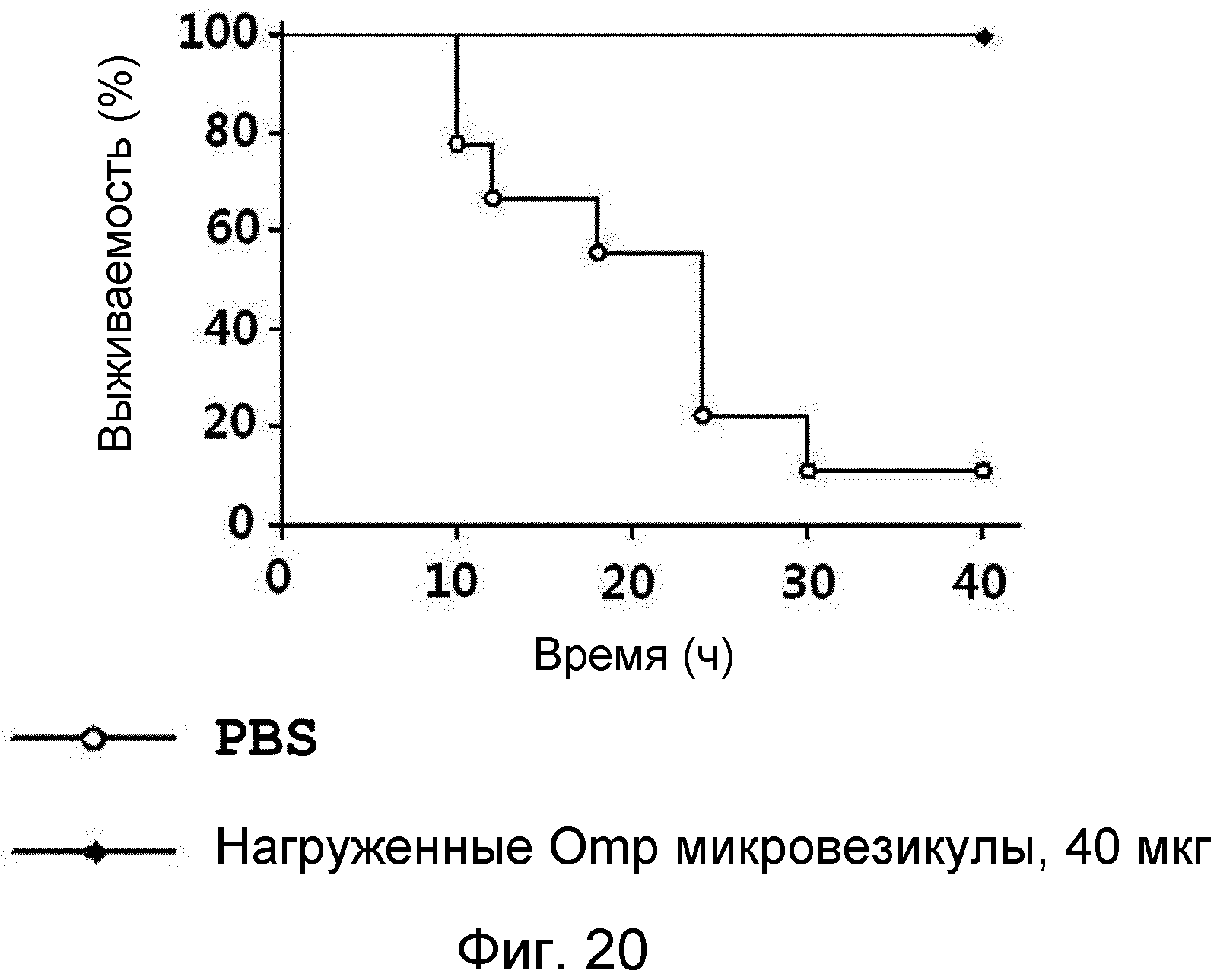
На ФИГ.20 представлен график, демонстрирующий, что нагруженные антигеном Omp микровезикулы действуют в качестве вакцин против бактерий.
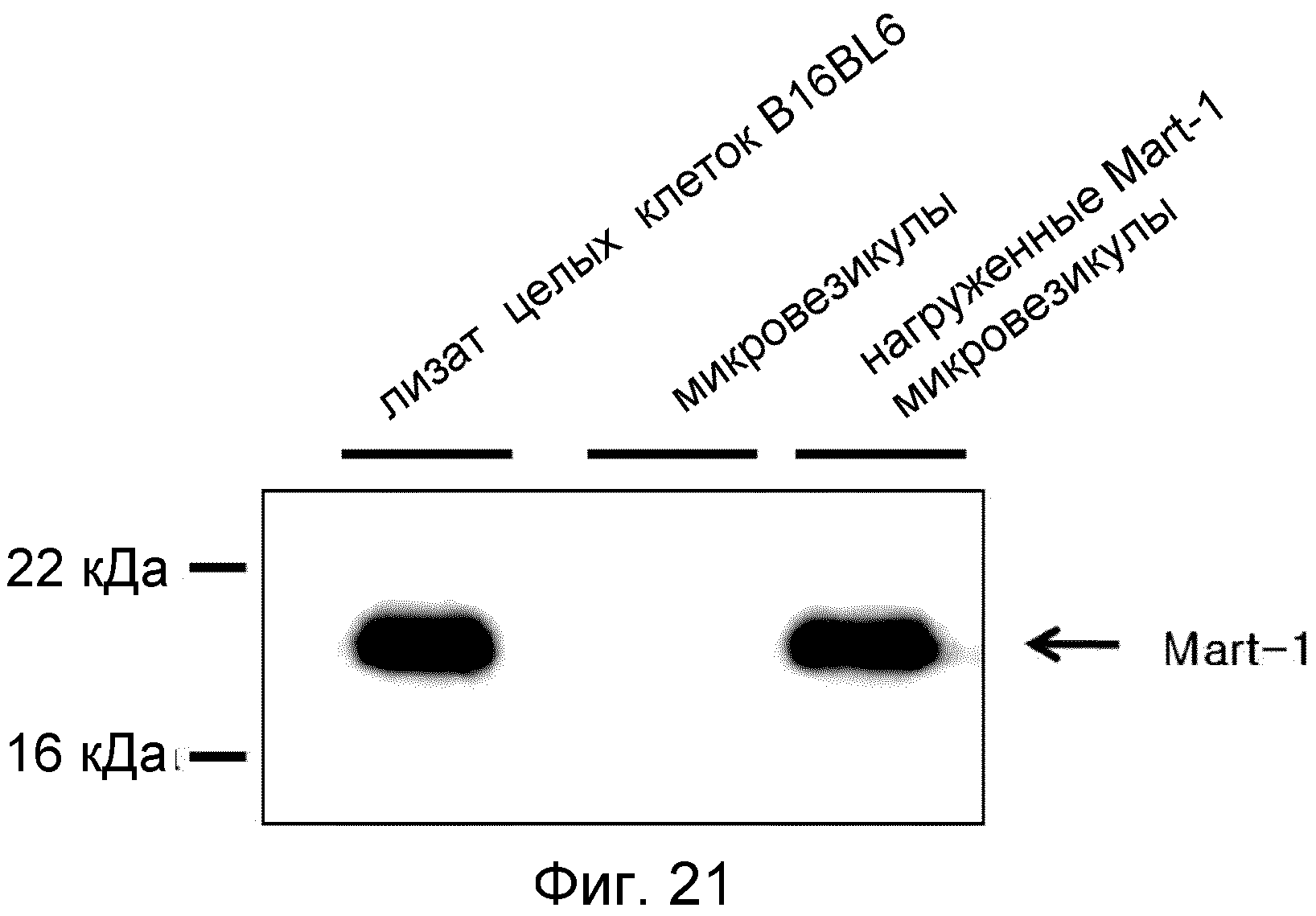
На ФИГ.21 представлено изображение, демонстрирующее антиген меланомы Mart-1, которым нагружены происходящие из протопластов микровезикулы.
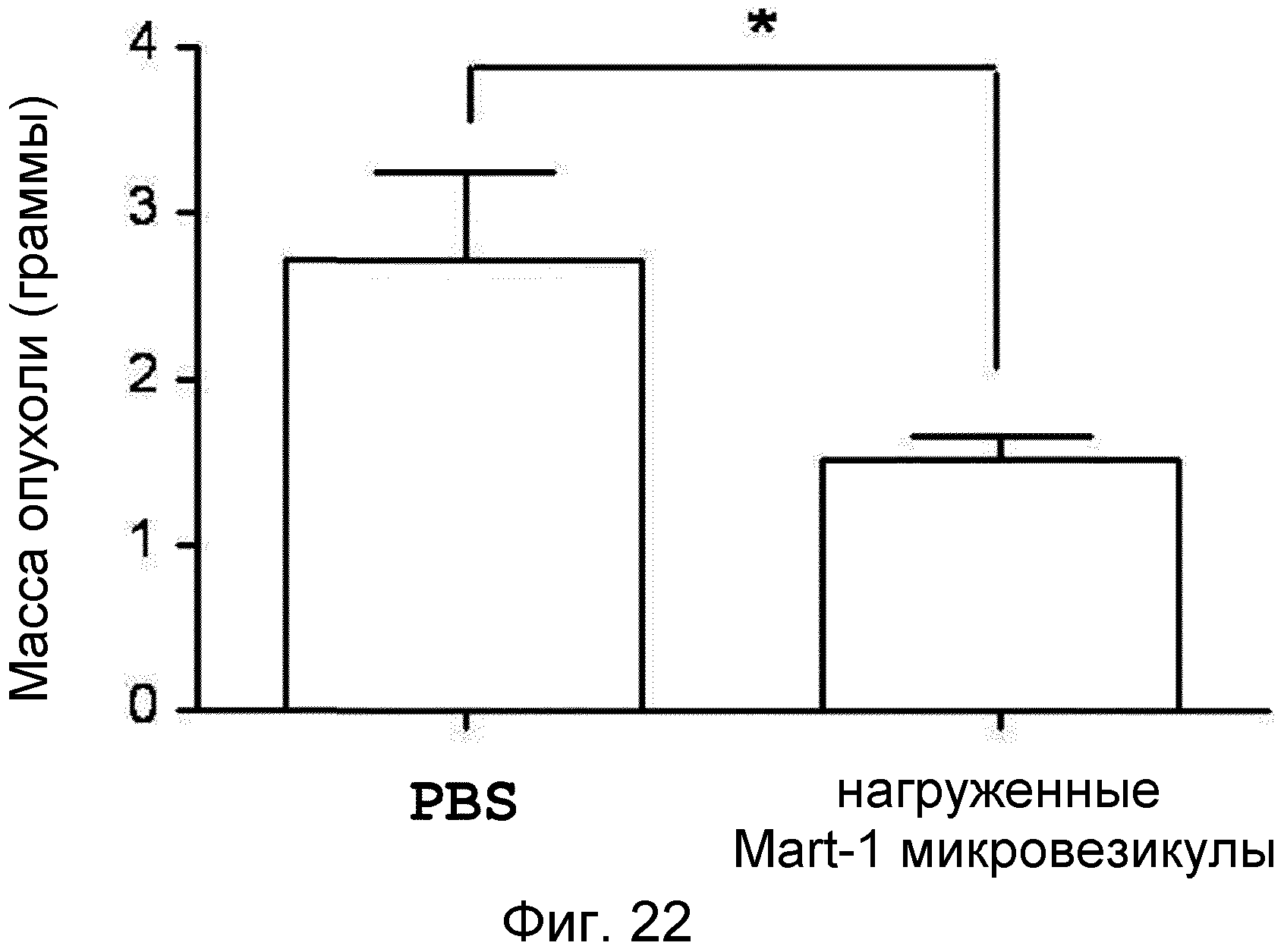
На ФИГ.22 представлен график, демонстрирующий вакцинный эффект нагруженных Mart-1 происходящих из протопластов микровезикул на меланому.
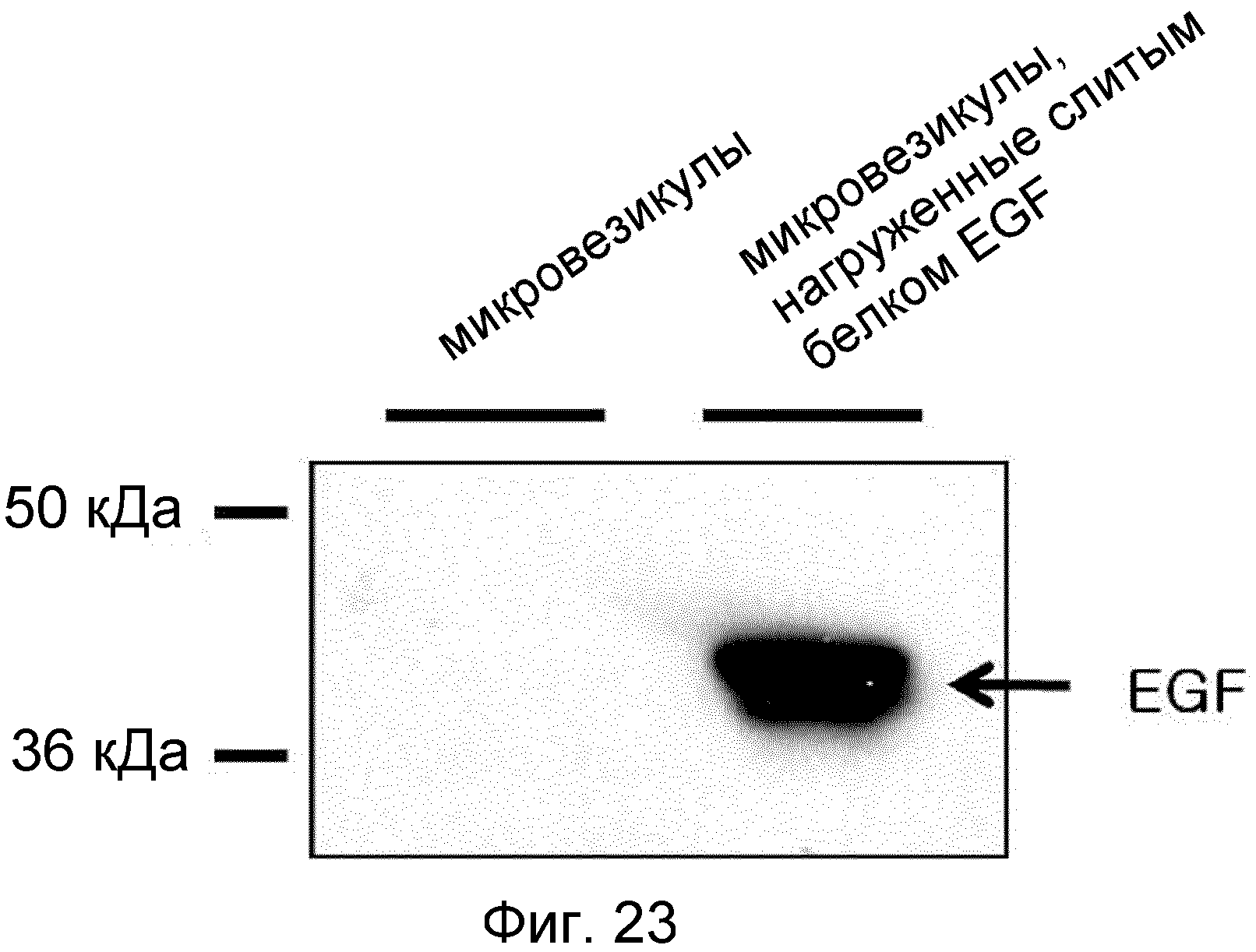
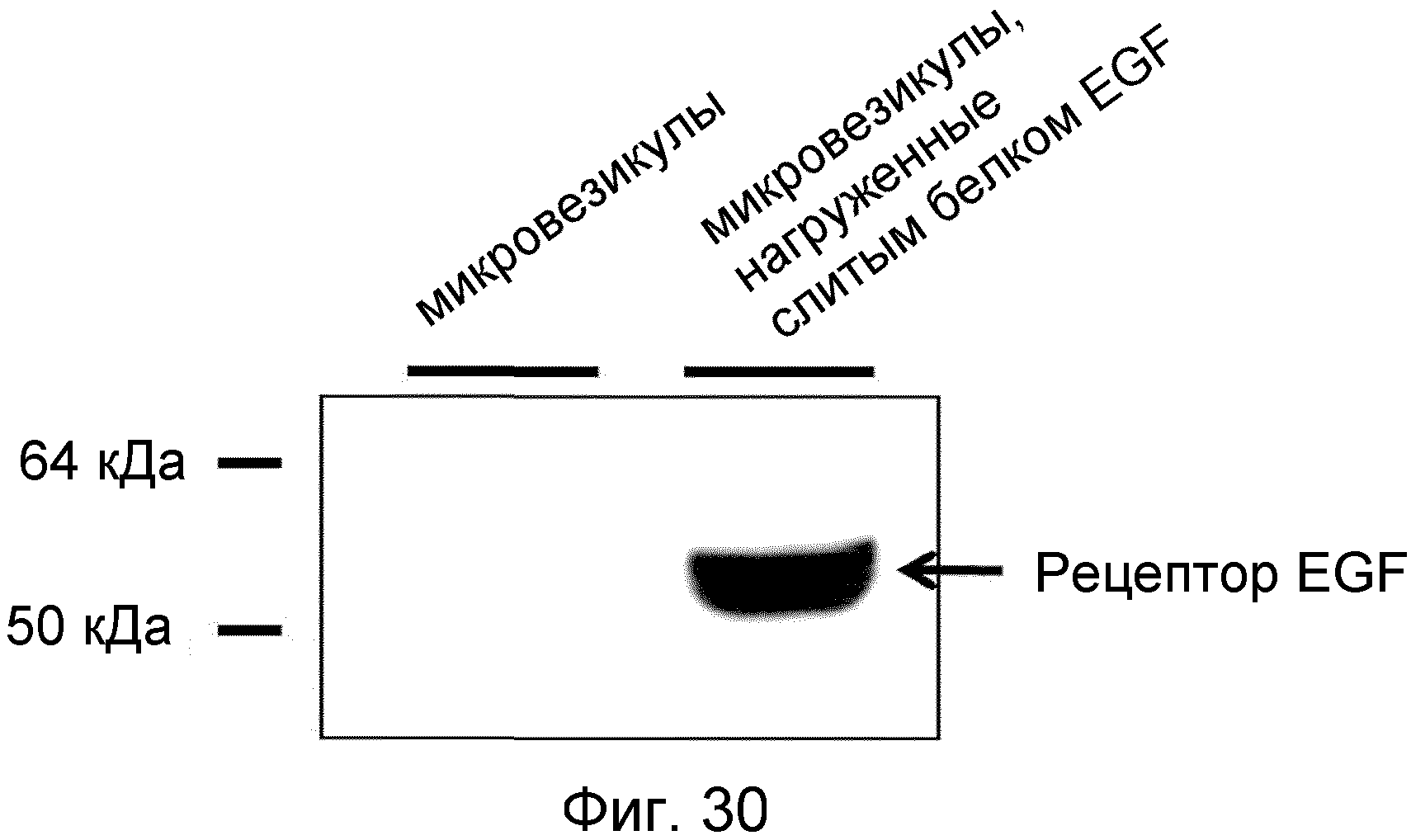
На ФИГ.23 представлено изображение, демонстрирующее слитый белок EGF, которым нагружены происходящие из протопластов микровезикулы.
На ФИГ.24 представлено изображение, демонстрирующее, что слитый белок EGF нагружает поверхность происходящих из протопластов микровезикул при сохранении точной топологии.
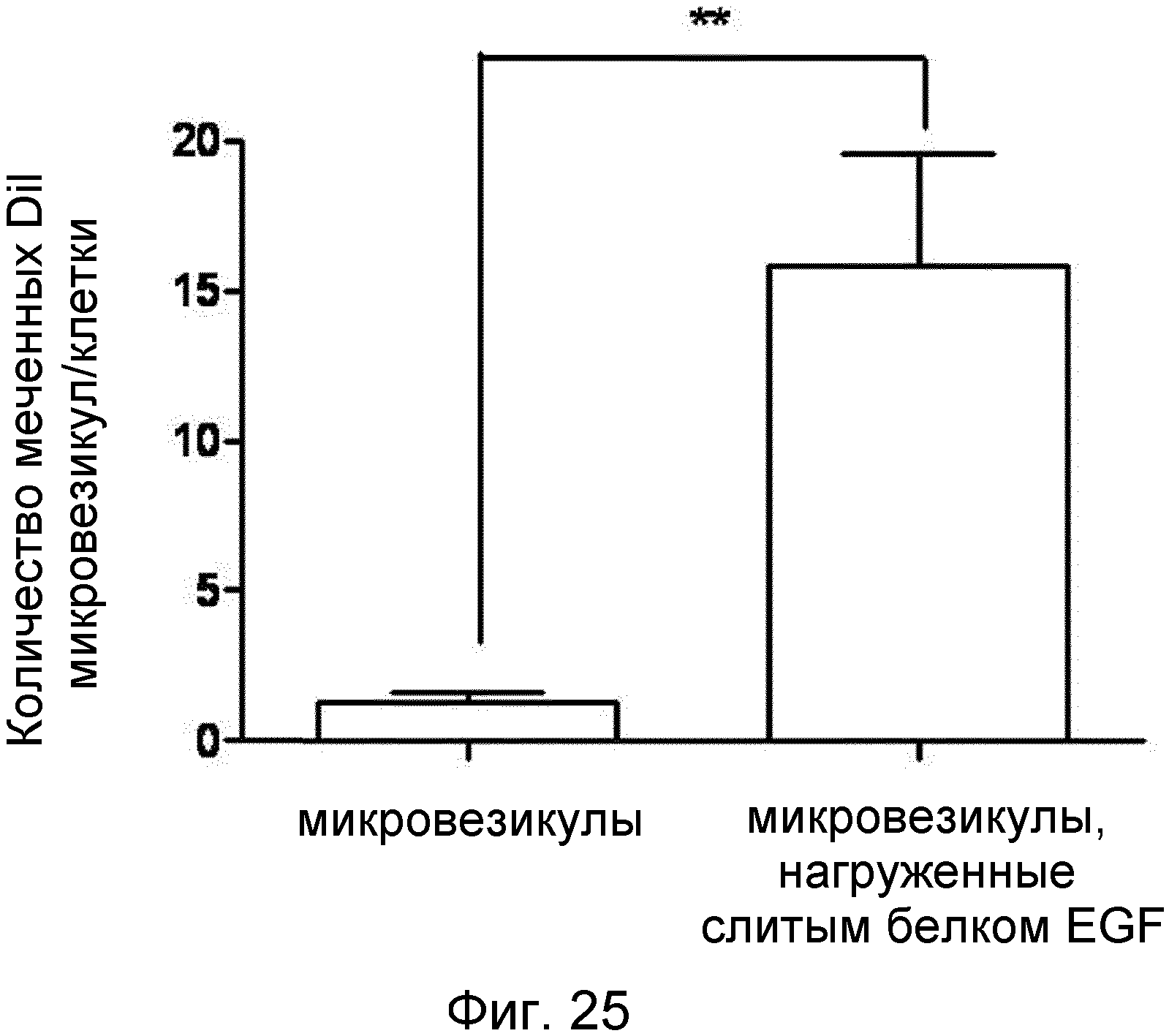
На ФИГ.25 представлен график, демонстрирующий селективную доставку слитого белка EGF, которым нагружены микровезикулы, в представляющие интерес клетки.
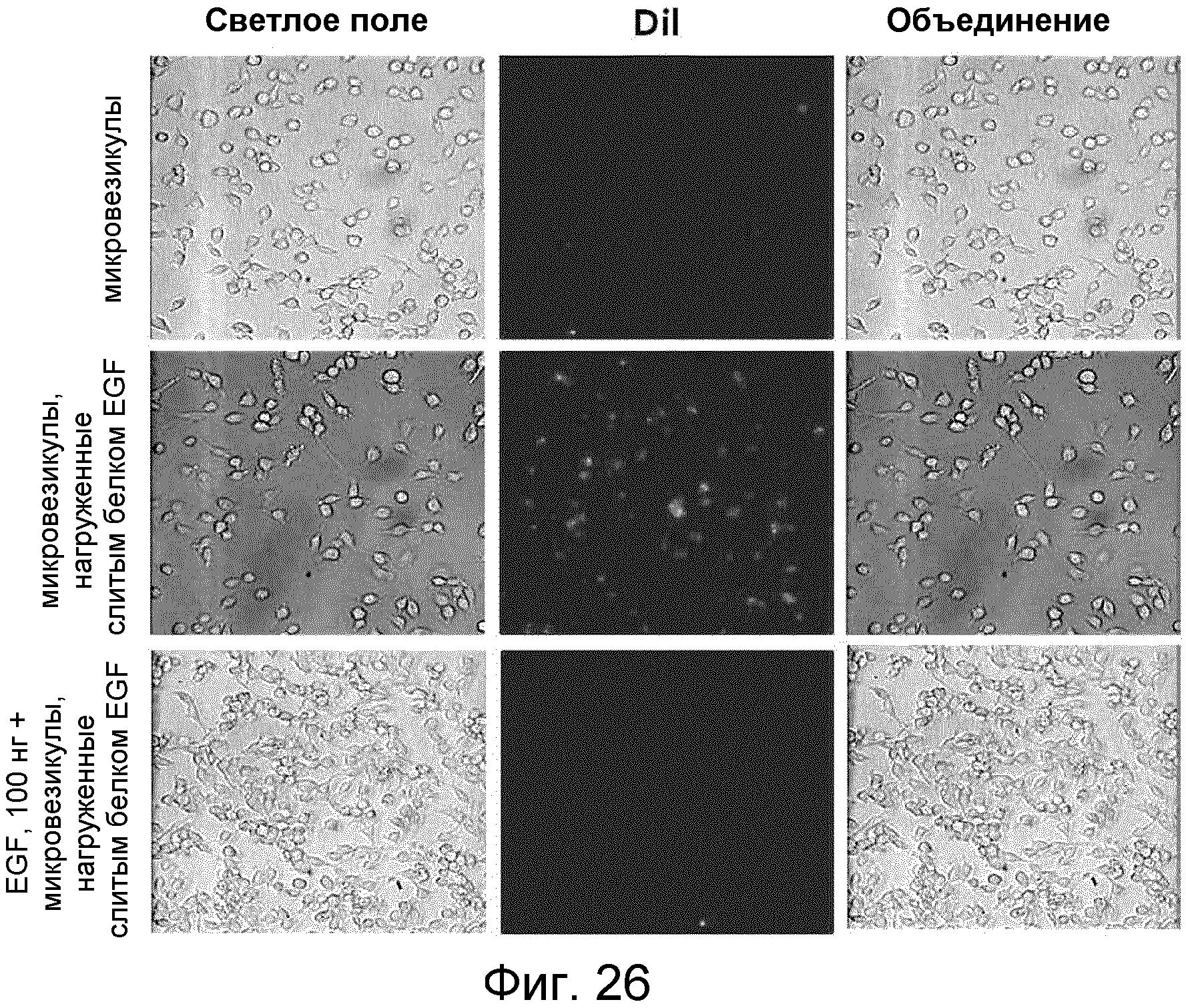
На ФИГ.26 представлены изображения, иллюстрирующие доставку слитого белка EGF, которым нагружены микровезикулы, направляемую EGF.
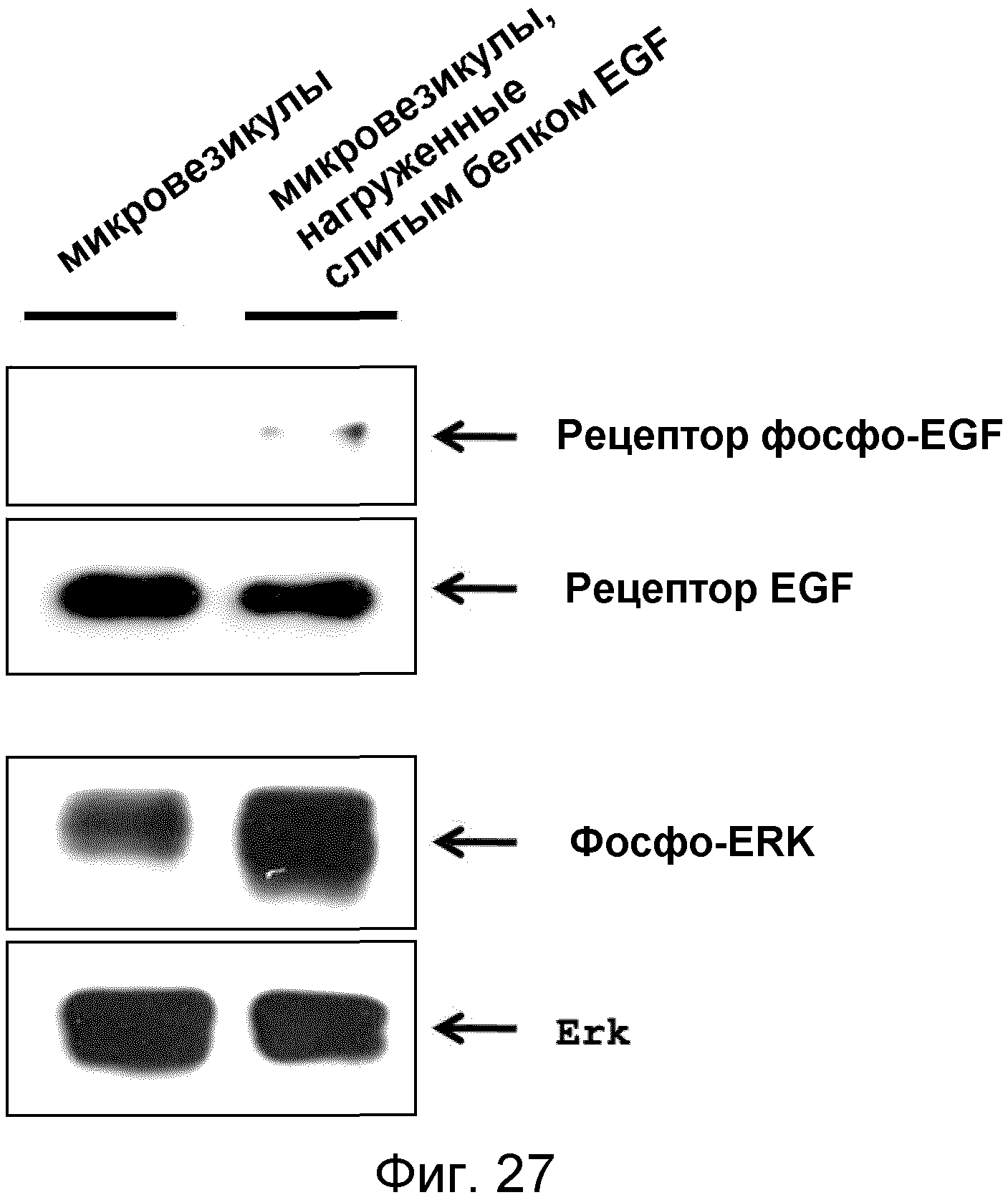
На ФИГ.27 представлены изображения, иллюстрирующие передачу сигнала EGF микровезикулами, которые нагружены слитым белком EGF.
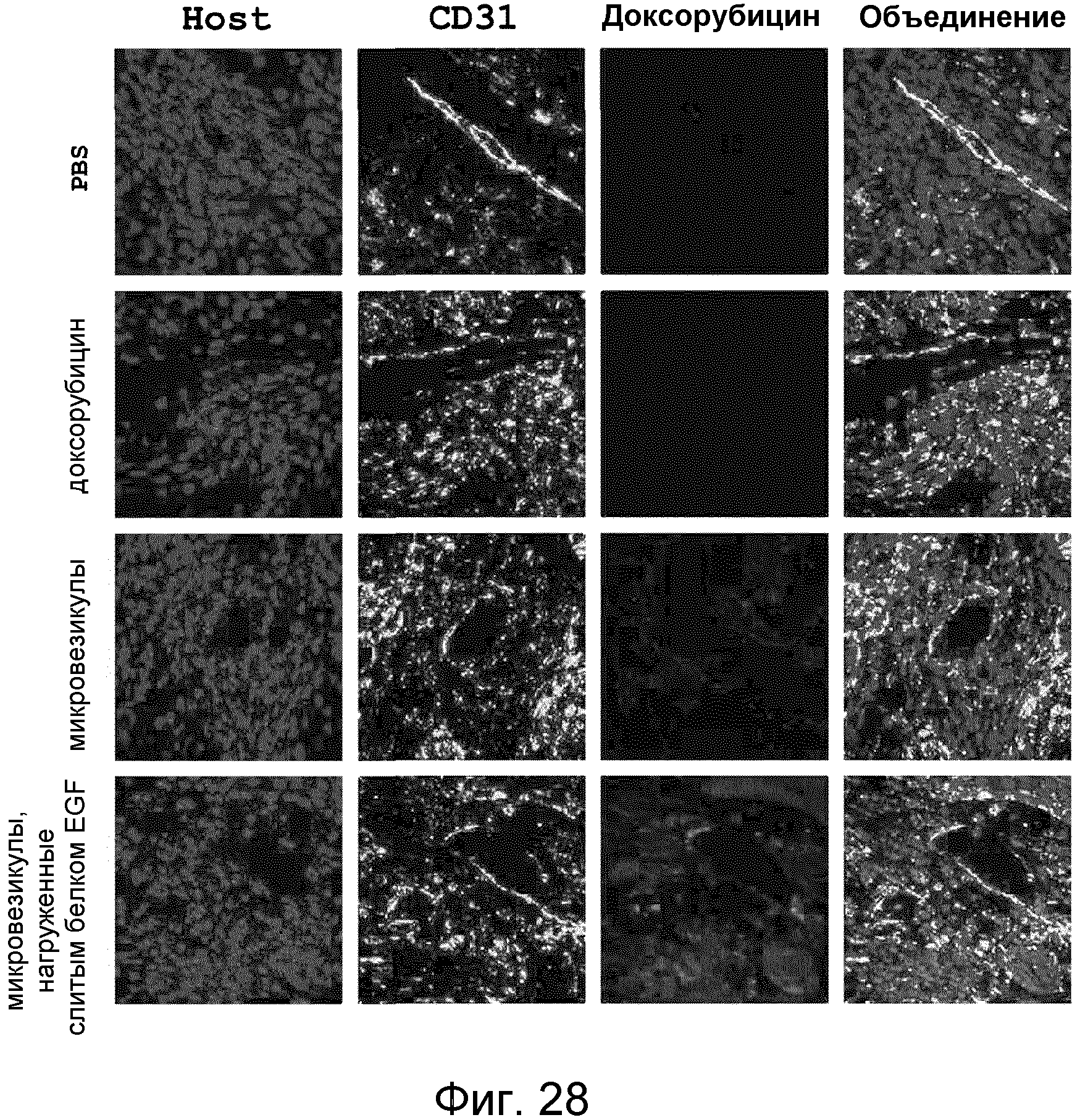
На ФИГ.28 представлены изображения, иллюстрирующие опосредуемую микровезикулами, нагруженными слитым белком EGF, доставку доксорубицина в представляющую интерес злокачественную ткань у мышей.
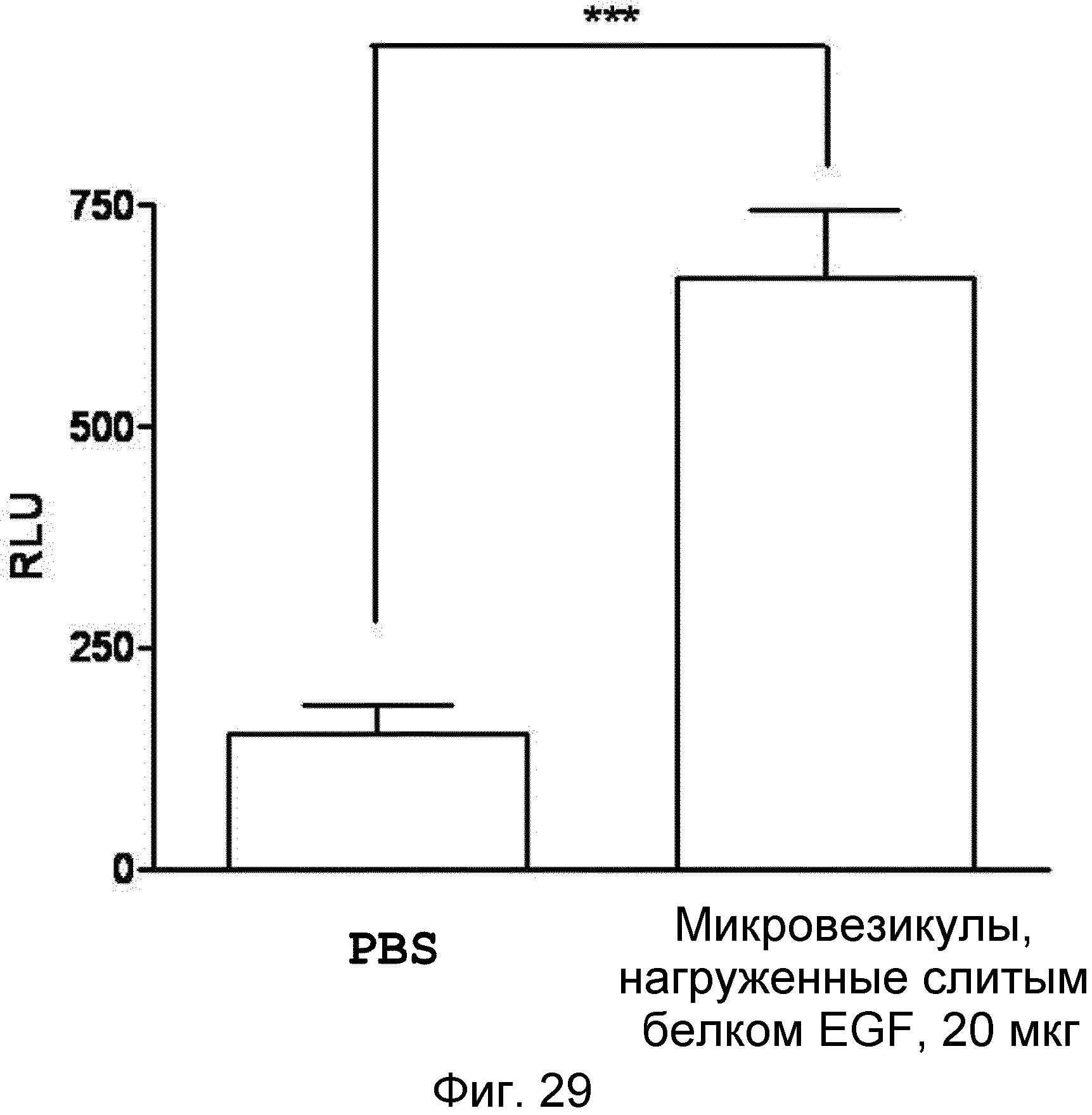
На ФИГ.29 представлен график, демонстрирующий индукцию EGF-специфического антитела микровезикулами, нагруженными слитым белком EGF, у мышей.
На ФИГ.30 проиллюстрирована нагрузка слитым белком рецептора EGF происходящих из протопластов микровезикул.
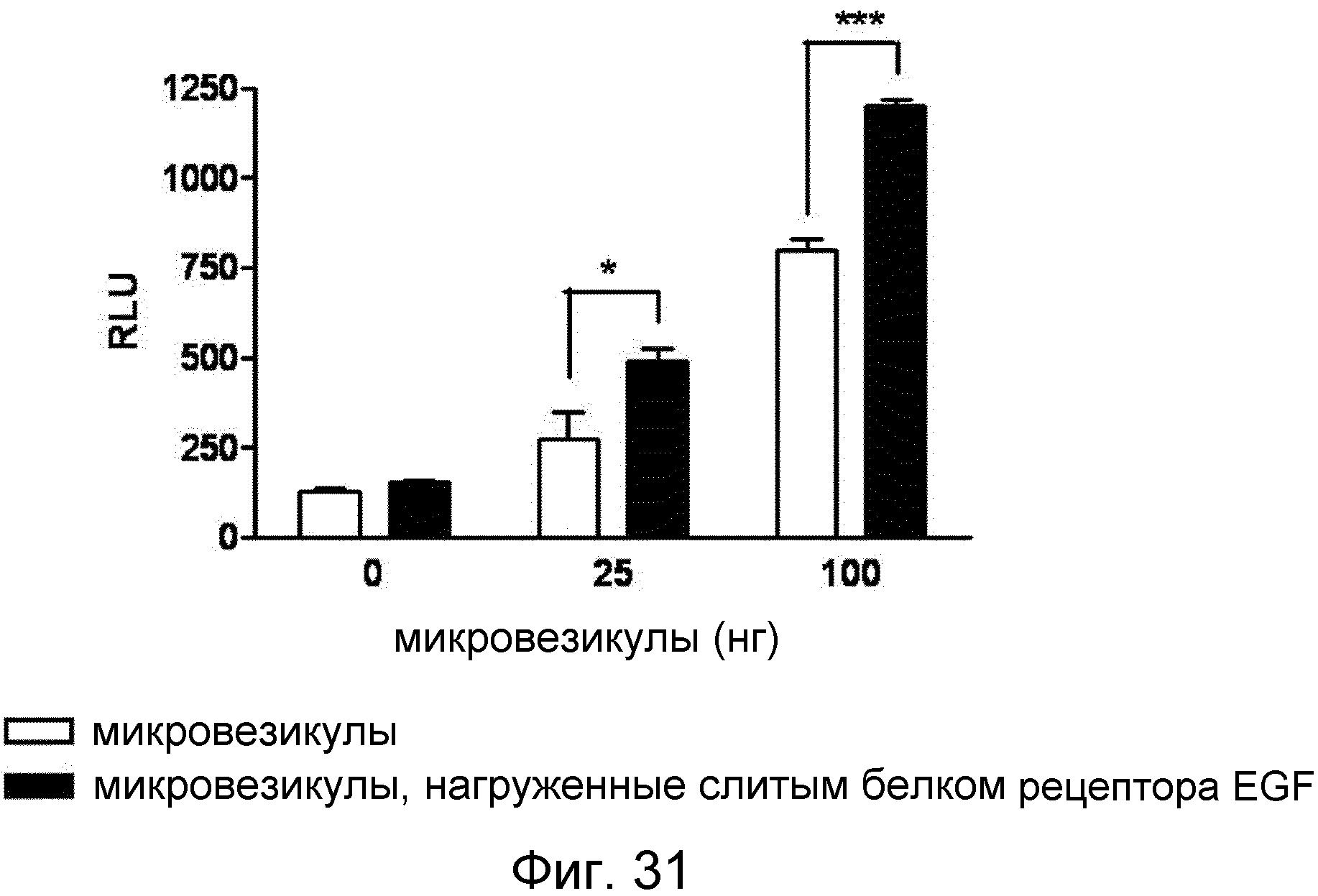
На ФИГ.31 представлен график, демонстрирующий аффинность микровезикул, нагруженных слитым белком рецептора EGF, к EGF.
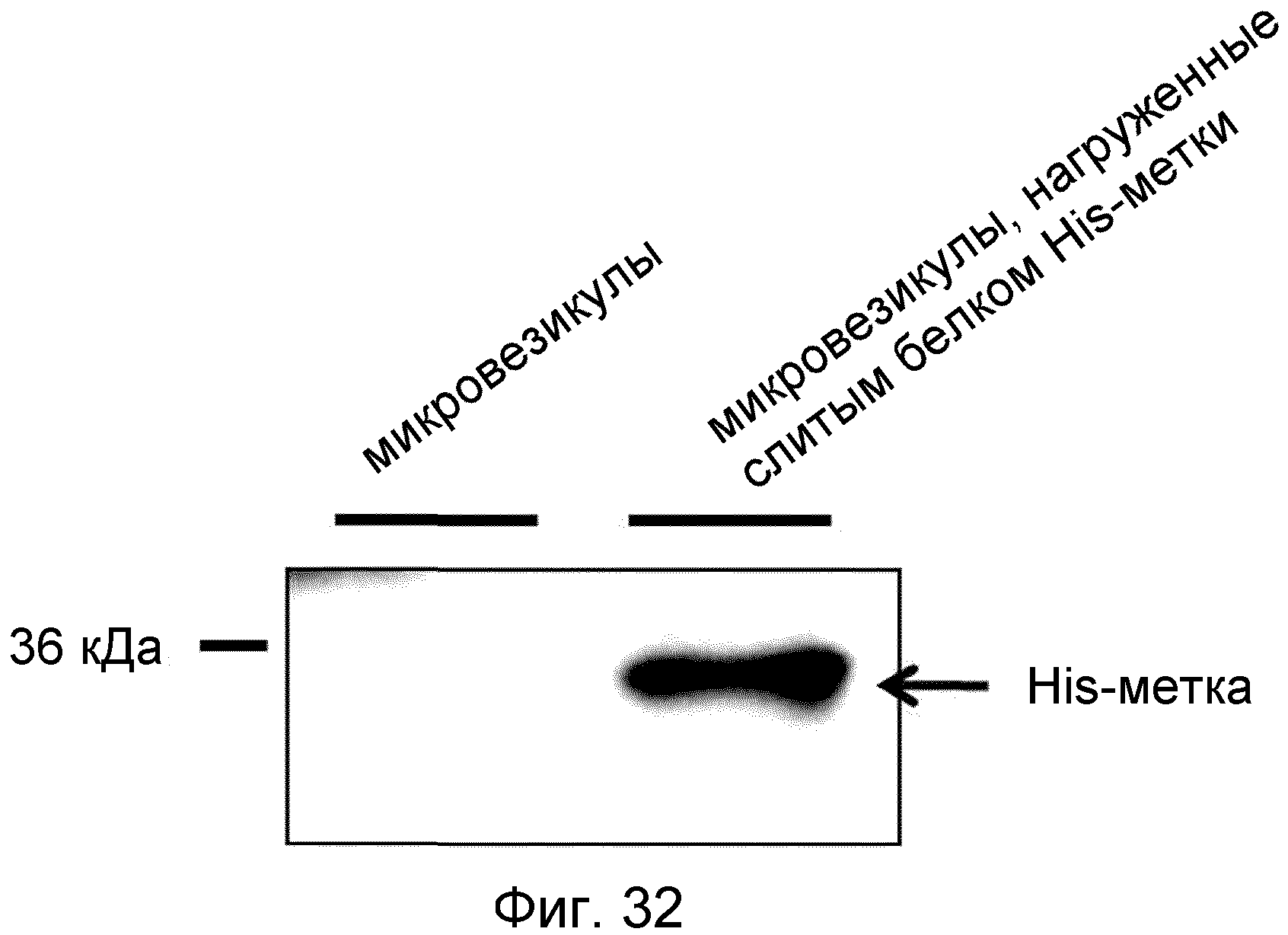
На ФИГ.32 представлено изображение, демонстрирующее слитый белок His-метки, которым нагружены происходящие из протопластов микровезикулы.
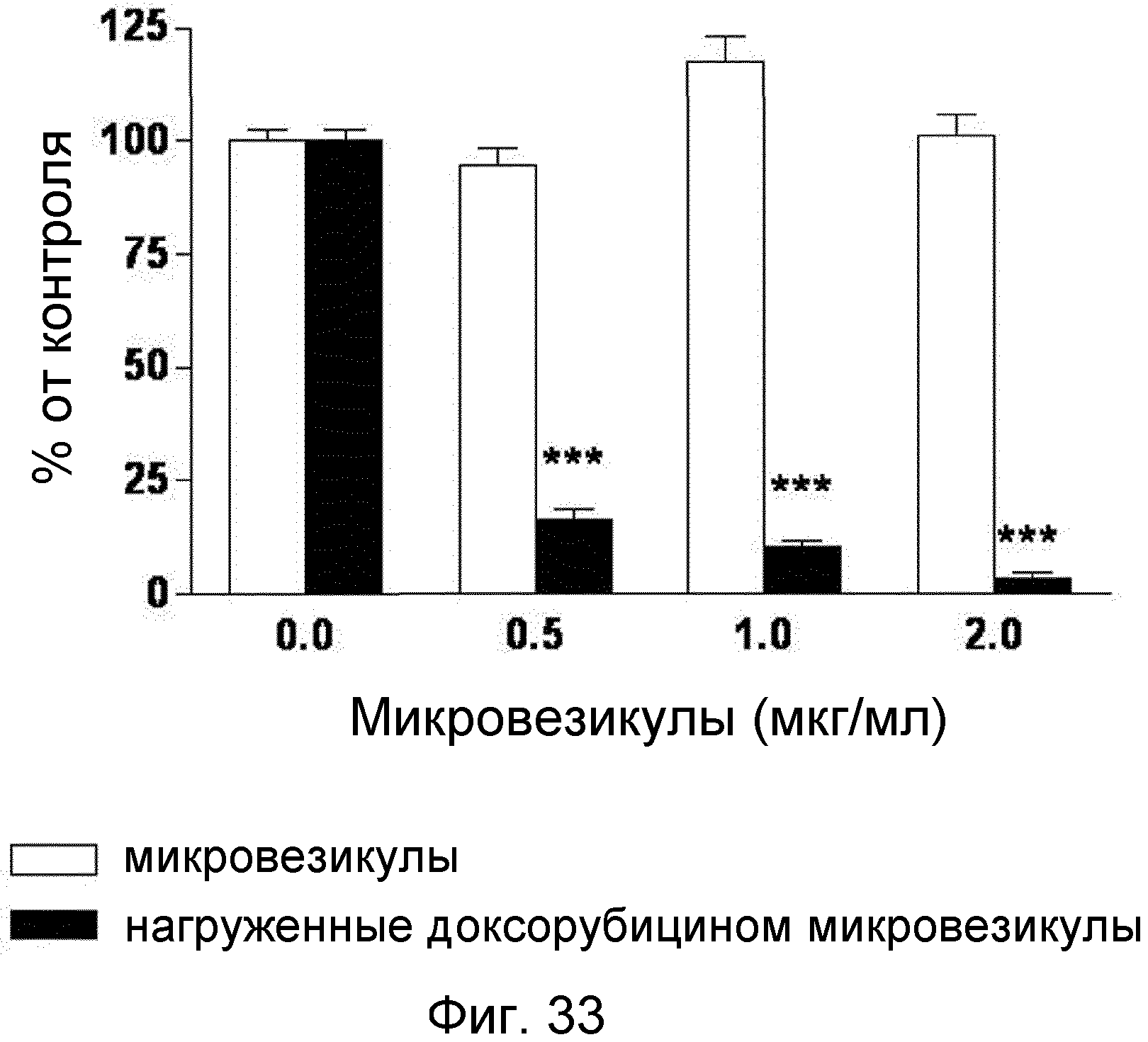
На ФИГ.33 представлен график, демонстрирующий индукцию гибели клеток эндотелия сосудов происходящими из протопластов микровезикулами, нагруженными доксорубицином.
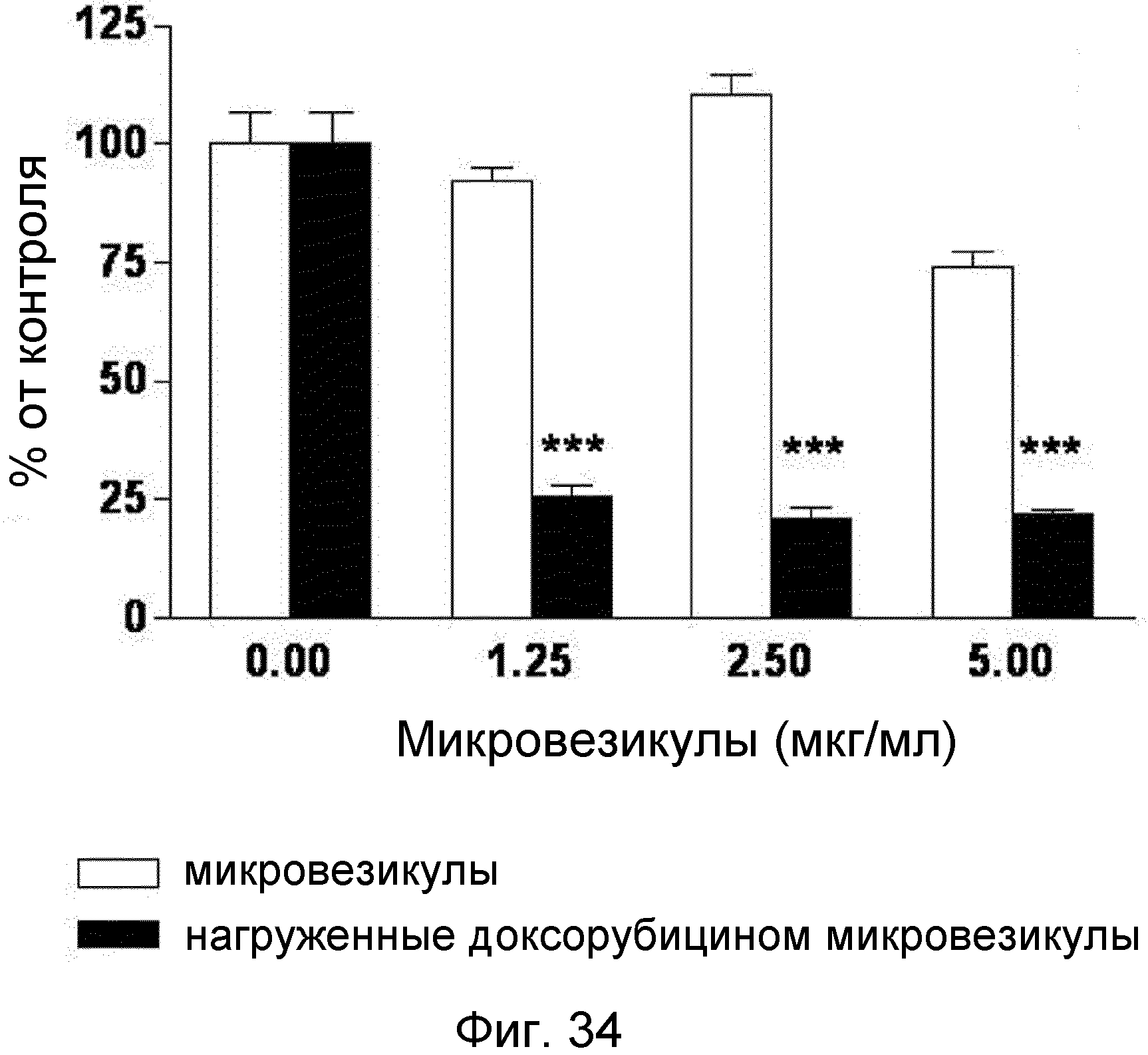
На ФИГ.34 представлен график, демонстрирующий индукцию гибели клеток толстого кишечника мыши происходящими из протопластов микровезикулами, нагруженными доксорубицином.
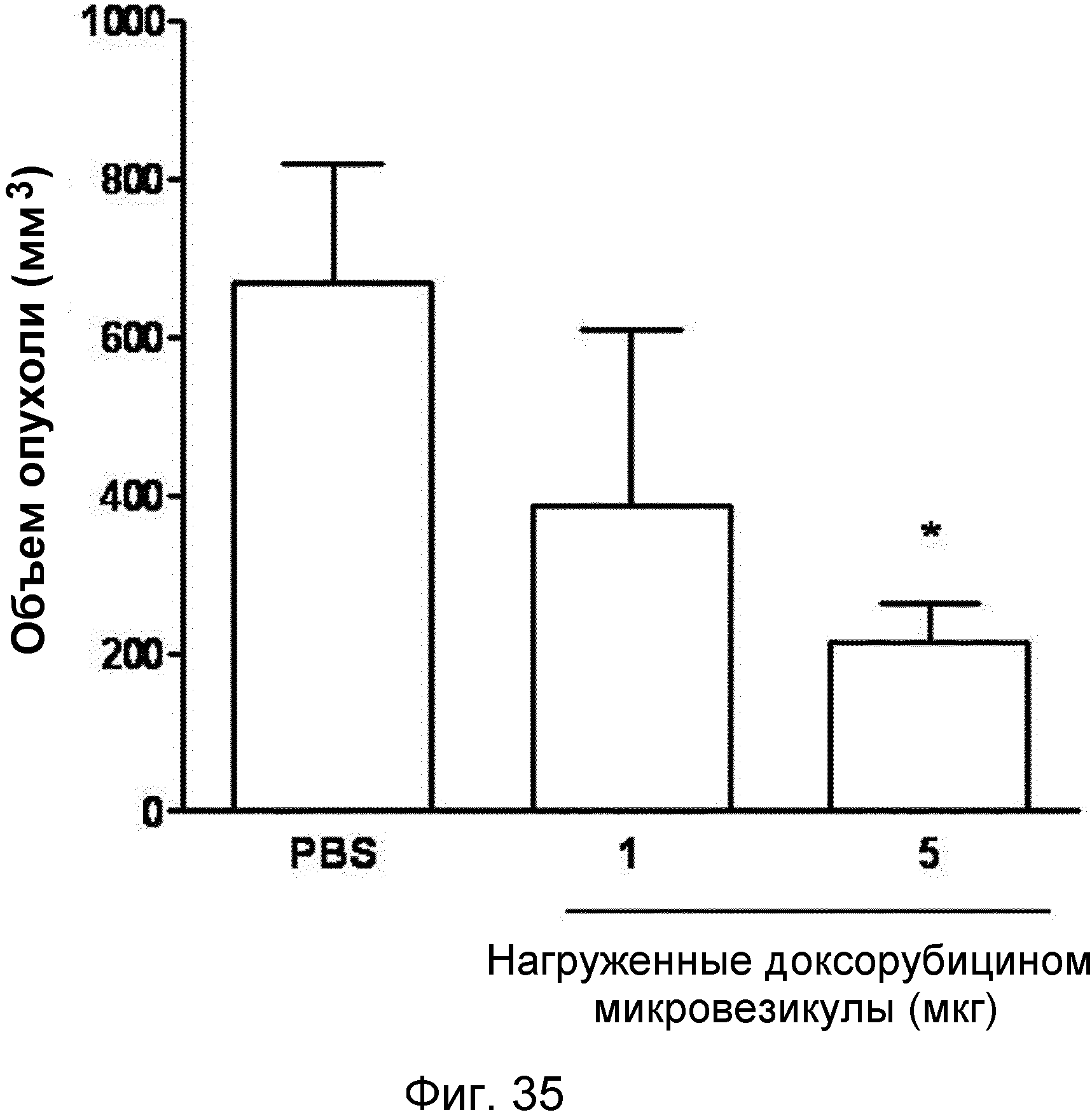
На ФИГ.35 представлен график, демонстрирующий ингибирование нагруженными доксорубицином происходящими из протопластов микровезикулами роста злокачественных тканей у мышей.
Способ осуществления изобретения
В соответствии с одним аспектом настоящее изобретение относится к композиции, содержащей микровезикулы, происходящие из протопластов клеток.
Примеры клетки, пригодной для настоящего изобретения, включают бактерии с клеточными стенками, археи, грибы, клетки растений, L-формы бактерий (или бактерии с дефицитом клеточной стенки (CWD)), но не ограничиваются ими. Бактерии могут быть грамположительными или грамотрицательными. Например, можно использовать Escherichia coli (E. coli) и Staphylococcus aureus (S. aureus), которые являются грамотрицательными и грамположительными, соответственно.
Кроме того, среди клеток, пригодных для настоящего изобретения, находятся “существующие в природе клетки” и “трансформированные клетки”.
Как используют в рамках изобретения, термин “существующие в природе клетки” включает клетки, которые могут быть направлены к конкретным клеткам или тканям, клетки, которые экспрессируют конкретные вещества.
Термин “трансформированные клетки”, как используют в рамках изобретения, включает, но не ограничивается ими, клетки, трансформированные так, чтобы они имели сниженную токсичность или ингибировали синтез их клеточной стенки; клетки, трансформированные для экспрессии вещества, необходимого для диагностики, лечения, вакцинации, нацеливания или слияния клеточной мембраны с клеткой-мишенью (фузоген); и их смесь.
Кроме того, “трансформированные клетки” включают клетки, которые трансформированы два или более раз, и клетки, которые трансформированы так, что в них предотвращается экспрессия конкретного белка.
В одном варианте осуществления настоящего изобретения трансформированные клетки могут быть трансформированы так, чтобы они экспрессировали вещество, выбранное из группы, состоящей из молекулы клеточной адгезии, антитела, нацеливающего белка, фузогена и их слитого белка.
Что касается “трансформации клеток”, ее можно достигать путем введения чужеродного гена в клетки, путем обработки клеток веществом или путем применения физического/ химического/ биологического/ электрического/ механического стимула к клеткам.
Термин “протопласт”, как используют в рамках изобретения, относится к клетке бактерий, архей, грибов или растений, в которой клеточная стенка полностью или частично удалена, с обнаженной липидной двухслойной мембраной, и, таким образом, она включает протопласты, у которых их клеточная стенка полностью удалена, сферопласты, в которых их клеточная стенка частично удалена, и “L-форму бактерий”, но не ограничивается ими.
“L-форма бактерий” включает существующие в природе клетки и трансформированные клетки, но не ограничиваются ими.
Термин “происходящая из протопласта микровезикула”, как используют в рамках изобретения, относится к везикуле субпротопластного размера, внутреннее содержимое которого отделено от внешней среды только липидной двухслойной мембраной, состоящей из липидов мембран, белков мембран и цитоплазматического компонента клеток.
Примеры “происходящей из протопласта микровезикулы”, пригодной для настоящего изобретения, включают, но не ограничиваются ими, микровезикулы, которые самопроизвольно секретируются из протопластов, микровезикулы, которые искусственно синтезированы из протопластов с использованием физического, механического, электрического или химического способа, и микровезикулы, полученные обработкой конкретным веществом или трансформацией, которая индуцирует секрецию микровезикул из протопластов.
В одном варианте осуществления настоящего изобретения микровезикулы могут сохранять ту же топологию мембраны, что и плазматическая мембрана, служащая в качестве источника.
В другом варианте осуществления настоящего изобретения микровезикулы могут включать, но не ограничиваться ими, тельца включения.
В другом варианте осуществления настоящего изобретения микровезикулы могут дополнительно включать компонент в их мембране, отличный от компонентов, происходящих из клеточной мембраны протопласта, служащего в качестве источника.
Компонент, отличный от компонента, происходящего из клеточной мембраны, может включать нацеливающие молекулы, фузогены, циклодекстрины и полиэтиленгликоль, но не ограничивается ими. Кроме того, компонент, отличный от компонента, происходящего из клеточной мембраны, можно добавлять с использованием различных способов, включая химическую модификацию клеточных мембран.
Согласно другому варианту осуществления настоящего изобретения, компоненты мембран везикул могут быть химически модифицированными. Например, они могут быть химически модифицированы тиольными (-SH) группами или аминогруппами (-NH2), или путем связывания с мембраной нацеливающей молекулы, фузогена или полиэтиленгликоля.
В соответствии с другим аспектом настоящего изобретения предусматривается фармацевтическая композиция, содержащая микровезикулы, нагруженные веществом, необходимым для диагностики, терапии, вакцинации, нацеливания, слияния клеточной мембраны с клеткой-мишенью, или уменьшения побочных эффектов и повышения стабильности in vivo и in vitro.
Как используют в рамках изобретения, “нагрузка” веществом происходящих из протопластов микровезикул означает, что одно или несколько веществ, необходимых для диагностики, терапии, вакцинации, нацеливания, слияния клеточной мембраны с клеткой-мишенью, и/или уменьшения побочных эффектов и повышения стабильности in vivo и in vitro экспонированы на поверхности микровезикул или инкапсулированы в микровезикулы, однако настоящее изобретение не ограничивается этим.
Вещество, предназначенное для нагрузки происходящих из протопластов микровезикул, может происходить из клеток (включая существующие в природе клетки и трансформированные клетки), служащих в качестве источника микровезикул. Иными словами, клетки, пригодные для настоящего изобретения, включают клетки, которые естественным образом экспрессируют терапевтическое, диагностическое или вакцинное вещество, или которые трансформированы так, чтобы экспрессировать вещество.
В одном варианте осуществления настоящего изобретения можно использовать клетку, которая трансформирована для экспрессии вещества, выбранного из группы, состоящей из, но не ограничиваясь ими, молекулы клеточной адгезии, антитела, нацеливающего белка, фузогена, их слитого белка, чтобы нагружать нацеливающим белком происходящие из протопластов микровезикулы. Нацеливающий белок может быть экспонирован на происходящей из протопласта микровезикуле или инкапсулирован в нее.
Трансформации клеток можно достигать путем стимуляции клеток или внесения чужеродного гена в клетки для модификации, например, активации или подавления, экспрессии представляющих интерес белков. Введение чужеродного гена может индуцировать экспрессию или ингибирование представляющего интерес белка.
В этом контексте плазмидную ДНК, РНК или вирус вводят в клетки с использованием осаждения с фосфатом кальция, с помощью липофектамина, путем электропорации, микроинъекции или другими способами, известными в данной области. После трансформации протопластов для экспрессии белка или антитела, способного связываться со злокачественными клетками, тканями или сосудами или воспаленными тканями, в чистом виде или в качестве слитого белка на поверхности, из клеток можно конструировать микровезикулы.
Для подавления экспрессии представляющего белка можно использовать микроРНК, миРНК или антисмысловую РНК. Когда микровезикулы, сконструированные из протопласта клетки, направлены на две мишени, клетку можно трансформировать так, чтобы экспрессия одного или нескольких конкретных белков ингибировалась для снижения направления клеток к одной из двух мишеней, что означает усиление специфичности доставки вещества в отношении микровезикул, происходящих из трансформированных клеток. Альтернативно можно использовать клетки, которые претерпели два или более раундов трансформации. Например, первичные трансформанты можно подвергать вторичной трансформации до того, как использовать их в качестве источника для протопластов, из которых конструируют микровезикулы.
Существует множество белков плазматической мембраны, которые вовлечены в направление моноцитов, макрофагов, дендритных клеток и стволовых клеток в конкретные ткани. Например, на поверхности моноцитов присутствуют молекулы клеточной адгезии, включающие интегрины, такие как LFA-1 (антиген, ассоциированный с функцией лейкоцитов-1) и Mac-1 (антиген макрофагов-1). Эти молекулы клеточной адгезии могут связываться с другими молекулами клеточной адгезии, такими как ICAM-1 (молекула внутриклеточной адгезии-1) и VCAM-1 (молекула адгезии клеток сосудов-1), на клетках сосудов. Взаимодействие между LFA-1 и ICAM-1 позволяет моноцитам проходить через эндотелиальные клетки сосудов, так чтобы моноциты могли направляться к воспалительным или злокачественным клеткам. Когда клетки трансформированы для экспрессии белков плазматической мембраны, специфичных к представляющей интерес злокачественной опухоли или тканям, их можно направлять в различные ткани, включая злокачественные и воспаленные ткани. Например, белок клеточной мембраны ERBB2 сверхэкспрессируется на поверхности клеток рака молочной железы. Нацеливание T-клеток на злокачественные клетки-мишени можно обеспечивать путем трансформации для экспрессии модифицированных T-клеточных рецепторов (TCR). T-клетки можно направлять на ткань рака молочной железы, если они трансформированы для экспрессии слитого белка, в котором TCR слит его внешним доменом с антителом, распознающим ERBB2, и его цитоплазматическим доменом с CD3 ζ (зета), ответственным за внутриклеточную передачу сигнала. Кроме того, T-клетки могут быть направлены на ткань рака толстого кишечника, рака поджелудочной железы и рака легкого, если они трансформированы для экспрессии слитого белка, в котором антитело, распознающее карциноэмбриональный антиген, в большом количестве находящемся на злокачественных тканях, слито с CD3 ζ. Происходящие из протопластов микровезикулы, сконструированные из клеток, которые экспрессируют белки или слитые белки, можно направлять в представляющие интерес ткани, однако нацеливающие молекулы не ограничиваются проиллюстрированными выше белками или слитыми белками.
В другом варианте осуществления настоящего изобретения микровезикулы можно получать из клетки, которая адаптирована для экспрессии вещества, выбранного из группы, состоящей из цитокина, фактора роста, молекулы клеточной адгезии, антитела, рецептора и их комбинации.
Вещество, подлежащее нагрузке в происходящие из протопластов микровезикулы, может не происходить из клеток-источников, а может быть чужеродным для этих клеток. Вещество для нагрузки может быть гомогенным или гетерогенным.
Микровезикулы по настоящему изобретению могут быть нагружены веществом, которое не происходит из клеток-источников, а является чужеродным для клеток, с использованием одного из следующих способов: нагрузка веществом 1) непосредственно клеток; 2) после получения протопластов из клеток; 3) при конструировании микровезикул; и 4) после конструирования происходящих из протопластов микровезикул.
Кроме того, веществом может быть нагружена поверхность микровезикул с использованием, но не ограничиваясь ими, физических, химических и/или биологических способов.
Подробно, микровезикулы по настоящему изобретению можно нагружать различными чужеродными веществами следующим образом.
Во-первых, микровезикулы можно получать из клетки, которая уже нагружена различными представляющими интерес терапевтическими, диагностическими и/или вакцинными веществами. Например, когда клетки культивируют в среде, содержащей представляющие интерес терапевтические или диагностические вещества, они могут содержать вещества. Альтернативно вещество можно вводить в клетки путем электропорации. Микровезикулы, которые самопроизвольно отделяются от клеток или которые конструируют из клеток, содержащих вещества, путем ультразвукового облучения, экструзии или механической деградации, нагружены веществом.
Далее, микровезикулы можно получать из протопласта, который уже нагружен различными представляющими интерес терапевтическими, диагностическими и/или вакцинными веществами. Например, когда протопласты, после преобразования из клеток, культивируют в среде, содержащей представляющие интерес терапевтические или диагностические вещества, они могут содержать вещества. Альтернативно вещество можно вводить в протопласты электропорацией. Микровезикулы, которые самопроизвольно отделяются от протопластов или которые конструируют из протопластов, содержащих вещества, путем ультразвукового облучения, экструзии или механической деградации, нагружены веществом.
C одной стороны, микровезикулы могут быть нагружены веществом в ходе их конструирования. Например, когда суспензию протопластов, содержащую представляющее интерес вещество, экструдируют через фильтр субпротопластного размера, образуются микровезикулы, нагруженные веществом.
В другой альтернативе, микровезикулы могут быть нагружены представляющим интерес веществом после их конструирования и формирования из протопластов. Например, нагрузку можно обеспечивать путем инкубации суспензии микровезикул с веществом или введения вещества путем электропорации в уже полученные микровезикулы.
Однако специалисты в данной области должны понимать, что нагрузка представляющим интерес веществом микровезикул не ограничивается проиллюстрированными выше способами.
Среди терапевтических и/или диагностических веществ, предназначенных для нагрузки происходящих из протопластов микровезикул по настоящему изобретению, находятся средства против злокачественной опухоли, противовоспалительные средства, ингибиторы ангиогенеза, пептиды, белки, токсины, нуклеиновые кислоты, гранулы, микрочастицы и наночастицы, однако настоящее изобретение на ограничивается ими.
Средство против злокачественной опухоли является общим термином для лекарственного средства, используемого для подавления роста и метастазирования злокачественной опухоли. Большинство средств против злокачественной опухоли действуют путем блокирования репликации, транскрипции и/или трансляции злокачественных клеток. Типы средств против злокачественной опухоли, пригодные для настоящего изобретения, конкретно не ограничены. Средства против злокачественной опухоли можно выбирать согласно общему принципу, учитывающему типы злокачественных клеток, скорость всасывания средств против злокачественной опухоли (длительность лечения, путь введения и т.д.), положение опухоли, размеры опухоли и т.д. Примеры средств против злокачественной опухоли, пригодных для настоящего изобретения, включают алкилирующие ДНК средства, такие как мехлорэтамин, хлорамбуцил, фенилаланин, иприт, циклофосфамид, ифосфамид, кармустин (BCNU), ломустин (CCNU), стрептозотоцин, бусульфан, тиотепа, цисплатин и карбоплатин, антибиотики против злокачественной опухоли, такие как дактиномицин (актиномицин D), доксорубицин (адриамицин), эпирубицин, идарубицин, митоксантрон, пликамицин, митомицин C и блеомицин, и алкалоиды растений, такие как винкристин, винбластин, паклитаксел, доцетаксел, даунорубицин, таксол, онковин, преднизон, цисплатин, герцептин, ритуксимаб, этопозид, тенипозид, топотекан и иридотекан. Также можно использовать радиоактивные вещества, известные в данной области. Однако средства против злокачественной опухоли, пригодные для настоящего изобретения, не ограничиваются этими примерами.
Кроме того, противовоспалительное средство, предназначенное для нагрузки происходящих из протопластов микровезикул по настоящему изобретению, выбрано из группы, состоящей из, но не ограничиваясь ими, дексаметазона, солумедрола, аспирина, индометацина, ибупрофена, клобетазола, пропионата, дифлоразона диацетата, галобетазола пропионата, амцинонида, флуоционида, мометазона фуроата, дезоксиметазона, диклофенака и пироксикама.
Как используют в рамках изобретения, термин “злокачественная опухоль” относится к группе различных заболеваний, которые характеризуются увеличенным ростом клеток и инфильтрацией соседних тканей вследствие нарушения запрограммированной гибели клеток. Мишень, на которую направлено лечение, в соответствии с настоящим изобретением может быть выбрана из злокачественной опухоли, выбранной из группы, состоящей из, но не ограничиваясь ими, карциномы, происходящей из эпителиальных клеток, такой как рак легкого, рак горла, рак желудка, рак толстого кишечника/прямой кишки, рак печени, рак желчного пузыря, рак поджелудочной железы, рак молочной железы, рак шейки матки, рак предстательной железы, рак почки, рак кожи и т.д., саркомы, происходящей из клеток соединительной ткани, такой как злокачественная опухоль костей, злокачественная опухоль мышц, злокачественная опухоль жировой ткани, злокачественные опухоли фиброзных клеток и т.д., злокачественной опухоли крови, происходящей из кроветворных клеток, такой как лейкоз, лимфома, множественная миелома, и т.д, и невромы, опухоли нервных тканей.
Как используют в рамках изобретения, термин “сосудистое заболевание” относится к группе различных заболеваний, при которых происходит дисфункция в кровеносных сосудах или в стенках кровеносных сосудов вследствие метаболических, инфекционных, токсических или иммунных причин. Мишень, на которую направлено лечение, в соответствии с настоящим изобретением может быть выбрана из сосудистого заболевания, выбранного из группы, состоящей из, но не ограничиваясь ими, артериосклероза (или атеросклероза), стенокардии, острого инфаркта миокарда, инсульта, сосудистой деменции, метаболических сосудистых заболеваний, таких как ишемические сосудистые заболевания, и инфекционные, токсические или иммунные сосудистые заболевания, такие как сепсис, диссеминированное внутрисосудистое свертывание, тромботическая эмболия, васкулит, нефрит, острый респираторный дистресс-синдром, эмфизема и т.д.
Термин “воспаление”, как используют в рамках изобретения, относится к синдрому или симптому, включающему отек вследствие аномального накопления жидкости организма в тканях, застой вследствие расширения сосудов, повышения температуры пирогенами и вследствие расширения сосудов, и боль, индуцируемую метаболитами арахидоновой кислоты. Воспаление может быть классифицировано как острое, подострое и хроническое воспаление в зависимости от времени, и как инфекционные, аллергические, аутоиммунные, токсические, метаболические и травматические воспалительные заболевания, в зависимости от патофизиологических условий. Мишень, на которую направлено лечение, в соответствии с настоящим изобретением может быть выбрана из группы, состоящей из, но не ограничиваясь ими, респираторных воспалительных заболеваний, таких как ринит, синусит, отит среднего уха, ринофарингит, ларингит, бронхит, астма, хроническое обструктивное заболевание легких, бронхоэктаз, бронхиолит, пневмония, фиброз легких и т.д., воспалительных заболеваний пищеварительной системы, таких как стоматит, эзофагит, гастрит, пептическая язва, синдром раздраженной кишки, язвенный колит, холецистит, холангит, панкреатит, гепатит, и т.д., воспаления кожи, такого как атопический дерматит, псориаз, и т.д., сердечно-сосудистых воспалительных заболеваний, таких как эндокардит, миокардит, перикардит, васкулит, артериосклероз, сепсис и т.д., воспалительных заболеваний эндокринной системы, таких как тиреоидит, паратиреоидит, диабет и т.д., воспалительных заболеваний мочеполовой системы, таких как нефрит, нефропатия, интерстициальный нефрит, орхит, оофорит, эндометрит, вагиноз и т.д., воспалительных заболеваний скелетно-мышечной системы, таких как ревматоидный артрит, спондилартрит, остеоартрит, подагра, системная красная волчанка, системная склеродермия, миопатия, синдром Шегрена и болезнь Бехчета, и психоневрологических воспалительных заболеваний, таких как сосудистая деменция, болезнь Альцгеймера, нейродегенеративное заболевание, депрессивное расстройство, шизофрения и т.д.
Как используют в рамках изобретения, термин “ингибитор ангиогенеза” относится к лекарственному средству, которое функционирует, подавляя рост новых кровеносных сосудов из ранее существующих сосудов. Большинство ингибиторов ангиогенеза обладают функцией подавления роста и метастазирования злокачественной опухоли и воспалительных реакций. Тип ингибиторов ангиогенеза, доступных в качестве терапевтического вещества по настоящему изобретению, конкретно не ограничен.
Терапевтическое или диагностическое вещество, которым нагружают происходящие из протопластов микровезикулы по настоящему изобретению, может включать белки или пептиды. В качестве примеров, можно использовать, без ограничений, факторы роста, такие как VEGF (сосудисто-эндотелиальный фактор роста) и EGF (эпидермальный фактор роста), цитокины, такие как IL-1 (интерлейкин-1), интерферон (IFN)-гамма и IL-10, лекарственные средства на основе антител, ДНКазу и различные белки или пептиды, подавляющие рост и метастазирование злокачественных клеток и воспалительные ответы.
Белки или пептиды могут экспрессироваться в клетках или экспонироваться на плазматических мембранах. Также их целиком или их активные центры можно экспрессировать в чистом виде или в качестве слитых белков. Известно, что активность белков или пептидов, экспонируемых на плазматических мембранах, превышает их активность, когда они экспрессируются в клетках, в результате более высокой локальной концентрации. Таким образом, белки или пептиды, которыми нагружена поверхность микровезикул, могут действовать в качестве экспонированных лигандов для запуска передачи сигнала, подобно молекулам клеточной адгезии, факторам роста, цитокинам, их слитым молекулам и т.д., или в качестве ловушек лигандов для ингибирования функции различных лигандов, таких как антитела, рецепторы или их слитые конструкции. Однако белки или пептиды, пригодные в качестве экспонируемых лигандов или ловушек для настоящего изобретения, не ограничиваются этими примерами.
Также терапевтическое или диагностическое вещество, которым нагружены происходящие из протопластов микровезикулы по настоящему изобретению, может включать токсины. Термин “токсин” относится к ядовитому веществу, продуцируемому живыми клетками или организмами, которое способно вызывать заболевание при контакте с тканями организма или всасывании ими. С использованием токсина можно индуцировать гибель клеток. Тип токсина, доступного в качестве терапевтического вещества по настоящему изобретению, конкретно не ограничен.
Нуклеиновая кислота, предназначенная для нагрузки происходящих из протопластов микровезикул, может быть выбрана из группы, состоящей из ДНК, РНК, аптамеров, LNA (замкнутая нуклеиновая кислота), PNA (пептидно-нуклеиновая кислота), и морфолино. Детально, примеры нуклеиновой кислоты включают ДНК, микроРНК, миРНК, антисмысловую РНК, смысловую РНК и гомологи нуклеиновых кислот, такие как LNA, PNA, морфолино и т.д., но не ограничиваются ими. Эти нуклеиновые кислоты можно использовать для обеспечения смысловых эффектов, антисмысловых эффектов, РНК-интерференции или ингибирования функций белков.
В настоящем изобретении происходящие из протопластов микровезикулы, нагруженные нуклеиновыми кислотами, кодирующими флуоресцентные белки или различные флуоресцентные вещества, можно использовать для диагностики. Когда происходящие из протопластов микровезикулы, сконструированные для нацеливания на конкретные клетки или ткани, нагружают плазмидной ДНК, несущей ген, кодирующий флуоресцентный белок, и вводят в организм, флуоресцентный сигнал, генерируемый флуоресцентным белком, позволяет узнать, где находятся клетки-мишени или ткани-мишени. Аналогично, происходящие из протопластов микровезикулы можно нагружать флуоресцентными квантовыми точками или другими различными флуоресцентными веществами и использовать для детекции положения конкретных клеток и тканей в организме. Следовательно, флуоресценцию, генерируемую клетками-мишенями или тканями-мишенями, можно использовать для диагностики. Кроме того, испускающие флуоресценцию квантовые точки можно использовать для лечения заболеваний, поскольку они индуцируют апоптоз.
Терапевтические или диагностические вещества, отличные от флуоресцирующих веществ, которыми нагружают происходящие из протопластов микровезикулы, могут быть проиллюстрированы микрочастицами или наночастицами. Примеры включают частицы оксида железа, частицы золота и углеродные нанотрубки, но они не ограничиваются ими. Магнитные гранулы можно использовать в качестве терапевтического или диагностического вещества, и ими можно нагружать микровезикулы. Магнитные частицы, такие как оксид железа, можно использовать в качестве контрастного агента для визуализации при MRI. Более того, можно использовать нуклеиновые кислоты или белки, конъюгированные с наночастицами. Также доступны диагностические радиоактивные вещества.
В соответствии со следующим аспектом, настоящее изобретение относится к фармацевтической композиции, содержащей происходящие из протопластов микровезикулы, нагруженные вакцинным веществом.
Примеры вакцинного вещества, которым нагружают происходящие из протопластов микровезикулы по настоящему изобретению, могут включать антиген, иммуностимулятор и иммуномодулятор. Также можно использовать другие различные типы вакцинных веществ, без ограничений.
Источником антигена могут быть вирусы или бактерии, и он может представлять собой белковый антиген или небелковый антиген, такой как липид/углевод. Также антиген может представлять собой белок, происходящий из определенных злокачественных клеток. Антиген может быть гомогенным или он может представлять собой комбинацию двух или более различных антигенов. Например, микровезикулы могут быть нагружены двумя или более различными бактериальными антигенами. Альтернативно микровезикулы можно нагружать бактериальным антигеном, происходящим из злокачественной клетки антигеном и вирусным антигеном одновременно.
Бактериальный антиген, пригодный для настоящего изобретения, может происходить из, но не ограничиваясь ими, видов enterobacter (Enterobacter aerogenes и Enterobacter cloacae), Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa и Enterococcus faecalis.
Вирусный антиген, которым нагружают микровезикулы по настоящему изобретению, может происходить из, но не ограничиваясь ими, вируса иммунодефицита человека (HIV), вируса папилломы человека (HPV), вируса гепатита B (HBV), вируса гепатита C (HCV) или вируса гриппа.
Кроме того, антиген может происходить из самой клетки, как неизмененной, так и трансформированной, которая служит в качестве источника, из которого конструируют происходящие из протопластов микровезикулы, или он может представлять собой вещество, которое является чужеродным для клетки. Например, микровезикулы могут быть нагружены всем компонентом или частью компонента, происходящего из вирусов, бактерий, злокачественных клеток или злокачественных тканей, в качестве чужеродного антигена.
В качестве иммуностимулятора для увеличения ответа антител или T-клеточного иммунного ответа, микровезикулы можно нагружать двухцепочечной РНК (дцРНК (dsRNA)), холерным токсином и/или квасцами. Среди иммуномодуляторов, которыми нагружают микровезикулы с целью повышения антигеспецифических иммунных ответов, находятся цитокины, такие как IL-2, IL-4, IL-6, IL-12, IL-17 и IFN-гамма, и факторы роста, такие как VEGF и фибробластный фактор роста (FGF)-2.
В дополнение к активному ингредиенту, выбранному из средств против злокачественной опухоли, противовоспалительных средств, ингибиторов ангиогенеза, пептидов, белков, токсинов, нуклеиновых кислот, гранул, микрочастиц, наночастиц и их комбинаций, фармацевтическая композиция по настоящему изобретению может содержать фармацевтически приемлемый носитель, например, физиологический раствор, стерильную воду, раствор Рингера, забуференный физиологический раствор, циклодекстрин, раствор декстрозы, раствор мальтодекстрина, глицерин, этанол, липосомы или их комбинацию. Если необходимо, фармацевтическая композиция, кроме того, может содержать типичную добавку, такую как антиоксидант, буфер и т.д. Кроме того, фармацевтическая композиция может быть изготовлена в инъецируемой форме, такой как водные растворы, суспензии, эмульсии и т.д., в форме пилюль, капсул, гранул или таблеток, с добавлением разбавителя, диспергирующего вещества, поверхностно-активного вещества, связующего вещества и/или смазывающего вещества. Более того, фармацевтическая композиция может быть изготовлена в виде пригодных дозированных форм в соответствии со способом, хорошо известным в данной области, или способом, описанным в Remington's Pharmaceutical Science, Mack Publishing Company, Easton PA. Составы фармацевтической композиции конкретно не ограничены. Предпочтительно, фармацевтическая композиция может быть изготовлена в форме инъекций или ингалируемых форм.
Введение фармацевтической композиции по настоящему изобретению конкретно не ограничено. Фармацевтическую композицию можно вводить перорально или парентерально, как например, внутривенно, подкожно, внутрибрюшинно, посредством ингаляции или местно. Количество активного ингредиента в фармацевтической композиции по настоящему изобретению может варьировать, в зависимости от различных факторов, включающих массу тела пациента, возраст, пол и состояние здоровья, режим питания, время введения, путь введения, скорость экскреции, тяжесть заболевания и т.п. Термин “суточная доза” означает количество терапевтически эффективного ингредиента по настоящему изобретению, которое является достаточным для снижения состояния заболевания, когда его вводят индивидууму, нуждающемуся в этом. Пригодная доза активного ингредиента в фармацевтической композиции по настоящему изобретению может зависеть от типа соединения, предназначенного для нагрузки, тяжести заболевания и состояния индивидуума, нуждающегося в лечении, и ее могут определять специалисты в данной области. Например, пригодная доза композиции по настоящему изобретению может варьировать, в зависимости от массы тела пациента, возраста, пола и состояния здоровья, пути введения и тяжести заболевания, и, как правило, находится в диапазоне от 0,1 до 1000 мг/сутки, и предпочтительно от 1 до 500 мг/сутки для взрослого пациента с массой тела 70 кг. Общее эффективное количество фармацевтической композиции по настоящему изобретению можно вводить пациентам в однократной дозе или его можно вводить по протоколу дробного введения, при котором множество доз вводят на протяжении более длительного периода времени.
Как используют в рамках изобретения, термин “индивидуум” относится к животному, нуждающемуся в лечении злокачественной опухоли, сосудистых заболеваний или воспалительных заболеваний, включая человека или не являющихся человеком млекопитающих, таких как приматы, мыши, крысы, собаки, кошки, лошади, коровы и т.д.
В соответствии со следующим аспектом настоящее изобретение предусматривает композицию для доставки терапевтического, диагностического и/или вакцинного вещества, содержащую происходящие из протопластов микровезикулы по настоящему изобретению.
В соответствии с другим аспектом настоящее изобретение также предусматривает систему для доставки терапевтического, диагностического и/или вакцинного вещества, содержащую происходящие из протопластов микровезикулы по настоящему изобретению.
Терапевтическое, диагностическое и/или вакцинное вещество являются такими, как проиллюстрировано выше.
В соответствии с другим аспектом, настоящее изобретение относится к способу получения происходящих из протопластов микровезикул, нагруженных терапевтическим, диагностическим или вакцинным веществом.
Микровезикулы могут представлять собой микровезикулу, которая самопроизвольно отделилась от клетки, или они могут представлять собой искусственно синтезированную микровезикулу.
Происходящие из протопластов микровезикулы в соответствии с настоящим изобретением можно конструировать с использованием различных механических, электрических или химических способов. Примеры способов включают цитолиз с использованием осмоса, электропорации, обработки ультразвуковым излучением, гомогенизации, обработки детергентом, замораживания-размораживания, экструзии, механической деградации и химической обработки, но они не ограничиваются ими. В способе механической деградации раствор клеток встряхивают вместе с металлическими, керамическими или достаточно твердыми пластмассовыми шариками. В контексте экструзии, клетки вынуждают последовательно проходить через фильтры, начиная с крупных пор и продолжая порами меньших размеров. Например, для формирования микровезикул клетки последовательно пропускают через три фильтра с соответствующими размерами пор 10 мкм → 5 мкм → 1 мкм.
В одном варианте осуществления способ получения в соответствии с настоящим изобретением включает следующие стадии: удаление клеточной стенки из клеток с получением протопластов; конструирование микровезикул в суспензии протопластов и выделение микровезикул из суспензии.
В другом варианте осуществления способ получения в соответствии с настоящим изобретением включает следующие стадии: нагрузка клеток извне терапевтическим, диагностическим или вакцинным веществом и удаление клеточной стенки из клеток с получением протопластов; конструирование микровезикул из суспензии протопластов и выделение микровезикул из суспензии.
В другом варианте осуществления способ получения в соответствии с настоящим изобретением включает следующие стадии: удаление клеточной стенки из клеток с получением протопластов; нагрузка протопластов извне терапевтическим, диагностическим или вакцинным веществом; конструирование микровезикул в суспензии нагруженных веществом протопластов и выделение микровезикул из суспензии.
В другом варианте осуществления способ получения в соответствии с настоящим изобретением включает следующие стадии: удаление клеточной стенки из клеток с получением протопластов; конструирование микровезикул в суспензии протопластов в присутствии терапевтического, диагностического или вакцинного вещества; и выделение микровезикул из суспензии.
В другом варианте осуществления способ получения в соответствии с настоящим изобретением включает следующие стадии: удаление клеточной стенки из клеток с получением протопластов; конструирование микровезикул из суспензии протопластов; добавление терапевтического, диагностического или вакцинного вещества к суспензии микровезикул для нагрузки веществом микровезикул; и выделение микровезикул, нагруженных терапевтическим, диагностическим или вакцинным веществом, из суспензии.
В другом варианте осуществления способ получения в соответствии с настоящим изобретением включает следующие стадии: удаление клеточной стенки из клеток с получением протопластов; конструирование микровезикул в суспензии протопластов; выделение микровезикул из суспензии; и добавление терапевтического, диагностического или вакцинного вещества к суспензии выделенных микровезикул для нагрузки веществом микровезикул.
Кроме того, способ может включать выделение микровезикул, нагруженных терапевтическим, диагностическим или вакцинным веществом, из суспензии микровезикул.
Выделение можно проводить с использованием способа, выбранного из группы, состоящей из ультрацентрифугирования, градиента плотности, фильтрации, диализа и электрофореза в свободном потоке.
Способ с градиентом плотности, один из наиболее известных способов различения материалов с различной плотностью, можно использовать для выделения микровезикул по настоящему изобретению, поскольку их плотность отличается от плотности свободных молекул. Для применения в способе с градиентом плотности, носитель можно выбирать из, но не ограничиваясь ими, Ficoll, глицерина, сахарозы и OptiPrep™. Микровезикулы, нагруженные или не нагруженные терапевтическими или диагностическими веществами, можно отделять друг от друга, учитывая различия в плотности между ними. Способ с градиентом плотности можно использовать в комбинации с центрифугированием или электрофорезом. Микровезикулы также можно выделять гель-фильтрацией или ультрифильтрацией. Вместо фильтрации можно использовать диализ для удаления небольших молекул. Кроме того, для выделения микровезикул по настоящему изобретению пригоден электрофорез в свободном потоке.
В соответствии с назначением, можно выбирать микровезикулы с определенным диапазоном размеров перед применением. Выбор везикул в пределах определенного диапазона размеров можно проводить до, в процессе или после нагрузки терапевтическими или диагностическими веществами.
Терапевтические, диагностические и/или вакцинные вещества, которыми нагружают происходящие из протопластов микровезикулы, являются такими, как определено выше, и они конкретно не ограничены.
Например, вещество, предназначенное для нагрузки происходящих из протопластов микровезикул, может происходить из клеток, служащих источником происходящих из протопластов микровезикул, или оно может быть чужеродным для клеток. Вещество может представлять собой один материал или комбинацию двух или более различных материалов. Нагрузка происходящих из протопластов микровезикул терапевтическим, диагностическим и/или вакцинным веществом означает экспонирование вещества на поверхности происходящих из протопластов микровезикул или инкапсулирование вещества в микровезикулы, однако настоящее изобретение не ограничивается ими.
В другом варианте осуществления настоящего изобретения способ получения, кроме того, может включать модификацию части компонентов мембран. Существуют различные способы модификации компонентов клеточных мембран. Например, когда микровезикулы конструируют из смеси слитого белка и клеток, слитый белок может быть экспонирован на микровезикулах. Микровезикулы можно конвертировать в микровезикулы-невидимки, покрывая их полиэтиленгликолем. Добавление циклодекстрина к микровезикулам может снизить неспецифическое нацеливание микровезикул. Проявляя как гидрофильность, так и гидрофобность, циклодекстрин, когда он связан с поверхностью микровезикул, может действовать, блокируя неспецифическое связывание между липидами. Микровезикулы могут быть химически модифицированными. Например, после конструирования микровезикул из клеток, мембранные или трансмембранные белки которых экспонированы наружу, различные молекулы можно химически связывать с тиольными группами остатков цистеина на экспонированной области белка. Химические модификации также можно осуществлять путем связывания различных молекул с аминогруппами на мембранных белках.
Согласно другому варианту осуществления настоящего изобретения способ получения, кроме того, может включать удаление микровезикул, мембраны которых топологически отличаются от мембран протопластов, служащих источником. После конструирования микровезикул можно выбирать только те микровезикулы, которые имеют ту же мембранную топологию, что и являющиеся их источником клетки, в соответствии с назначением. С использованием антител, распознающих цитоплазматические домены мембранных белков, можно удалять микровезикулы, в которых цитоплазматические домены экспонированы наружу. Следовательно, удаляют микровезикулы, в которых плазматическая мембрана вывернута наоборот, и остаются только микровезикулы, в которых внеклеточные домены мембранных белков расположены так, что они направлены наружу.
В соответствии с другим аспектом настоящее изобретение относится к способу доставки терапевтического, диагностического и/или вакцинного вещества в конкретную клетку или ткань, включающему применение происходящих из протопластов микровезикул, нагруженных веществом.
Подробно, способ доставки терапевтического, диагностического и/или вакцинного вещества в конкретные клетки или ткани включает использование микровезикул, которые имеют мембрану, происходящую из протопласта, имеют меньший размер, чем у протопласта, и нагружены веществом. Если необходимо, для доставки терапевтического, диагностического и/или вакцинного вещества в конкретную клетку или ткань можно использовать происходящие из протопластов микровезикулы, нагруженные нацеливающими молекулами и/или фузогенами.
Конкретная клетка или ткань не ограничены. Например, конкретная клетка может представлять собой эндотелиальную клетку, клетку злокачественной опухоли, воспалительную клетку или иммунную клетку. Конкретная ткань может включать сосуды, злокачественные ткани и воспалительные ткани. Кроме того, терапевтическое, диагностическое или вакцинное вещество является таким, как проиллюстрировано выше.
В одном варианте осуществления настоящего изобретения два или более различных веществ можно доставлять в конкретные клетки или ткани.
В другом варианте осуществления настоящего изобретения, две или более различных микровезикул, выбранных из группы, состоящей из микровезикулы, нагруженной одним веществом, микровезикулы, нагруженной двумя или более веществами и их комбинации, можно использовать для доставки вещества(веществ). Например, две или более различных микровезикул можно вводить одновременно.
В другом варианте осуществления настоящего изобретения две или более различных микровезикул, выбранных из группы, состоящей из микровезикулы, нагруженной одним веществом, микровезикулы, нагруженной двумя или более веществами, и их комбинации, можно вводить последовательно.
Подробно, для доставки веществ можно использовать микровезикулы, нагруженные одновременно двумя или более различными веществами. Альтернативно используют микровезикулы, нагруженные различными веществами по отдельности или в комбинации, так чтобы можно было доставлять два или более различных веществ. Для доставки трех различных веществ, например, первую, вторую и третью микровезикулы можно нагружать тремя различными веществами, соответственно. С другой стороны, для доставки трех различных веществ можно использовать четвертую микровезикулу, нагруженную одновременно двумя веществами, и пятую микровезикулу, нагруженную другим отличающимся веществом. Первую, вторую и третью микровезикулы можно использовать одновременно или последовательно. Аналогично, можно использовать четвертую и пятую микровезикулы одновременно или последовательно.
Если необходимо, в процессе конструирования происходящих из протопластов микровезикул можно использовать нуклеазу для удаления из микровезикул нуклеиновых кислот, не являющихся необходимыми для доставки терапевтического, диагностического и/или вакцинного вещества.
В соответствии с дополнительным аспектом, настоящее изобретение предусматривает способ лечения и/или диагностики заболевания, включающий использование происходящих из протопластов микровезикул, нагруженных диагностическим или терапевтическим веществом, для доставки вещества в конкретные клетки или ткани. Следовательно, микровезикулу можно использовать для доставки диагностического или терапевтического вещества к клеткам-мишеням, тканям-мишеням или в кровь.
Из клеточных протопластов можно легко конструировать микровезикулы различных размеров, такие как липосомы, и нагружать их различными терапевтическими, диагностическими или вакцинными веществами, подлежащими доставке. Таким образом, микровезикулы можно использовать для одиночной или комбинированной терапии или диагностики или как для терапии, так и для диагностики (терагнозис, фармакодиагностика). В этом контексте, вещества, подлежащие доставке, могут присутствовать внутри микровезикул, когда они инкапсулированы, на поверхности микровезикул для связывания с рецептором, или в липидном бислое, когда они углублены или погружены в него подобно трансмембранному белку.
Благодаря эффекту EPR (усиленная проницаемость и удержание), как правило, молекулы размером 100 нм или более могут накапливаться в злокачественной ткани в течение более длительного периода времени, чем они накапливаются в нормальных тканях. Таким образом, лекарственное средство, которым нагружены микровезикулы размером 100 нм или более, является преимущественным для диагностики и терапии, поскольку оно может оставаться дольше в злокачественной ткани, тем самым, усиливая терапевтический или диагностический эффект. С другой стороны, при ингаляции только частицы размером 1 мкм или менее достигают альвеол, благодаря структуре легких. Вещество, например, ингибитор воспаления для лечения астмы, можно доставлять в ткань легких, если им нагружены микровезикулы, которые имеют размер менее 1 мкм. Как описано, можно конструировать микровезикулы различных размеров, в зависимости от ткани, к которой применяют нагруженное вещество. Предпочтительно, размер микровезикул по настоящему изобретению находится в диапазоне от 10 нм до 10 мкм.
Также в соответствии с другим дополнительным аспектом настоящее изобретение предусматривает способ профилактики и/или лечения заболевания, включающий использование происходящих из протопластов микровезикул, нагруженных вакцинным веществом, для доставки вакцинного вещества в конкретную клетку или ткань. Вакцинное вещество является таким, как описано выше.
В соответствии со следующим дополнительным аспектом настоящее изобретение относится к набору для диагностики заболевания, содержащему происходящую из протопласта микровезикулу субпротопластного размера, нагруженную праймером, зондом, антисмысловой нуклеиновой кислотой или антителом в качестве активного ингредиента, необходимого для диагностики.
Происходящие из протопластов микровезикулы, нагруженные терапевтическими и/или диагностическими веществами и способ их получения в соответствии с настоящим изобретением можно использовать для доставки веществ в клетки-мишени или ткани-мишени in vitro и/или in vivo. Например, происходящие из протопластов микровезикулы, нагруженные ферментом, терапевтическим, диагностическим или вакцинным веществом, и способ их получения можно использовать для экспериментов in vitro. Кроме того, на основе данных, полученных с помощью экспериментов in vitro, микровезикулы и способ их получения можно использовать in vivo, так чтобы пораженные клетки вылечились, однако настоящее изобретение не ограничивается ими.
Настоящее изобретение будет более понятным с помощью следующих примеров, которые приведены для иллюстрации настоящего изобретения, но их не следует истолковывать как ограничивающие его.
ПРИМЕРЫ
ПРИМЕР 1: Получение протопластов из грамотрицательных бактерий путем обработки лизоцимом
Что касается ФИГ.1, она представляет собой схематическое изображение, иллюстрирующее получение протопластов из грамотрицательных бактерий путем гидролиза лизоцимом, и преобразование протопластов в микровезикулы с одновременной нагрузкой протопластов или микровезикул лекарственным средством на каждой стадии.
Согласно ФИГ.1, протопласты получали из грамотрицательных бактерий. В связи с этим, грамотрицательные бактерии E. coli w3110 msbB выращивали до O.D600=1,0 в бульоне LB и осаждали центрифугированием при 3000 × g в течение 10 мин. Полученный таким образом клеточный осадок ресуспендировали в 10 мл буфера для получения протопластов, а затем медленно добавляли EDTA до конечной концентрации 0,01 M с последующей инкубацией в течение 40 мин при 37°C при встряхивании при 100 об./мин. После центрифугирования при 3000 × g в течение 10 мин, полученный таким образом клеточный осадок ресуспендировали в 100 мл буфера для получения протопластов, содержавшего 0,02 M MgCl2.
Суспензию инкубировали в течение 2 ч при 37°C в присутствии 2 мг/мл лизоцима, при встряхивании при 100 об./мин., и осаждали центрифугированием при 5000 × g в течение 10 мин с получением протопластов в качестве осадка, в то время как супернатант содержал наружную мембрану и клеточную стенку. Осадок в виде протопластов суспендировали в 3 мл TBS (забуференный Tris физиологический раствор), содержавшем CaCl2 и MgCl2 в концентрации 0,02 M.
Для подтверждения получения протопластов бактериальные клетки метили биотином и из меченных биотином бактериальных клеток получали протопласты. После центрифугирования при 5000 × g в течение 10 мин целые клетки отделяли от содержащего белок супернатанта. Содержащие белок супернатанты образцов и супернатант, содержащий наружную мембрану и клеточную стенку, удаленные из препарата протопластов, по отдельности смешивали с 5× нагрузочным красителем (250 мМ Tris-HCl, 10% SDS, 0,5% бромфеноловый синий, 50% глицерин), в таком количестве, чтобы нагрузочный краситель был разбавлен до концентрации 1×. Смеси кипятили при 100°C в течение 5 мин, и наносили на 8% полиакриламидный гель. После электрофореза при 80 В в течение 2 ч белки переносили на мембрану PVDF (поливинилиденфторид) при 400 мА в течение 2 ч. Мембрану блокировали в течение 2 ч в 3% растворе обезжиренного молока в PBS, инкубировали при 4°C в течение 12 ч с конъюгароиванным с пероксидазой антителом против биотина и промывали в течение 30 мин с PBS, а затем подвергали визуализации с субстратом ECL (Enhanced Chemiluminescence, Amersham Co. No. RPN2106). Результат представлен на ФИГ. 2.
Как можно видеть на ФИГ.2, реакция антитела с биотином выявлялась в бактериях, но не в протопластах. Также реакцию антитела с биотином наблюдали в супернатанте, содержавшем биотинилированную наружную мембрану и клеточную стенку, что указывает на то, что наружная мембрана и клеточная стенка были удалены из бактерий путем обработки лизоцимом. Таким образом, из этого результата очевидно, что с помощью гидролиза лизоцимом получали протопласты, свободные от наружных мембран и клеточных стенок.
ПРИМЕР 2: Конструирование микровезикул, происходящих из протопластов грамотрицательных бактерий, путем экструзии
Согласно методике, проиллюстрированной на схеме ФИГ.1, получали происходящие из протопластов микровезикулы. Из способов, предложенных на ФИГ.1, были выбраны экструзия и градиент плотности.
Протопласты из грамотрицательных бактерий, полученные согласно примеру 1, пропускали три раза через каждый из мембранных фильтров с размером пор 10 мкм, 5 мкм и 1 мкм, в указанном порядке. В 5-мл пробирку для ультрацентрифуги последовательно помещали 1 мл 50% OptiPrep, 1 мл 5% OptiPrep и 3 мл суспензии клеток, полученной после мембранных фильтров. Ультрацентрифугирование при 100000 × g в течение 2 часов приводило к образованию слоя микровезикул между 50% OptiPrep и 5% OptiPrep.
ПРИМЕР 3: Свойства микровезикул, происходящих из протопластов грамотрицательных и грамположительных бактерий
Микровезикулы конструировали из протопластов грамотрицательной бактерии E. coli и грамположительной бактерии Bacillus subtilis согласно способам примеров 1 и 2.
Каждую из микровезикул адсорбировали в течение 3 мин на покрытую углеродом медную решетку тлеющего разряда. Решетку промывали дистиллированной водой и окрашивали 2% уранилацетатом, а затем наблюдали под электронным микроскопом JEM101 (Jeol, Япония). Изображения, полученные с помощью электронного микроскопа, представлены на ФИГ.3 и 4.
На ФИГ.3 и 4 представлены изображения TEM (трансмиссионный электронный микроскоп) микровезикул, происходящих из протопластов грамотрицательной бактерии E. coli и грамположительной бактерии B. subtilis, соответственно. Как можно видеть на изображениях TEM ФИГ.3 и 4, микровезикулы, сконструированные из протопластов бактериальных клеток путем экструзии, состояли из липидного бислоя, и, как правило, имели сферическую форму размером 100 ~ 200 нм в случае микровезикул, полученных из грамотрицательных бактерий, и размером 50 ~ 100 нм для микровезикул, полученных из грамположительных бактерий.
Каждый тип микровезикул разбавляли до концентрации 5 мкг/мл в 1 мл PBS, а затем помещали в кювету и анализировали размер их частиц с использованием анализатора размера частиц на основе динамического рассеяния света (DLS). Результаты приведены на ФИГ.5 и 6.
На ФИГ.5 и 6 представлены графики, демонстрирующие распределение размеров микровезикул, сконструированных из протопластов грамотрицательных бактерий E. coli и грамположительных бактерий B. subtilis, соответственно. Как можно видеть на ФИГ.5 и 6, размер микровезикул, полученных из протопластов грамотрицательных и грамположительных бактерий, находился в диапазоне от 100 до 200 нм и от 50 до 100 нм, соответственно.
ПРИМЕР 4: Сравнение in vitro побочных эффектов микровезикул, происходящих из бактериальных клеток и бактериальных протопластов
Микровезикулы, происходящие из протопластов грамотрицательных бактерий E. coli и грамположительных бактерий S. aureus, получали с использованием способов, описанных в примерах 1 и 2. Отдельно, использовали общепринятые способы для получения микровезикул, происходящих из грамотрицательных бактерий [Proteomics. 2007 Sep; 7(17): 3143-53] и микровезикул, происходящих из грамположительных бактерий [Proteomics. 2009 Dec; 9(24): 5425-36].
Проводили исследование, чтобы узнать, вызывают ли эти микровезикулы иммунные ответы. Для этого, макрофаги обрабатывали микровезикулами, происходящими из бактериальных клеток или из бактериальных протопластов, и количественно анализировали секрецию макрофагами провоспалительного цитокина TNF-α с использованием ELISA.
Каждый тип микровезикул использовали в концентрации 1000 нг/мл в течение 16 ч на макрофагах мыши (Raw 264.7) для индукции иммунного ответа. После обработки в течение 16 ч получали кондиционированную среду и центрифугировали ее при 500 × g в течение 5 мин с получением супернатантов. Отдельно, 96-луночные планшеты, покрытые антителом против TNF-α, блокировали 100 мкл 1% BSA/PBS на лунку в течение 1 ч. Супернатанты кондиционированной среды разбавляли 1/10, и разведения высевали в планшеты и инкубировали при комнатной температуре в течение 2 часов. После инкубации с конъюгированным с биотином детектирующим антителом к TNF-α в течение 2 часов планшеты промывали 0,05% Tween-20 в PBS. После обработки стрептавидином-POD в течение 20 мин проводили цветное проявление с субстратом BM-POD.
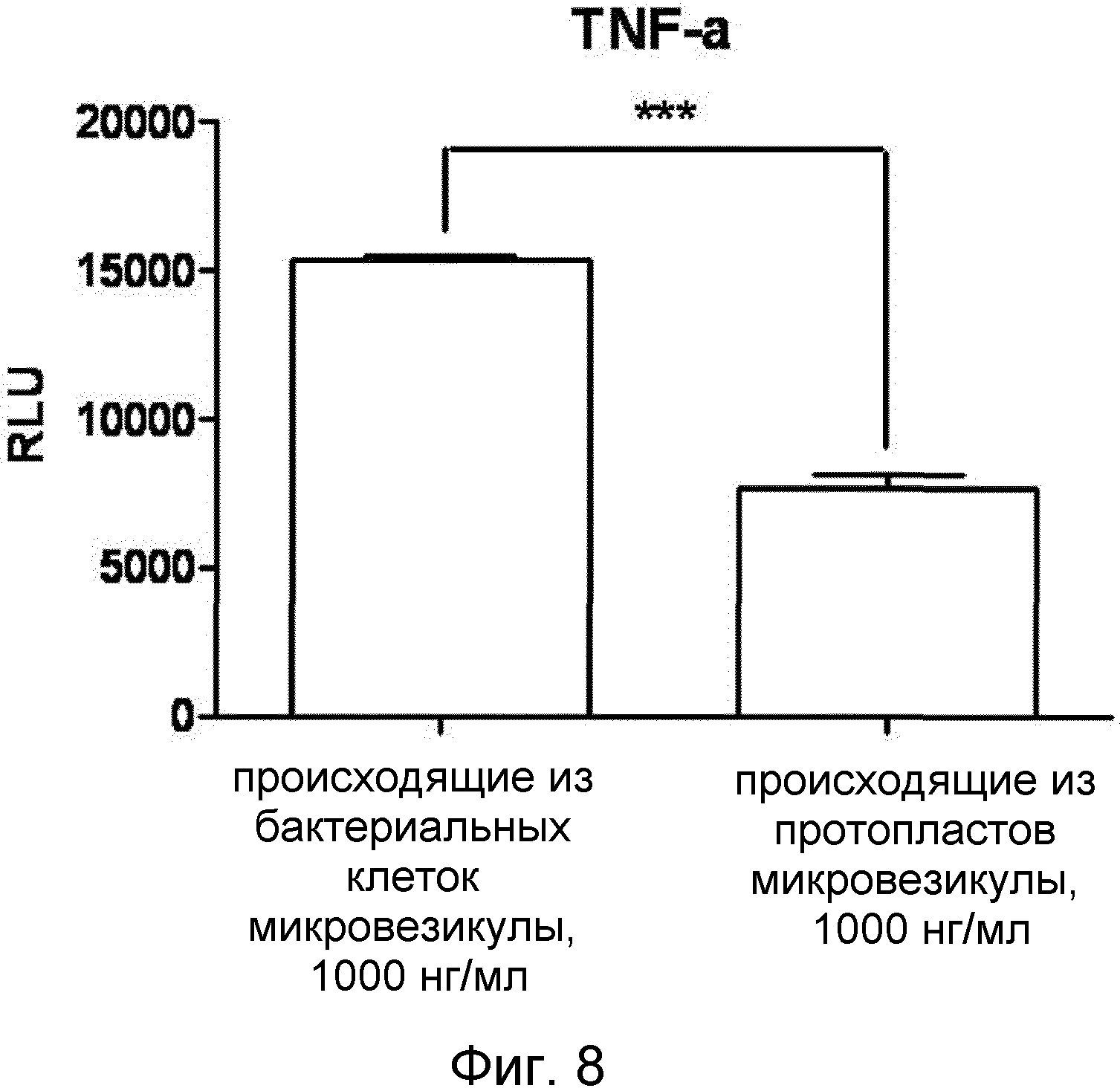
На ФИГ.7 представлен график, демонстрирующий уровни TNF-α, секретируемого макрофагами в присутствии микровезикул, происходящих из грамотрицательных бактериальных клеток или протопластов грамположительных бактерий. На ФИГ.8 представлены уровни TNF-α, секретируемого макрофагами, обработанными микровезикулами, происходящими из грамположительных бактериальных клеток или протопластов грамположительных бактерий.
Как понятно из данных ФИГ.7, микровезикулы, происходящие из грамотрицательных бактериальных клеток, содержавшие как наружную мембрану, так и клеточную стенку, вызывали иммунные ответы, увеличивающие секрецию TNF-α, в то время как микровезикулы, происходящие из протопластов грамотрицательных бактерий, свободные от наружной мембраны и клеточной стенки, не индуцировали секрецию TNF-α, подобно контролю.
Кроме того, как показано на фИГ.8, микровезикулы, происходящие из клеток грамположительных бактерий B. subtilis, индуцировали секрецию макрофагами TNF-α на увеличенном уровне, в то время как в присутствии микровезикул, происходящих из протопластов, свободных от клеточной стенки, секретировался более низкий уровень TNF-α.
Эти данные подразумевают, что происходящие из бактериальных протопластов микровезикулы вызывают воспалительный ответ на значительно более низком уровне с минимальными побочными эффектами, по сравнению с микровезикулами, происходящими из бактериальных клеток.
ПРИМЕР 5: Сравнение in vivo побочных эффектов между микровезикулами, происходящими из бактериальных клеток, и микровезикулами, происходящими из бактериальных протопластов
Микровезикулы, происходящие из протопластов грамотрицательных бактерий E. coli, получали с использованием способов, описанных в примерах 1 и 2. Также получали микровезикулы, происходящие из грамотрицательных бактериальных клеток.
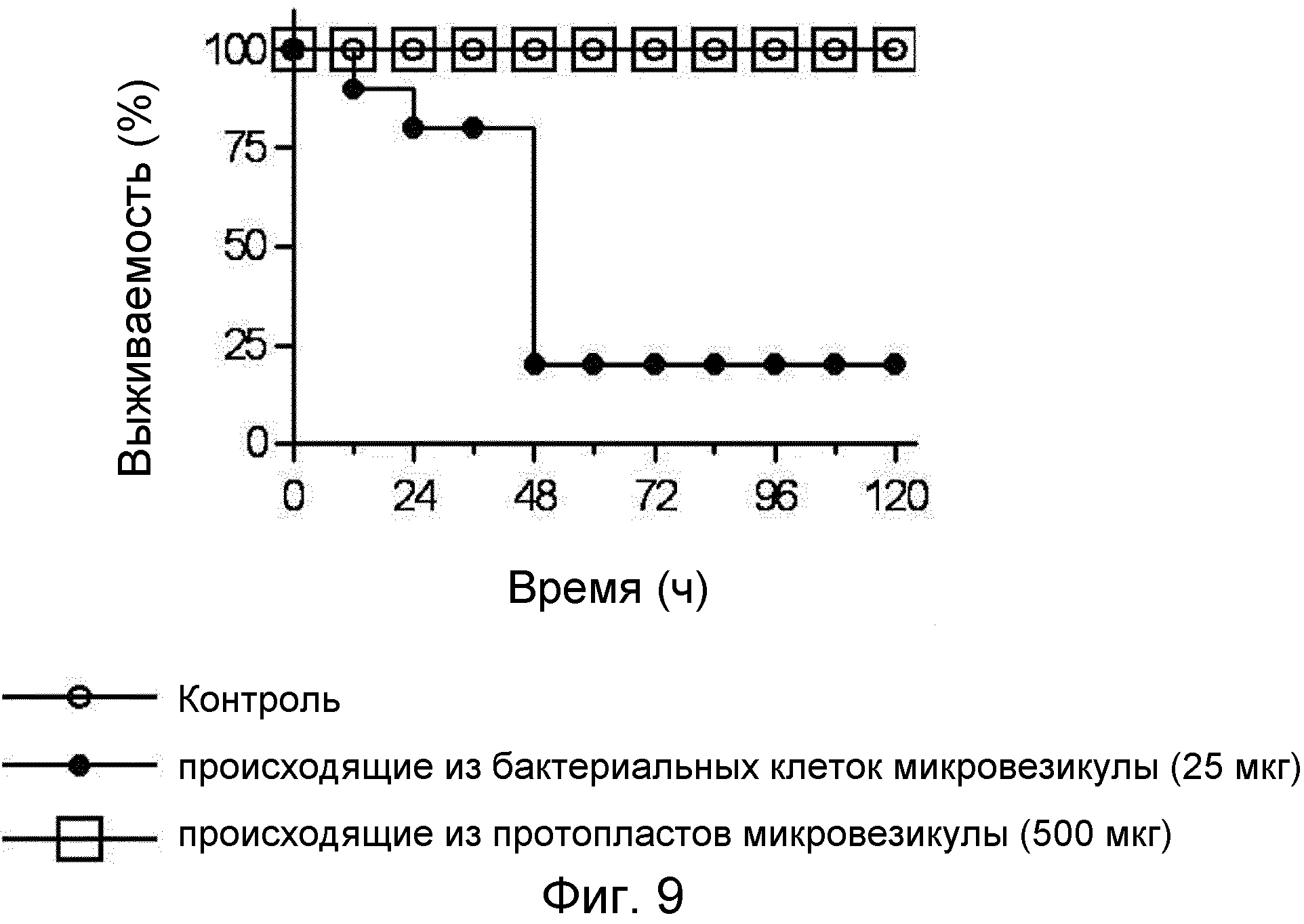
Мышам внутрибрюшинно инъецировали 25 мкг микровезикул, происходящих из бактериальных клеток, или 500 мкг микровезикул, происходящих из бактериальных протопластов, и исследовали их в отношении выживания с течением времени. Результаты представлены на ФИГ.9.
Из десяти мышей, как можно видеть на ФИГ.9, восемь погибли через 48 ч после инъекции микровезикул, происходящих из бактериальных клеток, в то время как после инъекции микровезикул, происходящих из бактериальных протопластов, в 20 раз превышающей дозе, ни одна из мышей не погибла.
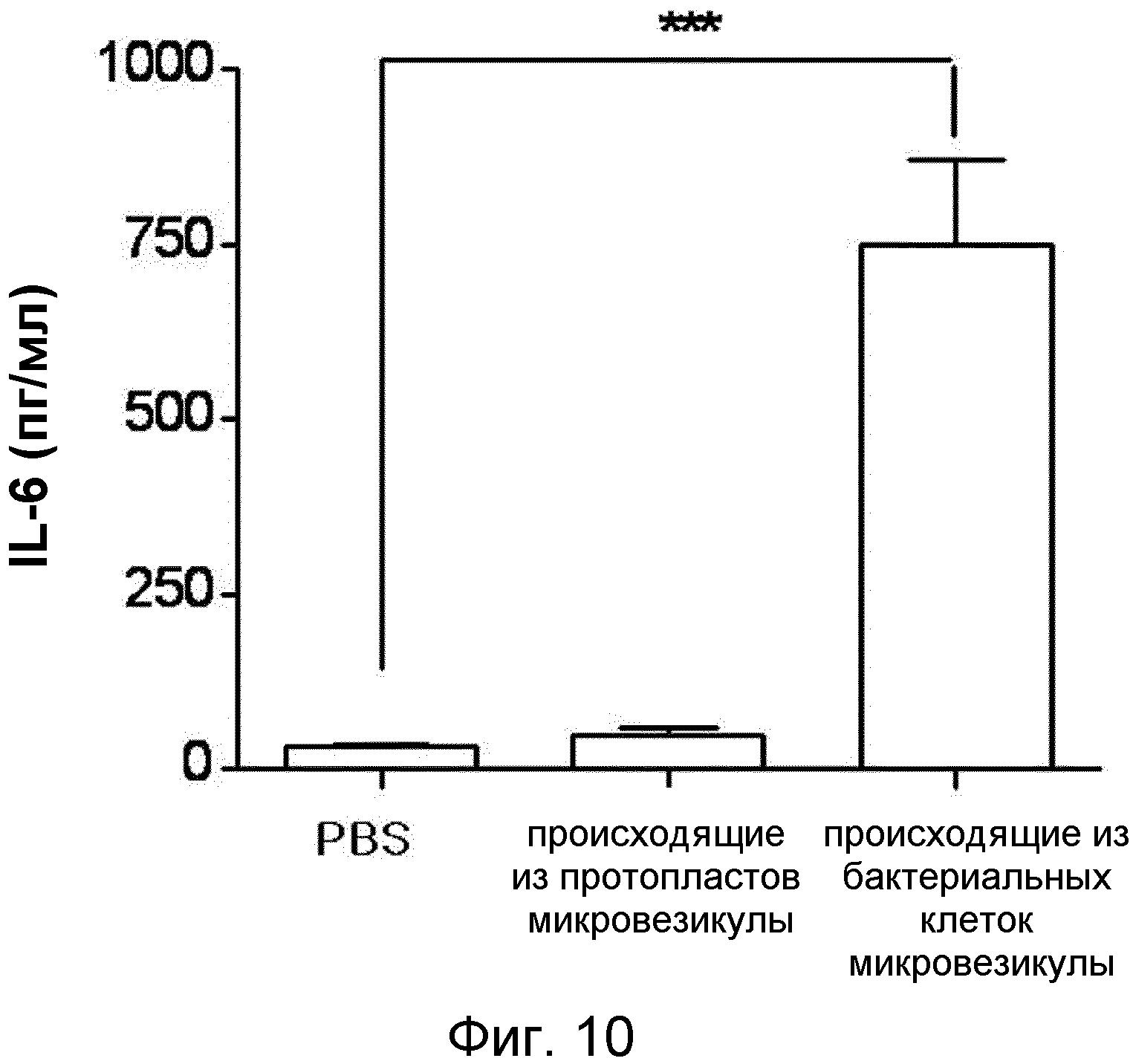
Через шесть часов после внутрибрюшинной инъекции 5 мкг микровезикул, происходящих из бактериальных клеток, или микровезикул, происходящих бактериальных протопластов, мышам, проводили взятие образцов крови мышей и использовали их для исследования индукции экспрессии у мышей воспалительного цитокина IL-6. В связи с этим, образцы крови хранили при комнатной температуре в течение 30 мин, а затем при 4°C в течение 1 ч для отделения сыворотки. Клетки крови осаждали центрифугированием при 1300 × g в течение 20 мин. Отдельно, 96-луночные планшеты, покрытые антителом против IL-6, блокировали 100 мкл 1% BSA/PBS на лунку в течение 1 ч. Супернатанты разбавляли 1/4 и разведения высевали в планшеты и инкубировали при комнатной температуре в течение 2 часов. После инкубации с конъюгированным с биотином детектирующим антителом к IL-6 в течение 2 часов планшеты промывали 0,05% Tween-20 в PBS. После обработки стрептавидином-POD в течение 20 мин проводили цветное проявление с помощью субстрата BM-POD. Результат представлен на ФИГ.10.
Как понятно из данных ФИГ.10, уровень провоспалительного цитокина IL-6 в крови был увеличен через шесть часов после инъекции микровезикул, происходящих из бактериальных клеток, в то время как не было выявлено изменений в группе, в которой вводили микровезикулы, происходящие из бактериальных протопластов.
Данные, полученные, как указано выше, показывают, что после инъекции микровезикулы, происходящие из бактериальных клеток, индуцируют системное воспаление, в то время как микровезикулы, происходящие из бактериальных протопластов, не вызывали побочных эффектов даже в высокой концентрации.
ПРИМЕР 6: Получение микровезикул, нагруженных бактериальной плазмидой
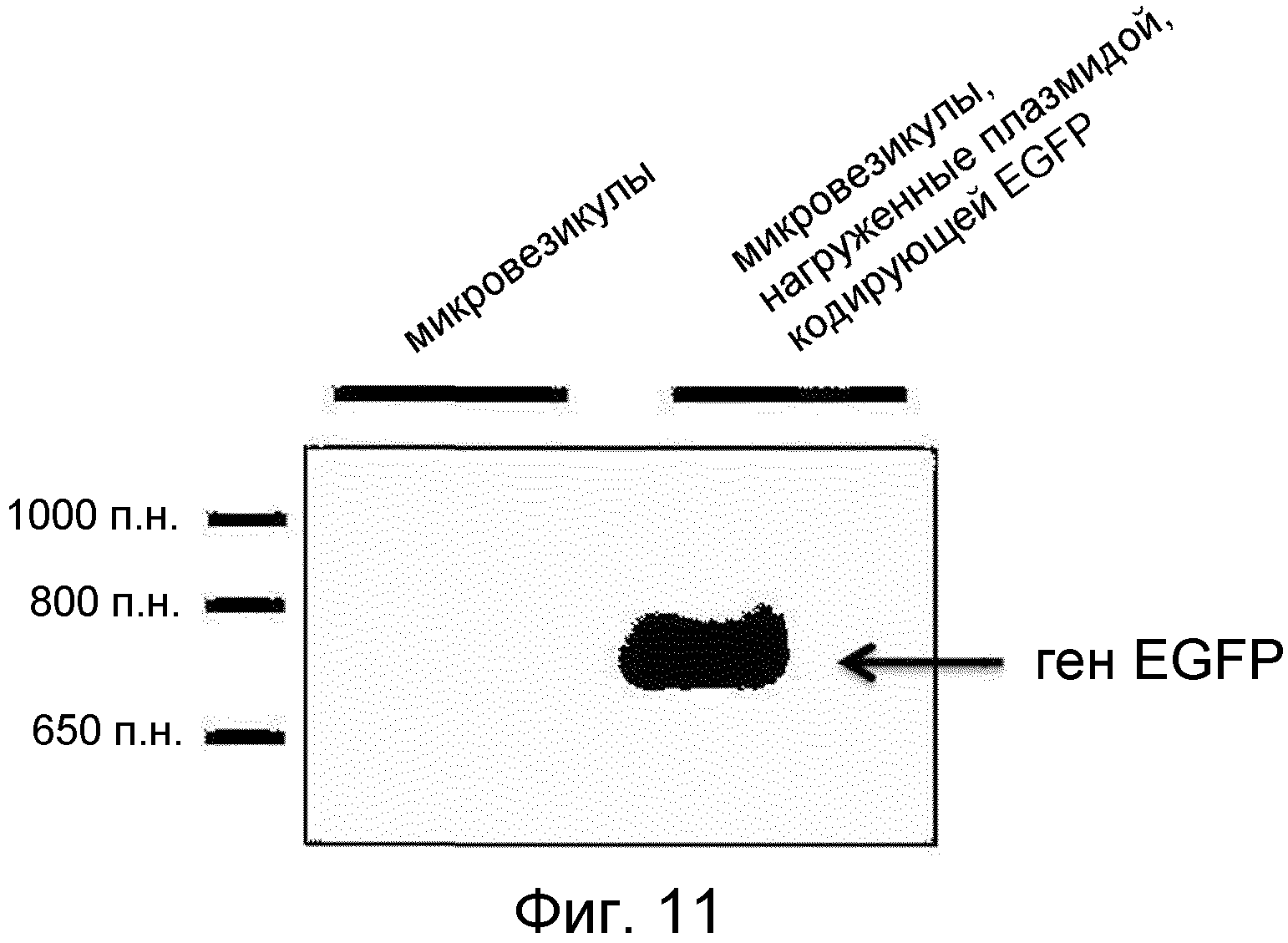
DH5α, как трансформированные рекомбинантным вектором pMSCV-EGFP, так и не трансформированные им, культивировали и использовали для получения происходящих из протопластов микровезикул аналогично тому, как в примерах 1 и 2. ПЦР (полимеразная цепная реакция) проводили с использованием праймеров EGFP, где в качестве матриц служили микровезикулы. Амплифицированную таким образом ДНК подтверждали электрофорезом на агарозном геле (буфер TBE, 1%), и результат приведен на ФИГ. 11. Праймеры EGFP были следующими.
Прямой праймер: 5'-GGAATTCCATATGGTGAGCAAGGGCGAGGA-3'
Обратный праймер: 5'-ACGCGTCGACTTACTTGTACACCTCGTCCAT-3'
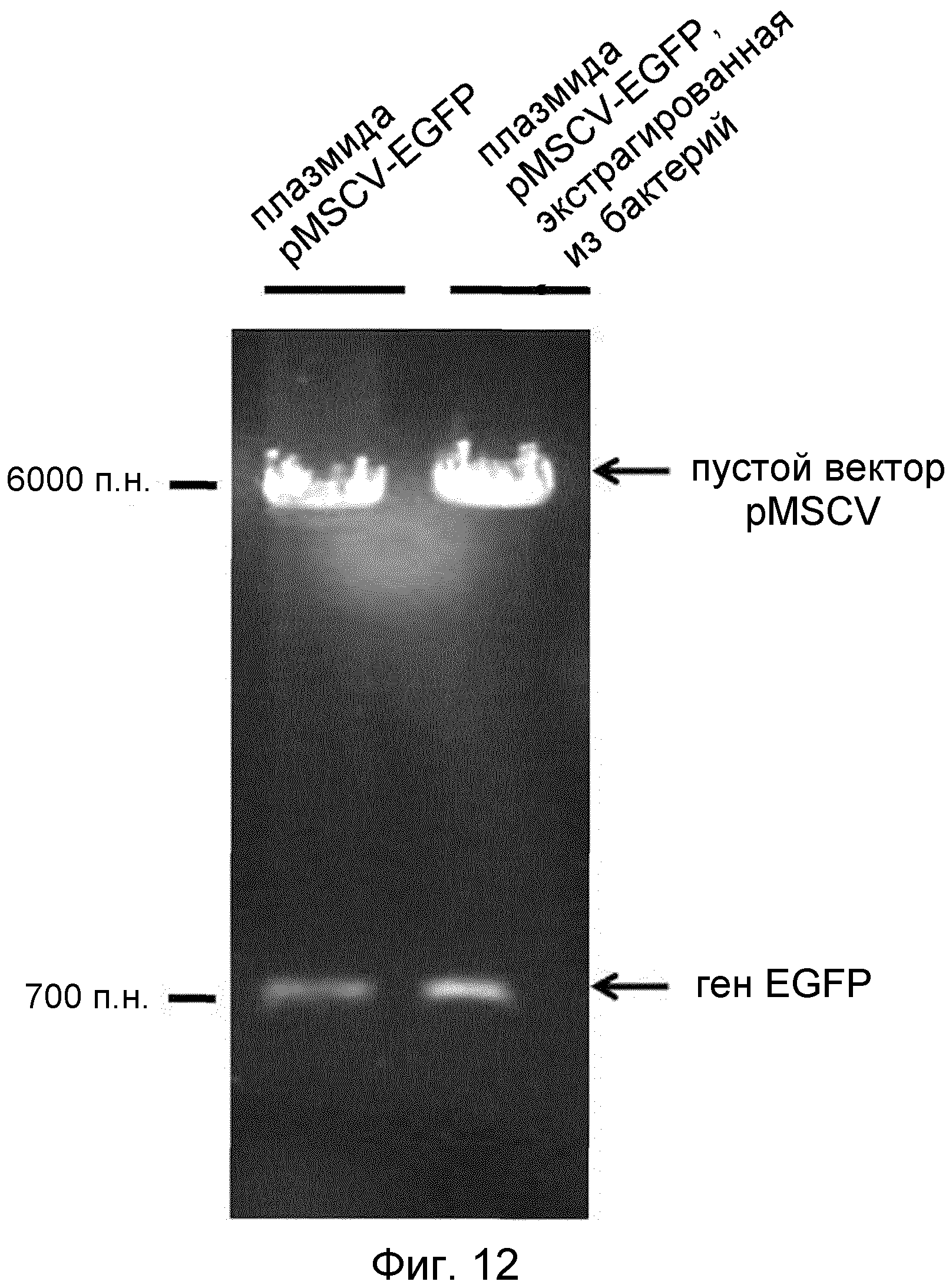
Как можно видеть на ФИГ.11, микровезикулы, нагруженные плазмидой, несущей ген EGFP, наблюдали в агарозном геле для выявления гена, амплифицированного с помощью праймеров EGFP, в то время как ничего не наблюдали в дорожке микровезикул, лишенных гена EGFP.
Для исследования целостности плазмиды, которой были нагружены микровезикулы, плазмиду экстрагировали из микровезикул с использованием набора Geneall miniprep kit (GENEALL каталожный номер № 101-102). Экстрагированную плазмиду трансформировали в E. coli BL21 посредством теплового шока. Этот штамм E. coli инкубировали при 37°C в течение 1 ч в 1 мл LB, и выращивали при 37°C в течение 16 ч на чашках с агаром LB, содержавших ампициллин. После появления колоний на чашках, одну из них выращивали при 37°C до O.D600=1,0 в среде LB, содержавшей ампициллин, а затем экстрагировали плазмиду с использованием набора Geneall miniprep kit. Экстрагированную плазмиду обрабатывали ферментами рестрикции для отделения гена EGFP от вектора pMSCV, и анализировали электрофорезом на агарозном геле (буфер TBE, 1%). Результат ферментативного картирования приведен на ФИГ.12.
Как можно видеть на ФИГ.12, плазмида pMSCV, экстрагированная из микровезикулы, имела ген EGFP, подобно рекомбинантному вектору pMSCV-EGFP.
Из этого результата очевидно, что бактериальной плазмидой можно нагружать микровезикулы без утраты ее целостности.
ПРИМЕР 7: Получение микровезикул, нагруженных бактериальной плазмидой, и возможность доставки плазмиды в бактерии
Происходящие из бактериальных протопластов микровезикулы исследовали в отношении их способности трансформировать бактерии путем доставки плазмиды в бактерии. Во-первых, конструировали плазмиду, экспрессирующую EGFP, для использования в целях создания зеленых флуоресцирующих бактерий. Для этого конструировали праймеры с участками ферментов рестрикции на основе последовательности ДНК EGFP.
Прямой праймер: 5'- GGAATTCCATATGGGTGAGCAAGGGCGAGGA-3'
Обратный праймер: 5'-AGGCGTCGACTTACTTGTACAGCTCGTCCAT-3'
(Участки ферментов рестрикции NdeI и SalI указаны полужирным шрифтом)
ПЦР проводили на геномной ДНК, несущей ген GFP, в присутствии праймеров, и полученный таким образом продукт ПЦР очищали из полосы после ПЦР с использованием набора для очистки из геля Quiaquick gel purification kit (QIAGEN, каталожный номер № 28104). Очищенный продукт расщепляли при 37°C в течение 8 ч с помощью ферментов рестрикции NdeI и SalI, и вновь очищали с помощью набора для очистки из геля Quiaquick PCR purification kit перед лигированием с вектором pHCE, расщепленным теми же ферментами. Полученный рекомбинантный вектор был назван "pHCE-GFP".
E. coli DH5α трансформировали рекомбинантным вектором pHCE-GFP посредством теплового шока и инкубировали при 37°C в течение 1 ч в 1 мл бульона LB, и выращивали при 37°C в течение 16 ч на чашках с агаром LB, содержащим ампициллин. Трансформацию проводили с помощью ПЦР колоний и ферментативного картирования.
Микровезикулы, нагруженные или не нагруженные pHCE-GFP, конструировали из грамотрицательных бактерий E. coli с рекомбинантным вектором pHCE-GFP или без него, соответственно, с использованием способов, описанных в примерах 1 и 2.
Бактерии, трансформированные вектором pHCE, могут расти на чашках с агаром, поскольку вектор имеет ген устойчивости к ампициллину. Безусловно, бактерии, трансформированные pHCE-GFP, оказываются флуоресцирующими зеленой флуоресценцией, вследствие присутствия гена EGFP в плазмиде.
E. coli DH5α выращивали при 37°C в течение 16 ч на типичных чашках с LB и на них наслаивали 10 мкг микровезикул, нагруженных плазмидой pHCE-GFP. Затем клетки наносили штрихами на чашки с агарозой, содержащей ампициллин, в зависимости от времени, а затем исследовали экспрессию по зеленой флуоресценции.
Как показано на ФИГ.13, микровезикулы, нагруженные плазмидой pHCE-GFP, доставляли плазмиду в клетки, осуществляя трансформацию.
Данные подразумевают, что микровезикулы, происходящие из бактериальных протопластов, могут быть нагружены плазмидой, и могут доставлять ее в бактерии.
ПРИМЕР 8: Способность к доставке и индукция иммунного ответа микровезикулами, нагруженными бактериальным антигенным белком
Нижеследующие эксперименты проводили для исследования того, можно ли использовать происходящие из бактериальных протопластов микровезикулы в качестве носителя для антигена для индукции образования антител. Для этого использовали EGFP, который не может индуцировать образование антител сам по себе, чтобы исследовать, могут ли микровезикулы индуцировать образование антител к EGFP.
Из грамотрицательных бактерий E. coli, как трансформированных рекомбинантным вектором pHCE-GFP, как в примере 7, так и не трансформированных им, конструировали микровезикулы, нагруженные или не нагруженные pHCE-GFP, соответственно, с использованием способов, описанных в примерах 1 и 2.
Проводили исследование способности микровезикул индуцировать образование антител и вызывать иммунный ответ. Мышам внутрибрюшинно инъецировали три раза через регулярные промежутки времени, составляющие семь суток, PBS, 5 мкг микровезикул, 5 мкг нагруженных EGFP микровезикул или 2,5 мкг EGFP, что соответствовало 5 мкг нагруженных EGFP микровезикул, соответственно. Каждая группа состояла из пяти мышей. Через семь суток после последней инъекции из глаз мышей отбирали образцы крови, инкубировали их при комнатной температуре в течение 30 мин, хранили при 4°C в течение 1 ч и центрифугировали при 1300 × g в течение 20 мин. Отбирали супернатанты, свободные от клеток.
Образование специфичного к EGFP антитела у мышей подтверждали следующим образом. На каждую лунку 96-луночных планшетов наносили 100 нг белка EGFP и блокировали их в течение 1 ч с помощью 100 мкл 3% BSA/PBS. Супернатанты крови мышей разбавляли 1/1000, добавляли в каждую лунку и инкубировали при комнатной температуре в течение 2 ч, а затем проводили инкубацию с конъюгированным с HRP антителом против IgG мыши или антителом против IgE мыши в течение 1 ч. После промывания с 0,05% Tween-20 в PBS проводили проявление цвета с помощью субстрата BM-POD.
На ФИГ.14 и 15, представлены величины RLU для IgG и IgE, специфичных к EGFP. Величина RLU соответствует относительному количеству специфичного к EGFP антитела. Как показано на ФИГ.14 и 15, у мышей продуцировались IgG и IgE против EGFP после инъекции происходящих из протопластов E. coli микровезикул, нагруженных EGFP, однако у них не продуцировались никакие антитела к EGFP, когда инъецировали микровезикулы с EGFP или без EGFP.
Также исследовали образование T-клеток памяти следующим образом. Клетки получали путем измельчения селезенки, вырезанной через трое суток после последней инъекции микровезикул, и суспендировали в 2,5% FBS в буфере DMEM. Клетки получали в качестве осадка центрифугированием при 1000 об./мин. в течение 5 мин. Клеточный осадок ресуспендировали в 5 мл буфера для лизиса RBC (0,15 M NH4Cl, 10 мМ KHCO3, 0,1 мМ Na2EDTA, pH 7,2), чтобы лизировать эритроциты. Суспензию вновь центрифугировали при 1000 об./мин. в течение 5 мин для образования осадка из спленоцитов. Эти спленоциты высевали с плотностью 1×105 клеток/лунка в 48-луночные планшеты, которые за сутки до этого покрыли 1 мкг/мл антител к CD3 и CD28. Инкубация при 37°C в течение 12 ч индуцировала экспрессию T-клеточных цитокинов. После этого культуры центрифугировали при 800 × g в течение 10 мин, а затем при 3000 × g в течение 20 мин, и отбирали супернатанты, свободные от клеток.
Супернатанты подвергали следующим экспериментам для исследования того, образовывались ли T-клетки памяти у вакцинированных мышей. 96-луночные планшеты покрывали T-клеточными цитокинами: IL-4, IFN-γ, IL-10 и IL-17, и блокировали в течение 1 ч с помощью 100 мкл 1% BSA/PBS на лунку. Суспернатанты кондиционированной среды разбавляли 1/10, и разведения высевали в планшеты и инкубировали при комнатной температуре в течение 2 часов. После инкубации с конъюгированным с биотином детектирующим антителом к цитокинам в течение 2 часов, планшеты промывали 0,05% Tween-20 в PBS. После обработки стрептавидином-POD в течение 20 мин проводили цветное проявление с помощью субстрата BM-POD.
На ФИГ.16 показаны анализированные уровни цитокинов в качестве величин RLU проявленного цвета. Как понятно из данных ФИГ.16, у мышей после инъекции происходящих из протопластов E. coli микровезикул, нагруженных белком EGFP, экспрессировались IL-4, IFN-γ, IL-10 и IL-17, и одновременно образовывались T-клетки памяти, ответственные за память иммунных ответов.
Эти результаты указывают на то, что микровезикулы могут доставлять белки (антигены), инкапсулированные в них, к иммунным клеткам, и индуцировать антигенспецифические иммунные ответы in vivo.
ПРИМЕР 9: Получение микровезикул, нагруженных бактериальными тельцами включения
Когда его сверхэкспрессируют искусственно, OmpA, бактериальный белок наружной мембраны, находится в клетке в качестве телец включения. Таким образом, искусственно сверхэкспрессированный OmpA может служить в качестве индикатора того, нагружены ли микровезикулы тельцами включения, или нет.
Ген OmpA встраивали в pET-30a(+), конструируя рекомбинантный вектор, называемый "pET-30a(+)-OmpA-His6".
E. coli BL21 трансформировали pET-30a(+)-OmpA-His6 посредством теплового шока, инкубировали при 37°C в течение 1 ч в 1 мл бульона LB и выращивали при 37°C в течение 16 ч на чашках с агаром LB, содержавших канамицин. Из колоний, образованных на чашках, одну отбирали и тестировали в отношении того, содержала ли она pET-30a(+)-OmpA-His6. Колонию инокулировали в 20 мл бульона LB, содержавшего канамицин, и выращивали при 37°C до O.D600=0,4 и в это время клетки индуцировали при 37°C в течение 3 ч в присутствии 1 мМ IPTG (изопропил β-D-тиогалактопиранозид) для сверхэкспрессии слитого белка. Таким образом, получали трансформированные бактерии, в которых сверхэкспрессировался белок OmpA-His-метка.
Микровезикулы, как нагруженные, так и не нагруженные, белком OmpA-His-метка, конструировали с использованием способов, описанных в примерах 1 и 2. После этого 20 мкг каждого из типов микровезикул по отдельности смешивали с таким количеством 5× нагрузочного красителя, чтобы нагрузочный краситель был разбавлен до концентрации 1×. Смеси кипятили при 100°C в течение 5 мин и наносили на 12% полиакриламидный гель. После электрофореза при 80 В в течение 2 ч белки переносили на мембрану PVDF при 400 мА в течение 2 ч. Мембрану блокировали при 4°C в течение 12 ч в 3% растворе обезжиренного молока в PBS. Мембрану обрабатывали при комнатной температуре в течение 2 ч антителом против His-метки, промывали два раза PBS, и подвергали реакции при комнатной температуре в течение 1 ч с конъюгированным с пероксидазой вторичным антителом. Ее вновь промывали в течение 30 мин PBS, а затем проводили визуализацию с помощью субстрата ECL. Результат представлен на ФИГ.17.
Как можно видеть на ФИГ.17, микровезикулы, сконструированные из протопласта бактерий, сверхэкспрессирующих белок OmpA-His-метка, выявлялись с помощью антитела против His-метки, в то время как в микровезикулах, сконстурированных из протопластов бактерий, лишенных белка OmpA-His-метка, белок His-метка не выявлялся.
Таким образом, из этого результата было очевидно, что тельца включения были нагружены микровезикулами.
ПРИМЕР 10: Получение микровезикул, нагруженных бактериальным белком наружной мембраны
E. coli трансформировали аналогично тому, как в примере 9, для сверхэкспрессии OmpA, OmpC или OmpF. Трансформированные бактерии смешивали в соотношении 1:1:1, и использовали для конструирования происходящих из протопластов микровезикул, нагруженных OmpA, OmpC и OmpF, с использованием способов, описанных в примерах 1 и 2.
Для исследования того, были ли происходящие из протопластов микровезикулы нагружены всеми из OmpA, OmpC и OmpF, и где OmpA, OmpC и OmpF располагались в микровезикулах, проводили следующие эксперименты. Сначала происходящие из бактериальных протопластов микровезикулы обрабатывали трипсином для расщепления экстравезикулярных доменов мембранных белков. После денатурации трипсина при высокой температуре микровезикулы подвергали лизису для экспонирования внутримембранных и внемембранных белков раствору, а затем обрабатывали антителом, специфичным к His6-метке, слитой с каждым из OmpA, OmpC и OmpF. Результат приведен на ФИГ.18.
Основываясь на том факте, что трипсин не может проходить через протопласт, микровезикулы обрабатывали трипсином до и после их лизиса, чтобы исследовать положение, где экспрессировались белки OmpA, OmpC и OmpF. Если белки располагались вне микровезикул, они не могли реагировать с антителом, поскольку они расщеплялись. С другой стороны, они могли реагировать с антителом, если они были расположены внутри, даже после обработки микровезикул трипсином.
Как понятно из данных на ФИГ.18 комплекс антиген-антитело выявлялся даже после обработки трипсином, что означает, что все из OmpA, OmpC и OmpF были расположены внутри микровезикул. Это указывает на вероятность того, что если бы их вводили, защищенными протопластом, OmpA, OmpC и OmpF могли избежать воспалительных ответов, но индуцировать иммунные ответы, таким образом, оказывая безопасное вакцинное действие.
ПРИМЕР 11: Вакцинная активность микровезикул, нагруженных бактериальным белком наружной мембраны
Микровезикулы, нагруженные бактериальными белками наружной мембраны, исследовали в отношении вакцинной активности. Происходящие из протопластов микровезикулы, нагруженные OmpA, OmpC и OmpF, внутрибрюшинно инъецировали три раза в дозе 40 мкг через регулярные промежутки времени, составляющие семь суток, мышам. Для контроля использовали PBS. Проводили исследование образования антитела, специфичного к OmpA. Через семь суток после последней инъекции из глаз мышей отбирали образцы крови, инкубировали их при комнатной температуре в течение 30 мин, хранили при 4°C в течение 1 ч и центрифугировали при 1300 × g в течение 20 мин. Отбирали супернатанты, свободные от клеток.
Каждую лунку 96-луночных планшетов покрывали 50 нг белка OmpA и блокировали в течение 2 ч 100 мкл 3% BSA/PBS. Супернатанты крови мыши разбавляли 1/1000, добавляли в каждую лунку и инкубировали при комнатной температуре в течение 2 ч, а затем проводили инкубацию с конъюгированным с HRP антителом против антител мыши в течение 1 ч. После промывания 0,05% Tween-20 в PBS, проводили проявление цвета с помощью субстрата BM-POD.
На ФИГ.19 представлены уровни специфичного к OmpA антитела, проанализированные в качестве величин RLU проявленного цвета.
Как показано на ФИГ.19, у мышей образовывалось антитело к OmpA после инъекции происходящих из протопластов микровезикул, нагруженных белком Omp.
Кроме того, проводили исследование, чтобы установить, имел ли иммунный ответ, индуцированный микровезикулами, вакцинный эффект на бактерии. E. coli C4 выращивали до O.D=1,0 и разбавляли 1/10 в PBS. Разведение бактерий в PBS внутрибрюшинно вводили мышам один раз в дозе 100 мкл через семь суток после последней инъекции микровезикул. Погибших мышей подсчитывали каждые шесть часов.
На ФИГ.20 представлена кривая выживания для мышей с течением времени после инъекции бактериальных клеток. Как можно видеть на кривой, все из мышей, иммунизированных микровезикулами, выжили, в то время как 90% группы PBS погибли, что указывает на то, что происходящие из протопластов микровезикулы можно использовать в качестве носителя для доставки антигена и индукции эффективного иммунного ответа на последующую бактериальную инфекцию.
ПРИМЕР 12: Получение микровезикул, нагруженных антигеном меланомы
Проводили исследование того, могут ли происходящие из бактериальных протопластов микровезикулы служить в качестве носителя для онкогенного антигена для применения в вакцине против злокачественной опухоли путем стимуляции иммунного ответа на злокачественные клетки. Бактериальные клетки трансформировали геном, кодирующим Mart-1, известным как онкогенный белок, вызывающий меланому.
Для применения в амплификации гена Mart-1 синтезировали праймеры с определенными участками ферментов рестрикции на основе последовательности гена Mart-1 следующим образом.
Прямой праймер: 5'-GGAATTCCATATGCCCCAAGAAGAC-3'
Обратный праймер: 5'-AGGCGTCGACTCAGGGTGAATAAGG-3'
(Буквы, выделенные полужирным шрифтом, указывают на участки рестрикции NdeI и SalI)
ПЦР проводили с использованием праймеров с геномной ДНК клеток меланомы мыши B16BL6, служащей в качестве матрицы. Полученный таким образом продукт ПЦР очищали с использованием набора для очистки из геля Quiaquick gel purification kit. После расщепления при 37°C в течение 8 ч ферментами рестрикции NdeI и SalI, и последующей очистки с помощью набора для очистки продуктов ПЦР Quiaquick PCR purification kit, амплифицированный ген лигировали с вектором pET-30a(+), который предварительно был расщеплен теми же ферментами рестрикции. Полученный рекомбинантный вектор был назван "pET-30a(+)-Mart-1-His6".
Рекомбинантный вектор pET-30a(+)-Mart-1-His6 трансформировали в E. coli BL21 посредством теплового шока, а затем инкубировали при 37°C в течение 1 ч в 1 мл бульона LB, и выращивали при 37°C в течение 16 ч на чашках с агаром LB, содержавших канамицин. Из колоний, образовавшихся на чашках, одну отбирали и исследовали в отношении того, содержала ли она pET-30a(+)-Mart-1-His6. Колонию инокулировали в 20 мл бульона LB, содержавшего канамицин, и выращивали при 37°C до O.D600=0,4, после чего клетки индуцировали при 37°C в течение 3 ч в присутствии 1 мМ IPTG для экспрессии Mart-1.
Микровезикулы, нагруженные белком Mart-1, конструировали с использованием способов, описанных в примерах 1 и 2.
Проводили исследование трансляции белка Mar-1 в микровезикуле. Для этого 20 мкг каждого из лизата цельных клеток клеточной линии B16BL6, микровезикул, нагруженных Mart-1, и не нагруженных микровезикул, по отдельности смешивали с таким количеством 5× нагрузочного красителя, чтобы нагрузочный краситель был разбавлен до концентрации 1×. Смеси кипятили при 100°C в течение 5 мин и наносили на 12% полиакриламидный гель. После электрофореза при 80 В в течение 2 ч белки переносили на мембрану PVDF при 400 мА в течение 2 ч. Мембрану блокировали при 4°C в течение 12 ч в 3% растворе обезжиренного молока в PBS. Мембрану обрабатывали при комнатной температуре в течение 2 ч антителом против Mart-1, промывали два раза PBS, и подвергали реакции при комнатной температуре в течение 1 ч с конъюгированным с пероксидазой вторичным антителом. Ее вновь промывали в течение 30 мин PBS, а затем проводили визуализацию с помощью субстрата ECL. Результат представлен на ФИГ.21.
Как можно видеть на ФИГ.21, микровезикулы, сконструированные из протопластов бактерий, свехэкспрессирующих Mart, выявлялись с помощью антитела против Mart-1, в то время как белок Mart-1 не выявлялся в микровезикулах, сконструированных из протопласта бактерий, лишенных Mart-1.
ПРИМЕР 13: Вакцинный эффект на меланому микровезикул, нагруженных антигеном меланомы
Микровезикулы, нагруженные Mart-1, полученные согласно примеру 12, внутрибрюшинно инъецировали в дозе 25 мкг три раза через регулярные промежутки, составляющие семь суток. Клеточную линию меланомы мыши (B16BL6) подкожно инъецировали в дозе 1×106 клеток мышам через семь суток после третьей инъекции. Злокачественную опухоль, которая образовывалась за 20 суток, вырезали из мышей и взвешивали.
Как можно видеть на ФИГ.22, злокачественная ткань, вырезанная из мышей, которым инъецировали микровезикулы, нагруженные белком Mart-1, весила меньше, чем злокачественная ткань, вырезанная из мышей, которым инъецировали PBS.
Из полученных результатов, представленных выше, очевидно, что происходящие из протопластов микровезикулы можно использовать в качестве носителя для онкогенного антигена, тем самым, стимулируя иммунный ответ против злокачественной опухоли.
ПРИМЕР 14: Получение микровезикул, происходящих из бактериальных протопластов, нагруженных слитым белком EGF
Белком EGF человека нагружали поверхность протопласта с использованием бактериального белка внутренней мембраны PrsA. Для этого ген, кодирующий полипептид, располагающийся от N-конца до положения 290 аминокислотной последовательности PrsA, амплифицировали с использованием не содержащих стоп-кодонов праймеров, которые синтезировали на основе известной последовательности оснований PrsA, причем в них были встроены участки ферментов рестрикции.
Прямой праймер: 5'-CATATGAAGAAAATCGCAATAGCAG-3'
Обратный праймер: 5'-TCTAGATTTAGAATTGCTTGAAGATGAAG-3'
(Буквы, выделенные полужирным шрифтом, обозначают участки распознавания NdeI и XbaI)
ПЦР проводили на геномной ДНК B. subtilis в присутствии праймеров, и полученный таким образом продукт ПЦР очищали из полосы после ПЦР с использованием набора для очистки из геля Quiaquick gel purification kit. Очищенный продукт расщепляли при 37°C в течение 8 ч ферментами рестрикции NdeI и XbaI и вновь очищали с помощью набора для очистки продуктов ПЦР Quiaquick PCR purification kit, а затем лигировали в вектор pHCE, расщепленный теми же ферментами. Полученный рекомбинантный вектор был назван "pHCE-prsA".
Для применения в слиянии с вектором pHCE-prsA, ген EGF человека амплифицировали с использованием праймеров, которые были синтезированы на основе последовательности гена EGF человека, причем в них были встроены определенные участки ферментов рестрикции.
Прямой праймер: 5'-GCTCTAGAAATACTGACTCTGAATGTCCC-3'
Обратный праймер: 5'-CAAGCTTTCAGCGCAGTTCCCACCACTTC-3'
(Буквы, выделенные полужирным шрифтом, обозначают участки рестрикции XbaI и HindII)
ПЦР проводили на геномной ДНК клеточной линии немелкоклеточного рака человека A549 в присутствии праймеров, и полученный таким образом продукт ПЦР очищали из полосы после ПЦР с использованием набора для очистки из геля Quiaquick gel purification kit. Очищенный продукт расщепляли при 37°C в течение 8 ч ферментами рестрикции XbaI и HindIII, и вновь очищали с помощью набора для очистки продуктов ПЦР Quiaquick PCR purification kit, а затем лигировали в вектор pHCE-prsA, расщепленный теми же ферментами. Полученный рекомбинантный вектор был назван "pHCE-prsA-EGF".
После трансформации вектором pHCE-prsA-EGF посредством теплового шока E. coli DH5α инкубировали при 37°C в течение 1 ч в 1 мл бульона LB и выращивали при 37°C в течение 16 ч на чашках с агаром LB, содержащим ампициллин. Из колоний, образовавшихся на чашках, одну отбирали и исследовали с помощью ПЦР колоний и картирования ферментами рестрикции в отношении того, содержала ли она pHCE-prsA-EGF.
Из грамотрицательных бактерий E. coli, трансформированных вектором pHCE-prsA-EGF, или бактерий, которые не были трансформированы, конструировали микровезикулы, нагруженные слитым белком EGF, или не нагруженные микровезикулы с использованием способов, описанных в примерах 1 и 2. После этого 20 мкг каждого из типов микровезикул по отдельности смешивали с таким количеством 5× нагрузочного красителя, чтобы нагрузочный краситель был разбавлен до концентрации 1×. Смеси кипятили при 100°C в течение 5 мин и наносили на 12% полиакриламидный гель. После электрофореза при 80 В в течение 2 ч белки переносили на мембрану PVDF при 400 мА в течение 2 ч. Мембрану блокировали в течение 2 ч в 3% растворе обезжиренного молока в PBS. Мембрану обрабатывали при 4°C в течение 12 ч антителом против EGF, промывали два раза PBS, и подвергали реакции при комнатной температуре в течение 1 ч с конъюгированным с пероксидазой вторичным антителом. Ее вновь промывали в течение 30 мин PBS, а затем проводили визуализацию с помощью субстрата ECL. Результат представлен на ФИГ.23.
Как можно видеть на ФИГ.23, микровезикулы, сконструированные из протопласта бактерий, сверхэкспрессирующих слитый белок EGF, выявлялись с помощью антитела против EGF, в то время как белок EGF не выявлялся в микровезикулах, сконструированных из протопластов бактерий, лишенных слитого белка EGF.
Этот результат указывает на то, что микровезикулы, нагруженные слитым белком EGF, были сконструированы правильно.
Для исследования того, был ли слитый белок EGF расположен на наружной поверхности микровезикул, использовали обработку трипсином. Основываясь на том факте, что трипсин не может проходить через протопласт, микровезикулы обрабатывали трипсином для расщепления экстравезикулярных доменов белков клеточной мембраны до исследования активности слитого белка EGF. После денатурации трипсина при высокой температуре микровезикулы подвергали лизису для экспонирования внутренних и трансмембранных белков раствору, а затем обрабатывали антителом, специфичным к EGF. Результат приведен на ФИГ.24.
На ФИГ.24, “+” и “-” означают обработку с трипсином и без трипсина, соответственно.
Как можно видеть на ФИГ.24, антитело против EGF не выявлялось при обработке трипсином, что позволяет заключить, что домен EGF слитого белка EGF направлен наружу микровезикул, и что микровезикулы, нагруженные слитым белком EGF, могут специфически нацеливаться на клетки, экспрессирующие рецептор EGF.
ПРИМЕР 15: Анализ in vitro специфичной доставки к клеткам микровезикул, нагруженных слитым белком EGF
Для применения для исследования in vitro специфичной доставки к клеткам микровезикул, нагруженных слитым белком EGF, клеточную линию немелкоклеточного рака легкого человека A549 высевали с плотностью 2×104 клеток/лунка в планшеты с 24-ячейками, а затем инкубировали в течение 24 часов. В клетках A549 рецептор EGF в большом количестве присутствует на клеточной мембране.
Из протопластов E. coli или экспрессирующих EGF E. coli, полученных согласно примеру 10, получали микровезикулы с использованием способов, описанных в примерах 1 и 2. К микровезикулам, происходящим из протопластов E. coli, добавляли DiI (1,1'-диоктадецил-3,3,3'3'-тетраметилиндокарбоцианин перхлорат, Invitrogen, No. V22885) до конечной концентрации 5 мкМ и инкубировали при комнатной температуре в течение 30 мин. DiI представляет собой красный флуоресцентный краситель.
Клетки промывали два раза PBS и в каждую ячейку планшетов, где были посеяны клетки, добавляли 500 мкл среды, а затем инкубировали с 10 мкг/мл меченных DiI микровезикул в течение 20 мин.
Вновь, клетки промывали PBS и в каждую ячейку добавляли 500 мкл бессывороточной среды и раствора Cell Tracker до конечной концентрации 5 мкМ, а затем проводили инкубацию в течение 30 мин. Клетки вновь промывали PBS и инкубировали в течение 30 мин в 500 мкл дополненной сывороткой среды в каждой ячейке. Покровное стекло фиксировали при комнатной температуре в течение 10 мин 500 мкл 4% параформальдегида в каждой ячейке и наблюдали под конфокальным микроскопом. Микровезикулы, меченные DiI, при наблюдении выглядели красными флуоресцирующими при длине волны родамина, в то время как клетки с GFP визуализировались как зеленые флуоресцирующие при длинах волн FITC. Клетки и микровезикулы подсчитывали и вычисляли количество микровезикул на клетку. Результаты приведены на ФИГ.25.
Как можно видеть на ФИГ.25, количество микровезикул, которые связывались с клетками A549, составляло приблизительно 1,2 на клетку, когда они происходили из протопластов E. coli, лишенных EGF, но возрастало до приблизительно 7,9 на клетку, когда они происходили из протопластов E. coli, нагруженных EGF.
Эти результаты позволяют заключить, что нагруженные EGF микровезикулы могут селективно подвергаться слиянию с клетками, экспрессирующими рецепторы EGF на клеточной мембране, такими как A549.
Кроме того, проводили исследование, чтобы узнать, было ли связывание микровезикул с клетками следствием специфического взаимодействия EGF-рецептор EGF. Клеточную линию карциномы толстого кишечника мыши CT26 высевали с плотностью 2×106 клеток/ячейка в планшеты с 12 ячейками и инкубировали в течение 24 ч. CT26 экспрессирует рецептор EGF мыши на клеточной мембране, и он может связываться с EGF человека. Клетки промывали два раза PBS и в каждую ячейку добавляли 500 мкл среды, а затем проводили инкубацию с 100 нг/мл EGF в течение 30 мин, чтобы не осталось несвязанных рецепторов EGF. Избыток белков EGF смывали с помощью PBS и клетки инкубировали в течение 20 мин с 10 мкг/мл меченных DiI микровезикул.
Клетки вновь промывали PBS и инкубировали в течение 30 мин в 500 мкл среды, дополненной сывороткой, в каждой ячейке. Покровное стекло фиксировали при комнатной температуре в течение 10 мин 500 мкл 4% параформальдегида в каждой ячейке. Микровезикулы, меченные DiI, при наблюдении выглядели красными флуоресцирующими при длине волны родамина под флуоресцентным микроскопом.
Когда рецепторы EGF были уже оккупированы свободными белками EGF, как можно видеть на ФИГ.26, сигналы красной флуоресценции, указывающее на вхождение микровезикул в клетки, исчезали, в противоположность случаю, где рецепторы EGF не обрабатывали заранее свободными белками EGF.
Данные, полученные, как описано выше, указывают на то, что микровезикулы, нагруженные слитым белком EGF, могут специфично подвергаться слиянию с клетками, экспрессирующими рецептор EGF, через взаимодействие между EGF и рецептором EGF.
ПРИМЕР 16: Внутриклеточная передача сигнала микровезикул, нагруженных слитым белком EGF
Клеточную линию немелкоклеточного рака легкого A549 высевали с плотностью 1×105 клеток/ячейка в планшеты с 6 ячейками, а затем инкубировали в течение 16 ч. Клетки промывали два раза PBS и культивировали в течение 16 ч в бессывороточной среде. Затем клетки инкубировали в течение 10 мин с 10 мкг/мл микровезикул, нагруженных слитым белком EGF, или ненагруженных микровезикул, полученных согласно примеру 14. Клетки промывали A549 PBS и лизировали в 150 мкл M-PER (Pierce), содержавшем ингибитор фосфатаз, в каждой ячейке, чтобы получить лизаты цельных клеток.
После этого 20 мкг каждого из лизатов цельных клеток по отдельности смешивали с таким количеством 5× нагрузочного красителя, чтобы нагрузочный краситель был разбавлен до концентрации 1×. Смеси кипятили при 100°C в течение 5 мин и наносили на 10% полиакриламидный гель. После электрофореза при 80 В в течение 2 ч белки переносили на мембрану PVDF при 400 мА в течение 2 ч. Мембрану блокировали в течение 2 ч в 3% растворе обезжиренного молока в TBS. Мембрану обрабатывали при 4°C в течение 12 ч антителом против рецептора EGF, антителом против фосфор-рецептор EGF, антителом против Erk или антителом против фосфор-Erk, промывали два раза TBS, и подвергали реакции при комнатной температуре в течение 1 ч с конъюгированным с пероксидазой вторичным антителом. Ее вновь промывали в течение 30 мин TBS, а затем проводили визуализацию с помощью субстрата ECL. Результат представлен на ФИГ.27.
Как можно видеть на ФИГ.27, обработка микровезикулами, нагруженными слитым белком EGF, запускала каскад передачи сигнала EGF путем индукции фосфорилирования рецептора EGF, которое, в свою очередь, стимулирует нижерасположенный каскад передачи сигнала, например, фосфорилирование Erk. В качестве контролей использовали рецептор EGF и белок Erk.
Эти результаты позволяют заключить, что микровезикулы, нагруженные слитым белком EGF, могут связываться с рецептором EGF.
ПРИМЕР 17: Получение микровезикул, нагруженных как лекарственным средством против злокачественной опухоли, так и слитым белком EGF, и анализ in vivo селективной доставки
Микровезикулы, нагруженные слитым белком EGF, получали способом согласно примеру 14, и хорошо перемешивали и инкубировали при 4°C в течение 12 ч с 400 мкг/мл доксорубицина, лекарственного средства против злокачественной опухоли. После этого суспензию подвергали ультрацентрифугированию при 100000 × g в течение 2 ч. Осадок ресуспендировали в TBS с получением микровезикул, нагруженных доксорубицином.
Клеточную линию рака легкого человека A431, которая сверхэкспрессирует рецептор EGF, подкожно инъецировали в дозе 1×106 мышам и культивировали в течение 7 суток. Через семь суток после имплантации злокачественных клеток мышам через хвостовую вену инъецировали PBS, PBS, содержащий 50 мкг микровезикул, нагруженных доксорубицином, PBS, содержащий 50 мкг микровезикул, нагруженных как доксорубицином, так и слитым белком EGF, или PBS, содержащим 80 мкг доксорубицина. Ткань злокачественной опухоли вырезали из мышей через 6 часов после инъекции и фиксировали в течение 24 часов в 4% параформальдегиде. Для дегидратации фиксированную ткань злокачественной опухоли погружали один раз в 70% этанол, четыре раза в 95% этанол, три раза в 100% этанол, и три раза в 100% ксилол, каждый раз на один час во всех случаях. После этого ткани погружали в парафин, нарезали на срезы толщиной 4 мкм и закрепляли на предметном стекле. Парафин плавили путем инкубации при 60°C в течение одного ч. Для гидратации ткани погружали три раза в 100% ксилол, четыре раза в 100% этанол и три раза в 95% этанол, каждый раз на одну мин во всех случаях, а затем хранили в течение 5 мин в проточной воде.
После гидратации ткани подвергали иммуногистохимии. В связи с этим, проводили извлечение антигена с использованием микроволнового способа. Ткани помещали в 10 мМ натрий-цитратный буфер (Sigma, No.S4641) и облучали три раза, каждый в течение пяти минут, микроволнами. Ткани охлаждали поточной водой и блокировали в течение двух ч TBS (забуференный Tris солевой раствор), содержавшем 5% сыворотку лошади и 0,02% Triton X-100. Антитело (SantaCruz, No.SC1506), распознающее эндотелиальный маркер CD31, смешивали в соотношении 1:200 с TBS, содержащим 5% сыворотку лошади и 0,02% Triton X-100, а затем инкубировали при 4°C в течение 12 часов. Ткани промывали три раза TBS, содержавшим 0,02% Triton X-100, и инкубировали при комнатной температуре в течение 1 ч со вторичным антителом, конъюгированным с зеленым флуоресцентным Alexa 488. Их промывали три раза TBS, содержавшим 0,02% Triton X-100, и окрашивали в течение 10 мин 5 мкМ базовым красителем. Ткани промывали пять раз TBS и покровное стекло накладывали на предметное стекло и наблюдали под конфокальным микроскопом. На изображениях измеряли области, окрашенные зеленым цветом.
На ФИГ.28 представлены микроскопические изображения злокачественных тканей в группах мышей. Как можно видеть на ФИГ.28, доксорубицин наблюдали в злокачественной ткани, взятой от мышей, которым инъецировали микровезикулы, нагруженные как слитым белком EGF, так и доксорубицином, что указывает на то, что слитый белок EGF играет важную роль в селективной доставке доксорубицина в злокачественные клетки.
Взятые вместе, данные, полученные, как описано выше, демонстрируют, что микровезикулы, нагруженные слитым белком EGF, специфично нацелены на злокачественные клетки, экспрессирующие рецептор EGF.
ПРИМЕР 18: Способность микровезикул, нагруженных слитым белком EGF, индуцировать образование антитела
Микровезикулы, нагруженные слитым белком EGF, полученные с использованием способа, описанного в примере 14, внутрибрюшинно инъецировали мышам в дозе 20 мкг, причем PBS служил в качестве контроля. Через семь суток после инъекции проводили исследование образования антитела, специфичного к белку EGF. Из глаз мышей отбирали образцы крови, инкубировали при комнатной температуре в течение 30 мин, хранили при 4°C в течение 1 ч и центрифугировали при 1300 × g в течение 20 мин. Отбирали супернатанты, свободные от клеток.
Каждую лунку 96-луночных планшетов покрывали 50 нг белка EGF и блокировали в течение 2 ч 100 мкл 1% BSA/PBS. Супернатанты крови мыши разбавляли 1/1000, добавляли в каждую лунку и инкубировали при комнатной температуре в течение 2 ч, а затем проводили инкубацию с конъюгированным с HRP антителом против антител мыши в течение 1 ч. После промывания 0,05% Tween-20 в PBS проводили проявление цвета с помощью субстрата BM-POD.
На ФИГ.29 представлены величины RLU специфичного к EGF антитела. Величина RLU представляет собой относительное количество антитела, специфичного к EGFP. Как можно видеть на ФИГ.29, у мышей продуцировались антитела против EGF, когда им инъецировали происходящие из протопластов микровезикулы, нагруженные слитым белком EGF.
Эти результаты указывают на то, что, когда происходящие из протопластов микровезикулы, доставляют в клетки нагруженные на них вещества, нагруженные вещества, расположенные либо на поверхности, либо внутри микровезикул, могут действовать в качестве антигенов для стимуляции образования антител.
ПРИМЕР 19: Получение происходящих из бактериальных протопластов микровезикул, нагруженных слитым белком рецептора EGF
Белком рецептора EGF человека нагружали поверхность протопластов с использованием бактериального белка внутренней мембраны PrsA. Для этого использовали вектор pHCE-prsA, полученный согласно примеру 14, несущий ген, кодирующий полипептид, располагающийся с N-конца до положения 290 аминокислотной последовательности PrsA.
Для применения в слиянии с вектором pHCE-prsA, ген EGF человека амплифицировали с использованием праймеров, которые были синтезированы на основе последовательности оснований гена EGF человека, в которые были внесены определенные участки для ферментов рестрикции.
Прямой праймер: 5'-GCCTCTAGACTGGAGGAAAAGAAAGTTTGC-3'
Обратный праймер: 5'-CCAAGCTTCAGGACGGGATCTTAGGC-3'
(Буквы, указанные полужирным шрифтом, обозначают участки рестрикции XbaI и HindII)
ПЦР проводили на геномной ДНК клеточной линии немелкоклеточного рака человека A549 в присутствии праймеров, полученный таким образом продукт ПЦР очищали из полосы после ПЦР с использованием набора для очистки из геля Quiaquick gel purification kit. Очищенный продукт расщепляли при 37°C в течение 8 ч ферментами рестрикции XbaI и HindIII, и вновь очищали с помощью набора для очистки продуктов ПЦР Quiaquick PCR purification kit, а затем лигировали в вектор pHCE-prsA, расщепленный теми же ферментами. Полученный рекомбинантный вектор был назван "pHCE-prsA-EGFR".
После трансформации вектором pHCE-prsA-EGFR посредством теплового шока E. coli DH5α инкубировали при 37°C в течение 1 ч в 1 мл бульона LB и выращивали при 37°C в течение 16 ч на чашках с агаром LB, содержащим ампициллин. Из колоний, образовавшихся на чашках, одну отбирали и исследовали с помощью ПЦР колоний и картирования ферментами рестрикции в отношении того, содержала ли она pHCE-prsA-EGFR.
Из грамотрицательных бактерий E. coli, трансформированных вектором pHCE-prsA-EGFR, или бактерий, которые не были трансформированы, конструировали микровезикулы, нагруженные слитым белком EGF, или не нагруженные микровезикулы с использованием способов, описанных в примерах 1 и 2. После этого 20 мкг каждого из типов микровезикул по отдельности смешивали с таким количеством 5× нагрузочного красителя, чтобы нагрузочный краситель был разбавлен до концентрации 1×. Смеси кипятили при 100°C в течение 5 мин и наносили на 12% полиакриламидный гель. После электрофореза при 80 В в течение 2 ч белки переносили на мембрану PVDF при 400 мА в течение 2 ч. Мембрану блокировали при 4°C в течение 2 ч в 3% растворе обезжиренного молока в PBS. Мембрану обрабатывали при 4°C в течение 12 ч антителом против EGF, промывали два раза PBS, и подвергали реакции при комнатной температуре в течение 1 ч с конъюгированным с пероксидазой вторичным антителом. Ее вновь промывали в течение 30 мин PBS, а затем проводили визуализацию с помощью субстрата ECL. Результат представлен на ФИГ.30.
Как можно видеть на ФИГ.30, микровезикулы, сконструированные из протопласта бактерий, сверхэкспрессирующих слитый белок рецептора EGF, выявлялись с помощью антитела против рецептора EGF, в то время как слитый белок рецептора EGF не выявлялся в микровезикулах, сконструированных из протопластов бактерий, лишенных слитого белка рецептора EGF.
Этот результат указывает на то, что микровезикулы, нагруженные слитым белком рецептора EGF, были сконструированы правильно.
ПРИМЕР 20: Связывание EGF с происходящими из бактериальных протопластов микровезикулами, нагруженными слитым белком рецептора EGF
Конструировали микровезикулы, нагруженные слитым белком рецептора EGF, полученным согласно примеру 19, и не нагруженные микровезикулы. Каждую микровезикулу помещали в количестве 0, 25 или 100 нг/лунка в 96-луночные планшеты и инкубировали при комнатной температуре в течение 12 ч или более, так чтобы позволить им прикрепиться к лункам. Микровезикулы фиксировали в течение 1 ч в 100 мкл 1% BSA/PBS в каждой лунке, после чего добавляли конъюгированный с биотином EGF в количестве 100 нг/мл, и инкубировали в течение 2 ч. Планшеты промывали 0,05% Tween-20 в PBS, и обрабатывали стрептавидином-POD в течение 20 мин, а затем проводили проявление цвета с помощью субстрата BM-POD.
На ФИГ.31 представлены уровни EGF, связанного с микровезикулами, проанализированные в качестве величин RLU проявления цвета. Как понятно из данных ФИГ.31, более высокие величины RLU выявлялись в микровезикулах, нагруженных слитым белком рецептора EGF, связанных с EGF, по сравнению с микровезикулами, лишенными слитого белка рецептора EGF.
Эти результаты указывают на то, что микровезикулы, нагруженные слитым белком рецептора EGF, могут связывать EGF.
ПРИМЕР 21: Получение происходящих из бактериальных протопластов микровезикул, нагруженных слитым белком с His-меткой
Белком с His-меткой нагружали поверхность протопласта с использованием бактериального белка внутренней мембраны PrsA. Для этого вектор pHCE-prsA расщепляли ферментами рестрикции NdeI и HindIII при 37°C в течение 8 ч, и продукт расщепления очищали с использованием набора для очистки из геля Quiaquick gel purification kit, и встраивали в вектор pET-30a(+), несущий His-метку, который ранее был обработан теми же ферментами рестрикции. Полученный рекомбинантный вектор был назван "pET-30a(+)-prsA-His6".
После трансформации вектором pET-30a(+)-prsA-His6 посредством теплового шока, E. coli DH5α инкубировали при 37°C в течение 1 ч в 1 мл бульона LB и выращивали при 37°C в течение 16 ч на чашках с агаром LB, содержащим канамицин. Из колоний, образовавшихся на чашках, одну отбирали и исследовали с помощью ПЦР колоний и картирования ферментами рестрикции в отношении того, содержала ли она pET-30a(+)-prsA-His6. Плазмиду амплифицировали и получали из бактерий и трансформировали в E. coli BL21 посредством теплового шока. Трансформированные E. coli инкубировали при 37°C в течение 1 ч в 1 мл бульона LB, и выращивали при 37°C в течение 16 ч на чашках с агаром LB, содержащих канамицин. Одну из колоний, полученных таким образом, инокулировали в 5 мл бульона LB, и выращивали при 37°C до O.D600=0,4, и после этого клетки индуцировали при 37°C в течение 3 ч в присутствии 1 мМ IPTG для сверхэкспрессии слитого белка.
Из грамотрицательных бактерий E. coli, трансформированной вектором pET-30a(+)-prsA-His6, или бактерий, которые не были трансформированы, конструировали микровезикулы, нагруженные слитым белком с His-меткой, или ненагруженные микровезикулы с использованием способов, описанных в примерах 1 и 2. После этого 20 мкг каждого из типов микровезикул по отдельности смешивали с таким количеством 5× нагрузочного красителя, чтобы нагрузочный краситель был разбавлен до концентрации 1×. Смеси кипятили при 100°C в течение 5 мин и наносили на 12% полиакриламидный гель. После электрофореза при 80 В в течение 2 ч белки переносили на мембрану PVDF при 400 мА в течение 2 ч. Мембрану блокировали при 4°C в течение 12 ч в 3% растворе обезжиренного молока в PBS. Мембрану обрабатывали при комнатной температуре в течение 2 ч антителом против His-метки, промывали два раза PBS, и подвергали реакции при комнатной температуре в течение 1 ч с конъюгированным с пероксидазой вторичным антителом. Ее вновь промывали в течение 30 мин PBS, а затем проводили визуализацию с помощью субстрата ECL. Результат представлен на ФИГ.32.
Как можно видеть на ФИГ.32, микровезикулы, сконструированные из протопласта бактерий, сверхэкспрессирующих слитый белок с His-меткой, выявлялись с помощью антитела против His-метки, в то время как белок с His-меткой не выявлялся в микровезикулах, сконструированных из протопластов бактерий, лишенных слитого белка с His-меткой.
Из этого результата очевидно, что микровезикулы, нагруженные слитым белком с His-меткой, были сконструированы правильно.
ПРИМЕР 22: Доставка in vitro лекарственных средств бактериальными происходящими из протопластов микровезикулами и индукция гибели сосудисто-эндотелиальных клеток
В планшеты с 6-ячейками помещали покровное стекло, покрытое 0,1% желатином, а затем в них высевали HUVEC с плотностью 1×105 клеток/покровное стекло, а затем инкубировали в течение 16 ч. Клетки промывали два раза PBS и инкубировали в течение 24 ч в 2 мл среды на лунку, содержащей микровезикулы, происходящие из протопластов грамотрицательных бактерий, полученные согласно примерам 1 и 2, или микровезикул, происходящих из протопластов грамотрицательных бактерий, нагруженных доксорубицином, полученных согласно примеру 17, в концентрациях 0, 0,5, 1 или 2 мкг/мл. Вновь, клетки промывали PBS, и в каждую ячейку добавляли 2 мл бессывороточной среды, а затем проводили инкубацию в течение 30 мин с 5 мкм Cell Tracker. Вновь, клетки промывали PBS и инкубировали в течение 30 мин в 2 мл дополненной сывороткой среды в каждой ячейке. Покровное стекло фиксировали в течение 10 мин 2 мл 4% параформальдегида в каждой ячейке и наблюдали под конфокальным микроскопом. Живые клетки подсчитывали и результаты приведены на ФИГ.33.
На ФИГ.33, “% от контроля” на оси Y соответствует проценту количества клеток, являющихся живыми после обработки микровезикулами в каждой концентрации, относительно количества клеток, живых после обработки микровезикулами в концентрации 0 мкг/мл, как вычисляют по следующему уравнению:
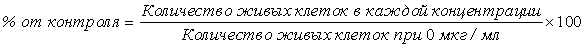
Более высокий процент от контроля при данной концентрации означает меньшую индукцию гибели клеток по сравнению с контролем, т.е. при 0 мкг/мл.
Как можно видеть на ФИГ.33, сами по себе микровезикулы, происходящие из бактериальных протопластов, не имели влияния на гибель клеток HUVEC, где нагруженные доксорубицином микровезикулы, происходящие из бактериальных протопластов, индуцировали гибель клеток HUVEC.
Эти результаты демонстрируют, что доксорубицин, которым нагружены происходящие из протопластов микровезикулы, доставлялся в клетки HUVEC и индуцировал их гибель.
ПРИМЕР 23: Индукция гибели клеток рака толстого кишечника in vitro с помощью происходящих из бактериальных протопластов нагруженных доксорубицином микровезикул
В планшеты с 24-ячейками помещали покровное стекло, покрытое 0,1% желатином, а затем в них высевали клеточную линию толстого кишечника мыши 26 с плотностью 2×104 клеток/покровное стекло, а затем инкубировали в течение 16 ч.
Клетки промывали два раза PBS и инкубировали в течение 24 ч в 500 мкл среды на лунку, содержащей микровезикулы, происходящие из протопластов грамположительных бактерий, полученные согласно примерам 1 и 2, или микровезикул, происходящих из протопластов грамположительных бактерий, нагруженных доксорубицином, полученных согласно примеру 17, в концентрациях 0, 1,25, 2,5 или 2 мкг/мл.
Вновь, клетки промывали PBS, и в каждую ячейку добавляли 500 мкл бессывороточной среды, а затем проводили инкубацию в течение 30 мин с 5 мкм Cell Tracker. Вновь, клетки промывали PBS и инкубировали в течение 30 мин в 500 мкл дополненной сывороткой среды в каждой ячейке. Покровное стекло фиксировали в течение 10 мин 500 мкл 4% параформальдегида в каждой ячейке и наблюдали под конфокальным микроскопом. Живые клетки подсчитывали, и результаты приведены на ФИГ.34.
На ФИГ.33 количества клеток, являющихся живыми после обработки микровезикулами при данных концентрациях, выражены в качестве процента от контроля, т.е. количества клеток, являющихся живыми после обработки микровезикулами в концентрации 0 мкг/мл, как вычисляют по следующему уравнению:
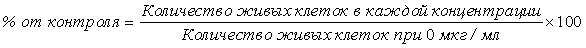
Как можно видеть на ФИГ.34 нагруженные доксорубицином происходящие из протопластов микровезикулы очень эффективно индуцировали гибель клеток рака толстого кишечника, по сравнению с собственно ненагруженными происходящими из протопластов миковезикулами.
Из этих результатов очевидно, что нагруженные доксорубицином происходящие из протопластов микровезикулы доставлялись в клетки рака толстого кишечника и индуцировали их гибель.
ПРИМЕР 24: Индукция гибели клеток злокачественной опухоли in vivo с помощью нагруженных доксорубицином происходящих из бактериальных протопластов микровезикул
Клеточную линию толстого кишечника мыши 26 подкожно инъецировали в дозе 1×106 клеток мышам и культивировали в течение 5 суток. После этого в хвостовую вену мышей инъецировали раствор PBS, содержащий 0 мкг, 1 мкг или 5 мкг нагруженных доксорубицином микровезикул, происходящих из протопластов грамотрицательных бактерий, полученных согласно примеру 17, в дозе 100 мкл два раза в неделю. Проводили мониторинг размеров злокачественной ткани, и результаты приведены на ФИГ.35. Объем злокачественной ткани определяли по уравнению v=ls2/2, где l представляет собой длину наиболее длинной оси опухоли и s представляет собой длину оси опухоли, перпендикулярной наиболее длинной оси.
Как можно видеть на ФИГ.35, более низкий рост злокачественной опухоли был выявлен у мышей, которым инъецировали микровезикулы, нагруженные доксорубицином, по сравнению с мышами, которым инъецировали только PBS, причем наименьший рост злокачественной ткани выявлялся при дозе нагруженных доксорубицином микровезикул, составляющей 5 мкг.
Этот результат указывает на то, что лекарственное средство против злокачественной опухоли доксорубицин может быть доставлено в злокачественные ткани с помощью происходящих из протопластов микровезикул.
Хотя предпочтительные варианты осуществления настоящего изобретения были описаны для иллюстративных целей, специалистам в данной области будут понятно, что возможны различные модификации, добавления и замены без отклонения от объема и сущности изобретения, как описано в прилагаемой формуле изобретения.
Промышленная применимость
Будучи происходящими из протопластов, сконструированных путем удаления клеточной стенки из бактерий, архей, грибов или клеток растений, микровезикулы по настоящему изобретению не запускают иммунный ответ сами по себе. Более того, происходящие из протопластов микровезикулы являются преимущественными в том, что их можно легко нагрузить терапевтическим и/или диагностическим веществом, или вакцинным веществом, и можно получать в крупном масштабе. Более того, если микровезикулы происходят из клетки, экспрессирующей терапевтическое, диагностическое и/или вакцинное вещество, они могут иметь промышленные и экономические преимущества, поскольку их можно получать без очистки вещества.
Реферат
Изобретение относится к области биохимии, в частности к способу получения микровезикул, происходящих из протопластов клеток Escherichia coli (Е. coli), включающему стадии: 1) удаление клеточных стенок из клеток Escherichia coli с получением протопластов; 2) конструирование микровезикул в суспензии протопластов; 3) выделение микровезикул. Также раскрыты способы получения микровезикул, нагруженных терапевтическими веществами, диагностическими веществами или вакцинными веществами, которые дополнительно включают стадию нагрузки или добавления вышеуказанных веществ. Изобретение позволяет получать микровезикулы для эффктивной доставки терапевтических, диагностических и вакцинных веществ в клетки-мишени и ткани-мишени. 3 н.п. ф-лы, 35 ил., 24 пр.
Формула
(a) удаление клеточных стенок из клеток Escherichia coli (Е. coli) с получением протопластов;
(b) конструирование микровезикул в суспензии протопластов, где конструирование включает цитолиз с использованием осмоса, электропорацию, обработку ультразвуковым излучением, гомогенизацию, обработку детергентом, замораживание-размораживание, экструзию, механическую деградацию и химическую обработку; и
(c) выделение сконструированных микровезикул из суспензии.
(a) нагрузка клеток Escherichia coli (Е. coli) терапевтическим, диагностическим или вакцинным веществами извне, а затем удаление клеточных стенок из клеток с получением протопластов;
(b) конструирование микровезикул в суспензии протопластов, где конструирование включает цитолиз с использованием осмоса, электропорацию, обработку ультразвуковым излучением, гомогенизацию, обработку детергентом, замораживание-размораживание, экструзию, механическую деградацию и химическую обработку; и
(c) выделение сконструированных микровезикул из суспензии.
(a) удаление клеточных стенок из клеток Escherichia coli (Е. coli) с получением протопластов;
(b) добавление терапевтических, диагностических или вакцинных веществ к суспензии протопластов для конструирования микровезикул, где конструирование включает цитолиз с использованием осмоса, электропорацию, обработку ультразвуковым излучением, гомогенизацию, обработку детергентом, замораживание-размораживание, экструзию, механическую деградацию и химическую обработку; и
(c) выделение сконструированных микровезикул из суспензии.

Комментарии