Способ лечения септического шока и применение мурамиловых соединений - RU2139086C1
Код документа: RU2139086C1
Чертежи












Описание
Настоящее изобретение относится к лечению и профилактике сепсиса, септического шока и других угрожающих жизни воспалительных состояний.
Смертность от системных бактериальных инфекций (бактериемии) является высокой, особенно при грамотрицательных инфекциях, при которых смертность все еще сравнима с той, что наблюдалась несколько десятилетий назад. Смертность при внутрибольничных инфекциях выше, чем при обычных; послеоперационные осложнения, связанные с бактериальной инфекцией, представляют реальную проблему во многих больницах по всему миру. Смертность при грамотрицательной бактериемии зачастую связана с септическим шоком.
Септический шок (известный также как токсический шок) является острым угрожающим жизни воспалительным состоянием, которое характеризуется гипотензией и/или симптомами недостаточной перфузии органов.
Гипотензия является результатом пониженного тонуса сосудов. Часто развиваются множественные органные нарушения и нарушения свертываемости крови.
В настоящее время лечение септического шока включает интенсивный гемодинамический мониторинг с массированным переливанием жидкости, если это необходимо для лечения гиповолемии, и введение инотропных препаратов, чтобы поднять давление крови путем увеличения сердечного выброса.
Некоторые из этих препаратов, в частности, норадреналин, вызывают также сужение сосудов и, таким образом, увеличивают сопротивление периферических сосудов. Часто требуются дополнительные поддерживающие мероприятия, включающие гемодиализ, искусственную вентиляцию легких и парентеральное питание. Основную инфекцию лечат антибиотиками и другими антибактериальными агентами.
Другие угрожающие жизни состояния воспалительной природы включают кахексию, которая является хроническим состоянием, вызываемым злокачественной опухолью или хроническими инфекциями, например, вирусом иммунодефицита человека. Кахексия характеризуется нарушенным липидным обменом, сопровождающимся гипертриглицеридемией, нарушенным обменом белков и глюкозы и потерей веса тела. Она также может сопутствовать системным бактериальным инфекциям.
Настоящее изобретение относится также к другим инфекциям и воспалительным состояниям, таким как пневмония, хирургическая раневая инфекция, нагноения в малом тазу, перитонит, перитонеальный абсцесс, параколостомический абсцесс, холангит, эмпиема желчного пузыря, флегмона передней брюшной стенки, флегмона сигмовидной кишки и постинъекционные абсцессы, а также к осложнениям, таким как эндотоксемия, снижение уровня глюкозы в крови, гипотензия, сердечная аритмия и вазодилятация.
В настоящее время существует множество эффективных антисептических агентов, доступных практикующему клиницисту. Антибиотики составляют важную подгруппу антибактериальных агентов. Антибиотики являются антибактериальными агентами, полученными из микроорганизмов; они включают пенициллины, стрептомицин, хлорамфеникол и хлортетрациклин.
Открытие и выделение пенициллинового ядра, 6-амино-пенициллановой кислоты (6-АПК) в 1958 году создало базу для синтеза большого количества новых пенициллинов, многие из которых до сих пор применяются в клинической практике. Другие антибактериальные агенты, помимо антибиотиков, также образуют основу для множества способов лечения: примеры включают сульфаниламиды и триметоприм, которые часто применяют совместно.
Поскольку частота возникновения угрожающих жизни воспалительных состояний, таких как септический шок, продолжает возрастать, становится очевидным, что существование большого количества лекарств, включая эффективные антибактериальные лекарства, не решает проблемы их лечения и профилактики.
В самом деле, эффективная антибактериальная химиотерапия может парадоксальным образом увеличивать вероятность возникновения септического шока и других осложнений: эндотоксин или его липополисахаридные фрагменты из стенок убитых бактериальных клеток могут служить медиаторами септического шока, возможно, приводя к увеличению уровня фактора некроза опухоли (ФНО), в частности, ФНО α.
Настоящее изобретение направлено именно на решение проблемы лечения и профилактики септического шока и других угрожающих жизни состояний воспалительной природы.
Было обнаружено, что группа мурамиловых пептидных соединений можно использовать для лечения и профилактики септицемии и септического шока. Некоторые мурамиловые дипептиды (МДП) были ранее описаны, как обладающие иммуностимулирующими, противоопухолевыми и некоторыми антибактериальными свойствами. Однако, было также обнаружено, что МДП являются синергистами эндотоксина (Parant, М. and Chedid, L "Various Aspects of Synergism between Endotoxin and MDP", Adv. Exptl. Med. Biol 256 537-547 (1990)) или, по меньшей мере, обостряют его действие (Langhans и др. Am. J. Physiol. 261 Р659 (1991)), поэтому едва ли можно ожидать, что они подходят для лечения состояний, о которых известно, что они опосредуются, по меньшей мере, частично, эндотоксином.
Более того, факт, что фармацевтическая пригодность, образующая основу настоящего изобретения, не может быть предсказана на основании антибактериального действия МДП, подтверждается наличием большого количества антибактериальных средств, не способных отвечать клиническим потребностям, в том, что касается борьбы с септическим шоком и другими, зачастую фатальными, воспалительными состояниями.
Настоящее изобретение основывается на открытии того факта, что, несмотря на то, что МДП обычно действуют как синергисты с липополисахаридами (ЛПС), вызывая воспаление и смерть, некоторые мурамиловые пептидные соединения способны противостоять активности эндотоксина in vitro и in vivo.
Следовательно, несмотря на ранее известные вышеприведенные сведения, некоторые, но не все, мурамиловые пептидные соединения являются полезными для лечения и профилактики септического шока и других опасных для жизни состояний воспалительной природы, которые опосредуются эндотоксинами, такими как ЛПС; и, кроме того, мурамиловые пептидные соединения настоящего изобретения могут быть без труда идентифицированы на основании рутинных тестов, без привлечения чрезмерно большой экспериментальной работы.
Давно известно, что неспецифическая стимуляция иммунной системы может быть достигнута путем воздействия на организм бактерий или компонентов бактериальной клетки. Специфические компоненты, обладающие такой активностью, были идентифицированы как сахарсодержащие пептиды клеточной стенки, а дальнейший биохимический анализ этих пептидов идентифицировал их как петидогликаны клеточной стенки. Самой маленькой эффективной синтетической молекулой оказался N-ацетилмурамил-L-аланил-D-изоглутамин (Merser и др. , Biochem, Biophys. Res. Comm. 66 1316 (1975)).
Способность этого соединения (упоминаемого часто как "прототип мурамилового дипептида" или "прототип МДП") защищать мышей от бактериальной инфекции (Klebsiella pneumonia) описана у Chedid и др., Proc. Natl. Acad. Sci. USA, 74 2089 (1977)).
Впоследствии был синтезирован целый ряд аналогов прототипа мурамилового дипептида, некоторые из которых предполагалось использовать в качестве терапевтических агентов для восстановления иммунной функции или неспецифической стимуляции иммунной системы. Эти аналоги и сам прототип МДП являются мурамиловыми пептидными соединениями.
Согласно одной особенности настоящего изобретения, раскрывается использование мурамилового пептидного соединения, которое:
(a) является непирогенным или обладает низкой
пирогенностью; и/или
(b) уменьшает эндотоксин-индуцированную потерю веса и/или гипофагию; и/или
(c) сокращает выработку ФНО; и/или
(d) стимулирует макрофаги к переработке
эндотоксина; для производства лекарственного средства для лечения или профилактики воспалительных состояний, опосредованных эндотоксином.
Этим эндотоксином обычно является ЛПС, хотя настоящее изобретение распространяется также на болезненные состояния, опосредованные другими эндотоксинами, например, вирусным или грибковым эндотоксинами.
Важно также то, что мурамиловые пептиды полезны для лечения пациентов с начавшейся септицемией. В свете известных свойств прототипа МДП такого открытия нельзя было предвидеть.
Особенно важным воспалительным состоянием, которое можно лечить или предотвращать с помощью МДП, является септический шок. Термин "мурамиловое пептидное соединение" ясен для специалистов. Конкретно, он относится к соединению, содержащему один или более остатков сахаров, один из которых часто является остатком мурамовой кислоты, замещенной одним или более (обычно двумя или более) аминокислотными остатками. Мурамиловые пептидные соединения могут являться пептидогликанами, способными усиливать клеточный антигенный ответ у млекопитающих и являющимися прототипом мурамилового дипептида (МДП) или его аналогами или производными.
Термин "непирогенный или обладающий низкой пирогенностью" относится к соединению, которое индуцирует повышение температуры тела у взрослого человека менее, чем на полградуса, после введения от 1 до 2 мг этого соединения.
В US 4357322 некоторые мурамиловые дипептиды предлагают для лечения воспаления. Однако перечень таких воспалительных состояний является весьма обширным, варьирующим от воспаления, вызванного небольшой раной, до аутоиммунных заболеваний, бактериальных, грибковых и вирусных инфекций и рака.
Какие именно воспалительные состояния можно эффективно лечить этими соединениями, из US 4357333 не ясно, и определенно отсутствует упоминание ЛПС-опосредованных воспалительных состояний. Более того, предпочтительными соединениями в этом документе являются мурамиловый дипептид, деметилированный мурамиловый дипептид и их производные; и было продемонстрировано, что, в противоположность тому, что было открыто в этом предшествующем документе, некоторые из этих соединений не только не облегчают ЛПС-опосредованного воспаления, а фактически обостряют его (Parant и др., Journal of Leukocyte Biology, 47, 164-169 (1990)).
Мурамиловые пептидные соединения, подходящие для целей настоящего изобретения, могут быть идентифицированы по некоторым их свойствам, о которых кратко сказано выше. Эти свойства, которые на самом деле могут иметь некоторые общие причинные связи, можно определить следующим образом.
Во-первых, мурамиловые пептидные соединения, подходящие для целей настоящего изобретения, могут быть непирогенными. Пирогенность можно легко измерить известными существующими методами. Если мурамиловое пептидное соединение-кандидат не дает статистически и физиологически значимого подъема температуры тела пациента и/или экспериментального животного, его можно отнести к достаточно непирогенным, чтобы отвечать требованиям настоящего изобретения. Прототип МДП является слишком пирогенным для использования в настоящем изобретении и поэтому по результатам этого теста отбраковывается.
Во-вторых, мурамиловые пептидные соединения, подходящие для целей настоящего изобретения, могут обладать способностью уменьшать ЛПС-индуцированную потерю веса и/или гипофагию, особенно если вводятся до введения ЛПС.
Во время течения сепсиса, и особенно септицемии и септического шока, наблюдается быстрая потеря веса. Этот эффект потери веса также можно продемонстрировать, подвергая животных воздействию эндотоксина, такого как ЛПС.
Лечение животных определенными мурамиловыми пептидными соединениями приводит к обострению эффекта ЛПС, вызывающего потерю веса, в то время как другие МДП мурамиловые пептидные соединения,
соответствующие требованиям настоящего изобретения, защищают животных от потери веса. Этот защитный эффект против физиологических последствий действия ЛПС позволяет быстро идентифицировать мурамиловые
пептидные соединения, которые могут быть полезны в клинике для лечения септического шока и других состояний, при которых эффект ЛПС физиологически значим
В основном, мурамиловые пептидные
соединения обладают одновременно как пирогенным, так и индуцирующим потерю веса эффектами. Сам прототип МДП усиливает активность ЛПС и, следовательно, приводит к увеличению потери веса животными
(Langhans и др., Am. J. Physiol 261 R659 (1991)).
Полагают, что индукция потери веса происходит частично благодаря гипофагическим эффектам этих соединений (т.е. уменьшенному приему пищи). Как прототип МДП, так и ЛПС обладают гипофагическим эффектом. Таким образом, можно ожидать, что мурамиловые пептидные соединения не подходят для целей лечения состояний, при которых в крови циркулирует ЛПС (например, сепсиса).
Вследствие этого наблюдения и их относительной пирогенности, мурамиловые пептидные соединения не нашли применения в лечении сепсиса. В настоящем исследовании показано, что некоторые аналоги МДП обладают противоположным ожидаемому эффектом; т. е. они смягчают действие ЛПС, в противоположность прототипу МДП (Langhans и др., 1991). Помимо этого, это наблюдение создает удобную основу для определения мурамиловых пептидных соединений, соответствующих целях настоящего изобретения. Соответствующий протокол экспериментального исследования прилагается.
Было сформировано четыре группы по шесть животных каждая, из крыс линии Wistar-Porton, весящих 80-100 г. Животных содержали поодиночке в стандартных условиях и кормили вволю стандартным рационом для крыс и мышей. 1-я группа животных получала мурамиловое пептидное соединение в подходящей дозе (такой как 150 мкг/кг в день) в течение определенного промежутка времени (например, 7 дней), под постоянным наблюдением. 2-я группа животных получала то же тестируемое соединение, что и группа 1 (150 мкг/кг в день в течение 7 дней) и липопосисахарид (ЛПС) в определенной дозе (такой как 3 мкг/кг) в течение определенного времени (например, 6 или 7 дней). 3-я группа животных получала физиологический раствор. 4-я группа получала физиологический раствор, как группа 3, и ЛПС, как группа 2. Вес животных постоянно фиксировался.
Соединениями, соответствующими требованиям настоящего изобретения, являются те из них, которые при оптимальной дозе приводят к статистически значимому уменьшению ЛПС-идуцированной потери веса. Например, при испытании глюкозаминилмурамил дипептида (ГМДП), соединения, полезного для целей настоящего изобретения, как будет описано ниже, получены результаты потери веса, приведенные на фиг. 1, показывающем конечный вес животных каждой из 4 групп; статистически значимое улучшение приводится (P < 0,032 при сравнении групп 2 и 4; P < 0,001 при сравнении групп 3 и 4).
Соединениями, подходящими для целей настоящего изобретения, могут быть те из них, которые в подходящей дозе приводят к статистически значимому улучшению ЛПС-индуцированной гипофагии. Например, при испытании вышеприведенным тестом ГМДП, получены результаты по гипофагии, приведенные на фиг. 2, показывающем количество съеденной пищи в каждой группе; наблюдалось статистически значимое улучшение (P < 0, 04 при сравнении групп 2 и 4; P < 0,001 при сравнении групп 3 и 4).
В-третьих, мурамиловые пептидные соединения, соответствующие целям настоящего изобретения, могут обладать способностью предотвращать или уменьшать, в статистически и физиологически значимой степени, выработку фактора некроза опухоли (ФНО) у пациентов или животных, подвергаемых воздействию ЛПС. На основе этого исследования также основывается простая процедура скрининга соединений.
В-четвертых, мурамиловые пептидные соединения, соответствующие требованиям настоящего изобретения, могут обладать способностью стимулировать, в статистически и физиологически значимой степени, макрофаги к переработке ЛПС. На этой основе также может быть создана простая процедура скрининга подходящих соединений.
Большое количество мурамиловых пептидных соединений, подходящих
для целей настоящего изобретения, обладают общей формулой I

где R1 представляет атом водорода или C1-C22 ацильную группу;
R2 представляет атом водорода или C1-C22 ацильную группу;
R3 представляет атом водорода или C1-C6 алкильную группу;
R4 представляет C1-C21 алкильную группу или C6 или C10 арильную группу;
R5 представляет атом водорода; и
R представляет остаток аминокислоты или линейный пептид, построенный из 2-6 аминокислотных остатков по крайней мере один из этих остатков необязательно может быть замещен на липофильную группу; иной, чем у прототипа мурамилового дипептида и деметилированного мурамилового дипептида.
Предпочтительными ацильными группами для R1 и R2 являются C1-C5 ацильные группы, такие как ацетил; нужно иметь в виду, что указанное количество атомов углерода не включает в себя карбонильную группу. Предпочтительными алкильными группами для R3 являются C1-C4 алкильные группы, такие как метил и этил. Предпочтительными алкильными группами для R4 являются C1-C6 алкильные группы, в частности, C1-C4 алкильные группы, такие как метил или этил; фенил является предпочтительной арильной группой.
R предпочтительно представляет моно-, ди- или трипептид. Проксимальный остаток пептида (или единственный, если он только один) предпочтительно является аминокислотой.
Примеры
включают:
L-аланил
L-валил
L-лейцил
L-изолейцил
L-α-аминобутирил
L-серил
L-треонил
L-метионил
L-цистеинил
L-фенилаланил
L-тирозил
L-триптофанил
L-лизил
L-орнитил
L-аргинил
L-гистидил
L-глутамил
L-глутаминил
L-аспартил
L-аспарагинил
L-пропил
L-гидроксипропил
L-аланил и L-треонил являются предпочтительными.
Следующий аминокислотный остаток от проксимального конца пептида предпочтительно имеет D-конфигурацию. Предпочтительно он имеет кислотную природу и может являться D-глутаминовой или D-аспарагиновой кислотой или моно-, ди- или смешанным C1-C22 (предпочтительно C1-C6) алкиловый эфиром, амидом или C1-C4 алкиламидом (выражение "смешанный" означает, например, соединение, в котором одна карбоксильная группа амидирована, а другая этерифицирована). Предпочтительными являются D-изоглутамин и D-глутамат.
Третий от проксимального конца цепи предпочтительно имеет L-конфигурацию, как обозначено выше по отношению к проксимальному аминокислотному остатку. Предпочтительными являются L-аланил и L-лизил.
Аминокислотный остаток или линейный пептид факультативно замещен по меньшей мере одной липофильной группой. Липофильной группой может являться C10-C22 ацильная группа, такая как стеароил или ди-(C10 -C22 ацил)- sn-глицеро-3'-гидрокси-фосфоферил-окси-группа, в которой, например, каждая из C10-C22 ацильных групп может быть пальмитоильной группой.
Липофильной группой может являться альтернативно (или в добавление, поскольку может быть больше одного заместителя) C1-C10 сложноэфирная группа, такая как C2-C6 сложноэфирная группа: примером является бутиловый эфир.
Примеры мурамиловых дипептидов с общей формулой l включают:
муростазин, также известный как МДП-Лиз (L-18)
(N2-(N-ацетилмурамил-L-аланил-D-изоглутаминил)-N6-стеароил-L- лизин);
МТП-ПЭ (N-ацетилмурамил-L-аланил-D-изоглутаминил-L- аланил-2-(1',
2'-дипальмитоил-sn-глицеро-3'- гидроксифосфорилокси)этиламид, однонатриевый);
мурабутид (N-ацетилмурамил-L-аланил-D-глутамин- α -N- бутиловый эфир); и
t-МДП
(N- ацетилмурамил-L-треонил-D-изоглутамин).
Приготовление муростазина раскрыто в ЕР-A-0021367 и US-A-4317771.
Изготовление МТП-ПЭ раскрыто в EP-A-0025495. Приготовление мурабутида описано у Lefrancier и др., J. Med. Chem., 25 87 (1982). Получение t-МДП осуществляется известными стандартными способами.
Патентные публикации, дающие подробное описание получения мурамиловых пептидных соединений включают BE- A-0834753, BE-A-0834754, BE-A-0847103, BE-A-0849214, DE-A-2710455, DE-A-2922533, DE-A-2747379, DE-A-2912865, FR-A-2355505, FR-A- 2358159, FR-A-2375249, EP-A-0004512, EP-A-0002677, JP-A-54063016, JP-A-54073729, JP-A-55019236, US-A-4082735, и USA-4082736.
Получение прототипа мурамилового дипептида раскрыто в DE-A-2450355 и US-A-4235771.
Не все мурамиловые дипептиды, подходящие для целей настоящего изобретения, подпадают под общую формулу I. Многие из них обладают общей формулой II, которая представляет
наиболее предпочтительную группу соединений для применения в настоящем изобретении:

где R представляет остаток аминокислоты или линейный пептид, построенный из 2-6 аминокислотных остатков, из которых по крайней мере один необязательно замещен липофильной группой; и n равно 1 или 2.
Предпочтительные варианты для R описаны выше для общей формулы 1. В частности, предпочтительно, чтобы пептид R соответствовал пептиду в прототипе МДП (L-Ала-D-изо-Глн). Напротив, в другом предпочтительном варианте осуществления изобретения, R может представлять L-Ала-D-Глу. Предпочтительное значение n равно 1.
Соединения общей формулы II раскрываются в US- A-4395399, и предпочтительные варианты, описанные в нем, в равной мере являются таковыми и в настоящем изобретении. В добавление, в настоящем изобретении группа R может быть липофильной группой, как описано выше.
Одно из наиболее предпочтительных соединений для применения в настоящем изобретении подпадает под общую формулу II и является N-ацетил- D-глюкозаминил- ( β 1-4)-
N-ацетилмурамил-L-аланил-D-изоглутамином (ГМДП), имеющим следующее строение:

Это соединение (Соединение II в US-A-4395399) также известное как гликопин, уже прошло преклиническое испытание на токсичность и фармакокинетические исследования, требующиеся для разрешения на клиническое применение в СССР (который существовал в то время). Острая токсичность на мышах, выраженная в LD50 составила 7 г/кг. Эта величина свидетельствует о том, что соединение почти на порядок менее токсично, чем муростазин, у которого LD50 на мышах составляет 625 мг/кг.
Поскольку пирогенность ГМДП достаточна мала, чтобы признать его соответствующим целям настоящего изобретения,
и не мешает его клиническому применению для других целей, при некоторых обстоятельствах может быть предпочтительным использование еще менее пирогенного его аналога. Такой аналог существует, это
-N-ацетил-D-глюкозаминил-(β1-4)- N-ацетилмурамил-L-аланил-D-глутаминовая кислота (ГМДП-К), или соединение III по US-А-4395399, имеющее следующее строение:

Другие предпочтительные соединения, подпадающие под общую формулу II, включают:
N-ацетил-D-глюкозаминил-( β 1-4)-N-ацетилмурамил-L-аланил-L- изоглутамин (ГМДП-LL) имеющий следующее строение:

N-ацетил-D-глюкозаминил-( β1-4)-N-ацетилмурамил-L- аланил-D-глутамин n-бутиловый сложный эфир (ГМДП-ОБу), имеющий следующее строение:

N-ацетил-D-глюкозаминил-( β1-4)-N-ацетилмурамил-L- аланил-D-изоглутаминил-L-лизин(ГМДП-Лиз), имеющий следующее строение:

N-[ Nα-ацетил-D-глюкозаминил-( β 1-4)-N-ацетилмурамил- L-аланил-D-изоглутаминил]-N∈-стеароил-L-лизин (ГМДП-Лиз (Ст)), имеющий следующее строение:

Другие полезные соединения включают:
Nα-[N-Ацетил-D-глюкозаминил-( β1-4)-N-ацетилмурамил- L-аланил-γ-D-глутамил]-N∈стеароил-L-лизин, имеющий следующее строение (ГМДПК-Лиз (Ст))

N-Ацетил-D-глюкозаминил-(1-4)-N-ацетилмурамил-L-аланил-D-глутаминовой кислоты дибензиловый сложный эфир, имеющий следующее строение:

N-Ацетил-D-глюкозаминил-( β1-4)-N-ацетилмурамил-N- метил-L-аланил-D-изоглутамин, имеющий следующее строение

N-Ацетил-D-глюкозаминил-(β1-4)-N-ацетилмурамил- ( β1-4)-N-ацетил-D-глюкозаминил-( β 1-4)- N-ацетилмурамил-бис-(L-аланил-D-изоглутамин), имеющий следующее строение:

N-Ацетил-D-глюкозаминил-( β 1-4)-N-ацетилмурамил-( β 1-4)-N-ацетил -D-глюкозаминил-( β 1- 4)-N-ацетилмурамил-бис- (L-аланил-D-глутаминовая кислота), имеющая следующее строение:
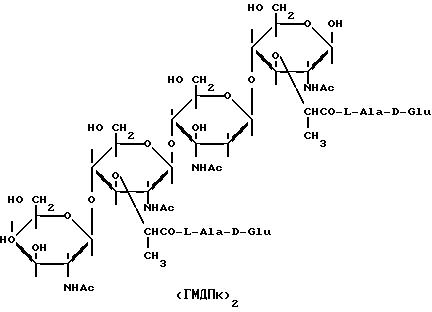
N-Ацетил-D-глюкозаминил-( β 1-4)-N-ацетилмурамил- ( β 1-4)-N-ацетил-D-глюкозаминил-( β 1-4)-N- ацетилмурамил-бис-(L-аланил-D-изоглутаминил-L-лизин), имеющий следующее строение:

N-ацетил-D-глюкозаминил-( β 1-4)-N-ацетилмурамил- ( β 1-4)-N-ацетил-D-глюкозаминил-( β 1-4)- N-ацетилмурамил-бис-[L-аланил-D- изоглутаминил-N∈-стеароил-L-лизин]:

N-Ацетил-D-глюкозаминил- ( β 1- 4)-N-ацетилмурамил-L-аланил-D-изоглутамин 1-адамантиловый сложный эфир, имеющий следующее строение:

L-Треонил-N∈-[N-ацетил-D-глюкозаминил-( β 1-4)-N-ацетилмурамил-L-аланил-γ-D-изоглутаминил] - L-лизил-L-пролил-L-аргинин, имеющий следующее строение:

N-Ацетил-D-глюкозаминил-(β 1-4)-N-ацетилмурамил-L-аланил-γ-D-изоглутаминил-L-треонил-L-лизил- L-пролил-L-аргинин, имеющий следующее строение:

N-Ацетил-D-глюкозаминил-( β 1-4)-N-ацетилмурамил- L-аланил-α-D-глутамил-L-лизил-L-треонил-N∈-стеароил-L-лизил-L-пролил-L-аргинин, имеющий следующее строение:
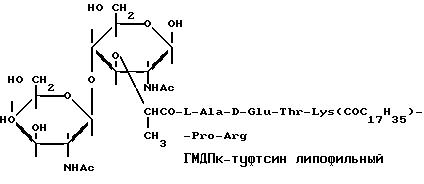
N∈-[N-Ацетил-D-глюкозаминил-(β 1-4)-N-ацетилмурамил-L-аланил-γ-D-изоглутаминил]-L-лизил-L-гистидил-L-глицин амид, имеющий следующее строение:

N-Ацетил-D-глюкозаминил-( β 1-4)-N-ацетилмурамил-L-аланил-D-изоглутаминил-L-глутамил-L-триптофан, имеющий следующее строение:

N-Ацетил-D-глюкозаминил-( β 1-4)-N-ацетилмурамил- L-аланил-D-изоглутаминил-ε -аминогексаноил-L-глутамил-L-триптофан, имеющий следующее строение:

Nα -[N-Ацетил-D-глюкозаминил-(β 1-4)-N-ацетилмурамил- L-аланил-D-изоглутаминил] -N∈-стеароил-L-лизил-L-глутамил-L-триптофан, имеющий следующее строение:

N-Ацетилмурамил-L-треонил-D-изоглутамин, имеющий следующее строение:

N-Ацетилмурамил-L-аланил-D-глутамин n-бутиловый сложный эфир, имеющий следующее строение:

В вышеприведенных формулах использованы следующие аббревиатуры:
Br1-бензил
Me-метил
Ahx-аминогексаноил.
Наиболее предпочтительными являются (по убывающей) ГМДП, ГМДП-К и мурабутид.
Глюкозаминил-мурамиловые дипептиды с общей формулой II могут быть приготовлены относительно дешево и в достаточных количествах посредством методики, описанной в US-А-4395399. Раскрытый способ приготовления основан на экстракции и очистке дисахаридного компонента из бактерий Micrococcus lysodecticus и их последующем химическом присоединении к дипептиду, синтезированному, например, посредством стандартного химического синтеза пептидов. Тем не менее, дисахарид также можно синтезировать, используя стандартный химический синтез сахаров.
Как уже было сказано, с помощью настоящего изобретения мурамиловые дипептиды являются полезными при лечении и профилактике септического шока и/или других опасных для жизни воспалительных состояний, опосредованных ЛПС, включая кахексию.
Настоящее изобретение, в частности, применяется для лечения и предотвращения осложнений, вызываемых бактериальной инфекцией, после хирургических вмешательств, особенно на брюшной полости, из-за возможности попадания кишечной флоры в брюшинную полость. Существует также риск инфекции и после других видов хирургических вмешательств, например при торакальной хирургии или операции по удалению желчного пузыря. В добавление, бактериальный сепсис и, в конечном итоге, септический шок могут возникать вследствие хронических или острых бактериальных инфекций органов, таких как легкие или органы мочеполовой системы, вследствие пневмонии, перфорированной язвы, панкреонекроза или воспаления желчного пузыря.
Таким образом, состояния, при которых можно применять настоящее изобретение, включают пневмонию, хирургическую раневую инфекцию, нагноения в малом тазу, перитонит, перитонеальный абсцесс, холангит, эмпиему желчного пузыря, флегмону передней брюшной стенки, флегмону сигмовидной кишки и постинъекционные абсцессы, а также связанные с ними осложнения в виде эндотоксемии, падения содержания глюкозы в крови, гипотензии, сердечной аритмии и вазодилятации.
В особенности настоящее изобретение касается хирургических вмешательств у пациентов с недостаточностью иммунной системы, поскольку эти пациенты особенно подвержены риску развития инфекций и понижения количества лимфоцитов и нейтрофилов.
Мурамиловые дипептиды настоящего изобретения могут принести дополнительную пользу этим пациентам, благодаря их иммуностимулирующему действию на нейтрофилы и лимфоциты, а также защитному действию в отношении эндотоксинов. Пациенты с иммунодефицитом включают онкологических больных, поскольку наличие опухоли с большой вероятностью приводит к подавлению иммунной системы. Кроме того, как химиотерапия, так и радиотерапия также приводят к подавлению иммунных функций.
Из всего вышесказанного видно, что настоящее изобретение относится также к способу лечения и профилактики септического шока и/или других угрожающих жизни состояний воспалительной природы, опосредованных эндотоксинами, такими как ЛПС; этот способ включает в себя введение пациенту эффективного количества мурамилового дипептида. Предпочтительные соединения для этой цели настоящего изобретения приведены выше.
Мурамиловые пептидные соединения настоящего изобретения можно вводить как парентерально, так и другими путями. Наиболее распространенным, и, разумеется, предпочтительным путем введения, является оральный путь, но другие непарентеральные пути включают назальное или буккальное введение или введение посредством ингаляции.
Препараты для парентерального введения обычно должны быть стерильными. Может присутствовать один или более подходящих носителей, таких как физиологический раствор. Мурамиловые пептидные соединения можно подвергать лиофилизации с защитным веществом, таким как глицин, до внесения его в физиологический раствор или воду для инъекций.
Мурамиловое пептидное соединение настоящего изобретения может являться единственным активным ингредиентом в фармацевтической композиции. Иногда может возникать потребность в присутствии и других активных ингредиентов. Например, могут присутствовать антибиотики или другие антибактериальные агенты, если опасно для жизни воспалительное состояние имеет бактериальную этиологию; другие микробные или вирусные воспалительные заболевания будут лечить другими антимикробными или противовирусными препаратами; в случае злокачественных опухолей могут присутствовать противораковые агенты, такие как винбластин, адриомицин, актиномицин Д, метотрексат и митомицин C.
Предпочтительными являются оральные рецептуры, в частности, в форме таблеток. Может присутствовать один (или более) подходящий носитель. Носители включают лактозу, сахарозу, картофельный крахмал, стеарат кальция и метилцеллюлозу.
Точная дозировка для введения всегда будет такой, которая признана целесообразной лечащим врачом. Принимая во внимание это обстоятельство, суточная доза варьируется от 0,1 до 100 мг (или на таблетку или другую разовую форму), предпочтительно - от 0,5 до 5 мг или 10 мг в день (или на таблетку или другую разовую оральную форму). Суточная доза в 1-2 мг признана оптимальной.
Дозы для парентерального введения обычно ниже (например, для внутривенного, внутримышечного или подкожного), от 0,01 до 1 мг в день (или на разовую дозу). Предпочтительны дозы в 0,05-0,5 мг в день (или на разовую дозу); оптимальной признана доза примерно 0,1 мг в день.
Время введения дозы также лучше прочих определит лечащий врач. В случае профилактики септического шока и других воспалительных состояний, которые могут возникнуть вследствие хирургических вмешательств, преимуществами обладает введение препаратов до операции.
В добавление, эти соединения можно также применять у больных, не подвергающихся хирургическому вмешательству, с целью снижения септических осложнений и смертности.
Настоящее изобретение будет далее проиллюстрировано следующими нелимитирующими примерами и чертежами.
Фиг.1 показывает эффект МДП на ЛПС-индуцированную смертность мышей;
Фиг. 2 показывает эффекты мурамиловых пептидов на фагоцитическую
активность макрофагов;
Фиг. 3 показывает эффекты мурамиловых пептидов на выработку ФНО в культуре цельной крови;
Фиг. 4 показывает подавление выработки ИЛ-1 МДП;
Фиг. 5
показывает эффекты МДП на ЛПС индукцию сывороточного ФНО;
Фиг. 6 показывает способность мурамиловых пептидов подавлять выработку ФНО α .
Фиг. 7 показывает эффект
мурамиловых пептидов на потерю веса, индуцированную ЛПС; и
Фиг. 8 показывает эффект мурамиловых пептидов на потерю веса, индуцированную ЛПС.
Пример 1
Применение
N-ацетил-глюкозаминил-N-ацетил- мурамил-L-аланил-D-изоглутамина (ГМДП) для профилактики послеоперационных осложнений, вызванных бактериальной инфекцией, с целью поддержки функции нейтрофилов и, в
конечном итоге, снижения смертности пациентов, подвергающихся оперативному вмешательству по поводу рака толстой кишки.
Всем пациентам предстояло подвергнуться обширному оперативному вмешательству по поводу карциномы толстой кишки.
Перед операцией (за 3 дня) у всех пациентов проверялась функция нейтрофилов в серии тестов.
Нейтрофилы выделяли из периферической крови. 3,5 мл гепаринизированной крови распределяли в среде M-PRM (Flow Laboratiries) и центрифугировали 40 мин, при 400g при 20oC. Нижняя промежуточная фаза, содержащая до 97% нейтрофилов удалялась, а клетки отмывали трижды сбалансированным солевым раствором Хенка. Жизнеспособность лейкоцитов (Трипановый синий) составляла не менее 98%. Клетки доводили до концентрации 2•106 в мл.
Измеряли следующие параметры:
- Адгезия: 100 мкл суспензии нейтрофилов помещали в лунки плоской культуральной чашки и инкубировали при 37oC в течение 60 мин. После отмывания незакрепившихся клеток, прикрепившиеся нейтрофилы фиксировали этанолом и окрашивали по Романовскому-Гимзе. После отмывания лишней краски, связанную с
клетками краску растворяли в изопропаноле и определяли оптическую плотность (ОП650) раствора с использованием микропроцессора "ELISA II" (Boehringer). Количество прикрепившихся клеток подсчитывали с
помощью стандартной кривой.
- Хемилюминесценция: Люминол-зависимую хемилюминесценцию измеряли на люминометре 1251 (LKB).
- Супероксид анион: Выработку супероксид аниона определяли с помощью теста NBT (Merck).
- Миелопероксидаза: 100 мкл субстратной смеси, состоящей из 0,04% ОРТО фенилендиамина (Sigma) и 0,014% пероксида водорода в фосфатно-цитратном буфере (pH 5,0), добавляли к клеткам и инкубировали 10 минут, после чего реакцию останавливали 100 мкл 10% серной кислоты. Оптическую плотность измеряли на 492 mu с помощью Multiscan Titertek Plus (Flow Laboratories).
- Кислая фосфатаза: 50 мкл субстратной смеси, состоящей из 0,24% паранитрофенилфосфата (Boehring) и 0,84% NaCI в натриевом цитратном буфере (pH 5,5) добавляли к клеткам и инкубировали 30 минут при 30oC, после чего реакцию останавливали прибавлением 100 мкл 0,2 М NaOH. Оптическую плотность определяли на 405 mu с помощью Multiscan Titertek Plus (Flow Laboratories).
Для хемилюминесценции, выработки супероксид аниона, миелопероксидазы и кислой фосфатазы измерялась как спонтанная, так и индуцированная реакция. Индукция выполнялась путем экспозиции клеток с опсонизированным зимозаном (30 мкл, 20 мг/мл) в течение 30 минут при 37oC перед анализом.
В экспериментальной группе ГМДП давали per os за два и за один день до операции, вводили подкожно на 1, 2 и 3 день после операции в дозе 1-2 мг в день. Общая доза ГМДП составила 3-7 мг. На пятый день после операции у всех пациентов определяли функцию нейтрофилов по всем параметрам, описанным выше.
Пациентов наблюдали на наличие послеоперационного сепсиса в течение четырех недель после операции. Септические осложнения, наличие или отсутствие которых наблюдали, включали диссеминированный сепсис, пневмонию, перитонит и абдоминальный абсцесс, о которых известно, что все они способны вызвать септический шок. Результаты представлены в табл. 1 и 2 (см. в конце описания).
Из таблицы 1 видно, что лечение ГМДП снижало частоту септических осложнений с 50% до 18,75%. Очень важно, что снижение смертности с 15% до 6,25% указывает на эффективность лечения или профилактики септического шока, который часто является причиной смерти в этих случаях.
Из данных таблицы 2 следует, что в контрольной группе наблюдалось уменьшение большинства параметров нейтрофильной функции после операции. В случае адгезии, хемилюминесценции и выработки супероксида, лечение ГМДП предотвращало из уменьшение, и, напротив, усиливало функцию нейтрофилов. Это явление не наблюдалось для миело-пероксидазы и кислой фосфатазы.
Пример 2
Применение
N- ацетил- глюкозаминил-N-ацетил- мурамил-L-аланил-D-изоглутамина (ГМДП) для приостановки развития острого сепсиса и поддержания функции нейтрофилов у пациентов, страдающих острым сепсисом.
В этом исследовании все пациенты уже страдали тяжелым системным бактериальным сепсисом, развившимся в результате деструктивного холецистита, абсцессов брюшной полости, перитонита, панкреонекроза и послеоперационной пневмонии.
За один день до начала лечения ГМДП (день-1) у всех пациентов определяли функцию нейтрофилов с помощью тестов, описанных выше в примере 1. ГМДП вводили парентерально в дозе 1-2 мг в день пять дней подряд. Общая доза составила 5-7 мг.
День спустя после прекращения лечения ГМДП (день +6) снова определяли функцию нейтрофилов у всех пациентов. Результаты представлены в табл. 3 и 4 (см. в конце описания).
Как видно из таблицы 3, лечение ГМДП снижало частоту прогрессирования септических осложнений с 61% до 28, 6%. И снова, снижение смертности с 27% до 14,3% продемонстрировало эффективность настоящего изобретения.
Из таблицы 4 следует, что в контрольной группе наблюдалось ухудшение почти всех параметров нейтрофильной функции за период времени от дня -1 до дня +6, а вследствие лечения ГМДП ухудшение предотвращалось и наступало улучшение.
Этот пример ясно демонстрирует, что ГМДП является эффективным лекарственным средством, даже если сепсис уже развился. В то же время, хотя прототип МДП обладает антибактериальной активностью, он не будет снижать смертность в условиях этого эксперимента.
Пример 3
Эффекты МДП на ЛПС-индуцированную смертность мышей
25 мышей линии BALB/c, самок с весом 16-18 г, разделили на 5 групп по пять животных.
Каждая группа получала дважды в день дозы физиологического раствора, ГМДП, ГМДП-ОБу, МДП или ГМДП-К. Соединения вводили интраперитонеально дважды в день в дозах 100 мкг или молярный эквивалент на мышь
в течение 9 дней перед тем, как вводить 300 мкг ЛПС на мышь.
Смертность определяли 2 дня спустя введения ЛПС: результаты представлены на фиг. 1. Фиг. 1 показывает, что определенные типы мурамиловых пептидов, такие как прототип МДП, действуют как синергисты с ЛПС, вызывая увеличение смертности по сравнению с группой мышей, получавших физиологический раствор. Напротив, ГМДП и ГМДП-К противостояли действию ЛПС.
Таким образом, ГМДП и ГМДП-К будут полезны для лечения и профилактики сепсиса и септического шока, в то время как МДП и ГМДП-ОБу не подходят для этих целей.
Пример 4
Эффекты мурамиловых пептидов на фагоцитарную активность макрофагов
В этом эксперименте мы попытались продемонстрировать эффект различных МДП на
фагоцитарную активность макрофагов; чем выше фагоцитарная активность, тем более эффективен МДП в повышении резистентности к ЛПС.
Мышей разделили на 9 групп, каждая из которых получала одно из следующих соединений: физиологический раствор, МДП, МДП-ОБу, МДП-Тре, ГМДП, МДП-Лиз(Ст), ГДМП-ОН и ГДМП-LL.
Испытуемое соединение вводили в перитонеальную полость мышей по 100 мкг или эквимолярную эквивалентную дозу на каждое животное. Контрольные животные получали по 200 мл физиологического раствора. Через день после инъекции мурамилового пептида животным вводили интраперитонеально летальную дозу ЛПС (300 мкг на животное) в 200 мкг физиологического раствора, а спустя 20 минут также интраперитонеально вводили по 1 мл черных чернил. Через десять минут брали перитонеальные макрофаги и дважды их отмывали. Подсчитывали количество клеток, затем макрофаги лизировали и определяли оптическую плотность надосадочной жидкости на 610 нм.
Результаты представлены на фиг. 2, откуда видно, что ГМДП увеличивал активность макрофагов, и остальные МДП также обладали этой способностью. Считается, что возросшая фагоцитарная активность макрофагов будет коррелировать со способностью животных справляться с бактериями и ЛПС. Следовательно, ГМДП, ГМДП- Лиз(Ст) и ГМДП - будут полезны для лечения сепсиса и септического шока. Однако, наряду с результатами этого исследования, необходимо также принимать во внимание другие свойства МДП, поскольку одни могут быть более пирогенными, чем другие.
Пример 5
Эффект МДП на выработку ФНО
в культуре цельной крови
Цельную гепаринизированную кровь человека разводили средой RPMI (Roswell Park Memorial Institute) в соотношении 1:2 и распределяли в 96-луночных микротитрационных
планшетах. Отдельные лунки обрабатывали физиологическим раствором, ГМДП, МДП или ЛПС в дозах, приведенных выше. После инкубации при 37oC в течение 6 часов, надосадки исследовали на
содержание ФНО α с помощью стандартной методики твердофазного иммуноферментного анализа (ELISA). Результаты представлены на фиг. 3, откуда следует, что ГМДП весьма слабо индуцирует выработку
ФНО, в то время как МДП и ЛПС обладают значительной способностью индуцировать выработку ФНО.
Этот метод является чувствительным анализом для измерения эффекта медиаторов на выработку ФНО альфа иммунокомпетентными клетками, который, как полагают, является главным медиатором воспаления, коагулопатии и смерти при сепсисе и септическом шоке. Из результатов видно, что ГМДП является наименьшим медиатором воспаления; ФНО-индуцирующая активность этих веществ будет коррелировать с их токсичностью.
Пример 6
Супрессия выработки ИЛ-1 различными МДП
Мыши (BAZB/c, самки) весом 13-14 г, по 5 животных в каждой группе, получали по две инъекции МДП с интервалом в 12 часов. Испытуемыми МДП являлись МДП, муростазин, МДП-Тре, МДП-ОБу, ГМДП-LL,
ГМДП- Лиз(Ст) и ГМДП-К. После последней инъекции собирали перитонеальные клетки и определяли индукцию выработки ИЛ-1 перитонеальными макрофагами.
Приготовление перитонеальных
макрофагов:
Макрофаги собирали из перитонеальной полости мышей путем промывания сбалансированным солевым раствором Хенка. После отмывания клеток их помещали в лунки плоскодонных 96-луночных
планшетов и инкубировали при 37oC в течение 1 часа в среде RPMI, содержащей 5% фетальной сыворотки телят. Планшеты затем отмывали теплой средой RPMI для удаления незакрепившихся клеток.
Затем в свежую культуральную среду добавляли ЛПС (25 мкг/мл) и планшеты культивировали дополнительно 24 часа.
Выработка ИЛ-1 перитонеальными макрофагами:
Выработку ИЛ-1
перитонеальными макрофагами определяли посредством совместной стимуляции с тимоцитами. Тимоциты, взятые от мышей (CBA* C 5 BL.6)F1 (106), ФГА (фитогемаглютинин) (1 мкг/мл) и испытуемую
надосадочную жидкость помещали в лунки 96-луночных плоскодонных планшетов. Скорость пролиферации тимоцитов измеряли спустя 72 часа путем инкорпорации 3H тимидина (1 μ Ci на лунку) в течение 6
часов перед окончанием культивирования. Результаты представлены на фиг. 4.
В добавление к ФНО α, предполагают, что ИЛ-1 является цитокином, обладающим центральной ролью в иммунном ответе и воспалении. Как и ФНО α, ИЛ-1 вырабатывается в ответ на стимуляцию ЛПС. Фиг. 4 показывает, что ГМДП, муростазин, МДП-ОБу, ГМДП-Лиз(Ст) и ГМДП- могут подавлять ИЛ-1 ответ на ЛПС.
МДП и МДП-Тре обладают этим свойством в очень малой степени. Как и предыдущие чертежи, эти данные должны рассматриваться совместно с эффектами МДП на ФНО, фагоцитарной активностью макрофагов и других моделей in vivo. Тем не менее, различие между МДП и ГМДП снова очевидно.
Пример 7
Эффекты аналогов МДП на ЛПС-индукцию сывороточного ФНО
В этом эксперименте испытывали 4 соединения: МДП, ГМДП-К, ГМДП-ОБу и ГМДП. Контрольным мышам вводили физиологический раствор. Мышам BAZB/c (6 мышей в группе)> вводили интраперитонеально 1,
4 мг убитой C.parvum (0,2 мл 7 мг/мл суспензии). Впоследствии (2 недели спустя) мышам вводили физиологический раствор, МДП (100 мкг) или аналог (100 мкг) в 0,5 мл физиологического раствора
интраперитонеально. Доза каждого МДП подбиралась таким образом, чтобы животные получали эквимолярные количества. ЛПС (25 мкг) инъецировали спустя 18 часов после инъекции МДП или аналога, затем мышей
убивали и обескровливали. ФНО определяли стандартным методом ELISA.
Результаты, представленные на фиг. 5, свидетельствуют о том, что ГМДП оказался способен подавлять выработку ФНО α , демонстрируя, таким образом, что он является противовоспалительным агентом. Напротив, МДП и ГМДП-К оказались веществами, усиливающими воспаление, вызывая повышение уровней ФНО, индуцированных ЛПС.
Пример 8
Индукция ФНО мурамиловыми пептидами
Испытуемыми мурамиловыми пептидами являлись: прототип МДП, ГМДП, ГМДП-К, ГМДП-ОБу, ГМДП-Лиз(Ст),
ГМДПК-Лиз(Ст) ГМДП-Бенз и Тре-МДП. Мышам BA B/с (6 мышей в группе) вводили интраперитонеально 1,4 мг убитой культуры C.parvum (0,2 мл 7 мг/мл суспензии). Впоследствии (спустя 2 недели) мышам вводили
интраперитонеально физиологический раствор, МДП (100 μ г) или аналог (100 мкг) в 0,5 мл физиологического раствора. Дозу каждого МДП подбирали таким образом, чтобы животные получали эквимолярные
количества. ЛПС вводили спустя 18 часов (25 мкг) после инъекции МДП или аналога, затем мышей убивали и обескровливали. ФНО определяли стандартным методом ELISA.
Результаты, представленные на фиг. 6, являются еще одним убедительным свидетельством способности ГМДП подавлять выработку ФНО α , и эти результаты подтверждают результаты примера 7. ГМДП - Лиз(Ст) и ГМДПК-Лиз(Ст) так же усиливали ЛПС-индуцированную выработку ФНО, а ГМДПК-ОБу не действовал как синергист с ЛПС.
Пример 9
Предупреждение ЛПС-индуцированной гипофагии и эффект
на нормальный рост крыс
В этом эксперименте сравнивали результаты, полученные у крыс, получавших отдельно ГМДП, ГМДП плюс ЛПС, физиологический раствор и ЛПС. Крыс линии Wistar-Porton весом
80-100 г, поделили на группы по 6 животных каждая. Животных вволю кормили (стандартным кормом для крыс и мышей), содержали раздельно в нормальных условиях клеточного содержания. Кумулятивное
потребление пищи определяли на 7 и 8 день. ГМДП вводили в течение 8 дней (150 мкг/кг в день); в группах, получавших также ЛПС, (3 мг/кг в день), эндотоксин вводили на 6 и 7 день.
В группах, получавших только ЛПС, животные получали физиологический раствор с 1 по 5 день и ЛПС на 6 и 7 день (3 мг/кг в день). Статистическая достоверность определялась по тестам Стьюдента.
ЛПС индуцировал быструю потерю веса животными. Одной из характеристик хронической или острой инфекции является потеря веса, и наблюдаемая потеря веса может быть отнесена на счет катаболизма тканей и снижения уровня потребления пищи. Фиг. 7 показывает, что ГМДП достоверно противостоит ЛПС-индуцированной потере веса (анорексии), в то время как фиг. 8 показывает, что ГМДП противостоит ЛПС-индуцированной потере веса. Это удивительное явление находится в противоречии с тем, что было известно о МДП, который взаимодействует как синергист с ЛПС, что приводит к увеличению потери веса и снижению уровня потребления пищи.
Реферат
Предложены новые способ и средство лечения септического шока, кахексии и других угрожающих жизни воспалительных состояний. В качестве такого средства предложены мурамиловые пептидные соединения. Предпочтительные соединения включают N-ацетил-глюкозаминил-N-ацетил-мурамил-L-аланил-D-изоглутамин (ГМДП) и N-ацетил-глюкозаминил-N-ацетил-мурамил-L-аланил-D-глутаминовую кислоту (ГМДП-К). Средство является непирогенным и/или уменьшает интенсивность симптомов потери веса, вызванной эндотоксинами, и/или гипофагию, и/или уменьшает выработку ФНО, и/или уменьшает стимуляцию макрофага к переработке эндотоксинов. 4 с. и 22 з.п.ф-лы, 4 табл., 8 ил.
Формула

где R представляет остаток аминокислоты или линейного пептида, построенного из 2 - 6 аминокислотных остатков, при этом по меньшей мере один из остатков необязательно замещен липофильной группой;
n имеет значение 1 или 2,
за исключением следующих соединений:
N-[Nα-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-D-изоглутаминил]-N∈-стеароил-L-лизин (ГМДП-Лиз(СТ));
Nα --[N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-γ-D-глутамил]-N∈-стеароил-L-лизин (ГМДПА-Лиз(СТ));
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-(β 1 - 4)-N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-бис-[L-аланил-D-изоглутаминил-N∈-стеароил-L-лизин] ([ГМДП-Лиз(СТ)]2);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-D-изоглутамина 1-адамантиловый эфир (ГМДП-Ад);
L-треонил-N∈-[N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-γ-D-изоглутаминил]-L-лизил-L-пролил-L-аргинин (ГДМП-ТУФТСИН Е);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-γ -D-изоглутаминил-L-треонил-L-лизил-L-пролил-L-аргинин (ГДМП-ТУФТСИН А);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-α-D-глутамил-L-лизил-L-треонил-N∈-стеароил-L-лизил-L-пролил-L-аргинин (ГДМП-ТУФТСИН липофильный);
N∈-[N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-γ -D-изоглубаминил]-L-лизил-L-гистидил-L-глициновый амид (ГМДПА-бурсин);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-D-изоглутаминил-L-глутамил-L-триптофан (ГДМП-тимоген I);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-D-изоглутаминил-∈-аминогексаноил-L-глутамил-L-триптофан (ГДМП-тимоген II), или
Nα -[N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-D-изоглутаминил]-N∈-стеароил-L-лизил-L-глутамил-L-триптофан (ГДМП-тимоген III),
для лечения или профилактики состояний воспалительной природы, опосредованных эндотоксином, указанные состояния являются септическим шоком или состоянием, являющимся результатом системной бактериальной инфекции или инфекции, занесенной во время или после операции.
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-D-глутамина-н-бутиловый эфир (ГМДП-Обу);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-D-глутаминовой кислоты дибензиловый эфир (ГМДП-А (ОБзл)2);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-N-метил-L-аланил-D-изоглутамин (Ме-ГМДП);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-(β 1 - 4)-N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-бис-(L-аланил-D-изоглутамин) ((ГМДП)2);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-(β 1 - 4)-N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-бис-(L-аланил-D-глутаминовая кислота) ((ГМДПА)2);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-(β 1 - 4)-N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-бис-(L-аланил-D-изоглутаминил-L-лизин) ((ГМДП Лиз)2);
N-ацетилмурамил-L-треонил-D-изоглутамин (Тре-МДП) или N-ацетилмурамил-L-аланил-D-глутамина н-бутиловый эфир (мурабутид).

где R представляет остаток аминокислоты или линейного пептида, построенного из 2 - 6 аминокислотных остатков, при этом по меньшей мере один из остатков необязательно замещен липофильной группой;
n имеет значение 1 или 2,
за исключением следующих соединений:
N-[Nα-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-D-изоглутаминил]-N∈-стеароил-L-лизин (ГМДП-Лиз(СТ));
Nα-[N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-γ-D-глутамил]-N∈-стеароил-L-лизин (ГМДПА-Лиз(СТ));
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-(β 1 - 4)-N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-бис-[L-аланил-D-изоглутаминил-N∈-стеароил-L-лизин] ([ГМДП-Лиз(СТ)]2);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-D-изоглутамина 1-адамантиловый эфир (ГМДП-Ад);
L-треонил-N∈-[N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-γ-D-изоглутаминил]-L-лизил-L-пролил-L-аргинин (ГДМП-ТУФТСИН Е);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-γ -D-изоглутаминил-L-треонил-L-лизил-L-пролил-L-аргинин (ГДМП-ТУФТСИН А);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-α-D-глутамил-L-лизил-L-треонил-N∈-стеароил-L-лизил-L-пролил-L-аргинин (ГМДП-ТУФТСИН липофильный);
N∈-[N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-γ -D-изоглутаминил]-L-лизил-L-гистидил-L-глициновый амид (ГМДП-бурсин);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-D-изоглутаминил-L-глутамил-L-триптофан (ГМДП-тимоген I);
N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-D-изоглутаминил-∈-аминогексаноил-L-глутамил-L-триптофан (ГДМП-тимоген II) или
Nα -[N-ацетил-D-глюкозаминил-(β 1 - 4)-N-ацетилмурамил-L-аланил-D-изоглутаминил] -N∈-стеароил-L-лизил-L-глутамил-L-триптофан (ГМДП-тимоген III), для лечения кахексии, опосредованной эндотоксином.
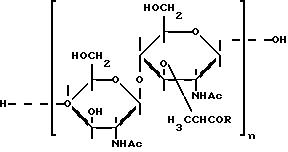
где R обозначает остаток аминокислоты или линейного пептида, построенного из 2 - 6 аминокислотных остатков, при этом хотя бы один остаток может быть замещен липофильной группой;
n принимает значение 1 или 2.

где R обозначает остаток аминокислоты или линейного пептида, построенного из 2 - 6 аминокислотных остатков, при этом хотя бы один остаток может быть замещен липофильной группой;
n принимает значение 1 или 2.
19.11.91. по пп.1, 3 - 13, 15 - 21, 24, 25;
08.05.92 по пп.2, 14, 22, 23, 26.

Комментарии