Антитела, которые специфично связывают альфа-токсин staphylococcus aureus, и способы их применения - RU2620065C2
Код документа: RU2620065C2
Чертежи


































































Описание
Область техники, к которой относится изобретение
Технология в части относится к антителам и в определенных вариантах осуществления к антителам, которые специфично связываются с альфа-токсином Staphylococcus aureus.
Уровень техники
Staphylococcus aureus представляет собой грамположительную, факультативно аэробную, образующую скопления кокковую бактерию, которая обычно колонизирует нос и кожу здоровых людей. Примерно 20-30% населения колонизированы S. aureus в любое время. Бактерии Staphylococcus aureus, иногда также называемые "staph", "Staph, aureus" или "S. aureus", считаются условно-патогенными микроорганизмами, которые вызывают незначительные инфекции (например, гнойнички, фурункулы) и системные инфекции.
Слизистый и эпидермальный барьеры (кожа) в норме защищают от инфекций S. aureus. Нарушение этих естественных барьеров в результате повреждений (например, ожогов, травмы, хирургических вмешательств и подобного) резко повышает риск инфекции. Заболевания, которые подвергают опасности иммунную систему (например, диабет, терминальная стадия почечной недостаточности, рак и подобное), также повышают риск инфицирования. Оппортунистические инфекции S. aureus могут стать серьезными, вызывающими ряд заболеваний или состояний, неограничивающие примеры которых включают бактериемию, флегмону, инфекции века, пищевое отравление, инфекции суставов, кожные инфекции, синдром ошпаренной кожи, синдром токсического шока, пневмонию, остеомиелит, эндокардит, менингит и абсцедирование.
S. aureus может также вызывать инфекцию и заболевание у животных. Например, S. aureus часто связан с коровьим маститом.
S. aureus экспрессирует ряд факторов вирулентности, включая капсулярные полисахариды и белковые токсины. Одним фактором вирулентности, часто связанным с инфекцией S. aureus, который является главным цитотоксическим агентом, является альфа-токсин (также известный как альфа-гемолизин или HIa), порообразующий и гемолитический экзопротеин, продуцируемый наиболее патогенными штаммами S. aureus. Токсин образует гептамерные поры в мембранах чувствительных клеток, таких как лейкоциты, тромбоциты, эритроциты, моноциты периферической крови, макрофаги, кератиноциты, фибробласты и эндотелиальные клетки. Образование пор альфа-токсина часто ведет к дисфункции или лизису клетки.
Краткое описание раскрытия
В определенных вариантах осуществления предлагается очищенное или выделенное антитело или его антигенсвязывающий фрагмент, причем антитело или фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus. Выражения "полипептид альфа-токсина", "мономер альфа-токсина" и "олигомеры альфа-токсина (например, гептамер)" называются в данном документе как "AT", "мономер AT" и "олигомер AT", соответственно. Выражение "вариабельный участок тяжелой цепи" называется "VH". Выражение "вариабельный участок легкой цепи" называется "VL".
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, включает (a) CDR1 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 7, 10, 13 или 69 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; (b) CDR2 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 8, 11, 14, 17, 70 или 75 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; и (c) CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат CDR1 VH, CDR2 VH и CDR3 VH, содержащие аминокислотные последовательности, идентичные SEQ ID NO: 7, 8 и 9; SEQ ID NO: 10, 11 и 12; SEQ ID NO: 13, 14 и 15; SEQ ID NO: 7, 17 и 18; SEQ ID NO: 7, 8 и 16; SEQ ID NO: 7, 8 и 65; SEQ ID NO: 7, 8 и 66; SEQ ID NO 7, 8 и 67; SEQ ID NO: 7, 8 и 78; SEQ ID NO: 69, 70 и 71; SEQ ID NO: 7, 8 и 72; SEQ ID NO: 69, 75 и 71; SEQ ID NO: 69, 75 и 76 или SEQ ID NO: 69, 70 и 71 или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по отношению к ним.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, включают (a) CDR1 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 1 или 4 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; (b) CDR2 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 2, 5, 73 или 77 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; и (c) CDR3 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 3, 6, 64, 68 или 74 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат CDR1 VL, CDR2 VL и CDR3 VL, содержащие аминокислотные последовательности, идентичные SEQ ID NO: 1, 2 и 3; SEQ ID NO: 4, 5 и 6; SEQ ID NO: 1, 2 и 64; SEQ ID NO: 1, 2 и 68; SEQ ID NO: 1, 73 и 74 или SEQ ID NO: 1, 77 и 74 или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по отношению к ним.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, содержит CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL, содержащие аминокислотные последовательности, идентичные или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по отношению к: (a) CDR1 VH, содержащему аминокислотную последовательность SEQ ID NO: 7,10, 13 или 69; (b) CDR2 VH, содержащему аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75; (c) CDR3 VH, содержащему аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78; (d) CDR1 VL, содержащему аминокислотную последовательность SEQ ID NO: 1 или 4; (e) CDR2 VL, содержащему аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и (f) CDR3 VL, содержащему аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL, содержащие аминокислотные последовательности, идентичные SEQ ID NO: 7, 8, 9, 1, 2 и 3; SEQ ID NO: 10, 11, 12, 1, 2 и 3; SEQ ID NO: 13, 14, 15, 4, 5 и 6; SEQ ID NO: 7, 17, 18, 1, 2 и 3; SEQ ID NO: 7, 8, 16, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1, 2 и 64; SEQ ID NO: 7, 8, 66, 1, 2 и 64; SEQ ID NO: 7, 8, 67, 1, 2 и 68; SEQ ID NO: 7, 8, 67, 1, 2 и 64; SEQ ID NO: 7, 8, 78, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1,2 и 68; SEQ ID NO: 69, 70, 71, 1, 2 и 68; SEQ ID NO: 7, 8, 72, 1, 73 и 74; SEQ ID NO: 69, 75, 71, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 77 и 74; SEQ ID NO: 69, 70, 71, 1, 77 и 74 или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по отношению к ним.
В некоторых вариантах осуществления предлагается композиция, которая содержит выделенное антитело или его антигенсвязывающий фрагмент, которые (i) включают VH-домен цепи, содержащий три CDR, и VL-домен цепи, содержащий три CDR; и (ii) иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, где три CDR VH-домена цепи включают (a) CDR1 VH, содержащий аминокислотную последовательность SEQ ID NO: 7, 10, 13 или 69; (b) CDR2 VH, содержащий аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75; и (c) CDR3 VH, содержащий аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78. В конкретных вариантах осуществления CDR1 VH, CDR2 VH и CDR3 VH соответствуют SEQ ID NO: 7, 8 и 9; SEQ ID NO: 10, 11 и 12; SEQ ID NO: 13, 14 и 15; SEQ ID NO: 7, 17 и 18; SEQ ID NO: 7, 8 и 16; SEQ ID NO: 7, 8 и 65; SEQ ID NO: 7, 8 и 66; SEQ ID NO 7, 8, и 67; SEQ ID NO: 7, 8 и 78; SEQ ID NO: 69, 70 и 71; SEQ ID NO: 7, 8 и 72; SEQ ID NO: 69, 75 и 71; SEQ ID NO: 69, 75 и 76; или SEQ ID NO: 69, 70 и 71.
В определенных вариантах осуществления также предлагается композиция, которая содержит выделенное антитело или его антигенсвязывающий фрагмент, которые (i) включают VH-домен цепи, содержащий три CDR, и VL-домен цепи, содержащий три CDR; и (ii) иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, где три CDR VL-домена цепи включают (a) CDR1 VL, содержащий аминокислотную последовательность SEQ ID NO: 1 или 4; (b) CDR2 VL, содержащий аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и (c) CDR3 VL, содержащий аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74. В конкретных вариантах осуществления CDR1 VL, CDR2 VL и CDR3 VL соответствуют SEQ ID NO: 1, 2 и 3; SEQ ID NO: 4, 5 и 6; SEQ ID NO: 1, 2 и 64; SEQ ID NO: 1, 2 и 68; SEQ ID NO: 1, 73 и 74; или SEQ ID NO: 1, 77 и 74.
В некоторых вариантах осуществления также предлагаются композиции, которые включают выделенное антитело или его антигенсвязывающий фрагмент, которые (i) иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, (ii) содержат вариабельный домен тяжелой цепи, который по меньшей мере на 90% идентичен аминокислотной последовательности SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62, и (iii) содержат вариабельный домен легкой цепи, который по меньшей мере на 90% идентичен аминокислотной последовательности SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент включает вариабельный домен тяжелой цепи с SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62 и вариабельный домен легкой цепи с SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат VH и VL, где каждый из VH и VL идентичен или каждый из VH и VL по меньшей мере на 90%, 95% или 98% идентичен аминокислотным последовательностям VH и VL SEQ ID NO: 20 и 19; SEQ ID NO: 22 и 21; SEQ ID NO: 24 и 23; SEQ ID NO: 26 и 25; SEQ ID NO: 28 и 27; SEQ ID NO: 41 и 42; SEQ ID NO: 43 и 44; SEQ ID NO: 45 и 46; SEQ ID NO: 47 и 48; SEQ ID NO: 47 и 48; SEQ ID NO: 49 и 50; SEQ ID NO: 51 и 52; SEQ ID NO: 51 и 52; SEQ ID NO: 53 и 54; SEQ ID NO: 55 и 56; SEQ ID NO: 57 и 58; SEQ ID NO: 59 и 60; SEQ ID NO: 61 и 58; SEQ ID NO: 62 и 58; SEQ ID NO: 62 и 63; SEQ ID NO: 79 и 63.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и характеризуется одной или несколькими характеристиками, выбранными из группы, состоящей из: (а) константы аффинности (KD) приблизительно 13 нМ или менее в отношении полипептида альфа-токсина Staphylococcus aureus; (b) ингибирования олигомеризации полипептида альфа-токсина Staphylococcus aureus по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95%; и (c) снижения лизиса A549 (легочный эпителий) или ТНР-1 (моноциты) и лизиса эритроцитов по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95%, где выделенное антитело или антигенсвязывающий фрагмент и токсин S. aureus присутствуют в молярном отношении приблизительно 1:1.
В некоторых вариантах осуществления эритроцит представляет собой клетку из крови. В определенных вариантах осуществления клеткой из крови является красное кровяное тельце. В некоторых вариантах осуществления лизис определяют с помощью in vitro анализа образования гемолитических бляшек. В других вариантах осуществления лизис определяют с помощью in vitro анализа высвобождения лактатдегидрогеназы. Эти анализы дополнительно описаны ниже, или их может провести в установленном порядке специалист в данной области техники.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент включает диагностическое средство. В определенных вариантах осуществления диагностическое средство включает визуализирующее средство. Диагностическое средство в некоторых вариантах осуществления включает детектируемую метку. В определенных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент связаны с диагностическим средством посредством линкера.
В некоторых вариантах осуществления полипептид альфа-токсина Staphylococcus aureus является нативным полипептидом токсина. Полипептид альфа-токсина Staphylococcus aureus в некоторых вариантах осуществления включает одну или несколько аминокислотных делеций, присоединений и/или замен (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 аминокислотных вставок, делеций и/или замен) по отношению к нативному полипептиду токсина. В некоторых вариантах осуществления полипептид альфа-токсина Staphylococcus aureus является рекомбинантным белком. В определенных вариантах осуществления полипептид альфа-токсина Staphylococcus aureus включает аминокислотную последовательность SEQ ID NO: 39 или ее фрагменты. В некоторых других вариантах осуществления полипептид альфа-токсина Staphylococcus aureus является аттенуированной формой полипептида, как например, H35L, в котором гистидин в положении 35 полипептида дикого типа замещен лейцином, например, как представлено в SEQ ID NO: 40.
В определенных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и включает CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или его антигенсвязывающий фрагмент нейтрализует полипептид альфа-токсина Staphylococcus aureus. В некоторых вариантах осуществления выделенное антитело или антигенсвязывающий фрагмент выделенного антитела иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и включает CDR3 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 3, 6, 64, 68 или 74 или включающую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или его антигенсвязывающий фрагмент нейтрализует полипептид альфа-токсина Staphylococcus aureus.
В определенных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и включает CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или включающую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или его антигенсвязывающий фрагмент ингибирует олигомеризацию полипептида альфа-токсина Staphylococcus aureus. В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и включает CDR3 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 3, 6, 64, 68 или 74 или включающую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или его антигенсвязывающий фрагмент ингибирует олигомеризацию полипептида альфа-токсина Staphylococcus aureus. В определенных вариантах осуществления ингибирование олигомеризации определяют с помощью in vitro анализа связывания и электрофоретической подвижности.
Также в данном документе предлагаются наборы, включающие (а) композицию, содержащую выделенное антитело или его антигенсвязывающий фрагмент, и (b) инструкции по применению композиции или указания для получения инструкций по применению композиции. В некоторых вариантах осуществления антитело в композиции связано с твердой подложкой. В определенных вариантах осуществления твердая подложка представляет собой гранулу, и в некоторых вариантах осуществления гранула представляет собой гранулу сефарозы. В некоторых вариантах осуществления инструкции по применению включают одно или несколько полипептидов выделения, очистки, детекции и количественного определения альфа-токсина Staphylococcus aureus.
В определенных вариантах осуществления набор включает буфер и мембрану, подходящие для вестерн-блоттинга. В некоторых вариантах осуществления набор включает загрузочный буфер и элюирующий буфер. В определенных вариантах осуществления набор включает буфер, подходящий для твердофазного иммуноферментного анализа (ELISA).
Также в данном документе предлагается способ предупреждения, лечения или контроля пневмонии у субъекта, включающий: введение композиции, которая включает антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, нуждающемуся в этом субъекту в количестве, эффективном для предупреждения, лечения или контроля пневмонии.
В некоторых вариантах осуществления с помощью данного способа предупреждают пневмонию. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с линейным или конформационным эпитопом, который содержит один или несколько остатков, или часть или фрагмент из аминокислот 1-293 или из аминокислот 51-293 полипептида стафилококкового альфа-токсина. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, где антитело или антигенсвязывающий фрагмент имеет контактирующие остатки в T261, T163, N264, K266 и K271 из SEQ ID NO: 39. В дополнительных вариантах осуществления антитело или его антигенсвязывающий фрагмент связывает фрагмент альфа-токсина, где антитело или антигенсвязывающий фрагмент имеет дополнительные контактирующие остатки в N177, W179, G180, P181, Y182, D183, D185, S186, W187, N188, P189, V190, Y191 и R200 из SEQ ID NO: 39.
В определенных вариантах осуществления антитело или антигенсвязывающий фрагмент имеет контактирующие остатки в N177, W179, G180, P181, Y182, D183, D185, S186, W187, N188, P189, V190, Y191, R200, T261, T163, N264, K266 и K271 из SEQ ID NO: 39. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, содержащим аминокислоты 261-272 из SEQ ID NO: 39. В дополнительных вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, содержащим аминокислоты 248-277 из SEQ ID NO: 39. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, содержащим аминокислоты 173-201 из SEQ ID NO: 39, и фрагментом, содержащим аминокислоты 261-272 из SEQ ID NO: 39, или с фрагментом, содержащим аминокислоты 173-201 из SEQ ID NO: 39, и фрагментом, содержащим аминокислоты 248-277 из SEQ ID NO: 39.
В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, где антитело или антигенсвязывающий фрагмент имеет контактирующие остатки в T261, T163, N264, K266 и K271 из SEQ ID NO: 40. В дополнительных вариантах осуществления антитело или его антигенсвязывающий фрагмент связывает фрагмент альфа-токсина, где антитело или антигенсвязывающий фрагмент имеет дополнительные контактирующие остатки в N177, W179, G180, P181, Y182, D183, D185, S186, W187, N188, P189, V190, Y191 и R200 из SEQ ID NO: 40.
В определенных вариантах осуществления антитело или антигенсвязывающий фрагмент имеет контактирующие остатки в N177, W179, G180, P181, Y182, D183, D185, S186, W187, N188, P189, V190, Y191, R200, T261, T163, N264, K266 и K271 из SEQ ID NO: 40. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, содержащим аминокислоты 261-272 в SEQ ID NO: 40. В дополнительных вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, содержащим аминокислоты 248-277 в SEQ ID NO: 40. В других вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, содержащим аминокислоты 173-201 в SEQ ID NO: 40, и фрагментом, содержащим аминокислоты 261-272 в SEQ ID NO: 40.
В других вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с фрагментом, содержащим (1) аминокислоты 261-272, (2) аминокислоты 248-277 или (3) аминокислоты 173-201 и 261-272 полипептида стафилококкового альфа-токсина или варианта полипептида стафилококкового альфа-токсина, где аминокислоты 261-272, аминокислоты 248-277 или аминокислоты 173-201 соответствуют такой же аминокислотной последовательности, как и у соответствующего участка в SEQ ID NO: 39, или содержат замены в пределах фрагмента с соответствующим участком в SEQ ID NO: 39, где замены не изменяют способность антитела или его антигенсвязывающего фрагмента связываться с полипептидом альфа-токсина.
В некоторых вариантах осуществления предлагается способ предупреждения, лечения или контроля состояния, вызванного кожной инфекцией у субъекта, который включает: введение композиции, которая включает антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus согласно настоящему изобретению, нуждающемуся в этом субъекте в количестве, эффективном для предупреждения, лечения или контроля состояния, вызванного кожной инфекцией. В определенных вариантах осуществления состоянием, вызванным кожной инфекцией, является дерматонекроз. В некоторых вариантах осуществления состояние, вызванное кожной инфекцией, включает инфицирование кожи Staphylococcus aureus. В определенных вариантах осуществления с помощью способа предупреждают состояние, вызванное кожной инфекцией.
В некоторых вариантах осуществления обеспечен способ предупреждения, лечения или контроля состояния, связанного с инфекцией Staphylococcus aureus, который включает: введение композиции, которая включает антитело или его антигенсвязывающий фрагмент, который иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus, согласно настоящему изобретению, нуждающемуся в этом субъекту, в количестве, эффективном для снижения олигомеризации полипептида токсина. В определенных вариантах осуществления с помощью способа предупреждают состояние, связанное с инфекцией Staphylococcus aureus.
В некоторых вариантах осуществления предлагается способ предупреждения, лечения или контроля инфекции S. aureus, связанной с лечением диализом, хирургическим вмешательством с высоким риском, пневмонией, ИВЛ-ассоциированной пневмонией (VAP) или повторным инфицированием после предшествующей выписки из больницы при предыдущем лечении или хирургическом вмешательстве, который включает введение композиции, которая включает антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, нуждающемуся в этом субъекту.
В некоторых вариантах осуществления также предлагается способ предупреждения, лечения или контроля состояния, связанного с инфекцией Staphylococcus aureus, который включает введение композиции, которая включает антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, нуждающемуся в этом субъекту в количестве, эффективном для снижения клеточного лизиса. В определенных вариантах осуществления с помощью способа предупреждают состояние, связанное с инфекцией Staphylococcus aureus. В некоторых вариантах осуществления клетка представляет собой эритроцит из крови или легкого.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с линейным или конформационным эпитопом, который содержит один или несколько остатков. В определенных вариантах осуществления композиция, вводимая субъекту, соответствует любой из композиций, описанных в данном документе.
В определенных вариантах осуществления также предлагается способ, который включает: введение композиции, описанной в данном документе, в клетки; и детекцию наличия, отсутствия или величины биологического эффекта, связанного с введением композиции в клетки. В некоторых вариантах осуществления также предлагается способ, который включает: введение композиции, описанной в данном документе, субъекту; и детекцию наличия, отсутствия или величины биологического эффекта у субъекта, связанного с введением композиции. В определенных вариантах осуществления также предлагается способ, который включает: введение композиции, описанной в данном документе, субъекту; и отслеживание состояния субъекта.
В некоторых вариантах осуществления также предлагается способ нейтрализации полипептида альфа-токсина Staphylococcus aureus путем введения нуждающемуся в этом субъекту эффективного количества любой из композиций, описанных в данном документе, для нейтрализации полипептида токсина.
В определенных вариантах осуществления также предлагается способ предупреждения, лечения или контроля состояния, опосредованного инфекцией Staphylococcus aureus, у нуждающегося в этом субъекта, причем способ включает введение субъекту эффективного количества любой из композиций, описанных в данном документе, для предупреждения, лечения или контроля состояния. В некоторых вариантах осуществления также предлагается способ лечения, предупреждения или облегчения симптомов расстройства, опосредованного альфа-токсином Staphylococcus aureus, у нуждающегося в этом субъекта, включающий введение эффективного количества любой из композиций, описанных в данном документе, субъекту для лечения, предупреждения или ослабления симптомов.
В определенных вариантах осуществления также предлагается способ диагностики состояния, опосредованного альфа-токсином Staphylococcus aureus, у субъекта, который включает отбор субъекта, нуждающегося в диагностике, и введение субъекту эффективной для диагностики дозы любой из композиций, описанных в данном документе. В некоторых вариантах осуществления субъектом является домашнее животное, и в определенных вариантах осуществления субъектом является человека.
Определенные варианты осуществления описаны дополнительно в следующем описании, примерах, формуле изобретения и графических материалах.
Краткое описание графических материалов
Графические материалы иллюстрируют в данном документе варианты осуществления и являются неограничивающими. Для ясности и простоты иллюстрации графические материалы выполнены без масштабирования, и в некоторых случаях различные виды могут быть показаны преувеличенными или укрупненными для облегчения понимания конкретных вариантов осуществления.
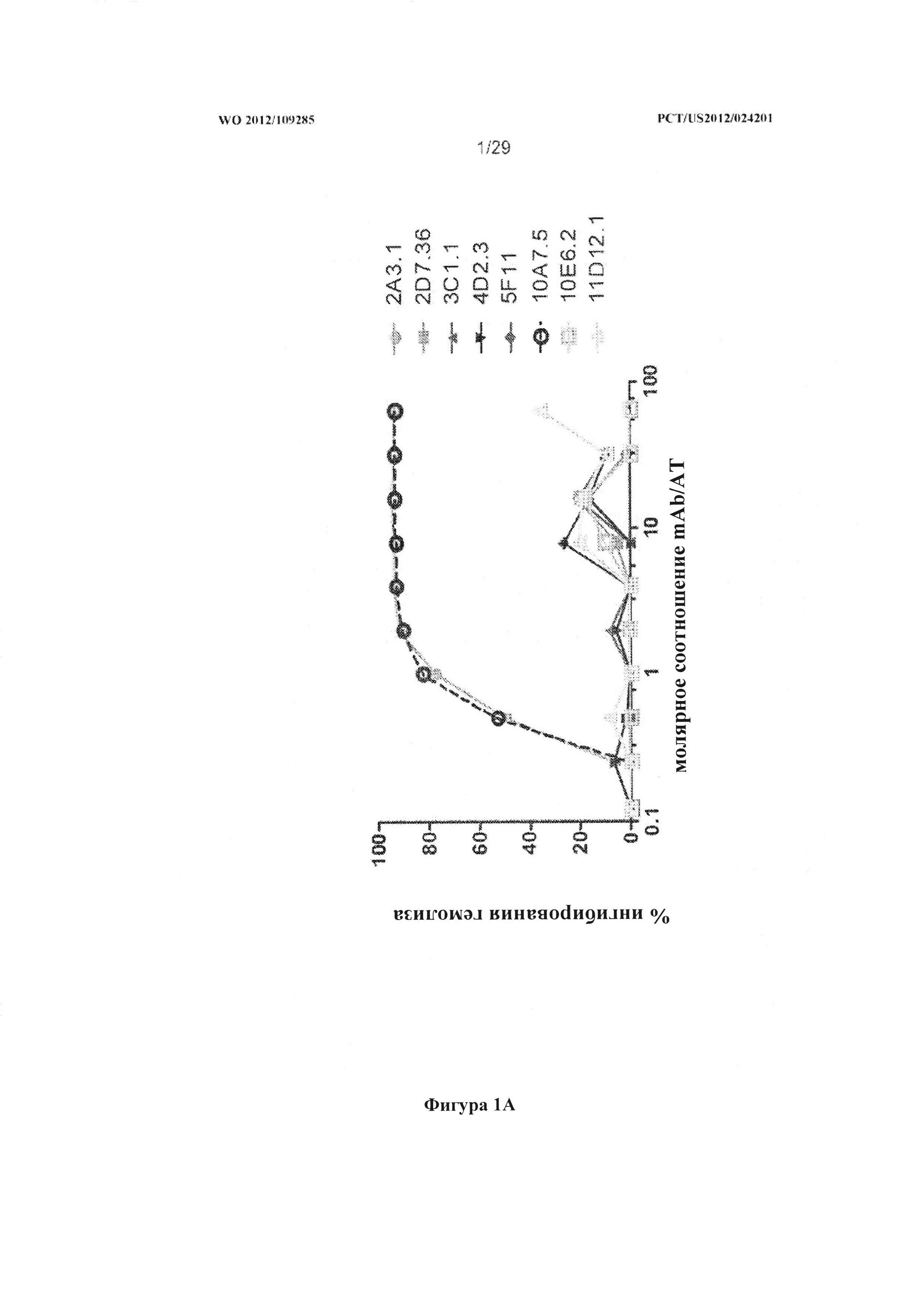
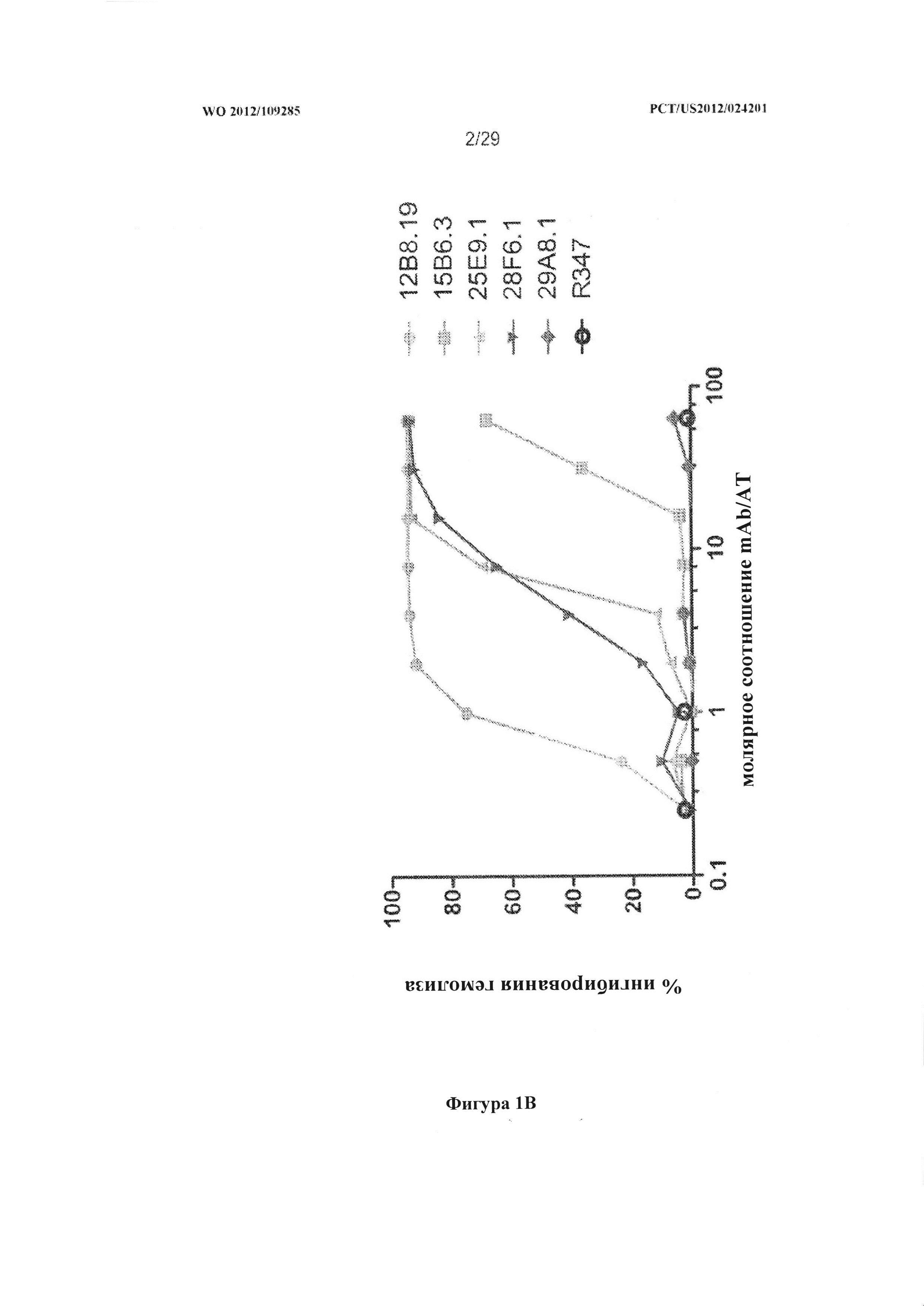
На фигурах 1A и 1B графически проиллюстрировано выраженное в процентах ингибирование лизиса красных кровяных телец антителами к альфа-токсину. Результаты и подробности эксперимента описаны в Примере 3.
На фигурах 2A и 2B графически проиллюстрировано выраженное в процентах ингибирование лизиса A549 и ТНР-1 клеток человека антителами к альфа-токсину. Результаты и подробности эксперимента описаны в Примере 3.
На фигурах 3А и 3В проиллюстрированы результаты пассивной иммунизации ингибирующими mAb к альфа-токсину S. aureus в модели дерматонекроза. Группы из 5 BALB/c мышей подвергали пассивной иммунизации 5 мг/кг ингибирующих mAb, и затем инфицировали S. aureus Wood, и размер пораженных участков отслеживали в течение 6 суток. На фигуре 3A показаны фотографии размера пораженных участков через 6 суток после инфицирования. На фигуре 3B графически проиллюстрировано снижение размера пораженных участков за время течения инфекции. Результаты и подробности эксперимента описаны в Примере 4.
На фигурах 4-7 графически проиллюстрирована выживаемость мышей, подвергшихся пассивной иммунизации различными mAb, описанными в данном документе, в модели пневмонии. На фигуре 4 проиллюстрированы результаты на C57BL/6J мышах, подвергшихся пассивной иммунизации 5, 15 и 45 мг/кг очищенного 12B8.19 за 24 часа до инфицирования S. aureus USA300 (3×108 КОЕ).
На фигуре 5 проиллюстрированы результаты на C57BL/6J мышах, подвергшихся пассивной иммунизации 5, 15 и 45 мг/кг очищенного 2A3.1 за 24 часа до инфицирования S. aureus USA300 (3×108 КОЕ).
На фигуре 6 проиллюстрированы результаты на C57BL/6J мышах, подвергшихся пассивной иммунизации 5, 15 и 45 мг/кг очищенного 28F6.1 за 24 часа до инфицирования S. aureus USA300 (3×108 КОЕ).
На фигуре 7 проиллюстрированы результаты на C57BL/6J мышах, подвергшихся пассивной иммунизации 5, 15 и 45 мг/кг очищенного 10A7.5 за 24 часа до инфицирования S. aureus USA300 (3×108 КОЕ). Результаты и подробности эксперимента описаны в Примере 5.
На фигурах 8A и 8B графически проиллюстрировано распределение бактерий в легком (фигура 8A) и почке (фигура 8B) у мышей, подвергшихся пассивной иммунизации полностью человеческим вариантом mAb 2A3.1 (например, 2A3hu) или изотипическим контролем (R347). C57BL/6J мыши подвергались пассивной иммунизации 2A3hu (15 мг/кг) за 24 часа до инфицирования USA300. Также собирали образцы для измерения уровней цитокинов и для гистопатологического анализа. Результаты и подробности эксперимента описаны в Примере 5.
На фигуре 9 графически проиллюстрировано снижение продукции воспалительных цитокинов после пассивной иммунизации mAb 2A3hu. Обведенные кругами результаты получены в момент времени 24 часа. Результаты и подробности эксперимента описаны в Примере 6.
На фигуре 10 показаны иллюстративные фотографии результатов гистологического исследования легкого у мышей, обработанных контролем R347 (смотри верхнюю и нижнюю фотографии в левой части фигуры 10) или обработанных 2A3hu (смотри верхнюю и нижнюю фотографии в правой части фигуры 10). Результаты и подробности эксперимента описаны в Примере 6.
На фигуре 11 графически проиллюстрировано, что mAb к AT (альфа-токсин S. aureus), описанные в данном документе, не ингибируют связывание нативного альфа-токсина (nAT) с рецепторами, присутствующими на "тенях" эритроцитов кролика. Результаты и подробности эксперимента описаны в Примере 8.
На фигуре 12 показаны иллюстративные результаты вестерн-блоттинга, демонстрирующие ингибирование образования гептамера антителами, описанными в данном документе. Результаты и подробности эксперимента описаны в Примере 8.
На фигурах 13A и 13B продемонстрированы иллюстративные результаты вестерн-блоттинга, подтверждающие ингибирование олигомеризации mAb к AT, описанными в данном документе, и, кроме того, проиллюстрировано, что ингибирование можно оценить с помощью титрования. Результаты и подробности эксперимента описаны в Примере 8.
На фигурах 14-16 графически проиллюстрирована активность полностью человеческих антител к AT в анализах ингибирования клеточного лизиса. Полностью человеческие варианты IgG антител к AT проявляют активность, подобную соответствующим химерным IgG антителам к AT. Ингибирующую активность полностью человеческих IgG антител сравнивали с химерными IgG антителами при лизисе RBC (красное кровяное тельце) кролика (фигура 14), лизисе А549 клеток (фигура 15) и лизисе ТНР-1 клеток (фигура 16). Результаты и подробности эксперимента описаны в Примере 9.
На фигуре 17, A и B графически проиллюстрировано снижение размера пораженных участков за время течения инфекции после пассивной иммунизации ингибирующими mAb QD20, QD37, LC10, QD33, 2A3 к альфа-токсину S. aureus и контрольным R347 в модели дерматонекроза. Группы из 5 BALB/c мышей подвергали пассивной иммунизации 1 мг/кг (фиг. 17, A) и 0,5 мг/кг (фиг. 17, B) указанных ингибирующих mAb, и затем инфицировали S. aureus Wood, и размер пораженных участков отслеживали в течение 6 суток.
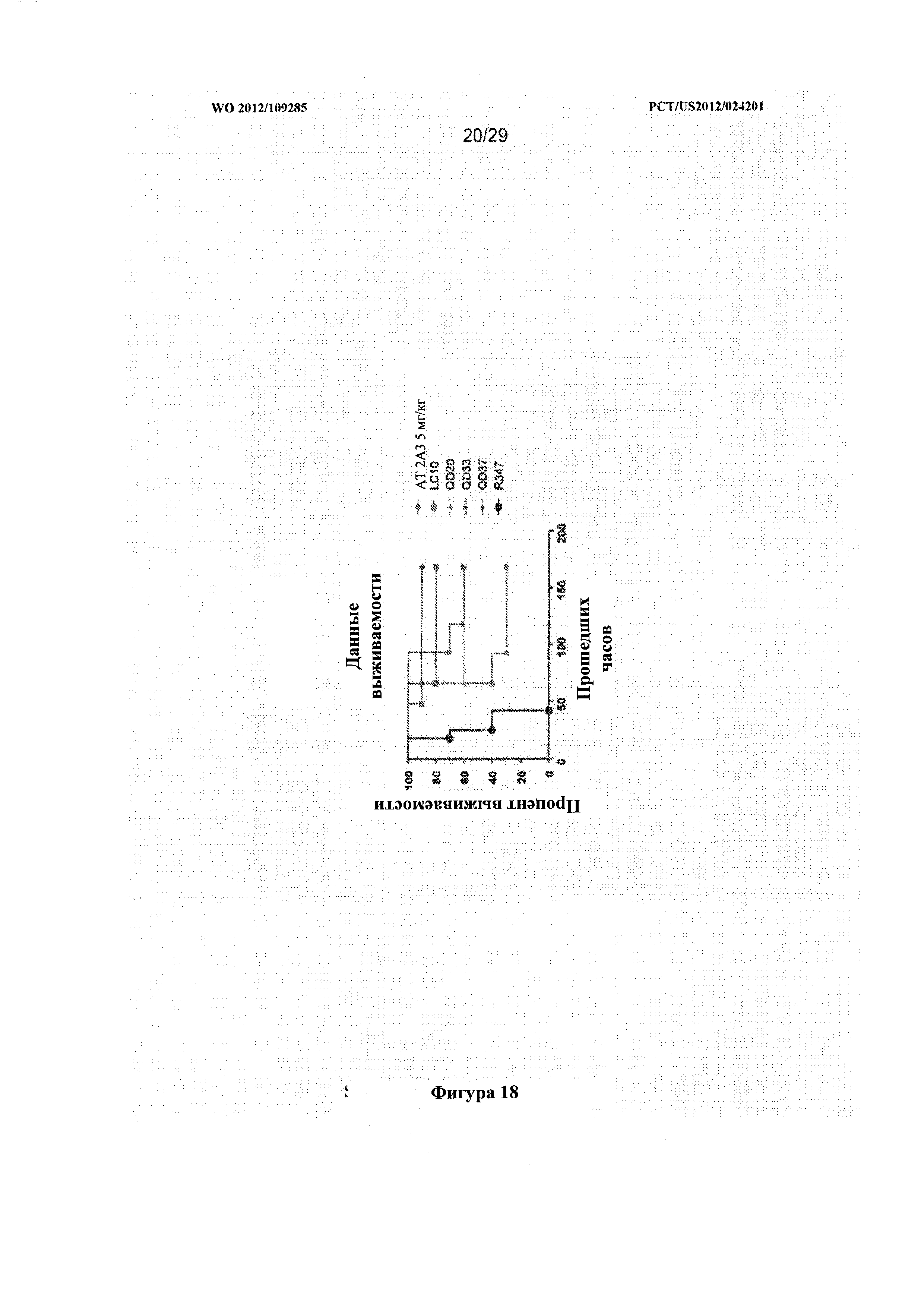
На фигуре 18 графически проиллюстрирована выживаемость мышей, подвергшихся пассивной иммунизации mAb QD20, QD37, LC10, QD33, 2А3 и контрольным R347 в модели пневмонии. Мышей подвергали пассивной иммунизации 5 мг/кг очищенного mAb за 24 часа до инфицирования S. aureus USA300 (~2×108 КОЕ).
На фигуре 19 графически изображена характеристика связывания LC10 YTE с альфа-токсином и LukF-PV с использованием ELISA. Бактериальным лизатом, содержащим меченный His альфа-токсин или LukF-PV, покрывали поверхность 96-луночного планшета. LC10 YTE или мышиные mAb к His добавляли в лунки с покрытием и инкубировали в течение 1 часа. Уровни экспрессии альфа-токсина и LukF-PV были подобны показанным по сигналам связывания mAb к His, тогда как только LC10 YTE в значительной степени связывался с альфа-токсином, а не LukF-PV.
На фигуре 20 показаны выравнивания последовательностей белков альфа-токсина и LukF-PV. Альфа-токсин характеризуется 25% идентичностью аминокислотной последовательности с LukF-PV (номер доступа B1Q018 в UniProtKB/TrEMBL). Нумерация аминокислот основывается на зрелых белках. Выравнивание проводили с использованием способа Clustal W. Сегмент аа 248-277 выделен подчеркиванием.
На фигуре 21 изображены в виде рисунков структуры альфа-токсина. A) Изображение в виде рисунка смоделированной структуры растворимого мономера альфа-токсина. Смоделированную структуру мономера альфа-токсина построили с помощью Maestro 9.1 (Schrodinger Inc) с использованием кристаллической структуры LukF-PV в качестве шаблона (Protein Data Bank entry 1PVL) (Pedelacq, Maveyraud et al. 1999). В) Изображение в виде рисунка кристаллической структуры протомера альфа-токсина из гексамера (запись 7AHL в Protein Data Bank) (Song, Hobaugh et al. 1996). aa 101-110 показаны синим, аа 224-231 - оранжевым и аа 248-277 - красным.
Фигура 22 представляет собой ленточную диаграмму комплекса Fab LC10 YTE - α-токсина. Молекула альфа-токсина указана лентой в верхней части диаграммы. Тяжелая цепь указана темной лентой в нижней части диаграммы, и легкая цепь указана светлой лентой в нижней части диаграммы.
Фигура 23 представляет собой изображение в виде рисунка гептамерного и мономерного состояний молекулы α-токсина. a. Грибоподобная гептамерная сборка молекулы α-токсина, которая создает поры на поверхности клетки-хозяина. Области серого и черного цвета соответствуют LC10 YTE контактирующим остаткам, которые заслонены на модели. Контактирующие остатки, присутствующие в заслоненных положениях, являются устойчивыми к блокированию образования гептамера LC10. b. Наложенные структуры молекул α-токсина до (светло-серый) и после (темно-серый) образования поры.
На фигуре 24 графически представлена эффективность обработки LC10 в мышиной модели дерматонекроза. Группы из 5 Balb/C мышей подвергали пассивной иммунизации 15 мг/кг LC10 или R347, Balb/C мышей инфицировали интраназально 2×108 S. aureus Wood. Через (А) 1 час, (B) 3 часа или (C) 6 часов после инфицирования мышей затем обрабатывали любым из 5, 15 или 45 мг/кг LC10 и размер пораженных участков отслеживали в течение 6 суток. Группы из 5, которым вводили 15 мг/кг LC10 или R347 за 24 часа до контрольного заражения бактериями, включены в качестве контролей.
На фигуре 25 графически представлена эффективность обработки LC10 в мышиной модели пневмонии. Группы из 10 C57BL/6 мышей подвергали пассивной иммунизации 15 мг/кг LC10 или R347 за 24 часа до интраназального контрольного заражения 2×108 S. aureus USA300. Группы из 10 C57BL/6 мышей инфицировали интраназально 2×108 S. aureus USA300. Через (A) 1 час, (B) 3 часа или (C) 6 часов после инфицирования мышей затем обрабатывали любым из 5, 15 или 45 мг/кг LC10 и выживаемость отслеживали в течение 7 суток. Группы из 10, которым вводили 15 мг/кг LC10 или R347 за 24 часа до контрольного заражения бактериями, включены в качестве контролей.
На фигуре 26 графически представлена эффективность обработки LC10 в мышиной модели пневмонии. Группы из 10 C57BL/6 мышей инфицировали интрадермально 2×108 S. aureus USA300. Через час после инфицирования животным давали одну внутрибрюшинную инъекцию LC-10 в концентрации (A) 15 мг/кг, (B) 45 мг/кг. Когорта животных получала подкожно ванкомицин (VAN) через 1 час после инфицирования. Дополнительные обработки VAN давали BID q 12 суммарно за 6 обработок. Контрольную группу из 10 мышей обрабатывали 15 мг/кг R347 через 1 час после инфицирования. Выживаемость отслеживали в течение 7 суток.
Фигура 27 представляет собой графическое представление изоболограмного анализа синергии, где N>1: анатагонизм, N=1: аддитивный эффект, N<1: синергия.
Подробное описание
В данном документе предлагаются антитела, включающие человеческие, гуманизированные и/или химерные формы, а также их фрагменты, производные/конъюгаты и композиции, которые связываются с альфа-токсином Staphylococcus aureus. Такие антитела могут быть полезны для детекции и/или визуализации альфа-токсина и, следовательно, могут быть полезны в анализах и диагностических способах. Антитела, описанные в данном документе, также препятствуют образованию гептамера альфа-токсин, таким образом ингибируя образование активного порообразующего комплекса, и, следовательно, могут быть полезны для терапевтических и профилактических способов.
Staphylococcus aureus является повсеместно распространенным патогеном и иногда является этиологическим возбудителем ряда состояний, варьирующих по тяжести от легких до летальных. S. aureus продуцирует большое количество внеклеточных и ассоциированных с клеткой белков, многие из которых вовлечены в патогенез, как например, альфа-токсин, бета-токсин, гамма-токсин, дельта-токсин, лейкоцидин, токсин синдрома токсического шока (TSST), энеротоксины, коагулаза, белок A, фибриноген, фибронектинсвязывающий белок и подобное. Альфа-токсин (например, кодируемый геном hla) является одним из факторов вирулентности Staphylococcus aureus и продуцируется большинством патогенных штаммов S. aureus.
Инфекции S. aureus являются относительно сложными для лечения и инвазивные заболевания, и рецидив может иметь место после лечения антибиотиком. Кроме того, метициллин-резистентные штаммы S. aureus стали более распространенными в условиях больницы (например, HA-MRSA или внутрибольничный) и не в условиях больницы (например, CA-MRSA или внебольничный), дополнительно осложняя лечение инфекций S. aureus. Во многих случаях метициллин-резистентные штаммы S. aureus также являются резистентными к одному или нескольким другим антибиотикам, включая аминогликозиды, тетрациклин, хлорамфеникол, макролиды и линкозамиды.
Альфа-токсин является порообразующим токсином и обладает цитолитической, гемолитической, дермонекротической и летальной активностями у людей, а также у животных. Стафилококковый альфа-токсин секретируется в виде водорастворимого одноцепочеченого полипептида из 293 аминокислот, вес которого составляет примерно 34 килодальтона (кДа). Не вдаваясь в какую-либо теорию, полагают, что существует два способа взаимодействия альфа-токсин/целевая клетка; (i) альфа-токсин связывается со специфическими высокоафинными рецепторами (ADAM 10) на поверхности клеток человеческих тромбоцитов, моноцитов, эндотелиальных клеток, лейкоцитов, альвеолярных клеток легких, макрофагов, кератиноцитов, фибробластов, эритроцитов кролика и других клеток (смотри, например, Wilke et al., Proc. Natl. Acad. Sci. 707: 13473-13478 (2010)), или (ii) альфа-токсин взаимодействует неспецифически путем адсорбции в липидный бислой. При каждом способе взаимодействия токсин/клетка семь молекул мономера альфа-токсина олигомеризуются с образованием гептамерного трансмембранного канала диаметром 1-2 нм. Последующий отток калия и нуклеотидов и приток натрия и кальция ведет к осмотическому лизису и/или множественным сопутствующим воздействиям, включая продукцию эйкозаноидов, секреторные процессы, сократительную дисфункцию, апоптоз и высвобождение цитокинов. Нарушение функционирования клетки и лизис клеток альфа-токсином, как полагают, способствует состояниям и заболеваниям, связанным с инфекцией S. aureus.
Неограничивающие примеры некоторых общеизвестных состояний, вызванных инфекцией S. aureus, включают ожоги, флегмону, дерматонекроз, инфекции века, пищевое отравление, инфекции суставов, пневмонию, кожные инфекции, инфекцию послеоперационной раны, синдром ошпаренной кожи и синдром токсического шока. Кроме того, он является частым патогеном при инфекции, связанной с инородным телом, таким как внутрисосудистые катетеры, электрокардиостимуляторы, искусственные сердечные клапаны и протезы суставов. Некоторые из состояний или заболеваний, вызванных S. aureus, описаны ниже. Некоторые или все из состояний и заболеваний, описанных ниже, могут включать непосредственное действие альфа-токсина в качестве составляющего инфекции или медиатора состояния или болезненного состояния, или некоторые или все из состояний могут включать опосредованное или сопутствующее воздействие альфа-токсина (например, основной фактор вирулентности вызывает главный симптом или большинство симптомов, связанных с состоянием, и альфа-токсин действует как дополнительно усугубляющий заболевание вследствие его активностей в отношении нарушения клеточной функции и клеточного лизиса).
Ожоги
Ожоговые раны часто являются первоначально стерильными. Однако умеренные и тяжелые ожоги обычно повреждают физические и иммунные барьеры для инфекции (например, образование волдырей, растрескивание или шелушение кожи), вызывая потерю жидкости и электролитов, и приводят в результате к местной или общей физиологической дисфункции. Контакт поврежденной кожи с жизнеспособными бактериями иногда может привести в результате к смешанной колонизации на участке повреждения. Инфекция может ограничиться нежизнеспособным дебрисом на поверхности ожога ("ожоговый струп"), или колонизация может развиться в глубокую кожную инфекцию и захватить жизнеспособные ткани ниже ожогового струпа. Более тяжелые инфекции могут проходить под кожу, попадать в лимфатическую систему и/или кровоток и развиваться в септицемию. S. aureus, как правило, обнаруживается среди патогенов, которые колонизируют инфекции ожоговых ран. S. aureus может уничтожать грануляционную ткань и являться причиной тяжелой септицемии.
Инфекции кожи и мягких тканей
Флегмона
Флегмона является острой инфекцией кожи, которая часто начинается как поверхностная инфекция, которая может распространяться под кожный слой. Флегмона чаще всего вызывается смешанной инфекцией S. aureus в сочетании с S. pyogenes. Флегмона может приводить к системной инфекции. Флегмона иногда является одним аспектом синергичной бактериальной гангрены. Синергичная бактериальная гангрена обычно вызвана смесью S. aureus и микроаэрофильных стрептококков. Синергичная бактериальная гангрена вызывает некроз, и лечение ограничено вырезанием некротической ткани. Состояние часто является летальным.
Дерматонекроз
Дерматонекроз является инфекцией кожи и подкожных тканей, легко распространяющейся по фасциальной плоскости в пределах подкожной ткани. Состояние приводит к тому, что верхние и/или нижние слои кожи становятся некротическими, и может распространяться на нижележащие и окружающие ткани.
Некротический фасцит
Некротический фасцит называют "плотоядной болезнью" или "синдром плотоядных бактерий". Некротический фасцит может быть вызван полимикробной инфекцией штаммом бактерий). Многие типы бактерий могут вызывать некротический фасцит, их неограничивающие примеры включают стрептококк группы A (например, Streptococcus pyrogenes), Staphylococcus aureus, Vibrio vulnificus, Clostridium perfringens и Bacteroides fragilis. Индивиды с подавленной или поврежденной иммунной системой, наиболее вероятно, будут страдать дерматонекрозом (например, некротическим фасцитом).
В прошлом, стрептококк группы A диагностировали в качестве причины большинства случаев дермонекротических инфекций II типа. Однако с 2001 года с возрастающей частотой наблюдали, что метициллин-резистентный Staphylococcus aureus (MRSA) вызывает мономикробный некротический фасцит. Инфекция начинается локально, иногда в месте травмы, которая может быть тяжелой (такая как результат хирургического вмешательства), незначительной или даже невидимой. Пациенты обычно жалуются на сильную боль, которая может казаться избыточной с учетом внешнего вида кожи. С развитием заболевания ткань становится припухшей, часто в пределах нескольких часов. Диарея и рвота также являются обычными симптомами.
Признаки воспаления могут не быть заметными на ранних стадиях инфекции, если бактерии находятся глубоко в ткани. Если бактерии находятся неглубоко, признаки воспаления, такие как покраснение и припухлость или горячая кожа, проявляются очень быстро. Цвет кожи может становиться фиолетовым, и могут образовываться волдыри с последующим некрозом (например, отмиранием) подкожных тканей. Пациенты с некротическим фасцитом, как правило, имеют лихорадку и выглядят очень больными. Показатели смертности, как было указано, составляют вплоть до 73 процентов при отсуствтвии лечения. Без надлежащей медицинской помощи инфекция развивается быстро и в итоге приводит к смерти.
Пневмония
S. aureus также диагностировали как причину стафилококковой пневмонии. Стафилококковая пневмония вызывает воспаление и отек легкого, что, в свою очередь, вызывает скопление жидкости в легком. Скопление жидкости в легком может препятствовать попаданию кислорода в кровоток. Больные гриппом имеют риск развития бактериальной пневмонии. Staphylococcus aureus является наиболее распространенной причиной бактериальной пневмонии у больных, уже страдающих гриппом. Обычные симптомы стафилококковой пневмонии включают кашель, затрудненное дыхание и лихорадку. Дополнительные симптомы включают утомляемость, желтую или кровавую слизь и боль в груди, которая усиливается при дыхании. Метициллин-резистентный S. aureus (MRSA) все чаще диагностируют как штамм, идентифицируемый при стафилококковой пневмонии.
Инфекции послеоперационных ран
Послеоперационные раны часто проникают глубоко в тело. Инфекция таких ран, следовательно, представляет серьезную опасность для пациента, если рана становится инфицированной. S. aureus часто является возбудителем инфекций в послеоперационных ранах. S. aureus является необычайно способным к проникновению в послеоперационные раны, раны с наложенными швами могут быть инфицированы гораздо меньшим количеством клеток S. aureus, чем необходимо для того, чтобы вызвать инфекцию в нормальной коже. Проникновение в послеоперационную рану может приводить к тяжелой, вызванной S. aureus, септицемии. Проникновение S. aureus в кровоток может приводить к диссеминации и инфицированию внутренних органов, особенно сердечных клапанов и кости, вызывая системные заболевания, такие как эндокардит и остеомиелит.
Синдром ошпаренной кожи
S. aureus может являться главным возбудителем, если не возбудителем, "синдрома ошпаренной кожи", также называемого "стафилококковый синдром ошпаренной кожи", "токсический эпидермальный некроз", "локализованное буллезное импетиго", "болезнь Риттера" и "болезнь Лайела". Синдром ошпаренной кожи часто встречается у старших детей, как правило, при вспышках, вызванных развитием штаммов S. aureus, которые продуцируют эпидермолитические экзотоксины (например, эксфолиатин A и B, иногда называемый токсином синдрома ошпаренной кожи), который вызывает отслойку в пределах эпидермального слоя. Один из экзотоксинов кодируется бактериальной хромосомой, а другой кодируется плазмидой. Экзотоксины представляют собой протеазы, которые расщепляют десмоглеин-1, который в норме удерживает гранулезный и шиповатый слои кожи вместе.
Бактерии могут первоначально инфицировать только незначительный пораженный участок, однако токсин разрушает межклеточные соединения, распространяется по эпидермальным слоям и дает возможность инфекции проникать в наружный слой кожи, приводя к слущиванию, которое характеризует заболевание. Шелушение наружного слоя кожи обычно открывает нормальную кожу ниже, но потеря жидкости в процессе может вызывать тяжелое повреждение у детей младшего возраста при отсутствии соответствующего лечения.
Синдром токсического шока
Синдром токсического шока (TSS) вызван штаммами S. aureus, которые продуцируют так называемый "токсин синдрома токсического шока". Заболевание может быть вызвано инфекцией S. aureus в любом месте, но часто ошибочно рассматривается исключительно как заболевание только женщин, которые используют тампоны. Заболевание включает токсемию и септицемию и может быть летальным.
Симптомы синдрома токсического шока варьируют в зависимости от первопричины. TSS, возникающий в результате инфекции бактерий Staphylococcus aureus, как правило, проявляется у здоровых в других отношениях индивидов сильной лихорадкой, сопровождаемой низким кровяным давлением, дискомфортом и спутанностью сознания, которая может быстро развиться в помрачнение сознания, кому и мультиорганную недостаточность. Характерная сыпь, часто наблюдаемая на ранних стадиях течения заболевания, напоминает солнечный ожог и может затрагивать любую область тела, включая губы, рот, глаза, ладони и подошвы стоп. У пациентов, которые пережили первоначальный приступ инфекции, сыпь слущивается или отслаивается через 10-14 дней.
Как указано выше, вследствие возрастания количества резистентных ко многим лекарственным средствам штаммов S. aureus, возрастающее количество антибиотиков, широко применявшихся для лечения инфекций S. aureus, больше не контролируют или устраняют инфекции резистентным к метициллину и резистентным ко многим лекарственным средствам Staphylococcus aureus. Антитела к альфа-токсину S. aureus, описанные в данном документе, могут помочь снизить тяжесть инфекции, а также могут оказать помощь в устранении, предупреждении (профилактически) или сокращении количества патогенного S. aureus в инфицированном хозяине.
Антитела
Как используется в данном документе, выражения "антитело", "антитела" (также известные как иммуноглобулины) и "антигенсвязывающие фрагменты" охватывают моноклональные антитела (включая моноклональные антитела полной длины), поликлональные антитела, мультиспецифичные антитела, образованные из по меньшей мере двух различных фрагментов, связывающих эпитопы (например, биспецифичные антитела), человеческие антитела, гуманизированные антитела, верблюжьи антитела, химерные антитела, одноцепоченые Fv (scFv), одноцепоченые антитела, однодоменные антитела, доменные антитела, Fab фрагменты, F(ab')2 фрагменты, фрагменты антител, которые проявляют необходимую биологическую активность (например, антигенсвязывающая часть), связанные дисульфидными мостиками Fv (dsFv) и антиидиотипические (анти-Id) антитела (включая, например, анти-Id антитела к антителам, предлагаемым в данном документе), внутриклеточные антитела и фрагменты, связывающие эпитоп, любого из вышеуказанных. В частности, антитела включают молекулы иммуноглобулина и иммунологически активные фрагменты молекул иммуноглобулина, т.е. молекулы, которые содержат по меньшей мере один антигенсвязывающий центр. Молекулы иммуноглобулина могут быть любого изотипа (например, IgG, IgE, IgM, IgD, IgA и IgY), субизотипа (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или аллотипа (например, Gm, например, G1m (f, z, a или x), G2m (n), G3m (g, b, или c), Am, Em, и Km (1, 2 или 3)). Антитела могут быть получены от любого млекопитающего, включая без ограничения людей, обезьян, свиней, лошадей, кроликов, собак, котов, мышей и подобных, или других животных, таких как птицы (например, куры).
Нативные антитела, в целом, представляют собой гетеротетрамерные гликопротеины весом приблизительно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, тогда как количество дисульфидных мостиков изменяется у тяжелых цепей разных изотипов иммуноглобулина. Каждая тяжелая и легкая цепь также имеет расположенные с равными интервалами дисульфидные мостики между цепями. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует ряд константных доменов (CH). Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен (CL) на ее другом конце. Константный домен легкой цепи расположен на одной линии с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи расположен на одной линии с вариабельным доменом тяжелой цепи. Легкие цепи классифицируют на лямбда цепи или каппа цепи на основе аминокислотной последовательности константного участка легкой цепи. Вариабельный домен каппа легкой цепи может также обозначаться в данном документе как VK.
Антитела, предлагаемые в данном документе, включают антитело полной длины или интактное антитело, фрагменты антител, антитело с нативной последовательностью или аминокислотные варианты, человеческие, гуманизированные, подвергнутые посттрансляционной модификации антитела, химерные или гибридные антитела, иммуноконъюгаты и их функциональные фрагменты. Антитела могут быть модифицированы в Fc участке и определенные модификации могут обеспечить необходимые эффекторные функции или период полувыведения из сыворотки.
Также предполагаются антитела с одной или несколькими биологическими характеристиками (например, активность, аффинность к альфа-токсину, эффекторная функция, связывающая способность в отношении ортологов, нейтрализация, ингибирование образования гептамера альфа-токсина и подобное) настоящих антител к альфа-токсину и их фрагментов. Антитела к альфа-токсину и их фрагменты можно применять для диагностики, и/или лечения, и/или облегчения, и/или предупреждения одного или нескольких симптомов заболевания, связанного со Staphylococcus aureus, у млекопитающего, как описано выше.
В данном документе предлагается композиция, содержащая антитело к альфа-токсину или его фрагмент и носитель. С целью лечения связанного с S. aureus заболевания, композиции можно вводить пациенту, нуждающемуся в таком лечении, где композиция может содержать одно или несколько антител к альфа-токсину и/или их фрагментов. Также предлагаются составы, содержащие антитело к альфа-токсину или его фрагмент, как представлено в данном документе, и носитель. В некоторых вариантах осуществления состав представляет собой профилактический или терапевтический состав, содержащий фармацевтически приемлемый носитель.
В определенных вариантах осуществления предлагаемые в данном документе способы являются полезными для лечения заболевания/состояния, связанного Staphylococcus aureus и/или связанного альфа-токсином, и/или предупреждения и/или облегчения одного или нескольких симптомов заболевания или состояния у млекопитающего, включающего введение терапевтически эффективного количества антитела к альфа-токсину или его фрагмента млекопитающему. Профилактические или терапевтические композиции антитела можно вводить кратковременно (срочно), или хронически, или периодически, как указывается врачом.
В определенных вариантах осуществления готовые изделия содержат, по меньшей мере, антитело к альфа-токсину или его фрагмент, как например, стерильная лекарственная форма и/или в наборе. Набор, содержащий антитело к альфа-токсину или его фрагмент, может найти применение, например, для анализов киллинга клеток S. aureus, для очистки или иммунопреципитации альфа-токсина из клеток. Например, для выделения и очистки альфа-токсина, набор может содержать антитело к альфа-токсину или его фрагмент, соединенный с гранулами (например, гранулами сефарозы). Набор может содержать антитело для детекции и количественного определения S. aureus и/или альфа-токсина in vitro, например, в ELISA или вестерн-блоттинге. Такое антитело, полезное для детекции, можно обеспечить с меткой, такой как флуоресцентная или радиоизотопная метка.
Терминология
Следует понимать, что способ, предлагаемый в данном документе, не ограничивается конкретными композициями или этапами способа, поскольку они могут варьироваться. Указано, что, как используется в данном описании и приложенной формуле изобретения, формы единственного числа включают и соответствующие формы во множественном числе, если контекст явно не предписывает иное.
Выделенное антитело или его антигенсвязывающий фрагмент, который специфично связывает полипептид альфа-токсина (например, мономер альфа-токсина, называется в данном документе "антителом к альфа-токсину или фрагментом" в форме единственного числа и "антителами к альфа-токсину и их фрагментами" в форме множественного числа). Полипептиды альфа-токсина иногда называются альфа-гемолизином. Альфа-токсин образует поры в клеточных мембранах после олигомеризации в гептамер, где олигомеризованные полипептиды иногда собирательно называются "альфа-токсиновой порой" или "альфа-токсиновым гептамером".
Аминокислоты часто называются в данном документе с помощью общеизвестных трехбуквенных символов или с помощью однобуквенных символов, рекомендуемых Комиссией по биохимической номенклатуре IUPAC-IUB. Нуклеотиды, подобным образом, часто называются с помощью общепринятых однобуквенных кодов.
При нумерации аминокислот в вариабельном домене, определяющие комплементарность участки (CDR) и каркасные участки (FR) антитела следуют, если не указано иное, определению по Kabat, как изложено в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Maryland. (1991). При использовании этой системы нумерации фактическая линейная аминокислотная последовательность может содержать меньшее количество или дополнительные аминокислоты, соответствующие укорочению или вставке в FR или CDR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать вставку одной аминокислоты (остаток 52a согласно Kabat) после остатка 52 в H2 и вставленные остатки (например, остатки 82a, 82b и 82c и т.д. согласно Kabat) после остатка 82 FR тяжелой цепи. Нумерацию остатков по Kabat можно определить для данного антитела путем выравнивания участков антитела с гомологией последовательности антитела со "стандартной", пронумерованной по Kabat, последовательностью. Максимальное выравнивание каркасных остатков часто требует вставки "спейсерных" остатков в систему нумерации, чтобы использовать ее для Fv участка. Кроме того, идентичность определенных отдельных остатков в любом указанном пронумерованном по Kabat положении может изменяться от цепи антитела к цепи антитела вследствие межвидовой или аллельной дивергенции.
Антитела к альфа-токсину и их фрагменты
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент является выделенным, и/или очищенным, и/или не содержащим пирогенов. Выражение "очищенный", как используется в данном документе, относится к представляющей интерес молекуле, которая была идентифицирована и отделена и/или извлечена из компонента ее естественного окружения. Таким образом, в некоторых вариантах осуществления предлагаемое антитело представляет собой очищенное антитело, где оно было отделено от одного или нескольких компонентов его естественного окружения. Выражение "выделенное антитело", как используется в данном документе, относится к антителу, которое, по существу, не содержит других молекул антител, имеющих отличающиеся антигенные специфичности (например, выделенное антитело, которое специфично связывается с альфа-токсином, является, по существу, не содержащим антител, которые специфично связывают антигены, отличные от альфа-токсина). Молекула би- или мультиспецифичного антитела представляет собой выделенное антитело, если, по существу, не содержит молекул других антител. Таким образом, в некоторых вариантах осуществления обеспечены антитела, которые являются выделенными антителами, где они были отделены от антител с отличающейся специфичностью. Выделенное антитело может быть моноклональным антителом. Выделенное антитело, которое специфично связывается с эпитопом, изформой или вариантом альфа-токсина S. aureus, может, тем не менее, обладать перекрестной реактивностью с другими родственными антигенами, например, из других видов (например, видов-гомологов Staphylococcus). Выделенное антитело, которое обеспечено, может быть, по существу, не содержащим один или несколько других клеточных материалов. В некоторых вариантах осуществления предлагается комбинация "выделенных" моноклональных антител, и она относится к антителам, имеющим отличающиеся специфичности и объединенным в определенную композицию. Способы получения и очистки/выделения антитела к альфа-токсину или его фрагмента описаны в данном документе более подробно.
Представленные выделенные антитела содержат аминокислотные последовательности антитела, раскрытые в данном документе, которые могут кодироваться любым подходящим полинуклеотидом. Выделенные антитела иногда предлагаются в составленной форме. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент связывает альфа-токсин S. aureus и посредством этого частично или по существу изменяет по меньшей мере одну биологическую активность альфа-токсина, например, олигомеризацию в активный комплекс из гептамера.
Антитело к альфа-токсину или его фрагмент часто иммуноспецифично связывается с одним или несколькими эпитопами, специфичными к белку, пептиду, субъединице, фрагменту, части, олигомерам альфа-токсина или любой их комбинацией и в целом не связывается специфично с другими полипептидами. Выражение "олигомеры" или "олигомеры альфа-токсина" относятся к ассоциации мономеров альфа-токсина (например, 2 мономеров, 3 мономеров, 4 мономеров, 5 мономеров, 6 мономеров или
7 мономеров) с образованием функциональной поры (например, 7 мономеров альфа-токсина). Эпитоп может содержать по меньшей мере один связывающийся с антителом участок, который содержит по меньшей мере одну часть белка альфа-токсина. Выражение "эпитоп", как используется в данном документе, относится к белковой детерминанте, способной связываться с антителом. Эпитопы обычно включают химически активные поверхностные группировки молекул, такие как аминокислоты и/или боковые цепи из Сахаров, и обычно характеризуются конкретными характеристиками трехмерной структуры, также как и конкретными химическими характеристиками (например, заряд, полярность, основность, кислотность, гидрофобность и подобное). Конформационные и неконформационные эпитопы отличаются тем, что связывание с первыми, но не с последними, теряется в присутствии денатурирующих растворителей. В некоторых вариантах осуществления распознанный эпитоп препятствует образованию активного гептамера (например, ингибирует олигомеризацию мономеров альфа-токсина в активный комплекс из гептамера),
В определенных вариантах осуществления эпитоп состоит из по меньшей мере части белка альфа-токсина, который вовлечен в образование комплекса из гептамера альфа-токсина. Определенный эпитоп может содержать любую комбинацию из по меньшей мере одной аминокислотной последовательности от по меньшей мере 3 аминокислотных остатков от полной определенной части из смежных аминокислот белка альфа-токсина. В некоторых вариантах осуществления эпитоп представляет собой по меньшей мере 4 аминокислотных остатка, по меньшей мере 5 аминокислотных остатков, по меньшей мере 6 аминокислотных остатков, по меньшей мере 7 аминокислотных остатков, по меньшей мере 8 аминокислотных остатков, по меньшей мере 9 аминокислотных остатков, по меньшей мере 10 аминокислотных остатков, по меньшей мере 11 аминокислотных остатков, по меньшей мере 12 аминокислотных остатков, по меньшей мере 13 аминокислотных остатков, по меньшей мере 14 аминокислотных остатков или по меньшей мере 15 аминокислотных остатков от полной определенной части из смежных аминокислот белка альфа-токсина. В некоторых других вариантах осуществления эпитоп содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 смежных или несмежных аминокислотных остатков. В дополнительных вариантах осуществления аминокислотные остатки, содержащиеся в пределах эпитопа, вовлечены в образование комплекса из гептамера альфа-токсина. В определенных вариантах осуществления контактирующие остатки содержат T261, T263, N264, K266 и K271. В других вариантах осуществления контактирующие остатки содержат N177, W179, G180, P181, Y182, D183, D185, S186, W187, N188, P189, V190, Y191 и R200 из SEQ ID NO: 39. В дополнительных вариантах осуществления контактирующие остатки содержат N177, W179, G180, P181, Y182, D183, D185, S186, W187, N188, P189, V190, Y191, R200, T261, T263, N264, K266 и K271 из SEQ ID NO: 39. В определенных вариантах осуществления часть альфа-токсина, контактирующая с антителом или его антигенсвязывающим фрагментом, содержит аминокислоты 261-272 из SEQ ID NO: 39. В других вариантах осуществления часть альфа-токсина, контактирующая с антителом или его антигенсвязывающим фрагментом, содержит аминокислоты 248-277 из SEQ ID NO: 39. В других вариантах осуществления часть альфа-токсина, контактирующая с антителом или его антигенсвязывающим фрагментом, содержит аминокислоты 173-201 и 261-272 из SEQ ID NO: 39.
Таким образом, в конкретных вариантах осуществления, выделенные/очищенные антитела к альфа-токсину и их фрагменты иммуноспецифично связываются с молекулой, содержащей аминокислотную последовательность в соответствии с SEQ ID NO: 39, и/или с молекулой, содержащей аминокислотную последовательность в соответствии с SEQ ID NO: 40. В определенных вариантах осуществления антитела к альфа-токсину и их фрагменты также связывают гомологи или ортологи альфа-токсина из различных видов или вариантов аминокислотной последовательности SEQ ID NO: 39, где гистидин в положении 35 заменен лейцином или заменен другими аминокислотами, соответствующими мутациям H35, известным специалисту в данной области техники.
Вариабельные участки
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент получают из исходного антитела. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент заключено в пределах исходного антитела. Как используется в данном документе, выражение "исходное антитело" относится к антителу, которое кодируется аминокислотной последовательностью, используемой для получения варианта или производного, определенных в данном документе. Исходный полипептид может содержать последовательность нативного антитела (т.е. встречающуюся в естественных условиях, включая встречающийся в естественных условиях аллельный вариант) или последовательность антитела с ранее существовавшими модификациями аминокислотной последовательности (такими как другие вставки, делеции и/или замены) встречающейся в естественных условиях последовательности. Исходное антитело может быть гуманизированным антителом или человеческим антителом. В конкретных вариантах осуществления антитела к альфа-токсину и их фрагменты являются вариантами исходного антитела. Как используется в данном документе, выражение "вариант" относится к антителу к альфа-токсину или его фрагменту, который отличается по аминокислотной последовательности от "исходного" антитела к альфа-токсину или фрагмента аминокислотной последовательности вследствие присоединения, делеции и/или замены одного или нескольких аминокислотных остатков в последовательности исходного антитела.
Антигенсвязывающая часть антитела содержит один или несколько фрагментов антитела, которые сохраняют способность к специфическому связыванию с антигеном (например, альфа-токсином). Было показано, что антигенсвязывающая функция антитела может осуществляться фрагментами антитела полной длины. Примеры связывающих фрагментов, охватываемые выражением "антигенсвязывающая часть" антитела, включают (i) Fab фрагмент, моновалентный фрагмент, состоящий из VL, VH, CL и CH1 доменов; (ii) F(ab')2 фрагмент, бивалентный фрагмент, содержащий два Fab фрагмента, связанные дисульфидным мостиком в шарнирном участке; (iii) Fd фрагмент, состоящий из VH и CH1 доменов; (iv) Fv фрагмент, состоящий из VL и VH доменов одного плеча антитела, (v) dAb фрагмент, который состоит из VH домена; и (vi) выделенный определяющий комплементарность участок (CDR). Хотя два домена Fv фрагмента, VL и VH, часто кодируются отдельными генами, их можно объединить с применением рекомбинантных способов с помощью синтетического линкера, который дает возможность их получения в виде одной белковой цепи, в которой VL и VH участки спариваются с образованием моновалентной молекулы (известной как одноцепочечный Fv (scFv)). Такие одноцепочечные антитела также охватываются выражениями "антитело" и "антигенсвязывающая часть" антитела. Эти фрагменты антител можно получить с использованием известных методик, и фрагменты можно подвергнуть скринингу в отношении активности связывания таким же образом, как и интактные антитела. Антигенсвязывающие части можно получить с помощью методик рекомбинантной ДНК или с помощью ферментативного или химического расщепления интактных иммуноглобулинов.
Данные антитела к альфа-токсину и их фрагменты содержат по меньшей мере один антигенсвязывающий домен. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент содержит VH, содержащий аминокислотную последовательность SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62. В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент содержит VL, содержащий аминокислотную последовательность SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63. В еще одном варианте осуществления антитело к альфа-токсину или его фрагмент содержит VH, содержащий аминокислотную последовательность SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62, и VL, содержащий аминокислотную последовательность SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63. Смотри Пример 11, Таблица 7 для получения представления о последовательностях VH и VL, как представлено в данном документе, которые могут присутствовать в любом сочетании с образованием антитела к альфа-токсину или его фрагмента или присутствовать в сочетании с образованием mAb согласно настоящему изобретению. В некоторых вариантах осуществления VH выбран из SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62. В различных вариантах осуществления VL выбран из SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63. Нуклеотидные последовательности определенных VH и VL представлены в Примере 11, Таблица 8.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат VH и VL, где VH и VL имеют аминокислотные последовательности, представленные SEQ ID NO: 20 и 19; SEQ ID NO: 22 и 21; SEQ ID NO: 24 и 23; SEQ ID NO: 26 и 25; SEQ ID NO: 28 и 27; SEQ ID NO: 41 и 42; SEQ ID NO: 43 и 44; SEQ ID NO: 45 и 46; SEQ ID NO: 47 и 48; SEQ ID NO: 47 и 48; SEQ ID NO: 49 и 50; SEQ ID NO: 51 и 52; SEQ ID NO: 51 и 52; SEQ ID NO: 53 и 54; SEQ ID NO: 55 и 56; SEQ ID NO: 57 и 58; SEQ ID NO: 59 и 60; SEQ ID NO: 61 и 58; SEQ ID NO: 62 и 58; SEQ ID NO: 62 и 63; SEQ ID NO: 79 и 63.
Таблицы 1-7 из Примера 11 представляют вариабельные участки тяжелой цепи (VH), вариабельные участки легкой цепи (VL) и определяющие комплементарность участки (CDR) для определенных вариантов осуществления антител и их фрагментов, представленных в данном документе. В определенных вариантах осуществления антитела к альфа-токсину и их фрагменты содержат VH и/или VL, которые имеют заданную процентную идентичность с по меньшей мере одной из последовательностей VH и/или VL, раскрытых в Таблице 7. Как используется в данном документе, выражение "процентная (%) идентичность последовательности", также включающее "гомологию", определено как процентная доля аминокислотных остатков или нуклеотидов в кандидатной последовательности, которые являются идентичными с аминокислотными остатками или нуклеотидами в эталонных последовательностях, таких как последовательность исходного антитела, после выравнивания последовательностей и введения гэпов, если необходимо, для достижения максимальной процентной идентичности последовательности, и не учитывает всех консервативных замен в рамках идентичности последовательности. Оптимальное выравнивание последовательностей для сравнения можно получить, помимо выравнивания вручную, с помощью алгоритмов локальной гомологии, известных в данной области техники, или с помощью компьютерных программ, которые используют эти алгоритмы (GAP, BESTFIT, FASTA, BLAST P, BLAST N и TFASTA в пакете программного обеспечения Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Drive, Мадисон, Висконсин).
В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент содержит аминокислотную последовательность VH, которая по меньшей мере на 65%, 70%, 75%, 80%, 85%, 90%, 95% идентична или которая на 100% идентична аминокислотной последовательности SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент включает аминокислотную последовательность VH, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичную или на 100% идентичную аминокислотной последовательности SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62. В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент содержит 1-10 консервативных замен в аминокислотной последовательности SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62. В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент, содержащий аминокислотную последовательность VH с заданной процентной идентичностью с SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62, характеризуется одной или несколькими характеристиками (описанными более подробно ниже), выбранными из группы, состоящей из следующего:
(a) константа аффинности (KD) к альфа-токсину приблизительно 13 нМ или менее;
(b) связывается с мономерами альфа-токсина, но не ингибирует связывание альфа-токсина с рецептором альфа-токсина;
(c) ингибирует образование олигомеров альфа-токсина по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95%;
(d) снижает цитолитическую активность альфа-токсина по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95% (например, как определено посредством анализов на основе клеточного лизиса и гемолиза);
(e) снижает клеточную инфильтрацию и высвобождение провоспалительных цитокинов (например, в животной модели пневмонии).
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент связывает антиген (например, альфа-токсин) с аффинностью, характеризующейся константой диссоциацией (KD) в диапазоне приблизительно от 0,01 нМ до приблизительно 50 нМ, 0,05 нМ, 0,1 нМ, 0,5 нМ, 1 нМ, 5 нМ, 10 нМ, 20 нМ, 30 нМ или 40 нМ.
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент содержат аминокислотную последовательность VL, по меньшей мере на 65%, 70%, 75%, 80%, 85%, 90%, 95% идентичную или на 100% идентичную аминокислотной последовательности SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент включают аминокислотную последовательность VL, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентична или на 100% идентична аминокислотной последовательности SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63. В различных вариантах осуществления антитело к альфа-токсину или его фрагмент содержат 1-10 консервативных замен в аминокислотной последовательности SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63. В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент содержит аминокислотную последовательность VL с заданной процентной идентичностью с SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63 и характеризуется одной или несколькими характеристиками (описанными более подробно ниже), выбранными из группы, состоящей из следующего:
(a) константа аффинности (KD) в отношении альфа-токсина приблизительно 13 нМ или менее;
(b) связывается с мономерами альфа-токсина, но не ингибирует связывание альфа-токсина с рецептором альфа-токсина;
(c) ингибирует образование олигомеров альфа-токсина по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95%;
(d) снижает цитолитическую активность альфа-токсина по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95%; (например, как определено посредством анализов на основе клеточного лизиса и гемолиза);
(e) снижает клеточную инфильтрацию и высвобождение провоспалительных цитокинов (например, в животной модели пневмонии).
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент связывают антиген (например, альфа-токсин) с аффинностью, характеризующейся константой диссоциации (KD) в диапазоне от приблизительно 0,01 нМ до приблизительно 50 нМ, 0,05 нМ, 0,1 нМ, 0,5 нМ, 1 нМ, 5 нМ, 10 нМ, 20 нМ, 30 нМ или 40 нМ.
В конкретных вариантах осуществления антитело или фрагмент антитела иммуноспецифично связывается с альфа-токсином и содержит вариабельный домен тяжелой цепи, который по меньшей мере на 90% идентичен аминокислотной последовательности SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62, и содержит вариабельный домен легкой цепи, который по меньшей мере на 90% идентичен аминокислотной последовательности SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63, где антитело обладает активностью ингибирования связывания одного или нескольких мономеров альфа-токсина друг с другом (например, ингибирует олигомеризацию).
Определяющие комплементарность участки
Хотя вариабельный домен (VH и VL) содержит антигенсвязывающий участок, вариабельность распределяется по вариабельным доменам антител неравномерно. Она концентрируется в сегментах, называемых определяющими комплементарность участками (CDR) в вариабельных доменах как легкой цепи (VL или VK), так и тяжелой цепи (VH). Более высококонсервативные части вариабельных доменов называются каркасными участками (FR). Каждый из вариабельных доменов нативных тяжелых и легких цепей содержит четыре FR, по большей части принимающие конфигурацию β-листа, соединенные тремя CDR, которые образуют петли, соединяющие и в некоторых случаях образующие часть бетаскладчатой структуры. CDR в каждой цепи удерживаются в непосредственной близости с помощью FR и с CDR из другой цепи способствуют образованию антигенсвязывающего сайта антител (смотри Kabat et al., выше). Три CDR тяжелой цепи обозначаются VH-CDR1, CDR2 VH и VH-CDR-3, и три CDR легкой цепи обозначаются VL-CDR1, VL-CDR2 и VI-CDR3. В данном документе используется система нумерации по Kabat. Соответственно, VH-CDR1 начинается примерно на аминокислоте 31 (т.е. примерно на 9 остатков после первого цистеинового остатка), включает примерно 5-7 аминокислот и заканчивается на следующем сериновом остатке. VH-CDR2 начинается на пятнадцатом остатке от конца CDR-H1, включает примерно 16-19 аминокислот и заканчивается на следующем глициновом остатке. VH-CDR3 начинается примерно на тридцатом аминокислотном остатке от конца VH-CDR2; включает примерно 13-15 аминокислот и заканчивается на последовательности M-D-V. VL-CDR1 начинается примерно на остатке 24 (т.е. после цистеинового остатка), включает примерно 10-15 остатков и заканчивается последовательностью Y-V-S. VL-CDR2 начинается примерно на шестнадцатом остатке от конца VL-CDR1 и включает примерно 7 остатков. VL-CDR3 начинается примерно на тридцать третьем остатке от конца VH-CDR2, включает примерно 7-11 остатков и заканчивается на последовательности Т-I-L. Следует отметить, что CDR варьируют в значительной степени от антитела к антителу (и по определению не будут проявлять гомологию с консенсусными последоватиельностями по Kabat).
Данные антитела к альфа-токсину и их фрагменты содержат по меньшей мере один антигенсвязывающий домен, который включает по меньшей мере один определяющий комплементарность участок (CDR1, CDR2 или CDR3). В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент содержит VH, который включает по меньшей мере один CDR VH (например, CDR-H1, CDR-H2 или CDR-H3). В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент содержит VL, который включает по меньшей мере один CDR VL (например, CDR-L1, CDR-L2 или CDR-L3).
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент, который иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus включает, (a) CDR1 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 7, 10, 13 или 69 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; (b) CDR2 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 8, 11, 14, 17, 70 или 75 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; и (c) CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат CDR1 VH, CDR2 VH и CDR3 VH, содержащие аминокислотные последовательности, идентичные SEQ ID NO: 7, 8 и 9; SEQ ID NO: 10, 11 и 12; SEQ ID NO: 13, 14 и 15; SEQ ID NO: 7, 17 и 18; SEQ ID NO: 7, 8 и 16; SEQ ID NO: 7, 8 и 65; SEQ ID NO: 7, 8 и 66; SEQ ID NO 7, 8, и 67; SEQ ID NO: 7, 8 и 78; SEQ ID NO: 69, 70 и 71; SEQ ID NO: 7, 8 и 72; SEQ ID NO: 69, 75 и 71; SEQ ID NO: 69, 75 и 76 или SEQ ID NO: 69, 70 и 71 или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по отношению к ним.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, включают (a) CDR1 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 1 или 4 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; (b) CDR2 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 2, 5, 73 или 77 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; и (c) CDR3 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 3, 6, 64, 68 или 74 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат CDR1 VL, CDR2 VL и CDR3 VL, содержащие аминокислотные последовательности, идентичные SEQ ID NO: 1, 2 и 3; SEQ ID NO: 4, 5 и 6; SEQ ID NO: 1, 2 и 64; SEQ ID NO: 1, 2 и 68; SEQ ID NO: 1, 73 и 74 или SEQ ID NO: 1, 77 и 74 или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по отношению к ним.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, содержат CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL, содержащие аминокислотные последовательности, идентичные или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по отношению к (a) CDR1 VH, содержащему аминокислотную последовательность SEQ ID NO: 7, 10, 13 или 69; (b) CDR2 VH, содержащему аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75; (c) CDR3 VH, содержащему аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78; (d) CDR1 VL, содержащему аминокислотную последовательность SEQ ID NO: 1 или 4; (e) CDR2 VL, содержащему аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и (f) CDR3 VL, содержащему аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL, содержащие аминокислотные последовательности, идентичные SEQ ID NO: 7, 8, 9, 1, 2 и 3; SEQ ID NO: 10, 11, 12, 1, 2 и 3; SEQ ID NO: 13, 14, 15, 4, 5 и 6; SEQ ID NO: 7, 17, 18, 1, 2 и 3; SEQ ID NO: 7, 8, 16, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1, 2 и 64; SEQ ID NO: 7, 8, 66, 1, 2 и 64; SEQ ID NO: 7, 8, 67, 1, 2 и 68; SEQ ID NO: 7, 8, 67, 1, 2 и 64; SEQ ID NO: 7, 8, 78, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1, 2 и 68; SEQ ID NO: 69, 70, 71, 1, 2 и 68; SEQ ID NO: 7, 8, 72, 1, 73 и 74; SEQ ID NO: 69, 75, 71, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 77 и 74; SEQ ID NO: 69, 70, 71, 1, 77 и 74 или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по отношению к ним.
В некоторых вариантах осуществления предлагается композиция, которая содержит выделенное антитело или его антигенсвязывающий фрагмент, которые (i) включают VH-домен цепи, содержащий три CDR, и VL-домен цепи, содержащий три CDR; и (ii) иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, где три CDR VH-домена цепи включают (a) CDR1 VH, содержащий аминокислотную последовательность SEQ ID NO: 7, 10, 13 или 69; (b) CDR2 VH, содержащий аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75; и (c) CDR3 VH, содержащий аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78. В конкретных вариантах осуществления CDR1 VH, CDR2 VH и CDR3 VH соответствуют SEQ ID NO: 7, 8 и 9; SEQ ID NO: 10, 11 и 12; SEQ ID NO: 13, 14 и 15; SEQ ID NO: 7, 17 и 18; SEQ ID NO: 7, 8 и 16; SEQ ID NO: 7, 8 и 65; SEQ ID NO: 7, 8 и 66; SEQ ID NO 7, 8, и 67; SEQ ID NO: 7, 8 и 78; SEQ ID NO: 69, 70 и 71; SEQ ID NO: 7, 8 и 72; SEQ ID NO: 69, 75 и 71; SEQ ID NO: 69, 75 и 76 или SEQ ID NO: 69, 70 и 71.
В определенных вариантах осуществления также предлагается композиция, которая содержит выделенное антитело или его антигенсвязывающий фрагмент, которые (i) включают VH-домен цепи, содержащий три CDR, и VL-домен цепи, содержащий три CDR; и (ii) иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, где три CDR VL-домена цепи включают (a) CDR1 VL, содержащий аминокислотную последовательность SEQ ID NO: 1 или 4; (b) CDR2 VL, содержащий аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и (c) CDR3 VL, содержащий аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74. В конкретных вариантах осуществления CDR1 VL, CDR2 VL и CDR3 VL соответствуют SEQ ID NO: 1, 2 и 3; SEQ ID NO: 4, 5 и 6; SEQ ID NO: 1, 2 и 64; SEQ ID NO: 1, 2 и 68; SEQ ID NO: 1, 73 и 74 или SEQ ID NO: 1, 77 и 74.
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент иммуноспецифично связывает альфа-токсин S. aureus и содержит (а) CDR1 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 7, 10, 13 или 69 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; (b) CDR2 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 8, 11, 14, 17, 70 или 75 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; и (c) CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним; (d) CDR1 VL, содержащий аминокислотную последовательность SEQ ID NO: 1 или 4; (e) CDR2 VL, содержащий аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и (f) CDR3 VL, содержащий аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74, и характеризуется одной или несколькими характеристиками (описанными более подробно ниже), выбранными из группы, состоящей из следующего:
(a) константа аффинности (KD) в отношении альфа-токсина приблизительно 13 нМ или менее;
(b) связывается с мономерами альфа-токсина, но не ингибирует связывание альфа-токсина с рецептором альфа-токсина;
(c) ингибирует образование олигомеров альфа-токсина по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95%;
(d) снижает цитолитическую активность альфа-токсина по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95%; (например, как определено посредством анализов на основе клеточного лизиса и гемолиза);
(e) снижает клеточную инфильтрацию и высвобождение провоспалительных цитокинов (например, в животной модели пневмонии).
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент связывает антиген (например, альфа-токсин) с аффинностью, характеризующейся константой диссоциации (KD) в диапазоне от приблизительно 0,01 нМ до приблизительно 50 нМ, 0,05 нМ, 0,1 нМ, 0,5 нМ, 1 нМ, 5 нМ, 10 нМ, 20 нМ, 30 нМ или 40 нМ.
В Таблицах 1-7 в Примере 11 представлены последовательности для CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL для антител согласно настоящему изобретению. В Таблице 9 представлено краткое описание CDR VH и VL. Эти участки можно комбинировать во множестве комбинаций, поскольку каждый участок CDR можно независимо выбрать для данного антитела. В Таблице 7 иллюстрируются различные последовательности, которые можно выбрать для каждого участка. В определенных вариантах осуществления последовательности CDR3 VL могут присутствовать в любой комбинации для образования данного антитела к альфа-токсину или его фрагмента. В определенных вариантах осуществления CDR1 VH выбран из SEQ ID NO: 7, 10, 13 или 69, CDR2 VH выбран из SEQ ID NO: 8, 11, 14, 17, 70 или 75, и CDR3 VH выбран из SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78, как описано в Таблице 9. В некоторых вариантах осуществления CDR1 VL выбран из SEQ ID NO: 1 или 4, CDR2 VL выбран из SEQ ID NO: 2, 5, 73 или 77, и CDR3 VL выбран из SEQ ID NO: 3, 6, 64, 68 или 74, как описано в Таблице 9.
CDR3 VH и CDR3 VL домены играют роль в специфичности связывания/связывающей способности антитела в отношении антигена. (Соответственно, в некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент или его антигенсвязывающий фрагмент содержит CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним. В различных вариантах осуществления антитело к альфа-токсину или его фрагмент содержит CDR3 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 3, 6, 64, 68 или 74 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним. Остальные части антител к альфа-токсину и их фрагментов (например, CDR1, CDR2, VH, VL и подобное) могут содержать специфические последовательности, раскрытые в данном документе, или известные последовательности, предоставляющие антителам к альфа-токсину и их фрагментам возможность иммуноспецифично связываться с альфа-токсином S. aureus.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывает альфа-токсин и содержит CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или антигенсвязывающий фрагмент ингибирует олигомеризацию альфа-токсина.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывает альфа-токсин и содержит CDR3 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 3, 6, 64, 68 или 74 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или антигенсвязывающий фрагмент ингибирует олигомеризацию альфа-токсина.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывает альфа-токсин и содержит CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или антигенсвязывающий фрагмент снижает или ингибирует высвобождение цитокинов.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывает альфа-токсин и содержит CDR3 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 3, 6, 64, 68 или 74 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или антигенсвязывающий фрагмент снижает или ингибирует высвобождение цитокинов.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывает альфа-токсин и содержит CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или антигенсвязывающий фрагмент ослабляет или устраняет дерматонекроз.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывает альфа-токсин и содержит CDR3 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 3, 6, 64, 68 или 74 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или антигенсвязывающий фрагмент ослабляет или устраняет дерматонекроз.
Антитела к альфа-токсину и их фрагменты часто содержат одну или несколько аминокислотных последовательностей, по существу аналогичных аминокислотной последовательности, описанной в данном документе. Аминокислотные последовательности, которые являются, по сути, аналогичными включают последовательности, содержащие консервативные аминокислотные замены, а также делеции и/или вставки аминокислот.Консервативная аминокислотная замена относится к замене первой аминокислоты на вторую аминокислоту, которая имеет химические и/или физические свойства (например, заряд, структуру, полярность, гидрофобность/гидрофильность), которые являются подобными таковым для первой аминокислоты. Консервативные замены включают замену одной аминокислоты на другую в пределах следующих групп: лизин (K), аргинин (R) и гистидин (H); аспартат (D) и глутамат (E); аспарагин (N), глутамин (Q), серии (S), треонин (Т), тирозин (Y), К, R, Н, D и Е; аланин (A), валин (V), лейцин (L), изолейцин (I), пролин (P), фенилаланин (F), триптофан (W), метионин (M), цистеин (C) и глицин (G); F, W и Y; C, S и. T.
Каркасные участки
Каждый из вариабельных доменов тяжелых и легких цепей содержит четыре каркасных участка (в целом, FR1, FR2, FR3, FR4 или, в качестве альтернативы, FW1, FW2, FW3, FW4), которые являются более высококонсервативными частями вариабельных доменов. Четыре каркасных участка тяжелой цепи обозначены в данном документе VH-FW1, VH-FW2, VH-FW3 и VH-FW4, а четыре каркасных участка легкой цепи обозначены в данном документе VL-FW1, VL-FW2, VL-FW3 и VH-FW4. В данном документе используется система нумерации по Kabat, и, соответственно, VH-FW1 начинается в положении 1 и заканчивается примерно на аминокислоте 30, VH-FW2 находится примерно от аминокислоты 36 до 49, VH-FW3 находится примерно от аминокислоты 66 до 94, и VH-FW4 находится примерно от аминокислоты 103 до 113. VL-FW1 начинается на аминокислоте 1 и заканчивается примерно на аминокислоте 23, VL-FW2 находится примерно от аминокислоты 35 до 49, VL-FW3 находится примерно от аминокислоты 57 до 88, и VL-FW4 находится примерно от аминокислоты 98 до 107. В определенных вариантах осуществления каркасные участки содержат замещения, в соответствии с системой нумерации по Kabat, например, вставку в 106А в VL-FW1. Дополнительно к встречающимся в естественных условиях замещениям, одно или несколько изменений (например, замещений) остатков FR можно ввести в антитело к альфа-токсину или его фрагмент. В определенных вариантах осуществления эти изменения приводят в результате к улучшению или оптимизации связывающей способности антитела в отношении альфа-токсина. Неограничивающие примеры остатков в каркасном участке, которые можно модифицировать, включают те, которые нековалентно связывают антиген напрямую, взаимодействуют с/оказывают воздействие на конформацию CDR и/или участвуют в поверхности контакта VL-VH.
В определенных вариантах осуществления каркасный участок может содержать одну или несколько аминокислотных замен с целью "модификации путем внедрения участков гена антител зародышевого типа". Например, аминокислотные последовательности тяжелой и легкой цепей выбранного антитела сравнивают для модификации аминокислотных последовательностей тяжелой и легкой цепи путем внедрения участков гена антител зародышевого типа, и где определенные каркасные остатки выбранных VL и/или VH цепей отличаются от конфигурации зародышевого типа (например, в результате соматической мутации генов иммуноглобулина, используемых для получения фаговой библиотеки), может быть желательно "мутировать к первоначальному виду" измененные каркасные остатки выбранных антител до конфигурации зародышевого типа (т.е. изменить каркасные аминокислотные последовательности выбранных антител с тем, чтобы они были аналогичными каркасным аминокислотным последовательностям зародышевого типа). Такая "мутация к первоначальному виду" (или "модификация путем внедрения участков гена антител зародышевого типа") каркасных остатков можно осуществить с помощью стандартных способов молекулярной биологии для внедрения специфических мутаций (например, сайт-направленный мутагенез; ПЦР-опосредованный мутагенез и подобное). В некоторых вариантах осуществления каркасные остатки вариабельных участков легкой и/или тяжелой цепи является мутированным к первоначальному виду. В определенных вариантах осуществления присутствующий вариабельный участок тяжелой цепи выделенного антитела или его антигенсвязывающего фрагмент является мутированным к первоначальному виду. В определенных вариантах осуществления вариабельный участок тяжелой цепи выделенного антитела или его антигенсвязывающий фрагмент содержат по меньшей мере один, по меньшей мере два, по меньшей мере три, по меньшей мере четыре или более мутаций к первоначальному виду.
В определенных вариантах осуществления VH антитела к альфа-токсину или его фрагмента, представленные в данном документе, могут содержать FR1, FR2, FR3 и/или FR4, которые имеют идентичность аминокислотной последовательности с соответствующими каркасными участками (т.е. FR1 антитела X в сравнении с FR1 антитела Y) в пределах SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62, которая составляет от приблизительно 65% до приблизительно 100%. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент содержит аминокислотную последовательность FR VH (FR1, FR2, FR3 и/или FR4), по меньшей мере на 65%, 70%, 75%, 80%, 85%, 90%, 95% идентичную или на 100% идентичную соответствующему FR из VH SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62. В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент содержит аминокислотную последовательность FR VH (FR1, FR2, FR3 и/или FR4), по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичную или на 100% идентичную соответствующему FR из VH SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62.
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент могут содержать FR VH (FR1, FR2, FR3 и/или FR4), содержащий аминокислотную последовательность, идентичную или содержащую 1, 2 или 3 аминокислотные замены по отношению к соответствующему FR из VH SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62. В частности, каждый из FR1, FR2, FR3 или FR4 из VH может иметь аминокислотную последовательность, идентичную или содержащую 1, 2 или 3 аминокислотные замены по отношению к соответствующему FR1, FR2, FR3 или FR4 из VH SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62.
В определенных вариантах осуществления VL антитела к альфа-токсину или его фрагмента, представленных в данном документе, могут содержать FR1, FR2, FR3 и/или FR4, которые имеют идентичность аминокислотной последовательности с соответствующими каркасными участками (т.е. FR1 антитела X в сравнении с FR1 антитела Y) в пределах FR из VL SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63 (например, идентичность последовательности от приблизительно 65% до приблизительно 100%). В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент содержит аминокислотную последовательность FR VL (FR1, FR2, FR3 и/или FR4), по меньшей мере на 65%, 70%, 75%, 80%, 85%, 90%, 95% идентичную или на 100% идентичную соответствующему FR из VL SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63. В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент содержит аминокислотную последовательность FR VL (FR1, FR2, FR3 и/или FR4), по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичную или на 100% идентичную соответствующему FR из VL SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент содержит FR VL (FR1, FR2, FR3 и/или FR4), содержащий аминокислотную последовательность, идентичную или содержащую 1,2 или 3 аминокислотные замены по отношению к соответствующему FR из VL SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63. В частности, каждый из FR1, FR2, FR3 или FR4 из VL может иметь аминокислотную последовательность, идентичную или содержащую 1, 2 или 3 аминокислотные замены по отношению к соответствующему FR1, FR2, FR3 или FR4 из VH SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
В определенных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывает альфа-токсин и содержит FR VH (FR1, FR2, FR3 и/или FR4), содержащий аминокислотную последовательность, идентичную или содержащую 1, 2 или 3 аминокислотные замены по отношению к соответствующему FR из VH SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62, и/или FR VL (FR1, FR2, FR3 и/или FR4), содержащий аминокислотную последовательность, идентичную или содержащую 1, 2 или 3 аминокислотные замены по отношению к соответствующему FR из VL SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63, где антитело характеризуется одной или несколькими характеристиками (описанными более подробно ниже), выбранными из группы, состоящей из следующего:
(a) константа аффинности (KD) в отношении альфа-токсина приблизительно 13 нМ или менее;
(b) связывается с мономерами альфа-токсина, но не ингибирует связывание альфа-токсина с рецептором альфа-токсина;
(c) ингибирует образование олигомеров альфа-токсина по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95%;
(d) снижает цитолитическую активность альфа-токсина по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95%; (например, как определено с помощью анализа клеточного лизиса и гемолиза);
(e) снижает клеточную инфильтрацию и высвобождение провоспалительных цитокинов (например, в животной модели пневмонии).
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент связывает антиген (например, альфа-токсин) с аффинностью, характеризующейся константой диссоциации (KD) в диапазоне от приблизительно 0,01 нМ до приблизительно 50 нМ, 0,05 нМ, 0,1 нМ, 0,5 нМ, 1 нМ, 5 нМ, 10 нМ, 20 нМ, 30 нМ или 40 нМ.
Нуклеотидные последовательности, кодирующие антитела к альфа-токсину и фрагменты
Дополнительно к аминокислотным последовательностям, описанным выше, предлагаются также нуклеотидные последовательности, соответствующие аминокислотным последовательностям и кодирующие человеческие, гуманизированные и/или химерные антитела, раскрытые в данном документе. В некоторых вариантах осуществления полинуклеотиды содержат нуклеотидную последовательность, кодирующую антитело к альфа-токсину или его фрагмент, описанные в данном документе, или ее фрагменты. Они включают без ограничения нуклеотидные последовательности, которые кодируют упомянутые выше аминокислотные последовательности. Нуклеотидные последовательности представлены в Таблице 8 в Примере 11. Следовательно, также предлагаются последовательности полинуклеотидов, кодирующих каркасные участки VH и VL, в том числе CDR и FR антител, описанных в данном документе, а также векторы экспрессии для их эффективной экспрессии в клетках (например, клетки млекопитающего). Способы получения антитела к альфа-токсину или его фрагмента с применением полинуклеотидов описаны далее более подробно.
Также включены полинуклеотиды, которые гибридизуются в жестких условиях гибридизации или в условиях более низкой жесткости, например, которые определены в данном документе, с полинуклеотидами, которые кодируют антитело к альфа-токсину или его фрагмент. Выражение "жесткость", как используется в данном документе, относится к условиям эксперимента (например, температуре и концентрации соли) для эксперимента по гибридизации для определения степени гомологии между двумя нуклеиновыми кислотами; чем выше жесткость, тем выше процент гомологии между двумя нуклеиновыми кислотами.
Жесткие условия гибридизации включают без ограничения гибридизацию связанной на фильтре ДНК в 6X хлориде натрия/цитрате натрия (SSC) при приблизительно 45 градусах Цельсия, за которой следует одна или несколько отмывок в 0,2X SSC/0,1% SDS при приблизительно 50-65 градусах Цельсия, состояния высокой жесткости, такие как гибридизация связанной на фильтре ДНК в 6X SSC при приблизительно 45 градусах Цельсия, за которой следует одна или несколько отмывок в 0,1X SSC/0,2% SDS при приблизительно 65 градусов Цельсия, или любые другие известные жесткие условия гибридизации.
В определенных вариантах осуществления нуклеиновая кислота или ее фрагмент могут кодировать антитело к альфа-токсину или его фрагмент и гибридизоваться в жестких условиях с нуклеиновой кислотой, включающей нуклеотидную последовательность, которая кодирует аминокислотную последовательность SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
В определенных вариантах осуществления последовательность полинуклеотида может содержать нуклеотидную последовательность, кодирующую антитело к альфа-токсину или его фрагмент, по меньшей мере приблизительно на 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичную нуклеотидной последовательности, которая кодирует аминокислотную последовательность SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63. В некоторых вариантах осуществления последовательность полинуклеотида может содержать нуклеотидную последовательность, кодирующую антитело к альфа-токсину или его фрагмент, по меньшей мере приблизительно на 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичную, нуклеотидной последовательности SEQ ID NO: 30, 31, 32, 33, 34, 35, 36, 37 или 38. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент включает нуклеотидную последовательность, по меньшей мере приблизительно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичную нуклеотидной последовательности, которая кодирует аминокислотную последовательность SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
В определенных вариантах осуществления последовательность полинуклеотида может содержать нуклеотидную последовательность, кодирующую антитело к альфа-токсину или его фрагмент, по меньшей мере приблизительно на 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичную нуклеотидной последовательности VH, которая кодирует аминокислотную последовательность VH SEQ ID NO: 20, 22,
24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62. В некоторых вариантах осуществления последовательность полинуклеотида может содержать нуклеотидную последовательность, кодирующую антитело к альфа-токсину или его фрагмент, по меньшей мере приблизительно на 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичную нуклеотидной последовательности VH SEQ ID NO: 30, 32, 34, 36 или 38. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент кодируется кодирующей VH нуклеотидной последовательностью, которая по меньшей мере приблизительно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична нуклеотидной последовательности, которая кодирует аминокислотную последовательность SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62.
В определенных вариантах осуществления последовательность полинуклеотида может содержать нуклеотидную последовательность, кодирующую антитело к альфа-токсину или его фрагмент, по меньшей мере приблизительно на 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичную нуклеотидной последовательности VL, которая кодирует аминокислотную последовательность VL SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63. В некоторых вариантах осуществления последовательность полинуклеотида может содержать нуклеотидную последовательность, кодирующую антитело к альфа-токсину или его фрагмент, по меньшей мере приблизительно на 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичную нуклеотидной последовательности VL SEQ ID NO: 29, 31, 33, 35 или 37. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент кодируется кодирующей VL нуклеотидной последовательностью, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична нуклеотидной последовательности, которая кодирует аминокислотную последовательность SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
В конкретных вариантах осуществления последовательность полинуклеотида может содержать нуклеотидную последовательность, кодирующую антитело к альфа-токсину или его фрагмент, по меньшей мере приблизительно на 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичную аминокислотной последовательности VH, и нуклеотидную последовательность, кодирующую антитело к альфа-токсину или его фрагмент, по меньшей мере приблизительно на 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичную аминокислотной последовательности VL, где последовательности VH и VL представлены SEQ ID NO: 20 и 19; SEQ ID NO: 22 и 21; SEQ ID NO: 24 и 23; SEQ ID NO: 26 и 25; SEQ ID NO: 28 и 27; SEQ ID NO: 41 и 42; SEQ ID NO: 43 и 44; SEQ ID NO: 45 и 46; SEQ ID NO: 47 и 48; SEQ ID NO: 47 и 48; SEQ ID NO: 49 и 50; SEQ ID NO: 51 и 52; SEQ ID NO: 51 и 52; SEQ ID NO: 53 и 54; SEQ ID NO: 55 и 56; SEQ ID NO: 57 и 58; SEQ ID NO: 59 и 60; SEQ ID NO: 61 и 58; SEQ ID NO: 62 и 58; SEQ ID NO: 62 и 63; SEQ ID NO: 79 и 63.
По существу идентичные последовательности могут быть полиморфами последовательностями, т.е. альтернативными последовательностями или аллелями в популяции. Различие между аллелями может составлять до одной пары оснований. По существу идентичные последовательности могут также содержать подвергнутые мутагенезу последовательности, в том числе последовательности, содержащие молчащие мутации. Мутация может включать изменения одного или нескольких остатков, делецию одного или нескольких остатков или вставку одного или нескольких дополнительных остатков.
Полинуклеотиды можно получить и нуклеотидную последовательность полинуклеотидов можно определить с помощью любого способа, известного в уровне техники. Например, если нуклеотидная последовательность антитела известна, полинуклеотид, кодирующий антитело, можно собрать из химически синтезированных олигонуклеотидов, который, вкратце, включает синтез перекрывающихся олигонуклеотидов, содержащих части последовательности, кодирующей антитело, отжиг и лигирование этих олигонуклеотидов и затем амплификацию лигированных олигонуклеотидов с помощью ПЦР.
Полинуклеотид, кодирующий антитело, можно также получить из нуклеиновой кислоты из подходящего источника. Если клон, содержащий нуклеиновую кислоту, кодирующую конкретное антитело, не доступен, а последовательность молекулы антитела известна, нуклеиновую кислоту, кодирующую иммуноглобулин можно химически синтезировать или получить из подходящего источника (например, библиотеки кДНК антител, или библиотеки кДНК, полученной из, или нуклеиновой кислоты, иногда полиА+РНК, выделенной из любой ткани или клеток, экспрессирующих антитело, таких как клетки гибридомы, отобранные для экспрессии антитела) с помощью ПЦР амплификации с использованием синтетических праймеров, поддающихся гибридизации с 3' и 5' концами последовательности, или с помощью клонирования с использованием олигонуклотидного зонда, специфичного в отношении идентификации последовательности конкретного гена, например, клона кДНК из библиотеки кДНК, которая кодирует антитело. Амплифицированные нуклеиновые кислоты, полученные с помощью ПЦР, можно затем клонировать в способные к репликации векторы клонирования с использованием любого способа, известного в уровне техники.
Как только нуклеотидная последовательность и соответствующая аминокислотная последовательность антитела определена, с нуклеотидной последовательностью антитела можно работать с использованием способов, известных в уровне техники для работы с нуклеотидными последовательностями, например, методики рекомбинантной ДНК, сайт-направленный мутагенез, ПЦР и подобное, для получения антител с различной аминокислотной последовательностью, например, для создания аминокислотных замен, делеций и/или вставок.
Как используется в данном документе, выражение "жесткие условия" относится к условиям гибридизации и отмывки. Способы оптимизации температурных условий реакции гибридизации известны специалисту в данной области техники. Водные и неводные способы описаны в этом отношении, и любой можно использовать. Неограничивающими примерами жестких условий гибридизации является гибридизация в 6X хлориде натрия/цитрате натрия (SSC) при приблизительно 45 градусах Цельсия, за которой следуют одна или несколько отмывок в 0,2X SSC, 0,1% SDS при 50 градусах Цельсия. Другим примером жестких условий гибридизации является гибридизация в 6X хлориде натрия/цитрате натрия (SSC) при приблизительно 45 градусах Цельсия, за которой следуют одна или несколько отмывок в 0,2X SSC, 0,1% SDS при 55 градусах Цельсия. Дополнительным примером жестких условий гибридизации является гибридизация в 6X хлориде натрия/цитрате натрия (SSC) при приблизительно 45 градусах Цельсия, за которой следуют одна или несколько отмывок в 0,2X SSC, 0,1% SDS при 60 градусах Цельсия. Часто жесткими условиями гибридизации является гибридизация в 6X хлориде натрия/цитрате натрия (SSC) при приблизительно 45 градусах Цельсия, за которой следуют одна или несколько отмывок в 0,2X SSC, 0,1% SDS при 65 градусах Цельсия. Чаще условиями с жесткостью являются 0,5M фосфат натрия, 7% SDS при 65 градусах Цельсия, за которым следует одна или несколько отмывок в 0,2X SSC, 1% SDS при 65 градусах Цельсия. Жесткие температуры гибридизации можно также изменять (т.е. снижать) добавлением определенных органических растворителей, например формамида. Органические растворители, подобные формамиду, снижают термостабильность двухцепочеченых полинуклеотидов так, чтобы гибридизация могла осуществляться при более низких температурах, при этом, все еще сохраняя жесткие условия и продлевая срок использования нуклеиновых кислот, которые могут быть термолабильными.
Как используется в данном документе, фраза "гибридизация" или ее грамматические варианты относятся к связыванию первой молекулы нуклеиновой кислоты со второй молекулой нуклеиновой кислоты в условиях низкой, средней или высокой жесткости или в условиях синтеза нуклеиновой кислоты. Гибридизация может включать случаи, при которых первая молекула нуклеиновой кислоты связывается со второй молекулой нуклеиновой кислоты, где первая и вторая молекулы нуклеиновой кислоты комплементарны. Как используется в данном документе, "специфически гибридизуется" относится к преимущественной гибридизации праймера в условиях синтеза нуклеиновой кислоты с молекулой нуклеиновой кислоты, имеющей последовательность, комплементарную праймеру, по сравнению с гибридизацией с молекулой нуклеиновой кислоты, не имеющей комплементарной последовательности. Например, специфическая гибридизация включает гибридизацию праймера с целевой последовательностью нуклеиновой кислоты, которая является комплементарной праймеру.
В некоторых вариантах осуществления праймеры могут включать нуклеотидную подпоследовательность, которая может быть комплементарной последовательности для твердофазной гибридизации праймера нуклеиновой кислоты или, по существу, комплементарной последовательности для твердофазной гибридизации праймера нуклеиновой кислоты (например, приблизительно на 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более чем на 99% идентичной комплементарной последовательности для гибридизации праймера при выравнивании). Праймер может содержать нуклеотидную подпоследовательность, не комплементарную или, по существу, не комплементарную последовательности для твердофазной гибридизации праймера нуклеиновой кислоты (например, на 3' или 5' конце подпоследовательности нуклеотидов в праймере, комплементарном или, по существу, комплементарном последовательности для твердофазной гибридизации с праймером).
Праймер в определенных вариантах осуществления может содержать модификацию, такую как инозины, участки с удаленными азотистыми основаниями, "закрытые" нуклеиновые кислоты, средства, связывающиеся с малой бороздкой, стабилизаторы дуплекса (например, акридин, спермидин), модификаторы Tm или любой модификатор, который изменяет свойства связывания праймеров или зондов.
Праймер в определенных вариантах осуществления может содержать детектируемую молекулу или частицу (например, флуорофор, радиоактивный изотоп, средства для колориметрического анализа, частицу, фермент и подобное). Если желательно, нуклеиновую кислоту можно модифицировать с включением детектируемой метки с использованием любого способа, известного специалисту в данной области техники. Метку можно включить в ходе синтеза или добавить перед применением праймера любым из способов, описанных в данном документе. Встраивание метки можно провести либо в жидкой фазе, либо на твердой фазе. В некоторых вариантах осуществления детектируемая метка может быть полезной для детекции мишеней. В некоторых вариантах осуществления детектируемая метка может быть полезной для количественного определения целевых нуклеиновых кислот (например, определения числа копий конкретной последовательности или частицы нуклеиновой кислоты). Любую детектируемую метку, подходящую для детекции взаимодействия или биологической активности в системе, может подходящим образом выбрать и использовать специалист в данной области. Примерами детектируемых меток являются флуоресцентные метки, такие как флуоресцеин, родамин и другие (например, Anantha, et al., Biochemistry (1998) 37:2709 2714; и Qu & Chaires, Methods Enzymol. (2000) 321: 353 369); радиоактивные изотопы (например, 1251, 1311, 35S, 31P, 32P, 33P, 14C, 3H, 7Be, 28Mg, 57Co, 65Zn, 67Cu, 68Ge, 82Sr, 83Rb, 95Tc, 96Tc, 103Pd, 109Cd и 127Xe); светорассеивающие метки (например, патент США №6214560, и коммерчески доступные от Genicon Sciences Corporation, Калифорния); хемилюминесцентные метки и субстраты ферментов (например, диоксетаны и сложные эфиры акридиния), ферментные или белковые метки (например, зеленый флуоресцентный белок (GFP) или его цветовой вариант, люцифераза, пероксидаза); другие хромогенные метки или красители (например, цианин) и другие кофакторы или биомолекулы, такие как дикоксигенин, стрептавидин, биотин (например, члены связывающейся пары, такие как биотин и авидин, например), фрагменты с аффинностью связывания и подобное. В некоторых вариантах осуществления праймер может быть меченым фрагментом с аффинностью связывания. В качестве детектируемых меток включены такие метки, используемые для модификации массы для детектирования масс-спектрометрией (например, масс-спектрометрия с матрично-активированной лазерной десорбцией/ионизацией (MALDI) и электрораспылительная (ES) масс-спектрометрия).
Праймер также может относиться к последовательности полинуклеотида, которая гибридизуется с подпоследовательностью целевой нуклеиновой кислоты или другого праймера и способствует детекции праймера, целевой нуклеиновой кислоты или и того, и другого, например как молекулярные маяки. Выражение "молекулярный маяк", как используется в данном документе, относится к детектируемой молекуле, где детектируемое свойство молекулы является детектируемым только в определенных конкретных условиях, таким образом создавая возможность ее функционирования в качестве специфического и информативного сигнала. Неограничивающими примерами детектируемых свойств являются оптические свойства, электрические свойства, магнитные свойства, химические свойства и время или скорость прохождения через отверстие заданного размера.
В некоторых вариантах осуществления молекулярный маяк может быть одноцепочечным олигонуклеотидом, способным образовывать структуру стебель-петля, где последовательность петли может быть комплементарной целевой последовательности нуклеиновой кислоты, представляющей интерес, и фланкирована короткими комплементарными ветвями, которые могут образовывать стебель. Олигонуклеотид может быть меченным по одному концу флуорофором и по другому концу молекулой-гасителем. В конформации стебель-петля энергия от возбужденного флуорофора переносится на гаситель посредством диполь-дипольного взаимодействия большой дальности, подобного таковому, наблюдаемому при резонансном переносе энергии флуоресценции или FRET, и выбеляется в виде тепла, а не света. Если последовательность петли гибридизуется со специфической целевой последовательностью, два конца молекулы разделяются и энергия от возбужденного флуорофора испускается в виде света, давая детектируемый сигнал. Молекулярные маяки предоставляют дополнительное преимущество в том, что удаление избытка зонда не является необходимым вследствие самогасящей природы негибридизированного зонда. В некоторых вариантах осуществления зонды-молекулярные маяки могут быть сконструированы для того, чтобы либо различать, либо допускать несовпадения между последовательностью петли и целевой последовательностью посредством моделирования относительной строгости условий гибридизации петля-мишень и образования стебля. Как упоминается в данном документе, выражение "несовпадающий нуклеотид" или "несовпадение" относится к нуклеотиду, который не является комплементарным целевой последовательности в положении или положениях. Зонд может иметь по меньшей мере одно несовпадение, но может также иметь 2, 3, 4, 5, 6 или 7 или более несовпадающих нуклеотидов.
Биологические характеристики антител к альфа-токсину и их фрагментов
Антитело может характеризоваться одной или несколькими характеристиками, идентичными или подобными таковым антитела, описанного в данном документе, и часто характеризуется одной или несколькими из биологических характеристик, которые отличают ее от других антител, которые связываются с тем же антигеном, альфа-токсином. Как используется в данном документе, "биологические характеристики" антитела относятся к любой одной или нескольким из биохимических характеристик, характеристик связывания и функциональных характеристик, которые можно использовать для выбора антител для терапевтических, исследовательских и диагностических применений. Например, антитела к альфа-токсину и их фрагменты могут быть одинаковыми или отличаться по связыванию эпитопа, нацеливанию, аффинности, нейтрализации и ингибированию олигомеризации или образованию поры комплексом из гептамера, например.
Биохимические характеристики антитела к альфа-токсину или его фрагмента включают без ограничения изоэлектрическую точку (pl) и температуру плавления (Tm). Характеристики связывания антитела к альфа-токсину или его фрагмента включают без ограничения специфичность связывания; константу диссоциации (Kd), или обратную ей константу ассоциации (Ka), или ее компоненты - скорости kon или koff; эпитоп, с которым оно связывается; способность различать различные формы и/или препараты альфа-токсина (например, рекомбинантный, нативный, ацетилированный) и способность связывать растворимый и/или иммобилизированный антиген. Функциональные характеристики антитела, представленного в данном документе, включают без ограничения ингибирование связывания альфа-токсина с рецептором, ингибирование олигомеризации альфа-токсина, ингибирование экспрессии генов, индуцируемой каскадными реакциями, отвечающими за экспрессию или активность альфа-токсина, элиминация клеток, экспрессирующих альфа-токсин, ингибирование роста клеток, экспрессирующих альфа-токсин, ингибирование локализации альфа-токсина и защиту при одном или нескольких заболеваниях или расстройствах, связанных с S. aureus, альфа-токсином или с S. aureus и альфа-токсином. В данном документе описаны характеристики антител к альфа-токсину и их фрагментов и способы модификации и тонкой настройки этих характеристик. Способы измерения характеристик антител известны в уровне техники, некоторые из которых подробно описаны ниже.
Характеристики связывания
Как описано выше, антитело к альфа-токсину или его фрагмент иммуноспецифично связывает по меньшей мере один определенный эпитоп или антигенные детерминанты белка, пептида, субъединицы, фрагмента, части или любой их комбинации исключительно или преимущественно по отношению к другим полипептидам. Выражение "эпитоп" или "антигенная детерминанта", как используется в данном документе, относится к белковой детерминанте, способной связываться с антителом, где выражение "связывание" в данном документе часто относится к специфическому связыванию. Эти белковые детерминанты или эпитопы часто включают химически активные поверхностные группировки молекул, такие как аминокислоты или боковые цепи из Сахаров, часто имеющие конкретные характеристики трехмерной структуры и часто имеющие конкретные характеристики заряда. Конформационные и неконформационные эпитопы различаются тем, что связывание с первыми, но не с последними, теряется в присутствии денатурирующих растворителей. Выражение "прерывающийся эпитоп", как используется в данном документе, относится к конформационному эпитопу на белковом антигене, образованному из по меньшей мере двух разделенных участков в первичной последовательности белка.
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент иммуноспецифично связывается с альфа-токсином Staphylococcus aureus и его антигенными фрагментами, связанными с олигомеризацией альфа-токсина. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент иммуноспецифично связывается с альфа-токсином или по меньшей мере любыми тремя смежными аминокислотами в SEQ ID NO: 39 или 40. В некоторых вариантах осуществления эпитоп представляет собой от по меньшей мере 4 аминокислотных остатка, по меньшей мере 5 аминокислотных остатков, по меньшей мере 6 аминокислотных остатков, по меньшей мере 7 аминокислотных остатков, по меньшей мере 8 аминокислотных остатков или по меньшей мере 9 аминокислотных остатков до полной определенной части из смежных аминокислот белка альфа-токсина. В определенных вариантах осуществления контактирующие остатки содержат T261, T263, N264, K266 и K271. В других вариантах осуществления контактирующие остатки содержат N177, W179, G180, P181, Y182, D183, D185, S186, W187, N188, P189, V190, Y191 и R200 из SEQ ID NO: 39. В дополнительных вариантах осуществления контактирующие остатки содержат N177, W179, G180, P181, Y182, D183, D185, S186, W187, N188, P189, V190, Y191, R200, T261, T263, N264, K266 и K271 из SEQ ID NO: 39. В определенных вариантах осуществления часть альфа-токсина, контактирующая с антителом или его антигенсвязывающим фрагментом, содержит аминокислоты 261-272 из SEQ ID NO: 39. В других вариантах осуществления часть альфа-токсина, контактирующая с антителом или его антигенсвязывающим фрагментом, содержит аминокислоты 248-277 из SEQ ID NO: 39. В других вариантах осуществления часть альфа-токсина, контактирующая с антителом или его антигенсвязывающим фрагментом, содержит аминокислоты 173-201 и 261-272 из SEQ ID NO: 39.
В различных вариантах осуществления антитело к альфа-токсину или его фрагмент, связанный с олигомеризацией альфа-токсина, иммуноспецифично связывает полипептид альфа-токсина или его антигенный фрагмент, по меньшей мере на 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% идентичный или на 100% идентичный аминокислотной последовательности SEQ ID NO: 39 или 40. Антитело к альфа-токсину или его фрагмент может иногда иммуноспецифично связываться с полипептидом альфа-токсина или его антигенным фрагментом, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичным или на 100% идентичным аминокислотной последовательности SEQ ID NO: 39 или 40.
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент может связывать эпитоп, консервативный среди видов. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент связывает альфа-токсин S. aureus и гомологи или ортологи альфа-токсина от других видов бактерий и их антигенных фрагментов. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент может связываться с одним или несколькими ортологами и или изоформами альфа-токсина. В конкретном варианте осуществления антитело к альфа-токсину или его фрагмент связывается с альфа-токсином и его антигенными фрагментами, связанными с олигомеризацией альфа-токсина, из одного или нескольких видов бактерий, обладающих гомологами или ортологами альфа-токсина. В определенных вариантах осуществления антитела к альфа-токсину или фрагменты могут связывать эпитоп в пределах гомологов, и/или изформ, и/или конформационных вариантов, и/или подтипов альфа-токсина среди Staphylococcus или других близкородственных бактерий.
Взаимодействия между антигенами и антителами часто являются такими же, как и другие нековалентные белок-белковые взаимодействия. В целом, между антигенами и антителами существуют четыре типа связывающих взаимодействий: (i) водородные связи, (ii) дисперсионные силы, (iii) электростатические силы между кислотами Льюиса и основаниями Льюиса и (iv) гидрофобные взаимодействия. Гидрофобные взаимодействия являются существенной движущей силой для взаимодействий антитело-антиген и основаны на отталкивании воды неполярными группами, а не на притяжении молекул. Однако определенные физические силы также способствуют связыванию антиген-антитело, например, соответствие или дополнение формами эпитопа различных сайтов связывания антитела. Другие материалы и антигены могут перекрестно реагировать с антителом, таким образом конкурируя за доступное несвязанное антитело.
Измерение константы аффинности и специфичности связывания между антигеном и антителом часто является составной частью при определении эффективности терапевтических, диагностических и исследовательских способов, применяющих антитела к альфа-токсину и их фрагменты. "Связывающая способность", в целом, относится к силе суммы всех нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитело) и его партнером по связыванию (например, антиген). Если не указано иное, как используется в данном документе, "связывающая способность" относится к объективной связывающей способности, которая отражает взаимодействие 1:1 между членами связывающейся пары (например, антителом и антигеном). Аффинность молекулы X к ее партнеру Y, в целом можно представить уравнением константы диссоциации (Kd), которую рассчитывают в виде соотношения koff/kon. Аффинность можно измерить с помощью общеизвестных способов, известных в уровне техники, в том числе таковые, описанные и проиллюстрированные примером в данном документе (например, способы BiaCore). Антитела с низкой аффинностью обычно связывают антиген медленно и проявляют тенденцию к легкой диссоциации, тогда как антитела с высокой аффинностью обычно связывают антиген быстрее и проявляют тенденцию к тому, чтобы оставаться связанными дольше. Ряд способов измерения связывающей способности известны в уровне техники, любой из которых можно применять для целей данной технологии.
Антитело к альфа-токсину или его фрагмент иногда имеет связывающую способность в отношении эпитопа альфа-токсина, характеризующуюся константой диссоциации (Kd) 1×10-2 М или менее, 1×10-3 М или менее, 1×10-4 М или менее, 1×10-5 М или менее, 1×10-6 М или менее, 1×10-7 М или менее, 1×10-8 М или менее, 1×10-9 М или менее, 1×10-10 М или менее, 1×10-11 М или менее, 1×10-12 М или менее, 1×10-13 М или менее, 1×10-14 М или менее или 1×10-15 М или менее. Например, Kd может составлять от 1×10-15 М до 1×10-2 М, от 1×10-14 М до 1×10-10 М, от 1×10-9 М до 1×10-5 М и от 1×10-4 М до 1×10-2 М.
В определенных вариантах осуществления антитела к альфа-токсину и их фрагменты представляют собой антитело с высокой аффинностью. Под "антителом с высокой аффинностью" подразумевают антитело, которое связывается с эпитопом альфа-токсина с аффинностью менее 10-8 М {например, 10-9 М, 10-10 М и т.п.).
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент описывается как имеющий связывающую способность, выраженную конкретной молярностью или лучше. "Или лучше" при использовании в данном документе относится более сильному связыванию, представленному меньшим численным значением Kd. Например, антитело, которое имеет аффинность в отношении антигена "0,6 нМ или лучше", аффинность антитела в отношении антигена составляет <0,6 нМ, т.е. 0,59 нМ, 0,58 нМ, 0,57 нМ и т.п. или любое значение менее 0,6 нМ.
В некоторых вариантах осуществления аффинность антитела к альфа-токсину или его фрагменту описывается по константе ассоциации (Ka), которую рассчитывают в виде соотношения kon/koff. В этом случае данные антитела к альфа-токсину и их фрагменты имеют связывающие способности в отношении эпитопа альфа-токсина, которые включают константу ассоциации (Ka) 1×102 М-1 или более, 1×103 М-1 или более, 1×10 М-1 или более, 1×105 М-1 или более, 1×106 М-1 или более, 1×107 М-1 или более, 1×108 М-1 или более, 1×109 М-1 или более, 1×1010 М-1 или более, 1×1011 М-1 или более, 1×1012 М-1 или более, 1×1013 М-1 или более, 1×1014 М-1 или более или 1×1015 М-1 или более. Например, Ka может составлять от 1×102 М-1 до 1×107 М-1, от 1×107 М-1 до 1×1010 М-1 и от 1×1010 М-1 до 1×1015 М-1.
В определенных вариантах осуществления скорость, с которой антитело к альфа-токсину или его фрагмент диссоциирует от эпитопа альфа-токсина, может быть уместной. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент может связываться с альфа-токсином с koff менее 10-3 с-1, менее 5×10-3 с-1, менее 10-4 с-1, менее 5×10-4 с-1 или менее 10-5 с-1. В некоторых вариантах осуществления скорость, с которой антитела к альфа-токсину и их фрагменты ассоциируют с эпитопом альфа-токсина, может быть более адекватной, чем значение Kd или Ka. В этом случае данные антитела к альфа-токсину и их фрагменты связывают альфа-токсин со скоростью kon по меньшей мере 10-4 M-1с-1 по меньшей мере 5×10-4 M-1c-1, по меньшей мере 105 М-1с-1, по меньшей мере 5×105 М-1с-1, по меньшей мере 106 M-1с-1, по меньшей мере 5×106 М-1с-1 по меньшей мере 107 М-1с-1.
Определение связывающей способности можно измерить с использованием конкретных методик, описанных дополнительно в разделе Примеры, смотри Пример 1, и способов, известных в уровне техники. Один пример такого способа включает измерение константы диссоциации "Kd" с помощью анализа связывания меченного радиоактивным изотопом антигена (RIA), проводимого с Fab версией антитела, представляющего интерес, и его антигеном, как описано в следующем анализе, в котором измеряют связывающую способность Fab в растворе в отношении антигена путем уравновешивания Fab минимальной концентрацией (125I)-меченого антигена при наличии ряда титрований немеченого антигена, последующего захвата связанного антигена на планшете, покрытом антителом к Fab антителу. Чтобы установить условия для анализа, микротитровальные планшеты (Dynex) покрывают в течение ночи 5 мкг/мл захватывающего антитела к Fab (Cappel Labs) в 50 мМ карбонате натрия (H 9,6) и затем блокируют 2% (вес/объем) бычьим сывороточным альбумином в PBS в течение двух-пяти часов при комнатной температуре (примерно 23 градуса Цельсия). В неабсорбирующем планшете (Nunc #269620) 100 пМ или 26 пМ [125I]-антигена смешивают серийными разведениями Fab, представляющего интерес. Представляющий интерес Fab затем инкубируют в течение ночи; однако инкубирование можно продолжить в течение более длительного периода (например, 65 часов) для того, чтобы гарантировать, что достигнуто равновесие. После этого смеси переносят в планшет для захвата для инкубирования при комнатной температуре (например, в течение одного часа). Раствор затем удаляют, и планшет отмывают восемь раз 0,1% Tween-20 в PBS. Когда планшеты высохли, добавляют 150 мкл/лунку сцинтиллятора (MicroScint-20; Packard) и производят подсчет излучения планшетов на счетчике гамма-излучения Topcount (Packard) в течение 10 минут. Концентрации каждого Fab, которые дают связывание менее или равное 20% максимального связывания, отбирают для использования в конкурентных анализах связывания.
В другом случае значение Kd можно измерить путем применения анализов поверхностного плазмонного резонанса, которые можно провести, например, с использованием BIAcore™-2000 или BIAcore™-3000 (BIAcore, Inc., Пискатауэй, Нью-Джерси) при 25 градусах Цельсия с СМ5 чипами с иммоблизированным антигеном при~10 единицах ответа (RU). Вкратце, в примере такого способа, биосенсорные чипы на основе карбоксиметилированного декстрана (СМ5, BIAcore Inc.) активируют N-этил-N'-(3-диметиламинопропил)-карбодиимид гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разводят 110 мМ ацетатом натрия, pH 4,8 до 5 мкг/микролитр (~0,2 мкМ) перед впрыскиванием со скоростью потока 5 мкл/минута для получения примерно 10 единиц ответа (RU) для связанного белка. После впрыскивания антигена IM этаноламин впрыскивают для блокирования непрореагировавших групп. Для измерений кинетики двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) впрыскивают в PBS с 0,05% Tween 20 (PBST) при 25 градусах Цельсия со скоростью потока примерно 25 мкл/мин. Скорости ассоциации (коп) и скорости диссоциации (koff) рассчитывают с использованием Ленгмюровской модели простого связывания в соотношении один к одному (программное обеспечение для оценки BIAcore Evaluation Software, версия 3.2) путем одновременной подгонки сенсограмм ассоциации и диссоциации.
Если скорость прямой реакции превышает 106 М-1 с-1 на основании указанного выше анализа поверхностного плазмонного резонанса, то скорость прямой реакции можно определить путем применения методики гашения флуоресценции, например, которая измеряет повышение или понижение интенсивности излучения флуоресценции (возбуждение = 295 нм; эмиссия = 340 нм, полоса пропускания 16 нм) при 25 градусах Цельсия 20 нМ антитела к антигену (Fab форма) в PBS, pH 7,2, в присутствии возрастающих концентраций антигена, что измеряют на спектрометре, таком как оборудованный устройством для остановки потока спектрофотометр (Aviv Instruments) или спектрофотометр SLM-Aminco серии 8000 (ThermoSpectronic) с кюветой с перемешиванием. "Скорость прямой реакции" или "скорость ассоциации" или "kon" в соответствии с этой технологией можно также определить той же методикой поверхностного плазмонного резонанса, описанной выше, с использованием BIAcore™-2000 или BIAcore™-3000 (BIAcore, Inc., Пискатауэй, Нью-Джерси), как описано выше.
Способы и реактивы, подходящие для определения характеристик связывания данного выделенного антитела или его антигенсвязывающего фрагмента или его измененного/мутантного производного (обсуждается ниже), известны в уровне техники и/или коммерчески доступны. Оборудование и программное обеспечение, разработанное для таких анализов кинетики, коммерчески доступно (например, инструменты Biacore® A100 и Biacore® 2000; Biacore International AB, Уппсала, Швеция).
В некоторых вариантах осуществления анализ связывания можно проводить в виде непосредственных анализов связывания или в виде конкурентных анализов связывания. Связывание можно детектировать с использованием стандартных анализов ELISA или стандартных анализов проточной цитометрии. При непосредственном анализе связывания антитело-кандидат исследуют в отношении связывания с антигеном альфа-токсина. В конкурентном анализе связывания, с другой стороны, оценивают способность антитела-кандидата конкурировать с известным антителом к альфа-токсину, или его фрагментом, или другим соединением, которое связывает альфа-токсин (например, рецептором, ингибитором). В целом, любой способ, который позволяет детектирование связывания антитела с альфа-токсином, включен в объем данной технологии для детекции и измерения характеристик связывания антител. Эти способы также можно использовать для скрининга панели антител на предмет таковых, обеспечивающих желаемые характеристики.
В определенных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с альфа-токсином и характеризуется одной или несколькими характеристиками, выбранными из группы, состоящей из следующего:
(a) константа аффинности (KD) в отношении альфа-токсина приблизительно 13 нМ или менее;
(b) связывается с мономерами альфа-токсина, но не ингибирует связывание альфа-токсина с рецептором альфа-токсина;
(c) ингибирует образование олигомеров альфа-токсина по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95%;
(d) снижает цитолитическую активность альфа-токсина по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95% (например, как определено с помощью анализа клеточного лизиса и гемолиза);
(e) снижает клеточную инфильтрацию и высвобождение провоспалительных цитокинов (например, в животной модели пневмонии).
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент связывает антиген (например, альфа-токсин) с аффинностью, характеризующейся константой диссоциации (Ко) в диапазоне приблизительно 0,01 нМ до приблизительно 50 нМ, 0,05 нМ, 0,1 нМ, 0,5 нМ, 1 нМ, 5 нМ, 10 нМ, 20 нМ, 30 нМ или 40 нМ.
Функциональные характеристики
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент изменяет биологические свойства альфа-токсина и/или экспрессирующих клеток альфа-токсина. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент нейтрализует биологическую активность альфа-токсина путем связывания с полипептидом и ингибирования сборки мономеров альфа-токсина в трансмембранную пору (например, гептамер альфа-токсина). Анализы нейтрализации можно провести с помощью способов, известных в уровне техники, с использованием, в некоторых условиях, коммерчески доступных реактивов. Нейтрализацию альфа-токсина часто измеряют с IC50 1×10-6 М или менее, 1×10-7 М или менее, 1×10-8 М или менее, 1×10-9 М или менее, 1×10-10 М или менее и 1×10-11 М или менее. В определенных вариантах осуществления нейтрализация происходит, когда антитело или антигенсвязывающий фрагмент, которые иммуноспецифично связываются с альфа-токсином S. aureus, присутствуют в концентрации, которая описана в Примерах 3-6. В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент нейтрализует способность альфа-токсина олигомеризоваться и образовывать трансмембранную пору. Выражение "ингибирующая концентрация 50%" (сокращенно "IC50") представляет концентрацию ингибитора (например, антитело к альфа-токсину или его фрагмент, представленные в данном документе), которая требуется для 50% ингибирования данной активности молекулы, на которую нацелен ингибитор (например, олигомеризация альфа-токсина с образованием трансмембранной поры комплекса гептамера). Более низкое значение IC50 обычно соответствует более сильному ингибитору.
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент ингибирует одну или несколько биологических активностей альфа-токсина. Выражение "ингибирование", как используется в данном документе, относится к статистически значимому снижению биологической активности, в том числе к полному блокированию активности. Например, "ингибирование" может относиться к снижению биологической активности приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100%. В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент ингибирует одну или несколько биологических активностей альфа-токсина по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100%.
В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент может элиминировать альфа-токсин, секретируемый патогенным S. aureus. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент может обеспечивать по меньшей мере приблизительно 20%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или приблизительно 100% элиминацию альфа-токсина, секретируемого S. aureus. В конкретных вариантах осуществления практически весь детектируемый секретируемый альфа-токсин элиминируется из клеток, инфицированных S. aureus.
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент может ингибировать in vitro стимулируемую активность альфа-токсина (например, связывание с рецептором, олигомеризация) и/или пролиферацию клеток, экспрессирующих или секретирующих альфа-токсин. Антитело к альфа-токсину или его фрагмент иногда ингибирует in vitro активность альфа-токсина, патогенность S. aureus по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 75%. Способы измерения клеточной пролиферации, патогенности и активности альфа-гемолизина известны в уровне техники.
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент могут ингибировать экспрессию одного или нескольких индуцибельных генов, которые реагируют непосредственно или опосредовано на окружение, создаваемое инфекцией S. aureus и/или экспрессией и функционированием альфа-токсина. В конкретных вариантах осуществления антитело к альфа-токсину или его фрагмент ингибирует экспрессию одного или нескольких индуцибельных генов, которые реагируют непосредственно или опосредовано на окружение, создаваемое инфекцией S. aureus и/или экспрессией и функционированием альфа-токсина, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 120%, по меньшей мере на 140%, по меньшей мере на 160%, по меньшей мере на 180% или по меньшей мере на 200%.
Получение антител к альфа-токсину и их фрагментов
Далее описаны примерные методики получения антител. Антиген альфа-токсина, используемый для получения антител, может представлять собой пептидный фрагмент, который, например, включает участок последовательности пептида альфа-токсина, вовлеченный в олигомеризацию. Антитела к альфа-токсину можно получить с использованием нативного альфа-токсина S. aureus, содержащего SEQ ID NO: 39, или мутантного альфа-токсина, содержащего SEQ ID NO: 40, его варианта или антигенного фрагмента. Клетки S. aureus, экспрессирующие и секретирующие альфа-токсин, можно также применять для создания антител. Доступны примеры нуклеотидных и аминокислотных последовательностей альфа-токсина, которые представлены, например, в Таблице 10. Альфа-токсин можно получать рекомбинантно в выделенной форме из бактериальных или эукариотических клеток с использованием стандартных методов рекомбинантной ДНК. Альфа-токсин можно экспрессировать в виде меченного (например, эпитопной меткой) или другого гибридного белка (например, слитый с GST) для облегчения выделения, а также идентификации в различных анализах. Доступны антитела или связывающие белки, которые связываются с различными метками и слитыми последовательностями, как подробно представлено ниже. Также можно применить другие формы альфа-токсина, подходящие для создания антител.
Различные полипептиды-метки и соответствующие им антитела известны в уровне техники. Примеры включают полигистидиновые (поли-his) или полигистидин-глициновые (поли-his-gly) метки; метку из полипептида НА вируса гриппа и антитело 12CA5 к нему; с-тус метку и 8F9, 3C7, 6Е10, G4, B7 и 9Е10 антитела к ней; и метку на основе гликопротеина D (gD) вируса простого герпеса и антитела к нему. Пептид FLAG распознается моноклональным антителом M2 к FLAG. Очистку белка, содержащего пептид FLAG, можно проводить с помощью иммуноаффинной хроматографии с использованием аффинной матрицы, содержащей моноклональное антитело M2 к FLAG, ковалентно присоединенное к агарозе. Другие полипептиды-метки включают пептид эпитопа KT3; пептид эпитопа α-тубулина; и пептидную метку на основе белка гена 10 T7.
Поликлональные антитела к антигену, представляющему интерес, можно получить с помощью различных процедур, известных в уровне техники. Например, полипептид альфа-токсина или его иммуногенный фрагмент можно вводить различным животным-хозяевам, включая без ограничения кроликов, мышей, крыс и подобных, для индукции продуцирования сывороток, содержащих поликлональные антитела, специфичные к антигену. Различные адъюванты можно применять для усиления иммунного ответа в зависимости от вида хозяина, и они включают без ограничения адъювант Фрейнда (полный и неполный), минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, такие как лизолецитин, полиолы pluronic, полианионы, пептиды, масляные эмульсии, гемоцианин фиссуреллы, динитрофенол и потенциально полезные адъюванты для человека, такие как BCG (бацилла Кальмета-Герена) и Corynebacterium parvum. Такие адъюванты также известны в уровне техники.
Продуцирование поликлональных антител у животных можно вызвать путем множественных подкожных (sc) или внутрибрюшинных (ip) инъекций соответствующего антигена и адъюванта. Может быть полезным конъюгирование соответствующего антигена (особенно если используют синтетические пептиды) с белком, который является иммуногенным у вида, который нужно иммунизировать.
Например, антиген можно конъюгировать с гемоцианином фиссуреллы (KLH), сывороточным альбумином, бычьим тиреоглобулином или соевым ингибитором трипсина с использованием бифункционального или дериватизирующего средства (реакционноспособной группы), например, активированного сложного эфира (конъюгация через цистеиновые или лизиновые остатки), глутаральдегида, янтарного альдегида, SOCl2 или R1N=C=NR, где R и R1 представляют собой разные алкильные группы. Конъюгаты также можно получить в культуре рекомбинантных клеток в виде гибридных белков.
Как правило, животных иммунизируют к антигену, иммуногенным конъюгатам или производным путем объединения соответствующей концентрации антигена или коньюгата с адъювантом и инъекции раствора в несколько участков. Иммунизации можно проводить, как описано в Примере 1 (иммунизация/получение гибридомы).
Моноклональные антитела можно получить с использованием большого разнообразия методик, известных в уровне техники, включая применение гибридом, рекомбинантных технологий и технологий фагового дисплея или их комбинации. Выражение "моноклональное антитело", как используется в данном документе, относится к антителу, полученному из популяции, по существу, однородных или выделенных антител, например, отдельные антитела, составляющие популяцию, являются идентичными за исключением возможных, встречающихся в естественных условиях, мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, при этом являясь направленными на единственный антигенный сайт или множество антигенных сайтов в случае мультиспецифичных сконструированных антител. Более того, в отличие от препаратов поликлональных антител, которые включают разные антитела, направленные на разные детерминанты (эпитопы), каждое моноклональное антитело направлено на ту же детерминанту на антигене. Кроме того, в отношении их специфичности моноклональные антитела являются преимущественными в том, что их можно синтезировать незагрязненными другими антителами. Модификатор "моноклональное" не следует толковать как требующий получения антитела каким-либо конкретным способом. Далее следует описание иллюстративных способов получения моноклональных антител, которое не предназначено для ограничения и может использоваться для получения, например, моноклональных антител млекопитающих, химерных, гуманизированных, человеческих антител, доменов антител, димерных антител, вакцител (vaccibodies), линейных и мультиспецифичных антител.
Способы получения и скрининга в отношении специфических антител с использованием гибридомной технологии являются обычным и известным в уровне техники. В гибридомном способе мышей или других подходящих животных-хозяев, таких как хомяк, иммунизируют, как описано выше, чтобы получить лимфоциты, которые продуцируют или способны продуцировать антитела, которые будут специфично связываться с антигеном, используемым для иммунизации. В качестве альтернативы, лимфоциты можно иммунизировать in vitro. После иммунизации лимфоциты выделяют и затем сливают с линией миеломных клеток с использованием подходящего фактора, вызывающего слияние клеток, или партнера по слиянию, как например, полиэтиленгликоль, с образованием клетки гибридомы. В определенных вариантах осуществления выбранные миеломные клетки представляют собой таковые, которые сливаются эффективно, поддерживают устойчивый высокий уровень продуцирования антитела выбранными антитело-продуцирующими клетками и являются чувствительными к селективной среде, с помощью которой проводят отбор, направленный против неслившихся исходных клеток. В одном аспекте линиями миеломных клеток являются мышиные миеломные линии, такие как полученные из мышиных опухолей МОРС-21 и МРС-11, доступных от Центра распределения клеток при институте Салка (Salk Institute Cell Distribution Center), Сан-Диего, Калифорния, США, и полученные от SP-2, например, X63-Ag8-653 клетки, доступные от Американской коллекции типовых культур, Роквилл, Мэриленд, США. Клеточные линии миеломы человека и гетеромиеломные линии клеток мыши-человека также были описаны для получения человеческих моноклональных антител.
Как только клетки гибридомы, которые продуцируют антитела с желаемой специфичностью, аффинностью и/или активностью идентифицировали, клоны можно пассировать с помощью процедур предельного разведения и выращивать с помощью стандартных способов. Подходящие культуральные среды для этой цели включают, например, среду D-MEM или RPMI-1640. Кроме того, клетки гибридомы можно выращивать in vivo в виде асцитных опухолей у животных, например, путем i.p. инъекции клеток в мышей.
Моноклональные антитела, секретируемые очередным пассажем подходящим образом, отделяют от культуральной среды, жидкости асцитов или сыворотки с помощью общепринятых процедур очистки антител, таких как, например, аффинная хроматография (например, с использованием белка A или белка G-сефарозы) или ионообменная хроматография, аффинные метки, хроматография на гидроксиапатитах, гель-электрофорез, диализ и подобное. Иллюстративные способы очистки более подробно описаны ниже.
Методики рекомбинантных ДНК
Способы получения и скрининга в отношении специфических антител с использованием технологии рекомбинантных ДНК являются обычным и известным в уровне техники. ДНК, кодирующую моноклональные антитела, можно легко выделить и/или секвенировать с использованием общепринятых процедур (например, путем использования олигонуклеотидных зондов, которые способны к специфическому связыванию с генами, кодирующими тяжелую и легкую цепи мышиных антител). После выделения ДНК можно поместить в векторы экспрессии, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, обезьяньи COS клетки, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в других случаях не продуцируют белок антитела, для достижения синтеза моноклональных антител в рекомбинантных клетках-хозяевах. Как описано ниже для антител, полученных с помощью фагового дисплея и гуманизации антител, ДНК или генетический материал для рекомбинантных антител можно получить из отличного от гибридом источника(источников) с тем, чтобы создать антитело к альфа-токсину или его фрагмент.
Рекомбинантная экспрессия антитела или его варианта часто требует конструирования вектора экспрессии, содержащего полинуклеотид, который кодирует антитело. В данном документе представлены способные к репликации векторы, содержащие нуклеотидную последовательность, кодирующую молекулу антитела, тяжелую или легкую цепь антитела, вариабельный домен тяжелой цепи или легкой цепи антитела или его часть или CDR тяжелой или легкой цепи, функционально связанную с промотором. Такие векторы могут включать нуклеотидную последовательность, кодирующую константный участок молекулы антитела и вариабельный домен антитела, их можно клонировать в такой вектор для экспрессии полной тяжелой, полной легкой цепи или полных и тяжелой, и легкой цепей.
Как только вектор экспрессии трансфицировали в клетку-хозяина с помощью общепринятых методик, трансфицированные клетки затем культивируют с помощью общепринятых методик с получением антитела. Следовательно, в данном документе предлагаются клетки-хозяева, содержащие полинуклеотид, кодирующий данные выделенное антитело или его антигенсвязывающий фрагмент, или их фрагменты, или их тяжелую или легкую цепи, или их часть, или одноцепоченое антитело в них, функционально связанный с гетерологичным промотором. В определенных вариантах осуществления для экспрессии антител с двумя цепями, векторы, кодирующие как тяжелую, так и легкую цепи, можно коэкспрессировать в клетке-хозяине для экспрессии целой молекулы иммуноглобулина, как подробно описано ниже.
Линии клеток млекопитающих, доступные в качестве хозяев для экспрессии рекомбинантных антител известны в уровне техники и включают многие иммортализированные клеточные линии, доступные от Американской коллекции типовых культур (АТСС), в том числе без ограничения клетки яичника китайского хомячка (СНО), HeLa клетки, клетки почки новорожденного хомячка (ВНК), клетки почки обезьяны (COS), клетки гепатоцеллюлярной карциномы человека (например, Hep G2), клетки почечного эпителия человека 293 и ряд других клеточных линий. Различные клетки-хозяева имеют характерные и специфические механизмы пострансляционного процессинга и модификации белков и генных продуктов. Подходящие клеточные линии или системы-хозяева можно выбрать для того, чтобы обеспечить правильные модификацию и процессинг экспрессируемого антитела или его части. В связи с этим, можно применять эукариотические клетки-хозяева, которые обладают клеточным аппаратом для правильного процессинга первичного транскрипта, гликозилирования и фосфорилирования генного продукта. Такие клетки-хозяева млекопитающих включают без ограничения СНО, VERY, ВНК, Hela, COS, MDCK, 293, 3Т3, W138, ВТ483, Hs578T, НТВ2, ВТ20 и T47D, NS0 (линия клеток мышиной миеломы, которая не продуцирует эндогенно каких-либо функциональных цепей иммуноглобулинов), SP20, CRL7030 и HsS78Bst клетки. В определенных вариантах осуществления линии клеток человека, разработанные путем иммортализации лимфоцитов человека, можно применять для рекомбинантного продуцирования моноклональных антител. В некоторых вариантах осуществления линию клеток человека PER. С6. (Crucell, Нидерланды) можно использовать для рекомбинантного продуцирования моноклональных антител.
Дополнительные клеточные линии, которые можно применять в качестве хозяев для экспрессии рекомбинантных антител, включают без ограничения клетки насекомых (например, Sf21/Sf9, Trichoplusia ni Bti-Tn5b1-4) или клетки дрожжей (например, S. cerevisiae, Pichia, US 7326681 и т.д.), клетки растений (US 20080066200) и куриные клетки.
В определенных вариантах осуществления антитела, представленные в данном документе, экспрессируются в клеточной линии при устойчивой экспрессии антитела. Устойчивую экспрессию можно использовать для длительного высокопродуктивного продуцирования рекомбинантных белков. Например, можно создать клеточные линии, которые устойчиво экспрессируют молекулу антитела.
Клетки-хозяева можно трансформировать подходящим образом сконструированным вектором, содержащим управляющие экспрессией элементы (например, промотор, энхансер, терминаторы транскрипции, сайты полиаденилирования и подобное) и ген селектируемого маркера. После внедрения чужеродной ДНК клеткам можно позволить расти в течение 1-2 суток на обогащенной среде, и затем их переводят на селективную среду. Селектируемый маркер в рекомбинантной плазмиде придает устойчивость отбору и позволяет клетками, которые устойчиво интегрировали плазмиду в их хромосомы, расти и образовывать центры, которые, в свою очередь, можно пассировать и разращивать в клеточные линии. Способы получения стабильных клеточных линий с высокой продуктивностью известны в уровне техники, и реактивы, в целом, являются коммерчески доступными.
В определенных вариантах осуществления антитела, представленные в данном документе, экспрессируются в клеточной линии с временной экспрессией антитела. Временная трансфекция представляет собой процесс, при котором нуклеиновая кислота, внедряемая в клетку, не интегрируется в геномную или хромосомную ДНК такой клетки. Нуклеиновая кислота часто сохраняется в виде внехромосомного элемента, например, в виде эписомы, в клетке. Процессы транскрипции нуклеиновой кислоты из эписомы не затрагиваются, и белок, кодируемый нуклеиновой кислотой из эписомы, продуцируется.
Клеточную линию, которую можно устойчиво или временно трансфицировать, поддерживают в среде для культивирования клеток и условиях, известных в уровне техники, что приводит в результате к экспрессии и продуцированию моноклональных антител. В определенных вариантах осуществления среда для культивирования клеток млекопитающих является таковой на основе коммерчески доступных составов сред, в том числе, например, DMEM или среды Хэма F12. В некоторых вариантах осуществления среда культивирования клеток является модифицированной для поддержки как роста клеток, так и биологической экспрессии белка. Как используется в данном документе, выражения "среда культивирования клеток", "культуральная среда" и "состав среды" относится к питательному раствору для поддержания, роста, размножения или разращивания клеток в искусственном in vitro окружении вне многоклеточного организма или ткани. Среду культивирования клеток можно оптимизировать для использования в конкретной клеточной культуре, включая, например, культуральную среду для роста клеток, которая составлена для стимуляции клеточного роста, или культуральную среду для продуцирования, которая составлена для того, чтобы стимулировать продукцию рекомбинантного белка. Выражения питательное вещество, ингредиент и компонент, используемые в данном документе взаимозаменяемо, относятся к составляющим, которые составляют среду культивирования клеток.
В различных вариантах осуществления клеточные линии поддерживают с использованием способа периодического культивирования с подпиткой. Как используется в данном документе, "способ периодического культивирования с подпиткой" относится к способу, при котором культуру одного производственного цикла дополняют дополнительными питательными веществами после первоначального инкубирования с базовой средой. Например, способ периодического культивирования с подпиткой может включать добавление среды с добавками в соответствии с определенным питательным режимом в течение заданного периода времени. Следовательно, "способ периодического культивирования с подпиткой" относится к клеточной культуре, где клетки, как правило, млекопитающего, и культуральная среда заполняются в сосуд для культивирования с самого начала, и дополнительные питательные вещества для культуры подаются непрерывно или пошагово в культуру во время культивирования с или без периодическим сбором клеток и/или продукта до завершения культивирования.
Применяемая среда культивирования клеток и питательные вещества, содержащиеся в ней, известны в уровне техники. В некоторых вариантах осуществления среда культивирования клеток содержит базовую среду и по меньшей мере один гидролизат, например, гидролизат на основе сои, гидролизат на основе дрожжей, или комбинацию двух типов гидролизатов, дающую в результате модифицированную базовую среду. Дополнительные питательные вещества могут иногда включать только базовую среду, такую как концентрированная базовая среда, или могут включать только гидролизаты или концентрированные гидролизаты. Подходящие базовые среды включают без ограничения среду Игла в модификации Дульбекко (DMEM), DME/F12, минимальную питательную среду (МЕМ), базовую среду Игла (ВМЕ), RPMI 1640, F-10, F-12, минимальную питательную среду α (α-МЕМ), минимальную питательную среду Глазго (G-MEM), PF СНО (смотри, например, не содержащую белков среду для CHO (Sigma) или не содержащую белков бессывороточную среду для CHO клеток EX-CELL™ 325 PF CHO (SAFC Bioscience) и среду Дульбекко в модификации Пскова. Другими примерами базовых сред, которые можно применять в технологии в данном документе, включают базовую среду ВМЕ; среду Игла в модификации Дульбекко (DMEM, порошковая) (Gibco-lnvitrogen (#31600). В определенных вариантах осуществления базовая среда может быть бессывороточной, это означает, что среда не содержит сыворотки (например, фетальной бычьей сыворотки (FBS), лошадиной сыворотки, козьей сыворотки или сыворотки, происходящей из любого другого животного, известного в уровне техники), или средой, не содержащей животных белков, или средой с определенным химическим составом.
Базовую среду можно модифицировать с целью удаления определенных компонентов, не являющихся питательными веществами, находящихся в стандартной базовой среде, таких как разнообразные неорганические и органические буферы, поверхностно-активное вещество(вещества) и хлорид натрия. Удаление таких компонентов из базовой среды для клеток позволяет повысить концентрацию остальных питательных компонентов и может улучшить общий рост клеток и экспрессию белка. Кроме того, изъятые компоненты можно добавить обратно в среду культивирования клеток, содержащую модифицированную базовую среду для клеток, в соответствии с требованиями условий культивирования клеток. В определенных вариантах осуществления среда культивирования клеток содержит модифицированную базовую среду для клеток и по меньшей мере один из следующих питательных веществ: источника железа, рекомбинантного ростового фактора; буфера; поверхностно-активного вещества; регулятора осмолярности; источника энергии и гидролизатов неживотного происхождения. Кроме того, модифицированная базовая среда для клеток может необязательно содержать аминокислоты, витамины или комбинацию и аминокислот, и витаминов. В некоторых вариантах осуществления модифицированная базовая среда дополнительно содержит глутамин, например L-глутамин, и/или метотрексат.
В некоторых вариантах осуществления продуцирование антитела проводится в большом количестве с помощью процесса в биореакторе с использованием способов периодического культивирования с подпиткой в биореакторе, периодического культивирования в биореакторе, способов для перфузионных биореакторов или биореакторов с непрерывной подачей, известных в уровне техники. Крупномасштабные биореакторы имеют емкость по меньшей мере 1000 литров, иногда емкость приблизительно 1000-100000 литров. В этих биореакторах могут применяться мешалки с импеллером для распределения кислорода и питательных веществ. Биореакторы небольшого масштаба относятся, в целом, к культивированию клеток в рабочем объеме не более примерно 100 литров и могут варьировать от приблизительно 1 литра до приблизительно 100 литров. В качестве альтернативы, биореакторы для разового использования (SUB) можно использовать либо для крупномасштабного, либо для мелкомасштабного культивирования.
Температура, pH, перемешивание, аэрация и плотность посева может изменяться в зависимости от применяемых клеток-хозяев и рекомбинантных белков, которые нужно экспрессировать. Например, клеточную культуру с рекомбинантным белком можно поддерживать при температуре от 30 до 45 градусов Цельсия. pH культуральной среды можно отслеживать в ходе процесса так, чтобы pH оставался на оптимальном уровне, который для определенных клеток-хозяев может быть в пределах диапазона pH от 6,0 до 8,0. Осуществляемое импеллером перемешивание можно использовать для таких способов культивирования для взбалтывания. Скорость вращения импеллера может быть окружной скоростью конца лопасти примерно 50-200 см/с, но часто можно использовать аэролифтные или другие системы для перемешивания/аэрации, известные в уровне техники, в зависимости от типа культивируемых клеток-хозяев. Достаточная аэрация обеспечивается для поддержания концентрации растворенного кислорода примерно от 20% до 80% насыщения культуры воздухом, опять же, в зависимости от выбранного типа культивируемых клеток-хозяев. В качестве альтернативы, биореактор может барботировать воздух или кислород непосредственно в культуральную среду. Существуют другие способы подачи кислорода, включающие системы с аэрацией беспузырьковым потоком, использующие аэраторы с мембраной из полых волокон.
Методики фагового дисплея
В некоторых вариантах осуществления моноклональные антитела или фрагменты антител могут быть выделены из фаговых библиотек антител, образованных с использованием методик, известных в данной области техники. В таких способах антитело к альфа-токсину или его фрагмент могут быть выделены путем скрининга рекомбинантной комбинаторной библиотеки антитела, иногда библиотеки фагового дисплея scFv, полученной с использованием кДНК VL и VH человека, полученных из мРНК из лимфоцитов человека. Методы получения и скрининга таких библиотек известны в уровне техники.
Очистка и выделение антител
Как только молекула антитела получена путем рекомбинантной или гибридомной экспрессии, ее можно очистить любым способом, известным в уровне техники, для очистки молекулы иммуноглобулина, например, путем хроматографии (например, ионообменной, аффинной, особенно аффинной для специфичных антигенов - белка A или белка G, и колоночной хроматографией размеров), центрифугирования, дифференциальной растворимости, или любой другой стандартной методикой для очистки белков. Кроме того, антитела по технологии в соответствии с настоящим изобретением или их фрагменты могут быть слиты с гетерологичными полипептидными последовательностями (названными в настоящем документе "метками"), описанными выше или где-либо еще в уровне техники для облегчения очистки.
Гуманизированные антитела
В определенных вариантах осуществления антитела по технологии в соответствии с настоящим изобретением являются гуманизированными антителами, которые получают с использованием способов, известных в уровне техники. Гуманизированные антитела могут быть химерными антителами. Химерными антителами являются антитела, у которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям в антителах, полученных от конкретного вида или принадлежащих конкретному классу или подклассу антитела, тогда как другая часть цепи(цепей) является идентичной или гомологичной соответствующим последовательностям в антителах, полученных от другого вида или принадлежащих другому классу или подклассу антитела, а также фрагменты таких антител, при условии, что они проявляют желаемую биологическую активность. Представляющие интерес химерные антитела в настоящем документе включают "приматизированные" антитела, содержащие антигенсвязывающие последовательности вариабельного домена, полученные из последовательностей константного участка отличного от человека примата (например, мартышковые, такие как бабуин, макак-резус или яванский макак) и человека.
Антитела человека
В качестве альтернативы гуманизации, антитела человека могут быть образованы с использованием способов, известных в уровне техники. Антитела человека избегают некоторых проблем, связанных с антителами, которые содержат вариабельные и/или константные участки мыши или крысы. Присутствие таких полученных от мыши или крысы белков может приводить к быстрому клиренсу антител или может приводить к образованию иммунного ответа на антитело у пациента. Для того чтобы избежать утилизации полученных от мыши или крысы антител, полностью человеческие антитела могут быть получены путем введения функциональных локусов антитела человека грызуну, другому млекопитающему или животному так, что грызун, другое млекопитающее или животное будут продуцировать полностью человеческие антитела.
Например, в настоящее время можно получать трансгенных животных (например, мышей), которые способны при иммунизации продуцировать полный репертуар антител человека в отсутствии эндогенной иммуноглобулиновой продукции. Например, было описано, что гомозиготная делеция гена соединяющего участка (JH) тяжелой цепи антитела у химерных и мутантных мышей зародышевой линии приводит в результате к полному ингибированию эндогенной продукции антитела. Передача матрицы гена иммуноглобулина зародышевой линии человека таким мутантным мышам зародышевой линии приведет в результате к продукции человеческих антител при стимуляции антигеном. Практически, применение штаммов XenoMouse® мышей, которые сконструированы с содержанием сконфигурированных фрагментов зародышевой линии размером менее 1000 т.п.н. локуса тяжелой цепи человека и локуса легкой цепи каппа. Штаммы XenoMouse® доступны от Amgen, Inc. (Фримонт, Калифорния).
Продукция штамма мышей XenoMouse® и антител, полученных от этих мышей, известна в уровне техники. Главным образом, линии мышей XenoMouse® иммунизируют представляющим интерес антигеном (например, альфа-токсином), лимфатические клетки (такие как B-клетки) извлекают из гипериммунизированных мышей, и извлеченные лимфоциты слиты с линией клеток миелоидного типа для получения бессмертных гибридомных клеточных линий с использованием методик, описанных выше и известных в уровне техники. Такие гибридомные клеточные линии скринируют и отбирают для идентификации гибридомных клеточных линий, которые продуцируют антитела, специфичные к представляющему интерес антигену.
В альтернативном подходе - минилокусном подходе, эндогенный локус Ig имитируют путем включения кусков (отдельных генов) из локуса Ig. Таким образом, один или несколько генов VH, один или несколько генов DH, один или несколько генов JH, константный участок mu и обычно второй константный участок (например, константный участок гамма) образуются в конструкт для вставки в животное.
Образование человеческих антител у мышей, которым путем микроклеточного слияния вводили большие куски хромосом или целые хромосомы, известно в уровне техники. Кроме того, получены мыши KM™, которые получены в результате кроссбридинга мышей Kirin’s Тс с минилокусными мышами Medarex (Humab). Эти мыши обладают человеческой трансхромосомой IgH мышей Kirin и трансгеном цепи каппа мышей Genpharm.
Человеческие антитела также могут быть получены способами in vitro. Приемлемые примеры включают без ограничения фаговый дисплей (Medlmmune (ранее CAT), Morphosys, Dyax, Biosite/Medarex, Xoma, Symphogen, Alexion (ранее Proliferon), Affimed) рибосомный дисплей (Medlmmune (ранее CAT)), дрожжевой дисплей и подобное. Технология фагового дисплея может быть использована для получения человеческих антител и фрагментов антител in vitro из репертуаров генов иммуноглобулина вариабельного (V) домена от неиммунизированных доноров. Согласно этой методике гены V домена антитела клонируют внутрирамочно либо в основной, либо в минорный ген оболочечного белка нитевидного бактериофага, такого как M13 или fd, и выявляют как функциональные фрагменты антител на поверхности фаговой частицы. Поскольку нитевидная частица содержит копию одноцепочечной ДНК фагового генома, отборы на основе функциональных свойств антитела также приводят в результате к отбору гена, кодирующего антитело, проявляющее эти свойства. Таким образом, фаг имитирует некоторые из свойств В-клетки. Фаговый дисплей может быть выполнен в ряде форматов. Для фагового дисплея могут быть использованы некоторые источники сегментов V-гена. Другая матрица антител к оксазолону выделяли из небольшой произвольной комбинаторной библиотеки V-генов, полученных из селезенок иммунизированных мышей. Может быть сконструирован репертуар V-генов от неиммунизированных доноров-людей, и антитела для другой матрицы антигенов (в том числе собственных антигенов) могут быть выделены преимущественно следующими методиками, известными в уровне техники. Как обсуждалось выше, человеческие антитела также могут быть получены с помощью in vitro активированных В-клеток.
Гены иммуноглобулина претерпевают различные модификации при развитии иммунного ответа, в том числе рекомбинация между сегментами генов V, D и J, переключение изотипов и гипермутация в вариабельных участках. Рекомбинация и соматическая гипермутация являются фундаментом для образования разнообразия антител и созревания аффинности, но они также могут создавать библиотеки последовательностей, с помощью которых можно осуществлять коммерческое получение таких иммуноглобулинов в качестве терапевтических средств, усложняющих или повышающих риск иммуногенности антитела. Как правило, мутации в участках CDR, вероятно, обеспечивают улучшенную аффинность и функцию, тогда как мутации в каркасных участках могут усиливать риск иммуногенности. Такой риск может быть снижен обращением мутаций в каркасе до зародышевого типа при обеспечении того, что активность антитела не претерпевает вредного влияния. Благодаря процессам разнообразия также могут быть получены некоторые структурные библиотеки или эти структурные библиотеки могут существовать в зародышевых последовательностях, участвующих в вариабельных доменах тяжелой и легкой цепи. Независимо от источника, может быть желательным удаление потенциальных структурных ответственностей, которые могут приводить в результате к нестабильности, агрегации, гетерогенности продукта или усиленной иммуногенности. Примеры нежелательных ответственностей включают неспаренные цистеины (которые могут приводить к "запутыванию" дисульфидной связи или к образованию вариабельного сульфгидрильного аддукта), N-связанные сайты гликозилирования (приводящие в результате к гетерогенности структуры и активности), а также сайты деамидирования (например, NG, NS), изомеризации (DG), окисления (раскрытый метионин) и гидролиза (DP).
Следовательно, для снижения риска иммуногенности и улучшения фармацевтических свойств антител, раскрытых в Примере 11, Таблицах 1-8, может быть желательным обращение последовательности каркаса к зародышевому типу, обращение CDR к зародышевому типу и/или удаление структурной ответственности. Таким образом, в некоторых вариантах осуществления, если конкретное антитело отличается от его соответствующей зародышевой последовательности на аминокислотном уровне, последовательность антитела может мутировать обратно в зародышевую последовательность. Такие корригирующие мутации могут происходить в одном, двух, трех или более положениях или в комбинации каких-либо из мутантных положений с использованием стандартных методик молекулярной биологии.
Дополнительные подходы включают методику Veloclmmune® (Regeneron Pharmaceuticals). Методика Velocimmune® может быть использована для создания полностью человеческих моноклональных антител к представляющим терапевтический интерес мишеням и предусматривает создание трансгенной мыши с геномом, содержащим вариабельные участки тяжелой и легкой цепи человека, функционально связанные с эндогенным локусом константного участка мыши так, что мышь продуцирует антитело, содержащее вариабельный участок человека и константный участок мыши, в ответ на стимуляцию антигеном. ДНК, кодирующую вариабельные участки тяжелых и легких цепей антитела выделяют и функционально связывают с ДНК, кодирующей человеческие константные участки тяжелой и легкой цепи. Затем ДНК экспрессируется в клетке, способной экспрессировать полностью человеческое антитело. См., например, патент США №6596541.
Фрагменты антител
В определенных вариантах осуществления антитела в соответствии с настоящим изобретением являются фрагментами антител или антителами, содержащими такие фрагменты. Фрагмент антитела содержит часть антитела полной длины, которое, как правило, является его антигенсвязывающим или вариабельным участком. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2, Fd и Fv. Диатела, линейные антитела, молекулы одноцепоченых антител и мультиспецифические антитела являются антителами, образованными из этих фрагментов антител.
Традиционно, эти фрагменты были получены путем протеолитического расщепления интактных антител с использованием методик, известных в уровне техники. Однако, эти фрагменты теперь могут быть получены непосредственно с помощью рекомбинантных клеток-хозяев. Все фрагменты Fab, Fv и scFv антител могут быть экспрессированы и секретированы Е. coli, что, таким образом, обеспечивает легкое продуцирование больших количеств этих фрагментов. В некоторых вариантах осуществления фрагменты антител могут быть выделены из обсуждаемых выше фаговых библиотек антител. В качестве альтернативы, фрагменты Fab'-SH также могут быть непосредственно извлечены из E. coli и химически соединены с образованием фрагментов F(ab')2. Согласно другому подходу фрагменты F(ab')2 могут быть выделены непосредственно из культуры рекомбинантных клеток-хозяев. Известны другие методики для получения фрагментов антител. В некоторых вариантах осуществления выбранным антителом является одноцепоченый фрагмент Fv (scFv). В определенных вариантах осуществления антителом не является фрагмент Fab. Fv и scFv являются единственными видами с интактными комбинирующимися сайтами, которые лишены константных участков; таким образом, они являются приемлемыми для снижения неспецифичного связывания во время применения in vivo. Белки слияния scFv могут быть сконструированы с получением слияния эффекторного белка либо на амино-, либо на карбокси-конце scFv.
В определенных вариантах осуществления антитела в соответствии с настоящим изобретением являются доменными антителами, например, антитела, содержащие небольшие функциональные связывающие единицы антител, соответствующие вариабельным участкам тяжелой (VH) или легкой (VL) цепей антител человека. Примеры доменных антител включают без ограничения антитела, доступные от Domantis, которые являются специфичными к терапевтическим мишеням.
Коммерчески доступные библиотеки доменных антител могут быть использованы для идентификации доменных антител к альфа-токсину. В определенных вариантах осуществления антитела к альфа-токсину и фрагменты содержат функциональные связывающие альфа-токсин единицы и функциональные связывающие Fc гамма рецептор единицы.
В определенных вариантах осуществления антителами в соответствии с настоящим изобретением являются линейные антитела. Линейные антитела содержат пару тандемных сегментов Fd (VH-CH1-VH-CH1), которые образуют пару антигенсвязывающих участков. Линейные антитела могут быть биспецифичными или моноспецифичными.
Определенные модификации аминокислотной последовательности
Вдобавок к вышеупомянутым человеческим, гуманизированным и/или химерным антителам, технология, в соответствии с настоящим изобретением, также предусматривает дополнительные модификации и их варианты и фрагменты антитела к альфа-токсину или его фрагменту, содержащие одно или несколько из следующего: замена, добавление и/или делеция аминокислотного остатка и/или полипептида в вариабельном легком (VL) домене и/или вариабельном тяжелом (VH) домене и/или участке Fc, а также пост-трансляционную модификацию. Такие модификации включают конъюгаты антитела, где антитело ковалентно присоединено к компоненту. Компоненты, приемлемые для присоединения к антителам, включают без ограничения белки, пептиды, лекарственные средства, метки и цитотоксины. Такие изменения антител могут быть выполнены для изменения или регулирования характеристик (например, биохимических, связывающих и/или функциональных) антител, как подходящих для лечения и/или диагностики ассоциированных с S. aureus и/или опосредованных альфа-токсином заболеваний. Способы образования конъюгатов, осуществляющих аминокислотные и/или полипептидные изменения и пост-трансляционные модификации, известны в уровне техники, причем некоторые из них подробно описаны ниже. Любая комбинация делеций, вставки и замены может быть выполнена для получения финального конструкта, при условии, что финальный конструкт обладает желаемыми характеристиками.
Аминокислотные изменения антител приводят в результате к последовательностям, которые на менее 100% идентичны последовательности антитела или последовательности исходного антитела, описанным в данном документе. В определенных вариантах осуществления в настоящем контексте антитела могут обладать от приблизительно 25% до приблизительно 95% идентичностью последовательности с аминокислотной последовательностью вариабельного домена тяжелой или легкой цепи антитела к альфа-токсину или его фрагмента, как описано в данном документе. Таким образом, в некоторых вариантах осуществления модифицированное антитело может иметь аминокислотную последовательность по меньшей мере с 25%, 35%, 45%, 55%, 65%, 75%, 80%, 85%, 90% или 95% идентичностью или подобием аминокислотной последовательности с аминокислотной последовательностью вариабельного домена либо тяжелой, либо легкой цепи антитела к альфа-токсину или его фрагмента, как описано в данном документе. В определенных вариантах осуществления измененное антитело имеет аминокислотную последовательность по меньшей мере с 25%, 35%, 45%, 55%, 65%, 75%, 80%, 85%, 90% или 95% идентичностью или подобием аминокислотной последовательности с аминокислотной последовательностью CDR1, CDR2, или CDR3 тяжелой или легкой цепи антитела к альфа-токсину или его фрагменту, как описано в данном документе. Измененное антитело иногда может иметь аминокислотную последовательность по меньшей мере с 25%, 35%, 45%, 55%, 65%, 75%, 80%, 85%, 90% или 95% идентичностью или подобием аминокислотной последовательности с аминокислотной последовательностью FR1, FR2, FR3 или FR4 тяжелой или легкой цепи антитела к альфа-токсину или его фрагменту, как описано в данном документе.
В определенных вариантах осуществления измененные антитела получают одним или несколькими аминокислотными изменениями (например, заменами, делецией и/или добавлениями), введенными в один или несколько из вариабельных участков антитела. В различных вариантах осуществления аминокислотные изменения вводят в каркасные участки. Одно или несколько изменений остатков каркасного участка могут привести в результате к улучшению связывающей способности антитела по отношению к антигену. Это особенно может быть справедливым, если такие изменения выполняют для гуманизированных антител, где каркасный участок может быть из другого вида, чем участки CDR. Примеры остатков каркасного участка для модификации включают те, что нековалентно связывают антиген непосредственно, взаимодействуют с конформацией CDR/влияют на нее и/или участвуют во взаимодействии VL-VH. В некоторых вариантах осуществления могут быть изменены от приблизительно одного до приблизительно пяти каркасных остатков. Иногда этого может быть достаточно для получения мутанта антитела, приемлемого для применения в доклинических испытаниях, даже если не было изменено ни одного остатка гипервариабельного участка. В норме, однако, измененное антитело будет содержать дополнительное изменение(изменения) гипревариабельного участка. В определенных вариантах осуществления остатки гипревариабельного участка могут быть изменены произвольно, особенно где начальная связывающая способность антитела к альфа-токсину или его фрагмента для антигена от второго вида млекопитающего является такой, что такие произвольно полученные антитела могут быть легко скринированы.
Одна применяемая процедура для образования измененных антител называется "сканирующим аланином мутагенезом". В этом способе один или несколько из остатков гипервариабельного участка замещаются аланиновым или полиаланиновым остатком(остатками) для изменения взаимодействия аминокислот с альфа-токсином. Такой остаток(остатки) гипервариабельного участка, демонстрирующий функциональную чувствительность к заменам, затем улучшают введением дополнительных или других мутаций в сайтах или вместо сайтов замены. Таким образом, хотя сайт для введения вариации аминокислотной последовательности устанавливается предварительно, нет необходимости per se в предварительном определении природы мутации. Ala-мутанты, полученные таким путем, скринируют по их биологической активности, как описано в данном документе.
В определенных вариантах осуществления заменяющий вариант предусматривает замену одного или нескольких остатков гипревариабельного участка исходного антитела (например, гуманизированного или человеческого антитела). Как правило, полученный в результате вариант(варианты), выбранный для дополнительного развития, будет обладать улучшенными биологическими свойствами относительно исходного антитела, из которого они получены. Подходящий способ образования таких заменяющих вариантов предусматривает развитие аффинности с использованием фага. Вкратце, несколько сайтов гипервариабельного участка (например, 6-7 сайтов) мутируют с образованием всех возможных аминокислотных замен на каждом сайте. Мутанты антитела, образованные таким образом, показывают в одновалентной форме из частиц нитчатого фага в виде слияний с продуктом гена III M13, упакованного в каждой частице. Показанных в фаге мутантов затем скринируют по их биологической активности (например, связывающей способности), как раскрыто в настоящем документе.
Мутации в последовательностях антитела могут включать замены, делеции, в том числе внутренние делеции, добавления, в том числе добавления, приводящие к слитым белкам, или консервативные замены аминокислотных остатков в аминокислотной последовательности и/или рядом с ней, но которые приводят в результате к "молчащему" изменению, так как изменение дает функционально эквивалентное антитело к альфа-токсину или его фрагмент. Консервативные аминокислотные замены могут быть выполнены на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы включенных остатков. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; полярные нейтральные аминокислоты включают глицин, серии, треонин, цистеин, тирозин, аспарагинин и глутамин; положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; а отрицательно заряженные (кислотные) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. Кроме того, глицин и пролин являются остатками, которые могут воздействовать на ориентацию цепи. Неконсервативные замены повлекут за собой замену члена одного из этих классов на член другого класса. Более того, если желательно, неклассические аминокислоты или химические аналоги аминокислот могут быть введены как замена или добавление в последовательность антитела. Неклассические аминокислоты включают без ограничения D-изомеры общих аминокислот, альфа-аминоизомасляную кислоту, 4-аминомасляную кислоту, Abu, 2-аминомасляную кислоту, гамма-Abu, эпсилон-Ahx, 6-аминогексановую кислоту, Aib, 2-аминоизомасляную кислоту, 3-аминопропионовую кислоту, орнитин, норлейцин, норвалин, гидроксипролин, саркозин, цитруллин, цистеиновую кислоту, t-бутилглицин, t-бутилаланин, фенилглицин, циклогексилаланин, бета-аланин, фтор-аминокислоты, конструированные аминокислоты, такие как бета-метиламинокислоты, С-альфа-метиламинокислоты, N-альфа-метиламинокислоты и аналоги аминокислот, как правило.
В определенных вариантах осуществления любой цистеиновый остаток, не участвующий в поддержании надлежащей конформации антитела к альфа-токсину или его фрагмента, также может быть заменен, как правило, серином, для улучшения устойчивости к окислению молекулы и предотвращения аберрантного сшивания. Наоборот, цистеиновая связь(связи) может быть добавлена к антителу для улучшения его стабильности (особенно, где антителом является фрагмент антитела, такой как фрагмент Fv).
В некоторых вариантах осуществления антитело может быть модифицировано с получением слитых белков; т.е. антитело или его фрагмент, слитые с гетерологичным белком, полипептидом или пептидом. В различных вариантах осуществления белком, слитым с частью антитела, является ферментный компонент антитело-опосредованной терапии с использованием ферментов и пролекарств (ADEPT). Примеры других белков или полипептидов, которые могут быть сконструированы как слитый белок с антителом, включают без ограничения токсины, такие как рицин, абрин, рибонуклеаза, ДНКаза I, стафилококковый энтеротоксин-A, противовирусный белок лаконоса, гелонин, дифтерийный токсин, экзотоксин Pseudomonas и эндотоксин Pseudomonas. Ферментативно активные токсины и их фрагменты, которые могут быть использованы, включают дифтерийную A цепь, несвязывающие активные фрагменты дифтерийного токсина, экзотоксиновая A цепь (из Pseudomonas aeruginosa), рициновая A цепь, абриновая A цепь, модессиновая A цепь, альфа-сакрин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецины.
Дополнительные слитые белки могут быть получены известными методиками перестановки генов, перестановки мотивов, перестановки экзонов и/или перестановки кодонов (вместе названных "перестановкой ДНК"). Перестановка ДНК может быть использована для изменения характеристик антитела или его фрагментов {например, антитела или его фрагмент с более высокими аффинностями и более низкими степенями диссоциации). Кроме того, антитело может быть связывающим домен иммуноглобулина слитым белком, как известно в данной области техники.
Вариантные Fc-участки
Настоящее изобретение также включает участники связывания согласно настоящему изобретению и, в частности, антитела согласно настоящему изобретению, которые имеют модифицированные константные домены IgG. Антитела человека класса IgG, которые имеют такие функциональные характеристики, как длительный период полужизни и способность к опосредованию различных эффекторных функций, применяют в определенных вариантах осуществления настоящего изобретения (Monoclonal Antibodies: Principles and Applications, Wiley-Liss, Inc., Chapter 1 (1995)). Антитело человека класса IgG дополнительно классифицируют на 4 подкласса: IgG1, IgG2, IgG3 и IgG4. На сегодняшний день значительное число исследований было проведено в отношении ADCC и CDC, как эффекторных функций антитела класса IgG, при этом было подтверждено, что среди антител человека класса IgG подкласс IgG1 обладает наивысшей ADCC активностью и CDC активностью у людей (Chemical Immunology, 65, 88 (1997)).
"Антителозависимая клеточно-опосредованная цитотоксичность" и "ADCC" относится к клеточно-опосредованной реакции, в которой неспецифические цитотоксические клетки (например, клетки-естественные киллеры (NK), нейтрофилы и макрофаги) распознают связанное антитело на клетке-мишени и впоследствии вызывают лизис клетки-мишени. В одном варианте осуществления такие клетки представляют собой клетки человека. Не вдаваясь в какой либо конкретный механизм действия, данные цитотоксические клетки, которые опосредуют ADCC, в основном экспрессируют Fc-рецепторы (FcR). Первичные клетки для опосредования ADCC, NK-клетки, экпрессируют FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII, FcγRIII и/или FcγRIV. Экспрессия FcR на гемопоэтических клетках кратко изложена в Ravetch и Kinet, Annu. Rev. Immunol., 9: 457-92 (1991). Для оценки ADCC активности можно провести анализ ADCC in vitro так, как описано в патентах США №№5500362 или 5821337. Пригодные для таких анализов эффекторные клетки включают мононуклеарные клетки периферической крови (РВМС) и клетки-естетственные киллеры (NK). Альтернативно или дополнительно, может быть проведена оценка ADCC активности представляющей интерес молекулы in vivo, например, на животной модели, такой как раскрытая в Clynes et al. PNAS (USA) 95: 652-656 (1998).
"Комплементзависимая цитотоксичность" или "CDC" относится к способности молекулы инициировать активацию комплемента и лизировать мишень в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, антителом), образующей комплекс с распознаваемым антигеном. Для оценки активации комплемента анализ CDC может быть осуществлен, как описано, например, в Gazzano-Santoro et al., J. Immunol. Methods, 202: 163 (1996).
Проявление ADCC активности и CDC активности антитела человека подкласса IgG1 обычно включает связывание Fc-участка антитела с рецептором для антитела (далее называемого "FcγR"), присутствующего на поверхности эффекторных клеток, таких как клетки-киллеры, клетки-естественные киллеры или активированные макрофаги. Могут быть связанными различные компоненты комплемента. В отношении связывания, было высказано предположение, что важными являются несколько аминокислотных остатков в шарнирном участке и втором домене С-участка (далее называемого "Сγ2-доменом") антитела (Eur. J. Immunol., 23, 1098 (1993), Immunology, 86, 319 (1995), Chemical Immunology, 65, 88 (1997)) и что важной также является цепь из Сахаров в Сγ2-домене (Chemical Immunology, 65, 88 (1997)).
"Эффекторные клетки" представляют собой лейкоциты, которые экспрессируют один или несколько FcR и выполняют эффекторные функции. Клетки экспрессируют по меньшей мере FcγRI, FCγRII, FcγRIII и/или FcγRIV и выполняют ADCC эффекторную функцию. Примеры лейкоцитов человека, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (РВМС), клетки-естественные киллеры (NK), цитотоксические Т-клетки и нейтрофилы.
Выражения "Fc-рецептор" или "FcR" применяют для описания рецептора, который связывается с Fc-участком антитела. В одном варианте осуществления FcR представляет собой нативную последовательность FcR человека. Более того, в определенных вариантах осуществления FcR является таким, который связывает IgG-антитело (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII, FcγRIII и FcγRIV, в том числе аллельные варианты и подвергнутые альтернативному сплайсингу формы данных рецепторов. Рецепторы FcγRII включают FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), которые имеют сходные аминокислотные последовательности, которые отличаются в первую очередь своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит иммунорецепторный тирозиновый активирующий мотив (ITAM) в своем цитоплазматическом домене. Ингибирующий рецептор FcγRIIB иммунорецепторный тирозиновый ингибирующий мотив (ITIM) в своем цитоплазматическом домене. (Смотри, Daeron, Annu. Rev. Immunol., 15: 203-234 (1997)). Обзор FcR приведен в Ravetch and Kinet, Annu. Rev. Immunol., 9: 457-92 (1991); Capel et al., Immunomethods, 4: 25-34 (1994); и de Haas et al., J. Lab. Clin. Med., 126:330-41 (1995). Остальные FcR, включая те, которые будут идентифицированы в будущем, охватываются выражением "FcR". Выражение также включает в себя рецептор новорожденных FcRn, который ответственен за перенос материнских IgG плоду (Guyer et al., Immunol., 117: 587 (1976) и Kim etal., J. Immunol., 24: 249 (1994)).
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент содержит измененный Fc-участок (также называемый "вариантным Fc-участком"), в котором одна или несколько перестроек были осуществлены в Fc-участке для изменения функциональных и/или фармакокинетических свойства антител. Подобные перестройки могут приводить к снижению или повышению связывания Clq и комплементзависимой цитотоксичности (CDC) или связывания Fc-raMMaR для IgG. Данная технология охватывает антитела, описанные в данном документе, с вариантными Fc-участками, где изменения были осуществлены для модификации эффекторной функции, обеспечивая желаемый эффект. Соответственно, в некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент содержит вариантный Fc-участок (т.е. Fc-участки, которые были перестроены, как описано ниже). Антитела к альфа-токсину и фрагменты в данном документе, содержащие вариантный Fc-участок, также называются в данном документе "Fc-вариантными антителами". Как используется в данном документе, нативный относится к немодифицированной исходной последовательности и антителу, содержащему нативный Fc-участок, обозначаемый в данном документе как "нативное Fc-антитело". В некоторых вариантах осуществления вариантный Fc-участок проявляет подобный уровень индукции эффекторной функции в сравнении с нативным Fc-участком. В определенных вариантах осуществления вариантный Fc-участок проявляет более высокую индукцию эффекторной функции в сравнении с нативным Fc. В определенных вариантах осуществления вариантный Fc-участок проявляет более низкую индукцию эффекторной функции в сравнении с нативным Fc. Некоторые конкретные варианты осуществления вариантных Fc-участков подробно описаны в данном документе. Способы измерения эффекторной функции известны в данном уровне техники.
Эффекторную функцию антитела можно модифицировать путем изменений в Fc-участке, включая без ограничения аминокислотные замены, аминокислотные присоединения, аминокислотные делеций и изменения при посстрансляционных модификациях Fc-аминокислот (например, гликозилирование). Способы, описанные ниже, могут быть использованы для изменения эффекторной функции выделенного антитела или антигенсвязывающего фрагмента, как описано в данном документе, в результате чего получают антитело или антигенсвязывающий фрагмент, имеющие определенные свойства, эффективные для профилактики или лечения конкретного заболевания или состояния, связанного со Staphylococcus aureus.
В некоторых вариантах осуществления Fc-вариантное антитело получают таким образом, чтобы изменить связывающие свойства Fc-лиганда (например, Fc-рецептор, C1q) по отношению к нативному Fc-антителу. Примеры связывающих свойств включают без ограничения специфичность связывания, равновесную константу диссоциации (Kd), скорости диссоциации и ассоциации (koff и kon, соответственно), связывающую способность и/или авидность. В данной области техники известно, что равновесная константа диссоциации (Kd) определяется как koff/kon. В определенных аспектах антитело, содержащее Fc-вариантный участок с низкой Kd, может быть более подходящим, чем антитело с высокой Kd. Тем не менее, в некоторых случаях значение kon или koff может быть более уместным, чем значение Kd. Можно определить, какой кинетический параметр является более важным для применения данного антитела.
В некоторых вариантах осуществления Fc-вариантные антитела проявляют измененную связывающую способность в отношении одного или нескольких Fc-рецепторов, включая без ограничения FcRn, Fc-гамма RI (CD64), в том числе изформ Fc-гамма RIA, Fc-гамма RIB и Fc-гамма RIC; Fc-гамма RII (CD32, в том числе изформ Fc-гамма RIIA, Fc-гамма RIIB и Fc-гамма RIIC); и Fc-гамма RIII (CD16, в том числе изформ Fc-гамма RIIIA и Fc-гамма RIIIB) в сравнении с нативным Fc-антителом.
В определенных вариантах осуществления Fc-вариантное антитело характеризуется повышенным связыванием с одним или нескольким Fc-лигандом по отношению к нативному Fc-антителу. В определенных вариантах осуществления Fc-вариантное антитело проявляет повышенную или пониженную аффинность к Fc-лиганду, которая в 2 раза или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз, или в 2-10 раз, или в 5-50 раз, или в 25-100 раз, или в 75-200 раз, или в 100-200 раз больше или меньше, чем у нативного Fc-антитела. В различных вариантах осуществления Fc-вариантное антитело проявляет аффинности к Fc-лиганду, которые по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, по меньшей мере на 50%, по меньшей мере на 40%, по меньшей мере на 30%, по меньшей мере на 20%, по меньшей мере на 10%, или по меньшей мере на 5% больше или меньше, чем у нативного Fc-антитела. В определенных вариантах осуществления Fc-вариантное антитело характеризуется повышенной аффинностью к Fc-лиганду. Fc-вариантное антитело может иногда характеризоваться пониженной аффинностью к Fc-лиганду.
В некоторых вариантах осуществления Fc-вариантное антитело характеризуется повышенным связыванием с Fc-рецептором Fc-гамма RIIIA. В некоторых вариантах осуществления Fc-вариантное антитело характеризуется повышенным связыванием с Fc-рецептором Fc-гамма RIIB. В определенных вариантах осуществления Fc-вариантное антитело характеризуется повышенным связыванием как с Fc-гамма RIIIA, так и с Fc-гамма RIIB Fc-рецепторами. В определенных вариантах осуществления Fc-вариантное антитело, характеризующееся повышенным связыванием с Fc-гамма RIIIA, не имеет одновременного повышения связывания с Fc-гамма RIIB рецептором по сравнению с нативным Fc-антителом. В определенных вариантах осуществления Fc-вариантное антитело характеризуется пониженным связыванием с Fc-рецептором Fc-гамма RIIIA. Fc-вариантное антитело иногда может характеризоваться пониженным связывании с Fc-рецептором Fc-гамма RIIB. В различных вариантах вариантах осуществления Fc-вариантное антитело, проявляющее измененную аффинность к Fc-гамма RIIIA и/или Fc-гамма RIIB, характеризуется повышенным связыванием с Fc-рецептором FcRn. В некоторых вариантах осуществления Fc-вариантное антитело, проявляющее измененную аффинность к Fc-гамма RIIIA и/или Fc-гамма RIIB, характеризуется измененным связыванем с C1q в сравнении с нативным Fc-антителом.
В определенных вариантах осуществления Fc-вариантные антитела проявляют аффинности к Fc-гамма RIIIA рецептору, которые по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз, или в 2-10 раз, или в 5-50 раз, или в 25-100 раз, или в 75-200 раз, или в 100-200 раз больше или меньше, чем у нативного Fc-антитела. В различных вариантах осуществления Fc-вариантное антитело проявляет повышенные аффинности к Fc-гамма RIIIA, которые по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, по меньшей мере на 50%, по меньшей мере на 40%, по меньшей мере на 30%, по меньшей мере на 20%, по меньшей мере на 10% или по меньшей мере на 5% больше или меньше, чем у нативного Fc-антитела.
В определенных вариантах осуществления Fc-вариантные антитела проявляют аффинности к Fc-гамма RIIB рецептору, которые по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз, или в 2-10 раз, или в 5-50 раз, или в 25-100 раз, или в 75-200 раз, или в 100-200 раз, больше или меньше, чем у нативного Fc-антитела. В определенных вариантах осуществления Fc-вариантные антитела проявляют повышенные аффинности к Fc-гамма RIIB, которые по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, по меньшей мере на 50%, по меньшей мере на 40%, по меньшей мере на 30%, по меньшей мере на 20%, по меньшей мере на 10% или по меньшей мере на 5% более или менее, чем у нативное Fc-антитела.
В некоторых вариантах осуществления Fc-вариантные антитела проявляют повышенные или пониженные аффинности к C1q в сравнении с нативным Fc-антителом. В некоторых вариантах осуществления Fc-вариантные антитела проявляют аффинности к C1q-рецептору, которые по меньшей мере 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз, или в 2-10 раз, или в 5-50 раз, или в 25-100 раз, или в 75-200 раз, или в 100-200 раз больше или меньше, чем у нативного Fc-антитела. В определенных вариантах осуществления Fc-вариантные антитела проявляют аффинности к C1q, которые по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, по меньшей мере на 50%, по меньшей мере на 40%, по меньшей мере на 30%, по меньшей мере на 20%, по меньшей мере на 10%, или по меньшей мере на 5% больше или меньше, чем у нативного Fc-антитела. В различных вариантах осуществления Fc-вариантное антитело, проявляющее измененную аффинность к Ciq, характеризуется повышенной аффинностью к Fc-рецептору FcRn. В еще одном конкретном варианте осуществления Fc-вариантное антитело, проявляющее измененную аффинность к C1q, характеризуется измененным связыванием с Fc-гамма RIIIA и/или Fc-гамма RIIB относительно нативного Fc-антитела.
Предполагается, что Fc-вариантные антитела характеризуют при помощи функциональных исследований in vitro для определения одной или нескольких опосредованных Fc-гамма R эффекторных клеточных функций. В определенных вариантах осуществления Fc-вариантные антитела обладают сходными связывающими свойствами и эффекторными клеточными функциями в моделях in vivo (таких как описанные и раскрытые в данном документе), как в таковых на основе исследований in vitro. Данная технология не исключает Fc-вариантные антитела, которые не проявляют желаемый фенотип в исследованиях in vitro, но проявляют желаемый фенотип в исследованиях in vivo.
Период полужизни белков сыворотки крови, содержащих Fc-участки, может быть увеличен путем повышения связывающей способности Fc-участка в отношении FcRn. Выражение "время полужизни антитела", как используется в данном документе, означает фармакокинетическое свойство антитела, которое представляет собой оценку среднего времени жизни молекул антитела, после их введения. Время полужизни антитела можно выразить как время, необходимое для выведения 50 процентов известного количества иммуноглобулина из организма пациента (или другого млекопитающего) или его конкретной части, например, измеренное в сыворотке крови, т.е. время полужизни в кровотоке или других тканях. Время полужизни может варьировать от одного иммуноглобулина или класса иммуноглобулина к другому. Как правило, повышение времени полужизни антитела приводит к повышению среднего времени нахождения (MRT) для введенного антитела в кровотоке.
Повышение времени полужизни позволяет снизить количество лекарственного средства даваемого пациенту, а также снизить частоту введения. Повышение времени полужизни также может быть преимущественным, например, для предупреждения заболевания или состояния, связанного со Staphylococcus aureus, а также для предупреждения повторного возникновения инфекции, что часто происходит, как только пациента выписывают из стационара. Для повышения времени полужизни антитела в сыворотке крови в антитело (в особенности во фрагмент антитела) может быть введен эпитоп, связывающий рецептор реутилизации, как известно в данном уровне техники. Как используется в данном документе, выражение "эпитоп, связывающий рецептор реутилизации" относится к эпитопу Fc-участка молекулы IgG (например, IgG1, IgG2, IgG3, или IgG4), который ответственен за увеличение времени полужизни молекулы IgG в сыворотке крови in vivo. Антитела с увеличенным временем полужизни также могут быть разработаны при помощи модификации аминокислотных остатков, идентифицированных как вовлеченные во взаимодействие между Fc- и FcRn-рецептором. Кроме того, время полужизни антитела к альфа-токсину или его фрагмента может быть увеличено при помощи конъюгирования с PEG или альбумином при помощи методик, широко используемых в данной области техники. В некоторых вариантах осуществления антитела, содержащие Fc-вариантные участки антитела к альфа-токсину, обладают увеличенным временем полужизни приблизительно на 5%, приблизительно на 10%, приблизительно на 15%, приблизительно на 20%, приблизительно на 25%, приблизительно на 30%, приблизительно на 35%, приблизительно на 40%, приблизительно на 45%, приблизительно на 50%, приблизительно на 60%, приблизительно на 65%, приблизительно на 70%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 100%, приблизительно на 125%, приблизительно на 150% или более по сравнению с антителом, содержащим нативный Fc-участок. В некоторых вариантах осуществления антитела, содержащие Fc-вариантные участки, обладают временем полужизни, увеличенным приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 10 раз, приблизительно в 20 раз, приблизительно в 50 раз или более, или 2-10 раз, или 5-25 раз, или 15-50 раз по сравнению с антителом, содержащим нативный Fc-участок.
В некоторых вариантах осуществления технология, представленная в данном документе, предлагает Fc-варианты, где Fc-участок содержит модификацию {например, аминокислотные замены, аминокислотные вставки, аминокислотные делеций) в одном или нескольких положениях, выбранных из группы, состоящей из 234, 235, 236, 237, 238, 239, 240, 241, 243, 244, 245, 247, 251, 252, 254, 255, 256, 262, 263, 264, 265, 266, 267, 268, 269, 279, 280, 284, 292, 296, 297, 298, 299, 305, 313, 316, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 339, 341, 343, 370, 373, 378, 392, 416, 419, 421, 440 и 443, пронумерованных при помощи индекса EU, как изложено у Kabat. Необязательно, Fc-участок может содержать не встречающийся в естественных условиях аминокислотный остаток в дополнительных и/или альтернативных положениях, известных в данной области техники.
В определенном варианте осуществления в данном документе предлагается Fc-вариант, где Fc-участок содержит по меньшей мере одну замену, выбранную из группы, состоящей из 234D, 234Е, 234N, 234Q, 234T, 234H, 234Y, 234I, 234V, 234F, 235A, 235D, 235R, 235W, 235P, 235S, 235N, 235Q, 235T, 235H, 235Y, 235I, 235V, 235F, 236E, 239D, 239E, 239N, 239Q, 239F, 239T, 239H, 239Y, 240I, 240A, 240T, 240M, 241W, 241L, 241Y, 241E, 241R, 243W, 243L 243Y, 243R, 243Q, 244H, 245A, 247L, 247V, 247G, 251F, 252Y, 254T, 255L, 256E, 256M, 262I, 262A, 262T, 262E, 263I, 263A, 263T, 263M, 264L, 264I, 264W, 264T, 264R, 264F, 264M, 264Y, 264E, 265G, 265N, 265Q, 265Y, 265F, 265V, 265I, 265L, 265H, 265T, 266I, 266A, 266T, 266M, 267Q, 267L, 268E, 269H, 269Y, 269F, 269R, 270E, 280A, 284M, 292P, 292L, 296E, 296Q, 296D, 296N, 296S, 296T, 296L, 296I, 296H, 269G, 297S, 297D, 297E, 298H, 298I, 298T, 298F, 299I, 299L, 299A, 299S, 299V, 299H, 299F, 299E, 305I, 313F, 316D, 325Q, 325L, 325I, 325D, 325E, 325A, 325T, 325V, 325H, 327G, 327W, 327N, 327L, 328S, 328M, 328D, 328E, 328N, 328Q, 328F, 328I, 328V, 328T, 328H, 328A, 329F, 329H, 329Q, 330K, 330G, 330T, 330C, 330L, 330Y, 330V, 330I, 330F, 330R, 330H, 331G, 331A, 331L, 331M, 331F, 331W, 331K, 331Q, 331E, 331S, 331V, 331I, 331C, 331Y, 331H, 331R, 331N, 331D, 331T, 332D, 332S, 332W, 332F, 332E, 332N, 332Q, 332T, 332H, 332Y, 332A, 339T, 370E, 370N, 378D, 392T, 396L, 416G, 419H, 421K, 440Y и 434W, пронумерованных при помощи индекса EU, как изложено у Kabat. Необязательно, Fc-участок может содержать дополнительные и/или альтернативные, не встречающиеся в естественных условиях аминокислотные остатки, известные в данной области техники.
В различных вариантах осуществления в данном документе предлагается Fc-вариантное антитело, где Fc-участок содержит по меньшей мере одну модификацию (например, аминокислотные замены, аминокислотные вставки, аминокислотные делеции) в одном или нескольких положениях, выбранных из группы, состоящей из 234, 235 и 331. В некоторых вариантах осуществления не встречающиеся в естественных условиях аминокислоты выбраны из группы, состоящей из 234F, 235F, 235Y и 331S. В данном документе предлагается Fc-вариант, где Fc-участок содержит по меньшей мере одну не встречающуюся в естественных условиях аминокислоту в одном или нескольких положениях, выбранных из группы, состоящей из 239, 330 и 332. В некоторых вариантах осуществления не встречающиеся в естественных условиях аминокислоты выбраны из группы, состоящей из 239D, 330L и 332E.
В некоторых вариантах осуществления в данном документе предлагается Fc-вариантное антитело, где Fc-участок содержит по меньшей мере одну не встречающуюся в естественных условиях аминокислоту в одном или нескольких положениях, выбранных из группы, состоящей из 252, 254 и 256. В определенных вариантах осуществления не встречающиеся в естественных условиях аминокислоты выбраны из группы, состоящей из 252Y, 254T и 256Е, описанные в патенте США №7083784, содержание которого включено в данный документ посредством ссылки во всей своей полноте.
В определенных вариантах осуществления в данном документе предлагается антитело к стафилококковому альфа-токсину, содержащее Fc-вариантный участок, который повышает время полужизни антитела в сыворотке крови, где антитело имеет следующие последовательности тяжелой цепи и легкой цепи:
Тяжелая цепь: LC10-IgG1-YTE

Легкая цепь: LC10-каппа

В определенных вариантах осуществления эффекторные функции, проявляемые IgG-антителами, в значительной степени зависят от углеводной функциональной группы, связанной с Fc-участком белка. Таким образом, гликозилирование Fc-участка может быть модифицировано для повышения или понижения эффекторной функции. Соответственно, в некоторых вариантах осуществления Fc-участки антител к альфа-токсину и фрагменты, представленные в данном документе, содержат измененные гликозилированием аминокислотные остатки. В определенных вариантах осуществления результатом изменения аминокислотных остатков гликозилированием является пониженная эффекторная функция. В определенных вариантах осуществления результатом изменения аминокислотных остатков гликозилированием является повышенная эффекторная функция. В некоторых вариантах осуществления Fc-участок обладает пониженным фукозилированием. В определенных вариантах осуществления Fc-участок нефукозилирован.
В некоторых вариантах осуществления Fc-варианты в данном документе могут быть объединены с другими известными Fc-вариантами, как известно в данной области техники. Могут быть введены другие модификации и/или замены, и/или присоединения, и/или делеции в Fc-домене.
Гпикозилирование
Помимо способности гликозилирования изменять эффекторную функцию антитела, модификация гликозилированием в вариабельном участке может изменять аффинность антитела к антигену-мишени. В некоторых вариантах осуществления паттерны гликозилирования в вариабельных участках данного антитела являются модифицированными. Например, может быть получено негликозилированное антитело (т.е. антитело не имеющее гликозилирования). Гликозилирование можно изменять, например, для повышения аффинности антитела к антигену мишени. Подобных углеводных модификаций можно достичь при помощи, например, изменения одного или нескольких сайтов гликозилирования в пределах последовательности антитела. Например, может быть осуществлена одна или несколько аминокислотных замен, результатом чего является удаление одного или нескольких сайтов гликозилирования каркасного участка вариабельной области, тем самым исключая гликозилирование в данном сайте. Подобное отсутствие гликозилирования может повышать аффинность антитела к антигену. Также могут быть получены одна или несколько аминокислотных замен, результатом чего является удаление сайта гликозилирования, представленного в Fc-участке (например, аспарагин 297 IgG). Кроме того, негликозилированные антитела могут быть получены в бактериальных клетках, которые не имеют необходимого механизма гликозилирования.
Конъюгаты антитела
В определенных вариантах осуществления антитела, представленные в данном документе, являются конъюгированными или ковалентно связанными с веществом с использованием способов, известных в уровне техники. В некоторых вариантах осуществления связанное вещество представляет собой детектируемую метку (также обозначаемая в данном документе как репортерная группа) или твердую подложку. Подходящие вещества для присоединения к антителу включают без ограничения аминокислоту, пептид, белок, полисахарид, нуклеозид, нуклеотид, олигонуклеотид, нуклеиновую кислоту, гаптен, лекарственное средство, гормон, липид, набор липидов, синтетический полимер, полимерную микрочастицу, биологическую клетку, вирус, флуорофор, хромофор, краситель, токсин, гаптен, фермент, антитело, фрагмент антитела, радиоактивный изотоп, твердые матрицы, полутвердые матрицы и их комбинации. Способы конъюгации или ковалентного присоединения другого вещества к антителу известны в уровне техники.
Способы применения в диагностике
Альфа-токсин представляет собой фактор вирулентности, который, как правило, выявляют только в патогенных штаммах S. aureus. Иногда альфа-токсин связывается с рецептором на поверхности клетки как часть образования активных комплексов. Тем не менее, олигомеризация и образование трансмембранной поры (например, гептамера альфа-токсина) могут происходить в отсутствие связывания со специфическим рецептором. Воздействие олигомеризованного альфа-токсина характеризуется нарушением функций клетки и лизисом (например, образованием трансмембранной поры) и способствует колонизации проникающими бактерий S. aureus. Антитела, описанные в данном документе, ингибируют сборку или олигомеризацию мономеров альфа-токсина в трансмембранную пору путем распознавания участков на молекуле альфа-токсина непосредственно или опосредовано вовлечен во взаимодействие мономер-мономер альфа-токсина.
В определенных вариантах осуществления антитела к альфа-токсину и их фрагменты и композиции, представленные в данном документе, могут быть использованы in vivo и/или in vitro для детекции штаммов S. aureus, которые продуцируют альфа-токсин и/или вызывают состояния/заболевания, связанные с альфа-токсином. Это может быть достигнуто, например, приведением в контакт исследуемого образца, необязательно вместе с контрольным образцом, с антителом в условиях, дающих возможность образования комплекса между антителом и альфа-токсином. Затем выявляют образование комплекса (например, с помощью ELISA). При использовании контрольного образца вместе с исследуемым образцом комплекс выявляют как в одном, так и в другом образце, и любая статистическая значимая разница между образцами в образовании комплексов является показателем наличия S. aureus, альфа-токсина или и S. aureus, и альфа-токсина в исследуемом образце.
В некоторых вариантах осуществления технология в данном документе предлагает способ определения наличия штаммов S. aureus, продуцирующих альфа-токсин, и/или альфа-токсина в образце, предположительно содержащем S. aureus и/или другие бактерии, продуцирующие гомолог альфа-токсина, при этом способ включает воздействие на образец антителом к альфа-токсину или его фрагментом и определение связывания антитела с альфа-токсином в образце, где связывание антитела с альфа-токсином в образце является показателем присутствия S. aureus и/или альфа-токсина в образце. В некоторых вариантах осуществления образец представляет собой биологический образец. В определенных вариантах осуществления биологический образец получают от млекопитающего, переживающего или предположительно переживающего заболевание/расстройство, связанное с S. aureus.
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент можно применять для детекции роста S. aureus и/или сверхэкспрессии альфа-токсина, используя диагностический анализ in vivo. В некоторых вариантах осуществления антитело к альфа-токсину или его фрагмент добавляют в образец, где антитело связывает альфа-токсин, который необходимо выявить, и метят детектируемой меткой (например, радиоактивным изотопом или флуоресцентной меткой), и снаружи сканируют пациента для обнаружения метки.
Анализы FISH, такие как INFORM™ (продано Ventana, Аризона) или PATHVISION™ (Vysis, Иллинойс), могут быть выполнены в фиксированной в формалине, погруженной в парафин ткани для определения степени (при наличии) сверхэкспрессии альфа-токсина в образце ткани.
В определенных вариантах осуществления антитела к альфа-токсину и фрагменты могут быть использованы в способе детекции альфа-токсина в образцах ткани, крови или сыворотки крови (например, растворимый альфа-токсин). В некоторых вариантах осуществления способ включает приведение в контакт исследуемого образца ткани, крови или сыворотки крови от млекопитающего, предположительно испытывающего расстройство, опосредованное альфа-токсином S. aureus, с антителом к альфа-токсину или его фрагментом, представленным в данном документе, и детекцию повышения альфа-токсина в исследуемом образце относительно контрольного образца крови или сыворотки крови от здорового млекопитающего. В некоторых вариантах осуществления способ детекции используется для диагностики расстройства, опосредованного S. aureus и/или альфа-токсином, ассоциированного с повышением альфа-токсина в ткани, крови или сыворотке крови млекопитающего.
Терапевтические способы применения
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент могут быть введены для предупреждения и/или лечения состояния, опосредованного альфа-токсином. В данном документе представлены способы предупреждения, лечения, контроля, облегчения и/или замедления заболевания или расстройства, опосредованного альфа-токсином, где способы включают введение антитела к альфа-токсину и фрагментов, предлагаемых в данном документе.
Расстройства, опосредованные альфа-токсином патогенного Staphylococcus aureus
В определенных вариантах осуществления представлены способы введения и применения композиций и антител, представленных в данном документе, для лечения и предупреждения широкого спектра состояний/заболеваний, опосредованных патогенным Staphylococcus aureus, включая как хронические, так и острые состояния, такие как без ограничения бактериемия, ожоги, флегмона, дерматонекроз, инфекции век, пищевое отравление, инфекции суставов, конъюнктивит новорожденного, остеомиелит, пневмония, кожные инфекции, послеоперационная раневая инфекция, синдром ошпаренной кожи, эндокардит, менингит, абсцедирование и синдром токсического шока.
Как CA-MRSA, так и HA-MRSA являются устойчивыми к традиционным противостафилококковым бета-лактамным антибиотикам, таким как цефалексин. CA-MRSA обладает более широким спектром чувствительности к антимикробным средствам, включая сульфаниламидные лекарственные средства (такие как ко-тримоксазол/триметоприм-сульфаметоксазол), тетрациклины (такие как доксициклин и миноциклин) и клиндамицин, но лекарственным средством выбора для лечения CA-MRSA в настоящее время считается ванкомицин, согласно Henry Ford Hospital Study. HA-MRSA устойчив даже к этим антибиотикам и зачастую чувствителен только к ванкомицину. Новейшие лекарственные средства, такие как линезолид (принадлежащий к новейшему классу оксазолидинонов) и даптомицин, являются эффективными как против CA-MRSA, так и HA-MRSA.
В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент настоящего изобретения могут быть использованы к комбинации с антибиотиком, который относится, например, к бета-лактамным антибиотикам (таким как цефалексин), сульфаниламидным лекарственным средствам (таким как ко-тримоксазол/триметоприм-сульфаметоксазол), тетрациклины (таким как доксициклин и миноциклин), клиндамицин, ванкомицин, линезолид, даптомицин, тейкопланин, хинупристин/далфопристин (синерцид) или тайгециклин.
Фармацевтические составы
В определенных вариантах осуществления антитело к альфа-токсину или его фрагмент, представленный в данном документе, могут быть составлены с фармацевтически приемлемым носителем в качестве фармацевтических (терапевтических) композиций и могут быть введены различными способами, известными в уровне техники. Путь и/или режим введения могут варьировать в зависимости от желаемых результатов. Используемые в данном документе фармацевтические составы, содержащие антитело к альфа-токсину или его фрагмент, называются составами по методике. Выражение "фармацевтически приемлемый носитель" означает один или несколько нетоксичных материалов, которые не препятствуют эффективности биологической активности активных ингредиентов. Такие препараты могут обычно содержать соли, буферизующие средства, консерванты, совместимые носители и необязательно другие терапевтические средства. Такие фармацевтически приемлемые препараты могут обычно содержать совместимые твердые и жидкие наполнители, разбавители или капсулирующие вещества, которые пригодны для введения человеку. Выражение "носитель" означает органический или неорганические ингредиент, природный или синтетический, с которым объединяют активный ингредиент для облегчения применения. Компоненты фармацевтических композиций также способны смешиваться с антителами настоящей методики и друг с другом так, чтобы отсутствовало взаимодействие, существенно снижающее желаемую фармацевтическую эффективность.
Терапевтические композиции настоящей методики могут быть составлены для индивидуального дозирования. Режимы дозирования можно корректировать для обеспечения оптимального желаемого ответа (например, терапевтическогой ответа). Например, может быть введен однократный болюс, несколько разделенных доз можно вводить на протяжении продолжительного периода, или дозу можно пропорционально уменьшить или увеличить, как диктуется обстоятельствами терапевтической ситуации. Особенно успешным является составление парентеральной композиции в виде лекарственной формы с однократной дозировкой для удобства введения и постоянства дозирования. Лекарственная форма с однократной дозировкой, используемая в данном документе, относится к физически дискретным единицам, пригодным в качестве единых доз для субъектов, подлежащих лечению; при этом каждая единица содержит предварительно определенное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Требования для лекарственных форм с однократной дозировкой обусловлены и непосредственно зависят от (а) характерных признаков антитела к альфа-токсину или его фрагмента и конкретного терапевтического эффекта, который должен быть достигнут, и от (b) ограничений, сопряженных с областью техники составления такого антитела к альфа-токсину или его фрагмента для лечения чувствительности у индивидуумов.
Терапевтические композиции по настоящей методике могут быть составлены для конкретных путей введения, таких как пероральный, назальный, легочной, местный (включая трансбуккальный и сублингвальный), ректальный, вагинальный и/или парентеральное введение. Составы могут быть удобно представлены в виде лекарственной формы с однократной дозировкой и могут быть получены при помощи любого способа известного в области фармации. Количество активного ингредиента, которое может быть объединено с материалом-носителем для получения единичной лекарственной формы, будет варьировать в зависимости от субъекта, подлежащего лечению, и конкретного способа введения. Количество активного ингредиента, который может быть объединен с материалом-носителем для получения единичной лекарственной формы будет, как правило, таким количеством композиции, которое вызывает терапевтический эффект.
Терапевтически эффективные дозировки
Состав антитела, описанный в данном документе, может быть введен в подходящей дозировке и режиме дозирования, при этом такие дозы и режимы дозирования могут зависеть от заболевания или состояния, подлежащих лечению. Терапевтически эффективная дозировка может быть установлена путем определения того, приводит ли доза или режим дозирования к терапевтическому эффекту или терапевтическому конечному результату.
Изделия и наборы
В данном документе представлены фармацевтическая упаковка или набор, содержащие один или несколько контейнеров, заполненных жидким составом или лиофилизированным составом по данном документу. В некоторых вариантах осуществления контейнер, заполненный жидким составом по данному документу, представляет собой предварительно заполненный шприц. В конкретных вариантах осуществления составы по данному документу содержат антитела к альфа-токсину или фрагменты, рекомбинантно слитые или химически конъюгированные с другим компонентом, включающим без ограничения гетерологичный белок, гетерологичный пептид, большую молекулу, малую молекулу, маркерную последовательность, диагностическое или детектируемое средство, терапевтический компонент, лекарственный компонент, ион радиоактивного металла, второе антитело и твердую подложку. В определенных вариантах осуществления составы по данному документу составляют в пузырьках с одной дозой в виде стерильной жидкости. Состав по данному документу иногда поставляется в виде предварительно заполненного шприца.
В определенных вариантах осуществления также представлены наборы, содержащие антитела к альфа-токсину и фрагменты, которые применимы для различных целей, например, для исследовательских и диагностических, включая очистку или иммунопреципитацию альфа-токсина из клеток, детекцию альфа-токсина и т.п. Для выделения и очистки альфа-токсина набор может содержать антитело к альфа-токсину или фрагмент, связанные с гранулами (например, гранулами сефарозы). Могут быть представлены наборы, которые содержат антитела для детекции и количественного определения альфа-токсина in vitro, например, в ELISA или вестерн-блоттинге. Как в случае изделия, набор содержит контейнер и этикетку или инструкцию по применению, связанную с контейнером. Контейнер вмещает композицию, содержащую по меньшей мере одно антитело к альфа-токсину или фрагмент, раскрытые в данном документе. Могут быть включены дополнительные контейнеры, которые содержат, например, разбавители и буферы, контрольные антитела. Этикетка или инструкция по применению может предлагать описание композиции, а также инструкции для предполагаемого диагностического или in vitro применения.
Настоящие методики также охватывают готовый упакованный и маркированный фармацевтический продукт. Такое изделие включает лекарственную форму с однократной дозировкой в соответствующем сосуде или контейнере, таком как стеклянный флакон, предварительно заполненный шприц или другой герметически запаянный контейнер. В некоторых вариантах осуществления предлагается лекарственная форма с однократной дозировкой в качестве стерильного, не содержащего частиц раствора, содержащего антитело к альфа-токсину или фрагмент, который пригоден для парентерального введения. В определенных вариантах осуществления предлагается лекарственная форма с однократной дозировкой в качестве стерильного лиофилизированного порошка, содержащего антитело к альфа-токсину или фрагмент, который пригоден для восстановления.
В некоторых вариантах осуществления лекарственная форма с однократной дозировкой является пригодной для внутривенной, внутримышечной, интраназальной, пероральной, местной или подкожной доставки. Таким образом, методика охватывает стерильные растворы для каждого пути доставки. Методика дополнительно охватывает стерильные лиофилизированные порошки, которые пригодны для растворения.
Как и в случае любого фармацевтического препарата, упаковочный материал и контейнер предназначены для защиты стабильности продукта при хранении и транспортировке. Кроме того, продукты по данному документу включают указания для применения или другой информационный материал, которые рекомендуют врачу, лаборанту или пациенту, как соответствующим образом предупреждать или лечить рассматриваемое заболевание или расстройство. Иными словами, изделие включает инструкции, предписывающие или указывающие режим дозирования, включая без ограничения фактические дозы, способы мониторинга и другую информацию о мониторинге.
Конкретно, методика обеспечивает изделие, включающее упаковочный материал, такой как коробок, флакон, пробирку, пузырек, контейнер, предварительно заполненный шприц, распылитель, инсуффлятор, мешок для внутривенного (i.v.) введения, оболочку и т.п.; и по меньшей мере одну лекарственную форму с однократной дозировкой фармацевтического средства, содержащегося внутри упаковочного материала, где фармацевтическое средство включает жидкий состав, содержащий антитело. Упаковочный материал включает инструкция, которая указывает, как данное антитело может быть использовано для предупреждения, лечения и/или контроля одного или нескольких симптомов, ассоциируемых с болезнью или нарушением.
Примеры
Изложенные ниже примеры иллюстрируют определенные варианты осуществления и не ограничивают методику.
Пример 1: Материалы и способы
Далее приведены материалы и способы, используемые для примера 2 - примера 9 и примера 11 - примера 13.
Клонирование и экспрессия AT S. aureus дикого типа и негемолитического мутанта H35L
Геномную ДНК от штамма АТСС BAA1556 Staphylococcus aureus применяли для амплификации гена альфа-токсина (AT) дикого типа с помощью ПЦР. Реакционная смесь содержала прямой праймер, atatatgagctcgcagattctgatattaatattaaaacc (SEQ ID NO: 41), обратный праймер, atatataagcttaatttgtcatttcttctttttccc (SEQ ID NO: 42), и примерно 00 нг геномной ДНК в 50 мкл реакционном объеме, в котором реакция протекает с помощью полимеразы Herculase II (Stratagene). Полученный фрагмент расщепили при помощи Sac I и Hind III и лигировали в ДНК-вектор pCold II (TaKaRa) внутри рамки с 6X His меткой на N конце. Мутант H35L получили путем сайт-направленного мутагенеза гена дикого типа с помощью набора для сайт-направленного мутагенеза QuikChange II XL (Stratagene) в соответствии с инструкциями производителя. Мутагенными праймерами, используемыми для мутагенеза, были gataaagaaaatggcatgctcaaaaaagtattttatagttttatc (SEQ ID NO: 43) и gataaaactataaaatacttttttgagcatgccattttctttatc (SEQ ID NO: 44).
Последовательности AT дикого типа и мутанта ATH35L подтвердили при помощи автоматизированного секвенирования ДНК. Альфа-токсин дикого типа и мутант H35L экспрессировали в штамме BL21 E. coli. 50 мл суточной культуры, выращенной в LB плюс карбенициллин, разбавили 1:10 в 500 мл культуры и выращивали при 37°C до А600 приблизительно 0,5. Культуру перенесли в 15°C на 30 минут и затем добавили 1 М IPTG для получения конечной концентрации приблизительно 100 мМ. Культуру инкубировали дополнительные 24 часа при 15°C. Клетки собрали с помощью центрифугирования.
Очистка рекомбинантного, his-меченного альфа-токсина (rAT-his)
Осадки с бактериальными клетками оттаяли на льду и ресуспендировали в Ni-NTA буфере A (20 мМ фосфат натрия, pH 7,2, 300 мМ NaCl). Клетки лизировали путем микрофлюидизации (Microfluidics, модель M-110P) под давлением 20000 фунт/кв. дюйм и сырой лизат осветлили путем центрифугирования при 27000×g в течение 10 минут при 4°C. После 0,2 мкм-фильтрации супернатант загрузили на 5 мл колонку Ni-NTA Superflow (Qiagen), уравновешенную Ni-NTA буфером A. rAT-his элюировали при помощи 300 мМ и 500 мМ имидазольного ступенчатого градиента, фракции собрали в пробирки, содержащие EDTA с конечной концентрацией 1 мМ и диализировали в SP буфер A (50 мМ фосфат натрия, pH 7,0, 25 мМ NaCl, 1 мМ EDTA). Диализаты загрузили на 5 мл колонку HiTrap SP Sepharose FF (GE Healthcare) в SP буфере A и rAT-his элюировали посредством ступенчатого градиента до 1 М NaCI. Фракции, содержащие rAT-his, диализировали в 1X PBS, pH
7,2 при помощи 1 мМ EDTA и аликвоты заморозили при -80°C.
Очистка нативного альфа-токсина от S. aureus
Нативный альфа-токсин (nAT) очистили из штамма Wood S. aureus. S. aureus Wood выращивали в течение ночи в триптиказо-соевом бульоне (TSB) при 37°C с помешиванием (например, приблизительно 250 об./мин.). Культуральный супернатант собрали путем центрифугирования, затем довели до 75% насыщения твердым сульфатом аммония. После помешивания в течение 3 часов при 4°C выделившуюся фазу собрали центрифугированием при 12000×g в течение 45 минут, ресуспендировали в SP буфере А (25 мМ ацетат натрия, pH 5,2, 20 мМ NaCl, 1 мМ EDTA) и диализировали против SP буфера A в течение ночи при 4°C с одной заменой. Нерастворимый материал удалили центрифугированием при 27000×g в течение 30 минут при 4°C. Растворимый диализат профильтровали (0,2 мкм) и загрузили на 10 мл колонку SP Sepharose FF (GE Healthcare), уравновешенную при помощи SP буфера A. Связанный nAT элюировали посредством линейного градиента до 300 мМ NaCl с последующими этапами с 0,5 и 1 М NaCl. Фракции, содержащие nAT, объединили и диализировали в течение ночи в PBS, pH 7,2, содержащем 1 мМ EDTA. Для конечной обработки диализат загрузили на колонку с высоким разрешением HiPrep Sephacryl S-200 (GE Healthcare) со скоростью потока 1,3 мл/мин. в 1X PBS, pH 7,2 с 1 мМ EDTA. Фракции, содержащие nAT, объединили, разделили на аликвоты и заморозили при -80°C.
Иммунизация/ получение гибридомы
Восьминедельные мыши Veloclmmune получили 5 циклов подкожных инъекций rATH25L в несколько мест после схемы иммунизации RIMMS по Kilpatrick et al (1997). Мышей иммунизировали в течение курса 13 дней с интервалами 2-3 дня. Для каждого цикла иммунизации мышей сначала анестезировали изофлураном. Иммуноген эмульгировали в полном или неполном адъюванте Фрейнда и адъюванте TiterMax Gold и билатерально ввели инъекцией в загривок, подмышечную область, заднюю часть голени и паховую область. Тестовые образцы крови собрали на 13 день и оценили в ELISA на антиген. Мышам внутрибрюшинно ввели повторную дозу антигена перед гибридизацией и на 17 день умертвили. Лимфоциты из лимфоузлов и спленоциты гибридизировали с миеломной клеткой-партнером с получением стабильных гибридом.
Нейтрализация гемолитической активности
Пятьдесят микролитров супернатанта каждой культуры гибридом В-клеток смешали с рекомбинантным альфа-токсин-His (rAT-his, с конечной концентрацией 0,1 мкг/мл) в 96-луночных планшетах с последующим добавлением 50 мкл 5% красных кровяных телец (RBC) кролика в PBS. Контрольные лунки содержали только RBC и культуральные среды с или без AT. Планшеты инкубировали в течение 1 часа при 37°C и интактные клетки осадили центрифугированием. 50 мкл супернатантов перенесли в новый 96-луночный планшет и измерили A490 в спектрофотометре. Нейтрализацию активности расчитали относительно лизиса с отдельно RBC и rAT-his и рассчитали: % ингибирования = 100 × [100-(A490 nAT+Ab)/(А490 nAT без Ab)].
Также протестировали ингибирование очищенных mAb. MAb к AT добавили в 96-луночный планшет в количестве 80 мкг/мл в PBS и произвели последовательное разбавление образцов (двухкратное) в PBS до конечного объема 50 мкл. В качестве изотипического контроля включили неспецифический IgG1 (R347). Двадцать пять микролитров разбавлений mAb смешали с 25 мкл nAT (нативный альфа-токсин) с концентрацией 0,1 мкг/мл в 96-луночных круглодонных планшетах с последующим добавлением 50 мкл 5% RBC. Ингибирование гемолитической активности расчитали как описано выше.
Экспрессия и очистка химерных mAb к AT
Осветленные супернатанты с антителами к AT от мышей (примерно 5 л с концентрацией 30-50 мг/л) сконцентрировали путем тангенциальной поточной фильтрации. Концентрированные супернатанты затем пропустили через пять последовательных 5 мл колонок Protein G HiTrap HP и связавшийся IgG элюировали посредством 50 мМ бикарбоната натрия, pH 11,0, и нейтрализовали до pH примерно 7,0 посредством 1 М фосфорной кислоты. Нейтрализованный материал загрузили на две последовательные 1 мл колонки HiTrap Q FF (GE Healthcare). Собрали содержащий IgG элюат и диализировали в PBS pH 7,2.
Нейтрализация лизиса A549
Клетки A549 хранили в 5% CO2 37°C термостате в RMPI, дополненной неосновной аминокислотой, глутамином и 10% эмбриональной бычьей сыворотки. Клетки один раз промыли сбалансированной средой Хенкса и высеяли в количестве 104/лунку в 50 мкл RPMI, 5% FBS, и инкубировали при 37°C с 5% CO2 в течение 20 часов. MAb к AT добавили в 96-луночный планшет в концентрации 80 мкг/мл в RPMI и произвели последовательное разбавление образцов (двухкратное) в RPMI. Несоответствующий IgG1 (R347) включили в качестве изотипического контроля. В отдельном 96-луночном планшете 30 мкл разведенных антител смешали с 30 мкл nAT (с конечной концентрацией 5 мкг/мл). Пятьдесят микролитров из каждой лунки перенесли в планшет, содержащий прикрепленные клетки A549. Включили контрольные лунки клеток A549 с или без nAT. Планшеты инкубировали при 37°C с 5% CO2 в течение 3 часов, отцентрифугировали и 50 мкл супернатанта перенесли в новый 96-луночный планшет. Клеточный лизис измеряли как высвобождение лактатдегидрогеназы (LDH) с применением набора для нерадиоактивного анализа Cytotox 96 (Promega), следуя протоколу производителя. Фоновую LDH вычли из каждой лунки и расчитали ингибирование высвобождения LDH: % ингибирования = 100 × [100-(A590 nAT+Ab)/(A590 nAT без Ab)].
Нейтрализация лизиса ТНР-1
Клетки ТНР-1 хранили в 5% CO2, 37°C термостате в RPMI среде (Invitrogen), дополненной неосновными аминокислотами (Invitrogen), 2 мМ глутамином (Invitrogen) и 10% эмбриональной бычьей сыворотки (Invitrogen). MAb к AT добавили в 96-луночный планшет в концентрации 80 мкг/мл в RPMI и произвели последовательное разбавление образцов (двухкратное) в RPMI до конечного объема 50 мкл. Несоответствующий IgG1 (R347) включили в качестве изотипического контроля. Двадцать пять микролитров разведений mAb смешали с 25 мкл нативного альфа-токсина (nAT) с конечной концентрацией 1,5 мкг/мл с последующим добавлением 50 мкл клеток ТНР-1, промытых RMPI (106 клеток/мл в RPMI с 10% FBS) в 96-луночном планшете. Контрольные лунки заключали в себе только клетки ТНР-1 или с nAT. Планшеты инкубировали в 5% CO2, 37°C термостате в течение 3 часов, отцентрифугировали и 50 мкл супернатанта перенесли в новый 96-луночный планшет. Клеточный лизис измерили как высвобождение лактатдегидрогеназы (LDH) с применением набора для нерадиоактивного анализа Cytotox 96 (Promega), следуя протоколу производителя. Ингибирование высвобождения LDH расчитали как описано выше.
Клонирование mAb IgG к AT и экспрессия в виде полностью человеческих mAb
ИРНК пяти клонов гибридом 2A3, 10A7, 12B8, 25Е9 и 28F6 выделили с помощью набора Dynabeads mRNA Direct Kit (Invitrogen). Первую цепь кДНК синтезировали с помощью обратной транскриптазы Superscript III (Invitrogen) и случайных гептамерных праймеров. VL (каппа) и VH Ig человека амплифицировали с помощью ПЦР с применением набора праймеров для lg (Novagen, каталожный №69830). Амплифицированные при помощи ПЦР VL и VH продукты клонировали в вектор ТОРО TA (Invitrogen pCR2.1-TOPO) и секвенировали. VH и VL (каппа) из каждой гибридомы повторно амплифицировали с помощью ПЦР с добавлением сайтов для ферментов рестрикции для клонирования в вектор human IgG.kappa.рОЕ, при этом VL клонировали в сайте BssHII/BsiWI, слитом с цепью каппа человека, a VH клонировали в сайте BsrGI/Sall, слитом с константным участком тяжелой цепи IgG-1 человека. Полученные плазм иды рОЕ проверили с помощью секвенирования ДНК.
Экспрессия и очистка mAb к альфа-токсину
Плазмидную ДНК из конструктов рОЕ получили с помощью набора Endofree Plasmid Maxi (Qiagen). Плазмиды pOE трансфицировали в суспензию клеток 293F с применением реагента 293fectin (Invitrogen) в среде для экспрессии Freestyle 293 (GIBCO). Через 6 и 9 дней после трансфекции собрали культуральную среду и IgG очистили с помощью колонки с А-сефарозой для очистки белка (GE Healthcare). Содержащие IgG пики объединили, диализировали в PBS, pH 7,4 и хранили при -70°C. Чистоту белков IgG проверили с помощью SDS-PAGE.
Мышиная модель пневмонии.
За двадцать четыре часа перед инфицированием группы из десяти 7-9 недельных мышей C57BL/6J (Harlan) получили 0,5 мл mAb в указанных концентрациях посредством внутрибрюшинной инъекции. Животных затем анестезировали при помощи изофлурана, удерживали вертикально и в левую и правую ноздри привили 0,05 мл бактериальной суспензией S. aureus (1×108 КОЕ - 3×108 КОЕ) в стерильном PBS. Животных поместили в клетку в положении лежа на спине для восстановления и наблюдали два раза в день во время курса исследования. Выживание животных отслеживали в течение максимум 6 дней.
Альтернативно, животных подвергли эвтаназии путем ингаляции CO2 через 48 часов после инфицирования бактериями. Забрали легкое и почку в стерильный PBS, гомогенизировали, разбавили и высеяли для подсчета бактерий. Статистическую значимость исследований смертности определили с помощью логарифмического рангового критерия. Значимость выделения бактерий из органов рассчитали с помощью дисперсионного анализа и апостериорного критерия Даннетта.
Мышиная модель дерматонекроза
Мышам из групп пяти 6-8 недельных самок BALB/c (Harlan) побрили их спины и ввели путем внутрибрюшинной инъекции 0,5 мл IgG в концентрации, указанной на графике. Двадцать четыре часа спустя мышей инфицировали при помощи подкожной инъекции 50 мкл бактериальной суспензии (1×108 S. aureus). Животных отслеживали два раза в день в отношении признаков инфекции и размера абсцесса, измеряемого в то же время ежедневно. Площадь пораженных участков рассчитывали с помощью формулы A=L×W. Статистическую значимость определяли с помощью дисперсионного анализа и апостериорного критерия Даннетта.
Анализ связывания с рецептором
"Тени" красных кровяных телец получили путем инкубирования 5 мл промытых и упакованных красных кровяных телец кролика (RBC) в 500 мл буфера для лизиса (5 мМ фосфат, 1 мМ EDTA, pH 7,4) в течение ночи при 4°C с постоянным помешиванием. Затем "тени" удалили путем центрифугирования при 15000×g и промыли 3х буфером для лизиса. Затем их промыли в PBS и ресуспендировали в конечном объеме 3 мл.
Для оценки связывания nAT с мембранами клеток "тени" RBC развели до OD600 приблизительно 0,2 в PBS и 50 мкл нанесли на ½-лунки 96-луночных планшетов (Costar) и инкубировали в течение ночи при 4°C. Затем жидкость удалили из планшетов и лунки блокировали посредством 100 мкл 1% BSA в PBS, pH 7,4 в течение 2 часов при 4°C и промыли 3х посредством PBS. 20-молярный избыток IgG смешивали с nAT в концентрации 3 мкг/мл и 50 мкл добавили в заблокированные планшеты. Планшеты инкубировали при 4°C в течение 2 часов и промыли 3х посредством PBS. Меченный биотином IgG кролика к AT добавили в лунки в концентрации 1 мг/мл и инкубировали при 4°C в течение 1 часа, промыли 3х и инкубировали с конъюгатом пероксидазы и стрептавидина (1:30000, Jackson Immunoresearch). Лунки промыли 3х и проявили посредством Sure Blue Reserve (KPL, Inc.). A450 считали с помощью планшетного ридера (Molecular Devices) и рассчитали % связанного AT. % связанного AT=100×(A450-AT+IgG/A450 - только AT).
Анализ олигомеризации
Липосомы получали с применением экструдера Liposofast (Avestin, Inc.) и мембраны с размером поры 100 нм. Смесь (молярное соотношение 5:1:4) фосфатидилхолина яичного желтка (15 мг, Avanti Polar Lipids), фосфатидилглицерина яичного желтка (2,9 мг, Avanti Polar Lipids) и холестерина (5,8 мг, Avanti Polar Lipids) в хлороформе высушили при 40°C под потоком азота. Высушенную липидную пленку затем регидратировали при помощи 3 мл PBS, pH 7,4 (Invitrogen), и инкубировали при 37°C в течение 30 минут. Затем образец энергично встряхивали на вортексе до тех пор, пока он не образовал однородную суспензию, а затем подвергли 3 циклам замораживания-оттаивания с помощью бани с изопропанолом и сухим льдом и воды комнатной температуры. Затем раствор 21 раз пропустили через экструдер Liposofast.
AT (0,5 мкг) смешали с очищенным IgG, 5 мкл "теней" RBC в PBS в конечном объеме 22 мкл и инкубировали при 37°C в течение 45 минут. Затем образцы солюбилизировали в 5 мкл буфера для подготовки образца к SDS-PAGE в течение 5 минут при 37°C и 10 мкл подвергли SDS-PAGE в 4-12% предварительно залитом полиакриламидном геле (Invitrogen). Разделенные белки затем перенесли на нитроцеллюлозу, блокировали в течение 10 минут блокирующим казеином в PBS (Thermo Scientific) и зондировали посредством IgG кролика к AT (2 мкг/мл) в течение 2 часов при комнатной температуре с постоянным помешиванием. Бэнды AT детектировали после 1-часовой инкубации с антителом козы к антителу кролика 2, меченным щелочной фосфатазой, и проявили с применением мембранной субстратной системы для фосфатазы BCIP/NBT (KPL, Inc.).
Измерение констант скорости реакции и связывания (KD)
Константы скорости реакции (kon, kofff связывания IgG-антител к AT с очищенным nAT измеряли с использованием схемы анализа IgG-захвата на приборе BIAcore 3000 (BIAcore, Inc). Если кратко, то IgG крысы к антителу мыши иммобилизировали на сенсорном чипе СМ5 согласно инструкциям производителя. Конечная поверхностная плотность захватывающего реактива на сенсорном чипе составляла примерно 2500 единиц ответа (RU), как описано в данном документе. Также на данном сенсорном чипе получили эталонную поверхность проточной ячейки с использованием идентичного протокола иммобилизации и исключая nAT. Приготовили IgG-антитела к AT в 20 нМ в буфере для прибора (HBS-EP буфер, содержащий 0,01 М HEPES, pH 7,4, 0,15 М NaCl, 3 мМ EDTA и 0,005% P-20), а также двухкратные последовательные разведения nAT. Последовательные разведения nAT выполнили в диапазоне от приблизительно 0,78 нМ до приблизительно 50 нМ в буфере для прибора.
Для кинетических измерений использовали последовательный подход. Каждый IgG к AT сначала ввели на поверхность захвата и эталонную поверхность со скорость потока 50 мкл/мин. После стабилизации связывания захваченного IgG единичную концентрацию белка nAT ввели на обе поверхности со скоростью потока 50 мкл/мин. Полученные кривые реакции связывания использовали для получения данных по ассоциированной фазе. Затем, после введения nAT поток переключили назад на буфер для прибора на 10 минут для того, чтобы сделать возможным сбор данных по диссоциированной фазе, с последующей 1-минутной подачей 10 мМ глицина, pH 1,5 для регенерации поверхности захвата IgG на чипе. Реакции связывания в результате повторных введений каждой концентрации nAT зарегистрировали ко всем IgG к AT.
Кроме того, в ходе серии введений сделали вразброс несколько введений буфера. Избранные введения буфера использовали вместе с ответами эталонной ячейки для сбора наборов необработанных данных в отношении артефактов введений и/или взаимодействий, вызванных неспецифическим связыванием, обычно называемых "двойной контроль" (D.G. Myszka, Improving biosensor analysis. J. Mol. Recognit. 12 (1999), pp. 279-284). Полностью скорректированные данные связывания затем в целом согласовали 1:1 с моделью связывания (программное обеспечение BIAevaluation 4.1, BIAcore, Inc, Уппсала, Швеция) с включением параметра для коррекции ограниченной переносом массы связывания, подлежащего выявлению. С помощью этих анализов определили константы (on, off) скорости реакции, из которых затем рассчитали кажущуюся KD в виде koff/kon.
Измерение уровней цитокинов в инфицированных S. aureus легких
Семи-девятинедельных мышей C57BL/6J обработали посредством 2A3.1hu (полностью человеческий 2A3.1) или R347 (45 мг/кг) путем внутрибрюшинной инъекции за 24 часа до интраназальной инфекции 1,5×108 КОЕ USA300 (BAA-1556, ATCC). Через четыре и двадцать четыре часа после инфицирования мышей подвергли эвтаназии и легкие 3х промыли посредством 1 мл PBS. Бронхоальвеолярную смывную жидкость (BAL) хранили при -70°C. Провоспалительные цитокины оценили с использованием набора для определения провоспалительных цитокинов у мышей 7 pro-inflammatory II mouse cytokine kit (Mesoscale, Гейтерсберг, Мэриленд) согласно инструкциям производителя. Уровни цитокинов выразили в виде пг/мл.
Клонирование и экспрессия гибридных белков GST
Генные последовательности, кодирующие AT1-50 и AT51-293, амплифицировали с помощью ПЦР с описанного выше клона AT pColdII. Реакционные смеси содержали 10 нг ДНК AT-pColdII и 0,1 мг каждого из прямого и обратного праймеров (АТ1-50-F, atattggatccgcagattctgatattaatattaaaac (SEQ ID NO: 45) и AT1-50-R, atacttctcgagttatttattatgatttttatcatcgataaaac (SEQ ID NO: 46); или AT51-293-F catagggatccaaactgctagttattagaacgaaag (SEQ ID NO: 47) и AT51-293-R, catagctcgagtcaatttgtcatttcttctttttcccaatc (SEQ ID NO: 48)), и используемой **PCR-полимеразы, (Invitrogen) согласно инструкциям производителя. Полученный ПЦР-фрагмент расщепили с помощью BamHI и Xhol и лигировали в ДНК-вектор pGex 6P (Stratagene) в рамке с N-концевой меткой, представляющей собой глутатион-S-трансферазу (GST). Последовательности клонов подтвердили с помощью автоматического секвенирования ДНК.
Экспрессию фрагментов осуществили при помощи штамма BL21(DE3) E. coli в качестве хозяина. Из чашки забрали несколько колоний и засеяли в 100 мл LB+100 мкг/мл ампициллина (Sigma Chemical Company) и выращивали в течение ночи при 37°C. Суточные культуры развели 1:100 в 3×1 л культурах LB+100 мкг/мл ампициллина и выращивали при помешивании со скоростью примерно 250 об./мин. до OD600 приблизительно 0,8. Затем экспрессию белков индуцировали путем добавления 1 мМ IPTG. Культуры продолжали инкубировать в течение 2 часов при 37°C при помешивании. Бактериальные клетки собрали путем центрифугирования и заморозили при -20°C.
Клеточные осадки ресуспендировали в 100 мл PBS, pH 7,4 (Invitrogen) и лизировали путем микрофлюидизации (Microfluidics, модель M110P) под давлением 20000 фунт/кв. дюйм и сырой лизат осветлили центрифугированием со скоростью 27000×g в течение 10 мин. при 4°C. Полученный супернатант загрузили на колонку GSTrap FF (GE Healthcare) и GST-AT1-50 и растворимую фракцию GST-AT51-293 очистили в соответствии с инструкциями производителя. Нерастворимую фракцию GST-AT51-293 очистили от нерастворимых клеточных осадков. Нерастворимый материал солюбилизировали в течение одного часа при комнатной температуре при легком помешивании в 3 М гуанидин-HCl в 25 мМ фосфате натрия, pH 7,4. Солюбилизированный материал 7-кратно развели буфером А для рефолдинга [25 мМ фосфат натрия, pH 7,4, с 2 М гуанидин-HCl]. GST-AT51-293 обеспечили возможность рефолдинга путем постепенного диализа. Равный объем буфера В для рефолдинга [25 мМ фосфата натрия, pH 7,4] добавляли в диализный стакан каждые 12-15 часов диализа при 4°C до концентрации гуанидина примерно 2, 1, затем 0,5 М. Затем GST-AT51-293 диализировали против буфера В для рефолдинга в течение 24 часов. Конечный диализат осветлили с помощью центрифугирования и растворимую фракцию очистили на колонке GSTrap как описано выше.
Дот-блот анализы
Синтезировали химическим методом (New England Peptide) перекрывающиеся пептиды, охватывающие аминокислоты 40-293. Осуществили попытку синтеза АТ1--50, но безуспешно. Альфа-токсин (AT), пептиды AT и фрагменты AT (1 мкг) нанесли в виде точек на нитроцеллюлозу и блокировали 10 минут посредством блокирующего казеина в PBS. Затем блоты зондировали посредством 2 мкг/мл отдельного IgG в течение 3 часов при комнатной температуре. Блоты промыли и инкубировали с щелочной фосфатазой, конъюгированной с IgG козы к антителу мыши или IgG козы к антителу кролика (1:1000, Caltag Laboratories) в течение 1 часа и проявили с применением мембранной субстратной системы для фосфатазы BCIP/NBT (KPL, Inc).
Характеристика связывания LC10 YTE с альфа-токсином и LukF-PV с использованием ELISA
Бактериальный лизат, содержащий His-меченный альфа-токсин или LukF-PV нанесли на поверхность 96-луночного планшет и оставили на ночь при 4°C. Планшеты промыли шесть раз посредством PBS/0,05% Tween 20 и блокировали при помощи 10% буфера для блокировки Superblock (Pierce, Рокфорд, Иллинойс) при 37°C в течение 1 часа. LC10 YTE или мышиные mAb к His в количестве 2 мкг/мл (R&D Systems, Миннеаполис, Миннесота) добавили в лунки и инкубировали в течение 1 часа при RT. Затем планшеты шесть раз промыли посредством PBS/0,05% Tween 20. Связавшиеся LC10 YTE или мышиные mAb к His детектировали с использованием конъюгатов HRP и антитела к IgG человека или мыши (Jackson ImmunoResearch laboratories, Inc. Вест Грув, Пенсильвания), соответственно.
Получение химерных вариантов альфа-токсина с LukF-PV
Создали химерные варианты, состоящие из частей альфа-токсина и LukF-PV, для идентификации связывающего участка LC10 YTE на альфа-токсине. С помощью генного синтеза создали ДНК-конструкты шести химерных вариантов альфа-токсина, кодирующие участки LukF-PV для аминокислот 1-51, аминокислот 52-110, аминокислот 111-147, аминокислот 148-205, аминокислот 204-241 или аминокислот 248-293. ДНК-конструкты, кодирующие другие химерные варианты, создали с помощью ПЦР по методу перекрывающегося сплайсинг-расширения с использованием плазмиды pET3d, кодирующей альфа-токсин или LukF-PV (плазмиды собственного изготовления), в качестве шаблонов. Все ДНК-конструкты затем клонировали в вектор pET3d для экспрессии в бактериальной системе (EMD Chemicals Inc, Филадельфия, Пенсильвания) и трансформировали в E. coli, штамм BL21 (DE3) (Invitrogen, Карлсбад, Калифорния). Трансформированные клетки BL21 (DE3) выращивали в среде для экспрессии E.coli MagicMedia (Invitrogen, Карлсбад, Калифорния) для экспрессии вариантных белков с использованием стандартных протоколов.
Характеристики связывания LC10 YTE с химерными вариантами с использованием ProteOn
Характеристики связывания LC10 YTE с химерными вариантами альфа-токсин/LukF-PV изучили с использованием прибора ProteOn XPR36 (BioRad, Геркулес, Калифорния). Стандартное связывание с амином использовали для иммобилизации поликлонального антитела к альфа-токсину (антитело собственного изготовления) в 10 мМ ацетата натрия [pH 5,0] на поверхности биосенсорного чипа GLC с приблизитльно 5000 резонансными единицами (RU) на каждый канал. Химерные белки альфа-токсин/LukF-PV в супернатанте бактериального лизата ввели на поверхность GLC с иммобилизированными антителами так, чтобы получить ответ на захват величиной приблизительно 200RU. Супернатант лизата нетрансформированных бактерий также ввели при тех же условиях что и для эталонного канала. Образцы LC10 YTE подготовили в фосфатно-солевом буферном растворе (PBS) (pH 7,4), 0,005% Tween-20, и ввели со скоростью 90 мкл/мин. за 150 или 180 секунд в концентрациях, как правило, варьирующих от 50 нМ до 3,125 нМ. Использовали время диссоциации 600 или 800 секунд. Уровни экспрессии химерных вариантов также отслеживали после введения LC10 YTE следующим образом: поликлональные антитела к альфа-токсину подавали со скоростью 90 мкл/мин. в течение 150 или 180 секунд в концентрациях, как правило варьирующих от 50 нМ до 3,125 нМ с временем диссоциации 600 или 800 секунд. Поверхность дважды регенерировали путем введения глицина (10 мМ, pH 1,5) со скоростью 100 мкл/мин. в течение 30 секунд. Все данные сенсограмм обработали с помощью программного обеспечения ProteOn Manager 3.0.1.
Пример 2: Получение mAb к альфа-токсину
Моноклональные антитела (mAb) к альфа-токсину (AT) получили в мышах Veloclmmune, которые были генетически сконструированы как содержащие репертуар антитела с полностью человеческими вариабельными участками, слитыми с мышиным константным доменом. Полученные антитела были человеческими:мышиными химерами, которые легко превращаются в полностью человеческое IgG путем генетического слияния вариабельного домена человека из химерного mAb с константными участками из клонированного IgG-1 человека. Мышей иммунизировали негемолитическим мутантом AT (ATH35L), описанным в данном документе, и создали гибридомы с использованием стандартных способов. Изначально было обнаружено, что более 1800 супернатантов гибридом содержат IgG, который связывается с рекомбинантным AT (rAT-his) в результате ELISA с антигеном. Супернатанты гибридом, которые демонстрировали связывание с rAT-his, затем подвергли скринингу в отношении активности по ингибированию rAT-his-опосредованного лизиса красных кровяных телец кролика (RBC) в анализе бляшкообразования, в результате чего пул функциональных mAb уменьшился до приблизительно 250. Супернатанты гибридом затем нормализовали по уровням IgG и сравнили их ингибирующие активности. Тринадцать из наиболее сильных ингибиторов rAT-his отобрали для клонирования методом серийных разведений и использовали для мелкомасштабной экспрессии и очистки IgG. После скрининга этих клонов и последующей биохимической и in vivo характеристики, как описано ниже, последовательности VH и VL дополнительно оптимизировали для создания дополнительных антител, которые приведены ниже в таблице 7.
Пример 3: Ингибирование цитолитической активности
Ингибирующие активности 13 очищенных IgG к AT сравнили в анализе бляшкообразования. Очищенные mAb к AT оттитровали в анализе бляшкообразования в присутствии постоянных количеств nAT и красных кровяных телец кролика. Каждому mAb понижали дозу от приблизительно 20 мкг/мл в присутствии постоянного количество нативного AT (nAT) и красных кровяных телец кролика (RBC). Гемолиз измеряли по высвобождению гемоглобина в супернатант. Процент (%) ингибирования гемолиза рассчитали следующим образом: % ингибирования = 100*[100-(А490 nAT+Ab)/(A490 nAT без Ab)]. Результаты иллюстративных анализов бляшкообразования, демонстрирующие тринадцать наболее сильных ингибиторов rAT-his, показаны на фигурах 1A и 1B. Неспецифический lgG-контроль (R347) включили в качестве отрицательного контроля.
Лишь 7 из 13 очищенных mAb (mAb 2A3.1, 10A7.5, 11D12.1, 12 B8.19, 15B6.3, 25E9.1 и 28F6.1) ингибировали nAT-опосредованный лизис RBC (см. фигуры 1A и 1B). Три антитела (2A3.1, 10A7.5 и 12B8.19) были сильными ингибиторами и демонстрировали приблизительно 80% ингибирование nAT-опосредованного лизиса RBC при соотношении 1:1 (моль IgC: моль AT). Эти результаты позволяют предположить, что созданные mAbs могут ингибировать порообразование у RBC кролика.
Эритроциты человека не обладают большим количеством рецепторов к AT. Следовательно, RBC человека не настолько чувствительны, как RBC кролика к nAT-опосредованному лизису, и, вероятно, не являются основной целью для AT при инфицировании. Другие типы клеток (например, эпителиальные, лимфоциты, монофицты и макрофаги) являются более уместными мишенями для эффектов nAT при стафилококковой инфекции. Активность очищенных антител изучили при nAT-опосредованном лизисе линий человеческих клеток, A549 (линия альвеолярных эпителиальных клеток) и ТНР-1 (линия моноцитов). Моноклональные антитела (mAb) оттитровали против постоянного уровня nAT в присутствии либо A549, либо ТНР-1 клеток. Клеточный лизис количественно оценили по высвобождению лактатдегидрогеназы (LDH) и определили % ингибирования высвобождения LDH, как описано в данном документе. Результаты графически представлены на фигурах 2A и 2B. MAb, которые ингибировали лизис RBC кролика, также ингибировали nAT-опосредованный лизис как у A549, так и у ТНР-1 клеток человека (см. фигуру 2A и B, соответственно) за исключением 11D12.1, которое ингибировало лизис A549 клеток и не оказывало эффект на nAT-опосредованный лизис ТНР-1 клеток. Сильная активность к AT, проявляемая этими mAb, указывает на потенциальную полезность этих антител для ингибирования AT-активности при инфицировании, таким образом ограничивая прогрессирование связанных со стафилококковой инфекцией симптомов и заболевания.
Пример 4: Пассивная иммунизация посредством mAb к AT уменьшает пораженные дерматонекрозом участки
S. aureus является основной причиной кожных инфекций и инфекций мягких тканей (SSTI) как в клинике, так и по месту жительства, которые зачастую характеризуются воспалением, повреждением ткани и нагноением. AT могут играть некоторую роль в этих инфекциях, приводя к гипервоспалительному ответу и повреждению ткани, и ингибирование функции AT может, в таком случае, ограничить способность бактерий вызывать серьезное заболевание. Для определения полезности mAb к AT в минимизации, уменьшении или устранении эффектов инфекции S. aureus, группам из пяти 5 мышей внутрибрюшинно (IP) ввели каждый из 7 ингибирующих mAb (например, приблизительно 5 мг/кг) и изотипический контроль IgG-1 (R347) за 24 часа до подкожного инфицирования S. aureus Wood. Размер пораженных дерматонекрозом участков измеряли ежедневно в течение 6 дней и документировали при помощи фотосъемки, результаты чего приведены на фигуре 3A (на фигуре 3A показан день 6). 5 наиболее сильных in vitro ингибиторов функции nAT (2A3.1, 10А7.5, 12B8.19, 25E9.1 и 28F6.1) значительно уменьшали размер пораженного участка по сравнению с контролем R347, в то время как наименее сильные mAb, in vitro (11D12.1, 15B6.3), не оказывали значительного эффекта на размер пораженного участка по сравнению с контролем, что показано на фигурах 3A и 2B. На фигуре 3B графически проиллюстрировано уменьшение размера пораженного участка стечением времени. 2A3.1, 10A7.5, 12B8.19, 25E9.1 и 28F6.1 являются сильными ингибиторами функции AT in vitro, а также проявляют сильное профилактическое действие в мышиной модели SSTI. Также в модели дерматонекроза протестировали дополнительные антитела LC10, QD20, QD33 и QD37. Эти моноклональные антитела внутрибрюшинно (IP) ввели пяти мышам на группу в количестве 1 и 0,5 мг/кг за 24 часа до подкожного инфицирования S. aureus Wood, как описано выше. Результаты показаны на Фигуре 17, A и B.). P-значения рассчитали с использованием апостериорного критерия Даннетта. Для экспериментов с 1 мг/кг p-значение для контроля R347 по сравнению с тестируемыми Ab было p<0,0001. Для экспериментов с 0,5 мг/кг p-значение для контроля R347 по сравнению с тестируемыми Ab было p<0,05.
Пример 5: Пассивная иммунизация посредством mAb к AT повышает выживаемость при пневмонии у мышей
Профилактику посредством наиболее сильного созданного mAb к AT протестировали в мышиной модели пневмонии. Мышей C57BL/6J пассивно иммунизировали посредством приблизительно 5 мг/кг, приблизительно 15 мг/кг и приблизительно 45 мг/кг 2A3.1, 10A7.5, 12B8.19 или 28F6.1 за двадцать четыре часа до интраназального инфицирования S. aureus USA300 (BAA-1556). Затем выживаемость отследили в течение 6 дней и сравнили с изотипическим контролем (R347) в количестве 45 мг/кг, результаты чего показаны на фигурах 4-7. Статистическую значимость рассчитали с использованием логарифмического рангового критерия. На фигуре 4 графически проиллюстрирована выживаемость в процентах в ходе протекания инфекции S. aureus после пассивной иммунизации различными количествами mAB 12 В. 19. На фигуре 5 графически проиллюстрирована выживаемость в процентах в ходе протекания инфекции S. aureus после пассивной иммунизации различными количествами mAB 2A3.1. На фигуре 6 графически проиллюстрирована выживаемость в процентах в ходе протекания инфекции S. aureus после пассивной иммунизации различными количествами mAB 28F6.1. На фигуре 7 графически проиллюстрирована выживаемость в процентах в ходе протекания инфекции S. aureus после пассивной иммунизации различными количествами mAB 10A7.5.
Все показанные антитела к AT вызывали значимое повышение выживаемости относительно контроля, приводя по меньшей мере к 90% выживаемости при дозе 45 мг/кг (см. фигуры 4-7). Полагают, что альфа-токсин является ключевым определителем степени патогенности при стафилококковой пневмонии. Приведенные в данном документе результаты иллюстрируют, что пассивное введение сильных ингибирующих mAb является действующим подходом для предупреждения заболевания. Вместе взятые, приведенные в данном документе исследования на животных позволяют сделать предположение о роли AT при стафилококковом заболевании и приводят доказательство того, что применение mAb, которые ингибируют функцию AT, ограничивает тяжесть заболевания или даже смертельные случаи, связанные с инфекцией S. aureus.
Для того, чтобы дополнительно охарактеризовать влияние mAb к AT на количества бактерий во время инфекции, полностью человеческую версию mAb 2A3.1 (например, 2A3hu) профилактически давали мышам за 24 часа до интраназального инфицирования посредством примерно 1,3×108 КОЕ S. aureus USA300. Через сорок восемь часов после инфицирования мышей подвергали эвтаназии и их легкие и почку забирали и обрабатывали для подсчета бактерий (см. фигуры 8A и 8B). Через 4 и 24 часа после инфицирования мышей подвергали эвтаназии и забирали образцы для измерения продуцирования цитокинов (описано ниже и см. фигуру 9) и для гистопатологического анализа (описано ниже и см. фигуру 10). P-значения рассчитали с использованием апостериорного критерия Даннетта. Иллюстративные результаты подсчета бактерий представлены на фигурах 8A и 8B. Профилактическое введение 2A3hu приводило к значимому уменьшению количеств бактерий как в почках (см. фигуру 8A), так и в почках (см. фигуру 8B) относительно контроля R347, что указывает на то, что ингибирование функции AT может ограничить прогрессирование заболевания, повысить клиренс, а также ограничить системное распространение инвазивного организма.
Также в модели пневмонии протестировали дополнительные антитела, LC10, QD20, QD33 и QD37. Эти моноклональные антитела внутрибрюшинно (IP) ввели десяти мышам на группу в дозировке 5 мг/кг за 24 часа до интраназального (IN) инфицирования посредством примерно 2×108 КОЕ S. aureus USA300. Результаты этих экспериментов показаны на фигуре 18. P-значения рассчитали с использованием апостериорного критерия Даннетта. P-значение для mAb 2A3 по сравнению с QD37 составляло p=0,0072; p-зачение для mAb 2A3 по сравнению с LC10 составляло p=0,0523; p-значение для mAb 2A3 по сравнению с QD33 составляло p=0,0521.
Пример 6: Ингибирование AT в модели пневмонии уменьшает продукцию провоспалительных цитокинов
Инфицирование легких S. aureus, как правило, сопровождается сверхпродукцией провоспалительных цитокинов, которая, как полагают, приводит к повышенной активации иммунных клеток и инфильтрации, что в конечном счете приводит к повышенной конгестии и некрозу тканей (Bubeck Wardenburg. J. 2007). Было показано, что в мышиной модели пневмонии мутант S. aureus с делецией по AT проявляет сниженную вирулентность по сравнению с его изогенным диким типом S. aureus. Было дополнительно продемонстрировано, что активная и пассивная иммунизация против AT снижала экспрессию IL-1β известного медиатора острого поражения легкого, и защищала мышей от тяжелой пневмонии (Bubeck Wardenburg. J. 2007; Bubeck Wardenburg. J. 2008). Эти результаты позволяют сделать предположение, что ингибирование AT при инфицировании S. aureus может снизить продуцирование провоспалительных цитокинов и, таким образом, ограничить избыточную клеточную инфильтрацию, при этом конечном результатом является меньшее количество симптомов пневмонии и повышенный бактериальный клиренс, что видно из вышеприведенного.
Для того чтобы проверить эту гипотезу, мышей пассивно иммунизировали 2A3hu за 24 часа до интраназального инфицирования посредством примерно 1,3×108 КОЕ S. aureus USA300. Через четыре и двадцать четыре часа после инфицирования мышей подвергли эвтаназии и половину легкого зафиксировали и подготовили для окрашивания гематоксилином и эозином и микроскопического исследования, в то же время из другой стороны собрали бронхоальвеолярную смывную жидкость и обработали для определения уровней цитокинов. Иллюстративные результаты продуцирования цитокинов после пассивной иммунизации показаны на фигуре 9. На фигуре 10 при помощи фотографии проиллюстрирована эффективность пассивной иммунизации посредством описываемых в данном документе mAb.
Через четыре часа после инфицирования уровни цитокинов были одинаковыми у R347- и 2A3hu-обработанных мышей, однако к 24 часам после инфицирования все уровни IL-6, TNF-α, КС и IL-1β уменьшились у 2A3hu-обработанных животных, как показано на фигуре 9 (см. отмеченные кругом результаты в момент времени 24 часа), что указывает на то, что профилактическое введение 2A3hu в результате дало уменьшенные уровни выявляемых цитокинов по отношению к контролю. Эти данные подкрепляются результатами гистопатологического исследования легкого, в котором у R347-обработанных мышей было выраженное воспаление легкого, некроз и альвеолит наряду с присутствием бактериальных колоний (см. верхнее левое и нижнее левое изображения на фигуре 10). Напротив, у 2A3hu-обработанных животных было ограниченное воспаление легкого без видимого некроза, альвеолита или бактериальных колоний (см. верхнее правое и нижнее правое изображения на фигуре 10). Защитный эффект mAb к AT в модели пневмонии связан со сниженным воспалительным ответом, что может ограничить локальное повреждение ткани и способствовать бактериальному клиренсу.
Пример 7: Кинетика связывания и конкуренция за связывание
Измерения аффинности осуществляли с использованием поверхностного плазмонного резонанса (SPR) для дополнительной характеристики mAb, которые демонстрировали сильную ингибирующую активность. Очищенный IgG захватывали на сенсоре с использованием IgG крысы к антителу мыши и чип выдержали в растворах с различными концентрациями nAT. Измерили константы скорости ассоциации и диссоциации, исходя из которых определили константы связывания. Антитела 2A3.1, 10A7.5, 25E9.1 и 12B8.19 имели похожие аффинности со значениями KD 601, 504, 337 и 485 пМ, соответственно, в то время как 28F6.1 демонстрировало значение KD 13 нМ, как показано в нижеприведенной таблице. KD рассчитали как koff/kon.
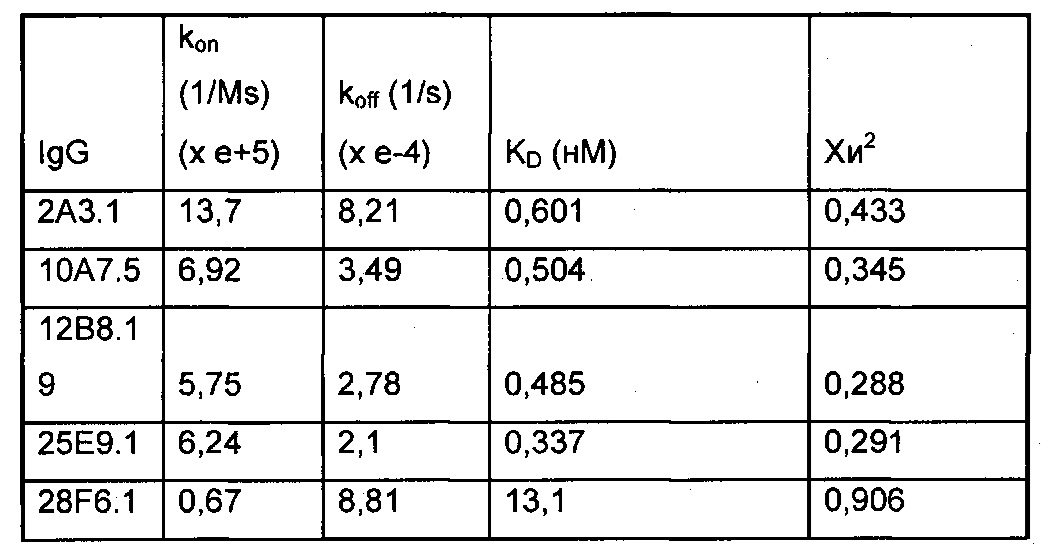
Также с использованием SPR провели эксперименты по конкурентному связыванию, результаты которых позволяют предположить, что антитела 2A3.1, 10А7.5, 25E9.1 и 12B8.19 вероятно связываются с одинаковым или похожим эпитопом.
Ниже приведены значения IC50 и Kd для mAb QD20, LC10, QD33, QD37 и 2A3GL.

IC50 рассчитали с использованием анализа на бляшкообразование у RBC в результате воздействия альфа-токсина S. aureus в количестве 0,1 мг/мл.
Пример 8: Ингибиторные mAb блокируют образование SDS-устойчивого гептамера
Считается, что альфа-токсин (AT) S. aureus лизирует клетки в ходе многоэтапного процесса, в котором секретируемая растворимая мономерная молекула AT связывается с рецептором на клеточной поверхности, или неспецифически адсорбируется на клеточных мембранах, олигомеризируется в гептамерный предшественник поры на клеточной поверхности и подвергается конформационному изменению, что приводит к образованию 14-цепочечного трансмембранного β-цилиндра, который опосредует последующий лизис клеток-мишеней. Описываемый в данном документе механизм ингибирования с помощью mAb дополнительно исследовали для определения, на каком этапе ингибиторные mAb блокируют функцию AT. Изучили способность этих mAb предупреждать связывание AT с "тенями" RBC кролика, прикрепленными к 96-луночному планшету для культивирования тканей. На 96-луночные планшеты для ELISA нанесли "тени" RBC и блокировали посредством 2% BSA. Затем "тени" инкубировали с nAT +/-20 молярный избыток IgG к AT. Затем определили связывание пАТ с IgG к AT кролика и рассчитали % связывания; % связывания = 100 × [100-(A490 nAT+mAb)/(A490 nAT без mAb)]. При 20 молярном избытке IgG ингибирование связывания nAT с мембранами RBC кролика отсутствовало, как показано на фигуре 11, что указывает на то, что эти ингибиторные mAb не задействованы на этапе связывания с рецептором.
Было показано, что помимо клеточных мембран AT и другие порообразующие токсины легко собираются и образуют поры в липосомных мембранах. Изначально влияние IgG к AT на образование гептамера AT протестировали на липосомах. После инкубации AT с 10-кратным молярным избытком на липосомах (липид : АТ, вес : вес), в присутствии IgG, изучили образование гептамера посредством вестерн-блот анализа, как показано на фигуре 12. Затем образцы солюбилизировали в буфере для образцов SDS-PAGE при 37°C и с помощью вестерн-блот анализа выявили образование гептамера. Наличие SDS-устойчивого гептамера хорошо заметно в верхней части геля, показанного на фигуре 12, на дорожках 6 и 7 (например, дорожка mAb9D7.3 и контроль без IgG, соответственно). Все ингибиторные mAb блокировали образование гептамера, в то время как несоответствующий изотипический контроль (например, дорожка 6; 9D7.3) не обладал таким эффектом. Ингибирование олигомеризирующей активности подтвердили с использованием mAb 2A3.1, 10A7.5 и 12B8.19 в анализе олигомеризации на "тенях" RBC кролика, что продемонстрировано иллюстративными вестерн-блотами, изображенными на фигурах 13A и 13B. AT инкубировали с титром IgG перед инкубацией с "тенями" эритроцитов кролика и выявлением образования гептамера посредством SDS-PAGE. mAb 2A3.1, 10A7.5 и 12B8.19 эффективно ингибировали образование гептамера AT даже при соотношении IgG : токсин 1:1 (моль : моль), и ингибирующий олигомеризацию эффект определяли путем титрования по мере снижения уровней mAb (см. фигуры 13A и 13B; появление гептамера при молярных соотношениях 0,5:1 и 0,25:1). Эти результаты позволяют сделать вывод, что mAb 2A3.1, 10A7.5 и 12B8.19 предупреждают AT-опосредованный клеточный лизис путем ингибирования образования SDS-устойчивого гептамера.
Пример 9: Преобразование в полностью человеческий IgG
Полностью человеческий IgG включает вариабельные домены тяжелой (VH) и легкой (VL) цепей из описанных в данном документе химерных mAb, генетически слитые с константными доменами IgG-1 человека. VH и VL из каждого химерного mAb клонировали, секвенировали и слили с Vh IgG-1 человека и константными доменами каппа-цепи человека, соответственно. Было показано, что полученные полностью человеческие IgG-1 сохраняют необходимый человеческий вариабельный участок и свойства связывания представляющего интерес mAb. Полностью человеческие антитела экспрессировали, очистили и их активность сравнили с химерными mAb, выделенными из мышиных гибридом Veloclmmune. Полностью человеческие mAb демонстрировали похожую с исходными химерами эффективность при ингибировании клеточного лизиса RBC, A549 и ТНР-1, за исключением 25E9.1hu, которое стало, по сути, еще эффективнее, чем исходная химера 25E9.1. На фигурах 14-16 графически представлено ингибирование высвобождения LDH, характеристики клеточного лизиса, у красных кровяных телец (RBC; см. фигуру 14), клеток A549 (см. фигуру 15) и клеток ТНР-1 (см. фигуру 16). Повышение эффективности человеческого mAb 25E9.1 (например, 25E9.1hu) могло быть результатом смешанной клеточной популяции у исходной гибридомы, которая содержала 2 различные молекулы IgG к AT, лишь одна из которых могла обладать активностью, что ингибировала функцию nAT. Таким образом, расчеты молярности и измерения активности для mAb исходной химеры могут не иметь прямой корреляции.
Пример 10: Иллюстративные аминокислотные и нуклеотидные последовательности для антител, которые специфично связываются с альфа-токсином S. aureus
Таблица 1: Последовательности CDR VL для mAb 2А3.1, 10A7.5, 12 B8.19 и 25E9.1





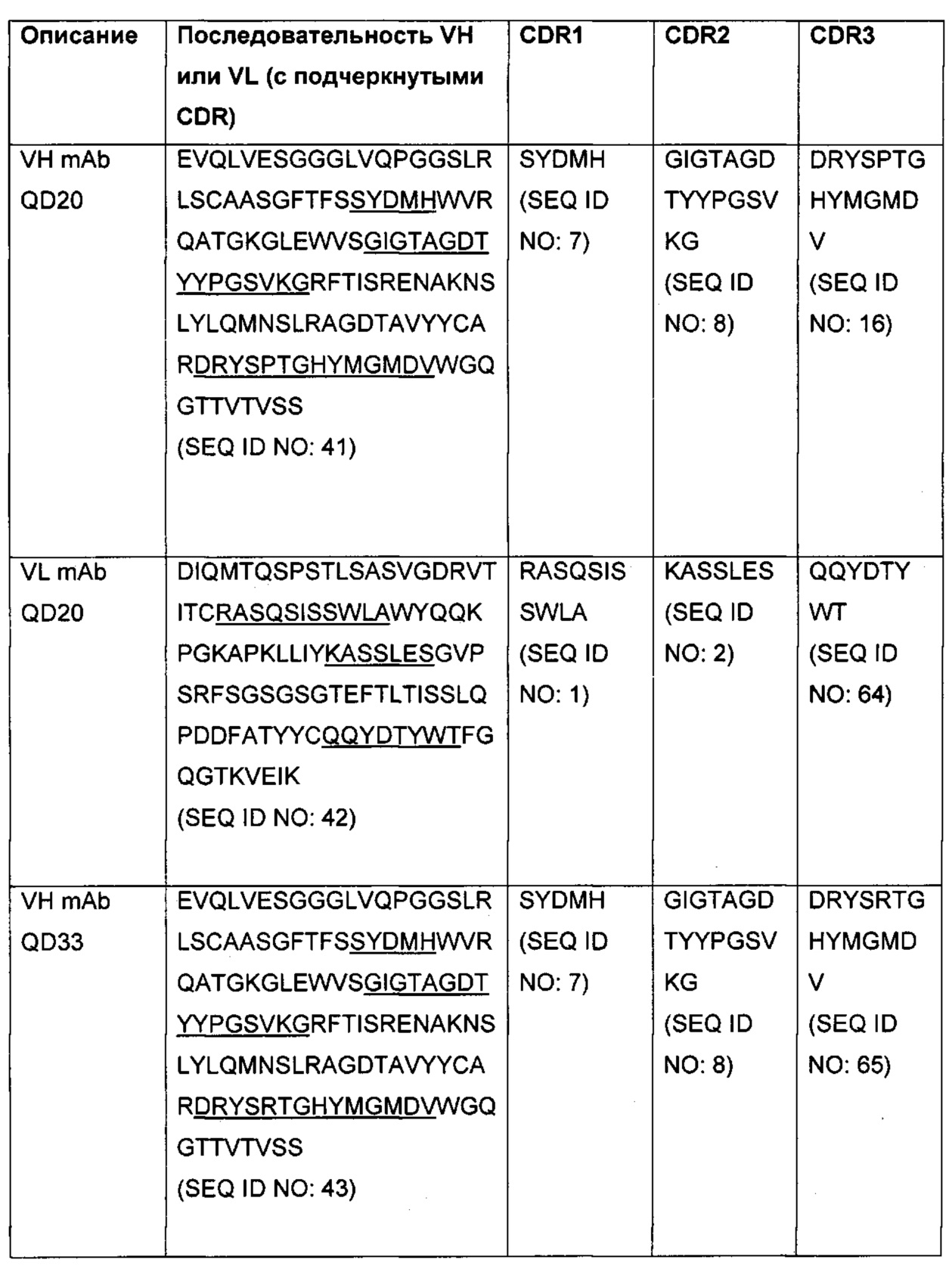















Пример 11: Картирование связывающих участков антител к стафилококковому альфа-токсину
Химерные варианты, состоящие из частей альфа-токсина и LukF-PV, конструировали для идентификации фрагмента альфа-токсина, с которым связывается антитело, соответствующее mAb LC10, содержащему вариант Fc (LC10 YTE). LukF-PV выбирали как химерный пертнер, поскольку он не распознается LC10 YTE (Фигура 19), но обладает высоким структурным подобием (Gouaux, E., M. Hobaugh, et al. "alpha-Hemolysin, gamma-hemolysin, and leukocidin from Staphylococcus aureus: distant in sequence but similar in structure." Protein Sci 6 (12): 2631-5 (1997); Meesters, C., A. Brack, et al. "Structural characterization of the alpha-hemolysin monomer from Staphylococcus aureus." Proteins 75 (1): 118-26 (2009)) и 25% идентичностью последовательности с альфа-токсином (Фигура 20). Серии химерных вариантов конструировали с помощью систематической замены 50 альфа-токсиновых аминокислот (аа) соответствующими им аналогами LukF-PV. Более короткие участки в выбранных представляющих интерес сегментах 50 аа также заменяли (Таблица 11). Использовали инструмент ProteOn для анализа связывающей способности LC10 YTE по отношению к этим вариантам. Результаты связывания LC10 YTE с вариантами приведены в Таблице 11.


Все химерные конструкты могли быть экспрессированы на некотором уровне за исключением KO_73-81 (Таблица 11). LC10 YTE не связывался с вариантами, кодирующими LukF-PV вместо аа 101-110 альфа-токсина (KO_52-110 и KO_101-110) или аа 224-231 (KO_204-241, KO_204-231 и KO_224-231). Связывание LC10 YTE существенно ухудшалось или совершенно нарушалось при замене аа 248-277 (KO_248-277) или его большего сегмента аа 248-293 (KO_248-293), соответственно.
В определенных случаях очевидное отсутствие связывания с LC10 YTE может быть объяснено существующим некорректным фолдингом отдельных вариантов альфа-токсина/LukF-PV. Полная неспособность к корректному фолдингу также может объясняться очевидным отсутствием экспрессии KO 73-81. Кроме того, гомология аминокислотных последовательностей между альфа-токсином и LukF-PV в основном варьирует на различных участках. Например, сегмент, соответствующий аа 179-193 альфа-токсина, обладает 67% идентичностью с LukF-PV, тогда как вся последовательность обладает 25% идентичностью. Таким образом, хотя не наблюдалось влияние на связывание LC10 YTE при замещении участков высокой гомологии последовательностей, эти участки потенциально могут содержать дополнительные последовательности, с которыми связывается антитело LC10 YTE.
Вышеупомянутые результаты анализа мутагенеза показывают, что замена любого из трех участков аа 101-110, аа 224-231 и 248-293 альфа-токсина остатками LukF-PV ухудшала связывание LC10 YTE, тогда как замена остальных участков аа не оказывала существенного влияния.
Эти три участка представлены двумя различными местоположениями в трехмерной структуре альфа-токсина. Сегменты, соответствующие аа 101-110 и 224-231, пространственно близки и расположены на одной стороне бета-сэндвич домена, тогда как сегмент, соответствующий аа 248-277, в основном расположен в домене "Rim" (Song, L., М. R. Hobaugh, et al., "Structure of staphylococcal alpha-hemolysin, a heptameric transmembrane pore." Science 274 (5294): 1859-66 (1996)) (Фигура 21).
Сегмент, соответствующий аа 248-277, показывал влияние на связывание, а также содержал исследованные рентгеноскопическим путем структурные контактные участки, идентифицированные как содержащие аа 261-272 (в которых T263, N264 и K266 являются действительными контактирующими остатками) (Фигура 20). Кроме того, по кристаллической структуре выявляли другой сегмент, соответствующий аа 173-201, в которых D183, W187 и N188 являются действительными контактирующими остатками (Фигура 20). Химерный вариант, который содержал этот конкретный сегмент (KO_148-205), все еще проявлял хорошее связывание с LC10 YTE. Вероятно, это связано с особенной высокой гомологией последовательностей участка (52% идентичность и 63% подобие) между альфа-токсином и LukF-PV. Аминокислоты вокруг контактирующих остатков (аа 179-193) обладают еще более высокой гомологией (67% идентичность), тогда как, в отличие от этого вся последовательность обладает всего лишь 25% идентичностью.
С использованием основанного на мутагенезе подхода сегмент, соответствующий аа 248-277, идентифицировали как важный для связывания LC10 YTE. Это дополнительно подтверждали структурным анализом структуры комплекса LC10 YTE/альфа-токсин. Структурный анализ также выявлял определенные контактные остатки во фрагменте аа 248-277, которые присутствуют в аа 261-272.
Как обсуждалось выше, проводили эксперименты с использованием рентгеновской кристаллографии по определению контактных остатков LC10 YTE mAb. Очищенный α-токсин (остатки 1-293) и LC10 YTE Fab концентрировали по отдельности. Почти эквимолярные количества этих белков смешивали вместе и раствор подвергали гель-фильтрационной хроматографии на колонке Sephadex S75 (GE Healthcare). Элюированный пик содержал обе белковые молекулы, связанные друг с другом. Дальнейшей концентрацией и кристаллизацией получали кристаллы, которые дифрагировали до 2,5 А.
Структуру комплекса объясняли с использованием метода молекулярной замены. Предварительно определенную структуру Fab (D25) с удаленными определяющими комплементарность участками использовали как шаблон для LC10 YTE Fab. Мономер молекулы α-токсина, полученной из гептамерного комплекса (PDB Id. 7AHL) с некоторыми усечениями, использовали как шаблон для молекулы α-токсина. Последовательность молекулы альфа-токсина, использованной для кристаллографического исследования, соответствует таковой из SEQ ID NO: 39. Два комплекса на асимметрическую единицу комплекса LC10 YTE-a-токсин идентифицировали с использованием программы Phaser из набора программ ССР4. Модель структуры далее обрабатывали с использованием программы Refmac из набора программ ССР4. Улучшения ручного построения и итеративной модели выполняли с использованием конкретной кристаллографической программы "O".
И тяжелая, и легкая цепи Fab, как выявили, находились в контакте с молекулой α-токсина (Фиг. 22). В частности, в кристаллографических исследованиях определяли контактные остатки в молекуле альфа-токсина, которые соответствовали следующим и для тяжелой, и для легкой цепей: N177, W179, G180, P181, Y182, D183, D185, S186, W187, N188, P189, V190, Y191 и R200. Кроме того, легкая цепь, как определили, имеет контакты с T261, T263, N264, K266 и K271. Паратопы идентифицировали как: LC - W32 (CDR1), K50 (CDR2), Y91, A92, N93, Y94, W95 (CDR3); HC - D33 (CDR1), T53, A54, D56, Y58 (CDR2), D98, Y100, P102, T103, G104, H105, Y106 (CDR3).
Молекулярное моделирование, включающее структурные данные от кристаллографического анализа, показало, что большая часть структуры α-токсина оставалась неизмененной во время перехода от мономерного состояния в гептамерное состояние. Однако, важный связывающий участок (если контактные остатки идентифицировали как T261, T263, N264, K266 и K271), как показали, отвечал части молекулы α-токсина, которая участвует в образовании гептамера. Именно этот важный участок, который компактно изогнут, если молекула α-токсина находится в мономерном состоянии, простирается в виде петли перед вставкой в мембрану клетки-хозяина (Фиг. 23b) и в конечном итоге образует ножку грибоподобной структуры после сборки в гептамерное состояние (Фиг. 23a). В гептамерном состоянии этот участок, как показано на Фиг. 24a, мог быть, как предсказано, защищен от связывания молекулой антитела LC10 YTE.
Пример 12: Терапевтическая эффективность антител к стафилококковому альфа-токсину
Обсуждаемые выше результаты описывают эффективность mAb к AT при использовании в профилактике. Для исследования возможности терапевтического функционирования этих mAb эффективность LC10 тестировали по терапевтическим параметрам на моделях и дерматонекроза, и пневмонии. В модели дерматонекроза вводили LC10 IV за 24 часа до бактериального заражением (профилактика) и через 1, 3 или 6 часов после внутрикожного инфицирования (терапия). Размер пораженного участка у животных отслеживали в течение 6 дней. Профилактика (-24 часа) и лечение 1 или 3 часа после инфицирования привели к уменьшению размера пораженного участка относительно отрицательного контроля (R347) (Фиг. 24). Существенный успех лечения утрачивался, если LC10 доставляли через 6 часов после инфекции на этой модели. Эти результаты показывают, что LC10 может функционировать как эффективная терапия от стафилококковых инфекций кожи и инфекций мягких тканей.
Подобные эксперименты проводили на модели пневмонии, при этом LC10 доставляли мышам (IV) либо для профилактики, либо через 1, 3 или 6 часов после интраназального инфицирования. Как предполагалось, профилактическое введение mAb приводило к полной выживаемости (Фиг. 25). Хотя в результате не получали полной выживаемости, если вводили LC10 через 1, 3 или 6 часа после инфицирования, наблюдали выигрыш во времени до смерти относительно отрицательного контроля, если LC10 использовали в лечении через 1 час после инфицирования при самых высоких дозах LC10. С учетом требования модели в отношении высокой инфицирующей дозы и быстрого наступления смерти такие улучшения выживаемости показывают, что может происходить терапевтическое улучшение при инфицировании человека.
Пример 13: Эффективность ванкомицина в комбинации с mAb к альфа-токсину LC-10
Проводили исследования для оценки потенциала mAb к альфа-токсину LC10 для применения в дополнительной терапии с ванкомицином на мышиной модели пневмонии путем сравнения монотерапии mAb к альфа-токсину и ванкомицина с комбинированной терапией.
Семинедельных самок мышей C57BL/6J инфицировали интраназально 2е8 КОЕ (LD100) устойчивого к метициллину Staphylococcus aureus USA300. Ванкомицин и LC-10 титровали отдельно для определения оптимальной и субэффективной доз. Для оценки mAb в монотерапии или двойной терапии с ванкомицином мышей обрабатывали через один час после инфицирования одной внутриперитонеальной дозой LC-10 или антителом R347 в качестве отрицательного контроля (15 мг/кг). Обработку ванкомицином в моно- или двойной терапии начинали через 1 час после инфекции и вводили BID подкожно 3 дня. Процент выживаемости для всех обрабатываемых групп определяли по истечении семи дней. Кривые выживаемости анализировали с использованием логарифмического рангового критерия Мантеля-Кокса.
Обработка ванкомицином при 200 или 40 мг/кг/сутки приводила к выживаемости 90% и 43%, соответственно. Послеинфекционная монотерапия с LC-10 при 45 или 15 мг/кг защищала 50% и 33% мышей (Фиг. 26A и B). Комбинированная терапия с единичными субэффективными дозами LC-10 (15 мг/кг) и BID дозирование ванкомицина при 40 мг/кг приводили к выживаемости 75% животных. Девяносто процентов мышей выживало с комбинацией 40 мг/кг/сутки ванкомицина с 45 мг/кг LC-10. Различия в выживаемости между монотерапией ванкомицином и комбинированной терапией либо с 15 мг/кг, либо с 45 мг/кг LC-10 были статистически значимыми (p=0,026 и p=0,015 соответственно). Совместное введение ванкомицина и LC-10 приводило к синергичному эффекту, выявляемому изоболограммным анализом (Фиг. 27).
Пример 14: Примеры конкретных вариантов осуществления
Далее представлены неограничивающие примеры определенных вариантов осуществления.
A1. Выделенное антитело или его антигенсвязывающий фрагмент, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus и включают:
(a) CDR1 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 7, 10, 13 или 69 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним;
(b) CDR2 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 8, 11, 14, 17, 70 или 75 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, и
(c) CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним.
A2. Антитело или антигенсвязывающий фрагмент варианта осуществления A1, где CDR1 VH, CDR2 VH и CDR3 VH представлены посредством SEQ ID NO: 7, 8 и 9; SEQ ID NO: 10, 11 и 12; SEQ ID NO: 13, 14 и 15; SEQ ID NO: 7, 17 и 18; SEQ ID NO: 7, 8 и 16; SEQ ID NO: 7, 8 и 65; SEQ ID NO: 7, 8 и 66; SEQ ID NO 7, 8 и 67; SEQ ID NO: 7, 8 и 78; SEQ ID NO: 69, 70 и 71; SEQ ID NO: 7, 8 и 72; SEQ ID NO: 69, 75 и 71; SEQ ID NO: 69, 75 и 76 или SEQ ID NO: 69, 70 и 71.
A3. Выделенное антитело или его антигенсвязывающий фрагмент, где выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и включает:
(a) CDR1 VH, содержащий аминокислотную последовательность SEQ ID NO: 7, 10, 13 или 69;
(b) CDR2 VH, содержащий аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75;
(c) CDR3 VH, содержащий аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78;
(d) CDR1 VL, содержащий аминокислотную последовательность SEQ ID NO: 1 или 4;
(e) CDR2 VL, содержащий аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и
(f) CDR3 VL, содержащий аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74.
A4. Антитело или антигенсвязывающий фрагмент варианта осуществления A3, где CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL соответствуют аминокислотным последовательностям SEQ ID NO: 7, 8, 9, 1, 2 и 3; SEQ ID NO: 10, 11, 12, 1, 2 и 3; SEQ ID NO: 13, 14, 15, 4, 5 и 6; SEQ ID NO: 7, 17, 18, 1, 2 и 3; SEQ ID NO: 7, 8, 16, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1, 2 и 64; SEQ ID NO: 7, 8, 66, 1, 2 и 64; SEQ ID NO: 7, 8, 67, 1, 2 и 68; SEQ ID NO: 7, 8, 67, 1, 2 и 64; SEQ ID NO: 7, 8, 78, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1, 2 и 68; SEQ ID NO: 69, 70, 71, 1, 2 и 68; SEQ ID NO: 7, 8, 72, 1, 73 и 74; SEQ ID NO: 69, 75, 71, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 77 и 74; SEQ ID NO: 69, 70, 71, 1, 77 и 74.
A5. Выделенное антитело или его антигенсвязывающий фрагмент варианта осуществления A1, где выделенное антитело или его антигенсвязывающий фрагмент (i) содержит VH-домен цепи, содержащий три CDR и VL-домен цепи, содержащий три CDR; и (ii) иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus, где три CDR VH-домена цепи содержат:
(a) CDR1 VH, содержащий аминокислотную последовательность SEQ ID NO: 7, 10, 13 или 69;
(b) CDR2 VH, содержащий аминокислотную последовательность SEQ ID NO: 8,11,14,17, 70 или 75; и
(c) CDR3 VH, содержащий аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78.
A6. Антитело или антигенсвязывающий фрагмент варианта осуществления A5, где CDR1 VH, CDR2 VH и CDR3 VH соответствуют аминокислотным последовательностям SEQ ID NO: 7, 8 и 9; SEQ ID NO: 10, 11 и 12; SEQ ID NO: 13, 14 и 15; SEQ ID NO: 7, 17 и 18; SEQ ID NO: 7, 8 и 16; SEQ ID NO: 7, 8 и 65; SEQ ID NO: 7, 8 и 66; SEQ ID NO 7, 8 и 67; SEQ ID NO: 7, 8 и 78; SEQ ID NO: 69, 70 и 71; SEQ ID NO: 7, 8 и 72; SEQ ID NO: 69, 75 и 71; SEQ ID NO: 69, 75 и 76 или SEQ ID NO: 69, 70 и 71.
A7. Выделенное антитело или его антигенсвязывающий фрагмент варианта осуществления A1, где выделенное антитело или его антигенсвязывающий фрагмент (i) содержит VH-домен цепи, содержащий три CDR, и VL-домен цепи, содержащий три CDR; и (ii) иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus, где три CDR VL-домена цепи содержат:
(a) CDR1 VL, содержащий аминокислотную последовательность SEQ ID NO: 1 или 4;
(b) CDR2 VL, содержащий аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и
(c) CDR3 VL, содержащий аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74.
A8. Антитело или антигенсвязывающий фрагмент варианта осуществления A7, где CDR1 VL, CDR2 VL и CDR3 VL соответствуют аминокислотным последовательностям SEQ ID NO: 1, 2 и 3; SEQ ID NO: 4, 5 и 6; SEQ ID NO: 1, 2 и 64; SEQ ID NO: 1, 2 и 68; SEQ ID NO: 1, 73 и 74 или SEQ ID NO: 1, 77 и 74.
A9. Выделенное антитело или его антигенсвязывающий фрагмент, которые (i) иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, (ii) содержат вариабельный домен тяжелой цепи, который по меньшей мере на 90% идентичен аминокислотной последовательности SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62, и (iii) содержат вариабельный домен легкой цепи, который по меньшей мере на 90% идентичен аминокислотной последовательности SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
A10. Антитело или антигенсвязывающий фрагмент варианта осуществления A9, где VH и VL соответствуют аминокислотным последовательностям SEQ ID NO: 20 и 19; SEQ ID NO: 22 и 21; SEQ ID NO: 24 и 23; SEQ ID NO: 26 и 25; SEQ ID NO: 28 и 27; SEQ ID NO: 41 и 42; SEQ ID NO: 43 и 44; SEQ ID NO: 45 и 46; SEQ ID NO: 47 и 48; SEQ ID NO: 47 и 48; SEQ ID NO: 49 и 50; SEQ ID NO: 51 и 52; SEQ ID NO: 51 и 52; SEQ ID NO: 53 и 54; SEQ ID NO: 55 и 56; SEQ ID NO: 57 и 58; SEQ ID NO: 59 и 60; SEQ ID NO: 61 и 58; SEQ ID NO: 62 и 58; SEQ ID NO: 62 и 63; SEQ ID NO: 79 и 63.
A11. Выделенное антитело или его антигенсвязывающий фрагмент, где выделенное антитело или его антигенсвязывающий фрагмент содержит вариабельный домен тяжелой цепи с SEQ ID NO 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62 и вариабельный домен легкой цепи SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
A12. Антитело или антигенсвязывающий фрагмент варианта осуществления A11, где VH и VL соответствуют аминокислотным последовательностям SEQ ID NO: 20 и 19; SEQ ID NO: 22 и 21; SEQ ID NO: 24 и 23; SEQ ID NO: 26 и 25; SEQ ID NO: 28 и 27; SEQ ID NO: 41 и 42; SEQ ID NO: 43 и 44; SEQ ID NO: 45 и 46; SEQ ID NO: 47 и 48; SEQ ID NO: 47 и 48; SEQ ID NO: 49 и 50; SEQ ID NO: 51 и 52; SEQ ID NO: 51 и 52; SEQ ID NO: 53 и 54; SEQ ID NO: 55 и 56; SEQ ID NO: 57 и 58; SEQ ID NO: 59 и 60; SEQ ID NO: 61 и 58; SEQ ID NO: 62 и 58; SEQ ID NO: 62 и 63; SEQ ID NO: 79 и 63.
A13. Антитело или антигенсвязывающий фрагмент по любому из вариантов осуществления A1-A12, где выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и характеризуется одной или несколькими характеристиками, выбранными из группы, состоящей из следующего:
(a) константа аффинности (KD) в отношении альфа-токсина составляет приблизительно 13 нМ или менее;
(b) связывается с мономерами альфа-токсина, но не ингибирует связывание альфа-токсина с рецептором альфа-токсина;
(c) ингибирует образование олигомеров альфа-токсина по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95%;
(d) снижает цитолитическую активность альфа-токсина по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95% (например, при определении посредством анализов на основе клеточного лизиса и гемолиза); и
(e) снижает клеточную инфильтрацию и высвобождение провоспалительных цитокинов (например, в животной модели пневмонии).
A14. Антитело или антигенсвязывающий фрагмент по любому из вариантов осуществления A1-A13, где выделенное антитело или его антигенсвязывающий фрагмент содержит дополнительное средство.
A15. Антитело или антигенсвязывающий фрагмент варианта осуществления A14, где дополнительным средством является антибиотик.
A16. Антитело или антигенсвязывающий фрагмент варианта осуществления A14, где выделенное антитело или его антигенсвязывающий фрагмент связаны с терапевтическим средством посредством линкера.
A17. Антитело или антигенсвязывающий фрагмент по любому из вариантов осуществления A1-A13, где выделенное антитело или его антигенсвязывающий фрагмент дополнительно содержит диагностическое средство.
A18. Антитело или антигенсвязывающий фрагмент варианта осуществления A17, где диагностическое средство включает визуализирующее средство.
A19. Антитело или антигенсвязывающий фрагмент варианта осуществления A17, где диагностическое средство включает детектируемую метку.
A20. Антитело или антигенсвязывающий фрагмент варианта осуществления A17, где выделенное антитело или его антигенсвязывающий фрагмент связаны с диагностическим средством посредством линкера.
A21. Антитело или антигенсвязывающий фрагмент по любому из вариантов осуществления A1-A20, где полипептид альфа-токсина Staphylococcus aureus является нативным полипептидом токсина.
A22. Антитело или антигенсвязывающий фрагмент по любому из вариантов осуществления A1-A20, где полипептид альфа-токсина Staphylococcus aureus включает аминокислотную последовательность SEQ ID NO: 39 или SEQ ID NO: 40.
A23. Антитело или антигенсвязывающий фрагмент варианта осуществления A13, где клетка является клеткой крови или легкого.
A24. Антитело или антигенсвязывающий фрагмент варианта осуществления A23, где клеткой крови является красное кровяное тельце.
A25. Антитело или антигенсвязывающий фрагмент по любому из вариантов осуществления, A13, A23 и A24, где клеточный лизис определен с помощью анализа бляшкообразования in vitro или анализа на лактатдегидрогеназу in vitro.
A26. Антитело или антигенсвязывающий фрагмент по любому из вариантов осуществления A1-A25, где выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и содержит CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или антигенсвязывающий фрагмент нейтрализует полипептид альфа-токсина Staphylococcus aureus.
A27. Антитело или антигенсвязывающий фрагмент по любому из вариантов осуществления A1-A26, где выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и содержит CDR3 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 3, 6, 64, 68 или 74 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или антигенсвязывающий фрагмент нейтрализует полипептид альфа-токсина Staphylococcus aureus.
A28. Антитело или антигенсвязывающий фрагмент по любому из вариантов осуществления A1-A27, где выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и содержит CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или антигенсвязывающий фрагмент ингибирует олигомеризацию полипептида альфа-токсина Staphylococcus aureus.
A29. Антитело или антигенсвязывающий фрагмент по любому из вариантов осуществления A1-A28, где выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с полипептидом альфа-токсина Staphylococcus aureus и содержит CDR3 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 3, 6, 64, 68 или 74 или содержащую 1, 2 или 3 замены аминокислотных остатков по отношению к ним, где антитело или антигенсвязывающий фрагмент ингибирует олигомеризацию полипептида альфа-токсина Staphylococcus aureus.
A30. Антитело или антигенсвязывающий фрагмент по любому из вариантов осуществления A13, A28 и A29, где ингибирование олигомеризации определено при помощи анализа in vitro связывания и/или электрофоретической подвижности.
D1. Композиция, содержащая антитело или антигенсвязывающий фрагмент по любому из вариантов осуществления A1-A30.
B1. Набор, содержащий:
(a) антитело или антигенсвязывающий фрагмент по любому из вариантов осуществления A1-A30 или композицию варианта осуществления D1;
(b) инструкции для применения композиции или указания касательно получения инструкций для применения композиции.
B2. Набор варианта осуществления B1, где антитело в композиции связано с твердой подложкой.
B3. Набор варианта осуществления B2, где твердой подложкой является гранула.
B4. Набор варианта осуществления B3, где гранула является гранулой сефарозы.
B5. Набор по любому из вариантов осуществления B1-B4, где инструкции для применения включают одно или несколько из выделения, очистки, детекции и количественного определения полипептида альфа-токсина Staphylococcus aureus.
B6. Набор по любому из вариантов осуществления B1-B5, содержащий буфер, твердую подложку или буфер и твердую подложку.
B7. Набор варианта осуществления B6, где твердая подложка представляет собой одно или несколько из гранулы, фильтра, мембраны и многослойной пластины.
B8. Набор варианта осуществления B6, который включает буфер и мембрану, подходящие для вестерн-блоттинга.
B9. Набор варианта осуществления B6, который включает загрузочный буфер и элюирующий буфер.
B10. Набор варианта осуществления B6, который включает буфер, подходящий для твердофазного иммуноферментного анализа (ELISA).
C1. Способ предупреждения, лечения или контроля пневмонии у субъекта, включающий:
введение антитела или антигенсвязывающего фрагмента по любому из вариантов осуществления A1-A30 или композиции варианта осуществления D1 нуждающемуся в этом субъекту в количестве, эффективном для предупреждения, лечения или контроля пневмонии.
C2. Способ варианта осуществления C1, который является способом предупреждения пневмонии.
C3. Способ варианта осуществления C1 или C2, где антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с конформационным эпитопом в пределах SEQ ID NO: 39.
C4. Способ предупреждения, лечения или контроля состояния, вызванного кожной инфекцией, у субъекта, включающий: введение антитела или его антигенсвязывающего фрагмента, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, нуждающемуся в этом субъекту в количестве, эффективном для предупреждения, лечения или контроля состояния, вызванного кожной инфекцией.
C5. Способ варианта осуществления C4, где состоянием, вызванным кожной инфекцией, является дерматонекроз.
C6. Способ варианта осуществления C4 или C5, где состояние, вызванное кожной инфекцией, включает инфекцию Staphylococcus aureus кожи.
C7. Способ по любому из вариантов осуществления C4-C6, который является способом предупреждения состояния, вызванного кожной инфекцией.
C8. Способ предупреждения, лечения или контроля состояния, связанного с инфекцией Staphylococcus aureus, включающий введение антитела или его антигенсвязывающего фрагмента, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, нуждающемуся в этом субъекту в количестве, эффективном для снижения олигомеризации полипептида токсина.
C9. Способ варианта осуществления C8, который является способом предупреждения состояния, связанного с инфекцией Staphylococcus aureus.
C10. Способ предупреждения, лечения или контроля состояния, связанного с инфекцией Staphylococcus aureus, включающий введение антитела или его антигенсвязывающего фрагмента, которые иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus, нуждающемуся в этом субъекту в количестве, эффективном для снижения лизиса эритроцитов.
C11. Способ варианта осуществления C10, который является способом предупреждения состояния, связанного с инфекцией Staphylococcus aureus.
C12. Способ варианта осуществления C10 или C11, где эритроцит является клеткой крови или легкого.
C13. Способ по любому из вариантов осуществления C4-C12, где антитело или его антигенсвязывающий фрагмент характеризуется одной или несколькими характеристиками, выбранными из группы, состоящей из следующего:
(a) константа аффинности (KD) в отношении альфа-токсина составляет приблизительно 13 нМ или менее;
(b) связывается с мономерами альфа-токсина, но не ингибирует связывание альфа-токсина с рецептором альфа-токсина;
(c) ингибирует образование олигомеров альфа-токсина по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95%;
(d) снижает цитолитическую активность альфа-токсина по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95% (например, при определении посредством анализов на основе клеточного лизиса и гемолиза); и
(e) снижает клеточную инфильтрацию и высвобождение провоспалительных цитокинов (например, в животной модели пневмонии).
C14. Способ варианта осуществления C13, где антитело или его антигенсвязывающий фрагмент иммуноспецифично связывается с конформационным эпитопом в пределах SEQ ID NO: 39.
C15. Способ по любому из вариантов осуществления C1-C14, где антитело, или антигенсвязывающий фрагмент, или композиция, вводимые субъекту, соответствуют любому из вариантов осуществления C1-C30 или D1.
C16. Способ, включающий:
введение антитела или антигенсвязывающего фрагмента по любому из вариантов осуществления A1-A30 или композиции варианта осуществления D1 в клетки; и
детекцию наличия, отсутствия или величины биологического эффекта, связанных с введением композиции в клетки.
C17. Способ, включающий:
введение антитела или антигенсвязывающего фрагмента по любому из вариантов осуществления A1-A30 или композиции варианта осуществления D1 субъекту; и
детекцию наличия, отсутствия или величины биологического эффекта у субъекта, связанных с введением композиции.
C18. Способ, включающий:
введение антитела или антигенсвязывающего фрагмента по любому из вариантов осуществления A1-A30 или композиции варианта осуществления D1 субъекту; и
отслеживание состояния субъекта.
C19. Способ нейтрализации полипептида альфа-токсина Staphylococcus aureus путем введения нуждающемуся в этом субъекту эффективного количества антитела или антигенсвязывающего фрагмента по любому из вариантов осуществления A1-A30 или композиции варианта осуществления D1 для нейтрализации полипептида токсина.
C20. Способ предупреждения, лечения или контроля состояния, опосредованного альфа-токсином Staphylococcus aureus, у нуждающегося в этом субъекта, причем способ включает введение субъекту эффективного количества антитела или антигенсвязывающего фрагмента по любому из вариантов осуществления A1-A30 или композиции варианта осуществления D1 для предупреждения, лечения или контроля состояния.
C21. Способ лечения, предупреждения или облегчения симптомов расстройства, опосредованного альфа-токсином Staphylococcus aureus, у нуждающегося в этом субъекта, включающий введение эффективного количества антитела или антигенсвязывающего фрагмента по любому из вариантов осуществления A1-A30 или композиции варианта осуществления D1 субъекту для лечения, предупреждения или облегчения симптомов.
C22. Способ диагностики состояния, опосредованного альфа-токсином Staphylococcus aureus, у субъекта, включающий отбор субъекта, нуждающегося в диагностике, и введение субъекту диагностически эффективной дозы антитела или антигенсвязывающего фрагмента по любому из вариантов осуществления A1-A30 или композиции варианта осуществления D1.
C23. Способ по любому из вариантов осуществления C1-C22, где субъектом является домашнее животное.
C24. Способ по любому из вариантов осуществления C1-C22, где субъектом является человек.
C25. Способ ингибирования образования олигомеров альфа-токсина Staphylococcus aureus по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95% при помощи антитела или антигенсвязывающего фрагмента по любому из вариантов осуществления A1-A30 или композиции варианта осуществления D1.
C26. Способ по C25, где ингибирование образования олигомеров альфа-токсина Staphylococcus aureus ингибирует образование активного порообразующего комплекса.
C27. Способ уменьшения цитолитической активности альфа-токсина Staphylococcus aureus по меньшей мере на 50%, 60%, 70%, 80%, 90% или 95% при помощи антитела или антигенсвязывающего фрагмента по любому из вариантов осуществления A1-A30 или композиции варианта осуществления D1, где цитолитическую активность определяют при помощи анализов на основе клеточного лизиса и/или гемолиза.
Каждый патент, патентная заявка, публикация и документ, на которые ссылается настоящий документ, тем самым включены в настоящий документ во всей их полноте посредством ссылки. Цитирование вышеупомянутых патентов, патентных заявок, публикаций и документов не является признанием того, что что-либо из вышеизложенного принадлежит предшествующему уровню техники, а также не представляет собой признание содержаний или дат этих публикаций или документов.
Для вышеупомянутого могут быть выполнены модификации без отступления от основных аспектов настоящего документа. Хотя технология описана, главным образом, в деталях со ссылкой на один или несколько конкретных вариантов осуществления, специалисты в данной области признают, что можно осуществить изменения в вариантах осуществления, специально раскрытых в настоящей заявке, и все эти модификации и усовершенствования будут попадать в объем и идею технологии.
Технологию, иллюстративно раскрытую в настоящем документе, соответствующим образом можно осуществить на практике при отсутствии какого-либо элемента(ов), специально не раскрытых в настоящем документе. Таким образом, например, в каждом случае в настоящем документе какой-либо из терминов "содержащий", "состоящий главным образом из" и "состоящий из" может быть заменен другими двумя терминами. Используемые термины и выражения применялись как описательные, а не ограничительные термины, и применение таких терминов и выражений не исключает какие-либо эквиваленты показанных и описанных признаков или их частей, и в объеме заявленной технологии возможны различные модификации. Термин в единственном числе может означать один или множество модифицируемых элементов (например, "реагент" может означать один или несколько реагентов), если в контексте четко не указано, что описан один из элементов или более чем один из элементов. Следует понимать, что хотя технология в соответствии с настоящим изобретением специально раскрыта с помощью типичных вариантов осуществления и необязательных признаков, модификация и вариация раскрытых в настоящем документе концепций могут быть использованы специалистами в данной области, и такие модификации и вариации учтены объемом технологии в соответствии с настоящим изобретением.
Определенные варианты осуществления настоящего изобретения изложены в следующей формуле изобретения.
Реферат
Изобретение относится к биохимии. Описано выделенное антитело или его антигенсвязывающий фрагмент. Антитело или его антигенсвязывающий фрагмент иммуноспецифично связываются с полипептидом альфа-токсина Staphylococcus aureus и включают CDR1 VH, содержащий аминокислотную последовательность SEQ ID NO: 7, 10, 13 или 69; CDR2 VH, содержащий аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75; CDR3 VH, содержащий аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78; CDR1 VL, содержащий аминокислотную последовательность SEQ ID NO: 1 или 4; CDR2 VL, содержащий аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и CDR3 VL, содержащий аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74. Также описаны набор и композиция для предупреждения, лечения или контроля пневмонии у субъекта и способ предупреждения или лечения пневмонии у субъекта. Изобретение расширяет арсенал средств для лечения пневмонии. 7 н. и 5 з.п. ф-лы, 27 ил., 11 табл., 14 пр.

Комментарии