Автоклавируемые взвеси циклоспорина а формы 2 - RU2630970C2
Код документа: RU2630970C2
Чертежи







Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Эта заявка на патент заявляет приоритет предварительной заявки на патент США No. 61/559849, поданной 15 ноября 2011 года полное содержание которой, включено в этот документ в виде ссылок.
УРОВЕНЬ ТЕХНИКИ
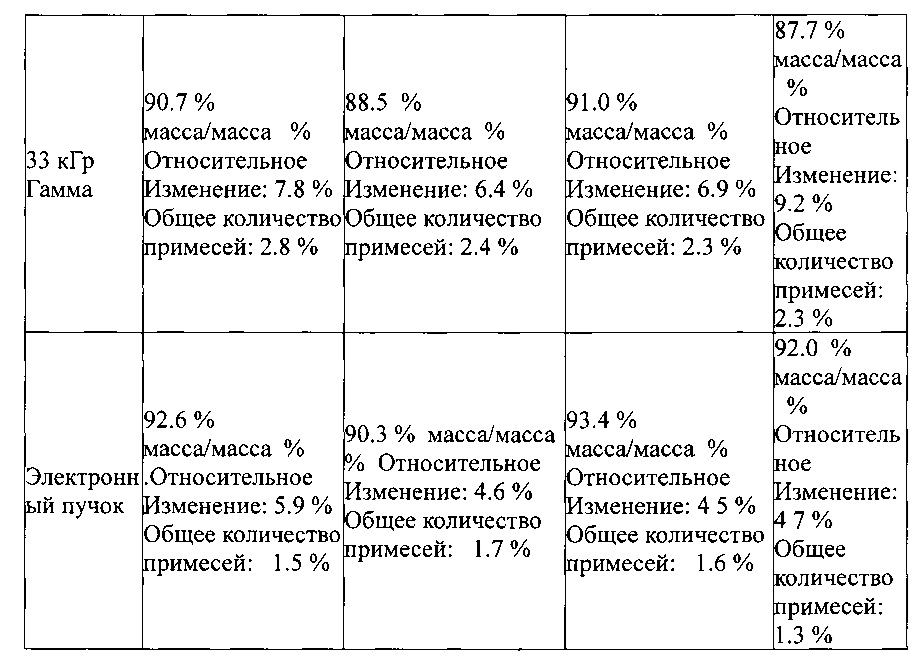
Асептическая обработка взвесей циклоспорина А суспензий в среде гиалуроновой кислоты (гидрогель используется в качестве суспендирующего агента), осложняется тем фактом, что, как само лекарство, так и гиалуроновая кислота нуждаются в предварительной стерилизации. Предварительно стерилизованая гиалуроновая кислота очень дорогая, и стоит около 1 млн. долл. США за несколько килограммов (примерно 10000 долл. США за унцию) стерильного сырьевого материала. Кроме того, в процессе предварительной стерилизации циклосприна А, он частично разлагается под действием облучения, как проиллюстрировано ниже и на Фигурах 1 и 2;

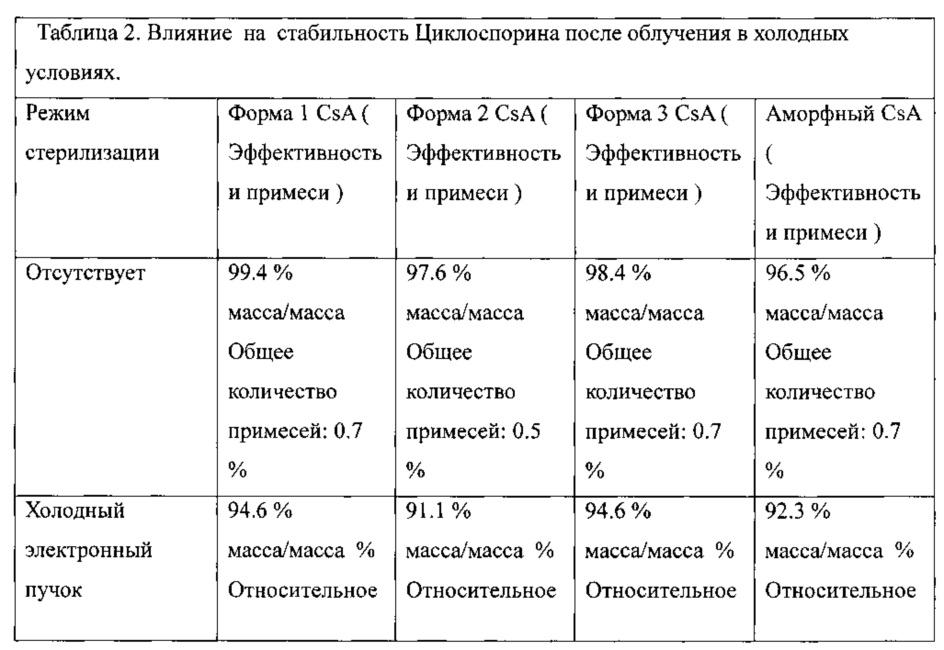
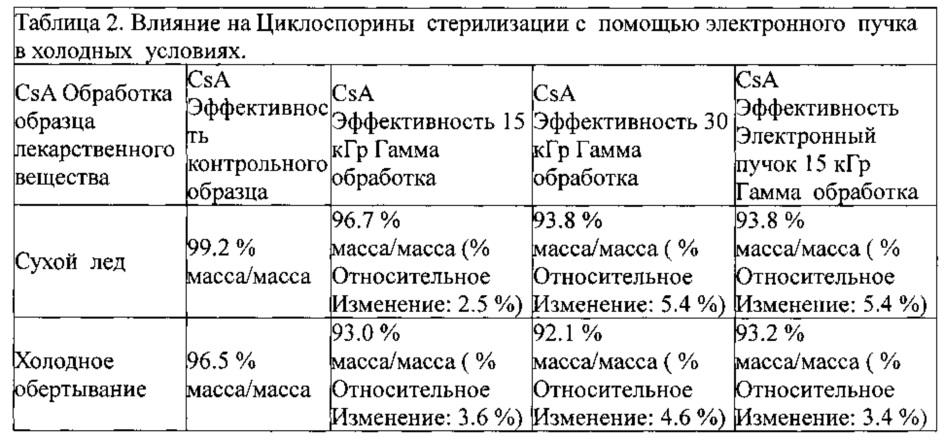
Охлаждение циклоспорина во время облучения не существенно улучшает результаты, как показано в таблице 2, ниже:

Дополнительные уровни продуктов разложения должны быть оцениваемы в доклинических исследованиях безопасности.
Кроме того, взвесь, приготовленная из циклоспорина А (из-за процесса предварительной стерилизации) с всего лишь 90-95% маркировочным знаком (чистоты лекарственной субстанции), имеет значительную вероятность не удовлетворить регуляторные нормы по сроку хранения, поскольку регулирующие органы обычно запрещают сроки хранения, для ниже, чем 90% маркировочных знаков.
Настоящее изобретение решает эти проблемы. Раскрытые здесь составы циклоспорина А, в сочетании с парентерально биосовместимыми суспендирующими агентами, которые являются стерильными, исключительно стабильны к нагревательной стерилизации и имеют превосходную долгосрочную стабильность.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигуры 1 и 2 иллюстрируют изменения эффективности циклоспорина А при изменении кристаллической формы и способа стерилизации.
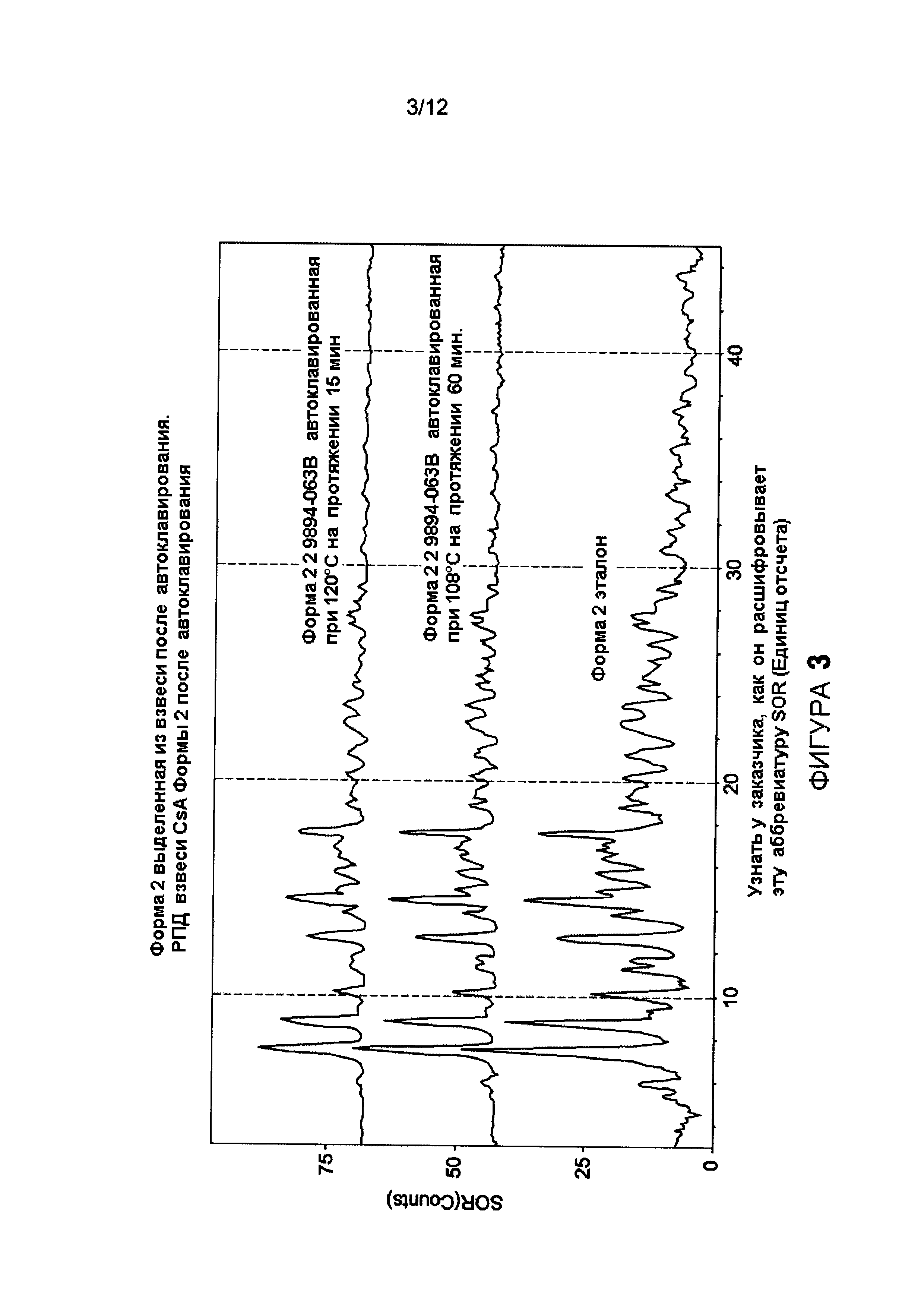
Фигура 3 иллюстрирует диаграмму данных порошковой дифракции рентгеновскими лучами циклоспорина А Формы 2 после автоклавирования.
Фигура 4 иллюстрирует гиперемию, наблюдаемую в исследовании щелевой лампой восьми различных составов.
Фигура 5 иллюстрирует характеристики диаграмм рентгеновской порошковой дифракции (РПД) CsA в новой кристаллической форме (называемой Формой 2 в настоящем документе), в тетрагональной форме (называемой Формой 1 в настоящем документе), и в орторомбической форме (называемой Формой 3 в настоящем документе).
Фигура 6 иллюстрирует РПД дифрактограмму CsA кристаллической Формы 2.
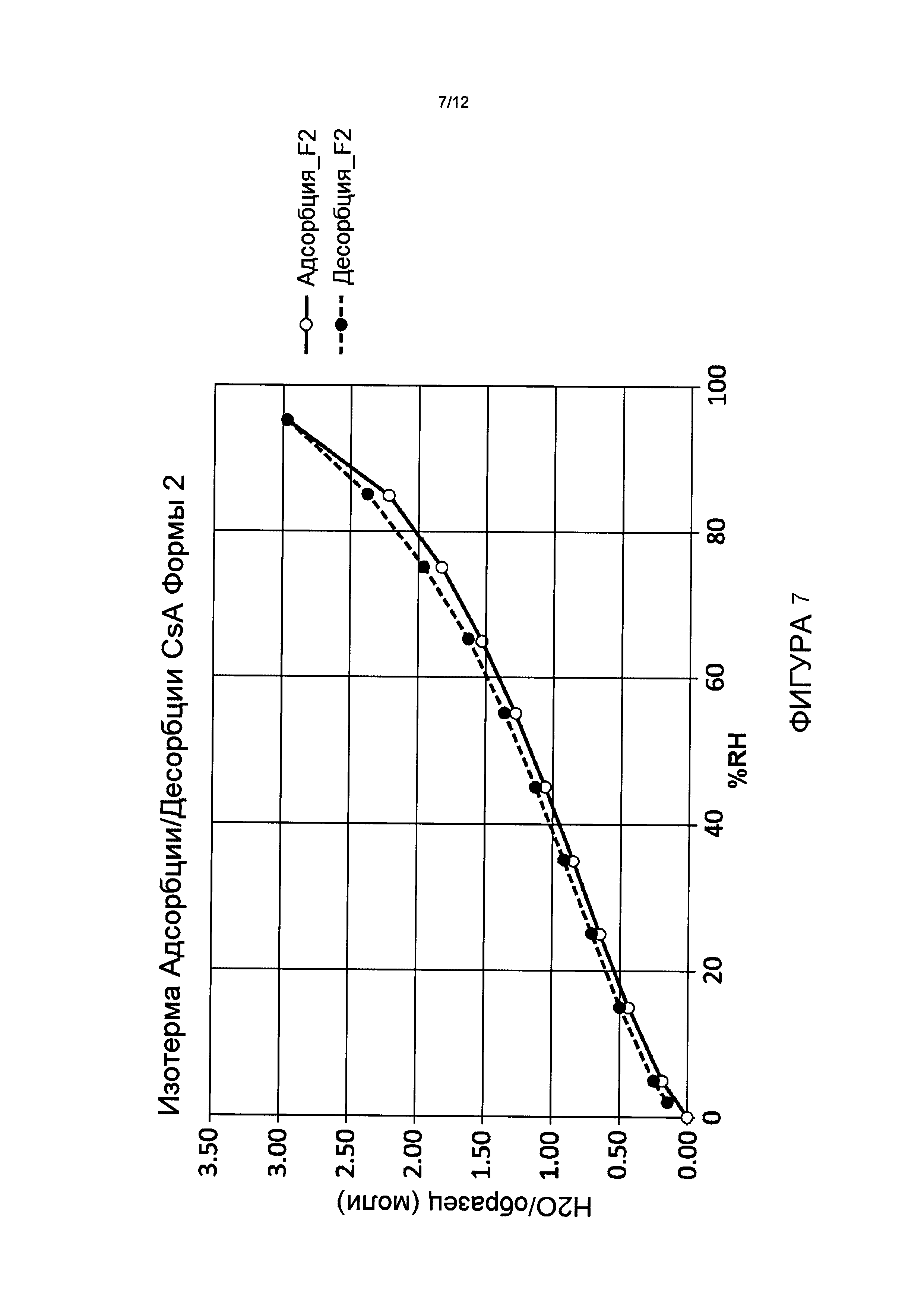
Фигура 7 иллюстрирует характеристику сорбции/десорбции воды для CsA Формы 2.
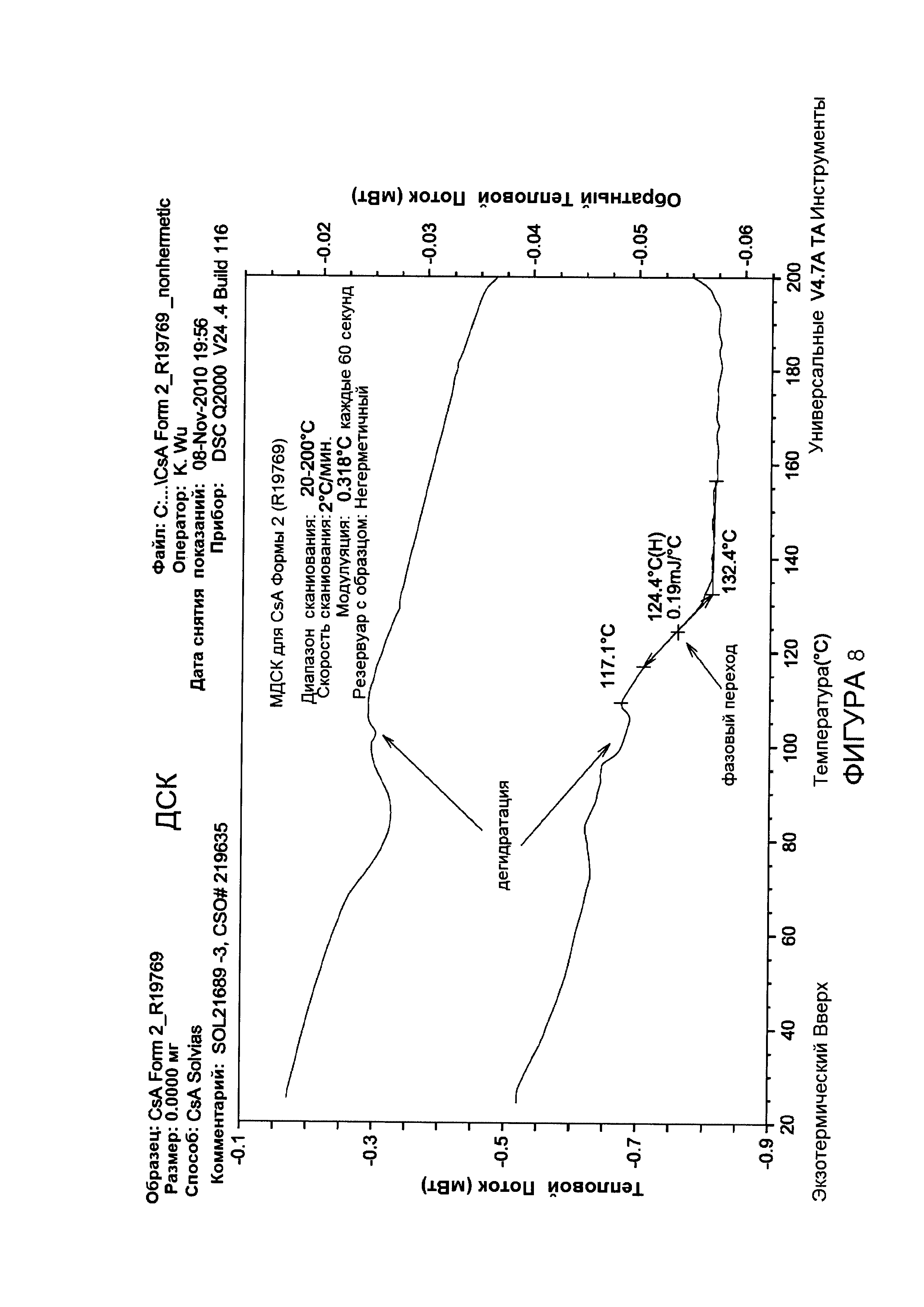
Фигура 8 иллюстрирует анализ МДСК CsA Формы 2, извлеченного из 0,04% состава, с 1% PS80.
Фигура 9 иллюстрирует макроскопическую глазную гиперемию, после того, как инъекция 100 ультралитров КМЦ, ГЭЦ, ГПМ1Д, Pluronic и ПВП в натрий-фосфатном буфере была применена субконъюнктивально на новозеландских белых кроликах. Кролики были под наблюдением на протяжении семи дней.
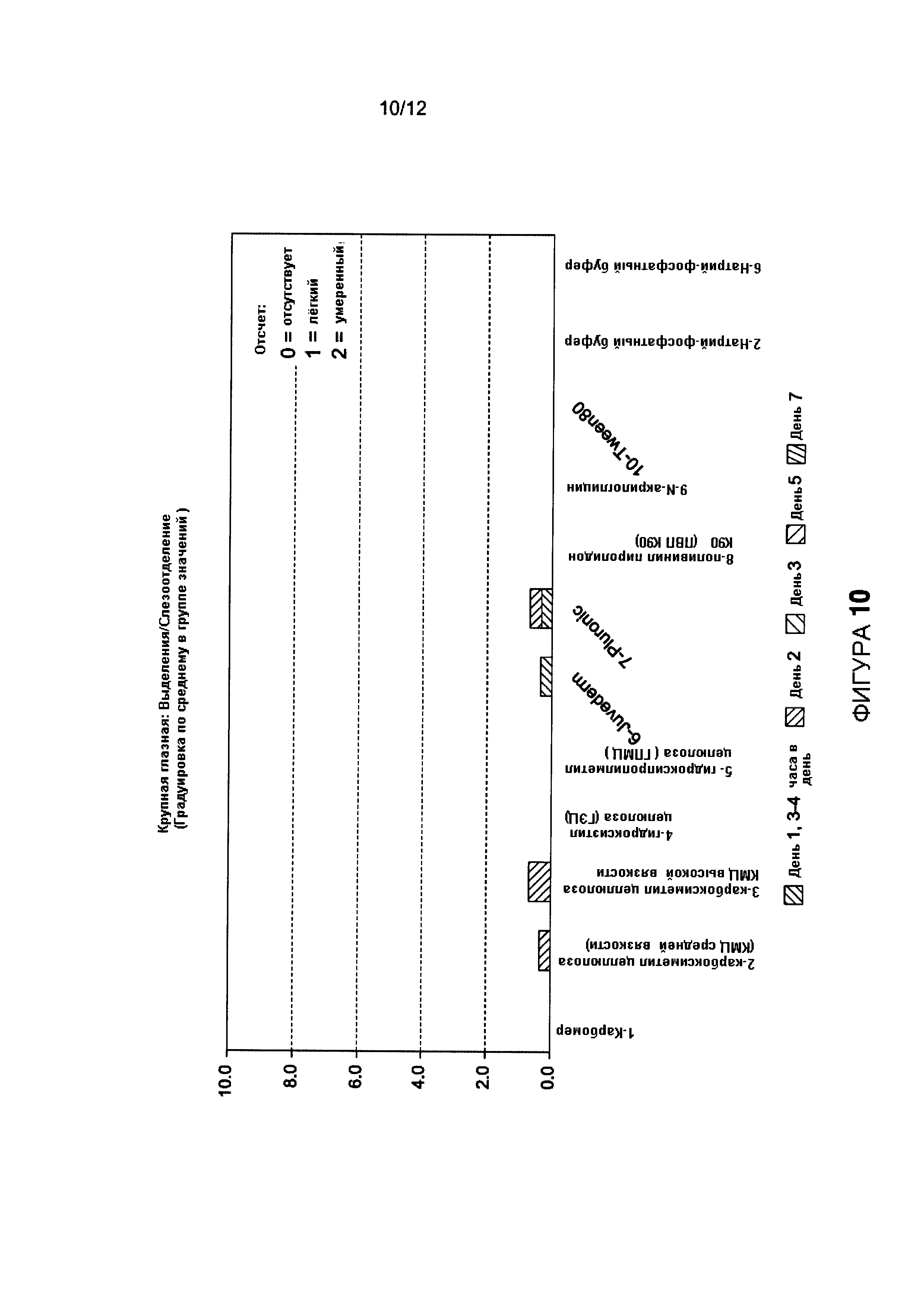
Фигура 10 иллюстрирует крупное глазное выделение в эксперименте, проиллюстрированном Фигурой 9.
Фигура 11 иллюстрирует крупное глазное переполнение в эксперименте, проиллюстрированном Фигурой 9.
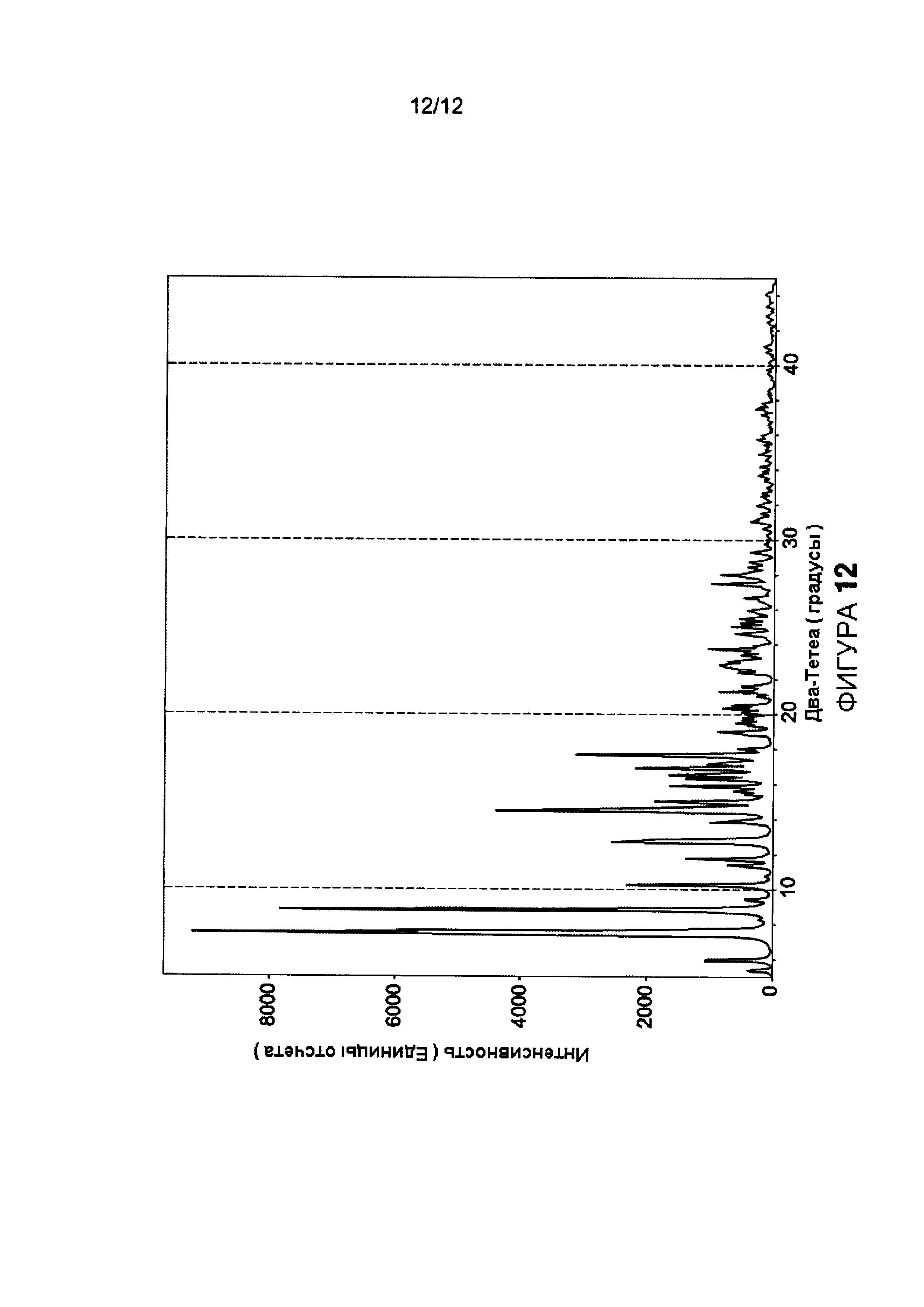
Фигура 12 иллюстрирует: воспроизведенную диаграмму РПД, образуемую циклоспорином А.
ПОДРОБНОЕ ОПИСАНИЕ
Циклоспорин А
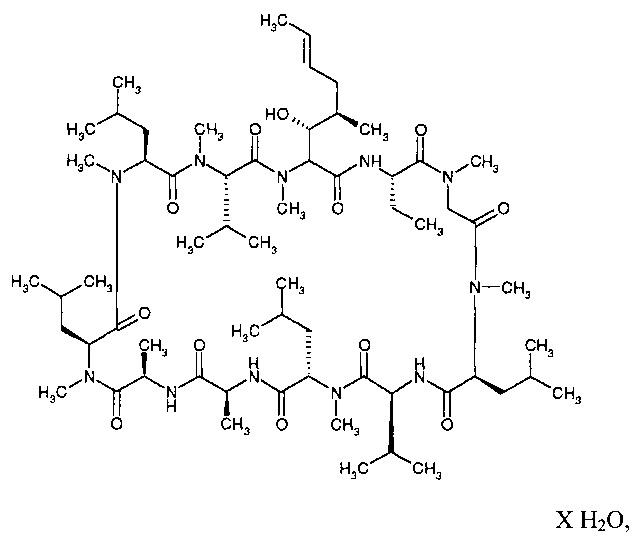
Циклоспорин А (CsA) является циклическим пептидом, имеющим следующую химическую структуру:
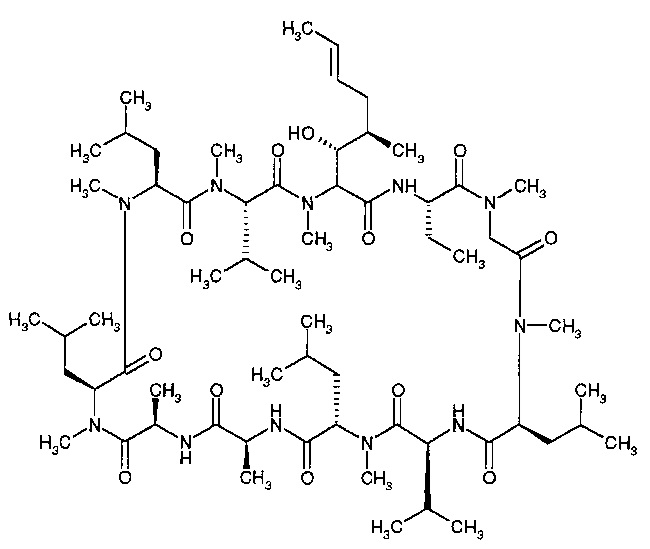
Его химическое название: цикло[[(E)-(2S,3R,4R)-3-гидрокси-4-метил-2-(метиламино)-6-октеноил]-L-2-аминобутирил-N-метилглицил-N-метил-L-лейцил-L-валил-N-метил-L-лейцил-L-аланил-D-аланил-N-метил-L-лейцил-N-метил-L-лейцил-N-метил-L-валил]. Он, также, известен под названиями: «cyclosporine», «cyclosporine A», «ciclosporine», и «ciclosporine ». Он является активным агентом в Restasis® (Allergan, Inc., Ирвин, штат Калифорния), эмульсии, содержащей 0,05% (масс./объем) циклоспорина. Restasis® одобрен в Соединенных Штатах для увеличения выработки слез у пациентов, чье слезовыделение предполагается подавленным из-за глазного воспаления, связанного с высушивающим кератоконъюнктивитом.
Циклоспорин А формы 2
Известно, что Циклоспорин А существует в аморфной форме, в форме жидкого кристалла, тетрагональной кристаллической форме (форма 1), и орторомбической форме (форма 3). Недавно обнаружена новая кристаллическая форма - циклоспорин А формы 2.
РПД диаграмма CsA Формы 2 значительно отличается от тетрагональной формы и орторомбической формы (ФИГ. 1). Главные кристаллические пики для CsA формы 2 появляются в (2θ) при сканировании рентгеновским дифрактометром с таким источником рентгеновского излучения, как излучение Cu Kα, λ=1,54 Å, при 30 кВ/15 мА: 7.5, 8.8, 10.2, 11.3, 12.7, 13.8, 14.5, 15.6 и 17,5 дюйма (d - расстояние в кристаллической решетке примерно 11.8, 10.0, 8.7, 7.8, 7.0, 6.4, 6.1, 5.6 и 5.1 - Ǻ, соответственно, Фиг.2). Эти главные пики, определяются, как уникальные для Формы 2, по отношению к орторомбической, или тетрагональной формам; а также пики с интенсивностью, превышающей фон более чем в 5 раз.
В одном из вариантов реализации, новая кристаллическая форма (Форма 2) CsA является нестехиометрическим гидратом Циклоспорина А. В другом варианте реализации, кристаллическая Форма 2 представлена следующей формулой:
где X это - количество молекул воды, варьирующееся в диапазоне от 0 до 3. В одном из вариантов реализации, X в формуле представляет собой 2.
Форма 2, оказывается кинетически стабильной формой CsA в водных взвесях. Взвеси, содержащие Форму 2, не проявляют превращения в другие известные полиморфные или псевдо морфные формы при хранении. Было установлено, что Форма 1 и аморфная форма превращаются в Форму 2 в присутствии воды.
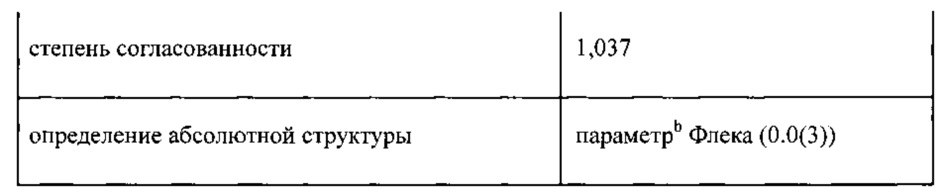
Определена структура одиночного кристалла гидратной формы CsA Формы 2 и параметры этой кристаллической структуры перечислены в Таблице 2. Эти результаты свидетельствуют о том, что Форма 2 является уникальной, по сравнению с другими известными кристаллическими формами Циклоспорина А.
Таблица 1: Данные о кристалле и параметры сбора данных о растворе кристаллической структуры CsA Формы 2.


Асимметричная элементарная ячейка CsA Формы 2 содержит одну молекулу циклоспорина А и две молекулы воды. Возможно, что любые маленькие молекулы, способные образовывать водородную связь с водой, могут играть роль заполнителя объема, что дало бы целый ряд потенциальных структур, начиная от орторомбического дигидрата до искаженного моноклинного дигидрата. РПД диаграмма, рассчитанная из монокристаллической структуры, проиллюстрирована на Фигуре 12 и она соответствует экспериментальной диаграмме проиллюстрированной на Фигуре 2. Эти сопоставляющиеся диаграммы в дальнейшем подтверждают, что Форма 2 является уникальной и чистой кристаллической формой циклоспорина А.
Без ограничения теорией, термогравиметрический анализ, в сочетании с титрованием KF и анализом сорбции десорбции пара (СДП), позволяют предположить, что CsA Формы 2 - является нестехиометрическим гидратом и CsA. Анализ сорбции пара для Циклоспорина Формы 2 показывает, что содержание воды в новой кристаллической форме обратимо зависит от относительной влажности, как проиллюстрировано на Фиг.7. Аналогично, с тетрагональной формой, эта новая форма CsA подвержена фазовому переходу к жидкому кристаллу, или аморфной форме при 124,4°C перед расплавлением, как проиллюстрировано модулированным дифференциальным калориметрическим анализом (МДСК) (Фигура 8).
Циклоспорин формы 2 может быть получен путем перевода во взвешенное состояние аморфного 0,05% циклоспорина А (масс./объем) в 1% Полисорбате 80, при нагревании раствора до 65°C, выдерживанием его при такой температуре в течение 24 часов, и последующим выделением преципитата вакуумной фильтрацией. В дальнейшем можно использовать этот циклоспорин А Формы 2, полученный таким способом, чтобы вырастить дополнительные количества, используя Циклоспорин А Формы 2 в качестве затравочного кристалла; в этом способе, во взвешенное состояние переводят около 30 г циклоспорина А в раствор 900 мл воды, содержащий 1% (масс./объем) Полисорбата 80, нагревают этот раствор до 65°C, а затем вносят затравку 0,2 г циклоспорина А Формы 2 при температуре 52°C. В дальнейшем этот раствор перемешивают около 22 часов при температуре в пределах от 61°C до 65°C, а затем выделяют образовавшийся преципитат.
Более подробные сведения относящиеся к CsA формы 2, могут быть найдены в Заявке США No. 13/480 710, полное содержимое которой включено в настоящий документ в виде ссылки.
Стойкие к нагреванию, стерилизуемые нагреванием взвеси Циклоспорина А формы 2
Составы изобретения являются офтальмологически приемлемыми составами Циклоспорина А формы 2. Под "офтальмологически приемлемыми", изобретатели подразумевают, что взвеси приготавливаются таким способом, чтобы быть нераздражающими применительно к глазу млекопитающего, такого, как человек.
Составы этого изобретения содержат Циклоспорин А формы 2 и какой-либо из суспендирующих агентов, например: гиалуроновой кислоты,, поливинилпиролидона и целлюлозы, Pluronic® сополимеров на основе окиси этилена и окиси пропилена и Carbopol® полимеров.
В одном варианте реализации, взвесь содержит циклоспорин А формы 2 с концентрацией от приблизительно 0,001% до приблизительно 10% (масс./объем). В одном варианте реализации, взвесь содержит циклоспорин А формы 2 с концентрацией от приблизительно 0,001% (масс./объем) до приблизительно 0,01%, от приблизительно 0,001% (масс./объем) до приблизительно 0,04% (масс./объем), от приблизительно 0,001% (масс./объем) до приблизительно 0,03% (масс./объем), от приблизительно 0,001% (масс./объем) до приблизительно 0,02% (масс./объем), или от приблизительно 0,001% (масс./объем) до приблизительно 0,01% (масс./объем). В другом варианте реализации, взвесь содержит циклоспорин А формы 2 с концентрацией от приблизительно 0,01% (масс./объем) до приблизительно 0,05%, от приблизительно 0,01% (масс./объем) до приблизительно 0,04% (масс./объем), от приблизительно 0,01% (масс./объем) до приблизительно 0,03% (масс./объем), от приблизительно 0,01% (масс./объем) до приблизительно 0,02% (масс./объем), или от приблизительно 0,01% (масс./объем) до приблизительно 0,01% (масс./объем). В другом варианте реализации, взвесь содержит циклоспорин А формы 2 с концентрацией от около 0,01% (масс./объем) до около 0,1%, от приблизительно 0,1% (масс./объем) до приблизительно 0,5% (масс./объем), от приблизительно 0,01% (масс./объем) до приблизительно 1% (масс./объем), или от приблизительно 1% (масс./объем) до приблизительно 10%.
Например, составы могут содержать приблизительно 0,001% (масс./объем), приблизительно 0,002% (масс./объем), приблизительно 0,003% (масс./объем), приблизительно 0,004% (масс./объем), приблизительно 0,005% (масс./объем), приблизительно 0,006% (масс./объем), приблизительно 0,007% (масс./объем), приблизительно 0,008% (масс./объем), приблизительно 0,009% (масс./объем), приблизительно 0,01% (масс./объем), приблизительно 0,015% (масс./объем), приблизительно 0,02% (масс./объем), приблизительно 0,025% (масс./объем), приблизительно 0,03% (масс./объем), приблизительно 0,035% (масс./объем), приблизительно 0,04% (масс./объем), приблизительно 0,045% (масс./объем), приблизительно 0,05% (масс./объем), приблизительно 0,055% (масс./объем), приблизительно 0,06% (масс./объем), приблизительно 0,065% (масс./объем), приблизительно 0,07% (масс./объем), приблизительно 0,075% (масс./объем), приблизительно 0,08% (масс./объем), приблизительно 0,085% (масс./объем), приблизительно 0,09% (масс./объем), приблизительно 0,095% (масс./объем), приблизительно 0,1% (масс./объем), приблизительно 0,15% (масс./объем), приблизительно 0,2% (масс./объем), приблизительно 0,25% (масс./объем), 0,3% (масс./объем), приблизительно 0,35% (масс./объем), приблизительно 0,4% (масс./объем), приблизительно 0,45% (масс./объем), приблизительно 0,5% (масс./объем), приблизительно 0,55% (масс./объем), приблизительно 0,6% (масс./объем), приблизительно 0,65% (масс./объем), приблизительно 0,7% (масс./объем), приблизительно 0,75% (масс./объем), приблизительно 0,8% (масс./объем), приблизительно 0,85% (масс./объем), приблизительно на 0,9% (масс./объем), приблизительно 0,95% (масс./объем), или приблизительно 1,0% (масс./объем) циклоспорина А формы 2.
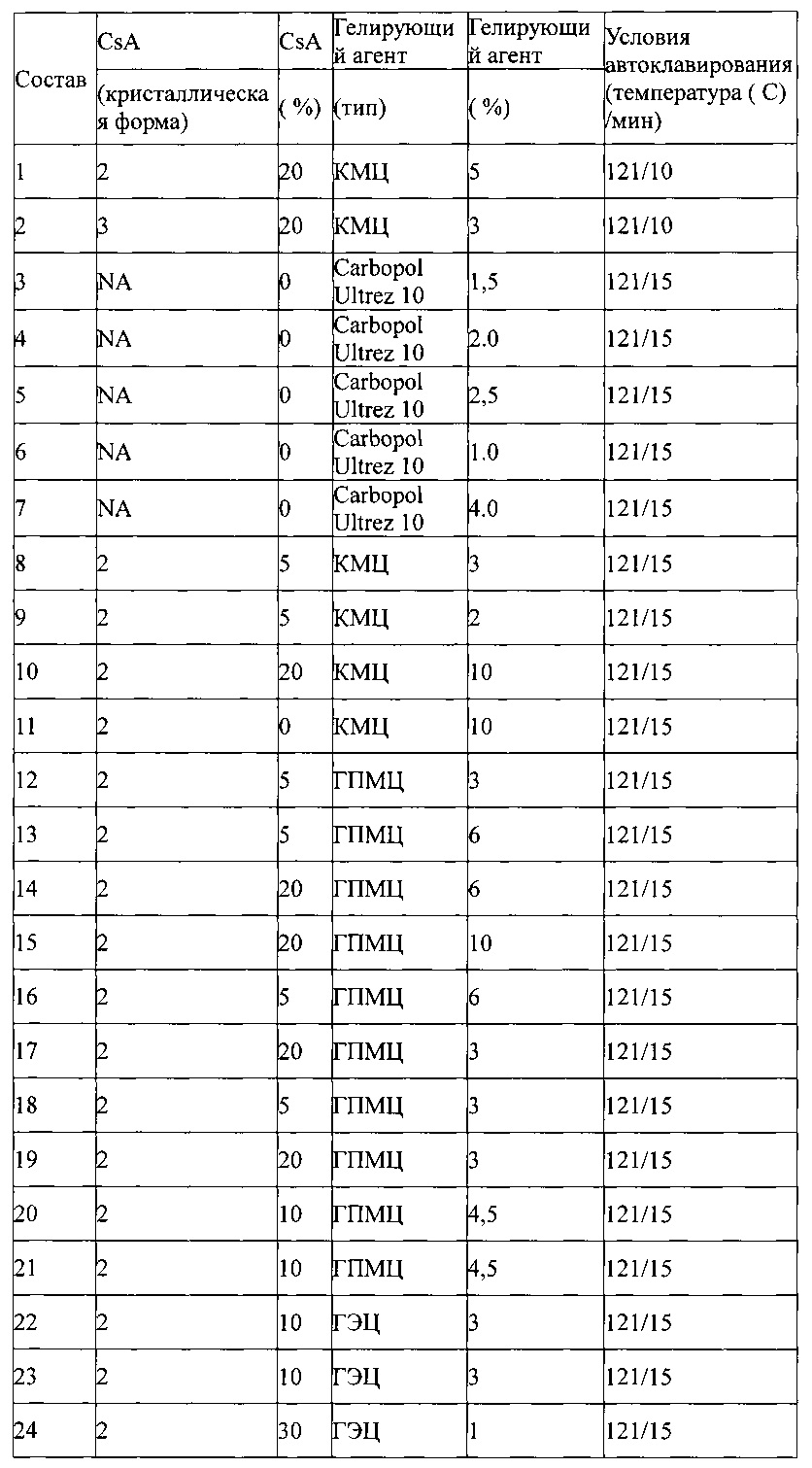
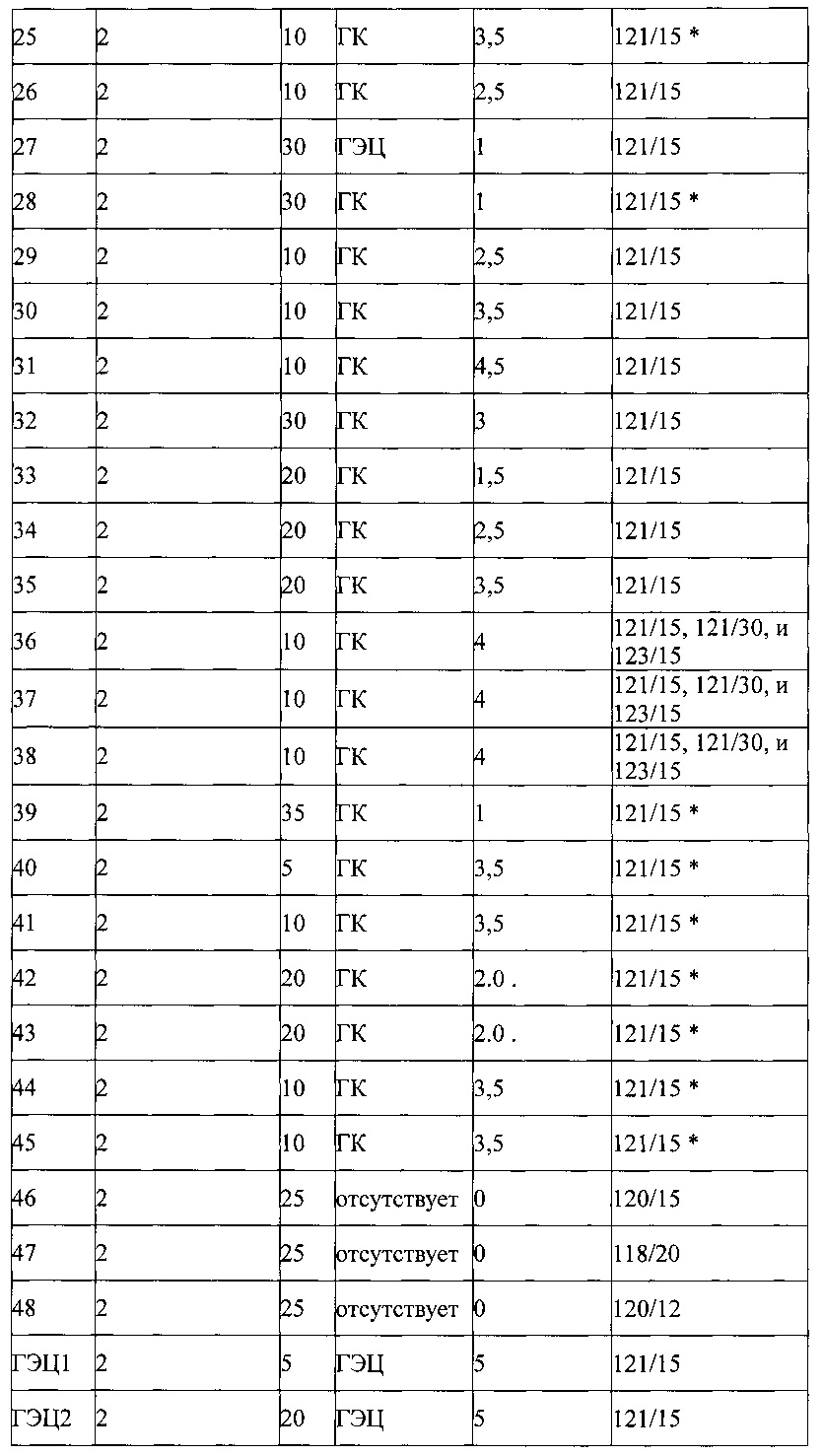
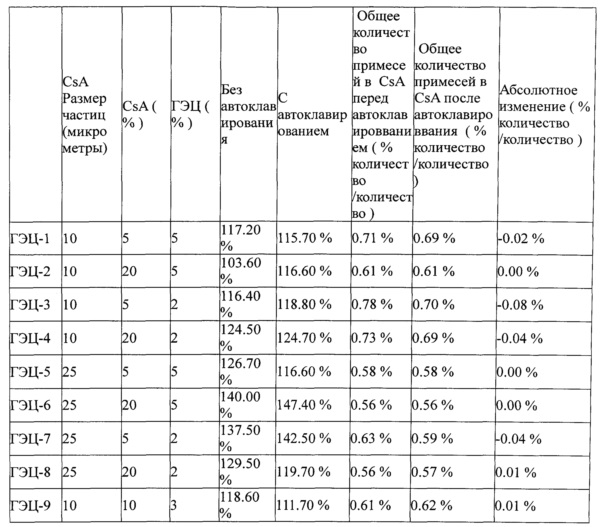
Примеры приведены в Таблице 3, ниже:
Таблица 3 - Автоклавируемые взвеси Циклоспорина А формы 2. CsA = циклоспорин А. CMC = карбоксиметилцеллюлоза. HPMC = гидроксипропилметилцеллюлоза. ГЭЦ = гидроксиэтилцеллюлоза. ГА = гиалуроновая кислота. ПВП = поливинилпирролидон. * = взвесь автоклавирована перед добавлением гелирующего агента.

Способы приготовления
Взвеси данного изобретения содержат циклоспорин А формы 2 и какой-либо суспендирующий агент. В другом варианте реализации, взвесь также содержит один или более из компонентов: воду, буфер, и соль, в количествах, достаточных для обеспечения биосовместимости состава. Под "биосовместимостью", изобретатели подразумевают, что взвесь предназначена для применения к глазу (например, путем парентерального применения).
Составы этого изобретения могут быть приготовлены, используя, либо тепловую стерилизацию взвеси циклоспорина Формы 2, смешанного асептически со стерильньным парентерально-биосовместимым суспендирующим агентом, или другим наполнителем; либо, путем сочетания циклоспорина Формы 2 с парентерально-биосовместимым суспендирующим агентом и другими наполнителями, и тепловой стерилизацией всего состава.
Эти способы относятся к различным важным проблемам связанным с составами циклоспорина:
1) твердый стерильный циклоспорин не может быть предварительно стерилизован способом облучения без значительного разложения лекарственного вещества и образования продуктов разложения; 2) стерильная фильтрация, также является неосуществимой, поскольку состав является взвесью; и 3) финальная стерилизация нагреванием уменьшает вязкость геля. Также, в одном варианте реализации, конечная вязкость лекарственного состава является достаточно высокой, чтобы поддерживать циклоспорин во взвешенном состоянии на протяжении всего срока хранения. В другом варианте реализации, вязкость состава является достаточно высокой для того, чтобы поддерживать циклоспорин во взвешенном состоянии на протяжении всего срока хранения, либо достаточно низкой, что позволяет конечному составу протекать через шприц узкого калибра, такого как 22, 23, 24, 25, или 26 калибр иглы, или более узкий.
Способы 1 и 2, ниже, используют гиалуроновую кислоту в качестве суспендирующего агента, но она может быть заменена другими подходящими суспендирующими агентами.
Следует отметить, что стерильная гиалуроновая кислота является очень дорогой, и что 2-й способ обеспечивает уникальный способ стерилизации, который позволяет использовать нестерильную гиалуроновую кислоту, в виде ее полимера, снижающего нагревание для соответствующего диапазона молекулярного веса этого полимера, таким образом, он достигает требуемой вязкости. Следовательно, Способ 2, требует точного производства, при котором каждая новая партия гиалуроновой кислоты может сдвигаться в другой диапазон вязкости, в одинаковых производственных условиях. Поэтому, для того, чтобы гарантировать достижение заданного диапазона вязкости в каждой коммерческой партии, тепловой цикл должен быть подстраиваемым, то есть, корректируемым в соответствии с набором регуляторных требований и экспериментов на партию сырьевого материала перед производством лекарственного средства.
Кроме того, следует отметить, что согласно способа 2, все этапы приготовления состава производят в одном сосуде. Эти два способа позволяют ускорить производство лекарственного средства и, следовательно, имеют существенное значение в сбережении одного или более дней ценного производственного времени над Способом 1.
Эти способы основаны на удивительном открытии изобретателей, того, что циклоспорин А формы 2, может быть автоклаирован и по-прежнему сохранять свою эффективность и стабильность. Другие формы циклоспорина - аморфная, Форма 1 и Форма 3 - не могут быть, автоклавиованны без неприемлемой потери лекарственного вещества из взеси.
Способ 1 - способ водной взвеси
Соответствующее количество циклоспорина А формы 2 - переводится во взвешенное состояние и смешивается натрий-фосфатным буферным раствором, и взвесь подвергается тепловой стерилизации в автоклаве. В асептических условиях, соответствующее количество предварительно стерилизованной гиалуроновой кислоты добавляется к стерильной взвеси циклоспорина, перемешивается, и затем растворяется. Объем лекарственного продукта доводится до требуемого объема стерильной водой для инъекций. Конечный продукт имеет вязкость в заданном диапазоне, образуя долговременно стабильную взвесь, и при этом, позволяя конечному составу протекать через шприц с узкокалиберной иглой, такой как, игла 25 калибра или более узкой.
2-й способ - способ одной посудины
Избыточное количество нестерильной гиалуроновой кислоты, растворенной в натрий-фосфатном буферном растворе. Циклоспорин А формы 2 - переводится во взвешенное состояние и смешивается. Получившийся состав взвеси подвергается тепловой стерилизации в автоклаве (с использованием "подстраиваемого" нагревательного цикла), до соответствующей температуры и соответствующее количество времени, для того, чтобы вместе простерилизовать состав и довести вязкость до желаемого диапазона значений.
Для парентеральных составов, может быть желательно, достичь достаточно высокой вязкости, чтобы поддерживать циклоспорин во взвешенном состоянии на протяжении всего срока хранения продукта, и при этом достаточно низкой (вязкости), чтобы позволить конечному составу протекать через шприц с иглой калибров 22, 23, 24, 25, или 26 или более узкого. В то время, как растворы гидрогелей в целом, признаются, как безопасные для местного применения, для парентерального применения были использованы очень немногие, и ни один из них не продемонстрировал себя таким, который можно безопасно вводить с помощью инъекции через иглу 25 калибра, или более узкую в субконъюнктивальную ткань при высоких концентрациях гидрогеля. Высокая концентрация суспендирующего агента (до 25%) необходима для того, чтобы поддерживать во взвешенном состоянии парентеральные составы с 5-40% циклоспорина, описанные в настоящем документе. В одном варианте реализации, парентеральные составы для применения к субконъюнктивальной ткани являются 1) инъецируемыми через узкокалиберную иглу, такую, как 25 калибр, или более узкий, с тем, чтобы свести к минимуму повреждения тканей иглой, обеспечить быстрое заживление точки входа иглы, и ограничить обратного потока инъециреумого состава; 2) стерильными; 3) биосовместимыми; и 4) достаточно вязкими, чтобы поддерживать циклоспорин во взвешенном состоянии на протяжении всего срока хранения состава, и для предотвращения тканевого вытеснения из субконъюнктивального пространства. В таких составах вязкость достаточно высока, чтобы длительно поддерживать частицы лекарственного вещества во взвешенном состоянии, и при этом достаточно низка, чтобы позволить конечному однородному составу протекать через иглу узкого калибра.
В одном варианте реализации данного изобретения, составы обладают очень высокой вязкостью (например ≥100,000 мПа*с) и все еще по-прежнему могут быть инъецируемыми из шприца через иглу узкого калибра. Следующая таблица приводит примеры таких составов.


Способы лечения
Составы по этому изобретению могут быть применены для лечения любого состояния глаза, для которого известно, что оно подлежит местному лечению циклоспорином А (например, с помощью Restasis®) в упомянутых здесь концентрациях. Например, фармацевтические составы этого изобретения могут быть применены для лечения пациентов, страдающих от синдрома сухого глаза, для лечения блефарита и болезни мейбомиевой железы, для восстановления чувствительности роговицы поврежденной из-за рефрактивной хирургии глаз, для лечения аллергического конъюнктивита и атопического кератоконъюнктивита, для лечения птеригия, воспаления конъюнктивы и роговицы, кератоконъюнктивита, реакции "трансплантат против хозяина", посттрансплантационной глаукомы, трансплантации роговицы, грибкового кератита, поверхностного точечного кератита Тиджэсона, среди прочих состояний.
Международный Симпозиум Сухого Глаза (ССГ) определяет сухой глаз, как "многофакторное заболевание слез и глазной поверхности, проявляющееся симптомами неприятного ощущения, нарушения зрения, и нестабильности слезной пленки с потенциальным повреждением глазной поверхности, сопровождающееся повышением осмотлярности слезной пленки и воспалением глазной поверхности". Оно включает такие состояния, как например, сухой кератоконъюнктивит, вызванный дефицитом слез, или чрезмерным испарением слез.
Блефарит является хроническим расстройством вызывающим воспаление переднего и заднего края века, с вовлечением кожи и относящихся к ней структур (волос и сальных желез), слизисто-кожного соединения, и мейбомиевых желез.
Он также может влиять на конъюнктиву, слезную пленку, и поверхность роговицы на последних стадиях, и может быть связан с сухим глазом. Блефарит обычно классифицируют как передний или задний блефарит, при этом передний, поражает участок век, несущий ресницы, а задний, главным образом поражает устья мейбомиевых желез.
Заболевание мейбомиевых желез наиболее часто встречается в одной из трех форм: первичный мейбомит, вторичный мейбомит, и мейбомиевая себорея. Мейбомиевая себорея характеризуется избыточной секрецией мейбомиевых желез при отсутствии воспаления (гиперсекреторное заболевание мейбомиевых желез). Первичный мейбомит, в отличие, распознается по застойной и сгущенной секреции мейбомиевых желез (обструктивное гиперсекреторное заболевание мейбомиевой железы). Вторичный мейбомит, представляет локализованный воспалительный ответ, в котором мейбомиевы железы вторично воспалены неоднородным образом, из-за переднего блефарита прилегающего века.
Ослабленная чувствительность роговицы часто случается после рефрактивной хирургии, такой, как субэпителиальный лазерный кератомилез (СКПЛ), ЭПИ-СКПЛ, индивидуальная трансэпителиальная бесконтактная абляция, или другие процедуры, в которых перерезаются роговичные нервы. Ослабленная я чувствительность роговицы может также произойти после вирусной инфекции, вызванной HSV-1, HSV-2 и VZV вирусами. Пациенты с ослабленной роговичной чувствительностью часто жалуются на ощущение сухости глаз, даже если выработка и испарение слез могут быть в норме, означая, что «сухость» у таких пациентов в действительности является формой роговичной невропатии, возникающей, когда роговичные нервы перерезаются хирургически или воспалены после вирусной инфекции.
Аллергический конъюнктивит является воспалением конъюнктивы в результате гиперчувствительности к одному или нескольким аллергенам. Он может быть острым, периодическим, или хроническим. Он случается сезонно, то есть, только в определенное время года, или постоянно, то есть, хронически на протяжении всего года. Симптомы сезонного и постоянного аллергического конъюнктивита, в дополнение к воспалению конъюнктивы включают слезотечение, слезоотделение, конъюнктивно васкулярное растяжение, зуд, папиллярная гиперплазия, хемоз, отек века, и выделение из глаза. Выделение может образовывать корку вокруг глаз после ночного сна.
Атопический конъюнктивит является хронической, тяжелой формой аллергических конъюнктивитов, что часто приводит к ослаблению зрения. Симптомы включают зуд, ощущение жжения, боль, покраснение, ощущение инородного тела, световую чувствительность и расплывчатое зрение. Часто, имеют место выделения, особенно при пробуждении после ночного сна; выделения могут быть вязкими, липкими, и слизистыми. Нижняя конъюнктива часто сильнее поражена, чем верхняя конъюнктива. Конъюнктива может изменяться в диапазоне от бледной, отечной и не имеющей особенностей, до имеющей характеристики прогрессирования болезни, включая папиллярную гипертрофию, субэпителиальный фиброз, укорочение свода, трихиаз, заворот века и мадароз. У некоторых пациентов заболевание прогрессирует до точечных эпителиальных эрозий, роговичной неоваскуляризации, и других проявлений поражения роговицы, которые могут ухудшать зрение. Обычно присутствует разрастание бокаловидных клеток в конъюнктиве, образование псевдотубулярного эпителия, и повышенное количество дегранулирующих эозинофилов и мастоцитов в эпителии. Количество CD25+T лимфоциты, макрофаги, дендритные клетки (HLA-DR.sup.+, HLA-CD1+) значительно увеличено в собственном веществе.
Как атопический конъюнктивит, весенний конъюнктивит является тяжелой формой аллергического конъюнктивита, но он, как правило, сильнее затрагивает верхнюю конъюнктиву, чем нижнюю. Он проявляется в двух формах. В пальпебральной форме присутствуют квадратные, твердые, жесткие, сплюснутые, тесно упакованные сосочки; в бульбарной (краевой) форме, окружающая конъюнктива становится гипертрофированной и сероватой. Обе формы часто сопровождаются слизистыми выделениями. Может произойти потеря эпителия роговицы, сопровождающаяся болью и светобоязнью, а также могут появиться бляшки в центральных отделах роговицы и точки Трантаса.
ПРИМЕРЫ
Изобретение далее проиллюстрировано следующими примерами.
Когда изобретатели автоклавировали водные взвеси циклоспорина А, частицы лекарственного вещества агрегировались, что делало продукт непригодным. Кроме того, изобретатели обнаружили, что гиалуроновая кислота также частично разлагается, вызывая заметное снижение вязкости. Более низкая 5 вязкость, в свою очередь, снижает способность частиц лекарственного вещества пребывать во взвешенном состоянии, и вызывает их осаждение. Составы, со слишком быстро осаждающимися из взвеси частицами лекарственного вещества, или необратимо осаждающиеся, могут оказаться полезными для лабораторных испытаний, но они коммерчески нежизнеспособны.
Изобретатели изучили составы четырех полиморфных форм циклоспорина А: аморфной формы, тетрагональной кристаллической формы (форма 1), орторомбической формы (форма 3), и циклоспорина А формы 2.
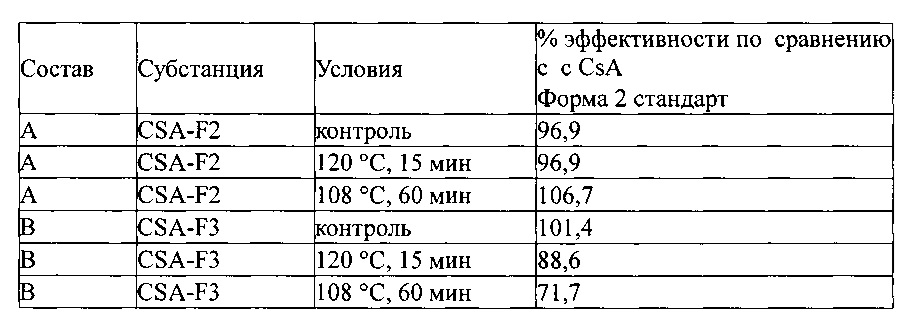
Взвесь формы 1 превращается в аморфную форму и агрегируется при автоклавиовании; также наблюдается налипание циклоспорина. Соответственно, ни форма 1, ни аморфная форма не подходят для автоклавной стабилизации. Кроме того, автоклавируемая взвесь F3 в воде теряет 11-28% своей эффективности при автоклавировании (таблица 4); это также является неприемлемым. В отличие от этого, взвесь формы 2 в воде была довольно стабильной к автоклавированию, стойкой к разложению по сравнению с контролем перед стерилизацией.
Анализ рентгеновскими лучами отфильтрованного твердого вещества из состава формы 2 также подтверждает, что форма 2 является полиморфно стабильной к автоклавированию. (Фиг.3). Эти два последних вывода крайне удивительны, учитывая недостатки химической либо полиморфической стабильности трех других форм.
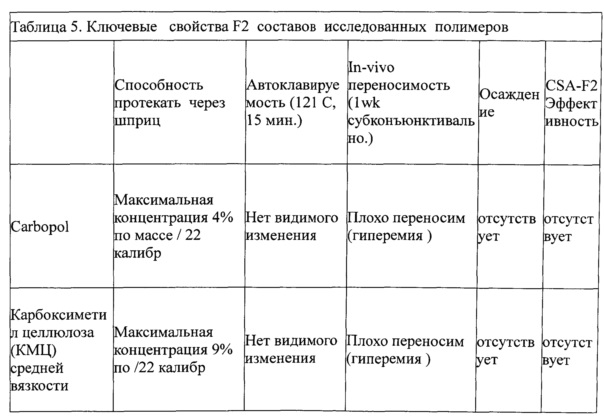
Изобретатели изучили автоклавируемость серии концентрированных растворов различных полимеров (не лекарственных веществ), которые, при загрузке в шприц, протекают через узкий калибр иглы (25 или более узкий). Эти полимеры были оценены следующим образом: гиалуроновая кислота с поперечными межмолекулярными связями (Juvederm®), карбомер, карбоксиметилцеллюлоза - средней молекулярной массы, карбоксиметилцеллюлоза - высокой молекулярной массы, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, Pluronic F127 и поливинилпирролидон K90. Все они легко доступны от коммерческих поставщиков.
Сто микролитров каждого из автоклавированных растворов вводили в конъюнктиву кроликам, для того, чтобы оценить его склонность к вызыванию воспаления. Те полимеры, которые вызывали воспалительную реакцию, были исключены из рассмотрения (Фигура. 4), КМЦ и ГПМЦ были исключены). Кроме того, Juvederm® был исключен, поскольку он сформировал долго незаживающий пузырь, который в организме человека, может вызвать раздражение, когда глазное веко перемещается на стороне инъекции. Оба ГПМЦ и Pluronic выделились из раствора во время / после автоклавирования и, следовательно, также были исключены. Из коммерчески жизнеспособных гидрогелей, только ГЭЦ и ПВП продемонстрировали то, что они не вызвали воспаления в конъюнктиве кроликов после автоклавирования. Эти два гидрогеля были использованы для разработки взвесей циклоспорина А для дальнейшего исследования. Результаты этих исследований отражены в таблице 5.
Первоначально, изобретатели изучали возможность тепловой стерилизации взвеси циклоспорина А формы 1 (который превращается в аморфную форму). Этот подход привел к агломерации лекарственного вещества и, следовательно, состав оказался непригодным. Дальнейшие исследования, добавление ПВП для подавления агломерации формы 1/аморфной формы, также не удались.
Поскольку тепловая стерилизация в водной взвеси оказалась неприменимой, изобретатели планировали готовить взвеси асептическим способом, используя предварительно стерилизованный твердый циклоспорин. Различные твердые циклоспорины (формы 1, 2, и 3, и аморфная) обрабатывалась излучением гамма или электронного пучка. Во всех случаях, значительные потери лекарственного вещества (3-9%) имели место (Фигура 2 и таблица 1). Кроме того, значительные потери лекарственного вещества указывает на то, что высокий уровень продуктов разложения (около 3-9%) образуется в субстанции подвергнутой стерилизации облучением. Эти примеси могут иметь негативные токсикологические и/или нормативные последствия; следовательно, этот подход к стерилизации представляется нежелательным.


Впоследствии, изобретатели попытались облучить твердый циклоспорин (Формы 1, 2, и 3, и аморфных), при наилучших условиях выше, при низких температурах. Значительного улучшения отмечено не было ни с какой из форм циклоспорина (таблица 2).
После того, как стало очевидным, что облучение твердых циклоспоринов приводит к излишнему разложению, изобретатели попытались облучить водную взвесь циклоспорина, используя гиалуроновую кислоту в качестве суспендирующего агента. Этот подход привел к 4-10% разложению лекарственного вещества в составе.


И наконец, изобретатели сосредоточили внимание на паровой стерилизации взвесей и полных составов циклоспоринов. Взвеси формы 1 (которая превращается в аморфную) агломерируют в ходе тепловой стерилизации. Взвеси формы 3, будучи физически стабильными и более химически стабильными, чем Форма 1, значительно разлагались при тепловой стерилизации. Но, на удивление изобретателей взвеси Формы 2, были, как физически, так и химически стабильны (Таблицы 4 и 5).


Глазная гиперемия
Парентерально-биосовместимые суспендирующие агенты исследовались путем инъецирования стерильных концентрированных растворов в субконъюнктивальное пространство и оценивания токсикологического ответа. Инъекция 100 ультралитров следующих полимеров в натрий-фосфатном буфере осуществлялась субконъюнктивально ново-зеландским белым кроликам и наблюдалась в течение семи дней.
- 2% Карбомер (Carbopol Ultrez 10NF, Lubrizol)
- 8%карбоксиметилцеллюлоза (с низкой вязкостью КМЦ, Lubrizol)
- 6%карбоксиметилцеллюлоза (высокая вязкость КМЦ, Lubrizol)
- 6% ГЭЦ (Ashland)
- 6% ГПМЦ (Dow Chemical)
- Juvederm Ultra (Allergan, Inc)
- Pluronic F127(BASF)
- Поливинилпирролидон (ПВП K90, BASF)


Показано, что крупная глазная гиперемия рассасывалась в течение 7 дней для КМЦ, ГЭЦ, ГПМЦ, и Pluronic ПВП. Показано, что глазной вылив рассасывался в течение трех дней для всех групп, кроме одной. Результаты эксперимента иллюстрированы на Фигурах 9-11.
Примеси и анализ эффективности.
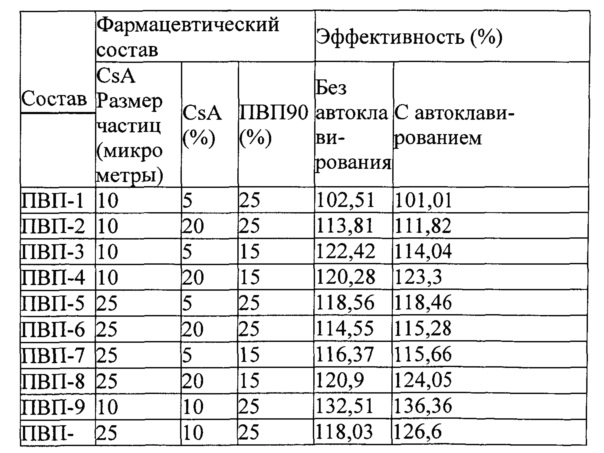
Изобретатели готовили различные составы и оценивали их эффективность и чистоту, а также распределение частиц по размерам.




Реферат
Группа изобретений относится к области медицины, а именно к фармации, и предназначена для приготовления состава циклоспорина А. Способ приготовления включает следующие стадии. Растворение циклоспорина А Формы 2 в растворе, автоклавирование раствора и добавление наполнителя, выбранного из карбоксиметилцеллюлозы, гидроксипропилметилцеллюлозы, гидроксиэтилцеллюлозы, гиалуроновой кислоты, поливинилпирролидона, Carbopol Ultrez 10NF и Pluronic F127. Также способ может осуществляться путем растворения указанного наполнителя, добавления к раствору циклоспорина А формы 2 и автоклавирования результирующей смеси. Циклоспорин А формы 2 характеризуется кристаллическими пиками ПРД, измеренной при излучении CuKα: 7,5, 8,8, 10,2, 11,3, 12,7, 13,8, 14,5, 15,6 и 17,5 °2θ. Использование группы изобретений обеспечивает получение состава циклоспорина А, который обладает высокой стабильностью в отношении тепловой стерилизации. 2 н.п. ф-лы, 5 табл., 12 ил., 1 пр.

Комментарии