Состав пролонгированного действия циклоспорина формы 2 - RU2639393C2
Код документа: RU2639393C2
Чертежи


Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Эта заявка на патент заявляет приоритет предварительной заявки на патент США 61/559,838, поданной 15 ноября 2011 года и предварительной заявки на патент США 61/563,199, поданной 23 ноября, 2011 года полное содержание которых, включено в этот документ в виде ссылок.
УРОВЕНЬ ТЕХНИКИ
Циклоспорин А является активным агентом в глазном фармацевтическом составе для местного применения Restasis®, одобренном в Соединенных Штатах для лечения синдрома "сухого глаза". Циклоспорин для местного применения также используется для лечения других офтальмологических состояний, таких как:
восстановление чувствительности роговицы после рефракционной хирургии, воспаление конъюнктивы и роговицы, кератоконъюнктивит, реакция "трансплантат против хозяина", посттрансплантационная глаукома, трансплантация роговицы, грибковый кератит, дисфункция мейбомиевой железы, поверхностный точечный кератит Тиджэсона, увеит, верхний лимбальный кератоконъюнктивит Теодора.
Соблюдение указаний врача пациентами очень важно, тем не менее многие из пациентов не выполняют назначение применения глазных лекарственных препаратов. Кроме того, некоторые способы лечения состояний, отличных от сухого глаза, требуют дозировки более частой, чем одобренная для Restasis дозировка два раза в день, а также более высокие концентрации циклоспорина А в ткани по сравнению с теми, которые может обеспечить Restasis после введения множественных доз, что являлось бы полезным для некоторых пациентов с тяжелыми состояниями, как, например, реакция "трансплантат против хозяина".
Некоторые глазные заболевания могут требовать долгосрочной терапии. Например, Национальный институт глаза (НИГ) завершил исследования для оценки биологически разлагаемых имплантатов циклоспорина в дозе 1 и 2 мг для лечения увеита. НИГ также изучает применение неразлагаемых циклоспориновых имплантатов для лечения реакции "трансплантат против хозяина". Вместе с тем следует отметить, что удаление неразлагающихся циклоспориновых имплантатов после исчерпания их дозы требует повторного хирургического вмешательства. Некоторые другие релевантные исследования уже проведены НИГ либо находятся в процессе набора пациентов для исследований. Результаты этих исследований еще не публиковались.
Желательна одиночная имплантация или инъекция, доставляющая постоянно высокие уровни циклоспорина в течение длительного периода времени (недели или месяцы). Желательным является применение системы доставки биоразлагающейся и биоразрушающейся системы доставки в течение нескольких месяцев, которая доставляет циклоспорин к целевым тканям передней части глаза в концентрациях, равных или больших, чем в Restasis. Желательно также иметь инъекционный состав, который позволит избежать хирургического вмешательства. Также будет полезен состав, способный пройти через иглу 22 калибра (или меньшую) и во избежание повреждения глазной ткани, которое может произойти при применении троакара, более крупных игл или хирургической имплантации.
Число описанных успешных инъекций циклоспорина в конъюнктиву для длительной терапии пока очень ограничено, в то время как краткосрочная эффективность продемонстрирована при применении некоторыми микросферами и прочими составами, ни один из продемонстрированных составов не являлся эквивалентным или превосходящим по доставке циклоспорина к ткани передней части глаза по сравнению с Restasis за период как минимум 3 месяца.
Биоразлагаемые имплантаты, которые могут быть введены через иглу 22 калибра, не доставляют достаточного количества лекарственного средства на протяжении достаточного периода времени для удовлетворения потребности. Биоразлагаемая гелеобразующая суспензия выполняет эту задачу лучше, но все еще не удовлетворяет потребность.
Было обнаружено, что составы изобретения, будучи вводимыми в субконъюнктивальное пространство глаза через иглу 22 или большего калибра, доставляют циклоспорин А к самой передней глазной ткани в течение длительного периода времени.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
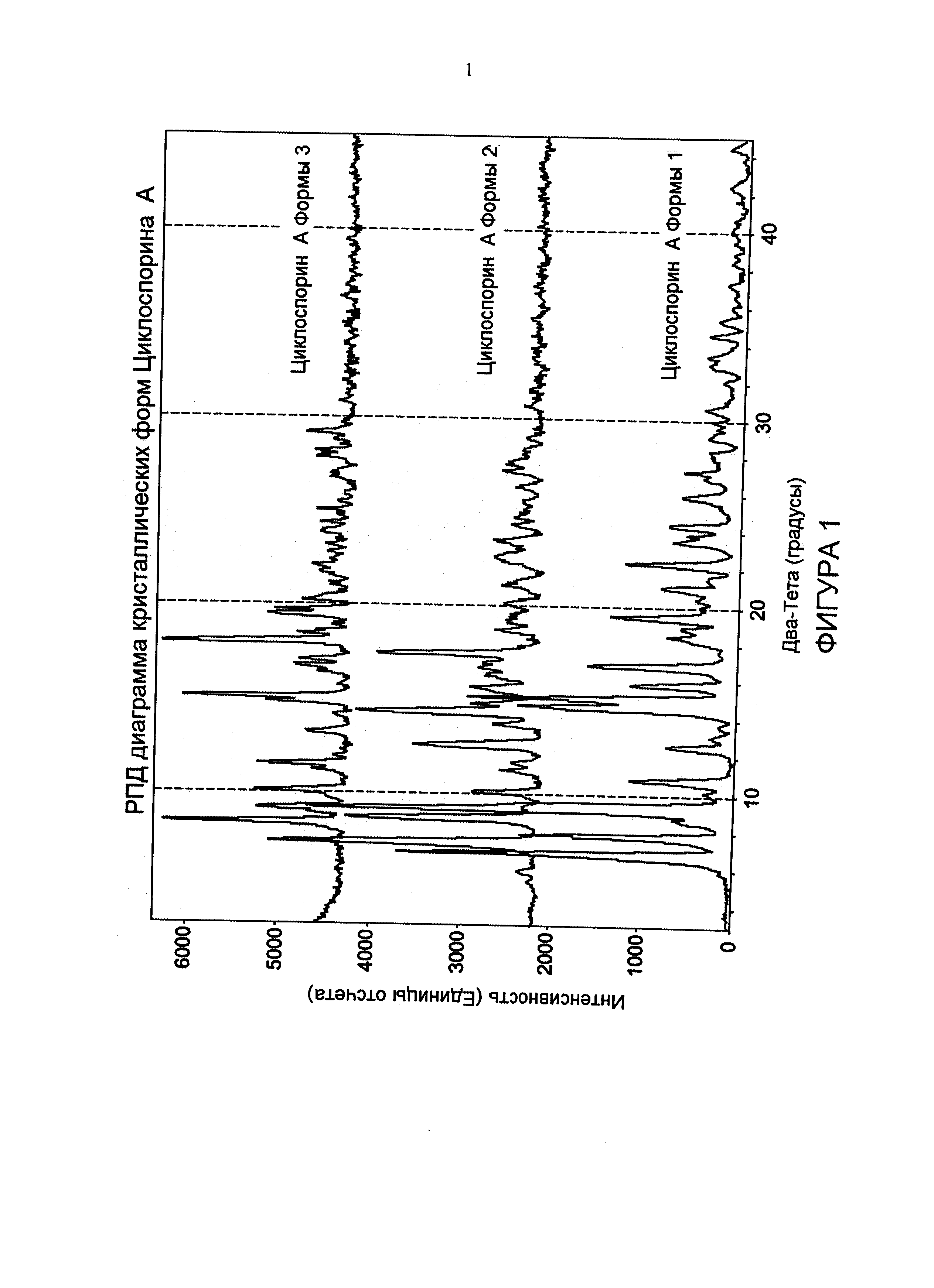
Фиг. 1 иллюстрирует характеристики диаграмм рентгеновской порошковой дифракции (РПД) CsA в новой кристаллической форме (называемой формой 2 в настоящем документе), в тетрагональной форме (называемой формой 1 в настоящем документе), и в орторомбической форме (называемой формой 3 в настоящем документе).
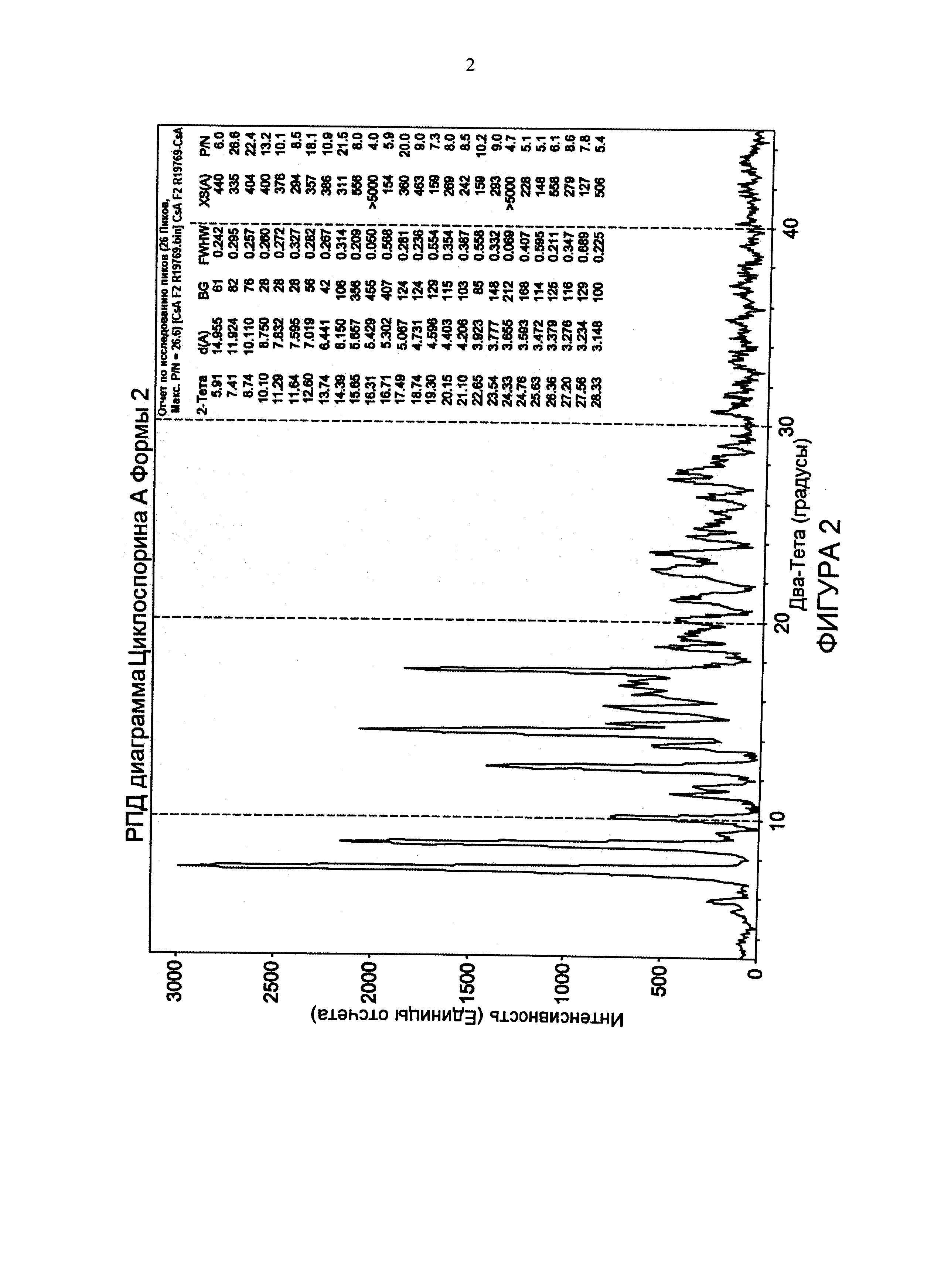
Фиг. 2 иллюстрирует РПД дифрактограмму CsA кристаллической формы 2.
Фиг. 3 иллюстрирует характеристику сорбции/десорбции воды для CsA формы 2.
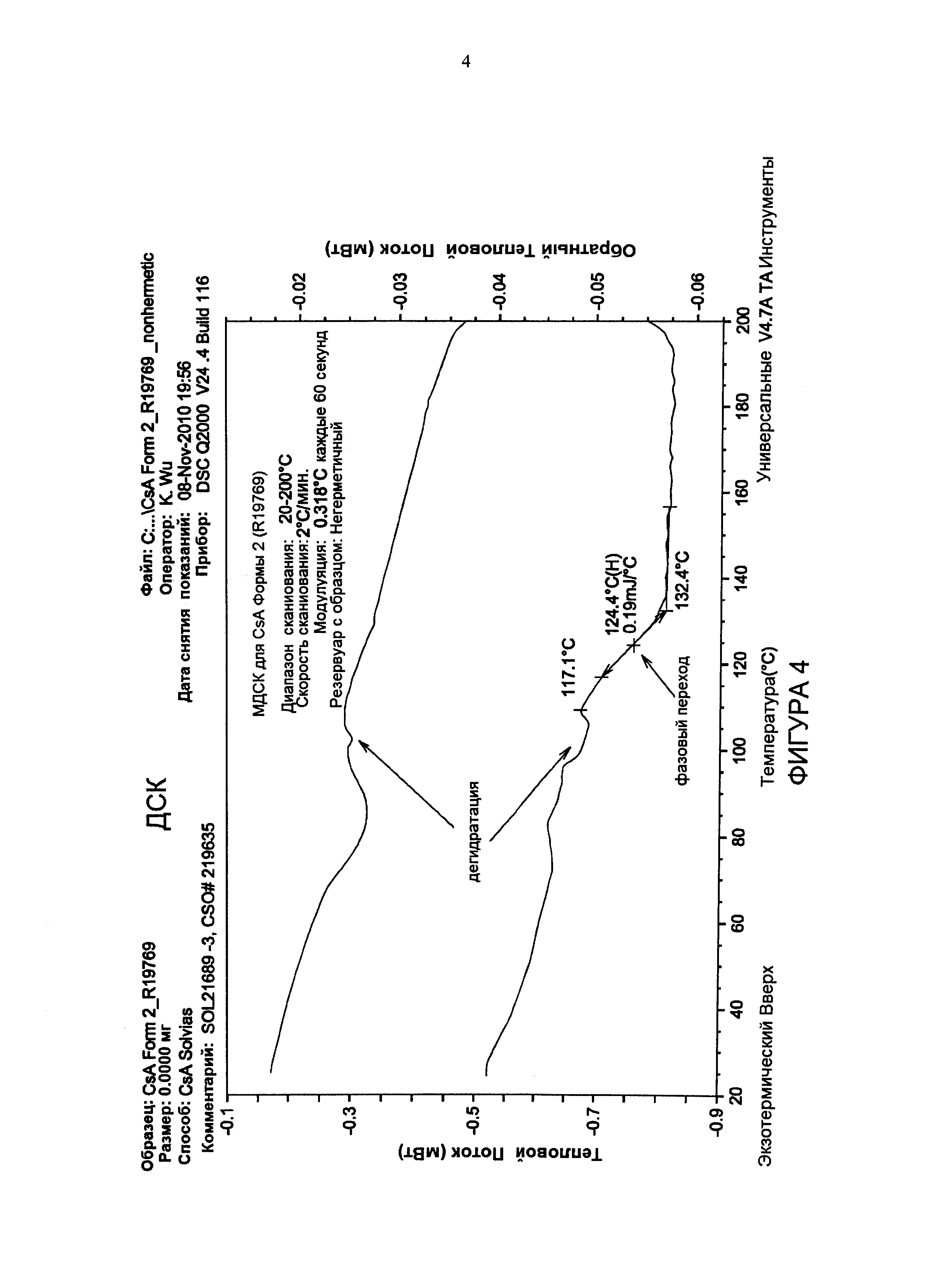
Фиг. 4 иллюстрирует анализ МДСК CsA формы 2, извлеченного из 0,04% состава, с 1% PS80.
Фиг. 5 иллюстрирует: переднюю часть глаза и различные квадранты конъюнктивы, относящиеся к краю и роговице.
Фиг. 6 иллюстрирует инъекцию стероидного соединения в верхнетемпоральный квадрант субконъюнктивального пространства глаза. Пациент смотрит вниз, в то время как большой палец одной руки используется, чтобы слегка оттянуть верхнее веко. Шприц, содержащий стероидсодержащий фармацевтический состав, размещен по касательной к глазному яблоку и вставлен через конъюнктиву глазного яблока, посредством этого внедряя иглу в субконъюнктивальное пространство.
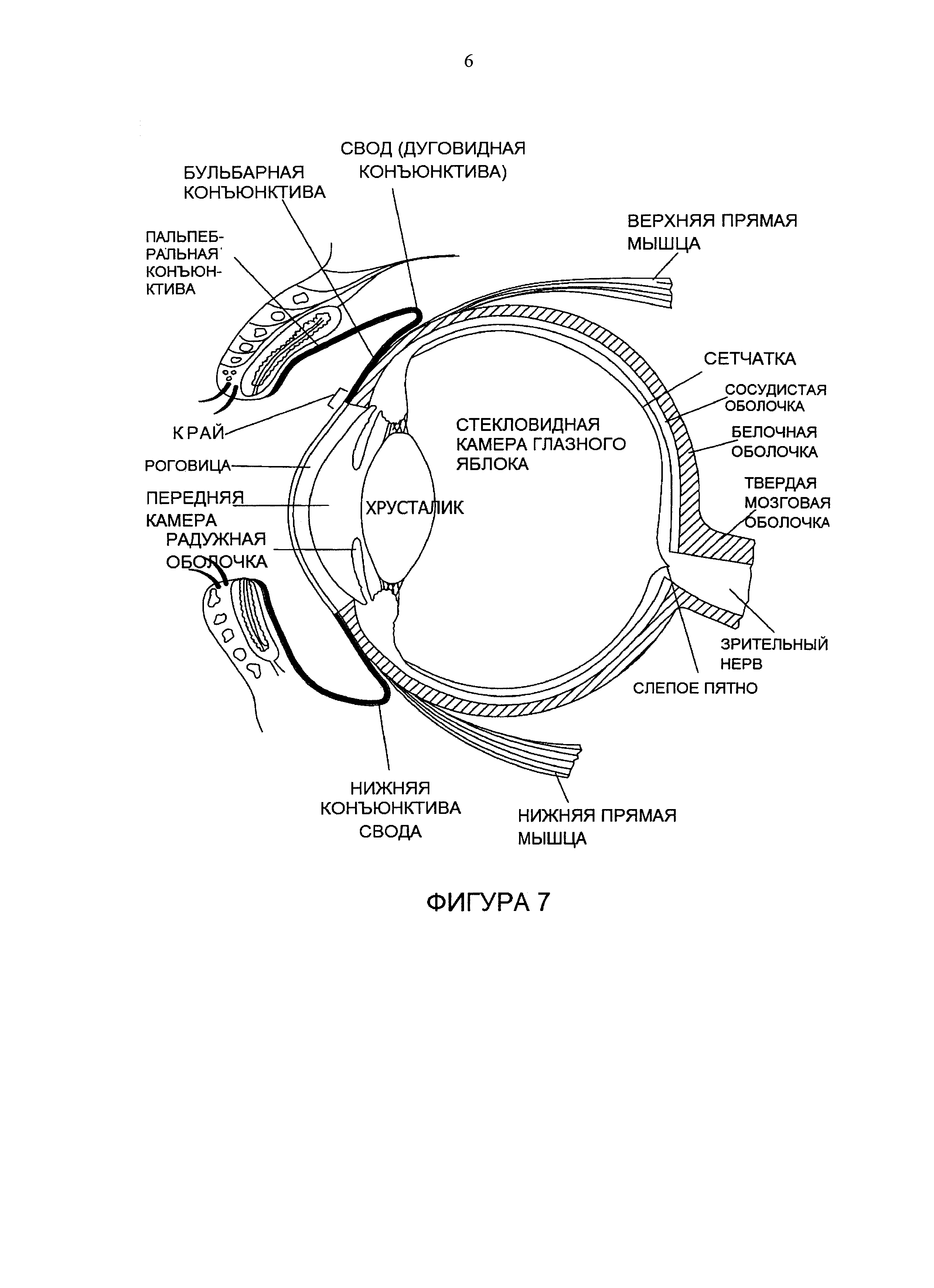
Фиг. 7 иллюстрирует поперечный разрез глаза и расположение трех зон конъюнктивы (жирная черная линия) - пальпебральной, конъюнктивы свода, бульбарной - относительно других анатомических зон в глазу.
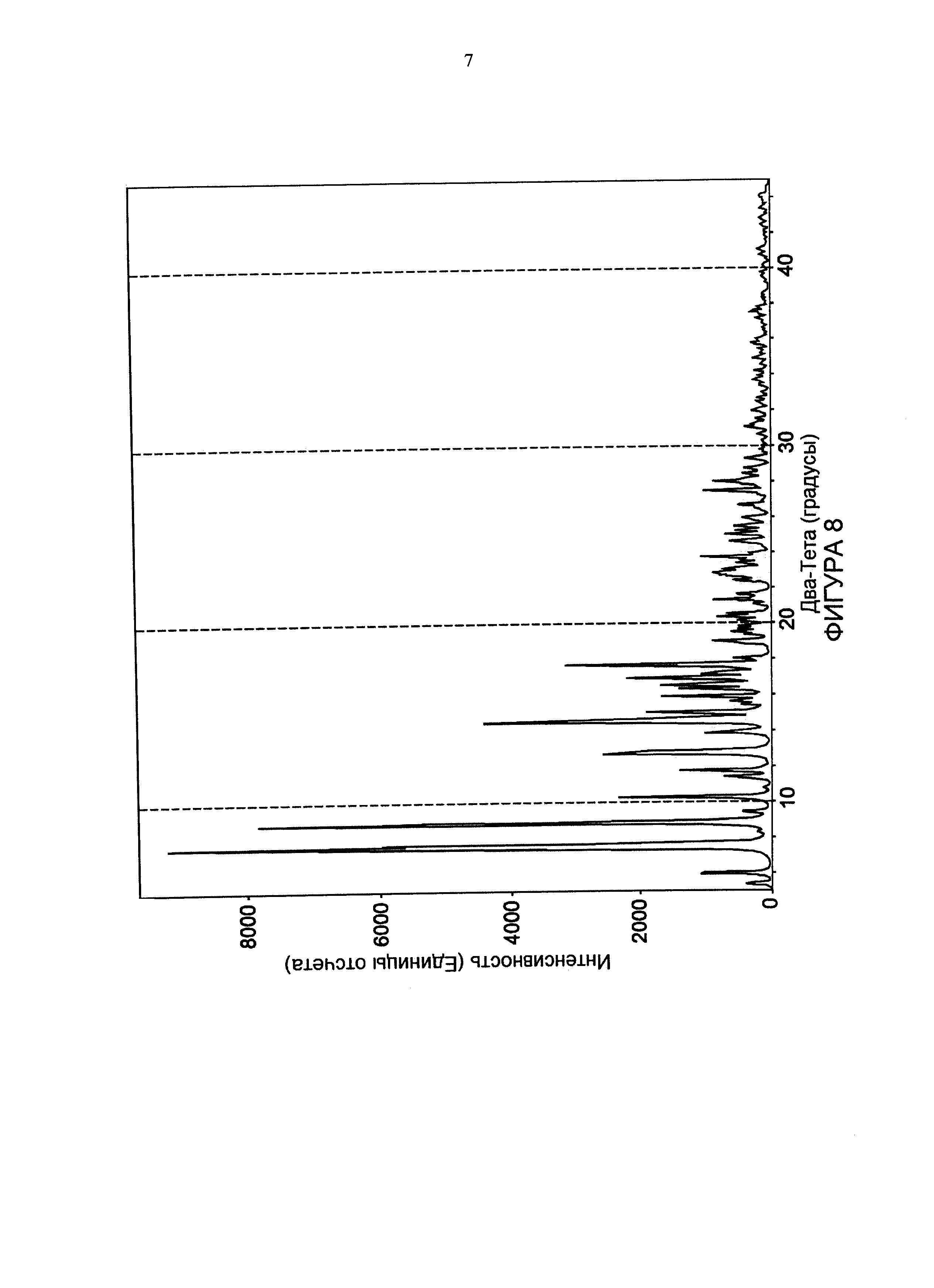
Фиг. 8 иллюстрирует воспроизведенную диаграмму РПД, образуемую циклоспорином А.
ПОДРОБНОЕ ОПИСАНИЕ
Циклоспорин А
Циклоспорин A (CsA) является циклическим пептидом, имеющим следующую химическую структуру:
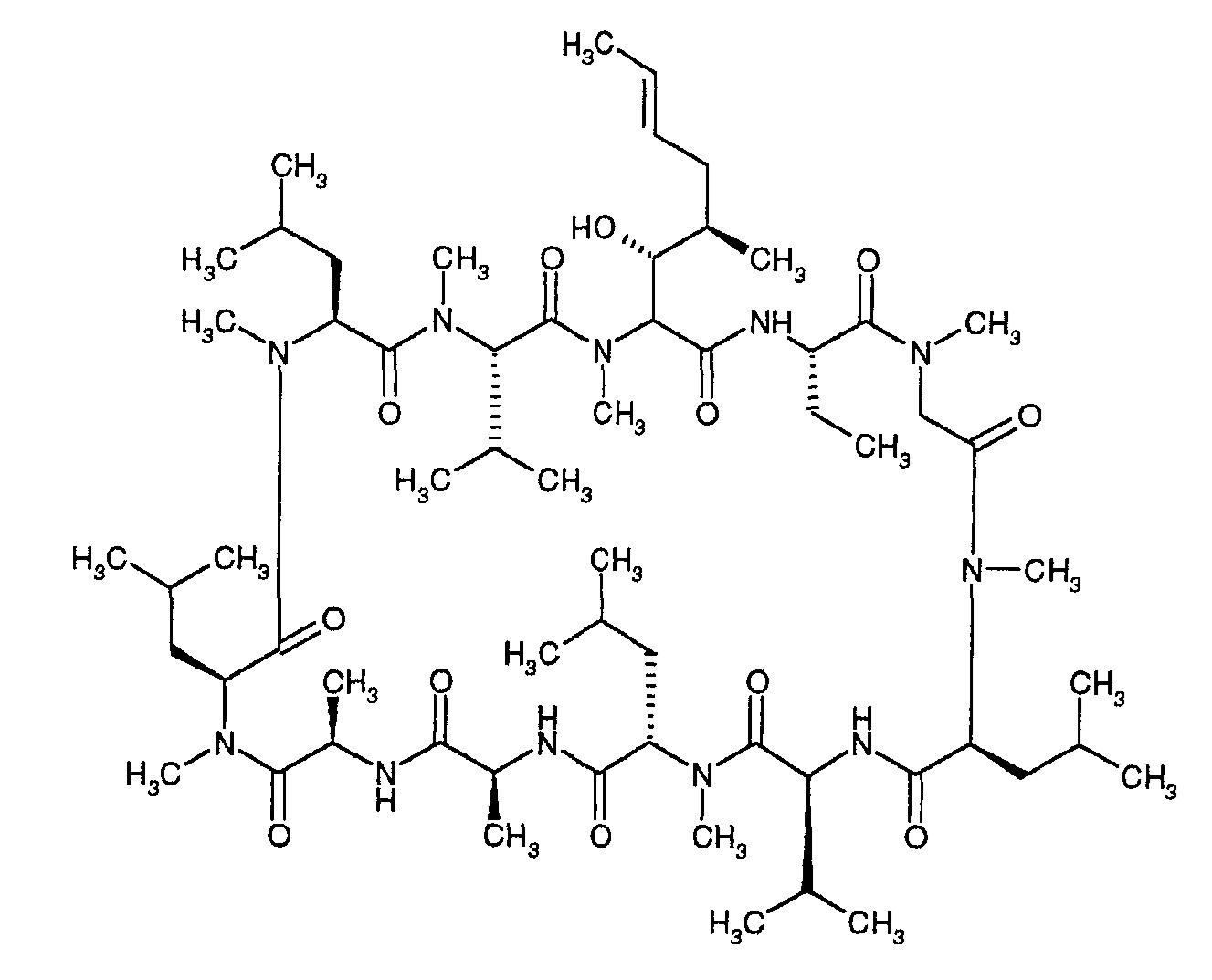
Его химическое название: цикло[[(Е)-(2S,3R,4R)-3-гидрокси-4-метил-2-(метиламино)-6-октеноил]-L-2-аминобутирил-N-метилглицил-N-метил-L-лейцил-L-валил-N-метил-L-лейцил-L-аланил-D-аланил-N-метил-L-лейцил-N-метил-L-лейцил-N-метил-L-валил]. Он также известен под названиями: «cyclosporine», «cyclosporine A», «ciclosporin» и «ciclosporin А». Он является активным агентом в Restasis® (Allergan, Inc., Ирвин, штат Калифорния), эмульсии, содержащей 0,05% (мас./об.) циклоспорина. Restasis® одобрен в Соединенных Штатах для увеличения выработки слез у пациентов, чье слезовыделение предполагается подавленным из-за глазного воспаления, связанного с высушивающим кератоконъюнктивитом.
Циклоспорин А формы 2
Известно, что Циклоспорин А существует в аморфной форме, в форме жидкого кристалла, тетрагональной кристаллической форме (форма 1), и орторомбической форме (форма 3). Недавно обнаружена новая кристаллическая форма - Циклоспорин А формы 2.
РПД диаграмма CsA формы 2 значительно отличается от тетрагональной формы и орторомбической формы (фиг. 1). Главные кристаллические пики для CsA формы 2 появляются в (2θ) при сканировании рентгеновским дифрактометром с таким источником рентгеновского излучения, как излучение Cu Кα,
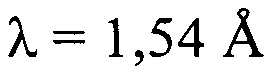

В одном из вариантов реализации новая кристаллическая форма (форма 2) CsA является нестехиометрическим гидратом Циклоспорина А. В другом варианте реализации кристаллическая форма 2 представлена следующей формулой:
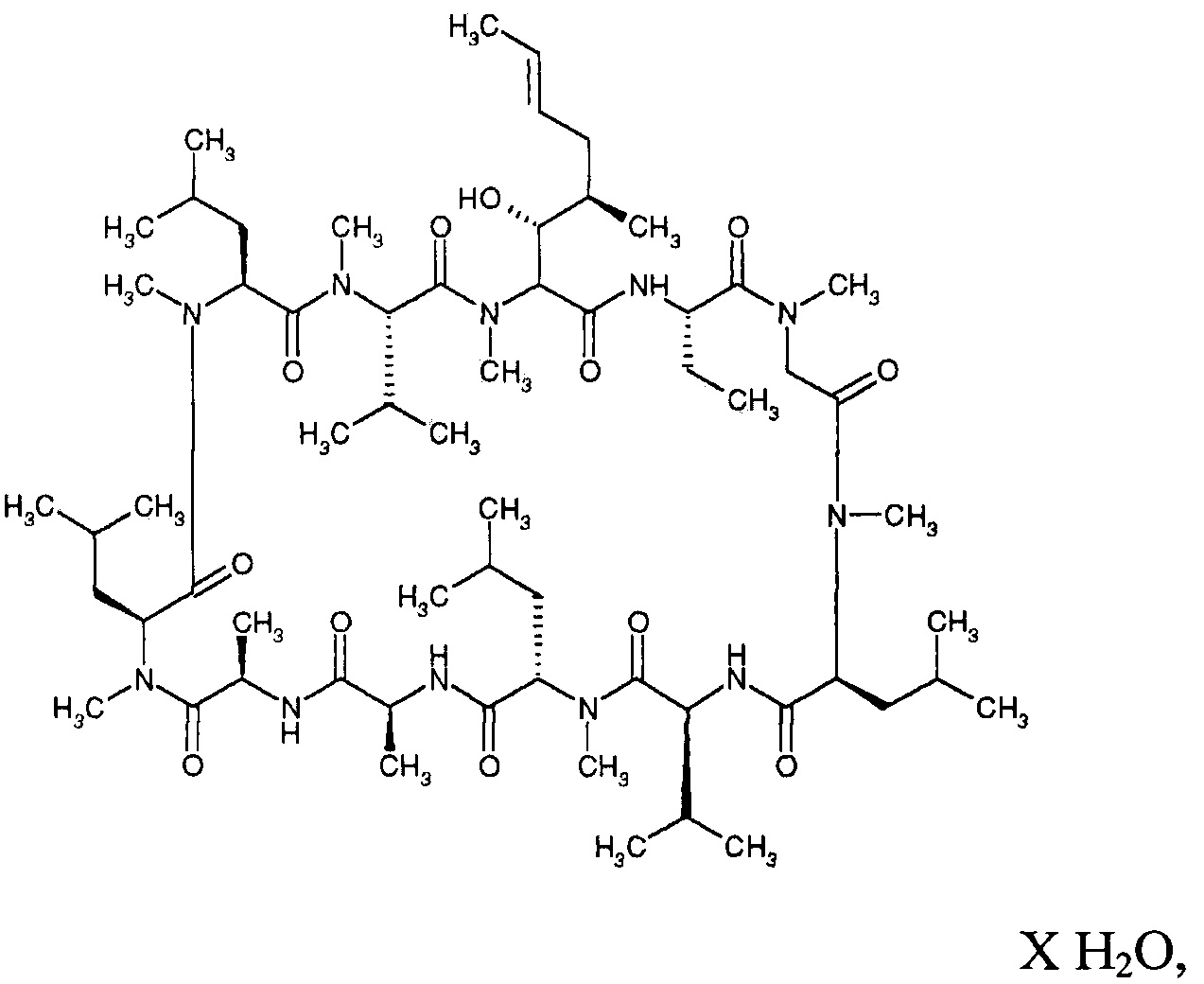
где X - количество молекул воды, варьирующееся в диапазоне от 0 до 3. В одном из вариантов реализации X в формуле представляет собой 2.
Форма 2 оказывается кинетически стабильной формой CsA вводных взвесях. Взвеси, содержащие форму 2, не проявляют превращения в другие известные полиморфные или псевдоморфные формы при хранении. Было установлено, что форма 1 и аморфная форма превращаются в форму 2 в присутствии воды.
Определена структура одиночного кристалла гидратной формы CsA формы 2 и параметры этой кристаллической структуры перечислены в таблице 1. Эти результаты свидетельствуют о том, что форма 2 является уникальной по сравнению с другими известными кристаллическими формами Циклоспорина А.
Асимметричная элементарная ячейка CsA формы 2 содержит одну молекулу циклоспорина А и две молекулы воды. Возможно, что любые маленькие молекулы, способные образовывать водородную связь с водой, могут играть роль заполнителя объема, что дало бы целый ряд потенциальных структур, начиная от орторомбического дигидрата до искаженного моноклинного дигидрата. РПД диаграмма, рассчитанная из монокристаллической структуры, проиллюстрирована на фиг. 8 и она соответствует экспериментальной диаграмме, проиллюстрированной на фиг. 2. Эти сопоставляющиеся диаграммы в дальнейшем подтверждают, что форма 2 является уникальной и чистой кристаллической формой циклоспорина А.
Без ограничения теорией термогравиметрический анализ в сочетании с титрованием KF и анализом сорбции десорбции пара (СДП) позволяет предположить, что CsA формы 2 является нестехиометрическим гидратом и CsA. Анализ сорбции пара для Циклоспорина формы 2 показывает, что содержание воды в новой кристаллической форме обратимо зависит от относительной влажности, как проиллюстрировано на фиг. 3. Аналогично с тетрагональной формой эта новая форма CsA подвержена фазовому переходу к жидкому кристаллу или аморфной форме при 124,4°С перед расплавлением, как проиллюстрировано модулированным дифференциальным калориметрическим анализом (МДСК) (фиг. 4).
Циклоспорин формы 2 может быть получен путем перевода во взвешенное состояние аморфного 0,05% циклоспорина А (мас./об.) в 1% Полисорбате 80, при нагревании раствора до 65°С, выдерживании его при такой температуре в течение 24 ч и последующем выделении преципитата вакуумной фильтрацией. В дальнейшем можно использовать этот циклоспорин А формы 2, полученный таким способом, чтобы вырастить дополнительные количества, используя Циклоспорин А формы 2 в качестве затравочного кристалла; в этом способе во взвешенное состояние переводят около 30 г циклоспорина А в раствор 900 мл воды, содержащий 1% (мас./об.) Полисорбата 80, нагревают этот раствор до 65°С, а затем вносят затравку 0,2 г циклоспорина А формы 2 при температуре 52°С. В дальнейшем этот раствор перемешивают около 22 ч при температуре от 61°С до 65°С, а затем выделяют образовавшийся преципитат.
Более подробные сведения относящиеся к CsA формы 2 могут быть найдены в Заявке США 13/480,710, которая включена в настоящий документ в виде ссылки.
Составы пролонгированного действия циклоспорина А формы 2
Составы изобретения являются офтальмологически приемлемыми составами Циклоспорина А формы 2. Под "офтальмологически приемлемыми" изобретатели подразумевают, что взвеси приготавливаются таким способом, чтобы быть нераздражающими применительно к глазу млекопитающего, такого как человек.
Составы изобретения содержат Циклоспорин А формы 2 и какой-либо гидрогель, например, гиалуроновой кислоты, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, гидроксиэтилцеллюлозы, поливинилпиролидона и карбоксиметилцеллюлозы.
В одном варианте реализации состав содержит циклоспорин А формы 2 с концентрацией от приблизительно 0,001% до приблизительно 10% (мас./об.). В одном варианте реализации взвесь содержит циклоспорин А формы 2 с концентрацией от приблиительно 0,001% (мас./об.) до приблизительно 0,01%, от приблизительно 0,001% (мас./об.) до приблизительно 0,04% (мас./об.), от приблизительно 0,001% (мас./об.) до приблизительно 0,03% (мас./об.), от приблизительно 0,001% (мас./об.) до приблизительно 0,02% (мас./об.) или от приблизительно 0,001% (мас./об.) до приблизительно 0,01% (мас./об.). В другом варианте реализации взвесь содержит циклоспорин А формы 2 с концентрацией от приблизительно 0,01% (мас./об.) до приблизительно 0,05%, от приблизительно 0,01% (мас./об.) до приблизительно 0,04% (мас./об.), от приблизительно 0,01% (мас./об.) до приблизительно 0,03% (мас./об.), от приблизительно 0,01% (мас./об.) до приблизительно 0,02% (мас./об.) или от приблизительно 0,01% (мас./об.) до приблизительно 0,01% (мас./об.).
В другом варианте реализации взвесь содержит циклоспорин А формы 2 с концентрацией от около 0,01% (мас./об.) до около 0,1%, от приблизительно 0,1% (мас./об.) до приблизительно 0,5% (мас./об.), от приблизительно 0,01% (мас./об.) до приблизительно 1% (мас./об.) или от приблизительно 1% (мас./об. до приблизительно 10%.
Например, составы могут содержать приблизительно 0,001% (мас./об.), приблизительно 0,002% (мас./об.), приблизительно 0,003% (мас./об.), приблизительно 0,004% (мас./об.), приблизительно 0,005% (мас./об.), приблизительно 0,006% (мас./об.), приблизительно 0,007% (мас./об.), приблизительно 0,008% (мас./об.), приблизительно 0,009% (мас./об.), приблизительно 0,01% (мас./об.), приблизительно 0,015% (мас./об.), приблизительно 0,02% (мас./об.), приблизительно 0,025% (мас./об.), приблизительно 0,03% (мас./об.), приблизительно 0,035% (мас./об.), приблизительно 0,04% (мас./об.), приблизительно 0,045% (мас./об.), приблизительно 0,05% (мас./об.), приблизительно 0,055% (мас./об.), приблизительно 0,06% (мас./об.), приблизительно 0,065% (мас./об.), приблизительно 0,07% (мас./об.), приблизительно 0,075% (мас./об.), приблизительно 0,08% (мас./об.), приблизительно 0,085% (мас./об.), приблизительно 0,09% (мас./об.), приблизительно 0,095% (мас./об.), приблизительно 0,1% (мас./об.), приблизительно 0,15% (мас./об.), приблизительно 0,2% (мас./об.), приблизительно 0,25% (мас./об.), 0,3% (мас./об.), приблизительно 0,35% (мас./об.), приблизительно 0,4% (мас./об.), приблизительно 0,45% (мас./об.), приблизительно 0,5% (мас./об.), приблизительно 0,55% (мас./об.), приблизительно 0,6% (мас./об.), приблизительно 0,65% (мас./об.), приблизительно 0,7% (мас./об.), приблизительно 0,75% (мас./об.), приблизительно 0,8% (мас./об.), приблизительно 0,85% (мас./об.), приблизительно на 0,9% (мас./об.), приблизительно 0,95% (мас./об.) или приблизительно 1,0% (мас./об.) циклоспорина А формы 2.
Способы лечения
Составы по изобретению могут быть применены для лечения любого состояния глаза, для которого известно, что оно подлежит местному лечению циклоспорином А (например, с помощью Restasis®) в упомянутых здесь концентрациях. Например, фармацевтические составы изобретения могут быть применены для лечения пациентов, страдающих от синдрома сухого глаза, для лечения блефарита и болезни мейбомиевой железы, для восстановления чувствительности роговицы поврежденной из-за рефрактивной хирургии глаз, для лечения аллергического конъюнктивита и атопического кератоконъюнктивита, для лечения птеригия, воспаления конъюнктивы и роговицы, кератоконъюнктивита, реакции "трансплантат против хозяина", пост-трансплантационной глаукомы, трансплантации роговицы, грибкового кератита, поверхностного точечного кератита Тиджэсона, среди прочих состояний.
Международный Симпозиум Сухого Глаза (ССГ) определяет сухой глаз как "многофакторное заболевание слез и глазной поверхности, проявляющееся симптомами неприятного ощущения, нарушения зрения, и нестабильности слезной пленки с потенциальным повреждением глазной поверхности, сопровождающееся повышением осмотлярности слезной пленки и воспалением глазной поверхности". Оно включает такие состояния, как, например, сухой кератоконъюнктивит, вызванный дефицитом слез или черезмерным испарением слез.
Блефарит является хроническим расстройством вызывающим воспаление переднего и заднего края века, с вовлечением кожи и относящихся к ней структур (волос и сальных желез), слизисто-кожного соединения и мейбомиевых желез. Он также может влиять на конъюнктиву, слезную пленку и поверхность роговицы на последних стадиях и может быть связан с сухим глазом. Блефарит обычно классифицируют как передний или задний блефарит, при этом передний поражает участок век, несущий ресницы, а задний главным образом поражает устья мейбомиевых желез.
Заболевание мейбомиевых желез наиболее часто встречается в одной из трех форм: первичный мейбомит, вторичный мейбомит и мейбомиевая себорея. Мейбомиевая себорея характеризуется избыточной секрецией мейбомиевых желез при отсутствии воспаления (гиперсекреторное заболевание мейбомиевых желез). Первичный мейбомит в отличие распознается по застойной и сгущенной секреции мейбомиевых желез(обструктивное гиперсекреторное заболевание мейбомиевой железы). Вторичный мейбомит представляет локализованный воспалительный ответ, в котором мейбомиевы железы вторично воспалены неоднородным образом из-за переднего блефарита прилегающего века.
Ослабленная чувствительность роговицы часто случается после рефрактивной хирургии, такой как субэпителиальный лазерный кератомилез (СКПЛ), ЭПИ-СКПЛ, индивидуальная трансэпителиальная бесконтактная абляция или другие процедуры, в которых перерезаются роговичные нервы. Ослабленная чувствительность роговицы может также произойти после вирусной инфекции, вызванной HSV-1, HSV-2 и VZV вирусами. Пациенты с ослабленной роговичной чувствительностью часто жалуются на ощущение сухости глаз, даже если выработка и испарение слез могут быть в норме, означая, что «сухость» у таких пациентов в действительности является формой роговичной невропатии, возникающей, когда роговичные нервы перерезаются хирургически или воспалены после вирусной инфекции.
Аллергический конъюнктивит является воспалением конъюнктивы в результате гиперчувствительности к одному или нескольким аллергенам. Он может быть острым, периодическим, или хроническим. Он случается сезонно, то есть только в определенное время года, или постоянно, то есть хронически на протяжении всего года. Симптомы сезонного и постоянного аллергического конъюнктивита в дополнение к воспалению конъюктивы включают слезотечение, слезоотделение, конъюнктивно васкулярное растяжение, зуд, папиллярная гиперплазия, хемоз, отек века и выделение из глаза. Выделение может образовывать корку вокруг глаз после ночного сна.
Атопический конъюнктивит является хронической, тяжелой формой аллергических конъюнктивитов, что часто приводит к ослаблению зрения. Симптомы включают зуд, ощущение жжения, боль, покраснение, ощущение инородного тела, световую чувствительность и расплывчатое зрение. Часто имеют место выделения, особенно при пробуждении после ночного сна; выделения могут быть вязкими, липкими и слизистыми. Нижняя конъюнктива часто сильнее поражена, чем верхняя конъюнктива. Конъюнктива может изменяться в диапазоне от бледной, отечной и не имеющей особенностей до имеющей характеристики прогрессирования болезни, включая папиллярную гипертрофию, субэпителиальный фиброз, укорочение свода, трихиаз, заворот века и мадароз. У некоторых пациентов заболевание прогрессирует до точечных эпителиальных эрозий, роговичной неоваскуляризации и других проявлений поражения роговицы, которые могут ухудшать зрение. Обычно присутствует разрастание бокаловидных клеток в конъюнктиве, образование псевдотубулярного эпителия и повышенное количество дегранулирующих эозинофилов и мастоцитов в эпителии. Количество CD25+T лимфоциты, макрофаги, дендритные клетки (HLA-DR.sup.+, HLA-CD1+) значительно увеличено в собственном веществе.
Как атопический конъюнктивит, весенний конъюнктивит является тяжелой формой аллергического конъюнктивита, но он, как правило, сильнее затрагивает верхнюю конъюнктиву, чем нижнюю. Он проявляется в двух формах. В пальпебральной форме присутствуют квадратные, твердые, жесткие, сплюснутые, тесно упакованные сосочки; в бульбарной (краевой) форме, окружающая конъюнктива становится гипертрофированной и сероватой. Обе формы часто сопровождаются слизистыми выделениями. Может произойти потеря эпителия роговицы, сопровождающаяся болью и светобоязнью, а также могут появиться бляшки в центральных отделах роговицы и точки Трантаса.
Применение
Составы изобретения вводят в субконъюнктивальное пространство. Как заявляется в настоящем документе "субконъюнктивальное пространство" указывает на любое из следующего: (1) потенциальное пространство между бульбарной конъюнктивой и теноновой капсулой и простирающееся от лимба до свода; (2) потенциальное пространство между бульбарной конъюнктивой и хрящом века и простирающееся от края глазного века (слизисто-кожная соединение глазного века) до свода; и (3) потенциальное пространство сразу ниже конъюнктивы свода на соединительном участке или своде.
Ссылаясь на фиг. 5, субконъюнктивальное пространство вокруг глаза может быть поделено на 4 квадранта: верхний, назальный, нижний, височный. Эти квадранты могут быть в дальнейшем подразделены на субквадранты, такие как верхневисочный, верхненазальный, нижний назальный, нижний височный и так далее. Следовательно, составы по изобретению можно вводить, например, в верхневисочный квадрант бульбарного субконъюнктивного пространства, в любой, один или несколько нижний, верхний, назальный, или височный квадрант бульбарного, пальпебрального, или относящегося к своду, субконъюнктивального пространства, или к верхневисочному, верхненазальному, нижнему височному, или нижнему назальному, бульбарному, пальпебральному, относящемуся к своду субконъюнктивальному пространству (фиг. 6 и 7). Поэтому, если в дальнейшем указано иное, введение в «субконъюнктивальное пространство» глаза указывает на применение к бульбарному, пальпебральному, и/или относящемуся к своду, субконъюнктивальному пространству в глазу, в любом одном или более из четырех квадрантов глаза (верхнему, назальному, височному и нижнему), или любому одному или более из субквадрантов глаза, включая верхневисочный, верхненазальный, нижний височный, нижний назальный участки бульбарного, пальпебрального, или относящегося к своду субконъюнктивнальных пространств.
В одном из вариантов реализации применение составов изобретения исключает их местную доставку (такую как с помощью глазных капель) на поверхности роговицы, в то время, как субконъюнктивальное пространство не включает какого-либо участка или пространства непосредственно над, под или внутри роговицы. В другом варианте реализации изобретения введение в субконъюнктивальное пространство в дальнейшем исключает способ доставки, который проходит сквозь или перфорирует Тенонову капсулу или белочную оболочку, который проходит сквозь или распространяется через белочную оболочку в стекловидное тело, или тот, которым доставляется под белочную оболочку. «Субконъюнктивальное пространство», как применено в настоящем документе, не эквивалентно "суб-тенононову пространству". Тенонова капсула является тонкой, волокнистой, несколько эластичной мембраной, ниже конъюнктивы, которая огибает глазное яблоко от края роговицы (лимб) до зрительного нерва. Она прикреплена свободно к белочной оболочке. Таким образом, суб-теноново пространство находится между Теноновой капсулой и белочной оболочкой. Суб-теноново введение какого-либо фармацевтического состава в глаз, как правило, включает в себя подъем как конъюнктивы, так и теноновой капсулы. Игла и шприц могут использоваться, чтобы проколоть тенонову капсулу и ввести при помощи инъекции фармацевтический состав в суб-теноново пространство.
В одном из вариантов реализации приспособлением для введения составов в соответствии с изобретением в субконъюнктивальное пространство глаза является шприц, оснащенный иглой или канюлей. Игла или канюля, используемая для введения офтальмологического фармацевтического состава в субконъюнктивальное пространство глаза, может быть 20 калибра или более высокого калибра игла или канюля. Игла или канюля может иметь округленный или срезанный конец. В предпочтительных вариантах реализации калибр иглы или канюли, примененный в этом способе, является иглой или канюлей калибра 25 или более высокого, или конкретно иглой или канюлей калибра 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, или 34.
В одном из вариантов реализации настоящего способа лечения воспаления поверхности глаза или воспаления смежных с глазной поверхностью органов у какого-либо субъекта, если требуется, состав изобретения, вводится в субконъюнктивальное пространство глаза (т.е. применяется) в соответствии со следующей процедурой. По отношению к субъекту, расположенному лицом к практикующему врачу, практикующий врач использует большой палец (или приспособление, например пинцет), чтобы оттянуть верхнее или нижнее веко глаза в зависимости от того, должна ли иметь место инъекция в субконъюнктивальное пространство в верхний (например, верхневисочный) или нижний квадранты соответственно (см. фиг. 2, для примера). С помощью другой руки практикующий врач позиционирует иглу (присоединенную к шприцу, содержащему фармацевтический состав) тангенциально к глазному яблоку так, чтобы срез иглы располагался навстречу к глазному яблоку (т.е. чтобы срез иглы располагался к низу). В некоторых примерах может быть предпочтительно ориентировать иглу срезом,расположенным к вверху (т.е. от глазного яблока). Удерживая иглу тангенциально к глазному яблоку и используя мягкое колющее движение, практикующий врач затем направляет иглу сзади сразу ниже конъюнктивы, чтобы ввести иглу в субконъюнктивальное пространство. Требуемый объем фармацевтического состава затем вводится в субконъюнктивальное пространство.
В зависимости от вводимого объема фармацевтический состав может проявиться как возвышение или небольшой бугорок в конъюнктиве. Затем иглу вынимают. В дальнейшем к глазу может быть применено надавливание при помощи марлевого тампона, чтобы помочь распределить и рассеять фармацевтический состав и пресечь возможное кровотечение.
В некоторых вариантах реализации такая же процедура может быть применена для введения анестетика в субконъюнктивальное пространство глаза перед введением составов по изобретению. Анестезирующий раствор может проявляться как возвышение или бугорок в конъюнктиве. Если эта процедура соблюдена, и как только анестетик подействовал, тогда фармацевтический состав вводится в возвышенный участок конъюнктивы, но со стороны другой, чем та, которая использовалась для введения анестетика. В некоторых вариантах реализации дополнительные дозы составов изобретения могут вводиться в назальное и/или нижнее (например, нижнее относящиеся к своду) субконъюнктивальное пространство с применением такой же процедуры, изложенной выше.
В качестве альтернативы глазной анестетик может быть применен местно к одному или обоим глазам перед введением состава в субконъюнктивальное пространство глаза. Анальгетические средства могут применяться после субконъюнктивального применения фармацевтического состава. Анальгетические средства включают тройную антибиотиковую мазь или атропиновые капли или мазь.
ПРИМЕРЫ
Изобретение далее продемонстировано на следующих примерах. Работа изобретателей предполагает, что биологически разлагаемые имплантаты будучи доставленными через иглу 22 калибра не доставляют достаточного количества лекарства в течение достаточного периода времени для эффективного лечения состояний глаза, для которых назначается циклоспорин для местного применения или для которых он является известным как эффективный при лечении.
Изобретатели приготавливали следующие составы и вводили их в глаза кроликов.


В таблице использованы следующие условные обозначения:
CsA: циклоспорин А формы 2
R100: Regel® 100
RB (5 мг): Regel® В (при дозе 5 мг CsA на глаз)
P1L (0,5 мг): Прототип 1, низкая доза (при дозе 0,5 мг CsA на глаз)
Р1Н: Прототип 1, высокая доза
P2L: Прототип 2, низкая доза
Р2Н: Прототип 2, высокая доза
P3L: Прототип 3, низкая доза
Р3Н: Прототип 3, высокая доза
НА: гиалуроновая кислота
CMC: карбоксиметилцеллюлоза
НРМС: Гидроксипропилметилцеллюлоза
PVP: Поливинилпирролидон
TBD: подлежит определению
NC: не собирали
Прототипы представляют собой имплантаты, ранее исследованные в качестве потенциально пригодных составов. Данные этих исследований приведены в таблице ниже.
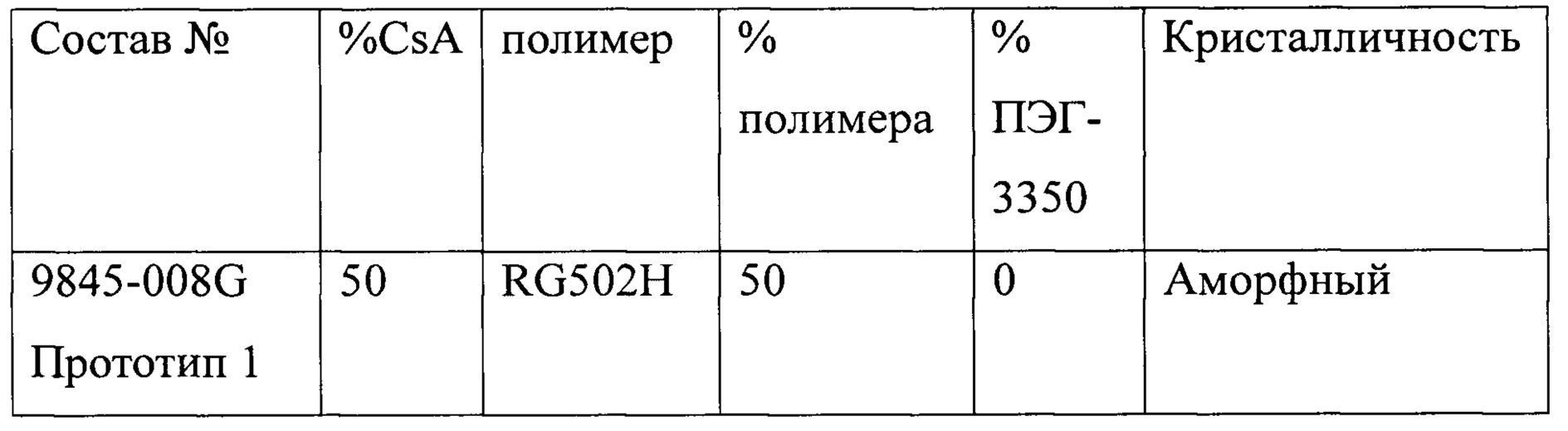
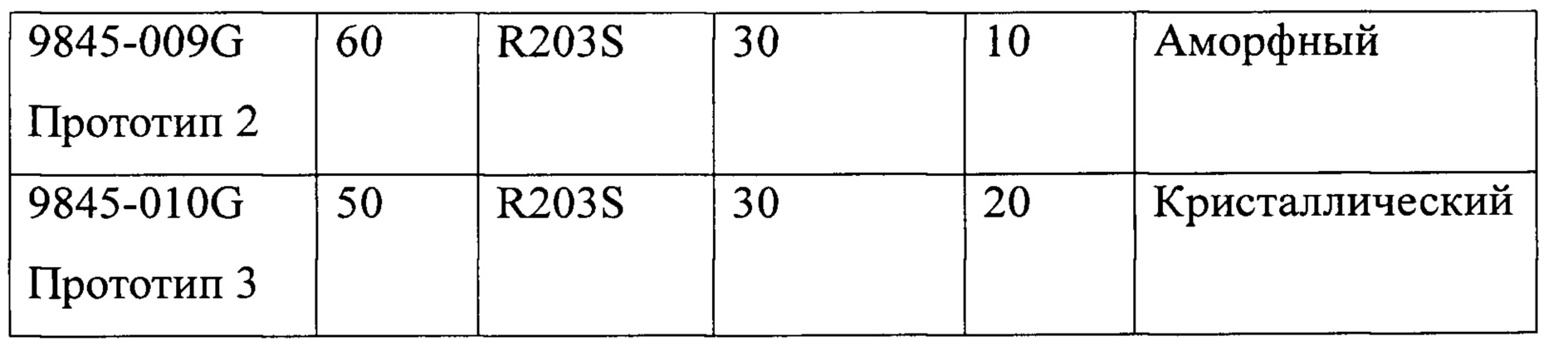
Где:
ПЭГ-3350 = полиэтиленгликоль с молекулярной массой 3350
RG502H = Resomer® RG 502 Н, поли(D,L-лактид-ко-гликолид)
R203S = Resomer® R 203 S, поли(D,L-лактид).
Реферат
Группа изобретений относится к области медицины и представляет собой офтальмологический состав, содержащий циклоспорин А формы 2 и какой-либо гидрогель, где циклоспорин А формы 2 характеризуется следующими пиками при сканировании рентгеновским дифрактометром с излучением Cu Кα, 2θ: 7,5, 8,8, 10,2, 11,3, 12,7, 13,8, 14,5, 15,6 и 17,5; а также способ лечения состояния, выбранного из: сидром сухого глаза, блефарит, заболевание мейбомиевой железы, нарушение чувствительности роговицы, аллегрический конъюнктивит, атопический кератоконънюктивит и птеригия, включающий этап применения к пациенту, имеющему такое состояние, указанного состава. 2 н. и 4 з.п. ф-лы, 8 ил., 3 табл., 1 пр.

Комментарии