Взвеси циклоспорина а формы 2 - RU2641963C2
Код документа: RU2641963C2
Чертежи












Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Эта заявка на патент заявляет приоритет предварительной заявки на патент США No. 61/559 866, поданной 15 ноября 2011 года полное содержание которой, включено в этот документ в виде ссылок.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ.
Это изобретение относится к областям нанотехнологии и технологии лекарственных средств.
УРОВЕНЬ ТЕХНИКИ
Циклоспорин A является активным агентом в Restasis®, лекарственном препарате используемом для лечения синдрома "сухого глаза". Циклоспорин A - мало растворим в воде, и поэтому, в настоящее время в фармацевтические составы его вводят, либо путем растворения лекарственной субстанции в масле, чтобы образовалась эмульсия, либо путем смешивания лекарственной субстанции с значительными количествами поверхностно-активных веществ и/или солюбилизаторов, чтобы образовался водный раствор. Изобретатели, изобрели, состав циклоспорина A, использующий новый кристаллический полиморф циклоспорина A, образующий нановзвеси, содержащие частицы циклоспорина со средним размером частиц около 1 микрометра или меньшим (для того, чтобы это число можно было себе представить, средняя толщина человеческого волоса около 100 микрометров).
Нановзвесь циклоспорина A, при доставке местно к глазу, может иметь одно или несколько преимуществ, включая следующие:
- более высокую биодоступность, по сравнению с взвесями, из-за большей площади поверхности при растворении;
- Более длительно удерживаться на глазе благодаря мелким частицам, что ведет к дальнейшему улучшению биодоступности;
- сниженное напряжение при ощущении постороннего тела, или раздражение частицами, тем самым уменьшенное слезотечение и дренаж составов из глаза;
- сниженное содержание поверхностно-активных веществ или солюбилизаторов в составе, улучшающее переносимость и биодоступность.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1 иллюстрирует распределение частиц циклоспорина A Формы 2 по размерам в нановзвесьях, приготовленных с помощью гомогенизатора высокого давления, по сравнению с взвесями предварительного размельчения.
Фигура 2 иллюстрирует распределение частиц циклоспорина A Формы 2 по размерам в нановзвесях, приготовленных с использованием различных поверхностно-активных веществ или стабилизаторов.
Фигура 3 иллюстрирует распределение частиц по размерам Состава разбавленного в среде содержащей Na КМЦ.
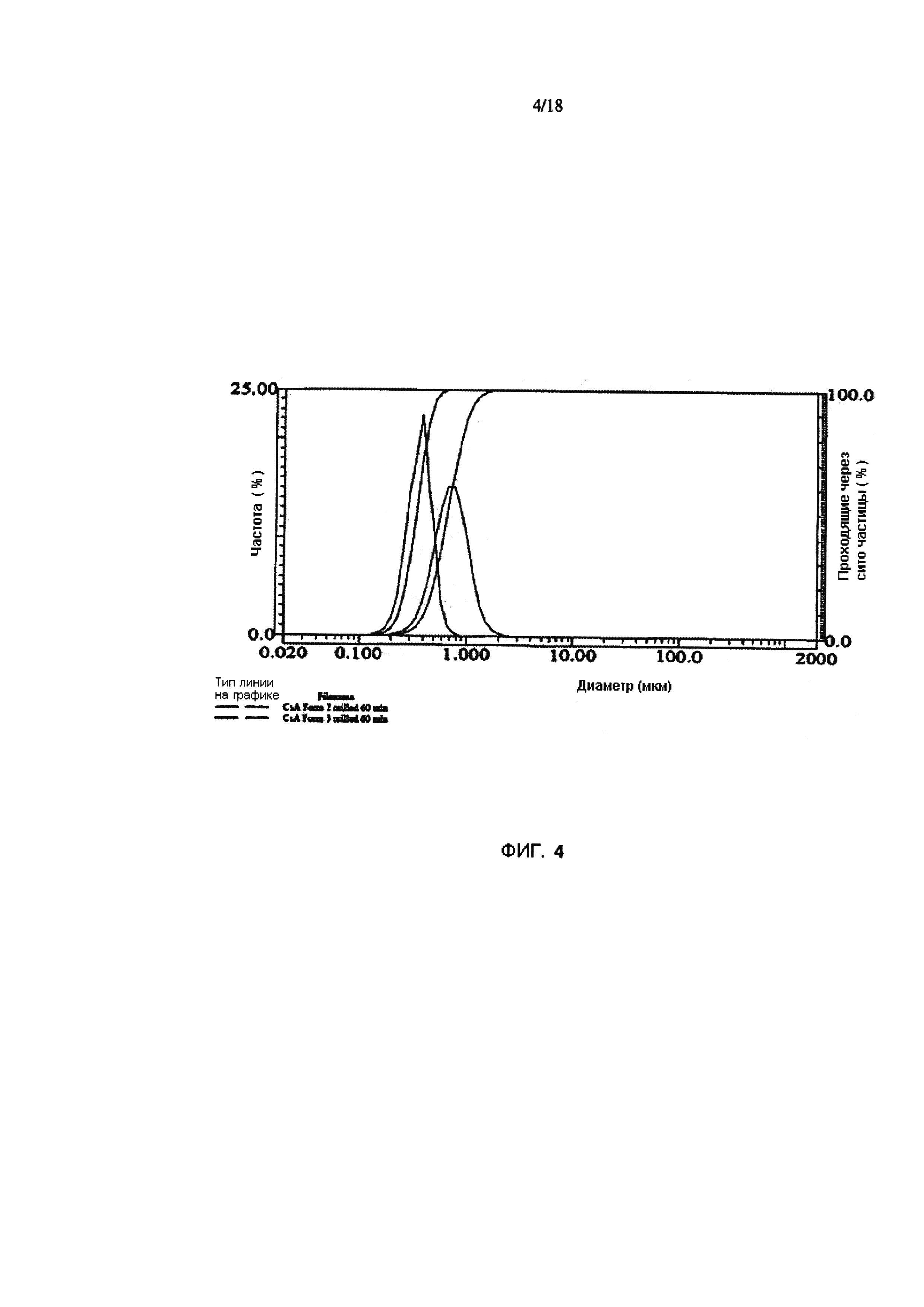
Фигура 4 иллюстрирует средний размер частиц нановзвеси из циклоспорина A Формы 3, по по сравнению с нановзвесью, использующей Форму 2 после размельчения с помощью микрофлюидизатора. Форма 2 образует нановзвесь (размер частиц <1 мкм), в то время, как Форма 3 не образует.
Фигуры 5-13 иллюстрируют результаты, когда четыре различные состава в соответствии с изобретением (подитоженные в таблице 2) и Restasis® применяются на самках NZW (породы Ново Зеландских) кроликов (всего два кролика, по одному составу в глаз) в единичной дозе местного применения:
Фигура 5 иллюстрирует концентрации в роговице.
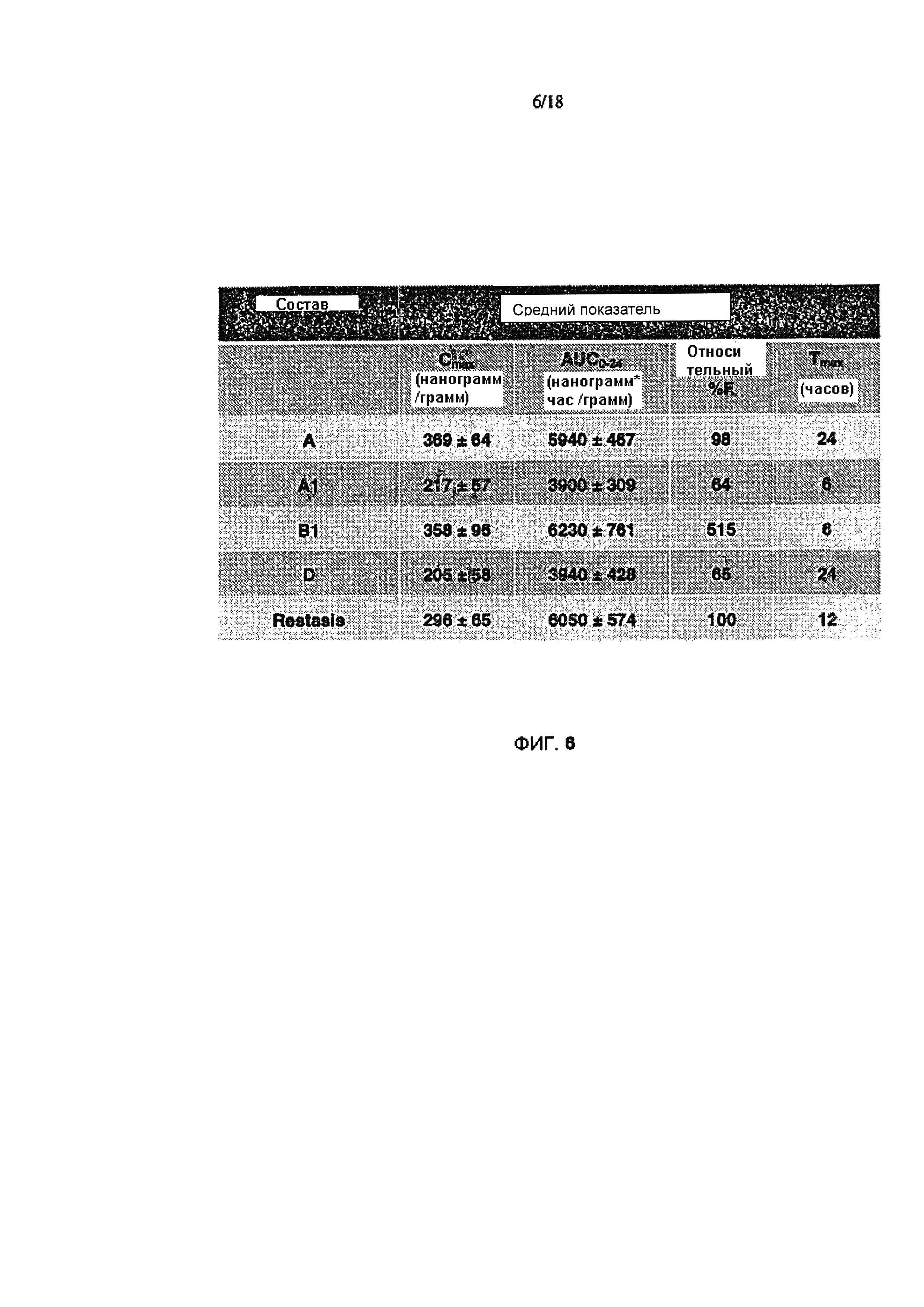
Фигура 6 подитоживает данные фармакокинетики.
Фигура 7 иллюстрирует концентрации в бульбарной конъюктиве.
Фигура 8 иллюстрирует концентрации в пальпебральной конъюктиве.
Фигура 9 подитоживает данные фармакокинетики для бульбарной конъюктивы и пальпебральной конъюктивы.
Фигура 10 иллюстрирует концентрации в бульбарной конъюктиве.
Фигура 11 иллюстрирует концентрации в пальпебральной конъюктиве.
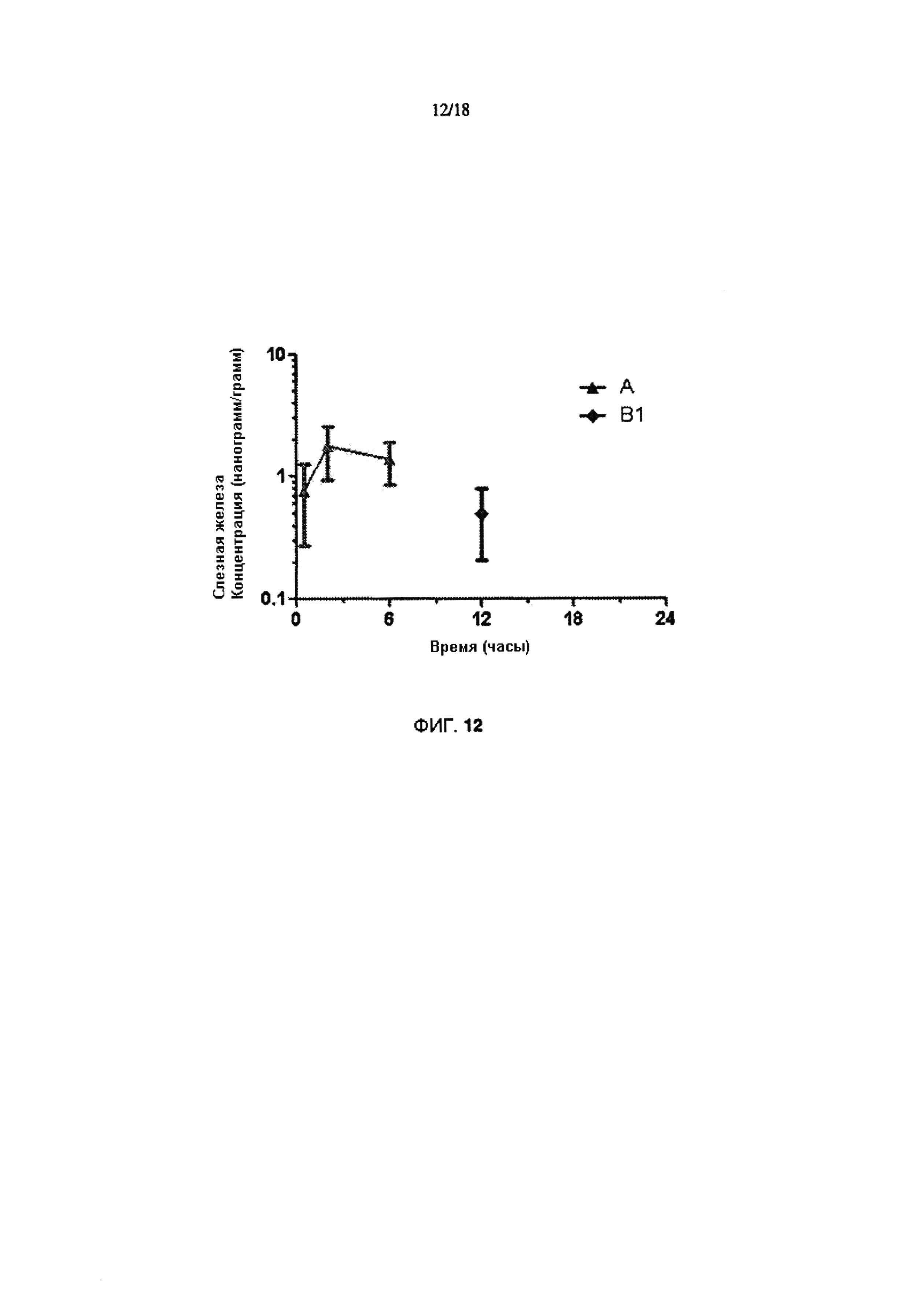
Фигура 12 иллюстрирует концентрации в слезной железе.
Фигура 13 подитоживает данные фармакокинетики для слезной железы.
Фигура 14 иллюстрирует характеристики диаграмм рентгеновской порошковой дифракции (РПД) CsA в новой кристаллической форме (называемой Формой 2 в настоящем документе), в тетрагональной форме (называемой Формой 1 в настоящем документе), и в орторомбической форме (называемой Формой 3 в настоящем документе).
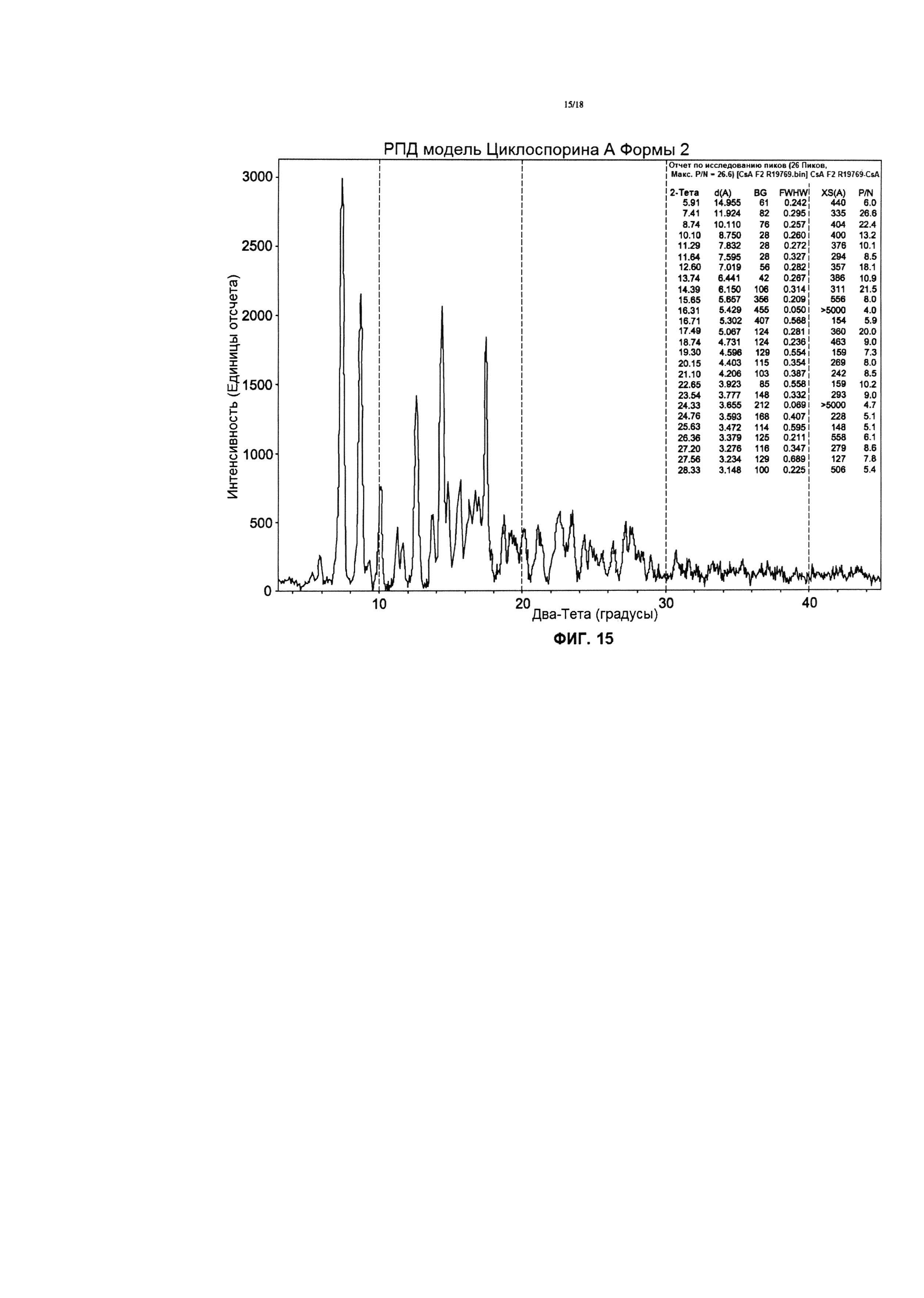
Фигура 15 иллюстрирует РПД дифрактограмму CsA кристаллической Формы 2.
Фигура 16 иллюстрирует характеристику сорбции/десорбции воды для CsA Формы 2.
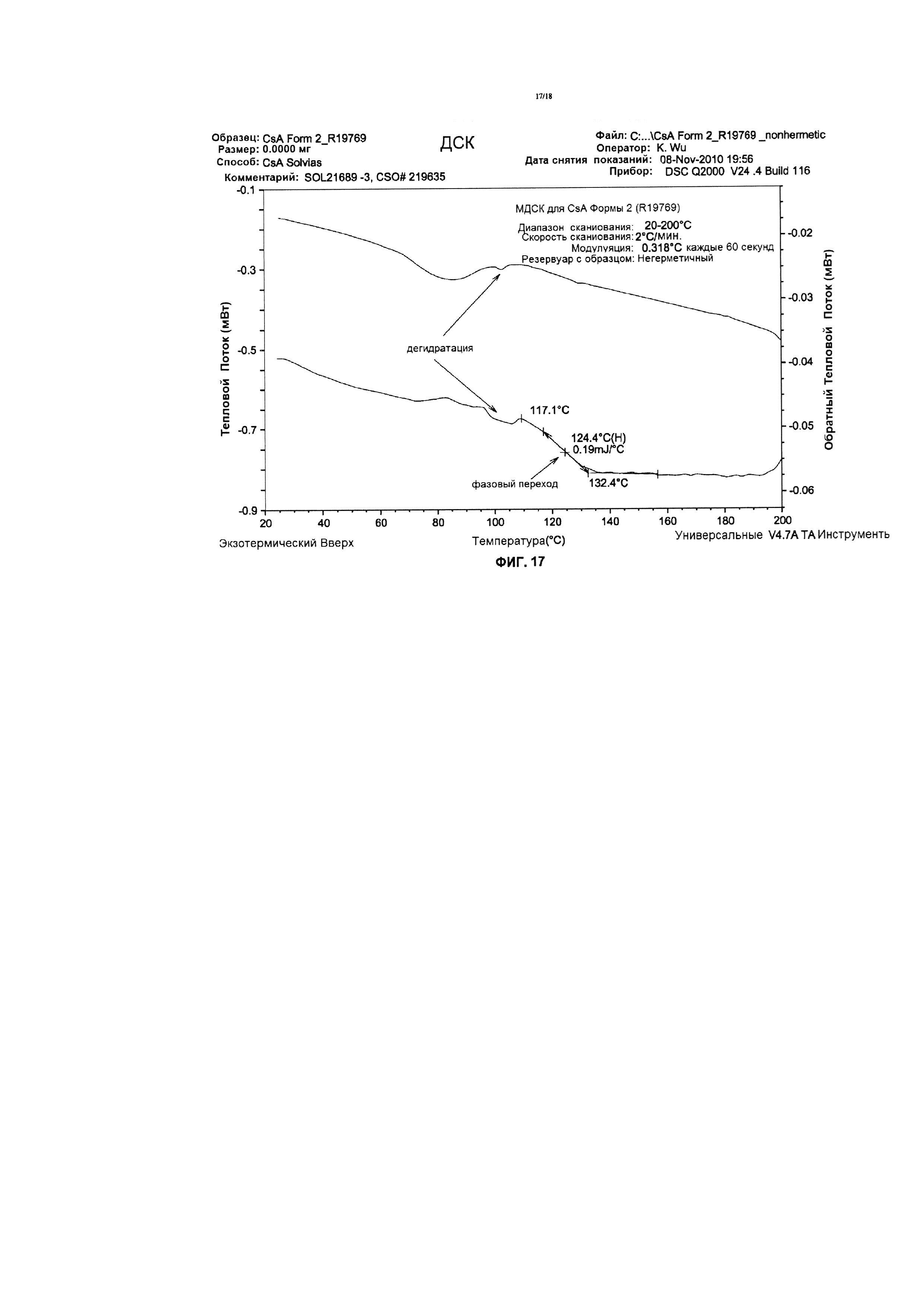
Фигура 17 иллюстрирует анализ МДСК CsA Формы 2, извлеченного из 0,04% состава, с 1% PS80.
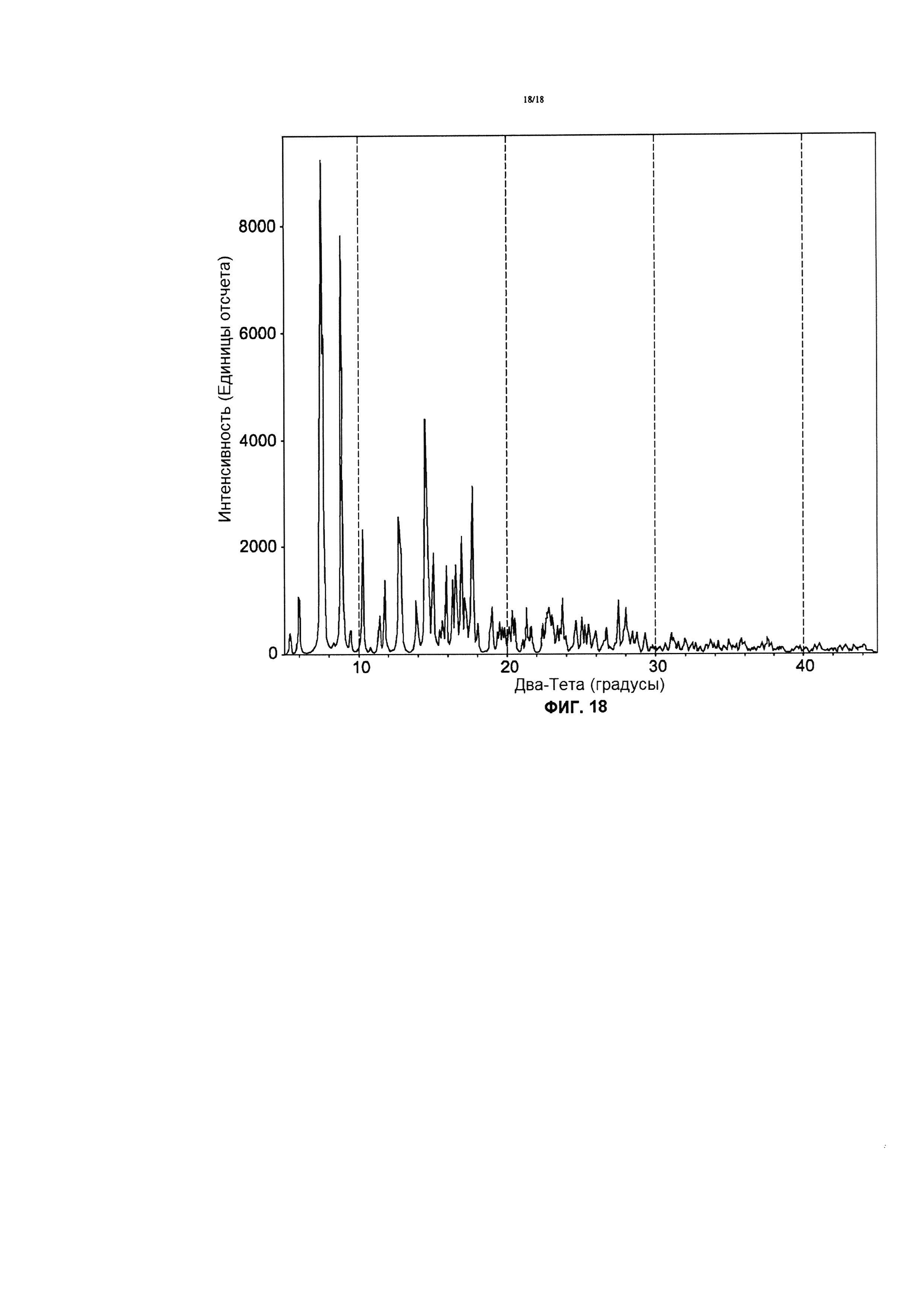
Фигура 18 иллюстрирует воспроизведенную диаграмму РПД образованную циклоспорином A.
ПОДРОБНОЕ ОПИСАНИЕ
Циклоспорин A
Циклоспорин A (CsA) является циклическим пептидом, имеющим следующую химическую структуру:

Его химическое название: цикло[[(E)-(2S,3R,4R)-3-гидрокси-4-метил-2-(метиламино)-6-октеноил]-L-2-аминобутирил-N-метилглицил-N-метил-L-лейцил-L-валил-N-метил-L-лейцил-L-аланил-D-аланил-N-метил-L-лейцил-N-метил-L-лейцил-N-метил-L-валил]. Он, также, известен под названиями: «cyclosporine», «cyclosporine A», «ciclosporin», и «ciclosporin А». Он является активным агентом в Restasis® (Allergan, Inc., Ирвин, штат Калифорния), эмульсии, содержащей 0,05% (масса/объем) циклоспорина. Restasis® одобрен в Соединенных Штатах для увеличения выработки слез у пациентов, чье слезовыделение предполагается подавленным из-за глазного воспаления, связанного с высушивающим кератоконъюнктивитом.
Циклоспорин A формы 2
Известно, что Циклоспорин A существует в аморфной форме, в форме жидкого кристалла, тетрагональной кристаллической форме (форма 1), и орторомбической форме (форма 3). Недавно обнаружена новая кристаллическая форма - циклоспорин A формы 2.
РПД диаграмма CsA Формы 2 значительно отличается от тетрагональной формы и орторомбической формы (ФИГ. 14). Главные кристаллические пики для CsA формы 2 появляются в (2θ) при сканировании рентгеновским дифрактометром с таким источником рентгеновского излучения, как излучение Cu Kα, λ=1,54 Å, при 30 кВ /15 мА: 7.5, 8.8, 10.2, 11.3, 12.7, 13.8, 14.5, 15.6 и 17,5 (d-расстояние в кристаллической решетке примерно 11.8, 10.0, 8.7, 7.8, 7.0, 6.4, 6.1, 5.6 и 5.1 - Å, соответственно, Фиг. 15). Эти главные пики, определяются, как уникальные для Формы 2, по отношению к орторомбической, или тетрагональной формам; а также пики с интенсивностью, превышающей фон более чем в 5 раз.
В одном из вариантов реализации, новая кристаллическая форма (Форма 2) CsA является нестехиометрическим гидратом Циклоспорина A. В другом варианте реализации, кристаллическая Форма 2 представлена следующей формулой:
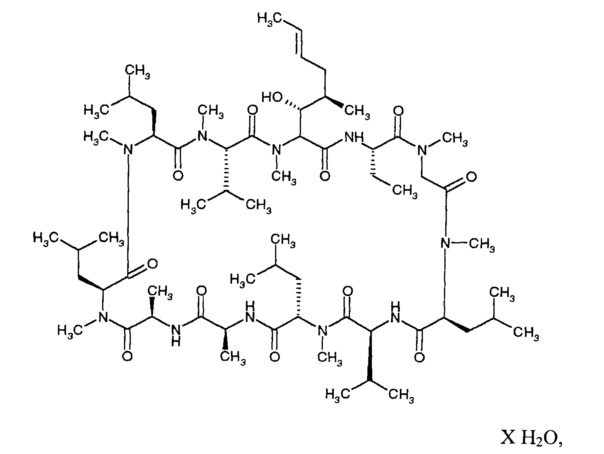
где X это - количество молекул воды, варьирующееся в диапазоне от 0 до 3. В одном из вариантов реализации, X в формуле представляет собой 2.
Форма 2, оказывается кинетически стабильной формой CsA в водных взвесях. Взвеси, содержащие Форму 2, не проявляют превращения в другие известные полиморфные или псевдо морфные формы при хранении. Было установлено, что Форма 1 и аморфная форма превращаются в Форму 2 в присутствии воды.
Определена структура одиночного кристалла гидратной формы CsA Формы 2 и параметры этой кристаллической структуры перечислены в Таблице 2. Эти результаты свидетельствуют о том, что Форма 2 является уникальной, по сравнению с другими известными кристаллическими формами Циклоспорина A.



Асимметричная элементарная ячейка CsA Формы 2 содержит одну молекулу циклоспорина A и две молекулы воды. Возможно, что любые маленькие молекулы, способные образовывать водородную связь с водой, могут играть роль заполнителя объема, что дало бы целый ряд потенциальных структур, начиная от орторомбического дигидрата до искаженного моноклинного дигидрата. РПД диаграмма, рассчитанная из монокристаллической структуры, проиллюстрирована на Фигуре 8 и она соответствует экспериментальной диаграмме проиллюстрированной на Фигуре 2. Эти сопоставляющиеся диаграммы в дальнейшем подтверждают, что Форма 2 является уникальной и чистой кристаллической формой циклоспорина A.
Без ограничения теорией, термогравиметрический анализ, в сочетании с титрованием KF и анализом сорбции десорбции пара (СДП), позволяют предположить, что CsA Формы 2 - является нестехиометрическим гидратом и CsA. Анализ сорбции пара для Циклоспорина Формы 2 показывает, что содержание воды в новой кристаллической форме обратимо зависит от относительной влажности, как проиллюстрировано на Фиг. 16. Аналогично, с тетрагональной формой, эта новая форма CsA подвержена фазовому переходу к жидкому кристаллу, или аморфной форме при 124,4°C перед расплавлением, как проиллюстрировано модулированным дифференциальным калориметрическим анализом (МДСК) (Фигура 17).
Циклоспорин формы 2 может быть получен путем перевода во взвешенное состояние аморфного 0,05% циклоспорина A (масса/объем) в 1% Полисорбате 80, при нагревании раствора до 65°C, выдерживанием его при такой температуре в течение 24 часов, и последующим выделением преципитата вакуумной фильтрацией. В дальнейшем можно использовать этот циклоспорин A Формы 2, полученный таким способом, чтобы вырастить дополнительные количества, используя Циклоспорин A Формы 2 в качестве затравочного кристалла; в этом способе, во взвешенное состояние переводят около 30 г циклоспорина A в раствор 900 мл воды, содержащий 1% (масса/объем) Полисорбата 80, нагревают этот раствор до 65°C, а затем вносят затравку 0,2 г циклоспорина A Формы 2 при температуре 52°C. В дальнейшем этот раствор перемешивают около 22 часов при температуре в пределах от 61°C до 65°C, а затем выделяют образовавшийся преципитат.
Более подробные сведения относящиеся к CsA формы 2, могут быть найдены в Заявке США No. 13/480 710, полное содержимое которой включено в настоящий документ в виде ссылки.
Взвеси Циклоспорина A формы 2
Составы изобретения являются офтальмологически приемлемыми составами Циклоспорина A формы 2. Под "офтальмологически приемлемыми", изобретатели подразумевают, что взвеси приготавливаются таким способом, чтобы быть нераздражающими применительно к глазу млекопитающего, такого, как человек. В одном варианте реализации, фармацевтические составы являются взвесями; то есть, они состоят из частиц циклоспорина A формы 2, со средним размером частиц несколько большим, чем около 1 мкм, диспергированных в жидкой среде. В другом варианте реализации, фармацевтические составы являются нановзвесями; то есть, они состоят из частиц циклоспорина A формы 2, со средним размером частиц несколько меньшим, чем около 1 мкм, диспергированных в жидкой среде. В одном варианте реализации, взвесь содержит циклоспорин A формы 2 с концентрацией от около 0,001% до около 10% (масса/объем). В одном варианте реализации, взвесь содержит циклоспорин A формы 2 с концентрацией от приблизительно 0,001% (масса/объем) до около 0,01%, от около 0,001% (масса/объем) до около 0,04% (масса/объем), от около 0,001% (масса/объем) до около 0,03% (масса/объем), от около 0,001% (масса/объем) до около 0,02% (масса/объем), или от около 0,001% (масса/объем) до около 0,01% (масса/объем). В другом варианте реализации, взвесь содержит циклоспорин A формы 2 с концентрацией от около 0,01% (масса/объем) до около 0,05%, от около 0,01% (масса/объем) до около 0,04% (масса/объем), от около 0,01% (масса/объем) до около 0,03% (масса/объем), от около 0,01% (масса/объем) до около 0,02% (масса/объем), или от около 0,01% (масса/объем) до около 0,01% (масса/объем).
В другом варианте реализации, взвесь содержит циклоспорин A формы 2 с концентрацией от около 0,01% (масса/объем) до около 0,1%, от около 0,1% (масса/объем) до около 0,5% (масса/объем), от около 0,01% (масса/объем) до около 1% (масса/объем), или от около 1% (масса/объем) до около 10%.
Например, составы могут содержать около 0,001% (масса/объем), около 0,002% (масса/объем), около 0,003% (масса/объем), около 0,004% (масса/объем), около 0,005% (масса/объем), около 0,006% (масса/объем), около 0,007% (масса/объем), около 0,008% (масса/объем), около 0,009% (масса/объем), около 0,01% (масса/объем), около 0,015% (масса/объем), около 0,02% (масса/объем), около 0,025% (масса/объем), около 0,03% (масса/объем), около 0,035% (масса/объем), около 0,04% (масса/объем), около 0,045% (масса/объем), около 0,05% (масса/объем), около 0,055% (масса/объем), около 0,06% (масса/объем), около 0,065% (масса/объем), около 0,07% (масса/объем), около 0,075% (масса/объем), около 0,08% (масса/объем), около 0,085% (масса/объем), около 0,09% (масса/объем), около 0,095% (масса/объем), около 0,1% (масса/объем), около 0,15% (масса/объем), около 0,2% (масса/объем), около 0,25% (масса/объем), 0,3% (масса/объем), около 0,35% (масса/объем), около 0,4% (масса/объем), около 0,45% (масса/объем), около 0,5% (масса/объем), около 0,55% (масса/объем), около 0,6% (масса/объем), около 0,65% (масса/объем), около 0,7% (масса/объем), около 0,75% (масса/объем), около 0,8% (масса/объем), около 0,85% (масса/объем), около на 0,9% (масса/объем), около 0,95% (масса/объем), или около 1,0% (масса/объем) циклоспорина A формы 2.
В одном варианте реализации взвесь, содержит поверхностно-активное вещество. В одном варианте реализации, поверхностно-активное вещество, выбирают из полиоксиэтилена (20), сорбитана моноолеата (Polysorbate 80), полиэтилен гликоля 660, гидроксистеарата (Solutol), полиоксиэтилена (40) стеарата Myrj 52 (РОЕ-40-Stearate), Pluronic F68 (Polaxamer 188), полиоксиэтилена сорбитана монолаурата (Polysorbate 20), гликохолата натрия (NaGC). Среда может содержать все эти поверхностно-активные вещества, или один, два, три, четыре или пять из них.
Можно использовать в пределах от около 0,001% (масса/объем) до около 5% (масса/объем) поверхностно-активного вещества. В одном варианте реализации, взвеси содержат от около 0,001% (масса/объем) до около 1% (масса/объем), от около 0,001% (масса/объем) до около 0,1% (масса/объем), от около 0,01% (масса/объем) до около 0,1% (масса/объем), или от около 0,1% (масса/объем) до около 1% (масса/объем) поверхностно-активного вещества. Например, взвеси могут содержать около 0,001% (масса/объем), около 0,002% (масса/объем), около 0,003% (масса/объем), около 0,004% (масса/объем), около 0,005% (масса/объем), около 0,006% (масса/объем), около 0,007% (масса/объем), около 0,008% (масса/объем), около 0,009% (масса/объем), около 0,01% (масса/объем), около 0,02% (масса/объем), около 0,03% (масса/объем), около 0,04% (масса/объем), около 0,05% (масса/объем), около 0,06% (масса/объем), около 0,07% (масса/объем), около 0,08% (масса/объем), около 0,09% (масса/объем), около 0,1% (масса/объем), около 0,2% (масса/объем), 0,3% (масса/объем), около 0,4% (масса/объем), около 0,5% (масса/объем), около 0,6% (масса/объем), около 0,7% (масса/объем), около 0,8% (масса/объем), около 0,9% (масса/объем), около 1% (масса/объем), около 2% (масса/объем), около 3% (масса/объем), около 4% (масса/объем), или около 5% (масса/объем) поверхностно-активного вещества.
При использовании более, чем одного поверхностно-активного вещества, взвесь может содержать равные или различные количества каждого из них.
В дополнение к поверхностно-активным веществам, взвесь может содержать стабилизатор. В одном варианте реализации, стабилизатор, выбирают из гидроксипропилцеллюлозы, гидроксипропилметил целлюлозы, гидроксиэтилцеллюлозы, поливинилпирролидона, карбоксиметилцеллюлозы, Pemulen®, и Pemulen® TR-2. Pemulen® - являются торговыми названиями сополимеров акриловой кислоты и C10-С30 алкил акрилата с поперечными связями высокого молекулярного веса, производимые компанией Lubrizol Corp. Pemulen® TR-2 - является сополимером C10-30 алкил акрилата, содержащим большее количество гидрофобных групп, чем другие полимеры Pemulen®. Среда может содержать все эти стабилизаторы, или ни одного из них, или может содержать один, два, три, четыре или пять из них.
Можно использовать между около 0,01% (масса/объем) и около 10% (масса/объем) стабилизатора. В одном варианте реализации, взвеси содержат от около 0,01% (масса/объем) до 1% (масса/объем), или от около 0,01% (масса/объем) до 0,1% (масса/объем), или
от около 0,1% (масса/объем) до около 1% (масса/объем) стабилизатора. Например, в взвесь может содержать около 0,01% (масса/объем), около 0,02% (масса/объем), около 0,03% (масса/объем), около 0,04% (масса/объем), около 0,05% (масса/объем), около 0,06% (масса/объем), около 0,07% (масса/объем), около 0,08% (масса/объем), около 0,09% (масса/объем), около 0,1% (масса/объем), около 0,2% (масса/объем), около 0,3% (масса/объем), около 0,4% (масса/объем), около 0,5% (масса/объем), около 0,6% (масса/объем), около 0,7% (масса/объем), около 0,8% (масса/объем), около 0,9% (масса/объем), около 1% (масса/объем), около 2% (масса/объем), около 3% (масса/объем), около 4% (масса/объем), около 5% (масса/объем), около 6% (масса/объем), около 7% (масса/объем), около 8% (масса/объем), около 9% (масса/объем), или около 10% стабилизатора.
При использовании более чем одного поверхностно-активного вещества, взвесь может содержать равные или различные количества каждого из них.
В дополнение к поверхностно-активному веществу, среда может также содержать регулятор тоничности, выбираемый из глицерина, маннитола, дигидрата цитрата натрия, хлорида калия, борной кислоты, и декагидрата бората натрия. Регулятор тоничности прибавляют поскольку нужно достичь желаемого состояния; среда может содержать все эти регуляторы тоничности, или ни одного из них, либо она может содержать один, два, три, четыре или пять из них. В одном варианте реализации, регуляторы тоничности присутствуют в количестве находящемся в пределах от около 0,1% (масса/объем) до около 10% (масса/объем). При использовании более чем одного регулятора тоничности, взвесь может содержать равные или различные количества каждого из них.
Взвесь обычно содержит воду, в количестве, достаточном для того, чтобы обеспечить требуемое pH, тоничность и другие характеристики, которые делали бы взвесь пригодной для применения к глазу.
Способы приготовления взвесей циклоспорина A формы 2.
Составы этого изобретения могут быть приготовлены путем смешивания циклоспорина A формы 2 с соответствующими поверхностно-активными веществами, стабилизаторами и регуляторами тоничности, как описано выше, для образования взвеси. Если требуются мельчайшие частицы Циклоспорина A, то взвесь размельчают используя гомогенизатор высокого давления, например, доступный в продаже у производителя Microfluidics Int'l Corp. Ньютон, штат Массачусетс. Уникальное и удивительное свойство Циклоспорина A Формы 2, заключается в том, что его можно размельчить, если требуется, для получения взвеси с средним размером частиц (d90) менее 1 мкм. Циклоспорин A в такой нановзвеси имеет более высокую биодоступность, по сравнению с другими (макро) взвесями циклоспорина A, из-за большей площади поверхности доступной для растворения; биодоступность в дальнейшем улучшают, поскольку мелкие частицы позволяют Циклоспорину A оставаться в глазу дольше. Меньшие частицы нановзвесей приводят к тому, что для состава снижается вероятность вызывать ощущение постороннего тела, или другие раздражения воспринимаемые субъектом, когда состав закапывают в глаз.
Кроме того, поскольку частицы меньше, они лучше ассоциируют с поверхностно-активными веществам и стабилизаторами, что позволяет использовать их более низкие концентрации.
После того, как взвесь циклоспорина A формы 2 размельчена, ее разбавляют до получения конечного продукта.
Способы лечения
Составы по этому изобретению могут быть применены для лечения любого состояния глаза, для которого известно, что оно подлежит местному лечению циклоспорином A (например, с помощью Restasis®) в упомянутых здесь концентрациях. Например, фармацевтические составы этого изобретения могут быть применены для лечения пациентов, страдающих от синдрома сухого глаза, для лечения блефарита и болезни мейбомиевой железы, для восстановления чувствительности роговицы поврежденной из-за рефрактивной хирургии глаз, для лечения аллергического конъюнктивита, атопического кератоконъюнктивита и весеннего кератоконъюнктивита, для лечения птеригия, воспаления конъюнктивы и роговицы, кератоконъюнктивита, реакции "трансплантат против хозяина", посттрансплантационной глаукомы, трансплантации роговицы, грибкового кератита, поверхностного точечного кератита Тиджэсона, среди прочих состояний.
Международный Симпозиум Сухого Глаза (ССГ) определяет сухой глаз, как " многофакторное заболевание слез и глазной поверхности, проявляющееся симптомами неприятного ощущения, нарушения зрения, и нестабильности слезной пленки с потенциальным повреждением глазной поверхности, сопровождающееся повышением осмотлярности слезной пленки и воспалением глазной поверхности". Оно включает такие состояния, как например, сухой кератоконъюнктивит, вызванный дефицитом слез, или черезмерным испарением слез.
Блефарит является хроническим расстройством вызывающим воспаление переднего и заднего края века, с вовлечением кожи и относящихся к ней структур (волос и сальных желез), слизисто-кожного соединения, и мейбомиевых желез. Он также может влиять на конъюнктиву, слезную пленку, и поверхность роговицы на последних стадиях, и может быть связан с сухим глазом. Блефарит обычно классифицируют как передний или задний блефарит, при этом передний, поражает участок век, несущий ресницы, а задний, главным образом поражает устья мейбомиевых желез.
Заболевание мейбомиевых желез наиболее часто встречается в одной из трех форм: первичный мейбомит, вторичный мейбомит, и мейбомиевая себорея. Мейбомиевая себорея характеризуется избыточной секрецией мейбомиевых желез при отсутствии воспаления (гиперсекреторное заболевание мейбомиевых желез). Первичный мейбомит, в отличие, распознается по застойной и сгущенной секреции мейбомиевых желез(обструктивное гиперсекреторное заболевание мейбомиевой железы). Вторичный мейбомит, представляет локализованный воспалительный ответ, в котором мейбомиевы железы вторично воспалены неоднородным образом, из-за переднего блефарита прилегающего века.
Ослабленная чувствительность роговицы часто случается после рефрактивной хирургии, такой, как субэпителиальный лазерный кератомилез(СКПЛ), ЭПИ-СКПЛ, индивидуальная трансэпителиальная бесконтактная абляция, или другие процедуры, в которых перерезаются роговичные нервы. Ослабленная я чувствительность роговицы может также произойти после вирусной инфекции, вызванной HSV-1, HSV-2 и VZV вирусами. Пациенты с ослабленной роговичной чувствительностью часто жалуются на ощущение сухости глаз, даже если выработка и испарение слез могут быть в норме, означая, что «сухость» у таких пациентов в действительности является формой роговичной невропатии, возникающей, когда роговичные нервы перерезаются хирургически или воспалены после вирусной инфекции.
Аллергический конъюнктивит является воспалением конъюнктивы в результате гиперчувствительности к одному или нескольким аллергенам. Он может быть острым, периодическим, или хроническим. Он случается сезонно, то есть, только в определенное время года, или постоянно, то есть, хронически на протяжении всего года. Симптомы сезонного и постоянного аллергического конъюнктивита, в дополнение к воспалению конъюктивы включают слезотечение, слезоотделение, конъюнктивно васкулярное растяжение, зуд, папиллярная гиперплазия, хемоз, отек века, и выделение из глаза. Выделение может образовывать корку вокруг глаз после ночного сна.
Атопический кератоконъюнктивит является хронической, тяжелой формой аллергических конъюнктивитов, что часто приводит к ослаблению зрения. Симптомы включают зуд, ощущение жжения, боль, покраснение, ощущение инородного тела, световую чувствительность и расплывчатое зрение. Часто, имеют место выделения, особенно при пробуждении после ночного сна; выделения могут быть вязкими, липкими, и слизистыми. Нижняя конъюнктива часто сильнее поражена, чем верхняя конъюнктива. Конъюнктива может изменяться в диапазоне от бледной, отечной и не имеющей особенностей, до имеющей характеристики прогрессирования болезни, включая папиллярную гипертрофию, субэпителиальный фиброз, укорочение свода, трихиаз, заворот века и мадароз. У некоторых пациентов заболевание прогрессирует до точечных эпителиальных эрозий, роговичной неоваскуляризации, и других проявлений поражения роговицы, которые могут ухудшать зрение. Обычно присутствует разрастание бокаловидных клеток в конъюнктиве, образование псевдотубулярного эпителия, и повышенное количество дегранулирующих эозинофилов и мастоцитов в эпителии. Количество CD25+T лимфоциты, макрофаги, дендритные клетки (HLA-DR.sup.+, HLA-CD1+) значительно увеличено в собственном веществе.
Как атопический кератоконъюнктивит, весенний кератоконъюнктивит является тяжелой формой аллергического конъюнктивита, но он, как правило, сильнее затрагивает верхнюю конъюнктиву, чем нижнюю. Он проявляется в двух формах. В пальпебральной форме присутствуют квадратные, твердые, жесткие, сплюснутые, тесно упакованные сосочки; в бульбарной (краевой) форме, окружающая конъюнктива становится гипертрофированной и сероватой. Обе формы часто сопровождаются слизистыми выделениями. Может произойти потеря эпителия роговицы, сопровождающаяся болью и светобоязнью, а также могут появиться бляшки в центральных отделах роговицы и точки Трантаса.
ПРИМЕРЫ
Изобретение далее проиллюстрировано следующими примерами.
Пример 1
Изобретатели приготовили следующие фармацевтические составы:

КМЦ = карбоксиметилцеллюлоза
ГЭЦ = гидроксиэтилцеллюлоза
ГПМЦ = гидроксипропилметилцеллюлоза
ПВП = поливинилпирролидон
qs = в достаточном количестве
Составы таблицы 1, были приготовлены по следующей процедуре:
1. Подготовка концентрированных нановзвесей Циклоспорина А
а. Циклоспорин А был смешан с соответствующей средой для образования взвеси.
Концентрация Циклоспорина А в этой взвеси находится в диапазоне 1-10%.
б. Взвесь Циклоспорина А была размельчена с использованием гомогенизатора высокого давления (Microfluidizer®, производства Microfluidics, Ньютон, МА), или шаровой мельницы до образования нановзвеси такой, что d90<11 мкм.
в. Среды, используемые для приготовления концентрата нановзвеси перечислены в Таблице 1
2. Приготовление конечного продукта
а. Концентрированные нановзвеси приготовленные в шаге - 1 были разбавлены в средах, пригодных для офтальмологического дозирования, чтобы получить конечный продукт с необходимой эффективностью дозы циклоспорина А. Среды, пригодные для разбавления могут содержать буферные растворы, стабилизаторы, гелирующие агенты, и/или разжижитель для получения конечных составов с нужной концентрацией CsA.
б. Фармацевтические композиции составов нановзвесей, приготовленные после разбавления концентратов нановзвесей, перечислены в Таблице 2,
Распределение частиц по размерам в различных составах иллюстрировано на Фигурах 1, 2 и 3.
Фигура 1 иллюстрирует распределение частиц Циклоспорина А Формы 2 по размерам в нановзвесях, приготовленных с помощью гомогенизатора высокого давления, по сравнению с взвесями пердварительного размельчения.
На Фигуре 2 сравнивается распределение частиц Циклоспорина А Формы 2 по размерам в нановзвесьях, приготовленных с использованием различных поверхностно-активных веществ и стабилизаторов.
Фигура 3 иллюстрирует распределение частиц по размерам Состава разбавленного в среде содержащей Na КМЦ. (Таблица-2, среда А). Следует заметить, что никаких изменений в размере частиц не наблюдается в разбавленных составах по прошествии 2 недель, по сравнению с концентратом нановзвеси.
Средний размер частиц Циклоспорина А Формы 3, иллюстрирован на Фигуре 4. Циклоспорин А Формы 2 образует нановзвеси (размер частиц <1 мкм), в то время, как форма 3 не образует.
Эти эксперименты показывают, что Форма 2 равномерно образует нановзвеси с более низким размером частиц, чем какая-либо другая кристаллическая форма CsA. Малый размер частиц нановзвесей формы 2 является преимуществом, по сравнению с другими формами; среди других предпосылок ожидается, что они проявят более высокую биодоступность благодаря большей площади поверхности для растворения, и более длительное удерживание на глазу, а также улучшение физической стабильности.
Пример 2
Изобретатели приготовили нановзвеси Циклоспорина А перечисленные в таблице 2, ниже:
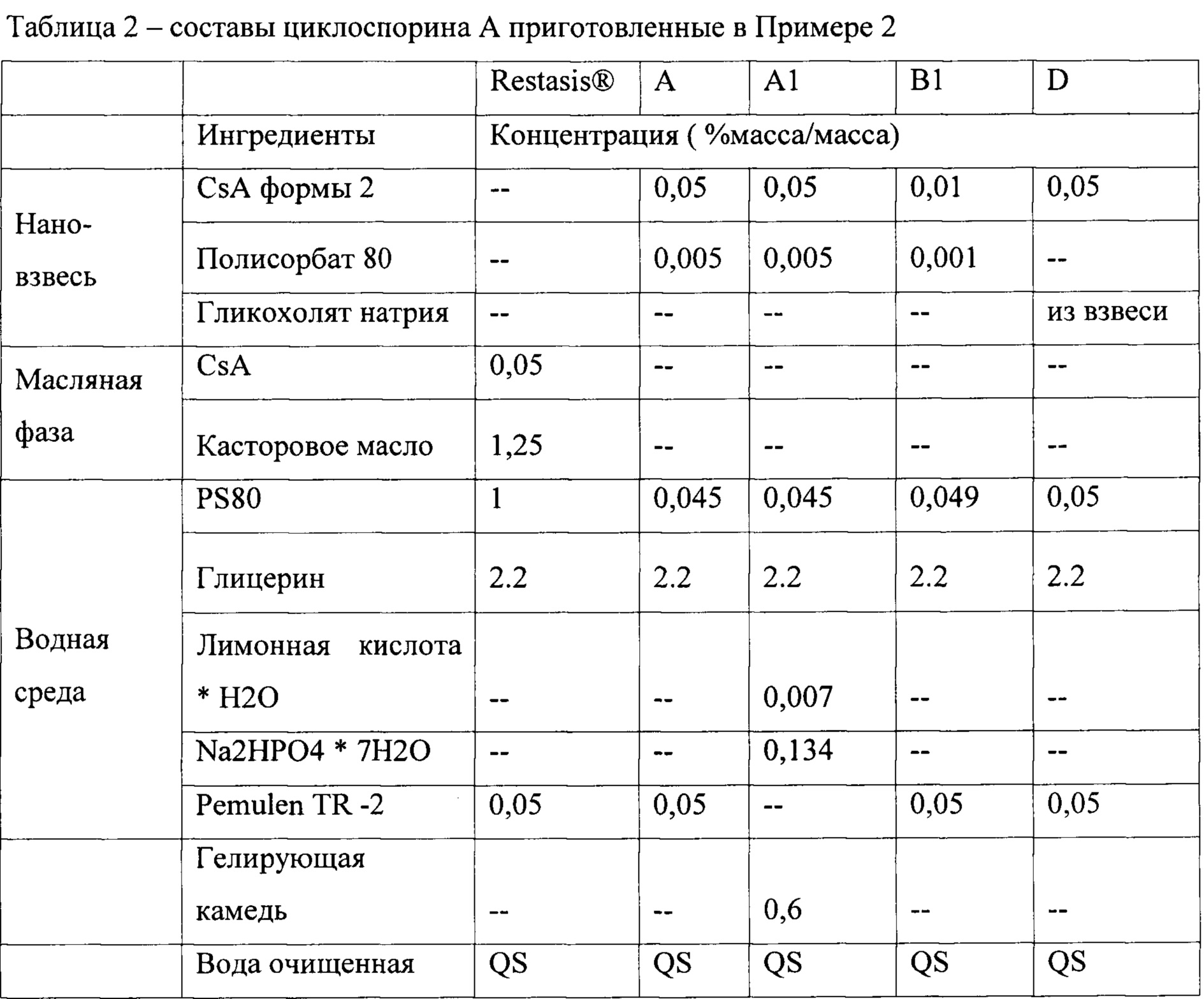
PS80 = полисорбат 80
Изобретатели испытывали указанные выше составы на породе Ново Зеландских (NZW) самок кроликов (два кролика в сумме, по одному составу в каждый глаз) в единичной дозе местного применения. Результаты, кратко изложены но Фигурах 5-13. Они свидетельствуют о том, что состав В1 обеспечивает в 5 раз меньшую дозу циклоспорина (0,01% по сравнению с 0,05%), при этом сохраняя сопоставимое с 0,05% Restasis® воздействие на роговицу, а также улучшает доставку к бульбарной и пальпебральной конъюктиве.
Реферат
Группа изобретений относится к области медицины и представляет собой: глазную взвесь, содержащую циклоспорин А формы 2 и какую-либо среду, где циклоспорин А формы 2 характеризуется следующими пиками при сканировании рентгеновским дифрактометром с излучением Cu Kα, 2θ: 7,5, 8,8, 10,2, 11,3, 12,7, 13,8, 14,5, 15,6 и 17,5; способ приготовления состава циклоспорина, который включает этапы смешивания циклоспорина А формы 2 со средой для образования взвеси; размельчение взвеси; глазную взвесь, содержащую частицы циклоспорина А Формы 2; и среду, в которой средний размер (d90) частиц меньше чем около 10 мкм; способ лечения состояния выбранного из: сидром сухого глаза, блефарит, заболевание мейбомиевой железы, нарушение чувствительности роговицы, аллергический конъюнктивит, атопический кератоконъюнктивит, весенний кератоконъюнктивит и птеригий, включающий этап применения к пациенту, имеющему такое состояние, вышеуказанной глазной взвеси. Изобретение обеспечивает новую кристаллическую форму циклоспорина А, за счет чего повышается биодоступность, снижается ощущение инородного тела и достигается большая стабильность. 4 н. и 11 з.п. ф-лы, 18 ил., 2 пр., 2 табл.

Комментарии