Hcv геномные последовательности для диагностических и терапевтических целей - RU2155228C2
Код документа: RU2155228C2
Чертежи
















































































































Описание
Рассматриваемая заявка является частичным продолжением заявки США N 07/69726, озаглавленной "Полинуклеотидные зонды, пригодные для скрининга вируса гепатита C", поданной 8 мая 1991 г.
Область изобретения
Настоящее изобретение относится к композициям и способам выявления и борьбы с вирусом гепатита C (HCV) инфекцией,
которую ранее называли как образующуюся в крови инфекцию вируса не-A и не-B гепатита (NANBV). Более конкретно, отличительной особенностью настоящего изобретения являются композиции и способы
детектирования HCV, и разработка вакцин для профилактического лечения инфекций HCV, и разработка препаратов антител для создания пассивного иммунитета к HCV.
Предпосылки изобретения
Прототип изолята HCV охарактеризован в патентной заявке США 122714 (см. также EPO публикацию N 318216). В том смысле, как здесь использован, термин "HCV" включает новые изоляты тех же видов
вируса. Термин "HCV-I" относится к патентной заявке США N 122714.
HCV является передаваемым заболеванием, которое отличается от других форм заболеваний печени вирусного происхождения, включая те, которые вызываются известными вирусами гепатита, то есть вирусом гепатита A (HAV), вирусом гепатита B (HBV) и вирусом дельта-гепатита (HDV), а также гепатитов, вызываемых питомегаловирусом (CMV) или Epstein-Barr вирусом (EBV). Впервые вирус HCV был обнаружен у пациентов, которые перенесли переливание крови.
Весьма существенная необходимость в чувствительных специфических методах скрининга и идентификации носителей HCV и зараженной HCV крови и продуктов, полученных в крови. Гепатиты, возникающие после переливания крови, наблюдаются у приблизительно 10% пациентов, которым это переливание делали (PTH), и HCV составляет вплоть до 90% на этих случаях. Это заболевание часто прогрессирует, что приводит к хроническому повреждению печени (25 - 55%).
Лечение пациента, а также предотвращение передачи HCV с кровью или продуктами крови, или за счет тесного контакта персонала, требует надежных средств скрининга, диагностики и прогнозирования для определения нуклеиновых кислот, антигенов и антител, относящихся к HCV.
Информация, содержащаяся в рассматриваемой заявке, предполагает наличие нескольких генотипов HCV. То есть, генетическая информация относительно вирусов HCV может быть полностью идентичной для всех HCV, но охватывает группы с отличающейся генетической информацией.
Генетическая информация хранится в нитевидных молекулах ДНК и РНК. ДНК состоит из ковалентно связанных цепей рибонуклеотидов. Каждый нуклеотид характеризуется одним из четырех оснований: аденином (A), гуанином (G), тимином (T) и цитозином (C). Эти основания комплементарны в том смысле, что за счет ориентации функциональных групп, некоторые пары оснований притягиваются и связываются друг с другом водородными связями и π- упаковывающими взаимодействиями. Аденин в одной нити ДНК составляет пару с тимином в противоположно комплементарной нити. Гуанин в одной нити ДНК составляет пару с цитозином в противоположно комплементарной нити. В РНК основание - тимин заменено на урацил (U), который составляет пару с аденином в противоположно комплементарной нити. Генетический код живого организма заключен в последовательности пар оснований. Живые клетки интерпретируют, транскрибируют и транслируют информацию о нуклеиновых кислотах для получения протеинов и пептидов.
HCV геном состоит из однонитевой положительной РНК. HCV геном обладает непрерывной трансляционной открытой считывающей рамкой (ORF), которая кодирует полипротеин из около 3000 аминокислот. В ORF структурный протеин (протеины), по-видимому, должен быть закодирован в приблизительно первой четверти N-терминального участка с большей частью полипротеина, ответственного за неструктурные протеины.
HCV полипротеин содержит в направлении от аминоконца и карбоксиконцу, нуклеокапсидный протеин (C), протеин оболочки (E) и неструктурные протеины (NS) 1, 2(b), 3, 4(b) и 5.
HCV отличающихся генотипов может кодировать протеины, которые изменяют реакцию иммунной системы хозяев. HCV отличающихся генотипов может быть трудно детектировать иммунодиагностическими методиками и методиками с использованием зондов нуклеиновых кислот, которые специфически не соответствуют такому генотипу.
Определения для выбранных терминов, которые использованы в заявке, представлены далее для облегчения понимания изобретения. Термин "соответствующий" означает гомологичный с или комплементарный конкретной последовательности нуклеиновых кислот. Если речь идет о нуклеиновых кислотах и пептидах, соответствующий относится к аминокислотам пептида в порядке, полученном из последовательности нуклеиновой кислоты или ее комплемента.
Термин "не встречающаяся в природе нуклеиновая кислота" (не нативная) относится к части геномной нуклеиновой кислоты, кДНК, полусинтетической нуклеиновой кислоте или синтетической аминокислоте, которая в результате ее происхождения или каких-либо либо манипуляций: (1) не связана со всеми нуклеиновыми кислотами, с которыми она связана в природе; (2) связана с нуклеиновой кислотой или другим химическим агентом, отличающимся от того, с которым она связана в природе, или (3) не встречается в природе.
Аналогично, термин "не встречающийся в природе пептид" относится к части большого, встречающегося в природе пептида, или протеина, или полусинтетического или синтетического пептида, который в результате своего происхождения или каких-либо манипуляций (1) не связан со всем пептидом, с которым он связан в природе, (2) связан с пептидами, функциональными группами или химическими агентами, отличающимися от тех, с которыми он связан в природе, или (3) не встречается в природе.
Термин "праймер" относится к нуклеиновой кислоте, которая способна инициировать синтез большей нуклеиновой кислоты, если ее поместить в соответствующие условия. Праймер бывает полностью или в основном комплементарен участку нуклеиновой кислоты, подлежащей копированию. Таким образом, в условиях, приводящих к гибридизации, праймер будет отожжен с комплементарным участком более крупной нуклеиновой кислоты. После добавления подходящих реагентов прймер удлиняют полимеризующим агентом с образованием копии более крупной нуклеиновой кислоты.
Термин "связываемая пара" относится к любой паре молекул, которая демонстрирует общее сродство или способность связываться. Для целей настоящей заявки термин "лиганд" относится к одной из молекул связываемой пары, а термин "антилиганд", или "рецептор", или "мишень" относится к противоположной молекуле связываемой пары. Так, например, по отношению к нуклеиновым кислотам связываемая пара может содержать две комплементарные нуклеиновые кислоты. Одну из нуклеиновых кислот обозначают как лиганд, а другую нить обозначают как антилигандный рецептор или мишень. Обозначение лиганда или антилиганда это просто вопрос удобства. Другие связываемые пары содержат, например, антигены и антитела, лекарственные препараты и сайты рецепторов этих препаратов, энзимы и субстраты энзимов.
Термин "меченый" относится к молекулярному фрагменту, который можно детектировать, включая, например (но без ограничений) радиоактивными изотопами, энзимами, люминесцентными агентами, осаждающими агентами и красителями.
Термин "носитель" включает такие обычные носители, как фильтры и мембраны, а также восстанавливаемые носители, которые можно диспергировать в среде и удалить или выделить из среды за счет иммобилизации, фильтрования, разделения и т.д. Термин "носитель" относится к носителю, который способен связываться с нуклеиновыми кислотами, пептидами или антителами за счет связывания партнеров ковалентной или нековалентной связями.
Ряд HCV штаммов и изоляторов был идентифицирован. При сравнении с последовательностью исходного изолята, полученного из USA ("HCV-I" см. Q.-L. Choo et al. (1989) Science 244; 359 - 362, Q.- L. Choo et al. (1990) Brit. Med. Bull. 46, 423 - 441, Q.- L. Choo et al., Proc. Natl. Acad. Sci. 88 : 2451 - 2455 (1991), and E.P.O. Patent Publication N 318216, цитированный ранее), было обнаружено, что японский изолят ("HCV JI") значительно отличается как в нуклеотидной, так и в полипептидной последовательности в NS3 и NS4 участках. Этот вывод был позднее распространен на участки NS5 и оболочки [E1/S и E2/NSI] (см. Tareuchi et al. , J. Gen. Virol (1990) 71 : 3027 - 3033, Y. Kubo, Nucl. Acids. Res. (1989) 17 : 1367 - 1372) и K. Tareuchi et al., Gene (1990) 91 : 287 - 291). Первая группа изолятов, впервые идентифицированная в США, называется "Генотип I" в контексте изобретения, тогда как последняя группа изолятов, впервые идентифицированная в Японии, называется здесь "Генотипом II".
Краткое описание изобретения
Настоящее изобретение относится к
композициям вещества, содержащего нуклеиновые кислоты и пептиды, соответствующие
нуклеиновым кислотам и пептидам различных генотипов. В настоящем изобретении предложены такие способы использования
композиций, соответствующих последовательностям HCV вирусного генома, которые
определяют описанные здесь генотипы.
A. Композиции нуклеиновых кислот
Нуклеиновая кислота
настоящего изобретения, соответствующая HCV вирусному геному, который определяет
различные генотипы, может использоваться в качестве зонда в гибридизированном анализе нуклеиновых кислот, в качестве
праймера для реакций, включающих синтез нуклеиновых кислот, в качестве связывающих
партнеров для выделения HCV вирусной нуклеиновой кислоты и других составляющих, которые могут присутствовать и в
качестве антисмысловой нуклеиновой кислоты для предотвращения транскрипции или
трансляции вирусной нуклеиновой кислоты.
В одном из вариантов отличительной чертой настоящего изобретения является композиция, содержащая не встречающуюся в природе нуклеиновую кислоту, содержащую последовательность нуклеиновых кислот из, по крайней мере, восьми нуклеотидов, соответствующих не-HCV-I нуклеотидной последовательности гемона вируса гепатита C. Предпочтительно, нуклеотидную последовательность выбирать из последовательностей, присутствующих в, по крайней мере, одном участке, состоящем из участка NS5, участка I оболочки, 5' UT участка и участка ядра.
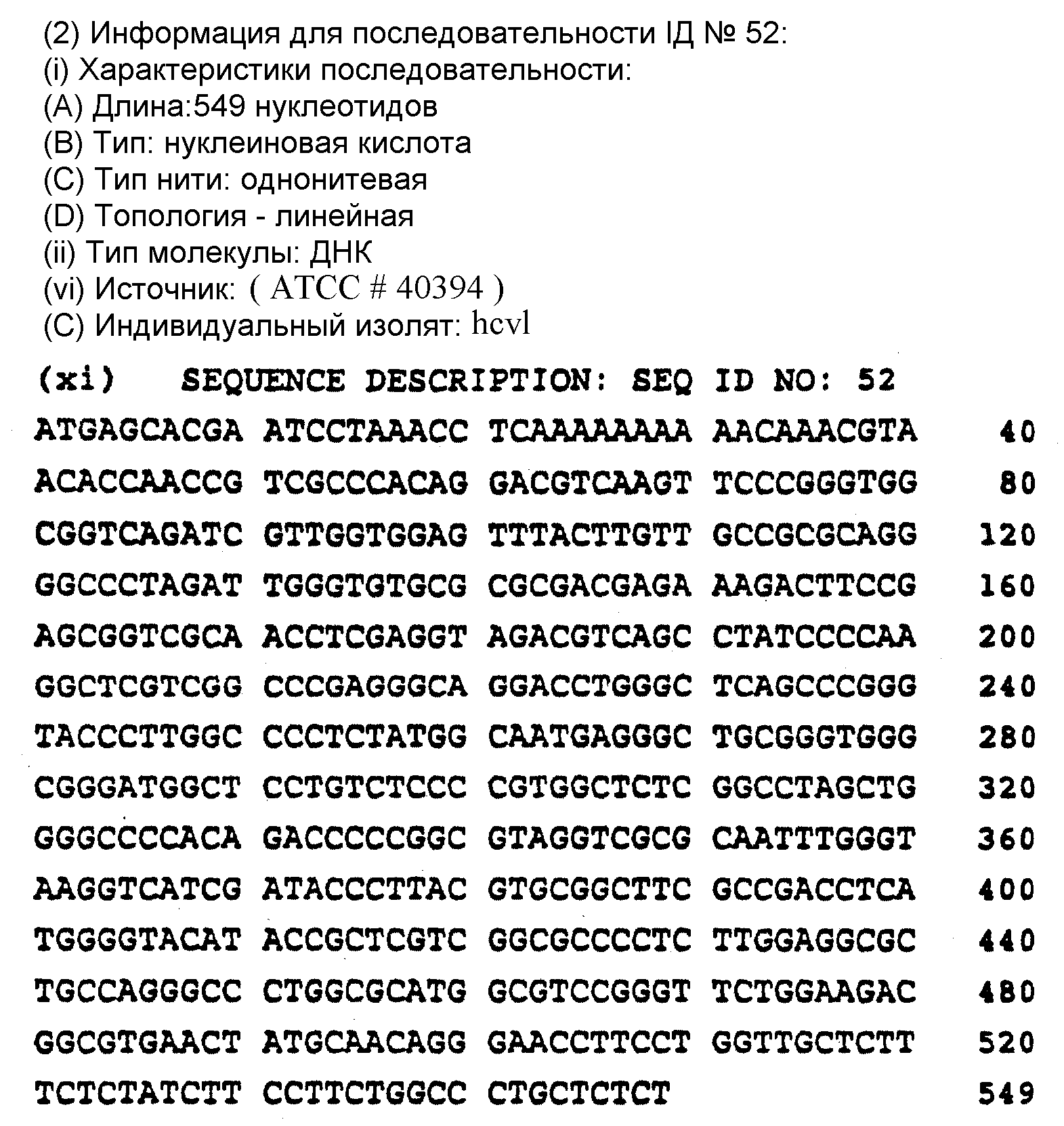
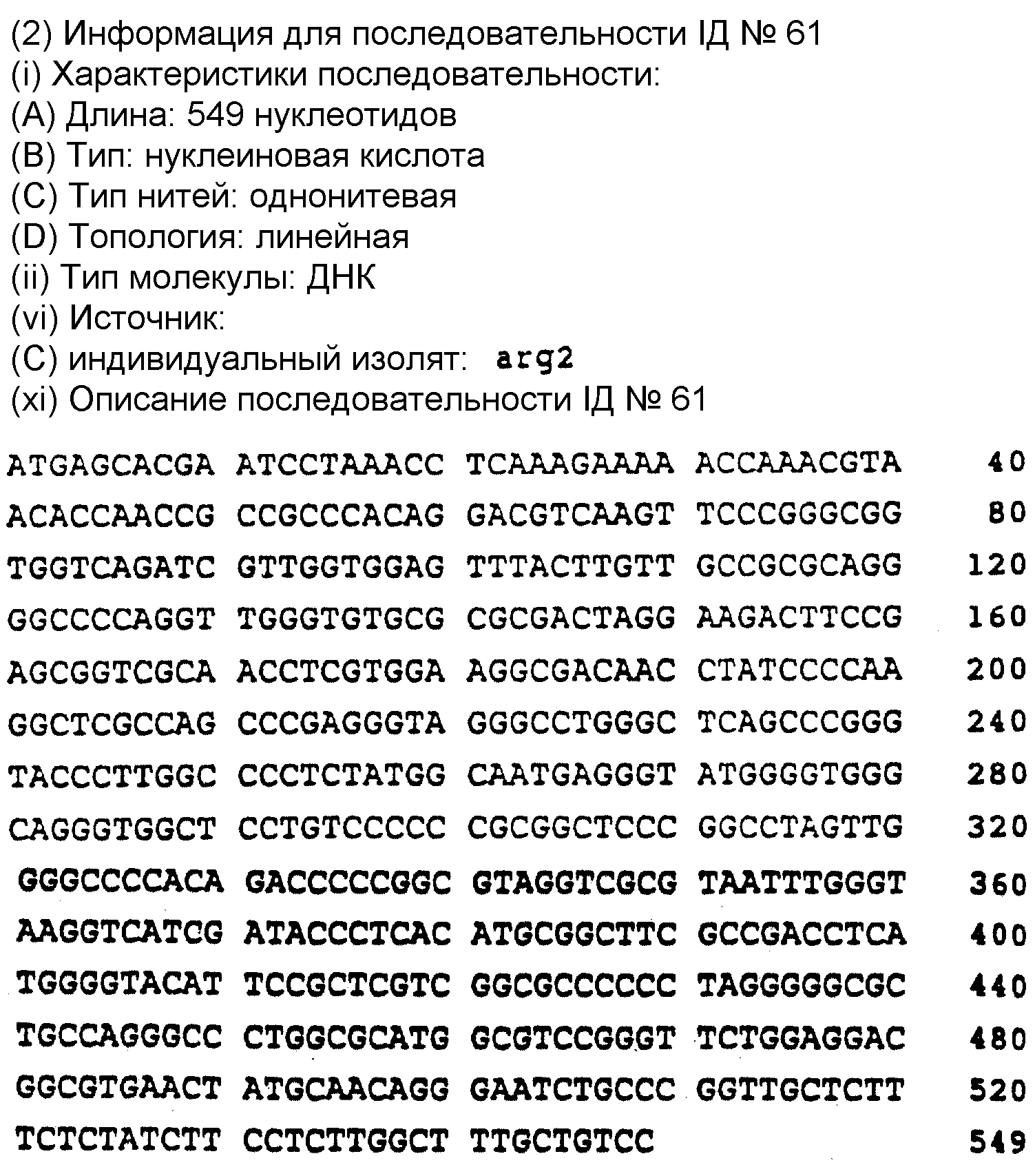
Предпочтительно, в отношении последовательностей, которые соответствуют NS5 участку, выбирать последовательность из последовательностей под номерами 2 - 22. Последовательность под номером 1 соответствует HCV-I. Последовательности 1 - 22 определены в описании последовательностей заявки.
Предпочтительно, в отношении последовательностей, соответствующих участку I оболочки, чтобы последовательность выбирали из последовательности, находящейся в ряду последовательностей 24 - 32. Последовательность N 23 соответствует HCV-I. Последовательности под номерами 23 - 32 приведены далее в описании последовательностей рассматриваемой заявки.
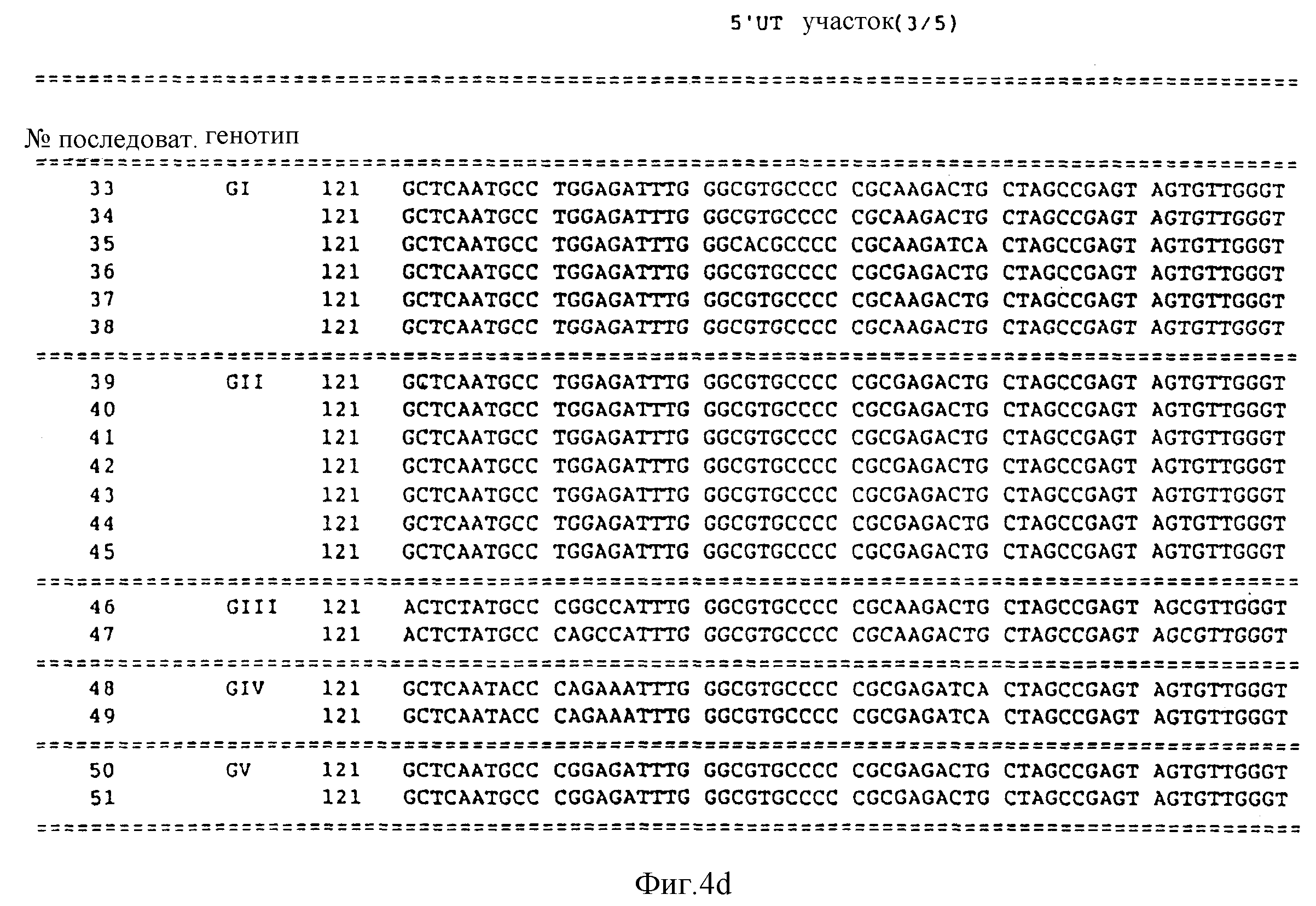
Предпочтительно, в отношении последовательностей, которые соответствуют 5' UT участкам, выбирать последовательность из последовательностей под номерами 34 - 51. Последовательность N 33 соответствует HCV-I. Последовательности N 33 - 51 представлены далее в описании последовательностей рассматриваемой заявки.
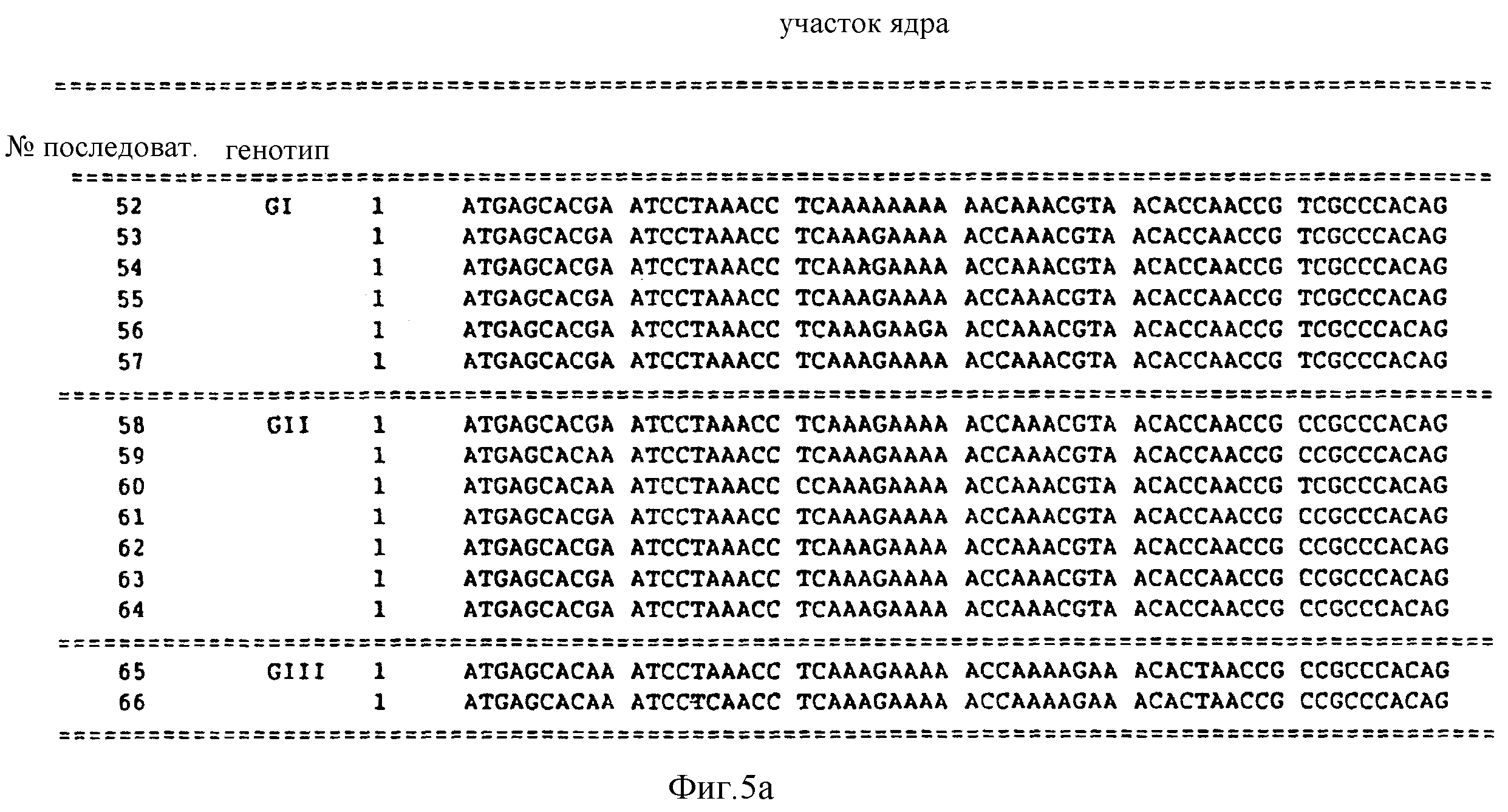
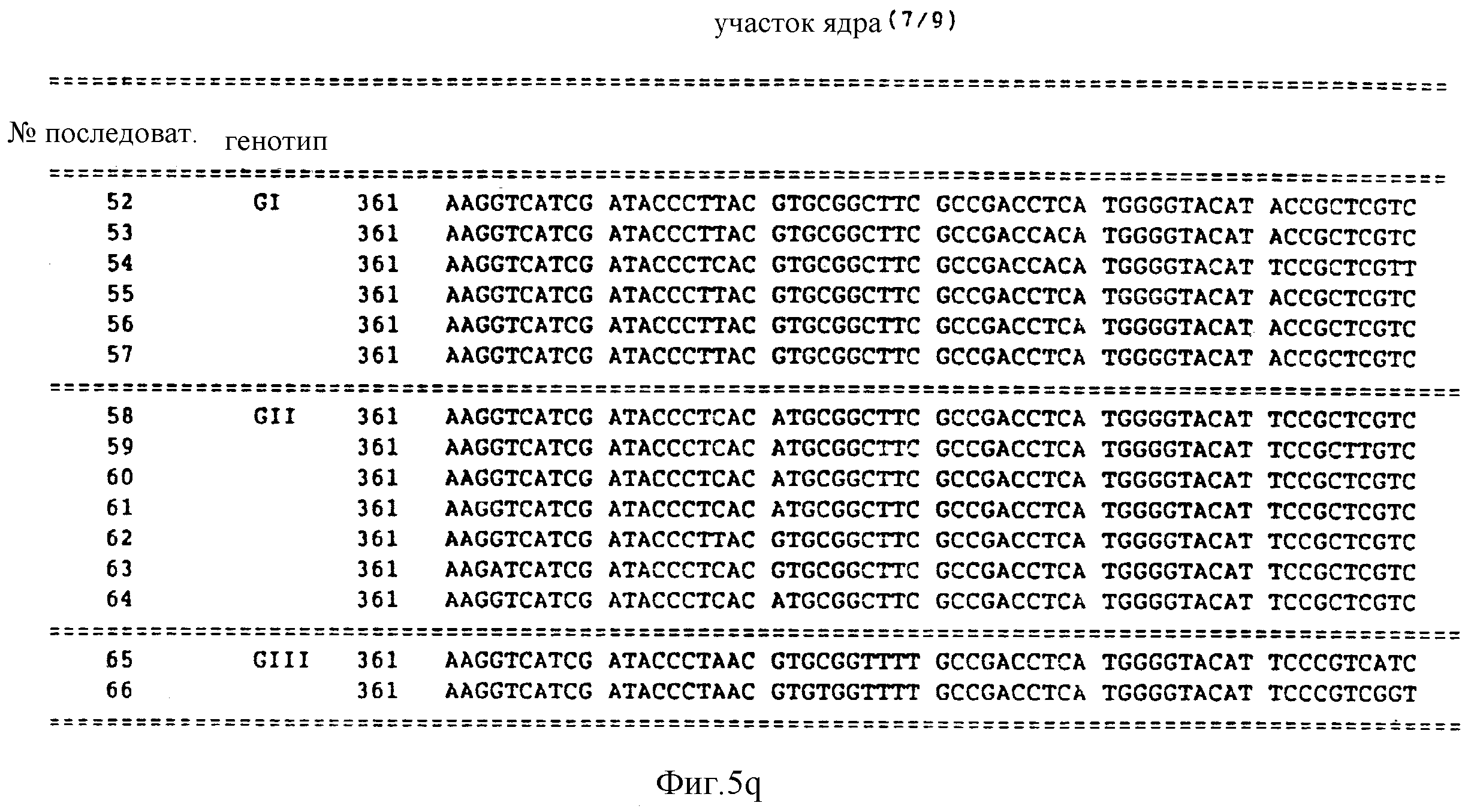
Предпочтительно, в отношении последовательностей, соответствующих участку ядра, выбирать последовательность из последовательностей под номерами 53 - 66. Последовательность N 52 соответствует HCV-I. Последовательности 52 - 65 представлены далее в описании последовательностей настоящей заявки.
Композиции настоящего изобретения образуют продукты гибридизации с нуклеиновыми кислотами, соответствующими различным генотипам HCV.
HCV имеет, по крайней мере, пять генотипов, которые далее в настоящем изобретении будут обозначать GI-GV. Первый генотип, представлен последовательностями под номерами 1 - 6, 23 - 25, 33 - 38 и 52 - 57. Второй генотип, G II, представлен последовательностями под номерами 7 - 12, 26 - 28, 39 - 45 и 58 - 64. Третий генотип, G III, представлен последовательностями под номерами 13 - 17, 32, 46 - 47 и 65 - 66. Четвертый генотип, G IV, представлен последовательностями под номерами 20 - 22 и 29 - 31 и 48 - 49. Пятый генотип GV, представлен последовательностями 18, 19, 50 и 51.
Отличительной чертой одного из вариантов настоящего изобретения являются композиции, содержащие нуклеиновые кислоты с последовательностями, соответствующими одной или более из последовательностей, которые представляют генотип HCV.
B. Способ получения продуктов гибридизации
Отличительной
чертой вариантов настоящего изобретения является способ получения продукта гибридизации с
нуклеиновой кислотой, содержащей последовательность, соответствующую HCV нуклеиновой кислоте. Один из способов
включает стадии помещения не-нативной нуклеиновой кислоты, имеющей не-HCV-I
последовательность, соответствующую HCV нуклеиновой кислоте, в условия, в которых может происходить гибридизации.
Не-нативная нуклеиновая кислота способна образовывать продукт гибридизации с HCV
нуклеиновой кислотой в условиях гибридизации. Этот способ включает далее стадию создания условий гибридизации для
образования продукта гибридизации в присутствии нуклеиновой кислоты, соответствующей
участку генома HCV.
Образование продукта гибридизации можно использовать для детектирования наличия одного или более из генотипов HCV. Предпочтительно, не-нативная нуклеиновая кислота образует продукт гибридизации с нуклеиновой кислотой HCV в одном или более из участков, содержащих участок NS5, участок I оболочки, 5'UT участок и участок ядра. Для определения продукта гибридизации удобно снабдить меткой не-нативную нуклеиновую кислоту. Образование продукта гибридизации отслеживают, отделяя продукт гибридизации от меченой не-нативной нуклеиновой кислоты, которая не образовала продукта гибридизации.
Образование продукта гибридизации можно использовать как средство для отделения одного или более генотипов HCV нуклеиновой кислоты от других возможно присутствующих составляющих. Для такого применения удобно связывать не-нативную нуклеиновую кислоту с носителем для выделения полученного продукта гибридизации из других составляющих.
"Сэндвичевый анализ" нуклеиновых кислот использует одну нуклеиновую кислоту, связанную с меткой, и вторую нуклеиновую кислоту, связанную с носителем. Одним из вариантов настоящего изобретения является отличительный сэндвичевый анализ, включающий две нуклеиновые кислоты, причем обе имеют последовательности, соответствующие HCV нуклеиновым кислотам, однако, по крайней мере, одна не-нативная нуклеиновая кислота имеет последовательность, соответствующую не-HCV-I HCV нуклеиновой кислоте. По крайней мере, одна нуклеиновая кислота способна связываться с меткой, а другая способна связываться с носителем. Связанную с носителем не-нативную нуклеиновую кислоту используют для выделения продуктов гибридизации, которые включают HCV нуклеиновую кислоту и не-нативную нуклеиновую кислоту, содержащую не-HCV-I последовательность.
Отличительной особенностью одного из вариантов настоящего изобретения является способ детектирования одного или более из генотипов HCV. Этот способ включает стадии помещения не-нативной нуклеиновой кислоты в условия, в которых может происходить гибридизация. Не-нативная нуклеиновая кислота способна связываться с нуклеиновой кислотой одного или более из генотипов HCV. Первый генотип, GI, представлен последовательностями под номерами 1 - 6, 23 - 25, 33 - 38 и 52 - 57. Второй генотип, G II, представлен последовательностями под номерами 7 - 12, 26 - 28, 39 - 45 и 58 - 64. Третий генотип, G III, представлен последовательностями под номерами 13 - 17, 32, 46 - 47 и 65 - 66. Четвертый генотип, G IV, представлен последовательностями под номерами 20 - 22 и 29 - 31. Пятый генотип, G V, представлен последовательностями под номерами 18, 19, 50 и 51.
Продукт гибридизации HCV нуклеиновой кислоты с не-нативной нуклеиновой кислотой, содержащей не-HCV-I последовательность, соответствующую последовательности в HCV геноме, можно использовать для примирования реакции синтеза нуклеиновой кислоты.
Продукт гибридизации HCV нуклеиновой кислоты с не-нативной нуклеиновой кислотой, содержащей последовательность, соответствующую HCV конкретного генотипа, можно использовать для примирования реакции синтеза нуклеиновой кислоты этого генотипа. В одном из вариантов синтезированная нуклеиновая кислота является показателем наличия одного или более из генотипов HCV.
Синтез нуклеиновых кислот может также облегчить клонирования нуклеиновых кислот в векторы экспрессии, которые синтезируют вирусные протеины.
Варианты настоящего изобретения имеют применение в качестве анти-смысловых агентов для предотвращения транскрипции или трансляции вирусной нуклеиновой кислоты. Образование продукта гибридизации не-нативной нуклеиновой кислоты, содержащей последовательность, которая соответствует геномной последовательности определенного генотипа HCV, с HCV нуклеиновой кислотой может блокировать трансляцию или транскрипцию такого генотипа. Можно создать терапевтические агенты для включения всех пяти генотипов для целостности.
C. Композиция пептида и антитела
Следующей
отличительной чертой настоящего изобретения
является вариант, в котором композиция содержит не-нативный пептид из трех или более аминокислот, соответствующих нуклеиновой кислоте, имеющей не-HCV-I
последовательность. Предпочтительно, чтобы
не-HCV-I последовательность соответствовала последовательности внутри одного или более из участков, состоящих из NS5 участка, участка I оболочки, 5'UT
участка и участка ядра.
Предпочтительно, в отношении пептидов, соответствующих нуклеиновой кислоте, содержащей не-HCV-I последовательность NS5 участка, чтобы последовательность выбрали из последовательностей 2 - 22. Последовательность под номером 1 соответствует HCV-I. Последовательности под номерами 1 - 22 представлены далее в разделе описание последовательностей.
Предпочтительно, в отношении пептидов, соответствующих нуклеиновой кислоте с не-HCV-I последовательностью участка I оболочки, чтобы последовательность выбирали из последовательностей под номерами 24 - 32. Последовательность под номером 23 соответствует HCV-1. Последовательности под номерами 23 - 32 представлены далее в разделе последовательностей.
Предпочтительно, в отношении пептидов, содержащих нуклеиновую кислоту с не-HCV-I последовательностью, направленной на участок ядра, чтобы последовательность выбирали из последовательностей под номерами 53 - 66. Последовательность под номером 52 соответствует HCV-I. Последовательности под номерами 52 - 66 представлены далее в описании последовательностей.
Следующим отличительным вариантом настоящего изобретения является пептидная композиция, соответствующая последовательностям нуклеиновых кислот генотипа HCV. Первый генотип, G I, представлен последовательностями под номерами 1 - 6, 23 - 25, 33 - 38 и 52 - 57. Второй генотип, G II, представлен последовательностями под номерами 7 - 12, 26 - 28, 39 - 45 и 58 - 64. Третий генотип, G III, представлен последовательностями под номерами 13 - 17, 32, 46 - 47 и 65 - 66. Четвертый генотип, G IV, представлен последовательностями под номерами 18, 19, 50 и 51.
Не-нативные полипептиды настоящего изобретения можно использовать в качестве компонентов вакцин. Информация о последовательностях настоящего изобретения позволяет сконструировать вакцины, которые включают все или часть HCV различных генотипов. Направленность вакцины на конкретный генотип позволяет осуществить профилактическую обработку для сведения к максимуму защиты вовлеченных агентов. Направленность вакцины на более чем один генотип позволяет вакцине быть более универсальной.
Пептидные композиции можно также использовать для выработки специфических антител к HCV протеинам. Отличительной особенностью одного из вариантов настоящего изобретения являются композиции, в которых антитела к пептидам соответствуют не-HCV-I последовательности HCV генома. Предпочтительно, не-HCV-I последовательность выбирать из последовательности внутри участка, состоящего из участка NS5, участка I оболочки и участка ядра. Там нет пептидов, связанных с нетранслируемым 5'UT участком.
Предпочтительно, по отношению к антителам к пептидам NS5 участка, чтобы пептид соответствовал последовательности из числа последовательностей под номерами 2 - 22. Предпочтительно, по отношению к антителам к пептидам, соответствующим участку I оболочки, чтобы пептид, соответствующий последовательности, был из числа последовательностей под номерами 24 - 32. Предпочтительно, по отношению к антителам к пептидам, соответствующим участку ядра, чтобы пептид соответствовал последовательности из последовательностей под номерами 53 - 66.
Антитела к пептидам, которые отражают определенный генотип, используют для детектирования таких генотипов HCV и в качестве терапевтических агентов.
Один из вариантов настоящего изобретения отличается антителами к пептидам, соответствующим нуклеиновой кислоте, имеющей последовательности определенного генотипа. Первый генотип, G I, представлен последовательностями под номерами 1 - 6, 23 - 25, 33 - 38 и 52 - 57. Второй генотип, G II, представлен последовательностями под номерами 7 - 12, 26 - 28, 39 - 45 и 58 - 64. Третий генотип, G III, представлен последовательностями под номерами 13 - 17, 32, 46 - 47 и 65 - 66. Четвертый генотип, G IV, представлен последовательностями под номерами 20 - 22, 29 - 31, 48 и 49. Пятый генотип, GV, представлен последовательностями под номерами 18, 19, 50 и 51.
Специалисты легко поймут, что композиции настоящего изобретения могут быть упакованы с инструкциями для использования в виде набора для проведения гибридизации нуклеиновых кислот или иммунохимических реакций.
Далее настоящее изобретение описывается со ссылкой на следующие чертежи, которые иллюстрируют последовательности, демонстрирующие генотипы HCV. Эти последовательности обозначены номерами 1 - 145, в которых нумерация и последовательности соответствуют нумерации и последовательностям, представленным далее в описании последовательностей. Последовательности 146 и 147 облегчают обсуждение анализа, нумерации и последовательности, в которых соответствуют нумерации и последовательностям в разделе описания последовательностей.
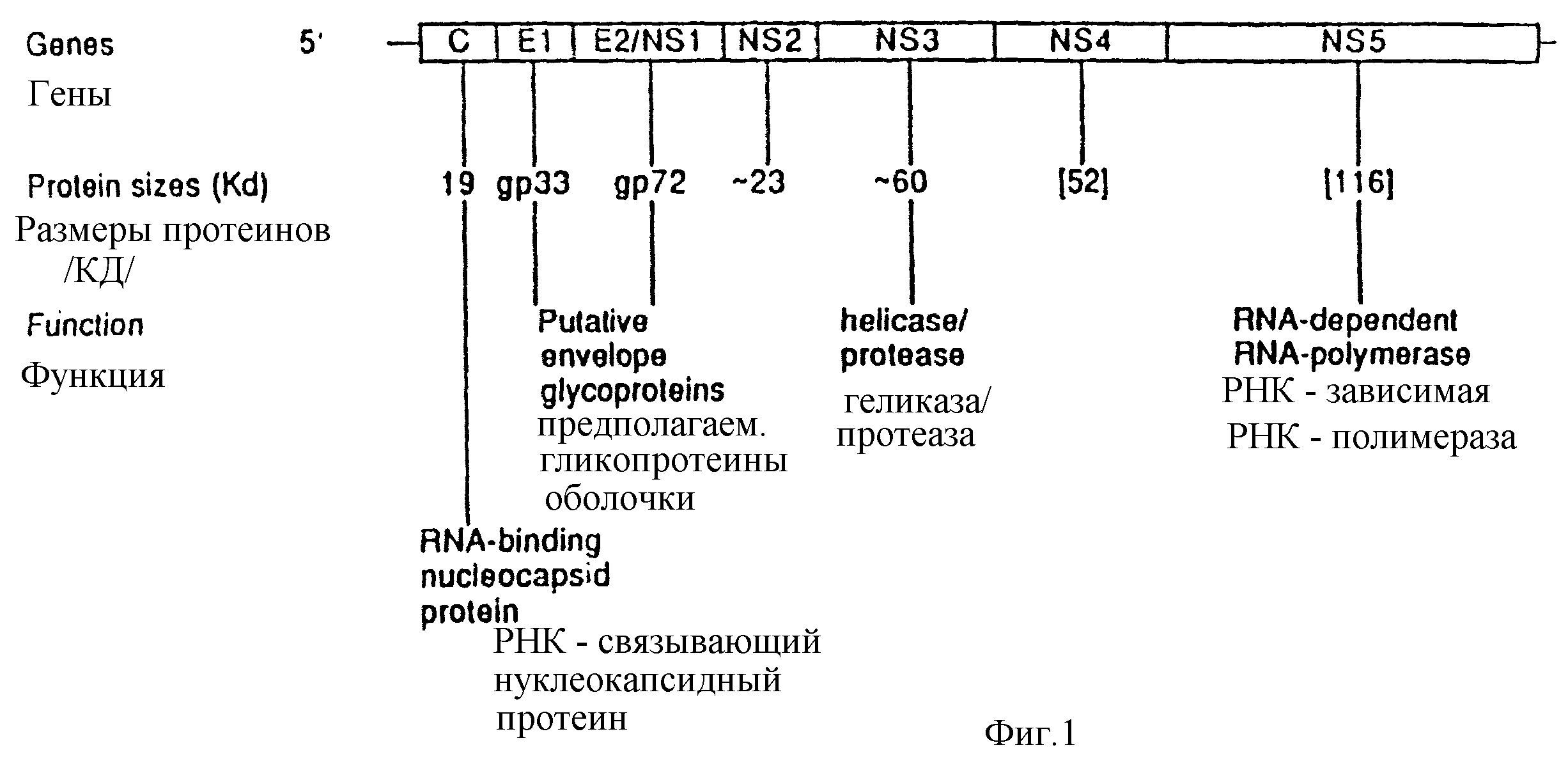
Фиг. 1 схематически изображает генетическую организацию HCV;
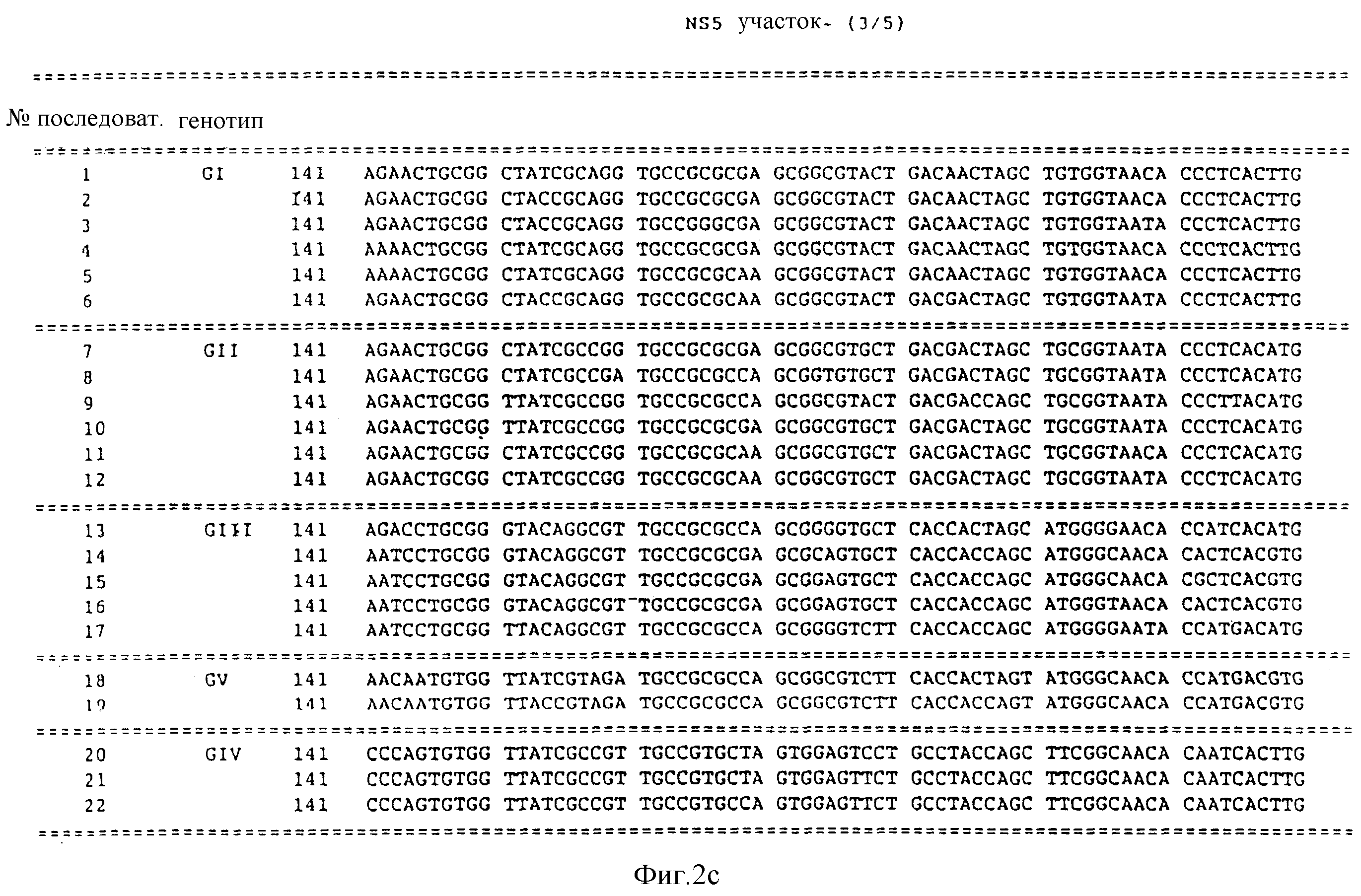
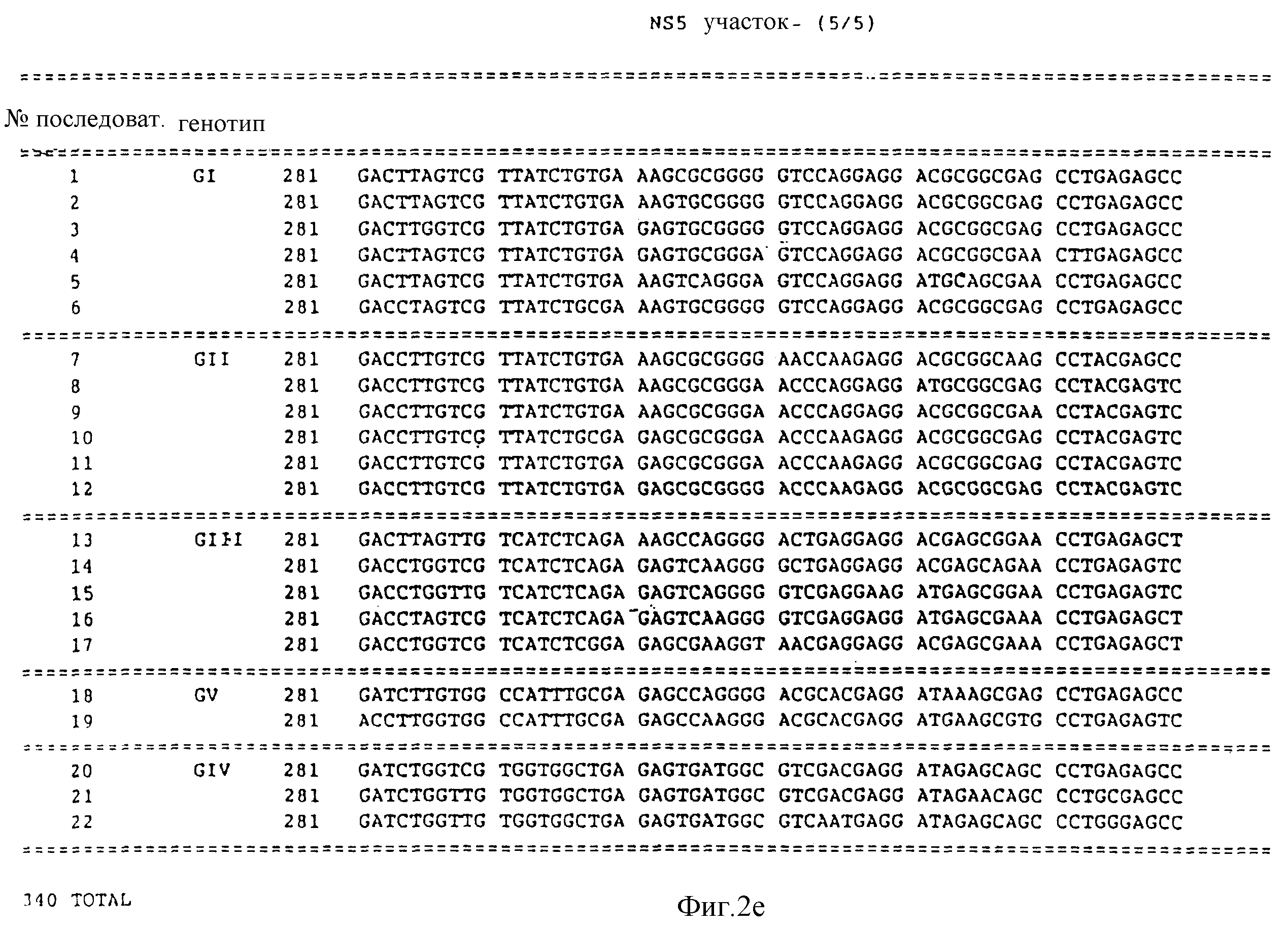
фиг. 2 изображает последовательности нуклеиновых кислот под номерами 1-22, причем эти последовательности получены из NS5 участка HCV вирусного генома;
фиг. 3 изображает
последовательности
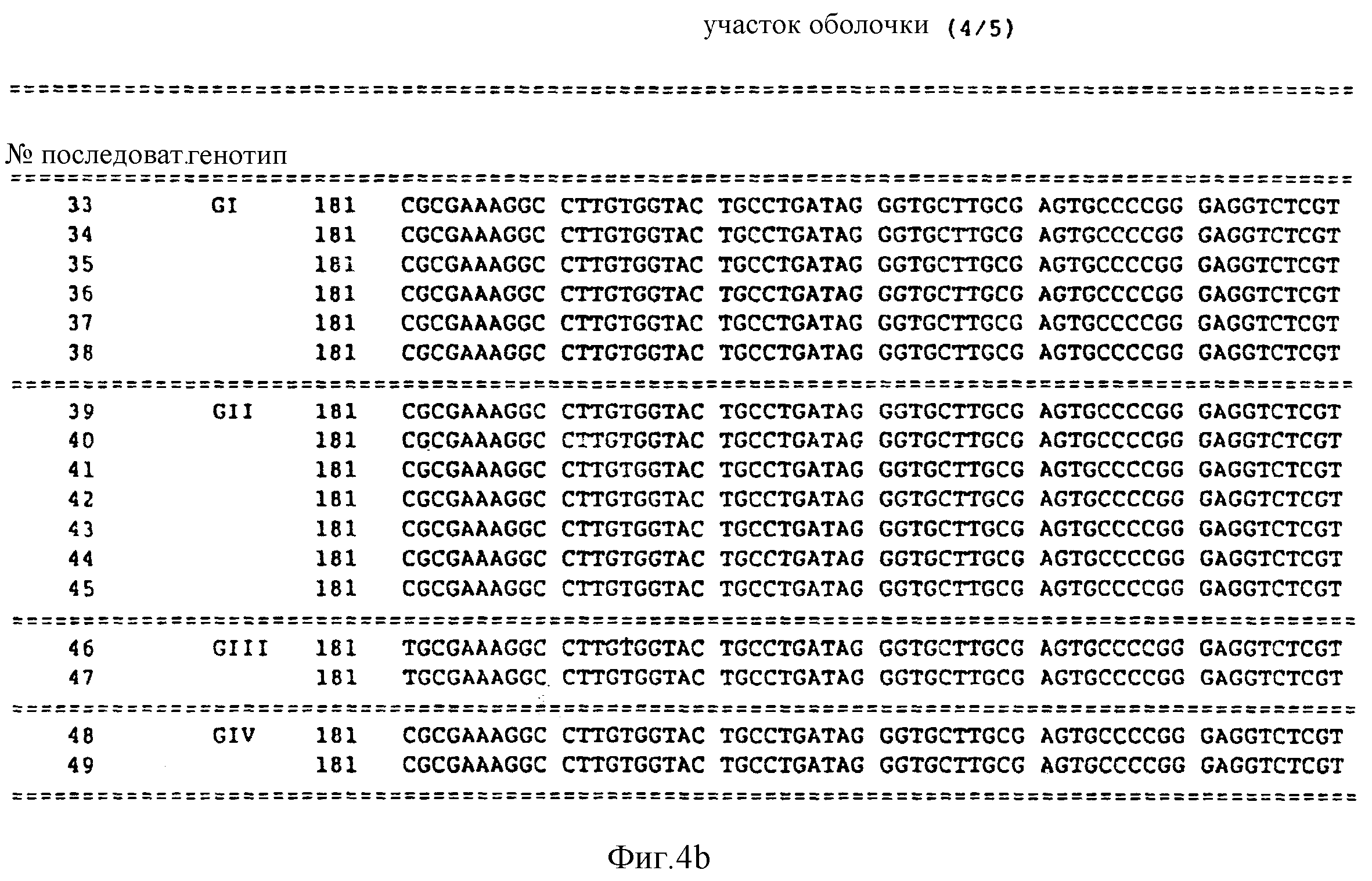
нуклеиновых кислот под номерами 23-32, причем эти последовательности получены из участка I оболочки HCV вирусного генома;
фиг. 4 изображает последовательности нуклеиновых
кислот под номерами
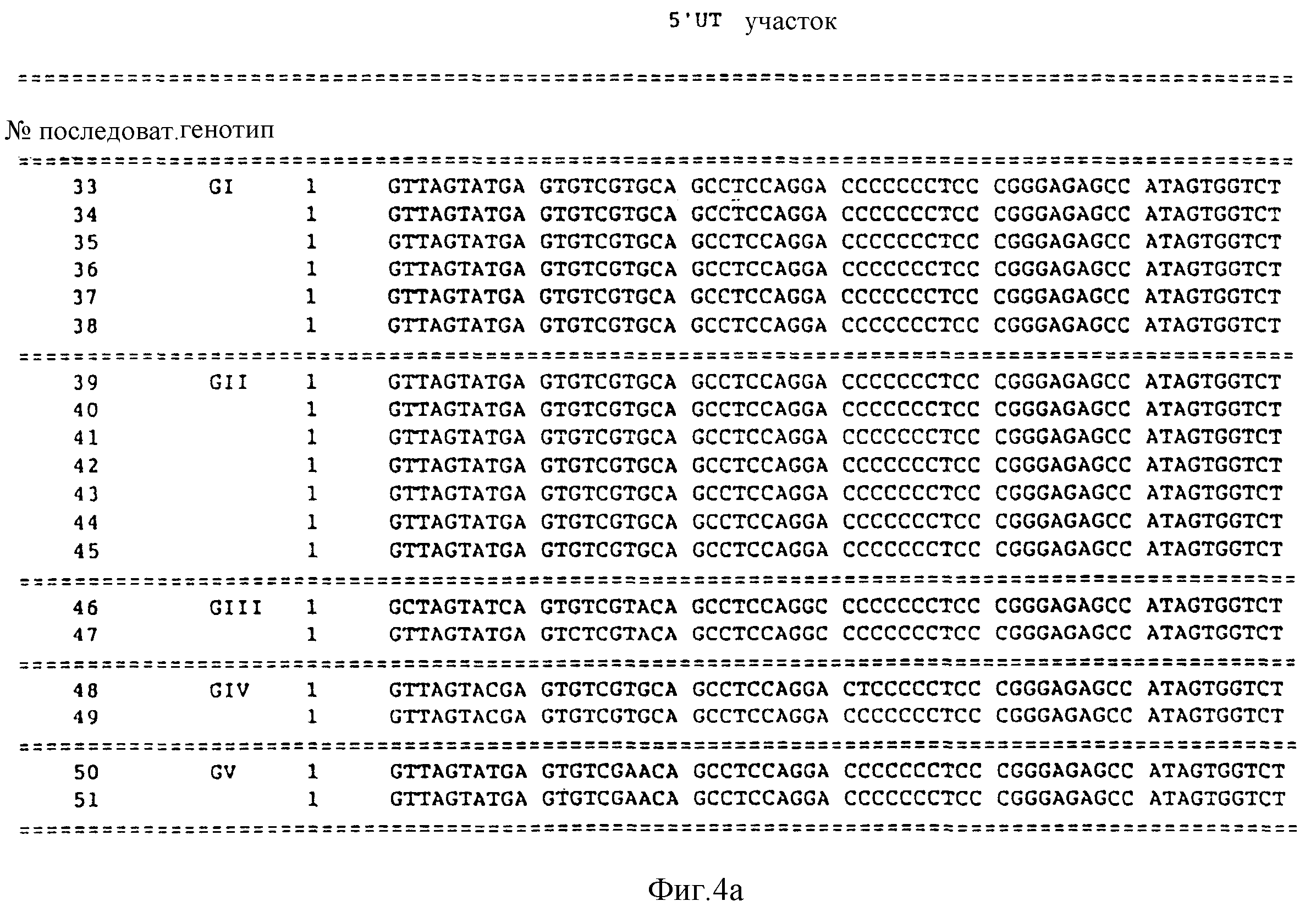
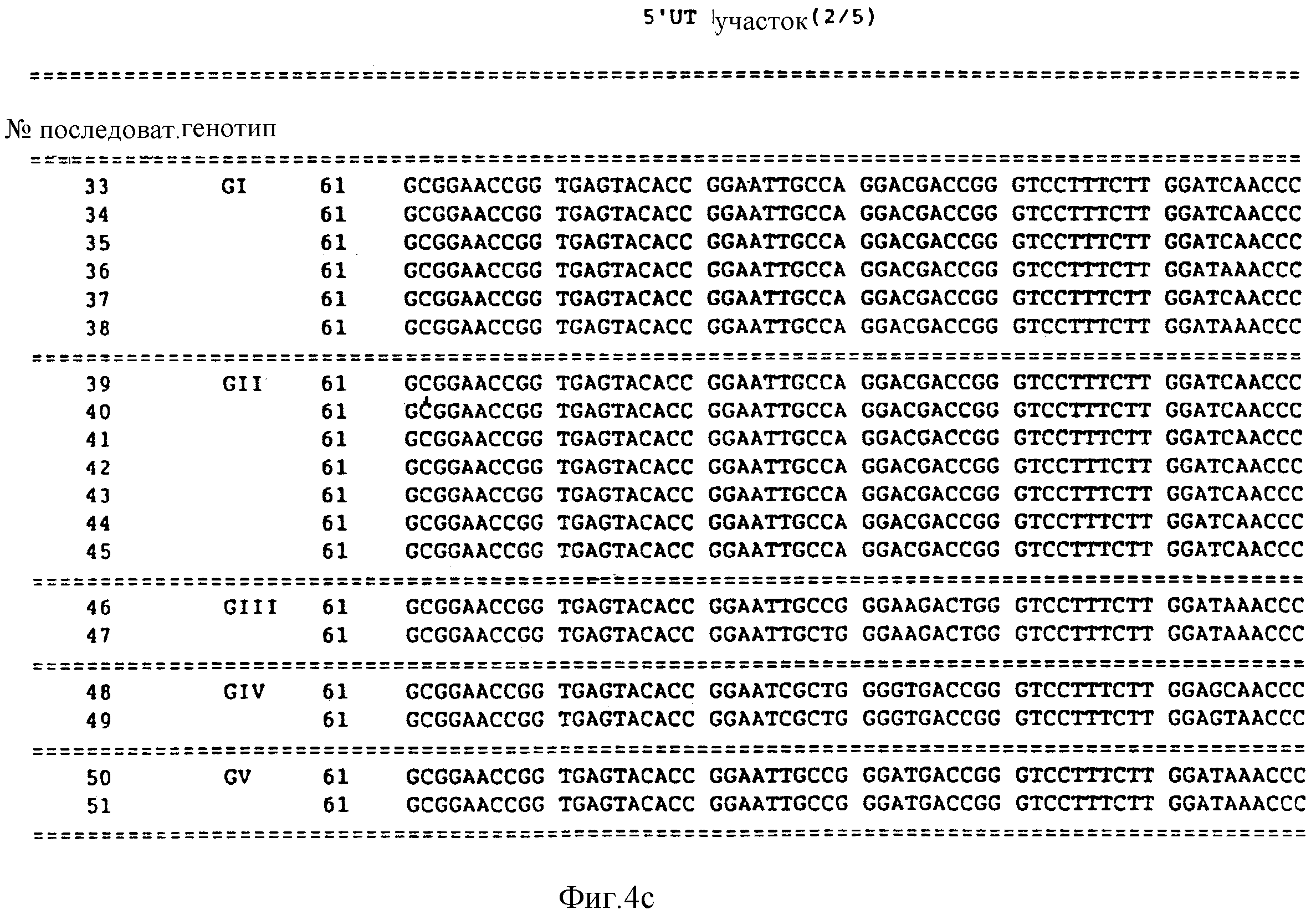
33-51, причем эти последовательности получены и 5'UT участка генома вируса HCV;
фиг. 5 изображает последовательности нуклеиновых кислот под номерами 52-66, причем эти
последовательности
получены из участка ядра генома вируса HCV.
Описание последовательностей представляет далее последовательности под номерами 1-147 (см. в конце описания).
Далее настоящее изобретение будет описано подробно, как нуклеиновая кислота с последовательностью, которая соответствует HCV геному, и родственные пептиды, и связывающие партнеры, для диагностического и терапевтического применений.
В практике настоящего изобретения будут использованы, если нет других указаний, обычные методики химии, молекулярной биологии, микробиологии, рекомбинантной ДНК и иммунологии, которые известны специалистам в данной области. Такие методики подробно описаны в литературе. См. Maniatis, Fitsch and Sambrook, Molecular Cloning; a Laborafory Manual (1982); DNA Cloning, Volumes I and II (D.N.Glover ed 1985); Oligonucleatide Syntnesis (M.J.Gait ed 1984); Nucleic Acid Hybridijation (B.D.Hames and S.J.Higgins eds. 1984); серия Methods in Enjymology (Academic Press, Anc.), особенно Vol. 154 and Vol. 155 (Wu and Grossman, eds.).
кДНК библиотеки получены из последовательностей нуклеиновх кислот, которые присутствуют в плазме HCV- инфицированных шимпанзе. Конструирование одной из таких библиотек, "с" библиотеки (АТСС N 40394) раскрыто в РСТ публикации N 090/14436. Последовательности библиотеки, относящиеся к настоящему изобретению, представлены далее как последовательности под номерами 1, 23, 33 и 52.
Нуклеиновые кислоты, выделенные или синтезированные в соответствии с отличительными особенностями настоящего изобретения, можно использовать, например (но не ограничиваясь этими применениями) в качестве зондов, праймеров, анти-смысловых генов, и для разработки систем экспрессии для синтеза пептидов, соответствующих таким последовательностям.
Описанные последовательности нуклеиновых кислот определяют генотипы HCV по отношению к четырем участкам вирусного генома. На фиг. 1 схематически изображена организация HCV. Представляющие интерес четыре участка являются NS5 участком, участком I оболочки, 5' UT участком и участком ядра.
Представленные далее последовательности в настоящем изобретении представлены под номерами 1-22, предполагают наличие, по крайней мере, пяти генотипов в NS5 участка. Последовательности под номерами 1-22 изображены на фиг. 2, а также перечислены в разделе описание последовательностей. Каждая из последовательностей 1-22 получена из нуклеиновой кислоты, содержащей 40 нуклеотидов из NS 5 участка.
Пять генотипов определяются группировками последовательностей, определенных последовательностями под номерами 1-22. Для удобства им далее будут присвоены латинские номера и буква "G".
Первый генотип (GI) представлен последовательностями из числа последовательностей под номерами 1-6. Второй генотип (G11) представлен последовательностями в числе последовательностей под номерами 7-12. Третий генотип (GIII) представлен последовательностями из числа последовательностей под номерами 13-17. Четвертый генотип (GIV) представлен последовательностями из числа последовательностей под номерами 20-22. Пятый генотип (GV) представлен последовательностями из числа последовательностей под номерами 18 и 19.
Представленные далее в настоящем изобретении последовательности под номерами 23-32 предполагают, по крайней мере, четыре генотипа в участке I оболочки HCV. Последовательности под номерами 23-32 изображены на фиг. 3, а также перечислены в описании последовательностей. Каждая из последовательностей 23-32 получена из нуклеиновой кислоты, содержащей 100 нуклеотидов из участка I оболочки.
Первая группа генотипа I оболочки (GI) представлена последовательностью из числа последовательностей 23-25. Второй участок генотипа I оболочки (GII) представлен последовательностью под номерами 26-28. Третий генотип I оболочки (GIII) представлен последовательностью из числа последовательностей под номерами 32. Четвертый генотип I оболочки (GIV) представлен последовательностью из числа последовательностей под номерами 29-31.
Представленные далее в рассматриваемой заявке последовательности под номерами 33-51 предполагают, по крайней мере, три генотипа в 5'UT участке HCV. Последовательности под номерами 33-51 изображены на фиг. 4, а также перечислены в описании последовательностей. Каждая из последовательностей под номерами 33-51 получена из нуклеиновой кислоты, содержащей 252 нуклеотида из 5'UT участка, хотя последовательности 50 и 51 несколько короче на приблизительно 180 нуклеотидов.
Первый из 5'UT генотип (GI) представлен последовательностью в числе последовательностей под номерами 33-38. Второй 5'UT генотип (GII) представлен последовательностями из числа последовательностей под номерами 39-45. Третий 5'UT генотип (GIII) представлен последовательностями из числа последовательностей под номерами 46-47. Четвертый 5'UT генотип (GIV) представлен последовательностями из числа последовательностей под номерами 48 и 49. Пятый генотип 5'UT(GV) представлен последовательностями из числа последовательностей под номерами 50 и 51.
Последовательности под номерами 48-62, предполагают, по крайней мере, три генотипа в участке ядра HCV. Последовательности под номерами 52-66 изображены на фиг. 5, а также перечислены в описании последовательностей.
Первый генотип участка ядра (GI) представлен последовательностями из числа последовательностей под номерами 52-57. Второй генотип (GII) участка ядра представлен последовательностями из числа последовательностей под номерами 58-64. Третий генотип (GIII) участка ядра представлен последовательностями из числа последовательностей под номерами 65-86. Последовательности под номерами 52-65 содержат 549 нуклеотидов. Последовательность под номером 66 содержит 510 нуклеотидов.
Различные генотипы, описанные по отношению к каждому из участков, совместимы. То есть, HCV, имеющий отличительные особенности первого генотипа по отношению к NS5 участку, будут существенно соответствовать особенностям первого генотипа участка I оболочки, 5'UT участка и участка ядра первого генотипа.
Нуклеиновые кислоты, выделенные или синтезированные в соответствии с последовательностями под номерами 1-66, представленные далее, можно использовать в качестве зондов, праймеров, лигандов-ловушек и анти-смысловых агентов. В качестве зондов праймеров, лигандов-ловушек и анти-смысловых агентов нуклеиновые кислоты обычно содержат приблизительно восемь или более нуклеотидов для специфичности, а также для того, чтобы они были способны образовывать стабильные продукты гибридизации.
Зонды
Нуклеиновые кислоты, выделенные или синтезированные в соответствии с последовательностями,
определяющими конкретный генотип участка HCV
генома, можно использовать в качестве зонда для определения такого генотипа или использовать в сочетании с другими зондами нуклеиновых кислот для
определения практически всех генотипов HCV.
Учитывая информацию о последовательностях, представленную далее в рассматриваемой заявке, последовательности из восьми или более нуклеотидов идентифицированы, что обеспечивает необходимую целостность и уникальность по отношению к различным генотипам HCV и последовательностям посторонних нуклеиновых кислот, которые могли быть вовлечены в гибридизацию в данных условиях.
Специалистам в данной области легко понять, что последовательности нуклеиновых кислот для использования в качестве зондов должны быть снабжены метками для облегчения детектирования продукта гибридизации.
Лиганд-ловушка
Для использования в качестве лиганда-ловушки нуклеиновая кислота, выбранная описанным ранее способом по
отношению к зонду, должна легко
связываться с носителями. Способы, которыми нуклеиновые кислоты могут быть связаны с носителями, хорошо известны. Нуклеиновые кислоты, имеющие последовательности,
соответствующие последовательностям
из числа последовательностей 1-66, можно использовать для отделения вирусной нуклеиновой кислоты одного генотипа от нуклеиновых кислот HCV других генотипов.
Нуклеиновые кислоты, выделенные или
синтезированные в соответствии с последовательностями из числа последовательностей под номерами 1-66, использованные в комбинациях, можно использовать для
улавливания практически всех нуклеиновых
кислот всех генотипов HCV.
Праймеры
Нуклеиновые кислоты, выделенные или синтезированные в соответствии с описанными далее
последовательностями, можно использовать в качестве
праймеров для амплификации HCV последовательностей. Что касается методик полимеразных цепных (PCR) реакций, последовательности нуклеиновых кислот
из восьми или более нуклеотидов, соответствующих одной
или более из последовательностей перечисленных под номерами 1-66, можно использовать в сочетании с подходящими энзимами и реагентами для
создания копий вирусной нуклеиновой кислоты. Множество
праймеров, имеющих последовательности, соответствующие более чем одному генотипу, можно использовать для создания копий вирусной нуклеиновой
кислоты для таких генотипов.
Эти копии можно использовать в диагностическом анализе для детектирования HCV вируса. Эти копии можно также включить в векторы клонирования и экспрессии для создания полипептидов, соответствующих нуклеиновым кислотам, синтезированным с помощью PCR, что будет более подробно описано далее.
Анти-смысловые
Нуклеиновые кислоты,
выделенные или синтезированные в соответствии с описанными
здесь последовательностями, можно использовать в качестве анти-смысловых генов для предотвращения экспрессии HCV.
Нуклеиновую кислоту, соответствующую генотипу HCV, помещают в подходящий носитель, например в липосому, для введения в клетку инфицированную HCV. Нуклеиновая кислота, содержащая восемь или более из нуклеотидов, способна связывать вирусную нуклеиновую кислоту или вирусную мРНК. Предпочтительно, чтобы анти-смысловая нуклеиновая кислота состояла из 30 или более нуклеотидов для обеспечения необходимой стабильности продукта гибридизации вирусной нуклеиновой кислоты или вирусной мРНК. Способы введения анти-смысловой нуклеиновой кислоты известны специалистам, и примеры их представлены в патенте США 4241046, выданном 23 декабря 1980 г. Papahadjopoulos et al.
Синтез пептидов
Нуклеиновые кислоты, выделенные или синтезированные в соответствии с описанными здесь
последовательностями, можно использовать для создания пептидов.
Последовательности, представленные последовательностями под номерами 1-32 и 52-66, можно клонировать в соответствующие векторы или
использовать для выделения нуклеиновой кислоты. Выделенные
нуклеиновые кислоты объединяют с подходящими ДНК линкерами и клонируют в подходящий вектор. Такой вектор можно использовать для
трансформации подходящего организма хозяина, например, E.coli, и
выделить пептид, закодированный этой последовательностью.
Методика молекулярного клонирования описана в тексте: Molecular Cloning: a Laboratory Manual, Maniatis et al., Coldspring Habor Laboratory (1982).
Выделенный пептид можно использовать в качестве антигенного вещества для выработки вакцин и антител к конкретному генотипу HCV.
Вакцины и
антитела
Пептидный материал настоящего изобретения можно использовать для выработки антител и вакцин.
Способность кДНК последовательностей или полученных из нее нуклеотидных последовательностей (включая сегменты и модификации последовательности) позволяют конструировать векторы экспрессии, кодирующие антигенно активные участки пептида, закодированного в каждой из нитей. Участки антигенно активные можно получить из NS5 участка, участков I оболочки и участка ядра.
Фрагменты, кодирующие целевые пептиды, получают из клонов кДНК, используя обычное рестрикционое переваривание или синтетическими способами, и лигируют в векторы, которые могут, например, содержать части слитых последовательностей, такие как бетагалактозидаза или супероксиддисмутаза (SOD), предпочтительно, SOD. Способ и векторы, которые пригодны для получения полипептидов, которые содержат слитые последовательности SOD, описаны в Европейской патентной открытой публикации 0196056, опубликованной 1 октября 1986 г.
Любую нужную часть HCV кДНК, содержащую открытую считывающую рамку, в любой смысловой нити, можно получить в виде рекомбинантного пептида, как например, зрелого или слитого протеина; в другом варианте, пептид, закодированный в кДНК, можно получить химическим синтезом.
ДНК, кодирующую целевой пептид, независимо от того, зрелый ли он или сплавленный, содержит ли он сигнальную последовательность, позволяющую секрецию или нет, можно лигировать в векторы экспрессии, подходящие для любого обычного хозяина. В настоящее время для образования рекомбинантных пептидов используют как эукариотные, так и прокариотные системы хозяев. Затем пептид выделяют из лигированных клеток или из культуральной среды и очищают до степени, необходимой для целевого использования. Очистку можно вести способами, известными специалистам, например дифференциальной экстракцией, солевым фракционированием, хроматографией на ионообменой смоле, афинной хроматографией, центрифугированием и т.п. См., например, "Способы в энзимологии для различных способов очистки протеинов". Такие пептиды можно использовать для диагностических целей, или те, которые являются источником нейтрализующих антител, можно приготовить в виде вакцин. Антитела, вырабатываемые против таких пептидов, также можно использовать как средства диагностики, или для пассивной иммунотерапии, или для выделения и идентификации HCV.
Антигенный участок пептида обычно относительно мал - обычно от 8 до 10 аминоксилот или менее в длину. Его фрагменты, столь малые, как 5 аминокислот, могут характеризовать участок антигена. Эти сегменты могут соответствовать NS5 участку, участку I оболочки и участку ядра HCV генома. Участок 5'UT, по-видимому, не транслируется. Соответственно, используя кДНК таких участков, ДНК-кодирующие короткие сегменты HCV пептидов, соответствующие этим участкам, можно рекомбинантно экспрессировать либо как слитые протеины, либо как выделенные пептиды. Кроме того, короткие аминокислотные последовательности можно удобно получать химическим синтезом. Так, например, в тех случаях, когда синтезированный пептид создан с правильной конфигурацией для обеспечения правильного эпитопа, но слишком мал, чтобы быть иммуногенным, пептид можно связать со стабильным носителем.
Специалистам известен целый ряд методик получения таких связей, включая образование дисульфидных связей, используя N-сукцинимидил-3-(2-пиридилтио)пропионат (SPDP) и сукцинимидил 4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), полученный от Pierce Company, Rockford, Illinois (если у пептида отсутствует сульфгидрильная группа, это можно обеспечить, добавляя цистеиновый остаток). Эти реагенты создают дисульфидные связи между ними и пептидными цистеиновыми остатками на одном протеине и амидные связи за счет эпсилон-амино на лизине или других свободных аминогруппах на другом. Известно множество таких агентов, образующих связи дисульфид/амид). См., например, Immun Rev (1982) 62:185. Другие буфункциональные сшивающие агенты образуют скорее тиоэфирные, а не дисульфидные связи. Многие из тио-эфир-образующих агентов коммерчески доступны и включают реакционноспособные сложные эфиры 6-малимидокапроновой кислоты, 2-бромуксусной кислоты, 2-иодоуксусной кислоты, 4-(N-малимидометил)циклогексан-1-карбоновой кислоты и т.п. Карбоксигруппы можно активировать, объединяя их с сукцинимидом или 1-гидроксил-2-нитро-4-сульфоновой кислотой, натриевой солью. Дополнительные способы сшивания антигенов используют ротавирус ("Связывающая пептидная" система, описанная в EPO публикации N 249149), раскрытие которого включено сюда по ссылке. Предшествующий список не претендует на исчерпывающий, и, конечно, можно использовать модификации указанных соединений.
Можно использовать любой носитель, который сам по себе не вызывает продуцирования антител, вредных для хозяина. Подходящие носители являются обычно крупными медленно метаболизируемыми макромолекулами, такими как протеины; полисахариды, такие как латексом функционализированная сефароза, агароза, целлюлоза, целлюлозные шарики и т.п.; полимерные аминокислоты, такие как полиглутаминовая кислота, полилизин и т.п.; сополимеры аминокислот; и инактивированные вирусные частицы. Особенно подходящими протеиновыми субстратами являются сывороточные альбумины, гемоцианин лимфы улитки, молекулы иммуноглобулина, тироглобулина, яичного альбумина, токсоид столбняка и другие протеины, хорошо известные специалистам.
Пептиды, составляющие HCV аминокислотные последовательности, кодирующие, по крайней мере, один вирусный эпитот, полученные из участков NS5, оболочки I и ядра, можно использовать в качестве иммунологических реагентов. 5'UT участок, по-видимому, не транслируется. Так, например, пептиды, содержащие такие усеченные последовательности, можно использовать в качестве реагентов в иммуноанализе. Эти пептиды известны так же, как кандидаты на субъединицы антигенов в композициях для получения антисывороток или вакцин. Хотя усеченные последовательности можно получить различными известными обработками нативного вирусного протеина, обычно предпочтительно получать синтетические или рекомбинантные пептиды, содержащие HCV последовательность. Пептиды, содержащие такие усеченные HCV последовательности, могут состоять из вплоть до полной HCV последовательности (один или более эпитопов, либо непрерывно, либо не непрерывно), или HCV последовательностей и гетерологических последовательностей в слитом протеине. Подходящие гетерологические последовательности включают последовательности, которые обеспечивают секрецию из рекомбинантного хозяина, повышают иммунологическую реакционную способность HCV эпитопа(ов) или облегчают сшивку полипептида с носителем для иммуноанализа или с носителем вакцины. См., например, E.G., EPO публ. N 116201; патент США 4722840; EPO публ. N 259149; патент США 4629783.
Размер пептидов, содержащих усеченные HCV последовательности, может меняться в широких пределах, причем минимальный размер представляет последовательность достаточного размера, чтобы получать HCV эпитоп, тогда как максимальный размер не является критическим. Для удобства максимальный размер не должен быть существенно больше размера, необходимого для создания целевых HCV эпитопов и функций гетероциклической последовательности. Обычно усеченная HCV аминокислотная последовательность находится в интервале от около 5 до около 100 аминокислот в длину. Чаще, однако, HCV последовательность содержит максимум около 50 аминокислот в длину, предпочтительно, максимум около 30 аминокислот. Обычно желательно выбирать HCV последовательности, по крайней мере, из около 10, 12 или 15 аминокислот, вплоть до максимального числа около 20 или 25 аминокислот.
HCV аминокислотные последовательности, содержащие эпитопы, можно идентифицировать рядом способов. Так, например, полную последовательность протеинов, соответствующую каждому из участков HS5, оболочки I и ядра можно скринировать, получив серию коротких пептидов, которые вместе составляют полную протеиновую последовательность таких участков. Начиная, например, с пептидов приблизительно в 100 аминокислот, принято тестировать каждый пептид на наличие эпитопа (эпитопов), обладающих нужной реакционной способностью, а затем тестировать последовательно меньшие и перекрывающиеся фрагменты из идентифицированных пептидов из 100 аминокислот для получения карты представляющего интерес эпитопа. Скрининг таких пептидов в иммуноанализе известен специалистам в этой области. Известно также проведение компьютерного анализа протеиновой последовательности для идентификации потенциальных эпитопов, а затем получения пептидов, содержащих идентифицированные участки для скрининга.
Иммуногенность эпитопов HCV можно также повысить, приготавливая их в системах млекопитающих или дрожжей, слитых или скомпонованных с такими образующими частицы протеинами, как, например, такими, которые связаны с антигеном поверхности гепатита B. См., например, патент США 4722840. Конструкции, в которых HCV эпитоп связан непосредственно с последовательностями, кодирующими образующий частицы протеин, продуцируют гибриды, которые иммуногенны по отношению к HCV эпитопу. Кроме того, все полученные векторы включают эпитопы, специфичные к HBV, имеющие различные степени иммуногенности такие, как например, пре-S-пептид. Так, частицы, сконструированные из протеина образующего частицы, который включает HCV последовательности, являются иммуногенными по отношению к HCV и HBV.
Гепатитные поверхностные антигены (HBSAg), как было показано, образованы и собраны в частицы в S.cerevisiae (P. Valenzuela et al. (1982)), а также, как например, в клетках млекопитающих (P. Valenzuela et al. (1984)). Образование таких частиц, как было показано, повышает иммуногенность мономерной субъединицы. Такие конструкции также могут включать иммунодоминантный эпитоп HBSAg, содержащий 55 аминокислот преповерхностного (пре-S) участка. Neurath et al. (1984). Конструирование пре-S-HBSAg частиц, экспрессируемых в дрожжи, раскрыто в EPO 174444, опубликованной 19 марта 1986; гибриды, включающие гетерологические вирусные последовательности для дрожжевой экспрессии, раскрыты в EPO 175261, опубликованный 26 марта 1966 г. Эти конструкции можно также экспрессировать в клетки таких млекопитающих, как клетки яичника китайского хомяка (CHO), используя SV 40-дигидрофолат-редуктазный вектор (Michelle et al. (1984)).
В дополнении, часть последовательности, кодирующей образующий частицы протеин, можно заменить кодонами, кодирующими HCV эпитоп. При такой замене участки, которые не требуются для аггрегации фрагментов до образования иммуногенных частиц млекопитающих, можно исключить в дрожжах, тем самым, исключая дополнительные HBV антигенные сайты из конкуренции с HCV эпитопами.
Вакцины
Можно получить вакцины от одного или более иммуногенных пептидов, полученных из HCV. Наблюдаемая
гомологичность между HCV и Flavi вирусами обеспечивает информацию относительно
пептидов, которые, по-видимому, наиболее эффективны в качестве вакцин, а также как участки генома, в которых они
закодированы.
Мультивалентные вакцины против HCV могут содержать один или более из эпитопов из одного или более протеинов, полученных из участков NS5, оболочки I и ядра. В частности, предлагаются вакцины, содержащие один или более из HCV протеинов или антигенов субъединиц, полученных из участков NS5, оболочки I и ядра. 5'UT участок, по-видимому, не транслируется.
Специалистам известны препараты вакцин, которые содержат иммуногенный пептид в качестве активного ингредиента. Обычно такие вакцины получают в виде жидких растворов или суспензий для инъекций; в твердых формах, пригодных для приготовления из них растворов или суспензий непосредственно перед инъекцией. Эти препараты могут быть также эмульгированы или протеин может быть инкапсулирован в липосомах. Активные иммуногенные ингредиенты часто смешивают с эксципиентами, которые приемлемы фармацевтически и совместимы с активным ингредиентом. Подходящими эксципиентами являются, например, вода, физиологический раствор, декстроза, глицерин, этанол или тому подобные и их сочетания. Кроме того, при желании вакцины могут содержать небольшие количества таких вспомогательных веществ, как смачивающие или эмульгирующие агенты, буферирующие pH агенты, и/или адъюванты, которые повышают эффективность вакцины. Примеры эффективных адъювантов могут включать (но не ограничиваются ими): гидроксид алюминия, N-ацетил-мурамил-L-теронил-D-изоглутамин (thr-MDP), N-ацетил-нор-мумамил-L-аланил-D-изоглутамин (CGP 11637, обозначаемый как нор-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланил-2(1-2-дипалмитоил-Sn-глицеро-3-гидроксифосфорилокси)-этиламин (CGP 19835A, обозначаемый MTP-PE), и RIBI, который содержит три компоненты, экстрагированные из бактерий, монофосфориллипид A, трегалоздимиколат и скелет клеточных стенок ((MPL+TDM+CWS) в 2% смеси сквален/твин 80 эмульсии. Эффективность адъюванта можно определить, измеряя количество антител, направленных против иммуногенного пептида, содержащего HCV антигенную последовательность, полученную при введении этого пептида в вакцины, которые также содержат различные адъюванты.
Обычно вакцины вводят парэнтерально путем инъекций, например, подкожных или внутримышечных. Дополнительные композиции, которые пригодны для других способов введения, включают суппозитории и, в некоторых для других способов введения, включают суппозитории и, в некоторых случаях, композиции для орального приема. Для суппозиториев можно использовать традиционные связующие и носители, например, полиалкиленгликоли или триглицериды; такие суппозитории можно приготовить из смесей, содержащих активный ингредиент в интервале от 0,5 до 10%, предпочтительно, 1-2%. Композиции для орального приема включают также обычно используемые эксципиенты, как, например, маннит, лактоза, крахмал, стеарат магния, натрийсахарин, целлюлоза, карбонат магния и т. п. фармацевтической степени чистоты.
Приводимые ниже примеры служат лишь целям иллюстрации и не должны ограничивать объем настоящего изобретения.
I. Определение HCV PHK в сыворотке.
PHK экстрагируют из сыворотки, используя соль гуанидиния, фенол и хлороформ по способу изготовителя набора (RNAzolm B kit, Cinna/Biotecx). Экстрагированную PHK осаждают изопропанолом и промывают этанолом. 25 мкл полной сыворотки обрабатывают для выделения PHK, и очищенную PHK снова суспендируют в 5 мкл воды, обработанной диэтилпирокарбонатом для последующего синтеза кДНК.
II. Синтез кДНК и амплификация полимеразной цепной реакции (PCR)
В таблице 1 перечислены
последовательности и положения (со ссылкой на HCV I) для всех PCR
праймеров и зондов, использованных в этих примерах. Буквенные обозначения для нуклеотидов соответствуют 37 C.F.P. (185)(185) 1821
- 1825; Так, буквами A, C, G, T и U обозначены обычные
последовательности аденина, цитозина гуанина, тимина и урацила. Буква M обозначает A или C, R означает A или G, W означает A или T/U; V означает
A или G, но не T/U; H означает A или C или T/U, но не G,
D означает A или G или T/U, но не C; B означает C или G или T/U, но не A; N означает (A или C или G или T/U) или (неизвестный или другой).
Для синтеза кДНК и PCR амплификации использовали протокол разработанный Perkin-Elmer Cetus/GeneAmp® RNA PCR kiT). Для примирования реакции обратной транскрипции (RT) использовали и случайные гексамеры и праймеры со специфическими комплементарными последовательностями к HCV. Все процессы, кроме добавления и перемешивания компонентов реакции, осуществляли в термоциклере (MJ Research, Inc. ). Реакцию синтеза первой нити кДНК инактивировали при 99oC в течение 5 мин, а затем охлаждали при 50oC в течение 5 мин, перед добавлением компонентов реакции для последующей амплификации. После начальных 5 циклов при 97oC в течение 1 мин, 50oC в течение 2 мин и при 72oC в течение 3 мин, провели 30 циклов при 94oC в течение 1 мин, 55oC в течение 2 мин, 72oC в течение 3 мин, а затем провели финальные 7 мин удлинения при 72oC.
Для анализа генотипов использовали последовательности 67 и 68 в качестве праймеров в реакции PCR. Эти праймеры амплифицируют сегмент, соответствующий участкам ядра и оболочки. После амплификации продукты реакции выделяют на агарозном геле, а затем переносят на нейлоновую мембрану. Иммобилизованным продуктам реакции дают возможность гибридизоваться с32P-меченой нуклеиновой кислотой, соответствующей либо генотипу I (ядро или оболочка I). Нуклеиновая кислота, соответствующая генотипу I, содержит последовательности под номерами 69 (ядро), 71 (оболочка) и 73 (оболочка). Нуклеиновая кислота, соответствующая генотипу II, содержит последовательности под номерами 70 (ядро), 72 (оболочка) и 74 (оболочка).
Зонды генотипа I гибридизуются только с продуктами, амплифицированными из изолятов, в которых есть последовательность генотипа I. Аналогично, зонды генотипа II гибридизуются только с продуктами, амплифицированными из изолятов, в которых есть последовательность генотипа II.
В других экспериментах продукты PCR создавали, используя последовательности 79 и 80. Эти продукты анализировали описанным ранее способом, за исключением того, что последовательность N 73 использовали для определения генотипа I, последовательность N 74 использовали для определения генотипа II, последовательность N 77 (5'UT) использовали для определения генотипа III, и последовательность N 78 (5'UT) использовали для определения гепотипа IV. Каждую из последовательностей гибридизовали способом, специфическим для генотипа.
III. Детектирование HCV Gi-GIV с применением сэндвичного гибридизационного
анализа для HCV PHK
В этом примере описан формат анализа сэндвичной гибридизации нуклеиновой кислоты
амплифицированного раствора. Формат анализа использует несколько зондов нуклеиновых кислот
для осуществления захвата и детектирования. Нуклеиновая кислота зонда-ловушки способна ассоциироваться с
комплементарным зондом, связанным с твердым носителем, и нуклеиновой кислотой HCV для
осуществления захвата. Нуклеиновая кислота детектирующего зонда имеет первый сегмент (A), который связывает с
нуклеиновой кислотой HCV, и второй сегмент (B), который гибридизует со второй
амплификаторной нуклеиновой кислотой. Амплификаторная нуклеиновая кислота имеет первый сегмент (B*), который
гибридизует с сегментом (B) зондовой нуклеиновой кислоты и также содержит
пятнадцать итераций сегмента (C). Сегмент C амплификаторной нуклеиновой кислоты способны гибридизоваться с тремя мечеными
нуклеиновыми кислотами.
Последовательности нуклеиновых кислот, которые соответствуют нуклеиотидным последовательностям гена оболочки I изолятов I группы HCV, представлены далее в последовательностях под номерами 81 - 98. В приведенной далее таблице 2 приведены участки генома HCV, которым соответствуют последовательности нуклеиновых кислот, и предпочтительное использование последовательностей.
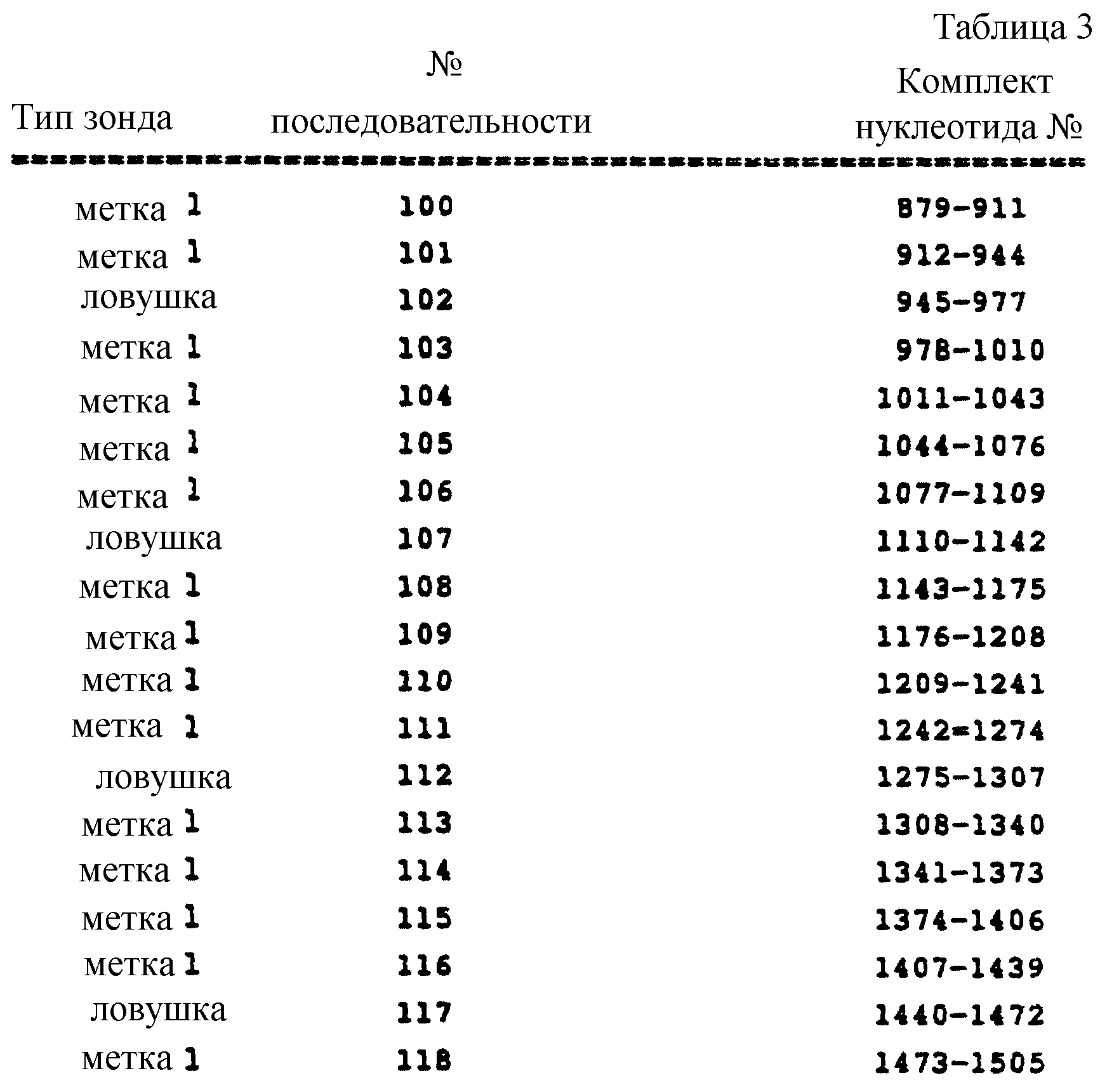
Последовательности нуклеиновых кислот, которые соответствуют нуклеотидным последовательностям гена оболочки I изолятов HCV группы II, представлены далее в последовательностях 100 - 108. В таблице 3 представлены участки генома HCV, которым соответствуют нуклеиновые кислоты, и предпочтительное использование этих последовательностей.
Последовательности нуклеиновых кислот, которые соответствуют нуклеотидным последовательностям в гене C, и 5'UT участке, представлены далее в последовательностях 119 - 145. В таблице 4 представлены последовательности с их предпочтительным применением.
Детектирующие и улавливающие зонды HCV - специфические сегменты, и их соответствующие названия, использованные в данном анализе, были следующими.
Последовательности-ловушки представляют последовательности под номерами 119-122 и 141-144.
Детектирующие последовательности являются последовательностями под номерами 119-140.
Каждая
детектирующая последовательность содержит, кроме последовательностей, практически комплементарных последовательностям HCV, 5'UT
удлиняющий сегмент (B), причем этот удлиняющий сегмент (B) является
комплементарным сегменту второй амплификаторной нуклеотидной кислоты. Удлиняющая (B) последовательность идентифицирована в описании
последовательностей под номером последовательности 146 и приводится
ниже:
AGGCATAGGACCCGTGTCTT
Каждая последовательность-ловушка содержит, помимо последовательностей, практически
комплементарных HVC последовательностям, последовательность,
комплементарную ДНК, связанной с твердой фазой. Последовательность, комплементированная ДНК, связанной с твердым носителем, расположена в
прямом направлении от последовательности-ловушки.
Последовательность, комплементарная ДНК, связанной с носителем, представлена далее как последовательность N 147:
CTTCTTTGGAGAAAGTGGTG
Микротитровальные пластины приготавливают
следующим образом
White Microlite 1 Removawell strips (микротитровальные пластинки из полистирола, 96 ячеек/пластину) получены от Dynatech
Jnc.
В каждую ячейку помещают 200 мкл 1 н. HCl и инкубируют при комнатной температуре в течение 15 - 20 мин. Затем пластинки 4 раза промывают IX PBS, и ячейки освобождают от жидкости. Затем ячейки заполняют 200 мкл 1 н. NaOH, и инкубируют при комнатной температуре в течение 15 - 20 мин. Затем пластинки снова промывают четыре раза IX PBS, и ячейки осушают, удаляя жидкость.
Poly (phe-lys) получая от Сигма Кемикалз Инк. Этот полипептид имеет молярное отношение phe: lys 1:1, и средний MB 47900 гм/моль. Средняя длина его 309 аминокислот, и он содержит 155 аминов/моль. 1 мг/мл раствора полипептида смешивают с 2 М NaCl/IX PBS до окончательной концентрации 0,1 мг/мл (pH 6,0). В каждую ячейку добавляют по 200 мкл этого раствора. Затем плотину оборачивают пластиком для предотвращения усыхания и инкубируют при 30oC в течение ночи. Затем пластину четыре раза промывают IX PBS, и жидкость из ячеек удаляют.
Следующую процедуру используют для соединения нуклеиновой кислоты, комплементарной последовательности 147, с пластиной, здесь и далее, именуемую иммобилизованной нуклеиновой кислотой. Синтез иммобилизованной нуклеиновой кислоты, содержащей последовательность, комплементарную последовательности N 133, описан в EPA 883096979. 20 мг дисукцинимидилсуберата растворяют в 300 мкл диметилформамида (DMF). 26 единиц ОД260 иммобилизованной нуклеиновой кислоты добавляют к 100 мкл сшивающего буфера (50 мМ натрийфосфат, pH 7,8) Сшивающую смесь добавляют затем к раствору DSS-DMF и перемешивают магнитной мешалкой в течение 30 мин. Колонку NAP-25 уравновешивают 10 мМ натрийфосфатом, pH 6,5. Сшивающую смесь DSS-DMF раствора добавляют к 2 мл 10 мМ натрийфосфата рН 6,5 при 4oC. Полученную смесь перемешивают и помещают в уравновешенную NAP-25 колонку. ДНК активированной ДНК, иммобилизованной нуклеиновой кислоты элюируют из колонки 3,5 мл 10 мМ натрийфосфата, pH 6,5. 5,6 ОД260 единиц элюированной ДНК DSS-активированной иммобилизованной нуклеиновой кислоты добавляют к 1500 мл 50 мМ натрийфосфата, pH 7,8. Объем 50 мкм этого раствора добавляют в каждую ячейку, и пластины инкубируют в течение ночи. Затем пластины 4 раза промывают IX PBS, и из ячеек удаляют жидкость.
Окончательную очистку пластин осуществляют следующим образом: 200 мкм 0,2 г NaOH, содержащего 0,5% (вес/объем) SDS, добавляют в каждую ячейку. Пластины оборачивают пластиком и инкубируют при 65oC в течение 60 мин. Затем пластины 4 раза промывают и из ячеек удаляют жидкость. Очищенные пластины хранят с осушающими шариками при 2 - 8oC.
Образцы сыворотки, подлежащие анализу, анализируют, используя PCR с последующим анализом последовательностей для определения генотипа.
Препараты образцов, состоящие из поставляемых 650 мкл образцов сыворотки 150 мкл P-K буфера (2 мг/мл протеиназы K в 53 мМ Tris -HCl, pH 8,0/0,6 мМ NaCl/0,06 М цитрата натрия/8 мМ ЕДТА, pH 8,0/1,3% SDS /16 мкг/ мл обработанной ультразвуком спермы лосося ДНК (7% формамид/5,0 f молей зондов-ловушек/160 f молей детекторных зондов) в каждую ячейку. Пластины встряхивают для перемешивания содержимого а ячейках, закрывают и инкубируют в течение 16 часов при 62oC.
После 10-минутного пребывания при комнатной температуре содержимое каждой из ячеек отсасывают для удаления всей жидкости, и ячейки промывают 2X промывочным буфером (0,1% SDS) 0,015 М NaCl/0,015 М цитрата натрия). Затем в каждую ячейку добавляют амплификаторную нуклеиновую кислоту (50 мкл 0,7 молей/мкл раствор в 0,048 М NaCl/0,048 М цитрат натрия/0,1% SDS /0,5% "блокирующего реагента" (Boehringer Mannheim, каталог N 1096176)). Пластины закрывают, и перемешивают содержимое в ячейках, затем их инкубируют в течение 30 минут при 52oC.
После 10-минутного пребывания при комнатной температуре ячейки промывают описанным ранее способом.
Затем в каждую ячейку добавляют меченую нуклеиновую кислоту щелочной фосфатазы, раскрытую в EP 883096976 (50 мкл/ячейку 2,66 f молей/мкл). После инкубирования при 52oC в течение 15 мин и 10 мин при комнатной температуре ячейки промывают дважды как указано ранее, а затем 3X 0,015 М NaCl/0,0015 M цитрат натрия.
Используя энзим-стимулированный диоксэтан (Schaap et al., Tet Lett. (1987) 28: 1159-1162 и EPA публ. N 0254051), полученный от Lumigen, Inc. Количество 50 мкл Lumiphos 530 (Lumigen) добавляют в каждую ячейку. По ячейкам слегка постукивают, чтобы реагент мог осесть на дно, и осторожно покручивают, чтобы реагент равномерно распределился по всему дну. Ячейки закрывают и инкубируют при 37oC в течение 20 - 40 мин.
Затем пластины считывают на Dynatech ML 1000 люминометре. На выходе получают полный интеграл света, образующегося во время реакции.
Анализ положительно детектирует каждый из образцов сыворотки независимо от генотипа.
IV. Экспрессия полипептида, закодированного в последовательностях, определенных за
счет дифференцирования генотипов
HCV полипептиды, закодированные
последовательностью внутри последовательностей 1-66, экспрессируют как слитые полипептиды с супероксиддисмутазой (SOD). кДНК,
содержащую такие последовательности, субклонируют в вектор экспрессии
pSODcf1 (Steimer et al., 1986).
Вначале, ДНК, выделенную из pSODcf1, обрабатывают BamHI и EcoRI, и следующий ликер лигируют в линейную ДНК, созданную рестрикционными энзимами.
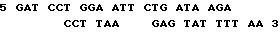
После клонирования выделяют плазмиду, содержащую вставку.
Плазмиду, содержащую вставку, подвергают рестрикции EcoRI. HCV кДНК лигируют в эту плазмидную ДНК, линеаризованную EcoRI. Смесь ДНК используют для трансформации E.coli штамма D1210 (Sadler et al. (1980)). Полипептиды выделяют на гелях.
V Антигенность полипептидов
Антигенность полипептидов, полученных в разделе IV,
оценивают следующим образом. Полиэтиленовые шпильки,
вставленные в блок в 8 12 стрелок (Coselco Mimetops, Victoria, Australia) приготавливают, помещая шпильки в ванну (20% объем/объем пиперидина в
диметилформамиде (ДМФ) на 30 минут при комнатной
температуре. Шпильки удаляют, промывают ДМФ в течение 5 мин. Затем промывают метанолом четыре раза (пол 2 мин на промывку). Шпильки оставляют высыхать
на воздухе, по крайней мере, 10 минут, затем
промывают в последний раз (ДМВ) (5 мин). В ДМФ (80 мкл) растворяют 1-гидроксибензотриазол (HOBt, 367 мг) для использования при сшивании Fмос
- защищенных полипептидов, полученных в разделе
IV.
Защищенные аминокислоты помещают в ячейки микротитровальной пластины с HOBt, и на пластину помещают блок шпилек, погружая шпильки в ячейки. Затем это сооружение запаивают в пластиковый пакет и оставляют реагировать в течение 18 часов при 25oC для осуществления сшивки первых аминокислот со шпильками. Затем блок удаляют, шпильки промывают ДМФ (2 мин), MeOH (4x, 2 мин) и снова ДМФ (2 мин) для очистки и удаления защиты у связанных аминокислот. Процедуру для каждой дополнительно сшиваемой аминокислоты до получения всех октамеров.
Затем свободные N-концы ацетилируют для получения свободного амида, так как большинство эпитопов не обнаружены у N-конца, и таким образом, не имели бы соответствующего положительного заряда. Ацетилирование осуществляют, заполняя ячейки микротитровальной пластины смесью ДМФ (уксусный ангидрид/триэтиламин) (5:2:1) объем/объем/объем) и оставляя шпильки реагировать в ячейках в течение 90 мин при 20oC. Затем шпильки промывают ДМФ (2 мин) и MeOH (4x, 2 мин), и сушат на воздухе, по крайней мере, 10 мин.
Защитные группы боковых цепей удаляют, обрабатывая шпильки смесью трифторуксусной кислоты/фенола/дитиоэтана (95:2,5:1,5), объем/объем/объем) в пропиленовых пакетах в течение 4 часов при комнатной температуре. Затем шпильки промывают дихлорметаном (2x, 2 мин), 5% диизопропилэтиламин/дихлорметаном (2х, 5 мин), дихлорметаном (5 мин) и сушат на воздухе в течение, по крайней мере, 10 мин. Затем шпильки промывают водой (2 мин), MeOH (18 часов), сушат в вакууме и хранят в негерметизированных пластиковых упаковках над силикагелем.
IV.B.15.b Анализ пептидов
Шпильки с
октамерами обрабатывают ультразвуком в течение 30 мин в буфере для
разрушения (1% натрийдодецилсульфат, 0,1% 2-меркаптоэтано, 0,1 M NaH2PO4) при 60oC.
Затем шпильки несколько раз погружают в воду (650oC) с последующим кипячением MeOH (2 мин) и оставляют сохнуть на воздухе.
Затем шпильки предварительно покрывают в течение 1 часа при 25oC в микротитровальных ячейках, содержащих 200 мкл блокирующего буфера (1% яичного альбумина, 1% BSA, 0,1% Твин и 0,05% NaN3 в PBS) при перемешивании. Затем шпильки погружают в микротитровальные ячейки, содержащие 175 мкл антисыворотки, полученной от пациентов, у которых был диагностирован HCV, и оставляют инкубироваться при 4oC в течение ночи. Образование комплекса между поликлональными антителами сыворотки и полипептидом приводит к тому, что эти пептиды приводят к иммунной реакции in vivo. Такие пептиды являются кандидатами для разработки вакцин.
Таким образом, настоящее изобретение было написано и проиллюстрировано. Специалистам в этой области должно быть очевидно, что множество вариантов и модификаций можно осуществить, не выходя из объема заявленного в формуле изобретения и не выходя за рамки раскрытия настоящего изобретения.
Реферат
Изобретение относится к генной инженерии. Фрагменты искусственной нуклеиновой кислоты (НК) содержат нуклеотидную последовательность из 18 или более нуклеотидов. Нуклеотиды соответствуют 5'UT-области генома вируса гепатита C. Последовательности выбирают из SEQ I D N 34-51. Искусственную НК помещают в условия, способствующие гибридизации в присутствии НК вируса гепатита С. Наличие продукта гибридизации является показателем наличия генотипа вируса гепатита С. Изобретение позволяет создать вакцины для профилактического лечения инфекций HCV и разработать препараты антител для создания пассивного иммунитета к HCV. 3 с. и 9 з.п.ф-лы, 4 табл., 5 ил.

Комментарии