Фармацевтическая композиция с улучшенной стабильностью - RU2728786C2
Код документа: RU2728786C2
Чертежи








Описание
ОБЛАСТЬ ТЕХНИКИ
[0001] Область изобретения относится к системе доставки для доставки биологически активных веществ с замедленным и контролируемым высвобождением. Более конкретно, в настоящем изобретении предложены композиции системы доставки для доставки биологически активного вещества с замедленным высвобождением посредством биологически разлагаемого полимера и способ получения такой композиции.
УРОВЕНЬ ТЕХНИКИ
[0002] Биологически совместимые и биологически разлагаемые полимеры все чаще используются в качестве носителей для доставки лекарственных средств для обеспечения замедленного или отсроченного высвобождения биологически активных веществ. Указанные системы доставки доступны в различных депо-формах для инъекций, включая жидкие формы, суспензии, твердые имплантаты, микросферы, микрокапсулы и микрочастицы.
[0003] Системы доставки с замедленным высвобождением с применением биологически совместимых и биологически разлагаемых полимеров особенно эффективны для сильнодействующих лекарственных средств с коротким периодом полувыведения. Такие системы доставки могут уменьшить частоту введения и боль, улучшить соблюдение пациентом режима и схемы лечения, повысить удобство для пациента и снизить стоимость. Для многих пептидных субстанций, в частности гормонов, требуется, чтобы доставка лекарственного средства осуществлялась непрерывно с контролируемой скоростью в течение длительного периода времени, и, таким образом, предпочтительна система доставки с контролируемым высвобождением. Такие системы можно получить путем включения биологически активных веществ в биологически разлагаемые и биологически совместимые полимерные матрицы. При одном подходе указанный полимер растворяют в органическом растворителе и далее смешивают с биологически активным веществом, которое изготавливают в форме микрочастиц, микросфер, микрокапсул, микрогранул или твердых имплантатов путем удаления органического растворителя. Указанное биологически активное вещество заключено внутри твердых полимерных матриц. Было успешно разработано несколько продуктов с применением биологически разлагаемых полимеров в форме микрочастиц и твердых имплантатов, такие как Lupron Depot, Zoladex, Trelstar, Sandostatin LAR и т.д. Хотя, по всей видимости, данные продукты и являются эффективными, они обладают недостатками и ограничениями, такими как большой объем суспендирующих жидкостей для микрочастиц или хирургическое введение для твердых имплантатов. Эти продукты не очень удобны для пациентов. Кроме того, производственные процессы для получения стерильных продуктов воспроизводимым образом являются сложными, что приводит к высокой стоимости изготовления. Весьма предпочтительно, чтобы композицию можно было легко получать и применять.
[0004] При другом подходе биологически разлагаемый полимер и биологически активные вещества растворяют в биологически совместимом органическом растворителе с получением жидкой или текучей композиции. Когда указанную жидкую композицию вводят в организм, растворитель распределяется в окружающую водную среду, и полимер образует твердое или гелевое депо, из которого биологически активное вещество высвобождается в течение длительного периода времени. Предполагается, что следующие ссылки на патенты США под номерами 8173148; 8313763; 6565874; 6528080; RE37950; 6461631; 6395293; 6355657; 6261583; 6143134; 5990194; 5945115; 5792469; 578044; 5759563; 5744153; 5739176; 5736152; 5733950; 5702716; 5681873; 5599552; 5487897; 5340849; 5324519; 5278202; 5278201 и 4938763 являются примерами ссылок в этой области и включены в настоящее описание посредством ссылки. Несмотря на некоторый успех, данные способы не являются полностью предпочтительными для большого количества биологически активных веществ, эффективная доставка которых будет осуществляться при таком подходе.
[0005] Полиэфир является одним из самых популярных полимеров, до сих пор применяемых в биологически разлагаемых системах доставки лекарственных средств с замедленным высвобождением. Полиэфир и его близкородственные формы, полиангидрид и поликарбонат, хорошо известны и используются для фармацевтического применения на протяжении многих лет. Например, поли(лактид-со-гликолид) или полилактид представляет собой полимерный материал, который применяют в продуктах Lupron Depot и Eligard для лечения рака предстательной железы на поздних стадиях. Эти полиэфиры биологически совместимы и разлагаются посредством обычных биохимических путей, таких как гидролиз и ферментативное расщепление, что приводит к образованию встречающихся в природе продуктов обмена веществ. Биологическая разлагаемость полиэфиров предпочтительна для применения в носителях для доставки лекарственного средства с замедленным высвобождением, однако восприимчивость также представляет собой проблему.
[0006] Многие биологически активные вещества часто содержат одну или более нуклеофильных групп, таких как аминогруппы, которые могут приводить к взаимодействию между биологически активным веществом и биологически разлагаемым полимером композиции. Когда комбинируют биологически активные вещества и биологически разлагаемый полимер, может происходить реакция между нуклеофильными группами указанных биологически активных веществ и эфирными связями указанного полимера. Такая реакция может оказывать неблагоприятное воздействие на физические и/или химические характеристики композиции, что приводит к потере преимуществ системы доставки с замедленным и контролируемым высвобождением. Было предпринято много усилий для решения данной проблемы с применением кислотных добавок, стабилизирующих ассоциатов и т.д. [см. Патенты США №№8173148 и 8343513].
[0007] В дополнение к разложению полимеров, другим аспектом является стабильность биологически активных веществ в системе доставки лекарственного средства, которая также имеет решающее значение. Значимое количество родственных биологически активными веществам примесей может образовываться во время процесса производства лекарственных форм, хранения и высвобождения in vivo. К примеру, раскрытый в патенте США №6565874 в примере 6 поли (D,L-лактид-со-гликолид) с молярным соотношением лактида к гликолиду, составляющим 75/25 (Birmingham Polymer, Inc.), растворяли в NMP с получением раствора с 45% содержанием полимера по массе. Этот раствор объединяли и смешивали с лейпролида ацетатом, чтобы получить текучий и вязкий состав для инъекций. Как представлено в настоящей заявке, неожиданным образом в течение короткого периода времени наблюдали значимое количество родственных лейпролиду веществ или примесей, полученных из состава данного типа, что отрицательно бы сказалось на качестве лекарственного продукта. Более неожиданно то, что основные образовавшиеся примеси не являлись продуктом реакции между биологически активными веществами и поли(D,L-лактид-со-гликолидом), что раскрыто в предшествующем уровне техники, а продуктом непосредственной реакции между биологически активными веществами и остаточными или невступившими в реакцию мономерами лактида указанного полимера.
[0008] В соответствии с руководящими принципами ICH [http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm073389.pdf], в новом лекарственном продукте должна быть указана любая примесь (отдельная примесь) при ее содержании более, чем 0,1%. Исходя из максимальной суточной дозы, должна быть идентифицирована любая примесь при содержании более, чем 0,1%, 0,2%, 0,5% или 1%. Если содержание примеси в новом лекарственном продукте превышает рассматриваемый уровень порога квалификации, данные примеси следует идентифицировать и надлежащим образом исследовать на предмет их неблагоприятного воздействия и биологической безопасности. Таким образом, любое образование примесей, превышающее соответствующий порог квалификации, приведет к возникновению проблем соблюдения нормативных требований. Определение характеристик и квалификация этих примесей по их неблагоприятным воздействиям и биологической безопасности может быть очень дорогим и трудоемким.
[0009] В патенте США №8343513 раскрыто несколько способов устранения или уменьшения примесей в микросферах. В нем говорится о том, что «при любых усилиях по устранению или уменьшению содержания примесей в микросферах следует учитывать следующие общие соображения: (i) чем выше содержание лактида в PLGA-микросфере, тем ниже будет количество родственных веществ, и микросферы, полученные из 100% PLA, будут содержать наименьшее количество родственных веществ; (ii) чем выше молекулярная масса PLGA, тем больше будет количество родственных веществ; чем выше целевое содержание компонентов в PLGA, тем выше будет уровень родственных веществ; и (iii) чем ниже уровень экстрагируемых олигомеров в PLGA, тем выше будет уровень родственных веществ; гидрофобный PLGA (PLGA с заблокированным концом) может образовывать больше родственных веществ по сравнению с гидрофильным PLGA (свободная концевая кислотная группа)» [см. Патент США №8343513, колонка 11, второй абзац]. Общая идея заключается в применении полиэфиров с низкой молекулярной массой, содержащих концевые кислотные группы с добавлением значимого дополнительного количества кислотных добавок или олигомеров с низким значением pKa. Примеры кислотных добавок включают молочную кислоту и гликолевую кислоту, которые представляют собой мономерные строительные блоки для PLGA. Избыточное количество кислотных добавок обладает некоторой ограниченной эффективностью в отношении уменьшения образования примесей в течение короткого периода времени (24 часа) в не фармацевтически приемлемых растворителях, таких как дихлорметан и метанол. Кроме того, кислотные добавки вызывают низкие значения рН в дисперсной фазе. Хорошо известно, что низкий уровень значения рН вызывает раздражения тканей. Таким образом, такие дисперсные фазы можно применять для получения микросфер, однако они не являются подходящими для введения пациентам посредством прямой инъекции. Кроме того, в патенте №8343513 определено, что примеси, наблюдаемые в микросферах, содержащих лейпролида ацетат и PLGA50:50, представляют собой продукты присоединения (аддукты) аргининовой группы лейпролида к фрагментам PLGA [см. Патент США №8343513, Фигура 16 и Колонки 43 и 44]. Эти микрочастицы получали с применением растворов полимера в не фармацевтически приемлемых растворителях, таких как дихлорметан и метанол. Примеси не представляют собой все типы образующихся в растворах примесей. Некоторые примеси можно экстрагировать в водную фазу в процессе получения микрочастиц и их нельзя обнаружить в микросферах. Кроме того, идентифицированные в микросферах примеси представляют собой продукты реакции между лейпролидом и полимером, а не мономером лактида [Murty SB, Thanoo ВС, Wei Q, DeLuca PP. Int. J. Pharm. 2005, June 13; 297(1-2): 50-61. Impurity formation studies with peptide-loaded polymeric microspheres, Part I. In vivo evaluation]. Неожиданным образом, основные примеси, образованные и описанные в настоящем изобретении, не были идентифицированы в патенте США №8343513 и другом известном предшествующем уровне техники.
[0010] В патенте США №8951973 описан способ модуляции высвобождения и повышения стабильности пептидов в микросферах. В нем описано изменение изоэлектрической точки пептида посредством изменения общего заряда указанного пептида, который может уменьшить выделение пептида из микросфер и улучшить стабильность. Тем не менее, это происходит посредством замены аминокислоты в пептидной последовательности, что обуславливает новую химическую структуру. Потребуется дополнительное исследование этой новой химической структуры для определения того, можно ли достичь такой же эффективности и безопасности.
[0011] Таким образом, существует потребность в разработке композиций с контролируемым высвобождением, которые будут минимизировать или предотвращать образование примесей, родственных биологически активным веществам, и нежелательное преждевременное разложение биологически разлагаемого полимера, и которые можно непосредственно вводить в виде инъекций пациентам для образования депо с замедленным высвобождением in situ.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0012] Неожиданно было обнаружено, что значимый уровень примесей довольно быстро образуется в биологически разлагаемом полимерном составе для инъекций с нуклеофильным биологически активным веществом в органическом растворителе, даже если кислотное число полимера больше 5 мгКОН/г. Эти примеси образуются в результате реакции указанного нуклеофильного биологически активного вещества с невступившими в реакцию или остаточными мономерами биологически разлагаемого полимера. В растворе нуклеофильное биологическое активное вещество и указанный полимер/мономер оказываются в тесном контакте, что тем самым создает благоприятные условия для реакции с образованием примесей/конъюгатов в зависимости от выбора растворителей.
[0013] В настоящем изобретении показано, что можно получить полимерные композиции, которые обладают улучшенной стабильностью по сравнению с предшествующим уровнем техники. Образование в композициях предшествующего уровня техники конъюгатов можно по существу уменьшить или предотвратить. В настоящем изобретении предложена стабильная биологически разлагаемая полимерная композиция для инъекций для системы доставки с замедленным высвобождением нуклеофильного биологически активного вещества и способ получения таких полимерных композиций.
[0014] В соответствии с настоящим изобретением указанные композиции содержат: а) нуклеофильное биологически активное вещество; b) фармацевтически приемлемый растворитель и с) подходящий биологически разлагаемый полимер, который при совместном приготовлении уменьшает или предотвращает образование примесей или родственных веществ. Указанная фармацевтическая композиция может представлять собой вязкую или невязкую жидкость, гель или крем, инъекцию которого можно осуществлять при помощи шприца. Фармацевтическая композиция является более стабильной, и ею можно предварительно заполнить отдельный шприц, тем самым обеспечивая готовую к применению систему.
[0015] Указанные биологически активные вещества согласно настоящему изобретению содержат нуклеофильную группу, которая способна катализировать разложение эфира и вступать в реакцию с полимером на основе лактата, олигомером или мономером. Биологически активные вещества могут быть в форме пептида, пролекарственного средства или его соли. Примеси, образующиеся в композиции, являются аддуктами биологически активного вещества и строительных блоков полимера на основе лактата (например, мономеров и олигомеров лактида).
[0016] Согласно настоящему изобретению указанный фармацевтически приемлемый органический растворитель можно выбрать из группы, состоящей из N-метил-2-пирролидона (NMP), 2-пирролидона, метоксиполиэтиленгликоля, алкоксиполиэтиленгликоля, сложных эфиров полиэтиленгликоля, гликофурола, формаля глицерина, метилацетата, этилацетата, метилэтилкетона, диметилформамида (ДМФА), диметилсульфоксида (ДМСО), диметилацетамид (ДМАА), тетрагидрофурана (ТГФ), капролактама, децилметилсульфоксида, бензилового спирта, бензилбензоата, этилбензоата, триацетина, диацетина, трибутирина, триэтилцитрата, трибутилцитрата, ацетилтриэтилцитрата, ацетилбутилцитрата, триэтилглицеридов, триэтилфосфата, диэтилфталата, диэтилтартрата, этиллактата, пропиленкарбоната, этиленкарбоната, бутиролактона и 1-додецилазациклогептан-2-она и их комбинаций.
[0017] Согласно настоящему изобретению указанный биологически разлагаемый полимер может представлять собой неразветвленный полимер или разветвленный полимер или их смесь. Предпочтительно указанный полимер представляет собой полимер на основе лактата. Полимер на основе лактата содержит гомополимеры молочной кислоты или мономеры лактида (полимолочная кислота или полилактид, PLA) и сополимеры молочной кислоты (или лактида) с другими мономерами (например, гликолевой кислотой, гликолидом (поли(лактид-со-гликолидом), PLG или PLGA) и им подобным). Средневзвешенная молекулярная масса полимера обычно составляет от 5000 до 50000. В идеале кислотное число полимера должно составлять менее, чем 3 мгКОН/г, предпочтительно менее, чем 2 мгКОН/г и более предпочтительно менее, чем 1 мгКОН/г.
[0018] Согласно настоящему изобретению указанный биологически разлагаемый полимер на основе лактата можно растворять в растворителе. Далее полимер можно осаждать в антирастворителе, в котором указанный полимер на основе лактата не растворяется, однако растворяются мономеры и олигомеры. Осажденный в результате полимер в идеале будет содержать 0,3% невступившего в реакцию или остаточного мономера лактида, предпочтительно 0,2% и более предпочтительно 0,1% или менее. Фракция олигомеров с молекулярной массой менее, чем 5000, будет составлять 20% по массе, предпочтительно 10% по массе, более предпочтительно 5% по массе или менее. Этот полимер, когда его приготавливают с нуклеофильным биологически активным веществом и фармацевтически приемлемым органическим растворителем, будет образовать стабильный раствор, которым можно предварительно заполнить отдельный шприц.
[0019] Согласно настоящему изобретению композицию для инъекций для доставки лекарственного средства с контролируемым высвобождением можно получить при помощи способа, включающего: объединение полимера на основе лактата, обладающего средневзвешенной молекулярной массой от 5000 до 50000 дальтон, кислотным числом, составляющим менее, чем 3 мгКОН/г, и содержанием остаточного мономера лактида в полимере на основе лактата менее, чем приблизительно 0,3% по массе с фармацевтически приемлемым органическим растворителем и биологически активным веществом или его солью, способным вступать в реакцию с мономером лактида с образованием конъюгата при условии, что при получении указанной композиции не добавляют кислотную добавку.
Краткое описание Фигур
[0020] ФИГ. 1. Хроматограмма ацетата лейпролида в 60% PLA-100DL2E в растворе NMP через один час при 37°С
[0021] ФИГ. 2. Хроматограмма LAAce 60% PLA-100DL2E в NMP в нулевой момент времени.
[0022] ФИГ. 3. Хроматограмма LAAce 60% PLA-100DL2E в ДХМ в нулевой момент времени.
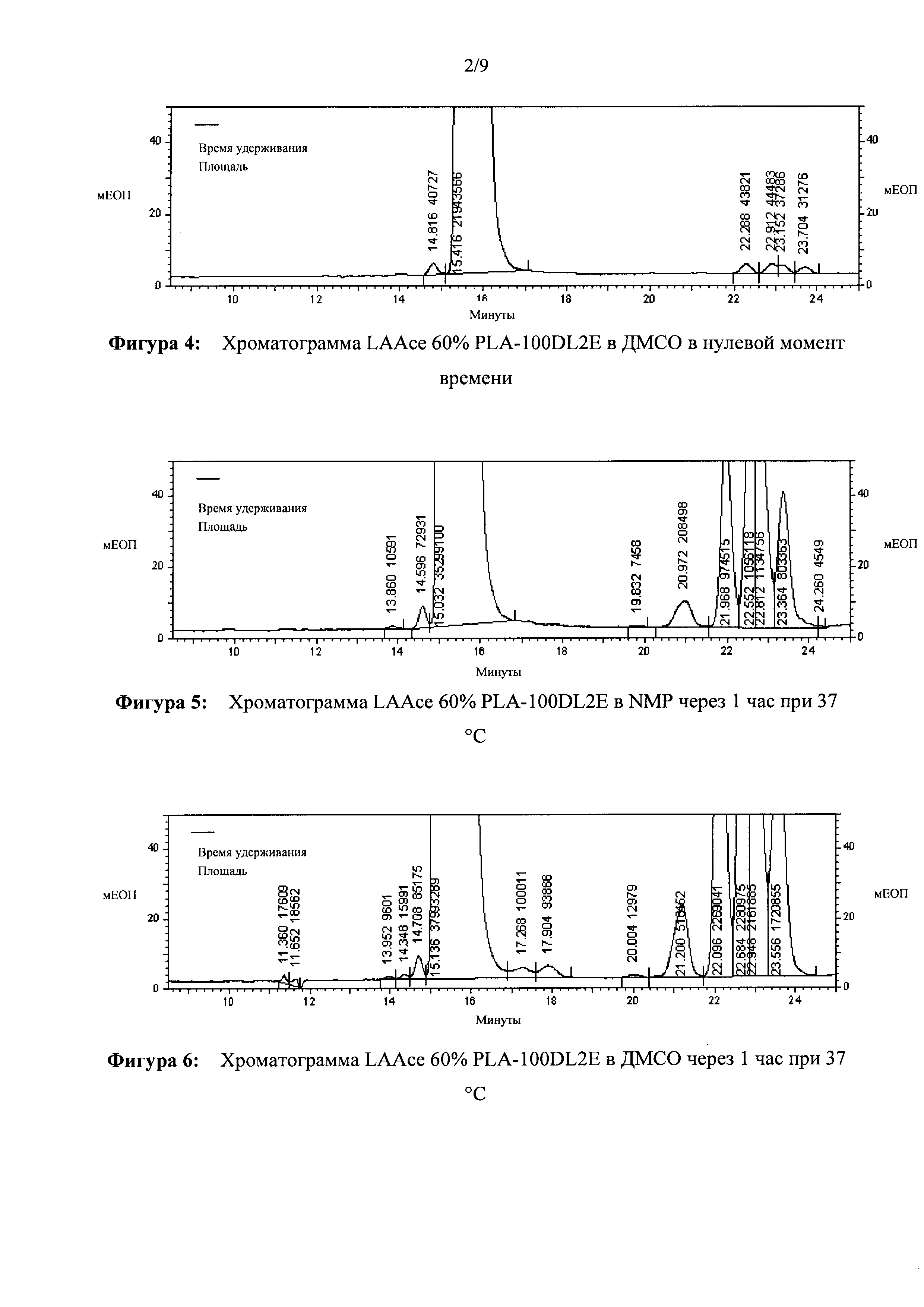
[0023] ФИГ. 4. Хроматограмма LAAce 60% PLA-100DL2E в ДМСО в нулевой момент времени.
[0024] ФИГ. 5. Хроматограмма LAAce 60% PLA-100DL2E в NMP через 1 час при 37°С.
[0025] ФИГ. 6. Хроматограмма LAAce 60% PLA-100DL2E в ДМСО через 1 час при 37°С.
[0026] ФИГ. 7. Хроматограмма LAAce 60% PLA-100DL2E в ДХМ через 1 час при 37°С.
[0027] ФИГ. 8. Хроматограмма FMOC-SER-OH в NMP с 25% D,L-лактидом через 3 часа при 25°С.
[0028] ФИГ. 9. Хроматограмма FMOC-SER-OH в NMP с 25% D,L-лактидом через 1 день при 25°С.
[0029] ФИГ. 10. Хроматограмма FMOC-ARG-OH в NMP с 25% D,L-лактидом через 3 часа при 25°С.
[0030] ФИГ. 11. Хроматограмма FMOC-ARG-OH в NMP с 25% D,L-лактидом через 1 день при 25°С.
[0031] ФИГ. 12. Хроматограмма LAMS в NMP с 10% L-лактидом, на которой представлены примеси, образованные из мономеров.
[0032] ФИГ. 13. Хроматограмма LAAce 57,5% PLA-0,1 в NMP.
[0033] ФИГ. 14. Хроматограмма LAAce 57,5% PLA-0,2 в NMP.
[0034] ФИГ. 15. Хроматограмма LAAce 57,5% PLA-0,3 в NMP.
[0035] ФИГ. 16. Хроматограмма LAAce 57,5% PLA-0,5 в NMP.
[0036] ФИГ. 17. Хроматограмма LAAce 57,5% PLA-1,0 в NMP.
[0037] ФИГ. 18. Хроматограмма LAAce 57,5% PLA-3,0 в NMP.
[0038] ФИГ. 19. Хроматограмма LAAce 57,5% PLA-0,1 в NMP через 24 часа при 37 °С.
[0039] ФИГ. 20. Хроматограмма LAAce 57,5% PLA-0,2 в NMP через 24 часа при 37°С.
[0040] ФИГ. 21. Хроматограмма LAAce 57, 5% PLA-0,3 в NMP через 24 часа при 37°С.
[0041] ФИГ. 22. Хроматограмма LAAce 57,5% PLA-0,5 в NMP через 24 часа при 37°С.
[0042] ФИГ. 23. Хроматограмма LAAce 57,5% PLA-1,0 в NMP через 24 часа при 37°С.
[0043] ФИГ. 24. Хроматограмма LAAce 57,5% PLA-3,0 в NMP через 24 часа при 37°С.
[0044] ФИГ. 25. Высвобождение LAMS из составов, содержащих очищенный или неочищенный полимер, in vitro.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0045] В настоящем изобретении предложена полимерная композиция для образования системы доставки с замедленным высвобождением биологически активных веществ и способ получения такой композиции. Полимерные композиции согласно настоящему изобретению содержат: а) биологически активное вещество или его соль; b) органический растворитель и с) биологически разлагаемый гомополимер или сополимер на основе лактата; Биологически активные вещества или их соли согласно настоящему изобретению как правило являются нуклеофильными и могут вступать в реакцию с мономерами лактида или олигомерами на основе лактата с образованием ковалентных конъюгатов или аддуктов. Органические растворители согласно настоящему изобретению могут представлять собой полярную протонную или апротонную жидкость. Полимеры на основе лактата согласно настоящему изобретению содержат по меньшей мере одну единицу мономера молочной кислоты, лактата или лактида в структуре полимерной композиции. Полимерные композиции согласно настоящему изобретению способны снижать или предотвращать реакцию биологически активного вещества с мономером или олигомером с образованием родственных примесей в указанных полимерных композициях.
[0046] Полимерная композиция согласно настоящему изобретению может находиться в форме микрочастиц, микросфер, микрокапсул, микрогранул или твердых имплантатов посредством удаления органического растворителя, полученного in vitro. Эти лекарственные формы можно вводить способами, известными в данной области техники, такими как при помощи инъекции или хирургического вмешательства. Альтернативным и предпочтительным образом они могут находиться в формах растворов, эмульсий, суспензий, пасты, крема или геля, которые перемещаются как жидкость, так что их можно вводить посредством инъекций через иглу, канюлю, трубку, лапроскоп, зонд или другое устройство доставки. При введении субъекту такая композиция для инъекций образует депо in situ, контролируемое высвобождение биологически активного вещества из которого можно замедлить на целевой период времени в зависимости от композиции. Депо или имплантат может представлять собой твердое вещество, гель, пасту, полутвердое вещество или вязкую жидкость. При выборе биологически разлагаемого полимера и других компонентов продолжительность замедленного высвобождения биологически активного вещества можно контролировать в течение периода времени от нескольких недель до одного года.
[0047] Полимерная композиция согласно настоящему изобретению может также содержать неполимерные соединения и/или добавки для контролируемого высвобождения, такие как агенты, регулирующие скорость высвобождения, агенты, образующие поры, пластификаторы, органические растворители, инкапсулирующие агенты для инкапсулирования биологически активного вещества, термические гелеобразующие агенты, материалы, снижающие эффект вспенивания, гидрогели, полигидроксильные материалы, выщелачивающие агенты, агенты, способствующие переносу в ткани, или другие подобные добавки или любую их комбинацию.
[0048] Предполагается, что в контексте настоящего описания термины «формы единственного числа» и «один» следует интерпретировать как «один или более» и «по меньшей мере один».
[0049] Определенный в настоящем описании термин «доставка с контролируемым высвобождением» предназначен для обозначения доставки биологически активного вещества in vivo в течение целевого длительного периода времени после введения, предпочтительно от по меньшей мере нескольких дней до одного года.
[0050] Предполагается, что термин «биологически активное вещество» включает в себя любые материалы, обладающие диагностическими и/или терапевтическими свойствами, включая, но не ограничиваясь ими, небольшие органические молекулы, небольшие неорганические молекулы, макромолекулы, пептиды, олигопептиды, белки или ферменты, нуклеотиды, нуклеозиды, олигонуклеотиды, олигонуклеозиды, полинуклеотиды, полинуклеотиды, полинуклеиновые кислоты или подобные молекулы, образующие такие химические соединения. Неограничивающими примерами терапевтических свойств являются антиметаболические, противогрибковые, противовоспалительные, противоопухолевые, противоинфекционные, противомикробные, питательные, агонистические и антагонистические свойства.
[0051] Биологически активные вещества согласно настоящему изобретению могут быть в форме свободной молекулы, органической или неорганической соли указанной свободной молекулы или могут быть в комплексе или ковалентно конъюгированы с агентом-носителем, могут являться пролекарственным средством или могут представлять собой биологически активное вещество во множественных формах (множественные единицы биологически активного вещества либо находящиеся в комплексе, либо ковалентно связанные друг с другом).
[0052] Биологически активные вещества согласно настоящему изобретению содержат нуклеофильную группу, которая способна катализировать разложение эфира и вступать в реакцию с полимером, олигомером или мономером на основе лактата. «Нуклеофильную группу» можно охарактеризовать как химический реагент, который предоставляет электронную пару электрофилу с образованием химической связи в реакции, которая направлена на ядра атомов или положительный конец полярной молекулы. Все молекулы или ионы со свободной парой электронов или по меньшей мере одной пи-связью являются нуклеофильными группами. Поскольку нуклеофильные группы предоставляют электроны, по определению они являются основаниями Льюиса. Нуклеофильные группы включают азотсодержащие группы, такие как аминогруппа, амидиновая группа, иминовая группа, азотсодержащая гетероароматическая группа, азотсодержащая гетероциклическая группа, любую другую группу, содержащую азот, или любые их комбинации в качестве нуклеофильной группы или групп. Нуклеофильная азотсодержащая группа или группы могут быть основными, как в свободной молекуле, или могут находиться в форме соли, образованной органической или неорганической кислотой. Нуклеофильные группы могут также включать кислородсодержащие группы, такие как гидроксидный анион, спирты, алкоксидные анионы, перекись водорода и карбоксилатные анионы и серосодержащие группы, такие как сероводород и его соли, тиолы (RSH), тиолятные анионы (RS-), анионы тиолкарбоксиловой кислоты (RC(O)-S-) и анионы дитиокарбонатов (RO-C(S)-S-) и дитиокарбаматов (R2N-C(S)-S-).
[0053] Биологически активное вещество согласно настоящему изобретению может представлять собой алифатическое, ароматическое, гетероароматическое, циклическое, алициклическое, гетероциклическое органическое соединение, необязательно содержащее одну или более групп карбоновой кислоты, сложного эфира, лактонных, ангидридных, карбонатных, карбаматных, мочевинных, амидных, лактамных, иминных, амидинных, енаминных, имидных, оксимных, карбонильных, гидроксильных, энольных, аминных, эфирных, сульфидных, сульфонильных, сульфоксильных, сульфоновых, тиоамидных, тиольных, тиокислотных, тиоэфирных, тиомочевинных, ацетальных, кетальных, галоидных, эпоксидных, нитро, нитрозо, ксантогенатных, инаминовых групп или их любую комбинацию, при этом необязательные заместители совместимы с нуклеофильной группой биологически активного вещества.
[0054] В контексте настоящего описания термин «пептид» в общем смысле включает в себя поли(аминокислоты), которые в целом обычно относятся к «пептидам», «олигопептидам» и «полипептидам» или «белкам», которые в настоящем описании используются взаимозаменяемо. Указанный термин также включает биологически активные аналоги пептидов, производные, ацилированные производные, гликозилированные производные, пэгилированные производные, гибридные белки и т.п. Подразумевается, что термин «пептид» включает в себя любые биологически активные пептиды, обладающие диагностическими и/или терапевтическими свойствами, включая, но не ограничиваясь ими, антиметаболические, противогрибковые, противовоспалительные, противоопухолевые, противоинфекционные, противомикробные, питательные, агонистические и антагонистические свойства. Термин также включает синтетические аналоги пептидов, неприродных аминокислот, содержащих основные функциональные группы или любую другую форму введенной основности. Пептид согласно настоящему изобретению содержит по меньшей мере одну нуклеофильную группу. Фраза «по меньшей мере один» означает, что указанный пептид может также содержать множественное число нуклеофильных групп.
[0055] Биологически активные пептиды согласно изобретению могут, в частности, включать, но не ограничиваться ими, окситоцин, вазопрессин, адренокортикотропный гормон (АСТН), эпидермальный фактор роста (EGF), фактор роста тромбоцитов (PDGF), пролактин, лютеинизирующий гормон, рилизинг-гормон лютеинизирующего гормона (ЛГРГ), агонистов ЛГРГ, антагонистов ЛГРГ, гормоны роста (включая человека, свиньи и быка), рилизинг-фактор гормона роста, инсулин, эритропоэтин (включая все белки с эритропоэтической активностью), соматостатин, глюкагон, интерлейкин (который включает ИЛ-2, ИЛ-11, ИЛ-12 и т.д.), интерферон-альфа, интерферон-бета, интерферон-гамма, гастрин, тетрагастрин, пентагастрин, урогастрон, секретин, кальцитонин, энкефалины, эндорфины, ангиотензины, рилизинг-гормон тиреотропина (TRH), фактор некроза опухоли (ФНО), паратиреоидный гормон (РТН), фактор роста нервов (NGF), гранулоцитарный колониестимулирующий фактор (Г-КСФ), гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), макрофагальный колониестимулирующий фактор (М-КСФ), гепариназу, фактор роста эндотелия сосудов (VEG-F), костный морфогенетический белок (BMP), hANP, глюкагоноподобный пептид (GLP-1), экзенатид, пептид YY (PYY), ренин, брадикинин, бацитрацины, полимиксины, колистины, тироцидин, грамицидины, циклоспорины, ферменты, цитокины, антитела, вакцины, антибиотики, антитела, гликопротеины, фолликулостимулирующий гормон, киоторфин, тафцин, тимопоэтин, тимозин, тимостимулин, гуморальный фактор тимуса, сывороточный фактор тимуса, колониестимулирующие факторы, мотилин, бомбезин, динорфин, нейротензин, церулеин, урокиназу, калликреин, аналоги и антагонисты вещества Р, ангиотензин II, факторы свертывания крови VII и IX, грамицидины, меланоцитстимулирующий гормон, рилизинг-гормон тиреоидного гормона, тиреостимулирующий гормон, панкреозимин, холецистокинин, плацентарный лактоген человека, хорионический гонадотропин человека, пептид, стимулирующий синтез белка, гастроингибиторный пептид, вазоактивный интестинальный пептид, фактор роста тромбоцитов и их синтетические аналоги и модификации и фармакологически активные фрагменты.
[0056] В контексте настоящего описания предпочтительные пептиды содержат аминокислоту серии в молекулярной структуре пептида. В контексте настоящего описания предпочтительные пептиды включают ЛГРГ и агонистов ЛГРГ, таких как лейпрорелин, бусерелин, гонадорелин, деслорелин, фертирелин, гистрелин, лютрелин, госерелин, нафарелин, трипторелин, цетрореликс, энфувиртид, тимозин α1, абареликс. В контексте настоящего описания предпочтительный пептид также включает пептиды, такие как соматостатин, октреотид, пазиреотид, SOM230 и ланреотид.
[0057] Биологически активные вещества согласно настоящему изобретению также включают нуклеотиды, нуклеозиды, олигонуклеотиды, олигонуклеозиды и полинуклеиновые кислоты, которые являются биологически активными соединениями, обладающими нуклеофильными свойствами.
[0058] Применяемое в настоящем изобретении биологически активное вещество может быть в исходном виде или представлять собой фармацевтически приемлемую соль. Кислота, применяемая для образования фармацевтически приемлемой соли биологически активного вещества, предпочтительно обладает значением pKa меньшим, чем 5. Кислоты, подходящие для настоящего изобретения, могут быть выбраны из, но не ограничиваться ими, группы, состоящей из хлористоводородной кислоты, бромистоводородной кислоты, азотной кислоты, хромовой кислоты, серной кислоты, метансульфоновой кислоты, трифторметансульфоновой кислоты, трихлоруксусной кислоты, дихлоруксусной кислоты, бромуксусной кислоты, хлоруксусной кислоты, цианоуксусной кислоты, 2-хлорпропановой кислоты, 2-оксобутановой кислоты, 2-хлорбутановой кислоты, 4-цианобутановой кислоты, памовой кислоты, перхлорной кислоты, фосфорной кислоты, йодоводорода, уксусной кислоты, 2,2-дихлоруксусной кислоты, адипиновой кислоты, альгиновой кислоты, L-аскорбиновой кислоты, L-аспарагиновой кислоты, бензолсульфоновой кислоты, бензойной кислоты, 4-ацетамидобензойной кислоты, (+)-камфорной кислоты, (+)-камфор-10-сульфоновой кислоты, каприновой кислоты (декановой кислоты), капроновой кислоты (гексановой кислоты), каприловой кислоты (октановой кислоты), угольной кислоты, коричной кислоты, лимонной кислоты, цикламовой кислоты, декановой кислоты, додецилсерной кислоты, этан-1,2-дисульфоновой кислоты, этансульфоновой кислоты, 2-гидроксиэтансульфоновой кислоты, муравьиной кислоты, фумаровой кислоты, галактовой кислоты, гентизиновой кислоты, D-глюкогептоновой кислоты, D-глюконовой кислоты, D-глюкуроновой кислоты, глутаминовой кислоты, глутаровой кислоты, 2-оксоглутаровой кислоты, глицерофосфорной кислоты, гликолевой кислоты, гиппуровая кислота, изомасляной кислоты, DL-молочной кислоты, лактобионовой кислоты, лауриновой кислоты, малеиновой кислоты, (-)-L-яблочной кислоты, малоновой кислоты, D,L-миндальной кислоты, мочевой кислоты, нафталин-1,5-дисульфоновой кислоты, нафталин-2-сульфоновой кислоты, 1-гидрокси-2-нафтойной кислоты, никотиновой кислоты, олеиновой кислоты, оротовой кислоты, щавелевой кислоты, пальмитиновой кислоты, эмбоновой кислоты, пропионовой кислоты, (-)-L-пироглутаминовой кислоты, салициловой кислоты, 4-аминосалициловой кислоты, себациновой кислоты, стеариновой кислоты, янтарной кислоты, (+)-L-винной кислоты, тиоциановой кислоты, n-толуолсульфоновой кислоты, ундециленовой кислоты. Выбор подходящих кислот хорошо известен специалистам в данной области техники.
[0059] Фармацевтически приемлемую соль биологически активного вещества можно получить при помощи простого кислотно-основного титрования или нейтрализации. Фармацевтически приемлемую соль биологически активного вещества можно получить в процессе его синтеза и очистки. Альтернативным образом соли можно получить из биологически активного вещества в форме свободного основания. Указанное свободное основание растворяют в подходящей жидкой среде. Данный раствор биологически активного вещества смешивают с раствором кислоты с образованием эффективных солей путем удаления растворителя при помощи подходящих методов, таких как фильтрация, осаждение или лиофилизация. Если биологически активное вещество находится в форме распространенной, коммерчески доступной соли, можно получить другую соль, применяя простой способ солевого обмена или метод ионного обмена, такой как лиофилизация, осаждение или другие способы, известные в данной области техники. К примеру, лейпролида ацетат растворяют в подходящей жидкой среде, например, в воде. Этот раствор пептида смешивают с водным раствором сильной кислоты, такой как метансульфоновая кислота. Когда лейпролида ацетат и сильную кислоту, такую как метансульфоновую кислоту, растворяются в воде, указанный пептид, как правило, связывается с мезилат-ионом, поскольку более сильная метансульфоновая кислота вытесняет более слабую карбоновую уксусную кислоту. Растворитель и высвобождаемую уксусную кислоту (или другую слабую, но летучую карбоновую кислоту) можно удалить под вакуумом. Таким образом, указанный раствор смеси лиофилизируют для удаления воды и более слабой кислоты с образованием целевых солей. Если биологически активное вещество нестабильно при низком значении рН, фармацевтически приемлемые соли биологически активного вещества можно получить посредством расширенного диализа против очень низкой концентрации кислоты.
[0060] Полимерные композиции согласно настоящему изобретению могут содержать биологически активное вещество в количестве, составляющим от 0,01 до 40% по массе. В целом оптимальное содержание лекарственного средства зависит от периода целевого высвобождения и активности биологически активного вещества. Очевидно то, что для биологически активного вещества с низкой активностью и более длительным периодом высвобождения может потребоваться более высокая степень включения.
[0061] Подразумевается, что термин «органический растворитель» включает в себя любые органические растворители, которые могут растворять полимеры на основе лактата. Типичные растворители, которые можно применять в полимерной композиции согласно настоящему изобретению, включают воду, метанол, этанол, диметилсульфоксид (ДМСО), диметилформамид, диметилацетамид, диоксан, тетрагидрофуран (ТГФ), ацетонитрил, метиленхлорид, этиленхлорид, тетрахлорметан, хлороформ, простые эфиры низших алкилов, такие как диэтиловый эфир и метилэтиловый эфир, гексан, циклогексан, бензол, ацетон, этилацетат и им подобные, сложные эфиры угольной кислоты и ариловых спиртов, такие как бензилбензоат; С4-С10 алкиловые спирты; C1-С6-алкил-С2-С6-алканоаты; сложные эфиры угольной кислоты и алкиловых спиртов, такие как пропиленкарбонат, этиленкарбонат и диметилкарбонат, алкиловые эфиры моно-, ди- и трикарбоновых кислот, такие как 2-этоксиэтилацетат, этилацетат, метилацетат, этилбутират, диэтилмалонат, диэтилглюконат, трибутилцитрат, диэтилсукцинат, трибутирин, изопропилмиристат, диметиладипат, диметилсукцинат, диметилоксалат, диметилцитрат, триэтилцитрат, ацетилтрибутилцитрат, глицерилтриацетат; алкилкетоны, такие как метил этил кетон; а также другие жидкие органические соединения, содержащие карбонил, простой эфир, сложный эфир карбоновой кислоты, амид и гидроксил, обладающие некоторой растворимостью в воде. Пропиленкарбонат, этилацетат, триэтилцитрат, изопропилмиристат и глицерилтриацетат являются предпочтительными из-за биологической совместимости и фармацевтической приемлемости. Выбор подходящих растворителей для данной системы будет находиться в компетенции специалистов в данной области техники в свете настоящего описания.
[0062] Органические растворители согласно настоящему изобретению предпочтительно являются биологически совместимыми и фармацевтически приемлемыми. Термин «биологически совместимый» означает, что органический растворитель, если он диспергируется или диффундирует из указанной композиции, не приводит к существенному раздражению тканей или некрозу, окружающих зону имплантата. Термин «фармацевтически приемлемый» означает, что органические растворители можно применять в лекарственном продукте для лечения нуждающихся в этом людей и животных.
[0063] Органические растворители согласно настоящему изобретению могут быть смешиваемыми или диспергируемыми в водной или биологической жидкости. Термин «диспергируемый» означает, что растворитель частично растворяется или смешивается в воде. Отдельный растворитель или смесь растворителей могут обладать растворимостью или смешиваемостью в воде большей, чем 0,1% по массе. Предпочтительно, растворитель обладает растворимостью или смешиваемостью в воде большей, чем 3% по массе. Более предпочтительно, растворитель обладает растворимостью или смешиваемостью в воде большей, чем 7% по массе. Подходящий органический растворитель должен быть способен диффундировать в жидкость организма таким образом, чтобы происходила коагуляция или затвердение жидкой композиции. Можно использовать одиночный растворитель и/или смесь таких растворителей; пригодность таких растворителей можно легко определить при помощи простых экспериментов.
[0064] Примеры фармацевтически приемлемого органического растворителя включают, но не ограничиваются ими, N-метил-2-пирролидон (NMP), 2-пирролидон, метоксиполиэтиленгликоль, алкоксиполиэтиленгликоль, сложные эфиры полиэтиленгликоля, гликофурол, формаль глицерина, метилацетат, этилацетат, метилэтилкетон, диметилформамид (ДМФ), диметилсульфоксид (ДМСО), диметилацетамид (ДМАА), тетрагидрофуран (ТГФ), капролактам, децилметилсульфоксид, бензиловый спирт, бензилбензоат, этилбензоат, триацетин, диацетин, трибутирин, триэтилцитрат, трибутилцитрат, ацетилтриэтилцитрат, ацетилтрибутилцитрат, триэтилглицериды, триэтилфосфат, диэтилфталат, диэтилтартрат, этиллактат, пропиленкарбонат, этиленкарбонат, бутиролактон и 1-додецилазациклогептан-2-он и их комбинации. Предпочтительные органические растворители включают N-метил-2-пирролидон, 2-пирролидон, диметилсульфоксид, диметилацетамид (ДМАА), этиллактат, гликофурол, формаль глицерина, бензиловый спирт, бензилбензоат, метоксиполиэтиленгликоль, алкоксиполиэтиленгликоль, сложные эфиры полиэтиленгликоля и изопропилиденгликоль.
[0065] Растворимость биологически разлагаемых полимеров в различных органических растворителях будет отличаться в зависимости от характеристик полимеров и их совместимости с растворителями. Таким образом, один и тот же полимер не будет растворяться в одинаковой степени в разных растворителях. Например, PLGA обладает значительно более высокой растворимостью в N-метил-2-пирролидоне (NMP), чем в триацетине. Однако тогда, когда раствор PLGA в NMP находится в контакте с водным раствором, NMP будет очень быстро распределяться с образованием твердой полимерной матрицы вследствие своей высокой смешиваемости с водой. Быстрая скорость диффузии растворителя может привести к быстрому образованию твердого имплантата, тем не менее, это также может привести к высокому первоначальному взрывному высвобождению. Когда раствор PLGA в триацетине находится в контакте с водным раствором, триацетин будет очень медленно распределяться вследствие своей низкой смешиваемости с водой. Медленная скорость диффузии растворителя может занять длительное время для перехода от вязкой жидкости к твердой матрице. Может существовать оптимальное равновесие, при котором растворитель диффундирует, а коагуляция полимера приводит к инкапсулированию пептидных субстанций. В связи с этим может быть выгодным объединять различные растворители для получения предпочтительной системы доставки. Растворители с низкой и высокой смешиваемостью с водой можно комбинировать для улучшения растворимости полимера, изменения вязкости композиции, оптимизации скорости диффузии и уменьшения первоначального взрывного высвобождения.
[0066] Полимерные композиции согласно настоящему изобретению обычно содержат органический растворитель в количестве, составляющим от 10 до 99% по массе. Вязкость полимерных композиций согласно настоящему изобретению зависит от молекулярной массы полимера и применяемого органического растворителя. Предпочтительно, концентрация полимера в указанных композициях составляет менее, чем 70% по массе.
[0067] «Полимер» представляет собой большую молекулу или макромолекулу, состоящую из многих повторяющихся субъединиц. Полимеры варьируются от известных синтетических пластмасс, таких как полистирол, до природных биополимеров, таких как ДНК и белки, которые являются фундаментальными для биологической структуры и функции. Полимеры, как природные, так и синтетические, получают путем полимеризации большого числа малых молекул, известных как мономеры. Полимеризация представляет собой процесс объединения большого числа малых молекул, известных как мономеры, в ковалентно связанную цепь или сеть. Полимер с большой молекулярной массой по сравнению с низкомолекулярными соединениями обладает уникальными физическими свойствами, включая ударную прочность, вязкоэластичность, и, как правило, образует стекла и полукристаллические структуры, нежели чем кристаллы.
[0068] Термин «биологически разлагаемый» относится к материалу, который постепенно разлагается, растворяется, гидролизуется и/или разрушается in situ. В целом в контексте настоящего описания «биологически разлагаемые полимеры» представляют собой полимеры, которые гидролизуются и/или биологически разрушаются in situ, главным образом, посредством гидролиза и/или ферментативного расщепления.
[0069] В контексте настоящего описания подразумевается, что термин «биологически разлагаемый полимер» включает любые биологически совместимые и/или биологически разлагаемые синтетические и природные полимеры, которые можно применять in vivo. В целом биологически разлагаемый полимер согласно настоящему изобретению может представлять собой неразветвленный полимер или разветвленный или звездообразный полимер, или смесь неразветвленного полимера и разветвленного и/или звездообразного полимера. Предпочтительно, биологически разлагаемый полимер согласно настоящему изобретению представляет собой полимер на основе лактата. В контексте настоящего описания «полимер на основе лактата» представляет собой полимер, который содержит звено лактата в полимере. В контексте настоящего описания термин «лактат» относится либо к молочной кислоте, либо к ее солям (лактатам), которых применяют в качестве реагентов при получении полимеров на основе лактата, или относится к таким фрагментам как остатки, которые включены посредством эфирных связей в молекулярные цепочки полимера на основе лактата. В контексте настоящего описания термин «лактат» также относится к циклическому димерному эфиру лактата (лактиду), когда речь идет о мономере, применяемом при получении полимеров на основе лактата. Мономер лактида представляет собой природное и возобновляемое соединение, которое получают из молочной кислоты (2-гидроксипропановой кислоты). Лактид как продукт молочной кислоты, который имеет две стереоизомерные формы (L(+)молочная кислота и D(-)молочная кислота), существует в трех стереоизомерных формах: L-лактид, D-лактид и мезолактид.
[0070] Лактид получают при двухстадийном синтезе: олигомеризации молочной кислоты с последующей циклизацией. L-лактид образуется, если исходной кислотой является L-молочная кислота, а D-лактид образуется, если исходной кислотой является D-молочная кислота. Мезолактид получают с применением комбинации L-молочной кислоты и D-молочной кислоты. Эффективная стадия очистки необходима для получения нужного уровня чистоты для полимеризации лактида в PLA [Savioli Lopes М., Jardini A., Maciel Filho R., 2014, Synthesis and characterizations of poly (lactic acid) by ringopening polymerization for biomedical applications, Chemical Engineering Transactions, 38, 331-336 DOI: 10.3303/CET1438056].
[0071] Понятно, что когда термины «молочная кислота», «лактат» или «лактид» используются в контексте настоящего описания, то любые и все хиральные формы соединений включены в термины. Таким образом, «молочная кислота» включает (R)-молочную кислоту и (S)-молочную кислоту или D-молочную кислоту, L-молочную кислоту, D,L-молочную кислоту или их любую комбинацию; «лактид» включает D-лактид, D,L-лактид, L,D-лактид, L-лактид, (R,R)-лактид, (S,S)-лактид и мезолактид или любую их комбинацию.
[0072] Полимеры на основе лактата включают любые полимеры/сополимеры, которые содержат лактат, молочную кислоту или мономеры лактида. Полимеры на основе лактата можно получить поликонденсацией (ПК), полимеризацией с раскрытием цикла (ПРЦ) и другими способами (удлинением цепи, привитой сополимеризацией). Различные типы полимеров, включая сополимеры, можно получить ПРЦ из D,L-лактида, L-лактида, D-лактида, гликолида (GA), ε-капролактона (CL), триметиленкарбоната (ТМС), 1,5-диоксепан-2-она (DXO) и других циклических аналогов.
[0073] Полимер на основе лактата согласно настоящему изобретению содержит гомополимеры молочной кислоты или мономеры лактида (полимолочная кислота или полилактид, PLA) и сополимеры молочной кислоты (или лактида) с другими мономерами (например, гликолевой кислотой (или гликолидом) (поли(лактид-со-гликолид), PLG или PLGA) и т.п.). Полимер на основе лактата может содержать одинаковые концевые группы, то есть все концевые группы являются одинаковыми, такие как группы сложного эфира или гидроксила или карбоновой кислоты. Полимер на основе лактата может содержать смешанные концевые группы сложного эфира, гидроксила или карбоновой кислоты. Полимер на основе лактата может содержать диольное ядро с концевыми гидроксильными группами, как те примеры, которые раскрыты в патенте США №8470359. Аналогичным образом, полимер на основе лактата может содержать триольный или полиольный центр, такой как глюкоза, с концевыми гидроксильными группами. Полимер на основе лактата может содержать одну концевую группу в виде группы сложного эфира и на другом конце иметь гидроксильную группу или карбоксильную группу. Полимер на основе лактата также может содержать одну концевую гидроксильную группу, а другом конце иметь группу карбоновой кислоты или сложного эфира, или наоборот.
[0074] Полимер на основе лактата согласно настоящему изобретению обычно обладает средневзвешенной молекулярной массой от 5000 до 50000. Полимер на основе лактата согласно настоящему изобретению может быть коммерчески доступным продуктом или полимером, полученным при помощи известного способа. Известные способы полимеризации, например, включают конденсационную полимеризацию молочной кислоты и сополимеризацию с другими мономерами, такими как гликолевая кислота, полимеризацию с раскрытием цикла лактида с использованием катализатора, такого как кислоты Льюиса или солей металлов, таких как диэтилцинк, триэтилалюминий, октилат олова, и сополимеризацию с другими циклическими мономерами, такими как гликолид; полимеризацию лактата с раскрытием цикла с присутствием в дальнейшем производного гидроксикарбоновой кислоты, у которого защищена карбоксильная группа (например, Международная публикация патента WO 00/35990); полимеризацию с раскрытием цикла лактида, в которой при нагревании к лактиду добавляют катализатор с целью вызвать полимеризацию с раскрытием цикла (например, J. Med. Chem., 16, 897 (1973)); и другие способы сополимеризации лактида с гликолидом и/или другими мономерами.
[0075] Полимеризацию можно осуществлять путем объемной полимеризации, в которой расплавляют лактид и другие сомономеры, или полимеризацией в растворе, в которой лактид и другие сомономеры растворяют в подходящем растворителе. Растворитель для растворения лактида при полимеризации в растворе включает, но не ограничивается ими, ароматические углеводороды, такие как бензол, толуол, ксилол и им подобные, декалин, диметилформамид и им подобные.
[0076] Важна молекулярная масса полимера, поскольку она определяет многие физические свойства. Некоторые примеры включают температуры для переходов от жидкостей к парафинам до каучуков до твердых веществ и механические свойства, такие как жесткость, прочность, вязкоэластичность, ударная прочность и вязкость. Для конкретного применения важно выбрать подходящий полимер с подходящей молекулярной массой.
[0077] Термины «средневзвешенная молекулярная масса, Mw» и «среднечисленная молекулярная масса, Mn» хорошо известны специалистам в данной области техники (см. http://www.chem.agilent.com/Library/technicaloverviews/Public/5990-7890EN.pdf) В контексте настоящего описания термин «коэффициент полидисперсности, КПД» определяют как средневзвешенную молекулярную массу полимера, деленную на среднечисленную молекулярную массу полимера (КПД=Mw/Mn). Известно, что коэффициент полидисперсности характеризует распределение молекулярных масс в полимере. КПД дает представление об однородности полимера. Полимеры, молекулы которых имеют почти одинаковые молекулярные массы, называются монодисперсными полимерами. Для этих молекул Mw=Mn и, следовательно, КПД равен единице. Полимеры, молекулы которых обладают широким диапазоном молекулярных масс, называются полидисперсными полимерами. Для этих полимеров Mw>Mn и, следовательно, их КПД больше единицы. Чем выше КПД, тем шире распределение молекулярной массы полимера. Значение КПД полимера на основе лактата согласно настоящему изобретению должно составлять менее, чем 2,5, предпочтительно менее, чем 2,0 и более предпочтительно менее, чем 1,8.
[0078] Полимер на основе лактата согласно настоящему изобретению можно подвергать повторному осаждению. От приблизительно 10 до 40% по массе полимера на основе лактата, обладающего средневзвешенной молекулярной массой от 5000 до 50000, можно добавлять к растворителю, способному растворять полимер на основе лактата. Указанный растворитель, например, включает хлороформ, дихлорметан, толуол, о-ксилол, м-ксилол, n-ксилол, тетрагидрофуран, ацетон, ацетонитрил, N-метил-2-пирролидон, ДМСО и N,N-диметилформамид. Органический раствор, содержащий полимер на основе лактата согласно настоящему изобретению, далее можно осадить в антирастворителе, в котором полимер на основе лактата согласно настоящему изобретению не растворяется. Указанный антирастворитель включает, но не ограничивается ими, спирты, такие как метанол и этанол, простые эфиры с короткой цепью, такие как этиловый эфир, алифатические углеводороды, такие как гексан, и воду. Мономеры и низкомолекулярные олигомеры полимера на основе лактата все еще растворяются в антирастворителе и поэтому остаются в растворе и не осаждаются.
[0079] Количество антирастворителя, которое может осаждать полимер на основе лактата, обычно кратно значению от 0,1 до 10 по массе, предпочтительно от 0,2 до 5 по массе, в расчете на растворитель раствора полимера на основе лактата. Например, когда 20 г полимера на основе лактата согласно настоящему изобретению растворяют в 100 г ацетона, далее в антирастворителе, таком как вода, в количестве, кратном значению от 0,1 до 10 по массе в расчете на ацетон, объединяют с раствором полимера на основе лактата для осаждения указанного полимера.
[0080] Процедуру осаждения можно осуществлять одним из следующих способов: 1) добавлять одновременно весь раствор полимера на основе лактата в органическом растворителе в антирастворитель; 2) по каплям добавлять раствор полимера на основе лактата в антирастворитель; 3) добавлять одновременно весь антирастворитель в раствор полимера на основе лактата; 4) по каплям добавлять антирастворитель в раствор полимера на основе лактата и тому подобное.
[0081] Полимер на основе лактата согласно настоящему изобретению можно очистить с использованием сверхкритической флюидной экстракции (SFE). SFE представляет собой процесс отделения одного компонента (экстрагента) от другого (матрицы) с применением сверхкритических флюидов в качестве экстрагирующего растворителя. Экстракцию обычно осуществляют из твердой матрицы, однако ее также можно проводить из жидкостей. В SPE используют флюид в сверхкритическом состоянии, которое для конкретной флюидной композиции определяют относительно давления и температуры. Каждый флюидный материал обладает характеристической комбинацией величин давления и температуры, называемой «критической точкой», и после превышения этих параметров указанный флюид находится в сверхкритическом состоянии. Флюид или растворитель, используемый при сверхкритической флюидной экстракции, может представлять собой одиночное соединение или может быть смесью соединений. Флюидные компоненты хорошо известны и легко доступны специалистам в данной области техники для выбора подходящего растворителя и сорастворителя для очистки полимера на основе лактата согласно настоящему изобретению.
[0082] Полимер на основе лактата согласно настоящему изобретению также содержит блок-сополимеры, такие как блок-сополимеры А-В-А, блок-сополимеры В-А-В и/или блок-сополимеры А-В и/или разветвленные сополимеры. Предпочтительными блок-сополимерами являются такие, в которых блок А содержит полимер на основе лактата, а блок В содержит полимер, выбранный из полигликолидов, поли(лактид-со-гликолидов), полиангидридов, поли(ортоэфиров), полиэфирэфиров, поликапролактонов, полиэфирамидов, поли(ε-капролактонов), поли(гидроксимасляных кислот) и их смесей и сополимеров. Блок В может также представлять собой полиэтиленгликоль или монофункциональное производное полиэтиленгликоля, такое как метоксиполиэтиленгликоль. Некоторые из этих комбинаций могут образовывать приемлемые термообратимые гели.
[0083] Согласно настоящему изобретению полимерная композиция для доставки лекарственного средства с контролируемым высвобождением представляет собой гомогенный раствор нуклеофильного лекарственного средства и полимера в растворителе. Упомянутые в настоящем описании примеси или вещества, родственные биологически активным веществам, представляют собой аддукты биологически активного вещества и строительных блоков полимера на основе лактата (например, молочной кислоты, лактата, мономера лактида и олигомеров). Проблема наличия примесей чаще встречается при применении гомогенного раствора нуклеофильного биологически активного вещества и полимера. В растворе указанные нуклеофильное биологически активное вещество и полимер совместно образуют благоприятные условия для взаимодействия/вступления в реакцию биологически активного вещества и полимера/олигомера/мономера вследствие тесного контакта между биологически активным веществом и полимером/олигомером/мономером.
[0084] Вещества, родственные биологически активным веществам, можно обнаружить при помощи ВЭЖХ-анализа. В патенте США №8343513 (колонки 43 и 44, Таблица 35 и Фигура 16) раскрыто, что 4 типа родственных лейпролиду примесей обнаружили при помощи ВЭЖХ и ВЭЖХ-МС в PLGA микросферах (RG503H), полученных с применением способа экстракции растворителем. Указанные микросферы получали из дисперсной фазы, состоящей из лейпролида ацетата, PLGA (RG503H), дихлорметана (ДХМ) и метанола. Оба растворителя токсичны и не пригодны для употребления человеком. В одном варианте реализации настоящего изобретения было установлено, что в фармацевтически приемлемых растворителях, таких как N-метилпирролидон (NMP) и диметилсульфоксид (ДМСО), образуется больше родственных биологически активным веществам примесей, нежели чем в токсичных растворителях, таких как ДХМ.
[0085] Было обнаружено, что все 4 типа родственных лейпролиду примесей, обнаруженных при помощи ВЭЖХ и ВЭЖХ-МС в патенте США №8343513, образовались в результате реакции остатка аргинина лейпролида с фрагментами полимера. В одном варианте реализации настоящего изобретения, когда мономеры лактида смешивали с аргинином или серином и растворяли в N-метилпирролидоне (NMP), фармацевтически приемлемом растворителе, при помощи ВЭЖХ неожиданным образом были обнаружены совершенно разные профили примесей. Было обнаружено, что серии является гораздо более реакционноспособным, нежели чем аргинин, в отношении мономеров лактида. Когда лейпролида ацетат смешивали с PLGA в NMP, при помощи ВЭЖХ обнаружили два основных типа родственных лейпролиду примесей. Обнаруженные при помощи ВЭЖХ вещества, родственные лейпролиду, анализировали при помощи тандемной масс-спектрометрии с ионизацией электрораспылением (ESI-MS/MS) для получения их профилей фрагментных ионов. На основании данных МС/МС у4Серина наблюдали увеличение массы на 144 Да. Достоверно и то, что эти два типа примесей обладали одним и тем же значением Mw и должны были быть модифицированы по4Серину по сравнению с данными масс-спектрометрии фрагментов лейпролида. Эти два типа примесей представляют собой конъюгаты лейпролида-лактида, образованные вследствие реакции серина лейпролида и мономеров лактида. Двумя главными конъюгатами являлись [Pyr-His-Trp-(Ser-D-Lactide)-Tyr-D-Leu-Leu-Arg-Pro-NHEt] и [Pyr-His-Trp-(Ser-L-Lactide)-Tyr-D-Leu-Leu-Arg-Pro-NHEt] (Pyr=L-пироглутамил), и их не обнаружили, что раскрыто в патенте США №8343513. Это указывает на то, что присутствие мономеров лактида отрицательно сказывается на стабильности лейпролида.
[0086] Также неожиданно и то, что образованию этих примесей и снижению молекулярной массы полимера не препятствовало применение низкомолекулярного полимера с высоким кислотным числом в данных полимерных композициях, содержащих PLA (Mw 11 тыс. и кислотное число 12 мгКОН/г). Фактически конъюгаты лейпролида-лактида образуются быстрее в составе с более высоким кислотным числом. Кроме того, когда в этих полимерных композициях применяли поли(лактид-со-гликолид) (PLGA 5050) с кислотным числом, составляющим 5 мгКОН/г, наблюдали, что более высокое содержание мономера лактида в растворе приводило к большему образованию примесей. Эти результаты являются неожиданными, исходя из того, что раскрыто в патенте США №8343513. В отличие от описания патента США №8343513, присутствие олигомеров не уменьшало, а увеличивало образование всех примесей.
[0087] В патенте США №8343513 также раскрыто, что для снижения образования примесей необходимо применять низкомолекулярные полимеры с высокими кислотными числами и значимым количеством добавок или олигомеров с низким значением pKa. Такие кислотные дисперсные фазы непригодны для парентерального применения человеком вследствие раздражения тканей от низкого значения рН. В другом варианте реализации настоящего изобретения, когда мезилат октреотида с избытком метансульфоновой кислоты, такой что значение рН раствора соли составляет 2,4, растворяют в фармацевтически приемлемом растворителе с добавлением мономера лактида, неожиданным образом образуется много примесей, и указанный пептид является сильно нестабильным. Фактически для раствора с избытком кислоты образуется больше примесей, чем без нее.
[0088] Согласно настоящему изобретению случайным и неожиданным образом было обнаружено, что можно уменьшить или предотвратить образование примесей посредством (1) применения полимеров на основе лактата с низким содержанием остаточного мономеров лактида; (2) применения полимеров на основе лактата, содержащих олигомеры с низкой экстрагируемостью; (3) применением полимеров на основе лактата с низким кислотным числом и (4) исключения применения каких-либо кислотных добавок.
[0089] Согласно настоящему изобретению полимеры на основе лактата обладают средневзвешенной молекулярной массой от 5000 до 50000, от 5000 до 45000, от 5000 до 40000, от 5000 до 35000, от 5000 до 30000, от 5000 до 25000, от 5000 до 20000, от 5000 до 15000, от 5000 до 12000 или от 10000 до 40000, или от 12000 до 35000, или от 15000 до 30000 дальтон.
[0090] У полимеров на основе лактата согласно настоящему изобретению содержание остаточного или невступившего в реакцию лактида составляет менее, чем 0,3%, предпочтительно менее, чем 0,2% и более предпочтительно менее, чем 0,1%.
[0091] Полимеры на основе лактата согласно настоящему изобретению содержат фракцию олигомеров, обладающих значением Mw менее, чем 5000, что составляет менее, чем 20% по массе, предпочтительно менее, чем 15%, предпочтительно менее, чем 10% и наиболее предпочтительно менее, чем 5%. Полимеры на основе лактата согласно настоящему изобретению содержат фракцию олигомеров, обладающих значением Mw меньшим, чем 1000, что составляет менее, чем 5% по массе, предпочтительно менее, чем 3%, более предпочтительно менее, чем 2% и наиболее предпочтительно менее, чем 1%.
[0092] Полидисперсность полимера на основе лактата согласно настоящему изобретению составляет от 1,1 до 2,5. Предпочтительно, полидисперсность полимера на основе лактата согласно настоящему изобретению составляет по меньшей мере 2,0 или менее. Более предпочтительно, полидисперсность полимера на основе лактата согласно настоящему изобретению составляет по меньшей мере 1,8 или менее.
[0093] Кроме того, «кислотное число» полимеров на основе лактата является другим критическим свойством, которое может влиять на образование примесей. Кислотное число полимера обозначает то количество гидроксида калия в «мг», которое необходимое для нейтрализации кислоты, присутствующей в одном грамме полимера. Полимеры с кислотными концевыми группами будут обладать некоторым кислотным числом. Полимеры с более низкой молекулярной массой будут содержать больше кислотных концевых групп и будут обладать более высокими кислотными числами. Экстрагируемые олигомеры кислот в полимерах могут также влиять на величину кислотного числа. Как правило, для полимеров с кислотными концевыми группами кислотное число показывает зависимость от молекулярной массы, больше в отношении среднечисленной молекулярной массы. Кислотное число полимеров на основе лактата согласно настоящему изобретению составляет от 0 до 30 мгКОН/г. Полимеры на основе лактата согласно настоящему изобретению обладают кислотным числом, составляющим менее, чем 20, предпочтительно менее, чем 10, более предпочтительно менее, чем 3 и наиболее предпочтительно менее, чем 2.
[0094] Фармацевтические композиции согласно настоящему изобретению могут содержать полимер на основе лактата в количестве, составляющим от 5 до 75% по массе. Вязкость фармацевтических композиций согласно настоящему изобретению зависит от молекулярной массы применяемого полимера и органического растворителя. Как правило, при применении одного и того же растворителя чем выше молекулярная масса и концентрация полимера, тем выше вязкость. Предпочтительно концентрация полимера в указанных композициях составляет менее, чем 70% по массе.
[0095] В настоящем изобретении предпочтительно применяют полимеры на основе лактата, такие как полимолочная кислота, и сополимеры молочной кислоты и гликолевой кислоты (PLGA), включая поли(D,L-лактид-со-гликолид) и поли(L-лактид-со-гликолид). Термопластичные полимеры сложного эфира обладают значениями соотношения мономеров молочной кислоты и гликолевой кислоты от приблизительно 50:50 до приблизительно 100:0 и средневзвешенной молекулярной массы от приблизительно 5000 до приблизительно 50000. Биологически разлагаемые термопластичные полимеры сложного эфира можно получить с применением способов, известных в данной области техники, например, поликонденсацией и полимеризацией с раскрытием цикла (например, патенты США №№4443440, 5224910, 5310865, которые все включены в настоящее описание посредством ссылки). Можно также проводить очистку биологически разлагаемых полимеров для удаления остаточных мономеров и олигомеров, применяя известные в данной области техники способы, таких как растворение и повторное осаждение полимера (например, патенты США №№4810775, 5585460, которые включены в настоящее описание посредством ссылки). Концевые группы поли(D,L-лактид-со-гликолида) могут представлять собой либо гидроксильные, карбоксильные, либо группы сложного эфира в зависимости от способа полимеризации и модификации концевой группы. Подходящие полимеры могут включать монофункциональный спирт или остаток полиола. Примерами монофункциональных спиртов являются метанол, этанол или 1-додеканол. Полиол может представлять собой диол, триол, тетраол, пентаол и гексаол, включая этиленгликоль, 1,6-гександиол, полиэтиленгликоль, глицерин, сахариды, глюкозу, сахарозу, восстановленные сахариды, такие как сорбит, и им подобные. Многие подходящие PLGA коммерчески доступны, и PLGA конкретного состава можно легко получить согласно предшествующему уровню техники.
[0096] Тип, молекулярная масса и количество биологически разлагаемого полимера, присутствующего в композициях, может влиять на продолжительность времени, в течение которого биоактивное вещество высвобождается из имплантата с контролируемым высвобождением. Выбор типа, молекулярной массы и количества биологически разлагаемого полимера, присутствующего в композициях для достижения целевых свойств имплантата с контролируемым высвобождением, можно определить при помощи простых экспериментов.
[0097] В одном предпочтительном варианте реализации настоящего изобретения полимерную композицию можно применять для приготовления системы доставки с контролируемым высвобождением лейпролида мезилата. В таком варианте реализации полимер на основе лактата может предпочтительно представлять собой поли(D,L-лактид-со-гликолид), содержащий 75% лактида в полимерной цепи или больше, гидроксильную концевую группу и концевую группу лаурилового эфира; может присутствовать в количестве от приблизительно 30% до приблизительно 65% от массы композиции и может обладать средней молекулярной массой от приблизительно 5000 до приблизительно 50000.
[0098] В другом предпочтительном варианте реализации настоящего изобретения полимерную композицию можно применять для приготовления системы доставки с контролируемым высвобождением лейпролида мезилата. В таком варианте реализации полимер на основе лактата может предпочтительно представлять собой поли(D,L-лактид-со-гликолид), содержащий 75% лактида в полимерной цепи или больше, две гидроксильные концевые группы; может присутствовать в количестве от приблизительно 30% до приблизительно 65% от массы композиции и может обладать средней молекулярной массой от приблизительно 5000 до приблизительно 50000.
[0099] В еще одном предпочтительном варианте реализации настоящего изобретения в биологически разлагаемом полимере композиции на основе лактата содержание остаточного лактида составляет 0,2% или менее, и его можно приготавливать с лейпролида мезилатом. В таком варианте реализации биологически разлагаемый полимер может предпочтительно представлять собой поли(лактид-со-гликолид) или 100/0 поли(D,L-лактид) с концевыми группами карбоновой кислоты или без них; может присутствовать в количестве от приблизительно 10% до приблизительно 65% от массы композиции и может обладать средней молекулярной массой от приблизительно 5000 до приблизительно 50000. При приготовлении с фармацевтически приемлемым органическим растворителем, таким как NMP, образование конъюгатов лейпролида-лактида посредством серинового сайта составляет менее, чем 5%, предпочтительно менее, чем 2%, более предпочтительно менее, чем 1% и наиболее предпочтительно менее, чем 0,5%.
[00100] В одном аспекте настоящего изобретения предложены стабилизированные биологически разлагаемые полимерные композиции для инъекций для образования экономичных, практичных и эффективных систем доставки с контролируемым высвобождением, которые содержат: а) биологически активное вещество или его соль; b) фармацевтически приемлемый органический растворитель; с) биологически разлагаемый гомополимер или сополимер на основе лактата. Биологически активные вещества или их соли согласно настоящему изобретению обычно являются нуклеофильными и могут вступать в реакцию с мономерами лактида или олигомерами на основе лактата с образованием ковалентных конъюгатов или аддуктов. Полимерная композиция предпочтительно является композицией для инъекций и ее можно упаковать в набор, включающий стадию наполнения шприца композицией в готовой к применению консистенции. Композиция в указанном наборе стабильна в течение разумного периода времени, предпочтительно по меньшей мере в течение одного года, для того, чтобы существовал подходящий срок хранения при контролируемых условиях хранения. Композицию предпочтительно вводят посредством инъекции субъекту для образования имплантата in situ, из которого биологически активное вещество высвобождается в терапевтически эффективном количестве в течение целевого продолжительного периода времени.
[00101] В другом предпочтительном варианте реализации настоящего изобретения предложен способ получения композиции для инъекции для доставки лекарственного средства с контролируемым высвобождением, включающий: объединение полимера на основе лактата, обладающего средневзвешенной молекулярной массой от 5000 до 50000 дальтон, кислотным числом, составляющим менее, чем 3 мгКОН/г, и содержанием остаточного мономера лактида в полимере на основе лактата, составляющим менее, чем приблизительно 0,3% по массе, с фармацевтически приемлемым органическим растворителем и биологически активным веществом или его солью, способным вступать в реакцию с мономером лактида с образованием конъюгата при условии, что при получении указанной композиции не добавляют кислотную добавку. При этом определенная в настоящем описании кислотная добавка не является кислотой, существующей в полимере на основе лактата, или полученной в результате разложения полимера на основе лактата. Кислотная добавка представляет собой материал, который необходимо добавить к композиции в дополнение к полимеру на основе лактата.
[00102] В одном аспекте предложен полимер на основе лактата, значение кислотного числа которого менее, чем предпочтительно 2 мгКОН/г и более предпочтительно менее, чем 1 мгКОН/г.
[00103] В другом аспекте предложен полимер на основе лактата, в котором содержание остаточного мономера лактида в полимере на основе лактата составляет менее, чем приблизительно 0,3% по массе, предпочтительно менее, чем 0,2% по массе и более предпочтительно менее, чем 0,1% по массе.
[00104] В еще одном аспекте предложен полимер на основе лактата, в котором содержание олигомеров с молекулярной массой 1000 или менее составляет приблизительно 2% по массе или менее.
ПРИМЕРЫ
[00105] В следующих примерах представлены композиции согласно настоящему изобретению. Указанные примеры не ограничивают изобретение, однако предназначены для объяснения того, каким образом получать подходящие композиции для доставки лекарственного средства с контролируемым высвобождением.
Пример 1: Лейпролида ацетат в растворе PLA полимера в NMP
[00106] Получили и оценили состав, аналогичный раскрытому в примере 6 патента США №6565874. Поли(D,L-лактид) со средневзвешенной молекулярной массой 14000 (100 DL 2Е, Evonik) и с содержанием остаточного мономера лактида, составляющим 3,2% по массе, растворяли в N-метилпирролидоне (NMP) с получением 60% раствора полимера в NMP по массе. Далее 61,8 мг лейпролида ацетата (чистота 99,5%) объединяли и смешивали с 690,3 мг раствора полимера с получением жидкого состава. Указанный состав хранили при 37°С в течение одного часа и далее анализировали при помощи ВЭЖХ.
[00107] Анализ проводили путем добавления аликвоты в приблизительно 10-20 мг состава в 1,5 мл центрифужную пробирку. К аликвоте указанного состава добавляли 333 мкл смеси 3 мл МеОН с 7 мл ACN (Раствор А) и пробирку встряхивали для растворения полимера. Далее добавляли 667 мкл буфера для стабилизации (6 мл триэтиламина (ТЭА) и 3 мл фосфорной кислоты к 1 литру воды, рН 3,0) и указанный раствор смешивали на аппарате для встряхивания титровальных планшетов от Lab Line в течение 10 минут при настройке оборотов 10. Анализ образца осуществляли путем внесения 0,5 мл указанного раствора в пробирку для ВЭЖХ таким образом, чтобы можно было достичь и измерить концентрацию лейпролида при значении, составляющим ~ 1 мг/мл. Степень чистоты лейпролида определяли с применением системы СВЭЖХ или ВЭЖХ с обращенной фазой градиента. Площадь пика лейпролида сравнивали с площадями пиков общего числа пиков и выражали в процентах.
Условия для ВЭЖХ:
Приборы: Система ВЭЖХ Shimadzu: Двойной насос, модель LC-10ADVP, Ультрафиолетовый детектор с изменяемой длиной волны, модель SPD-M10AVP, Автоматический дозатор, модель SIL-10ADVP
Колонка: YMC ODS-A С-18 4,6×250 мм, 5μ, 120
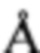
Подвижная фаза: А: 0,05% трифторуксусная кислота (TFA) в воде
В: 0,05% TFA в ацетонитриле
В: концентрация 24% (исходная) → 24% (2 мин) → 30% (35 мин) → 95% (37 мин) → 24% (38 мин) → повторное уравновешивание (40 мин)
Скорость потока: 1,0 мл/мин
Температура колонки: 40°С
Объем пробы: 10 мкл
Обнаружение: 220 нм
Время проведения анализа: 40 мин
[00108] Неожиданно было обнаружено, что значимое количество примесей образуется в течение 1 часа при 37°С.
[00109] Как представлено на Фигуре 1, время удерживания лейпролида составляет приблизительно 15,03 мин, тогда как основные примеси, родственные лейпролиду, появляются при значении относительного времени удерживания (RRT) относительно пика лейпролида приблизительно 1,40, 1,46, 1,50, 1,52 и 1,55. Более, чем приблизительно 10,8% примесей, родственных лейпролиду, образовывались в течение одного часа при 37°С, которое рассчитали по площади пиков. Такой уровень родственных лекарственному средству примесей будет значительно превышать пороги квалификации, указанные в руководящих принципах FDA и ICH. Значимое количество родственных лейпролиду примесей, образующихся в этих типах составов в течение такого короткого периода времени, отрицательно скажется на качестве лекарственного продукта.
Пример 2: Лейпролида ацетат, приготовленный с PLA полимером в различных растворителях
[00110] Составы получали, применяя лейпролида ацетат (LAAce) в PLА (100 DL 2Е с содержанием остаточного мономера лактида, составляющим 3,2% по массе, Evonik) растворе (60% масс/масс) в различных растворителях для исследования образования родственных лейпролиду примесей. Исследуемыми растворителями являлись N-метилпирролидон (NMP), дихлорметан (ДХМ) и диметилсульфоксид (ДМСО). В Таблице 1 приведены компоненты составов.


[00111] Составы смешивали и хранили в стеклянных флаконах при 37°С. Образец брали в нулевой момент времени и анализировали при помощи ВЭЖХ для измерения чистоты лейпролида. На Фигурах 2-4 представлены исходные хроматограммы лейпролида из составов.
[00112] На хроматограммах представлено, что в нулевой момент времени (сразу после смешивания) уже наблюдаются некоторые родственные лейпролиду примеси со значениями относительного времени удерживания (RRT) относительно лейпролида 1,46, 1,49, 1,52 и 1,55. После инкубации при 37°С составы повторно анализировали при помощи ВЭЖХ на определение лейпролида. На Фигурах 5-7 представлены хроматограммы лейпролида через 1 час при 37°С в составах с NMP, ДМСО и ДХМ соответственно.
[00113] Содержание родственных лейпролиду примесей, наблюдаемых при значениях PRT относительно пика лейпролида приблизительно 1,40, 1,46, 1,50, 1,52 и 1,55, значимо больше того, которое наблюдается в нулевой момент времени. Результаты показывают, что образование родственных лейпролиду примесей происходит намного быстрее в составах, содержащих ДМСО и NMP, нежели чем в составе, содержащем ДХМ. Образование родственной лейпролиду примеси в содержащем ДХМ составе не менялось в течение периода исследования. Эти результаты объясняют, почему примеси, наблюдаемые в настоящей заявке, отличаются от тех, которые раскрыты в патенте США №8343513. Кроме того, ДХМ не смешивается с водой и не является фармацевтически приемлемым растворителем для инъекций. В Таблице 2 приведены данные чистоты лейпролида в составах, определенные при помощи ВЭЖХ. Снижение значения чистоты лейпролида хорошо коррелирует с увеличением количества родственных лейпролиду примесей.

[00114] Таким образом, значимое количество примесей может образовываться, когда лейпролид находится в присутствии фармацевтически приемлемого смешивающегося с водой растворителя, такого как NMP и ДМСО.
Пример 3. Реакция аргинина и серина с мономерами D,L-лактида
[0015] В патенте США №8343513 на Фигуре 16 (колонки 43-44) представлены структуры примесей, образующихся с лейпролида ацетатом в микросферах, полученных из полимера RG503H в растворах ДХМ. Все идентифицированные структуры примесей содержат полимеры, вступающие в реакцию с аргининовой группой пептида. В настоящем изобретении показано, что конъюгаты мономеров лактида, вступающие в реакцию с сериновой группой пептида, представляют собой более значимые образующиеся примеси, которые ранее не наблюдались. Чтобы исследовать образование конъюгатов лейпролида с мономерами лактида, FMOC-ARG-OH или FMOC-SER-OH растворяли в NMP. К этому раствору добавляли мономеры D,L-лактида. Раствор хорошо перемешивали при помощи встряхивания. 5 мкл указанного раствора вносили в виалу для ВЭЖХ с 0,5 мл ацетонитрила и 0,5 мл буфера для стабилизации (0,6% ТЭА/0,3% Н3РО4 в воде, рН=3,0). Далее образец анализировали при помощи ВЭЖХ. Оставшиеся растворы хранили в стеклянном флаконе при 25°С. Образцы отбирали в определенные моменты времени и анализировали при помощи СВЭЖХ. В Таблице 3 приведены составы композиций.

[00116] Представлены ВЭЖХ-хроматограммы на 3-й час и 24-й час для каждого из составов. На Фигуре 8 представлена ВЭЖХ-хроматограмма для раствора FMOC-SER-OH после 3 часов инкубации.
[00117] Как представлено на Фигуре 8, очень малое количество примесей образуется после 3 часов инкубации с мономерами лактида. Значение времени удерживания для основного пика серина составляет 22,5 минуты. Двойные пики примесей начинают появляться через 29,5 и 30,0 минут. На Фигуре 9 представлена хроматограмма через 1 день при 25°С.
[00118] На Фигуре 9 представлено образование примесей при реакции D,L-лактида с серином при 29,5 и 30,0 минутах. Эти 2 пика являются результатом реакцией серина с каждым из мономеров (D- и L-лактидом). Неожиданно то, что в результате этой реакции образуется значимое количество примесей, которые не были идентифицированы в патенте США №8343513. На Фигуре 10 представлена хроматограмма FMOC-ARG-OH в NMP при 3 часах.
[00119] Пик аргинина появляется на 16,8 минуте. В то время как примеси наблюдаются через 20,0 мин, двойной пик примесей не наблюдается. На Фигуре 11 представлена хроматограмма того же образца через 1 день при 25°С.
[00120] Через 1 день содержание примеси, наблюдаемое на 20,0 минуте, увеличилось, как и примеси на 25,5 мин. Двойного пика, который наблюдается с серином, с аргинином не образуется. Кроме того, общее образование примесей все еще меньше того количества, которое наблюдается с серином, что указывает на то, что серии лейпролида является более реакционноспособным в отношении мономеров D,L-лактида в составе в фармацевтически приемлемом, смешивающемся с водой растворителе, таком как NMP.
Пример 4. Стабильность лейпролида с PLA с различными кислотными числами в NMP.
[00121] В патенте США №8343513 заявлено нуклеофильное соединение с органическим растворителем и полимером, которое можно стабилизировать дополнительной кислотой. В настоящем изобретении представлено, что полимеры с более высоким кислотным числом все еще не могут предотвратить реакцию указанного нуклеофильного соединения с остаточными мономерами полимера в смешивающимся с водой органическом растворителе. Свойства полимера приведены в Таблице 4.

[00122] PLA полимеры, PLA1 и PLA2, растворяли в NMP для получения 57,5% и 60% раствора полимера соответственно. Составы получали смешиванием лейпролида ацетата (LAAce) (CSBio, № GF1122) в указанных растворах полимеров. В Таблице 5 приведен состав композиций.

[00123] Растворы тщательно перемешивали и хранили при 37°С. В определенные моменты времени чистоту раствора анализировали при помощи СВЭЖХ, а молекулярную массу полимера анализировали при помощи гель-проникающей хроматографии (ГПХ). Условиями для СВЭЖХ были:
Приборы: Система СВЭЖХ Shimadzu: Двойной насос, модель LC-10AD, Ультрафиолетовый детектор с изменяемой длиной волны, модель SPD-M10A, Автоматический дозатор, модель SIL-10AC
Колонка: Acquity UPLC ВЕН С18 колонка, 130
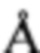
Подвижная фаза: А: буфер для стабилизации (6 мл триэтиламина (ТЭА) и 3 мл фосфорной кислоты к 1 литру воды со значением рН, доведенным до 3,0)
В: Ацетонитрил
В: концентрация 15% (исходная) → 24% (40 мин) → 24,9% (44 мин) → 70% (46 мин) → 70% (48,5 мин) → 15% (49 мин) → повторное уравновешивание (56 мин)
Скорость потока: 0,4 мл/мин
Температура колонки: 60°С
Объем пробы: 2 мкл
Обнаружение: 220 нм
Время проведения анализа: 56 мин
[00124] В Таблице 6 приведены значения относительного времени удерживания (RRT) для наблюдаемых для составов пиков в определенные моменты времени.

[00125] Общее содержание примесей или конъюгатов лактида-лейпролида при значениях RRT 1,29 и 1,31 возрастает с течением времени. Неожиданно то, что общее содержание примесей или конъюгатов лактида-лейпролида возрастает быстрее для состава с более высоким кислотным числом.
[00126] Молекулярную массу полимера анализировали при помощи ГПХ. В Таблице 7 приведены данные по изменению молекулярной массы с течением времени в процентах от начальной молекулярной массы.

[00127] В отличие от патента США №8343513, полимер в составе с более высоким кислотным числом (PLA2) не является таким стабильным, как полимер с более низким кислотным числом.
Пример 5. Стабильность лейпролида в растворе с PLGA, содержащим различное количество мономеров D,L-лактида
[00129] В патенте США №8343515 заявлено нуклеофильное соединение в дисперсной фазе в органическом растворителе и полимере с кислотным числом, составляющим по меньшей мере 5, которое можно стабилизировать. В настоящем изобретении показано, что более высокие значения кислотных чисел не предотвращают образование примесей и конъюгатов лактида с лейпролидом. Для измерения разницы в значениях стабильности состава применяли PLGA полимер PLGA5050, содержащий различное количество остаточных мономеров лактида. В Таблице 8 приведены свойства этого полимера.

[00130] 50% растворы PLGA полимеров, содержащих различные количества остаточного D,L-лактида, получали путем растворения указанных полимеров в подходящем количестве NMP.
[00131] Составы получали путем смешивания лейпролида ацетата (CSBio, № GF1122) в растворах полимеров. В Таблице 9 приведены составы композиций.

[00132] Растворы тщательно перемешивали и хранили при 37°С. В определенные моменты времени чистоту раствора анализировали при помощи СВЭЖХ, а молекулярную массу полимера анализировали при помощи ГПХ.
[00133] В таблице 10 приведены значения относительного времени удерживания (RRT) для наблюдаемых у составов пиков в определенные моменты времени.

*Н.О. - не определено
[00134] Конъюгаты лактида-лейпролида обнаруживаются при значениях RRT 1,297 и 1,312. В этом же случае видно, что содержание примесей увеличивается с течением времени и увеличивается быстрее для состава, содержащего больше мономеров лактида.
[00135] Молекулярную массу полимера анализировали при помощи ГПХ.
[00136] Существенной разницы между значениями Mw этих двух составов в разные моменты времени не наблюдается.
Пример 6: Образование примесей мономера L-лактида с лейпролидом
[00137] Для доказательства того, что примеси образуются в результате реакции с мономерами D,L-лактида, лейпролида мезилат (LAMS) инкубировали с L-лактидом, чтобы убедиться в том, что образовавшиеся примеси демонстрируют только один пик вместо двойного пика, наблюдаемого ранее.
[00138] В таблице 11 приведен состав данного раствора.

[00139] На Фигуре 12 представлена хроматограмма LAMS в NMP с 10% L-лактидом после 3 часов при 37°С.
[00140] Как представлено на Фигуре 12, наблюдаемый ранее двойной пик теперь является пиком одиночным. Двойные пики означают, что оба изомера лактида вступают в реакцию. Фигура 12 подтверждает то, что мономер лактида вызывает образование примесей, поскольку примеси видны при одном и том же значении RRT, однако только одиночные пики присутствуют при инкубации только с одним из изомеров лактида.
Пример 7. Лейпролид с различными концентрациями мономеров D,L-лактида
[00141] Получали растворы с лейпролида ацетатом (LAAc) в NMP с различными количествами D,L-лактида согласно Таблице 12 для исследования стабильности лейпролида.

[00142] Растворы тщательно перемешивали и хранили при 37°С. В определенные моменты времени небольшую аликвоту растворов добавляли в виалу для ВЭЖХ и при помощи ВЭЖХ анализировали чистоту раствора. В Таблице 13 приведены данные по чистоте этих составов с течением времени с основными примесями, образовавшимися из мономеров лактида.

[00143] Как показывают данные из Таблицы 13, процентное содержание лейпролида уменьшается с увеличением содержания лактида. Содержание примесей, наблюдаемое при значениях относительного времени удерживания (RRT) 1,083 и 1,086, также увеличивается с увеличением содержания лактида. Не наблюдали и образование конъюгатов в образце без присутствия мономеров лактида в течение 4 часов при 37°С.
Пример 8: Очистка полимеров на основе лактида
[00144] Соответствующее количество полимера PLA100DL2E на основе лактида (Mw 14 тыс., содержание остаточного мономера составляет 3,2%) растворяли в заранее определенном количестве ацетона для достижения целевой концентрации раствора полимера на основе лактида. Концентрация полимера может составлять от 5 до 50% по массе. В этом примере приблизительно 25 г полимера растворяли в 100 мл ацетона с образованием прозрачного раствора в подходящей емкости, такой как химический стакан. К этому раствору при перемешивании добавляли приблизительно 100 мл воды для осаждения полимера (Способ 1) или добавляли приблизительно 40 мл воды для осаждения полимера (Способ 2). Указанный супернатант декантировали. Эту процедуру повторяли не более 4 раз. После последней декантации осажденный полимер замораживали и сушили под вакуумом в течение приблизительно 48 часов. Характеристики полученного полимера определяли при помощи ГПХ, и результаты приведены в Таблице 14.
[00145] Добавление большего количества воды приводит к осаждению большего количества меньших по массе олигомеров и не приводит к изменению общей молекулярной массы полимера. Добавление меньшего количества воды приводит к большему удалению меньших по массе олигомеров и увеличению молекулярной массы полимера и уменьшению величины полидисперсности.
Пример 9: Влияние стабильности лейпролида на очистку полимера
[00146] Полимеры из Примера 8 применяли для получения растворов полимеров и смешивали с лейпролидом для получения составов, чтобы сравнить значения стабильности очищенных полимеров и неочищенных полимеров. 8% лейпролида ацетат смешивали с 60% раствором полимера в NMP, применяя очищенные и неочищенные полимеры. Составы хранили при 37°С и анализировали при помощи ВЭЖХ для измерения стабильности лейпролида. В Таблице 15 приведено значение стабильности лейпролида в каждый момент времени для каждого состава.

[00147] Как представлено в Таблице 15, очистка полимера повышает стабильность лейпролида. Более 10% лейпролида с неочищенным полимером разлагается уже через 1 час при 37°С, в то время как содержание лейпролида в составах очищенных полимеров по-прежнему остается близким к 99% через 1 час. К 24 часам наблюдается некоторое различие между составами с полимером, очищенным при помощи 2-х циклов в сравнении с 4-мя циклами, что указывает на то, что до сих пор присутствует некоторое количество мономеров, которое увеличивает скорость разложениия. Таким образом, большее количество стадий очистки приводит к удалению большего количества мономеров лактида, что уменьшает образование конъюгатов лейпролида-лактида и повышает стабильность состава. Разница в способе очистки минимальна с точки зрения стабильности состава.
Пример 10: Стабильность LAMS с очищенными PLGA полимерами
[00148] Неочищенные полимеры сравнивали с полимерами, которые были высокоочищенными. Способ очистки включал растворение полимера в ацетоне и далее осаждение путем добавления воды в раствор ацетон/полимер, как в Способе 2 Примера 8. Этот процесс повторяли не более трех раз для PLGA полимера 8515DLG2CE-P, чтобы значительно снизить содержание мономера лактида. В Таблице 16 приведено содержание мономеров в исследуемых полимерах.
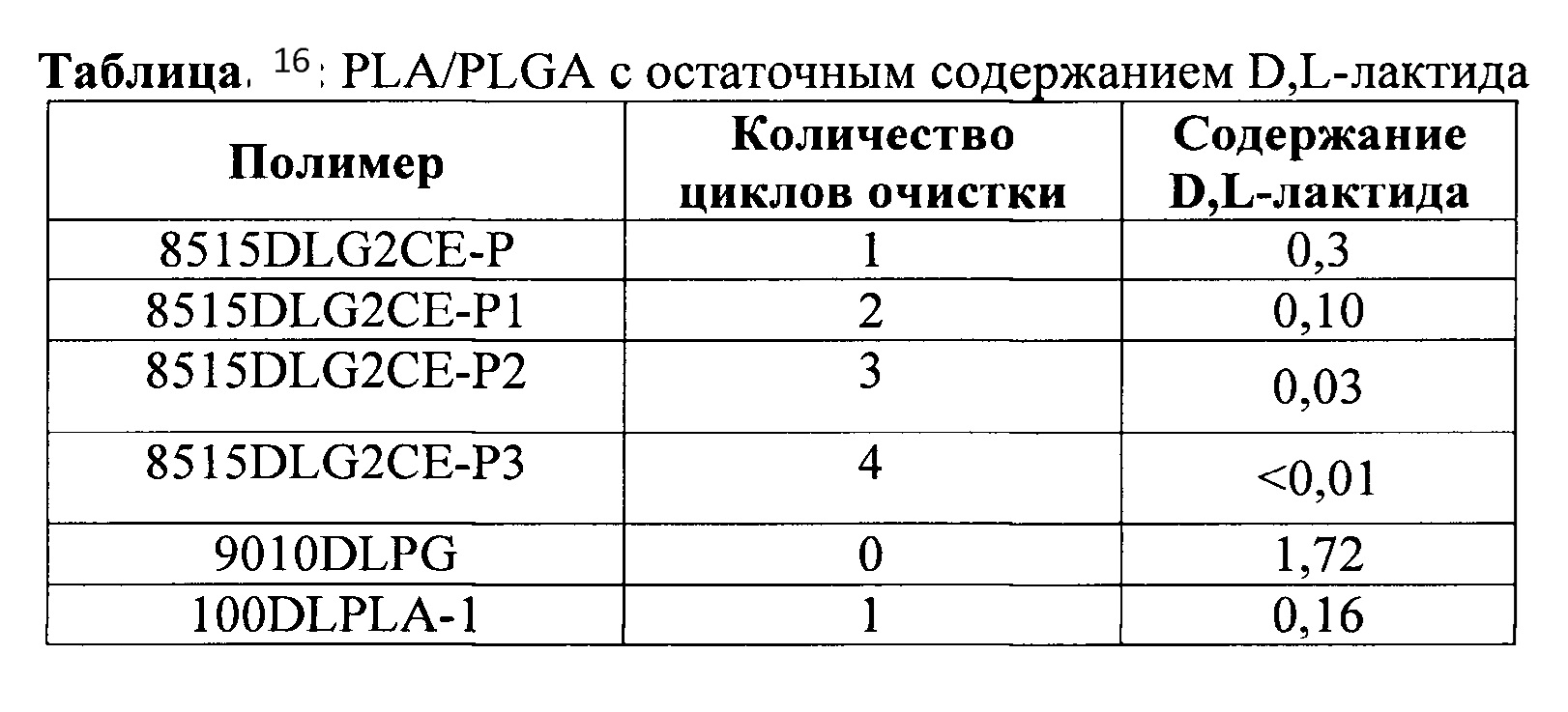
[00149] Как представлено в Таблице 16, содержание мономеров уменьшается с каждой последующей очисткой PLGA 8515DLG2CE-P. Составы получали с лейпролида мезилатом (LAMS) согласно Таблице 17.

[00150] Составы хранили в стеклянных флаконах при 37°С. В определенные моменты времени измеряли стабильность лейпролида и суммарное содержание примесей, образующихся из мономера D,L-лактида, определяли как процент от общей площади под кривой (AUC), полученной из ВЭЖХ-хроматограммы, которое приведено в Таблице 18.


[00151] Как представлено в Таблице 18, пики родственных мономеру примесей непосредственно коррелируют с начальной концентрацией мономера. Уменьшение содержания мономера посредством очистки может значимо уменьшить количество примесей в составе. Многократные стадии очистки могут дополнительно снизить содержание мономера и, как результат, повысить стабильность состава. По меньшей мере две стадии очистки предпочтительны для того, чтобы снизить остаточное содержания мономера для значимого уменьшения образования конъюгатов лактида-лейпролида.
Пример 11: Образование примеси лейпролида в PLA-содержащих составах с различным содержанием мономеров лактида
[00152] Составы получали, применяя LAAce с PLА с различными количествами D,L-лактида, для исследования реакционной способности лейпролида. В Таблице 19 приведены компоненты составов.


[00153] Составы хранили в стеклянных флаконах при 37°С. Образец отбирали в нулевой момент времени и анализировали при помощи ВЭЖХ для измерения чистоты лейпролида. На Фигурах 13-18 представлены хроматограммы лейпролида из первоначальных составов.
[00154] Видно то, что количество примесей при значениях RRT 1,49 и 1,53 существенно увеличивается с увеличением содержания D,L-лактида в указанных составах даже сразу после смешивания. Образцы повторно анализировали через 1 час, 4 часа и 24 часа. На Фигурах 19-24 представлены 24-часовые хроматограммы.
[00155] В Таблице 20 приведены данные по сравнению чистоты лейпролида для составов в различные моменты времени с точки зрения площади ВЭЖХ пиков.

[00156] В Таблице 21 приведены данные суммарного содержания двух основных конъюгатов лейпролида-лактида, образующихся в результате реакции D,L-лактида с сериновым сайтом лейпролида.


[00157] Данные этих таблицы показывают, что количество примесей, образующихся из лактида, увеличивается с течением времени и увеличивается быстрее при более высоком содержании мономера, что указывает на необходимость в полимере с низким содержанием мономера в составе.
Пример 12: Влияние очистки полимера на стабильность состава
[00158] Приблизительно 25 г полимера 8515PLGA (Mw 17 тыс., содержание остаточного лактида составляет ~ 0,15% по массе), полученного от компании Durect, растворяли в приблизительно 100 мл ацетона в стеклянном химическом стакане при перемешивании. Двукратно дистиллированную воду добавляли по 1 мл к указанному раствору. В общей сложности добавили 45 мл воды, и указанный полимер осаждался и образовывал слой на дне стакана. Указанный раствор декантировали и далее повторно растворяли в приблизительно 100 мл ацетона. Повторно добавляли по 1 мл двукратно дистиллированной воды до тех пор, пока в общей сложности не добавили 45 мл. Осадок декантировали и центрифугировали. Осадок 2 раза промывали водой и далее замораживали и лиофилизировали. Было обнаружено, что молекулярная масса очищенного полимера слегка увеличилась с 17,9 тыс. до 18,3 тыс. Ожидалось, что содержание остаточного мономера лактида будет снижено от приблизительно 0,15% до менее, чем 0,03% по массе.
[00159] Очищенные и неочищенные полимеры смешивали с NMP для получения 57,5% раствора полимера в NMP. Лейпролида мезилат (LAMS) добавляли в каждый из растворов полимера для получения состава, содержащего 8% LAMS с 57,5% раствором полимера. Указанными составами заполняли шприцы СОС от компании Schott с объемом в 1 мл с серыми поршнями 4023/50 от компании West. Далее указанные шприцы с составом стерилизовали при помощи электроннолучевого облучения при дозе в 27 кГр.
[00160] Составы после облучения хранили при 25°С и измеряли стабильность состава. В Таблице 22 приведены данные по содержанию примесей в указанных составах, а также образованию конъюгата лейпролида-лактида на сериновом сайте (Leup-Serine-Lac).
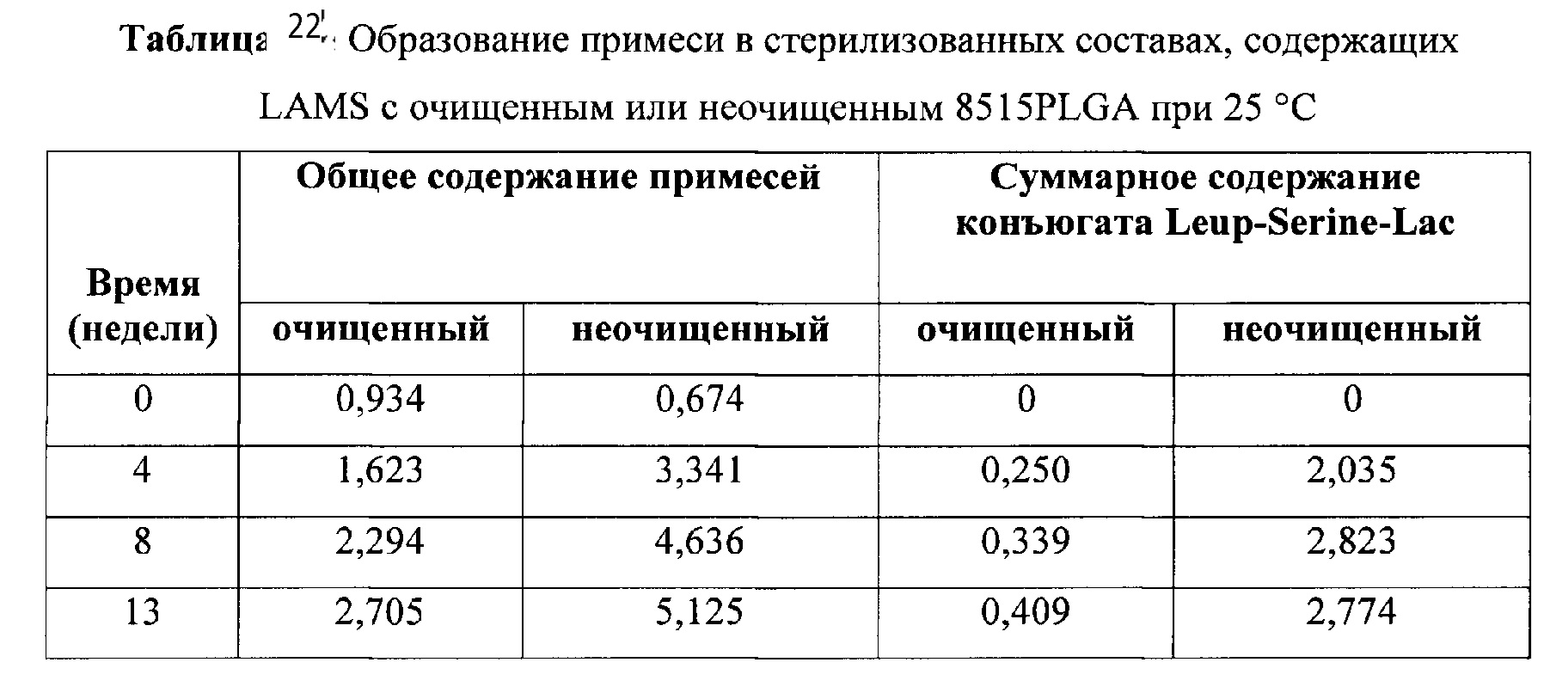
[00161] Как представлено в Таблице 22, существует значимое образование конъюгатов с неочищенным полимером, которое приблизительно в 8 раз больше, чем при применении очищенного полимера в составе.
[00162] Также измеряли молекулярную массу, которая приведена в Таблице 23.

В течение времени наблюдается небольшая разница в молекулярной массе между двумя составами. Кроме того, разницы в значении коэффициента полидисперсности между двумя составами не наблюдается.
[00163] Высвобождение в ФСБ при 37°С in vitro также измеряли для двух составов, что представлено на Фигуре 25.
[00164] Как представлено на Фигуре 25, высвобождение состава с 8515PLGA-P длится на несколько недель дольше, чем состава с 8515PLGA. Это является неожиданным, поскольку значения молекулярной массы и полидисперсности полимеров в обоих составах в основном одинаковы. Разница в высвобождении, вероятнее всего, связана с удалением малых олигомеров в полимере. В этом примере удаление малых олигомеров приводит к замедлению разложения полимера. Это удивительно и находится в противоречии с идеей предшествующего уровня техники, то есть когда «кислоты олигомеров включают в раствор полимера и лекарственного средства, это может значительно уменьшить или устранить снижение молекулярной массы полимера» [см. Патент США №8343513, Колонка 3, Строки 44-48].
[00165] Для определенных терапевтических средств, таких как аналоги агонистов GnRH, высокое первоначальное высвобождение может быть предпочтительным. Агонист GnRH прерывает нормальную пульсирующую стимуляцию и, таким образом, десенсибилизирует рецепторы GnRH; это косвенно понижает регуляцию секреции гонадотропинов лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ), что приводит к гипогонадизму и, следовательно, к резкому снижению уровня эстрадиола и тестостерона у обоих полов. Первоначальное лечение требует более высокой дозы агониста GnRH для подавления уровней тестостерона. После подавления уровня тестостерона ниже кастрационного уровня в сыворотке (<0,5 нг/мл), для поддержания кастрационного уровня требуется только очень низкая доза агониста GnRH. Таким образом, эффективно как более высокое первоначальное взрывное высвобождение, так и длительная продолжительность доставки агонистов GnRH.
Реферат
Группа изобретений относится к области медицины, а именно к способу получения композиции для инъекций, который включает:очистку полимера на основе лактата, выбранного из группы, состоящей из поли(D,L-лактид-со-гликолида) или поли(D,L-лактида), обладающего средневзвешенной молекулярной массой от 5000 до 50000 дальтон, значением кислотного числа, составляющим менее чем 3 мгКОН/г, и содержанием остаточных мономеров лактида в указанном полимере на основе лактата, составляющим менее чем приблизительно 0,3% по массе, и объединение указанного очищенного полимера на основе лактата с фармацевтически приемлемым органическим растворителем и лейпролидом или его ацетатом или мезилатом, способными вступать в реакцию с мономером лактида с образованием конъюгата, при условии, что при получении указанной композиции не добавляют кислотную добавку и также относится к композиции для инъекций для доставки лекарственного средства с контролируемым высвобождением, содержащая: полимер на основе лактата, выбранный из группы, состоящей из поли(D,L-лактид-со-гликолида) или поли(D,L-лактида), обладающий средневзвешенной молекулярной массой от 5000 до 50000 дальтон, значением кислотного числа, составляющим менее чем 3 мгКОН/г, и содержанием остаточных мономеров лактида в полимере на основе лактата, составляющим менее чем приблизительно 0,3% по массе; фармацевтически приемлемый органический растворитель; а также лейпролид или его ацетат или мезилат, способные вступать в реакцию с мономером лактида с образованием конъюгата, при условии, что при получении указанной композиции не добавляют кислотную добавку. Группа изобретений обеспечивает минимизацию или предотвращение образования примесей, родственных биологически активным веществам, и нежелательного преждевременного разложения биологически разлагаемого полимера.2 н. и 12 з.п. ф-лы, 23 табл., 12 пр., 25 ил.

Комментарии