Антитела против edb и конъюгаты антитело-лекарственное средство - RU2758632C2
Код документа: RU2758632C2
Чертежи




Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к антителам против EDB и конъюгатам (ADC) антитела против EDB и лекарственного средства. Настоящее изобретение также относится к способам применения таких антител и ADC для лечения расстройств, таких как злокачественные новообразования, при которых клетки экспрессируют EDB+ FN.
УРОВЕНЬ ТЕХНИКИ
Фибронектины представляют собой высокомолекулярные адгезивные гликопротеины, присутствующие в растворимой форме в плазме и других жидкостях организма и в нерастворимой форме во внеклеточном матриксе (ЕСМ). Вариант сплайсинга фибронектина 1 с дополнительным доменом B (EDB+ FN или EDB) представляет собой неинтернализующий белок ECM. EDB представляет собой гомологичный домен типа III из 91 аминокислоты, который вставляется в молекулу фибронектина по механизму альтернативного сплайсинга на уровне первичного транскрипта каждый раз, когда происходит ремоделирование ткани. Было показано, что EDB+ FN избирательно накапливается в строме вокруг новых кровеносных сосудов при опухолях и других патологиях, но по большей части отсутствует в нормальной сосудистой сети взрослого человека. Zardi et al., Embo J. 6 (8): 2337-42 (1987). EDB+ FN экспрессируется во многих агрессивных опухолях и в зависимости от типа опухоли проявляет преимущественно сосудистый или диффузный стромальный профили экспрессии. Carnemolla et al., J. Cell Biol. 108 (3): 1139-48 (1989).
Антитело, которое специфически связывается с доменом EDB фибронектина (FN), антитело L19, было выделено с помощью технологии фагового дисплея. Carnemolla et al., Int. J. Cancer 68 (3): 397-405 (1996); Neri et al., Nat. Biotechnol. 15 (12): 1271-5. (1997); Pini et al., J. Biol. Chem. 273(34): 21769-76 (1998). Антитело L19 способно окрашивать опухолевые кровеносные сосуды в широком диапазоне экспериментальных моделей опухолей и на срезах опухолей человека и других ангиогенных расстройств. Carnemolla et al., J. Cell Biol. 108 (3): 1139-48 (1989); Kaczmarek et al., Int. J. Cancer 59 (1): 11-6 (1994); Berndt et al., Histochem. Cell Biol. 109 (3): 249-55 (1998).
Различные стратегии направленного воздействия были изучены с использованием различных форматов антитела L19 при лечении злокачественного новообразования. Например, фрагмент моноклонального антитела scFv (L19), Birchler et al. Nat Biotechnol. 17: 984-8 (1999), слитые белки, включая интерлейкин-12 (IL-12) и фактор некроза опухоли (TNF-альфа), слитые с scFv (L19), Halin C. et al. Cancer Res. 63 (12): 3202-10 (2003), и индивидуально небольшой иммунный белок L19 (SIP) и конъюгированный с фотосенсибилизатором, Fabbrini M. et al.Int J Cancer 118 (7): 1805-13 (2006).
Несмотря на то что были описаны различные способы лечения на основе антител L19, остается существенная клиническая потребность в разработке дополнительных улучшенных и оптимизированных способов лечения, направленных на EDB+ FN, таких как конъюгаты антитело-лекарственное средство, для пациентов с расстройствами или заболеваниями, при которых клетки экспрессируют EDB+ FN, такими как злокачественные новообразования, ассоциированные с экспрессией EDB+ FN, и/или злокачественные новообразования, при которых клетки экспрессируют EDB+ FN.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к конъюгату антитело-лекарственное средство, содержащему (а) антитело или его антигенсвязывающий фрагмент, которые связываются с дополнительным доменом B (EDB) фибронектина (FN), (b) линкер и (c) лекарственное средство. В некоторых аспектах конъюгат антитело-лекарственное средство содержит антитело или антигенсвязывающий фрагмент, которые могут содержать вариабельную область тяжелой цепи, содержащую три CDR, содержащие SEQ ID NO: 3, 5 и 7, и вариабельную область легкой цепи, содержащую три CDR, содержащие SEQ ID NO: 12, 13 и 14. В некоторых аспектах конъюгат антитело-лекарственное средство содержит антитело или его антигенсвязывающий фрагмент, которые могут содержать вариабельную область тяжелой цепи, содержащую SEQ ID NO: 1 или 21, и вариабельную область легкой цепи, содержащую SEQ ID NO: 10.
Настоящее изобретение также относится к конъюгату антитело-лекарственное средство, содержащему антитело или антигенсвязывающий фрагмент, которые могут содержать вариабельную область тяжелой цепи, содержащую SEQ ID NO: 1, и вариабельную область легкой цепи, содержащую SEQ ID NO: 10; или вариабельную область тяжелой цепи, содержащую SEQ ID NO: 21, и вариабельную область легкой цепи, содержащую SEQ ID NO: 10. В некоторых аспектах конъюгат антитело-лекарственное средство содержит антитело или антигенсвязывающий фрагмент, которые содержат тяжелую цепь, содержащую SEQ ID NO: 8, 17, 19, 23, 25, 27 или 29, и легкую цепь, содержащую SEQ ID NO: 15 или 31
Настоящее изобретение также относится к конъюгату антитело-лекарственное средство, содержащему антитело или антигенсвязывающий фрагмент, содержащие тяжелую цепь, содержащую SEQ ID NO: 8, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 8, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 17, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 17, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 19, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 19, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 23, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 23, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 25, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 25, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 27, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 27, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 29, и легкую цепь, содержащую SEQ ID NO: 15; или тяжелую цепь, содержащую SEQ ID NO: 29, и легкую цепь, содержащую SEQ ID NO: 31.
Настоящее изобретение также относится к конъюгату антитело-лекарственное средство, содержащему антитело или антигенсвязывающий фрагмент, имеющим константную область тяжелой цепи и/или легкой цепи, содержащую встроенный остаток цистеина для сайт-специфической конъюгации. В некоторых аспектах конъюгат антитело-лекарственное средство имеет константную область тяжелой цепи, содержащую встроенный остаток цистеина в положении 290 (K290C) согласно нумерации индекса EU по Kabat. В некоторых аспектах конъюгат антитело-лекарственное средство имеет константную область легкой цепи, содержащую встроенный остаток цистеина в положении 183 (κK183C) согласно нумерации Kabat. В некоторых аспектах конъюгат антитело-лекарственное средство имеет константную область тяжелой цепи, содержащую встроенный остаток цистеина в положении 290 (K290C), в соответствии с нумерацией индекса EU по Kabat, а константная область легкой цепи содержит встроенный остаток цистеина в положении 183 (κK183C), в соответствии с нумерацией Kabat.
Настоящее изобретение также относится к конъюгату антитело-лекарственное средство, содержащему антитело или антигенсвязывающий фрагмент, содержащие константную область тяжелой цепи, содержащую встроенную глутаминсодержащую метку, вставленную в антитело, или замену одной или более эндогенных аминокислот в антителе. В некоторых аспектах конъюгат антитело-лекарственное средство имеет встроенную глутаминсодержащую метку, вставленную в антитело в положении E294-N297. В некоторых аспектах конъюгат антитело-лекарственное средство имеет глутаминсодержащую метку, содержащую аминокислотную последовательность LLQG (SEQ ID NO: 40). В некоторых аспектах конъюгат антитело-лекарственное средство, имеющий константную область тяжелой цепи, дополнительно содержит лизин (K), замещающий аргинин (R) в положении 222 (K222R) согласно нумерации индекса EU по Kabat.
Настоящее изобретение также относится к конъюгату антитело-лекарственное средство, содержащему антитело или антигенсвязывающий фрагмент, содержащим вариабельную область тяжелой цепи, содержащую лизин (K), замещающий аргинин (R) в положении 94 (K94R) в соответствии с нумерацией Kabat.
Настоящее изобретение дополнительно относится к конъюгату антитело-лекарственное средство, имеющему линкер, который является расщепляемым линкером. В некоторых аспектах расщепляемый линкер выбран из группы, состоящей из vc, diS, diS-C2OCO и AcLys-vc.
Настоящее изобретение также относится к конъюгату антитело-лекарственное средство, содержащему лекарственное средство, которое представляет собой цитотоксический агент. В некоторых аспектах цитотоксический агент представляет собой ауристатин. В некоторых аспектах ауристатин выбран из группы, состоящей из 0101, 1569, 9411 и 4574. В некоторых аспектах цитотоксический агент представляет собой димер CPI. В некоторых аспектах димер CPI представляет собой CPI-8314 или CPI-0326.
Настоящее изобретение также относится к конъюгату антитело-лекарственное средство, содержащему (а) антитело или его антигенсвязывающий фрагмент, содержащим вариабельную область тяжелой цепи, содержащую три CDR, содержащие SEQ ID NO: 3, 5 и 7, и вариабельную область легкой цепи, содержащую три CDR, содержащие SEQ ID NO: 12, 13 и 14, (b) линкер vc и (c) лекарственное средство 0101.
Настоящее изобретение также относится к конъюгату антитело-лекарственное средство, содержащему (а) антитело или его антигенсвязывающий фрагмент, содержащим вариабельную область тяжелой цепи, содержащую SEQ ID NO: 21, и вариабельную область легкой цепи, содержащую SEQ ID NO: 10; (b) линкер vc и (c) лекарственное средство 0101.
Настоящее изобретение также относится к конъюгату антитело-лекарственное средство, содержащему (а) антитело или его антигенсвязывающий фрагмент, содержащим тяжелую цепь, содержащую SEQ ID NO: 25, и легкую цепь, содержащую SEQ ID NO: 31; (b) линкер vc и (c) лекарственное средство 0101.
Настоящее изобретение также относится к фармацевтической композиции, содержащей конъюгат антитело-лекарственное средство по изобретению и фармацевтически приемлемый носитель. Настоящее изобретение также относится к композиции, содержащей множество конъюгатов антитело-лекарственное средство по изобретению и, необязательно, фармацевтический носитель, где композиция имеет среднее значение DAR в диапазоне от 3 до 5. Настоящее изобретение также относится к композиции, содержащей множество конъюгатов антитело-лекарственное средство по любому из пп. 1-5 и, необязательно, фармацевтический носитель, где композиция имеет среднее значение DAR в диапазоне от 1 до 3.
Настоящее изобретение относится к нуклеиновой кислоте, кодирующей тяжелую цепь или легкую цепь антитела по изобретению. В некоторых аспектах нуклеиновая кислота может содержать SEQ ID NO: 9, 18, 20, 24, 26, 28 или 30, кодирующие тяжелую цепь, или может содержать SEQ ID NO: 16 или 32, кодирующие легкую цепь. Настоящее изобретение дополнительно относится к вектору, содержащему любую нуклеиновую кислоту по изобретению. Также настоящее изобретение относится к клетке-хозяину, содержащей любую нуклеиновую кислоту по изобретению.
Настоящее изобретение относится к способу получения конъюгата антитело-лекарственное средство по изобретению, включающему: (а) связывание линкера с лекарственным средством; (b) конъюгацию линкера и лекарственного средства с антителом; и (c) очистку конъюгата антитело-лекарственное средство. В некоторых аспектах конъюгация является сайт-специфической в отношении одного или более встроенных остатков цистеина и/или встроенных остатков глутамина на антителе.
Настоящее изобретение также относится к способу лечения расстройства или заболевания, при котором клетки экспрессируют EDB+ FN, причем способ включает введение нуждающемуся в этом пациенту эффективного количества композиции, содержащей конъюгат антитело-лекарственное средство по изобретению. В некоторых аспектах расстройство или заболевание, при котором клетки экспрессируют EDB+ FN, представляет собой злокачественное новообразование. В некоторых аспектах злокачественное новообразование представляет собой солидную опухоль или гемобластоз. В некоторых аспектах солидная опухоль представляет собой рак щитовидной железы, саркому, рак молочной железы, рак поджелудочной железы, глиобластому, рак желчного пузыря, рак почки, рак кожи, рак матки, мезотелиому, колоректальный рак, рак головы и шеи, рак яичников, рак мочевого пузыря, рак яичек, рак предстательной железы, рак печени, рак эндокринной системы, рак тимуса, рак головного мозга, рак надпочечников, рак глаз, рак шейки матки и рак легких. В некоторых аспектах гемобластоз представляет собой лейкоз, лимфому или миелому.
Настоящее изобретение дополнительно относится к применению конъюгата антитело-лекарственное средство по изобретению при изготовлении лекарственного средства для лечения пациента с расстройством или заболеванием, при котором клетки экспрессируют EDB+ FN. В некоторых аспектах расстройство или заболевание, при котором клетки экспрессируют EDB+ FN, представляет собой злокачественное новообразование. В некоторых аспектах злокачественное новообразование представляет собой солидную опухоль или гемобластоз. В некоторых аспектах солидная опухоль представляет собой рак щитовидной железы, саркому, рак молочной железы, рак поджелудочной железы, глиобластому, рак желчного пузыря, рак почки, рак кожи, рак матки, мезотелиому, колоректальный рак, рак головы и шеи, рак яичников, рак мочевого пузыря, рак яичек, рак предстательной железы, рак печени, рак эндокринной системы, рак тимуса, рак головного мозга, рак надпочечников, рак глаз, рак шейки матки и рак легких. В некоторых аспектах гемобластоз представляет собой лейкоз, лимфому или миелому.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
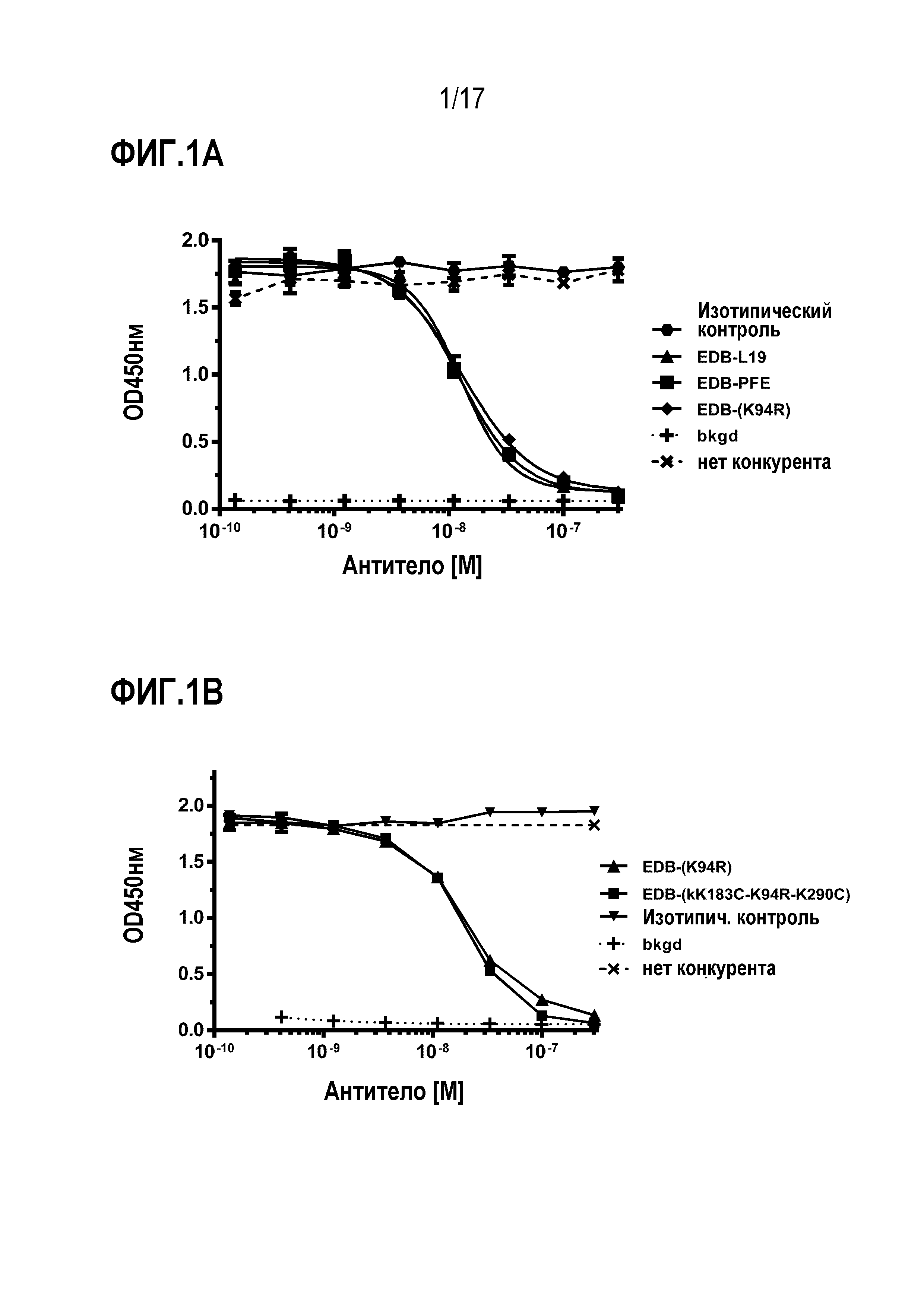
ФИГ. 1А и 1В демонстрируют свойства связывания [A] EDB-L19, EDB-PFE и EDB-(K94R) антител; и [B] EDB-(K94R) и EDB-(κK183C-K94R-290C) антител.
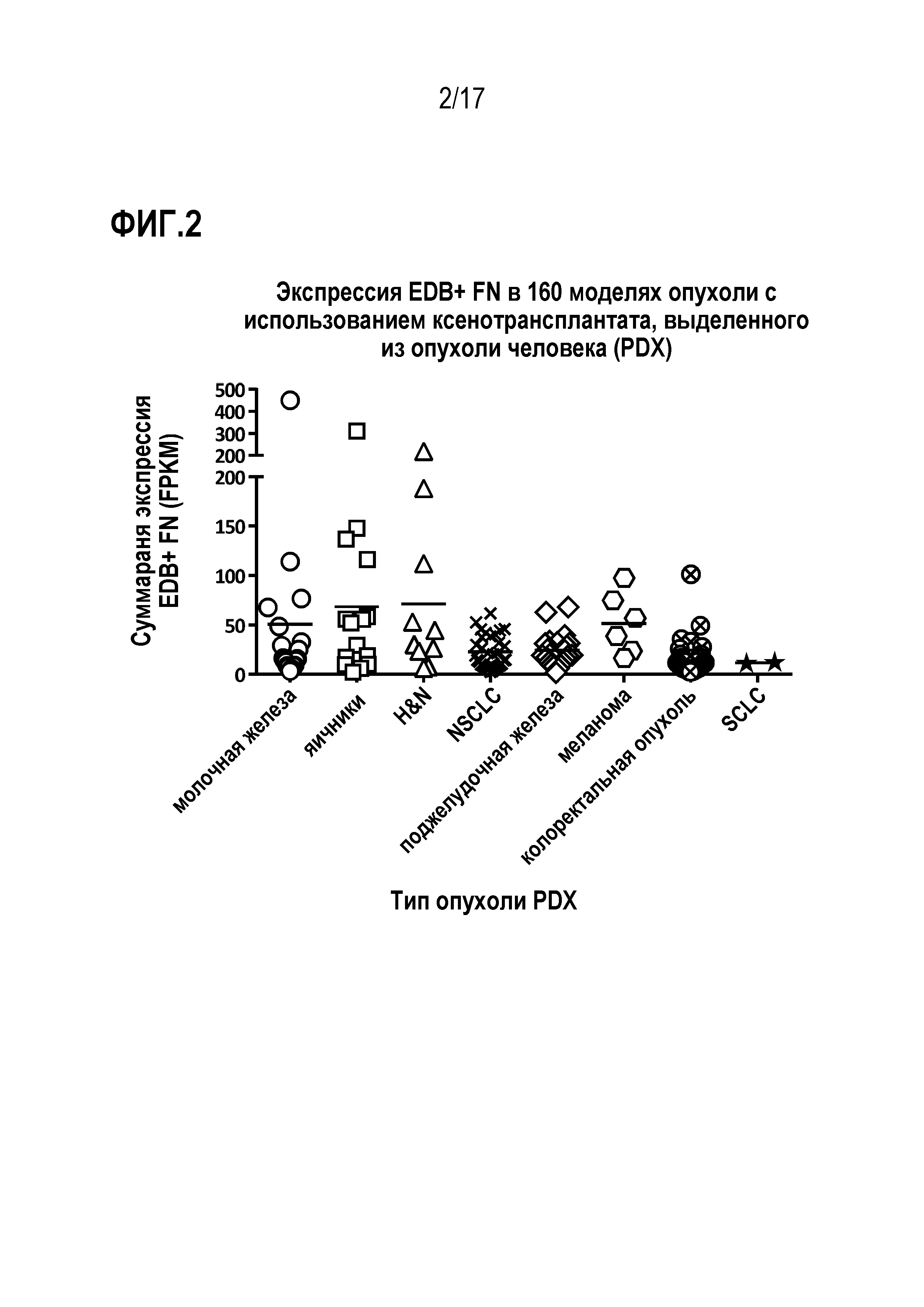
ФИГ. 2 демонстрирует экспрессию EDB+ FN с использованием анализа RNA-Seq на моделях опухоли с использованием ксенотрансплантата (PDX), полученного от человека.
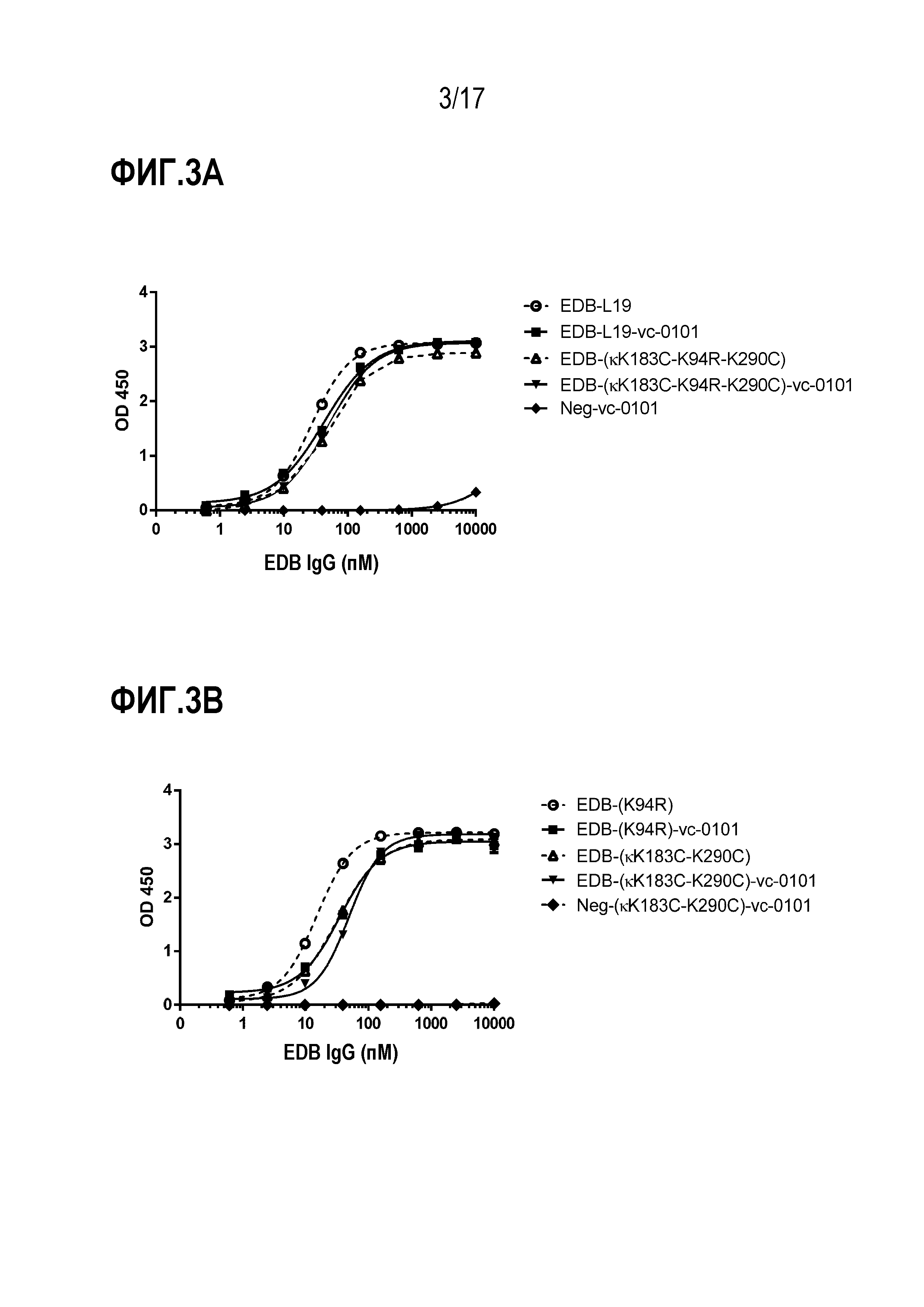
ФИГ. 3A и 3B демонстрируют кривые связывания ИФА для [A] EDB-L19 антитела и EDB-L19-VC-0101 ADC, и EDB-κK183C-K94R-290C) антитела и EDB-κK183C-K94R-290C)-vc-0101 ADC; и [B] EDB-(K94R) антитела и EDB-(K94R)-vc-0101 ADC, и EDB-(κK183C-K290C) антитела и EDB-(κK183C-K290C)-vc0101 ADC.
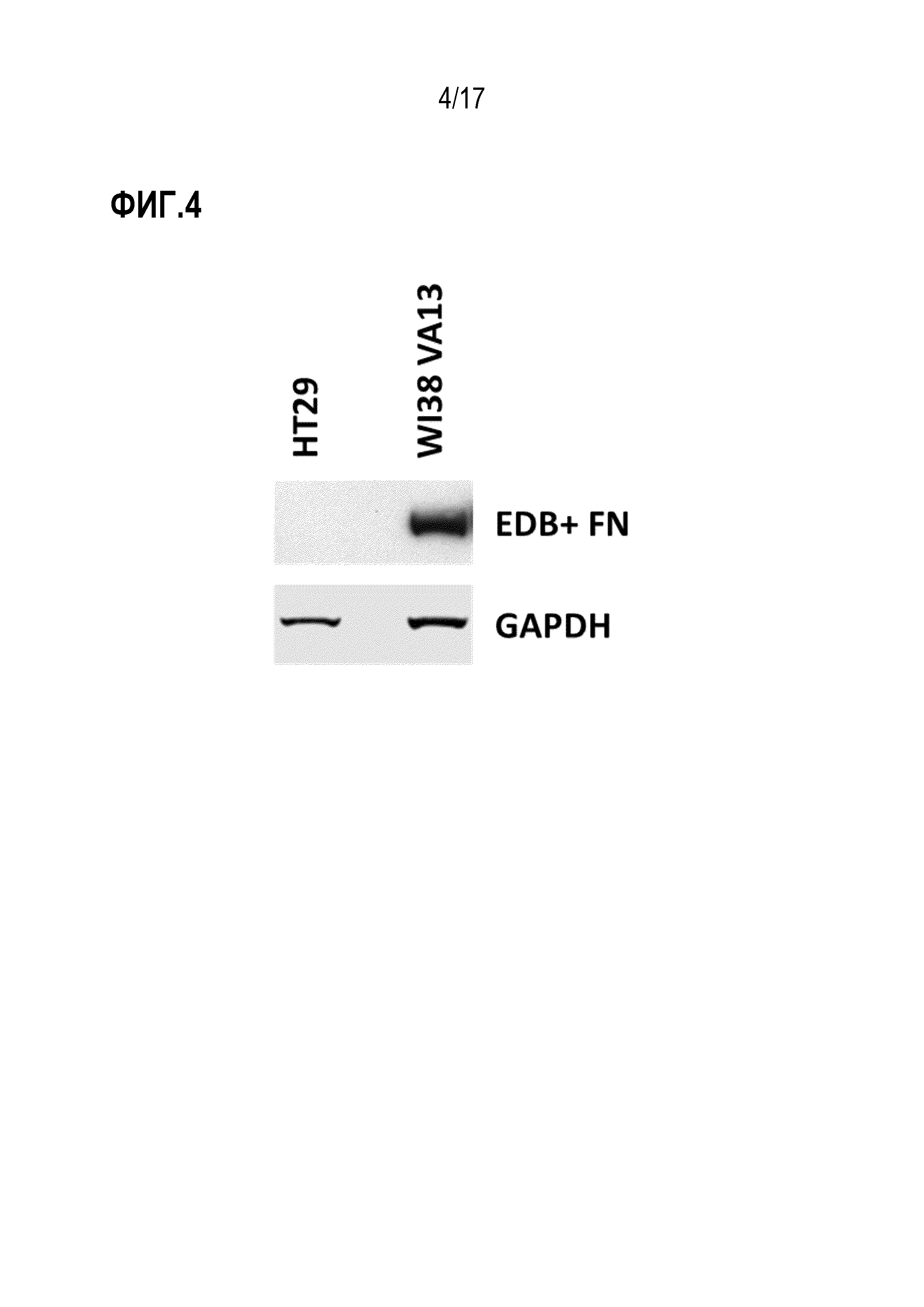
ФИГ. 4 демонстрирует экспрессию EDB+ FN с помощью вестерн-блот-анализа в клетках WI38-VA13 и HT-29.
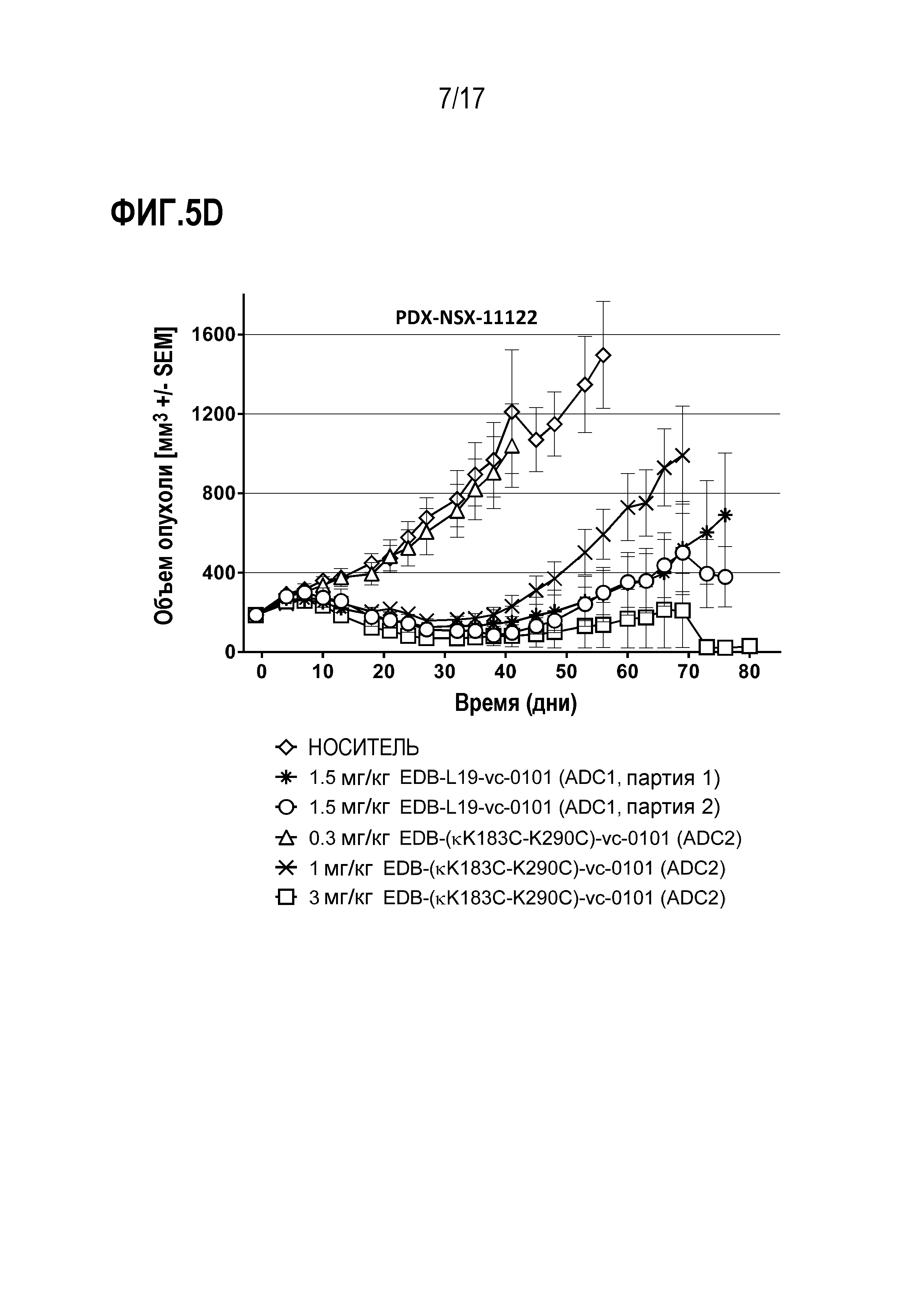
ФИГ. 5A-5F демонстрируют противоопухолевую эффективность в PDX-NSX-11122, модели рака легких человека с использованием ксенотрансплантата, полученного у пациентов с NSCLC, (PDX), с высоким уровнем экспрессии EDB+ FN, в виде кривых ингибирования роста опухоли для каждой отдельной мыши, несущей опухоль, для [A] группы введения EDB-L19-vc-0101 в дозах 0,3, 0,75, 1,5 и 3 мг/кг; [B] EDB-L19-vc-0101 в дозах 3 мг/кг и 10 мг/кг дисульфидно-связанного EDB-L19-diS-DM1; [C] EDB-L19-vc-0101 в дозах 1 и 3 мг/кг и 5 мг/кг дисульфидно-связанного EDB-L19-diS-C2OCO-1569; [D] сайт-специфически конъюгированного EDB-(κK183C+K290C)-vc-0101 и стандартно конъюгированного EDB-L19-vc-0101 (ADC1) в дозах 0,3, 1 и 3 мг/кг и 1,5 мг/кг, соответственно; [E] сайт-специфически конъюгированного EDB-(κK183C-K94R-K290C)-vc-0101 в дозах 0,3, 1 и 3 мг/кг; и [F] группы введения EDB- (κK183C-K94R-K290C)-vc-0101, которой вводили по 3 мг/кг.
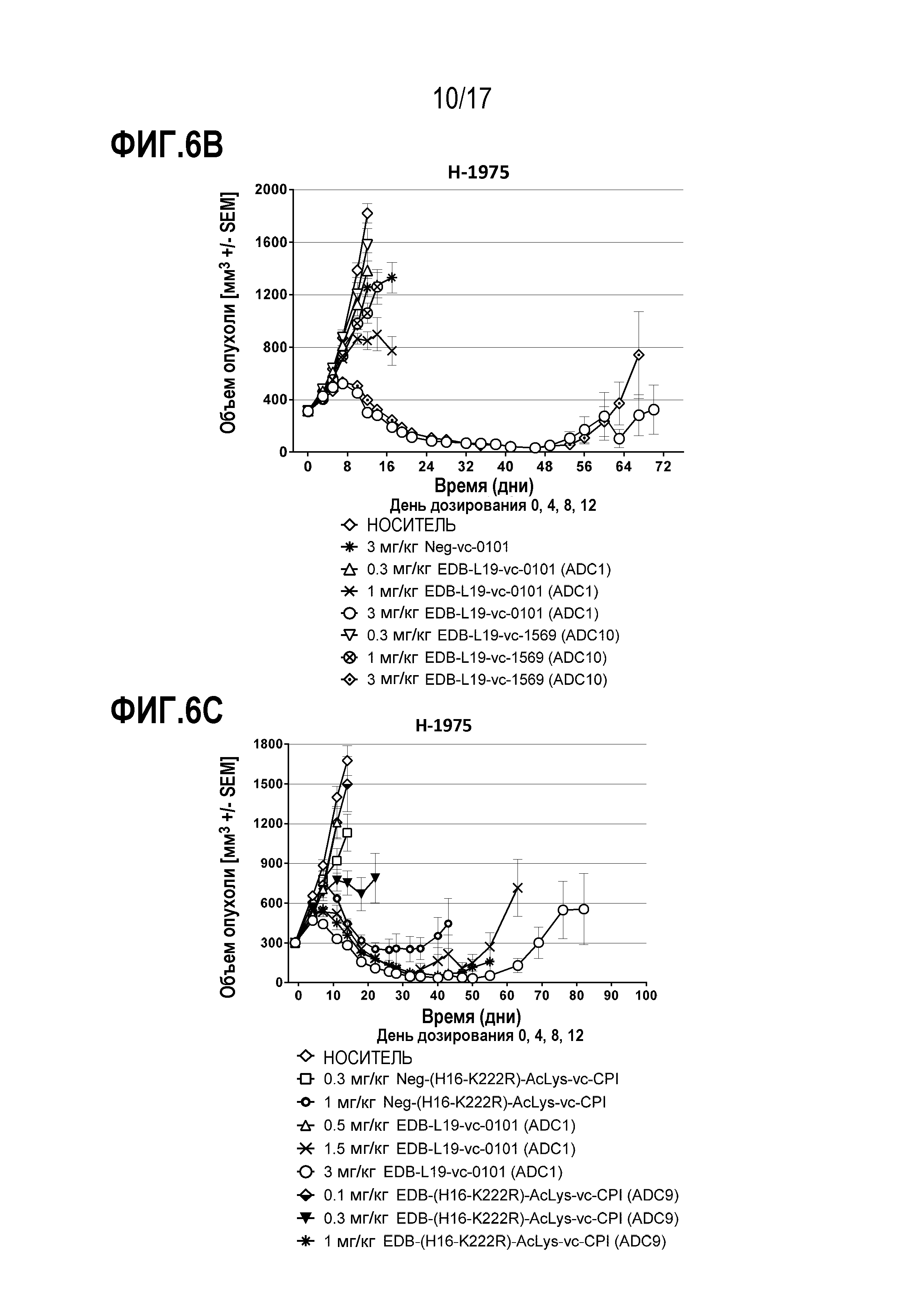
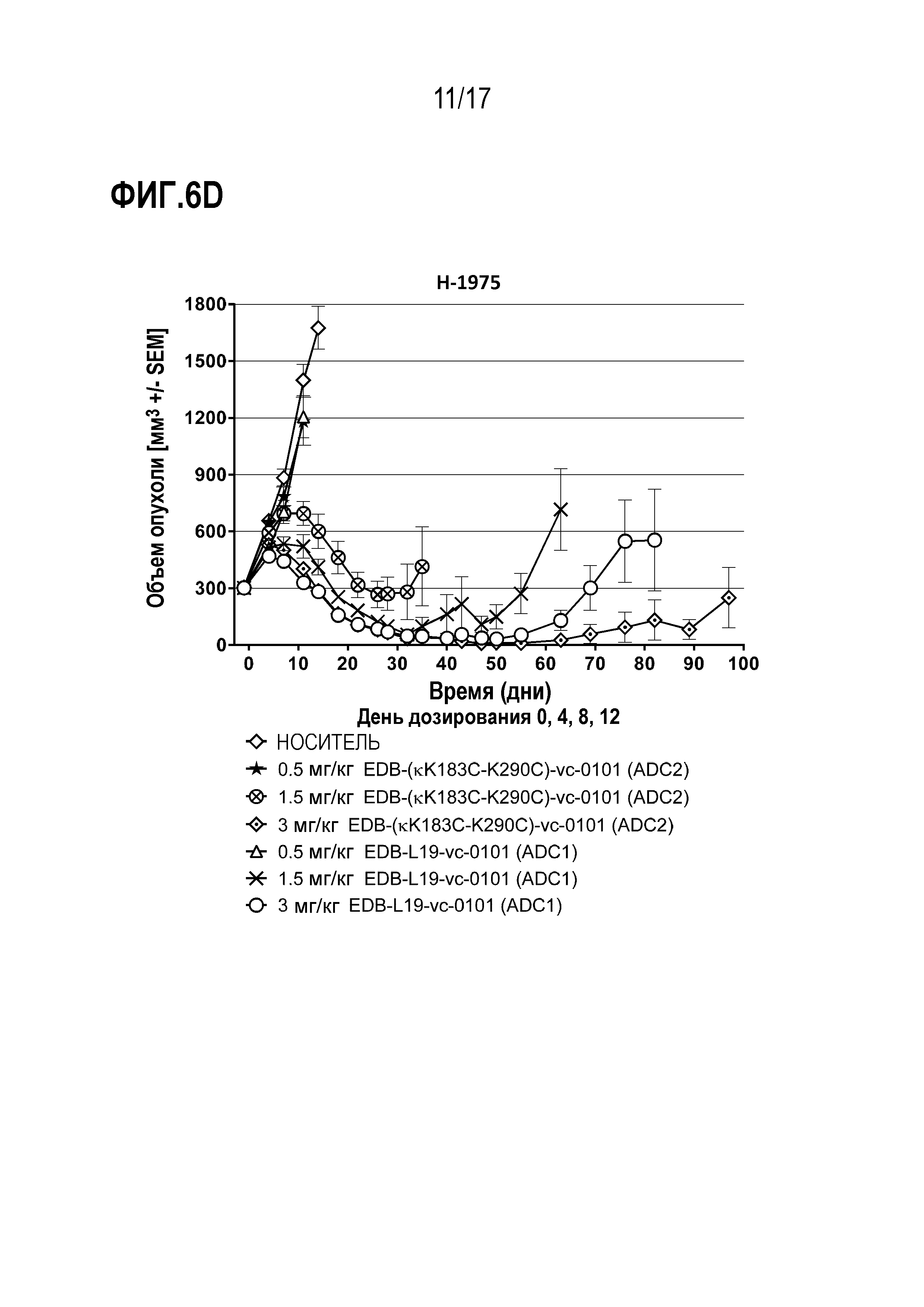
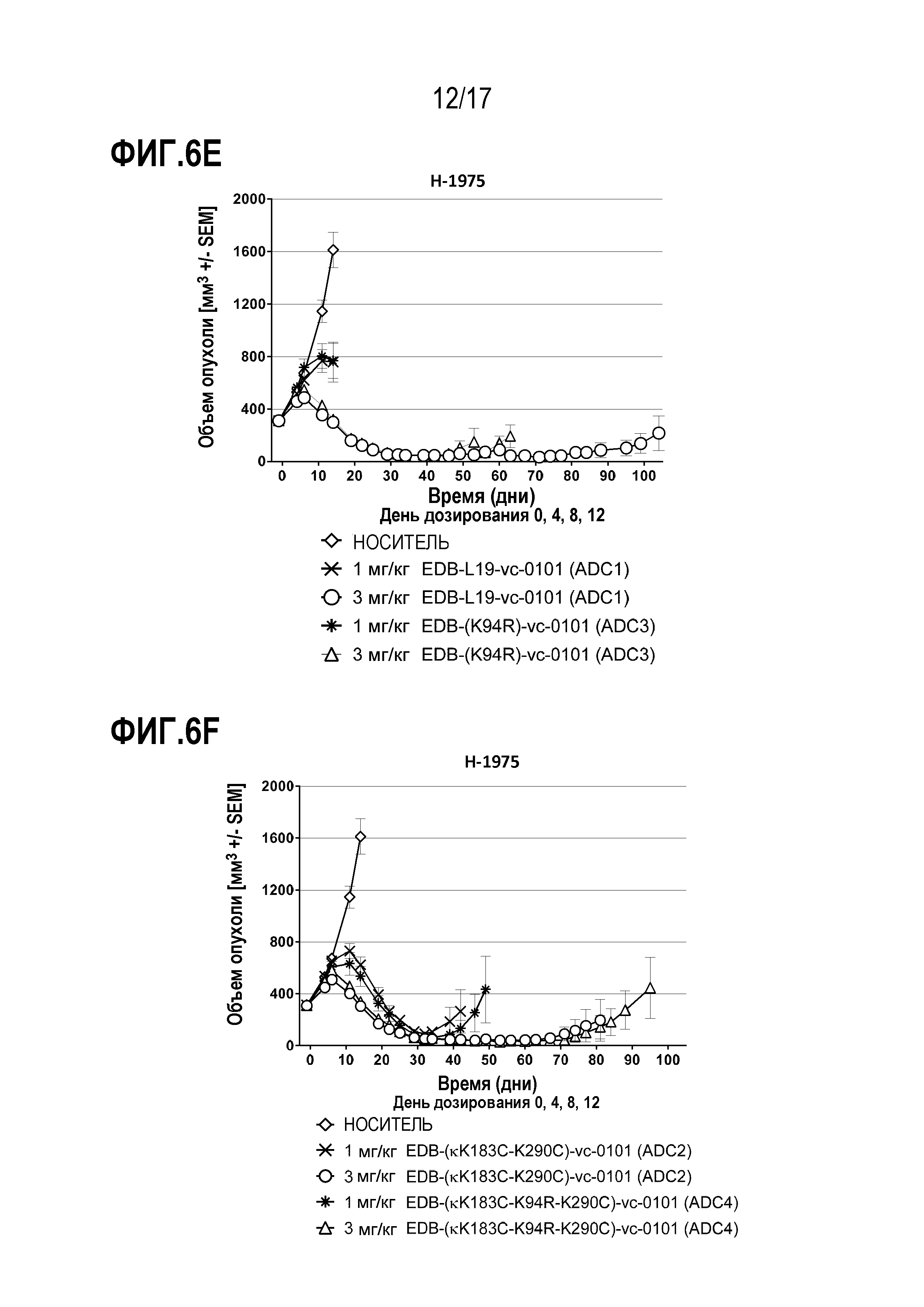
ФИГ. 6А-6F демонстрируют противоопухолевую эффективность в H-1975, модели опухоли человека с использованием ксенотрансплантата (CLX) клеточной линии NSCLC, экспрессирующей EDB+ FN на уровне от умеренного до высокого, [A] EDB-L19-vc-0101 до 0,3, 0,75, 1,5 и 3 мг/мг; [B] EDB-L19-vc-0101 и EDB-L19-vc-1569 в дозах 0,3, 1 и 3 мг/кг; [C] EDB-L19-vc-0101 и EDB-(H16-K222R)-AcLys-vc-CPI-8314 в дозах 0,5, 1,5 и 3 мг/кг и 0,1, 0,3 и 1 мг/кг, соответственно; [D] сайт-специфически конъюгированного EDB-(κK183C+K290C)-vc-0101 и стандратно конъюгированного EDB-L19-vc-0101 в дозах 0,5, 1,5 и 3 мг/кг; [E] EDB-L19-vc-0101 и EDB-(K94R)-vc-0101 в дозах 1 и 3 мг/кг; и [F], EDB-κK183C+K290C)-vc-0101 и EDB-κK183C-K94R-K290C)-vc-0101 в дозах 1 и 3 мг/кг.
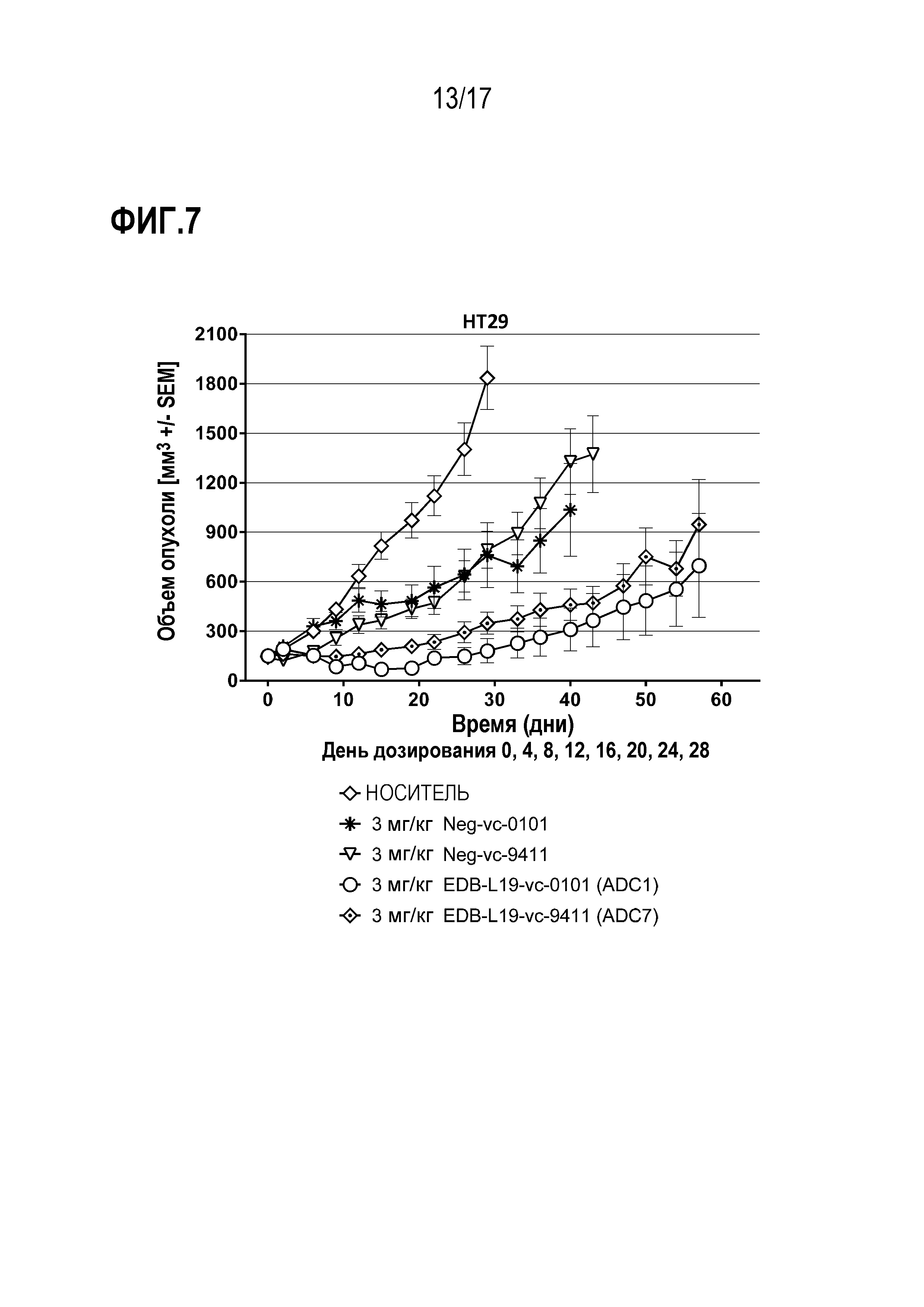
ФИГ.7 демонстрирует противоопухолевую эффективность в HT29, модели CLX рака толстой кишки человека при умеренной экспрессии EDB+ FN, EDB-L19-vc-0101 и EDB-L19-vc-9411 при дозе 3 мг/кг.
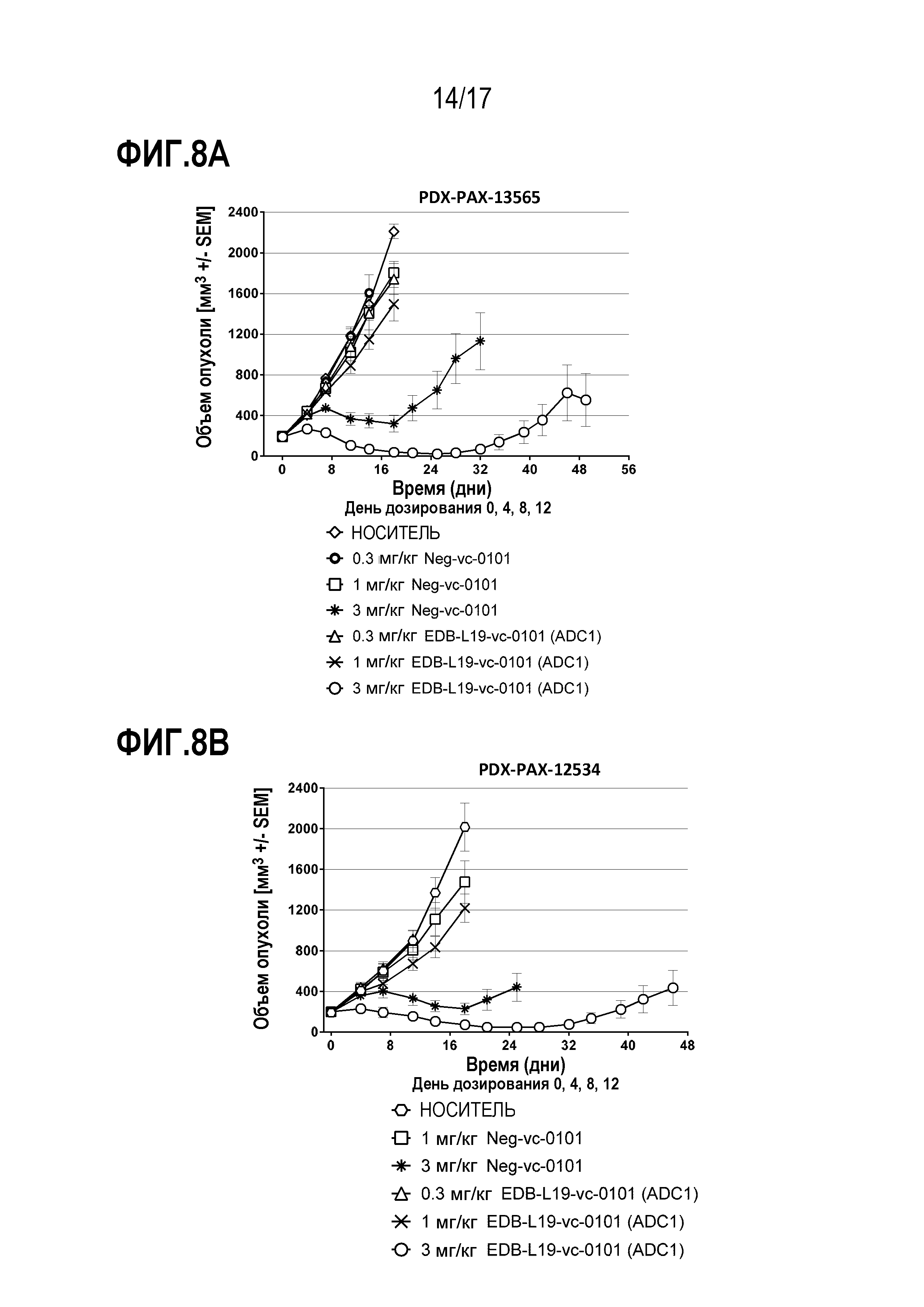
ФИГ. 8А и 8В демонстрируют противоопухолевую эффективность EDB-L19-vc-0101 в дозах 0,3, 1 и 3 мг/кг в [A] PDX-PAX-13565, PDX-модели опухоли поджелудочной железы при экспрессии EDB+ FN на уровне от умеренного до высокого; и [B] PDX-PAX-12534, PDX-модели опухоли поджелудочной железы при экспрессии EDB+ FN на уровне от низкого до умеренного.
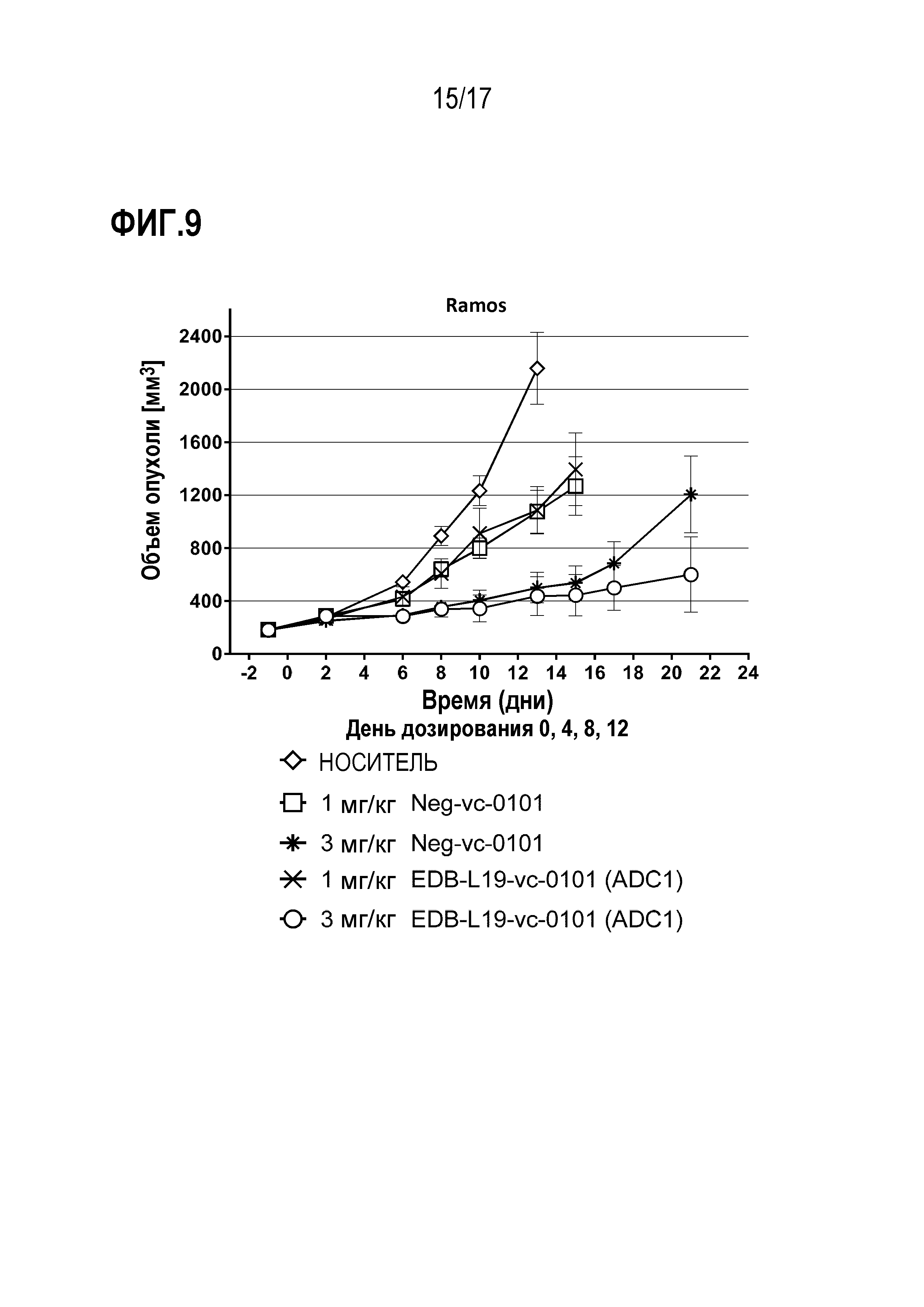
ФИГ. 9 демонстрирует противоопухолевую эффективность EDB-L19-vc-0101 в дозе 1 и 3 мг/кг в клетках Ramos, CLX-модели лимфомы рака человека с умеренной экспрессией EDB+ FN.
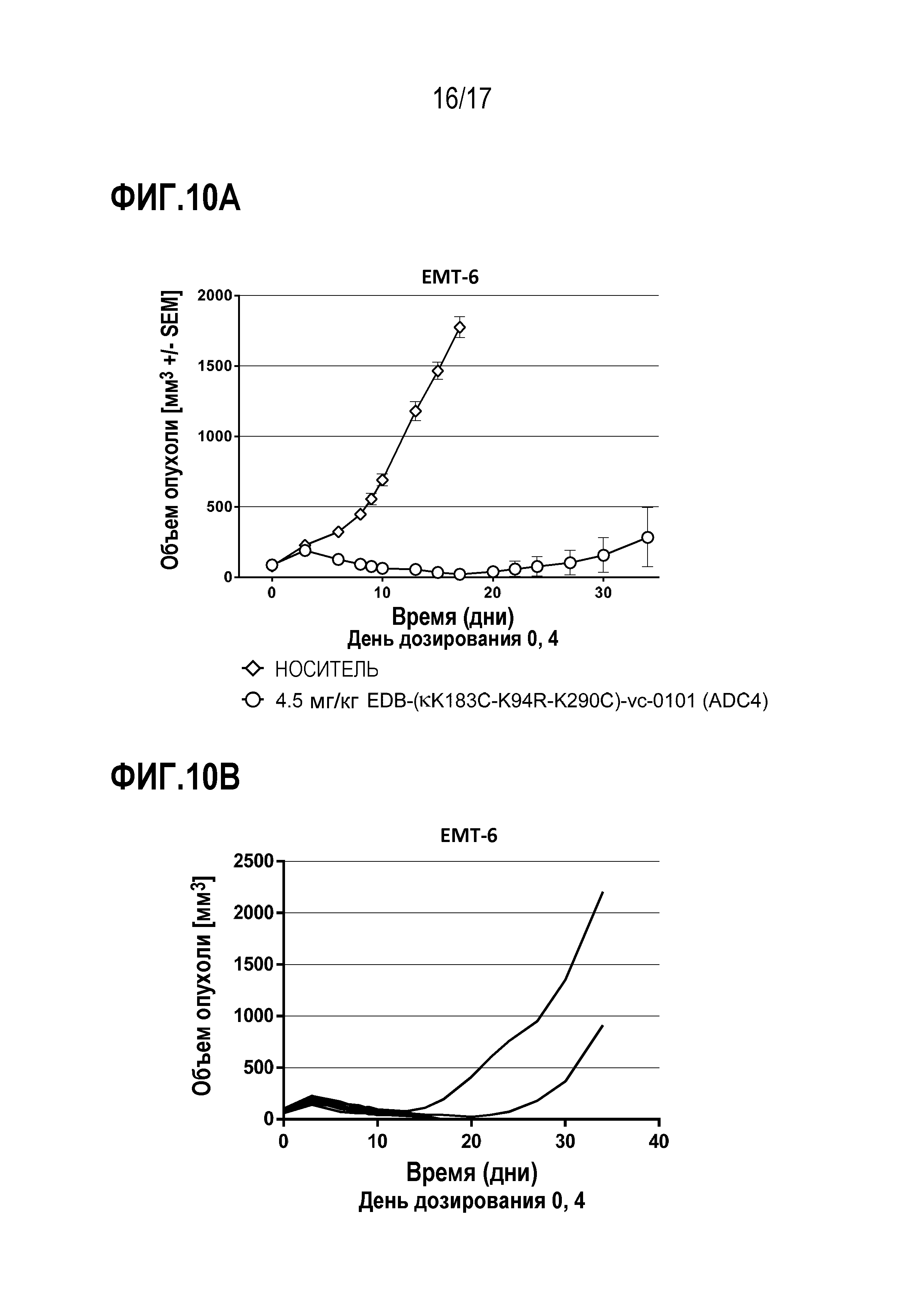
ФИГ. 10A и 1 демонстрируют противоопухолевую эффективность в ЕМТЕ-6, мышиной модели синотрансплантата рака молочной железы, в виде кривых ингибирования роста опухоли для каждой отдельной мыши, несущей опухоль, в [А] группе введения EDB-κK183C-K94R-K290C)-vc-0101, получавшей дозу 4,5 мг/кг; и в группе [B] EDB-(κK183C-K94R-K290C)-vc-0101, получавшей дозу 4,5 мг/кг.
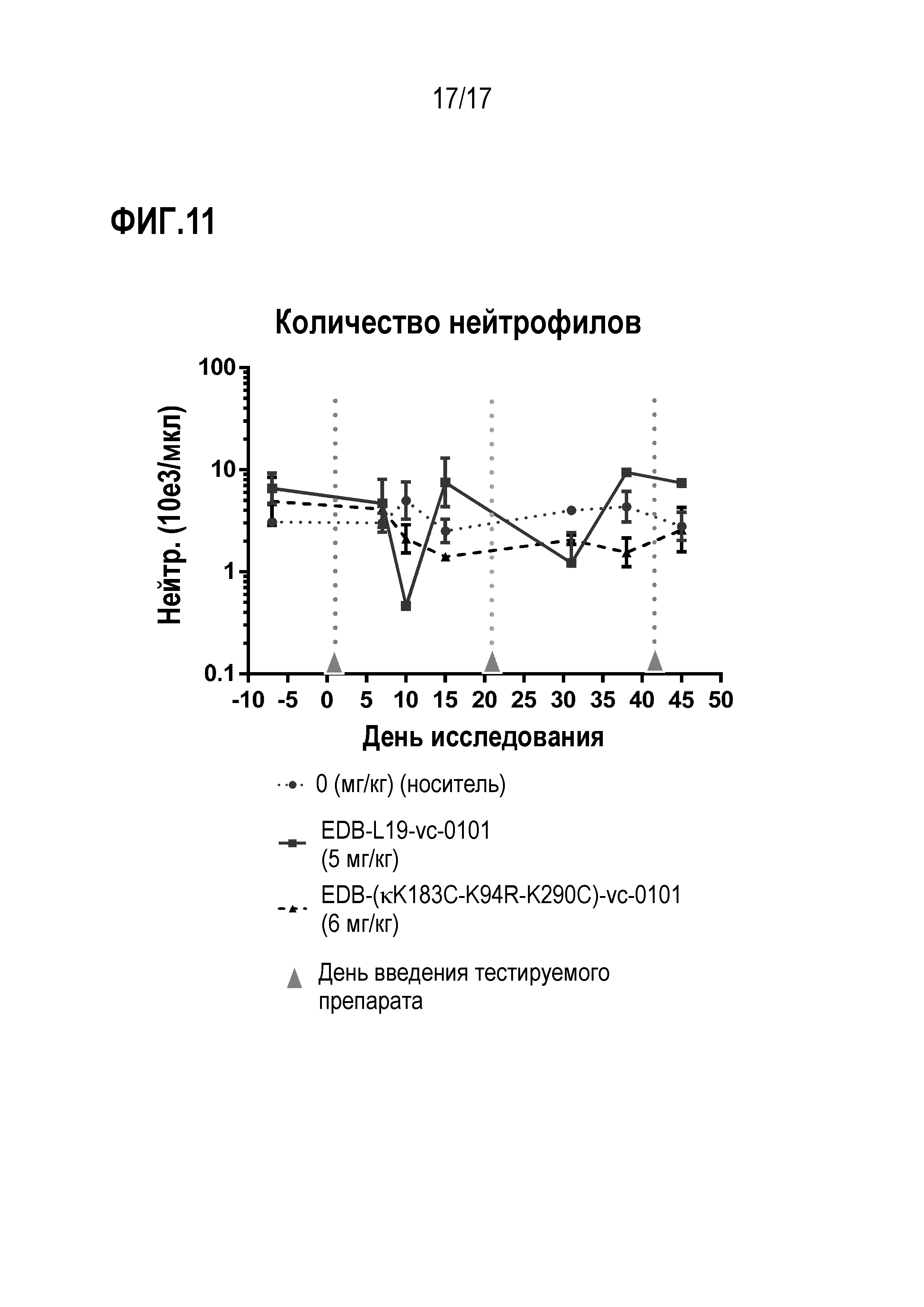
ФИГ. 11 демонстрирует абсолютное количество нейтрофилов для стандартно-конъюгированного EDB L19-VC-0101 в дозе 5 мг/кг по сравнению с сайт-специфически конъюгированным EDB-κK183C-K94R-K290C)-vc-0101 (ADC4) в дозе 6 мг/кг.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам и конъюгатам антитело-лекарственное средство (ADC), которые связываются с дополнительным доменом B (EDB) фибронектина (FN), обозначаемым взаимозаменяемо как «EDB+ FN» или «EDB». Изобретение также относится к способам получения ADC с использованием антител против EDB, линкеров и лекарственных средств (полезных нагрузок). Изобретение дополнительно относится к ADC, сгенерированным с использованием технологии стандартной и/или сайт-специфической конъюгации. Антитела и ADC по изобретению полезны для приготовления и изготовления композиций, таких как лекарственные средства, которые могут использоваться при диагностике, профилактике и/или лечении гиперпролиферативных расстройств, характеризующихся или ассоциированных с экспрессией EDB+ FN, таких как злокачественное новообразование. Изобретение также относится к нуклеиновым кислотам, кодирующим антитела против EDB, используемые при получении EDB ADC.
ADC содержат антительный компонент, конъюгированный с лекарственным средством, обычно с использованием линкера. ADC, полученные с помощью технологии стандартной конъюгации, случайным образом связывают лекарственное средство с антителом через остатки лизина или цистеина, которые эндогенно находятся в тяжелой и/или легкой цепи антитела. Соответственно, такие ADC представляют собой гетерогенную смесь видов, имеющих различные соотношения лекарственное средство:антитело (DAR). ADC, полученные с помощью технологии сайт-специфической конъюгации, связывают лекарственное средство с антителом в определенных встроенных остатках тяжелой и/или легкой цепи антитела. Таким образом, сайт-специфически конъюгированные ADC представляют собой гомогенную смесь ADC, состоящую из видов с определенным соотношением лекарственное средство:антитело (DAR). Таким образом, сайт-специфически конъюгированные ADC демонстрируют однородную стехиометрию, что приводит к улучшению фармакокинетики, биораспределения и профиля безопасности.
ADC по настоящему изобретению включают антитела против EDB, конъюгированные с одним или более лекарственными средствами через линкер (т.е. образующие фрагменты лекарственное средство-линкер). Настоящее изобретение относится к ADC, содержащим (a) антитело или его антигенсвязывающий фрагмент, которые связываются с EDB; (b) линкер и (c) лекарственное средство. Настоящее изобретение также относится к ADC формулы Ab-(LD), где (a) Ab представляет собой антитело или его антигенсвязывающий фрагмент, которые связываются с EDB, и (b) LD представляет собой фрагмент линкер-лекарственное средство, где L является линкером, а D является лекарственным средством. В другом аспекте настоящее изобретение относится к ADC формулы Ab-(LD)p, где (a) Ab представляет собой антитело или его антигенсвязывающий фрагмент, которые связываются с EDB, (b) LD представляет собой фрагмент лекарственное средство-линкер, где L представляет собой линкер, и D представляет собой лекарственное средство, и (c) p представляет собой число фрагментов, содержащих линкер-лекарственное средство, прикрепленных к антителу.
Количество фрагментов линкер-лекарственное средство, прикрепленных к антителу, может быть любым числом, предпочтительным для развития ADC. В некоторых аспектах количество фрагментов линкер-лекарственное средство на антитело составляет 4. В других аспектах количество фрагментов линкер-лекарственное средство на антитело составляет 3. В другом аспекте количество фрагментов линкер-лекарственное средство на антитело составляет 2. В другом аспекте количество фрагментов линкер-лекарственное средство на антитело составляет 1. В других аспектах количество фрагментов линкер-лекарственное средство на антитело составляет больше чем 4, например, 5, 6, 7, 8, 9, 10, 11, 12 или больше чем 12 фрагментов линкер-лекарственное средство на антитело.
Кроме того, настоящее изобретение относится к ADC, где фрагменты линкер-лекарственное средство прикреплены к антителу с помощью технологии стандартной или сайт-специфической конъюгации. В некоторых аспектах антитела против EDB или их антигенсвязывающие фрагменты конъюгированы или связаны с лекарственным средством, таким как цитотоксический, цитостатический и/или терапевтический агент, как описано далее в настоящем документе. Например, цитотоксический агент может быть связан или конъюгирован с антителом против EDB, как описано в настоящем документе, для направленной локальной доставки цитотоксического агента. Также предоставлены способы подготовки и изготовления таких ADC и их использование в клинических применениях.
В отличие от других ADC, разрабатываемых для нацеливания на интернализующие экспрессируемые на клеточной поверхности белки, ADC по настоящему изобретению нацелены на EDB, белок, экспрессируемый во внеклеточном матриксе (ECM). Направленное воздействие на белок, экспрессируемый в ECM, может обеспечить преимущества по сравнению с направленным воздействием на белок, экспрессируемый в опухолевых клетках. ADC может напрямую получить доступ к цели без необходимости проникать через стромальные и ECM-барьеры, характерные для многих трудно поддающихся лечению злокачественных новообразований человека. Кроме того, направленное воздействие EDB в ECM с помощью ADC обеспечивает специальный механизм для доступа ко многим типам клеток, на которые сложно воздействовать, в микроокружении опухоли. Это может привести к внеклеточному высвобождению цитотоксической полезной нагрузки или лекарственного средства, что приводит к уничтожению множества клеток с помощью таких механизмов, как гибель клеток/остановка клеточного цикла опухолевых клеток и/или стромальных клеток с помощью механизма «свидетеля». Кроме того, дополнительные механизмы включают, но не ограничиваются этим, нерегулируемый ангиогенез или цитотоксическое нацеливание/коллапс сосудов, нормализацию сосудов, иммуномодуляцию и индукцию клеточной дифференцировки и/или препятствия перехода от эпителия к мезенхиме.
Приведенные в настоящем описании примеры демонстрируют улучшенные характеристики, полученные во время генерации антител против EDB и EDB ADC, такие как оптимизация аллотипа для снижения иммуногенности, удаление COOH-концевого лизина для повышения гомогенности продукта и введение мутаций для уменьшения потенциальной способности к гликированию и снижения гетерогенности (см. Примеры 1 и 2). Кроме того, как показано в примерах, EDB ADC, полученные с использованием различных технологий стандартной и сайт-специфической конъюгации (т.е. цистеиновых, лизиновых и/или меток в виде глутаминсодержащих ацильных доноров (Q)) и различных фрагментов линкер-лекарственное средство, демонстрируют стабильность in vitro и эффективность in vivo (см. Примеры 6-8). Приведенные в настоящем описании Примеры также показали, что EDB ADC, полученные с использованием сайт-специфической конъюгации с помощью встроенных остатков цистеина, продемонстрировали улучшенные характеристики по сравнению с EDB ADC, полученными с использованием стандартной конъюгации с помощью остатков цистеина, такие как улучшенный фармакокинетический (PK) профиль (то есть увеличение стабильности при воздействии, и конъюгация, приводящая к меньшему количеству нецелевых токсических эффектов), благоприятная термостабильность и неклинический профиль безопасности (т.е. облегчение миелосупрессии) (см. Примеры 9, 10 и 11, соответственно). Кроме того, улучшенная характеристика EDB ADC, полученных с помощью технологий сайт-специфической конъюгации, может обеспечить более высокие дозы при лечении человека и, таким образом, повысить эффективность. В некоторых аспектах EDB ADC могут содержать замену лизина (K) в положении 290 (в соответствии с индексом EU по Kabat) в константной области тяжелой цепи человеческого IgG1 на реакционноспособный цистеин (C) (K290C) и/или замену лизина (K) в положении 183 (по Kabat) в константной области легкой цепи каппа человека на реакционноспособный цистеин (C) (κK183C) для обеспечения сайт-специфической конъюгации.
Дополнительный домен B фибронектина
Используемые в настоящем описании «EDB+ FN» и «EDB» используются взаимозаменяемо и относятся к фибронектину (FN), содержащему дополнительный домен B (EDB). Кроме того, «антитела против EDB» и «антитела против EDB+ FN» используются взаимозаменяемо и относятся к антителам, которые связываются с EDB. «Конъюгаты антитело против EDB-лекарственное средство», «Конъюгаты EDB антитело-лекарственное средство», «анти-EDB ADC», «EDB ADC» используются взаимозаменяемо и относятся к ADC, содержащим антитела или их антигенсвязывающие фрагменты, которые связываются с EDB и конъюгированы или связаны с лекарственным средством. FN представляет собой высокомолекулярный гликопротеин, присутствующий во внеклеточном матриксе (ECM), и участвует в процессах адгезии и миграции клеток, включая эмбриогенез, заживление ран, свертывание крови, защиту хозяина и метастазирование. FN обычно существует в виде димера, образованного двумя почти идентичными субъединицами ~ 250 кДа, ковалентно связанными вблизи их С-конца парой дисульфидных связей. Каждый мономер состоит из трех типов повторяющихся звеньев: повторы FN типа I, типа II и типа III. Один ген размером 75 т.п.н. кодирует FN, однако у человека наблюдается двадцать вариантов белка. Альтернативный сплайсинг гена FN происходит в трех областях, что приводит к включению или исключению одного из двух повторов типа III, называемого дополнительным доменом A (EDA) и дополнительным доменом B (EDB), и сегмента, соединяющего два других повтора типа III, называемых соединительным сегментом типа III (IIICS). EDB представляет собой последовательность из 91 аминокислоты, которая на 100% идентична у мышей, крыс, кроликов, собак, яванских макак и людей. Репрезентативная нуклеотидная последовательность EDB+ FN представлена под номером доступа No. NM_001306129.1, а соответствующая аминокислотная последовательность представлена под номером доступа No. NP_001293058.1. EDB и аминокислотные последовательности рекомбинантного человеческого 7-EDB-8-9 представлены в Таблице 1. Рекомбинантный человеческий 7-EDB-8-9 содержит EDB, фланкированный доменом 7 на аминоконце и доменом 8 и доменом 9 на карбоксиконце EDB.
Таблица 1. Последовательности EDB и 7-EDB-8-9
Антитела против EDB
Антитела по настоящему изобретению специфически связываются с EDB. Для получения ADC по изобретению антитело или его антигенсвязывающий фрагмент может представлять собой любое антитело (включая антитела, описанные в настоящем документе) или его антигенсвязывающий фрагмент, которые специфически связываются с EDB. Антитело или его антигенсвязывающий фрагмент могут быть выделены, очищены или подвергнуты модификации для использования при получении EDB ADC.
Используемый в настоящем описании термин «антитело» или «Ab» относится к молекуле иммуноглобулина, способной распознавать и связывать конкретную мишень или антиген, такой как углевод, полинуклеотид, липид, полипептид и т. д., по меньшей мере, через один сайт распознавания антигена, локализованный в вариабельной области молекулы иммуноглобулина. Термин может охватывать антитела любого типа, включая, но не ограничиваясь ими, моноклональные антитела, поликлональные антитела, «антигенсвязывающие фрагменты» (или части), такие как Fab, Fab', F(ab')2, Fd, Fv, Fc и т. д. интактных антител, которые сохраняют способность специфически связываться с данным антигеном (например, EDB), выделенная область, определяющая комплементарность, (CDR), биспецифичные антитела, гетероконъюгированные антитела, их мутанты, слитые белки, содержащие антитело, или их антиген-связывающие фрагменты (например, доменное антитело), одноцепочечные (ScFv) и однодоменные антитела (например, антитела акулы и верблюда), макси-тела, мини-тела, интра-тела, диатела, триатела, тетратела, v-NAR и бис-scFv ( см., например, Holliger and Hudson, 2005, Nature Biotechnology 23 (9): 1126-1136), гуманизированные антитела, химерные антитела и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая включает сайт распознавания антигена требуемой специфичности, включая варианты гликозилирования антител, варианты аминокислотных последовательностей антител и ковалентно модифицированные антитела. Антитела могут быть мышиного, крысиного, человеческого или любого другого происхождения (включая химерные или гуманизированные антитела). В некоторых аспектах изобретения антитело или его антигенсвязывающий фрагмент раскрытых EDB ADB представляют собой химерное, гуманизированное или рекомбинантное человеческое антитело или его EDB-связывающий фрагмент.
Нативные или встречающиеся в природе антитела и нативные иммуноглобулины обычно представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 дальтон, состоящие из двух идентичных легких цепей (LC) и двух идентичных тяжелых цепей (HC). Каждая тяжелая цепь имеет вариабельный домен (VH), за которым следует ряд константных доменов или областей (например, шарнир, СН1, СН2 или СН3), называемых «доменами СН». Каждая легкая цепь имеет вариабельный домен (VL) и константный домен, называемый «доменом CL». Термин «константная область» или «константный домен» антитела относится к константной области легкой цепи антитела или константной области тяжелой цепи антитела, отдельно или в комбинации. Константные домены не участвуют непосредственно в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как связывание с Fc-рецептором (FcR), участие антитела в антителозависимой клеточной токсичности (ADCC), опсонизация, инициация комплемент-зависимой цитотоксичности и дегрануляция тучных клеток. Константные области антител к EDB могут быть получены из константных областей любого из IgG IgA, IgD, IgE, IgG, IgM или любых их изотипов (например, IgG1, IgG2, IgG3 или IgG4), а также подклассов и их мутированных версий.
Домен CH1 включает в себя первый (самый N-концевой) домен константной области тяжелой цепи иммуноглобулина, который простирается, например, примерно от положений 118-215 в соответствии с индексом EU по Kabat. Домен CH1 находится рядом с доменом VH и в N-концевой области относительно шарнирной области тяжелой цепи молекулы иммуноглобулина и не образует часть Fc-области тяжелой цепи иммуноглобулина.
Шарнирная область включает часть молекулы тяжелой цепи, которая соединяет домен CH1 с доменом CH2. Эта шарнирная область содержит приблизительно 25 остатков и является гибкой, что позволяет двум N-концевым антигенсвязывающим областям перемещаться независимо. Шарнирные области можно подразделить на три отдельных домена: верхний, средний и нижний шарнирные домены.
Домен CH2 включает часть тяжелой цепи молекулы иммуноглобулина, которая простирается, например, приблизительно от положений 231-340 в соответствии с индексом EU по Kabat. Домен CH2 уникален тем, что он не является тесно связанным с другим доменом. Скорее, две N-связанные разветвленные углеводные цепи расположены между двумя доменами CH2 интактной нативной молекулы IgG. В некоторых аспектах антитело (или его фрагмент) по изобретению содержит домен CH2, полученный из молекулы IgG, такой как IgG1, IgG2, IgG3 или IgG4. В некоторых аспектах IgG представляет собой человеческий IgG.
Домен СН3 включает часть молекулы иммуноглобулина с тяжелой цепью, которая простирается приблизительно на 110 остатков от N-конца домена СН2, например, примерно от положений 341-447 в соответствии с индексом EU по Kabat. Домен СН3 обычно образует С-концевую часть антитела. Однако в некоторых иммуноглобулинах дополнительные домены могут простираться от домена СН3 с образованием С-концевой части молекулы (например, домена СН4 в μ-цепи IgM и ε-цепи IgE). В некоторых аспектах антитело (или его фрагмент) по изобретению содержит домен CH3, полученный из молекулы IgG, такой как IgG1, IgG2, IgG3 или IgG4. В некоторых аспектах IgG представляет собой человеческий IgG.
Домен CL включает в себя домен константной области легкой цепи иммуноглобулина, который простирается, например, примерно от положений 108-214 в соответствии с индексом EU по Kabat. Домен CL является смежным с доменом VL. В некоторых аспектах антитело (или его фрагмент) по изобретению содержит константный домен легкой цепи каппа (CLκ). В некоторых аспектах антитело (или его фрагмент) содержит константный домен легкой цепи лямбда (CLλ). CLκ имеет известные полиморфные локусы CLκ-V/A45 и CLκ-L/V83 (с использованием нумерации Kabat), что позволяет учитывать полиморфизмы Km (1): CLκ-V45/L83; Км (1,2): CLκ-A45/L83; и Km (3): CLκ-A45/V83. Полипептиды, антитела и ADC по изобретению могут иметь антительные компоненты с любой из этих константных областей легкой цепи.
Fc-область обычно содержит домен CH2 и домен CH3. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут варьироваться, Fc-область тяжелой цепи человеческого IgG обычно определяется как протяженный фрагмент от аминокислотного остатка в положении Cys226 или от Pro230 (согласно индексу EU по Kabat) до его карбоксильного конца. Fc-область может представлять собой Fc-область с нативной последовательностью или вариантную Fc-область. (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md., 1991).
«Вариабельная область» антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела, отдельно или в комбинации. Как известно в данной области техники, каждая вариабельная область тяжелой и легкой цепи состоит из четырех каркасных областей (FR), соединенных тремя определяющими комплементарность областями (CDR), также известными как гипервариабельные области. CDR в каждой цепи удерживаются вместе в непосредственной близости FR и вместе с CDR из другой цепи способствуют образованию антигенсвязывающего сайта антител.
CDR вариабельного домена может быть идентифицирована в соответствии с определениями Kabat (Kabat et al., 1992, Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, NIH, Washington D.C), Chothia (Chothia et al., Nature 342:877-883, (1989)), суммирование как Kabat, так и Chothia, определение AbM (получено с помощью программного обеспечения для моделирования антител AbM Oxford Molecular (теперь Accelrys®)), определение контакта (на основе наблюдаемых контактов антигена, как изложено в MacCallum et al., J. Mol. Biol., 262: 732-745 ((1996)) и/или определение конформации (Makabe et al., Journal of Biological Chemistry, 283: 1156-1166, 2008) или любой метод определения CDR, хорошо известный в данной области. Используемая в настоящем описании CDR может относиться к CDR, определенной любым подходом, известным в данной области техники, включая комбинации подходов. Для настоящего изобретения CDR, представленные в Таблице 2 ниже, были получены с использованием определений Kabat и Chothia. Антитела против EDB или их антигенсвязывающие фрагменты по настоящему изобретению включают одну или более CDR (как например, одну, две, три, четыре, пять или все шесть CDR).
Антитело, ADC или полипептид, который «специфически связывается» или «предпочтительно связывается» (используется в настоящем описании взаимозаменяемо) с мишенью или антигеном (например, белком EDB), является термином, хорошо известным в данной области, и способы определения такого специфического или предпочтительного связывания также хорошо известны в данной области. Говорят, что молекула проявляет «специфическое связывание» или «предпочтительное связывание», если она реагирует или ассоциируется чаще, быстрее, с большей продолжительностью и/или с большей аффинностью с конкретной клеткой или веществом, чем с альтернативными клетками или веществами. Антитело «специфически связывается» или «предпочтительно связывается» с мишенью или антигеном, если оно связывается с большей аффинностью, авидностью, более легко и/или с большей продолжительностью, чем оно связывается с другими веществами. Например, антитело, которое специфически или предпочтительно связывается с эпитопом EDB, представляет собой антитело, которое связывает этот эпитоп с большей аффинностью, авидностью, более легко и/или с большей продолжительностью, чем оно связывается с другими эпитопами EDB или не-EDB эпитопами.
Используемый в настоящем описании термин «аффинность связывания» или «KD» предназначен для обозначения константы равновесной диссоциации конкретного взаимодействия антиген-антитело. KD - это отношение скорости диссоциации, также называемой «off-rate» или «kd», к скорости ассоциации, или «on-rate» или «ka». Таким образом, KD равно kd/ka, и выражается как молярная концентрация (M). Отсюда следует, что чем меньше KD, тем сильнее аффинность связывания. Следовательно, KD 1 мкМ указывает на слабую аффинность связывания по сравнению с KD 1 нМ. Значения KD для антител могут быть определены с использованием методов, хорошо известных в данной области. Одним из способов определения KD антитела является использование поверхностного плазмонного резонанса, обычно с использованием биосенсорной системы, такой как система BIAcore®. Другие стандартные анализы для оценки способности связывания лигандов, таких как антитела, с мишеням известны в данной области, включая, например, ИФА, вестерн-блот-анализ, RIA и анализ с помощью проточной цитометрии.
Используемый в настоящем описании термин «выделенное антитело» относится к антителу, которое по существу не содержит других антител, обладающих отличной антигенной специфичностью (например, выделенное антитело, которое специфически связывает EDB, по существу не содержит антител, которые специфически связывают антигены, отличные от EDB). Кроме того, выделенное антитело может быть практически свободным от других клеточных материалов и/или химических веществ. Также понятно, что, читая это определение, например, антитело (или фрагмент или эпитоп), которое специфически или предпочтительно связывается с первой мишенью, может специфически или предпочтительно не связываться со второй мишенью.
В некоторых аспектах изобретения EDB ADC включает антитело, которое конкурирует за связывание с EDB человека и/или связывает тот же эпитоп, что и антитело или его антигенсвязывающий фрагмент, описанные в настоящем документе.
Термин «конкурировать», используемый в настоящем документе в отношении антитела, означает, что первое антитело или его антигенсвязывающий фрагмент связывается с эпитопом способом, достаточно сходным со связыванием второго антитела или его антигенсвязывающего фрагмента, так что результат связывания первого антитела с его родственным эпитопом заметно уменьшается в присутствии второго антитела по сравнению со связыванием первого антитела в отсутствие второго антитела. Альтернатива, где связывание второго антитела с его эпитопом также заметно снижается в присутствии первого антитела, может иметь место, но не обязательно. То есть первое антитело может ингибировать связывание второго антитела с его эпитопом без того, чтобы это второе антитело ингибировало связывание первого антитела с его соответствующим эпитопом. Однако в тех случаях, когда каждое антитело детектируемо ингибирует связывание другого антитела с его родственным эпитопом или лигандом, в одинаковой, большей или меньшей степени антитела считаются «перекрестно конкурирующими» друг с другом за связывание их соответствующего эпитопа (эпитопов). Как конкурирующие, так и перекрестно конкурирующие антитела охватываются настоящим изобретением. Независимо от механизма, посредством которого происходит такая конкуренция или перекрестная конкуренция (например, стерическое затруднение, конформационное изменение или связывание с общим эпитопом или его частью), специалист в данной области техники оценил бы, основываясь на представленных в настоящем описании идеях, что такие конкурирующие и/или перекрестно конкурирующие антитела охватываются и могут быть полезны для способов, раскрытых в настоящем описании.
Антитело «L19», также обозначаемое в настоящем описании как антитело «EDB-L19», представляет собой антитело человека, которое связывается с EDB. Антитело L19 раскрыто и охарактеризовано в международных публикациях РСТ WO 1997/045544, WO 1999/058570 и WO 2001/062800, которые включены в настоящий документ посредством ссылки в полном объеме, и последовательности L19-EDB представлены в настоящем описании в Таблице 2 (SEQ ID NO. 1-16).
В некоторых аспектах изобретения антитела, используемые для получения EDB ADC, могут быть моноклональными антителами. Термин «моноклональное антитело» или «mAb» относится к антителу, полученному из популяции по существу гомогенных антител, то есть отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными и направлены против одного антигенного сайта. Кроме того, в отличие от препаратов поликлональных антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Модификатор «моноклональное» указывает на характер антитела, получаемого из по существу гомогенной популяции антител, и его не следует истолковывать как требование получения антитела каким-либо конкретным способом.
В некоторых аспектах изобретения антитела, используемые для получения ADC по изобретению, могут быть моновалентными, то есть иметь один антигенсвязывающий сайт на молекулу (например, IgG или Fab). В некоторых случаях моновалентное антитело может иметь более чем один антигенсвязывающий сайт, но при этом сайты связывания происходят от разных антигенов. В некоторых аспектах изобретения антитело или его антигенсвязывающий фрагмент ADC по изобретению может включать «двухвалентное антитело», то есть иметь два антигенсвязывающих сайта на молекулу (например, IgG). В некоторых случаях два сайта связывания имеют одинаковую антигенную специфичность. Альтернативно, двухвалентные антитела могут быть биспецифичными. «Биспецифичное», «дважды специфичное» или «бифункциональное» антитело представляет собой гибридное антитело, имеющее два разных антигенсвязывающих сайта. Два антигенсвязывающих сайта биспецифичного антитела связываются с двумя разными эпитопами, которые могут находиться на одной или разных белковых мишенях.
Термин «химерное антитело» предназначен для обозначения антител, в которых часть или все последовательности вариабельной области получены из одного вида, а последовательности константной области получены из другого вида, как например, антитело, в котором последовательности вариабельной области получены из мышиного антитела, а последовательности константной области получены из человеческого антитела.
Используемый в настоящем описании термин «гуманизированное» или «CDR-трансплантированное» антитело относится к формам антител, не являющихся человеческими (например, мышиных), которые представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, полученную из иммуноглобулина, не являющегося человеческим. Предпочтительно гуманизированные антитела представляют собой человеческие иммуноглобулины (антитело-реципиент), в которых остатки из одной или более CDR реципиента заменены остатками из одной или более CDR вида, отличного от человека (донорское антитело), такого как мышь, крыса или кролик, имеющих желаемую специфичность, аффинность и способность.
Антитела по изобретению могут быть получены с использованием методов, хорошо известных в данной области, например, рекомбинантных технологий, технологий фагового дисплея, синтетических технологий или комбинаций таких технологий или с использованием других технологий, которые легко обнаружить в данной области (см., например, Jayasena, SD, Clin., Chem., 45: 1628-50 (1999) и Fellouse, FA, et al., J. MoI. Biol., 373 (4): 924-40 (2007)). Дополнительное руководство можно найти в Sambrook J. & Russell D. Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2000); Ausubel et al., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Wiley, John & Sons, Inc. (2002); Harlow and Lane Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1998); и Coligan et al., Short Protocols in Protein Science, Wiley, John & Sons, Inc. (2003).
Нуклеиновые кислоты, кодирующие тяжелые и легкие цепи антител, используемых для получения ADC по изобретению, могут быть клонированы в вектор для экспрессии или размножения. Последовательность, кодирующая интересующее антитело, может сохраняться в векторе в клетке-хозяине, а затем клетка-хозяин может быть размножена и заморожена для будущего использования. Продуцирование рекомбинантных моноклональных антител в клеточной культуре может быть осуществлено путем клонирования генов антител из В-клеток способами, известными в данной области. См., например, Tiller et al., J. Immunol. Methods 329:112-124, 2008; U.S. Patent No. 7,314,622.
Используемый в настоящем описании термин «вектор» относится к конструкции, которая способна доставлять и, предпочтительно, экспрессировать один или более генов или последовательностей, представляющих интерес, в клетке-хозяине. Примеры векторов включают, но не ограничиваются ими, вирусные векторы, векторы экспрессии «голой» ДНК или РНК, плазмидные векторы, космидные или фаговые векторы экспрессии ДНК или РНК, связанные с катионными конденсирующими агентами, векторы экспрессии ДНК или РНК, инкапсулированные в липосомы, и некоторые эукариотические клетки, такие как клетки-продуценты.
Используемый в настоящем описании термин «клетка-хозяин» включает отдельную клетку или клеточную культуру, которая может быть или являлась реципиентом для вектора(ов), предназначенных для включения полинуклеотидных вставок. Клетки-хозяева включают потомство одной клетки-хозяина, и потомство необязательно может быть полностью идентичным (по морфологии или по комплементарности геномной ДНК) исходной родительской клетке из-за естественной, случайной или преднамеренной мутации. Клетка-хозяин включает клетки, трансфецированные in vivo полинуклеотидом(ами) по настоящему изобретению.
Как известно в данной области, «полинуклеотид», «нуклеиновая кислота/нуклеотид» и «олигонуклеотид» используются в настоящем описании взаимозаменяемо и включают полимерные формы нуклеотидов любой длины, либо дезоксирибонуклеотиды, либо рибонуклеотиды, их аналоги или любой субстрат, которые могут быть включены в цепь с помощью ДНК или РНК-полимеразы. Полинуклеотиды могут иметь любую трехмерную структуру и могут выполнять любую функцию, известную или неизвестную. Полинуклеотиды могут быть встречающимися в природе, синтетическими, рекомбинантными или любой их комбинацией.
Для всех аминокислотных положений константной области тяжелой цепи, обсуждаемых в настоящем изобретении, нумерация соответствует индексу Eu, впервые описанному в публикации Edelman et al., 1969, Proc. Natl. Acad. Sci. USA 63 (1): 78-85, описывающей аминокислотную последовательность белка миеломы Eu, который является первым секвенированным человеческим lgG1. Индекс Eu Edelman et al. также представлен в Kabat et al., 1991, Sequences of Proteins of Immunological Interest, 5th Ed., United States Public Health Service, National Institutes of Health, Bethesda. Таким образом, «индекс EU, указанный у Kabat» или «индекс EU Kabat» относится к системе нумерации остатков на основе человеческого IgG1-антитела Eu из Edelman et al., как изложено у Kabat 1991.
Система нумерации, используемая для аминокислотной последовательности константной области легкой цепи, представлена в Kabat 1991.
EDB ADC по настоящему изобретению могут быть конъюгированы с лекарственным средством/полезной нагрузкой с использованием стандартной технологии конъюгации на основе цистеина или технологии сайт-специфической конъюгации. Чтобы приспособить сайт-специфическую конъюгацию с помощью встроенных цистеинов, константный домен может быть модифицирован для обеспечения реакционноспособного остатка цистеина, встроенного в одном или нескольких конкретных сайтах (иногда называемых мутантами «Cys»). Чтобы приспособить сайт-специфическую конъюгацию через конъюгацию на основе трансглутаминазы, глутаминсодержащий ацильный донор («Q») в виде метки или эндогенный глутамин делают реакционноспособными с помощью полипептидного конструирования в присутствии трансглутаминазы и аминогруппы.
Настоящее изобретение относится к оптимизации антитела L19-EDB путем генерации неиммуногенного антитела. В некоторых аспектах константная область человеческого IgG1, L19-EDB, содержащая аллотип G1m(a), имеющий аспарагиновую кислоту (D) в положении 356 и лейцин (L) в положении 358, может быть замещена аллотипом, отличным от G1m(a), имеющим глутаминовую кислоту (E) в положении 356 и метионин (M) в положении 358 (согласно нумерации индекса EU по Kabat).
Кроме того, для снижения потенциальных химических особенностей и связывания антигена с предполагаемым сайтом гликирования белка антитела против EDB по настоящему изобретению могут иметь вариабельную область тяжелой цепи, содержащую мутацию лизина (K) в положении 94 (согласно нумерации индекса EU по Kabat) до аргинина (R), например, (K94R).
Для сайт-специфической конъюгации с помощью встроенных цистеинов константный домен тяжелой цепи антитела против EDB может содержать реакционноспособный встроенный остаток цистеина в положении 290 (K290C), согласно нумерации индекса EU по Kabat. Могут быть введены дополнительные замены цистеина. В другом аспекте константный домен легкой цепи антитела против EDB может содержать реакционноспособный встроенный остаток цистеина в положении 183 (κK183C), согласно нумерации Kabat. Могут быть введены дополнительные замены цистеина.
Для сайт-специфической конъюгации с помощью встроенных остатков глутамина константный домен тяжелой цепи антитела против EDB может содержать встроенную H16-глутаминсодержащую метку LLQG (SEQ ID NO: 40). Кроме того, для оптимизации этой сайт-специфической конъюгации аминокислота лизин (K) в положении 222 (в соответствии с индексом EU Kabat) на тяжелой цепи может быть заменена аргинином (R), например (K222R).
Аминокислотные модификации могут быть сделаны любым способом, известным в данной области, и многие такие способы хорошо известны и очевидны для специалиста в данной области, например, мутации, замены, делеции и/или вставки. Например, но не в качестве ограничения, аминокислотные замены, делеции и вставки могут быть выполнены с использованием любого хорошо известного метода на основе ПЦР. Аминокислотные замены могут быть сделаны сайт-направленным мутагенезом (см., например, Zoller and Smith, 1982, Nucl. Acids Res. 10: 6487-6500; и Kunkel, 1985, PNAS 82: 488).
В некоторых аспектах изобретения EDB ADC включают антитело или его антигенсвязывающий фрагмент, имеющие тяжелую цепь и/или легкую цепь, содержащую аминокислотную последовательность, которая по меньшей мере на 90%, 95%, 98% или 99% идентична любой из тяжелых или легких цепей, раскрытых в настоящем описании. Остатки, которые были изменены, могут находиться в вариабельной области или в константной области антитела. В некоторых аспектах имеется не более чем 1, 2, 3, 4 или 5 остатков, которые были изменены по сравнению с любой из тяжелых или легких цепей, описанных в настоящем документе.
Термин «процент идентичности» в контексте аминокислотных последовательностей означает количество остатков в двух последовательностях, которые являются одинаковыми при выравнивании для максимального соответствия. В данной области техники известен ряд различных алгоритмов, которые можно использовать для измерения процента аминокислотной идентичности (то есть, Basic Local Alignment Tool или BLAST®). Если не указано иное, используются параметры по умолчанию для конкретной программы или алгоритма.
Для использования при получении EDB ADC, антитела, описанные в настоящем документе, могут быть по существу чистыми, то есть, по меньшей мере, на 50% чистыми (т.е. не содержащими загрязнений), более предпочтительно, по меньшей мере, на 90% чистыми, более предпочтительно, по меньшей мере, на 95% чистыми, но более предпочтительно, по меньшей мере, на 98% и наиболее предпочтительно, по меньшей мере, на 99%.
В Таблицах 2 и 3 представлены аминокислотные (белковые) последовательности и соответствующие последовательности нуклеиновых кислот (ДНК) антител против EDB по настоящему изобретению. CDR определены Kabat и Chothia. Затененные остатки идентифицируют аминокислотные мутации, замены и/или вставки, относящиеся к оптимизации антител, а подчеркнутые остатки идентифицируют аминокислотные мутации, замены и/или вставки, относящиеся к технологии сайт-специфической конъюгации.
Таблица 2. Последовательности антител против EDB
В некоторых аспектах изобретения EDB ADC включают антитело или его антигенсвязывающий фрагмент, которые связываются с дополнительным доменом B (EDB) фибронектина (FN).
В некоторых аспектах изобретения антитело по настоящему изобретению или его антигенсвязывающий фрагмент имеют вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), где VH имеет три CDR, содержащие SEQ ID NO: 3, 5 и 7. В некоторых аспектах изобретения антитело или его антигенсвязывающий фрагмент имеет вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), где VL имеет три CDR, содержащие SEQ ID NO: 12, 13 и 14. Антитело или его антигенсвязывающий фрагмент могут иметь VH, имеющую три CDR, содержащие SEQ ID NO: 3, 5 и 7; и VL, имеющую три CDR, содержащие SEQ ID NO: 12, 13 и 14.
В другом аспекте антитело по настоящему изобретению или его антигенсвязывающий фрагмент могут иметь вариабельную область тяжелой цепи (VH), содержащую VH CDR1 SEQ ID NO: 3, VH CDR2 SEQ ID NO: 5 и VH CDR3 SEQ ID NO: 7 (согласно Kabat) или VH CDR1 SEQ ID NO: 4, VH CDR2 SEQ ID NO: 6 и VH CDR3 SEQ ID NO: 7 (согласно Chothia), или CDR1 VH SEQ ID NO: 3 или 4, CDR2 VH SEQ ID NO: 5 или 6 и CDR3 VH SEQ ID NO: 7. В другом аспекте антитело или его антигенсвязывающий фрагмент могут иметь вариабельную область легкой цепи (VL), содержащую VL CDR1 SEQ ID NO: 12, VL CDR2 SEQ ID NO: 13 и VL CDR3 SEQ ID NO: 14 (согласно Kabat и Chothia). В дополнительном аспекте антитело или его антигенсвязывающий фрагмент могут иметь VR CDR1 SEQ ID NO: 3 или 4, VH CDR2 SEQ ID NO: 5 или 6 и VH CDR3 SEQ ID NO: 7 и CDR1 VL SEQ ID NO: 12, CDR2 VL SEQ ID NO: 13 и CDR3 VL SEQ ID NO: 14.
В некоторых аспектах изобретения антитело или его антигенсвязывающий фрагмент могут иметь вариабельную область тяжелой цепи, содержащую SEQ ID NO: 1 или 21, и/или вариабельную область легкой цепи, содержащую SEQ ID NO: 10. Антитело или его антигенсвязывающий фрагмент может содержать вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 1, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, которая по меньшей мере, на 90% идентична SEQ ID NO: 10; вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 21, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 10; вариабельную область тяжелой цепи, содержащую SEQ ID NO: 1, и вариабельную область легкой цепи, содержащую SEQ ID NO: 10; или вариабельную область тяжелой цепи, содержащую SEQ ID NO: 21, и вариабельную область легкой цепи, содержащую SEQ ID NO: 10.
В другом аспекте изобретения антитело или его антигенсвязывающий фрагмент могут иметь тяжелую цепь, содержащую любую из SEQ ID NO: 8, 17, 19, 23, 25, 27 и 29, и/или легкую цепь, содержащую SEQ ID NO: 15 или 31.
Антитело по настоящему изобретению или его антигенсвязывающий фрагмент могут содержать: тяжелую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 8, и легкую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 15; тяжелую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 8, и легкую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 31; тяжелую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 17, и легкую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 15; тяжелую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 17, и легкую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 31; тяжелую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 19, и легкую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 15; тяжелую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 19, и легкую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 31; тяжелую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 23, и легкую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 15; тяжелую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 23, и легкую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 31; тяжелую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 25, и легкую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 15; тяжелую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 25, и легкую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 31; тяжелую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 27, и легкую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 15; тяжелую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 27, и легкую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 31; или тяжелую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 29, и легкую цепь, имеющую аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 15.
Антитело по настоящему изобретению или его антигенсвязывающий фрагмент могут содержать: тяжелую цепь, содержащую SEQ ID NO: 8, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 8, и легкую цепь, содержащая SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 17, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 17, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 19, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 19, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 23, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 23, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 25, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 25, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 27, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 27, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 29, и легкую цепь, содержащую SEQ ID NO: 15; или тяжелую цепь, содержащую SEQ ID NO: 29, и легкую цепь, содержащую SEQ ID NO: 31.
Репрезентативные ДНК, кодирующие вариабельные области тяжелой цепи и легкой цепи антитела против EDB, содержат SEQ ID NO: 2 и 22 и SEQ ID NO: 11, соответственно. Репрезентативные ДНК, кодирующие тяжелые цепи и легкие цепи антитела против EDB, содержат SEQ ID NO: 9, 18, 20, 24, 26, 28 и 30 и SEQ ID NO: 16 и 32, соответственно.
Таблица 3. SEQ ID NO для различных антител против EDB. CDR по Kabat и (Chothia).
Лекарственные средства
Лекарственные средства, полезные для получения раскрытых EDB ADC, включают любое вещество, обладающее биологической или детектируемой активностью, например, терапевтические агенты, детектируемые метки, связывающие агенты и т. д., и пролекарственные средства, которые метаболизируются до активного агента in vivo. Лекарственное средство также может представлять собой производное лекарственного средства, где лекарственное средство функционализировано для обеспечения возможности конъюгации с антителом по изобретению.
Терапевтический агент представляет собой агент, который оказывает цитотоксическое, цитостатическое и/или иммуномодулирующее действие на опухолевые клетки или активированные иммунные клетки. Примеры терапевтических агентов включают цитотоксические агенты, химиотерапевтические агенты, цитостатические агенты и иммуномодулирующие агенты. Цитотоксический эффект относится к истощению, устранению и/или уничтожению клетки-мишени. Цитотоксический агент относится к агенту, который оказывает цитотоксическое и/или цитостатическое действие на клетку. Цитостатический эффект относится к ингибированию пролиферации клеток. Цитостатический агент относится к агенту, который оказывает цитостатическое действие на клетку, тем самым ингибируя рост и/или экспансию определенного подмножества клеток. Химиотерапевтический агент относится к агенту, который представляет собой химическое соединение, полезное для лечения злокачественного новообразования. Иммуномодулирующий агент относится к агенту, который стимулирует иммунный ответ через выработку цитокинов и/или антител, и/или модулирование функции Т-клеток, тем самым ингибируя или уменьшая прямо или косвенно рост подмножества клеток (то есть опухолевых клеток), позволяя другому агенту быть более эффективным.
В некоторых аспектах лекарственное средство представляет собой проницаемое для мембран лекарственное средство. В таких аспектах полезная нагрузка может вызывать «эффект свидетеля», при котором клетки, которые могут не экспрессировать EDB+ FN или иметь EDB+ FN, связанный с их поверхностью, но окружают клетку, которая связана с ADC, уничтожаются проницаемой для клетки полезной нагрузкой. Это происходит, когда полезная нагрузка высвобождается из антитела (т. е. путем расщепления расщепляемого линкера) и проникает через клеточную мембрану и при диффузии вызывает уничтожение окружающих клеток.
В соответствии с раскрытыми способами EDB ADC могут быть получены или сгенерированы (а) с антителом или его антигенсвязывающим фрагментом, который связывается с EDB; (b) с линкером и (c) с лекарственным средством. Отношение лекарственное средство-антитело (DAR), или нагрузка лекарственного средства, указывает количество конъюгированных молекул лекарственного средства на антитело. Композиции, партии и/или составы множества ADC могут характеризоваться средним значением DAR. DAR и средним значением DAR могут быть определены различными традиционными способами, такими как УФ-спектроскопия, масс-спектроскопия, анализ ИФА, радиометрические методы, хроматография гидрофобного взаимодействия (HIC), электрофорез и ВЭЖХ.
В аспектах изобретения EDB ADC может иметь DAR 1, DAR 2, DAR 3, DAR 4, DAR 5, DAR 6, DAR 7, DAR 8, DAR 9, DAR 10, DAR 11, DAR 12 или DAR более чем 12. В аспектах изобретения EDB ADC может иметь одну молекулу лекарственного средства, или 2 молекулы лекарственного средства, или 3 молекулы лекарственного средства, или 4 молекулы лекарственного средства, или 5 молекул лекарственного средства, или 6 молекул лекарственного средства, или 7 молекул лекарственного средства, или 8 молекул лекарственного средства, или 9 молекул лекарственного средства, или 10 молекул лекарственного средства, или 11 молекул лекарственного средства, или 12 молекул лекарственного средства, или более чем 12 молекул.
В аспектах изобретения EDB ADC может иметь среднее значение DAR в диапазоне примерно от 2 примерно до 4, или среднее значение DAR в диапазоне примерно от 3 примерно до 5, или среднее значение DAR в диапазоне примерно от 4 примерно до 6 или среднее значение DAR в диапазоне примерно от 5 примерно до 7, или среднее значение DAR в диапазоне примерно от 6 примерно до 8, или среднее значение DAR в диапазоне примерно от 7 примерно до 9, или среднее значение DAR в диапазоне примерно от 8 примерно до 10, или среднее значение DAR в диапазоне примерно от 9 примерно до 11, или среднее значение DAR в диапазоне примерно от 10 примерно до 12 и т. д. В некоторых аспектах композиции, партии и/или составы EDB ADC могут иметь среднее значение DAR примерно 1, или среднее значение DAR примерно 2, среднее значение DAR примерно 3, или среднее значение DAR примерно 4, или среднее значение DAR примерно 5, или среднее значение DAR примерно 6, или среднее значение DAR примерно 7, или среднее значение DAR примерно 8, или среднее значение DAR примерно 9, или среднее значение DAR примерно 10, или среднее значение DAR примерно 11, или среднее значение DAR примерно 12, или среднее значение DAR, более чем 12. Как используется в вышеупомянутых диапазонах среднего значения DAR, термин «примерно» означает +/- 0,5%.
Композиция, партия и/или состав EDB ADC могут характеризоваться предпочтительным диапазоном среднего значения DAR, например, средним значением DAR в диапазоне примерно от 3 примерно до 5, средним значением DAR в диапазоне примерно от 3 примерно до 4 или средним значением DAR в диапазоне примерно от 4 примерно до 5. Кроме того, состав, партия и/или состав EDB ADC могут характеризоваться предпочтительным диапазоном среднего значения DAR, например, средним значением DAR в диапазоне от 3 до 5, средним значением DAR в диапазоне от 3 до 4 или средним значением DAR в диапазоне от 4 до 5.
В некоторых аспектах изобретения композиция, партия и/или состав EDB ADC могут характеризоваться средним значением DAR примерно 1,0, или средним значением DAR 1,0, или средним значением DAR 1,1, или средним значением DAR 1,2 или средним значением DAR 1,3, или средним значением DAR 1,4, или средним значением DAR 1,5, или средним значением DAR 1,6, или средним значением DAR 1,7, или средним значением DAR 1,8, или средним значением DAR 1,9. В другом аспекте композиция, партия и/или состав EDB ADC могут характеризоваться средним значением DAR примерно 2, или средним значением DAR 2, или средним значением DAR 2,1, или средним значением DAR 2,2, или средним значением DAR 2,3, или средним значением DAR 2,4, или средним значением DAR 2,5, или средним значением DAR 2,6, или средним значением DAR 2,7, или средним значением DAR 2,8, или средним значением DAR 2,9. В другом аспекте композиция, партия и/или состав EDB ADC могут характеризоваться средним значением DAR примерно 3, или средним значением DAR 3, или средним значением DAR 3,1, или средним значением DAR 3,2, или средним значением DAR 3,3, или средним значением DAR 3,4, или средним значением DAR 3,5, или средним значением DAR 3,6, или средним значением DAR 3,7, или средним значением DAR 3,8, или средним значением DAR 3,9. В другом аспекте композиция, партия и/или состав EDB ADC могут характеризоваться средним значением DAR примерно 4, или средним значением DAR 4, или средним значением DAR 4,1, или средним значением DAR 4,2, или средним значением DAR 4,3, или средним значением DAR 4,4, или средним значением DAR 4,5, или средним значением DAR 4,6, или средним значением DAR 4,7, или средним значением DAR 4,8, или средним значением DAR 4,9, или средним значением DAR 5.
В другом аспекте композиция, партия и/или состав EDB ADC могут характеризоваться средним значением DAR 12 или менее, средним значением DAR 11 или менее, средним значением DAR 10 или менее, средним значением DAR 9 или менее, средним значением DAR 8 или менее, средним значением DAR 7 или менее, средним значением DAR 6 или менее, средним значением DAR 5 или менее, средним значением DAR 4 или менее, средним значением DAR 3 или менее, средним значением DAR 2 или менее или средним значением DAR 1 или менее.
В других аспектах композиция, партия и/или состав EDB ADC могут характеризоваться средним значением DAR 11,5 или менее, средним значением DAR 10,5 или менее, средним значением DAR 9,5 или менее, средним значением DAR 8,5 или менее, средним значением DAR 7,5 или менее, средним значением DAR 6,5 или менее, средним значением DAR 5,5 или менее, средним значением DAR 4,5 или менее, средним значением DAR 3,5 или менее, средним значением DAR 2,5 или менее, средним значением DAR 1,5 или менее.
В некоторых аспектах настоящего изобретения способы стандартной конъюгации через остатки цистеина и условия очистки, раскрытые в настоящем документе, обеспечивают композицию, партию состав и/или состав EDB ADC с оптимизированным средним значением DAR в диапазоне примерно от 3 до 5, предпочтительно примерно 4.
В некоторых аспектах настоящего изобретения способы сайт-специфической конъюгации с помощью встроенных остатков цистеина и условия очистки, раскрытые в настоящем документе, обеспечивают композицию, партию и/или состав EDB ADC с оптимизированным средним значением DAR в диапазоне примерно от 3 до 5, предпочтительно примерно 4.
В некоторых аспектах настоящего изобретения способы сайт-специфической конъюгации с использованием условий конъюгации и очистки на основе трансглутаминазы, раскрытые в настоящем документе, обеспечивают композицию, партию и/или состав EDB ADC с оптимизированным средним значением DAR в диапазоне примерно от 1 до 3, предпочтительно примерно 2.
Примеры цитотоксических агентов включают, но не ограничиваются ими, антрациклин, ауристатин, CC-1065, доластатин, дуокармицин, энедиин, гелданамицин, майтанзин, пуромицин, таксан, алкалоид барвинка, SN-38, тубулизин, гемиастерлин и стереоизомеры, изостеры, их аналоги или производные. Растительные токсины, другие биоактивные белки, ферменты (то есть, ADEPT), радиоизотопы, фотосенсибилизаторы (то есть для фотодинамической терапии) также могут быть использованы.
Антрациклины получены из бактерий Strepomyces и используются для лечения широкого спектра злокачественных новообразований, таких как лейкозы, лимфомы, рак молочной железы, матки, яичников и легких. Типичные антрациклины включают, но не ограничиваются ими, даунорубицин, доксорубицин (то есть адриамицин), эпирубицин, идарубицин, валрубицин и митоксантрон.
Доластатины и их пептидные аналоги и производные, ауристатины, являются сильнодействующими антимитотическими агентами, которые, как было показано, обладают противоопухолевой и противогрибковой активностью. См., например, патент США № 5663149 и Pettit et al., Antimicrob. Agents Chemother. 42: 2961-2965 (1998). Типичные доластатины и ауристатины включают, но не ограничиваются ими, доластатин 10, ауристатин E, ауристатин EB (AEB), ауристатин EFP (AEFP), MMAD (монометил-ауристатин D или монометил-доластатин 10), MMAF (монометил-нуристалин F или N-валин-долаизолейнин-долапроин-фенилаланин), MMAE (монометил-ауристатин Е или N-метилвалин-валин-долаизолейнин-долапроин-норэфедрин), сложный эфир 5-бензоилвалериановой кислоты-AE (AEVB) и другие новые соединения.
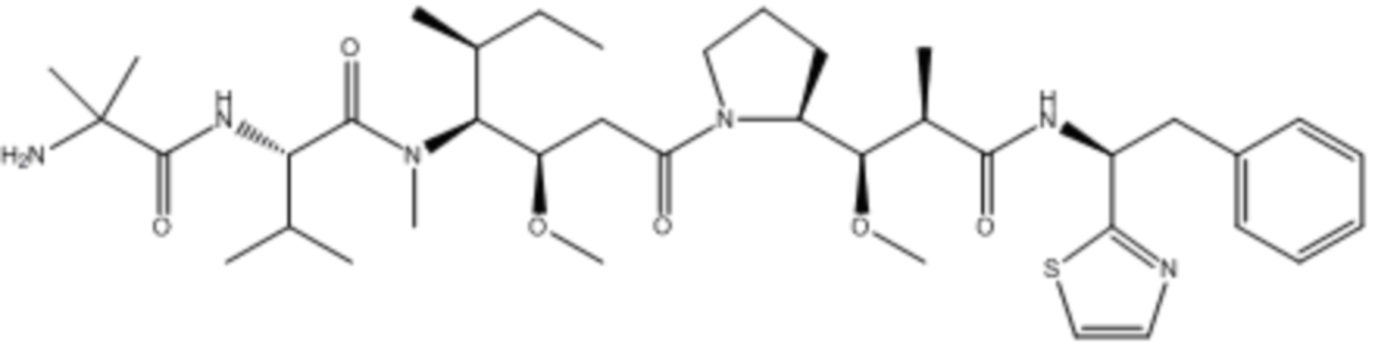
В некоторых аспектах лекарственное средство/полезная нагрузка представляет собой ауристатин. Ауристатины ингибируют пролиферацию клеток, ингибируя образование микротрубочек во время митоза путем ингибирования полимеризации тубулина. В международной публикации РСТ № WO 2013/072813, которая включена в настоящее описание посредством ссылки в полном объеме, раскрыты ауристатины, которые могут быть использованы в EDB ADC по настоящему изобретению, и предлагаются способы получения ауристатинов. Например, полезная нагрузка 0101, имеющая структуру:
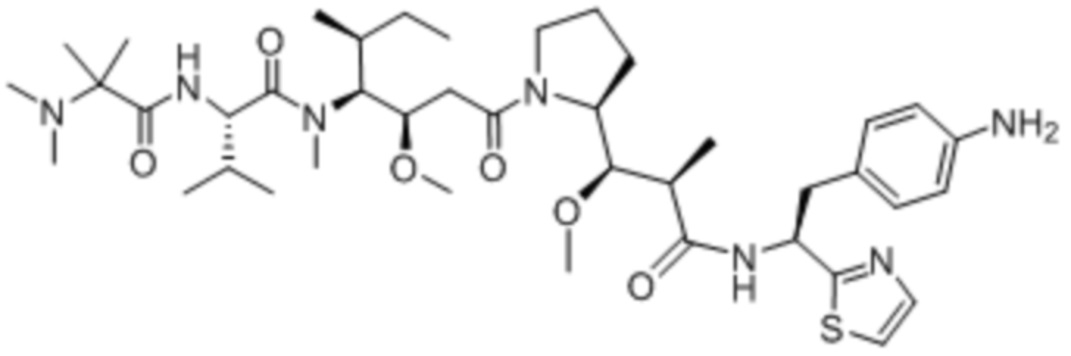
Полезная нагрузка 1569, имеющая структуру:
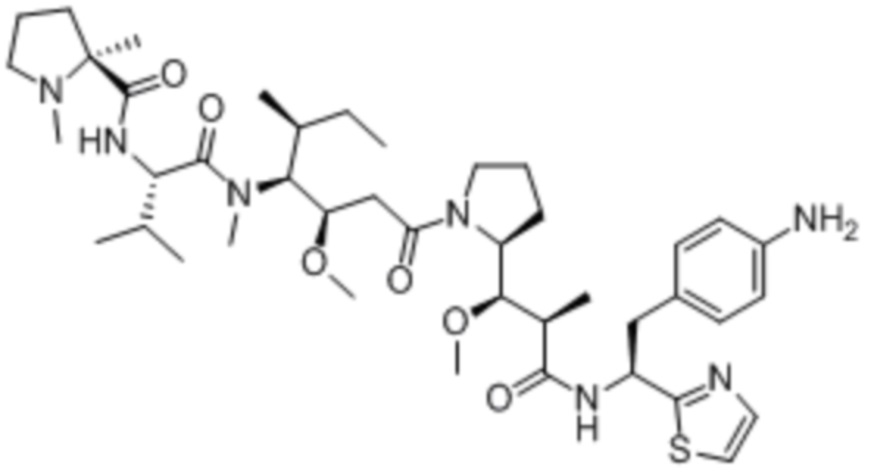
полезная нагрузка 9411, имеющая структуру:
полезная нагрузка 4574, имеющая структуру:
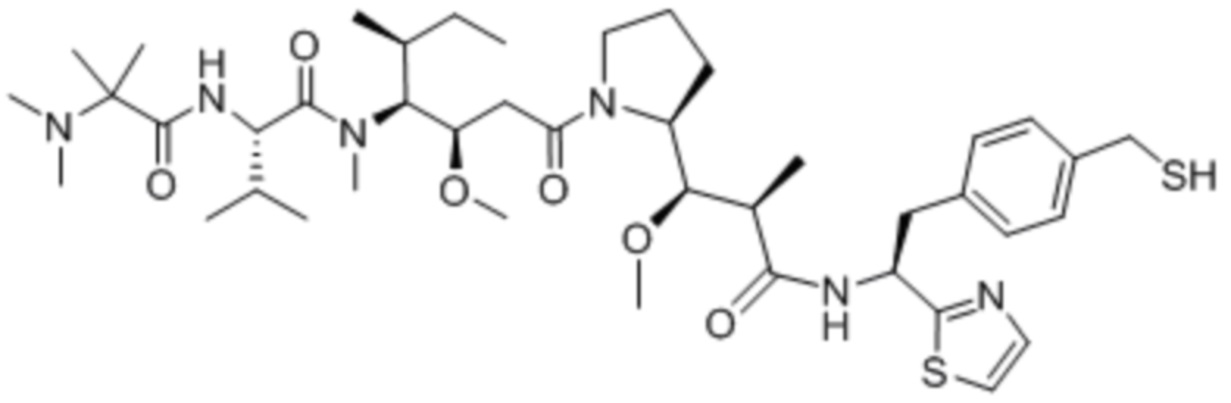
Полезная нагрузка DM1, имеющая структуру:
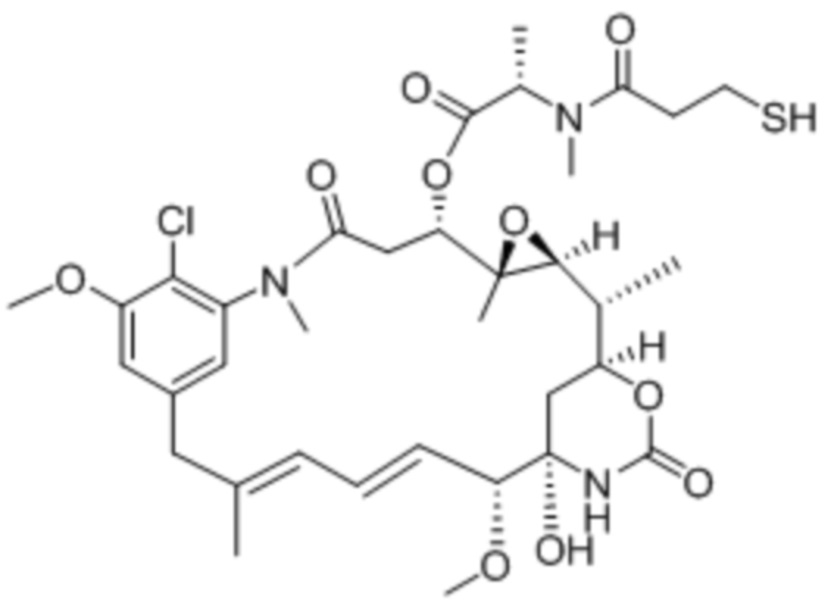
Полезная нагрузка Цемадотин, имеющая структуру:
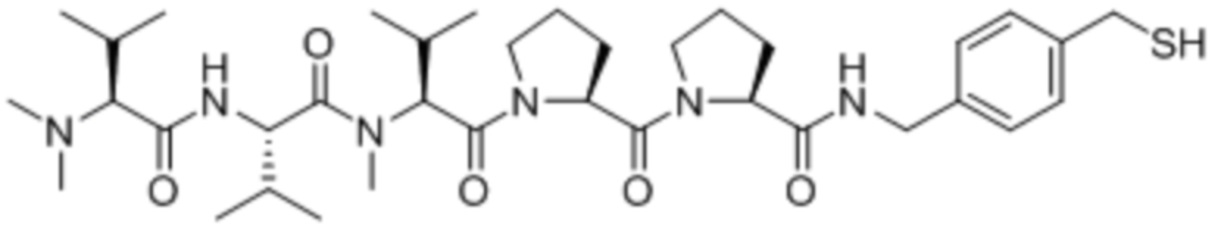
Дуокармицин и CC-1065 являются мономерами на основе CPI, которые действуют как ДНК-алкилирующие агенты с цитотоксической активностью. См. Boger and Johnson, PNAS 92: 3642-3649, 1995. Типичные доластатины включают, но не ограничиваются ими, (+)-докармицин A и (+)-дуокармицин SA и (+)-CC-1065.
В некоторых аспектах лекарственное средство/полезная нагрузка представляет собой димер CPI или CBI. Димеры CPI индуцируют межцепочечную сшивку ДНК и сильную цитотоксичность. В международной публикации РСТ № WO 2015/110935, которая полностью включена в настоящее описание посредством ссылки, раскрыты димеры CPI и CBI, которые полезны в EDB ADC по настоящему изобретению, и представлены способы получения димеров CPI и CBI. Например, полезная нагрузка димера CPI-8314, имеющая структуру:
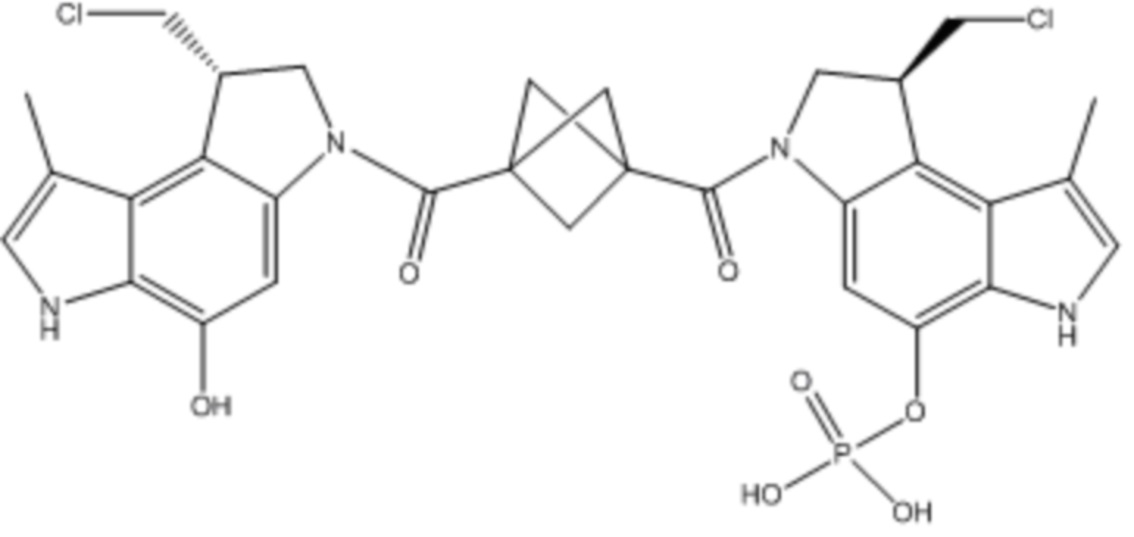
Полезная нагрузка CPI-0326, имеющая структуру:
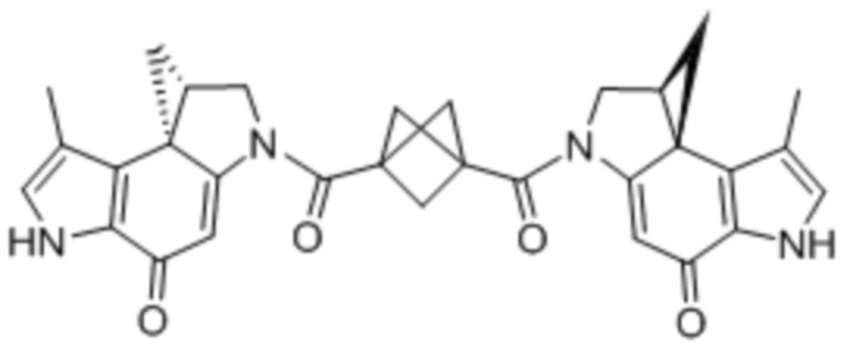
Энедиины представляют собой класс противоопухолевых бактериальных продуктов, характеризующихся либо девяти- и десятичленными кольцами, либо наличием циклической системы сопряженных тройных-двойных-тройных связей. Типичные энедиины включают, но не ограничиваются ими, калихеамицин, эсперамицин и динемицин. Калихеамицин, также называемый комплексом LL-E33288, например, β-калихеамицин, γ-калихеамицин или N-ацетил-γ-калихеамицин (гамма-калихеамицин (γ1)), является энедииновым антибиотиком, который первоначально был выделен в виде натурального продукта из почвенного организм Micromonospora echinospora ssp. calichensis (Zein et al. Science 27; 240 (4856): 1198-1201, 1988); он генерирует двухцепочечные разрывы ДНК и впоследствии вызывает апоптоз в клетках-мишенях (Zein et al. Science 27;240(4856):1198-1201, 1988; Nicolaou et al. Chem. Biol. Sep;1(1):57-66, 1994; Prokop et al. Oncogene 22: 9107-9120, 2003). Дисульфидным аналогом является диметилгидразид N-ацетил-γ-калихеамицина.
Гелданамицины представляют собой бензохиноновый ансамициновый антибиотик, который связывается с Hsp90 (Heat Shock Protein 90) и используются в качестве противоопухолевых лекарственных средств. Типичные гелданамицины включают, но не ограничиваются ими, 17-AAG (17-N-аллиламино-17-деметоксигелданамицин) и 17-DMAG (17-диметиламиноэтиламино-17-деметоксигелданамицин).
Майтанзины или их производные майтанзиноиды ингибируют пролиферацию клеток, ингибируя образование микротрубочек во время митоза путем ингибирования полимеризации тубулина. См. Remillard et al., Science 189: 1002-1005, 1975. Типичные майтанзины и мейтанзиноиды включают, но не ограничиваются ими, мертанзин (DM1) и его производные, а также ансамитоцин.
Таксаны - это дитерпены, которые действуют как анти-тубулиновые агенты или ингибиторы митоза. Типичные таксаны включают, но не ограничиваются ими, паклитаксел (например, TAXOL®) и доцетаксел (TAXOTERE®).
Алкилоиды барвинка также являются анти-тубулиновыми агентами. Типичные алкилоиды барвинка включают, но не ограничиваются ими, винкристин, винбластин, виндезин и винорелбин.
В некоторых аспектах изобретения агент представляет собой иммуномодулирующий агент. Примеры иммуномодулирующего агента включают, но не ограничиваются ими, ганцикловир, этанерцепт, такролимус, сиролимус, воклоспорин, циклоспорин, рапамицин, циклофосфамид, азатиоприн, микофенолгат мофетил, метотрексат, глюкокортикоид и его аналоги, цитокины, ксантины, факторы роста стволовых клеток, лимфотоксины, фактор некроза опухолей (TNF), гематопоэтические факторы, интерлейкины (например, интерлейкин-1 (IL-1), IL-2, IL-3, IL-6, IL-10, IL-12, IL-18 и IL-21), колониестимулирующие факторы (например, гранулоцит-колониестимулирующий фактор (G-CSF) и гранулоцитарный макрофаг-колониестимулирующий фактор (GM-CSF)), интерфероны (например, интерфероны-α, -β и -γ), фактор роста стволовых клеток, обозначенный как «фактор S1», эритропоэтин и тромбопоэтин или их комбинацию.
Иммуномодулирующие агенты, используемые в изобретении, также включают антигормоны, которые блокируют действие гормонов на опухоли, и иммуносупрессивные агенты, которые подавляют продуцирование цитокинов, подавляют экспрессию собственных антигенов или имитируют антигены МНС. Типичные антигормоны включают антиэстрогены, включающие, например, тамоксифен, ралоксифен, ингибирующие ароматазу 4(5)-имидазолы, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY 117018, онапнстон и торемифен; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; и антиадреналиновые агенты. Типичные иммуносупрессивные агенты включают 2-амино-6-арил-5-замещенные пиримидины, азатиоприн, циклофосфамид, бромокриптин, даназол, дапсон, глутаральдегид, антиидиотипические антитела для антигенов МНС и фрагментов МНС, циклоспорин А, стероиды, такие как глюкокортикостероиды, антагонисты цитокинов или цитокиновых рецепторов (например, антитела против интерферона, антитела против IL10, антитела против TNFα, антитела против IL2), стрептокиназа, TGFβ, рапамицин, Т-клеточный рецептор, фрагменты Т-клеточных рецепторов и антитела к Т-клеточным рецепторам.
В некоторых аспектах изобретения лекарственное средство представляет собой терапевтический белок, включающий, но не ограничиваясь этим, токсин, гормон, фермент и фактор роста.
Примеры токсинового белка (или полипептида) включают, но не ограничиваются ими, дифтерийный токсин (например, дифтерийную А-цепь), Pseudomonas экзотоксин и эндотоксин, рицин (например, А-цепь рицина), абрин (например, А-цепь абрина), модессин (например, А-цепь модессина), альфа-сарцин, белки Aleurites fordii, белки диантина, рибонуклеаза (РНКаза), ДНКаза I, стафилококковый энтеротоксин-A, антивирусный белок Pokeweed, гелонин, токсин дифтерина, белки Phytolaca americana (PAPI, PAPII, PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, митогеллин, рестриктоцин, феномицин, эномицин, трихотецены, пептиды ингибитора цистинового узла (ICK) (например, цератотоксины) и конотоксин (например, KIIIA или SmIII).
Примеры гормонов включают, но не ограничиваются ими, эстрогены, андрогены, прогестины и кортикостероиды.
В некоторых аспектах изобретения лекарственное средство представляет собой олигонуклеотиды, такие как антисмысловые олигонуклеотиды.
Дополнительные лекарственные средства, используемые в изобретении, включают антиангиогенные агенты, которые ингибируют образование кровеносных сосудов, например, ингибиторы фарнезилтрансферазы, ингибиторы COX-2, ингибиторы VEGF, ингибиторы bFGF, ингибиторы стероидной сульфатазы (например, 2-метоксиэстрадиол бис-сульфамат (2-MeOE2bisMATE)), интерлейкины-24, тромбоспондин, металлоспондиновые белки, интерфероны класса I, интерлейкин 12, протамин, ангиостатин, ламинин, эндостатин и фрагменты пролактина.
Антипролиферативные агенты и проапоптотические агенты включают активаторы PPAR-гамма (например, циклопентеноновые простагландины (cyPG)), ретиноиды, тритерпиноиды (например, циклоартан, лупан, урсан, олеанан, фриделан, даммаран, кукурбитацин, и лимоноидные тритерпеноиды), ингибиторы рецептора EGF (например, HER4), рампамицин, кальцитриол® (1,25-дигидроксихолекальциферол (витамин D)), ингибиторы ароматазы (FEMARA® (летрозон)), ингибиторы теломеразы, хелаторы железа (например, 3-аминопиридин-2- карбоксальдегид, тиосемикарбазон (триапин), апоптин (вирусный белок 3 - VP3 из куриного вируса анемии), ингибиторы Bcl-2 и Bcl-X (L), TNF-альфа, лиганд FAS, TNF-связанный индуцирующий апоптоз лиганд (TRAIL/Apo2L), активаторы передачи сигналов TNF-альфа/FAS-лиганд/TNF-связанный индуцирующий апоптоз лиганд (TRAIL/Apo2L) и ингибиторы передачи сигналов пути выживания PI3K-Akt (например, UCN-01 и гелданамицин).
Типичные химиотерапевтические агенты включают алкилирующие агенты, такие как тиотепа и циклосфосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиидины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; азотистый иприт, такой как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембицин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномизины, актиномицин, аутрамицин, азазерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, келамицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-EU; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антиадреналиновые средства, такие как аминоглютетимид, митотан, трилостан; пополнитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновая кислота; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфомитин; ацетат эллиптиния; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновая кислота; 2-этилгидразид; прокарбазин; разоксан; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2'-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (Ara-C); циклофосфамид; тиотепа; таксоиды, например паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology of Princeton, NJ) и доксетаксел (TAXOTERE®, Rhone-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДМФО); ретиноевая кислота; эсперамицины; и капецитабин.
Дополнительные терапевтические агенты, которые могут быть использованы в соответствии с настоящим изобретением, включают фотосенсибилизирующие агенты, такие как в публикации США № 20020197262 и патенте США № 5952329, которые включены сюда посредством ссылки в полном объеме для фотодинамической терапии; магнитные частицы для термотерапии, такие как в публикации США № 20030032995, которая включена в настоящее описание посредством ссылки в полном объеме; связывающие агенты, такие как пептиды, лиганды, лиганды клеточной адгезии и т. д., и пролекарственные средства, такие как фосфатсодержащие пролекарственные средства, тиофосфатсодержащие пролекарственные средства, сульфатсодержащие пролекарственные средства, пептидсодержащие пролекарственные средства, β-лактамсодержащие пролекарственные средства, замещенные феноксиацетамидсодержащие пролекарственные средства или замещенные фенилацетамидсодержащие пролекарственные средства, 5-фторцитозин и другие 5-фторуридиновые пролекарственные средства, которые могут быть превращены в более активный цитотоксическое свободное лекарственное средство.
Для диагностических методов, использующих антитела против EDB, лекарственное средство может включать детектируемую метку, используемую для детектирования присутствия EDB+ FN-экспрессирующих ECM или клеток in vitro или in vivo. Радиоизотопы, которые можно детектировать in vivo, такие как метки, которые можно детектировать с помощью сцинтиграфии, магнитно-резонансной томографии или ультразвука, можно использовать в клинических диагностических применениях. Полезные сцинтиграфические метки включают позитронные излучатели и γ-излучатели. Типичными контрастными агентами для визуализации магнитных источников являются парамагнитные или суперпарамагнитные ионы (например, железо, медь, марганец, хром, эрбий, европий, диспрозий, гольмий и гадолиний), частицы оксида железа и водорастворимые контрастные агенты. Для ультразвукового детектирования газы или жидкости могут быть захвачены пористыми неорганическими частицами, которые высвобождаются в качестве контрастных агентов в виде микропузырьков. Для детектирования in vitro приемлемые детектируемые метки включают флуорофоры, детектируемые эпитопы или связывающие агенты и радиоактивные метки.
Таким образом, в некоторых аспектах изобретения лекарственное средство представляет собой визуализирующий агент (например, метку флуорофора или ПЭТ (позитронно-эмиссионная томография), метку ОЭКТ (однофотонная эмиссионная компьютерная томография)) или метку МРТ (магнитно-резонансная томография).
Термин «метка» при использовании в настоящем описании относится к детектируемому соединению или композиции, которые прямо или косвенно конъюгированы с антителом с получением «меченого» антитела. Метка может быть детектируемой сама по себе (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментативной метки, может катализировать химическое изменение соединения или композиции субстрата, которое можно обнаружить. Радионуклиды, которые могут служить в качестве детектируемых меток, включают, например, I-131, I-123, I-125, Y-90, Re-188, Re-186, At-211, Cu-67, Bi-212 и Pd-109. Метка также может быть не детектируемой сущностью, такой как токсин.
Примеры флуорофоров включают, но не ограничиваются ими, изотиоцианат флуоресцеина (FITC) (например, 5-FITC), амидит флуоресцеина (FAM) (например, 5-FAM), эозин, карбоксифлуоресцеин, эритрозин, Alexa Fluor® (например, Alexa 350, 405, 430, 488, 500, 514, 532, 546, 555, 568, 594, 610, 633, 647, 660, 680, 700 или 750), карбокситетраметилродамин (TAMRA) (например, 5,-TAMRA) тетраметилродамин (TMR) и сульфородамин (SR) (например, SR101).
Терапевтические или диагностические радиоизотопы или другие метки (например, метки ПЭТ или ОЭКТ) могут быть включены в агент для конъюгации с антителами против EDB, как описано в настоящем документе. Изотоп может быть непосредственно связан с антителом, например, в остатке цистеина, присутствующем в антителе, или может использоваться хелатор для обеспечения связывания антитела и радиоизотопа. Радиоизотопы, подходящие для лучевой терапии, включают, но не ограничиваются ими, α-излучатели, β-излучатели и электроны Оже. Для диагностических применений приемлемые радиоизотопы включают позитронные излучатели и γ-излучатели. Антитело против EDB по изобретению может быть дополнительно йодировано, например, на остатке тирозина антитела, чтобы облегчить детектирование или терапевтический эффект антитела.
Примеры радиоизотопов или других меток включают, но не ограничиваются ими,3H,11C,13N,14C,15N,15O,35S,18F,32P,33P,47Sc,51Cr,57Co,58Co,59Fe,62Cu,64Cu,67Cu,67Ga,68Ga,75Se,76Br,77Br,86Y,89Zr,90Y,94Tc,95Ru,97Ru,99Tc,103Ru,105Rh,105Ru,107Hg,109Pd,111Ag,111In,113In,121Te,122Te,123I,124I,125I,125Te,126I,131I,131In,133I,142Pr,143Pr,153Pb,153Sm,161Tb,165Tm,166Dy,166H,167Tm,168Tm,169Yb,177Lu,186Re,188Re,189Re,197Pt,198Au,199Au,201Tl,203Hg,211At,212Bi,212Pb,213Bi,223Ra,224Ac, и225Ac.
Линкеры
EDC ADC по настоящему изобретению могут быть получены с использованием линкера для прямой или косвенной связи или конъюгации лекарственного средства с антителом. Линкер представляет собой бифункциональное соединение, которое связывает лекарственное средство и антитело с образованием ADC. Такие ADC обеспечивают селективную доставку лекарственных средств через антитела, которые связываются со специфическими антигенами или белками. Подходящие линкеры включают, например, расщепляемые и не расщепляемые линкеры. Расщепляемый линкер обычно чувствителен к расщеплению и высвобождению лекарственного средства при определенных внутриклеточных и внеклеточных состояниях. Основные механизмы, с помощью которых конъюгированное лекарственное средство может быть отщеплено от антитела внутриклеточно, включают гидролиз в кислом рН лизосом (гидразоны, ацетали и цис-аконитат-подобные амиды), расщепление пептидов лизосомными ферментами (катепсинами и другими лизосомными ферментами) и восстановление дисульфидов. Конъюгированное лекарственное средство может быть отщеплено от антитела внеклеточно с помощью протеаз в микроокружении опухоли (TME), таких как катепсины. В результате этих различных механизмов расщепления механизмы связывания лекарственного средства с антителом также широко варьируются, и можно использовать любой подходящий линкер.
Подходящие линкеры могут включать любой расщепляемый линкер. В некоторых аспектах подходящие линкеры включают линкер валин-цитруллин (val-cit), линкер фенилаланин-лизин (phe-lys) или линкер малеимидокапроил-валин-цитруллин-p-аминобензилоксикарбонил (vc) или содержат присоединенный дипептид к дополнительным иммобилизующим элементам, таким как N~2~-ацетил-L-лизил-L-валил-L-цитрулин-п-аминобензилоксикарбонил-N, N'-диметиламиноэтил-CO-(AcLys-vc) линкер, подходящий для технологии конъюгации на основе трансглутаминазы. В другом аспекте подходящие линкеры включают дисульфидные линкеры, такие как сульфанилпиридин (диS) линкер и 2-(пиридин-2-илдисульфанил) этилкарбамоил (диS-C2OCO) линкер. В другом аспекте линкер может представлять собой нерасщепляемый линкер, такой как малеимидокапроил (mc), малеимидо-гептаноил (me) и малеимидо-Peg6C2 (MalPeg6C2). В других аспектах подходящие линкеры включают линкеры, гидролизуемые при определенном рН или диапазоне рН, такие как линкер на основе гидразона.
Линкер может быть ковалентно связан с антителом через тиоэфирную связь, например, путем реакции малеимида или галоацетамида, присутствующего на линкере, с нативным или сконструированным остатком цистеина, присутствующим на антителе. В другом аспекте линкер может быть ковалентно связан с антителом посредством амидных связей с остатками лизина, присутствующими в антителе, например, путем реакции N-гидроксисукцинимид-активированной карбоновой кислоты, присутствующей на линкере, со свободным амином остатка лизина. В другом аспекте линкер может быть ковалентно связан с антителом посредством амидных связей с боковыми цепями остатков глутамина, присутствующих или встроенных в антитело, например, посредством ферментативной реакции, катализируемой ферментом трансглутаминазы, который создает новую амидную связь из первичного амина, присутствующего на линкере, с амидом боковой цепи глутаминового остатка.
В некоторых аспектах линкеры по настоящему изобретению включают:
Линкер «mc-vc-PABC», «vc-PABC» или «vc», имеющий структуру:
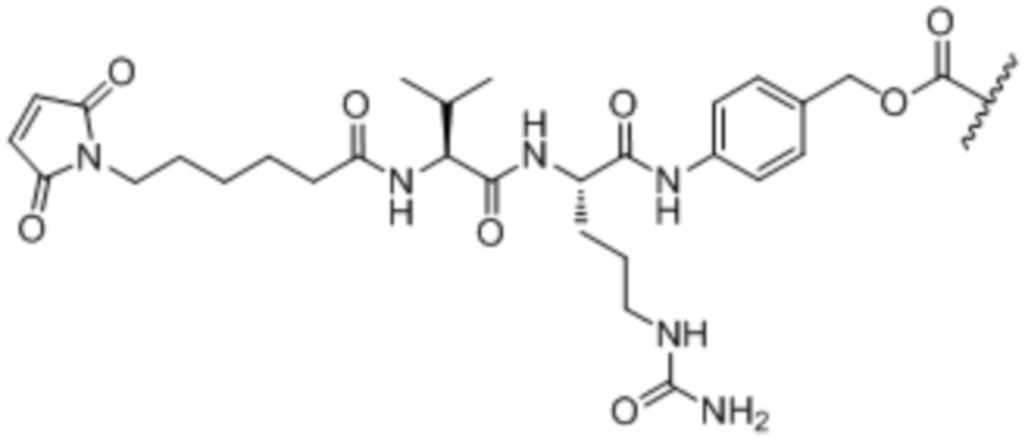
Линкер «AcLys-vc-PABC-DMAE-CO» или «AcLys-vc», имеющий структуру:

diS-линкер, имеющий структуру:
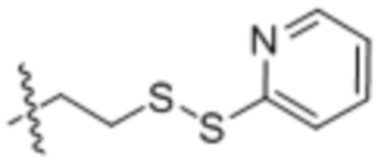
линкер diS-C2OCO, имеющий структуру:
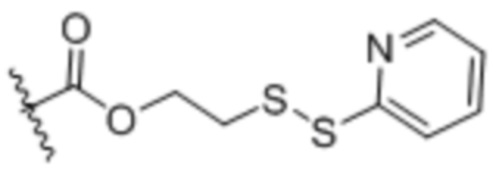
Методы получения EDB ADC
В настоящем документе представлены способы получения EDB ADC по настоящему изобретению. Настоящее изобретение дополнительно относится к способу получения или генерирования стандартных и сайт-специфически конъюгированных EDB ADC, как описано в настоящем документе, и может включать (а) связывание линкера с лекарственным средством; (b) конъюгацию фрагмента линкер-лекарственное средство с антителом; и (с) очистку конъюгата антитело-лекарственное средство. Смотрите Примеры 3 и 4.
В некоторых аспектах EDB ADC могут быть получены с использованием стандартной неспецифической конъюгации фрагментов линкер-полезная нагрузка через один или более остатков цистеина антитела против EDB или его антигенсвязывающего фрагмента.
В другом аспекте EDB ADC могут быть получены с использованием сайт-специфической конъюгации фрагментов линкер-полезная нагрузка, хотя один или более реакционноспособных остатков цистеина встроены в константный домен антитела против EDB. Способы получения антител для сайт-специфической конъюгации с помощью встроенных остатков цистеина описаны в международной публикации PCT № WO2013/093809, которая включена в настоящий документ посредством ссылки в полном объеме.
Один или более аминокислотных остатков тяжелой цепи антитела против EDB могут быть замещены другой аминокислотой, такой как остаток цистеина, с целью конъюгации с лекарственным средством или полезной нагрузкой. В одном аспекте изобретение относится к антителу против EDB или его антигенсвязывающему фрагменту, содержащему константную область тяжелой цепи антитела, содержащую встроенный остаток цистеина в положении: 118 (114 по Kabat), 246, 249, 265, 267, 270, 276, 278, 283, 290, 292, 293, 294, 300, 302, 303, 314, 315, 318, 320, 327, 332, 333, 334, 336, 345, 347, 354, 355, 358, 360, 362, 370, 373, 375, 376, 378, 380, 382, 386, 388, 390, 392, 393, 401, 404, 411, 413, 414, 416, 418, 419, 421, 428, 431, 432, 437, 438, 439, 443 или 444, или любую их комбинацию, в соответствии с нумерацией индекса EU по Kabat). В частности, можно использовать положения 118 (114 по Kabat), 290, 334, 347, 373, 375, 380, 388, 392, 421, 443 или любую их комбинацию. Могут быть введены дополнительные замены цистеина.
В другом аспекте изобретение относится к антителу против EDB или его антигенсвязывающему фрагменту, содержащему константный домен тяжелой цепи, содержащий встроенный остаток цистеина в положении 290 (K290C) в соответствии с нумерацией индекса EU по Kabat.
Один или более аминокислотных остатков константного домена легкой цепи антитела против EDB могут быть заменены другой аминокислотой, такой как остаток цистеина, для конъюгации с лекарственным средством или с полезной нагрузкой. В одном аспекте изобретение относится к антителу против EDB или его антигенсвязывающему фрагменту, содержащему константную область легкой цепи антитела, содержащую (i) встроенный остаток цистеина в положении 110, 111, 125, 149, 155, 158, 161, 183, 185, 188, 189, 191, 197, 205, 207, 208 или 210 или любую их комбинацию, согласно нумерации Kabat); (ii) встроенный остаток цистеина в положении, соответствующем остатку 4, 42, 81, 100, 103 или любую их комбинацию, SEQ ID NO: 37, когда константный домен выровнен с SEQ ID NO: 37 (легкая цепь каппа); или (iii) встроенный остаток цистеина в положении, соответствующем остатку 4, 5, 19, 43, 49, 52, 55, 78, 81, 82, 84, 90, 96, 97, 98, 99, 101 или любую их комбинацию, SEQ ID NO: 38, когда константный домен выровнен с SEQ ID NO: 38 (легкая цепь лямбда). Могут быть введены дополнительные замены цистеина.
В другом аспекте изобретение относится к антителу против EDB или его антигенсвязывающему фрагменту, содержащему константную область легкой цепи каппа антитела, содержащую (i) встроенный остаток цистеина в положении 111, 149, 188, 207, 210 или любую их комбинацию (предпочтительно 111 или 210), согласно нумерации Kabat; или (ii) встроенный остаток цистеина в положении, соответствующем остатку 4, 42, 81, 100, 103 или любую их комбинацию, SEQ ID NO: 37 (предпочтительно остаток 4 или 103), когда константный домен выровнен с SEQ ID NO: 37.
В другом аспекте изобретение относится к антителу против EDB или его антигенсвязывающему фрагменту, содержащему константную область легкой цепи лямбда антитела, содержащую (i) встроенный остаток цистеина в положении 110, 111, 125, 149, 155, 158, 161, 185 188, 189, 191, 197, 205, 206, 207, 208, 210 или любую их комбинацию (предпочтительно 110, 111, 125, 149 или 155) в соответствии с нумерацией Kabat; или (ii) встроенный остаток цистеина в положении, соответствующем остатку 4, 5, 19, 43, 49, 52, 55, 78, 81, 82, 84, 90, 96, 97, 98, 99, 101 или любую их комбинацию SEQ ID NO: 38 (предпочтительно остаток 4, 5, 19, 43 или 49), когда константный домен выровнен с SEQ ID NO: 38.
В другом аспекте изобретение относится к антителу против EDB или его антигенсвязывающему фрагменту, содержащему константный домен легкой цепи, содержащий (i) встроенный остаток цистеина в положении 183 (κK183C), согласно нумерации Kabat; или (ii) встроенный остаток цистеина в положении, соответствующем остатку 76 SEQ ID NO: 37, когда указанный константный домен выровнен с SEQ ID NO: 37.
SEQ ID NO: 37 (Cκ константный домен)
RTVAAPSVFI FPPSDEQLKS GTASVVCLLN NFYPREAKVQ WKVDNALQSG NSQESVTEQD SKDSTYSLSS TLTLSKADYE KHKVYACEVT HQGLSSPVTK SFNRGEC
SEQ ID NO 38 (Cλ константный домен)
GQPKANPTVT LFPPSSEELQ ANKATLVCLI SDFYPGAVTV AWKADGSPVK AGVETTKPSK QSNNKYAASS YLSLTPEQWK SHRSYSCQVT HEGSTVEKTV APTECS
В другом аспекте EDB ADC могут быть получены с использованием технологии сайт-специфической конъюгации, при этом один или более из встроенных глутаминсодержащих меток, являющихся ацильными донорами, или эндогенных остатков глутамина делают реакционноспособными в константной области антитела против EDB. Способы получения антител для сайт-специфической конъюгации через глутаминсодержащие метки, являющиеся ацильными донорами, или остатки глутамина описаны в международной публикации РСТ № WO 2012/059882, которая включена в настоящий документ посредством ссылки в полном объеме.
В некоторых аспектах глутаминсодержащая метка, являющаяся ацильным донором, содержит, по меньшей мере, один глутамин (Q) и может быть присоединена к другому положению тяжелой и/или легкой цепи (т.е. на N-конце, С-конце или внутри). В другом аспекте глутаминсодержащая метка, являющаяся ацильным донором, может содержать аминокислотную последовательность, выбранную из: LLQGG (SEQ ID NO: 39), LLQG (SEQ ID NO: 40), LSLSQG (SEQ ID NO: 41), GGGLLQGG (SEQ ID NO: 42), GLLQG (SEQ ID NO: 43), LLQ, GSPLAQSHGG (SEQ ID NO: 44), GLLQGGG (SEQ ID NO: 45), GLLQGG (SEQ ID NO: 46), GLLQ (SEQ ID NO: 47), LLQLLQGA (SEQ ID NO: 48), LLQGA (SEQ ID NO: 49), LLQYQGA (SEQ ID NO: 50), LLQGSG (SEQ ID NO: 51), LLQYQG (SEQ ID NO: 52), LLQLLQG (SEQ ID NO: 53), SLLQG (SEQ ID NO: 54), LLQLQ (SEQ ID NO: 55), LLQLLQ (SEQ ID NO: 56) и LLQGR (SEQ ID NO: 57). В некоторых аспектах глутаминсодержащая метка, являющаяся ацильным донором, заменяет положения аминокислот дикого типа в константном домене тяжелой цепи. В некоторых аспектах антитело против EDB может содержать ацилглутаминсодержащую метку, имеющую аминокислотную последовательность LLQG (SEQ ID NO: 40), которая заменяет аминокислоты в положениях E294-N297 (в соответствии с индексом EU по Kabat) тяжелой цепи.
Оптимальные условия реакции для генерации ADC могут быть определены эмпирически путем варьирования переменных параметров реакции, таких как температура, pH, входная составляющая линкера-полезной нагрузки и концентрация добавки. Условия, подходящие для конъюгации других лекарственных средств, могут быть определены специалистами в данной области без чрезмерных экспериментов. Типичные способы конъюгации и характеристики EDB ADC описаны в Примерах 3 и 4.
После конъюгации конъюгаты могут быть отделены, очищены от неконъюгированных реагентов и/или агрегированных форм конъюгатов и охарактеризованы общепринятыми способами. Это включает в себя такие процессы, как, но не ограничиваясь ими, масс-спектрометрию, эксклюзионную хроматографию (SEC), ультрафильтрацию/диафильтрацию, ионообменную хроматографию (IEC), хроматофокусирование (CF), сайт-направленный мутагенез, мечение с использованием флуоресценции, рентгеновскую кристаллографию, высокоэффективную жидкостную хроматографию (ВЭЖХ), быструю белковую жидкостную хроматографию (FPLC), хроматографию на сефакриле S-200 или хроматографию гидрофобного взаимодействия (HIC). Подходящие среды HIC включают, но не ограничиваются ими, хроматографическую среду с фенил-сефарозой 6 Fast Flow, хроматографическую среду с бутил-сефарозой 4 Fast Flow, хроматографическую среду с октил-сефарозой 4 Fast Flow, хроматографическую среду Toyopearl Ether-650M, среду Macro-Prep methyl HIC или среду Macro-Prep t-Butyl HIC.
В таблице 13 представлены EDB ADC, полученные в соответствии со способами конъюгации и очистки, описанными в настоящем документе, и использованные для получения данных, представленных в примерах.
В некоторых аспектах изобретения EDB ADC по настоящему изобретению содержат (a) антитело или его антигенсвязывающий фрагмент, который связывается с EDB; (b) линкер и (c) лекарственное средство.
В другом аспекте изобретения EDB ADC по настоящему изобретению содержат (a) антитело или его антигенсвязывающий фрагмент, который связывается с EDB; (b) линкер и (c) лекарственное средство, где линкер представляет собой расщепляемый или не расщепляемый линкер. В некоторых аспектах линкер представляет собой vc, diS, diS-C2OCO или AcLys-vc.
В другом аспекте изобретения EDB ADC по настоящему изобретению содержат (a) антитело или его антигенсвязывающий фрагмент, который связывается с EDB; (b) линкер и (c) лекарственное средство, где лекарственное средство представляет собой цитотоксический агент. В некоторых аспектах лекарственное средство представляет собой ауристатин. В некоторых аспектах лекарственное средство представляет собой димер CPI или CBI. В некоторых аспектах ауристатин представляет собой 0101, 1569, 9411 или 4574. В некоторых аспектах димер CPI представляет собой CPI-8314 или CPI-0326.
В некоторых аспектах изобретения EDB ADC по настоящему изобретению содержат (а) антитело или его антигенсвязывающий фрагмент, включающие: тяжелую цепь, содержащую SEQ ID NO: 8, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 8, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 17, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 17, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 19, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 19, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 23, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 23, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 25, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 25, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 27, и легкую цепь, содержащую SEQ ID NO: 15; тяжелую цепь, содержащую SEQ ID NO: 27, и легкую цепь, содержащую SEQ ID NO: 31; тяжелую цепь, содержащую SEQ ID NO: 29, и легкую цепь, содержащую SEQ ID NO: 15; или тяжелую цепь, содержащую SEQ ID NO: 29, и легкую цепь, содержащую SEQ ID NO: 31; (b) линкер и (c) лекарственное средство. В некоторых аспектах линкер представляет собой расщепляемый или нерасщепляемый линкер. В некоторых аспектах линкер представляет собой vc, diS, diS-C2OCO или AcLys-vc. В некоторых аспектах лекарственное средство представляет собой цитотоксический агент. В некоторых аспектах лекарственное средство представляет собой ауристатин. В некоторых аспектах лекарственное средство представляет собой димер CPI или CBI. В некоторых аспектах ауристатин представляет собой 0101, 1569, 9411 или 4574. В некоторых аспектах димер CPI представляет собой CPI-8314 или CPI-0326.
Применения EDB ADC
Антитела против EDB и EDB ADC по настоящему изобретению полезны в различных применениях, включая, но не ограничиваясь ими, методы терапевтического лечения и методы диагностического лечения.
Настоящее изобретение относится к способу лечения у пациента расстройств или заболеваний, при которых клетки экспессируют EDB+ FN, таких как не злокачественные или злокачественные новообразования, связанные с экспрессией EDB+ FN, и/или злокачественные новообразования, клетки которых экспрессируют EDB+ FN. Изобретение также относится к EDB ADC или к фармацевтической композиции, как описано в настоящем документе, для применения в способе лечения у пациента расстройства, при котором клетки экспрессирую EDB+ FN, такого как не злокачественное или злокачественное новообразование, связанные с экспрессией EDB+ FN, и/или злокачественные новообразования, клетки которых экспрессируют EDB+ FN. Изобретение, кроме того, относится к применению EDB ADC или фармацевтической композиции, как описано в настоящем документе, в производстве лекарственного средства для лечения у пациента расстройства, при котором клетки экспрессирую EDB+ FN, такого как не злокачественное или злокачественное новообразование, связанные с экспрессией EDB+ FN, и/или злокачественные новообразования, клетки которых экспрессируют EDB+ FN.
В некоторых аспектах изобретение относится к способу ингибирования роста или прогрессирования опухоли у пациента, у которого есть расстройство, при котором клетки экспрессируют EDB, такое как не злокачественное или злокачественное новообразование, связанные с экспрессией EDB+ FN, и/или злокачественные новообразования, клетки которых экспрессируют EDB, причем способ включает введение пациенту, нуждающемуся в этом, необходимого эффективного количества композиции (т.е. фармацевтической композиции), содержащей один или более EDB ADC, описанных в настоящем документе. В других аспектах изобретение относится к способу ингибирования у пациента метастазирования опухолевых клеток, связанных с экспрессией EDB+ FN и/или злокачественного новообразования, клетки которого экспрессируют EDB+ FN, причем способ включает введение пациенту, нуждающемуся в этом, эффективного количества композиции (т.е. фармацевтической композиции), содержащей один или более EDB ADC, описанных в настоящем документе. В других аспектах изобретения предложен способ индукции у пациента регрессии опухоли, связанной с экспрессией EDB+ FN и/или злокачественного новообразования, клетки которого экспрессируют EDB+ FN, причем способ включает введение пациенту, нуждающемуся в этом, эффективного количества композиции (т.е. фармацевтической композиции), содержащей один или более EDB ADC, описанных в настоящем документе.
В некоторых аспектах экспрессия EDB+ FN может быть обнаружена во внеклеточном матриксе (ECM), смежном с опухолевыми клетками. EDB+ FN может экспрессироваться клетками, отличными от фибробластов в микроокружении опухоли, включая опухолевые клетки. Секретируемый EDB+ FN затем может быть депонирован в матриксе, смежном с опухолевыми клетками или на плазматической мембране опухолевых клеток. В других аспектах изобретение относится к фармацевтической композиции, содержащей один или более EDB ADC, описанных в настоящем документе, для применения в способе, как описано выше. В других аспектах изобретение относится к применению одного или более EDB ADC, как описано в настоящем документе, или фармацевтической композиции, содержащей EDB ADC, как описано в настоящем документе, при изготовлении лекарственного средства для применения в способах, описанных выше.
Злокачественные новообразования, связанные с экспрессией EDB+ FN, и/или злокачественные новообразования, клетки которых экспрессируют EDB+ FN, обычно могут включать любое злокачественное новообразование, связанное с изменением ткани. Кроме того, злокачественные новообразования, связанные с экспрессией EDB+ FN и/или злокачественные новообразования, клетки которых экспрессируют EDB+ FN, могут включать, но не ограничиваются этим, солидные опухоли и гемобластоз. В некоторых аспектах солидные опухоли включают, но не ограничиваются этим, рак щитовидной железы, саркому, рак молочной железы, рак поджелудочной железы, глиобластому, рак желчного пузыря, рак почки, рак кожи, рак матки, мезотелиому, колоректальный рак, рак головы и шеи, рак яичников, рак мочевого пузыря, рак яичка, рак предстательной железы, рак печени, рак эндокринной системы, рак тимуса, рак головного мозга, рак надпочечников, рак глаз, рак шейки матки и рак легких. В другом аспекте гемобластоз включает, но не ограничивается этим, лейкоз, лимфому и миелому.
EDB ADC по настоящему изобретению полезны при лечении расстройств, при которых клетки экспрессируют EDB+ FN, таких как злокачественное новообразование, связанное с экспрессией EDB+ FN, и/или злокачественное новообразование, клетки которого экспрессируют EDB+ FN. EDB ADC по изобретению можно использовать для лечения злокачественных новообразований, клетки которых экспрессируют EDB+ FN на высоком уровне, на умеренном уровне или на низком уровне.
Таким образом, пациентов, которые подлежат лечению с использованием EDB ADC по изобретению, можно отбирать на основе экспрессии биомаркера, включая, но не ограничиваясь этим, мРНК (кПЦР) в объемных образцах опухоли и повышенную экспрессию белка EDB+ FN, что приводит к получению популяции пациентов, выбранных по обогащенной целевой экспрессии, а не на основе происхождения опухоли или гистологии. Целевая экспрессия может быть измерена как функция количества окрашивания клеток в сочетании с интенсивностью окрашивания клеток.
Опухолевый рост или аномальная пролиферация относится к любому из ряда показателей, которые предполагают изменение внутри клеток к более прогрессирующей форме злокачественного новообразования или состояния расстройства. Ингибирование роста опухолевых клеток или клеток неопухолевого пролиферативного расстройства можно анализировать способами, известными в данной области, такими как замедленный рост опухоли и ингибирование метастазирования. Другие показатели для измерения ингибирования опухолевого роста включают уменьшение выживаемости опухолевых клеток, уменьшение объема или морфологии опухоли (например, как определено с помощью компьютерной томографии (КТ), сонографии или другого метода визуализации), разрушение сосудистой системы опухоли, улучшение эффективности в кожной пробе с замедленной гиперчувствительностью, увеличение активности цитолитических Т-лимфоцитов и снижение уровня опухолеспецифических антигенов.
Целевые результаты раскрытых терапевтических методов, как правило, представляют собой количественные показатели по сравнению с контрольным или базовым измерением. Используемые в настоящем описании относительные термины, такие как «улучшать», «увеличивать» или «уменьшать», указывают значения, относящиеся к контрольной или сравнительной молекуле, как например, измерение у того же пациента до начала лечения, описанного в настоящем документе, или измерение у контрольного пациента (или у нескольких контрольных пациентов) в отсутствие лечения, описанного в настоящем документе. Репрезентативным контрольным пациентом является пациент, пораженный той же формой злокачественного новообразования, что и пациент, подвергаемый лечению, который примерно того же возраста, что и пациент, которого подвергают лечению (для обеспечения того, чтобы стадии расстройства у подвергаемого лечению пациента и контрольного пациента были сопоставимы.
Изменения или улучшения в ответ на терапию, как правило, статистически значимы. Используемый в настоящем описании термин «значимость» или «значимый» относится к статистическому анализу вероятности неслучайной связи между двумя или более объектами. Чтобы определить, является ли связь «значимой» или имеет «значимость», статистические манипуляции с данными могут представлять собой «р-значения». Те p-значения, которые попадают ниже определенной пользователем точки отсечения, считаются значимыми. р-значение, меньшее или равное 0,1, меньше 0,05, меньше 0,01, меньше 0,005 или меньше 0,001, может считаться значимым.
in vivo детектирование и диагностика
В другом аспекте предложен способ детектирования, диагностики и/или мониторинга расстройства, при котором клетки экспрессируют EDB+ FN, такого как злокачественное новообразование, связанное с экспрессией EDB+ FN, и/или злокачественное новообразование, клетки которого экспрессируют EDB+ FN. Например, антитела против EDB, как описано в настоящем документе, могут быть помечены детектируемым фрагментом, таким как визуализирующий агент и метка фермент-субстрат. Антитела, как описано в настоящем документе, также можно использовать для диагностических анализов in vivo, таких как визуализация in vivo (например, ПЭТ или ОФЭКТ), или окрашивающий реагент.
После введения EDB ADC пациенту, у которого лекарственное средство представляет собой детектируемую метку, и по истечении времени, достаточного для связывания, можно визуализировать биораспределение белка EDB+ FN, связанного с антителом. Раскрытые способы диагностики могут быть использованы в сочетании с методами лечения. Кроме того, EDB ADC по изобретению можно вводить с двойной целью детектирования и терапии.
Типичные неинвазивные методы детектирования включают сцинтиграфию (например, ОФЭКТ (однофотонная эмиссионная компьютерная томография), ПЭТ (позитронно-эмиссионная томография), изображение с помощью гамма-камеры и прямолинейное сканирование), магнитно-резонансная томография (например, обычная магнитно-резонансная томография, магнитно-резонансная томография) (МРТ), протонная магнитно-резонансная спектроскопия (MRS), диффузионно-взвешенная визуализация (DWI) и функциональная МРТ (fMRI)) и ультразвук.
Составы
Настоящее изобретение дополнительно относится к фармацевтическим композициям, включающим любой из EDB ADC, раскрытых в настоящем документе, и фармацевтически приемлемый носитель. Кроме того, композиции могут включать более чем один EDB ADC, раскрытый в настоящем документе.
Композиция, используемая в настоящем изобретении, может дополнительно включать фармацевтически приемлемые носители, вспомогательные вещества или стабилизаторы (Remington: The Science and Practice of Pharmacy 21st Ed., 2005, Lippincott Williams and Wilkins, Ed. KE Hoover), в форме лиофилизированных составов или водных растворов. Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиентов при дозировках и концентрациях и могут включать буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстраны; хелатообразующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG). Используемый в настоящем описании термин «фармацевтически приемлемая соль» относится к фармацевтически приемлемым органическим или неорганическим солям молекулы или макромолекулы. Фармацевтически приемлемые вспомогательные вещества дополнительно описаны в настоящем документе.
Для введения могут быть использованы различные составы EDB ADC, включая, но не ограничиваясь ими, составы, содержащие фармацевтически приемлемое вспомогательное вещество. Фармацевтически приемлемые вспомогательные вещества известны в данной области и являются относительно инертными веществами, которые облегчают введение фармакологически эффективного вещества. Например, вспомогательное вещество может придавать форму или консистенцию или действовать в качестве разбавителя. Подходящие вспомогательные вещества включают, но не ограничиваются ими, стабилизирующие агенты, смачивающие и эмульгирующие агенты, соли для различной осмолярности, инкапсулирующие агенты, буферы и усилители проникновения через кожу. Вспомогательные вещества, а также составы для парентеральной и непарентеральной доставки лекарств изложены в Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing, 2000.
В некоторых аспектах изобретения эти агенты могут быть приготовлены для введения путем инъекции (например, внутрибрюшинно, внутривенно, подкожно, внутримышечно и т. д.). Соответственно, эти агенты можно комбинировать с фармацевтически приемлемыми носителями, такими как физиологический раствор, раствор Рингера, раствор декстрозы и тому подобное. Конкретный режим дозирования, то есть доза, время и повторение, будет зависеть от конкретного пациента и его истории болезни.
Терапевтические составы EDB ADC, используемые в соответствии с настоящим изобретением, могут быть приготовлены для хранения путем смешивания антитела, имеющего желаемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, вспомогательными веществами или стабилизаторами (Remington, The Science and Practice of Pharmacy, 21st Ed., Mack Publishing., 2005), в форме лиофилизированных составов или водных растворов. Приемлемые носители, вспомогательные вещества или стабилизаторы являются нетоксичными для реципиентов при используемых дозировках и концентрациях и могут включать буферы, такие как фосфат, цитрат и другие органические кислоты; соли, такие как хлорид натрия; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид, бензетония хлорид; фенол, бутил или бензиловый спирт; алкилпарабены, такие как метил или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (ПЭГ).
Терапевтические композиции EDB ADC обычно помещают в контейнер со стерильным портом доступа, например, в пакет для внутривенного раствора или флакон с пробкой, прокалываемой иглой, для подкожных инъекций. Композиции по настоящему изобретению могут быть представлены в стандартных лекарственных формах, таких как таблетки, пилюли, капсулы, порошки, гранулы, растворы или суспензии или суппозитории, для перорального, парентерального или ректального введения или введения путем ингаляции или инсуффляции.
Подходящие поверхностно-активные агенты включают, в частности, неионные агенты, такие как полиоксиэтиленсорбитаны (например, Tween™ 20, 40, 60, 80 или 85) и другие сорбитаны (например, Span™ 20, 40, 60, 80 или 85). Композиции с поверхностно-активным агентом обычно включают от 0,05 до 5% поверхностно-активного агента и могут составлять от 0,1 до 2,5%. Понятно, что при необходимости могут быть добавлены другие ингредиенты, например, маннит или другие фармацевтически приемлемые носители.
Подходящие эмульсии могут быть приготовлены с использованием коммерчески доступных жировых эмульсий, таких как INTRALIPID™, LIPOSYN™, INFONUTROL™, LIPOFUNDIN™ и LIPIPHYSAN™. Активный ингредиент может быть либо растворен в предварительно смешанной эмульсионной композиции, либо, альтернативно, он может быть растворен в масле (например, соевом масле, сафлоровом масле, хлопковом масле, кунжутном масле, кукурузном масле или миндальном масле) и эмульсии, образованной после смешивания с фосфолипидами (например, яичные фосфолипиды, соевые фосфолипиды или соевый лецитин) и водой. Понятно, что могут быть добавлены другие ингредиенты, например глицерин или глюкоза, для регуляции тоничности эмульсии. Подходящие эмульсии обычно содержат до 20% масла, например, от 5 до 20%. Жировая эмульсия может включать жировые капли от 0,1 до 1 мкм, в частности от 0,1 до 0,5 мкм, и иметь рН в диапазоне от 5,5 до 8. Эмульсионные композиции могут быть такими, которые получены путем смешивания EDB ADC с INTRALIPID™ или его компонентами (соевое масло, яичные фосфолипиды, глицерин и вода).
Изобретение также относится к наборам для использования в способах по настоящему изобретению. Наборы по изобретению включают один или более контейнеров, включающих антитело к EDB или EDB ADC, как описано в настоящем документе, и инструкции по применению в соответствии с любым из способов по изобретению, описанных в настоящем документе. Как правило, эти инструкции включают описание введения антитела против EDB или EDB ADC для вышеописанных диагностических или терапевтических способов лечения.
Инструкции, относящиеся к использованию антитела против EBD или EDB ADC, как описано в настоящем документе, обычно включают информацию о дозировке, схеме дозирования и пути введения для назначенного лечения. Контейнеры могут быть в виде единичных доз, объемных упаковок (например, многодозовых упаковок) или в виде субъединичных доз. Инструкции, прилагаемые к наборам по изобретению, обычно представляют собой письменные инструкции на этикетке или вкладыше в упаковку (например, лист бумаги, включенный в комплект), но машиночитаемые инструкции (например, инструкции, хранящиеся на магнитном или оптическом диске для хранения) также приемлемы.
Наборы по настоящему изобретению представлены в подходящей упаковке. Подходящая упаковка включает, но не ограничивается этим, флаконы, бутылки, банки, гибкую упаковку (например, герметичные майларовые или пластиковые пакеты) и тому подобное. Также рассматриваются упаковки для использования в сочетании с конкретным устройством, таким как ингалятор, устройство для назального введения (например, распылитель) или инфузионное устройство, такое как минипомпа. Набор может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для внутривенного раствора или флакон с пробкой, прокалываемой иглой для подкожных инъекций). Контейнер также может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для внутривенного раствора или флакон с пробкой, прокалываемой иглой для подкожных инъекций). По меньшей мере один активный агент в композиции представляет собой антитело к EDB или EDB ADC. Контейнер может дополнительно включать второй фармацевтически активный агент.
Наборы могут дополнительно предоставлять дополнительные компоненты, такие как буферы и интерпретирующая информация. Как правило, в комплект входит контейнер и этикетка или вкладыш(и) упаковки на контейнере или связаны с ним.
Доза и введение
Настоящее изобретение относится к EDB ADC, вводимым в эффективной дозировке. Используемое в настоящем описании выражение «эффективная дозировка» или «эффективное количество» относятся к количеству ADC, лекарственного средства, полезной нагрузки, соединения или фармацевтической композиции, необходимому для достижения любого одного или более полезных или желательных терапевтических результатов. Для профилактического применения полезные или желаемые результаты включают устранение или уменьшение риска, уменьшение тяжести или отсрочку возникновения расстройства, включая биохимические, гистологические и/или характерные симптомы расстройства, его осложнения и промежуточные патологические фенотипы, проявляющиеся в процессе развития расстройства. Для терапевтического применения полезные или желаемые результаты включают клинические результаты, такие как снижение частоты или ослабления одного или более симптомов различных расстройств, при которых клетки экспрессируют EDB+ FN, таких как злокачественное новообразование, уменьшение дозы других лекарственных средств, необходимых для лечения расстройства, усиление эффекта другого лекарственного средства и/или задержка у пациентов прогрессирования расстройств, при которых клетки экспрессируют EDB+ FN.
Эффективная дозировка может быть введена за одно или более введений. Эффективная дозировка ADC, лекарственного средства, соединения или фармацевтической композиции может достигаться или не достигаться в сочетании с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, «эффективная дозировка» может рассматриваться в контексте введения одного или более терапевтических агентов, и можно считать, что один агент вводится в эффективном количестве, если в сочетании с одним или более другими агентами желаемый результат может иметь место или достигается.
Например, при введении пациенту, имеющему злокачественное новообразование, эффективное количество включает количество, достаточное для проявления противоопухолевой активности, включая цитолиз опухолевых клеток, ингибирование пролиферации опухолевых клеток, индукцию апоптоза опухолевых клеток, уменьшение антигенов опухолевых клеток, отсроченный рост опухоли и/или ингибирование метастазирования. Уменьшение размера опухоли является общепризнанным в качестве клинического суррогатного маркера эффективности. Другим хорошо известным маркером эффективности является выживаемость без прогрессирования заболевания.
EDB ADC по настоящему изобретению можно вводить пациенту любым подходящим путем. Специалистам в данной области должно быть понятно, что примеры, описанные в настоящем документе, предназначены не для ограничения, а для иллюстрации доступных методик. Соответственно, в некоторых аспектах изобретения EDB ADC вводят пациенту в соответствии с известными способами, такими как внутривенное введение, например, в виде болюса или путем непрерывной инфузии в течение периода времени, внутримышечно, внутрибрюшинно, интрацереброспинально, интракраниально, трансдермально, подкожно, интраартикулярно, подъязычно, интрасиновиально, через инсуффляцию, интратекально, перорально, ингаляционно или местно. Введение может быть системным, например, внутривенным или локальным. Коммерчески доступные небулайзеры для жидких составов, включая струйные небулайзеры и ультразвуковые небулайзеры, пригодны для введения. Жидкие составы можно распылять сразу, а лиофилизированный порошок можно распылять после восстановления. Альтернативно, EDB ADC может быть аэрозолизован с использованием фторуглеродного состава и ингалятора с отмеренной дозой или может вводиться ингаляцией в виде лиофилизированного и мелкодисперсного порошка.
В некоторых аспектах изобретения EDB ADC вводят с помощью методов сайт-специфической доставки или направленной локальной доставки. Примеры методов сайт-специфической доставки или направленной локальной доставки включают в себя различные имплантируемые депо-источники EDB ADC или катетеры локальной доставки, такие как инфузионные катетеры, постоянные катетеры или игольчатые катетеры, синтетические трансплантаты, адвентициальные оболочки, шунты и стенты или другие имплантируемые устройства, сайт-специфические носители, прямая инъекция или прямое нанесение.
Для цели настоящего изобретения соответствующая дозировка EDB ADC может зависеть от конкретного используемого EDB ADC (или его композиций), типа и серьезности симптомов, которые нужно лечить, от того, вводят ли агент в терапевтических целях, от предшествующей терапии, история болезни пациента и реакции на агент, частоты клиренса пациента для введенного агента и на усмотрение лечащего врача. Клиницист может назначать EDB ADC до тех пор, пока не будет достигнута дозировка, обеспечивающая достижение желаемого результата и лучше. Доза и/или частота могут варьироваться в течение курса лечения, но также могут оставаться постоянными. Эмпирические соображения, такие как период полужизни, как правило, будут способствовать определению дозировки. Например, антитела, которые совместимы с иммунной системой человека, такие как гуманизированные антитела или полностью человеческие антитела, могут быть использованы для продления периода полужизни антитела и предотвращения атаки иммунной системы хозяина на антитела. Частота введения может быть определена и скорректирована в течение курса терапии и, как правило, но не обязательно, основана на лечении и/или подавлении, и/или ослаблении, и/или задержке симптомов, например, ингибировании или задержке роста опухоли и т. д. Альтернативно, могут быть подходящими составы с продолжительным высвобождением EDB ADC. В данной области техники известны различные составы и устройства для достижения замедленного высвобождения.
Для цели настоящего изобретения типичная суточная доза может варьироваться примерно от 3 мкг/кг до 30 мкг/кг, до 300 мкг/кг, до 3 мг/кг, до 30 мг/кг, до 100 мг/кг или более, в зависимости от факторов, упомянутых выше. Например, можно использовать дозу примерно 1 мг/кг, примерно 2,5 мг/кг, примерно 5 мг/кг, примерно 10 мг/кг и примерно 25 мг/кг. Для повторных введений в течение нескольких дней или дольше, в зависимости от расстройства, лечение продолжают до тех пор, пока не произойдет желаемое подавление симптомов или пока не будут достигнуты достаточные терапевтические уровни, например, для ингибирования или задержки роста/прогрессирования опухоли или метастазирования опухолевых клеток. Примерные режимы дозирования могут включать введение увеличивающихся доз (например, начальная доза 1 мг/кг и постепенное увеличение до одной или нескольких более высоких доз каждую неделю или в течение более продолжительного периода времени). Другие режимы дозирования также могут быть полезны, в зависимости от характера фармакокинетического распада, которого желает достичь практикующий врач. Например, в некоторых аспектах изобретения предполагается дозирование от одного до четырех раз в неделю. В других аспектах предполагается дозирование один раз в месяц или один раз в два месяца или каждые три месяца, а также еженедельно, раз в две недели и каждые три недели. Прогресс этой терапии можно легко контролировать с помощью обычных методов и анализов. Режим дозирования (включая используемый EDB ADC) может меняться со временем.
В некоторых аспектах изобретения дозировки для EDB ADC могут быть определены эмпирически для пациентов, которым делали одно или более введений EDB ADC. Пациентам могут быть назначены дополнительные дозировки EDB ADC. Для оценки эффективности можно использовать показатель расстройства.
Введение EDB ADC в соответствии со способом по настоящему изобретению может быть непрерывным или дискретным, в зависимости, например, от физиологического расстройства реципиента, от того, является ли цель введения терапевтической или профилактической, и от других факторов, известных квалифицированным специалистам. Введение EDB ADC может быть, по существу, непрерывным в течение предварительно выбранного периода времени или может быть осуществлено с помощью серии разнесенных доз.
Комбинированные терапии
В некоторых аспектах изобретения способы, описанные в настоящем документе, дополнительно включают стадию лечения пациента с использованием дополнительной формы терапии. В некоторых аспектах дополнительная форма терапии представляет собой дополнительную противоопухолевую терапию, включая, но не ограничиваясь этим, применение в химиотерапии, лучевой терапии, хирургии, гормональной терапии и/или дополнительной иммунотерапии.
Раскрытые EDB ADC можно вводить в качестве начального лечения или для лечения злокачественных новообразований, которые не реагируют на обычные способы лечения. Кроме того, EDB ADC могут комбинироваться с другими видами терапии (например, хирургическим удалением, облучением, дополнительными противоопухолевыми лекарственными средствами и т. д.), вызывая тем самым аддитивные или потенцированные терапевтические эффекты и/или уменьшая цитотоксичность некоторых противоопухолевых агентов. EDB ADC по изобретению могут вводиться совместно или в одном составе с дополнительными агентами или могут быть приготовлены для последовательного введения с дополнительными агентами в любом порядке.
EDB ADC по изобретению можно использовать в комбинации с другими терапевтическими агентами, включая, но не ограничиваясь ими, терапевтические антитела, ADC, иммуномодулирующие агенты, цитотоксические агенты и цитостатические агенты. Репрезентативные агенты, полезные для комбинированной терапии, также включают в себя любые лекарственные средства, описанные выше, в качестве полезных для приготовления EDB ADC под подзаголовком «Лекарственные средства».
Терапевтические агенты включают, но не ограничиваются ими, введение химиотерапевтического агента, вакцины, терапии на основе клеток CAR-T, лучевую терапию, терапию цитокинами, вакцину, биспецифическое антитело, ADC, ингибитор других путей иммуносупрессии, ингибиторы ангиогенеза, активатор Т-клеток, ингибитор метаболического пути, ингибитор mTOR, ингибитор пути аденозина, ингибитор тирозинкиназы, включая, но не ограничиваясь этим, инлиту, ингибиторы ALK и сунитиниб, ингибитор BRAF, эпигенетический модификатор, ингибиторы или средства истощения клеток Treg и/или миелоидных клеток-супрессоров, ингибитор JAK, ингибитор STAT, ингибитор циклин-зависимой киназы, биотерапевтический агент (включая, но не ограничиваясь этим, антитела к VEGF, VEGFR, EGFR, Her2/neu, рецепторы других факторов роста, CD20, CD40, CD-40L, CTLA-4, OX-40, 4-1BB и ICOS), иммуногенный агент (например, аттенуированные опухолевые клетки, опухолевые антигены, антигенпрезентирующие клетки, такие как дендритные клетки, стимулированные с помощью полученного из опухоли антигена или нуклеиновых кислот, иммуностимулирующих цитокинов (например, IL-2, IFNa2, GM-CSF) и клетки, трансфецированные генами, кодирующими иммуностимулирующие цитокины, такие как GM-CSF, но не ограничиваясь ими).
Дополнительные репрезентативные антитела, которые можно использовать отдельно или в качестве ADC, включают, но не ограничиваются ими, антитела против 5T4 (например, A1, A2 и A3), антитела против CD19, антитела против CD20 (например, RITUXAN ®, ZEVALIN®, BEXXAR®), антитела против CD22, анти-антитела (например, MYLOTARG®), конъюгаты антитело против CD33-лекарственное средство, антитела против Льюис Y (например, Hu3S193, Mthu3S193, AGmthu3S193), антитела против HER-2 (например, HERCEPTIN® (трастузумаб), MDX-210, OMNITARG® (пертузумаб, rhuMAb 2C4)), антитела против CD52 (например, CAMPATH®), антитела против EGFR (например, ERBITUX® (цетуксимаб), ABX-EGF (панитумумаб)), антитела против VEGF (например, AVASTIN® (бевацизумаб)), антитела против ДНК/гистоновые комплексы (например, ch-TNT-1/b), антитела против СЕА (например, CEA -Cide, YMB-1003) hLM609, антитела против CD47 (например, 6H9), антитела против VEGFR2 (или против рецептора, содержащего киназный домен, KDR) (например, IMC-1C11), антитела против Ep-CAM (например, ING-1), антитела против FAP (например, сибротузумаб), антитела против DR4 (например, TRAIL-R), антитела против прогестеронового рецептора (например, 2C5), антитела против CA19.9 (например, GIVAREX®) и антитела против фибрина (например, MH-1).
Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и циклосфосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включающие алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (особенно криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CBI-TMI); элейтеробин; панкратистатин; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, особенно калихеамицин гаммал 1 и калихеамицин phiM, см., например, Agnew, Chem. Intl. Ed. Engl., 33: 183-186 (1994); динемицин, включая динемицин А; бисфосфонаты, такие, как клодронат; эсперамицин; а также неокарциностатиновый хромофор и родственные хромофоры в виде хромопротеиновых энедииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, каминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая морфолин-доксорубицин, цианоморфолин-доксорубицин, 2-пирролин-доксорубицин и дезоксидоксорубицин), пегилированный липосомный доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антиадреналиновые средства, такие как аминоглутетимид, митотан, трилостан; пополнитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамидный гликозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; эльформитин; ацетат эллиптиния; эпотилон; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновая кислота; 2-этилгидразид; прокарбазин; разоксан; ризоксин; сизофуран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2'-трихлортриэтиламин; трихотецены (особенно токсин Т-2, верракурин А, риридин А и ангидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); циклофосфамид; тиотепа; таксоиды, например паклитаксел и доксетаксел; хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; платиновые аналоги, такие как цисплатин и карбоплатин; винбластин; винорелбин; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДМФО); ретиноиды, такие как ретиноевая кислота; капецитабин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленного.
Также включены антигормональные агенты, которые действуют для регуляции или ингибирования действия гормонов на опухоли, такие как антиэстрогены и селективные модуляторы рецепторов эстрогена (SERM), включая, например, тамоксифен, ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY1 17018, онапристон и торемифен (Fareston); ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует выработку эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола, экземестан, форместан, фадрозол, ворозол, летрозол и анастрозол; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленного.
В некоторых аспектах EDB ADC могут быть использованы в комбинации с кризотинибом, пальбоциклибом, гемцитабином, циклофосфамидом, фторурацилом, FOLFOX, фолиевой кислотой, оксалиплатином, акситинибом, сунитинибом малатом, тофацитинибом, бевацизумабом, ритуксимабом и трастузумабом.
В одном аспекте, после лечения EDB ADC может наблюдаться увеличение инфильтрирующих опухоль лимфоцитов, увеличение соотношений CD8/CD4, увеличение макрофагов F4/80+и/или увеличение иммуномодулирующих белков, таких как PDL1 и 41BB, или любая их комбинация. Таким образом, может быть эффективной комбинация EDB ADC и ингибитора иммунной контрольной точки или агента IO, такого как антагонистическое моноклональное антитело против 41BB и/или против PDL1. (См. Пример 12). Кроме того, EDB ADC по настоящему изобретению могут иметь механизмы иммуномодулирующего и иммуно-онкологического (IO) действия, которые могут усиливаться при комбинированной терапии.
В некоторых аспектах EDB ADC можно использовать в комбинации с одним или более другими терапевтическими агентами, нацеленными на модулятор иммунной контрольной точки, включая, но не ограничиваясь этим, агент (такой как антитело), нацеленный на PD-1, PD-L1, CTLA- 4, LAG-3, B7-H3, B7-H4, B7-DC (PD-L2), B7-H5, B7-H6, B7-H8, B7-H2, B7-1, B7-2, ICOS, ICOS -L, TIGIT, CD2, CD47, CD80, CD86, CD48, CD58, CD226, CD155, CD1 12, LAIR1, 2B4, BTLA, CD160, TIM1, TIM-3, TIM4, VISTA (PD-H1), OX40, OX40L, GITR, GITRL, CD70, CD27, 4-1BB, 4-BBL, DR3, TL1A, CD40, CD40L, CD30, CD30L, LIGHT, HVEM, SLAM (SLAMF1, CD150), SLAMF2 (CD48), SLAMF3 (CD229), SLAMF4 (2B4, CD244), SLAMF5 (CD84), SLAMF6 (NTB-A), SLAMCF7 (CS1), SLAMF8 (BLAME), SLAMF9 (CD2F), CD28, CEACAM1 (CD66a), CEACAM3, CEACAM4, CEACAM5, CEACAM6, CEAMAM6,, CEACAM8, CEACAM1-3AS, CEACAM3C2, CEACAM1-15, PSG1-11, CEACAM1-4C1, CEACAM1-4S, CEACAM1-4L, IDO, TDO, CCR2, CD39-CD73-аденозиновый путь (A2AR), BTKs, TIKs, CXCR, CCR4, CCR8, CCR5, путь VEGF, CSF-1 или модулятор врожденного иммунного ответа.
Для комбинированной терапии EDB ADC и/или один или более дополнительных терапевтических агентов вводят в течение любого периода времени, подходящего для выполнения предполагаемой терапии. Таким образом, отдельные агенты могут вводиться по существу одновременно (то есть в виде одной композиции или в течение минут или часов друг относительно друга) или последовательно в любом порядке. Например, лечение одним агентом может проводиться в течение примерно 1 года относительно друг друга, например, в течение примерно 10, 8, 6, 4 или 2 месяцев или в течение 4, 3, 2 или 1 недели или в течение примерно 5, 4, 3, 2 или 1 дней относительно друга друга.
Раскрытые комбинированные терапии могут вызывать синергетический терапевтический эффект, то есть эффект, превышающий сумму их индивидуальных эффектов или терапевтических результатов. Например, синергетический терапевтический эффект может быть эффектом, по меньшей мере, приблизительно в два раза превышающим терапевтический эффект, вызванный одним агентом, или суммой терапевтических эффектов, вызванных отдельными агентами данной комбинации, или, по меньшей мере, приблизительно в пять раз больше, или, по меньшей мере, примерно в десять раз больше, или, по меньшей мере, примерно в двадцать раз больше, или, по меньшей мере, примерно в пятьдесят раз больше, или, по меньшей мере, примерно в сто раз больше. Синергетический терапевтический эффект также может наблюдаться как увеличение терапевтического эффекта по меньшей мере на 10% по сравнению с терапевтическим эффектом, вызванным одним агентом, или суммой терапевтических эффектов, вызванных отдельными агентами данной комбинации, или, по меньшей мере, на 20%, или, по меньшей мере, на 30%, или, по меньшей мере, на 40%, или, по меньшей мере, на 50%, или, по меньшей мере, на 60%, или, по меньшей мере, на 70%, или, по меньшей мере, на 80%, или, по меньшей мере, на 90%, или, по меньшей мере, на 100%, или больше. Синергетический эффект также является эффектом, который позволяет уменьшить дозировку терапевтических агентов, когда они используются в комбинации.
ПРИМЕРЫ
Следующие примеры конкретных аспектов для осуществления настоящего изобретения предлагаются только для иллюстративных целей и не предназначены для какого-либо ограничения объема настоящего изобретения. Действительно, различные модификации изобретения в дополнение к тем, которые показаны и описаны в настоящем документе, станут очевидными для специалистов в данной области техники из предшествующего описания и попадут в объем прилагаемой формулы изобретения.
ПРИМЕР 1
Получение антител против EDB и приготовление для конъюгации
Получение антител против EDB
кДНК, кодирующая различные полностью человеческие антитела, которые связываются с EDB, была сконструирована с использованием стандартной методологии молекулярной биологии и получена из человеческого моноклонального антитела L19, которое специфически связывается с EDB (в настоящем документе как антитела «против EDB-L19» или «EDB-L19»). Антитело к EDB-L19 содержит константную область человеческого IgG1 с аллотипом G1m(a), содержащую аспарагиновую кислоту (D) в положении 356 и лейцин (L) в положении 358 (в соответствии с индексом EU по Kabat) и константную область легкой цепи каппа человека. Вариабельные области тяжелой и легкой цепи антитела EDB-L19 представлены в SEQ ID NO 1 и 10, соответственно, а тяжелая и легкая цепи представлены в SEQ ID NO 8 и 15, соответственно.
Для получения неиммуногенного антитела, аллотип, отличный от G1m(a), имеющий глутаминовую кислоту (E) в положении 356 и метионин (M) в положении 358 (в соответствии с индексом EU Kabat), вводили в тяжелую цепь EDB-L19. Для генерации тяжелой цепи нуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи EDB-L19, сливали с кДНК константной области человеческого IgG1 аллотипа Glmz, не-(a), не-(x). В некоторых аспектах антитела дополнительно изменяли для уменьшения заряженного варианта антитела и повышения гомогенности путем удаления C-концевого лизина (K) константной области IgG1 антитела EDB-L19, генерируя EDB-PFE HC (SEQ ID NO: 17). Тяжелые и легкие цепи антитела EDB-PFE представлены в SEQ ID NO. 17 и 15, соответственно.
Как показано в Таблице 4, капиллярный электрофорез с визуализацией (iCE) осуществляли с использованием iCE3 с автоматическим дозатором Prince для определения процента заряженных вариантов для препаратов антител. Антитело EDB-L19 имело существенное увеличение основных вариантов и уменьшение основного пика антитела в результате неполного процессирования С-концевого лизина во время культивирования клеток по сравнению с антителом EDB-PFE.
Таблица 4: Процент (%) заряженных вариантов для антител против EDB.
Антитела для сайт-специфической конъюгации с помощью сконструированных остатков цистеина
Способы получения антител против EDB для сайт-специфической конъюгации с различными линкерами-полезными нагрузками через реакционноспособные встроенные остатки цистеина, как правило, выполняли, как описано в международной публикации PCT № WO2013/093809, которая включена в настоящее описание посредством ссылки в полном объеме. Один или более остатков либо на тяжелой цепи, как например положение K290 (в соответствии с индексом EU по Kabat), либо на легкой цепи, как например, K183 (согласно Kabat), были заменены на остаток цистеина (C) с помощью сайт-направленного мутагенеза.
В некоторых аспектах положение K290 (в соответствии с индексом EU по Kabat) в константной области тяжелой цепи человеческого IgG1 антитела EDB-PFE было заменено реакционноспособным цистеином (C) для обеспечения возможности сайт-специфической конъюгации, генерирующей EDB-(K290C) HC (SEQ ID NO: 19). В других аспектах остаток K183 (в соответствии с Kabat) в константной области легкой цепи каппа человека был заменен реакционноспособным цистеином (C), чтобы обеспечить возможность сайт-специфической конъюгации, генерирующей EDB-(κK183C) LC (SEQ ID NO: 31).
Антитела для сайт-специфической конъюгации с помощью встроенных остатков глутамина
Антитела против EDB экспрессировали с использованием подтипов человеческого IgG1, с встроенными активными остатками глутамина, такими как глутаминсодержащие (Q) метки, в различных положениях аминокислот для конъюгации с различными линкерами-полезными нагрузками. Способы получения антител против EDB для сайт-специфической конъюгации через реакционноспособные остатки глутамина обычно выполняли, как описано в международной публикации РСТ WO2012/059882, которая включена в настоящий документ посредством ссылки в полном объеме.
В некоторых аспектах H16-глутаминовая метка LLQG (SEQ ID NO: 40) была встроена в области человеческого IgG1-Fc антитела EDB-PFE для обеспечения опосредованной DAR2 трансглутаминазой сайт-специфическую конъюгацию. Например, в тяжелой цепи антитела против EDB-PFE аминокислоты в положениях E294-N297 (в соответствии с индексом EU по Kabat) были заменены H16-глутаминсодержащей меткой LLQG (SEQ ID NO: 40). В других аспектах антитела были дополнительно изменены для увеличения специфичности конъюгации с встроенной меткой, содержащей H16-глутамин. Аминокислота лизин (K) в положении 222 (в соответствии с индексом EU по Kabat) на тяжелой цепи была заменена аргинином (R), генерируюя EDB-(H16-K222R) HC (SEQ ID NO. 27). Замена K222R обеспечивала увеличение гомогенных ADC, улучшение межмолекулярной сшивки между антителом и линкером-полезной нагрузкой и/или значительное уменьшение межцепочечной сшивки с H16-глутаминсодержащей меткой на С-конце легкой цепи антитела.
Потенциальные химические особенности
Потенциальные химические особенности, особенно в CDR, могут влиять на молекулярную гетерогенность и приводить к связыванию антигена с предполагаемыми сайтами гликирования белка. Белковое гликирование представляет собой неферментативное гликозилирование, которое может происходить в рекомбинантных антителах во время культивирования клеток, и гликированные белки могут подвергаться дальнейшим реакциям с образованием плохо охарактеризованных гетерогенных продуктов, которые в совокупности называют конечными продуктами продвинутого гликирования. Чтобы уменьшить потенциальную способность к гликированию, положение K94 (нумерация Kabat) рядом с CDR3 в вариабельной области тяжелой цепи EDB-L19 было подвергнуто мутации до аргинина (R) для генерации VH EDB- (K94R) (SEQ ID NO: 21) и было затем слито с константной областью человеческого IgG1 с получением EDB-(K94R) HC (SEQ ID NO: 23). Мутацию гликирования K94R также вводили в тяжелые цепи EDB-(K290C) и EDB-(H16-K222R), сконструированные для сайт-специфической конъюгацией для генерации EDB-(K94R-K290C) HC (SEQ ID NO: 25) и EDB-(K94R-H16-K222R) HC (SEQ ID NO: 29), соответственно.
ПРИМЕР 2
Характеристика свойств связывания варианта антитела EDB
Анализ аффинности связывания
Поверхностный плазмонный резонанс (SPR) использовали для характеристики кинетики связывания вариантов антител против EDB с рекомбинантным человеческим, яванской макаки и крысиным 7-EDB-89 (SEQ ID NO: 34, SEQ ID NO: 35 и SEQ ID NO: 36, соответственно) и для подтверждения того, что свойства связывания антител против EDB, имеющих мутацию гликирования K94R, были полностью сохранены. Связывание детектировали поверхностным SPR лазерного излучения, отраженного от поверхности. Анализ кинетики сигнала скорости ассоциации (ka) и диссоциации (kd) позволяет различать неспецифические и специфические взаимодействия.
Антитело против IgG человека (GE Healthcare) ковалентно связывалось путем конденсации аминогрупп на всех 4 проточных ячейках сенсорного чипа CM5 на основе карбоксиметилированного декстрана до плотности примерно 10000 резонансных единиц (RU) в соответствии с протоколом производителя, а затем каждый вариант антитела против EDB был захвачен до уровня примерно 60-90 RU. Используемый буфер для образца представлял собой буфер HBS-EP+ (0,01 М HEPES, 0,15 М NaCl, 3 мМ ЭДТА и 0,05% об./об. поверхностно-активного вещества P20 pH 7,4). Серии 3-кратного серийного разведения 7-EDB-89 с концентрацией в диапазоне от 600 нМ до 11,1 нМ вводили на поверхность со скоростью потока 50 мкл/мин в течение 60-секундной ассоциации и 120-секундной диссоциации. Затем поверхность регенерировали 30-секундным импульсом 3 М MgCl2, 30-секундным импульсом буфера ионной регенерации (0,46 М KSCN, 1,83 М MgCl2, 0,92 М мочевины и 1,83 М гуанидин-HCl pH 7,4) и затем уравновешивали с помощью 30-секундного импульса рабочим буфером HBS-EP+. Все анализы SPR выполняли при 25°C со скоростью сбора данных 1 Гц с использованием прибора BIAcore® T200 (GE Healthcare). Полученные сенсограммы имели двойной контроль (Myszka, DG, J. Mol. Recognit., 12: 279-284, 1999) с использованием как контрольной поверхности, так и буферных инъекций. Константы скорости определяли путем соответствия данных к модели Ленгмюра 1:1 с помощью аналитического программного обеспечения BIAcore® T200 v2.0 и уравнения KD=kd/ka. Каждый эксперимент проводили в двух экземплярах и определяли среднюю KD. Как показано в Таблице 5, антитела EDB-L19 и EDB-(K94R) демонстрируют сопоставимое связывание с человеческим 7-EDB-89. t1/2=период полужизнми, Rmax=максимальный отклик, RU=резонансные единицы.
Таблица 5. Свойства связывания антител EDB-L19 и EDB-(K94R).
Кроме того, определяли аффинность связывания антител EDB-L19 и EDB-(κK183C-K94R-K290C) с человеческим, яванской макаки и крысиным 7-EDB-89. Как показано в Таблице 6, аффинности связывания антител EDB-L19 и EDB-κK183C-K94R-K290C) были сходными. Как показано в Таблице 7, аффинность связывания антитела EDB-(κK183C-K94R-K290C) с человеческим, яванской макаки и крысиным 7-EDB-89 была сопоставимой, подтверждая, что реактивность между видами сохранялась после конструирования антитела EDB-L19 для возможности сайт-специфической конъюгации и удаления предполагаемого сайта гликирования.
Таблица 6. Свойства связывания антител 7-EDB-89 против EDB.
Таблица 7. Свойства связывания антитела EDB-(κK183C-K94R-K290C) с 7-EDB-89.
Конкурентное связывание методом ИФА
Свойства связывания антител EDB-(K94R) и EDB-(κK183C-K94R-K290C) дополнительно оценивали с использованием конкурентного ИФА с биотинилированным EDB-L19 для подтверждения того, что связывание с EDB полностью поддерживалось. Человеческий 7-EDB-89 (SEQ ID NO: 34) иммобилизовали (100 нг/лунку) на 96-луночном планшете для ИФА и добавляли 20 нг/мл биотинилированного антитела EDB-L19, чтобы конкурировать с различными концентрациями образцов модифицированного антитела против EDB, и связывание детектировали с использованием антитела против стрептавидина-HRP (Southern Biotech, Birmingham, AL).
Как показано на Фиг. 1А и в Таблице 8 антитела EDB-L19 и EDB-(K94R) имели сходные значения концентрации половины максимального ингибирования. На ФИГ 1В и в Таблице 9 показано, что антитела EDB- (K94R) и EDB-κK183C-K94R-K290C) также имели сходные значения концентрации половины максимального ингибирования. Это указывает на то, что модифицированные антитела EDB-(K94R) и EDB-(κK183C-K94R-K290C) сохраняли свойства связывания EDB и что (K94R) модификация тяжелой цепи и/или введение реакционноспособных встроенных цистеинов для сайт-специфической конъюгации не изменяло связывание к EDB.
Таблица 8. Конкуренция с bioEDB-L19 за связывание с человеческим 7-EDB-89.
Таблица 9. Конкуренция с bioEDB-L19 за связывание с человеческим 7-EDB-89.
Анализ авидности
Было определено, что аффинность связывания антитела EDB-L19 и EDB представляет собой слабое связывающее взаимодействие при ~230 нМ. Таким образом, SPR использовали для исследования того, влияет ли авидность на связывание с различными уровнями мишени в микроокружении опухоли. Различные плотности человеческого 7-EDB-89 (SEQ ID NO: 34) подвергали ковалентной аминоконденсации на отдельных проточных ячейках сенсорного чипа CM5 на основе карбоксиметилированного декстрана. Рабочий буфер и буфер для образцов были такими же, как описано выше для анализа аффинности связывания. Серии 3-кратных серийных разведений антитела EDB-L19 в диапазоне концентраций от 6 нМ до 0,074 нМ вводили при скорости потока 50 мкл/мин для 110-секундной ассоциации и 900-секундной диссоциации. Затем поверхность регенерировали двумя 30-секундными импульсами буфера для ионной регенерации (0,46 М KSCN, 1,83 М MgCl2, 0,92 М мочевины и 1,83 М гуанидин-HCl pH 7,4) и затем уравновешивали 30-секундным импульсом рабочим буфером HBS-EP+. Каждый эксперимент проводили в двух экземплярах и определяли средние значения ka, kd и KD.
Как показано в Таблице 10, результаты показали, что, когда уровень иммобилизованного человеческого 7-EDB-89 повышался, скорости диссоциации (kd) замедлялись, и последующие аффинности увеличивались. Кажущиеся значения KD были пропорциональны уровням иммобилизации человеческого 7-EDB-89 и подтверждали, что антитело EDB-L19 связывает EDB с большим компонентом авидности.
Таблица 10. Кажущиеся значения KD антитела EDB, связывающегося с EDB.
Полиреактивность антител против EDB
Полиреактивность ассоциируется с быстрым клиренсом in vivo (Hotzel et al. MAbs 4 (6): 753-760, 2012) и нежелательными межбелковыми взаимодействиями (Xu et al. Protein Eng Des Sel 26 (10): 663-670 (2013). Было показано, что ИФА прямого связывания ДНК и инсулина коррелируют с известной фармакокинетикой (ФК) клинически подтвержденных антител. Серийные разведения антител, начиная с 10 мкг/мл в четырехкратном повторении, оценивали в анализе низкой строгости на связывание либо с ДНК, либо с инсулином, который непосредственно наносили на планшет для ИФА.
Как показано в Таблице 11, антитела EDB-(K94R) и EDB-(κK183C-K94R-K290C) имеют очень низкие показатели полиреактивности, которые сопоставимы или лучше, чем у отрицательного контроля, который имеет оптимальные свойства ФК. Кроме того, показатели полиреактивности были значительно ниже, чем у положительного контрольного антитела, имеющего плохую ФК и приводящего к быстрому клиренсу.
Таблица 11. Показатели полиреактивности антител против EDB.
FcRn Хроматография
Хроматографию FcRn использовали для исследования опосредованного зарядом потенциального влияния введения реакционноспособных встроенных цистеинов в константную область IgG1 дикого типа на FcRn-зависимую фармакокинетику. Оценка антител с использованием методологии FcRn-колонки показала, что время элюирования демонстрировало положительную корреляцию с клиренсом у человека и низших приматов (Schoch A. et al. PNAS, 2015, Vol. 112). Аффинные FcRn-колонки получали в соответствии с Schlothauer et al., MAbs 5 (4): 576-586, 2013. Затем инъецировали 50 мкг антитела EDB-(κK183C-K94R-K290C) или (EDB-(κK183C-K94R-K290C)-vc-0101 ADC и затем элюировали в линейном градиенте pH (30 CV) от pH 5,5 до 8,8 в течение 60 минут, используя 20 мМ MES, 150 мМ NaCl, pH 5,5 и 20 мМ Трис, 150 мМ NaCl, pH 8,8, в качестве элюентов.
Как показано в Таблице 12, в FcRn-колонке относительное время элюирования EDB-(κK183C-K94R-K290C) антитела и EDB-(κK183C-K94R-K290C)-vc-0101 ADC было согласовано с приемлемыми параметрами ФК. Эти данные демонстрируют, что включение реакционноспособного встроенного остатка цистеина K290 в константную область IgG1 не влияет на связывание FcRn.
Таблица 12. Относительное время элюирования FcRn-колонки.
ПРИМЕР 3
Биоконъюгация EDB ADC
Антитела против EDB по настоящему изобретению были конъюгированы с лекарственными средствами/полезными нагрузками через линкеры для генерирования EDB ADC. Используемый метод конъюгации представлял собой либо стандартную конъюгацию (т.е. посредством случайных цистеиновых остатков), либо сайт-специфическую конъюгацию (т.е. посредством встроенных остатков цистеина или встроенных остатков глутамина). В Таблице 13 показаны методы конъюгации, используемые для различных EDB ADC.
Метод A: Стандартная конъюгация через остатки цистеина
Антитело против EDB в концентрации 27 мг/мл в PBS, pH 7,2 восстанавливали с использованием 2,3-2,6-кратного (по массе) TCEP при 37°C в течение 2 часов и затем конъюгировали. Молярное отношение обычно составляло 2,5, но его оптимизировали в зависимости от количества конъюгата антитела, необходимого для достижения оптимального конечного среднего значения DAR, равного приблизительно 4. Частично восстановленное антитело конъюгировали с 6-7-кратным (по массе) линкером-полезной нагрузкой в PBS с 10% DMA при 25°C в течение 1 часа. Избыток линкера-полезной нагрузки гасили L-цистеином при 25°С в течение 15 минут. Неочищенный ADC диализовали в течение ночи в PBS при 4-6°C.
Неочищенный ADC очищали с помощью эксклюзионной хроматографии (SEC) на Superdex 200 в PBS, и собранный пик мономера либо хранили при 4-6°C, либо диализовали в 20 мМ гистидине, 8,5% сахарозе, pH 5,8; стерильно фильтровали и замораживали при -70°С. Антитело отрицательного контроля huNeg-8.8 конъюгировали тем же способом.
Метод B: Сайт-специфическая конъюгация с помощью встроенных остатков цистеина
Два грамма антитела против EDB, генерированного с помощью реакционноспособных встроенных остатков цистеина, при 27,2 мг/мл в PBS, pH 7,2, восстанавливали с использованием 15-кратного (по массе) TCEP при 37°C в течение 7 часов и обессоливали на Sephadex® G-25 в PBS для удаления избытка TCEP. Межцепочечные цистеины окисляли с использованием 30-кратного DHA (по массе) при 4-6 °С в течение ночи. DHA удаляли обессоливанием на Sephadex® G-25 в PBS. Для ADC, имеющего более высокую степень покрытия глутатионом, вместо предпочтительного покрытия сайт-специфическим цистеином, для восстановления использовали 100-кратный TCEP (по массе).
Восстановленное и окисленное антитело конъюгировали с 9-кратным (по массе) линкером-полезной нагрузкой в PBS с 10% DMA при 25°C в течение 2 часов. Избыток линкера-полезной нагрузки гасили 9-кратным (по массе) L-цистеином при 25°С в течение 15 минут. Неочищенный ADC диализовали в течение ночи в PBS при 4-6°C.
Неочищенные ADC очищали с помощью SEC на Superdex 200 в PBS, и собранный пик мономера диализовали в 20 мМ гистидине, 8,5% сахарозе, рН 5,8; стерильно фильтровали и замораживали при -70°С. Антитело отрицательного контроля huNeg-8.8 конъюгировали тем же способом.
Метод С: сайт-специфическая конъюгация с помощью встроенных остатков глутамина
Антитело против EDB, генерированное с помощью реакционноспособных встроенных остатков глутамина, подвергали диализу в реакционном буфере; 100 мМ фосфат, 200 мМ NaCl, рН 7. 20 мг/мл антитела конъюгировали с линкером-полезной нагрузкой (10-кратной по массе) при комнатной температуре в течение 15 часов, используя 1 единицу коммерческой очищенной трансглутаминазы (TG) на 1 мг антитела, при перемешивании в 100 мМ фосфате калия, 200 мМ NaCl 10% DMSO. Неочищенные ADC центрифугировали, и супернатант очищали SEC.
Неочищенные ADC очищали с помощью SEC на Superdex 200 в PBS, собирали пик мономера и подвергали диализу в 20 мМ гистидина, 8,5% сахарозы, pH 5,8; стерильно фильтровали и замораживали при -70°С. Антитело отрицательного контроля huNeg-8.8 конъюгировали тем же способом.
Метод D: стандартная конъюгация через цистеиновые остатки с использованием дисульфидных линкеров
Антитело против EDB в концентрации 27 мг/мл в PBS, pH 7,2 частично восстанавливали с использованием 5-кратного (по массе) TCEP при 37°C в течение 2 часов и обессоливали с использованием Sephadex® G-25 SEC.
Частично восстановленное антитело конъюгировали с 12-15-кратным (по массе) восстановленным линкером-полезной нагрузкой в 67 мМ HEPES, pH 7,0 с 0,7 мМ DTPA и 7% DMA при 25°C в течение 15 минут. Избыток линкера-полезной нагрузки гасили 20-кратным NEM (по массе) при 25°C в течение 15 минут.
Неочищенный ADC очищали с помощью SEC на Superdex 200 в PBS с 50 мМ DHA и 50 мМ DTPA и собирали пик мономера, который хранили при 4-6°C. Отрицательный контроль конъюгировали тем же методом.
Таблица 13. Структуры различных EDB ADC (X представляет антитело).
ПРИМЕР 4
Характеристика EDB ADC
EDB ADC по настоящему изобретению были охарактеризованы с использованием комбинации эксклюзионной хроматографии (SEC), LC-MS и хроматографии гидрофобного взаимодействия (HIC). Среднее отношение лекарственное средство:антитело (DAR) определяли масс-спектрометрией (MS). В Таблице 14 приведены аналитические характеристики различных EDB ADC.
LC-MS: колонка=Waters BEH300-C4, 2,1×100 мм (P/N=186004496); Прибор=Acquity UPLC с детектором масс-спектрометрии SQD2; Скорость потока=0,7 мл/мин; Температура=80°С; Буфер А=вода+0,1% муравьиная кислота; Буфер B=ацетонитрил+0,1% муравьиная кислота. Градиент колеблется от 3% B до 95% B в течение 2 минут, сохраняется при 95% B в течение 0,75 мин, а затем повторно уравновешивается при 3% B. Образец восстанавливали с помощью TCEP или DTT непосредственно перед инъекцией. Элюат контролировали с помощью LCMS (400-2000 дальтон), и пик белка подвергали разворачиванию, используя MaxEnt1. DAR регистрировали как средневзвешенную загрузку, как было описано ранее.
SEC: колонка: Superdex200 (5/150 GL); Подвижная фаза: фосфатно-солевой буферный раствор, содержащий 2% ацетонитрила, рН 7,4; Скорость потока=0,25 мл/мин; Температура=температура окружающей среды; Прибор: ВЭЖХ Agilent 1100.
HIC: колонка: TSKGel Butyl NPR, 4,6 мм х 3,5 см (P/N=S0557-835); Буфер А=1,5 М сульфат аммония, содержащий 10 мМ фосфата, рН 7; Буфер B=10 мМ фосфат, pH 7+20% изопропиловый спирт; Скорость потока=0,8 мл/мин; Температура=температура окружающей среды; Градиент=от 0% B до 100% B в течение 12 минут, выдерживают при 100% B в течение 2 минут, затем повторно уравновешивают при 100% A; Прибор: ВЭЖХ Agilent 1100.
Таблица 14. Аналитические характеристики EDB ADC.
ПРИМЕР 5
Экспрессия EDB+ FN
Чтобы провести широкое исследование показаний для применения при злокачественных новообразованиях терапии на основе EDB ADC, экспрессию EDB+ FN анализировали на уровне белка и мРНК в опухолях человека и моделях PDX.
РНК-Seq анализ экспрессии EDB+ FN
Данные РНК-Seq были проанализированы из 10660 отдельных образцов опухолей, собранных в рамках проекта The Atlas Genome Atlas (TCGA) (Национальный институт рака в HIH, Bethesda, MD), охватывающего 31 тип опухолей. Данные по уровню экспрессии изоформ были получены с помощью программного обеспечения OmicSoft (Cary, NC). Экспрессию EDB+ FN рассчитывали как сумму уровней экспрессии изоформ фибронектина (FN1), которые содержат EDB. Уровни экспрессии измеряли по фрагменту на 1 тысячу пар оснований транскрипта на миллион считываний (FPKM), а сводная статистика уровней экспрессии EDB+ FN для каждого типа опухоли показана в Таблице 15. Как правило, ген считается экспрессирующимся, если FPKM составляет примерно 1 или выше.
Таблица 15 демонстрирует анализ РНК-Seq EDB+ FN в опухолях человека. Экспрессия EDB+ FN продемонстрирована в широком диапазоне проявлений опухолей человека, включая, но не ограничиваясь этим, рак щитовидной железы, саркому, рак молочной железы, аденокарциному поджелудочной железы, глиобластому, холангиокарциному, аденокарциному легкого, рак почки, меланому, карциносаркому матки, мезотелиому, плоскоклеточную карциному легкого, аденокарциному прямой кишки и толстой кишки, гепатоклеточную карциному печени, карциному толстой кишки, серозную цистаденокарциному яичника и карциному мочевого пузыря.
Таблица 15. РНК-Seq анализ EDB+ FN в образцах TCGA.
Количественную оценку экспрессии генов проводили по данным РНК-Seq на 160 моделях ксенотрансплантата, полученных от пациентов Pfizer, (PDX), с раком молочной железы, раком яичников, раком головы и шеи, колоректальным раком, меланомой, поджелудочной железы, немелкоклеточным раком легкого (NSCLC) и мелкоклеточным раком легкого с использованием программы RSEM. См. Li et al., BMC Bioinformatics, 12: 323, 2011. Экспрессию EDB+ FN рассчитывали как сумму уровней экспрессии изоформ фибронектина (FN1), которые содержат EDB. Как показано на Фиг. 2, EDB+ FN экспрессировался на разных уровнях (все образцы имели уровни> 1) для всех проанализированных типов опухолей. Данные представлены в виде фрагмента на 1 тысячу пар оснований транскрипта на миллион операций считывания (FPKM).
Иммуногистохимическое (IHC) детектирование экспрессии EDB+ FN
Экспрессию белка EDB+ FN при злокачественных новообразованиях человека подтверждали с помощью IHC с использованием антитела EDB-L19 в замороженных срезах. Восьмимикронные срезы свежезамороженной ткани, которые были залиты в соединение Tissue-Tek O.C.T. (Sakura Finetek), фиксировали в течение 4 минут в смеси 3:1 ацетона с 100% этанолом и затем погружали в 10% нейтральный забуференный формалин на 20 секунд. Препараты промывали в TBS. Эндогенную активность пероксидазы инактивировали с помощью Peroxidazed 1 (Biocare Medical) в течение 10 минут. Неспецифические белковые взаимодействия блокировали в течение 10 минут с помощью Background Punisher (Biocare Medical). Антитело EDB-L19 или антитело отрицательного контроля по изотипу huNeg-8.8 предварительно объединяли в комплекс с кроличьим антителом к человеческому IgG (Jackson ImmunoResearch) в конечной концентрации 3 мкг/мл и 0,5 мкг/мл, соответственно, в течение 1 часа при комнатной температуре. Предварительно объединенную в комплекс смесь инкубировали с избытком цельного человеческого IgG (Jackson ImmunoResearch) в течение 15 минут при комнатной температуре и добавляли к препаратам в течение 1 часа. Срезы промывали в TBS и инкубировали с SignalStain Boost Rabbit HRP (CellSignaling Technologies) в течение 30 минут. Хромогенный сигнал проявляли с помощью DAB+ (Dako) в течение 5 минут, а затем гасили дистиллированной водой. Препараты кратко подкрашивали CAT гематоксилином (Biocare Medical), промывали в воде, обезвоживали в наборе спиртов повышающейся концентрации, очищали в ксилоле и покрывали средой для заливки Permount Mounting Medium (FisherChemicals). Проводили и подтверждали анализ экспрессии.
Как показано в Таблице 16, белок EDB+ FN экспрессировался на умеренном и на высоком уровне при всех профилях признаков рака человека, включая рак головы и шеи (данные не показаны), рак поджелудочной железы, немелкоклеточный рак легкого (NSCLC), рак яичников и рак молочной железы. Экспрессия во всех опухолях была преимущественно стромальной (включая фибробластную и связанную с сосудистой сетью), хотя также наблюдалось некоторое окрашивание опухолевых клеток.
Таблица 16. Экспрессию белка EDB+ FN при злокачественном новообразовании человека оценивали с помощью анализа IHC.
ПРИМЕР 6
In vitro связывание EDB ADC
Для оценки относительного связывания антител против EDB и EDB ADC с EDB на 96-луночные планшеты MaxiSorp наносили покрытие 0,5 или 1 мкг/мл человеческого 7-EDB-89 (SEQ ID NO: 34) в PBS и инкубировали в течение ночи при 4°C с легким встряхиванием. Затем планшеты опорожняли, промывали 200 мкл PBS и блокировали 100 мкл блокирующего буфера (ThermoScientific) в течение 3 часов при комнатной температуре. Блокирующий буфер удаляли, лунки промывали PBS и инкубировали с 100 мкл антител против EDB или EDB ADC, которые последовательно разводили (в 4 раза) в буфере для анализа ИФА (EAB; 0,5% BSA/0,02% Tween-20/PBS). Первый ряд планшета оставляли пустым, а последний ряд планшета заполняли EAB в качестве пустых контролей. Планшет инкубировали при комнатной температуре в течение 3 часов. Реагенты удаляли и планшет промывали 200 мкл 0,03% Tween-20 в PBS (PBST). Антитело к человеческому IgG-Fc-HRP (Thermo/Pierce), разведенное 1:5000 в EAB, добавляли в лунки в виде 100 мкл и инкубировали в течение 15 минут при комнатной температуре. Планшет промывали 200 мкл PBST, затем добавляли 100 мкл BioFX TMB (Fisher) и давали цвету проявиться в течение 4 минут при комнатной температуре. Реакцию останавливали с помощью 100 мкл 0,2Н серной кислоты, и поглощение при 450 нм считывали на ридере Victor (Perkin Elmer, Waltham, MA).
В Таблице 17 представлено относительное связывание антител против EDB и EDB ADC с фрагментом белка 7-EDB-89 человека, связанным с 96-луночным планшетом в формате ИФА. Все антитела и ADC, нацеленные на EDB, связываются с белком-мишенью со сходной аффинностью в диапазоне от 19 до 58 пМ. Напротив, антитела, не нацеленные на EDB, и ADC имеют высокие значения EC50> 10000 пМ. Типичные кривые связывания ИФА показаны на Фиг. 3А и 3В.
Таблица 17. Связывание антитела против EDB и ADC с человеческим EDB.
Среднее EC50 ± стандартное отклонение и число (n) определений. ND=не определено.
Пример 7.
In vitro цитотоксичность EDB ADC
Клеточная культура
WI38-VA13 представляют собой SV40-трансформированные фибробласты легкого человека, полученные из ATCC и поддерживаемые в среде MEM Eagles (Cell-Gro) с добавлением 10% FBS, 1% MEM незаменимых аминокислот, 1% пирувата натрия, 100 единиц/мл пенициллина-стрептомицина и 2 мМ GlutaMax. HT29 получены из колоректальной карциномы человека (ATCC) и поддерживаются в среде DMEM с добавлением 10% FBS и 1% глутамина.
Детектирование транскрипта EDB+ FN
Для экспрессии генов и анализа транскриптов EDB+ FN прикрепленные пролиферирующие клетки WI38-VA13 и HT29 диссоциировали из культуральных флаконов с помощью TrypLE Express (Gibco). Мини-набор RNeasy (Qiagen) использовали для очистки суммарной РНК из собранных клеточных осадков. Остаточную ДНК удаляли с помощью набора свободной от РНК-азы ДНК-азы (Qiagen) во время очистки РНК. Набор с высокой производительностью РНК-кДНК (Applied Biosystems) использовали для обратной транскрипции суммарной РНК в кДНК. кДНК анализировали с помощью количественной ПЦР в реальном времени с использованием TaqMan Universal Master Mix II с UNG (Applied Biosystems). Сигнал EDB+ FN детектировали праймером TaqMan Hs01565271_m1 и нормализовали по среднему значению обоих сигналов от ACTB (праймер TaqMan Hs99999903_m1) и GAPDH (праймер TaqMan Hs99999905_m1). Все праймеры были от ThermoFisher Scientific. Представлены данные из репрезентативного эксперимента.
Детектирование белка EDB+ FN с помощью вестерн-блот-анализа
Для детектирования EDB+ FN с помощью вестерн-блот-анализа прикрепленные пролиферирующие клетки WI38-VA13 и HT29 собирали путем соскоба клеток. Клеточные лизаты готовили в буфере лизиса клеток (Cell Signaling Technology) с ингибиторами протеаз и таблетками PhcOmplete ULTRA Tablets, Mini, ингибиторами фосфатазы без EDTA. Опухолевые лизаты готовили либо в буфере для лизиса RIPA, либо в 2X буфере для лизиса клеток (технология Cell Signaling) с ингибиторами протеаз и таблетками phcOmplete ULTRA, Mini, ингибиторами фосфатазы без EDTA. Белковые лизаты анализировали с помощью SDS-PAGE с последующим вестерн-блот-анлизом. Белки переносили на нитроцеллюлозную мембрану и затем блокировали 5%-ным молоком/TBS с последующей инкубацией с антителом EDB-L19 и антителом против GAPDH (технология Cell Signaling) в течение ночи при 4°C. После промывания блот с антителом против EDB инкубировали с вторичным антителом против человеческого IgG, связанным с ECL HRP (GE Healthcare), в течение 1 часа при комнатной температуре. После промывки сигнал EDB+ FN проявляли субстратом вестерн-блот-анализа Pierce ECL 2 (Thermo Scientific) и детектировали с помощью рентгеновских пленок. Блот с антителом против GAPDH инкубировали с конъюгированным с Alexa Fluor 680 вторичным антителом против кроличьего IgG (Invitrogen) в блокирующем буфере в течение 1 часа при комнатной температуре. После промывки сигнал GAPDH детектировали системой визуализации LI-COR Odyssey. Денситометрический анализ вестерн-блот-анализа EDB+ FN проводили с использованием денситометра с калиброванной визуализацией Bio-Rad GS-800 и количественно определяли с использованием программного обеспечения Quantity One версии 4.6.9. Представлены данные из репрезентативного эксперимента.
ФИГ. 4 демонстрирует экспрессию EDB+ FN с помощью вестерн-блот-анализа в клетках WI38-VA13 и HT-29. EDB+ FN экспрессируется в клеточной линии WI38-VA13, а клеточная линия рака толстой кишки HT29 является отрицательной при наращивании in vitro.
Детектирование белка EDB+ FN методом проточной цитометрии
Антитело EDB-L19 использовали для измерения экспрессии EDB+ FN на клеточной поверхности клеток WI38-VA13 или HT29 с помощью проточной цитометрии. Клетки диссоциировали неферментативным буфером для диссоциации клеток (Gibco) и инкубировали с буфером холодного потока (FB, 3% BSA/PBS+Ca+Mg) на льду для блокирования. Затем клетки инкубировали с первичными антителами на льду в FB. После инкубации клетки промывали холодным PBS-Ca-Mg и затем инкубировали с красителем на жизнеспособность (Biosciences) для различия живых и мертвых клеток в соответствии с процедурой производителя. Сигналы анализировали на проточном цитометре BD Fortessa, а данные анализировали с использованием программного обеспечения BD FACS DIVA. Представлены данные из репрезентативного эксперимента.
Таблица 18 суммирует результаты вестерн-блот-анализа, кРВ-ПЦР и проточной цитометрии. Данные показывают, что WI38-VA13 являются EDB+ FN-положительными, а HT29 - EDB+ FN-отрицательными.
Таблица 18. Характеристика экспрессии EDB+ FN в клетках WI38 VA13 и HT29
Анализы цитотоксичности in vitro
Пролиферирующие клетки WI38-VA13 или HT29 собирали из культуральных флаконов с использованием неферментативного буфера для диссоциации клеток и культивировали в течение ночи в 96-луночных планшетах (Corning) при 1000 клеток/лунку во влажной камере (37°C, 5% CO2). На следующий день клетки обрабатывали EDB ADC или контролем изотипа в виде ADC, не связывающихся с EDB, путем добавления 50 мкл 3х концентратов в двух экземплярах при 10 концентрациях. В некоторых экспериментах клетки высевали при 1500 клеток/лунку и обрабатывали в тот же день. Затем клетки инкубировали с EDB ADC или с ADC, не связывающимися с EDB, в течение четырех дней. В день сбора к клеткам добавляли 50 мкл Cell Titer Glo (Promega) и инкубировали 0,5 часа при комнатной температуре. Люминесценцию измеряли на планшет-ридере Victor (Perkin Elmer, Waltham, MA). Относительную жизнеспособность клеток определяли как процент необработанных контрольных лунок. Значения IC50 рассчитывали с использованием четырехпараметрической логистической модели # 203 с XLfit v4.2 (IDBS).
Таблица 19 демонстрирует IC50 (нг/мл антитела) обработок EDB ADC в анализах цитотоксичности, выполненных на WI38-VA13 (EDB+ FN-положительная опухолевая клеточная линия) и HT29-клетках рака толстой кишки (EDB+ FN-отрицательная опухолевая клеточная линия). EDC ADC индуцировали гибель клеток в экспрессирующей EDB+ FN клеточной линии. Значения IC50 были одинаковыми для всех EDB ADC, имеющих vc-0101 линкер-полезную нагрузку, в диапазоне приблизительно от 184 нг/мл до 216 нг/мл (EDB-L19-vc-0101, EDB-(κK183C-K290C)-vc-0101, EDB-(K94R)-vc-0101, EDB-(κK183C-K94R-K290C) -vc-0101). vc-0101 ADC отрицательного контроля были существенно менее эффективными, причем значения IC50 примерно в 70-200 раз выше, чем у EDB-vc-0101 ADC. Все ADC vc-0101 имели в 46-83 раза более высокие значения IC50 в EDB+ FN-отрицательной опухолевой клеточной линии, НТ29. Следовательно, EDB ADC зависели от экспрессии EDB+ FN в отношении их цитотоксичности in vitro.
Другие ADC на основе ауристатина с «vc», расщепляемыми протеазами линкерами, EDB-L19-vc-9411 и EDB-L19-vc-1569, также продемонстрировали сильную цитотоксичность в клетках WA38-VA13 с высокой селективностью, примерно 50-180-кратной по сравнению с соответствующими отрицательными контрольными ADC, и примерно с 25-140-кратной селективностью по сравнению с неэкспрессирующей клеточной линией. EDB-L19-diS-DM1 ADC обладали такой же эффективностью, что и vc-0101 ADC, однако со значительно более низкой селективностью по сравнению с ADC отрицательного контроля (примерно 3-кратной) и с клетками НТ29 (примерно 0,9-кратной).
Таблица 19. In vitro цитотоксичность EDC ADC и контрольных ADC, не связывающихся с EDB.
Среднее значение IC50 ± стандартное отклонение и число (n) определений. ND=не определено.
Как показано в Таблице 20, неконъюгированные полезные нагрузки были высокоэффективными в обеих клеточных линиях, независимо от экспрессии EDB+ FN, что указывает на то, что эти клетки чувствительны к цитотоксическим агентам, используемым в качестве полезных нагрузок ADC.
Таблица 20. Эффективность цитотоксичности in vitro различных неконъюгированных соединений.
Среднее значение IC50 ± стандартное отклонение и число (n) определений. ND=не определено.
ПРИМЕР 8
In Vivo Эффективность EDB ADC
EDB ADC оценивали на ксенотрансплантате клеточной линии (CLX), на ксенотрансплантате, полученном от пациента (PDX), и на моделях сингенной опухоли. Экспрессию EDB+ FN детектировали с использованием иммуногистохимического (IHC) анализа, как описано ранее в настоящем документе.
Для создания CLX-моделей подкожно имплантировали 8×106-10×106 клеток опухолевых клеточных линий H-1975, HT29 или Ramos самкам бестимусных голых мышей. Клетки Ramos и H-1975 для инокуляции суспендировали в 50% и 100% матригеле (BD Biosciences), соответственно. Для модели Ramos животные получали облучение всего тела (4 Гр) перед инокуляцией клеток для облегчения образования опухолей. Когда средний объем опухоли достигал приблизительно от 160 до 320 мм3, животных рандомизировали в группы обработок по 8-10 мышей в каждой группе. ADC или носитель (PBS) вводили внутривенно в день 0, а затем животным вводили один раз каждые 4 дня по 4-8 доз. Опухоли измеряли один или два раза в неделю, а объем опухоли рассчитывали как объем (мм3)=(ширина х ширина х длина)/2. Массу тела животных контролировали в течение 4-9 недель, и ни в одной из групп обработок не наблюдали снижения массы тела животного.
Для создания PDX-моделей опухоли собирали у животных-доноров, а фрагменты опухолей размером приблизительно 3×3 мм подкожно имплантировали в бок самок голых мышей (для модели PDX-NSX-11122) или мышей SCID NOD (для PDX-PAX-13565 и PDX-PAX-12534 модели) с использованием троакара 10 калибра. Когда средний объем опухоли достигал приблизительно от 160 до 260 мм3, мышей рандомизировали в группы обработок по 7-10 мышей в каждой группе. Режим дозирования ADC или носителя (PBS) и способ введения, а также процедуры измерения опухоли являются такими же, как описано выше для CLX-моделей. Массу тела животных контролировали в течение 5-14 недель, и ни в одной из групп обработок не наблюдали снижения массы тела животного. Ингибирование роста опухоли представлено как среднее значение размера опухоли ± SEM.
Экспрессия EDB+ FN
Как показано в Таблице 21, экспрессию EDB+ FN в моделях H-1975, HT29 и Ramos CLX, моделях PDX-NSX-11122, PDX-PAX-13565 и PDX-PAX-12534 и моделях сингенной опухоли EMT-6 измеряли по связыванию антитела EDB-L19 и последующему детектированию в анализе IHC. CLX-модель HT-29 представляла собой умеренно экспрессирующую CLX-модель, однако она была отрицательной при исследовании in vitro из-за преобладания экспрессии белка в CLX при получении из стромы опухоли.
Таблица 21. Экспрессия EDB+ FN
PDX-NSX-11122 NSCLC PDX
Эффекты различных ADC оценивали в PDX-NSX-11122, NSCLC PDX моделях опухолей человека, клетки которых экспрессируют на высоком уровне EDB+ FN. На ФИГ. 5А показана противоопухолевая активность для EDB-L19-vc-0101 при дозах 0,3, 0,75, 1,5 и 3 мг/кг. Данные демонстрируют, что EDB-L19-vc-0101 показал регресс опухоли в зависимости от дозы при 3 мг/кг и 1,5 мг/кг.
Противоопухолевую эффективность vc-связанных ADC сравнивали с дисульфидно-связанными ADC. На ФИГ.5B и 5C показана противоопухолевая активность EDB-L19-vc-0101 при 3 мг/кг по сравнению с 10 мг/кг дисульфидно-связанных EDB-L19-diS-DM1 и EDB-L19-vc-0101 при дозе 1 и 3 мг/кг по сравнению с 5 мг/кг дисульфидно-связанных EDB-L19-diS-C2OCO-1569, соответственно. Как показано на ФИГ. 5B и 5C, EDB-L19-vc-0101 продемонстрировал более высокую эффективность по сравнению с ADC отрицательного контроля изотипа и ADC, которые были получены с использованием дисульфидного линкера, EDB-L19-diS-DM1 и EDB-L19-dis-C2OCO-1569. Кроме того, животные с опухолями, которых обрабатывали EDB-L19-vc-0101, имели задержку роста опухоли при 1 мг/кг и полную регрессию при 3 мг/кг. Данные показывают, что EDB-L19-vc-0101 (ADC1) ингибирует рост ксенотрансплантатов NSCLC PDX-NSX-11122 дозозависимым образом.
Оценивали активность сайт-специфически и стандартно конъюгированных ADC. На ФИГ. 5D показана противоопухолевая эффективность сайт-специфически конъюгированного EDB-(κK183C+K290C)-vc-0101 по сравнению с стандартно конъюгированным EDB-L19-vc-0101 в дозах 0,3, 1 и 3 мг/кг и 1,5 мг/кг, соответственно. Эффективность на основе уровня дозы была сопоставимой, и EDB-(κK183C+K290C)-vc-0101 приводил к регрессии опухоли дозозависимым образом.
Оценивали активность vc-0101 EDB ADC, имеющих различные мутации. На ФИГ.5Е показана противоопухолевая эффективность сайт-специфически конъюгированного EDB-(κK183C-K94R-K290C)-vc-0101 в дозах 0,3, 1 и 3 мг/кг. EDB-(κK183C-K94R-K290C)-vc-0101 индуцировал регрессию опухоли в дозе 1 и 3 мг/кг. На ФИГ. 5F показаны кривые ингибирования роста опухоли для 10 отдельных мышей, несущих опухоли в группе обработки EDB-κK183C-K94R-K290C)-vc-0101, которой вводили дозу 3 мг/кг ФИГ. 5E. Регрессии опухоли в группе 3 мг/кг были полными и длительными у 8 из 10 мышей (80%) в конце исследования (95 дней).
H-1975 NSCLC CLX
Эффекты различных vc-связанных ауристатиновых и CPI ADC оценивали в H-1975, NSCLC CLX модели опухоли человека, клетки которой экспрессируют EDB+ FN от умеренной до высокой степени. На ФИГ.6А показан EDB-L19-vc-0101, который оценивали на противоопухолевую активность при 0,3, 0,75, 1,5 и 3 мг/мг. Данные демонстрируют, что EDB-L19-vc-0101 демонстрировал регрессию опухоли дозозависимым образом при 3 мг/кг и на уровне до 1,5 мг/кг. На ФИГ. 6B показано, что EDB-L19-vc-0101 и EDB-L19-vc-1569 оценивали на противоопухолевую активность при 0,3, 1 и 3 мг/кг. Данные демонстрируют, что EDB-L19-vc-0101 и EDB-L19-vc-1569 показали регрессию опухоли дозозависимым образом.
Противоопухолевую активность vc-связанных ауристатиновых ADC сравнивали с CPI ADC. Как показано на ФИГ. 6C, EDB-L19-vc-0101 и EDB-(H16-K222R)-AcLys-vc-CPI-8314 оценивали при 0,5, 1,5 и 3 мг/кг и 0,1, 0,3 и 1 мг/кг, соответственно. EDB-L19-vc-0101 и EDB- (H16-K222R)-AcLys-vc-CPI-8314, оба показали регрессию опухоли при самых высоких тестированных дозах.
Оценивали активность сайт-специфически и стандартно конъюгированных EDB ADC. На ФИГ. 6D показана противоопухолевая эффективность сайт-специфически конъюгированного EDB-(κK183C+K290C)-vc-0101 по сравнению со стандартно конъюгированным EDB-L19-vc-0101 при дозах 0,5, 1,5 и 3 мг/кг. Эффективность на основе уровня дозы была сопоставимой, и EDB-(κK183C+K290C)-vc-0101 приводил к регрессии опухоли дозозависимым образом.
Оценивали активность vc-0101 EDB ADC, имеющих различные мутации. На ФИГ. 6E показана противоопухолевая эффективность EDB-L19-vc-0101 и EDB-(K94R)-vc-0101 при дозах 1 и 3 мг/кг. На ФИГ. 6F показана противоопухолевая эффективность сайт-специфических EDB-(κK183C+K290C)-vc-0101 и EDB-(κK183C-K94R-K290C)-vc-0101 при 1 и 3 мг/кг. 4 ADC продемонстрировали сходную эффективность в модели H-1975 независимо от того, содержали ли они мутации κK183C-K29°C и/или K94R. Кроме того, все протестированные ADC приводили к сильной противоопухолевой эффективности, включая регрессию опухоли при дозе 3 мг/кг. Эти данные демонстрируют, что введение мутаций κK183C-K29°C и/или K94R не оказывало отрицательного влияния на эффективность ADC.
CLX клеток толстой кишки HT29
Эффекты различных vc-связанных ауристатиновых ADC оценивали в HT29, модели CLX толстой кишки человека с умеренной экспрессией EDB+ FN. Как показано на ФИГ. 7, EDB-L19-vc-0101 и EDB-L19-vc-9411 были протестированы на противоопухолевую активность при 3 мг/кг. Как EDB-L19-vc-0101, так и EDB-L19-vc-9411 показали регрессию опухоли при дозе 3 мг/кг с течением времени.
PDX поджелудочной железы, PDX-PAX-13565 и PDX-PAX-12534
Противоопухолевую эффективность EDB-L19-vc-0101 оценивали на PDX-моделях поджелудочной железы человека. Как показано на ФИГ.8А, EDB-L19-vc-0101 оценивали при 0,3, 1 и 3 мг/кг в PDX-PAX-13565, модели PDX поджелудочной железы с экспрессией EDB+ FN от умеренной до высокой. Как показано на ФИГ.8В, EDB-L19-vc-0101 оценивали при 0,3, 1 и 3 мг/кг в PDX-PAX-12534, PDX-модели поджелудочной железы с экспрессией EDB+ FN от низкой до умеренной. EDB-L19-vc-0101 продемонстрировал регрессию опухоли дозозависимым образом в обеих протестированных PDX-моделях поджелудочной железы.
CLX-модель лимфомы Ramos
Противоопухолевую эффективность EDB-L19-vc-0101 оценивали в клетках Ramos, CLX-модели лимфомы с умеренной экспрессией EDB+ FN. EDB-L19-vc-0101 оценивали на противоопухолевую активность в дозах 1 и 3 мг/кг. Как показано на ФИГ. 9, EDB-L19-vc-0101 показал регрессию опухоли при дозе 3 мг/кг дозозависимым образом.
EMT-6 Модель сингенной опухоли молочной железы
Противоопухолевую эффективность EDB-(κK183C-K94R-K290C)-vc-0101 оценивали в клетках EMT-6, модели сингенной карциномы молочной железы у мышей на иммунокомпетентном фоне. Как показано на ФИГ. 10А, EDB-(κK183C-K94R-K290C)-vc-0101 продемонстрировал ингибирование роста опухоли при 4,5 мг/кг. Ингибирование роста опухоли наносили на график как средний размер опухоли у одиннадцати животных с опухолями ± SEM. На ФИГ.10B показаны кривые ингибирования роста опухоли для 11 отдельных мышей с опухолями в группе обработки EDB-(κK183C-K94R-K290C)-vc-0101, получавших дозу 4,5 мг/кг. Регрессия опухоли в группе 4,5 мг/кг была полной и продолжительной у 9 из 11 мышей (82%) в конце исследования (34 дня).
Яичники
Активность EDB-(κK183C-K94R-K290C)-vc-0101 исследовали на PDX-моделях рака яичников и молочной железы человека, клетки которых экспрессируют EDB+ FN. Активность наблюдали при уровнях доз 3 мг/кг и 10 мг/кг (данные не показаны).
ПРИМЕР 9
Фармакокинетика (ФК)
Воздействие стандартно конъюгированных EDB-L19-vc-0101 и сайт-специфически конъюгированных EDB-(κK183C-K94R-K290C)-vc-0101 конъюгатов антител и лекарственных средств определяли после внутривенного (IV) введения болюсной дозы 5 или 6 мг/кг у яванской макаки, соответственно. Концентрации суммарного антитела (суммарное Ab; измерение как конъюгированного mAb, так и неконъюгированного mAb), ADC (mAb, которое конъюгировано по меньшей мере с одной молекулой лекарственного средства) измеряли с использованием анализов связывания лиганда (LBA), а концентрации высвобождаемой полезной нагрузки 0101 измеряли с использованием масс-спектрометрии. Количественный анализ концентраций суммарного Ab и ADC осуществляли с помощью анализа связывания лиганда (LBA) с использованием станции Gyrolab® с флуоресцентным детектированием. Используемый биотинилированный белок захвата представлял собой овечье антитело против человеческого IgG, а детектируемое антитело представляло собой меченое Alexa Fluor 647 козье антитело против человеческого IgG для суммарного антитела или меченое Alexa Fluor 647 mAb против 0101 для ADC (данные были обработаны системой LIMS Watson v 7.4). in vivo образцы готовили для анализа неконъюгированной полезной нагрузки с использованием осаждения белка и вводили в масс-спектрометр AB Sciex API5500 (QTRAP) с использованием режима ионизации электрораспылением Turbo IonSpray (ESI) и мониторинга множественных реакций (MRM). Переходы 743,6 → 188,0 и 751,6 → 188,0 использовали для аналита и дейтерированного внутреннего стандарта, соответственно. Сбор и обработку данных проводили с использованием программного обеспечения Analyst версии 1.5.2 (Applied Biosystems/MDS Sciex, Канада).
Фармакокинетика суммарного Ab, ADC и выделенной полезной нагрузки из ADB-L19-vc-0101 ADC (в дозе 5 мг/кг) и EDB-(κK183C-K94R-K290C)-vc-0101 ADC (6 мг/кг), которые вводили яванским макакам, представлена в Таблице 22. Подверженность воздействию сайт-специфически конъюгированного EDB-(κK183C-K94R-K290C)-vc-0101 показала как повышенную подверженность воздействиям (~2,3-кратное увеличение, измеренное с помощью нормализованной по дозе AUC), так и повышенную стабильность конъюгации по сравнению со стандартным конъюгатом. Стабильность конъюгации оценивали как по более высокому отношению ADC/Ab (84% по сравнению с 75%), так и по меньшему высвобождению полезной нагрузки (нормализованная по дозе AUC; 0,0058 по сравнению с 0,0082 мкг*ч/мл) для сайт-специфически конъюгированного EDB-(κK183C-K94R-K290C)-vc-0101 ADC по сравнению со стандартным EDB ADC-L19-vc-0101, соответственно. NA=не применимо.
Таблица 22. Сводная информация фармакокинетики у низших приматов.
ПРИМЕР 10
Оценка термостабильности EDB ADC
Дифференциальную сканирующую калориметрию (DCS) использовали для определения термостабильности вариантов антител против EDB и соответствующих стандартно и сайт-специфически конъюгированных EDB ADC. Образцы, приготовленные в PBS-CMF pH 7,2, были распределены в кювету для образцов MicroCal VP-Capillary DSC с автодозатором (GE Healthcare Bio-Sciences, Piscataway, NJ), уравновешены в течение 5 минут при 10°C и затем отсканированы до 110 °С со скоростью 100 °С в час. Выбирали период фильтрации 16 секунд. Исходные данные были скорректированы с исходным уровнем, а концентрация белка была нормализована. Origin Software 7.0 (OriginLab Corporation, Нортгемптон, Массачусетс) использовали для согласования данных с моделью MN2-State Model с соответствующим числом переходов.
Как показано в Таблице 23, оценивали различные антитела против EDB и EDB ADC, используя как технологию сайт-специфической, так и стандартной конъюгации, и они продемонстрировали благоприятную термостабильность при определении по первому переходу плавления (Tm1)> 65 °C. Эти результаты демонстрируют, что антитело EDB-κK183C-K94R-K29°C и κK183C-K94R-K290C-VC-0101 ADC, включающие встроенные остатки цистеина, были термостабильны.
Таблица 23: Термостабильность вариантов антител против EDB и EDB ADC
* Значения, определенные в другом эксперименте, приведены в таблице.
ПРИМЕР 11
Исследования токсичности
Неклинический профиль безопасности стандартно конъюгированных EDB-L19-vc-0101 и сайт-специфически конъюгированных EDB-(κK183C-K94R-K290C)-vc-0101 был охарактеризован в диагностических исследованиях с повторной дозой (Q3Wx3) на крысах Wistar-Han и яванских макаках. Крысы и яванские макаки считаются фармакологически релевантными неклиническими видами для оценки токсичности благодаря 100% гомологии последовательности белка с человеческим EDB, а также сходной аффинности связывания антител EDB-L19 и EDB-(κK183C-K94R-K290C) с крысиным, человеческим и обезьяньим белком с помощью анализа Biacore, как показано в Примере 2.
EDB-L19-vc-0101 оценивали на крысах линии Wistar-Han и яванских макаках до 10 и 5 мг/кг/доза, соответственно, а EDB-(κK183C-K94R-K290C)-vc-0101 оценивали на яванских макаках до 12 мг/кг/доза. Крысам или обезьянам проводили внутривенные введения один раз каждые 3 недели (в дни 1, 22 и 43) и подвергали эвтаназии в день 46 (через 3 дня после 3-й дозы). Животных оценивали по клиническим признакам, изменениям массы тела, потреблению пищи, параметрам клинической патологии, массе органов и макроскопическим наблюдениям и с помощью микроскопии. В этих исследованиях не было отмечено смертности или значительных изменений клинического состояния животных.
Не было никаких признаков зависимой от мишени токсичности в тканях/органах, экспрессирующих EDB+ FN, у крыс и обезьян. У обоих видов основной токсичностью была обратимая миелосуппрессия с сопутствующими гематологическими изменениями. У обезьян наблюдалась выраженная транзиторная нейтропения при использовании стандартно конъюгированного EDB-L19-vc-0101 в дозе 5 мг/кг/доза, в то время как наблюдалось только минимальное влияние на количество нейтрофилов при сайт-специфически конъюгированном EDB-(κK183C-K94R-K290C)-vc-0101 при дозе 6 мг/кг/дозу, как показано в Таблице 24 и на ФИГ. 11. Точки представляют среднее значение, а планки погрешностей представляют ± 1 стандартное отклонение (SD) от среднего значения.
Данные демонстрируют значительное ослабление миелосупрессии с помощью сайт-специфической конъюгации. Профиль токсичности EDB-L19-vc-0101 и EDB-(κK183C-K94R-K290C)-vc-0101 соответствовал независимым от мишени эффектам этих конъюгатов, и самые высокие неопасные токсичные дозы (HNSTD) для EDB-L19-vc-0101 и EDB-(κK183C-K94R-K290C)-vc-0101 были определены как ≥ 5 мг/кг/доза и ≥ 12 мг/кг/доза, соответственно.
Таблица 24 Абсолютное количество нейтрофилов у яванских макак за время исследования.
ПРИМЕР 12
IO комбинации
Когда опухолевые клетки умирают, они высвобождают антигены, которые поглощаются и презентируются дендритными клетками (DC). Из-за мутаций в этих опухолевых клетках некоторые из этих антигенов включают опухолевые неоэпитопы, которые могут быть презентированы зрелыми DC T-клеткам, тем самым активируя их и вызывая противоопухолевое нацеливание. Тем не менее, у онкологических пациентов активируются негативные регуляторные механизмы. Например, передача сигналов через контрольные точки, такие как сигнальные пути PD-1/PD-L1, может ограничивать распознавание неоэпитопов и активацию Т-клеток.
Полезные нагрузки, конъюгированные с антителами в формате ADC, могут участвовать в вовлечении путей созревания дендритных клеток, что приводит к усилению перекрестной презентации опухолевого антигена, что позволяет примировать Т-клетки и увеличивать опухолевое нацеливание Т-клеток. EDB ADC по настоящему изобретению, содержащие различные полезные нагрузки, такие как полезная нагрузка-0101, были использованы для улучшения иммунного распознавания неоантигенов опухоли путем создания иммуногенного опухолевого окружения. Это окружение становится чувствительным к иммунно-онкологическим агентам, которые блокируют пути отрицательной регуляции, когда EDB ADC и иммунно-онкологический агент вводят в комбинации.
Данные исследований эффективности сингенных опухолей ЕМТ6, обработанных EDB-L19-vc-0101, позволяют предположить, что индуцируется эффекторный ответ на полезную нагрузку-0101. Наблюдали повышенную инфильтрацию CD3+ Т-клеток в опухолях, обработанных EDB-L19-vc-0101, по сравнению с контрольными носителями. Кроме того, наблюдали повышенную экспрессию PDL1 в обработанных опухолях что свидетельствует о высвобождении IFNγ, обусловленном увеличением ответа эффекторных Т-клеток.
Комбинация EDB ADC с агентами, которые нацелены на иммуномодулирующие пути, такими как антагонистические антитела против PDL1 или агонистические антитела против 41BB, вероятно, улучшит противоопухолевую эффективность и обеспечит более длительные ответы.
ПРИМЕР 13
Биомаркер/Механизм действия
Модель NSCLC PDX PDX-NSX-11122 была разработана для голых мышей, как описано ранее. EDB-(K94R)-vc-0101, EDB-(κK183C-K94R-K290C)-vc-0101 и Neg-vc-0101 ADC вводили путем инъекции в хвостовую вену в дозе 3 мг/кг (4 животных на каждый момент времени на группу). Через 96 часов после однократного введения животных анестезировали и перфузировали физиологическим раствором. После перфузии солевым раствором опухоли удаляли и готовили для измерения антител и ADC с помощью анализа связывания лиганда (LBA) или готовили для иммуногистохимии (IHC).
Анализ связывания лиганда (LBA)
Для анализа LBA 5-кратный буфер добавляли к образцам опухоли. Реагент для экстракции ткани (Invitrogen) содержал 1% ингибитор протеазы (Sigma), (об./масс.) с конечным 6x разведением (мкг/мл гомогената → мкг/г ткани). Добавляли гранулы из нержавеющей стали и ткань гомогенизировали с использованием Mini-Beadbeater-96 (BioSpec). Гомогенат (~100-300 мкл в зависимости от размера образца) переносили в соответствующий флакон (пробирка Марша) и центрифугировали при 14000 об/мин в течение 10 минут (4°C). Центрифугированный гомогенат разбавляли (MRD) Super Block™ для анализа в соответствии с аналитическим протоколом.
Как показано в Таблице 25, анализы связывания лиганда использовали для определения среднего значения концентрации суммарных антител и ADC в плазме (мкг/мл), концентрации в опухоли (мкг/г) после введения однократной дозы EDB ADC. Данные демонстрируют, что EDB-(K94R)-vc-0101 и EDB-(κK183C-K94R-K290C)-vc-0101 были обнаружены в участке опухоли на повышенном уровне, что было измерено по суммарным антителам и ADC по сравнению с Neg-VC-0101. Кроме того, было отмечено снижение отношения концентрации в плазме к концентрации в опухоли как для ADC, так и для суммарных антител, наблюдаемое для EDB-(K94R)-vc-0101 и EDB-(κK183C-K94R-K290C)-vc-0101 по сравнению с Neg-vc-0101, что указывает на повышенную эффективность опухолеспецифического нацеливания ADC, нацеленных на EDB.
Таблица 25. Средние концентрации суммарных Ab и ADC в плазме и опухоли в NSCLC PDX.
Иммуногистохимия (IHC)
Для иммуногистохимического определения распределения ADC и впоследствии активированных биомаркеров ответа образцы фиксировали в 10% нейтральном забуференном формалине в течение 48 часов. После фиксации образцы заливали в парафин и делали 5 мкМ-срезы. Разрезанные парафиновые срезы депарафинизировали в заменителе ксилола и регидратировали с помощью набор спиртов повышающейся концентрации до дистиллированной воды. Антигены извлекали в: 10 мМ цитратном буфере pH 6 (Invitrogen) для детектирования фосфо-гистона H3 и расщепленной каспазы 3 или в буфере Borg Decloaker pH 9,5 (Biocare Medical) для детектирования антитела к человеческому IgG и детектирования анти-0101 в автоклаве (Electron Microscopy Sciences) и охлаждали до комнатной температуры. Эндогенную пероксидазу блокировали 3% перекисью водорода в течение 10 минут. Неспецифические белковые взаимодействия блокировали с помощью Protein-блока (DAKO) в течение 20 минут. Срезы тканей инкубировали с первичным антителом в течение 1 часа при комнатной температуре. Первичными антителами были: 0,3 мкг/мл антитела против человеческого Pan IgG (Epitomics); 10 мкг/мл анти-0101 Ab; 0,13 мкг/мл антитела против фосфо-гистона H3 (pHH3, Cell Signaling Technologies); 1,3 мкг/мл антитела против расщепленной каспазы 3 (Cell Signaling Technologies). Чтобы избежать детектирования мышиных антител против мышиных белков, изотипические антитела против 0101 метили AlexaFluor 488 с использованием набора для мечения белка Alexa Fluor 488 (Life Technologies). Немеченые первичные антитела детектировали с помощью реагента Signalstain Boost (Cell Signaling Technologies) в течение 30 минут при комнатной температуре. Меченные AlexaFluor 488 первичные антитела детектировали с использованием 1 мкг/мл кроличьего анти-AlexaFluor488 (Life Technologies) в течение 45 минут при комнатной температуре с последующей инкубацией с реагентом Signalstain Boost (Cell Signaling Technologies) в течение 30 минут при комнатной температуре. DAB+(3',3'-диаминобензидин; Dako) использовали для проявления цвета в течение 5 минут. Срезы на короткое время контрастировали в гематоксилине, промывали в воде, дегидратировали в наборе спиртов повышающейся концентрации, очищали в заменителе ксилола и заливали средой Permount Mounting Medium.
Через 96 часов после однократного введения как стандартно конъюгированный EDB-(K94R)-vc-0101, так и сайт-специфически конъюгированный EDB-(κK183C-K94R-K290C)-vc-0101 одинаково детектировали с помощью антитела против человеческого IgG IHC в PDX-модели PDX-NSX-11122. Повышение pHH3-положительных клеток, маркера остановки митоза, наблюдали в опухолях, обработанных EDB-(K94R)-vc-0101 и EDB-(κK183C-K94R-K290C)-vc-0101, по сравнению с опухолями, обработанными ADC отрицательного контроля (Neg-vc-0101). Большинство клеток, несущих маркер митотической остановки, pHH3, были опухолевыми клетками, что свидетельствует об эффекте «свидетеля». Окраска на расщепленную каспазу 3 выявила повышенный апоптоз в тех опухолях, которые были обработаны EDB-(K94R)-vc-0101 (и EDB-κK183C-K94R-K290C)-vc-0101 по сравнению с опухолями, обработанными ADC отрицательного контроля (Neg-vc-0101).
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Pfizer Inc.
Hooper, Andrea Therese
Marquette, Kimberly Ann
Subramanyam, Chakrapani
Gerber, Hans-Peter
May, Chad Michael
<120> АНТИТЕЛА ПРОТИВ EDB И КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО
<130> PC72276
<160> 57
<170> PatentIn version 3.5
<210> 1
<211> 116
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 1
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Ser Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro Phe Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 2
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность
<400> 2
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agtttttcga tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatct attagtggta gttcgggtac cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaagac acggccgtat attactgtgc gaaaccgttt 300
ccgtattttg actactgggg ccagggaacc ctggtcaccg tctcgagt 348
<210> 3
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 3
Ser Phe Ser Met Ser
1 5
<210> 4
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 4
Gly Phe Thr Phe Ser Ser Phe
1 5
<210> 5
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 5
Ser Ile Ser Gly Ser Ser Gly Thr Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 6
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 6
Ser Gly Ser Ser Gly Thr
1 5
<210> 7
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 7
Pro Phe Pro Tyr Phe Asp Tyr
1 5
<210> 8
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 8
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Ser Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro Phe Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 9
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность
<400> 9
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agtttttcga tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatct attagtggta gttcgggtac cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaagac acggccgtat attactgtgc gaaaccgttt 300
ccgtattttg actactgggg ccagggaacc ctggtcaccg tctcgagtgc gtcgaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtacaccctg cccccatccc gggatgagct gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctacag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtctc cgggtaaa 1338
<210> 10
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 10
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Tyr Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Thr Gly Arg Ile Pro
85 90 95
Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 11
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность
<400> 11
gaaattgtgt taacgcagtc tccaggcacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttagc agcagctttt tagcctggta ccagcagaaa 120
cctggccagg ctcccaggct cctcatctat tatgcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg gtctgggaca gacttcactc tcaccatcag cagactggag 240
cctgaagatt ttgcagtgta ttactgtcag cagacgggtc gtattccgcc gacgttcggc 300
caagggacca aggtggaaat caaa 324
<210> 12
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 12
Arg Ala Ser Gln Ser Val Ser Ser Ser Phe Leu Ala
1 5 10
<210> 13
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 13
Tyr Ala Ser Ser Arg Ala Thr
1 5
<210> 14
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 14
Gln Gln Thr Gly Arg Ile Pro Pro Thr
1 5
<210> 15
<211> 215
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 15
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Tyr Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Thr Gly Arg Ile Pro
85 90 95
Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 16
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность
<400> 16
gaaattgtgt taacgcagtc tccaggcacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttagc agcagctttt tagcctggta ccagcagaaa 120
cctggccagg ctcccaggct cctcatctat tatgcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg gtctgggaca gacttcactc tcaccatcag cagactggag 240
cctgaagatt ttgcagtgta ttactgtcag cagacgggtc gtattccgcc gacgttcggc 300
caagggacca aggtggaaat caaacgtacg gtggctgcac catctgtctt catcttcccg 360
ccatctgatg agcagttgaa atctggaact gcctctgttg tgtgcctgct gaataacttc 420
tatcccagag aggccaaagt acagtggaag gtggataacg ccctccaatc gggtaactcc 480
caggagagtg tcacagagca ggacagcaag gacagcacct acagcctcag cagcaccctg 540
acgctgagca aagcagacta cgagaaacac aaagtctacg cctgcgaagt cacccatcag 600
ggcctgagct cgcccgtcac aaagagcttc aacaggggag agtgt 645
<210> 17
<211> 445
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 17
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Ser Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro Phe Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 18
<211> 1335
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность
<400> 18
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agtttttcga tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatct attagtggta gttcgggtac cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaagac acggccgtat attactgtgc gaaaccgttt 300
ccgtattttg actactgggg ccagggaacc ctggtcaccg tctcgagtgc gtcgaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtacaccctg cccccatccc gggaggagat gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctatag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtccc cgggt 1335
<210> 19
<211> 445
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 19
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Ser Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro Phe Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Cys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 20
<211> 1335
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность
<400> 20
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agtttttcga tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatct attagtggta gttcgggtac cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaagac acggccgtat attactgtgc gaaaccgttt 300
ccgtattttg actactgggg ccagggaacc ctggtcaccg tctcgagtgc gtcgaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacatgcccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtacaccctg cccccatccc gggaggagat gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctatag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtccc cgggt 1335
<210> 21
<211> 116
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 21
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Ser Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Phe Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 22
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность
<400> 22
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agtttttcga tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatct attagtggta gttcgggtac cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaagac acggccgtat attactgtgc gagaccgttt 300
ccgtattttg actactgggg ccagggaacc ctggtcaccg tctcgagt 348
<210> 23
<211> 445
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 23
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Ser Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Phe Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 24
<211> 1335
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность
<400> 24
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agtttttcga tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatct attagtggta gttcgggtac cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaagac acggccgtat attactgtgc gagaccgttt 300
ccgtattttg actactgggg ccagggaacc ctggtcaccg tctcgagtgc gtcgaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtacaccctg cccccatccc gggaggagat gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctatag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtccc cgggt 1335
<210> 25
<211> 445
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 25
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Ser Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Phe Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Cys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 26
<211> 1335
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность
<400> 26
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agtttttcga tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatct attagtggta gttcgggtac cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaagac acggccgtat attactgtgc gagaccgttt 300
ccgtattttg actactgggg ccagggaacc ctggtcaccg tctcgagtgc gtcgaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
aaaactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacatgcccg cgggaggagc agtacaacag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtacaccctg cccccatccc gggaggagat gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctatag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtccc ccgga 1335
<210> 27
<211> 445
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 27
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Ser Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro Phe Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Arg Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Leu Leu Gln Gly Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 28
<211> 1335
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность
<400> 28
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agtttttcga tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatct attagtggta gttcgggtac cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaagac acggccgtat attactgtgc gaaaccgttt 300
ccgtattttg actactgggg ccagggaacc ctggtcaccg tctcgagtgc gtcgaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tagtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
cgcactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggagctgc tgcaggggag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtacaccctg cccccatccc gggaggagat gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctatag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtctc cgggt 1335
<210> 29
<211> 445
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 29
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Ser Gly Thr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Phe Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Arg Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Leu Leu Gln Gly Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 30
<211> 1335
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность
<400> 30
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agtttttcga tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatct attagtggta gttcgggtac cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaagac acggccgtat attactgtgc gagaccgttt 300
ccgtattttg actactgggg ccagggaacc ctggtcaccg tctcgagtgc gtcgaccaag 360
ggcccatcgg tcttccccct ggcaccctcc tccaagagca cctctggggg cacagcggcc 420
ctgggctgcc tggtcaagga ctacttcccc gaaccggtga cggtgtcgtg gaactcaggc 480
gccctgacca gcggcgtgca caccttcccg gctgtcctac agtcctcagg actctactcc 540
ctcagcagcg tagtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac 600
gtgaatcaca agcccagcaa caccaaggtg gacaagaaag ttgagcccaa atcttgtgac 660
cgcactcaca catgcccacc gtgcccagca cctgaactcc tggggggacc gtcagtcttc 720
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc 780
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc 840
gtggaggtgc ataatgccaa gacaaagccg cgggagctgc tgcaggggag cacgtaccgt 900
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc 960
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggg 1020
cagccccgag aaccacaggt gtacaccctg cccccatccc gggaggagat gaccaagaac 1080
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg 1140
gagagcaatg ggcagccgga gaacaactac aagaccacgc ctcccgtgct ggactccgac 1200
ggctccttct tcctctatag caagctcacc gtggacaaga gcaggtggca gcaggggaac 1260
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacacgca gaagagcctc 1320
tccctgtccc ccgga 1335
<210> 31
<211> 215
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 31
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Phe Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Tyr Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Thr Gly Arg Ile Pro
85 90 95
Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Cys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 32
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность
<400> 32
gaaattgtgt taacgcagtc tccaggcacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca gggccagtca gagtgttagc agcagctttt tagcctggta ccagcagaaa 120
cctggccagg ctcccaggct cctcatctat tatgcatcca gcagggccac tggcatccca 180
gacaggttca gtggcagtgg gtctgggaca gacttcactc tcaccatcag cagactggag 240
cctgaagatt ttgcagtgta ttactgtcag cagacgggtc gtattccgcc gacgttcggc 300
caagggacca aggtggaaat caaacgaact gtggctgcac catctgtctt catcttcccg 360
ccatctgatg agcagttgaa atctggaact gcctctgttg tgtgcctgct gaataacttc 420
tatcccagag aggccaaagt acagtggaag gtggataacg ccctccaatc gggtaactcc 480
caggagagtg tcacagagca ggacagcaag gacagcacct acagcctcag cagcaccctg 540
acgctgagct gcgcagacta cgagaaacac aaagtctacg cctgcgaagt cacccatcag 600
ggcctgagct cgcccgtcac aaagagcttc aacaggggag agtgt 645
<210> 33
<211> 91
<212> Белок
<213> Homo sapiens
<400> 33
Glu Val Pro Gln Leu Thr Asp Leu Ser Phe Val Asp Ile Thr Asp Ser
1 5 10 15
Ser Ile Gly Leu Arg Trp Thr Pro Leu Asn Ser Ser Thr Ile Ile Gly
20 25 30
Tyr Arg Ile Thr Val Val Ala Ala Gly Glu Gly Ile Pro Ile Phe Glu
35 40 45
Asp Phe Val Asp Ser Ser Val Gly Tyr Tyr Thr Val Thr Gly Leu Glu
50 55 60
Pro Gly Ile Asp Tyr Asp Ile Ser Val Ile Thr Leu Ile Asn Gly Gly
65 70 75 80
Glu Ser Ala Pro Thr Thr Leu Thr Gln Gln Thr
85 90
<210> 34
<211> 374
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 34
Val Val Thr Gln Leu Ser Pro Pro Thr Asn Leu His Leu Glu Ala Asn
1 5 10 15
Pro Asp Thr Gly Val Leu Ala Val Ser Trp Glu Arg Ser Thr Thr Pro
20 25 30
Asp Ile Thr Gly Tyr Arg Ile Thr Thr Thr Pro Thr Asn Gly Gln Gln
35 40 45
Gly Asn Ser Leu Glu Glu Val Val His Ala Asp Gln Ser Ser Cys Thr
50 55 60
Phe Asp Asn Leu Ser Pro Gly Leu Glu Tyr Asn Val Ser Val Tyr Thr
65 70 75 80
Val Lys Asp Asp Lys Glu Ser Val Pro Ile Ser Asp Thr Ile Ile Pro
85 90 95
Glu Val Pro Gln Leu Thr Asp Leu Ser Phe Val Asp Ile Thr Asp Ser
100 105 110
Ser Ile Gly Leu Arg Trp Thr Pro Leu Asn Ser Ser Thr Ile Ile Gly
115 120 125
Tyr Arg Ile Thr Val Val Ala Ala Gly Glu Gly Ile Pro Ile Phe Glu
130 135 140
Asp Phe Val Asp Ser Ser Val Gly Tyr Tyr Thr Val Thr Gly Leu Glu
145 150 155 160
Pro Gly Ile Asp Tyr Asp Ile Ser Val Ile Thr Leu Ile Asn Gly Gly
165 170 175
Glu Ser Ala Pro Thr Thr Leu Thr Gln Gln Thr Ala Val Pro Pro Pro
180 185 190
Thr Asp Leu Arg Phe Thr Asn Ile Gly Pro Asp Thr Met Arg Val Thr
195 200 205
Trp Ala Pro Pro Pro Ser Ile Asp Leu Thr Asn Phe Leu Val Arg Tyr
210 215 220
Ser Pro Val Lys Asn Glu Glu Asp Val Ala Glu Leu Ser Ile Ser Pro
225 230 235 240
Ser Asp Asn Ala Val Val Leu Thr Asn Leu Leu Pro Gly Thr Glu Tyr
245 250 255
Val Val Ser Val Ser Ser Val Tyr Glu Gln His Glu Ser Thr Pro Leu
260 265 270
Arg Gly Arg Gln Lys Thr Gly Leu Asp Ser Pro Thr Gly Ile Asp Phe
275 280 285
Ser Asp Ile Thr Ala Asn Ser Phe Thr Val His Trp Ile Ala Pro Arg
290 295 300
Ala Thr Ile Thr Gly Tyr Arg Ile Arg His His Pro Glu His Phe Ser
305 310 315 320
Gly Arg Pro Arg Glu Asp Arg Val Pro His Ser Arg Asn Ser Ile Thr
325 330 335
Leu Thr Asn Leu Thr Pro Gly Thr Glu Tyr Val Val Ser Ile Val Ala
340 345 350
Leu Asn Gly Arg Glu Glu Ser Pro Leu Leu Ile Gly Arg Ser Arg Ser
355 360 365
His His His His His His
370
<210> 35
<211> 374
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 35
Val Val Thr Pro Leu Ser Pro Pro Thr Asn Leu His Leu Glu Thr Asn
1 5 10 15
Pro Asp Thr Gly Val Leu Thr Val Ser Trp Glu Arg Ser Thr Thr Pro
20 25 30
Asp Ile Thr Gly Tyr Arg Ile Thr Thr Thr Pro Thr Asn Gly Gln Gln
35 40 45
Gly Tyr Ser Leu Glu Glu Val Val His Ala Asp Gln Ser Ser Cys Thr
50 55 60
Phe Asp Asn Leu Ser Pro Gly Leu Glu Tyr Asn Val Ser Val Tyr Thr
65 70 75 80
Val Lys Asp Asp Lys Glu Ser Val Pro Ile Ser Asp Thr Ile Ile Pro
85 90 95
Glu Val Pro Gln Leu Thr Asp Leu Ser Phe Val Asp Ile Thr Asp Ser
100 105 110
Ser Ile Gly Leu Arg Trp Thr Pro Leu Asn Ser Ser Thr Ile Ile Gly
115 120 125
Tyr Arg Ile Thr Val Val Ala Ala Gly Glu Gly Ile Pro Ile Phe Glu
130 135 140
Asp Phe Val Asp Ser Ser Val Gly Tyr Tyr Thr Val Thr Gly Leu Glu
145 150 155 160
Pro Gly Ile Asp Tyr Asp Ile Ser Val Ile Thr Leu Ile Asn Gly Gly
165 170 175
Glu Ser Ala Pro Thr Thr Leu Thr Gln Gln Thr Ala Val Pro Pro Pro
180 185 190
Thr Asp Leu Arg Phe Thr Asn Ile Gly Pro Asp Thr Met Arg Val Thr
195 200 205
Trp Ala Pro Pro Pro Ser Ile Asp Leu Thr Asn Phe Leu Val Arg Tyr
210 215 220
Ser Pro Val Lys Asn Glu Glu Asp Val Ala Glu Leu Ser Ile Ser Pro
225 230 235 240
Ser Asp Asn Ala Val Val Leu Thr Asn Leu Leu Pro Gly Thr Glu Tyr
245 250 255
Val Val Ser Val Ser Ser Val Tyr Glu Gln His Glu Ser Thr Pro Leu
260 265 270
Arg Gly Arg Gln Lys Thr Gly Leu Asp Ser Pro Thr Gly Ile Asp Phe
275 280 285
Ser Asp Ile Thr Ala Asn Ser Phe Thr Val His Trp Ile Ala Pro Arg
290 295 300
Ala Thr Ile Thr Gly Tyr Arg Ile Arg His His Pro Glu His Met Ser
305 310 315 320
Gly Arg Pro Arg Glu Asp Arg Val Pro Pro Ser Arg Asn Ser Ile Thr
325 330 335
Leu Thr Asn Leu Thr Pro Gly Thr Glu Tyr Val Val Ser Ile Val Ala
340 345 350
Leu Asn Gly Arg Glu Glu Ser Pro Leu Leu Ile Gly Arg Ser Arg Ser
355 360 365
His His His His His His
370
<210> 36
<211> 374
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 36
Val Val Thr Pro Leu Ser Pro Pro Thr Asn Leu His Leu Glu Ala Asn
1 5 10 15
Pro Asp Thr Gly Val Leu Thr Val Ser Trp Glu Arg Ser Thr Thr Pro
20 25 30
Asp Ile Thr Gly Tyr Arg Ile Thr Thr Thr Pro Thr Asn Gly Gln Gln
35 40 45
Gly Thr Ala Leu Glu Glu Val Val His Ala Asp Gln Ser Ser Cys Thr
50 55 60
Phe Glu Asn Leu Asn Pro Gly Leu Glu Tyr Asn Val Ser Val Tyr Thr
65 70 75 80
Val Lys Asp Asp Lys Glu Ser Ala Pro Ile Ser Asp Thr Val Ile Pro
85 90 95
Glu Val Pro Gln Leu Thr Asp Leu Ser Phe Val Asp Ile Thr Asp Ser
100 105 110
Ser Ile Gly Leu Arg Trp Thr Pro Leu Asn Ser Ser Thr Ile Ile Gly
115 120 125
Tyr Arg Ile Thr Val Val Ala Ala Gly Glu Gly Ile Pro Ile Phe Glu
130 135 140
Asp Phe Val Asp Ser Ser Val Gly Tyr Tyr Thr Val Thr Gly Leu Glu
145 150 155 160
Pro Gly Ile Asp Tyr Asp Ile Ser Val Ile Thr Leu Ile Asn Gly Gly
165 170 175
Glu Ser Ala Pro Thr Thr Leu Thr Gln Gln Thr Ala Val Pro Pro Pro
180 185 190
Thr Asp Leu Arg Phe Thr Asn Ile Gly Pro Asp Thr Met Arg Val Thr
195 200 205
Trp Ala Pro Pro Pro Ser Ile Glu Leu Thr Asn Leu Leu Val Arg Tyr
210 215 220
Ser Pro Val Lys Asn Glu Glu Asp Val Ala Glu Leu Ser Ile Ser Pro
225 230 235 240
Ser Asp Asn Ala Val Val Leu Thr Asn Leu Leu Pro Gly Thr Glu Tyr
245 250 255
Leu Val Ser Val Ser Ser Val Tyr Glu Gln His Glu Ser Ile Pro Leu
260 265 270
Arg Gly Arg Gln Lys Thr Gly Leu Asp Ser Pro Thr Gly Phe Asp Ser
275 280 285
Ser Asp Val Thr Ala Asn Ser Phe Thr Val His Trp Val Ala Pro Arg
290 295 300
Ala Pro Ile Thr Gly Tyr Ile Ile Arg His His Ala Glu His Ser Ala
305 310 315 320
Gly Arg Pro Arg Gln Asp Arg Val Pro Pro Ser Arg Asn Ser Ile Thr
325 330 335
Leu Thr Asn Leu Asn Pro Gly Thr Glu Tyr Ile Val Thr Ile Ile Ala
340 345 350
Val Asn Gly Arg Glu Glu Ser Pro Pro Leu Ile Gly Arg Ser Arg Ser
355 360 365
His His His His His His
370
<210> 37
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 37
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 38
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 38
Gly Gln Pro Lys Ala Asn Pro Thr Val Thr Leu Phe Pro Pro Ser Ser
1 5 10 15
Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp
20 25 30
Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro
35 40 45
Val Lys Ala Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn
50 55 60
Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys
65 70 75 80
Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val
85 90 95
Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 39
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 39
Leu Leu Gln Gly Gly
1 5
<210> 40
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 40
Leu Leu Gln Gly
1
<210> 41
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 41
Leu Ser Leu Ser Gln Gly
1 5
<210> 42
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 42
Gly Gly Gly Leu Leu Gln Gly Gly
1 5
<210> 43
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 43
Gly Leu Leu Gln Gly
1 5
<210> 44
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 44
Gly Ser Pro Leu Ala Gln Ser His Gly Gly
1 5 10
<210> 45
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 45
Gly Leu Leu Gln Gly Gly Gly
1 5
<210> 46
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 46
Gly Leu Leu Gln Gly Gly
1 5
<210> 47
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 47
Gly Leu Leu Gln
1
<210> 48
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 48
Leu Leu Gln Leu Leu Gln Gly Ala
1 5
<210> 49
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 49
Leu Leu Gln Gly Ala
1 5
<210> 50
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 50
Leu Leu Gln Tyr Gln Gly Ala
1 5
<210> 51
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 51
Leu Leu Gln Gly Ser Gly
1 5
<210> 52
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 52
Leu Leu Gln Tyr Gln Gly
1 5
<210> 53
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 53
Leu Leu Gln Leu Leu Gln Gly
1 5
<210> 54
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 54
Ser Leu Leu Gln Gly
1 5
<210> 55
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 55
Leu Leu Gln Leu Gln
1 5
<210> 56
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 56
Leu Leu Gln Leu Leu Gln
1 5
<210> 57
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая пептидная последовательность
<400> 57
Leu Leu Gln Gly Arg
1 5
<---
Реферат
Группа изобретений относится к медицине и касается конъюгата антитело-лекарственное средство для лечения субъекта с EDB+ FN-экспрессирующим злокачественным новообразованием, содержащего (a) антитело или его антигенсвязывающий фрагмент, которые связываются с дополнительным доменом В фибронектина (EDB+ FN), (b) линкер vc и (c) цитотоксический агент, где константная область тяжелой цепи содержит встроенный остаток цистеина в положении 290 (K290C) согласно нумерации индекса EU по Kabat, и где константная область легкой цепи содержит встроенный остаток цистеина в положении 183 (κK183C) согласно нумерации Kabat. Группа изобретений также касается фармацевтической композиции для лечения EDB+ FN-экспрессирующего злокачественного новообразования, содержащей указанный конъюгат антитело-лекарственное средство и фармацевтически приемлемый носитель; способа получения указанного конъюгата антитело-лекарственное средство. Группа изобретений обеспечивает лечение субъекта с EDB+ FN-экспрессирующим злокачественным новообразованием. 12 н. и 13 з.п. ф-лы, 11 ил., 25 табл., 13 пр.
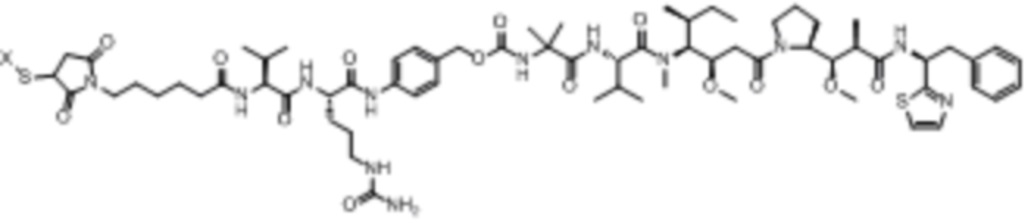
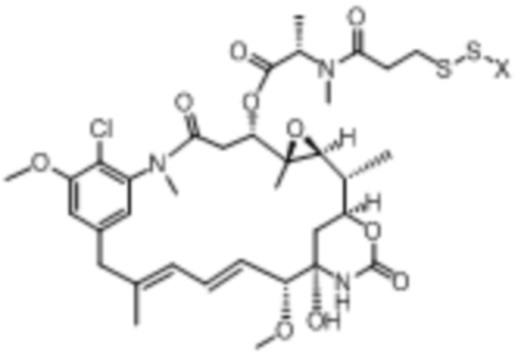
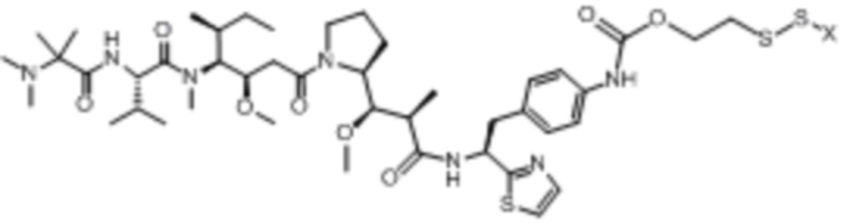


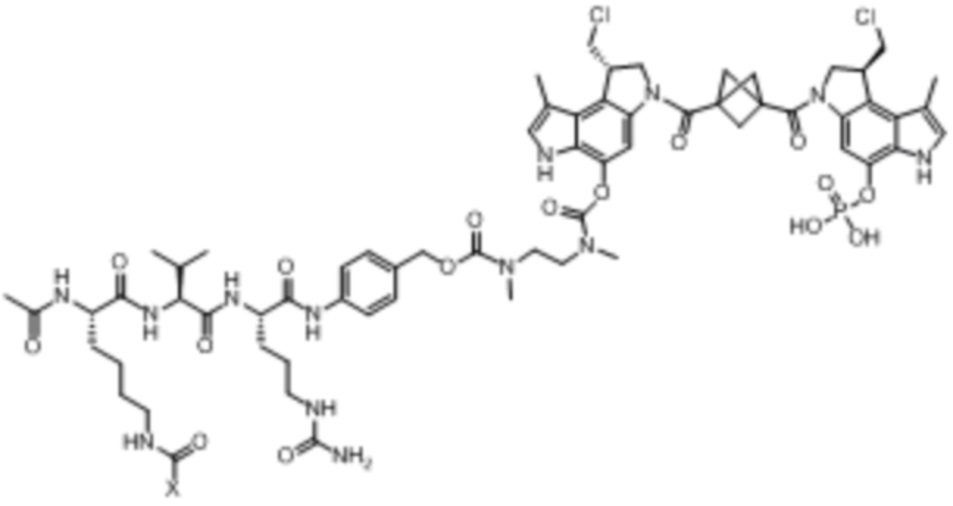


Комментарии