Антитела и иммуноконъюгаты и их применения - RU2639543C2
Код документа: RU2639543C2
Чертежи














































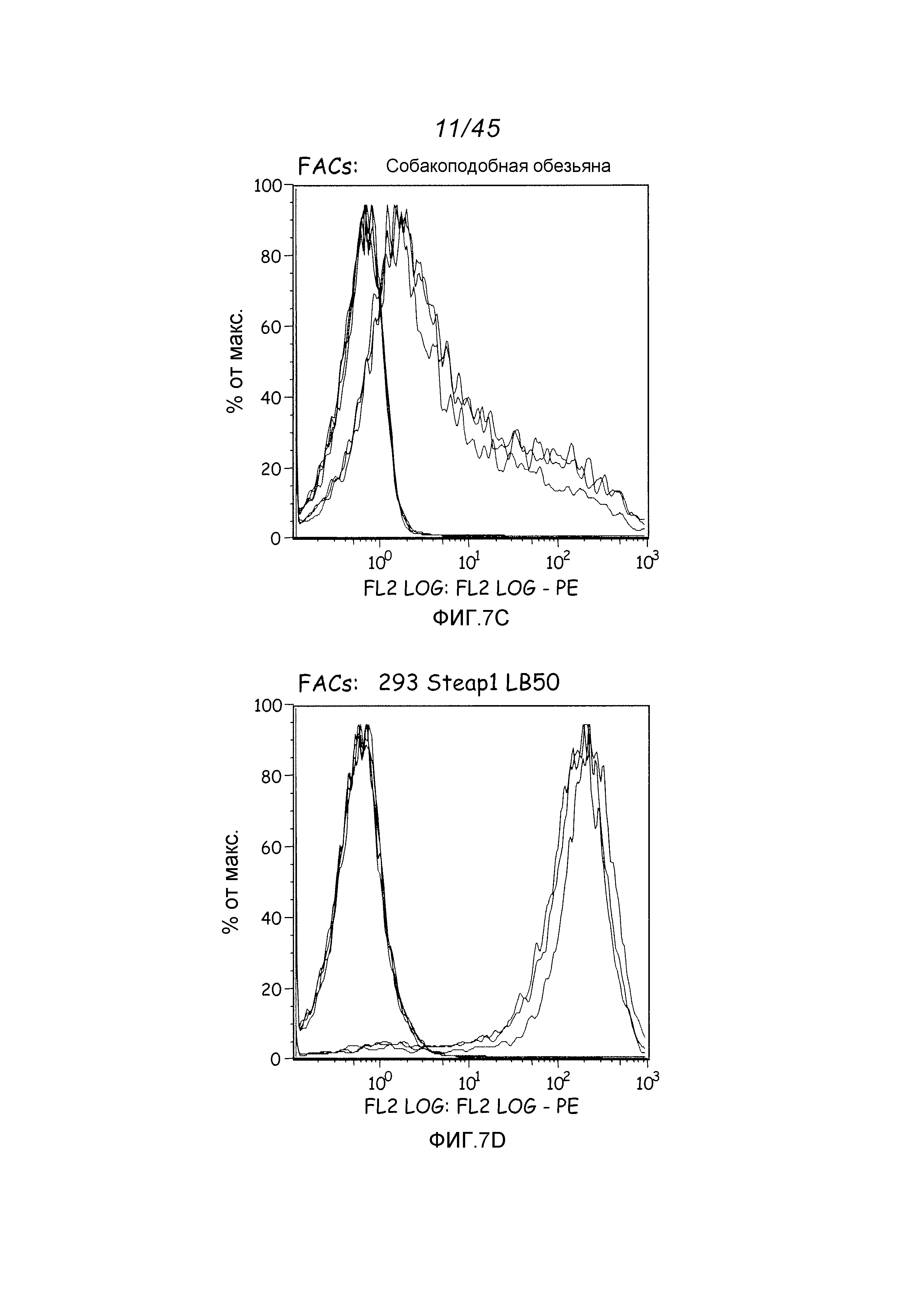




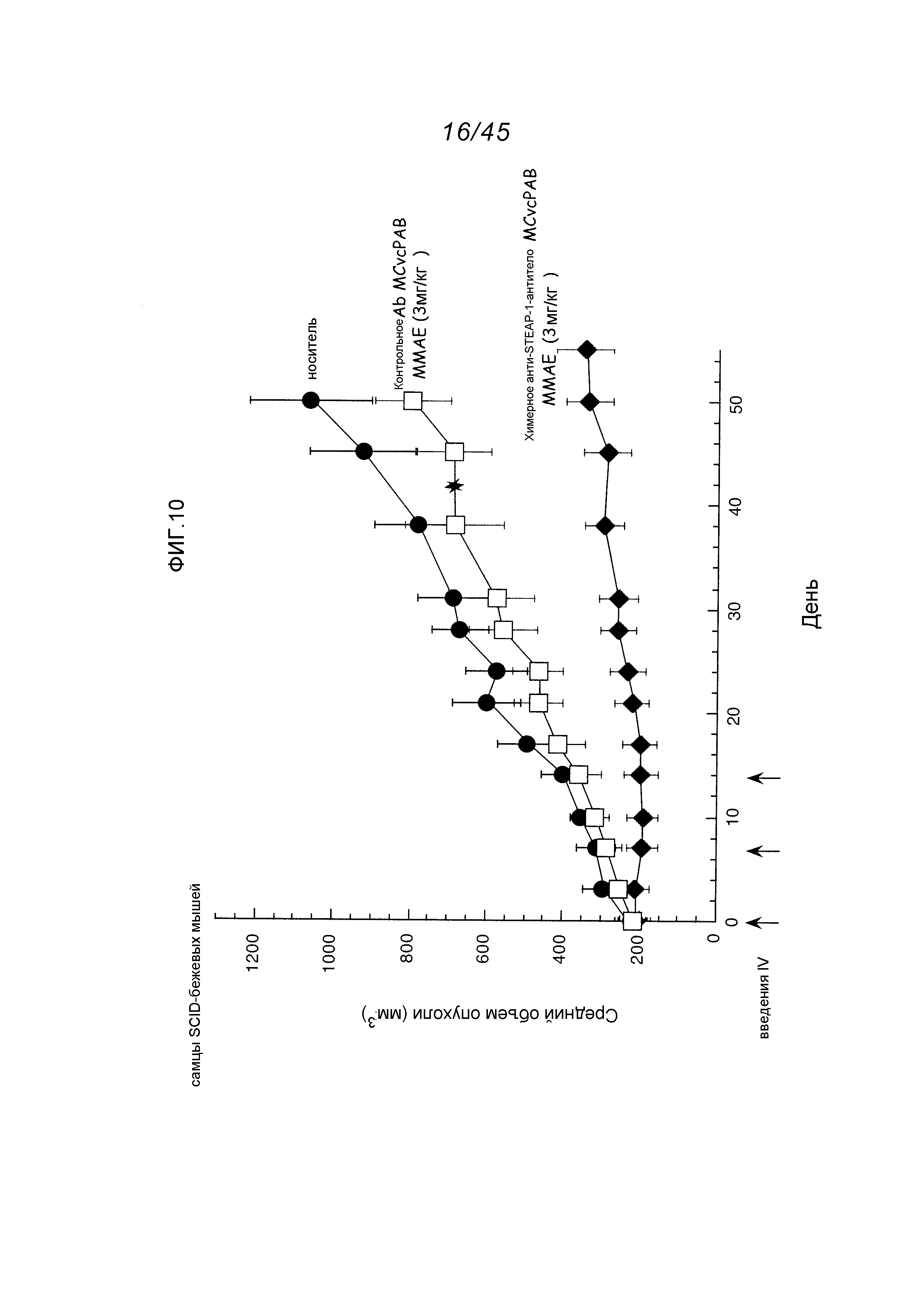



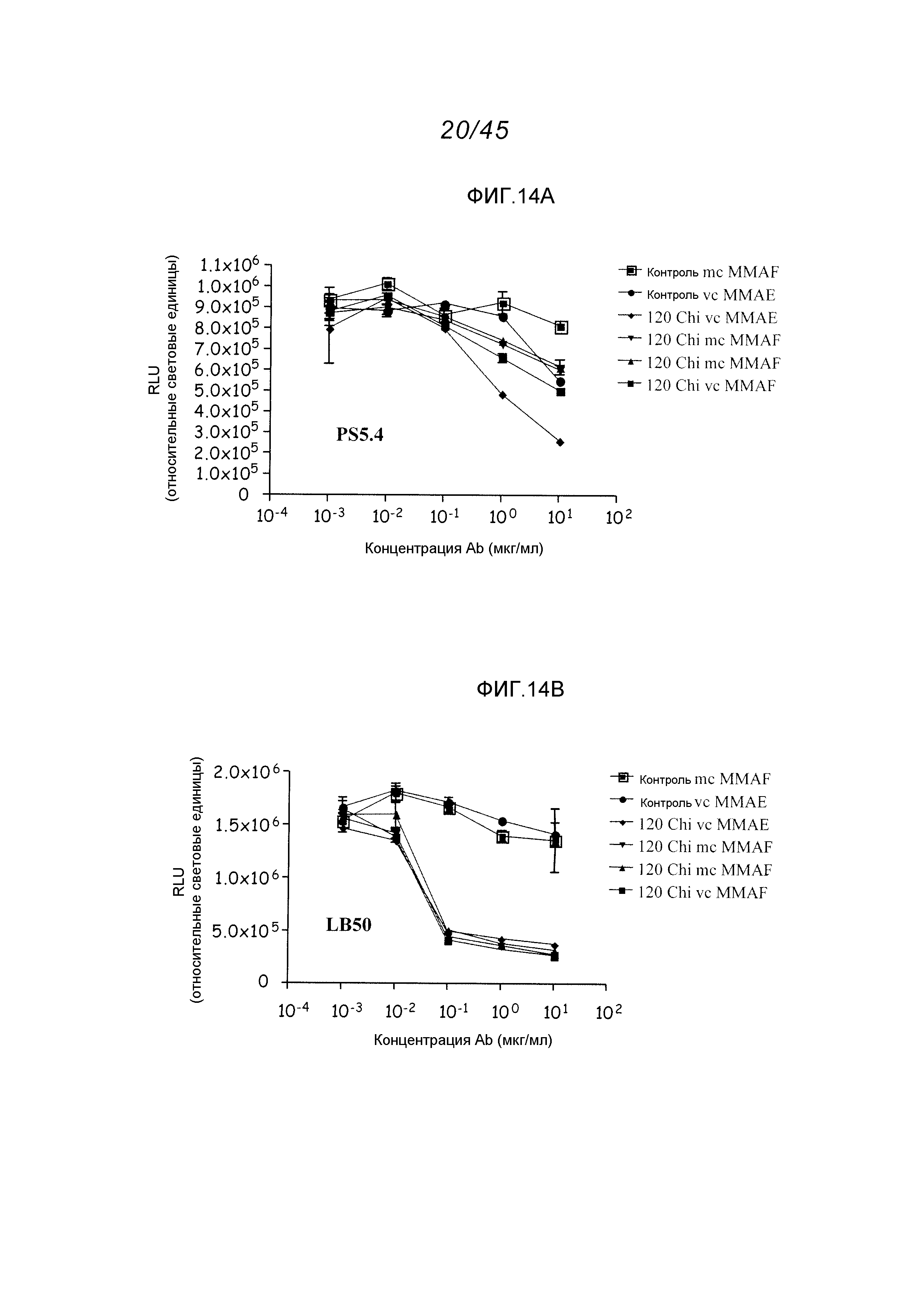

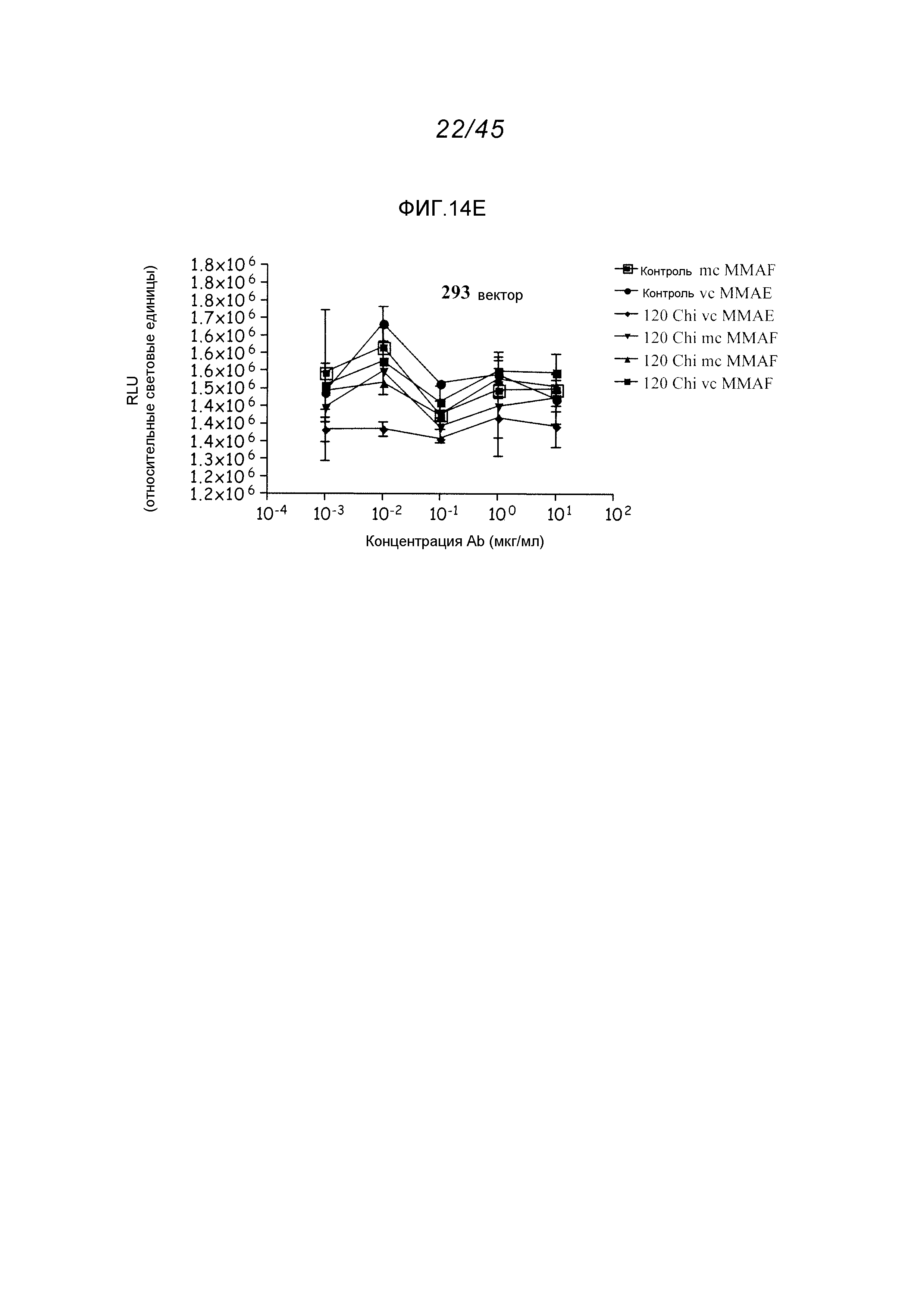















Описание
Область техники, к которой относится изобретение
Данное изобретение относится к анти-STEAP-1-антителам и их конъюгатам. Кроме того, изобретение относится к способам применения анти-STEAP-1-антител и их конъюгатов.
Уровень техники
У человека рак предстательной железы является одной из наиболее часто диагностируемых злокачественных опухолей у мужчин и является второй основной причиной рака, вызывающего смерть у мужчин. Американская ассоциация рака оценила, что в течение 2000 года будет диагностировано 180400 новых случаев рака предстательной железы, с 31900 смертными исходами от этого заболевания. На поздних стадиях, рак предстательной железы метастазирует в кость. Несмотря на достигнутые успехи в ранней диагностике и лечении локально ограниченных опухолей, рак предстательной железы после метастазирования является неизлечимым. У пациентов с метастазирующим раком предстательной железы при гормональной терапии будет в конечном счете развиваться не поддающееся лечению андрогеном (андроген-независимое) состояние, которое будет приводить к прогрессированию и смерти. В настоящее время простатический антиген (антиген предстательной железы) (PSA) является наиболее широко используемым опухолевым маркером для скрининга, диагностики и мониторинга рака предстательной железы. Однако широко распространенное применение PSA в качестве инструмента для скрининга является дискуссионным, так как PSA не дает возможности точно отличить доброкачественное заболевание предстательной железы от злокачественного.
В зависимости от стадии, лечение рака предстательной железы и мочевого пузыря включает в себя одно из следующих терапевтических воздействий или их комбинацию: хирургии для удаления раковой ткани, лучевой терапии, химиотерапии, депривации андрогена (например, гормональной терапии) в случае рака предстательной железы. Хотя хирургия или лучевая терапия существенно улучшают выживаемость пациентов с ранними стадиями этого заболевания, терапевтические возможности ограничены для запущенных случаев, в частности, для рецидивов опухолей после гормонального удаления. У большинства пациентов, которые подвергаются гормональной терапии, прогрессирует развитие андроген-независимого заболевания. В настоящее время нет эффективного лечения для 20-40% пациентов с раком предстательной железы, у которых развивается рецидивирующее заболевание после хирургии или лучевой терапии, или для пациентов, у которых обнаружены метастазы в момент установления диагноза. Химиотерапия имеет токсичные побочные действия, особенно у пожилых пациентов. Развитие новых форм терапии, особенно для заболевания, не поддающегося лечению депривацией андрогена, крайне необходимо для лечения рака предстательной железы.
Был идентифицирован новый антиген клеточной поверхности, STEAP-1 (см. патент США № 6329503). STEAP-1 является членом семейства поверхностных серпентиноподобных трансмембранных антигенов. Он экспрессируется преимущественно при раке предстательной железы, и, следовательно, члены этого семейства были названы “STEAP-1” (Шестидоменные Трансмембранные Эпителиальные Антигены Простаты). Белки STEAP человека обнаруживают высокую степень структурной консервативности в этом семействе, но не обнаруживают существенной структурной гомологии с каким бы то ни было из известных белков человека. По-видимому, STEAP-1 является мембранным белком типа IIIa, экспрессируемым преимущественно в клетках предстательной железы в тканях здорового человека. Структурно STEAP-1 является состоящим из 339 аминокислот белком, характеризующимся молекулярной топологией из шести трансмембранных доменов и внутриклеточных N- и С-концов, что позволяет предположить, что он уложен «серпентиноподобным» образом в три внеклеточные и две внутриклеточные петли. Экспрессия белка STEAP-1 поддерживается на высоком уровне при различных состояниях рака предстательной железы. STEAP-1 сверхэкспрессируется в высокой степени и при других типах рака у человека, таких как рак легкого и ободочной кишки. Были индуцированы мышиные антитела к фрагментам STEAP-1 человека, и было показано, что эти антитела связывают STEAP-1 на клеточной поверхности (см. патент США № 20040253232А1).
Терапия на основе антител оказалась очень эффективной в лечении различных типов рака. Например, HERCEPTIN® и RITUXAN® (оба из Genentech, S. San Francisco) успешно использовались для лечения рака молочной железы и не-ходжкинской лимфомы, соответственно. HERCEPTIN® является гуманизированным моноклональным антителом, полученным из рекомбинантной ДНК, и это антитело селективно связывается с внеклеточным доменом протоонкогена рецептора 2 эпидермального фактора роста (HER2) человека. Сверхэкспрессия HER2 наблюдается в 25-30% первичных раковых опухолей молочной железы. RITUXAN® является генетически сконструированным моноклональным химерным мышь/человек антителом, направленным против антигена CD20, обнаруживаемого на поверхности нормальных и злокачественных В-лимфоцитов. Оба эти антитела продуцируются в клетках СНО.
Применение конъюгатов антитело-лекарственное средство для локальной доставки цитотоксических и цитостатических агентов, т.е. лекарственных средств для уничтожения или ингибирования опухолевых клеток, в лечении рака (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26:151-172; Патент США 4975278) дает возможность нацеленной доставки лекарственной части молекулы в опухоль и внутриклеточного накопления в ней, когда системное введение этих неконъюгированных лекарственных агентов может приводить к неприемлемым уровням токсичности в отношении нормальных клеток, а также клеток опухоли, которые должны быть элиминированы (Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986):603-05; Thrope, (1985) “Antinody Carriers Of Cytotoxic Agents In Cancer Therapy: A Rewiew,” in Monoclonal Antibodies ’84: Biological And Clinical Applications, A. Pinchera et al., (eds), pp. 475-506). Посредством этого добиваются максимальной эффективности с минимальной токсичностью. Сообщалось, что как поликлональные, так и моноклональные антитела применимы в этих стратегиях (Rowland et al., (1986) Cancer Immunol. Immunother., 21:183-87). Лекарственные средства, используемые в этих способах, включают в себя даунорубицин, доксорубицин, метотрексат и виндесин (Rowland et al., Cancer Immunol. Immunother., 21:183-87 (1986)). Токсины, используемые в конъюгатах антитело-токсин, включают в себя бактериальные токсины, такие как дифтерийный токсин, токсины растений, такие как рицин, токсины с малыми молекулами, такие как гелданамицин (Kerr et al. (1997) Bioconjugate Chem. 8(6):781-784; Mandler et al. (2000) Journal of the Nat. Cancer Inst. 92(19): 1573-1581; Mandler et al. (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al. (2000) Bioconjugate Chem. 13:786-791), майтансиноиды (ЕР 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) и калихеамицин (Lode et al. (1998) Cancer Res. 58:2928; Hinman et al. (19933) Cancer Res. 53:3336-3342). Эти токсины могут выполнять их цитотоксическое и цитостатическое действия с использованием механизмов, включающих в себя связывание тубулина, связывание ДНК или ингибирование топоизомеразы (Meyer, D.L. and Senter, P.D. “Recent Advances in Antibody Drug Conjugates for Cancer Therapy” in Annual Reports in Medicnal Chemistry, Vol 38 (2003) Chapter 23, 229-237). Некоторые терапевтические лекарственные средства имеют тенденцию быть неактивными или менее активными при конъюгации с большими антителами или лигандами рецепторов белков.
ZEVALIN® (ибритумомаб тиуксетан, Biogen/Idec) является конъюгатом антитело-радиоизотоп, состоящим из мышиного IgG1 каппа моноклонального антитела, направленного против антигена CD20, обнаруживаемого на поверхности нормальных и злокачественных В-лимфоцитов, и радиоизотопа111In или90Y, связанного линкером-хелатором тиомочевиной (Wiseman et al (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al (2002) Blood 99(12):4336-42; Witzig et al (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al (2002) J. Clin. Oncol. 20(15):3262-69). Хотя ZEVALIN имеет активность против В-клеточной не-ходжкинской лимфомы (NHL), введение приводит к тяжелым и пролонгированным цитопениям у большинства пациентов. MYLOTARG™ (гемтуцумаб озогамицин, Wyeth Pharmaceuticals), конъюгат антитело-лекарственное средство, состоящее из huCD33-антитела, связанного с калихеамицином, был одобрен в 2000 году для лечения острого миелоидного лейкоза посредством инъекции (Drugs of the Future (2000) 25(7):686; Патенты США с номерами 4970198; 5079233; 5585089; 5606040; 5693762; 5739116; 5767285; 5773001). Кантуцумаб мертансин (Immunogen, Inc.), конъюгат антитело-лекарственное средство, состоящий из антитела huC242, связанного через дисульфидный линкер SPP с частью майтансиноидного лекарственного средства, DM1, разрабатывается для лечения типов рака, которые экспрессируют антиген CanAg, таких как рак ободочной кишки, рак поджелудочной железы, рак желудка и другие. MLN-2704 (Millennium Pharm., BZL Biologies, Immunogen Inc.), конъюгат антитело-лекарственное средство, состоящий из моноклонального антитела против специфического мембранного антигена (PSMA), связанного с частью майтансиноидного лекарственного средства, DM1, разрабатывается для потенциального лечения опухолей предстательной железы. Ту же самую часть майтансиноидного лекарственного средства, DM1, связывали через не-дисульфидный линкер, SMCC, с мышиным моноклональным антителом, TA.1 (Chari et al. (1992) Cancer Research 52: 127-131). Сообщалось, что этот конъюгат был в 200 раз более сильным, чем соответствующий конъюгат с дисульфидным линкером. Авторы этой ссылки считали, что линкер SMCC является “нерасщепляемым”.
Несколько коротких пептидных соединений были выделены из морского моллюска, Dolabella auricularia, и было обнаружено, что они имеют биологическую активность (Pettit et al (1993) Tetrahedron 49:9151; Nakamura et al (1995) Tetrahedron Letters 36:5059-5062; Sone et al (1995) Journal Org Chem. 60:4474). Были также получены аналоги этих соединений, и было обнаружено, что некоторые из них имеют биологическую активность (см. обзор Pettit et al (1998) Anti-Cancer Drug Design 13:243-277). Например, ауристатин E (US 5635483) является синтетическим аналогом морского природного продукта Доластатина 10, агента, который ингибирует полимеризацию тубулина связыванием с тем же сайтом на тубулине, что и противораковое лекарственное средство винкристин (G. R. Pettit, (1997) Prog. Chem. Org. Nat. Prod. 70: 1-79). Доластатин 10, ауристатин PE и ауристатин E являются линейными пептидами, имеющими 4 аминокислоты, три из которых являются уникальными для класса соединений доластатина, и С-концевой амид.
Эти ауристатиновые пептиды, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги доластатина, конъюгировали: (i) с химерными моноклональными антителами cBR96 (специфичными в отношении Lewis Y на карциномах); (ii) с cAC10, которые специфичны в отношении CD30 при гематологических злокачественных заболеваниях (Klussman, et al (2004), Bioconjugate Chemistry 15(4):765-773; Doronina et al (2003) Nature Biotechnology 21 (7):778-784; "Monomethylvaline Compounds Capable of Conjugation to Ligands"; Francisco et al (2003) Blood 102(4):1458- 1465; US 2004/0018194; (iii) анти-CD20-антителами, такими как RITUXAN® (ритуксимаб) (WO 04/032828), для лечения CD20-экспрессирующих раковых заболеваний и иммунных нарушений; (iv) анти-EphB2-антителами 2H9 и анти-IL-8-антителами для лечения колоректального рака (Mao, et al (2004) Cancer Research 64(3):781-788); (v) E-селектин-антителом (Bhaskar et al (2003) Cancer Res. 63:6387-6394); и (vi) другими анти-CD30-антителами (WO 03/043583). Монометилауристатин (MMAE) был также конъюгирован с 2H9, антителом против EphB2R, являющимся рецептором тирозинкиназы типа 1 TM с близкой гомологией между мышью и человеком и сверхэкспрессируется в клетках колоректального рака (Mao et al (2004) Cancer Res. 64:781-788).
Сообщалось, что монометилауристатин MMAF, вариант ауристатина E (MMAE) с фенилаланином на С-конце (US 5767237; US 6124431), является менее эффективным, чем MMAE, но более эффективным при конъюгации с моноклональными антителами (Senter et al, Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623, presented March 28, 2004). Ауристатин F фенилендиамин (AFP); вариант с фенилаланином MMAE связывали с анти-CD70-mAb, 1F6, через С-конец посредством фенилендиаминового спейсера (Law et al, Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 625, presented March 28, 2004).
В данной области существует потребность в дополнительных лекарственных средствах для лечения различных типов рака, таких как раковые опухоли и метастазы раковых опухолей в предстательной железе, легком и ободочной кишке. Особенно полезные лекарственные средства для этой цели включают в себя нацеленные на клетки предстательной железы, легкого или ободочной кишки конъюгаты анти-STEAP-1-антитело-лекарственное средство, имеющие более низкую токсичность, но все еще полезную терапевтическую эффективность. Данное изобретение нацелено на эти и другие ограничения и проблемы, имеющиеся в прошлом.
Цитирование любой ссылки в этой заявке не является признанием того, что эта ссылка является прототипом этой заявки. Все цитированные здесь ссылки, в том числе патенты, заявки на патенты и публикации включены в качестве ссылки в их полном виде.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Это изобретение обеспечивает анти-STEAP-1-антитела и способы их применения.
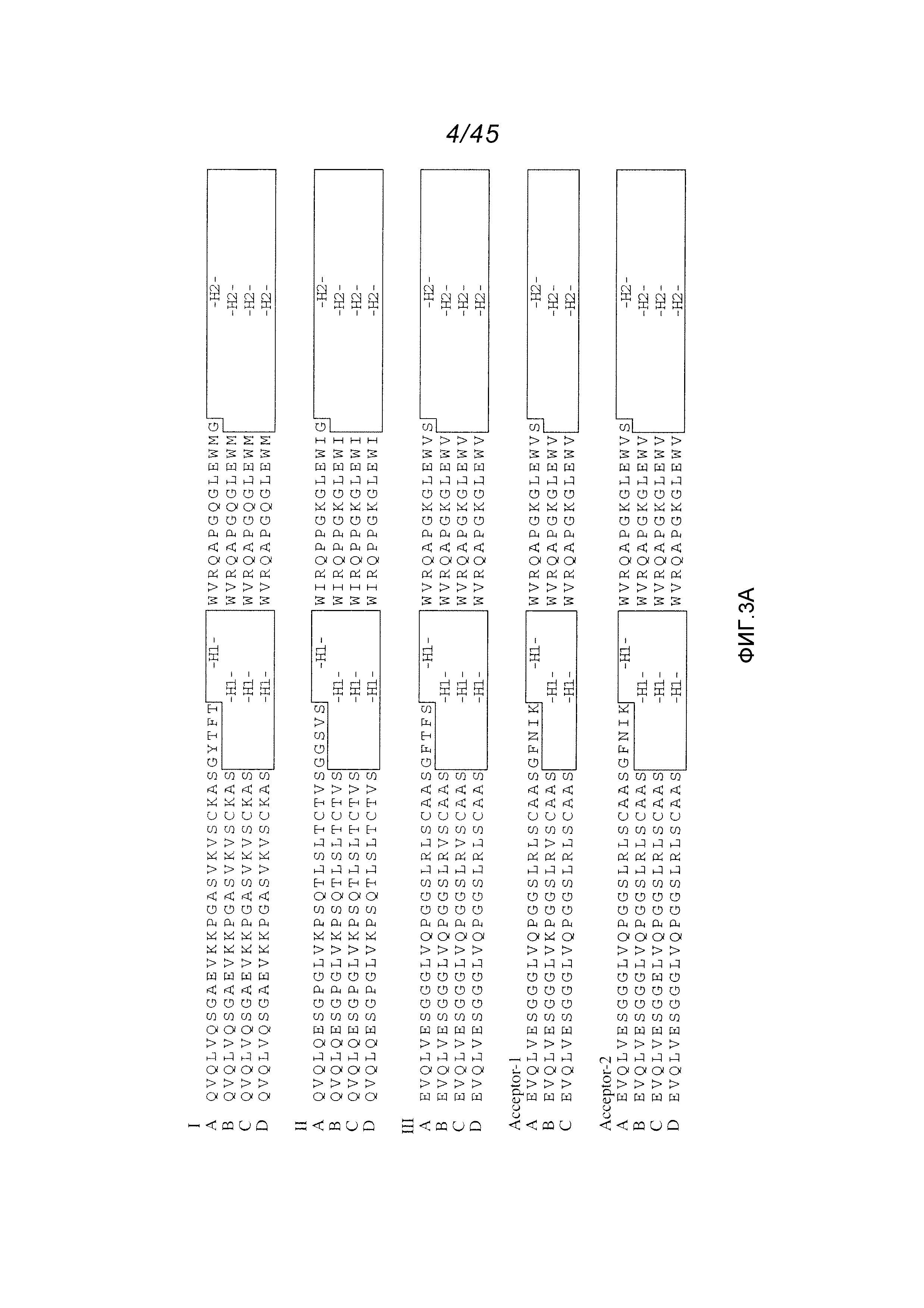
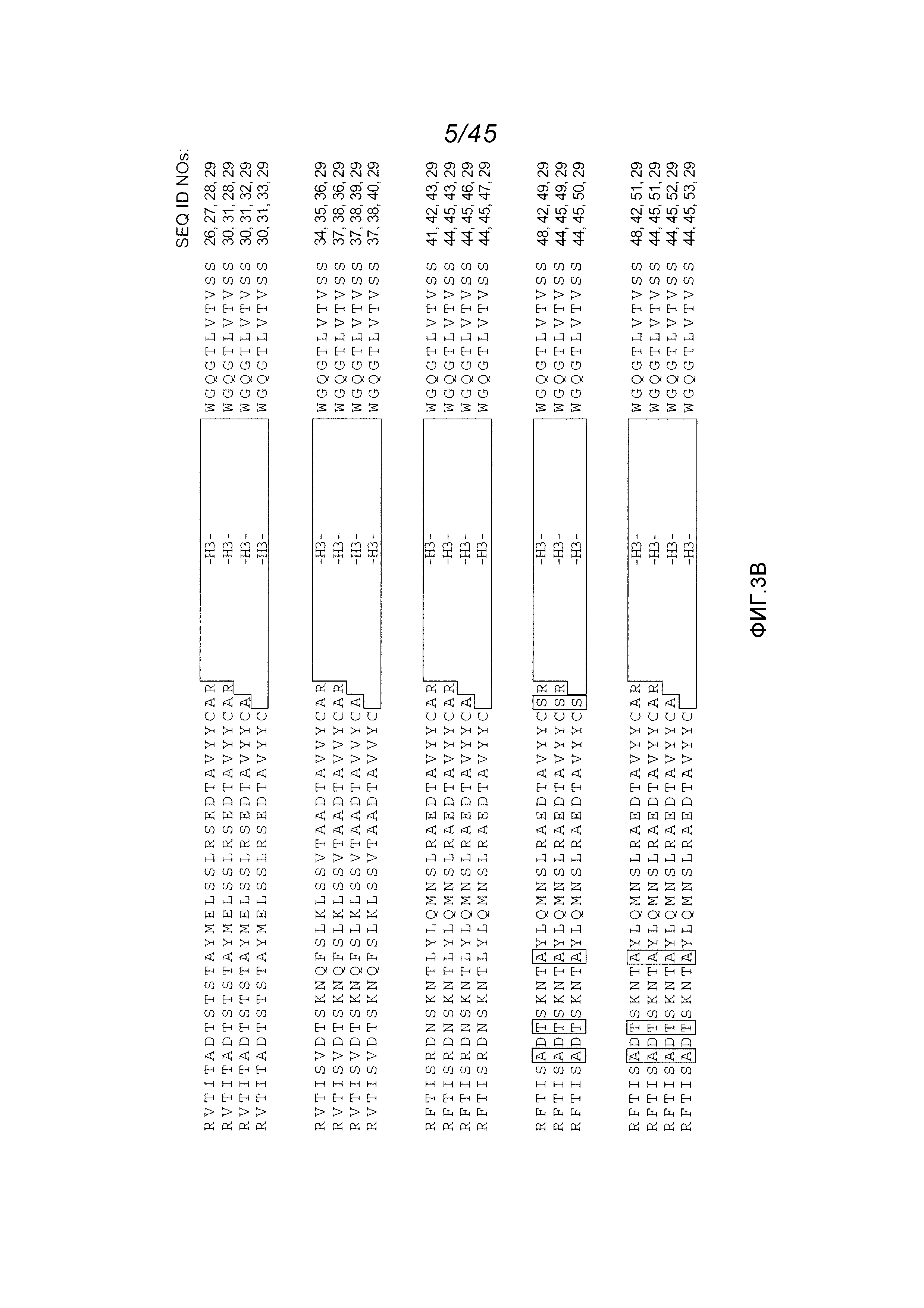
В одном аспекте, обеспечено антитело, которое связывается с STEAP-1, причем это антитело содержит вариабельный домен легкой цепи, содержащий аминокислотную последовательность, показанную на фигуре 2А (SEQ ID NO:6), или вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность, показанную на фигуре 2В (SEQ ID NO:9). В одном аспекте, обеспечено антитело, которое связывается с STEAP-1, причем это антитело содержит вариабельный домен легкой цепи, содержащий аминокислотную последовательность, показанную на фигуре 2А (SEQ ID NO:6), и вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность, показанную на фигуре 2В (SEQ ID NO:9).
В одном аспекте, обеспечено антитело, которое связывается с STEAP-1, причем это антитело содержит вариабельный домен тяжелой цепи, имеющий по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:9 или 10. В одном варианте осуществления, это антитело содержит каркасную область 1 вариабельного домена тяжелой цепи SEQ ID NO:9 или 10. В одном варианте осуществления, это антитело содержит каркасную область 1 вариабельного района тяжелой цепи SEQ ID NO:25 или каркасную область 2 вариабельного района тяжелой цепи SEQ ID NO:75 или 76 или 77 или каркасную область 3 вариабельного района тяжелой цепи SEQ ID NO:78 или 79.
В одном аспекте, это антитело содержит вариабельный домен легкой цепи, имеющий по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:6. В одном варианте осуществления, это антитело содержит вариабельный домен легкой цепи SEQ ID NO:6.
В одном аспекте, обеспечено антитело, которое связывается с STEAP-1, причем это антитело содержит вариабельный домен тяжелой цепи, имеющий по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:9 или 10. В одном варианте осуществления, это антитело содержит каркасную область 1 вариабельного домена тяжелой цепи SEQ ID NO:9 или 10. В одном варианте осуществления, это антитело содержит каркасную область 1 вариабельного района тяжелой цепи SEQ ID NO:25 или каркасную область 2 вариабельного района тяжелой цепи SEQ ID NO:75 или 76 или 77 или каркасную область 3 вариабельного района тяжелой цепи SEQ ID NO:78 или 79. В одном варианте осуществления, это антитело дополнительно содержит вариабельный домен легкой цепи, имеющий по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:6. В одном варианте осуществления, это антитело содержит вариабельный домен легкой цепи SEQ ID NO:6.
В некоторых вариантах осуществления, обеспечен полинуклеотид, кодирующий любое из вышеуказанных антител. В одном варианте осуществления, обеспечен вектор, содержащий этот полинуклеотид. В одном варианте осуществления, обеспечена клетка-хозяин, содержащая этот вектор. В одном варианте осуществления, эта клетка-хозяин является эукариотической. В одном варианте осуществления, этой клеткой-хозяином является клетка яичника китайского хомячка (СНО). В одном варианте осуществления, обеспечен способ получения анти-STEAP-1-антитела, причем этот способ предусматривает культивирование клетки-хозяина при условиях, подходящих для экспрессии полинуклеотида, кодирующего это антитело, и выделение этого антитела.
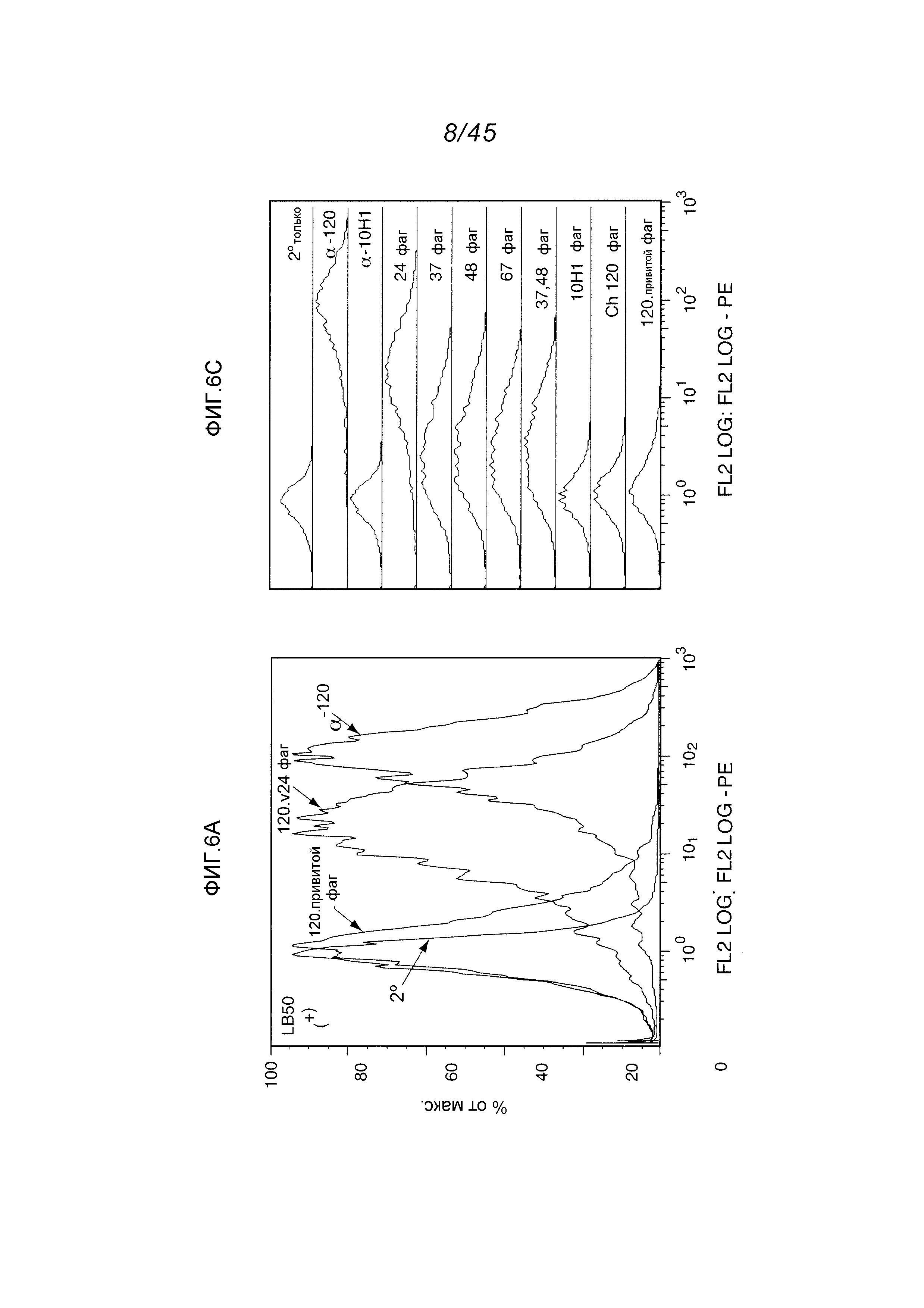
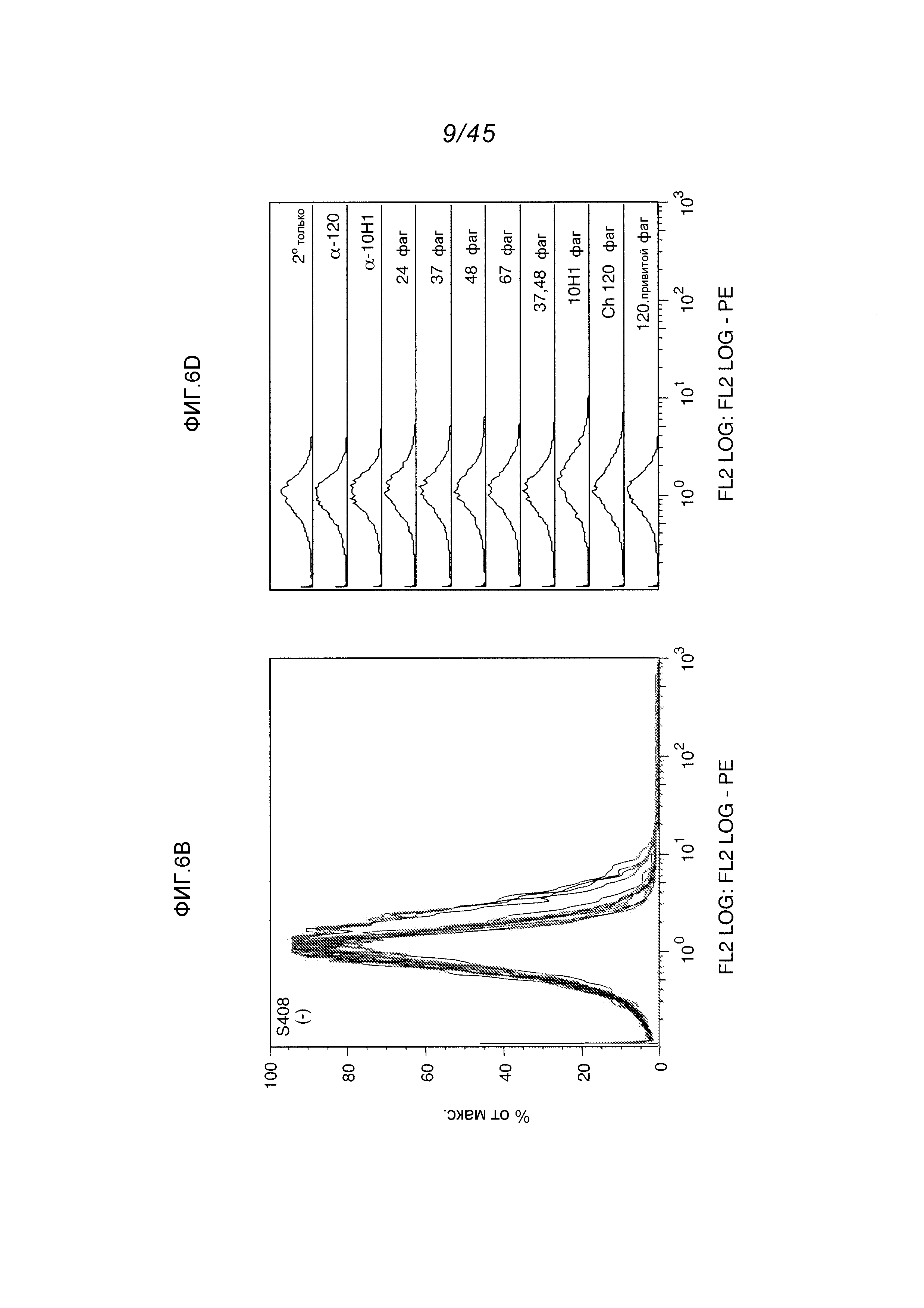
В одном аспекте, обеспечено антитело, которое связывается с STEAP-1, экспрессируемым на поверхности клетки. В одном варианте осуществления, это антитело связывается с эпитопом в районе STEAP-1 человека или мыши. В одном варианте осуществления, эта клетка является клеткой млекопитающего. В одном варианте осуществления, эта клетка является клеткой человека. В одном варианте осуществления, эта клетка является раковой клеткой. В одном варианте осуществления, эта клетка является клеткой предстательной железы, легкого или ободочной кишки. В одном варианте осуществления, эта раковая клетка является клеткой рака предстательной железы. В другом варианте осуществления, эта клетка является клеткой из метастаза первичного рака предстательной железы, легкого или ободочной кишки.
В некоторых вариантах осуществления, любое из вышеуказанных антител является моноклональным антителом. В одном варианте осуществления, это антитело является фрагментом антитела, выбранным из фрагментов Fab, Fab’-SH, Fv, scFv или (Fab’)2. В одном варианте осуществления, это антитело является гуманизированным. В одном варианте осуществления, это антитело является антителом человека.
В одном аспекте, обеспечен способ детектирования присутствия STEAP-1 в биологической пробе, причем этот способ предусматривает контактирование биологической пробы с любым из вышеуказанных антител при условиях, пермиссивных для связывания этого антитела с STEAP-1, и детектирование, образуется ли комплекс между этим антителом и STEAP-1. В одном варианте осуществления, эта биологическая проба является пробой из млекопитающего, испытывающего или предположительно испытывающего нарушение клеток предстательной железы и/или клеточно-пролиферативное нарушение клеток или тканей, включающее в себя рак предстательной железы, легкого, ободочной кишки, мочевого пузыря и яичника и саркому Юинга, а также метастазы первичного рака предстательной железы, легкого, ободочной кишки, мочевого пузыря и яичника и саркомы Юинга. См., например, патент США No. 6329503; и Rodeberg, D.A. et al., Clin. Cancer Res. 11(12):4545-4552 (2005).
В одном аспекте, обеспечен способ диагностики клеточно-пролиферативного нарушения, ассоциированного с увеличенной экспрессией STEAP-1, предусматривающий контактирование тест-клетки с любым из вышеуказанных антител; определение уровня экспрессии STEAP-1 детектированием связывания этого антитела с STEAP-1 и сравнение уровня экспрессии STEAP-1 этой тест-клеткой с уровнем экспрессии STEAP-1 контрольной клеткой, причем более высокий уровень экспрессии STEAP-1 тест-клеткой в сравнении с контрольной клеткой указывает на присутствие клеточно-пролиферативного нарушения, ассоциированного с увеличенной экспрессией STEAP-1. В одном варианте осуществления, этой тест-клеткой является клетка из пациента, предположительно имеющего клеточно-пролиферативное нарушение, такое как пролиферативное нарушение предстательной железы. В одном варианте осуществления, этот способ предусматривает определение уровня экспрессии STEAP-1 на поверхности тест-клетки (такой как, например, раковая клетка предстательной железы) и сравнение уровня экспрессии STEAP-1 на поверхности тест-клетки с уровнем экспрессии STEAP-1 на поверхности контрольной клетки (такой как, например, нормальная клетка предстательной железы, другая, чем ненормально пролиферирующая клетка предстательной железы).
В одном аспекте, обеспечен способ диагностики клеточно-пролиферативного нарушения, ассоциированного с увеличением клеток, таких как клетки предстательной железы, экспрессирующие STEAP-1, предусматривающий контактирование тест-клеток в биологической пробе с любым из вышеуказанных антител; определение уровня антитела, связанного в тест-клетками в пробе, детектированием связывания этого антитела с STEAP-1 и сравнения этого уровня антитела, связанного с клетками в контрольной пробе, причем этот уровень связанного антитела нормализуют относительно количества STEAP-1-экспрессирующих клеток в тест-пробе и контрольной пробе, причем более высокий уровень связанного антитела в тест-пробе в сравнении с контрольной пробой указывает на присутствие клеточно-пролиферативного нарушения, ассоциированного с клетками, экспрессирующими STEAP-1.
В одном аспекте, обеспечен способ детектирования растворимого STEAP-1 в крови или сыворотке, предусматривающий контактирование тест-пробы крови или сыворотки из млекопитающего, предположительно испытывающего клеточно-пролиферативное нарушение предстательной железы, с анти-STEAP-1-антителом согласно изобретению и детектирование увеличения растворимого STEAP-1 в тест-пробе относительно контрольной пробы крови или сыворотки из здорового млекопитающего. В одном варианте осуществления, этот способ детектирования применим в качестве способа диагностики клеточно-пролиферативного нарушения предстательной железы, ассоциированного с увеличением растворимого STEAP-1 в крови или сыворотке млекопитающего.
В одном аспекте, антитела согласно изобретению включают в себя цистеин-встроенные антитела, где одна или несколько аминокислот исходного антитела заменены свободной аминокислотой цистеином, как описано в WO2006/034488 (включенном здесь в качестве ссылки в полном виде). Цистеин-встроенное антитело содержит одну или несколько аминокислот в виде свободного цистеина, имеющего величину реакционной способности (реактивности) тиола в диапазоне 0,6–1,0. Аминокислота свободный цистеин является остатком цистеина, который был встроен в исходное антитело и не является частью дисульфидного мостика. Цистеин-встроенные антитела применимы для присоединения цитотоксических и/или визуализирующих соединений в сайте встроенного цистеина, например, через малеимид или галогенацетил. Нуклеофильная реакционная способность (реактивность) тиоловой группы остатка цистеина с малеимидной группой является приблизительно в 1000 раз более высокой в сравнении с группой любой другой аминокислоты в белке, такой как аминогруппа остатков лизина или N-концевая аминогруппа. Тиол-специфическая функциональная группа в иодацетильных реагентах и малеимидных реагентах может взаимодействовать с аминными группами, но требуются более высокий рН (>9,0) и более продолжительные периоды времени реакции (Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London).
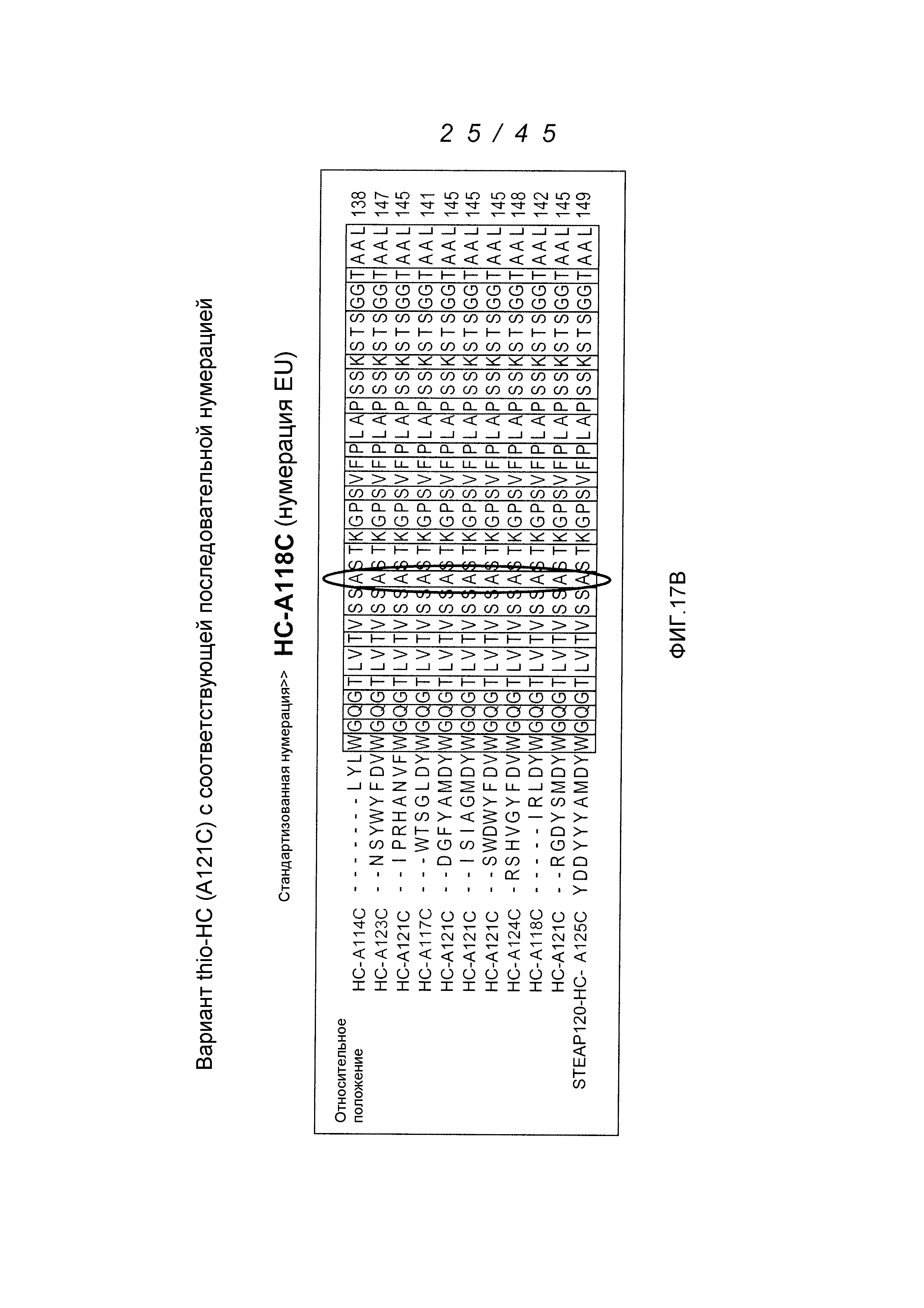
Цистеин-встроенные антитела могут быть применимы в лечении рака и включают в себя антитела, специфичные в отношении поверхностных и трансмембранных рецепторов и опухоль-ассоциированных антигенов (ТАА). Такие антитела могут быть использованы в виде «голых» антител (не конъюгированных с лекарственным средством или меткой) или в виде конъюгатов антитело-лекарственное средство (ADC). Цистеин-встроенные антитела согласно изобретению могут быть сайт-специфическими и эффективно связанными с тиол-реактивным реагентом. Этим тиол-реактивным реагентом может быть мультифункциональный линкерный реагент, захватывающий меченый реагент, содержащий флуорофор реагент или промежуточный продукт лекарственное средство-линкер. Это цистеин-встроенное антитело может быть помечено детектируемой меткой, иммобилизовано на твердофазном носителе и/или конъюгировано с лекарственным средством. Реакционная способность тиола может быть придана любому антителу, где замена аминокислот реакционноспособными аминокислотами (цистеинами) может быть получена в диапазонах в легкой цепи, выбранных из диапазонов аминокислот: L-10-L-20; L-38-L-48; L-105-L-115; L-139-L-149; L-163-L-173; и в диапазонах в тяжелой цепи, выбранных из диапазонов аминокислот: H-35-H-45; H-83-H-93; H-114-H-127 и H-170-H-184, и в Fc-районе в диапазонах, выбранных из H-268-H-291; H-319-H-344; H-370-H-380 и H-395-H-405, где нумерация положений аминокислот начинается от положения 1 системы нумерации Кабата (Kabat et al. (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD) и продолжается последовательно после этого, как описано в WO 2006/034488. Реакционная способность тиола может быть также придана определенным доменам антитела, таким как константный домен легкой цепи (CL) и константные домены тяжелой цепи, CH1, CH2 и CH3. Цистеиновые замены, приводящие к величинам реакционной способности тиола 0,6 и более, могут быть получены в константных доменах тяжелой цепи α, δ, ε, γ и μ интактных антител: IgA, IgD, IgE, IgG и IgM, соответственно, в том числе в подклассах IgG: IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Такие антитела и их применения описаны в WO 2006/034488.
Цистеин-встроенные антитела согласно изобретению предпочтительно сохраняют антигенсвязывающую способность их копий дикого типа, исходных антител. Таким образом, цистеин-встроенные антитела способны связываться, предпочтительно специфически, с антигенами. Такие антигены включают в себя, например, опухоль-ассоциированные антигены (ТАА), поверхностные рецепторные белки и другие поверхностные молекулы клеток, трансмембранные белки, белки передачи сигналов, регуляторные факторы выживания клеток, регуляторные факторы пролиферации клеток, молекулы, ассоциированные с развитием или дифференцировкой ткани (например, молекулы, о которых известно или предполагается, что они способствуют функционально развитию или дифференцировке ткани), лимфокины, цитокины, молекулы, участвующие в регуляции клеточного цикла, молекулы, участвующие в образовании и развитии сосудов, и молекулы, ассоциированные с ангиогенезом (например, молекулы, о которых известно или предполагается, что они способствуют функционально ангиогенезу).
Антитело согласно изобретению может быть конъюгировано с другими тиол-реактивными агентами, в которых реактивной группой является, например, малеимид, иодацетамид, пиридилдисульфид или другой тиол-реактивный партнер конъюгации (Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Hermanson, G. in Bioconjugate Techniques (1996) Academic Press, San Diego, pp. 40-55, 643-671). Этим партнером может быть цитотоксический агент (например, токсин, такой как доксорубицин или коклюшный токсин), флуорофор, такой как флуоресцентный краситель, такой как флуоресцеин или родамин, хелатобразующий агент для визуализации или радиотерапевтического металла, пептидильная или непептидильная метка или метка детектирования или модифицирующий клиренс агент, такой как различные изомеры полиэтиленгликоля, пептид, который связывается с третьим компонентом, или другой углеводный или липофильный агент.
В одном аспекте, антитела согласно изобретению могут быть конъюгированы с любым фрагментом, который может быть ковалентно присоединен к антителу через реактивный фрагмент, активированный фрагмент или реакционноспособную тиоловую группу цистеина. (Singh et al (2002) Anal. Biochem. 304: 147-15; Harlow E. and Lane, D. (1999) Using Antibodies: A Laboratory Manual, Cold Springs Harbor Laboratory Press, Cold Spring Harbor, NY; Lundblad R.L. (1991) Chemical Reagents for Protein Modification, 2nd ed. CRC Press, Boca Raton, FL). Эта присоединенная метка может функционировать для: (i) обеспечения детектируемого сигнала; (ii) взаимодействия со второй меткой для модификации детектируемого сигнала, обеспечиваемого первой или второй меткой, например, для образования FRET (передачи энергии резонанса флуоресценции); (iii) стабилизации взаимодействий или увеличения аффинности связывания, с антигеном или лигандом; (iv) влияния на подвижность, например, электрофоретическую подвижность или проникаемость в клетку, посредством заряда, гидрофобности, формы или других физических параметров, или (v) обеспечения захватывающей части, для модуляции аффинности лигандов, связывания антитело/антиген, или комплексообразования ионов.
Меченые цистеин-встроенные антитела могут быть применимы в диагностических анализах, например, для детектирования экспрессии представляющего интерес антигена в конкретных клетках, тканях или сыворотке. Для диагностических применений, это антитело обычно метят детектируемой частью молекулы. Доступны многочисленные метки, которые могут быть обычно сгруппированы в следующие категории.
Радиоизотопы (радионуклиды), такие как3H,11C,14C,18F,32P,35S,64Cu,68Ga,86Y,99Tc,111In,123I,124I,125I,131I,133Xe,177Lu,211At или213Bi. Меченные радиоизотопом антитела применимы в экспериментах визуализации с нацеливанием с использованием рецептора. Это антитело может быть помечено реагентами-лигандами, которые связывают, хелатируют или иным образом образуют комплекс с радиоизотопным металлом, где этот реагент является реактивным с тиолом встроенного цистеина, с использованием способов, описанных в Current Protocols in Immunology, Volumes 1 and 2, Coligen et al, Ed. Wiley- Interscience, New York, NY, Pubs. (1991). Хелатобразующие лиганды, которые могут образовывать комплекс с ионом металла, включают в себя DOTA, DOTP, DOTMA, DTPA и TETA (Macrocyclics, Dallas, TX). Радионуклиды могут быть нацелены посредством комплексообразования с конъюгатами антитело-лекарственное средство согласно изобретению (Wu et al (2005) Nature Biotechnology 23(9): 1 137-1 146).
Линкерные реагенты, такие как DOTA-малеимид (4-малеимидобутирамидобензил-DOTA), могут быть получены реакцией аминобензил-DOTA с 4-малеимидомасляной кислотой (Fluka), активированной изопропилхлорформиатом (Aldrich), согласно процедуре Axworthy et al (2000) Proc. Natl. Acad. Sci. USA 97(4): 1802-1807). Реагенты DOTA-малеимид взаимодействуют с аминокислотными остатками свободного цистеина цистеин-встроенных антител и обеспечивают комплексообразующий металл лиганд на этом антителе (Lewis et al (1998) Bioconj. Chem. 9:72-86). Хелатобразующие линкерные метящие реагенты, такие как DOTA-NHS (моно-(N-гидроксисукцинимидный эфир 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты) коммерчески доступны (Macrocyclics, Dallas, TX). Визуализация с использованием рецептора-мишени с меченными радионуклидом антителами может обеспечивать маркер активации пути посредством детектирования и количественного определения прогрессивного накапливания антител в ткани опухоли (Albert et al (1998) Bioorg. Med. Chem. Lett. 8: 1207-1210). Эти конъюгированные радиоизотоп-металлы могут оставаться внутриклеточными после деградации лизосомами.
Комплексы хелатов металлов, подходящие в качестве меток антител для экспериментов визуализации описаны в: US 5,342,606; US 5,428,155; US 5,316,757; US 5,480,990; US 5,462,725; US 5,428,139; US 5,385,893; US 5,739,294; US 5,750,660; US 5,834,456; Hnatowich et al (1983) J. Immunol. Methods 65: 147-157; Meares et al (1984) Anal. Biochem. 142:68-78; Mirzadeh et al (1990) Bioconjugate Chem. 1:59-65; Meares et al (1990) J. Cancer l990, Suppl. 10:21-26; Izard et al (1992) Bioconjugate Chem. 3:346-350; Nikula et al (1995) Nucl. Med. Biol. 22:387-90; Camera et al (1993) Nucl. Med. Biol. 20:955-62; Kukis et al (1998) J. Nucl. Med. 39:2105-2110; Verel et al (2003) J. Nucl. Med. 44: 1663- 1670; Camera et al (1994) J. Nucl. Med. 21:640-646; Ruegg et al (1990) Cancer Res. 50:4221-4226; Verel et al (2003) J. Nucl. Med. 44: 1663-1670; Lee et al (2001) Cancer Res. 61:4474-4482; Mitchell, et al (2003) J. Nucl. Med. 44: 1 105-11 12; Kobayashi et al (1999) Bioconjugate Chem. 10: 103-1 11; Miederer et al (2004) J. Nucl. Med. 45: 129-137; DeNardo et al (1998) Clinical Cancer Research 4:2483-90; Blend et al (2003) Cancer Biotherapy & Radiopharmaceuticals 18:355-363; Nikula et al (1999) J. Nucl. Med. 40:166-76; Kobayashi et al (1998) J. Nucl. Med. 39:829-36; Mardirossian et al (1993) Nucl. Med. Biol. 20:65-74; Roselli et al (1999) Cancer Biotherapy & Radiopharmaceuticals, 14:209-20.
(b) Флуоресцентные метки, такие как хелаты редкоземельных металлов (хелаты европия), типы флуоресцеина, в том числе FITC, 5-карбоксифлуоресцеин, 6-карбоксифлуоресцеин; типы родамина, в том числе TAMRA; дансил; Лиссамин; цианины; фикоэритрины; Техасский красный; и их аналоги. Эти флуоресцентные метки могут быть конъюгированы с антителами с использованием способов, описанных, например, в Current Protocols in Immunology, supra. Флуоресцентные красители и флуоресцентные реагенты-метки включают в себя красители и метки, коммерчески доступные из Invitrogen/Molecular Probes (Eugene, OR) и Pierce Biotechnology, Inc. (Rockford, IL).
(c) Различные фермент-субстратные метки являются доступными или описанными (US 4275149). Фермент обычно катализирует изменение окраски в субстрате, которое может быть измерено спектрофотометрически. Альтернативно, этот фермент может изменять флуоресценцию или хемилюминесценцию субстрата. Способы количественного определения изменения флуоресценции описаны выше. Хемилюминесцентный субстрат становится электронно-возбужденным химической реакцией и может затем испускать свет, который может быть измерен (например, с использованием хемилюминометра), или отдает энергию флуоресцентному акцептору. Примеры ферментных меток включают в себя люциферазы (например, люциферазу светляков и бактериальную люциферазу; US 4,737,456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, такую как пероксидаза хрена (HRP), щелочную фосфатазу (AP), β-галактозидазу, глюкоамилазу, лизозим, сахаридоксидазы (например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу), гетероциклические оксидазы (такие как уриказа и ксантиноксидаза), лактопероксидазу, микоперокисдазу, и т.п.Способы конъюгации ферментов с антителами описаны в O'Sullivan et al (1981) "Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay", in Methods in Enzym. (ed J. Langone & H. Van Vunakis), Academic Press, New York, 73: 147-166.
Примеры фермент-субстратных комбинаций включают в себя, например:
(i) пероксидазу хрена (HRP) с пероксидазой водорода в качестве субстрата, причем эта пероксидаза водорода окисляет предшественник красителя (например, ортофенилендиамин (OPD) или гидрохлорид 3,3’,5,5’-тетраметилбензидина (TMB));
(ii) щелочную фосфатазу (AP) с пара-нитрофенилфосфатом в качестве хромогенного субстрата и
(iii) β-D-галактозидазу (β-D-Gal) с хромогенным субстратом (например, p-нитрофенил-β-D-галактозидазой) или флуорогенным субстратом 4-метилумбеллиферил-β-D-галактозидазой.
Многочисленные другие фермент-субстратные комбинации доступны квалифицированным в данной области специалистам. В отношении общего обзора см. US 4275149 и US 4318980.
Метка может быть опосредованно конъюгирована с боковой цепью аминокислоты, боковой цепью активированной аминокислоты, цистеин-встроенным антителом и т.п. Например, это антитело может быть конъюгировано с биотином, и любая из этих трех широких категорий меток, указанных выше, может быть конъюгирована с авидином или стрептавидином, или наоборот. Биотин связывается селективно со стрептавидином и, следовательно, эта метка может быть конъюгирована с антителом этим непрямым способом. Альтернативно, для достижения непрямой конъюгации этой метки с полипептидным вариантом, этот полипептидный вариант конъюгируют с малым гаптеном (например, дигоксином), и один из различных вышеуказанных типов меток конъюгируют с антителом против конъюгата гаптен-полипептидный вариант (например, анти-дигоксин-антителом). Таким образом, может быть достигнута непрямая конъюгация метки с этим полипептидным вариантом (Hermanson, G. (1996) in Bioconjugate Techniques Academic Press, San Diego).
Антитело данного изобретения может быть использовано в любом способе анализа, таком как ELISA, анализы конкурентного связывания, прямые и непрямые сэндвич-анализы и анализы иммунопреципитации (Zola, (1987) Monoclonal Antibodies: A Manual of Techniques, pp.147-158, CRC Press, Inc.).
Метка детектирования может быть использована для локализации, визуализации и количественного определения события связывания или узнавания. Меченые антитела согласно изобретению могут детектировать рецепторы клеточной поверхности. Другим применением для детектируемо меченых антител является способ иммунозахвата на основе гранул, предусматривающий конъюгацию гранулы с флуоресцентно меченым антителом и детектирование сигнала флуоресценции после связывания лиганда. Сходные методологии детектирования связывания используют действия резонанса поверхностных плазмонов (SPR) для измерения и детектирования взаимодействий антитело-антиген.
Метки детектирования, такие как флуоресцентные красители и хемилюминесцентные красители (Briggs et al (1997) "Synthesis of Functionalised Fluorescent Dyes and Their Coupling to Amines and Amino Acids," J. Chem. Soc, Perkin-Trans. 1:1051-1058), обеспечивают детектируемый сигнал и обычно применимы для мечения антител, предпочтительно имеющих следующие свойства: (i) это меченое антитело должно производить очень высокий сигнал с низким фоном, так что малые количества антител могут быть точно детектированы как в бесклеточных анализах, так и в анализах на основе клеток; и (ii) это меченое антитело должно быть фотохимически устойчивым, так что этот флуоресцентный сигнал может быть подвергнут наблюдению, мониторингу и регистрации без значимого фотообесцвечивания. Для применений с вовлечением поверхностного связывания меченого антитела с мембранами или поверхностями клеток, в частности, живых клеток, эти метки предпочтительно (iii) имеют хорошую водорастворимость для получения эффективной концентрации конъюгата и чувствительности детектирования и (iv) являются нетоксичными для живых клеток, так чтобы не разрушить нормальные метаболические процессы этих клеток или не вызвать преждевременной смерти клеток.
Прямое количественное определение интенсивности клеточной флуоресценции и подсчет флуоресцентно меченых событий, например, связывания клеточной поверхностью конъюгатов пептид-краситель, может проводиться на системе (FMAT® 8100 HTS System, Applied Biosystems, Foster City, Calif.), которая автоматизирует смешивание и считывание, в нерадиоактивных анализах с живыми клетками или гранулами (Miraglia, "Homogeneous cell- and bead-based assays for high throughput screening using fluorometric microvolume assay technology", (1999) J. of Biomolecular Screening 4: 193-204). Применения меченых антител также включают в себя анализы связывания рецептора клеточной поверхности, иммунозахватывающие анализы, иммунофлуоресцентные твердофазные анализы (FLISA), расщепление каспазой (Zheng, "Caspase-3 controls both cytoplasmic and nuclear events associated with Fas-mediated apoptosis in vivo", (1998) Proc. Natl. Acad. Sci. USA 95:618-23; US 6,372,907), анализы апоптоза (Vermes, "A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V" (1995) J. Immunol. Methods 184:39-51) и цитотоксичности. Технология флуорометрического анализа микрообъема может быть также использована для идентификации повышающей или понижающей регуляции молекулой, которая нацелена на клеточную поверхность (Swartzman, "A homogeneous and multiplexed immunoassay for high-throughput screening using fluorometric microvolume assay technology", (1999) Anal. Biochem. 271: 143-51).
Меченые антитела согласно изобретению применимы в качестве визуализирующих биомаркеров и зондов различными методами и способами медико-биологической и молекулярной визуализации, такой как: (i) MRI (МРТ) (магнитно-резонансная томография); (ii) MicroCT (микро-КТ) (компьютерная томография); (iii) SPECT (однофотонная эмиссионная компьютерная томография); (iv) PET (позитронная эмиссионная томография) Chen et al (2004) Bioconjugate Chem. 15:41-49; (v) биолюминесценция; (vi) флуоресценция и (vii) ультразвуковое исследование. Иммуносцинтиграфия является процедурой визуализации, в которой антитела, меченные радиоактивными веществами, вводят пациенту-животному или пациенту-человеку и получают картину участков в теле, в которых локализуется это антитело (US 6528624). Биомаркеры визуализации могут быть объективно измерены и оценены в качестве индикатора нормальных биологических процессов, патогенных процессов или фармакологических ответных реакций на терапевтическое вмешательство. Биомаркеры могут быть биомаркерами нескольких типов: маркеры Типа 0 являются природными анамнестическими маркерами заболевания и коррелируют продолжительно с известными клиническими показателями, например, MRI-оценкой синовиального воспаления в ревматоидном артрите; маркеры Типа I улавливают действие вмешательства в соответствии с механизмом действия, даже хотя этот механизм не ассоциирован с клиническим результатом; маркеры Типа II действуют в качестве суррогатных конечных результатов, где изменение в этом биомаркере или сигнал из этого биомаркера предсказывает клиническую пользу для «валидизации» нацеленной реакции, например, измеренной при помощи СТ (КТ) эрозии кости в ревматоидном артрите. Таким образом, биомаркеры визуализации могут обеспечивать фармакодинамическую (PD) терапевтическую информацию относительно: (i) экспрессии белка-мишени, (ii) связывания терапевтического средства с этим белком-мишенью, т.е. селективности, и (iii) фармакокинетических данных клиренса и периода полувыведения. Преимущества биомаркеров визуализации in vivo относительно биомаркеров на основе лабораторных анализов включают в себя: неинвазивную обработку, количественную оценку всего тела, повторяемые введения доз и оценку, т.е. множественные временные точки, и потенциально переносимые эффекты от преклинических (малые животные) к клиническим (человек) результатам. Для некоторых применений, биовизуализация вытесняет или минимизирует количество экспериментов на животных в преклинических исследованиях.
Способы мечения пептидов хорошо известны. См. Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, (1997) Non-Radioactive Labelling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Glazer et al (1975) Chemical Modification of Proteins. Laboratory Techniques in Biochemistry and Molecular Biology (T. S. Work and E. Work, Eds.) American Elsevier Publishing Co., New York; Lundblad, R. L. and Noyes, C. M. (1984) Chemical Reagents for Protein Modification, VoIs. I and II, CRC Press, New York; Pfleiderer, G. (1985) "Chemical Modification of Proteins", Modern Methods in Protein Chemistry, H. Tschesche, Ed., Walter DeGryter, Berlin and New York; and Wong (1991) Chemistry of Protein Conjugation and Cross-linking, CRC Press, Boca Raton, FIa.); De Leon-Rodriguez et al (2004) Chem.Eur. J. 10: 1149-1155; Lewis et al (2001) Bioconjugate Chem. 12:320-324; Li et al (2002) Bioconjugate Chem. 13:110-115; Mier et al (2005) Bioconjugate Chem. 16:240-237.
Пептиды и белки, меченные двумя частями молекулы, флуоресцентным репортером и гасителем в достаточной близости, подвергают переносу энергии резонанса флуоресценции (FRET). Репортерные группы обычно являются флуоресцентными красителями, которые возбуждаются светом при определенной длине волны и переносят энергию к акцепторной группе, или гасителю, с подходящим сдвигом Стокса для эмиссии при максимальной яркости. Флуоресцентные красители включают в себя молекулы с повышенной ароматичностью, такие как флуоресцеин и родамин, и их производные. Флуоресцентный репортер может быть частично или по существу погашен гасящей частью в интактном пептиде. После расщепления этого пептида пептидазой или протеазой, может быть измерено детектируемое увеличение флуоресценции (Knight, C. (1995) "Fluorimetric Assays of Proteolytic Enzymes", Methods in Enzymology, Academic Press, 248: 18-34).
Меченые антитела согласно изобретению могут быть также использованы в качестве агента аффинной очистки. В этом процессе, меченое антитело иммобилизуют на твердой фазе, такой как смола Сефадекс или фильтровальная бумага, с использованием способов, хорошо известных в данной области. Это иммобилизованное антитело контактирует с пробой, содержащей подлежащий очистке антиген, и после этого носитель промывают подходящим растворителем, который будет удалять по существу весь материал в этой пробе, за исключением подлежащего очистке антигена, который связан с иммобилизованным полипептидным вариантом. Наконец, этот носитель промывают другим подходящим растворителем, таким как глициновый буфер, рН 5,0, который будет высвобождать этот антиген из полипептидного варианта.
Метящие реагенты обычно несут реакционноспособную функциональную группу, которая может реагировать (i) непосредственно с тиолом цистеина цистеин-встроенного антитела с образованием меченого антитела, (ii) с линкерным реагентом с образованием промежуточного продукта линкер-метка, или (iii) с линкерным антителом с образованием меченого антитела. Реакционноспособные функциональные группы метящих реагентов включают в себя: малеимид, галогенацетил, сукцинимидиловый эфир иодацетамида (например, NHS, N-гидроксисукцинимид), изотиоцианат, сульфонилхлорид, 2,6-дихлортриазинил, пентафторфениловый эфир и фосфорамидит, хотя могут быть также использованы другие функциональные группы.
Примером реакционноспособной функциональной группы является N-гидроксисукцинимидиловый эфир (NHS) заместителя карбоксильной группы детектируемой метки, например, биотина или флуоресцентного красителя. NHS-эфир этой метки может быть предварительно образован, выделен, очищен и/или охарактеризован, или он может быть образован in situ и может реагировать с нуклеофильной группой антитела. Обычно карбоксильная форма этой метки активируется реакцией с некоторой комбинацией карбодиимидного реагента, например, дициклогексилкарбодиимида, диизопропилкарбодиимида, или урониевого реагента, например, TSTU (тетрафторбората O-(N-сукцинимидил)-N,N,N’,N’-тетраметилурония, HBTU (гексафторфосфата O-бензотриазол-1-ил)-N,N,N’,N’-тетраметилурония) или HATU (гексафторфосфатом O-(7-азабензотриазол-1-ил)-N,N,N’,N’-тетраметилурония), активатора, такого как 1-гидроксибензотриазол (HOBt) и N-гидроксисукцинимид, с получением NHS-эфира этой метки. В некоторых случаях, эта метка и антитело могут быть связаны активацией in situ этой метки и реакцией с антителом с образованием конъюгата метка-антитело в одной стадии. Другие активирующие и связывающие реагенты включают в себя TBTU (гексафторфосфат 2-(1H-бензотриазо-1-ил)-1-1,3,3-тетраметилурония), TFFH (2-фторгексафторфосфат N,N’,N",N’"-тетраметилурония), PyBOP (гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидинофосфония, EEDQ (2-этокси-1-этоксикарбонил-1,2-дигидрохинолин), DCC (дициклогексилкарбодиимид); DIPCDI (диизопропилкарбодиимид), MSNT (1-(мезитилен-2-сульфонил)-3-нитро-1H-1,2,4-триазол и арилсульфонилгалогениды, например, триизопропилбензолсульфонилхлорид.
Альбуминсвязывающие пептид-Fab-соединения согласно изобретению:
В одном аспекте, антитело согласно изобретению сливают с альбуминсвязывающим белком. Связывание с белком плазмы может быть эффективным средством улучшения фармакокинетических свойств короткоживущих молекул. Альбумин является наиболее изобилующим белком в плазме. Связывающие сывороточный альбумин пептиды (ABP) могут изменять фармакодинамику слитых белков с активными доменами, в том числе изменять поглощение тканью, проникновение в ткань и диффузию в ткани. Эти фармакодинамические параметры могут модулироваться специфическим выбором подходящей последовательности связывающего сывороточный альбумин пептида (US 20040001827). Ряд альбуминсвязывающих белков был идентифицирован скринингом с использованием фагового дисплея (Dennis et al. (2002) "Albumin Binding As A General Strategy For Improving The Pharmacokinetics Of Proteins" J Biol Chem. 277:35035-35043; WO 01/45746). Соединения согласно изобретению включают в себя последовательности ABP, описанные: (i) Dennis et al (2002) J Biol Chem. 277:35035-35043 в таблицах III и IV, стр. 35038; (ii) US 20040001827 в [0076] SEQ ID NO: 9-22; и (iii) WO 01/45746 на страницах 12-13, все из которых включены здесь в качестве ссылки. Альбуминсвязывающие (ABP)-Fab конструировали слиянием альбуминсвязывающего пептида, например, с C-концом тяжелой цепи Fab в стехиометрическом соотношении 1:1 (1 ABP/1 Fab). Было показано, что ассоциация этих ABP-Fab с альбумином увеличивала период полувыведения антитела более чем в 25 раз в кроликах и мышах. Таким образом, вышеописанные реакционноспособные остатки Cys могут вводиться в эти ABP-Fab и использоваться для сайт-специфической конъюгации с цитотоксическими лекарственными средствами с последующими исследованиями на животных in vivo.
Примерные последовательности альбуминсвязывающих белков включают в себя, но не ограничиваются ими, аминокислотные последовательности, приведенные в SEQ ID NO:80-84.
Конъюгаты антитело-лекарственное средство
В другом аспекте, это изобретение обеспечивает иммуноконъюгаты, или конъюгаты антитело-лекарственное средство (ADC), содержащие антитело, конъюгированное с цитотоксическим агентом, таким как химиотерапевтический агент, лекарственное средство, ингибирующий рост агент, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения, или их фрагменты), или радиоактивный изотоп (т.е. радиоконъюгат). В другом аспекте, это изобретение обеспечивает способы применения этих иммуноконъюгатов. В одном аспекте, этот иммуноконъюгат содержит любое из вышеуказанных анти-STEAP-1-антител, ковалентно присоединенное к цитотоксическому агенту или детектируемому агенту.
Применение конъюгатов антитело-лекарственное средство для локальной доставки цитотоксических или цитостатических агентов, т.е. лекарственных средств для уничтожения или ингибирования опухолевых клеток при лечении рака (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26: 151-172; Патент США 4,975,278), дает возможность нацеленной доставки лекарственной части молекулы в опухоль и внутриклеточное ее накапливание, в то время как системное введение этих неконъюгированных лекарственных агентов может приводить к неприемлемым уровням токсичности для нормальных клеток, а также опухолевых клеток, которые должны быть элиминированы (Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986):603-05; Thorpe, (1985) "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review," in Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al. (eds), pp. 475-506). Посредством этого добиваются максимальной эффективности с минимальной токсичностью. Сообщалось, что как поликлональные, так и моноклональные антитела применимы в этих стратегиях (Rowland et al., (1986) Cancer Immunol. Immunother., 21:183-87). Лекарственные средства, используемые в этих способах, включают в себя даунорубицин, доксорубицин, метотрексат и виндесин (Rowland et al., Cancer Immunol. Immunother., 21:183-87 (1986)). Токсины, используемые в конъюгатах антитело-токсин, включают в себя бактериальные токсины, такие как дифтерийный токсин, токсины растений, такие как рицин, токсины с малыми молекулами, такие как гелданамицин (Mandler et al. (2000) Journal of the Nat. Cancer Inst. 92(19): 1573-1581; Mandler et al. (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al. (2000) Bioconjugate Chem. 13:786-791), майтансиноиды (ЕР 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) и калихеамицин (Lode et al. (1998) Cancer Res. 58:2928; Hinman et al. (19933) Cancer Res. 53:3336-3342). Эти токсины могут выполнять их цитотоксическое и цитостатическое действия с использованием механизмов, включающих в себя связывание тубулина, связывание ДНК или ингибирование топоизомеразы. Некоторые терапевтические лекарственные средства имеют тенденцию быть неактивными или менее активными при конъюгации с большими антителами или лигандами рецепторов белков.
ZEVALIN® (ибритумомаб тиуксетан, Biogen/Idec) является конъюгатом антитело-радиоизотоп, состоящим из мышиного IgG1 каппа моноклонального антитела, направленного против антигена CD20, обнаруживаемого на поверхности нормальных и злокачественных В-лимфоцитов, и радиоизотопа111In или90Y, связанного линкером-хелатором тиомочевиной (Wiseman et al (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al (2002) Blood 99(12):4336-42; Witzig et al (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al (2002) J. Clin. Oncol. 20(15):3262-69). Хотя ZEVALIN имеет активность против В-клеточной не-ходжкинской лимфомы (NHL), введение приводит к тяжелым и пролонгированным цитопениям у большинства пациентов. MYLOTARG™ (гемтуцумаб озогамицин, Wyeth Pharmaceuticals), конъюгат антитело-лекарственное средство, состоящий из huCD33-антитела, связанного с калихеамицином, был одобрен в 2000 году для лечения острого миелоидного лейкоза посредством инъекции (Drugs of the Future (2000) 25(7):686; Патенты США с номерами 4,970,198; 5,079,233; 5,585,089; 5,606,040; 5,693,762; 5,739,116; 5,767,285; 5,773,001). Кантуцумаб мертанзин (Immunogen, Inc.), конъюгат антитело-лекарственное средство, состоящий из антитела huC2042, связанного через дисульфидный линкер SPP с частью майтансиноидного лекарственного средства, DM1, развивается для лечения типов рака, которые экспрессируют антиген CanAg, таких как рак ободочной кишки, рак поджелудочной железы, рак желудка и другие. MLN-2704 (Millennium Pharm., BZL Biologies, Immunogen Inc.), конъюгат антитело-лекарственное средство, состоящий из антитела против специфического мембранного моноклонального антигена предстательной железы (PSMA), связанного с частью майтансиноидного лекарственного средства, DM1, развивается для потенциального лечения опухолей предстательной железы. Ауристатиновые пептиды, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги доластатина, конъюгировали с химерными моноклональными антителами cBR96 (специфичными в отношении Lewis Y на карциномах) и cAC10 (специфичными в отношении CD30 на гематологических злокачественных опухолях (Doronina et al (2003) Nature Biotechnology 21 (7):778-784) и находятся в развитии в отношении терапевтического применения.
Здесь описаны химиотерапевтические агенты, применимые в генерировании иммуноконъюгатов. Ферментативно активные токсины и их фрагменты, которые могут быть использованы, включают в себя цепь А дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модеккина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Saponaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. См., например, WO 93/21232, опубликованный 28 октября, 1993. Различные радионуклиды доступны для получения радиоконъюгированных антител. Примеры включают в себя212Bi,131I,131In,90Y и186Re. Конъюгаты этого антитела и цитотоксического агента получают с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидо-соединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta et al (1987) Science, 238: 1098. Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является примерным хелатобразующим агентом для конъюгации радионуклида с антителом (WO94/11026).
Конъюгаты антитела и одного или нескольких токсинов с малой молекулой, таких как калихеамицин, майтансиноиды, доластатины, ауристатины, трихотецен и CC1065, и производных этих токсинов, которые имеют активность токсинов, также обсуждаются здесь.
Майтансин и майтансиноиды
В некоторых вариантах осуществления, иммуноконъюгат содержит антитело (полной длины или фрагменты) согласно изобретению, конъюгированное с одной или несколькими молекулами майтансиноидов.
Майтансиноиды являются митотическими ингибиторами, которые действуют ингибированием полимеризации тубулина. Майтансин был впервые выделен из Африканского кустарника Maytenus serrata (Патент США № 3896111). Затем было обнаружено, что некоторые микробы также продуцируют майтансиноиды, такие как майтансинол и С-3-эфиры майтансинола (патент США № 4151042). Описаны синтетический майтансинол и его производные и аналоги, например, в патентах США с номерами 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 и 4371533.
Группы майтансиноидных лекарственных средств являются привлекательными группами лекарственных средств в конъюгатах антитело-лекарственное средство, так как они являются: (i) относительно доступными для получения ферментацией или химической модификацией, дериватизацией продуктов ферментации, (ii) пригодными для дериватизации функциональными группами, подходящими для конъюгации через недисульфидные линкеры с антителами, (iii) стабильными в плазме и (iv) эффективными против различных линий опухолевых клеток.
Производные майтансина, подходящие для применения в качестве групп майтансиноидных лекарственных средств, хорошо известны в данной области и могут быть выделены из природных источников в соответствии с известными способами, получены способами генной инженерии (см. Yu et al (2002) PNAS 99:7968-7973), или майтансинол и аналоги майтансинола получают синтетически в соответствии с известными способами.
Примерные группы майтансиноидных лекарственных средств включают в себя группы, имеющие модифицированное ароматическое кольцо, такое как: C-19-дехлор (US 4256746) (полученное восстановлением гидридом лития-алюминия ансамитоцина P2); C-20-гидрокси (или C-20-деметил) +/-C-19-дехлор (патенты США с номерами 4361650 и 4307016) (полученные деметилированием с использованием Streptomyces или Actinomyces или дехлорированием с использованием LAH) и C-20-деметокси, C-20-ацилокси (-OCOR), +/-дехлор (патент США № 4294757) (полученные ацилированием с использованием ацилхлоридов), и имеющие модификации в других положениях.
Примерные группы майтансиноидных лекарственных средств включают в себя также такие группы майтансиноидных лекарственных средств конъюгата, как: C-9-SH (US 4424219) (полученные реакцией майтансинола с H2S или P2S5); C-14-алкоксиметил(деметокси/CH2OR) (US 4331598); C-14-гидроксиметил или ацилоксиметил (CH2OH или CH2OAc) (US 4450254) (полученные из Nocardia); C-15-гидрокси/ацилокси (US 4,364,866) (полученные превращением майтансинола с использованием Streptomyces); C-15-метокси (патенты США с номерами 4313946 и 4315929) (выделенные из Trewia nudlflora); C-18-N-деметил (патенты США с номерами 4362663 и 4322348) (полученные деметилированием майтансинола с использованием Streptomyces) и 4,5-дезокси (патент США 4371533) (полученные восстановлением майтансинола смесью трихлорид титана/LAH).
Примерные варианты групп майтансиноидных лекарственных средств конъюгатов включают в себя: DM1; DM3 и DM4, имеющие структуры:

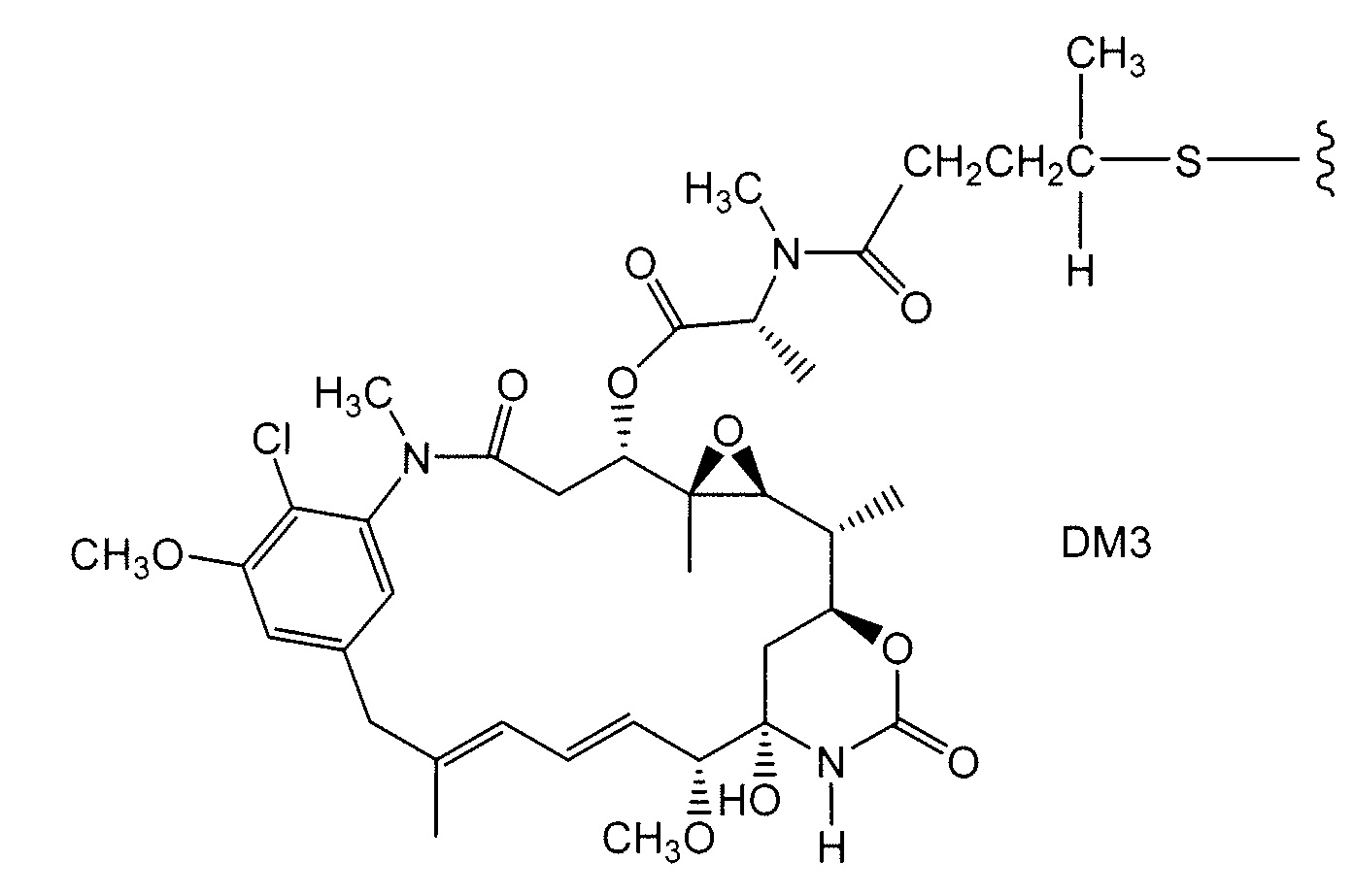

в которых волнистая линия указывает на ковалентное присоединение атома серы этого лекарственного средства к линкеру (L) конъюгата антитело-лекарственное средство. Был сообщен HERCEPTIN® (трастуцумаб), связанный при помощи SMCC с DM1 (WO 2005/037992, который специально включен здесь в качестве ссылки в полном виде). Конъюгат антитело-лекарственное средство данного изобретения может быть получен в соответствии с описанными в этой ссылке процедурами.
Другие примерные майтансиноидные конъюгаты антитело-лекарственное средство имеют следующие структуры и аббревиатуры (где Ab означает антитело и р равно 1-~8):
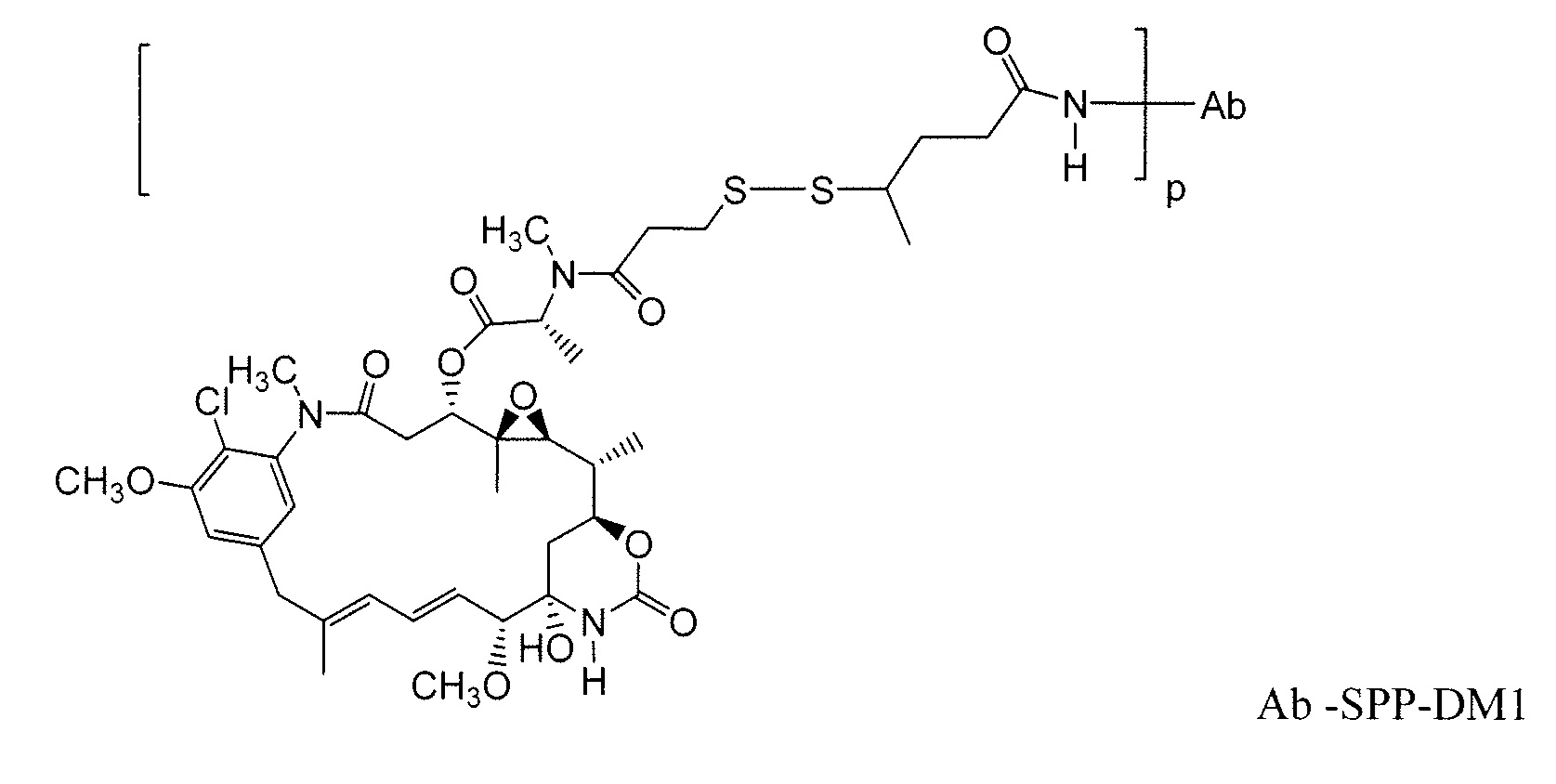
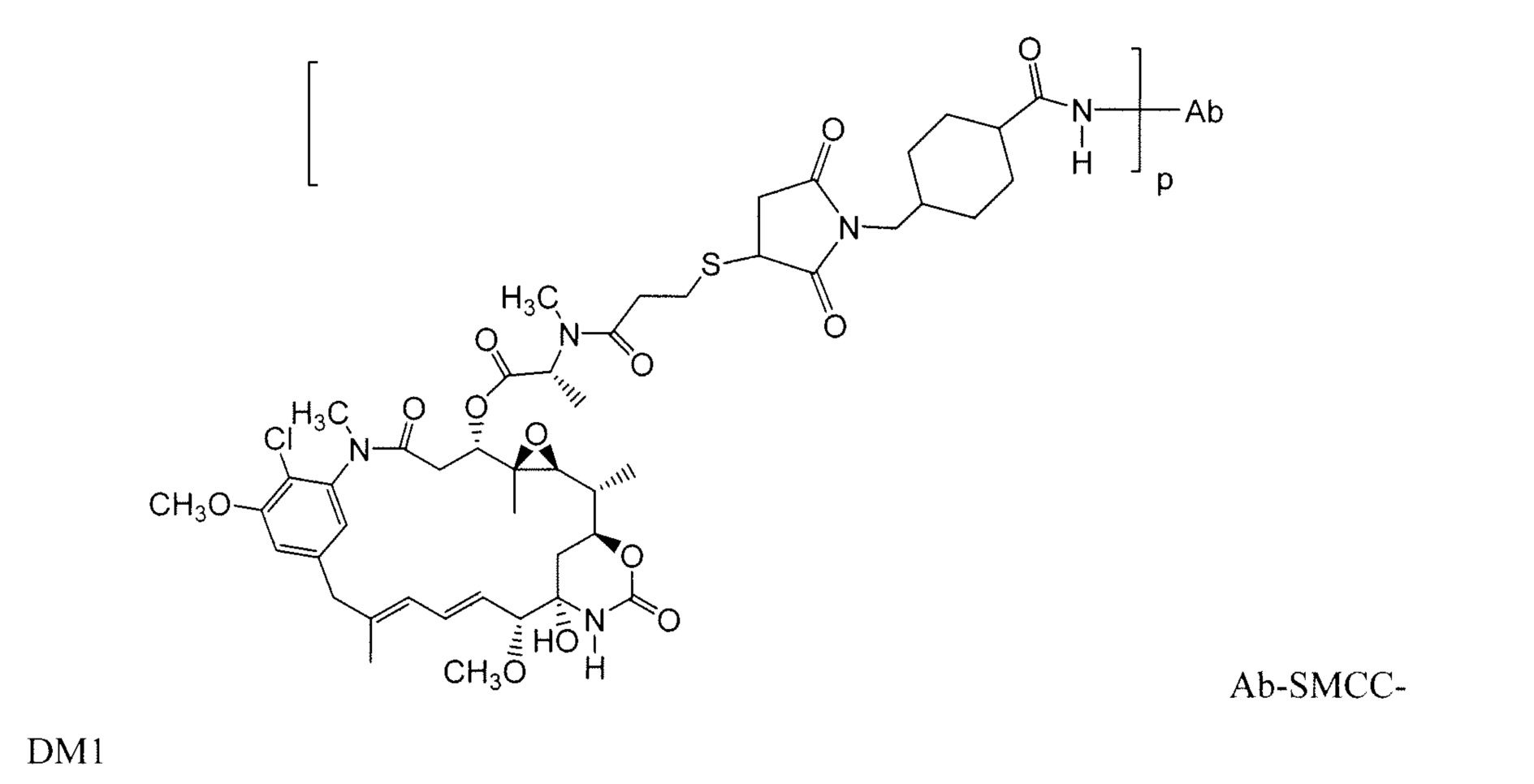
Примерные конъюгаты антитело-лекарственное средство, в которых DM1 связан через линкер BMPEO с тиоловой группой этого антитела, имеют структуру и аббревиатуру:

где Ab означает антитело; n равно 0, 1 или 2 и р равно 1, 2, 3 или 4.
Иммуноконъюгаты, содержащие майтансиноиды, способы их получения и их терапевтическое применение описаны, например, в патентах США с номерами 5208020; 5416064; 6441163 и Европейском патенте EP 0425235 B1, описания которых специально включены здесь в качестве ссылки. Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996) описывали иммуноконъюгаты, содержащие майтансиноид, названный DM1, связанный с моноклональным антителом C242, направленным против колоректального рака человека. Было обнаружено, что этот конъюгат был высокотоксичным в отношении культивируемых клеток рака ободочной кишки и проявлял противоопухолевую активность в анализе роста опухоли in vivo. Chari et al., Cancer Research 52:127-131 (1992) описывают иммуноконъюгаты, в которых майтансиноид был конъюгирован через дисульфидный линкер с мышиным антителом A7, связывающимся с антигеном на линиях клеток рака ободочной кишки, или с другим мышиным моноклональным антителом TA.1, которое связывает онкоген HER-2/neu. Цитотоксичность этого конъюгата TA.1-майтансиноид испытывали in vitro на линии клеток рака молочной железы SK-BR-3, которая экспрессирует 3 × 105 поверхностных антигенов HER-2 на клетку. Этот конъюгат с лекарственным средством достигал степени цитотоксичности, сходной со степенью цитотоксичности свободного майтансиноидного лекарственного средства, которая могла быть увеличена увеличением количества молекул майтансиноида на молекулу антитела. Конъюгат A7-майтансиноид обнаруживал низкую системную цитотоксичность в мышах.
Конъюгаты анти-STEAP-1-антитело-майтансиноид получают путем химического связывания антитела с молекулой майтансиноида без значимого уменьшения биологической активности этого антитела или молекулы майтансиноида. См., например, патент США 5208020 (описание которого специально включено здесь в качестве ссылки). В среднем 3-4 молекулы майтансиноида на молекулу антитела проявляли эффективность в усилении цитотоксичности в отношении клеток-мишеней и не оказывали отрицательного воздействия на функцию или растворимость этого антитела, хотя ожидалось, что даже одна молекула токсина на антитело будет усиливать цитотоксичность в сравнении с применением «голого» антитела. Майтансиноиды хорошо известны в данной области и могут быть синтезированы известными способами или выделены из природных источников. Подходящие майтансиноиды описаны, например, в патент США № 5208020 и в других патентах и непатентных публикациях, на которые приводятся ссылки выше. Предпочтительными майтансиноидами являются майтансинол и аналоги майтансинола, модифицированные в ароматическом кольце или в других положениях молекулы майтансинола, например, различные сложные эфиры майтансинола.
В данной области известны многие связывающие (линкерные) группы для получения конъюгатов антитело-майтансиноид, в том числе, например, связывающие группы, описанные в патентах США с номерами 5208020, 6441163 или Европейском патенте 0425235 B1, Chari et al., Cancer Research 52: 127-131 (1992) и US 2005/0169933 A1, описания которых специально включены здесь в качестве ссылки. Конъюгаты антитело-майтансиноид, содержащие линкерный компонент SMCC, могут быть получены, как описано в Заявке на патент США № 11/141344, поданной 31 мая 2005 года, "Antibody Drug Conjugates and Methods". Эти связывающие группы включают в себя дисульфидные группы, простые тиоэфирные группы, кислотолабильные группы, фотолабильные группы, пептидаза-лабильные группы или эстераза-лабильные группы, описанные в приведенных выше патентах. Дополнительные связывающие группы описаны и приведены в качестве примеров здесь.
Конъюгаты антитела и майтансиноида могут быть получены с использованием различных бифункциональных агентов связывания белков, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидо-соединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Особенно предпочтительные связывающие агенты включают в себя N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al, Biochem. J. 173:723-737 (1978)) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP), для обеспечения дисульфидной связи.
Этот линкер может быть присоединен к молекуле майтансиноида в различных положениях в зависимости от типа этой связи. Например, эфирная связь может быть образована реакцией с гидроксильной группой с использованием общепринятых способов связывания. Эта реакция может происходить в положении С-3, имеющем гидроксильную группу, в положении С-14, модифицированном гидроксиметилом, в положении С-15, модифицированном гидроксильной группой и в положении С-20, имеющем гидроксильную группу. В предпочтительном варианте осуществления, эта связь образована в положении С-3 майтансинола или аналога майтансинола.
В одном варианте осуществления, любое из антител согласно изобретению (полной длины или фрагмент) конъюгируют с одной или несколькими молекулами майтансиноида. В одном варианте этого иммуноконъюгата, цитотоксическим агентом D является майтансиноид DM1. В одном варианте этого иммуноконъюгата, этот линкер выбран из группы, состоящей из SPDP, SMCC, IT, SPDP и SPP.
Ауристатины и доластатины
В некоторых вариантах осуществления этот иммуноконъюгат содержит антитело согласно изобретению, конъюгированное с доластатинами или пептидными аналогами и производными доластатинов, ауристатинами (Патенты США № 5,635,483; 5,780,588). Было показано, что доластатины и ауристатины препятствуют динамике микротрубочек, гидролизу GTP и делению ядер и клеток (Woyke et al (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584) и имеют противораковую и противогрибковую активность (Pettit et al (1998) Antimicrob. Agents Chemother. 42:2961-2965). Доластатиновая или ауристатиновая лекарственная часть может быть присоединена к антителу через N (амино)-конец или С (карбоксил)-конец части пептидного лекарственного средства (WO 02/088172).
Примерные варианты ауристатина включают в себя связанные с N-концом части лекарственного средства монометилауристатина DE и DF, описанные в статье "Senter et al, Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623, presented March 28, 2004, описание которой специально включено в качестве ссылки в полном виде.
Одним примерным вариантом ауристатина является ММАЕ в котором волнистая линия указывает на ковалентное присоединение к линкеру (L) конъюгата антитело-лекарственное средство).

Другим примерным вариантом ауристатина является MMAF, в котором волнистая линия указывает на ковалентное присоединение к линкеру (L) конъюгата антитело-лекарственное средство) (US 2005/0238649):

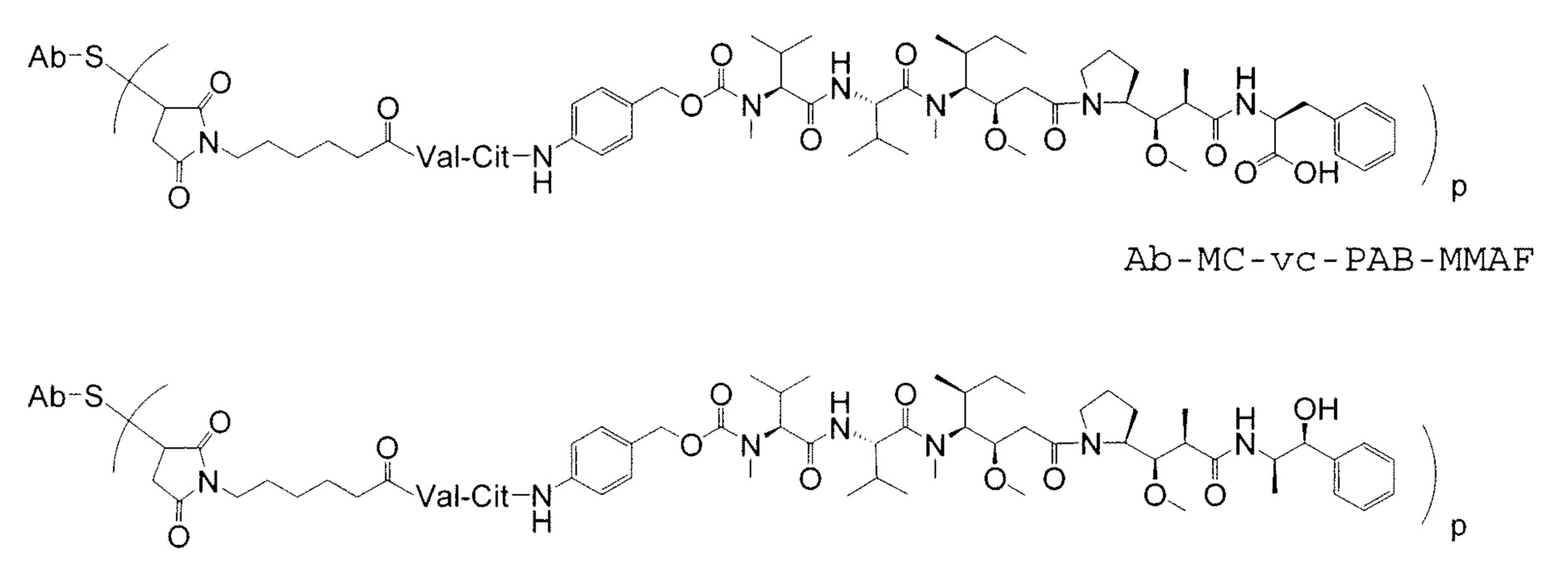
Дополнительные примерные варианты, содержащие MMAE или MMAF и различные линкерные компоненты (описанные дополнительно здесь), имеют следующие структуры и аббревиатуры (где Ab означает антитело и р равно 1-~8):

Обычно части лекарственного средства на основе пептидов могут быть получены путем образования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть получены, например, в соответствии со способом жидкофазного синтеза (см. E. Schroder and K. Lϋbke, "The Peptides", volume 1, pp 76-136, 1965, Academic Press), который хорошо известен в области химии пептидов. Части лекарственного средства ауристатина/доластатина могут быть получены в соответствии со способами: Патентов США 5,635,483; 5,780,588; Pettit et al (1989) J. Am. Chem. Soc. 111:5463-5465; Pettit et al (1998) Anti-Cancer Drug Design 13:243-277; Pettit, G.R., et al. Synthesis, 1996, 719-725; Pettit et al (1996) J. Chem. Soc. Perkin Trans. 15:859-863 и Doronina (2003) Nat Biotechnol 21(7):778-784.
Калихеамицин
В других вариантах осуществления, этот иммуноконъюгат содержит антитело согласно изобретению, конъюгированное с одной или несколькими молекулами калихеамицина. Семейство калихеамициновых антибиотиков способно продуцировать разрывы в двухцепочечной ДНК при субпикомолярных концентрациях. В отношении получения конъюгатов семейства калихеамицина см. патенты США с номерами 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все принадлежат American Cyanamid Company). Структурные аналоги калихеамицина, которые могут быть использованы, включают в себя, но не ограничиваются ими, γ11, α21, α31, N-ацетил-γ11, PSAG и θ11) (Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) вышеуказанные патенты США, выданные American Cyanamid). Другим противоопухолевым лекарственным средством, с которым может быть конъюгировано это антитело, является QFA, которое представляет собой антифолат. Как калихеамицин, так и QFA имеют внутриклеточные сайты действия и не пересекают легко плазматическую мембрану. Таким образом, клеточное поглощение этих агентов через опосредованную антителом интернализацию в сильной степени усиливает их цитотоксические эффекты.
Другие цитотоксические агенты
Другие противоопухолевые агенты, которые могут быть конъюгированы с антителами согласно изобретению, включают в себя BCNU, стрептозоицин, винкристин и 5-фторурацил, семейство агентов, известное под общим названием LL-E33288-комплекс, описанное в патентах США 5053394, 5770710, а также эсперамицины (патент США 5877296).
Ферментативно активные токсины и их фрагменты, которые могут быть использованы, включают в себя цепь А дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модеккина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Saponaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. См., например, WO 93/21232, опубликованный 28 октября, 1993.
Данное изобретение рассматривает дополнительно иммуноконъюгат, образованный между антителом и соединением с нуклеолитической активностью (например, рибонуклеазной или ДНК-эндонуклеазной, например, дезоксинуклеазной, ДНК-азной активностью).
Для селективной деструкции опухоли, это антитело может содержать высоко радиоактивный атом. Различные радиоактивные изотопы являются доступными для получения радиоконъюгированных антител. Примеры включают в себя At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. При использовании этого конъюгата для детектирования, он может содержать радиоактивный атом для сцинтиграфических исследований, например, Tc99m или I123, или спиновую метку для магнитной ядерно-резонансной (ЯМР) томографии (также известной как магнитная резонансная томография, MRI), такую как иод-123, иод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки могут быть включены в конъюгат известными способами. Например, пептид может быть синтезирован химическим синтезом аминокислот с использованием подходящих предшественников аминокислот, включающих в себя, например, фтор-19 вместо водорода. Такие метки, как Tc99m или I123, Re186, Re188 и In111 могут быть присоединены через остаток цистеина в этом пептиде. Иттрий-90 может быть присоединен через остаток лизина. Способ IODOGEN (Fraker et al (1978) Biochem. Biophys. Res. Commun. 80: 49-57) может быть использован для включения иода-123. "Monoclonal Antibodies in Immunoscintigraphy" (Chatal, CRC Press 1989) подробно описывает другие способы.
Конъюгаты антитела и цитотоксического агента могут быть получены с использованием различных бифункциональных агентов связывания белков, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидо-соединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин может быть получен, как описано в Vitetta et al., Science 238: 1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является примерным хелатобразующим агентом для конъюгации радионуклида с антителом. См. WO94/11026. Этот линкер может быть «расщепляемым линкером», облегчающим высвобождение цитотоксического лекарственного средства в клетке. Например, может быть использован кислотолабильный линкер, пептидаза-чувствительный линкер, фотолабильный линкер, диметильный линкер или дисульфидсодержащий линкер (Chari et al., Cancer Research 52: 127-131 (1992); Патент США № 5,208,020).
В качестве соединений согласно изобретению особо обсуждаются, но не ограничиваются ими, ADC, полученный со сшивающими реагентами: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, из Pierce Biotechnology, Inc., Rockford, IL., U.S.A). См. страницы 467-498, 2003-2004 Applications Handbook and Catalog.
Получение конъюгатов антитело-лекарственное средство:
В конъюгатах антитело-лекарственное средство (ADC) согласно изобретению, антитело (Ab) конъюгировано с одной или несколькими частями (составляющими молекулы) лекарственного средства (D), например, приблизительно 1 – приблизительно 20 частями лекарственного средства на антитело, через линкер (L). В одном варианте осуществления, количество частей лекарственного средства (D) на антитело равно от приблизительно 1 до приблизительно 5, альтернативно, от приблизительно 2 до приблизительно 6, альтернативно, от приблизительно 2 до приблизительно 5, альтернативно, от приблизительно 3 до приблизительно 4 частей лекарственного средства на антитело. Поскольку количество частей лекарственного средства на антитело является средним количеством во всех конъюгатах в популяции конъюгата антитело-лекарственное средство, количество частей лекарственного средства на антитело может не быть целым числом. ADC формулы I может быть получен несколькими способами с использованием реакций органической химии, условий и реагентов, известных квалифицированным в данной области специалистам, включающими в себя: (1) реакцию нуклеофильной группы антитела с бивалентным линкерным реагентом, с образованием Ab-L, через ковалентную связь, с последующей реакцией с частью лекарственного средства D; и (2) реакцию нуклеофильной группы части лекарственного средства с бивалентным линкерным реагентом, с образованием D-L, через ковалентную связь, с последующей реакцией с нуклеофильной группой антитела. Дополнительные способы получения ADC описаны здесь.
Этот линкер может быть составлен из одного или нескольких линкерных компонентов. Примерные линкерные компоненты включают в себя 6-малеимидокапроил ("MC"), малеимидопропаноил ("MP"), валин-цитруллин ("val-cit"), аланин-фенилаланин ("ala-phe"), п-аминобензилоксикарбонил ("PAB"), N-сукцинимидил-4-(2-пиридилтио)пентаноат ("SPP"), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат ("SMCC) и N-сукцинимидил-(4-иодацетил)аминобензоат ("SIAB"). В одном варианте осуществления этим линкером является валин-цитруллин-п-аминобензилоксикарбонил ("vc-PAB"). Дополнительные линкерные компоненты известны в данной области и некоторые описаны здесь.
В некоторых вариантах осуществления, этот линкер может содержать аминокислотные остатки. Примерные аминокислотные линкерные компоненты включают в себя дипептид, трипептид, тетрапептид или пентапептид. Примерные дипептиды включают в себя: валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe). Примерные трипептиды включают в себя: глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотные остатки, которые составляют аминокислотный линкерный компонент, включают в себя аминокислотные остатки, встречающиеся в природе, и аминокислотные аналоги, не встречающиеся в природе, такие как цитруллин. Аминокислотные линкерные компоненты могут быть сконструированы и оптимизированы в их селективности в отношении ферментативного расщепления конкретными ферментами, например, опухолеассоциированной протеазой, катепсином В, С и D, или протеазой плазмином.
Примерные структуры линкерных компонентов показаны ниже (где волнистая линия указывает на сайты ковалентного присоединения к другим компонентам ADC):

Дополнительные примерные линкерные компоненты и аббревиатуры включают в себя (где Ab означает антитело и р равно 1-~8):
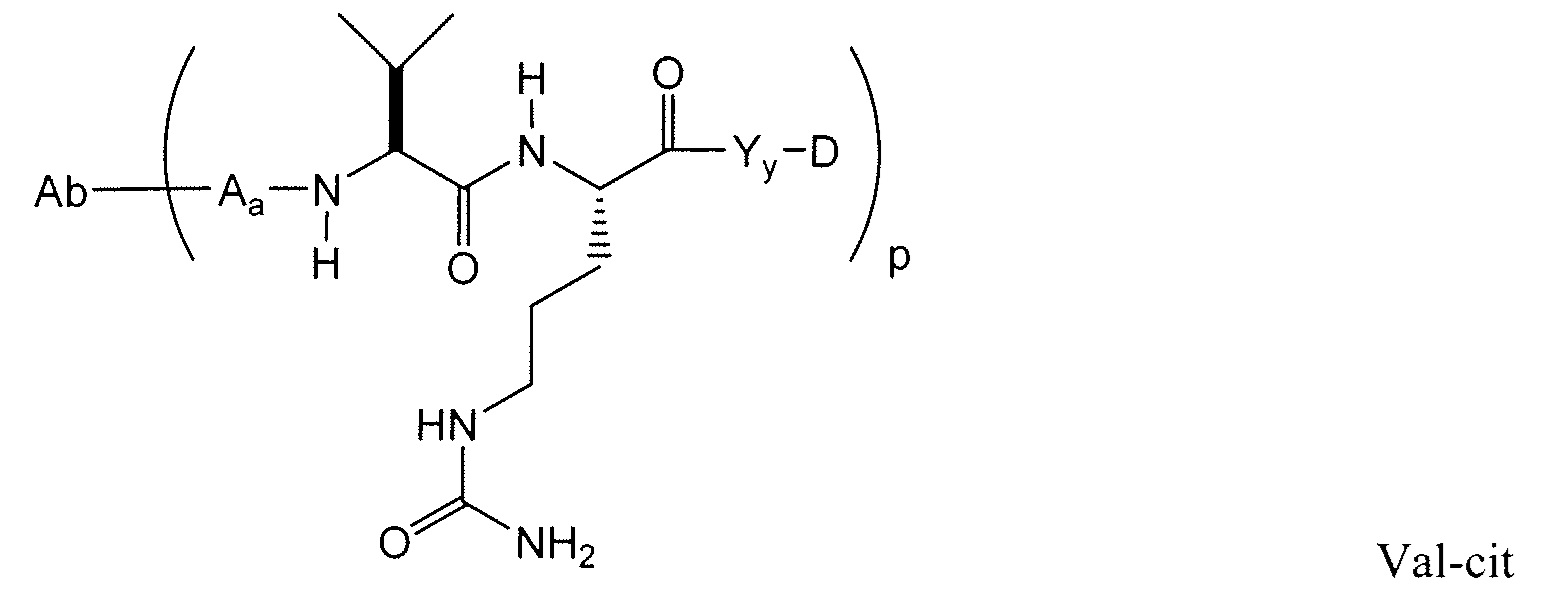

Нуклеофильные группы на антителах включают в себя, но не ограничиваются ими: (i) N-концевые аминогруппы, (ii) аминогруппы боковых цепей, например, лизина, (iii) тиоловые группы боковых цепей, например, цистеина, и (iv) гидроксил сахара или аминогруппы, если это антитело является гликозилированным. Аминогруппы, тиоловые и гидроксильные группы являются нуклеофильными и способны реагировать с образованием ковалентных связей с электрофильными группами на линкерных частях молекулы и линкерных реагентах, включающих в себя:: (i) активные эфиры, такие как NHS-эфиры, HOBt-эфиры, галогенформиаты и галогенангидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегидные, кетоновые, карбоксильные и малеимидные группы. Некоторые антитела имеют восстанавливающие межцепочечные дисульфиды, т.е. цистеиновые мостики. Антитела могут быть сделаны реакционноспособными для конъюгации с линкерными реагентами обработкой восстанавливающим агентом, таким как ДТТ (дитиотреитол). Таким образом, каждый цистеиновый мостик будет образовывать, теоретически, два реакционноспособных тиоловых нуклеофила. Дополнительные нуклеофильные группы могут быть введены в антитела посредством реакции лизинов с 2-иминотиоланом (реагентом Траута), что приводит к превращению амина в тиол. Реакционноспособные тиоловые группы могут быть введены в антитело (или его фрагмент) введением одного, двух, трех, четырех или более остатков цистеина (например, получением мутантных антител, содержащих один или несколько неприродных цистеиновых аминокислотных остатков).
Конъюгаты антитело-лекарственное средство согласно изобретению могут быть также получены путем модификации антитела для введения электрофильных частей молекул, которые могут взаимодействовать с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. Сахара гликозилированных антител могут быть окислены, например, периодатными окисляющими реагентами, с образованием альдегидных или кетоновых групп, которые могут взаимодействовать с аминогруппой линкерных реагентов или лекарственных частей. Иминогруппы оснований Шиффа могут образовывать стабильную связь или могут быть восстановлены, например, боргидридными реагентами с образованием стабильных аминных связей. В одном варианте осуществления, реакция углеводной части гликозилированного антитела с галактозооксидазой или метапериодатом натрия может давать карбонильные (альдегидные или кетоновые) группы в белке, которые могут взаимодействовать с подходящими группами на лекарственном средстве (Hermanson, Bioconjugate Techniques). В другом варианте осуществления, белки, содержащие N-концевые остатки серина или треонина, могут взаимодействовать с метапериодатом натрия, приводя к образованию альдегида вместо первой аминокислоты (Geoghegan & Stroh, (1992) Bioconjugate Chem. 3: 138-146; US 5362852). Такой альдегид может реагировать с лекарственной частью или нуклеофилом линкера.
Подобным образом, нуклеофильные группы на части лекарственного средства включают в себя, но не ограничиваются ими: аминогруппу, тиоловую, гидроксильную, гидразидную, оксимную, гидразиновую, тиосемикарбазоновую, гидразиновую, карбоксилатную и арилгидразидную группы, способные реагировать с образованием ковалентных связей с электрофильными группами на линкерных частях и линкерных реагентах, включающих в себя: (i) активные эфиры, такие как NHS-эфиры, HOBt-эфиры, галогенформиаты и галогенангидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы.
Способы конъюгации частей линкер-лекарственное средство с нацеленными на клетки белками, такими как антитела, иммуноглобулины или их фрагменты, могут быть найдены, например, в US 5,208,020; US 6,441,163; WO2005037992; WO2005081711 и WO2006/034488, все из которых включены здесь в качестве ссылки в их полном виде.
Альтернативно, слитый белок, содержащий антитело и цитотоксический агент, может быть получен, например, рекомбинантными способами или пептидным синтезом. Длина ДНК может содержать соответствующие районы, кодирующие эти две части конъюгата, либо расположенные рядом друг с другом, либо разделенные районом, кодирующим линкерный пептид, который не разрушает желаемые свойства этого конъюгата.
Еще в одном варианте осуществления, это антитело может быть конъюгировано с «рецептором» (таким как стрептавидин) для использования в предварительном нацеливании на опухоль, в котором этот конъюгат антитело-рецептор вводят пациенту, с последующим удалением не связанного конъюгата из кровотока с использованием агента клиренса, и затем введением «лиганда» (например, авидина), который конъюгирован с цитотоксическим агентом (например, радионуклидом).
В одном варианте такого иммуноконъюгата цитотоксический агент, D, является ауристатином формулы DE или DF

в которых каждый из R2 и R6 означают метил, каждый из R3 и R4 означают изопропил, R7 означает втор-бутил, каждый R8 независимо выбран из CH3, О-CH3, OH и H; R9 означает H; R10 означает арил; Z означает -O- или -NH-; R11 означает H, C1-C8 алкил или -(CH2)2-O-(CH2)2-O-(CH2)2-O-CH3 и R18 означает -C(R8)2-C(R8)2-арил; и
(d) p находится в интервале от приблизительно 1 до 8.
Следующие варианты осуществления обеспечены дополнительно для любого из вышеописанных конъюгатов. В одном варианте осуществления, иммуноконъюгат имеет убивающую клетки in vitro или in vivo активность. В одном варианте осуществления, линкер присоединяют к антителу через тиоловую группу на антителе. В одном варианте осуществления, этот линкер может быть отщеплен протеазой. В одном варианте, линкер содержит дипептид val-cit. В одном варианте, линкер содержит п-аминобензильное звено. В одном варианте, это п-аминобензильное звено расположено между лекарственным средством и сайтом расщепления протеазой в этом линкере. В одном варианте, этим п-аминобензильным звеном является п-аминобензилоксикарбонил (PAB). В одном варианте, линкер содержит 6-малеимидокапроил. В одном варианте, 6-малеимидокапроил расположен между антителом и сайтом расщепления протеазой в этом линкере. Вышеописанные варианты могут встречаться по отдельности или в любой комбинации друг с другом.
В одном варианте, лекарственное средство выбрано из MMAE и MMAF. В одном варианте, иммуноконъюгат имеет формулу

в которой Ab означает любое из вышеуказанных анти-STEAP-1-антител, S означает атом серы и p находится в интервале от приблизительно 2 до приблизительно 5. В одном варианте, иммуноконъюгат имеет формулу

в которой Ab означает любое из вышеуказанных анти-STEAP-1-антител, S означает атом серы и p находится в интервале от приблизительно 1 до приблизительно 6, от приблизительно 2 до приблизительно 5, от приблизительно 2 до приблизительно 6, от приблизительно 2 до приблизительно 4, от приблизительно 2 до приблизительно 3, от приблизительно 3 до приблизительно 4, от приблизительно 3 до приблизительно 5, от приблизительно 3 до приблизительно 6 или от приблизительно 4 до приблизительно 6.
Способы визуализации меченого антитела:
В другом варианте осуществления согласно изобретению, цистеин-встроенные антитела могут быть помечены через тиол цистеина радионуклидами, флуоресцентными красителями, запускающими биолюминесценцию субстратными частями, запускающими хемилюминесценцию субстратными частями, ферментами и другими детектирующими метками для экспериментов визуализации с диагностическими, фармакодинамическими и терапевтическими применениями. Обычно, меченое цистеин-встроенное антитело, т.е. «биомаркер» или «зонд», вводят инъекцией, перфузией или пероральным введением внутрь живому организму, например, человеку, грызуну или другому малому животному, в перфузируемый орган или в пробу ткани. Распределение этого зонда детектируется на протяжении некоторого периода времени и представляется в виде изображения.
Изделия:
В другом варианте осуществления согласно изобретению, обеспечено изделие, или «набор», содержащий материалы, применимые для лечения вышеописанных нарушений. Это изделие включает в себя контейнер и инструкцию или вкладыш упаковки на этом контейнере или прилагаемый к этому контейнеру. Подходящие контейнеры включают в себя, например, склянки, флаконы, шприцы, блистерную упаковку и т.д. Эти контейнеры могут быть выполнены из различных материалов, таких как стекло или пластик. Контейнер содержит композицию конъюгата антитело-лекарственное средство (ADC), которая является эффективной для лечения этого состояния, и может иметь стерильное отверстие доступа (например, этот контейнер может быть пакетом для внутривенного раствора или флаконом с крышкой, прокалываемой иглой для подкожных инъекций). По меньшей мере один активный агент в этой композиции является ADC. Инструкция или вкладыш упаковки указывает, что эта композиция используется для лечения выбранного состояния, такого как рак. Альтернативно или дополнительно, это изделие может, кроме того, содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекции (BWFI), забуференный фосфатом солевой раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать в себя другие материалы, желаемые с коммерческой точки зрения и с точки зрения пользователя, в том числе другие буферы, разбавители, фильтры, иглы и шприцы.
Фармацевтические композиции:
В одном аспекте, обеспечена фармацевтическая композиция, содержащая любой из вышеописанных иммуноконъюгатов и фармацевтически приемлемый носитель. В одном аспекте, обеспечен способ лечения клеточно-пролиферативного нарушения предстательной железы, легкого, ободочной кишки, мочевого пузыря или яичника или саркомы Юинга, причем этот способ предусматривает введение индивидууму этой фармацевтической композици. В одном варианте осуществления, раком предстательной железы, легкого, ободочной кишки, мочевого пузыря или яичника или клеточно-пролиферативным нарушением саркомы Юинга является метастазирование первичного рака предстательной железы, легкого, ободочной кишки, мочевого пузыря или яичника или саркомы Юинга. В одном варианте осуществления, это клеточно-пролиферативное нарушение ассоциировано с увеличенной экспрессией STEAP-1 на поверхности клетки.
В одном аспекте, обеспечен способ ингибирования пролиферации клеток, причем этот способ предусматривает подвергание клетки действию любого из вышеописанных иммуноконъюгатов при условиях, пермиссивных для связывания этого иммуноконъюгата в STEAP-1. В одном варианте осуществления, опухолевой клеткой является опухолевая клетка предстательной железы, легкого, ободочной кишки, мочевого пузыря или яичника или клетка саркомы Юинга млекопитающего, испытывающего или предположительно испытывающего пролиферативное нарушение клеток предстательной железы, легкого, ободочной кишки, мочевого пузыря или яичника или саркомы Юинга, в том числе, но не только, метастазирование первичной раковой опухоли предстательной железы, легкого, ободочной кишки, мочевого пузыря или яичника или опухоли саркомы Юинга. В одном варианте осуществления, клеткой рака предстательной железы, легкого, ободочной кишки, мочевого пузыря или яичника или саркомы Юинга является ксенотрансплантат. В одном варианте осуществления, это воздействие происходит in vitro. В одном варианте, это воздействие происходит in vivo.
В одном аспекте, обеспечен способ применения анти-STEAP-1-антитела согласно изобретению для анализа растворимого STEAP-1 в сыворотке млекопитающего, испытывающего клеточно-пролиферативное нарушение предстательной железы, легкого или ободочной кишки (или метастазирование первичного случая такого нарушения), измеряющего клиническую прогрессию или регрессию этих заболеваний, или установления отягощенности опухолью или рецидива.
Краткое описание фигур
Файл этого патента или заявки содержит по меньшей мере один рисунок, выполненный в цвете. Копии этого патента или публикации заявки на патент с цветным рисунком (рисунками) будут обеспечены патентным ведомством после запроса и уплаты требуемых пошлин.
Фигура 1 изображает аминокислотную последовательность STEAP-1 человека (SEQ ID NO:1), сопоставленную с STEAP-1 из мыши и собакоподобной обезьяны (cyno) (SEQ ID NO:2 и 3, соответственно). Внеклеточные домены 1, 2 и 3 помечены и маркированы затененными боксами.
Фигуры 2А-2В: Фигура 2А изображает аминокислотную последовательность вариабельного района легкой цепи мышиного анти-STEAP-1-антитела 120.545, сопоставленную с химерным антителом (120 химера) и гуманизированным антителом (120 трансплантат) и сопоставленную с последовательностью подгруппы III человека. CDR заключены в боксы (CDR-L1, CDR-L2 и CDR-L3). Последовательности, окружающие эти CDR, являются каркасными последовательностями (FR-L1-FR-L4). Эти последовательности пронумерованы в соответствии с нумерацией Кабата. Кабат, Хотиа и контактные CDR указаны около заключенных в боксы CDR. Фигура 2B изображает аминокислотную последовательность вариабельного района тяжелой цепи мышиного анти-STEAP-1-антитела (120.545), сопоставленную с химерным антителом (120 химера) и гуманизированным антителом (120 трансплантат) и сопоставленную с последовательностью каппа I человека. Гуманизированные варианты 24, 37, 48, 67 и 37/48, 67, 71 и 78 получали выполнением следующих аминокислотных изменений: A24V, V37I, V48M, F67I и L78F в тяжелой цепи антитела 120 трансплантат. CDR заключены в боксы. Последовательности FR-H1, FR-H2, FR-H3 и FR-H4 окружают эти CDR (CDR-H1, CDR-H2 и CDR-H3). Эти последовательности пронумерованы в соответствии с нумерацией Кабата. Кабат, Хотиа и контактные CDR указаны около заключенных в боксы CDR.
Фигуры 3А и 3В показывают примерные акцепторные последовательности консенсусных каркасов вариабельной области тяжелой цепи (VH) человека для применения на практике данного изобретения со следующими идентификаторами последовательностей, где SEQ ID NO FR перечислены в последовательности FR-H1, FR-H2, FR-H3, FR-H4:
- консенсусный каркас “A” подгруппы I VH человека минус CDR по Кабату (SEQ ID NO:26, 27, 28, 29).
- консенсусные каркасы “В”, “C” и “D” подгруппы I VH человека минус удлиненные гипервариабельные районы (SEQ ID NO:30, 31, 28, 29; SEQ ID NO:30, 31, 32, 29 и SEQ ID NO:30, 31, 33, 29).
- консенсусный каркас “A” подгруппы II VH человека минус CDR по Кабату (SEQ ID NO:34, 35, 36, 29).
- консенсусные каркасы “В”, “C” и “D” подгруппы II VH человека минус удлиненные гипервариабельные районы (SEQ ID NO:37, 38, 36, 29; SEQ ID NO:37, 38, 39, 29 и SEQ ID NO:37, 38, 40, 29).
- консенсусный каркас “A” подгруппы III VH человека минус CDR по Кабату (SEQ ID NO:41, 42, 43, 29).
- консенсусные каркасы “В”, “C” и “D” подгруппы III VH человека минус удлиненные гипервариабельные районы (SEQ ID NO:44, 45, 43, 29; SEQ ID NO:44, 45, 46, 29 и SEQ ID NOs:44, 45, 46, 29).
- каркас “A" акцептора 1 VH человека минус CDR по Кабату (SEQ ID NO:48, 42, 49, 29).
- каркасы “B” и “C” акцептора 1 VH человека минус удлиненные гипервариабельные районы (SEQ ID NO:44, 45, 49, 29 и SEQ ID NO:44, 45, 50, 29).
- каркас “A" акцептора 2 VH человека минус CDR по Кабату (SEQ ID NO:48, 42, 51, 29).
- каркасы “B”, “C” и “D” акцептора 2 VH человека минус удлиненные гипервариабельные районы (SEQ ID NO:44, 45, 51, 29; SEQ ID NO:44, 45, 52, 29 и SEQ ID NO:44, 45, 53, 29).
Фигуры 4А и 4В показывают примерные акцепторные последовательности консенсусных каркасов вариабельной области легкой цепи (VL) человека для применения на практике данного изобретения со следующими идентификаторами последовательностей:
- консенсусный каркас (kv1-1) подгруппы I-1 каппа VL человека: SEQ ID NO:54, 55, 56, 57
- консенсусный каркас (kv1) подгруппы I каппа VL человека: SEQ ID NO:54, 58, 56, 57
- консенсусный каркас (kv2) подгруппы II каппа VL человека: SEQ ID NO: 58, 59, 60, 57
- консенсусный каркас (kv3) подгруппы III каппа VL человека: SEQ ID NO:61, 62, 63, 57
- консенсусный каркас (kv4) подгруппы IV каппа VL человека: SEQ ID NO:64, 65, 66, 57.
Фигура 5 изображает сопоставления последовательностей Fc-районов IgG человека, humIgG1 (не-A-аллотипа, SEQ ID NO:85; и А-аллотипа, где аминокислотная последовательность SREEM в SEQ ID NO:85 изменена на SRDEL), humIgG2 (SEQ ID NO:86), humIgG3 (SEQ ID NO:87) и humIgG4 (SEQ ID NO:88) с различиями между этими последовательностями, отмеченными звездочками. Цифры над этими последовательностями представляют систему нумерации EU. Показана также константная область каппа.
Фигуры 6А-6D изображают FACS-анализ, нормализованный относительно уровня дисплея каждого антитела или варианта на фаге. Фигура 6А показывает смещения FACS на STEAP-1-экспрессирующих клетках (LB50) для четырех примеров антител. Фигура 6В показывает смещения FACS на не экспрессирующих STEAP-1 клетках (S408) для нескольких антител, как показано на этой фигуре и в примере 1. Фигуры 6С и 6D являются сопоставлениями смещений FACS после нормализации относительно уровней фагового дисплея.
Фигуры 7А-7F графически изображают FACS-анализы, показывающие связывание анти-STEAP-1-мышиной, химерной и гуманизированной версии 24 антител с STEAP-1 человека, экспрессированным на клеточной поверхности. Фигуры 7А-7С показывают, что мышиное анти-STEAP-1-антитело 120, химерное антитело 120 и гуманизированное антитело 120v.24 связывают STEAP-1 человека и собакоподобной обезьяны, но не мышиный STEAP-1. Фигуры 7D-7F являются графиками FACS, показывающими связывание мышиного антитела 120, химерного антитела 120 и гуманизированного антитела 120v.24 (клона 67) с STEAP-1 человека, экспрессируемым на клеточной поверхности. Экзогенный STEAP-1 стабильно экспрессировался в клетках 293 (названных клетками LB50) и клетках PC3 названных клетками PS5.4) (фигуры 7D и 7E) и эндогенно экспрессировался в клетках LNCaP BR (фигура 7F).
Фигуры 8А и 8В. Фигура 8А является графиком, показывающим, что введение мышиного анти-STEAP-1-антитела 120-МС-vc-PAB-MMAE при 3 мг/кг было эффективным в модели ксенотрансплантата опухоли предстательной железы (клетках LNCaP-Ner). См. пример 4. Фигура 8В является графиком, показывающим, что единственное введение дозы гуманизированного анти-STEAP-1-антитела 120v.24-MC-vc-PAB-MMAE (3 мг/кг), 120v.24-MC-MMAF (6 мг/кг), 120v.24-MC-MMAF (12 мг/кг) и химерного анти-STEAP-1-антитела 120 chimera-MC-vc-PAB-MMAE (3 мг/кг) является эффективным в модели ксенотрансплантата клеток LNCaP предстательной железы. См. пример 4.
Фигура 9 является графиком, показывающим, что введение анти-STEAP-1-антитела 120 chimera-MC-vc-PAB-MMAE (сокращаемого как анти-STEAP-vcMMAE) при 3 мг/кг или анти-STEAP-1-антитела 120 chimera-MC-MMAF (сокращаемого как анти-STEAP-mcMMAF) при 6 мг/кг, является эффективным в модели ксенотрансплантата рака предстательной железы кастрированных SCID-бежевых мышей (с врожденным отсутствием естественных клеток-киллеров), трансплантированных клетками LNCaP. См. пример 4.
Фигура 10 является графиком, показывающим, что введение анти-STEAP-1-антитела 120 chimera-MC-vc-PAB-MMAE (сокращаемого как анти-STEAP-vcMMAE (при 3 мг/кг) является эффективным в модели ксенотрансплантата рака предстательной железы самцов SCID-бежевых мышей (с врожденным отсутствием естественных клеток-киллеров) (андроген-зависимых), трансплантированных клетками LuCap 77. См. пример 4.
Фигура 11 является графиком, показывающим, что введение гуманизированного анти-STEAP-1-антитела 120v.24-MC-vc-PAB-MMAE при 3 мг/кг, гуманизированного анти-STEAP-1-антитела 120v.24-MC-MMAF при 6 мг/кг и 12 мг/кг кастрированным SCID-бежевым мышам (с врожденным отсутствием естественных клеток-киллеров) (андроген-зависимым), трансплантированным опухолью предстательной железы LuCap35V, является эффективным относительно контролей. См. пример 4.
Фигура 12 является диаграммой, изображающей STEAP-1, заключенный в клеточной мембране. Связывание анти-STEAP-1-антитела 120 зависит от конформации и не узнает линейный эпитоп STEAP-1 (пептид, описанный как SEQ ID NO:102).
Фигуры 13А-13D показывают STEAP-1, экспрессируемый на поверхности клеток, детектированный иммуногистохимией. Фигура 13А показывает иммуногистохимическое окрашивание клеток 293, экспрессирующих экзогенный STEAP-1 на клеточной поверхности. Фигура 13В показывает иммунохимическое окрашивание клеток PC3, экспрессирующих экзогенный STEAP-1 на клеточной поверхности. Фигура 13С показывает иммуногистохимическое окрашивание клеток LNCaP, экспрессирующих эндогенный STEAP-1 на клеточной поверхности. Фигура 13D показывает иммуногистохимическое окрашивание клеток LuCAP 77, экспрессирующих эндогенный STEAP-1 на клеточной поверхности.
Фигуры 14A-14E являются графиками, показывающими относительную эффективность анти-STEAP-1-антитела 120v.24-MCMMAF и анти-STEAP-1-антитела 120v.24-MC-vc-PAB-MMAE для уничтожения STEAP-1-экспрессирующих клеток in vitro. Клетки PS5.4 (фигура 14А) являются клетками PC3, трансформированными вектором, кодирующим STEAP-1, так что STEAP-1 экспрессируется на клеточной поверхности. Клетки LB50 (фигура 14B) являются клетками 293, трансформированными вектором, кодирующим STEAP-1, так что STEAP-1 экспрессируется на клеточной поверхности. Клетки LNCaP (фигура 14C) экспрессируют STEAP-1 эндогенно. "PC3 vec" (фигура 14D) и "293 vec" (фигура 14E) относятся к клеткам 293 и клеткам PC3, соответственно, трансформированным контрольным вектором.
Фигура 15 показывает изображения цистеиновых сконструированных конъюгатов анти-STEAP-1-антитело-лекарственное средство (ADC), в которых часть, являющаяся лекарственным средством, присоединена к группе цистеина, находящейся в: легкой цепи (LC-ADC); тяжелой цепи (HC-ADC) и Fc-районе (Fc-ADC).
Фигура 16 показывает стадии: (i) восстановления аддуктов дисульфидов цистеина и межцепочечных и внутрицепочечных дисульфидов в цистеиновом сконструированном анти-STEAP-1-антителе (ThioMab) восстанавливающим агентом TCEP (гидрохлоридом трис-(2-карбоксиэтил)фосфина); (ii) частичного окисления, т.е. повторного окисления для повторного образования межцепочечных и внутрицепочечных дисульфидов, при помощи dhAA (дегидроаскорбиновой кислоты) и (iii) конъюгации повторно окисленного антитела с промежуточным продуктом лекарственное средство-линкер с образованием конъюгата цистеин-встроенное анти-STEAP-1-антитело-лекарственное средство (ADC).
Фигуры 17А-C показывают сайты аминокислотных замен, выполненные для генерирования цистеин-встроенных анти-STEAP-1-антител (thio-mAb). Фигура 17А показывает тио-LC-вариант V205C с соответствующей последовательной нумерацией и стандартизованной нумерацией в соответствии с системой Кабата (SEQ ID NO:103-113, соответственно, в порядке возникновения). Фигура 17В показывает тио-НС-вариант A118 с соответствующей последовательной нумерацией и стандартизованной нумерацией в соответствии с системой EU (SEQ ID NO:114-124, соответственно, в порядке возникновения). Фигура 17С показывает тио-Fc-вариант S400C с соответствующей последовательной нумерацией и стандартизованной нумерацией в соответствии с системой EU (SEQ ID NO:125-135, соответственно, в порядке возникновения).
Фигуры 18А-F изображают FACS-анализы, показывающие, что конъюгаты анти-STEAP-1-тиоантитело-лекарственное средство (TDC) сохраняют способность связывания с STEAP-1, экспрессируемым на клеточной поверхности. Фигуры 18A-18C являются FACS-графиками, показывающими связывание FACS анти-STEAP-1-TDC thio-human120-vc-PAB-MMAE (LCV205C) (сокращаемого как huSteap1 TDC (L205C) vcE и thio-human120-vc-PAB-MMAE (HCA118C) (сокращаемого как huSteap1 TDC (HCA118C) vcE) с STEAP-1 человека, экспрессируемым на клеточной поверхности. Экзогенный STEAP-1 стабильно экспрессировался в клетках 293 (называемых клетками LB50) и клетках PC3 (называемых клетками PS5.4) (Фигуры 18А и 18В), и эндогенно экспрессировался в клетках LNCaP BR (Фигура 18С). Фигуры 18D, 18E и 18F являются сопоставлениями FACS-смещений, показанных на фигурах 7А, 7В и 7С, соответственно.
Фигуры 19A-C показывают относительную эффективность конъюгатов анти-STEAP-1-тиоантитело-лекарственное средство (TDC) thio-humanl20-vc-P AB-MMAE (LCV205C) (сокращаемого как huSteap1 TDC (L205C) vcE) и thio-humanl20-vc-PAB-MMAE (HCA118C) (сокращаемого как huSteap1 TDC (HCA118C) vcE) для уничтожения STEAP-1-экспрессирующих клеток in vitro. Клетки LB50 (фигура 19А) являются клетками 293, трансформированными вектором, кодирующим STEAP-1, так что STEAP-1 экспрессируется на клеточной поверхности. Клетки PS5.4 (фигура 19В) являются клетками PC3, трансформированными вектором, кодирующим STEAP-1, так что STEAP-1 экспрессируется на клеточной поверхности. Клетки LNCaP (фигура 19С) экспрессируют STEAP-1 эндогенно.
Фигура 20 является графиком, показывающим, что введение анти-STEAP-1-TDC thio-humanl20-vc-PAB-MMAE (HCA118C) (сокращаемого как hu Steap1 HC TDC vcE) при 3 мг/кг является эффективным относительно контролей в модели ксенотрансплантата рака предстательной железы самцов SCID-бежевых мышей (с врожденным отсутствием естественных клеток-киллеров) (андроген-зависимых), трансплантированных клетками LNCaP. См. пример 8.
Фигура 21 является графиком, показывающим, что введение анти-STEAP-1-TDC thio-human120-vc-PAB-MMAE (HCA118C) (сокращаемого как hu Steap1 HC TDC vcE) при 3 мг/кг или thio-human120-MC-MMAF (HCA118C) (сокращаемого как hu Steap1 HC TDC mcF) при 1, 3 или 6 мг/кг, является эффективным относительно контролей в модели ксенотрансплантата рака предстательной железы самцов SCID-бежевых мышей (с врожденным отсутствием естественных клеток-киллеров) (андроген-зависимых), трансплантированных клетками LNCaP. См. пример 8.
Фигура 22 является графиком, показывающим, что введение анти-STEAP-1-TDC thio-human120-vc-PAB-MMAE (HCA118C) (сокращаемого как hu Steap1 HC TDC vcE) при 3 мг/кг или thio-human120-MC-MMAF (HCA125C) (сокращаемого как hu Steap1 HC TDC mcF) при 3 или 6 мг/кг, является эффективным относительно контролей в модели ксенотрансплантата рака предстательной железы кастрированных SCID-бежевых мышей (с врожденным отсутствием естественных клеток-киллеров), трансплантированных опухолью LuCaP 35V предстательной железы. См. пример 8.
Фигура 23 показывает сайты аминокислотных замен, выполненных для генерирования цистеин-встроенного анти-STEAP-1-антитела (thio-mAb), названного “Simmons IV" или просто “SGIV". Аминокислотная последовательность легкой цепи SGIV (SEQ ID NO:90) показана в сопоставлении с легкой цепью антитела mu 120 (SEQ ID NO:5) и антитела 120.v24 antibody (SEQ ID NO:91). Этот тио-LC-вариант SGIV с соответствующей последовательной нумерацией и стандартизованной нумерацией в соответствии с системой Кабата показан в сопоставлении с исходным антителом mu 120, а также тио-LC-вариантом 120.v24 с соответствующей последовательной нумерацией и стандартизованной нумерацией в соответствии с системой. CDR заключены в боксы (CDR-L1, CDR-L2 и CDR-L3). Последовательности, окружающие эти CDR, являются каркасными последовательностями (FR-L1-FR-L4). Эти последовательности пронумерованы в соответствии с нумерацией Кабата. Кабат, Хотиа и контактные CDR указаны около заключенных в боксы CDR. См. пример 9.
Фигура 24 показывает сайты каркасных аминокислотных замен, выполненных для генерирования различных вариантов цистеин-встроенных анти-STEAP-1-антител (thio-mAb), антител SGIV и 120v.24. Аминокислотная последовательность легкой цепи SGIV (SEQ ID NO:136) со стандартизованной нумерацией в соответствии с нумерацией Кабата показана в сопоставлении с вариантами LS.VLVH1 (SEQ ID NO:92); LS.VLVH2 (SEQ ID NO:93); LS.Q (SEQ ID NO:94) и LS.CH1 (SEQ ID NO:95). Аминокислотная последовательность легкой цепи 120.v24 (SEQ ID NO:137) со стандартизованной нумерацией в соответствии с нумерацией Кабата показана в сопоставлении с вариантами ED.FW1 (SEQ ID NO:96); ED.FW2 (SEQ ID NO:97); ED.FW3 (SEQ ID NO:98); ED.all (SEQ ID NO:99); ED.Pro (SEQ ID NO:100) и ED.pl (SEQ ID NO:101). CDR заключены в боксы. Последовательности пронумерованы в соответствии с нумерацией Кабата. См. пример 9.
Фигура 25 показывает графики Скетчарда связывания антител с STEAP-1, экспрессируемым на поверхности клеток LNCaP.BR. Пробы в двух повторностях измеряли с использованием антитела 120.v24 (фигуры 25(A)-(D)) и SGIV-варианта (фигуры 25(E)-(H)). См. пример 9.
Фигура 26 показывает графики Скетчарда связывания антител с STEAP-1, экспрессируемым на поверхности клеток 293.LB50. Пробы в двух повторностях измеряли с использованием антитела 120.v24 (фигуры 25(A)-(D)) и SGIV-варианта (фигуры 26(E)-(H)). См. пример 9.
Фигура 27 является таблицей, сравнивающей средние аффинности связывания, измеренные анализом Скетчарда, для антител mu 1789, mu 120, Fc-химерного антитела, гуманизированного антитела 120.v24, thio-120.v24 и thio-SGIV в клетках PC-3-PS5.4, 293-LB50 и LNCaP-BR, а также в клетках 293, транзиторно экспрессирующих STEAP-1. См. пример 9.
Фигура 28 изображает FACS-анализ, показывающий FACS-смещения на клетках, стабильно трансфицированных STEAP-1 (293 STEAP-1 LB48, 293 STEAP-1 LB50 и 293 STEAP-1 LB53), с пробами антител SGIV и 120.v24. См. пример 9.
Фигура 29 показывает титр антител, наблюдаемый в различных сборах из клеток, продуцирующих антитело SGIV или 120.v24.
Подробное описание вариантов изобретения
Обеспечены выделенные антитела, которые связываются со STEAP-1. Кроме того, обеспечены иммуноконъюгаты, содержащие анти-STEAP-1-антитела. Антитела и иммуноконъюгаты согласно изобретению применимы, например, для диагностики или лечения нарушений, ассоциированных с измененной экспрессией, например, увеличенной экспрессией, STEAP-1. В некоторых вариантах осуществления, антитела и иммуноконъюгаты согласно изобретению применимы для диагностики или лечения клеточно-пролиферативного нарушения, такого как опухоль или рак. В некоторых вариантах осуществления, STEAP-1 экспрессируется в опухоли или раковой опухоли ткани предстательной железы, легкого или ободочной кишки. В некоторых вариантах осуществления, антитела или иммуноконъюгаты согласно изобретению применимы для детектирования экспрессии STEAP-1 на поверхности нормальных и/или опухолевых или раковых клеток тканей предстательной железы, легкого или ободочной кишки.
Обеспечены полинуклеотиды, кодирующие анти-STEAP-1-антитела. Обеспечены векторы, содержащие полинуклеотиды, кодирующие анти-STEAP-1-антитела, и обеспечены клетки-хозяева, содержащие такие векторы. Обеспечены также композиции, в том числе фармацевтические композиции, содержащие любые один или несколько из этих полинуклеотидов, анти-STEAP-1-антител или иммуноконъюгатов согласно изобретению.
Обеспечены способы лечения клеточно-пролиферативного нарушения, включающего в себя, но не ограничивающегося ими, опухоль или рак, анти-STEAP-антителом, конъюгатом антитело-лекарственное средство или иммуноконъюгатом. Такие способы включают в себя, но не ограничиваются ими, лечение опухоли или рака предстательной железы, легкого или ободочной кишки млекопитающего. Обеспечены способы детектирования экспрессии STEAP-1 в клетке ткани с использованием анти-STEAP-1-антитела, конъюгата антитело-лекарственное средство или иммуноконъюгата. Такие способы включают в себя, но не ограничиваются ими, детектирование экспрессии STEAP-1, в качестве не ограничивающего примера, на нормальной клетке, опухолевой клетке или раковой клетке предстательной железы, легкого или ободочной кишки.
Общие способы
Способы и процедуры, описанные или цитируемые здесь, обычно вполне понятны и обычно применяются с использованием общепринятой методологии квалифицированными в данной области специалистами, такой как, например, широко используемые методологии, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual 3rd, edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y.; Current Protocols in Molecular Biology (F. M. Ausubel, et al. eds., (2003)); the series Methods in Enzymology (Academic Press, Inc.): Pcr 2: A Practical Approach (M. J. MacPherson, B. D. Hames and G. R. Taylor eds. (1995)), Harlow and Lane, eds. (1988) Antibodies, A Laboratory Manual, and Animal Cell Culture (R. I. Freshney, ed. (1987)); Oligonucleotide Synthesis (M. J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J. E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R. I. Freshney), ed., 1987); Introduction to Cell and Tissue Culture (J. P. Mather and P. E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J. B. Griffiths, and D. G. Newell, eds., 1993-8) J. Wiley and Sons; Handbook of Experimental Immunology (D. M. Weir and C. C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J. M. Miller and M. P. Calos, eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J. E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C. A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: A Practical Approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal Antibodies: A Practical Approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using Antibodies: A Laboratory Manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J. D. Capra, eds., Harwood Academic Publishers, 1995); and Cancer: Principles and Practice of Oncology (V. T. De Vita et al., eds., J. B. Lippincott Company, 1993).
Определения и аббревиатуры
Определения
“Выделенным" антителом является антитело, которое было идентифицировано и отделено или извлечено из компонента его природного окружения. Загрязняющие компоненты его природного окружения являются веществами, которые могут препятствовать исследованию, диагностическим или терапевтическим применениям этого антитела и могут включать в себя ферменты, гормоны и другие белковые или небелковые растворенные вещества. В некоторых вариантах осуществления, антитело очищают (1) до более чем 95 масс.% антитела, как определено, например, при помощи метода Лоури, и, в некоторых вариантах осуществления, до более чем 99 масс.%; (2) до степени, достаточной для получения по меньшей мере 15 остатков N-конца или внутренней аминокислотной последовательности, с использованием например, секвенатора с вращающейся чашей, или (3) до гомогенности при помощи электрофореза в ДСН-ПААГ при восстанавливающих или невосстанавливающих условиях с использованием, например, красителя Кумасси или содержащего серебро красителя. Выделенное антитело включает в себя антитело in situ в рекомбинантных клетках, так как по меньшей мере один компонент природного окружения антитела не будет присутствовать. Однако, обычно выделенное антитело получают с использованием по меньшей мере одной стадии очистки.
“Выделенной молекулой нуклеиновой кислоты” является молекула нуклеиновой кислоты, которая отделена по меньшей мере от одной другой молекулы нуклеиновой кислоты, с которой она обычно ассоциирована, например, в ее природном окружении. Кроме того, выделенная молекула нуклеиновой кислоты включает в себя молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно экспрессируют эту молекулу нуклеиновой кислоты, но эта молекула нуклеиновой кислоты присутствует внехромосомно или в хромосомном местоположении, которое отличается от ее природного хромосомного местоположения.
“Очищенная” означает, что молекула присутствует в пробе в концентрации по меньшей мере 95 масс.% или по меньшей мере 98 масс.% в расчете на пробу, в которой она содержится.
Термин “по существу одинаковая” или “по существу такая же” означает в данном контексте достаточно высокую степень сходства между двумя численными величинами (например, одной, ассоциированной с антителом согласно изобретению, и другой, ассоциированной со ссылочным/сравнительным антителом), так что квалифицированный в данной области специалист может считать, что различие между этими двумя величинами является малым или не имеющим биологической и/или статистической значимости, в контексте биологического свойства, измеряемого указанными величинами (например, величинами KD). Это различие между указанными двумя величинами равно, например, менее приблизительно 50%, менее приблизительно 40%, менее приблизительно 30%, менее приблизительно 20% и/или менее приблизительно 10% как функция ссылочной/сравнительной величины.
Фраза “существенно уменьшенная” или “существенно отличающаяся” означает в данном контексте достаточно высокую степень различия между двумя численными величинами (обычно одной, ассоциированной с некоторой молекулой, и другой, ассоциированной со ссылочной/сравнительной молекулой), так что квалифицированный в данной области специалист может считать, что различие между этими двумя величинами является статистически значимым различием в контексте биологического свойства, измеряемого указанными величинами (например, величинами KD). Это различие между указанными двумя величинами составляет, например, приблизительно более 10%, приблизительно более 20%, приблизительно более 30%, приблизительно более 40% и/или приблизительно более 50% как функции ссылочной/сравнительной величины.
Термин “вектор” относится в данном контексте к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой он был связан. Одним типом вектора является “плазмида”, которая является кольцевой двухцепочечной ДНК, в которую могут быть лигированы дополнительные ДНК-сегменты. Другим типом вектора является фаговый вектор. Другим типом вектора является вирусный вектор, в котором дополнительные ДНК-сегменты могут быть лигированы в вирусный геном. Некоторые векторы способны к репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальный сайт инициации репликации, и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина после введения в клетку-хозяина и посредством этого реплицироваться вместе с геномом хозяина. Кроме того, некоторые векторы способны управлять экспрессией генов, с которыми они функционально связаны. Такие векторы называют здесь «рекомбинантными экспрессирующими векторами» или просто «экспрессирующими векторами». Обычно, экспрессирующие векторы, используемые в способах рекомбинантных ДНК, находятся часто в форме плазмид. В данном описании, «плазмида» или «вектор» могут использоваться взаимозаменяемо, так как плазмида является наиболее часто используемой формой вектора.
“Полинуклеотид” или “нуклеиновая кислота”, используемые взаимозаменяемо здесь, означает полимеры нуклеотидов любой длины, и включают в себя ДНК и РНК. Эти нуклеотиды могут быть дезоксирибонуклеотидами, рибонуклеотидами, модифицированными нуклеотидами или основаниями и/или их аналогами или любым субстратом, который может быть включен в полимер ДНК- или РНК-полимеразой или синтетической реакцией. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Если присутствует модификация в отношении нуклеотидной структуры, она может производиться до или после сборки этого полимера. Последовательность нуклеотидов может прерываться ненуклеотидными компонентами. Полинуклеотид может содержать модификацию (модификации), произведенные после синтеза, например, конъюгацию с меткой. Другие типы модификаций включают в себя, например, «кэпы», замену одного или нескольких природно-встречающихся нуклеотидов аналогом, межнуклеотиные модификации, такие как модификации с незаряженными связями (например, метилфосфонаты, фосфоэфиры, фосфоамидаты, карбаматы и т.д.) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, содержащие боковые цепи, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), модификации с интеркаляторами (например, акридином, псораленом и т.д.), модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), модификации, содержащие алкилирующие агенты, модификации с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида (полинуклеотидов). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахарах, может быть заменена, например, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами или активирована для получения дополнительных связей с дополнительными нуклеотидами или может быть конъюгирована с твердыми или полутвердыми носителями. 5’- и 3’-концевые ОН могут быть фосфорилированы или заменены аминогруппами или органическими кэппирующими группами из 1-20 атомов углерода. Другие гидроксилы могут быть также дериватизованы стандартными защитными группами. Полинуклеотиды могут также содержать аналоговые формы сахаров рибозы или дезоксирибозы, которые обычно известны в данной области, в том числе, например, 2’-О-метил-, 2’-О-аллил-, 2’-фтор- или 2’-азидорибозу, карбоциклические аналоги сахаров, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и основные нуклеозидные аналоги, такие как метилрибоза. Одна или несколько фосфодиэфирных связей могут быть заменены альтернативными связывающими группами. Эти альтернативные связывающие группы включают в себя, но не ограничиваются ими, варианты, в которых фосфат заменен P(O)S (“тиоатом”), P(S)S (“дитиоатом”), (O)NR2 (“амидатом”), P(O)R, P(O)OR', CO или CH2 (“формацеталем”), в которых каждый R или R’ означает независимо H или замещенный или незамещенный алкил (1-20 C), необязательно содержащий простую эфирную связь (-O-), арил, алкенил, циклоалкил, циклоалкенил или аралкил. Не все связи в полинуклеотиде должны быть идентичными. Предыдущее описание применимо ко всем упоминаемым здесь полинуклеотидам, включающим в себя РНК и ДНК.
“Олигонуклеотид” означает обычно в данном контексте короткие, обычно одноцепочечные, обычно синтетические полинуклеотиды, которые обычно, но не обязательно, имеют длину приблизительно 200 нуклеотидов. Термины “олигонуклеотид” и “полинуклеотид” не являются взаимоисключающими. Предыдущее описание для полинуклеотидов равным образом и полностью применимо к олигонуклеотидам.
“Процентная (%) идентичность аминокислотной последовательности” в отношении ссылочной полипептидной последовательности определяется как процент аминокислотных остатков в кандидатной последовательности, которые идентичны с аминокислотными остатками в ссылочной полипептидной последовательности, после сопоставления этих последовательностей и введения «гэпов», если необходимо, для достижения максимальной процентной идентичности последовательности, без учета консервативных замен как части идентичности этой последовательности. Сопоставление для целей определения процентной идентичности аминокислотной последовательности может достигаться различными способами, которые находятся в рамках квалификации в данной области, например, с использованием публично доступного компьютерного программного обеспечения, такого как программы BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Квалифицированные в данной области специалисты могут определить подходящие параметры для сопоставления последовательностей, в том числе любые алгоритмы, необходимые для получения максимального сопоставления на протяжении полной длины сравниваемых последовательностей. Однако, для этих целей величины % идентичности аминокислотной последовательности генерируют с использованием компьютерной программы для сравнения последовательностей ALIGN-2. Автором компьютерной программы для сравнения последовательностей является Genentech, Inc., и исходный код программы был введен с документацией пользователя в U.S. Copyright Office, Washington D. C, 20559, где он был зарегистрирован под U.S. Copyright Registration No. TXU510087. Эта программа ALIGN-2 публично доступна из Genentech, Inc., South San Francisco, California, или может быть компилирована из исходного кода. Программа ALIGN-2 должна компилироваться для применения на операционной системе UNIX, предпочтительно цифровой UNIX V4.0D. Все параметры сравнения устанавливаются программой ALIGN-2 и не варьируются.
В ситуациях, когда ALIGN-2 используется для сравнения аминокислотных последовательностей, эту %-ую идентичность конкретной аминокислотной последовательности А относительно конкретной аминокислотной последовательности В, с конкретной аминокислотной последовательностью В или против конкретной аминокислотной последовательности В (что может быть альтернативно перефразировано как конкретная аминокислотная последовательность А, которая имеет или содержит некоторую % идентичность аминокислотной последовательности относительно конкретной аминокислотной последовательности В, с конкретной аминокислотной последовательностью В или против конкретной аминокислотной последовательностью В) рассчитывают следующим образом:
100 × X/Y,
где Х означает количество аминокислотных остатков, оцененных как идентичные совпадения программой сопоставления последовательностей ALIGN-2 в сопоставлении этой программой А и В, и где Y означает общее количество аминокислотных остатков в В. Должно быть понятно, что, когда длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, %-ая идентичность аминокислотной последовательности А относительно В не будет равна %-ой идентичности аминокислотной последовательности В относительно А. Если нет других указаний, все величины %-ой идентичности аминокислотных последовательностей, используемые здесь, получены, как описано в непосредственно предыдущем абзаце, с использованием компьютерной программы ALIGN-2.
Термин “STEAP-1” относится в данном контексте к любому нативному STEAP-1 из любого позвоночного животного, включающего в себя млекопитающих, таких как приматы (например, люди, собакоподобная обезьяна (cyno)) и грызуны (например, мыши и крысы), если нет другого указания. Этот термин включает в себя «полноразмерный» непроцессированный STEAP-1, а также любую форму STEAP-1, которая возникает из процессинга в клетке. Этот термин включает в себя также природно-встречающиеся варианты STEAP-1, например, сплайсинговые варианты, аллельные варианты и изоформы. Аминокислотная последовательность STEAP-1 человека изображена на фигуре 1 (SEQ ID NO:1). В одном варианте осуществления, STEAP-1 экспрессируется на клеточной поверхности, например, на поверхности нормальных клеток предстательной железы, легкого или ободочной кишки и имеет увеличенную экспрессию в раковых клетках предстательной железы, легкого или ободочной кишки или метастазах таких раковых клеток. Фигура 1 изображает также аминокислотную последовательность STEAP-1 из мыши и собакоподобной обезьяны (SEQ ID NO:2 и 3, соответственно).
“Антитела” (Ab) и “иммуноглобулины” (Ig) являются гликопротеинами, имеющими сходные структурные характеристики. В то время как антитела проявляют специфичность связывания в отношении конкретного антигена, иммуноглобулины включают в себя как антитела, так и другие антитело-подобные молекулы, которые обычно лишены антигенной специфичности. Полипептиды последнего типа продуцируются, например, при низких уровнях лимфатической системой и при увеличенных уровнях миеломами.
Термины “антитело” и “иммуноглобулин” используются взаимозаменяемо в самом широком смысле и включают в себя моноклональные антитела (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, моновалентные антитела, мультиспецифические антитела (например, биспецифические антитела, пока они проявляют желаемую биологическую активность) и могут также включать в себя некоторые фрагменты антител (как описано более подробно здесь). Антитело может быть химерным антителом, антителом человека, гуманизированным антителом и/или аффинно зрелым антителом.
Термин “анти-STEAP-1-антитело” или “антитело, которое связывается с STEAP-1”, относится к антителу, которое способно связывать STEAP-1 с достаточной аффинностью, так что это антитело применимо в качестве диагностического и/или терапевтического агента в нацеливании на STEAP-1. Предпочтительно, степень связывания анти-STEAP-1-антитела с неродственным белком, не являющимся белком STEAP-1, составляет приблизительно менее 10% связывания этого антитела с STEAP-1, как измерено, например, радиоиммуноанализом (RIA). В некоторых вариантах осуществления, антитело, которое связывается с STEAP-1, имеет константу диссоциации (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ или ≤0,1 нМ. В некоторых вариантах осуществления, анти-STEAP-1-антитело связывается с эпитопом STEAP-1, который является консервативным среди STEAP-1 из разных видов.
Термин “вариабельная область” или “вариабельный домен” антитела относится к амино-концевым доменам тяжелой или легкой цепи этого антитела. Вариабельный домен тяжелой цепи может называться “VH”. Вариабельный домен легкой цепи может называться “VL”. Эти домены являются обычно наиболее вариабельными частями антитела и содержат антигенсвязывающие сайты.
Термин «вариабельные» относится к тому факту, что определенные части вариабельных доменов сильно отличаются по последовательности среди антител и используются в связывании и специфичности каждого конкретного антитела в отношении его конкретного антигена. Однако, эта вариабельность распределена неравномерно на протяжении вариабельных доменов антител. Она сконцентрирована в трех сегментах, называемых определяющими комплементарность районами (CDR) или гипервариабельными районами (HVR), в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высоко консервативные части вариабельных доменов называют каркасными районами (областями) (FR). Вариабельные домены нативных тяжелой и легкой цепей, каждый, содержат четыре FR-области, в значительной степени принимающие конфигурацию бета-слоя, соединенные тремя CDR, которые образуют петли, соединяющие эту структуру бета-складчатого бислоя или, в некоторых случаях образующие часть этой структуры бета-складчатого бислоя. CDR в каждой цепи удерживаются вместе в тесной близости этими FR-областями, причем CDR из другой цепи способствует образованию антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, MD (1991)). Константные домены не участвуют непосредственно в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной токсичности.
“Легкие цепи” антител (иммуноглобулинов) из любого вида позвоночных могут быть отнесены в одному из двух ясно различных типов, называемых каппа (κ) и лямбда (λ), на основе аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотных последовательностей константных доменов их тяжелых цепей, антитела (иммуноглобулины) могут быть отнесены к различным классам. Имеются пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелых цепей, которые соответствуют этим различным классам иммуноглобулинов, названы α, δ, ε, γ и μ, соответственно. Структуры субъединиц и трехмерные кофигурации различных классов иммуноглобулинов хорошо известны и описаны в общем виде, например, в Abbas et al. Cellular and Mol. Immunology, 4th ed. (2000). Антитело может быть частью большей слитой молекулы, образованной ковалентной или нековалентной ассоциацией этого антитела с одним или несколькими другими белками или пептидами.
Термины “полноразмерное антитело”, “интактное антитело” и “полное антитело” используются здесь взаимозаменяемо в отношении антитела в его по существу интактной форме, не в виде фрагментов антител, определенных ниже. Эти термины относятся, в частности, к антителу с тяжелыми цепями, которые содержат Fc-район.
“Фрагменты антител” содержат только часть интактного антитела, причем эта часть сохраняет по меньшей мере одну функцию или большинство функций или все функции интактного антитела и, следовательно, сохраняет способность связывания антигена. В другом варианте осуществления, фрагмент антитела, например, фрагмент, который содержит Fc-район, сохраняет по меньшей мере одну из биологических функций, обычно ассоциированных с Fc-районом, когда он присутствует в интактном антителе, таких как FcRn-связывание, модуляция времени полужизни антитела (in vivo), ADCC-функция и связывание комплемента. В одном варианте осуществления, фрагментом антитела является моновалентное антитело, которое имеет время полужизни in vivo, по существу такое же, что и время полужизни интактного антитела. Например, такой фрагмент антитела может содержать антигенсвязывающее плечо, связанное с Fc-последовательностью, способное придавать этому фрагменту стабильность in vivo.
Расщепление антител папаином производит два идентичных антигенсвязывающих фрагмента, называемых фрагментами “Fab", каждый из которых имеет единственный антигенсвязывающий сайт, и остаточный фрагмент “Fc”, название которого отражает его способность легко кристаллизоваться. Обработка пепсином производит фрагмент F(ab’)2, который имеет два антигенсвязывающих сайта и все еще способен сшивать антиген.
“Fv” является минимальным фрагментом антитела, который содержит полный антигенсвязывающий сайт. В одном варианте осуществления, двухцепочечная разновидность Fv состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи в тесной, нековалентной ассоциации. В одноцепочечной разновидности Fv (scFv), один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи могут быть ковалентно связаны гибким пептидным линкером, так что легкая и тяжелая цепи могут ассоциироваться в «димерной» структуре, аналогичной структуре в двухцепочечной разновидности Fv. Именно в этой конфигурации три CDR каждого вариабельного домена взаимодействуют, определяя антигенсвязывающий сайт на поверхности этого димера VH-VL. Вместе, эти шесть CDR придают антигенсвязывающую специфичность этому антителу. Однако, даже единственный вариабельный домен (или половина Fv, содержащая только три CDR, специфических в отношении антигена) имеет способность узнавать и связывать антиген, хотя и с более низкой аффинностью, чем полный сайт связывания.
Фрагмент Fab содержит вариабельные домены тяжелой и легкой цепи и также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Фрагменты Fab’ отличаются от фрагментов Fab добавлением нескольких остатков на карбокси-конце СН1-домена тяжелой цепи, в том числе одного или нескольких цистеинов из шарнирной области антитела. Fab’-SH означает здесь Fab’, в котором остаток (остатки) цистеина константных доменов несут свободную тиоловую группу. Фрагменты F(ab’)2 антитела первоначально продуцируются в виде пар фрагментов Fab’, которые имеют цистеины шарнирной области между ними. Известны также другие химические сцепления фрагментов антител.
“Одноцепочечные Fv” или фрагменты “scFv” антитела содержат домены VH и VL антитела, причем эти домены присутствуют в одноцепочечной полипептидной цепи. Обычно, этот полипептид scFv дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет scFv образовывать желаемую структуру для связывания антигена. В отношении обзора scFv см. Pluckthun, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994).
Термин “диатела" относится к малым фрагментам антител с двумя антигенсвязывающими сайтами, причем эти фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL). С использованием линкера, который является слишком коротким для позволения спаривания между этими двумя доменами на одной и той же цепи, эти домены побуждаются к спариванию с комплементарными доменами другой цепи и создают два антигенсвязывающих сайта. Диатела могут быть бивалентными или биспецифическими. Диатела описаны более полно, например, в EP 404,097; WO93/1161; Hudson et al. (2003) Nat. Med. 9: 129-134; and Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Триатела и тетратела описаны также в Hudson et al. (2003) Nat. Med. 9: 129-134.
Термин “моноклональное антитело” относится в данном контексте к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, составляющие эту популяцию, являются идентичными, за исключением возможных мутаций, например, природно-встречающихся мутаций, которые могут присутствовать в минорных количествах. Таким образом, определение «моноклональные» указывает природу этого антитела как не являющегося смесью разных антител. В некоторых вариантах осуществления, такое моноклональное антитело обычно включает в себя антитело, содержащее полипептидную последовательность, которая связывает мишень, причем эта мишень-связывающая полипептидная последовательность была получена способом, который включает в себя отбор связывающей единственную мишень полипептидной последовательности из множества полипептидных последовательностей. Например, этим способом отбора может быть отбор уникального клона из множества клонов, например, пула гибридомных клонов, фаговых клонов или клонов рекомбинантных ДНК. Должно быть также понятно, что отобранная мишень-связывающая последовательность может быть дополнительно изменена, например, для улучшения аффинности в отношении этой мишени, для гуманизации мишень-связывающей последовательности, для улучшения ее продуцирования в культуре клеток, для уменьшения ее иммуногенности in vivo, для создания мультиспецифического антитела и т.д., и что антитело, содержащее эту измененную мишень-связывающую последовательность, является также моноклональным антителом согласно изобретению. В противоположность препаратам поликлональных антител, которые обычно включают в себя различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело из препарата моноклональных антител направлено против единственной детерминанты на антигене. Кроме их специфичности, препараты моноклональных антител являются предпочтительными вследствие того, что они обычно не загрязнены другими иммуноглобулинами.
Определение “моноклональное” указывает на природу этого антитела как полученного по существу из гомогенной популяции антител, и не должно пониматься как требующее получения этого антитела каким-либо конкретным способом. Например, моноклональные антитела, которые должны использоваться в соответствии с данным изобретением, могут быть получены различными способами, в том числе, например, гибридомным способом (например, Kohler et al., Nature, 256: 495 (1975); Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-CeIl Hybridomas 563-681 (Elsevier, N. Y., 1981)), recombinant DNA methods (see, e.g., U.S. Patent No. 4,816,567), phage display technologies (see, e.g., Clackson et al., Nature, 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); and Lee et al., J. Immunol. Methods 284(1-2): 119-132(2004), и технологиями получения антител человека или антител, подобных антителам человека, в животных, которые имеют части или все из локусов или генов иммуноглобулина человека, кодирующих последовательности иммуноглобулина человека (см., например, WO98/24893; WO96/34096; WO96/33735; WO91/10741; Jakobovits et al., Proc. Natl. Acad. Sci. USA 90: 2551 (1993); Jakobovits et al., Nature 362: 255-258 (1993); Bruggemann et al., Year in Immunol. 7:33 (1993); патенты США с номерами 5545807; 5545806; 5569825; 5625126; 5633425; 5661016; Marks et al., Bio.Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-813 (1994); Fishwild et al., Nature Biotechnol. 14: 845-851 (1996); Neuberger, Nature Biotechnol. 14: 826 (1996) и Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93 (1995).
Моноклональные антитела, описанные здесь, особо включают в себя “химерные” антитела, в которых часть тяжелой и/или легкой цепи идентична соответствующим последовательностям или гомологична соответствующим последовательностям в антителах, полученных из конкретного вида или принадлежащих к конкретному классу или подклассу антител, а также фрагменты таких антител, пока они обнаруживают желаемую биологическую активность (патент США № 4816567; and Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
“Гуманизированные” формы не-человеческих антител (например, мышиных антител) являются химерными антителами, которые содержат минимальную последовательность, произведенную из не-человеческого иммуноглобулина. В одном варианте осуществления, гуманизированное антитело является иммуноглобулином человека (реципиентным антителом), в котором остатки из гипервариабельного района реципиента заменены остатками из гипервариабельного района не-человеческого вида (донорского антитела), такого как мышь, крыса, кролик или примат (не являющийся человеком), имеющими желаемую специфичность, аффинность и/или потенциал. В некоторых случаях, остатки каркасной области (FR) иммуноглобулина человека заменяют соответствующими остатками не-человеческого иммуноглобулина. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаружены в реципиентном антителе или в донорском антителе. Эти модификации могут быть произведены для дополнительного улучшения эффективности антитела. Обычно, гуманизированное антитело будет содержать по существу все из по меньшей мере одного, и обычно двух, вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют гипервариабельным петлям не-человеческого иммуноглобулина, а все или по существу все FR являются FR последовательности иммуноглобулина человека. Это гуманизированное антитело будет иногда содержать также по меньшей мере часть константной области (Fc), обычно константной области (Fc) иммуноглобулина человека. В отношении дополнительных деталей см, Jones et al., Nature 321:522-525 (1986); Riechmann et al, Nature 332:323-329 (1988); and Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). См. также следующие обзорные статьи и цитируемые в них ссылки: Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-1 15 (1998); Harris, Biochem. Soc. Transactions 23: 1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994).
“Антитело человека” является антителом, которое имеет аминокислотную последовательность, которая соответствует аминокислотной последовательности, продуцируемой человеком, и было получено с использованием любого из способов получения антител человека, описанных здесь. Это определение антитела человека особо исключает гуманизированное антитело, содержащее антигенсвязывающие остатки не-человеческого антитела.
Термин “гипервариабельный район (участок)”, “HVR” или “HV”, относится в данном контексте к районам вариабельного домена антитела, которые являются гипервариабельными по последовательности и/или образуют определенные выше петли. Обычно, антитела содержат шесть гипервариабельных районов; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). В нативных антителах, H3 и L3 проявляют наибольшее разнообразие из этих шести гипервариабельных районов, и считается, в частности, что H3 играет уникальную роль в придании тонкой специфичности антителам Xu et al. (2000) Immunity 13:37-45; Johnson and Wu (2003) in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, NJ). Действительно, природно-встречающиеся антитела семейства верблюдовых, состоящие только из тяжелой цепи, являются функциональными и стабильными в отсутствие легкой цепи. Hamers-Casterman et al. (1993) Nature 363:446-448; Sheriff et al. (1996) Nature Struct. Biol. 3:733-736.
Ряд гипервариабельных районов с установленными размерами используются здесь и включены в это изобретение. Определяющие комплементарность районы Кабата (CDR) основаны на вариабельности последовательности и наиболее часто используются (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Хотиа ссылается вместо этого на местоположение структурных петель (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). Гипервариабельные районы AbM представляют компромисс между CDR Кабата и структурными петлями Хотиа и используются программным обеспечением для моделирования AbM-антител (Oxford Molecular’s AbM). «Контактные» гипервариабельные районы основаны на анализе доступных комплексных кристаллических структур. Остатки из каждого из этих гипервариабельных районов представлены ниже.
Гипервариабельные районы могут содержать следующие “удлиненные гипервариабельные районы”: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL и 26-35 или 26-35A (H1), 50-65 или 49-65 (H2) и 93-102, 94-102 или 95-102 (H3) в VH. Остатки вариабельных доменов пронумерованы в соответствии с Kabat et al., supra, для каждого из этих определений. Гипервариабельными районами HVR-H1, HVR-H2 и HVR-H3 гуманизированных анти-STEAP-1-антител 120v.24 согласно изобретению являются H26-H35A, H49-H6 и H95-H102 с использованием нумерации Кабата. Гипервариабельными районами HVR-L1, HVR-L2 и HVR-L3 гуманизированных анти-STEAP-1-антител 120v.24 согласно изобретению являются L24-34, L50-56 и L89-97 с использованием нумерации Кабата. В данном контексте, термины “HVR” и “CDR” используются взаимозаменяемо.
“Остатками каркаса” или “FR” являются остатки вариабельных доменов, другие, чем остатки гипервариабельных районов, как определено здесь.
Термин “нумерация остатков вариабельных доменов по Кабату” или “нумерация положений аминокислот по Кабату" относится к системе нумерации, используемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи компиляции антител в Kabat et al, Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). С использованием этой системы нумерации, фактическая линейная аминокислотная последовательность может содержать меньше аминокислот или дополнительные аминокислоты в соответствии с укорочением FR или HVR или инсертированием в FR или HVR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать инсерцию одной аминокислоты (остаток 52а в соответствии с Кабатом после остатка 52 H2, и инсертированные остатки (например, остатки 82a, 82b и 82c, и т.д. в соответствии с Кабатом) после остатка 82 FR тяжелой цепи. Нумерация Кабата остатков может быть определена для конкретного антитела сопоставлением в районах гомологии последовательности антитела со “стандартной” пронумерованной по Кабату последовательностью.
“Аффинно созревшим” антителом является антитело с одним или несколькими изменениями в одном или нескольких его HVR, которые приводят к улучшению аффинности этого антитела в отношении антигена, в сравнении с исходным антителом, которое не имеет этого изменения (этих изменений). В одном варианте осуществления, аффинно созревшее антитело имеет наномолярные или даже пикомолярные аффинности в отношении антигена-мишени. Аффинно созревшие антитела получают процедурами, известными в данной области. Marks et al. Bio/Technology 10:779-783 (1992) описывает созревание аффинности перетасовкой доменов VH и VL. Случайный мутагенез остатков HVR и/или каркаса описан Barbas et al. Proc Nat. Acad. Sci. USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155: 1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995) и Hawkins et al, J. Mol. Biol. 226:889-896 (1992).
“Блокирующим” антителом или антителом-“антагонистом” является антитело, которое ингибирует или уменьшает биологическую активность антигена, который оно связывает. Некоторые блокирующие антитела или антитела-антагонисты существенно или полностью ингибируют биологическую активность антигена.
“Антителом-агонистом” является в данном контексте антитело, которое имитирует по меньшей мере одну из функциональных активностей представляющего интерес полипептида.
“Эффекторными функциями” антитела называют биологические активности, приписываемые Fc-району (Fc-району нативной последовательности или вариантному Fc-району аминокислотной последовательности) антитела, и они варьируются в зависимости от изотипа антитела. Примеры эффекторных функций антител включают в себя: связывание C1q и комплемент-зависимую цитотоксичность; связывание Fc-рецептора; антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов поверхности клетки (например, рецептора В-клеток) и активацию В-клеток.
“Fc-рецептор” или “FcR” описывает рецептор, который связывается с Fc-районом антитела. В некоторых вариантах осуществления, FcR является нативным FcR человека. В некоторых вариантах осуществления, FcR является рецептором, который связывает IgG-антитело (гамма-рецептором) и включает в себя рецепторы подклассов FcγRI, FcγRII и FcγRIII, включающих в себя аллельные варианты и альтернативно сплайсированные формы этих рецепторов. Рецепторы FcγRII включают в себя FcγRIIA (“активирующий рецептор”) и FcγRIIB (“ингибирующий рецептор”), которые имеют сходные аминокислотные последовательности, которые различаются прежде всего в их цитоплазматических доменах. Активирующий рецептор FcγRIIA содержит мотив активации на основе тирозина иммунорецептора (ITAM) в его цитоплазматическом домене. Ингибирующий рецептор FcγRIIB содержит мотив ингибирования на основе тирозина иммунорецептора (ITIM) в его цитоплазматическом домене (см Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). FcR обсуждаются в обзоре Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). Другие FcR, в том числе FcR, которые будут идентифицированы в будущем, включены в используемый здесь термин “FcR”.
Термин “Fc-рецептор” или “FcR” включает в себя также неонатальный рецептор, FcRn, который является ответственным за перенос материнских IgG в плод (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)) и регуляцию гомеостаза иммуноглобулинов. Способы измерения связывания с FcRn известны (см., например, Ghetie 1997, Hinton 2004). Связывание с FcRn человека in vivo и сывороточное время полужизни высокоаффинных связывающих полипептидов FcRn человека могут анализироваться, например, в трансгенных мышах или трансфицированных клеточных линиях человека, экспрессирующих FcRn человека, или в приматах, которым были введены вариантные полипептиды Fc.
WO00/42072 (Presta) описывает варианты антител с улучшенным или уменьшенным связыванием с FcR. Содержание этой патентной публикации специально включено здесь в качестве ссылки. См. также Shields et al. J. Biol. Chem. 9(2): 6591-6604 (2001).
“Эффекторными клетками человека” являются лейкоциты, которые экспрессируют один или несколько FcR и выполняют эффекторную функцию (эффекторные функции). В некоторых вариантах осуществления, эти клетки экспрессируют по меньшей мере FcγRIII и выполняют ADCC-эффекторную функцию (функции). Примеры лейкоцитов человека, которые опосредуют ADCC, включают в себя мононуклеарные клетки периферической крови (PBMC), природные клетки-киллеры (NK), моноциты, цитотоксические T-клетки и нейтрофилы. Эффекторные клетки могут быть выделены из природного источника, например, из крови.
“Антитело-зависимой клеточно-опосредованной цитотоксичностью” или “ADCC” называют форму цитотоксичности, в которой секретированный Ig, связанный на Fc-рецепторах (FcR), присутствующий на определенных цитотоксических клетках (например, природных клетках-киллерах (NK), нейтрофилах и макрофагах) позволяет этим цитотоксическим эффекторным клеткам специфически связываться с несущей антиген клеткой-мишенью и затем убивать эту клетку-мишень цитотоксинами. Первичные клетки для опосредования ADCC, NK-клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках суммирована в таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991). Для оценки активности ADCC представляющей интерес молекулы может быть выполнен анализ ADCC in vitro, такой как анализ, описанный в патентах США с номерами 5500362 или 5821337 или патенте США Presta № 6737056. Применимые эффекторные клетки для таких анализов включают в себя мононуклеарные клетки периферической крови (PBMC) и природные клетки-киллеры (NK). Альтернативно или дополнительно, активность ADCC представляющей интерес молекулы может быть оценена in vivo, например, в модели животного, такой как модель животного, описанная в Clynes et al. PNAS (USA) 95:652-656 (1998).
“Комплемент-зависимой цитотоксичностью” или “CDC” называют лизис клетки-мишени в присутствии комплемента. Активацию классического пути комплемента инициируют связыванием первого компонента системы комплемента (C1q) с антителами (подходящего подкласса), которые связываются с когнатным антигеном. Для оценки активации комплемента может выполняться CDC-анализ, например, описанный в Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996).
Полипептидные варианты с измененными аминокислотными последовательностями Fc-района и увеличенной или уменьшенной способностью связывания C1q описаны в патенте США № 6194551B1 и WO99/51642. Содержания этих патентных публикаций специально включены здесь в качестве ссылки. См. также Idusogie et al. J. Immunol. 164: 4178-4184 (2000).
Термин “Fc-районсодержащий полипептид” относится к полипептиду, такому как антитело или иммуноадгезин, которые содержат Fc-район. С-концевой лизин (остаток 447 в соответствии с системой нумерации EU) Fc-района может быть удален, например, во время очистки этого полипептида или при помощи рекомбинантного конструирования нуклеиновой кислоты, кодирующей этот полипептид. Таким образом, композиция, содержащая полипептид, имеющий Fc-район по этому изобретению, может содержать полипептиды с удаленным К447, со всеми удаленными К447 или смесь полипептидов с остатком К447 или без остатка К447.
“Акцепторный каркас человека” для поставленных здесь целей является каркасом, содержащим аминокислотную последовательность каркаса VL или VH, произведенную из каркаса иммуноглобулина человека или консенсусного каркаса человека. Акцепторный каркас человека, “произведенный из” каркаса иммуноглобулина человека или консенсусного каркаса человека, может содержать такую же аминокислотную последовательность, или он может содержать предсуществующие изменения аминокислотной последовательности. В некоторых вариантах осуществления, количество предсуществующих изменений аминокислот равно 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. Если предсуществующие изменения аминокислот присутствуют в VH, эти изменения предпочтительно встречаются только в трех, двух или одном из положений 71H, 73H и 78H; например, аминокислотные остатки в этих положениях могут быть 71A, 73T и/или 78A. В одном варианте осуществления, акцепторный каркас VL человека является идентичным в последовательности каркасу VL иммуноглобулина человека или консенсусной последовательности каркаса человека.
“Консенсусный каркас человека” является каркасом, который представляет наиболее часто встречающиеся аминокислотные остатки в отборе (селекции) каркасных последовательностей VL или VH иммуноглобулина человека. Обычно, отбор последовательностей VL или VH иммуноглобулина человека выполняют из подгруппы последовательностей вариабельных доменов. Обычно этой подгруппой последовательностей является подгруппа, описанная в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). В одном варианте осуществления, для VL, этой подгруппой является подгруппа каппа I, как в Kabat et al., supra. В одном варианте осуществления, для VH, этой подгруппой является подгруппа III, как в Kabat et al., supra.
“Консенсусный каркас подгруппы III VH” содержит консенсусную последовательность, полученную из аминокислотных последовательностей в подгруппе III вариабельной тяжелой цепи Kabat et al., supra. В одном варианте осуществления, аминокислотная последовательность консенсусного каркаса подгруппы III VH содержит по меньшей мере часть каждой из следующих последовательностей или всю последовательность из каждой из следующих последовательностей:
EVQLVESGGGLVQPGGSLRLSCAAS (FR-H1, SEQ ID NO:21)-HVR-H1-
WVRQAPGKGLEWV (FR-H2, SEQ ID NO:22)-HVR-H2-
RFTISRDTSKNTLYLQMNSLRAEDTAVYYCAR (FR-H3, SEQ ID NO:138)-HVR-H3-
WGQGTLVTVSS (FR-H4, SEQ ID NO:24).
“Консенсусный каркас подгруппы I VL” содержит консенсусную последовательность, полученную из аминокислотных последовательностей в подгруппе I вариабельной легкой цепи Kabat et al., supra. В одном варианте осуществления, аминокислотная последовательность консенсусного каркаса подгруппы I VL содержит по меньшей мере часть каждой из следующих последовательностей или всю последовательность из каждой из следующих последовательностей:
DIQMTQSPSSLSASVGDRVTITC (FR-L1, SEQ ID NO:17)-HVR-L1-
WYQQKPGKAPKLLIY (FR-L2, SEQ ID NO:18)-HVR-L2-
GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (FR-L3, SEQ ID NO:19)-HVR-L3-
FGQGTKVEIKR (FR-L4, SEQ ID NO:20).
“Последовательностью сигнала секреции” или “сигнальной последовательностью” называют последовательность нуклеиновой кислоты, кодирующей короткий сигнальный пептид, который может быть использован для направления представляющего интерес нового синтезированного белка через клеточную мембрану, обычно внутреннюю мембрану или как внутреннюю, так и наружную мембраны прокариот. Например, представляющей интерес белок, такой как полипептид легкой или тяжелой цепи иммуноглобулина, секретируется в периплазму прокариотических клеток-хозяев или в культуральную среду. Сигнальный пептид, кодируемый сигнальной последовательностью секреции, может быть эндогенным для клеток-хозяев, или эти сигнальные пептиды могут быть экзогенными, включающими в себя сигнальные пептиды, нативные в отношении подлежащего экспрессии полипептида. Сигнальные последовательности секреции обычно присутствуют на амино-конце экспрессируемого полипептида и обычно удаляются ферментативно между биосинтезом и секрецией этого полипептида из цитоплазмы. Таким образом, сигнальный пептид обычно не присутствует в зрелом белковом продукте.
“Свободной аминокислотой цистеином” называют аминокислотный остаток цистеина, который был встроен в исходное антитело, имеет тиоловую функциональную группу (-SH) и не является спаренным в виде внутримолекулярного или межмолекулярного дисульфидного мостика или не является другим образом частью внутримолекулярного или межмолекулярного дисульфидного мостика.
Термин “величина реакционной способности тиола” является количественной характеристикой свободной аминокислоты цистеина. Величина реакционной способности тиола является процентом свободной аминокислоты цистеина в цистеин-встроенном антителе, которая реагирует с тиол-реактивным реагентом и превращается до максимальной величины 1. Например, свободная аминокислота цистеин на цистеин-встроенном антителе, которая реагирует со 100%-ым выходом с тиол-реактивным реагентом, таким как реагент биотин-малеимид, с образованием меченого биотином антитела, имеет величину реакционной способности тиола 1,0. Другая аминокислота цистеин, встроенная в то же самое или другое исходное антитело, которая реагирует с 80% выходом с тиол-реактивным реагентом, имеет величину реакционной способности тиола 0,8. Другая аминокислота цистеин, встроенная в то же самое или другое исходное антитело, которая полностью не способна реагировать с тиол-реактивным реагентом, имеет величину реакционной способности тиола 0. Определение величины реакционной способности конкретного цистеина может выполняться при помощи анализа ELISA, масс-спектроскопии, жидкостной хроматографии, радиоавтографии или других количественных аналитических тестов. Тиол-реактивные реагенты, которые делают возможным захват цистеин-встроенного антитела и сравнение и количественное определение реакционной способности цистеина, включают в себя биотин-PEO-малеимид ((+)-биотинил-3-малеимидопропионамидил-3,6-диоксаоктаиндиамин, Oda et al (2001) Nature Biotechnology 19:379-382, Pierce Biotechnology, Inc.), биотин-BMCC, PEO-иодацетилбиотин, иодацетил-LC-биотин и биотин-HPDP (Pierce Biotechnology, Inc.) и Nα-(3-малеимидилпропионил)биоцитин (MPB, Molecular Probes, Eugene, OR). Другие коммерческие источники для реагентов биотинилирования, бифункциональных и мультифункциональных линкерных реагентов включают в себя Molecular Probes, Eugene, OR и Sigma, St. Louis, MO.
“Исходным антителом” является антитело, содержащее аминокислотную последовательность, в которой один или несколько аминокислотных остатков заменены одним или несколькими остатками цистеина. Исходное антитело может содержать природную последовательность или последовательность дикого типа. Исходное антитело может иметь предсуществующие модификации аминокислотной последовательности (такие как добавления, делеции и/или замены), родственные другим природным, дикого типа, или модифицированным формам антитела. Исходное антитело может быть направлено против представляющего интерес антигена-мишени, например, биологически важного полипептида. Рассматриваются также антитела, направленные против неполипептидных антигенов (таких как опухолеассоциированные гликолипидные антигены; см. патент США 5091178).
“Аффинностью связывания” обычно называют прочность суммарного итога нековалентных взаимодействий между единственным сайтом связывания молекулы (например, антитела) и его партнером связывания (например, антигеном). Если нет другого указания, «аффинностью связывания», в данном контексте, называют внутреннюю аффинность связывания, которая отражает взаимодействие 1:1 между членами пары связывания (например, антитела и антигена). Аффинность молекулы Х в отношении ее партнера Y может быть обычно представлена константой диссоциации (Kd). Аффинность может быть измерена обычными способами, известными в данной области, в том числе описанными здесь. Антитела низкой аффинности связывают антиген медленно и склонны легко диссоциироваться, тогда как антитела высокой аффинности обычно связывают антиген быстрее и склонны оставаться связанными более продолжительно. В данной области известны разнообразные способы измерения аффинности связывания, любой из которых может быть использован для целей данного изобретения. Конкретные иллюстративные варианты представлены в дальнейшем описании.
В одном варианте осуществления, “Kd” или “величину Kd” по этому изобретению измеряют при помощи анализа связывания радиоактивно меченого антигена (RIA), выполняемого с Fab-версией представляющего интерес антитела и его антигеном, как описано на примере следующего анализа. Аффинность связывания в растворе Fab в отношении антигена измеряют уравновешиванием Fab с минимальной концентрацией125I-меченого антигена в присутствии ряда разведений немеченого антигена, с последующим улавливанием связанного антигена покрытым анти-Fab-антителом планшетом (Chen, et al., (1999) J. Mol. Biol. 293:865-881). Для установления условий для этого анализа, микротитрационные планшеты (Dynex) покрывают в течение ночи 5 мкг/мл захватывающего анти-Fab-антитела (Cappel Labs) в 50 мМ карбонате натрия (pH 9,6) и затем блокируют 2% (масса/объем) бычьим сывороточным альбумином в ЗФР в течение двух-пяти часов при комнатной температуре (приблизительно 23ºC). В неадсорбентном планшете (Nunc #269620), 100 пМ или 26 пМ [125I]-антиген смешивают с серийными разведениями представляющего интерес Fab (например, в соответствии с оценкой анти-VEGF-антитела, Fab-12, в Presta et al., (1997) Cancer Res. 57:4593-4599). Затем представляющий интерес Fab инкубируют в течение ночи; однако это инкубирование может продолжаться в течение более продолжительного периода времени (например, приблизительно 65 часов) для гарантии того, что равновесие достигнуто. После этого, эти смеси переносят в захватывающий планшет для инкубирования при комнатной температуре (например, в течение одного часа). Затем этот раствор удаляют и планшет промывают восемь раз 0,1% Твином-20 в ЗФР. После высушивания планшетов, добавляют 150 мкл на лунку сцинтиллятора (MicroScint-20; Packard) и эти планшеты считают на гамма-счетчике Topcount (Packard) в течение десяти минут. Концентрации каждого Fab, которые дают связывание, меньшее или равное 20% максимального связывания, отбирают для применения в анализах конкурентного связывания.
Согласно другому варианту осуществления, Kd или величину Kd измеряют при помощи анализа резонанса поверхностных плазмонов с использованием BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ) при 25ºC чипов (микропроцессоров) СМ5 с иммобилизованным антигеном при ~10 реакционных единицах (RU). Вкратце, биосенсорные чипы (микропроцессоры) из карбоксиметилированного декстрана (CM5, BIAcore® Inc.) активируют гидрохлоридом N-этил-N’-(3-диметиламинопропил)карбодиимидом (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разбавляют 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ) перед инжекцией при скорости потока 5 мкл/мин для получения приблизительно 10 реакционных единиц (RU) связанного белка. После инжекции антигена, инжектируют 1 М этаноламин для блокирования непрореагировавших групп. Для измерения кинетики, двухкратные серийные разведения Fab (0,78 нМ-500 нМ) инжектируют в ЗФР с 0,05% Твином 20 (PBST) при 25ºC при скорости потока приблизительно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают с использованием простой 1:1 модели связывания Langmuir (BIAcore® Evaluation Software version 3.2) посредством одновременной подгонки сенсограмм ассоциации и диссоциации. Константу диссоциации (Kd) рассчитывают в виде отношения koff/kon. См., например, Chen, Y., (1999) J. Mol. Biol. 293:865-881. Если скорость ассоциации выше 106 М на л/с согласно анализу резонанса поверхностных плазмонов, то скорость ассоциации может быть определена с использованием способа тушения флуоресценции, который измеряет увеличение или уменьшение интенсивности эмиссии флуоресценции (возбуждение=295 нм; эмиссия=340 нм, 16 нм полоса пропускания) при 25ºC 20 нМ анти-антиген-антитела (Fab-формы) в ЗФР, pH 7,2, в присутствии увеличивающихся концентраций антигена при измерении в спектрофотометре, таком как спектрофотометр с ограничителем потока (Aviv Instruments) или спектрофотометр 8000-series SLM-Aminco (ThermoSpectronic) с перемешиваемой кюветой.
“Скорость ассоциации” или “kon” согласно этому изобретению может быть также определена, как описано выше, при помощи системы BIAcore™-2000 или BIAcore™-3000 (BIAcore®, Inc., Piscataway, NJ).
“Нарушение” является любым состоянием или заболеванием, которое будет получать пользу от лечения веществом/молекулой согласно изобретению. Оно включает в себя хронические и острые нарушения, в том числе патологические состояния, которые предрасполагают млекопитающее к рассматриваемому нарушению. Не ограничивающие примеры нарушений, подлежащих лечению, описанному здесь, включают в себя раковые состояния, такие как раковые опухоли или метастазы предстательной железы, легкого и ободочной кишки.
Термины “клеточно-пролиферативное нарушение” и “пролиферативное нарушение” относятся к нарушениям, которые ассоциированы с некоторой степенью патологической пролиферации клеток. В одном варианте осуществления, этим клеточно-пролиферативным нарушением является рак.
“Опухолью” называют, в данном контексте, любые неопластический рост и пролиферацию клеток, независимо от того являются ли они злокачественными или доброкачественными, и все предраковые и раковые клетки и ткани. Термины “рак”, “раковый”, “клеточно-пролиферативное нарушение”, “пролиферативное нарушение” и “опухоль” не являются взаимоисключающими, как описано здесь.
Термины “рак” и “раковое” относятся к физиологическому состоянию в млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. Примеры рака включают в себя, но не ограничиваются ими, карциному, лимфому, бластому, саркому и лейкоз или лимфоидные злокачественные опухоли. Более конкретные примеры таких раковых заболеваний включают в себя плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легкого, в том числе мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточный рак легкого, рак брюшины, печеночно-клеточный рак, желудочный рак или рак желудка, в том числе желудочно-кишечный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, рак мочевых путей, гепатому, рак молочной железы, рак ободочной кишки, ректальный рак, колоректальный рак, карциному эндометрия или матки, карциному слюнных желез, рак почки или ренальный рак, рак вульвы, рак щитовидной железы, карциному печени, анальную карциному, рак полового члена, меланому, множественную миелому и В-клеточную лимфому, рак головного мозга, а также рак головы и шеи и ассоциированные метастазы.
“STEAP-1-экспрессирующей клеткой” является клетка, которая экспрессирует эндогенный или трансфицированный STEAP-1 на поверхности клетки. “STEAP-1-экспрессирующий рак” является раком, содержащим клетки, которые имеют белок STEAP-1, присутствующий на поверхности клеток. “STEAP-1-экспрессирующий рак” продуцирует достаточные уровни STEAP-1 на поверхности его клеток, так что анти-STEAP-1-антитело может связываться с ним и оказывать терапевтическое действие в отношении этого рака. Раком, который «сверхэкспрессирует» STEAP-1, является рак, который имеет значимо более высокие уровни STEAP-1 на поверхности его клеток в сравнении с нераковой клеткой того же самого типа ткани. Такая сверхэкспрессия может быть обусловлена амплификацией гена или увеличенной транскрипцией или трансляцией. Сверхэкспрессия STEAP-1 может быть определена в диагностическом или прогностическом анализе оценкой увеличенных уровней белка STEAP-1, присутствующих на поверхности клетки (например, посредством иммуногистохимического анализа; FACS-анализа). Альтернативно или дополнительно, можно измерить уровни STEAP-1 кодирующей нуклеиновой кислоты или мРНК в клетке, например, при помощи флуоресцентной гибридизации in situ; (FISH; см. WO98/45479, опубликованный в октябре 1998 года), способов блоттинга по Саузерну, Нозерн-блоттинга или полимеразной цепной реакции (PCR), например, количественной ПЦР реального времени (ОТ-ПЦР). Можно также исследовать сверхэкспрессию STEAP-1 измерением антигена, выделяемого в биологическую жидкость, такую как сыворотка, например, при помощи анализов на основе антител (см. также, например, патент США № 4933294, выданный 12 июля 1990 года; WO91/05264, опубликованный 18 апреля 1991 года; патент США 5401638, выданный 28 марта 1995 года, и Sias et al. J. Immunol. Methods 132: 73-80 (1990)). Наряду с вышеуказанными анализами, квалифицированному практику доступны различные анализы in vivo. Например, можно подвергнуть клетки в теле пациента воздействию антитела, которое необязательно помечено детектируемой меткой, например, радиоактивным изотопом, и связывание этого антитела с клетками в этом пациенте может быть оценено, например, наружным сканированием радиоактивности или анализом биопсии, взятой из пациента, предварительно подвергнутого действию этого антитела. STEAP-1-экспрессирующий рак включает в себя рак предстательной железы, легкого и ободочной кишки.
В данном контексте термин "лечение" (или вариации, такие как “лечить”, “проведение лечения”) относится к клиническому вмешательству в попытке изменения естественного хода заболевания получающих лечение индивидуума или клетки, и оно может выполняться либо для профилактики, либо во время развития клинической патологии. Желаемые эффекты лечения включают в себя предотвращение появления или рецидива заболевания, ослабление симптомов, уменьшение любых прямых или опосредованных патологических последствий этого заболевания, предотвращение метастазирования, уменьшение скорости прогрессирования заболевания, ослабление или облегчение состояния заболевания и ремиссию или улучшенный прогноз. В некоторых вариантах осуществления, антитела согласно изобретению используют для задержки развития заболевания или нарушения или для замедления прогрессирования заболевания или нарушения.
Приведенные выше параметры для оценки успешного лечения и улучшения в этом заболевании могут быть легко измерены рутинными процедурами, известными врачу. Для противораковой терапии, эффективность может быть измерена, например, оценкой времени до прогрессирования заболевания (TTP) и/или определением скорости ответной реакции (RR). Для рака предстательной железы, успех терапии может оцениваться рутинными способами, обычно измерением уровней PSA (антигена предстательной железы) в сыворотке; чем выше уровень PSA в крови, тем более экстенсивным является рак. Доступны коммерческие анализы для детектирования PSA, например, наборы для анализа PSA Hybitech Tandem-E и Tandem-R PSA, поликлональный анализ Yang ProsCheck(Yang Labs, Bellevue, WA), Abbott Imx (Abbott Labs, Abbott Park, IL), и т.д. Метастазирование может быть определено тестами стадирования и получением сканограммы кости и тестами на уровень кальция и некоторых ферментов для определения распространения в кость. CT-сканы могут также выполняться для наблюдения распространения в область таза и лимфатические узлы в этой зоне. Рентгенография грудной клетки и измерение уровней ферментов печени известными способами используют для наблюдения наличия метастазирования в легкие и печень, соответственно. Другие рутинные способы для мониторинга заболевания включают в себя трансректальную ультрасонографию и (TRUS) и трансректальную пункционную биопсию (TRNB).
“Индивидуум” является позвоночным животным. В некоторых вариантах осуществления, этим позвоночным животным является млекопитающее. Млекопитающие включают в себя, но не ограничиваются ими, сельскохозяйственных животных (например, коров), спортивных животных, домашних любимцев (таких как кошки, собаки и лошади), приматов, мышей и крыс. В некоторых вариантах осуществления, млекопитающим является человек.
“Эффективным количеством” является количество, эффективное, в дозах и в течение необходимых периодов времени, для получения желаемого терапевтического или профилактического результата. “Терапевтически эффективное количество” вещества/молекулы согласно изобретению может варьироваться в соответствии с такими факторами, как состояние заболевания, возраст, пол и масса индивидуума и способность этого вещества/этой молекулы индуцировать желаемую ответную реакцию в этом индивидууме. Терапевтически эффективное количество включает в себя количество, в котором любые токсические или вредные для здоровья эффекты вещества/молекулы перевешиваются терапевтически полезными эффектами. «Профилактически эффективное количество» является количеством, эффективным, в дозах и в течение необходимых периодов времени, для достижения желаемого профилактического результата. Обычно, но необязательно, поскольку профилактическую дозу используют в субъектах до заболевания или на ранних стадиях заболевания, профилактически эффективное количество должно быть меньшим, чем терапевтически эффективное количество. В случае рака, терапевтически эффективное количество этого лекарственного средства может уменьшать количество раковых клеток; уменьшать размер опухоли; ингибировать (т.е. замедлять до некоторой степени или предпочтительно останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. замедлять до некоторой степени и предпочтительно останавливать) метастазирование опухоли; ингибировать до некоторой степени рост опухоли и/или облегчать до некоторой степени один или несколько симптомов, ассоциированных с раком. См. предыдущее определение “лечения”. Что касается степени, в которой это лекарственное средство может предупреждать рост и/или убивать существующие раковые клетки, эта степень может быть цитостатической и/или цитотоксической.
“Продолжительным (хроническим)” введением называют введение агента (агентов) в непрерывном режиме, в отличие от однократного экстренного введения, для поддержания начального терапевтического действия (активности) в течение продолжительного периода времени. “Дробное” введение является введением, которое не выполняется последовательно без прерывания, а скорее является циклическим по характеру.
Введение «в комбинации с» одним или несколькими дополнительными терапевтическими агентами включает в себя одновременное (сопутствующее) и последовательное введение в любом порядке.
“Носители”, в данном контексте, включают в себя фармацевтически приемлемые носители, эксципиенты или стабилизаторы, которые являются нетоксичными для клетки или млекопитающего в используемых дозах и концентрациях. Часто физиологически приемлемым носителем является водный раствор с забуференным рН. Примеры физиологически приемлемых носителей включают в себя буферы, такие как фосфатный, цитратный и содержащий другие органические кислоты; антиоксиданты, в том числе аскорбиновую кислоту; низкомолекулярный полипептид (содержащий приблизительно менее 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, в том числе глюкозу, маннозу или декстрины; хелатобразующие агенты, такие как ЭДТА; сахароспирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как ТВИН™, полиэтиленгликоль (ПЭГ) и Плюроники™.
“Меткой” называют, в данном контексте, детектируемое соединение или композицию, которые конъюгированы прямо или опосредованно с этим антителом с образованием «меченого» антитела. Эта метка может быть сама детектируемой (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментной метки, может катализировать химическое изменение субстратного соединения или композиции, которое является детектируемым.
Термин “эпитоп, маркированный” относится, в данном контексте, к химерному полипептиду, содержащему полипептид анти-PSCA-антитела, слитый с “полипептидом-маркером”. Этот полипептид-маркер имеет достаточно остатков для обеспечения эпитопа, против которого может быть получено антитело, но все еще достаточно коротким, чтобы не препятствовать активности Ig-полипептида, с которым он связан. Этот полипептид-маркер предпочтительно является довольно уникальным, так что это антитело по существу не реагирует перекрестно с другими эпитопами. Подходящие полипептиды-маркеры имеют по меньшей мере шесть аминокислотных остатков и обычно приблизительно 8-50 аминокислотных остатков (предпочтительно приблизительно 10-20 аминокислотных остатков).
“Малая молекула” определяется здесь как молекула, имеющая молекулярную массу менее приблизительно 500 Дальтон.
Термин “вкладыш упаковки” означает здесь инструкции, обычно включаемые в коммерческие упаковки терапевтических продуктов, которые содержат информацию относительно показаний, применения, дозы, введения, противопоказаний и/или предупреждений, касающихся применения таких терапевтических продуктов.
“Выделенной нуклеиновой кислотой” является нуклеиновая кислота, например, РНК, ДНК или смешанный полимер, которые выделены из других геномных последовательностей ДНК, а также белков или комплексов, таких как рибосомы и полимеры, которые природно сопутствуют природной последовательности. Этот термин включает в себя последовательность нуклеиновой кислоты, которая была извлечена из природно-встречающегося окружения, и включает в себя рекомбинантные или клонированные изоляты ДНК и химически синтезированные аналоги или аналоги, биологически синтезированные гетерологичными системами. По существу чистая молекула включает в себя выделенные формы этой молекулы.
“Вектор” включает в себя челночные и экспрессирующие векторы. Обычно, плазмидная конструкция будет также включать в себя сайт инициации репликации (например, сайт инициации репликации ColE1) и селектируемый маркер (например, устойчивости к ампициллину или тетрациклину), для репликации и селекции (отбора), соответственно, этих плазмид в бактериях. “Экспрессирующим вектором” называют вектор, который содержит необходимые регуляторные элементы для экспрессии антител, в том числе фрагмент антитела согласно изобретению, в бактериальных или эукариотических клетках. Подходящие векторы описаны ниже.
Клетка, которая продуцирует анти-STEAP-1-антитело согласно изобретению, будет включать в себя исходную гибридомную клетку, например, гибридомы, которые депонированы АТСС, а также бактериальные и эукариотические клетки-хозяева, в которые были введены нуклеиновые кислоты, кодирующие эти антитела. Подходящие клетки-хозяева описаны ниже.
Термин “ингибирующий рост агент” при применении к соединению или композиции, которая ингибирует рост клетки, в частности, PSCA-экспрессирующей раковой клетки, in vitro или in vivo. Таким образом, ингибирующим рост агентом может быть агент, который значимо уменьшает процент PSCA-экспрессирующих клеток в S-фазе. Примеры ингибирующих рост агентов включают в себя агенты, которые блокируют прогрессирование клеточного цикла (в месте, другом, чем S-фаза), такие как агенты, которые индуцируют остановку G1-фазы и М-фазы. Классические блокаторы М-фазы включают в себя соединения Vinca (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Агенты, которые останавливают G1, участвуют также в остановке S-фазы, например, ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, меклоретамин, цисплатин, метотрексат, 5-фторурацил и ara-С. Дополнительная информация может быть найдена в Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, под заголовком “Cell cycle regulation, oncogenes, and antineoplastic drugs” by Murakami et al. (WB Saunders: Philadelphia, 1995), особенно на стр. 13. Таксаны (паклитаксел и доцетаксел) являются противораковыми лекарственными средствами, которые произведены из тиса. Доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer), полученный из тиса европейского, является полусинтетическим аналогом паклитаксела (TAXOL®, Bristol-Myers Squibb). Паклитаксел и доцетаксел стимулируют сборку микротрубочек из димеров тубулина и стабилизируют микротрубочки предотвращением деполимеризации, что приводит к ингибированию митоза в клетках.
Термин “цитотоксический агент” относится в данном контексте к веществу, которое ингибирует или предотвращает клеточную функцию и/или вызывает смерть или деструкцию клеток. Предполагается, что этот термин включает в себя радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu), химиотерапевтические агенты (например, метотрексат, адриамицин, винкаалкалоиды (винуристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин C, хлорамбуцил, даунорубицин или другие агенты интеркаляции, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики и токсины, такие как токсины с малыми молекулами или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, в том числе их фрагменты и/или варианты, токсины, ингибирующие рост агенты, части лекарственных средств и различные противоопухолевые или противораковые агенты, описанные ниже. Уничтожающий опухолевые клетки агент вызывает деструкцию опухолевых клеток.
“Токсином” является любое вещество, способное оказывать вредное действие на рост или пролиферацию клетки.
“Химиотерапевтический агент” является химическим соединением, применимым в лечении рака. Примеры химиотерапевтических агентов включают в себя алкилирующие агенты, такие как тиотепа и CYTOXAN®, циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбохон, метуредопа и уредопа; этиленимины и метиламеламины, включающие в себя алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (в частности, буллатацин и буллатационон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (в том числе синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (в том числе его синтетические аналоги адозелесин, карцелесин и бизелесин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (в том числе синтетические аналоги, KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктилин; спонгистатин; азотные аналоги иприта, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, меклоретамин, гидрохлорид меклоретаминоксида, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урацилпроизводное иприта; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как ендииновые антибиотики (например, калихеамицин, в частности, калихеамицин гамма I1 и калихеамицин омега I1 (см., например, Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, в том числе динемицин A; эсперамицин; а также хромофор неокарциностатин и родственные хромопротеины ендииновые антибиотические хромофоры), аклациномисины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, скарцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин ADRIAMYCIN® (в том числе морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролидино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексатит 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антиадренали, такие как аминоглутетимид, митотан, трилостан; добавку к фолиевой кислоте, такую как фролиновая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазихон; элфорнитин; эллиптиния ацетат; эпотилон; этоглуцид; галлия нитрат; гидроксимочевину; лентинан; лонидаинин; майтансиноиды, такие как майтансин и ансамитоцины; митогуазон; митоксинтрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лосоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизоферан; спирогерманий; тенуазоновую кислоту; триазихон; 2,2’,2"-трихлортриэтиламин; трихотецены (в частности, токсин T-2, верракурин A, роридин A и ангвидин); уретан; виндесин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитосин; арабинозид (“Ara-C”); тиотепа; таксолы, например, паклитаксел TAXOL® (Bristol-Myers Squibb Oncology, Princeton, N. J.), не содержащий Кремофора ABRAXANE™, альбумин-встроенный состоящий из наночастиц препарат паклитаксела (American Pharmaceutical Partners, Schaumberg, Illinois) и доцетаксел TAXOTERE® (Rhόne-Poulenc Rorer, Antony, France); хлоранбуцил; гемцитабин (GEMZAR®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейкововин; винорелбин (NAVELBINE®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиновая кислота; капецитабин (XELOD A®); фармацевтически приемлемые соли, кислоты или производные любого из вышеописанных веществ; а также комбинации из двух или более из вышеописанных соединений, такие как CHOP, аббревиатура для комбинированного терапевтического средства с использованием циклофосфамида, доксорубицина, винкристина и преднизолона, и FOLFOX, аббревиатура для схемы лечения с использованием оксалиплатина (ELOXATIN™), объединенного с 5-ФУ и лейкововином.
В это определение включены также противогормональные агенты, которые действуют, регулируя, уменьшая, блокируя или ингибируя действия гормонов, которые стимулируют рост рака, и часто используются в форме, подходящей для системного лечения всего организма. Они сами могут быть гормонами. Примеры включают в себя антиэстрогены и селективные модуляторы рецептора эстрогена (SERM), в том числе, например, тамоксифен (в том числе тамоксифен NOLVADEX®), ралоксифен EVISTA®, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY1 17018, онапристон и торемифен FARESTON®; антипрогестероны; понижающие регуляторы рецептора эстрогена (ERD); агенты, которые функционируют, подавляя или выключая яичники, например, агонист рилизинг-фактора лютеинизирующего гормона (LHRH), такие как LUPRON® и лейпролида ацетат ELIGARD®, госерелина ацетат, бусерелина ацетат и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует продуцирование эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглютетимид, мегестрола ацетат MEGASE®, эксеместан AROMASIN®, форместан, фадрозол, форозол RIVISOR®, летрозол FEMARA® и анастрозол ARIMIDEX®. Кроме того, такое определение химиотерапевтических агентов включает в себя бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат DIDROCAL®, NE-58095, золедроновую кислоту/золедронат ZOMETA®, алендронат FOSAMAX®, памидронат AREDIA®, тилудронат SKELID® или ризедронат ACTONEL®; а также троксацитабин (аналог цитозина 1,3-диоксалан-нуклеозид); антисмысловые олигонуклеотиды, в частности, олигонуклеотиды, которые ингибируют экспрессию генов в путях передачи сигнала, которые предположительно вовлечены в аберрантную пролиферацию клеток, такие как, например, PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE®, и вакцины генной терапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 LURTOTECAN®; ABARELIX® rmRH; лапатиниба дитозилат (ингибитор с малой молекулой двойной ErbB-2 и EGFR тирозинкиназы, также известной как GW572016); и фармацевтически приемлемые соли, кислоты и производные любого из вышеуказанных соединений.
“Ингибирующим рост агентом” называют, в данном контексте, соединение или композицию, которые ингибируют рост клетки (например, клетки, экспрессирующей STEAP-1) in vitro или in vivo. Таким образом, ингибирующим рост агентом может быть агент, который значимо уменьшает процент клеток (например, клеток, экспрессирующих STEAP-1) в S-фазе. Примеры ингибирующих рост агентов включают в себя агенты, которые блокируют прогрессирование клеточного цикла (в месте, другом, чем S-фаза), такие как агенты, которые индуцируют остановку фазы G1 и М-фазы. Классические блокаторы М-фазы включают в себя алкалоиды Vinca (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Агенты, которые останавливают G1, участвуют также в остановке S-фазы, например, ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, меклоретамин, цисплатин, метотрексат, 5-фторурацил и ara-С. Дополнительная информация может быть найдена в Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, entitled "Cell cycle regulation, oncogenes, and antineoplastic drugs" by Murakami et al. (WB Saunders: Philadelphia, 1995), в частности, стр. 13. Таксаны (паклитаксел и доцетаксел) являются противораковыми агентами, полученными из тиса. Доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer), полученный из тиса европейского, является полусинтетическим аналогом паклитаксела (TAXOL®, Bristol-Myers Squibb). Паклитаксел и доцетаксел стимулируют сборку микротрубочек из димеров тубулина и стабилизируют микротрубочки предотвращением деполимеризации, что приводит к ингибированию митоза в клетках.
Термин “внутриклеточный метаболит” относится к соединению, происходящему из метаболического процесса или метаболической реакции внутри клетки на конъюгате антитело-лекарственное средство (ADC). Этим метаболическим процессом или этой метаболической реакцией может быть ферментативный процесс, такой как протеолитическое расщепление пептидного линкера ADC или гидролиз функциональной группы, такой как гидразоногруппа, эфирная группа или амидная группа. Внутриклеточные метаболиты включают в себя, но не ограничиваются ими, антитела, и свободные лекарственные средства, которые были подвергнуты внутриклеточному расщеплению после вхождения, диффузии, поглощения или транспорта в клетку.
Термины “внутриклеточно расщепленные” и “внутриклеточное расщепление” относятся к метаболическому процессу или метаболической реакции внутри клетки на конъюгате антитело-лекарственное средство (ADC) посредством которых ковалентное присоединение, т.е. линкер, между частью лекарственного средства (D) и антителом (Ab) разрывается, что приводит к свободному лекарственному средству, диссоциированному из антитела внутри этой клетки. Таким образом, эти отщепленные части молекулы ADC являются внутриклеточными метаболитами.
Термин “биодоступность” относится к системной доступности (т.е. уровням кровь/плазма) конкретного количества лекарственного средства, вводимого пациенту. Биодоступность является абсолютным термином, который указывает на измерение как времени (скорости), так и общего количества (степени) лекарственного средства, которое достигает общей циркуляции из введенной дозированной лекарственной формы.
Термин “цитотоксическая активность” относится к убиванию клеток, цитостатическому или ингибирующему рост действию конъюгата антитело-лекарственное средство или внутриклеточного метаболита конъюгата антитело-лекарственное средство. Цитотоксическая активность может быть выражена в виде величины IC50, которая является концентрацией (молярной или массовой) на единицу объема, при которой выживает половина клеток.
“Алкил” означает C1-C18 углеводород, содержащий нормальный, вторичный, третичный атомы углерода или атом углерода кольца. Примерами являются метил (Me, -CH3), этил (Et, -CH2CH3), 1-пропил (n-Pr, н-пропил, -CH2CH2CH3), 2-пропил (i-Pr, изо-пропил, -CH(CH3)2), 1-бутил (n-Bu, н-бутил, -CH2CH2CH2CH3), 2-метил-1-пропил (i-Bu, изо-бутил, -CH2CH(CH3)2), 2-бутил (s-Bu, втор-бутил, -CH(CH3)CH2CH3), 2-метил-2-пропил (t-Bu, трет-бутил, -C(CH3)3), 1-пентил (н-пентил, -CH2CH2CH2CH2CH3), 2-пентил (-CH(CH3)CH2CH2CH3), 3-пентил (-CH(CH2CH3)2), 2-метил-2-бутил (-C(CH3)2CH2CH3), 3-метил-2-бутил (-CH(CH3)CH(CH3)2), 3-метил-1-бутил (-CH2CH2CH(CH3)2), 2-метил-1-бутил (-CH2CH(CH3)CH2CH3), 1-гексил (-CH2CH2CH2CH2CH2CH3), 2-гексил (-CH(CH3)CH2CH2CH2CH3), 3-гексил (-CH(CH2CH3)(CH2CH2CH3)), 2-метил-2-пентил (-C(CH3)2CH2CH2CH3), 3-метил-2-пентил (-CH(CH3)CH(CH3)CH2CH3), 4-метил-2-пентил (-CH(CH3)CH2CH(CH3)2), 3-метил-3-пентил (-C(CH3)(CH2CH3)2), 2-метил-3-пентил (-CH(CH2CH3)CH(CH3)2), 2,3-диметил-2-бутил (-C(CH3)2CH(CH3)2), 3,3-диметил-2-бутил (-CH(CH3)C(CH3)3).
Термин “C1-C8 алкил” означает в данном контексте имеющий прямую цепь или разветвленный, насыщенный или ненасыщенный углеводород, имеющий 1-8 атомов углерода. Репрезентативные группы “С1-С8 алкил” включают в себя, но не ограничиваются ими, -метил, -этил, -н-пропил, -н-бутил, -н-пентил, -н-гексил, -н-гептил, -н-октил, -н-нонил и -н-децил; тогда как разветвленные С1-С8 алкилы включают в себя, но не ограничиваются ими, -изопропил, -втор-бутил, -изобутил, -трет-бутил, -изопентил, 2-метилбутил, ненасыщенные С1-С8 алкилы включают в себя, но не ограничиваются ими, -винил, -аллил, -1-бутенил, -2-бутенил, -изобутиленил, -1-пентенил, -2-пентенил, -3-метил-1-бутенил, -2-метил-2-бутенил, -2,3-диметил-2-бутенил, 1-гексил, 2-гексил, 3-гексил, ацетиленил, -пропинил, -1-бутинил, -2-бутинил, -1-пентинил, -2-пентинил, -3-метил-1-бутинил, метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, изогексил, 2-метилпентил, 3-метилпентил, 2,2-диметилбутил, 2,3-диметилбутил, 2,2-диметилпентил, 2,3-диметилпентил, 3,3-диметилпентил, 2,3,4-триметилпентил, 3-метилгексил, 2,2-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 3,5-диметилгексил, 2,4-диметилпентил, 2-метилгептил, 3-метилгептил, н-гептил, изогептил, н-октил и изооктил. С1-С8 алкильная группа может быть незамещенной или замещена одной или несколькими группами, включающими в себя, но не ограничивающимися ими, С1-С8 алкил, -О-(С1-С8 алкил), -арил, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(0)N(R’)2, -NHC(O)R’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, -галоген, -N3, -NH2, -NH(R’), -N(R’)2 и -CN; где каждый R’ независимо выбран из H, С1-С8 алкила и арила.
“Алкенил” означает С2-С18 углеводород, содержащий нормальный, вторичный, третичный атомы углерода или атом углерода кольца по меньшей мере с одним сайтом ненасыщенности, т.е. углерод-углеродной, sp2 двойной связью. Примеры включают в себя, но не ограничиваются ими: этилен или винил (-CH=CH2), аллил (-CH2CH=CH2), циклопентенил (-C5H7) и 5-гексенил (-CH2CH2CH2CH2CH-CH2).
“Алкинил” означает С2-С18 углеводород, содержащий нормальный, вторичный, третичный или циклический атомы углерода по меньшей мере с одним сайтом ненасыщенности, т.е. углерод-углеродной, sp тройной связью. Примеры включают в себя, но не ограничиваются ими: ацетиленовую группу (-C≡CH) и пропаргил (-CH2C≡CH).
“Алкилен” означает содержащий насыщенную, разветвленную или прямую цепь или циклический углеводородный радикал из 1-18 атомов углерода, и имеющий два одновалентных центра радикала, полученных удалением двух атомов водорода от одного и того же или двух разных атомов углерода исходного алкана. Типичные алкиленовые радикалы включают в себя, но не ограничиваются ими: метилен (-CH2-), 1,2-этил (-CH2CH2-), 1,3-пропил (-CH2CH2CH2-), 1,4-бутил (-CH2CH2CH2CH2-), и т.п.
“С1-С10 алкилен” означает имеющую прямую цепь, насыщенную углеводородную группу формулы -(CH2)1-10-. Примеры С1-С10 алкилена включают в себя метилен, этилен, пропилен, бутилен, пентилен, гексилен, гептилен, октилен, нонилен и декален.
“Алкенилен” означает имеющий ненасыщенную, разветвленную или прямую цепь или циклический углеводородный радикал из 2-18 атомов углерода, и имеющий два одновалентных центра радикала, полученных удалением двух атомов водорода от одного и того же или двух разных атомов углерода исходного алкена. Типичные алкениленовые радикалы включают в себя, но не ограничиваются ими: 1,2-этилен (-CH=CH-).
“Алкинилен” означает имеющий ненасыщенную, разветвленную или прямую цепь или циклический углеводородный радикал из 2-18 атомов углерода, и имеющий два одновалентных центра радикала, полученных удалением двух атомов водорода от одного и того же или двух разных атомов углерода исходного алкина. Типичные алкениленовые радикалы включают в себя, но не ограничиваются ими: ацетилен (-C≡C-), пропаргил (-CH2C≡C-) и 4-пентинил (-CH2CH2CH2C=C-).
“Арил” означает карбоциклическую ароматическую группу. Примеры арильных групп включают в себя, но не ограничиваются ими, фенил, нафтил и антраценил. Карбоциклическая ароматическая группа или гетероциклическая ароматическая группа может быть незамещенной или замещена одной или несколькими группами, включающими в себя, но не ограничивающимися ими, -C1-C8 алкил, -О-(С1-С8 алкил), -арил, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(O)N(R’)2, -NHC(O)R’, -S(O)2R’, -S(O)R’, -OH, -галоген, -N3, -NH2, -NH(R’), -N(R’)2 и -CN; где каждый R’ независимо выбран из H, С1-С8 алкила и арила.
“Арилен” означает арильную группу, которая имеет две ковалентные связи и может быть в конфигурациях орто, мета или пара, как показано в следующих структурах:

в которых фенильная группа может быть незамещенной или замещена группами (до четырех групп), включающими в себя, но неограничивающимися ими, -C1-C8 алкил, -О-(С1-С8 алкил), -арил, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(O)N(R’)2, -NHC(O)R’, -S(O)2R’, -S(O)R’, -OH, -галоген, -N3, -NH2, -NH(R’), -N(R’)2 и -CN; где каждый R’ независимо выбран из H, С1-С8 алкила и арила.
“Арилалкил” означает ациклический алкильный радикал, в котором один из атомов водорода, связанных с атомом углерода, обычно концевым или sp3 атомом углерода, заменен арильным радикалом. Типичные арилалкильные группы включают в себя, но не ограничиваются ими, бензил, 2-фенилэтан-1-ил, 2-фенилэтен-1-ил, нафтилметил, 2-нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и т.п. Арилалкильная группа содержит 6-20 атомов углерода, например, алкильную часть, включающую в себя алканильную, алкенильную или алкинильную группы, арилалкильной группы, имеющую 1-6 атомов углерода, и арильную часть, имеющую 5-14 атомов углерода.
“Гетероарилалкил” означает ациклический алкильный радикал, в котором один из атомов водорода, связанных с атомом углерода, обычно концевым или sp3 атомом углерода, заменен гетероарильным радикалом. Типичные гетероарилалкильные группы включают в себя, но не ограничиваются ими, 2-бензимидозолилметил, 2-фурилэтил и т.п. Гетероарилалкильная группа содержит 6-20 атомов углерода, например, алкильная часть, включающая в себя алканильную, алкенильную или алкинильную группы, гетероарилалкильной группы имеет 1-6 атомов углерода, и гетероарильная часть имеет 5-14 атомов углерода и 1-3 гетероатома, выбранных из N, O, P и S. Гетероарильная часть гетероарилалкильной группы может быть моноциклом, имеющим 3-7 членов кольца (2-6 атомов углерода) или бициклом, имеющим 7-10 членов кольца (4-9 атомов углерода и 1-3 гетероатома, выбранных из N, O, P и S), например, системой бицикло [4,5], [5,5], [5,6] или [6,6].
“Замещенный алкил”, “замещенный арил” и “замещенный арилалкил” означают алкил, арил и арилалкил, соответственно, в котором один или несколько атомов водорода, каждый, независимо заменены заместителем. Типичные заместители включают в себя, но не ограничиваются ими, -X, -R, -О-, -OR, -SR, -S-, -NR2, -NR3, =NR, -CX3, -CN, -OCN, -SCN, -N=C=O, -NCS, -NO, -NO2, =N2, -N3, NC(O)R, -C(=О)R, -C(O)NR2, -SO3-, -SO3H, -S(O)2R, -OS(O)2OR, -S(=O)2NR, -S(=O)R, -OP(=O)(OR)2, -P(=O)(OR)2, -PO-3, -PO3H2, -C(=O)R, -C(=O)X, -C(=S)R, -CO2R, -CO2-, -C(=S)OR, -C(O)SR, -C(=S)SR, -C(=O)NR2, -C(=S)NR2, -C(=NR)NR2, где каждый X означает независимо галоген: F, Cl, Br или I; и каждый R означает независимо -H, C2-C18 алкил, C6-C2O арил, C3-C14 гетероцикл, защитную группу или группу пролекарства. Алкиленовые, алкениленовые и алкиниленовые группы, описанные выше, могут быть сходным образом замещены.
“Гетероарил” и “гетероцикл” означают кольцевую систему, в которой один или несколько атомов кольца являются гетероатомами, например, азотом, кислородом и серой. Радикал гетероцикл содержит 1-20 атомов углерода и 1-3 гетероатомов, выбранных из N, O, P и S. Гетероцикл может быть моноциклом, имеющим 3-7 членов кольца (2-6 атомов углерода и 1-3 гетероатома, выбранных из N, O, P и S), или бициклом, имеющим 7-10 членов кольца (4-9 атомов углерода и 1-3 гетероатомов, выбранных из N, O, P и S), например, системой: бицикло [4,5], [5,5], [5,6] или [6,6].
Гетероциклы описаны в Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968), в частности, в Частях 1, 3, 4, 6, 7 и 9; "The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, 1950 и до переизданий настоящего времени), в частности, Volumes 13, 14, 16, 19 и 28; и J. Am. Chem. Soc. (1960) 82:5566.
Примеры гетероциклов включают в себя, в качестве иллюстрации, но не для ограничения, пиридил, дигидропиридил, тетрагидропиридил (пиперидил), тиазолил, тетрагидротиофенил, тетрагидротиофенил с окисленной серой, пиримидинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, бензофуранил, тианафталенил, индолил, индоленил, хинолинил, изохинолинил, бензимидазолил, пиперидинил, 4-пиперидонил, пирролидинил, 2-пирролидонил, пирролинил, тетрагидрофуранил, бис-тетрагидрофуранил, тетрагидропиранил, бис-тетрагидропиранил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, октагидроизохинолинил, азоцинил, триазинил, 6H-1,2,5-тиадиазинил, 2H,6H-1,5,2-дитиазинил, тиенил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил, феноксатинил, 2H-пирролил, изотиазолил, изоксазолил, пиразинил, пиридазинил, индолизинил, изоиндолил, 3H-индолил, 1H-индазолил, пуринил, 4H-хинолизинил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, 4aH-карбазолил, карбазолил, β-карболинил, фенантридинил, акридинил, пиримидинил, фенантролинил, феназинил, фенотиазинил, фуразинил, феноксазинил, изохроманил, хроманил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил, индолинил, изоиндолинил, хинуклидинил, морфолинил, оксазолидинил, бензотриазолил, бензизоксазолил, оксиндолил, бензоксазолинил и изатиноил.
В качестве примера, а не ограничения, углерод-связанные гетероциклы связаны в положении 2, 3, 4, 5 или 6 пиридина положении 3, 4, 5 или 6 пиридазина, положении 2, 4, 5 или 6 пиримидина, положении 2, 3, 5 или 6 пиразина, положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, положении 2, 4 или 5 оксазола, имидазола или тиазола, положении 3, 4 или 5 изоксазола, пиразола или изотиазола, положении 2 или 3 азиридина, положении 2, 3 или 4 азетидина, положении 2, 3, 4, 5, 6, 7 или 8 хинолина или в положении 1, 3, 4, 5, 6, 7 или 8 изохинолина. Еще более предпочтительно, углерод-связанные гетероциклы включают в себя 2-пиридил, 3-пиридил, 4-пиридил, 5-пиридил, 6-пиридил, 3-пиридазинил, 4-пиридазинил, 5-пиридазинил, 6-пиридазинил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 6-пиримидинил, 2-пиразинил, 3-пиразинил, 5-пиразинил, 6-пиразинил, 2-тиазолил, 4-тиазолил или 5-тиазолил.
В качестве примера, а не ограничения, азот-связанные гетероциклы связаны в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1H-индазола, положении 2 изоиндола или изоиндолина, положении 4 морфолина и положении 9 карбазола или β-карболина. Еще более предпочтительно, азот-связанные гетероциклы включают в себя 1-азиридил, 1-азетидил, 1-пирролил, 1-имидазолил, 1-пиразолил и 1-пиперидинил.
“C3-C8 гетероцикл” означает ароматический или неароматический C3-C8 карбоцикл, в котором один-четыре атомов углерода кольца независимо заменены гетероатомом из группы, состоящей из O, S и N. Репрезентативные примеры C3-C8 гетероцикла включают в себя, но не ограничиваются ими, бензофуранил, бензотиофен, индолил, бензопиразолил, кумаринил, изохинолинил, пирролил, тиофенил, фуранил, тиазолил, имидазолил, пиразолил, триазолил, хинолинил, пиримидинил, пиридинил, пиридонил, пиразинил, пиридазинил, изотиазолил, изоксазолил и тетразолил. C3-C8 гетероцикл может быть незамещенным или замещен группами (до семи групп), включающими в себя, но не ограничивающимися ими, С1-С8 алкил, -О-(С1-С8 алкил), -арил, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(O)N(R’)2, -NHC(O)R’, -S(O)2R’, -S(O)R’, -OH, -галоген, -N3, -NH2, -NH(R’), -N(R’)2 и -CN; где каждый R’ независимо выбран из H, С1-С8 алкила и арила.
“C3-C8 гетероцикл” означает C3-C8 гетероциклическую группу, определенную выше, причем один из атомов водорода этой гетероциклической группы заменен группами (до шести групп), включающими в себя, но не ограничивающимися ими, С1-С8 алкил, -О-(С1-С8 алкил), -арил, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(O)N(R’)2, -NHC(O)R’, -S(O)2R’, -S(O)R’, -OH, -галоген, -N3, -NH2, -NH(R’), -N(R’)2 и -CN; где каждый R’ независимо выбран из H, С1-С8 алкила и арила.
“Карбоцикл” означает насыщенное или ненасыщенное кольцо, имеющее 3-7 атомов углерода в виде моноцикла, или 7-12 атомов углерода в виде бицикла. Моноциклические карбоциклы имеют 3-6 атомов кольца, более типично, 5-6 атомов кольца. Бициклические карбоциклы имеют 7-12 атомов кольца, например, размещенных в виде системы бицикло [4,5], [5,5], [5,6] или [6,6], или 9-10 атомов кольца, размещенных в виде системы бицикло [5,6] или [6,6]. Примеры моноциклических карбоциклов включают в себя циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогептил и циклооктил.
“C3-C8 карбоцикл” означает 3-, 4-, 5-, 6-, 7- или 8-членное насыщенное или ненасыщенное неароматическое карбоциклическое кольцо. Репрезентативные C3-C8 карбоциклы включают в себя, но не ограничиваются ими, -циклопропил, -циклобутил, -циклопентил, -циклопентадиенил, -циклогексил, -циклогексенил, -1,3-циклогексадиенил, -1,4-циклогексадиенил, -циклогептил, -1,3-циклогептадиенил, -1,3,5циклогептатриенил, -циклооктил и -циклооктадиенил. Группа C3-C8 карбоцикл может быть незамещенной или замещена одной или несколькими группами, включающими в себя, но не ограничивающимися ими, С1-С8 алкил, -О-(С1-С8 алкил), -арил, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(O)N(R’)2, -NHC(O)R’, -S(O)2R’, -S(O)R’, -OH, -галоген, -N3, -NH2, -NH(R’), -N(R’)2 и -CN; где каждый R’ независимо выбран из H, С1-С8 алкила и арила.
“C3-C8 карбоцикл” означает группу C3-C8 карбоцикл, определенную выше, причем один атом водорода этих карбоциклических групп заменен связью.
“Линкер” означает химическую часть молекулы, содержащую ковалентную связь или цепь атомов, которые ковалентно присоединяют антитело к части лекарственного средства. В различных вариантах осуществления, линкеры включают в себя двухвалентный радикал, такой как алкилдиил, гетероарилдиил, группы, такие как-(CR2)nO(CR2)n-, повторяющиеся единицы алкилокси (например, полиэтиленокси, ПЭГ, полиметиленокси) и алкиламино (например, полиэтиленамино, Jeffamine™); и эфир дикислоты и амиды, в том числе сукцинат, сукцинамид, дигликолат, малонат и капроамид.
Термин “хиральная” относится к молекулам, которые имеют свойство, заключающееся в том, что они не могут быть наложены на партнера зеркального изображения, в то время как термин “ахиральная” относится к молекулам, которые могут быть наложены на партнера зеркального изображения.
Термин “стереоизомеры” относится к соединениям, которые имеют идентичное химическое строение, но различаются в отношении расположения их атомов и групп в пространстве.
Термин “диастереомер” относится к стереоизомеру с двумя или более центарми хиральности, и молекулы диастереомеров не являются зеркальными изображениями друг друга. Диастереомеры имеют разные физические свойства, например, точки плавления, точки кипения, спектральные свойства и реакционные способности. Смеси диастереомеров могут быть разделены при аналитических процедурах высокого разрешения, таких как электрофорез и хроматография.
“Энантиомеры” являются двумя стереоизомерами соединения, которые не являются накладывающимися зеркальными изображениями друг друга.
Стереохимические определения и общепринятые стандарты, используемые здесь, обычно соответствуют S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; and Eliel, E. and Wilen, S., Stereochemistry of Organic Compounds (1994) John Wiley & Sons, Inc., New York. Многие органические соединения существуют в оптически активных формах, т.е. они способны вращать плоскость плоскополяризованного света. В описании оптически активного соединения, префиксы D и L или R и S используются для обозначения абсолютной конфигурации молекулы около ее хирального центра (хиральных центров). Префиксы d и l или (+) и (-) используются для обозначения знака вращения плоскополяризованного света этим соединением, причем (-) означает, что это соединение является левовращающим. Соединение с префиксом (+) или d, является правовращающим. Для конкретной химической структуры, эти стереоизомеры являются идентичными, за исключением того, что они являются зеркальными отображениями друг друга. Конкретный стереоизомер может также называться энантиомером, а смесь таких изомеров часто называют энантиомерной смесью. Смесь 50:50 энантиомеров называют рацемической смесью или рацематом, который может встречаться, когда в химической реакции или химическом процессе не было стереоселекции или стереоспецифичности. Термины «рацемическая смесь» или «рацемат» относятся к эквимолярной смеси двух энантиомерных разновидностей, лишенных оптической активности.
“Уходяшая (отщепляемая) группа” является функциональной группой, которая может быть заменена другой функциональной группой. Определенные отщепляемые группы хорошо известны в данной области, и примеры включают в себя, но не ограничиваются ими, галогенид (например, хлорид, бромид, иодид), метансульфонил (мезил), п-толуолсульфонил (тозил), трифторметилсульфонил (трифлат) и трифторметилсульфонат.
Аббревиатуры
Линкерные компоненты:
MC=6-малеимидкапроил
Val-Cit или "vc"=валин-цитруллин (примерный дипептид в расщепляемом протеазами линкере)
Цитруллин=2-амино-5-уреидопентановая кислота
PAB=п-аминобензилоксикарбонил (пример «самоуничтожающегося» линкерного компонента)
Me-Val-Cit=N-метил-валин-цитруллин (где пептидная связь линкера была модифицирована для предотвращения расщепления катепсином В)
MC(PEG)6-OH=малеимидокапроил-полиэтиленгликоль (может быть присоединен к цистеинам антитела)
SPP=N-сукцинимидил-4-(2-пиридилтио)пентаноат
SPDP=N-сукцинимидил-3-(2-пиридилдитио)пропионат
SMCC=сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат
IT=иминотиолан
Цитотоксические лекарственные средства:
MMAE=монометилауристатин Е (MW 718)
MMAF=вариант ауристатина Е (MMAE) с фенилаланином на С-конце лекарственного средства (MW 731.5)
MMAF-DMAEA=MMAF с DMAEA (диметиламиноэтиламином) в амидной связи с С-концевым фенилаланином (MW 801.5)
MMAF-TEG=MMAF с тетраэтиленгликлем, этерифицированным с фенилаланином
MMAF-NtBu=N-трет-бутил, присоединенный в виде амида к С-концу MMAF
DM1=N(2’)-деацетил-N(2’)-(3-меркапто-1-оксопропил)майтансин
DM3=N(2’)-деацетил-N2-(4-меркапто-1-оксопентил)майтансин
DM4=N(2’)-деацетил-N2-(4-меркапто-4-метил-1-оксопентил)майтансин
Дополнительными аббревиатурами являются следующие аббревиатуры: AE означает ауристатин E, Boc означает N-(трет-бутоксикарбонил), cit означает цитруллин, dap означает долапроин, DCC означает 1,3-дициклогексилкарбодимид, DCM означает дихлорметан, DEA означает диэтиламин, DEAD означает диэтилазодикарбоксилат, DEPC означает диэтилфосфорилцианидат, DIAD означает диизопропилазодикарбоксилат, DIEA означает N,N-диизопропилэтиламин, dil означает долаизолейцин, DMA означает диметилацетамид, DMAP означает 4-диметиламинопиридин, DME означает простой диметиловый эфир этиленгликоля (или 1,2-диметоксиэтан), DMF означает N,N-диметилформамид, DMSO означает диметилсульфоксид, doe означает долафенин, dov означает N,N-диметилвалин, DTNB означает 5,5’-дитиобис-(2-нитробензойную кислоту), DTPA означает диэтилентриаминпентауксусную кислоту, DTT означает дитиотреитол, EDCI означает гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида, EEDQ означает 2-этокси-1-этоксикарбонил-12-дигидрохинолин, ES-MS означает электрораспылительную масс-спектрометрию, EtOAc означает этилацетат, Fmoc означает N-(9-флуоренилметоксикарбонил), gly означает глицин, HATU означает гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N’,N’-тетраметилурония, HOBt означает 1-гидроксибензотриазол, HPLC означает жидкостную хроматографию высокого давления, ile означает изолейцин, lys означает лизин, MeCN (CH3CN) означает ацетонитрил, MeOH означает метанол, Mtr означает 4-анисилдифенилметил (или 4-метокситритил), nor означает 1S,2R)-(+)-норэфедрин, PBS (ЗФР) означает забуференный фосфатом солевой раствор (pH 7,4), PEG (ПЭГ) означает полиэтиленгликоль, Ph означает фенил, Pnp означает п-нитрофенил, MC означает 6-малеидокапроил, phe означает L-фенилаланин, PyBrop означает гексафторфосфат бром-трис-пирролидинофосфония, SEC означает вытеснительную (гель-фильтрационную) хроматографию, Su означает сукцинимид, TFA (ТФУ) означает трифторуксусную кислоту, TLC (ТСХ) означает тонкослойную хроматографию, УФ означает ультрафиолет и val означает валин.
Композиции и способы их получения
Обеспечены антитела, которые связываются с STEAP-1. Обеспечены иммуноконъюгаты, содержащие анти-STEAP-1-антитела. Антитела и иммуноконъюгаты согласно изобретению применимы, например, для диагностики или лечения нарушений, ассоциированных с измененной экспрессией, например, увеличенной экспрессией, STEAP-1. В некоторых вариантах осуществления, антитела и иммуноконъюгаты согласно изобретению применимы для диагностики или лечения клеточно-пролиферативного нарушения, например, рака.
Анти-STEAP-1-антитела
В одном аспекте, это изобретение обеспечивает антитела, которые связываются с STEAP-1. В некоторых вариантах осуществления, обеспечены антитела, которые связываются со зрелой формой STEAP-1 человека и собакоподобной обезьяны (cyno). В одном таком варианте осуществления, зрелая форма STEAP-1 человека имеет аминокислотную последовательность SEQ ID NO:1 (фигура 1). STEAP-1 cyno имеет аминокислотную последовательность SEQ ID NO:3 (фигура 1). В некоторых вариантах осуществления, антитело к STEAP-1 связывается со зрелой формой STEAP-1, экспрессируемой на поверхности клетки. В некоторых вариантах осуществления, антитело, которое связывается со зрелой формой STEAP-1, экспрессируемой на поверхности клетки, ингибирует рост этой клетки. В некоторых вариантах осуществления, анти-STEAP-1-антитело связывается со зрелой формой STEAP-1, экспрессируемой на поверхности клетки, и ингибирует пролиферацию клетки. В некоторых вариантах осуществления, анти-STEAP-1-антитело связывается со зрелой формой STEAP-1, экспрессируемой на поверхности клетки, и индуцирует смерть клетки. В некоторых вариантах осуществления, анти-STEAP-1-антитело связывается со зрелой формой STEAP-1, экспрессируемой на поверхности раковых клеток. В некоторых вариантах осуществления, анти-STEAP-1-антитело связывается со зрелой формой STEAP-1, которая сверхэкспрессируется на поверхности раковых клеток относительно нормальных клеток, происходящих из той же самой ткани. В некоторых вариантах осуществления, анти-STEAP-1-антитело конъюгировано с цитотоксином или детектируемой меткой и связывается со STEAP-1 на поверхности клетки. В некоторых вариантах осуществления, конъюгат антитело-токсин ингибирует рост этой клетки. В некоторых вариантах осуществления, конъюгат антитело-детектируемая метка делает клетку, экспрессирующую STEAP-1 на ее поверхности, детектируемой in vitro или in vivo.
В одном аспекте, анти-STEAP-1-антитело является моноклональным антителом. В одном аспекте, анти-STEAP-1-антитело является фрагментом антитела, например, фрагментом Fab, Fab’-SH, Fv, scFv или (Fab’)2. В одном аспекте, анти-STEAP-1-антитело является химерным, гуманизированным антителом или антителом человека. В одном аспекте, любое из описанных здесь анти-STEAP-1-антител является очищенным.
Здесь обеспечены примерные моноклональные антитела, полученные из фаговой библиотеки. Антигеном, используемым для скрининга этой библиотеки, был полипептид, имеющий последовательность аминокислотных последовательностей SEQ ID NO:28 или SEQ ID NO:30, соответствующих внеклеточным доменам (ECD) STEAP-1 бета и альфа. Антитела, полученные из скрининга этой библиотеки, являются аффинно зрелыми.
В одном аспекте, обеспечены моноклональные антитела, которые конкурируют со связыванием мышиного антитела 120.545, 120-трансплантата, и гуманизированного антитела 120v.24 с STEAP-1. Обеспечены также моноклональные антитела, которые связываются с тем же самым эпитопом, с которым связываются мышиное антитело 120.545, 120-трансплантат и гуманизированное антитело 120v.24.
В одном аспекте согласно изобретению, обеспечены полинуклеотиды, кодирующие анти-STEAP-1-антитела. В некоторых вариантах осуществления, обеспечены векторы, содержащие полинуклеотиды, кодирующие анти-STEAP-1-антитела. В некоторых вариантах осуществления, обеспечены клетки-хозяева, содержащие такие векторы. В другом аспекте согласно изобретению обеспечены композиции, содержащие анти-STEAP-1-антитела, или полинуклеотиды, кодирующие анти-STEAP-1-антитела. В некоторых вариантах осуществления, композиция согласно изобретению является фармацевтической композицией для лечения клеточно-пролиферативного нарушения, такого как перечисленные здесь нарушения.
Далее следует подробное описание примерных анти-STEAP-1-антител.
1. Конкретные варианты анти-STEAP-1-антител
В одном аспекте, это изобретение обеспечивает анти-STEAP-1-антитело, содержащее вариабельный домен тяжелой цепи, содержащий SEQ ID NO:9 или 10 фигуры 2В. В одном аспекте, это изобретение обеспечивает анти-STEAP-1-антитело, содержащее вариабельный домен легкой цепи, содержащий SEQ ID NO:6 фигуры 2А.
В одном аспекте, это изобретение обеспечивает анти-STEAP-1-антитело, содержащее тяжелую цепь, содержащую SEQ ID NO:9, имеющую одно или несколько следующих изменений аминокислот в указанном положении по Кабату: A24V, V371, V48M, F671 и L78F. В одном варианте осуществления, эта тяжелая цепь содержит каркасную область тяжелой цепи, выбранную из SEQ ID NO:25, 75, 76, 77, 78 и 79. В данном контексте, каркасные области тяжелой цепи обозначены “FR-H1-H4” или “HC-FR1-FR4”, а каркасные области легкой цепи обозначены “FR-L1-L4” или “LC-FR1-FR4”. В одном аспекте, это изобретение обеспечивает анти-STEAP-1-антитело, содержащее легкую цепь, содержащую SEQ ID NO:6.
В одном аспекте, это изобретение обеспечивает анти-STEAP-1-антитело, содержащее 1, 2, 3, 4, 5 или 6 последовательностей HVR антитела 120. v24, показанных на фигурах 2A и 2B.
Анти-STEAP-1-антитело может содержать любую подходящую каркасную последовательность вариабельного домена, при условии, что это антитело сохраняет способность связывания STEAP-1. Например, В некоторых вариантах осуществления, анти-STEAP-1-антитела согласно изобретению содержат консенсусную последовательность каркаса тяжелой цепи подгруппы III человека. В одном варианте этих антител, консенсусная последовательность каркаса тяжелой цепи содержит замену (замены) в положении 24, 37, 48, 67 и/или 78. В одном варианте этих антител, положение 24 является А или V, положение 37 является I или V, положение 48 является M или V, положение 67 является I или F и/или положение 78 является F или L. В одном варианте осуществления, эти антитела содержат каркасную последовательность вариабельного домена тяжелой цепи huMAb4D5-8, например, SEQ ID NO:21, 22, 49 и 24 (FR-H1, FR-H2, FR-H3, FR-H4, соответственно). huMAb4D5-8 коммерчески известно как анти-HER2-антитело HERCEPTINT®, Genentech, Inc., South San Francisco, CA, USA; на которое дается ссылка также в Патентах США с номерами 6,407,213 и 5,821,337 и Lee et al, J. Mol. Biol. (2004), 340(5): 1073-93. В одном таком варианте осуществления, эти антитела содержат дополнительно консенсусную последовательность каркаса легкой цепи κI человека. В одном таком варианте осуществления, эти полимераза содержат каркасную последовательность вариабельного домена легкой цепи huMAb4D5-8, например, SEQ ID NO: 17, 18, 139 и 20 (FR-L1, FR-L2, FR-L3, FR-L4, соответственно).
В одном варианте осуществления, анти-STEAP-1-антитело содержит вариабельный домен тяжелой цепи, содержащий каркасную последовательность и гипервариабельные районы, где эта каркасная последовательность содержит последовательности FR-H1-FR-H4 SEQ ID NO:21 или 25 (FR-H1), 22 (FR-H2), 23 (FR-H3) и 24 (FR-H4), соответственно; HVR H1 содержит аминокислотную последовательность SEQ ID NO:14; HVR-H2 содержит аминокислотную последовательность SEQ ID NO:15 и HVR-H3 содержит аминокислотную последовательность SEQ ID NO:16. В одном варианте осуществления, анти-STEAP-1-антитело содержит каркасную последовательность и гипервариабельные районы, причем эта каркасная последовательность содержит последовательности FR-L1-FR-L4 SEQ ID NO:17, 18, 19 и 20, соответственно; HVR-L1 содержит аминокислотную последовательность, выбранную из SEQ ID NO:11, 12 и 13. В одном варианте этих антител, вариабельный домен тяжелой цепи содержит SEQ ID NO:9 или 10 и вариабельный домен легкой цепи содержит SEQ ID NO:6.
В некоторых вариантах осуществления, это изобретение обеспечивает анти-STEAP-1-антитело, содержащее вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность, имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательности относительно аминокислотной последовательности SEQ ID NO:9 или 10. В некоторых вариантах осуществления, аминокислотная последовательность, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательности, содержит замены, инсерции или делеции относительно ссылочной последовательности, но антитело, содержащее эту аминокислотную последовательность, сохраняет способность связываться с STEAP-1. В некоторых вариантах осуществления, в целом 1-10 аминокислот были заменены, инсертированы или делетированы в последовательности SEQ ID NO:9, 10, 14, 15, 16, 21, 22, 23, 24, 25, 75, 76, 77, 78 и/или 79. В некоторых вариантах осуществления, анти-STEAP-1-антитело содержит вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность, выбранную из SEQ ID NO:9 или 10.
В некоторых вариантах осуществления, это изобретение обеспечивает анти-STEAP-1-антитело, содержащее вариабельный домен тяжелой цепи, изображенный на фигуре 2В (SEQ ID NO:9 или 10).
В некоторых вариантах осуществления, последовательности HVR и FR тяжелой цепи включают в себя следующие последовательности:
HVR-H1 (GYSITSDYAWN, SEQ ID NO:14)
HVR-H2 (GYISNSGSTSYNPSLKS, SEQ ID NO:15)
HVR-H3 (ERNYDYDDYYYAMDY, SEQ ID NO:16)
FR-H1 (EVQLVESGGGLVQPGGSLRLSCAAS, SEQ ID NO:21)
FR-H1 (EVQLVESGGGLVQPGGSLRLSCAVS, SEQ ID NO:25)
FR-H2 (WVRQAPGKGLEWV, SEQ ID NO:22)
FR-H2 (WIRQAPGKGLEWV, SEQ ID NO:75)
FR-H2 (WVRQAPGKGLEWM, SEQ ID NO:76)
FR-H2 (WIRQAPGKGLEWM, SEQ ID NO: 77)
FR-H3 (RFTISRDNSKNTLYLQMNSLRAEDTAVYYCAR, SEQ ID NO:23)
FR-H3 (RITISRDNSKNTLYLQMNSLRAEDTAVYYCAR, SEQ ID NO:78)
FR-H3 (RFTISRDNSKNTFYLQMNSLRAEDTAVYYCAR, SEQ ID NO:79)
FR-H4 (WGQGTLVTVSS, SEQ ID NO:24)
В некоторых вариантах осуществления, это изобретение обеспечивает анти-STEAP-1-антитело, содержащее вариабельный домен легкой цепи, изображенный на фигуре 2А (SEQ ID NO:6).
В некоторых вариантах осуществления, последовательности HVR легкой цепи включают в себя следующие последовательности:
HVR-L1 (KSSQSLLYRSNQKNYLA, SEQ ID NO:11)
HVR-L2 (WASTRES, SEQ ID NO:12)
HVR-L3 (QQYYNYPRT, SEQ ID NO:13).
В некоторых вариантах осуществления, последовательности FR легкой цепи включают в себя следующие последовательности:
FR-L1 (DIQMTQSPSSLSASVGDRVTITC, SEQ ID NO:17);
FR-L2 (WYQQKPGKAPKLLIY, SEQ ID NO: 18);
FR-L3 (GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC, SEQ ID NO:19);
FR-L4 (FGQGTKVEIKR, SEQ ID NO:20).
В одном аспекте, это изобретение обеспечивает анти-STEAP-1-антитело, содержащее вариабельный домен легкой цепи, содержащий аминокислотную последовательность, имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательности относительно аминокислотной последовательности SEQ ID NO:6. В некоторых вариантах осуществления, аминокислотная последовательность, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательности, содержит замены, инсерции или делеции относительно ссылочной последовательности, но антитело, содержащее эту аминокислотную последовательность, сохраняет способность связываться с STEAP-1. В некоторых вариантах осуществления, в целом 1-10 аминокислот были заменены, инсертированы или делетированы в последовательности, выбранной из SEQ ID NO:6, 11, 12, 13, 17, 18, 19 и 20. В некоторых вариантах осуществления, эти замены, инсерции и делеции встречаются в районах вне HVR (т.е. в FR). В некоторых вариантах осуществления, анти-STEAP-1-антитело содержит вариабельный район легкой цепи, содержащий аминокислотную последовательность SEQ ID NO:6.
В одном аспекте, это изобретение обеспечивает анти-STEAP-1-антитело, содержащее (а) вариабельный район тяжелой цепи, содержащий аминокислотную последовательность, имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательности относительно аминокислотной последовательности, выбранной из SEQ ID NO:9 и 10; и (b) вариабельный домен легкой цепи, содержащий аминокислотную последовательность, имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99% идентичность последовательности относительно аминокислотной последовательности SEQ ID NO:6. В некоторых вариантах осуществления, аминокислотная последовательность, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность последовательности, содержит замены, инсерции или делеции относительно ссылочной последовательности, но антитело, содержащее эту аминокислотную последовательность, сохраняет способность связываться с STEAP-1. В некоторых вариантах осуществления, в целом 1-10 аминокислот были заменены, инсертированы или делетированы в этой ссылочной последовательности, включающей в себя, но не ограничивающейся ими, последовательность, выбранную из SEQ ID NO:9, 10, 14, 15, 16, 21, 22, 23, 24, 25, 75, 76, 77, 78, 79. В некоторых вариантах осуществления, эти замены, инсерции или делеции встречаются в районах вне HVR (т.е. в FR). В некоторых вариантах осуществления, анти-STEAP-1-антитело содержит вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO:9 или 10, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность, выбранную из SEQ ID NO:6.
В одном аспекте, это изобретение обеспечивает анти-STEAP-1-антитело, содержащее (a) один, два или три VH HVR, выбранные из VH HVR, показанных на фигуре 2В, и/или (b) один, два или три VL HVR, выбранных из VL HVR, показанных на фигуре 2А. В одном аспекте, это изобретение обеспечивает анти-STEAP-1-антитело, содержащее вариабельный домен тяжелой цепи, выбранный из вариабельных доменов тяжелой цепи, показанных на фигуре 2В, и вариабельный домен легкой цепи, выбранный из вариабельных доменов легкой цепи, показанных на фигуре 2А.
2. Фрагменты антител
Данное изобретение включает в себя фрагменты антител. Фрагменты антител могут быть генерированы традиционными способами, такими как ферментативное расщепление, или рекомбинантными способами. В некоторых случаях, имеются преимущества использования фрагментов антител, а не полных антител. Меньший размер этих фрагментов делает возможным быстрый клиренс и может приводить к улучшенному доступу к солидным опухолям. В отношении обзора некоторых фрагментов антител, см. Hudson et al. (2003) Nat. Med. 9: 129-134.
Были разработаны различные способы для получения фрагментов антител. Традиционно, эти фрагменты получали протеолитическим расщеплением интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24: 107-1 17 (1992) и Brennan et al., Science, 229:81 (1985)). Однако, эти фрагменты могут быть теперь продуцированы непосредственно рекомбинантными клетками-хозяевами. Фрагменты антител Fab, Fv и scFv (все) могут быть экспрессированы в E. coli и секретированы из E. coli,, что делает возможным легкое получение больших количеств этих фрагментов. Фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно, фрагменты Fab’-SH могут быть извлечены непосредственно из E. coli и химически связаны с получением фрагментов F(ab’)2 (Carter et al., Bio/Technology 10:163-167 (1992)). Согласно другому подходу, фрагменты F(ab’)2 могут быть выделены непосредственно из культуры рекомбинантных клеток-хозяев. Фрагменты Fab и F(ab’)2 с увеличенным временем полужизни in vivo, содержащие остатки связывающего рецептор спасения эпитопа, описаны в патент США № 5869046. Другие способы получения фрагментов антител будут очевидными для квалифицированного в данной области специалиста. В некоторых вариантах осуществления, антитело является одноцепочечным Fv-фрагментом (scFv). См. WO 93/16185; патент США с номерами 5571894 и 5587458. Fv и scFv являются единственными разновидностями с интактными антигенсвязывающими сайтами, которые лишены константных областей; таким образом, они могут быть пригодны для уменьшенного неспецифического связывания во время использования in vivo. Могут быть сконструированы scFv-слитые белки для получения слияния эффекторного белка на амино- или карбокси-конце scFv. См. Antibody Engineering, ed. Borrebaeck, supra. Этот фрагмент антитела может быть также «линейным антителом», например, как описано в патенте США № 5641870. Такие линейные антитела могут быть моноспецифическими или биспецифическими.
3. Гуманизированные антитела
Настоящее изобретение включает в себя гуманизированные антитела. В данной области известны различные способы гуманизации не-человеческих антител. Например, гуманизированное антитело может иметь один или несколько аминокислотных остатков, введенных в него, из источника, который не является человеком. Эти не-человеческие аминокислотные остатки часто называют «импортными» остатками, которые обычно берутся из «импортного» вариабельного домена. Гуманизация может выполняться по существу в соответствии со способом Winter et al. (Jones et al. (1986) Nature 321:522-525; Riechmann et al. (1988) Nature 332:323-327; Verhoeyen et al. (1988) Science 239:1534-1536), заменой последовательностями гипервариабельных областей соответствующих последовательностей антитела человека. Таким образом, такие «гуманизированные» антитела являются химерными антителами (патент США № 4816567), в которых по существу менее чем один интактный вариабельный домен человека был заменен соответствующей последовательностью из вида, не являющегося человеком. На практике, гуманизированные антитела являются обычно антителами человека, в которых некоторые остатки гипервариабельной области и, возможно, некоторые остатки FR заменены остатками из аналогичных сайтов в антителах грызуна.
Выбор вариабельных доменов человека, как легкой цепи, так и тяжелой цепи, для использования в получении гуманизированных антител, может быть важным для уменьшения антигенности. В соответствии с так называемым "best-fit" (наиболее приспособленным) способом, последовательность вариабельного домена антитела грызуна подвергают скринингу против всей библиотеки известных последовательностей вариабельных доменов человека. Затем последовательность человека, которая является наиболее близкой к последовательности грызуна, принимают как человеческий каркас для гуманизированного антитела (Sims et al. (1993) J. Immunol. 151:2296; Chothia et al. (1987) J. Mol. Biol. 196:901. Другой способ использует конкретный каркас, произведенный из консенсусной последовательности всех антител человека конкретной подгруппы легких или тяжелых цепей. Такой же каркас может быть использован для нескольких других гуманизированных антител (Carter et al. (1992) Proc. Natl. Acad. ScL USA, 89:4285; Presta et al. (1993) J. Immunol., 151:2623.
Кроме того, обычно желательно, чтобы гуманизируемые антитела сохраняли высокую аффинность в отношении этого антигена и другие благоприятные биологические свойства. Для достижения этой задачи, согласно одному способу, гуманизированные антитела получают способом анализа исходных последовательностей и различных умозрительных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулина обычно являются доступными и известны квалифицированным в данной области специалистам. Доступны и компьютерные программы, которые иллюстрируют и изображают возможные трехмерные конформационные структуры выбранных кандидатных последовательностей иммуноглобулинов. Исследование этих изображений позволяет анализировать возможную роль этих остатков в функционировании кандидатной последовательности иммуноглобулина, т.е. анализировать остатки, которые влияют на способность кандидатного иммуноглобулина связываться с его антигеном. Таким путем, остатки FR могут быть отобраны и комбинированы из реципиентных и импортных последовательностей, так что достигается желаемое свойство антитела, такое как увеличенная аффинность в отношении антигена (антигенов)-мишени. Обычно, остатки гипервариабельной области участвуют непосредственно и наиболее существенно в действии на связывание антигена.
4. Антитела человека
Анти-STEAP-1-антитела человека согласно изобретению могут быть сконструированы объединением последовательности (последовательностей) вариабельного домена Fv-клона, выбранной (выбранных) из библиотек фагового дисплея на основе последовательностей человека, с известной последовательностью (последовательностями) константного домена человека, описанными выше. Альтернативно, моноклональные анти-STEAP-1-антитела человека согласно изобретению могут быть получены гибридомным способом. Линии клеток миеломы человека и гетеромиеломы мышь-человек для получения моноклональных антител человека были описаны, например, Kozbor J Immunol, 133 3001 (1984), Brodeur et al, Monoclonal Antibody Production Techniques and Applications, pp 51-63 (Marcel Dekker, Inc, New York, 1987) и Boerner et al, J Immunol, 147 86 (1991).
Теперь можно получать трансгенных животных (например, мышей), которые способны, после иммунизации, продуцировать полный репертуар (спектр) антител человека в отсутствие получения эндогенного иммуноглобулина. Например, было описано, что гомозиготная делеция гена соединяющего района тяжелой цепи (JH) в химерных или мутантных в отношении зародышевой линии мышей приводит к полному ингибированию эндогенного продуцирования антитела. Перенос ряда генов иммуноглобулина зародышевой линии человека в таких мутантных в отношении зародышевой линии мышей будет приводить к продуцированию антител человека после стимуляции антигеном. См., например, Jakobovits et al. Proc Natl Acad Sci USA, 90:2551 (1993), Jakobovits et al, Nature, 362 255 (1993), Bruggermann et al., Year in Immunol, 7 33 (1993).
Перетасовка генов может быть также использована для получения антител человека из не-человеческих антител, например, грызуна, где это антитело человека имеет сходные аффинности и специфичности с исходным не-человеческим антителом. Согласно этому способу, который также называют “импринтингом эпитопа”, вариабельный район либо тяжелой цепи, либо легкой цепи фрагмента не-человеческого антитела, полученный способами фагового дисплея, описанными здесь, заменяют репертуаром (спектром) генов V-домена человека с получением популяции scFv- или Fab-химер цепь не-человека/цепь человека, в которых цепь человека восстанавливает антигенсвязывающий сайт, разрушенный после удаления соответствующей не-человеческой цепи в первичном клоне фагового дисплея, т.е. этот эпитоп регулирует (производит импринтинг) выбор цепи-партнера человека. При повторении этого процесса для замены остальной не-человеческой цепи, получают антитело человека (см. PCT WO 93/06213, опубликованный 1 апреля 1993 года). В отличие от традиционной гуманизации не-человеческих антител трансплантацией CDR, этот способ обеспечивает полностью человеческие антитела, которые не имеют остатков FR или CDR, происходящих из не-человеческих антител.
5. Биспецифические антитела
Биспецифические антитела являются моноклональными антителами, которые имеют специфичности связывания в отношении по меньшей мере двух различных антигенов. В некоторых вариантах осуществления, биспецифические антитела являются антителами человека или гуманизированными антителами. В некоторых вариантах осуществления, одна из специфичностей связывания является специфичностью связывания в отношении STEAP-1, а другая является специфичностью связывания в отношении любого другого антигена. В некоторых вариантах осуществления, биспецифические антитела могут связываться с двумя различными эпитопами STEAP-1. Биспецифические антитела могут быть также использованы для локализации цитотоксических агентов в клетках, которые экспрессируют STEAP-1. Эти антитела имеют STEAP-1-связывающее плечо и плечо, которое связывает цитотоксический агент, такой как сапорин, анти-интерферон-α, алколоид Vinca, цепь А рицина, метотрексат или гаптен с радиоактивным изотопом. Биспецифические антитела могут быть приготовлены в виде полноразмерных антител или фрагментов антител (например, F(ab’)2-биспецифических антител).
Способы получения биспецифических антител известны в данной области. Традиционно, рекомбинантное получение биспецифических антител основано на коэкспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулина, где две тяжелые цепи имеют разные специфичности (Milstein and Cuello, Nature, 305: 537 (1983)). Вследствие случайной реаранжировки тяжелых и легких цепей иммуноглобулина эти гибридомы (квадромы) продуцируют потенциальную смесь из 10 разных молекул антител, из которых только одна имеет правильную биспецифическую структуру. Очистка правильной молекулы, которую обычно выполняют с использованием стадий аффинной хроматографии, является довольно громоздкой, и выходы продукта являются низкими. Сходные процедуры описаны в WO 93/08829, опубликованном 13 мая 1993 года, и в Traunecker et al, EMBO J., 10: 3655 (1991).
Согласно другому подходу, вариабельные домены антитела с желаемыми специфичностями связывания (антигенсвязывающими сайтами) сливают с последовательностями константного домена иммуноглобулина. Это слияние является, например, слиянием с контатным доменом тяжелой цепи иммуноглобулина, содержащим по меньшей мере часть шарнирной области, районы СН2 и СН3. В некоторых вариантах осуществления, первая константная область (СН1) тяжелой цепи, содержащая сайт, необходимый для связывания легкой цепи, присутствует по меньшей мере в одном из этих слияний. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и, если желательно, легкой цепи иммуноглобулина, инсертируют в раздельные экспрессирующие векторы и котрансфицируют в подходящий организм-хозяин. Это обеспечивает большую гибкость в коррекции взаимных долей этих трех полипептидных фрагментов в вариантах, когда неравные соотношения этих трех полипептидов, используемых в конструировании, обеспечивают оптимальные выходы. Однако, можно инсертировать кодирующие последовательности для двух или всех трех полипептидных цепей в одном экспрессирующем векторе, когда экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит к высоким выходам или когда эти соотношения не имеют особого значения.
В одном варианте этого подхода, биспецифические антитела состоят из тяжелой цепи гибридного иммуноглобулина с первой специфичностью связывания в одном плече и парой тяжелая цепь-легкая цепь гибридного иммуноглобулина (обеспечивающей вторую специфичность) в другом плече. Было обнаружено, что эта асимметричная структура облегчает отделение желаемого биспецифического соединения от нежелательных комбинаций цепей иммуноглобулина, так как присутствие легкой цепи иммуноглобулина только в одной половине этой биспецифической молекулы обеспечивает легкий способ отделения. Этот подход был описан в WO 94/04690. В отношении дополнительных деталей генерирования биспецифических антител см., например, Suresh et al., Methods in Enzymology, 121:210 (1986).
Согласно другому подходу, может быть сконструирована граница раздела между парой молекул антител для максимизации процента гетеродимеров, которые извлекаются из культуры рекомбинантных клеток. Эта граница раздела содержит по меньшей мере часть домена CH3 константного домена антитела. В этом способе, одну или несколько малых боковых цепей аминокислот из поверхности раздела молекулы первого антитела заменяют большими боковыми цепями (например, тирозина или триптофана). Компенсаторные «впадины» идентичного или сходного размера с большими боковыми цепями создают на поверхности раздела молекулы второго антитела заменой больших цепей аминокислот меньшими цепями (например, аланина или треонина). Это обеспечивает механизм для увеличения выхода гетеродимера в сравнении с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифические антитела включают в себя сшитые или «гетероконъюгатные» антитела. Например, одно из этих антител в гетероконъюгате может быть связано с авидином, другое с биотином. Такие антитела предлагались, например, для направления клеток иммунной системы к нежелательным клеткам (патент США № 4676980), и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/00373 и EP 03089). Гетероконъюгатные антитела могут быть приготовлены с использованием любого подходящего способа сшивания. Подходящие сшивающие агенты хорошо известны в данной области и описаны в патенте США № 4676980, вместе с рядом способов сшивания.
Способы генерирования биспецифических антител из фрагментов антител также были описаны в литературе. Например, биспецифические антитела могут быть получены с использованием химической связи. Brennan et al., Science, 229: 81 (1985) описывают процедуру, в которой интактные антитела протеолитически расщепляют для генерирования фрагментов F(ab’)2. Эти фрагменты восстанавливают в присутствии дитиол-комплексирующего агента арсенита натрия для стабилизации соседних дитиолов и предотвращения образования межмолекулярных дисульфидов. Затем генерированные Fab’-фрагменты превращают в производные тионитробензоата. Затем одно из производных Fab’-TNB превращают обратно в Fab’-тиол восстановлением меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab’-TNB с образованием биспецифического антитела. Полученные таким образом биспецифические антитела могут быть использованы в виде агентов для селективной иммобилизации ферментов.
Недавний прогресс способствовал прямому извлечению фрагментов Fab’-SH из E. coli, которые могут быть химически связаны с образованием биспецифических антител. Shalaby et al., J. Exp. Med., 175: 217-225 (1992) описывают получение полностью гуманизированной биспецифической молекулы F(ab’)2. Каждый фрагмент Fab’ отдельно секретировался из E. coli и подвергался нацеленному химическому связыванию in vitro для образования биспецифического антитела. Образованное таким образом биспецифическое антитело было способно связываться с клетками, сверхэкспрессирующими HER2-рецептор, и нормальными Т-клетками человека, а также запускать литическую активность цитотоксичесих лимфоцитов против опухолей молочной железы-мишеней человека.
Были описаны различные способы получения и выделения биспецифическх фрагментов антител непосредственно из культуры рекомбинантных клеток. Например, биспецифические антитела были получены с использованием лейциновых молний. Kostelny et al., J. Immunol., 148(5): 1547-1553 (1992). Пептиды лейциновых молний из белков Fos и Jun связывали Fab’-части двух различных антител слиянием генов. Гомодимеры антител восстанавливали при шарнирной области и затем повторно окисляли для образования гетеродимеров антител. Этот способ использовали также для получения гомодимеров антител. Технология "диател", описанная Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993), обеспечила альтернативный механизм получения биспецифических фрагментов антител. Эти фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) линкером, который является слишком коротким, чтобы позволить спаривание между этими двумя доменами на одной и той же цепи. Таким образом, домены VH и VL одного фрагмента вынуждены спариваться с комплементарными доменами VL и VH другого фрагмента, образуя посредством этого два антигенсвязывающих сайта. Сообщалась также другая стратегия получения биспецифических фрагментов антител с использованием димеров одноцепочечных Fv (scFv). См. Gruber et al., J. Immunol., 152:5368 (1994).
Обсуждаются антитела с более чем двумя валентностями. Например, могут быть получены триспецифические антитела. Tutt et al. J. Immunol. 147: 60 (1991).
6. Мультивалентные антитела
Мультивалентное антитело может быть интернализовано (и/или катаболизировано) быстрее, чем бивалентное антитело клеткой, экспрессирующей антиген, с которым связываются антитела. Антитела данного изобретения могут быть мультивалентными антителами (которые являются другими антителами, чем антитела класса IgM) с тремя или более антигенсвязывающими сайтами (например, тетравалентными антителами), которые могут быть легко получены рекомбинантной экспрессией нуклеиновой кислоты, кодирующей полипептидные цепи этого антитела. Мультивалентное антитело может содержать домен димеризации и три или более антигенсвязывающих сайта. В некоторых вариантах осуществления, этот домен димеризации содержит Fc-район или шарнирный район (или состоит из этих районов) и три или более антигенсвязывающих сайтов амино-терминально (слева) от Fc-района. В некоторых вариантах осуществления, мультивалентное антитело содержит три – приблизительно восемь антигенсвязывающих сайтов (или состоит из них). В одном таком варианте осуществления, мультивалентное антитело содержит четыре антигенсвязывающих сайта (или состоит из них). Мультивалентное антитело содержит по меньшей мере одну полипептидную цепь (например, две полипептидные цепи), причем эта полипептидная цепь (полипептидные цепи) содержат два или более вариабельных домена. Например, эта полипептидная цепь (полипептидные цепи) может содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 является первым вариабельным доменом, VD2 является вторым вариабельным доменом, Fc является однополипептидной цепью Fc-района, X1 и X2 представляют аминокислоту или полипептид и n равно 0 или 1. Например, эта полипептидная цепь (полипептидные цепи) может содержать: цепь VH-CH1-гибкий линкер-VH-CH1-Fc-район; или цепь VH-CH1-VH-CH1-Fc-район. Кроме того, описанное здесь мультивалентное антитело может содержать по меньшей мере два (например, четыре) полипептида вариабельного домена легкой цепи. Это мультивалентное антитело может, например, содержать от приблизительно двух до приблизительно восьми полипептидов вариабельного домена легкой цепи. Полипептиды вариабельного домена легкой цепи, рассматриваемые здесь, содержат вариабельный домен легкой цепи и, необязательно, содержат дополнительно домен CL.
7. Однодоменные антитела
В некоторых вариантах осуществления, антитело согласно изобретению является однодоменным антителом. Однодоменное антитело является единственной цепью полипептида, содержащей весь вариабельный домен тяжелой цепи или его часть или весь вариабельный домен легкой цепи или его часть антитела. В некоторых вариантах осуществления, однодоменное антитело является однодоменным антителом человека (Domantis, Inc., Waltham, MA; см., например, патент США № 6248516 B1). В одном варианте осуществления, однодоменное антитело состоит из всего вариабельного домена тяжелой цепи или его части антитела.
8. Варианты антител
В некоторых вариантах осуществления, обсуждаются модификация (модификации) описанных здесь антител. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств этого антитела. Варианты аминокислотной последовательности антитела могут быть получены введением подходящих изменений в нуклеотидную последовательность, кодирующую это антитело, или пептидным синтезом. Такие модификации включают в себя, например, делеции остатков из антитела и/или инсерции остатков в антитело и/или замены остатков в аминокислотных последовательностях этого антитела. Любая комбинация делеции, инсерции и замены может быть произведена для получения конечной конструкции, при условии, что эта конечная конструкция имеет желаемые характеристики. Эти аминокислотные изменения могут быть введены в аминокислотной последовательности рассматриваемого антитела в момент образования этой последовательности.
Применимый способ идентификации некоторых остатков или областей этого антитела, которые являются предпочтительными местоположениями для мутагенеза, назван «аланин-сканирующим мутагенезом», описанным Cunningham and Wells (1989) Science, 244: 1081-1085. В нем идентифицируют остаток-мишень или группу остатков-мишеней (например, заряженные остатки, такие как arg, asp, his, lys и glu) и заменяют нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином) для влияния на взаимодействие этих аминокислот с антигеном. Затем местоположения аминокислот, демонстрирующие функциональную чувствительность к заменам, улучшают введением дополнительных или других вариантов в этих в сайтах замен или для сайтов замен. Таким образом, хотя сайт для введения вариации аминокислотной последовательности является заранее определенным, характер мутации в этом сайте не может быть предварительно определенным. Например, для анализа выполнения мутации в конкретном сайте проводят аланин-сканирование или случайный мутагенез в кодоне-мишени или районе-мишени и экспрессируемые иммуноглобулины подвергают скринингу на желаемую активность.
Инсерции аминокислотных последовательностей включают в себя амино- и/или карбоксил-концевые слияния, с длиной от одного остатка до полипептидов, содержащих сто или более остатков, а также инсерции единственных или множественных аминокислотных остатков внутри последовательности. Примеры терминальных инсерций включают в себя антитело с N-концевым метионильным остатком. Другие инсерционные варианты этой молекулы антитела включают в себя слияние с N- или С-концом антитела с ферментом (например, для ADEPT) или полипептидом, который увеличивает время полужизни в сыворотке этого антитела.
В некоторых вариантах осуществления, антитело согласно изобретению изменяют для увеличения или уменьшения степени гликозилирования этого антитела. Гликозилирование полипептидов является обычно либо N-связанным, либо О-связанным. N-связанным называют присоединение углеводной части к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, где Х является любой аминокислотой, за исключением пролина, являются последовательностями узнавания для ферментативного присоединения углеводной части к боковой цепи аспарагина. Таким образом, присутствие любой из этих трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. О-связанным называют присоединение одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, наиболее обычно серину или треонину, хотя может быть также использован 5-гидроксипролин или 5-гидроксилизин.
Добавление или делецию сайтов гликозилирования в антителе обычно выполняют изменением аминокислотной последовательности таким образом, что создается или удаляется одна или несколько вышеописанных трипептидных последовательностей (для N-связанных сайтов гликозилирования). Это изменение может быть также произведено добавлением, делецией или заменой одного или нескольких остатков серина или треонина в последовательности исходного антитела (для О-связанных сайтов гликозилирования).
Если антитело содержит Fc-район, может быть изменен присоединенный к нему углевод. Например, антитела со зрелой углеводной структурой, которая лишена фукозы, присоединенной к Fc-району этого антитела, описаны в заявке на патент США № US 2003/0157108 (Presta, L.). См. US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Антитела с рассечением N-ацетилглюкозамина (GlcNAc) в углеводе, присоединенном к Fc-району этого антитела, цитируются в WO 2003/01 1878, Jean-Mairet et al. и Патенте США № 6,602,684, Umana et al. Антитела по меньшей мере с одним остатком галактозы в олигосахариде, присоединенном к Fc-району этого антитела, сообщаются в WO 1997/30087, Patel et al. См. также WO 1998/58964 (Raju, S.) и WO 1999/22764 (Raju, S.) в отношении антител с измененным углеводом, присоединенным к их Fc-району. См. также US 2005/0123546 (Umana et al.) в отношении антигенсвязывающих молекул с модифицированным гликозилированием.
В некоторых вариантах осуществления, гликозилированный вариант содержит Fc-район, в котором углеводная структура, присоединенная к Fc-району, не содержит фукозы. Такие варианты имеют улучшенную функцию ADCC. Необязательно, Fc-район дополнительно содержит одну или несколько аминокислотных замен в нем, которые дополнительно улучшают ADCC, например, замен в положениях 298, 333 и/или 334 Fc-района. (нумерация остатков EU). Примеры публикаций, относящихся к «дефукозилированным» или «фукозо-недостаточным» антителам, включают в себя: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/01 10704; US 2004/01 10282; US 2004/0109865; WO 2003/0851 19; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO2005/053742; Okazaki et al. J. Mol. Biol. 336: 1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). Примеры клеточных линий, продуцирующих дефукозилированные антитела, включают в себя клетки СНО Led 3, недостаточные в отношении фукозилирования белков (Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986); Заявку на патент США № US 2003/0157108 A1, Presta, L; и WO 2004/056312 A1, Adams et al., в частности, в примере 11) и линии клеток с нокаутом гена, такого как ген альфа-1,6-фукозилтрансферазы, FUT8, клетки СНО с нокаутом (Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004)).
В одном варианте осуществления, антитело изменяют для улучшения времени его полужизни в сыворотке. Для увеличения времени полужизни в сыворотке этого антитела, можно включить связывающий рецептор спасения эпитоп в это антитело (в частности, во фрагмент антитела), как описано, например, в US 5739277. В данном контексте, термин "связывающий рецептор спасения эпитоп" относится к эпитопу Fc-района на молекуле IgG (например, IgG1, IgG2, IgG3 или IgG4), который является ответственным за увеличение времени полужизни in vivo молекулы IgG (US 2003/0190311, US6821505; US 6165745; US 5624821; US 5648260; US 6165745;US 5834597).
Другим типом варианта является вариант с заменой аминокислоты. Эти варианты имеют по меньшей мере один аминокислотный остаток в молекуле антитела, замененный другим остатком. Представляющие интерес сайты для заменяющего мутагенеза включают в себя гипервариабельные районы, но обсуждаются также изменения FR. Консервативные замены показаны в таблице 1 под заголовком «предпочтительные замены». Если такие замены приводят к желаемому изменению в биологической активности, то могут быть введены более существенные изменения, названные «примерными заменами» в таблице 1, или изменения, дополнительно описанные ниже в ссылке на классы аминокислот, и эти продукты могут быть подвергнуты скринингу.
Существенные модификации в биологических свойствах антитела выполняют выбором замен, которые значимо отличаются по их действию на поддержание (а) структуры пролипептидного скелета в зоне замены, например, в виде складчатой или спиральной конформации, (b) заряда или гидрофобности этой молекулы в сайте-мишени или (c) объема боковой цепи. Аминокислоты могут быть разделены на группы в соответствии со сходствами в свойствах их боковых цепей (в A. L. Lehninger, in Biochemistry, second ed., pp. 73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala (A), Val (V), Leu (L), He (I), Pro (P), Phe (F), Trp (W), Met (M)
(2) незаряженные полярные: GIy (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q)
(3) кислотного характера: Asp (D), Glu (E)
(4) основного характера: Lys (K), Arg (R), His(H)
Альтернативно, природно-встречающиеся остатки могут быть подразделены на группы на основе общих свойств боковых цепей:
(1) гидрофобные: Норлейцин, Met, Ala, VaI, Leu, He;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотного характера: Asp, Glu;
(4) основного характера: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены повлекут за собой изменение члена одного из этих классов на другой класс. Такие замененные остатки могут быть введены в сайты консервативных замен или в оставшиеся (неконсервативные) сайты.
Один тип замещенного варианта включает в себя замену остатков одного или нескольких остатков гипервариабельных районов исходного антитела (например, гуманизированного антитела или антитела человека). Обычно полученный вариант (полученные варианты), выбранный (выбранные) для дальнейшего развития, будет иметь модифицированные (например, улучшенные) биологические свойства относительно исходного антитела, из которого они генерированы. Общепринятый способ генерирования таких вариантов с заменами включает в себя созревание аффинности с использованием фагового дисплея. Вкратце, несколько сайтов гипервариабельных районов (например, 6-7 сайтов) мутируют для генерирования всех возможных аминокислотных замен в каждом сайте. Генерированные таким образом антитела представляются из частиц нитчатых фагов в виде слияний по меньшей мере с частью белка оболочки фага (например, продукта III М13), упакованных в каждой частице. Затем представляемые фагом варианты подвергают скринингу на их биологическую активность (например, аффинность связывания). Для идентификации кандидатных сайтов гипервариабельных районов для модификации, может выполняться сканирующий мутагенез (например, аланин-сканирующий мутагенез) для идентификации остатков гипервариабельных районов, способствующих значимо связыванию антигена. Альтернативно или дополнительно, может быть предпочтительным анализ структуры кристалла комплекса антиген-антитело для идентификации точек контакта между антителом и антигеном. Такие остатки контакта и соседние остатки являются кандидатами на замену в соответствии со способами, известными в данной области, в том числе способов, разработанных здесь. После генерирования таких вариантов, панель вариантов подвергают скринингу с использованием технологий, известных в данной области, в том числе описанных здесь, и антитела с превосходными свойствами в одном или нескольких релевантных анализах могут быть отобраны для дополнительного развития.
Молекулы нуклеиновых кислот, кодирующие варианты аминокислотных последовательностей этого антитела, получают различными способами, известными в данной области. Эти способы включают в себя, но не ограничиваются ими, выделение из природного источника (в случае природно-встречающихся вариантов аминокислотных последовательностей) или получение при помощи олигонуклеотид-опосредованного (или сайт-направленного мутагенеза, ПЦР-мутагенез и кассетный мутагенез ранее полученного варианта или невариантной версии этого антитела.
Может быть желательным введение одной или нескольких аминокислотных модификаций в Fc-район антител согласно изобретению, с получением посредством этого варианта Fc-района. Вариант Fc-района может содержать последовательность Fc-района человека (например, Fc-района IgG1, IgG2, IgG3 или IgG4), содержащую модификацию аминокислоты (например, замену) в одном или нескольких положениях аминокислот, в том числе цистеина шарнирной области.
В соответствии с этим описанием и обсуждениями в данной области, предполагается, что в некоторых вариантах осуществления, антитело согласно изобретению может содержать одно или несколько изменений в сравнении с антителом-копией дикого типа, например, в Fc-районе. Эти антитела сохраняют тем не менее те же самые характеристики, требуемые для терапевтического применения, в сравнении с их копией дикого типа. Например, считается, что некоторые изменения могут быть произведены в Fc-районе, которые могут приводить к измененному (т.е. улучшенному или уменьшенному) связыванию C1q и/или комплементзависимой цитотоксичности (CDC), например, как описано в WO99/51642. См. также Duncan & Winter Nature 322:738-40 (1988); патент США № 5648260; патент США № 5624821 и WO94/29351, касающиеся других примеров вариантов Fc-районов. WO00/42072 (Presta) и WO 2004/056312 (Lowman) описывают варианты антител с улучшенным или уменьшенным связыванием с FcR. Содержание этих патентых публикаций специально включены здесь в качестве ссылки. См. также Shields et al. J. Biol. Chem. 9(2): 6591-6604 (2001). Антитела с увеличенными периодами полужизни и улучшенным связыванием с неонатальным Fc-рецептором (FcRn), которые ответственны за перенос материнских IgG в плод (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)), описаны в US2005/0014934A1 (Hinton et al.). Эти антитела содержат Fc-район с одной или несколькими заменами в нем, которые улучшают связывание Fc-района с FcRn. Полипептидные варианты с измененными аминокислотными последовательностями Fc-района и увеличенной или уменьшенной способностью связывания C1q, описаны в патенте США № 6194551 B1, WO99/51642. Содержания этих патентных публикаций специально включены здесь в качестве ссылки. См. также Idusogie et al. J. Immunol. 164: 4178-4184 (2000).
В одном аспекте, это изобретение обеспечивает антитела, содержащие модификации в границе раздела Fc-полипептидов, содержащих Fc-район, причем эти модификации облегчают или стимулируют гетеродимеризацию. Эти модификации содержат введение выпуклости в первый Fc-полипептид и впадины во второй Fc-полипептид, причем эта выпуклость вмещается в эту впадину, образуя комплекс первого и второго Fc-полипептидов. Способы генерирования антител с этими модификациями известны в данной области, например, описаны в патенте США № 5731168.
9. Производные антител
Антитела данного изобретения могут быть дополнительно модифицированы для содержания дополнительных небелковых частей молекул, которые известны в данной области и легко доступны. Предпочтительно, части молекул, подходящие для дериватизации этого антитела, являются водорастворимыми полимерами. Не ограничивающие примеры водорастворимых полимеров включают в себя, но не ограничиваются ими, полиэтиленгликоль (ПЭГ), сополимеры этиленгликоль/пропиленгликоль, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилен/малеиновый ангидрид, полиаминокислоты (либо гомополимеры, либо случайные сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксид/этиленоксид, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Полиэтиленгликольпропиональдегид может иметь преимущества в их изготовлении вследствие его стабильности в воде. Этот полимер может иметь любую молекулярную массу и быть разветвленным или неразветвленным. Количество полимеров, присоединенных к этому антителу, может варьироваться, и, если присоединен более чем один полимер, они могут быть одинаковыми или различными молекулами. Обычно, количество и/или тип полимеров, используемых для дериватизации, могут быть определены на основе рассмотрений, включающих в себя, но не ограничиваюшихся ими, конкретные свойства или функции улучшаемого антитела, будет ли использоваться это производное антитела в терапии при определенных условиях, и т.д.
В другом варианте осуществления, обеспечены конъюгаты антитела и небелковой части молекулы, которые могут селективно нагреваться при воздействии облучения. В одном варианте осуществления, небелковой частью является угольная нанотрубка (Kam et al., Proc. Natl. Acad. Sci. 102: 1 1600-11605 (2005)). Облучение может иметь любую длину волны и включает в себя, но не ограничивается ими, длины волн, которые не повреждают обычные клетки, но которые нагревают небелковую часть молекулы до температуры, при которой убиваются клетки, проксимальные относительно конъюгата антитело-небелковая часть молекулы.
Некоторые способы получения антител
1. Некоторые способы на основе гибридом
Моноклональные анти-STEAP-1-антитела согласно изобретению могут быть получены с использованием гибридомного способа, впервые описанного Kohler et al., Nature, 256:495 (1975), или могут быть получены способами рекомбинантных ДНК (патент США № 4816567).
В гибридомном способе, мышь или другое подходящее животное-хозяин иммунизируют для индукции лимфоцитов, которые продуцируют или способны продуцировать антитела, которые будут специфически связываться с белком, используемым для иммунизации. Антитела к STEAP-1 обычно индуцируют в животных множественными подкожными (sc) или внутрибрюшинными (ip) инъекциями STEAP-1 и адъюванта. STEAP-1 может быть получен с использованием способов, хорошо известных в данной области, некоторые из которых дополнительно описаны здесь. Например, STEAP-1 может быть получен рекомбинантно. В одном варианте осуществления, животных иммунизируют производным STEAP-1, которое содержит внеклеточную часть STEAP-1, слитую с Fc-частью тяжелой цепи иммуноглобулина. В одном варианте осуществления, животных иммунизируют слитым белком STEAP-1-IgG1. В одном варианте осуществления, животных иммунизируют иммуногенными производными STEAP-1 в растворе со смесью монофосфориллипид А (MPL)/дикриномиколат трегалозы (TDM) (Ribi Immunochem. Research, Inc., Hamilton, MT), и этот раствор инъецируют интрадермально во множественных участках. Спустя две недели животным инъецируют бустер-дозу. Спустя семь-четырнадцать дней проводят извлечение крови животных, и сыворотку анализируют на титр анти-STEAP-1-антитела. Животных повторно инъецируют до получения плато титра.
Альтернативно, лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты сливают с миеломными клетками с использованием подходящего сливающего агента, такого как полиэтиленгликоль, для образования гибридомной клетки (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Полученные таким образом гибридомные клетки высевают и выращивают в подходящей культуральной среде, например, среде, которая содержит одно или несколько веществ, которые ингибируют рост или выживаемость неслитых, исходных миеломных клеток. Например, если исходные миеломные клетки лишены гипоксантин-гуанинфосфорибозилтрансферазы (HGPRT или HPRT), культуральная среда для этих гибридом должна включать в себя гипоксантин, аминоптерин и тимидин (среда HAT), причем эти вещества предотвращают рост HGPRT-недостаточных клеток.
В некоторых вариантах осуществления, миеломные клетки являются клетками, которые эффективно сливают, поддерживают стабильное продуцирование высоких уровней антитела отобранными антитело-продуцирующими клетками и являются чувствительными к такой среде, как среда НАТ. Примерные миеломные клетки включают в себя, но не ограничиваются ими, мышиные миеломные линии, такие как линии, произведенные из опухолей MOPC-21 и MPC-11 мыши, доступные из Salk Institute Cell Distribution Center, San Diego, California USA, и клетки SP-2 или X63-Ag8-653, доступные из American Type Culture Collection, Rockville, Maryland USA. Линии клеток миеломы человека и гетеромиеломы мышь-человек были также описаны для получения моноклональных антител человека (Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой растут гибридомные клетки, анализируют на продуцирование моноклональных антител, которые связываются с STEAP-1. Предпочтительно, специфичность связывания моноклональных антител, продуцируемых гибридомными клетками, определяют иммунопреципитацией или анализом связывания in vitro, таким как радиоиммуноанализ (RIA) или твердофазный иммуноферментный анализ (ELISA). Аффинность связывания моноклонального антитела может быть, например, определена анализом Скетчарда Munson et al., Anal. Biochem., 107:220 (1980).
После идентификации гибридомных клеток, которые продуцируют антитела желаемой специфичности, аффинности и/или активности, эти клоны могут быть субклонированы процедурами лимитирующих разведений и выращены стандартными способами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Подходящие культуральные среды для этой цели включают в себя, например, среду D-MEM или RPMI-1640. Кроме того, гибридомные клетки могут быть выращены in vivo в виде асцитических опухолей в животном. Моноклональные антитела, секретируемые этими субклонами, подходящим образом отделяют от культуральной среды, асцитической жидкости или сыворотки общепринятыми процедурами очистки иммуноглобулинов, такими как, например, белок А-Сефарозная, гидроксиапатитная хроматография, гель-электрофорез, диализ или аффинная хроматография.
2. Некоторые способы скрининга библиотек
Анти-STEAP-1-антитела согласно изобретению могут быть получены с использованием комбинаторных библиотек для скрининга на антитела с желаемой активностью или желаемыми активностями. Например, в данной области известны различные способы генерирования библиотек фагового дисплея и скрининга таких библиотек на антитела, имеющие желаемые характеристики связывания. Такие способы описаны в общем виде в Hoogenboom et al. (2001) in Methods in Molecular Biology 178: 1-37 (O'Brien et al., ed., Human Press, Totowa, NJ) и, в некоторых вариантах, в Lee et al. (2004) J. Mol. Biol. 340: 1073-1093.
В принципе, синтетические клоны антител отбирают скринингом фаговых библиотек, содержащих фаг, который представляет различные фрагменты вариабельного района (Fv) антитела, слитого с белком оболочки фага. Такие фаговые библиотеки подвергают пэннингу аффинной хроматографией против желаемого антигена. Клоны, экспрессирующие Fv-фрагменты, способные связываться с желаемым антигеном, адсорбируются с этим антигеном и, следовательно, отделяются от несвязывающихся клонов в этой библиотеке. Затем связывающиеся клоны элюируют из этого антигена и они могут быть дополнительно обогащены дополнительными циклами адсорбции/элюции антигена. Любое из анти-STEAP-1-антител согласно изобретению может быть получено при помощи схемы подходящей процедуры скрининга антигена для отбора на представляющий интерес фаговый клон с последующим конструированием полноразмерного клона анти-STEAP-1-антитела с использованием Fv-последовательностей, описанных в Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3.
В некоторых вариантах осуществления, антигенсвязывающий домен антитела образован из двух вариабельных (V) районов из приблизительно 110 аминокислот, в каждом случае одного из легкой цепи (VL) и другого из тяжелой цепи (VH), оба из которых представляют три гипервариабельные петли (HVR) или определяющих комплементарность районов (CDR). Вариабельные домены могут быть представлены функционально на фаге, либо в виде одноцепочечных Fv (scFv)-фрагментов, в которых VH и VL ковалентно связаны через короткий, гибкий пептид, либо в виде Fab-фрагментов, в которых они (каждый) слиты с константным доменом и взаимодействуют нековалентно, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). В данном контексте, scFv-кодирующие фаговые клоны и Fab-кодирующие фаговые клоны называют совместно “фаговыми клонами Fv” или “Fv-клонами”.
Репертуары генов VH и VL могут быть клонированы раздельно полимеразной цепной реакцией (ПЦР) и рекомбинированы случайным образом в фаговых библиотеках, которые затем подвергают поиску на антигенсвязывающие клоны, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Библиотеки из иммунизированных источников обеспечивают высокоаффинные антитела к иммуногену без необходимости конструирования гибридом. Альтернативно, «наивный» («необученный») репертуар может быть клонирован для обеспечения единственного источника антител человека до широкого диапазона не-аутоантигенов, а также аутоантигенов без какой-либо иммунизации, как описано Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, «необученные» библиотеки могут быть также приготовлены синтетически клонированием нереаранжированных сегментов V-генов из стволовых клеток и с использованием ПЦР-праймеров, содержащих случайную последовательность, для кодирования высоковариабельных районов CDR3 и для выполнения реаранжировки in vivo, как описано Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992).
В некоторых вариантах осуществления, использовали нитчатый фаг для дисплея фрагментов антител слиянием с минорным белком pIII оболочки. Эти фрагменты антител могут быть представлены в виде одноцепочечных Fv-фрагментов, в которых домены VH и VL соединены на одной и той же полипептидной цепи гибким полипептидным спейсером, например, как описано Marks et al., J. Mol. Biol., 222: 581-597 (1991), или в виде Fab-фрагментов, в которых одна цепь слита с pIII, а другая секретируется в периплазму бактериальной клетки-хозяина, где сборка структуры Fab-белок оболочки, которая выставляется на поверхности фага, происходит вытеснением некоторых из белков оболочки дикого типа, например, как описано в Hoogenboom et al., Nucl. Acids Res., 19: 4133-4137 (1991).
Обычно нуклеиновые кислоты, кодирующие фрагменты генов антител, получают из иммобилизованных клеток, собранных из людей или животных. Если желательна библиотека, смещенная в пользу анти-STEAP-1-клонов, субъекта иммунизируют STEAP-1 для генерирования реакции в виде антител и клетки селезенки и/или циркулирующие в кровотоке В-клетки и другие лимфоциты периферической крови (PBL) извлекают для конструирования библиотеки. В предпочтительном варианте осуществления, библиотеку фрагментов генов антител человека, смещенную в пользу анти-STEAP-1-клонов, получают генерированием ответной реакции в виде анти-STEAP-1-антител в трансгенных мышах, несущих ряд функциональных генов иммуноглобулина человека (и лишенных функциональной эндогенной системы продуцирования антител), так что иммунизация STEAP-1 вызывает образование В-клеток, продуцирующих антитела человека против STEAP-1. Генерирование трансгенной мыши, продуцирующей антитело человека, описано ниже.
Дополнительное обогащение в отношении популяции анти-STEAP-1-реактивных клеток может быть получено с использованием подходящей процедуры скрининга для выделения В-клеток, экспрессирующих STEAP-1-специфическое мембраносвязанное антитело, например, посредством отделения клеток с использованием STEAP-1-аффинной хроматографии или адсорбции клеток с флуорохром-меченым STEAP-1 с последующим проточным сортингом активированных клеток (FACS).
Альтернативно, использование клеток селезенки и/или В-клеток или других PBL из неиммунизированного донора позволяет лучшую репрезентацию возможного репертуара антител, а также позволяет конструировать библиотеку антител с использованием любого вида животного (человека или не-человеческих), в котором STEAP-1 не является антигенным. Для библиотек, включающих в себя конструкцию гена антитела in vitro, стволовые клетки берут из этого субъекта для обеспечения нуклеиновых кислот, кодирующих нереаранжированные генные сегменты антитела. Представляющие интерес иммунные клетки могут быть получены из различных видов животных, таких как человек, мышь, крыса, виды зайцеобразных, волчьих, собачьих, кошачьих, свиных, коровьих, лошадиных и видов птиц и т.д.
Вариабельные генные сегменты нуклеиновой кислоты, кодирующей антитело (в том числе сегменты VH и VL), извлекают из представляющих интерес клеток и амплифицируют. В случае библиотек реаранжированных генов VH и VL, желаемые ДНК могут быть получены выделением геномной ДНК или мРНК из лимфоцитов с последующей полимеразной цепной реакцией (ПЦР) с праймерами, соответствующими 5’- и 3’-концам реаранжированных генов VH и VL, как описано в Orlandi et al., Proc. Natl. Acad. Sci. (USA), 86: 3833-3837 (1989), с получением посредством этого разнообразных репертуаров V-генов для экспрессии. Эти V-гены могут быть амплифицированы из кДНК и геномной ДНК с обратными праймерами на 5’-конце экзона, кодирующего зрелый V-домен, и прямыми праймерами на основе последовательности внутри J-сегмента, как описано в Orlandi et al. (1989) и в Ward et al., Nature, 341: 544-546 (1989). Однако, для амплификации из кДНК, обратные праймеры могут быть также основаны на последовательности в лидерном экзоне, как описано в Jones et al., Biotechnol., 9: 88-89 (1991), и обратные праймеры на последовательности в константной области, как описано в Sastry et al., Proc. Natl. Acad. Sci. (USA), 86: 5728-5732 (1989). Для максимизации комплементарности, в эти праймеры может быть включена вырожденность, как описано в Orlandi et al. (1989) или Sastry et al. (1989). В некоторых вариантах осуществления, разнообразие библиотеки максимизируют с использованием ПЦР-праймеров, нацеленных на каждое семейство V-генов, для амплификации всех доступных расположений, присутствующих в пробе нуклеиновой кислоты иммунных клеток, например, как описано в способе Marks et al., J. Mol. Biol., 222: 581-597 (1991), или как описано в способе Orum et al., Nucleic Acids Res., 21: 4491-4498 (1993). Для клонирования амплифицированной ДНК в экспрессирующие векторы, в ПЦР-праймер могут быть введены редкие сайты рестрикции в качестве метки на одном конце, как описано в Orlandi et al. (1989), или дополнительной ПЦР-амплификацией с меченым праймером, как описано в Clackson et al., Nature, 352: 624-628 (1991).
Репертуары синтетически реаранжированных V-генов могут быть произведены in vitro из сегментов V-генов. Большинство сегментов VH-генов клонировали и секвенировали (как сообщалось в Tomlinson et al., J. Mol. Biol., 227: 776-798 (1992)) и картировали (как сообщалось в Matsuda et al., Nature Genet., 3: 88-94 (1993)); эти клонированные сегменты (в том числе все из основных конформаций петли Н1 и Н2) могут быть использованы для генерирования разнообразных репертуаров VH-генов с ПЦР-праймерами, кодирующими петли Н3 разной последовательности и длины, как описано в Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). VH-репертуары могут быть также получены со всем разнообразием последовательностей, сосредоточенным в длинной петле Н3 единственной длины, как описано в Barbas et al., Proc. Natl. Acad. Sci. USA, 89: 4457-4461 (1992). Сегменты Vκ и Vλ человека были клонированы и секвенированы (как сообщалось в Williams and Winter, Eur. J. Immunol., 23: 1456-1461 (1993)) и могут быть использованы для получения синтетических репертуаров легких цепей. Синтетические репертуары V-генов, основанные на диапазоне складок VH и VL и длинах L3 и H3, будут кодировать антитела с существенным структурным разнообразием. После амплификации кодирующей V-ген ДНК, сегменты V-гена зародышевой линии могут быть генерированы in vitro в соответствии со способами Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992).
Репертуары фрагментов антител могут быть сконструированы объединением репертуаров VH- и VL-генов вместе несколькими путями. Каждый репертуар может быть создан в разных векторах, и эти векторы могут рекомбинироваться in vitro, например, как описано в Hogrefe et al., Gene, 128: 1 19-126 (1993), или в комбинированном инфицировании in vivo, например, системы loxP, описанной в Waterhouse et al., Nucl. Acids Res., 21: 2265-2266 (1993). Этот подход рекомбинации in vivo использует двухцепочечную природу Fab-фрагментов для преодоления ограничения в отношении размера библиотек, налагаемого эффективностью трансформации E. coli. «Необученные» репертуары VH и VL клонируют раздельно, один в фагмиду, а другой в фаговый вектор. Затем эти две библиотеки объединяют инфицированием фагом содержащей плазмиду бактерии, так что каждая клетка содержит отличающуюся комбинацию, и размер этой библиотеки ограничивается только количеством присутствующих клеток (приблизительно 1012 клонов). Оба вектора содержат сигналы рекомбинации in vivo, так что гены VH и VL рекомбинируются на единственном репликоне и совместно упаковываются в фаговые вирионы. Эти огромные библиотеки обеспечивают большие количества разнообразных антител с хорошей аффинностью (Kd-1 приблизительно 10-8 M).
Альтернативно, эти репертуары могут быть клонированы последовательно в один и тот же вектор, например, как описано в Barbas et al., Proc. Natl. Acad. Sci. USA, 88: 7978-7982 (1991), или собраны вместе посредством ПЦР и затем клонированы, например, как описано в Clackson et al., Nature, 352: 624-628 (1991). ПЦР-сборка может быть также использована для соединения ДНК VH и VL с ДНК, кодирующей гибкий пептидный спейсер, с образованием репертуаров одноцепочечных Fv (scFv). Еще в одном способе, “в клеточной ПЦР-сборке” используют объединение генов VH и VL в лимфоцитах при помощи ПЦР и затем клонируют репертуары связанных генов, как описано в Embleton et al., Nucl. Acids Res., 20: 3831-3837 (1992).
Антитела, продуцируемые «необученными» библиотеками (природными или синтетическими), могут иметь среднюю аффинность (Kd-1 приблизительно 106-107 M-1), но созревание аффинности может также имитироваться in vitro конструированием и повторным отбором из вторичных библиотек, как описано в Winter et al. (1994), supra. Например, может быть введена мутация in vitro случайным образом с использованием склонной к ошибкам полимеразы (сообщенной в Leung et al., Technique, 1: 1 1-15 (1989)) в способе Hawkins et al., J. Mol. Biol., 226: 889-896 (1992) или в способе Gram et al., Proc. Natl. Acad. Sci USA, 89: 3576-3580 (1992). Кроме того, созревание аффинности может выполняться случайным мутированием одного или нескольких CDR, например, с использованием ПЦР с праймерами, несущими случайную последовательность, простирающуюся через представляющий интерес CDR, в отобранных индивидуальных Fv-клонах и скринингом на клоны с более высокой аффиностью. WO 9607754 (опубликованный 14 марта 1996 года) описывал способ индуцирования мутагенеза в определяющем комплементарность районе легкой цепи иммуноглобулина для создания библиотеки генов легких цепей. Другим эффективным подходом является рекомбинация доменов VH или VL, отобранных при помощи фагового дисплея, с репертуарами природно-встречающихся вариантов V-доменов, полученных из неиммунизированных доноров, и скрининг на более высокую аффинность в нескольких раундах перетасовки цепи, как описано в Marks et al., Biotechnol., 10: 779-783 (1992). Этот способ позволяет получать антитела и фрагменты антител с аффинностями приблизительно 10-9 M или менее.
Скрининг этих библиотек может выполняться разными способами, известными в данной области. Например, STEAP-1 может быть использован для покрытия стенок адсорбционных чашек, экспрессирован на клетках-хозяевах, прикрепленных к адсорбционным чашкам, или использован в сортинге клеток или конъюгирован с биотином для улавливания покрытыми стрептавидином гранулами или использован в любом другом способе для пэннинга библиотек фагового дисплея.
Пробы фаговой библиотеки контактируют с иммобилизованным STEAP-1 при условиях, подходящих для связывания по меньшей мере части фаговых частиц с адсорбентом. Обычно, эти условия, включающие в себя рН, ионную силу, температуру и т.п., выбирают для имитации физиологических условий. Фаги, связанные с твердой фазой, промывают и затем элюируют кислотой, например, как описано в Barbas et al., Proc. Natl. Acad. Sci USA, 88: 7978-7982 (1991), или щелочью, например, как описано в Marks et al., J. Mol. Biol., 222: 581-597 (1991), или конкуренцией за антиген STEAP-1, например, в процедуре, сходной со способом конкуренции за антиген Clackson et al., Nature, 352: 624-628 (1991). Фаги могут быть обогащены в 20-1000 раз в единственном раунде отбора. Кроме того, обогащенные фаги могут выращиваться в бактериальной культуре и могут быть подвергнуты дополнительным раундам отбора.
Эффективность отбора зависит от многих факторов, в том числе от кинетики диссоциации во время промывания и от того, могут ли множественные фрагменты антител на единственном фаге одновременно связываться с антигеном. Антитела с быстрой кинетикой диссоциации (и слабыми связывающими аффинностями) могут сохраняться с использованием кратковременных промывок, мультивалентного фагового дисплея и высокой плотности покрытия антигена в твердой фазе. Эта высокая плотность не только стабилизирует этот фаг посредством мультивалентных взаимодействий, но и благоприятствует повторному связыванию фага, который был диссоциирован. Отбор антител с медленной кинетикой диссоциации (и хорошей связывающей аффинностью) может быть стимулирован использованием продолжительных промывок и моновалентного фагового дисплея, как описано в Bass et al., Proteins, 8: 309-314 (1990) и в WO 92/09690, и низкой плотностью покрытия, как описано в Marks et al., Biotechnol, 10: 779-783 (1992).
Возможным является выбор между фаговыми антителами разной аффинности, даже в случае аффинностей, которые слабо отличаются, в отношении STEAP-1. Однако, случайная мутация выбранного антитела (например, выполняемая в некоторых способах созревания аффинности) индуцирует, вероятно, многие мутанты, большая часть которых связывается с антигеном, и мало мутантов с более высокой аффинностью. С ограничением STEAP-1, редкий фаг с высокой аффинностью мог бы быть выбран на основе конкуренции. Для сохранения всех мутантов с более высокой аффинностью, фаги могут быть инкубированы с избытком биотинилированного STEAP-1, но с биотинилированным STEAP-1 в концентрации более низкой молярности, чем желаемая молярная константа аффинности для STEAP-1. Затем фаги с высокой аффинностью связывания могут быть уловлены стрептоавидин-покрытыми парамагнитными гранулами. Такой «равновесный захват» позволяет отбирать антитела в соответствии с их аффиностями связывания, с чувствительностью, которая позволяет выделять мутантные клоны с такой малой, как в 2 раза более высокая, аффинностью из большого избытка фагов с более низкой аффинностью. Условия, используемые в промывке фагов, связанных с твердой фазой, могут быть также подвергнуты манипуляции для различения на основе кинетики диссоциации.
Клоны анти-STEAP-1 могут быть отобраны на основе активности. В некоторых вариантах осуществления, это изобретение обеспечивает анти-STEAP-1-антитела, которые связываются с живыми клетками, которые природно экспрессируют STEAP-1. В одном варианте осуществления, это изобретение обеспечивает анти-STEAP-1-антитела, которые блокируют связывание между лигандом STEAP-1 и STEAP-1, но не блокируют связывание между лигандом STEAP-1 и вторым белком. Fv-клоны, соответствующие таким анти-STEAP-1-антителам, могут быть отобраны (1) выделением анти-STEAP-1-клонов из фаговой библиотеки, как описано выше, и необязательной амплификацей выделенной популяции фаговых клонов выращиванием этой популяции в подходящем бактериальном хозяине; (2) отбором STEAP-1 и второго белка, против которых желательна блокирующая и неблокирующая активность, соответственно; (3) адсорбцией анти-STEAP-1 фаговых клонов иммобилизованным STEAP-1; (4) использованием избытка второго белка для элюции любых нежелательных клонов, которые узнают STEAP-1-связывающие детерминанты второго белка; и (5) элюцией клонов, которые остаются адсорбированными после стадии (4). Необязательно, клоны с желаемыми блокирующими/неблокирующими свойствами могут быть дополнительно обогащены повторением процедуры отбора, описанной здесь, один или несколько раз.
ДНК, кодирующую произведенные из гибридомы моноклональные антитела или Fv-клоны фагового дисплея согласно изобретению, легко выделяют и секвенируют с использованием общепринятых процедур (например, с использованием олигонуклеотидных праймеров, сконструированных для специфической амплификации представляющих интерес кодирующих районов тяжелой цепи и легкой цепи из матрицы гибридомной или фаговой ДНК). После выделения, эта ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки COS обезьяны, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в противном случае не продуцируют белок иммуноглобулин, для получения синтеза желаемых моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи по рекомбинантной экспрессии в бактериях кодирующей антитело ДНК включают в себя Skerra et al., Curr. Opinion in Immunol., 5: 256 (1993) и Pluckthun, Immunol. Revs, 130: 151 (1992).
ДНК, кодирующая Fv-клоны согласно изобретению, может быть объединена с известными ДНК-последовательностями, кодирующими константные области тяжелой цепи и/или легкой цепи (например, подходящие ДНК-последовательности могут быть получены из Kabat et al., supra) для образования клонов, кодирующих тяжелые цепи и/или легкие цепи полной длины или частичной длины. Будет понятно, что для этой цели могут быть использованы константные области любого изотипа, в том числе константные области IgG, IgM, IgA, IgD и IgE, и что такие константные области могут быть получены из любого человека или вида животного. Fv-клон, произведенный из ДНК вариабельного домена одного вида животного (например, человека) и затем слитый с ДНК константной области другого вида животного для образования кодирующей последовательности (кодирующих последовательностей) для «гибридной», полноразмерной тяжелой цепи и/или легкой цепи, включен в определение «химерного» и «гибридного» антитела, в данном контексте. В некоторых вариантах осуществления, Fv-клон, произведенный из вариабельной ДНК человека, слит с константной областью ДНК для образования кодирующей последовательности (кодирующих последовательностей) полноразмерных или частичных тяжелой и/или легкой цепей человека.
ДНК, кодирующая анти-STEAP-1-антитело, произведенное из гибридомы согласно изобретению, может быть также модифицирована, например, заменой кодирующей последовательности константных доменов тяжелой и легкой цепи человека вместо гомологичных мышиных последовательностей, произведенных из гибридомного клона (например, как в способе Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)). ДНК, кодирующая произведенное из гибридомы или из Fv-клона антитело или фрагмент антитела, может быть дополнительно модифицирована ковалентным присоединением к этому иммуноглобулину кодирующей последовательности всей или части кодирующей последовательности полипептида, не являющегося иммуноглобулином. В этом способе получают «химерное» или «гибридное» антитела, которые имеют связывающую специфичность этих произведенных из Fv-клона или из гибридомы антител согласно изобретению.
3. Векторы, клетки-хозяева и рекомбинантные способы
Для рекомбинантного получения антитела согласно изобретению, нуклеиновую кислоту, кодирующую его, выделяют и инсертируют в реплицируемый вектор для дополнительного клонирования (амплификации этой ДНК) или для экспрессии. ДНК, кодирующую это антитело, легко выделяют и секвенируют с использованием общепринятых процедур (например, с использованием олигонуклеотидных зондов, которые способны связываться специфически с генами, кодирующими тяжелую и легкую цепи этого антитела). Многие векторы являются доступными. Выбор вектора зависит отчасти от используемой клетки-хозяина. Будет понятно, что для этой цели могут быть использованы константные области любого изотипа, в том числе константные области IgG, IgM, IgA, IgD и IgE, и что такие константные области могут быть получены из любых источников человека или видов животного.
Генерирование антител с использованием прокариотических клеток-хозяев:
Конструирование векторов
Полинуклеотидные последовательности, кодирующие полипептидные компоненты антитела согласно изобретению, могут быть получены с использованием стандартных рекомбинантных способов. Желаемые полинуклеотидные последовательности могут быть выделены и секвенированы из продуцирующих антитело клеток, таких как гибридомные клетки. Альтернативно, полинуклеотиды могут быть синтезированы с использованием нуклеотидного синтезатора или ПЦР-способов. После получения, последовательности, кодирующие эти полипептиды, инсертируют в рекомбинантный вектор, способный реплицироваться и экспрессировать гетерологичные полинуклеотиды в прокариотических клетках. Многие векторы, которые доступны и известны в данной области, могут быть использованы для цели данного изобретения. Выбор подходящего вектора будет зависеть в основном от размера нуклеиновых кислот, встраиваемых в этот вектор, и от конкретной клетки-хозяина, которая должна трансформироваться этим вектором. Каждый вектор содержит различные компоненты, в зависимости от его функции (амплификации или экспрессии гетерологичного полинуклеотида или и той, и другой) и его совместимости с конкретной клеткой-хозяином, в которой он находится. Компоненты вектора обычно включают в себя, но не ограничиваются ими: сайт инициации репликации, ген селективного маркера, промотор, сайт связывания рибосом (RBS), сигнальную последовательность, инсерт гетерологичной нуклеиновой кислоты и последовательность терминации транскрипции.
Обычно, плазмидные векторы, содержащие репликон и регуляторные последовательности, которые произведены из вида, совместимого с клеткой-хозяином, используют в связи с этими хозяевами. Этот вектор обычно несет сайт инициации репликации, а также маркирующие последовательности, которые способны обеспечивать фенотипический отбор в трансформированных клетках. Например, E. coli обычно трансформируют с использованием pBR322, плазмиды, произведенной из вида E. coli. pBR322 содержит гены, кодирующие устойчивость к ампициллину (AMP) и тетрациклину (Tet) и, следовательно, обеспечивает легкое средство для идентификации трансформированных клеток. pBR322, ее производные или другие микробные плазмиды или бактериофаг могут также содержать, или могут быть модифицированы, чтобы содержать, промоторы, которые могут быть использованы этим микробным организмом для экспрессии эндогенных белков. Примеры производных pBR322, используемых для экспрессии конкретных антител, описаны подробно в Carter et al., U.S. Patent No. 5,648,237.
Кроме того, фаговые векторы, содержащие репликон и регуляторные последовательности, которые совместимы с микроорганизмом-хозяином, могут быть использованы в качестве трансформирующих векторов в связи с этими хозяевами. Например, бактериофаг, такой как λGEM.TM.-11, может быть использован для трансформации восприимчивых клеток-хозяев, таких как E. coli LE392.
Экспрессирующий вектор согласно изобретению может содержать две или более пар промотор-цистрон, кодирующих каждый из этих полипептидных компонентов. Промотор является нетранслируемой регуляторной последовательностью, расположенной слева (5’) относительно цистрона, который модулирует его экспрессию. Прокариотические промоторы обычно разделяются на два класса, индуцируемые промоторы и конститутивные промоторы. Индуцируемый промотор является промотором, который инициирует увеличенные уровни транскрипции цистрона под его контролем в ответ на изменения в условии культивирования, например, присутствие или отсутствие нутриента, или на изменение температуры.
Хорошо известно большое количество промоторов, узнаваемых различными потенциальными клетками-хозяевами. Выбранный промотор может быть функционально связан с ДНК цистрона, кодирующей легкую или тяжелую цепь, выделением этого промотора из ДНК-источника с использованием расщепления рестрикционным ферментом (рестриктазой) и инсертированием выделенной последовательности промотора в вектор согласно изобретению. Как последовательность нативного промотора, так и многие гетерологичные промоторы могут быть использованы для управления амплификацией и/или экспрессией генов-мишеней. В некоторых вариантах осуществления, используют гетерологичные промоторы, так как они обычно делают возможной более высокую транскрипцию и более высокие выходы экспрессируемого гена-мишени в сравнении с нативным полипептидным промотором-мишенью.
Промоторы, подходящие для использования с прокариотическими хозяевами, включают в себя промотор PhoA, системы промоторов β-галактамазы и лактозы, систему промотора триптофана (trp) и гибридные промоторы, такие как промотор tac или trc. Однако, применимы также другие промоторы, которые функциональны в бактериях (такие как другие известные бактериальные или фаговые промоторы). Их нуклеотидные последовательности были опубликованы, что позволяет квалифицированному работнику функционально лигировать их с цистронами, кодирующими легкую и тяжелую цепи-мишени (Siebenlist et al. (1980) Cell 20: 269), с использованием линкеров или адапторов для обеспечения любых требуемых сайтов рестрикции.
В одном аспекте согласно изобретению, каждый цистрон в рекомбинантном векторе содержит компонент сигнальной последовательности секреции, который управляет перемещением экспрессируемых полипептидов через мембрану. Обычно, эта сигнальная последовательность может быть компонентом этого вектора или она может быть частью ДНК полипептида-мишени, которая встроена в этот вектор. Сигнальная последовательность, выбранная для цели согласно изобретению, должна быть сигнальной последовательностью, которая узнается и процессируется (т.е. отщепляется сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не узнают и не процессируют сигнальные последовательности, природные относительно гетерологичных полипептидов, эту сигнальную последовательность заменяют выбранной прокариотической сигнальной последовательностью, например, из группы, состоящей из промоторов щелочной фосфатазы, пенициллиназы, Ipp, устойчивых к нагреванию лидеров энтеротоксина II (STII), LamB, PhoE, PelB, OmpA и MBP. В одном варианте осуществления, сигнальными последовательностями, используемыми в обоих цистронах этой системы экспрессии, являются сигнальные последовательности STII или их варианты.
В другом аспекте, продуцирование иммуноглобулинов в соответствии с этим изобретением может происходить в цитоплазме клетки-хозяина и, следовательно, не требует присутствия сигнальных последовательностей секреции в каждом цистроне. В этой связи, легкая и тяжелая цепи иммуноглобулина экспрессируются, укладываются и собираются с образованием функциональных иммуноглобулинов в цитоплазме. Некоторые штаммы-хозяева (например, штаммы E. coli trxB) обеспечивают условия в цитоплазме, которые являются благоприятными для образования дисульфидных связей, что делают возможным правильную укладку и сборку экспрессированных белковых субъединиц. Proba and Pluckthun Gene, 159:203 (1995).
Антитела согласно изобретению могут быть также продуцированы с использованием экспрессионной системы, в которой количественное соотношение экспрессируемых полипептидных компонентов может модулироваться для максимизации выхода секретируемых и правильно собранных антител согласно изобретению. Такую модуляцию выполняют по меньшей мере частично одновременной модуляцией трансляционных эффективностей для полипептидных компонентов.
Один способ модуляции трансляционной эффективности описан в Simmons et al., патент США № 5840523. Он использует варианты района инициации трансляции (TIR) в цистроне. Для конкретного TIR, может быть создан ряд аминокислотных последовательностей и последовательностей нуклеиновых кислот с диапазоном трансляционных эффективностей, что обеспечивает удобное средство, при помощи которого этот фактор можно корректировать в отношении желаемого уровня экспрессии конкретной цепи. Варианты TIR могут быть генерированы общепринятыми способами мутагенеза, которые приводят к изменениям кодонов, которые могут изменять аминокислотную последовательность. В некоторых вариантах осуществления, изменения в этой нуклеотидной последовательности являются молчащими. Изменения в этих TIR могут включать в себя, например, изменения в количестве или пространственном распределении последовательностей Шайна-Далгарно, вместе с изменениями в сигнальной последовательности. Одним способом генерирования мутантных сигнальных последовательностей является генерирование «банка кодонов» в начале кодирующей последовательности, который не изменяет аминокислотную последовательность сигнальной последовательности (т.е. эти изменения являются молчащими). Это может быть выполнено изменением третьего положения нуклеотида каждого кодона; кроме того, некоторые аминокислоты, такие как лейцин, серин и аргинин, имеют множественные первое и второе положения, которые могут добавлять комплексность в изготовлении этого банка. Этот способ мутагенеза описан подробно в Yansura et al. (1992) METHODS: A Companion to Methods in Enzymol. 4: 151-158.
В одном варианте осуществления, генерируют набор векторов с диапазоном эффективностей для каждого цистрона в нем. Этот ограниченный набор обеспечивает сравнение уровней экспрессии каждой цепи, а также выхода желаемых продуктов антитела при различных комбинациях эффективностей TIR. Эффективности TIR могут быть определены количественным определением уровня экспрессии репортерного гена, как описано подробно в Simmons et al. патент США № 5840523. На основе сравнения трансляционных эффективностей, желаемые индивидуальные TIR выбирают для объединения в конструкциях экспрессирующего вектора согласно изобретению.
Прокариотические клетки-хозяева, подходящие для экспрессии антител согласно изобретению, включают в себя Archaebacteria и Eubacteria, такие как грамотрицательные и грамположительные организмы. Примеры применимых бактерий включают в себя Escherichia (например, E. coli), бациллы (например, B. subtilis), Enterobacteria, виды Pseudomonas (например, P. aeruginosa), Salmonella typhimurium, Serratia marcescans, Klebsiella, Proteus, Shigella, Rhizobia, Vitreoscilla или Paracoccus. В одном варианте осуществления, используют грамотрицательные клетки. В одном варианте осуществления, в качестве хозяев для согласно изобретению используют клетки E. coli. Примеры штаммов E. coli включают в себя штамм W3110 (Bachmann, Cellular and Molecular Biology, vol. 2 (Washington, D. C: American Society for Microbiology, 1987), pp. 1 190-1219; ATCC Deposit No. 27,325) и его производные, включающие в себя штамм 33D3, имеющий генотип W3110 ΔfhuA (ΔtonA) ptr3 lac Iq lacL8 ΔompTΔ(nmpc-fepE) degP41 kanR (патент США № 5639635). Подходящими являются также другие штаммы и производные, такие как E. coli 294 (ATCC 31,446), E. coli B, E. coliλ 1776 (ATCC 31,537) и E. coli RV308(ATCC 31,608). Эти примеры являются иллюстративными, а не ограничивающими. Способы конструирования производных любой из вышеуказанных бактерий, имеющих определенные генотипы, известны в данной области и описаны, например, в Bass et al., Proteins, 8:309-314 (1990). Обычно необходимо отбирать подходящие бактерии, принимая во внимание реплицируемость репликона в клетках бактерии. Например, E. coli, виды Serratia или Salmonella могут быть подходящим образом использованы в качестве хозяина при использовании хорошо известных плазмид, таких как pBR322, pBR325, pACYC177 или pKN410 для обеспечения репликона. Обычно, клетка-хозяин должна секретировать минимальные количества протеолитических ферментов, и может быть желательным включение дополнительных ингибиторов протеаз в эту культуру клеток.
Получение антител
Клетки-хозяева трансформируют вышеописанными экспрессирующими векторами и культивируют в общепринятой питательной среде, модифицированной подходящим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желаемые последовательности.
Под трансформацией имеется в виду введение ДНК в прокариотического хозяина таким образом, что эта ДНК является реплицируемой, либо в виде внехромосомного элемента, либо в виде хромосомного интегранта (неотъемлемой части хромосомы). В зависимости от используемой клетки-хозяина, трансформацию выполняют с использованием стандартных способов, обычно используемых для бактериальных клеток, которые содержат существенные барьеры клетка-стенка. Другой способ трансформации использует смесь полиэтиленгликоль-ДМСО. Еще один способ использует электропорацию.
Прокариотические клетки, используемые для продуцирования полипептидов согласно изобретению, выращивают в средах, известных в данной области и подходящих для культуры выбранных клеток-хозяев. Примеры подходящих сред включают в себя бульон Луриа (LB) плюс необходимые питательные добавки. В некоторых вариантах осуществления, эти среды содержат также агент отбора, выбранный на основе конструкции экспрессирующего вектора, для селективного позволения роста прокариотических клеток, содержащих этот экспрессирующий вектор. Например, к среде для роста клеток, экспрессирующих ген устойчивости к ампициллину, добавляют ампициллин.
Любые необходимые добавки, кроме источников углерода, азота и неорганического фосфата, могут быть также включены при подходящих концентрациях, вводимые отдельно или в виде смеси с другой добавкой или средой, такой как комплексный источник азота. Необязательно, эта культуральная среда может содержать один или несколько восстанавливающих агентов, выбранных из группы, состоящей из глутатиона, цистеина, цистамина, тиогликолата, дитиоэритрита и дитиотреитола.
Прокариотические клетки-хозяева культивируют при подходящих температурах. В некоторых вариантах осуществления, для E. coli, используют диапазон температур от приблизительно 20ºC до приблизительно 39ºC; от приблизительно 25ºC до приблизительно 37ºC; или приблизительно 30ºC. рН этой среды может быть любым рН в диапазоне от приблизительно 5 до приблизительно 9, в зависимости в основном от организма-хозяина. В некоторых вариантах осуществления, для E. coli, рН равен приблизительно 6,8 – приблизительно 7,4, или приблизительно 7,0.
При использовании индуцируемого промотора в экспрессирующем векторе согласно изобретению, экспрессию белка индуцируют при условиях, подходящих для активации этого промотора. В одном аспекте согласно изобретению, используют промоторы PhoA для регуляции транскрипции полипептидов. Таким образом, трансформированные клетки-хозяева культивируют в среде с ограничением фосфата для индукции. В некоторых вариантах осуществления, средой с ограничением фосфата является среда C.R.A.P. (см., например, Simmons et al., J. Immunol. Methods (2002), 263: 133-147). Могут быть использованы различные другие индукторы в соответствии с используемой конструкцией вектора, как известно в данной области.
В одном варианте осуществления, экспрессируемые полипептиды данного изобретения секретируются в периплазму и извлекаются из периплазмы клеток-хозяев. Извлечение белка обычно включает в себя разрушение микроорганизма, обычно такими средствами, как осмотический шок, обработка ультразвуком или лизис. После разрушения клеток, остатки клеток или целые клетки могут быть удвлены центрифугированием или фильтрованием. Эти белки могут быть дополнительно очищены, например, аффинной хроматографией на смоле. Альтернативно, белки могут быть транспортированы в культуральную среду и выделены в ней. Клетки могут быть извлечены из этой культуры и культуральный супернатант фильтруют и концентрируют для дополнительной очистки полученных белков. Кроме того, эти экспрессированные полипептиды могут быть выделены и идентифицированы с использованием обычно известных способов, таких как электрофорез в полиакриламидном геле (PAGE) и Вестерн-блот-анализ.
В одном аспекте согласно изобретению, получение антител проводят в большом количестве с использованием ферментационного процесса. Различные крупномасштабные процедуры ферментации с подпиткой доступны для получения рекомбинантных белков. Крупномасштабные ферментации имеют емкость 1000 литров и, в некоторых вариантах осуществления, приблизительно 1000-100000 литров. Эти ферментеры используют перемешивающие лопасти для распределения кислорода и нутриентов, в частности, глюкозы (предпочтительного источника углерода/энергии). Ферментациями малого масштаба называют обычно ферментацию в ферментере, который имеет объемную вместимость приблизительно 100 литров и может иметь вместимость в диапазоне от приблизительно 1 литра до приблизительно 100 литров.
В ферментационном процессе индукцию экспрессии белка обычно инициируют, после того как клетки были выращены при подходящих условиях до желаемой плотности, например, OD550 приблизительно 180-220, и в этой стадии эти клетки находятся в ранней стационарной фазе. Могут быть использованы различные индукторы, в соответствии с используемой конструкцией вектора, как известно в данной области и описано выше. Клетки могут выращиваться в течение коротких периодов перед индукцией. Клетки обычно индуцируют в течение приблизительно 12-50 часов, хотя может быть использовано более продолжительное или более короткое время индукции.
Для улучшения продукционного выхода и качества полипептидов согласно изобретению, различные условия ферментации могут быть модифицированы. Например, для улучшения правильной сборки и укладки (фолдинга) секретируемых полипептидов антител, могут быть использованы дополнительные векторы, сверхэкспрессирующие белки-шапероны, такие как белки Dsb (DsbA, DsbB, DsbC, DsbD и/или DsbG) или FkpA (пептидилпролил-цис,транс-изомераза с активностью шаперона) для котрансформации прокариотических клеток-хозяев. Было продемонстрировано, что белки-шапероны облегчают правильную укладку (фолдинг) и растворимость гетерологичных белков, продуцируемых в бактериальных клетках-хозяевах. Chen et al. (1999) J. Biol. Chem. 274: 19601-19605; Georgiou et al, U.S. Patent No. 6,083,715; Georgiou et al., U.S. Patent No. 6,027,888; Bothmann and Pluckthun (2000) J. Biol. Chem. 275: 17100-17105; Ramm and Pluckthun (2000) J. Biol. Chem. 275: 17106-17113; Arie et al. (2001) Mol. Microbiol. 39: 199-210.
Для минимизации протеолиза экспрессируемых гетерологичных белков (особенно белков, которые являются протеолитически чувствительными) для данного изобретения могут быть использованы некоторые штаммы-хозяева, недостаточные в отношении протеолитических ферментов. Например, штаммы-хозяева могут быть использованы для выполнения генетической мутации (генетических мутаций) в генах, кодирующих известные бактериальные протеазы, такие как Протеаза III, OmpT, DegP, Tsp, Протеаза I, Протеаза Mi, Протеаза V, Протеаза VI и их комбинации. Некоторые протеаза-недостаточные штаммы E. coli являются доступными и описаны, например, в Joly et al. (1998), supra; Georgiou et al., Патент США № 5,264,365; Georgiou et al., Патент США № 5,508,192; Hara et al., Microbial Drug Resistance, 2:63-72 (1996).
В одном варианте осуществления, в качестве клеток-хозяев в экспрессионной системе согласно изобретению используют штаммы E. coli, недостаточные в отношении протеолитических ферментов и трансформированные плазмидами, экспрессирующими один или несколько белков-шаперонов.
Очистка антител
В одном варианте осуществления, белок антитела, полученный, как описано здесь, очищают для получения препаратов, которые являются по существу гомогенными, для дополнительных анализов и применений. Могут быть использованы стандартные способы очистки белков, известные в данной области. Примерными подходящими процедурами очистки являются следующие процедуры: фракционирование на иммуноаффинных или ионообменных колонках, осаждение этанолом, обращенно-фазовая ВЖХ, хроматография на диоксиде кремния или на катионообменной смоле, такой как ДЭАЭ, хроматофокусирование, электрофорез в ДСН-ПААГ, осаждение сульфатом аммония и гель-фильтрация с использованием, например, Сефадекса G-75.
В одном аспекте, Белок А, иммобилизованный на твердой фазе, используют для иммуноаффинной очистки продуктов антител согласно изобретению. Белок А является белком клеточной стенки 41 кД из Staphylococcus aureas, который связывается с высокой аффинностью с Fc-районом антител. Lindmark et al (1983) J. Immunol. Meth. 62: 1-13. Твердой фазой, с которой может быть иммобилизован Белок А, может быть колонка, имеющая стеклянную или изготовленную из диоксида кремния поверхность, или стеклянная колонка с контролируемыми порами или колонка из кремниевой кислоты. В некоторых применениях, эта колонка покрыта реагентом, таким как глицерин, для возможного предотвращения неспецифического прикрепления загрязнителей.
В качестве первой стадии очистки, препарат, полученный из культуры клеток, как описано выше, может быть нанесен на твердую фазу с иммобилизованным Белком А для возможности специфического связывания представляющего интерес антитела с Белком А. Затем эту твердую фазу промывают для удаления загрязнителей, неспецифически связанных с этой твердой фазой. Наконец, представляющее интерес антитело извлекают из твердой фазы элюцией.
Генерирование антител с использованием эукариотических клеток-хозяев:
Вектор для применения в эукариотической клетке-хозяине обычно включает в себя один или несколько из следующих не ограничивающих компонентов: сигнальную последовательность, сайт инициации репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
Компонент сигнальной последовательности
Вектор для применения в эукариотической клетке-хозяине может также содержать сигнальную последовательность или другой полипептид, имеющий сайт специфического расщепления на N-конце зрелого представляющего интерес белка или полипептида. Выбранной гетерологичной сигнальной последовательностью может быть последовательность, которая узнается и процессируется (то есть расщепляется сигнальной пептидазой) этой клеткой-хозяином. В экспрессии клеток млекопитающих, доступны сигнальные последовательности млекопитающих, а также вирусные секреторные лидеры, например, сигнал gD вируса простого герпеса. ДНК такого района-предшественника лигируют в рамке считывания с ДНК, кодирующей это антитело.
Сайт инициации репликации
Обычно, компонент, называемый сайтом инициации репликации, не является необходимым для экспрессирующих векторов млекопитающих. Например, сайт инициации репликации SV40 может обычно использоваться только потому, что он содержит ранний промотор.
Компонент отбора генов
Экспрессирующие и клонирующие векторы могут содержать ген отбора, называемый также селектируемым маркером. Типичные гены отбора кодируют белки, которые (а) придают устойчивость к антибиотикам или другим токсинам, например, ампициллину, неомицину, метотрексату или тетрациклину, (b) восполняют ауксотрофные недостаточности, где необходимо, или (c) снабжают критическими нутриентами, не доступными из комплексных сред.
Один пример схемы селекции (отбора) использует лекарственное средство для остановки роста клетки-хозяина. Клетки, которые успешно трансформированы гетерологичным геном, продуцируют белок, придающий устойчивость к лекарственным средствам, и, следовательно, выживают при этой схеме отбора. Примеры такого доминантного отбора используют лекарственные средства неомицин, микофеноловую кислоту и гигромицин.
Другим примером подходящих селектируемых маркеров для клеток млекопитающих являются маркеры, которые способны идентифицировать клетки, компетентные в отношении прерывания синтеза нуклеиновой кислоты антитела, такие как гены DHFR, тимидинкиназы, металлотионеина-I и -II, предпочтительно гены металлотионеина приматов, аденозиндеаминазы, орнитиндекарбоксилазы и т.д.
Например, в некоторых вариантах осуществления, клетки, трансформированные геном отбора DHFR, идентифицируют сначала культивированием этих трансформантов в культуральной среде, которая содержит метотрексат (Mtx), конкурентный антагонист DHFR. В некоторых вариантах осуществления, подходящей клеткой-хозяином, при использовании DHFR дикого типа, является линия клеток яичника китайского хомячка (СНО), недостаточная в отношении активности DHFR (например, ATCC CRL-9096).
Альтернативно, клетки-хозяева (в частности, хозяева дикого типа, которые содержат эндогенный DHFR), трансформированные или котрансформированные ДНК-последовательностями, кодирующими антитело, белок DHFR дикого типа и другой селектируемый маркер, такой как аминогликозид-3’-фосфотрансфераза (APH), могут быть отобраны по росту клеток в среде, содержащей агент отбора на этот селектируемый маркер, такой как аминогликозидный антибиотик, например, канамицин, неомицин или G418. См. патент США № 4965199.
Промоторный компонент
Экспрессирующие и клонирующие векторы обычно содержат промотор, который узнается организмом-хозяином и функционально связан с нуклеиновой кислотой, кодирующей представляющий интерес полипептид (например, антитело). Промоторные последовательности для эукариот известны. Например, практически все эукариотические гены имеют АТ-богатый район, расположенный приблизительно на 25-30 оснований слева от сайта, в котором инициируется транскрипция. Другой последовательностью, обнаруженной на 70-80 оснований слева от старта транскрипции многих генов, является район CNCAAT, где N может быть любым нуклеотидом. На 3’-конце большинства эукариотических генов находится последовательность AATAAA, которая может быть сигналом для добавления поли А-хвоста к 3’-концу этой кодирующей последовательности. В некоторых вариантах осуществления, любая или все из этих последовательностей, могут быть подходящим образом инсертированы в эукариотические экспрессирующие векторы.
Транскрипция из векторов в клетках-хозяевах млекопитающих регулируется, например, промоторами, полученными из геномов вирусов, таких как полиомавирусы, вирус оспы птиц, аденовирус (такой как Аденовирус 2), бычий папилломавирус, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита-В и вирус обезьян 40 (SV40), из гетерологичных промоторов млекопитающих, например, промотора актина или промотора иммуноглобулина, из промоторов белков теплового шока, при условии, что такие промоторы совместимы с системами клетки-хозяина.
Ранние и поздние промоторы вируса SV40 удобным образом получают в виде фрагмента рестрикции SV40, который содержит сайт инициации репликации вируса SV40. Немедленно ранний промотор цитомегаловируса человека удобным образом получают в виде фрагмента рестрикции HindIII Е. Система для экспрессии ДНК в хозяевах-млекопитающих с использованием бычьего папилломовируса в качестве вектора описана в патенте США № 4419446. Модификация этой системы описана в патенте США № 4601978. См. также Reyes et al., Nature 297:598-601 (1982), где описана экспрессия кДНК β-интерферона человека в клетках мыши под контролем промотора тимидинкиназы из вируса простого герпеса. Альтернативно, в качестве промотора может быть использован длинный концевой повтор вируса саркома Рауса.
Компонент, являющийся энхансерным элементом
Транскрипция ДНК, кодирующей антитело согласно изобретению, высшими эукариотами часто увеличивается инсертированием энхансерной последовательности в вектор. Теперь известны многие энхансерные последовательности из генов млекопитающих (глобина, эластазы, альбумина, α-фетопротеина и инсулина). Однако, обычно используют энхансер из вируса эукариотической клетки. Примеры включают в себя энхансер SV40 на поздней стороне сайта инициации репликации (пары оснований 100-270), энхансер раннего промотора SV40, энхансер полиомавируса на поздней стороне сайта инициации репликации и энхансеры аденовируса. См., также Yaniv, Nature 297: 17-18 (1982), где описаны энхансерные элементы для активации эукариотических промоторов. Энхансер может быть сплайсирован в вектор в положении 5’ (слева) или 3’ (справа) относительно кодирующей полипептид антитела последовательности, но обычно расположен в сайте 5’ (слева) от промотора.
Компонент терминации транскрипции
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах, могут также содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны из 5’- и, изредка, 3’- нетранслируемых районов эукариотических или вирусных ДНК или кДНК. Эти районы содержат нуклеотидные сегменты, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемой части мРНК, кодирующей антитело. Одним применимым компонентом терминации транскрипции является район полиаденилирования бычьего гормона роста. См. WO94/11026 и описанный в нем экспрессирующий вектор.
Отбор и трансформация клеток-хозяев
Подходящие клетки-хозяева для клонирования или экспрессии ДНК в описанных здесь векторах включают в себя высшие эукариотические клетки, описанные здесь, в том числе клетки-хозяева позвоночных. Размножение клеток позвоночных в культуре (культуре ткани) стало рутинной процедурой. Примерами применимых линий клеток-хозяев млекопитающих являются клетки линии CV1 почки обезьяны, трансформированные SV40 (COS-7, ATCC CRL 1651); клетки линии эмбриональной почки человека (клетки 293 или клетки 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки детенышей хомячка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки Сертоли мыши (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки Африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки рака шейки матки (HELA, ATCC CCL 2); клетки почки собачьих (MDCK, ATCC CCL 34); клетки печени buffalo-крысы (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N. Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4 и клетки линии гепатомы человека (Hep G2).
Клетки-хозяева трансформируют вышеописанными экспрессирующими или клонирующими векторами для продуцирования антител, и культивируют в общепринятых питательных средах, модифицированных подходящим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желаемые последовательности.
Культивирование клеток-хозяев
Клетки-хозяева, используемые для получения антитела согласно изобретению, могут культивироваться в различных средах. Коммерчески доступные среды, такие как среда Ham F10 (Sigma), минимальная эссенциальная среда (MEM), (Sigma), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла ((DMEM), Sigma), пригодны для культивирования клеток-хозяев. Кроме того, любая из сред, описанных в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патентах США с номерами 4767704; 4657866; 4927762; 4560655 или 5122469; WO 90/03430; WO 87/00195 или U.S. Patent Re. 30,985, могут быть использованы в качестве культуральных сред для этих клеток-хозяев. Любая из этих сред может быть дополнена при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, соли кальция, магния и фосфат), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство GENTAMYCIN™), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне), и глюкозой или эквивалентным источником энергии. Любые другие добавки могут быть также включены в подходящих концентрациях, которые будут известны квалифицированным в данной области специалистам. Условия культивирования, такие как температура, рН и т.п., являются такими условиями, которые ранее использовали с клеткой-хозяином, выбранным для экспрессии, и будет очевидными для специалиста с обычной квалификацией в данной области.
Очистка антител
При использовании рекомбинантных способов, это антитело может быть продуцировано внутриклеточно или секретировано непосредственно в среду. При продуцировании антитела внутриклеточно, в качестве первой стадии, состоящий из частиц остаток клеток, клетки-хозяева или лизированные фрагменты, могут быть удалены, например, центрифугированием или ультрафильтрацией. При секреции антитела в среду, супернатанты из таких экспрессионных систем могут быть сначала сконцентрированы с использованием коммерчески доступного фильтра для концентрирования белков, например, ультрафильтрующего блока Amicon или Millipore Pellicon A. Ингибитор протеаз, такой как PMSF, может быть включен в любой из предыдущих стадий для ингибирования протеолиза и могут быть включены антибиотики для предотвращения роста случайных загрязнителей.
Композиция антитела, полученная из этих клеток, может быть очищена с использованием, например, гидроксиапатитной хроматографии, гель-электрофореза, диализа и аффинной хроматографии, причем аффинная хроматография является предпочтительным способом. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа Fc-домена любого иммуноглобулина, который присутствует в этом антителе. Белок А может быть использован для очистки антител, которые основаны на тяжелых цепях γ1, γ2 или γ4 человека (Lindmark et al., J. Immunol. Methods 62:1-13 (1983)). Белок G рекомендован для всех изотипов мыши и для γ3 человека. (Guss et al., EMBO J. 5:15671575 (1986)). Матриксом, к которому может быть присоединен аффинный лиганд, может быть агароза, но доступны и другие матриксы. Механически стабильные матриксы, такие как стекло или поли(стиролдивинил)бензол с контролируемыми порами делают возможными более быстрые скорости потока и более короткие периоды процессинга, чем матриксы, достигаемые с агарозой. Когда это антитело содержит СН3-домен, для очистки применима смола Bakerbond ABX™ (J. T. Baker, Phillipsburg, NJ). Другие способы очистки белков, такие как фракционирование на ионообменной колонке, осаждение этанолом, обращенно-фазовая ВЖХ, хроматография на диоксиде кремния, хроматография на гепарин-SEPHAROSE™, хроматография на анионо- или катионообменной смоле (такой как колонка с полиаспарагиновой кислотой), хроматофокусирование, электрофорез в ДСН-ПААГ и осаждение сульфатом аммония, также являются доступными в зависимости от извлекаемого антитела.
После любой предварительной стадии очистки (стадий очистки) смесь, содержащая представляющее интерес антитело и загрязнители, может быть подвергнута дополнительной очистке, например, гидрофобной хроматографией с низким рН с использованием буфера для элюции при рН приблизительно 2,5-4,5, предпочтительно выполняемой при низких концентрациях соли (например, приблизительно 0-0,25 М).
В целом, разные методы получения антител для исследований и клинического применения хорошо известны в данной области, и специалист может выбрать, в соответствии с описанными выше методиками, подходящую для получения конкретного представляющего интерес антитела.
Иммуноконъюгаты
Это изобретение обеспечивает также иммуноконъюгаты (взаимозаменяемо называемые «конъюгатами антитело-лекарственное средство» или «ADC»), содержащие любое из анти-STEAP-1-антител согласно изобретению, конъюгированное с одним или несколькими цитотоксическими агентами, такими как химиотерапевтический агент, лекарственное средство, ингибирующий рост агент, токсин (например, ферментативно активный токсин бактериального, грибного, растительного или животного происхождения, или их фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат).
В некоторых вариантах осуществления, иммуноконъюгат содержит анти-STEAP-1-антитело и химиотерапевтический агент или другой токсин. Химиотерапевтические агенты, применимые в генерировании иммуноконъюгатов, описаны здесь (например, выше). Ферментативно активные токсины и их фрагменты могут быть также использованы, и они описаны здесь.
В некоторых вариантах осуществления, иммуноконъюгат содержит анти-STEAP-1-антитело и один или несколько токсинов с малой молекулой, в том числе, но не только, лекарственные средства с малой молекулой, такие как калихеамицин, майтансиноид, доластатин, ауристатин, трихотецен и СС1065 и производные этих лекарственных средств, которые имеют цитотоксическую активность. Примеры таких иммуноконъюгатов обсуждаются более подробно ниже.
1. Примерные иммуноконъюгаты
Иммуноконъюгат (или «конъюгат «антитело-лекарственное средство» (“ADC”)) согласно изобретению может иметь формулу I, показанную ниже, где анти-STEAP-1-антитело конъюгировано (т.е. ковалентно связано с одним или несколькими лекарственными средствами (D) через необязательный линкер (L).
Таким образом, анти-STEAP-1-антитело может быть конъюгировано с лекарственным средством непосредственно или через линкер. В формуле I, р означает среднее количество частей лекарственного средства на антитело, которое может находиться в интервале, например, от приблизительно 1 до приблизительно 20 частей лекарственного средства на антитело, и, в некоторых вариантах осуществления, от приблизительно 1 до приблизительно 8 частей лекарственного средства на антитело.
Примерные линкеры
Примерные линкеры и части лекарственного средства описаны здесь. Линкер может содержать один или несколько линкерных компонентов. Примерные линкерные компоненты включают в себя 6-малеимидокапроил ("MC"), малеимидопропаноил ("MP"), валин-цитруллин ("val-cit" или “vc”), аланин-фенилаланин ("ala-phe"), п-аминобензилоксикарбонил ("PAB"), N-сукцинимидил-4-(2-пиридилтио)пентаноат ("SPP"), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат ("SMCC) и N-сукцинимидил-(4-иодацетил)аминобензоат ("SIAB") и этиленокси –СН2СН2О- в виде одной или нескольких повторяющихся единиц (“EO” или “PEO”). В данной области известны различные линкерные компоненты, некоторые из которых описаны ниже.
Линкер может быть «расщепляемым линкером», облегчающим высвобождение лекарственного средства в клетке. Например, могут быть использованы кислотолабильный линкер (например, гидразон), протеаза-чувствительный (например, пептидаза-чувствительный) линкер, фотолабильный линкер, диметильный линкер или дисульфидсодержащий линкер (Chari et al., Cancer Research 52: 127-131 (1992); патент США № 5208020).
В одном варианте осуществления, линкер L ADC имеет формулу:
-Aa-Ww-Yy-
в которой:
-A- означает удлиняющее звено, ковалентно связанное с тиолом цистеина этого антитела (Ab);
a равно 0 или 1;
каждый -W- означает независимо аминокислотное звено;
w означает независимо целое число в диапазоне 0-12;
-Y- означает спейсерное звено, ковалентно присоединенное к лекарственной части; и
y равно 0, 1 или 2.
Удлиняющее звено
Удлиняющее звено (-A-), когда оно присутствует, способно связывать звено антитела со звеном аминокислоты (-W-). В этой связи, антитело (Ab) имеет свободную тиоловую группу цистеина, которая может образовывать связь с электрофильной функциональной группой удлиняющего звена. Примерные удлиняющие звенья в формуле I изображены формулами II и III, в которых Ab-, -W-, -Y-, -D, w и y имеют определенные выше значения, и R17 означает двухвалентный радикал, выбранный из (CH2)r, С3-С8 карбоциклила, О-(СН2)r, арилена, (CH2)r-арилена, -арилен-(CH2)r-, (СН2)r-(C3-C8 карбоциклила), (C3-C8 карбоциклила)-(CH2)r, C3-C8 гетероциклила, (CH2)r-(C3-C8 гетероциклила), -(C3-C8 гетероциклил)-(CH2)r-, -(CH2)rC(O)NRb(CH2)r-, -(CH2CH2O)r-, -(CH2CH2O)r-CH2-, -(CH2)rC(O)NRb(CH2CH2O)r-, -(CH2)rC(O)NRb(CH2CH2O)r-CH2-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-CH2- и -(CH2CH2O)rC(O)NRb(CH2)r-, где Rb означает H, C1-C6 алкил, фенил или бензил и r означает независимо целое число в диапазоне 1-10.
Арилен включает в себя двухвалентные ароматические углеводородные радикалы из 6-20 атомов углерода, полученные удалением двух атомов водорода из ароматической циклической системы. Типичные ариленовые группы включают в себя, но не ограничиваются ими, радикалы, произведенные из бензола, замещенного бензола, нафталина, антрацена, бифенила и т.п.
Гетероциклильные группы включают в себя циклическую систему, в которой один или несколько кольцевых атомов означают гетероатом, например, азот, кислород и серу. Этот радикал гетероцикл содержит 1-20 атомов углерода и 1-3 гетероатома, выбранных из N, O, P и S. Гетероцикл может быть моноциклом, имеющим 3-7 членов кольца (2-6 атомов углерода и 1-3 гетероатома, выбранных из N, O, P и S), или бициклом, имеющим 7-10 членов кольца (4-9 атомов углерода и 1-3 гетероатома, выбранных из N, O, P и S), например: системой бицикло [4,5], [5,5], [5,6] или [6,6]. Гетероциклы описаны в Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968), особенно в Частях 1, 3, 4, 6, 7 и 9; "The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, 1950 и последующие переиздания до настоящего времени), в частности, в томах 13, 14, 16, 19 и 28; и J. Am. Chem. Soc. (1960) 82:5566.
Примеры гетероциклов включают в себя, в качестве примера, но не ограничения, пиридил, дигидропиридил, тетрагидропиридил (пиперидил), тиазолил, тетрагидротиофенил, тетрагидротиофенил с окисленной серой, пиримидинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, бензофуранил, тианафталенил, индолил, индоленил, хинолинил, изохинолинил, бензимидазолил, пиперидинил, 4-пиперидонил, пирролидинил, 2-пирролидонил, пирролинил, тетрагидрофуранил, бис-тетрагидрофуранил, тетрагидропиранил, бис-тетрагидропиранил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, октагидроизохинолинил, азоцинил, триазинил, 6H-1,2,5-тиадиазинил, 2H,6H-1,5,2-дитиазинил, тиенил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил, феноксатинил, 2H-пирролил, изотиазолил, изоксазолил, пиразинил, пиридазинил, индолизинил, изоиндолил, 3H-индолил, 1H-индазолил, пуринил, 4H-хинолизинил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, 4Ah-карбазолил, карбазолил, β-карболинил, фенантридинил, акридинил, пиримидинил, фенантролинил, феназинил, фенотиазинил, фуразинил, феноксазинил, изохроманил, хроманил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил, индолинил, изоиндолинил, хинуклидинил, морфолинил, оксазолидинил, бензотриазолил, бензизоксазолил, оксиндолил, бензоксазолинил и изатиноил.
Карбоциклильные группы включают в себя насыщенное или ненасыщенное кольцо, имеющее 3-7 атомов углерода в виде моноцикла, или 7-12 атомов углерода в виде бицикла. Моноциклические карбоциклы имеют 3-6 атомов кольца, более типично, 5-6 атомов кольца. Бициклические карбоциклы имеют 7-12 атомов кольца, например, размещенных в виде системы бицикло [4,5], [5,5], [5,6] или [6,6], или 9-10 атомов кольца, размещенных в виде системы бицикло [5,6] или [6,6]. Примеры моноциклических карбоциклов включают в себя циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогептил и циклооктил.
Должно быть понятно из всех примерных вариантов формулы I ADC, таких как II-VI, что даже когда нет особого указания, 1-4 части лекарственного средства связаны с антителом (p=1-4), в зависимости от количества встроенных остатков цистеина.

Одно иллюстративное удлиняющее звено формулы II произведено из малеимидокапроила (MC), где R17 означает -(CH2)5-:

Одно иллюстративное удлиняющее звено формулы II произведено из малеимидопропаноила (MP), где R17 означает -(CH2)2-:

Другое иллюстративное удлиняющее звено формулы II, где R17 означает -(CH2CH2CO)r-CH2- и r равно 2:
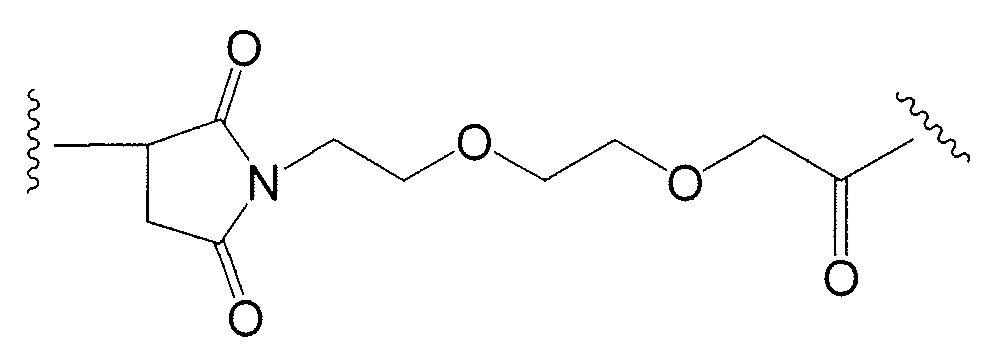
Другое иллюстративное удлиняющее звено формулы II, где R17 означает -(CH2)rC(O)NRb(CH2CH2O)r-CH2- где Rb означает H и каждое r равно 2:
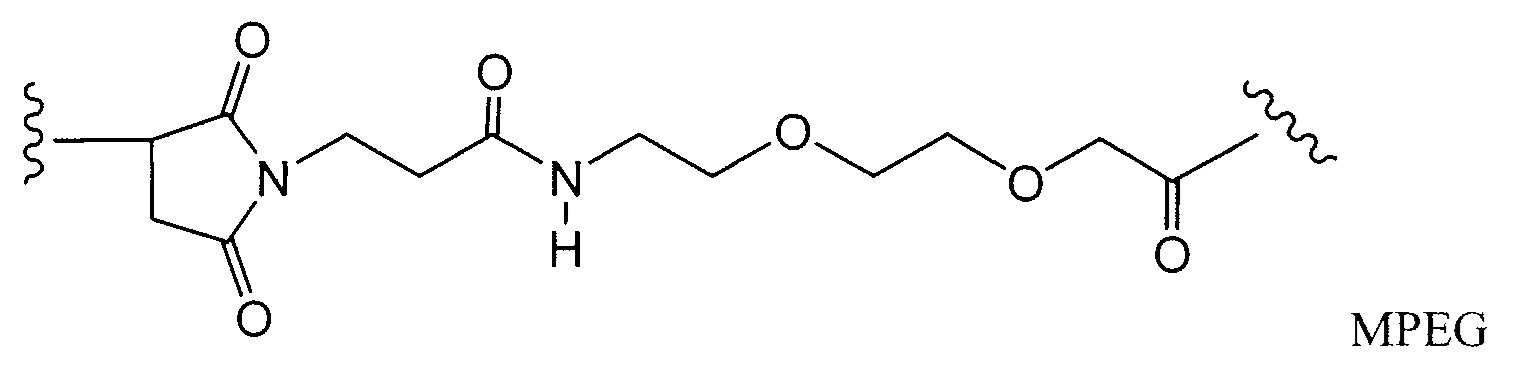
Иллюстративное удлиняющее звено формулы III, где R17 означает -(CH2)5-:

В другом варианте осуществления, удлиняющее звено связано с цистеин-встроенным антителом через дисульфидную связь между атомом серы встроенного цистеина и атомом серы удлиняющего звена. Репрезентативное удлиняющее звено этого варианта изображено формулой IV, где R17, Ab-, -W-, -Y-, -D, w и y имеют определенные выше значения.

Еще в одном варианте осуществления, реакционноспособная группа удлиняющего звена содержит тиол-реактивную функциональную группу, которая может образовывать связь со свободным тиолом цистеина антитела. Примеры тиол-реактивных функциональных групп включают в себя, но не ограничиваются ими, малеимид, α-галогенацетил, активированные сложные эфиры, такие как сукцинимидные эфиры, 4-нитрофениловые эфиры, пентафторфениловые эфиры, тетрафторфениловые эфиры, ангидриды, хлорангидриды кислот, сульфонилхлориды, изоцианаты и изотиоцианаты. Репрезентативные удлиняющие звенья этого варианта осуществления изображены формулами Va и Vb, в которых -R17-, Ab-, -W-, -Y-, -D, w и y имеют определенные выше значения;

В другом варианте осуществления, этот линкер может быть линкером дендритного типа для ковалентного присоединения более чем одной части лекарственного средства через ветвящуюся мультифункциональную линкерную часть к антителу (Sun et al (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215; Sun et al (2003) Bioorganic & Medicinal Chemistry 11:1761-1768; King (2002) Tetrahedron Letters 43: 1987-1990). Дендритные линкеры могут увеличивать молярное отношение лекарственного средства к антителу, т.е. нагрузку, которая связана с активностью этого ADC. Таким образом, когда цистеин-встроенное антитело несет только одну реакционноспособную тиоловую группу цистеина, множество лекарственных частей могут быть присоединены через дендритный линкер.
Аминокислотное звено
Линкер может содержать аминокислотные остатки. Аминокислотное звено (-Ww-), когда присутствует, связывает антитело (Ab) с частью лекарственного средства (D) цистеин-встроенного конъюгата антитело-лекарственное средство (ADC) согласно изобретению.
-Ww- означает дипептидное, трипептидное, тетрапептидное, пентапептидное, гексапептидное, гептапептидное, октапептидное, нонапептидное, декапептидное, ундекапептидное или додекапептидное звено. Аминокислотные остатки, которые составляют это аминокислотное звено, включают в себя аминокислотные остатки, природно-встречающиеся, а также минорные аминокислоты и не встречающиеся в природе аминокислотные аналоги, такие как цитруллин. Каждое звено -W- независимо имеет формулу, показанную ниже в квадратных скобках, а w означает целое число в интервале 0-12:

где R19 означает водород, метил, изопропил, изобутил, втор-бутил, бензил, п-гидроксибензил, -CH2OH, -CH(OH)CH3, -CH2CH2SCH3, -CH2CONH2, -CH2COOH, -CH2CH2CONH2, -CH2CH2COOH, -(CH2)3NHC(=NH)NH2, -(CH2)3NH2, -(CH2)3NHCOCH3, -(CH2)3NHCHO, -(CH2)4NHC(-NH)NH2, -(CH2)4NH2, -(CH2)4NHCOCH3, -(CH2)4NHCHO, -(CH2)3NHCONH2, -(CH2)4NHCONH2, -CH2CH2CH(OH)CH2NH2, 2-пиримидилметил-, 3-пиримидилметил-, 4-пиримидилметил-, фенил, циклогексил,

Когда R19 является другим, чем водород, атом углерода, к которому присоединен R19, является хиральным. Каждый атом углерода, к которому присоединен R19, находится независимо в (S) или (R) конфигурации или в виде рацемической смеси. Таким образом, аминокислотные звенья могут быть энантиомерно чистыми, рацемическими или диастереомерными.
Примерные аминокислотные звенья -Ww- включают в себя дипептид, трипептид, тетрапептид или пентапептид. Примерные дипептиды включают в себя: валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe). Примерные трипептиды включают в себя: глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотные остатки, которые составляют аминокислотный линкерный компонент, включают в себя аминокислотные остатки, природно-встречающиеся, а также минорные аминокислоты и не встречающиеся в природе аминокислотные аналоги, такие как цитруллин.
Аминокислотное звено может быть ферментативно расщеплено одним или несколькими ферментами, включающими в себя опухолеассоциированную протеазу, для высвобождения части лекарственного средства (-D), которая в одном варианте осуществления протонируется in vivo после высвобождения с обеспечением лекарственного средства (D). Аминокислотные линкерные компоненты могут быть сконструированы и оптимизированы в их селективности для ферментативного расщепления конкретными ферментами, например, опухолеассоциированной протеазой, катепсином B, C и D или протеазой плазмином.
Спейсерное звено
Спейсерное звено (-Yy), когда присутствует (y=1 или 2), связывает аминокислотное звено (-Ww-)с частью лекарственного средства (D), когда аминокислотное звено присутствует (w=1-12).
Альтернативно, спейсерное звено связывает удлиняющее звено с частью лекарственного средства, когда аминокислотное звено отсутствует. Спейсерное звено связывает также часть лекарственного средства со звеном антитела, когда отсутствуют как аминокислотное звено, так и удлиняющее звено (w, y=0). Спейсерные звенья являются звеньями двух основных типов: жертвующими собой и не жертвующими собой. Не жертвующее собой спейсерное звено является звеном, в котором часть спейсерного звена или все спейсерное звено остается связанным с частью лекарственного средства после отщепления, в частности, ферментативного, аминокислотного звена от конъюгата антитело-лекарственное средство или лекарственного средства-линкера. Когда конъюгат ADC, содержащий спейсерное звено глицин-глицин или спейсерное звено глицин, подвергается ферментативному расщеплению опухолеассоциированной протеазой или лимфоцит-ассоциированной протеазой, глицин-глицин-лекарственное средство или глицин-лекарственное средство отщепляется от Ab-A3-Ww-. В одном варианте осуществления, имеет место независимая реакция гидролиза в клетке-мишени, расщепляющая связь глицин-лекарственное средство и высвобождающая это лекарственное средство.
В другом варианте осуществления, -Yy- является п-аминобензилкарбамоиловым (PAB) звеном, фениленовая часть которого замещена Qm, где Q означает -С1-С8 алкил, -О-(С1-С8 алкил), -галоген, -нитро или -циано; и m означает целое число в интервале 0-4.
Примерные варианты не жертвующего собой спейсерного звена (-Y-) являются: -Gly-Gly-; -Gly-; -Ala-Phe-; -Val-Cit-.
В одном варианте осуществления, обеспечены лекарственное средство-линкер или ADC, в котором спейсерное звено отсутствует (y=0),или его фармацевтически приемлемая соль или сольват.
Альтернативно, ADC, содержащий жертвующее собой спейсерное звено, может высвобождать -D. В одном варианте осуществления, -Y- является группой PAB, которая связана с -Ww- через атом азота аминогруппы группы PAB и соединена непосредственно с –D через карбонатную, карбаматную или простую эфирную группу, где этот ADC имеет примерную структуру:

в которой Q означает С1-С8 алкил, -О-(С1-С8 алкил), -галоген, -нитро или -циано; m означает целое число в интервале 0-4 и р находится в интервале 1-4.
Другие примеры жертвующих собой спейсеров включают в себя, но не ограничиваются ими, ароматические соединения, которые являются электронно сходными с группой PAB, такими как производные 2-аминоимидазол-5-метанола (Hay et al. (1999) Bioorg. Med. Chem. Lett. 9:2237), гетерологичные аналоги PAB (US 2005/0256030), бета-глюкуронид (WO 2007/01 1968) и орто- или пара-аминобензилацетали. Могут быть использованы спейсеры, которые подвергаются циклизации после гидролиза амидной связи, такие как замещенные и незамещенные амиды 4-аминомасляной кислоты (Rodrigues et al (1995) Chemistry Biology 2:223), подходящим образом замещенные циклические системы бицикло[2.2.1] и бицикло[2.2.2] (Storm et al. (1972) J. Amer. Chem. Soc. 94:5815) и амиды 2-аминофенилпропионовой кислоты (Amsberry, et al (1990) J. Org. Chem. 55:5867). Элиминация аминосодержащих лекарственных средств, которые замещены при глицине (Kingsbury et al (1984) J. Med. Chem. 27: 1447), также является примером жертвующего собой спейсера, применимого в ADC.
Примерные спейсерные звенья (-Yy-) представлены формулами X-XII:

Дендритные линкеры
В другом варианте осуществления, линкер L может быть линкером дендритного типа для ковалентного присоединения более чем одной лекарственной части через ветвящуюся, мультифункциональную связь к антителу (Sun et al (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215; Sun et al (2003) Bioorganic & Medicinal Chemistry 11:1761-1768). Дендритные линкеры могут увеличивать молярное отношение лекарственного средства к антителу, т.е. нагрузку, которая связана с активностью этого ADC. Таким образом, когда цистеин-встроенное антитело несет только одну реакционноспособную тиоловую группу цистеина, множество лекарственных частей могут быть присоединены через дендритный линкер. Примерные варианты разветвленных, дендритных линкеров включают в себя дендримерные звенья 2,6-бис(гидроксиметил)-п-крезол и 2,4,6-трис(гидроксиметил)фенол (WO 2004/01993; Szalai et al (2003) J. Amer. Chem. Soc. 125: 15688-15689; Shamis et al (2004) J. Amer. Chem. Soc. 126: 1726-1731; Amir et al (2003) Angew. Chem. Int. Ed. 42:4494-4499).
В одном варианте осуществления, спейсерным звеном является бис(гидроксиметил)стирол (BHMS), который может быть использован для включения и высвобождения множественных лекарственных средств, имеющий структуру:
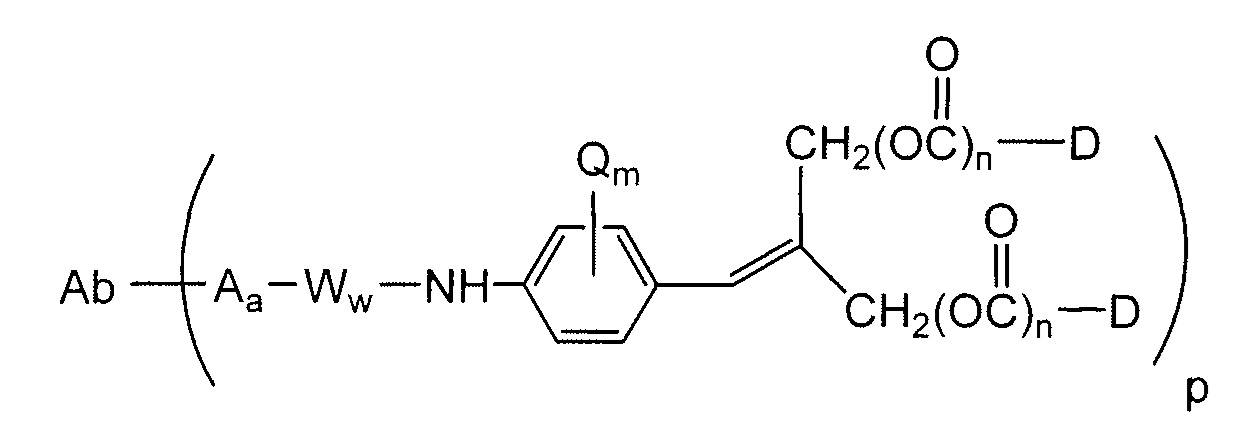
содержащую дендримерное звено 2-(4-аминобензилиден)пропан-1,3-диол (WO 2004/043493; de Groot et al (2003) Angew. Chem. Int. Ed. 42:4490-4494), в которой Q означает С1-С8 алкил, -О-(С1-С8 алкил), -галоген, -нитро или -циано; m означает целое число в интервале 0-4; n равно 0 или 1; и р находится в интервале 1-4.
Примерные варианты соединений конъюгатов антитело-лекарственное средство формулы I включают в себя XIIIa (MC), XIIIb (val-cit), XIIIc (MC-val-cit) и XIIId (MC-val-cit-PAB):


Другие примерные варианты соединений конъюгатов антитело-лекарственное средство формулы Ia включают в себя XIVa-e:

где X означает:

Y означает:

и R означает независимо H или С1-С6 алкил и n равно 1-12.
В другом варианте осуществления, линкер имеет реакционноспособную функциональную группу, которая имеет нуклеофильную группу, которая является реакционноспособной в отношении электрофильной группы, присутствующей на антителе. Применимые электрофильные группы на антителе включают в себя, но не ограничиваются ими, альдегидные и кетоновые карбонильные группы. Гетероатом нуклеофильной группы линкера может взаимодействовать с электрофильной группой на антителе и образовывать ковалентную связь со звеном антитела. Применимые нуклеофильные группы на линкере включают в себя, но не ограничиваются ими, гидразид, оксим, амино, гидразин, тиосемикарбазон, карбоксилат гидразина и арилгидразид. Электрофильная группа на антителе обеспечивает подходящий сайт для присоединения к линкеру.
Обычно, линкеры пептидного типа могут быть приготовлены образованием пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть получены, например, в соответствии со способом жидкофазного синтеза (E. Schroder and K. Lϋbke (1965) "The Peptides", volume 1, pp 76-136, Academic Press), который хорошо известен в области химии пептидов. Линкерные промежуточные продукты могут быть собраны с любой комбинацией или последовательностью реакций, включающих в себя спейсерное, удлиняющее и аминокислотное звенья. Эти спейсерное, удлиняющее и аминокислотное звенья могут использовать реакционноспособные функциональные группы, которые являются по природе электрофильными, нуклеофильными группами или группами свободных радикалов. Реакционноспособные функциональные группы включают в себя, но не ограничиваются ими, карбоксилы, гидроксилы, пара-нитрофенилкарбонатные, изотиоцианатные и уходящие (отщепляемые) группы, такие как О-мезил, О-тозил, -Cl, -Br, -I, или малеимидные группы.
В другом варианте осуществления, линкер может быть замещен группами, которые модулируют растворимость или реакционноспособнную способность. Например, заряженный заместитель, такой как сульфонат (-SO3-) или аммоний, может увеличивать водорастворимость этого реагента и облегчать реакцию связывания линкерного реагента с антителом или частью лекарственного средства или облегчать реакцию связывания Ab-L (промежуточного продукта антитело-линкер) с D или D-L (промежуточного продукта лекарственное средство-линкер) с Ab, в зависимости от синтетического пути, используемого для получения ADC.
Примерные части лекарственного средства
Майтансин и майтансиноиды
В некоторых вариантах осуществления, иммуноконъюгат содержит антитело согласно изобретению, конъюгированное с одной или несколькими майтансиноидными молекулами. Майтансиноиды являются митотическими ингибиторами, которые действуют посредством ингибирования полимеризации тубулина. Майтансин был впервые выделен из западного Африканского кустарника Maytenus serrata (патент США № 3896111). Впоследствии было обнаружено, что некоторые микробы также продуцируют майтансиноиды, такие как майтансинол и С-3-эфиры майтансинола (патент США № 4151042). Синтетический майтансинол и его производные и аналоги описаны, например, в патентах США с номерами 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 и 4371533.
Части (группы) майтансиноидного лекарственного средства являются привлекательными частями лекарственных средств в конъюгатах антитело-лекарственное средство, так как они являются (i) относительно доступными для получения при помощи ферментационной или химической модификации или дериватизации продуктов ферментации, (ii) поддающимися дериватизации функциональными группами, подходящими для конъюгации посредством недисульфидных линкеров с антителами, (iii) стабильными в плазме и (iv) эффективными против различных линий опухолевых клеток.
Соединения майтансина, подходящие для применения в качестве майтансиноидных лекарственных частей, хорошо известны в данной области и могут быть выделены из природных источников в соответствии с известными способами или получены с использованием способов генной инженерии (см. Yu et al (2002) PNAS 99:7968-7973). Майтансинол и аналоги майтансинола могут быть также получены синтетически в соответствии с известными способами.
Примерные варианты майтансиноидных лекарственных средств включают в себя: DM1; DM3 и DM4, как описано здесь.
Ауристатины и доластатины
В некоторых вариантах осуществления, этот иммуноконъюгат содержит антитело согласно изобретению, конъюгированное с доластатином или пептидными аналогами или производными доластатина, например, ауристатином (Патенты США с номерами 5635483; 5780588). Было показано, что доластатины и ауристатины препятствуют динамике микротрубочек, гидролизу GTP и ядерному и клеточному делению (Woyke et al (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584) и имеют противораковую (Патент США № 5663149) и противогрибковую активность (Pettit et al (1998) Antimicrob. Agents Chemother. 42:2961-2965). Доластатиновая или ауристатиновая лекарственная часть может быть присоединена к антителу через N-(амино)-конец или С-(карбоксил)-конец группы пептидного лекарственного средства (WO 02/088172).
Примеры вариантов ауристатина включают в себя связанные с N-концом монометилауристатиновые лекарственные части DE и DF, описанные в статье Senter et al, Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623, presented March 28, 2004, описание которой специально включено здесь в качестве ссылки в полном виде.
Часть пептидного лекарственного средства может быть выбрана из формул DE и DF ниже:
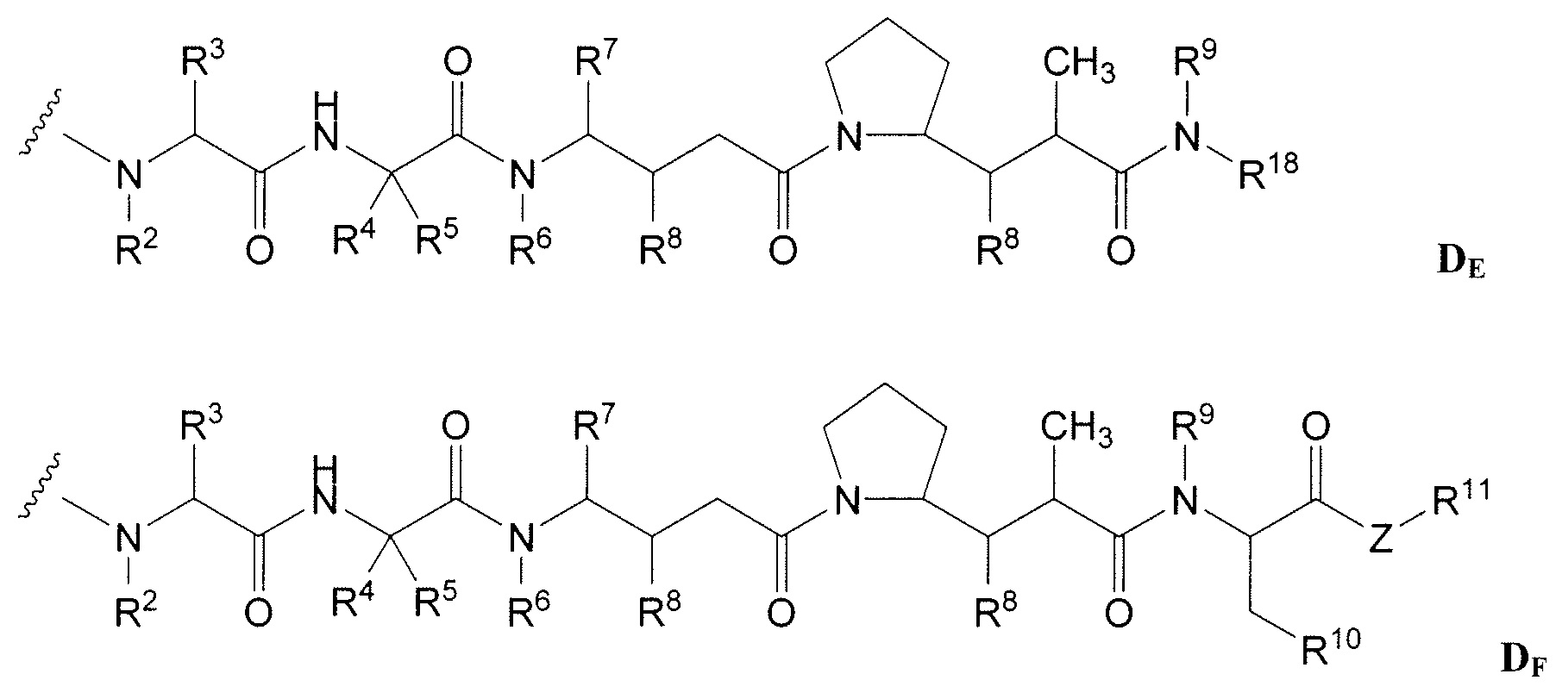
в которых волнистая линия DE и DF указывает сайт ковалентного присоединения к антителу или компоненту антитело-линкер, и в каждом положении независимо:
R2 выбран из H и С1-С8 алкила;
R3 выбран из H, С1-С8 алкила, С3-С8 карбоцикла, арила, С1-С8 алкиларила, С1-С8 алкил-(С3-С8 карбоцикла), С3-С8 гетероцикла и С1-С8 алкил-(С3-С8 гетероцикла);
R4 выбран из H, С1-С8 алкила, С3-С8 карбоцикла, арила, С1-С8 алкиларила, С1-С8 алкил-(С3-С8 карбоцикла), С3-С8 гетероцикла и С1-С8 алкил-(С3-С8 гетероцикла);
R5 выбран из H и метила; или
R4 и R5 вместе образуют карбоциклическое кольцо и имеют формулу -(CRaRb)n-, в которой Ra и Rb независимо выбраны из H, С1-С8 алкила и С3-С8 карбоцикла и n выбран из 2, 3, 4, 5 и 6;
R6 выбран из H и С1-С8 алкила;
R7 выбран из H, С1-С8 алкила, С3-С8 карбоцикла, арила, С1-С8 алкиларила, С1-С8 алкил-(С3-С8 карбоцикла), С3-С8 гетероцикла и С1-С8 алкил-(С3-С8 гетероцикла);
каждый R8 независимо выбран из H, OH, С1-С8 алкила, С3-С8 карбоцикла и O-(C1-C8 алкила);
R9 выбран из H и С1-С8 алкила;
R10 выбран из арила или С3-С8 гетероцикла;
Z означает O, S, NH или NR12, где R12 означает С1-С8 алкил;
R11 выбран из Н, С1-С20 алкила, арила, С3-С8 гетероцикла, -(R13O)m-R14 или-(R13O)m-СН(R15)2;
m означает целое число в интервале 1-1000;
R13 означает C2-C8 алкил;
R14 означает H или С1-С8 алкил;
R15 в каждом случае означает независимо H, COOH, -(CH2)n-N(R16)2, -(CH2)n-SO3H или -(CH2)nSO3-С1-С8 алкил;
R16 в каждом случае означает независимо H, С1-С8 алкил или -(CH2)n-COOH;
R18 выбран из -C(R8)2-C(R8)2-арила, -C(R8)2-C(R8)2-(C3-C8 гетероцикла) и -C(R8)2-C(R8)2-(C3-C8 карбоцикла); и
n означает целое число в интервале 0-6.
В одном варианте осуществления, R3, R4 и R7 означают независимо изопропил или втор-бутил и R5 означает -H или метил. В примерном варианте осуществления, R3 и R4, каждый, означают изопропил, R5 означает –H и R7 означает втор-бутил.
Еще в одном варианте осуществления, R2 и R6 означают, каждый, метил и R9 означает -H.
Еще в одном варианте осуществления, R8 в каждом случае означает -OCH3.
В примерном варианте осуществления, R3 и R4, каждый, означают изопропил, R2 и R6, каждый, означают метил, R5 означает -H, R7 означает втор-бутил, R8 в каждом случае означает -OCH3 и R9 означает -H.
В одном варианте осуществления, Z означает -O- или -NH-.
В одном варианте осуществления, R10 означает арил.
В одном варианте осуществления, R10 означает -фенил.
В примерном варианте осуществления, когда Z означает -O-, R11 означает -H, метил или трет-бутил.
В одном варианте осуществления, когда Z означает -NH, R11 означает -CH(R15)2, где R15 означает -(CH2)n-N(R16)2 и R16 означает С1-С8 алкил или -(CH2)n-COOH.
В другом варианте осуществления, когда Z означает -NH, R11 означает -CH(R15)2, где R15 означает -(CH2)n-SO3H.
Одним примерным вариантом ауристатина формулы DE является MMAE, где волнистая линия указывает ковалентное присоединение к линкеру (L) конъюгата антитело-лекарственное средство:
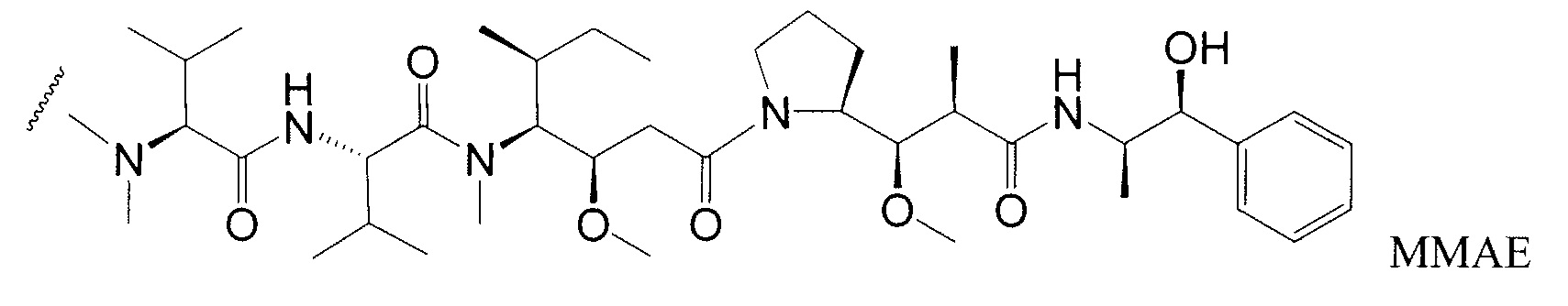
Одним примерным вариантом ауристатина формулы DF является MMAF, где волнистая линия указывает ковалентное присоединение к линкеру (L) конъюгата антитело-лекарственное средство (см. Патент США 2005/0238649 и Doronina et al. (2006) Bioconjugate Chem. 17:114-124):

Другие группы лекарственного средства включают в себя следующие производные MMAF, в которых волнистая линия указывает ковалентное присоединение к линкеру (L) конъюгата антитело-лекарственное средство:
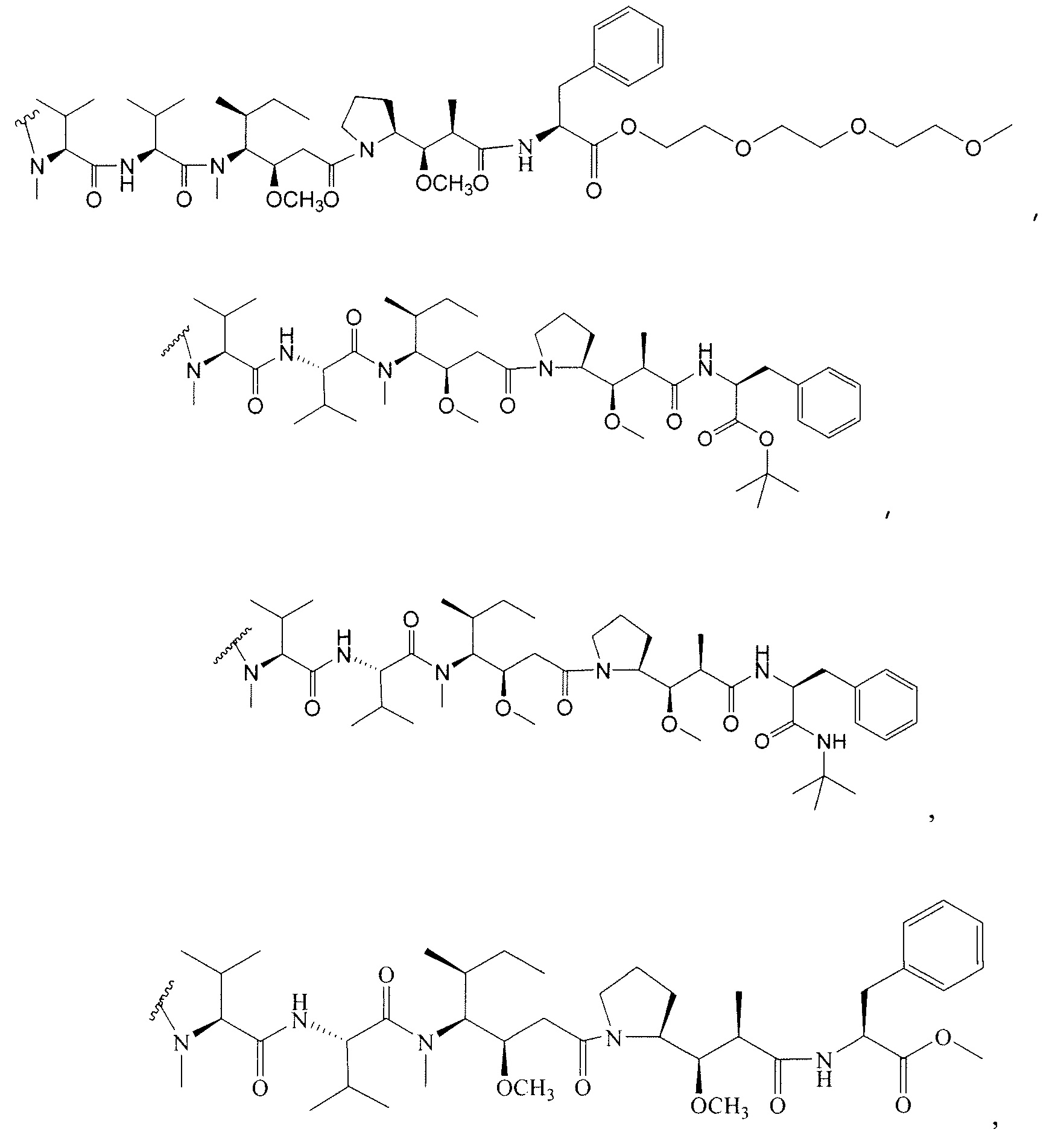

В одном аспекте, гидрофильные группы, включающие в себя, но не ограничивающиеся ими, эфиры триэтиленгликоля (TEG), показанные выше, могут быть присоединены к группе (части) лекарственного средства при R11. Без связывания какой-либо конкретной теорией, эти гидрофильные группы способствуют интернализации и отсутствию агломерации группы лекарственного средства.
Примерные варианты осуществления ADC формулы I, содержащие ауристатин/доластатин или их производное, описаны в US 2005-0238649 A1 и статье Doronina et al. (2006) Bioconjugate Chem. 17: 114-124, которая специально включена здесь в качестве ссылки. Примерные варианты осуществления ADC формулы I, содержащие MMAE или MMAF и различные линкерные компоненты, имеют следующие структуры и аббревиатуры (где “Ab” означает антитело; p равно 1 - приблизительно 8, “Val-Cit” означает дипептид валин-цитруллин и “S” означает атом серы:
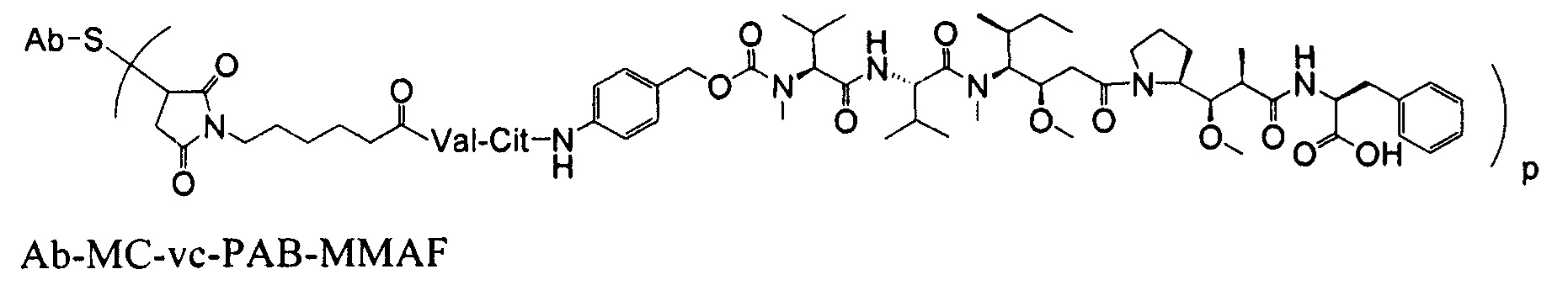


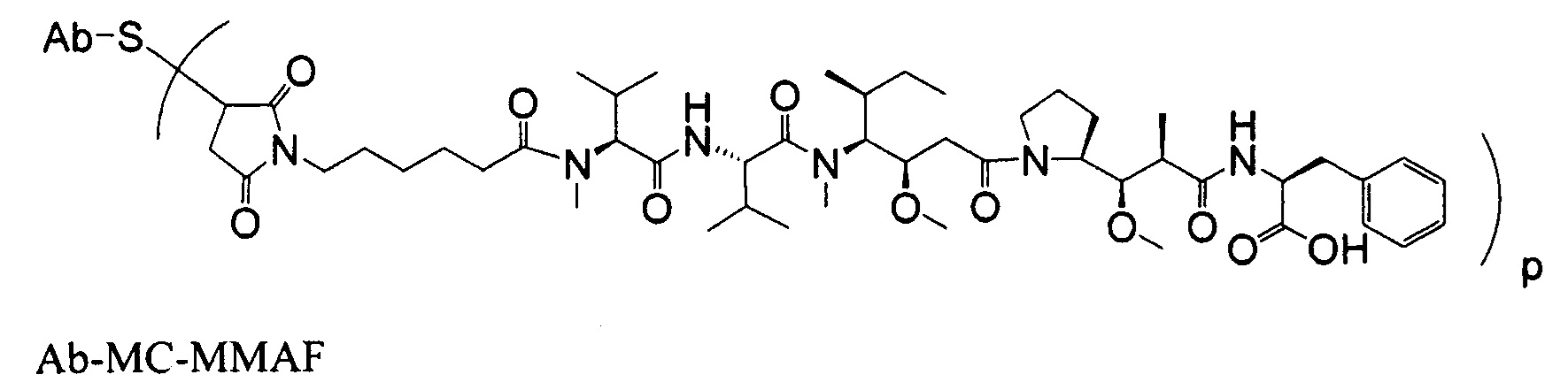
Примерные варианты осуществления ADC формулы I, содержащие MMAF и различные линкерные компоненты, дополнительно включают в себя Ab-MC-PAB-MMAF и Ab-PAB-MMAF. Интересно, что, как было показано, иммуноконъюгаты, содержащие MMAF, присоединенный к антителу линкером, который не является протеолитически расщепляемым, имеют активность, сравнимую с активностью иммуноконъюгатов, содержащих MMAF, присоединенный к антителу протеолитически расщепляемым линкером. См. Doronina et al. (2006) Bioconjugate Chem. 17: 114-124. Считается, что в таких случаях высвобождение лекарственного средства выполняется деградацией антитела в клетке.
Обычно, группы (части) лекарственного средства на основе пептидов могут быть получены образованием пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть получены, например, в соответствии со способом жидкофазного синтеза (см. E. Schroder and K. Lubke, "The Peptides", volume 1, pp 76-136, 1965, Academic Press), который хорошо известен в области химии пептидов. Группы лекарственных средств ауристатина/доластатина могут быть получены в соответствии со способами: US 2005-0238649 A1; патента США № 5635483; патента США № 5780588; Pettit et al (1989) J. Am. Chem. Soc. 111:5463-5465; Pettit et al (1998) Anti-Cancer Drug Design 13:243-277; Pettit, G.R., et al. Synthesis, 1996, 719-725; Pettit et al (1996) J. Chem. Soc. Perkin Trans. 15:859-863; и Doronina (2003) Nat. Biotechnol. 21(7):778-784.
В частности, группы (части) лекарственных средств ауристатина/доластатина формулы DF, такие как MMAF и его производные, могут быть получены с использованием способов, описанных в US 2005-0238649 A1 и Doronina et al. (2006) Bioconjugate Chem. 17: 114-124. Группы лекарственных средств ауристатина/доластатина формулы DE, такие как MMAE и его производные, могут быть получены с использованием способов, описанных в Doronina et al. (2003) Nat. Biotech. 21:778-784. Группы лекарственное средство-линкер MC-MMAF, MC-MMAE, MC-vc-PAB-MMAF и MC-vc-PAB-MMAE могут быть подходящим образом синтезированы рутинными способами, например, как описано в Doronina et al. (2003) Nat. Biotech. 21:778-784 и Публикации заявки на патент № US 2005/0238649 A1 и затем конъюгированы с представляющим интерес антителом.
Нагрузка лекарственного средства
Нагрузка лекарственного средства представлена как р и является средним количеством групп (частей) лекарственного средства на антитело в молекуле формулы I. Нагрузка лекарственного средства может находиться в интервале 1-20 групп лекарственного средства (D) на антитело. ADC формулы I включают в себя совокупности антител, конъюгированных с диапазоном 1-20 групп лекарственного средства. Среднее количество групп (частей) лекарственного средства на антитело в препаратах ADC из реакций конъюгирования может быть охарактеризовано общепринятыми средствами, такими как масс-спектроскопия, анализ ELISA и ВЖХ. Может быть также определено количественное распределение ADC в виде р. В некоторых случаях, выделение, очистка и характеристика гомогенного ADC, где р является определенной величиной из ADC с другими нагрузками лекарственного средства, может быть достигнута такими способами, как обращенно-фазовая ВЖХ или электрофорез.
Для некоторых конъюгатов антитело-лекарственное средство, р может быть ограничено количеством сайтов присоединения на этом антителе. Например, когда присоединение осуществляется с тиолом цистеина, как в приведенных выше примерных вариантах осуществления, антитело может иметь только одну или несколько тиоловых групп цистеина или может иметь только одну или несколько достаточно реакционноспособных тиоловых групп, посредством которых может быть присоединен линкер. В некоторых вариантах осуществления, более высокая нагрузка лекарственного средства, например, с р>5, может вызывать агрегацию, нерастворимость, токсичность или потерю клеточной проникаемости некоторых конъюгатов антитело-лекарственное средство. В некоторых вариантах осуществления, нагрузка лекарственного средства для ADC согласно изобретению находится в интервале от 1 до приблизительно 8; от приблизительно 2 до приблизительно 6; от приблизительно 3 до приблизительно 5; от приблизительно 3 до приблизительно 4; от приблизительно 3,1 до приблизительно 3,9; от приблизительно 3,2 до приблизительно 3,8; от приблизительно 3,2 до приблизительно 3,7; от приблизительно 3,2 до приблизительно 3,6; от приблизительно 3,3 до приблизительно 3,8 или от приблизительно 3,3 до приблизительно 3,7. Действительно, было показано, что для некоторых ADC, оптимальное отношение групп (частей) лекарственного средства на антитело может быть менее 8 и может быть приблизительно 2 – приблизительно 5. См. US 2005-0238649 A1 (включенный здесь в качестве ссылки в его полном виде).
В некоторых вариантах осуществления, меньшее количество, чем теоретическое максимальное количество групп (частей) лекарственного средства конъюгируются с антителом во время реакции конъюгации. Антитело может содержать, например, остатки лизина, которые не реагируют с промежуточным продуктом лекарственное средство-линкер или линкерным реагентом, как обсуждается ниже. Обычно, антитела не содержат много свободных и реакционноспособных тиоловых групп цистеина, которые могут быть связаны с группой лекарственного средства; фактически, большинство тиоловых остатков цистеина в антителах существуют в виде дисульфидных мостиков. В некоторых вариантах осуществления, антитело может быть восстановлено восстанавливающим агентом, таким как дитиотреитол (ДТТ) или трикарбонилэтилфосфин (TCEP), при частичных или общих восстанавливающих условиях с генерированием реакционноспособных тиоловых групп цистеина. В некоторых вариантах осуществления, антитело подвергают денатурирующим условиям для выявления реакционноспособных нуклеофильных групп, таких как лизин или цистеин.
Нагрузка (отношение лекарственное средство/антитело) ADC может регулироваться различными путями, например: (i) ограничением молярного избытка промежуточного продукта лекарственное средство-линкер или линкерного реагента относительно антитела, (ii) ограничением времени или температуры реакции конъюгации, (iii) частичными или ограниченными восстанавливающими условиями для модификации тиолов цистеина, (iv) конструированием рекомбинантными способами аминокислотной последовательности антитела таким образом, что количество и положение остатков цистеина модифицируется для регуляции количества и/или положения присоединений линкер-лекарственное средство (такой как thioMab или thioFab, полученной, как описано здесь и в WO2006/034488 (включенном здесь в качестве ссылки в его полном виде)).
Должно быть понятно, что, когда более чем одна нуклеофильная группа взаимодействует с промежуточным продуктом лекарственное средство-линкер или линкерным реагентом и затем реагентом, являющимся группой лекарственного средства, то полученный продукт является смесью соединений ADC с некоторым распределением одной или нескольких групп лекарственного средства, присоединенных к антителу. Среднее количество лекарственных средств на антитело может быть рассчитано из этой смеси двойным анализом антител ELISA, который является специфическим в отношении антитела и специфическим в отношении этого лекарственного средства. Индивидуальные молекулы ADC могут быть идентифицированы в этой смеси масс-спектроскопией и разделены при помощи ВЖХ, например, хроматографией гидрофобного взаимодействия (см., например, Hamblett, K.J., et al. "Effect of drug loading on the pharmacology, pharmacokinetics, and toxicity of an anti-CD30 antibody-drug conjugate," Abstract No. 624, American Association for Cancer Research, 2004 Annual Meeting, March 27-31, 2004, Proceedings of the AACR, Volume 45, March 2004; Alley, S.C., et al. "Controlling the location of drug attachment in antibody-drug conjugates," Abstract No. 627, American Association for Cancer Research, 2004 Annual Meeting, March 27-31, 2004, Proceedings of the AACR, Volume 45, March 2004). В некоторых вариантах осуществления гомогенные ADC с единой величиной нагрузки могут быть выделены из смеси для конъюгации электрофорезом и хроматографией.
Некоторые способы получения иммуноконъюгатов
ADC формулы I могут быть получены несколькими способами с использованием реакций органической химии, условий и реагентов, известных квалифицированным в данной области специалистам, в том числе: (1) реакции нуклеофильной группы антитела с бивалентным линкерным реагентом для образования Ab-L посредством ковалентной связи, с последующей реакцией с группой (частью) лекарственного средства D; и (2) реакции нуклеофильной группы лекарственного средства с бивалентным линкерным реагентом для образования D-L посредством ковалентной связи, с последующей реакцией с нуклеофильной группой антитела. Примерные способы получения ADC формулы I при помощи последнего способа описаны в US 20050238649 A1, который специально включен здесь в качестве ссылки.
Нуклеофильные группы на антителах включают в себя, но не ограничиваются ими: (i) N-концевые аминогруппы, (ii) аминогруппы боковых цепей, например, лизина, (iii) тиоловые группы боковых цепей, например, цистеина, и (iv) гидроксильные группы сахаров или аминогруппы, когда это антитело является гликозилированным. Аминогруппы, тиоловые и гидроксильные группы являются нуклеофильными и способны реагировать с образованием ковалентных связей с электрофильными группами на линкерных частях и линкерных реагентах, включающими в себя: (i) активные сложные эфиры, такие как NHS-эфиры, HOBt-эфиры, галогенформиаты и галогенангидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегидные, кетоновые, карбоксильные и малеимидные группы. Некоторые антитела имеют восстанавливаемые межцепочечные дисульфиды, т.е. цистеиновые мостики. Антитела могут быть сделаны реакционноспособными в отношении конъюгации с линкерными реагентами обработкой восстанавливающим агентом, таким как DTT (дитиотреитол) или трикарбонилэтилфосфин (TCEP), так что это антитело является полностью или частично восстановленным. Таким образом, каждый цистеиновый мостик образует, теоретически, два реакционноспособных тиоловых нуклеофила. Дополнительные нуклеофильные группы могут быть введены в антитела посредством модификации остатков лизина, например, реакцией остатков лизина с 2-иминотиоланом (реагентом Траута), которая приводит к превращению аминогруппы в тиоловую группу. Реакционноспособные тиоловые группы могут быть введены в антитело введением одного, двух, трех, четырех или более остатков цистеина (например, получением вариантных антител, содержащих один или несколько неприродных аминокислотных остатков цистеина).
Конъюгаты антитело-лекарственное средство согласно изобретению могут быть также получены реакцией между электрофильной группой на антителе, такой как альдегидная или кетоновая карбонильная группа, с нуклеофильной группой на линкерном реагенте или лекарственном средстве. Применимые нуклеофильные группы на линкерном реагенте включают в себя, но не ограничиваются ими, гидразид, оксим, амино, гидразин, тиосемикарбазон, карбоксилат гидразина и арилгидразид. В одном варианте осуществления, антитело модифицировано для введения электрофильных групп, которые способны взаимодействовать с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. В одном варианте осуществления, сахара гликозилированных антител могут быть окисленными, например, окисляющими периодат реагентами, с образованием альдегидных или кетоновых групп, которые могут взаимодействовать с аминогруппой линкерных реагентов или групп (частей) лекарственного средства. Полученные иминогруппы оснований Шиффа могут образовывать стабильную связь или могут быть восстановлены, например, боргидридными реагентами, с образованием стабильных аминных связей. В одном варианте осуществления, реакция углеводной части гликозилированного антитела с галактозооксидазой или метапериодатом натрия может давать карбонильные (альдегидные или кетоновые) группы в антителе, которые могут взаимодействовать с подходящими группами на лекарственном средстве (Hermanson, Bioconjugate Techniques). В другом варианте осуществления, антитела, содержащие N-концевые остатки серина или треонина, могут взаимодействовать с метапериодатом натрия, приводя к образованию альдегида вместо первой аминокислоты (Geoghegan & Stroh, (1992) Bioconjugate Chem. 3: 138-146; US 5362852). Такой альдегид может реагировать с частью лекарственного средства или нуклеофилом линкера.
Нуклеофильные группы на группе (части) лекарственного средства включают в себя, но не ограничиваются ими: аминогруппу, тиоловую, гидроксильную, гидразидную, оксимную, гидразиновую, тиосемикарбазоновую группу, группу карбоксилата тирозина и арилгидразидную группу, способные реагировать с образованием ковалентных связей с электрофильными группами на линкерных частях и линкерных реагентах, включающих в себя: (i) активные эфиры, такие как NHS-эфиры, HOBt-эфиры, галогенформиаты и галогенангидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы.
Особо обсуждаются соединения согласно изобретению, включающие в себя, но не ограничивающиеся ими, ADC полученные со следующими сшивающими реагентами: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоатом), которые являются коммерчески доступными (например, из Pierce Biotechnology, Inc., Rockford, IL., U.S.A). См. страницы 467-498, 2003-2004 Applications Handbook and Catalog.
Иммуноконъюгаты, содержащие антитело и цитотоксический агент, могут быть получены с использованием различных бифункциональных агентов связывания белков, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидо-соединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин может быть получен, как описано в Vitetta et al., Science 238: 1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является примерным хелатобразующим агентом для конъюгации радионуклида с антителом. См. WO94/11026.
Альтернативно, слитый белок, содержащий антитело и цитотоксический агент, может быть получен рекомбинантными способами или пептидным синтезом. Рекомбинантная молекула ДНК может содержать районы, кодирующие это антитело и цитотоксические части конъюгата, либо смежные друг с другом, либо разделенные районом, кодирующим линкерный пептид, который не разрушает желаемые свойства этого конъюгата.
Еще в одном варианте осуществления, это антитело может быть конъюгировано с «рецептором» (таким как стрептавидин) для использования в предварительном нацеливании на опухоль, причем этот конъюгат антитело-рецептор вводят пациенту с последующим удалением несвязанного конъюгата из кровотока с использованием агента клиренса и затем введением «лиганда» (например, авидина), который конъюгирован с цитотоксическим агентом (например, радионуклидом.
Получение цистеин-встроенных анти-STEAP-1-антител
Способы конструирования, отбора и получения согласно изобретению делают также возможным получение цистеин-встроенных анти-STEAP-1-антител, которые являются реакционноспособными с электрофильной функциональной группой. Кроме того, эти способы позволяют получать конъюгатные соединения антител, такие как соединения конъюгатов антитело-лекарственное средство (ADC) с молекулами лекарственного средства в определенных, спланированных, селективных сайтах. Реакционноспособные остатки цистеина на поверхности антител позволяют специфически конъюгировать часть (группу) лекарственного средства через тиол-реактивную функциональную группу в белке, такую как малеимид или галогенацетил. Нуклеофильная реакционная способность тиоловой функциональной группы остатка Cys с малеимидной группой является приблизительно в 1000 раз более высокой в сравнении с любой другой аминокислотной функциональной группой в белке, такой как аминогруппа остатков лизина или N-концевая аминогруппа. Тиол-специфическая функциональная группа в иодацетильных реагентах и малеимидных реагентах может взаимодействовать с аминогруппами, но требуются более высокий рН (>9,0) и более продолжительные периоды времени реакции (Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London). Количество свободного тиола в белке может быть определено стандартным анализом Эллмана. Иммуноглобулин М является примером дисульфид-связанного пентамера, тогда как иммуноглобулин G является примером белка с внутренними дисульфидными мостиками, связывающими эти субъединицы вместе. В таких белках, как этот белок, восстановление дисульфидных связей таким реагентом, как дитиотреитол (DTT) или селенол (Singh et al (2002) Anal. Biochem. 304:147-156), является необходимым для генерирования реакционноспособного свободного тиола. Этот подход может приводить к потере третичной структуры антитела и антигенсвязывающей специфичности.
Pheselector-анализ (фаговый анализ ELISA для отбора реакционноспособных тиолов) позволяет детектировать реакционноспособные цистеиновые группы в антителах в фаговом формате ELISA, что способствует конструированию цистеин-встроенных антител (WO 2006/034488). Цистеин-встроенное антитело наносят на поверхности лунок с последующим инкубированием с частицами фага, добавлением HRP-меченого вторичного антитела и детектирования оптической плотности. Мутантные белки, представленные на фаге, могут быть подвергнуты скринингу быстрым, ясным и высокопроизводительным способом. Библиотеки цистеин-встроенных антител могут быть получены и подвергнуты отбору на связывание с использованием того же самого подхода для идентификации соответствующих реакционноспособных сайтов включения свободного Cys из случайных библиотек белок-фаг антител или других белков. Этот способ включает в себя реакцию цистеин-мутантных белков, представленных на фаге, с аффинным реагентом или репортерной группой, которая также является тиол-реактивной.
Этот PHESELECTOR-анализ позволяет выполнять скрининг реакционноспособных тиоловых групп в антителах. Примером является идентификация варианта А121С этим способом. Полная Fab-молекула может быть эффективно подвергнута поиску для идентификации большего количества вариантов ThioFab с реакционноспособными тиоловыми группами. Параметр фракционная (парциальная) доступность поверхности, был использован для идентификации и количественного определения доступности растворителя к аминокислотным остаткам в полипептиде. Доступность поверхности может быть выражена как площадь поверхности (ангстрем2, Å2), которая может быть контактирована молекулой растворителя, например, воды. Занимаемое водой пространство аппроксимировали в виде сферы с радиусом 1,4 Å. Программное обеспечение (программа) является свободно доступной или лицензируемой (Secretary to CCP4, Daresbury Laboratory, Warrington, WA4 4AD, United Kingdom, Fax: (+44) 1925 603825, или по Интернету: www.ccp4.ac.uk/dist/htm1/INDEX.html) в виде программ Комплекта CCP4 кристаллографии, которые используют алгоритмы для расчета доступности поверхности каждой аминокислоты белка с известными полученными при помощи рентгеновской кристаллографии координатами ("The CCP4 Suite: Programs for Protein Crystallography" (1994) Acta. Cryst. D50:760-763). Два примерных модуля, которые выполняют расчеты доступности поверхности, являются “AREAIMOL” и “SURFACE”, основанные на алгоритмах B.Lee and F.M.Richards (1971) J. Mol.Biol. 55:379-400. AREAIMOL определяет доступную для растворителя поверхность белка в виде локуса центра сферы-зонда (представляющей молекулу растворителя), когда она катится по ван-дер-ваальсовой поверхности этого белка. AREAIMOL рассчитывает доступную для растворителя площадь поверхности генерированием точек поверхности на распрямленной сфере около каждого атома (на расстоянии от центра атома, равном сумме радиусов атома и зонда) и исключением тех точек, которые лежат в пределах эквивалентных сфер, ассоциированных с соседними атомами. AREAIMOL находит доступную для растворителя площадь атомов в файле координат PDB и суммирует доступную площадь на остаток, на цепь и для всей молекулы. Доступные площади (или различия площадей) для индивидуальных атомов могут быть записаны в файле псевдо-PDV-результатов. AREAIMOL предполагает единственный радиус для каждого элемента и узнает только ограниченное количество различных элементов.
AREAIMOL и SURFACE сообщают абсолютные доступности, т.е. количество ангстрем в квадрате (А). Фракционную (парциальную) доступность поверхности рассчитывают со ссылкой на стандартное состояние, релевантное для одной аминокислоты в полипептиде. Это ссылочное состояние является трипептидом Gly-X-Gly, где X является представляющей интерес аминокислотой, а ссылочное состояние должно быть «распрямленной» конформацией, т.е. конформацией, подобной бета-тяжам. Эта распрямленная конформация максимизирует доступность Х. Рассчитанную доступную площадь делят на доступную площадь в ссылочном состоянии трипептида Gly-X-Gly и сообщают частное, которое является фракционной (парциальной) доступностью. Процентной доступностью является фракционная (парциальная) доступность, умноженная на 100. Другой примерный алгоритм для расчета доступности поверхности основан на модуле SOLV программы xsae (Broger, C, F. Hoffman-LaRoche, Basel), который рассчитывает фракционную (парциальную) доступность аминокислотного остатка для водной сферы на основе координат рентгеновского излучения полипептида. Фракционная доступность поверхности для каждой аминокислоты в антителе может быть рассчитана с использованием доступной информации о кристаллической структуре. (Eigenbrot et al. (1993) J. Mol. Biol. 229:969-995).
ДНК, кодирующую цистеин-встроенные антитела, легко выделяют и секвенируют с использованием общепринятых процедур (например, с использованием олигонуклеотидных зондов, которые способны связываться специфически с генами, кодирующими тяжелые и легкие цепи мышиных антител). В качестве источника такой ДНК служат гибридомные клетки. После выделения, эта ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки COS обезьяны, клетки яичника китайского хомячка (CHO) или клетки-хозяева других млекопитающих, такие как клетки миеломы (US 5807725; US 2005/0048572; US 2004/0229310), которые в противном случае не продуцируют белок антитела, для получения синтеза моноклональных антител в рекомбинантных клетках-хозяевах.
После конструирования и отбора, цистеин-встроенные антитела, например, ThioFabs, со сконструированными, высоко реакционноспособными неспаренными остатками Cys, могут быть получены: (i) экспрессией в бактериальной системе, например, системе E. coli (Skerra et al (1993) Curr. Opinion in Immunol. 5:256-262; Plϋckthun (1992) Immunol. Revs. 130: 151-188) или системе культуры клеток млекопитающих (WO 01/00245), например, клеток яичника китайского хомячка (CHO); и (ii) очисткой с использованием обычных способов очистки белков (Lowman et al (1991) J. Biol. Chem. 266(17): 10982-10988).
Сконструированные (встроенные) тиоловые группы Cys взаимодействуют с электрофильными линкерными реагентами и промежуточными продуктами лекарственное средство-линкер с образованием конъюгатов цистеин-встроенное антитело-лекарственное средство и других меченых цистеин-встроенных антител. Остатки Cys цистеин-встроенных антител и присутствующие в исходных антителах, которые спарены и образуют межцепочечные и внутрицепочечные дисульфидные связи, не имеют никаких реакционноспособных тиоловых групп (если они не обработаны восстанавливающим агентом) и не реагируют с электрофильными линкерными реагентами или промежуточными продуктами лекарственное средство-линкер. Вновь сконструированный (встроенный) остаток Cys, может оставаться неспаренным и способен реагировать, т.е. конъюгироваться, с электрофильным линкерным реагентом или промежуточным продуктом лекарственное средство-линкер, таким как лекарственное средство-малеимид. Примерные промежуточные продукты лекарственное средство-линкер включают в себя: MC-MMAE, MC-MMAF, MC-vc-PAB-MMAE и MC-vc-PAB-MMAF. Положения в структуре встроенных остатков Cys тяжелой и легкой цепей нумеруются в соответствии с системой последовательной нумерации. Эта система последовательной нумерации коррелирует с системой нумерации Кабата (Kabat et al., (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD), начинающейся с N-конца, отличается от системы нумерации Кабата (нижний ряд) инсерциями, отмеченными a,b,c. С использованием этой системы нумерации Кабата, истинная линейная последовательность аминокислот может содержать меньше аминокислот или может содержать дополнительные аминокислоты, соответствующие укорочению FR или CDR вариабельного домена или инсертированию в FR или CDR вариабельного домена. Сайты цистеин-встроенного варианта тяжелой цепи идентифицируют посредством схем последовательной нумерации Кабата.
В одном варианте осуществления, цистеин-встроенное анти-STEAP-1-антитело получают способом, предусматривающим:
(a) замену одного или нескольких аминокислотных остатков исходного анти-STEAP-1-антитела цистеином; и
(b) определение реакционноспособности тиола цистеин-встроенного анти-STEAP-1-антитела реакцией цистеин-встроенного антитела с тиол-реактивным реагентом.
Цистеин-встроенное антитело может быть более реакционноспособным, чем исходное антитело, с тиол-реактивным реагентом.
Аминокислотные остатки свободного цистеина могут быть расположены в тяжелой и легкой цепях или в константном или вариабельном доменах. Фрагменты антител, например, Fab, могут быть также сконструированы с одним или несколькими аминокислотами, являющимися цистеином, заменяющими аминокислоты этого фрагмента антитела, для образования цистеин-встроенных фрагментов антитела.
Другой вариант осуществления согласно изобретению обеспечивает способ получения (изготовления) цистеин-встроенного анти-STEAP-1-антитела, предусматривающий:
(a) введение одного или нескольких аминокислотных остатков цистеина в исходное анти-STEAP-1-антитело для генерирования цистеин-встроенного анти-STEAP-1-антитела; и
(b) определение реакционноспособности тиола цистеин-встроенного анти-STEAP-1-антитела реакцией цистеин-встроенного антитела с тиол-реактивным реагентом;
причем цистеин-встроенное антитело является более реакционноспособным, чем исходное антитело, с тиол-реактивным реагентом.
Стадия (а) способа изготовления цистеин-встроенного антитела может включать в себя:
(i) мутагенизацию последовательности нуклеиновой кислоты, кодирующей цистеин-встроенное антитело;
(ii) экспрессию цистеин-встроенного антитела; и
(iii) выделение и очистку цистеин-встроенного антитела.
Стадия (b) способа изготовления цистеин-встроенного антитела может включать в себя экспрессию цистеин-встроенного антитела на вирусной частице, выбранной из частицы фага или фагмиды.
Стадия (b) способа изготовления цистеин-встроенного антитела может также включать в себя:
(i) реакцию цистеин-встроенного антитела с тиол-реактивным аффинным реагентом для генерирования аффинно меченого, цистеин-встроенного антитела; и
(ii) измерение связывания аффинно меченого, цистеин-встроенного антитела с захватывающей средой.
Другим вариантом осуществления согласно изобретению является способ скрининга цистеин-встроенных антител с высоко реакционноспособными, неспаренными аминокислотными остатками цистеина на реакционную способность тиола, включающий в себя:
(a) введение одного или нескольких аминокислотных остатков цистеина в исходное антитело для генерирования цистеин-встроенного антитела;
(b) реакцию цистеин-встроенного антитела с тиол-реактивным аффинным реагентом для генерирования аффинно меченого, цистеин-встроенного антитела; и
(c) измерение связывания аффинно меченого, цистеин-встроенного антитела с захватывающей средой; и
(d) определения реакционной способности тиола цистеин-встроенного антитела с тиол-реактивным реагентом.
Стадия (а) способа скрининга цистеин-встроенных антител может включать в себя:
(i) мутагенизацию последовательности нуклеиновой кислоты, кодирующей цистеин-встроенное антитело;
(ii) экспрессию цистеин-встроенного антитела и
(iii) выделение и очистку цистеин-встроенного антитела.
Стадия (b) способа скрининга цистеин-встроенных антител может включать в себя экспрессию цистеин-встроенных антител на вирусной частице, выбранной из частицы фага или фагмиды.
Стадия (b) способа скрининга цистеин-встроенных антител может включать в себя:
(i) реакцию цистеин-встроенного антитела с тиол-реактивным аффинным реагентом для генерирования аффинно меченого, цистеин-встроенного антитела; и
(ii) измерение связывания аффинно меченого, цистеин-встроенного антитела с захватывающей средой.
Меченые цистеин-встроенные анти-STEAP-1-антитела
Цистеин-встроенные анти-STEAP-1-антитела могут быть сайт-специфически и эффективно связаны с тиол-реактивным реагентом. Тиол-реактивным реагентом может быть мультифункциональный линкерный реагент, захватывающий, т.е. аффинный, меченый реагент (например, биотин-линкерный реагент), детектируемая метка (например, флуорофорный реагент), твердофазный иммобилизирующий реагент (например, SEPHAROSE™, полистирол или стекло), или промежуточный продукт лекарственное средство-линкер. Одним примером тиол-реактивного реагента является N-этилмалеимид (NEM). В одном примерном варианте осуществления, реакция ThioFab с реагентом биотин-линкер обеспечивает биотинилированный ThioFab, при помощи которого могут быть детектированы и измерены присутствие и реакционная способность встроенного остатка цистеина. Реакция ThioFab с мультифункциональным линкером обеспечивает ThioFab с функционализированным линкером, который может дополнительно реагировать с реагентом группы лекарственного средства или другой меткой. Реакция с промежуточным продуктом лекарственное средство-линкер обеспечивает конъюгат ThioFab-лекарственное средство.
Описанные здесь примерные способы могут быть применены к идентификации и получению антител и, более часто, к другим белкам посредством применения стадий конструирования и скрининга, описанных здесь.
Такой подход может быть применен к конъюгации других тиол-реактивных реагентов, в которых реакционноспособной группой является, например, малеимид, иодацетамид, пиридилдисульфид или другой тиол-реактивный партнер конъюгации (Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Hermanson, G. in Bioconjugate Techniques (1996) Academic Press, San Diego, pp. 40-55, 643-671). Этим тиол-реактивным реагентом может быть группа лекарственного средства, флуорофор, такой как флуоресцентный краситель, такой как флуоресцеин или родамин, хелатобразующий агент для визуализации или радиотерапевтический металл, пептидильная или непептидильная метка или детектирующий маркер или модифицирующий клиренс агент, такой как различные изомеры полиэтиленгликоля, пептид, который связывается с третьим компонентом, или другой углеводный или липофильный агент.
Применения цистеин-встроенных анти-STEAP-1-антител
Цистеин-встроенные анти-STEAP-1-антитела и их конъюгаты могут найти применение в качестве терапевтических и/или диагностических агентов. Данное изобретение обеспечивает дополнительно способы предотвращения, лечения, терапии или ослабления одного или нескольких симптомов, ассоциированных со связанным с STEAP-1 нарушением. В частности, данное изобретение обеспечивает способы предотвращения, лечения, терапии или ослабления одного или нескольких симптомов, ассоциированных с клеточно-пролиферативным нарушением, таким как рак, например, рак предстательной железы, рак легкого, рак ободочной кишки, рак мочевого пузыря, рак яичника и саркома Юинга. Кроме того, данное изобретение обеспечивает способы диагностики связанного с STEAP-1 нарушения или предрасположения к развитию такого нарушения, а также способы идентификации антител и антигенсвязывающих фрагментов антител, которые преимущественно связывают клеточно-ассоциированные полипептиды STEAP-1.
Другой вариант осуществления данного изобретения относится к применению цистеин-встроенного анти-STEAP-1-антитела для изготовления лекарственного средства, применимого в лечении состояния, которое ответственно за связанное со STEAP-1 нарушение.
Получение цистеин-встроенных конъюгатов анти-STEAP-1-антитело-лекарственное средство
ADC формулы I может быть получен несколькими способами, с использованием реакций органической химии, условий и реагентов, известных квалифицированным в данной области специалистам, включающими в себя: (1) реакцию группы цистеина цистеин-встроенного антитела с линкерным реагентом с образованием промежуточного продукта антитело-линкер Ab-L, через ковалентную связь, с последующей реакцией с частью активированного лекарственного средства D; и (2) реакцию нуклеофильной группы части лекарственного средства с бивалентным линкерным реагентом, с образованием промежуточного продукта лекарственное средство-линкер D-L, через ковалентную связь, с последующей реакцией с группой цистеина цистеин-встроенного антитела. Способы конъюгации (1) и (2) могут быть использованы с различными цистеин-встроенными антителами, лекарственными частями и линкерами для получения конъюгатов антитело-лекарственное средство формулы I.
Тиоловые группы цистеина антитела являются нуклеофильными и способны взаимодействовать с образованием ковалентных связей с электрофильными группами на линкерных реагентах и промежуточных продуктах лекарственное средство-линкер, включающих в себя: (i) активные эфиры, такие как NHS-эфиры, HOBt-эфиры esters, галогенформиаты и галогенангидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегидные, кетоновые, карбоксильные и малеимидные группы; (iv) дисульфиды, в том числе пиридилдисульфиды, посредством обмена сульфидов. Нуклеофильные группы на части лекарственного средства включают в себя, но не ограничиваются ими: аминогруппу, тиоловую, гидроксильную, гидразидную, оксимную, гидразиновую, тиосемикарбазоновую, гидразинкарбоксилатную и арилгидразидную группы, способные реагировать с образованием ковалентных связей с электрофильными группами на линкерных частях и линкерных реагентах.
Цистеин-встроенные антитела могут быть сделаны реакционноспособными для конъюгации с линкерными реагентами обработкой восстанавливающим агентом, таким как DTT (реагент Клеланда, дитиотреитол) или TCEP (гидрохлорид трис-(2-карбоксиэтил)фосфина; Getz et al (1999) Anal. Biochem. VoI 273:73-80; Soltec Ventures, Beverly, MA), с последующим повторным окислением для повторного образования межцепочечных и внутрицепочечных дисульфидных связей. Например, полноразмерные, цистеин-встроенные моноклональные антитела (ThioMab), экспрессируемые в клетках CHO, восстанавливают приблизительно 50-кратным избытком TCEP в течение 3 часов при 37оС для восстановления дисульфидных связей в аддуктах цистеина, которые могут образовываться между вновь введенными остатками цистеина и цистеином, присутствующим в культуральных средах. Эти восстановленные ThioMab разводят и наносят на колонку HiTrap S в 10 мМ ацетате натрия, pH 5, и элюируют ЗФР, содержащим 0,3 M хлорид натрия. Дисульфидные связи повторно устанавливали между остатками цистеина, присутствующими в исходном Mab, разведенным (200 нМ) водным сульфатом меди (CuSO4) при комнатной температуре в течение ночи. Альтернативно, дегидроаскорбиновая кислота (DHAA) является эффективным оксидантом для повторного установления внутриклеточных дисульфидных групп цистеин-встроенного антитела после восстановительного расщепления аддуктов цистеина. Могут быть использованы другие оксиданты, т.е. окисляющие агенты, и окисляющие условия, которые известны в данной области. Окисление воздухом окружающей среды также является эффективным. Эта стадия мягкого, частичного повторного окисления образует эффективно внутриклеточные дисульфиды с высокой точностью и защищает тиоловые группы нововведенных остатков цистеина. Добавляют приблизительно 10-кратный избыток промежуточного продукта лекарственное средство-линкер, например, MC-vc-PAB-MMAE, смешивают и дают смеси стоять в течение приблизительно часа при комнатной температуре для осуществления конъюгации и образования конъюгата антитело-лекарственное средство. Эту смесь конъюгации гель-фильтруют и наносят на колонку HiTrap S и элюируют для удаления избытка промежуточного продукта лекарственное средство-линкер и других примесей.
Фигура 16 показывает общий процесс получения цистеин-встроенного антитела, экспрессируемого из культуры клеток, для конъюгации. Когда среда культуры клеток содержит цистеин, могут образовываться дисульфидные аддукты между нововведенной аминокислотой цистеином и цистеином из среды. Эти аддукты цистеина, изображенные в виде кружка в примерном ThioMab (слева) на фигуре 12, должны быть восстановлены для генерирования цистеин-встроенных антител, реакционноспособных в отношении конъюгации. Аддукты цистеина, предположительно вместе с различными межцепочечными дисульфидными связями, восстановительно расщепляют с получением восстановленной формы антитела восстанавливающими агентами, такими как TCEP. Межцепочечные дисульфидные связи между спаренными остатками цистеина повторно образуются при условиях частичного окисления сульфатом меди, DHAA или воздействия кислорода окружающей среды. Нововведенные, встроенные и неспаренные остатки цистеина остаются доступными для реакции с линкерными реагентами или промежуточными продуктами лекарственное средство-линкер для образования конъюгатов антитела согласно изобретению. ThioMab, экспрессированные в клеточных линиях млекопитающих, приводят к получению наружно конъюгированного Cys-аддукта со встроенным Cys через образование связи -S-S-. Таким образом, очищенные ThioMab обрабатывают процедурами восстановления и повторного окисления, как описано в примере 5, для получения реакционноспособных ThioMab. Эти ThioMab используют для конъюгации с содержащими малеимид цитотоксическими лекарственными средствами, флуорофорами и другими метками.
Фигура 15 показывает варианты конъюгатов цистеин-встроенное анти-STEAP-1-антитело-лекарственное средство (ADC), где часть ауристатинового лекарственного средства присоединена к группе встроенного цистеина в: легкой цепи (LC-ADC); тяжелой цепи (HC-ADC) и Fc-районе (Fc-ADC).
Фармацевтические композиции
Введение конъюгатов антитело-лекарственное средство
Конъюгаты антитело-лекарственное средство (ADC) согласно изобретению могут быть введены любым способом, подходящим для подлежащего лечению состояния. ADC обычно вводят парентерально, т.е. инфузией, подкожно, внутримышечно, внутривенно, интрадермально, подоболочечно и эпидурально.
Для лечения рака, например, предстательной железы, легкого и/или ободочной кишки, в одном варианте осуществления, конъюгат антитело-лекарственное средство вводят внутривенной инфузией. Вводимая посредством инфузии доза находится в интервале приблизительно 1 мкг/м2 – приблизительно 10000 мкг/м2 на дозу, обычно в виде одной дозы в неделю, в целом в количестве одной, двух, трех или четырех доз. Альтернативно, используют диапазон доз от приблизительно 1 мкг/м2 до приблизительно 1000 мкг/м2, от приблизительно 1 мкг/м2 до приблизительно 800 мкг/м2, от приблизительно 1 мкг/м2 до приблизительно 600 мкг/м2, от приблизительно 1 мкг/м2 до приблизительно 400 мкг/м2, от приблизительно 10 мкг/м2 до приблизительно 500 мкг/м2, от приблизительно 10 мкг/м2 до приблизительно 300 мкг/м2, от приблизительно 10 мкг/м2 до приблизительно 200 мкг/м2 и от приблизительно 1 мкг/м2 до приблизительно 200 мкг/м2. Доза может вводиться один раз в неделю, много раз в неделю, но менее одного раза в день, много раз в месяц, но менее одного раза в день, много раз в месяц, но менее одного раза в неделю, один раз в месяц или периодически для облегчения или ослабления симптомов этого заболевания. Введение может продолжаться при любом из этих описанных интервалов до ремиссии опухоли или симптомов лимфомы, лейкоза, в отношении которых проводится лечение. Введение может продолжаться после достижения ремиссии или облегчения симптомов, когда такие ремиссия или облегчения пролонгируются таким непрерывным введением.
Это изобретение обеспечивает способ лечения рака предстательной железы, легкого и/или ободочной кишки и/или метастазирования такого рака, предусматривающий введение пациенту, страдающему от рака предстательной железы, легкого и/или ободочной кишки, терапевтически эффективного количества гуманизированного антитела 120v.24 любого из предыдущих вариантов осуществления, причем антитело не конъюгировано с цитотоксической молекулой или детектируемой молекулой. Это антитело будет обычно вводиться в интервале доз от приблизительно 1 мкг/м2 до приблизительно 1000 мкг/м2.
Это изобретение обеспечивает также способ лечения рака предстательной железы, легкого и/или ободочной кишки и/или метастазирования такого рака, предусматривающий введение пациенту, страдающему от рака предстательной железы, легкого и/или ободочной кишки, терапевтически эффективного количества гуманизированного антитела 120v.24 любого из предыдущих вариантов осуществления, причем антитело конъюгировано с цитотоксической молекулой или детектируемой молекулой. Это антитело будет обычно вводиться в интервале доз приблизительно 1 мкг/м2 – приблизительно 1000 мкг/м2.
В одном аспекте, это изобретение дополнительно обеспечивает фармацевтические композиции, содержащие по меньшей мере одно анти-STEAP-1-антитело согласно изобретению и/или по меньшей мере его один иммуноконъюгат и/или по меньшей мере один конъюгат анти-STEAP-1-антитело-лекарственное средство согласно изобретению. В некоторых вариантах осуществления, фармацевтическая композиция содержит 1) анти-STEAP-1-антитело и/или конъюгат анти-STEAP-1-антитело-лекарственное средство и/или его иммуноконъюгат, и 2) фармацевтически приемлемый носитель. В некоторых вариантах осуществления, фармацевтическая композиция содержит 1) анти-STEAP-1-антитело и/или его иммуноконъюгат и, необязательно, 2) по меньшей мере один дополнительный терапевтический агент.
Фармацевтические композиции, содержащие антитело или иммуноконъюгат согласно изобретению или конъюгат антитело-лекарственное средство согласно изобретению готовят для хранения смешиванием этого антитела или конъюгата антитело-лекарственное средство, имеющего желаемую степень чистоты, с необязательными физиологически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)) в форме водных растворов или лиофилизированных или других высушенных композиций. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают в себя буферы, такие как фосфатный, цитратный и содержащий другие органические кислоты; антиоксиданты, включающие в себя аскорбиновую кислоту и метионин; консерванты (такие как хлорид окстадецилдиметилбензиламмония; гексаметонийхлорид; бензалконийхлорид, бензетонийхлорид); фенол, бутиловый или бензиловый спирт; алкилпарабены, такой как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (содержащие приблизительно менее 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие в себя глюкозу, маннозу или декстрины; хелатобразующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как ТВИН™, Плюроники™ или полиэтиленгликоль (ПЭГ). Фармацевтические композиции, подлежащие введению in vivo, обычно являются стерильными. Это легко выполняется фильтрованием через стерильные фильтрационные мембраны.
Активные ингредиенты могут быть также заключены в микрокапсулу, полученную, например, способами коацервации или межфазной полимеризацией, например, гидроксиметилцеллюлозную или желатиновую микрокапсулу и поли(метилметакрилатную) микрокапсулу, соответственно, в коллоидальные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Могут быть приготовлены препараты длительного высвобождения. Подходящие примеры препаратов длительного высвобождения включают в себя полупроницаемые матриксы твердых гидрофобных полимеров, находящиеся в форме сформованных изделий, например, пленок или микрокапсул. Примеры матриксов длительного высвобождения включают в себя полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, недеградируемый этилен-винилацетат, деградируемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочная кислота-гликолевая кислота и лейпролидацетата) и поли-D-(-)-3-гидроксимасляную кислоту. Хотя такие полимеры, как этилен-винилацетат и молочная кислота-гликолевая кислота, высвобождают молекулы в течение более 100 дней, некоторые гидрогели высвобождают белки в течение более коротких периодов времени. Когда инкапсулированные антитела или иммуноконъюгаты остаются в теле в течение длительного времени, они могут денатурироваться или агрегироваться вследствие воздействия влаги при 37°С, что приводит к потере биологической активности и возможным изменениям иммуногенности. Могут быть придуманы рациональные стратегии для стабилизации в зависимости от участвующего механизма. Например, если обнаружено, что механизмом агрегации является образование межмолекулярных связей S-S посредством тиол-дисульфидного взаимопревращения, стабилизация может быть достигнута модификацией сульфгидрильных остатков, лиофилизацией из кислотных растворов, регуляцией содержания влаги, с использованием подходящих добавок и развитием специфических композиций полимерных матриксов.
Варианты терапии с использованием конъюгата антитело-лекарственное средство
Предполагается, что конъюгаты антитело-лекарственное средство (ADC) данного изобретения могут быть использованы для лечения различных заболеваний или нарушений, например, характеризующихся сверхэкспрессией опухолевого антигена. Примерные состояния или гиперпролиферативные нарушения включают в себя доброкачественные или злокачественные опухоли; лейкозные и лимфоидные злокачественные опухоли. Другие включают в себя нейронные, глиальные, астроцитарные, гипоталамусные, гландулярные, макрофагальные, эпителиальные, стромальные, бластоцельные, воспалительные, ангиогенные и иммунологические, в том числе аутоиммунные, нарушения. Другие заболевания включают в себя рак предстательной железы, легкого и ободочной кишки.
Соединения ADC, которые идентифицированы в моделях животных и анализах на основе клеток, могут быть дополнительно тестированы в несущих опухоль высших приматах и клинических испытаниях на человеке. Клинические испытания на человеке могут быть спланированы для испытания эффективности моноклонального анти-STEAP-1-антитела или иммуноконъюгата согласно изобретению у пациентов, испытывающих пролиферативное нарушение предстательной железы, легкого или ободочной кишки, включающих в себя, без ограничения, рак предстательной железы, легкого или ободочной кишки и метастазирование таких типов рака. Это клиническое испытание может быть спланировано для оценки эффективности в комбинациях с известными терапевтическими схемами, такими как лучевая терапия или химиотерапия, включающая в себя известные химиотерапевтические и/или цитотоксические агенты.
Этот рак может содержать STEAP-1-экспрессирующие клетки, так что ADC данного изобретения может быть способен связывать эти раковые клетки. Для определения экспрессии STEAP-1 в раке, доступны различные диагностические/прогностические анализы. В одном варианте осуществления, сверхэкспрессия STEAP-1 может анализироваться при помощи IHC. Залитые в парафин срезы ткани из биопсии опухоли могут быть подвергнуты анализу IHC и предоставлять критерии интенсивности окрашивания белка STEAP-1 в отношении степени окрашивания и в отношении доли испытанных опухолевых клеток.
Для предупреждения или лечения заболевания, подходящая доза ADC будет зависеть от типа подлежащего лечению заболевания, как определено выше, тяжести и хода этого заболевания, от того, вводится ли эта молекула для превентивных или терапевтических целей, предыдущей терапии, клинической истории пациента и реакции на это антитело и от суждения лечащего врача. Эту молекулу вводят подходящим образом пациенту один раз или на протяжении ряда введений. В зависимости от типа и тяжести заболевания, доза приблизительно 1 мкг/кг – 15 мг/кг (например, 0,1-20 мг/кг) молекулы является начальной кандидатной дозой для введения пациенту, например, посредством одного или нескольких отдельных введений или непрерывной инфузией. Типичная суточная доза может находиться в интервале от приблизительно 1 мкг/кг до 100 мг/кг или более, в зависимости от вышеуказанных факторов. Примерная доза для введения пациенту находится в интервале приблизительно 0,1 – приблизительно 1 мкг/кг массы пациента.
Для повторяемых введений на протяжении нескольких дней или более, в зависимости от состояния, лечение поддерживается, пока не происходит желаемая супрессия симптомов заболевания. Примерная схема введения доз предусматривает введение начальной ударной (нагрузочной) дозы приблизительно 4 мг/кг, с последующей еженедельной поддерживающей дозой приблизительно 2 мг/кг анти-STEAP-1-антитела. Могут использоваться другие схемы введения. Прогрессирование этой терапии можно легко подвергать мониторингу при помощи общепринятых способов и анализов.
Комбинированная терапия
Конъюгат антитело-лекарственное средство (ADC) может комбинироваться в виде фармацевтической комбинированной композиции или в схеме введения доз в виде комбинированной терапии, по меньшей мере с одним дополнительным соединением, имеющим противораковые свойства. Это по меньшей мере одно дополнительное соединение фармацевтической комбинированной композиции или схемы введения доз предпочтительно имеет дополняющие активности к ADC этой комбинации, так что они не оказывают вредного влияния друг на друга.
Это по меньшей мере одно дополнительное соединение может быть химиотерапевтическим агентом, цитотоксическим агентом, цитокином, ингибирующим рост фактором, антигормональным агентом и/или защищающим сердце агентом. Такие молекулы предпочтительно присутствуют в комбинации в количествах, которые являются эффективными для предполагаемой цели. Фармацевтическая композиция, содержащая ADC согласно изобретению, может также иметь терапевтически эффективное количество химиотерапевтического агента, такого как ингибитор образования тубулина, ингибитор топоизомеразы или связывающий ДНК агент.
В одном аспекте, первым соединением является анти-STEAP-1-ADC согласно изобретению и по меньшей мере одним дополнительным соединением является терапевтическое антитело, другое, чем анти-STEAP-1-антитело («голое» антитело или ADC). В одном варианте осуществления, по меньшей мере одним дополнительным соединением является анти-PSCA-антитело. В одном варианте осуществления, по меньшей мере одним дополнительным соединением является анти-HER2 антитело, трастуцумаб (например, Herceptin®, Genentech, Inc., South San Francisco, CA). В одном варианте осуществления, по меньшей мере одним дополнительным соединением является анти-HER2-антитело, пертуцумаб (Omnitarg™, Genentech, Inc., South San Francisco, CA, см. US6949245). В одном варианте осуществления, по меньшей мере одним дополнительным антителом является анти-VEGF-антитело (например, Avastin®, Genentech, Inc.). В каждом случае, этим по меньшей мере одним соединением является либо «голое» антитело, либо ADC. В одном варианте осуществления, этим по меньшей мере одним дополнительным антителом является антитело (либо «голое» антитело, либо ADC), а дополнительное антитело является вторым, третьим, четвертым, пятым, шестым антителом или более, так что комбинация такого второго, третьего, четвертого, пятого, шестого или более антител (либо «голых», либо ADC) является эффективной в лечении клеточно-пролиферативного заболевания в ткани, экспрессирующей STEAP-1.
Другие терапевтические схемы введения могут комбинироваться с введением противоракового агента, идентифицированного в соответствии с этим изобретением, в том числе, без ограничения, лучевой терапией и/или трансплантатами костного мозга и периферической крови, и/или введением цитотоксического агента, химиотерапевтического агента или ингибирующего рост фактора. В одном из таких вариантов изобретения, химиотерапевтическим агентом является агент или комбинация агентов, таких как, например, циклофосфамид, гидроксидаунорубицин, адриамицин, доксорубицин, винкристин (Oncovin™), преднизолон, CHOP, CVP или COP или иммунотерапевтические вещества, такие как анти-PSCA, анти-HER2 (например, Herceptin®, Omnitarg™) или анти-VEGF (например, Avastin®). Это комбинированное терапевтическое средство может вводиться в виде одновременной или последовательной схемы введения. При последовательном введении, эта комбинация может вводиться в виде двух или более введений. Это комбинированное введение включает в себя совместное введение с использованием отдельных композиций или единой фармацевтической композиции, и последовательное введение, при котором предпочтительно имеется некоторый период времени, во время которого оба (или все) активные агенты одновременно проявляют их биологические действия.
В одном варианте осуществления, лечение с использованием ADC включает в себя комбинированное введение противоракового агента, идентифицированного здесь, и одного или нескольких химиотерапевтических агентов или ингибирующих рост агентов, в том числе совместное введение коктейлей (смесей) различных химиотерапевтических агентов. Химиотерапевтические агенты включают в себя таксаны (такие как паклитаксел и доцетаксел) и/или антрациклиновые антибиотики. Получение и схемы введения доз для таких химиотерапевтических агентов могут быть использованы в соответствии с инструкциями изготовителя или определены эмпирически квалифицированным практиком. Получение и схемы ввдения доз для такой химиотерапии описаны также в “Chemotherapy Service”, (1992) Ed., M. C. Perry, Williams & Wilkins, Baltimore, Md.
Подходящие дозы для любого из приведенных выше совместно вводимых агентов являются дозами, используемыми в настоящее время, и могут быть понижены вследствие комбинированного действия (синергии) нового идентифицированного агента и других химиотерапевтических агентов или терапий.
Комбинированная терапия может обеспечивать «синергию» и быть «синергической», т.е. эффект, достигаемый при совместном применении этих активных ингредиентов, является большим, чем сумма эффектов, происходящих при применении этих соединений по отдельности. Этот синергический эффект может быть получен, когда эти активные ингредиенты: (1) готовят вместе и вводят или доставляют одновременно в объединенной готовой форме унифицированной стандартной дозы; (2) доставляют чередованием или параллельно в виде отдельных готовых форм; или (3) с использованием некоторой другой схемы. При доставке в виде чередующейся терапии синергическое действие получают, когда эти соединения вводят или доставляют последовательно, например, с использованием разных инъекций в отдельных шприцах. Обычно, во время чередующейся терапии эффективную дозу каждого активного ингредиента вводят последовательно, т.е. серийно, тогда как в комбинированной терапии, эффективные дозы двух или более активных ингредиентов вводят вместе.
Метаболиты конъюгатов антитело-лекарственное средство
В объем согласно изобретению включены также метаболические in vivo продукты ADC-соединений, описанных здесь, в пределах, когда такие продукты являются новыми и неочевидными на протяжении известного уровня техники. Такие продукты могут образовываться, например, из окисления, восстановления, гидролиза, амидирования, этерификации, ферментативного расщепления и т.п. введенного соединения. Таким образом, это изобретение включает в себя новые и неочевидные соединения, образуемые процессом, предусматривающим контактирование соединения согласно изобретению с млекопитающим в течение периода времени, достаточного для образования его метаболического продукта.
Продукты-метаболиты обычно идентифицируют приготовлением радиоактивно меченого (например,14С или3Н) ADC, введением его парентерально в детектируемой дозе (например, в дозе, меньшей приблизительно 0,5 мг/кг) животному, такому как крыса, мышь, морская свинка, обезьяна, или человеку, ожиданием в течение некоторого времени, чтобы произошел метаболизм (обычно приблизительно 30 секунд – 30 часов) и выделением продуктов его превращения из мочи, крови или других биологических проб. Эти продукты легко выделить, так как они являются мечеными (другие продукты выделяют с использованием антител, способных связывать эпитопы, сохраняющиеся в этом метаболите). Структуры метаболитов определяют общепринятым образом, например, при помощи анализа MS (масс-спектрометрии), LC/MS (жидкостной хроматографии с масс-спектрометрическим детектированием) или NMR (ядерного магнитного резонанса). Обычно, анализ метаболитов выполняют таким же образом, что и общепринятые исследования метаболизма лекарственных средств, хорошо известные квалифицированным в данной области специалистам. Продукты превращения, пока они не обнаружены иным образом in vivo, применимы в диагностических анализах для терапевтического введения ADC-соединений согласно изобретению.
Дополнительные способы применения анти-STEAP-1-антител и иммуноконъюгатов
Диагностические способы и способы детектирования
В одном аспекте, анти-STEAP-1-антитела и иммуноконъюгаты согласно изобретению применимы для детектирования присутствия STEAP-1 в биологической пробе. Термин «детектирование» в данном контексте включает в себя количественное и качественное детектирование. В некоторых вариантах осуществления, биологическая проба содержит клетку или ткань. В некоторых вариантах осуществления, такие ткани включают в себя нормальные и/или раковые ткани, которые экспрессируют STEAP-1 при высоких уровнях относительно других тканей, например, предстательной железы, легкого и ободочной кишки.
В одном аспекте, это изобретение обеспечивает способ детектирования присутствия STEAP-1 в биологической пробе. В некоторых вариантах осуществления, этот способ включает в себя контактирование биологической пробы с анти-STEAP-1-антителом при условиях, пермиссивных для связывания анти-STEAP-1-антитела с STEAP-1, и детектирование, образуется ли комплекс между анти-STEAP-1-антителом и STEAP-1.
В одном аспекте, это изобретение обеспечивает способ диагностики нарушения, связанного с увеличенной экспрессией STEAP-1. В некоторых вариантах осуществления, этот способ включает в себя контактирование тест-клетки с анти-STEAP-1-антителом; определение уровня экспрессии (либо количественно, либо качественно) STEAP-1 тест-клеткой детектированием связывания анти-STEAP-1-антитела с STEAP-1 и сравнение уровня экспрессии STEAP-1 тест-клеткой с уровнем экспрессии STEAP-1 контрольной клеткой (например, нормальной клеткой, происходящей из той же самой ткани, из которой происходит тест-клетка, или клеткой, которая экспрессирует STEAP-1 при уровнях, сравнимых с уровнями такой нормальной клетки), причем более высокий уровень экспрессии STEAP-1 тест-клеткой в сравнении с контрольной клеткой указывает на присутствие нарушения, ассоциированного с увеличенной экспрессией STEAP-1. В некоторых вариантах осуществления, эту тест-клетку получают из индивидуума, предположительно имеющего нарушение, ассоциированное с увеличенной экспрессией STEAP-1. В некоторых вариантах осуществления, этим нарушением является клеточно-пролиферативное нарушение, такое как рак или опухоль.
Примерные клеточно-пролиферативные нарушения, которые могут быть диагностированы с использованием антитела согласно изобретению, включают в себя рак предстательной железы, легкого и ободочной кишки или метастазы таких типов рака.
В некоторых вариантах осуществления, способ диагностики или детектирования, такой как описанные выше, предусматривает детектирование связывания анти-STEAP-1-антитела со STEAP-1, экспрессируемым на поверхности клетки или в препарате мембран, полученном из клетки, экспрессирующей STEAP-1 на ее поверхности. В некоторых вариантах осуществления, этот способ предусматривает контактирование клетки с анти-STEAP-1-антителом при условиях, пермиссивных для связывания анти-STEAP-1-антитела со STEAP-1, и детектирование, образуется ли комплекс между анти-STEAP-1-антителом и STEAP-1 на поверхности этой клетки. Примерным анализом для детектирования связывания анти-STEAP-1-антитела со STEAP-1, экспрессируемым на поверхности клетки, является анализ “FACS”.
Некоторые другие способы могут быть использованы для детектирования связывания анти-STEAP-1-антител со STEAP-1. Такие способы включают в себя, но не ограничиваются ими, анализы связывания антигена, которые хорошо известны в данной области, такие как Вестерн-блоттинг, радиоиммуноанализы, ELISA (твердофазный иммуноферментный анализ), “сэндвич”-иммуноанализы, анализы иммунопреципитации, флуоресцентные анализы, белок А-иммуноанализы и иммуногистохимия (INC).
В некоторых вариантах осуществления, анти-STEAP-1-антитела являются мечеными. Метки включают в себя, но не ограничиваются ими, метки или группы молекул, которые детектируются непосредственно (такие как флуоресцентные, хромофорные, метки плотности электронов, хемилюминесцентные и радиоактивные метки), а также части молекул, такие как ферменты или лиганды, которые детектируются опосредованно, например, через ферментативную реакцию или молекулярное взаимодействие. Примерные метки включают в себя, но не ограничиваются ими, радиоизотопы32Р,14C,125I,3H и131I, флуорофоры, такие как хелаты редкоземельных металлов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люцифераза светляка, и бактериальная люцифераза (патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, перокисдазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы, например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, сопряженные с ферментом, который использует пероксид водорода для окисления предшественника-красителя, таким как пероксидаза хрена (HRP), лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, бактериофаговые метки, стабильные свободные радикалы и т.п.
В некоторых вариантах осуществления, анти-STEAP-1-антитела иммобилизованы на нерастворимом матриксе. Иммобилизация влечет за собой отделение анти-STEAP-1-антитела от любого STEAP-1, который остается свободным в растворе. Это обычно выполняют либо переведением в нерастворимую форму анти-STEAP-1-антитела перед процедурой анализа, например, адсорбцией с водорастворимым матриксом или поверхностью (Bennich et al., U.S. 3,720,760), либо ковалентным связыванием (например, с использованием сшивания глутаровым альдегидом), либо переведением в нерастворимую форму анти-STEAP-1-антитела после образования комплекса между анти-STEAP-1-антителом и STEAP-1, например, иммунопреципитацией.
Любой из вышеуказанных вариантов диагностики или детектирования может проводиться с использованием иммуноконъюгата согласно изобретению вместо анти-STEAP-1-антитела или наряду с анти-STEAP-1-антителом.
Терапевтические способы
Антитело или иммуноконъюгат согласно изобретению могут быть использованы, например, в терапевтических способах in vitro, ex vivo и in vivo. В одном аспекте, это изобретение обеспечивает способы ингибирования роста или пролиферации клеток, in vivo или in vitro, причем этот способ предусматривает подвергание клетки действию анти-STEAP-1-антитела или его иммуноконъюгата при условиях, пермиссивных для связывания этого иммуноконъюгата со STEAP-1. “Ингибирование роста или пролиферации клеток” означает уменьшение роста или пролиферации клеток по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100% и включает в себя индукцию смерти клеток. В некоторых вариантах осуществления, эта клетка является клеткой предстательной железы, легкого, ободочной кишки, мочевого пузыря или яичника или клеткой саркомы Юинга. В некоторых вариантах осуществления, эта клетка является ксенотрансплантатом, например, как иллюстрировано здесь.
В одном аспекте, антитело или иммуноконъюгат согласно изобретению используют для лечения или предупреждения клеточно-пролиферативного нарушения клетки предстательной железы, легкого, ободочной кишки, мочевого пузыря или яичника или клетки саркомы Юинга. В некоторых вариантах осуществления, это клеточно-пролиферативное нарушение ассоциировано с увеличенной экспрессией и/или активностью STEAP-1. Например, в некоторых вариантах осуществления, клеточно-пролиферативное нарушение клетки предстательной железы, легкого, ободочной кишки, мочевого пузыря или яичника или клетки саркомы Юинга ассоциировано с увеличенной экспрессией STEAP-1 на поверхности клетки предстательной железы, легкого, ободочной кишки, мочевого пузыря или яичника или клетки саркомы Юинга. В некоторых вариантах осуществления, клеточно-пролиферативным нарушением клетки предстательной железы, легкого, ободочной кишки, мочевого пузыря или яичника или клетки саркомы Юинга является опухоль или рак или метастазирование такого типа рака.
В одном аспекте, это изобретение обеспечивает способы лечения клеточно-пролиферативного нарушения предстательной железы, легкого или ободочной кишки, предусматривающие введение индивидууму эффективного количества анти-STEAP-1-антитела или его иммуноконъюгата. В некоторых вариантах осуществления, способ лечения клеточно-пролиферативного нарушения предстательной железы, легкого или ободочной кишки предусматривает введение индивидууму эффективного количества фармацевтической композиции, содержащей анти-STEAP-1-антитело или анти-STEAP-1-иммуноконъюгат и, необязательно по меньшей мере одного дополнительного терапевтического агента, такого как обеспеченные здесь терапевтические агенты.
В одном аспекте, по меньшей мере некоторые из антител или иммуноконъюгатов согласно изобретению могут связывать STEAP-1 из видов, других чем человек. Таким образом, антитела или конъюгаты согласно изобретению могут быть использованы для связывания STEAP-1, например, в культуре клеток, содержащей STEAP-1, в людях или других млекопитающих, имеющих STEAP-1, с которым антитело или конъюгат согласно изобретению перекрестно реагирует (например, шимпанзе, павиане, игрунке, собакоподобной обезьяне и макаке-резусе, собаке, свинье, крысе и мыши). В одном варианте осуществления, анти-STEAP-1-антитело или иммуноконъюгат могут быть использованы для нацеливания на STEAP-1 клетки предстательной железы, легкого или ободочной кишки контактированием этого антитела или иммуноконъюгата с STEAP-1 с образованием комплекса антитело-антиген или иммуноконъюгат-антиген, так что конъюгированный цитотоксин этого иммуноконъюгата вступает во внутреннее пространство этой клетки. В одном варианте осуществления, STEAP-1, с которым связывается анти-STEAP-1-антитело, является STEAP-1 человека. В одном варианте осуществления, STEAP-1, с которым связывается анти-STEAP-1-антитело, является STEAP-1 собакоподобной обезьяны. В одном варианте осуществления, гуманизированное анти-STEAP-1-антитело связывается с STEAP-1 человека и/или собакоподобной обезьяны.
В одном варианте осуществления, анти-STEAP-1-антитело или иммуноконъюгат могут быть использованы в способе связывания STEAP-1 в индивидууме, страдающем от нарушения, ассоциированного с увеличенной экспрессией или активностью STEAP-1, причем этот способ предусматривает введение этому индивидууму этого антитела или иммуноконъюгата, так что STEAP-1 в этом индивидууме связывается. В одном варианте осуществления, эти связанные антитело или иммуноконъюгат, интернализуются в клетку предстательной железы, легкого, ободочной кишки или яичника или клетку саркомы Юинга, экспрессирующую STEAP-1. В одном варианте осуществления, этот STEAP-1 является STEAP-1 человека и этот индивидуум является индивидуумом-человеком. Альтернативно, этот индивидуум может быть млекопитающим, экспрессирующим STEAP-1, с которым связывается анти-STEAP-1-антитело. Дополнительно, этим индивидуумом является млекопитающее, в которое был введен STEAP-1 (например, введением STEAP-1 или экспрессией трансгена, кодирующего STEAP-1).
Анти-STEAP-1-антитело или иммуноконъюгат могут быть введены человеку для терапевтических целей. Кроме того, анти-STEAP-1-антителоо или иммуноконъюгат могут быть введены млекопитающему, не являющемуся человеком, экспрессирующему STEAP-1, с которым это антитело перекрестно реагирует (например, примату, собаке, свинье, крысе или мыши), для ветеринарных целей или в качестве модели заболевания человека в животном. Что касается последнего примера, такие модели животных могут быть применимы для оценки терапевтической эффективности антител или иммуноконъюгатов согласно изобретению (например, тестирования доз и временных схем введения).
Антитела или иммуноконъюгаты согласно изобретению могут быть использованы либо по отдельности, либо в комбинации с другими композициями в терапии. Например, антитело или иммуноконъюгат согласно изобретению может вводиться вместе по меньшей мере с одним дополнительным терапевтическим агентом и/или адъювантом. В некоторых вариантах осуществления, дополнительным терапевтическим агентом является цитотоксический агент, химиотерапевтический агент или ингибирующий рост агент. В одном из таких вариантов осуществления, химиотерапевтический агент является агентом или комбинацией агентов, таких как, например, циклофосфамид, гидроксидаунорубицин, адриамицин, доксорубицин, винкристин (Oncovin™), преднизолон, CHOP, CVP или COP, или иммунотерапевтические вещества, такие как анти-PSCA, анти-HER2 (см. например, US6824780), анти-VEGF (e.g., Avastin®, Genentech, Inc.), анти-HER2 (например, Herceptin®, Omnitarg™ Genentech, Inc.) или анти-HER2 в комбинации с Taxol® (см., например, BioWorld Today, November 17, 1999, page 1), причем эта комбинированная терапия применима в лечении клеточно-пролиферативных нарушений, рака и/или метастазов рака предстательной железы, легкого и/или ободочной кишки.
Такие комбинированные терапии, указанные выше, включают в себя комбинированное введение (в котором два или более терапевтических агентов включены в одни и те же или отдельные готовые формы) и раздельное введение, в случае котрого введение антитела или иммуноконъюгата согласно изобретению может иметь место до, одновременно и/или после введения дополнительного терапевтического агента и/или адъюванта. Антитела или иммуноконъюгаты согласно изобретению могут быть также использованы в комбинации с лучевой терапией.
Антитело или иммуноконъюгат согласно изобретению (и любой дополнительный терапевтический агент или адъювант) может вводиться любым подходящим способом, в том числе парентеральным, подкожным, внутрибрюшинным, внутрилегочным и интраназальным, и, если желательно, для локального лечения, введением в повреждение. Парентеральные инфузии включают в себя внутримышечное, внутривенное, интраартериальное, внутрибрюшинное или подкожное введение. Кроме того, это антитело или иммуноконъюгат вводят подходящим образом импульсной инфузией, в частности, с уменьшающимися дозами антитела или иммуноконъюгата. Введение доз может выполняться любым подходящим способом, например, инъекциями, такими как внутривенные или подкожные инъекции, зависящими отчасти от того, является это введение кратковременным или долгосрочным.
Антитела или иммуноконъюгаты согласно изобретению могут быть приготовлены, дозированы и введены способами, согласующимися с хорошей медицинской практикой. Факторы, которые должны учитываться в этом контексте, включают в себя конкретное подлежащее лечению нарушение, конкретное проходящее лечение млекопитающее, клиническое состояние пациента, причину нарушения, участок доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам. Эти антитело или иммуноконъюгат готовят, но необязательно, с одним или несколькими агентами, используемыми в настоящее время для предотвращения или лечения рассматриваемого нарушения. Эффективное количество таких других агентов зависит от количества антитела или иммуноконъюгата, присутствующего в готовой форме, типа нарушения или лечения и других факторов, обсуждаемых выше. Их обычно используют в тех же дозах и с использованием таких же способов введения, которые описаны здесь, или приблизительно в интервале 1-99% описанных здесь доз или в любой дозе и при помощи любого способа введения, которые определены эмпирически/клинически как подходящие.
Для предотвращения или лечения заболевания, подходящая доза антитела или иммуноконъюгата согласно изобретению (при использовании отдельно или в комбинации с одним или несколькими дополнительными терапевтическими агентами, такими как химиотерапевтические агенты) будет зависеть от типа подлежащего лечению заболевания, типа антитела или иммуноконъюгата, тяжести и хода этого заболевания, от того, вводят это антитело или иммуноконъюгат для превентивных или терапевтических целей, предшествующей терапии, клинической истории пациента и реакции на это антитело или иммуноконъюгат и от суждения лечащего врача. Это антитело или иммуноконъюгат вводят подходящим образом пациенту один раз или на протяжении ряда введений. В зависимости от типа и тяжести заболевания, доза приблизительно 1 мкг/кг – 100 мг/кг (например, 0,1-20 мг/кг) антитела или иммуноконъюгата может быть начальной кандидатной дозой для введения пациенту, например, посредством одного или нескольких отдельных введений или непрерывной инфузией. Одна типичная суточная доза может находиться в интервале от приблизительно 1 мкг/кг до 100 мг/кг или более, в зависимости от вышеуказанных факторов. Для повторяемых введений на протяжении нескольких дней или более, в зависимости от состояния, лечение обычно поддерживается, пока не происходит желаемая супрессия симптомов заболевания. Одна примерная доза антитела или иммуноконъюгата могла бы находиться в интервале от приблизительно 0,05 мкг/кг до приблизительно 10 мг/кг. Таким образом, одна или несколько доз приблизительно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или любая их комбинация) антитела или иммуноконъюгата может быть введена пациенту. Такие дозы могут вводиться периодически, например, каждую неделю или каждые три недели (например, таким образом, что пациент получает приблизительно две – приблизительно двадцать или, например, приблизительно шесть доз этого антитела или иммуноконъюгата). Может быть введена начальная более высокая ударная (нагрузочная) доза с последующими одной или несколькими более низкими дозами. Примерная схема введения доз предусматривает введение начальной загрузочной дозы приблизительно 4 мг/кг, с последующей еженедельной поддерживающей дозой приблизительно 2 мг/кг антитела. Однако, могут быть использованы другие схемы введения доз. Прогрессирование этой терапии может быть легко подвергнуто мониторингу с использованием общепринятых способов и анализов.
Анализы
Анти-STEAP-1-антитела и иммуноконъюгаты согласно изобретению могут быть охарактеризованы в отношении их физических/химических свойств и/или биологических активностей при помощи различных анализов, известных в данной области.
Анализы активности
В одном аспекте, обеспечены анализы для идентификации анти-STEAP-1-антител или их иммуноконъюгатов, имеющих биологическую активность. Биологическая активность может включать в себя, например, способность ингибировать рост или пролиферацию клеток (например, активность “уничтожения клеток”) или способность индукции смерти клеток, в том числе программированной смерти клеток (апоптоза). Обеспечены также антитела или иммуноконъюгаты, имеющие такую биологическую активность in vivo и/или in vitro.
В некоторых вариантах осуществления, анти-STEAP-1-антитело или его иммуноконъюгат тестируют на его способность ингибировать рост или пролиферацию клеток in vitro. Анализы на ингибирование роста или пролиферации клеток хорошо известны в данной области. Некоторые анализы на пролиферацию клеток, иллюстрированные анализами “уничтожения клеток”, описанными здесь, измеряют жизнеспособность клеток. Одним подобным анализом является люминесцентный анализ жизнеспособности клеток CellTiter-Glo™, который коммерчески доступен из Promega (Madison, WI). Этот анализ определяет количество жизнеспособных клеток в культуре на основе количественного определения присутствующего АТФ, который является показателем метаболически активных клеток. См. Crouch et al (1993) J. Immunol. Meth. 160:81-88, Патент США № 6602677. Этот анализ может проводиться в 96- или 384-луночном формате, что делает его пригодным для автоматизированного высокопроизводительного скрининга (HTS). См. Cree et al (1995) Anticancer Drugs 6:398-404. Процедура этого анализа включает в себя добавление единственного реагента (реагента CellTiter-Glo®) непосредственно к культивируемым клеткам. Это приводит к лизису клеток и генерированию люминесцентного сигнала, продуцируемого люциферазной реакцией. Этот люминесцентный сигнал пропорционален количеству жизнеспособных клеток, присутствующих в культуре. Данные могут регистрироваться люминометром или устройством визуализации с камерой CCD. Выход люминесценции выражают в виде относительных световых единиц (RLU).
Другим анализом на пролиферацию клеток является анализ “MTT”, колориметрический анализ, который измеряет окисление бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия в формазан митохондриальной редуктазой. Подобно анализу CellTiter-Glo™, этот анализ измеряет количество метаболически активных клеток, присутствующих в культуре клеток. См., например, Mosmann (1983) J. Immunol. Meth. 65:55-63 и Zhang et al. (2005) Cancer Res. 65:3877-3882.
В одном аспекте, анти-STEAP-1-антитело тестируют на его способность индуцировать смерть клеток in vitro. Анализы на индукцию смерти клеток хорошо известны в данной области. В некоторых вариантах осуществления, такие анализы измеряют, например, потерю целостности мембраны, которую обнаруживают по поглощению иодида пропидия (PI), трипанового синего (см. Moore et al. (1995) Cytotechnology, 17: 1-11) или 7AAD. В примерном анализе поглощения PI, клетки культивируют в модифицированной по способу Дульбекко среде Игла (D-MEM):Ham F-12 (50:50), дополненной 10% инактивированной нагреванием ФТС (Hyclone) и 2 мМ L-глутамином. Таким образом, этот анализ выполняют в отсутствие комплемента и иммунных эффекторных клеток. Клетки высевают при плотности 3 × 106 на чашках 100 × 20 мм и дают им прикрепляться в течение ночи. Среду удаляют и заменяют только свежей средой или средой, содержащей различные концентрации этого антитела или иммуноконъюгата. Клетки инкубируют в течение 3-дневного периода. После обработки монослои промывают ЗФР и отделяют трипсинизацией. Затем клетки центрифугируют при 1200 об/мин в течение 5 минут при 4ºC, осадок ресуспендируют в 3 мл холодного Ca2+-связывающего буфера (10 мМ Hepes, pH 7,4, 140 мМ NaCl, 2,5 мМ CaCl2) и помещают в виде аликвот в закрытые фильтром 35 мм пробирки 12 × 75 мм (1 мл на пробирку, 3 пробирки на группу обработки) для удаления скоплений клеток. Затем в пробирку добавляют PI (10 мкг/мл). Пробы анализируют с использованием проточного цитометра FACSCAN™ и программного обеспечения FACSCONVERT™ CellQuest (Becton Dickinson). Таким образом идентифицируют антитела или иммуноконъюгаты, которые индуцируют статистически значимые уровни смерти клеток.
В одном аспекте, анти-STEAP-1-антитело или иммуноконъюгат тестируют на его способность индуцировать апоптоз (программированную смерть клеток) in vitro. Примерным анализом на антитела или иммуноконъюгаты, которые индуцируют апоптоз, является анализ связывания аннексина. В примерном анализе связывания аннексина, клетки культивируют и высевают в чашках, как обсуждалось в предыдущем абзаце. Эту среду удаляют и заменяют только свежей средой или средой, содержащей 0,001-10 мкг/мл этого антитела или иммуноконъюгата. После трехдневного инкубационного перода, монослои промывают ЗФР и отделяют трипсинизацией. Затем клетки центрифугируют, ресуспендируют в Ca+-связывающем буфере и помещают в виде аликвот в пробирки, как обсуждалось в предыдущем абзаце. Затем к ним добавляют меченый аннексин (например, аннексин V-FITC) (1 мкг/мл). Пробы анализируют с использованием проточного цитометра FACSCAN™ и программного обеспечения FACSCONVERT™ CellQuest (Becton Dickinson). Таким образом идентифицируют антитела или иммуноконъюгаты, которые индуцируют статистически значимые уровни связывания аннексина относительно контроля. Другим примерным анализом на антитела или иммуноконъюгаты, которые индуцируют апоптоз, является колориметрический анализ ELISA для гистонов ДНК для детектирования межнуклеосомной деградации геномной ДНК. Такой анализ может выполняться с использованием, например, набора для ELISA для детектирования смерти клеток (Roche, Palo Alto, CA).
Клетки для использования в любом из описанных выше анализов in vitro включают в себя клетки или клеточные линии, которые природно экспрессируют STEAP-1 или которые были сконструированы для экспрессии STEAP-1. Такие клетки включают в себя опухолевые клетки, которые сверхэкспрессируют STEAP-1 относительно нормальных клеток, происходящих из той же самой ткани. Такие клетки включают в себя линии клеток (в том числе линии опухолевых клеток), которые экспрессируют STEAP-1, и линии клеток, которые в норме не экспрессируют STEAP-1, но были трансфицированы нуклеиновой кислотой, кодирующей STEAP-1.
В одном аспекте, анти-STEAP-1-антитело или его иммуноконъюгат тестируют на его способность ингибировать рост и пролиферацию клеток in vivo. В некоторых вариантах осуществления, анти-STEAP-1-антитело или его иммуноконъюгат тестируют на его способность ингибировать рост опухолей in vivo. Модельные системы in vivo, такие как модели ксенотрансплантатов, могут быть использованы для такого тестирования. В примерной системе ксенотрансплантата, опухолевые клетки человека вводят в иммунокомпрометированное подходящим образом животное (не являющееся человеком), например, в мышь SCID. Этому животному вводят антитело или иммуноконъюгат согласно изобретению. Измеряют способность этого антитела или иммуноконъюгата ингибировать или уменьшать рост опухоли. В некоторых вариантах осуществления вышеуказанной системы ксенотрансплантата опухолевыми клетками человека являются опухолевые клетки пациента-человека. Такие клетки, применимые для приготовления моделей с ксенотрансплантатом, включают в себя линии опухолевых клеток предстательной железы, легкого или ободочной кишки человека., которые включают в себя, без ограничения, клетки PC3, экспрессирующие экзогенный STEAP-1, и клетки, природно экспрессирующие STEAP-1, которые включают в себя, без ограничения, клетки LnCAP (Southern Research Institute, Birmingham, AL), клетки LuCAP 77 и клетки LuCAP35V (University of Washington, Seattle, WA). В некоторых вариантах осуществления, опухолевые клетки вводят в подходящим образом иммунокомпрометированного (иммунодефектного) животного подкожной инъекцией или трансплантацией в подходящем участке, таком как жировое скопление млекопитающего.
Анализы связывания и другие анализы
В одном аспекте, анти-STEAP-1-антитело тестируют на его антигенсвязывающую активность. Например, в некоторых вариантах осуществления, анти-STEAP-1-антитело тестируют на его способность связываться с экзогенным или эндогенным STEAP-1, экспрессируемым на поверхности клетки. Для такого тестирования может быть использован анализ FACS.
В одном аспекте, может быть использован конкурентный анализ для идентификации моноклонального антитела, которое конкурирует с антителом 120-трансплантат или его гуманизированными вариантами, в том числе, без ограничения, антителом 120v.24, за связывание с STEAP-1. В некоторых вариантах осуществления, такое конкурирующее антитело связывается с тем же самым эпитопом (например, линейным эпитопным пептидом или конформационным эпитопом, образованным экспрессией STEAP-1 на поверхности клетки), который связан с антителом 120-трансплантат, или гуманизированным антителом 120-трансплантат, в том числе вариантным гуманизированным анти-STEAP-1-антителом 120v.24. Примерные конкурентные анализы включают в себя, но не ограничиваются ими, рутинные анализы, такие как анализы, обеспеченные в Harlow and Lane (1988) Antibodies: A Laboratory Manual ch.14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY). Подробные конкурентные анализы для картирования эпитопа, с которым связывается антитело, обеспечены в Morris (1996) "Epitope Mapping Protocols," in Methods in Molecular Biology vol. 66 (Humana Press, Totowa, NJ). Говорят, что два антитела связываются с одним и тем же эпитопом, если каждый из них блокирует связывание другого на 50% или более.
В примерном конкурентном анализе, иммобилизованный STEAP-1 инкубируют в растворе, содержащем первое меченое антитело, которое связывается с STEAP-1 (например, мышиным антителом 120.545, антителом 120-трансплант) и вторым немеченым антителом, которое тестируется на его способность конкурировать с этим первым антителом с STEAP-1. Это второе антитело может присутствовать в супернатанте гибридомы. В качестве контроля, иммобилизованный STEAP-1 инкубируют в растворе, содержащем первое меченое антитело, но не второе немеченое антитело. После инкубации при условиях, пермиссивных для связывания первого антитела с STEAP-1, избыток несвязавшегося антитела удаляют и измеряют количество метки, ассоциированной с иммобилизованным STEAP-1. Если количество метки, ассоциированное с иммобилизованным STEAP-1, существенно уменьшается в тест-пробе относительно контрольной пробы, то это указывает на то, что второе антитело конкурирует с первым антителом за связывание с STEAP-1. В некоторых вариантах осуществления, иммобилизованный STEAP-1 присутствует на поверхности клетки или в препарате мембран, полученном из клетки, экспрессирующей STEAP-1 на ее поверхности.
В одном аспекте, очищенные анти-STEAP-1-антитела могут быть дополнительно охарактеризованы при помощи ряда анализов, включающих в себя, но не ограничивающихся ими, N-концевое секвенирование, аминокислотный анализ, неденатурирующая вытеснительная жидкостная хроматография высокого давления (ВЖХ), масс-спектрометрия, ионообменная хроматография и расщепление папаином.
В одном варианте осуществления, это изобретение рассматривает измененное антитело, которое имеет некоторые, но не все эффекторные функции, которые делают его желаемым кандидатом для многих применений, в которых важным является время полужизни in vivo, но некоторые эффекторные функции (такие как комплемент и ADCC) являются необязательными или вредными. В некоторых вариантах осуществления, измеряют Fc-активности этого антитела для гарантии того, что сохраняются только желаемые свойства. Могут проводиться анализы цитотоксичности in vitro и/или in vivo для подтверждения уменьшения/истощения активностей CDC и/или ADCC. Например, могут проводиться анализы связывания Fc-рецептора для гарантии того, что это антитело лишено связывания FcγR (следовательно, лишено, вероятно, активности ADCC), но сохраняет способность связывания FcRn. Первичные клетки для опосредования ADCC, NK-клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках суммирована в таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991). Один пример анализа in vitro для оценки активности ADCC представляющей интерес молекулы описан в Патентах США № 5,500,362 или № 5,821,337. Применимые эффекторные клетки для таких анализов включают в себя мононуклеарные клетки периферической крови (PBMC) и природные клетки-киллеры (NK). Альтернативно или дополнительно, активность ADCC представляющей интерес молекулы может быть оценена in vivo, например, в модели животного, такой как модель животного, описанная в Clynes et al. PNAS (USA) 95:652-656 (1998). Анализы связывания C1q могут также проводиться для подтверждения, что это антитело неспособно связывать C1q и, следовательно, лишено активности CDC. Для оценки активации комплемента, может быть выполнен анализ CDC, например, описанный в Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996). Могут быть также выполнены определения связывания FcRn и клиренс/время полужизни in vivo с использованием способов, известных в данной области.
ПРИМЕРЫ
Далее следуют примеры способов и композиций согласно изобретению. Понятно, что могут практиковаться другие варианты осуществления при условии обеспеченного выше общего описания.
Пример 1: Получение гуманизированных анти-STEAP-1-антител
Молекулы нуклеиновых кислот, кодирующие варианты аминокислотной последовательности этого антитела, фрагмента антитела, VL-домена или VH-домена получают различными способами, известными в данной области. Эти способы включают в себя, но не ограничиваются ими, выделение из природного источника (в случае природно-встречающихся вариантов аминокислотной последовательности) или получение олигонуклеотид-опосредованным (или сайт-направленным) мутагенезом, ПЦР-мутагенезом и кассетным мутагенезом ранее полученного варианта или невариантной версии этого антитела, фрагмента антитела, VL-домена или VH-домена. Например, могут быть созданы библиотеки с мишенью VL-доступных положений аминокислот в VH, и необязательно в одном или нескольких CDR, для замены аминокислот вариантными аминокислотами с использованием способа Кункеля. См., например, Kunkel et al., Methods Enzymol. (1987), 154:367-382 и примеры в этой статье. Генерирование рандомизированных последовательностей описано также ниже в примерах.
Эта последовательность олигонуклеотидов включает в себя один или несколько сконструированных наборов кодонов для конкретного положения в CDR (HVR) или FR-районе полипептида согласно изобретению. Набор кодонов является набором различных триплетных последовательностей нуклеотидов, используемым для кодирования вариантных аминокислот. Наборы кодонов могут быть представлены с использованием символов для обозначения конкретных нуклеотидов или эквимолярных смесей нуклеотидов, показанных ниже, в соответствии с кодом IUB.
КОДЫ IUB
G Гуанин
A Аденин
T Тимин
C Цитозин
R (A или G)
Y (C или T)
M (A или C)
K (G или T)
S (C или G)
W (A или T)
H (A или C или T)
B (C или G или T)
V (A или C или G)
D (A или G или T)
N (A или C или G или T)
Например, в наборе кодонов DVK, D может быть нуклеотидами A или G или T; V может быть A или G или C; и K может быть G или T. Этот набор кодонов может представлять 18 различных кодонов и может кодировать аминокислоты Ala, Trp, Tyr, Lys, Thr, Asn, Lys, Ser, Arg, Asp, Glu, Gly и Cys.
Наборы олигонуклеотидов или праймеров могут быть синтезированы с использованием стандартных способов. Например, может быть синтезирован твердофазным синтезом набор олигонуклеотидов, содержащий последовательности, которые представляют все возможные комбинации триплетов нуклеотидов, обеспечиваемых этим набором кодонов, и которые будут кодировать желаемую группу аминокислот. Синтез олигонуклеотидов с «вырожденностью» выбранного нуклеотида в определенных положениях хорошо известен в данной области. Такие наборы нуклеотидов, имеющие определенные наборы кодонов, могут быть синтезированы с использованием коммерческих синтезаторов нуклеиновых кислот (доступных, например, из Applied Biosystems, Foster City, CA), или могут быть получены коммерчески (например, из Life Technologies, Rockville, MD). Таким образом, набор синтезированных олигонуклеотидов, имеющих конкретный набор кодонов, будет обычно включать в себя множество олигонуклеотидов с различными последовательностями, причем эти различия устанавливаются набором кодонов в полной последовательности. Олигонуклеотиды, используемые в соответствии с этим изобретением, имеют последовательности, которые делают возможной гибридизацию с матрицей, нуклеиновой кислотой вариабельного домена, а также могут включать в себя сайты рестрикционных ферментов (рестриктаз) для целей клонирования.
В одном способе, последовательности нуклеиновых кислот, кодирующие вариантные аминокислоты, могут быть созданы олигонуклеотид-опосредованным мутагенезом. Этот способ хорошо известен в данной области, например, описанный Zoller et al, 1987, Nucleic Acids Res. 10:6487-6504. Вкратце, последовательности нуклеиновых кислот, кодирующие вариантные аминокислоты, создают гибридизацией набора олигонуклеотидов, кодирующих желаемые наборы кодонов, с ДНК-матрицей, где эта матрица является одноцепочечной формой плазмиды, содержащей матричную последовательность нуклеиновой кислоты вариабельной области. После гибридизации, используют ДНК-полимеразу для синтеза полной второй комплементарной цепи этой матрицы, которая будет, следовательно, включать в себя этот олигонуклеотидный праймер и будет содержать наборы кодонов, обеспеченные этим олигонуклеотидным набором.
Обычно, используют олигонуклеотиды с длиной по меньшей мере 25 нуклеотидов. Оптимальный олигонуклеотид будет иметь 12-15 нуклеотидов, которые полностью комплементарны матрице на любой стороне нуклеотида (нуклеотидов), кодирующих эту мутацию (эти мутации). Это гарантирует то, что данный олигонуклеотид будет гибридизоваться правильно с одноцепочечной матричной молекулой ДНК. Эти олигонуклеотиды легко синтезируются с использованием способов, известных в данной области, таких как способы, описанные Crea et al, Proc. Nat'l. Acad. Sci. USA, 75:5765 (1978).
Эту ДНК-матрицу генерируют при помощи векторов, которые либо произведены из векторов бактериофага М13 (пригодны коммерчески доступные векторы M13mpl8 и M13mpl9), либо при помощи векторов, которые содержат одноцепочечный сайт инициации репликации фага, описанных Viera et al., Meth. Enzymol., 153:3 (1987). Таким образом, DNA, которая должна быть мутирована, может быть встроена в один из этих векторов для генерирования одноцепочечной матрицы. Получение одноцепочечной матрицы описано в разделах 4.21-4.41 Sambrook et al., выше.
Для изменения природной ДНК-последовательности этот олигонуклеотид гибридизуют с одноцепочечной матрицей при подходящих условиях гибридизации. Затем добавляют ДНК-полимеризующий фермент, обычно ДНК-полимеразу Т7 или фрагмент Кленова ДНК-полимеразы I, для синтеза комплементарной цепи этой матрицы с использованием олигонуклеотида в качестве праймера для синтеза. Таким образом образуется гетеродуплексная молекула, так что одна цепь ДНК кодирует мутированную форму гена 1, а другая цепь (первоначальная матрица) кодирует природную, неизмененную последовательность гена 1. Эту гетеродуплексную молекулу трансформируют затем в подходящую клетку-хозяина, обычно прокариот, такой как E. coli JM101. После выращивания этих клеток их высевают на чашки с агарозой и подвергают скринингу с использованием олигонуклеотидного праймера, радиоактивно меченого 32-фосфатом, для идентификации бактериальных колоний, которые содержат мутированную ДНК.
Описанный непосредственно выше способ может быть модифицирован таким образом, что создается гомодуплексная молекула, в которой обе цепи этой плазмиды содержат мутацию (мутации). Эти модификации являются следующими. Одноцепочечный олигонуклеотид отжигают с одноцепочечной матрицей, как описано выше. Смесь трех дезоксирибонуклеотидов, дезоксирибоаденозина (dATP), дезоксирибогуанозина (dGTP) и дезоксириботимидина (dTT) объединяют с модифицированным тиодезоксирибоцитозином, названным dCTP-(aS) (который может быть получен из Amersham). Эту смесь добавляют к комплексу матрица-олигонуклеотид. После добавления ДНК-полимеразы к этой смеси, генерируют цепь ДНК, идентичную этой матрице, за исключением мутированных оснований. Кроме того, эта новая цепь ДНК будет содержать dCTP-(aS) вместо dCTP, который служит для защиты ее от расщепления рестрикционной эндонуклеазой. После разрыва цепи матрицы двухцепочечного гетеродуплекса подходящим рестрикционным ферментом, эта цепь матрицы может быть расщеплена нуклеазой ExoIII или другой подходящей нуклеазой после района, который содержит сайт (сайты), которые должны быть мутагенизированы. Затем эту реакцию останавливают с оставлением молекулы, которая является только частично одноцепочечной. Затем образуют полностью двухцепочечный ДНК-гомодуплекс с использованием ДНК-полимеразы в присутствии всех четырех дезоксирибонуклеотидтрифосфатов, АТФ и ДНК-лигазы. Затем эта гомодуплексная молекула может быть трансформирована в подходящую клетку-хозяина.
Как было указано ранее, последовательность набора олигонуклеотидов имеет достаточную длину для гибридизации с нуклеиновой кислотой-матрицей, а также может, но не обязательно, содержать сайты рестрикции. Эта ДНК-матрица может быть генерирована векторами, которые произведены либо из векторов бактериофага М13, либо из векторов, которые содержат одноцепочечный сайт инициации репликации фага, как описано Viera et al. ((1987) Meth. Enzymol., 153:3). Таким образом, ДНК, которая должна быть мутирована, должна быть встроена в один из этих векторов для генерирования одноцепочечной матрицы. Получение одноцепочечной матрицы описано в разделах 4.21-4.41 Sambrook et al., supra.
Согласно другому способу, может быть генерирована библиотека обеспечением наборов левых и правых олигонуклеотидов, причем каждый набор имеет множество олигонуклеотидов с различными последовательностями, где эти различные последовательности устанавливаются наборами кодонов, обеспеченными в последовательности этих олигонуклеотидов. Наборы левых и правых олигонуклеотидов, вместе с последовательностью матричной нуклеиновой кислоты вариабельного домена, могут быть использованы в полимеразной цепной реакции для генерирования «библиотеки» продуктов ПЦР. Эти продукты ПЦР могут называться «кассетами нуклеиновых кислот», так как они могут быть слиты с другими родственными или неродственными последовательностями нуклеиновых кислот, например, белков оболочки вируса и доменов димеризации, с использованием установленных способов молекулярной биологии.
Наборы олигонуклеотидов могут быть использованы в полимеразной цепной реакции с использованием матричной последовательности нуклеиновой кислоты вариабельного домена в качестве матрицы для создания кассет нуклеиновых кислот. Матричной последовательностью нуклеиновой кислоты вариабельного домена может быть любая часть тяжелых цепей иммуноглобулина, содержащих последовательности-мишени нуклеиновых кислот (т.е. последовательности нуклеиновых кислот, кодирующие аминокислоты, являющиеся мишенями для замены). Матричная последовательность нуклеиновой кислоты вариабельного домена является частью двухцепочечной молекулы ДНК, имеющей первую цепь нуклеиновой кислоты и комплементарную вторую цепь нуклеиновой кислоты. Матричная последовательность нуклеиновой кислоты вариабельного домена содержит по меньшей мере часть вариабельного домена и имеет по меньшей мере один CDR. В некоторых случаях, матричная последовательность нуклеиновой кислоты вариабельного домена содержит более чем один CDR. Левая часть и правая часть матричной последовательности нуклеиновой кислоты вариабельного домена может быть мишенью для гибридизации с членами набора левых олигонуклеотидов и набора правых олигонуклеотидов.
Первый олигонуклеотид набора левых праймеров может гибридизоваться с первой цепью нуклеиновой кислоты, а второй олигонуклеотид набора правых праймеров может гибридизоваться со второй цепью нуклеиновой кислоты. Эти олигонуклеотидные праймеры могут включать в себя один или несколько наборов кодонов и быть сконструированы для гибридизации с частью матричной последовательности нуклеиновой кислоты вариабельного района. Применение этих олигонуклеотидов может вводить два или более наборов кодонов в продукт ПЦР (т.е. кассету нуклеиновых кислот) после ПЦР. Олигонуклеотидный праймер, который гибридизуется с районами последовательности нуклеиновой кислоты, кодирующими вариабельный домен антитела, включает в себя части, которые кодируют остатки CDR, которые являются мишенями для аминокислотной замены.
Наборы левых и правых олигонуклеотидов могут быть также синтезированы для включения сайтов рестрикции в этой олигонуклеотидной последовательности. Эти сайты рестрикции могут облегчать встраивание кассет нуклеиновых кислот (т.е. продуктов ПЦР-реакции) в экспрессирующий вектор, имеющий дополнительную последовательность антитела. В одном варианте осуществления, конструируют сайты рестрикции для облегчения клонирования кассет нуклеиновых кислот без введения посторонних последовательностей нуклеиновых кислот или удаления первоначальных CDR или каркасных последовательностей нуклеиновых кислот.
Кассеты нуклеиновых кислот могут быть клонированы в любой подходящий вектор для экспрессии части или полной последовательности легкой или тяжелой цепи, содержащей аминокислотные замены-мишени, генерированные с использованием ПЦР-реакции. Согласно способам, подробно описанным в этом изобретении, кассету нуклеиновых кислот клонируют в вектор, позволяющий продуцировать часть последовательности или полную последовательность легкой или тяжелой цепи, слитые со всем белком оболочки вируса или частью белка оболочки вируса (т.е. создавать слитый белок), и представляют на поверхности частицы или клетки. Хотя несколько типов векторов доступны и могут использоваться для применения на практике согласно изобретению, предпочтительными векторами для применения здесь, являются фагмидные векторы, так как они могут быть относительно легко сконструированы и могут быть легко амплифицированы. Фагмидные векторы содержат различные компоненты, в том числе промоторы, сигнальные последовательности, гены фенотипического отбора, сайты инициации репликации и другие необходимые компоненты, как известно специалистам с обычной квалификацией в данной области.
Когда должна быть экспрессирована конкретная комбинация вариантных аминокислот, кассета нуклеиновых кислот содержит последовательность, которая способна кодировать весь вариабельный домен тяжелой или легкой цепи или часть вариабельного домена тяжелой или легкой цепи, и способна кодировать эти комбинации вариантных аминокислот. Для получения антител, содержащих эти вариантные аминокислоты или комбинации вариантных аминокислот, как и в библиотеке, эти кассеты нуклеиновых кислот могут быть инсертированы в экспрессирующий вектор, содержащий дополнительную последовательность антитела, например, полные вариабельные домены и константные домены или части вариабельных доменов и константных доменов вариабельных областей легкой и тяжелой цепи. Эти дополнительные последовательности антител могут быть также слиты с другими последовательностями нуклеиновых кислот, такими как последовательности, которые кодируют белки оболочки вируса и, следовательно, позволяют продуцировать слитый белок.
Здесь описана гуманизация мышиного анти-STEAP-1-антитела.
Материалы и способы
Номера остатков являются номерами в соответствии с Кабат (Kabat et ah, Sequences of proteins of immunological interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Используются однобуквенные аббревиатуры аминокислот. Вырожденности ДНК представлены с использованием кода IUB (N=A/C/G/T, D=A/G/T, V=A/C/G, B=C/G/T, H=A/C/T, K=G/T, M=A/C, R=A/G, S=G/C, W=A/T, Y=C/T).
Клонирование вариабельных доменов мышиного антитела 120 и генерирование химерного антитела 120 – Тотальную РНК экстрагировали из гибридомных клеток, продуцирующих M2-120.545 (означаемый здесь как “мышиный 120” или “mu120”) с использованием стандартных способов. Вариабельные легкие (VL) и вариабельные тяжелые (VH) домены амплифицировали с использованием ОТ-ПЦР с вырожденными праймерами к тяжелой и легкой цепям. Прямые праймеры были специфичными в отношении N-концевой аминокислотной последовательности районов VL и VH. Соответственно, обратные праймеры LC и HC конструировали для отжига с районом в константном легком (CL) и константном тяжелом домене 1 (CH1), которые являются высококонсервативными среди видов. Амплифицированные VL и VH клонировали в экспрессирующие векторы млекопитающих. Полинуклеотидную последовательность инсерта определяли с использованием рутинных способов секвенирования. Аминокислотные последовательности VL и VH M2-120.545 (“mu 120”) показаны на фигурах 2A и 2B, соответственно.
Генерирование 120-химеры мышиного антитела – Химерное анти-STEAP-1-антитело получали слиянием вариабельных тяжелых (VH) и вариабельных легких (VL) районов мышиного антитела 120 с константными доменами IgG человека. Полученное антитело означают здесь как “химера 120”, “химерный IgG 120” или “Fc-химера”.
Прямые трансплантаты гипервариабельного района на акцепторный консенсусный каркас человека – Варианты, сконструированные во время гуманизации мышиного антитела 120, оценивали в виде белка в форме IgG или в виде Fab, представленного на фаге.
Фагмидой, используемой для этого исследования, является моновалентный дисплей-вектор Fab-g3, и он состоит из двух открытых рамок считывания под контролем промотора phoA. Первая открытая рамка считывания состоит из сигнальной последовательности stII, слитой с доменами VL и CH1 акцепторной легкой цепи, а вторая состоит из сигнальной последовательности stII, слитой с доменами VH и CH1 акцепторной тяжелой цепи, за которыми следует минорный белок оболочки фага P3.
Домены VL и VH из мышиного 120 сопоставляли с консенсусными последовательностями VL каппа I человека (huKI) и VH подгруппы III человека (huIII). Для получения CDR-трансплантатов, гипервариабельные районы из мышиного антитела 120 трансплантировали в акцепторные каркасы huKI и huIII.
Гипервариабельные районы из мышиного антитела 120 (mu120) встраивали в акцепторный консенсусный каркас человека для генерирования прямого CDR-трансплантата (называемого здесь “120-трансплантат” или “трансплантат 120”). В VL-домене в консенсусный акцептор человека трансплантировали следующие районы: положения 24-34 (L1), 50-56 (L2) и 89-97 (L3). В VH-домене трансплантировали положения 26-35a (H1), 49-65 (H2) и 95-102 (H3). Эти последовательности вариабельных областей легкой и тяжелой цепей трансплантата 120 показаны на фигурах 2А-2В. Эти CDR (также называемые здесь как HRV) показаны в боксах (фигуры 2А-2В). Эти определения CDR включают в себя положения, определяемые их гипервариабельностью последовательности (ссылка Kabat), их структурным положением (ссылка Chothia) и их участием в контактах антиген-антитело (MacCallum et al. J. Mol. Biol. 262: 732-745 (1996)).
Варианты прямых трансплантатов, экспрессируемые в виде Fab, представленных на фаге или в виде IgG, генерировали с использованием мутагенеза Кункеля с использованием отдельных олигонуклеотидов для каждого гипервариабельного района. Правильные клоны оценивали секвенированием ДНК.
Генерирование гуманизированных фаговых вариантов 120 – Гуманизированные варианты 120 генерировали в виде Fab, представленных на фаге, с использованием мутагенеза Кункеля. Фосфорилированный олигонуклеотид добавляли к 300 нг матрицы Кункеля в 50 мМ Трисе рН 7,5, 10 мМ MgCl2 в конечном объеме 10 мкл. Эту смесь отжигали при 90ºC в течение 2 минут, 50ºC в течение 5 минут и затем охлаждали на льду. Затем отожженную матрицу достраивали добавлением 0,5 мкл 10 мМ АТФ, 0,5 мкл 10 мМ dNTP (10 мМ каждого из dATP, dCTP, dGTP и dTTP), 1 мкл 100 мМ ДТТ, 1 мкл 10X TM-буфера (0,5 M Трис pH 7,5, 0,1 M MgCl2), 80 Е лигазы Т4 и 4 Е полимеразы T7 в общем объеме 20 мкл в течение 2 часов при комнатной температуре. Затем достроенный и лигированный продукт трансформировали в клетки XL1-blue (Stratagene). Правильные клоны идентифицировали секвенированием ДНК
Правильные фаговые клоны выращивали в 25 мл 2YT, содержащей 50 мкг/мл карбенациллина и фаг-помощник M13/KO7 (MOI 10), в течение ночи при 37ºC.
Оценка гуманизированных вариантов 120 – Гуманизированные варианты, экспрессированные в виде IgG, оценивали анализом FACS с использованием STEAP-1-положительных (293 Steap1 NT LB50) и отрицательных (293 вектор S408) клеточных линий.
Гуманизированные варианты, экспрессированные в виде Fab, представленного на фаге, также оценивали анализом FACS. Экспрессируемые фагом Fab-варианты сначала оценивали на их уровень дисплея Fab с использованием ELISA для фагов, используемого для детектирования flag-метки, слитой с легкой цепью этого Fab. Микротитрационные планшеты MaxiSorp покрывали анти-gD 1766 при 10 мкг/мл в ЗФР в течение ночи и затем блокировали с использованием блокатора Casein Blocker. Фаг из супернатантов культуры серийно разводили в PBST, содержащем 0,5% БСА, в микротитрационном планшете для культуры ткани и переносили в покрытые лунки на 1 час для захвата Fab-представляющего фага. Планшет промывали PBST и добавляли HRP-конъюгированное анти-M13 (Amersham Pharmacia Biotech) (1:5000 в PBST, содержащем 0,5% БСА) и выдерживали в течение 40 минут. Планшет промывали PBST и проявляли добавлением тетраметилбензидина в качестве субстрата (Kirkegaard and Perry Laboratories, Gaithersburg, MD). Оптическую плотность при 405 нм использовали в качестве оценки уровня дисплея Fab на поверхности этого фага. Препараты фага нормализовали в отношении дисплея разведением. Фаг с низким дисплеем (представлением) (например, химеру) использовали неразведенным для анализа FACS.
Для FACS-анализа связывания фага клетки извлекали из планшета с использованием 2 мМ ЭДТА, собирали в пробирку на 15 мл с коническим дном и осаждали центрифугированием. Клетки (5 × 105 клеток на пробу) ресуспендировали в 100 мкл фага (нормализованного относительно уровня дисплея) в FACS-буфере (1% ФТС, ЗФР с 2 мМ ЭДТА) и инкубировали в течение 1-2 часов на льду. Пробы промывали дважды FACS-буфером с использованием центрифугирования. Добавляли контрольное анти-М13 5G7-антитело (Genentech, Inc. South San Francisco, CA) при 2 мкг/мл и инкубировали на льду в течение по меньшей мере 45 минут. Пробы промывали дважды FACS-буфером с использованием центрифугирования. Добавляли разведение 1:200 анти-мышиный PE-антитела (козьего антитела против мышиного Fcγ-фрагмента IgG, конъюгированного с R-фикоэритрином, Jackson Immunoresearch) и инкубировали на льду в течение 30 минут. Пробы опять промывали дважды FACS-буфером с использованием центрифугирования и анализировали при помощи FACS.
Для анализа IgG при помощи FACS, клетки готовили, как и в случае FACS фага. Каждый IgG добавляли при 5 мкг/мл на льду и выдерживали в течение 1 часа. Пробы промывали дважды FACS-буфером с использованием центрифугирования и добавляли разведение 1:200 анти-PE человека-конъюгата (козьего антитела против Fcγ-фрагмента IgG человека, конъюгированного с R-фикоэритрином, Jackson Immunoresearch) и выдерживали в течение 30 минут. Пробы опять промывали дважды FACS-буфером с использованием центрифугирования и анализировали при помощи FACS.
Получение IgG и определение аффинности - IgG очищали белок G-хроматографией. Определения аффинности выполняли анализом Скетчарда на клетках 293 STEAP-1 NT LB50.
Результаты и обсуждение
Конструирование последовательностей вариабельного домена мышиного 120 и передаваемых CDR-трансплантатов – Акцепторный каркас человека, используемый для гуманизации М2-120.545, основан на консенсусном домене VL каппа I человека и консенсусном домене VH подгруппы III человека. Домены VL и VH мышиного антитела M2-120.545, каждый, сопоставляли с доменами каппа I и подгруппы III человека; каждый определяющий комплементарность район (CDR) идентифицировали и трансплантировали в акцепторный каркас человека для генерирования CDR-трансплантата, который мог бы представляться в виде Fab на фаге и экспрессироваться в виде IgG. Последовательности вариабельных областей версии 24 гуманизированного анти-STEAP-1-антитела показаны на фигурах 2А и 2В. Антитело 120-трансплантат Fab, представленное на фаге, и антитело 120-трансплантат IgG тестировали на связывание с экспрессирующими экзогенный STEAP-1 клетками (293 STEAP-1 NT LB50) при помощи FACS-анализа. Хотя антитело 120-трансплантат IgG связывалось специфически со STEAP-1-экспрессирующими клетками, сигнал FACS, наблюдаемый для антитела 120-трансплантат IgG, был меньшим, чем сигнал FACS, наблюдаемый для химерного 120-IgG, что указывает на потерю аффинности связывания. Фаг, представляющий 120-трансплантат Fab, также генерировал сигнал FACS, который наблюдали только на STEAP-1-экспрессирующих клетках. Это смещение было меньшим, чем наблюдаемое для химерного 120-IgG. Анализ Скетчарда антитела 120-трансплантат IgG также показал значимую (приблизительно 50-кратную) потерю аффинности связывания (KD=36 нМ для 120v.78; KD=260 нМ для антитела 120-трансплантат).
Гуманизация M2-120.545 – Были идентифицированы приблизительно 30 vernier-положений (корректирующих и подгоняющих положений), которые влияют на конформацию CDR и упаковку VL:VH-доменов, и изменения в этих положениях между донорским каркасом и каркасом человека должны учитываться при гуманизации антител (Foote, J. and Winter, G., J. Mol. Biol. 224(2):487-499 (1992)). Оценка сопоставления мышиного антитела M2-120.545 с консенсусным доменом VL каппа I человека и доменом VH подгруппы III человека выявила различия последовательностей при 6 ключевых vernier-положениях в домене VH: 24, 37, 48, 67, 73, 78 (см. фигуру 2B). Для оценки влияния этих положений мышиные остатки вводили индивидуально в консенсусный домен VH подгруппы III человека этого Fab на фаге. Это включало в себя создание следующих мутаций в отношении 120-трансплантат Fab, представленного на фаге, индивидуально: A24V (120.v24), V37I (120.v37), V48M (120.v48), F67I (120.v67) и L78F (120.v78). N73T не тестировали. Каждый фаговый вариант нормализовали разведением до эквивалентного уровня дисплея Fab, определяемого титрованием эпитопной метки, слитой с легкой цепью, представленной на этом фаге, и затем оценивали на связывание с STEAP-1 анализом FACS на STEAP-1-экспрессирующих клетках (293 STEAP-1 NT LB 50) и не экспрессирующих STEAP-1 клетках (293 вектор S408). Термин “2°” относится ко вторичному антителу в анализе FACS. Термин “α-120” относится к мышиному анти-STEAP-1-антителу 120. Термин “α-10H1” относится к контрольному антителу. Термины “24 фаг”, “37 фаг” и т.п. относятся к гуманизированным вариантам анти-STEAP-1-антител, описанным здесь, представленным на фаге. Термин “Ch 120 фаг” относится к химере 120, представленной на фаге, а термин “120.трансплантат фаг” относится к антителу 120-трансплантат, представленному на фаге (фигура 6). Важность нормализации фаговых клонов относительно их уровня представления (дисплея) Fab иллюстрируется анализом FACS варианта 120-трансплантат при различных титрах фага: 7×1012 фаг/мл на фигуре 6 и 2 × 1011 фаг/мл на фигуре 6. После разведения до более низкой концентрации фага, фаг 120-трансплантат уже не продуцирует наблюдаемое смещение FACS. Таким образом, нормализация разных фаговых клонов относительно их уровня представления (дисплея) была важной стадией для оценки их различий аффинности в отношении STEAP-1.
После нормализации относительно уровней дисплея Fab, вариант 120-трансплантат, содержащий дополнительную мутацию A24V (120.v24), производил смещение FACS, превосходящее другие варианты (фигура 6). При экспрессии в виде IgG, 120.v24 производил сходное смещение FACS относительно химерного антитела 120 при всех испытанных концентрациях. Последующий анализ Скетчарда антитела 120.v24 показал Kd 2,2 нМ для связывания с клетками 293 STEAP-1 NT LB50, двухкратное улучшение в сравнении с химерой 120 и исходным мышиным антителом M2-120.545 (таблица 2).
Связывающую аффинность голых анти-STEAP-1-антител, мышиного антитела 120 и химеры 120 испытывали также с использованием анализа FACS. Связывание сравнивали в отношении экзогенного STEAP-1 в стабильных клетках 293 STEAP-1 NT LB50, стабильных клетках PC3 STEAP-1 PS5.4 и эндогенного STEAP-1 в клетках LNCaP. Эти результаты показаны также на фигурах 7D-7F. Клетки NT LB50, экспрессирующие экзогенный STEAP-1 человека на поверхности клеток, получали стабильной трансформацией клеток 293 (ATCC CRL-1573) ДНК STEAP-1 человека. Клетки PS5.4, экспрессирующие экзогенный STEAP-1 на поверхности клеток, получали стабильной трансформацией PC3 (ATCC CLL-1435) ДНК STEAP-1 человека. Клетки LNCaP (ATCC CRL-1740) экспрессируют STEAP-1 эндогенно.
Пример 2: Характеристика анти-STEAP-1-антител
Анти-STEAP-1-антитела (голые антитела и конъюгаты антитело-лекарственное средство, описанные здесь) характеризовали в соответствии со стандартными способами.
Анализы на основе ELISA: Скрининг на анти-STEAP-1-антитело при помощи ELISA выполняют следующим образом, со всеми инкубациями, выполняемыми при комнатной температуре. Тест-планшеты (Nunc Immunoplate) покрывали в течение 2 часов очищенным STEAP-1 в 50 мМ натрий-карбонатном буфере, рН 9,6, затем блокировали 0,5% бычьим сывороточным альбумином в забуференном фосфатом солевом растворе (ЗФР) в течение 30 минут, затем промывали четыре раза ЗФР, содержащим 0,05% Твин 20 (PBST).
Супернатанты тест-антител добавляют и инкубируют два часа при встряхивании, затем промывают четыре раза PBST. Эти планшеты проявляют добавлением 100 мкг на лунку раствора, содержащего 10 мг дигидрохлорида о-фенилендиамина (Sigma, #P8287), и 10 мкл 30% раствора пероксида натрия в 25 мл фосфат-цитратного буфера, рН 5,0) и инкубированием в течение 15 минут. Реакцию останавливают добавлением 100 мкг на лунку 2,5 М серной кислоты. Результаты получают считыванием планшетов в автоматизированном планшет-ридере для ELISA при оптической плотности 490 нм.
Характеристика анти-STEAP-1-связывания при помощи анализа Скетчарда:
Связывающая аффинность моноклонального антитела может быть, например, определена анализом Скетчарда, описанным в Munson et al., Anal. Biochem., 107:220 (1980), с использованием стандартных способов, хорошо известных в данной области. См. также Scatchard, G., Ann. N.Y. Acad. Sci. 51:660 (1947).
Пример 3: Получение конъюгатов анти-STEAP-1-антитело-лекарственное средство
Получение ADC анти-STEAP-1-антитело-ауристатин – ADC анти-STEAP-1-антитела получали конъюгацией анти-STEAP-1-антител мыши 120.545, 120-химеры, 120-трансплантата и гуманизированных вариантов каркасов 120 со следующими компонентами лекарственное средство-линкер: spp-DM1, smcc-DM1, MC-vc-PAB-MMAE; MC-vc-PAB-MMAF; MC-MMAE, MC-MMAF, vc-MMAE и vc-MMAF, которые являются компонентами лекарственного средства и компонентами линкера, и способы присоединения описаны здесь, а также в WO 2004/010957, опубликованном 5 февраля 2004 года, WO2006/034488, опубликованном 9 сентября 2005 года и в Doronina, S.O. et al., Nature Biotechnol. 21:778-784 (2003), (причем каждая из цитируемых здесь ссылок включена в качестве ссылки в ее полном виде). Перед конъюгацией, эти антитела частично восстанавливали TCEP с использованием стандартных способов в соответствии с методологией, описанной в WO 2004/010957. Эти частично восстановленные антитела конъюгировали с приведенными выше компонентами лекарственное средство-линкер с использованием стандартных способов в соответствии с методологией, описанной в Doronina et al. (2003) Nat. Biotechnol. 21:778-784 и US 2005/0238649 A1. Вкратце, частично восстановленные антитела объединяли с компонентами лекарственное средство-линкер для возможности конъюгации с остатками цистеина. Реакции конъюгации гасили и эти ADC очищали. Нагрузку лекарственного средства (среднее количество частей (групп) лекарственного средства на антитело) для каждого ADC определяли при помощи ВЖХ. В данном контексте, компонент линкер-лекарственное средство ADC, “-MC-vc-PAB-MMAE” или “-MC-vc-PAB-MMAF” сокращают иногда как “-vcMMAE” или “-vcMMAF”, а компонент “-MC-MMAF” сокращают иногда как “MCMMAF” или “mcMMAF”.
Получение ADC анти-STEAP-1-майтансиноид – ADC анти-STEAP-1 получали конъюгацией анти-STEAP-1-антител, мышиного 120, 120-химеры, 120-трансплантата и гуманизированных вариантов каркасов 120 с компонентом линкер-лекарственное средство -smcc-DM1. Такая конъюгация может выполняться в соответствии со способом, описанным в WO 2005/037992 для конъюгации и анти-HER2-антитела Herceptin®.
Пример 4: Анализ уменьшения объема опухоли in vivo
Для испытания эффективности токсин-конъюгированных или неконъюгированных моноклональных анти-STEAP-1-антител на способность уменьшения объема опухоли in vivo и in vitro использовали следующий протокол.
Линии клеток млекопитающих и ксенотрансплантаты опухолей человека: 293 является иммортализованной линией клеток эмбриональной почки человека (ATCC-ссылка CRL1573), PC-3 является линией клеток аденокарциномы человека (ATCC-ссылка CRL1435) и LNCaP является линией клеток карциномы предстательной железы (ATCC CRL1740). Все клетки выращивали в 50/50 модифицированной по способу Дульбекко среде Игла, Ham F12, дополненной 10% фетальной телячьей сывороткой (ФТС), 2 мМ глутамином, 1% пенициллином-стрептомицином, и культивировали при 37оС в 5% CO2. Стабильные линии клеток 293 и PC-3 генерировали трансфекцией (Fugene, Roche) с запускаемым цитомегаловирусом вектором, кодирующим либо полноразмерный STEAP-1 (LB50 и PS5.4, соответственно), либо пустой вектор, и отбирали в 400 мкг/мл G418 (Geneticin, Life Technologies). Модели эксплантатов предстательной железы человека, LuCAP 77 и LuCAP 35V, получали из университета Сиэтла.
Экспрессию экзогенного и эндогенного STEAP-1 на поверхности клетки демонстрировали иммуногистохимией (IHC) и FACS-анализом следующим образом. Анти-STEAP-1-антитела овцы и мыши (Agensys, Inc., Santa Monica, CA) генерировали против внутриклеточного амино-концевого пептида STEAP-1 (см. Hubert, R.S., Vivanco, I. et al., PNAS 25:14523-14528 (1999)). Моноклональные антитела против внеклеточных доменов STEAP-1 (Agensys, Inc.) генерировали иммунизацией мышей клетками 293T, транзиторно трансфицированными STEAP-1. Для IHC-анализа, использовали первичное овечье анти-STEAP-1-антитело для детектирования. Для FACS-анализа, клетки выращивали до 90% конфлюэнтности и извлекали из чашек с использованием 2 мМ ЭДТА в ЗФР. Клетки промывали и ресуспендировали в FACS-буфере (ЗФР с 1% БСА) и инкубировали в течение 60 минут с анти-STEAP-1-антителами при комнатной температуре с последующими 60 минутами с подходящим вторичным антителом, конъюгированным с фикоэритрином. Анализ выполняли на FACSscan (BD Biosciences). Для иммунофлуоресценции, клетки выращивали в камерах предметных стекол в течение ночи и затем инкубировали с первичным антителом при 37оС в течение 60 минут. Клетки фиксировали в параформальдегиде, блокировали в 1% БСА и инкубировали с подходящим вторичным антителом, конъюгированным с флуоресцеином.
Модели ксенотрансплантата рака предстательной железы in vivo использовали для испытания эффективности ADC анти-STEAP-1. Эти модели включали в себя линию клеток LNCaP человека (ATCC CRL-1740 или Southern Research Institute, Birmingham, AL). Модели эксплантатов предстательной железы включали в себя LuCaP 77 и LuCaP35V (University of Washington, Seattle, WA). Каждую модель эксплантата предстательной железы поддерживали серийной трансплантацией в кастрированных (андроген-независимой модели LuCAP 35V) или некастрированных (андроген-зависимой модели LuCAP 77), самцов SCID-бежевых мышей (с врожденным отсутствием клеток-киллеров) из Charles River Lab. Некастрированные мыши получали гранулы тестостерона перед имплантацией, тогда как кастрацию выполняли по меньшей мере за две недели перед имплантацией опухоли, чтобы получить самые низкие уровни тестостерона. Когда донорские мыши имели опухоли между 800 и 1000 мм3, ткань опухоли асептически извлекали и рассекали в кусочки малого имплантируемого размера (приблизительно 20 мм3) для исследования животных. Эту опухоль помещали в «карман» в участке имплантации и кожу закрывали с использованием кламмера для сближения краев кожной раны. Для модели клеточной линии LNCaP, выращенные in vitro клетки LNCaP инъецировали подкожно при 8-10 миллионов клеток на мышь в 50% матригеле в самцов SCID-бежевых мышей, которые получали гранулу тестостерона. Когда средний размер опухоли достигал 100-200 мм3, животных случайным образом распределяли в десять групп по десять мышей, каждая, и выполняли единственное IV-введение тест-антитела ADC или контрольного антитела («голого» или контрольного). В некоторых экспериментах, вводили множественные дозы тест-антитела или контрольного антитела (см. фигуры 8А, 9 и 10). В некоторых экспериментах, вводили единственную дозу тест-антитела и контрольного антитела, как видно на фигурах 8В и 11. Когда моделью эксплантата предстательной железы был LuCap 77, гранулу тестостерона имплантировали в этих мышей приблизительно за 3-7 дней перед трансплантацией экзогенной опухоли. Опухоли измеряли два раза в неделю на протяжении всего этого исследования. Значимо более низкий объем опухоли в тест-животных на протяжении времени считали показателем эффективности. В некоторых случаях, объем опухоли значимо уменьшался в сравнении с начальным объемом и оставался низким на протяжении всего этого исследования. Результаты представлены в виде графиков на фигурах 8-11.
Конъюгаты анти-STEAP-1-ауристатиновое лекарственное средство уменьшают объем опухоли предстательной железы in vivo
Введение мышиного анти-STEAP-1-антитела 120-MC-vc-PAB-MMAE при 3 мг/кг было эффективным в модели ксенотрансплантата опухоли предстательной железы (клеток LNCaP-Ner). ЗФР и анти-gpl20-MC-vc-PAB-MMAE (3 мг/кг) использовали в качестве контролей. Дозы вводили в дни 0, 7 и 14. См. фигуру 8А.
Было показано, что введение гуманизированного анти-STEAP-1-антитела 120v.24-MC-vc-PAB-MMAE (3 мг/кг), 120v.24-MC-MMAF (6 мг/кг), 120v.24-MC-MMAF (12 мг/кг) и анти-STEAP-1 120-химеры-MC-vc-PAB-MMAE (3 мг/кг) SCID-бежевым мышам, трансплантированным опухолью LNCap-Ner (обработанным гранулой тестостерона, как описано здесь) является эффективным. Носитель, анти-амброзия-MC-vc-PAB-MMAE (3 мг/кг) и анти-амброзия-MC-MMAF (12 мг/кг) использовали в качестве контролей. Дозы вводили в дни, указанные на фигуре 8. Эти результаты показаны в виде графиков на фигуре 8В.
Было показано, что введение анти-STEAP-1-антитела 120-химера-MC-vc-PAB-MMAE (3 мг/кг) и анти-STEAP-1-антитела 120-химера-MC-MMAF (6 мг/кг) является эффективным в модели ксенотрансплантата рака предстательной железы SCID-бежевых мышей, трансплантированных клетками LNCaP. Мышам вводили три дозы приблизительно в дни 15, 25 и 30 при 3 мг/кг (анти-STEAP-vcMMAE) или 6 мг/кг (анти-STEAP-mcMMAF). Использовали контрольные анти-амброзия-MC-vc-PAB-MMAE (3 мг/кг) и анти-амброзия-MC-MMAF (6 мг/кг). См. фигуру 9.
Было показано, что введение гуманизированного анти-STEAP-1-антитела 120-химера-MC-vc-PAB-MMAE (3 мг/кг) является эффективным в модели ксенотрансплантата рака предстательной железы SCID-бежевых мышей (андроген-зависимых), трансплантированных клетками LuCap 77. Контролями были носитель и анти-амброзия-MC-vc-PAB-MMAE. Вводили три дозы при 3 мг/кг тест-антител и контрольных антител. См. фигуру 10.
Было показано, что введение гуманизированного анти-STEAP-1-антитела 120-химера-MC-vc-PAB-MMAE (3 мг/кг), анти-STEAP-1-антитела 120v.24-MC-MMAF при 6 мг/кг и 12 мг/кг кастрированным SCID-бежевым мышам, трансплантированным опухолью предстательной железы LuCap35V, является эффективным относительно контролей. Нагрузка лекарственного средства была 3,1 на антитело. Контрольными антителами были анти-амброзия-MC-MMAF, вводимое при 12 мг/кг, и анти-gp120-MC-vc-PAB-MMAE, вводимое при 6 мг/кг. См. фигуру 11.
Конъюгаты анти-STEAP-1-ауристатиновое лекарственное средство уменьшают объем опухоли предстательной железы in vitro
Анализы уничтожения клеток in vitro выполняли для оценки эффективности конъюгатов анти-STEAP-1-антитело-лекарственное средство для ингибирования роста и/или уничтожения клеток, экспрессирующих STEAP-1. Вкратце, клетки, экспрессирующие STEAP-1, высевали при приблизительно 2000 клеток на лунку в 96-луночном планшете и обрабатывали спустя 24 часа в двух повторностях конъюгатом антитело-лекарственное средство. Планшеты инкубировали в течение 5-7 дней при 37оС и проявляли с использованием набора для люминесцентного анализа жизнеспособности клеток CellTiter-Glo® (Promega, Madison, WI, USA). Тест-клетки включали в себя клетки PS5.4 (клетки PC3, экспрессирующие экзогенный STEAP-1), клетки LB50 (клетки 293, экспрессирующие экзогенный STEAP-1), клетки PC3, трансфицированные только вектором, клетки 293, трансфицированные только вектором и клетки LNCaP, экспрессирующие эндогенный STEAP-1. Тестируемые конъюгаты антитело-лекарственное средство включали в себя контрольное антитело-MC-MMAF, контрольное антитело-vc-MMAE, анти-STEAP-1-антитело 120 chimera-vc-MMAE, анти-STEAP-1-антитело 120 химера-MC-MMAF (две разные партии материала) и анти-STEAP-1-антитело chimera-vc-MMAF. Эти результаты показаны на фигуре 14А-Е.
Пример 5: Получение цистеин-встроенных моноклональных анти-STEAP-1-антител для конъюгации посредством восстановлении и повторного окисления
Полноразмерные, цистеин-встроенные моноклональные анти-STEAP-1-антитела (ThioMab), экспрессируемые в клетках СНО, растворяли в 500 мМ борате натрия и 500 мМ хлориде натрия приблизительно при рН 8,0 и восстанавливали приблизительно 50-100-кратным избытком 1 мМ TCEP (гидрохлорида трис(2-карбоксиэтилфосфина (Getz et al (1999) Anal. Biochem. Vol 273:73-80; Soltec Ventures, Beverly, MA) в течение приблизительно 1-2 часов при 37ºC. Восстановленный ThioMab разбавляли и наносили на колонку HiTrap S в 10 мМ ацетате натрия, pH 5, и элюировали ЗФР, содержащим 0,3 М хлорид натрия. Элюированный восстановленный ThioMab обрабатывали 2 мМ дегидроаскорбиновой кислотой (dhAA) при рН 7 в течение 3 часов или 2 мМ водном сульфате меди (CuSO4) при комнатной температуре в течение ночи. Может быть также эффективным окисление воздухом окружающей среды. Буфер заменяли элюцией через смолу Сефадекс G25 и элюировали ЗФР с 1 мМ DTPA. Величину тиол/Ab контролировали определением концентрации восстановленного антитела по оптической плотности при 280 нм этого раствора и концентрации тиола реакцией с DTNB (Aldrich, Milwaukee, WI) и определением оптической плотности при 412 нм.
Пример 6: Получение цистеин-встроенных конъюгатов анти-STEAP-1-антитело-лекарственное средство конъюгацией цистеин-встроенных анти-STEAP-1-антител и промежуточных продуктов лекарственное средство-линкер
После процедур восстановления и повторного окисления примера 5, цистеин-встроенное анти-STEAP-1-антитело растворяют в ЗФР (забуференном фосфатом солевом растворе) и охлаждают на льду. Приблизительно 1,5 молярных эквивалентов относительно встроенных цистеинов на антитело промежуточного продукта ауристатиновое лекарственное средство-линкер, такого как MC-MMAE (малеимидокапроилмонометилауристатин Е), MC-MMAF, MC-val-cit-PAB-MMAE или MC-val-cit-PAB-MMAF, с тиол-реактивной функциональной группой, такой как малеимидо, растворяют в ДМСО, разбавляют в ацетонитриле и воде и добавляют к охлажденному восстановленному, повторно окисленному антителу в ЗФР. Спустя приблизительно один час, добавляют избыток малеимида для гашения реакции и блокирования любых непрореагировавших тиоловых групп антитела. Эту реакционную смесь концентрируют центрифужной ультрафильтрацией и цистеин-встроенный конъюгат анти-STEAP-1-антитело-лекарственное средство очищают и обессоливают элюцией через смолу G25 в ЗФР, фильтруют через фильтры 0,2 мкм при стерильных условиях и замораживают для хранения.
С использованием описанной выше процедуры готовили следующие цистеин-встроенные конъюгаты анти-STEAP-1-антитело-лекарственное средство (где нумерация для этих вариантов является стандартизованной (нумерация Кабата для легкой цепи и нумерация EU для тяжелой цепи), обеспеченные здесь и на фигуре 17):
thio-human 120-MC-MMAF конъюгацией легкой цепи V205C thio-hu 120 и MC-MMAF;
thio-human 120-MC-MMAF конъюгацией тяжелой цепи A118C thio-hu 120 и MC-MMAF;
thio-human 120-MC-val-cit-PAB-MMAE конъюгацией легкой цепи V205C thio-hu 120 и MC-val-cit-PAB-MMAE; и
thio-human 120-MC-val-cit-PAB-MMAE конъюгацией тяжелой цепи A118C thio-hu 120 и MC-val-cit-PAB-MMAE.
Пример 7: Характеристика цистеин-встроенных анти-STEAP-1-антител
Цистеин-встроенные конъюгаты анти-STEAP-1-антитело-лекарственное средство (TDC), полученные, как описано выше, анализировали для подтверждения, что они сохраняли активность исходного антитела in vitro. Анти-STEAP-1-TDC thio-humanl20-vc-PAB-MMAE (LCV205C) (сокращаемый как huSteap1 TDC (L205C) vcE, и thio-humanl20-vc-PAB-MMAE (HCA118C) (сокращаемый как huSteap1 TDC (HCA118C) vcE) оценивали на связывание с STEAP-1 при помощи FACS-анализа на STEAP-1-экспрессирующих клетках (293 STEAP-1 NT LB50) и не экспрессирующих STEAP-1 клетках (293 вектор S408). Термин “только 2-е” относится к вторичному антителу в анализе FACS. TDC-контроль (vcE) и ADC-std (стандартный) контроль (vcE) являются контрольными антителами тио- и не-тио-конъюгатами vc-PAB-MMAE-лекарственное средство, соответственно. huSteap1 ADC (std) является конъюгатом vc-PAB-MMAE-лекарственное средство, полученным из исходного анти-STEAP-1-антитела человека. Как показано, эти TDC производили смещения FACS, сходные со смещениями FACS исходного huSteap1 ADC.
Выполняли также анализы уничтожения клеток in vitro для оценки эффективности цистеин-встроенных конъюгатов анти-STEAP-1-антитело-лекарственное средство для ингибирования роста и/или уничтожения клеток, экспрессирующих STEAP-1. Вкратце, клетки, экспрессирующие STEAP-1, высевали при приблизительно 2000 клеток на лунку в 96-луночном планшете и обрабатывали спустя 24 часа в двух повторностях конъюгатом антитело-лекарственное средство. Планшеты инкубировали в течение 5-7 дней при 37оС и проявляли с использованием набора для люминесцентного анализа жизнеспособности клеток CellTiter-Glo® (Promega, Madison, WI, USA). Тест-клетки включали в себя клетки PS5.4 (клетки PC3, экспрессирующие экзогенный STEAP-1), клетки LB50 (клетки 293, экспрессирующие экзогенный STEAP-1) и клетки LNCaP, экспрессирующие эндогенный STEAP-1. Тестируемые конъюгаты антитело-лекарственное средство включали в себя контрольное антитело-vc-MMAE (ADC std контроль (vcE)), контрольное тио-антитело-vc-MMAE (TDC-контроль (vcE)), анти-STEAP-1-TDC thio-humanl20-vc-PAB-MMAE (LCV205C) (сокращаемый как huSteap1 TDC (L205C) vcE и thio-human120-vc-PAB-MMAE (HCA118C) (сокращаемый как huSteap1 TDC (HCA118C) vcE), и huSteap1 ADC (std), конъюгат vc-PAB-MMAE-лекарственное средство, полученный из исходного анти-STEAP-1-антитела человека. Как показано на фигурах 19A-C, анти-STEAP-1-TCD сохраняют активность исходных ADC in vitro.
Пример 8: Анализы уменьшения объема опухоли in vivo для цистеин-встроенных конъюгатов анти-STEAP-1-антитело-лекарственное средство
Модели ксенотрансплантатов рака предстательной железы in vivo использовали для испытания эффективности цистеин-встроенных анти-STEAP-1-антитело-ADC. Используемые модели и тест-протоколы соответствуют моделям и тест-протоколам, описанным в примере 4.
Было показано, что введение анти-STEAP-1-TDC thio-humanl20-vc-PAB-MMAE (HCA118C) (сокращаемого как huSteap1 HC TDC vcE) (3 мг/кг) SCID-бежевым мышам, трансплантированным опухолью LNCap-Ner (обработанным гранулой тестостерона, как описано здесь), является эффективным. Носитель (ЗФР), контрольное антитело-vc-MMAE (ADC std Ctrl vcE) и контрольное тио-антитело-vc-MMAE (TDC HC Ctrl vcE) использовали в качестве контролей. Действие анти-STEAP-1-TDC сравнивали также с анти-STEAP-1-антителом человека 120-MC-vc-PAB-MMAE (hu Steap1 std ADC vcE) в качестве положительного контроля. Вводили единственную дозу в день 0. Все антитела вводили при 3 мг/кг. Результаты показаны в виде графиков на фигуре 20.
Фигура 21 показывает, что введение анти-STEAP-1-TDC thio-humanl20-vc-PAB-MMAE (HCA118C) (сокращаемого как huSteapl HC TDC vcE) при 3 мг/кг и анти-STEAP-1-TDC thio-humanl20-MC-MMAF (HCA118C) (сокращаемого как huSteap1 HC TDC mcF) при 1, 3 или 6 мг/кг является эффективным в модели ксенотрансплантата рака предстательной железы SCID-бежевых мышей, трансплантированных клетками LNCaP. Мышам вводили дозы в день 0 при 0,3, 1 или 3 мг/кг (huSteapl HC TDC vcE) или 1, 3 или 6 мг/кг (huSteapl HC TDC mcF). Носитель (ЗФР), контрольное антитело-vc-MMAE (ADC std Ctrl vcE) и контрольное thio antibody-vc-MMAE (TDC HC Ctrl vcE) использовали в качестве контролей.
Фигура 22 показывает, что введение анти-STEAP-1-TDC thio-humanl20-vc-PAB-MMAE (HCA118C) (сокращаемого как huSteap1 HC TDC vcE) при 3 мг/кг и анти-STEAP-1-TDC thio-human120-MC-MMAF (HCA118C) (сокращаемого как huSteap1 HC TDC mcF) при 3 или 6 мг/кг является эффективным в модели ксенотрансплантата рака предстательной железы самцов SCID-бежевых мышей (андроген-зависимых), трансплантированных клетками LuCap 35V. Мышам вводили единственные дозы в день 0 при 0,3, 1 или 3 мг/кг (huSteapl HC TDC vcE) или 1, 3 или 6 мг/кг (huSteap1 HC TDC mcF). Носитель (ЗФР), контрольное антитело-vc-MMAE (ADC std Ctrl vcE) и контрольное тио-антитело-vc-MMAE (TDC HC Ctrl vcE) вводили в качестве контролей.
Пример 9: Получение и характеристика анти-STEAP-1-антитела SGIV из варианта 24 антитела 120
Получали другой вариант LC-анти-STEAP-1-антитела, в котором легкую цепь и каркасные районы дополнительно модифицировали для получения улучшенных уровней экспрессии антитела.
Материалы и способы
Номера остатков соответствуют нумерации Кабата (Kabat et al, Sequences of proteins of immunological interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Используются однобуквенные аббревиатуры аминокислот. Вырожденности ДНК представлены с использованием кода IUB (N=A/C/G/T, D=A/G/T, V=A/C/G, B=C/G/T, H=A/C/T, K=G/T, M=A/C, R=A/G, S=G/C, W=A/T, Y=C/T).
Получение измененного варианта легкой цепи: Генерировали и характеризовали вариант антитела 120.v24, названный “Simmons IV” или просто “SGIV”. Аминокислотная последовательность легкой цепи SGIV представлена в SEQ ID NO:90. Эта последовательность, сопоставленная с соответствующими районами антитела mu 120 (SEQ ID NO:5) и антитела 120.v24 (SEQ ID NO:91), показана на фигуре 23.
Оценка варианта SGIV в сравнении с вариантом 120.v24 - Антитела SGIV и 120.v24, экспрессированные в виде IgG, оценивали при помощи анализа FACS с использованием стабильно трансфицированных STEAP-1-положительных клеточных линий 293 Steap1 NT LB48, 293 Steap1 NT LB50 и 293 Steap1 NT LB53, а также в клетках LNCaP, которые экспрессируют эндогенный STEAP-1 (фигура 28). Клетки получали, как описано в примере 1. Каждый IgG добавляли при 5 мкг/мл на льду в течение 1 часа. Пробы промывали дважды FACS-буфером с использованием центрифугирования и добавляли разведение 1:200 конъюгата анти-PE человека-антитела (козьего антитела против Fcγ-фрагмента IgG человека, конъюгированного с R-фикоэритрином, Jackson Immunoresearch) и инкубировали в течение 30 минут. Пробы опять промывали дважды FACS-буфером с использованием центрифугирования и анализировали при помощи FACS.
Определение аффинности SGIV на основе Скетчарда и связывания 120.v24 с STEAP-1 – Аффинности связывания антител 120.v24 и Simmons IV ("SGIV") с STEAP-1 определяли с использованием анализа Скетчарда в соответствии со стандартными способами. IgG очищали Белок G-аффинной хроматографией. Определения аффинности выполняли анализом Скетчарда в клетках PC-3-PS5.4, 293-LB50 и LNCaP-BR в двух повторностях. Графики Скетчарда 120.v24 и SGIV в клетках LNCaP-BR и клетках 293.LB50 показаны на фигурах 25 и 26, соответственно. Таблица, сравнивающая средние аффинности связывания для mu 1789, mu 120, Fc-химеры, гуманизированного 120.v24, тио-120.v24 и тио-SGIV в клетках PC-3-PS5.4, 293-LB50 и LNCaP-BR, а также клетках 293, транзиторно экспрессирующих STEAP-1, показана на фигуре 27.
Сайт-направленный мутагенез вариантов SGIV и 120.v24: Варианты антител SGIV и 120.v24 получали с использованием стандартных протоколов мутагенеза, описанных выше. Первый класс вариантов происходил из сайт-направленного мутагенеза, посредством которого конкретные остатки Simmons IV (“SGIV”) заменяли соответствующим остатком 120.v24 для дополнительного улучшения аффинности связывания. Конкретные полученные варианты, показанные на фигуре 24, были следующими:
(1) LS.VLVH1, где остатки 42 (“Q”) и 43 (“P”) были модифицированы в “K” и “A”, соответственно (SEQ ID NO:92)
(2) LS.VLVH2, где остаток 3 (“V”) был модифицирован в “Q”, остатки 42 (“Q”) и 43 (“P”) были модифицированы в “K” и “A”, соответственно, и остаток 85 (“V”) был модифицирован в “T” (SEQ ID NO:93)
(3) LS.Q, где остаток 3 (“V”) был модифицирован в “Q” (SEQ ID NO:94)
(4) LS.CH1, где остаток 15 (“L”) был модифицирован в“V” и остаток 83 (“V”) был модифицирован в “F” (SEQ ID NO:95)
Второй класс вариантов генерировали посредством сайт-направленного мутагенеза, в котором конкретные остатки 120.v24 заменяли соответствующим остатком Simmons IV (SGIV) в попытке улучшения уровней экспрессии антител. Конкретные варианты, показанные на фигуре 24, были следующими:
(1) ED.FW1, где остаток 3 (“Q”) был модифицирован в “V”; остаток 9 (“S”) был модифицирован в “D”; остаток 12 (“S”) был модифицирован в “A”; остаток 13 (“A”) был модифицирован в “V”; остаток 15 (“V”) был модифицирован в “L”; остаток 17 (“D”) был модифицирован в “E”; остаток 19 (“V”) был модифицирован в “A” и остаток 22 (“T”) был модифицирован в “N” (SEQ ID NO:96)
(2) ED.FW2, где остатки 42 (“K”) и 43 (“A”) 120.v24 были модифицированы в “Q” и “P”, соответственно (SEQ ID NO:97)
(3) ED.FW3, где остаток 60 (“S”) был модифицирован в “D”; остаток 80 (“P”) был модифицирован в “A”; остаток 83 (“F”) был модифицирован в “V” и остаток 85 (“T”) был модифицирован в “V” (SEQ ID NO:98)
(4) ED.all, где остаток 3 (“Q”) был модифицирован в “V”; остаток 9 (“S”) был модифицирован в “D”; остаток 12 (“S”) был модифицирован в “A”; остаток 13 (“A”) был модифицирован в “V”; остаток 15 (“V”) был модифицирован в “L”; остаток 17 (“D”) был модифицирован в “E”; остаток 19 (“V”) был модифицирован в “A”; остаток 22 ("T") был модифицирован в "N"; остатки 42 ("K") и 43 (“A”) 120.v24 были модифицированы в “Q” и “P”; остаток 60 (“S”) был модифицирован в “D”; остаток 80 (“P”) был модифицирован в “A”; остаток 83 (“F”) был модифицирован в “V” и остаток 85 (“T”) был модифицирован в “V” (SEQ ID NO:99)
(5) ED.Pro, где остаток 43 (“A”) был модифицирован в “P” и остаток 80 (“P”) был модифицирован в “A” (SEQ ID NO:100)
(6) ED.pl, где остаток 9 (“S”) был модифицирован в “D”; остаток 42 (“K”) был модифицирован в “Q” и остаток 60 (“S”) был модифицирован в “D” (SEQ ID NO: 101).
Результаты и обсуждение
Получение антитела SGIV – Последовательности вариабельной области версии 24 анти-STEAP-1-антитела (120.v24) показаны на фигурах 23 и 24 (SEQ ID NO:91). С использованием сайт-направленного мутагенеза, получали другой вариант, названный “Simmons IV" или просто “SGIV", при помощи стандартного мутагенеза, как описано выше. Фигуры 23 и 24 показывают последовательность легкой цепи SGIV в сопоставлении с последовательностью легкой цепи антитела mu 120 и 120.v24. Титры различных сборов антитела SGIV показаны на фигуре 29.
Сравнение связывания SGIV и 120.v24 с STEAP-1 при помощи FACS – Способность обоих антител, 120.v24 и SGIV, связываться с STEAP-1, экспрессируемым на клеточной поверхности, измеряли при помощи FACS. Связывание антител с клеточными линиями, экспрессирующими либо экзогенный STEAP-1 (293 STEAP-1 LB48, 293 STEAP-1 LB50 и 293 STEAP-1 LB53), либо эндогенный STEAP-1 (LNCaP.Br) измеряли в двух повторностях; эти результаты суммированы на фигуре 28. Как показано на фигуре 28, оба антитела были способны связывать STEAP-1 во всех четырех клеточных линиях.
Аффинность связывания антитела SGIV с STEAP-1 и сравнение с 120.v24 – Аффинности связывания SGIV и 120.v24 с STEAP-1 испытывали с использованием анализа Скетчарда. Графики Скетчарда 120.v24 и SGIV в клетках LNCaP-BR и клетках 293.LB 50 показаны на фигурах 25 и 26, соответственно. Таблица, сравнивающая средние аффинности связывания для антител mu 1789, mu 120, Fc-химеры, гуманизированного 120.v24, тио-120.v24 и тио-SGIV в клетках PC-3-PS5.4, 293-LB50 и LNCaP-BR, а также клетках 293, транзиторно экспрессирующих STEAP-1, показана на фигуре 27. Эти результаты показывают, что аффинность связывания антитела 120.v24 в клетках 293-LB50 и LNCaP.BR является приблизительно в 1,5-раза более высокой, чем аффинность связывания варианта SGIV.
Хотя в предыдущем описании изобретения описаны некоторые подробности в качестве иллюстрации и примера с целью облегчения понимания, эти описания и примеры не должны пониматься как ограничение объема согласно изобретению. Описания всех патентов и научной литературы, цитируемых здесь, специально включены в их полном виде в качестве ссылки.
Реферат
Изобретение относится к области иммунологии. Предложено гуманизированное антитело, специфичное к STEAP-1, и его антигенсвязывающий фрагмент. Описаны: полинуклеотид, кодирующий антитело или его антигенсвязывающий фрагмент, вектор, клетка-хозяин, способ получения анти-STEAP-1-антитела. Также раскрыты: способ визуализации опухоли, фармацевтическая композиция, лекарственное средство для лечения клеточно-пролиферативного нарушения, иммуноконъюгаты и цистеин-встроенное антитело на основе указанного антитела. Данное изобретение обеспечивает новые антитела к STEAP-1 и может найти применение в медицине. 14 н. и 16 з.п. ф-лы, 29 ил., 2 табл., 9 пр.
Формула






Комментарии