Содержащий ингибитор тромбина водный раствор для внутривенного введения, стабильный при хранении - RU2164803C2
Код документа: RU2164803C2
Чертежи
Описание
Изобретение относится к новой, улучшенной, стабильной при хранении, готовой формы препаратов ингибиторов тромбина для внутривенного вливания, особенно пептидных ингибиторов тромбина HOOC-CH2-(R)Cha-Pic-Nag и HOOC-CH2-(R)Cgl-Aze-Pab соответственно к способу получения указанной формы и к способу лечения путем введения указанных форм препаратов.
Полагают, что тромбиновые ингибиторы являются эффективными лекарственными средствами в ряде заболеваний, характеризуемых гиперкоагуляцией. Их терапевтическое использование может быть облегчено, если имеются стабильные готовые формы, т.е. формы, имеющие длительный срок годности при хранении при комнатной температуре.
В WO 93/111528, Пример P1, раскрывается водный раствор для парентерального введения, и указанная форма представляет раствор в ацетатном буфере HOOC-CH2-(R)Cha-Pic-Nag · 2HBr для парентерального использования с величиной pH 3-7, которая находится в физиологически приемлемом диапазоне pH, подходящем для инъекций непосредственно в организм человека. Данный раствор также включает добавки, такие как хлорид натрия, для получения изотонического раствора.
Активное соединение HOOC-CH2-(R)-Cgl-Aze-Pab раскрывается в PCT/SE 94/00535, поданной 2 июля 1994, еще не опубликованной. Пример P2 в этом документе раскрывает раствор для парентерального введения, а именно водный раствор активного соединения и хлорида натрия, который доводят с помощью NaOH до pH 3-9, предпочтительно 5-7.
Стабильность пептидов является обычно проблемой в фармацевтической индустрии. Фармацевтические готовые формы, в частности с низкой концентрацией пептидов, часто теряют активность во время хранения.
Каждый пептид является разным с точки зрения фармакологических свойств. При приготовлении фармацевтической готовой формы конкретного пептида во внимание должны приниматься не только фармакологические свойства, но также следует учитывать и другие аспекты, такие как промышленное производство, простое и удобное хранение и обращение с ней для персонала больницы и безопасность для пациента. Результаты этих аспектов непредсказуемы при испытании различных готовых форм и для каждого пептида имеется свой особый раствор с учетом стабильности.
Хорошо известно, что пептиды обычно являются более чувствительными к разрушению в кислой и основной среде, чем в нейтральном растворе. Однако неожиданно было обнаружено, что для пептидных тромбиновых ингибиторов HOOC-CH2-(R)-Cha-Pic-Nag и HOOC-CH2-(R)Cgl-Aze-Pab их стабильность при хранении улучшается в кислых водных растворах.
Объем данного изобретения охватывает
стабильный при хранении концентрированный водный раствор для внутривенного вливания активного тромбинового ингибитора, имеющего формулу
HOOC-CH2-Y
где Y представляет
(R)-Cha-Pic-Nag или (R)-Cgl-Aze-Pab, имеющий pH в диапазоне от 0,1 до 2,5, который не требует специальных условий хранения и может храниться при комнатной температуре, т.е. в диапазоне 15-30oC, предпочтительно 18-20oC, в частности, например, при 25oC.
Таким образом, стабильный водный раствор данного изобретения, который представляет концентрированный водный раствор тромбинового ингибитора, доводят физиологически приемлемой органической или неорганической кислотой, предпочтительно неорганической минеральной кислотой, такой как хлористоводородная кислота, бромистоводородная кислота и т.д., до получения требуемого pH. Хлористоводородная кислота наиболее предпочтительна. Данная готовая форма является простой формой без каких-либо стабилизирующих добавок.
В кислом растворе растворимость двух различных лекарственных средств соответственно увеличивается и можно получить более концентрированный раствор, что означает, что могут использоваться небольшие контейнеры, которые просты в обращении.
Важно, что с данной готовой формой легко обращаться и ее легко дозировать. Поэтому указанную форму следует поставлять в контейнерах, предназначенных для парентерального использования, таких как пластиковые или стеклянные контейнеры, например пузырьки, ампулы или предварительно заполненные шприцы, и добавлять в баллоны для инфузии или флаконы, т.е. стабильный при хранении концентрированный водный раствор должен разбавляться перед введением пациентам.
Дополнительное улучшение состоит в том, что растворы не требуют добавок, таких как буферные соли, изотонические соли или со-растворители, ввиду их стабильности. Однако стабильный раствор может также содержать консерванты, т. е. для предотвращения микробиологического роста. Раствор предназначен для добавления к раствору для внутривенного вливания, такого как физиологический раствор или другие электролиты, глюкоза, маннит, декстран и т.д. или их сочетания, и для парентерального введения.
Раствор может быть приготовлен с активными пептидными тромбиновыми ингибиторами соответственно HOOC-CH2-(R)-Cha-Pic-Nag и HOOC-CH2-(R)Cgl-Aze-Pab в виде обычно используемых солей или в форме основания.
Раствор данного изобретения достаточно стабилен для хранения при комнатной температуре в течение длительных периодов времени. Коммерческий продукт предпочтительно должен иметь срок хранения, по крайней мере, два года, и в конце этого периода должно оставаться, по крайней мере, 95% активного соединения, т.е. суммарное количество продуктов деградации должно быть менее 5%.
Предпочтительные концентрации HOOC-CH2 -(R)-Cha-Pic-Nag можно варьировать в широких пределах между 0,001-200 мг/мл, более предпочтительно 0,1-100 мг/мл, наиболее предпочтительно 10-100 мг/мл. Предпочтительные концентрации HOOC-CH2-(R)Cgl-Aze-Pab можно варьировать в широких пределах 0,001-300 мг/мл, предпочтительно 0,1-200 мг/мл, наиболее предпочтительно 1-100 мг/мл.
Данное изобретение относится также к способу получения стабильного при хранении водного раствора, который включает растворение в воде активных тромбиновых ингибиторов HOOC-CH2-(R)Cha-Pic-Nag или HOOC-CH2 -(R)Ggl-Aze-Fab соответственно, доведение pH полученного раствора до от 1,0 до 2,5, предпочтительно от 1,5 до 2,0, или до конкретного требуемого значения, например 1,0, 1,5, 2,0, 2,5. Подходящие объемы при использовании ампул, пузырьков или шприцов, составляют 0,1-100 мл, предпочтительно 1-10 мл.
Оба активных тромбиновых ингибитора HOOC-CH2-(R)Cha-Pic-Nag и HOOC-CH2-(R)Cgl-Aze-Pab соответственно должны быть способны растворяться в воде при комнатной температуре.
Получение соединения, в котором Y представляет (R)-Cgl-Aze-Pab
Масс-спектры регистрировались на тройном квадрупольном масс-спектрометре Finnigan MAT TSQ 700, с электрораспылительной системой ввода.
Измерения спектров1H ЯМР и13C ЯМР выполнялись на спектрометрах BRUKER AC-P 300 и BRUKER AM 500, при этом первый работал на1H частоте 500,14 МГц и13C частоте 125,76 МГц, а второй на1H и13C частоте 300,13 МГц и 75,46 МГц соответственно.
Образцы представляли собой количества около 10-50 мг, растворенные в 0,6 мл одного из следующих растворителей: CDCl3 (изотопная чистота >99,8%), CD3OD (изотопная чистота >99,95%) или D2O (изотопная чистота >99,98%). Все растворители закупали у фирмы Dr. Glaser AG, Базель.
Величины химического сдвига1H и13C в CDCl3 и CD3OD соотнесены с тетраметилсиланом, используемым в качестве внешнего стандарта. Химические сдвиги1H в D2O соотнесены с натриевой солью 3-(триметилсилил)-d4-пропановой кислоты, а химические сдвиги13C в D2O соотнесены с 1, 4-диоксаном (67,3 м.д.), оба взяты в качестве внешнего стандарта. Калибровка с внешним стандартом в некоторых случаях может вызывать незначительные различия в сдвиге в сравнении с внутренним стандартом, однако, разница в1H химическом сдвиге составляет меньше, чем 0,02 м.д., а в13C сдвиге меньше чем 0,1 м.д.
Спектр1H ЯМР пептидных последовательностей, содержащих пролин или "подобный пролину" остаток, часто дает два ряда резонансов. Это соответствует существованию двух конформеров, которые вносят свой вклад относительно вращения вокруг амидной связи, когда пролин содержит N-часть амидной связи. Эти конформеры называют цис и транс. В соединениях, содержащих такие последовательности, последовательности (R)Cha-Aze и (R)Cha-Pic - часто приводят к цис-транс равновесию с одним конформером в виде преобладающего конформера (>90%). В этих случаях представлены данные1H химических сдвигов только основного ротамера. Только в случаях четкого разрешения сигналов второстепенного ротамера эти данные включены в спектральные данные ЯМР. Тот же критерий действителен и для NH-сигналов в CDCl3, только в случае четкого разрешения этих сигналов они представлены в спектральных данных ЯМР. Это означает, что число протонов, сообщаемое для некоторых промежуточных соединений, составляет меньше, чем число протонов, ожидаемое на основании химической формулы.
Флэш-хроматографию выполняли на Merck Silica Gel 60 (40-63 мм, 230-400 меш) при атмосферном давлении.
Лиофилизацию осуществляли на установке Leydold-Heraeus, модели Lyovac GT2.
4-Аминометил-1-(N-бензилоксикарбониламидино)-бензол(H-Pab(Z))
(i) 4-цианобензилазид
К 49,15 г (251
ммоль) 4-цианобензилбромида в 200 мл ДМФ при комнатной температуре добавляли раствор 20,23 г (0,31 моль) азида натрия в 50 мл воды. Происходила экзотермическая реакция, и через 1,5 ч реакционную смесь
разбавляли 200 мл толуола (внимание: во избежание выделения потенциально взрывчатых азидных соединений желательно добавить к реакционной смеси толуол перед добавлением воды) и 500 мл воды. Водную фазу
экстрагировали дополнительными 2х50 мл толуола. Объединенные органические экстракты промывали 2х50 мл воды и насыщенным солевым раствором и после этого сушили (MgSO4) и фильтровали. Раствор
использовали как таковой на следующей стадии.
1H-ЯМР (300 МГц, CDCl3); δ 4,4 (с, 2H), 7,4 (д, 2H), 7,7 (д, 2H).
(ii) 4-амидинобензилазид
В смесь 250 мл абсолютного этанола и раствора со стадии (i) (приблизительно 200 мл) барботировали хлористый водород при температуре выше -5oC до насыщения. В результате хранения в
течение 24 ч при 8oC и выпаривания большей части растворителя с последующим осаждением посредством добавления безводного эфира получали белые кристаллы, которые выделяли при помощи
фильтрования и растворяли в 1,8 л спиртового аммиачного раствора. Через 48 ч основное количество растворителя удаляли и добавляли 200 мл 3,75 М раствора NaOH, после чего 4-амидинобензилазид осаждался
в виде бесцветных кристаллов. Кристаллы выделяли фильтрованием. В этот момент выход 4-амидинобензилазида составил 22,5 г (всего 51%).
Гидрохлорид этилимидатобензилазида;
1H-ЯМР (500 МГц, CD3OD); δ 1,6 (т, 3H), 4,5 (с, 2H), 4,65 (кв, 2H), 4,8 (ушир.с, 2H), 7,6 (д, 2H), 8,1 (д, 2H).
4-амидинобензилазид:
1H-ЯМР
(500 МГц, CDCl3); δ 4,3 (с, 2H), 5,7 (ушир.с, 3H), 7,3 (д, 2H), 7,6 (д, 2H).
13C-ЯМР (125 МГц, CDCl3): углерод амидина: δ 165,5.
(iii) 4-(бензилоксикарбониламидино)бензилазид
Кристаллы, полученные на стадии (ii), как указано выше, растворяли в 500 мл метиленхлорида и полученный раствор сушили (K2
CO3), фильтровали и добавляли 27 мл (194 ммоль) триэтиламина. К перемешиваемому раствору медленно добавляли 25 мл бензилхлорформиата при охлаждении при этом реакционной смеси на ледяной
бане. Через 30 мин дополнительно добавляли 2 мл бензилхлорформиата и перемешивание продолжали еще 30 мин. После этого добавляли воду и водную фазу доводили до pH 7 при помощи 2М HCl. Органическую фазу
сушили (MgSO4) и растворитель удаляли в вакууме. В завершение из смеси эфир/метиленхлорид/гексан выделяли 4-(бензилоксикарбониламидино)бензилазид в виде бесцветных кристаллов.
1H-ЯМР (500 МГц, CDCl3); δ 4,4 (с, 2H), 5,3 (с, 2H), 6,3-7,0 (ушир. с, 1H), 7,3-7,4 (м, 5H), 7,5 (д, 2H), 7,9 (д, 2H), 9,3-9,6 (ушир. с, 1H).
13C-ЯМР (125 МГц, CDCl3): углерод амидина: δ 167,5.
(iv) 4-аминометил-1-(N-бензилоксикарбониламидино)бензол(H-Pab(Z))
К
4-(бензилоксикарбониламидино)бензилазиду со стадии (iii) выше, растворенному в 160 мл ТГФ, при комнатной температуре добавляли 26,3 г (100 ммоль) трифенилфосфина. Через 16 ч добавляли еще 6,6 г (25
ммоль) трифенилфосфина и раствору давали выстояться в течение 4 ч перед удалением растворителя в вакууме. Остаток растворяли в метиленхлориде и экстрагировали 2 М HCl. Водную фазу промывали
метиленхлоридом и эфиром и затем подщелачивали 3,75 М раствором гидроксида натрия. В результате экстракции метиленхлоридом с последующей сушкой (K2CO3) и удалением растворителя в
вакууме получали 20 г (общий выход в расчете на исходный цианобензилбромид составил 28%) желтого масла, которое застывало при выстаивании.
1H-ЯМР (500 МГц, CDCl3); δ 1,2-2,2 (ушир.с, 2H), 3,8 (с, 2H), 5,2 (с, 2H), 7,2-7,35 (м, 5H), 7,4 (д, 2H), 7,8 (д, 2H), 9,1-9,6 (ушир.с, 1H).
13C-ЯМР (125 МГц, CDCl3): углероды амидина и карбонила: δ 164,6 и 168,17.
H-Aze-OMe · HCl
Получали в соответствии с процедурой, описанной Seebach D. Et al., Liebigs Ann. Chem., p. 687, 1990.
Boc-(R)Cgl-OH
Boc-(R)-Pgl-OH, 32 г (0,13 моль), растворяли в 300 мл метанола и добавляли 5 г Rh/AI2O3. Раствор гидрировали при 5,2 - 2,8 MPa в течение 3 дней.
После фильтрования и выпаривания растворителя анализ ЯМР показал присутствие около 25% метилового эфира, указанного в заголовке соединения. Сырой материал растворяли в 500 мл ТГФ и 300 мл воды и
добавляли 20 г LiOH. Смесь перемешивали в течение ночи и ТГФ выпаривали. Оставшуюся водную фазу подкисляли KHSO4 и три раза экстрагировали этилацетатом. Объединенный органический слой
промывали водой, сушили (Na2SO4) и выпаривали с получением 28,3 г (83%) желаемого продукта.
1H-ЯМР (300 МГц, CDCl3): δ 0,9-1,7 (м, 20H), 4,0-4,2 (м, 1H), 5,2 (д, 1H).
Boc-(R)Cgl-Aze-OH
(i) Boc-(R)Cgl-Aze-OMe
К перемешиваемой смеси 3,86 г (15 ммоль) Boc-(R)Cgl-OH, 2,27 г (15 ммоль) H-Aze-OMe
· HCl и 2,75 г (22,5 ммоль) DMAP в 40 мл CH3CN при 5oC добавляли 3,16 г (16,5 ммоль) EDC. Реакционную смесь перемешивали при комнатной температуре в течение 48 ч.
Растворитель выпаривали и остаток растворяли в 150 мл EtOAc и 20 мл H2O. Отделенный органический слой промывали 2 х 20 мл 0,5М KHSO4, 2 х 10 мл NaHSO3 (насыщенный), 1
х 10 мл H2O, 1 х 10 мл насыщенного солевого раствора и сушили (MgSO4). После выпаривания растворителя получали 4,91 г (92%) указанного в заголовке соединения, которое
использовали на следующей стадии без дополнительной очистки.
1H ЯМР (500 МГц, CDCl3, 0,1 г/мл); основной ротамер, 0,83-1,35 (м, 5H), 1,38 (с, 9H), 1,47-1,84 (м, 6H), 2,18-2,27 (м, 1H), 2,50-2,62 (м, 1H), 3,72 (с, 3H), 3,94-4,06 (м, 1H), 4,07-4,15 (м, 1H), 4,39-4,47 (м, 1H), 4,68 (дд, 1H), 5,09 (д, 1H). Разрешенные пики от второстепенного ротамера, 2,27-2,35 (м, 1H), 3,77 (с, 3H), 3,80-3,87 (м, 1H), 3,88-3,95 (м, 1H), 4,92 (д, 1H), 5,21 (дд, 1H).
(ii) Boc-(R)Cgl-Aze-OH
Гидролиз Boc-(R)Cgl-Aze-OMe осуществляли в соответствии с
процедурой, описанной для Boc-(R)Cha-Pic-OEt (см. ниже). Продукт кристаллизовали из EtOH/ацетона/воды (1/1/3,95), выход 80%.
1H-ЯМР (500 МГц, CDCl3): δ 0, 85-1,3 (м, 5H), 1,40 (с, 9H), 1,5-1,9 (м, 6H), 1,95-2,2 (м, 2H), 3,92 (м, 1H), 4,09 (м, 1H), 4,35 (м, 1H), 4,95 (м, 1H), 5,16 (ушир.д, 1H).
Получение соединения HOOC-CH2
-(R)Cgl-Aze-Pab
(i) Boc-(R)Cgl-Aze-Pab(Z)
К перемешиваемой смеси 3,40 г (10 ммоль) Boc-(R)Cgl-Aze-OH (см. получение исходных материалов) и 5,13 г DMAP (42 ммоль) в 120 мл CH3CN добавляли 3,18 г H-Pab(Z) · HCl (см. Получение исходных материалов). После перемешивания в течение двух часов при комнатной температуре смесь охлаждали до -8oC и добавляли
2,01 г (10,5 ммоль) EDC. Реакционной смеси давали достичь комнатной температуры и перемешивание продолжали еще 47 ч. Растворитель выпаривали и остаток растворяли в 200 мл EtOAc. Органическую фазу
промывали 1 х 50 мл водой, 1 х 50 + 2 х 25 мл 0,5 М KHSO4, 2 х 25 мл NaHCO3 (насыщенный), 1 х 50 мл водой и сушили. После выпаривания растворителя получали 5,21 г (86%)
указанного в заголовке соединения.
1H-ЯМР (500 МГц, CDCl3): δ 0,8-1,9 (м, 20H; из этого 1,30 (с, 9H)), 2,35-2,6 (м, 2H), 3,74 (ушир.т, 1H), 4,10 (м, 1H), 4, 25-4,4 (м, 2H), 4,45-4,6 (м, 1H, ротамеры), 4,75-5,0 (м, 1H, ротамеры), 5,08 (ушир.д, 2H), 5,15 (с, 2H), 7,15-7,35 (м, 5H), 7,41 (д, 2H), 7,77 (д, 2H), 8,21 (м, 1H).
(ii)
H-(R)Cgl-Aze-Pab(Z)
К холодному раствору (температура ледяной бани) 18,8 г HCl(g) в 195 мл EtOAc добавляли 4,69 г (7,743 ммоль) Boc-(R)Cgl-Aze-Pab(Z) вместе с 40 мл EtOAc.
Реакционной смеси давали достичь комнатной температуры и перемешивали ее в течение 30 мин. К прозрачному раствору добавляли 140 мл Et2O, после чего образовывался осадок. Реакционную смесь
оставляли стоять при комнатной температуре в течение еще 1 ч 40 мин. Осадок отфильтровывали, быстро промывали 150 мл Et2O и сушили в вакууме. Осадок растворяли в 50 мл воды и подщелачивали
15 мл 2 М NaOH. Щелочную водную фазу экстрагировали 1 х 100 + 1 х 50 мл CH2Cl2. Объединенную органическую фазу промывали 1 х 20 мл водой, 1 х 20 мл насыщенным солевым раствором и
сушили (MgSO4). Выпаривание растворителя давало 3,44 г (88%) указанного в заголовке соединения.
1H-ЯМР (500 МГц, CDCl3): δ 0,8-2,0 (м, 11H), 2,51 (м, 1H), 2,67 (м, 1H), 3,07 (д, 1H), 4,11 (м, 1H), 4,18 (м, 1H), 4,43 (дд, 1H), 4,53 (дд, 1H), 4,91 (м, 1H), 5,22 (с, 2H), 7,2-7,4 (м, 7H), 7,45 (д, 2H), 8,51 (д, 2H).
(iii)
BnOOC-CH2-(R)Cgl-Aze-Pab(Z)
1,13 г (2,2 ммоль) H-(R)Cgl-Aze-Pab(Z), 0,9 г (2,6 ммоль) бензил-2-(орто-нитробензолсульфонилокси)ацетата ((2-NO2)Ph-SO2-OCH2-COOBn) (см. Получение исходных материалов), 0,99 г (5,6 ммоль) K2CO3 и 113 мл CH3CN смешивали и нагревали в масляной бане при 60oC в течение 3 ч.
Растворитель выпаривали в вакууме. Добавляли EtOAc и смесь промывали водой, органическую фазу экстрагировали 1 M KHSO4 и данную водную фазу промывали EtOAc. Кислую водную фазу подщелачивали
1н. NaOH до pH>8 и экстрагировали EtOAc. Органическую фазу промывали водой, сушили (Na2SO4), фильтровали и выпаривали в вакууме с получением 1,17 г остатка, который дважды
подвергали флэш-хроматографии с использованием в качестве элюентов сначала CH2Cl2/MeOH (NH3-насыщенный) 95/5, а затем диэтилового эфира/MeOH (NH3
-насыщенный) 9/1, с получением 0,525 г (36%) указанного в заголовке соединения.
Алкилирование также осуществляли с использованием бензил-2-(пара-нитробензолсульфонилокси)ацетата ((4-NO2)Ph-SO2-OCH2-COOBn) (см. Получение исходных материалов), используя ту же процедуру, как указана выше, с получением указанного в заголовке соединения с 52% выходом.
1H-ЯМР (300 МГц, CDCl3): δ 0,85-2,15 (м, 11H), 2,48 (м, 1H), 2,63 (м, 1H), 2,88 (д, 1H), 3,24 (д, 1H), 3,27 (д, 1H), 3,95 (м, 1H), 4,05 (м, 1H), 4, 44 (м, 1H), 4,55 (м, 1H), 4,91 (м, 1H), 5,07 (с, 2H), 5,22 (с, 2H), 7,2-7,4 (м, 10H), 7,45 (д, 2H), 7,79 (д, 2H), 8,42 (м, 1H).
(iva) HOOC-CH2-(R)Cgl-Aze-Pab ·
2HCl
BnOOC-CH2-(R)Cgl-Aze-Pab(Z), 20 мг (0,031 ммоль), растворяли в 5 мл метанола. Добавляли несколько капель хлороформа и 5% Pd/C и смесь гидрировали при атмосферном давлении в
течение 1 ч. После фильтрования и выпаривания продукт лиофилизировали из воды с получением 11 мг (72%) указанного в заголовке соединения.
1H-ЯМР (500 МГц, D2O): δ 1,0-2,0 (м, 11H), 2,10 (м, 1H), 2,44 (м, 1H), 2,82 (м, 1H), 3,90 (с, 2H), 4,09 (д, 1H), 4,4-4,55 (м, 2H), 4,66 (с, 2H), 5,08 (м, 1H), 7,65 (д, 2H), 7,89 (д, 2H).
13 C-ЯМР (75,5 МГц, D2O): углероды амидина и карбонила: δ 167,3, 167,9, 169,9 и 172,4.
(ivb) HOOC-CH2-(R)Cgl-Aze-Pab
BnOOC-CH2-(R)Cgl-Aze-Pab(Z)
растворяли в EtOH (99%) и гидрировали над 5% Pd/C при атмосферном давлении в течение 5 ч. Фильтрование катализатора через целлит и выпаривание растворителя давали указанное в заголовке соединение с
выходом 97%.
1H-ЯМР (500 МГц, CD3OD, смесь двух ротамеров): основной ротамер: δ 1,00-1,12 (м, 1H), 1,13-1,34 (м, 4H), 1,55-1,70 (м, 3H), 1,73-1,85 (м, 2H), 1,94-2,02 (ушир. д, 1H), 2,32-2,42 (м, 1H), 2,54-2,64 (м, 1H), 2,95-3,10 (AB-система плюс d, 3H), 4,18-4,25 (ушир.кв, 1H), 4,28-4,32 (ушир.кв, 1H), 4,43-4,60 (AB-система, 2H), 4,80-4,85 (дд, 1H), 7, 48-7,54 (д, 2H), 7,66-7,71 (д, 2H). Разрешенные сигналы от второстепенного ротамера появляются при δ 0,95 (м), 1,43 (м), 2,24 (м), 2,84 (д), 3,96 (м), 4,03 (м), 7,57 (ушир.д), 7,78 (ушир.д).
13C-ЯМР (125 МГц, CD3OD): углероды амидина и карбонила: δ 168,0, 173,0, 176,3 и 179,0.
Примеры
Аналитические методы, используемые в
нижеследующих примерах
Анализ на стабильность
Для HOOC-CH2-(R)Cha-Pic-Nag и HOOC-CH2-(R)Cgl-Aze-Pab соответственно разработан способ, указывающий на
стабильность, с использованием жидкостной хроматографии с обращенной фазой в ион-парном методе и УФ-детектирования при 210 и 238 нм.
Стандартный раствор тромбиновых ингибиторов 0,018-0, 022 мг/мл получают в подвижной фазе. Раствор образца разбавляют до концентрации около 0,02 мг/мл подвижной фазой. Колонку уравновешивают подвижной фазой до тех пор, пока не получат стабильную базовую линию. Стандарт и образец инъецируют с подходящими интервалами. Время удерживания для активных тромбиновых ингибиторов HOOC-CH2-(R)Cha-Pic-Nag и HOOC-CH2-(R)Cgl-Aze-Pab составляет для данных способов соответственно около 4 и 12 мин.
pH
pH растворов измеряют потенциометрически без предварительного разбавления, используя Radiometer PHM
Reference pH метр со стеклянным электродом (GK2401C электрод).
Следующие примеры иллюстрируют, но никоим образом не ограничивают данное изобретение.
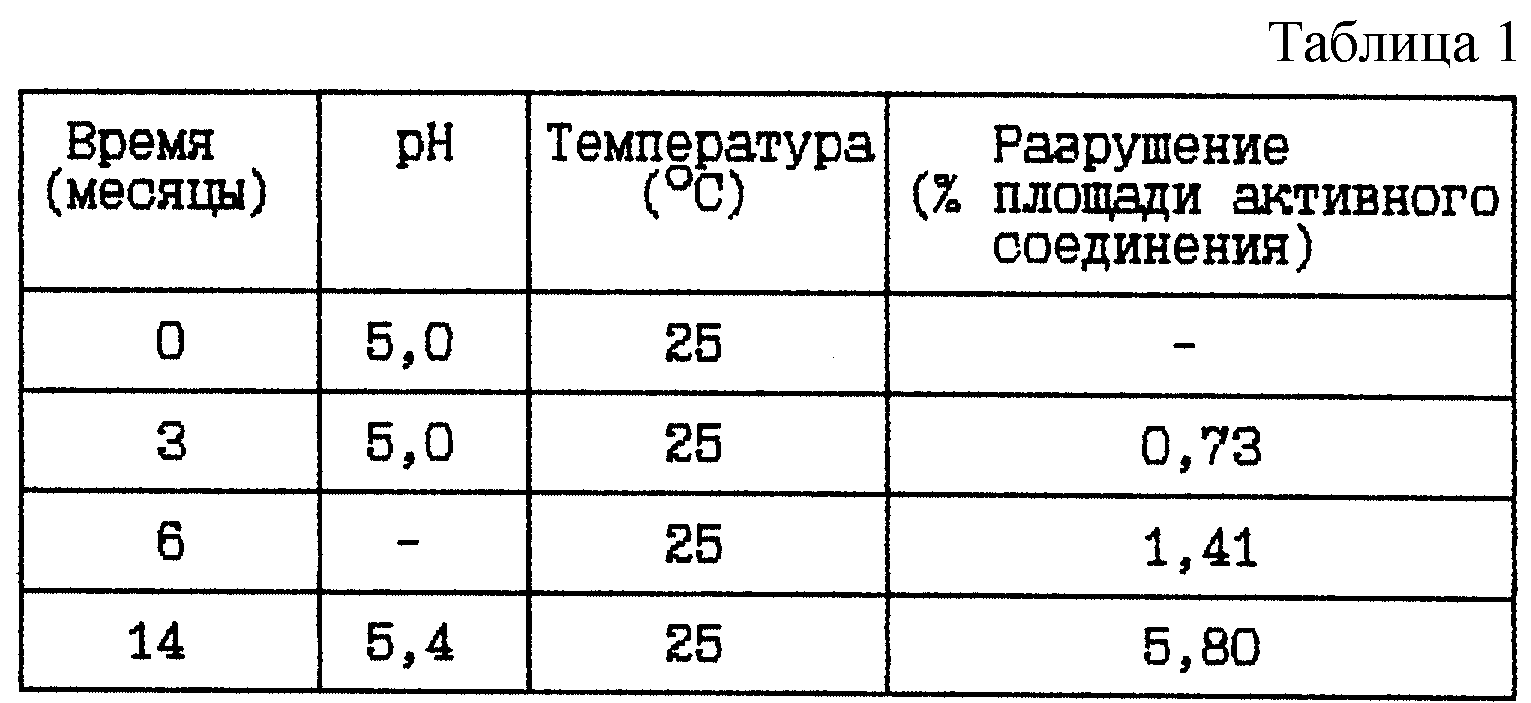
Пример 1. Данный пример представляет результаты изучения стабильности при 25oC ранее известного раствора ацетатного буфера, содержащего гидробромидную соль HOOC-CH2-(R)Cha-Pic-Nag при двух различных концентрациях и имеющего pH 5,0 в начале исследования.
(i) HOOC-CH2-(R)Cha-Pic-Nag · 2HBr буферный раствор (0,04 мг/мл), pH 5
Композиция:
HOOC-CH2-(R)Cha-Pic-Nag · 2HBr - 0,04 мг
Гидроксид натрия 1 М до pH 5 - Сколько необходимо
Ацетатный буфер 0,05 М (включая NaCl, 9 мг/мл) - До 1 мл
Стабильность (см. в табл. 1)
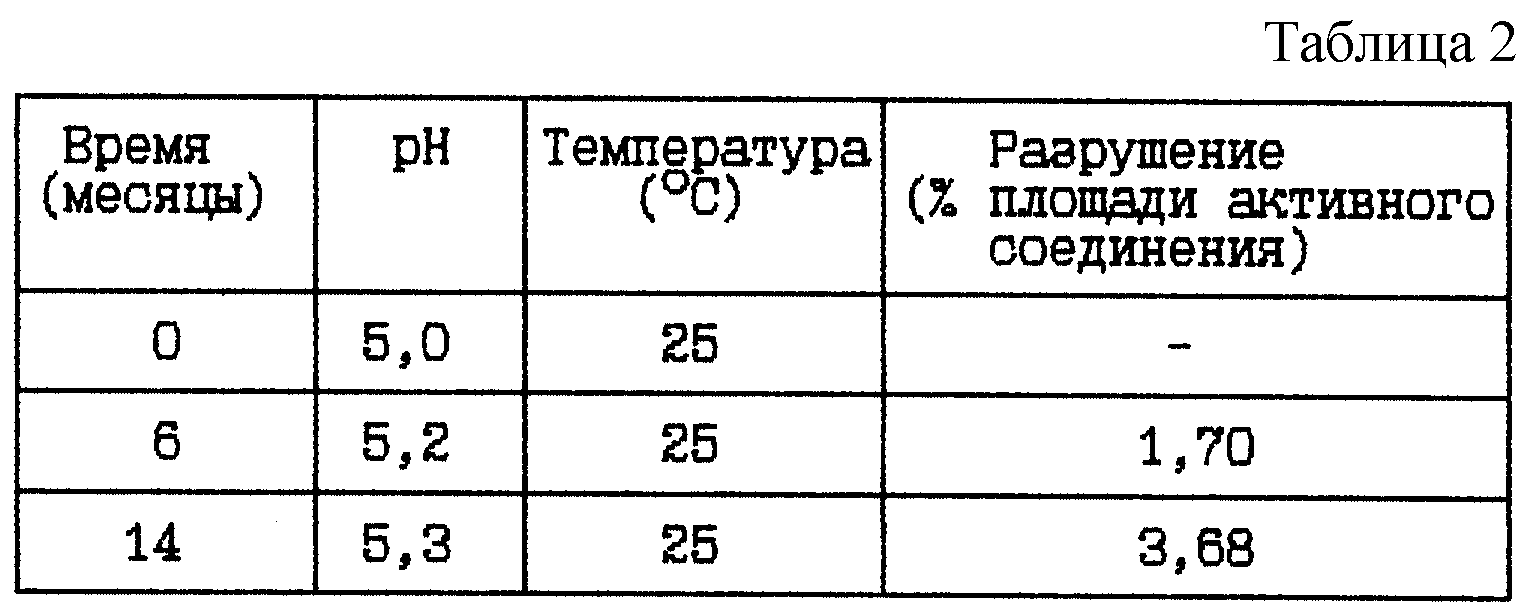
(ii) HOOC-CH2-(R)Cha-Pic-Nag · 2HBr буферный раствор (9 мг/мл), pH 5
Композиция:
HOOC-CH2-(R)Cha-Pic-Nag ·
2HBr - 9 мг
Гидроксид натрия 1 М до pH 5 - Сколько необходимо
Ацетатный буфер 0,05 М (включая NaCl, 9 мг/мл) - До 1 мл
Стабильность (см. табл. 2).
Вывод
Данное исследование по хранению указывает на то, что хранение при комнатной температуре, 25oC, в течение 2 лет не может быть приемлемым из-за значительного разрушения активного
соединения.
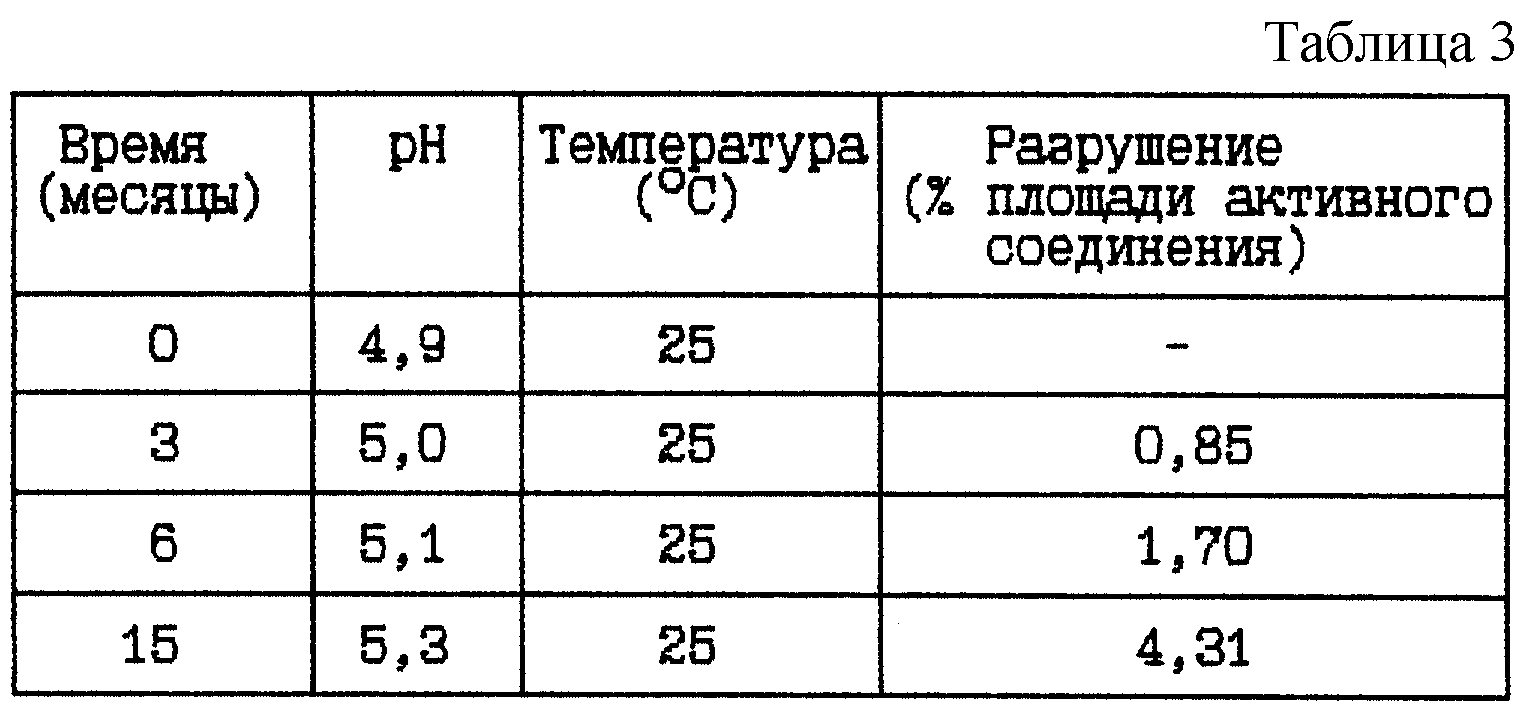
Пример 2. Данный пример представляет результаты исследования стабильности при 25oC HOOC-CH2-(R)Cha-Pic-Nag в виде свободного основания в той же самой концентрации, как в вышеуказанном примере 1 (ii), и начальном значении pH около 5. Цель данного исследования состояла в сравнении стабильности HOOC-CH2-(R)Cha-Pic-Nag в виде свободного основания и в виде его соли.
HOOC-CH2-(R)Cha-Pic-Nag буферный раствор (9 мг/мл), pH 5
Композиция:
HOOC-CH2-(R)Cha-Pic-Nag в виде свободного
основания - 9 мг
Хлористоводородная кислота 1 М до pH 5 - Сколько необходимо
Ацетатный буфер 0,05 М (включая NaCl, 9 мг/мл) - До 1 мл
Стабильность (см. табл. 3).
Вывод
Данное исследование показывает, что нет большого различия в стабильности при хранении при комнатной температуре, 25oC, при использовании HOOC-CH2
-(R)Cha-Pic-Nag в виде соли или в виде свободного основания (ср. пример 1).
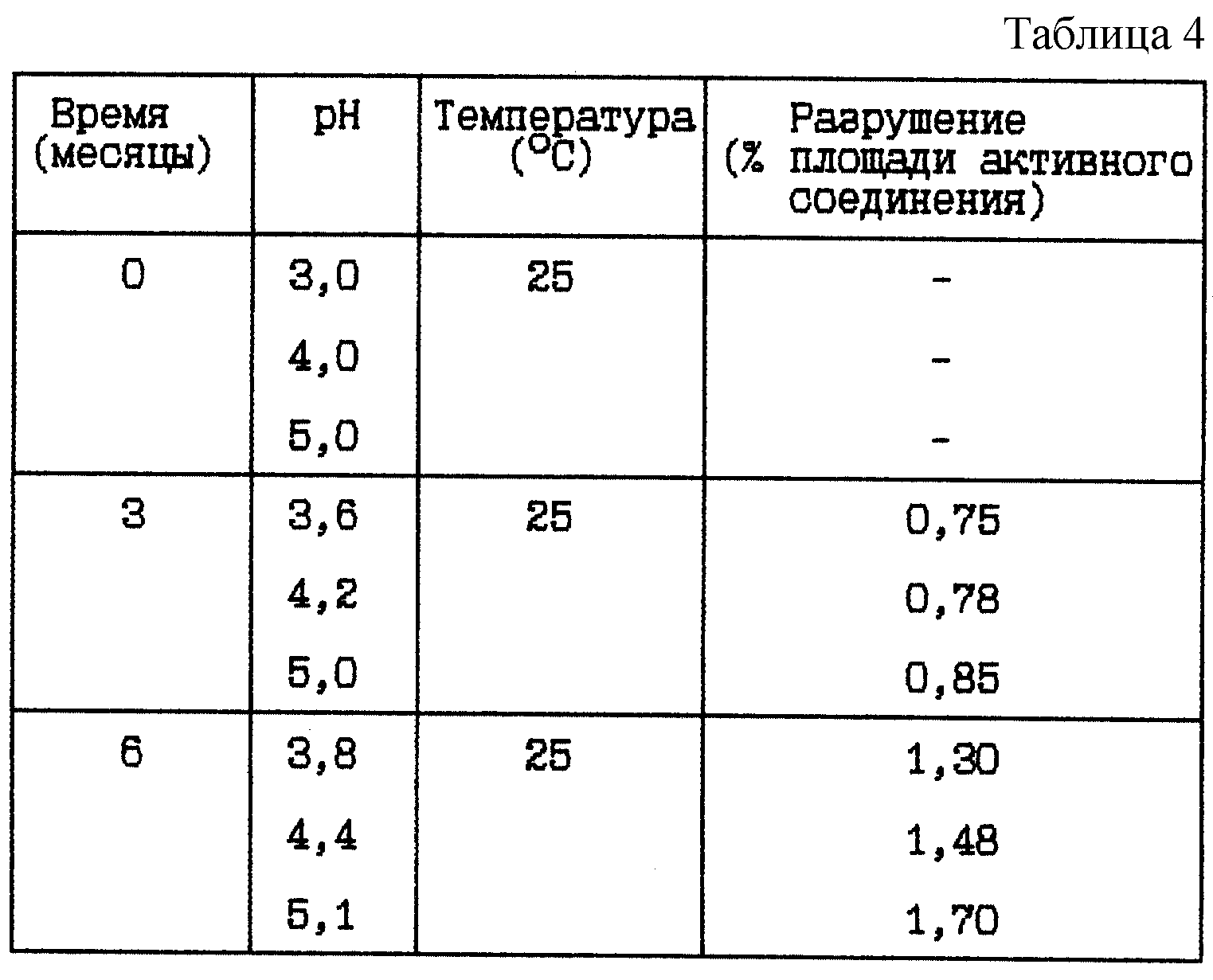
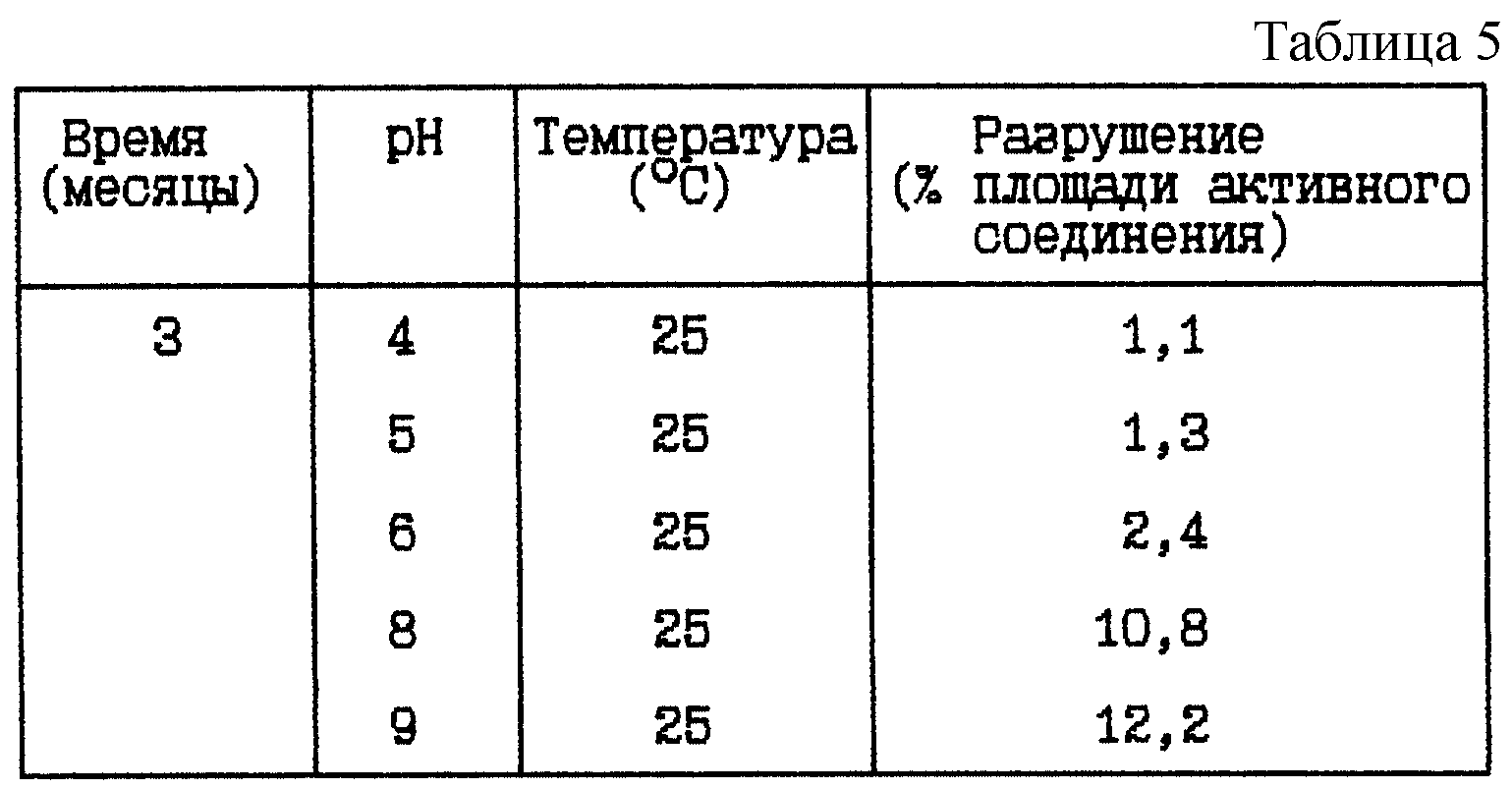
Пример 3. Данный пример представляет результат по изучению стабильности при 25oC буферных растворов HOOC-CH2-(R)Cha-Pic-Nag при различных pH между 3 и 9.
(i) HOOC-CH2-(R)Cha-Pic-Nag буферный раствор (9 мг/мл) при различных pH
Композиция:
HOOC-CH2-(R)Cha-Pic-Nag в виде свободного основания - 9 мг
Хлористоводородная кислота (1 M) до pH - Сколько необходимо
Ацетатный буфер 0,05 M (вкл. NaCl, 9 мг/мл)
- До 1 мл
Стабильность (см. табл. 4).
(ii) HOOC-CH2-(R)Cha-Pic-Nag · 2HCl буферные растворы (1 мг/мл) при различных pH
Композиция:
HOOC-CH2-(R)Cha-Pic-Nag · 2HCl - 9 мг
Буферный раствор*) - До 1 мл
*)(для ацетатного буфера с pH 4, 5 и 6, для фосфатного буфера с pH 8, для
карбонатного буфера с pH 9)
Стабильность (см. табл. 5).
Вывод
Данное исследование показывает, что разрушение HOOC-CH2-(R)Cha-Pic-Nag уменьшается при более
низком значении pH, независимо от того, какая это форма - основная или форма соли.
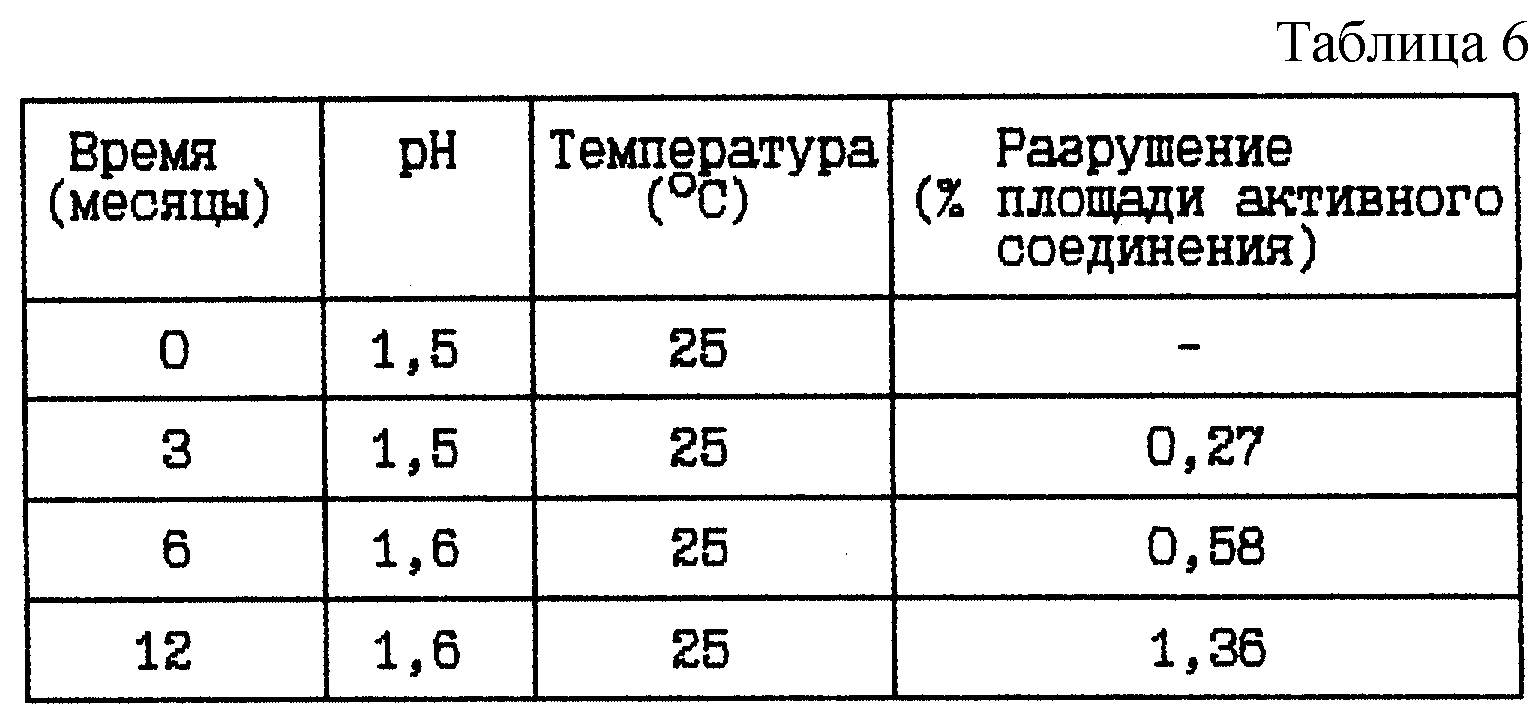
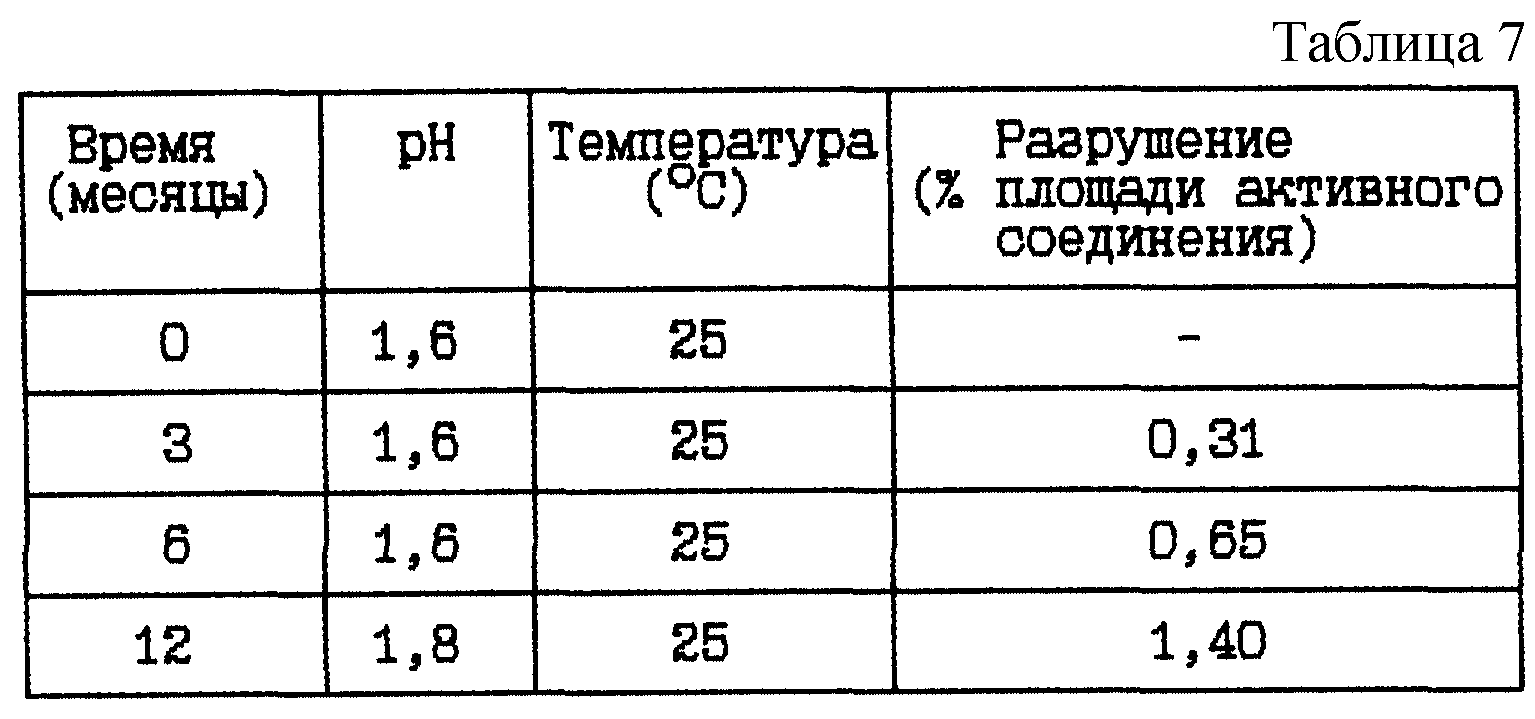
Пример 4. Данный пример представляет результат исследования стабильности при 25oC HOOC-CHa-(R)Cha-Pic-Nag в двух различных концентрациях при pH около 1,5, а именно от 1,5 до 1,6.
HOOC-CH2-(R)Cha-Pic-Nag водный раствор (0,4 мг/мл), pH 1,5
Композиция:
HOOC-CH2-(R)Cha-Pic-Nag в виде свободного основания - 0,4 мг
Хлористоводородная кислота 1 М до pH 1,5 - Сколько необходимо
Вода - До 1 мл
Стабильность (см. табл. 6).
(ii) HOOC-CH2-(R)Cha-Pic-Nag водный раствор (66 мг/мл), pH 1,5
Композиция:
HOOC-CH2-(R)Cha-Pic-Nag в виде свободного
основания - 66 мг
Хлористоводородная кислота 1 М до pH 1,5 - Сколько необходимо
Вода - До 1 мл
Стабильность (см. табл. 7).
Вывод
Данное исследование
показывает, что разрушение HOOC-CH2-(R)Cha-Pic-Nag уменьшается при указанном низком значении pH.
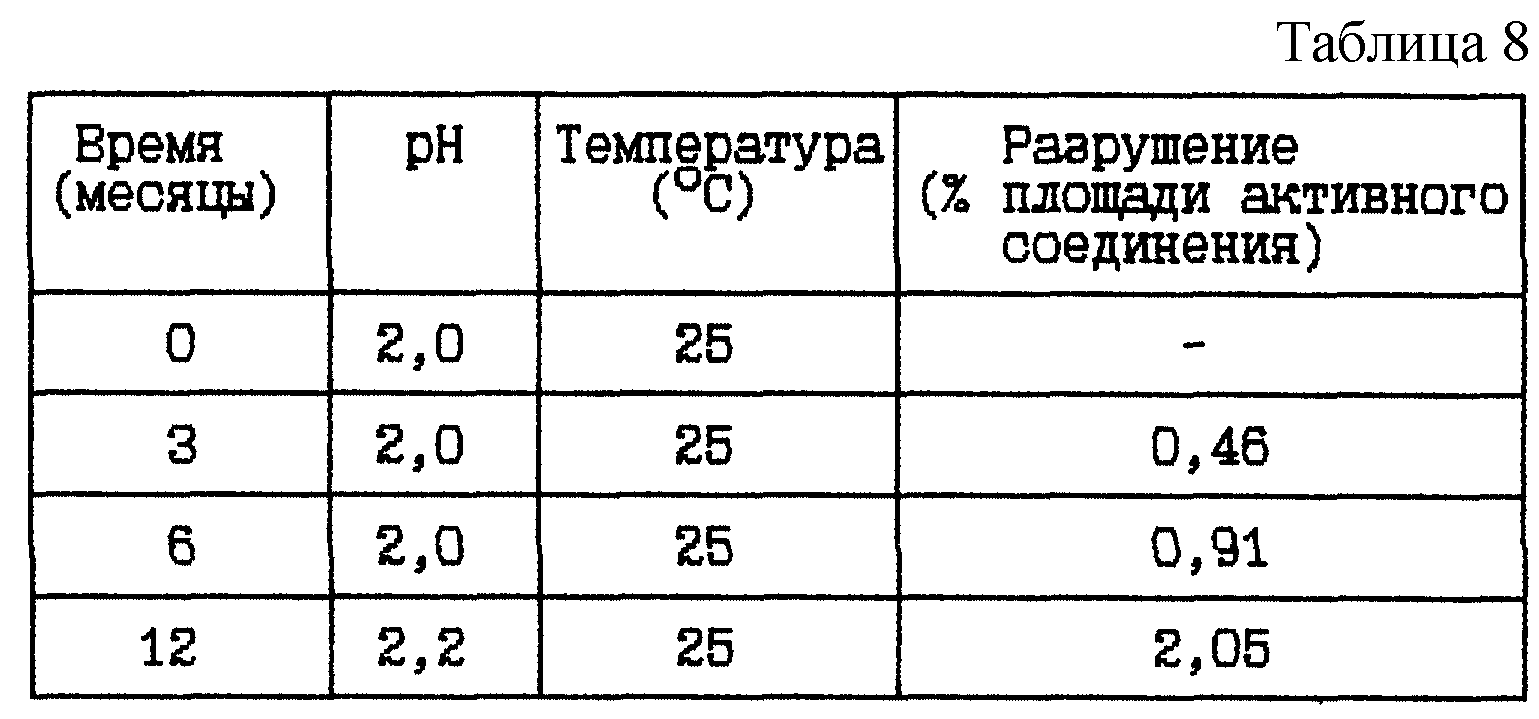
Пример 5. Данный пример представляет результат исследования стабильности при 25oC HOOC-CH2-(R)Cha-Pic-Nag в двух различных концентрациях при pH 2,0. Цель исследования состоит в сравнении разрушения при различных значениях pH в диапазоне от 1,5 до 2,5 с помощью сравнения (i) с Примером 4 (i).
(i) HOOC-CH2-(R)Cha-Pic-Nag водный раствор (0,4 мг/мл), pH 2
Композиция:
HOOC-CH2-(R)Cha-Pic-Nag в виде
свободного основания - 0,4 мг
Хлористоводородная кислота 1 М до pH 2 - Сколько необходимо
Вода - До 1 мл
Стабильность (см. табл. 8).
(ii) HOOC-CH2
-(R)Cha-Pic-Nag водный раствор (26 мг/мл), pH 2
Композиция:
HOOC-CH2-(R)Cha-Pic-Nag в виде свободного основания - 26 мг
Хлористоводородная кислота 1 М до pH 2
- Сколько необходимо
Вода - До 1 мл
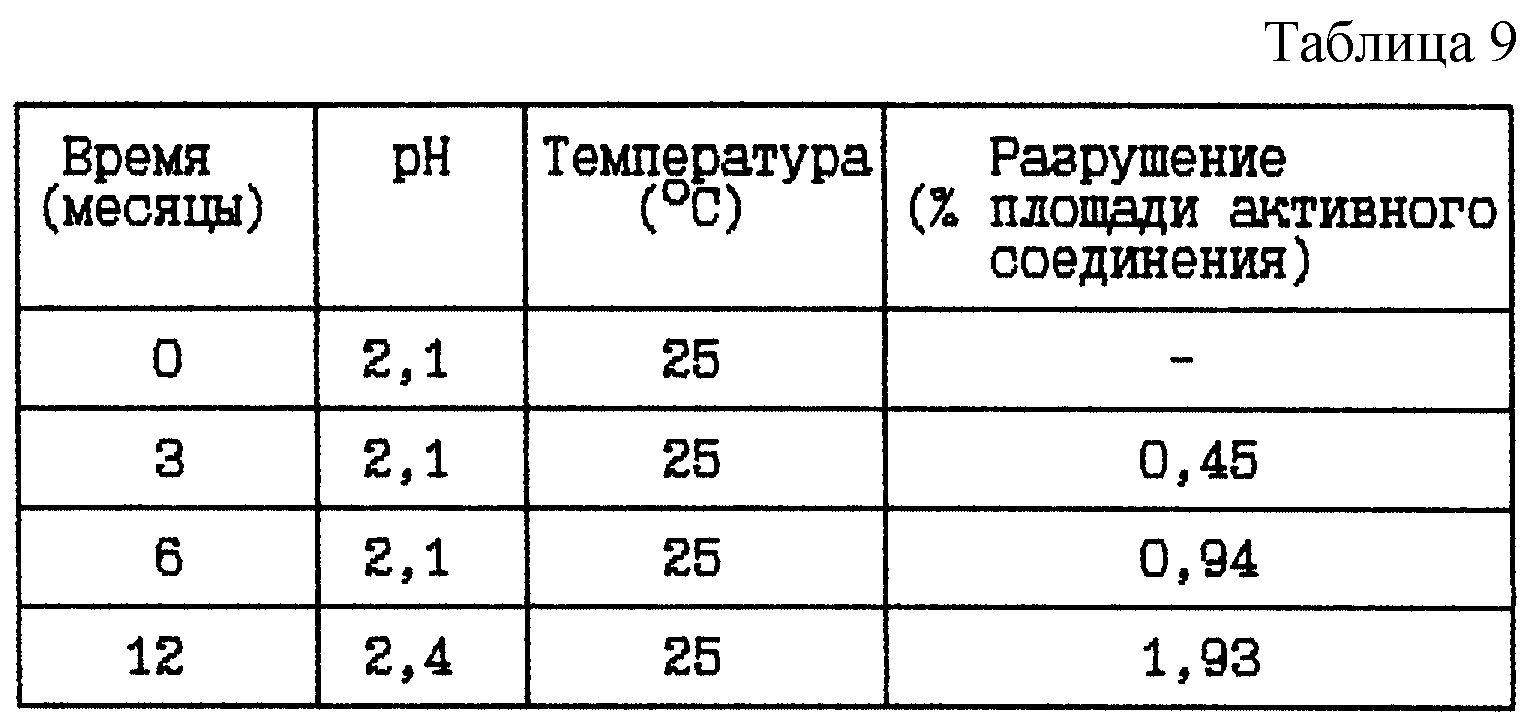
Стабильность (см. табл. 9).
Вывод
Данное исследование показывает, что разрушение уменьшается при данном низком значении
pH.
Пример 6. Данный пример представляет результаты исследования стабильности при 25oC HOOC-CH2-(R)-Cgl-Aze-Pab в виде свободного основания.
HOOC-CH2-(R)-Cgl-Aze-Pab буферный раствор (0,4 мг/мл), pH 6
Композиция:
HOOC-CH2-(R)-Cgl-Aze-Pab в виде свободного основания - 0,04 мг
Гидроксид натрия
(1 М) до pH 6 - Сколько необходимо
Ацетатный буфер (0,05 М) (вкл. NaCl 9 мг/мл) - До 1 мл
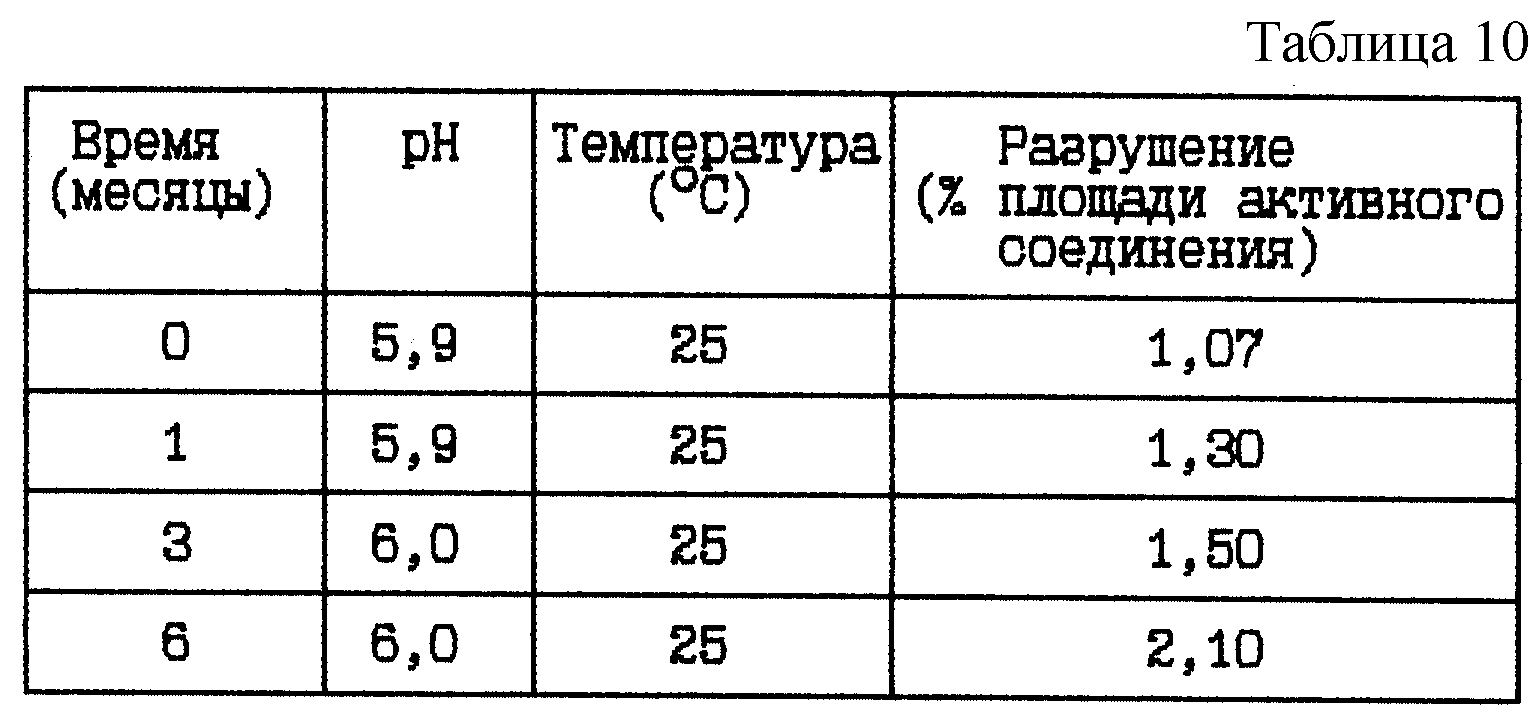
Стабильность (см. табл. 10).
Вывод
Данное исследование по хранению
показывает, что продолжительное хранение при 25oC данной готовой формы с pH 6 приводит к существенному разрушению.
Пример 7. Данный пример представляет результат исследования стабильности при 25oC HOOC-CH2-(R)-Cgl-Aze-Pab в виде буферного раствора и виде водного раствора соответственно при различных pH.
(i) HOOC-CH2-(R)-Cgl-Aze-Pab буферные растворы (12,9 мг/мл) при различных pH
Композиция:
HOOC-CH2-(R)-Cgl-Aze-Pab в виде свободного основания - 12,9 мг
Хлористоводородная кислота 1 М до pH - Сколько необходимо
Ацетатный буфер 0,05 М (вкл. NaCl, 9 мг/мл) - До 1 мл
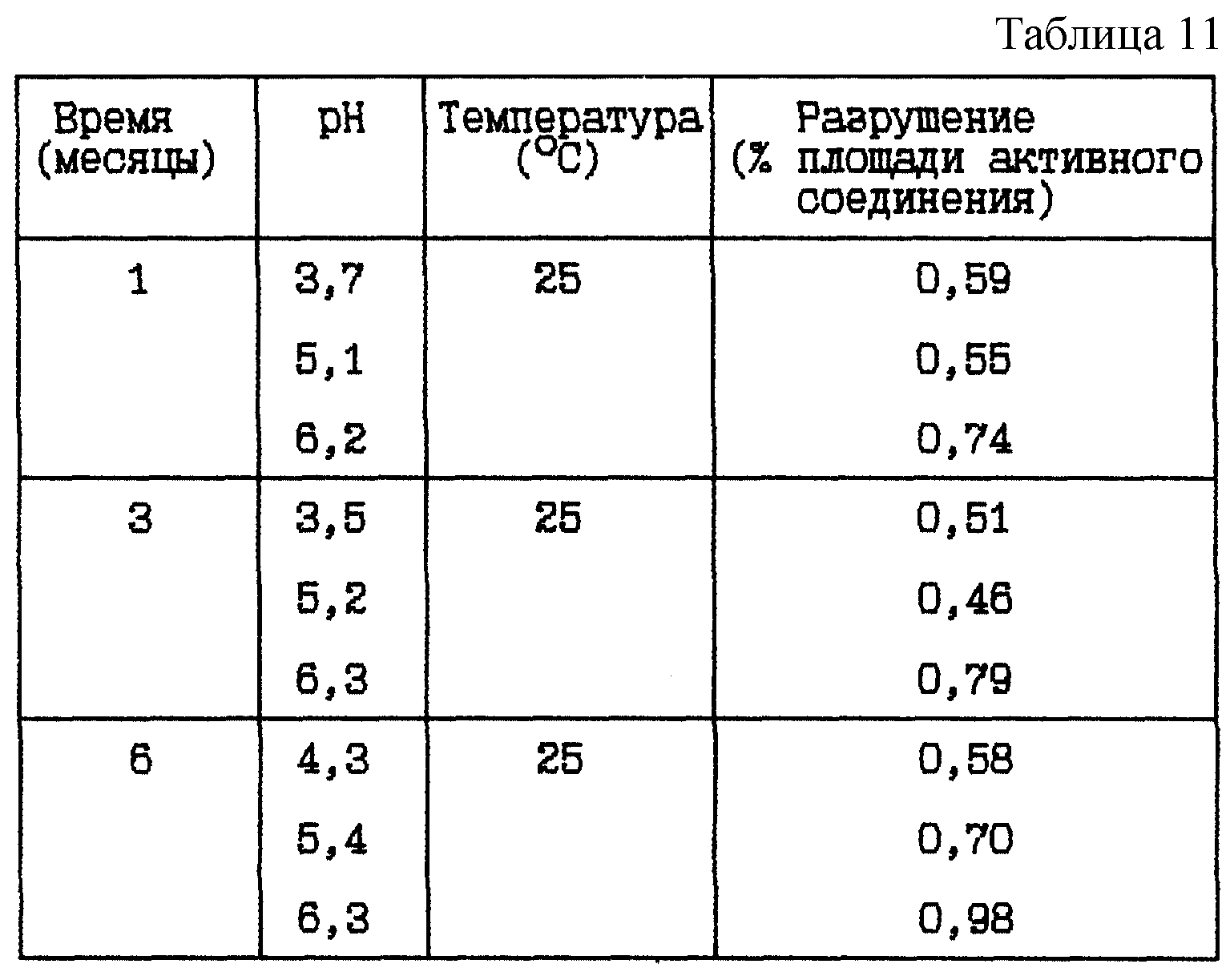
Стабильность (см. табл. 11).
(ii) HOOC-CH2
-(R)-Cgl-Aze-Pab водные растворы (12,9 мг/мл) при различных pH
Композиция:
HOOC-CH2-(R)-Cgl-Aze-Pab в виде свободного основания - 12,9 мг
Хлористоводородная
кислота 1 М до pH - Сколько необходимо
Вода - До 1 мл
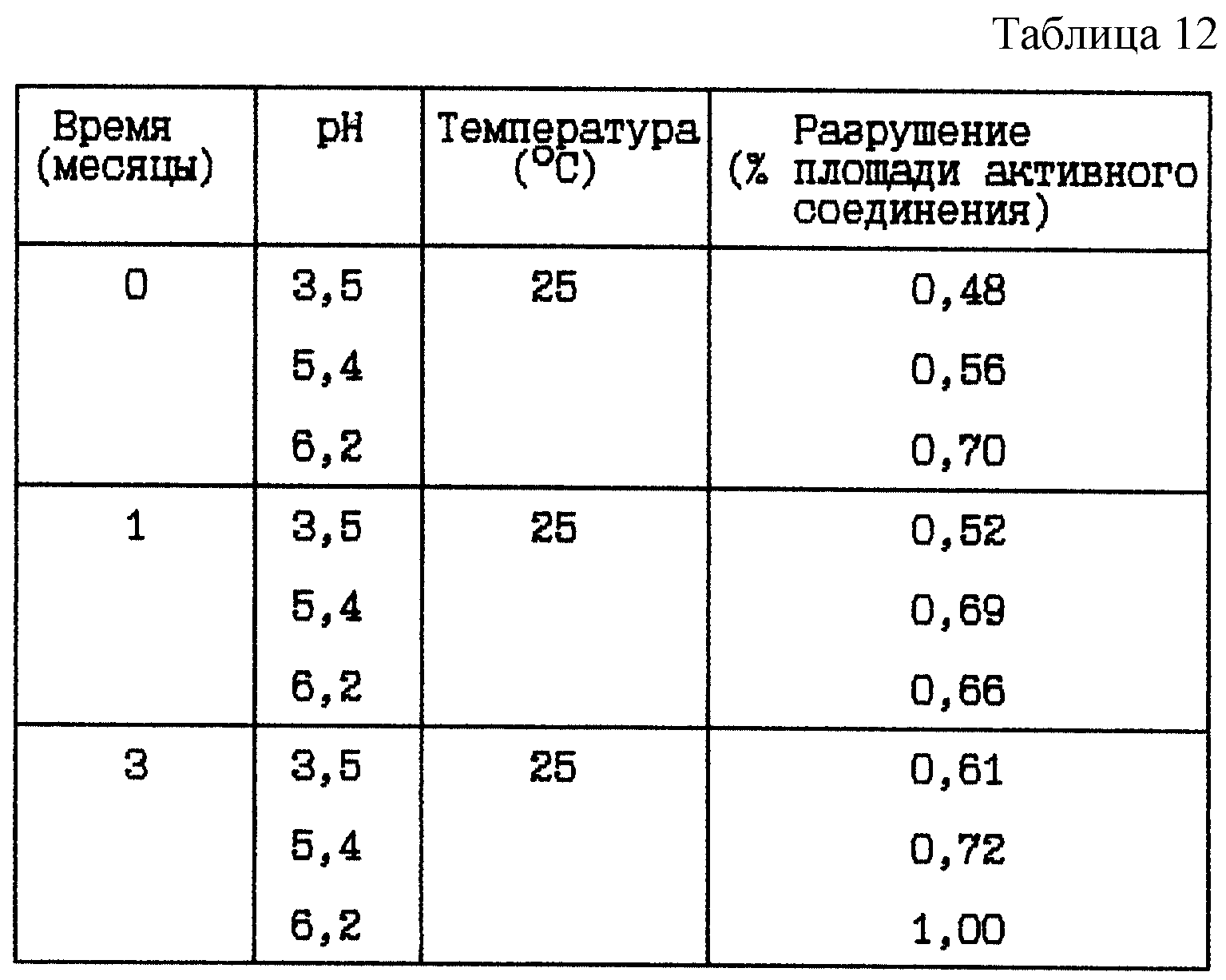
Стабильность (см. табл. 12).
Вывод
Данное исследование показывает, что разрушение HOOC-CH2
-(R)-Cgl-Aze-Pab уменьшается при более низком значении
pH, с или без буферных систем.
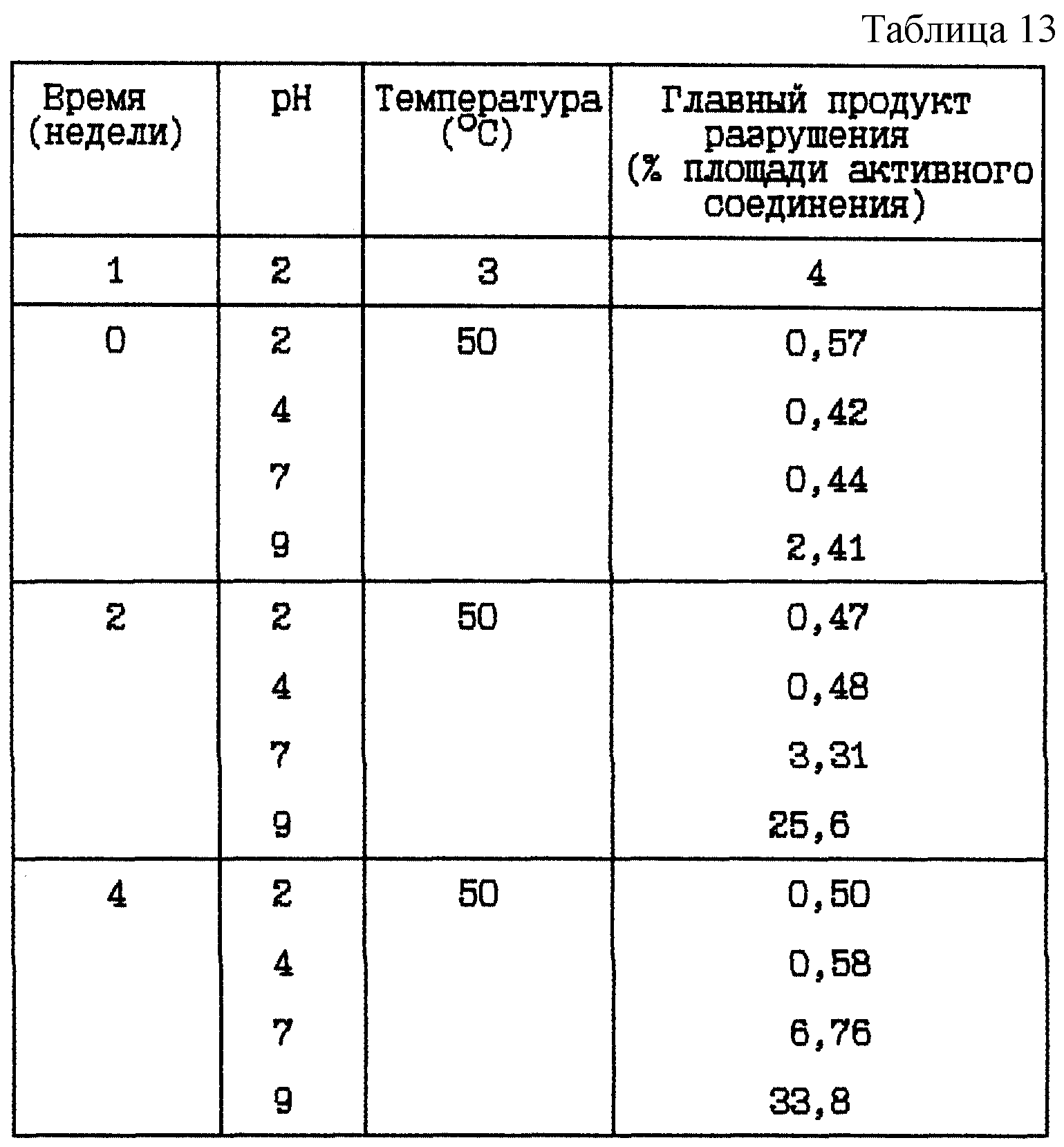
Пример 8. Данный пример представляет результат исследования стабильности при 50oC HOOC-CH2-(R)-Cgl-Aze-Pab в виде водных растворов, при различных pH.
HOOC-CH2-(R)-Cgl-Aze-Pab водные растворы (12,0 мг/мл) при различных pH
Композиция:
HOOC-CH2-(R)-Cgl-Aze-Pab в виде свободного основания - 12,0 мг
Хлористоводородная кислота 1 М или NaOH до указанной величины pH - Сколько необходимо
Вода - До 1 мл
Стабильность (см. табл. 13).
Вывод
Это исследование показывает, что при повышенной температуре разрушение HOOC-CH2-(R)-Cgl-Aze-Pab также
уменьшается при более низком значении pH.
Окончательные выводы
Вышеупомянутые исследования показывают, что при комнатной температуре, 25oC, разрушение активных
тромбиновых ингибиторов HOOC-CH2-(R)Cha-Pic-Nag и HOOC-CH2-(R)-Cgl-Aze-Pab соответственно ке уменьшается при более низком значении pH независимо от того, находятся ли они в форме
основания или в форме соли, и независимо от концентрации активного соединения.
Кроме того, исследования показывают, что водные растворы указанных тромбиновых ингибиторов, имеющие pH в диапазоне от 1,0 до 2,5, являются более стабильными при хранении при комнатной температуре в течение продолжительных периодов времени.
Реферат
Изобретение относится к препарату, предназначенному для внутривенного введения. Он может быть использован для лечения заболеваний, сопровождающихся гиперкоагуляцией. Водный раствор имеет pH 1,0-2,5 и содержит ингибитор тромбина формулы НООС-СН2-Y, где Y-(R)-Cha -Piс-Nag или (R)-Cgl-Aze-Pab, в виде соли или свободного основания. Предпочтительная концентрация ингибитора 0,001-300 мг/мл. Изобретение позволяет получить препарат, стабильный при хранении при комнатной температуре в течение не менее двух лет. После этого срока остается не менее 95% активного соединения. 7 з.п. ф-лы, 13 табл.

Комментарии