Трипептидное соединение, способ его получения и его применение - RU2685709C2
Код документа: RU2685709C2
Чертежи


Описание
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым соединениям формулы (I) и соответствующим фармацевтически приемлемым солям. Настоящее изобретение также относится к способу для получения соединений или соответствующих солей или их промежуточных соединений. Настоящее изобретение также относится к фармацевтической композиции таких соединений. Соединения обладают биоактивностью ингибирования ангиотензин-превращающего фермента, и соединения и фармацевтическая композиция таких соединений играют роль в профилактике и лечении гипертензии и других заболеваний кардиоцеребральной сосудистой системы.
Предпосылки создания изобретения
Темой Всемирного дня здоровья 2013 был контроль гипертензии. В соответствии с данными обследования, опубликованными Всемирной Организацией Здравоохранения (ВОЗ), гипертензия и ассоциированные с ней осложнения стали одним из основных заболеваний, которые угрожают жизни и здоровью человека, с частотой заболеваний и смертностью, которые превзошли опухолевые заболевания, и занимают первое место. В мире насчитывается около 1 миллиарда пациентов, страдающих гипертензией, приводящей к 7,1 миллионов случаев смерти от сердечно-сосудистых заболеваний каждый год, и, если это не контролировать, в 2025 году количество пациентов увеличится до 1,56 миллиарда. Центр профилактики и контроля хронических неинфекционных заболеваний Центра Контроля и Профилактики Заболеваний Китая опубликовал результаты последних исследований в 2010: распространение гипертензии в Китае среди взрослого населения доходило до 33,5%, и общее количество людей с таким заболеванием согласно оценкам превышало 330 миллионов. Гипертензия является наиболее серьезным фактором риска для частоты заболеваний и смертности от сердечного заболевания, инсульта, почечного заболевания и диабета. Около 2 миллионов смертей в год связаны с гипертензией, и гипертензия стала серьезной проблемой здравоохранения. (China News Network, October 10, 2010 16:26) Гипертензия и ее осложнения являются сильным экономическим бременем для общества и семей. К настоящему времени большой прогресс достигнут в исследовании лечения гипертензии и ее осложнений, но проблема боли у гипертензивных пациентов до сих пор не может быть разрешена. В то же время, широко распространенные факторы риска гипертензии и ее осложнений привели к быстрому развитию рынка антигипертензивных лекарственных средств. В последние 30 лет гипертензию в основном лечат лекарственными средствами, и поэтапно были разработаны шесть категорий антигипертензивных лекарственных средств, включая диуретики, блокаторы β-рецепторов, блокаторы α-рецепторов, антагонисты кальция (CCB), ингибиторы ангиотензин-превращающего фермента (ACEI) и антагонисты ангиотензиновых рецепторов (ARB), а также их различные комбинации.
Что касается ингибирования ангиотензин-превращающего фермента (ACEI), начиная с появления каптоприла в 1981, разработка лекарственного средства с использованием пролина в качестве исходного ядра и трагетирование ангиотензин-превращающего фермента (ACE, цинковый ион-содержащая экзопептидаза) является основной проблемой в области антигипертензивных средств, и были успешно разработаны ACEI лекарственные средства и лидерные соединения дипептидов и трипептидов, содержащих тиол, карбоновую кислоту, фосфорную кислоту и другие ключевые функциональные группы. На настоящий момент, по меньшей мере 17 ACEI лекарственных средств стали клиническими препаратами первой линии для лечения гипертензии. Другим антигипертензивным лекарственным средствам придают разное значение, в частности, ARB антигипертензивные средства постепенно стали важной частью антигипертензивных лекарственных средств, благодаря их пролонгированному действию и низкому риску побочных эффектов. Однако в клинических случаях пациенты с гипертензией часто имеют сопутствующие диабет, почечное заболевание и другие сердечно-сосудистые и церебрально-васкулярные заболевания. Только одно антигипертензивное лекарственное средство часто не может достичь желаемого эффекта, поэтому комбинация двух или более антигипертензивных лекарственных средств стала тенденцией в области клинических антигипертензивных лекарственных средств. Поэтому общим направлением является разработка мультиэффективных антигипертензивных лекарственных средств, которые являются более эффективными и подходящими для многих показаний.
Сущность изобретения
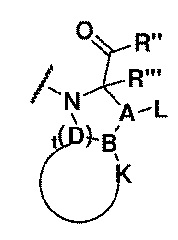
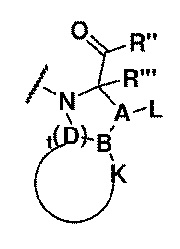
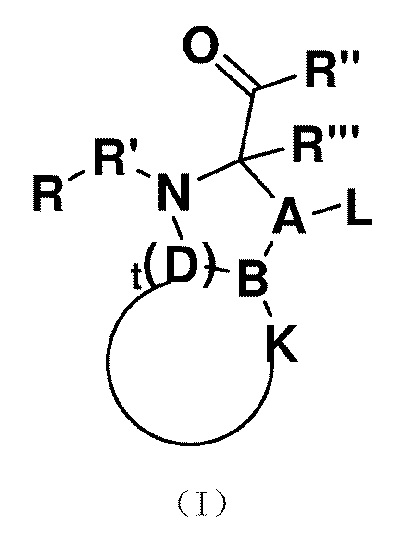
Настоящее изобретение обеспечивает трипептидное соединение со структурой формулы (I)

(I)
где, в формуле (I),
R представлен формулой (II)

(II)
где, в формуле (II),
R1 выбран из водорода, алкила, циклоалкила, гетероалкила, гетероциклила, алкенила, алкинила, ацила, ароила, арила, аралкила, гетероарила или гетероаралкила;
R2 выбран из водорода, алкила, циклоалкила, гетероалкила, гетероциклила, алкенила, алкинила, ацила, ароила, арила, аралкила, гетероарила, гетероаралкила, алкилтио, аралкилтио, арилтио, F, Cl, Br, I, NO2илиCN;
R1 и R2 являются одинаковыми или отличными друг от друга;
n=0, 1, 2, 3, 4 или 5; и когда n ≥2, группы R1 являются одинаковыми или отличными друг от друга;
m =0, 1, 2, 3, 4 или 5; и когда m ≥2, группы R2 являются одинаковыми или отличными друг от друга;
W выбран из


X выбран из кислорода или водорода;
где, в формуле (I),
Rʹ представляет собой остаток L- или D-аминокислоты или аминокислотного производного, как показано в формуле (III), или R' отсутствует, и

(III)
когда Rʹ представляет собой остаток L- или D-аминокислоты или аминокислотного производного, C-конец

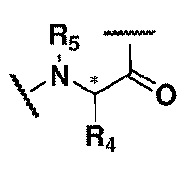

когда R' отсутствует,

где R4 и R5, каждый независимо, выбраны из водорода, алкила, циклоалкила, гетероалкила, гетероциклила, алкенила, алкинила, арила, аралкила, гетероарила или гетероаралкила; и R4 и R5 являются одинаковыми или отличными друг от друга;
где, в формуле (I),
Rʹʹ представлен формулой (IV):

где:
Y выбран из кислорода, азота или серы, и
когда Y представляет собой азот, Rʹʹʹʹ представляет собой R7 и R8, и Rʹʹ представляет собой

когда Y представляет собой кислород, Rʹʹʹʹ представляет собой R9, и Rʹʹ представляет собой -OR9;
когда Y представляет собой серу, Rʹʹʹʹ представляет собой R10, и Rʹʹ представляет собой -SR10;
где, R7, R8, R9 и R10 могут быть одинаковыми или отличными друг от друга и, каждый независимо, выбраны из водорода, алкила, циклоалкила, гетероалкила, гетероциклила, алкенила, алкинила, арила, аралкила, гетероарила или гетероаралкила;
где, в формуле (I),
Rʹʹʹ выбран из водорода или алкила;
A=углерод;
L выбран из водорода, алкила, замещенного алкила, арила или замещенного арила;
D представляет собой углерод или отсутствует, t=0, 1, 2, 3; и
когда D представляет собой углерод и B представляет собой углерод, A связан с B углерод-углеродной двойной связью или углерод-углеродной простой связью, и K и B и D присутствуют в кольцевой системе; или A связан с B углерод-углеродной двойной связью или углерод-углеродной простой связью, и K связан с B и не связан с D;
где K и B и D присутствуют в кольцевой системе, K выбран из алкила или гетероалкила с количеством атомов углерода от 2 до 8 или алкенила с количеством атомов углерода от 3 до 8, или K вместе с B и D образует арил, замещенный арил, гетероарил или замещенный гетероарил;
когда K связан с B и не связан с D, K выбран из водорода, алкила, гетероалкила, циклоалкила, гетероциклила, алкенила, алкинила, гидрокси, алкокси, арилокси, арила, аралкила, гетероарила или гетероаралкила;
когда D представляет собой углерод и B представляет собой серу, A связан с B через простую связь углерод-сера, и K отсутствует; и
когда D отсутствует, B представляет собой углерод и K представляет собой водород;
где алкильная, циклоалкильная, гетероалкильная, гетероциклильная, алкенильная, алкинильная, арильная, аралкильная, гетероарильная и гетероаралкильная группа, каждая, может быть незамещенной или необязательно замещенной одним или несколькими заместителями, выбранными из гидрокси, алкокси, арилокси, тио, тиоалкильной, арилтио, амино, амидо, алкиламино, ариламино, алкилсульфонильной, арилсульфонильной, сульфонамидо, алкильной, арильной, гетероарильной, алкилсульфонамидо, арилсульфонамидо, кето, карбокси, алкоксикарбонильной, карбоксамидо, алкоксикарбониламино, алкоксикарбонилокси, алкилуреидо, арилуреидо, галогенов, циано или нитро групп.
В некоторых вариантах, R группа

(II)
выбрана из следующих структур:


В некоторых вариантах, Rʹ группа

(III)
выбрана из следующих структур:


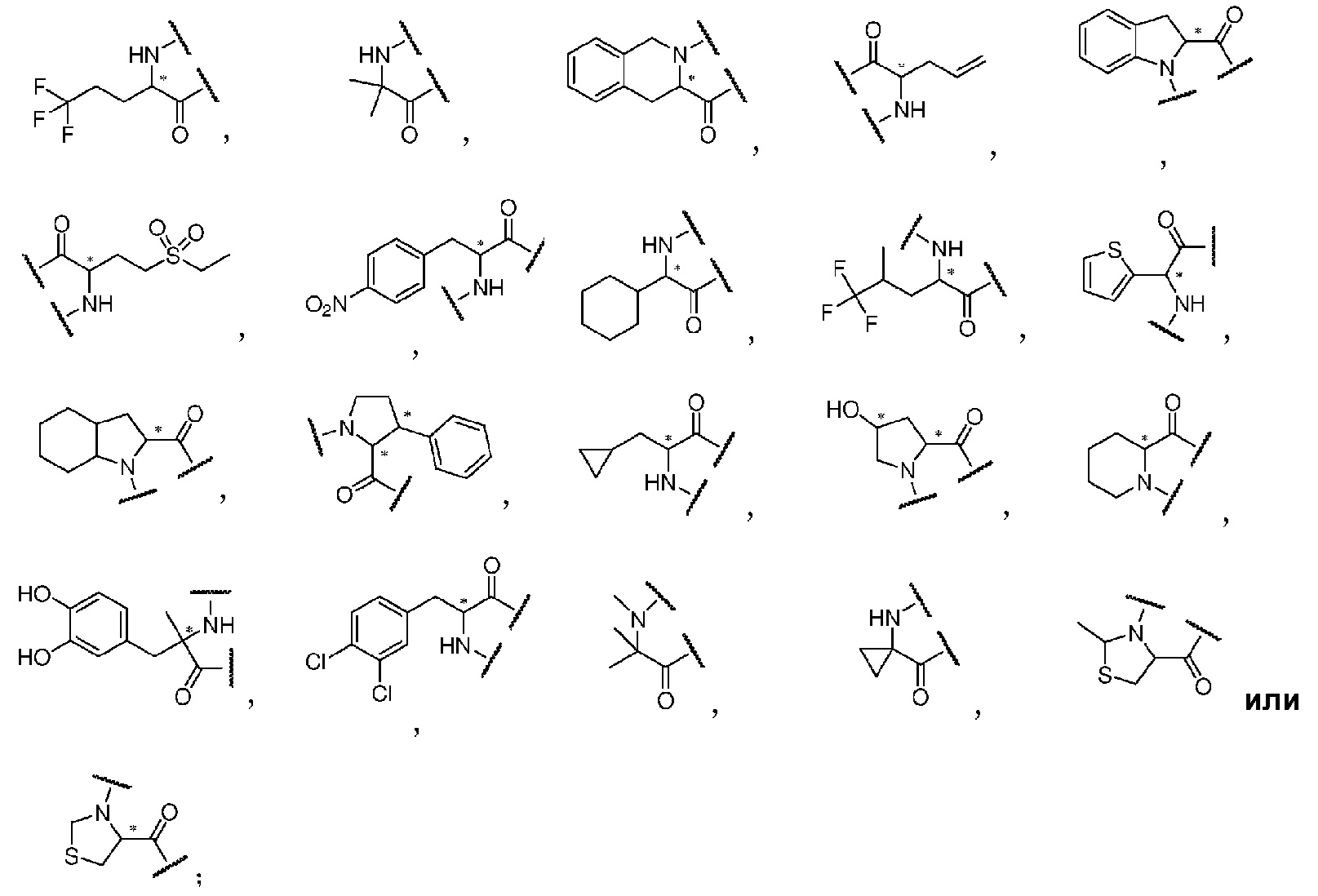
где ʺ*ʺ представляет собой хиральный центр, и соединение, включающее ʺ*ʺ, включает все хиральные изомеры структурной формулы.
В некоторых вариантах, когда Y представляет собой кислород, R9 представляет собой группу, выбранную из метила, этила, пропила, изопропила, н-бутила, изобутила, трет-бутила, н-пентила, циклопропила, циклобутила, циклопентила, циклогексила, циклогептила или следующих структур:

В некоторых вариантах, когда Y представляет собой азот, Rʹʹ представляет собой группу, выбранную из

где ʺ*ʺ представляет собой хиральный центр, и соединение, включающее ʺ*ʺ, включает все хиральные изомеры структурной формулы.
В некоторых вариантах, когда Y представляет собой серу, Rʹʹ представляет собой группу, выбранную из

где ʺ*ʺ представляет собой хиральный центр, и соединение, включающее ʺ*ʺ, включает все хиральные изомеры структурной формулы.
В некоторых вариантах, формула (I) выбрана из следующих формул:

где ʺ*ʺ представляет собой хиральный центр, и соединение, включающее ʺ*ʺ, включает все хиральные изомеры структурной формулы.
В некоторых вариантах, трипептидное соединение, указанное выше, выбрано из соединений, имеющих следующие структуры:





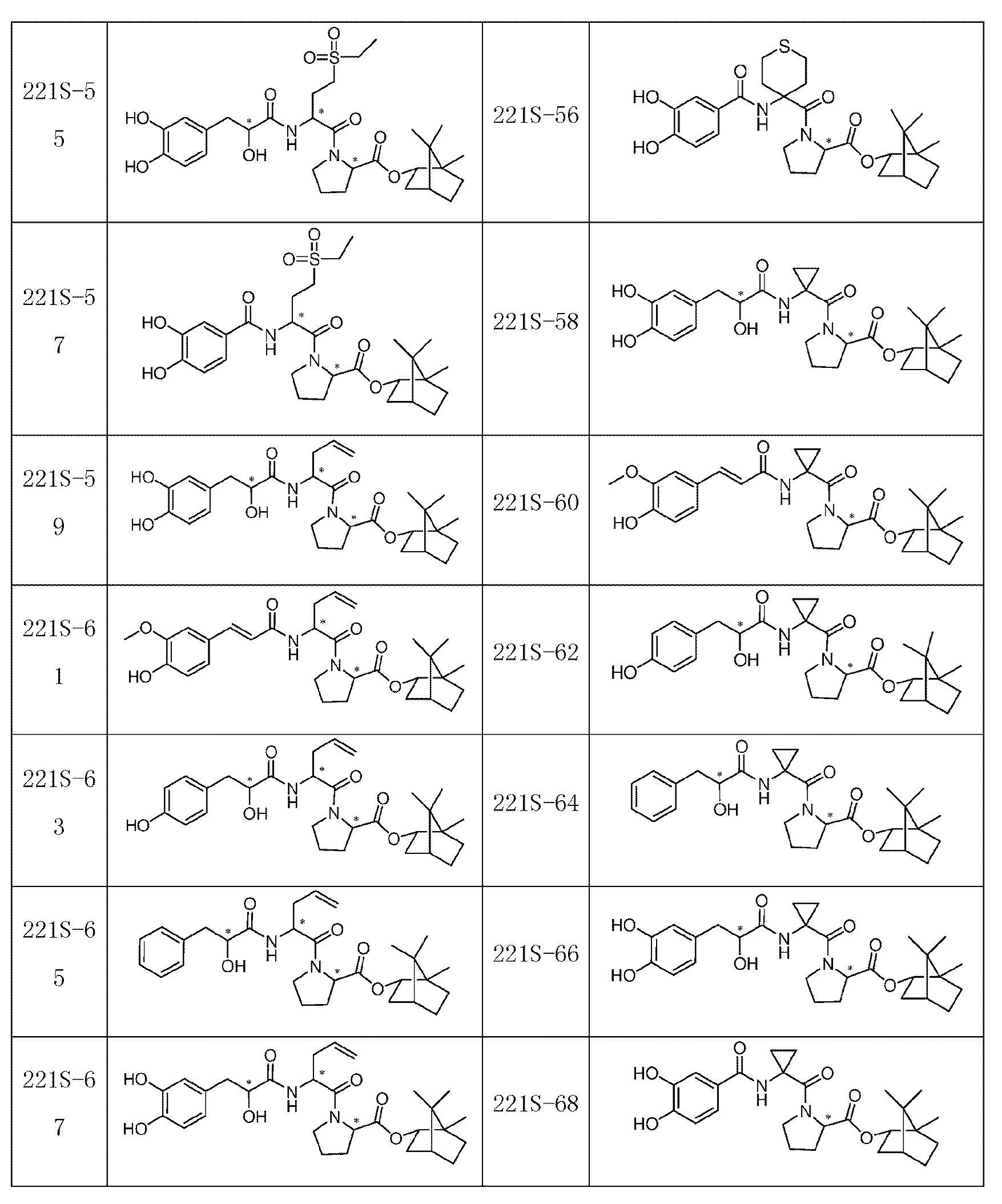











где ʺ*ʺ представляет собой хиральный центр, и соединение, включающее ʺ*ʺ, включает все хиральные изомеры структурной формулы.
Настоящее изобретение также обеспечивает гидролизат соединения, описанного выше, где Y представляет собой кислород.
Настоящее изобретение также обеспечивает энантиомер, таутомер, стереоизомер, ротамер, диастереомер или рацемат соединения, описанного выше.
Настоящее изобретение также обеспечивает фармацевтически приемлемую соль и фармацевтически приемлемый сложный эфир соединения, описанного выше, где фармацевтически приемлемая соль включает фармацевтически приемлемую соль кислоты и фармацевтически приемлемую соль основания, где фармацевтически приемлемая соль кислоты включает соль, образованную с одной из следующих кислот: серная кислота, гидросульфат, хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, азотная кислота, угольная кислота, борная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, пирувиновая кислота, малеиновая кислота, яблочная кислота, винная кислота, лимонная кислота, аскорбиновая кислота, бензойная кислота, камфорная кислота, фумаровая кислота, щавелевая кислота, янтарная кислота, камфорсульфоновая кислота, малеиновая кислота, салициловая кислота или α-молочная кислота; фармацевтически приемлемая соль основания включает соль, образованную с одним из следующих оснований: щелочные металлы, включающие литий, натрий и калий; щелочно-земельные металлы, включающие магний и кальций; гидроксид лития, гидроксид натрия, гидроксид калия, гидрид лития, гидрид натрия, бутиллитий, аммоний, триэтиламин, диизопропилэтиламин, орнитин, аргинин, лизин или гистидин; и фармацевтически приемлемый сложный эфир включает сложный эфир, образованный через гидроксильную группу или фенольную гидроксильную группу в соединении с кислотой.
Настоящее изобретение также обеспечивает сольватированную смесь соединения, описанного выше, где сольват выбран из сольвата, образованного с водой, метанолом, этанолом, изопропанолом, бутанолом, этилацетатом и DMSO или их комбинациями.
Настоящее изобретение также обеспечивает способ получения соединения, указанного выше, где способ включает:

или

где,
когда Y выбран из азоты или серы, стадия (2) завершается после синтеза соединения (Iʹ), или стадия (2ʹ) завершается после синтеза соединения (Iʹʹ),
A, B, D, L, K, n, m, R1, R2, R4, R5, Rʹʹʹ, Rʹʹʹʹ, t, W и Y имеют значения, определенные в любом из пунктов формулы изобретения 1-7;
a: защита амино α-аминокислоты; P представляет собой подходящую защитную группу и выбран из трет-бутоксикарбонила(Boc), аллилоксикарбонила(Alloc), бензилоксикарбонила, тритила, бензилоксиметила, флуоренилметоксикарбонила(Fmoc), фталоила, дитиосукцинила, метоксиформила, этоксиформила, бензолсульфонила, п-толуолсульфонила, 2-(триметилсилил)этансульфонила, бензила(Bn), тритила(Tr) или аллила;
b: условия для синтеза пептидной связи;
c: удаление защиты, соответствующей стадии a;
e: также как b;
f: также как c;
g: также как b;
gʹ: восстановительное аминирование;
h: условия для сложноэфирного гидролиза;
где ʺ*ʺ представляет собой хиральный центр, и соединение, включающее ʺ*ʺ, включает все хиральные изомеры структурной формулы.
В другом аспекте, настоящее изобретение обеспечивает применение соединения, указанного выше, для получения лекарственного средства для профилактики, лечения или отсрочки гипертензии и ее осложнений, где осложнения включают одно или несколько таких осложнений, как коронарное сердечное заболевание, стенокардия, острая сердечная недостаточность, хроническая застойная сердечная недостаточность, инфаркт миокарда и осложнения, застойное сердечное заболевание, ишемия миокарда, миокардит, миокардиальный фиброз, гипертрофия миокарда, атеросклероз, доброкачественный нефросклероз малых артерий, злокачественный нефросклероз малых артерий, аномальный рост и ремоделирование сосудов, связанные с ангиогенезом заболевания (такие как неоваскулярная дегенерация желтого пятна), гиперальдостеронизм, аритмия, почечное заболевание, диабет, инсульт, тромбоз, почечная недостаточность (такая как диабетическая нефропатия), гиперлипидемия, ожирение, гипергликемия, ретинальный артериосклероз и гипертензивные поражения глазного дна.
В другом аспекте, настоящее изобретение обеспечивает фармацевтическую композицию, включающую: соединение, указанное выше, фармацевтически приемлемую соль соединения в соответствии любым из пунктов формулы изобретения 1-8, фармацевтически приемлемый носитель, эксципиент и разбавитель для соединения, указанного выше.
В другом аспекте, настоящее изобретение обеспечивает применение указанной выше фармацевтической композиции для получения лекарственного средства для профилактики, лечения или отсрочки гипертензии и ее осложнений, где осложнения включают одно или несколько из осложнений, таких как коронарное сердечное заболевание, стенокардия, сердечная недостаточность (острая или хроническая застойная сердечная недостаточность), инфаркт миокарда и осложнения, застойное сердечное заболевание, ишемия миокарда, миокардит, миокардиальный фиброз, гипертрофия миокарда, атеросклероз, доброкачественный нефросклероз малых артерий, злокачественный нефросклероз малых артерий, аномальный рост и ремоделирование сосудов, связанные с ангиогенезом заболевания (такие как неоваскулярная дегенерация желтого пятна), гиперальдостеронизм, аритмия, почечное заболевание, диабет, инсульт, тромбоз, почечная недостаточность (например, диабетическая нефропатия), гиперлипидемия, ожирение, гипергликемия, ретинальный артериосклероз и гипертензивные поражения глазного дна.
Соединение в соответствии с настоящим изобретением обладает эффектом ингибирования биологической активности ангиотензин-превращающего фермента, и соединение как таковое и его фармацевтическая композиция обладают профилактическим и терапевтическим эффектом на гипертензию и другие сердечно-сосудистые и церебрально-васкулярные заболевания.
Краткое описание чертежей
Фиг. 1 представляет график подгонки квадратической кривой между концентрацией ангиотензин-превращающего фермента и значением OD 450 нм;
Фиг. 2 показывает изменение артериального систолического давления в течение 6 часов после внутрижелудочного введения 221S-1a крысам SHR;
Фиг. 3 показывает изменение артериального систолического давления в течение 6 часов после внутрижелудочного введения 221S-1a при разных дозах (1#, 3#, и 5#) крысам SHR;
Фиг. 4 показывает изменение артериального систолического давления в течение 14 дней после внутрижелудочного введения 221S-1a в течение 7 дней крысам SHR; и
Фиг. 5 показывает изменение артериального систолического давления в течение 14 часов после внутрижелудочного введения 221S-1a при разных дозах (2#, 4#, и 6#) крысам SHR.
Подробное описание вариантов осуществления
Даншен (красный шалфей, латинское название: Salvia miltiorrhiza Bunge), в качестве средства традиционной китайской медицины, используется в лечении сердечно-сосудистых и церебрально-васкулярных заболеваний. В последнее время появилось большое число публикаций, сообщающих о синергическом эффекте даншена в лечении гипертензии. (Biological & Pharmaceutical Bulletin, 2011, 34 (10), 1596-1601.; Phytotherapy Research, 2010, 24(5), 769-774.; American Journal of Physiology, 2007, 292(5, Pt. 2), H2131-H2137.; Chinese Journal of Clinical Rehabilitation, 2006, 10(23), 73-75; Medicinal and Aromatic Plants-Industrial Profiles, 2000, 14(Sage), 193-205). В комбинации с приловыми и сартановыми антигипертензивными средствами лекарственные средства на основе даншена имеют существенный клинический эффект, особенно у пациентов с гипертензией, ассоциированной с диабетом.
Даншенсу представляет собой основной ингредиент водорастворимого экстракта даншена, и его катехоловая и молочно-кислотная структура придает ему уникальные эффекты антиоксиданта, сердечно-сосудистой защиты, промотирования вазодилатации, снижения кровяного давления и т.п. (Characterization of the Radical Scavenging and Antioxidant Activities of Danshensu and Salvianolic Acid B. Food and Chemical Toxicology, 2008, 46(1), 73-81; Protective effect of danshensu on endothelial vascular activity in rats with isoproterenol-induced injury and its mechanism, Chinese herbal medicine, 2013, 1: 59-64). Было обнаружено, что полифенольные природные продукты обладают ингибиторными эффектами на ангиотензин-превращающий фермент. (Angiotensin-Converting Enzyme Inhibitory Effects by Plant Phenolic Compounds: A Study of Structure Activity Relationships. J. Agric. Food Chem. 2013, 61, 11832-11839.; Inhibition of Angiotesin-Converting Enzyme by Quercetin Alters the Vascular Response to Brandykinin and Angiotensin I. Pharmacology, 2002, 65, 182-186.; Ferulic Acid Improves Cardiovascular and Kidney Structure and Function in Hypertensive Rats. J. Cardiovasc. Pharmacol. 2013, 61, 240-249.; Tannic Acid, an Inhibitor for Renal Angiotensin Type 1 Receptor and Hypertension in Spontaneously Hypertensive Rats. Endocr. Rev. 2012, 33, SAT-248.) Настоящее изобретение, ссылаясь на результаты предыдущего исследования (CN 1868998A, борнеол β-(3,4-дигидроксифенил)-α-гидроксипропионат, способ его синтеза и применение), вводит даншенсу группу и другие фенольные группы в скелет молекул традиционных ACE лекарственных средств и, в то же время, вводит борнеол, ментол и другие группы в соответствии с идеями ʺлекарство монарх - лекарство-проводникʺ и разработкой пролекарств, и, таким образом, был разработан новый класс лекарственных средств с активностью, направленной на ингибирование ангиотензин-превращающего фермента.
Настоящее изобретение ссылается на химические структуры раскрытых ингибиторов ангиотензин-превращающего фермента, таких как каптоприл, эналаприл, лизиноприл, периндоприл, аласеприл, делаприл, хинаприл, рамиприл, цилазаприл, беназеприл, фосиноприл, зофеноприл, трандолaприл, имидаприл, темокаприл, спираприл и моексиприл.
Настоящее изобретение также ссылается на патентную литературу, описывающую ингибиторы ангиотензин-превращающего фермента, такую как Антигипертензивные производные меркаптоациламинокислоты и их применение, (1980, EP 9898 Al), Получение ингибитора превращающего фермента 5,6-дигидро[1,4]тиазино[4,3-a]хинолин-1(2H), 4(4aH)-дион, (1981, US 4273927 A), [4R]-3-(ω-Ароилпропионил)-4-тиазолидинкарбоновые кислоты и сложные эфиры, (1983, US 4374249 A).
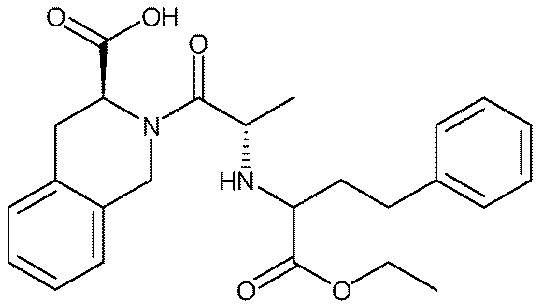
Настоящее изобретение также ссылается на WO 9302679 A1 (1993), Способ лечения предменструального синдрома путем введения ингибитора ангиотензин-превращающего фермента, который раскрывает следующее соединение:
Настоящее изобретение также ссылается на US 20070032661 A1 (2007), Способ для получения промежуточных соединений периндоприла, который раскрывает следующие соединения:

В полном тексте настоящего изобретения, если не указано иное, следующие определения названий или терминов применимы ко всем аспектам настоящего изобретения.
Термин ʺалкилʺ означает линейную или разветвленную алифатическую углеводородную группу, содержащую от 1 до 15 атомов углерода, предпочтительно от 1 до 6 атомов углерода, включающую, но не ограничиваясь этим, метил, этил, пропил и изопропил.
Термин ʺзамещенный алкилʺ означает алкильную группу, замещенную одним или несколькими заместителями, которые могут быть одинаковыми или отличными друг от друга, и каждый независимо выбран из группы, состоящей из алкила, циклоалкила, арила, циано, нитро, галогена, алкокси, амино, алкил-замещенного первичного, вторичного или третичного амино или циклоалкил-замещенного первичного, вторичного или третичного амино, гидрокси, меркапто, алкилтио, алкилкето и карбоксила.
Термин ʺалкенилʺ относится к линейному или разветвленному или циклическому алифатическому углеводородному радикалу, содержащему по меньшей мере одну С=С двойную связь и от 2 до 15 атомов углерода, предпочтительно от 2 до 8 атомов углерода.
Термин ʺзамещенный алкенилʺ относится к алкенильной группе, замещенной одним или несколькими заместителями, которые могут быть одинаковыми или отличными друг от друга, и каждый независимо выбран из группы, состоящей из алкила, циклоалкила, арила, циано, нитро, галогена, алкокси, амино, алкил-замещенного первичного, вторичного или третичного амино или циклоалкил-замещенного первичного, вторичного или третичного амино, гидрокси, меркапто, алкилтио, алкилкето и карбоксила.
Термин ʺалкинилʺ относится к линейному или разветвленному или циклическому алифатическому углеводородному радикалу, содержащему по меньшей мере одну С≡С тройную связь и от 2 до 15 атомов углерода, предпочтительно от 2 до 8 атомов углерода.
Термин ʺзамещенный алкинилʺ относится к алкинильной группе, замещенной одним или несколькими заместителями, которые могут быть одинаковыми или отличными друг от друга, и каждый независимо выбран из группы, состоящей из алкила, циклоалкила, арила, циано, нитро, галогена, алкокси, амино, алкил-замещенного первичного, вторичного или третичного амино или циклоалкил-замещенного первичного, вторичного или третичного амино, гидрокси, меркапто, алкилтио, алкилкето и карбоксила.
Термин ʺарилʺ относится к ароматической моноциклической или полициклической структуре, включающей от 6 до 14 атомов углерода, предпочтительно от 6 до 12 атомов углерода.
Термин ʺзамещенный арилʺ относится к арильной группе, замещенной одним или несколькими заместителями, которые могут быть одинаковыми или отличными друг от друга, и каждый независимо выбран из группы, состоящей из алкила, циклоалкила, арила, циано, нитро, галогена, алкокси, амино, алкил-замещенного первичного, вторичного или третичного амино или циклоалкил-замещенного первичного, вторичного или третичного амино, гидрокси, меркапто, алкилтио, алкилкето и карбоксила.
Термин ʺгетероарилʺ относится к ароматической моноциклической или полициклической структуре, включающей от 5 до 14 атомов углерода, предпочтительно от 5 до 12 атомов углерода, в которой один или несколько атомов углерода колец замещен другими элементами включающими, но не ограничивающимися этим, азот, кислород и серу. Предпочтительные гетероарильные группы включают, но не ограничиваются этим, пиридинил, пиримидинил, пиразинил, пиридазинил, индолил, хинолил, изохинолил, пиразолил, фурил, тиенил, тиазолил, оксазолил, пирролил, бензофуранил и бензотиенил.
Термин ʺзамещенный гетероарилʺ относится к гетероарильной группе, замещенной одним или несколькими заместителями, которые могут быть одинаковыми или отличными друг от друга, и каждый независимо выбран из группы, состоящей из алкила, циклоалкила, арила, циано, нитро, галогена, алкокси, амино, алкил-замещенного первичного, вторичного или третичного амино или циклоалкил-замещенного первичного, вторичного или третичного амино, гидрокси, меркапто, алкилтио, алкилкето и карбоксила. Предпочтительные замещенные аралкильные группы включают, но не ограничиваются этим, группу тетраметилпиразинового спирта.
Термин ʺаралкилʺ означает арил-алкильную группу, в которой арил и алкил имеют значение, определенное выше. Предпочтительные аралкильные группы включают, но не ограничиваются этим, бензил и фенетил.
Термин ʺзамещенный аралкилʺ относится к аралкильной группе, замещенной одним или несколькими заместителями, которые могут быть одинаковыми или отличными друг от друга, и каждый независимо выбран из группы, состоящей из алкила, циклоалкила, арила, циано, нитро, галогена, алкокси, амино, алкил-замещенного первичного, вторичного или третичного амино или циклоалкил-замещенного первичного, вторичного или третичного амино, гидрокси, меркапто, алкилтио, алкилкето и карбоксила. Предпочтительные замещенные аралкильные группы включают, но не ограничиваются этим, п-метилбензильную и азарум-спиртовую группу.
Термин ʺциклоалкилʺ относится к неароматической моноциклической или полициклической структуре, типично содержащей от 3 до 10 атомов углерода, предпочтительно от 3 до 7 атомов углерода, включающей, но не ограничивающейся этим, циклопропил, циклобутил, циклопентил, циклогексил и циклогептил.
Термин ʺзамещенный циклоалкилʺ относится к циклоалкильной группе, замещенной одним или несколькими заместителями, которые могут быть одинаковыми или отличными друг от друга, и каждый независимо выбран из группы, состоящей из алкила, циклоалкила, арила, циано, нитро, галогена, алкокси, амино, алкил-замещенного первичного, вторичного или третичного амино или циклоалкил-замещенного первичного, вторичного или третичного амино, гидрокси, меркапто, алкилтио, алкилкето и карбоксила. Предпочтительная замещенная циклоалкильная группа содержит 3-7 атомов углерода и включает, но не ограничивается этим, декстроборнил, левоментол и норборнил.
Термин ʺгалогенʺ означает фтор, хлор, бром и иод. Предпочтительные галогены включают фтор, хлор и бром.
Термин ʺгетероциклилʺ означает неароматическую насыщенную моноциклическую или полициклическую кольцевую систему, как правило, содержащую 10 или меньше кольцевых атомов, и предпочтительно от 4 до 10 кольцевых атомов, и содержащую один или несколько не-углеродных атомов, таких как атомы азота, кислорода, серы, которые могут присутствовать отдельно или в комбинации, где никакие смежные кислород-кислород, кислород-сера или сера-сера группы не присутствуют в кольцевой системе. Предпочтительные гетероциклильные группы включают, но не ограничиваются этим, пиперазинил, морфолинил, тиоморфолинил, пиперидинил, пирролил и т.п.
Термин ʺзамещенный гетероциклилʺ относится к гетероциклильной группе, замещенной одним или несколькими заместителями, которые могут быть одинаковыми или отличными друг от друга, и каждый независимо выбран из группы, состоящей из алкила, циклоалкила, арила, циано, нитро, галогена, алкокси, амино, алкил-замещенного первичного, вторичного или третичного амино или циклоалкил-замещенного первичного, вторичного или третичного амино, гидрокси, меркапто, алкилтио, алкилкето и карбоксила. Предпочтительные замещенные гетероциклильные группы включают, но не ограничиваются этим, N-метилпиперазинил, 3-фторпиперидинил, 2,6-диметилморфолинил, 2-метилпирролил и т.п.
Термин ʺгетероарилалкилʺ относится к гетероарилалкильной группе, в которой гетероарил и алкил имеют значение, определенное выше. Предпочтительные гетероарилалкильные группы включают, но не ограничиваются этим, 2-пиридилметил, 3-пиридилметил и 4-пиридилметил.
Термин ʺацилʺ относится к группе алкил-C(O)-, замещенный алкил-C(O)-, циклоалкил-C(O)-, замещенный циклоалкил-C(O)- и гетероциклил-C(O)-, где каждая группа имеет значение, определенное выше. Предпочтительные ацильные группы включают, но не ограничиваются этим, ацетил, пропионил и циклобутаноил.
Термин ʺароилʺ относится к группе арил-C(O)- и замещенный арил-C(O)-, где каждая группа имеет значение, определенное выше. Предпочтительные ароильные группы включают, но не ограничиваются этим, бензоил и п-метилбензоил.
Термин ʺалкоксиʺ относится к группе алкил-O- и замещенный алкил-O-, где каждая группа имеет значение, определенное выше. Предпочтительные алкокси группы включают, но не ограничиваются этим, метокси, этокси, изопропил, декстроборнилокси, левоментолокси, 2,3,4-триметоксибензол-2ʹ-аллилокси (окси группа азарового спирта) и тетраметилпиразин окси группу.
Термин ʺаралкилоксиʺ относится к группе аралкил-O- и замещенный аралкил-O-, где каждая группа имеет значение, определенное выше. Предпочтительные аралкилокси группы включают, но не ограничиваются этим, бензилокси, и,3,4-триметоксибензол-2ʹ-аллилокси (окси группа азарового спирта).
Термин ʺарилоксиʺ относится к группе арил-O- и замещенный арил-O-, где каждая группа имеет значение, определенное выше. Предпочтительные арилокси группы включают, но не ограничиваются этим, фенокси и п-метилфенокси.
Термин ʺалкилтиоʺ относится к алкил-S- группе, в которой алкильная часть имеет значение, определенное выше. Предпочтительные алкилтио группы включают, но не ограничиваются этим, метилтио, этилтио и пропилтио.
Термин ʺаралкилтиоʺ относится к аралкил-S- группе, в которой ʺаралкильная часть имеет значение, определенное выше. Предпочтительные аралкилтио группы включают, но не ограничиваются этим, фенилметилтио и фенилэтилтио.
Термин ʺарилтиоʺ относится к арил-S- группе, в котор арильная группа имеет значение, определенное выше. Предпочтительные арилтио группы включают, но не ограничиваются этим, фенилтио.
Термин ʺалкилсульфонилʺ относится к алкил-S(O2)- группе, в котор алкил имеет значение, определенное выше. Предпочтительные алкилсульфонильные группы включают, но не ограничиваются этим, метилсульфонил и этилсульфонил.
Термин ʺарилсульфонилʺ относится к арил-S(O2)- группе, в которой арил имеет значение, определенное выше. Предпочтительные арилсульфонильные группы включают, но не ограничиваются этим, бензолсульфонил и нафтилсульфонил.
Термин ʺпо меньшей мере одинʺ означает один или несколько.
Термин ʺзамещенныйʺ означает, что указанные группы замещают один или несколько атомов водорода на указанном атоме, соответствуя при этом нормальной валентности указанного атома и приводя к стабильному соединению.
Термин ʺнеобязательно замещенныйʺ означает выбор определенной группы, радикала или части для замещения.
3. Соль и сольват
Трипептиды и их аналоги, созданные в настоящем изобретении, также включают их ʺпролекарстваʺ, ʺсольватыʺ, ʺсолиʺ (включая ʺсоли кислотʺ, ʺсоли основанийʺ и внутренние соли) и ʺсложные эфирыʺ. ʺПролекарстваʺ, ʺсольватыʺ, ʺсолиʺ и ʺсложные эфирыʺ трипептидов все включены в объем настоящего изобретения. ʺСольватʺ и ʺсольʺ эквивалентны свободной форме соответствующего соединения.
Термин ʺпролекарствоʺ относится к соединению-предшественнику лекарственного средства, которое может метаболизироваться или может химически преобразовываться in vivo в соединение формулы (I) или его соль, сольват или его сложный эфир.
Термин ʺсольватʺ означает, что соединение по настоящему изобретению находится в физической ассоциации с одной или несколькими молекулами растворителя. Физическая ассоциация включает различные степени ионного и ковалентного связывания, включая водородное связывание, ван-дер-ваальсовые силы и т.д. ʺСольватʺ состоит из двух частей: фаза раствора и выделяемый сольват. Подходящие сольваты включают, но не ограничиваются этим, гидраты, метаноляты, этаноляты, DMSO сольват и этилацетатный сольват.
Термин ʺсольʺ включает соли кислот, соли оснований и внутренние соли и означает кислотные соли, образованные трипептидными соединениями (формулы (I)), созданными в настоящем изобретении, с неорганическими кислотами или органическими кислотами, соли оснований, образованные с неорганическими основаниями и органическими основаниями, и внутренние соли, образованные оснóвными группами (такими как амино группа, гуанидино группа, имидазолильная группа или индолильная группа и т.д.), содержащимися в трипептидных соединениях (формулы (I)), и кислотными группами (такими как карбоксилат, алкилсульфонат или фосфат и т.д.).
Кислоты, используемые для образования кислотных солей, включают, но не ограничиваются этим, следующие кислоты:
серная кислота, гидросульфат, хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, азотная кислота, угольная кислота, борная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, пирувиновая кислота, малеиновая кислота, яблочная кислота, винная кислота, лимонная кислота, аскорбиновая кислота, бензойная кислота, камфорная кислота, фумаровая кислота, щавелевая кислота, янтарная кислота, камфорсульфоновая кислота, малеиновая кислота, салициловая кислота и α-молочная кислота. Кроме того, фармацевтически приемлемые солеобразующие кислоты, описанные в P. Stahl, Camille G. eds. Handbook of Pharmaceutical Salts. Properties, Selection and Use, 2002, Zurich: Wiley-VCH, включены в настоящую заявку посредством ссылки.
Основание, используемое для образования щелочной соли, включает, но не ограничивается этим, следующие основания:
щелочные металлы, такие как литий, натрий и калий; щелочно-земельные металлы, такие как магний и кальций; гидроксид лития, гидроксид натрия, гидроксид калия, гидрид лития, гидрид натрия, бутиллития, аммония, триэтиламин, диизопропилэтиламин, оснóвные аминокислоты, такие как орнитин, аргинин, лизин или гистидин.
Кроме того, фармацевтически приемлемый сложный эфир, образованный трипептидным соединением по настоящему изобретению, означает карбоксилатный сложный эфир, образованный из гидроксильной группы или фенольной гидроксильной группы в соединении и карбоновой кислоты (включая, но не ограничиваясь этим: алкилкарбоновую кислоту, замещенную алкилкарбоновую кислоту, арилкарбоновую кислоту, замещенную арилкарбоновую кислоту, аралкилкарбоновую кислоту, замещенную аралкилкарбоновую кислоту, циклоалкилкарбоновую кислоту, замещенную циклоалкилкарбоновую кислоту, гетероциклическую карбоновую кислоту и гетероарилалкилкарбоновую кислоту, например, ацетат, пропионат, бензоат и никотинат); сульфонатный сложный эфир, образованный из гидроксильной группы или фенольной гидроксильной группы в соединении и сульфоновой кислоты (включая, но не ограничиваясь этим: сложный эфир алкилсульфоновой кислоты, арилсульфоновой кислоты и замещенной арилсульфоновой кислоты, такой как метансульфонат, бензолсульфонат, п-толуолсульфонат); и сложный эфир, образованный из гидроксильной группы или фенольной гидроксильной группы в соединении и аминокислоты (включая, но не ограничиваясь этим: α-аминокислоту, β-аминокислоту, ω-аминокислоту, например, сложные эфиры аланина и сложные эфиры глутамата); и фосфатный сложный эфир, образованный из гидроксильной группы или фенольной гидроксильной группы в соединении и фосфорной кислоты, моноалкилфосфорной кислоты, диалкилфосфорной кислоты, фосфористой кислоты (такой как, диэтилфосфит).
Кроме того, трипептидные соединения по настоящему изобретению и фармацевтически приемлемые (нетоксичные физиологически приемлемые) ʺсольватыʺ, ʺсолиʺ (включая ʺсоли кислотʺ, ʺсоли основанийʺ и внутренние соли), ʺсложные эфирыʺ, соответствующие ʺпролекарстваʺ и соответствующие энантиомеры, стереоизомеры, ротамеры, таутомеры, позиционные изомеры и рацематы включены в объем настоящего изобретения.
Кроме того, можно защитить чувствительные или реакционноспособные группы молекул, представляющих интерес, в процессе синтеза. Репрезентативные защитные группы описаны в T. W. Greene and P. G. M. Wuts "Protective Groups in Organic Synthesis" John Wiley & Sons, Inc., New York, 1999, полное содержание которого включено в настоящую заявку посредством ссылки. Соответствующие защитные группы могут быть добавлены или удалены с использованием способов, хорошо известных в данной области техники.
4. Фармацевтическая композиция
Термин ʺкомпозицияʺ относится к продукту, включающему определенное количество конкретного ингредиента, и к любому продукту, который непосредственно или опосредованно образован комбинацией определенных количеств конкретных ингредиентов.
ʺМлекопитающееʺ означает человека и других млекопитающих.
ʺПациентыʺ включают людей и животных.
Термин ʺэффективное количествоʺ означает, что количество соединения или фармацевтической композиции, описанных в настоящей заявке, является эффективным для ингибирования ангиотензин-превращающего фермента и, таким образом, обеспечивает желаемый эффект профилактики, лечения, облегчения тяжести или ингибирования.
Термин ʺфармацевтически приемлемый носительʺ относится к соединению и композициям, обладающим достаточной чистотой и качеством для формулирования композиции по настоящему изобретению, которые не вызывают нежелательные реакции и действуют как фармацевтический носитель при введении животному.
Термин ʺфармацевтически приемлемый разбавительʺ относится к соединению и композициям, обладающим достаточной чистотой и качеством для формулирования композиции по настоящему изобретению, которые не вызывают нежелательные реакции и действуют как фармацевтический разбавитель при введении животному.
Фармацевтические композиции, как правило, включают по меньшей мере одно соединение по настоящему изобретению и один или несколько фармацевтически приемлемых носителей. Твердые лекарственные формы могут включать: наполнители (такие как крахмал, микрокристаллическая целлюлоза, сахароза, глюкоза, лактоза, сорбит, маннит и т.д.), связующие (желатин, карбоксиметилцеллюлоза, альгинат, аравийская камедь), увлажнители (глицерин), разрыхлители (карбонат кальция, крахмал, агар, альгиновая кислота), агенты, замедляющие растворение (парафин), ускорители абсорбции (четвертичные аммониевые соединения), смачивающие вещества (цетиловый спирт, глицерилмоностеарат), адсорбенты (каолин, бентонит), смазывающие вещества (тальк; твердый полиэтиленгликоль; соответствующая калиевая, кальциевая или магниевая соль; лаурилсульфат; водорастворимые смазывающие вещества, включая хлорид натрия, ацетат натрия, бензоат натрия, олеат натрия, красители (глина, оксид алюминия) и буферы.
Соединения по настоящему изобретению можно сформулировать в подходящие лекарственные формы, такие как таблетки и капсулы, в соответствии со способами, традиционно используемыми в фармацевтике.
5. Расстройства и заболевания
Соединения (I) по настоящему изобретению и фармацевтически приемлемые (нетоксичные физиологически приемлемые) соли, сложные эфиры и фармацевтические композиции являются полезными для профилактики, лечения или отсрочки сердечно-сосудистых и церебрально-васкулярных заболеваний, особенно тех, которые ассоциированы с гипертензией, и их осложнений.
Расстройства и заболевания включают одно или несколько, выбранных из гипертензии, коронарного сердечного заболевания, стенокардии, сердечной недостаточности (острой или хронической застойной сердечной недостаточности), инфаркта миокарда и осложнений, застойного сердечного заболевания, ишемии миокарда, миокардита, миокардиального фиброза, гипертрофии миокарда, атеросклероза, доброкачественного нефросклероза малых артерий, злокачественного нефросклероза малых артерий, аномального роста и ремоделирования сосудов, связанных с ангиогенезом заболеваний (таких как неоваскулярная дегенерация желтого пятна), гиперальдостеронизма, аритмии, почечного заболевания, диабета, инсульта, тромбоза, почечной недостаточности (такой как диабетическая нефропатия), гиперлипидемии, ожирения, гипергликемии, ретинального артериосклероза и гипертензивного поражения глазного дна.
6. Способ для получения азарум-спирта, используемого в настоящем изобретении, включает:
(1) взаимодействие соединения V с соединением VI в присутствии жирного спирта и катализатора с получением соединения VII:

где R1 выбран из линейного или разветвленного C1-C5 алкила; и
(2) восстановление соединения VII с получением соединения VIII;

На стадии (1), соединение VI подвергают взаимодействию с алифатическим спиртом в ксилоле, толуоле или бензоле при кипячении с обратным холодильником в течение 3-12 часов, и предпочтительно в течение 4-10 часов. После охлаждения до комнатной температуры к реакционной смеси добавляют 2,4,5-триметоксибензальдегид (соединение V) и катализатор и смесь снова кипятят с обратным холодильником в течение 5-24 часов, и предпочтительно в течение 8-14 часов, с получением соединения VII. Алифатический спирт, используемый на стадии (1), выбран из метанола, этанола, пропанола, изопропанола, бутанола, изобутанола, н-амилового спирта и изоамилового спирта или любой их комбинации, и предпочтительно выбран из метанола и этанола или любой их комбинации. Молярное отношение алифатического спирта к соединению VI составляет от 1:1 до 1:10, и предпочтительно молярное отношение алифатического спирта к соединению VI составляет от 1:1 до 1:4. Используемый катализатор представляет собой катализатор, выбранный из пиридина, 2,4,6-триметилпиридина, 2,6-диметилпиридина, 2,6-ди-трет-бутил-4-метилпиридина, 4-диметилпиридина, пиперидина и тетрагидропиррола или любой их комбинации. Молярное отношение катализатора к 2,4,5-триметоксибензальдегиду составляет от 0,1:1 до 2:1.
На стадии 2, используемый восстановитель представляет собой борогидрид натрия, дигидро-бис(2-метоксиэтокси)алюминат натрия, литийалюминийгидрид или диизобутилалюминийгидрид, и молярное отношение восстановителя к соединению VII составляет от 1:1 до 10:1. Используемый растворитель представляет собой растворитель, выбранный из тетрагидрофурана, 1,4-диоксана, диметилэтилового эфира, толуола, бензола, ксилола, диэтилового эфира, метил трет-бутилового эфира, дихлорметана, дихлорэтана, трихлорметана, тетрахлорметана и н-гексана или любой их комбинации. Температура реакции находится в пределах от 78°C до 25°C; и время реакции составляет от 0,5 до 24 часов.
Аббревиатуры:
Далее будут описаны конкретные получения и примеры настоящего изобретения. Если не указано иное, эти конкретные примеры не предназначены для ограничения каким-либо образом объема настоящего изобретения, и различные вещества и способы, используемые в примерах, известны специалистам в данной области техники.
Пример 1:

Стадия 1:

В 1000-мл трехгорлую колбу, снабженную термометром, добавляли L-пролин (115,1 г, 1,0 моль), 1,4-диоксан (300 мл) и 2 моль/л водный раствор гидроксида натрия (400 мл). Смесь охлаждали до 0°C и перемешивали в течение 10 минут. Добавляли по каплям (в течение 60 минут) ди-трет-бутилдикарбонат (283,8 г, 1,3 моль), после этого смесь медленно нагревали и перемешивали при комнатной температуре в течение 6 часов или в течение ночи. Реакционный раствор доводили до pH=4 при помощи 4 моль/л разбавленной хлористоводородной кислоты, экстрагировали с использованием системы этилацетат/вода и промывали три раза. Органические фазы объединяли и сушили над безводным сульфатом натрия с получением 189,2 г соединения 221S-1a-1 в виде белого твердого вещества с выходом 88%.
Стадия 2:

В 500-мл трехгорлую колбу, снабженную термометром, добавляли соединение 221S-1a-1(2,15 г, 10,0 ммоль), тетрагидрофуран (35 мл), D-борнеол (1,39 г, 9 ммоль) и DMAP (0,12 г, 1 ммоль). Смесь охлаждали до 0°C и перемешивали в течение 5 минут. Добавляли EDCI (2,30 г, 12 ммоль) по порциям (в течение 15 минут), после этого смесь медленно нагревали до комнатной температуры в течение 24 часов. Реакционный раствор экстрагировали с использованием системы этилацетат/вода и промывали три раза. Органические фазы объединяли и сушили над безводным сульфатом натрия и фильтровали с отсосом. Полученное твердое вещество разделяли колоночной хроматографией на силикагеле с получением 2,28 г соединения 221S-1a-2 с выходом 60%.
Стадия 3:

В 500-мл одногорлую колбу добавляли соединение 221S-1a-2 (3,51 г, 10 ммоль), трифторуксусную кислоту (8 мл) и дихлорметан (16 мл). Смесь перемешивали при комнатной температуре в атмосфере азота в течение 5 часов, концентрировали при пониженном давлении и после добавления этилацетата (50 мл), воды (50 мл) и насыщенного водного раствора бикарбоната натрия (50 мл) экстрагировали три раза. Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали с отсосом и концентрировали при пониженном давлении, с получением 2,2 г соединения 221S-1a-3 в виде бледно-желтого масла или полутвердого вещества с выходом 88%. Этот продукт использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия 4:

В 250-мл одногорлую колбу добавляли соединение 221S-1a-3 (2,51 г, 10 ммоль), N-Boc-Ala (2,08 г, 11 ммоль), дихлорметан (50 мл), HOBT (1,49 г, 11 ммоль) и EDCI (2,30 г, 12 ммоль). Смесь перемешивали в течение ночи при комнатной температуре в атмосфере азота, концентрировали при пониженном давлении и после добавления этилацетата (50 мл), воды (50 мл) и насыщенного водного раствора бикарбоната натрия (50 мл) экстрагировали три раза. Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали с отсосом и концентрировали при пониженном давлении. Полученный неочищенный продукт выделяли колоночной хроматографией на силикагеле с получением 3,85 г соединения 221S-1a-4 в виде бледно-желтого масла с выходом 91,2%.
MS m/z=[M+1]423,2900
1Н ЯМР (600 МГц, CDCl3) δ 5,39 (д, J=8,0 Гц, 1Н), 4,96 (д, J=9,7 Гц, 1Н), 4,56 (дд, J=8,4, 3,9 Гц, 1Н), 4,52-4,44 (м, 1Н), 3,65-3,58 (м, 1Н), 2,38-2,30 (м, 1Н), 2,27-2,20 (м, 1Н) 2,09-1,97 (м, 3Н), 1,90-1,84 (м, 1Н), 1,77-1,72 (м, 1Н), 1,70-1,67 (м, 1Н), 1,43 (с, 1Н), 1,36 (д, J=6,9 Гц, 3Н), 1,33-1,21 (м, 3Н), 1,03 (дд, J=13,8, 3,3 Гц, 1Н), 0,89 (с, 3Н), 0,86 (с, 3Н), 0,80 (с, 3Н).
Стадия 5:

4,22 г соединения 221S-1a-4 добавляли в соответствии с процедурой, описанной для стадии 3 Примера 1, с получением 2,93 г соединения 221S-1a-5 в виде светло-желтого или не совсем белого твердого вещества с выходом 91%. Этот продукт использовали непосредственно на следующей стадии без дополнительной очистки.
MS m/z=[M+1]323,2386
1Н ЯМР (600 МГц, CDCl3) δ 4,94 (д, J=9,7 Гц, 1Н), 4,54 (дд, J=8,6, 4,4 Гц, 1Н), 4,34 (д, J=6,7 Гц, 1Н), 3,69-3,63 (м, 1Н), 3,59-3,54 (м, 1Н), 2,36-2,27 (м, 1Н), 2,13-2,00 (м, 4Н) 1,83-1,74 (м, 2Н), 1,72-1,68 (м, 1Н), 1,56 (д, J=7,0 Гц, 3Н), 1,51 (д, J=6,9 Гц, 1Н), 1,34-1,27 (м, 1Н), 1,26-1,20 (м, 1Н), 0,97 (дд, J=13,8, 3,2 Гц, 1Н), 0,89 (с, 3Н), 0,87 (с, 3Н), 0,78 (с, 3Н).
Стадия 6:

В 100-мл одногорлую колбу добавляли соединение 221S-1a-5 (0,322 г, 1,0 ммоль), D-Даншенсу (0,22 г, 1,1 ммоль), N,N-диметилформамид (5 мл)/гексаметилфосфорамид (5 мл), HOBT (0,15 г, 1,1 ммоль) и EDCI (0,18 г, 1,3 ммоль). Смесь перемешивали в течение 36 часов при комнатной температуре в атмосфере азота и после добавления этилацетата (50 мл), воды (50 мл) и насыщенного водного раствора бикарбоната натрия (50 мл) экстрагировали три раза. Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали с отсосом и концентрировали при пониженном давлении. Полученный неочищенный продукт выделяли колоночной хроматографией на силикагеле с получением 0,28 г соединения 221S-1a в виде не совсем белого или беловатого пенообразного твердого вещества с выходом 56%.
MS m/z=[M+1]: 503,0
1Н ЯМР (600 МГц, CDCl3) δ 8,16 (с, 1Н), 7,42 (д, J=8,1 Гц, 1Н), 6,81 (д, J=8,0 Гц, 1Н), 6,71 (с, 1Н), 6,65 (д, J=9,8 Гц, 1Н), 5,95 (с, 1Н), 4,93 (д, J=9,0 Гц, 1Н), 4,81-4,73 (м, 1Н), 4,31-4,26 (м, 1Н), 4,23 (дд, J=8,6, 4,3 Гц, 1Н), 3,81 (дд, J=17,0, 7,3 Гц, 1Н), 3,68-3,59 (м, 1Н), 3,34 (д, J=4,6 Гц, 1Н), 3,10 (дд, J=14,1, 3,9 Гц, 1Н), 2,96 (дд, J=14,1, 8,1 Гц, 1Н), 2,37-2,31 (м, 1Н), 2,25-2,17 (м, 1Н), 2,12-2,01 (м, 2Н), 1,98-1,92 (м, 1Н), 1,90-1,84 (м, 1Н), 1,79-1,73 (м, 1Н), 1,68 (т, J=4,4 Гц, 1Н), 1,40 (д, J=7,0 Гц, 3Н), 1,35-1,20 (м, 3Н), 1,02 (дд, J=13,8, 3,4 Гц, 1Н), 0,88 (с, 3Н), 0,86 (с, 3Н), 0,80 (с, 3Н).
13С ЯМР (600 МГц, CDCl3) δ 173,49 (с), 171,96 (с), 171,74 (с), 144,03 (с), 143,97 (с), 128,27 (с), 121,54 (с), 116,89 (с), 115,15 (с), 81,17 (с), 72,79 (с), 59,51 (с), 49,08 (с), 48,10 (с), 47,32 (с), 46,48 (с), 44,95 (с), 39,81 (с), 36,64 (с), 29,30 (с), 28,14 (с), 27,29 (с), 24,94 (с), 19,82 (с), 18,94 (с), 17,71 (с), 13,70 (с), 0,15 (с).
Стадия 7:

В 100-мл одногорлую колбу добавляли соединение 221S-1a (0,251 г, 0,5 ммоль), гидроксид лития (0. 05 г, 2,0 ммоль), воду:метанол:тетрагидрофуран 3:1:1 (10 мл). Смесь перемешивали в течение 16 часов при комнатной температуре в атмосфере азота и после добавления этилацетата (30 мл) и воды (30 мл) экстрагировали три раза. Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали с отсосом и концентрировали при пониженном давлении. Полученный неочищенный продукт выделяли колоночной хроматографией на силикагеле с получением 0,14 г соединения 221S-1a-6 в виде не совсем белого или беловатого пенообразного твердого вещества с выходом 76%.
MS m/z=[M+1]: 366,9
Следующие примеры соединений 2-28 формулы (I) получали в соответствии с процедурой, описанной в примере 1 выше, с использованием подходящих исходных веществ и реагентов.




Связывающий агент, используемый в синтезе соединения 221S-2a и соединения 221S-144a, представлял собой T3P®; связывающий агент, используемый в синтезе соединения 7a, представлял собой HATU, и используемое основание представляло собой DIPEA; связывающий агент, используемый в синтезе соединения 221S-119a, представлял собой PyBOP; и агент, используемый в синтезе соединения 221S-11a и соединения 221S-12a, представлял собой DCC.
Описание синтеза ключевого промежуточного соединения L-Даншенсу можно найти в CN 103288630, описание синтеза лигустразинового спирта можно найти в Journal of Natural Products, 2012, 75 (9), 1589-1594, и описание синтеза циклогексанпролина можно найти в Org. Biomol. Chem., 2012, 10, 2840-2846. Путь синтеза азарум-спирта представляет собой следующий:

i: (1) метанол, толуол, 110°C, 4 часа; (2) пиридин, гексагидропиридин, кипячение с обратным холодильником в течение 18 часов; j: LiAlH4, ТГФ, лед, AlCl3, 0°C, 30 минут
Пример 29:

Стадия 1:

В 500-мл трехгорлую колбу, снабженную термометром, добавляли N-Cbz пролин (2,49 г, 10 ммоль), DCM (50 мл), 1-метилпиперазин (1,10 г, 11 ммоль) и DMAP (0,12 г, 1,0 ммоль). Смесь охлаждали до 0°C и перемешивали в течение 5 минут. Добавляли EDCI (2,30 г, 12 моль) по порциям (в течение 15 минут), после этого смесь медленно нагревали при комнатной температуре в течение 24 часов. Реакционный раствор экстрагировали с использованием системы этилацетат/вода и промывали три раза. Органические фазы объединяли, сушили над безводным сульфатом натрия и фильтровали с отсосом. Полученное твердое вещество разделяли колоночной хроматографией на силикагеле с получением 2,91 г соединения 221S-151a-1 с выходом 88%.
Стадия 2:

В 500-мл трехгорлую колбу добавляли соединение 221S-151a-1 (1,66 г, 5 ммоль), палладий на углероде (0,16 г) и метанол (25 мл) и вводили газообразный водород. Смесь перемешивали при комнатной температуре при нормальном давлении в течение 24 часов. Палладий на углероде удаляли фильтрованием и фильтрат упаривали на роторном испарителе при пониженном давлении. Полученное масло разделяли колоночной хроматографией на силикагеле с получением 0,89 г соединения 221S-151a-2 с выходом 90%.
Стадия 3:

В 500-мл трехгорлую колбу, снабженную термометром, добавляли соединение 221S-151a-2 (1,97 г, 10 ммоль), DCM (50 мл), N-Cbz аланин (2,45, 11 ммоль) и DMAP (0,12 г, 1,0 ммоль), соответственно. Смесь охлаждали до 0°C и перемешивали в течение 5 минут. Добавляли EDCI (2,30 г, 12 моль) по порциям (в течение 15 минут), после этого смесь медленно нагревали и при комнатной температуре в течение 24 часов. Реакционный раствор экстрагировали с использованием системы этилацетат/вода и промывали три раза. Органические фазы объединяли, сушили над безводным сульфатом натрия и фильтровали с отсосом. Полученное твердое вещество разделяли колоночной хроматографией на силикагеле с получением 3,26 г соединения 221S-151a-3 с выходом 81%.
Стадия 4:
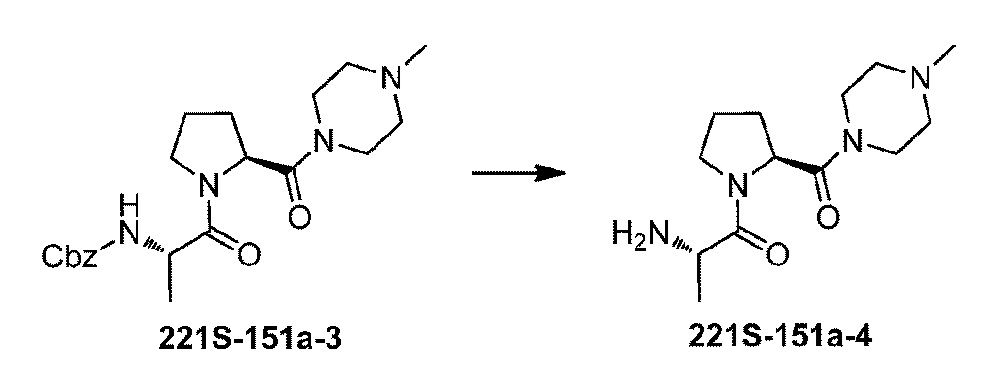
В соответствии с процедурой, аналогичной той, которую использовали на стадии 2 Примера 29, добавляли 4,02 г соединения 221S-151a-3 с получением 2,01 г соединения 221S-151a-4 с выходом 75%.
Стадия 5:

В соответствии с процедурой, аналогичной той, которую использовали на стадии 6 Примера 1, добавляли 0,27 г соединения 221S-151a-4 с получением 0,27 г соединения 221S-151a с выходом 61%.
Стадия 6:

В 500-мл трехгорлую колбу добавляли соединение 221S-151a (0,45 г, 1 ммоль) и метанол (25 мл). Смесь охлаждали до 0°C и перемешивали в течение 5 минут, затем медленно вводили газообразный хлористый водород, после этого смесь перемешивали при 2-4°C в течение 4 часов, затем фильтровали с отсосом с получением 0,40 г соединения 221S-151a-5 с выходом 83%.
Другие соединения, содержащие амины, можно получить таким же способом в виде гидрохлоридной соли. Кроме того, соли других кислот могут быть получены таким же способом, где соответствующую кислоту медленно добавляют в растворитель, содержащий аминовое соединение, и смесь перемешивают при низкой температуре (2-4°C) или комнатной температуре в течение 2-10 часов с получением соли соответствующей кислоты.
Примеры 30-35
Следующие соединения были получены в соответствии с процедурой, описанной в Примере 19 выше, с использованием подходящих исходных веществ и реагентов.

В синтезе соединения 221S-153a, пролин и аланин защищали при помощи группы Boc, и реакцию удаления защитной группы Boc осуществляли в соответствии со Стадией 2 Примера 1.
Пример 36:

Стадия 1:

N-Boc пролин (21. 5 г, 0,1 моль), DCC (20,6 г, 1,0 моль), DMAP (1,22 г, 0,01 ммоль) добавляли последовательно к 150 мл DMF. Реакционную смесь перемешивали при комнатной температуре в течение 10 минут и затем охлаждали до 0°C. Добавляли по каплям этантиол (6,82 г, 0,11 моль), после этого реакционную смесь оставляли для взаимодействия в течение ночи. К реакционной смеси добавляли 200 мл воды для гашения реакции. Реакционную смесь фильтровали и фильтровальную лепешку промывали этилацетатом для удаления DCU. Органические фазы объединяли, промывали последовательно насыщенным водным раствором карбоната натрия (20 мл ×3), водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали. После очистки колоночной хроматографией низкого давления получали 18,4 г продукта 221S-177a-1 с выходом 71%.
Стадия 2:
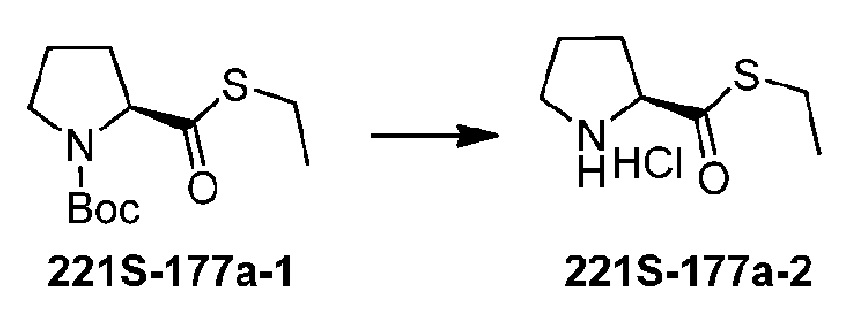
Соединение 221S-177a-1 (2,59 г, 10 ммоль) растворяли в EtOAc (25 мл) и тщательно перемешивали. Смесь барботировали газообразным HCl при комнатной температуре в течение 30 минут и затем оставшийся газообразный HCl удаляли путем продувки газообразным азотом. Смесь упаривали на роторном испарителе при пониженном давлении, с последующей сушкой в вакууме, с получением 1,66 г соединения 221S-177a-2 в виде белого твердого вещества с выходом 85%.
Стадия 3:

В 250-мл одногорлую колбу добавляли соединение 221S-117a-2 (1,98 г, 10 ммоль), N-Boc-аланин (2,08 г, 11 ммоль), DCM (50 мл), HOBT (1,49 г, 11 ммоль) и EDCI (2,30 г, 12 ммоль). Смесь перемешивали в течение ночи при комнатной температуре под защитным слоем газообразного азота, концентрировали при пониженном давлении и после добавления этилацетата (50 мл), воды (50 мл) и насыщенного водного раствора бикарбоната натрия (50 мл) экстрагировали три раза. Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали с отсосом и концентрировали при пониженном давлении. Полученный неочищенный продукт выделяли колоночной хроматографией на силикагеле с получением 2,51 г соединения 221S-177a-3 в виде бледно-желтого масла с выходом 76%.
Стадия 4:

В соответствии с процедурой, аналогичной той, которую использовали на стадии 5 Примера 1, добавляли 3,3 г соединения 221S-177a-3 с получением 1,66 г соединения 221S-177a-4 в виде не совсем белого твердого вещества с выходом 74%.
MS ESI +ve m/z: 231,9.
Этот продукт использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия 5:

В соответствии с процедурой, аналогичной той, которую использовали на стадии 6 Примера 1, добавляли 0,23 г соединения 221S-177a-4 с получением 0,22 г соединения 221S-177a с выходом 51%. MS ESI +ve m/z: 411,2.
Пример 37:

Стадия 1:

В безводном ТГФ (40 мл) растворяли N-Boc (2,15 г, 10 ммоль) и затем добавляли 2,2'-дитиопиридин (2,20 г, 10 ммоль) и трифенилфосфин (3,14 г, 12 ммоль). Смесь перемешивали при комнатной температуре в течение 3 часов и экстрагировали с использованием системы этилацетат/вода. Органические фазы объединяли, промывали водой, насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали. После очистки колоночной хроматографией низкого давления получали 2,46 г продукта 221S-181a-1 с выходом 80%.
Стадия 2:

В соответствии с процедурой, аналогичной той, которую использовали на стадии 3 Примера 1, добавляли 3,08 г соединения 221S-181a-1 с получением 1,62 г соединения 221S-181a-2 с выходом 78%. MS ESI +ve m/z: 209,0.
Стадия 3:

В соответствии с процедурой, аналогичной той, которую использовали на стадии 4 Примера 1, добавляли 2,08 г соединения 221S-181a-2 с получением 3,31 г соединения 221S-181a-3 с выходом 87%. MS ESI +ve m/z: 379,9.
Стадия 4:

В соответствии с процедурой, аналогичной той, которую использовали на стадии 3 Примера 1, добавляли 3,80 г соединения 221S-181a-3 с получением 2,0 г соединения 221S-181a-4 с выходом 73%. MS ESI +ve m/z: 279,9.
Стадия 5:

В соответствии с процедурой, аналогичной той, которую использовали на стадии 6 Примера 1, добавляли 0,28 г соединения 221S-181a-4 с получением 0,22 г соединения 221S-181 с выходом 48%. MS ESI +ve m/z: 460,0.
Пример 38:
Стадия 1:

В 250-мл одногорлую колбу добавляли соединение 221S-1a-5 (0,32 г, 1,0 ммоль), протокатехуальдегид (0,166 г, 1,2 ммоль), дихлорэтан (25 мл), цианоборогидрид натрия (0,10 г, 1,5 ммоль) и 2 капли уксусной кислоты. Смесь выдерживали при комнатной температуре под защитным слоем газообразного азота в течение 6 часов, концентрировали при пониженном давлении и после добавления этилацетата (50 мл), воды (50 мл) и насыщенного водного раствора бикарбоната натрия (50 мл) экстрагировали три раза. Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали с отсосом и концентрировали при пониженном давлении. Полученный неочищенный продукт выделяли колоночной хроматографией на силикагеле с получением 0,15 г соединения 221S-221 в виде бледно-желтого масла с выходом 34%.
Стадия 2:

В соответствии с процедурой, аналогичной той, которую использовали на стадии 7 Примера 1, добавляли 0,44 г соединения 221S-221 с получением 0,16 г соединения 221S-221-1 с выходом 52%. MS ESI +ve m/z: 309,2.
Конкретные примеры, описанные в настоящем изобретении, являются только иллюстративным описанием существа настоящего изобретения. Специалистам в области, к которой относится настоящее изобретение, должно быть понятно, что возможны различные модификации, дополнения и альтернативы описанных конкретных вариантов осуществления без отступления от существа настоящего изобретения или как оно определено в прилагаемой формуле изобретения.
LC-MS метод испытания в соответствии с настоящим изобретением
LC-QTOF MS & MS/MS условия: ВЭЖХ оборудование: Agilent 1200 Infinity LC; колонка: Agilent HC-C18 4,6 × 250 мм, 5 мкм; скорость потока: 0,6 мл/мин; температура колонки: 30°C; подвижная фаза: A-H2O, 0,1% уксусной кислоты/B-метанол, A:B=20:80; MS оборудование: Agilent 6520 QTOF; источник ионизации: Dual ESI; режим ионизации: положительный; напряжение на капилляре: 3500 В; температура осушающего газа: 350°C; скорость потока осушающего газа: 10,0 л/мин. (N2); давление распыляющего газа: 45 ф/дюйм2(3,164 кг/см2) (N2); тормозящее напряжение: 130 В; энергия столкновения: 10, 25 и 40 эВ, соответственно.
Настоящее изобретение относится к новым ингибиторам ангиотензин-превращающего фермента, и их биологическая активность более подробно описана в следующих in vivo и in vitro анализах.
Определение активности ангиотензин-превращающего фермента (ACE)
ИспытаниеACE активности in vitro
Анализ методом высокоэффективной жидкостной хроматографии: имеется в виду метод, описанный в Cushman et al. (Biochemical Pharmacology, 1971, 20 (7): 1637-1648.; Journal of Dairy Science, 1995, 78 (4): 777-783.), активность соединений по настоящему изобретению в отношении ангиотензин-превращающего фермента анализировали с использованием описанного метода. Этот метод основан на определении содержания гиппуровой кислоты (Hip), гидролизата Ang I мимика гиппурил-гистидил-лейцина (HHL), что является подходящим для непрерывного отслеживания ACE активности. При добавлении ингибитора ACE развитие реакции может ингибироваться, снижая, таким образом, продукцию гиппуровой кислоты. Таким образом, ACE-ингибирующую активность определяли путем измерения изменения УФ абсорбции при 228 нм гиппуровой кислоты, продуцируемой до и после добавления ингибитора.
Материалы и метод:
(1) Материалы:
Экспериментальное оборудование:
Используемые в экспериментах реагенты:
(2) Экспериментальный метод
Смесь 25 мкл раствора образца (растворенный в 50 мМ HEPES буфере с хлористоводородной кислотой, pH=8,3, содержащем 300 мМ NaCl, 50 мкмоль) и 200 мкл 3% субстрата HHL (растворенный в таком же буфере) поддерживали при 37°C в течение 6 минут. После добавления 50 мкл ACE (0,5 Ед., растворенный в 1,5 мл такого же буфера), реакцию осуществляли при 37°C в течение 15 минут, затем добавляли 250 мкл 1 моль/л хлористоводородной кислоты для остановки реакции. Реакционную смесь смешивали равномерно и давали выстояться в течение 5 минут. После добавления 2 мл этилацетата смесь сильно встряхивали в течение 60 сек и центрифугировали при 1000 × g в течение 10 минут. Супернатант помещали в кипящую водяную баню на 15 минут и после добавления 3 мл деионизированной воды перемешивали и давали выстояться. 20 мкл реагентов загружали для определения гиппуровой кислоты обращенно-фазовой высоко-эффективной жидкостной хроматографией. Ингибиторный эффект образца на ACE оценивали по количеству образовавшейся гиппуровой кислоты, и буфер использовали вместо раствора образца в качестве контрольной пустой пробы. Процент ингибирования ACE испытываемым образцом (%)=(максимальное значение гиппуровой кислоты для контроля - максимальное значение гиппуровой кислоты для образца)/максимальное значение гиппуровой кислоты для контроля × 100%.
Хроматографические условия:
УФ детектор; длина волны: 228 нм; Колонка: Agilent HC-C18 4,6 × 250 мм, 5 мкм; Скорость потока: 1,0 мл/мин; Объем вводимой пробы: 20 мкл; Температура колонки: 30°C; Подвижная фаза: ацетонитрил-вода (80/20). Результаты показаны в Таблице 5:
ИспытаниеACE активности in vivo
Материалы и метод:
Экспериментальное оборудование:
Вещества, используемые в экспериментах:
Принцип эксперимента:
Определение содержания ACE с использованием двойного сэндвич-метода ELISA: антимышиное ACE антитело наносили сверху на содержащий фермент планшет, и в этом эксперименте мышиный ACE в образце или стандарте связывался с покрывающим планшет антителом, и свободные ингредиенты удаляли промывкой. Последовательно добавляли биотинилированные антимышиные ACE антитела и меченный пероксидазой хрена авидин. Антимышиное ACE антитело связывалось с мышиным ACE, связанным с покрывающим антителом, и биотин специфически связывался с авидином, таким образом, был образован иммунный комплекс, и свободные компоненты удаляли промывкой. Добавляли хромогенный субстрат (TMB), который становился синим в условиях катализа пероксидазы хрена и становился желтым после добавления стоп-раствора. OD значение измеряли при длине волны 450 нм с использованием считывающего устройства для микропланшетов. Было показано квадратичное нелинейное сотношение между концентрацией ACE и значением OD450, и концентрацию ACE в образце рассчитывали путем построения стандартной кривой.
Экспериментальные методы:
(1) Обработка экспериментальных животных
108 самцов мышей Kunming с массой тела 20 ± 2 г рандомизированно разделяли на 18 групп, включая нормальную контрольную группу, группу введения каптоприла в качестве положительного контроля и группу введения соединения 221S, соответственно, по 6 мышей на группу. Животным в каждой группе вводили внутрижелудочно 0,05 ммоль/кг (10 мл/кг), один раз в день, в течение 7 последовательных дней. Через 2 часа после конечного внутрижелудочного введения мышей умерщвляли путем цервикальной дислокации и брали для исследования сердце, печень, головной мозг, легкое, почку и кровь. Почку использовали для этого испытания, а образцы других тканей использовали для других экспериментальных исследований. Почки 10-кратно разводили при помощи PBS, гомогенизировали, центрифугировали и супернатант использовали для анализа или хранили при -20°C.
(2) Процедура осуществления ELISA
Уровни ACE в ткани почки мышей определяли методом ELISA. Все стадии осуществляли строго в соответствии с инструкциями. Основные стадии были следующими:
(a) добавление образца: устанавливали пустую лунку (в пустую контрольную лунку не добавляли образцы и реагенты, но остальные процедуры соблюдали), стандартную лунку и лунки с образцом для измерений, соответственно. 100 мкл стандартного раствора или образец для испытания осторожно добавляли в остальные лунки при разных концентрациях. Следует соблюдать осторожность, чтобы не было пузырьков воздуха. Смесь затем осторожно смешивали. Планшет закрывали крышкой и реакцию осуществляли при 37°C в течение 90 минут.
(b) Жидкость сливали и планшет сушили центрифугированием без промывки. 100 мкл содержащего биотинилированное антитело рабочего раствора (полученного не раньше чем за 15 минут до использования) добавляли в каждую лунку. Планшет покрывали пленкой и инкубировали при 37°C в течение 1 часа.
(c) Жидкость из лунок сливали и планшет сушили центрифугированием и промывали 3 раза. В процессе промывки планшет пропитывали в течение 1-2 минут при около 350 мкл/лунка, сушили центрифугированием и содержащуюся в лунке жидкость удаляли, осторожно постукивая планшет на абсорбирующей бумаге.
(d) 100 мкл содержащего конъюгированный фермент рабочего раствора (полученного не раньше чем за 15 минут до использования) добавляли в каждую лунку. Планшет покрывали пленкой и инкубировали при 37°C в течение 30 минут.
(e) Жидкость из лунок сливали и планшет сушили центрифугированием и промывали 5 раз с использованием такой же процедуры, как на стадии (c).
(f) 90 мкл раствора субстрата (TMB) добавляли в каждую лунку и планшет покрывали пленкой и инкубировали при 37°C в темноте в течение 15 минут (соответственно в течение меньшего или большего периода времени, в зависимости от реального развития процесса, но не более 30 минут, и останавливали, когда наблюдали существенный градиент в стандартных лунках).
(g) 50 мкл стоп-раствора добавляли в каждую лунку для остановки реакции, где сразу происходило изменение цвета от синего до желтого. Порядок добавления стоп-раствора должен быть таким же, как при добавлении раствора субстрата.
(h) Оптическую плотность (OD) каждой лунки определяли при 450 нм с использованием считывающего устройства для микропланшетов. Считывающее устройство для микропланшетов следует включить заранее, чтобы подогреть инструмент и настроить на процедуру испытания.
Полученные экспериментальные данные выражали как χ±SD (SPSS19.0 статистическая программа, использовали t-критерий для статистической обработки).
Результаты экспериментов показаны на Фиг. 1. Формула: y=ax2+bx+c; где a: -0,0052; b: 0,2556; c: -0,0233; R2: 0,9968.
In vivo активность (ELISA), результаты показаны в Таблице 8:
Результаты показали, что соединения по настоящему изобретению могут снижать содержание ACE фермента в крови крыс, и снижение было больше, чем при использовании положительного контроля Каптоприла, при этом соединение 221S-1a обладало наиболее существенным эффектом снижения.
Определение кровяного давления у спонтанно-гипертензивных крыс (SHR)
Экспериментальное оборудование и реагенты
Экспериментальное оборудование
Вещества, используемые в экспериментах:
Экспериментальные методы:
Самцов SPF-категории спонтанно-гипертензивных крыс (SHR) (самцы, возраст 12 недель, масса тела 200г ± 20г) разделяли на три группы: группа введения пустого контроля, контрольная группа и группа введения образца, по 6 крыс в каждой группе. Животных размещали в биомедицинской лаборатории для животных провинции Шэньси при школе медико-биологических наук Северо-Западного Университета, при температуре 22°C и влажности 50%, с 12-часовым циклом свет/темнота и свободным доступом к пище и воде. SHR крыс приучали к процедурам измерения кровяного давления после 5 дней адаптации к условиям окружающей среды. Перед введением, у крыс в каждой группе измеряли базальное кровяное давление, и систолическое кровяное давление было в пределах 190 ± 5 мм рт.ст.
Определение кровяного давления у SHR крыс после одного введения:
Систолическое кровяное давление у экспериментальных крыс измеряли опосредованно путем измерения импульсов в области хвоста.
Введение SHR крысам осуществляли внутрижелудочно, где образец и сравнительный препарат (каптоприл) оба растворяли в дистиллированной воде, содержащей 1% Tween 80, и группе введения пустого контроля внутрижелудочно вводили такой же объем дистиллированной воды, содержащей 1% Tween 80. Количество для внутрижелудочного введения составляло 0,05 ммоль/кг (10 мл/кг по объему), и кровяное давление измеряли в точках врмени 1 час, 2 часа, 3 часа, 4 часа и 6 часов после внутрижелудочного введения, соответственно.
Подробное описание стадий измерения: здоровых крыс помещали в закрепленный бокс устройства для измерения кровяного давления. На дне закрепленного бокса обеспечивали нагревательную пластину при 30°C, и бокс предварительно нагревали в течение 10 минут для локального расширения кровеносных сосудов. После того, как крысы достигали спокойного состояния, надувную цилиндрическую трубку оборачивали вокруг хвоста SHR крысы и электронный датчик давления помещали у основания хвоста крысы, и сигнал появлялся на экране компьютера. После того, как сигнал стабилизировался, измеряли кровяное давление и регистрировали 5 показаний с изменением давления крови меньше чем 10 мм рт.ст. с интервалом 10 секунд. Среднее значение принимали за значение систолического кровяного давления крыс.
(a) Изменение артериального систолического давления в течение 6 часов после внутрижелудочного введения соединения 221S-1a крысам SHR показано на Фиг. 2.
(b) Изменение артериального систолического давления в течение 6 часов после внутрижелудочного введения соединения 221S-1a при разных дозах крысам SHR показано на Фиг. 3.
Результаты показали, что соединение 221S-1a продемонстрировало лучшее антигипертензивное действие на SHR крыс с хорошим дозо-зависимым эффектом, и антигипертензивный эффект был лучше, чем у каптоприла.
(2) Определение кровяного давления у крысы SHR после нескольких введений:
В соответствии с описанными выше способом и дозой, введение крысам осуществляли внутрижелудочно в течение последовательных 7 дней, один раз в день. Кровяное давление измеряли через 2 часа после введения. После завершения введения кровяное давление измеряли в течение последовательных 7 дней, один раз в день, и регистрировали изменение кровяного давления.
(a) Изменение артериального систолического давления в течение 14 дней после внутрижелудочного введения 221S-1a в течение 7 дней крысам SHR показано на Фиг. 4.
(b) Изменение артериального систолического давления в течение 14 дней после внутрижелудочного введения 221S-1a при разных дозах крысам SHR показано на Фиг. 5.
После продолжительного введения соединения 221S-1a в течение 7 дней введение прекращали и затем регистрировали изменение артериального систолического давления в течение 14 дней. Результаты показали, что соединение 221S-1a обладает лучшим антигипертензивным эффектом по сравнению с каптоприлом. Эффект разных доз соединения 221S-1a на артериальное систолическое давление у SHR крыс был дозо-зависимым.
Полученные экспериментальные данные выражали как χ ± SD (SPSS19.0 статистическая программа, использовали t-критерий для статистической обработки).
Реферат
Изобретение относится к трипептидному соединению формулы (I), где R, R’, R’’, R’’’, A, B, D, L, K, t указаны в формуле изобретения, способу его получения и его применению в профилактике и лечении гипертензии и других кардиоцеребральных сосудистых заболеваний. 5 н. и 2 з.п. ф-лы, 5 ил., 19 табл., 38 пр.(I)
Формула



































Документы, цитированные в отчёте о поиске
Периндоприл





Комментарии