Пептиды, способ их получения, фармацевтическая композиция и способ ее получения - RU2146262C1
Код документа: RU2146262C1
Чертежи














Описание
Изобретение относится к области биологии клетки, в частности к новым пептидам, способным взаимодействовать с трансдукторами внутриклеточного сигнала и тем самым препятствовать процессу передачи сигнала, приводящему к пролиферации и подвижности клеток. Изобретение относится также к способу получения указанных пептидов, фармкомпозиции на их основе и способу получения таких композиций.
Известно, что полипептидные факторы роста опосредуют физиологические ответы путем связывания рецепторов клеточной поверхности с тирозин-киназой, обладающей ферментной активностью (см. Ullrich A. и Schlessinger J. Cell 61: 203 - 211 (1990). После связывания этих лигандов рецепторы фактора роста подвергаются димеризации с последующим аутофосфорилированием специфичных тирозиновых остатков.
Во внутриклеточной среде, окружающей белки, имеются молекулы с определенными биологическими функциями, служащие в качестве субстратов для лиганд-активированных тирозин-киназных рецепторов.
Экспериментальные данные, накопленные за последние годы, свидетельствуют о том, что после связывания с рецептором эти субстратные молекулы преобразуются в свою активированную форму и становятся важными участниками процесса передачи сигнала с использованием факторов роста для регулирования пролиферации клеток.
Показано, что некоторые цитоплазматические молекулы, которые опосредуют клеточный ответ на действие факторов роста, взаимодействуют с активированными рецепторами посредством их SRC-гомологичной области 2 (Koch C.A. et al. Science 252: 668 - 674 (1991), (SH2)-домена.
Домен SH2 представляет собой консервативную область белка, составляющую приблизительно 100 аминокислот, и обнаруживаемую в самых различных группах цитоплазматических белков, участвующих в передаче сигнала.
Белки, имеющие SH2-домены, часто обладают характерной последовательностью приблизительно в 50 остатков (домен SH3) которая также участвует в регуляции белок-белкового взаимодействия в процессе передачи сигнала (см. Clark. G. и др. Nature 356: 340 - 344 (1992) и ссылки).
Аутофосфорилирование рецептора после связывания с лигандом действует как переключение этого рецептора на создание сайтов связывания для SH2-доменов цитоплазматических сигнальных белков (Anderson D и др. Science 250: 979 - 982 (1990), которые становятся, тем самым, мишенями или активации SH2-домены способны непосредственно распознавать фосфотирозин (Matsuda. M. и др. Science 248: 1537 - 1539 (1990).
Однако для достижения высокой аффинности SH2-домена необходимо, чтобы фосфотирозин входил в состав специфической аминокислотной последовательности, как первоначально предполагалось исходя из анализа сайтов SH2-связывания (Cantley L.C. и др. Cell 64: 281 - 302 (1991).
Например, каждый из SH2-содержащих белков, а именно фосфатидилинозитол (P1)-3-киназа, Ras-G-TP-дезактивирующий белок (Ras-GAP) и фосфолипаза C-γ(PLC-γ), связывается с различными сайтами аутофосфорилирования β-рецептора для тромбоцитарного фактора роста (Kashishian. A. EMBO J. 11: 1373 - 1382 (1992), Fantl. W.J. и др. Cell 69: 413 - 423 (1992).
Сайты аутофосфорилирования, действующие как специфические сайты связывания ("прикрепления") для P1-3-киназы, PIC -γ, и Ras-GAP, идентифицированы в рецепторе эпидермального фактора роста (EGF-R), рецепторе колониестимулирующего фактора 1 (CSF-IR) и в рецепторе фактора роста фибробластов (FGF-R) (Cantley L.C. et. al. Cell 64: 281 - 302 (1991) Mohammadi M. et. al. Mol. Cell. Biol 11: 5068 - 5078 (1991) Reedij K. M. et al., EMBO J. 1: 1365 - 1372 (1992) Rotin D. et. al. EMBO J. 11: 559 - 567 (1992).
Известно, что относительно короткие пептидные последовательности, соответствующие сайтам фосфорилирования рецептора PDGF (тромбоцитарного фактора роста), ингибируют взаимодействие между активированным PDGF рецептором и P1-3-киназой (Escobedo J. A. и др. Mol. Cell. Biol. 11: 1125 - 1132).
Очевидно, что селективность в отношении специфических SH2-доменов обеспечивается остатками, раcположенными непосредственно возле фосфотирозина с C-конца, особенно остатками в положениях + 1, + 2 и + 3.
Таким образом, элемент распознавания для p 85-субъединицы P1-3-киназы идентифицирован в PDGF-рецепторе: т. е. этот элемент представляет собой последовательность Tyr-Met/Val-Xxx-Met (YMXM или YVXM), где Xxx и X являются любым аминокислотным остатком в трехбуквенном или однобуквенном обозначении, соответственно (Domchek S. M. и др. Biochemistry 31: 9865 - 9870 (1992).
В настоящее время идентификация новых членов семейства SH2-содержащих молекул, а также соответствующего элемента распознавания быстро продвигается.
Известно непосредственное участие некоторых из этих молекул в выявлении биологического ответа к лиганду. Высказывают предположение, что такой молекулой является белок Grb2, который ассоциируется, посредством своего SH2-домена, с EGF-рецептором после стимуляции лигандом.
Микроинъекция белков Grb2 и H-ras в клетки млекопитающего приводит к стимуляции синтеза ДНК и тем самым к митогенному эффекту (Lowenstein E.J и др. Cell 70, 431 - 442 (1992).
Полученные результаты свидетельствуют о том, что Grb2 играет важную роль в механизме регулирования фактором роста передачи ras-сигнала.
Задачей настоящего изобретения является исследование рецептора фактора роста гепатоцитов (HGF).
HGF, известный также как фактор Скаттера (Scatter) (SF), представляет собой гетеродимерный белок, выделяемый клетками мезодермального происхождения (Stoker M. и др, Nature 327: 239 - 242 (1987), Weidner K.M. и др. J. Cell Biol 111: 2097 - 2108 (1990).
Этот фактор индуцирует определенный спектр биологических активностей в эпителиальных клетках, включая митогенез, стимуляцию подвижности клеток, и стимуляцию матриксной инвазии (Makamura T. et. al, Biochem. Biophys. Res. Comm. 122: 1450 - 1459 (1984), Stoker. M. et. al, Nature 327: 239 - 242 (1987), Weidner K.M. et. al. J. Cell Biol. 111: 2097 - 2108 (1990), Pubin. J. S. et al. Proc. Natl. Acad. Sci. U.S.A. 88: 415 - 419 (1991).
HGF/SF также представляет собой морфогенный in vitro (Stern C.D. et. al, Development 110: 1271 - 1284 (1990) Montesano et. al. Cell 66: 697 - 711 (1991) и сильный антигенный фактор in vitro и in vivo (Bussolino. M. F. et. al. J. Cell. Biol. 119: 629 - 641 (1992).
Хотя биологическое действие HGF/SF варьируется в зависимости от клетки-мишени, однако HGF/SF сигнал опосредуется одним конкретным рецептором, а именно, рецептором тирозин-киназы, кодируемой МЕТ-протоонкогеном (см. например, Comoglio P.M. в "I.D. Goldberg. & E.M. Rosen (eds) Hepatocyte Grown Factor-Scatter Factor (HGF/SF) and C-Met Receptor, Birkhauser Verlag Basel / Switzerland".
HGF-рецептор, известный также как p190MET, представляет собой гетеродимерный рецептор, состоящий из внеклеточной и трансмембранной β-субъединиц (Giordano. S. и др. Nature 339: 155 - 156 (1989), обе из которых образуются в результате протеолитического расщепления общего одноцепочечного предшественника (170 кДА) (Giordano S. и др. Oncogene 4: 1383 - 1388 (1989).
NIH3T3-фибробласты, трансфицированные MET-кДНК человека, экспрессируют функциональные рецепторы и индуцируют реакцию на HGF/SF с увеличением подвижности и инвазии внеклеточного матрикса (Giordano S и др. PNAS, 90: 649 - 653 (1993).
Нерегулируемая тирозин-киназная активность HGF/SF-рецептора наблюдается в трансформированных клеточных линиях после хромосомных перестроек (Park и др. Cell 45: 895 - 904 (1986), сверхэкспрессии гена (Giordano S. и др. Nature 339: 155 - 186 (1989) "дефектного посттрансляционного процессинга (Mondino и др. Mol. Cell. Biol. 11: 6084 - 6092 (1991) и самосжатия петли.
Сверхэкспрессия рецептора наблюдается в ряде человеческих опухолей эпителиального происхождения (Di Renzo и др. Oncogene 6: 1997 - 2003 (1991), Di Renzo и др. Oncogene 7: 2549 - 2553 (1992) Prat и др. Int. J. Cancer, 49: 323 - 328 (1991).
Этот факт особенно явно указывает на онкогенный потенциал HGF/SF-рецептора.
Однако очень мало имеется сведений о пути трансдукции сигнала, стимулируемого HGF/SF.
Плейотропный биологический ответ, индуцируемый указанным фактором, позволяет предположить, что может быть активирован более чем один механизм традукции. Еще ранее, авторами настоящего изобретения показано, что HGF/SF-рецептор после аутофосфорилирования связывается in vitro с P1-3-киназой, ras-GAP, PLC -γ и Src-ассоциированной тирозин-киназой (Bardelli A. и др. Oncogene 7: 1973 - 1978 (1992).
Ассоциирование P1-3-киназы с активированным рецептором
обнаружено in vivo в клетках, стимулированных HGF/SF (Graziani A. и др. J. Biol. Chem. 266: 22087 - 22090 (1991)
Недавно авторами настоящей заявки показано, что HGF/SF активирует Ras путем
усиления обмена между его GDP- и GTP-связанным состоянием посредством стимуляции фактора гуанин-нуклеотидного обмена (Graziani A. и др. J. Biol. Chem. в печати (1993).
Авторами настоящей заявки также обнаружено, что HGF/SF-рецептор ассоциируется с белками Shc и Gbr 2. Ген Shc млекопитающего кодирует три с высокой степени экспрессируемых перекрывающихся белка размером 66, 46 и 52 кДА (p66Shc, p46Shc и 52Shc), содержащие C-концевой SH2-домен и N-концевой коллаген-подобный домен (Pelicci и др. Cell 70: 93-104 (1992). Белки p46Shc и p52Shc кодируются тем же самым транскриптом с использованием двух различных ATG.
Белок p66Shc кодируется альтернативно сплайсированным транскриптом (Migliccio и др. в работе). Экспериментальные данные указывают на то, что Shc-белки участвуют в трансдукции сигналов, генерированных рецепторами тирозин-киназы. Помимо этого наблюдается быстрое тирозин-фосфорилирование Shc-белков в ответ на активацию EGF-рецептора (PeIicci и др. см. выше) и PDGF-рецептора (неопубликованные данные), Erb-B-2-(Segatto и др. Oncogene 2105-2112 (1993), Src и Fps (McGIage и др. Proc. Natl. Acad. Sci USA 89: 8869-8873 (1992). Сверхэкспрессия Shc-белков индуцирует чрезмерный рост нейритов в феохромоцитомных клетках PC12, и это действие блокируется экспрессией доминант-негативного Ras-мутанта (Rozakis-Adcock и др. Nature 360: 689-692 (1992). После стимуляции клеток некоторыми факторами роста Shc-белки образуют стабильные комплексы с Grb 2//Sem5-адаптором (Lowenstein и др. Cell 70: 431-442 (1992), Rozakis-Adcock и др. см. выше). Известно, что указанный адаптор активирует функции посредством рекрутинга SoS, фактора гуанин-нуклеотидного обмена (Li и др. Nature 363: 85-87 (1993), Gale и др. Nature 363: 88-92 (1993), Rozakis-Adcock и др. Nature: 363:83-85(1993), Egan и др. Nature 363: 45-51 (1993), Simon и др. Cell 73: 169-177 (1993) Oliver и др. Cell 73: 179-191 (1993) к мембране.
Исходя из вышеуказанного очевидно, что взаимодействие между активированным рецептором тирозин-киназы и молекулой цитозольного трансдуктора является решающей стадией в процессе передачи сигнала, способствующей пролиферации клетки и ее подвижности.
Поскольку указанные биологические реакции представляют собой наиболее характерные отличительные особенности роста и распространения опухолей, то любому специалисту ясно, что необходимо разработать способы, препятствующие вышеуказанному взаимодействию.
Целью настоящего изобретения являются новые фосфопептиды, способные взаимодействовать с трансдукторами внутриклеточного сигнала, и тем самым препятствовать процессу, приводящему к пролиферации и подвижности клеток, а также к инвазии внеклеточного матрикса.
Эти биологические свойства могут быть использованы для ингибирования роста опухолевых клеток и их метастатического размножения.
Настоящим изобретением получены следующие новые сведения: (1) Shc-белки, связываются с тирозин-фосфорилированным SF/HGF -рецептором посредством SH2-домена: (2) Shc белки связываются с фосфотирозином Y1356 и Y1356 концевой части SF/HGF-рецептора, (3) сверхэкспрессия Shc-белков способствует усилению мотогенного ответа на SF/HGF, (4) после связывания с SF/HGF-рецептором, Shc-белки фосфорилируются в Y317, (5) Shc-белки, фосфорилованные в Y317, образуют специфические комплексы с белками Grb2 и (6) сайт связывания с Crb2 на Shс (Y317 VNV) имеет последовательность, идентичную последовательности сайтов связывания с сигнальным трансдуктором, находящимся на HGF/SF рецепторе (YVNV).
Поставленная цель достигается новыми синтезированными пептидами из сайтов связывания с Crb2, находящихся в Shc и из сайтов связывания с Shc содержащих распознающие участки Y1349 VHV и Y1356 VNV на рецепторе фактора роста гепатоцитов. Эти пептиды обладают способностью ингибировать процессы, приводящие к пролиферации и подвижности клеток, а также к инвазии внеклеточного матрикса.
В соответствии с этим настоящее изобретение, кроме того, относится к пептиду, содержащему последовательность части Shc-белка, который обладает способностью связываться с трансдуктором цитозольного сигнала. Этот пептид, в основном, способен ингибировать связывание между белками и Crb2 или между белками Crb2 и активированным рецептором фактора роста гепатоцитов.
Кроме того, настоящее изобретение относится к пептиду, имеющему последовательность части внеклеточной области рецептора фактора роста гепатоцитов и обладающему способностью связываться с трансдуктором цитозольного сигнала.
Указанный пептид, в основном, способен ингибировать связывание между Shc-белками или p85-субъединицей фосфатидил-инозитол-3-киназы и активированным рецептором фактора роста гепатоцитов, либо между Shc и другими трансдукторами цитозольного сигнала.
Пептидами настоящего изобретения являются, в основном, тирозин-содержащие молекулы, представляющие собой сайты фосфорилирования тирозина. Эти пептиды имеют длину, например, в 4-20 аминокислот, в частности 8-12 аминокислот.
Из таких пептидов, в основном, продуцируются потенциальные участки распознавания для SH2-доменов трансдукторов внутриклеточного сигнала.
Указанные пептиды могут содержать 4-20 аминокислот и иметь последовательность XN -YVN (или H)V-Xc, где XN и Xc каждый представляют собой последовательности, состоящие из 0-16 аминокислот.
Предпочтительно, если XN и Xc представляют собой последовательности, фланкирующие одну из последовательностей YVN (или H)V в HGF-/SF-рецепторе и Shc-белка. Взаимодействие трансдуктора с активированным рецептором тирозин-киназы стимулирует рекрутинг и активацию самого трансдуктора.
Активация HGF/SF-рецептора может быть физиологической (т.е. является результатом
связывания с лигандом и димеризации рецептора), либо конститутивной (т. е. рецептор непрерывно активируется даже в отсутствие лиганда). Причем конститутивная активация может происходить в том случае,
когда рецептор не содержит внеклеточного домена связывания с лигандом, например в случае онкогенного рецептора, либо после хромосомной транслокации (например, в случае TPP-МЕТ-слияния, описанного
ниже). Установлено, что большинство трансдукторов внутриклеточного сигнала коррелирует с клеточным ростом и онкогенной трансформацией (Fantl W.J. и др. Cell, 69: 413-423 (1992) Reedijk и др. MoI Cell.
Bioll 10: 5601-5608 (1990) Lowenstein E.J. и др. Cell 70: 431-442 (1992)
Таким образом, ингибирование связывания с активированным рецептором тирозин-киназы или связывания между Shc-белком, и
другими трансдукторами приводит к ингибированию клеточного митогенеза и мотогенеза, а поэтому пептид настоящего изобретения позволяет предотвратить развитие опухоли.
В предпочтительном варианте осуществления настоящего изобретения пептид выбирают из следующих пептидов (см. табл. 1 в конце описания).
Из всех известных трансдукторов внутриклеточного сигнала P1-3-киназа связывается с HGF рецепторами либо in vitro, либо in vivo после стимулирования лигандом. Однако распознающий эту киназу элемент на HGF/SF рецепторе еще не определен.
Предыдущее исследование, приведенное с использованием PDGF - рецептора, показывает, что аминокислотная последовательность, состоящая из 4 аминокислот, а именно, Tyr-Xxx-Xxx-Met (YXXM), где (Xxx или X представляют собой любой аминокислотный остаток в трехбуквенном или однобуквенном обозначении, соответственно) представляет собой каноническую консенсусную последовательность для P1-3-киназы.
В HGF-рецепоре имеется потенциальный участок распознавания Ter-Glu-Val-Met (Y1313 EVM), который может представлять собой сайт связывания с P1-3-киназой.
Экспериментальные результаты неожиданно показали, что хотя синтетический фосфопептид, содержащий консенсусную последовательность Y1313EVM, способен связываться без какого-либо воздействия на связывание с P1-3-киназой.
Используя синтетический фосфопептиды настоящего изобретения и рецепторные Tyr-Phe-мутанты, идентифицированы сайты связывания для P1-3-киназы с двумя фосфотирозинами в положении 1349 и 1356, что иллюстрируется с помощью данных ингибирования, полученных с использованием фосфопептидов: H-Tyr*-Val-His-Val-Asn-Ala-Thr-Tyr-OH, H-Tyr*-Val-Asn-Val-Lys-Cys-Val-Ala-OH и H-Tyr*-Val-His-Val-Ash-Ala-Thr-Tyr*-Val-Asn-Val-Lys-OH.
Таким образом, эти остатки идентифицируют новый участок распознавания для P1-3-киназы Tyr-Val-(Asn или His)-Val-[YV(N или H)V], а соответствующие фосфопептиды могут быть с успехом использованы в качестве ингибиторов связывания HGF-рецептора с P1-3- киназой.
Поэтому в соответствии с настоящим изобретением особенно предпочтительно использован фосфопептид, имеющий формулу:
H-Tyr*
-Val-His-Val-Asn-Ala-Thr-Tyr-OH или H-
Tyr*-Val-Asn-Val-Lys-Cys-Val-Ala-OH или H-Tyr*-Val-His-Val-Asn-Ala-Thr-Tyr*-Val-Asn-Val-Lys-OH, где Tyr*
означает остаток фосфорилированного тирозина.
В еще одном предпочтительном варианте настоящего изобретения пептид имеет формулу: H-Asp-Asp-Pro-Ser-Tyr*-Val-Asn-Val-Glu-OH (DDPSY*VNVQ), где Tyr*(Y*) представляет собой фосфорилированный или нефосфорилированный тирозин.
Пептиды настоящего изобретения могут быть получены в виде их фармацевтически приемлемых солей. Подходящими для этих целей солями являются основные соли, такие как соли щелочных металлов (например, соли натрия или калия) и соли аммония, а также кислые аддитивные соли, также как гидрохлоридные и ацетатные соли.
Пептиды настоящего изобретения могут быть синтезированы стандартным методом, например, таким как метод, описанный Escobedo J.A. и др. Mol. Cell, Biol. 11:1125-1132 (1991) или Turck C.W. Peptid Res. 5:156-160 (1992), например, с использованием защищенного предварительно фосфорилированного тирозинового остатка.
В частности, указанные пептиды могут быть получены с использованием жидкостного или твердофазного методов, известных каждому специалисту (Schroeder et al "The Peptides" Vol. 1, Academic Press 1965, или Bodanszky et al. "Peptide Synthesis", Interscience Publiscers 1966, или Meomie (ed) "Protective Group in Organic Chemistry", Plenum Press, 1973, или Barany et al. , "The Peptiodes: Analysis, Synthesis, Boibogy" 2, Chapter 1, Academic Press 1980).
Настоящее изобретение относится также к способу получения пептида настоящего изобретения путем химического синтеза пептида из отдельных аминокислот и/или из предварительно cинтезированных пептидов, состоящих из двух или более аминокислотных остатков.
Если необходимо получить пептид, в котором тирозиновый остаток является фосфорилированным, то предварительно фосфорилированный защищенный тирозиновый остаток может быть введен в процессе твердофазного синтеза, либо тирозиновый остаток в предварительно полученном защищенном пептиде может быть фосфорилирован, после чего указанный пептид может быть присоединен к твердому носителю.
В случае твердофазного синтеза может быть использован любой ручной или автоматический синтезатор пептидов, с помощью которого может быть осуществлен постадийный синтез пептидов на полимерном носителе с использованием BOc- или Fmoc-стратегии.
Все реагенты, используемые в качестве исходных материалов, являются коммерческими продуктами, либо они могут быть получены и очищены в соответствии со стандартной технологией.
При получении фосфопептида во избежание отщепления фосфатной группы в процессе разблокирования защищенных пептидов используют раствор трифторметансульфоновой кислоты/ трифторуксусной кислоты, содержащий соответствующую смесь акцепторов.
Разблокированные пептиды очищают с помощью обращенно-фазовой высокоразрешающей жидкостной хроматографии на C18-уоас-колонке (Hesperia Calif) в 0,1%-ной трифторуксусной кислоте, используя линейный градиент ацетонитрила, после чего эти пептиды выделяют и подвергают лиофилизации. Все фосфолипиды получают в виде полигидратированных политрифторацетатов. Содержание пептидов во всех продуктах составляет 65-90%, а хроматографическая чистота составляет более чем 95% при относительной интеграции ВЭЖХ-пиков при λ = 225 нм. Аминокислотный анализ осуществляют на гидролизатах кислоты (110oC, 22 час, в 6 н. HCl+0,1% фенол). Альтернативно, сначала может быть синтезирован пептид, содержащий нефосфорилированный тирозин, а затем в тирозиновый остаток может быть введена фосфатная группа с помощью ферментного или химического метода в этом случае, другие функциональные группы, восприимчивые к реакции с фосфорилирующим гаентом, должны быть соответствующим образом защищены.
В настоящем описании обозначения аминокислот и защитных групп используются в соответствии с IUPAC-IUB по биологической номенклатуре (см. Eur. J. Biochem vol. 138-9-37, 1984). В частности, в тексте настоящего описания использованы следующие обозначения: Вос-т-бутилоксикарбонил: t Bu-трет-бутил, BzI-бензил, ClZ-4-хлорбензилоксикарбонил, DPCDI-диизопропилкарбодиимид, ДХМ-дихлорметан, ДМФ-диметилформамид, ДНФ-динитрофенил, Fmoc-9-флуоренилметоксикарбонил, ОФ-ВЭЖХ-обращенно-фазовый высокоразрешающая жидкостная хроматография, Trt-тритил.
Способность фосфопептидов настоящего изобретения ингибировать связывание внутриклеточных трансдукторов с рецептором тирозин-киназы или Shc - белком может быть экспериментально проанализирована на конкуретное связывание, как показано в экспериментальной части, посвященной связыванию с рецептором тирозин-киназы.
Биологическое значение сайтов аутофосфорилирования на рецепторе тирозин-киназы проиллюстрировано ниже (см. экспериментальную часть) с помощью анализа на фокус-образование.
Этот анализ, в частности, иллюстрирует каким образом трансформирующая активность нативного активированного HGF-рецептора может быть эффективно ингибирована посредством мутации специфических сайтов аутофосфорилирования на самом рецепторе (мутация Tyr-Phe).
Пептид, репродуцирующий один из свойств фосфорилирования HGF - /SF-рецептора или Shc, может затем препятствовать связыванию трансдукторов, ингибируя, тем самым, передачу "вниз по течению" митогенного и мотогенного сигнала.
Поэтому пептиды настоящего изобретения могут быть использованы для лечения опухолевых
заболеваний у человека или животных
Пептиды настоящего изобретения могут быть фосфорилированными или нефосфорилированными. Активная форма пептидов обычно является фосфорилированной, но может
оказаться предпочтительным вводить пептид в нефосфорилированной форме для того, чтобы он затем фосфорилировался в организме человека. Преимущество такого введения заключается в том, что в
нефосфорилированном виде пептиды легче поглощаются клетками.
Пептиды настоящего изобретения могут быть введены пациенту любым традиционным парентеральным способом, либо для повышения ферментной стабильности и клеточной проницаемости эти пептиды могут быть соответствующим образом конъюгированы.
Выбор типа парентерального введения (т.е. подкожного, внутривенного или внутримышечного введения), дозы и частоты введения зависит от ряда факторов. Такими факторами являются цель введения, возраст, вес и состояние пациента. И в соответствии с этими факторами определяется терапевтически эффективное количество данного пептида. Однако, в основном, пептид вводят в количестве от 10 до 1000 мкг на дозу, а предпочтительно от 50 до 500 мкг на дозу (для каждого способа введения).
Пептид настоящего изобретения может быть введен в виде фармацевтической композиции. Такая фармацевтическая композиция может также содержать фармацевтически приемлемый носитель или разбавитель. Выбор соответствующего носителя или разбавителя зависит от способа введения композиции.
Настоящее изобретение иллюстрируется нижеприведенными примерами.
Описание чертежей.
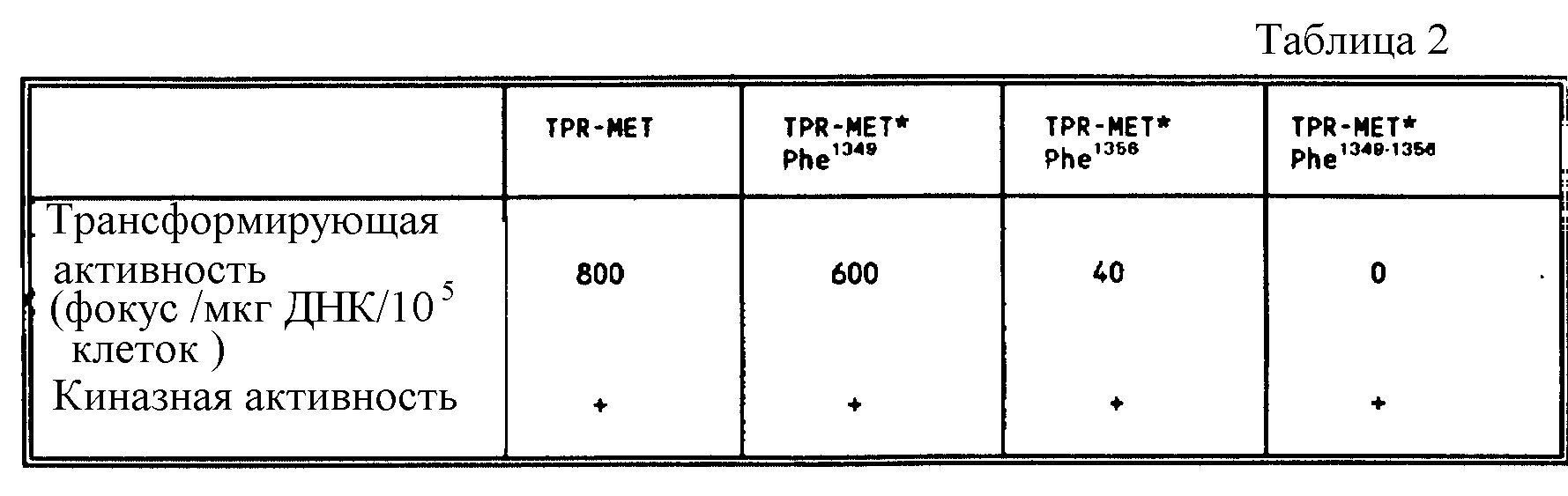
Фиг. 1. Ингибирование связывания p 85 с HGF /SF-рецептором с использованием тирозин-фосфорилированных пептидов.
Рекомбинатный HGF /SF-рецептор выделяют путем иммунопреципитации из инфицированных бакуловирусных клеток Sf9 с использованием кроличьей поликлональной антисыворотки и фосфорилируют холодным ATP. Лизаты клеток Sf9, экспрессирующих p 85, предварительно инкубируют с каждым из фосфопептидов (10 мкМ). Затем эти лизаты оставляют для связывания с иммобилизованными рекомбинантными HGF/SF рецепторами. После связывания комплекс промывают и связанный с рецепторами p85-белок детектируют с помощью киназного анализа in vitro, как описано в "Материалах и методах" примера 4. Фосфопептиды идентифицированы.
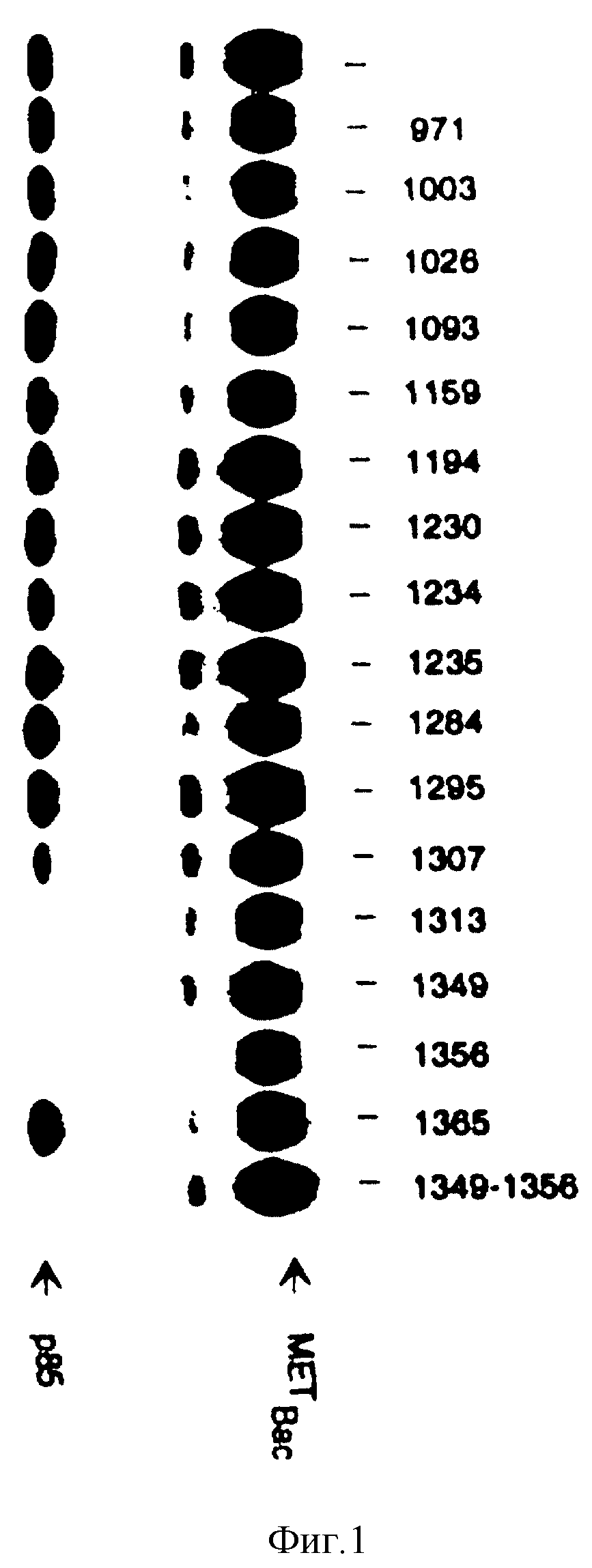
Фиг. 2. Ингибирование связывания p85 с HGF/SF-рецептором с использованием различных концентраций тирозин-фосфорилированных пептидов.
Фосфопептиды, которые успешно конкурируют, с p85 в связывании с HGF/SF-рецептором (фиг. 1), используют в возрастающих концентрациях (10 нМ, 100 нМ, 1 мкМ, слева направо) для того чтобы определить их относительное сродством к p85. Условия эксперимента аналогичны условиям, описанным в фиг. 1, фосфопептид 1365 используют в качестве негативного контроля при взаимодействии с p 85.
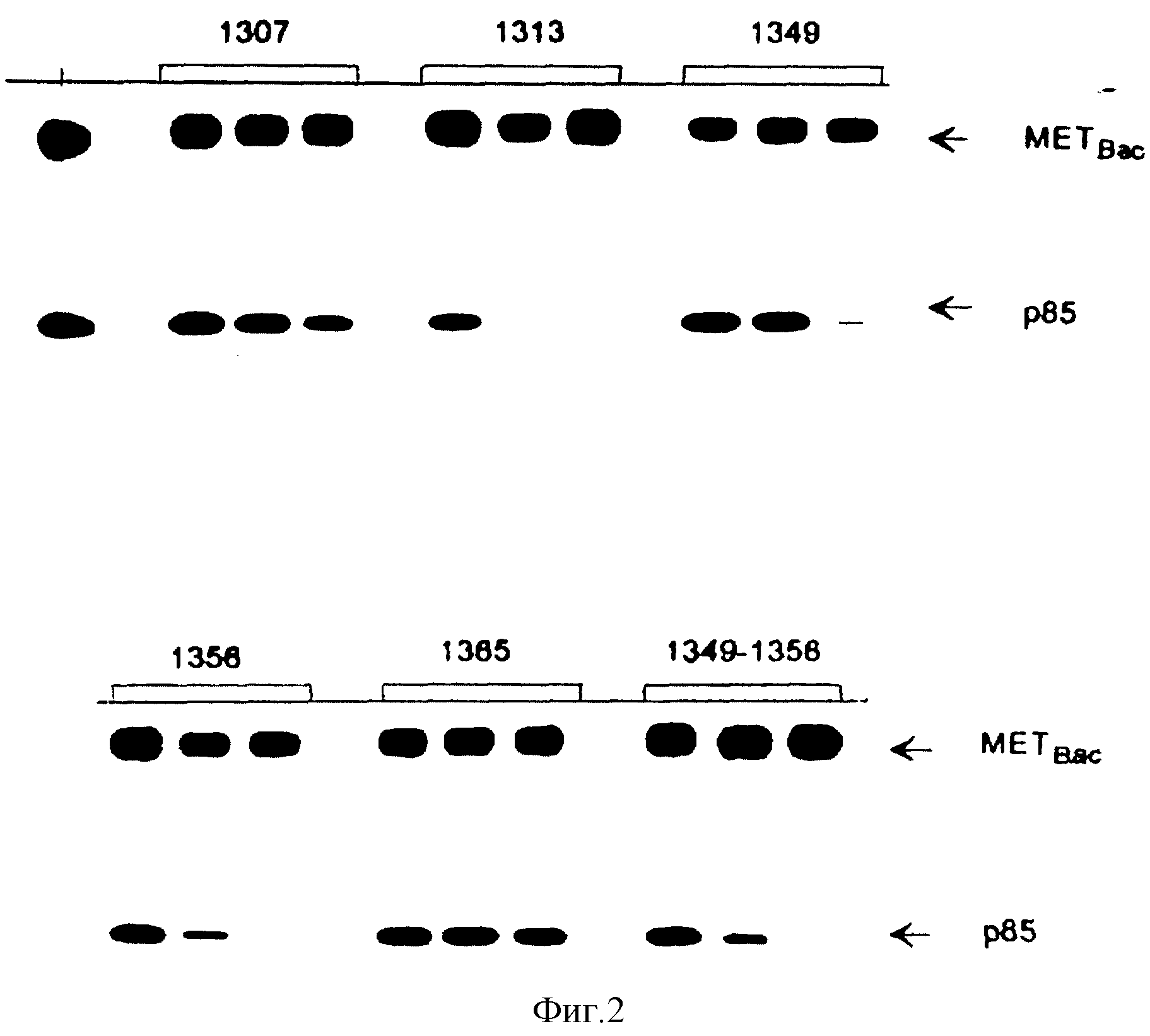
Фиг. 3. Ингибирование связывания P1-3 -киназного холофермента с HGF /SF-рецептором тирозин-фосфорилированными пептидами.
Фосфопептиды, которые успешно конкурируют с p85 (фиг.1), анализируют на их способность ингибировать связывание P1-3-киназного хлорфермента с HGF /GF рецептором. Цитозольные экстракты, полученные от клеток A549, которые были в течение трех дней культивированы в минимальной среде, предварительно инкубируют с каждым из фосфопептидов (10 мкМ), после чего эти экстракты инкубируют с иммобилизованным рекомбинантным HGF /SF-рецептором. Присутствие ассоциированной с рецептором P1-3-киназы в иммунокомплексах определяют с помощью анализа на P1-3-киназную активность, описанного в примере 4, в главе "Материалы и методы". На чертеже показано положение фосфатидилинозитол-3-фосфатного (PIP)продукта P1-3-киназной реакции.
Фиг. 4. Влияние Tyr-Rhe-мутаций на взаимодействие HGF /SF-рецептора с p85.
Клетки COS 7 трансфецированы плазмидами, кодирующими HGF /SF рецептором дикого типа (wt) или рецепторы, в которых тиразиновый кодон в указанном положении превращен в фенилаланиновый кодон отдельно или в комбинации. Клетки COS 7 экспрессируют эндогенный HGF /SF-рецептор. Однако обезьяний белок не распознается моноклональным антителом, направленным против карбоксиконцевого человеческого пептида. Эти антитела используют для селективной иммунопреципитации человеческого HGF /SF-рецептора из трансфецированных клеток COS 7. Иммобилизованные предварительно фосфорилированные рецепторы инкубируют с лизатами клеток Sf9, экспрессирующих p85. Панель A: рецептор и p85 подвергают мечению с помощью киназного in vitro - анализа, описанного в примере 4 в "Материалах и методах". Панель B: присутствие p85 в рецепторном иммуном комплексе определяют путем иммуноблоттинга с использованием моноклональных антител против p85.
Фиг. 5. in vivo - влияние Tyr-Phe- -мутаций на взаимодействие HGF /SF-рецептора с P1-3-киназным холоферментом.
Клетки COS 7, экспрессирующие рецептор дикого типа или мутированные рецепторы, стимулируют с использованием HGF /SF и лизируют. Рецепторы осаждают посредством иммунопреципитации с использованием античеловеческого моноклонального антитела.
Панели A и B: присутствие P1-3-киназы, связанной с рецептором, определяют с помощью анализа на P1-3-киназную активность, описанного в примере 4 ("Материалы и методы"). На чертеже показано положение фосфатидилинозитол-3-фосфатного (PIP) продукта P1-3-киназной реакции. Панели C и D: с помощью иммуноблоттинга (с использованием античеловеческого моноклонального антитела) показано, что образцы, проанализированные на P1-3-киназную активность, содержат эквивалентные количества рекомбинантного рецептора. Мутантный TK--рецептор получают путем замены аспарагиновой кислоты в положении 1204 на аспарагиновый остаток. Эта мутация приводит к инактивации HGF/SF-рецептора в отношении киназы.
Фиг. 6. Идентификация Y1349 и Y1356 как сайтов in vitro-фосфорилирования в HGF /SF-рецепторе путем триптического фосфопептидного картирования.
Профиль A
иллюстрирует ВРЖХ (при 214 нм) синтетического нефосфорилированного пептида (124 K), который соответствует триптическому пептиду, содержащему тирозин Y1349 и Y1356 в
HGF/SF-рецепторе. 124 K элюирует из ВРЖХ-колонки через 65 минут. B и C иллюстрируют профили радио -ВРЖХ-элюции триптических фосфопептидов, полученных in vitro от [V32
P]ATP-фосфорилированного рецептора дикого типа (B) и Phe1349-1356-мутантного рецептора (C)
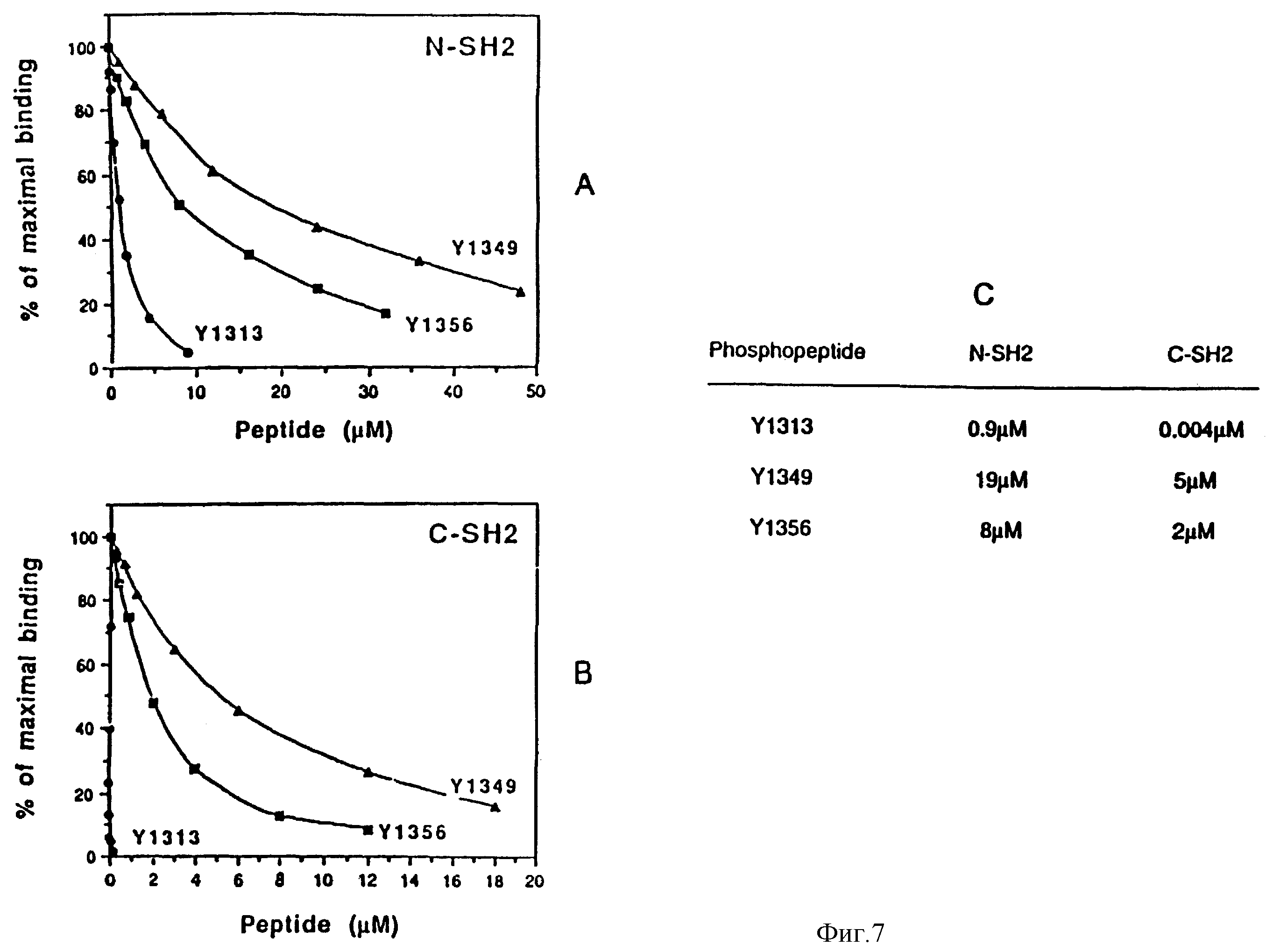
Фиг. 7 Оценка относительных аффинитетов фосфотиразина 1313, 1349 и 1356 в отношении N- и
C -SH2-доменов p85-белка.
Аффинитеты определяют с помощью анализа на биоспецифическое взаимодействие с использованием прибора BIAcore (Jonsson. U. Fagerstam L, Roos H, Ronnberg J,
Sjolander, Stenber E, Stahlberg R, UrbaniczKy C, Octlin H и Halmguist. 1991, Surface plasmon reasonance and microfluidics for real time biospecific interaction analysis. Aiotechnigues 11: 520-527,
Jonsson U. &c. M. Malmguist 1992 Real time biospecitic ana lysis. The intergration of surface plasmon resonance detection, general biospecific interface chemistry and microfluidics into one
analytic system p. 291-336. B" F. Turner(ed) Advaces in Bioslnsors, vol. 2. JAI Press, London, Karlsson, R. Michaelsson A. &c. L. Mattsson. 1991. Kinetic analisis of monoclonal antibody-antigen
interaction with a new biosensor based analytical system. J. Jmmunol. Meth. 145: 229-246)
Относительные аффинитеты определяют путем оценки способности фосфопептидов ингибировать
взаимодействие SH2-доменов с иммобилизованным фосфопептидом (DMSKDESVDV•VPMLDMK), который включает в себя Y751 чел. PDGF-рецептор. На фиг. 7A и 7B показаны результаты этой оценки,
выраженные как % ингибирования связывания с Y751 фосфопептида. На фиг. 7C показаны концентрации фосфопептида, составляющего половину от максимального ингибирования связывания.
Фиг. 8. Анализ на фокус-образование с использованием различных TPR-MET-конструкций.
В TPT-MET1349, TPR-MET-Phe1356 и TTP-MET-Phe1349-1356, тирозиновые остатки, соответствующие Tyr1349 и/или Tyr1356 HGF/SF-рецептора, подвергают мутагенезу путем замены на фенилаланин.
Фиг. 9. SF/HGF индуцирует фосфорилирование Shc и связывание с SF/HGF-рецептором и Crb2.
Клетки A549 (контрольные или экспрессирующие Y317--->F-мутантную Shc-кДНК (A549/Y317 F) культивируют в бессывороточной среде в течение 24 часов, а затем подвергают лизису. Знак (+) означает, что клетки стимулированы с 51-конца 200 ед/мл очищенного SF/HGF. Иммунокомплексы, осажденные с помощью первого антитела (IPP), разделяют путем электрофореза в 9% ДСН-ПААГ, а затем анализируют путем иммуноблотирования с использованием второго антитела (WB), как показано на чертеже. Стрелками показаны эндогенные Shc-изоформы (p46, p52, p56), β-цепь SF/HGF-рецептора (p145), трансфецированные меченые мутантные Shc-изоформы (p53 и p58), и Crb2-белок (p23).
Фиг. 10. Связывание и тирозин-фосфорилирование Shc зависит от киназной активности SF/HGF-рецептора.
Лизаты клеток COS-1, кратковременно экспрессирующие кДНК SF/HGF-рецептора дикого типа (WT) или киназа-дефектного мутантного рецептора (LYS), подвергают иммунопрецитации с использованием анти-Met моноклонального антитела (A и B) или поликлональной анти- Shc-сыворотки (C и D), затем подвергают Вестерн-блотированию, и зондируют с использованием либо анти-Met, либо P-Tyr-антитела, как показано на чертеже. Стрелками показан белок-предшественник (p170), который в клетках COS-1 представляет собой диминирующую, полностью функциональную форму SF/HGF-рецептора (Ponzetto и др. Mol. Cell. Biol. 13: 4600-4608(1993) и Shc-изоформы (p46, p 52 и p56).
Фиг. 11. Связывание Shc и Crb2-SH2-доменов с белками, солюбилизированными из SF/HGF-обработанных клеток.
Лизаты получают из слитых монослоек нестимулированных (-) или SF/HGF-стимулированных (+) клеток A549. Эксперименты на связывание осуществляют путем инкубирования полного клеточного белка с рекомбинантными GST-SH2. Shc(A) или GST-SH2. Crb2 (B), иммобилизованными на глутатионсефарозе. Связанные белки элюируют и анализируют путем вестерн-блотирования с использованием вышеуказанных антител.
Фиг. 12. Картирование сайтов Shc-связывания на SF/HGF-рецепторе.
Клетки COS-1, экспрессирующие SF/HGF-рецепторы (либо дикого типа (WT), либо мутированные Y ---> F в остатках, указанных сверху) подвергают совместной иммунопреципитации с антителами против Shc, блотируют и обнаруживают с помощью антител против Met. Стрелками показан предшественник рецептора (p170).
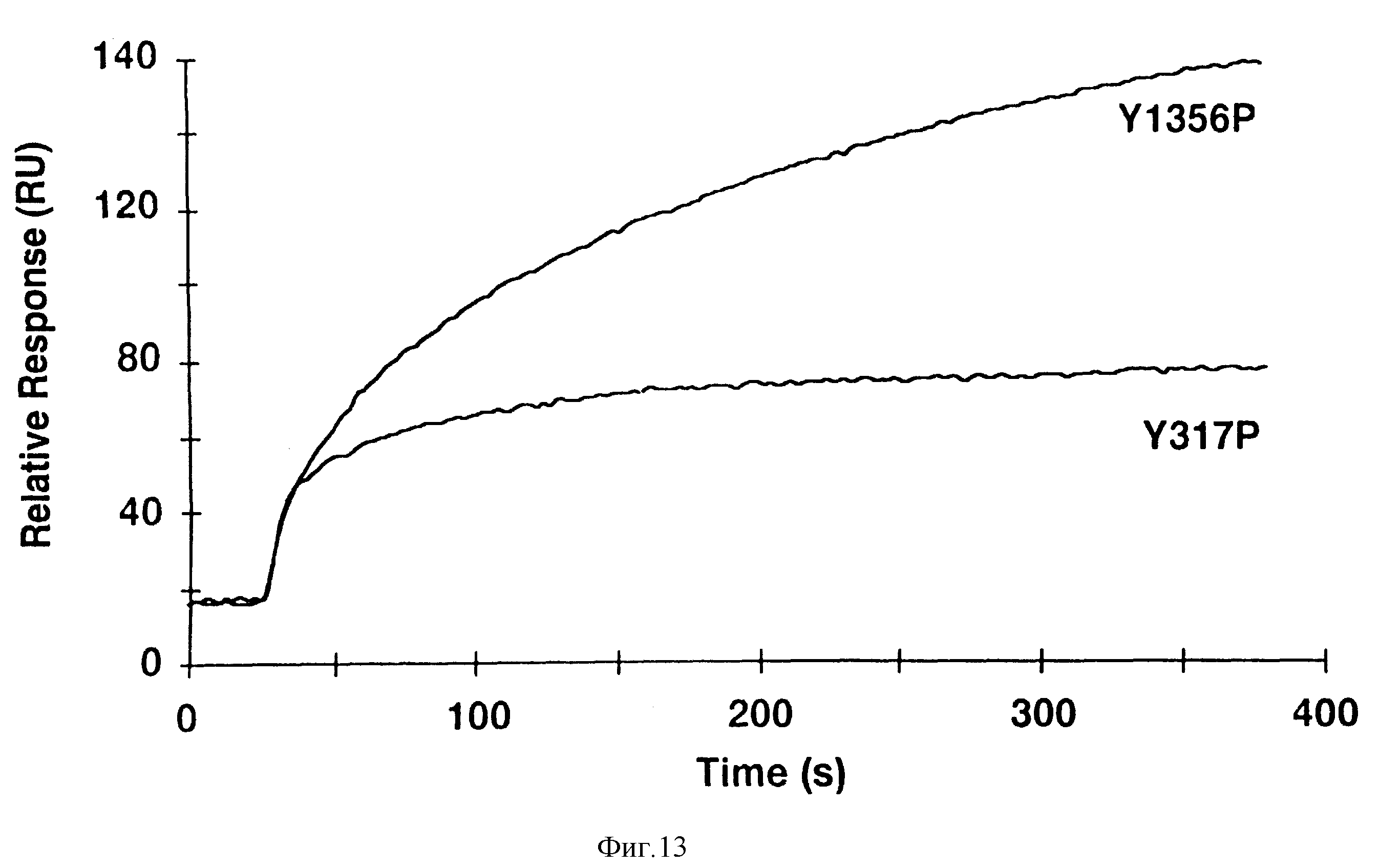
Фиг. 13. Shc-H2-домен, связывается с сайтом связывания SF/HGF рецептора (Y1356), но не со своим собственным сайтом Y317).
На поверхности двух биосенсоров, на которых были иммобилизованы два фосфопептида, наносят равные концентрации Shc-H2. Y1356P получают из концевой последовательности рецептора (VNATY1356VNVK), а Y317P получают из последовательности DDPSY317VNVQ. При этом следует отметить, что оба пептида содержат одинаковую сердцевину (YVNV), но различные последовательности, расположенные "вверх по течению". Быстрое начальное усиление ответа обусловлено "эффектом набухания" инъецированного раствора.
Фиг. 14. Сверхэкспрессия Shc способствует усилению мотогенного ответа на SF/HGF.
Камеры Бойдена с полупроницаемыми перегородками укомплектовывают поликарбонатными фильтрами (с порами размером 8 мкм), покрытыми желатином. Клетки подвергают мечению 5-[125I] йодо-2'-дезоксиуридином (см. "Методы") и засевают в верхнюю камеру. Нижнюю камеру заполняют бессывороточной средой, в которую добавляют указанные концентрации очищенного SF/HGF. Через 6 часов после инкубирования, при 37oC, клетки, прикрепленные к верхней стороне фильтров, механически удаляют, а клетки, переместившиеся к нижней стороне фильтра, фиксируют и подсчитывают с использованием гамма-счетчика (ось Y: связанные клетки, число импульсов в минуту, имп./мин) В нижней части чертежа показаны клетки (микрофотография с низким увеличением (4 х ), переместившиеся к нижней стороне фильтров в присутствии 40 ед/мл SF/HGF. Клетки инфицируют либо ретровирусом, несущим SHC-кДНК (SHC-pIXSN), либо "пустым" вирусом (МОСК).
Фиг. 15. SH2-домен Crb2 связывается с сайтом связывания Y317Shc.
Панель A: показаны сенсограммы, полученные путем нанесения ряда концентраций Gst-SH2. Crb2. на иммобилизованный фосфопептид, происходящий от Shc-последовательности DDPSY317-VNVQ. Панель B: проиллюстрировано действие конкурирующего пептида на скорость диссоциации. После нанесения Crb2. наносят буфер или 20 М небиотинилированного фосфопептида. Панель C: проиллюстрирован анализ данных, представленных на панели A. В левой части панели C представлен график зависимости скорости связывания от относительного ответа (для шести различных сенсограмм). В правой части панели C показан график зависимости углов наклона каждой линии от концентрации, при этом новый угол наклона представляет собой величину константы скорости ассоциации.
Фиг. 16. Модель взаимодействия между SF/HGF-рецептором и SH2-содержащими адапторными молекулами Shc и Crb2.
Crb2 с высокой степенью аффинности связывается с сайтом присоединения Y1356

Пример 1
Получение H-Tur*-Val-His-Val-Asn-Ala-Thr-Tyr-OH (формула I)
0,89 г (0,5 мМ) Fmoc-Tyr (tBu)-4-(оксиметил)фенокси-метил-сополи(стирол-1% дивинилбензол)-смолы (0,56 мМ/г) подвергают
следующей обработке (стадии 1-5):
(1) диметилформамидом,
(2) пиперидином (20%) в ДМФ
(3) диметилформамидом,
(4) предварительно полученным 1-гидроксибензотриазольным
сложным эфиром (2,0 мМ) Fmoc-аминокислоты в ДМФ.
Объемы промывок и реагентов составляют от 10 до 20 мл. Каждую стадию повторяют несколько раз, либо для полного завершения реакции смолы (стадии 2-4), либо для полной замены предыдущего реагента смолой (стадии 1, 3, 5). После каждого цикла берут образцы смолы и контролируют на полное завершение реакции с помощью нингидринового теста. 1-Гидроксибензотриазольные сложные эфиры Fmoc-аминокислот получают непосредственно перед использованием посредством реакции Froc-аминокислоты (2,0 мМ) 1-гидроксибензотриазола (2,0 мМ) и DPCDI (2,0 мМ) в ДМФ.
Цикл реакций (1) - (5) повторяют для каждых аминокислотных остатков, в результате чего получают последовательность формулы I.
После этого защищенные аминокислоты добавляют в следующем порядке: Fmoc-Thr-(tBu)-OH, Fmoc-Ala-OH, Fmoc-Asn-OH, Fmoc-Val-OH, Fmoc-His(Trt)-OH, Fmoc-Val-OH и Boc-Tyr-(PO3Bz12)-OH. После завершения последнего цикла пептидильную смолу промывают несколько раз дихлорметаном, а затем осушают. Для исходной смолы получают увеличение массы в 0,54 г.
1,0 г Пептидильной смолы в течение 3 часов при 0oC перемешивают с 20 мл смеси трифторметансульфоновой кислоты /трифторуксусной кислоты/ диметилсульфида /этандитиола (20:50:3:3:1). Разблокированный пептид осаждают диэтиловым эфиром (1 л) и собирают путем фильтрации.
Неочищенный пептид очищают с помощью ОФ-ВРЖХ на колонке (2,2 х 25 см) и C18-Vydac(Hesperia, CA), в 0,1 трифтороуксусной кислоте, в течение 90 минут, с
использованием линейного градиента (0 - 65% ацетонитрил)
Фракции, содержащие продукт в чистой форме, объединяют, а ацетонитрил выпаривают в вакууме, после чего оставшийся раствор лиофилизуют.
Таким образом, получают 132 мг соединения формулы I, с чистотой (ВРЖХ-анализ) 95,7%
Аминокислотные соотношения: Ala 1(1), Asp 1,07 (1), His 0,96 (1), Thr 0,91 (1), Tyr 1,88 (2), Val 2,03 (2).
Содержание пептида составляют 73,7%, FAB-масс-спектроскопия: m/z = 1044,4 [M-H]-.
Пример 2
Получение H-Tyr*-Val-Asn-Val-Lys-Cys-Val-Ala-OH (формула
II)
С использованием 0,5 мМ - Fmoc-Ala-4-(оксиметил) феноксиметил-сополи (стирол-1%-дивинилбензол)смолы и с добавлением защищенных аминокислот в следующем порядке: Fmoc-Val-OH,
Fmoc-Cys-(Trt)-OH, Fmoc-Lys(Boc)-OH, Fmoc-Val-OH, Fmoc-Asn-OH, Fmoc-Val-OH и Boc-Tyr-OH, на указанную смолу синтезируют дефосфопептид способом, описанным в примере 1.
После завершения последнего цикла фосфорилированный Tyr-остаток получают непосредственно на пептиде, еще связанном со смолой, путем обработки пептидиловой смолы в течение 1 часа при 25oC раствором 1H-тетразола (30 экв) и ди-трет-бутил-N, N-диизопропилфосфорамидата в ДМФ (10 экв), а затем путем обработки в течение 1 часа и при 25oC трет-бутилгидропероксидом в толуоле (20 экв). Отщепление, удаление защитных групп и очистку неочищенного продукта осуществляют на 1,0 г пептидиловой смолы, описанной в примере 1.
Аминокислотные соотношения: Ala 1(1), Asp 1,02 (1), Cys nd (1), Lys 0,99 (1), Tyr 0,95 (1), Val 2,98 (3). Содержание пептида = 68,9%. FAB-масс-спектроскопия: m/z = 973,4 [M-H]-.
Пример 3
Получение H-Tyr*
-Val-His-Val-Asn-Ala-Asn-Thr-Tyr*- Val-Asn-Val-Lys-OH (формула III)
0,74 г (0,5 мМ) Boc-Lys (CIZ)-4-(оксиметил)фенилацетамидометил-сополи(стирол-1% дивинилбензол)смолы (0,68 мМ/г)
подвергают следующей обработке (стадии 1-7):
(1) дихлорметаном,
(2) трифторуксусной кислотой (50%) в ДХМ,
(3) дихлорметаном,
(4) диизопропилэтиламином (5%) в ДМФ
(5) диметилформамидом,
(6) предварительно полученным 1-гидроксибензотриазольным сложным эфиром (2,0 мМ) Boc-аминокислоты в ДМФ и
(7) диметилформамидом.
Каждую стадию повторяют несколько раз, либо для полного завершения реакции смолы (стадии 2, 4, 6), либо для полной замены предыдущего реагента смолой (стадии 1, 3, 5, 7). После каждого цикла берут образцы смолы и контролируют на полное завершение реакции с помощью нингидринового теста.
1-Гидроксибензотриазольные сложные эфиры Boc-аминокислот получают непосредственно перед использованием посредством реакции Boc-аминокислоты (2,0 мМ), 1-гидроксибензотриазола (2,0 мМ) и DPCDI (2,0 мМ) в ДМФ.
Цикл реакций (1 - 7) повторяют для каждых аминокислотных остатков, в результате чего получают последовательность формулы III.
После этого защищенные аминокислоты добавляют в следующем порядке: Boc-Val-OH, Boc-Asn-OH, Boc-Val-OH, Boc-Tyr-(PO3Bz12)-OH, Boc-Thr(BzI)-OH, Boc-Ala-OH, Boc-Asn-OH, Boc-Val-OH, Boc-His(Dnp)-OH, Boc-Val-OH и Boc-Tyr-(PO3Bz12)-OH.
После полного завершения синтеза His(Dnp)-защитную группу удаляют с использованием 15 мл 1 М - тиофенола в ДМФ, непосредственно на пептиде, еще прикрепленным к смоле, а затем пептидиловую смолу промывают несколько раз дихлорметаном и осушают. Таким образом получают 1,51 г пептидиловой смолы.
Отщепление, удаление защитных групп и очистку неочищенного продукта осуществляют на 1,0 г исходной пептидиловой смолы, описанной в примере 1. Таким образом получают 196 мг соединения III с чистотой (ВРЖХ-анализ), составляющей 95,9%. Соотношения аминокислот: Ala 1(1), Asp 1,99 (2), His 1,05 (1), Lys 0,97 (1), Thr 0,93 (1), Tyr 1,85 (2), Val 4,01 (4).
Содержание пептида: 71,1%
FAB-масс-спектроскопия: m/z 1564,62 [M-H]6-.
Пример 4
Материалы и методы
Реагенты,
клетки, антитела. Все реагенты, если это не указано особо, поставляются фирмой Sigma Chemical Co. Белок A, ковалентно связанный с Сефарозой, поставляется фирмой Pharmacia LKB Biothechnology Inc. Все
радиоактивные изотопы поставляются от Amersham Corp. Клетки карциномы легких A549 и клетки COS-7, которые поставляются из ATCC (CCL 185) (Американская коллекция типовых культур), культивируют в среде
MEM, дополненной 10% околоплодной телячьей сывороткой (Flow Laboratories, Inc) в 5% CO2-водонасыщенной атмосфере. Клетки Spodoptera frugipedra (Sf 9) (из ATCC (CPL 1711), культивируют в
монослойных культурах в среде SF-900 (GIBCO BPI). Антисыворотку и моноклональные анти-Met антитела продуцируют против синтетического пептида, соответствующего 19C-концевым аминокислотам чел.
MET-последовательности (Prat M и др. Mol. Cell, Biol. 11 (12): 5954 - 5962 (1991).
Синтетические фосфопептиды синтезированы в соответствии с процедурой, описанной в примере 1-3.
Экспрессия HGF/SF- рецептора и p85 -кДНК в клетках насекомых с использованием векторов бакуловирусов.
Рекомбинантный HGF/SF-рецептор и p85-бакуловирусы конструируют как описано в литературе (Bardelli A. и др. Oncogene 7: 1973-1978 (1992) Otsu M и др. Cell 65: 91-104(1991) и используют для инфицирования клеток St9 (Piwnica-Wotms H и др.J. Virol 64: 61-6 (1990).
Гибридные белки с GST-SH2-доменом N- и C-SH2-домены p85-субъединицы бычьей P1-3 киназы (аминокислоты 314-431 и 612-722) получают полимеразоцепной реакцией и клонируют в бактериальный экспрессирующий векторpGEX-2 (Smith D.B. и Johnson K.S. Gene 67: 31-40 (1988). Гибридные белки глутатион-S-трансферазы (GST)-SH2) выделяют из бактериальных лизатов с помощью глутатион-аффинной хроматографии (Panayoton C. и др. EMBO J.II" 4261-4272 (1992). Для определения концентрации рекомбинантных белков используют аминокислотный анализ, проводимый на анализаторе системы.
Сайт-направленный мутагенез и экспрессия МЕТ-кДНК в клетках COS7.
Клонирование МЕТ-кДНК описано в литературе (Pouzetto C. и др. Oncogene 6, 553-559 (1991). EMBI Data-Bank reference No X54559), 3'- концевой фрагмент (от нуклеотида 2355 до конца) субклонируют в pSELECTTM-I. Сайт-направленный мутагенез осуществляют in vitro с использованием олигонуклеотидов (in vitro система мутагенеза с изменением сайтов Promega). Олигонуклеотиды синтезируют с использованием аппаратуры Applied Bio-System 391. Мутанные клоны идентифицируют путем секвенирования (набор для T7-секвенирования, Pharmacia). Полную МЕТ-кДНК-несущую соответствующую Tyr-Phe-мутацию реконструируют в векторе PMT2, который содержит главный поздний промотор аденовируса. Все плазмиды трансфецируют липофектином (GIBCO BRL) в клетках COS7. In vitro- эксперименты на связывание.
После инфицирования в буфере A (10 мМ Трис-HCl-буфера, pH 7,5 10% глицерина, 1% Тритон X-100, 150 мМ NaCl, 5 мМ EDTA), в который добавляют 0,2 мМ фенилметилсульфонилфторида, 1 мкг/мл лейпептина, 0,1 TЕд/мл апротинина и 1 мкг/мл пепстатина, клетки Sf9, экспрессирующие рекомбинантный HGF/SF-рецептор (приблизительно 4 • 106 клеток/стадия), подвергают лизису в течение 36 часов. Лизаты осветляют в течение 15 минут с помощью центрифугирования (15000 х г, 4oC), а супернатанты инкубируют 2 часа с анти-Met-антителами, связанными с белком A-Сефарозой, а затем подвергают иммунопреципитации. Иммунокомплексы три раза промывают буфером A, один раз буфером B (IP, мМ Трис-HCl, pH 7,4, 100 мМ NaCl, 1 мМ EDTA), и один раз буфером C (25 мМ 4-(2-гидроксиэтил)-1-пиперазин-этансульфоновой кислоты (HEPES буфер), pH 7,2, 100 мМ NaCl, 5 мМ MgCl2). Образцы предварительно фосфорилируют путем 15-минутного инкубирования при 25oC в буфере C с 10 мкМ немеченного ATP, а затем три раза промывают холодным буфером A, в который добавляют 1 мМ орто-ванадат натрия. Связывание между иммобилизованным рецептором и экспрессированным в бакуловирусе p85 осуществляют способом, описанным Bardelli A. и др. (Oncogene 7: 1973-1978 (1992). В качестве источника P1-3 киназы в экспериментах на связывание холофермента P2-3 киназы используют клетки A549, которые три дня культивируют в бессывороточной среде (приблизительно 2 • 106 клеток/стадию). После этого клетки A549 гомогенизируют с использованием гомогенизатора Даунса в буфере MOPS (20 мМ 3-(N-морфолино) пропансульфоновой кислоты, pH 7,5 мМ MgCl2, 0,1 мМ EDTA, 200 мМ сахарозы, 1 мМ орто-ванадата натрия), в который добавляют 0,2 мМ фенилметилсульфонилфторида, 1 мкм/мл лейпептина, 0,1 T Eд/мл, апротинина и 1 мкг/мл пепстатина. Гомогенаты центрифугируют 20 минут при 100 000 х г/ (4oC). Для контролирования на способность фосфопептидов блокировать связывание с рецептром клеточные лизаты предварительно инкубируют с фосфопептидами в течение 1 часа при 4oC, а затем инкубируют с иммобилизованным рекомбинантным HGF/SF рецептором. После связывания, иммунокомплексы три раза промывают буфером A, два раза буфером D (0,5 М LiCl, 100 мМ Трис- HCl, pH 7,6) и два раза буфером B.
Присутствие p85-субъединицы P1-3-киназы в иммунопреципитате рецептора определяют посредством: 1) мечения рецептора и связанных белков с использованием [γ-32P]: ATP в киназном in vitro-анализе), II/Вестерн-иммуноблотинга, и III/ анализа на активность P1-3-киназы.
In vivo- эксперименты на связывание
Трансфецированные клетки COS7, экспрессирующие мутантные HGF/SF рецепторы, в течение 10 минут и при 37oC стимулируют 12 нг/мл HGF/SF, и лизируют
в буфере A в присутствии 1 мМ орто-ванадата натрия. Затем лизаты в течение 15 минут (4oC) осветляют при 15000 х г, после чего супернатанты 2 часа инкубируют с анти-Met-антителами против
человеческого белка, конъюгированным с белком A-сефарозы. Полученные комплексы два раза промывают буфером A, два раза буфером D и два раза буфером. Присутствие ассоциированной с рецептором P1-3 киназы
в указанных комплексах определяют с помощью P1-3-киназного анализа, описанного Whitman и др. (Whitman M. и др. Nature 315: 239-242, (1985).
Киназный in vitro - анализ
Ассоциированные с рецептором белки подвергают мечению в 20 мл буфера C в присутствии 10 мкКи [ γ-32P]ATP (удельная активность 7000 Ки/Мм, Amersham) в течение 15 минут при 25oC. Реакцию прекращают путем добавления 1 мл охлажденного льдом буфера A, не содержащего ингибиторов протеазы. Образцы три раза промывают холодным буфером A. Меченые иммунокомплексы элюируют из
Белка-A-Сефарозы в кипящем буфере Лэммли. Супернатанты подвергают электрофорезу в полиакриламидном геле с 8% додецилсульфатом натрия (ДСН-ПААГ).
Вестерн-иммуноблоттинг
После
связывания иммунопреципитаты солюбилизуют в кипящем буфере Лэммли, выделяют на 8% ДСН-ПААГ и подвергают электроблоттингу на нитроцеллюлозные фильтры (Hi-bond Amersham). Затем фильтры инкубируют с
указанными антителами, и специфическое связывание обнаруживают с помощью системы усиленной хемилюминесценции (ELCтм, Amersham).
Триптическое картирование фосфопептидов
32P-меченые полосы, соответствующие in vitro -фосфорилированному дикого типа и мутантному HGF/SF рецепторам, вырезают из полиакриламидных гелей и обрабатывают в соответствии с
процедурой, описанной Ferracini R и др. J. Biol. Chem 266: 1958-1964 (1991). Триптические пептидные перевары растворяют в 100%-ном диметилформамиде, разводят до 50% буфером для ВРЖХ-загрузки и
выделяют с помощью высокоразрешающей жидкостной хроматографии (ВРЖХ) на обращенно-фазовой колонке (C2/C18 Superpack Pep-S, Pharmacia), элюируя градиентом ацетонитрила (0-32%, 70
минут), в присутствии 0,1 трифторуксусной кислоты, со скоростью потока 1 мл/мин. Элюируемую радиоактивность контролируют с помощью радиоактивного проточного детектора (Racliomatic A-100, Packard
Jnstrument.Co).
В качестве контроля синтетической пептид (124K, Noosystem Laboratories) выделяют с помощью ВРЖХ, как описано выше, и анализируют при 214 нм. 124K охватывает 24 аминокислоты (от изолейцина 1337 до лизина 1360 последовательности Met-белка) и тем самым соответствует предсказанному нужному триптическому фосфопептиду, за исключением того, что он не является фосфорилированным.
Анализ взаимодействия Y1349 и Y1356 c p85-N- и C- концевыми H2-доменами с использованием биосенсора BIAcore
Устройство и принцип
работы биосенсора BIAcore подробно описаны в литературе (Jonsson и др. Biothechnigue II: 520-527 (1991), Jonsson U. и M.Malmguist 1992, b" F. Turner (ed), Advanced in Biosensor, vol. 2, JAI Press,
London (1992), Karlsson P. и др. J.Jmmunol.Meth.145: 22-246(1991).
SH2-домены, используемые в данных экспериментах, обессоливают на колонке (Pharmacia) хроматографической системы SMAPT в целях замены буфера на буяер, используемый для BIAcore и состоящий из 20 мМ Hepes, pH 7,4, 150 мМ NaCl, 3,4 мМ EDTA 0,005% Твин-20 и 4 мМ DTT. Авидин (Boehringer) (50 мкг/мл) в 20 мМ натрийацетатного буфера, pH 4,0 иммобилизовывают на поверхность кристалла сенсора после активации смесью (1:1) N-гидроксисукцинимида (NHS) и N-этил-N-(3-диметил-аминопропил)-карбодиимида и гидрохлорида (EDC)(Pharmacia). Избыточные реактивные группы блокированы этаноламином (1,0 М).
На авидин (в течение 50 секунд, при скорости потока 5 мкг/сек) наносят биотинилированный фосфопептид Y751 (DMsKDEsVDYV PMLD-MK). Неспецифически связанный материал удаляют коротким импульсом (4 сек) с использованием 0,1% ДСН.
Гибридные белки с GTS-SH2-доменом, смешивают с различными концентрациями фосфопептидов HCF/SF-рецептора, и наносят на поверхность в течение 40 секунд, при постоянной температуре 25oC и скорости потока 5 мкл/мин. Материал, связанный с поверхностью, удаляют с использованием 4-секундного импульса 0,1% ДСН, что доводило сигнал до уровня фона.
Результаты
Эксперименты на
связывание с синтетическими фосфопептидами.
В наших первоначальных исследованиях используют синтетические фосфопептиды для успешного конкурирования с p85 или P1-3-киназой в in vitro-экспериментах на связывание с рекомбинантным HGF/SF рецептором. Сконструированы фосфопептиды, которые покрывают все возможные тирозины, присутствующие в цитоплазматической части HGF/SF рецептора. Эти фосфопептиды перечислены выше в главе "Подробное описание изобретения". Из них, 16 фосфопептидов состоит из 8 аминокислот и начинают с фосфотирозинового остатка в N-конце. Один фосфопептид состоит из 12 аминокислот и включает в себя два фосфотирозина. Предыдущая работа, проведенная с использованием PDGF-рецептора, показывает, что 4 аминокислоты, расположенные непосредственно ниже (5'---> 3') фосфотиразина, играют важную роль для определения сайта распознавания SH2(Fantl W.J. и др. Cell 69: 413-423 (1992).
В экспериментах, проиллюстрированных на фиг. 1, использованы лизаты клеток насекомых (Sf9), инфицированных рекомбинантным бакуловирусом, взятым как источник белка p85 (Otsu M и др. Cell 65:91-104 (1991). Эти лизаты соответствующим образом разводят (см. "Материалы и методы), предварительно инкубируют с каждым из фосфопептидов (10 мкМ), а затем инкубируют с рекомбинантным HGF/SF-рецептором. Указанный рецептор подвергают иммунопреципитации из лизатов клеток Sf9, инфицированных рекомбинантным бакуловирусом, несущим полную человеческую MET-кДНК (Bardelli A и др. Oncogene 7: 1973 - 1978 (1992). В этих клетках рецептор синтезируют, главным образом, в виде нерасщепленного предшественника (на чертежах MATBac), который однако, был абсолютно фукнциональным (Bardelli. A и др. Oncogene 7: 1973 - 1978 (1992). Этот рецептор иммобилизуют на микросферах белка A-Сефарозы и предварительно фосфорилируют холодным ATP. После связывания, сферы промывают, а комплексы фосфорилируют [ γ-32P]-ATP. В процессе реакции фосфорилирования рецептор и p85 становится меченым и тем самым обнаружимыми в ДСН-ПААГ. Из фиг. 1 видно, что лишь три фосфопептида успешно конкурируют с p85, а именно: H-Tyr*-Glu-Val-Met-Leu-Lys-Cys-Trp-OH, H-Tyr*-Val-His-Val-Asn-Ala-Thr-Tyr-OH, H-Tyr*-Val-Asn-Val-Lys-Cys-Val-Ala-OH.
Фосфопептид H-Tyr* -Val-His-Val-Asn-Ala-Thr-Tyr*-Val-Asn-Val-Lys-OH также полностью препятствует связыванию p85, тогда как фосфопептид H-Tyr*-Cys-Pro-Asn-Pro-Leu-Tyr-Glu-OH, является эффективным лишь частично. В эксперименте, проиллюстрированном на фиг. 2, приведена приблизительная оценка относительных аффининетов указанных фосфопептидов по отношению к p85. Этот эксперимент осуществляют, как и предыдущий за исключением того, что указанные фосфопептиды использованы в различных концентрациях (от 10 нМ до 1 мкМ). Наивысшей конкурентной способностью в отношении p85 обладает фосфопептид H-Tyr*-Glu-Val-Met-Leu-Lys-Cys-Trp-OH, а за ним уже фосфопептиды H-Tyr*-Val-Asn-Val-Lus-Cys-Val-Ala-OH, H-Tyr*-Val-His-Val-Asn-Ala-Thr-Tyr-OH, и H-Tyr* -Cys-Pro-Asp-Pro-Leu-Tyr-Glu-OH.
По своему сродству к p85 фосфопептид H-Tyr*-Val-His-Val-Asn-Ala-Thr-Tyr*-Val-Asn-Val-Lys-OH сравним с фосфопептидом H-Tyr*-Val-Asn-Val-Lys-Cys-Val-Ala-OH.
Поскольку взаимодействие с каталитической субъединицей p110 может повлиять на конформацию p85, то эти результаты не отражают истинных свойств SH2-доменов p85 в данном комплексе. Чтобы исключить эту возможность, проведены аналогичные эксперименты по конкурентному связыванию, где в качестве источника P1-3-киназного холофермента используют лизаты клеток A549. Связывание между холоферментом и рекомбинатным рецептором оценивают путем изменения P1-3-киназной активности в рецепторных комплексах. Из фиг. 3 видно, что фосфопептиды, которые способны к эффективной конкуренции с p85, также препятствует связыванию P1-3-киназного холофермента с HGF/SF-рецептором. При этом следует отметить, что фосфопептид, содержащий оба фосфотирозина (1349 и 1356) является более эффективным конкурентом P1-3-киназного холофермента при связывании с HGF/SF-рецептором, чем фосфопептиды, содержащие лишь один из этих остатков.
Результаты этой первой серии экспериментов позволяют предположить, что, возможно, в HGF/SF-рецепторе имеется двойной сайт связывания с P1-3-киназой, который состоит из фосфотирозиновых пар 1307-1313 и 1349-1356. Как было показано для PDGF-рецептора, он может содержать пару фосфотирозиновых остатков Tyr740 и Tyr751, которые, как известно, образуют сайт связывания с P1-3-киназой (Fantl. W.J. и др. Cell 69: 413-423 (1992), Kazlauskas A. и др. Mol, Cell Biol. 12: 2534 - 2544 (1992).
Связывание p85 или P1-3-киназного холофермента с Tyr-Phe-мутантами рецептора HGF/SF.
В соответствии со стандартной методикой, хорошо известной специалистам, изготовлены серии конструкций посредством сайт-направленного мутагенеза кДНК рецептора дикого типа. Эти конструкции подвергают кратковременной экспрессии в клетках COS 7, в результате чего получают соответствующие рецепторные Tyr-Phe-мутанты: Phe1003, Phe1307, Phe1313, Phe1349, Phe1356 и Phe1365.
Помимо замещений в одной аминокислоте, также сделаны множественные замещения. В частности продуцированы два двухсайтовых мутанта, необходимых для последующей оценки результатов экспериментов на связывание, а именно: мутант Phe1307-1313 и мутант Phe1349-1356.
На фиг. 4 показаны результаты экспериментов на связывание, которые являются аналогичными результатами, представленным на фиг. 1, и которые получены с использованием того же самого источника p85 (экспрессирующие клетки Sf9), а также с использованием лизата трансфецированных клеток COS7 как источника HGF/SF-рецептора дикого типа и мутантных HGF/SF-рецепторов. Трансфецированные клетки COS 7 экспрессируют одноцепочечный предшественник рецептора, а также его протеолитически процессированную зрелую форму в соотношении 1: 1. После реакции связывания образцы разделяют надвое и подвергают различным обработкам, в результате чего получают результаты, представленные на панелях A и B. На панели A рецептор и p85 оценивают с помощью киназного анализа. На этой панели показано, что все мутантные рецепторы являются активными, и присутствуют почти в одинаковых количествах. Причем двойной мутант Phe1349-1356 оказывается неспособным фосфорилировать p85 и связываться с ним, тогда как все остальные мутанты (и, в частности, Phe1307-1313 ) обнаруживают такую способность.
В экспериментах, проиллюстрированных на панели B, киназный анализ после связывания не проводят, а вместо этого образцы повергают электрофорезу в ПААГ с ДСН, а затем переносят на нитрофцеллюлозу. После этого осуществляют вестерн-блотирование с использованием антител против p85. Этот эксперимент подтверждает тот факт, что мутант Phe1349-1356 утрачивает способность связываться с p85. Сравнивая панели A и B, следует отметить, что мутант Phe1356 еще обладает способностью связываться с p85, но уже утрачивает способность фосфорилировать p85, что позволяет предположить, что в комплексе, содержащем этот мутантный рецептор, расположение p85 может быть не подходящим для эффективного фосфорилирования.
Как показано на фиг. 5, аналогичные результаты могут быть получены также в in vivo-экспериментах. В этих экспериментах, HGF/SF-рецептор после его стимуляции подвергали иммунопреципитации из лизатов трансфецированных клеток COS 7. Во избежание дефосфорилирования рецептора, лизис и иммунопреципитацию проводят в присутствии орто-ванадата натрия. Затем рецепторные иммунопреципитаты подвергают P1-3-киназному анализу, корректируют на содержание Met-белка, и оценивают количество эндогенной P1-3-каназы, компреципитированной в комплексе с рецептором. При этом лишь двойной Phe1349-1356-мутант обнаруживает компреципитацию с P1-3-киназной активностью, меньшей, чем активность связывания рецептора дикого типа. Остаточная активность двойного Phe1349-1356-мутанта, очевидно, обусловлена образованием рецепторных димеров с эндогенным Met-белком из клеток COS 7. Это предположение подтверждается тем фактом, что аналогичный уровень остаточного связывания наблюдается также на иммунопреципитатах, полученных от клеток COS 7, трансфецированных киназно-инактивированным мутантом (TK-, фиг. 5).
Результаты этой второй серии экспериментов показывают, что остатки Y1349 и Y1356 опосредуют связывание P1-3-киназы с рецептором HGF/SF, тогда как остатки Y1307 и Y1313 такого действия не показывают.
Фосфопептидное картирование рецептора дикого типа и мутантных рецепторов
Результаты, полученные с использованием
мутантных рецепторов, свидетельствуют о том, что тирозины 1349 и 1356 фосфорилируются in vivo. Сконструирован синтетический пептид (124K), который соответствовал триптическому пептиду, содержащему два
указанных остатка. Для наилучшего выделения этого пептида необходимо использовать комбинацию водного и органического растворителей, а при разделении ВРЖХ-способом он элюируется с колонки в очень
позднее время (см. фиг. 6, панель A). При использовании той же самой процедуры для прогона триптического перевара, полученного от рецептора дикого типа, который фосфорилирует in vitro, пик элюции в
данное время очень близок к пику элюции выделенного нефосфорилированного 124K-пептида (см. фиг. 6, панель B). Этот новый пик отсутствует в двухсайтовом мутанте (фиг. 6, панель C), и уменьшен в
односайтовых мутантах (не показано). Все рецепторы экспрессируют в клетках COS 7 и фосфорилируют in vitro перед осуществлением триптического переваривания.
Полученные результаты указывают на то, что тирозины 1349-1356 действительно представляют собой сайты фосфорилирования in vitro, а если принять во внимание результаты эксперимента на связывание, проиллюстрированного на фиг. 5, то имеется полное основание утверждать, что эти же самые тирозиновые остатки также являются сайтами фосфорилирования in vivo.
Оценка относительных аффинитетов фосфотирозинов 1349 и
1356 по отношению к N- и C-концевых SH2-доменов p85-белка
Присутствие двух SH2-доменов в молекуле p85 и необходимость удаления двух фосфотиразинов в HGF/SF-рецепторе для подавления связывания
с P1-3-киназой позволяют предположить, что каждый SH2-домен взаимодействует с одним из двух тирозинов (Kashishian A. и др. EMBO, J. 11 ":1373-1382 Kavanaugh W. M. и др. Mol.Cell.Biol 12": 3415-3424
(1992).
Поэтому интересно измерить относительные аффинитеты двух фосфопептидов по отношению к N- и C-концевым SH2-доменам p85. Для этого сделаны попытки осуществить анализ на биоспецифическое взаимодействие с использованием прибора BIAcore (Jansson U. и др. Biothechnigues 11: 520-527 (1991) Jonsson U. и M. Malmguist. B." F.Turner. (ed), Advances in Biosensors, vol. 2 JAI Press, London (1992), Karlsson R. и др. J. Jmmunol Meth. 145:229-246 (1991). Однако присоединение фосфопептидов к матрице, осуществляемое непосредственно либо после биотинилирования путем связывания с иммобилизованным на матрице авидином, не дает заметного ответа. Вероятно, это обусловлено тем фактом, что в этих пептидах фосфотирозин находится в N-конце, и иммобилизация подавляет его способность к связыванию. Поэтому определение аффинитетов осуществляют непрямым способом путем измерения способности фосфопептидов ингибировать взаимодействие SH2-доменов с иммобилизованным фосфопептидом, который включает в себя фосфотирозин 751 (Y751) в чел. PDGF-рецепторе, и который, обладает высокой степенью аффинности по отношению к двум SH2-доменам. N- и C-концевые SH2-домены p85 смешивают с различными концентрациями Met-фосфопептидов и инъецируют на иммобилизованный Y751-фосфопептид. На фиг. 7 показаны результаты проведенных измерений, выраженные в % ингибирования связывания с Y751-фосфопептидом. Хотя для этих взаимодействий невозможно получить значения абсолютных аффинитетов, однако, сравнение величин, соответствующих 50% от максимального ингибирования, дает полезную информацию об относительных аффинитетах. Суммарные данные представлены на панели. C. Наиболее высокая кажущаяся аффинность наблюдается для Y1313 -фосфопептида, который содержит канонический элемент YXXM. Фосфопептиды Y1349 и Y1356, которые содержат нетрадиционный сайт связывания YVXV, также ингибируют связывание N- и C-концевых SH2-доменов p85 с фосфопептидом Y751, но при более высоких концентрациях. Все фосфопептиды, а особенно явно фосфопептид Y1313, обнаруживают более высокое сродство к C-концевому SH2, чем к N-концевому SH2. Эти данные согласуются с данными, полученными из эксперимента, проиллюстрированного на фиг. 2, и свидетельствуют о том, что, по крайней мере, in vitro и в условиях эксперимента, новый элемент связывания Tyr-Val-Xxx-Val-(YVXV) обладает сродством к p85, величина которого на два порядка ниже, чем сродство канонической консенсусной последовательности.
Пример 5.
Трансформирующая активность tyr-phe-мутантов TPR-MET
Посредством экспериментов, описанных в примере 4, тирозиновые остатки в положениях 1349 и 1356 HGF/SF- рецептора (кодируемого
MET-протоонкогеном) идентифицируют как сайты связывания, участвующие в рекрутинге и активации P1-3-киназы и, возможно, других цитоплазматических трансдукторов. При непрерывном активировании
трансдукторы действуют как постоянные эффекторы митогенного сигнала, индуцируя таким образом тонкогенную трансформацию клетки.
Для того чтобы продемонстрировать важную роль, которую играют тирозиновые остатки в положении 1349 и 1356 HGF/SF - рецептора в процессах, ведущих к онкогенной трансформации, использовали TPR-MET-молекулу, перманентно активированную форму МЕТ- протоонкогена. (Gonzatti- Haces и др. Proc. Natl. Acad. Sci. USA 85: 21-25 (1988). TPR-MET получают в результате ДНК-реаранжировки между TPR- последовательностями из хромосомы 1 и МЕТ-последовательностями из хромосомы. 7. TPR-MET-продукт обладает конструктивной тирозин-киназной активностью, ответственной за трансформацию фибробластов NIH 3T3.
Посредством сайт-направленного мутагенеза, тирозиновый остаток в положении 1349 и 1356 TPR-MET молекулы заменен на фенилаланин.
Для осуществления анализа на фокус-образование используют
протоонкоген TPR-MET дикого типа, а также его мутированные формы TPR-MET -Phe1349, TPR-MET-Phe1356 и TPR-MET-Phe1349-1356 (см. табл. 2). В этом анализе фибробласты от
крыс Фишера трансфецируют фосфатом кальция, содержащим различные конструкции TPR-MET, клонированные в плазмиде pXMT2 (Sambrook и др. Mollcular Gloning. A. Laboratory manual (второе издание), стр.
16.22, Cold Spring Harbor Laboratory Press . (1989 Клетки культивируют в DMEM, содержащей 5%-ную околоплодную телячью сыворотку и через 10 дней подсчитывают фокусы. Полученные результаты
проиллюстрированы на фиг. 9
Как можно видеть из таблицы или из фиг. 8, мутация Tyr1349, а особенно Tyr1356 продуцируют значительное снижение числа трансформирующих
фокусов.
Кроме того, если оба тирозиновых остатка заменяются на фенилаланин, то трансформирующая активность TPR-MET полностью ингибируется.
Эти данные еще раз демонстрируют важную биологическую роль, которую играют данные сайты во внутриклеточной трансдукции митогенного сигнала.
Таким образом, фосфопептиды настоящего изобретения обладают способностью предотвращать связывание внутриклеточных трансдукторов с Tyr1349 и Tyr1356 HGF/SF рецептора, а поэтому они являются потенциальными ингибиторами онкогенной трансформации.
Пример 6
Материалы и методы
Клеточные линии.
Клетки карциномы легких A549 и клетки CoS-1 культивируют традиционным способом в PPMI-среде, в которую добавляют 10%-ную околоплодную телячью сыворотку (FCS). Клеточную линию, несущую амфотропный вирус PA317 (Miller & Bullimore (1(86)) Mol. Cell.Biol 6: 2895-2902) и клеточную линию Psi-2, несущую экотропный вирус и др. (1983) Cell 33: 153-159), поддерживают в модифицированной по способу Дульбекко среде Игла, в которую добавляют 10% FCS.
Пример
7
Стерильное сухое вещество для инъекций.
500 мкг Соединения, полученного согласно примеру 1, в качестве активного ингредиента растворяют в 1 мл водного раствора, содержащего 5 мг маннитола и 20% циклодекстринов в качестве солюбилизаторов. Раствор фильтруют через стерильный фильтр и помещают в ассептических условиях в 2 мл ампулы, глубоко замораживают и лиофилизируют. Перед использованием лиофилизат растворяют в 1 мл дистиллированной воды или 1 мл физиологического солевого раствора. Раствор вводят внутривенно или внутримышечно.
Моноклональные
антитела и поликлональная антисыворотка
Поликлональную антисыворотку против Shc продуцируют путем иммунизации кроликов Shc-SH2-доменов, экспрессированным в бактериях. Анти- TAG-сыворотку
продуцируют против PMI-пептида (Pandolli и др. Oncodene 6: 1285-1292 (1991). Моноклональные антитела к фосфотиразину поставляют от фирмы Upstate Biotochnology. Анти-Met-антитела продуцируют против
синтетического пептида, соответствующего 19C- концевым аминокислотам Met-белка человека (Data - Bank reference N X54559).
Иммунопреципитация и вестерн-блотирование. Лизаты получают от клеток А 549, культивированных в бессывороточной среде и обработанных SF/HGF. Клетки подвергают лизису на льду в PY- буфере (20 мМ, Трис- HCl,pH 7,8, 50 мМ NaCl, 50 мМ NaF-, 30 мМ Na4P2O7, 5 мМ EGTA, 1 мм орто-ванадата натрия, 1% (об/об) Тритон X-100), содержащем свежедобавленные ингибиторы протеазы (1 мМ фенилметилсульфонилфторида, 10 мг/мл лейпептина и 5 мг/мл апротинина). Лизаты осветляют путем центрифугирования при 4oC, с использованием BCA-реагента (Pieree) определяют концентрацию белка. Для проведения иммунопреципитации соответствующие антитела адсорбируют на Белке A-Сефарозе (Pharmacia), а затем инкубируют в течение полутора часов (4oC) с клеточными лизатами. Иммунные комплексы три раза промывают охлажденным льдом NET-буфером (50 мМ Трис-HCl, pH 7,5, 150 мМ NaCl, 0,1% P-40, 1 мМ EDTA, pH 8,0, 0,25% желатин), элюируют, а затем денатурируют путем нагрева их в течение 3 минут (при 95o) в восстанавливающем буфере Лэммли, после чего белки разделяют с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (ДСН-ПААГ). Для проведения иммуноблот-анализа специфические иммунопреципитаты или 20-50 мг полных клеточных лизатов переносят (после ЭФ в ПААГ с ДСН) на нитроцеллюлозные фильтры. После блокирования неспецифической реактивности с помощью 2% обезжиренного сухого молока, растворенного в TBST (20 мМ Трис- HCl, pH 7,8, 150 мМ NaCl, 0,02% Твин-20) инкубирование 1 час при 22oC), фильтры зондируют в течение 2 часов при 22oC специфическими антителами, разведенными в TBST. После тщательного промывания, иммунные комплексы детектируют с помощью конъюгированной с пероксидазой хрена видоспецифической вторичной сыворотки (Bio Rad и последующей усиленной реакции хемилюминесценции (ECLтм, Amersham).
Сайт-направленный мутагенез кДНК и экспрессия
Клонирование МЕТ-кДНК описано в литературе
(Ponzetto и др. Oncogene 6: 553-559 (1991) EMBL Data-Bank reference N 54559). 3'-концевой фрагмент, простирающийся от нуклеотида 2355 до 3'- конца, субклонируют в pSELECTтм-1. Сайт
- направленный мутагенез осуществляют in vitro с использованием системы олигонуклеотидов (Altered SitesTM in vitro Mutagenesis System, Promega). Олигонуклеотиды синтезируют с использованием
прибора Applied Biosystem. 391. Мутантные клоны идентифицируют путем секвенирования (набор для T7-секвенирования, Pharmacia). Мутацию Tyr-Phe реконструируют в векторе PMT2, содержащем поздний промотор
аденовируса. Все плазмиды трансфецированы липофектином (GIBCO BRL) в клетках COS 1. Shс-кДНК, несущую мутацию Y317--->F, клонируют в экспрессирующий вектор млекопитающего LXSN.
Мутированную кДНК подвергают мечению чужеродным эпитопом путем гибридизации с сохранением рамки считывания с 162 п.о.-фрагментом PML-кДНК (Pandolfi и др. см. выше). Меченая кДНК кодирует
PML-меченые Shc-белки размером 53 и 58 кДа как результат альтернативной инициации. Подробное описание этой конструкции указывалось ранее (Salcini и др. в работе). Вектор экспрессии
трансфецируют совместно с геном резистентности к неомицину в клетках A549 с использованием фосфата кальция. Стабильные клеточные линии, эспрессирующие меченые Shс-белки, отбирают на G418- содержащей
среде. Исследование in vitro-связывания, проводимое с использованием GST- гибридного белка.
Область Crb2-кДНК, соответствующую его SH2- домену (от нуклеотида 256 до нуклеотида 551) выделяют с помощью полимеразо-цепной реакции (PCR) и клонируют в Bau HI-EcoRI-сайты бактериальной экспрессирующей плазмиды pGEX-2T (GST-Grb2). Культуры бактерий, экспрессирующих GST, GST-Grb2 или GST-Shc (Segatto и др. Oncogene 2105-2112 (1993), культивируют 3-4 часа при 37oC в IB - среде, содержащей 1 мМ IPTG. Бактерии центрифугируют, ресуспендируют в 1/100-объеме охлажденного льдом PY-буфере, не содержащего Тритонтм, и подвергают лизису путем обработки ультразвуком. После добавления Тритона X-100 до 1% лизаты осветляют путем центрифугирования. Рекомбинантные белки очищают на глутатион-сефарозетм (Pharmacia) и непосредственно используют для анализа на связывание. Для каждой реакции, около 5 мкг GST, GST-Crb2 или -GST-Shc связанных с глутатион-сефарозой, 2 часа (4oC) инкубируют с 300 мг соответствующих клеточных лизатов, разведенных в PY-буфере. Белковые комплексы 5 раз промывают в охлажденном льдом PY-буфере, затем элюируют и денатурируют путем нагревания 3 минуты при 95oC в буфере Лэммли, после чего белки разделяют на ДСН-ПААГ и анализируют с помощью иммуноблотирования.
Сверхэкспрессия Shc-белков
Плазмиду LSHCSN конструируют путем клонирования Shc - кодирующей последовательности (Pelicci и др. Cell 70: 93-104 (1992) в рестрикционный EcoRI-сайт ретровирусной
плазмиды LYSN (Miller и др. (1989) подаренная D.Miller). Плазмиды LXCN или LSHCSN трансфицируют в Y2 клеточных линий, несущих ретровирус РA317, с помощью осаждения фосфатом кальция (Sambrook и др.
Molecular Gloming: A. Laboratory Manual 2-ое изд., Cold Spring Harbor Laboratory, Cold Spring Harbor NV (1989). Через 48 часов супернатанты Y-2 используют для инфицирования РA317. Затем клетки
отбирают с использованием-C18- содержащей среды в условиях ограничения разведения. На основании высоких уровней экспрессии экзогенного Shc и вирусного титра отбирают один вирус - продуцирующий клон,
который используют для инфицирования клеток-мишеней.
BIAcore-анализ
Основные принципы работы, а также методологии проведения кинетических измерений взаимодействия SH2- домена
с использованием прибора BIAcore (Dharmacia) подробно описаны в литературе (Panayotou и др. Mol. Cell.Biol. 13: 3567-3576 (1993), Ponzetto и др. Mol. Cell. Biol. 13: 4600-4608 (1993).
Очищенные GST-SH2- домены или интактные белки обессоливают в проточном буфере BIAcore (20 мМ Hepes, pH 7,4, 150 мМ NaCl, 3,4 EDTA, 0,005% Твин 20 и 4 мМ DTT) и наносят на авидин-иммобилизованные биотинилированные фосфопептиды. Количество иммобилизованных фосфопептидов нормализуют путем оценки связывания с антителами против фосфотиразина. Оценку связывания проводят с различными концентрациями белка и связанный материал диссоциируют либо в проточном буфере, либо после введения 20 мкМ конкурирующего небиотинилированного фосфопептида. Концентрацию пептидов и белков вычисляют с помощью аминокислотного анализа на анализаторе Applied Biosystem.
Анализ на рост и подвижность клеток
2,5•103 клеток засевают в 96-луночные планшеты (Costar) с
DMEM-средой, содержащей 10% FCS (Flow). Через 24 часа среду удаляют и заменяют DMEM-средой, содержащей 5% FCS с широким диапазоном концентрацией SF/HGF (1-10 нг/мл). После окрашивания кристаллическим
фиолетовым, с помощью колориметрического анализа определяют число клеток (Kueng и др. Anal. Biochem 182: 16-19 (1989), при этом, лунки считывают при 595 нм с использованием планшет-ридера (Model 3550,
Bio-Rad) Используемые для исследований хематоксиса камеры Бойдена и поликарбонатные фильтры, не содержащие поливинилпирролидона (поры 13 мм 8 мкм), поставляются от Nuclepore. Анализ хематоксиса
осуществляют известным способом (Albim и др. Cancer Research 47: 3239-3245 (1987) Клетки метят 5[125I] иодо- 2'-дезоксиуридином (3 мкКи/мл в среде RPMI 1640+10% FGS). После 16-20 часового
инкубирования клетки трипсинизируют и три раза промывают средой, не содержащей FCS. Затем 3•105 клеток, ресуспендированных в бессывороточной среде, засевают в верхнюю часть камеры
Бойдена, а в нижнюю камеру добавляют бессывороточную среду, содержащую или не содержащую SF/HGF (5-40 ед/мл). Камеры Бойдена инкубируют 6 часов при 37oC в 5% CO2-водонасыщенной
атмосфере. Клетки, прикрепленные к верхней стороне фильтров, после инкубирования механически удаляют, а фильтры с клетками, мигрировавшими на их нижнюю сторону, фиксируют и подсчитывают в
гамма-счетчике.
Результаты
Shc-белки, связываются с тирозин-фосфорилированным SF/HGF рецептором посредством SH2-домена
Клетки карциномы легких A549 экспрессируют
функциональные рецепторы SF/HGF и три изоформы Shc, составляющие 46, 52 и 66 кДа. Для того чтобы проверить образуют ли тирозин-фосфорилированный SF/HGF-рецептор и Shc стабильный комплекс in vivo
лизаты от SF/HGF-обработанных клеток подвергают иммунопреципитации с анти-Met и иммуноблотированными анти-Shc-антителами. Shc-белки совместно осаждают с SF/HGF-рецептором (фиг. 1A). Аналогичные
результаты получают в обратных экспериментах, где анти Shc иммунопреципитаты из лизатов SF/HGF-обработанных клеток A549 зондируют с использованием антител против рецептора (анти-Met) Shc-белки
осаждают совместно с SF/HGF-рецептором (фиг. 1B). Полученные результаты показывают, что SF/HGF-рецептор и Shc-белок связываются в SF/HGF-стимулированных клетках.
Кроме того, чтобы убедиться в том, что связывание между SF/HGF-рецептором и Shc-белками строго зависит от тирозин-фосфорилирования рецептора, проводят аналогичные эксперименты с использованием COS-1-клеточных лизатов, кратковременно экспрессирующих кДНК либо SF/HGF-рецептора дикого типа, либо киназо-дефектного мутантного рецептора (Lys1110--->A). Как было установлено ренее (Longati и др. в печати), рецептор дикого типа, сверхэкспрессия которого обеспечивается COS-I/-клетками, конструктивно фосфорилируется in vivo, тогда как киназо-инактивированный Lys111--->A-мутант не обладает такой способностью (фиг. 2A и 2B). Стабильные комплексы между трансфецированным рецептором и эндогенным Shc образуются лишь в клетках COS-I, экспрессирующих тирозин-фосфорилированные рецепторы дикого типа (фиг. 2C). Взаимодействие Shc-SF/HGF-рецептор "также исследуют посредством реконструирования комплекса in vitro с использованием Shc-SH2-домена, экспрессированного в бактерии как GST-гибридный белок. Иммобилизованный Shc-SH2-домен обнаруживает стабильное связывание с тирозин-фосфорилированным рецептором, солюбилизированным из SF/HGF-обработанных клеток A549, тогда как с нефосфорилированным рецептором, солюбилизированным из контрольных клеток, такого связывания не наблюдается (фиг. 3A). Анализ на связывание с контрольным GST-белком дает отрицательный результат. Полученные результаты показывают, что присутствие SH2-домена Shc-белка является достаточным условием для связывания с аутофосфорилированным SF/HGF-рецептором in vitro.
Shc-белки
связываются с фосфотиразинами Y1349 и Y1356 концевой части SF/HGF-рецептора
Путем фосфопептидного картирования рецептора дикого типа и мутантного SF/HGF-рецептора
показывают, что два остатка, расположенные в C-концевой части рецептора Y1349 и Y1356, фосфорилируют в ответ на связывание с лигандом (Ponzetto и др. 1993, см. выше), Возможное
участие этих сайтов как посредников взаимодействия с Shc изучалось в экспериментах на связывание с мутантными рецепторами, в которых один или несколько тирозинов заменены на фенилаланин Y1349--->F, Y1356--->F, или Y1349,1356--->F). Как указывалось ранее, рецепторные молекулы, несущие отдельные или комбинированные мутации в этих сайтах,
обладают нативной тирозинкиназной активностью (Ponzetto и др. 1993, см. выше) Клетки COS-I трансфецируют конструкциями, экспрессирующими мутантные рецепторы, а затем подвергают иммунопреципитации с
использованием анти-Shc-антител. Иммунопреципитаты блотируют с помощью анти-Met-антител. Способность рецепторов с одной мутацией Y1349--->F или Y1356--->F
связываться с эндогенным Shc является лишь немного ниже, чем способность рецепторов дикого типа или контрольного рецептора, несущего "неправильную" ( Y1003--->F) мутацию. В
противоположность этому двойной мутант (Y1349-1356--->F) полностью утрачивает свою способность связываться с Shc-белками (фиг. 4).
Прямое взаимодействие между SH2-доменом Shc-белка и фосфотирозином Y1349 или Y1356 подтверждают с помощью биосенсорного анализа в реальном масштабе времени (Panagoton и др. см. выше, Felder и др. Mol. Cell, Biol. 13: 1449-1455 (1993). Синтетический фосфопептид VNATY1356 VNUK, происходящий от концевой последовательности рецептора, специфически связан посредством аффинно-очищенного GST-SH2 домена белка Shc (фиг. 5). Аналогичные результаты получают для пептида IGEHY1349VHVN. В обоих случаях константа связывания по сродству, вычисленная исходя из отношения константы скорости диссоциации (Кдис) и скорости ассоциации (Касс), была слишком высокой для точного определения.
Полученные данные показывают, что Shc связывается с низкой аффинностью либо с тирозином 1349, либо с тирозином 1356 концевой части SF/HGF-рецептора.
Сверхэкспрессии Shc-белков усиливает мотогенный ответ на SF/HGF.
SF/HGF является мотогенным для эпителиальных клеток, которые после стимуляции мигрируют через фильтры камер Бойдена с полунепроницаемой перегородкой (Giorolano и др. Proc. Natl. Acad. Sci. USA 90: 649-653 (1993). Влияние Shc на мотогенный ответ исследуют с помощью сверхэкспрессии белка в A549-клетках. Клетки инфицируют амфотропным ретровирусом, несущим Shc-кДНК, и несколько различных инфицированных суммарных популяций клеток отбирают на высокие уровни экспрессии Shc посредством вестерн-блот-анализа с использованием анти-Shc-антител.
Мотогенный ответ клеток A549, обеспечивающих сверхэкспрессию Shc-белков, значительно выше, чем ответ, полученный для контрольных неинфицированных клеток или клеток, инфицированных лишь одним вектором (фиг. 6, нижняя панель). Более высокий уровень ответов клеток, обеспечивающих сверхэкспрессию Shc, на SF/HGF наблюдается для всех испытуемых концентраций лигандов (фиг. 6, верхняя панель).
Митогенный ответ измеряют либо
путем подсчета клеток, либо путем включения тимидина. Сверхэкспрессия Shc в клетках A549 не влияет на рост клеток в ответ на стимулирование SF/HGF или сывороткой. Аналогично, при сверхэкспрессии
экзогенного Shc не наблюдается значительного влияния SF/HGF-индуцированной гуанин-нуклеотид-обменной активности на RaS, измеренной как описано Graziani и др. (J. Biol. Chem. 268: 9165-9168 (1993)
Shc-белки фосфорилируются на Y317 после связывания с SF/HGF рецептором.
Для того чтобы определить фосфорилируется ли Shc-белок в ответ на активацию киназы для SF/HGF рецептора, клетки A549 стимулируют рекомбинантным SF/HGF, лизируют, подвергают иммунопреципитации с использованием анти-Shc-антител, а затем подвергают иммуноблотингу с помощью антител против фосфотиразина. Через 5 минут после стимуляции клеток A549 (фиг. 1C) наблюдают заметное увеличение тирозин-фосфорилирования p 46Shc, p 52Shc и p 66Shc, что свидетельствует о том, что Shc является субстатом для SF/HGF-рецептора. Аналогичные эксперименты осуществляют с использованием клеток COS-I, трансфецированных SF/HGF-рецептором. В клетках, обеспечивающих сверхэкспрессию киназы рецептора дикого типа (конститутивно активного), эндогенные Shc-белки были тирозинфосфорилированы. Однако Shc не фосфорилируют в клетках COS-I, трансфецированных киназонегативным Lys1110--->A-рецептором (фиг. 2D).
Путем фосфопептидного картирования и анализа с помощью мутаций показывают, что в EGF-обработанных клетках главным сайтом фосфорилирования Shc-белка, является Y317 (Salcini и др. в работе). Для того чтобы установить фосфорилируется ли этот же самый остаток также после SF/HGF-обработки, меченую Shc-кДНК с мутацией Y317--->F экспрессируют в клетках 4549. В этих клетках после F/HGF-обработки мутант Y317--->F, селективно иммуноосажденный с помощью антител против "метки", нефосфорилируют на тирозине (фиг. 1D).
Shc-белки, фосфорилированные на Y317, образуют специфические комплексы с /"адаптором Grb2"
С помощью
Вестерн-блот-анализа анти-Shc-иммунопреципитатов с использованием антител против Grb2 исследуют возможность того, что SF/HGF стимулирует образование Shc-Grb2-комплекса в клетках A549. Как показано на
фиг. IE, - Shc белок, фосфорилированный в ответ на SF/HGF, связывается с Grb2. Это связывание опосредуется SH2-доменом Grb2, что показано с помощью in vitro-экспериментов, в которых используют
иммобилизованный SH2-домен Grb2 Shc-белка (экспрессированного в бактериях как GST-гибридный белок) и цитоплазматические лизаты, полученные от контрольных или SF/HGF-стимулированных клеток A549. После
SF/HGF-стимуляции наблюдают заметное увеличение количества Shc-белка, связанного с гибридным белком Grb2 (фиг. 3B).
Кинетические параметры и константы равновесия диссоциации указанного взаимодействия получают с использованием биосенсора для измерения в реальном масштабе времени связывания GST-SH2-гибридного белка Grb2 с иммобилизованным тирозин-фосфорилированным Shc-пептидом DDPSY317•VNVQ (фиг. 7). Полученные данные используют для вычисления Касс (2,6•105 M-1 c-1), как показано на фиг. 7C. Константу Кдис измеряют в буфере и в присутствии конкурирующего фосфопептида для предупреждения повторного связывания. Как показано на фиг. 7B, добавление конкурирующего фосфопептида оказывает решающее действие на скорость диссоциации, как уже ранее наблюдается для других взаимодействий SH2-домена и фосфопептида (Panayotou и др. 1993 (см. выше) Felder и др. 1993 (см. выше).
Полученное значение Кдис составляет 0,04 с-1 и в соответствии с этим общая аффинность составляет 153 нМ.
Эти данные показывают, что фосфорилирование Shc-белков на тирозине Y317 в ответ на SF/HGF-стимуляцию является важным фактором для образования сайта связывания с высокой степенью аффинности для "адаптора" Grb2. Таким образом, фосфорилированные Shc-белки могут действовать как молекулы, образующие мостиковую связь между активированным SF/HGF-рецептором и Grb2. Интересно отметить, что аминокислотная последовательность сайта-Shc-связывания для Grb2 (Grb2 Y317VNV) идентична последовательности, расположенной в концевой части SF/HGF рецептора (фиг. 8) (Y1356VNV), которая непосредственно связывается с Grb2 после стимуляции лигандом (Ponzetto и др. в работе).
Shc-белки не образуют конкатамеров
Shc-последовательность Y317VNV идентична
последовательности одного из двух сайтов Shc-связывания, присутствующих в SF/HGF рецепторе (фиг. 8). Эти наблюдения дают основание предположить, что Shc могут образовывать конкатамеры при связывании
фосфотирозина Y317 другой Shc-молекулы. Для сравнения связывания Shc-SH2-домена с фосфопептидом DDPS Y317VNVQ присутствующим на Shc-молекуле, и с фосфопептидом VNAT Y1356VNVK, присутствующим, на SF/HGF-рецепторе, используют биосенсор. Shc-SH2 связывается с Shc-фосфопептидом гораздо слабее, чем с SF/HGF рецепторным фосфопептидом (фиг. 5). Эти данные
свидетельствуют о том, что аминокислоты в N-конце Y317(в Shc) и Y1356(в SF/HGF-рецепторе) распознаются Shc SW2 доменом. Таким образом, Shc-Shc-связывание не имеет место in vivo и
фосфотирозиновый остаток Shc Y317, вместо образования конкатамеров, опосредует связывание с другими молекулами.
Таким образом, пептид, имеющий длину, например, 4-20 аминокислот, охватывающих сайт связывания Shc Y317VNV), а именно пептид H-Asp-Asp-Pro-Ser-Tyr*-Val-Asn-Val-Gln-OH, (DDP Y*VNVQ) и пептид, имеющий длину, например, 4-20 аминокислот, охватывающих элемент распознавания Tyr1356 рецептора фактора роста гепатоцитов (Y1356VNN), а именно пептид H-Val-Asn-Ala-Thr-Tyr*-Val-Asn-Val-Iys-OH (VNATY*VNVK), где Tyr* (Y*) представляет собой фосфорилированный или нефосфорилированный тирозиновый остаток, обладают способностью связываться с Grb2-SH2-доменом.
Таким образом, эти пептиды могут быть использованы в качестве конкурентов при связывании, а значит и для предупреждения связывания SH2-домена Grb2-белка, с тирозин-фосфорилированными рецепторами, такими как активированный рецептор фактора роста гепатоцитов (HGF/SF-рецептор), PDGF-рецептор, EGF-рецептор, либо с другими цитозольными тирозин-фосфорилированными трансдукторами, такими как белок Shc или IRS-I, в результате чего может быть предотвращен митогенез, а значит и пролиферация опухолевых клеток.
С другой стороны, пептиды, охватывающие Tyr1356 или Tyr1349-элемент распознавания рецептора фактора роста гепатоцитов (Y1356VNV или Y1349VHV, соответственно), а именно, вышеупомянутый пептид H-Val-Asn-Thr-Tyr* -Val-Asn-Val-Lys-OH, (VNATY*VNVK) и пептид H-Ile-Gly-GLu-His-Tyr*-Val-His-Val-Asn-OH) (IGENY*VHVN), либо пептид, содержащий оба вышеупомянутых тирозиновых остатка, такой, как H-IIe-Gly-GIu-His-Tyr*-Val-His-Val-Asn-Ala-Thr-Tyr*-Val- Asn-Val-Lys-OH (IGENY*VHVNATY*VNVK), где Tyr* (Y*) представляет собой фосфорилированный или нефосфорилированный тирозиновый остаток, обладают способностью связываться с Shc-SH2-доменом. Таким образом, эти пептиды могут быть использованы в качестве конкурентов при связывании, а значит и для предупреждения связывания SH2-домена Shc-белка, с тирозин-фосфорилированными рецепторами, такими как активированный рецептор фактора роста гепатоцитов, EGF-рецепторов, либо с другими цитозольными тирозин-фосфорилированными трансдукторами, такими как IRS-I или цитозольные тирозин-киназы, например, в результате чего может быть предотвращен митогенез, особенно мотогенез, а значит может быть предотвращено распространение опухолевых клеток. Отсюда следует, что указанные пептиды обладают антиопухолевым и антиметастатическим действием.
Пептид настоящего изобретения может быть с успехом введен в нефосфорилированной форме в качестве пролекарства. В этом случае указанный пептид может биохимически трансформироваться в свою фосфорилированную форму внутри клетки, где он будет осуществлять свое фармакологическое действие.
Реферат
Изобретение относится к области биологии клеток, в частности к новым пептидам, обладающим способностью взаимодействовать с внутриклеточным трансдуктором сигнала, препятствуя тем самым процессу передачи сигнала, приводящему к пролиферации и подвижности клеток. Описывается новый пептид, имеющий последовательность части внутриклеточной области рецептора фактора роста гепатоцидов человека общей формулы Xn - YVN (или Н) V - Xc, где Xn и Xc каждый является последовательностью 0 - 16 аминокислот. Пептиды могут быть использованы для лечения опухолевых заболеваний. Описываются способ их получения, фармацевтическая композиция и способ ее получения. 4 с. и 13 з.п. ф-лы, 16 ил.
Формула
Xn-YVN (или H) V - Xc, (1),
где Xn и Xc каждый является последовательностью 0 - 16 аминокислот,
и обладающий способностью связываться с цитозольным трансдуктором сигнала.
30.06.93 по пп.1, 2 и 5 - 17.

Комментарии