Способы лечения заболеваний, ассоциированных с s. aureus - RU2661406C2
Код документа: RU2661406C2
Чертежи




































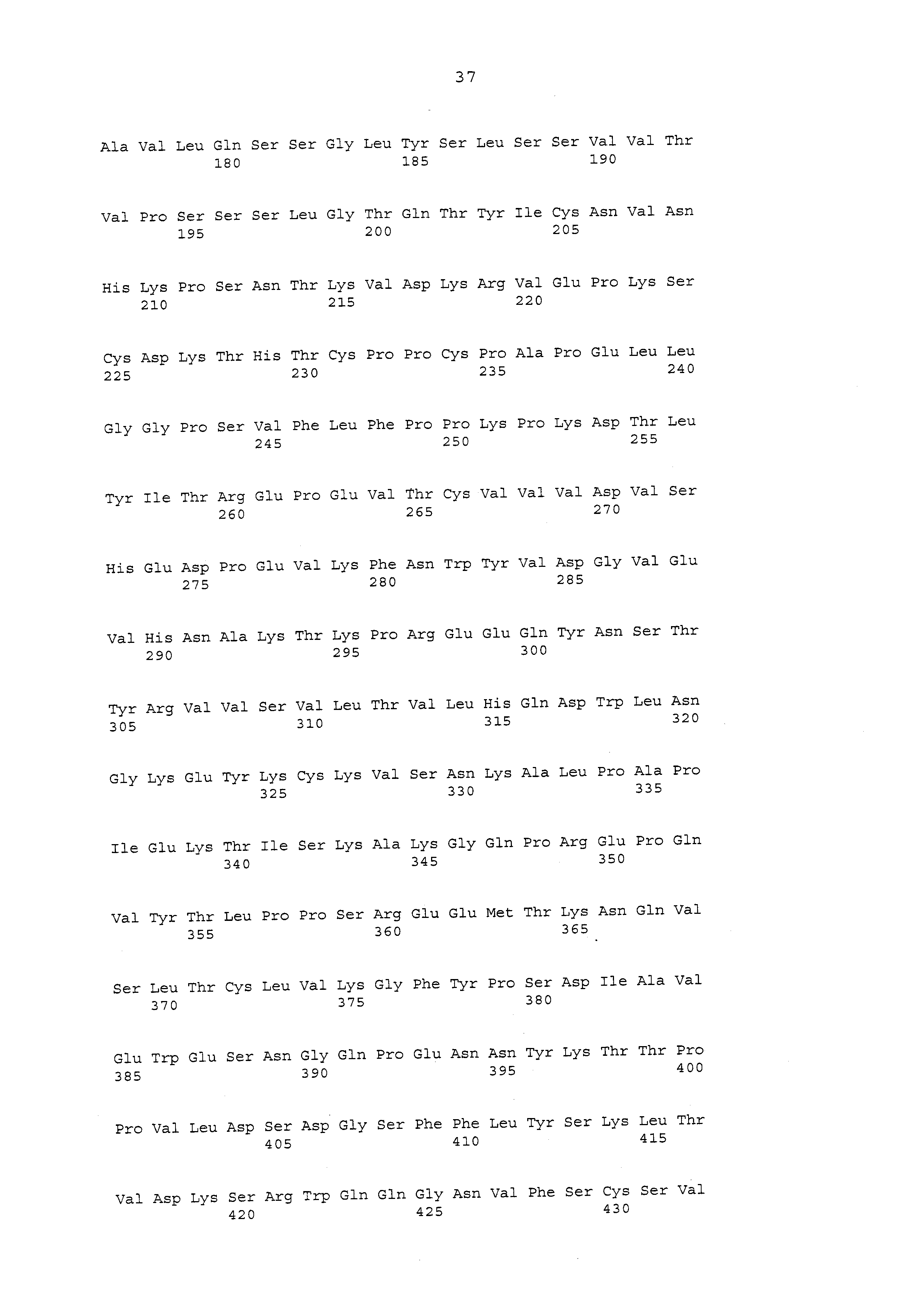








Описание
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении представлены способы предупреждения и/или лечения бактериемии и сепсиса, ассоциированных с S. aureus, и способы предупреждения и/или лечения пневмонии, ассоциированной с S. aureus, у пациентов с ослабленным иммунитетом с помощью антител к альфа-токсину S. aureus (антител к АТ).
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Staphylococcus aureus (S. aureus) является главной причиной смертности и заболеваемости во всем мире, вызывая ряд разнообразных инфекций, начиная от легких инфекций кожи и мягких тканей и заканчивая тяжелыми инвазивными заболеваниями, такими как эндокардит, остеомиелит и некротическая пневмония (Lowy FD, N Engl J Med, 339(8): 520-32 (1998); Klevens et al., JAMA 298(15): 1763-71 (2007). S. aureus обычно классифицируют как метициллинрезистентные (MRSA) либо метициллинчувствительные (MSSA). В нескольких сообщениях было показано, что инфекции, вызываемые S. aureus, приводят в результате к серьезным последствиям вне зависимости от состояния резистентности (Fowler et al., Arch Intern Med. 163(17):2066-72 (2003); de Kraker et al., PLoS Med. Oct; 8(10):e1001104 (2011).
Применение антибиотиков является стандартом лечения для лечения заболевания, вызываемого S. aureus. Несмотря на внедрение новых антибиотиков против S. aureus, появление новых механизмов резистентности требует новых подходов для предупреждения или лечения заболеваний, вызываемых S. aureus. До эры антибиотиков в клинической практике применяли пассивное введение иммунных сывороток инфицированным пациентам для лечения бактериальных инфекций (Keller and Stiehm, Clin Microbiol Rev 13(4):602-14 (2000)). В настоящее время аналогичные способы применяют для лечения некоторых бактериальных заболеваний, опосредованных токсинами (например, ботулизма, дифтерии, столбняка) (Keller and Stiehm, Clin Microbiol Rev 13(4):602-14 (2000); Arnon et al., N. Engl. J. Med. 354: 462-471 (2006). Альфа-токсин (AT) S. aureus является ключевой детерминантой вирулентности (среди многих других внеклеточных факторов), как было показано в нескольких моделях заболеваний, вызываемых S. aureus (например, дермонекроза, пневмонии, сепсиса, эндокардита и мастита) при сравнении штаммов S. aureus с дефицитом экспрессии AT с изогенными родительскими штаммами дикого типа (Bramley et al., Infect Immun. 57(8):2489-94 (1989); Bayer et al., Infect. Immun. 65: 4652-4660 (1997); Kernodle et al., Infect. Immun. 65: 179-184 (1997); Bubeck Wardenburg et al., Infect Immun. 75(2):1040-4 (2007); Bubeck Wardenburg et al., J Exp Med. 205(2):287-94 (2008); Kobayashi et al., J Infect Dis. 204(6):937-41 (2011)).
AT представляет собой цитолитический порообразующий токсин размером 33 кДа, вырабатываемый 90% штаммов S. aureus и, как считается, является основным фактором вирулентности. Он секретируется как мономер и связывается со специфичным рецептором ADAM-10 на мембранах клеток-мишеней (Wilke and Bubeck Wardenburg, PNAS 107(30):13473-8 (2010); Inoshima et al., Nat Med 17(10):1310-4 (2011). AT олигомеризуется в гептамерную препору и претерпевает конформационное изменение, которое приводит в результате к образованию трансмембранного β-цилиндра и последующему лизису клетки (Bhakdi and Tranum-Jensen, 1991; Song et al., 1996). Тромбоциты, а также эпителиальные, эндотелиальные и иммунные клетки (например, лимфоциты и макрофаги) подвержены AT-лизису, что позволяет предположить, что повреждение ткани и ускользание от иммунологического надзора обусловлены непосредственным влиянием токсина (Bhakdi and Tranum-Jensen, Microbiol Rev. 55(4):733-51 (1991); Ragle and Bubeck Wardenburg, Infect Immun. 77(7):2712-8 (2009); Tkaczyk et al., Clin Vaccine Immunol 19(3):377-85 (2012)). В сублитических концентрациях AT, как также было показано, оказывает значительные цитотоксические эффекты (Grimminger et al., J Immunol. 159(4):1909-16 (1997); Wilke and Bubeck Wardenburg, PNAS 107(30):13473-8 (2010); Inoshima et al., Nat Med 17(10):1310-4 (2011)). Связывание и олигомеризация AT на мембранах макрофагов активирует инфламмасому NLRP3, которая наряду с другими стафилококковыми патогенассоциированными молекулярными паттернами (PAMP) индуцирует секрецию IL-1β и вызывает гибель клетки (Craven et al., PLoS One 4(10) (2009); Kebaier et al., J Infect Dis 205(5):807-17 (2012). Повышенная экспрессия провоспалительных цитокинов (например, IL-1β) является отличительным признаком острого повреждения легких (Goodman et al., Cytokine Growth Factor Rev. 14(6):523-35 (2003)).
В сублитических концентрациях AT также активирует ADAM-10-опосредованный протеолиз E-кадгерина, присутствующего в адгезионных межклеточных контактах, что приводит к нарушению целостности эпителия и способствует повреждению эпителия, которое наблюдается при пневмонии и инфекциях кожи и мягких тканей (Inoshima et al., Nat Med 17(10):1310-4 (2011); Maretzky et al., PNAS 102(26):9182-7 (2005); Inoshima et al., J Invest Dermatol. 132(5):1513-6 (2012). AT оказывает свои цитотоксические эффекты посредством прямой и опосредованной активности с созданием благоприятных условий для бактериального роста и инвазивного заболевания. Вследствие этого целенаправленное ингибирование AT может предупреждать или ограничивать развитие заболевания, ассоциированного с S. aureus. Эту гипотезу подтверждают другие исследования, в которых продемонстрировано уменьшение тяжести заболевания, вызываемого S. aureus, в мышиных моделях инфекции после активной или пассивной иммунизации, направленной против AT (Menzies and Kernodle, Infect Immun 64(5):1839-41(1996); Bubeck Wardenburg et al., J Exp Med. 205(2):287-94 (2008); Ragle and Bubeck Wardenburg, Infect Immun. 77(7):2712-8 (2009); Kennedy et al., J Infect Dis. 202(7):1050-8 (2010); Tkaczyk et al., Clin Vaccine Immunol 19(3):377-85 (2012)).
Антитело к АТ, содержащее вариант Fc-участка, и его исходное антитело LC10 представляют собой человеческие высокоаффинные mAb к АТ (ранее раскрытые в предварительной заявке на патент США № 61/440581 и в международной заявке № PCT/US 2012/024201 (опубликованной под номером WO 2012/109205), содержание каждой из которых включено в данный документ посредством ссылки, и в Tkaczyk et al., Clinical and Vaccine Immunology, 19(3): 377 (2012).
Бактериемия и септический шок составляют большую часть инвазивных заболеваний, вызываемых Staphylococcus aureus (Klevens, et al., JAMA, 298(15): 1763-71 (2007). Предполагается, что AT является важным фактором вирулентности при сепсисе, вызываемом S. aureus, и обуславливает повреждение эндотелия при сепсисе (Powers, et al., J. Infect Dis. 206(3):352-6 (2012). Взаимодействие AT с его рецептором на эндотелиальных клетках делает возможным опосредование токсином повреждения сосудов путем прямого лизиса клеток или активации ADAM-10-опосредованного протеолиза плотных соединений эндотелиальных клеток (там же). Оба механизма будут повышать проницаемость сосудов, что является отличительным признаком бактериального сепсиса.
Хотя пассивная иммунизация моноклональными антителами к АТ, как было показано, приводит в результате к значительному повышению выживаемости в мышиной модели стафилококковой пневмонии, как описано в предварительной заявке на патент США № 61/440581 и в международной заявке № PCT/US 2012/024201, неизвестно, являются ли антитела к АТ эффективными для повышения выживаемости у млекопитающих с ослабленным иммунитетом, имеющих заболевания, ассоциированные с S. aureus. Уяснение данного вопроса является весьма важным, так как у индивидов с ослабленным иммунитетом, в частности у индивидов, страдающих нейтропенией, имеется повышенный риск инфекций, вызываемых S. aureus (Andrews and Sullivan, Clin Microbiol Rev. 16(4):597-621 (2003); Bouma et al., Br J Haematol. 151(4):312-26 (2010)).
В настоящем изобретении впервые представлена демонстрация того, что антитела к АТ являются эффективными в профилактике сепсиса и пневмонии у индивидов с ослабленным иммунитетом.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном документе представлены способы предупреждения или уменьшения тяжести сепсиса, ассоциированного с S. aureus, у субъекта-млекопитающего, включающие введение субъекту эффективного количества выделенного антитела к альфа-токсину S. aureus (антитела к АТ) или его антигенсвязывающего фрагмента. Также представлены способы уменьшения бактериальной нагрузки S. aureus в кровотоке или сердце субъекта-млекопитающего, включающие введение субъекту эффективного количества выделенного антитела к альфа-токсину S. aureus (антитела к АТ) или его антигенсвязывающего фрагмента. Также представлены способы уменьшения агглютинации бактерий S. aureus и/или формирования очагов тромбоэмболического поражения у субъекта-млекопитающего, включающие введение субъекту эффективного количества выделенного антитела к альфа-токсину S. aureus (антитела к АТ) или его антигенсвязывающего фрагмента. Также представлены способы предупреждения или уменьшения тяжести пневмонии, ассоциированной с S. aureus, у субъекта-млекопитающего с ослабленным иммунитетом, включающие введение субъекту эффективного количества выделенного антитела к альфа-токсину S. aureus (антитела к АТ) или его антигенсвязывающего фрагмента.
В различных способах, описанных в данном документе, бактериальная нагрузка S. aureus в кровотоке или сердце субъекта надлежащим образом уменьшается, а в дополнительных вариантах осуществления у субъекта уменьшаются агглютинация бактерий S. aureus и/или формирование очагов тромбоэмболического поражения.
В подходящем случае субъектом-млекопитающим в различных способах, описанных в данном документе, является человек.
В различных способах выделенное антитело к АТ или его антигенсвязывающий фрагмент выбраны из группы, состоящей из Fv, Fab, Fab' и F(ab')2. В других вариантах осуществления антитело является антителом полной длины. В еще нескольких дополнительных вариантах осуществления антитело содержит вариант Fc-участка.
В вариантах осуществления различных способов, описанных в данном документе, выделенное антитело или его антигенсвязывающий фрагмент иммуноспецифически связываются с полипептидным альфа-токсином Staphylococcus aureus и содержат
(a) CDR1 VH, содержащий аминокислотную последовательность SEQ ID NO: 7, 10, 13 или 69;
(b) CDR2 VH, содержащий аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75;
(c) CDR3 VH, содержащий аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78;
(d) CDR1 VL, содержащий аминокислотную последовательность SEQ ID NO: 1 или 4;
(e) CDR2 VL, содержащий аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и
(f) CDR3 VL, содержащий аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74.
В вариантах осуществления CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL для применения в различных способах, описанных в данном документе, соответствуют аминокислотным последовательностям SEQ ID NO: 7, 8, 9, 1, 2 и 3; SEQ ID NO: 10, 11, 12, 1, 2 и 3; SEQ ID NO: 13, 14, 15, 4, 5 и 6; SEQ ID NO: 7, 17, 18, 1, 2 и 3; SEQ ID NO: 7, 8, 16, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1, 2 и 64; SEQ ID NO: 7, 8, 66, 1, 2 и 64; SEQ ID NO: 7, 8, 67, 1, 2 и 68; SEQ ID NO: 7, 8, 67, 1, 2 и 64; SEQ ID NO: 7, 8, 78, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1, 2 и 68; SEQ ID NO: 69, 70, 71, 1, 2 и 68; SEQ ID NO: 7, 8, 72, 1, 73 и 74; SEQ ID NO: 69, 75, 71, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 77 и 74; SEQ ID NO: 69, 70, 71, 1, 77 и 74.
В дополнительных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный аминокислотной последовательности SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62, и (iii) содержит вариабельный домен легкой цепи, по меньшей мере на 90% идентичный аминокислотной последовательности SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63. В подходящем случае выделенное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен тяжелой цепи с SEQ ID NO 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62 и вариабельный домен легкой цепи с SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
В дополнительных вариантах осуществления различных способов, описанных в данном документе, VH и VL соответствуют аминокислотным последовательностям SEQ ID NO: 20 и 19; SEQ ID NO: 22 и 21; SEQ ID NO: 24 и 23; SEQ ID NO: 26 и 25; SEQ ID NO: 28 и 27; SEQ ID NO: 41 и 42; SEQ ID NO: 43 и 44; SEQ ID NO: 45 и 46; SEQ ID NO: 47 и 48; SEQ ID NO: 47 и 48; SEQ ID NO: 49 и 50; SEQ ID NO: 51 и 52; SEQ ID NO: 51 и 52; SEQ ID NO: 53 и 54; SEQ ID NO: 55 и 56; SEQ ID NO: 57 и 58; SEQ ID NO: 59 и 60; SEQ ID NO: 61 и 58; SEQ ID NO: 62 и 58; SEQ ID NO: 62 и 63; SEQ ID NO: 79 и 63.
В еще нескольких дополнительных вариантах осуществления различных способов выделенное антитело или его антигенсвязывающий фрагмент включают в себя антитело к АТ, содержащее вариант Fc-домена, где антитело включает в себя VH-IgG1-YTE, соответствующий SEQ ID NO: 80, и/или VL-каппа, соответствующий SEQ ID NO: 81.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1. Профилактика с помощью LC10 улучшает выживаемость в модели IV-заражения смертельной дозой. Мышей (по 10 в каждой группе) подвергали пассивной иммунизации с помощью LC10 (45 и 15 мг/кг) или изотипического контроля (R347, 45 мг/кг) за 24 часа до IV контрольного заражения с помощью SF8300 (3×108 CFU). Выживаемость отслеживали в течение 14 дней. Данные являются репрезентативными для 4 независимых экспериментов. Статистическую значимость оценивали с помощью логарифмического рангового критерия (Мантеля-Кокса): *p-значение = 0,0005; **p-значение = 0,0043).
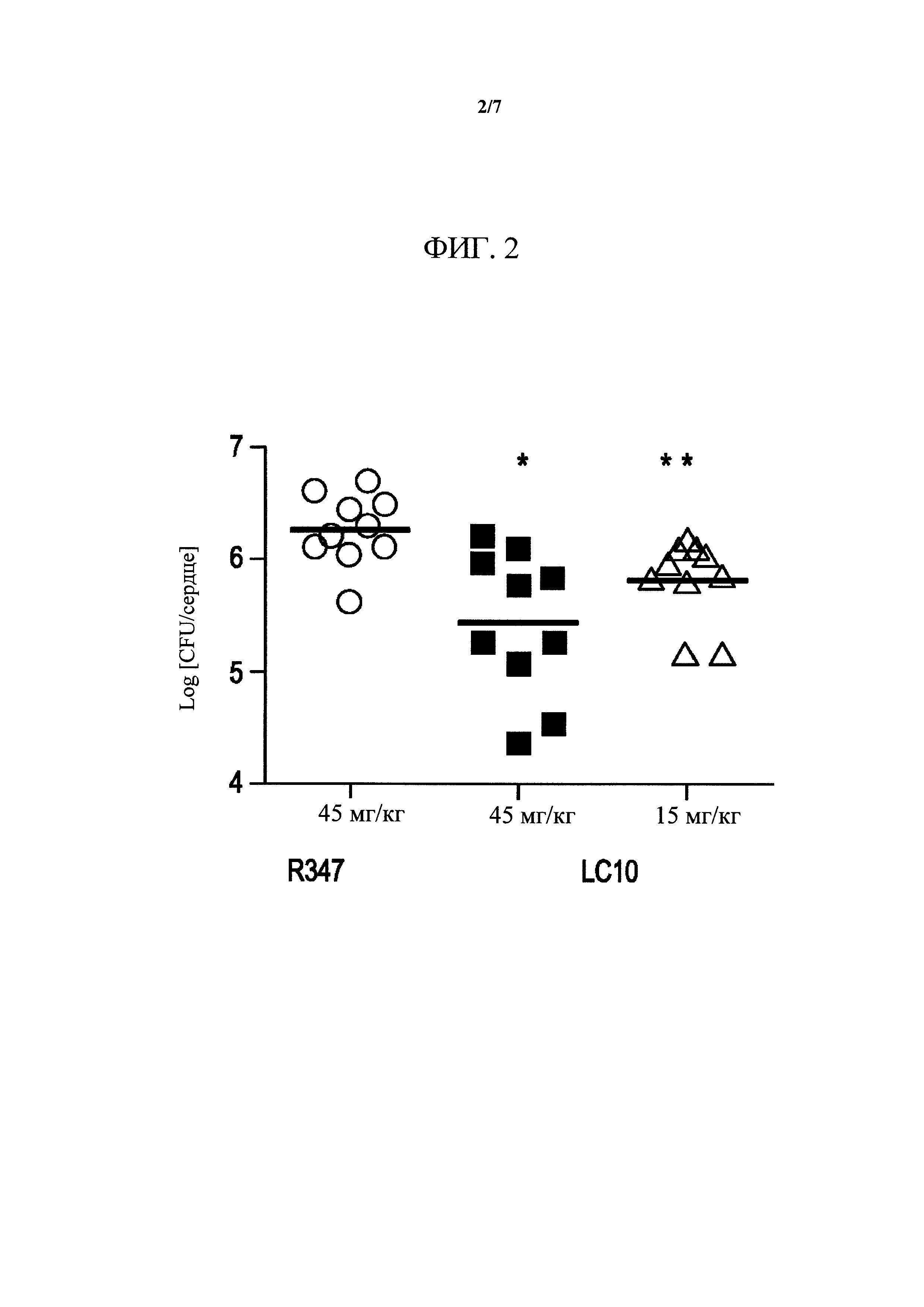
Фигура 2. Профилактика с помощью LC10 уменьшает бактериальную нагрузку в сердце. Мышей подвергали пассивной иммунизации с помощью LC10 (45 и 15 мг/кг) или изотипического контроля (R347, 45 мг/кг) за 24 часа до IV контрольного заражения с помощью SF8300 (2,98e8 CFU). Через четырнадцать часов после инфицирования сердца инфицированных животных собирали и обрабатывали для подсчета CFU. Статистический анализ проводили с применением непарного двустороннего t-критерия Стьюдента: *p-значение = 0,0028; **p-значение = 0,0082).
Фигура 3. Профилактика с помощью LC10 уменьшает интенсивность стафилококковой бактериемии. Мышей подвергали пассивной иммунизации с помощью LC10 (45 и 15 мг/кг) или изотипического контроля (R347, 45 мг/кг) за 24 часа до IV контрольного заражения с помощью SF8300 (3×108 CFU). В разные моменты времени после инфицирования кровь собирали посредством пункции сердца и высевали на чашки для подсчета CFU. Статистический анализ проводили при помощи t-критерия Стьюдента. Данные считались статистически отличными от таковых для R347, если *p-значение <0,05.
Фигура 4. Подсчет общего числа лейкоцитов и дифференциальный подсчет лейкоцитов. Мышам C57BL6/J вводили 6 разных доз CPM (мг/кг) в день 0 и день 3. Брали образы крови в каждый момент времени от 5 мышей из каждой группы в дни 0, 1, 4 и 6. Анализ с подсчетом общего числа лейкоцитов и дифференциальным подсчетом лейкоцитов (нейтрофилов, лимфоцитов) проводили при помощи автоматического гематологического анализатора Sysmex.
Фигура 5. Титрование дозы бактерий. Осуществляли контрольное IN-заражение пяти мышей с ослабленным иммунитетом с помощью 50 мкл суспензии бактерий в фазе логарифмического роста (доза в диапазоне от 1×107 до 2×108 CFU) через 24 часа после второй дозы CPM (день 4). Выживаемость животных отслеживали в течение периода 7 дней.
Фигура 6. LC10 повышает выживаемость у животных с ослабленным иммунитетом. Животным, которым инъецировали CPM, вводили LC10 (45 или 15 мг/кг) или R347 (45 мг/кг) за 24 часа до IN-инфицирования с помощью 50 мкл суспензии бактерий SF8300 (5×107 CFU). Выживаемость животных отслеживали в течение 5 дней. Статистическую значимость определяли с помощью логарифмического рангового критерия, и * означает статистически значимое различие по сравнению с животными, обработанными с помощью R347 (p<0,0001).
Фигура 7. Подсчет общего числа лейкоцитов и дифференциальный подсчет лейкоцитов. Мышам C57BL/6 давали 2 дозы CPM (150 мг/кг и 100 мг/кг) в дни -4 и -1 соответственно. Образцы крови от 5 мышей собирали в дни -4, -3, -1, 0, 2 и 3. Результаты подсчета общего числа лейкоцитов и дифференциального подсчета лейкоцитов (нейтрофилов, лимфоцитов) определяли при помощи автоматического гематологического анализатора Sysmex.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Выражения «полипептид», «пептид», «белок» и «белковый фрагмент» используются взаимозаменяемо в данном документе по отношению к полимеру из аминокислотных остатков. Выражения применимы к полимерам на основе аминокислот, в которых один или несколько аминокислотных остатков представляют собой искусственный химический миметик соответствующей встречающейся в природе аминокислоты, а также к полимерам на основе встречающихся в природе аминокислот и к полимерам на основе не встречающихся в природе аминокислот.
Выражение «аминокислота» относится к встречающимся в природе и синтетическим аминокислотам, а также к аналогам аминокислот и миметикам аминокислот, которые выполняют функцию, аналогичную таковой у встречающихся в природе аминокислот.
Как используется в данном документе, «рекомбинантный» предполагает обозначение белка, полученного с помощью клеток, которые в своем природном состоянии не содержат эндогенную копию ДНК, способную к экспрессии белка. Клетки вырабатывают рекомбинантный белок по той причине, что они были генетически изменены путем введения соответствующей выделенной последовательности нуклеиновой кислоты.
Как используется в данном документе, «антитело» и «иммуноглобулин» применяются взаимозаменяемо в наиболее широком смысле и включают моноклональные антитела (например, моноклональные антитела полной длины или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела, полиспецифические антитела (например, биспецифические антитела при условии, что они проявляют желаемую биологическую активность) и антигенсвязывающие фрагменты, описанные в данном документе. Нативные антитела и иммуноглобулины обычно представляют собой гетеротетрамерные гликопротеины с массой приблизительно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, при этом среди тяжелых цепей разных изотипов иммуноглобулина количество дисульфидных связей различается. Каждая тяжелая и легкая цепь также имеет расположенные с равными интервалами дисульфидные мостики между цепями. Каждая тяжелая цепь содержит на одном конце вариабельный домен (VH), за которым расположен ряд константных доменов. Каждая легкая цепь содержит вариабельный домен на одном конце (VL) и константный домен на своем другом конце. Выражения «константный» и «вариабельный» применяют в функциональном значении.
Константный домен легкой цепи расположен на одном уровне с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи расположен на одном уровне с вариабельным доменом тяжелой цепи. Определенные аминокислотные остатки, как полагают, образуют зону контакта между вариабельными доменами легкой и тяжелой цепи (Clothia, et al., J. Mol. Biol. 186, 651-66 (1985); Novotny and Haber, Proc. Natl. Acad. Sci. USA 82, 4592-4596 (1985)). Выделяют пять классов человеческих иммуноглобулинов на основании строения их тяжелых цепей, и они называются IgG, IgM, IgA, IgE и IgD. Классы антител IgG и IgA дополнительно делят на подклассы, а именно IgG1, IgG2, IgG3 и IgG4, а также IgA1 и IgA2. Тяжелые цепи в антителах IgG, IgA и IgD содержат три домена константного участка, которые обозначают CH1, CH2 и CH3, а тяжелые цепи в антителах IgM и IgE содержат четыре домена константного участка - CH1, CH2, CH3 и CH4. Таким образом, тяжелые цепи содержат один вариабельный участок и три или четыре константных участка. Структура и функция иммуноглобулинов рассматриваются, например, в Harlow et al., Eds., Antibodies: A Laboratory Manual, Chapter 14, Cold Spring Harbor Laboratory, Cold Spring Harbor (1988).
Обозначения «VH» или «VH» относятся к вариабельному участку тяжелой цепи иммуноглобулина, в том числе Fv, scFv, dsFv или Fab.
Обозначения «VL» или «VL» относятся к вариабельному участку легкой цепи иммуноглобулина, в том числе Fv, scFv, dsFv или Fab.
Выражение «антигенсвязывающий фрагмент» относится к части интактного антитела и относится к вариабельным участкам интактного антитела, определяющим антигены. Примеры антигенсвязывающих фрагментов включают, без ограничения, Fab, Fab', F(ab')2, Fv и одноцепочечные Fv-фрагменты, линейные антитела, одноцепочечные антитела и полиспецифические антитела, образованные из антигенсвязывающих фрагментов.
Выражения «одноцепочечный Fv» или «scFv» относятся к антителу, в котором вариабельные домены тяжелой цепи и легкой цепи обычного двухцепочечного антитела были соединены с образованием одной цепи. Выражения включают связывающие молекулы, которые состоят из одного вариабельного домена легкой цепи (VL) или его части и одного вариабельного домена тяжелой цепи (VH) или его части, где каждый вариабельный домен (или его часть) получен из одинаковых или различных антител. Молекулы scFv, как правило, содержат линкер scFv, расположенный между VH-доменом и VL-доменом. Молекулы scFv известны из уровня техники и описаны, например, в патенте США № 5892019, Ho, et al., Gene 77:51-59 (1989); Bird, et al., Science 242:423-426 (1988); Pantoliano, et al., Biochemistry 30:10117-10125 (1991); Milenic, et al., Cancer Research 51:6363-6371 (1991); Takkinen, et al., Protein Engineering 4:837-841 (1991), все из которых настоящим включены посредством ссылки во всей своей полноте.
АНТИГЕНСВЯЗЫВАЮЩИЕ ФРАГМЕНТЫ И АНТИТЕЛА К АЛЬФА-ТОКСИНУ S. AUREUS
Антитело к альфа-токсину S. aureus (также называемое антителом к AT S. aureus или антителом к АТ) или его антигенсвязывающий фрагмент, как применяется в данном документе, иммуноспецифически связывается с одним или несколькими эпитопами, специфичными для белка, пептида, субъединицы, фрагмента, части, олигомеров альфа-токсина или любой их комбинации, и обычно не связывается специфически с другими полипептидами. Выражение «олигомеры» или «олигомеры альфа-токсина» относятся к ассоциации мономеров альфа-токсина (например, из 2 мономеров, 3 мономеров, 4 мономеров, 5 мономеров, 6 мономеров или 7 мономеров), образующей функциональную пору (например, из 7 мономеров альфа-токсина). Эпитоп может содержать по меньшей мере один антителосвязывающий участок, который содержит по меньшей мере одну часть белкового альфа-токсина. Выражение «эпитоп», как используется в данном документе, относится к детерминанте белка, способной связываться с антителом. Эпитопы обычно включают химически активные поверхностные группировки молекул, таких как аминокислоты и/или боковые цепи из сахаров, и обычно характеризуются конкретными характеристиками трехмерной структуры, так же как и конкретными химическими характеристиками (например, зарядом, полярностью, основностью, кислотностью, гидрофобностью и т. п.). Конформационные и неконформационные эпитопы отличаются тем, что связывание с первым, но не с последним утрачивается в присутствии денатурирующих растворителей. В некоторых вариантах осуществления распознавание эпитопа препятствует образованию активного гептамера (например, ингибирует олигомеризацию мономеров альфа-токсина в активный гептамерный комплекс).
В определенных вариантах осуществления эпитоп состоит из по меньшей мере части белкового альфа-токсина, который вовлечен в образование гептамерного комплекса гептамера альфа-токсина. Определенный эпитоп может содержать любую комбинацию из от по меньшей мере одной аминокислотной последовательности длиной по меньшей мере 3 аминокислотных остатка до полной определенной части из смежных аминокислот белкового альфа-токсина. В некоторых вариантах осуществления эпитоп состоит из от по меньшей мере 4 аминокислотных остатков, по меньшей мере 5 аминокислотных остатков, по меньшей мере 6 аминокислотных остатков, по меньшей мере 7 аминокислотных остатков, по меньшей мере 8 аминокислотных остатков, по меньшей мере 9 аминокислотных остатков, по меньшей мере 10 аминокислотных остатков, по меньшей мере 11 аминокислотных остатков, по меньшей мере 12 аминокислотных остатков, по меньшей мере 13 аминокислотных остатков, по меньшей мере 14 аминокислотных остатков или по меньшей мере 15 аминокислотных остатков до полной определенной части из смежных аминокислот белкового альфа-токсина. В некоторых других вариантах осуществления эпитоп содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 смежных или несмежных аминокислотных остатков. В дополнительных вариантах осуществления аминокислотные остатки, содержащиеся в эпитопе, вовлечены в образование гептамерного комплекса альфа-токсина.
Таким образом, в конкретных вариантах осуществления выделенные/очищенные антигенсвязывающие фрагменты и антитела к альфа-токсину иммуноспецифически связываются с молекулой, содержащей аминокислотную последовательность согласно SEQ ID NO: 39, и/или с молекулой, содержащей аминокислотную последовательность согласно SEQ ID NO: 40. В определенных вариантах осуществления антигенсвязывающие фрагменты и антитела к альфа-токсину также связываются с гомологами или ортологами альфа-токсина из различных видов или с вариантами аминокислотной последовательности SEQ ID NO: 39, где гистидин в положении 35 замещен лейцином или замещен другими аминокислотами, соответствующими мутациям H35, известным специалисту в данной области.
Вариабельные участки
В определенных вариантах осуществления антигенсвязывающий фрагмент или антитело к альфа-токсину получают из исходного антитела. В некоторых вариантах осуществления антигенсвязывающий фрагмент или антитело к альфа-токсину содержатся в исходном антителе. Как используется в данном документе, выражение «исходное антитело» относится к антителу, которое кодируется аминокислотной последовательностью, применяемой для получения варианта или производного, определенных в данном документе. Исходный полипептид может содержать нативную последовательность антитела (т. е. встречающуюся в природе, в том числе встречающийся в природе аллельный вариант) или последовательность антитела с ранее существовавшими модификациями аминокислотной последовательности (такими как другие вставки, делеции и/или замены) во встречающейся в природе последовательности. Исходное антитело может быть гуманизированным антителом или человеческим антителом. В конкретных вариантах осуществления антигенсвязывающие фрагменты и антитела к альфа-токсину являются вариантами исходного антитела. Как используется в данном документе, выражение «вариант» относится к антигенсвязывающему фрагменту или антителу к альфа-токсину, которые отличаются по аминокислотной последовательности от аминокислотной последовательности «исходного» антигенсвязывающего фрагмента или антитела к альфа-токсину вследствие добавления, делеции и/или замены одного или нескольких аминокислотных остатков в последовательности исходного антитела.
Антигенсвязывающая часть антитела содержит один или несколько фрагментов антитела, которые сохраняют способность к специфическому связыванию с антигеном (например, альфа-токсином). Было показано, что антигенсвязывающую функцию антитела могут выполнять фрагменты антитела полной длины (т. е. антигенсвязывающие фрагменты). Примеры «антигенсвязывающих фрагментов», охватываемые выражением «антигенсвязывающая часть» антитела, включают (i) Fab-фрагмент, моновалентный фрагмент, состоящий из VL-, VH-, CL- и CH1-доменов; (ii) F(ab')2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, соединенных дисульфидным мостиком в шарнирном участке; (iii) Fd-фрагмент, состоящий из VH- и CH1-доменов; (iv) Fv-фрагмент, состоящий из VL- и VH-доменов одного плеча антитела, (v) dAb-фрагмент, который состоит из VH-домена; и (vi) выделенный участок, определяющий комплементарность (CDR). Хотя два домена Fv-фрагмента, VL и VH, часто кодируются отдельными генами, их можно соединить с применением рекомбинантных способов с помощью синтетического линкера, который обеспечивает возможность получения из них одной белковой цепи, в которой VL- и VH-участки спариваются с образованием моновалентной молекулы (известной как одноцепочечный Fv (scFv)). Такие одноцепочечные антитела также охватываются выражениями «антитело» и «антигенсвязывающий фрагмент» антитела. Эти антигенсвязывающие фрагменты можно получить с использованием известных методик, а фрагменты можно подвергнуть скринингу в отношении связывающей активности таким же образом, как и интактные антитела. Антигенсвязывающие фрагменты можно получить с помощью методик рекомбинантных ДНК или с помощью ферментативного или химического расщепления интактных иммуноглобулинов.
Антигенсвязывающие фрагменты и антитела к альфа-токсину по настоящему изобретению содержат по меньшей мере один антигенсвязывающий домен. В некоторых вариантах осуществления антигенсвязывающий фрагмент или антитело к альфа-токсину содержат VH, содержащую аминокислотную последовательность SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62. В определенных вариантах осуществления антигенсвязывающий фрагмент или антитело к альфа-токсину содержат VL, содержащий аминокислотную последовательность SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63. В еще одном варианте осуществления антигенсвязывающий фрагмент или антитело к альфа-токсину содержат VH, содержащий аминокислотную последовательность SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62, и VL, содержащий аминокислотную последовательность SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63. См. таблицу 7 для получения представления о последовательностях VH и VL, представленных в данном документе, которые могут присутствовать в любой комбинации для образования антигенсвязывающего фрагмента или антитела к альфа-токсину или могут присутствовать в комбинации для образования mAb по настоящему изобретению. В некоторых вариантах осуществления VH выбран из SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62. В различных вариантах осуществления VL выбран из SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63. Некоторые нуклеотидные последовательности VH и VL представлены в таблице 8.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат VH и VL, где VH и VL имеют аминокислотные последовательности, представленные под SEQ ID NO: 20 и 19; SEQ ID NO: 22 и 21; SEQ ID NO: 24 и 23; SEQ ID NO: 26 и 25; SEQ ID NO: 28 и 27; SEQ ID NO: 41 и 42; SEQ ID NO: 43 и 44; SEQ ID NO: 45 и 46; SEQ ID NO: 47 и 48; SEQ ID NO: 47 и 48; SEQ ID NO: 49 и 50; SEQ ID NO: 51 и 52; SEQ ID NO: 51 и 52; SEQ ID NO: 53 и 54; SEQ ID NO: 55 и 56; SEQ ID NO: 57 и 58; SEQ ID NO: 59 и 60; SEQ ID NO: 61 и 58; SEQ ID NO: 62 и 58; SEQ ID NO: 62 и 63; SEQ ID NO: 79 и 63.
В таблицах 1-7 представлены вариабельные участки тяжелой цепи (VH), вариабельные участки легкой цепи (VL) и участки, определяющие комплементарность (CDR), для определенных вариантов осуществления антител и антигенсвязывающих фрагментов, представленных в данном документе. В определенных вариантах осуществления антигенсвязывающие фрагменты и антитела к альфа-токсину содержат VH и/или VL с определенным процентом идентичности по отношению по меньшей мере к одной из последовательностей VH и/или VL, раскрытых в таблице 7. Как используется в данном документе, выражение «процент (%) идентичности последовательности», также включающее «гомологию», определено как процентная доля аминокислотных остатков или нуклеотидов в последовательности-кандидате, идентичных аминокислотным остаткам или нуклеотидам в эталонных последовательностях, таких как последовательность исходного антитела, после выравнивания последовательностей и введения гэпов, если необходимо, для достижения максимального процента идентичности последовательности, и не учитывает какие-либо консервативные замены как часть идентичности последовательности. Оптимальное выравнивание последовательностей для сравнения можно получить, помимо ручного способа, с помощью алгоритмов поиска локальной гомологии, известных в данной области техники, или с помощью компьютерных программ, в которых применяются эти алгоритмы (GAP, BESTFIT, FASTA, BLAST P, BLAST N и TFASTA в пакете программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Drive, Мэдисон, Висконсин).
В конкретных вариантах осуществления антитело или антигенсвязывающий фрагмент иммуноспецифически связываются с альфа-токсином и содержат вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный аминокислотной последовательности SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62, и содержат вариабельный домен легкой цепи, по меньшей мере на 90% идентичный аминокислотной последовательности SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63, где антитело обладает активностью ингибирования связывания одного или нескольких мономеров альфа-токсина друг с другом (например, ингибирует олигомеризацию).
Участки, определяющие комплементарность
Несмотря на то, что вариабельный домен (VH и VL) содержит антигенсвязывающий участок, вариабельность распределяется по вариабельным доменам антител неравномерно. Она сосредоточена в сегментах, называемых участками, определяющими комплементарность (CDR), в вариабельных доменах как легкой цепи (VL или VK), так и тяжелой цепи (VH). Более высококонсервативные части вариабельных доменов называются каркасными участками (FR). Каждый из вариабельных доменов нативной тяжелой и легкой цепей содержит четыре FR, по большей части принимающих конфигурацию β-листа, соединенных тремя CDR, которые образуют петли, объединяющие структуру бета-листа и в некоторых случаях образующие ее часть. CDR в каждой цепи удерживаются в непосредственной близости друг с другом с помощью FR и вместе с CDR из другой цепи участвуют в образовании антигенсвязывающего центра антител (см. Kabat et al., выше). Три CDR тяжелой цепи обозначают VH-CDR1, VH-CDR2 и VH-CDR3, а три CDR легкой цепи обозначают VL-CDR1, VL-CDR2 и VL-CDR3. В данном документе используется система нумерации по Kabat. Соответственно VH-CDR1 начинается примерно с аминокислоты 31 (т. е. примерно через 9 остатков от первого цистеинового остатка) содержит примерно 5-7 аминокислот и заканчивается на следующем сериновом остатке. VH-CDR2 начинается с пятнадцатого остатка от конца CDR-H1, содержит примерно 16-19 аминокислот и заканчивается на следующем глициновом остатке. VH-CDR3 начинается примерно с тридцатого аминокислотного остатка от конца VH-CDR2, содержит примерно 13-15 аминокислот и заканчивается на последовательности M-D-V. VL-CDR1 начинается примерно с остатка 24 (т. е. после цистеинового остатка), включает примерно 10-15 остатков и заканчивается последовательностью Y-V-S. VL-CDR2 начинается примерно с шестнадцатого остатка от конца VL-CDR1 и включает примерно 7 остатков. VL-CDR3 начинается примерно с тридцать третьего остатка от конца VH-CDR2, содержит примерно 7-11 остатков и заканчивается на последовательности T-I-L. Следует отметить, что CDR среди разных антител значительно различаются (и по определению не будут проявлять гомологию с консенсусными последовательностями по Kabat).
Антигенсвязывающие фрагменты и антитела к альфа-токсину по настоящему изобретению содержат по меньшей мере один антигенсвязывающий домен, который содержит по меньшей мере один участок, определяющий комплементарность (CDR1, CDR2 или CDR3). В некоторых вариантах осуществления антигенсвязывающий фрагмент или антитело к альфа-токсину содержит VH, который содержит по меньшей мере один CDR VH (например, CDR-H1, CDR-H2 или CDR-H3). В определенных вариантах осуществления антигенсвязывающий фрагмент или антитело к альфа-токсину содержит VL, который содержит по меньшей мере один CDR VL (например, CDR-L1, CDR-L2 или CDR-L3).
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент, которые иммуноспецифически связываются с полипептидным альфа-токсином Staphylococcus aureus, содержат (a) CDR1 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 7, 10, 13 или 69 или содержащую 1, 2 или 3 замены аминокислотных остатков по сравнению с таковой; (b) CDR2 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 8, 11, 14, 17, 70 или 75 или содержащую 1, 2 или 3 замены аминокислотных остатков по сравнению с таковой; и (c) CDR3 VH, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78 или содержащую 1, 2 или 3 замены аминокислотных остатков по сравнению с таковой.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат CDR1 VH, CDR2 VH и CDR3 VH, содержащие аминокислотные последовательности, идентичные SEQ ID NO: 7, 8 и 9; SEQ ID NO: 10, 11 и 12; SEQ ID NO: 13, 14 и 15; SEQ ID NO: 7, 17 и 18; SEQ ID NO: 7, 8 и 16; SEQ ID NO: 7, 8 и 65; SEQ ID NO: 7, 8 и 66; SEQ ID NO: 7, 8 и 67; SEQ ID NO: 7, 8 и 78; SEQ ID NO: 69, 70 и 71; SEQ ID NO: 7, 8 и 72; SEQ ID NO: 69, 75 и 71; SEQ ID NO: 69, 75 и 76 или SEQ ID NO: 69, 70 и 71 или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по сравнению с таковыми.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент, которые иммуноспецифически связываются с полипептидным альфа-токсином Staphylococcus aureus, содержат (a) CDR1 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 1 или 4 или содержащую 1, 2 или 3 замены аминокислотных остатков по сравнению с таковой; (b) CDR2 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 2, 5, 73 или 77 или содержащую 1, 2 или 3 замены аминокислотных остатков по сравнению с таковой; и (c) CDR3 VL, содержащий аминокислотную последовательность, идентичную SEQ ID NO: 3, 6, 64, 68 или 74 или содержащую 1, 2 или 3 замены аминокислотных остатков по сравнению с таковой.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат CDR1 VL, CDR2 VL и CDR3 VL, содержащие аминокислотные последовательности, идентичные SEQ ID NO: 1, 2 и 3; SEQ ID NO: 4, 5 и 6; SEQ ID NO: 1, 2 и 64; SEQ ID NO: 1, 2 и 68; SEQ ID NO: 1, 73 и 74 или SEQ ID NO: 1, 77 и 74 или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по сравнению с таковыми.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент, которые иммуноспецифически связываются с полипептидным альфа-токсином Staphylococcus aureus, содержат CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL, содержащие аминокислотные последовательности, идентичные (a) CDR1 VH, содержащему аминокислотную последовательность SEQ ID NO: 7, 10, 13 или 69; (b) CDR2 VH, содержащему аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75; (c) CDR3 VH, содержащему аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78; (d) CDR1 VL, содержащему аминокислотную последовательность SEQ ID NO: 1 или 4; (e) CDR2 VL, содержащему аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и (f) CDR3 VL, содержащему аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74, или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по сравнению с таковыми.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL, содержащие аминокислотные последовательности, идентичные SEQ ID NO: 7, 8, 9, 1, 2 и 3; SEQ ID NO: 10, 11, 12, 1, 2 и 3; SEQ ID NO: 13, 14, 15, 4, 5 и 6; SEQ ID NO: 7, 17, 18, 1, 2 и 3; SEQ ID NO: 7, 8, 16, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1, 2 и 64; SEQ ID NO: 7, 8, 66, 1, 2 и 64; SEQ ID NO: 7, 8, 67, 1, 2 и 68; SEQ ID NO: 7, 8, 67, 1, 2 и 64; SEQ ID NO: 7, 8, 78, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1, 2 и 68; SEQ ID NO: 69, 70, 71, 1, 2 и 68; SEQ ID NO: 7, 8, 72, 1, 73 и 74; SEQ ID NO: 69, 75, 71, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 77 и 74; SEQ ID NO: 69, 70, 71, 1, 77 и 74 или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по сравнению с таковыми.
В некоторых вариантах осуществления представлена композиция, содержащая выделенное антитело или его антигенсвязывающий фрагмент, которые (i) содержат VH-домен цепи, содержащий три CDR, и VL-домен цепи, содержащий три CDR; и (ii) иммуноспецифически связываются с полипептидным альфа-токсином Staphylococcus aureus, где три CDR VH-домена цепи включают (a) CDR1 VH, содержащий аминокислотную последовательность SEQ ID NO: 7, 10, 13 или 69; (b) CDR2 VH, содержащий аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75; и (c) CDR3 VH, содержащий аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78. В конкретных вариантах осуществления CDR1 VH, CDR2 VH и CDR3 VH соответствуют SEQ ID NO: 7, 8 и 9; SEQ ID NO: 10, 11 и 12; SEQ ID NO: 13, 14 и 15; SEQ ID NO: 7, 17 и 18; SEQ ID NO: 7, 8 и 16; SEQ ID NO: 7, 8 и 65; SEQ ID NO: 7, 8 и 66; SEQ ID NO: 7, 8 и 67; SEQ ID NO: 7, 8 и 78; SEQ ID NO: 69, 70 и 71; SEQ ID NO: 7, 8 и 72; SEQ ID NO: 69, 75 и 71; SEQ ID NO: 69, 75 и 76 или SEQ ID NO: 69, 70 и 71.
В определенных вариантах осуществления также представлена композиция, содержащая выделенное антитело или его антигенсвязывающий фрагмент, которые (i) содержат VH-домен цепи, содержащий три CDR, и VL-домен цепи, содержащий три CDR; и (ii) иммуноспецифически связываются с полипептидным альфа-токсином Staphylococcus aureus, где три CDR VL-домена цепи включают (a) CDR1 VL, содержащий аминокислотную последовательность SEQ ID NO: 1 или 4; (b) CDR2 VL, содержащий аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и (c) CDR3 VL, содержащий аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74. В конкретных вариантах осуществления CDR1 VL, CDR2 VL и CDR3 VL соответствуют SEQ ID NO: 1, 2 и 3; SEQ ID NO: 4, 5 и 6; SEQ ID NO: 1, 2 и 64; SEQ ID NO: 1, 2 и 68; SEQ ID NO: 1, 73 и 74 или SEQ ID NO: 1, 77 и 74.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент, которые иммуноспецифически связываются с полипептидным альфа-токсином Staphylococcus aureus, содержат CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL, содержащие аминокислотные последовательности, идентичные (a) CDR1 VH, содержащему аминокислотную последовательность SEQ ID NO: 7, 10, 13 или 69; (b) CDR2 VH, содержащему аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75; (c) CDR3 VH, содержащему аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78; (d) CDR1 VL, содержащему аминокислотную последовательность SEQ ID NO: 1 или 4; (e) CDR2 VL, содержащему аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и (f) CDR3 VL, содержащему аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74, или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по сравнению с таковыми.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL, содержащие аминокислотные последовательности, идентичные SEQ ID NO: 7, 8, 9, 1, 2 и 3; SEQ ID NO: 10, 11, 12, 1, 2 и 3; SEQ ID NO: 13, 14, 15, 4, 5 и 6; SEQ ID NO: 7, 17, 18, 1, 2 и 3; SEQ ID NO: 7, 8, 16, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1, 2 и 64; SEQ ID NO: 7, 8, 66, 1, 2 и 64; SEQ ID NO: 7, 8, 67, 1, 2 и 68; SEQ ID NO: 7, 8, 67, 1, 2 и 64; SEQ ID NO: 7, 8, 78, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1, 2 и 68; SEQ ID NO: 69, 70, 71, 1, 2 и 68; SEQ ID NO: 7, 8, 72, 1, 73 и 74; SEQ ID NO: 69, 75, 71, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 77 и 74; SEQ ID NO: 69, 70, 71, 1, 77 и 74 или содержащие 1, 2 или 3 замены аминокислотных остатков в каждом CDR по сравнению с таковыми.
В некоторых вариантах осуществления представлена композиция, содержащая выделенное антитело или его антигенсвязывающий фрагмент, которые (i) содержат VH-домен цепи, содержащий три CDR, и VL-домен цепи, содержащий три CDR; и (ii) иммуноспецифически связываются с полипептидным альфа-токсином Staphylococcus aureus, где три CDR VH-домена цепи включают (a) CDR1 VH, содержащий аминокислотную последовательность SEQ ID NO: 7, 10, 13 или 69; (b) CDR2 VH, содержащий аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75; и (c) CDR3 VH, содержащий аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78. В конкретных вариантах осуществления CDR1 VH, CDR2 VH и CDR3 VH соответствуют SEQ ID NO: 7, 8 и 9; SEQ ID NO: 10, 11 и 12; SEQ ID NO: 13, 14 и 15; SEQ ID NO: 7, 17 и 18; SEQ ID NO: 7, 8 и 16; SEQ ID NO: 7, 8 и 65; SEQ ID NO: 7, 8 и 66; SEQ ID NO: 7, 8 и 67; SEQ ID NO: 7, 8 и 78; SEQ ID NO: 69, 70 и 71; SEQ ID NO: 7, 8 и 72; SEQ ID NO: 69, 75 и 71; SEQ ID NO: 69, 75 и 76 или SEQ ID NO: 69, 70 и 71.
В некоторых вариантах осуществления также представлены композиции, которые содержат выделенное антитело или его антигенсвязывающий фрагмент, которые (i) иммуноспецифически связываются с полипептидным альфа-токсином Staphylococcus aureus, (ii) содержат вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный аминокислотной последовательности SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62, и (iii) содержат вариабельный домен легкой цепи, по меньшей мере на 90% идентичный аминокислотной последовательности SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
В некоторых вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат вариабельный домен тяжелой цепи с SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62 и вариабельный домен легкой цепи с SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
В конкретных вариантах осуществления выделенное антитело или его антигенсвязывающий фрагмент содержат VH и VL, где каждый из VH и VL идентичен либо каждый из них по меньшей мере на 90%, 95% или 98% идентичен аминокислотным последовательностям VH и VL SEQ ID NO: 20 и 19; SEQ ID NO: 22 и 21; SEQ ID NO: 24 и 23; SEQ ID NO: 26 и 25; SEQ ID NO: 28 и 27; SEQ ID NO: 41 и 42; SEQ ID NO: 43 и 44; SEQ ID NO: 45 и 46; SEQ ID NO: 47 и 48; SEQ ID NO: 47 и 48; SEQ ID NO: 49 и 50; SEQ ID NO: 51 и 52; SEQ ID NO: 51 и 52; SEQ ID NO: 53 и 54; SEQ ID NO: 55 и 56; SEQ ID NO: 57 и 58; SEQ ID NO: 59 и 60; SEQ ID NO: 61 и 58; SEQ ID NO: 62 и 58; SEQ ID NO: 62 и 63; SEQ ID NO: 79 и 63.
Варианты Fc-участков
Настоящее изобретение также охватывает участников связывания по настоящему изобретению и, в частности, антитела по настоящему изобретению, которые содержат модифицированные константные домены IgG. Человеческие антитела класса IgG, которые имеют такие функциональные характеристики, как длительное время полужизни в сыворотке крови и способность к опосредованию различных эффекторных функций, применяют в определенных вариантах осуществления настоящего изобретения (Monoclonal Antibodies: Principles and Applications, Wiley-Liss, Inc., Chapter 1 (1995)). Человеческие антитела класса IgG дополнительно подразделяют на следующие 4 подкласса: IgG1, IgG2, IgG3 и IgG4. К настоящему времени было проведено большое число исследований в отношении ADCC и CDC как эффекторных функций антител класса IgG, и сообщалось, что среди человеческих антител класса IgG подкласс IgG1 обладает самой высокой ADCC-активностью и CDC-активностью у людей (Chemical Immunology, 65, 88 (1997)).
«Антителозависимая клеточноопосредованная цитотоксичность» и «ADCC» относятся к клеточноопосредованной реакции, при которой неспецифические цитотоксические клетки (например, естественные клетки-киллеры (NK), нейтрофилы и макрофаги) распознают связанное антитело на клетке-мишени и вслед за этим вызывают лизис клетки-мишени. В одном варианте осуществления такие клетки являются клетками человека. Не желая ограничиваться каким-либо конкретным механизмом действия, полагают, что данные цитотоксические клетки, которые опосредуют ADCC, как правило, экспрессируют Fc-рецепторы (FcR). Основные клетки, опосредующие ADCC, NK-клетки, экспрессируют FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII, FcγRIII и/или FcγRIV. Экспрессия FcR на поверхности гемопоэтических клеток кратко изложена в Ravetch and Kinet, Annu. Rev. Immunol., 9:457-92 (1991). Для оценки ADCC-активности можно провести in vitro анализ ADCC так, как описано в патентах США №№ 5500362 или 5821337. Пригодные для таких анализов эффекторные клетки включают мононуклеарные клетки периферической крови (PBMC) и естественные клетки-киллеры (NK). Альтернативно или дополнительно ADCC-активность молекул, представляющих интерес, можно оценивать in vivo, например, в животной модели, такой как раскрытая в Clynes et al., Proc. Natl. Acad. Sci. (USA), 95:652-656 (1998).
«Комплементзависимая цитотоксичность» или «CDC» относится к способности молекулы к инициированию активации системы комплемента и лизису мишени в присутствии системы комплемента. Путь активации системы комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, антителом), образующей комплекс с распознанным антигеном. Для оценки активации системы комплемента можно проводить анализ CDC, например, описанный в Gazzano-Santaro et al., J. Immunol. Methods, 202:163 (1996).
Проявление ADCC-активности и CDC-активности человеческого антитела подкласса IgG1 обычно включает связывание Fc-участка антитела с рецептором для антитела (далее называемого «FcγR»), присутствующим на поверхности эффекторных клеток, таких как клетки-киллеры, естественные клетки-киллеры или активированные макрофаги. Могут быть связанными различные компоненты системы комплемента. В отношении связывания предполагалось, что важными являются несколько аминокислотных остатков в шарнирном участке и втором домене C-участка (далее называемом «Cγ2-домен») антитела (Eur. J. Immunol., 23, 1098 (1993), Immunology, 86, 319 (1995), Chemical Immunology, 65, 88 (1997)), и что сахарная цепь в Cγ2-домене (Chemical Immunology, 65, 88 (1997)) также важна.
«Эффекторные клетки» представляют собой лейкоциты, которые экспрессируют один или несколько FcR и выполняют эффекторные функции. Клетки экспрессируют по меньшей мере FcγRI, FcγRII, FcγRIII и/или FcγRIV и осуществляют эффекторную функцию ADCC. Примеры лейкоцитов человека, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (PBMC), естественные клетки-киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы.
Выражения «Fc-рецептор» или «FcR» применяют для описания рецептора, который связывается с Fc-участком антитела. В одном варианте осуществления FcR представляет собой человеческий FcR с нативной последовательностью. Более того, в определенных вариантах осуществления FcR является рецептором, который связывается с антителом IgG (гамма-рецептором) и включает рецепторы подклассов FcγRI, FcγRII, FcγRIII и FcγRIV, в том числе аллельные варианты и подвергнутые альтернативному сплайсингу формы данных рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют сходные аминокислотные последовательности, отличающиеся в первую очередь своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит иммунорецепторный тирозиновый активирующий мотив (ITAM) в своем цитоплазматическом домене. Ингибирующий рецептор FcγRIIB содержит иммунорецепторный тирозиновый ингибирующий мотив (ITIM) в своем цитоплазматическом домене. (См. Daëron, Annu. Rev. Immunol., 15:203-234 (1997)). FcR рассматриваются в Ravetch and Kinet, Annu. Rev. Immunol., 9:457-92 (1991); Capel et al., Immunomethods, 4:25-34 (1994), и de Haas et al., J. Lab. Clin. Med., 126:330-41 (1995). Другие FcR, включая те, которые будут идентифицированы в будущем, охватываются выражением «FcR» в данном документе. Выражение также включает в себя неонатальный рецептор FcRn, который отвечает за перенос IgG матери плоду (Guyer et al., Immunol., 117:587 (1976) и Kim et al., J. Immunol., 24:249 (1994)).
В определенных вариантах осуществления антигенсвязывающий фрагмент или антитело к альфа-токсину содержат измененный Fc-участок (также называемый в данном документе «вариантом Fc-участка»), в котором одно или несколько изменений были осуществлены в Fc-участке для модификации функциональных и/или фармакокинетических свойств антител. Подобные изменения могут приводить к усилению или ослаблению связывания с Clq и комплементзависимой цитотоксичности (CDC) или связывания с Fc-гамма-R для IgG. Данная технология охватывает антитела, описанные в данном документе, с вариантами Fc-участков, где были осуществлены модификации для изменения эффекторной функции, что обеспечивало желаемый эффект. Соответственно в некоторых вариантах осуществления антигенсвязывающий фрагмент или антитело к альфа-токсину содержит вариант Fc-участка (т. е. Fc-участки, которые были изменены, как описано ниже). В данном документе антигенсвязывающие фрагменты и антитела к альфа-токсину, содержащие вариант Fc-участка, также называются «антителами с вариантами Fc». Как используется в данном документе, нативный относится к немодифицированной исходной последовательности, и антитело, содержащее нативный Fc-участок, называется в данном документе «антителом с нативным Fc». В некоторых вариантах осуществления вариант Fc-участка проявляет сходный уровень индукции эффекторной функции по сравнению с нативным Fc-участком. В определенных вариантах осуществления вариант Fc-участка проявляет более высокую индукцию эффекторной функции по сравнению с нативным Fc. В определенных вариантах осуществления вариант Fc-участка проявляет более низкую индукцию эффекторной функции по сравнению с нативным Fc. Некоторые конкретные варианты осуществления вариантов Fc-участков подробно описаны в данном документе. Способы измерения эффекторной функции известны в данной области техники.
Эффекторную функцию антитела можно модифицировать путем изменений в Fc-участке, в том числе, без ограничения, замен аминокислот, добавлений аминокислот, делеций аминокислот и изменений посттрансляционных модификаций аминокислот в Fc (например, гликозилирования). Способы, описанные ниже, можно применять для изменения эффекторной функции выделенного антитела или антигенсвязывающего фрагмента, как описано в данном документе, в результате чего получают антитело или антигенсвязывающий фрагмент, имеющие определенные свойства, благоприятные для профилактики или лечения конкретного заболевания или состояния, ассоциированного со Staphylococcus aureus.
В некоторых вариантах осуществления получают антитело с вариантом Fc, которое обладает измененными свойствами связывания с лигандом Fc (например, Fc-рецептором, C1q) по сравнению с антителом с нативным Fc. Примеры свойств связывания включают, без ограничения, специфичность связывания, равновесную константу диссоциации (Kd), скорости диссоциации и ассоциации (koff и kon соответственно), аффинность и/или авидность связывания. В данной области техники известно, что равновесная константа диссоциации (Kd) определяется как koff/kon. В определенных аспектах антитело, содержащее вариант Fc-участка, с низкой Kd может быть более желательным, чем антитело с высокой Kd. Однако в некоторых случаях значение kon или koff может быть более существенным, чем значение Kd. Можно определить, какой кинетический параметр является более важным для применения данного антитела.
В некоторых вариантах осуществления антитела с вариантом Fc проявляют измененную аффинность связывания в отношении одного или нескольких Fc-рецепторов, включая, без ограничения, FcRn, Fc-гамма-RI (CD64), в том числе изоформы Fc-гамма-RIA, Fc-гамма-RIB и Fc-гамма-RIC; Fc-гамма-RII (CD32, в том числе изоформы Fc-гамма-RIIA, Fc-гамма-RIIB и Fc-гамма-RIIC) и Fc-гамма-RIII (CD16, в том числе изоформы Fc-гамма-RIIIA и Fc-гамма-RIIIB), по сравнению с антителом с нативным Fc.
В определенных вариантах осуществления антитело с вариантом Fc характеризуется повышенным связыванием с одним или нескольким лигандами Fc по сравнению с антителом с нативным Fc. В определенных вариантах осуществления антитело с вариантом Fc проявляет повышенную или пониженную аффинность в отношении лиганда Fc, которая по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз, или в 2-10 раз, или в 5-50 раз, или в 25-100 раз, или в 75-200 раз, или в 100-200 раз выше или ниже, чем у антитела с нативным Fc. В различных вариантах осуществления антитела с вариантом Fc характеризуются значениями аффинности в отношении лиганда Fc, которые по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, по меньшей мере на 50%, по меньшей мере на 40%, по меньшей мере на 30%, по меньшей мере на 20%, по меньшей мере на 10% или по меньшей мере на 5% выше или ниже, чем у антитела с нативным Fc. В определенных вариантах осуществления антитело с вариантом Fc характеризуется повышенной аффинностью в отношении лиганда Fc. Антитело с вариантом Fc может иногда характеризоваться пониженной аффинностью в отношении лиганда Fc.
В некоторых вариантах осуществления антитело с вариантом Fc характеризуется повышенным связыванием с Fc-рецептором Fc-гамма-RIIIA. В некоторых вариантах осуществления антитело с вариантом Fc характеризуется повышенным связыванием с Fc-рецептором Fc-гамма-RIIB. В определенных вариантах осуществления антитело с вариантом Fc характеризуется повышенным связыванием с Fc-рецепторами как Fc-гамма-RIIIA, так и Fc-гамма-RIIB. В определенных вариантах осуществления антитела с вариантом Fc, характеризующиеся повышенным связыванием с Fc-гамма-RIIIA, не характеризуются при этом повышенным связыванием с рецептором Fc-гамма-RIIB по сравнению с антителом с нативным Fc. В определенных вариантах осуществления антитело с вариантом Fc характеризуется пониженным связыванием с Fc-рецептором Fc-гамма-RIIIA. Антитело с вариантом Fc иногда может характеризоваться пониженным связыванием с Fc-рецептором Fc-гамма-RIIB. В различных вариантах осуществления антитело с вариантом Fc, проявляющее измененную аффинность в отношении Fc-гамма-RIIIA и/или Fc-гамма-RIIB, характеризуется повышенным связыванием с Fc-рецептором FcRn. В некоторых вариантах осуществления антитело с вариантом Fc, проявляющее измененную аффинность в отношении Fc-гамма-RIIIA и/или Fc-гамма-RIIB, характеризуется измененным связыванием с C1q по сравнению с антителом с нативным Fc.
В определенных вариантах осуществления антитела с вариантом Fc характеризуются значениями аффинности в отношении рецептора Fc-гамма-RIIIA, которые по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз, или в 2-10 раз, или в 5-50 раз, или в 25-100 раз, или в 75-200 раз, или в 100-200 раз выше или ниже, чем у антитела с нативным Fc. В различных вариантах осуществления антитела с вариантом Fc характеризуются значениями аффинности в отношении Fc-гамма-RIIIA, которые по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, по меньшей мере на 50%, по меньшей мере на 40%, по меньшей мере на 30%, по меньшей мере на 20%, по меньшей мере на 10% или по меньшей мере на 5% выше или ниже, чем у антитела с нативным Fc.
В определенных вариантах осуществления антитела с вариантом Fc характеризуются значениями аффинности в отношении рецептора Fc-гамма-RIIB, которые по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз, или в 2-10 раз, или в 5-50 раз, или в 25-100 раз, или в 75-200 раз, или в 100-200 раз выше или ниже, чем у антитела с нативным Fc. В определенных вариантах осуществления антитела с вариантом Fc характеризуются значениями аффинности в отношении Fc-гамма-RIIB, которые по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, по меньшей мере на 50%, по меньшей мере на 40%, по меньшей мере на 30%, по меньшей мере на 20%, по меньшей мере на 10% или по меньшей мере на 5% выше или ниже, чем у антитела с нативным Fc.
В некоторых вариантах осуществления антитела с вариантом Fc характеризуются повышенными или пониженными значениями аффинности в отношении C1q по сравнению с антителом с нативным Fc. В некоторых вариантах осуществления антитела с вариантом Fc характеризуются значениями аффинности в отношении C1q-рецептора, которые по меньшей мере в 2 раза, или по меньшей мере в 3 раза, или по меньшей мере в 5 раз, или по меньшей мере в 7 раз, или по меньшей мере в 10 раз, или по меньшей мере в 20 раз, или по меньшей мере в 30 раз, или по меньшей мере в 40 раз, или по меньшей мере в 50 раз, или по меньшей мере в 60 раз, или по меньшей мере в 70 раз, или по меньшей мере в 80 раз, или по меньшей мере в 90 раз, или по меньшей мере в 100 раз, или по меньшей мере в 200 раз, или по меньшей мере в 200 раз, или в 2-10 раз, или в 5-50 раз, или в 25-100 раз, или в 75-200 раз, или в 100-200 раз выше или ниже, чем у антитела с нативным Fc. В определенных вариантах осуществления антитела с вариантом Fc характеризуются значениями аффинности в отношении C1q, которые по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, по меньшей мере на 50%, по меньшей мере на 40%, по меньшей мере на 30%, по меньшей мере на 20%, по меньшей мере на 10% или по меньшей мере на 5% выше или ниже, чем у антитела с нативным Fc. В различных вариантах осуществления антитело с вариантом Fc, проявляющее измененную аффинность в отношении C1q, характеризуется повышенным связыванием с Fc-рецептором FcRn. В еще одном конкретном варианте осуществления антитело с вариантом Fc, проявляющее измененную аффинность в отношении C1q, характеризуется измененным связыванием с Fc-гамма-RIIIA и/или Fc-гамма-RIIB по сравнению с антителом с нативным Fc.
Предполагается, что характеристики антител с вариантом Fc получают при помощи in vitro функциональных анализов для определения одной или нескольких эффекторных клеточных функций, опосредованных Fc-гамма-R. В определенных вариантах осуществления антитела с вариантом Fc в in vivo моделях (таких как описанные и раскрытые в данном документе) обладают свойствами связывания и эффекторными клеточными функциями, сходными с таковыми, полученными в in vitro анализах. Данная технология не исключает антитела с вариантом Fc, которые не проявляют желаемый фенотип в in vitro анализах, но проявляют желаемый фенотип in vivo.
Время полужизни белков, содержащих Fc-участки, в сыворотке крови может быть увеличено путем повышения аффинности связывания Fc-участка с FcRn. Выражение «время полужизни антитела», используемое в данном документе, означает фармакокинетическое свойство антитела, которое представляет собой меру среднего времени жизни молекул антитела после их введения. Время полужизни антитела можно выразить как время, необходимое для выведения 50 процентов известного количества иммуноглобулина из организма пациента (или другого млекопитающего) или его определенной части, например, измеренное в сыворотке крови, т. е. время полужизни в кровотоке, или других тканях. Время полужизни может различаться среди разных иммуноглобулинов или классов иммуноглобулинов. Как правило, увеличение времени полужизни антитела приводит к увеличению среднего времени удержания (MRT) введенного антитела в кровотоке.
Увеличение времени полужизни позволяет уменьшить количество лекарственного средства, даваемого пациенту, а также снизить частоту введения. Увеличение времени полужизни также может быть благоприятным, например, для предупреждения заболевания или состояния, ассоциированного с Staphylococcus aureus, а также для предупреждения рецидива инфекции, что часто происходит, как только пациента выписывают из больницы. Для увеличения времени полужизни антитела в сыворотке крови в состав антитела (в частности, в антигенсвязывающий фрагмент) может быть включен эпитоп, связывающийся с рецептором реутилизации, как известно из уровня техники. Как используется в данном документе, выражение «эпитоп, связывающийся с рецептором реутилизации» относится к эпитопу Fc-участка молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), который отвечает за увеличение времени полужизни молекулы IgG в сыворотке крови in vivo. Антитела с увеличенными значениями времени полужизни также могут быть получены при помощи модификации аминокислотных остатков, идентифицированных как участвующие во взаимодействии между Fc и рецептором FcRn. Кроме того, время полужизни антигенсвязывающего фрагмента или антитела к альфа-токсину может быть увеличено путем конъюгации с PEG или альбумином при помощи методик, широко используемых в данной области техники. В некоторых вариантах осуществления антитела, содержащие варианты Fc-участков антитела к альфа-токсину, характеризуются временем полужизни, увеличенным приблизительно на 5%, приблизительно на 10%, приблизительно на 15%, приблизительно на 20%, приблизительно на 25%, приблизительно на 30%, приблизительно на 35%, приблизительно на 40%, приблизительно на 45%, приблизительно на 50%, приблизительно на 60%, приблизительно на 65%, приблизительно на 70%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 100%, приблизительно на 125%, приблизительно на 150% или более по сравнению с антителом, содержащим нативный Fc-участок. В некоторых вариантах осуществления антитела, содержащие варианты Fc-участков, характеризуются временем полужизни, увеличенным приблизительно в 2 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 5 раз, приблизительно в 10 раз, приблизительно в 20 раз, приблизительно в 50 раз или более, или в 2-10 раз, или в 5-25 раз, или в 15-50 раз по сравнению с антителом, содержащим нативный Fc-участок.
В некоторых вариантах осуществления технология, представленная в данном документе, предлагает варианты Fc, где Fc-участок содержит модификацию (например, аминокислотные замены, аминокислотные вставки, аминокислотные делеции) в одном или нескольких положениях, выбранных из группы, состоящей из 234, 235, 236, 237, 238, 239, 240, 241, 243, 244, 245, 247, 251, 252, 254, 255, 256, 262, 263, 264, 265, 266, 267, 268, 269, 279, 280, 284, 292, 296, 297, 298, 299, 305, 313, 316, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 339, 341, 343, 370, 373, 378, 392, 416, 419, 421, 440 и 443, пронумерованных при помощи индекса EU, как изложено у Kabat. Необязательно Fc-участок может содержать аминокислотный остаток, не встречающийся в природе, в дополнительных и/или альтернативных положениях, известных в данной области техники.
В определенных вариантах осуществления в данном документе представлен вариант Fc, где Fc-участок содержит по меньшей мере одну замену, выбранную из группы, состоящей из 234D, 234E, 234N, 234Q, 234T, 234H, 234Y, 234I, 234V, 234F, 235A, 235D, 235R, 235W, 235P, 235S, 235N, 235Q, 235T, 235H, 235Y, 235I, 235V, 235F, 236E, 239D, 239E, 239N, 239Q, 239F, 239T, 239H, 239Y, 240I, 240A, 240T, 240M, 241W, 241 L, 241Y, 241E, 241 R, 243W, 243L, 243Y, 243R, 243Q, 244H, 245A, 247L, 247V, 247G, 251F, 252Y, 254T, 255L, 256E, 256M, 262I, 262A, 262T, 262E, 263I, 263A, 263T, 263M, 264L, 264I, 264W, 264T, 264R, 264F, 264M, 264Y, 264E, 265G, 265N, 265Q, 265Y, 265F, 265V, 265I, 265L, 265H, 265T, 266I, 266A, 266T, 266M, 267Q, 267L, 268E, 269H, 269Y, 269F, 269R, 270E, 280A, 284M, 292P, 292L, 296E, 296Q, 296D, 296N, 296S, 296T, 296L, 296I, 296H, 269G, 297S, 297D, 297E, 298H, 298I, 298T, 298F, 299I, 299L, 299A, 299S, 299V, 299H, 299F, 299E, 305I, 313F, 316D, 325Q, 325L, 325I, 325D, 325E, 325A, 325T, 325V, 325H, 327G, 327W, 327N, 327L, 328S, 328M, 328D, 328E, 328N, 328Q, 328F, 328I, 328V, 328T, 328H, 328A, 329F, 329H, 329Q, 330K, 330G, 330T, 330C, 330L, 330Y, 330V, 330I, 330F, 330R, 330H, 331G, 331A, 331L, 331M, 331F, 331W, 331K, 331Q, 331E, 331S, 331V, 331I, 331C, 331Y, 331H, 331R, 331N, 331D, 331T, 332D, 332S, 332W, 332F, 332E, 332N, 332Q, 332T, 332H, 332Y, 332A, 339T, 370E, 370N, 378D, 392T, 396L, 416G, 419H, 421K, 440Y и 434W, пронумерованных при помощи индекса EU, как изложено у Kabat. Необязательно Fc-участок может содержать дополнительные и/или альтернативные аминокислотные остатки, не встречающиеся в природе, известные в данной области техники.
В различных вариантах осуществления в данном документе представлено антитело с вариантом Fc, где Fc-участок содержит по меньшей мере одну модификацию (например, замены аминокислот, вставки аминокислот, делеции аминокислот) в одном или нескольких положениях, выбранных из группы, состоящей из 234, 235 и 331. В некоторых вариантах осуществления аминокислоты, не встречающиеся в природе, выбраны из группы, состоящей из 234F, 235F, 235Y и 331S. В данном документе представлен вариант Fc, где Fc-участок содержит по меньшей мере одну аминокислоту, не встречающуюся в природе, в одном или нескольких положениях, выбранных из группы, состоящей из 239, 330 и 332. В некоторых вариантах осуществления аминокислоты, не встречающиеся в природе, выбраны из группы, состоящей из 239D, 330L и 332E.
В некоторых вариантах осуществления в данном документе представлено антитело с вариантом Fc, где Fc-участок содержит по меньшей мере одну аминокислоту, не встречающуюся в природе, в одном или нескольких положениях, выбранных из группы, состоящей из 252, 254 и 256. В определенных вариантах осуществления аминокислоты, не встречающиеся в природе, выбраны из группы, состоящей из 252Y, 254T и 256E, описанных в патенте США № 7083784, содержание которого включено в данный документ во всей своей полноте посредством ссылки.
В определенных вариантах осуществления эффекторные функции, проявляемые антителами IgG, в значительной степени зависят от углеводного фрагмента, соединенного с Fc-участком белка. Таким образом, гликозилирование Fc-участка можно модифицировать для усиления или ослабления эффекторной функции. Соответственно в некоторых вариантах осуществления Fc-участки антител к альфа-токсину и антигенсвязывающие фрагменты, представленные в данном документе, содержат аминокислотные остатки с измененным гликозилированием. В определенных вариантах осуществления изменение гликозилирования аминокислотных остатков приводит к ослаблению эффекторной функции. В определенных вариантах осуществления изменение гликозилирования аминокислотных остатков приводит к усилению эффекторной функции. В некоторых вариантах осуществления Fc-участок характеризуется пониженным фукозилированием. В определенных вариантах осуществления Fc-участок является нефукозилированным.
В некоторых вариантах осуществления варианты Fc в данном документе могут быть объединены с другими известными вариантами Fc, как известно в данной области техники. Могут быть введены другие модификации, и/или замены, и/или добавления, и/или делеции в Fc-домен. В конкретных вариантах осуществления антитело к АТ по настоящему изобретению, содержащее вариант Fc-домена, содержит VH-IgG1-YTE, соответствующий SEQ ID NO: 80, и/или VL-каппа, соответствующий SEQ ID NO: 81.
ТИПИЧНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ ДЛЯ АНТИТЕЛ К AT S. AUREUS
ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ, СОДЕРЖАЩИЕ АНТИТЕЛА К АТ И ИХ АНТИГЕНСВЯЗЫВАЮЩИЕ ФРАГМЕНТЫ
Также представлены фармацевтические составы, содержащие антитело к альфа-токсину или его антигенсвязывающий фрагмент, описанные в данном документе, и носитель. Такие составы можно легко вводить различными способами, описанными во всем данном документе. В некоторых вариантах осуществления состав содержит фармацевтически приемлемый носитель.
Как используется в данном документе, фармацевтические составы, содержащие антитело к альфа-токсину или его антигенсвязывающий фрагмент, называются составами по технологии. Выражение «фармацевтически приемлемый носитель» означает один или несколько нетоксичных материалов, которые не препятствуют эффективности биологической активности активных ингредиентов. Такие препараты, как правило, могут содержать соли, буферные средства, консерванты, совместимые носители и необязательно другие терапевтические средства. Такие фармацевтически приемлемые препараты, как правило, также могут содержать совместимые твердые или жидкие наполнители, разбавители или инкапсулирующие вещества, которые пригодны для введения в организм человека. Выражение «носитель» обозначает органический или неорганический ингредиент, природный или синтетический, с которым объединяют активный ингредиент для облегчения применения. Компоненты фармацевтических композиций также способны смешиваться с антителами и антигенсвязывающими фрагментами, описанными в данном документе, а также друг с другом таким образом, что отсутствует взаимодействие, которое могло бы существенно уменьшить желаемую фармацевтическую эффективность.
Фармацевтические композиции, описанные в данном документе, могут быть составлены для индивидуального дозирования. Схемы дозирования можно корректировать для обеспечения оптимального желаемого ответа. Например, можно вводить одну болюсную дозу, можно вводить несколько дробных доз в течение некоторого времени, или дозу можно пропорционально уменьшить или увеличить, что определяется потребностями терапевтической ситуации. Особенно преимущественным является составление композиций для парентерального применения в виде лекарственной формы с однократной дозировкой для удобства введения и однородности дозирования. Лекарственная форма с однократной дозировкой, как используется в данном документе, относится к физически дискретным единицам, пригодным в качестве однократных доз для субъектов, подлежащих лечению; при этом каждая единица содержит предварительно определенное количество активного соединения (т. е. антитела или антигенсвязывающего фрагмента), рассчитанное для получения желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Требования для лекарственных форм с однократной дозировкой обусловлены (a) характерными признаками антигенсвязывающего фрагмента или антитела к альфа-токсину и конкретным терапевтическим эффектом, который должен быть достигнут, а также (b) ограничениями в данной области техники, сопряженными с составлением такого антигенсвязывающего фрагмента или антитела к альфа-токсину для лечения чувствительности у индивидов, и непосредственно зависят от таковых.
Терапевтические композиции по настоящей технологии могут быть составлены для конкретных путей введения, таких как пероральное, назальное, легочное, местное (включая трансбуккальное и сублингвальное), ректальное, вагинальное и/или парентеральное введение. Составы в целях удобства можно представить в лекарственной форме с однократной дозировкой и можно получать любыми способами, известными в области фармации. Количество активного ингредиента (т. е. антитела или антигенсвязывающего фрагмента), которое можно объединять с материалом-носителем для получения единичной лекарственной формы, будет варьировать в зависимости от субъекта, подвергаемого лечению, и конкретного способа введения. Количество активного ингредиента, которое можно объединить с материалом-носителем для получения единичной лекарственной формы будет, как правило, таким количеством композиции, которое вызывает терапевтический эффект.
ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, АССОЦИИРОВАННЫХ С S. AUREUS
В настоящем изобретении также представлены способы предупреждения и/или лечения заболеваний и состояний, ассоциированных с S. aureus, в том числе, например, бактериемии и сепсиса, с помощью антител к альфа-токсину S. aureus (антител к АТ) и их антигенсвязывающих фрагментов. Также представлены способы предупреждения и/или лечения заболеваний и состояний, ассоциированных с S. aureus, в том числе, например, пневмонии у пациентов с ослабленным иммунитетом, с помощью антител к альфа-токсину S. aureus (антител к АТ) и их антигенсвязывающих фрагментов.
Любые антитела к АТ или их антигенсвязывающие фрагменты, описанные во всем данном документе, а также мутантные формы, варианты и производные таких антител можно использовать в различных способах, описанных в данном документе. Хотя иллюстративные антитела к АТ и их антигенсвязывающие фрагменты описаны в данном документе для применения в различных способах и представлены в разделе «Примеры», следует понимать, что любое антитело к АТ или его антигенсвязывающий фрагмент, известные из уровня техники, и, в частности, таковые, описанные в данном документе и раскрытые в опубликованной международной заявке на патент № WO 2012/109285, раскрытие которой включено в данный документ во всей своей полноте посредством ссылки, можно использовать в различных способах.
Бактериемия, также известная как заражение крови, возникает, когда бактерии S. aureus попадают в кровоток млекопитающего, в том числе людей. Постоянная лихорадка является одним из признаков бактериемии. Бактерии могут распространяться в глубоко расположенные участки тела, вызывая инфекции, поражающие внутренние органы, такие как головной мозг, сердце, легкие, кости и мышцы, или имплантированные хирургическим путем устройства, такие как искусственные суставы или кардиостимуляторы. Одним из отличительных признаков сепсиса, вызываемого S. aureus, является агглютинация бактерий и формирование очагов тромбоэмболического поражения, которые можно оценить как количество колониеобразующих единиц (CFU) бактерий в сердце (McAdow et al., 2011).
В вариантах осуществления представлены способы предупреждения сепсиса, ассоциированного с S. aureus, у субъекта-млекопитающего или уменьшения тяжести сепсиса, ассоциированного с S. aureus, у субъекта-млекопитающего. Такие способы в подходящем случае включают введение субъекту эффективного количества выделенного антитела к альфа-токсину S. aureus (антитела к АТ) или его антигенсвязывающего фрагмента, в том числе выделенных антигенсвязывающих фрагментов или антител к альфа-токсину S. aureus (антител к АТ), описанных в данном документе или иначе известных в данной области техники.
Способы предупреждения сепсиса, ассоциированного с S. aureus, у субъекта-млекопитающего в подходящем случае включают введение эффективного количества выделенного антитела к АТ или его антигенсвязывающего фрагмента субъекту до события инфицирования. Как используется в данном документе, «событие инфицирования» относится к событию, при котором субъект подвергается или мог бы подвергнуться воздействию инфекции, вызываемой S. aureus. Иллюстративные события инфицирования включают, без ограничения, хирургическое вмешательство на любой части тела, включая голову, ротовую полость, кисти, руки, ноги, туловище, внутренние органы (например, сердце, головной мозг, кишечник, почки, желудок, легкие, печень, селезенку, поджелудочную железу и т. д.), кости, кожу. Хирургическое вмешательство обеспечивает условия, такие как открытые хирургические раны и органы, которые могут быть легко инфицированы S. aureus. Дополнительные события инфицирования включают травму любой части тела, при которой образуются открытые раны или предоставляется иной доступ к кровотоку, посредством которого инфекция, вызываемая S. aureus, может попасть в организм. Дополнительные события инфицирования включают гемотрансфузии, инъекции лекарственных препаратов или неразрешенных законодательством или разрешенных законодательством лекарственных средств, уколы иглой, иглами для татуировок, введение и присутствие внутривенных (IV) катетеров, введение и присутствие хирургических дренажных трубок и наличие участков разрушения кожи, например, пролежней (декубитальных язв).
В вариантах осуществления, в которых способы обеспечивают предупреждение сепсиса, ассоциированного с S. aureus, антитело к АТ или его антигенсвязывающий фрагмент в подходящем случае вводят по меньшей мере за 1 час до события инфицирования. Например, по меньшей мере за 1 час до хирургического вмешательства (события инфицирования). В подходящем случае антитело к АТ или его антигенсвязывающий фрагмент вводят по меньшей мере за 6 часов, по меньшей мере за 12 часов, по меньшей мере за 18 часов, по меньшей мере за 24 часа, по меньшей мере за 30 часов, по меньшей мере за 36 часов, по меньшей мере за 42 часа, по меньшей мере за 48 часов или более до события инфицирования. В вариантах осуществления антитело к АТ или его антигенсвязывающий фрагмент в подходящем случае вводят за от приблизительно 6 часов до приблизительно 36 часов, от приблизительно 6 часов до приблизительно 36 часов, от приблизительно 12 часов до приблизительно 36 часов, от приблизительно 12 часов до приблизительно 24 часов, от приблизительно 24 часов до приблизительно 36 часов, от приблизительно 20 часов до приблизительно 30 часов, от приблизительно 20 часов до приблизительно 28 часов, от приблизительно 22 часов до приблизительно 26 часов или приблизительно за 12 часов, приблизительно за 13 часов, приблизительно за 14 часов, приблизительно за 15 часов, приблизительно за 16 часов, приблизительно за 17 часов, приблизительно за 18 часов, приблизительно за 19 часов, приблизительно за 20 часов, приблизительно за 21 час, приблизительно за 22 часа, приблизительно за 23 часа, приблизительно за 24 часа, приблизительно за 25 часов, приблизительно за 26 часов, приблизительно за 27 часов, приблизительно за 28 часов, приблизительно за 29 часов, или приблизительно за 30 часов, или приблизительно за 31 час, или приблизительно за 32 часа, или приблизительно за 33 часа, или приблизительно за 34 часа, или приблизительно за 35 часов, или приблизительно за 36 часов до события инфицирования.
Как используется в данном документе, «предупреждение» сепсиса, ассоциированного с S. aureus, относится к снижению риска возникновения у субъекта сепсиса, ассоциированного с S. aureus, во время события инфицирования. В подходящем случае риск возникновения у субъекта сепсиса, ассоциированного с S. aureus, снижается по меньшей мере на 30% по сравнению с субъектом, которому не вводили антигенсвязывающий фрагмент или антитело к АТ до события инфицирования. В более подходящем случае риск снижается по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или риск полностью устраняется по сравнению с субъектом, которому не вводили антигенсвязывающий фрагмент или антитело к АТ до события инфицирования.
В способах уменьшения тяжести сепсиса, ассоциированного с S. aureus, у субъекта-млекопитающего такие способы в подходящем случае включают введение эффективного количества выделенного антитела к альфа-токсину S. aureus (антитела к АТ) или его антигенсвязывающего фрагмента субъекту, у которого наблюдаются симптомы сепсиса, ассоциированного с S. aureus. Такие симптомы могут включать, например, озноб, спутанность сознания или бред, лихорадку или низкую температуру тела (гипотермию), головокружение, обусловленное низким кровяным давлением, учащенное сердцебиение, тремор, кожную сыпь и горячие кожные покровы.
Как используется в данном документе, «уменьшение тяжести» при применении по отношению к сепсису относится к уменьшению интенсивности симптомов, наблюдающихся у субъекта, у которого возник сепсис, ассоциированный с S. aureus. В подходящем случае интенсивность симптомов уменьшается по меньшей мере на 30% по сравнению с интенсивностью симптомов, наблюдающихся у субъекта, у которого также возник сепсис, ассоциированный с S. aureus, но при этом данному субъекту не вводили антитело к АТ или его антигенсвязывающий фрагмент. В более подходящем случае интенсивность симптомов уменьшается по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или симптомы полностью устраняются (т. е. субъект излечивается от инфекции и сепсиса) по сравнению с субъектом, которому не вводили антитело к АТ или его антигенсвязывающий фрагмент до события инфицирования.
Как используется в данном документе, выражения «лечить», «лечат» или «лечение» может относиться к терапевтическому лечению и профилактическим или предупредительным мерам, при которых целью является предупреждение или замедление (уменьшение интенсивности) нежелательного физиологического изменения или нарушения, такого как прогрессирование заболевания. Благоприятные или желаемые клинические результаты включают, без ограничения, смягчение симптомов, уменьшение степени заболевания, стабилизацию (т. е. отсутствие ухудшения) состояния заболевания, задержку или замедление прогрессирования заболевания, улучшение или облегчение состояния заболевания. «Лечение» может также означать увеличение выживаемости по сравнению с ожидаемой выживаемостью в том случае, если лечение не было получено. К тем, кто нуждается в лечении, относятся те, у кого уже есть состояние или нарушение, а также те, кто склонен иметь состояние или нарушение, или те, у кого нужно предупредить состояние или нарушение.
В подходящем случае субъектами, которым можно вводить антитела к АТ или их антигенсвязывающие фрагменты различными способами, описанными в данном документе, являются млекопитающие, такие как, например, люди, собаки, кошки, приматы, крупный рогатый скот, овцы, лошади, свиньи и т. д.
Антитело или его антигенсвязывающий фрагмент, описанные в данном документе, можно вводить в подходящей дозировке и при подходящей схеме дозирования, и такие дозировка и схема дозирования могут зависеть от заболевания или состояния. «Эффективную дозировку» можно установить, определив, вызывает ли дозировка и схема дозирования терапевтический эффект или терапевтический результат (например, предупреждение). Дозирование антитела или его антигенсвязывающего фрагмента может быть обеспечено однократным введением или многократными введениями с промежутками в соответствии с желаемыми эффектами и другими клиническими соображениями.
Иллюстративные способы, с помощью которых антитело к АТ или его антигенсвязывающий фрагмент можно вводить субъекту в любом из различных способов, описанных в данном документе, включают, без ограничения, внутривенное (IV), внутриопухолевое (IT), внутриочаговое (IL), аэрозольное, чрескожное, эндоскопическое, местное, внутримышечное (IM), внутрикожное (ID), внутриглазное (IO), внутрибрюшинное (IP), трансдермальное (TD), интраназальное (IN), интрацеребральное (IC), внутриорганное (например, внутрипеченочное), подкожное введение, или введение с помощью имплантата с медленным высвобождением лекарственного вещества, или введение с помощью осмотического или механического насоса.
В дополнительных вариантах осуществления представлены способы уменьшения бактериальной нагрузки S. aureus в кровотоке или сердце субъекта-млекопитающего. Такие способы в подходящем случае включают введение субъекту эффективного количества выделенного антитела к альфа-токсину S. aureus (антитела к АТ) или его антигенсвязывающего фрагмента.
В подходящем случае бактериальную нагрузку в кровотоке или сердце субъекта-млекопитающего измеряют с помощью способов, известных в данной области техники, для определения количества бактерий, в подходящем случае бактериальных колоний S. aureus, в кровотоке или сердце. Например, бактериальную нагрузку в подходящем случае измеряют путем высевания образца из организма на чашку с агаром, инкубирования чашки, а затем подсчета количества колониеобразующих единиц (CFU) на чашке. Такие способы хорошо известны в данной области техники. Можно также использовать дополнительные подходящие способы определения бактериальной нагрузки. В подходящем случае собранный образец получен из образца крови, взятого из организма в целом или из конкретного органа в частности.
В подходящем случае бактериальная нагрузка (т. е. количество бактерий, измеренное в колониеобразующих единицах) в организме субъекта, инфицированного S. aureus, уменьшается по меньшей мере на 30% у субъектов, подвергнутых лечению с помощью антител к АТ или их антигенсвязывающих фрагментов, по сравнению с субъектами, которые также были инфицированы S. aureus, но при этом данным субъектам не вводили антитело к АТ или его антигенсвязывающий фрагмент. В более подходящем случае количество бактерий уменьшается по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или бактериальная нагрузка полностью устраняется по сравнению с субъектом, которому не вводили антигенсвязывающий фрагмент или антитело к АТ.
В подходящем случае антитела к АТ или их антигенсвязывающие фрагменты вводят как можно скорее после диагностирования инфекции, вызванной S. aureus, например, в течение нескольких часов или дней. Продолжительность введения и количество антигенсвязывающих фрагментов или антител к АТ, которое необходимо вводить, может без труда определить специалист в данной области.
Также представлены способы уменьшения агглютинации бактерий S. aureus и/или формирования очагов тромбоэмболического поражения у субъекта-млекопитающего. В подходящем случае такие способы включают введение указанному субъекту эффективного количества выделенного антитела к альфа-токсину S. aureus (антитела к АТ) или его антигенсвязывающего фрагмента, в том числе антител к альфа-токсину S. aureus (антител к АТ) или их антигенсвязывающих фрагментов, описанных в данном документе или иначе известных в данной области техники.
Как описано в данном документе, способы уменьшения агглютинации бактерий S. aureus относятся к снижению степени агрегации бактерий S. aureus при контакте с кровью и/или в органе. Иллюстративные способы измерения агглютинации бактерий известны в данной области техники, включая, например, описанные в McAdow et al., PLos Pathogens 7:e1002307 (2011), раскрытие которой включено в данный документ во всей своей полноте посредством ссылки. В подходящем случае способы, представленные в данном документе, позволяют также снижать формирование очагов тромбоэмболического поражения в кровотоке и/или органах субъекта. Способы измерения формирования очагов тромбоэмболического поражения известны в данной области техники и включают, например, магнитно-резонансную томографию (MRI), исследование методом компьютерной томографии (CT) или аксиальной компьютерной томографии (CAT) или другие подходящие способы визуализации.
Способы уменьшения агглютинации бактерий S. aureus и/или формирования очагов тромбоэмболического поражения у субъекта-млекопитающего в подходящем случае приводят в результате к уменьшению агглютинации бактерий и/или формирования очагов тромбоэмболического поражения по меньшей мере на 30% у субъектов, обработанных антителами к АТ или их антигенсвязывающими фрагментами, по сравнению с субъектами, которые также были инфицированы S. aureus, но при этом данным субъектам не вводили антитело к АТ или его антигенсвязывающий фрагмент. В более подходящем случае агглютинация бактерий и/или формирование очагов тромбоэмболического поражения уменьшаются по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или агглютинация бактерий и/или формирование очагов тромбоэмболического поражения полностью устраняются по сравнению с субъектом, которому не вводили антитело к АТ или его антигенсвязывающий фрагмент.
В подходящем случае способы предупреждения сепсиса, ассоциированного с S. aureus, у субъекта-млекопитающего или уменьшения тяжести сепсиса, ассоциированного с S. aureus, у субъекта-млекопитающего также приводят в результате к уменьшению бактериальной нагрузки в кровотоке или сердце субъекта. В других вариантах осуществления способы предупреждения сепсиса, ассоциированного с S. aureus, у субъекта-млекопитающего или уменьшения тяжести сепсиса, ассоциированного с S. aureus, у субъекта-млекопитающего также приводят в результате к уменьшению агглютинации бактерий и/или формирования очагов тромбоэмболического поражения у субъекта.
В дополнительных вариантах осуществления представлены способы предупреждения или уменьшения тяжести пневмонии, ассоциированной с S. aureus, у субъекта-млекопитающего с ослабленным иммунитетом. Такие способы в подходящем случае включают введение субъекту эффективного количества выделенного антитела к альфа-токсину S. aureus (антитела к АТ) или его антигенсвязывающего фрагмента.
Как описано в данном документе, неожиданно было обнаружено, что субъектам-млекопитающим с ослабленным иммунитетом можно вводить антитела к АТ или их антигенсвязывающие фрагменты для того, чтобы предупредить пневмонию, ассоциированную с S. aureus, либо уменьшить тяжесть пневмонии, ассоциированной с S. aureus, у субъектов, которые уже были заражены пневмонией.
Как используется в данном документе, «с ослабленным иммунитетом» относится к субъектам-млекопитающим, у которых не способен развиться нормальный иммунный ответ, и обычно такие субъекты страдают нейтропенией, что означает патологически низкое количество нейтрофилов. Тяжесть нейтропении определяется абсолютным числом нейтрофилов (ANC), измеряемым как число клеток на микролитр крови. Мягкая нейтропения (1000≤ANC<1500); умеренная нейтропения (500≤ANC<1000) и тяжелая нейтропения (ANC<500) являются общепринятыми уровнями, определяемыми специалистами в данной области.
Как используется в данном документе, «предупреждение» пневмонии, ассоциированной с S. aureus, у субъекта-млекопитающего с ослабленным иммунитетом относится к уменьшению риска возникновения у субъекта с ослабленным иммунитетом пневмонии, ассоциированной с S. aureus, во время события инфицирования. В подходящем случае риск возникновения у субъекта с ослабленным иммунитетом пневмонии, ассоциированной с S. aureus, уменьшается по меньшей мере на 30% по сравнению с субъектом с ослабленным иммунитетом, которому не вводили антигенсвязывающий фрагмент или антитело к АТ до события инфицирования. В более подходящем случае риск уменьшается по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или риск полностью устраняется по сравнению с субъектом с ослабленным иммунитетом, которому не вводили антитело к АТ или его антигенсвязывающий фрагмент до события инфицирования.
В способах уменьшения тяжести пневмонии, ассоциированной с S. aureus, у субъекта-млекопитающего такие способы в подходящем случае включают введение эффективного количества выделенного антитела к альфа-токсину S. aureus (антитела к АТ) или его антигенсвязывающего фрагмента субъекту, у которого наблюдаются симптомы пневмонии, ассоциированной с S. aureus. Такие симптомы могут включать, например, кашель, боль в груди, лихорадку и затрудненное дыхание.
Как используется в данном документе, «уменьшение тяжести» при применении по отношению к пневмонии относится к уменьшению интенсивности симптомов, которые наблюдаются у субъекта (в подходящем случае у субъекта с ослабленным иммунитетом), у которого возникла пневмония, ассоциированная с S. aureus. В подходящем случае интенсивность симптомов уменьшается по меньшей мере на 30% по сравнению с симптомами, которые наблюдаются у субъекта, у которого также возникла пневмония, ассоциированная с S. aureus, но при этом данному субъекту не вводили антитело к АТ или его антигенсвязывающий фрагмент. В более подходящем случае интенсивность симптомов уменьшается по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или симптомы полностью устраняются (т. е. субъект излечивается от инфекции и, таким образом, пневмонии) по сравнению с субъектом с ослабленным иммунитетом, которому не вводили антитело к АТ или его антигенсвязывающий фрагмент до события инфицирования.
Как описано в данном документе, в подходящем случае различные способы осуществляют по отношению к субъектам-млекопитающим, которыми являются люди, в том числе взрослые любого возраста и дети.
В подходящем случае в способах, описанных в данном документе, антитела или их антигенсвязывающие фрагменты, которые вводят, представляют собой выделенные антигенсвязывающие фрагменты Fv, Fab, Fab' и F(ab')2. В дополнительных вариантах осуществления антитело является антителом полной длины, описанным в данном документе. В подходящем случае антитело содержит вариант Fc-участка, подробно описанный во всем данном документе.
В способах, описанных во всем данном документе, в подходящем случае используют выделенные антитела или их антигенсвязывающие фрагменты, которые иммуноспецифически связываются с полипептидным альфа-токсином Staphylococcus aureus. Такие антитела и их антигенсвязывающие фрагменты в подходящем случае содержат
(a) CDR1 VH, содержащий аминокислотную последовательность SEQ ID NO: 7, 10, 13 или 69;
(b) CDR2 VH, содержащий аминокислотную последовательность SEQ ID NO: 8, 11, 14, 17, 70 или 75;
(c) CDR3 VH, содержащий аминокислотную последовательность SEQ ID NO: 9, 12, 15, 18, 16, 65, 66, 67, 71, 72, 76 или 78;
(d) CDR1 VL, содержащий аминокислотную последовательность SEQ ID NO: 1 или 4;
(e) CDR2 VL, содержащий аминокислотную последовательность SEQ ID NO: 2, 5, 73 или 77; и
(f) CDR3 VL, содержащий аминокислотную последовательность SEQ ID NO: 3, 6, 64, 68 или 74.
Кроме того, также можно использовать мутантные формы, варианты и производные таких антител или антигенсвязывающих фрагментов, а также антитела или их антигенсвязывающие фрагменты, по меньшей мере на 90% идентичные указанным аминокислотным последовательностям.
В дополнительных вариантах осуществления в различных способах, описанных в данном документе, используют антитела или их антигенсвязывающие фрагменты, содержащие CDR, в том числе, например, CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL, соответствующие аминокислотным последовательностям SEQ ID NO: 7, 8, 9, 1, 2 и 3; SEQ ID NO: 10, 11, 12, 1, 2 и 3; SEQ ID NO: 13, 14, 15, 4, 5 и 6; SEQ ID NO: 7, 17, 18, 1, 2 и 3; SEQ ID NO: 7, 8, 16, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1, 2 и 64; SEQ ID NO: 7, 8, 66, 1, 2 и 64; SEQ ID NO: 7, 8, 67, 1, 2 и 68; SEQ ID NO: 7, 8, 67, 1, 2 и 64; SEQ ID NO: 7, 8, 78, 1, 2 и 64; SEQ ID NO: 7, 8, 65, 1, 2 и 68; SEQ ID NO: 69, 70, 71, 1, 2 и 68; SEQ ID NO: 7, 8, 72, 1, 73 и 74; SEQ ID NO: 69, 75, 71, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 2 и 68; SEQ ID NO: 69, 75, 76, 1, 77 и 74; SEQ ID NO: 69, 70, 71, 1, 77 и 74.
В вариантах осуществления выделенное антитело к АТ или его антигенсвязывающий фрагмент, используемые в различных способах, описанных в данном документе, содержат вариабельный домен тяжелой цепи, по меньшей мере на 90% идентичный аминокислотной последовательности SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62, и содержат вариабельный домен легкой цепи, по меньшей мере на 90% идентичный аминокислотной последовательности SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
В еще нескольких дополнительных вариантах осуществления способов, описанных в данном документе, используемое выделенное антитело к АТ или его антигенсвязывающий фрагмент содержат вариабельный домен тяжелой цепи с SEQ ID NO: 20, 22, 24, 26, 28, 41, 43, 45, 47, 49, 51, 53, 55, 57, 79, 59, 61 или 62 и вариабельный домен легкой цепи с SEQ ID NO: 19, 21, 23, 25, 27, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60 или 63.
В дополнительных вариантах осуществления в способах, описанных в данном документе, используют антитела к АТ или их антигенсвязывающие фрагменты, содержащие VH и VL, соответствующие аминокислотным последовательностям SEQ ID NO: 20 и 19; SEQ ID NO: 22 и 21; SEQ ID NO: 24 и 23; SEQ ID NO: 26 и 25; SEQ ID NO: 28 и 27; SEQ ID NO: 41 и 42; SEQ ID NO: 43 и 44; SEQ ID NO: 45 и 46; SEQ ID NO: 47 и 48; SEQ ID NO: 47 и 48; SEQ ID NO: 49 и 50; SEQ ID NO: 51 и 52; SEQ ID NO: 51 и 52; SEQ ID NO: 53 и 54; SEQ ID NO: 55 и 56; SEQ ID NO: 57 и 58; SEQ ID NO: 59 и 60; SEQ ID NO: 61 и 58; SEQ ID NO: 62 и 58; SEQ ID NO: 62 и 63; SEQ ID NO: 79 и 63.
В подходящих вариантах осуществления выделенное антитело к АТ включает в себя выделенное антитело к АТ, содержащее вариант Fc-домена, где антитело содержит VH-IgG1-YTE, соответствующий SEQ ID NO: 80, и/или VL-каппа, соответствующий SEQ ID NO: 81.
ПРИМЕРЫ
Пример 1. Создание модели сепсиса
Приготовление дозы контрольного заражения бактериями
SF8300 (USA300) S. aureus получали от Binh Diep (Калифорнийский университет в Сан-Франциско). Бактерии культивировали в течение ночи при 37°C в 50 мл триптического соевого бульона (TSB) с перемешиванием при 250 об/мин. Десять мл из суточной культуры добавляли к 1 л свежего TSB, и бактерии выращивали при 37°C с перемешиванием до оптической плотности 0,8 при 600 нм (OD600). Бактерии извлекали посредством центрифугирования при 8000 об/мин в течение 15 мин при 4°C и промывали в фосфатно-солевом буфере (PBS). Бактерии собирали посредством центрифугирования и повторно суспендировали в PBS с 10% глицерином до конечной концентрации бактерий в исходном растворе ~2×1010 CFU/мл.
Контрольное заражение и выживаемость мышей
Мышам BALB/c в группах из десяти самок в возрасте 8-9 недель внутрибрюшинно (IP) инъецировали LC10 в указанных концентрациях или mAb R347 (45 мг/кг) в 500 мкл PBS. Животных через 24 ч подвергали контрольному заражению путем внутривенного (IV) введения в хвостовую вену 200 мкл бактериальной суспензии (5×107 CFU, разбавленных в PBS, pH 7,2, из замороженного исходного раствора). Отслеживали выживаемость мышей в течение 14 дней после контрольного заражения. Статистический анализ проводили с применением логарифмического рангового критерия: животные, иммунизированные с помощью R347 (контроля), по сравнению с животными, иммунизированными с помощью LC10 (Ab к АТ).
Бактериальная нагрузка в сердце
Инфицированных мышей умерщвляли при помощи CO2 через 14 ч после инфицирования. Сердце удаляли, гомогенизировали в пробирках с лизирующей матрицей A в 1 мл холодного PBS и высевали на чашки с TSA для подсчета бактерий. Бактериальную нагрузку в ткани сердца анализировали путем попарного сравнения mAb R347 и LC10 с применением непарного двустороннего t-критерия Стьюдента. Данные считались значимыми, если p<0,05.
Бактериальная нагрузка в крови
Животных умерщвляли при помощи CO2 через 8, 24, 48, 72 и 144 ч после инфицирования. Кровь собирали посредством пункции сердца, и 100 мкл незамедлительно высевали на чашку с TSB для подсчета CFU. Данные анализировали при помощи непарного t-критерия Стьюдента. Значения для mAb LC10 и R347 считались статистически различными, если p<0,05.
Пример 2. Профилактический эффект антител к АТ при сепсисе
Чтобы определить, будет ли ингибирование AT, опосредованное антителами к АТ, влиять на прогрессирование сепсиса, группы из 10 мышей подвергали пассивной иммунизации с помощью LC10 (45 и 15 мг/кг) или изотипического контроля (R347, 45 мг/кг) за 24 ч до IV контрольного заражения с помощью SF8300 (USA300) S. aureus, и выживаемость отслеживали в течение 14 дней. Профилактика с помощью LC10 значительно увеличивала выживаемость, что указывало на то, что AT играет ключевую роль в системном заболевании, вызываемом S. aureus, и что его ингибирование с помощью LC10 защищает животных от смерти (фигура 1).
Одним из отличительных признаков сепсиса, вызываемого S. aureus, является агглютинация бактерий и формирование очагов тромбоэмболического поражения, которые можно оценить как количество CFU бактерий в сердце (McAdow et al., 2011). Чтобы определить, уменьшила ли профилактика с помощью LC10 бактериальную нагрузку в сердце, мышей подвергали пассивной иммунизации с помощью LC10 (15 и 45 мг/кг) или R347 (45 мг/кг) за 24 ч до IV инфицирования с помощью SF8300. Через четырнадцать часов после инфицирования животных умерщвляли, и их сердца обрабатывали для подсчета CFU. У мышей, подвергнутых пассивной иммунизации с помощью LC10, наблюдалось значительное уменьшение количества CFU в сердце по сравнению с мышами, которые получали контрольное R347 (фигура 2).
Эффект профилактики с помощью LC10 в отношении количества бактерий в крови также оценивали через 24-72 ч после IV инфицирования. Количество бактерий в кровотоке инфицированных мышей для мышей, обработанных с помощью R347, сохранялось на уровне ~103 CFU в течение 72 ч. Однако профилактика с помощью LC10 привела в результате к уменьшению бактериальной нагрузки во все исследуемые моменты времени с максимальным уменьшением величины на 2 порядка через 72 ч (фигура 3). Данные результаты указывают на то, что AT важен для прогрессирования сепсиса, и ингибирование AT с помощью LC10 уменьшает количество CFU бактерий в кровотоке и сердце и способствует увеличению выживаемости после IV контрольного заражения смертельной дозой S. aureus.
Пример 3. Создание модели пневмонии у индивидов с ослабленным иммунитетом
У индивидов с ослабленным иммунитетом, в частности у индивидов, страдающих нейтропенией, имеется повышенный риск инфекций, вызываемых S. aureus (Andrews and Sullivan, 2003; Bouma et. al., 2010). Для изучения эффективности антител к АТ для применения при предупреждении пневмонии, вызываемой S. aureus, у индивидов с ослабленным иммунитетом разрабатывали и использовали модель пневмонии у мышей с ослабленным иммунитетом. Чтобы сымитировать инфекцию в популяции индивидов с ослабленным иммунитетом, у мышей вызывали нейтропению путем введения циклофосфамида, алкилирующего средства, которое, как известно, приводит к истощению популяции лейкоцитов, в том числе нейтрофилов, лимфоцитов и тромбоцитов, у мышей (Zuluaga, et. al. 2006).
Проводили эксперименты, чтобы определить оптимальную схему дозирования циклофосфамида (CPM), необходимую для уменьшения количества циркулирующих иммунных клеток у мышей C57BL/6 на >90%. Порошкообразный CPM растворяли в стерильной воде для инъекции до конечной концентрации 20 мг/мл. Мышей в группах из 20 особей обрабатывали посредством внутрибрюшинной инъекции в дни 0 и 3 при различных схемах дозирования CPM. Животных в группах из 5 особей умерщвляли в дни 0, 1, 4 и 6 и кровь собирали посредством пункции сердца в пробирки Vacutainer с EDTA. Результаты дифференциального подсчета лейкоцитов (WBC) (нейтрофилов, лимфоцитов) затем получали при помощи автоматического гематологического анализатора Sysmex.
Мышиная модель пневмонии
Приготовление дозы контрольного заражения бактериями
SF8300 (USA300) S. aureus культивировали в течение ночи при 37°C в 50 мл триптического соевого бульона (TSB) с перемешиванием при 250 об/мин. Десять мл суточной культуры добавляли к 1 л свежего TSB и бактерии выращивали при 37°C с перемешиванием до оптической плотности 0,8 при 600 нм (OD600). Бактерии извлекали посредством центрифугирования при 8000 об/мин в течение 15 мин при 4°C и промывали в фосфатно-солевом буфере (PBS). Бактерии снова собирали посредством центрифугирования и повторно суспендировали в PBS с 10% глицерином до конечной концентрации бактерий в исходном растворе 2×1010 CFU/мл.
Модель пневмонии у мышей с ослабленным иммунитетом
Сперва определяли минимальную смертельную дозу S. aureus для мышей с ослабленным иммунитетом в эксперименте с титрованием дозы контрольного заражения. Через двадцать четыре часа после введения второй дозы CPM мышей с ослабленным иммунитетом анестезировали изофлураном перед инокуляцией 50 мкл суспензии S. aureus (от 1×107 до 2×108 CFU) в левую и правую ноздрю. Животных помещали в клетку в положении на спине для восстановления и наблюдали в отношении смертности в течение периода 7 дней.
Пример 4. Профилактический эффект антител к стафилококковому AT при пневмонии на фоне нейтропении
Исследование эффективности mAb к АТ в модели пневмонии у индивидов с ослабленным иммунитетом
В данном эксперименте использовали 30 животных, случайным образом разделенных на 3 группы. Животным вводили CPM за 4 дня и за 1 день до инфицирования. В каждой группе также вводили LC10 (45 или 15 мг/кг) либо R347 (45 мг/кг) за 24 ч (день -1) до интраназального (IN) контрольного заражения с помощью SF8300 S. aureus (5×107), и выживаемость наблюдали в течение периода до 7 дней. Статистическую значимость определяли при помощи логарифмического рангового критерия.
Подтверждение иммунодефицита
Проводили эксперименты для того, чтобы определить оптимальную схему дозирования CPM для уменьшения количества WBC, включая нейтрофилы, на 90%. Мышей в группах из 20 особей обрабатывали согласно 6 различным схемам дозирования CPM в дни 0 и 3. Образцы крови от 5 мышей в каждой группе дозирования собирали в дни 0, 1, 4 и 6 и осуществляли подсчет общего числа лейкоцитов и дифференциальный подсчет лейкоцитов при помощи автоматического гематологического анализатора Sysmex. В дни 4 и 6 у животных в группе 6 (1-я доза CPM 150 мг/кг; 2-я доза CPM 100 мг/кг (CPM150/100)) наблюдалось уменьшение общего количества WBC на 90% по сравнению с необработанными животными. В данной группе имело место уменьшение количества нейтрофилов и лимфоцитов на 90% в день 4 и день 6 (фигура 4). Количество лейкоцитов начинало восстанавливаться в день 7. Данные результаты соответствуют результатам, о которых сообщалось ранее (Zuluaga et al., 2006). Таким образом, дозу CPM 150/100 выбирали для оценки профилактики с помощью LC10 у животных с ослабленным иммунитетом.
Определение дозы контрольного заражения бактериями в модели пневмонии у индивидов с ослабленным иммунитетом
Для определения минимальной смертельной дозы контрольного заражения для животных с ослабленным иммунитетом SF8300 S. aureus титровали (от 2×108 до 1×107 CFU) с помощью IN контрольного заражения в группах из 5 мышей. Смертность наблюдали в течение 7 дней (фигура 5). Наиболее низкая смертельная доза составляла 5×107 CFU, и ее выбирали как дозу для исследования профилактики с помощью LC10.
LC10 увеличивает выживаемость у животных с пневмонией с ослабленным иммунитетом
Для того, чтобы понять эффект профилактики с помощью LC10 у мышей с ослабленным иммунитетом, животным, которым инъецировали CPM, вводили LC10 (45 или 15 мг/кг) или R347 при 45 мг/кг за 24 часа до IN контрольного заражения с помощью 50 мкл бактериальной суспензии (SF8300 при 5×107 CFU), и смертность наблюдали, как описано выше.
Пассивная иммунизация с помощью LC10 при 45 или 15 мг/кг приводила в результате к значительному увеличению выживаемости по сравнению с контрольным R347 (p<0,0001) (фигура 6). Для подтверждения того, что в данном исследовании животные имели ослабленный иммунитет, образцы крови собирали в группах из 5 неинфицированных мышей в дни -4, -3, 1, 0, 2 и 3. Осуществляли подсчет общего числа лейкоцитов и дифференциальный подсчет лейкоцитов и для этих животных в промежутке между днями -4 и -2 наблюдали уменьшение общего количества WBC, а также нейтрофилов и лимфоцитов на 90%. У животных наблюдалась тяжелая нейтропения (≤10 нейтрофилов/мкл крови) в дни 0-2 (фигура 7). Таким образом, профилактика с помощью LC10 может уменьшать тяжесть заболевания в мышиной модели пневмонии, вызванной S. aureus, на фоне нейтропении.
Выводы
Разрабатывали модель пневмонии, вызванной S. aureus, у мышей с ослабленным иммунитетом с использованием циклофосфамида, что приводило в результате к уменьшению количества циркулирующих лейкоцитов, в том числе нейтрофилов и лимфоцитов, на >90%. У мышей наблюдалась тяжелая нейтропения при ≤10 нейтрофилов/мкл крови. Профилактика с помощью LC10 значительно улучшала выживаемость в мышиной модели пневмонии, вызванной S. aureus, на фоне нейтропении. Данные результаты указывают на то, что пассивная иммунизация с помощью LC10 за 24 часа до инфицирования с помощью S. aureus мышей, у которых была вызвана нейтропения путем введения циклофосфамида, значительно улучшает выживаемость. Таким образом, это показывает, что с помощью антител к АТ можно предупреждать заболевание у пациентов с ослабленным иммунитетом.
Все документы, патенты, журнальные статьи и другие материалы, упомянутые в настоящей заявке, настоящим включены в данный документ посредством ссылки.
Хотя настоящее изобретение было в полной мере описано вместе с несколькими вариантами его осуществления со ссылкой на прилагающиеся графические материалы, следует понимать, что различные изменения и модификации могут быть очевидны для специалистов в данной области. Такие изменения и модификации следует понимать как включенные в объем настоящего изобретения, который определяется прилагающейся формулой изобретения, если только они не отклоняются от него.
Реферат
Группа изобретений относится к медицине, в частности к способу предупреждения и/или уменьшения тяжести сепсиса, ассоциированного с S. aureus, и к способу предупреждения и/или уменьшения тяжести пневмонии, ассоциированной с S. aureus, у пациентов с ослабленным иммунитетом с помощью антител к альфа-токсину S. aureus. Также представлен способ снижения бактериальной нагрузки S. aureus в кровотоке или сердце субъекта-млекопитающего, включающий введение субъекту эффективного количества выделенного антитела к альфа-токсину S. aureus или его антигенсвязывающего фрагмента. Также представлен способ уменьшения агглютинации бактерий S. aureus и/или формирования очагов тромбоэмболического поражения у субъекта-млекопитающего, включающий введение субъекту эффективного количества выделенного антитела к альфа-токсину S. aureus или его антигенсвязывающего фрагмента. Антитела к альфа-токсину S. aureus являются эффективными в профилактике сепсиса и пневмонии у индивидов с ослабленным иммунитетом. 4 н. и 26 з.п. ф-лы, 7 ил., 11 табл., 4 пр.

Комментарии