Регуляторы ммр-9 и их применение - RU2474433C2
Код документа: RU2474433C2
Чертежи

























Описание
ОБЛАСТЬ И УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение относится к регуляторам ММР-9, а именно к регуляторам, нацеленным на OG-домен ММР-9.
Матриксные металлопротеиназы (ММР) играют многообразную роль в физиологии и патологии. Установлено, что представители семейства ММР участвуют в многочисленных аспектах миграции клеток воспаления и раковых клеток в соединительной ткани, осуществляя данное участие не только посредством катаболизации компонентов внеклеточного матрикса (ВКМ), но и посредством обработки различных растворимых медиаторов, способствующих развитию многих заболеваний. Хотя все ММР обладают одинаковыми каталитическими участками, наблюдаются выраженные различия их субстратной специфичности, обусловленные, по крайней мере частично, присутствием дополнительных участков связывания субстратов в некаталитических доменах белка. Вследствие этого ММР различаются по выполняемым биологическим функциям. ММР-9, называемая также желатиназой В, является стандартной мишенью при воспалительных заболеваниях, так как оказывает повреждающее воздействие на ткани, а также осуществляет обработку растворимых белков, включая ингибиторы протеазы, хемокины и цитокины, способствующую развитию воспаления.
ММР-2 (или желатиназа А) в отличие от ММР-9 обладает в основном противовоспалительными и гомеостатическими функциями, осуществляемыми, предположительно, посредством инактивации воспалительных хемокинов и регуляции процессов обновления соединительной ткани. Таким образом, для проведения эффективной противовоспалительной терапии, не сопровождающейся возникновением побочных эффектов, требуется применение селективных ингибиторов, различающих эти ферменты, характеризующиеся высокой степенью сходства. С этой целью возможно использование селективных ингибиторов, различающих ММР-2 и ММР-9, нацеленных на другие, некаталитические участки фермента.
Представляет интерес тот факт, что основное структурное различие между ММР-9 и ММР-2 заключается в присутствии в ММР-9 домена, характеризующегося высокой степенью О-гликозилирования (OG) [Opdenakker, G.С соавт. (2001), Trends Immunol. 22, 571-579; Van den Steen, P.E. с соавт. (2006) J Biol Chem. 281, 18626-18637]. Другие домены, присутствующие в ММР-9, обнаруживаются и в ММР-2; они включают в себя пропептидный домен, ответственный за поддержание латентности; каталитический домен, содержащий три фибронектиновых повтора; и С-концевой домен, также называемый гемопексин-подобным доменом, который образует экзосайт для связывания с эндогенным ингибитором ММР-9 и ММР-2 - тканевым ингибитором металлопротеиназы-1 (TIMP-I). Несмотря на важную роль, которую ММР-9 играет в патогенезе многих заболеваний, имеющаяся информация о структуре ММР-9 (в отличие от аналогичной информации об ММР-2) ограничивается ее двумя концевыми доменами, а не распространяется на всю длину фермента. Рентгеноструктурное исследование N-концевой части, содержащей прокаталитический домен [Elkins с соавт. 2002 Acta Crystallogr D Biol Crystallogr 58, 1182-1192], продемонстрировало наличие матриксинового складывания. С-концевой гемопексин-подобный домен имеет структуру четырехлопастного (?) пропеллера с ложной четырехкратной симметрией [Cha с соавт., 2002, J Mol Biol 320, 1065-1079]. На Фиг.IA представлена кристаллическая структура прокаталитического и гемопексин-подобного доменов про-ММР-9. Эти домены соединены пунктирной линией, обозначающей линкерное звено, состоящее из 64 аминокислотных остатков (содержащее 22 остатка пролина, 6 остатков глицина и приблизительно 12-14 О-связанных гликанов [Van den Steen с соавт., 2001, Biochim Biophys Acta 1528, 61-73]. Важное значение имеет тот факт, что данный линкерный домен про-ММР-9 в 2-3 раза длиннее линкерных областей коллагеназ, стромелизинов и желатиназы А семейства ММР, у которых типичная длина линкера составляет всего лишь от 21 до 27 аминокислотных остатков.
Кристаллизация линкерного домена про-ММР-9 - как в отдельности, так и вместе с другими доменами белка - затруднена. Отсутствие большой боковой цепи у глицина и наличие собственного изгиба молекулы пролина препятствуют формированию вторичной структуры и часто приводят к образованию петель или неструктурированных областей. Кроме того, присутствие кластеров остатков серина и треонина, являющихся точками прикрепления О-гликанов, может приводить к стерическим эффектам, способным препятствовать кристаллографической упаковке. Этот домен, в связи со сходством его аминокислотной последовательности с последовательностью коллагена V, был также назван "коллаген V-подобным доменом"; недавно данный домен получил новое название "О-гликозилированный (OG) домен". OG-домен принимает активное участие в ориентировании гемопексиновых доменов, обеспечивающем возможность взаимодействий экзосайта. Вместе с тем, какая-либо информация о влиянии OG-домена на общую трехмерную структуру ММР-9 и ее биофизическую природу отсутствует.
В патенте США №20040175817 предлагается идентификация модуляторов ММР-9 на основании оценки кристаллической структуры ее каталитической субъединицы. Вместе с тем, учитывая наличие, в целом, высокой степени гомологии аминокислотных последовательностей каталитических участков матриксных металлопротеиназ, модуляторы, рассчитанные на нацеливание на каталитический участок, не могут быть селективными в отношении ММР-9.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Существует потребность в специфических регуляторах ММР-9.
Один из признаков настоящего изобретения связан со способом регулирования активности металлопротеиназы 9 (ММР-9); данный способ заключается в осуществлении контакта ММР-9 с агентом, специфически взаимодействующим с OG-доменом ММР-9 и, таким образом, регулирующим активность ММР-9.
Другой признак настоящего изобретения связан со способом идентификации агента, способного специфически регулировать ММР-9; данный способ заключается в определении способности агента, являющегося предполагаемым специфическим регулятором ММР-9, взаимодействовать с OG-доменом ММР-9.
Другой признак настоящего изобретения связан со способом лечения заболеваний, в патогенезе которых участвует ММР-9; данный способ заключается во введении пациенту, нуждающемуся в данном лечении, терапевтически эффективного количества агента, специфически взаимодействующего с OG-доменом ММР-9 и, таким образом, осуществляющего лечение заболевания или патологического состояния, в патогенезе которого участвует ММР-9.
Другой признак настоящего изобретения связан с молекулой, способной специфически регулировать активность ММР-9, отличающейся тем, что она взаимодействует с OG-доменом ММР-9, при условии, что эта молекула не является антителом, не относящимся к гуманизированным антителам.
Другой признак настоящего изобретения связан с гуманизированным антителом, содержащим антиген-распознающий домен, специфически взаимодействующий с OG-доменом ММР-9.
Другой признак настоящего изобретения связан с фармацевтическим составом, содержащим, в качестве активного ингредиента, молекулу, способную специфически регулировать активность ММР-9, отличающимся тем, что данная молекула взаимодействует с OG-доменом ММР-9, при условии, что эта молекула не является антителом, не относящимся к гуманизированным антителам, и используется фармацевтически приемлемый носитель.
Вариант осуществления: данный ММР-9 является нативным ММР-9.
Другой вариант осуществления: данная активность является коллагенолитической активностью.
Другой вариант осуществления: данная активность является желатинолитической активностью.
Другой вариант осуществления: данная регуляция является повышающей регуляцией.
Другой вариант осуществления: данная регуляция является понижающей регуляцией.
Другой вариант осуществления: данный агент включает в себя полипептидный агент.
Другой вариант осуществления: данный полипептидный агент включает в себя антитело.
Другой вариант осуществления: данный агент включает в себя небольшую молекулу.
Другой вариант осуществления: данное определение осуществляется путем сравнения структуры данного агента со структурой OG-домена ММР-9.
Другой вариант осуществления: данное определение осуществляется путем обеспечения контакта указанного агента с выделенным OG-доменом ММР-9.
Другой вариант осуществления: данный агент включает в себя полипептид.
Другой вариант осуществления: данный полипептид включает в себя антитело.
Другой вариант осуществления: данный агент включает в себя небольшую молекулу.
Другой вариант осуществления: данный агент идентифицируют в соответствии с описанием, представленным в настоящем изобретении.
Другой вариант осуществления: данный агент включает в себя небольшую молекулу или полипептидный агент.
Другой вариант осуществления: данный полипептидный агент включает в себя антитело.
Другой вариант осуществления: данная молекула включает в себя гуманизированное антитело, включающее в себя антиген-распознающий домен, специфически взаимодействующий с OG-доменом ММР-9.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Данное изобретение описано ниже с помощью примеров, иллюстрируемых чертежами. В отношении этих детальных чертежей следует подчеркнуть, что представленные на них подробности являются всего лишь примерами, предназначенными для иллюстрации обсуждения предпочтительных вариантов осуществления настоящего изобретения; эти чертежи представлены с целью обеспечения предполагаемого наиболее удобного и понятного описания принципов и концептуальных признаков данного изобретения. В связи с этим не было предпринято каких-либо попыток представить структурные детали данного изобретения более подробно, чем это необходимо для понимания основ изобретения; для специалистов в данной области это описание в сочетании с данными чертежами дает четкое представление о том, каким образом различные формы этого изобретения могут быть осуществлены на практике.
На данных чертежах представлено следующее.
На Фиг.1A-D представлены компьютерно сгенерированные модели и графики, характеризующие про-ММР-9. На Фиг.1А представлена иллюстрация кристаллических структур концевых доменов. N-концевой домен про-ММР-9 (код PDB: 1L6J) состоит из пропептида (зеленый), трех фибронектиновых (тип II) повторов (синие) и каталитического домена (красный) с активным участком, содержащим цинк (серый шар). OG-домен (пунктирная линия) содержит фрагмент неизвестной структуры, состоящий из 64 остатков аминокислот, и соединяет N-концевой домен с С-концевым гемопексин-подобным доменом (код PDB: HTV), состоящим из четырех пропеллерных лопастей (циан). На Фиг.1В представлен график, иллюстрирующий эксклюзионную хроматографию, показывающую профиль элюирования олигомерных (пик 1, 15,8 минут и пик 2, 22,7 минут) и мономерных (пик 3, 25,1 минут) форм про-ММР-9. Вставка: График Пората [57] для стандартов белков с известными радиусами Стокса; эти стандарты были использованы с целью калибрования колонки Superdex 200 (слева направо: тиреоглобулин 85 Å, ферритин 61 Å, каталаза 52,2 Å, альдолаза 48,1 Å, альбумин 35,5 Å). Представлена зависимость кубического корня Kd от радиуса Стокса каждого белка, а также показана подгонка методом наименьших квадратов. На Фиг.1С представлена фотография желатиновой зимограммы. С целью отделения мономеров от более высокомолекулярных олигомерных структур в препаративных количествах была применена глицериновая седиментация. Был проведен анализ аликвотных количеств каждой фракции на желатиновых зимограммах. Высокомолекулярные олигомерные структуры присутствовали во фракциях 1-3. Фракция 3 содержала смесь всех олигомерных форм. Фракции 4-7 содержали преимущественно мономерную форму. На Фиг.1D представлен анализ скорости седиментации при аналитическом ультрацентрифугировании, осуществленный с целью расчета распределения коэффициента седиментации. Вставка: моделирование профилей седиментации (линий) на основании экспериментальных данных (точек) как функции времени и расстояния от оси вращения. Вверху представлен график остатков. В целях упрощения восприятия данных показан только каждый десятый профиль, использованный в данном анализе.
На Фиг.2А-Е представлены компьютерно сгенерированные модели и графики, иллюстрирующие структурный анализ про-ММР-9. На Фиг.2А представлен график, иллюстрирующий данные малоуглового рентгеновского рассеяния (МУРР) про-ММР-9 в растворе. Экспериментальные данные интенсивности рентгеновского излучения (черные точки) были сопоставлены с наиболее вероятной моделью (серая линия) с помощью CHADD. Вставка: парная функция распределения экспериментальных данных МУРР. На Фиг.2В представлены модели про-ММР-9, реконструированные с помощью CHADD. Модели, полученные на основании данных МУРР, представлены в виде белых шаров, имеющих радиус 5 Å. Каждая модель была повернута на 0° и 90° вокруг вертикальной оси. Пристыкованные кристаллические структуры N-концевого и С-концевого доменов [22, 24] представлены соответственно в виде синей и красной лент. На Фиг.2С представлена область долгого разупорядочения, спрогнозированная с помощью PONDR (толстая черная линия) [37] в последовательности про-ММР-9, и соответствующая организация домена (верхняя полоса: PRO-пропептид, CAT+FN - каталитический домен и три фибронектиновых (тип II) повтора, OG - О-гликозилированный домен, РЕХ - гемопексин-подобный домен). На Фиг.2D продемонстрировано соответствие экспериментальным данным расчетной кривой рассеяния про-ММР-9 полной длины с реконструированным OG-доменом. Эти расчетные кривые трех лучших моделей представлены в виде зеленой, зеленовато-голубой и желтой линий. Экспериментальные данные представлены в виде черных точек. Три лучшие модели OG-домена были рассчитаны с помощью RAPPER [38, 39] в рамках модели CHADD. На Фиг.2Е представлена реконструкция структуры OG-домена. Три лучшие модели представлены в виде зеленой, зеленовато-голубой и желтой лент.
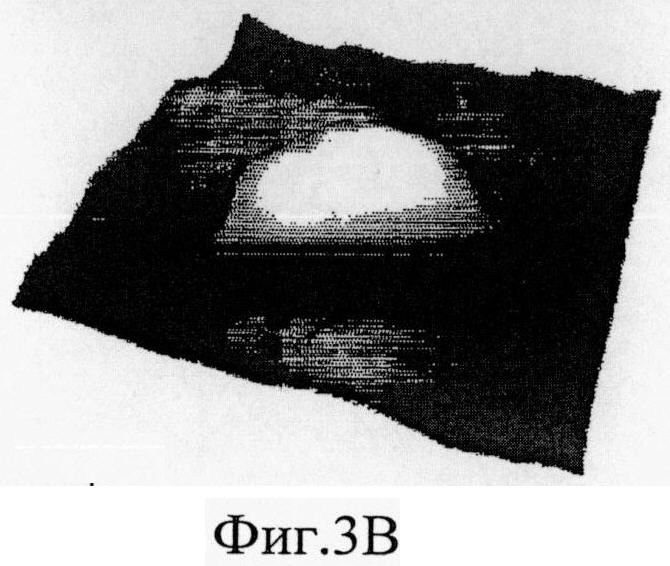
На Фиг.3A-F представлены графики и изображения про-ММР-9 дикого типа и мутировавшего про-ММР-9, полученные с помощью атомно-силовой микроскопии (АСМ). С целью ковалентного соединения аминных групп на поверхности белка был использован глютаральдегид. Все скенограммы были получены с использованием зонда с острым наконечником. На Фиг.3А-С представлены скенограммы про-ММР-9 дикого типа, полученные в полусухом режиме. На Фиг.3D-F представлены скенограммы мутанта npo-MMP-9ΔOG, полученные в полусухом режиме. На Фиг.3А и 3D представлены двухмерные изображения. На Фиг.3В и 3Е представлены трехмерные изображения. На Фиг.3С и 3F представлены поперечные сечения XZ вдоль пунктирной линии, показанной на Фиг.3А и Фиг.3D. Подготовка пробы и условия получения изображений описаны в тексте. Шкала высоты обозначена столбиком, расположенным с правой стороны: диапазон оси Z составляет от 0 до 50 Å (от темного к светлому).
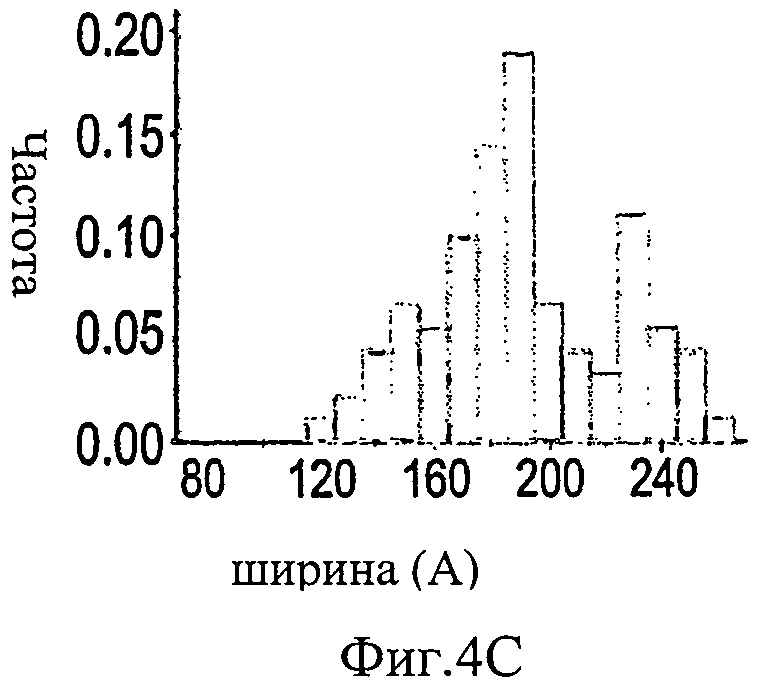
На Фиг.4A-F представлены гистограммы распределения размеров про-ММР-9 дикого типа (слева) и про-MMP-9ΔOG (справа) согласно результатам измерений с помощью АСМ. На оси "у" всех гистограмм отложена нормализованная частота, полученная с помощью деления подсчитанного количества импульсов на общую популяцию. На Фиг.4А и 4В представлено распределение по высоте. На Фиг.4С и 4D представлено распределение по ширине. Величины ширины были скорректированы в соответствии с описанием, представленным в разделе, посвященном методикам проведения экспериментов. На Фиг.4Е представлено распределение межлопастных расстояний про-ММР-9 дикого типа. Разделение лопастей про-MMP-9ΔOG отсутствовало. На Фиг.4F показано моделирование конформационных состояний про-ММР-9. Стандартное отклонение, равное 9,5 Å, рассчитанное на основании данных АСМ в отношении межлопастных расстояний, было вычтено (слева) из междоменного разделения усредненной структуры (посередине), полученной с помощью структурной реконструкции на основе МУРР, или добавлено (справа) к данному междоменному разделению. N- и С-концевой домены [22, 24] обозначены соответственно синим и красным цветом. OG-домен был реконструирован с помощью RAPPER [38, 39]; он обозначен зеленой С?-линией.
На Фиг.5А-В представлены реконструированные модели про-ММР-9, полученные с помощью МУРР. На Фиг.5А представлена модель GASBOR. На Фиг.5В представлена модель CHADD. Белые шары радиусом 5 Å представляют полученные модели. Пристыкованные кристаллические структуры N- и С-концевых доменов обозначены соответственно синим и красным цветом. Каждая модель была повернута на 0° и 90° вокруг вертикальной оси.
На Фиг.6А-С представлены АСМ-изображения про-ММР-9. С целью ковалентного соединения аминных групп на поверхности белка был использован глютаральдегид. Все скенограммы были получены с использованием зонда с острым наконечником, за исключением скенограммы, представленной на Фиг.6А, которая была получена с использованием зонда с кремниево-нитридным наконечником, заостренным оксидом. На Фиг.6А представлен про-ММР-9 дикого типа под буферным раствором. На Фиг.6В представлен обезвоженный образец фермента дикого типа, просканированный в условиях окружающей среды. На Фиг.6С представлена пустая проба, подвергнутая той же процедуре иммобилизации, но без нанесения фермента. Стрелкой показана одиночная частица, наблюдаемая на скенограмме 1×1? м2. Шкала высоты обозначена столбиком, расположенным с правой стороны: диапазон оси Z составляет от 0 до 50 Å (от темного к светлому).
Фиг.7А-В: На Фиг.7А представлена зимография in situ клеток линии НТ1080, экспрессирующих секретируемую ММР-9. Наличие зеленой флюоресценции свидетельствует о протеолитической активности в отношении коллагена IV типа. Синим цветом окрашивается ядро (Hoehst). На Фиг.7В проиллюстрировано инкубирование клеток линии НТ1080 с антителами против ММР (9 часов) с последующим нанесением слоя коллагена IV типа, конъюгированного с Орегонским зеленым. Отсутствие выраженной зеленой флюоресценции вокруг клеток свидетельствует об ингибировании перицеллюлярного протеолиза, обеспечиваемого ММР-9.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение относится к регуляторам ММР-9, а более конкретно к регуляторам, нацеленным на OG-домен ММР-9.
Чертежи и сопровождающие их описания способствуют лучшему пониманию принципов и осуществления настоящего изобретения.
Перед началом подробного рассмотрения вариантов осуществления настоящего изобретения необходимо уточнить, что применение данного изобретения не ограничивается деталями, представленными ниже в описании или в разделе "Примеры". Возможны и другие варианты осуществления данного изобретения, а также различные пути его реализации или выполнения. Кроме того, следует иметь в виду, что используемые в данном документе фразы и термины используются лишь в целях описания и не должны рассматриваться как ограничители объема данного изобретения.
Установлено, что представители семейства металлопротеиназ (ММР) участвуют в многочисленных аспектах миграции клеток воспаления и раковых клеток в соединительной ткани, способствуя развитию многих заболеваний. Хотя все ММР имеют одинаковые каталитические участки, их участки связывания субстрата различны. Вследствие этого ММР различаются по своим биологическим функциям. Так, например, ММР-9 способствует повреждению ткани и развитию воспаления, тогда как ММР-2 выполняет в основном противовоспалительные функции и функцию поддержания гомеостаза. Таким образом, селективные ингибиторы, различающие эти ферменты, обладающие высокой степенью сходства, имеют очень важное значение как средство эффективной противовоспалительной терапии, не вызывающее побочных эффектов.
На предварительном этапе разработки данного изобретения его авторы пришли к пониманию того, что основное структурное различие между ММР-9 и ММР-2 заключается в присутствии в ММР-9 домена, характеризующегося высокой степенью О-гликозилирования (OG). Вместе с тем, имеющаяся информация о структуре ММР-9 ограничивается ее двумя концевыми доменами и не захватывает этот OG-домен. Таким образом, какая-либо информация, имеющая отношение к влиянию OG-домена на общую трехмерную структуру ММР-9 и ее биофизическую природу, отсутствует.
В процессе практического осуществления настоящего изобретения данные изобретатели выполнили новый структурный анализ, применив сочетание малоуглового рентгеновского рассеяния (МУРР) и мономолекулярной атомно-силовой микроскопии (АСМ) для того, чтобы впервые выяснить характеристики структуры полной длины про-ММР-9 и молекулярные характеристики ее О-гликозилированного линкерного домена. В результате МУРР с последующим анализом изображений и структурной реконструкции была установлена молекулярная форма полной длины про-ММР-9, представляющая ее усредненную конформацию в растворе (Фиг.2А-Е). Согласно полученным структурным данным, подтвержденным АСМ высокого разрешения (Фиг.3A-F и 4А-Е) и биофизическими измерениями, про-ММР-9 представляет собой белок вытянутой формы, в котором OG-домен действует как гибкое соединительное звено (линкер) длиной 30 Å, расположенное между двумя концевыми доменами (Фиг.5А-В). Степень гибкости OG-домена была оценена статистически на основании данных о разных конформациях белка, выявленных с помощью мономолекулярных изображений (Фиг.4F). Структурно-динамическая модель полной длины про-ММР-9 дает возможность получить новые представления о роли гибкости данного домена белка в регулировании распознавания, связывания и обработки субстратов, лигандов и рецепторов, необходимом для обеспечения эффектов ММР-9.
В процессе дальнейшего практического осуществления настоящего изобретения данными изобретателями с помощью зимографии in situ было показано, что антитело, способное специфически взаимодействовать с OG-доменом ММР-9, блокирует коллагенолитическую активность ММР-9, но не блокирует ее желатинолитическую активность (Фиг.7А-В). Таким образом, данные изобретатели предлагают использование агентов, регулирующих гибкость OG-домена, с целью препятствования эффектам этого фермента, способствующим возникновению патологических изменений.
Таким образом, один из признаков данного изобретения связан со способом регулирования активности металлопротеиназы 9 (ММР-9), заключающимся в осуществлении контакта ММР-9 с агентом, специфически взаимодействующим с OG-доменом ММР-9 и, таким образом, регулирующим активность ММР-9.
В рамках данного документа термин "ММР-9" (мультидоменная цинковая эндопептидаза матриксная металлопротеиназа-9, также называемая желатиназой В) относится к предшественнику и активным формам полипептида ММР-9 млекопитающих (например, человека) (ЕС 3.4.24.35; Swiss Prot №Р 14780), включая их гомологи, ортологи и изоформы. Как правило, ММР-9 включает в себя три домена -каталитический домен; домен, связывающий субстрат; и расположенный между ними линкерный домен. Этот линкерный домен, который в этом документе также называется "коллаген V-подобным доменом" или "О-гликозилированным (OG) доменом", включает в себя 64 аминокислоты, 22 из которых представляют собой остаток пролина, 6 являются остатком глицина и приблизительно 12-14 - О-связанными гликанами.
Вариант осуществления этого признака изобретения: ММР-9 является нативным (то есть не денатурированным) ферментом. Другой вариант осуществления этого признака изобретения: ММР-9 является активным (предпочтительно полностью активным) ферментом.
Виды активности ММР-9 включают в себя, помимо прочего, желатинолитическую активность, разложение нативных коллагенов I, III и XI типов (коллагенолитическую активность), а также разложение эластина, агрекана, цепи А ламинина и основного белка миелина.
В рамках данного документа термин "регулирующий" означает понижающую регуляцию или повышающую регуляцию. Следует иметь в виду, что агенты, подавляющие гибкость OG-домена, снижают функцию ММР-9, для осуществления которой требуется гибкость OG-домена (например, коллагенолитическую активность ММР-9). В отличие от этого активность, требующая наличия особой трехмерной структуры ММР-9 и не требующая наличия гибкости OG-домена, может повышаться под действием агентов, взаимодействующих с OG-доменом. Примером такой активности является желатинолитическая активность ММР-9 или ее способность взаимодействовать с рецепторами и/или факторами роста.
Как было отмечено выше, способ данного изобретения осуществляется путем обеспечения контакта ММР-9 с агентом, способным специфически взаимодействовать с OG-доменом ММР-9.
В рамках данного документа термин "обеспечение контакта" означает обеспечение возможности ММР-9 вступать в контакт с соответствующим агентом в условиях (то есть в определенное время, при определенной температуре и при наличии определенного буфера), позволяющих агенту взаимодействовать с OG-доменом ММР-9 (например, связываться с OG-доменом) и воздействовать на жесткость OG-домена. Следует иметь в виду, что контакт может обеспечиваться в условиях in vivo, ex vivo или in vitro.
В рамках данного документа фраза "специфически взаимодействующий" означает как повышенное сродство с OG-доменом ММР-9 по сравнению с другим доменом ММР-9 (например, каталитическим доменом или доменом, связывающим субстрат), так и повышенное сродство с OG-доменом ММР-9 по сравнению с OG-доменом другой металлопротеиназы (например, ММР-2). Примером минимального сродства, вероятно, является величина сродства, равная 10-5 М. Предпочтительно агент взаимодействует с OG-доменом ММР-9 с уровнем сродства, не менее чем в 3 раза превышающим сродство, указанное выше; более предпочтительно, если это взаимодействие осуществляется с уровнем сродства, не менее чем в 5 раз превышающим вышеуказанное сродство, а еще более предпочтительно не менее чем в 10 раз превышающим это сродство. Следует иметь в виду, что агенты, способные специфически взаимодействовать с OG-доменом ММР-9, способны и специфически регулировать ММР-9, так как аминокислотная последовательность OG-домена ММР-9 специфична для ММР-9 (в отличие от аминокислотной последовательности каталитического домена, который характеризуется высокой степенью гомологии между ММР-9 и ММР-2).
Агенты (то есть молекулы), рассматриваемые в настоящем изобретении как способные к взаимодействию с OG-доменом ММР-9, включают в себя, помимо прочего, полипептидные агенты (например, антитела, содержащие антиген-распознающий домен, специфически взаимодействующий с OG-доменом ММР-9), пептиды и небольшие молекулы. Следует иметь в виду, что данные агенты могут взаимодействовать с OG-доменом на основе распознавания специфической последовательности аминокислот и/или на основе конформационного распознавания. Агенты-антитела, распознающие OG-домен ММР-9, имеются в продаже (например, антитела, выпускаемые компаниями Сигма, Кемикон и Абкам).
В данном изобретении термин "антитело" охватывает интактные молекулы, а также их функциональные фрагменты (например, Fab, F(ab')2 и Fv), способные связываться со специфическими митохондриальными белками. Фрагменты антител, имеющие меньшие размеры, могут иметь преимущество над целыми антителами, поскольку они способны более активно проникать в ткани и быстрее выводятся из организма. Особенно важное значение эти преимущества имеют при использовании ММР-9-специфичных антител in vivo. Кроме того, дополнительным преимуществом фрагментов антител является то, что они могут быть продуцированы бактериями или дрожжами.
Выработка антител против OG-домена ММР-9 может быть индуцирована пептидом, включающим в себя OG-домен. Селекция данных антител может быть осуществлена с использованием других доменов ММР-9 в качестве отрицательных контролей.
К фрагментам антител, подходящим для практического применения настоящего изобретения, относятся область, определяющая комплементарность (ООК; CDR), легкая цепь иммуноглобулина (далее называемая "легкой цепью"); область, определяющая комплементарность, тяжелой цепи иммуноглобулина (далее называемая "тяжелой цепью"); вариабильная область легкой цепи; вариабильная область тяжелой цепи; легкая цепь, тяжелая цепь; фрагмент Fd; и фрагменты антител, содержащие практически целые вариабильные области легкой и тяжелой цепей - такие как Fv, одноцепочечный Fv, Fab, Fab' и F(ab')2.
Функциональными фрагментами антител, содержащими целые или практически целые вариабильные области легкой и тяжелой цепей, являются:
(i) фрагмент Fv, созданный с помощью методов генной инженерии, состоящий из вариабильной области легкой цепи и вариабильной области тяжелой цепи и экспрессируемый в виде двух цепей;
(ii) одноцепочечный фрагмент Fv ("scFv"), представляющий собой одноцепочечную молекулу, созданную с помощью методов генной инженерии; эта молекула включает в себя вариабильную область легкой цепи и вариабильную область тяжелой цепи, соединенные с помощью подходящего полипептидного линкера;
(iii) фрагмент Fab, представляющий собой фрагмент молекулы антитела, содержащий моновалентную антиген-связывающую часть молекулы антитела, которая может быть получена путем обработки целого антитела ферментом папаином, в результате которой получают интактную легкую цепь и фрагмент Fd тяжелой цепи, который состоит из ее вариабильного домента и СНl-домена;
(iv) фрагмент Fab', представляющий собой фрагмент молекулы антитела, содержащий моновалентную антиген-связывающую часть молекулы антитела, которая может быть получена путем обработки целого антитела ферментом пепсином с последующим восстановлением (на одну молекулу антитела приходятся два получаемых фрагмента Fab'); и
(v) фрагмент F(ab')2, представляющий собой фрагмент молекулы антитела, содержащий моновалентную антиген-связывающую часть молекулы антитела, которая может быть получена путем обработки целого антитела ферментом пепсином (то есть димер фрагментов Fab', удерживаемых вместе двумя дисульфидными связями).
Способы выработки антител (моноклональных и поликлональных) хорошо известны в данной отрасли знаний. Выработка антител может осуществляться любым из нескольких известных способов; эти способы могут включать в себя индукцию выработки молекул антител in vivo, скрининг библиотек иммуноглобулинов (Orlandi D.R. с соавт., 1989. Proc. Natl. Acad. Sci. U.S.A. 86:3833-3837; Winter G. с соавт., 1991. Nature 349:293-299) или выработку молекул моноклональных антител непрерывными клеточными линиями в культуре. Эти способы включают в себя, помимо прочего, гибридомную методику; методику гибридомных В-клеток человека и методику вируса Эпштейна-Барр (ЕВV)-гибридомы (Kohler G. с соавт., 1975. Nature 256:495-497; Kozbor D. с соавт., 1985. J. Immunol. Methods 81:31-42; Cote RJ. с соавт., 1983. Proc. Natl. Acad. Sci. U.S.A. 80:2026-2030; Cole SP. с соавт., 1984. Mol. Cell. Biol. 62:109-120).
В тех случаях, когда целевые антигены слишком малы для того, чтобы вызвать адекватный иммунный ответ при выработке антител in vivo, данные антигены (гаптены) могут быть спарены с антигенно нейтральными носителями, такими как гемоцианин моллюска рода фиссурелла (KLH) или сывороточный альбумин [например, бычий сывороточный альбумин (BSA)] (см., например, патенты США №5,189,178 и №5,239,078]. Спаривание гаптена с носителем может быть осуществлено с помощью способов, хорошо известных в данной отрасли знаний. Так, например, может быть осуществлено прямое присоединение к аминогруппам и, по выбору, последующее восстановление образовавшейся иминосвязи. Как альтернативный вариант, носитель может быть присоединен с помощью конденсирующих агентов, например дициклогексилкарбодиимида или других карбодиимидных дегидратирующих агентов. Кроме того, с целью обеспечения данного спаривания могут быть использованы соединяющие вещества (линкеры); как гомобифункциональные, так и гетеробифункциональные линкеры могут быть приобретены у Пирс Кемикал Компани, Рокфорд, 111. Иммуногенный комплекс, полученный в результате спаривания, можно вводить подходящим млекопитающим, например мышам, кроликам и т.д. Подходят протоколы, предусматривающие повторные инъекции иммуногена в присутствии адъювантов в соответствии со схемой, ускоряющей продукцию антител и, соответственно, повышение их уровня в сыворотке. Титры антител в иммунной сыворотке легко определяются с помощью методик иммунологического анализа, хорошо известных в данной отрасли знаний.
Возможно непосредственное использование полученных антисывороток, либо могут быть получены моноклональные антитела, как описано выше.
С помощью способов, хорошо известных в данной отрасли знаний, могут быть получены фрагменты антител [(см., например, работу Harlow и Lane, "Antibodies: А Laboratory Manual", Cold Spring Harbor Laboratory, New York, (1988)]. Так, например, фрагменты антител по настоящему изобретению могут быть получены с помощью протеолитического гидролиза антитела или с помощью экспрессии E. coli или клетками млекопитающих (например, культурой клеток яичника китайского хомячка или другими системами экспрессии белка) ДНК, кодирующей данный фрагмент.
Как альтернативный вариант, фрагменты антител могут быть получены с помощью переваривания целых антител пепсином или папаином в соответствии с общепринятыми способами. Как описано выше, фрагмент антитела (Fab')2 может быть получен путем ферментного расщепления антитела пепсином с получением 5S фрагмента. Этот фрагмент может быть дополнительно расщеплен с помощью тиолового восстанавливающего агента и, необязательно, блокирующей группы для сульфгидрильных групп, образующихся в результате разрыва дисульфидных связей, с получением моновалентных 3,5S Fab' фрагментов. Как альтернативный вариант, применяется ферментное расщепление с помощью пепсина, в результате которого непосредственно получают два моновалентных Fab' фрагмента и один Fc фрагмент. В научной литературе присутствуют полные руководства по применению данных способов (например, Goldenberg, патенты США №4,036,945 и 4,331,647; Porter, RR., 1959. Biochem. J. 73:119-126). Кроме того, могут быть использованы и другие способы расщепления антител, например отделение тяжелых цепей с образованием моновалентных фрагментов легкой-тяжелой цепи, дополнительное расщепление фрагментов или другие ферментные, химические или генетические методики, при условии, что получаемые фрагменты связываются с антигеном, распознаваемым интактным антителом.
Как было описано выше, Fv состоит из спаренных вариабильного домена тяжелой цепи и вариабильного домена легкой цепи. Эта связь может быть нековалентной (см., например, работу Inbar с соавт., 1972. Proc. Natl. Acad. Sci. USA. 69:2659-62). Как альтернативный вариант (см. выше), данные вариабильные домены могут быть соединены с помощью межмолекулярной дисульфидной связи с образованием одноцепочечного Fv; в качестве другого альтернативного варианта, эти цепи могут быть соединены поперечными связями с помощью химических веществ, например глютаральдегида.
Предпочтительно Fv является одноцепочечным Fv.
Одноцепочечные Fv получают путем конструирования структурного гена, содержащего последовательности ДНК, кодирующие вариабильный домен тяжелой цепи и вариабильный домен легкой цепи, соединенные олигонуклеотидом, кодирующим пептидный линкер. Этот структурный ген внедряют в экспрессионный вектор, который затем вводят в клетку-хозяина (например, клетку Е. coli). Рекомбинантные клетки-хозяева синтезируют одиночную полипептидную цепь с линкерным пептидом, связывающим два вариабильных домена. В научной литературе присутствуют полные руководства по получению одноцепочечных Fv (см., например, Whitlow и Filpula, 1991. Methods 2:97-105; Bird с соавт., 1988. Science 242:423-426; Pack с соавт., 1993. Bio/Technology 11:1271-77; и Ladner с соавт., патент США №4,946,778).
Изолированные пептиды области, определяющей комплементарность, могут быть получены путем конструирования генов, кодирующих область, определяющую комплементарность, интересующего антитела. Такие гены могут быть получены, например, с помощью полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) мРНК антителопродуцирующей клетки. В научной литературе присутствуют полные руководства по применению данных способов (см., например, Larrick и Fry, 1991. Methods 2:106-10).
Следует иметь в виду, что при лечении людей предпочтение отдается гуманизированным антителам. Гуманизированные формы антител, вырабатываемых животными (например, мышами), представляют собой химерные антитела или фрагменты антител, полученные методами генной инженерии и содержащие участки (предпочтительно очень небольшие), происходящие от антитела животного. К гуманизированным антителам относятся антитела, в которых области, определяющие комплементарность, человеческого антитела (антитела-реципиента) замещены остатками, обладающими желаемыми функциональными свойствами, взятыми из области, определяющей комплементарность, антитела животного (антитела-донора) (например, мыши, крысы или кролика). В некоторых случаях остатки человеческого антитела, присутствующие в каркасе Fv замещают соответствующими остатками антитела животного. Кроме того, гуманизированные антитела могут содержать остатки, не обнаруживаемые ни в антителе-реципиенте, ни в импортируемой области, определяющей комплементарность, ни в каркасных последовательностях. В целом, гуманизированное антитело содержит, практически полностью, как минимум один (а как правило, два) вариабильных домена, в которых все (или практически все) области, определяющие комплементарность, соответствуют областям, определяющим комплементарность, антитела животного, и все (или практически все) каркасные области соответствуют каркасным областям соответствующей человеческой консенсусной последовательности. В оптимальном варианте гуманизированные антитела также включают в себя по крайней мере часть константной области антитела (например, область Fc), происходящую, как правило, от антитела человека (см., например, работы Jones с соавт., 1986. Nature 321:522-525; Riechmann с соавт., 1988. Nature 332:323-329; и Presta, 1992. Curr. Op. Struct. Biol. 2:593-596). Способы гуманизации антител животных хорошо известны в данной отрасли знаний. Обычно гуманизированное антитело содержит не менее чем один аминокислотный остаток, внедренный в него из животного источника. Эти животные аминокислотные остатки часто называют импортированными остатками; как правило, они принадлежат к импортируемому вариабильному домену. В целом, гуманизация может быть осуществлена в соответствии с описаниями, имеющимися в литературе (см., например, работы Jones с соавт., 1986. Nature 321:522-525; Riechmann с соавт., 1988. Nature 332:323-327; Verhoeyen с соавт., 1988. Science 239:1534-1536; патент США №4,816,567), путем замещения человеческих областей, определяющих комплементарность, соответствующими областями, определяющими комплементарность, грызуна. Таким образом, данные гуманизированные антитела являются химерными антителами, отличающимися тем, что соответствующей последовательностью животного происхождения заменен человеческий вариабильный домен, причем не полностью, а существенно меньше, чем на всю величину интактного человеческого вариабильного домена. На практике гуманизированные антитела могут представлять собой типичные человеческие антитела, в которых некоторые остатки области, определяющей комплементарность, и, возможно, некоторые остатки каркаса заменены остатками, относящимися к аналогичным участкам антитела грызуна. Кроме того, человеческие антитела могут быть получены с помощью различных методик, известных в данной отрасли знаний, включая фаговые дисплейные библиотеки [см., например, работы Hoogenboom и Winter, 1991. J. Mol. Biol. 227:381; Marks с соавт., 1991. J. MoL Biol. 222:581; Cole с соавт. "Monoclonal Antibodies and Cancer Therapy", Alan R. Liss, pp.77 (1985); Boerner с соавт., 1991. J. Immunol. 147:86-95). Гуманизированные антитела могут быть также получены путем введения последовательностей локусов, кодирующих иммуноглобулин человека, трансгенным животным (например, мышам), у которых гены, кодирующие эндогенный иммуноглобулин, частично или полностью инактивированы. После антигенной стимуляции у этих животных наблюдается выработка человеческих антител, во всех отношениях сходных с антителами, обнаруживаемыми у человека, включая реаранжировку генов, сборку цепей и репертуар антител. В научной литературе присутствуют полные руководства по применению данного подхода (см., например: патенты США №№5,545,807, 5,545,806, 5,569,825, 5,625,126, 5,633,425 и 5,661,016; Marks с соавт., 1992. Bio/Technology 10:779-783; Lonberg с соавт., 1994. Nature 368:856-859; Morrison, 1994. Nature 368:812-13; Fishwild с соавт., 1996. Nature Biotechnology 14:845-51; Neuberger, 1996. Nature Biotechnology 14:826; Lonberg и Huszar, 1995. Intern. Rev. Immunol. 13:65-93).
С целью идентификации возможных агентов, способных специфически регулировать ММР-9, может осуществляться оценка агента в отношении его способности взаимодействовать с OG-доменом ММР-9.
Соответственно, один из признаков настоящего изобретения связан со способом определения принадлежности агента к специфическим регуляторам ММР-9, включающим в себя определение способности агента взаимодействовать с OG-доменом ММР-9, когда агент представляет собой возможный специфический регулятор ММР-9. Проведя тщательные экспериментальные исследования, данные изобретатели установили трехмерную структуру полной длины молекулы про-ММР-9. Описанная в данном документе трехмерная структура полной молекулы ММР-9 может быть использована при рациональной разработке лекарственных препаратов, модулирующих (предпочтительно ингибирующих) действие ММР9. Эти модуляторы ММР9 могут быть использованы с целью предотвращения или терапевтической коррекции нежелательных физических и фармакологических эффектов активности ММР9. Соответственно, один из вариантов осуществления данного признака настоящего изобретения заключается в том, что агент может быть оценен в отношении его способности специфически регулировать ММР-9 путем сравнения его структуры со структурой OG-домена ММР-9. Эта задача может быть выполнена с использованием компьютерных моделей полной длины ММР-9, например моделей, созданных данными изобретателями с помощью таких программ, как GASBOR и CHADD. Этот способ может быть особенно пригоден для идентификации пептидных агентов и небольших молекул.
После выяснения структуры агента появляется возможность сконструировать пептиды, встраивающиеся в трехмерную структуру OG-домена и обеспечивающие его желаемую стабилизацию или разрушение. Можно осуществлять скрининг таких пептидов/небольших молекул с целью выявления агентов, специфически связывающихся с OG-доменом.
Как описано выше, пептидные миметики можно создавать, используя разные подходы, в том числе, например, дисплейные методики.
Способы конструирования таких дисплейных библиотек хорошо известны в данной отрасли знаний. Эти способы описаны, например, в работах Young АС с соавт. "The three-dimensional structures of a polysaccharide binding antibody to Cryptococcus neoformans and its complex with a peptide from a phage display library: implications for the identification of peptide mimotopes" J Mol Biol 1997 Dec 12; 274(4):622-34; Giebel LB с соавт. "Screening of cyclic peptide phage libraries identifies ligands that bind streptavidin with high affinities" Biochemistry 1995 Nov 28; 34(47): 15430-5; Davies EL с соавт. "Selection of specific phage-display antobodies using libraries derived from chicken immunoglobulin genes" J Immunol Cnoco6s 1995 Oct 12; 186(1): 125-35; Jones С RT al. "Current trends in molecular recognition and bioseparation" J Chromatogr A 1995 Jul 14; 707(1):3-22; Deng SJ с соавт. "Basis for selection of improved carbohydrate-binding single-chain antibodies from synthetic gene libraries" Proc Natl Acad Sci USA 1995 May 23; 92(11):4992-6; and Deng SJ с соавт. "Selection of antibody single-chain variable fragments with improved carbohydrate binding by phage display" J Biol Chem 1994 Apr 1; 269(13):9533-8; эти работы включены в данный документ посредством ссылки на них точно так же, как было бы в случае их полного изложения в нем.
Кроме того, возможна идентификация пептидных миметиков с помощью методов вычислительной биологии. Так, например, способность различных соединений связываться с OG-доменом может быть оценена вычислительными методами с использованием различных трехмерных вычислительных средств, подобных тем, которые описаны в разделе "Примеры" ниже. С целью моделирования взаимодействий между OG-доменом и предполагаемыми пептидными миметиками и, таким образом, идентификации пептидов, демонстрирующих наиболее высокую вероятность связывания с OG-областью, могут быть использованы компьютерные программы, пригодные для демонстрации трехмерных структурных моделей, такие как RIBBONS (Carson, М., 1997. Methods in Enzymology 277, 25), О (Jones, ТА. et al, 1991. Acta Crystallogr. A47, 110), DINO (DINO: Visualizing Structural Biology (2001) www.dino3d.org); и QUANTA, INSIGHT, SYBYL, MACROMODE, ICM, MOLMOL, RASMOL и GRASP (см. обзор Kraulis, J., 1991. Appl Crystallogr. 24, 946). Вычислительное моделирование взаимодействий "белок-пептид" успешно применяется с целью рациональной разработки лекарственных препаратов; дополнительные подробности по данной проблеме представлены в работах Lam с соавт., 1994. Science 263, 380; Wlodawer с соавт., 1993. Ann Rev Biochem. 62, 543; Appelt, 1993. Perspectives in Drug Discovery and Design 1, 23; Erickson, 1993. Perspectives in Drug Discovery and Design 1, 109 и Mauro MJ. с соавт., 2002. J Clin Oncol. 20, 325-34.
Согласно другому варианту осуществления данного признака настоящего изобретения способность агента специфически регулировать ММР-9 может быть оценена путем инкубирования данного агента с выделенной ММР-9. Поскольку последовательность аминокислот ММР-9 известна, изолированная ММР-9 или ее фрагмент, включающий в себя OG-домен, могут быть получены с помощью стандартной технологии рекомбинантной ДНК или химического синтеза. С целью анализа связывания агента с мишенью могут быть использованы стандартные методики мечения белка. Мечение может быть прямым (например, мечение ММР-9 с помощью S35) или непрямым (например, с помощью вторичных антител). С целью оценки связывания агента могут быть использованы стандартные иммунологические (твердофазный иммуноферментный анализ (ИФА; ELISA), иммунопреципитация) и биохимические (например, гель-фильтрация) способы.
Способность идентифицированных предполагаемых агентов регулировать функции ММР-9, а также селективность данных агентов в отношении ММР-9, может быть проверена с помощью соответствующего анализа. Примером такого анализа является зимографический анализ коллагенолитической активности in-situ, описанный ниже в Примере 7.
Как было отмечено выше, ММР-9 является известной стандартной мишенью при воспалительных заболеваниях, поскольку она участвует в механизмах повреждения ткани и обработки растворимых белков, способствующих развитию воспаления, включая ингибиторы протеазы, хемокины и цитокины. В связи с этим агенты, способные снижать активность ММР-9, могут применяться с целью лечения заболеваний, в патогенезе которых участвует ММР-9.
Таким образом, один из признаков настоящего изобретения связан со способом лечения заболеваний, в патогенезе которых участвует ММР-9; этот способ заключается во введении пациенту, нуждающемуся в данном лечении, терапевтически эффективного количества агента, специфически взаимодействующего с OG-доменом ММР-9 и благодаря этому взаимодействию обеспечивающего лечение заболеваний, в развитии которых участвует ММР-9.
В рамках данного документа термин "пациент, нуждающийся в данном лечении" означает представителя млекопитающих, предпочтительно человека.
В рамках данного документа термин "лечение" означает предотвращение, излечение, обеспечение обратного развития, уменьшение тяжести, облегчение, минимизацию, подавление или остановку вредных воздействий ММР-9, участвующей в патогенезе заболевания или патологического состояния.
Фраза "патологическое состояние, в патогенезе которого участвует ММР-9" обозначает заболевание или расстройство, к началу или прогрессированию которого может иметь отношение ММР-9. Примером патологического состояния, в патогенезе которого участвует ММР-9, является рак (например, метастатический рак молочной железы, яичника, кости, легкого, поджелудочной железы или простаты).
Помимо участия в патогенезе рака, ММР-9 может играть роль и при других заболеваниях, например при артрите или нейродегенеративных заболеваниях, в частности рассеянном склерозе (Firestein, Curr. Opin. Rheumatol. 4:348-354 (1992); Gijbels с соавт., J. Neuroimmumol. 41:29-34 (1992)). Так, например, повышенный уровень ММР-9 был выявлен в сыворотке и синовиальной жидкости пациентов с воспалительным артритом (such as rheumatoid arthritis compared to healthy patients or patients with osteoarthritis (Ahrens с соавт., Arthritis & Rheumatism 39:1576-87 (1996); Gruber с соавт., Clin. Immunol. & Immunopathol., 78:161-171 (1996)). Кроме того, была выявлена корреляция между баллами активности воспаления в суставе при артрите и количеством ММР-9, присутствующей в аспирированной синовиальной жидкости (Koolwijk с соавт. J. Reumatology, 22:385-393 (1995)).
Экспрессия ММР-9 обнаруживается и при заболеваниях нервной системы. Так, например, выраженную экспрессию ММР-9 демонстрируют реактивные астроциты и макрофаги, присутствующие в демиелинизирующих поражениях, по сравнению с нормальной тканью головного мозга (Cuzner с соавт., J. Neuropathol. Exp. Neurol, 55:1194-1204 (1996)). Уровень ММР-9 повышен при энцефаломиелите (Gijbels с соавт., J. Neuro. Res. 36:432-440 (1993); Proost, с соавт., Biochem, Biophys, Res. Comm. 192:1175-1181 (1993)), в цереброспинальной жидкости пациентов с рассеянным склерозом (Leppert, с соавт., Brain 121:2327-2334 (1998); Rosenberg с соавт., Brain Res., 703:151-155(1995)) и у пациентов с деменцией, вызванной СПИДом (Conant с соавт., Annals of Neurology 46: 391-398 (1999)). Кроме того, экспрессию ММР-9 демонстрируют пирамидные клетки двигательной зоны коры и двигательные нейроны спинного мозга пациентов с амиотрофическим латеральным склерозом (Lim с соавт., J. Neurochem., 67:251-259 (1996)).
Имеются данные о связи ММР-9 с различными прочими воспалительными заболеваниями. Так, например, высокий уровень активности ММР-9 обнаруживается в стенке аорты в области аневризмы (Freestone с соавт. Arteriosclerosis, Thrombosis & Vascular Biology, 15:1145-1151 (1995); Newman с соавт. Connective Tissue Research, 30:265-276 (1994); Sakalihasan с соавт., J. Vascular Surgery, 24:127-33 (1996)). Кроме того, у пациентов с гигантоклеточным артериитом присутствуют повышенные уровни ММР-9 и мРНК ММР-9 в гладкомышечных клетках и фибробластах в зонах фрагментации эластических волокон lamina media воспаленных сосудов (Sorbi с соавт., Arthitis & Rheumatism, 35:1747-1753 (1996)). Повышенный уровень ММР-9 был также выявлен в мокроте пациентов с муковисцидозом, а также в бронхоальвеолярной промывной жидкости пациентов с бронхоэктазами (Delacourt с соавт., Amer. J. Respiratory & Critical Care Med., 152:765-764 (1995); Sepper с соавт. Chest, 106:1129-1133 (1994)). Кроме того, высокий уровень ММР-9 был выявлен в жидкости пузырей кожных поражений у пациентов с буллезным пемфигоидом (Stahle-Backdahl с соавт., J. Clinical Invest, 93:2022-2030 (1994)).
Помимо этого, экспрессию ММР-9 связывают с патогенезом и рядом других заболеваний. Так, например, считается, что ММР-9 участвует в патогенезе поликистоза почек (Murray с соавт., Conn. Tissue Res., 33:249-256 (1996)), мембранозной нефропатии (McMillin с соавт., J. Clin. Invest., 97:1094-1101 (1996)) и болезни Альцгеймера (Lim с соавт., J. Neurochem., 68:1606-1611 (1997)).
Таким образом, настоящее изобретение предусматривает лечение всех вышеуказанных заболеваний и патологических состояний с использованием агентов, способных селективно взаимодействовать с OG-доменом ММР-9.
Агенты по настоящему изобретению можно вводить пациентам в отдельности или как часть фармацевтического состава, дополнительно включающего в себя физиологически приемлемый носитель. Фармацевтический состав предназначен для облегчения введения в организм активного ингредиента.
В рамках данного документа термин "фармацевтический состав" означает препарат, содержащий один или несколько активных ингредиентов, описанных в данном документе, в сочетании с другими химическими компонентами, например с физиологически пригодными носителями и неактивными веществами. Фармацевтический состав предназначен для облегчения введения в организм активного ингредиента.
В рамках данного документа термин "активный ингредиент" означает агент, обеспечивающий достижение желаемого биологического эффекта, то есть снижения активности ММР-9.
В дальнейшем фразы "физиологически приемлемый носитель" и "фармацевтически приемлемый носитель" будут использоваться как равноценные для обозначения носителя или растворителя, не вызывающего значительного раздражающего воздействия на организм и не блокирующего биологической активности и свойств вводимого соединения. Эти фразы также охватывают адъювант. Одним из ингредиентов, охватываемых фразой "фармацевтически приемлемый носитель", может быть, например, полиэтиленгликоль (ПЭГ), являющийся биосовместимым полимером с широким диапазоном растворимости как в органических, так и в водных средах [Mutter с соавт. (1979)].
В рамках данного документа термин "неактивное вещество" означает неактивное вещество, добавляемое к фармацевтическому составу с целью дополнительного облегчения введения активного ингредиента. Примерами неактивных веществ являются, без каких-либо ограничений, карбонат кальция, фосфат кальция, различные сахара и виды крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли.
Методики приготовления составов и введения лекарственных препаратов представлены в последнем издании книги "Remington's Pharmaceutical Sciences" Mack Publishing Co., Easton, PA, включенном в данный документ посредством ссылки на него точно так же, как было бы в случае его полного изложения в нем.
Для использования пригодны, например, следующие пути введения препарата: пероральный, ректальный, трансмукозальный (особенно трансназальный), интестинальный или парентеральный, включая внутримышечные, подкожные и интрамедуллярные инъекции, а также интратекальные, прямые интравентрикулярные, внутривенные, интраперитонеальные, интраназальные и внутриглазные инъекции.
Как альтернативный вариант, препарат можно вводить местно, а не системно, например с помощью инъекции непосредственно в конкретную область тела пациента. Производство фармацевтических составов по настоящему изобретению может осуществляться с помощью технологических процессов, хорошо известных в данной отрасли знаний, например с помощью обычного смешивания, растворения, гранулирования, получения драже, отмучивания, эмульгирования, инкапсулирования, включения или лиофилизации.
Фармацевтические составы, предназначенные для использования в соответствии с настоящим изобретением, могут быть обычными, то есть могут иметь один или несколько физиологически приемлемых носителей, включающих в себя неактивные и вспомогательные вещества, способствующие превращению активных ингредиентов в препараты, которые могут быть использованы в фармацевтических целях. Выбор состава зависит от применяемого способа введения.
Составы, содержащие активные ингредиенты по настоящему изобретению, предназначенные для инъекций, могут иметь форму водных растворов, предпочтительно физиологически совместимых буферных растворов, например раствора Хэнка, раствора Рингера или физиологического солевого буферного раствора. Для трансмукозального введения используются составы, содержащие проникающие вещества, соответствующие преодолеваемому барьеру. Такие проникающие вещества, в целом, известны в данной отрасли знаний.
Фармацевтические составы для перорального введения могут быть легко приготовлены путем объединения активных соединений с фармацевтически приемлемыми носителями, хорошо известными в данной отрасли знаний. Такие носители дают возможность приготавливать фармацевтические составы в форме таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, пульп, суспензий и подобных форм для перорального приема пациентом. Производство фармакологических препаратов для перорального применения может осуществляться с использованием твердого неактивного вещества, необязательно, путем измельчения получаемой смеси и превращения смеси в гранулы после добавления, по желанию, подходящих вспомогательных ингредиентов с целью получения ядер таблеток или драже. Подходящими неактивными веществами являются, в частности, наполнители (например, сахара, включая лактозу, сахарозу, маннитол или сорбитол; препараты целлюлозы, например кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза и натриевая соль карбоксиметилцеллюлозы; и/или физиологически приемлемые полимеры, например поливинилпирролидон (ПВП). По желанию можно добавлять разрыхлители, например поперечно-сшитый поливинилпирролидон, агар или альгиновую кислоту либо соль альгиновой кислоты (например, альгинат натрия).
Ядра драже покрывают соответствующей оболочкой. С этой целью могут быть использованы концентрированные растворы сахаров, содержащие, необязательно, аравийскую камедь, тальк, поливинилпирролидон, карбополовый гель, полиэтиленгликоль, двуокись титана, растворы лака и подходящие органические растворители или смеси растворителей. В оболочки таблеток или драже можно добавлять красители или пигменты с целью идентификации или характеристики разных сочетаний доз активных соединений.
Фармацевтические составы для перорального приема включают в себя как плотные (push-fit) капсулы, изготовленные из желатина, так и мягкие запечатанные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. Push-fit капсулы могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связывающими веществами, такими как крахмалы, скользящими веществами, такими как тальк или стеарат магния, и, необязательно, стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как нелетучие масла, жидкий парафин или жидкие полиэтиленгликоли. В дополнение к этому, могут быть добавлены стабилизаторы. Дозы всех фармацевтических составов для перорального приема должны быть пригодными для данного пути введения.
Фармацевтические составы для буккального введения могут быть представлены в форме таблеток или лепешек, приготавливаемых с использованием обычных технологий.
Активные ингредиенты по настоящему изобретению для введения с помощью носовых ингаляций могут быть представлены в удобной форме аэрозольного спрея в упаковке под давлением или небулайзера с использованием подходящего газа-вытеснителя, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана или двуокиси углерода. В случае аэрозоля под давлением установка единичных доз может осуществляться с помощью клапана, обеспечивающего мерную подачу препарата. Состав, заключенный в капсулах и картриджах (например, желатиновых) для использования в диспенсере, может быть представлен порошковой смесью активного соединения и подходящей порошковой основы, например лактозы или крахмала.
Препараты, описанные в этом документе, могут выпускаться в формах, предназначенных для парентерального введения, например для введения одиночными инъекциями или непрерывной инфузией. Составы для инъекций могут быть представлены в форме единичных доз (например, в ампулах) или в емкостях, содержащих большое количество доз, с необязательным добавлением консерванта. Эти составы могут иметь форму суспензий, растворов или эмульсий в масляных или водных носителях и могут содержать формообразующие агенты, например суспендирующие, стабилизирующие и/или диспергирующие вещества.
Фармацевтические составы для парентерального введения включают в себя водные растворы активного препарата в водорастворимой форме. Кроме того, могут быть приготовлены суспензии активных ингредиентов в форме соответствующих инъекционных суспензий на масляной или водной основе. Подходящими липофильными растворителями или носителями являются нелетучие масла (например, кунжутное масло) или синтетические эфиры жирных кислот (например, этилолеат, триглицериды) или липосомы. Водные инъекционные суспензии могут содержать вещества, повышающие вязкость суспензии, например натриевую соль карбоксиметилцеллюлозы, сорбитол или декстран. Кроме того, суспензия может содержать, необязательно, подходящие стабилизаторы или агенты, повышающие растворимость активных ингредиентов, с целью получения растворов высокой концентрации.
Как альтернативный вариант, активный ингредиент может иметь форму порошка, смешиваемого перед использованием с подходящим носителем, например со стерильным и апирогенным водным раствором.
Кроме того, фармацевтический состав по настоящему изобретению может иметь форму состава для ректального введения (например, форму свечей или удерживающих клизм), содержащего, например, обычную свечную основу (например, масло какао или другие глицериды).
В фармацевтических составах, пригодных для использования в соответствии с настоящим изобретением, активные ингредиенты должны присутствовать в количествах, обеспечивающих эффективное достижение цели, в связи с которой они применяются. Соответствующий термин "терапевтически эффективное количество" означает количество активных ингредиентов (например, нуклеиновокислотного конструкта), обеспечивающее эффективную профилактику, облегчение или улучшение симптоматики расстройства (например, ишемии) либо увеличение периода выживания пациента, получающего лечение.
Определение терапевтически эффективного количества является вполне осуществимой задачей для специалистов в данной области, особенно учитывая представленные в этом документе подробные данные.
Доза или терапевтически эффективное количество любого препарата, используемого в соответствии со способами, представленными в данном изобретении, могут быть рассчитаны предварительно на основании результатов анализов in vitro и в клеточной культуре. Так, например, доза, обеспечивающая достижение желаемой концентрации или титра, может быть определена в исследованиях на животных. Эта информация может быть использована с целью более точного определения доз, полезных при лечении человека.
Токсичность и терапевтическая эффективность активных ингредиентов, описанных в данном документе, может быть определена с помощью стандартных фармацевтических методик in vitro, в культурах клеток или на экспериментальных животных. Данные, полученные в этих анализах in vitro и в культурах клеток, а также в исследованиях на животных, могут быть использованы с целью определения диапазона доз для применения у человека. Дозы могут варьировать в зависимости от используемой фармацевтической формы и пути введения препарата. Каждый врач может самостоятельно выбирать конкретный состав, путь введения и дозу препарата с учетом состояния пациента (см., например, работу Fingl E. с соавт. (1975) "The Pharmacological Basis of Therapeutics", глава 1, стр.1).
Возможна индивидуальная коррекция величины дозы и интервалов между введениями доз с целью обеспечения уровней активного ингредиента в плазме или головном мозге, достаточных для индукции или подавления биологического эффекта (то есть коррекция с целью обеспечения минимальной эффективной концентрации (МЭК)). МЭК варьирует в зависимости от конкретного препарата, но может быть рассчитана на основании данных, полученных в исследованиях in vitro. Дозы, необходимые для достижения МЭК, зависят от характеристик конкретного пациента и пути введения препарата. С целью определения концентраций препарата в плазме могут быть использованы соответствующие методы количественного анализа.
В зависимости от тяжести заболевания и его чувствительности к лечению возможно однократное или многократное введение доз, и курс лечения может длиться от нескольких дней до нескольких недель либо до излечения или уменьшения тяжести заболевания.
Конечно, вводимое количество препарата зависит от пациента, которому проводится лечение, тяжести заболевания, способа введения препарата, мнения врача, назначившего препарат, и т.д.
Составы по настоящему изобретению могут, по желанию, выпускаться в упаковке или диспенсерном устройстве (например, в наборе, одобренном Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA)), которые могут содержать одну или более одной единичных доз активного ингредиента. Упаковка может быть изготовлена из металлопластиковой фольги (например, блистерная упаковка). К упаковке или диспенсерному устройству могут прилагаться инструкции по применению препарата. К упаковке или диспенсерному устройству может также прилагаться уведомление, форма которого установлена государственным органом, регулирующим производство, использование или продажу фармацевтических препаратов; это уведомление информирует о том, что данный состав в данной форме одобрен указанным государственным органом для введения человеку или животным. Такое уведомление, например, может содержать текст этикетки, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для препаратов, отпускаемых по рецепту, или текст одобренного вкладыша в упаковку продукта. Кроме того, составы, содержащие препарат по данному изобретению в фармацевтически приемлемом носителе, могут быть приготовлены, помещены в подходящую емкость и этикетированы с целью последующего использования в качестве средства лечения в соответствии с указанным показанием согласно подробному описанию, представленному выше.
Дополнительные объекты, преимущества и новые признаки настоящего изобретения станут очевидными для обычных специалистов в данной области, обладающих соответствующими навыками, после ознакомления со следующими примерами, не налагающими каких-либо ограничений на применение настоящего изобретения. Кроме того, каждый из различных вариантов осуществления и признаков настоящего изобретения, указанных выше и заявленных в разделе "Формула изобретения" ниже, экспериментально подкреплен следующими примерами.
ПРИМЕРЫ
Ниже приведены ссылки на примеры, которые в совокупности с вышеприведенными описаниями иллюстрируют данное изобретение, никоим образом не ограничивая его применения.
В целом, используемая в этом документе номенклатура, а также используемые в настоящем изобретении лабораторные методики относятся к молекулярным, биохимическим и микробиологическим методикам, а также к методикам применения рекомбинантой ДНК. Эти методики подробно разъяснены в литературе, например в таких работах, как "Molecular Cloning: A laboratory Manual", Sambrook с соавт., (1989); "Current Protocols in Molecular Biology" Volumes I-III, под ред. Ausubel, R.M. (1994); Ausubel с соавт. "Current Protocols in Molecular Biology", John Wiley and Sons, Baltimore, Maryland (1989); Perbal "A Practical Guide to Molecular Cloning", John Wiley & Sons, New York (1988); Watson с соавт. "Recombinant DNA", Scientific American Books, New York; "Genome Analysis: A Laboratory Manual Series", Vols.1-4, под ред. Birren с соавт., Cold Spring Harbor Laboratory Press, New York (1998); в патентах США №№4,666,828; 4,683,202; 4,801,531; 5,192,659 и 5,272,057; "Cell Biology: A Laboratory Handbook", Volumes I-III, под ред. Cellis, J. E. (1994); "Current Protocols in Immunology" Volumes I-III, под ред. Coligan J.E. (1994); "Basic and Clinical Immunology" (8-е издание), под ред. Stites с соавт., Appleton & Lange, Norwalk, CT (1994); "Selected Methods in Cellular Immunology" под ред. Mishell и Shiigi, W.H.Freeman и Co., New York (1980); соответствующие иммунологические анализы подробно описаны в патентной и научной литературе, например в патентах США №№3,791,932; 3,839,153; 3,850,752; 3,850,578; 3,853,987; 3,867,517; 3,879,262; 3,901,654; 3,935,074; 3,984,533; 3,996,345; 4,034,074; 4,098,876; 4,879,219; 5,011,771 и 5,281,521; "Oligonucleotide Synthesis" под ред. Gait, М.J. (1984); "Nucleic Acid Hybridization" под ред. Hames В.D. и Higgins S.J. (1985); "Transcription и Translation" под ред. Hames В.D. и Higgins S.J. (1984); "Animal Cell Culture" под ред. Freshney R.I. (1986); "Immobilized Cells and Enzymes" IRL Press, (1986); "A Practical Guide to Molecular Cloning", Perbal, B. (1984) и "Methods in Enzymology" Vol.1-317, Academic Press; "PCR Protocols: A Guide To Methods and Applications", Academic Press, San Diego, CA (1990); "Strategies for Protein Purification and Characterization - A Laboratory Course Manual", Marshak с соавт., CSHL Press (1996); все эти работы включены в данный документ посредством ссылки на них точно так же, как было бы в случае их полного изложения в нем. В разных разделах этого документа приведены другие общие ссылки. Методики, описанные в работах, на которые даны ссылки, считаются хорошо известными в данной отрасли знаний и представлены для удобства читателя. Вся информация, содержащаяся в этих работах, включена в данный документ посредством ссылок на эти работы.
ОБЩИЕ МАТЕРИАЛЫ И СПОСОБЫ
Экспрессия ММР-9: Экспрессия рекомбинантной про-ММР-9 была обеспечена путем инфицирования клеток насекомого линии Sf9 бакуловирусом, несущим цДНК, кодирующую про-ММР-9 человека [19]. Жидкость культуры клеток в количестве, измеряемом литрами, отцентрифугировали, профильтровали и очистили до состояния однородности с помощью желатин-сефарозной хроматографии [52]. Перед дальнейшей обработкой материал был подвергнут тщательному диализу в 100 мМ растворе Tris (pH 7,4), 100 мМ растворе NaCl, 10 мМ растворе CaCl2 (буфер С), и примерно 20 мг были использованы в данном исследовании. Аналогичным образом был подготовлен мутант, не содержавший OG-домена (ММР-9? OG) [19].
Малоугловое рентгеновское рассеяние: Эксперименты с МУРР в растворе были проведены на станции 2.1 [53] Источника синхротронного излучения Лаборатории Дэрсбери (Великобритания) с использованием стандартных методик. Перед проведением измерений при температуре 4°C раствор белка центрифугировали в течение 5 минут при 13000 g. Кривые рассеяния получали с помощью двухмерного многопроводного пропорционального счетчика при расстояниях от пробы до детектора, равных 1 м (7 мг/мл, 100 мкл) и 4,25 м (0,8, 1,6 и 2,5 мг/мл, 100 мкл), при длине волны (λ) 1,54 Å, с охватом диапазона передачи момента 0,008
С помощью программы CRYSOL [36] осуществляли анализ кристаллических структур двух доменов ММР-9 (N-концевого каталитического домена и С-концевого гемопексин-подобного домена) с целью расчета их соответствующих теоретических кривых рассеяния. Они были дополнительно подвергнуты трансформации Фурье с целью получения их теоретических парных функций распределения; были рассчитаны величины Dmax и Rg. Ниже подробно описано моделирование кривых МУРР с самого начала этого процесса (ab initio). Изображения структур получены с помощью системы PyMOL (DeLano WX "The PyMOL Molecular Graphics System" (2002), DeLano Scientific, San Carlos, CA, США. www.pymol.org).
С целью дополнительного подтверждения точности данной модели был осуществлен расчет гидродинамических свойств ее раствора с помощью HYDROPRO [34], после чего полученные данные были сопоставлены с экспериментальными данными. Радиус мини-гранул оболочки варьировал от 2,2 до 4,2 Å в шести приращениях. С помощью SEDNTERP [27] были рассчитаны плотность и вязкость растворителя, а также парциальный удельный объем белка. Радиусы сфер гидродинамической модели оболочки варьировали от 3,8 до 5,3 Å. Радиус мнимых остатков (МО; DRs) в модели МУРР составлял 3,8 Å. Вместе с тем, действительный размер модели оболочки немного больше в связи с гидратацией белка, однако действительную степень увеличения определить сложно [34]. Ранее было высказано предположение о том, что величина возрастания радиуса МО, равная 1,5 Å, надежно учитывает гидратацию [56].
Атомно-силовая микроскопия: Были получены изображения с помощью мультимодального атомно-силового микроскопа (ММАСМ Veeco/Digital Instruments, Santa Barbara, CA, США), оснащенного Е-сканером, с максимальным диапазоном сканирования 14×14 мкм2. С использованием полуконтактного режима исследования получали изображения проб, находившихся в воздухе или в буфере. С целью получения проб, свободных от артефактов, связанных с ложными адсорбатами (в основном, отложением соли), применялось энергичное ополаскивание. Путем использования силановых поверхностей, модифицированных амином, и методики поперечного сшивания были приготовлены поверхности, обеспечивавшие удаление почти всего фона (подтверждаемое с помощью пустых прогонов) при сохранении значительной концентрации белка на поверхности.
С целью минимизации прилагаемой силы величину установки амплитуды поднимали до максимального уровня, при котором обеспечивалась стабильная запись. С помощью "острых" наконечников (зондов DP 14 "HIRES™" компании Микромаш (Эстония)) получали изображения биологических образцов в воздухе, характеризовавшиеся высокой степенью разрешения. Эти зонды имеют резонансную частоту, равную примерно 160 кГц, силовую константу, равную примерно 5 Н/м, и номинальный радиус скругления острия - не более 1 нм, однако они пригодны только для проведения измерений на поверхностях, шероховатость которых, измеряемая как среднеквадратичное отклонение поверхности (RMS), составляет менее 20 нм; это связано с присутствием дополнительных "заострений", которые могут приводить к многочисленным контактам с шероховатой поверхностью. Для проведения измерений в жидкости использовали зонды DNP-S (Veeco) с номинальным радиусом 20 нм; эти измерения проводили в стандартной жидкостной ячейке ММАСМ. Размеры молекул белка определяли с помощью анализа поперечных срезов. Толщины корректировали с учетом расширения под действием наконечника путем вычитания габаритов наконечника, наблюдаемых на обычных изображениях, получаемых с помощью сканирующей электронной микроскопии высокого разрешения.
Эксклюзионная хроматография: Смесь олигомеров про-ММР-9 загружали в колонку Superdex-200 (300×10 мм, Amersham Biosciences); колонку предварительно уравновешивали и эксплуатировали при температуре 4°C. Объем пробы про-ММР-9 в концентрации 1,1 мг/мл составлял 100 мкл; расход составлял 0,5 мл/мин. Элюцию контролировали с помощью данных поглощательной способности при длине волны 280 нм. Радиус Стокса определяли с помощью анализа времени элюции с учетом калибрационной кривой и использованием графика Пората и графика Лорана и Килландера [Siegel, L.M. и Monty, KJ. (1966). Biochim Biophys Acta 112, 346-362]. Для построения калибрационной кривой были использованы пять стандартных белков (Amersham Biosciences) с известными радиусами Стокса - тиреоглобулин (85 Å), ферритин (61 Å), каталаза (52,2 Å), альдолаза (48,1 Å) и альбумин (35,5 Å). "Мертвый объем", измеренный с помощью синего декстрана, имел время удерживания (t0), равное 16,23 мин; общий объем, измеренный с помощью витамина В12, имел время удерживания (tT), равное 39,44 мин. На основании этих величин был рассчитан коэффициент распределения данного белка (Kd) с использованием следующей формулы: Kd=(te-t0)/(tT-t0), где te - время удерживания данного белка. Были получены очень близкие данные графика Пората и графика Лорана и Килландера. Неопределенность времени удерживания в трех повторностях эксперимента составляла в среднем 0,5%. Коэффициент корреляции при подгонке методом наименьших квадратов (r2) составлял 0,97 как для графика Пората, так и для графика Лорана и Килландера.
Седиментация в градиенте концентрации глицерина: Слой пробы очищенной про-ММР-9 (0,2 мг) был помещен в четыре полиалломерные пробирки, содержавшие градиент концентрации глицерина от 10 до 45% (приготовленный в GradientMaster BioComp™) в буфере. Затем пробирки были отцентрифугированы в роторе SW41 со скоростью 37000 об/мин в течение 63 часов при температуре 4°C. Градиент был затем фракционирован, и полученные пробы объемом 0,5 мл были подвергнуты желатиновой зимографии с целью выявления присутствия мономерных и других олигомерных структур [Masure, S., Proost, P., Van Damme, J. и Opdenakker, G. (1991). Eur J Biochem. 198, 391-398]. Фракции, содержавшие однородные мономерные структуры, были объединены и подвергнуты диализу против буфера с целью удаления избытка глицерина. Концентрацию белка определяли с помощью набора реактивов для количественного определения белка ВСА (Pierce).
Аналитическое ультрацентрифугирование: На аналитической ультрацентрифуге Beckman Optima XL-A, оснащенной титановым ротором Аn-50, были проведены эксперименты, оценивавшие скорость седиментации. Данные эксперименты были проведены при температуре 20°C в буфере С. Пробу, содержавшую белок в концентрации 0,4 мг/мл, загружали в ячейки длиной 12 мм и центрифугировали со скоростью 50000 об/мин. Каждые 160 секунд регистрировали поглощательную способность при длине волны 280 нм, используя радиальный интервал 0,001 см и радиальный диапазон 6-7,3 см.
Профили седиментации были проанализированы с помощью программного обеспечения SEDFIT [Schuck, Р. (2000). Biophys J. 78, 1606-1619], дающего возможность оценивать коэффициент седиментации (s). Были проанализированы 130 экспериментальных кривых, и было получено распределение коэффициента седиментации (c(s)) между 0,3 и 50 S при разрешении 200 шагов в данной области и размере решетки 500 точек. Был выбран доверительный уровень параметризации, равный 0,9. Для расчета плотности растворителя (p) (1,0062 г/см3) и вязкости (η) (1,045 сП) было использовано программное обеспечение SEDNTERP [Laue, Т.М., Shah, В.D., Ridgeway, Т.М., и Pelletier, S.L. (1992). Analytical Ultracentifugation in Biochemistry and Polymer Science (Cambridge, U.K.: Royal Society of Chemistry)]. Парциальный удельный объем белка

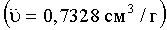
Приготовление амино-функцинализированного субстрата с целью получения изображений с помощью АСМ: Были выбраны поверхности с высокой концентрацией первичных аминогрупп, взаимодействующих с глютаральдегидом, обеспечивающим поперечное сшивание и связывание белка. Глютаральдегид образует амидное соединение с поверхностной аминогруппой. Свободный амин глютаральдегида спонтанно образует поперечную связь с белком посредством ковалентного взаимодействия с аминогруппами, повсеместно присутствующими на наружной поверхности белка. Таким образом, необходимость какой-либо инженерии или модификации с целью фиксации белка на поверхности отсутствует. Кроме того, этот способ лишь в очень малой степени нарушает случайное распределение конформации и ориентации белка на поверхности.
Ниже представлены краткое описание приготовления и оценки характеристик амино-функцинализированных субстратов, использованных с целью специфичного связывания белка (Veeco Metrology, Inc Santa Barbara, CA Part Number FSUB-11). От полированных пластин <111> (International Wafer Servive Inc., Дания) отрезали кусочки силикона размером 1 см2. С целью создания амино-функцинализированного субстрата кусочек силикона модифицировали с помощью аминоконцевого силана с использованием химического осаждения из паровой фазы, усиленного плазмой (4th State, LLC, Belmont, CA). Состав поверхности субстратов анализировали методом рентгеновской фотоэлектронной спектроскопии (XPS) с помощью Kratos Axis Ultra (Kratos, Manchester, Великобритания) с монохроматизированным источником рентгеновского излучения Аl k? при 1486,6 эВ как перед аминным функционализированием, так и после него. Аминогруппы, обнаруживаемые в XPS-спектрах по пику азота, присутствовали на поверхности только после аминного функционализирования. Атомно-силовая микроскопия (АСМ), проведенная в воздухе, в полуконтактном режиме, с использованием зондов OTESP (VEECO), показала, что шероховатость поверхности обработанных субстратов, выраженная как среднеквадратичное отклонение поверхности (RMS), составляла 1,8 Å. С целью определения связывающего потенциала амино-функцинализированных субстратов был использован анализ с применением пероксидазы хрена (HRP). Антитела, меченные HRP, были иммобилизованы на амино-функцинализированном субстрате с помощью поперечного сшивания глютаральдегидом. Субстраты были обработаны ультразвуком с целью удаления всех несвязанных антител, а затем подвергнуты анализу с помощью SureBlue Reserve ТМВ 1 Component Peroxidase Substrate (Kirkegaard and Perry Labs, Maryland). Активность связывания определяли на основании данных поглощательной способности при длине волны 450 нм.
Методика иммобилизации белка: Аминизированные подложки хранили в эксикаторе при температуре 4°C. Про-ММР-9 фиксировали непосредственно перед использованием на амино-функцинализированных субстратах с помощью поперечного сшивания глютаральдегидом в соответствии со следующей методикой: 1,25% раствор глютаральдегида в 0,1 М растворе карбоната натрия (pH 9) инкубировали с вечера до утра на амино-функцинализированном субстрате. Затем субстрат тщательно споласкивали раствором карбоната натрия с целью удаления несвязанного глютаральдегида. Пробу объемом 100 мкл, представлявшую собой монодисперсный раствор мутанта про-MMP-9ΔOG или про-ММР-9 дикого типа в концентрации 0,1 мг/мл, фракционированный с целью обеспечения присутствия в нем только мономерной формы, инкубировали на подложках в течение 3 часов. Пробы мягко споласкивали буфером (2 смены по 200 мкл), а затем водой Milli-Q (5 смен по 200 мкл) и, наконец, высушивали под потоком азота. Глютаральдегид выполнял функцию ковалентного поперечного сшивания белка с аминизированной поверхностью. Это обеспечивало надежное прикрепление молекул белка к поверхности во время ополаскивания и последующего получения изображений. При проведении АСМ-экспериментов в буфере пробы постоянно поддерживали в увлажненном состоянии.
Моделирование кривых МУРР ab initio: С целью создания моделей низкого разрешения были использованы программы GASBOR [Svergun, D.I., Petoukhov, M.V., и Koch, М.Н. (2001). Biophys J 80, 2946-2953] и CHADD [Petoukhov, M.V., Eady, N.A., Brown, K.A., и Svergun, D.I. (2002). Biophys J 83, 3113-3125]. Учет степени гликозилирования про-ММР-9 при данном моделировании осуществлялся исходя из допущения о том, что один гликан приходится примерно на 1,6 аминокислотных остатков; это допущение основано на данных об электронной плотности и длине про-ММР-9 [Receveur, V., Czjzek, М., Schulein, М., Panine, Р., и Henrissat, В. (2002). J Biol Chem. 277, 40887-40892]. Кроме того, было установлено, что эта величина отражает соотношение между усредненными молекулярными весами гликанов и аминокислотных остатков. Затем на основании последовательности аминокислот и ранее охарактеризованного состава гликанов [Van den Steen, Р.Е., Van Aelst, L, Hvidberg, V., Piccard, H., Fiten, P., Jacobsen, C, Moestrup, S.K., Fry, S., Royle, L., Wormald, M.R., Wallis, R., Rudd, P.M., Dwek, R.A., и Opdenakker, G. (2006). J Biol Chem. 281, 18626-18637] было рассчитано общее количество мнимых остатков (МО; DRs).
С целью оценки приближения модели к единственному решению с помощью методики случайных сопоставлений Монте-Карло для каждого способа было создано несколько моделей с одинаковыми вводными параметрами. Эти модели были проверены с помощью программы DAMAVER [Volkov, V.V. и Svergun, D.I. (2003). Journal of Applied Crystallography 36, 860-864] с целью выбора наиболее вероятного решения и расчета средних величин нормализованного пространственного несоответствия (НПН; NSD) (см. "Результаты оценки дополнительных данных"). Кристаллические структуры концевых доменов [Elkins, Р.А., Но, Y.S., Smith, W.W., Janson, С.А., D'Alessio, K.J., McQueney, M.S., Cummings, M.D., и Romanic, A.M. (2002). Acta Crystallogr D Biol Crystallogr 58, 1182-1192; Cha, H., Kopetzki, E., Huber, R., Lanzendorfer, M., и Brastetter, H. (2002). J Mol Biol 320, 1065-1079] были затем включены в репрезентативную модель с помощью программы SUPCOMB [Kozin М.В. и Svergun D.I. (2001). Journal of Applied Crystallography 34, 33-41].
Зимографический анализ коллагенолитической активности in situ: Зимографический анализ in situ [Deshane, 2003] был выполнен с помощью инкубирования клеток фибросаркомы человека НТ1080 (CCL- 121; АТСС, Роквиль, Мэриленд) с 60 нМ раствором антител против MMP9hr или соответствующим буферным раствором в качестве контроля и с 450 нМ раствором меченого коллагена (внутримолекулярно конденсированного коллагена IV типа, меченого Орегоном зеленым (Molecular Probes)) при температуре 37°C в течение 16 часов. Разложение коллагена сопровождается зеленой флюоресценцией, свидетельствующей о действительной коллагенолитической активности. Перед получением изображений пробы окрашивали Хехстом 33258 (Molecular Probes) в конечной концентрации 3,8 мкг/мл для мечения ядер. Пробы исследовали и фотографировали с помощью флюоресцентного микроскопа (Е600; Nikon, Токио, Япония) с объективами Plan Fluor, соединенными с CCD-камерой (DMX1200F; Nikon). Данный эксперимент выполняли в шести повторностях. Сборка изображений осуществлялась с помощью Adobe Photoshop (Adobe systems, Сан Хосе, Калифорния).
ПРИМЕР 1
Выделение и оценка характеристик про-ММР-9 в ее мономерной форме
Для определения размеров и формы молекулы, а также для структурной реконструкции и анализа мономолекулярных изображений мономеров про-ММР-9 требуется наличие монодисперсных и гомогенных проб белка. В представленном ниже примере описано сочетание различных способов обеспечения экспрессии, выделения и оценки характеристик мономерной формы про-ММР-9. Оценка характеристик молекулярного радиуса была использована с целью валидации спектроскопического определения формы.
РЕЗУЛЬТАТЫ
Была обеспечена экспрессия рекомбинантной про-ММР-9 клетками линии Sf9, инфицированными бакуловирусом, и осуществлено выделение чистой рекомбинантной про-ММР-9 из этих клеток в соответствии с ранее описанной методикой [19] (см. раздел "Материалы и способы"). Этот фермент образует смеси мономеров и других, более высоких, олигомерных форм [20].
На Фиг.1B показано молекулярное соотношение мономеров про-ММР-9 и олигомерных форм про-ММР-9, установленное с помощью аналитической эксклюзионной хроматографии (ЭХ; SEC). Основной пик (пик №3) на хроматограмме соответствует мономеру про-ММР-9 с радиусом Стокса 45,4 Å (см. вставку). Радиус Стокса был определен на основании соответствующего времени удерживания с помощью общепринятых методик.
Препаративное количество мономеров про-ММР-9 отделяли от более высоких олигомерных форм с помощью седиментации в градиенте концентрации глицерина [26]. На Фиг.1С представлен зимографический анализ разных фракций. Выделенная мономерная фракция была подвергнута аналитическому ультрацентрифугированию (АУЦ; AUC) с целью дополнительной оценки ее радиуса Стокса (Фиг.1D). В этом эксперименте по оценке скорости седиментации однородный раствор про-ММР-9 подвергали воздействию гравиметрического поля. В результате этого воздействия отмечалось уменьшение количества растворенного вещества у мениска и образование четкой границы между зоной с уменьшенным количеством растворенного вещества и зоной с однородной концентрацией осаждаемого растворенного вещества (Фиг.1D, вставка). Скорость перемещения этой границы может быть измерена и использована для расчета коэффициента седиментации, который прямо пропорционален массе частиц и обратно пропорционален фрикционному отношению, которое, в свою очередь, является мерой эффективного размера и формы.
Было обнаружено, что мономеры про-ММР-9 осаждаются единой массой, и на основной пик приходится 91% от общего количества белка, присутствующего в пробе, при этом нормализованный коэффициент седиментации (s°20,w) равен 4,4 S (Фиг.1D). Эта величина согласуется с результатами измерений, выполненных недавно [19]. Радиус Стокса, рассчитанный с помощью программы SEDNTERP [27] исходя из расчетной величины парциального удельного объема, равной 0,7328 см3/г, составил 44,1 Å. Результаты анализа формы, основанного на АУЦ (с использованием экспериментального фрикционного отношения), указывали на наличие эллиптической формы с соотношением осей а/b, равным 1:6. Данные о молекулярном радиусе, полученные с помощью АУЦ, согласуются с величиной, полученной с помощью ЭХ (45,4 Å). Кроме того, теоретический расчет радиуса с помощью SEDNTERP, произведенный с использованием молекулярной массы про-ММР-9, а также аминокислотного и гликанового составов про-ММР-9, выявил молекулярный эквивалентный радиус для сферических частиц, равный 28,7 Å. Отклонение этой величины от экспериментальных радиусов Стокса является дополнительным свидетельством несферической формы - либо вытянутой, либо заключающей в себе полости.
ПРИМЕР 2
Анализ формы молекулы про-ММР-9 с помощью малоуглового рентгеновского рассеяния (МУРР) выявил вытяную трехдоменную структуру
РЕЗУЛЬТАТЫ
Глобальная конформация мономера про-ММР-9 в растворе была исследована с помощью МУРР. Профиль рассеяния, получаемый при МУРР, формируется всем набором случайно ориентированных молекул и дает информацию об их усредненной конформации (примерный порядок величин - один нанометр). Таким образом, МУРР отличается от кристаллографического структурного анализа, требующего осуществления сложной процедуры получения высококачественных кристаллов макромолекул, и является одной из немногих методик структурного анализа, пригодных для изучения белков в растворе. Этот способ основан на эластическом рассеянии падающих рентгеновских фотонов электронами молекулы-мишени. Распределение плотностей электронов, определяемое расположением атомов в молекуле, формирует интерференционную картину. Затем на основании профиля рассеяния осуществляется реконструкция трехмерной формы молекулы [28].
Интенсивность рассеянного света оценивали в диапазоне передачи момента 0,008
С помощью программ GASBOR [32] и CHADD [33] была получена модель трехмерной реконструкции про-ММР-9. На основании данных о трехмерном расположении сферических центров (или мнимых остатков), отражающих белковые остатки, было осуществлено моделирование теоретических кривых рассеяния, совокупность которых характеризует общую форму белка. Окончательную форму белка определяли путем многократного сопоставления смоделированных теоретических кривых с экспериментальными данными. Преимуществом CHADD является введение ограничений в процедуры анализа данных на основании результатов предварительного изучения имеющейся кристаллической структуры выделенных доменов. В отличие от этого модели, производимые GASBOR, рассчитываются без учета каких-либо предварительно полученных данных. Подробное сравнение CHADD и GASBOR представлено в Примере 3 ниже.
На Фиг.2В показана реконструированная трехмерная структура про-ММР-9. Радиус Стокса реконструированной структуры про-ММР-9 был рассчитан с помощью программы HYDROPRO [34]. Этот расчетный радиус выарьирует от 44,9 до 47,1 Å, что согласуется с величинами 45,4 и 44,1 Å, измеренными с помощью ЭХ и АУЦ соответственно. Кроме того, как модель МУРР, так и параметр соотношения осей, полученный с помощью АУЦ, свидетельствуют о вытянутой форме про-ММР-9. Таким образом, форма, реконструированная на основании экспериментального профиля МУРР, согласуется с измеренными гидродинамическими данными, полученными как с помощью ЭХ, так и с помощью АУЦ.
На Фиг.2А представлен анализ соответствия смоделированной кривой (серая кривая) для данной структуры. В анализе структурной реконструкции расположение альфа-углеродного скелета прокаталитического домена было использовано как ограничение; а OG-домен и гемопексин-подобный домен были реконструированы с помощью CHADD. Наконец, кристаллические структуры прокаталитического домена [22] и гемопексин-подобного домена [24] были последовательно встроены в плотность контура с помощью программного обеспечения SUPCOMB [35] (Фиг.2В). Остальная плотность принадлежит OG-домену, разделяющему два концевых домена интервалом, равным примерно 30 Å. Эта величина была дополнительно проверена с помощью расчета теоретических кривых р(r) на основании кристаллических структур выделенных N-концевого и С-концевого доменов с использованием программного обеспечения CRYSOL [36]. Расчетные величины Dmax этих доменов составляют соответственно 80 Å и 50 Å. Вычитание этих величин из экспериментальной Dmax про-ММР-9 полной длины (160 Å) является дополнительной проверкой реконструированной структуры, в которой концевые домены разделены интервалом, равным примерно 30 Å.
Было показано, что объемы, занимаемые OG-доменом и гемопексин-подобным доменом, одинаковы. Вместе с тем, расчетный молекулярный вес OG-домена, включая О-гликаны, примерно в два раза меньше молекулярного веса гемопексин-подобного домена. Вычислительный анализ последовательности OG-домена с помощью PONDR [37] показал, что данная область значительно менее упорядоченна по сравнению с другими доменами (Фиг.2С). Так, несмотря на его наблюдаемую компактную конформацию, данный OG-домен, богатый пролином, имеет разупорядоченную структуру, характеризующуюся относительно низкой плотностью. Таким образом, выявляемая с помощью МУРР электронная плотность OG-домена, имеющая относительно большой объем, отражает набор конформаций, сохраняемых этим линкерным пептидом в растворе. Это свидетельствует о гибкости данного линкерного OG-домена. С целью моделирования возможных конформаций линкера, соответствующих наблюдаемому профилю рассеяния и карте плотности, была использована программа структурного моделирования RAPPER [38, 39]. Было установлено, что 8 из 500 расчетных конформеров соответствуют модели МУРР линкера. С помощью программы МУРР CRYSOL [36] были рассчитаны теоретические кривые рассеяния для общей структуры модели про-ММР-9. На Фиг.2D и 2Е представлены лучшие модели линкера, соответствующие как экспериментальной кривой рассеяния, так и карте плотности МУРР для про-ММР-9. OG-линкер, по-видимому, демонстрирует множественные предполагаемые неструктурированные конформации.
ПРИМЕР 3
Сравнение вариантов моделирующего программного обеспечения, используемых для анализа данных МУРР
РЕЗУЛЬТАТЫ
С целью создания модели про-ММР-9 низкого разрешения были использованы программы GASBOR [Svergun, D.L, Petoukhov, М.V. и Koch М.Н. (2001). Biophys J 80, 2946-2953] и CHADD [Petoukhov, М.V., Eady, N.A., Brown, K.A. и Svergun, D.I. (2002). Biophys J 83, 3113-3125]. Обе программы отражают белок на основании расположения в трехмерном пространстве сферических рассеивающих центров, воспроизводящих построенную кривую рассеяния. CHADD имеет преимущество, связанное с использованием ранее полученных данных о части мест расположения Сα, установленных на основании кристаллической структуры выделенных доменов; остальная часть молекулы моделируется. GASBOR же моделирует всю структуру без использования ранее полученных данных. При использовании обеих этих программ с целью анализа сходимости структурных решений сравниваются несколько независимых расчетов.
Восемь самостоятельных прогонов GASBOR сошлись на единственном решении - вытянутой общей конформации, в которой один конец имеет большие размеры и может содержать кристаллическую структуру N-концевого домена, тогда как другой конец, имеющий дискообразную форму, может содержать кристаллическую структуру С-концевого домена (Фиг.5А). Концевые домены были включены в модель GASBOR с помощью программы SUPCOMB [Kozin, М.В. и Svergun, D.I. (2001). Journal of Applied Crystallography 34, 33-41]. Остальная часть плотности относится к OG-домену, разделяющему концевые домены интервалом, равным 50 Å; этот интервал считается равным длине OG-домена. В этих восьми расчетах нормализованное пространственное несоответствие (НПН; NSD) варьировало в диапазоне от 1,42 до 1,57. Величина НПН отражает сходство структурных решений: чем меньше НПН, тем более выражено взаимное соответствие структур. Величины НПН были рассчитаны с помощью DAMAVER [Petoukhov, M.V., и Svergun, D.I. (2003). Journal of Applied Crystallography 36, 540-544]; эта программа также способна выбирать наиболее вероятное решение (χ2=1,38) и определять выбросы.
Структура всей длины про-ММР-9 была реконструирована с помощью CHADD-альтернативной схемы моделирования, в которой используется известная информация о структуре. Было осуществлено 11 самостоятельных прогонов CHADD и получены величины НПН в диапазоне от 1,59 до 1,75, без выбросов; эти данные свидетельствуют о схождении решений на единственной модели. Наиболее вероятное решение (χ2=1,66) показано на Фиг.5В. Данная модель представляет собой вытянутую трехдоменную структуру - крупную бимодальную форму с дискообразными доменами, соединенными посредством OG-домена, имеющего относительно низкую плотность. Кристаллические структуры про-каталитического домена и гемопексинового домена были последовательно встроены в плотность контура с помощью программного обеспечения SUPCOMB [Kozin, М.В., и Svergun, D.I. (2001). Journal of Applied Crystallography 34, 33-41]. Остальная плотность принадлежит OG-домену, разделяющему два концевых домена интервалом, равным примерно 30 Å; эта величина хорошо согласуется с теоретической величиной OG-домена, рассчитанной с помощью CRYSOL.
Две структуры, полученные с помощью двух самостоятельных алгоритмов моделирования, являются результатом схождения нескольких расчетов на единственном решении. Величина НПН, равная 1,68, полученная в результате проверки сходства между моделью GASBOR и моделью CHADD, свидетельствует о достаточно высокой степени соответствия между моделями. Хотя модель GASBOR имеет довольно вытянутую форму (OG-домен равен 50 Å, а не 30 Å), обе модели обладают очень близкими характеристиками, то есть двумя доменами, довольно приближенными к шарообразной форме, соединенными линкером (эллиптическим N-концевым доменом и С-концевым гемопексин-подобным доменом, соединенными OG-линкером); в результате получается общая вытягнутая структура, состоящая из двух доменов, довольно приближенных к шарообразной форме, соединенных линкером. Соответствие величины OG-домена его величине, рассчитанной с помощью CRYSOL, а также соответствие общей формы результатам АСМ, позволили данным изобретателям сделать вывод о том, что CHADD является более надежной моделью.
ПРИМЕР 4
Оценка характеристик формы про-ММР-9 и гибкости ее доменов с помощью мономолекулярных изображений
РЕЗУЛЬТАТЫ
С целью дополнительной проверки результатов анализа МУРР данные изобретатели разработали эксперимент по непосредственной визуализации формы про-ММР-9 и оценке молекулярных свойств ее OG-домена, спрогнозированных на Фиг.2В и Е. Более конкретно, данные изобретатели провели анализ мономолекулярных изображений про-ММР-9 дикого типа и мутировавшего про-ММР-9 с удаленным OG-доменом (про-ММР-9? OG) с помощью атомно-силовой микроскопии (АСМ). Воспроизводимые изображения одиночных молекул про-ММР-9 (Фиг.3) были получены с использованием поперечного сшивания проб белка с силановым слоем, модифицированным амином, на поверхности Si(111) перед исследованием АСМ-изображений.
Изображения проб получали как в условиях размещения пробы под буферным раствором, так и в воздухе (Фиг.6А-С). Лучшие изображения были получены в полусухом режиме с использованием острого наконечника. На Фиг.3А-С представлено мономолекулярное изображение про-ММР-9 дикого типа, иммобилизованной на модифицированной поверхности Si(111). Изображение белка имеет вытянутую мультидоменную структуру, согласующуюся с полученными данными анализа МУРР. На изображении поперечного среза (Фиг.3С), демонстрирующем молекулу в высоту и ширину, видны два отдельных домена белка, соединенных, предположительно, OG-линкером. В отличие от этого мутант про-ММР-9? OG, у которого отсутствует OG-домен, состоящий из 64 остатков аминокислот, имеет форму, довольно близкую к сферической, и не имеет заметного разъединения доменов (Фиг.3D-F).
ПРИМЕР 5
Выбор условий и контролей для атомно-силовой микроскопии (АСМ) про-ММР-9
РЕЗУЛЬТАТЫ
Изображения проб получали как в условиях размещения пробы под буферным раствором, так и в воздухе. Хотя размещение пробы под буферным раствором приближено к физиологическим условиям, качество изображений было низким (Фиг.6А). Плохое качество изображений могло быть связано с несколькими факторами: (1) Наконечники, предназначенные для использования во влажных условиях, имеют значительно больший радиус по сравнению с острыми наконечниками, используемыми в условиях окружающей среды. (2) Возможно, полностью оводненная проба более мягкая и легче искажается под давлением наконечника. (3) Возможно, в условиях полного оводнения связывание белка с поверхностью таково, что остается возможность некоторой подвижности. Таким образом, с целью улучшения качества изображений были использованы условия окружающей среды: пробу споласкивали и избыток воды удаляли с помощью 2-3-минутной обработки мягким потоком азота. После данной процедуры на пробе, вероятно, остается тонкий оводняющий слой, в связи с чем этот режим исследования был назван "полусухим". С целью оценки формы белка в условиях отсутствия оводняющего слоя, мы применяли тщательное обезвоживание (Фиг.6В), которое приводило к потере мелких деталей, сокращению белка и появлению помех на изображениях поперечных срезов.
Основные затруднения при проведении исследований в полусухом режиме были связаны с получением проб, не содержавших артефактов, вызванных ложными адсорбатами (в основном, отложением соли). Для удаления этих адсорбатов требовались энергичные процедуры споласкивания, которые, однако, удаляли и большие количества белка. Благодаря использованию силановых поверхностей, модифицированных амином, и процедуры поперечного сшивания, было возможным приготовление поверхностей, почти полностью исключавших наличие какого-либо фона (оцениваемого с помощью пустых прогонов) при одновременном сохранении значительной поверхностной концентрации белка, аналогичной той концентрации, которая наблюдается в условиях полного оводнения. Пустые пробы (Фиг.6С), приготовленные с помощью инкубирования в тех же условиях, в которых инкубировались исследуемые пробы, но не содержавшие про-ММР-9, как правило, содержали не более одного микрообъекта на 1 мкм2 изображения. Сравнение с пробами, содержавшими про-ММР-9, показало, что артефактами, связанными с детритом или высушенной солью, могли быть в среднем менее 5% наблюдаемых микрообъектов.
Статистический анализ АСМ-изображений: Был проведен статистический анализ высоты, ширины и межлопастных расстояний для про-ММР-9 дикого типа и про-ММР-9? OG. Эти данные приведены на гистограммах на Фиг.4А-Е и суммированы в таблице 1 ниже. Представлены наиболее вероятные величины, поскольку присутствие двух субпопуляций может приводить к смещению средней величины. В скобках указано стандартное отклонение. Величины относятся к про-ММР-9 дикого типа (n=90) и мутантной про-ММР-9ΔOG (n=120). Межлопастные расстояния были измерены между пиками на поперечном срезе XZ. Извлечение величин осуществлялось только в том случае, если ориентация белка на поверхности давала возможность идентифицировать два разных домена (n=83). Разделение лопастей про-ММР-9ΔOG не обнаруживалось.
Наиболее вероятными высотами были 34 Å и 22 Å соответственно для про-ММР-9 дикого типа и мутантной про-MMP-9ΔOG. Сравнение с возможными высотами, извлеченными в анализах кристаллических структур [Elkins, Р.А., Но, Y.S., Smith, W.W., Janson, С.А., D'Alessio, KJ., McQueney, M.S., Cummings, M.D., и Romanic, A.M. (2002). Acta Crystallogr D Biol Crystallogr 55, 1182-1192; Cha, H., Kopetzki, E., Huber, R., Lanzendorfer, M., и Brandstetter, H. (2002). J Mol Biol 320, 1065-1079], свидетельствует об уплощенном изображении белка при АСМ, которое может быть обусловлено взаимодействиями с поверхностью или некоторым сдавливанием структуры АСМ-наконечником. Форма гистограммы на Фиг.4А показывает, что белок дикого типа распределяется в две субпопуляции, тогда как мутант, не содержащий OG (Фиг.4В), демонстрирует только один пик распределения. Наиболее вероятными величинами ширины были 190 Å и 130 Å соответственно для про-ММР-9 дикого типа (Фиг.4С) и про-ММР-9? OG (Фиг.4D). Эта разница показывает, что OG-домен вносит значительный вклад в величину ширины белка дикого типа. Высота и ширина могут в некоторой степени увеличиваться в связи с особенностями конфигураций связывания белка с поверхностью. В связи с тем что белок не сферичен, при разных состояниях связывания, характеризующихся разными величинами угла наклона основной оси белка по отношению к нормали к поверхности, отмечаются и разные максимальные величины высоты и ширины, регистрируемые при АСМ. Так, высота изменяется пропорционально косинусу, а ширина - пропорционально синусу этого угла.
Наиболее вероятная величина межлопастного расстояния для про-ММР-9 дикого типа составила 78 Å (Фиг.4Е). Это расстояние хорошо согласуется с величинами межлопастного расстояния, полученными с помощью анализа МУРР. Диапазон возможных величин межлопастного расстояния, полученных с помощью анализа модели МУРР, 75-87 Å в зависимости от разрешенных ориентации индивидуальных доменов.
ПРИМЕР 6
Статистический анализ мономолекулярных изображений в сочетании с данными анализа МУРР демонстрирует доменную гибкость белка, обусловленную OG-доменом
РЕЗУЛЬТАТЫ
Характерной особенностью, отличающей фермент дикого типа от мутантной формы фермента, является наличие у фермента дикого типа значительно большего разброса величин ширины и высоты (Фиг.4А-Е). Это различие может быть связано с дополнительными степенями свободы, придаваемыми структуре дикого типа OG-доменом, в отличие от мутанта, у которого две лопасти более ограниченны в пространстве. Эта неоднородность размеров обусловлена различиями двух основных переменных параметров: ориентации белка на поверхности и конформаций белка. Поскольку мутант не содержит OG-домена, он характеризуется меньшей степенью конформационной неоднородности; эти данные свидетельствуют о том, что разброс величин обусловлен, в основном, разнообразием ориентации на поверхности.
Влияние OG-домена на гибкость белка четко продемонстрировано на Фиг.4Е, показывающем результаты измерений межлопастных расстояний. Данные расстояния варьируют в диапазоне от 55 до 85 Å и могут быть разделены на две субпопуляции. Следует отметить, что эти результаты подтверждают существование множественных конформаций фермента, обусловленных гибкой молекулярной природой OG-домена. На Фиг.4F представлены некоторые возможные модели разных конформаций белка, основанные на выявленных межлопастных расстояниях. Допускалось варьирование межлопастных расстояний в пределах одного стандартного отклонения (9,5 Å). Различные конформации OG-домена, представленные на Фиг.4F, были рассчитаны с помощью программы структурного моделирования RAPPER [38, 39].
Гибкость белка про-ММР-9, выявленная с помощью этого нового молекулярного анализа, дает возможность сформировать новые представления об общей молекулярной структуре и динамике данного фермента, подчеркивающие структурно-функциональную уникальность про-ММР-9 по сравнению с другими представителями семейства ММР, включая желатиназу А/ММР-2 [21]. Так, например, в коллагеназе-1/ММР-1 гибкость гораздо менее длинной линкерной области дополнительно уменьшается под влиянием взаимодействий между гемопексиновым доменом и про-доменом [40]. В ММР-2 также вторая лопасть гемопексинового домена соединяется водородной связью с фибронектиновым доменом (Morgunova с соавт. Science 1999).
ПРИМЕР 7
Роль гибкости доменов белка в ферментной функции про-ММР-9
РЕЗУЛЬТАТЫ
ММР-9 - это секретируемый фермент, точные сведения о механизмах нацеливания на соответствующие мишени и контроле активности которого в перицеллюлярном пространстве отсутствуют [41]. В частности, отсутствует ясность в отношении функций различных доменов в обеспечении эффективного взаимодействия "белок-субстрат" и "белок-белок" при катализе. Представленное в данном документе описание структуры полной длины молекулы про-ММР-9 содержит важные новые сведения о структуре этого фермента и очевидной гибкости его доменов. В частности, представленные результаты дают возможность предполагать, что наблюдаемая гибкость белка ММР-9 является необходимым условием обеспечения его функции.
В ранее опубликованных работах было высказано предположение о том, что важную роль в функционировании фермента играет OG-домен, являющийся промежуточным звеном, обеспечивающим возможность независимых движений концевых доменов [19, 42, 43]. Интересно, что биоинформационный поиск "BLAST" [44, 45], охватывавший все имеющиеся базы данных, показал, что OG-домен молекулы про-ММР-9 гомологичен аналогичным неупорядоченным доменам ряда белков, связанных с клеточной поверхностью, и белков прикрепления в ВКМ (см. таблицу 2 ниже). Результаты, представленные в таблице 2, превышают стандартную пороговую величину Е. Величины идентичности и сходства представлены в процентах.
Следует отметить наличие близкой структурной гомологии между про-ММР-9 и целлюлазой грибов в отношении OG-линкера и общей организации доменов [29, 31], а также то, что линкер целлюлазы, предположительно, обеспечивает связывание "белок-целлюлоза" и миграцию фермента в интактном матриксе. Это свидетельствует о том, что про-ММР-9 осуществляет свою биологическую функцию и ферментативную активность посредством связи с клеточной поверхностью и/или взаимодействий с твердыми субстратами (например, ВКМ). Недавно Owen с соавт. описали активность ММР-9, резистентную к TIMP-I, у клеточной поверхности нейтрофилов [46]. Один из способов прикрепления гемопексинового домена ММР-9 к клетке может быть связан с взаимодействиями с комплексом MT6-MMP/TIMP-1 у клеточной поверхности. Данные, имеющиеся в настоящее время, свидетельствуют о том, что гибкость OG-домена обеспечивает возможность доступа N-конца ММР-9 к сложным субстратным сетям (например, к коллагеноподобным молекулам) в перицеллюлярном пространстве. Стабилизация таких взаимодействий "белок-субстрат" может быть достигнута за счет неспецифических взаимодействий "белок-белок", обеспечиваемых последовательностями с высоким содержанием пролина [47], присутствующими в OG-домене ММР-9. В отличие от этого гемопексин-подобный домен и фибронектиновый домен про-ММР-9 стехиометрически связываются с субстратами, с которыми они имеют высокую степень сродства [48, 49]. Это свидетельствует о том, что каталитическое действие про-ММР-9 обеспечивается как посредством ее специфических, так и неспецифических взаимодействий с субстратами. В соответствии с данным молекулярным сценарием эти два концевых домена обеспечивают субстратную специфичность, тогда как гибкий OG-домен используется, например, для дестабилизации третичной структуры субстратов коллагенового типа посредством слабых неспецифических взаимодействий.
Следует подчеркнуть, что для правильного взаимодействия с TIMP-I, LRP-I и мегалином необходимо участие OG-домена с целью достижения адекватной ориентации гемопексин-подобного и каталитического доменов [19]. Мутант с удаленным OG-доменом демонстрировал пониженное сродство с этими молекулами; это свидетельствует о том, что OG-домен играет важнейшую роль в регулировании биодоступности активной ММР-9. Хотя результаты анализа мономолекулярных изображений показывают, что интервал между концевыми доменами непостоянен, квазиглобулярная форма OG-домена, выявленная с помощью реконструкции модели МУРР, подтверждает наличие небольшого разъединения этих двух доменов, обеспечивающего возможность связывания регуляторов с С-концевым доменом без возникновения каких-либо стерических препятствий со стороны N-концевого каталитического домена. Такая доменная гибкость не наблюдается у ММР-2. Этим может объясняться способность ММР-9 непосредственно связываться с LRP-I и, с другой стороны, необходимость образования комплекса-предшественника с TIMP-2 [50] или тромбоспондином [51] для достижения эффективного связывания ММР-2 с LRP-I.
С целью оценки роли OG-домена в коллагенолитической активности ММР-9 были проведены анализы ингибирования in situ. Были использованы антитела против шарнирного участка молекулы ММР-9 (MMP-9hr), приобретенные у трех разных поставщиков - Sigma, Chemicon и Abeam. Это коммерчески доступное антитело нацелено на пептид, присутствующий в OG-домене. В качестве субстрата был использован коллаген IV типа, меченный флюоресцентной меткой, демонстрирующий повышенную флюоресценцию при разложении. На Фиг.7А-В показано, что данное антитело снижает коллагенолитическую активность либо за счет уменьшения гибкости OG-домена, либо за счет стерического препятствования, нарушающего контакт "фермент-субстрат", как было показано с помощью зимографии in situ.
Коллаген IV типа, меченный флюоресцентной меткой, наносили на клетки линии НТ-1080, продуцирующие ММР-2/9. Как ММР-2, так и ММР-9, продуцируемые этой линией клеток, способны разлагать коллаген IV типа; вместе с тем, было показано, что более 70% очищенных ММР представляют собой ММР-9, специфическая активность которой в отношении коллагена IV типа в 4 раза выше аналогичной активности ММР-2. Коллагенолитическая активность была исследована по периферии клеток в условиях воздействия (Фиг.7А) и в условиях отсутствия воздействия (Фиг.7В) антител против MMP-9hr. В условиях воздействия антител против MMP-9hr коллагенолитическая активность была ограниченной, а в условиях отсутствия воздействия данных антител (в контроле) - диффузной.
На основании совокупности полученных данных можно предположить, что повреждение OG-домена снижает коллагенолитическую активность, но не оказывает какого-либо воздействия на желатинолитическую активность.
ВЫВОДЫ
В этой работе представлено первое экспериментальное определение структуры полной длины человеческой про-ММР-9, осуществленное с использованием сочетания новейших видов структурного анализа. С целью формирования всесторонней молекулярной модели, расширяющей представления о структуре и динамике этого важного фермента, было использовано сочетание метода получения мономолекулярных изображений и анализа МУРР. Следует отметить, что полученные результаты продемонстрировали наличие гибкого и неструктурированного OG-домена, соединяющего каталитическое ядро фермента и гемопексиновый домен. Такое строение обеспечивает уникальность доменной архитектуры про-ММР-9 на фоне других представителей данного семейства ферментов. Такая структурная исключительность может быть использована при разработке изоформоспецифичных ингибиторов ММР-9. Разработка регуляторов ММР-9 может быть нацелена на ограничение доменной гибкости ММР-9, которое может блокировать патологическую активность данного фермента при определенных заболеваниях.
Следует подчеркнуть, что определенные признаки данного изобретения, описанные в целях облегчения понимания в контексте отдельных вариантов осуществления, могут быть также представлены в сочетании друг с другом в одном варианте осуществления. Наоборот, различные признаки данного изобретения, описанные в целях обеспечения краткости изложения в контексте одного варианта осуществления, могут быть также представлены в отдельности или в любом подходящем сочетании меньшего количества этих признаков.
Хотя данное изобретение описано в связи с конкретными вариантами его осуществления, ясно, что многие альтернативы, модификации и варианты станут очевидными для специалистов в данной отрасли знаний. Соответственно, целью данного изобретения является охват всех таких альтернатив, модификаций и вариантов, соответствующих сущности и широкому объему прилагаемой формулы изобретения. Все публикации, патенты и заявки на изобретение, а также каталожные номера GenBank, упомянутые в этой спецификации, включены в данный документ во всей их полноте посредством ссылки на данную спецификацию, точно так же, как было бы в том случае, если бы каждая отдельная публикация, патент или заявка на изобретение или каталожный номер GenBank были бы конкретно и индивидуально включены в данный документ посредством ссылки на них. Кроме того, цитирование или указание в этой заявке какой-либо ссылки не должно рассматриваться как признание доступности информации, на которую дана эта ссылка, как принадлежащей к известному уровню техники.






Реферат
Изобретение относится к медицине и касается способа идентификации агента для лечения рака и воспалительных заболеваний, заключающегося в определении способности агента взаимодействовать с OG-доменом ММР-9, где упомянутый агент является предполагаемым понижающим регулятором коллагенолитической активности ММР, и определении способности указанного агента понижающе регулировать коллагенолитическую активность ММР-9. Изобретение обеспечивает снижение коллагенолитической активности ММР-9. 2 н. и 8 з.п. ф-лы, 7 пр., 7 ил., 2 табл.

Комментарии