Селективные ингибиторные пептиды nox-1 и их применение - RU2699726C2
Код документа: RU2699726C2
Чертежи



























Описание
[0001] Изобретение относится к новым пептидам, композициям и способам профилактики и/или лечения патологических состояний и заболеваний, связанных с активностью НАДФН-оксидазы 1 (Nox1), и/или увеличением продукции активных форм кислорода (ROS). Новые пептиды, таким образом, особенно эффективны в лечении и/или профилактике рака, атеросклероза, ангиогенеза и старения.
Уровень техники
[0002] Nox1 генерирует ROS в физиологических условиях и при некоторых патологических состояниях. Известно, что ROS участвуют в повреждении организмов, и поэтому они связаны с множеством различных состояний. Также известно, что НАДФН-оксидазы являются источником окислительного стресса, который вносит вклад в этиологию многих состояний. Известно, что экспрессия Nox1 связана с множеством различных состояний, включающая рак.
[0003] Терапевтическая селективность без токсичности, несомненно, важна для терапевтического агента. В частности, избирательное уничтожение раковых клеток без токсичности в отношении нормальных клеток является одним из наиболее важных аспектов в терапии рака.
[0004] До настоящего изобретения были идентифицированы несколько ингибиторов НАДФН-оксидазы (Νοx), но до сих пор не были созданы специфические ингибиторы Νοx.
[0005] Также тестировали несколько проникающих в клетку пептидных ингибиторов, таких как пептид gp91ds-tat, PR-39, а также пептидные ингибиторы Rac. Пептид gp9 lds-tat был создан специально для ингибирования Nox2 путем имитации последовательности Nox2, которая, как считают, важна для взаимодействия с p47phox. Однако пептид не обладал специфичностью, поскольку участок, на который воздействует пептид, является гомологичным для других изоформ NOX. Кроме того, пептид являлся низкоэффективным ингибитором, ингибируя образование ROS нейтрофилами на 25% в дозе 50 мМ.
[0006] Недавно компания GenKyoTex разработала более специфические ингибиторы с использованием дионовых производных пиразоло-пиридо-диазепина, -пиразина и -оксазина, воздействующих конкретно на ферменты Nox1 и Nox4. В настоящее время GenKyoTex проводит клинические испытания фазы 1 небольшой молекулы, GKT137831, для лечения диабетической нефропатии. Также проводятся доклинические эксперименты в отношении лечения диабетической нефропатии, атеросклероза, идиопатического легочного фиброза, фиброза печени и моделей ангиогенеза. Однако, будучи специфичным в отношении Nox1/Nox4, GKT137831 в то же время проявляет аффинность к Nox2, Nox3 и Nox5, и, таким образом, имеет низкую селективность.
[0007] Другие химические соединения использовались в течение многих лет, в том числе апоцинин, дифенилен иодоний (DPI), и 4-(2-аминоэтил)бензенсульфонилфторида гидрохлорид (AEBSF) и неоптерин.
[0008] Апоцинин, который был выделен из Picrorhiza kurroa, может предотвратить образование активного оксидазного комплекса. Однако ингибиторный эффект апоцинина является спорным. В действительности было показано, что апоцинин не является специфичным в отношении НАДФН-оксидаз, но, скорее, влияет на другие события, такие как образование тромбоксана А2 и индукцию фактора транскрипции АР-1, и что апоцинин, скорее, является антиоксидантом, чем ингибитором фермента Nox.
[0009] Дифенилен иодоний (DPI) является неспецифическим ингибитором всех флавоферментов, и таким образом может ингибировать ферменты Nox, но также ксантиноксидазу и ферменты группы цитохрома Р450. Кроме того, что DPI является неселективным, было показано, что DPI является токсичным. DPI также является ингибитором ацетилхолинэстеразы и бутирилхолинэстеразы, а также внутреннего Са2+ насоса, что в дополнение к его собственной токсичности вызывает серьезное беспокойство относительно его применения.
[0010] Показано, что аминоэтил-бензенсульфонофторид (AEBSF) предотвращает связывание флавоцитохрома b558 с p47phox, активацию НАДФН-оксидазы и активацию продукции O-2 в макрофагах. Однако AEBSF является, главным образом, ингибитором сериновых протеаз; следовательно, AEBSF способен ингибировать с высокой эффективностью протеазы, такие как химотрипсин, калликреин, плазмин, тромбин, и трипсин, и имеет множество дополнительных эффектов.
[0011] Было показано, что некоторые другие неспецифические молекулы, ошибочно называемые непрямыми ингибиторами Nox, воздействуют на восходящие пути передачи сигнала, оказывая влияние на ферменты Nox. Они включают в себя VAS2870, который является соединением тиотриазолопиримидина, которое ингибирует ΡDGF-зависимую активацию Src ферментов Nox, ингибиторы ангиотензинпревращающего фермента (ингибиторы АСЕ), блокаторы рецепторов Ang II (ARB), фосфодиэстеразу, эйкозаноиды, кортикостероиды, МАР-киназу, ингибиторы протеинкиназы С (такие как производное бензо(b)пиран-4-она, соединение S17834 производства Shionogi Pharma).
[0012] Также имеется увеличивающееся число сообщений о подходах с применением миРНК, направленных против ферментов Nox. В частности, были разработаны некоторые интерферирующие РНК для нокдауна экспрессии Nox1. Однако применение РНК-интерференции в качестве метода лечения человека находится еще на ранней стадии развития, и оптимизация метода может занять годы. К сожалению, только несколько миРНК были протестированы соответствующим образом в отношении специфичности к изоформам Nox. Не существует удовлетворительных подходов с использованием миРНК для селективного ингибирования Nox, в частности Nox1.
[0013] Таким образом, соединения, которые были созданы до настоящего времени, не действуют, непосредственно блокируя фермент, но либо влияют на восходящий путь передачи сигнала, либо действуют как антиоксиданты или акцепторы ROS. Несколько соединений, которые способны непосредственно блокировать фермент, однако, не обладают селективностью и ингибируют другие ферментативные активности. Они также имеют низкую активность и биодоступность, что заранее исключает фармакологическое выявление Nox в качестве терапевтических мишеней in vivo. Несколько низкомолекулярных и пептидных ингибиторов ферментов Nox были эффективны в экспериментальных исследованиях, но проблемы специфичности и токсичности не позволяют использовать любое из существующих соединений в качестве кандидата для разработки лекарственного препарата.
[0014] Принимая во внимание широкий спектр целевых заболеваний, описанных в недавней работе, важно найти новые клинически эффективные ингибиторы ферментов Nox. Однако самой большой проблемой является выявление пептидных ингибиторов, которые способны действовать специфически в отношении отдельных изоформ Nox.
[0015] Заявитель попытался решить указанную проблему и успешно справился с ней. Действительно, данное изобретение предлагает новые пептидные ингибиторы, которые блокируют непосредственно и специфически сборку НАДФН-оксидазы-1 (Nox1) без ингибирования других НАДФН-оксигеназ, в частности Nox2, Nox4, Nox5, Duox1 и Duox2. Nox1 участвует в развитии и прогрессировании широкого спектра заболеваний, в том числе рака, старения, нейродегенеративных заболеваний, сердечно-сосудистых заболеваний и, таким образом, представляет собой важную терапевтическую мишень. Новые пептиды по настоящему изобретению, таким образом, также являются особенно эффективными, поскольку они не обладают неспецифической активностью акцепторов ROS или антиоксидантной активностью, и они не ингибируют другие источники ROS. По сравнению с технологией PHKi, пептидные ингибиторы очень специфичны в отношении своего целевого белка, благодаря чему снижается вероятность нецелевого действия. По сравнению с химическими ингибиторами, пептиды по настоящему изобретению не оказывают токсического действия in vivo. Кроме того, их легко разрабатывать и производить.
Сущность изобретения
[0016] Таким образом, настоящее изобретение относится к пептиду per se, содержащему аминокислотную последовательность, содержащую по меньшей мере от 7 до 35 смежных аминокислот, содержащих часть следующей общей аминокислотной последовательности X1-P-X2-X3-P-X4-R (SEQ ID NO: 1), где X1 представляет собой А, Ρ или Q; Х2 представляет собой Ρ, Τ, V, А, S, С, M или K; Х3 представляет собой L, I, V или А, и Х4 представляет собой Τ, V, S, А, М. Такие пептиды особенно эффективны в способе профилактики и/или лечения патологического состояния или заболевания, связанного или с активностью Nox1, и/или с повышенной продукцией активных форм кислорода (ROS).
[0017] Настоящее изобретение относится к новым селективным пептидам, которые способны избирательно ингибировать активацию Nox1, и в дальнейшем их называют Nox1-ингибиторными пептидами. Таким образом, указанные новые пептиды эффективны в качестве лекарственного средства, в качестве фотопротективного средства и/или в качестве противовозрастного средства. В некоторых случаях они могут быть конъюгированы с проникающим пептидом или с агентом, который увеличивает накопление указанного пептида в клетке (клеточный носитель).
[0018] Согласно первому варианту осуществления настоящее изобретение относится к композициям, содержащим эффективное количество Nox1-ингибиторных пептидов по настоящему изобретению, а также к фармацевтическим композициям, содержащим терапевтически эффективное количество Nox1-ингибиторных пептидов и фармацевтически приемлемый носитель или вспомогательное вещество, и к косметическим композициям.
[0019] Новые Nox1-ингибиторные пептиды и композиции согласно настоящему изобретению могут быть успешно использованы в способе лечения и/или профилактики заболеваний, опосредованных свободными радикалами, и более конкретно заболеваний, связанных с НАДФН-оксидазой-1/Nox1, включая сердечно-сосудистые нарушения, нарушения, связанные с ангиогенезом, респираторные нарушения, поражения кожи, нейродегенеративные расстройства, аллергические и аутоиммунные нарушения, желудочно-кишечные нарушения, рак, и болезни, связанные с нарушением обмена веществ. Более конкретно, они эффективны в способе лечения и/или профилактики сердечнососудистых заболеваний, раковых заболеваний, таких как рак толстой кишки и рак кожи, а также заболеваний кожи, УФ-повреждений кожи, кожных заболеваний, вызванных старением, повреждений кожи, вызванных ROS, преждевременного старения, и/или образования опухолей кожи после УФ-облучения (УФ-А или УФ-В).
[0020] Согласно второму варианту осуществления настоящее изобретение относится к способу снижения уровней активных форм кислорода (ROS) и/или ингибированию продукции активных форм кислорода (ROS) у индивида, который в этом нуждается, и в частности, к способу избирательного снижения и/или ингибирования активности НАДФН-оксидазы 1 (Nox1), способ включает введение терапевтически эффективного количества новых ингибиторных пептидов Nox1 или композиций.
[0021] Согласно третьему варианту осуществления настоящее изобретение относится к способу лечения и/или профилактики заболеваний, опосредованных кислородными радикалами, и более конкретно заболеваниями, связанными с НАДФН-оксидазой-1/Nox1, включая сердечно-сосудистые нарушения, нарушения, связанные с ангиогенезом, респираторные нарушения, поражения кожи, нейродегенеративные нарушения, аллергические и аутоиммунные нарушения, желудочно-кишечные нарушения, рак, такой как рак толстой кишки и рак кожи, и болезни, связанные с нарушением обмена веществ. Способы настоящего изобретения также эффективны в лечении и/или профилактике кожных заболеваний, УФ-повреждений кожи, кожных заболеваний, вызванных старением, повреждений кожи, вызванных ROS, преждевременного старения, и/или образования опухолей кожи после УФ-облучения (УФ-А или УФ-В облучения).
[0022] Согласно четвертому варианту осуществления, настоящее изобретение относится к способу получения новых пептидов, а также пептидов, которые необязательно конъюгированы с проникающим пептидом или клеточным носителем.
Краткое описание чертежей
[0023] На фигурах 1А и 1В представлен цитотоксический эффект каждого пептида в отношении нормальных первичных человеческих кератиноцитов, который оценивали с использованием теста вытеснения трипанового синего и МТТ-теста. Как показано на фигурах 1А и 1В, человеческие кератиноциты обрабатывали различными концентрациями пептидов A (SEQ ID NO: 41), В (SEQ ID NO: 42), и С (SEQ ID NO: 43) и определяли жизнеспособность клеток через 24, 48 и 72 часа после обработки с использованием теста вытеснения трипанового синего (А) и МТТ-теста (В). Процент жизнеспособных клеток среди обработанных кератиноцитов нормализовали по отношению к необработанным клеткам (NTC).
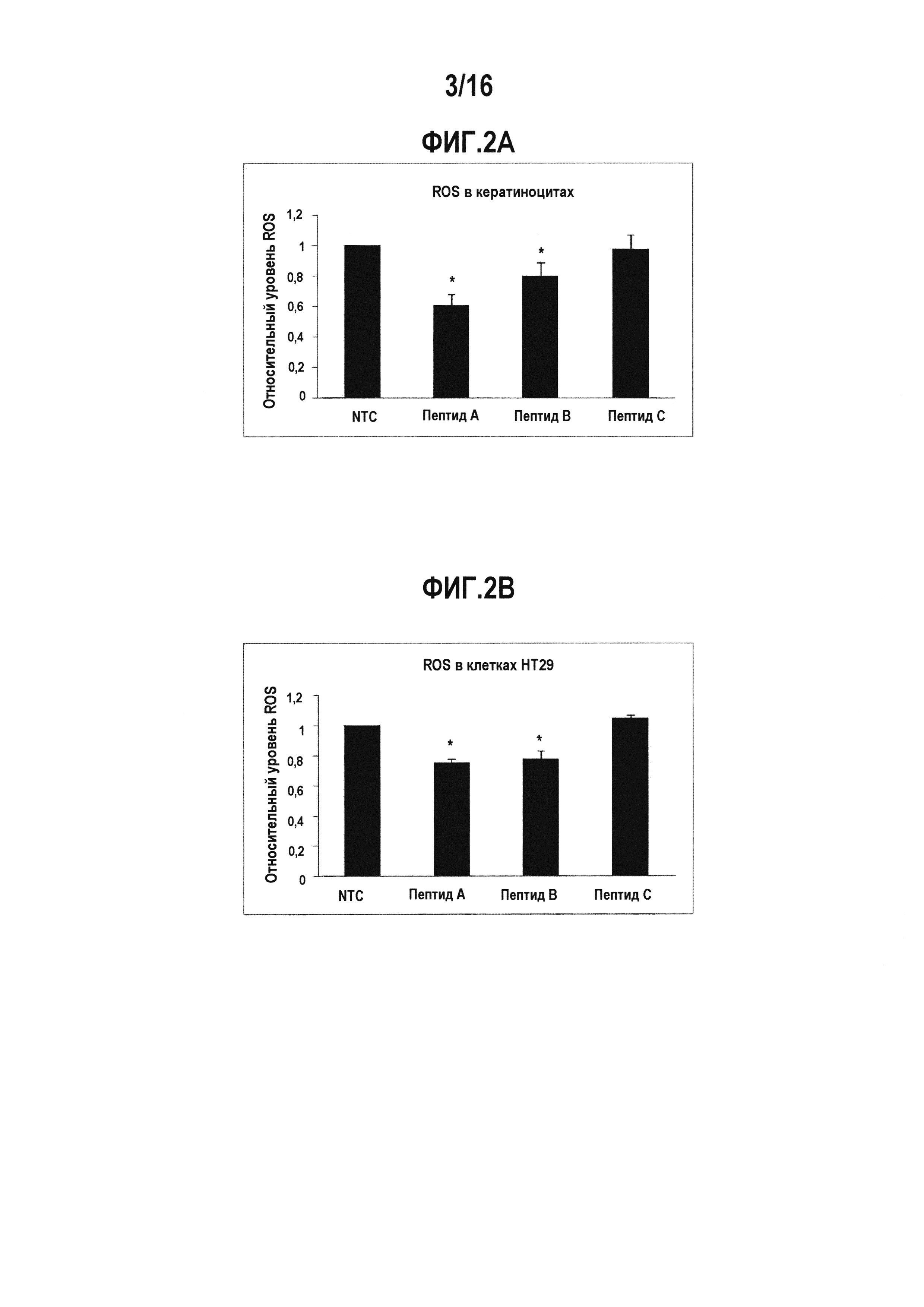
[0024] На фигурах 2А и 2В представлен относительный уровень ROS, который измеряли в первичных кератиноцитах человека и в клетках НТ2 9 (линия клеток аденокарциномы толстого кишечника человека), обработанных 10 или 50 мкМ пептидного ингибитора в течение 24 часов с использованием зондов CM-H2DCF-DA. Клетки обрабатывали 10 мкМ пептидов A (SEQ ID NO: 41), В (SEQ ID NO: 42), и С (SEQ ID NO: 43), и измеряли уровень ROS через 24 часа после обработки. Уровень ROS нормализовали по отношению к необработанным клеткам (NTC) (*Р<0,05). Согласно фиг. 2А, существенное снижение уровня ROS наблюдали в кератиноцитах, обработанных пептидом A (SEQ ID NO: 41) и пептидом В (SEQ ID NO: 42). Согласно фиг. 2В, измерение уровня ROS в клетках НТ29 показало, что обработка пептидами А и В приводила к существенному снижению уровня ROS, что позволяет предположить существенный ингибиторный эффект указанных пептидов в отношении активности Nox1.
[0025] На фигурах 3А, 3В и 3С представлено ингибирование эндогенной экспрессии белков Nox1 и Nox2 с использованием лентивирус-опосредованной экспрессии shPHK против Nox1 и Nox2. Кератиноциты трансдуцировали различными shPHK (shNox1, shNox2 и контрольной shCtrl). Эффективность трансдукции проверяли с помощью вестерн-блоттинга. На фиг. 3А показано, что как shNox1 так и shNox2 стабильно ингибировали более чем на 80% экспрессию Nox1 и Nox2, соответственно. Эффективность трансдукции проверяли с помощью вестерн-блоттинга. Относительный уровень ROS (3В) и активность Nox (3С) измеряли через 24 часа после обработки Nox1-ингибиторным пептидом А, в сравнении с контрольным пептидом С. Уровень ROS нормализовали относительно значения, полученного для аналогичных клеток, обработанных пептидом С. НАДФН-оксидазную активность измеряли в относительных единицах люминесценции (RLU) на мкг белков. *Р<0,05. Согласно фиг. 3В измерение концентрации ROS показало, что обработка пептидным ингибитором А не оказывала эффекта на плато концентраций ROS в shNox1-трансфицированных клетках, что указывает на то, что пептид А блокировал Nox1 зависимое образование ROS с очень высокой (почти 100%) эффективностью и специфичностью. На фиг. 3С активность НАДФН-оксидазы оценивали в shCtrl- и shNox1-трансфицированных клетках, обработанных или не обработанных Nox1-ингибиторным пептидом А.
[0026] На фиг. 4А, 4В, и 4С представлено ингибирование продукции ROS и активности НАДФН-оксидазы и соответственно эффект фотозащиты кератиноцитов человека и мыши Nox1-ингибиторным пептидом А. Кератиноциты, выделенные из биоптатов человека (кер. человека) и эпидермиса мыши (кер. мыши), обрабатывали 10 мкМ Nox1-ингибиторного пептида А или контрольного рандомизированного пептида С. Уровень ROS (4А) и активность НАДФН-оксидазы (4В) измеряли через 24 часа после обработки. Активность НАДФН-оксидазы в человеческих и мышиных кератиноцитах, обработанных контрольным рандомизированным пептидом (С) произвольно принимали за 100%. Затем оценивали % ингибирования активности НАДФН-оксидазы после обработки Nox1-ингибиторным пептидом А (4С).
[0027] На фиг. 5А и 5В представлен эффект пептида А на активность Nox1 в коже мышей. Мышей породы SKH-1 обрабатывали местно различными дозами: 0,4, 3 и 12 мг/кг (3 мыши на дозу) Nox1-ингибиторного пептида А. Биоптаты кожи получали через 2 ч, 24 ч, 48 ч и 72 ч после обработки и измеряли активность НАДФН-оксидазы (RLU/мкг белков). Результаты нормализовали по отношению к необработанным мышам (NT) и выражали в виде % ингибирования активности Nox. (В) Мышей обрабатывали местно в дозе 3 и 12 мг/кг пептида А (2 мыши на дозу). Через 10 мин после обработки мышей облучали УФ-В (150 мДж/см2). Биоптаты кожи получали через 2 ч, 24 ч. Через 4 6 часов после первой обработки мышей вновь обрабатывали той же самой концентрацией пептида А и облучали УФ-В спустя 10 мин. Затем получали биоптаты кожи через 2 ч, 24 ч (т.е. через 48 и 72 ч после первой обработки, соответственно). Измеряли активность НАДФН-оксидазы (RLU/мкг белков) и нормализовали значения по отношению к значениям, полученным для необработанных (NT) и необлученных мышей.
[0028] На фиг. 6А, 6В и 6С представлены фотопротективные эффекты пептида А на индукцию УФВ-вызванной плоскоклеточной карциномы (SCC) в модели бесшерстных мышей SKH-1. Мышей обрабатывали местно 3 мг/кг пептида А или контрольного пептида и облучали УФ-В излучением спустя 10 мин три раза в неделю. Число (6А) и размер (6В) опухолей оценивали один раз в неделю в течение 2 9 недель (6С). Распределение опухолевого объема оценивали на 29-й неделе. Наблюдали очевидное существенное снижение числа и размера УФ-В-индуцированных опухолей у мышей SKH-1, получавших местно пептид А.
[0029] На фиг. 7 показано существенное снижение активности НАДФН-оксидазы в коже, не несущей опухоли, и УФВ-индуцированных опухолях у мышей SKH-1, обработанных пептидом А или контрольным пептидом. Мышей умерщвляли после 29 недель лечения. Кожу, не несущую опухоли, и опухоли получали от облученных мышей, обработанных пептидом А или носителем. Активность НАДФН-оксидазы измеряли в виде RLU/мкг белков в коже, не несущей опухоли, и в УФВ-индуцированных опухолях. Относительное ингибирование активности Νοx в коже, не несущей опухоли, и в опухолях оценивали, принимая условно за 100% активность Νοx в коже, не несущей опухоли, и в опухолях, полученных от мышей, обработанных носителем. Затем результаты выражали в виде среднего значения в процентах от значения, полученного для мышей, обработанных носителем.
[0030] На фиг. 8А и 8В показано, что пептид А без tat может ингибировать активность Νοx также эффективно, как и пептид А. Кроме того, пептиды меньшего размера, полученные из пептида А, эффективно ингибируют активность НАДФН-оксидазы. Кератиноциты обрабатывали 10 мкМ указанных пептидов: рандомизированный контрольный пептид PI (SEQ ID NO: 57), пептид А с последовательностью tat (SEQ ID NO: 41) или без последовательности tat (SEQ ID NO: 20); более короткие пептиды Р7 (SEQ ID NO: 2) и Р8 (SEQ ID NO: 56) (фиг. 8А). Активность НАДФН-оксидазы измеряли через 24 часа после обработки (RLU/мкг белков) и нормализовали по отношению к значениям, полученным для клеток, обработанных контрольным пептидом (фиг. 8В).
[0031] На фиг. 9А и 9В представлена экспрессия прогенина в биоптатах кожи молодых и старых профицитных по гену ХРС (ХРС+/+) и дефицитных (ХРС-/-) мышей. Возраст молодых мышей составлял 4 месяца, и возраст старых мышей составлял 1,5 года. (А) Экстракты общего белка биоптатов кожи оценивали в отношении прогерина с помощью вестерн-блоттинга, β-актин использовали в качестве вносимого контрольного белка. (В) Полоски белка, соответствующие прогерину, оценивали количественно и нормализовали по β-актину. Среднее значение плотности ± SD, полученное от шести мышей в каждой группе, представлено в виде относительного значения к плотности, полученной для молодых мышей дикого типа.
[0032] На фиг. 10А, 10В и 10С показаны эффекты дефицита гена ХРС на активность Nox и экспрессию комплексов OXPHOS. (А) Активность измеряли (RLU/мкг белка) в биоптатах кожи молодых и старых ХРС+/+ и ХРС-/- мышей. Результаты нормализовали к показателям, полученным у молодых мышей дикого типа. (В) Экспрессию комплексов OXPHOS оценивали с помощью вестерн-блоттинга у молодых и старых мышей, профицитных и дефицитных по гену ХРС. (С) Полоски, соответствующие различным комплексам OXPHOS, оценивали количественно и нормализовали по β-актину. Среднее значение плотности ± SD, полученное от шести мышей в каждой группе, представлено в виде относительного значения к плотности, полученной для молодых мышей дикого типа.
[0033] На фиг. 11А и 11В показан эффект NOX1-ингибиторного пептида A (InhNOX) на экспрессию прогерина в биоптатах кожи молодых ХРС+/+ и ХРС-/- мышей. Мышей в возрасте одного месяца обрабатывали местно 3 мг/кг (6 мышей в группе) Nox1-ингибиторным пептидом A (InhNOX) или контрольным пептидом (носителем) три раза в неделю в течение трех месяцев. (А) Экстракты общего белка биоптатов кожи оценивали в отношении прогерина с помощью вестерн-блоттинга, β-актин использовали в качестве вносимого контрольного белка. (В) Полоски белка, соответствующие прогерину, оценивали количественно и нормализовали по β-актину. Среднее значение плотности ± SD, полученное от шести мышей в каждой группе, представлено в виде относительного значения к плотности, полученной для молодых мышей дикого типа.
[0034] На фиг. 12А и 12В показаны эффекты Nox1-ингибиторного пептида A (InhNOX) на экспрессию белков комплексов OXPHOS в биоптатах кожи молодых ХРС+/+ и ХРС-/- мышей. Мышей в возрасте одного месяца обрабатывали местно 3 мг/кг (6 мышей в группе) Nox1-ингибиторным пептидом A (InhNOX) или контрольным пептидом (носителем) три раза в неделю в течение трех месяцев. (А) Экспрессию комплексов OXPHOS оценивали с помощью вестерн-блоттинга, β-актин использовали в качестве вносимого контрольного белка. (В) Полоски белка, соответствующие различным комплексам OXPHOS, оценивали количественно и нормализовали по β-актину. Среднее значение плотности ± SD, полученное от шести мышей в каждой группе, представлено в виде относительного значения к плотности, полученной для молодых мышей дикого типа.
Подробное описание изобретения
[0035] Настоящее изобретение относится к новым селективным пептидам, которые способны избирательно ингибировать активацию Nox1, путем специфического блокирования сборки НАДФН-оксидазы-1 и, следовательно, ее активации, а также к их применению в качестве лекарственного средства и фотопротективных агентов. Таким образом, изобретение относится как к терапевтическому, так и к косметическому способам. Указанные пептиды могут обозначаться далее как ингибиторные пептиды Nox1.
[0036] Дополнительные модификации могут предусматривать проникновение пептидов в клетки для воздействия на белки в цитозоле. Примером успешного применения способа является добавление последовательности, богатой аргинином, или последовательности tat. Пептиды по настоящему изобретению были выбраны на основании их потенциальных возможностей конкурировать со сборкой Nox1 путем взаимодействия с Nox1.
[0037] Индивиды, которые будут получать лечение, включают людей и животных, предпочтительно млекопитающих, таких как грызуны и приматы. Индивид может представлять собой нечеловекообразное животное или нечеловекообразное млекопитающее. Индивид может иметь любое из состояний, указанных в настоящем документе, или может иметь риск их развития. В случае человеческих индивидов, их возраст может составлять по меньшей мере 50 лет, например, по меньшей мере 60 или 70 лет.
[0038] Пептиды по изобретению получены из SEQ ID NO: 44 (участок PRR Nox01) или из SEQ ID NO: 45 (участок SH3 NoxA1). Обычно они могут содержать от 5 до 35 аминокислот, или от 5 до 20 аминокислот, или 7 до 2 0 смежных аминокислот из последовательности SEQ ID NO: 44 или SEQ ID NO: 45. SEQ ID NO: 44 представляет собой


[0039] Пептид по изобретению, как правило, состоит из двух отдельных последовательностей. Одну из них, как правило, обозначают в настоящем документе как "часть" и она отвечает за терапевтическую активность рассматриваемого пептида. Указанная часть может составлять в длину от 5 до 20 аминокислот, или от 7 до 20 аминокислот, например, от 7 до 19; от 7 до 18; от 7 до 17; от 7 до 16; от 7 до 15; от 7 до 14; от 7 до 13; от 7 до 12; от 7 до 11; от 7 до 10; предпочтительно от 7 до 18; от 7 до 15; от 7 до 10; приблизительно 7 аминокислот; или от 8 до 18; от 8 до 15; от 8 до 10 аминокислот.
[0040] Вторая отдельная последовательность, или любая из оставшейся части последовательности в пептиде, может придать пептиду дополнительные полезные свойства. Указанная вторая часть пептида может отсутствовать, и поэтому в одном варианте осуществления пептид состоит только из последовательности "части", описанной выше, которая придает терапевтические свойства, т.е. длина указанной части и длина пептида являются одинаковыми. Длина второй последовательности обычно составляет от 0 до 31 аминокислот, например, от 5 до 30, от 7 до 30, от 10 до 25 или от 15 до 20 аминокислот. Вторая последовательность может представлять собой проникающий пептид, который идентичен или гомологичен любому из специфических проникающих пептидов, указанных в данном документе. Очевидно, что дополнительная "вторая" последовательность может быть на обеих N-концевой и С-концевой сторонах указанной части.
[0041] Пептид обычно имеет длину от 7 до 35 аминокислот, или от 7 до 30, или от 7 до 20, или от 7 до 15, или от 7 до 10, или приблизительно 7, 8, 9 или 10 аминокислот, или предпочтительно 7, 8 или 9, или наиболее предпочтительно 7 аминокислот.
[0042] Указанный пептид или его часть могут представлять собой или могут содержать последовательность, которая представлена в приведенной ниже общей аминокислотной формуле X1-P-X2-X3-P-X4-R (SEQ ID NO: 1),
где X1 представляет собой А, Р или Q
Х2 представляет собой Р, Т, V, A, S, С, М или K
Х3 представляет собой L, I, V или А, и
Х4 представляет собой Т, V, S, А или М.
[0043] указанный пептид или часть может представлять собой, или также может содержать, любую из последовательностей, которые перечислены в таблице 1 ниже, или может представлять собой их гомолог.

[0044] Согласно другому варианту осуществления указанный пептид или часть может представлять собой, или также может содержать, любую из последовательностей, которые перечислены в таблицах 2 и 3 ниже, или может представлять собой их гомолог.


[0045] Согласно другому варианту осуществления настоящее изобретение также относится к пептиду или его части, содержащей аминокислотную последовательность, состоящую из по меньшей мере от 7 до 35 смежных аминокислот, от 7 до 30 смежных аминокислот, или от 7 до 20 смежных аминокислот, которые могут быть идентичны или могут обладать гомологией с фрагментом последовательности SEQ ID NO: 44 (участок PRR в Nox01) или SEQ ID NO: 45 (участок SH3 в NoxA1). Подходящие уровни гомологии рассматриваются ниже в разделе, относящемся к гомологии, и включают, например, аналоги или их консервативные варианты. Предпочтительно, последовательность терапевтической части или пептида идентична на 75%, 80%, 85%, 87%, 90%, 93%, 95%, 96%, 97%, 98%, или 99% последовательности SEQ ID NO: 44 или SEQ ID NO: 45. В некоторых случаях указанный пептид предназначен для использования в способе профилактики и/или лечения патологического состояния или заболевания, связанного или с активностью Nox1, и/или с повышенной продукцией активных форм кислорода (ROS). Предпочтительно указанный пептид имеет в длину от 7 до 15 аминокислот и/или указанная часть имеет в длину предпочтительно от 7 до 10 аминокислот, более предпочтительно приблизительно 7 аминокислот. Наиболее предпочтительно указанный пептид идентичен по меньшей мере 7 смежным аминокислотам последовательности SEQ ID NO: 44 (участок PRR в Nox01) или SEQ ID NO: 45 (участок SH3 в NoxA1), или идентичен по меньшей мере на 80%, или на 85%, или на 90% или на 95% последовательности SEQ ID NO: 44 или SEQ ID NO: 45. [0046] Гомологичные последовательности
[0047] Гомологичные последовательности указаны в настоящем документе. Гомологичные последовательности могут представлять собой последовательность терапевтической "части" в пептиде или представлять собой вторую (оставшуюся) последовательность в пептиде по изобретению. Гомологичные последовательности могут быть гомологичны любой из конкретных последовательностей, упомянутых в описании. Гомолог имеет одно или более (например, по меньшей мере 2, 3, 4 или 5) дополнений и/или делеций и/или замен по сравнению с исходной последовательностью. Гомологичная последовательность может включать в себя по меньшей мере 7 0%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 87%, по меньшей мере 90%, по меньшей мере 95%, 96%, 97%, 98%, или по меньшей мере 99% идентичной аминокислотной последовательности по всей длине исходной последовательности или больше чем 4, 6, 10, 15 или 20 аминокислот исходной последовательности.
[0048] Термин "идентичность последовательностей" обычно относится к последовательностям, которые имеют установленное значение при оценке с использованием ClustalW (Thompson et al., 1994, выше) со следующими параметрами: параметры сравнения двух последовательностей - метод: точный, матрица: РАМ, штраф на внесение делеций: 10,00, штраф на продолжение делеций: 0,10; параметры множественного выравнивания - матрица: РАМ, штраф на внесение делеций: 10,00, % идентичности для задержки: 30, штраф на закрытие делеций: вкл, расстояние между пропусками: 0, отрицательная матрица: нет, штраф на продолжение делеций: 0,20, штрафы за пропуски специфичных остатков: вкл, штрафы за пропуски гидрофильных остатков: вкл, гидрофильные остатки: G, Р, S, N, D, Q, Е, K. Предполагается, что идентичные последовательности в положении конкретного остатка содержат идентичные остатки, которые просто унаследованы.
[0049] Гомологичные последовательности могут иметь 1, 2, 3, 4, 5 или более, или до 10 аминокислотных замен по сравнению с исходной последовательностью. Замены предпочтительно являются консервативными заменами. Они могут быть произведены в соответствии с таблицей 4, приведенной ниже. Аминокислоты, находящиеся в одном блоке во второй колонке и предпочтительно на одной строке в третьей колонке, можно заменять друг на друга.

[0050] Пептиды по данному изобретению могут быть получены любым подходящим способом, известным в данной области, таким как химический синтез и/или технология рекомбинантной ДНК. Например, согласно изобретению пептид может быть синтезирован с использованием технологий твердофазного синтеза пептидов (например, Fmoc). Альтернативно, пептид можно синтезировать с использованием технологии рекомбинантной ДНК (например, с использованием бактериальных или эукариотических систем экспрессии). Нуклеотидную последовательность, кодирующую полипептид по изобретению, можно сконструировать путем выделения или синтеза нуклеотидной последовательности, кодирующей исходный пептид, и последующего изменения нуклеотидной последовательности так, чтобы обеспечить введение (т.е. вставку или замену) или удаление (т.е. делецию или замену) соответствующего аминокислотного остатка(ков). Способы твердофазного синтеза белка и рекомбинантного синтеза белка хорошо известны в данной области. Например, руководство "Molecular Cloning, A Laboratory Manual" (Sambrook et al., 3d Edition, Cold Spring Harmor Press), является хорошо известной ссылкой, подробно описывающей многие подходящие способы рекомбинантного получения полипептидов.
Вариант пептида может быть вариантом, встречающимся в природе, или вариантом, не встречающимся в природе. Неприродные варианты пептидов могут быть получены путем прямого синтеза, или, альтернативно, мутации могут быть введены случайным образом по всей длине пептида или в части пептида по изобретению, например, путем насыщающего мутагенеза или сайт-направленного мутагенеза в соответствии с общепринятыми способами. Независимо от способа получения, конечные варианты могут быть подвергнуты скринингу на способность ингибировать Nox1 и/или ROS, для идентификации вариантов по изобретению.
[0051] Новые пептиды могут быть выделены и/или очищены (или по существу выделены и/или по существу очищены). Соответственно, изобретение предлагает пептид по первому аспекту настоящего изобретения в выделенной или по существу выделенной форме (например, по существу выделенный из других белков или примесей). Пептид может быть отделен от других пептидов, например, при твердофазном белковом синтезе. Альтернативно, пептид может быть по существу отделен от других белков после лизиса клеток в результате рекомбинантного получения. Стандартные способы очистки белка (например, ВЭЖХ) можно использовать, чтобы по существу очистить пептиды по изобретению. Таким образом, препарат пептида по настоящему изобретению предпочтительно является по меньшей мере на 90% (по весу) свободным от других пептидов и/или примесей, и более предпочтительно является по меньшей мере приблизительно на 95% (по весу) свободным от других пептидов и/или примесей (например, по меньшей мере приблизительно на 97% или на 98% (по весу) свободным от других пептидов и/или примесей).
[0052] Термин "пептид" включает в себя не только молекулы, в которых аминокислотные остатки соединяются пептидными (-CO-NH-) связями, но также молекулы, в которых пептидная связь инвертирована. Такие ретро-инверсо-пептидомиметики могут быть получены с использованием способов, известных в данной области. Этот подход включает в себя создание псевдопептидов, содержащих изменения, затрагивающие основную цепь, и не затрагивающих ориентацию боковых цепей. Ретро-инверсо-пептиды, которые содержат связи NH-CO вместо пептидных связей CO-NH, являются гораздо более устойчивыми к протеолизу. Аналогичным образом, можно полностью отказаться от пептидной связи, если используется соответствующий линкерный компонент, который поддерживает расстояние между атомами углерода аминокислотных остатков; особенно предпочтительно, если линкерный компонент имеет по существу то же распределение заряда и, по существу, ту же планарность, что и пептидная связь. Следует также иметь в виду, что пептид можно для удобства блокировать по его N- или С-концу, чтобы способствовать уменьшению чувствительности к экзопротеолитическому расщеплению. Например, N-концевая аминогруппа пептидов может быть защищена с помощью реакции с карбоновой кислотой и С-концевая карбоксильная группа пептида, может быть защищена с помощью реакции с амином. Другие примеры модификаций включают гликозилирование и фосфорилирование. Другая возможная модификация заключается в том, что атомы водорода в боковой цепи аминов R или K могут быть заменены метиленовыми группами (-NH2-'' -NH(Me) или -N(Me)2).
[0053] Пептид может быть модифицирован другими путями, например, для увеличения или уменьшения времени полужизни пептида in vivo. Таким образом, можно использовать пептоидные аналоги, производные D-аминокислот и пептид-пептоидные гибриды. Дополнительный вариант осуществления различных полипептидов, используемых согласно изобретению, включает D-аминокислотные формы полипептида. Изготовление полипептидов с использованием D-аминокислот вместо L-аминокислот существенно уменьшает любое нежелательное разрушение такого агента при обычных метаболических процессах, что позволяет снизить количество агента, которое необходимо ввести, а также частоту его введения.
[0054] Пептид по изобретению способен снижать активность Nox1, например, по меньшей мере на 20%, или по меньшей мере на 30%, или по меньшей мере на 35%, 40%, 45%, 50%, 54%, 55%, 56%, 57%, 58%, 59% или 60%. Предпочтительно пептид избирательно снижает и/или ингибирует активность Nox1, но не ингибирует активность человеческих НАДФН-оксидаз, выбранных из Nox2, Nox4, Nox5, Duox1 и Duox2. Более предпочтительно, пептиды согласно настоящему изобретению избирательно снижают и/или ингибируют активность Nox1 путем специфического подавления взаимодействия между NoxOl и NoxAl, но не между p47phox и p67phox. Пептиды по настоящему изобретению, которые описаны в настоящем документе выше, таким образом, являются Nox1-специфическими ингибиторными пептидами.
[0055] Настоящее изобретение также относится к способам и композициям для уменьшения индуцированного НАДФН-оксидазой или NOX ROS-опосредованного повреждения кожи или слизистых оболочек индивида. Один из вариантов осуществления настоящего изобретения представляет собой способ ингибирования и уменьшения индуцированного НАДФН-оксидазой или NOX ROS-опосредованного повреждения кожи или слизистых оболочек индивида, способ включает стадию доставки эффективной дозы пептида по настоящему изобретению в фармацевтически приемлемом носителе индивиду, страдающему от индуцирванного НАДФН-оксидазой или NOX ROS-опосредованного повреждения кожи или слизистых оболочек. Более того, настоящее изобретение относится к способам модуляции индуцированного НАДФН-оксидазой или NOX ROS-опосредованного образования свободных радикалов, ответственных за окислительное повреждение тканей, связанное с преждевременным старением. Кроме того, настоящее изобретение в широком смысле охватывает включение пептидов по изобретению в виде нутрицевтического и/или фармацевтического агента в подходящие композиции. Термин "модулировать", "модуляция" или "модулирующий" охватывает любое увеличение или уменьшение активности любого компонента системы НАДФН-оксидазы или N0X, в особенности Nox1. Поскольку ROS являются высокореакционными молекулами и могут вызывать различные повреждения в клетках, считают, что порочный цикл ROS вызывает экспоненциальное увеличение окислительного повреждения во время старения, которое приводит к постепенному функциональному снижению, которое характеризует процесс старения.
[0056] В предпочтительных вариантах осуществления пептиды и их композиции являются очень эффективными в качестве фотозащитных агентов. Солнечный свет оказывает выраженное воздействие на кожу, вызывая преждевременное старение кожи, рак кожи, и множество изменений кожи. Воздействие ультрафиолетового света, особенно УФ-А или УФ-В вызывает 90% симптомов преждевременного старения кожи. Рак кожи является серьезным последствием хронического воздействия УФ-излучения. Ультрафиолетовое (УФ) излучение солнца является основной причиной рака кожи. УФ-лучи повреждают ДНК, генетический материал, который образует гены. Гены контролируют рост и общее состояние клеток кожи. Если генетическое нарушение является серьезным, нормальная клетка кожи может начать расти неконтролируемым, беспорядочным образом и превратиться в раковую клетку. УФ-излучение также может вызвать ожог и другое повреждение, которое преждевременно придает коже старый и морщинистый вид. Существуют различные типы рака кожи в зависимости от типа клетки кожи, из которой они возникли. Рак кожи может представлять собой базальноклеточную карциному, плоскоклеточный рак или злокачественную меланому.
[0057] Согласно настоящему изобретению описывается композиция на основе пептидов по изобретению, которая повышает фотозащиту как против УФ-А так и против УФ-В излучения. Такие композиции можно использовать для лечения пациентов, которые предрасположены к повреждениям кожи, связанным с острым или хроническим УФ-облучением. Указанная композиция мозно применять с помощью топических, пероральных или интрадермальных средств. Композицию можно легко включить в носители для местного применения, такие как такие как растворы, суспензии, эмульсии, масла, кремы, мази, порошки, мази, бальзамы и т.п., в качестве средства введения активных агентов непосредственно в желаемую область кожи. Кроме того, указанная композиция также может быть включена в пероральные лекарственные формы, такие как капсулы, таблетки, сиропы, сиропы, ириски, шоколадные конфеты, функциональные напитки и тому подобное.
[0058] В предпочтительных вариантах осуществления настоящее изобретение предлагает способ, направленный на лечение и/или профилактику онкогенеза кожи вследствие хронического УФ-воздействия (УФ-А или УФ-В). В других вариантах осуществления настоящее изобретение относится к способу обработки кожи для обеспечения защиты от УФ-облучения, способ включает: нанесение на кожу композиции, содержащей терапевтически эффективное количество ингибиторных пептидов Nox1, которые описаны выше, или их аналогов или консервативных вариантов, где пептид необязательно конъюгирован или соединен с агентом, который увеличивает накопление указанного пептида в клетке. Наиболее предпочтительно, может быть использован пептид, имеющий последовательность в соответствии с общей формулой аминокислотной последовательности SEQ ID NO: 1, или в соответствии с любой из аминокислотных последовательностей, как указано в SEQ ID NO: от 2 до 42, и предпочтительно от 2 до 19.
[0059] В других предпочтительных вариантах осуществления настоящее изобретение относится к способу лечения и/или ухода за кожей, слизистыми оболочками, кожей головы и/или волосами, который включает введение косметически или фармацевтически эффективного количества ингибиторных пептидов Nox1, которые описаны выше, их аналогов или консервативных вариантов, где пептид необязательно конъюгирован или соединен с агентом, который увеличивает накопление указанного пептида в клетке. Предпочтительно пептид имеет последовательность ID NO: 1 или 42. В предпочтительных вариантах осуществления изобретение относится к способу лечения и/или ухода при указанных состояниях, нарушениях и/или патологиях кожи, слизистых оболочек, кожи головы и/или волос, которые являются результатом образования ROS. При этом специфическое лечение и/или уход, предусмотренные способами и композициями согласно настоящему изобретению, представляют собой фотозащиту, защиту клеточной ДНК и/или восстановление клеточной ДНК кожи, слизистых оболочек, кожи головы и/или волос.
[0060] В соответствии с альтернативными вариантами лечение и/или уход за кожей с помощью композиций по настоящему изобретению осуществляется, чтобы уменьшить, отсрочить и/или предотвратить появление признаков старения, фотостарения и т.п. В частности, болезненные состояния, которые можно лечить, могут включать кожные состояния, вызванные старением или преждевременным старением, где пептид по изобретению применяют в качестве реагента, предотвращающего старение, или фотопротективного средства.
[0061] Настоящее изобретение также относится к композиции, которая усиливает фотозащиту против повреждения кожи, индуцированного УФ-А и УФ-В, указанная композиция содержит терапевтически эффективное количество Nox1-ингибиторного пептида, который описан выше, его аналогов или консервативных вариантов. Указанный пептид необязательно может быть конъюгирован или присоединен к агенту, который увеличивает накопление указанного пептида в клетке. В предпочтительных вариантах осуществления такая композиция предлагает безопасное, долгосрочное терапевтическое решение для индивидов, которые нуждаются в повышенной фотозащите как от УФ-А, так и от УФ-В лучей. В частности, такую композицию можно вводить индивидам, которые предрасположены к риску развития рака кожи в связи с продолжительным воздействием УФ-А и УФ-В.
[0062] Настоящее изобретение относится к способу избирательного снижения или ингибирования или модуляции NOX/НАДФН-оксидазы, в особенности активности, функции или уровней Nox1 у индивида, который в этом нуждается. Указанный способ включает введение субъекту эффективного количества Nox1-ингибиторного пептида, который описан в настоящем документе, где пептид необязательно конъюгирован или соединен с агентом, который увеличивает его накопление указанного пептида в клетке.
[0063] Настоящее изобретение дополнительно относится к способу снижения уровней активных форм кислорода (ROS) или к ингибированию продукции активных форм кислорода (ROS) у индивида, который в этом нуждается, способ включает введение индивиду эффективного количества Nox1-ингибиторного пептида, который описан в настоящем документе, который необязательно конъюгирован или соединен с агентом, который увеличивает его накопление указанного пептида в клетке.
[0064] Пептид необязательно конъюгирован или присоединен к агенту, который увеличивает накопление указанного пептида в клетке. Такое конъюгирование с подходящим агентом, как, например, с носителями, проходящими через клеточную мембрану, способствовало бы прохождению указанного пептида через мембраны. Такой агент может представлять собой носитель, проникающий через клеточную мембрану, например, пептид, богатый положительно заряженными аминокислотами, например, пептид, богатый аргинином. В качестве примера пептида, богатого аргинином, можно привести полиаргининовую метку, имеющую последовательность RRRRRRRRR (SEQ ID NO: 46). Другие проникающие пептиды могут быть выбраны из пептида NGR, полученного из N-лиганда аминопептидазы, (CD13) (CNGRCG: SEQ ID NO: 47), или лидерного пептида Antennapedia (СТ) (KKWKMRRNQFWVKVQRG: SEQ ID:48), пептида, связывающего Вс1-2 (деканоил-KNLWAAQRYGRELRRMSDEFEGSFKGL: SEQ ID NO: 49), последовательности tat (RKKRRQRRR: SEQ ID NO: 50), буфорина (TRSSRAGLQFPVGRVHRLLRK: SEQ ID NO: 51), пептидного фрагмента человеческого Т-клеточного лимфотрофического вируса (HTLV)-II Rex (TRRQRTRRARRNR: SEQ ID NO: 52), пептида, обеспечивающего перенос через липидную мембрану (KKAAAVLLPVLLAAP: SEQ ID NO: 53), пептида, воздействующего на NRP-1, полученного из Streptomyces hygroscopicus (RPARPAR: SEQ ID NO: 54), и пенетратина (RQIKIWFQNRRMKWKKGG: SEQ ID NO: 55).
[0065] Пептиды согласно настоящему изобретению можно использовать для профилактики и/или лечения любого нарушения, связанного с НАДФН-оксидазами, которые могут включать сердечно-сосудистые заболевания и нарушения, включающие, но без ограничения гипертониию, атеросклероз, гипертрофию сердца, сердечную недостаточность, инфаркт миокарда, рестеноз, диабет, диабетическую нефропатию, повреждение слизистой оболочки кишечника (в частности, поражения слизистой оболочки при воспалительном заболевании кишечника), гиперплазию неоинтимы и стенокардию, другие заболевания и нарушения, совпадающие с повышенной супероксидной продукцией, опосредованной НАДФН-оксидазами, включают, но без ограничения артрит, хронические воспалительные заболевания кишечника (IBD), сепсис и другие воспалительные заболевания, бронхиальную астму, хроническое обструктивное заболевание легких, (C0PD), инфекционное легочное заболевание, фиброз легких, острый респираторный дистресс-синдром (ARDS), рак, аутоиммунные заболевания, реперфузионные травмы, заболевания почек, инсульт, болезнь Альцгеймера, болезнь Паркинсона и другие нейродегенеративные заболевания, кистозный фиброз, отторжение органов и легочную гипертензию. В целом, пептиды по изобретению можно использовать для профилактики или лечения любого воспалительного нарушения, опосредованного активными формами кислорода (ROS), включая, но без ограничения, нарушения, опосредованные фосфорилированием, нарушения, опосредованные полиморфно-ядерными лейкоцитами, нарушения, опосредованные макрофагами, нарушения, опосредованные липополисахаридами, нарушения, опосредованные фактором некроза опухолей-α, нарушения, опосредованные цитокином IFN-γ, нарушения, опосредованные интерлейкином-2, воспалительный артрит, артрит, индуцированный пероксохроматом калия, ревматоидный артрит, остеоартрит или болезнь Альцгеймера. В предпочтительных вариантах осуществления настоящее изобретение относится к способу лечения или профилактики, где активность НАДФН-оксидазы 1 (Nox1) или активность ROS приводит к болезненному состоянию, выбранному из группы, состоящей из сердечно-сосудистых нарушений, респираторных нарушений, нарушений обмена веществ, кожных нарушений, поражений костей, нарушений ЦНС, нейровоспалительных и/или нейродегенеративных нарушений, заболеваний почек, нарушений сна, репродуктивных нарушений, заболеваний, поражающих глаз и/или хрусталик, воспалительных заболеваний, заболеваний печени, боли, рака, опухолей, острой почечной недостаточности (ARF), аллергических нарушений, кожных нарушений, УФ-повреждений, состояний кожи, вызванных старением, фотоповреждения кожи, повреждения кожи, индуцированного ROS, преждевременного старения, заболевания или нарушения, связанного со старением, заболеваний желудочно-кишечного тракта, нарушений ангиогенеза, атеросклероза, рестеноза после введения стента, и/или гипертензии и т.п.
[0066] В предпочтительном варианте осуществления настоящее изобретение относится к способу ингибирования роста опухолевых клеток у индивида, который в этом нуждается, способ включает введение терапевтически эффективного количества Nox1-ингибиторного пептида по изобретению, его аналогов или консервативных вариантов. Указанный пептид необязательно может быть конъюгирован или соединен с агентом, который увеличивает накопление указанного пептида в клетке. В наиболее предпочтительном варианте осуществления указанное ингибирование роста опухолевых клеток представляет собой ингибирование роста онкогенных кератиноцитов. В другом предпочтительном варианте осуществления указанный способ представляет собой способ лечения и/или профилактики онкогенеза кожи после хронического УФ-воздействия (УФ-А или УФ-В).
[0067] В предпочтительных аспектах способы согласно настоящему изобретению являются эффективными для множества состояний, выбранных из группы, состоящей из рака, ROS-индуцированного повреждения кожи, профилактики старения кожи и других нарушений, связанных со старением, атеросклероза, рестеноза после установки стента, и/или гипертонии и т.п. В очень предпочтительных вариантах осуществления рак, который поддается лечению способами по настоящему изобретению, выбирают из группы, состоящей из рака кожи, предраковых поражений кожи, толстой кишки, аденокарциномы толстой кишки, рака предстательной железы, доброкачественной или злокачественной папилломы и т.п. Рак может представлять собой меланому или гемопоэтическую злокачественную опухоль, такую как острый лимфобластный лейкоз (ALL), миелодиспластический синдром (MDS), или миелоидный лейкоз, такой как хронический миелолейкоз (CML) или острый миелоидный лейкоз (AML). Это может быть рак поджелудочной железы.
[0068] Рак может представлять собой рак, вызванный Ras-индуцированной онкогенетической клеточной трансформацией, например, колоректальный рак. Рак может представлять собой аденокарциному или желудочно-кишечного новообразование, вызванное инфекцией Helicobacter pylori. Рак может быть вызван вирусом папилломы. Рак может быть вызван подавлением экспрессии гена при пигментной ксеродерме типа С (ХРС).
[0069] В широком смысле настоящее изобретение охватывает косметическую или фармацевтическую композицию, содержащую косметически или фармацевтически или терапевтически эффективное количество по меньшей мере одного пептида по изобретению или смесей пептидов по изобретению с фармацевтически приемлемой солью, и обычно по меньшей мере с одним косметически или фармацевтически приемлемым вспомогательным веществом или адъювантом.
[0070] Настоящее изобретение также относится к фармацевтическим или нутрицевтическим композициям для ингибирования или модуляции активности Nox1 у индивида, включающим пептид по изобретению. В других предпочтительных вариантах осуществления настоящее изобретение относится к композициям для избирательного снижения и/или ингибирования активности Nox1 у индивида, который в этом нуждается, или к композициям для снижения уровней активных форм кислорода (ROS) или ингибирования продукции активных форм кислорода (ROS) у индивида, который в этом нуждается, где указанная композиция содержит эффективное количество Nox1-ингибиторного пептида согласно настоящему изобретению. В наиболее предпочтительном варианте осуществления настоящее изобретение относится к композиции для селективного снижения и/или ингибирования активности Nox1 и/или уменьшения уровней активных форм кислорода (ROS) или ингибирования продукции активных форм кислорода (ROS) у индивида, который в этом нуждается, композиция содержит эффективное количество пептида, имеющего аминокислотную последовательность, выбранную из последовательностей SEQ ID NO: с 1 по 42 и предпочтительно с 1 по 19, его аналогов или консервативных вариантов, где пептид необязательно конъюгирован или соединен с агентом, который увеличивает его накопление указанного пептида в клетке.
[0071] В еще одном аспекте настоящее изобретение относится к композициям, содержащим пептиды согласно настоящему изобретению, где указанная композиция дополнительно содержит фармацевтически приемлемое вспомогательное вещество или носитель. В частности, настоящее изобретение относится к применению Nox1-ингибиторных пептидов по настоящему изобретению в качестве активного ингредиента, вместе с по меньшей мере одним фармацевтически приемлемым носителем, вспомогательным веществом и/или разбавителями для изготовления фармацевтической композиции для лечения и/или профилактики заболеваний, описанных в настоящем документе. Такие фармацевтические композиции содержат Nox1-ингибиторный пептид по меньшей мере вместе с одним фармацевтически приемлемым носителем, вспомогательным веществом, связующими веществами, разрыхлителями, веществами, способствующими скольжению, разбавителями, лубрикантами, красителями, подсластителями, ароматизаторами, консервантами или т.п. Фармацевтические композиции по настоящему изобретению могут быть получены в обычном твердом или жидком носителе или в разбавителях, и в обычно применяемом фармацевтически произведенном адъюванте в соответствующей дозировке известным способом. Лекарственные формы включают, например, пилюли, таблетки, таблетки с пленочным покрытием, таблетки, покрытые оболочкой, капсулы, липосомальные препараты, микро- и нано-препараты, порошки и "депо"-формы. Кроме того, настоящее изобретение также включает фармацевтические препараты для парентерального применения, в том числе для дермального, интрадермального, интрагастрального, внутрикожного, интравазального, внутривенного, внутримышечного, внутрибрюшинного, интраназального, интравагинального, интрабуккального, чрескожного, ректального, подкожного, сублингвального, местного или трансдермального применения, указанные препараты в дополнение к типичным носителям и/или разбавителям содержат новые пептиды согласно настоящему изобретению. Способы разработки и введения пептида по настоящему изобретению, можно найти в руководстве "Remington's Pharmaceutical Sciences" Mack Publishing Co., Easton PA.
[0072] Пептиды по изобретению могут быть также применены в форме фармацевтически активных солей. Подходящие фармацевтически активные соли включают соли присоединения кислоты и щелочи или соли щелочноземельных металлов. Например, могут быть получены соли натрия, калия, лития, магния или кальция. Nox1-ингибиторный пептид или пептидная комбинация по настоящему изобретению образует фармацевтически приемлемые соли с органическими и неорганическими кислотами. Примерами подходящих кислот для создания такой соли присоединения кислоты являются соляная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, уксусная кислота, лимонная кислота, щавелевая кислота, малоновая кислота, салициловая кислота, п-аминосалициловая кислота, яблочная кислота, фумаровая кислота, янтарная кислота, аскорбиновая кислота, малеиновая кислота, сульфокислоты, фосфоновая кислота, хлорная кислота, азотная кислота, муравьиная кислота, пропионовая кислота, глюконовая кислота, молочная кислота, винная кислота, гидроксималеиновая, пировиноградная, фенилуксусная кислота, бензойная кислота, п-аминобензойная кислота, п-гидроксибензойная кислота, метансульфоновая кислота, этансульфоновая кислота, азотистая кислота, гидроксиэтансульфокислота, этиленсульфоновая кислота, п-толуолсульфоновая кислота, нафталинсульфоновая кислота, сульфаниловая кислота, камфорсульфоновая кислота, хинная кислота, миндальная кислота, о-метилминдальная кислота, водород-бензолсульфоновая кислота, пикриновая кислота, адипиновая кислота, D-o-толилвинная кислота, тартроновая кислота, α-толуиловая кислота, (о, м, п)-толуиловая кислота, нафтиламинсульфокислота и другие минеральные или карбоновые кислоты, хорошо известные специалистам в данной области. Соли получают путем взаимодействи свободного основания с достаточным количеством желаемой кислоты с получением соли общепринятым способом.
[0073] В одном варианте осуществления данного аспекта изобретения, Nox1-ингибиторный пептид по настоящему изобретению может быть конъюгирован с непептидным фрагментом. Полимерная молекула, которую соединяют с пептидом, может быть любой подходящей полимерной молекулой, такой как природный или синтетический гомополимер или гетерополимер, как правило, с молекулярной массой в диапазоне приблизительно 300-100000 Да, например, приблизительно 500-20000 Да. Примеры подходящих полимерных молекул включают полимерные молекулы, выбранные из группы, состоящей из полиалкиленоксида (РАО), включая полиалкиленгликоль (ПАГ), такой как полиэтиленгликоль (ПЭГ) и полипропиленгликоль (ППГ), разветвленные ПЭГ, поли-виниловый спирт (ПВС), поликарбоксилат, поли-(винилпиролидон), сополимер полиэтилена и ангидрида малеиновой кислоты, сополимер полистирола и ангидрида малеиновой кислоты, декстран, включая карбоксиметил-декстран, или любой другой биополимер, подходящий для снижения иммуногенности и/или увеличения функционального времени полужизни in vivo и/или сыворточного времени полужизни. Другим примером молекулы полимера является альбумин человека или другой распространенный белок плазмы. В целом, полимеры производные полиалкиленгликоля являются биосовместимыми, нетоксичными, неантигенными, неиммуногенными, обладают различной растворимостью в воде, и легко выводятся из живых организмов.
[0074] Ингибиторные пептиды Nox1 по настоящему изобретению могут также быть включены в фармацевтические системы доставки и/или системы пролонгированного высвобождения, термин "системы доставки" относится к разбавителю, адъюванту, вспомогательному веществу или носителю, с которым вводят пептид по изобретению. Указанные косметические или фармацевтические носители могут представлять собой жидкости, такие как вода, масла или поверхностно-активные вещества, в том числе получаемые из нефти, животного, растительного или синтетического происхождения, такие как, но без ограничения, арахисовое масло, соевое масло, минеральное масло, кунжутное масло, касторовое масло, полисорбаты, сложные эфиры сорбита, сульфаты простых эфиров, сульфаты, бетаины, гликозиды, мальтозиды, жирные спирты, ноноксинолы, полоксамеры, полиоксиэтилены, полиэтиленгликоли, декстроза, глицерин, дигитонин и т.п. В руководстве "Remington's Pharmaceutical Sciences" по E.W. Martin разбавители, адъюванты или вспомогательные вещества описываются как подходящие носители. Термин "замедленное высвобождение" используется в обычном смысле, в отношении системы доставки соединения, которое обеспечивает постепенное высвобождение указанного соединения в течение периода времени, предпочтительно, хотя и не обязательно, с относительно постоянными уровнями высвобождения соединения в течение времени. Примерами систем доставки или пролонгированного высвобождения являются липосомы, смешанные липосомы, олеосомы, ниосомы, этосомы, милличастицы, микрочастицы, наночастицы и твердые липидные наночастицы, наноструктурированные липидные носители, губки, циклодекстрины, везикулы, мицеллы, смешанные мицеллы сурфактантов, смешанные мицеллы из сурфактантов и фосфолипидов, миллисферы, микросферы и наносферы, липосферы, милликапсулы, микрокапсулы и нанокапсулы, а также микроэмульсии и нано-эмульсии, которые могут быть добавлены для достижения большего проникновения Nox1-ингибиторных пептидов и/или улучшения их фармакокинетических и фармакодинамических свойств. Предпочтительными системами доставки или системами с замедленным высвобождением являются липосомы, смешанные мицеллы сурфактант/фосфолипид и микроэмульсии, более предпочтительны микроэмульсии вода-в-масле с внутренней структурой обратной мицеллы.
[0075] При использовании в качестве фотопротективного средства или реагента, предотвращающего старение, композиции по изобретению могут также содержать обычные косметические добавки и адъюванты, выбранные, в частности, из жировых веществ, органических растворителей, загустителей, смягчителей, антиоксидантов, опалесцирующих компонентов, стабилизаторов, смягчающих веществ, гидроксикислот, пеногасителей, увлажнителей, витаминов, ароматизаторов, консервантов, сурфактантов, наполнителей, комплексообразующих соединений, полимеров, пропеллентов, подщелачивающих или подкисляющих агентов, красителей, колорантов или любого другого ингредиента, обычно включаемых в состав косметических средств, в частности для изготовления антисолнечных/солнцезащитных композиций в виде эмульсий.
[0076] Способы и композиции по настоящему изобретению можно использовать в сочетании с другими композициями и процедурами для лечения заболеваний. Например, опухоль можно лечить обычным путем с помощью хирургического вмешательства, лучевой терапии, химиотерапии или иммунотерапии, в сочетании со способами и композициями по настоящему изобретению. Затем способы и композиции по настоящему изобретению также могут быть применены у пациента в дальнейшем для продления латентного периода развития метастазов и для стабилизации и подавления роста любой остаточной первичной опухоли. Композиции по настоящему изобретению также могут быть объединены с другими антиангиогенными соединениями или белками, фрагментами, антисыворотками, агонистами рецепторов, антагонистами рецепторов других антиангиогенных белков. Кроме того, новые Nox1-ингибиторные пептиды по настоящему изобретению могут быть объединены с фармацевтически приемлемыми вспомогательными веществами, и необязательно с матрицей для замедленного высвобождения, такой как биодеградируемые полимеры, для создания терапевтических композиций.
[0077] Кроме того, композиции по настоящему изобретению можно применять одновременно с другими видами лечения, например, в сочетании с курсом лечения химиотерапией или лучевой терапией. Примеры химиотерапевтических агентов, которые могут быть объединены с новыми Nox1-ингибиторными пептидами по настоящему изобретению, включают алкилирующие агенты, например, азотистые иприты, этилениминовые соединения, алкилсульфонаты и другие соединения с алкилирующим действием, такие как нитрозомочевина, цисплатин и дакарбазин; антиметаболиты, например, например, фолиевая кислота, пуриновые или пиримидиновые антагонисты; митотические ингибиторы, например, алкалоиды барвинка и производные подофиллотоксина; цитотоксические антибиотики и производные камптотецина. Предпочтительные химиотерапевтические агенты или химиотерапия включает амифостин (этиол), цисплатин и/или другие соединения платины, предпочтительно, включая карбоплатин и/или оксалиплатин, дакарбазин (DTIC), дактиномицин, мехлорэтамин (азотистый иприт), стрептозоцин, циклофосфамид, кармустин (BCNU), ломустин (CCNU), доксорубицин (адриамицин), доксорубицин липо (доксил), гемцитабин (гемзар), даунорубицин, даунорубицин липо (даунозом), прокарбазин, митомицин, цитарабин, этопозид, метотрексат, 5-фторурацил (5-ФУ), винбластин, винкристин, блеомицин, паклитаксел (таксол), доцетаксел (таксотер), алдеслейкин, аспарагиназа, бусульфана, карбоплатин, кладрибин, камптотецин, СРТ-11,10-гидрокси-7-этил-камптотецин (SN38), дакарбазин, флоксуридин, флударабин, гидроксимочевину, ифосфамид, идарубицин, месна, интерферон-альфа, интерферон бета, иринотекан, митоксантрон, топотекан, лейпролид, мегестрол, мелфалан, меркаптопурин, пликамицин, митотан, пэгаспаргазу, пентостатин, пипоброман, пликамицин, стрептозоцин, тамоксифен, тенипозид, тестолактон, тиогуанин, тиотепа, урацил иприт, винорелбин, хлорамбуцил и их комбинации.
[0078] При использовании для лечения или контроля атеросклероза, рестеноза после установки стента, и/или гипертензии, Nox1-ингибиторные пептиды по настоящему изобретению можно использовать либо по отдельности, либо в комбинации с другими лекарственными средствами для лечения и/или контроля атеросклероза, рестеноза после установки стента, и/или гипертензии. Указанные другие лекарственные средства могут включать, но без ограничения тромболитические средства, такие как стрептокиназа, тканевой активатор плазминогена, плазмин и урокиназа, антитромботические средства, такие как ингибиторы тканевого фактора протеазы (TFPI), белки-антикоагулянты, выделенные из нематод (NAP) и т.п., ингибиторы металлопротеиназ, противовоспалительные агенты, антидиабетические или антигипергликемические агенты, в том числе инсулин, стимуляторы секреции инсулина или сенсибилизаторы инсулина, ингибиторы SGLT-2, антагонист рецептора ΑΊΊ, ингибитор редуктазы HMG-Co-A, ингибитор ангиотензинпревращающего фермента (АСЕ), блокатор кальциевого канала, ингибитор альдостеронсинтазы, антагонист альдостерона, двойной ингибитор ангиотензин-превращающего фермента/нейтральной эндопептидазы (ACE/NEP), антагонист эндотелина, диуретик и т.п.
[0079] При использовании в качестве реагента, предотвращающего старение, или фотопротективного средства, Nox1-ингибиторные пептиды по настоящему изобретению можно объединять с одним или более ботаническими/растительными экстрактами; тиодипропионовой кислотой (TDPA) и ее сложными эфирами; ретиноидами (например, полностью транс-ретиноевая кислота, 9-цис ретиноевая кислота, фитановая кислота и др.); гидроксикислотами (включая альфа-гидроксикислоты и бета-гидроксикислоты), с салициловой кислотой и салицилатами; отшелушивающими агентами (например, гликолевая кислота, 3,6,9-триоксо-уноктандикарбоновая кислота, etc.), стимуляторы ароматазы (например, кофеин и его производные); соединения, способные ингибировать активность 5-альфа-редуктазы (например, линоленовая кислота, линолевая кислота, финастерид и их смеси); агенты, усиливающие барьерные функции (например, керамиды, глицериды, холестерин и его эфиры, альфа-гидрокси и омега-гидрокси жирные кислоты и сложные эфиры, и т.д.); ингибиторы коллагеназы; и ингибиторы эластазы и т.п.
[0080] Омолаживающие или фотопротективные композиции также могут содержать одно или более из перечисленного ниже: средство, усиливающее проникновение через кожу, смягчающее средство, средство, придающее коже упругость, оптический диффузор, солнцезащитное средство, отшелушивающее средство и антиоксидант. Смягчающее средство обеспечивает функциональные преимущества увеличения гладкости кожи и уменьшения появления мимических морщинок и глубоких морщин. Смягчающие средства включают в качестве примеров, изопропилмиристат, вазелин, изопропилланолат, силиконы (например, метикон, диметикон), масла, минеральные масла, сложные эфиры жирных кислот, или любые их смеси. Смягчающее средство предпочтительно может быть представлено в количестве приблизительно от 0,1% масс. до 50% масс. от общей массы композиции.
[0081] Средство, придающее коже упругость, служит в качестве усилителя коллагена кожи. Примером подходящего и предпочтительного средства, придающего коже упругость, является пальмитоилолигопептид. Другие средства, придающие коже упругость, представляют собой коллаген и/или другие вещества повышающие содержание гликозаминогликанов (GAG). Если присутствует средство, придающее коже упругость, его концентрация может составлять приблизительно от 0,1% масс. до 20% масс. от общей массы композиции. Оптический диффузор представляет собой частицу, которая изменяет поверхностные оптометрические свойства кожи, что приводит к визуальному разглаживанию и смягчению, например, мимических морщинок и складок. Примеры оптических диффузоров, которые можно использовать в настоящем изобретении, включают, но не ограничиваются ими, нитрид бора, слюду, нейлон, полиметилметакрилат (РММА), полиуретановый порошок, серицит, диоксид кремния, силиконовый порошок, тальк, тефлон, диоксид титана, оксид цинка или любые их смеси. Если присутствует оптический диффузор, он может быть представлен в концентрации приблизительно от 0,01% масс. до 20% масс. от общей массы композиции.
[0082] Солнцезащитное средство для защиты кожи от повреждений ультрафиолетовыми лучами также может быть включено в состав. Предпочтительные солнцезащитные средства представляют собой средства с широким диапазоном УФ-В и УФ-А защиты, такие как октокрилен, авобензон (парсол 1789), октилметоксициннамат, октилсалицилат, оксибензон, гомосалат, бензофенон, производные камфоры, оксид цинка, и диоксид титана. Если присутствует солнцезащитное средство, его концентрация может составлять приблизительно от 0,01% масс. до 70% масс. от общей массы композиции.
[0083] Подходящие отшелушивающие средства включают, например, альфа-гидроксикислоты, бета-гидроксикислоты, оксикислоты, оксидикислоты и их производные, такие как сложные эфиры, ангидриды и их соли. Подходящие гидроксикислоты включают в частности, гликолевую кислоту, молочную кислоту, яблочную кислоту, винную кислоту, лимонную кислоту, 2-гидроксиалкановую кислоту, миндальную кислоту, салициловую кислоту и их производные. Предпочтительным отшелушивающим средством является гликолевая кислота. Если присутствует отшелушивающее средство, его концентрация может составлять приблизительно от 0,1% масс. до 80% масс. от общей массы композиции.
[0084] Действие антиоксиданта, помимо всего прочего, заключается в удалении из кожи свободных радикалов с целью защиты кожи от агрессивных воздействий окружающей среды. Примеры антиоксидантов, которые могут быть использованы в композициях по настоящему изобретению, включают соединения, имеющие фенольные гидроксильные функциональные группы, такие как аскорбиновая кислота и ее производные/сложные эфиры; бета-каротин; катехины; куркумин; производные феруловой кислоты (например, этиловый ферулат, ферулат натрия); производные галловой кислоты (например, пропилгаллат); ликопин; редуктиновая кислота; розмариновая кислота; дигалловая кислота; тетрагидрокуркумин; токоферол и его производные; мочевая кислота; или любые их смеси. Другими подходящими антиоксидантами являются антиоксиданты, которые имеют одну или несколько функциональных тиоловых групп (-SH), в восстановленной или невосстановленной форме, такие как глутатион, липоевая кислота, тиогликолевая кислота и другие сульфгидрильные соединения. Антиоксидант может быть неорганическим, таким как бисульфиты, метабисульфиты, сульфиты, или другие неорганические соли и кислоты, содержащие серу.
[0085] Другие типичные добавки включают витамины, такие как токоферол и аскорбиновая кислота; производные витаминов, такие как аскорбил монопальмитат; загустители, такие как гидроксиалкил целлюлозы; гелеобразователи; структурирующие агенты, такие как бентонит, смектит, алюмосиликат магния и силикат лития магния; металлхелатирующие агенты, такие как ЭДТА; пигменты, такие как оксид цинка и двуокись титана; красители; смягчающие вещества; и увлажнители.
[0086] Настоящее изобретение также относится к участку или части или к фрагменту гена Nox1 или мРНК, в частности к длинному варианту изоформы НАДФН-оксидазы 1, к изоформе 3 активатора 1 НАДФН-оксидазы, к изоформе организатора 1 НАДФН-оксидазы. В частности, настоящее изобретение относится к последовательностям нуклеиновой кислоты, кодирующим пептиды по настоящему изобретению. "Участок или часть или фрагмент" определяется как имеющий минимальный размер по меньшей мере приблизительно 8 нуклеотидов или предпочтительно приблизительно 12-17 нуклеотидов или более предпочтительно по меньшей мере приблизительно 18-25 нуклеотидов и может иметь максимальный размер по меньшей мере приблизительно 5000 нуклеотидов. Также можно использовать геномные эквиваленты больше чем 5000 нуклеотидов. Указанное определение включает все размеры в диапазоне 8-5000 нуклеотидов. Таким образом, указанное определение включает нуклеиновые кислоты, состоящие по меньшей мере из 12, 15, 20, 25, 40, 60, 80, 100, 200, 300, 400, 500 или 1000 нуклеотидов или нуклеиновые кислоты, имеющие любое число нуклеотидов в пределах указанных значений (например, 13, 16, 23, 30, 28, 50, 72, 121 нуклеотидов и т.д.) или нуклеиновые кислоты, имеющие более чем 500 нуклеотидов или любое число нуклеотидов в пределах 500. Настоящее изобретение включает все новые нуклеиновые кислоты, имеющие по меньшей мере 8 нуклеотидов, полученных из нуклеиновых кислот, кодирующих Nox1-ингибиторные пептиды по настоящему изобретению, их комплементарный или его функциональный эквивалент. В наиболее предпочтительном варианте осуществления настоящее изобретение относится к нуклеиновой кислоте, кодирующей пептид с последовательностью SEQ ID NO: от 2 до 42, или его аналоги или консервативные варианты. Более того, изобретение относится к плазмидам или векторам, содержащим нуклеиновые кислоты, кодирующие Nox1-ингибиторные пептиды по настоящему изобретению. Нуклеиновые кислоты, плазмиды и векторы по изобретению могут быть использованы для лечения любого из состояний, упомянутых в описании.
[0087] Пептид по настоящему изобретению может быть помечен одной или несколькими детектируемыми метками. Метка может быть конъюгирована с пептидом, либо непосредственно, либо с использованием линкера. Если пептид по настоящему изобретению конъюгируют с прямой меткой, прямая метка соответственно представляет собой частицу, которую можно обнаружить в ее естественном состоянии. Например, если прямая метка представляет собой окрашенную частицу, такую как золи красителей, металлические золи (например, коллоидное золото), и окрашенные латексные частицы, она может быть видна невооруженным глазом, или она становится видимой с использованием оптического фильтра. Если прямая метка представляет собой флуоресцентную метку, она может быть подвергнута внешней стимуляции, например, УФ-светом, чтобы способствовать созданию флуоресценции. Подходящие детектируемые вещества включают различные ферменты, простетические группы, флуоресцентные вещества, люминесцентные вещества и радиоактивные вещества.
[0088] В одном варианте осуществления настоящего изобретения Nox1-ингибиторные пептиды по изобретению могут быть конъюгированы с одним или более маркирующим, диагностическим или терапевтическим агентом для селективной доставки к пораженным участкам, например, к раковым клеткам, в частности у человека. Конъюгирование может быть либо непосредственным, либо с использованием линкера, аналогично конъюгированию, описанному выше. Соответствующие способы обнаружения, диагностики и терапии заболеваний представляют собой соответствующие аспекты по настоящему изобретению, поскольку представляют собой пептиды для использования в указанных способах обнаружения, диагностики и терапии. Маркирующие, диагностические или терапевтические агенты могут быть природными, модифицированными, или синтетическими. Терапевтические агенты могут способствовать или препятствовать биологическому процессу, вовлеченному в развитие заболевания у человека. Способы обнаружения, диагностики и терапии с использованием пептидов по настоящему изобретению, конъюгированных с одним или более маркирующим, диагностическим или терапевтическим агентом для селективной доставки к пораженным участкам, могут быть осуществлены in vitro, в частности, на образце, полученном от индивида, или in vivo в организме индивида (пациента), которого обследуют или лечат. Например, дополнительный агент может представлять собой терапевтический агент, известный в данной области, как эффективный агент для лечения рака. Взаимодействие при специфическом связывании между пептидом и клетками позволяет терапевтическому агенту воздействовать с высокой точностью на раковые клетки пациента-млекопитающего. Терапевтические агенты, подходящие для указанного использования, могут включать любое соединение, которое индуцирует апоптоз, гибель клеток, дифференцировку клеток, остановку клеточного роста и/или антиангиогенез, или влияет иным образом на жизнеспособность и/или скорость роста раковой клетки.
[0089] Изобретение дополнительно относится к способу получения Nox1-ингибиторного пептида по изобретению путем твердофазного или жидкофазного синтеза, где указанный способ необязательно включает стадию конъюгации или присоединения агента, который увеличивает накопление указанного пептида в клетке.
Способы доставки
[0090] После создания композиции по изобретению (содержащие пептид или полинуклеотид по изобретению) могут быть доставлены индивиду in vivo с использованием различных известных технологий и путей. Например, композиция может быть предоставлена в виде инъекционного раствора, суспензии или эмульсии и введена с помощью парентеральной, подкожной, эпидермальной, внутрикожной, внутримышечной, внутриартериальной, внутрибрюшинной, внутривенной инъекции с использованием обычной иглы и шприца, или с использованием инъекционной системы для струйной подачи жидкости. Композиции также можно наносить местно на кожу или слизистые ткани, например, назально, интратрахеально, интестинально, ректально или вагинально, или они могут быть предоставлены в виде мелкодисперсного спрея, подходящего для респираторного или легочного введения. Другие способы введения включают пероральное введение, суппозитории, сублингвальное введение и методы активной или пассивной чрескожной доставки.
Схемы доставки
[0091] Введение пептидов/полинуклеотидов может осуществляться любым подходящим способом, как описано выше. Подходящие количества пептида могут быть определены эмпирически, но, как правило, они находятся в диапазоне, приведенном ниже. Однократное введение каждого пептида может быть достаточным для оказания благоприятного воздействия на пациента, но следует понимать, что может быть полезным, если пептид вводят более чем один раз, и в этом случае типичные схемы введения могут представлять собой, например, введение один раз или два раза в неделю в течение 2-4 недель каждые шесть месяцев, или раз в день в течение недели каждые четыре-шесть месяцев. Как будет понятно, каждый пептид или полинуклеотид, или комбинация пептидов и/или полинуклеотидов могут быть введены пациенту отдельно или в комбинации.
[0092] Дозы для введения будут зависеть от ряда факторов, включая природу композиции, способ введения и схему, и время введения. Подходящие дозы молекулы или комбинации молекул по изобретению могут составлять примерно от 1 мкг до 10 мкг, до 15 мкг, до 20 мкг, до 25 мкг, до 30 мкг, до 35 мкг, до 50 мкг, до 100 мкг, до 500 мкг или больше на введение. Подходящие дозы могут составлять меньше чем 15 мкг, но по меньшей мере 1 нг, или по меньшей мере 2 нг, или по меньшей мере 5 нг, или по меньшей мере 50 нг, или по меньшей мере 100 нг, или по меньшей мере 500 нг, или по меньшей мере 1 мкг, или по меньшей мере 10 мкг. Для некоторых молекул по изобретению используемая доза может быть выше, например, до 1 мг, до 2 мг, до 3 мг, до 4 мг, до 5 мг или выше. Такие дозы могут быть предоставлены в жидком препарате, в концентрации, подходящей для обеспечения соответствующего объема для введения выбранным способом.
ПРИМЕРЫ
Два новых пептида, называемых А и В, по настоящему изобретению, тестировали и сравнивали с контрольным пептидом С, пептиды описаны в таблице 5 ниже.
Пептид A (SEQ ID NO: 41) содержит последовательность tat, которая является N-концевой для последовательности SEQ ID NO: 20. Пептид В (SEQ ID NO: 42) содержит последовательность tat, которая является N-концевой для последовательности SEQ ID NO: 21. Пептид С (SEQ ID NO: 43) является контрольным пептидом (или рандомизированным пептидом).

Цитотоксический эффект каждого пептида вначале оценивали в отношении нормальных первичных человеческих кератиноцитов с использованием теста вытеснения трипанового синего и МТТ-теста. Как показано на фигурах 1А и 1В, не наблюдали выраженной токсичности после обработки клеток пептидами в дозе ниже 50 мкМ.
Обнаружили, что Nox1-ингибиторные пептиды эффективно снижали внутриклеточные уровни ROS, что подтверждено приведенными ниже результатами.
Уровень ROS в первичных человеческих кератиноцитах, обработанных 10 или 50 мкМ пептидов А, В и С в течение 24 часов, оценивали с помощью зондов CM-H2DCF-DA (фиг. 2А). Наблюдали существенное снижение уровня ROS в клетках, обработанных Nox1-ингибиторными пептидами А и В. Для проверки специфичности действия указанных пептидов оценивали уровни ROS в клетках линии аденокарциномы толстой кишки человека НТ29, в которых Nox1 является единственным активным членом семейства Nox. Измерение уровня ROS в клетках НТ29 показало, что обработка Nox1-ингибиторными пептидами А и В приводила к существенному снижению уровня ROS, что указывает на специфический ингибиторный эффект пептидов в отношении активности Nox1 (фиг. 2В).
Для проверки специфичности указанных пептидов, ингибировали экспрессию эндогенного белка Nox1 и Nox2 с использованием лентивирус-опосредованной экспрессии shPHK против Nox1 и Nox2. Как shNox1, так и shNox2 стабильно ингибировали более чем на 80% экспрессию Nox1 и Nox2 соответственно (фиг. 3А). Затем shCtr1, shNox1 или shNox2-трансфицированные кератиноциты обрабатывали пептидом А. Измерения уровня ROS показали, что обработка пептидом А не оказывала эффекта на уровни ROS в стационарном состоянии в shNox1-трансфицированных клетках, что показывает, что пептид А блокировал Nox1-зависимое образование ROS с очень высокой (почти 100%) эффективностью и специфичностью (фиг. 3В). Кроме того, измеряли активность НАДФН-оксидазы в shCtrl и shNox1-трансфектированных клетках, обработанных или не обработанных пептидом А (фиг. 3С). Аналогичным образом обнаружили сниженную активность НАДФН-оксидазы в shNox1 трансфицированных клетках, клетках, обработанных пептидом А, и в shNox1-трансфицированных клетках, обработанных пептидом А, что показывает эффективность и специфичность действия пептида А при блокировании активации Nox1.
Пример 1
Оценка in vivo Nox1-ингибиторных пептидов
Для оценки фотозащитного эффекта Nox1-ингибиторного пептида А сначала проверяли, оказывал ли пептид ингибиторный эффект на Nox1-индуцированное образование ROS в кератиноцитах человека и мыши (фиг. 4). Результаты показали сходный превентивный эффект пептида А на Nox1-индуцированное образование ROS и активность Nox в кератиноцитах человека и мыши.
Для оценки эффекта пептида А на активность Nox1 в коже мышей, мышей SKH-1 обрабатывали местно различными дозами пептида А (фиг. 5А). Результаты показали, что пептид А эффективно ингибировал активность Nox в течение 3 дней при использовании в дозе 3 и 12 мг/кг. Затем проверяли действие пептида А на мышах, облученных УФ-В (фиг. 5В). Результаты показали, что местная обработка пептидом А за 10 мин до облучения, эффективно блокировала УФ-В-индуцированную активацию Nox у мышей, получавших дозы 3 и 12 мг/кг.
Чтобы изучить фотозащитные эффекты пептида А, оценивали действие пептида А на индукцию УФ-В-вызванных плоскоклеточных карцином (SCC) с использованием бесшерстных мышей породы SKH-1, хорошо известной мышиной модели для изучения фотоканцерогенеза, в которой развиваются опухоли кожи, в том числе доброкачественная папиллома и злокачественная SCC. Достоверность модели иллюстрируется существенным сходством между УФ-В-вызванным канцерогенезом у данных мышей и развитием УФ-канцерогенеза в коже человека. В модели бесшерстных мышей SKH-1 получали важные результаты относительно дозы, зависимости от времени и спектра действия в случае онкогенеза кожи после хронического облучения УФ-В. В данном исследовании пептид А (3 мг/кг) применяли три раза в неделю, за 10 мин до каждого облучения УФ-В. Результаты показали, что обработка пептидом А приводила к снижению в 2,3 раза и в 2,9 раза числа опухолей и размера опухолей соответственно (фиг. 6А и 6В). Кроме того, 57% опухолей у мышей, обработанных пептидом А, имели объем меньше 5 мм3, по сравнению с только 8% у мышей, обработанных контрольным пептидом С (фиг. 6С).
Измерения активности НАДФН-оксидазы в опухолях мышей показали достоверную эффективность пептида А в предотвращении активности Nox (фиг. 7). Активность НАДФН-оксидазы снижалась на 7 0% в коже, не несущей опухоли, и на 54% в опухолях, полученных от мышей, обработанных пептидом А, по сравнению с мышами, обработанными носителем (фиг. 7).
Пример 2
Эффект ингибиторных пептидов Nox1 в терапии рака

Пример 2.1
Эффект in vitro на раковые клеточные линии
Эффект ингибирования Nox1 оценивают на различных клеточных линиях, которые перечислены в таблице 6. Клеточную пролиферацию, прохождение клеточного цикла и апоптоз можно сравнить в необработанных клетках и в клетках, которые обрабатывали Nox1-ингибиторными пептидами.
Пример 2.2
Ксенотрансплантаты клеток у мышей NOD/SCID
Клетки трипсинизируют, отмывают в буфере DPBS и ресуспендируют в DPBS с 25% матригеля (BD Biosciences). Клетки в количестве 2×106 вводят подкожно мышам NOD/SCID в возрасте 6-8 недель (The Jackson Laboratory). Мышей каждой линии делят на две группы: одну группу обрабатывают носителем и другую группу обрабатывают Nox1-ингибиторным пептидом. Образование опухоли и рост опухоли контролируют в течение двух месяцев. Каждую опухоль иссекают, измеряют, фиксируют в 4% параформальдегиде, заливают в парафин и обрабатывают для окрашивания гематоксилином и эозином. Оценивают скорость пролиферации и скорость апоптоза.
Пример 2.3
Мышиные модели
Эффекты Nox1-ингибиторных пептидов на опухоли кожи проверяли с использованием следующих моделей: спонтанные и УФ-В-индуцированные ВСС у мышей Patch+/-; УФ-В-индуцированные SCC у мышей SKH-1; и спонтанное образование меланом у мышей BRAF. Для каждой модели мышей распределяли в две группы: одну группу обрабатывали носителем и другую группу обрабатывали Nox1-ингибиторными пептидами.
Пример 3
Эффект Nox1-ингибиторных пептидов в отношении воспалительных и аутоиммунных заболеваний

Пример 3.1
Эффекты in vitro
Проверяют действие Nox1-ингибиторных пептидов при артрите, макрофаги, полученные из лимфоцитов периферической крови (PBL), активируют в присутствии и в отсутствие ингибиторных пептидов Nox1. Определяют секрецию различных медиаторов воспаления (TNF-α, IL-6, IL-Iβ, IL-8, IL-10).
Эффекты Nox1-ингибиторных пептидов также проверяют при астме путем оценки IgE-DNP-индуцированного воспаления в присутствии и в отсутствие Nox1-ингибиторных пептидов.
Пример 3.2
Эффекты in vivo
В модели артрита крысы получают различные дозы Nox1-ингибиторных пептидов для оценки благоприятного действия пептидов на клинические показатели и на предотвращение разрушения костей.
Кроме того, оценивают эффективность Nox1-ингибиторных пептидов при астме, при ушной гиперчувствительности у крыс в присутствии и в отсутствие ингибиторных пептидов Nox1.
Пример 4
Действие Nox1-ингибиторных пептидов на ангиогенез

Для оценки эффекта Nox1-ингибиторных пептидов на нормальный ангиогенез in vitro, используют тесты миграции эндотелиальных клеток и образования трубочкоподобных структур с использованием клеток HUVEC.
Для оценки эффекта Nox1-ингибиторных пептидов на нормальный ангиогенез in vivo, проверяют кожный ангиогенез в моделях мышей C57BL/6 и SKH-1, обработанных носителем или Nox1-ингибиторными пептидами. Для оценки эффекта Nox1-ингибиторных пептидов на опухолевый ангиогенез можно использовать анализ ангиогенеза в матригеле, модели ксенотрансплантатов. Клетки различных линий, которые перечислены в таблице 6, можно ввести с помощью инъекции мышам, и затем можно сравнить ангиогенез у мышей, получавших носитель и получавших Nox1-ингибиторные пептиды.
Пример 5
Эффект Nox1-ингибиторных пептидов на сосудистые и сердечнососудистые нарушения

Эффект Nox1-ингибиторных пептидов на гемангиому, трансформацию эндотелиальных клеток, вызванную средним Т-антигеном вируса полиомы мышей (PymT), проверяют в присутствии и в отсутствие Nox1-ингибиторных пептидов.
Кроме того, оценивают эффект ингибиторных пептидов Nox1 на гипертензию в модели индукции гипертензии после инфузии ангиотензина-II в присутствии и в отсутствие ингибиторных пептидов Nox1.
Пример 6
Эффект Nox1-ингибиторных пептидов на нейродегенеративные нарушения


Для оценки эффекта Nox1-ингибиторных пептидов на болезнь Паркинсона и синдром Альцгеймера используют нервные клетки, полученные из клеток кожи с помощью технологии iPS. Также проверяют эффекты Nox1-ингибиторных пептидов на уровни ROS в нервных клетках, полученных от пациентов, и из здоровой кожи.
Эффект Nox1-ингибиторных пептидов оценивают при рассеянном склерозе, в мышиных моделях экспериментального аутоиммунного энцефаломиелита (ЕАЕ). По существу, используют модель ЕАЕ, индуцированного пептидом PLP139-151, у мышей SJL.
Пример 7
Эффект NOX1-ингибиторов на кожные нарушения

Эффекты Nox1-ингибиторных пептидов оценивают при атопическом дерматите путем определения секреции медиаторов воспаления IgE-индуцированными активированными кератиноцитами в присутствии и в отсутствие ингибиторных пептидов Nox1. IgE-индуцированную ушную гиперчувствительность также оценивают в присутствии и в отсутствие ингибиторных пептидов Nox1.
Для оценки эффектов Nox1-ингибиторных пептидов при витилиго можно использовать тест отделения меланоцитов от базальной мембраны с использованием реконструированного эпидермиса и первичных меланоцитов.
В заключение, эффекты, предотвращающие старение кожи, Nox1-ингибиторных пептидов тестируют на первичных кератиноцитах и на реконструированном эпидермисе. Дифференцировку и маркеры старения сравнивают в клетках, обработанных носителем или Nox1-ингибиторными пептидами.
Пример 8
Эффект Nox1-ингибиторных пептидов на старение кожи Для оценки эффектов, предотвращающих старение кожи, Nox1-ингибиторного пептида A (SEQ ID NO: 41), сначала оценивали ускоренное старение у мышей, дефицитных по гену ХРС. С этой целью экспрессию прогерина, усеченной версии ламина А, белка, вовлеченного в синдром ускоренного старения, оценивали у 4-месячных (молодых) и 1,5-летних (старых) профицитных и дефицитных по гену ХРС мышей (ХРС+/+ и ХРС-/-, соответственно) (фиг. 9А и 9В). Результаты показали, что уровень прогерина повышался с возрастом, и что его экспрессия была выше у ХРС-/- мышей, чем у мышей дикого типа.
Чтобы проверить, связан ли указанный фенотип с повышенной активностью НАДФН-оксидазы, активность НАДФН-оксидазы сначала измеряли в коже мышей (фиг. 10А). Результаты показали, что активность NOX возрастала с возрастом, и что она также была выше у ХРС-/- мышей, чем у мышей дикого типа. Поскольку в нескольких исследованиях показан широкий спектр изменений в митохондриях и в митохондриальных ДНК (мтДНК), в том числе повышенная дезорганизация митохондриальной структуры, снижение функции митохондриального окислительного фосфорилирования (OXPHOS) и накопление мутаций мтДНК с возрастом, затем уровень экспрессии белков OXPHOS сравнивали у молодых и старых ХРС-/- и ХРС+/+ мышей (фиг. 10В). Результаты показали существенное снижение экспрессии белков комплекса I, II и III у старых мышей дикого типа по сравнению с молодыми мышами. Кроме того, уровень экспрессии указанных комплексов у молодых ХРС-/- мышей был таким же низким, как и у старых мышей дикого типа, что коррелирует с преждевременным старением у ХРС-/- мышей.
Чтобы изучить роль активности НАДФН-оксидазы в преждевременном старении ХРС-дефицитных мышей, ХРС+/+ и ХРС-/- мышей в возрасте одного месяца обрабатывали Nox1-ингибиторным пептидом или носителем три раза в неделю в течение трех месяцев. Затем оценивали экспрессию прогерина (фиг. 11), экспрессию белков OXPHOS (фиг. 12) и метаболический профиль в эпителиальных клетках мышей. Результаты показали, что ингибирование активности Nox1 уменьшало ускоренное старение у ХРС-дефицитных мышей. По существу, ингибирование Nox1 блокировало увеличение экспрессии прогерина (фиг. 11) и нейтрализовало снижение экспрессии комплексов OXPHOS I, II и III (фиг. 12). С целью получения общего понимания эффектов Nox1-пептидного ингибитора на изменение метаболизма, вызванное нокдауном гена ХРС, использовали протеомный подход. Результаты показали существенное снижение экспрессии нескольких белков, участвующих в пентозофосфатном пути, цикле трикарбоновых кислот, митохондриальном OXPHOS и β-окислении жирных кислот. Обработка мышей Nox1-ингибиторным пептидом устраняла эффекты дефицита ХРС на изменение метаболизма.
Все указанные эксперименты осуществляли с Nox1-ингибиторным пептидом, который описан в последовательности SEQ ID NO: 2, и получали аналогичные результаты.
В целом, результаты показывают, что Nox1-ингибиторный пептид А, также как и Nox1-ингибиторный пептид, который описан в последовательности SEQ ID NO: 2, препятствовали преждевременному старению, вызванному дефицитом ХРС.
Реферат
Настоящее изобретение относится к области биотехнологии, конкретно к новым пептидам, ингибирующим НАДФН-оксидазу 1 (Nox1), и может быть использовано в медицине для профилактики или лечения патологических состояний и заболеваний, связанных с повышенной продукцией Nox1 активных форм кислорода (ROS), в том числе рака, атеросклероза, ангиогенеза и преждевременного старения. Пептиды, как и содержащие их композиции, эффективны также в уходе, восстановлении и защите кожи, слизистой оболочки, кожи головы и/или волос от УФ-облучения, УФ-повреждения, УФ-старения или для повышения фотозащиты от как УФ-А, так УФ-В облучения. Изобретение обеспечивает получение пептидов, которые способны селективно снижать или ингибировать активность Nox1. 10 н. и 12 з.п. ф-лы, 12 ил., 11 табл., 8 пр.

Комментарии