Композиции и способы лечения сердечной недостаточности - RU2646481C2
Код документа: RU2646481C2
Чертежи

Описание
1. ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к использованию белка нейрегулина для подготовки препаратов для профилактики, лечения или отсрочки сердечной недостаточности в организме человека и способов профилактики, лечения или отсрочки сердечной недостаточности в организме человека с помощью указанного лекарства. В частности, изобретение предоставляет способы профилактики, лечения или отсрочки сердечной недостаточности с помощью препарата, содержащего белок нейрегулин, у конкретных групп пациентов с хронической сердечной недостаточностью.
2. ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Сердечной недостаточностью страдают около пяти миллионов американцев, и каждый год с этим состоянием диагностируется более 550000 новых больных. Современная лекарственная терапия сердечной недостаточности, прежде всего, направлена на ингибиторы ангиотензин-превращающего фермента (АСЕ), являющиеся вазодилататорами, которые вызывают расширение кровеносных сосудов, снижение артериального давления и снижение рабочей нагрузки сердца. Несмотря на то, что процентное снижение смертности было значительным, фактическое сокращение смертности с ингибиторами АПФ в среднем составляет лишь 3-4%, и существует несколько возможных побочных эффектов. Дополнительные ограничения связаны с другими опциями для профилактики или лечения сердечной недостаточности. Например, пересадка сердца явно является более дорогой и инвазивной, чем медикаментозное лечение, и это дополнительно ограничивается наличием донорских сердец. Применение механических устройств, таких как электрокардиостимуляторы кровообращения, также является инвазивным и дорогим. Таким образом, возникла потребность в новых способах лечения с учетом недостатков текущей терапии.
Одна из многообещающих новых терапий включает введение нейрегулина (в дальнейшем именуемого "NRG") пациенту, страдающему от или подверженному риску развития сердечной недостаточности. NRG, семейство EGF-подобных факторов роста, состоит из семейства структурно связанных факторов роста и дифференциации, которое включает NRG1, NRG2, NRG3 и NRG4 и их изоформ, участвуют в ряде биологических реакций: стимуляции дифференциации клеток рака молочной железы и секреции молочных белков; индукции дифференцировки клеток нервного гребня в Шванновские клетки; стимулировании синтеза рецепторов ацетилхолина в скелетных мышечных клетках; и стимулировании выживаемости и синтез ДНК в клетках миокарда. Исследования in vivo эмбрионов мышей, гомозиготных по целевому гену нейрегулина, с сильными дефектами желудочкового трабекулярного формирования и развития ганглиев спинного корня указывают на то, что нейрегулин важен для развития сердца и нервной системы.
NRG связываются с семейством EGF-рецепторов, которое включает в себя EGFR, ErbB2, ErbB3 и ErbB4, каждый из которых играет важную роль в нескольких клеточных функциях, в том числе клеточный рост, дифференцировка и выживание. Они представляют собой белковые тирозинкиназные рецепторы, состоящие из внеклеточного лиганд-связывающего домена, трансмембранного киназного домена и цитоплазматического тирозинкиназного домена. После связывания NRG с внеклеточным доменом ErbB3 или ErbB4 происходит индукция конформационных изменений, что приводит к образованию гетеродимеров между ErbB3, ErbB4 и ErbB2 или формированию гомодимера ErbB4 самого по себе, что приводит к фосфорилированию С-концевого домена рецептора внутри клеточной мембраны. Фосфорилированный внутриклеточный домен затем связывает дополнительные сигнальные белки внутри клеток, активируя соответствующий, расположенный вниз по течению сигнальный путь АКТ или ERK, и вызывая серии клеточных реакций, таких как стимуляция или подавление клеточной пролиферации, дифференцировки клеток, апоптоза клеток, клеточной миграции или клеточной адгезии. Среди этих рецепторов, ErbB2 и ErbB4, в основном, экспрессируются в сердце.
Было показано, что EGF-подобные домены NRG-1, варьирующие по размеру от 50 до 64 аминокислоты, достаточны для связывания и активации этих рецепторов. Предыдущие исследования показали, что нейрегулин-1β (NRG-1β) может непосредственно связываться с ErbB3 и ErbB4 с высокой аффинностью. Орфанный рецептор, ErbB2, может образовывать гетеродимер с ErbB3 и ErbB4 с более высокой аффинностью, чем гомодимеры ErbB3 или ErbB4. Исследование нейронного развития показало, что формирование симпатической нервной системы требует интактной сигнальной системы NRG-1β, ErbB2 и ErbB3. Направленное нарушение NRG-1β, или ErbB2, или ErbB4 приводит к эмбриональной летальности от пороков развития сердца. Недавние исследования также подчеркнули роль NRG-1β, ErbB2 и ErbB4 в сердечно-сосудистом развитии, а также в поддержании нормальной работы сердца у взрослых. Было показано, что NRG-1β усиливает организацию саркомера в кардиомиоцитах взрослых. Введения рекомбинантного EGF-подобного домена NRG-1β значительно улучшает и защищает от износа при работе миокарда в определенных животных моделях сердечной недостаточности, а также в клинических испытаниях. Эти результаты делают NRG-1 перспективным в качестве ведущего компонента для лечения сердечной недостаточности. Однако все еще нужны дополнительные доказательства того, может ли лечение NRG-1 обеспечить долгосрочные выгоды для пациентов с сердечной недостаточностью и может ли быть предоставлена польза всем пациентам с хронической сердечной недостаточностью или нескольким подгруппам.
3. КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Во время клинических испытаний нейрегулина для лечения сердечной недостаточности у людей заявители обнаружили, что оценивающая сердечную функцию классификация нью-йоркской кардиологической ассоциации (NYHA) и измерение уровня NT-proBNP или BNP в плазме крови пациентов позволяет выбрать пациентов с сердечной недостаточностью, которые получат значительные преимущества от лечения нейрегулином. Такие преимущества включают в себя значительное снижение уровня смертности.
Заявитель обнаружил, что NRG усиливает дифференцировку клеток сердечной мышцы и организации структуры саркомер и цитоскелета, а также клеточной адгезии. Заявитель также обнаружил, что NRG значительно улучшает и защищает от повреждения при функционировании миокарда в определенных животных моделях сердечной недостаточности и в клинических испытаниях. Нейрегулин, полипептид нейрегулина, производные нейрегулина или соединения, которые имитируют активность нейрегулинов, подпадают под сферу действия настоящего изобретения.
Таким образом, в первом аспекте изобретение предоставляет фармацевтическую композицию, включающую эффективное количество нейрегулина, для лечения пациентов с хронической сердечной недостаточностью, и пациенты получили значительные преимущества от фармацевтической композиции. В некоторых вариантах осуществления преимущество представляет собой значительное снижение уровня смертности. В некоторых вариантах осуществления, преимущество представляет собой значительное снижение повторной госпитализации. В некоторых вариантах осуществления, преимущество представляет собой повышения уровня биомаркеров, которые указывают на улучшение в плане хронической сердечной недостаточности. В некоторых вариантах осуществления, фармацевтическую композицию вводят пациентам в вводном режиме. В некоторых оптимизированных вариантах осуществления вводный режим включает в себя введение фармацевтической композиции, по меньшей мере, в течение 3, 5, 7 или 10 дней подряд. В некоторых оптимизированных вариантах осуществления, фармацевтическую композицию вводят пациентам в поддерживающем режиме в течение, по меньшей мере, 3, 6 или 12 месяцев после вводного режима. В некоторых оптимизированных вариантах осуществления, поддерживающий режим включает в себя введение фармацевтической композиции каждые 3, 5, 7 или 10 дней.
Во втором аспекте изобретение предоставляет способ улучшения выживания или уменьшения смертности у пациентов с хронической сердечной недостаточностью, включающий введение фармацевтической композиции, содержащей эффективное количество нейрегулина, пациентам с хронической сердечной недостаточностью. В некоторых вариантах осуществления, фармацевтическую композицию вводят пациентам для вводного режима. В некоторых оптимизированных вариантах осуществления, вводный режим включает в себя введение фармацевтической композиции, по меньшей мере, 3, 5, 7 или 10 дней подряд. В некоторых оптимизированных вариантах осуществления, фармацевтическую композицию вводят пациентам в поддерживающем режиме в течение, по меньшей мере, 3, 6 или 12 месяцев после вводного режима. В некоторых оптимизированных вариантах осуществления, поддерживающий режим включает введение фармацевтической композиции каждые 3, 5, 7 или 10 дней.
В третьем аспекте изобретения фармацевтически эффективное количество нейрегулина применяют для лечения пациентов с хронической сердечной недостаточностью, у которых уровень NT-proBNP в плазме находится в пределах предпочитаемой зоны лечения до лечения нейрегулином. В одном варианте осуществления предпочитаемая зона лечения составляет не более чем 4000 фмоль/мл. В другом варианте осуществления, предпочитаемая зона лечения находится между 1600 фмоль/мл и 4000 фмоль/мл. В еще одном варианте осуществления, предпочитаемая зона лечения составляет не более чем 1600 фмоль/мл. В другом предпочтительном варианте осуществления уровень в плазме крови измеряется с помощью иммуноферментного анализа.
В четвертом аспекте изобретения фармацевтически эффективное количество нейрегулина применяется для лечения пациентов с хронической сердечной недостаточностью, которые имеют определенный класс сердечной функции, классифицируемый по NYHA-классификации сердечной функции. В некоторых вариантах осуществления определенный класс сердечной функции представляет собой класс II по NYHA. В некоторых вариантах осуществления, определенный класс сердечной функции представляет собой класс III по NYHA.
В пятом аспекте изобретение описывает способ выбора пациента с сердечной недостаточностью для лечения нейрегулином. Этот способ включает измерение уровня NT-proBNP в плазме крови пациента. В одном варианте осуществления уровень не более 4000 фмоль/мл свидетельствует о том, что пациент подходит для лечения сердечной недостаточности при помощи нейрегулина. В другом варианте осуществления уровень между 1600 фмоль/мл и 4000 фмоль/мл свидетельствует о том, что пациент подходит для лечения сердечной недостаточности при помощи нейрегулина. В еще одном варианте осуществления уровень не более 1600 фмоль/мл свидетельствует о том, что пациент подходит для лечения сердечной недостаточности при помощи нейрегулина.
В шестом аспекте изобретение описывает способ выбора пациента с сердечной недостаточностью для лечения нейрегулина. Этот способ включает в себя оценивание класса сердечной функции по NYHA-классификации сердечной функции. В одном из вариантов осуществления, класс II по NYHA свидетельствует о том, что пациент подходит для лечения сердечной недостаточности при помощи нейрегулина. В другом варианте осуществления, класс III по NYHA свидетельствует о том, что пациент подходит для лечения сердечной недостаточности при помощи нейрегулина.
В седьмом аспекте изобретение описывает диагностические наборы для выбора пациента с сердечной недостаточностью для лечения нейрегулином. В одном из вариантов осуществления диагностический набор состоит из реагентов для иммуноферментного анализа для измерения уровня NT-proBNP в плазме крови пациента с сердечной недостаточностью, где уровень не более 4000 фмоль/мл свидетельствует о том, что пациент подходит для лечения сердечной недостаточности при помощи нейрегулина. В другом варианте осуществления уровень между 1600 фмоль/мл и 4000 фмоль/мл свидетельствует о том, что пациент подходит для лечения сердечной недостаточности при помощи нейрегулина. В еще одном варианте осуществления уровень не более 1600 фмоль/мл свидетельствует о том, что пациент подходит для лечения сердечной недостаточности при помощи нейрегулина.
В восьмом аспекте изобретения предоставляется использование белка нейрегулина для приготовления лекарственного препарата. Лекарственный препарат может быть предоставлен пациентам с хронической сердечной недостаточностью для обеспечения долгосрочных преимуществ. В одном из вариантов осуществления долгосрочное преимущество представляет собой улучшение выживаемости. В одном варианте осуществления долгосрочное преимущество представляет собой снижение повторной госпитализации. В другом варианте осуществления долгосрочное преимущество представляет собой улучшение биомаркеров, которые указывают на долгосрочный прогноз хронической сердечной недостаточности. В некоторых вариантах осуществления препарат вводят пациентам в вводном режиме. В некоторых оптимизированных вариантах осуществления, вводный режим включает в себя введение лекарственного препарата, по меньшей мере, 3, 5, 7 или 10 дней подряд. В некоторых оптимизированных вариантах осуществления, лекарственный препарат вводят пациентам в поддерживающем режиме в течение, по меньшей мере, 3, 6 или 12 месяцев после вводного режима. В некоторых оптимизированных вариантах осуществления, поддерживающий режим включает введение медикаментов каждые 3, 5, 7 или 10 дней.
В девятом аспекте изобретения предоставляется сопутствующий диагностический тест для лечения хронической сердечной недостаточности при помощи белка нейрегулина. N-концевой промозговой натрийуретический пептид (NT-proBNP) используется в качестве биомаркера для сопутствующего диагностического теста. В одном из вариантов осуществления уровень не более чем 4000 фмоль/мл свидетельствует о том, что пациент подходит для лечения сердечной недостаточности при помощи нейрегулина. В другом варианте осуществления уровень между 1600 фмоль/мл и 4000 фмоль/мл свидетельствует о том, что пациент подходит для лечения сердечной недостаточности при помощи нейрегулина. В еще одном варианте осуществления уровень не более 1600 фмоль/мл свидетельствует о том, что пациент подходит для лечения сердечной недостаточности при помощи нейрегулина.
В десятом аспекте изобретения предоставляется способ лечения хронической сердечной недостаточности с помощью нейрегулина.
Способ включает в себя процедуру оценки до начала лечения и определяет, подходит ли любой пациент для прохождения лечения нейрегулином, в соответствии с результатом оценивания. В одном варианте осуществления процедура оценки включает в себя классификацию сердечной функции по NYHA у пациента с хронической сердечной недостаточностью. В другом варианте процедура оценки включает в себя тест плазмы (NT-proBNP) или BNP для каждого пациента с хронической сердечной недостаточностью.
В одиннадцатом аспекте изобретения предоставляется сопутствующий диагностический набор для определения того, является ли пациент с хронической сердечной недостаточностью пригодным для получения лечения белком нейрегулином. Сопутствующий диагностический набор включает тест-набор для плазматического (NT-proBNP) или BNP и инструкцию того, как использовать комплект и как судить, является ли субъект подходящим для лечения белком нейрегулином в зависимости от результата теста.
4. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для ясности раскрытия информации и не для ограничения, подробное описание изобретения далее разделяется на подразделы. Все публикации, упомянутые в настоящем документе, включены посредством ссылки для раскрытия и описания способов и/или материалов, в связи с которым приводятся публикации.
А. ОПРЕДЕЛЕНИЯ
Если не определено иначе, все технические и научные термины, использованные в настоящем документе, имеют то же значение, которое обычно подразумевается любым специалистом в рассматриваемой области, которой это изобретение принадлежит. Все патенты, заявки, опубликованные заявки и другие публикации, указанные в настоящем документе, включенные посредством ссылки в полном объеме. Если определение, изложенное в этом разделе, противоречит или иным образом несовместимо с определением, изложенным в патентах, заявках, опубликованных заявках и других публикациях, включенных посредством ссылки в настоящем документе, определения, изложенные в этом разделе, имеют преимущественную силу над определением, которое включено в настоящий документ посредством ссылки.
Как используется в настоящем документе, "нейрегулин" или "NRG", используемый в настоящем изобретении, относится к белкам или пептидам, которые могут связывать и активировать ErbB2, ErbB3, ErbB4 или их комбинации, включая, без ограничения, все изоформы нейрегулина, EGF-подобный домен нейрегулина сам по себе, полипептиды, содержащие EGF-подобный домен нейрегулина, мутанты или производные нейрегулина и любой вид нейрегулин-подобных генных продуктов, которые также активируют вышеописанные рецепторы, как это подробно описано ниже. Нейрегулин также включает в себя белки NRG-1, NRG-2, NRG-3 и NRG-4, пептиды, фрагменты и соединения, которые имитируют активность нейрегулина. Нейрегулин, используемый в настоящем изобретении, может активировать выше ErbB рецепторы и модулировать их биологические реакции, например, стимулировать синтез ацетилхолинового рецептора в клетках скелетных мышц; и/или улучшать дифференциацию кардиоцитов, выживаемость и синтез ДНК. Нейрегулин также включает в себя те варианты с консервативными аминокислотными заменами, которые не приводят к существенному изменению их биологической активности. Подходящие консервативные замены аминокислот известны специалистам в рассматриваемой области, и могут производиться, как правило, без изменения биологической активности образующейся в результате молекулы. Специалисты в рассматриваемой области признают, что, как правило, единичные аминокислотные замены в несущественных областях полипептида не существенно изменяют биологическую активность (см., например, Watson et al., Molecular Biology of the Gene, 4th Edition, 1987, The Bejacmin/Cummings Pub.со.,p.224). В предпочтительных вариантах осуществления нейрегулин, используемый в настоящем изобретении, связывается и активирует гетеродимеры ErbB2/ErbB4 или ErbB2/ErbB3, например, но не для целей ограничения, пептиды, включающие остатки 177-237 изоформы NRG-1 β2, содержащей последовательность аминокислот: SHLVKCAEKEKTFCVNGGECFMVKDLSNPSRYLCKCPNEFTGDRCQNYVMASFYKAEELYQ (SEQ ID NO: 1). Пептиды, включающие остатки 177-237 изоформы NRG-1 β2, включают в себя EGF-подобный домен, который, как было показано, достаточен для связывания с и активации рецепторов.
Как используется в настоящем документе, "домен, подобный эпидермальному фактору роста" или "EGF-подобный домен" относится к полипептидному мотиву, кодируемому геном нейрегулина, который связывает и активирует ErbB2, ErbB3, ErbB4 или их сочетания, и имеет структурное сходство с EGF-связывающим доменом, как указано в документе WO 00/64400, Holmes et al., Science, 256: 1205-1210 (1992); патенты США Nos.5,530,109 и 5,716,930; Hijazi et al., Int. J. Oncol., 13: 1061-1067 (1998); Chang et al., Nature, 387:509-512 (1997); Carraway et al., Nature, 387:512-516 (1997); Higashiyama et al., J. Biochem., 122:675-680 (1997); и WO 97/09425, содержание каждого из которых включено в настоящий документ посредством ссылки. В определенных вариантах осуществления EGF-подобный домен связывает и активирует гетеродимеры ErbB2/ErbB4 или ErbB2/ErbB3. В определенных вариантах осуществления EGF-подобный домен включает в себя последовательность аминокислот рецептор-связывающего домена NRG-1. В некоторых вариантах осуществления EGF-подобный домен включает в себя последовательность аминокислот, соответствующую аминокислотным остаткам 177-226, 177-237 или 177-240 NRG-1. В определенных вариантах осуществления EGF-подобный домен включает в себя последовательность аминокислот рецептор-связывающего домена NRG-2. В определенных вариантах осуществления EGF-подобный домен включает в себя последовательность аминокислот рецептор-связывающего домена NRG-3. В определенных вариантах осуществления, EGF-подобный включает в себя последовательность аминокислот рецептор-связывающего домена NRG-4. В определенных вариантах осуществления EGF-подобный включает в себя последовательность аминокислот Ала-Glu-Lys-Glu-Lys-Thr-Phe-Cys-Val-Asn-Gly-Gly-Glu-Cys-Phe-Met-Val-Lys-Asp-Leu-Ser-Asn-Pro, как описано в патенте США No 5834229.
Состав, дозировка и способы введения белка нейрегулина, предпочтительно в виде фармацевтических композиций, могут быть определены в соответствии со способами, известными в рассматриваемой области (см., например, Remington: The Science and Practice of Pharmacy, Alfonso R. Gennaro (Editor) Mack Publishing Company, April 1997; Therapeutic Peptides and Proteins: Formulation, Processing, and Delivery Systems, Banga, 1999; и Pharmaceutical Formulation Development of Peptides and Proteins, Hovgaard and Frkjr (Ed.), Taylor & Francis, Inc., 2000; Medical Applications of Liposomes, Lasic and Papahadjopoulos (Ed.), Elsevier Science, 1998; Textbook of Gene Therapy, Jain, Hogrefe & Huber Publishers, 1998; Adenoviruses: Basic Biology to Gene Therapy, Vol.15, Seth, Landes Bioscience, 1999; Biopharmaceutical Drug Design and Development, Wu-Pong and Rojanasakul (Ed.), Humana Press, 1999; Therapeutic Angiogenesis: From Basic Science to the Clinic, Vol. 28, Dole et al. (Ed.), Springer - Verlag New York, 1999).
Белок нейрегулин может быть составлен для перорального, ректального, местного, ингаляционного, защечного (например, подъязычного), парентерального (например, подкожного, внутримышечного, подкожного или внутривенного), трансдермального введения или любого другого подходящего способа введения. Наиболее подходящий способ в каждом конкретном случае будет зависеть от характера и тяжести подвергаемого лечению заболевания лечат и природы конкретного белка нейрегулина, который используется. Белок нейрегулин можно вводить сам по себе. Альтернативно и предпочтительно, белок нейрегулин вводят совместно с фармацевтически приемлемым носителем или наполнителем. Любой подходящий фармацевтически приемлемый носитель или наполнитель может быть использован в настоящем способе (см., например, Remington: The Science and Practice of Pharmacy, Alfonso R. Gennaro (Editor) Mack Publishing Company, April 1997).
В соответствии с настоящим изобретением, белок нейрегулин, сам по себе или в комбинации с другими агентами, носителями или наполнителями, можно составить для любого подходящего способа введения, такого как внутрикавернозная инъекция, подкожная инъекция, внутривенная инъекция, внутримышечная инъекция, внутрикожная инъекция, пероральное или местное введение. Способ может использовать составы для инъекционного введения в единичной лекарственной форме, в ампулах или в мультидозовых контейнерах, с добавлением консерванта. Составы могут иметь такие формы, как суспензии, растворы или эмульсии в маслянистых или водных носителях, и могут содержать рецептурные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в форме порошка для составления с подходящим носителем, стерильной апирогенной водой или другими растворителями, до использования. Местное введение в настоящем изобретении может использовать пену, гель, крем, мазь, трансдермальный пластырь или пасту.
Фармацевтически приемлемые композиции и способы их введения, которые могут быть использованы для применения в этом изобретении, включают, но не ограничиваются теми, что описаны в патентах США No. 5736154; 6197801 В1; 5741511; 5886039; 5941868; 6258374 В1 и 5686102.
Величина терапевтической дозы при лечении или профилактике будет варьировать в зависимости от тяжести состояния, подлежащего лечению, и способа введения. Доза, и, возможно, дозовая частота будет также варьировать в зависимости от возраста, массы тела, состояния и реакции конкретного пациента.
Необходимо отметить, что лечащему врачу следует знать, как и когда прекратить, прервать или скорректировать терапию, чтобы снизить дозировки из-за токсичности или побочных эффектов. С другой стороны, врачу также следует знать, как и когда скорректировать лечение до более высоких уровней, если клинический ответ не является адекватным (исключая токсические побочные эффекты).
Любой подходящий способ введения может быть использован. Лекарственные формы включают планшеты, таблетки, крахмальные капсулы, дисперсии, суспензии, растворы, капсулы, наклейки и т.п. См., Remington's Pharmaceutical Sciences. В практическом использовании, белок нейрегулин, сам по себе или в комбинации с другими агентами, может быть объединен в качестве актива в однородной смеси с фармацевтическим носителем или наполнителем, таким как бета-циклодекстрин и 2-гидроксипропил-бета-циклодекстрин, в соответствии с традиционными методиками фармацевтических рецептур. Носитель может принимать широкую форму препарата, необходимого для введения, местного или парентерального. При подготовке композиций для лекарственных форм для парентерального введения, таких как внутривенные инъекции или инфузии, аналогичные фармацевтические среды могут быть использованы, такие как вода, гликоли, масла, буферы, сахара, консерванты, липосомы и подобные, известные специалистам в рассматриваемой области. Неограничивающие примеры таких парентеральных композиций включают 5% масс./об. декстрозу, физиологический раствор или другие растворы. Общую дозу белка нейрегулина, самого по себе или в комбинации с другими вводимыми агентами, можно вводить во флаконе жидкости для внутривенного введения в пределах от 1 мл до 2000 мл. Объем жидкости для разбавления будет зависеть от общей вводимой дозы.
Изобретение также предоставляет наборы для проведения терапевтических режимов по изобретению. Такие комплекты включают в одном или нескольких контейнерах терапевтически эффективное количество белка нейрегулина, самого по себе или в комбинации с другими агентами, в фармацевтически приемлемой форме. Предпочтительные лекарственные формы могут быть в комбинации со стерильным физиологическим раствором, раствором декстрозы или буферным раствором, или другими фармацевтически приемлемыми стерильными жидкостями. Кроме того, композиция может быть лиофилизированной или высушенной; в этом случае набор необязательно дополнительно содержит в контейнере фармацевтически приемлемый раствор, желательно стерильный, чтобы разбавлять комплекс до исходной концентрации для образования раствора для целей инъекции. Типичные фармацевтически приемлемые растворы представляют собой физиологический раствор и раствор декстрозы.
В другом варианте осуществления комплект по изобретению дополнительно содержит иглу или шприц, желательно упакованные в стерильном виде, для инъекции композиции, и/или упакованную спиртовую салфетку. Дополнительно включены инструкции для введения композиции врачом или пациентом.
Как используется в настоящем документе, "лечить", "лечение" и "лечебный" относятся к любому способу, при котором симптомы состояния, расстройства или заболевания облегчаются или иным образом благотворно изменяются. Эффект может быть профилактическим с точки зрения полного или частичного предотвращения болезни или симптома этого, и/или может быть терапевтическим с точки зрения частичного или полного излечения от заболевания и/или негативного эффекта, обусловленного болезнью. Лечение также включает в себя любое фармацевтическое использование композиций по настоящему документу.
Как используется в настоящем документе, "сердечная недостаточность" означает нарушение функции сердца, когда сердце не перекачивает кровь с частотой, необходимой для потребностей метаболизма тканей. Сердечная недостаточность включает в себя широкий спектр болезненных состояний, таких как застойная сердечная недостаточность, инфаркт миокарда, тахиаритмия, семейная гипертрофическая кардиомиопатия, ишемическая болезнь сердца, идиопатическая дилатационная кардиомиопатия, миокардиты и тому подобное. Сердечная недостаточность может быть вызвана любым числом факторов, в том числе, без ограничения, ишемического, наследственного, ревматического, вирусного, токсического или идиопатического видов. Хроническая сердечная гипертрофия представляет собой в значительной степени болезненное состояние, которое является предпосылкой застойной сердечной недостаточности и остановки сердечной деятельности.
Как используется в настоящем документе, "белок" является синонимом "полипептида" или "пептида", если из контекста явно не следует обратное.
Как используется в настоящем документе, "плазма" является синонимом "сыворотки", если из контекста явно не следует обратное.
Как используется в настоящем документе, "долгосрочное преимущество" означает преимущество, вызванное лечением или вмешательством, которое может не наблюдаться в короткий период после лечения или вмешательства. Для пациентов с хронической сердечной недостаточностью, долгосрочное преимущество может представлять собой улучшение выживаемости, снижение повторной госпитализации или улучшение биомаркеров, которые указывают на долгосрочный прогноз. В некоторых вариантах осуществления период времени для наблюдения преимущества составляет около 6 месяцев. В некоторых вариантах осуществления, период времени для наблюдения преимущества составляет около 1 года. В некоторых вариантах осуществления, период времени для наблюдения преимущества составляет около 2 лет. И в других вариантах осуществления, период времени для наблюдения преимущества составляет около 3 лет, 5 лет, 10 лет или дольше.
Как используется в настоящем документе, "выживание" означает время, или вероятность того, что один субъект может остаться в живых или выжить. Это может быть выражено временем выживания или выживаемостью. Время выживания представляет собой период времени, начинающийся от диагностики или лечения до конца жизни. Выживаемость означает процент людей, которые являются живыми в течение заданного периода времени после установления диагноза или лечения. Для каждого субъекта, пролонгированное время выживания, вызванное лечением или вмешательством, может рассматриваться как преимущество. Для группы субъектов или больших групп населения, пролонгированное среднее время выживания или увеличенная выживаемость может рассматриваться как преимущество.
Как используется в настоящем документе, "повторная госпитализация" означает времена или частоту поступления пациента в больницу в данный период времени. Госпитализация в больницу может быть вызвана всеми состояниями, или вызываться только тем состоянием, которое подлежит лечению. Для каждого субъекта, уменьшение времен повторных госпитализаций в течение определенного периода времени может рассматриваться как преимущество. И для группы субъектов или больших групп населения, сокращение общих времен или средних времен повторных госпитализаций может рассматриваться как преимущество.
Как используется в настоящем документе, "N-концевой натрийуретический пептид мозга" или "NT-proBNP" означает неактивный остаточный N-концевой proBNP, последний представляет собой прогормон BNP, являющийся гормонально активным натрийуретическим пептидом, который в основном высвобождается из кардиомиоцитов стенки левого желудочка. В реакции на растяжение и напряжение стенки миокарда прогормон proBNP расщепляется на BNP и гормонально неактивный остаточный NT-proBNP путем протеолитического расщепления.
Уровни BNP и NT-proBNP в плазме крови представляют собой перспективные инструменты ежедневного управления предполагаемой или установленной сердечной недостаточностью. В большинстве исследований по использованию BNP и NT-proBNP в клинической практике рассматриваются вопросы их диагностических свойств, и появляется все большее количество доказательств в поддержку прогностического значения BNP и NT-proBNP. Поскольку NT-proBNP имеет примерно в 6 раз большее время полужизни в крови, чем BNP, он более широко используется в качестве диагностического или прогностического маркера сердечной недостаточности. Плазменный уровень NT-proBNP можно проанализировать с помощью коммерческих наборов. В качестве примера, но без ограничения, коммерческие наборы от Roche или Biomedica. В примерах настоящего изобретения, уровень NT-proBNP детектировали при помощи набора от Biomedica (Австрия).
Уровни в крови как BNP, так и NT-proBNP используются для скрининга, диагностики сердечной недостаточности и полезны для установления прогноза при сердечной недостаточности, поскольку оба маркера обычно выше у пациентов с худшим результатом. И, в настоящем изобретении обнаружено, что плазменные уровни BNP и NT-proBNP свидетельствуют о том, что пациент подходит для лечения сердечной недостаточности при помощи нейрегулина. В самом деле, любые диагностические или прогностические маркеры сердечной недостаточности могут быть использованы, чтобы определить, подходит ли пациент для лечения сердечной недостаточности при помощи нейрегулина. Плазменный уровень NT-proBNP, выявленный в этом изобретении, будет использоваться в качестве руководства, а не ограничением для отбора пациентов с сердечной недостаточностью, которые получат значительные преимущества от лечения нейрегулином. Например, при использовании плазменного уровня 5000 фмоль/мл по-прежнему можно выбирать пациентов, страдающих сердечной недостаточностью, которые будут получать преимущества от лечения нейрегулином, но некоторые из этих пациентов получат преимущества лечения в меньшей степени.
Как используется в данном документе, классификация сердечной функции "New York Heart Association" или "NYHA" представляет собой простой способ классификации степени сердечной недостаточности. Она относит пациентов к одной из четырех категорий, основываясь на том, насколько они ограничены во время физической активности; ограничения/симптомы относятся к нормальному дыханию и одышке в разной степени и/или боль при стенокардии: I, отсутствие симптомов и отсутствие ограничений при обычной физической активности, например одышке при ходьбе, подъеме по лестнице и т.д.; II, легкие симптомы (легкая одышка и/или стенокардия) и небольшое ограничение в ходе обычной деятельности; III, отмеченные ограничения в активности из-за симптомов, даже при меньшей, чем обычно, активности, например, ходьба на короткие расстояния (20-100 м), комфортно только в состоянии покоя; и IV, серьезные ограничения, проявленные симптомы, даже в состоянии покоя, в основном у прикованных к постели пациентов.
Как используется в настоящем документе, "единица активности" или "ЕС" или "U" означает количество стандартного продукта, которое способно вызывать 50% максимальной реакции. Другими словами, для определения единицы активности для заданного активного агента должно быть измерено ЕС50. Например, если ЕС50 для партии продукта составлял 0,1 мкг, что может представлять собой одну единицу. Далее, если используется 1 мкг этого продукта, то используется 10 ЕС (1/0,1). ЕС50 можно определить любым способом, известным в рассматриваемой области, в том числе способом, пользуемым авторами изобретения. Это определение единицы активности является важным фактором для контроля качества продуктов генной инженерии и клинически используемые лекарственные препараты, позволяет продукты из различных лекарственных препаратов и/или партий с разными номерами количественно определять с помощью единых критериев.
Ниже приводится примерный, быстрый, чувствительный, с высокой плотностью потока и количественный способ определения биологической активности NRG-1 через соединение NRG с молекулой ErbB3/ErbB4 поверхности клетки и косвенное посредничество фосфорилирования ErbB2 (см., например, Michael D. Sadick et al., 1996, Analytical Biochemistry, 235:207-214 и WO 03/099300).
Вкратце, анализ, названный твердофазный иммуноферментный анализ, связанный с ферментом активации киназного рецептора (KIRA-ELISA), состоит из двух отдельных планшетов для микротитрования, один для культивирования клеток, стимуляции лигандом и лизиса клеток/солюбилизации рецептора, а другой планшет - для захвата рецепторов и ELISA с фосфотирозином. Тест был разработан для анализа NRG-индуцированной активации ErbB2 и использует стимуляцию интактного рецептора на линии прикрепленных клетках карциномы молочной железы, MCF-7. Мембранные белки делали растворимыми посредством лизиса с Тритоном Х-100 и рецептор захватывается лунками ELISA, покрытыми ErbB2-специфическими антителами с отсутствием перекрестной реакции с ErbB3 или ErbB4. Степень фосфорилирования рецептора затем количественно определяли при помощи ELISA против фосфотирозина. Воспроизводимую стандартную кривую образуют с ЕС50 примерно 360 пМ для херегулина бета 1 (177-244). При анализе одинаковых образцов HRG бета 1 (177-244) с помощью как KIRA-ELISA, так и количественным Вестернблот-анализом против фосфотирозина, результаты очень тесно коррелируют друг с другом. Анализ, описанный в данном сообщении, способен специфически количественно определять фосфорилирование тирозина ErbB2, что является результатом взаимодействия HRG с ErbB3 и/или ErbB4.
Так как большинство из генно-инженерных лекарственных средств представляют собой белки и полипептиды, их активность может быть определена по их аминокислотным последовательностям или активному центру, образованному их пространственной структурой. Титр активности белка и полипептида не согласуется с его абсолютным качеством, поэтому не может быть определен с единицей массы, что и для химических препаратов. Однако биологическая активность генно-инженерных лекарств, как правило, находится в соответствии с их фармакодинамикой, и система определения титра, созданная с помощью данной биологической активности, может определить его единицу титра. Таким образом, определение биологической активности может быть частью процесса титрования вещества с биологической активностью и является важным компонентом контроля качества генетически модифицированных продуктов. Важно определить критерии биологической активности для контроля качества генно-инженерных продуктов и клинически используемых лекарственных препаратов.
Количество стандартного продукта, которое может вызывать 50% максимальной реакции, определяется как единица активности (1 EU). Соответственно, продукт из различных лекарственных препаратов и партий с разными номерами может быть оценен количественно при помощи единообразных критериев.
В. Примеры
Пример 1: Эффект введения Neucardin™ различными способами на выживаемость крыс с CHF
Введение
В этом исследовании мы использовали модель CHF, вызванного лигированием коронарных артерий (CAL), для исследования того, имеет ли введение Neucardin™ при помощи капельницы IV с помощью насоса для микроинъекций или при помощи подкожного (SC) болюса какой-либо эффект на выживаемость и гемодинамику сердца, через 120 дней после начала введения Neucardin™ через 4 недели после CAL. Эхокардиография и ремоделирования сердца также были использованы для определения функции сердца и восстановления от CAL.
2. Способы
2.1. Экспериментальные животные:
Порода, происхождение: крысы линии Вистар, Shanghai SLAC Laboratory Animal CO. LTD; Масса, 200+10 г, самцы;
2.2 Статья анализа: 2.2.1 Neucardin™
Идентификация: Рекомбинантный человеческий нейрегулин-1 для инъекций (rhNRG-1, Neucardin™)
Номер лота: 200607009
Производитель: Zensun (Шанхай) Sci & Tech Co., Ltd
Дозовая форма: Лиофилизированный порошок
Внешний вид: белая или не совсем белая лепешка
Меченое содержание rhNRG-1: 250 мкг/фл
Удельная активность: 4897 и/фл
Условия хранения: от 2 до 8°C
2.2.2 Носитель
Идентификация: Плацебо для рекомбинантного человеческого нейрегулина-1
Дозовая форма: Лиофилизированный порошок
Внешний вид: белая или не совсем белая лепешка
Композиция: Сывороточный альбумин человека, маннитол, фосфат, NaCl
Условия хранения: от 2 до 8°C
2.3 Процедура
2.3.1 Для создания CHF-модели на крысах:
LAD крыс перевязывали. Вкратце, крыс анестезировали кетамингидрохлоридом (100 мг/кг, IP), и их грудь брили и стерилизовали. Крыс эндотрахеально интубировали и механически вентилировали воздухом помещения (частота дыхания 60 вдохов и выдохов/мин, дыхательный объем - 20 мл). Затем была проведена торакотомия слева по 4-му и 5-му межреберью и затем кожа была прорезана вдоль левого края грудины. Четвертое ребро затем разрезали проксимальнее грудины. Перикардиальный мешок перфорировали и сердце обнажали. LAD лигировали приблизительно в 2 мм от его начала с применением шелковой нитки 6-0. Затем воздух в грудной клетке удаляли, а грудь закрывали в три слоя (ребра, мышцы, а затем кожу). Крысам затем была предоставлена возможность возобновить спонтанное дыхание, оправиться от анестезии и затем возвратиться всвои клетки. Крыс поддерживали в течение 4 недель, затем оценивали по эхокардиографии, включали в формальное исследование, если они показывали значение EF % в 30-45%. Животных всех групп размещали по 5 на клетку, кормили без ограничения стандартной диетой и предоставляли свободный доступ к чистой воде. Температуру в помещении поддерживали на уровне 21±1°С, при 12-часовом цикле день/ночь.
2.3.2 Внутривенно капельно с помощью насоса для микроинъекций
Способ внутривенно капельно носителя или Neucardin™ осуществляли через хвостовую вену. Для этой процедуры, соответствующее зажимное приспособление для крыс использовалось в зависимости от массы животного. Крысу помещали рядом с зажимным приспособлением и осторожно помещали на аппарат. Обычно крысы входили в зажимное приспособление без помощи. Впоследствии хвост крысы смазывали марлей, смоченной в спирте, чтобы увеличить приток крови в хвостовую вену и смягчить роговой слой кожи. Две боковых (сбоку) хвостовых вены были локализованы, и со скосом иглой, повернутым вверх, с иглой, почти параллельной вене, была вставлена игла 2 мм в хвостовую вену на расстоянии 2-3 см от конца хвоста. Чтобы убедиться, что игла была успешно вставлена в хвостовую вену, кровь экстрагировали в ступице иглы. Игла была зафиксирована на хвосте с помощью медицинской ленты. Начинали инфузию лекарственного препарата или носителя с соответствующей скоростью (0,2-0,4 мл/ч) с помощью микроинъекционного насоса или болюсной инъекции.
2.3.3 Болюс SC
Болюс SC носителя или Neucardin™ был со спины крысы. Для этой процедуры, соответствующее зажимное приспособление для крысы использовали в зависимости от массы животного. Спину крысы протирали марлей, смоченной в спирте, для стерилизации кожи. Со скосом иглы, направленном вверх, и иглой почти параллельно коже, игла была подкожно вставлена на 3-4 см в спину крысы. Иглу фиксировали на спине с помощью медицинской ленты и подключали к перфузионной трубке. Затем, крыса была помещена рядом с зажимным приспособлением и бережно помещена в прибор. Обычно крысы входили в зажимное приспособление без помощи. После закрепления зажимного приспособления начинали болюсную инъекцию.
2.3.4 Экспериментальные группы и инфузия препарата
MI-крыс рандомизировали при помощи значения EF % в следующие группы:
группа А (отрицательный контроль) как для IV, так и для и SC-болюса. n=58 крыс: Внутривенно капельно носитель в течение 10 дней при помощи насоса для микровпрыскивания со скоростью 0,2 мл/ч в течение 8 часов каждый день в течение первых 10 дней, SC-болюс носителя (такой же объем, что и Neucardin™), каждые 5 дней до дня 120;
группа В (SC-болюс Neucardin™), n=58: Внутривенно капельно носитель при помощи насоса для микровпрыскивания со скоростью 0,2 мл/ч в течение 8 часов каждый день в течение первых 10 дней, SC-болюс Neucardin™ (10 мкг/сут), каждые 5 дней до дня 120;
группа С (Внутривенно капельно Neucardin™), n=57: Внутривенно капельно Neucardin™ (0,625 мкг/кг/ч) при помощи насоса для микровпрыскивания со скоростью 0,2 мл/ч в течение 8 часов каждый день в течение первых 10 дней, SC-болюс носителя (такой же объем, что и Neucardin™), каждые 5 дней до дня 120;
группа D (Внутривенно капельно и SC-болюс Neucardin™), n=57: Внутривенно капельно Neucardin™ (0,625 мкг/кг/ч) при помощи насоса для микровпрыскивания со скоростью 0,2 мл/ч в течение 8 часов каждый день в течение первых 10 дней, SC болюс носителя (такой же объем, что и Neucardin™) в 1-й, 6-й, 11-й день, а затем SC-болюс Neucardin™ (10 мкг/сут), каждые 5 дней с 16-го дня и до конца.
2.3.5 Сбор данных
Выживаемость; Параметры эхокардиографии; Параметры гемодинамики;
3. Результаты
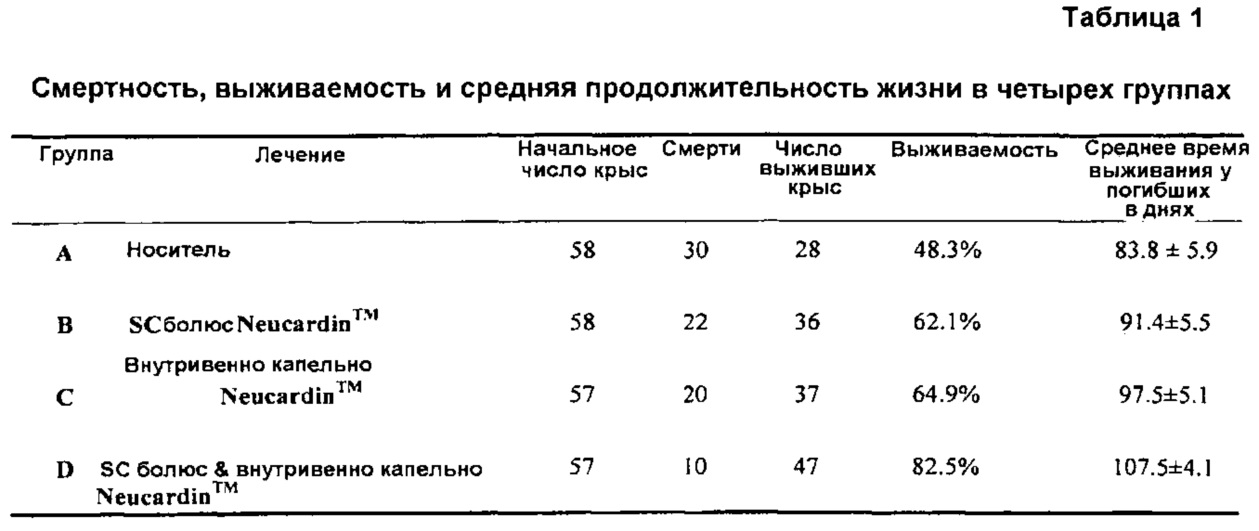
3.1 Выживаемость
Таблица 1 иллюстрирует выживаемости в каждой группе. Выживаемость составила 48,3%, 62,1%, 64,9% и 82,5% при внутривенном капельном & SC-болюс носителя Группы А, SC-болюса Neucardin™ Группы В, внутривенном капельном Neucardin™ Группы С и внутривенном капельном & SC-болюса Neucardin™ Группы D, соответственно. Все выживаемости или среднее время выживания погибших в Группе В, С и D были улучшены или пролонгированы по сравнению с Группой А, Группа D имела наилучшую эффективность.
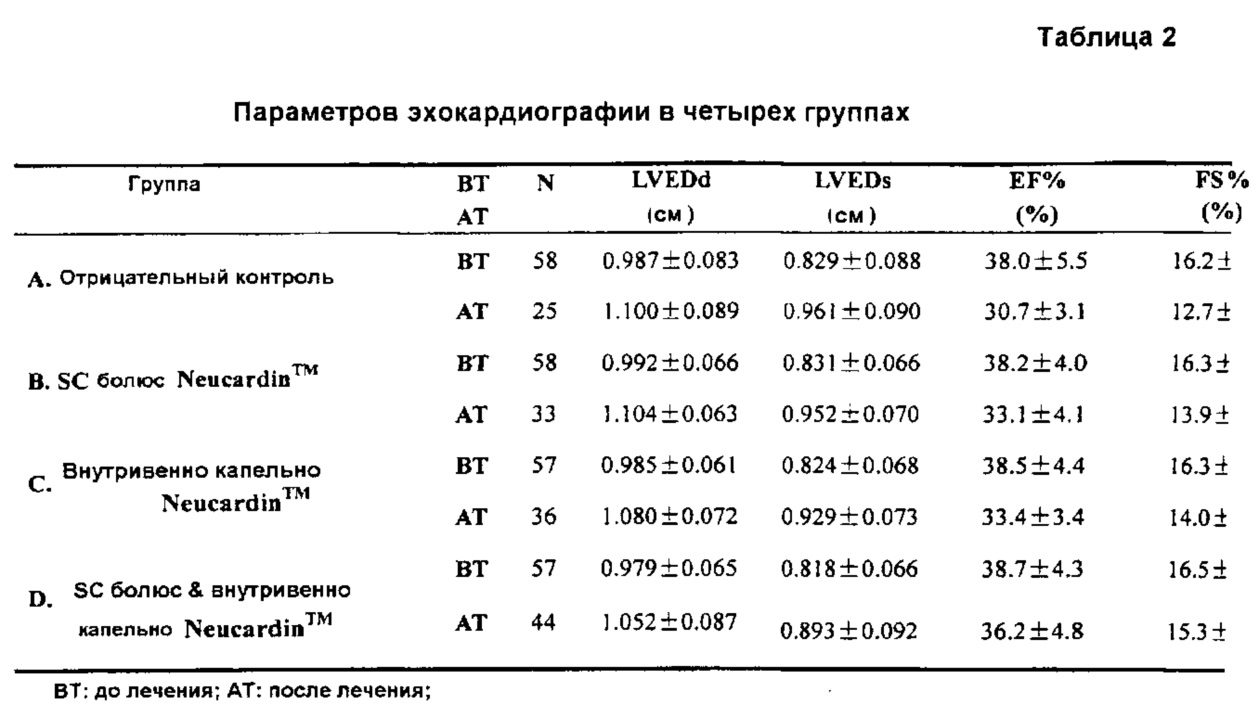
3.2 Параметры эхокардиографии
Параметры эхокардиографии были показаны в таблице 2. Через четыре недели после лигирования коронарных артерий и перед введением тестируемого продукта, CHF-крысы были рандомизированы по четырем группам в соответствии с их значениями EF %. Как показано в Таблице 2, не было никаких существенных различий между четырьмя группами до лечения (ВТ). Через 120 дней после начала введения, значения EF % составили 30,7±3,1, 32,9±4,1, 33,5±3,4, 36,2±4,8% для групп носителя, Neucardin™ с помощью SC болюса, Neucardin™ внутривенно капельно и Neucardin™ внутривенно капельно плюс SC-болюс, соответственно. После лечения, EF % и FS % Групп В, С и D были выше, чем в группе А.
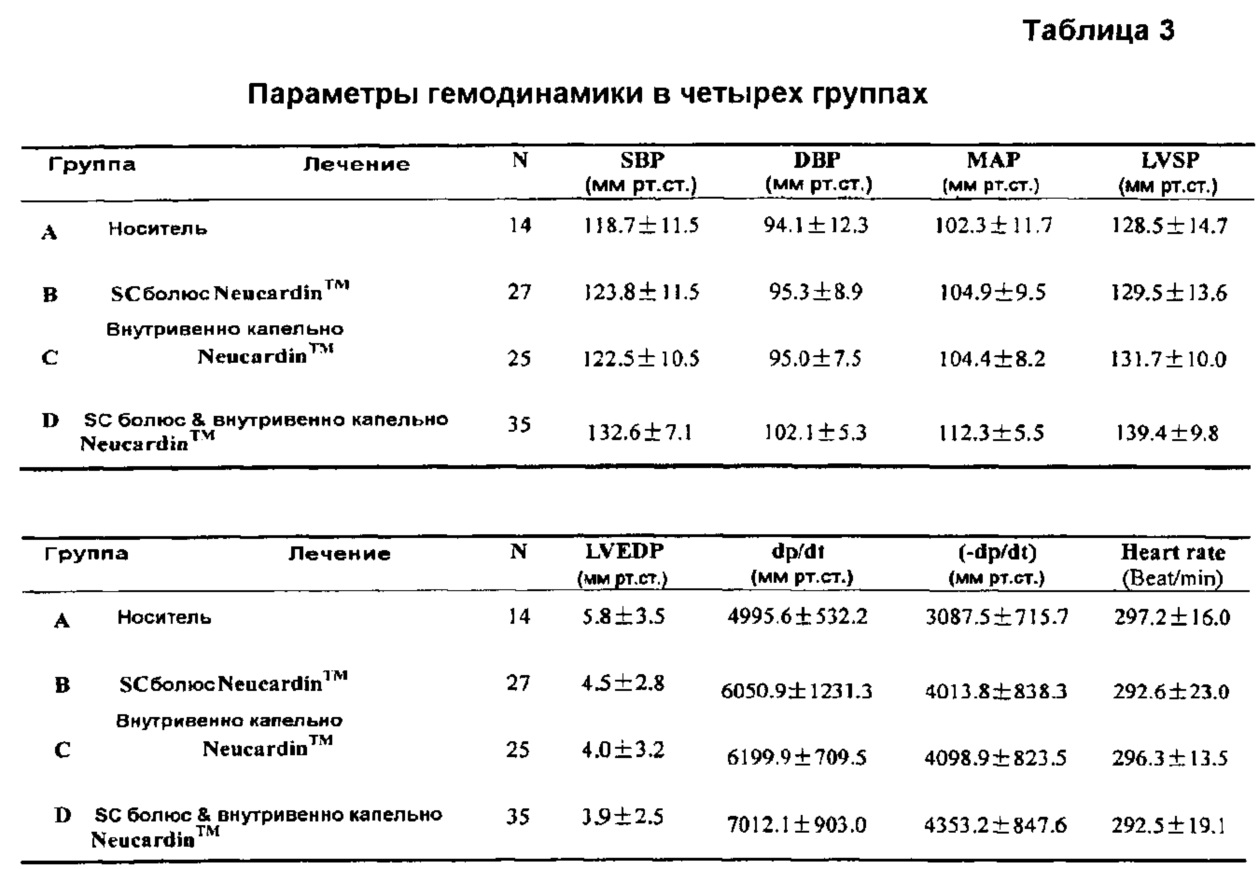
3.3 Гемодинамические параметры
Таблица 3 показывает значения MAP, HR, ±dp/dt, LVEDP и LVSP, определенные в четырех группах наркотизированных животных на 121 день. Когда Neucardin вводили при помощи SC-болюса или внутривенно капельно в одиночку (группы В и С), Neucardin™ значительно увеличивал dp/dt и -dp/dt на 19,6% и 27,1%, на 22,5% и 2 9,8% по сравнению с Группой А. Когда Neucardin™ вводили при помощи способов как внутривенного капельного, так и SC-болюсного (Группа D), было получено значительное увеличение среднего артериального давления (MAP, 112,3±5,5 мм рт.ст.), систолического давления левого желудочка (LVSP, 139,4±9 мм рт.ст.), +dp/dt (7012,1±903, 0 мм рт.ст./с), -dp/dt (-4353,2±847,6 мм рт.ст./с) по сравнению с носителем. Интересно, что эти значения MAP, LVSP, +dp/dt и -dp/dt были на 10,6%, 9,2%, 38,5% и 37,8% выше, чем у крыс, получавших лечение носителем, соответственно. Результаты показали, что каждая из Группа В, С и D была лучше, чем Группа А по параметрам гемодинамики, а Группа D имела лучшую эффективность.
4. Заключение
Комбинированное введение Neucardin™ внутривенно капельно & SC-болюс или введение пептида, даваемого каждым способом в одиночку, все увеличивало выживаемость крыс с CHF, индуцированного CAL, и улучшало функциональные параметры сердца по сравнению с крысами, получавшими носитель.
Пример 2: Рандомизированное, двойное слепое, многоцентровое, плацебо-контролируемое исследование для оценки эффективности и безопасности применения рекомбинантного человеческого нейрегулина 1 у пациентов с хронической сердечной недостаточностью на основе стандартного лечения Чтобы оценить эффективность рекомбинантного человеческого нейрегулина-1 для инъекций на хроническую сердечную недостаточность, фаза II, двойное слепое, многоцентровое, плацебо-контролируемое, на основе стандартного лечения исследование проводилось в нескольких клинических центрах в Китае. В общей сложности 195 пациентов со стабильной хронической сердечной недостаточностью класса II или III по NYHA были зачислены и рандомизированы по трем группам: плацебо, или 0,6 мкг/кг и 12 мкг/кг rhNRG-1. Значимых вариаций в демографии или фоновой терапии между группами не было. В соответствии с графиком, пациентам вводили препарат в течение 10 дней подряд сначала в больнице, после окончания и планового учета на 11 день они были выписаны из больницы. Еще два учета по месту жительства проводили в 30 и 90 день. Телефонный опрос был проведен через год после того, как поступил последний пациент.
Исследуемый продукт
Спецификация: Neucardin™, полипептид в 61 аминокислоту, включает EGF-подобный домен изоформы β2 нейрегулина-1, с молекулярной массой 7054 Да (1 мкг = 0,14 нмоль). 250 мкг (5000 EU)/флакон (1 мкг = 20 EU).
Препарат: Для инъекций.
Режим введения: внутривенно капельно.
Хранение: в безопасном месте, с ограниченным доступом и в защищенном от света месте, при 3-8°C.
Плацебо
Спецификация: Наполнитель для Neucardin™ (250 мкг /флакон без белка активного рекомбинантного человеческого нейрегулина-1)
Группы дозировки:
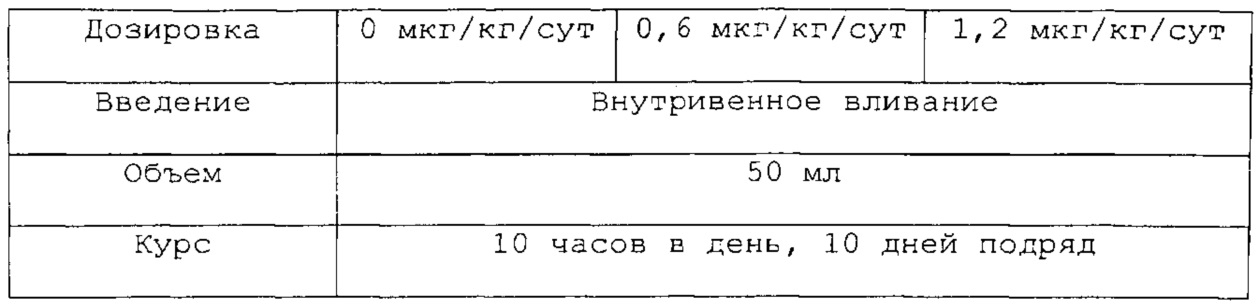
Процедура исследования
Критерии для участия в исследовании включали пациентов с CHF (класса II или III по NYHA) в возрасте от 18 до 65 лет, LVEF ≤40%, в относительно стабильном клиническом состоянии (включая клинические признаки, симптомы и общепринятое стандартное лечение для CHF при назначенной дозе или предельно допустимой дозе в течение более 1 месяца). Основные критерии исключения включали острый инфаркт миокарда, гипертрофическая кардиомиопатия, сдавливающий перикардит, значительное заболевание клапана или врожденный порок сердца, высокая легочная гипертензия, систолическое артериальное давление <90 мм рт.ст. или >160 мм рт.ст., тяжелое желудочковое нарушение ритма сердца, хирургия сердца или нарушение мозгового кровообращения в течение предыдущих шести месяцев, клаустрофобия или беременность у женщин. Все пациенты предоставили засвидетельствованное своей подписью письменное согласие.
Пациенты были рандомизированы на три группы, получавшие плацебо или rhNRG-1 (0,6 или 1,2 мкг/кг/сут) в течение 10 дней подряд, после окончания и планового учета на 11 день они были выписаны из больницы. Еще два учета по месту жительства проводили в 30 и 90 день. Образцы крови каждого пациента были собраны до начала лечения и на 11-й, 30 и 90 день. Плазменный NT-proBNP тестировали в ведущей лаборатории с анализами NT-proBNP (набор от Biomedica). Через год после поступления последнего пациента, был проведен телефонный опрос для сбора информации о повторных госпитализациях, все телефонные интервью были записаны в специальную форму с подписью исследователей.
Из 48 пациентов с имеющейся информацией о повторной госпитализации в группе плацебо, 12 (25,0%) были повторно госпитализированы с обострением сердечной недостаточности, по меньшей мере, один раз. В группе с 0,6 мкг/кг только 4 (8,7%) из 46 пациентов снова попали в больницу (Р=0,05 по сравнению с плацебо); степень повторной госпитализации группы с 1,2 мкг/кг составляла 22,0% (11/50). Средние времена повторных госпитализаций составляло 0,458 (22/48) в расчете на одного больного в группе плацебо, в то время как они были снижены на 57,4% и 17,0%, соответственно, в группе 0,6 (8/41) и 1,2 мкг/кг (19/50).
В группе плацебо, NT-proBNP были почти те же в ходе исследования, при сравнении с базовым уровнем. В 11-й день NT-proBNP был существенно увеличен в группах, получавших rhNRG-1 (с 1853±1512 до 2399±1841 фмоль/мл в группе с 0,6 мкг/кг, Р<0,01; с 1562±1275 до 2774±1926 фмоль/мл в группе с 1,2 мкг/кг, Р<0,01). Но его рост был кратковременным и не был вызван ухудшением функции сердца, поскольку сердечная функция, как показано, была увеличена, NT-proBNP снизился к базовому уровню в день 30 и день 90 дня в группе с 1,2 мкг/кг. Кроме того, в группе с 0,6 мкг/кг, NT-proBNP был значительно уменьшен в день 30 (1323±1124 фмоль/мл, Р=0,01) и день 90 (1518±1403 фмоль /мл, р=0,01), при сравнении с базовым уровнем.
Эти результаты показали, что лечение rhNRG-1 может уменьшить повторные госпитализации и плазменный уровень NT-proBNP, что может указывать на то, что rhNRG-1 может обеспечивать долгосрочные преимущества пациентам с хронической сердечной недостаточностью.
Пример 3: Рандомизированное, двойное слепое, многоцентровое, плацебо-контролируемое исследование выживания рекомбинантного человеческого нейрегулина 1 у пациентов с хронической сердечной недостаточностью на основе стандартного лечения
Чтобы оценить эффективность рекомбинантного человеческого нейрегулина-1 для инъекций при хронической сердечной недостаточности, двухфазовое, двойное слепое, многоцентровое, плацебо-контролируемое, основанное на стандартном лечении исследование проводилось в нескольких клинических центрах в Китае. В общей сложности 351 пациентов со стабильной хронической сердечной недостаточностью класса III или IV по NYHA были зачислены и рандомизированы в плацебо-группу или в группу с rhNRG-1 (0,6 мкг/кг). Между группами не было значимых вариаций в демографии или в фоновой терапии. Согласно схеме, пациентам вводили препарат в течение 10 дней подряд в больнице, после окончания и планового учета на 11 день они были выписаны из больницы, и им вводили препарат один раз в неделю с 3 недели до 25 недели амбулаторно. Образцы крови каждого пациента были собраны перед лечением (базовый уровень), и на каждой последующей. Плазменный уровень NT-proBNP был протестирован в ведущей лаборатории при помощи анализа NT-proBNP (набор от Biomedica). Информация о выживании была собрана на 52-й неделе исследования.
Исследуемый продукт
Спецификация: Neucardin™, полипептид в 61 аминокислоту, включает EGF-подобный домен изоформы 02 нейрегулина-1, с молекулярной массой 7054 Да (1 мкг = 0,14 нмоль). 250 мкг (5000 EU)/флакон (1 мкг=20 EU).
Препарат: для инъекций.
Режим введения: внутривенно капельно или инфузия.
Хранение: в безопасном место, с ограниченным доступом и в защищенном от света месте, при 3-8°C.
Плацебо:
Спецификация: наполнитель для Neucardin™. 250 мкг/флакон и без активного белка рекомбинантного нейрегулина-1 человека. Дозировка и режимы:

Критерии для участия в исследовании включали пациентов с CHF (класс III или IV по NYHA) в возрасте от 18 лет до 80 лет, LVEF <40%, в относительно стабильном клиническом состоянии (включая клинические признаки, симптомы и общепринятое стандартное лечение для CHF при назначенной дозе или предельно допустимой дозе в течение более 1 месяца). Основные критерии исключения включали острый инфаркт миокарда, гипертрофическая кардиомиопатия, сдавливающий перикардит, значительное заболевание клапана или врожденный порок сердца, высокая легочная гипертензия, систолическое артериальное давление <90 мм рт.ст. или >160 мм рт.ст., тяжелое желудочковое нарушение ритма сердца, хирургия сердца или нарушение мозгового кровообращения в течение предыдущих шести месяцев, клаустрофобия или беременность у женщин. Все пациенты предоставили засвидетельствованное своей подписью письменное согласие.
Смертности от всех причин в группе плацебо на 52 неделе составляет 15,91%, с 28 смертями из 176 пациентов, в то время как число составляет 9,71% в группе rhNRG-1, с 16 смертями из 175 завершивших испытание пациентов (соотношение рисков = 0,425, 95% CI 0,222-0,813, р=0,0097). Учитывая смертность, вызванную сердечно-сосудистыми событиями, количество в группе, получавшей плацебо, на 52 неделе составляло 14,77%, с 26 смерти среди 176 пациентов, и 9,71% в группе rhNRG-1. Так, из результатов, мы можем обнаружить примерно 40%-ное уменьшение смертности от введения rhNRG-1 по сравнению с группой плацебо, хотя в группе плацебо по-прежнему сохранялся прежний стандарт лечения хронической сердечной недостаточности.
Мы также проанализировали смертность от всех причин на основе стратификации базового NT-proBNR. Когда уровень NT-proBNP разделяли на 3 группы, такие как <1600 фмоль/мл >1600 фмоль /мл и <4000 фмоль /мл, или >4000 фмоль /мл, смертность группы rhNRG-1 vs группы плацебо составляет 1,49% против 8,49%, 8,96% против 23,33%, и 26,67% против 28,00%, соответственно. И если уровень NT-proBNP стратифицирован как <4000 фмоль /мл или >4000 фмоль/мл, смертность группы rhNRG-1 vs группы плацебо составляет 5,22% против 14,89% (р=0,0092), и 26,67% против 28,00%, соответственно. Эти результаты показывают статистическую значимость того, что rhNRG-1 может эффективно повышать выживаемость пациентов с хронической сердечной недостаточностью.
Далее, пациенты были стратифицированы по их базовому классу функции сердца по NYHA, относясь к классу III или классу IV. Смертность от всех причин у пациентов класса III в группе rhNRG-1 или группе плацебо составляла 6,06% (8 смертей на 132 пациента) и 15,49% (22 смерти на 142 пациента), соответственно, р=0,0189. В то же время смертность от всех причин пациентов класса IV в группе rhNRG-1 или группе плацебо составляет 20,93% (9 смертей на 43 пациента) и 17,65% (6 смертей на 34 пациента), соответственно, р=0,7789.
Реферат
Настоящая группа изобретений относится к медицине, а именно к кардиологии, и касается лечения хронической сердечной недостаточности (ХСН). Для этого осуществляют предварительное тестирование для определения плазменного уровня N-концевого промозгового натрийуретического пептида (NT-proBNP), и при уровне NT-proBNP менее или равном 4000 фмоль/мл осуществляют введение нейрегулина. Это обеспечивает эффективное лечение ХСН за счет выявления группы больных, для которых лечение нейрегулином является наиболее адекватным. 4 н. и 28 з.п. ф-лы, 3 пр.,3 табл.

Комментарии