Растительный экстракт, обладающий допаминергической активностью - RU2072859C1
Код документа: RU2072859C1
Чертежи
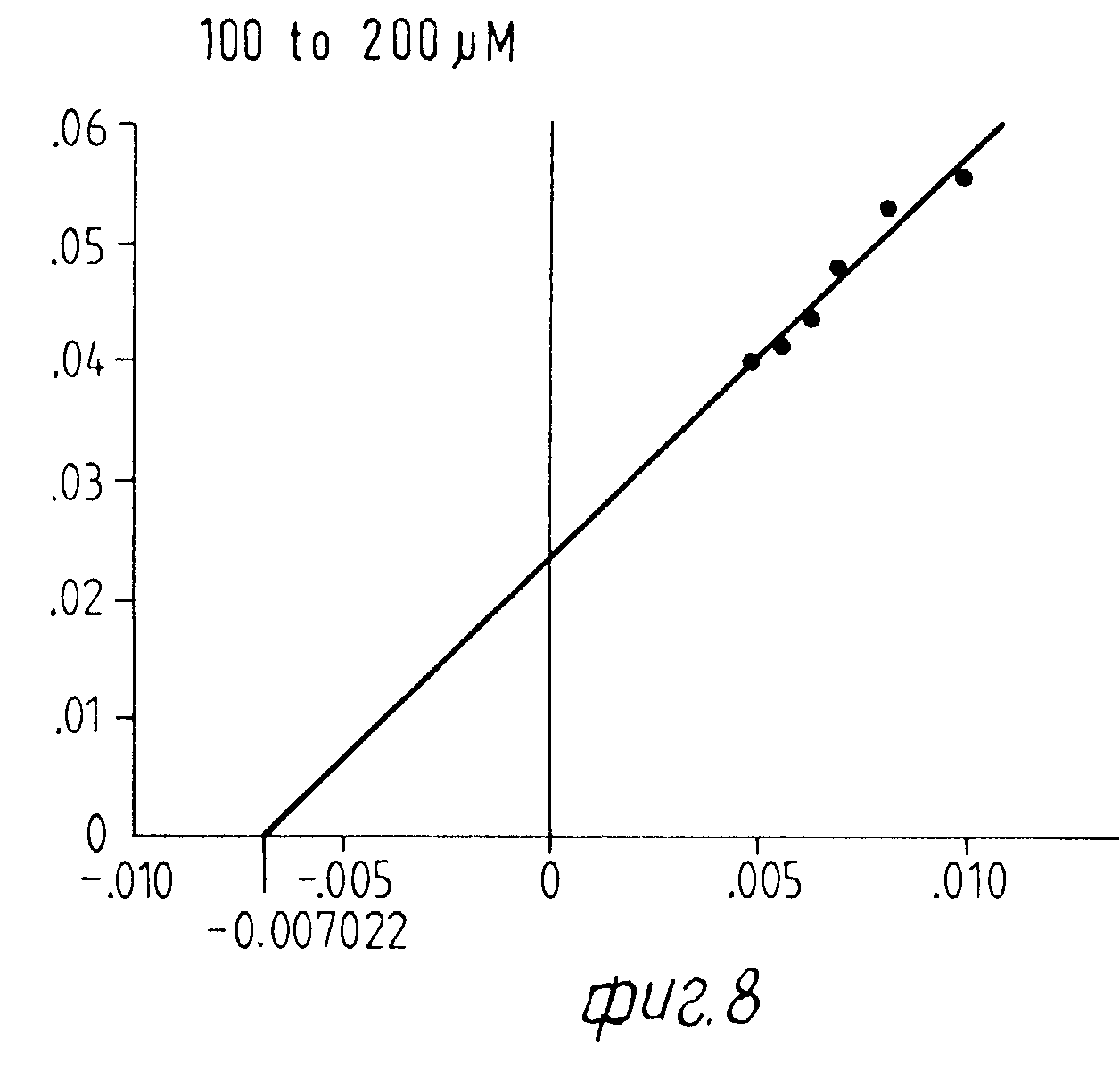
Описание
Изобретение относится к растительному экстракту, который может найти применение для смягчения состояния возбуждения и нервных дисфункций.
Известно, что промежуточные и конечные продукты обмена веществ пирокатехоламина оказывают влияние на состояние возбуждения у человека. Так, например, конечный продукт адреналин действует как нейропередатчик адренергической нервной системы как на альфа-, так и на β-рецепторы. Как симпатокомиметический препарат адреналин повышает силу сердечного сокращения. Коме того, так как адреналин повышает окислительный обмен веществ в клетках, он вызывает в итоге повышенную мобилизационную готовность организма. В соответствии с этим наблюдают также увеличение выброса адреналина в ситуациях, вызванных стрессом. Особенно высокие концентрации адреналина и также его предстадии, норадреналина, могут иметь последствием перевозбуждение, нервозность и тем самым недостаточную функциональную способность организма, в то время как лишь немного повышенные величины этих аминов оказывают вполне положительное действие: пульсовый удар и кровяное давление слегка повышены, мускулатура и головной мозг возбуждены, чувствительность повышена.
Кроме того, известно, что нарушения в уровне концентрации допамина, следующей предстадии к адреналину, могут приводить к состояниям возбуждения к нервным дисфункциям. В частности, при недостатке дипамина могут появляться депрессии. Специальный синдром недостатка допамина представляет болезнь Паркинсона, частичными симптомами которой являются акинезия, оцепенение и дрожание в покое. Новейшие клинические результаты говорят об терапевтической эффективности допа при лечении паркинсонизма. Это действие становится понятным на основании наблюдаемого уменьшения допамина в базальных ганглиях.
Таким образом, при недостатке допамина желательно естественным путем повышать концентрацию этого пирокатехиламина. Этого можно достигнуть повышением синтеза допа (допамина) и подавлением расщепления допамина.
Задачей настоящего изобретения является создание лекарственного средства, повышающего концентрацию допамина в организме пациента.
Указанную задачу, согласно изобретению, решают путем получения растительного экстракта раздельной экстракцией спиртом (2,5:10) Corydalis и Eschscholtzia с последующим смешиванием экстрактов. При этом массовое отношение сухих веществ экстрактов Corydalis и Eschscholtzia составляет 1:1-20.
Предпочтительно, чтобы объемное соотношение спиртовых экстрактов Corydalis и Eschscholtzia составляло 1:2-10 или, что еще предпочтительнее, 1:4.
В частности растительный экстракт может представлять собой смесь экстрактов Corydalidis canae rhizoma и Eschscholtziae californiae herba. Он может представлять собой, в частности, порошок. Растительный экстракт может дополнительно содержать фармацевтически приемлемые целевые добавки. Он может представлять собой форму для орального введения, может представлять собой настойку, таблетку, драже или капсулу. Растительный экстракт может быть получен из высушенных растений.
Растительный экстракт по изобретению может содержать полученные в результате экстракции спиртом экстракты в форме подвергнутого сушке вымораживанием порошка, водного и/или спиртового раствора. Подвергнутый сушке вымораживанием порошок получают, как правило, сублимационной сушкой полученного в результате экстракции спиртом экстракта (вытяжки из растительного сырья) обычными для этого способами сублимационной сушки.
Подвергнутые сушке вымораживанием экстракты Corydalis и Esxhsxholtzia можно хранить отдельно или в смеси, а в случае необходимости для получения лекарственного средства смешивать с подходящими фармацевтическими веществами-носителями/растворителями. Для получения настоек для этого применяют в частности воду и/или спирт. Экстракт содержит, главным образом, активные вещества в форме полученной в результате экстракции спиртом (2,5:10) вытяжки из растительного сырья, и оно состоит, в частности, из такой вытяжки из растительного сырья.
Отношение Eschscholtzia к Corydalis (в пересчете на вес сухого экстракта) лежит преимущественно в области от 10:1 до 2:1 и составляет особенно 4:1.
В качестве активного вещества применяют согласно изобретению преимущественно экстракты Corydalidis cavae rhizoma и Eschscholtziae calofornicae herba.
Экстракт, согласно изобретению, может существовать в обычной для орального введения форме, в частности в форме таблеток, драже, капсул или, главным образом, настоек. Получение этих форм введения осуществляют, в случае необходимости, с применением обычных для отдельных форм введения и подходящих фармацевтических растворителей и/или веществ-носителей, обычным методом, например таблетированием, дражированием, капсулированием находящегося в подвергунтой сублимационной сушке форме экстракта или спиртового и/или водного раствора из него. Для получения жидких форм введения, как, в частности, настоек, непосредственно применяют полученные в результате экстракции спиртом спиртовые вытяжки из растительного сырья. Наряду с сублимационной сушкой этих спиртовых вытяжек из растительного сырья для получения подвергнутых сублимационной сушке экстрактов можно также выпаривать досуха непосредственно спиртовые вытяжки из растительного сырья, преимущественно в вакууме и/или в атмосфере инертного газа, и полученный таким путем остаток можно затем обрабатывать дальше в желательную форму введения.
Содержание активных веществ в экстракте согласно изобретению можно изменять в широких пределах. Как правило, оно составляет от 0,5 до 20 мас. в пересчете на готовый состав экстракта, особенно от 1 до 10 мас. главным образом, от 1 до 4 мас. Если применяют полученную в результате экстракции спиртом (2,5: 10) спиртовую вытяжку из растительного сырья, то последнюю применяют преимущественно в полученной непосредственно после экстракции концентрации; при этом вытяжки из растительного сырья из Corydalidis и Eschscholtziae применяют особенно в таком отношении, чтобы отношение Corydalis к Eschscholtzia соответствовало предпочтительно названным отношениям.
Для получения отдельных экстрактов Corydalis и Eschscholtzia, особенно Coradalidis cavae zhizoma и Eschscholtzia californicae herba, применяют высушенные лекарственные растения, которые соответствуют спецификациям DAB 9 (немецкой фармакопеи). Это обеспечивается контролем качества при получении высушенных лекарственных растений.
Получение отдельных экстрактов осуществляют известным образом обычными для этого и стандартными способами экстракции, как например мацерацией или перколяцией при помощи этанола или смесей этанола/воды. При этом сохраняют отношение высушенных лекарственных растений-экстракта 2,5:10, т.е. из 2,5 г высушенного лекарственного растения получают 10 мл экстракта высушенного лекарственного растения. В качестве экстрагирующего агента применяют преимущественно 30 объем. этанола. Получением можно управлять на основании контроля за процессом.
Для оценки и гарантирования постоянного качества экстрактов используют обычные для этого критерии качества. В частности, для этого служат общие спектры экстрагированных веществ и, с другой стороны, анализы известных из литературы основных алкалоидов обоих высушенных лекарственных растений.
Затем освобожденные после контроля качества экстракты в соотношении с желательной формой введения и в соответствии с желательными концентрациями перерабатывают дальше как жидкий или подвергнутый сублимационной сушке экстракт.
Вид и количество экстракта зависит, в частности, от тяжести заболевания, от общего состояния и от возраста пациента. Как правило, количество назначаемого экстракта в форме настойки, которое предпочитают по изобретению, составляет от 1 до 2 капель/кг веса тела, один или несколько раз в день. В форме других оральных форм введения назначают, как правило, соответствующие количества, предпочтительно от 2 до 5 мг общего сухого экстракта/кг веса тела, один или несколько раз в день.
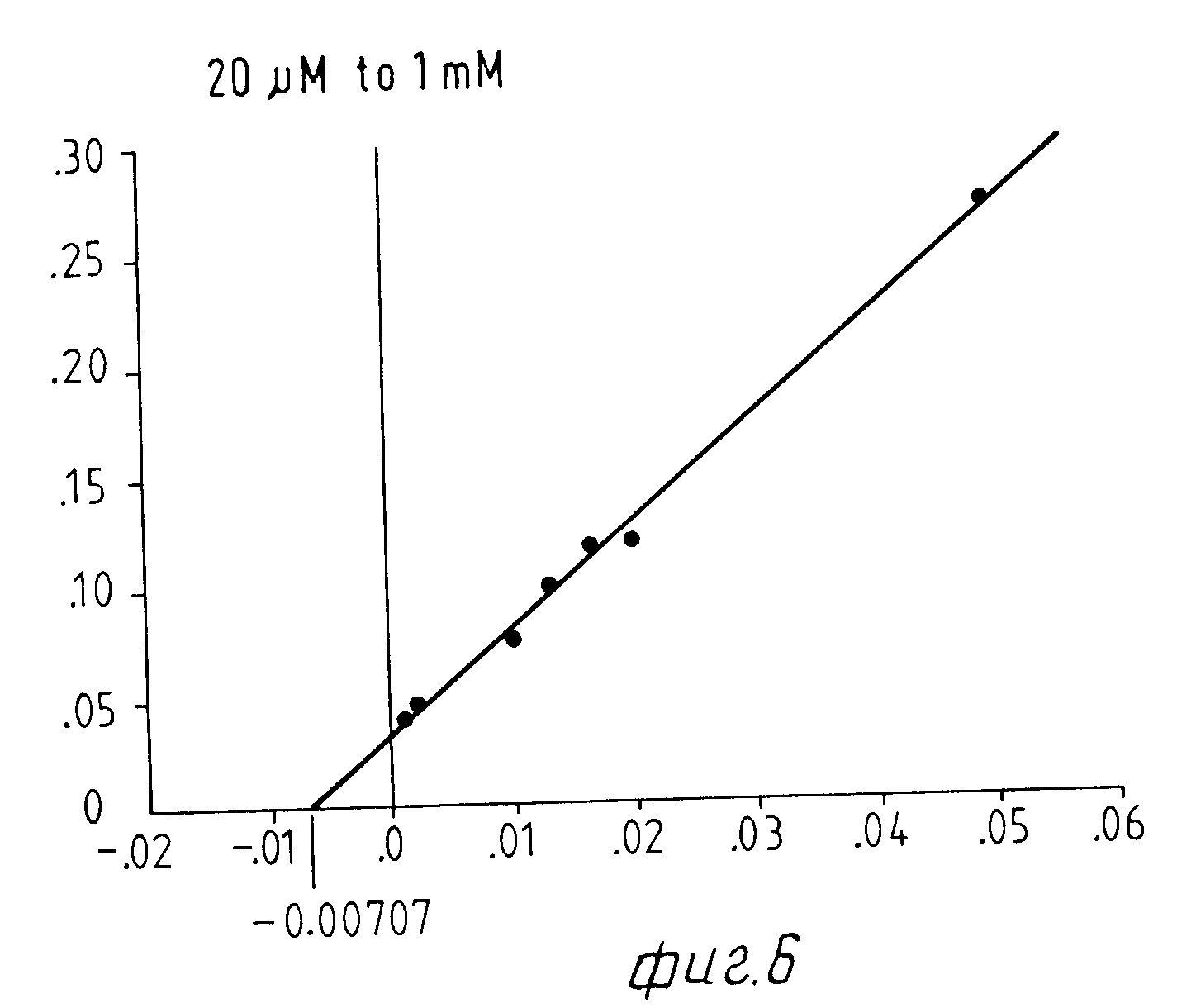
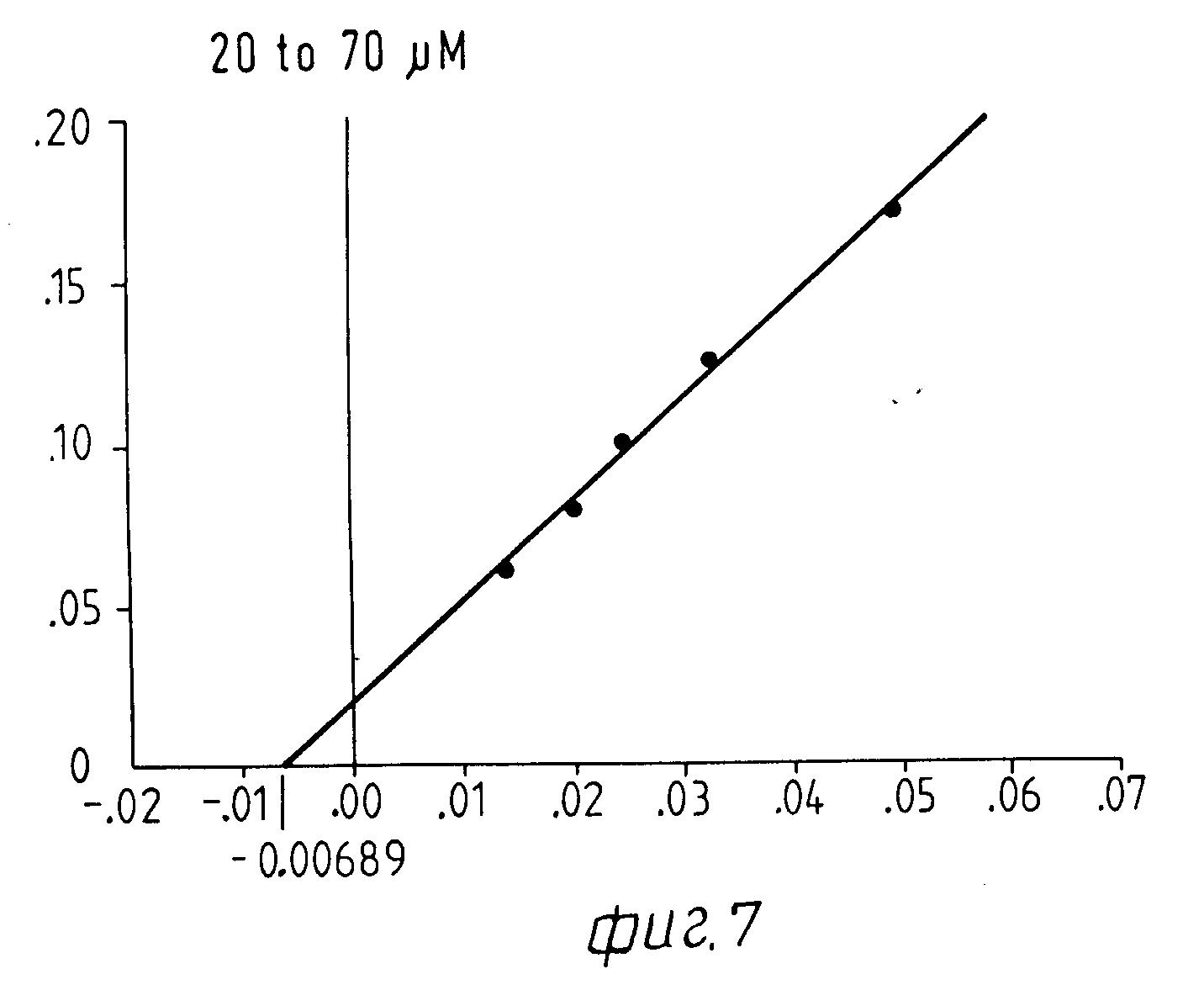
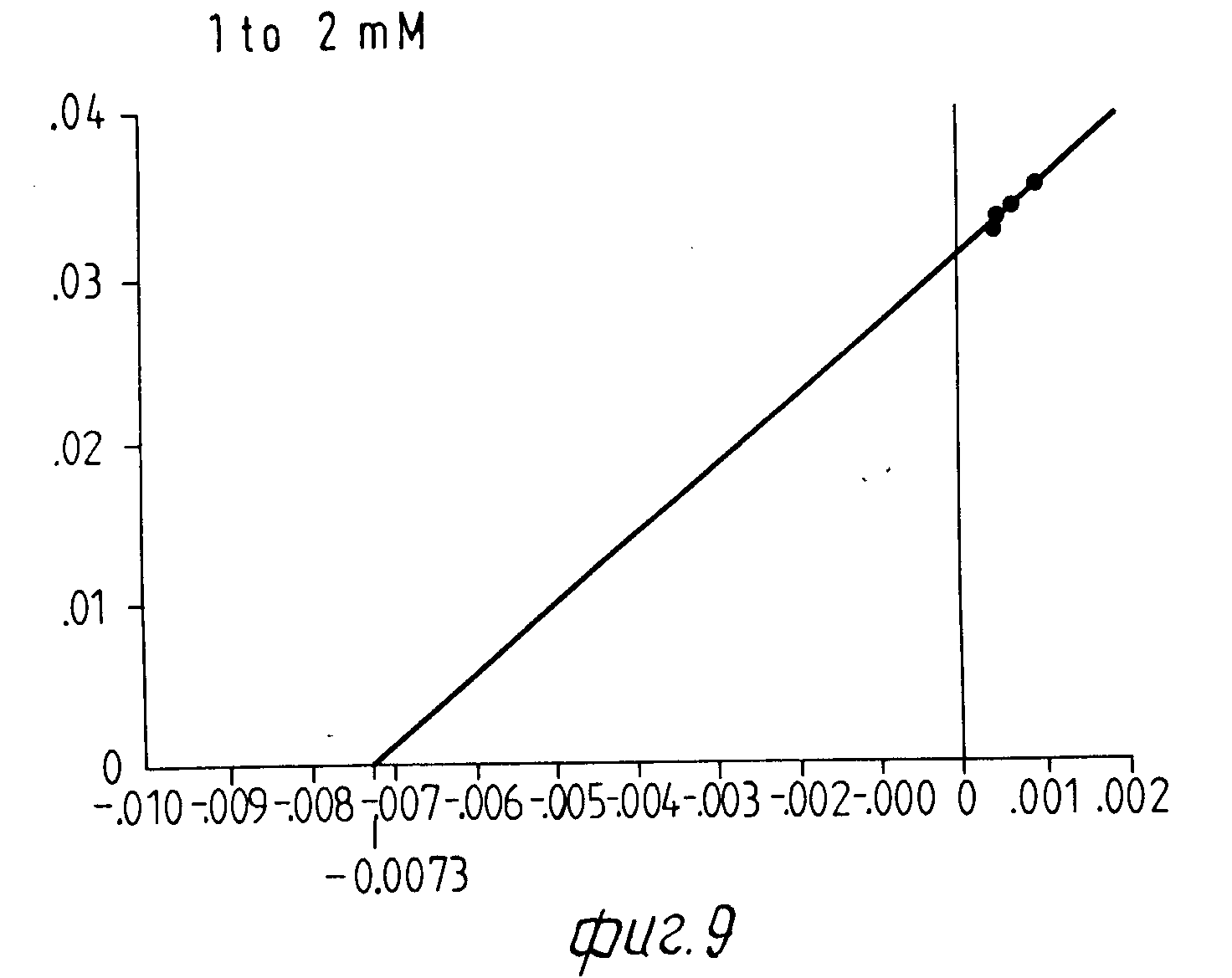
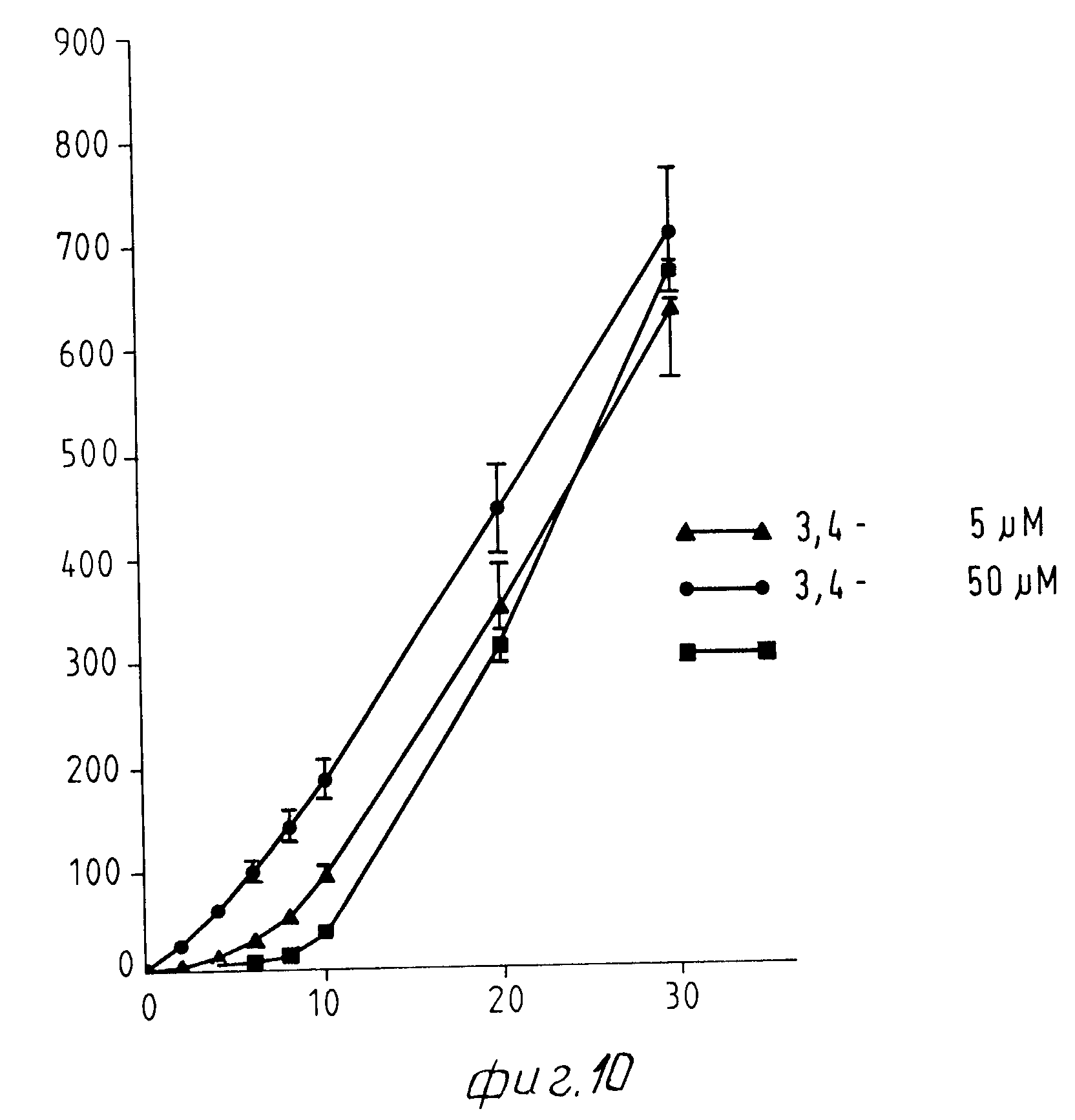
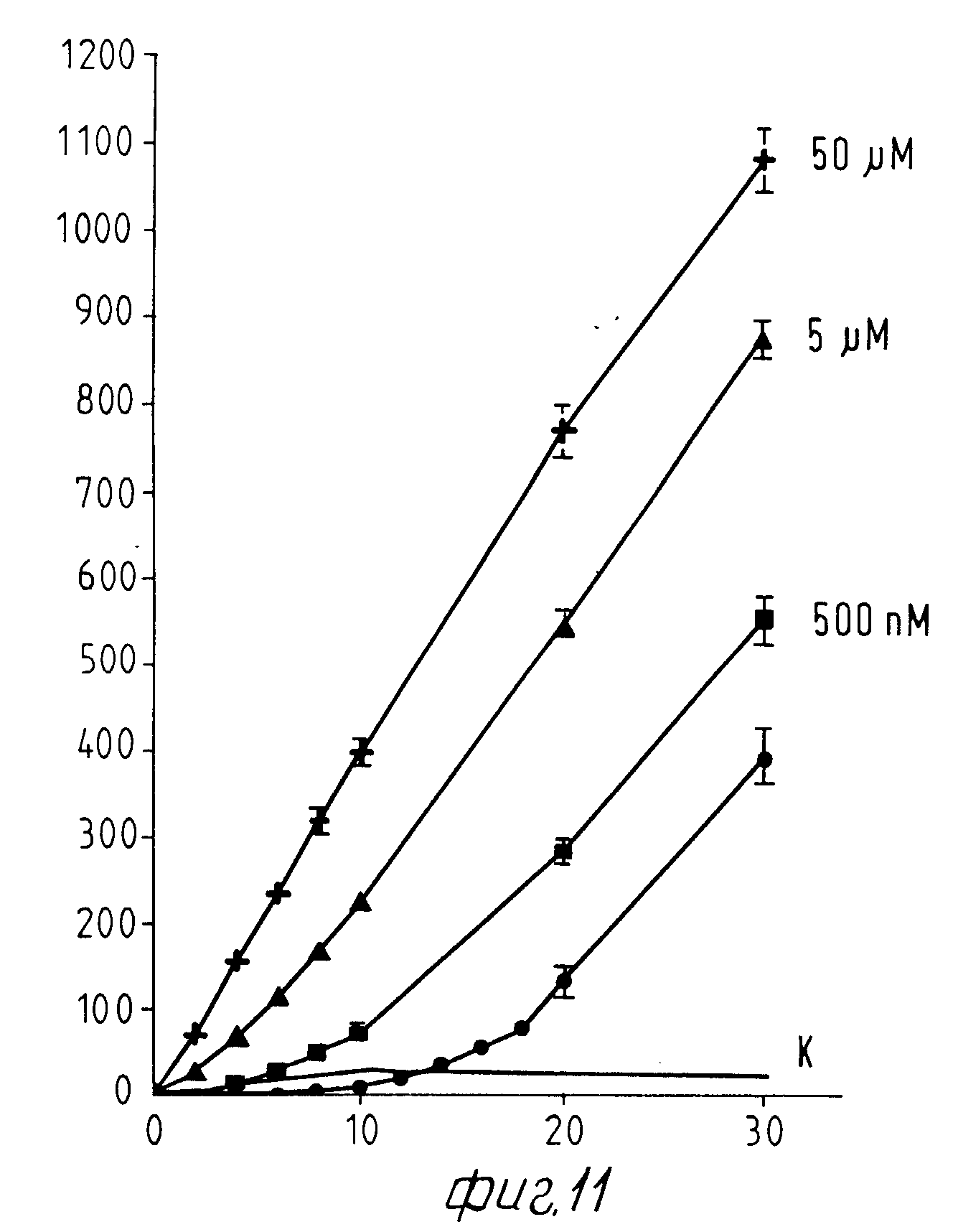
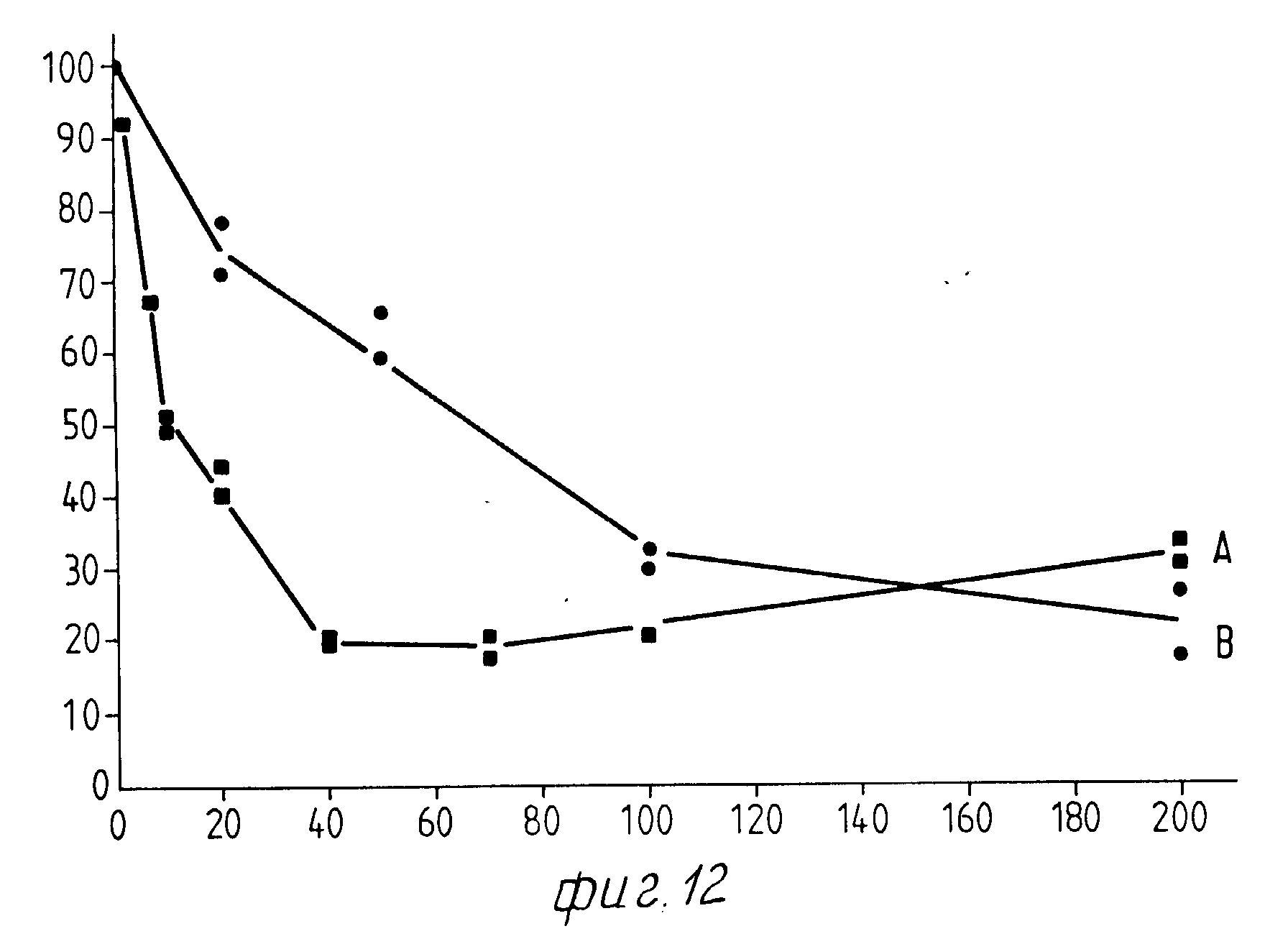
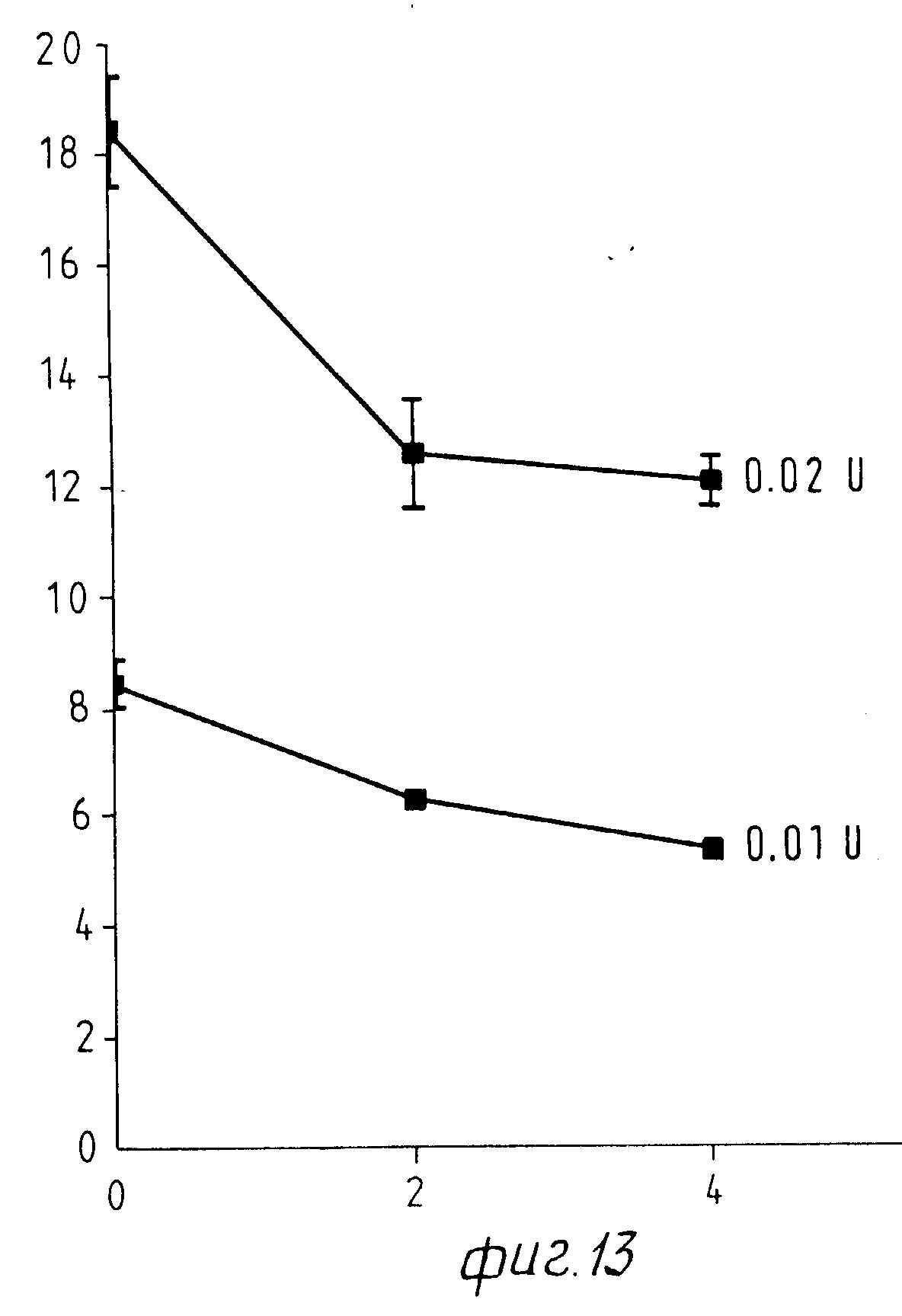
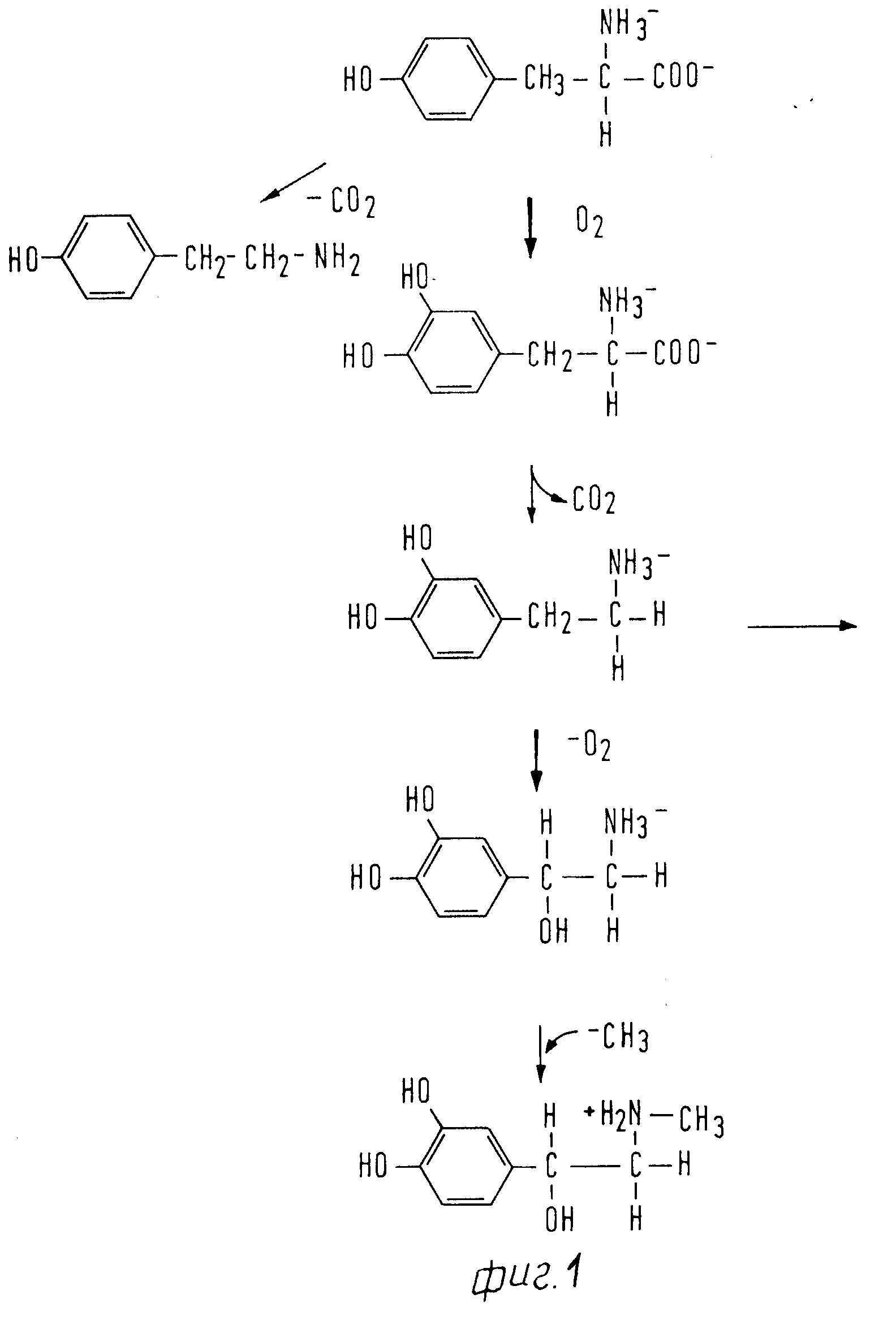
На Фиг. 1 показана форма обмена вещества синтеза пирокатехоламина; на фиг. 2 обзор схемы реакции тирозина через допахинон до допахрома или меланина; на Фиг.3 определенное при 303 нм ультрафиолетового спектра гидроксилирование тирозина в присутствии Corydalis экстракта 1:10.000, Eschscholtzia экстракта 1: 10.000 или 20 Е фенолазы; на Фиг.4 график Lineweaver Burk для реакции фенолазы с Corydalis экстрактом (фиг.4 и 5) и для сравнения без Corydalis экстракта (фиг.6 и 9); на Фиг.10 передает реакцию фенолазы в присутствии 3, 4-дигидроксибензола; Фиг.11 показывает влияние D,L-допа на реакцию фенолазы при различных концентрациях допа (К контроль); Фиг.12 показывает торможение допамин-b-гидроксилазы Eschscholtzia-экстрактом (кривая А) и водным 1%-ным раствором подвергнутых сублимационной сушке экстрактов Coradalis и Eschscholtzia (кривая В); фиг.13 показывает при помощи фотометра при 24 нм торможение катализированной благодаря аминооксидазе реакции превращения бензиламина до бензальдегида Corydalis экстрактом. Фиг.14 показывает торможение катализированного МАО (моноаминоксилазой) образования бензальдегида при 241 нм в зависимости от концентрации экстpакта из Eschscholtzia; Фиг.15 показывает торможение катализированного МАО образования бензальдегида при 241 нм экстрактами Eschscholtzia (A), Corydalis (B) и смесью экстрактов Corydalis и Eschscholtzia в отношении 20:80.
Из фиг.1 видна схема обмена веществ пирокатехинаминов. Появляющиеся при этом соединения Допа и допамина относительно их концентрации, во-первых, зависят от того, как быстро происходит превращение трирозина до допа, и, во-вторых, с какой скоростью допамин реагирует дальше до норадреналина и адреналина. Кроме того, допамин подвергается также расщеплению моноамиооксидазами (МАО), так что и это может оказывать значительное влияние на его концентрацию в обмене веществ.
Как видно из фиг.1, повышенную концентрацию допамина получают, если повышают реакцию фенолоксидазы (фенолаза, тиросиназа), и влияние допамин-b-гидроксилазы и моноаминооксидаз можно уменьшать.
Ниже были приведены эксперименты, которые показывают, в какой степени активные компоненты лекарственного средства по изобретению влияют на три ферментативные реакции.
Следующие исследования, поскольку не было ничего другого, были осуществлены с имеющимися в продаже ферментами и с Carydalidis cavae rhizoma и Eschscholtziar californicae herba.
1. Исследование реакции тирозинозы:
Тирозин при обмене веществ гидроксилируют в расходующей кислород реакции до L-допа. Эту первую стадию синтеза пирокатехинамина катализирует тирозиназа или фенолаза или фенолоксидаза, которая
представляет содержащий медь, мало специфический фермент.
Известно, что фенолазы широко распространены в природе и встречаются в растениях, грибах и в различных животных тканях. Они повсюду играют важную роль там, где окисляют моно- или дифенолы, причем во многих случаях начинаются окислительные реакции полимеризации, как например образование лигнина или меланина.
Фенолазы катализируют две следующие друг за другом стадии окисления, которые можно описать следующим образом:
1. "Активность крезолазы" фермента вызывает гидроксилирование монофенола в
орто-положении с образованием дифенола.
2. "Активность пирокатехинолазы" катализирует дальнейшее окисление образованного о-диола до соответствующего хинона.
Обе реакции
зависят непосредственно друг от друга. Тесная связь реакции крезолазы и реакции пирокатехинолазы основывается на состоянии окисления атома меди в активном центре, который определен по D.Kertesz и
R.Zito в O.Hayaishi (Hrsg. ) "Oxygenases", Academic Press, Лондон (1962), глава 8: Фенолаза, как указано следующим образом: (Сu++)2-фермент + о-дигидроксифенол-_→
(Cu+)2 фермент + о+хинон + 2 Н+;
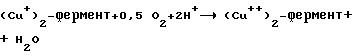
В вышеприведенном электронном балансе меди реакция крезолазы остается не учтенной. Фактически, остается неясным, катализируют ли гидроксилирование монофенола прямой ферментативной реакцией или эта реакция протекает химическим путем параллельно окислению пирокатехина по следующей схеме:
o-хинон+монофенол+H2O _→ 20-дифенол.
За гипотезу неферментативной реакции говорит тот факт прежде всего, что при реакции монофенолов с фенолазами можно наблюдать индукционную фазу, которая при тирозиназах из животной ткани может продолжаться до одного часа. Непрерывная ферментативная реакция может начинаться лишь тогда, когда диоды или хиноны присутствуют как примеси или образованы в результате самоокисления.
Исследование реакции тирозиназы с растительными экстрактами из Corydalis и Eschscholtzia.
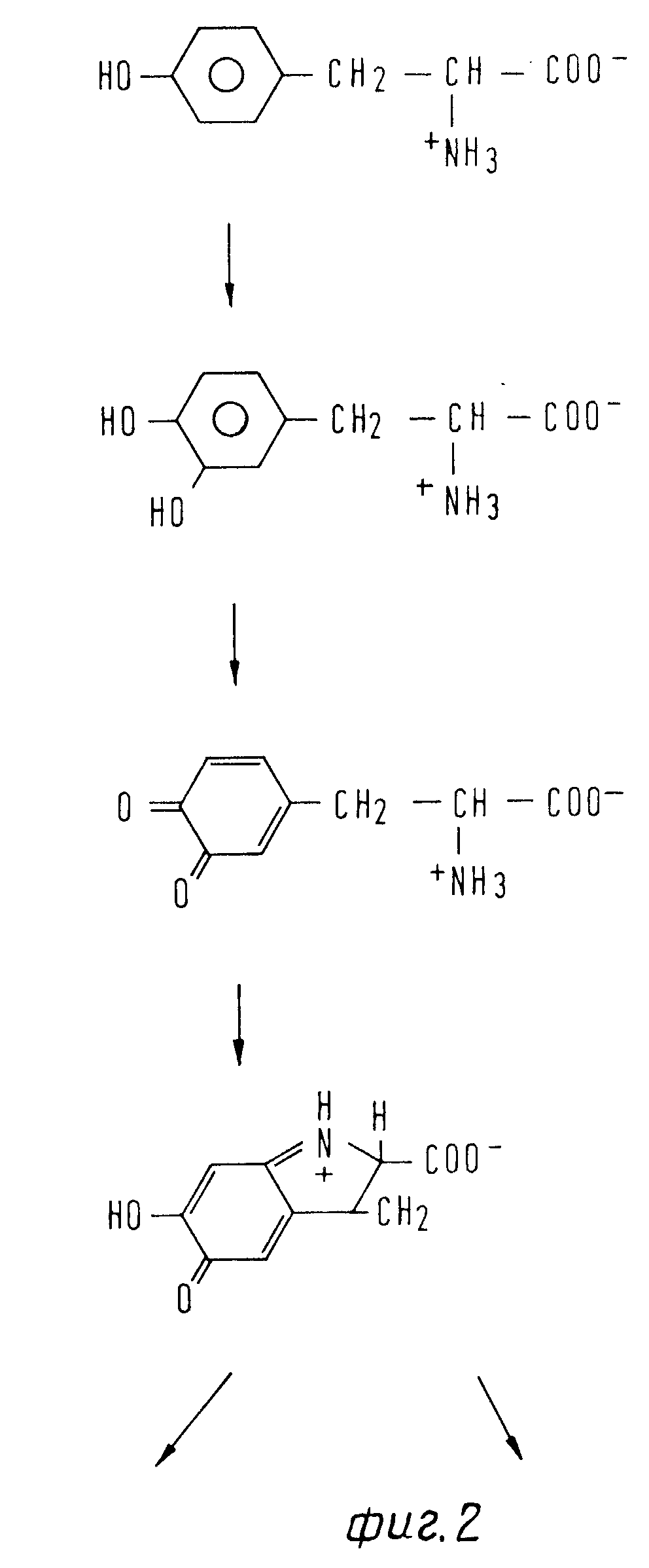
Фиг.2 показывает схематический обзор реакции, исходя из тирозина, до допахрома и его превращения до хинонимина или меланина.
Экспериментально наблюдали ниже окисление тирозина до допахрома (фиг.2), первого продукта окисления дигидроксифенилаланина (Допа). Сам допахром является субстpатом для допахромтаутомеразы и представляет предстадию образования меланина. Как образование допахрома, так и синтез меламина приводят к расщеплению Допа и тем самым к уменьшенному синтезу допамина.
За концентрацией допахрома можно следить в ультрафиолетовом спектре при длине волны 303-318 нм. При этом его образование из тирозина приравнивается к активности исследуемой фенолазы, которую считают определяющей скорость реакции.
Исследования проводили на следующих смесях субстратов: 2 ммол тирозина, 100 ммол фосфатного буферного раствора, рН 6,5, 20 единиц тирозиназы или спиртовых вытяжек Eschscholtzia или Corydalis, разбавленных в отношении 1: 10000 (исходя из основного экстракта по нижеследующему примеру).
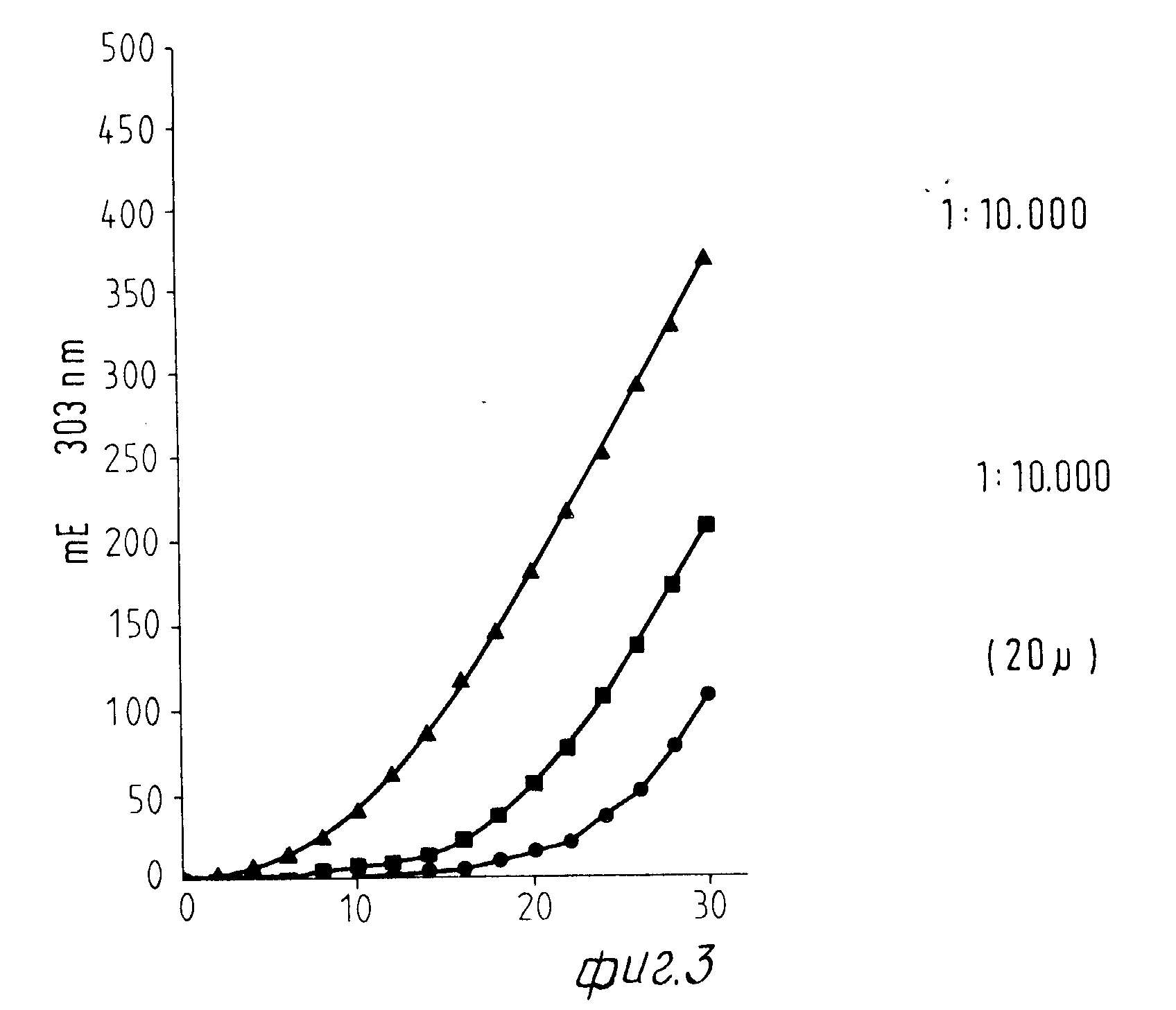
Фиг.3 показывает определенное при 303 нм ультрафиолетового спектра гидроксилирование тирозина в присутствии фенолоксидазы или экстрактов из Corydalis и Eschscholtzia. При этом наблюдают в присутствии одной фенолазы появление приблизительно 15-минутной 'Lag-фазы (стадии покоя).
Разбавления из экстрактов Corydalis до 1:10000 приводят к определенному сокращению этой "lag-фазы" или начальной фазы, как это видно из фиг.3. При более высоких концентрациях Corydalis наблюдают немедленное наступление максимальной нормы превращения без 'lag-фазы'.
Экстракт из Eschscholtzia приводит также к сокращенной начальной фазе: однако эффективность экстракта Eschscholtzia лежит значительно ниже эффективности Corydalis.
Контрольные опыты показали, что присутствие соответствующих количеств этанола не оказывают никакого влияния на реакцию. Кроме того, опыты с пирролохинолинхиноном (PGG) показали, что добавка этого физиологически очень интересного хинона не оказывает никакого влияния на начальную фазу реакции фенолазы. И гиперицин, который как пара-хинон возможно мог бы оказывать влияние на lag-фазу, не влияет на реакцию.
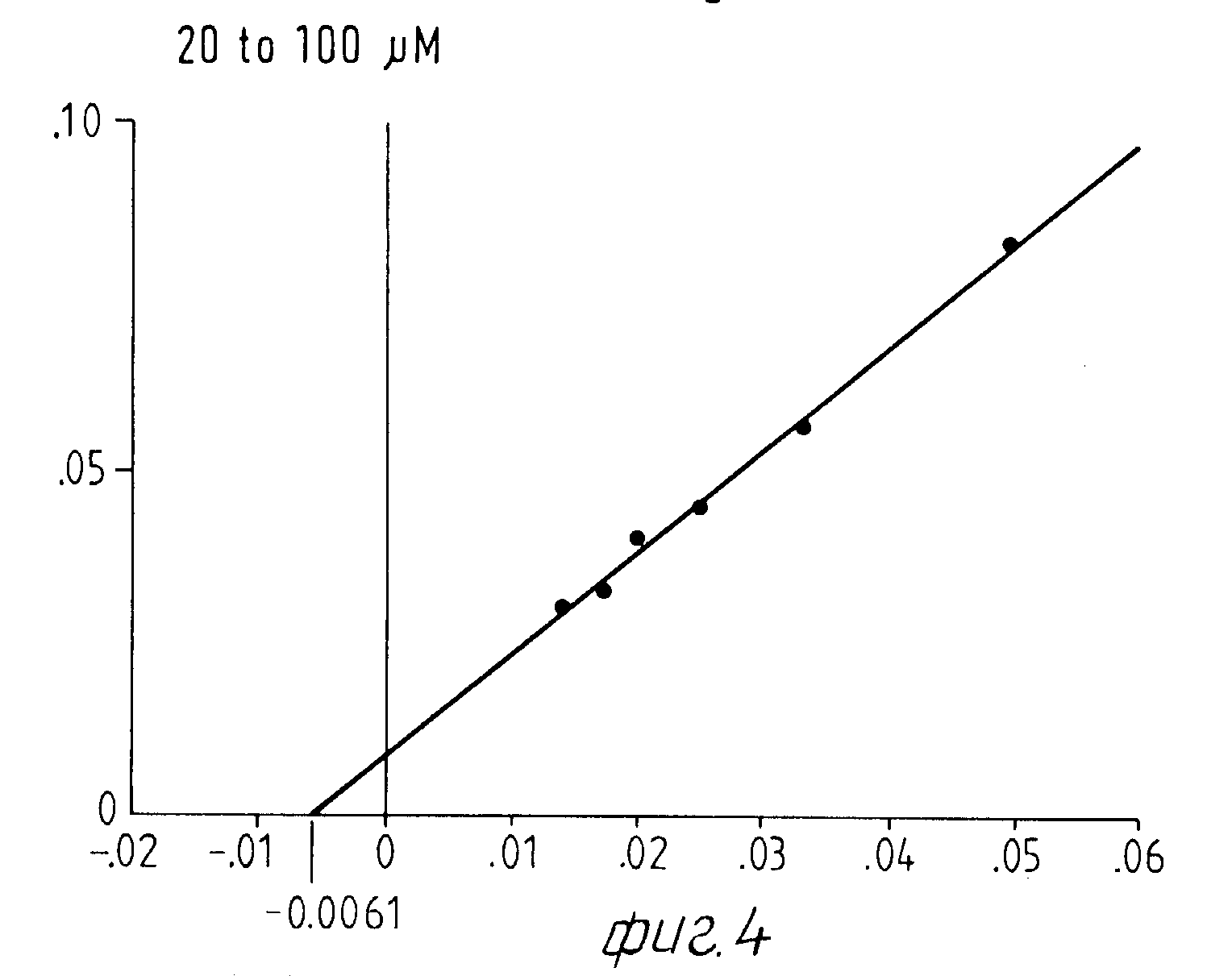
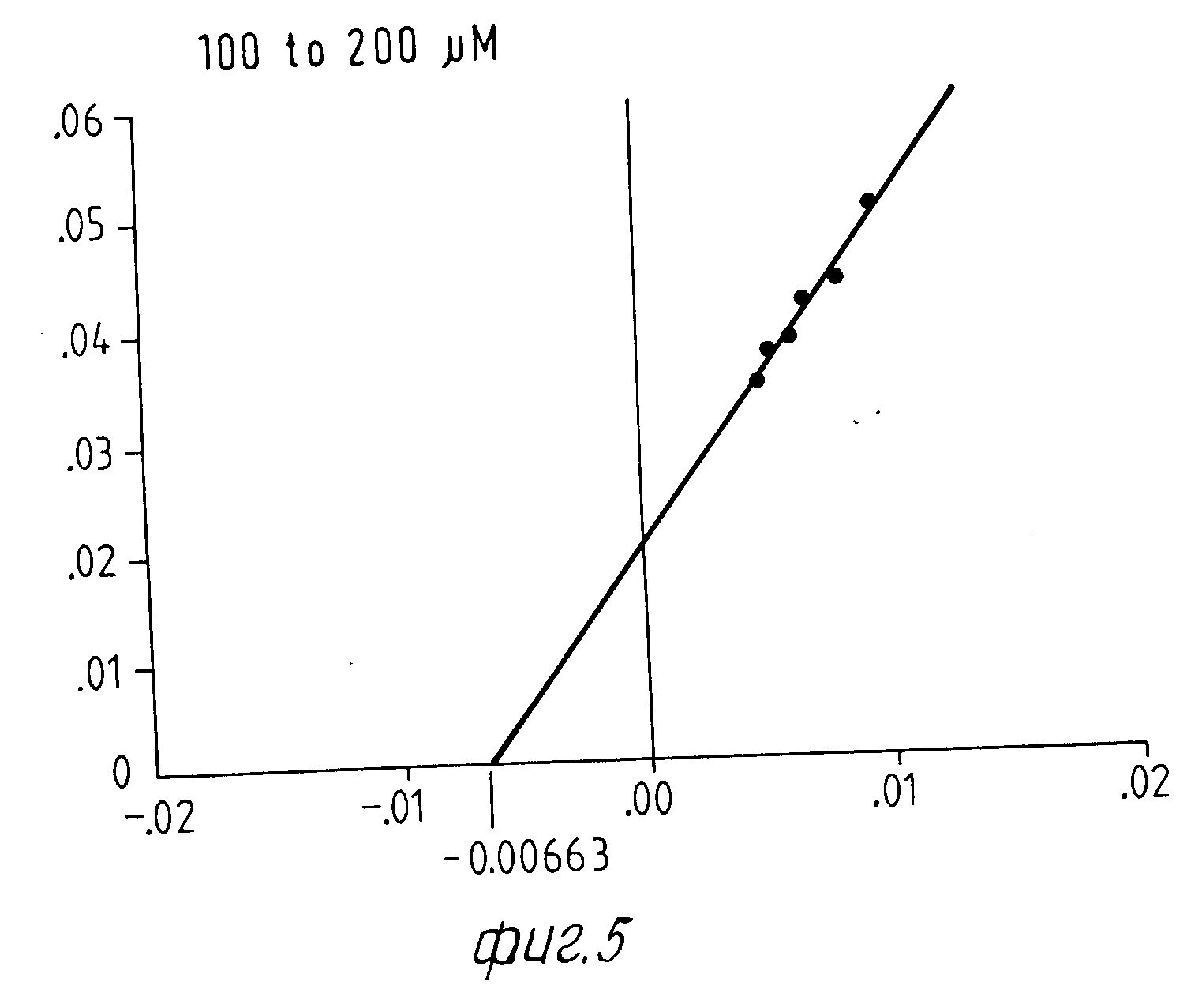
При этой серии опытов интересен тот факт, что экстракт из Corydalis хотя и определенно смещает вперед момент максимальной нормы превращения тирозина, но не оказывает никакого влияния на максимальную норму превращения. Опыты с различными концентрациями субстрата на графике Lineweaver Burk Plot не показывают никакого смещения Кm-величины реакции фенолазы (см. для этого фиг. 4-9).
Для дальнейшего пояснения механизма реакции тирозиназы, в
частности, учитывая сокращение lag-фазы, к испытываемой исходной смеси добавляют другие вещества:
а) Добавка солей меди не оказывала никакого влияния на ферментативную реакцию.
b) Аскорбиновая кислота как восстанавливающий действующий фактор как это известно из литературы может подавлять стадию покоя при различных типах реакции. Однако этого нельзя было наблюдать в пределах настоящей серии опытов: аскорбиновая кислота хотя и может начинать превращение тирозина до L-допа, но одновременно препятствует его дальнейшему окислению до дипахрома. Реакцию фонолазы нельзя было наблюдать в присутствии аскорбиновой кислоты при 303 нм в течение 30 минут; "стадия покоя" была, возможно, даже удлинена.
с) Комбинация PQQ с аскорбиновой кислотой, причем образуется восстановленная форма PQQH2, которая могла бы влиять на реакцию в качестве диола, так же вызывала удлинение стадии покоя.
d) Добавка настоящих диолов, как 3, 4-дигидроксибензол и D,L-допа (ДОФА-, 3,4-диоксифенилаланина), сокращает стадию покоя реакции (в случае добавки 3,4-диоксифенилаланина, благодаря большему количеству субстрата повышается также скорость образования допахрома).
На фиг.10 показана реакция фенолазы в присутствии 3,4-дигидроксибензола. Фиг. 11 показывает влияние D, L-допа на реакцию фенолазы в зависимости от концентрации допа. Как из фиг. 10, так и из фиг.11 моно отчетливо видеть влияние названных диолов на стадию покоя.
Самоокисление 3,4-диоксифенилаланина, которое наступает при щелочных величинах рН, можно не наблюдать или наблюдать лишь немного при рН 6,5.
Вышеприведенные опыты показывают, что сокращение начальной фазы реакции фенолазы можно вызывать только добавкой диолов. Хинолины и аскорбиновая кислота не оказывают никакого влияния. Поэтому следует полагать, что экстракты Corydalis и Eschscholtzia содержат орто-диолы, которые вызывают немедленное превращение тирозина до 3,4-диоксифенилаланина. Далее, следует предполагать, что экстракты Coryladis и Eschscholtzia и на живом организме приводят к более быстрому превращению тирозина и тем самым к более повышенной концентрации "Допа" 3,4-диоксифенилаланина.
2. Исследование реакции допамин-β-гидроксилазы:
Фермент допамин-b-гидроксилазы катализируют превращение допамина
до норадреналина. Допамин-b-гидроксилаза также представляет содержащий медь фермент. Гидроксилирование происходит при расходе кислорода и требует аскорбиновой кислоты и фумарата в качестве
восстанавливающих агентов, чтобы регенерировать окислительный статус атома меди.
Активность фермента определяют потенциометром на основании расхода молекулярного кислорода.
Соответствующая тест-добавка содержала следующие компоненты:
По 100 mI тирамина, фумарата, аскорбата (соответственно 5 ммол),
1 мл фосфатного буферного раствора, рН 5 (100 ммол),
1 мл воды,
100 μл фермента (соответственно 0,1 единицы).
Нормы расхода кислорода вычисляли на основании О2-содержания раствора с температурой 37oС при соответствующем объеме.
При добавке Eschscholtzia-экстракта происходит заметное, зависящее от концентрации торможения ферментативной реакции, т.е. гидроксилирование боковой цепи в значительной степени подавляется. Наблюдали, что ферментативная активность тормозится также этанолом. Однако торможение экстрактом значительно выше, так что здесь можно видеть определенное различие.
Фиг. 12 показывает торможение допамин-β-гидроксилазы Eschscholtzia-экстрактом (кривая А) и водным 1%-ным раствором подвергнутых сублимационной сушке экстрактов Eschscholtzia и Corydalis в отношении 20:1 (кривая В) по изобретению.
На фиг. 12 обе кривые показывают отчетливое торможение ферментативной активности. Различия в ходе кривых следовало бы отнести к присутствию или к отсутствию этанола и Corydalis-экстракта (кривая В). Снижающееся действие ферментативного торможения при Eschscholtzia-экстракте частично можно объяснять расходом кислорода различными субстратами экстракта. Хотя водный раствор подвергнутых сублимационной сушке экстрактов Corydalis и Eschscholtzia также показывают расход кислорода с тирамином, аскорбатом и фумаратом; однако тормозящее действие на фермент не снижается, вследствие чего здесь значительно затруднена интерпретация эффекта.
Вышеприведенные опыты ясно показывают, что фермент допамин-b-гидроксилазы тормозят спиртовым экстрактом Eschscholtzia (кривая А) и также водным раствором подвергнутых сублимационной сушке Eschscholtzia и Corydalis (кривая В), что при обмене пирокатехинамина приводит к уменьшению образования норадреналина и адреналина. Это тормозящее действие объясняется успокаивающее действие лекарственного средства по изобретению. Поддерживаемая торможением высокая концентрация допамина вызывает положительное влияние в случае паркинсонизма, картины болезни, при которой допаминэргические нервные клетки разрушены и содержание допамина в головном мозге следует поддерживать высоким искусственными приемами.
3. Исследование реакции моноаминооксидазы (МАО)
Как видно из фиг.1, концентрацию Допа (3,
4-диоксифенилаланина) или допамина регулируют также путем его расщепления моноаминооксидазами. Моноаминооксидазы превращают первичные амины при помощи кислорода в водной среде до соответствующего
альдегида, аммиака и до соответствующей перекиси водорода в стехиометрическом отношении. Примененная здесь аминооксидаза была куплена у фирмы Сигма Кемикалс. Эта аминооксидаза показывает высокое
сродство к бензиламину в качестве субстрата. Поэтому были проведены нижеследующие исследования с бензиламином в качестве субстрата и было проверено влияние Corydalis и Eschscholtzia на активность этой
моноаминооксидазы.
Превращение бензиламина до бензилальдегида благодаря моноаминооксидазе определяли фотометром и потенциометром:
а) При помощи фотометра обнаруживают
образующий бензальдегид, который при 241 нм имеет высокий молекулярный удельный показатель поглощения (1,2 х 104)). Это чувствительное обнаружение позволяет применять очень маленькие
количества фермента, которые могут находиться при 0,01 и 0,02 единицы моноаминооксидазы (МАС) в реакционном объеме 2 мл.
Соответствующая тест-добавка с общим объемом 2000 mл
содержала:
50 μл 100 ммол водного раствора бензиламина-HCl (соответственно 2,5 ммол),
100 ммол фосфатного буферного раствора, рН 7,4,
0,01 единицы или 0,02 единицы
МАО, добавленной частями по 100 μл в соответствующий основной раствор;
эталонная кювета содержала буферный раствор, воду и бензиламин.
В опытах с вышеописанной тест-добавкой через 10 мин реакционного времени в измерительную кювету и в эталонную кювету добавляли разбавленные экстракты Eschscholtzia и Corydalis и определяли измененную активность. Фиг.13 показывает торможение образования бензальдегида в зависимости от концентрации Corydalis (20 или 40 μл 1:10 разбавленного раствора основного экстракта).
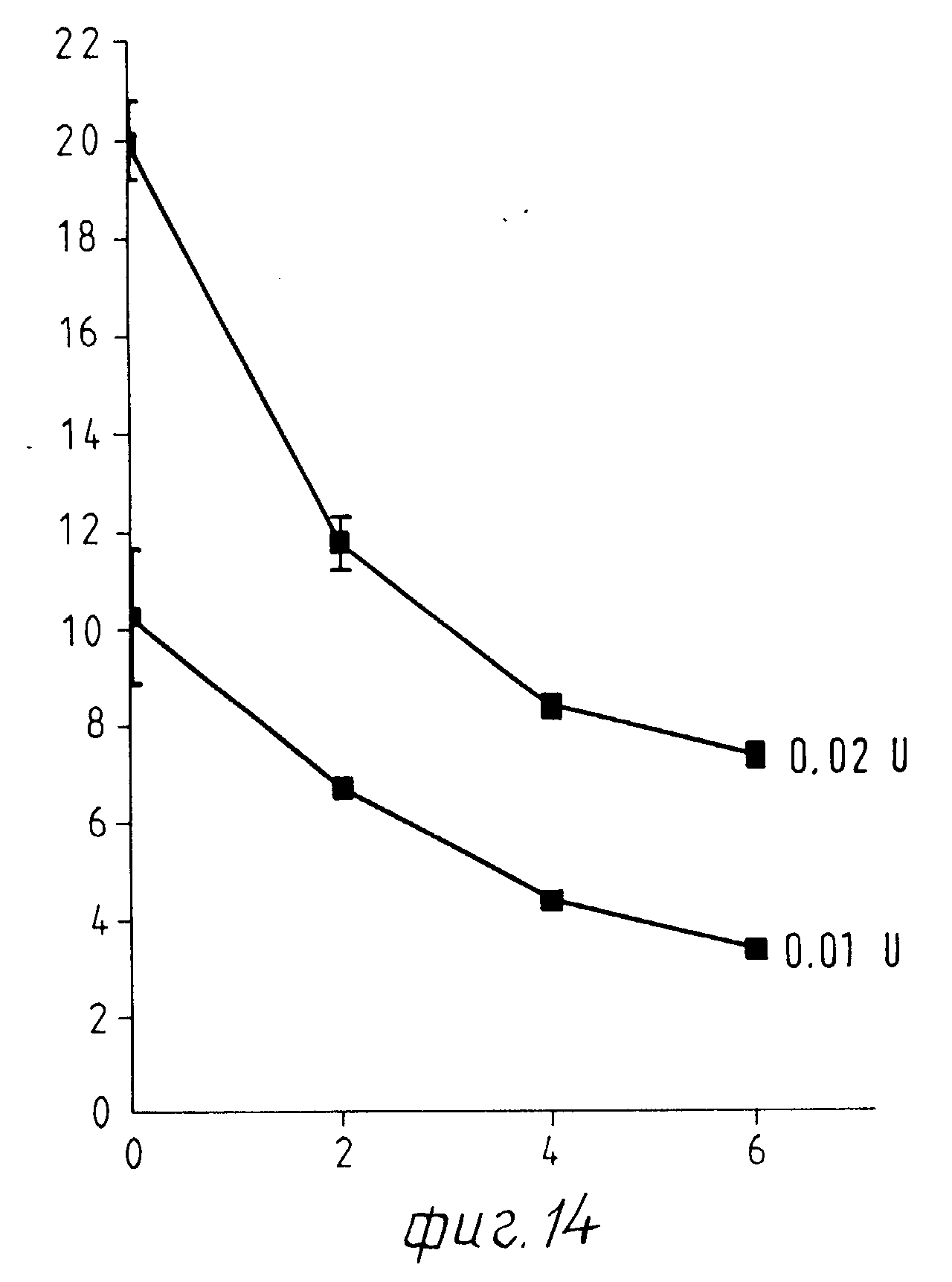
На фиг.14 показано торможение экстракта из Eschscholtzia на МАО-активность при различных количествах экстракта. При этом наблюдается отчетливое торможение МАО-активности.
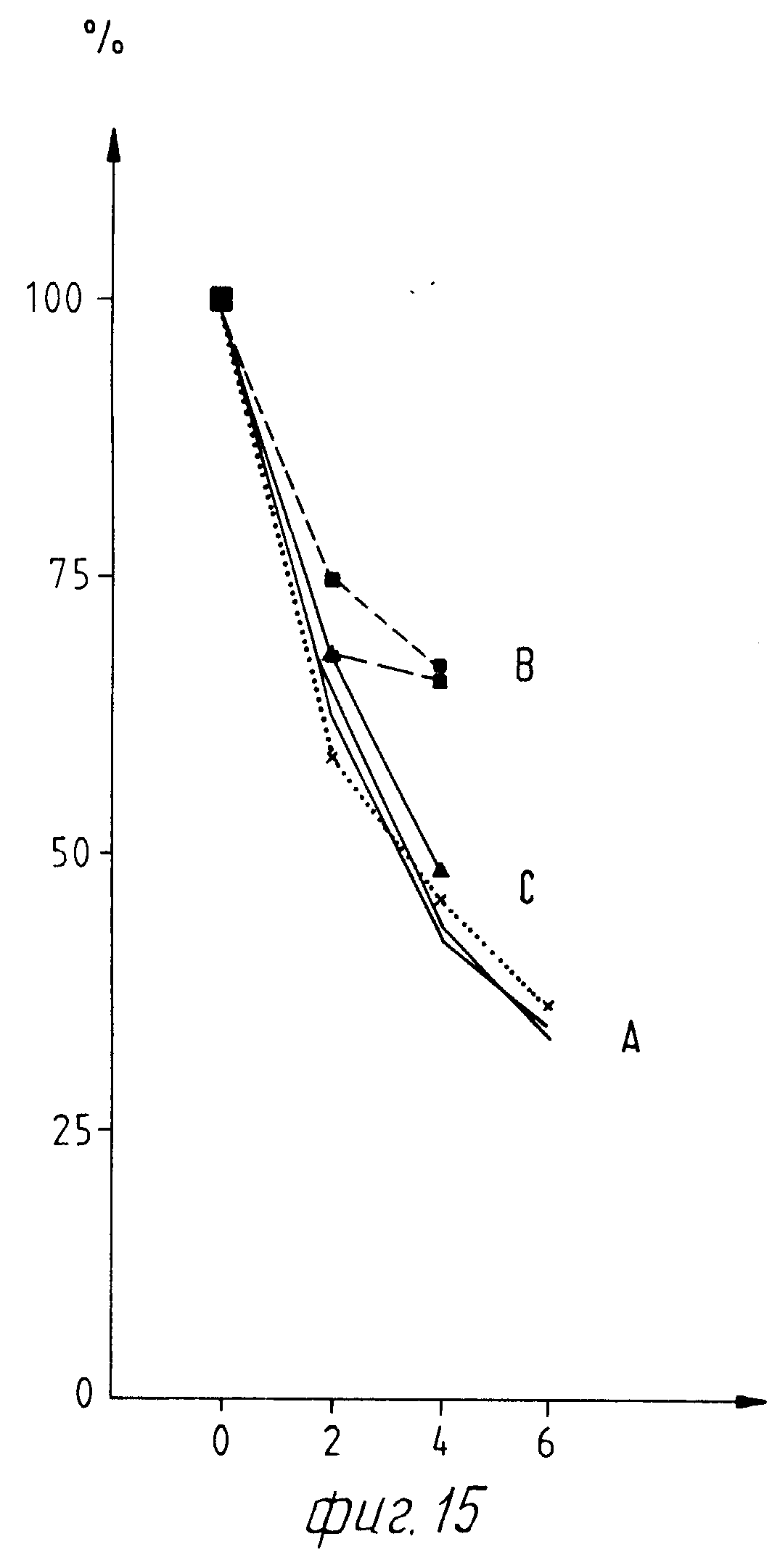
Фиг. 15 показывает тормозящее действие МАО-активности в результате добавки различных концентраций Eschscholtzia-экстракта (кривая А), Corydalis-экстракта (кривая В) и смеси экстрактов Corydalis и Eschscholtzia в отношении 20:80 (кривая С). Для лучшего сравнения результатов опытов на фиг. 15 дана схема тормозящих действий в При этом активность МАО в каждом опыте была принята за 100% (на основании вязкого раствора сульфата аммония-фермента было трудно брать постоянные количества фермента предложенного в продаже продукта).
Оценка опытов показывает, что экстрактом Corydalis вызывает умеренное торможение МАО-активности. Более сильное влияние можно наблюдать благодаря Eschscholtzia-экстракту. Значительным является также МАО-торможение в присутствии смеси обоих экстрактов, состоящей из 80% Eschscholtzia-экстракта и 20% Corydalis-экстракта.
б) При помощи потенциометра можно определить реакцию
200 μл 100 ммолярного раствора бензиламина (соответственно 10 ммол),
1.000 μл 200 ммолярного фосфатного буферного раствора, рН 7,5 (соответственно 100 ммол),
1.000 μл дистиллированной воды,
0,05 единицы МАО.
Добавкой 100 μл экстрактов Corydalis и Eschscholtzia после 3 мин реакционного времени можно вычислить различные нормы превращения кислорода.
Результаты на кислородном электроде показывают уменьшение активности моноаминооксидазы благодаря отдельным экстрактам из Corydalis и Eschscholtzia. При этом было подтверждено сильное влияние экстракта Eschscholtzia на МАО-активность.
Вышеприведенные опыты показывают, что можно достигнуть значительного торможения МАО экстрактами из Corydalis и Eschscholtzia и смесью этих двух экстрактов. Отсюда можно сделать вывод, что если тормозить активность аминооксидаз в плазме, то амины, как допамин, имеют более длительное время пребывания в токе крови и тем самым дольше остаются эффективными. Отсюда вытекает положительный эффект лекарственного средства согласно изобретению при смягчении состояний возбуждения и дисфункций нервов и получающихся в результате этого состояния депрессии, особенно также при синдромах дефицита допамина, как паркинсонизм.
Пример 1.
Получение экстракта.
Были получены отдельные экстракты Corydalis cavae rhizoma и Eschscholtzia californicae herba. Получение отдельных экстрактов осуществляли экстракцией при помощи перколяции при 50oС в течение 16 ч. Соблюдали отношение высушенных лекарственных растений экстракта 2,5:10, т.е. из 2,5 г соответствующего высушенного лекарственного растения получали 10 мл экстракта высушенного лекарственного растения. Экстрагирующий агент: 30 об. этанол.
Полученные таким путем экстракты можно непосредственно применять для получения состава лекарственного средства, или можно переводить их лиофилизацией в сухой экстракт.
Пример 2.
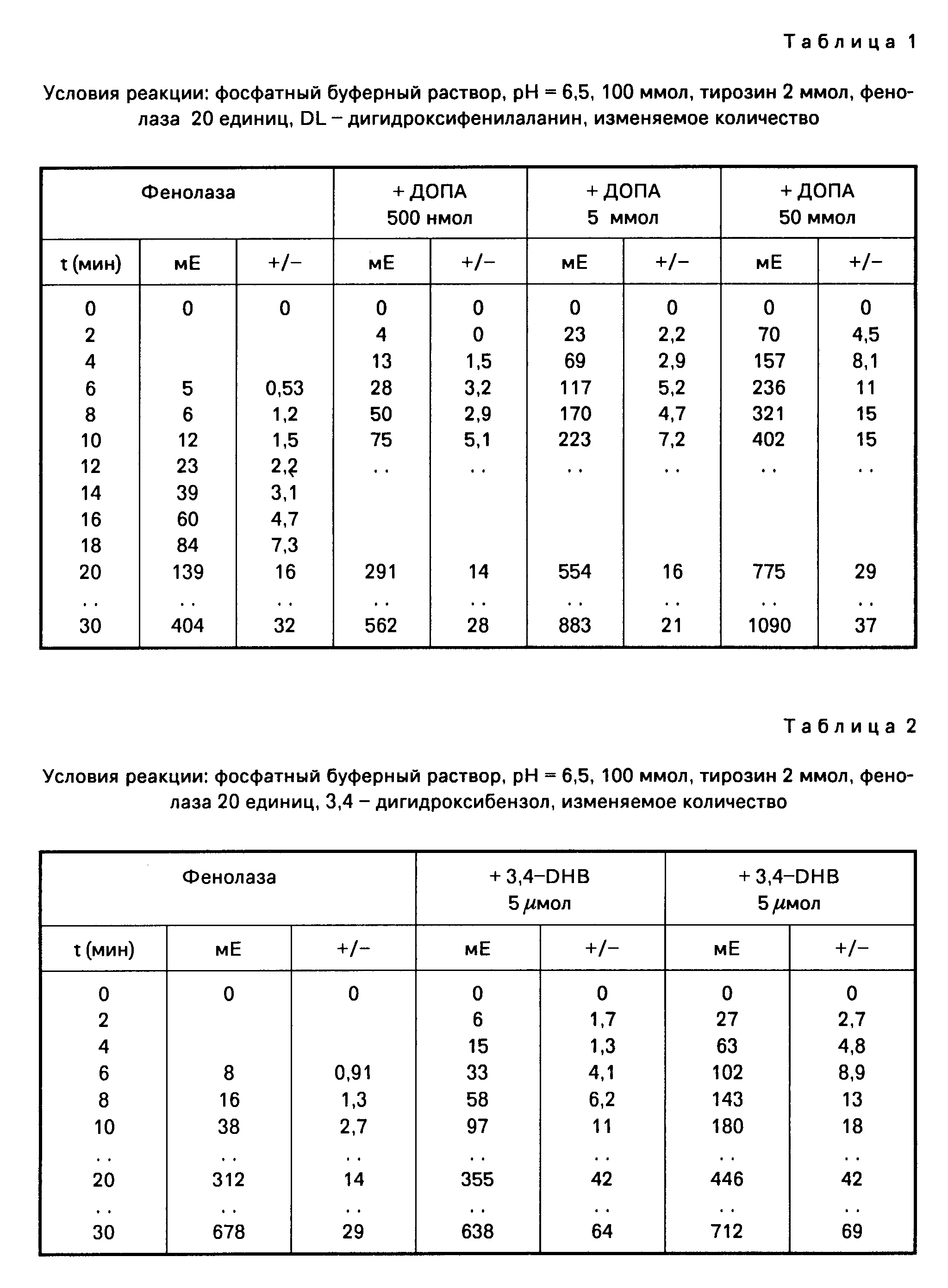
Влияние DL-дигидроксифенилаланина на реакцию фенолазы (табл.1).
Как показывает фиг.11, DL-допа можно заметно сокращать стадию покоя фенолазы, причем 5 μмол допа вызывают немедленное образование допахрома. С 50 μмол допа реакция непосредственно после начала, вызванного ферментом уже протекает с максимальной нормой превращения.
Самоокисление допа, т.е. образование допахрома без участия фермента, при рН 6,5 в наблюдаемом интервале времени не было установлено.
Однако DL-допа представляет не любой диол, а субстрат фенолазы, продукт которого снова дает допахром. Поэтому ниже были предприняты (пример 3) сравнительные исследования с 3,4-дигидроксибензолом.
Пример 3.
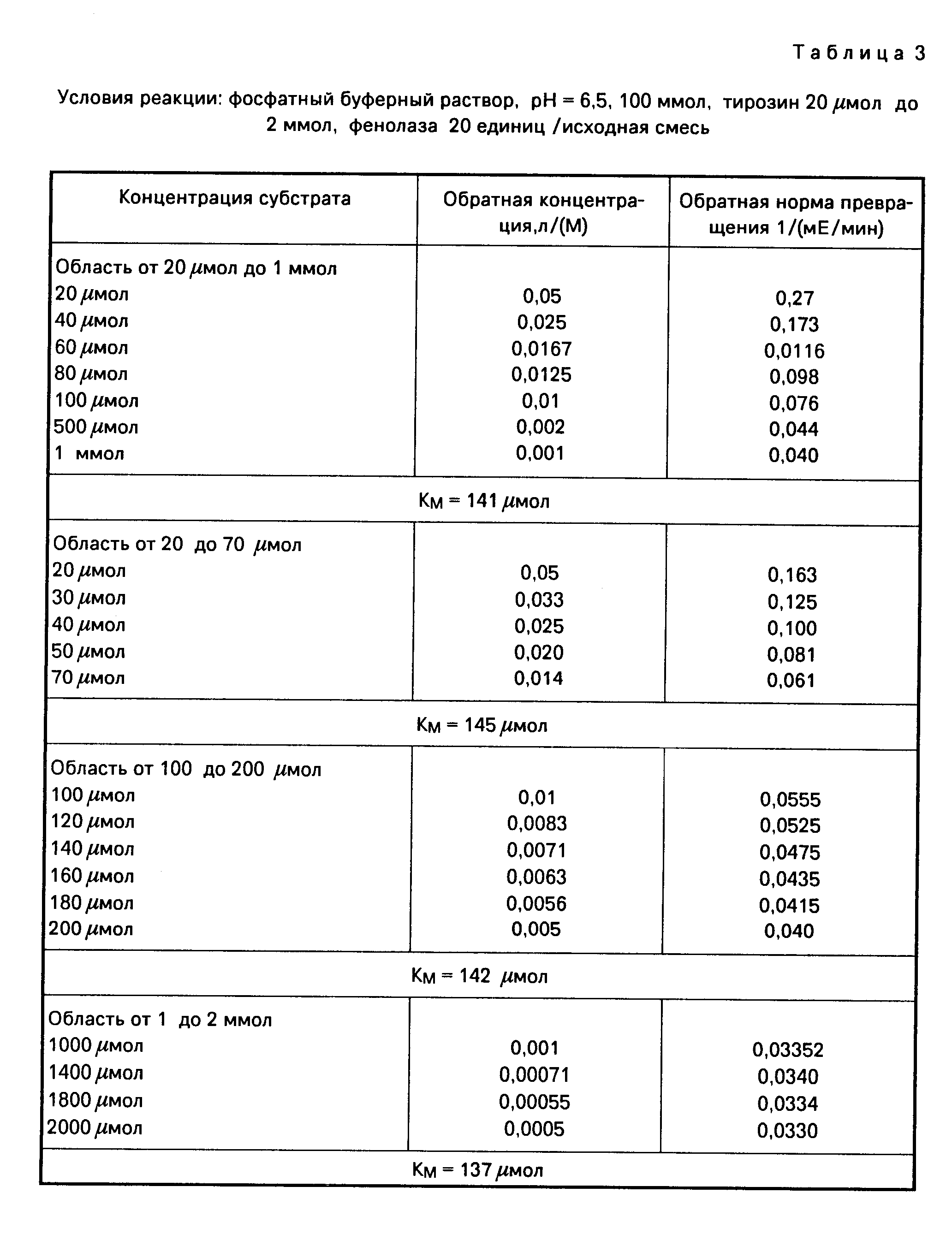
Влияние 3,4-дигидроксибензола (как стартера) на реакцию фенолазы (табл. 2).
Оказывается, что орто-дигидроксибензол при концентрациях 5 и 50 μмол может сокращать или снимать стадию покоя реакции фенолазы (фиг.10).
Пример 4.
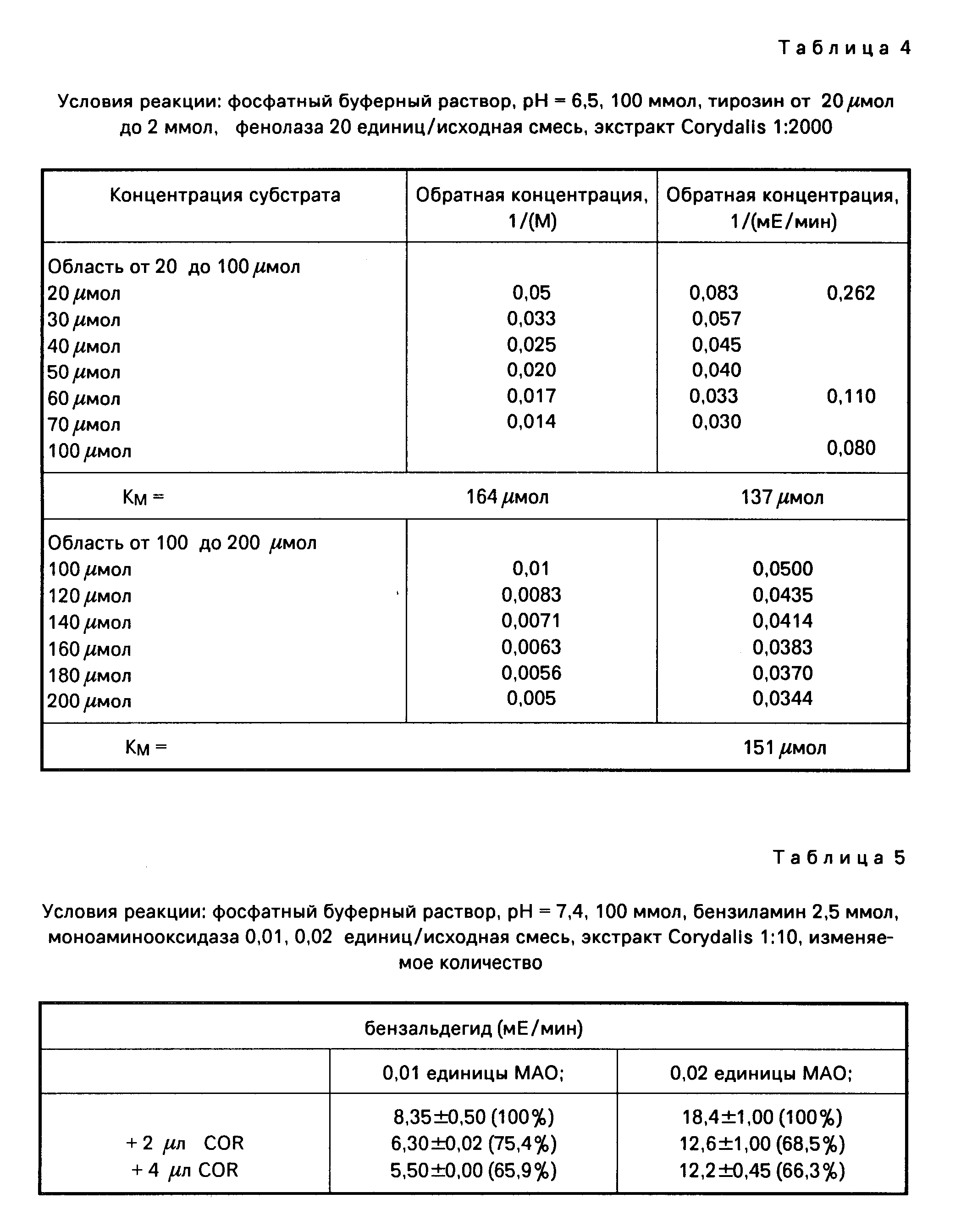
а) Определение константы Михаэлиса для превращения тирозина благодаря фенолоксидазе
Условия реакции: фосфатный буферный раствор, рН 6,5,
100 ммол, тирозин 20 μмол до 2 ммол, фенолаза 20 единиц/исходная смесь (табл.3).
Результаты представлены на фиг.6-9.
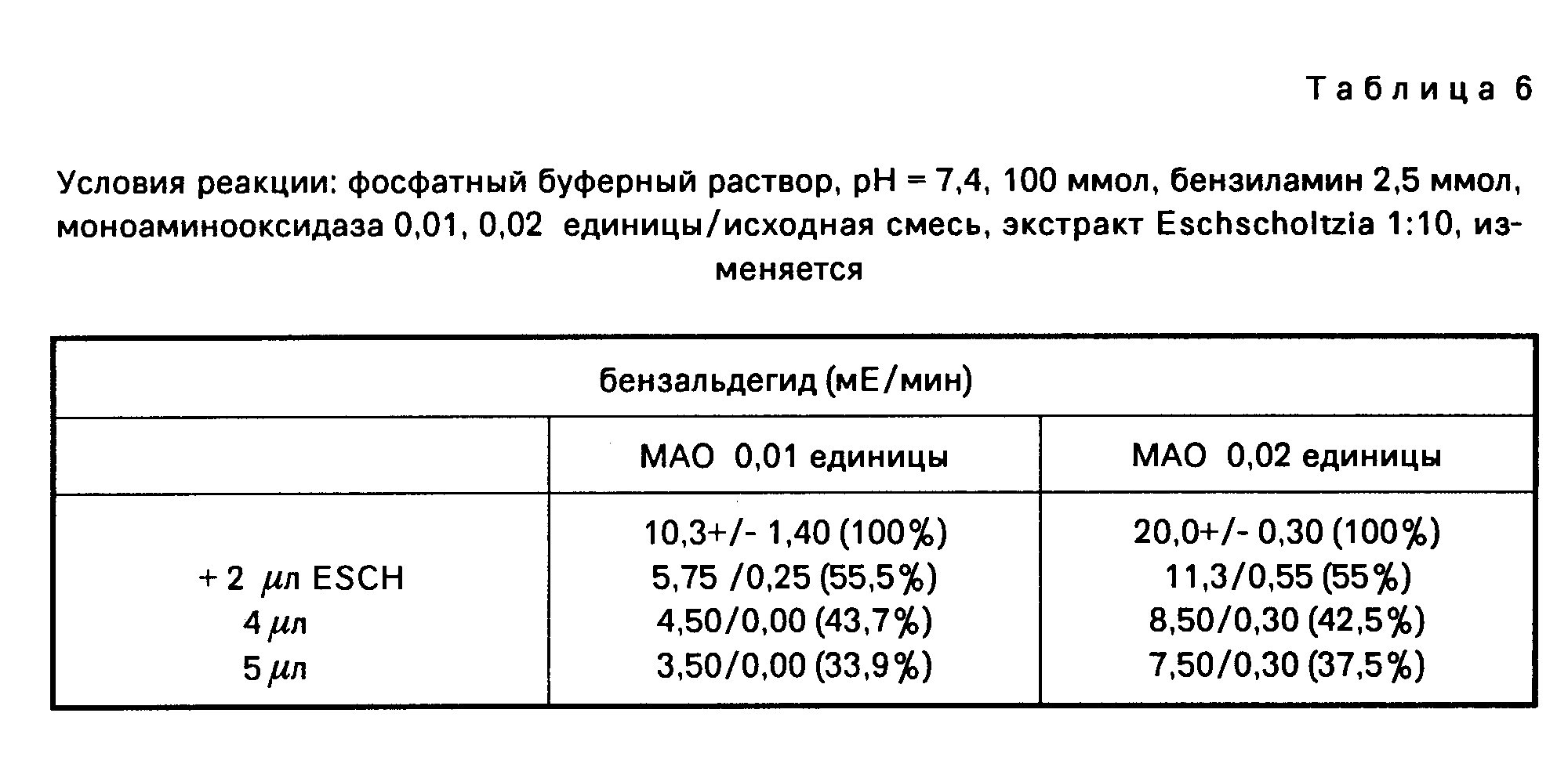
б) Константа Михаэлиса реакции с экстрактом Corydalis.
Исследование нормы превращения в присутствии экстракта Corydalis проводится с разбавлением экстракта 1:200. Это количество экстракта приводило в предшествующих опытах к немедленному наступлению полной ферментативной активности, начальная фаза составляет 0 мин.
Определенные Km-величины показывают в присутствии Corydalis-экстракта несколько повышенный разброс, однако лежат в одинаковой области концентрацией.
Константы Михаэлиса в присутствии экстракта Corydalis (табл.4).
Результаты представлены на фиг.4 и 5.
Пример 5.
а) Влияние экстракта Corydalis:
Как показывает табл.5 и фиг.13, экстракт из Corydalis cava тормозит активность МАО. При этом применяют 20 или 40
μл 1:10 разбавленного раствора экстракта (2 или 2 μл основного вещества). Эти количества соответствуют, в пересчете на общий объем реакции 2 мл, разбавлению 1:1000 или 1:500. Собственная
абсорбция экстракта при 241 нм благодаря присутствию многочисленных ароматических соединений препятствует исследованию более крупных количеств экстракта, так как в этом случае невозможно больше
уравновешивание реакционной и эталонной кюветы.
Активность МАО [мЕ/мин] под влиянием Corydalis
Результаты представлены на фиг.4
б) Влияние экстракта Eschscholtzia:
На основании повышенной прозрачности экстракта Eschscholtzia в этом исследовании можно применять 20, 40 и 60 μл 1:10 разбавленного раствора. В этом случае в реакционной исходной смеси
находится 1:1000, 1:500 и 1:330 разбавленный раствор экстракта Eschscholtzia.
Табл.6 и фиг.14 поясняют высокую тормозящую способность этого экстракта: уже с разбавлением 1: 500 поддерживают активность моноаминооксидазы четко ниже 50% с разбавлением 1:330 активность фермента снижается до трети первоначальной величины.
Активность МАО под влиянием
Eschscholtzia
Результаты представлены в табл.14.
Пример 6.
Получение фармацевтической лекарственной формы.
а) Получение настойки.
Для получения настойки смешивали изготовленные по примеру 1 спиртовые экстракты высушенных лекарственных растений, а именно 20 мл экстракта высушенного лекарственного растения Corydalis cavae rhizoma и 80 мл экстракта высушенного лекарственного растения Eschscholtzia califorcae herba. Получают 10 мл готовой к употреблению настойки.
б) Получение таблеток.
Полученные по примеру 1 экстракты из Corydalis cavae rhizoma и Eschscholtzia californicae herba сушили (например лиофилизацией), и сухие экстракты перемешивали в весовом отношении Eschscholtzia/Corydalis 4/1 вместе с измельченным в порошок крахмалов (в качестве фармацевтического вещества-носителя) и формовали на таблетировочном прессе в таблетки (0,5 г, диаметр 0,6 см). Количество экстрактов активного вещества в таблетках составляло 2 мас.
Реферат
Использование: в медицине для смягчения состояний возбуждения и нервных диофункций. Сущность изобретения: растительный экстракт получен раздельной экстракцией спиртом (2,5:10) Corydalidis и Eschscholtzia с последующим смешением экстрактов при массовом соотношении сухих веществ экстракта Corydalidis и экстракта Eschscholtzia 1:1-20. Предпочтительно объемное соотношение указанных экстрактов равно 1:2-10. Экстракт может представлять собой порошок, содержать фармацевтически приемлемые целевые добавки, представлять собой форму для орального введения, настойку, таблетку, драже или капсулу. Он может быть получен из высушенных растений. 9 з.п. ф-лы, 15 ил., 6 табл.

Комментарии