Иммунотерапевтические композиции на основе дрожжей с brachyury - RU2619850C2
Код документа: RU2619850C2
Чертежи



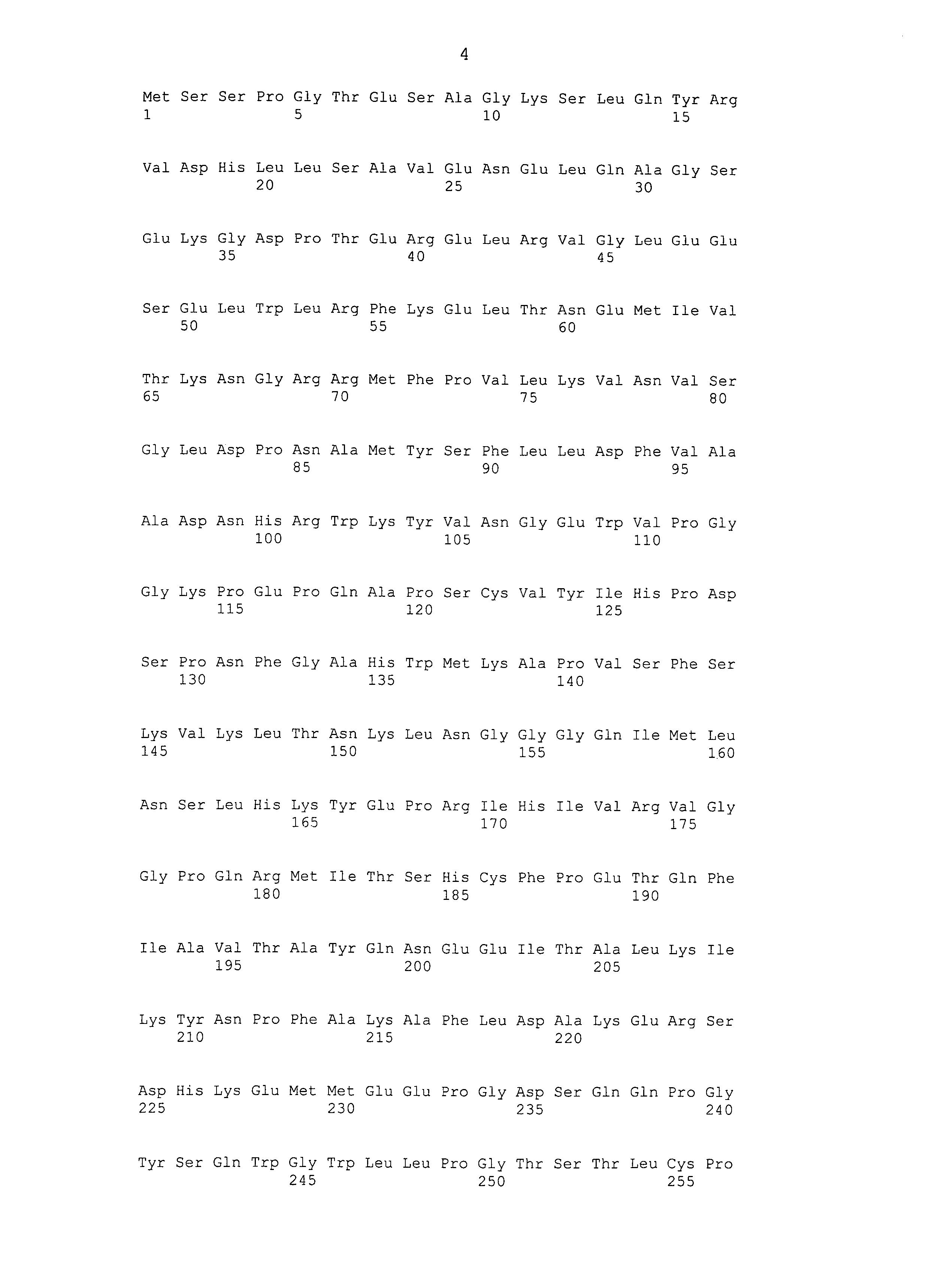


































Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается преимущество приоритета согласно 35 U.S.C. §119(e) временной заявки США с серийным номером № 61/453656, поданной 17 марта 2011 года. Полное содержание временной заявки США с серийным номером № 61/453656, поданной 17 марта 2011 года, включено в настоящее описание в качестве ссылки.
ПРАВА ПРАВИТЕЛЬСТВА
Настоящее изобретение осуществлено в соответствии с выполнением Соглашения о совместном исследовании и разработке с National Institutes of Health, Agency of the Department of Health and Human Services. Правительство США имеет определенные права на это изобретение.
ЗАЯВЛЕНИЕ, КАСАЮЩЕЕСЯ СОГЛАШЕНИЯ О СОВМЕСТНОМ ИССЛЕДОВАНИИ
Настоящее изобретение было осуществлено сторонами или от имени сторон Соглашения о совместном исследовании и разработке, подписанном 8 мая 2008 года. Сторонами Соглашения о совместном исследовании и разработке являются: GlobeImmune, Inc. и U.S. Department of Health and Human Services, который представлен National Cancer Institute, an Institute, Center or Division of the National Institutes of Health.
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка включает список последовательностей, предоставленный в электронном виде в качестве текстового файла через EFS-Web. Текстовый файл под названием "3923-34-PCT_ST25" имеет размер в байтах 76 кБайт, и он был записан 13 марта 2012 года. Информация, содержащаяся в текстовом файле, включена в настоящее описание в качестве ссылки в полном объеме согласно 37 CFR § 1.52(e)(5).
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, главным образом, относится к иммунотерапевтическим композициям на основе дрожжей и к способам профилактики и/или лечения злокачественных опухолей, характеризующихся экспрессией или сверхэкспрессией Brachyury.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Brachyury, также известный как "T", является мезодермальным фактором транскрипции и представителем комплекса генов T-box. Ген, кодирующий Brachyury (обозначаемый либо как ген T, либо как ген Brachyury, у человека) был первоначально идентифицирован в 1927 году Nadine Dobrovolskaïa-Zavadskaïa посредством мутации у мышей, которая влияла на длину хвоста и крестцовые позвонки у гетерозиготных животных. Ген Brachyury был клонирован у мышей в 1990 году Hermann и коллегами (Herrmann et al., 1990, Nature 343:617-622) и у человека в 1996 году Edwards и коллегами (Edwards et al., 1996, Genome Res. 6:226-223), которые также описали установленную аминокислотную последовательность Brachyury человека.
В качестве представителя семейства факторов транскрипции T-box, Brachyury содержит высоко консервативный мотив ДНК-связывающего домена, называемый "T-box" или T-доменом, который связывается с палиндромной консенсусной последовательностью. Было показано, что Brachyury, подобно другим белкам T-box, играет роль в раннем развитии, и является жизненно важным для формирования и дифференцировки задней мезодермы и развития осевых структур у позвоночных (см., например, Wilkinson et al., 1990, Nature 343(6259):657-659); Beddington et al., 1992, Development (Suppl.):157-165; Schulte-Merker et al., 1994, Development 120: 1009-1015; Kispert and Herrmann, 1994, Dev. Biol. 161:179-193; Showell et al., 2004, Dev Dyn 229:201-218). Позднее, Palena и коллеги продемонстрировали, что Brachyury экспрессируется в различных опухолевых тканях и злокачественных линиях человека, и показали, что пептиды Brachyury можно использовать для получения специфичных к Brachyury линий T-клеток у нормальных доноров и пациентов со злокачественной опухолью (Palena et al., 2007, Clin. Cancer Res. 13(8):2471-2478). Исследования Fernando et al. показали, что Brachyury стимулирует эпителиально-мезенхимальный переход (EMT) в опухолевых клетках человека, сообщая опухолевым клеткам мезенхимальный фенотип, а также способности к миграции и инвазии, одновременно ослабляя прогрессирование клеточного цикла опухолей (Fernando et al., 2010, J. Clin. Invest. 120(2):533-544). Таким образом, Brachyury вовлечен в метастатическое прогрессирование злокачественной опухоли.
Злокачественная опухоль является ведущей причиной смертности по всему миру и разработка эффективных способов терапии злокачественной опухоли продолжает быть одной из наиболее активных областей исследований и клинической разработки. Хотя было предложено множество инновационных подходов для лечения и профилактики злокачественной опухоли, многие злокачественные опухоли продолжают иметь высокий уровень смертности, и могут с трудом поддаваться лечению, или могут быть относительно неотвечающими на общепринятые способы терапии. Злокачественные опухоли, ассоциированные с экспрессией Brachyury, могут быть найдены в различных тканях, включая молочную железу, тонкий кишечник, желудок, почку, мочевой пузырь, матку, яичник, яичко, легкое, толстый кишечник и предстательную железу, и включают метастатические злокачественные опухоли и злокачественные опухоли поздней стадии. Кроме того, Brachyury экспрессируется в опухолях B-клеточного происхождения, таких как хронический лимфоцитарный лейкоз (CLL), трансформированные вирусом Эпштейна-Барр B-клетки, лимфома Беркитта и лимфома Ходжкина. Таким образом, Brachyury, по-видимому, играет роль в большом количестве злокачественных опухолей человека. Хотя Brachyury был предложен в качестве мишени для иммунотерапии злокачественной опухоли (см., например, Palena et al., выше, Fernando et al., выше, и WO 2008/106551), поскольку он является относительно новой мишенью при злокачественной опухоли, в данной области остается потребность в новых иммунотерапевтических продуктах, которые эффективно лечат и/или предупреждают злокачественные опухоли, ассоциированные с экспрессией или сверхэкспрессией Brachyury.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Один вариант осуществления изобретения относится к способу снижения, остановки, обращения вспять, замедления или предупреждения метастатического прогрессирования злокачественной опухоли у индивидуума со злокачественной опухолью. Способ включает стадию введения индивидууму со злокачественной опухолью, которая претерпевает метастатическое прогрессирование, имеет риск метастатического прогрессирования, или начинает, согласно прогнозам, претерпевать метастатическое прогрессирование, иммунотерапевтическую композицию, содержащую: (a) дрожжевой носитель; и (b) антиген злокачественной опухоли, содержащий по меньшей мере один антиген Brachyury. Другой вариант осуществления изобретения относится к применению иммунотерапевтической композиции, содержащей дрожжевой носитель и антиген злокачественной опухоли, содержащий по меньшей мере один антиген Brachyury, для снижения, остановки, обращения вспять или предупреждения метастатического прогрессирования злокачественной опухоли у индивидуума со злокачественной опухолью.
В одном аспекте этих вариантов осуществления изобретения Brachyury не выявляется в злокачественной опухоли индивидуума, когда композицию вводят впервые. В одном аспекте экспрессия Brachyury выявляется в злокачественной опухоли индивидуума, когда композицию вводят впервые. Индивидуум может иметь злокачественную опухоль стадии I, злокачественную опухоль стадии II, злокачественную опухоль стадии III или злокачественную опухоль стадии IV.
Другой вариант осуществления изобретения относится к способу предупреждения или замедления появления опухоли, экспрессирующей Brachyury. Способ включает стадию введения индивидууму иммунотерапевтической композиции, содержащей: (a) дрожжевой носитель; и (b) антиген злокачественной опухоли, содержащий по меньшей мере один антиген Brachyury. Другой вариант осуществления изобретения относится к применению иммунотерапевтической композиции, содержащей дрожжевой носитель и антиген злокачественной опухоли, содержащий по меньшей мере один антиген Brachyury, для предупреждения или замедления появления злокачественной опухоли, экспрессирующей Brachyury.
В одном аспекте этих вариантов осуществления злокачественная опухоль не выявляется у индивидуума. В одном аспекте индивидуум имеет высокий риск развития злокачественной опухоли (например, вследствие генетической предрасположенности). В одном аспекте индивидуум имеет предзлокачественный очаг повреждения.
В одном аспекте этих вариантов осуществления индивидуум имеет злокачественную опухоль, однако в злокачественной опухоли не выявляются злокачественные клетки, экспрессирующие Brachyury. В одном аспекте злокачественная опухоль еще не является метастазирующей. В одном аспекте злокачественная опухоль имеет высокий риск метастазирования. В одном аспекте индивидуум имеет злокачественную опухоль стадии I. В одном аспекте индивидуум имеет злокачественную опухоль стадии II.
Другой вариант осуществления изобретения относится к способу уменьшения или предупреждения устойчивости к химиотерапии или устойчивости к лучевой терапии опухолевых клеток у пациента со злокачественной опухолью. Способ включает стадии введения индивидууму со злокачественной опухолью, которому проводят химиотерапию и/или лучевую терапию, иммунотерапевтической композиции, содержащей: (a) дрожжевой носитель; и (b) антиген злокачественной опухоли, содержащий по меньшей мере один антиген Brachyury. Другой вариант осуществления изобретения относится к применению иммунотерапевтической композиции, содержащей дрожжевой носитель и антиген злокачественной опухоли, содержащий по меньшей мере один антиген Brachyury, для снижения или предупреждения устойчивости к химиотерапии или устойчивости к лучевой терапии опухолевых клеток у пациента со злокачественной опухолью. В одном аспекте этого варианта осуществления изобретения Brachyury не выявляется в злокачественной опухоли индивидуума, когда композицию вводят впервые. В одном аспекте экспрессия Brachyury выявляется в злокачественной опухоли, когда композицию вводят впервые.
Другой вариант осуществления изобретения относится к способу лечения злокачественной опухоли. Способ включает стадии: (a) введение индивидууму со злокачественной опухолью, у которого экспрессия Brachyury не выявляется, первой иммунотерапевтической композиции, содержащей дрожжевой носитель и первый антиген злокачественной опухоли, который не содержит антиген Brachyury; и (b) введение индивидууму до, одновременно или после введения первой иммунотерапевтической композиции второй иммунотерапевтической композиции, содержащей дрожжевой носитель и второй антиген злокачественной опухоли, содержащий антиген Brachyury. В одном аспекте способ дополнительно включает на стадии (a) введение одной или нескольких дополнительных иммунотерапевтических композиций, где каждая из одной или нескольких дополнительных иммунотерапевтических композиций содержит дополнительный антиген злокачественной опухоли. В одном аспекте любого из описанных выше вариантов осуществления антиген злокачественной опухоли выбран из: мутантного Ras, карциноэмбрионального антигена (CEA), MUC-1, EGFR, BCR-Abl, MART-1, MAGE-1, MAGE-3, GAGE, GP-100, MUC-2, PSMA, тирозиназы, TRP-1 (gp75), NY-ESO-1, TRP-2, TAG72, KSA, CA-125, PSA, HER-2/neu/c-erb/B2, hTERT, p73, B-RAF, антигена аденоматозного полипоза толстого кишечника (APC), Myc, белка фон Гиппеля-Ландау (VHL), Rb-1, Rb-2, рецептора андрогенов (AR), Smad4, MDR1, Flt-3, BRCA-1, BRCA-2, pax3-fkhr, ews-fli-1, HERV-H, HERV-K, TWIST, мезотелина и NGEP. В одном аспекте антиген злокачественной опухоли выбран из группы, состоящей из: мутантного Ras, карциноэмбрионального антигена (CEA) и MUC-1. Другой вариант осуществления изобретения относится к применению комбинации иммунотерапевтических композиций для лечения злокачественной опухоли, причем иммунотерапевтические композиции содержат: (a) первую иммунотерапевтическую композицию, содержащую дрожжевой носитель и первый антиген злокачественной опухоли, который не содержит антиген Brachyury; и (b) вторую иммунотерапевтическую композицию, содержащую дрожжевой носитель и второй антиген злокачественной опухоли, содержащий антиген Brachyury.
Другой вариант осуществления изобретения относится к способу лечения злокачественной опухоли. Способ включает стадии: (a) введение индивидууму со злокачественной опухолью первой иммунотерапевтической композиции, содержащей дрожжевой носитель и мутантный антиген Ras; (b) введение индивидууму согласно (a) второй иммунотерапевтической композиции, содержащей дрожжевой носитель и антиген, выбранный из группы, состоящей из карциноэмбрионального антигена (CEA) и муцина-1 (MUC-1); и (c) введение индивидууму (a) и (b) третьей иммунотерапевтической композиции, содержащей дрожжевой носитель и антиген Brachyury. В одном аспекте стадии введения в (a), (b) и (c) являются одновременными. Другой вариант осуществления изобретения относится к применению комбинации иммунотерапевтических композиций для лечения злокачественной опухоли, причем иммунотерапевтические композиции содержат: (a) первую иммунотерапевтическую композицию, содержащую дрожжевой носитель и мутантный антиген Ras; (b) вторую иммунотерапевтическую композицию, содержащую дрожжевой носитель и антиген, выбранный из группы, состоящей из карциноэмбрионального антигена (CEA) и муцина-1 (MUC-1); и (c) третью иммунотерапевтическую композицию, содержащую дрожжевой носитель и антиген Brachyury.
В любом из вариантов осуществления или аспектов изобретения, описанных выше или где-либо еще в настоящем описании, когда индивидуум имеет злокачественную опухоль или предзлокачественную опухоль, в одном аспекте изобретения индивидуума лечат или лечили другим способом терапии злокачественной опухоли. Например, такой способ терапии может включать, но не ограничиваться ими, химиотерапию, направленную терапию злокачественной опухоли, лучевую терапию, адоптивный перенос T-клеток и/или введение одной или нескольких дополнительных иммунотерапевтических композиций. В одном аспекте дополнительная иммунотерапевтическая композиция содержит дрожжевой носитель и второй антиген злокачественной опухоли, который не включает антиген Brachyury. Второй антиген злокачественной опухоли может включать, но не ограничиваться ими, мутантный Ras, карциноэмбриональный антиген (CEA), MUC-1, EGFR, BCR-Abl, MART-1, MAGE-1, MAGE-3, GAGE, GP-100, MUC-2, PSMA, тирозиназу, TRP-1 (gp75), NY-ESO-1, TRP-2, TAG72, KSA, CA-125, PSA, HER-2/neu/c-erb/B2, hTERT, p73, B-RAF, белок аденоматозного полипоза толстого кишечника (APC), Myc, белок фон Гиппеля-Ландау (VHL), Rb-1, Rb-2, рецептор андрогенов (AR), Smad4, MDR1, Flt-3, BRCA-1, BRCA-2, pax3-fkhr, ews-fli-1, HERV-H, HERV-K, TWIST, мезотелин и NGEP. В одном аспекте второй антиген злокачественной опухоли выбран из: мутантного Ras, карциноэмбрионального антигена (CEA) и MUC-1.
В одном аспекте любого из вариантов осуществления или аспектов изобретения, описанных выше или где-либо еще в настоящем описании, способ или применение снижают опухолевую нагрузку у индивидуума, повышают выживаемость индивидуума и/или ингибируют рост опухоли у индивидуума.
В одном аспекте любого из вариантов осуществления или аспектов изобретения, описанных выше или где-либо еще в настоящем описании, способ дополнительно включает хирургическое удаление опухоли из индивидуума.
В одном аспекте любого из вариантов осуществления или аспектов изобретения, описанных выше или где-либо еще в настоящем описании, злокачественная опухоль имеет происхождение из эпителиальных клеток. В одном аспекте злокачественная опухоль может включать, но не ограничиваться ими, рак молочной железы, рак тонкого кишечника, рак желудка, рак поджелудочной железы, рак почки, рак мочевого пузыря, рак тела матки, рак яичника, рак яичка, рак легкого, рак толстого кишечника, рак предстательной железы, хронический лимфоцитарный лейкоз (CLL), трансформированные вирусом Эпштейна-Барр B-клетки, лимфому Беркитта, лимфому Ходжкина или их метастатические злокачественные опухоли.
В одном аспекте любого из вариантов осуществления или аспектов изобретения, описанных выше или где-либо еще в настоящем описании, антиген Brachyury представляет собой полноразмерный Brachyury человека. В одном аспекте антиген Brachyury является неполноразмерным Brachyury. В одном аспекте антиген Brachyury имеет аминокислотную последовательность, соответствующую SEQ ID NO: 6, SEQ ID NO: 18, SEQ ID NO: 2, или аминокислотную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 6, SEQ ID NO: 18 или SEQ ID NO: 2. В одном аспекте антиген Brachyury содержит по меньшей мере от положения 1 или 2 вплоть до от положения 255 до C-конца SEQ ID NO: 6, SEQ ID NO: 18 или SEQ ID NO: 2. В одном аспекте антиген Brachyury содержит по меньшей мере от положения 1 или 2 вплоть до от положения 430 до C-конца SEQ ID NO: 6, SEQ ID NO: 18 или SEQ ID NO: 2. В одном аспекте антиген Brachyury содержит положения 246-254 SEQ ID NO: 6, SEQ ID NO: 18 или SEQ ID NO: 2. В одном аспекте антиген Brachyury содержит SEQ ID NO: 6, положения 2-435 SEQ ID NO: 6 или аминокислотную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 6. В одном аспекте антиген Brachyury содержит SEQ ID NO: 18, положения 2-435 SEQ ID NO: 18 или аминокислотную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 18. В одном аспекте антиген Brachyury содержит SEQ ID NO: 2, положения 2-435 SEQ ID NO: 2 или аминокислотную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 2. В одном аспекте антиген Brachyury содержит SEQ ID NO: 6, положения 2-435 SEQ ID NO: 6 или аминокислотную последовательность, которая по меньшей мере на 99% идентична SEQ ID NO: 6. В одном аспекте антиген Brachyury содержит SEQ ID NO: 18, положения 2-435 SEQ ID NO: 18 или аминокислотную последовательность, которая по меньшей мере на 99% идентична SEQ ID NO: 18. В одном аспекте антиген Brachyury содержит SEQ ID NO: 2, положения 2-435 SEQ ID NO: 2 или аминокислотную последовательность, которая по меньшей мере на 99% идентична SEQ ID NO: 2. В одном аспекте антиген злокачественной опухоли имеет длину по меньшей мере 25 аминокислот. В одном аспекте антиген Brachyury имеет длину по меньшей мере 25 аминокислот. В одном аспекте антиген Brachyury имеет длину более 30 аминокислот. В одном аспекте антиген злокачественной опухоли содержит два или более иммуногенных домена Brachyury.
В одном аспекте любого из вариантов осуществления или аспектов изобретения, описанных выше или где-либо еще в настоящем описании, антиген злокачественной опухоли представляет собой слитый белок. В одном аспекте слитый белок имеет аминокислотную последовательность, соответствующую SEQ ID NO: 8, или аминокислотную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 8. В одном аспекте слитый белок имеет аминокислотную последовательность, соответствующую SEQ ID NO: 20, или аминокислотную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 20.
Другой вариант осуществления изобретения относится к иммунотерапевтической композиции на основе дрожжей с Brachyury, где иммунотерапевтическая композиция содержит: (a) дрожжевой носитель; и (b) антиген, экспрессируемый дрожжевым носителем и содержащий по меньшей мере один антиген Brachyury, где антиген Brachyury содержит более 30 аминокислот аминокислотной последовательности, соответствующей SEQ ID NO: 6, SEQ ID NO: 18 или SEQ ID NO: 2. В одном аспекте антиген Brachyury содержит аминокислотную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 6, SEQ ID NO: 18 или SEQ ID NO: 2. В одном аспекте антиген содержит Brachyury от по меньшей мере положения 1 или 2 вплоть до от положения 255 до C-конца SEQ ID NO: 6, SEQ ID NO: 18 или SEQ ID NO: 2. В одном аспекте антиген Brachyury содержит от по меньшей мере положения 1 или 2 вплоть до от положения 430 до C-конца SEQ ID NO: 6, SEQ ID NO: 18 или SEQ ID NO: 2. В одном аспекте антиген Brachyury содержит положения 246-254 SEQ ID NO: 6, SEQ ID NO: 18 или SEQ ID NO: 2. В одном аспекте антиген Brachyury содержит SEQ ID NO: 6, положения 2-435 SEQ ID NO: 6 или аминокислотную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 6. В одном аспекте антиген Brachyury содержит SEQ ID NO: 18, положения 2-435 SEQ ID NO: 18 или аминокислотную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 18. В одном аспекте антиген Brachyury содержит SEQ ID NO: 2, положения 2-435 SEQ ID NO: 2 или аминокислотную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 2. В одном аспекте антиген Brachyury содержит SEQ ID NO: 6, положения 2-435 SEQ ID NO: 6, или аминокислотную последовательность, которая по меньшей мере на 99% идентична SEQ ID NO: 6. В одном аспекте антиген Brachyury содержит SEQ ID NO: 18, положения 2-435 SEQ ID NO: 18 или аминокислотную последовательность, которая по меньшей мере на 99% идентична SEQ ID NO: 18. В одном аспекте антиген Brachyury содержит SEQ ID NO: 2, положения 2-435 SEQ ID NO: 2 или аминокислотную последовательность, которая по меньшей мере на 99% идентична SEQ ID NO: 2. В одном аспекте антиген злокачественной опухоли представляет собой слитый белок. В одном аспекте слитый белок имеет аминокислотную последовательность, которая представляет собой SEQ ID NO: 8, или аминокислотную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 8. В одном аспекте слитый белок имеет аминокислотную последовательность SEQ ID NO: 20 или аминокислотную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 20. В одном аспекте дрожжевым носителем являются целые дрожжи. В одном аспекте целые дрожжи инактивированы нагреванием.
Другой вариант осуществления изобретения относится к иммунотерапевтической композиции на основе дрожжей с Brachyury, содержащей: (a) целые инактивированные дрожжи; и (b) слитый белок Brachyury, содержащий аминокислотную последовательность положений 2-435 SEQ ID NO: 6. Экспрессия слитого белка Brachyury находится под контролем промотора CUP1, слитый белок Brachyury экспрессируется дрожжами и композиция индуцирует специфичный к Brachyury T-клеточный ответ. В одном аспекте слитый белок содержит аминокислотную последовательность SEQ ID NO: 8.
Другой вариант осуществления изобретения относится к иммунотерапевтической композиции на основе дрожжей с Brachyury, содержащей: (a) целые инактивированные дрожжи; и (b) слитый белок Brachyury, содержащий аминокислотную последовательность положений 2-435 SEQ ID NO: 18. Экспрессия слитого белка Brachyury находится под контролем промотора CUP1, слитый белок Brachyury экспрессируется дрожжами и композиция индуцирует специфичный к Brachyury T-клеточный ответ. В одном аспекте слитый белок содержит аминокислотную последовательность SEQ ID NO: 20.
В одном аспекте любого из вариантов осуществления или аспектов изобретения, описанных выше или где-либо еще в настоящем описании, дрожжевым носителем являются целые дрожжи. В одном аспекте целые дрожжи являются убитыми. В одном аспекте целые дрожжи являются инактивированными нагреванием. В одном аспекте дрожжи экспрессируют антиген. В одном аспекте дрожжи взяты из рода, выбранного из группы, состоящей из: Saccharomyces, Candida, Cryptococcus, Hansenula, Kluyveromyces, Pichia, Rhodotorula, Schizosaccharomyces и Yarrowia. В одном аспекте дрожжи взяты из Saccharomyces. В одном аспекте дрожжи взяты из Saccharomyces cerevisiae.
В одном аспекте любого из вариантов осуществления изобретения, описанных выше или где-либо еще в настоящем описании, композицию составляют в фармацевтически приемлемом эксципиенте, пригодном для введения индивидууму.
Другой вариант осуществления изобретения относится к применению любой из иммунотерапевтических композиций на основе дрожжей с Brachyury, описанных в настоящем описании, для лечения заболевания. В одном аспекте заболевание представляет собой злокачественную опухоль. В одном аспекте заболевание ассоциировано с инфекционным агентом. В одном аспекте заболевание ассоциировано с вирусом или вирусной инфекции. Такой вирус может включать, но не ограничиваться ими, вирус Эпштейна-Барр (EBV).
Другой вариант осуществления изобретения относится к способу лечения или профилактики заболевания или состояния, ассоциированного с инфекцией вирусом Эпштейна-Барр (EBV). Способ включает стадию введения индивидууму любых из иммунотерапевтических композиций на основе дрожжей с Brachyury, описанных в настоящем описании.
Другой вариант осуществления изобретения относится к способу получения иммунотерапевтической композиции на основе дрожжей с Brachyury. Способ включает стадии: (a) культивирование дрожжей, которые трансформированы рекомбинантной молекулой нуклеиновой кислоты, кодирующей антиген Brachyury под контролем промотора CUP1, в подходящей среде в отсутствие CuSO4 до тех пор, пока дрожжи не достигнут середины логарифмической фазы роста; (b) индукция экспрессии антигена Brachyury в дрожжах путем добавления CuSO4 в среду; (c) культивирование дрожжей после стадии (b) в течение вплоть до 6-8 часов; и (d) сбор дрожжей. В одном аспекте дрожжи на стадии (a) культивируют до плотности клеток от 1,0 до 2,0 Д.Е. на миллилитр общего объема культуры. В одном аспекте дрожжи на стадии (a) культивируют для плотности клеток от 1,0 до 1,5 Д.Е. на миллилитр общего объема культуры. В одном аспекте дрожжи культивируют на стадиях (a)-(c) в среде, где pH поддерживается на уровне pH 5,5 или выше. В одном аспекте способ дополнительно включает стадию инактивации нагреванием дрожжей после стадии (d). Например, в одном аспекте дрожжи инактивируют нагреванием при приблизительно 56°C в течение приблизительно 1 часа. В следующем аспекте этого варианта осуществления дрожжи можно составлять для инъекции с фармацевтически приемлемым эксципиентом. В одном аспекте дрожжи взяты из Saccharomyces. В одном аспекте дрожжи взяты из Saccharomyces cerevisiae.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1A представлено оцифрованное изображение вестерн-блота, на котором показано выявление с помощью антитела против Brachyury экспрессии Brachyury в иммунотерапевтической композиции на основе дрожжей с Brachyury, в случае как среды U2, так и среды UL2.
На фиг.1B представлено оцифрованное изображение вестерн-блота, на котором показано выявление с помощью антитела против His экспрессиии Brachyury в иммунотерапевтической композиции на основе дрожжей с Brachyury, в случае как среды U2, так и среды UL2.
На фиг.2 представлено оцифрованное изображение вестерн-блота, демонстрирующее экспрессию Brachyury в иммунотерапевтической композиции на основе дрожжей с Brachyury, где варьировали плотность клеток при индукции антигеном и время до сбора после индукции антигеном.
На фиг.3A-3C представлены графики, на которых показано, что мононуклеарные клетки периферической крови (PBMC) от двух из трех здоровых доноров, обработанные дрожжами с Brachyury посредством двух циклов стимуляции с последующей обработкой пептидом Brachyury CTL, были способны генерировать CD8+ CTL, которые могли уничтожать клетки карциномы SW480 (положительные по HLA-A2/высокая экспрессия Brachyury), при минимальном лизисе клеток карциномы MCF7 (положительные по HLA-A2/низкая экспрессия Brachyury); (фиг.3A, донор 07706; фиг.3B, донор 17663; фиг.3C, донор 26532).
На фиг.4A представлен график, на котором показано, что специфичные к Brachyury T-клетки из PBMC здорового донора, стимулированные иммунотерапевтической композицией на основе дрожжей с Brachyury, специфически лизируют опухолевые клетки, которые имеют соответствующий MHC (SW480, положительные по HLA-A2/с высокой экспрессией Brachyury) относительно клеток карциномы H226 (отрицательные по HLA-A2/с высокой экспрессией Brachyury).
На фиг.4B представлен график, на котором показана экспрессия мРНК Brachyury относительно экспрессии мРНК контрольного гена (GAPDH) в клетках опухоли SW480 и H226, используемых в эксперименте, представленном на фиг.4A.
На фиг.5 представлен график, на котором показана пролиферация CD4+ T-клеток, выделенных из селезенки мышей, которых вакцинировали дрожжами с Brachyury (GI-6301, круги) или контрольными дрожжами (дрожжевой контроль, треугольники), в ответ на указанные дозы очищенного белка Brachyury или контрольного белка β-gal.
На фиг.6 представлен график, на котором показано, что введение иммунотерапевтической композиции на основе дрожжей с Brachyury (GI-6301, круги) по изобретению проявляет тенденцию в отношении уменьшения экспрессирующих Brachyury опухолей у мышей по сравнению с мышами, которым вводили дрожжи отдельно (без антигена Brachyury).
На фиг.7A и 7B представлены данные анализа способом проточной цитометрии, демонстрирующие, что специфическая с Brachyury линия T-клеток T-2-BR-A связывается со специфичным к Brachyury тетрамером HLA-A2 (фиг.7B) и не связывается с контрольным тетрамером (фиг.7A).
На фиг.8 представлены данные анализа способом проточной цитометрии, демонстрирующие экспрессию перфорина в специфичной к Brachyury линии T-клеток T-2-BR-A после стимуляции с помощью обработанных пептидом-агонистом Brachyury аутологичных B-клеток.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение, главным образом, относится к иммунотерапевтическим композициям на основе дрожжей и способам профилактики и/или лечения злокачественных опухолей, которые экспрессируют или сверхэкспрессируют Brachyury. Изобретение относится к применению иммунотерапевтической композиции на основе дрожжей (также называемой иммунотерапией на основе дрожжей), содержащей дрожжевой носитель и антигены Brachyury или их иммуногенные домены (также называемой в настоящем описании "иммунотерапией на основе дрожжей с Brachyury" или "иммунотерапевтическими композициями на основе дрожжей с Brachyury"). Авторы изобретения описывают в настоящем описании конструирование и получение новых иммунотерапевтических продуктов на основе дрожжей с Brachyury, и демонстрируют, что иммунотерапия на основе дрожжей с Brachyury увеличивает в количестве специфичные к Brachyury T-клетки, в том числе CD8+ CTL, от нормальных индивидуумов и пациентов со злокачественной опухолью. Кроме того, у мышей, иммунизированных иммунотерапевтическими композициями на основе дрожжей с Brachyury, формировались специфичные к Brachyury T-клеточные ответы in vivo, и у этих мышей ингибировался рост опухоли, экспрессирующей Brachyury. Взятые вместе, эти данные, представленные в настоящем описании, демонстрируют, что иммунотерапия на основе дрожжей с Brachyury пригодна для индукции специфичных к Brachyury клеточных иммунных ответов (CD4+ и CD8+) и для профилактики и лечения экспрессирующих Brachyury опухолей, обеспечивая новую терапию для профилактики и/или лечения метастатических опухолей и ассоциированных с ними состояний.
Иммунотерапевтические композиции на основе дрожжей с Brachyury, пригодные в рамках настоящего изобретения, уникальным образом адаптированы для эффективного нацеливания на злокачественные опухоли, экспрессирующие Brachyury, по нескольким причинам. Во-первых, Brachyury вовлечен в процессы EMT, и, таким образом, без связи с теорией, авторы изобретения полагают, что он играет роль в опухолях поздней стадии и метастатических опухолях. Таким образом, в одном аспекте изобретения иммунотерапия на основе дрожжей с Brachyury является эффективной в отношении нацеливания на опухолевые клетки до момента или в момент, когда они начинают приобретать подвижность и инвазировать другие ткани, тем самым предупреждая, ингибируя, останавливая, обращая вспять или замедляя возникновение метастатической злокачественной опухоли и/или прогрессирование злокачественной опухоли, и особенно метастатической злокачественной опухоли. Существует значительная потребность в эффективных способах лечения злокачественных опухолей поздней стадии, особенно метастатических злокачественных опухолей, которые могут иметь мало вариантов лечения после неуспеха общепринятой терапии злокачественной опухоли. Дрожжи с Brachyury обеспечивают новый подход для лечения таких злокачественных опухолей или для замедления, ингибирования, обращения вспять или предупреждения их всецело. Кроме того, иммунотерапию на основе дрожжей с Brachyury можно использовать для предупреждения или замедления метастазирования злокачественной опухоли или прогрессирования злокачественной опухоли у индивидуумов со злокачественной опухолью ранней стадии. В одном варианте осуществления терапия пригодна при злокачественных опухолях, которые имеют высокий уровень метастатического прогрессирования, и могут быть пригодны для остановки прогрессирования злокачественной опухоли. Более того, иммунотерапия на основе дрожжей с Brachyury пригодна у индивидуумов, которые имеют предраковый (предзлокачественный) очаг повреждения или опухоль, у индивидуумов, которые имеют высокий риск развития злокачественной опухоли, в частности злокачественной опухоли, которая имеет высокий уровень метастазирования, и даже у здоровых индивидуумов в качестве профилактического средства для предупреждения злокачественной опухоли, которое можно использовать совместно с другой профилактической иммунотерапией против злокачественной опухоли, как описано в настоящем описании.
Иммунотерапия на основе дрожжей с Brachyury также обеспечивает пользу индивидуумам, которым проводят другую терапию злокачественной опухоли, в том числе химиотерапию и лучевую терапию. Более конкретно, известно, что метастатические опухоли в некоторых случаях являются более устойчивыми к химиотерапии и/или лучевой терапии, чем первичные опухоли. Таким образом, иммунотерапевтические композиции на основе дрожжей с Brachyury по изобретению можно использовать для ингибирования или снижения или устранения устойчивости к химиотерапии или устойчивости к лучевой терапии, которая может появляться в метастатической злокачественной опухоли, путем ингибирования экспрессии Brachyury в злокачественной опухоли (и, тем самым, ингибирования антипролиферативных влияний), и композиции по изобретению могут усиливать эффективность химиотерапии или лучевой терапии у индивидуума.
Иммунотерапию на основе дрожжей с Brachyury также можно использовать для лечения состояний или заболеваний, ассоциированных с экспрессией Brachyury, которые могут быть неонкологическими по своей природе, или которые могут предшествовать злокачественной трансформации. Например, Brachyury может активироваться в клетках, которые инфицированы инфекционным агентом, например, вирусом, таким как вирус Эпштейна-Барр (EBV). Таким образом, иммунотерапию на основе дрожжей с Brachyury можно использовать для лечения или профилактики любого заболевания или состояния, ассоциированного с экспрессией Brachyury, включая, но не ограничиваясь ими, инфекционные заболевания, такие как вирусная инфекция, включая, но не ограничиваясь ими, ассоциированные с EBV состояния (например, мононуклеоз).
Иммунотерапию на основе дрожжей с Brachyury также легко адаптировать для применения дополнительных опухолевых антигенов в той же дрожжевой композиции, или для применения в комбинации с другими иммунотерапевтическими средствами на основе дрожжей, которые нацелены на другие опухолевые антигены (последовательно или одновременно) или другие иммунотерапевтическими средствами и способами лечения/терапии злокачественной опухоли. Таким образом, иммунотерапию на основе дрожжей с Brachyury можно адаптировать к типу злокачественной опухоли, стадии злокачественной опухоли, степени злокачественной опухоли, антигенам, экспрессируемым опухолью, и общему медицинскому состоянию индивидуума (т.е. терапию легко персонализировать), и для индивидуума, который уже имеет злокачественную опухоль, ее можно модифицировать по мере прогрессирования злокачественной опухоли у индивидуума для обеспечения максимальной эффективности различных стадий опухоли. Иммунотерапия на основе дрожжей с Brachyury обеспечивает возможность создания продуманных и эффективных индивидуализированных подходов для широкого профилактического и/или терапевтического лечения широкого диапазона злокачественных опухолей.
Композиции на основе дрожжей с Brachyury, описанные в настоящем описании, могут индуцировать врожденные иммунные ответы, а также адаптивные иммунные ответы против антигена-мишени (Brachyury), включая CD4-зависимые ответы TH17 и TH1 T-клеток и антигенспецифические ответы CD8+ T-клеток, которые включают ответы цитотоксических T-лимфоцитов (CTL), во всех случаях без использования экзогенных адъювантов, цитокинов или других иммуностимулирующих молекул, многие из которых имеют проблемы токсичности. Кроме того, иммунотерапевтические композиции на основе дрожжей с Brachyury ингибируют количества и/или функциональность регуляторных T-клеток (Treg), тем самым усиливая ответы эффекторных T-клеток, которые обычно могут подавляться, например, присутствием опухоли. Более того, полагают, что по сравнению с иммунотерапевтическими композициями, которые иммунизируют путем формирования антительных ответов, антигенспецифические, всеобъемлющие и мощные клеточные иммунные ответы, индуцируемые иммунотерапией на основе дрожжей с Brachyury, являются особенно эффективными при нацеливании на опухолевые клетки. Действительно, многочисленные исследования показали, что иммунотерапевтические подходы усиливаются, когда на опухолевые клетки осуществляют нацеливание CD8+ CTL, которые распознают пептиды опухоли в контексте молекул MHC класса I.
Иммунотерапия на основе дрожжей с Brachyury обладает высокой способностью активировать антигенпредставляющие клетки, и обладает уникальной способностью перекрестно стимулировать иммунный ответ, формируя ответы CD8+ CTL, которые, как правило, эффективны против опухолей, даже несмотря на условия, которые в ином случае могут быть подавляющей окружающей средой. Поскольку для этого типа иммунотерапии используется естественная способность антигенпредставляющей клетки представлять соответствующие иммуногены, необязательно знать точную идентичность эпитопов CTL или эпитопов MHC класса II из Brachyury для получения эффективного иммунотерапевтического средства в соответствии с настоящим изобретением. В действительности, в одной иммунотерапевтической композиции на основе дрожжей с Brachyury можно осуществлять нацеливание на множество эпитопов CD4+ и CD8+ T-клеток, и, таким образом, иммунотерапевтические средства на основе дрожжей с Brachyury по изобретению не ограничиваются применением коротких пептидов и в действительности применение более длинных полипептидов и слитых белков в этих композициях является эффективным. Таким образом, использование иммунотерапии на основе дрожжей с Brachyury устраняет использование алгоритмов и сложных формул для идентификации предполагаемых T-клеточных эпитопов.
Более того, поскольку Brachyury не экспрессируется в большинстве нормальных (неопухолевых) тканей и, как правило, сверхэкспрессируется в опухолевых клетках, любой из "нецелевых" эффектов, связанных с нормальными тканями, не вызывает беспокойства. Как упоминалось выше, дрожжи с Brachyury можно эффективно использовать в протоколе иммунизации (профилактическом или терапевтическом) без применения экзогенных адъювантов, иммуностимулирующих средств или молекул, костимуляторных молекул или цитокинов, хотя такие средства могут быть включены, если желательно. Более того, иммунотерапию на основе дрожжей с Brachyury можно проводить неоднократно без снижения эффективности, что может быть проблематичным в случае других типов иммунотерапии.
Композиции по изобретению
Один вариант осуществления настоящего изобретения относится к иммунотерапевтической композиции на основе дрожжей, которую можно использовать для профилактики и/или лечения злокачественных опухолей, характеризующихся экспрессией или сверхэкспрессией Brachyury (включая злокачественные опухоли, которые первоначально могут не содержать клетки, экспрессирующие поддающийся выявлению Brachyury, но которые могут или будут содержать клетки, экспрессирующие Brachyury, на более поздних стадиях развития злокачественной опухоли). Композиция представляет собой иммунотерапевтическую композицию на основе дрожжей с Brachyury, содержащую: (a) дрожжевой носитель; и (b) антиген злокачественной опухоли, содержащий один или несколько антиген(ов) Brachyury и/или его иммуногенный домен(ы). Антиген Brachyury или его иммуногенный домен наиболее часто экспрессируется в качестве рекомбинантного белка дрожжевым носителем (например, интактными дрожжами или дрожжевым сферопластом, который необязательно можно далее преобразовывать в дрожжевой цитопласт, дрожжевую оболочку или дрожжевой мембранный экстракт или его фракцию), хотя одним вариантом осуществления изобретения является то, что одним или несколькими антигенами Brachyury нагружают дрожжевой носитель или иным образом формируют их комплекс, связывают, смешивают или вводят с дрожжевым носителем, как описано в настоящем описании, для получения композиции по настоящему изобретению.
"Иммунотерапевтическая композиция на основе дрожжей с Brachyury" представляет собой конкретный тип "иммунотерапевтической композиции на основе дрожжей", которая содержит по меньшей мере один антиген Brachyury или его иммуногенный домен. Выражение "иммунотерапевтическая композиция на основе дрожжей" можно использовать взаимозаменяемо с "иммунотерапевтическим продуктом на основе дрожжей ", "иммунотерапевтической композицией на основе дрожжей", "композицией на основе дрожжей", "иммунотерапевтическим средством на основе дрожжей", "вакциной на основе дрожжей" или производными этих выражений. "Иммунотерапевтическая композиция" представляет собой композицию, которая индуцирует иммунный ответ, достаточный для достижения по меньшей мере одной терапевтической пользы у индивидуума. Как используют в рамках изобретения иммунотерапевтическая композиция на основе дрожжей относится к композиции, которая включает компонент в виде дрожжевого носителя и которая индуцирует иммунный ответ, достаточный для достижения по меньшей мере одной терапевтической пользы у индивидуума. Более конкретно, иммунотерапевтическая композиция на основе дрожжей представляет собой композицию, которая включает компонент в виде дрожжевого носителя и, как правило, антигенный компонент, и может вызывать или индуцировать иммунный ответ, такой как клеточный иммунный ответ, включая, но не ограничиваясь этим, опосредуемый T-клетками иммунный ответ. В одном аспекте иммунотерапевтическая композиция на основе дрожжей, пригодная для изобретения, способна индуцировать опосредуемый CD8+ и/или CD4+ T-клетками иммунный ответ и в одном аспекте опосредуемый CD8+ и CD4+ T-клетками иммунный ответ, в частности, против антигена-мишени (например, антигена злокачественной опухоли). CD4+ иммунный ответ может включать иммунные ответы TH1, иммунные ответы TH2, иммунные ответы TH17 или любую комбинацию указанных выше. Иммунотерапевтические средства на основе дрожжей, в частности, способны генерировать ответы TH1 и TH17. CD8+ иммунный ответ может включать ответ цитотоксических T-лимфоцитов (CTL), и иммунотерапевтические средства на основе дрожжей способны генерировать такие ответы. В одном аспекте иммунотерапевтическая композиция на основе дрожжей модулирует количество и/или функциональность регуляторных T-клеток (Treg) у индивидуума. Иммунотерапию на основе дрожжей также можно модифицировать для стимуляции одного типа ответа относительно другого, например, путем добавления цитокинов, антител и/или модулирования процесса производства дрожжей. Необязательно, иммунотерапевтическая композиция на основе дрожжей способна индуцировать гуморальный иммунный ответ.
Иммунотерапевтические композиции на основе дрожжей с Brachyury по изобретению могут быть либо "профилактическими", либо "терапевтическими". Когда их предоставляют профилактически, композиции по настоящему изобретению предоставляют до развития или выявления развития злокачественной опухоли, которая экспрессирует Brachyury, с целью предупреждения, ингибирования или замедления развития опухолей, экспрессирующих Brachyury; и/или предупреждения, ингибирования или замедления миграции опухоли и/или инвазии опухоли в другие ткани (метастазов) и/или, главным образом, предупреждения или ингибирования прогрессирования злокачественной опухоли у индивидуума. Как описано в настоящем описании, Brachyury экспрессируется в нескольких злокачественных опухолях, включая злокачественные опухоли поздней стадии, и было показано, что он вовлечен в процесс EMT, который является процессом, ассоциированным с инвазивностью и миграцией опухолей, таких как метастатические злокачественные опухоли. Таким образом, профилактические композиции можно вводить индивидуумам, которые кажутся свободными от злокачественной опухоли (здоровым или нормальным индивидуумам), индивидуумам с предраковыми (предзлокачественными) очагами повреждения, а также индивидуумам со злокачественной опухолью, но у которых Brachyury еще не был выявлен (т.е. до экспрессии Brachyury опухолевыми клетками в злокачественной опухоли). Индивидуумы, которые имеют риск развития злокачественной опухоли, в частности, злокачественной опухоли, с которой обычно ассоциированы экспрессия Brachyury и/или метастазирование, можно лечить профилактически композицией по изобретению. При терапевтическом предоставлении иммунотерапевтические композиции предоставляют индивидууму с экспрессирующей Brachyury злокачественной опухолью с целью смягчения злокачественной опухоли, как например, путем снижения опухолевой нагрузки у индивидуума; ингибирования роста опухоли у индивидуума; повышения выживаемости индивидуума; предупреждения, ингибирования, обращения вспять или замедления возникновения миграции опухоли и/или инвазии опухоли в другие ткани (метастатическая злокачественная опухоль) и/или предупреждения, ингибирования, обращения вспять или замедления прогрессирования злокачественной опухоли у индивидуума. В одном аспекте иммунотерапию на основе дрожжей с Brachyury используют терапевтически для ингибирования, снижения или устранения устойчивости к химиотерапии или устойчивости к лучевой терапии, которая может возникать в метастатической опухоли, путем ингибирования экспрессии Brachyury в злокачественной опухоли, и композиции по изобретению могут усиливать эффективность химиотерапии или лучевой терапии у индивидуума.
Как правило, иммунотерапевтическая композиция на основе дрожжей с Brachyury включает дрожжевой носитель и по меньшей мере один антиген злокачественной опухоли, включающий антиген Brachyury или его иммуногенный домен, где антиген злокачественной опухоли экспрессируется посредством, связан с, нагружен на или смешан с дрожжевым носителем. В некоторых вариантах осуществления антиген злокачественной опухоли, антиген Brachyury или его иммуногенный домен предоставлен в качестве слитого белка. Несколько белков Brachyury и слитых белков, пригодных для применения в композициях и способах по изобретению, описаны ниже. В некоторых вариантах осуществления антиген злокачественной опухоли и антиген Brachyury представляют собой один и тот же элемент. В некоторых вариантах осуществления антиген злокачественной опухоли включает другие антигены, включающие другие антигены злокачественной опухоли, в дополнение к антигену Brachyury. В одном аспекте изобретения слитый белок, пригодный в качестве антигена злокачественной опухоли, может включать два или более антигенов, например, антиген Brachyury и другой антиген злокачественной опухоли, который не является антигеном Brachyury, или два различных антигена Brachyury. В одном аспекте слитый белок может включать два или более иммуногенных доменов одного или нескольких антигенов, таких как два или более иммуногенных домена антигена Brachyury, или два или более эпитопов одного или нескольких антигенов, таких как два или более эпитопов антигена Brachyury.
В соответствии с настоящим изобретением, дрожжевой носитель, используемый в иммунотерапевтической композиции на основе дрожжей с Brachyury, представляет собой любую дрожжевую клетку (например, целую или неизмененную клетку) или ее производное (см. ниже), которую можно использовать совместно с одним или несколькими антигенами, их иммуногенными доменами или их эпитопами в композиции по изобретению (например, терапевтической или профилактической композиции). Таким образом, дрожжевой носитель может включать, но не ограничиваться ими, живой неизмененный (целый) дрожжевой микроорганизм (т.е. дрожжевую клетку, имеющую все ее компоненты, включая клеточную стенку), убитый (погибший) или инактивированный дрожжевой микроорганизм, или производные неизмененных дрожжей, включающие: сферопласт дрожжей (т.е. дрожжевая клетка, лишенная клеточной стенки), цитопласт дрожжей (т.е. дрожжевая клетка, лишенная клеточной стенки и ядра), дрожжевую оболочку (т.е. дрожжевая клетка, лишенная клеточной стенки, ядра и цитоплазмы), субклеточный дрожжевой мембранный экстракт или его фракцию (также называемые дрожжевыми мембранными частицами и ранее субклеточной дрожжевой частицей), любую другую дрожжевую частицу или препарат клеточной стенки дрожжей.
Сферопласты дрожжей, как правило, получают ферментативным расщеплением клеточной стенки дрожжей. Такой способ описан, например, в Franzusoff et al., 1991, Meth. Enzymol. 194, 662-674., включенной в настоящее описание в качестве ссылки в полном объеме.
Цитопласты дрожжей, как правило, получают энуклеацией клеток дрожжей. Такой способ описан, например, в Coon, 1978, Natl. Cancer Inst. Monogr. 48, 45-55, включенной в настоящее описание в качестве ссылки в полном объеме.
Дрожжевые оболочки, как правило, получают повторным уплотнением клетки, в которой увеличили проницаемость, или лизированной клетки, и они могут, но не должны, содержать по меньшей мере некоторые органеллы этой клетки. Такой способ описан, например, в Franzusoff et al., 1983, J. Biol. Chem. 258, 3608-3614 и Bussey et al., 1979, Biochim. Biophys. Acta 553, 185-196, все из которых включены в настоящее описание в качестве ссылки в полном объеме.
Дрожжевая мембранная частица (субклеточный дрожжевой мембранный экстракт или его фракция) относится к дрожжевой мембране, которая лишена природного ядра или цитоплазмы. Частица может иметь любой размер, включая размеры в диапазоне от размера природной дрожжевой мембраны до микрочастиц, получаемых обработкой ультразвуком или другими способами разрушения мембран, известными специалистам в данной области, с последующим повторным уплотнением. Способ получения экстрактов субклеточных дрожжевых мембран описан, например, в Franzusoff et al., 1991, Meth. Enzymol. 194, 662-674. Также можно использовать фракции мембранных частиц дрожжей, которые содержат части дрожжевых мембран и, когда антиген или другой белок экспрессировался рекомбинантно дрожжами перед получением дрожжевых мембранных частиц, антиген или другой представляющий интерес белок. Антигены или другие представляющие интерес белки могут содержаться внутри мембраны, на любой поверхности мембраны или их комбинациях (т.е. белок может быть как внутри, так и снаружи мембраны и/или он может проходить через мембрану дрожжевой мембранной частицы). В одном варианте осуществления дрожжевая мембранная частица представляет собой рекомбинантную дрожжевую мембранную частицу, которая может быть неизмененной, разрушенной, или разрушенной и повторно уплотненной дрожжевой мембраной, которая включает по меньшей мере один желаемый антиген или другой представляющий интерес белок на поверхности мембраны или по меньшей мере частично погруженный в мембрану.
Примером препарата клеточной стенки дрожжей является препарат выделенных клеточных стенок дрожжей, содержащих антиген на их поверхности или по меньшей мере частично погруженных в клеточную стенку, так что препарат клеточной стенки дрожжей при введении животному стимулирует желаемый иммунный против целевого заболевания.
Для получения дрожжевого носителя по настоящему изобретению можно использовать любой штамм дрожжей. Дрожжи представляют собой одноклеточные микроорганизмы, которые принадлежат одному из трех классов: Ascomycetes, Basidiomycetes и Fungi Imperfecti. Одним из факторов, учитываемых при выборе типа дрожжей для применения в качестве иммунного модулятора, является патогенность дрожжей. В одном варианте осуществления дрожжи представляют собой непатогенный штамм, такой как Saccharomyces cerevisiae. Выбор непатогенного штамма дрожжей минимизирует какие-либо неблагоприятные эффекты у индивидуума, которому вводят дрожжевой носитель. Однако можно использовать патогенные дрожжи, если патогенность дрожжей можно нейтрализовать любыми способами, известными специалисту в данной области (например, мутантные штаммы). В соответствии с одним аспектом настоящего изобретения используют непатогенные штаммы.
Роды штаммов дрожжей, которые можно использовать в рамках изобретения, включают, но не ограничиваются ими, Saccharomyces, Candida (которые могут быть патогенными), Cryptococcus, Hansenula, Kluyveromyces, Pichia, Rhodotorula, Schizosaccharomyces и Yarrowia. В одном аспекте роды дрожжей выбирают из Saccharomyces, Candida, Hansenula, Pichia или Schizosaccharomyces, и в одном аспекте используют Saccharomyces. Виды штаммов дрожжей, которые можно использовать в рамках изобретения, включают, но не ограничиваются ими, Saccharomyces cerevisiae, Saccharomyces carlsbergensis, Candida albicans, Candida kefyr, Candida tropicalis, Cryptococcus laurentii, Cryptococcus neoformans, Hansenula anomala, Hansenula polymorpha, Kluyveromyces fragilis, Kluyveromyces lactis, Kluyveromyces marxianus вариант lactis, Pichia pastoris, Rhodotorula rubra, Schizosaccharomyces pombe и Yarrowia lipolytica. Должно быть понятно, что ряд этих видов включают различные подвиды, типы, подтипы и т.д., которые, как подразумевается, включены в упомянутые выше виды. В одном аспекте виды дрожжей, используемые в изобретении, включают S. cerevisiae, C. albicans, H. polymorpha, P. pastoris и S. pombe. S. cerevisiae пригодны, поскольку ими относительно легко манипулировать и они являются "общепризнанными безопасными" или "GRAS" для применения в качестве пищевых добавок (GRAS, предложенное FDA Правило 62FR18938, 17 апреля 1997 года). Одним вариантом осуществления настоящего изобретения являются штамм дрожжей, который способен реплицировать плазмиды до особенно высокого количества копий, такой как штамм S. cerevisiae cir. Этот штамм S. cerevisiae является одним из таких штаммов, которые способны поддерживать экспрессирующие векторы, которые позволяют экспрессию одного или нескольких антигена(ов)-мишени и/или антигенного слитого белка(ов) и/или других белков, подлежащих экспрессии на высоких уровнях. Другим штаммом, пригодным в рамках настоящего изобретения, является Saccharomyces cerevisiae W303α. Кроме того, в рамках настоящего изобретения можно использовать любые мутантные штаммы дрожжей, включая штаммы дрожжей, которые проявляют сниженные посттрансляционные модификации экспрессируемых антигенов-мишеней или других белков, такие как мутации в ферментах, которые увеличивают N-связанное гликозилирование.
Иммунотерапевтическая композиция на основе дрожжей с Brachyury по изобретению включает по меньшей мере один антиген злокачественной опухоли, включающий антиген Brachyury. В соответствии с настоящим изобретением общее применение в настоящем описании термина "антиген" относится: к любой части белка (например, пептид, неполный белок, полноразмерный белок), где белок является встречающимся в природе или имеет синтетическое происхождение или сконструирован, к клеточной композиции (целая клетка, клеточный лизат или разрушенные клетки), к организму (целый организм, лизат или разрушенные клетки) или к углеводу или другой молекуле или их части. Антиген может индуцировать антигенспецифический иммунный ответ (например, гуморальный и/или клеточно-опосредуемый иммунный ответ) против тех же или сходных антигенов, которые встречаются элементом иммунной системы (например, T-клетками, антителами).
Антиген может быть настолько малым, как отдельный эпитоп, отдельный иммуногенный домен, или более крупным, и он может включать несколько эпитопов или иммуногенных доменов. По существу, размер антигена может быть настолько малым, как приблизительно 8-11 аминокислот (т.е. пептид) и настолько большим как: полноразмерный белок, мультимер, слитый белок, химерный белок, целая клетка, целый микроорганизм или любая их часть (например, фрагменты белков (полипептиды), лизаты целых клеток или экстракты микроорганизмов). Антигены, пригодные в иммунотерапевтическом средстве на основе дрожжей с Brachyury по настоящему изобретению, представляют собой пептиды, полипептиды, полноразмерные белки, мультимеры, слитые белки и химерные белки. Кроме того, антигены могут включать углеводы, которые можно нагружать на дрожжевой носитель или на композицию по изобретению. Будет понятно, что в некоторых вариантах осуществления (например, когда антиген экспрессируется дрожжевым носителем из рекомбинантной молекулы нуклеиновой кислоты), антиген представляет собой белок, слитый белок, химерный белок или их фрагмент, а не целую клетку или микроорганизм. Для экспрессии в дрожжах антиген имеет минимальный размер, который может быть рекомбинантно экспрессирован в дрожжах, если антиген представляет собой целый белок, предназначенный для экспрессии дрожжами, и, как правило, он имеет по меньшей мере или более 25 аминокислот в длину, или по меньшей мере или более 26, по меньшей мере или более 27, по меньшей мере или более 28, по меньшей мере или более 29, по меньшей мере или более 30, по меньшей мере или более 31, по меньшей мере или более 32, по меньшей мере или более 33, по меньшей мере или более 34, по меньшей мере или более 35, по меньшей мере или более 36, по меньшей мере или более 37, по меньшей мере или более 38, по меньшей мере или более 39, по меньшей мере или более 40, по меньшей мере или более 41, по меньшей мере или более 42, по меньшей мере или более 43, по меньшей мере или более 44, по меньшей мере или более 45, по меньшей мере или более 46, по меньшей мере или более 47, по меньшей мере или более 48, по меньшей мере или более 49, или по меньшей мере или более 50 аминокислот в длину, или по меньшей мере или более 25-50 аминокислот в длину, или по меньшей мере или более 30-50 аминокислот в длину или по меньшей мере или более 35-50 аминокислот в длину, или по меньшей мере или более 40-50 аминокислот в длину, или по меньшей мере или более 45-50 аминокислот в длину, хотя могут экспрессироваться белки меньшего размера и значительно большего размера (например, сотни аминокислот в длину или даже несколько тысяч аминокислот в длину). В одном аспекте можно экспрессировать полноразмерный белок или белок, который лишен от 1 до 20 аминокислот с N- и/или C-конца. Слитые белки и химерные белки также являются антигенами, которые могут экспрессироваться в рамках изобретения. "Антиген-мишень" представляет собой антиген, на который специфически нацелена иммунотерапевтическая композиция по изобретению (т.е. антиген, против которого является желательной индукция иммунного ответа). "Антиген злокачественной опухоли" представляет собой антиген, который включает по меньшей мере один антиген, который ассоциирован со злокачественной опухолью, такой как антиген, экспрессируемый опухолевой клеткой, так что нацеливание на антиген также обеспечивает нацеливание на злокачественную опухоль. Антиген злокачественной опухоли может включать один или несколько антигенов из одного или нескольких белков, включая один или несколько ассоциированных с опухолью белков. "Антиген Brachyury" представляет собой антиген, происходящий, сконструированный или полученный из белка Brachyury.
При указании на стимуляцию иммунного ответа, термин "иммуноген" является разновидностью термина "антиген", и, таким образом, в некоторых случаях, его можно использовать взаимозаменяемо с термином "антиген". Иммуноген, как используют в рамках изобретения, описывает антиген, который индуцирует гуморальный и/или клеточно-опосредуемый иммунный ответ (т.е. является иммуногенным), так что введение иммуногена индивидууму индуцирует антигенспецифический иммунный ответ против того же или сходных антигенов, которые встречает иммунная система индивидуума. В одном варианте осуществления иммуноген индуцирует клеточно-опосредуемый иммунный ответ, включая CD4+ T-клеточный ответ (например, TH1, TH2 и/или TH17) и/или CD8+ T-клеточный ответ (например, CTL-ответ).
"Иммуногенный домен" данного антигена может представлять собой любую часть, фрагмент или эпитоп антигена (например, пептидный фрагмент или субъединца или эпитоп антитела или другой конформационный эпитоп), которые содержат по меньшей мере один эпитоп, который может действовать в качестве иммуногена при введении животному. Таким образом, иммуногенный домен больше, чем единичная аминокислота, и обладает размером, по меньшей мере достаточным для того, чтобы он содержал по меньшей мере один эпитоп, который может действовать в качестве иммуногена. Например, единичный белок может содержать множество различных иммуногенных доменов. Иммуногенные домены не обязательно должны представлять собой линейные последовательности в белке, как например, в случае гуморального иммунного ответа, где предусматриваются конформационные домены.
Эпитоп определяют в настоящем описании как единичный иммуногенный участок в данном антигене, который является достаточным для индукции иммунного ответа, когда он предоставляется иммунной системе в контексте соответствующих костимуляторных сигналов и/или активированных клеток иммунной системы. Иными словами, эпитоп является частью антигена, которая в действительности распознается компонентами иммунной системы, и также он может называться антигенной детерминантой. Специалистам в данной области будет понятно, что T-клеточные эпитопы отличаются по размеру и составу от B-клеточных или антительных эпитопов, и что эпитопы, представляемые через каскад MHC класса I, отличаются по размеру и структурным признакам от эпитопов, представляемых через каскад MHC класса II. Например, T-клеточные эпитопы, представляемые молекулами MHC класса I, как правило, имеют длину от 8 до 11 аминокислот, в то время как эпитопы, представляемые молекулами MHC класса II, менее ограничены по длине и могут иметь длину от 8 аминокислот вплоть до 25 аминокислот или более. Кроме того, T-клеточные эпитопы имеют предсказанные структурные характеристики, зависящие от конкретных молекул MHC, связываемых эпитопом. Эпитопы могут представлять собой эпитопы с линейной последовательностью или конформационные эпитопы (консервативные связывающие области). Большинство антител распознают конформационные эпитопы.
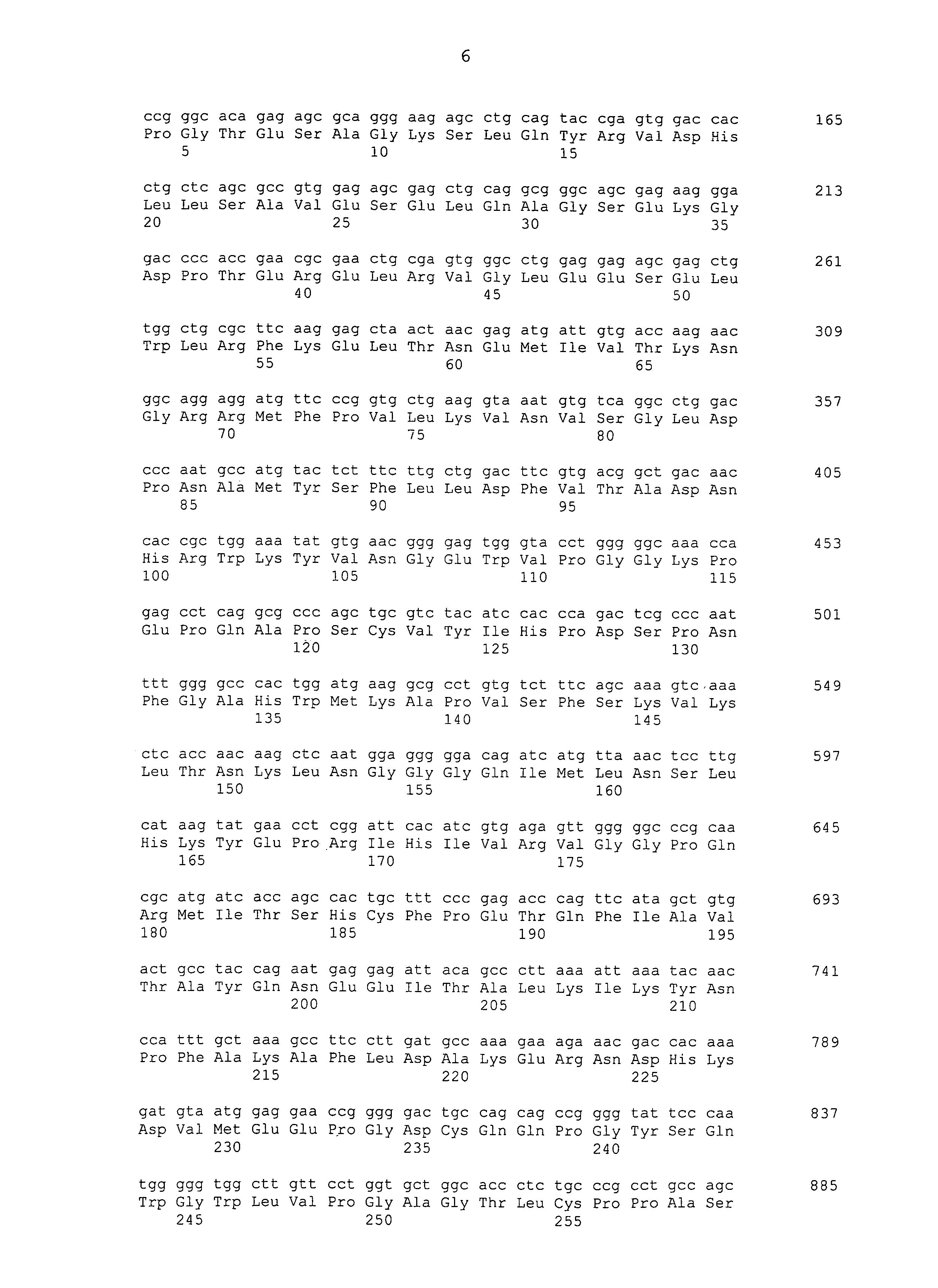
Brachyury (который также может обозначаться как "T") является высоко консервативным белком среди множества различных видов животных и он представляет собой фактор транскрипции, который содержит домен "T-box" или "T-домен", мотив ДНК-связывающего домена, являющийся общим для нескольких различных белков, в совокупности называемых семейством белков T-box. Brachyury человека впервые был клонирован в 1996 году (Edwards et al., выше). Одна нуклеотидная последовательность, кодирующая Brachyury человека, представлена в настоящем описании как SEQ ID NO: 1, которая представляет собой последовательность мРНК, полученную из GENBANK® под номером доступа № NM_003181 (GI:19743811). SEQ ID NO: 1 кодирует белок Brachyury человека из 435 аминокислот, аминокислотная последовательность которого представлена в настоящем описании как SEQ ID NO: 2 (также находящаяся в GENBANK® под номером доступа № NP_003172; GI:4507339).
Другой белок Brachyury человека, описанный в настоящем описании, представляет собой вариант белка Brachyury человека, соответствующий SEQ ID NO: 2, и он имеет аминокислотную последовательность SEQ ID NO: 6. SEQ ID NO: 6, также белок из 435 аминокислот, кодируется нуклеотидной последовательностью, представленной в настоящем описании с помощью SEQ ID NO: 5. SEQ ID NO: 6 приблизительно на 99% идентична SEQ ID NO: 2 на протяжении всей длины белка. SEQ ID NO: 6 отличается от SEQ ID NO: 2 в положении 177 (Asp против Gly, соответственно), положении 368 (Thr против Ser, соответственно) и положении 409 (Asn против Asp, соответственно).
Другой белок Brachyury человека, описанный в настоящем описании, является агонистом белка Brachyury человека, соответствующего SEQ ID NO: 2 или SEQ ID NO: 6. Как в общем используется в настоящем описании, "агонист" представляет собой соединение или средство, включающее, но не ограничивающееся ими, низкомолекулярные соединения, белки, пептиды, антитела, соединения, связывающиеся с нуклеиновыми кислотами и т.д., которое связывается с рецептором или лигандом и вызывает или запускает ответ, которое может включать средства, которые имитируют или усиливают действие встречающегося в природе вещества, которое связывается с рецептором или лигандом. Когда его используют в контексте антигена Brachyury по изобретению, антиген-"агонист" или белок-"агонист" относится к антигену или белку, который содержит по меньшей мере один эпитоп-агонист T-клеток, который также может быть обозначен как "мимотоп". Пептид-мимотоп представляет собой пептид, который имитирует структуру эпитопа дикого типа, и в качестве агониста мимотоп имитирует или усиливает действие (биологическую функцию) природного эпитопа. Например, аминокислотная последовательность SEQ ID NO: 12 (WLLPGTSTL) представляет собой T-клеточный эпитоп белка Brachyury дикого типа. Аминокислотная последовательность SEQ ID NO: 13 (WLLPGTSTV) представляет собой мимотоп или агонист T-клеточного эпитопа SEQ ID NO: 12.
Один антиген-агонист Brachyury человека представлен в настоящем описании как SEQ ID NO: 18. SEQ ID NO: 18 представляет собой белок из 435 аминокислот, который кодируется нуклеотидной последовательностью, представленной в настоящем описании как SEQ ID NO: 17. SEQ ID NO: 18 идентична SEQ ID NO: 6, за исключением замены лейцина в положении 254 SEQ ID NO: 6 на валин в SEQ ID NO: 18. Эта замена создает эпитоп-агонист T-клеток в SEQ ID NO: 18 в положениях 246-254, который, как полагают без связи с теорией, индуцирует усиленные T-клеточные ответы против Brachyury по сравнению с эпитопом дикого типа (положения с 246 по 254 SEQ ID NO: 6).
Положения с 41 по 223 любой из SEQ ID NO: 2, SEQ ID NO: 6 или SEQ ID NO: 18 соответствуют ДНК-связывающему домену T-box Brachyury человека, и домен T-box в других последовательностях Brachyury, включая последовательности Brachyury из других видов, можно легко идентифицировать путем сравнения с этими последовательностями. Как используют в рамках изобретения, указание на домен T-box любого белка Brachyury, описанного в настоящем описании или известного в данной области и используемого в рамках изобретения, может включать дополнительные 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 последовательно расположенных аминокислот последовательности Brachyury на N-конце и/или C-конце определенного домена T-box (например, на любой стороне от положений 41-223 SEQ ID NO: 2, 6 или 18). Brachyury человека, включающий два белка Brachyury человека, описанных в настоящем описании, также содержит различные CD4+ и CD8+ T-клеточные эпитопы. Такие эпитопы описаны, например, в WO 2008/106551 и включают эпитоп CD8+ CTL, WLLPGTSTL (также обозначаемый в настоящем описании как Tp2, SEQ ID NO: 12), в положениях 246-254 SEQ ID NO: 2 или SEQ ID NO: 6. Как рассмотрено выше, SEQ ID NO: 18 содержит эпитоп-агонист из SEQ ID NO: 12, представленный в настоящем описании как SEQ ID NO: 13.
Brachyury человека имеет очень высокую гомологию с Brachyury из других видов животных и, таким образом, можно использовать последовательности Brachyury из других организмов для получения иммунотерапевтической композиции на основе дрожжей с Brachyury по изобретению, в частности, где эти последовательности являются идентичными, по существу гомологичными, и индуцируют эффективный иммунный ответ против антигена-мишени (например, нативный Brachyury, экспрессируемый опухолевой клеткой). Например, Brachyury мыши, который первоначально был клонирован Hermann и коллегами в 1990 году (Hermann et al., выше) приблизительно на 85% идентичен Brachyury человека на нуклеотидном уровне и приблизительно на 91% идентичен на уровне аминокислот. Что касается Brachyury из других животных, на уровне аминокислот Brachyury человека на 99,5% идентичен Brachyury из Pan troglodytes, на 90,1% идентичен Brachyury из Canis lupus familiaris, на 88,5% идентичен Brachyury из Bos Taurus, на 92,2% идентичен Brachyury из Rattus norvegicus, и на 80,9% идентичен Brachyury из Gallus gallus. В пределах аминокислот 1-223 Brachyury, который содержит домен T-box, Brachyury мыши и человека отличаются только двумя аминокислотами (в положениях 26 и 96). Нуклеотидная последовательность, кодирующая Brachyury мыши, представлена в настоящем описании как SEQ ID NO: 3, которая представляет собой последовательность мРНК, полученную из GENBANK® под номером доступа № NM_009309 (GI:118130357). SEQ ID NO: 3 кодирует белок Brachyury мыши из 436 аминокислот, аминокислотная последовательность которого представлена в настоящем описании в качестве SEQ ID NO: 4. Положения 41-223 SEQ ID NO: 4 соответствуют ДНК-связывающему домену T-box Brachyury мыши.
В одном варианте осуществления изобретения антиген Brachyury содержит или состоит из аминокислотной последовательности, соответствующей SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 18, или по меньшей мере одного ее иммуногенного домена. В одном варианте осуществления антиген Brachyury содержит или состоит из двух, трех, четырех, пяти или более иммуногенных доменов Brachyury. В одном варианте осуществления изобретения антиген Brachyury содержит или состоит из аминокислотной последовательности, соответствующей аминокислотным положениям с 1 или 2 по одну из последних 25 аминокислот на C-конце SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6 или SEQ ID NO: 18 (т.е. по любое из положений 441-435 SEQ ID NO: 2 или SEQ ID NO: 6 или SEQ ID NO: 18, или по любое из положений 442-436 SEQ ID NO: 4). Другой антиген Brachyury, пригодный в рамках изобретения, также включает по меньшей мере аминокислотные положения 1-223 Brachyury (например, положения 1-223 SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6 или SEQ ID NO: 18) или положения 41-223 Brachyury (например, положения 41-223 SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6 или SEQ ID NO: 18). Другой антиген Brachyury, пригодный в рамках изобретения, включает по меньшей мере от положений аминокислот 1-85 до положений от 255 до C-конца SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6 или SEQ ID NO: 18. Другой антиген Brachyury, пригодный в рамках изобретения, включает по меньшей мере от положений аминокислот 1-85 до от положения 430 до C-конца SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6 или SEQ ID NO: 18. Другой антиген Brachyury, пригодный в рамках изобретений, включает по меньшей мере от положений аминокислот 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 до от положения 255 до C-конца SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6 или SEQ ID NO: 18.
В соответствии с любым вариантом осуществления настоящего изобретения указание на "полноразмерный" белок (или полноразмерный функциональный домен или полноразмерный иммунологический домен) включает полноразмерную аминокислотную последовательность белка или функционального домена или иммунологического домена, как описано в настоящем описании или как в ином случае известно или описано для общедоступной последовательности. Белок или домен, который является "практически полноразмерным", который также является типом гомолога белка, отличается от полноразмерного белка или домена вставкой или делецией или пропуском 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот с N- и/или C-конца такого полноразмерного белка или полноразмерного домена. В качестве примера, несколько слитых белков, описанных в настоящем описании, содержат "практически полноразмерный" антиген Brachyury, поскольку в антигене пропущен метионин в положении 1 и заменен N-концевой пептид. Общее указание на белок или домен или антиген может включать как полноразмерные, так и практически полноразмерные белки, а также их гомологи.
В одном аспекте любых вариантов осуществления, связанных с антигеном Brachyury, антиген злокачественной опухоли или антиген Brachyury имеет минимальный размер, достаточный для того, чтобы обеспечить экспрессию антигена дрожжами. Для экспрессии в дрожжах белок, как правило, имеет длину по меньшей мере приблизительно 25 аминокислот, хотя в дрожжах могут экспрессироваться белки меньшего размера, и могут экспрессироваться значительно более крупные белки. Например, антиген Brachyury, пригодный в рамках изобретения, представляет собой фрагмент белка Brachyury, который может экспрессироваться рекомбинантно дрожжами и который содержит по меньшей мере один иммуногенный домен Brachyury, который может включать по меньшей мере один иммуногенный домен любой из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6 или SEQ ID NO: 18. В одном аспекте такой антиген имеет длину по меньшей мере 25 аминокислот и содержит по меньшей мере один иммуногенный домен Brachyury. В одном аспекте такой антиген имеет длину более 30 аминокислот и содержит по меньшей мере один иммуногенный домен Brachyury. В одном аспекте такой антиген имеет длину по меньшей мере 25-50 аминокислот и содержит по меньшей мере один иммуногенный домен Brachyury. В одном аспекте такой антиген имеет длину по меньшей мере 30-50 аминокислот и содержит по меньшей мере один иммуногенный домен Brachyury. В одном аспекте такой антиген имеет длину по меньшей мере 35-50 аминокислот и содержит по меньшей мере один иммуногенный домен Brachyury. В одном аспекте такой антиген имеет длину по меньшей мере 40-50 аминокислот и содержит по меньшей мере один иммуногенный домен Brachyury. В одном аспекте такой антиген имеет длину по меньшей мере 45-50 аминокислот и содержит по меньшей мере один иммуногенный домен Brachyury. В одном варианте осуществления антиген Brachyury, пригодный в рамках настоящего изобретения, имеет длину по меньшей мере 25 аминокислот или по меньшей мере: 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 205, 210, 215, 220, 225, 230, 235, 240, 245, 250, 255, 260, 265, 270, 275, 280, 285, 290, 295, 300, 305, 310, 315, 320, 325, 330, 335, 340, 345, 350, 355, 360, 365, 370, 375, 380, 385, 390, 395, 400, 405, 410, 415, 420, 425 или 430 аминокислот, что может включать любой фрагмент с по меньшей мере любой из этих длин из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6 или SEQ ID NO: 18.
В одном аспекте антиген Brachyury содержит один или несколько эпитопов CTL, которые могут включать две или более копий любого одного, двух, трех или более из эпитопов CTL, описанных в настоящем описании. В одном аспекте антиген Brachyury содержит один или несколько эпитопов CD4+ T-клеток. В одном аспекте антиген Brachyury содержит один или несколько эпитопов CTL и один или несколько эпитопов CD4+ T-клеток. В одном аспекте T-клеточный эпитоп представляет собой эпитоп-агонист.
В одном аспекте антиген Brachyury содержит аминокислотную последовательность WLLPGTSTL (SEQ ID NO: 12, также соответствующая положениям 245-254 SEQ ID NO: 2 или SEQ ID NO: 6). В одном аспекте антиген Brachyury содержит аминокислотную последовательность WLLPGTSTV (SEQ ID NO: 13, также соответствующая положениям 245-254 SEQ ID NO: 18). В одном аспекте аминокислота в положении 4 либо SEQ ID NO: 12, либо SEQ ID NO: 13 (пролин или P в этих последовательностях) замещена серином (S), треонином (T), изолейцином (I) или валином (V).
В одном аспекте антиген Brachyury содержит аминокислотную последовательность SQYPSLWSV (SEQ ID NO: 14). В одном аспекте аминокислота в положении 2 SEQ ID NO: 14 (глутамин или Q в этой последовательность) заменена лейцином (L). В одном аспекте аминокислота в положении 4 SEQ ID NO: 14 (пролин или P в этой последовательности) заменена серином (S), треонином (T), лейцином (L) или валином (V). В одном аспекте аминокислота в положении 7 SEQ ID NO: 14 (триптофан или W в этой последовательности) заменена валином (V), лейцином (L), изолейцином (I), серином (S) или треонином (T). В одном аспекте аминокислота в положении 9 SEQ ID NO: 14 (валин или V в этой последовательности) заменена лейцином (L). Изобретением предусматривает антиген, содержащий последовательность, имеющую любую комбинацию одной или нескольких из этих замен в SEQ ID NO: 14.
В одном аспекте антиген Brachyury содержит аминокислотную последовательность RLIASWTPV (SEQ ID NO: 15). В одном аспекте аминокислота в положении 1 SEQ ID NO: 15 (аргинин или R в этой последовательности) заменена на тирозин (Y) или триптофан (W). В одном аспекте аминокислота в положении 6 SEQ ID NO: 15 (триптофан или W в этой последовательности) заменена на валин (V), лизин (L), изолейцин (I), серин (S) или треонин (T). Изобретение предусматривает антиген, содержащий последовательность, имеющую комбинацию одной или обеих из этих замен в SEQ ID NO: 15.
В одном аспекте антиген Brachyury содержит аминокислотную последовательность AMYSFLLDFV (SEQ ID NO: 16). В одном аспекте аминокислота в положении 2 SEQ ID NO: 16 (метионин или M в этой последовательности) заменена на лейцин (L).
В одном варианте осуществления изобретения антиген Brachyury содержит, по существу состоит или состоит из слитого белка, имеющего аминокислотную последовательность SEQ ID NO: 8. Слитый белок SEQ ID NO: 8 представляет собой единый полипептид со следующими элементами последовательности, слитыми в рамке считывания от N-конца к C-концу: (1) N-концевой пептид, сообщающий устойчивость к протеасомной деградации и стабилизирующий экспрессию в дрожжах (положения 1-6 SEQ ID NO: 8); (2) антиген Brachyury человека, состоящий из положений 2-435 SEQ ID NO: 6 (положений 7-440 SEQ ID NO: 8); и (3) гексагистидиновая метка (положения 441-446 SEQ ID NO: 8). Аминокислотная последовательность SEQ ID NO: 8 кодируется полинуклеотидной последовательностью SEQ ID NO: 7.
В другом варианте осуществления изобретения антиген Brachyury содержит, по существу состоит или состоит из слитого белка, имеющего аминокислотную последовательность SEQ ID NO: 10. Слитый белок SEQ ID NO: 10 представляет собой единый полипептид со следующими элементами последовательности, слитыми в рамке считывания от N-конца к C-концу: (1) N-концевой пептид, придающий устойчивость к протеасомной деградации и стабилизирующий экспрессию в дрожжах (положения 1-6 SEQ ID NO: 10); (2) антиген Brachyury мыши, состоящий из положений 2-436 SEQ ID NO: 4 (положения 7-441 SEQ ID NO: 10); и (3) гексагистидиновая метка (положения 442-447 SEQ ID NO: 10). Аминокислотная последовательность SEQ ID NO: 10 кодируется полинуклеотидной последовательностью SEQ ID NO: 9.
В другом варианте осуществления изобретения антиген Brachyury содержит, по существу состоит или состоит из слитого белка, имеющего аминокислотную последовательность SEQ ID NO: 20. Слитый белок SEQ ID NO: 20 представляет собой единый полипептид со следующими элементами последовательности, слитыми в рамке считывания от N-конца к C-концу: (1) N-концевой пептид, придающий устойчивость к протеасомной деградации и стабилизирующий экспрессию (положения 1-6 SEQ ID NO: 20, пептидная последовательность, также представленная в настоящем описании как SEQ ID NO: 11); 2) аминокислоты 2-435 SEQ ID NO: 18 (положения 7-440 SEQ ID NO: 20), SEQ ID NO: 18, соответствующая полноразмерному белку-агонисту Brachyury человека; и (3) гексагистидиновая метка (положения 441-446 SEQ ID NO: 20). Эпитоп-агонист (SEQ ID NO: 13) расположен в положениях 251-259 SEQ ID NO: 20 (положения 246-254 SEQ ID NO: 18). Аминокислотная последовательность SEQ ID NO: 20 кодируется полинуклеотидной последовательностью SEQ ID NO: 19.
Антиген Brachyury, пригодный в рамках настоящего изобретения, также включает белки, имеющие аминокислотную последовательность, которая по меньшей мере на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности любого из белков или антигенов Brachyury, описанных в настоящем описании, на протяжении полной длины белка или в отношении их определенного фрагмента или домена (например, иммунологический домен или функциональный домен (домен с по меньшей мере одним видом биологической активности)), который образует часть белка. Например, домен белка Brachyury, описанный в настоящем описании, включает домен T-box. Иммунологический домен подробно описан выше.
В некоторых аспектах изобретения можно вносить аминокислотные инсерции, делеции и/или замены в одну, две, три, четыре, пять, шесть, семь, восемь, девять, десять или более аминокислот белка Brachyury дикого типа или эталонного белка Brachyury, при условии, что полученный белок Brachyury, когда его используют в качестве антигена в иммунотерапевтической композиции на основе дрожжей с Brachyury по изобретению, индуцирует иммунный ответ против нативного белка Brachyury в качестве белка Brachyury дикого типа или эталонного белка Brachyury, который может включать усиленный иммунный ответ, сниженный иммунный ответ или по существу сходный иммунный ответ. Например, изобретение включает применение антигенов-агонистов Brachyury, которые могут включать один или несколько T-клеточных эпитопов, подвергнутых мутации для усиления T-клеточного ответа против агониста Brachyury, как например, путем повышения авидности или аффинности эпитопа в отношении молекулы MHC или в отношении T-клеточного рецептора, который распознает эпитоп в контексте представления MHC. Таким образом, агонисты Brachyury могут повышать мощность или эффективность T-клеточного ответа против нативного Brachyury, экспрессируемого опухолевой клеткой. Антиген Brachyury, имеющий аминокислотную последовательность SEQ ID NO: 18, является неограничивающим примером агониста Brachyury (или антигена Brachyury, содержащего эпитоп-агонист).
Кроме того, N-концевые экспрессируемые последовательности и C-концевые метки, такие как N-концевые экспрессируемые последовательности и C-концевые метки, описанные выше в отношении слитых белков SEQ ID NO: 8, SEQ ID NO: 10 или SEQ ID NO: 20, являются необязательными, но могут быть выбраны из нескольких различных последовательностей, описанных где-либо еще в настоящем описании, для повышения или способствования экспрессии, стабильности и/или обеспечения идентификации и/или очистки белка. Также, многие различные промоторы, пригодные для применения в дрожжах, известны в данной области. Более того, короткие промежуточные линкерные последовательности (например, пептиды из 1, 2, 3, 4 или 5 аминокислот) можно встраивать между частями слитого белка, содержащими антиген Brachyury, для различных целей, включая внесение участков ферментов рестрикции, способствующих клонированию, в качестве участков для расщепления протеазами фагосом хозяина, для ускорения процессинга белка или антигена и для манипулирования конструкциями.
Необязательно, белки, включая слитые белки, которые используют в качестве компонента иммунотерапевтической композиции на основе дрожжей с Brachyury по изобретению, получают с использованием антигенных конструкций, которые особенно пригодны для повышения или стабилизации экспрессии гетерологичных антигенов в дрожжах. В одном варианте осуществления желаемый антигенный белок(белки) или пептид(ы) слиты на их N-конце с: (a) конкретным синтетическим пептидом, который стабилизирует экспрессию слитого белка в дрожжевом носителе или препятствует посттрансляционной модификации слитого белка (такие пептиды подробно описаны, например, в публикации патента США № 2004-0156858 A1, опубликованной 12 августа 2004, включенной в настоящее описание в качестве ссылки в полном объеме); (b) по меньшей мере частью эндогенного дрожжевого белка, включая, но не ограничиваясь ими, лидерную последовательность альфа-фактора дрожжей, где партнер по слиянию обеспечивает увеличенную стабильность экспрессии белка в дрожжах и/или препятствует посттрансляционной модификации белков дрожжевыми клетками (такие белки также подробно описаны, например, в публикации патента США № 2004-0156858 A1, выше); и/или (c) по меньшей мере частью дрожжевого белка, которая вызывает экспрессию слитого белка на поверхности дрожжей (например, белок Aga, более подробно описанный в настоящем описании). Кроме того, настоящее изобретение необязательно относится к применению пептидов, которые слиты с C-концом кодирующей антиген конструкции, в частности для применения в выборе и идентификации белка. Такие пептиды включают, но не ограничиваются ими, любой синтетический или природный пептид, такой как пептидная метка (например, 6X His или гексапептид) или любая другая короткая эпитопная метка. Пептиды, связанные с C-концом антигена согласно изобретению, можно использовать с N-концевыми пептидами, рассмотренными выше, или без них, и наоборот.
В одном варианте осуществления синтетический пептид, пригодный в слитом белке, подлежащем экспрессии в дрожжах, связан с N-концом антигена, причем пептид состоит из по меньшей мере двух положений аминокислот, которые являются гетерологичными для антигена, где пептид стабилизирует экспрессию слитого белка в дрожжевом носителе или препятствует посттрансляционной модификации экспрессированного слитого белка. Синтетический пептид и N-концевая часть антигена вместе образуют слитый белок, который удовлетворяет следующим требованиям: (1) аминокислотный остаток в первом положении слитого белка представляет собой метионин (т.е. первая аминокислота в синтетическом пептиде представляет собой метионин); (2) аминокислотный остаток во втором положении слитого белка не является глицином или пролином (т.е. вторая аминокислота в синтетическом пептиде не является глицином или пролином); (3) ни одно из положений аминокислот 2-6 слитого белка не является метионином (т.е. аминокислоты в положениях 2-6, являющиеся частью синтетического пептида или белка, если синтетический пептид короче 6 аминокислот, не включают метионин); и (4) ни одна из аминокислот в положениях 2-6 слитого белка не является лизином или аргинином (т.е. аминокислоты в положениях 2-6, являющиеся частью синтетического пептида или белка, если синтетический пептид короче 5 аминокислот, не включают лизин или аргинин). Синтетический пептид может иметь длину только две аминокислоты, однако в одном аспекте он составляет 2-6 аминокислот (включая 3, 4, 5 аминокислот) и он может быть длинней 6 аминокислот, в целых числах, вплоть до приблизительно 200 аминокислот, 300 аминокислот, 400 аминокислот, 500 аминокислот или более.
В одном варианте осуществления слитый белок содержит аминокислотную последовательность M-X2-X3-X4-X5-X6, где M представляет собой метионин; где X2 представляет собой любую аминокислоту, за исключением глицина, пролина, лизина или аргинина; где X3 представляет собой любую аминокислоту, за исключением метионина, лизина или аргинина; где X4 представляет собой любую аминокислоту, за исключением метионина, лизина или аргинина; где X5 представляет собой любую аминокислоту, за исключением метионина, лизина или аргинина; и где X6 представляет собой любую аминокислоту, за исключением метионина, лизина или аргинина. В одном варианте осуществления остаток X6 представляет собой пролин. Иллюстративная синтетическая последовательность, которая повышает стабильность экспрессии антигена в дрожжевой клетке и/или препятствует посттрансляционной модификации белка в дрожжах, включает последовательность M-A-D-E-A-P (представленная в настоящем описании как SEQ ID NO: 11). В дополнение к увеличенной стабильности продукта экспрессии, этот партнер по слиянию, по-видимому, не оказывает отрицательного влияния на иммунный ответ против иммунизирующего антигена в конструкции. Кроме того, синтетические слитые пептиды можно конструировать для обеспечения эпитопа, который может распознаваться селектирующим агентом, таким как антитело.
В одном аспекте изобретения дрожжевой носитель подвергают манипулированию, так чтобы антиген экспрессировался или обеспечивался путем доставки или перемещения экспрессированного белкового продукта, частично или полностью, на поверхности дрожжевого носителя (внеклеточная экспрессия). Одним способом осуществления этого аспекта изобретения является применение спейсера для помещения одного или нескольких белка(ов) на поверхности дрожжевого носителя. Например, можно использовать спейсер для создания слитого белка из антигена(ов) или другого представляющего интерес белка, который нацеливает антиген(ы) или другой представляющий интерес белок на клеточную стенку дрожжей. Например, одним таким белком, который можно использовать для нацеливания на другие белки, является дрожжевой белок (например, белок клеточной стенки 2 (cwp2), белок Aga2, Pir4 или Flo1), который обеспечивает нацеливание антигена(ов) или другого белка к клеточной стенке дрожжей, чтобы антиген или другой белок были расположены на поверхности дрожжей. Для спейсера можно использовать белки, отличные от дрожжевых белков; однако для любого спейсера наиболее желательным является наличие иммуногенного ответа, направленного против антигена-мишени, а не против спейсерного белка. По существу, если для спейсера использовать другие белки, тогда спейсерный белок, который используют, не должен генерировать такой значительный иммунный ответ на сам спейсерный белок, так чтобы преобладал иммунный ответ на антиген(ы)-мишень. Специалист в данной области должен стремиться к незначительному иммунному ответу на спейсерный белок относительно иммунного ответа на антиген(ы)-мишень. Спейсер можно конструировать так, чтобы он имел участки расщепления (например, участки расщепления протеазой), которые позволяют легкое удаление или процессинг антигена из дрожжей, если желательно. Можно использовать любой известный способ определения величины иммунного ответа (например, продукция антител, литические анализы и т.д.), и они хорошо известны специалисту в данной области.
Другим способом помещения антигена(ов)-мишени или других белков на поверхность дрожжей является использование сигнальных последовательностей, таких как гликозилфосфатидилинозитол (GPI), для заякоривания мишени на клеточной стенке дрожжей. Альтернативно помещение можно проводить путем присоединения сигнальных последовательностей, которые направляют антиген(ы) или другие представляющие интерес белки на секреторный путь через перемещение в эндоплазматическую сеть (ER), так чтобы антиген связывался с белком, который связан с клеточной стенкой (например, cwp).
В одном аспекте спейсерный белок представляет собой белок дрожжей. Белок дрожжей может состоять из от приблизительно двух до приблизительно 800 аминокислот дрожжевого белка. В одном варианте осуществления дрожжевой белок составляет приблизительно от 10 до 700 аминокислот. В другом варианте осуществления дрожжевой белок составляет приблизительно от 40 до 600 аминокислот. Другие варианты осуществления изобретения включают дрожжевой белок, составляющий по меньшей мере 250 аминокислот, по меньшей мере 300 аминокислот, по меньшей мере 350 аминокислот, по меньшей мере 400 аминокислот, по меньшей мере 450 аминокислот, по меньшей мере 500 аминокислот, по меньшей мере 550 аминокислот, по меньшей мере 600 аминокислот или по меньшей мере 650 аминокислот. В одном варианте осуществления дрожжевой белок имеет длину по меньшей мере 450 аминокислот. Другим учитываемым фактором для оптимизации экспрессии антигена на поверхности, если она является желательной, является то, должна ли комбинация антигена и спейсера экспрессироваться в качестве мономера или качестве димера или в качестве тримера, или еще большего количества элементов, связанных вместе. Это применение мономеров, димеров, тримеров и т.д. обеспечивает надлежащее расположение в пространстве и сворачивание антигена, так чтобы некоторая часть антигена, или весь антиген, экспонировалась на поверхности дрожжевого носителя так, чтобы он был более иммуногенным.
Применение дрожжевых белков может стабилизировать экспрессию слитых белок в дрожжевом носителе, препятствует посттрансляционной модификации экспрессированного слитого белка и/или нацеливает слитый белок в конкретный компартмент у дрожжей (например, для экспрессии на клеточной поверхности дрожжей). Для доставки на секреторный путь дрожжей иллюстративные белки для применения включают, но не ограничиваются ими: Aga (включая, но не ограничиваясь ими, Aga1 и/или Aga2); SUC2 (инвертаза дрожжей); сигнальную лидерную последовательность альфа-фактора; CPY; Cwp2p вследствие его локализации и удержания на клеточной стенке; гены BUD вследствие локализации на почке дрожжевой клетки в ходе первоначальной фазы образования дочерней клетки; Flo1p; Pir2p и Pir4p.
Можно использовать другие последовательности для нацеливания, удержания и/или стабилизации белка в других частях дрожжевого носителя, например, в цитозоле или митохондриях или эндоплазматической сети или ядре. Примеры подходящего дрожжевого белка, который можно использовать для любого из описанных выше вариантов осуществления, включают, но не ограничиваются ими, продукты генов TK, AF, SEC7; фосфоенолпируваткарбоксикиназу PCK1, фосфоглицерокиназу PGK и триозофосфатизомеразы TPI вследствие репрессии их экспрессии при наличии глюкозы и локализации в цитозоле; белки теплового шока SSA1, SSA3, SSA4, SSC1, экспрессия которых индуцируются и которые являются более термостабильными при воздействии на клетки тепловой обработки; митохондриальный белок CYC1 для импорта в митохондрии; ACT1.
Способы получения дрожжевых носителей и экспрессии, комбинирования и/или связывания дрожжевых носителей с антигенами и/или другими представляющими интерес белками и/или агентами для получения иммунотерапевтических композиций на основе дрожжей, охватываются изобретением.
В соответствии с настоящим изобретением, термин "комплекс дрожжевой носитель-антиген комплекс" или "комплекс дрожжи-антиген" используют, главным образом, для описания любой ассоциации дрожжевого носителя с антигеном и его можно использовать взаимозаменяемо с "иммунотерапевтической композицией на основе дрожжей", когда такую композицию используют для индукции иммунного ответа, как описано выше. Такая ассоциация включает экспрессию антигена дрожжами (рекомбинантные дрожжи), введение антигена в дрожи, физическое связывание антигена с дрожжами и смешение дрожжей и антигена вместе, как например, в буфере или другом растворе или составе. Эти типы комплексов подробно описаны ниже.
В одном варианте осуществления клетку дрожжей, используемую для получения дрожжевого носителя, трансфицируют гетерологичной молекулой нуклеиновой кислоты, кодирующей белок (например, антиген) так чтобы белок экспрессировался клеткой дрожжей. Такие дрожжи также обозначаются в настоящем описании как рекомбинантные дрожжи или рекомбинантный дрожжевой носитель. Затем клетку дрожжей можно составлять с фармацевтически приемлемым эксципиентом и вводить прямо пациенту, хранить для последующего введения, или можно ей нагружать дендритную клетку в виде целой клетки. Дрожжевую клетку также можно убивать, или ее можно преобразовать, например, путем формирования дрожжевых сферопластов, цитопластов, оболочек или субклеточных частиц, любой из которых можно впоследствии хранить, вводить или нагружать ими производное дендритной клетки. Сферопласты дрожжей также можно прямо трансфицировать рекомбинантной молекулой нуклеиновой кислоты (например, сферопласт получают из целых дрожжей, а затем трансфицируют) для получения рекомбинантного сферопласта, который экспрессирует антиген. Клетки дрожжей или сферопласты дрожжей, которые рекомбинантным путем экспрессируют антиген(ы), можно использовать для получения дрожжевого носителя, содержащего дрожжевой цитопласт, дрожжевую оболочку, или дрожжевую мембранную частицу или частицу клеточной стенки дрожжей, или их фракцию.
Как правило, дрожжевой носитель и антиген(ы) и/или другие агенты можно ассоциировать любым способом, описанным в настоящем описании. В одном аспекте дрожжевой носитель нагружен внутриклеточно антигеном(ами) и/или агентом(ами). В другом аспекте антиген(ы) и/или агент(ы) ковалентно или нековалентно связан с дрожжевым носителем. В другом аспекте дрожжевой носитель и антиген(ы) и/или агент(ы) ассоциированы путем смешения. В другом аспекте и в одном варианте осуществления антиген(ы) и/или агент(ы) экспрессируются рекомбинантно дрожжевым носителем или дрожжевой клеткой или дрожжевым сферопластом, из которых происходит дрожжевой носитель.
Количество антигенов и/или других белков, подлежащих продуцированию дрожжевым носителем по настоящему изобретению, представляет собой любое количество антигенов и/или других белков, которые могут в разумных пределах продуцироваться дрожжевым носителем, и, как правило, оно находится в диапазоне от по меньшей мере одного до по меньшей мере приблизительно 6 или более, включая от приблизительно 2 до приблизительно 6 антигенов и/или других белков.
Экспрессию антигена или другого белка в дрожжевом носителе по настоящему изобретению проводят с использованием способов, известных специалистам в данной области. В кратком изложении, молекулу нуклеиновой кислоты, кодирующую по меньшей мере один желаемый антиген или другой белок, встраивают в экспрессирующий вектор так, чтобы молекула нуклеиновой кислоты была функционально связана с последовательностью контроля транскрипции для того, чтобы она была способна осуществлять либо конститутивную, либо регулируемую экспрессию молекулы нуклеиновой кислоты после трансформации в дрожжевую клетку хозяина. Молекулы нуклеиновых кислот, кодирующие один или несколько антигенов и/или других белков, могут представлять собой один или несколько экспрессирующих векторов, функционально связанных с одной или несколькими последовательностями контроля экспрессии. Особенно важными последовательностями контроля экспрессии являются последовательности, которые контролируют инициацию экспрессии, такие как промоторы и вышележащие активирующие последовательности. В рамках настоящего изобретения можно использовать любой подходящий дрожжевой промотор и множество таких промоторов известно специалистам в данной области. Промоторы для экспрессии в Saccharomyces cerevisiae включают, но не ограничиваются ими, промоторы генов, кодирующих следующие дрожжевые белки: алкогольдегидрогеназа I (ADH1) или II (ADH2), CUP1, фосфоглицераткиназа (PGK), триозофосфатизомераза (TPI), трансляционный фактор элонгации EF-1 альфа (TEF2), глицеральдегид-3-фосфатдегидрогеназа (GAPDH; также обозначаемая как TDH3 по триозофосфатдегидрогеназе), галактокиназа (GAL1), галактоза-1-фосфатуридилтрансфераза (GAL7), UDP-галактозоэпимираза (GAL10), цитохром c1 (CYC1), белок Sec7 (SEC7) и кислая фосфатаза (PHO5), включая гибридные промоторы, такие как промоторы ADH2/GAPDH и CYC1/GAL10, и включая промотор ADH2/GAPDH, который индуцируется, когда концентрации глюкозы в клетке являются низкими (например, от приблизительно 0,1 до приблизительно 0,2 процента), а также промотор CUP1 и промотор TEF2. Аналогично, известен ряд вышележащих активирующих последовательностей (UAS), также называемых энхансерами. Вышележащие активирующие последовательности для экспрессии в Saccharomyces cerevisiae включают, но не ограничиваются ими, UAS генов, кодирующих следующие белки: PCK1, TPI, TDH3, CYC1, ADH1, ADH2, SUC2, GAL1, GAL7 и GAL10, а также другие UAS, активируемые продуктом гена GAL4, причем в одном аспекте используют UAS ADH2. Поскольку UAS ADH2 активируется продуктом гена ADR1, может быть предпочтительной сверхэкспрессия гена ADR1, когда гетерологичный ген функционально связан с UAS ADH2. Последовательности терминации транскрипции для экспрессии в Saccharomyces cerevisiae включают последовательности терминации генов α-фактора, GAPDH и CYC1.
Последовательности контроля транскрипции для экспрессии генов в метилотрофных дрожжах включают области контроля транскрипции генов, кодирующих алкогольоксидазу и формиатдегидрогеназу.
Трансфекцию молекулы нуклеиновой кислоты в дрожжевую клетку в соответствии с настоящим изобретением можно проводить любым способом, посредством которого молекулу нуклеиновой кислоты можно вводить в клетку, и он включает, но не ограничивается ими, диффузию, активный транспорт, обработку ультразвуком в ванне, электропорацию, микроинъекцию, липофекцию, адсорбцию и слияние протопластов. Трансфицированные молекулы нуклеиновых кислот можно встраивать в хромосомы дрожжей или оставлять на внехромосомных векторах с использованием способов, известных специалистам в данной области. Примеры дрожжевых носителей, несущих такие молекулы нуклеиновых кислот, подробно описаны в настоящем описании. Как рассмотрено выше, дрожжевой цитопласт, дрожжевую оболочку и дрожжевые мембранные частицы или препараты клеточной стенки также можно получать рекомбинантными способами путем трансфекции неизмененных дрожжевых микроорганизмов или дрожжевых сферопластов желаемыми молекулами нуклеиновых кислот, продуцирования в них антигена, а затем дальнейшего манипулирования микроорганизмам и/или сферопластами с использованием способов, известных специалистам в данной области, с получением цитопласта, оболочки или субклеточной дрожжевой мембраны или их фракций, содержащих желаемые антигены или другие белки.
Эффективные условия для получения рекомбинантных дрожжевых носителей и экспрессии антигена и/или другого белка дрожжевым носителем включают эффективную среду, в которой можно культивировать штамм дрожжей. Эффективная среда, как правило, представляет собой водную среду, содержащую источники усвояемых углеводов, азота и фосфора, а также соответствующие соли, минералы, металлы и другие питательные вещества, такие как витамины и факторы роста. Среда может содержать комплексные питательные вещества или она может представлять собой минимальную среду с определенным составом. Штаммы дрожжей по настоящему изобретению можно культивировать в различных контейнерах, включая, но не ограничиваясь ими, биореакторы, колбы Эрленмейера, пробирки, микротитровальные чашки, и чашки Петри. Культивирование проводят при температуре, pH и содержании кислорода, подходящих для дрожжевого штамма. Такие условия культивирования находятся в пределах квалификации специалиста в данной области (см., например, Guthrie et al. (eds.), 1991, Methods in Enzymology, vol. 194, Academic Press, San Diego). Например, согласно одному протоколу, жидкие культуры, содержащие подходящую среду, можно инокулировать с использованием культур, получаемых из стартовых чашек и/или стартовых культур иммунотерапевтических композиций на основе дрожжей с Brachyury, и выращивать в течение приблизительно 20 ч при 30°C при встряхивании при 250 об./мин Затем первичные культуры можно увеличивать в количестве до более крупных культур, если желательно. Экспрессия белка с векторов, которыми трансформированы дрожжи (например, экспрессия Brachyury), может быть конститутивной, если используемый промотор представляет собой конститутивный промотор или она может быть индуцирована путем добавления соответствующих условий индукции промотора, если используемый промотор представляет собой индуцибельный промотор (например, сульфат меди в случае промотора CUP1). В случае индуцибельного промотора индукцию экспрессии белка можно инициировать после выращивания культуры до подходящей клеточной плотности, которая может составлять приблизительно 0,2 Д.Е./мл или представлять собой более высокие плотности.
Одним неограничивающим примером среды, пригодной для культивирования иммунотерапевтической композиции на основе дрожжей с Brachyury, является среда U2. Среда U2 содержит следующие компоненты: 20 г/л глюкозы, 6,7 г/л азотистых оснований дрожжей, содержащих сульфат аммония, и 0,04 мг/мл каждого из гистидина, лейцина, триптофана и аденина. Другим неограничивающим примером среды, пригодной для культивирования иммунотерапевтической композиции на основе дрожжей с Brachyury по изобретению, является среда UL2. Среда UL2 содержит следующие компоненты: 20 г/л глюкозы, 6,7 г/л азотистых оснований дрожжей, содержащих сульфат аммония, и 0,04 мг/мл каждого из гистидина, триптофана и аденина.
В одном варианте осуществления изобретения, когда используют индуцибельный промотор (например, промотор CUP1) для экспрессии белка Brachyury в дрожжевом носителе согласно изобретению, инициируется экспрессия белка при более высокой плотности клеток по сравнению с плотностью клеток, которая была бы пригодна для большинства белков, экспрессируемых дрожжами с использованием такого промотора. Более конкретно, авторы настоящего изобретения открыли, что оптимальная экспрессия антигена Brachyury, запускаемая промотором CUP1, происходит, когда дрожжам, экспрессирующим антиген Brachyury, позволяют расти до плотности клеток от по меньшей мере 0,5 Д.Е./мл и до приблизительно 2,0 Д.Е./мл, и в одном аспекте от 0,5 Д.Е./мл до приблизительно 1,5 Д.Е./мл, и в одном аспекте от по меньшей мере 1,0 Д.Е./мл до приблизительно 2,0 Д.Е./мл, и в другом аспекте по меньшей мере приблизительно 1,0 Д.Е./мл, перед индукцией экспрессии антигена Brachyury в дрожжах. Авторы настоящего изобретения открыли, что после индукции экспрессии Brachyury, дрожжи будут удваиваться только приблизительно от 1X до 1,5X. Более того, авторы настоящего изобретения открыли, что после индукции экспрессии Brachyury рост дрожжей до плотности клеток более чем приблизительно 2,0 Д.Е./мл или в течение более чем приблизительно 6-8 часов, приводит к снижению жизнеспособности культур, при этом по существу без повышения накопления антигена в дрожжах. Таким образом, в одном варианте осуществления изобретения иммунотерапевтическую композицию на основе дрожжей с Brachyury, имеющую экспрессию антигена под контролем индуцибельного промотора, такого как промотор CUP1, перед индукцией экспрессии антигена выращивают до середины логарифмической фазы. В одном аспекте клетки выращивают до приблизительно от 1 до 2 Д.Е./мл перед индукцией экспрессии антигена. В одном аспекте экспрессию антигена индуцируют (например, добавлением сульфата меди) и продолжают в течение вплоть до 6, 6,5, 7, 7,5 или 8 часов. В одном аспекте индукция происходит при температуре приблизительно 30°C и скорости встряхивания 250 об./мин.
В некоторых вариантах осуществления изобретения дрожжи выращивают в условиях нейтральных значений pH. Как используют в рамках изобретения общее применение термина "нейтральные значения pH" относится к диапазону pH от приблизительно pH 5,5 до приблизительно pH 8, и в одном аспекте от приблизительно pH 6 до приблизительно 8. Специалисту в данной области будет понятно, что могут возникать небольшие отклонения (например, на десятые или сотые доли) при измерении с помощью pH-метра. По существу, применение нейтральных значений pH для выращивания клеток дрожжей означает, что клетки дрожжей выращивают в нейтральных значениях pH в течение наибольшего периода времени, когда они находятся в культуре. В одном варианте осуществления дрожжи выращивают в среде, поддерживаемой при уровне pH по меньшей мере 5,5 (т.е. pH культуральной среды не позволяют снижаться ниже pH 5,5). В другом аспекте дрожжи выращивают при уровне pH приблизительно 6, 6,5, 7, 7,5 или 8. Применение нейтральных значений pH при культивировании дрожжей обеспечивает несколько биологических эффектов, которые являются желательными характеристиками для применения дрожжей в качестве носителей для иммунизации. Например, культивирование дрожжей при нейтральных значениях pH обеспечивает хороший рост дрожжей без отрицательного эффекта на время образования клеток (например, замедление времени удвоения). Дрожжи могут продолжать расти до высоких плотностей без потери их пластичности клеточной стенки. Применение нейтральных значений pH позволяет получение дрожжей с пластичными клеточными стенками и/или дрожжей, которые являются более чувствительными к ферментам, расщепляющим клеточную стенку (например, глюканазам) при всех плотностях сбора. Этот признак является желательным, поскольку дрожжи с пластичными клеточными стенками могут индуцировать отличающиеся и улучшенные иммунные ответы по сравнению с дрожжами, выращиваемыми в более кислотных условиях, например, путем обеспечения секреции цитокинов антигенпредставляющими клетками, которые фагоцитировали дрожжи (например, цитокины TH1-типа, включающие, но не ограничивающиеся ими, IFN-γ, интерлейкин-12 (IL-12) и IL-2, а также провоспалительные цитокины, такие как IL-6). Кроме того, такие способы культивирования обеспечивают более высокую доступность антигенов, расположенных на клеточной стенке. В другом аспекте использование нейтральных значений pH для некоторых антигенов позволяет высвобождение связанного дисульфидной связью антигена путем обработки дитиотреитолом (DTT), которая невозможна, когда такие экспрессирующие антиген дрожжи культивируют в среде с более низким значением pH (например, pH 5).
В одном варианте осуществления контроль уровня гликозилирования у дрожжей используют для контроля экспрессии антигена дрожжами, в частности, на поверхности. Уровень гликозилирования у дрожжей может влиять на иммуногенность и антигенность антигена, в частности антигена, экспрессируемого на поверхности, поскольку части сахаров имеют тенденцию к тому, чтобы быть объемными. По существу, существование частей сахаров на поверхности дрожжей и их влияние на трехмерное пространство вокруг антигена(ов)-мишени следует учитывать при модулировании дрожжей согласно изобретению. Любой способ можно использовать для уменьшения уровня гликозилирования у дрожжей (или увеличения его, если желательно). Например, можно использовать мутантный штамм дрожжей, который отобран так, чтобы он имел низкий уровень гликозилирования (например, мутанты mnn1, och1 и mnn9), или можно путем мутации устранять акцепторные последовательности гликозилирования на антигене-мишени. Альтернативно, можно использовать дрожжи с уменьшенными профилями гликозилирования, например, Pichia. Также можно обрабатывать дрожжи с использованием способов, которые снижают или изменяют гликозилирование.
В одном варианте осуществления настоящего изобретения в качестве альтернативы рекомбинантной экспрессии антигена или другого белка в дрожжевом носителе, дрожжевой носитель внутриклеточно нагружают белком или пептидом, или углеводами или другими молекулами, которые служат в качестве антигена и/или пригодны в качестве иммуномодулирующих средств или модификаторов биологического ответа согласно изобретению. Затем дрожжевой носитель, который содержит антиген и/или другие белки внутриклеточно, можно вводить индивидууму, или им можно нагружать носитель, такой как дендритная клетка. Пептиды и белки можно прямо вводить в дрожжевые носители по настоящему изобретению способами, известными специалистам в данной области, такими как диффузия, активный транспорт, слияние липосом, электропорация, фагоцитоз, циклы замораживания-размораживания и обработка ультразвуком в ванне. Дрожжевые носители, которые можно прямо нагружать пептидами, белками, углеводами или другими молекулами, включают неизмененные дрожжи, а также сферопласты, оболочки или цитопласты, которые можно нагружать антигенами и другими агентами после их продуцирования. Альтернативно, неизмененные дрожжи можно нагружать антигеном и/или агентом, а затем сферопластами, оболочками, цитопластами, или из них можно получать субклеточные частицы. В этом варианте осуществления дрожжевой носитель можно нагружать любым количеством антигенов и/или других средств, от по меньшей мере 1, 2, 3, 4 или любого целого числа вплоть до сотен или тысяч антигенов и/или других агентов, например, как может быть осуществлено путем нагрузки микроорганизма или его частей.
В другом варианте осуществления настоящего изобретения антиген и/или другой агент физически связывают с дрожжевым носителем. Физическое связывание антигена и/или другого агента с дрожжевым носителем можно проводить любым способом, пригодным в данной области, включая способы ковалентного и нековалентного связывания, которые включают, но не ограничиваются ими, химическое сшивание антигена и/или другого агента с наружной поверхностью дрожжевого носителя или биологическое связывание антигена и/или другого агента с наружной поверхностью дрожжевого носителя, как например, с использованием антитела или другого партнера по связыванию. Химического сшивания можно достигать, например, способами, включающими связывание через глутаральдегидную связь, фотоаффинное мечение, обработку карбодиимидами, обработку химическими веществами, способными образовывать дисульфидные связи, и обработку другими сшивающими химическими веществами, являющимися стандартными в данной области. Альтернативно химическое вещество можно контактировать с дрожжевым носителем, который изменяет заряд липидного бислоя дрожжевой мембраны или композицию клеточной стенки так, чтобы наружная поверхность дрожжей с большей вероятностью подвергалась слиянию или связывалась с антигенами и/или другим средством, имеющим конкретные зарядовые характеристики. Нацеливающие агенты, такие как антитела, связывающие пептиды, растворимые рецепторы и другие лиганды, также можно включать в антиген в качестве слитого белка или иным образом ассоциированными с антигеном, для связывания антигена с дрожжевым носителем.
Когда антиген или другой белок экспрессируют или физически связывают с поверхностью дрожжей, в одном аспекте спейсер можно тщательно выбирать так, чтобы оптимизировать экспрессию антигена или другого белка или содержимое на поверхности. Размер спейсера(ов) может влиять на то, сколько антигена или другого белка будет экспонировано для связывания на поверхности дрожжей. Таким образом, в зависимости от того, какой антиген(ы) или другой белок(белки) используют, специалист в данной области будет выбирать спейсер, который обеспечивает соответствующее расположение в пространстве антигена или другого белка на поверхности дрожжей. В одном варианте осуществления спейсер представляет собой дрожжевой белок по меньшей мере из 450 аминокислот. Спейсеры подробно рассмотрены выше.
В другом варианте осуществления дрожжевой носитель и антиген или другой белок ассоциированы друг с другом с помощью более пассивного, неспецифического или нековалентного механизма связывания, как например, путем осторожного смешения дрожжевого носителя и антигена или другого белка вместе в буфере или другом подходящем составе (например, смеси).
В одном варианте осуществления неизмененные дрожжи (с экспрессией гетерологичных антигенов или других белков или без нее) можно группировать или обрабатывать так, чтобы получать препараты клеточной стенки дрожжей, дрожжевые мембранные частицы или дрожжевые фрагменты (т.е. не являющиеся неизмененными) и в некоторых вариантах осуществления фрагменты дрожжей могут быть предоставлены или могут вводиться с другими композициями, которые включают антигены (например, ДНК-вакцины, белковые субъединичные вакцины, убитые или инактивированные патогены, вакцины на основе вирусных векторов) для усиления иммунных ответов. Например, можно использовать ферментативную обработку, химическую обработку или физическую силу (например, механическое усилие сдвига или обработку ультразвуком) для разрушения дрожжей на части, которые используют в качестве адъюванта.
В одном варианте осуществления изобретения дрожжевые носители, пригодные в рамках настоящего изобретения, включают дрожжевые носители, которые являются убитыми или инактивированными. Обеспечение гибели или инактивацию дрожжей можно проводить любым из различных подходящих способов, известных в данной области. Например, инактивация дрожжей нагреванием является стандартным путем инактивации дрожжей, и специалист в данной области может осуществлять мониторинг структурных изменений антигена-мишени, если желательно, стандартными способами, известными в данной области. Альтернативно можно использовать другие способы инактивации дрожжей, такие как химические, электрические, радиоактивные или УФ-способы. См., например, методологию, описанную в стандартных справочниках по культивированию, таких как Methods of Enzymology, Vol. 194, Cold Spring Harbor Publishing (1990). При любой используемой стратегии инактивации следует учитывать вторичную, третичную или четвертичную структуру антигена-мишени и сохранять такую структуру, чтобы оптимизировать ее иммуногенность.
Дрожжевые носители можно составлять в иммунотерапевтические композиции или продукты на основе дрожжей по настоящему изобретению с использованием ряда способов, известных специалистам в данной области. Например, дрожжевые носители можно сушить лиофилизацией. Составы, содержащие дрожжевые носители, также можно получать путем упаковывания дрожжей в выпечку или таблетку, как например, проводят для дрожжей, используемых в выпекании или пивоварении. Кроме того, дрожжевые носители можно смешивать с фармацевтически приемлемым эксципиентом, таким как изотонический буфер, который является переносимым для хозяина или клетки-хозяина. Примеры таких эксципиентов включают воду, солевой раствор, раствор Рингера, раствор декстрозы, раствор Хэнкса и другие водные физиологически сбалансированные солевые растворы. Также можно использовать неводные носители, такие как жирные масла, кунжутное масло, этилолеат или триглицериды. Другие пригодные составы включают суспензии, содержащие увеличивающие вязкость средства, такие как натрий карбоксиметилцеллюлоза, сорбит, глицерин или декстран. Эксципиенты также могут содержать небольшие количества добавок, таких как вещества, которые увеличивают изотоничность и химическую стабильность. Примеры буферов включают фосфатный буфер, бикарбонатный буфер и Tris-буфер, в то время как примеры консервантов включают тимеросал, м- или о-крезол, формалин и бензиловый спирт. Стандартные составы могут представлять собой либо жидкие инъецируемые составы, либо твердые вещества, которые могут быть добавлены в подходящую жидкость, такую как суспензия или раствор для инъекции. Таким образом, в нежидком составе эксципиент может содержать, например, декстрозу, сывороточный альбумин человека и/или консерванты, к которым можно добавлять стерильную воду или солевой раствор перед введением.
В одном варианте осуществления настоящего изобретения композиция может включать дополнительные средства, которые также могут называться соединениями, модифицирующими биологический ответ, или способна продуцировать такие средства/модификаторы. Например, дрожжевой носитель можно трансфицировать или нагружать по меньшей мере одним антигеном и по меньшей мере одним средством/соединением, модифицирующим биологический ответ, или композицию по изобретению можно вводить вместе по меньшей мере с одним средством/модификатором биологического ответа. Модификаторы биологического ответа включают адъюванты и другие соединения, которые могут модулировать иммунные ответы, которые могут называться иммуномодулирующими соединениями, а также соединения, которые модифицируют биологическую активность другого соединения или средства, такие как иммунотерапевтические средства на основе дрожжей, причем такая биологическая активность не ограничивается эффектами на иммунную систему. Определенные иммуномодулирующие соединения могут стимулировать защитный иммунный ответ, в то время как другие могут подавлять вредоносный иммунный ответ, и то, пригодно ли иммуномодулирующее средство в комбинации с данным иммунотерапевтическим средством на основе дрожжей, может зависеть, по меньшей мере частично, от заболевания или состояния, подлежащего лечению или профилактике, и/или от индивидуума, подлежащего лечению. Определенные модификаторы биологического ответа предпочтительно усиливают клеточно-опосредуемый иммунный ответ, в то время как другие предпочтительно усиливают гуморальный иммунный ответ (т.е. могут стимулировать иммунный ответ, в котором имеется увеличенный уровень клеточно-опосредуемого иммунитета по сравнению с гуморальным, или наоборот). Определенные модификаторы биологического ответа имеют одно или несколько общих свойств с биологическими свойствами иммунотерапевтических средств на основе дрожжей или усиливают или дополняют биологические свойства иммунотерапевтических средств на основе дрожжей. Существует ряд способов, известных специалистам в данной области, для измерения стимуляции или подавления иммунных ответов, а также для отличения клеточно-опосредуемых иммунных ответов от гуморальных иммунных ответов, и для отличения одного типа клеточно-опосредуемого ответа от другого (например, ответ TH17 против ответа TH1).
Средства/модификаторы биологического ответа, пригодные в рамках изобретения, могут включать, но не ограничиваться ими, цитокины, хемокины, гормоны, липидные производные, пептиды, белки, полисахариды, низкомолекулярные лекарственные средства, антитела и их антигенсвязывающие фрагменты (включая, но не ограничиваясь ими, антитела против цитокинов, антитела против рецепторов цитокинов, антитела против хемокинов), витамины, полинуклеотиды, связывающиеся части нуклеиновых кислот, аптамеры и модуляторы роста. Некоторые подходящие средства включают, но не ограничиваются ими, IL-1 или агонисты IL-1 или IL-1R, антитела против IL-1 или другие антагонисты IL-1; IL-6 или агонисты IL-6 или IL-6R, антитела против IL-6 или другие антагонисты IL-6; IL-12 или агонисты IL-12 или IL-12R, антитела против IL-12 или другие антагонисты IL-12; IL-17 или агонисты IL-17 или IL-17R, антитела IL-17 или другие антагонисты IL-17; IL-21 или агонисты IL-21 или IL-21R, антитела против IL-21 или другие антагонисты IL-21; IL-22 или агонисты IL-22 или IL-22R, антитела против IL-22 или другие антагонисты IL-22; IL-23 или агонисты IL-23 или IL-23R, антитела против IL-23 или другие антагонисты IL-23; IL-25 или агонисты IL-25 или IL-25R, антитела против IL-25 или другие антагонисты IL-25; IL-27 или агонисты IL-27 или IL-27R, антитела против IL-27 или другие антагонисты IL-27; интерферон типа I (включая IFN-α) или агонисты или антагонисты интерферона типа I или его рецептора; интерферон типа II (включая IFN-γ) или агонисты или антагонисты интерферона типа II или его рецептора; антитело против CD40, CD40L, белок гена активации лимфоцитов 3 (LAG3) и/или IMP321 (T-клеточный иммуностимулирующий фактор, происходящий из растворимой формы LAG3), антитело против CTLA-4 (например, для высвобождения анергических T-клеток); костимуляторы T-клеток (например, антитело против CD137, антитело против CD28, антитело против CD40); алемтузумаб (например, Campath®), денилейкин дифтитокс (например, ONTAK®); антитело против CD4; антитело против CD25; антитело против PD-1, антитело против PD-L1, антитело против PD-L2; средства, которые блокируют FOXP3 (например, устраняют активность/уничтожают CD4+/CD25+ T-регуляторные клетки); Flt3-лиганд, имиквимод (AldaraTM), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF); гранулоцитарный колониестимулирующий фактор (G-CSF), сарграмостим (Leukine®); гормоны, включающие, но не ограничивающиеся ими, пролактин и гормон роста; агониситы Toll-подобного рецептора (TLR), включая, но не ограничиваясь ими, агонисты TLR-2, агонисты TLR-4, агонисты TLR-7 и агонисты TLR-9; антагонисты TLR, включая, но не ограничиваясь ими, антагонисты TLR-2, антагонисты TLR-4, антагонисты TLR-7 и антагонисты TLR-9; противовоспалительные средства и иммуномодуляторы, включая, но не ограничиваясь ими, ингибиторы COX-2 (например, целекоксиб, NSAIDS), глюкокортикоиды, статины, и талидомид и его аналоги, включая IMiD™s (которые являются структурными и функциональными аналогами талидомида (например, REVLIMID® (леналидомид), ACTIMID® (помалидомид)); провоспалительные средства, такие как грибковые или бактериальные компоненты или любой провоспалительный цитокин или хемокин; иммунотерапевтические вакцины, включая, но не ограничиваясь ими, вирусные вакцины, бактериальные вакцины или антительные вакцины; и любые другие иммуномодуляторы, усилители иммунной системы, противовоспалительные средства, провоспалительные средства и любые средства, которые модулируют количество, модулируют состояние активации и/или модулируют выживаемость антигенпредставляющих клеток или клеток TH17, TH1 и/или Treg. Изобретение предусматривает любую комбинацию таких средств, и любое из таких средств, комбинированное или вводимое в протоколе (например, одновременно, последовательно или в других форматах) с иммунотерапевтическим средством на основе дрожжей, является композицией, охватываемой изобретением. Такие средства хорошо известны в данной области. Эти средства можно использовать отдельно или в комбинации с другими средствами, описанными в настоящем описании.
Средства могут включать агонисты и антагонисты данного белка или пептида или их домена. Как используют в рамках изобретения, "агонист" представляет собой любое соединение или средство, включая, но не ограничиваясь ими, низкомолекулярные соединения, белки, пептиды, антитела, средства, связывающие нуклеиновые кислоты и т.д., которые связываются с рецептором или лигандом и обеспечивают или запускают ответ, которое может включать средства, которые имитируют или усиливают действие встречающегося в природе вещества, которое связывается с рецептором или лигандом. "Антагонист" представляет собой любое соединение или средство, включая, но не ограничиваясь ими, низкомолекулярные соединения, белки, пептиды, антитела, средства, связывающие нуклеиновые кислоты, и т.д., которые блокируют или ингибируют или снижают действие агониста.
Композиции по изобретению дополнительно могут включать или их можно вводить с (одновременно, последовательно или периодически) любыми другими средствами или композициями или протоколами, которые пригодны для предупреждения или лечения злокачественной опухоли, или любыми соединениями, которые осуществляют лечение или смягчают любой симптом злокачественной опухоли, и, в частности, злокачественных опухолей, ассоциированных с экспрессией или сверхэкспрессией Brachyury. Кроме того, композиции по изобретению можно использовать вместе с другими иммунотерапевтическими композициями, включая профилактическую и/или терапевтическую иммунотерапию. Действительно, композиции по изобретению можно использовать для ингибирования или снижения устойчивости к химиотерапии или устойчивости к лучевой терапии, которая может появляться при метастатической злокачественной опухоли, путем ингибирования экспрессии Brachyury в злокачественной опухоли (и, тем самым, ингибирования антипролиферативных влияний), или композиции по изобретению могут усиливать эффективность химиотерапии или лучевой терапии у индивидуума. Дополнительные средства, композиции или протоколы (например, терапевтические протоколы), которые пригодны для лечения злокачественной опухоли, включают, но не ограничиваются ими, химиотерапию, хирургическую резекцию опухоли, лучевую терапию, трансплантацию аллогенных или аутологических стволовых клеток, и/или направленную терапию злокачественной опухоли (например, низкомолекулярные лекарственные средства, биологические вещества или терапевтические средства на основе моноклональных антител, которые специфически нацелены на молекулы, вовлеченные в рост и прогрессирование опухоли, включая, но не ограничиваясь ими, селективные модуляторы рецепторов эстрогена (SERM), ингибиторы ароматазы, ингибиторы тирозинкиназы, ингибиторы серин/треониновой киназы, ингибиторы деацетилазы гистонов (HDAC), активаторы ретиноидных рецепторов, стимуляторы апоптоза, ингибиторы ангиогенеза, ингибиторы поли(ADP-рибоза)полимеразы (PARP), или иммуностимуляторы). Любые из этих дополнительных лекарственных средств можно вводить и/или любые из этих протоколов терапии можно проводить до, одновременно, поочередно после иммунотерапевтических композиций по изобретению, или в другие моменты времени. Например, при введении индивидууму вместе с химиотерапией или направленной терапией злокачественной опухоли, может быть желательным введение иммунотерапевтических композиций на основе дрожжей с Brachyury в течение "отдыха" между дозами химиотерапии или направленной терапии злокачественной опухоли, для максимизации эффективности иммунотерапевтических композиций. Введению иммунотерапевтической композиции на основе дрожжей с Brachyury часто может предшествовать хирургическая резекция опухоли, однако дополнительная или первичная хирургическая операция может происходить в ходе или после введения иммунотерапевтической композиции на основе дрожжей с Brachyury.
Изобретение также относится к набору, содержащему любую из композиций, описанных в настоящем описании, или любые из индивидуальных компонентов композиции, описанной в настоящем описании. Наборы могут включать дополнительные реагенты и письменные инструкции или указания по применению любой из композиций по изобретению для предупреждения или лечения злокачественной опухоли, ассоциированной с экспрессией или сверхэкспрессией Brachyury.
Способы введения или применения композиций по изобретению
Иммунотерапевтические композиции на основе дрожжей с Brachyury по изобретению предназначены для применения для предупреждения или лечения злокачественных опухолей, которые ассоциированы или характеризуются экспрессией или сверхэкспрессией Brachyury, включая предупреждение возникновения таких злокачественных опухолей, остановку прогрессирования таких злокачественных опухолей или устранение таких злокачественных опухолей. Более конкретно, иммунотерапевтические композиции на основе дрожжей с Brachyury можно использовать для предупреждения, ингибирования или замедления развития опухолей, экспрессирующих Brachyury, и/или для предупреждения, ингибирования или замедления миграции опухоли и/или инвазии опухоли в другие ткани (метастазы) и/или для предупреждения или ингибирования в общем злокачественной опухоли у индивидуума. Иммунотерапевтические композиции на основе дрожжей с Brachyury также можно использовать для смягчения по меньшей мере одного симптома злокачественной опухоли, как например, путем снижения опухолевой нагрузки у индивидуума; ингибирования роста опухоли у индивидуума; увеличения выживания индивидуума; предупреждения, ингибирования, обращения вспять или замедления возникновения миграции опухоли и/или инвазии опухоли в другие опухоли (метастатическая злокачественная опухоль) и/или предупреждения, ингибирования, обращения вспять или замедления прогрессирования злокачественной опухоли у индивидуума. Иммунотерапию на основе дрожжей с Brachyury также можно использовать терапевтически для ингибирования, снижения или устранения устойчивости к химиотерапии или устойчивости к лучевой терапии, которая может возникать в метастатической злокачественной опухоли, путем ингибирования экспрессии Brachyury в злокачественной опухоли, и композиции по изобретению могут усиливать эффективность химиотерапии или лучевой терапии у индивидуума.
Злокачественные опухоли, к которым имеют отношение композиции и способы по изобретению, представляют собой любую злокачественную опухоль, которая экспрессирует или может экспрессировать Brachyury, или злокачественные опухоли, расположенные вблизи злокачественных опухолей, которые экспрессируют или могут экспрессировать Brachyury, и включают, но не ограничиваются ими, злокачественную опухоль молочной железы, тонкого кишечника, желудка, почки, мочевого пузыря, матки, яичника, яичка, легкого, толстого кишечника, поджелудочной железы или предстательной железы, и включают метастатические злокачественные опухоли и злокачественные опухоли поздней стадии. Кроме того, Brachyury экспрессируется в опухолях B-клеточного происхождения, таких как хронический лимфоцитарный лейкоз (CLL), B-клетки, трансформированные вирусом Эпштейна-Барр, лимфома Беркитта и Ходжкина, а также их метастатические злокачественные опухоли.
Один вариант осуществления изобретения относится к способу ингибирования миграции опухоли и/или снижения, прекращения (остановки), обращения вспять или предупреждения метастатического прогрессирования злокачественной опухоли у индивидуума со злокачественной опухолью, или обращения вспять развития метастатических событий в злокачественной опухоли. Как рассмотрено выше, Brachyury стимулирует эпителиально-мезенхимальный переход (EMT) в опухолевых клетках человека, сообщая опухолевым клеткам мезенхимальный фенотип, а также способность к миграции и инвазии, одновременно ослабляя прогрессирование цикла опухолевых клеток. Таким образом, вовлечение Brachyury в метастатические процессы делает его идеальной мишенью для предупреждения или ингибирования метастатических процессов, включая остановку злокачественной опухоли на предметастатической стадии. Применение иммунотерапевтической композиции на основе дрожжей с Brachyury по изобретению может быть эффективным для предупреждения или лечения метастатической злокачественной опухоли, включая остановку прогрессирования злокачественной опухоли при наличии угрозы ускользания (или попытки к ускользанию) злокачественной опухоли от традиционной терапии, такой как химиотерапия и лучевая терапия. Способ включает стадии введения индивидууму со злокачественной опухолью иммунотерапевтической композиции на основе дрожжей с Brachyury по изобретению, как описано в настоящем описании, включающей, но не ограничивающейся ими: (a) дрожжевой носитель; и (b) антиген злокачественной опухоли, содержащий по меньшей мере один антиген Brachyury.
В одном аспекте Brachyury не выявляется в злокачественной опухоли индивидуума в момент первого введения композиции. Как правило, когда Brachyury не выявляется в злокачественной опухоли индивидуума, индивидуум может иметь более раннюю стадию злокачественной опухоли, при которой экспрессия Brachyury еще не проявляется (например, стадия I или стадия II), или при которой экспрессия Brachyury в любом случае не поддается выявлению (т.е., Brachyury может экспрессироваться или может не экспрессироваться на низком уровне или в небольшом количестве клеток, но еще абсолютно не выявляется при использовании стандартных способов выявления). В этом аспекте изобретения развитие экспрессирующих Brachyury опухолевых клеток предупреждается, замедляется или ингибируется с использованием иммунотерапевтической композиции на основе дрожжей с Brachyury. В результате миграция опухоли и/или другие метастатические процессы, ведущие к метастатическому прогрессированию опухоли, предотвращаются, замедляются или ингибируются, и/или происходит общая остановка прогрессирования опухоли у индивидуума.
В другом аспекте экспрессия Brachyury выявляется или может выявляться в злокачественной опухоли индивидуума в момент, когда композицию вводят впервые. В этом аспекте изобретения индивидуум может иметь злокачественную опухоль стадии I, стадии II, стадии III или стадии IV. В этом аспекте применение иммунотерапевтической композиции на основе дрожжей с Brachyury снижает, устраняет или замедляет или останавливает рост опухолей, экспрессирующих Brachyury, что может приводить к снижению опухолевой нагрузки у индивидуума, ингибированию роста экспрессирующей Brachyury опухоли и/или увеличению выживаемости индивидуума. Индивидуум может испытывать остановку, замедление или обращение вспять метастатических процессов, повышение выживаемости и улучшение здоровья пациента, и, более того, может происходит обеспечение лечения злокачественной опухоли с помощью других протоколов.
Действительно, метастатическая злокачественная опухоль может быть ассоциирована с устойчивостью или увеличенной устойчивостью к способам терапии злокачественной опухоли, таким как химиотерапия, лучевая терапия или направленная терапия злокачественной опухоли, посредством чего злокачественная опухоль "ускользает" от терапии или просто в меньшей степени поддается терапии и прогрессирует. Таким образом, существует потребность в снижении или устранении устойчивости к такой терапии для повышения или усиления эффективности терапии и улучшения здоровья пациента и повышения выживаемости. Таким образом, один вариант осуществления изобретения относится к способу снижения или предупреждения устойчивости к химиотерапии, устойчивости к направленной терапии злокачественной опухоли или устойчивости к лучевой терапии у пациента со злокачественной опухолью. Способ включает введение индивидууму со злокачественной опухолью, которому проводят химиотерапию и/или лучевую терапию злокачественной опухоли, иммунотерапевтической композиции на основе дрожжей с Brachyury, как описано в настоящем описании, которая может включать композицию, содержащую: (a) дрожжевой носитель; и (b) антиген злокачественной опухоли, содержащий по меньшей мере один антиген Brachyury. Этот способ по изобретению также можно использовать для лечения устойчивости, ассоциированной с другими терапевтическими способами лечения злокачественной опухоли, включая, но не ограничиваясь ими, направленную терапию злокачественной опухоли.
В одном аспекте этого варианта осуществления Brachyury не выявляется в злокачественной опухоли индивидуума в момент, когда композицию вводят впервые. В этом аспекте введение иммунотерапевтической композиции на основе дрожжей с Brachyury предупреждает или ингибирует возникновение устойчивости к химиотерапии или лучевой терапии путем ингибирования развития экспрессирующих Brachyury опухолевых клеток в злокачественной опухоли. В другом аспекте экспрессия Brachyury выявляется в злокачественной опухоли индивидуума в момент, когда композицию вводят впервые. В одном аспекте индивидуум может уже иметь устойчивость к химиотерапии или лучевой терапии или может не иметь ее. В любом случае введение иммунотерапевтической композиции на основе дрожжей с Brachyury по изобретению предупреждает или ингибирует устойчивость к химиотерапии или лучевой терапии или усиливает способность химиотерапии или лучевой терапии лечить индивидуума, путем снижения или устранения экспрессирующих Brachyury опухолевых клеток у пациента.
Другой вариант осуществления изобретения относится к способу лечения злокачественной опухоли, и, в частности, экспрессирующей Brachyury злокачественной опухоли. Способ включает введение индивидууму с экспрессирующей Brachyury злокачественной опухолью иммунотерапевтической композиции на основе дрожжей с Brachyury, описанной в настоящем описании, которая может включать композицию, содержащую: (a) дрожжевой носитель; и (b) антиген злокачественной опухоли, содержащий по меньшей мере один антиген Brachyury. В одном аспекте способ снижает опухолевую нагрузку у пациента. В одном аспекте способ увеличивает выживаемость пациента. В одном аспекте способ ингибирует рост опухоли у индивидуума. В одном аспекте способ предупреждает, останавливает или обращает вспять метастатическое прогрессирование опухоли.
Поскольку полагают, что экспрессия Brachyury является более широко распространенной по мере перехода или прогрессирования злокачественной опухоли в более поздние стадии (например, от стадии I к стадии II к стадии III к стадии IV, в зависимости от конкретной злокачественной опухоли) и ассоциирована с метастатическими процессами, вариантом осуществления изобретения является предоставление способа предупреждения или замедления возникновения злокачественной опухоли, экспрессирующей Brachyury, или остановки злокачественной опухоли на предметастатической или предзлокачественной стадии. Такой способ включает введение индивидууму, у которого злокачественные клетки, экспрессирующие Brachyury, не выявляются иммунотерапевтической композиции на основе дрожжей с Brachyury, описанной в настоящем описании, которая может включать композицию, содержащую: (a) дрожжевой носитель; и (b) антиген злокачественной опухоли, содержащий по меньшей мере один антиген Brachyury. В одном аспекте этого варианта осуществления известно, что злокачественная опухоль экспрессирует или предположительно подвержена экспрессии Brachyury на некоторой стадии злокачественной опухоли по меньшей мере у подгруппы индивидуумов со злокачественной опухолью. В одном аспекте этого варианта осуществления индивидуум уже имеет злокачественную опухоль, однако Brachyury не выявляется в злокачественной опухоли в момент, когда композицию вводят впервые, что означает, что индивидуум может иметь более раннюю стадию злокачественную опухоли, при которой экспрессия Brachyury еще не проявляется или при которой экспрессия Brachyury в любом случае не поддается выявлению (т.е. Brachyury может экспрессироваться или может не экспрессироваться на низком уровне или в небольшом количестве опухолевых клеток, однако абсолютно не поддается выявлению с использованием стандартных способов выявления). В некоторых случаях, может быть известно, что тип злокачественной опухоли имеет высокий уровень метастатического прогрессирования. В этом аспекте введение иммунотерапевтической композиции на основе дрожжей с Brachyury предупреждает, замедляет или ингибирует развитие опухоли, экспрессирующей Brachyury, в опухолевых клетках злокачественной опухоли пациента, и, таким образом, предупреждает, останавливает, замедляет или ингибирует метастатические процессы, которые сопровождают экспрессию Brachyury. В другом аспекте индивидуум не имеет злокачественной опухоли, когда вводят композицию. Такой индивидуум может быть "предрасположенным" или у него вероятно может развиться злокачественная опухоль, возможно, из-за семейного анамнеза или генетического маркера, или из-за того, что индивидуум имеет признаки предзлокачественных клеток или очагов повреждения или имеет предраковые (предзлокачественные) клетки или очаги повреждения.
В одном аспекте индивидуума дополнительно лечат с помощью по меньшей мере одного другого терапевтического соединения или терапевтического протокола, пригодных для лечения злокачественной опухоли. Такие лекарственные средства и протоколы подробно описаны в другой части настоящего описания. Например, в любом из вариантов осуществления, касающихся способов по изобретению, описанных в настоящем описании, в одном аспекте, когда индивидуум имеет злокачественную опухоль (независимо от статуса поддающейся выявлению экспрессии Brachyury в опухолевых клетках) индивидуума лечат или лечили другой терапией злокачественной опухоли. Такая терапия может включать любой из терапевтических протоколов или применение любого терапевтического соединения или средства, описанного в настоящем описании выше, включая, но не ограничиваясь ими, химиотерапию, лучевую терапию, направленную терапию злокачественной опухоли, хирургическую резекцию опухоли, перенос стволовых клеток, терапию цитокинами, адоптивый перенос T-клеток и/или введение второй иммунотерапевтической композиции. В случае введения второй иммунотерапевтической композиции, такие композиции могут включать, но не ограничиваться ими, дополнительную иммунотерапию на основе дрожжей, рекомбинантную иммунотерапию на основе вируса (вирусные векторы), терапию цитокинами, иммуностимулирующую терапию (включая химиотерапию с иммуностимулирующими свойствами), ДНК-вакцины и другие иммунотерапевтические композиции.
В одном аспекте вторая иммунотерапевтическая композиция включает второй антиген злокачественной опухоли, который не включает антиген Brachyury. Например, вторая иммунотерапевтическая композиция, пригодная в комбинации с иммунотерапевтической композицией на основе дрожжей с Brachyury, представляет собой иммунотерапевтическую композицию на основе дрожжей, содержащую другой антиген злокачественной опухоли. Такие антигены злокачественной опухоли могут включать, но не ограничиваться ими, карциноэмбриональный антиген (CEA), онкобелок Ras с точковой мутацией, MUC-1, EGFR, BCR-Abl, MART-1, MAGE-1, MAGE-3, GAGE, GP-100, MUC-2, нормальные онкобелки p53 и онкобелки p53 с точковой мутацией, PSMA, тирозиназу, TRP-1 (gp75), NY-ESO-1, TRP-2, TAG72, KSA, CA-125, PSA, HER-2/neu/c-erb/B2, hTERT, p73, B-RAF, белок аденоматозного полипоза толстого кишечника (APC), Myc, белок фон Гиппеля-Ландау (VHL), Rb-1, Rb-2, рецептор андрогенов (AR), Smad4, MDR1, Flt-3, BRCA-1, BRCA-2, pax3-fkhr, ews-fli-1, HERV-H, HERV-K, TWIST, мезотелин, NGEP, модификации таких антигенов, варианты по сплайсингу таких антигенов, и эпитопные агонисты таких антигенов, а также комбинации таких антигенов и/или их иммуногенные домены, их модификации, их варианты и/или их эпитопные агонисты.
Как используют в рамках изобретения, термин "лечить" злокачественную опухоль, или любое его преобразование (например, "подвергнутый лечению от злокачественной опухоли", и т.д.), главным образом, относится к введению композиции по изобретению после возникновения злокачественной опухоли (например, после диагностики или выявления злокачественной опухоли у индивидуума), с по меньшей мере одной терапевтической целью лечения (по сравнению с отсутствием этого лечения) включая: уменьшение опухолевой нагрузки, ингибирование роста опухоли, увеличение выживаемости индивидуума, замедление, ингибирование, остановку или предупреждение возникновения или развития метастатической злокачественной опухоли (как например, путем замедления, ингибирования, остановки или предупреждения возникновения миграции опухоли и/или инвазии опухоли в ткани за пределами первичной злокачественной опухоли и/или других процессов, ассоциированных с метастатическим прогрессированием злокачественной опухоли), замедление или остановку прогрессирования злокачественной опухоли, усиление иммунного ответа против опухоли, усиления длительных иммунных ответов памяти против опухолевых антигенов и/или улучшение общего состояния здоровья индивидуума. Термины "предупреждать" или "защищать" от злокачественной опухоли или любое их преобразование (например, "предупреждение злокачественной опухоли", и т.д.), главным образом, относятся к введению композиции по изобретению до возникновения злокачественной опухоли или до возникновения конкретной стадии злокачественной опухоли или экспрессии опухолевого антигена при злокачественной опухоли (например, до выявления экспрессии Brachyury в злокачественной опухоли), с по меньшей мере одной целью лечения (по сравнению с отсутствием этого лечения), включающей: предупреждение или замедление возникновения или развития злокачественной опухоли, или, если злокачественная опухоль возникла после лечения, по меньшей мере снижение тяжести злокачественной опухоли (например, снижение уровня роста опухоли, остановка прогрессирования злокачественной опухоли, повышение иммунного ответа против злокачественной опухоли, ингибирование метастатических процессов) или улучшение исхода у индивидуума (например, повышение выживаемости).
Настоящее изобретение включает доставку (введение, иммунизацию) иммунотерапевтической композиции на основе дрожжей с Brachyury по изобретению субъекту или индивидууму. Процесс введения можно осуществлять ex vivo или in vivo, однако, как правило, его проводят in vivo. Введение ex vivo относится к выполнению части требуемой стадии вне пациента, такой как введение композиции по настоящему изобретению в группу клеток (дендритные клетки), извлеченных из пациента, в условиях, обеспечивающих нагрузку клетки дрожжевым носителем, антигеном(ами) и любыми другими средствами или композициями, и возвращение клеток пациенту. Терапевтическую композицию по настоящему изобретению можно возвращать пациенту или вводить пациенту любым подходящим способом введения.
Введение композиции может быть системным, через слизистую оболочку и/или вблизи расположения целевой области (например, вблизи области опухоли). Подходящие пути введения будут очевидными специалистам в данной области, в зависимости от типа злокачественной опухоли, подлежащего предупреждению или лечению, и/или целевой популяции клеток или ткани. Различные приемлемые способы введения включают, но не ограничиваются ими, внутривенное введение, внутрибрюшинные введение, внутримышечное введение, внутриузловое введение, внутрикоронарное введение, внутриартериальное введение (например, в сонную артерию), подкожное введение, чрескожную доставку, внутритрахеальное введение, внутрисуставное введение, внутрижелудочковое введение, ингаляцию (например, аэрозоль), внутричерепное, внутрипозвоночное, внутриглазное, ушное, интраназальное, пероральное, легочное введение, установку катетера и прямую инъекцию в ткань. В одном аспекте пути введения включают: внутривенный, внутрибрюшинный, подкожный, внутрикожный, внутриузловой, внутримышечный, чрескожный, ингаляционный, интраназальный, пероральный, внутриглазной, внутрисуставной, внутричерепной и внутрипозвоночный. Парентеральная доставка может включать внутрикожный, внутримышечный, внутрибрюшинный, внутриплевральный, внутрилегочный, внутривенный, подкожный пути, путь через предсердный катетер и венозный катетер. Ушная доставка может включать ушные капли, интраназальная доставка может включать назальные капли или интраназальную инъекцию, и внутриглазная доставка может включать глазные капли. Также можно осуществлять доставку с помощью аэрозоля (ингаляционную) с использованием способов, стандартных в данной области (см., например, Stribling et al., Proc. Natl. Acad. Sci. USA 189:11277-11281, 1992). В одном аспекте иммунотерапевтическую композицию на основе дрожжей с Brachyury по изобретению вводят подкожно. В одном аспекте иммунотерапевтическую композицию на основе дрожжей с Brachyury вводят прямо в окружение опухоли.
Как правило, подходящая единичная доза представляет собой дозу иммунотерапевтической композиции на основе дрожжей с Brachyury, которая способна эффективно предоставлять дрожжевой носитель и антиген Brachyury данному типу клетки, ткани или области организма пациента в количестве, эффективном для индукции антигенспецифического иммунного ответа против одного или нескольких антигенов или эпитопов Brachyury при введении один или несколько раз на протяжении подходящего периода времени. Например, в одном варианте осуществления единичная доза дрожжей с Brachyury по настоящему изобретению составляет от приблизительно 1×105 до приблизительно 5×107 эквивалентов клеток дрожжей на килограмм массы организма, в который вводят композицию. В одном аспекте единичная доза дрожжевого носителя по настоящему изобретению составляет от приблизительно 0,1 дрожжевых единиц (Д.Е., что составляет 1×106 клеток дрожжей или эквивалентов клеток дрожжей) до приблизительно 100 Д.Е. (1×109 клеток) на дозу (т.е. на организм), включая любую промежуточную дозу с приращением 0,1×106 клеток (т.е. 1,1×106, 1,2×106, 1,3×106…). В одном варианте осуществления подходящая доза включает дозы от 1 Д.Е. до 40 Д.Е., и в одном аспекте от 10 Д.Е. до 40 Д.Е. В одном варианте осуществления дозы вводят в различные области индивидуума, но в ходе одного и того же периода дозирования. Например, дозу 40 Д.Е. можно вводить путем инъекции доз 10 Д.Е. в четыре различных области индивидуума в ходе одного периода дозирования. Изобретение относится к введению количества иммунотерапевтической композиции на основе дрожжей с Brachyury (например, 1, 2, 3, 4, 5, 6, 7, 8, 9 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 Д.Е. или более) в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более различных областей индивидуума, достигая единичной дозы. Одна дрожжевая единица (Д.Е.) составляет 1×107 клеток дрожжей или эквивалентов клеток дрожжей.
"Вспомогательные средства" или "усиливающие средства" для терапевтической композиции вводят, например, когда иммунный ответ против антигена снижается или если необходимо обеспечить иммунный ответ или индуцировать память против конкретного антигена антигена или антигена(ов). Вспомогательные средства можно вводить с интервалом приблизительно 1, 2, 3, 4, 5, 6, 7 или 8 недель, или раз в месяц, раз в два месяца, раз в три месяца, раз в год и/или с приращением в несколько или некоторое количество лет после первоначального введения, в зависимости от состояния индивидуума, подвергаемого лечению, и цели лечения во время введения (например, профилактика, активное лечение, поддержание). В одном варианте осуществления схема введения представляет собой схему, когда дозы иммунотерапевтической композиции на основе дрожжей с Brachyury вводят по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более раз на протяжении периода времени, составляющего от недель до месяцев и лет. В одном варианте осуществления дозы вводят раз в неделю или раз в две недели на протяжении 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или доз, с последующими дозами раз в две недели или раз в месяц при необходимости для достижения желаемого профилактического или терапевтического лечения злокачественной опухоли. Затем можно вводить дополнительные вспомогательные вещества со сходными или более длительными интервалами (месяцы или годы) в качестве поддерживающей терапии или обеспечивающей ремиссию терапии, если желательно.
В одном аспекте изобретения одно или несколько дополнительных лекарственных средств вводят или один или несколько дополнительных терапевтических протоколов проводят последовательно и/или одновременно с введением иммунотерапевтической композиции на основе дрожжей с Brachyury (например, хирургическая резекция опухоли, проведение химиотерапии, проведение лучевой терапии, введение другой иммунотерапевтической композиции или выполнение другого протокола, терапия цитокинами, адоптивный перенос T-клеток или трансплантация стволовых клеток). Например, одно или несколько терапевтических можно вводить или одну или несколько терапий можно проводить до первой дозы иммунотерапевтической композиции на основе дрожжей с Brachyury или после введения первой дозы. В одном варианте осуществления одно или несколько терапевтических можно вводить или одну или несколько терапий можно проводить поочередно с дозированием иммунотерапевтической композиции на основе дрожжей с Brachyury, как например, в протоколе, в котором композицию на основе дрожжей с Brachyury вводят с заданными интервалами за одну или несколько последовательных доз химиотерапии или другой терапии. В одном варианте осуществления иммунотерапевтическую композицию на основе дрожжей с Brachyury вводит за одну или несколько доз в течение некоторого периода времени перед началом дополнительных способов терапии. Иными словами, иммунотерапевтическую композицию на основе дрожжей с Brachyury вводят в качестве монотерапии в течение периода времени, а затем добавляют дополнительную терапию (например, химиотерапию), либо одновременно с новыми дозами иммунотерапии на основе дрожжей с Brachyury, либо поочередно с иммунотерапией на основе дрожжей с Brachyury. Альтернативно или дополнительно, другую терапию можно проводить в течение периода времени перед началом введения иммунотерапевтической композиции на основе дрожжей с Brachyury, и эти подходы можно комбинировать (например, хирургическая резекция опухоли с последующей монотерапией посредством иммунотерапии на основе дрожжей с Brachyury в течение нескольких недель, а затем чередующиеся дозы химиотерапии и иммунотерапии на основе дрожжей с Brachyury в течение недель или месяцев, необязательно с последующей монотерапией с использованием иммунотерапии на основе дрожжей с Brachyury или другой терапии, или новым протоколом комбинаций способов терапии, предоставленных последовательно, одновременно или поочередно). Изобретение предусматривает различные протоколы для лечения злокачественной опухоли с использованием иммунотерапии на основе дрожжей с Brachyury, и эти примеры следует считать неограничивающими примерами различных возможных протоколов.
В одном аспекте изобретения с использованием иммунотерапии на основе дрожжей также осуществляют нацеливание на дополнительные антигены, отличные от Brachyury в дополнение к нацеливанию на Brachyury. Такие дополнительные антигены-мишени могут быть включены в тот же самый дрожжевой носитель, что и антигены Brachyury, или можно получать дополнительные иммунотерапевтические композиции на основе дрожжей, нацеленные на различные антигены, а затем комбинировать при желании, в зависимости от индивидуума, подвергаемого лечению, антигенов, экспрессируемых данным типом злокачественной опухоли или конкретной опухолью индивидуума, и/или в зависимости от стадии злокачественной опухоли у индивидуума или стадии лечения индивидуума. Например, может быть выбрана комбинация антигенов, которая охватывает: (1) антигены, вовлеченные в основополагающие события в развитии злокачественной опухоли, такие как мутантный Ras, антигены, вовлеченные в или ассоциированные с нарушением регуляции клеточных процессов, такие как CEA, и (3) Brachyury, который вовлечен в метастатические процессы. Например, одна или несколько иммунотерапевтических композиций на основе дрожжей могут экспрессировать один или несколько антигенов, включающих, но не ограничивающихся ими, карциноэмбриональный антиген (CEA), онкобелок Ras с точковой мутацией, MUC-1, EGFR, BCR-Abl, MART-1, MAGE-1, MAGE-3, GAGE, GP-100, MUC-2, нормальные онкобелки p53 и онкобелки p53 с точковой мутацией, PSMA, тирозиназу, TRP-1 (gp75), NY-ESO-1, TRP-2, TAG72, KSA, CA-125, PSA, HER-2/neu/c-erb/B2, hTERT, p73, B-RAF, белок аденоматозного полипоза толстого кишечника (APC), Myc, белок фон Гиппеля-Ландау (VHL), Rb-1, Rb-2, рецептор андрогенов (AR), Smad4, MDR1, Flt-3, BRCA-1, BRCA-2, pax3-fkhr, ews-fli-1, HERV-H, HERV-K, TWIST, мезотелин, NGEP, модификации таких антигенов, варианты по сплайсингу таких антигенов, и эпитопные агонисты таких антигенов, а также комбинации таких антигенов и/или их иммуногенные домены, их модификации, их варианты и/или их эпитопные агонисты. Одну, две, три или более из этих иммунотерапевтических композиций на основе дрожжей можно вводить индивидууму до, одновременно или поочередно и/или после введения иммунотерапевтической композиции на основе Brachyury, для оптимизации нацеливания на антигены в опухоли индивидуума. Как описано выше, также в таких протоколах можно использовать дополнительные способы лечения (например, хирургическая резекция опухоли, химиотерапии, направленная терапия злокачественной опухоли, лучевая терапия и т.д.).
В одном варианте осуществления изобретения предусмотрен способ лечения злокачественной опухоли. Способ включает стадии: (a) введения индивидууму со злокачественной опухолью, у которого экспрессия Brachyury не выявляется, первой иммунотерапевтической композиции, содержащей дрожжевой носитель и первый антиген злокачественной опухоли, который не содержит антиген Brachyury; и (b) введение индивидууму до, одновременно или после введения первой иммунотерапевтической композиции второй иммунотерапевтической композиции, содержащей дрожжевой носитель и второй антиген злокачественной опухоли, содержащий антиген Brachyury. В дополнительных вариантах осуществления способ может включать введение одной или нескольких дополнительных иммунотерапевтических композиций, где каждая из одной или нескольких дополнительных иммунотерапевтических композиций содержит дополнительный антиген злокачественной опухоли. Дополнительный антиген может представлять собой любой из антигенов, известных в данной области или описанных в настоящем описании, включая, но не ограничиваясь ими, мутантный Ras, карциноэмбриональный антиген (CEA) и MUC-1.
В другом варианте осуществления изобретения способ лечения злокачественной опухоли включает следующие стадии: (a) введение индивидууму со злокачественной опухолью первой иммунотерапевтической композиции, содержащей дрожжевой носитель и мутантный антиген Ras; (b) введение индивидууму (a) второй иммунотерапевтической композиции, содержащей дрожжевой носитель и антиген, выбранный из группы, состоящей из карциноэмбрионального антигена (CEA) и муцина-1 (MUC-1); и (c) введение индивидууму согласно (a) и (b) третей иммунотерапевтической композиции, содержащей дрожжевой носитель и антиген Brachyury. Одну или несколько стадий введения согласно (a), (b) и (c) можно проводить одновременно или последовательно. При необходимости для лечения злокачественной опухоли конкретного индивидуума стадии можно повторять, и антигены злокачественной опухоли можно модифицировать до или в процессе лечения для специфического нацеливания на злокачественную опухоль конкретного индивидуума.
В способе по настоящему изобретению композиции и терапевтические композиции можно вводить животному, включая любое позвоночное, и, в частности, любому представителю позвоночных класса млекопитающие, включая, но не ограничиваясь, приматов, грызунов, домашний скот и домашних животных. Домашний скот включает млекопитающих, подлежащих употреблению в пищу или которые продуцируют полезные продукты (например, овцы для получения шерсти). Млекопитающие, подлежащие лечению или защите с использованием изобретения, включают человека, не являющихся человеком приматов, собак, кошек, мышей, крыс, коз, овец, крупный рогатый скот, лошадей и свиней.
"Индивидуумом" является позвоночное, такое как млекопитающее, включая, но не ограничиваясь этим, человека. Млекопитающие включают, но не ограничиваются ими, сельскохозяйственных животных, спортивных животных, домашних животных, приматов, мышей и крыс. Термин "индивидуум" можно использовать взаимозаменяемо с термином "животное", "субъект" или "пациент".
Общие способы, пригодные для изобретения
Для применения настоящего изобретения на практике могут быть использованы, если нет иных указаний, общепринятые способы молекулярной биологии (включая рекомбинантные способы), микробиологии, клеточной биологии, биохимии, химии нуклеиновых кислот и иммунологии, которые хорошо известны специалистам в данной области. Такие способы полностью проиллюстрированы в литературе, такой как Methods of Enzymology, Vol. 194, Guthrie et al., eds., Cold Spring Harbor Laboratory Press (1990); Biology and activities of yeasts, Skinner, et al., eds., Academic Press (1980); Methods in yeast genetics: a laboratory course manual, Rose et al., Cold Spring Harbor Laboratory Press (1990); The Yeast Saccharomyces: Cell Cycle и Cell Biology, Pringle et al., eds., Cold Spring Harbor Laboratory Press (1997); The Yeast Saccharomyces: Gene Expression, Jones et al., eds., Cold Spring Harbor Laboratory Press (1993); The Yeast Saccharomyces: Genome Dynamics, Protein Synthesis, and Energetics, Broach et al., eds., Cold Spring Harbor Laboratory Press (1992); Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989) и Molecular Cloning: A Laboratory Manual, third edition (Sambrook and Russel, 2001), (вместе обозначаемые в настоящем описании как "Sambrook"); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987, включая дополнения по 2001 год); ПЦР: The Polymerase Chain reaction, (Mullis et al., eds., 1994); Harlow and Lane (1988), Antibodies, A Laboratory Manual, Cold Spring Harbor Publications, New York; Harlow and Lane (1999) Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (вместе обозначаемые в настоящем описании как "Harlow and Lane"), Beaucage et al. eds., Current Protocols in Nucleic Acid Chemistry, John Wiley & Sons, Inc., New York, 2000); Casarett and Doull’s, Toxicology The Basic Science of Poisons, C. Klaassen, ed., 6th edition (2001), и Vaccines, S. Plotkin, W. Orenstein, и P. Offit, eds., Fifth Edition (2008).
Общие определения
"TARMOGEN®" (GlobeImmune, Inc., Louisville, Colorado), главным образом, относится к дрожжевому носителю, экспрессирующему один или несколько гетерологичных антигенов внеклеточно (на его поверхности), внутриклеточно (внутри или в цитозоле) или как внеклеточно, так и внутриклеточно. TARMOGEN®, в основном, описан (см., например, патент США № 5830463). Определенные композиции для иммунотерапии на основе дрожжей и способы получения и, главным образом, их применения, также подробно описаны, например, в патенте США № 5830463, патенте США № 7083787, патенте США № 7736642, Stubbs et al., Nat. Med. 7:625-629 (2001), Lu et al., Cancer Research 64:5084-5088 (2004), и Bernstein et al., Vaccine 2008 Jan 24; 26(4):509-21, каждый из которых включен в настоящее описание в качестве ссылки в полном объеме.
Как используют в рамках изобретения, термин "аналог" относится к химическому соединению, которое является структурно сходным с другим соединением, но немного отличается по составу (как в случае замены одного атома атомом другого элемента или в присутствии конкретной функциональной группы, или в случае замены одной функциональной группы другой функциональной группой). Таким образом, аналог представляет собой соединение, которое является сходным или сравнимым по функции и внешнему виду, но которое имеет отличающуюся структуру или происхождение относительно эталонного соединения.
Термины "замещенный", "замещенное производное" и "производное", когда их используют для описания соединения, означают, что по меньшей мере одна водородная связь незамещенного соединения заменена отличающимся атомом или химической группой.
Хотя производное имеет сходную физическую структуру с исходным соединением, производное может иметь отличающиеся химические и/или биологические свойства от исходного соединения. Такие свойства могут включать, но не ограничиваются ими, увеличенную или сниженную активность исходного соединения, новую активность по сравнению с исходным соединением, усиленную или сниженную биодоступность, усиленную или сниженную эффективность, усиленную или сниженную стабильность in vitro и/или in vivo, и/или свойства усиленного или сниженного всасывания.
Как правило, термин "биологически активный" указывает на то, что соединение (включая белок или пептид) имеет по меньшей мере один поддающийся выявлению вид активности, который имеет эффект на метаболические, физиологические, химические или другие процессы в клетке, ткани или организме, при измерении или наблюдении in vivo (т.е. в нейтральных физиологических условиях) или in vitro (т.е. в лабораторных условиях).
В соответствии с настоящим изобретением, термин "модулировать" может использоваться взаимозаменяемо с "регулировать" и относится, главным образом, к активации или подавлению конкретной активности. Как используют в рамках изобретения, термин "активировать" может использоваться, главным образом, для описания любого из: индукции, инициации, увеличения, усиления, форсирования, улучшения, повышения, умножения, стимуляции или обеспечения, в отношении конкретной активности. Аналогично, термин "подавлять" можно использовать для описания любого из: уменьшения, снижения, ингибирования, смягчения, сокращения, убавления, блокирования или предупреждения в отношении конкретной активности.
В одном варианте осуществления настоящего изобретения любую из аминокислотных последовательностей, описанных в настоящем описании, можно получать с по меньшей мере одной и вплоть до приблизительно 20 дополнительных гетерологичных аминокислот, фланкирующих каждый из C- и/или N-концов указанной аминокислотной последовательности. Полученный белок или полипептид может быть обозначен как "по существу состоящий из" указанной аминокислотной последовательности. В соответствии с настоящим изобретением гетерологичные аминокислоты представляют собой последовательность аминокислот, которая не встречаются природным образом (т.е. не встречаются в природе, in vivo), фланкируя конкретную аминокислотную последовательность, или которая не связана с функцией указанной аминокислотной последовательности, или которая не кодируются нуклеотидами, которые фланкируют встречающуюся в природе последовательность нуклеиновой кислоты, кодирующую указанную аминокислотную последовательность, как она встречается в гене, если бы такие нуклеотиды во встречающейся в природе последовательности транслировались с использованием стандартного использования кодонов для организма, из которого данная аминокислотная последовательность происходит. Аналогично, выражение "по существу состоящий из", когда его используют в рамках настоящего изобретения в отношении последовательности нуклеиновой кислоты, относится к последовательности нуклеиновой кислоты, кодирующей указанную аминокислотную последовательность, которая фланкируется посредством от одного и вплоть до 60 дополнительных гетерологичных нуклеотидов на каждом из 5'- и/или 3'-конца последовательности нуклеиновой кислоты, кодирующей указанную аминокислотную последовательность. Гетерологичные нуклеотиды не встречаются природным образом (т.е. не встречаются в природе, in vivo), фланкируя последовательность нуклеиновой кислоты, кодирующую определенную аминокислотную последовательность, как она встречается в природном гене, или не кодируют белок, который сообщает любую дополнительную функцию белку или изменяет функцию белка, имеющего определенную аминокислотную последовательность.
В соответствии с настоящим изобретением, выражение "селективно связывается с" относится к способности антитела, антигенсвязывающего фрагмента или связывающего партнера по настоящему изобретению предпочтительно связываться с определенными белками. Более конкретно, выражение "селективно связывает" относится к специфичному связыванию одного белка с другим (например, антитела, его фрагмента или связывающего партнера с антигеном), где уровень связывания при измерении в любом стандартном анализе (например, иммуноанализе), является статистически значимо более высоким, чем фоновый контроль для анализа. Например, при выполнении иммуноанализа контроли, как правило, включают реакционную лунку/пробирку, которая содержит антитело или антигенсвязывающий фрагмент отдельно (т.е. в отсутствие антигена), где величина реактивности (например, неспецифического связывания с лункой) антитела или его антигенсвязывающего фрагмента в отсутствие антигена считается фоновым уровнем. Связывание можно измерять с использованием различных способов, стандартных в данной области, включая иммуноферментные анализы (например, ELISA, анализы с использованием иммуноблоттинга и т.д.).
Общее указание на белок или полипептид, используемые в рамках настоящего изобретения, включает полноразмерные белки, практически полноразмерные белки (определенные выше), или любой фрагмент, домен (структурный, функциональный или иммуногенный), конформационный эпитоп, или гомолог или вариант данного белка. Слитый белок также может в общем называться белком или полипептидом. Выделенный белок в соответствии с настоящим изобретением представляет собой белок (включающий полипептид или пептид), который извлечен из его природной среды (т.е. который подвергнут манипулированию человеком) и может включать очищенные белки, частично очищенные белки, рекомбинантно продуцированные белки и синтетически продуцированные белки. По существу, "выделенный" не отражает степени очистки белка. Предпочтительно, выделенный белок по настоящему изобретению продуцируют рекомбинантным путем. В соответствии с настоящим изобретением, термины "модификация" и "мутация" могут быть использованы взаимозаменяемо, в частности, в отношении модификаций/мутаций аминокислотной последовательности белков или их частей (или последовательностей нуклеиновых кислот), описанных в настоящем описании.
Как используют в рамках изобретения, термин "гомолог" или "вариант" используют для обозначения белка или пептида, которые отличаются от эталонного белка или пептида (т.е. "прототипного" белка или белка "дикого типа") незначительными модификациями эталонного белка или пептида, но которые сохраняют основную структуру белка и боковой цепи встречающейся в природе формы. Такие изменения включают, но не ограничиваются ими: изменения одной или нескольких боковых цепей аминокислот; изменения одной или нескольких аминокислот, включая делеции (например, укороченный вариант белка или пептида), инсерции и/или замены; изменения стереохимии одного или нескольких атомов; и/или незначительные преобразования, включая, но не ограничиваясь ими: метилирование, гликозилирование, фосфорилирование, ацетилирование, миристоилирование, пренилирование, пальмитирование, амидацию и/или присоединение гликозилфосфатидилинозитола. Гомолог или вариант может иметь усиленные, сниженные или по существу сходные свойства по сравнению с эталонным белком или пептидом. Гомолог или вариант может включать агонист белка или антагонист белка. Гомологи или варианты можно получать с использованием способов получения белков, известных в данной области, включая, но не ограничиваясь ими, прямые модификации выделенного эталонного белка, прямой синтез белка или модификации последовательности нуклеиновой кислоты, кодирующей белок, с использованием, например, классических технологий или технологий рекомбинантных ДНК для достижения случайного или направленного мутагенеза, обеспечивающего кодирование варианта белка. Кроме того, могут существовать встречающиеся в природе варианты эталонного белка (например, изоформы, аллельные варианты или другие природные варианты, которые могут возникать от индивидуума к индивидууму) и их можно выделять, получать и/или использовать в рамках изобретения.
Гомолог или вариант данного белка может содержать, по существу состоять или состоять из аминокислотной последовательности, которая по меньшей мере приблизительно на 45%, или по меньшей мере приблизительно на 50%, или по меньшей мере приблизительно на 55%, или по меньшей мере приблизительно на 60%, или по меньшей мере приблизительно на 65%, или по меньшей мере приблизительно на 70%, или по меньшей мере приблизительно на 75%, или по меньшей мере приблизительно на 80%, или по меньшей мере приблизительно на 85%, или по меньшей мере приблизительно на 86%, или по меньшей мере приблизительно на 87%, или по меньшей мере приблизительно на 88%, или по меньшей мере приблизительно на 89%, или по меньшей мере приблизительно на 90%, или по меньшей мере приблизительно на 91% идентична, или по меньшей мере приблизительно на 92% идентична, или по меньшей мере приблизительно на 93% идентична, или по меньшей мере приблизительно на 94% идентична, или по меньшей мере приблизительно на 95% идентична, или по меньшей мере приблизительно на 96% идентична, или по меньшей мере приблизительно на 97% идентична, или по меньшей мере приблизительно на 98% идентична, или по меньшей мере приблизительно на 99% идентична (или любая процентная идентичность между 45% и 99%, с шагом, составляющим целые числа), аминокислотной последовательности эталонного белка (например, аминокислотной последовательности, указанной в настоящем описании или аминокислотной последовательности указанного белка). В одном варианте осуществления гомолог содержит, по существу состоит или состоит из аминокислотной последовательности, которая менее чем на 100% идентична, менее чем приблизительно на 99% идентична, менее чем приблизительно на 98% идентична, менее чем приблизительно на 97% идентична, менее чем приблизительно на 96% идентична, менее чем приблизительно на 95% идентична, и т.д., с шагом 1%, до менее чем приблизительно 70% идентичности аминокислотной последовательности эталонного белка.
Как используют в рамках изобретения, если нет иных указаний, указание на процентную (%) идентичность относится к оценке гомологии, которую проводят с использованием: (1) базового поиска гомологии в Basic Local Alignment Search Tool (BLAST) с использованием blastp для поиска по аминокислотам и blastn для поиска по нуклеиновым кислотам со стандартными параметрами по умолчанию, где последовательность запроса фильтруют по областям низкой комплексности по умолчанию (например, как описано Altschul, S.F., Madden, T.L., Schaaffer, A.A., Zhang, J., Zhang, Z., Miller, W. & Lipman, D.J. (1997) "Gapped BLAST and PSI-BLAST: a new generation of protein database search programs", Nucleic Acids Res. 25:3389-3402, включенная в настоящее описание в качестве ссылки в полном объеме); (2) выравнивание BLAST двух последовательностей (например, с использованием параметров, описанных ниже); (3) и/или PSI-BLAST со стандартными параметрами по умолчанию (Position-Specific Iterated BLAST). Следует отметить, что вследствие некоторых отличий в стандартных параметрах между Basic BLAST и BLAST для двух последовательностей, две конкретных последовательности могут быть распознаны как имеющие значительную гомологию с использованием программы BLAST, в то время как поиск, проведенный в Basic BLAST с использованием одной из последовательностей в качестве последовательности запроса, может не идентифицировать вторую последовательность среди наилучших совпадений. Кроме того, PSI-BLAST обеспечивает автоматизированную простую в использовании версию "профильного" поиска, которая является чувствительным способом для поиска гомологов последовательностей. Сначала программа выполняет поиск в базе данных Gapped BLAST. Программа PSI-BLAST использует информацию от любых значительных выданных выравниваниях для конструирования специфической к положению оценочной матрицы, которая заменяет последовательность запроса для следующего раунда поиска в базе данных. Таким образом, следует понимать, что процентную идентичность можно определять с использованием любой из этих программ.
Две конкретных последовательности можно выравнивать друг с другом с использованием BLAST, как описано в Tatusova and Madden, (1999), "Blast 2 sequences - a new tool for comparing protein and nucleotide sequences", FEMS Microbiol Lett. 174:247-250, включенной в настоящее описание в качестве ссылки в полном объеме. Такое выравнивание последовательностей проводят в blastp или blastn с использованием алгоритма BLAST 2.0 для выполнения поиска в Gapped BLAST (BLAST 2.0) между двумя последовательностями, допуская внесение пропусков (делеций и инсерций) в результат выравнивания. Для целей ясности в рамках настоящего описания, выравнивание последовательностей в BLAST для двух последовательностей проводят с использованием следующих стандартных параметров.
Для blastn, использование матрицы 0 BLOSUM62:
Награда за совпадение = 1
Штраф за несовпадение = -2
Штрафы за внесение пропуска (5) и продолжение пропуска (2)
gap x_dropoff (50) ожидание (10) размер слова (11) фильтр (on)
Для blastp, использование матрицы 0 BLOSUM62:
Штраф за внесение пропуска (11) и продолжение пропуска (1)
gap x_dropoff (50) ожидание (10) размер слова (3) фильтр (on).
Выделенная молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которая извлечена из ее природной среды (т.е. которая подвергнута манипулированию человеком), причем ее природная среда представляет собой геном или хромосому, в которых молекула нуклеиновой кислоты встречается в природе. По существу, "выделенный" не обязательно отражает степень, с которой молекула нуклеиновой кислоты очищена, а указывает на то, что молекула не включает целый геном или целую хромосому или сегмент генома, содержащий более одного гена, в которых молекула нуклеиновой кислоты встречается в природе. Выделенная молекула нуклеиновой кислоты может включать полный ген. Выделенная молекула нуклеиновой кислоты, которая включает ген, не является фрагментом хромосомы, который включает такой ген, а вместо этого включает кодирующую область и регуляторные области, ассоциированные с геном, но не включает дополнительные гены, которые встречаются в природе на той же хромосоме. Выделенная молекула нуклеиновой кислоты также может включать части гена. Выделенная молекула нуклеиновой кислоты также может включать указанную последовательность нуклеиновой кислоты, фланкированную (т.е. на 5'- и/или 3'-конце последовательности) дополнительными нуклеиновыми кислотами, которые обычно не фланкируют указанную последовательность нуклеиновой кислоты в природе (т.е. гетерологичные последовательности). Выделенная молекула нуклеиновой кислоты может включать ДНК, РНК (например, мРНК), или производные либо ДНК, либо РНК (например, кДНК). Хотя выражение "молекула нуклеиновой кислоты", главным образом, относится к физической молекуле нуклеиновой кислоты и выражение "последовательность нуклеиновой кислоты", главным образом, относится к последовательности нуклеотидов в молекуле нуклеиновой кислоты, эти два выражения могут использоваться взаимозаменяемо, особенно в отношении молекулы нуклеиновой кислоты или последовательности нуклеиновой кислоты, способной кодировать белок или домен белка.
Рекомбинантная молекула нуклеиновой кислоты представляет собой молекулу, которая может включать по меньшей мере одну из любой последовательности нуклеиновой кислоты, кодирующей любой один или несколько белков, описанных в настоящем описании, функционально связанных по меньшей мере с одной из любых последовательностей контроля транскрипции, способных эффективно регулировать экспрессию молекулы(молекул) нуклеиновой кислоты в клетке, подлежащей трансфекции. Хотя выражение "молекула нуклеиновой кислоты", главным образом, относится к физической молекуле нуклеиновой кислоты и выражение "последовательность нуклеиновой кислоты", главным образом, относится к последовательности нуклеотидов в молекуле нуклеиновой кислоты, эти два выражения могут использоваться взаимозаменяемо, особенно в отношении молекулы нуклеиновой кислоты или последовательности нуклеиновой кислоты, способной кодировать белок. Кроме того, выражение "рекомбинантная молекула", главным образом, относится к молекуле нуклеиновой кислоты, функционально связанной с последовательностью контроля транскрипции, однако его можно использовать взаимозаменяемо с выражением "молекула нуклеиновой кислоты", которую вводят животному.
Рекомбинантная молекула нуклеиновой кислоты включает рекомбинантный вектор, который представляет собой любую последовательность нуклеиновой кислоты, как правило, гетерологичную последовательность, которая функционально связана с выделенной молекулой нуклеиновой кислоты, кодирующей слитый белок по настоящему изобретению, который способен обеспечивать рекомбинантную продукцию слитого белка, и который способен доставлять молекулу нуклеиновой кислоты в клетку-хозяина в соответствии с настоящим изобретением. Такой вектор может содержать последовательности нуклеиновых кислот, которые не встречаются в природе рядом с выделенными молекулами нуклеиновых кислот, подлежащими встраиванию в вектор. Вектор может представлять собой вектор на основе РНК или ДНК, может быть прокариотическим или эукариотическим, и предпочтительно в рамках настоящего изобретения вектор представляет собой плазмиду, пригодную для трансформации дрожжей. Рекомбинантные векторы можно использовать в клонировании, секвенировании и/или ином манипулировании молекулами нуклеиновых кислот, и его можно использовать для доставки таких молекул (например, как в композиции ДНК или композиции на основе вирусного вектора). Рекомбинантные векторы предпочтительно используют при экспрессии молекул нуклеиновых кислот, и также они могут называться экспрессирующими векторами. Предпочтительные рекомбинантные векторы могут экспрессироваться в трансфицированной клетке-хозяине, такой как дрожжи.
В рекомбинантной молекуле по настоящему изобретению молекулы нуклеиновых кислот функционально связаны с экспрессирующими векторами, содержащими регуляторные последовательности, такие как последовательности контроля транскрипции, последовательности контроля трансляции, ориджины репликации и другие регуляторные последовательности, которые совместимы с клеткой-хозяином и которые контролируют экспрессию молекул нуклеиновых кислот по настоящему изобретению. В частности, рекомбинантные молекулы по настоящему изобретению включают молекулы нуклеиновых кислот, которые функционально связаны с одной или несколькими последовательностями контроля экспрессии. Выражение "функционально связанный" относится к связыванию молекулы нуклеиновой кислоты с последовательностью контроля экспрессии так, чтобы молекула экспрессировалась после трансфекции (т.е. трансформации, трансдукции или трансфекции) клетки-хозяина.
В соответствии с настоящим изобретением термин "трансфекция" используют для обозначения любого способа, посредством которого экзогенную молекулу нуклеиновой кислоты (т.е. рекомбинантную молекулу нуклеиновой кислоты) можно вводить в клетку. Термин "трансформация" может использоваться взаимозаменяемо с термином "трансфекция", когда такой термин используют для обозначения введения молекул нуклеиновых кислот в микробные клетки, такие как водоросли, бактерии и дрожжи. В микробных системах термин "трансформация" используют для описания приобретенного изменения вследствие введения экзогенных нуклеиновых кислот микроорганизмом, и он является по существу синонимичным с термином "трансфекция". Таким образом, способы трансфекции включают, но не ограничиваются ими, трансформацию, химическую обработку клеток, бомбардировку частицами, электропорацию, микроинъекцию, липофекцию, адсорбцию, инфекцию и слияние протопластов.
Следующие экспериментальные результаты предоставлены для целей иллюстрации и не предназначены для ограничения объема изобретения.
ПРИМЕРЫ
Пример 1
В представленном ниже примере описано получение иммунотерапевтической композиции на основе дрожжей с Brachyury.
В этом эксперименте дрожжи (Saccharomyces cerevisiae) модифицировали способами инженерии для экспрессии Brachyury человека под контролем индуцируемого медью промотора CUP1, или конститутивного промотора TEF2, получая иммунотерапевтические композиции на основе дрожжей с Brachyury. В каждом случае слитый белок, содержащий антиген Brachyury, получали в виде единого полипептида со следующими элементами последовательности, слитыми в рамке считывания от N- к C-концу, соответствующими SEQ ID NO: 8 (1) N-концевой пептид, придающий устойчивость к протеасомной деградации и стабилизирующий экспрессию (положения 1-6 SEQ ID NO: 8, пептидная последовательность также представлена в настоящем описании как SEQ ID NO: 11); 2) аминокислоты 2-435 SEQ ID NO: 6, причем SEQ ID NO: 6 соответствует практически полноразмерному белку Brachyury человека (положения 7-440 SEQ ID NO: 8); и (3) гексагистидиновая метка (положения 441-446 SEQ ID NO: 8). Аминокислотные последовательности, используемые в этом слитом белке, можно модифицировать с использованием дополнительных или альтернативных аминокислот, фланкирующих любой из концов антигена Brachyury, если желательно, и также можно использовать более короткие части антигена Brachyury. Последовательность нуклеиновой кислоты, кодирующая слитый белок SEQ ID NO: 8 (кодон-оптимизированная для экспрессии в дрожжах) представлена в настоящем описании в качестве SEQ ID NO: 7.
В кратком изложении, ДНК, кодирующую полноразмерный белок Brachyury человека, из плазмиды Brachyury-PCRII, предоставленной National Cancer Institute (Dr. Jeffrey Schlom), амплифицировали с использованием ПЦР, а затем встраивали в участки клонирования EcoRI и SpeI после промотора CUP1 (вектор pGI-100) или промотора TEF2 (вектор plu011 или pGI-172) в экспрессирующих векторах дрожжей 2 µm. Нуклеотидные последовательности, кодирующие N-концевой стабилизирующий пептид MADEAP (SEQ ID NO: 11) и C-концевой гексагистидиновый пептид, также добавляли к плазмидному вектору, чтобы кодировался полный слитый белок, соответствующий SEQ ID NO: 8. Полученные плазмиды переносили в DH5α для хранения плазмиды и в Saccharomyces cerevisiae W303α для получения иммунотерапевтических композиций на основе дрожжей с Brachyury.
Трансформацию в Saccharomyces cerevisiae проводили посредством трансфекции с ацетатом лития/полиэтиленгликолем, и селекцию первичных трансфектантов проводили на чашках с твердой минимальной средой, лишенной урацила (UDM; среда без уридина). Селекцию колоний проводили путем выращивания в U2 (среда без уридина) или UL2 (среда без уридина и лейцина) при 30°C.
Иммунотерапевтическую композицию на основе дрожжей с Brachyury, содержащую полинуклеотид, кодирующий слитый белок Brachyury человека, соответствующий SEQ ID NO: 8, под контролем промотора CUP1, также обозначают в настоящем описании как GI-6301. Иммунотерапевтическую композицию на основе дрожжей с Brachyury, содержащую полинуклеотид, кодирующий слитый белок Brachyury человека, соответствующий SEQ ID NO: 8, под контролем промотора TEF2 (в векторе plu011) также обозначают в настоящем описании как GI-6302. Иммунотерапевтическую композицию на основе дрожжей с Brachyury, содержащую полинуклеотид, кодирующий слитый белок Brachyury человека, соответствующий SEQ ID NO: 8, под контролем промотора TEF2 (в векторе pGI-172) также обозначают в настоящем описании как GI-6303.
Жидкие культуры, лишенные уридина (U2) или лишенные уридина и лейцина (UL2), инокулировали с использованием чашек и стартовых культур, описанных выше, и выращивали в течение 20 ч при 30°C, 250 об./мин. Также инокулировали pH-забуференную среду, содержащую 4,2 г/л Bis-Tris (BT-U2; BT-UL2) для оценки иммунотерапевтических средств на основе дрожжей с Brachyury, полученных в условиях изготовления с нейтральным значением pH (данные не представлены). Первичные культуры использовали для инокуляции конечных культур с тем же составом.
Состав жидкой среды U2:
- 15 г/л глюкозы
- 6,7 г/л азотистых оснований дрожжей, содержащих сульфат аммония
- 0,04 г/л каждого из гистидина, триптофана, аденина и 0,06 г/л лейцина
Состав жидкой среды UL2:
- 15 г/л глюкозы
- 6,7 г/л азотистых оснований дрожжей, содержащих сульфат аммония
- 0,04 г/л каждого из гистидина, триптофана и аденина.
В первоначальных экспериментах, в которых сравнивались иммунотерапевтические композиции на основе дрожжей с Brachyury под контролем различных промоторов, запускаемую CUP1 (индуцибельная экспрессию) экспрессию Brachyury дрожжами инициировали добавлением 0,5 мМ сульфата меди после достижения культурой дрожжей с Brachyury плотности приблизительно 0,2 Д.Е./мл, и продолжали до достижения культурой плотности 0,5-1,5 Д.Е. (после добавления сульфата меди дрожжи с Brachyury удваивались только в 1-1,5 раза, однако клетками продуцировалось большое количество белка Brachyury). Запускаемая TEF2 экспрессия дрожжами Brachyury является конститутивной, и выращивание этих клеток продолжали до тех пор, пока культуры не достигали плотности от 1,1 до 4,0 Д.Е./мл. Затем клетки из каждой культуры собирали, промывали и убивали нагреванием при 56°C в течение 1 часа в PBS. Также для сравнения обрабатывали живые клетки из каждой культуры.
После обеспечения гибели культур нагреванием клетки промывали три раза в PBS. Общую экспрессию белка измеряли анализом преципитации с TCA/связывания нитроцеллюлозы и вестерн-блоттингом с использованием моноклонального антитела против his-метки и антитела против Brachyury (Abcam, Cambridge, MA). Содержание белка количественно определяли с использованием полуколичественных способов цифровой визуализации.
Результаты первоначальных экспериментов по экспрессии (данные не представлены) продемонстрировали, что каждая из иммунотерапевтических композиций дрожжей с Brachyury по изобретению экспрессировала слитый белок Brachyury, т.е. с использованием как промотора CUP1, так и промотора TEF2, и экспрессия выявлялась с использованием любой из сред (U2 и UL2). Кроме того, экспрессия антигена выявлялась как в убитых нагреванием, так и в живых клетках дрожжей (данные не представлены). Экспрессия Brachyury была значительно более высокой в иммунотерапевтической композиции на основе дрожжей с Brachyury, содержащей промотор CUP1 (GI-6301), и, таким образом, эта композиция была выбрана для дальнейших испытаний, включая оптимизацию экспрессии, и для экспериментов in vitro и in vivo (см. примеры ниже).
На фиг.1A представлена экспрессия Brachyury в GI-6301 с использованием как среды U2, так и среды UL2, при использовании антитела против Brachyury для детекции. Контрольные дрожжи, экспрессирующие антиген, не являющийся Brachyury, не окрашивались антителом. На фиг.1B показана экспрессия Brachyury в тех же препаратах GI-6301 с использованием антитела против His для идентификации гексагистидиновой метки на слитом белке Brachyury. Также показаны контрольные дрожжи, экспрессирующие антиген, не являющийся Brachyury, но имеющий гексагистидиновую метку. Эти результаты показали хорошую экспрессию Brachyury с использованием любой из сред, хотя экспрессия в среде UL2 была значительно более высокой.
Пример 2
В представленном ниже примере описана идентификация условий экспрессии антигена и производства иммунотерапевтической композиции на основе дрожжей с Brachyury GI-6301.
Для определения оптимальной плотности для индукции медью экспрессии антигена GI-6301, приготавливали исходную и промежуточную культуры GI-6301 с использованием стандартных условий выращивания в среде UL2, описанной в примере 1 выше. Затем аликвоты культуры разбавляли до 0,5 Д.Е./мл, 1,0 Д.Е./мл и 1,5 Д.Е./мл и инкубировали при 30°C в течение 1 часа. К культурам добавляли 0,5 мМ CuSO4 для индукции экспрессии и Brachyury и культивирование продолжали. Клетки собирали и подсчитывали через 6 часов и 14 часов для измерения плотности клеток. 20 Д.Е. убитых нагреванием дрожжей из каждых условий подвергали лизису, измеряли общий уровень белка и получали вестерн-блоты с использованием антитела против His.
Как показано в таблице 1, дрожжи удваивались приблизительно только 1 раз после индукции медью (другие эксперименты показали вплоть до 1,5X удвоения), и плотность и жизнеспособность клеток (не представлено) снижалась через 6 часов после индукции медью. На фиг.2 показано, что все три плотности индукции приводили к значительной экспрессии Brachyury, с тенденцией к более высокой экспрессии Brachyury при более высоких плотностях индукции. Однако дополнительные эксперименты с использованием плотностей начала индукции 2,1 Д.Е./мл и 2,8 Д.Е./мл и 375 мкМ CuSO4 показали, что экспрессия белка начала снижаться по мере увеличения плотности культур в начале индукции медью, и не улучшалась значительно через приблизительно 6-8 часов (данные не представлены).
Далее исследовали эффект количества CuSO4 на экспрессию Brachyury. GI-6301 выращивали из исходных и промежуточных культур в среде UL2, как описано в примере 1. Затем аликвоты культуры разбавляли до 1,0 Д.Е./мл и инкубировали при 30°C в течение 1 часа. CuSO4 добавляли к каждой культуре в концентрации либо 375 мкМ, либо 500 мкМ, и индукции экспрессии белка позволяли происходить в течение различных моментов времени (2 ч, 4 ч, 6 ч, 8 ч, 24 ч), и в этот момент времени клетки собирали, убивали нагреванием и обрабатывали для оценки экспрессии белка с использованием вестерн-блотов с антителами против His, как описано выше. Хотя обе концентрации CuSO4 приводили к хорошей экспрессии Brachyury, экспрессия белка с использованием 375 мкМ оказалась немного лучшей, в частности, в более поздние моменты времени (данные не представлены).
Таким образом, для запускаемой CUP1 экспрессии дрожжами Brachyury (индуцибельная экспрессия), авторы изобретения открыли, что индукция экспрессия антигена в средней логарифмической фазе роста дрожжей была оптимальной для продуцирования антигена. Для продуцирования иммунотерапевтической композиции на основе дрожжей с Brachyury (GI-6301), используемой в следующих примерах, клетки выращивали в среде UL2, как описано в примере 1, до от 1 до 2 Д.Е./мл, а затем индуцировали добавлением 0,375-0,5 мМ сульфата меди в течение вплоть до 6-8 часов при 30°C, 250 об./мин. Клетки собирали, промывали и убивали нагреванием при 56°C в течение 1 ч в PBS.
Пример 3
В представленном ниже примере описано конструирование и продуцирование дополнительной иммунотерапевтической композиции на основе дрожжей с Brachyury, где антиген Brachyury содержит эпитоп-агонист T-клеток.
В этом эксперименте дрожжи (Saccharomyces cerevisiae) конструировали так, чтобы они экспрессировали антиген Brachyury человека, который представляет собой практически полноразмерный белок Brachyury, содержащий T-клеточный эпитоп WLLPGTSTV (SEQ ID NO: 13), который является эпитопом-агонистом. Нативный T-клеточный эпитоп Brachyury, присутствующий в SEQ ID NO: 6 или 8, например, представляет собой WLLPGTSTL (SEQ ID NO: 12). Антиген-агонист Brachyury человека экспрессировали под контролем индуцируемого медью промотора CUP1, с получением иммунотерапевтической композиции на основе дрожжей с Brachyury. Более конкретно, слитый белок, содержащий антиген-агонист Brachyury (т.е. антиген Brachyury, содержащий по меньшей мере один эпитоп-агонист) продуцировали в качестве единого полипептида со следующими элементами последовательности в рамке считывания от N- к C-концу, соответствующими SEQ ID NO: 20 (1) N-концевой пептид, сообщающий устойчивость к протеасомной деградации и стабилизирующий экспрессию (положения 1-6 SEQ ID NO: 20, пептидная последовательность также представлена в настоящем описании как SEQ ID NO: 11); 2) аминокислоты 2-435 SEQ ID NO: 18 (соответствующие положениям 7-440 SEQ ID NO: 20; SEQ ID NO: 18 соответствует полноразмерному белку-агонисту Brachyury человека, имеющему одну аминокислотную замену в положении 254 по сравнению с белком Brachyury дикого типа); и (3) гексагистидиновая метка (положения 441-446 SEQ ID NO: 20). Эпитоп-агонист (SEQ ID NO: 13) расположен в положениях 251-259 SEQ ID NO: 20 (положения 246-254 SEQ ID NO: 18). Аминокислотные последовательности, используемые в этом слитом белке, можно модифицировать с использованием дополнительных или альтернативных аминокислот, фланкирующих любой из концов антигена Brachyury, если желательно, и также можно использовать более короткие части антигена Brachyury. Последовательность нуклеиновой кислоты, кодирующая слитый белок SEQ ID NO: 20 (кодон-оптимизированная для экспрессии в дрожжах) представлена в настоящем описании как SEQ ID NO: 19.
В кратком изложении, ДНК, кодирующую практически полноразмерный белок Brachyury человека, как описано в примере 1 (т.е. полноразмерный Brachyury минус N-концевой метионин), модифицированную посредством сайт-направленного мутагенеза для внесения замены лейцина на валин в положении 254 в отношении полноразмерного белка Brachyury, амплифицировали с использованием ПЦР, а затем встраивали в участки клонирования EcoRI и SpeI после промотора CUP1 (вектор pGI-100) в экспрессирующих векторах дрожжей 2 мкм. Также в плазмидный вектор добавляли нуклеотидные последовательности, кодирующие N-концевой стабилизирующий пептид MADEAP (SEQ ID NO: 11) и C-концевой гексагистидиновый пептид так, чтобы кодировался полный слитый белок, соответствующий SEQ ID NO: 20. Полученными плазмидами трансформировали DH5α для хранения плазмиды и Saccharomyces cerevisiae W303α для продукции иммунотерапевтической композиции на основе дрожжей с Brachyury.
Трансформацию в Saccharomyces cerevisiae проводили трансфекцией с ацетатом лития/полиэтиленгликолем, и первичные трансфектанты отбирали на чашках с твердой минимальной средой, лишенной урацила (UDM; среда без уридина). (UDM; среда без уридина). Селекцию колоний проводили путем выращивания в UL2 (среда без уридина и лейцина) при 30°C.
Иммунотерапевтическую композицию на основе дрожжей с Brachyury, содержащую полинуклеотид, кодирующий слитый белок агониста Brachyury человека, соответствующий SEQ ID NO: 20, под контролем промотора CUP1, также обозначают в настоящем описании как GI-6305.
Клетки GI-6305 выращивали в среде UL2, как описано в примере 1, до от 1 до 2 Д.Е./мл, а затем индуцировали добавлением 0,375-0,5 мМ сульфата меди в течение вплоть до 6-8 часов при 30°C, 250 об./мин, с использованием условий, разработанных авторами изобретения для GI-6301, как описано в примере 2. Клетки собирали, промывали и обеспечивали их гибель нагреванием при 56°C в течение 1 ч в PBS.
После обеспечения гибели нагреванием культур клетки промывали три раза в PBS. Общую экспрессию белка измеряли в анализе преципитации с TCA/связывания нитроцеллюлозы и вестерн-блоттингом с использованием моноклонального антитела против his-метки и антитела против Brachyury (Abcam, Cambridge, MA). Содержание белка количественно определяли с использованием полуколичественных способов цифровой визуализации.
На фиг.1C показана устойчивая экспрессия антигена-агониста Brachyury в GI-6305 с использованием антитела против His для идентификации гексагистидиновой метки на слитом белке Brachyury. Приблизительное содержание антигена для GI-6305, выращенных в среде UL2 в этом эксперименте составило >22615 нг/Д.Е.
Пример 4
Следующий пример демонстрирует увеличение в количестве специфичных к Brachyury T-клеток с использованием иммунотерапевтической композиции на основе дрожжей с Brachyury по изобретению.
Для определения того, способны ли T-клетки от нормальных доноров формировать T-клетки, которые являются специфичными к антигену Brachyury, получали дендритные клетки (DC) из мононуклеарных клеток периферической крови (PBMC) двух нормальных доноров. В кратком изложении, выделенные PBMC культивировали в течение 5 суток в присутствии GM-CSF и IL-4, а затем инкубировали с контрольными дрожжами (также обозначаемыми как "YVEC", которые представляют собой дрожжи Saccharomyces cerevisiae, которые трансформированы пустым вектором или вектором, который не содержит кодирующей антиген вставки) или дрожжами с Brachyury (GI-6301, описаны в примерах 1 и 2 выше), в соотношении дрожжи:DC=1:1. После кокультивирования в течение 48 часов DC использовали в качестве APC для стимуляции аутологичных T-клеток. Каждый цикл стимуляции, обозначенный как IVS (стимуляция in vitro), состоял из культивирования в течение 3 суток в отсутствие IL-2, с а затем в течение 4 дополнительных суток в присутствии рекомбинантного IL-2 (20 Е/мл). В конце IVS 2, T-клетки окрашивали контрольным тетрамером или тетрамером, специфичным к пептиду Brachyury Tp2 (WLLPGTSTL, положения 246-254 SEQ ID NO: 2 или SEQ ID NO: 6). В таблице 2 представлен процент CD8+ T-клеток, которые окрашивались положительно каждым тетрамером.
Во втором эксперименте получали дендритные клетки (DC) из PBMC девяти здоровых доноров с использованием культивирования в течение 5 суток в присутствии GM-CSF и IL-4, а затем инкубировали с дрожжами Brachyury (GI-6301), в соотношении дрожжи:DC = 1:1, как описано выше. После кокультивирования в течение 48 часов DC использовали в качестве APC для стимуляции аутологичных T-клеток. Каждый цикл IVS выполняли, как описано выше. В конце IVS 2 T-клетки окрашивали контрольным тетрамером или тетрамером, специфичным к пептиду Brachyury Tp2. В таблице 3 представлен процент CD8+ T-клеток, окрашенных положительно каждым тетрамером.
Результаты в таблицах 2 и 3 показывают, что стимуляция T-клеток здорового донора иммунотерапевтической композицией на основе дрожжей с Brachyury по изобретению увеличивает процент тетрамер-положительных CD8+ T-клеток у большинства здоровых доноров по сравнению с контролями, указывая на то, что нормальные T-клетки человека способны распознавать Brachyury в качестве иммуногена.
Пример 5
Представленный ниже пример демонстрирует способность иммунотерапевтической композиции на основе дрожжей с Brachyury формировать из PBMC здорового донора специфичные к Brachyury CTL, которые лизируют экспрессирующие Brachyury мишени.
В этом эксперименте специфичные к Brachyury T-клетки от трех из здоровых доноров, представленных в таблице 2 выше, увеличивали в количестве in vitro с использованием DC, инкубированных с дрожжами с Brachyury (GI-6301) на протяжении 2 циклов IVS (как описано в примере 4). Третью IVS проводили с DC, созревшими в присутствии CD40L и обработанными специфическим для Brachyury пептидом Tp2 (WLLPGTSTL, положения 246-254 SEQ ID NO: 2 или SEQ ID NO: 6). На 5 сутки CD8+ T-клетки выделяли и использовали в анализе цитотоксических T-лимфоцитов (CTL) в течение ночи против опухолевых клеток-мишеней SW480 (HLA-A2+/высокая экспрессия Brachyury) и MCF7 (HLA-A2+/низкая экспрессия Brachyury), при указанных соотношениях эффектор:мишень (ET) (см. фиг.3). В таблице 4 показан процент CD8+ T-клеток, которые окрашивались положительно контрольным тетрамером относительно специфического для Tp2 Brachyury тетрамера.
На фиг.3A (донор 07706), 3B (донор 17663) и 3C (донор 26532) показано, что PBMC от двух из трех здоровых доноров были способны формировать CD8+ CTL, которые могли убивать мишени, экспрессирующие Brachyury. Взятые вместе, эти данные демонстрируют, что иммунотерапевтические композиции на основе дрожжей с Brachyury могут формировать специфичные к Brachyury CTL, которые способны убивать экспрессирующую Brachyury опухолевую клетку.
Чтобы показать, что иммунотерапия на основе дрожжей с Brachyury может индуцировать специфичные к Brachyury CTL в отсутствие обработки специфическим пептидом (т.е. путем формирования CTL против потенциально множества различных эпитопов CTL), проводили дополнительные эксперименты с использованием T-клеток здоровых доноров, увеличенных в количестве in vitro с использованием только иммунотерапевтической композиции на основе дрожжей с Brachyury GI-6301 (т.е. без обработки пептидом). В кратком изложении, специфичные к Brachyury T-клетки из PBMC здорового донора (донор 19063) увеличивали в количестве in vitro с использованием DC, инкубированных с GI-6301, на протяжении 2 циклов IVS (как описано в примере 4). На 5 сутки CD8+ T-клетки выделяли и использовали в анализе CTL в течение ночи против клеток опухоли SW480 (HLA-A2-положительные/с высокой экспрессией Brachyury) и H226 (HLA-A2-отрицательные/с высокой экспрессией Brachyury) при соотношении эффектор:мишень (ET) 15:1. На фиг.4A показан процент специфического лизиса опухолевых клеток SW480 и H226. На фиг.4B показана экспрессия мРНК Brachyury относительно экспрессии мРНК GAPDH в клетках опухоли SW480 и H226 с помощью ОТ-ПЦР в реальном времени. Эти эксперименты далее демонстрируют, что иммунотерапевтическая композиция на основе дрожжей с Brachyury может формировать специфичные к Brachyury CTL, которые способны убивать экспрессирующую Brachyury клетку опухоли.
Пример 6
Представленный ниже пример демонстрирует, что композиция на основе дрожжей с Brachyury может увеличивать в количестве специфичные к Brachyury T-клетки от пациентов со злокачественной опухолью.
В этом эксперименте получали DC из PBMC двух пациентов с раком молочной железы после вакцинации вакцинами на основе вирусного вектора, содержащего антигены CEA и MUC-1. DC получали культивированием в течение 5 суток в присутствии GM-CSF и IL-4, как описано в примере 4, а затем путем инкубации в присутствии дрожжей Brachyury (GI-6301) в соотношении дрожжи:DC=1:1. После кокультивирования в течение 48 часов DC использовали в качестве APC для стимуляции аутологичных T-клеток. Каждый цикл IVS состоял из 3 суток в отсутствие IL-2, а затем 4 дополнительных суток в присутствии 20 Е/мл рекомбинантного IL-2. В таблице 5 представлен процент CD8+ T-клеток (IVS1), которые окрашивались положительно контрольным тетрамером или тетрамером, специфичным к пептиду Brachyury Tp2.
Результаты, представленные в таблице 5, демонстрируют, что стимуляция T-клеток от доноров с раком молочной железы иммунотерапевтической композицией на основе дрожжей с Brachyury по изобретению увеличивает процент положительных по тетрамеру CD8+ T-клеток у большинства доноров по сравнению с контролями, указывая на то, что T-клетки от доноров с имеющейся злокачественной опухолью обладают способностью распознавать Brachyury в качестве иммуногена.
Пример 7
Представленный ниже пример демонстрирует формирование ответов CD4+ T-клеток, специфичных к Brachyury, in vivo с использованием иммунотерапии на основе дрожжей с Brachyury.
В этом эксперименте мышей C57BL/6 вакцинировали раз в неделю всего 4 раза посредством 4 Д.Е дрожжей с hBrachyury (GI-6301), вводимых в четыре различных области инъекции по 1 Д.Е. на область). Через две недели после последнего вспомогательного введения мышей умерщвляли и CD4+ T-клетки очищали и анализировали в отношении пролиферации в присутствии различных концентраций очищенного белка Brachyury (полученного из клеток насекомых). В качестве контроля использовали β-Gal в концентрации 40 мкг/мл.
Результаты, показывающие пролиферацию CD4+ T-клеток, выделенных из селезенок животных, вакцинированных дрожжевым контролем (YVEC, см. пример 4) и дрожжами с hBrachyury (GI-6301), представлены на фиг.5. На фиг.5 показано, что иммунизация дрожжами с Brachyury (GI-6301) формирует специфичные к Brachyury CD4+ T-клетки.
Пример 8
Представленный ниже пример демонстрирует, что иммунизация иммунотерапевтической композицией на основе дрожжей с Brachyury уменьшает экспрессирующие Brachyury опухоли in vivo.
В этом эксперименте мышам C57BL/6 вводили 1×106 клеток MC38-phBrachyury (клетки опухоли MC38, экспрессирующие рекомбинантный Brachyury человека) через хвостовую вену (0 сутки). Через четверо суток после имплантации опухоли животным начинали проводить вакцинацию раз в неделю посредством контроля (YVEC, см. пример 4) против дрожжей с hBrachyury (GI-6301), вводимых в дозе 1 Д.Е. на область в четыре различных области (всего 4 Д.Е. на дозу). На 40 сутки после имплантации животных умерщвляли и оценивали количество узлов опухоли в легких. Результаты двух объединенных экспериментов представлены на фиг.6. В таблице 6 показано среднее количество опухолей в легких (±SEM) и количество (и процент) животных, имеющих ≥5 узлов в легких.
Результаты, представленные на фиг.6 и в таблице 6, демонстрируют, что введение иммунотерапевтической композиции на основе дрожжей с Brachyury по изобретению способно уменьшать экспрессирующие Brachyury опухоли у мышей по сравнению с мышами, которым вводили дрожжи отдельно (без антигена Brachyury).
Пример 9
Следующий пример демонстрирует формирование ответов специфичных к Brachyury CD4+ T-клеток in vitro с использованием иммунотерапии на основе дрожжей с Brachyury в мононуклеарных клетках периферической крови (PBMC) человека, полученных от здоровых доноров.
В следующих экспериментах полноразмерный белок Brachyury человека экспрессировали в клетках насекомых с помощью бакуловирусной экспрессии, а затем очищали.
Дендритные клетки (DC) получали из PBMC здоровых доноров посредством культивирования в течение 5 суток с GM-CSF и IL-4, а затем обрабатывали in vitro дрожжевым контролем (YVEC, см. пример 4) или дрожжами с Brachyury (GI-6301, см. примеры 1 и 2) (соотношение дрожжи:DC=1:1). Через 48 часов DC собирали, облучали (30 Гр) и использовали для стимуляции аутологичных PBMC в соотношении DC:PBMC=1:10. На 3 сутки к культурам добавляли IL-2 (10 Е/мл). На 7 сутки стимулированные T-клетки собирали, а затем исследовали в отношении продукции IFN-γ в ответ на аутологичные облученные PBMC (соотношение T-клетки:PBMC = 1:3) отдельно или в присутствии 10 мкг/мл очищенного белка Brachyury или контрольного белка сывороточного альбумина человека. После стимуляции в течение 96 часов супернатанты собирали и оценивали в отношении уровней IFN-γ с помощью анализа ELISA. Оценивали всего 9 здоровых доноров, причем 3/9 доноров демонстрировали ответы специфичных к Brachyury CD4+ T-клеток после стимуляции in vitro DC, обработанными дрожжами с Brachyury. Результаты для 3 положительных случаев представлены в таблице 7 (величины указывают на уровни IFN-γ в ответ на белок Brachyury после вычитания фоновых уровней, индуцированных стимуляцией контрольным белком сывороточного альбумина человека; для донора 3 проводили два цикла стимуляции перед оценкой ответа на белок Brachyury).
Шесть дополнительных здоровых доноров оценивали в отношении ответов CD4+ T-клеток на белок Brachyury после стимуляции in vitro посредством DC, обработанных дрожжами с Brachyury (GI-6301), путем внутриклеточного окрашивания цитокина IFN-γ в CD4+ клетках. Дендритные клетки получали из PBMC здоровых доноров путем культивирования в течение 5 суток с GMCSF и IL-4, а затем обрабатывали in vitro дрожжевым контролем (YVEC) или дрожжами с Brachyury (GI-6301) (соотношение дрожжи:DC = 1:1). Через 48 часов DC собирали, облучали (30 Гр) и использовали для стимуляции аутологичных PBMC при соотношении DC:PBMC = 1:10. На 3 сутки к культурам добавляли IL-2 (10 Е/мл). На 7 сутки стимулированные T-клетки собирали, а затем исследовали в отношении продукции IFN-γ в ответ на аутологичные PBMC (соотношение T-клетки: PBMC = 1:3) отдельно или в присутствии 10 мкг/мл очищенного белка Brachyury или контрольного белка сывороточного альбумина человека. После стимуляции в течение 2 часов к культурам добавляли ингибитор транспорта белков BD GOLGISTOP™ (BD Biosciences). После стимуляции в течение 4 часов клетки собирали, обеспечивали их проницаемость и окрашивали в отношении CD4 и IFN-γ с использованием антитела против CD4 с PerCP-Cy5.5 и антитела против IFN-γ с FITC (BD Biosciences). Оценивали всего 6 здоровых доноров, причем 2/6 доноров продемонстрировали специфичные к Brachyury ответы CD4+ T-клеток после стимуляции in vitro посредством DC, обработанных дрожжами с Brachyury. Результаты для положительных случаев представлены в таблице 8 (величины указывают на процент T-клеток, которые были одновременно положительными в отношении CD4 и внутриклеточного IFN-γ в ответ на контрольный сывороточный альбумин человека (HSA) или белок Brachyury после вычитания фоновых уровней, индуцированных стимуляцией посредством PBMC отдельно).
Пример 10
Представленный ниже пример демонстрирует, что иммунотерапевтическая композиция на основе дрожжей с Brachyury, экспрессирующая антиген-агонист Brachyury, формирует специфичные к Brachyury T клетки из клеток пациента с раком предстательной железы.
Для получения специфичной к Brachyury линии T-клеток, незрелые аутологичные дендритные клетки (DC) подвергали воздействию иммунотерапевтической композиции на основе дрожжей с Brachyury, известной как GI-6305 (см. пример 3) в соотношении DC:GI-6305=1:1 в течение 48 часов, а затем использовали в качестве антигенпредставляющих клеток (APC) для стимуляции аутологичных неприкрепляющихся клеток в соотношении эффектора к APC 10:1. Культуры инкубировали в течение 3 суток при 37°C в увлажненной атмосфере, содержащей 5% CO2, а затем дополняли рекомбинантным IL-2 человека в концентрации 20 Е/мл в течение дополнительных 7 суток. Культивирование в течение 10 суток составляло один цикл стимуляции in vitro (IVS). T-клетки повторно стимулировали посредством подвергнутых воздействию GI-6305 аутологичных DC, как описано выше, на 11 сутки, чтобы начать следующий цикл IVS. Подвергнутые воздействию GI-6305 аутологичные DC использовали в качестве APC в течение трех циклов IVS. После третьей IVS облученные (23000 рад) аутологичные трансформированные EBV B-клетки, обработанные пептидом-агонистом Brachyury WLLPGTSTV (SEQ ID NO: 13), использовали в качестве APC. Получали специфичную к Brachyury линию T-клеток, обозначаемую T-2-BR-A. Эту линию T-клеток использовали в иммуноанализах, описанных ниже.
В таблице 9 продемонстрировано, что специфичные к Brachyury T-клетки (T-2-BR-A) высвобождают значительные уровни IFN-γ после стимуляции аллогенными DC, обработанными GI-6305, в то время как контроли (YVEC, см. пример 4) не стимулировали высвобождение IFN-γ клетками T-2-BR-A. Результаты выражены в пг/мл/105 T-клеток. В кратком изложении, аллогенные положительные по HLA-A2 DC от здорового донора обрабатывали GI-6305 в течение 48 часов при различных соотношениях дрожжей и DC (указанных в таблице 9), а затем использовали для стимуляции специфичных к эпитопу-агонисту Brachyury T-клеток (T-2-BR-A). В этом эксперименте соотношение DC и T-клеток составило 1:10.
В таблице 10 показано, что специфичные к Brachyury T-клетки, полученные с использованием DC, обработанных GI-6305, могут эффективно лизировать клетки рака молочной железы MDA-MB-231, которые являются положительными по HLA-A2/положительными по Brachyury, но не лизируют клетки рака поджелудочной железы ASPC-1, которые являются отрицательными по HLA-A2 /положительными по Brachyury. В кратком изложении специфичную к Brachyury линию T-клеток T-2-BR-A использовали после IVS-6 в анализе цитотоксических T-лимфоцитов (CTL) в течение ночи против опухолевых клеток-мишеней MDA-MB-231 (HLA-A2+/Brachyury+) и ASPC-1 (HLA-A2-/Brachyury+), при указанных соотношениях эффектор:мишень (ET) (см. таблицу 10). Результаты выражены в качестве процентного специфического лизиса.
В другом эксперименте оценивали способность линии клеток T-2-BR-A связываться со специфичными к Brachyury тетрамерами HLA-A2. В кратком изложении клетки T-2-BR-A (использованные после IVS-4) окрашивали контрольным тетрамером или тетрамером, специфичным к пептиду-агонисту Brachyury. На фиг.7A и 7B показано, что 10,8% CD8+ T-клеток в линии клеток T-2-BR-A, полученных с помощью DC, обработанных GI-6305, специфично связываются с тетрамером Brachyury-HLA-A2 (фиг.7B), но не с контрольным тетрамером (фиг.7A).
Экспрессию перфорина линией T-клеток T-2-BR-A анализировали проточной цитометрией (перфорин является медиатором цитолитической активности цитотоксических T-лимфоцитов (CTL)). В кратком изложении, T-клетки исследовали на 5 сутки после повторной стимуляции обработанными пептидом-агонистом Brachyury аутологичными трансформированными EBV B-клетками. На фиг.8 показана экспрессия перфорина в клеточной линии T-2-BR-A после стимуляции обработанными пептидом-агонистом Brachyury аутологичными B-клетками, далее демонстрируя цитотоксическую способность этой специфичной к Brachyury линии T-клеток, которую получали с использованием DC, обработанных GI-6305.
Пример 11
В представленном ниже примере описано клиническое испытание 1 фазы у индивидуумов с положительной по Brachyury злокачественной опухолью.
Было начато открытое клиническое испытание 1 фазы с поэтапным увеличением дозы с использованием иммунотерапевтической композиции на основе дрожжей с Brachyury, известной как GI-6301, описанной в примерах 1, 2 и 4-9. Согласно этому протоколу клинических испытаний 9-18 пациентам со злокачественной опухолью (3-6 пациентов на группу введения дозы) вводят иммунотерапевтическую композицию на основе дрожжей с Brachyury, известную как GI-6301, в протоколе поэтапного увеличение дозы в группах с использованием диапазонов доз 4 Д.Е. (1 Д.Е. × 4 области, что означает, что 1 Д.Е. GI-6301 вводят в 4 различных области тела пациента при каждом посещении), 16 Д.Е. (4 Д.Е. × 4 области) и 40 Д.Е. (10 Д.Е. × 4 области), вводимых подкожно. GI-6301 вводят с интервалами 2 недели в течение всего 7 посещений (~3 месяца), а затем каждый месяц до тех пор, пока пациенты не начнут удовлетворять критериями исключения из испытания. Для дополнительного исследования выбирают расширенную группу пациентов (n=10) при максимальной переносимой дозе (MTD) или наилучшей наблюдаемой дозе. Результатами является мониторинг безопасности и переносимости в качестве первичного результата и в расширенной группе результатом является то, выявляется ли значительное изменение предшественников T-клеток, измеряемое по увеличению специфичных к Brachyury T-клеток в анализе ELISpot и пролиферации в ответ на белок Brachyury (например, специфичные к Brachyury CD8+ или CD4+ T-клетки, появляющиеся или увеличивающиеся в количестве при введении). В качестве вторичных результатов измеряют клиническую пользу, такую как выживаемость без прогрессирования, клинический радиографический ответ, снижение уровней сывороточных маркеров и/или уменьшение количества циркулирующих опухолевых клеток, а также параметры общей активации иммунной системы, включая частоту подгрупп иммунных клеток в периферической крови (CD8+ памяти /эффекторные T-клетки, CD4+ памяти/эффекторные T-клетки, Treg, NK-клетки, DC) и изменения уровней цитокинов в сыворотке (например, IFN-γ, IL-10, IL-12, IL-2, IL-4, TGF-β и т.д.).
Ожидается, что GI-6301 является безопасным и хорошо переносимым без значительной токсичности. Кроме того, ожидается, что GI-6301 обеспечит вызываемые лечением ответы специфичных к Brachyury T-клеток или улучшение ранее существующих специфичных к Brachyury исходных ответов T-клеток по меньшей мере у никоторых или у большинства пациентов. Также ожидается, что некоторые пациенты будут иметь стабилизированное заболевание.
В дополнительном испытании или расширении этого испытания иммунотерапевтическую композицию на основе дрожжей с Brachyury, известную как GI-6305 (см. пример 3), вводят дополнительной группе пациентов с использованием максимально переносимой дозы или наблюдаемой наилучшей дозы, определенной выше, и измеряют те же первичные и вторичные результаты. Также ожидается, что GI-6305 будет безопасным и хорошо переносимым без значительной токсичности, а также обеспечит вызываемые лечением ответы специфичных к Brachyury T-клеток или улучшение ранее существующих исходных ответов специфичных к Brachyury T-клеток по меньшей мере у некоторых или у большинства пациентов. Также ожидается, что некоторые пациенты будут иметь стабилизированное заболевание.
Пример 12
В представленном ниже примере описано клиническое испытание 2 фазы с использованием иммунотерапевтических композиций на основе дрожжей с Brachyury.
Проводят рандомизированное клиническое испытание 2 фазы у пациентов с раком молочной железы с использованием иммунотерапевтической композиции на основе дрожжей с Brachyury, как описано в примере 1 и 2 (например, GI-6301) или в примере 3 (GI-6305). Включают по меньшей мере 100 или более индивидуумов с положительным по Brachyury раком молочной железы стадии I, II или III. Критерии включения индивидуумов могут включать индивидуумов со злокачественными опухолями степени 1, 2 или 3. Критерии включения индивидуумов также включают индивидуумов с "тройным отрицательным" раком молочной железы (злокачественные опухоли, которые являются отрицательными по каждому из рецептора эстрогена (ER), рецептора прогестерона (PR) и HER2). Критерии включения индивидуумов также могут включать пациентов со злокачественной опухолью, отрицательной по лимфатическим узлам.
Испытание проводят в качестве двойного слепого или открытого плацебо-контролируемого многоцентрового испытания. Всем пациентам проводят стандартную терапию, где пациентам группы введения проводят несколько серийных инъекций иммунотерапевтической композиции на основе дрожжей с Brachyury в ходе лечения. Первичным результатом является выживаемость без рецидива или общая выживаемость. Дополнительные результаты могут включать ответы антигенспецифических T-клеток (например, специфичные к Brachyury CD8+ T-клетки, появившиеся или увеличившиеся в количестве при лечении), поддержание негативности по лимфатическим узлам, прогрессирование в метастазы и экспрессия Brachyury в опухолевых клетках.
Ожидается, что иммунотерапевтическая композиция на основе дрожжей с Brachyury будет безопасной и хорошо переносимой без значительной токсичности. Кроме того, ожидается, что иммунотерапевтическая композиция на основе дрожжей с Brachyury будет вызывать вызываемые лечением ответы специфичных к Brachyury T-клеток и/или увеличение ранее существующих исходных ответов специфичных к Brachyury T-клеток по меньшей мере у некоторых или большинства пациентов. Также ожидается, что некоторые или большинство пациентов будут иметь стабилизированное заболевание, у них будет поддерживаться негативность по лимфатическим узлам и/или будет предупреждаться, снижаться или останавливаться метастатическое прогрессирование.
Хотя различные варианты осуществления настоящего изобретения подробно описаны, очевидно, что модификации и адаптации этих вариантов осуществления будут приходить на ум специалистам в данной области. Однако совершенно понятно, что такие модификации и адаптации находятся в пределах объема настоящего изобретения, как указано в представленной ниже иллюстративной формуле изобретения.
Реферат
Группа изобретений относится к медицине, а именно к иммунологии, и может быть использовано для замедления или профилактики метастатического прогрессирования злокачественной опухоли. Для этого индивидууму вводят композицию, содержащую: a) дрожжевой носитель и b) антиген злокачественной опухоли, включающий по меньшей мере один антиген Brachyury, где антиген Brachyury содержит SEQ ID NO: 6, положения 2-435 в SEQ ID NO: 6, SEQ ID NO: 18, положения 2-435 в SEQ ID NO: 18 или аминокислотную последовательность, которая по меньшей мере на 85% идентична SEQ ID NO: 18 и содержит замену лейцина в положении 254 на валин. Группа изобретений относится также к иммунотерапевтической композиции и способу ее получения, а также применению данной композиции для лечения злокачественной опухоли. Использование антигена Brachyury, включающего SEQ ID NO: 6, SEQ ID NO: 18, и дрожжевых векторов позволяет получить иммунотерапевтическую композицию, обеспечивающую увеличение специфичных к Brachyury Т-клеток (специфичные к Brachyury CD8CD4Т-клетки) при введении. 15 н. и 83 з.п. ф-лы, 12 пр., 10 табл., 9 ил.

Комментарии