Нереплицируемые происходящие от вирусов частицы и их применение - RU2705556C2
Код документа: RU2705556C2
Чертежи






































Описание
Ссылка на родственные заявки
По настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на патент США №61/740856, поданной 21 декабря 2012 г., и предварительной заявкой на патент США №61/835310, поданной 14 июня 2013 г., полное содержание которых включено в настоящий документ посредством ссылки.
Область техники, к которой относится настоящее изобретение
Настоящее изобретение в целом относится к нереплицируемым происходящим от вирусов частицам и их применению в качестве противоракового средства.
Предшествующий уровень техники настоящего изобретения
Следующее обсуждение предшествующего уровня техники не подразумевает и не признает, что что-либо из описанного ниже представляет собой предшествующую область техники или часть знаний специалистов в настоящей области техники в любой стране.
Онколитические вирусы (OV) были разработаны с помощью мутаций ослабления или делеций, которые позволяют вирусу реплицировать исключительно в клетках, связанных с нарушенной иммунной реакцией или повышенной метаболической активностью, двумя ключевыми характеристиками онкогенеза. Примеры текущих передовых онколитических терапевтических средств включают в себя вирус простого герпеса OncoVEXGM-CSF и вирус коровьей оспы (JX594). На сегодняшний день основное внимание в области OV было обращено на развитие платформ, в которых живой вирус характеризуется преимущественной способностью к репликации/распространению в локальной опухолевой окружающей среде.
Вирусы Rhabdoviruses (RV), такие как вирус везикулярного стоматита (VSV) и Maraba, в настоящее время изучаются в качестве противораковых терапевтических средств. В опухолях размножение вирусов обеспечивается неограниченными метаболическими активностями и нарушенными противовирусными программами. Чувствительность опухоли к воздействию RV дополнительно усиливается из-за предрасположенности к опосредованному вирусами апоптозу.
В области Rhabdovirus разработанные на сегодняшний день онколитические платформы используют компетентный по репликации вирус, где вирус распространяется между опухолевыми клетками. На самом деле, доклады, описывающие использование живых компетентных по репликации/экспрессии рабдовирусов в качестве прямой виротерапии злокачественной опухоли, как правило, сравнивают эффективность с нереплицируемыми/неэкспрессирующими вирусными контролями, в которых не наблюдается никакой измеримой эффективности. Из этих докладов можно сделать вывод, что репликация и/или экспрессия генома Rhabdovirus представляет собой критический и важный компонент цитотоксичности опухоли и терапевтической эффективности.
Отсутствие онколитических эффектов в этих предыдущих исследованиях отражается в способах, используемых для нарушения репликации и/или экспрессии вирусного генома, а также в числе используемых вирусных частиц. Действительно, когда используются предыдущие способы, чтобы нарушить репликацию и/или экспрессию вирусного генома, не наблюдается биологической активности вируса. Кроме того, в этих исследованиях применяются нереплицируемые вирусные контроли в той же дозе, что и их живые вирусные аналоги, а не в более высоких дозах, чтобы гарантировать, что каждая клетка обнаруживает нереплицируемую частицу.
Требуются альтернативные, и, предпочтительно, более эффективные, подходы для воздействия на и лечения большинства форм злокачественных опухолей. Например, исход для большинства взрослых пациентов, страдающих от острой лимфобластной или острой миелоидной лейкемии, остается мрачным. Это отчасти связано со значительным ослаблением иммунной системы, характерным для заболевания. Для некоторых пациентов противоопухолевые иммунные ответы частично восстанавливают с помощью трансплантации аллогенных стволовых клеток после миелоаблативного кондиционирования. Этот способ лечения представляет собой потенциально лечебный, однако связан с частыми неблагоприятными событиями и значительной связанной с лечением смертностью. Для многих пациентов с хроническим миелоидным лейкозом (CML) в хронической фазе, способ лечения с нацеленно воздействующим ингибитором тирозинкиназы (TKI) предлагает превосходный контроль заболевания. Однако, когда происходит прогрессирование острого лейкозного бластного криза, существуют очень ограниченные варианты лечения в связи с развитием множественной лекарственной устойчивости и быстрой кинетики этой формы не поддающегося лечению лейкоза.
Таким образом, существует потребность в альтернативных противораковых средствах, в частности, для пациентов с ослабленным иммунитетом. Противораковое средство в силу своей конструкции и компонентов будет предпочтительно характеризоваться возможностью решать текущие неудовлетворенные клинические потребности и/или преодолевать по меньшей мере некоторые из рассмотренных выше проблем.
Краткое раскрытие настоящего изобретения
Следующее краткое раскрытие настоящего изобретения предназначено, чтобы представить читателю одно или несколько из описанных в настоящем документе изобретений, но не для определения любого из них. Изобретениям могут быть присущи любые комбинации особенностей, описанных в любом месте в настоящем документе.
В то время как развивается стратегия живых OV для лечения различных типов опухолей, их применение в кроветворных злокачественных образованиях, в частности, осложняется несколькими факторами. Ограниченное производство вирионов и сниженное распространение между лейкозными клетками требует вирусной терапии высокими дозами для преодоления этих неэффективностей. Тем не менее, неконтролируемое распространение живого вируса и воздействие мимо мишени в нормальной ткани ставит под угрозу безопасность этого подхода, в частности, у пациентов с иммуносупрессией.
Проблемы, связанные с использованием живого вируса включают в себя: 1) безопасность, которая основана на способности живого Rhabdovirus распространяться только в патологической опухолевой ткани, оставляя нетронутыми здоровые ткани; 2) низкие дозы для введения, поскольку введение живого способного к распространению вируса пациенту требует введения относительно низких доз этих живых вирусных средств, чтобы обеспечить безопасность; 3) иммунное отклонение от опухоли по отношению к живому вирусу, которое эффективно снижает эффективность противоопухолевых иммунных реакций; и 4) сконструированные живые вирусы, разработанные со склонностью к опухоли, часто характеризуются нарушенной способностью к производству, по сравнению с вирусом дикого типа, а следовательно, и эффективность состава и производственные затраты представляют собой неоптимальные с производственной точки зрения.
Ранее было показано, что внутриопухолевая инъекция с VSV, сконструированным с делецией гена гликопротеина (VSVΔG), который предотвращает окончательную сборку и распространение вириона, вызывает противоопухолевые иммунные ответы. Тем не менее, лечение VSVΔG не может обеспечить значительное снижение массы диссеминированной опухоли, отчасти из-за неспособности производить и поставлять терапевтически эффективные дозы.
Авторы осведомлены об отсутствии докладов, которые подробно описывают использование нереплицируемой и не экспрессирующей происходящей от Rhabdovirus платформы в качестве противоракового терапевтического средства. Нереплицируемые происходящие от вирусов частицы (NVRP) согласно настоящему раскрытию и нереплицируемые происходящие от рабдовирусов частицы (NRRP), в частности, представляют собой вирусные частицы дикого типа, модифицированные таким образом, чтобы не обладать способностью к распространению между клетками. После модификации нереплицируемая происходящая от вирусов частица (NVRP) не может поддерживать репликацию вириона.
NVRP уникальны тем, что они сохраняют тропизм, такой как цитолитический тропизм, против иммортализованных клеток. Это означает, что NVRP будут индуцировать гибель клеток преимущественно в иммортализованных клетках, таких как опухолевые или злокачественные клетки и трансформированные иммортализованные клетки. Специфические примеры NVRP характеризуются врожденными и/или адаптивными иммуностимулирующими свойствами против иммортализованных клеток.
Согласно одному аспекту настоящее изобретение описывает нереплицируемую происходящую от рабдовируса частицу, которая не способна к распространению между клетками, при этом характеризуется тропизмом против иммортализованных клеток. Тропизм может представлять собой цитолитический тропизм. Нереплицируемая происходящая от рабдовируса частица может характеризоваться врожденными или адаптивными иммуностимулирующими свойствами против иммортализованных клеток.
Согласно еще одному аспекту в настоящем изобретении предусмотрено использование нереплицируемой происходящей от рабдовируса частицы для воздействия на популяцию гиперпролиферативных клеток или злокачественных клеток. Популяция гиперпролиферативных клеток представляет собой клетки предпочтительно кроветворной природы и предпочтительно лейкозные клетки. Популяция гиперпролиферативных клеток может представлять собой солидные опухолевые клетки.
Согласно еще одному аспекту настоящее изобретение описывает способ лечения пациента, содержащего популяцию гиперпролиферативных клеток или злокачественных клеток. Способ предусматривает введение пациенту нереплицируемых происходящих от рабдовирусов частиц. Популяция гиперпролиферативных клеток может предпочтительно представлять собой клетки кроветворной природы, предпочтительно лейкозные клетки. Популяция гиперпролиферативных клеток может представлять собой солидные опухолевые клетки.
Другие аспекты и особенности настоящего изобретения станут очевидными специалистам в настоящей области техники после рассмотрения следующего описания конкретных вариантов осуществления в сочетании с прилагаемыми фигурами.
Краткое описание графических материалов
Варианты осуществления настоящего изобретения будут теперь описаны посредством только примера со ссылкой на прилагаемые фигуры.
Фиг. 1А представляет собой график, показывающий воздействие дозировки УФ на опосредованную NRRP цитотоксичность на клетки Vero и HDFN. Никакого сигнала GFP не было обнаружено у следующего индуцированного УФ поколения NRRP. Жизнеспособность количественно оценивали с использованием анализа с резазурином через 72 ч после инфицирования. MOI этого эксперимента была установлена на уровне 100 частиц на клетку. Усы обозначают стандартное отклонение между тройными экспериментами.
Фиг. 1В представляет собой график, показывающий влияние MOI на цитотоксичность, индуцированную NRRP в клетках Vero и HDFN, что показано с помощью жизнеспособности как функциональной MOI. Жизнеспособность количественно оценивали с использованием анализа с резазурином через 72 ч после инфицирования. Усы обозначают стандартное отклонение между тройными экспериментами.
Фиг. 2А представляет собой набор изображений, показывающий цитотоксичность NRRP в иммортализованных клетках Vero через изображения флуоресцентной и световой микроскопии клеток Vero, обработанных PBS, живыми VSV-GFP или NRRP, взятыми через 24 и 72 часа после инфицирования или после воздействия. Используемая в этих экспериментах множественность заражения (MOI) была установлена на уровне 100 частиц на клетку.
Рис. 2В представляет собой график, показывающий цитотоксичность NRRP через количественное определение с резазурином жизнеспособности клеток через 72 ч после воздействия. Усы обозначают стандартное отклонение между тройными экспериментами.
Фиг. 2С представляет собой график, показывающий полученные вирусные титры. NAN означает "не как число" как не обнаруженные вирионы.
Фиг. 3A представляет собой набор изображений флуоресцентной микроскопии (4Х) лейкозных (L1210) и Vero клеток, обработанных PBS, живым вирусом Maraba и полученными из вируса Maraba NRRP. Изображения получали через 24 часа после воздействия.
Фиг. 3B представлен график, показывающий вирусные титры, полученные из опухолевых клеток.
Фиг. 3C представляет собой график, показывающий количественное определение с резазурином клеточной жизнеспособности лейкозных клеток L1210 и нормальных клеток HDF через 72 ч после инфицирования.
Фиг. 4А представляет собой набор изображений, показывающий флуоресцентные изображения клеток L1210 и Vero, обработанных PBS, живыми VSV-GFP или NRRP.
Фиг. 4В представляет собой график, показывающий вирусные титры, полученные из клеток острого лейкоза L1210 и иммортализованных Vero.
Фиг. 5 представляет собой изображение Вестерн-блоттинга экспрессии генома NRRP в сравнении с экспрессией генома вируса, подвергнутого воздействию УФ в дозе 20000 мДж/см2, где наблюдалась потеря цитотоксичности, и живым вирусом в качестве контроля. Ссылка на 1х или 2х относится к количеству белка, загруженного на гель. Белки экстрагировали через 15 ч после инфицирования.
Фиг. 6А представляет собой набор изображений флуоресцентной и световой микроскопии клеток Vero, обработанных полученными химически или полученными с бусульфаном NRRP.
Фиг. 6В представляет собой изображение световой микроскопии клеток Vero, обработанных только бусульфаном в той же дозе, что и используемая для получения NRRP на фиг. 6А, в течение 15 часов.
Фиг. 6С представляет собой набор изображений флуоресцентной и световой микроскопии клеток Vero, обработанных живым VSV-GFP.
Фиг. 7А представляет собой набор изображений флуоресцентной и световой микроскопии клеток Vero, обработанных NRRP, полученных путем забора 1Е10 замороженного VSV дикого типа и облучения этого препарата с 15 кГр кобальт-60.
Фиг. 7В представляет собой набор изображений флуоресцентной и световой микроскопии клеток Vero, обработанных живым VSV-GFP дикого типа.
Фиг. 7С представляет собой набор изображений флуоресцентной и световой микроскопии клеток Vero в PBS.
Фиг. 8А представляет собой набор изображений световой микроскопии клеток L1210 и HDF, обработанных PBS или NRRP при MOI 100.
Фиг. 8В представляет собой график, показывающий количественное определение с резазурином жизнеспособности в лейкозных и нормальных клеточных линиях. Мышиные клеточные линии обозначены *.
Фиг. 8С представляет собой набор изображений флуоресцентной микроскопии воздействия PBS, живым VSV-GFP или NRRP в мышиной клеточной линии Jurkat Т-клеток острого лейкоза человека, мышиной клеточной линии А20 В-клеточного лимфобластного лейкоза, клеточной линии A301 Т-клеточного лимфобластного лейкоза и клеточной линии HL60 острого промиелоцитарного лейкоза и нормальных клеточных линиях GM38 и HDF.
Фиг. 9 представляет собой набор графиков, показывающих анализ проточной цитометрии окрашивания аннексином V-APC и 7-AAD в клетках L1210, обработанных PBS или NRRP.
Фиг. 10 представляет собой график, показывающий жизнеспособность клеток после количественного анализа с резазурином для клеточной линии острого лейкоза L1210, взятой через 72 часа после обработки полученными с УФ NRRP и комбинаторного эффекта полученных с УФ NRRP с бендамустином (300 мкМ).
Фиг. 11 представляет собой график, показывающий жизнеспособность клеток после количественного анализа с резазурином для клеточной линии острого лейкоза L1210, взятой через 72 часа после обработки полученными с УФ NRRP и комбинаторного эффекта полученных с УФ NRRP с дексаметазоном (45 мкМ).
Фиг. 12 представляет собой график, показывающий жизнеспособность клеток после количественного анализа с резазурином для клеточной линии острого лейкоза L1210, взятой через 72 часа после обработки полученными с УФ NRRP и комбинаторного эффекта полученных с УФ NRRP с доксорубицином (0,025 мкМ).
Фиг. 13 представляет собой график, показывающий жизнеспособность клеток после количественного анализа с резазурином для клеточной линии острого лейкоза L1210, взятой через 72 часа после обработки полученными с УФ NRRP и комбинаторного эффекта полученных с УФ NRRP с винкристином (0,0125 мкМ).
Фиг. 14 представляет собой график, показывающий жизнеспособность клеток после количественного анализа с резазурином для Ph-положительной миелоидной лейкозной клеточной линии K562, взятой через 15 часов после обработки полученными с УФ NRRP и комбинаторного эффекта полученных с УФ NRRP с идаруцибином (0,05 мкМ).
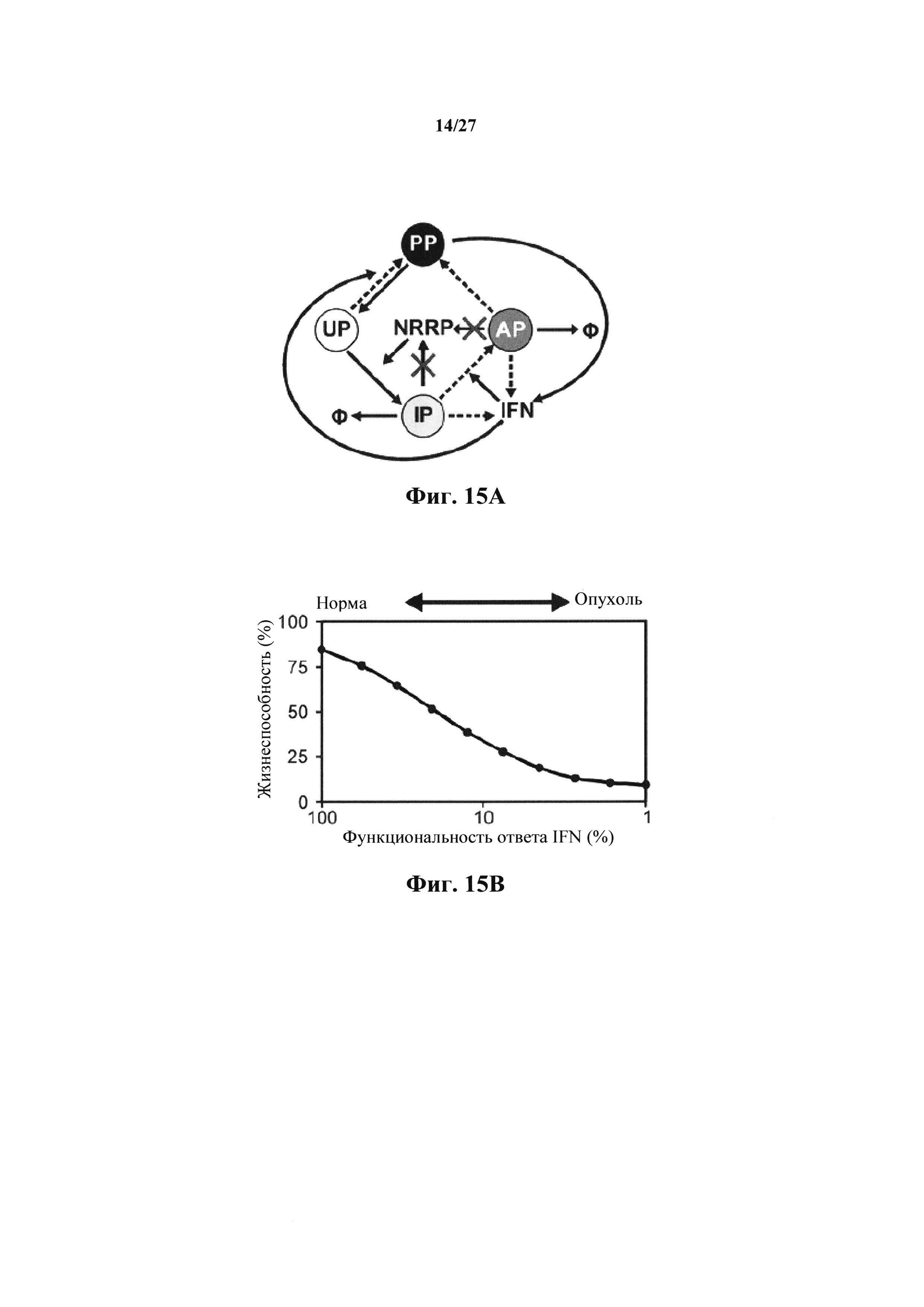
Фиг. 15А представляет собой иллюстрацию феноменологической модели, разработанной Le Boeuf с соавт. для имитации цитотоксичности NRRP в нормальных клетках и опухолях с дефектами в противовирусных сигнальных путях. Для описания кинетики NRRP исходную модель модифицировали путем удаления вирусной репликации (X). Пунктирные линии описывают IFN-дефекты, связанные с опухолевыми клетками.
Фиг. 15В представляет собой график, показывающий моделируемую связь между дефектами в противовирусном сигнальном пути и жизнеспособностью после воздействия NRRP через 72 часа.
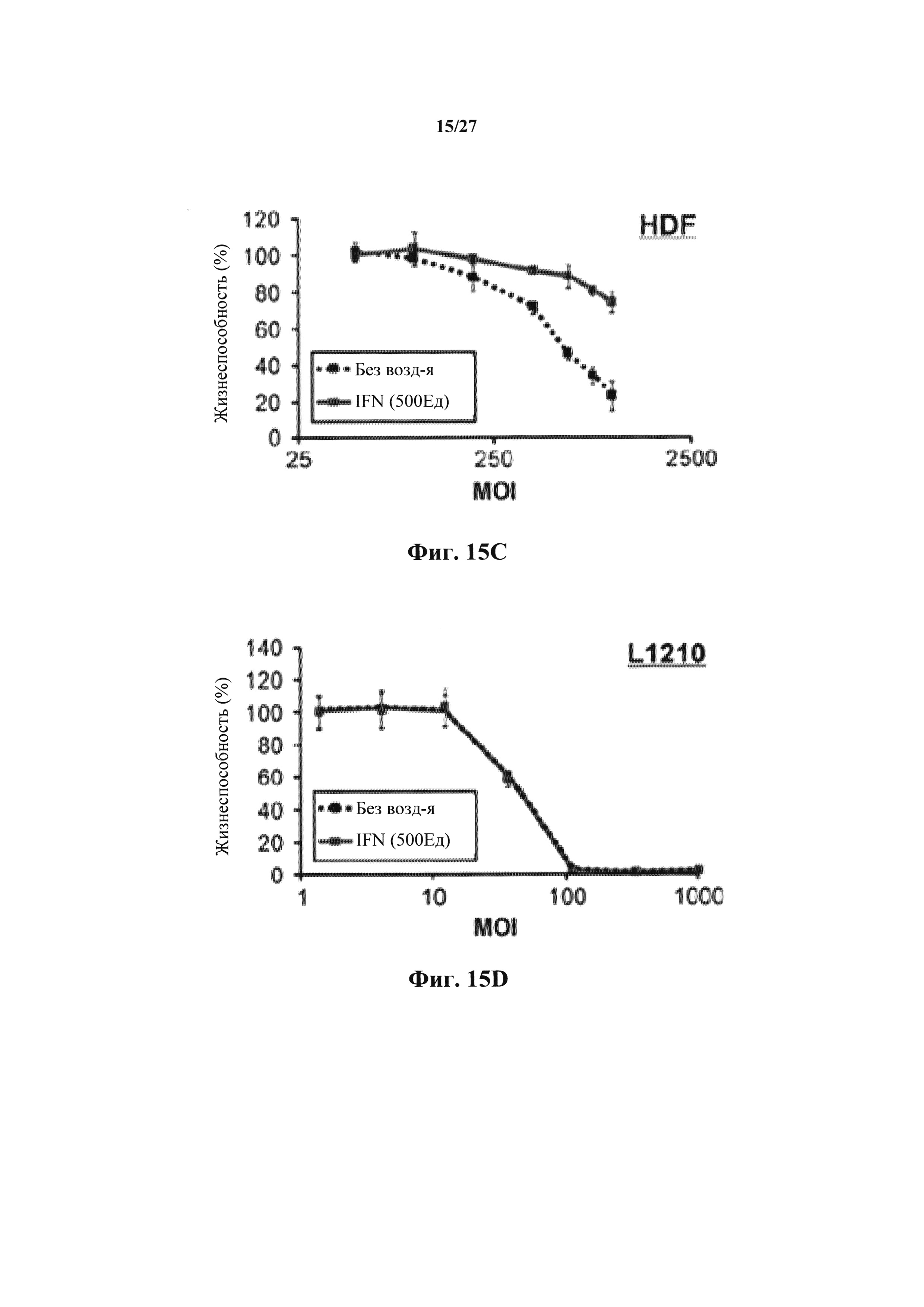
Фиг. 15С представляет собой график, показывающий связь in vitro между MOI и жизнеспособностью через 72 ч после инфицирования NRRP в нормальных клетках HDF в присутствии или в отсутствии IFN.
Фиг. 15D представляет собой график, показывающий связь in vitro между MOI и жизнеспособностью через 72 ч после обработки NRRP в лейкозных клетках L1210 в присутствии или в отсутствии IFN.
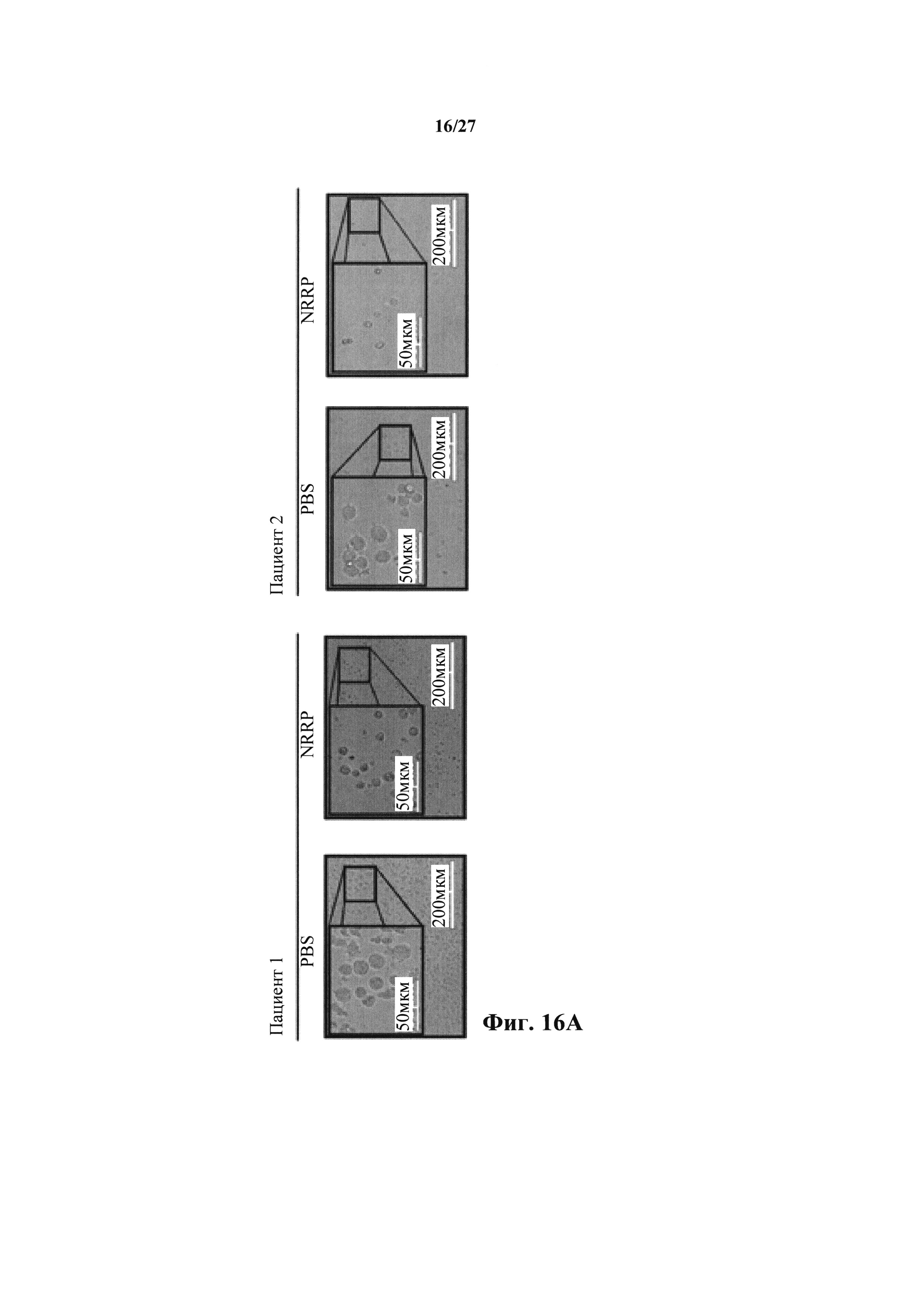
Фиг. 16А представляет собой набор изображений световой микроскопии двух образцов пациентов с бластным кризом хронического миелоидного лейкоза, получавших PBS или NRRP.
Фиг. 16В представляет собой набор изображений флуоресцентной микроскопии (4Х) острого лейкоза (бластный криз CML) от образцов периферической крови пациента-человека. Обогащенные лейкозом образцы, собранные из периферической крови, обработанной PBS, живым VSV-GFP или NRRP, закодированными для GFP. Изображения через 24 ч после инфицирования при MOI=100.
Фиг. 16С представляет собой диаграмму проточной цитометрии, дополняющую данные, представленные на фиг. 16А и 16С, окрашивания аннексин-V и CD33 в двух образцах пациентов с бластным кризом CML, получавших PBS или NRRP (MOI=100) через 48 часов после лечения. Властную популяцию CD33+ обогащали путем долгосрочной культуры клеток.
Фиг. 16D представляет собой графики, иллюстрирующие анализ проточной цитометрии окрашивания CD33 в двух образцах пациентов с бластным кризом CML, обработанных PBS или NRRP.
Фиг. 17А представляет собой набор изображений световой микроскопии образца здорового костного мозга, обработанного PBS или NRRP в течение 18 часов.
Фиг. 17В представляет собой график, показывающий количественный анализ окрашивания аннексином-V в образце здорового костного мозга, обработанного PBS или NRRP в течение 65 часов.
Фиг. 18А представляет собой график, показывающий кривую выживаемости в мышиной модели лечения бластного криза. После сенсибилизации L1210 у мышей на 1 день, мыши получали три дневные дозы NRRP или PBS.
Фиг. 18В представляет собой набор графиков, отражающих основанный на Luminex количественный анализ цитокинов, индуцированных NRRP в несущих L1210 мышах во время острого бластного криза. Все идентифицированные цитокины индуцируют более 2 раз с помощью обработанных NRRP мышей и представляют собой статистически значимые (непарный t-критерий Стьюдента pV<0,05). pV был исправлен, чтобы отвечать проверке гипотезы для многомерных данных (способ Бенджамини-Хохберга).
Фиг. 19 представляет собой график, показывающий кривую выживаемости в мышиной иммунокомпетентной модели иммуногенного апоптоза. Перед сенсибилизацией L1210 на 1 день, мыши получали три еженедельных дозы γ-облученных клеток L1210, инкубированных или не инкубированных с NRRP.
Фиг. 20 представляет собой набор изображений световой микроскопии клеточных линий миеломы МРС-11 и RPMI-8226, взятых через 15 часов после воздействия PBS или NRRP. NRRP вводили при МО1=250, в дозе, ранее определенной, как не оказывающей никакого влияния на нормальную жизнеспособность клеток.
Фиг. 21 представляет собой график, показывающий жизнеспособность клеток после проведения количественного анализа с резазурином для миеломных клеточных линий МРС-11 и RPMI-8226, полученных через 15 часов после воздействия NRRP, вводимых при MOI=250. SR4987 представляет собой клеточную линию нормального стромального костного мозга.
Фиг. 22 представляет собой график, иллюстрирующий жизнеспособность клеток после количественного анализа с резазурином для множественной миеломной клеточной линии МРС-11, полученной через 72 часа после воздействия полученными с УФ NRRP и комбинаторного воздействия полученных с УФ NRRP с мелфаланом (20 мкМ).
Фиг. 23 представляет собой график, иллюстрирующий жизнеспособности клеток после количественного анализа с резазурином для множественной миеломной клеточной линии МРС-11, полученной через 72 часа после воздействия полученными с УФ NRRP и комбинаторного воздействия полученных с УФ NRRP со вторым полученным из митохондрий активатором миметика каспазы (SMAC), LCL161 (15 мкМ).
Фиг. 24 представляет собой график, иллюстрирующий жизнеспособность клеток после количественного анализа с резазурином для множественной миеломной клеточной линии RPMI-8226, полученной через 72 часа после воздействия полученными с УФ NRRP и комбинаторного воздействия полученных с УФ NRRP с карфилзомибом (5 нМ).
Фиг. 25А представляет собой набор изображений световой микроскопии мышиной клеточной линии отсроченной глиобластомы опухоли мозга (DBT), полученный через 24 часа после воздействия PBS или NRRP.
Фиг. 25В представляет собой набор изображений световой микроскопии клеточной линии астроцитомы (K1491), полученный через 24 часа после воздействия PBS или NRRP.
Фиг. 25С представляет собой набор изображений световой микроскопии клеточной линии мышиной глиомы (GL261), полученный через 24 часа после воздействия PBS или NRRP.
Фиг. 26 представляет собой график, показывающий жизнеспособность клеток после количественного анализа с резазурином клеточных линий злокачественных опухолей мозга DBT, K1491, K1492, СТ2А и GL261 по отношению к нормальному контролю HDFN.
Фиг. 27 представляет собой график, иллюстрирующий жизнеспособность клеток после количественного анализа с резазурином клеточной линии глиобластомы СТ2А, взятой через 72 часа после воздействия полученными с УФ NRRP и комбинаторного воздействия полученными с УФ NRRP с HDAC-ингибитором SAHA (10 мкМ).
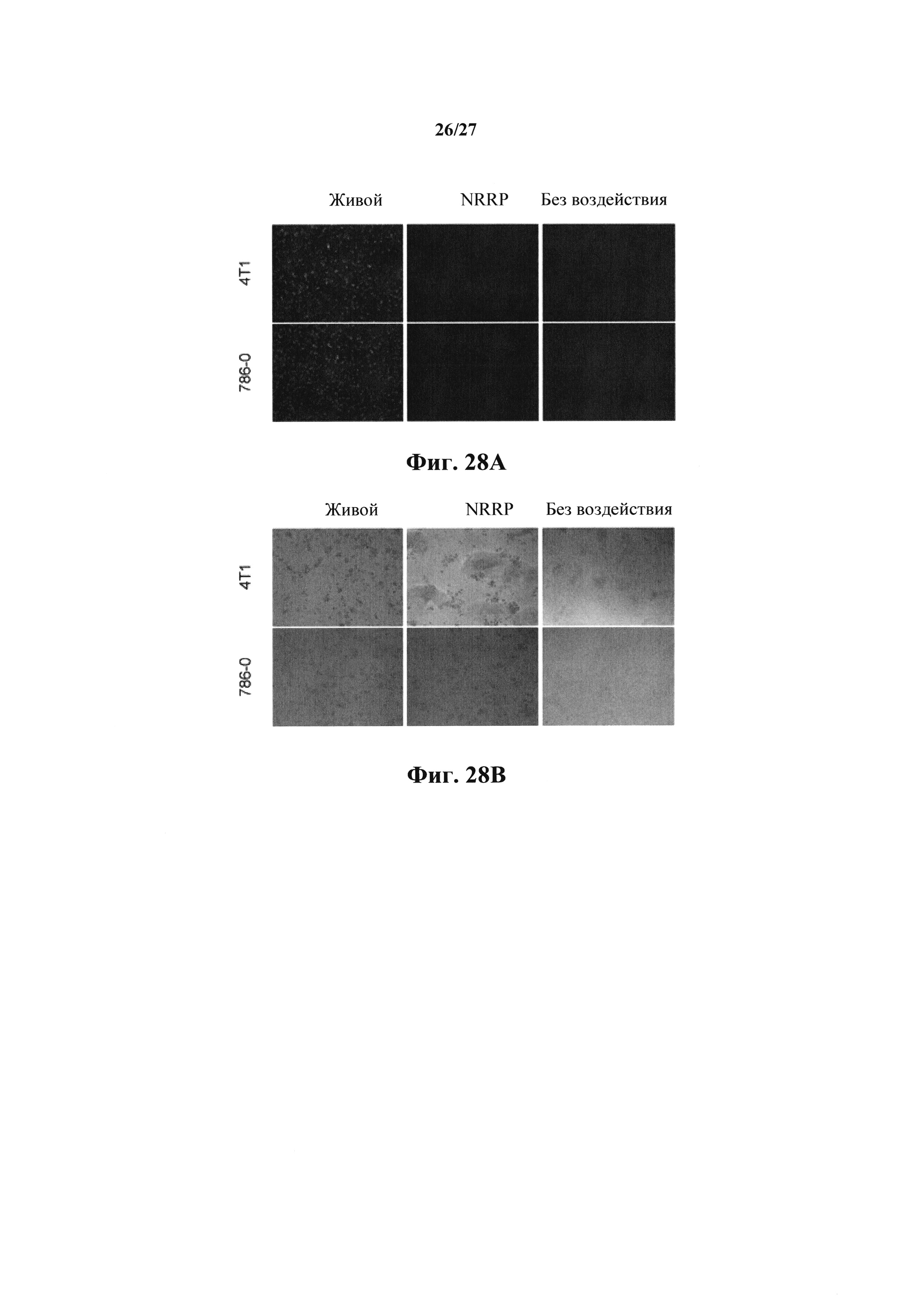
Фиг. 28А представляет собой набор изображений флуоресцентной микроскопии (4Х) опосредованной NRRP цитотоксичности клеток опухоли в резистентных солидных опухолевых клеточных линиях. Набор изображений показывает злокачественные клетки молочной железы или груди мыши (4Т1) и почки человека (786-0), обработанных PBS, живым VSV и NRRP. Изображения получали через 24 часа после инфицирования.
Фиг. 28В представляет собой набор изображений световой микроскопии, полученный через 72 ч после инфицирования опосредованной NRRP цитотоксичностью клеток опухоли в резистентных солидных опухолевых клеточных линиях, в злокачественных клетках груди (4Т1) и почки (786-0), обработанных PBS, живым VSV и NRRP.
Фиг. 28С представляет собой график, показывающий количественное определение с резазурином жизнеспособности клеток в устойчивых солидных опухолевых клеточных линиях, в злокачественных клетках груди (4Т1) и почек (786-0), обработанных PBS, живым VSV и NRRP, через 72 ч после инфицирования.
Фиг. 29 представляет собой график, иллюстрирующий преимущество в выживаемости подкожной злокачественной опухоли толстой кишки КТ-26, обработанной полученными с УФ NRRP 2Е9, через 16, 18 и 21 день после погружения опухоли.
Подробное описание настоящего изобретения
В общем, в настоящем изобретении предусмотрена нереплицируемая происходящая от вируса частица и ее использование в качестве противоракового средства. Нереплицируемая происходящая от вируса частица (NRVP) представляет собой происходящую от вируса частицу, которая способна связываться с и поглощаться клеткой, но модифицирована таким образом, чтобы предотвратить образование или существенно уменьшить образование новых вирусных частиц, когда NRVP находится в клетке. Один пример NRVP представляет собой нереплицируемую происходящую от рабдовируса частицу (NRRP).
NRVP включает в себя: оболочку, содержащую достаточное количество функциональных G белков на поверхности оболочки, чтобы позволить полученной из вируса частице связываться с поверхностью клетки и поглощаться ею. Она также включает в себя полинуклеотид РНК с последовательностью, которая кодирует все белки, необходимые для сборки новой вирусной частицы, и смесь белков, которые образуют структуру вокруг полинуклеотида РНК. Однако, структура РНК NRVP достаточно сшита или была расщеплена с образованием таких прерывистых сегментов РНК, что геном NRVP не может быть использован для производства белков, необходимых для образования нового вируса. Например, последовательность РНК может не быть транскрибирована в мРНК, транслирована в белок или и то и другое, когда частица находится в клетке. Ухудшение или отсутствие транскрипции и/или трансляции означает, что недостаточно белков продуцируются в клетке и новые вирусные частицы не могут быть собраны.
Функциональный белок G может характеризоваться последовательностью, которая включает в себя SEQ ID NO: 1, показанную ниже, которая представляет собой последовательность зрелого пептида гликопротеина вируса везикулярного стоматита Индиана. Этот функциональный G белок характеризуется учетным номером NCBI NP 955548,1.

Кроме того, функциональный G белок может характеризоваться последовательностью, которая по меньшей мере на 75% идентична SEQ ID NO: 1 до тех пор, пока он способен связываться с поверхностью клетки и осуществлять интернализацию частицы. Например, консервативные замены аминокислот могут быть сделаны без отмены способности белка связываться с поверхностью клеток и осуществлять интернализацию частицы. Примеры консервативных замен показаны ниже в таблице 1.


Менее консервативные замены могут быть сделаны в частях G белка, которые не участвуют в связывании с клеточной поверхностью (например, в трансмембранном домене), в то время как более консервативные замены могут потребоваться в частях белка, которые взаимодействуют с рецептором белка G. Белки G известны в настоящей области техники, и специалист в настоящей области техники сможет определить, что возможны аминокислотные замены без отмены способности белка связываться с поверхностью клеток и осуществлять интернализацию частицы.
Смесь белков, которая образует структуру вокруг РНК, может включать в себя по меньшей мере белки N, Р, М и L. NRVP, содержащая белки N, Р, М, G и L, может включать в себя происходящий от рабдовирусов NRVP. Происходящие от рабдовирусов NRVP могут относиться к нереплицируемым происходящим от рабдовирусов частицам (NRRP). Для целей настоящего изобретения термин "Rhabdovirus" (таксономический ID NCBI: 11270) может включать в себя любой один из следующих родов вирусов и их вариантов: Cytorhabdovirus (таксономический идентификационный номер NCBI: 11305), Ephemerovirus (таксономический идентификационный номер NCBI: 32613), Vesiculovirus (таксономический идентификационный номер NCBI: 11271), неклассифицируемый Dimarhabdovirus supergroup (таксономический идентификационный номер NCBI: 349166), Lyssavirus (таксономический идентификационный номер NCBI: 11286), Novirhabdovirus (таксономический идентификационный номер NCBI: 186778), Nucleorhabdovirus (таксономический идентификационный номер NCBI: 11306), неопределенный рабдовирус (таксономический идентификационный номер NCBI: 686606) и неклассифицированный рабдовирус (таксономический идентификационный номер NCBI: 35303). Виды в семействе Rhabdovirus включают в себя без ограничения вирус Maraba, вирус везикулярного стоматита (VSV) и вирус Фармингтон.
Белок N может характеризоваться последовательностью, которая включает в себя SEQ ID NO: 2, показанную ниже, которая представляет собой последовательность белка нуклеокапсида вируса везикулярного стоматита Индиана. Этот белок N характеризуется учетным номером NCBI NC 041712.1.

Кроме того, белок N может характеризоваться последовательностью, которая по меньшей мере на 80% идентична SEQ ID NO: 2 при условии, что он способен участвовать в образовании белковой структуры. Например, консервативные замены аминокислот могут быть сделаны без отмены способности белка участвовать в образовании белковой структуры. Примеры консервативных замен показаны в таблице 1.
Белок Р может характеризоваться последовательностью, которая включает в себя SEQ ID NO: 3, показанную ниже, которая представляет собой последовательность белка NS вируса везикулярного стоматита Индиана. Это белок Р характеризуется учетным номером NCBI NC 041713.1.

Альтернативно, белок Р может характеризоваться последовательностью, которая по меньшей мере на 80% идентична SEQ ID NO: 3, пока он способен участвовать в образовании белковой структуры. Например, консервативные замены аминокислот могут быть сделаны без отмены способности белка участвовать в образовании белковой структуры. Примеры консервативных замен показаны в таблице 1.
Белок М может характеризоваться последовательностью, которая включает в себя SEQ ID NO: 4, показанную ниже, которая представляет собой последовательность матриксного белка вируса везикулярного стоматита Индиана. Этот белок М характеризуется учетным номером NCBI NC 041714.1.

Альтернативно, белок М может характеризоваться последовательностью, которая по меньшей мере на 80% идентична SEQ ID NO: 4, пока он способен участвовать в образовании белковой структуры. Например, консервативные замены аминокислот могут быть сделаны без отмены способности белка участвовать в образовании белковой структуры. Примеры консервативных замен показаны в таблице 1.
Белок L может характеризоваться последовательностью, которая включает в себя SEQ ID NO: 5, показанную ниже, которая представляет собой последовательность белка-полимеразы вируса везикулярного стоматита Индиана. Это белок L характеризуется учетным номером NCBI NC 041716.1.


Альтернативно, белок L может характеризоваться последовательностью, которая по меньшей мере на 70% идентична SEQ ID NO: 5, пока он способен участвовать в образовании белковой структуры. Например, консервативные замены аминокислот могут быть сделаны без отмены способности белка участвовать в образовании белковой структуры. Примеры консервативных замен показаны в таблице 1.
В некоторых примерах, NRVP может производить функциональные белки N, Р, М и G после того, как NRVP связывается с и поглощается клеткой. Тем не менее, NRVP не способна или характеризуется сниженной способностью производить функциональный белок L. Без функционального белка L или без правильного количества функционального белка L новые вирусные частицы не могут быть собраны.
В других примерах NRVP может производить функциональные белки N, Р и М после того, как NRVP связывается с и поглощается клеткой. Тем не менее, NRVP не способна или характеризуется сниженной способностью производить функциональные белки G и L. Без функциональных белков G и L или без правильных количеств и соотношений функциональных белков G и L новые вирусные частицы не могут быть собраны.
В еще других примерах NRVP может продуцировать функциональные белки N и Р после того, как NRVP связывается с и поглощается клеткой. Тем не менее, NRVP не способна или характеризуется сниженной способностью производить функциональные белки М, G и L. Без функциональных белков М, G и L или без правильных количеств и соотношений функциональных белков М, G и L новые вирусные частицы не могут быть собраны.
В еще других примерах NRVP может производить функциональный белок N после того, как NRVP связывается с и поглощается клеткой. Тем не менее, NRVP не способна или характеризуется сниженной способностью производить функциональные белки Р, М, G и L. Без функциональных белков Р, М, G и L или без правильных количеств и соотношений функциональных белков Р, М, G и L новые вирусные частицы не могут быть собраны.
В еще других примерах NRVP не способна или характеризуется сниженной способностью производить функциональные белки N, Р, М, G и L. Без функциональных белков N, Р, М, G и L или без правильных количеств и соотношений функциональных белков N, Р, М, G и L, новые вирусные частицы не могут быть собраны.
Для того, чтобы нереплицируемая происходящая от вируса частица была способна связываться с поверхностью клетки и поглощаться ею, NRVP должна содержать достаточное количество функциональных белков G на оболочке вирусной частицы. Ожидается, что NRVP, содержащая по меньшей мере 5% от числа белков G, обнаруженных на вирусной частицы дикого типа, будет по-прежнему способна связываться с клеткой и поглощаться ею. Предпочтительно, NRVP будет содержать по меньшей мере 50% от количества белков G, обнаруженных на вирусной частицы дикого типа, а более предпочтительно NRVP будет содержать по меньшей мере 100% от числа белков G, обнаруженных на вирусной частицы дикого типа. Согласно конкретным примерам NRVP содержит по меньшей мере 60 функциональных белков G на одну частицу, по меньшей мере 600 функциональных белков G на одну частицу или по меньшей мере 1200 функциональных белков G на одну частицу.
Как отмечалось выше, NRVP включает в себя РНК, характеризующуюся последовательностью, которая кодирует все белки, необходимые для сборки новой вирусной частицы. Одна из причин того, что последовательность РНК может быть не в состоянии производить эти белки, когда NRVP находится в клетки, заключается в том, что РНК сшивают до такой степени, что производство белка снижается или останавливается. В некоторых примерах по меньшей мере 0,05% сшитых нуклеотидов может быть достаточно, чтобы уменьшить или прекратить производство белка из последовательности РНК. В других примерах сшитая РНК может включать в себя по меньшей мере 0,5% сшитых нуклеотидов. Может быть предпочтительно содержать по меньшей мере 1% сшитых нуклеотидов и более предпочтительно содержать по меньшей мере 10% или по меньшей мере 20% сшитых нуклеотидов.
Сшивка нуклеотидов может увеличивать вероятность получения белков G, не способных связываться с клеточной поверхностью. Соответственно, может быть предпочтительно, чтобы были сшиты менее 80% нуклеотидов.
Нуклеотиды в структуре РНК могут быть сшиты с другими нуклеотидам РНК, аминокислотами в белке в белковой структуре вокруг РНК или и теми и другими.
В дополнение к сшитой структуре РНК, белковая структура вокруг РНК может включать в себя белок, который содержит аминокислоту, которая: сшита с другим белком белковой структуры; сшита с другой аминокислотой того же самого белка; сшита со структурой РНК или любую их комбинацию.
Кроме того, структура РНК NRVP может быть не в состоянии реплицировать путем удаления функции полимеразной активности РНК NRVP, кодируемой белками Р и L. Это может быть осуществлено с помощью достаточного сшивания белков Р и L со структурой РНК, сшивания белков Р и L с другими белками или путем повреждения белковой структуры NRVP таким образом, что на функцию белков Р и L оказывается негативное влияние.
Еще одна причина того, что последовательность РНК может быть не в состоянии производить эти белки, когда NRVP находится в клетке, заключается в том, что структура РНК была расщеплена с образованием прерывистых сегментов РНК. РНК-вирусы, такие как рабдовирусы, содержат один непрерывный полинуклеотид РНК, который включает в себя последовательности всех генов, которые кодируют белки, необходимые для репликации вируса. Расщепление одного непрерывного полинуклеотида на два или более прерывистых полинуклеотида РНК приводит к дефектной транскрипции, трансляции генома или тому и другому. Белки, которые кодируются на полинуклеотиде без сайта инициации транскрипции, не могут быть транскрибированы. Кроме того, геном не может подвергаться полноразмерной репликации и не может быть должным образом включен в образующуюся вирусную частицу, тем самым предотвращая производство вирусной частицы.
NRVP могут включать в себя по меньшей мере два прерывистых полинуклеотида РНК, только один из которых содержит сайт инициации транскрипции. Тем не менее, может быть предпочтительно расщеплять РНК на более чем два сегмента. Соответственно, NRVP предпочтительно включают в себя по меньшей мере пять, более предпочтительно по меньшей мере 10 и еще более предпочтительно по меньшей мере 100 прерывистых полинуклеотидов РНК.
РНК-вирусы могут содержать последовательность РНК с порядка 11000 нуклеотидов. В РНК-вирусах, содержащих последовательности РНК с 11000 нуклеотидами или более, может быть желательно расщеплять РНК на сегменты размером не более 10000 нуклеотидов. NRVP, полученный в результате расщепления РНК-вируса с 11000 нуклеотидами, могла бы содержать по меньшей мере один сегмент РНК размером менее 10000 нуклеотидов и другой сегмент РНК размером менее 1000 нуклеотидов. Поскольку только один из сегментов включает в себя сайт инициации транскрипции либо поскольку кодирующая белок последовательность прерывистая, другой из сегментов не может быть транскрибирован или транслирован, и любые кодируемые в этом сегменте белки не будут произведены.
Может быть предпочтительно расщеплять РНК на более мелкие части. Например, прерывистые полинуклеотиды РНК могут составлять не более чем 7000, не более чем 5000, не более чем 3000 или не более чем 1000 нуклеотидов.
Нереплицируемую происходящую от вируса частицу получают из живого вируса, который включает в себя РНК, характеризующуюся последовательностью, которая кодирует белки N, Р, М, G и L, путем: необязательного отделения происходящей от вируса частицы от поглощающего УФ соединения и затем подвергания живого вируса воздействию повреждающего РНК средства либо для сшивания структуры РНК, либо для расщепления структуры РНК, таким образом, предотвращая РНК от производства достаточных белков, необходимых для сборки новой вирусной частицы.
Структура РНК живого вируса достаточно сшита, так что, когда полученная из вируса частица находится в клетке: транскрипция РНК в мРНК снижается; трансляция мРНК в белок снижается или и то и другое. Аналогично, структура РНК живого вируса расщепляется на достаточно прерывистые сегменты РНК так что, когда полученная из вируса частица находится в клетке: транскрипция РНК в мРНК снижается; трансляция мРНК в белок снижается или и то и другое.
Сшивание РНК может быть достигнуто путем воздействия на живой вирус электромагнитным излучением. Электромагнитное излучение может характеризоваться длиной волны менее чем приблизительно 1 мм. Энергия, связанная с электромагнитным излучением, возрастает с уменьшением длины волны. Увеличенная энергия связана с повреждением ДНК, что подтверждается увеличением частоты заболеваемости злокачественными опухолями при воздействии УФ-излучением, рентгеновским излучением и гамма-излучением. Соответственно, предпочтительно, чтобы электромагнитное излучение характеризовалось длиной волны менее чем приблизительно 500 мм и более предпочтительно, если длина волны будет составлять приблизительно 280 нм. Согласно конкретным примерам длина волны составляет приблизительно 0,1 пм и 280 нм.
Может быть особенно желательно использовать электромагнитное излучение, характеризующееся длиной волны от приблизительно 100 до приблизительно 280 нм, поскольку такая длина волны предпочтительно индуцирует сшивание в нуклеотидах, по сравнению со сшиванием в белках. Когда электромагнитное излучение происходит в УФ-спектре, т.е. от приблизительно 100 нм до приблизительно 400 нм, раствор, содержащий живой вирус, может быть подвергнут дозе электромагнитного излучения от приблизительно 100 мДж/см2 до приблизительно 8000 мДж/см2. Предпочтительно, доза составляет от приблизительно 150 мДж/см2 до приблизительно 5000 мДж/см2. Еще более предпочтительно доза составляет от приблизительно 150 мДж/см2 до приблизительно 1000 мДж/см2. Еще даже более предпочтительно доза составляет от приблизительно 150 мДж/см2 до приблизительно 500 мДж/см2. Наиболее предпочтительно доза составляет от приблизительно 150 мДж/см2 до приблизительно 300 мДж/см2.
Фактическая доза может зависеть от характеристик раствора. Например, если раствор включает в себя красители, которые поглощают ультрафиолетовый свет, то требуется больше доза. Аналогичным образом, если раствор облучают с одной точки и контейнер большой, там может быть живой вирус, который не подвергается полной интенсивности ультрафиолетового света. В такой ситуации может быть полезна большая доза или перемешивание раствора. Специалист в настоящей области техники будет способен определить параметры, необходимые для обеспечения соответствующей дозы.
В ситуациях, когда поддерживающая живой вирус среда мутная, содержит краситель или иным образом поглощает ультрафиолетовый свет, может быть желательно облучать живой вирус рентгеновскими лучами (т.е. электромагнитным излучением с длиной волны от 0,01 до 10 нм) или гамма-лучами (т.е. электромагнитным излучением с длиной волны менее 10 пм). Когда электромагнитное излучение представляет собой гамма-излучение, живой вирус может быть подвергнут дозе от приблизительно 1 кГр до 50 кГр. Более предпочтительно, доза составляет от приблизительно 5 кГр до 20 кГр. Гамма-излучение может быть получено от кобальта-60.
Живой вирус может быть подвергнут электромагнитному излучению при температуре 4°C или ниже. Например, живой вирус может быть подвергнут УФ-излучению при температуре приблизительно 4°C. Согласно другому примеру живой вирус может быть подвергнут гамма-излучению при температуре приблизительно -80°C. Согласно еще одному примеру живой вирус может быть подвергнут гамма-излучению при температуре приблизительно -130°C.
Как отмечено выше, структура РНК может быть сшита или расщеплена на достаточно прерывистые сегменты РНК, чтобы уменьшить или предотвратить транскрипцию РНК в мРНК; трансляцию мРНК в белок или и то и другое. В дополнение к обсуждаемому выше электромагнитному излучению, это может быть достигнуто путем воздействия на живой вирус химическим средством, таким как алкилирующее средство, способное сшивать РНК, или образующим свободные радикалы средством, способным к расщеплению РНК. Примеры таких сшивающих средств включают в себя бусульфан, циклофосфамид, мелфалан, формальдегид, карбодиимид и бис-сульфосукцинимидилсуберат. Примеры образующих свободные радикалы средств включают в себя пероксиды, бромистый водород, персульфат аммония и гидроксильный радикал.
Живой вирус может быть выделен из поглощающего УФ соединения путем фракционирования питательной среды, используемой для получения вирусных частиц. Питательная среда может быть фракционирована, например, в градиенте сахарозы. После получения NRVP, NRVP может быть разделена фракционированием или фильтрацией разбавителя, содержащего происходящие от вирусов частицы. Разбавитель может быть фракционирован, например, в градиенте сахарозы или профильтрован с помощью тангенциальной проточной фильтрации.
В настоящем изобретении также предусмотрен способ стимуляции иммунного ответа на введение описанных выше нереплицируемых происходящих от вирусов частиц пациенту. Введение NRVP индуцирует экспрессию и высвобождение цитокинов у пациента. Иллюстративные цитокины, которые могут быть высвобождены у пациента, включают в себя: интерлейкины, интерфероны, воспалительные цитокины, представителей семейства хемокинов СХС, представителей семейства факторов некроза опухоли или любую их комбинацию. Эти факторы могут приводить к презентации или распознаванию опухолевых антигенов.
В настоящем изобретении также предусмотрен способ индукции клеточной гибели злокачественных клеток у пациента. Способ предусматривает введение описанных выше нереплицируемых происходящих от вирусов частиц пациенту.
В настоящем изобретении также предусмотрен способ преимущественного индуцирования клеточной гибели злокачественных клеток или незлокачественных клеток. Способ предусматривает введение описанных выше нереплицируемых происходящих от вирусов частиц пациенту.
Гибель клеток может происходить через апоптоз, например, вызванный наличием NRVP или составляющих NRVP в клетке. Альтернативно, гибель клеток может быть связана с вовлечением врожденных иммунных эффекторных клеток, адаптивных иммунных эффекторных клеток или любой их комбинации, например, вызванных высвобождением цитокинов клеткой. Адаптивные иммунные эффекторные клетки могут представлять собой Т-клетки, В-клетки или и те и другие. Врожденные иммунные эффекторные клетки могут включать в себя тучные клетки, фагоциты (например, нейтрофилы, макрофаги или дендритные клетки), базофилы, эозинофилы, клетки натуральные киллеры, Т-клетки γδ или любую их комбинацию.
Пациента лечат достаточным количеством NRVP, чтобы стимулировать иммунный ответ или индуцировать клеточную гибель злокачественных клеток. Поскольку NRVP не образуют живые вирусные частицы, желательно вводить NRVP в количестве, которое больше, чем воздействия с компетентными по репликации вирусами. Пациенту могут быть введены от 1Е10 до 1Е15 нереплицируемых происходящих от вирусов частиц, хотя в предпочтительных примерах пациенту вводят от 1Е11 до 1Е13 происходящих от вирусов частиц.
Возможно синергетическое преимущество при комбинировании лечения пациента с NRVP и лечения с химиотерапевтическим средством. Химиотерапевтическое средство может представлять собой, например: бендамустин, дексаметазон, доксорубицин, винкристин, иматиниб, дазатиниб или идарубицин. Эти средства могут повышать чувствительность к опосредованному NRVP апоптозу, усиливать секрецию цитокинов, улучшать противоопухолевые иммунные ответы, вызывать сосудистое выключение или любую их комбинацию.
NRVP могут быть использованы для лечения солидных опухолей или несолидных опухолей, таких как лейкемия. Однако, поскольку NRVP не образуют живые вирусные частицы в клетке, особенно желательно подвергать все злокачественные клетки введенным NRVP. Это отличается от введения компетентных по репликации вирусов, где воздействие на часть злокачественных клеток введенным вирусом приводит к получению дополнительного вируса и последующему воздействию на оставшиеся злокачественные клетки полученными вирусными частицами.
В связи с отсутствием производства вирусных частиц, предпочтительно использовать NRVP для лечения лейкемии, поскольку внутривенное введение NRVP приводит к подверганию существенной фракции лейкозных клеток действию частиц. В противоположность этому, с солидными опухолями, часть клеток в солидной опухоли может не быть подвержена введенным NRVP. Способ введения нереплицируемых происходящих от вирусов частиц может определяться подлежащей лечению злокачественной опухолью. NRVP можно вводить пациенту внутриопухолево, интраназально, внутримышечно, внутрикожно, внутрибрюшинно, внутриартериально, внутривенно, подкожно или интракраниально.
Нереплицируемые происходящие от вирусов частицы (NRVP) согласно настоящему изобретению могут быть образованы из частиц Rhabdovirus дикого типа, модифицированных так, чтобы не обладать способностью к распространению между клетками. Нереплицируемые происходящие от Rhabdovirus частицы могут быть получены от компетентной по репликации частицы Rhabdovirus дикого типа. После модификации NRRP не может выдержать репликацию вириона. NRRP могут сохранять цитолитический тропизм против иммортализованных клеток. Специфические примеры NRRP характеризуются врожденными и/или адаптивными иммуностимулирующими свойствами против иммортализованных клеток.
Для целей настоящего изобретения термин "иммортализованные клетки" означает клетки с неконтролируемым клеточным делением, и включает в себя без ограничения гиперпролиферативные клетки, опухолевые или злокачественные клетки и трансформированные иммортализованные клетки. Гиперпролиферативная клетка(и) относится к любому новообразованию или любой хронически инфицированной клетке или ткани. Новообразование может представлять собой, например, любое доброкачественное новообразование, кистозное новообразование, карциному, злокачественное новообразование, метастатическое новообразование или вторичное новообразование. Гиперпролиферативная клетка может представлять собой гемопоэтическую злокачественную клетку или клетку из солидной опухоли.
NRRP в соответствии с настоящим изобретением могут сохранять цитолитический тропизм в отношении иммортализованных клеток. Это означает, что NRRP будут индуцировать гибель клеток преимущественно в иммортализованных клетках, таких как опухолевые или злокачественные клетки, и трансформированных иммортализованных клетках.
Rhabdovirus дикого типа может быть модифицирован, чтобы производить NRRP с помощью средств, которые разрушают репликацию и/или экспрессию его генома. Это означает, что репликация и/или экспрессия генома уменьшается, по сравнению с исходной экспрессией. Экспрессия генома также может быть удалена.
Чтобы нарушить экспрессию генома Rhabdovirus дикого типа, может быть использовано электромагнитное (ЭМ) излучение. Электромагнитное излучение может включать в себя УФ-излучение, инфракрасное, рентгеновское, гамма и другие виды излучения в спектре электромагнитного, такие как UVC (200-280 нанометров). Индуцированное химическими веществами разрушение может также использоваться, чтобы нарушить экспрессию генома Rhabdovirus дикого типа. Например, можно использовать повреждающее геном средство, такое как бусульфан.
Доза ЭМ, необходимая для достаточного нарушения экспрессии генома Rhabdovirus дикого типа, будет зависеть от способа и будет варьировать в зависимости от таких параметров, как концентрация вируса, мутность препарата вируса, используемого объема, наличия примесей или чистоты исходного раствора препарата вируса, используемого разбавителя и сосуда, в котором препарат вируса сохраняется для процедуры (пластик, стекло и т.д.). В химическом дозировании также могут быть затронуты различные параметры.
В одном примере 50 мкл исходного раствора 1Е10 БОЕ/мл Rhabdoviruses дикого типа, очищенного с использованием способа сахарозной подушки, облучали при 250 мДж/см2 (приблизительно 40 секунд).
В настоящем изобретении дополнительно предусмотрена нереплицируемая происходящая от Rhabdovirus частица, которая была получена из происходящей от Rhabdovirus дикого типа частицы. Вирус дикого типа был модифицирован, чтобы не обладать способностью к распространению между клетками, но, чтобы сохранить врожденные и/или адаптивные иммуностимулирующие свойства.
В настоящем изобретении также предусмотрено использование NRVP и, в частности NRRP, для лечения популяции иммортализованных клеток.
Для целей настоящего изобретения "лечить" будет означать применения, где NRVP или NRRP используется отдельно или в сочетании с лучевой терапией, химиотерапией, иммунотерапией, хирургией, основанным на онколитических вирусах способом лечения или другими основанными на вирусах способами лечения.
Специалисту в настоящей области техники будет понятно, что "химиотерапия" включает в себя без ограничения способы лечения, включающие в себя использование ингибиторов митоза, IMiDS, таких как леналидомид или помалидомид, модифицирующее хроматин средство, ингибиторы HDAC, такие как SAHA, гипометилирующие средства, алкилирующие средства, ингибиторы mTOR, ингибиторы тирозинкиназы, ингибиторы протеасом, антиметаболиты, повреждающие ДНК или регулирующие ДНК средства, ингибиторы фосфодиэстеразы, имитаторы SMAC, такие как LCL161, кортикостероиды и цитокин/хемокины.
Например, химиотерапия будет включать в себя способы лечения, использующие: алкилирующие средства, повреждающие ДНК средства или регулирующие ДНК средства, митотические ингибиторы, ингибиторы тирозинкиназы, ингибиторы протеасом, IMiDS, антиметаболиты, ингибиторы mTOR, модифицирующие хроматин средства, ингибиторы HDAC, гипометилирующие средства, ингибиторы фосфодиэстеразы, кортикостероиды и цитокины/хемокины. Конкретная химиотерапия включает в себя без ограничения: бендамустин, бусульфан, карбоплатин, кармустин, хлорамбуцил, цисплатин, циклофосфамид, дакарбазин, ломустин, мелфалан, темозоломид, тиотепу, оксалиплатин, прокарбазин, пентостатин, кладрибин, клофарабин, цитарабин, флударабин, гемцитабин, гидроксимочевину, меркаптопурин, неларабин, фторурацил, блеомицин, дактиномицин, даунорубицин, доксорубицин, липосомальный доксорубицин, идарубицин, митоксантрон, капецитабин, топотекан, иринотекан, этопозид, паклитаксел, тенипозид, тиогуанин, омацетаксин, альтретамин, аспарагиназу, пегаспаргазу, изотретиноин, ретиноевую кислоту, мышьяк, винбластин, винкристин, липосомальный винкристин, босутиниб, дазатиниб, иматиниб, нилотиниб, сунитиниб, вемурафениб, регорафениб, бортезомиб, карфилзомиб, талидомид, леналидомид, помалидомиб, метотрексат, пралатрексат, эверолимус, темсиролимус, вориностат, ромидепсин, вальпроевую кислоту, децитабин, азацитидин, анагрелид, кортизон, дексаметазон, преднизолон и триамцинолон, интерферон альфа-2а, интерферон альфа-2b, пегинтерферон альфа-2b, интерферон бета-1b, альдеслейкин/IL-2, денилейкин дифтитокс, гранулоцитарный колониестимулирующий фактор и гранулоцитарно-макрофагальный колониестимулирующий фактор.
Для целей настоящего изобретения термин "иммунотерапия" следует понимать как иммунотерапия, нацеленно воздействующая CD20 (например, ритуксимаб, ибритумомаб тиуксетан и тозитумомаб), CD47, CD33, CD38, CD138, CD52, КС1 (например, алемтузимаб), VEGF (например, бевацизумаб), Her2/Neu (например, трастузумаб), EGFR (например, цетуксимаб и нимотузумаб), CTLA4 (например, ипилимумаб) или IGF-1 (например, ганитумаб). Другая иммунотерапия известная специалистам в настоящей области техники может быть также включена в объем термина "иммунотерапия".
Ссылка на "основанные на онколитических вирусах способы лечения" включает в себя известные в настоящей области техники, включающие в себя основанные на вирусе оспы, способы лечения (основанные на вирусах Vaccinia), основанные на вирусе простого герпеса способы лечения (OncoVEXGM-CSF), основанные на рабдовирусе способы лечения (MG1, VSV-IFNb, VSVd51), реовирус (Reolysin), основанные на аденовирусах способы лечения (ONYX 015), основанные на вирусе кори способы лечения, основанные на вирусе болезни Ньюкасла способы лечения, основанные на вирусе альфа способы лечения и основанные на видах парвовируса способы лечения.
NRVP и NRRP можно вводить внутриопухолево, интраназально, внутримышечно, внутрикожно, внутрибрюшинно, внутриартериально, внутривенно, подкожно или интракраниально.
Были продемонстрированы онколитические свойства NRRP в нескольких различных моделях in vitro и in vivo с использованием двух различных полученных из рабдовирусов штаммов и нескольких различных типов клеток, включающих в себя образцы пациентов, как описано более подробно ниже.
Опухолеспецифическую цитотоксичность характеризовали в ряде анализов, включающих в себя микроскопическую характеристику клеточного фенотипа, количественное определение цитотоксичности с резазурином и проточную цитометрию уничтожения опухолевых клеток.
Использование модели иммунной защиты против L1210 показывает, что активация NRRP запрограммированных путей клеточной гибели приводит к созданию врожденного и адаптивного иммунного ответа против опухоли. Таким образом, лечение с NRRP не требует, чтобы каждая клетка заражалась для поддержания эффективности и, следовательно, может быть использована в качестве лечения в отдельности или в качестве адъюванта в противораковых терапевтических схемах лечения.
Также проводили основанное на Luminex количественное определение цитокинов, индуцированных NRRP у несущих L1210 мышей во время острого бластного криза. Все идентифицированные цитокины были индуцированы более чем 2-кратно обработанными NRRP мышами и представляют собой статистически значимые (непарный критерий Стьюдента pV<0,05). pV был исправлен, чтобы отвечать проверке гипотезы для многомерных данных (способ Бенджамини-Хохберга).
Этот эксперимент также показывает, что NRRP могут быть оптимально эффективными при применении в высоком соотношении NRRP к клеткам (т.е. >1). Это высокое дозирование гарантирует, что большинство клеток в клеточной популяции сталкивается с цитотоксической NRRP. Это контрастирует со способами лечения живыми OV, которые полагаются на вирусное распространение, надеясь на достижение терапевтической эффективности, и по своей сути используют низкое соотношение OV к клеткам для способствования безопасной доставки реципиенту.
ПРИМЕРЫ
Для всех фигур, за исключением фиг. 1А, NRRP получали с помощью облучением UVC в дозе 250 мДж/см2 образца объемом 50 мкл 1Е10 БОЕ/мл живого VSV-GFP, очищали с использованием способа сахарозной подушки, при котором препарат вируса центрифугировали через 20% (масса/объем) сахарозную подушку в воде (5 мл) при 148000 g в течение 120 минут.
Пример 1: Основанные на VSV NRRP, полученные с помощью облучения электромагнитным излучением.
Фотонное УФ повреждение рабдовирусов может быть использовано для создания нереплицируемой происходящей от вируса частицы, которая сохраняет биологическую активность. Использование высоких доз УФ-облучения разрушает геном рабдовируса, вызывая биологическую инертность вируса. Тем не менее, в настоящее время было обнаружено, что УФ-облучение может быть применено в дозе, которая все еще позволяет вирусу связываться с и поглощаться клеткой, но останавливает или существенно снижает способность частицы образовывать новые вирусные частицы, когда вирусная частица находится в клетке. Соответственно, репликация вируса теряется, в то время как биологическая активность сохраняется.
Было установлено, что облучение очищенного VSV (Rhabdovirus), экспрессирующего зеленый флуоресцентный белок, дозой от приблизительно 100 до приблизительно 1000 мДж/см2 УФ потока, создает NRRP, которая сохраняет цитолитический тропизм в отношении иммортализованных клеток (фиг.1А и 1В), но не способна к распространению между клетками (фиг. 2).
Дозу УФ-облучения 250 мДж/см2 применяли к штамму VSV дикого типа для создания основанных на VSV NRRP в соответствии с настоящим изобретением. На фиг. 1А доза УФ 1Е2 соответствует 100 мДж/см2. Таким образом, при облучении в дозе 250 мДж/см2, VSV-eGFP теряли свои возможности экспрессии, все еще поддерживая мощную цитотоксичность против иммортализованной клеточной линии (Vero) (фиг. 2В). Титрование вируса после заражения подтвердило, что полученная в результате частица не могла реплицировать в этих клетках в резком противоречии с живой вирусной инфекцией (фиг. 2С). Этот эффект в равной степени наблюдался при использовании других представителей семейства Rhabdovirus, включая в себя Maraba (фиг. 3A, 3B и 3C).
Кривые дозовой зависимости, показанные на фиг. 1А, показывают, что цитотоксичность снижается при дозах УФ свыше 1000 мДж/см2 и полностью аннулируется при дозе УФ 10000 мДж/см2. Считается, что цитотоксичность отменяется при этой дозе, так как белки G сшиваются до такой степени, что они не могут позволить вирусу связываться с клеточной поверхностью и/или поглощаться клеткой. Сравнивая с и противопоставляя нормальным неонатальным фибробластам кожи человека (HDF) (фиг. 1А и 1В), кажется, что цитотоксичность предпочтительна для злокачественных клеток, по сравнению с незлокачественными клетками. Действительно, похоже, что незлокачественные клетки требуют приблизительно в 10 раз больше вирусов, чтобы стать чувствительными к опосредованной NRRP цитотоксичности (фиг. 1В).
Для подтверждения отсутствия репликации и распространения NRRP в острых лейкозных клетках, синтез GFP и вирусные титры оценивали количественно после воздействия in vitro на агрессивную мышиную клеточную линию острого лимфобластного лейкоза (L1210), наряду с контрольной клеточной линией Vero (нормальные эпителиальные клетки почек). В обеих обработанных клеточных линиях не наблюдали обнаруживаемого живого вируса (фиг. 4А и 4В).
Анализ Вестерн-блоттинг вирусного генома показывает, что NRRP характеризуются пониженной глобальной экспрессией генома (фиг. 5). Дозы УФ, которые блокируют продукцию вириона и снижают экспрессию генома, связаны с явной онколитической активностью. В этих экспериментах высокая (большая или равная 1) множественность заражения (MOI) или соотношение частиц к клеткам могут быть использованы для уверенности в том, что каждая опухолевая клетка обнаруживает NRRP и индуцирует обширную гибель клеток в популяции (фиг. 1В).
Пример 2: Основанные на VSV NRRP, полученные путем воздействия алкилирующего РНК средства
Согласно другому примеру NRRP химически получали путем обработки VSV бусульфаном в концентрации 6 мг/мл при 4°C в течение 24 часов и добавляли к клеткам Vero в течение 24 часов. Менее 4% клеток Vero оставались жизнеспособными после обработки (фиг. 6А). Этот эффект присущ NRRP, поскольку воздействие одного бусульфана в течение 24 часов показало, что клетки Vero оставались жизнеспособными приблизительно на 82% (фиг. 6В). На фиг. 6С показан цитопатический эффект живого VSV-GFP, инфицировавшего клетки Vero в течение 24 часов, и что этот исходный раствор живого вируса (VSV-GFP), из которого были получены NRRP, был компетентным по репликации - по доказательству экспрессии GFP.
Пример 3: Основанные на VSV NRRP, полученные с помощью воздействия гамма-излучением
В еще одном примере NRRP получены с помощью облучения замороженным VSV 1Е10 с 15 кГр кобальта-60 при -80°C, и 1000 частиц на клетку добавляли к клеткам Vero в течение 48 часов. Опять же, цитопатический эффект NRRP был отчетливо виден на этих иммортализованных клетках (фиг. 7А). Индуцированные NRRP морфологические эффекты клеточного апоптоза и гибели сравнивают с цитопатическими эффектами воздействия на те же клетки с живым VSV-GFP в течение того же периода времени 48 часов (фиг. 7В). Клетки Vero, обработанные только PBS, оставались полностью жизнеспособными, без цитопатического эффекта и не показывали флуоресценции (фиг. 7С).
Пример 4: NRRPS представляют собой эффективное лечение против лейкозных клеток in vitro
Чувствительны ли клетки острого лейкоза к опосредованной NRRP гибели клеток исследовали с основанными на VSV NRRP, полученными с помощью УФ способа. Во-первых, определяли цитотоксичность, индуцированную в клеточной линии L1210 и которая наблюдалась в нормальных человеческих фибробластах кожи (HDF). В то время как обе клеточные линии были чувствительны к живой вирусной инфекции, NRRP исключительно индуцировали гибель в лейкозных клетках L1210 (фиг. 8А). Классический апоптический фенотип, характеризующийся уменьшенным диаметром клеток, "сморщенным" внешним видом с многочисленными апоптическими телами и фрагментированным ядерным содержанием, наблюдался в клетках острого лейкоза L1210. Цитотоксичность количественно оценивали с использованием стандартного анализа с резазурином в нескольких клеточных линиях человека и мыши. В этих экспериментах острые лейкозы были очень чувствительны к опосредованной NRRP гибели клеток с сохранением жизнеспособности нормальных клеток (фиг. 8В). Аналогичные результаты определяли с использованием основанных на Maraba NRRP, альтернативном штамме Rhabdovirus (фиг. 3A и 3B). Отсутствие экспрессии генома подтверждали с помощью флуоресцентной микроскопии (фиг. 8С).
Уровень апоптоза в клеточных линиях L1210 количественно определяли с помощью проточной цитометрии. Через тридцать часов после воздействия NRRP индуцировали обширный (84% популяции) ранний/поздний апоптоз (фиг. 9). Было показано, что индуцированный VSV апоптоз непосредственно коррелирует с уровнем присутствующего стресса эндоплазматического ретикулума (ER) (10). Интересно, что, когда способность клетки уменьшать стресс ER нарушается, иммуногенный апоптоз может быть индуцирован (16). NRRP индуцирует этот уникальный вид клеточной смерти, как описано ниже.
В других примерах лейкозные клетки L1210 обрабатывали NRRP в сочетании либо с 300 мкМ бендамустина (фиг. 10); 45 мкМ дексаметазона (фиг. 11); 0,025 мкМ доксорубицина (фиг. 12), либо 0,0125 мкМ винкристина (фиг. 13) в течение 72 часов. Было показано, что NRRP сами индуцируют цитотоксический эффект обычным способом, однако в сочетании с вышеописанными лекарственными средствами наблюдается дополнительный и/или синергический цитотоксический эффект. Это показывает, что уникальный терапевтический эффект потенцирования возникает, когда способы лечения с NRRP сочетают с другими
химиотерапевтическими/фармакологическими средствами.
В еще одном примере Ph-позитивные миелоидные лейкозные клетки К562 обрабатывали полученными с помощью УФ NRRP в сочетании с 0,05 мкМ ирарубицина (фиг. 14) в течение 72 часов. В этом примере также миелоидная лейкозная клеточная линия была высоко чувствительна к опосредованной NRRP клеточной гибели, и эффект потенцирования снова наблюдали с использованием этого класса химиотерапевтических соединений в сочетании с NRRP. Эти наблюдения показывают, что способ лечения с NRRP может действительно быть дополнен за счет использования дополнительных терапевтических средств. Это представляет собой альтернативную стратегию лечения злокачественных опухолей, в частности трудно поддающихся лечению форм злокачественных опухолей, которые могут требовать этого уникального комбинаторного подхода для повышения эффективности.
Пример 5: Изображение моделирования противоопухолевой специфичности NRRP.
Модель, используемую для описания специфичности NRRP против клеток с дефектами в противовирусных сигнальных путях, адаптировали из предыдущей работы авторов настоящего изобретения, описанной в LeBoeuf et al 2013 (фиг. 15А). Вкратце, эта модель представлена подмножеством из шести обыкновенных дифференциальных уравнений, описывающих переход между клеточными популяциями (UP, IP, АР и РР) в зависимости от концентрации NRRP (N) и интерферона (IFN) в окружающей среде. Эти уравнения представляют собой:
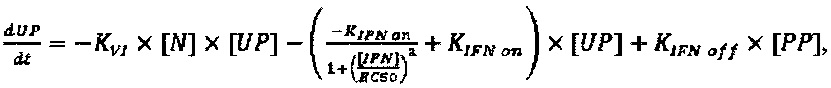
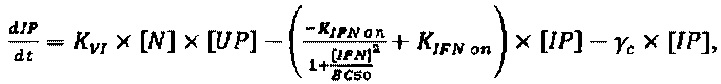


Параметры, используемые в приведенных выше уравнениях, представляют собой скорость интернализации NRRP (KNI), скорость активации передачи сигналов IFN (KIFN on), скорость инактивации передачи сигналов IFN (KIFN off), EC50 IFN (ЕС50), скорость гибели клеток (γC) и скорость клиренса NRRP (KNC).
Следующее подмножество уравнений описывает динамику NVRP (N) и интерферона (IFN), в котором:


Параметры, описанные в приведенных выше уравнениях, представляют собой скорость интернализации NRRP (KNI), деградацию NRRP (γN), производство IFN из IP, АР и РР (KIFN1, KIFN2.1 and KIFN2.2, соответственно) и деградацию IFN (γIFN).
Моделирование Монте-Карло проводили путем случайного варьирования вышеуказанных параметров в окне регистрации 1 (таблица 2), охватывающем физиологический параметр, полученный из литературы и экспериментальных данных (18). Моделирования проводили в Matlab с использованием ODE15s, задавая условие отсутствия негативности. Описанные на фиг. 15В тенденции представляют собой среднее значение из более 1000 моделей. Число клеток, используемых в этих моделях, составляло 2.5Е5, объем сред устанавливали в 1 мл и соотношение БОЕ к клеткам устанавливали на уровне 100 частиц на клетку. В этих моделированиях дефекты в путях передачи сигналов IFN моделировали путем уменьшения KIFN1, KIFN2.1, KIFN2.2, Kvc и KIFN on от 100% до 1% от их первоначального значения.
Для исследования механизма, с помощью которого достигается специфичность в отношении опухолевых клеток, авторы настоящего изобретения моделировали цитотоксичность, индуцированную NRRP в нормальных и опухолевых клетках. Недавно авторы настоящего изобретения разработали основанную на популяции модель, описывающую взаимосвязь между цитотоксичностью и динамиками репликации живого онколитического вируса в нормальных и опухолевых клетках. Согласно этой модели, цикл инфицирования начинается как только неинфицированная популяция клеток (UP) сталкивается с вирионами. Это позволяет популяции UP становиться инфицированной, и, в контексте живого вируса, вирионы и цитокин, известный как интерферон (IFN), высвобождаются в окружающую среду.
Поскольку IFN постепенно увеличивается, популяция клеток активирует противовирусную передачу сигналов (АР), которая в течение долгого времени позволяет этой популяции очищать вирусную инфекцию и становиться защищенной от дальнейшего поражения (РР). Для адаптации этой модели к NRRP авторы настоящего изобретения удалили динамику репликации вируса из модели и моделировали отношения между опосредованной NRRP цитотоксичностью и степенью дефектов в путях передачи сигналов IFN в процессе, известном как происходящий в ~80% злокачественных опухолей. Эти дефекты были смоделированы путем снижения скорости производства IFN, скорости активации передачи сигналов IFN и скорости клиренса NRRP между опухолевыми и нормальными клетками. Чтобы убедиться, что это наблюдение представляет собой систематическое, использовали платформу моделирования Монте-Карло. Здесь все кинетические параметры варьировали в пределах окна регистрации 1, охватывающего оценки, полученные из литературы или экспериментальных данных (таблица 2).
После моделирования 1000 пар случайных параметров (фиг. 15B), авторы настоящего изобретения установили, что поскольку злокачественные клетки теряют способность передавать сигнал или реагировать на IFN, эти клетки становятся более чувствительными к опосредованной NRRP цитотоксичности. Чтобы проверить это наблюдение, авторы настоящего изобретения исследовали влияние IFN на опосредованную NRRP цитотоксичность в нормальных (HDF) и лейкозных (L1210) клетках. Интересно, что в то время как IntronA (рекомбинантный IFN) мог дополнительно увеличивать защиту нормальных клеток от поражения NRRP (фиг. 15С), IntronA не оказывал обнаруживаемого влияния на лейкозные клетки (фиг. 15D).


Пример 6: Активность NRRP при бластном кризе AML
Трансляционный потенциал платформы NRRP исследовали в клинических образцах. Мононуклеарные клетки периферической крови получали от двух пациентов-людей с высоким бременем острого бластного криза и исследовали чувствительность к опосредованной NRRP клеточной гибели. Пациенты содержали циркулирующие бласты с CD33-положительным фенотипом. Оба ранее получали продолжительное лечение хронической миелоидной лейкемии (CML) и развили устойчивость к лечению ингибитором тирозинкиназы (TKI). Подобно наблюдению в бластных клетках L1210, образцы пациентов развивали очевидный индуцированный NRRP апоптоз с классической морфологией (фиг. 16А). Флуоресцентная микроскопия подтвердила отсутствие экспрессии генома NRRP (фиг. 16В). Действительно, после воздействия NRRP эти CD33+ лейкозные клетки сильно окрашивались маркером апоптоза аннексином V (фиг. 16С). Некультивируемые образцы пациентов использовали для оценки специфичности этой реакции. Действительно, у обоих пациентов, преобладающая лейкозная CD33+ популяция удалялась после лечения NRRP, оставляя нормальные клетки доминировать в образце (фиг. 16D).
Для того, чтобы убедиться, что NRRP не влияют на нормальные белые клетки крови, на выделенные от здорового донора мононуклеарные клетки костного мозга воздействовали PBS или NRRP. В обоих ранних (18 час) и поздних (65 час) моментах времени NRRP не индуцировали апоптоз в этих образцах (фиг. 17А и 17В).
Пример 7: Противолейкозная активность NRRP in vivo
Мышиную модель лейкозного бластного криза использовали для оценки потенциала NRRP в качестве терапевтического средства. Вкратце, в первый день мышей DBA/2 сенсибилизировали дозой 1×106 бластных клеток L1210. На следующий день мышей подвергали режиму дозирования 3×109 NRRP, вводимых внутривенно, в течение трех дней подряд, и контролировали выживание. Параллельно на отдельные когорты мышей воздействовали живым VSV в MTD 2×106 вируса на инъекцию (19), или PBS в той же схеме лечения. Обработанные NRRP мыши достигали 80% выживаемости к 40 дню, что составляет значительное преимущество в сравнении с обработкой PBS (Р≤0,0045) или живым вирусом (Р≤0,044) (фиг. 18А). NRRP хорошо переносились и вводились в максимальной возможной дозе для этого конкретного эксперимента, который представлял собой в 1500 раз более высокую дозу, чем MTD живого вируса. Учитывая то, что острый лейкоз часто распространяется к центральной нервной системе и что VSV дикого типа обладает высокой нейротоксичностью, выполняли внутричерепные инъекции NRRP и живым вирусом. В то время как мыши могут переносить дозу максимального производства для внутричерепных инъекций 1×108 частиц, все мыши быстро погибали от дозы 1×104 живого вируса.
Воодушевленным эффективностью и дифференцированным MTD, предоставляемыми способом лечения NRRP, авторам настоящего изобретения было интересно знать, активирована ли иммунная система после лечения. Мышиную сыворотку крови собирали от мышей с опухолью L1210 через 20 часов после воздействия PBS или NRRP (фиг. 18В). В этом анализе ясно, что цитокины, как правило, известные тем, что вовлекают и дифференцируют Т-клетки, индуцируются после обработки NRRP. Примеры таких иммунномодулирующих цитокинов, значительно индуцированные воздействием NRRP, включают в себя ингибирующий лейкоз фактор LIF, IL-2, IL-4, CCL-2, RANTES и М1Р-1α (фиг. 18В).
Для подтверждения стимуляции иммунной системы, в частности Т-клеточной активации, авторы настоящего изобретения приняли стратегию вакцины, описанную в предыдущих публикациях. Экспериментально, эта платформа состоит из вводимых апоптических клеток в иммунокомпетентных животных и измерения защитного адаптивного иммунитета против последующей сенсибилизации опухоли. Действительно, обработанные NRRP клетки L1210 развивают заметный апоптоз, как можно увидеть на фиг. 16С по увеличению окрашивания аннексином-V. Таким образом, этот классический экспериментальный подход был принят для изучения того, запускают ли NRRP иммуногенный апоптоз.
Две когорты мышей DBA/2 (сингенных к L1210) получали три раза в неделю внутривенные дозы 1×106 γ-облученных клеток L1210, предварительно обработанных NRRP. Другая когорта получала то же количество γ-облученных клеток L1210. Через одну неделю после этой схемы введения, вводили лейкозную сенсибилизацию L1210 (1×106 клеток) через хвостовую вену и записывали выживание. Когорта, получающая обработанные NRRP клетки L1210, характеризовалась 80% защитой после лейкозной сенсибилизации, которая была в противном случае равным образом летальна у когорты, которой вводили необработанные L1210 (фиг. 19). Выжившие мыши содержались в течение >150 дней, чтобы обеспечить длительную защиту. Это согласуется с идеей, что обработанные NRRP клетки острого лейкоза подвергаются иммуногенному апоптозу.
Используя клеточные линии острого лимфобластного и миелоидного лейкоза, а также первичные лейкозные клетки от сильно предварительно обработанных пациентов с CML в фазе острого бластного криза, было продемонстрировано, что NRRP представляют собой по меньшей мере специфические к лейкозу цитолитические средства. Через описанные выше эксперименты in vitro и in vivo было подтверждено, что NRRP предлагают мультимодальную терапевтическую платформу.
Пример 8: Активность NRRP в клеточных линиях множественной миеломы, злокачественной опухоли мозга и злокачественной опухоли толстой кишки
В дополнение к описанным выше экспериментам было также показано, что NRRP представляют собой цитопатические в нескольких миеломных клеточных линиях МСР-11 и RPMI-8226 (фиг. 20), когда клеточные линии обрабатывали PBS или полученными из VSV NRRP в течение 15 ч. В частности, на фиг. 21 показана жизнеспособность клеток после цитотоксичности с Alamar blue или анализа с резазурином для миеломных клеточных линий, полученных через 72 часа после воздействия NRRP, вводимыми при MOI=250. В этом эксперименте, SR4987 представляет собой клеточную линию нормального стромального костного мозга. Как видно на фиг. 21, SR4987 демонстрирует устойчивость к NRRP, так как это незлокачественная клетка. Никакой репликации генома NRRP или VSV не было обнаружено, когда NRRP получали, поскольку не производилось закодированных вирусами GFP (данные не показаны).
В другом примере множественную миеломную клеточную линию МСР-11 обрабатывали 20 мкМ мелфалана (фиг. 22) или 15 мкМ миметика СМАК LCL161 (фиг. 23) в сочетании с NRRP. Комбинированный способ лечения дополняли цитопатическим эффектом NRRP в обоих случаях. Синергичная активность между миметиками SMAC и NRRP представляет собой перспективный подход. Следует отметить, что противоопухолевая активность миметика SMAC значительно увеличивается, а в некоторых случаях существенно зависит от совместного введения NRRP.
В еще одном примере клеточную линию множественной миеломы RPMI-8226 обрабатывали 5 нМ карфилзомиба с потенцирующим цитотоксическим эффектом (фиг. 24). Показано, что совместное введение NRRP с алкилирующим средством (таким как мелфалан), ингибитором протеасом (таким как карфилзомиб) или миметиком SMAC (таким как LCL161) представляет собой альтернативную стратегию лечения различных видов злокачественных опухолей, особенно перспективное при основанных на гемопоэтических клетках злокачественных опухолей, таких как множественная миелома.
Применимость NRRP в виде противоракового терапевтического средства далее демонстрируется его действием на опухолевых клеточных линиях головного мозга. Опосредованная NRRP цитотоксичность определяли в клеточной линии глиобластомы СТ2А, клеточной линии отсроченной глиобластомы опухоли мозга (DBT) (фиг. 25А), клеточной линии астроцитомы K1491 (фиг. 25В) и K1492, и мышиной клеточной линии глиомы (GL261) (фиг. 25С), по сравнению с нормальными клетками HDNF, когда эти клетки были обработаны в течение 24 часов PBS или NRRP (фиг. 26).
Кроме того, в еще одном примере клеточную линию глиобластомы СТ2А обрабатывали 10 мкМ ингибитора HDAC SAHA в сочетании с NRRP, и наблюдался потенцирующий цитопатический эффект, по сравнению с NRRP с PBS (фиг. 27). Ингибирование HDAC показало небольшую перспективу в качестве противоракового средства. Тем не менее, в сочетании с NRRP отмечена значительная активность, представляя очень перспективный подход для лечения основанных на глиобластоме злокачественных образований, неудовлетворенный клинической необходимостью.
Клеточные линии злокачественных опухолей почек (786-0) и молочной железы (4Т1) одинаково чувствительны к цитопатическим эффектам NRRP (фиг. 28А, 28В, 28С). В этой серии экспериментов клеточные линии обрабатывали NRRP с MOI=250, и жизнеспособность количественно определяли с помощью анализа с резазурином в течение 72 ч. Флуоресцентная микроскопия, осуществляемая на протяжении эксперимента, подтвердила отсутствие экспрессии генома.
В другом примере, подкожные клетки злокачественной опухоли толстой кишки СТ26 имплантировали мышам. Затем мышей обрабатывали NRRP 2Е9 в дни 16, 18 и 21 после погружения опухоли (фиг. 29). Несмотря на большое бремя опухоли перед воздействием NRRP, получали длительное выживание и излечивание, когда NRRP вводили внутриопухолево или внутривенно. Контрольные мыши, которым вводили PBS, все быстро достигали конечной точки. Эта модель представляет собой дополнительные доказательства того, что солидные опухоли могут также быть пригодны для основанных на NRRP схем лечения.
Примеры выше показывают через исследование in silico и in vitro, что NRRP, аналогично живому вирусу, представляют собой опухолеселективные, учитывая, что они используют дефекты врожденных иммунных путей, общих для большинства опухолей. Тем не менее, предел безопасности, обеспечиваемый платформой NRRP, был примером наблюдения того, что высокий титр внутричерепного введения NRRP хорошо переносится реципиентами-мышами.
Исход для большинства взрослых пациентов, страдающих острым лимфобластным или острым миелоидным лейкозом, остается мрачным. Для некоторых пациентов трансплантация аллогенных стволовых клеток после миелоаблативного кондиционирования представляет собой потенциально лечебную, однако эта процедура связана с частыми неблагоприятными событиями и значительной связанной с лечением смертностью. Для многих пациентов с хронической фазой CML, способ лечения с нацелено воздействующим ингибитором тирозинкиназы предлагает превосходный контроль заболевания. Когда происходит прогрессирование острого бластного криза, существуют очень ограниченные варианты лечения в связи с развитием множественной лекарственной устойчивости и быстрой кинетикой этой формы неподдающегося лечению лейкоза.
NRRP проявляют как прямые цитолитические, так и иммуногенные свойства в моделях мышиной множественной острой лейкемии. Своеобразная форма запрограммированной клеточной гибели включает в себя индукцию адаптивных иммунных ответов против умирающей клетки. Этот процесс, как правило, называемый иммуногенным апоптозом, характеризуется важным значением для эффективности нескольких текущих химиотерапевтических средств и требуется для защиты хозяина против вирусной инфекции, включая в себя живых RV. Результаты in vivo выше, показывают, что аналогичный процесс индуцируется NRRP и представляет собой фактор для эффективности лечения.
Большим значением характеризуются наблюдения того, что мультирезистентные первичные миелобласты от пациентов в бластном кризе CML вынуждены подвергаться апоптозу и, наконец, полностью уничтожаться с помощью воздействия NRRP. Кроме того, на нелейкозные лейкоциты, производимые здоровым костным мозгом, не оказывалось негативного влияния. Это наблюдение предполагает, что, несмотря на мощную противоопухолевую активность NRRP, лейкопении, которая обычно наблюдается после стандартной асинхронной и консолидационной химиотерапии, можно было бы избежать. Это может значительно снизить связанные с лечением неблагоприятные явления. Кроме того, учитывая сохранение нормальных лейкоцитов во время лейкозной циторедукции с помощью NRRP, одновременная индукция эффективного противолейкозного иммунного ответа может быть достижима для большинства пациентов, которые не представляют собой кандидатов для радиоактивной химиотерапии высокими дозами с последующей трансплантацией аллогенных стволовых клеток. После индукции иммуногенного апоптоза с помощью NRRP, широкий спектр иммуномодулирующего цитокина высвобождается и, вероятно, оказывает содействие в разработке эффективной адаптивной иммунной активности - важного компонента для достижения долговременных лечебных ответов.
Примеры демонстрируют производство NRRP с высоким титром. Через индуцирующий клеточный лизис, главным образом, через пути запрограммированной клеточной гибели, системные и внутриопухолевые иммунные ответы, включая в себя активацию клеток натуральных киллеров, а также активацию дендритных клеток или сосудистое выключение в опухоли - NRRP укрывают несколько противораковых свойств. Эти особенности могут быть использованы с помощью NRRP отдельно или в качестве адъюванта в сочетании с лучевой терапией, химиотерапией, иммунотерапией, хирургией, полученными из онколитических вирусов или других вирусов терапевтическими платформами.
В предыдущем описании для целей пояснения множественные детали изложены для того, чтобы обеспечить полное понимание примеров. Тем не менее, специалисту в настоящей области техники будет очевидно, что эти конкретные детали не требуются.
Описанные выше примеры предназначены только в качестве примера. Могут быть осуществлены изменения, модификации и вариации с конкретными примерами специалистами в настоящей области техники без отступления от сущности и объема, который определен исключительно прилагаемой формулой изобретения.
Ссылки:
1. Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100: 57-70.
2. Hanahan D, Weinberg RA. Hallmarks of cancer: The next generation. Cell 2011; 144: 646-674.
3. Liu BL, Robinson M, Han Z-, Branston RH, English C, Reay P, et al. ICP34.5 deleted herpes simplex virus with enhanced oncolytic, immune stimulating, and anti-tumour properties. Gene Ther 2003; 10: 292-303.
4. Senzer N, Bedell C, Nemunaitis J. OncoVEXGM-CSF. Armed oncolytic virus. Drugs of the Future 2010; 35: 449-455.
5. Park B-, Hwang T, Liu T-, Sze DY, Kim J-, Kwon H-, et al. Use of a targeted oncolytic poxvirus, JX-594, in patients with refractory primary or metastatic liver cancer: a phase I trial. The Lancet Oncology 2008; 9: 533-542.
6. Breitbach CJ, Thorne SH, Bell JC, Kirn DH. Targeted and armed oncolytic poxviruses for cancer: The lead example of JX-594. Curr Pharm Biotechnol 2012; 13: 1768-1772.
7. Breitbach CJ, Burke J, Jonker D, Stephenson J, Haas AR, Chow LQM, et al. Intravenous delivery of a multi-mechanistic cancer-targeted oncolytic poxvirus in humans. Nature 2011; 477: 99-104.
8. Barber GN. VSV-tumor selective replication and protein translation. Oncogene 2005; 24: 7710-7719.
9. Stojdl DF, Lichty BD, TenOever BR, Paterson JM, Power AT, Knowles S, et al. VSV strains with defects in their ability to shutdown innate immunity are potent systemic anti-cancer agents. Cancer Cell 2003; 4: 263-275.
10. Mahoney DJ, Lefebvre C, Allan K, Brun J, Sanaei C, Baird S, et al. Virus-Tumor Interactome Screen Reveals ER Stress Response Can Reprogram Resistant Cancers for Oncolytic Virus-Triggered Caspase-2 Cell Death. Cancer Cell 2011; 20: 443-456.
11. Saloura V, Wang L-S, Fridlender ZG, Sun J, Cheng G, Kapoor V, et al. Evaluation of an attenuated vesicular stomatitis virus vector expressing interferon-β for use in malignant pleural mesothelioma: Heterogeneity in interferon responsiveness defines potential efficacy. Hum Gene Ther 2010; 21: 51-64.
12. Brun J, McManus D, Lefebvre С, Hu K, Falls T, Atkins H, et al. Identification of genetically modified maraba virus as an oncolytic rhabdovirus. Molecular Therapy 2010; 18: 1440-1449.
13. Willmon CL, Saloura V, Fridlender ZG, Wongthida P, Diaz RM, Thompson J, et al. Expression of IFN-β enhances both efficacy and safety of oncolytic vesicular stomatitis virus for therapy of mesothelioma. Cancer Res 2009; 69: 7713-7720.
14. Galivo F, Diaz RM, Wongthida P, Thompson J, Kottke T, Barber G, et al. Single-cycle viral gene expression, rather than progressive replication and oncolysis, is required for VSV therapy of B16 melanoma. Gene Ther 2010; 17: 158-170.
15. Swarna Bais, Eric Bartee, Masmudur M. Rahman, Grant McFadden, Christopher R. Cogle. Oncolytic Virotherapy for Hematological Malignancies. Advances in Virology 2012; 8.
16. Zitvogel L, Kepp O, Senovilla L, Menger L, Chaput N, Kroemer G. Immunogenic tumor cell death for optimal anticancer therapy: The calreticulin exposure pathway. Clinical Cancer Research 2010; 16: 3100-3104.
17. Ebert O, Harbaran S, Shinozaki K, Woo SLC. Systemic therapy of experimental breast cancer metastases by mutant vesicular stomatitis virus in immune-competent mice. Cancer Gene Ther 2005; 12: 350-358.
18. Finke J, Nagler A. Viewpoint: What is the role of allogeneic haematopoietic cell transplantation in the era of reduced-intensity conditioning - Is there still an upper age limit? A focus on myeloid neoplasia. Leukemia 2007; 21: 1357-1362.
19. Daenen S, Van Der Holt B, Dekker AW, Willemze R, Rijneveld AW, Biemond BJ, et al. Intensive chemotherapy to improve outcome in patients with acute lymphoblastic leukemia over the age of 40: A phase II study for efficacy and feasibility by HOVON. Leukemia 2012; 26: 1726-1729.
20. Giles FJ, O'Dwyer M, Swords R. Class effects of tyrosine kinase inhibitors in the treatment of chronic myeloid leukemia. Leukemia 2009; 23: 1698-1707.
21. Hehlmann R. How I treat CML blast crisis. Blood 2012; 120: 737-747.
Реферат
Изобретение относится к области биотехнологии, молекулярной биологии и вирусологии. Предложен нереплицируемый, поглощаемый клеткой рабдовирус, представляющий собой вирус везикулярного стоматита, причем указанный вирус получен путем воздействия на живой вирус УФ излучением, применяемым в дозе от 100 мДж/смдо 1000 мДж/см, так что по меньшей мере 0,05%, но не более 80% нуклеотидов РНК вируса сшивается и/или РНК вируса расщепляется на по меньшей мере две дискретные полинуклеотидные последовательности, и при этом поверхность оболочки вирусной частицы содержит по меньшей мере 5% от числа G белков вирусной частицы дикого типа. Изобретение может быть использовано в медицине для лечения лейкемии. 3 н. и 5 з.п. ф-лы, 29 ил., 2 табл., 8 пр.
Формула
Документы, цитированные в отчёте о поиске
Удаление клеток с использованием вирусов

Комментарии