Конструирование облигатного вектора на основе онколитических вирусов простого герпеса (ohsv) и конструкции для терапии рака - RU2751236C2
Код документа: RU2751236C2
Чертежи





Описание
ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение в целом относится к лечению рака с применением онколитических вирусов простого герпеса (oncolytic herpes simplex viruses, oHSV). В частности, настоящее изобретение относится к получению облигатного вектора HSV, способного нести и экспрессировать множество генов, кодирующих иммуностимулирующие и/или иммунотерапевтические агенты (средства). Настоящее изобретение также относится к инновационно разработанному геному, который может функционировать в качестве вектора, способного нести и экспрессировать множество терапевтических генов для эффективной терапии рака.
УРОВЕНЬ ТЕХНИКИ
[0002] Проводятся интенсивные исследования онколитических вирусов простого герпеса (oHSV) для лечения солидных опухолей. Данная группа вирусов обеспечивает множество преимуществ по сравнению с традиционными вариантами терапии рака (Markert et al., 2000; Russell et al., 2012; Shen and Nemunaitis, 2006). В частности, oHSV обычно содержат мутацию, которая делает их чувствительными ингибированию одной из составляющих врожденного иммунитета. Как следствие, данные вирусы реплицируются в раковых клетках, в которых нарушен один или более врожденных иммунных ответов на инфекцию, но не в нормальных клетках, в которых врожденные иммунные ответы не нарушены. oHSV обычно доставляют непосредственно в опухолевую массу, в которой вирус может реплицироваться. Поскольку вирус доставляют в ткань-мишень, а не системно, побочные эффекты, характерные для противораковых лекарственных средств, отсутствуют. Вирусы обычно запускают адаптивные иммунные ответы, которые ограничивают возможность их многократного введения. oHSV вводили в опухоли множество раз, и при этом свидетельства утраты активности или индукции нежелательной реакции, такой как воспалительные ответы, отсутствовали. HSV представляют собой большие ДНК-вирусы, способные встраивать в свои геномы чужеродную ДНК и регулировать экспрессию этих генов после введения в опухоли. Чужеродные гены, подходящие для применения с oHSV, представляют собой гены, которые помогают вызывать адаптивный иммунный ответ на опухоль.
[0003] Дефект в преодолении клеточного врожденного иммунного ответа определяет диапазон опухолей, в которых вирус проявляет свой онколитический oHSV в качестве противоракового агента. Чем более обширны делеции, тем более ограничен диапазон раковых клеток, в которых oHSV эффективен, в зависимости от функции делетированного вирусного гена. Наиболее новые oHSV содержат по меньшей мере один клеточный ген для усиления их противораковой активности (Cheema et al., 2013; Goshima et al., 2014; Markert et al., 2012; Walker et al., 2011).
[0004] Удобно отдельно рассматривать структуру oHSV, обозначаемую «остов», и чужеродные гены, подходящие для встраивания в остов. Как отмечается выше, структура остова определяет диапазон чувствительных типов рака. Благодаря чужеродным генам хозяин воспринимает раковые клетки как легитимную мишень адаптивного иммунного ответа.
[0005] Геном HSV-1 состоит из двух ковалентно связанных компонентов, обозначенных L и S. Каждый компонент состоит из уникальных последовательностей (UL для компонента L, US для компонента S), фланкированных инвертированными повторами. Инвертированные повторы компонента L обозначаются ab и b'а'. Инвертированные повторы компонента S обозначаются а'с' и са. Инвертированные повторы b'а' и а'с' составляют внутреннюю область инвертированных повторов. Известно, что области инвертированных повторов компонентов L и S содержат две копии пяти генов, кодирующих белки, обозначенные ICP0, ICP4, ICP34.5, ORF Р и ORF О, соответственно, и крупные участки ДНК, которые транскрибируются, но не кодируют белки.
[0006] Исторически вирусы, исследование которых проводили на пациентах, страдающих от рака, делятся на 3 различные варианта дизайна. Первый основывался на доказательстве того, что делеция гена ICP34.5 в значительной степени аттенуировала вирус (Andreansky et al., 1997; Chou et al., 1995; Chou et al., 1990; Chou and Roizman, 1992) Затем G207, первый вирус, исследование которого проводили на пациентах, аттенуировали посредством дополнительной мутации в гене, кодирующем вирусную рибонуклеотидредуктазу, чтобы гарантировать безопасности для лечения злокачественных глиобластом (Mineta et al., 1995). G207, несущий мутации как в гене ICP34.5, так и в гене рибонуклеотидредуктазы, был чрезмерно аттенуированным и не функционировал в раковых клетках, экспрессирующих протеинкиназу R дикого типа (Smith et al., 2006).
[0007] Второй дизайн основывался на демонстрации того, что, если вирусный белок, обозначенный US11, экспрессируется на ранних стадиях инфекции, он частично компенсирует отсутствие ICP34.5 и восстанавливает способность расти в клетках, экспрессирующих протеинкиназу R дикого типа (Cassady et al., 1998а). Позже был представлен дизайн остова данного вируса, который был опубликован Cassady с соавт. (Cassady et al., 1998b) и в котором ген US12 и промотор US11 были делетированы. Как следствие, US11 экспрессируется как немедленно-раннего гена, а не позднего гена.
[0008] Остов третьего вируса, изначально обозначенного R7020, а затем переименованного в NV1020, является результатом модификаций спонтанного мутанта, который изначально исследовали в качестве живой аттенуированной вирусной вакцины (Meignier et al., 1988; Weichselbaum et al., 2012). В данном мутанте отсутствовали внутренние инвертированные повторы (которые состоят из b'а' и а'с', кодирующих одну копию генов ICP0, ICP4, ICP34.5, ORF Р и ORF О), а также гены, кодирующие UL56 и UL24. Помимо этого, данный мутант содержал бактериальные последовательности, и, поскольку был предназначен для применения в качестве вакцины, он также содержал гены, кодирующие несколько гликопротеинов HSV-2. Исследования R7020 интенсивно проводили на пациентах, на метастазах рака толстой кишки в печень. Помимо этого, исследование R7020 проводили на ксенотрансплантатах эпителиальной плоскоклеточной карциномы головы и шеи и аденокарциномы предстательной железы на бестимусных мышах и на моделях опухоли мочевого пузыря (Cozzi et al., 2002; Cozzi et al., 2001; Currier et al., 2005; Fong et al., 2009; Geevarghese et al., 2010; Kelly et al., 2008; Kemeny et al., 2006; Wong et al., 2001).
[0009] Успех терапии на основе oHSV зависит от степени разрушения раковых клеток. В начале разработки oHSV было установлено, что HSV сам по себе не был способен убить все раковые клетки в солидной опухоли, и что маловероятно, что лечение с применением oHSV может эффективно устранить все раковые клетки, и что разрушение опухолей с применением oHSV в клинических исследованиях должно включать адаптивный иммунный ответ на опухоль. В последующих исследованиях было показано, что противоопухолевый иммунный ответ, вызванный дебрисом инфицированных опухолевых клеток, может быть увеличен посредством добавления цитокинов. Сравнение oHSV, лишенного гена цитокина, с oHSV, содержащим иммуностимулирующий цитокин, подтвердило эту гипотезу (Andreanski et al.) и, в конечном счете, привело к встраиванию в oHSV, разработанный для лечения меланомы, ГМ-КСФ (гранулоцитарно-макрофагального колониестимулирующего фактора) (Andtbacka et al., 2015).
[0010] Профиль безопасности oHSV зависит от делеций генов, которые выключают одну или более вирусных функций, блокирующих врожденные иммунные ответы хозяина на инфекцию. Анализ опубликованных данных свидетельствует, что oHSV в клинических исследованиях, проведенных на сегодняшний день, являются чрезмерно аттенуированными и могут быть улучшены (Miest and Cattaneo, 2014).
[0011] Встраивание генов, кодирующих иммуностимулирующие цитокины, усиливает иммунный ответ на опухоль, но не обеспечивает эффективного усиления цитотоксичности, вызванной Т-клетками, которая важна для противоопухолевых эффектов. Опухоли вовлекают ингибиторные пути PD-1 и CTLA-4, чтобы заглушить иммунную систему. PD-1 экспрессируется на активированных Т-клетках и других гемопоэтических клетках, а CTLA-4 экспрессируется на активированных Т-клетках, включая регуляторные Т-клетки (Fife and Pauken, 2011; Francisco et al., 2010; Keir et al., 2008; Krummel and Allison, 1995; Walunas et al., 1994). Опухоли используют ингибиторный путь PD-1 и CTLA-4, чтобы уклониться от иммунного ответа хозяина. Для максимизации противоопухолевых ответов важно активировать цитотоксические Т-клетки посредством нейтрализации PD-1 антителом к PD1 и, в некоторых случаях, нейтрализовать CTLA4, который присутствует на поверхности Т-клеток (Topalian et al., 2015). Хотя системное введение одноцепочечного антитела к PD-1 или CTLA4 эффективно для усиления терапевтических эффектов oHSV, такое антитело часто вызывает побочные эффекты и его можно вводить лишь ограниченное число раз.
[0012] Таким образом, существует насущная клиническая потребность в формировании стратегии для разработки безопасного, но более сильного oHSV, и для сочетания его введения с введением иммунотерапевтических агентов.
КРАТКОЕ ОПИСАНИЕ
[0013] Один из аспектов настоящего изобретения относится к модифицированному вирусу простого герпеса типа 1 (также обозначаемому далее по тексту HSV-1, облигатный вектор или вектор, вирус (вирусы) HSV-1), содержащему модифицированный геном HSV-1. Модификация включает делецию между промотором гена UL56 и промотором US1 генома HSV-1 дикого типа, такую, что (i) одна копия всех представленных в двух копиях генов отсутствует, и (ii) последовательности, необходимые для экспрессии всех существующих открытых рамок считывания (ОРС) в вирусной ДНК, после делеций являются интактными.
[0014] В другом аспекте настоящего изобретения предложена конструкция онколитического вируса простого герпеса типа 1 (HSV-1), содержащая (i) последовательности, необходимые для экспрессии всех представленных в одной копии открытых рамок считывания (ОРС) в вирусном геноме; (ii) только одну копию каждого из всех представленных в двух копиях генов в вирусном геноме и (iii) одну копию дуплицированной ДНК, кодирующей некодирующие РНК.
[0015] Следующий аспект настоящего изобретения относится к рекомбинантному онколитическому вирусу простого герпеса типа 1 (HSV-1), содержащему (а) модифицированный геном HSV-1, причем модификация включает делецию между промотором гена UL56 и промотором гена US1 генома HSV-1 дикого типа, вследствие чего (i) одна копия всех представленных в двух копиях генов отсутствует, и (ii) последовательности, необходимые для экспрессии всех существующих открытых рамок считывания (ОРС) в вирусной ДНК, после делеций являются интактными; и (b) последовательность гетерологичной нуклеиновой кислоты, кодирующую иммуностимулирующий и/или иммунотерапевтический агент, причем последовательность гетерологичной нуклеиновой кислоты стабильно встроена по меньшей мере в делетированную область модифицированного генома HSV-1.
[0016] Следующий аспект настоящего изобретения заключается в том, что вирусный вектор, содержащий одну копию всех открытых рамок считывания, а именно от UL1 до UL56 и от US1 до US12, и включающий последовательности «а» на концах генома, представляет собой облигатный вектор, поскольку сам по себе он не может реплицироваться в высокочувствительных клетках Vero. Вектор может реплицироваться после встраивания ДНК, содержащей (а) кодирующие или некодирующие последовательности клеточной ДНК или (b) вирусную ДНК, состоящую из некодирующих последовательностей. Суммарное количество ДНК, которое может переноситься облигатным вектором, составляет по меньшей мере 15 т.п.о. (тысяч пар оснований) или до 22 т.п.о.
[0017] Следующий аспект относится к фармацевтической композиции, содержащей эффективное количество рекомбинантного онколитического HSV-1 согласно настоящему изобретению и фармацевтически приемлемый носитель. Композиция выполнена в форме для, например, внутриопухолевого введения.
[0018] Следующий аспект относится к способу лечения рака, причем указанный способ включает введение субъекту, который нуждается в этом, эффективного количества рекомбинантного онколитического HSV-1 или фармацевтической композиции согласно настоящему изобретению. Далее, настоящее изобретение относится к применению рекомбинантного онколитического HSV-1 согласно настоящему изобретению для применения в способе лечения рака.
[0019] Еще один аспект настоящего изобретения относится к применению рекомбинантного онколитического HSV-1 или фармацевтической композиции согласно настоящему изобретению для получения противоракового лекарственного средства.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0020] Эти и другие аспекты и преимущества настоящего изобретения очевидны из следующего далее описания, в котором они подробно описаны со ссылкой на прилагаемые чертежи, на которых:
[0021] Фигура 1: схематические представления вирусов HSV-1. HSV-1, структура генома HSV-1 дикого типа, демонстрирующая внутреннюю область инвертированных повторов b'a'-а'с', расположенную между п.о. (парами оснований) 117005 и п. о. 132096; IMMV201, структура генома oHSV-1, также называемого облигатным вектором; IMMV202, oHSV-1, экспрессирующий ИЛ (интерлейкин)-12 мыши; IMMV203, oHSV-1, экспрессирующий ИЛ-12 человека; IMMV303, oHSV-1, экспрессирующий scFv к CTLA-4 человека; IMMV403, oHSV-1, экспрессирующий scFv к PD-1 человека.
[0022] Фигура 2: схематические представления онколитических вирусов HSV-1 на основе облигатных векторов, которые экспрессируют иммуностимулирующие и/или иммунотерапевтические агенты. IMMV502, oHSV-1, экспрессирующий scFv к PD-1 человека и ИЛ-12 мыши; IMMV504, oHSV-1, экспрессирующий scFv к CTLA-4 мыши и ИЛ-12 мыши; IMMV503, oHSV-1, экспрессирующий scFv к PD-1 человека и ИЛ-12 человека; IMMV505, oHSV-1, экспрессирующий scFv к CTLA-4 человека и ИЛ-12 человека; IMMV507, oHSV-1, экспрессирующий scFv к CTLA-4 человека и scFv к PD-1 человека; IMMV603, oHSV-1, экспрессирующий scFv к CTLA-4 человека, scFv к PD-1 человека и ИЛ-12 человека.
[0023] Фигура 3: экспрессия scFv к PD-1 по секреции исследуемых конструкций. Экспрессия меченного His scFv к PD-1, запускаемая промотором CMV, вместе с областями, кодирующими сигнальный пептид, из различных природных источников. Лизаты клеток и супернатант собирали, а затем проводили анализ методом ПААГ-ДСН (электрофореза в полиакриламидном геле с додецилсульфатом натрия) и проводили блоттинг с применением антитела к His. Дорожка 1, сигнальный пептид ГМ-КСФ; Дорожка 2, сигнальный пептид люциферазы Гауссии; Дорожка 3, сигнальный пептид скрытой модели Маркова 38 (Hidden Markov Model 38, HMM38); Дорожка 4, сигнальный пептид гена V антитела.
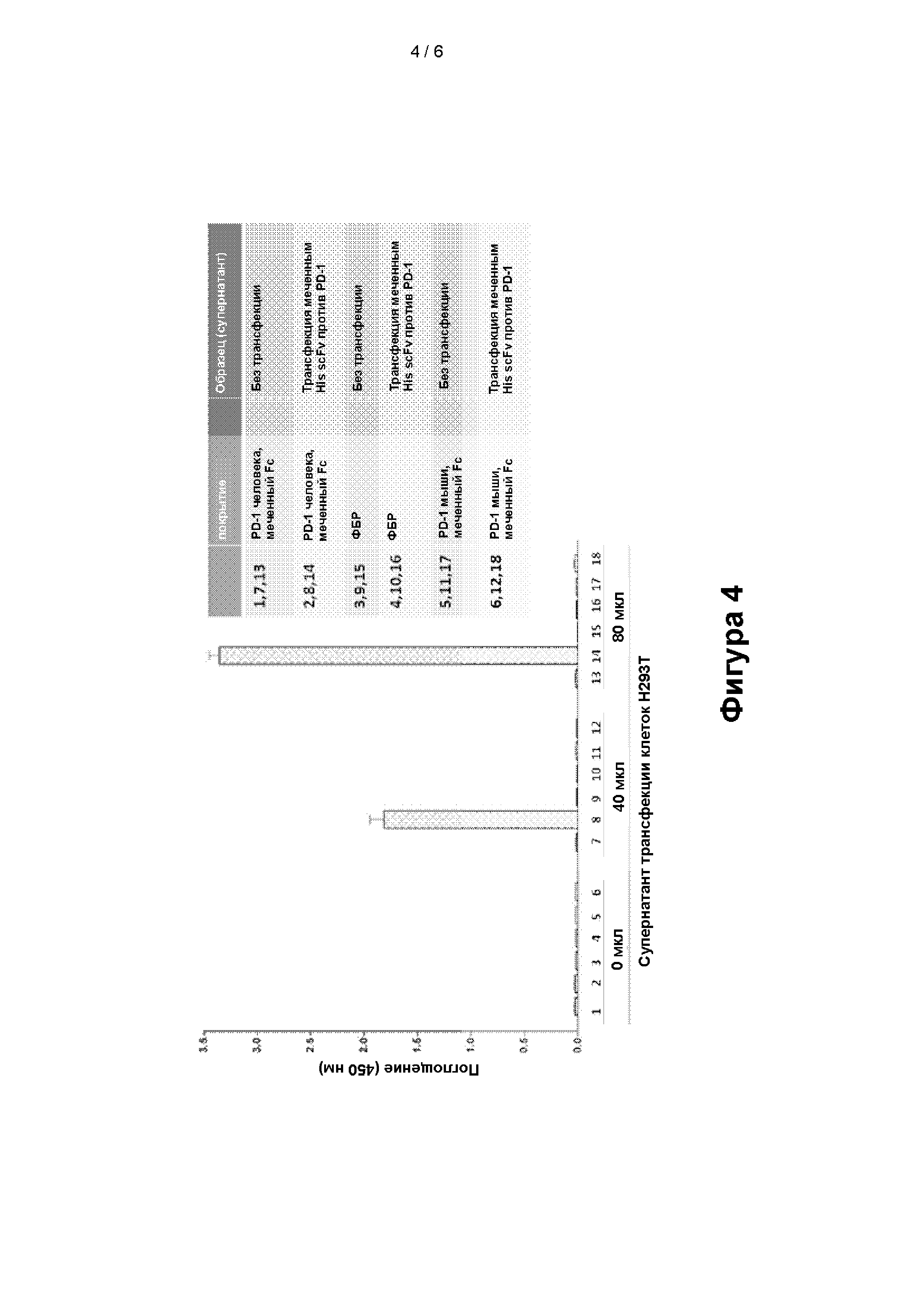
[0024] Фигура 4: Анализ аффинности связывания scFv к PD-1 с PD-1. Анализ методом ELISA меченного His scFv к PD-1, запускаемого промотором CMV, вместе с сигнальным пептидом НММ38. Супернатант собирали и проводили анализ ELISA, обнаружение проводили с помощью антитела к His.
[0025] Фигура 5: жизнеспособность клеток в анализе роста in vitro. (а): Т24, карцинома мочевого пузыря человека; (b) ЕСА109, рак пищевода человека; (с) CNE1, носоглоточная карцинома человека; (d) НСТ116, карцинома толстой кишки человека; (е) Нер2, карцинома гортани человека; (f) MD-MB-231, рак молочной железы человека; (g) Hela, эпителиальная аденокарцинома человека; (h) А549, эпителиальная аденокарцинома легких человека; (i) Н460, немелкоклеточная карцинома легких человека.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
[0026] Следует отметить, что термин, обозначающий объект в единственном числе, означает один или более таких объектов; например, «рекомбинантный онколитический HSV-1» следует понимать как относящийся к одному или более рекомбинантным онколитическим вирусам HSV-1. В связи с этим термины, обозначающие объект в единственном числе, «один или более» объектов и «по меньшей мере один» объект, могут использоваться в настоящем документе взаимозаменяемо.
[0027] «Гомология», или «идентичность», или «подобие» обозначает подобие (сходство) последовательности между двумя пептидами или между двумя молекулами нуклеиновой кислоты. Гомологию можно определить посредством сравнения положения в каждой последовательности, которую можно выровнять для целей сравнения. Если положение в последовательности сравнения занято тем же основанием или той же аминокислотой, то молекулы являются гомологичными по данному положению. Степень гомологии между последовательностями представляет собой функцию числа совпадающих или гомологичных положений, общих для последовательностей. «Неродственные» или «негомологичные» последовательности характеризуются идентичностью менее 40%, но, предпочтительно, идентичностью менее 25%, с одной из последовательностей согласно настоящему изобретению.
[0028] Полинуклеотид или область полинуклеотида (либо полипептид или область полипептида) характеризуется определенным процентом (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99%) «идентичности последовательности» с другой последовательностью; это означает, что при выравнивании указанный процент оснований (или аминокислот) является одинаковым при сравнении двух последовательностей. Это выравнивание и процент гомологии или идентичности последовательности могут быть определены с применением программного обеспечения, известного в данной области техники.
[0029] В настоящем документе «антитело» или «антигенсвязывающий полипептид» обозначает полипептид или комплекс полипептидов, который специфично распознает и связывает один или более антигенов. Антитело может представлять собой целое антитело и любой антигенсвязывающий фрагмент или одну цепь антитела. Таким образом, термин «антитело» включает любой белок или пептид, содержащий молекулу, которая содержит по меньшей мере часть молекулы иммуноглобулина, обладающую биологической активностью связываться с антигеном. Примеры таковых включают, без ограничения, участок, определяющий комплементарность (complementarity determining region, CDR), тяжелой или легкой цепи либо лигандсвязывающую часть указанных цепей, вариабельную область тяжелой цепи или легкой цепи, константную область тяжелой цепи или легкой цепи, каркасный участок (framework, FR) или любую его часть, или по меньшей мере одну часть связывающего белка. Термин «антитело» также включает полипептиды или комплексы полипептидов, которые после активации обладают антигенсвязывающими свойствами.
[0030] Термины «фрагмент антитела» или «антигенсвязывающий фрагмент» в настоящем документе представляют собой часть антитела, такую как F(ab')2, F(ab)2, Fab', Fab, Fv, scFv и т.п. Вне зависимости от структуры фрагмент антитела связывается с тем же антигеном, который распознается интактным антителом. Термин «фрагмент антитела» включает аптамеры, шпигельмеры и диатела. Термин «фрагмент антитела» также включает любые синтетические или генно-инженерные белки, которые функционируют аналогично антителу посредством связывания со специфичным антигеном с образованием комплекса.
[0031] Антитела, антигенсвязывающие полипептиды, варианты или производные указанных антител согласно настоящему изобретению включают, без ограничения, поликлональные, моноклональные, мультиспецифичные антитела, антитела человека, гуманизированные, приматизированные или химерные антитела, одноцепочечные антитела, эпитопсвязывающие фрагменты, например, Fab, Fab' и F(ab')2, Fd, Fv, одноцепочечные Fv (scFv), одноцепочечные антитела, связанные дисульфидной связью Fv (sdFv), фрагменты, содержащие домен VK или VH, фрагменты, полученные в экспрессионной библиотеке Fab, и антиидиотипические (anti-Id) антитела (включая, например, anti-Id антитела к антителам LIGHT, раскрытые в настоящем документе). Молекулы иммуноглобулина или антитела согласно настоящему изобретению могут относиться к любому типу (например, IgG, IgE, IgM, IgD, IgA и IgY), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу молекулы иммуноглобулина.
[0032] Под «специфично связывается» или «характеризуется специфичностью в отношении», как правило, подразумевают, что антитело связывается с эпитопом своим антигенсвязывающим доменом, и что связывание включает некоторую комплементарность между антигенсвязывающим доменом и эпитопом. В соответствии с этим определением говорят, что антитело «специфично связывается» с эпитопом в том случае, если оно связывается с этим эпитопом посредством своим антигенсвязывающим доменом более легко, чем оно связывалось бы с произвольным неродственным эпитопом. Термин «специфичность» употребляется в настоящем документе для оценки относительной аффинности, с которой определенное антитело связывается с определенным эпитопом. Например, может считаться, что антитело «А» обладает более высокой специфичностью в отношении данного эпитопа, чем антитело «В», или можно сказать, что антитело «А» связывается с эпитопом «С» с более высокой специфичностью, чем та, которой оно обладает в отношении родственного эпитопа «D».
[0033] В настоящем документе термины «рак» или «опухоль» используются взаимозаменяемо и обозначают группу заболеваний, которые можно лечить согласно настоящему изобретению, и которые сопровождаются аномальным ростом клеток с потенциалом инвазии или распространения в другие части тела. Не все опухоли являются раковыми; доброкачественные опухоли не распространяются в другие части тела. Возможные признаки и симптомы включают, среди прочих: новую припухлость, аномальное кровотечение, длительный кашель, необъяснимую потерю массы тела и изменение перистальтики кишечника. Существует свыше 100 различных известных типов рака, которые поражают людей. Настоящее изобретение относится преимущественно к солидным опухолям. Неограничивающие примеры рака или опухоли представляют собой рак мочевого пузыря, базальноклеточную карциному, холангиокарциному, рак толстой кишки, рак эндометрия, рак пищевода, саркому Юинга, рак предстательной железы, рак желудка, глиому, гепатоклеточную карциному, ходжкинскую лимфому, карциному гортани, рак печени, рак легких, меланому, мезотелиому, рак поджелудочной железы, рак прямой кишки, рак почек, рак щитовидной железы, злокачественную опухоль периферических нервных клеток, злокачественную опухоль оболочки периферического нерва (ЗООПН), кожные и ветвистые нейрофибромы, лейомиоаденоматоидную опухоль, фиброиды, фиброиды матки, лейомиосаркому, папиллярный рак щитовидной железы, анапластический рак щитовидной железы, медуллярный рак щитовидной железы, фолликулярный рак щитовидной железы, карциному клеток Гюртле, рак щитовидной железы, асциты, злокачественные асциты, мезотелиому, опухоли слюнных желез, мукоэпидермоидную карциному слюнных желез, ацинарно-клеточную карциному слюнных желез, желудочно-кишечную стромальную опухоль (ЖКСО), опухоли, которые вызывают излияния в потенциальные пространства тела, плевральные экссудаты, перикардиальные экссудаты, перитонеальные экссудаты, также называемые асцитами, гигантоклеточные опухоли (ГКО), ГКО кости, пигментный виллезонодулярный синовит (ПВНС), теносиновиальную гигантоклеточную опухоль (ТГКО), ТГКО влагалища сухожилия (ТГКО-ВС) и другие саркомы. Согласно предпочтительному варианту реализации настоящее изобретение применяют для лечения рака пищевода, рака легких, рака предстательной железы или рака мочевого пузыря.
[0034] В настоящем документе термины «лечить» или «лечение» обозначают как терапевтическое лечение, так и профилактические или превентивные меры, целью которых является предотвращение или замедление (уменьшение) нежелательного физиологического изменения или нарушения, такого как прогрессирование рака. Благоприятные или желаемые клинические результаты включают, без ограничения, облегчение симптомов, уменьшение степени заболевания, стабилизацию (т.е. отсутствие ухудшения) состояния заболевания, отсрочивание или замедление прогрессирования заболевания, улучшение или временное облегчение состояния заболевания и ремиссию (будь то частичную или полную), обнаруживаемые или необнаруживаемые. «Лечение» может также означать увеличение продолжительности выживаемости по сравнению с ожидаемой выживаемостью без получения лечения. Нуждающиеся в лечении субъекты включают субъектов, уже страдающих от состояния или нарушения, а также субъектов, подверженных развитию такого состояния или нарушения, либо субъектов, у которых состояние или нарушение необходимо предотвратить.
[0035] Под «субъектом», или «индивидуумом», или «животным», или «пациентом», или «млекопитающим» подразумевают любого субъекта, в частности, субъекта,, представляющего собой млекопитающее, для которого желательными являются диагностика, прогноз или терапия. Субъекты-млекопитающие включают людей, одомашненных животных, сельскохозяйственных животных и животных, содержащихся в зоопарке, используемых для спорта или домашних животных, таких как собаки, кошки, морские свинки, кролики, крысы, мыши, лошади, крупный рогатый скот, коровы и т.д.
[0036] В настоящем документе такие фразы как «пациенту, который нуждается в лечении», или «субъект, который нуждается в лечении», включают субъектов, таких как субъекты-млекопитающие, которые получили бы пользу пользу от введения антитела или композиции согласно настоящему изобретению, при ее применении, например, для детектирования, для диагностической процедуры и/или для лечения.
[0037] Средний специалист в данной области техники также понимает, что модифицированные геномы, раскрытые в настоящем документе, могут быть модифицированы так, что их нуклеотидная последовательность отличается от модифицированных полинуклеотидов, из которых они были получены. Например, полинуклеотидная или нуклеотидная последовательность, полученная из приведенной последовательности ДНК, может быть подобной, например, может характеризоваться определенным процентом идентичности, исходной последовательности, например, данная последовательность может быть идентичной на 60%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99% исходной последовательности.
[0038] Кроме того, могут быть сделаны замены, делеций или вставки нуклеотидов или аминокислот, приводящие к консервативным заменам или изменениям в «несущественных» областях аминокислот. Например, полипептидная или аминокислотная последовательность, являющаяся производным обозначенного белка, может быть идентична исходной последовательности, за исключением одной или более замен, вставок или делеций отдельных аминокислот, например, одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, пятнадцати, двадцати или более замен, вставок или делеций индивидуальных аминокислот. Согласно некоторым вариантам реализации полипептидная или аминокислотная последовательность, являющаяся производным обозначенного белка, содержит от одной до пяти, от одной до десяти, от одной до пятнадцати или от одной до двадцати замен, вставок или делеций индивидуальных аминокислот по сравнению с исходной последовательностью.
[0039] Антитела можно пометить детектируемой меткой посредством присоединения их к хемилюминесцентному соединению. Затем присутствие меченного хемилюминесцентным соединением антигенсвязывающего полипептида определяют путем детектирования присутствия люминесценции, которая возникает в ходе химической реакции. Примерами особенно подходящих хемилюминесцентных соединений-меток являются люминол, изолюминол, сложный тероматический эфир акридиния, имидазол, соль акридиния и сложный эфир щавелевой кислоты.
Модифицированный облигатный вектор HSV-1
[0040] Согласно одному аспекту настоящего раскрытия предложен вирус HSV-1, содержащий модифицированный геном HSV-1, также называемый облигатным вектором HSV-1. Геном HSV-1 состоит из двух ковалентно связанных компонентов, обозначенных L и S. Каждый компонент состоит из уникальных последовательностей (UL для компонента L, US для компонента S), фланкированных инвертированными повторами. Инвертированные повторы компонента L обозначаются ab и b'а'. Инвертированные повторы компонента S обозначаются а'с' и са. Области инвертированных повторов содержат две копии единиц транскрипции. Существует по меньшей мере пять открытых рамок считывания, известных в данной области техники, которые представлены в двух копиях, белки которых обозначены ICP0, ICP4, ICP34.5, ORF Р и ORF О, соответственно. Инвертированные повторы b'а' и а'с' (b'a'-а'с') объединены с образованием внутренней области инвертированных повторов. Напротив, инвертированные повторы ab и са обозначаются в настоящем документе как внешние области повторов.
[0041] Согласно одному варианту реализации настоящего изобретения модификация включает делецию между промотором гена UL56 и промотором гена US1 генома HSV-1 дикого типа. Фактически делетированные последовательности включают следующие:
(a) Единичные копии единиц транскрипции, кодирующих по меньшей мере 5 белков (ICP0, ICP4, ICP34.5, ORF-O и ORF-P), все другие открытые рамки считывания сохраняются.
(b) Единицы транскрипции, которые полностью содержатся в пределах последовательности b'а'-а'с'.
(c) Единицы транскрипции, которые начинаются в уникальной области, но продолжаются в делетированной области.
[0042] В настоящем изобретении делецию осуществляют прецизионным образом для обеспечения того, что последовательности, необходимые для экспрессии всех существующих открытых рамок считывания (ОРС) в вирусной ДНК, после делеций остались интектными. В данном контексте «последовательности, необходимые для экспрессии всех существующих открытых рамок считывания», включают ОРС сами по себе и регуляторные последовательности, необходимые для экспрессии каждой ОРС, такие как промоторы и энхансеры, для обеспечения эффективной экспрессии ОРС и функциональности белков, транслированных таким способом. Под «интактными» подразумеваются последовательности, определенные таким образом, которые являются по меньшей мере функциональными, но это не означает, что последовательности должны быть на 100% идентичными встречающимся в природе последовательностям. Последовательности могут незначительно отличаться нуклеотидной последовательностью от встречающихся в природе последовательностей вследствие содержания, например консервативных замен или изменений в «несущественных» областях. В данном контексте последовательности могут быть на 90%, 95%, 98% или 99% идентичны природным последовательностям.
[0043] Как понимают специалисты в данной области техники, точное первое и последнее положения нуклеотидов, которые должны быть делетированы согласно настоящему изобретению, зависит от штаммов и изомеров генома вируса HSV-1, и эти положения можно легко определить с помощью известных в данной области техники методик. Следует понимать, что не предполагается ограничения настоящего изобретения какими-либо конкретными изомерами генома или штаммами вируса HSV-1. В одном из вариантов реализации делеция приводит к удалению в геноме нуклеотидов с 117005 по 132096. Специалисту в данной области техники также очевидно, что также возможны другие штаммы, при условии, что геномная ДНК секвенирована. Технологии секвенирования легко доступны в литературных источниках и на рынке. Например, согласно другому варианту реализации делецию можно осуществить в штамме 17 HSV-1, геном которого доступен под учетным номером GenBank № NC_001806.2. Согласно другому варианту реализации делецию можно осуществить в штамме KOS 1.1, геном которого доступен под учетным номером GenBank № KT899744. Согласно еще одному варианту реализации делецию можно осуществить в штамме F, геном которого доступен под учетным номером GenBank № GU734771.1.
[0044] Согласно некоторым вариантам реализации делецию осуществляют точно в заранее определенных положениях, в результате чего достигают удаления фрагмента ДНК, начинающегося от промотора последнего известного гена в компоненте L (такого как UL56), до последовательности промотора первого известного гена в компоненте S (такого как US1). Таким образом, все ОРС генов с UL1 по UL56 в компоненте UL и с US1 по US12 в компоненте US, а также последовательность, необходимая для экспрессии ОРС, остаются интактными. Точное удаление и сохранение последовательностей, необходимых для экспрессии всех существующих открытых рамок считывания (ОРС), в вирусной ДНК после делеций характеризуется множеством преимуществ. Под «сохранением» подразумевают, что модифицированный вектор содержит все гены в уникальных последовательностях (ULи US) и только одну копию всех представленных в двух копиях генов, например, генов для ICP0, ICP4, ICP34.5, ORF Р и ORF О. Следует отметить, что большая часть делетированных последовательностей не кодируют белки, но представляют собой дуплицированные некодирующие последовательности, занимающие промежутки между делетированными областями, например, интроны ICP0, домен LAT, последовательности «а» и т.д. Предполагается, что облигатный вектор согласно настоящему изобретению содержит также только одну копию дуплицированных некодирующих последовательностей.
[0045] Сохранение всех ОРС обеспечивает более мощный вирус до или после включения встроенных чужеродных генов, который является в максимальной степени устойчивым к факторам окружающей среды, таким как температура, давление, УФ-свет и т.д. Данный подход также позволяет максимизировать диапазон раковых клеток, в которых онколитический HSV-1 является эффективным.
[0046] Для получения модифицированного вектора HSV-1, описанного в настоящем описании, можно применять различные способы генетического манипулирования, известные в данной области техники. Например, применяют технологию бактериальных искусственных хромосом (bacterial artificial chromosomes, ВАС). См., например, публикацию Horsburgh ВС, Hubinette MM, Qiang D, et al. Allele replacement: an application that permits rapid manipulation of herpes simplex virus type 1 genome. Gene Ther, 1999, 6(5):922-30. В качестве другого примера с настоящим раскрытием можно применять COS-плазмиду. См., например, публикацию van Zijl М., Quint W, Briaire J, et al. Regeneration of herpes viruses from molecularly cloned subgenomic fragments. J Virol, 1988, 62(6):2191-5.
[0047] Ключевым свойством конструкции, описанной в настоящем документе, является то, что она функционирует в качестве облигатного вектора. Определение, применимое к таким конструкциям, состоит в том, что данные конструкции не размножаются в чувствительных клетках, но размножаются после встраивания последовательностей вирусной или клеточной ДНК, и вследствие этого функционируют в качестве векторов для экспрессии генов, встроенных в последовательности вектора.
Рекомбинантный онколитический вирус H5V-1
[0048] Количество последовательностей чужеродной ДНК, которые можно встроить в вирус дикого типа, ограничено, поскольку она препятствуют упаковке ДНК в вирионы. Точная делеция в обозначенной области обеспечивает идеальное пространство для встраивания последовательностей чужеродной ДНК. В одном из вариантов реализации настоящего изобретения делеция удаляет по меньшей мере 15 т.п.о. онколитического вирусного вектора, в результате чего можно разместить аналогичное количество последовательностей чужеродной ДНК. В других исследованиях было показано, что геномы дикого типа переносят дополнительные 7 т.п.о. ДНК.
[0049] Вследствие этого согласно другому аспекту настоящего раскрытия предложен рекомбинантный онколитический вирус простого герпеса типа 1 (HSV-1), содержащий (а) модифицированный геном HSV-1, причем модификация включает делецию между промотором гена UL56 и промотором гена US1 генома HSV-1 дикого типа, вследствие чего (i) одна копия всех представленных в двух копиях генов отсутствует, и (ii) последовательности, необходимые для экспрессии всех существующих открытых рамок считывания (ОРС) в вирусной ДНК, после делеций являются интактными; и (b) последовательность гетерологичной нуклеиновой кислоты, кодирующую иммуностимулирующий и/или иммунотерапевтический агент, причем последовательность гетерологичной нуклеиновой кислоты стабильно встроена по меньшей мере в делетированную область модифицированного генома HSV-1.
[0050] В одном из вариантов реализации рекомбинантный онколитический HSV-1 содержит последовательность гетерологичной нуклеиновой кислоты, кодирующую иммуностимулирующий агент. Согласно некоторым вариантам реализации иммуностимулирующий агент выбран из группы, состоящей из ГМ-КСФ, ИЛ-2, ИЛ-5, ИЛ-12, ИЛ-15, ИЛ-24 и ИЛ-27. В одном из вариантов реализации иммуностимулирующий агент представляет собой ИЛ-12. В одном из вариантов реализации иммуностимулирующий агент представляет собой ИЛ-12 человека или гуманизированный ИЛ-12. В одном из вариантов реализации иммуностимулирующий агент представляет собой ИЛ-12 мыши. Согласно другому варианту реализации иммуностимулирующий агент представляет собой ИЛ-15.
[0051] В одном из вариантов реализации рекомбинантный онколитический HSV-1 содержит последовательность гетерологичной нуклеиновой кислоты, кодирующую иммунотерапевтический агент. Согласно некоторым вариантам реализации иммунотерапевтический агент выбран из анти-PD-1 агента и анти-CTLA-4 агента. В одном из вариантов реализации иммунотерапевтический агент представляет собой анти-PD-1 агент. Согласно другому варианту реализации иммунотерапевтическое средство представляет собой анти-CTLA-4 агент.
[0052] Когда встраивают только одну последовательность гетерологичной нуклеиновой кислоты, кодирующую иммуностимулирующий или иммунотерапевтический агент, последовательность гетерологичной нуклеиновой кислоты, предпочтительно, встраивают в делетированную область генома. В одном из вариантов реализации последовательность гетерологичной нуклеиновой кислоты имеет длину, подобной таковой делетированной области. В одном из вариантов реализации последовательность гетерологичной нуклеиновой кислоты имеет длину, на 20% большей или меньшей, чем таковая делетированной области. Согласно другому варианту реализации последовательность гетерологичной нуклеиновой кислоты имеет длину, на 15%, 10%, 5%, 4%, 3%, 2% или 1% большей или меньшей, чем таковая делетированной области.
[0053] В одном из вариантов реализации последовательность гетерологичной нуклеиновой кислоты имеет длину менее приблизительно 18 т.п.о., приблизительно 17 т.п.о. или приблизительно 16 т.п.о. Водном из вариантов реализации последовательность гетерологичной нуклеиновой кислоты имеет длину более приблизительно 10 т.п.о., 11 т.п.о., 12 т.п.о., 13 т.п.о. или 14 т.п.о. В одном из вариантов реализации последовательность гетерологичной нуклеиновой кислоты имеет длину от приблизительно 14 т.п.о. до приблизительно 16 т.п.о. В одном из вариантов реализации последовательность гетерологичной нуклеиновой кислоты имеет длину приблизительно 15 т.п.о.
[0054] Согласно некоторым вариантам реализации рекомбинантный онколитический HSV-1 содержит по меньшей мере две последовательности гетерологичной нуклеиновой кислоты, кодирующие иммуностимулирующие и/или иммунотерапевтические агенты. Согласно некоторым вариантам реализации рекомбинантный онколитический HSV-1 содержит последовательности гетерологичной нуклеиновой кислоты, кодирующие два различных иммуностимулирующих агента. Например, согласно одному варианту реализации рекомбинантный онколитический HSV-1 содержит последовательности гетерологичной нуклеиновой кислоты, кодирующие как ИЛ-12, так и ГМ-КСФ. Согласно другому варианту реализации рекомбинантный онколитический HSV-1 содержит последовательности гетерологичной нуклеиновой кислоты, кодирующие как ИЛ-15, так и ГМ-КСФ. Согласно следующему варианту реализации рекомбинантный онколитический HSV-1 содержит последовательности гетерологичной нуклеиновой кислоты, кодирующие как ИЛ-12, так и ИЛ-15.
[0055] Согласно некоторым вариантам реализации рекомбинантный онколитический HSV-1 содержит последовательности гетерологичной нуклеиновой кислоты, кодирующие два различных иммунотерапевтических агента. Согласно одному варианту реализации, например, рекомбинантный онколитический HSV-1 содержит последовательности гетерологичной нуклеиновой кислоты, кодирующие как анти-PD-1 агент, так и анти-CTLA-4 агент.
[0056] Согласно некоторым вариантам реализации рекомбинантный онколитический HSV-1 содержит последовательности гетерологичной нуклеиновой кислоты, кодирующие три различные иммуностимулирующие и/или иммунотерапевтические агента. Например, В одном из вариантов реализации рекомбинантный онколитический HSV-1 содержит последовательности гетерологичной нуклеиновой кислоты, кодирующие ИЛ-12, анти-CTLA-4 агент и анти-PD-1 агент.
[0057] Если встраивают более одной последовательности гетерологичной нуклеиновой кислоты, кодирующей иммуностимулирующие и/или иммунотерапевтические агенты, первую последовательность гетерологичной нуклеиновой кислоты, предпочтительно, встраивают в делетированную область генома. Вторую или следующую последовательность гетерологичной нуклеиновой кислоты можно встроить в компонент L генома. В одном из вариантов реализации вторую последовательность гетерологичной нуклеиновой кислоты встраивают между генами UL3 и UL4 компонента L. В одном из вариантов реализации вторую последовательность гетерологичной нуклеиновой кислоты встраивают между генами UL37 и UL38 компонента L.
[0058] В одном из вариантов реализации первую последовательность гетерологичной нуклеиновой кислоты встраивают в делетированную область генома, и вторую последовательность гетерологичной нуклеиновой кислоты встраивают между генами UL3 и UL4. В одном из вариантов реализации первую последовательность гетерологичной нуклеиновой кислоты встраивают в делетированную область внутреннего инвертированного повтора генома, и вторую последовательность гетерологичной нуклеиновой кислоты встраивают между генами UL37 и UL38 компонента L. В одном из вариантов реализации первую последовательность гетерологичной нуклеиновой кислоты встраивают в делетированную область внутреннего инвертированного повтора генома, вторую последовательность гетерологичной нуклеиновой кислоты встраивают между генами UL3 и UL4, и третью последовательность гетерологичной нуклеиновой кислоты встраивают между генами UL37 и UL38 компонента L.
[0059] В одном из вариантов реализации первая последовательность гетерологичной нуклеиновой кислоты кодирует ИЛ-12. В одном из вариантов реализации вторая последовательность гетерологичной нуклеиновой кислоты кодирует анти-CTLA-4 агент или анти-PD-1 агент. В одном из вариантов реализации третья последовательность гетерологичной нуклеиновой кислоты кодирует анти-PD-1 агент или анти-CTLA-4 агент.
[0060] Следует понимать, что вставки одной или более последовательностей гетерологичной нуклеиновой кислоты в онколитический геном HSV-1 не препятствуют экспрессии нативных генов HSV-1, и последовательности гетерологичной нуклеиновой кислоты стабильно встроены в модифицированный геном HSV-1, вследствие чего можно ожидать функциональную экспрессию последовательностей гетерологичной нуклеиновой кислоты.
[0061] Рекомбинантный ген, кодирующий иммуностимулирующие и/или иммунотерапевтические агенты, содержит нуклеиновую кислоту, кодирующую белок, вместе с регуляторными элементами для экспрессии белка. Как правило, регуляторные элементы, которые присутствуют в рекомбинантном гене и которые выбирают в зависимости от клеток-хозяев, применяемых для экспрессии, функционально связанные с последовательностью нуклеиновой кислоты, экспрессию которой проводят, включают промотор транскрипции, участок связывания рибосомы и терминатор. В пределах рекомбинантного вектора экспрессии «функционально связаны» означает, что нуклеотидная последовательность, представляющая интерес, присоединена к регуляторной последовательности или последовательностям способом, который позволяет проводить экспрессию нуклеотидной последовательности (например, в системе транскрипции/трансляции in vitro или в клетке-хозяине, когда вирус вводят в клетку-хозяин). Термин «регуляторная последовательность» предназначен для обозначения промоторов, энхансеров и других контрольных элементов экспрессии (например, сигналов полиаденилирования). Регуляторные последовательности включают последовательности, которые направляют конститутивную экспрессию последовательности нуклеотидов во множестве типов клетки-хозяина, и последовательности, которые направляют экспрессию последовательности нуклеотидов исключительно в определенных клетках-хозяевах (например, тканеспецифичные регуляторные последовательности).
[0062] Недавно была обнаружены регуляторное последовательности инсуляторы (изоляторы), которые включают класс элементов ДНК, обнаруженных на клеточных хромосомах, которые защищают гены в одной области хромосомы от регуляторного влияния другой области. Amelio с соавт. обнаружили область размером 1,5 т.п.о., содержащую кластер из мотивов CTCF в области LAT, который обладает активностями инсулятора, а именно, блокирования и сайленсинга энхансера (Amelio et al.. A Chromatin Insulator-Like Element in the Herpes Simplex Virus Type 1 Latency-Associated Transcript RegionBinds CCCTC-Binding Factor and Displays Enhancer-Blocking and Silencing Activities. Journal of Virology, Vol. 80, No. 5, Mar. 2006, p. 2358-2368).
[0063] Промотор определяется как последовательность ДНК, которая направляет РНК-полимеразу для связывания с ДНК и инициации синтеза РНК. Сильный промотор является промотром, который стимулирует инициацию синтеза мРНК с высокой частотой. Подходящим элементом для процессинга в эукариотических клетках является сигнал полиаденилирования. Также могут присутствовать связанные с антителом интроны. Примеры кассет экспрессии для продукции антитела или фрагмента антитела хорошо известны в данной области техники (например, Persic et al., 1997, Gene 187:9-18; Boel et al., 2000, J Immunol. Methods 239:153-166; Liang et al., 2001, J. Immunol. Methods 247:1 19-130; Tsurushita et al., 2005, Methods 36:69-83).
[0064] Специалисты в данной области техники могут выбрать соответствующие регуляторные элементы на основании, например, желаемой тканеспецифичности и уровня экспрессии. Например, специфичный для типа ткани или опухоль-специфичный промотор можно применять для ограничения экспрессии продукта гена конкретным типом клеток. Помимо применения тканеспецифичных промоторов, местное введение вирусов может привести к локализированным экспрессии и действию. Примеры нетканеспецифичных промоторов, которые можно применять, включают ранний промотор цитомегаловируса (CMV) (патент США №4,168,062) и промотор вируса саркомы Рауса. Также можно применять промоторы HSV, такие как промоторы HSV-1 IE. Согласно некоторым вариантам реализации промотор выбран из промотора в следующей таблице.

[0065] Примеры тканеспецифичных промоторов, которые можно применять в этой методике, включают, например, промотор простат-специфического антигена (ПСА), специфичный для клеток предстательной железы; промотор десмина, специфичный для мышечных клеток; промотор енолазы, специфичный для нейронов; промотор бета-глобина, специфичный для эритроидных клеток; промотор тау-глобина, также специфичный для эритроидных клеток; промотор гормона роста, специфичный для питуицитов; промотор инсулина, специфичный для бета-клеток поджелудочной железы; промотор глиофибриллярного кислого белка, специфичный для астроцитов; промотор тирозингидроксилазы, специфичный для катехоламинергических нейронов; промотор белка-предшественника амилоида, специфичный для нейронов; промотор дофамин-бета-гидроксилазы, специфичный для норадренергических и адренергических нейронов; промотор триптофан-гидроксилазы, специфичный для серотонина/клеток шишковидной железы; промотор холинацетилтрансферазы, специфичный для холинергических нейронов; промотор декарбоксилазы ароматических L-аминокислот (aromatic L-amino acid decarboxylase, AADC), специфичный для катехоламинергических/5-НТ/D)-типа клеток; промотор проэнкефалина, специфичный для нейрональных/сперматогенных эпидидимальных клеток; промотор reg (липостатин), специфичный для опухолей толстой и прямой кишки, а также клеток поджелудочной железы и почек; и промотор пептида, родственного паратиреоидному гормону (parathyroid hormone-related peptide, PTHrP), специфичный для опухолей печени и слепой кишки, а также неврилеммомы почек, поджелудочной железы и клеток надпочечников.
[0066] Примеры промоторов, которые специфично функционируют в опухолевых клетках, включают промотор стромелизина 3, специфичный для раковых клеток молочной железы; промотор поверхностно-активного белка А, специфичный для клеток немелкоклеточного рака легких; промотор секреторного ингибитора протеазы лейкоцитов (СИПЛ), специфичный для экспрессирующих СИПЛ карцином; промотор тирозиназы, специфичный для клеток меланомы; стресс-индуцибельный промотор grp78/BiP, специфичный для фибросаркомы/клеток, обладающих опухолеобразующей способностью; энхансер АР2 адипозы, специфичный для адипоцитов; промотор а-1 антитрипсина транстиретина, специфичный для гепатоцитов; промотор интерлейкина-10, специфичный для клеток мультиформной глиобластомы; промотор с-erbB-2, специфичный для клеток поджелудочной железы, молочной железы, желудка, яичников и немелкоклеточных клеток легких; промотор а-В-кристаллина/белка теплового шока 27, специфичный для клеток опухоли головного мозга; промотор основного фактора роста фибробластов, специфичный для клеток глиомы и менингиомы; промотор рецептора эпидермального фактора роста, специфичный для клеток плоскоклеточной карциномы, глиомы и опухоли молочной железы; промотор муцин-подобного гликопротеина (DF3, MUC1), специфичный для клеток карциномы молочной железы; промотор mtsl, специфичный для метастатической опухоли; промотор NSE, специфичный для клеток мелкоклеточного рака легких; промотор рецептора соматостатина, специфичный для клеток мелкоклеточного рака легких; промоторы с-erbB-3 и с-erbB-2, специфичные в отношении раковых клеток молочной железы; промотор с-erbB4, специфичный для рака молочной железы и желудка; промотор тироглобулина, специфичный для клеток карциномы щитовидной железы; промотор офетопротеина (AFP), специфичный для клеток гепатомы; промотор виллина, специфичный для клеток рака желудка; и промотор альбумина, специфичный для клеток гепатомы. Согласно другому варианту реализации применяют промотор TERT или промотор сурвивина.
[0067] Например, согласно некоторым вариантам реализации последовательности гетерологичной нуклеиновой кислоты функционально связаны с промотором, например, промотором CMV или промотором Egr. В одном из вариантов реализации нуклеотидная последовательность, кодирующая mIL12 (ИЛ-12 мыши), функционально связана с промотором Egr. Согласно другому варианту реализации нуклеотидная последовательность, кодирующая scFv против hPD1 (PD1 человека), функционально связана с промотором CMV.
Иммуностимулирующие или иммунотерапевтические агенты
[0068] Согласно определенным вариантам реализации oHSV-1 согласно настоящему изобретению кодирует один или более иммуностимулирующих агентов (также называемых иммуностимулирующими молекулами), включая цитокины, такие как ИЛ-2, ИЛ-4, ИЛ-12, ГМ-КСФ, ИФНγ, хемокины, такие как MIP-1, МСР-1, ИЛ-8, и факторы роста, такие как лиганд FLT3.
[0069] В качестве альтернативы или дополнительно, oHSV-1 согласно настоящему изобретению кодирует один или более иммунотерапевтических агентов, например, агент, связывающий PD-1 (или анти-PD-1 агент), либо агент, связывающий CTLA-4 (или анти-CTLA-4 агент), включая антитела или их фрагменты, например, антитело против PD1, специфично связывающееся с PD-1, или антитело к CTLA-4, специфично связывающееся с CTLA-4. Антитело против PD-1 может представлять собой одноцепочечное антитело, которое выступает антагонистом активности PD-1. Согласно другим вариантам реализации онколитический вирус экспрессирует агент, который выступает антагонистом связывания лигандов PD-1 с рецептором, например, антитела к PD-L1 и/или ловушки PD-L2, PD-L1 и/или PD-L2, или растворимый рецептор PD-1.
[0070] Путь передачи сигналов PD-1 играет важную роль в опухоль-ассоциированной иммунной дисфункции. Инфекция и лизис опухолевых клеток может вызвать высокоспецифичный противоопухолевый иммунный ответ, который уничтожает клетки перевивной опухоли, а также клетки дальней, развившейся, не-инокулированной опухоли. Опухоли и их микроокружения выработали механизмы для уклонения от природного противоопухолевого иммунного ответа, подавления и инактивации природного противоопухолевого иммунного ответа. Например, опухоли могут понижающе регулировать целевые рецепторы, заключать себя в волокнистый внеклеточный стромальный матрикс или повышающе регулировать рецепторы или лиганды хозяина, участвующие в активации или рекрутировании регуляторных иммунных клеток. Природные и/или адаптивные Т-регуляторные клетки (Treg) участвуют в опухоль-опосредованной иммунной супрессии. Без намерения ограничения теоретическим обоснованием, считают, что блокада PD-1 может ингибировать активность Treg и улучшать эффективность опухоль-реактивных ЦТЛ (цитотоксических лимфоцитов). Другие аспекты методики будут описаны более подробно ниже. Блокада PD-1 может также стимулировать противоопухолевый иммунный ответ за счет блокирования инактивации Т-клеток (ЦТЛ и хелперов) и В-клеток.
[0071] Согласно одному аспекту предложенная методика обеспечивает онколитический вирус, который несет ген, кодирующий агент, связывающий PD-1. Белок программируемой смерти клеток (Programmed Cell Death 1, PD-1) представляет собой трансмембранный рецептор I типа размером 50-55 кДа, изначально идентифицированный путем вычитающей гибридизации линии Т-клеток мыши, которые подвергаются апоптозу (Ishida et al., 1992, Embo J. 11:3887-95). Член семейства гена CD28, PD-1 экспрессируется на активированных Т-, В- и клетках миелоидной линии (Greenwald et al., 2005, Annu. Rev. Immunol. 23:515-48; Sharpe et al., 2007, Nat. Immunol. 8:239-45). PD-1 человека и мыши характеризуются приблизительно 60%ой идентичностью аминокислот с сохранением четырех потенциальных сайтов N-гликозилирования и остатков, которые определяют домен Ig-V. Были идентифицированы два лиганда PD-1: лиганд 1 (PD-L1) и лиганд 2 (PD-L2) PD; оба принадлежат к суперсемейству В7. PD-L1 экспрессируется на многих типах клеток, включая Т-, В-, эндотелиальные и эпителиальные клетки, а также антигенпрезентирующие клетки. Напротив, PD-L2 узко экспрессируется на профессиональных антигенпрезентирующих клетках, таких как дендритные клетки и макрофаги.
[0072] PD-1 отрицательно модулирует активацию Т-клеток, и эта ингибиторная функция связана с ингибиторным мотивом на основе иммунорецептора тирозина (immunoreceptor tyrosine-based inhibitory motif, ITIM) его цитоплазматического домена (Parry et al., 2005, Mol. Cell. Biol. 25:9543-53). Нарушение этой ингибиторной функции PD-1 может привести к аутоиммунитету. Обратный сценарий также может быть пагубным. Устойчивые отрицательные сигналы от PD-1 участвуют в нарушении функции Т-клеток во многих патологических ситуациях, таких как ускользание опухоли от иммунного надзора и хронические вирусные инфекции.
[0073] Противоопухолевый иммунитет хозяина, главным образом, зависит от инфильтрующих опухоль лимфоцитов (ИОЛ) (Galore et al., 2006, Science 313:1960-4). Множество данных позволили установить, что ИОЛ попадают под ингибиторную регуляцию PD-1. Во-первых, экспрессия PD-L1 подтверждена во многих опухолевых линиях человека и мыши, и экспрессия может затем повышающе регулироваться ИФН-γ in vitro (Dong et al., 2002, Nat. Med. 8:793-800). Во-вторых, экспрессия PD-L1 опухолевыми клетками была непосредственно связана с их устойчивостью к лизису под действием противоопухолевых Т-клеток in vitro (Blank et al., 2004, Cancer Res. 64:1 140-5). В-третьих, мыши с нокаутом PD-1 являются устойчивыми к угрозе опухоли (Iwai et al., 2005, Int. Immunol. 17:133-44), и Т-клетки от мышей с нокаутом PD-1 высоко эффективны при отторжении опухоли при адаптивном переносе мышам с опухолью (Blank ef al., ссылка выше). В-четвертых, блокировка ингибиторных сигналов PD-1 моноклональным антителом может усиливать противоопухолевый иммунитет хозяина у мышей (Iwai et al., ссылка выше; Hirano et al., 2005, Cancer Res. 65:1089-96). В-пятых, высокие степени экспрессии PD-L1 в опухоли (обнаруженные посредством иммуногистохимического окрашивания) связаны с неблагоприятным прогнозом для многих типов рака человека (Hamanishi et al., 2007, Proc. Natl. Acad. Sci. USA 104:3360-5).
[0074] Онколитическая виротерапия является эффективным способом формирования иммунной системы хозяина за счет расширения популяций Т- или В-клеток, специфичных в отношении опухоль-специфичных антигенов, которые высвобождаются после онколизиса. Иммуногенность опухоль-специфичных антигенов в большой степени зависит от аффинности иммунных рецепторов хозяина (В-клеточных рецепторов или Т-клеточных рецепторов) к антигенным эпитопам и порога толерантности хозяина. Взаимодействия с высокой аффинностью направят иммунные клетки хозяина на множество циклов пролиферации и дифференцировки для превращения в клетки памяти длительного действия. Механизмы толерантности хозяина уравновесят такую пролиферацию и экспансию с минимизацией потенциального повреждения ткани, которое является следствием локальной иммунной активации. Ингибиторные сигналы PD-1 являются частью таких механизмов толерантности хозяина, что подтверждается следующим набором данных. Во-первых, экспрессия PD-1 повышена в активно пролиферирующих Т-клетках, в особенности, в клетках с конечно дифференцированными фенотипами, т.е. эффекторными фенотипами. Эффекторные клетки часто связаны с мощной цитотоксической функцией и продукцией цитокинов. Во-вторых, PD-L1 важен для поддержания периферической толерантности и для ограничения чрезмерно активных Т-клеток на местном уровне. Вследствие этого ингибирование PD-1 с применением агента, связывающего PD-1, экспрессируемого в микроокружении опухоли, может являться эффективной стратегией для повышения активности ИОЛ и стимуляции эффективного и долговременного противоопухолевого иммунного ответа.
[0075] Антиген 4 цитотоксических Т-лимфоцитов (cytotoxic T-lymphocyte antigen 4, CTLA-4) является членом суперсемейства белков-иммуноглобулинов (Ig). Суперсемейство Ig представляет собой группу белков, которые характеризуются ключевыми структурными свойствами вариабельного (V) или константного (С) домена молекулы Ig. Члены суперсемейства Ig включают, без ограничения, иммуноглобулины сами по себе, молекулы класса главного комплекса гистосовместимости (major histocompatibility complex, МНС, ГКГС) (т.е. классы I и II ГКГС) и молекулы ТКР (Т-клеточного рецептора). Для активации и последующей дифференцировки к эффекторной функции Т-клеткам требуются два типа сигналов от антигенпрезентирующей клетки (АПК). Во-первых, существует антиген-специфичный сигнал, образующийся в результате взаимодействий между ТКР на Т-клетке с молекулами ГКГС, презентирующими пептиды на АПК. Во-вторых, существует антиген-независимый сигнал, опосредуемый взаимодействием CD28 с членами семейства В7 (В7-1 (CD80) или В7-2 (CD86)). Там, где CTLA-4 вписывается в окружение иммунологической реактивности, изначально наблюдалось уклонение. CTLA-4 мышей был впервые идентифицирован и клонирован (публикация Brunet et al. Nature 328:267-270 (1987)) в рамках поиска молекул, которые потенциально экспрессируются на цитотоксических Т-лимфоцитах. Вскоре после этого был идентифицирован и клонирован CTLA-4 человека (публикация Dariavach et al. Eur. J. Immunol. 18:1901-1905 (1988)). Молекулы CTLA-4 мыши и человека характеризуются общей гомологией последовательности приблизительно 76%, и приближаются к полной идентичности последовательности в их цитоплазматических доменах (Dariavach et at. Eur. J. Immunol. 18:1901-1905 (1988)).
[0076] Начиная с 1993 года, с пиком в 1995 году, исследователи начали дополнительно выяснять роль CTLA-4 в стимуляции Т-клеток. Во-первых, посредством применения моноклональных антител к CTLA-4 (публикация Walunas et al. Immunity 1:405-13 (1994)) были получены свидетельства того, что CTLA-4 может функционировать в качестве отрицательного регулятора активации Т-клетки.
[0077] Применительно к раку в публикации Kwon et al. PNA5 USA 94:8099-103 (1997) была установлена сингенная модель рака предстательной железы на мышах и было проведено исследование двух различных манипуляций для того, чтобы вызвать ответ против рака предстательной железы посредством усиленной костимуляции Т-клеток: (i) обеспечение прямой костимуляции посредством трансдукции клеток рака предстательной железы для экспрессии лиганда В7.1 и (ii) опосредованная антителами блокада CTLA-4 Т-клеток in vivo, которая предотвращает понижающую регуляцию Т-клеток. Было продемонстрировано, что опосредованная антителами блокада CTLA-4 in vivo усиливала иммунные ответы против рака предстательной железы. Также в публикации Yang et al. Cancer Res 57:4036-41 (1997) было описано исследование того, приводит ли блокада функции CTLA-4 к усилению противоопухолевых ответов Т-клетки на различных стадиях роста опухоли. На основании результатов, полученных in vitro и in vivo, данные исследователи обнаружили, что блокада CTLA-4 у индивидуумов с опухолью усиливала способность вызывать противоопухолевые Т-клеточные ответы, но проявление этого усиливающего эффекта на данной модели было ограничено ранними стадиями роста опухоли. Затем в публикации Hurwitz et al. Proc Natl Acad Sci USA 95:10067-71 (1998) было описано исследование образования опосредованного Т-клетками противоопухолевого ответа в зависимости от связывания Т-клеточного рецептора главным комплексом гистосовместимости/антигеном, а также связывания CD28 членами семейства В7. Некоторые опухоли опухоли, такие как карцинома молочной железы SM1, не поддавались анти-CTLA-4 иммунотерапии. Так, при применении комбинации блокады CTLA-4 и вакцины, состоящей из клеток SM1, экспрессирующих гранулоцитарно-моноцитарный колониестимулирующий фактор - SM1, наблюдалась регрессия родительской опухоли, несмотря на неэффективность каждого варианта лечения самого по себе. Данная комбинированная терапия обеспечивала длительный иммунитет к SM1 и зависела как от CD4(+), так и от CD8(+) Т-клеток. Эти результаты свидетельствуют, что блокада CTLA-4 действует на уровне антигенпрезентирующих клеток хозяина.
Анти-PD-1 агенты и анти-CTLA-4 агенты
[0078] Согласно одному аспекту настоящая методика обеспечивает онколитический вирус, содержащий гетерологичную нуклеиновую кислоту, кодирующую анти-PD-1 агент и/или анти-CTLA-4 агент. Согласно некоторым вариантам реализации анти-PD-1 агента или анти-CTLA-4 агента содержат вариабельную область антитела, которая обеспечивает специфичное связывание с эпитопом PD-1 или CTLA-4. Вариабельная область антитела может присутствовать, например, в полном антителе, фрагменте антитела и рекомбинантном производном антитела или фрагмента антитела. Термин «антитело» описывает иммуноглобулин, будь то природный либо частично или полностью полученный синтетическим способом. Таким образом, анти-PD-1 агента или анти-CTLA-4 агента согласно технологии настоящего изобретения включают любой полипептид или белок, содержащий связывающий домен, специфичный для связывания с эпитопом PD-1 или CTLA-4.
[0079] Различные классы антител характеризуются различными структурами. Различные области антитела могут быть проиллюстрированы на примере IgG. Молекула IgG содержит четыре полипептидные цепи: две более длинные тяжелые цепи и две более короткие легкие цепи, которые соединены между собой дисульфидными связями. Каждая тяжелая и легкая цепь содержит константную область и вариабельную область. Тяжелая цепь содержит вариабельную область тяжелой цепи (VH) и константную область тяжелой цепи (CH1, СН2 и СН3). Легкая цепь содержит вариабельную область легкой цепи (VL) и константную область легкой цепи (CL). В пределах вариабельных областей существует три гипервариабельных участка, которые отвечают за антигенную специфичность. (См., например, руководства Breitling et al., Recombinant Antibodies, John Wiley & Sons, Inc. and Spektrum Akademischer Verlag, 1999; и Lewin, Genes IV, Oxford University Press and Cell Press, 1990).
[0080] Гипервариабельные участки, которые обычно называют участками, определяющими комплементарность (complementarity determining regions, CDR), расположены между более консервативными фланкирующими участками, называемыми «каркасными участками» (framework regions, FW). Существует четыре (4) участка FW и три (3) CDR, которые расположены от NH2-конца к COOH-концу в следующем порядке: FW1, CDR1, FW2, CDR2, FW3, CDR3, FW4. Аминокислоты, ассоциируемые с каркасными участками и CDR, можно пронумеровать и выровнять с применением подходов, описанных в публикациях Kabat et al., Sequences of Proteins of Immunological Interest, U.S. Department of Health and Human Services, 1991; C. Chothia and A. M. Lesk, J Mot Biot 196(4):901 (1987); или В. Al-Lazikani, et al., J Moi Biol 273(4): 27, 1997. Например, каркасные участки и CDR можно идентифицировать на основании определений как Кэбота, так и Чотиа. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Две карбоксильные области тяжелой цепи представляют собой константные области, соединенные посредством образования дисульфидных связей с получением Fc-области. Fc-область является важной для обеспечения эффекторных функций. (Presta, Advanced Drug Delivery Reviews 58:640-656, 2006.) Каждая из двух тяжелых цепей, образующих Fc-область, продолжается в различные Fab-области через шарнирную область.
[0081] Анти-PD-1 агенты или анти-CTLA-4 агенты, как правило, содержат вариабельную область антитела. Такие фрагменты антитела включают, без ограничения (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VH, VL, CH и CL; (ii) Fab2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, соединенные дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VH и VL одного плеча антитела; (v) dAb-фрагмент, который содержит домен VH или VL; (vi) scAb, фрагмент антитела, содержащий VH и VL, а также C1 или CH1, и (vii) искусственные антитела на основе белковых остовов, включая, без ограничения, полипептидные антитела на основе фибронектина типа III (например, см. патент США №6,703,199). Более того, несмотря на то, что два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, их можно объединить с применением рекомбинантных способов посредством синтетического линкера, который дает возможность получить их в виде единой белковой цепи, в которой области VL и VH спариваются с образованием моновалентной молекулы, известной как одноцепочечный Fv (single chain Fv, scFv). Таким образом, в рекомбинантном производном может присутствовать вариабельная область антитела. Примеры рекомбинантных производных включают одноцепочечные антитела, диатело, триатело, тетратело и миниантитело. Анти-PD-l агент или анти-CTLA-4 агент могут также содержать одну или более вариабельных областей, распознающих один и тот же или различные эпитопы.
[0082] Согласно некоторым вариантам реализации анти-PD-1 агенты или анти-CTLA-4 агенты кодируются онколитическим вирусом, полученным с применением методик рекомбинантной нуклеиновой кислоты. Различные анти-PD-1 агенты можно получить с применением различных методик, включая, например, одноцепочечный белок, содержащий область VH и область VL, соединенные линкерной последовательностью, такой как scFv, и антитела или их фрагменты; и многоцепочечный белок, содержащий область VH и VL на отдельных полипептидах. Технологии рекомбинантных нуклеиновых кислоты включают конструирование нуклеиновой кислоты - матрицы для синтеза белка. Подходящие технологии рекомбинантных нуклеиновых кислот хорошо известны в данной области техники. (См., например, публикации Ausubel, Current Protocols in Molecular Biology, John Wiley, 2005; Harlow et al., Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, 1988). Рекомбинантную нуклеиновую кислоту, кодирующую антитело к PD-1 или антитело к CTLA-4, может экспрессироваться в клетке, инфицированной онколитическим вирусом, и высвобождаться в микроокружение опухоли после лизиса вируса. По существу, клетка выступает фабрикой кодируемого белка.
[0083] Нуклеиновую кислоту, содержащую один или более рекомбинантных генов, кодирующих одну из области VH или области VL анти-PD-1 агента или к CTLA-4 либо обе указанные области, можно применять для получения полного белка/полипептида, связывающегося с PD-1/CTLA-4. Полноразмерный связывающий агент можно получить, например, с применением одного гена для кодирования одноцепочечного белка, содержащего область VH и область VL, соединенные линкером, таким как scFv, или с применением нескольких рекомбинантных областей, например, для получения областей как VH, так и VL.
[0084] Примеры антител к PD-1 или антител к CTLA-4, либо их фрагментов или производных, подходящих для настоящего изобретения, доступны в данной области техники. См., например, публикации WO 2006/121168, WO 2014/055648, WO 2008/156712, US 2014/0234296 или патент США №6,984,720.
[0085] Рекомбинантный oHSV-1 в настоящем изобретении доставляет иммуностимулирующий белок в опухоль в точности туда, где данный белок необходим, а не системно. Более того, посредством снижения продукции и, очень вероятно, также поглощения белков в опухолевой массе, цитотоксические проявления, вероятно, сильно снижаются или отсутствуют.
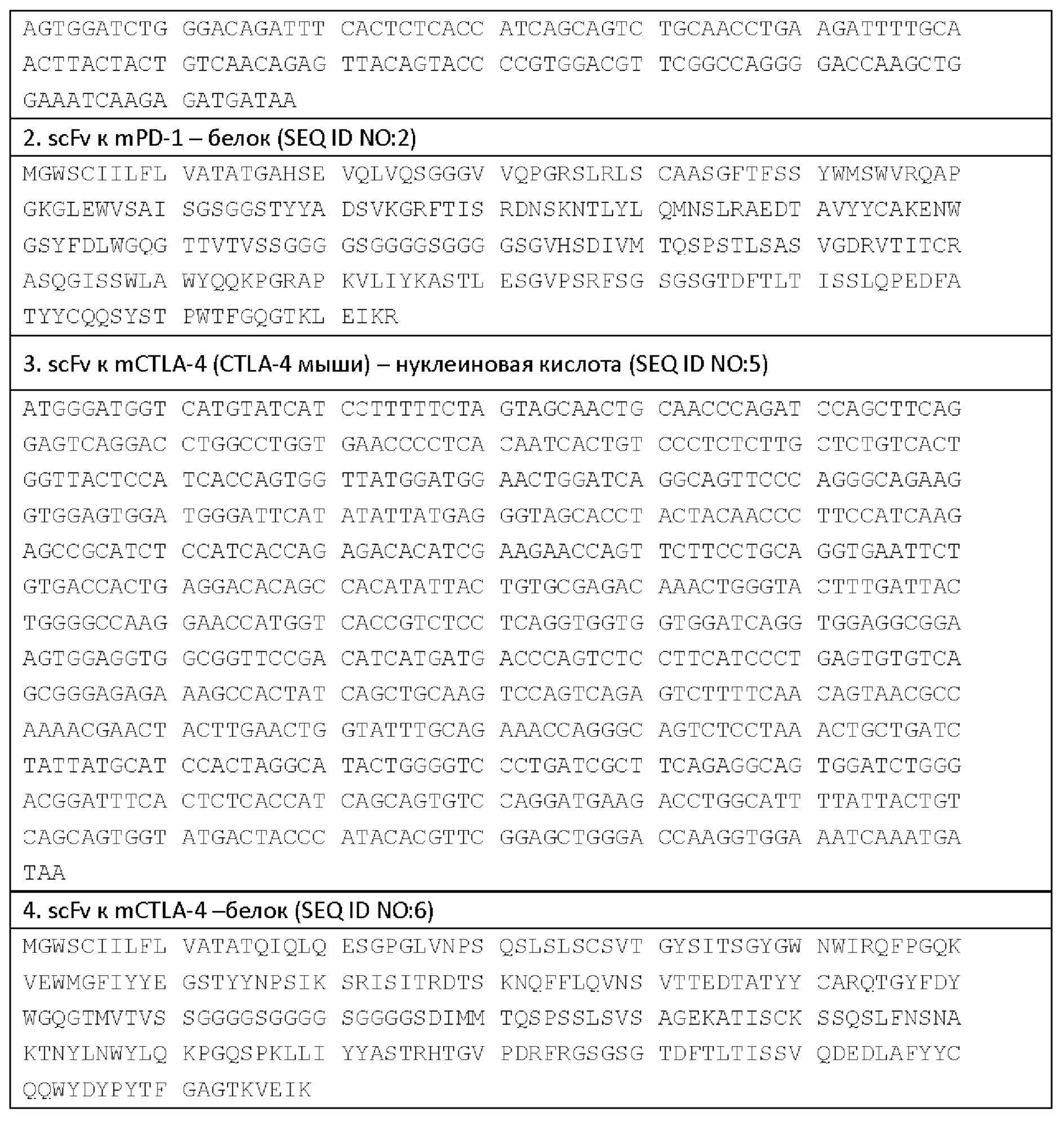
Пример последовательностей scFv к PD-1 и scFv к CTLA-4

Композиции
[0086] Онколитический вирус может быть приготовлен в подходящем фармацевтически приемлемом носителе или вспомогательном веществе. В обычных условиях хранения и применения такие препараты содержат консервант для предотвращения роста микроорганизмов. Лекарственные формы, подходящие для инъекционного применения, включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий непосредственно перед применением (патент США №5,466,468). Во всех случаях форма должна быть стерильной и должна быть жидкой в той степени, чтобы ее можно было легко ввести через шприц. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы.
[0087] Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.), подходящие смеси данных компонентов и/или растительные масла. Надлежащую текучесть можно поддерживать, например, посредством использования покрытия, такого как лецитин, посредством поддержания требуемого размера частиц в случае дисперсии и посредством использования поверхностно-активных веществ. Действие микроорганизмов можно предотвратить с помощью различных антибактериальных и противогрибковых средств, например, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и т.п. Во многих случаях будет предпочтительно включать в композицию изотонические вещества, например, сахара или хлорид натрия. Пролонгированное всасывание инъекционных композиций можно обеспечить посредством включения в композицию веществ, которые отсрочивают всасывание, например, моностеарата алюминия и желатина.
[0088] Для парентерального введения в водном растворе, например, раствор должен быть подходящим образом забуферен, при необходимости, и жидкий разбавитель сначала делают изотоническим с помощью достаточного количества солевого раствора или глюкозы. Эти конкретные водные растворы являются особенно подходящими для внутривенного, внутримышечного, подкожного, внутриопухолевого и интраперитонеального введения. В этой связи стерильная водная среда, которую можно использовать, известна специалистам в данной области техники в свете настоящего раскрытия. Например, одну дозу можно растворить в 1 мл изотонического раствора NaCl и добавить к 1000 мл гиподермоклизисной жидкости или инъецировать в предложенный участок инфузии (см., например, руководство "Remington's Pharmaceutical Sciences" 15th Edition, стр. 1035-1038 и 1570-1580). Некоторая вариабельность в дозах обязательно возникнет в зависимости от состояния субъекта, которого лечат. В любом случае лицо, ответственное за введение, определит соответствующую дозу для индивидуального субъекта. Более того, для введения человеку препараты должны соответствовать стандартам стерильности, пирогенности, общей безопасности и чистоты согласно требованиям Службы биологических стандартов Управления США по контролю за качеством пищевых продуктов и лекарственных средств (FDA Office of Biologies standards).
[0089] Стерильные инъекционные растворы готовят посредством включения активных компонентов в требуемом количестве в соответствующий растворитель с различными другими компонентами, перечисленными выше, по необходимости, с последующей стерилизацией фильтрованием. Как правило, дисперсии готовят посредством включения различных простерилизованных активных компонентов в стерильный наполнитель, который содержит основную дисперсионную среду и другие требуемые компоненты из перечисленных выше. В случае стерильных порошков для приготовления стерильных инъецируемых растворов предпочтительными способами получения являются вакуумная сушка и лиофильная сушка, которые позволяют получить активный компонент в виде порошка в комбинации с любым дополнительным желаемым компонентом из его предварительно стерилизованного фильтрованием раствора.
[0090] Композиции, раскрытые в настоящем документе, могут быть представлены в нейтральной форме или в форме соли. Фармацевтически приемлемые соли включают соли присоединения кислоты (образованные со свободными аминогруппами белка), которые образованы с неорганическими кислотами, такими как, например, хлороводородная или фосфорная кислоты, или такими органическими кислотами, как уксусная, щавелевая, винная, миндальная и т.п. Соли, образованные свободными карбоксильными группами, также могут быть получены из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа, и из органических оснований, таких как изопропиламин, триметиламин, гистидин, прокаин и т.п. После приготовления растворы будут вводить способом, совместимым с лекарственной формой, и в таком количестве, которое является терапевтически эффективным. Составы легко вводить в различных лекарственных формах, таких как инъекционные растворы, капсулы, высвобождающие лекарственные средства, и т.п.
[0091] В настоящем документе «носитель» включает любой из и все растворители, дисперсионные среды, наполнители, покрытия, разбавители, антибактериальные и противогрибковые средства, изотонические и замедляющие поглощение средства, буферы, растворы-носители, суспензии, коллоиды и т.п. Применение такой среды и средств для активных фармацевтических субстанций хорошо известно в данной области техники. За исключением случаев, когда какая-либо общепринятая среда или средство является несовместимым с активным компонентом, предусмотрено их применение в терапевтических композициях. В композиции также можно вводить дополнительные активные компоненты.
[0092] Выражение «фармацевтически приемлемый» означает химические соединения и композиции, которые при введении человеку не вызывают аллергической или аналогичной нежелательной реакции. Получение водных композиций, которые содержат белок в качестве активного компонента, хорошо известно в данной области техники. Как правило, такие композиции получают в виде инъекционных растворов, водных растворов или суспензий; также можно получить твердые формы, подходящие для растворения или суспендирования в жидкости перед инъекцией.
Варианты терапии
[0093] В следующем аспекте настоящего раскрытия предложен способ лечения или облегчения рака, причем указанный способ включает введение субъекту, который нуждается в этом, эффективного количества рекомбинантного онколитического вируса HSV-1 или фармацевтической композиции, содержащей рекомбинантный онколитический вирус HSV-1, как описано выше. В равной степени, в настоящем изобретении предложен онколитический вирус HSV-1, как описано выше, для применения в способе лечения или облегчения рака.
[0094] Согласно некоторым вариантам реализации рекомбинантный онколитический вирус HSV-1 или фармацевтическую композицию вводят внутриопухолевым способом. В одном из вариантов реализации вирус HSV-1 или фармацевтическую композицию инъецируют непосредственно в опухолевую массу в форме инъекционного раствора.
[0095] Согласно некоторым вариантам реализации может быть желательно объединить онколитический вирус, несущий ген, который кодирует иммуностимулирующий и/или иммунотерапевтический агент, с другими агентами (средствами), эффективными в лечении рака. Например, лечение рака можно осуществлять с применением онколитического вируса и других вариантов противораковой терапии, таких как противораковые агенты или хирургическое вмешательство. В контексте технологии согласно настоящему изобретению предусмотрено, что терапию онколитический вирус можно применять в сочетании с химиотерапевтическим, радиотерапевтическим, иммунотерапевтическим или другим биологическим воздействием.
[0096] «Противораковый» агент способен отрицательно влиять на рак у субъекта, например, посредством уничтожения раковых клеток, индукции апоптоза раковых клеток, снижения скорости роста раковых клеток, снижения частоты возникновения или количества метастазов, уменьшения размера опухоли, ингибирования роста опухоли, снижения кровоснабжения опухоли или раковых клеток, стимуляции иммунного ответа против раковых клеток или опухоли, предотвращения или ингибирования прогрессирования рака или увеличения продолжительности жизни субъекта, страдающего от рака. Противораковые агенты включают биологические агенты (биотерапию), химиотерапевтические агенты и радиотерапевтические агенты. В более широком смысле данные другие композиции будут предложены в объединенном количестве, эффективном для уничтожения или ингибирования пролиферации клетки. Данный процесс может включать осуществление контакта клеток с конструкцией экспрессии и агентом или агентами либо множественными факторами одновременно. Этого можно достичь посредством осуществления контакта клетки с единой композицией или фармакологическим составом, который содержит оба агента, или посредством осуществления контакта клетки с двумя отдельными композициями или составами одновременно, причем одна композиция содержит конструкцию экспрессии, а другая содержит второй агент или агенты.
[0097] Согласно некоторым вариантам реализации онколитический вирус, несущий ген, который кодирует иммуностимулирующий и/или иммунотерапевтический агент, объединяют с адъювантом. Согласно одному варианту реализации адъювант представляет собой олигонуклеотид, содержащий неметилированный мотив CpG. Неметилированные динуклеотидные мотивы CpG в бактериальной дезоксирибонуклеиновой кислоте (ДНК) характеризуются преимуществом, которое заключается в стимуляции некоторых иммунных клеток секретировать цитокины для усиления врожденного и адаптивного иммунитета.
[0098] Виротерапия может предшествовать или следовать после лечения другими агентами с интервалами, варьирующими от минут до недель. В вариантах реализации, в которых другой агент и онколитический вирус применяют в отношении клетки по отдельности, как правило, следует убедиться, что между временем каждой доставки не прошел значительный период времени, так, чтобы агент и вирус все еще были способны оказать преимущественно комбинированное действие на клетку. В таких случаях предусмотрено, что можно осуществить контакт клетки с обоими агентами в течение интервала приблизительно 12 - 24 ч. Однако, если промежуток между соответствующими введениями составляет от нескольких дней (2, 3, 4, 5, 6 или 7) до нескольких недель (1, 2, 3, 4, 5, 6, 7 или 8), в некоторых случаях может быть желательно значительно увеличить период времени для лечения.
Конструкции oHSV, экспрессирующие иммуностимулирующий или иммунотерапевтический гены
Конструкция модифицированного облигатного вектора oHSV-1 (IMMV201)
[0099] При получении облигатного вектора IMMV201 с применением технологии бактериальных искусственных хромосом (ВАС) кассеты промотора CMV, ATGCAGGTGCAGTAATAGTAA, который образует 3 стоп-кодона, встраивали в вектор T-Easy. Применяли HSV-1 в компоновке прототипа (Р). Кассеты, фланкированные выше по течению от нуклеотидов 117005 и ниже по течению от нуклеотидов 132096 применительно к геному дикого типа, ПЦР-амплифицировали с вирусного генома HSV-1 с помощью двух наборов праймеров, соответственно (GAAGATCTAATATTTTTATTGCAACTCCCTG, CTAGCTAGCTTATAAAAGGCGCGTCCCGTGG) и (GCTCTAGATTGCGACGCCCCGGCTC, CCTTAATTAAGGTTACCACCCTGTAGCCCCGATGT), и встраивали в плазмиду, содержащую CMV и 3 стоп-кодона, описанные выше, затем конструировали в плазмиду замещения гена pKO5 для получения pKO-CMV-STOP. IMMV201 конструировали посредством встраивания pKO-CMV-STOP в Е. coli RecA+, несущую ВАС HSV.
BAC-IMMV201 был не способен обеспечивать рост вируса в клетках млекопитающих
[00100] Клетки Vero трансфицировали 2-3 микрограммами BAC-IMMV201, сконструированного, как описано выше, с конфлюэнтностью 70% с применением среды OptiMEM (Life Technologies, Inc.) согласно инструкции производителя. Клетки инкубировали в инкубаторе при температуре 37°C с содержанием СО2 5% в течение 4 часов. После инкубации заменяли среду на 4 мл свежей полной среды для роста (5% сыворотка новорожденных телят/DMEM). Через 3-4 дня какие-либо вирусные бляшки не образовались. Эксперимент повторили трижды, и какие-либо вирусные бляшки не образовались.
Конструкции oHSV-1, экспрессирующие единичный иммуностимулирующий или иммунотерапевтический ген (IMMV202, 203, 303, 403)
[00101] Кассеты промотора CMV, запускающего иммуностимулирующие гены (ИЛ-12 мыши, ИЛ-12 человека) или иммунотерапевтические гены (scFv к PD-1 человека (SEQ ID No. 1 или 3), scFV к CTLA-4 человека (SEQ ID No. 5)), конструировали посредством электропорации кассет pKO в Е. coli RecA+, несущие IMMV201 (представлены на фигуре 1).
Конструкции oHSV-1, экспрессирующие два иммуностимулирующих или иммунотерапевтических гена (IMMV502, 503, 504, 505, 507)
[00102] Затем кассеты промотора CMV, запускающего иммуностимулирующие гены (ИЛ-12) и иммунотерапевтические гены (scFv к PD-1, scFV к CTLA-4), встраивали между генами UL3 и UL4 в вектор IMMV202, 203, 303, 403 для получения рекомбинантных oHSV, которые экспрессировали комбинации иммуностимулирующих генов (ИЛ-12) и иммунотерапевтических генов и которые представлены на фигуре 2.
Конструкция oHSV-1, экспрессирующая один иммуностимулирующий ген и два иммунотерапевтических гена (IMMV603)
[00103] IMMV603 экспрессировал все три иммуностимулирующие и иммунотерапевтические кДНК, кодирующие ИЛ-12, scFv к PD-1 и scFV к CTLA-4 человека, посредством вставки scFV к CTLA-4 между генами UL37 и UL38 в векторе IMMV503 (представлен на фигуре 2).
Анализы in vitro
Экспрессия scFv к PD-1
[00104] В сериях экспериментов, описанных в настоящем документе, 2×106 клеток Н293Т ложно трансфицировали или трансфицировали плазмидами, содержащими кДНК, которая кодировала меченный His scFv к PD-1, запускаемый промотором CMV, вместе с областями, кодирующими сигнальный пептид, из различных природных источников. Лизаты клеток и супернатант собирали через 46 часов после трансфекции, затем проводили анализ методом ПААГ-ДСН и проводили блоттинг с применением антитела к His. Сорок микролитров из 2 мл супернатанта, 30 мкл из 200 мкл лизатов клеток наносили на 12% ПАА гель. Количества scFv к PD-1, накопившиеся в супернатанте культуры клеток (фигура 3), отражали эффективность различных сигнальных пептидов.
Аффинность связывания scFv к PD-1 с PD-1
[00105] 2×106 клеток Н293Т ложно трансфицировали или трансфицировали плазмидами, содержащими кДНК, кодирующую меченный His scFv к PD-1, запускаемый промотором CMV, вместе с сигнальным пептидом НММ38. Супернатанты собирали через 46 часов после трансфекции, а затем проводили их анализ методом ELISA, детектирование осуществляли с применением антитела к His (фигура 4). Секретированный scFv к PD-1 связывался с PD-1 дозозависимым образом.
Жизнеспособность клеток в анализе роста in vitro
[00106] 5×103 опухолевых клеток человека, указанных следующим образом, высеянных в 96-луночные планшеты, ложно инфицировали (отрицательный контроль) или инфицировали IMMV507 (oHSV-1, экспрессирующий антитела к PD-1 и CTLA-4) со множественностью заражения 0,01, 0,1, 1, 10 и 100 БОЕ (бляшкообразующих единиц) на клетку, соответственно. Жизнеспособность клеток роста измеряли посредством применения набора CCK-8 каждые 24 часа в течение 96 часов (фигура 5). Оптическое поглощение определяли при 450 нм с помощью микропланшетного ридера (BiotekEpoch).
[00107] Опухолевые линии клеток в данных исследованиях: Т24, карцинома мочевого пузыря человека; ЕСА109, рак пищевода человека; CNE1, носоглоточная карцинома человека; НСТ116, карцинома толстой кишки человека; Нер2, карцинома гортани человека; MD-MB-231, рак молочной железы человека; Hela, эпителиальная аденокарцинома человека; А549, эпителиальная аденокарцинома легких человека; Н460, немелкоклеточная карцинома легких человека.
[00108] IMMV507 уничтожал опухолевые клетки дозозависимым образом.
Опухолевые клетки уменьшались в течение времени после осуществления контакта с вирусами oHSV-1.

[00109] Следует понимать, что несмотря на то, что настоящее изобретение было подробно раскрыто посредством предпочтительных вариантов реализации и необязательных характеристик, специалист в данной области техники сможет осуществить изменение, улучшение и варьирование настоящих концепций, реализованных в настоящем изобретении и раскрытых в настоящем документе, и такие модификации, улучшения и вариации считаются включенными в объем настоящего изобретения. Материалы, методы и примеры, представленные в настоящем документе, характеризуют предпочтительные варианты реализации, являются иллюстративными и не предназначены для ограничения объема настоящего изобретения.
[00110] Настоящее изобретение было описано в настоящем документе широко и в общем смысле. Каждый из более узких видов и субродовых групп, попадающих в общее раскрытие, также образует часть настоящего раскрытия. Это включает общее описание настоящего изобретения при условии или отрицательном ограничении, исключающем любой объект изобретения из рода, вне зависимости от того, указан ли конкретно удаляемый материал в настоящем документе или нет. Помимо этого, если характеристики или аспекты настоящего изобретения описаны в терминах групп Маркуша, специалисты в данной области техники поймут, что тем самым настоящее изобретение также описывается применительно к любому отдельному члену или подгруппе членов группы Маркуша.
[00111] Все публикации, заявки на патент, патенты и другие источники, упомянутые в настоящем документе, однозначно и полностью включены посредством ссылки в той же степени, как если бы каждый из них был в отдельности включен посредством ссылки. В случае противоречия настоящее описание, включая определения, будет определяющим. Изобретения, иллюстративно описанные в настоящем документе, можно подходящим способом реализовать на практике при отсутствии любого элемента или элементов, ограничения или ограничений, конкретно не раскрытых в настоящем документе. Таким образом, например, термины «содержащий», «включая», «включающий» и т.д. следует истолковывать расширительно и без ограничения. Дополнительно, термины и выражения, применяемые в настоящем документе, были использованы в качестве терминов описания, а не ограничения, и при использовании таких терминов и выражений отсутствует намерение исключить какие-либо эквиваленты представленных или описанных характеристик либо их частей, однако следует понимать, что в пределах заявленного объема настоящего изобретения возможны различные модификации.
Перечень цитируемых источников
1. Andreansky, S., Soroceanu, L., Flotte, E. R., Chou, J., Markert, J. M., Gillespie, G. Y., Roizman, B., and Whitley, R. J. (1997). Evaluation of genetically engineered herpes simplex viruses as oncolytic agents for human malignant brain tumors. Cancer Res 57, 1502-1509.
2. Andreansky, S., He, B., van Cott, J., McGhee, J.V., Markert, J.M., e, Y., Roizman, B. and Whitley, R.J. Treatment of intracranial gliomas in immunocompetent mice using herpes simplex viruses that express murine interleukins. Gene Ther. 5:121-130,1998.
3. Andtbacka, R.H., Kaufman, H.L., Collichio, F., Amatruda, T., Senzer, N., Chesney, J., Delman, K.A., Spitler, L.E., Puzanov, I., Agarwala, S.S., Milhem, M., Cranmer, L., Curti, B., Lewis, K., Ross, M., Guthrie, T., Linette, G.P., Daniels, G.A., Harrington, K., Middleton, M.R., Miller, W.H., Jr., Zager, J.S., Ye, Y., Yao, B., Li, A., Doleman, S., VanderWalde, A., Gansert, J., and Coffin, R.S. (2015). Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma. J Clin Oncol.
4. Brunda, M. J. (1994). Interleukin-12. J Leukoc Biol 55, 280-288.
5. Burgess, A.W., Camakaris, J., and Metcalf, D. (1977). Purification and properties of colony-stimulating factor from mouse lung-conditioned medium. J Biol Chem 252, 1998-2003.
6. Cassady, K.A., Gross, M., and Roizman, B. (1998a). The herpes simplex virus US11 protein effectively compensates for the gamma 1(34.5) gene if present before activation of protein kinase R by precluding its phosphorylation and that of the alpha subunit of eukaryotic translation initiation factor 2. J Virol 72, 8620-8626.
7. Cassady, K. A., Gross, M., and Roizman, B. (1998b). The second-site mutation in the herpes simplex virus recombinants lacking the gamma 134.5 genes precludes shutoff of protein synthesis by blocking the phosphorylation of elF-2alpha. J Virol 72, 7005-7011.
8. Cheema, T.A., Wakimoto, H., Fecci, P.E., Ning, J., Kuroda, T., Jeyaretna, D.S., Martuza, R.L., and Rabkin, S.D. (2013). Multifaceted oncolytic virus therapy for glioblastoma in an immunocompetent cancer stem cell model. Proc Natl Acad Sci USA 110, 12006-12011.
9. Chou, J., Chen, J.J., Gross, M., and Roizman, B. (1995). Association of a M(r) 90,000 phosphoprotein with protein kinase PKR in cells exhibiting enhanced phosphorylation of translation initiation factor elF-2 alpha and premature shutoff of protein synthesis after infection with gamma 134.5- mutants of herpes simplex virus 1. Proc Natl Acad Sci USA 92, 10516-10520.
10. Chou, J., Kern, E.R., Whitley, R.J., and Roizman, B. (1990). Mapping of herpes simplex virus-1 neurovirulence to gamma 134.5, a gene nonessential for growth in culture. Science 250, 1262-1266.
11. Chou, J., and Roizman, B. (1992). The gamma 1(34.5) gene of herpes simplex virus 1 precludes neuroblastoma cells from triggering total shutoff of protein synthesis characteristic of programed cell death in neuronal cells. Proc Natl Acad Sci USA 89, 3266-3270.
12. Cozzi, P.J., Burke, P.B., Bhargav, A., Heston, W.D., Huryk, B., Scardino, P.T., and Fong, Y. (2002). Oncolytic viral gene therapy for prostate cancer using two attenuated, replication-competent, genetically engineered herpes simplex viruses. Prostate 53, 95-100.
13. Cozzi, P.J., Malhotra, S., McAuliffe, P., Kooby, D.A., Federoff, H.J., Huryk, B., Johnson, P., Scardino, P.T., Heston, W.D., and Fong, Y. (2001). Intravesical oncolytic viral therapy using attenuated, replication-competent herpes simplex viruses G207 and Nv1020 is effective in the treatment of bladder cancer in an orthotopic syngeneic model. FASEB J 15, 1306-1308.
14. Currier, M.A., Adams, L.C., Mahller, Y.Y., and Cripe, T.P. (2005). Widespread intratumoral virus distribution with fractionated injection enables local control of large human rhabdomyosarcoma xenografts by oncolytic herpes simplex viruses. Cancer Gene Ther 12, 407-416.
15. Dharmadhikari, N., Mehnert, J.M., and Kaufman, H.L. (2015). Oncolytic virus immunotherapy for melanoma. Curr Treat Options Oncol 16, 326.
16. Fife, B.T., and Pauken, K.E. (2011). The role of the PD-1 pathway in autoimmunity and peripheral tolerance. Ann N Y Acad Sci 1217, 45-59.
17. Fong, Y., Kim, T., Bhargava, A., Schwartz, L., Brown, K., Brody, L., Covey, A., Karrasch, M., Getrajdman, G., Mescheder, A., Jarnagin, W., and Kemeny, N. (2009). A herpes oncolytic virus can be delivered via the vasculature to produce biologic changes in human colorectal cancer. Mol Ther 17, 389-394.
18. Francisco, L.M., Sage, P.T., and Sharpe, A.H. (2010). The PD-1 pathway in tolerance and autoimmunity. Immunol Rev 236, 219-242.
19. Geevarghese, S.K., Geller, D.A., de Haan, H.A., Horer, M., Knoll, A.E., Mescheder, A., Nemunaitis, J., Reid, T.R., Sze, D.Y., Tanabe, K.K., and Tawfik, H. (2010). Phase I/II study of oncolytic herpes simplex virus NV1020 in patients with extensively pretreated refractory colorectal cancer metastatic to the liver. Hum Gene Ther 21, 1119-1128.
20. Goshima, F., Esaki, S., Luo, C., Kamakura, M., Kimura, H., and Nishiyama, Y. (2014). Oncolytic viral therapy with a combination of HF10, a herpes simplex virus type 1 variant and granulocyte-macrophage colony-stimulating factor for murine ovarian cancer. Int J Cancer 134, 2865-2877.
21. Hsieh, C.S., Macatonia, S.E., Tripp, C.S., Wolf, S.F., O'Garra, A., and Murphy, K.M. (1993). Development of TH1 CD4+ T cells through IL-12 produced by Listeria-induced macrophages. Science 260, 547-549.
22. Inaba, K., Inaba, M., Romani, N., Aya, H., Deguchi, M., Ikehara, S., Muramatsu, S., and Steinman, R.M. (1992). Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. J Exp Med 176, 1693-1702.
23. Keir, M.E., Butte, M.J., Freeman, G.J., and Sharpe, A.H. (2008). PD-1 and its ligands in tolerance and immunity. Annu Rev Immunol 26, 677-704.
24. Kelly, K.J., Wong, J., and Fong, Y. (2008). Herpes simplex virus NV1020 as a novel and promising therapy for hepatic malignancy. Expert Opin Investig Drugs 17, 1105-1113.
25. Kemeny, N., Brown, K., Covey, A., Kim, T., Bhargava, A., Brody, L., Guilfoyle, B., Haag, N.P., Karrasch, M., Glasschroeder, B., Knoll, A., Getrajdman, G., Kowal, K.J., Jarnagin, W.R., and Fong, Y. (2006). Phase I, open-label, dose-escalating study of a genetically engineered herpes simplex virus, NV1020, in subjects with metastatic colorectal carcinoma to the liver. Hum Gene Ther 17, 1214-1224.
26. Krummel, M.F., and Allison, J.P. (1995). CD28 and CTLA-4 have opposing effects on the response of T cells to stimulation. J Exp Med 182, 459-465.
27. Markert, J.M., Cody, J.J., Parker, J.N., Coleman, J.M., Price, K.H., Kern, E.R., Quenelle, D.C., Lakeman, A.D., Schoeb, T.R., Palmer, C.A., Cartner, S.C., Gillespie, G.Y., and Whitley, R.J. (2012). Preclinical evaluation of a genetically engineered herpes simplex virus expressing interleukin-12. J Virol 86, 5304-5313.
28. Markert, J.M., Gillespie, G.Y., Weichselbaum, R.R., Roizman, B., and Whitley, R.J. (2000). Genetically engineered HSV in the treatment of glioma: a review. Rev Med Virol 10, 17-30.
29. Markowicz, S., and Engleman, E.G. (1990). Granulocyte-macrophage colony-stimulating factor promotes differentiation and survival of human peripheral blood dendritic cells in vitro. J Clin Invest 85, 955-961.
30. Meignier, B., Longnecker, R., and Roizman, B. (1988). In vivo behavior of genetically engineered herpes simplex viruses R7017 and R7020: construction and evaluation in rodents. J Infect Dis 158, 602-614.
31. Miest, T.S., and Cattaneo, R. (2014). New viruses for cancer therapy: meeting clinical needs. Nat Rev Microbiol 12, 23-34.
32. Mineta, T., Rabkin, S.D., Yazaki, T., Hunter, W.D., and Martuza, R.L. (1995). Attenuated multi-mutated herpes simplex virus-1 for the treatment of malignant gliomas. Nat Med 1, 938-943.
33. Russell, S.J., Peng, K.W., and Bell, J.C. (2012). Oncolytic virotherapy. Nat Biotechnol 30, 658-670.
34. Shen, Y., and Nemunaitis, J. (2006). Herpes simplex virus 1 (HSV-1) for cancer treatment. Cancer Gene Ther 13, 975-992.
35. Smith, K.D., Mezhir, J.J., Bickenbach, K., Veerapong, J., Charron, J., Posner, M.C., Roizman, B., and Weichselbaum, R.R. (2006). Activated MEK suppresses activation of PKR and enables efficient replication and in vivo oncolysis by Deltagamma(1)34.5 mutants of herpes simplex virus 1. J Virol 80, 1110-1120.
36. Topalian, S.L., Drake, C.G., and Pardoll, D.M. (2015). Immune Checkpoint Blockade: A Common Denominator Approach to Cancer Therapy. Cancer Cell 27, 450-461.
37. Valiante, N. M., Rengaraju, M., and Trinchieri, G. (1992). Role of the production of natural killer cell stimulatory factor (NKSF/IL-12) in the ability of B cell lines to stimulate T and NK cell proliferation. Cell Immunol 145, 187-198.
38. Walker, J.D., Sehgal, I., and Kousoulas, K.G. (2011). Oncolytic herpes simplex virus 1 encoding 15-prostaglandin dehydrogenase mitigates immune suppression and reduces ectopic primary and metastatic breast cancer in mice. J Virol 85, 7363-7371.
39. Walunas, T.L., Lenschow, D.J., Bakker, C.Y., Linsley, P.S., Freeman, G.J., Green, J.M., Thompson, C.B., and Bluestone, J.A. (1994). CTLA-4 can function as a negative regulator of T cell activation. Immunity 1, 405-413.
40. Weichselbaum, R.R., Roizman, B., and Whitley, R.J. (2012). Treatment of tumors with genetically engineered herpes virus. In, pp. 11-27.
41. Wong, R.J., Kim, S.H., Joe, J.K., Shah, J.P., Johnson, P.A., and Fong, Y. (2001). Effective treatment of head and neck squamous cell carcinoma by an oncolytic herpes simplex virus. J Am Coll Surg 193, 12-21.
Реферат
Изобретение относится к биотехнологии. Предложен вектор экспрессии на основе вируса простого герпеса типа 1 (HSV-1), содержащий делеционную модификацию в геноме HSV-1 дикого типа, где указанный вектор содержит (i) только одну копию каждого из всех представленных в двух копиях генов генома HSV-1 дикого типа, (ii) только одну копию дуплицированных некодирующих последовательностей генома HSV-1 дикого типа, и (iii) последовательности, необходимые для экспрессии всех представленных в одной копии открытых рамок считывания (ОРС, ORF) генома HSV-1 дикого типа, содержащие сами ОРС и регуляторные последовательности, необходимые для экспрессии каждой ОРС, причем указанные регуляторные последовательности включают промоторы. Также предложена фармацевтическая композиция для лечения рака, содержащая эффективное количество указанного рекомбинантного онколитического HSV-1 и фармацевтически приемлемый носитель. Изобретение расширяет арсенал средств для лечения рака. 3 н. и 26 з.п. ф-лы, 5 ил., 1 табл.
Формула
Документы, цитированные в отчёте о поиске
Онколитический аденовирус для лечения рака, его применение и фармацевтическая композиция, содержащая его

Комментарии