Противоопухолевая композиция - RU2768287C1
Код документа: RU2768287C1
Чертежи









Описание
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к композиции против опухоли или для усиления противоопухолевого иммунитета, содержащей рекомбинантный аденовирус, который совместно экспрессирует интерлейкин-12 (IL-12) и молекулу нуклеиновой кислоты, ингибирующую экспрессию тирозинкиназы Met (C-met).
Предшествующий уровень техники настоящего изобретения
Иммунотерапия опухолей представляет собой способ индуцирования иммунного ответа против опухоли путем усиления общей иммунной функции организма и лечения посредством этого опухолей. Активно ведутся исследования по иммунотерапии опухолей. Однако иммуносупрессивная среда почти всегда формируется на стадии возникновения рака, поэтому, даже если иммунная система организма активно работает, опухоль удалять сложно. Сами опухолевые клетки экспрессируют множество аномальных антигенов. Эти антигены вызывают реакцию эрадикации посредством иммунного надзора, позволяя опухолевым клеткам уклоняться от иммунного надзора, даже если иммунная система организма активна. Кроме того, обнаружили, что это явление опосредуется различными факторами, продуцируемыми опухолевыми клетками. Сообщалось, что опухолевые ткани могут продуцировать иммуносупрессивные молекулы, такие как фактор роста эндотелия сосудов (VEGF), фактор роста опухоли (TGF)-β и интерлейкин (IL)-10, а регуляторные Т-клетки проникают в опухоль с подавленным иммунитетом. Кроме того, стимуляция экспрессии ингибирующего рецептора, называемого PD-1, постоянно усиливается активированными Т-клетками, и в случае раковых клеток PD-L1, который является лигандом, специфически связывающимся с PD-1, экспрессируется в большом количестве с инактивацией активированных Т-клеток, чтобы избежать иммунных ответов, что приводит к иммуносупрессивному микроокружению и иммунной толерантности в опухолях.
Недавнее исследование доказало, что ингибитор, способный ингибировать иммунную контрольную точку PD-1, которая участвует в подавлении активности Т-клеток, индуцирует сильный противоопухолевый иммунный ответ. Следовательно, преодоление избегания иммунного надзора является основной стратегией иммунотерапии. Таким образом, в качестве пути преодоления этих ограничений активно проводится исследование по прямому введению гена цитокина, обладающего иммуностимулирующим эффектом, в раковые клетки для образования и секреции цитокинов из раковых клеток и, таким образом, специфического устранения раковых клеток посредством индукции противоопухолевых иммунных ответов. Среди усиливающих иммунитет генов цитокинов, противоопухолевые эффекты которых были зарегистрированы на сегодняшний день, интерлейкин-12 (IL-12) является одним из наиболее эффективных и многообещающих цитокинов.
Интерлейкин-12 (IL-12), который представляет собой гетеродимерный белок, содержащий субъединицы 40 кДа и 35 кДа, связанные дисульфидными связями, секретируется антигенпрезентирующими клетками (АРС), такими как активированные макрофаги, моноциты, дендритные клетки и активированные В-лимфоциты, и действует непосредственно на Т-клетки и NK-клетки, которые могут эффективно устранять раковые клетки с активацией Т-клеток и NK-клеток и индуцировать секрецию IFN-γ, а также повышать способность Т-клеток и NK-клеток к уничтожению раковых клеток. Локальная экспрессия IL-12 делает опухолевые клетки чувствительными к цитотоксичности, опосредованной Т-клетками, что приводит к ингибированию роста опухоли и установлению системного иммунитета.
Однако клиническое применение IL-12 затруднено, поскольку введение IL-12 может вызвать связанную с цитокинами системную токсичность, которая ограничивает приемлемую для больного дозу. Кроме того, происходит общее подавление иммунного эффекта, повышенная экспрессия IL-10 в сыворотке больного и поляризация IL-12 с обусловленного Th1 иммунитета на обусловленный Th2 иммунитет из-за пониженной экспрессии IFN-γ и TNF-β. По этой причине IL-12 иногда вводят повторно. Эти клинические результаты показывают ограничения IL-12 как единственного средства для лечения рака.
В последнее время проводятся исследования факторов роста и их рецепторов как биологических индикаторов, отражающих степень злокачественности рака. Среди них активно проводятся исследования C-met, которая является представителем семейства тирозинкиназных рецепторов. C-met действует как рецептор фактора роста гепатоцитов/рассеивающего фактора (HGF/SF) и надэкспрессируется при различных раковых заболеваниях. Большинство больных с надэкспрессией C-met имеют плохой прогноз лечения рака. Надэкспрессия C-met усиливает митогенез и клеточную подвижность благодаря системе передачи сигналов HGF/SF-Met, ингибирует апоптоз, формирует кровеносные сосуды и индуцирует инвазию и миграцию во внеклеточный матрикс (ЕСМ), то есть вызывает усиление злокачественности рака. Поскольку быстрая пролиферация и миграция раковых клеток, индуцированная надэкспрессией C-met, превышает скорость удаления раковых клеток иммунной системой, трудно устранять раковые клетки с помощью иммунного ответа. Кроме того, поскольку центр иммунного ответа в микроокружении опухоли очень склонен к ингибированию по мере увеличения размера опухоли, контролировать опухолевые клетки с использованием единственного терапевтического средства труднее, а улучшенный противоопухолевый эффект с помощью противоопухолевой иммунотерапии не может быть достигнут.
Следовательно, разработка противоопухолевых терапевтических средств без побочных эффектов, зависящих от дозировки и т.д., обладающих лучшими противораковыми эффектами за счет повышения противоопухолевого иммунитета, остается задачей, которую предстоит решить в данной области.
Краткое раскрытие настоящего изобретения
Техническая проблема
Таким образом, настоящее изобретение выполняли с учетом вышеупомянутых проблем, и авторы настоящего изобретения попытались разработать цель для лечения, способную снизить дозировку при отличном противоопухолевом действии, и предложить способ, который может более эффективно лечить рак с использованием комбинации лечения, нацеленного на IL-12 и C-met. Авторы настоящего изобретения подтвердили, что возможно подавление опухолей и преодоление избегания иммунного надзора с получением синергетического эффекта при лечении рака по сравнению со случаем использования каждой терапевтической цели по отдельности, с использованием аденовируса, способного ингибировать надэкспрессию C-met при экспрессии интерлейкина-12, в лечении рака, что тем самым составляет настоящее изобретение.
По всему настоящему описанию упоминается ряда статей и патентных документов и ссылки на них. Раскрытое содержание процитированных статей и патентных документов полностью включено посредством ссылки в настоящее описание, так что уровень технической области, к которой принадлежит настоящее изобретение, и содержание настоящего изобретения описаны более четко.
Техническое решение
Согласно аспекту настоящего изобретения упомянутые выше и другие цели могут быть достигнуты путем обеспечения системы доставки генов, содержащей ген, кодирующий интерлейкин-12 (IL-12); и ген, экспрессирующий олигонуклеотид, который комплементарен мРНК C-met, для ингибирования экспрессии C-met.
Согласно другому аспекту настоящего изобретения представлена фармацевтическая композиция, содержащая систему доставки генов, которая включает в себя последовательность нуклеиновой кислоты, кодирующую интерлейкин-12 (IL-12); и последовательность нуклеиновой кислоты, экспрессирующую олигонуклеотид, комплементарно связывающийся с геном C-met и ингибирующий экспрессию C-met.
Система доставки гена может представлять собой аденовирусную систему, а аденовирусная система может представлять собой рекомбинантный аденовирус или рекомбинантную аденовирусную ДНК.
Фармацевтическая композиция может представлять собой противоопухолевую композицию или композицию для усиления противоопухолевого иммунитета.
Полезные эффекты
Аденовирусная система, совместно экспрессирующая интерлейкин-12 и ингибирующую экспрессию C-met молекулу нуклеиновой кислоты в соответствии с настоящим изобретением, может восстанавливать иммунные функции в среде опухоли, значительно усиливая противораковые эффекты, такие как ремоделирование опухоли и ингибирование миграции, а также ингибирование роста опухоли. В частности, аденовирусная система может обеспечивать заметные синергетические эффекты при лечении рака благодаря совместной экспрессии обоих терапевтических генов.
Краткое описание графических материалов
На фиг. 1 иллюстрируется структура аденовирусной плазмидной ДНК, сконструированной согласно варианту осуществления настоящего изобретения.
На фиг. 2 иллюстрируется, что аденовирусная плазмидная ДНК, сконструированная согласно варианту осуществления настоящего изобретения, может экспрессировать мышиный интерлейкин-12 (mIL-12) или человеческий интерлейкин-12 (hIL-12) в клетках.
На фиг. 3 иллюстрируется, что аденовирус, сконструированный согласно варианту осуществления настоящего изобретения, усиливает экспрессию интерлейкина-12 (IL-12) и ингибирует экспрессию C-met.
На фиг. 4 иллюстрируются противораковые аденовирусные структуры, которые совместно экспрессируют IL-12 и shc-met, сконструированные согласно варианту осуществления настоящего изобретения.
На фиг. 5а и 5b иллюстрируются in vivo противоопухолевые эффекты противоракового аденовируса, совместно экспрессирующего IL-12 и shc-met, согласно варианту осуществления настоящего изобретения в полученных от мышей клетках B16-F10 и СТ26, соответственно.
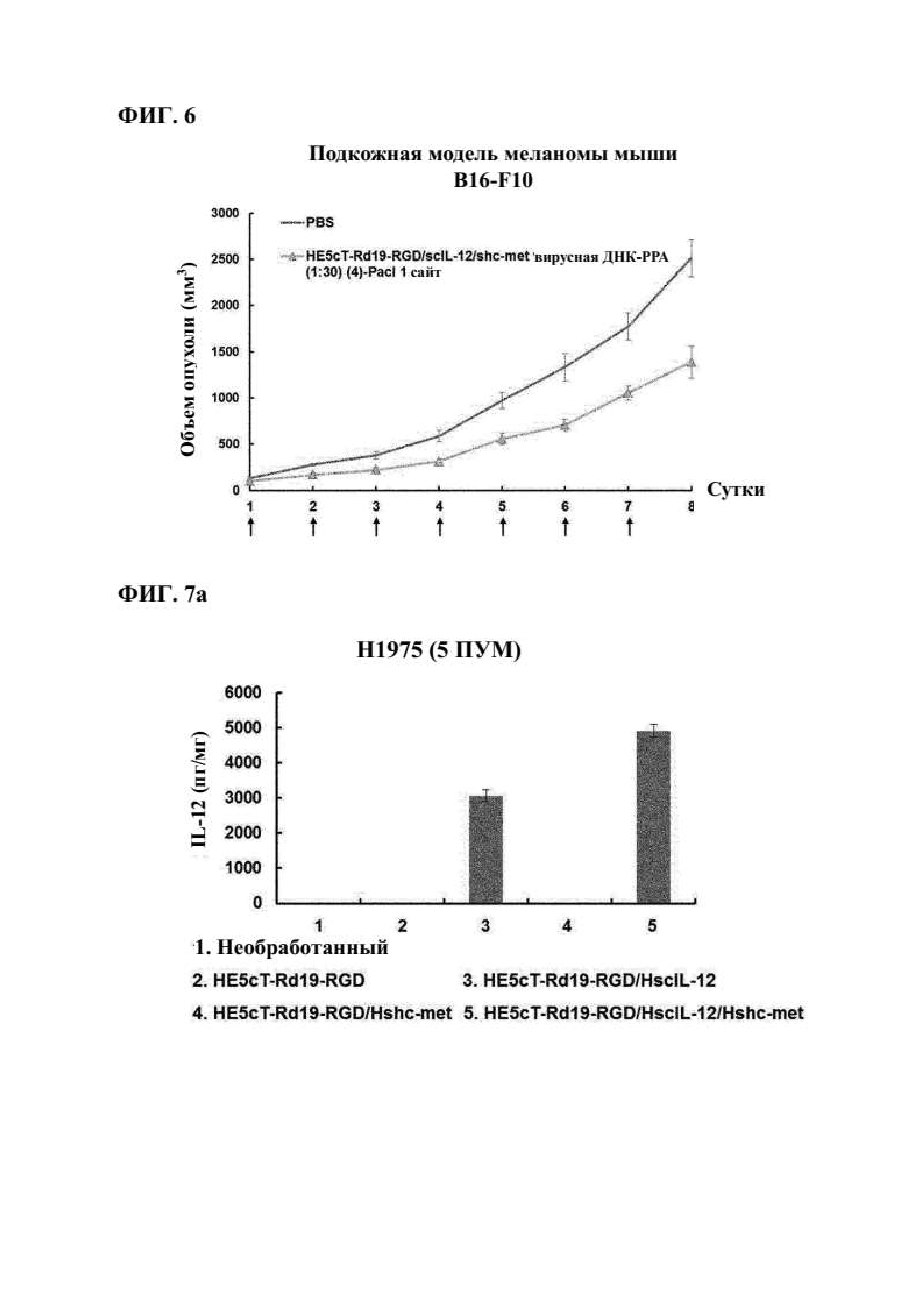
На фиг. 6 иллюстрируются in vivo противоопухолевые эффекты комплекса противораковой аденовирусной пДНК/РРА, совместно экспрессирующего IL-12 и shc-met, согласно варианту осуществления настоящего изобретения в полученных от мышей клетках B16-F10.
На фиг. 7а и 7b иллюстрируется in vivo экспрессия IL-12 (фиг. 7а) и способность ингибировать in vivo экспрессию C-met (фиг. 7b) противоракового аденовируса, совместно экспрессирующего IL-12 и shc-met, согласно варианту осуществления настоящего изобретения в линии клеток рака человека H1975.
На фиг. 8а и 8b иллюстрируется способность уничтожать раковые клетки противораковых аденовирусов, экспрессирующих IL-12 и/или shc-met, согласно вариантам осуществления настоящего изобретения в линии клеток рака человека Н1975 в условии нормального содержания кислорода (8а) и в условии низкого содержания кислорода (8b).
На фиг. 9а, 9b, 9 с и 9d иллюстрируются эффекты ингибирования миграции (9а и 9b) и инвазии (9 с и 9d) клеток HUVEC противораковыми аденовирусами, экспрессирующими IL-12 и/или shc-met, согласно варианту осуществления настоящего изобретения.
На фиг. 10 иллюстрируется ингибирование миграции опухолевых клеток посредством ингибирования эндотелиально-мезенхимального перехода (эндо-МТ) в клетках HUVEC противораковыми аденовирусами, экспрессирующими IL-12 и/или shc-met, согласно вариантам осуществления настоящего изобретения.
На фиг. 11 иллюстрируются противоопухолевые эффекты на ксенотрансплантатной модели опухоли человека (Н1975) с помощью противораковых аденовирусов, экспрессирующих IL-12 и/или shc-met, согласно вариантам осуществления настоящего изобретения.
На фиг. 12 схематически иллюстрируется структура системы доставки генов, которая совместно экспрессирует IL-12, и система CRISPR/Cas, содержащая нацеленную на C-met направляющую РНК, согласно варианту осуществления настоящего изобретения.
На фиг. 13а, 13b и 13 с иллюстрируется межклеточный эффект экспрессии IL-12 (13а) и эффект ингибирования C-met (13b и 13с) противораковым вирусом, совместно экспрессирующим IL-12 и Lbcpf1-crMET, согласно варианту осуществления настоящего изобретения.
На фиг. 14 иллюстрируется противоопухолевый эффект на ксенотрансплантатной модели опухоли человека (Н1975) противоракового вируса, совместно экспрессирующего IL-12 и Lbcpf1-crMET, согласно варианту осуществления настоящего изобретения.
Подробное раскрытие настоящего изобретения
Согласно аспекту настоящего изобретения настоящее изобретение относится к системе доставки генов, содержащей ген, кодирующий интерлейкин-12 (IL-12), и ген, экспрессирующий олигонуклеотид, который комплементарно связывается с геном C-met с ингибированием экспрессии C-met.
Согласно другому аспекту настоящего изобретения настоящее изобретение относится к противораковой композиции, которая включает в себя систему доставки генов, содержащую ген, кодирующий интерлейкин-12 (IL-12), и ген, экспрессирующий олигонуклеотид, который комплементарно связывается с геном C-met с ингибированием экспрессии C-met; к противометастатической композиции для раковых клеток, которая включает в себя систему доставки генов; или к фармацевтической композиции для усиления противоопухолевого иммунитета, которая включает в себя систему доставки генов.
Согласно другому аспекту настоящего изобретения настоящее изобретение относится к применению системы доставки генов, которая включает в себя ген, кодирующий интерлейкин-12 (IL-12), и ген, экспрессирующий олигонуклеотид, который комплементарно связывается с геном C-met с ингибированием экспрессии C-met, в качестве противоракового средства.
Согласно еще одному аспекту настоящего изобретения настоящее изобретение относится к способу лечения рака, при этом способ предусматривает введение субъекту системы доставки генов, которая включает в себя ген, кодирующий интерлейкин-12 (IL-12), и ген, экспрессирующий олигонуклеотид, который комплементарно связывается с геном С-met с ингибированием экспрессии C-met, или фармацевтической композиции, содержащей систему доставки генов.
В соответствии с настоящим изобретением термин «система доставки генов» относится к векторной системе для доставки гена в клетки. В соответствии с настоящим изобретением, если не указано иное, термины «система доставки генов», «аденовирусный вектор», «аденовирусная система» или «аденовирусная векторная система» имеют одинаковое значение. Аденовирусная система в соответствии с настоящим изобретением включает в себя как аденовирус, так и аденовирусную ДНК (вирусную ДНК). Предпочтительно аденовирусная система может представлять собой рекомбинантный аденовирус или рекомбинантную аденовирусную ДНК для усиления противоракового или противоопухолевого иммунитета.
Аденовирусная система может включать в себя геномную последовательность аденовируса, так что аденовирус образуется из аденовируса или рекомбинантной ДНК, доставленных в клетку, с обеспечением тем самым противоракового или противоопухолевого иммунного эффекта. В соответствии с настоящим изобретением поскольку гены, соответственно экспрессирующие IL-12 и shc-met, могут быть вставлены в аденовирусный геном и могут быть доставлены в клетки в форме самого аденовируса или его рекомбинантной ДНК, по всему описанию настоящего изобретения, если не указано иное, аденовирус включает в себя и рекомбинантный аденовирус, и рекомбинантную аденовирусную ДНК.
Согласно предпочтительному варианту осуществления настоящего изобретения аденовирусная система в соответствии с настоящим изобретением может представлять собой онколитический аденовирус (oAd), способный специфически пролиферировать только в опухоли и избирательно убивать опухолевые клетки. Термин «онколитический аденовирус» в настоящем описании может использоваться взаимозаменяемо с такими терминами, как «противораковый вирус», «oAd» или «вирус, убивающий опухоль». Все онколитические аденовирусы, генетически модифицированные обычными методами, используемыми в данной области, к которой относится настоящее изобретение, включены в аденовирусную систему в соответствии с настоящим изобретением. Например, Е1А и/или Е1В могут быть удалены из генома аденовируса для пролиферации только в раковых клетках, таким образом, они не пролиферируют в нормальных клетках, или целевая последовательность вирусного белка может быть изменена для использования протеазы, секретируемой раковыми клетками, или последовательность, экспрессирующую лиганд, вставляют в вирусный геном так, чтобы экспрессировать рецепторный лиганд, который должен связываться с рецептором (например, EGFR), присутствующим в раковых клетках.
Кроме того, для улучшения способности убивать раковые клетки ген TRAIL может быть вставлен в селективный в отношении опухоли онколитический аденовирус в соответствии с настоящим изобретением, так что происходит гибель клетки, или может быть применен ген IFN в селективном в отношении опухоли онколитическом аденовирусе, подлежащем вставке в раковые клетки и эффективной экспрессии в них, так что происходит иммунный ответ.
Рекомбинантный аденовирус, используемый в соответствии с настоящим изобретением, включает в себя промотор, функционирующий в клетках животных, предпочтительно в клетках млекопитающих. Промоторы, подходящие для настоящего изобретения, включают в себя промоторы, происходящие из вирусов млекопитающих, и промоторы, происходящие из генома клеток млекопитающих. Трансген, вставляемый в рекомбинантный аденовирус, предпочтительно вставляют в экспрессионную кассету последовательности промотор-трансген-поли А. В этом случае в качестве промотора могут быть использованы последовательности контроля экспрессии гена в соответствии с настоящим изобретением (HRE-TERT, HRE-E2F, HRE-TERT-E2F, HRE-E2F-TERT, HRE-E2F-5myc-TERT и HRE могут быть включены дважды) или общие промоторы.
Общие промоторы, связанные с трансгеном, предпочтительно функционируют в клетках животных, более предпочтительно в клетках млекопитающих, для контроля транскрипции трансгенов. Общие промоторы включают в себя промотор, полученный из вируса млекопитающего, и промотор, полученный из генома клетки млекопитающего. Примеры общих промоторов включают в себя промотор U6, промотор H1, промотор цитомегаловируса (CMV), поздний промотор аденовируса, промотор 7.5K вируса осповакцины, промотор SV40, промотор tk HSV, промотор RSV, промотор EF1 альфа, промотор металлотионеина, промотор бета-актина, промотор гена IL-2 человека, промотор гена IFN человека, промотор гена IL-4 человека, промотор гена лимфотоксина человека, промотор гена GM-CSF человека, индуцибельный промотор, промотор, специфический для опухолевых клеток (например, промотор TERT, промотор PSA, промотор PSMA, промотор СЕА, промотор E2F и промотор AFP) и специфический в отношении ткани промотор (например, промотор альбумина), но настоящее описание не ограничивается перечисленными. Предпочтительно, чтобы конструкции экспрессии для экспрессии трансгена включали в себя полиаденилированные последовательности, связанные с трансгеном в 5'-3' направлении. Полиаденилированные последовательности включают в себя терминатор бычьего гормона роста (Gimmi, Е. R., et al., Nucleic Acids Res. 17: 6983-6998(1989)), полиаденилированную последовательность, полученную из SV40 (Schek, N, et al., Mol. Cell Biol. 12: 5386-5393(1992)), поли A HIV-1 (Klasens, В. I. F., et al., Nucleic Acids Res. 26: 1870-1876(1998)), поли А β-глобина (Gil, A, et al, Cell 49: 399-406 (1987)), поли A TK HSV (Cole, C. N. and T. P. Stacy, Mol. Cell. Biol. 5: 2104-2113 (1985)) или поли A полиомавируса (Batt, D. В and G. G. Carmichael, Mol. Cell. Biol. 15: 4783-4790 (1995)), но настоящее описание не ограничивается перечисленными.
В рекомбинантном аденовирусе, используемом в соответствии с настоящим изобретением, последовательность гена IL-12 и последовательность, экспрессирующая РНК, которая ингибирует C-met, функционально связаны с промотором. В соответствии с настоящим описанием термин «функционально связанный» относится к функциональной связи между последовательностью контроля экспрессии нуклеиновой кислоты (например, промотором, сигнальной последовательностью или массивом сайтов связывания факторов регуляции транскрипции) и другой последовательностью нуклеиновой кислоты. Соответственно, регуляторная последовательность контролирует транскрипцию и/или трансляцию различных последовательностей нуклеиновых кислот.
Рекомбинантный аденовирус в соответствии с настоящим изобретением может дополнительно включать в себя ген устойчивости к антибиотику и репортерный ген (например, зеленого флуоресцентного белка (GFP), люциферазы и (3-глюкуронидазы) в качестве селективных маркеров. Ген устойчивости к антибиотику включает в себя ген устойчивости к антибиотикам, как правило, используемым в уровне техники, и, например, может представлять собой ген устойчивости к ампициллину, гентамицину, карбенициллину, хлорамфениколу, стрептомицину, канамицину, генетицину, неомицину или тетрациклину, предпочтительно ген устойчивости к неомицину. Селективный маркер может экспрессироваться отдельным промотором, внутренним участком посадки рибосомы (IRES) или системой экспрессии, связанной системой 2А, и при этом IRES, используемый в соответствии с настоящим изобретением, представляет собой регуляторную последовательность, обнаруженную в РНК нескольких видов вирусов и клеток (McBratney et. al. Current Opinion in Cell Biology 5:961 (1993)). Кроме того, термин «пептид 2А» означает последовательность, кодирующую разрезаемый малый пептид (18-22 аминокислоты), который обеспечивает эффективную согласованную экспрессию дискретных белковых продуктов в пределах одной кодирующей последовательности. Например, можно использовать пептид 2А из вируса, такого как вирус ящура (F2A), вируса ринита А лошадей, тешовируса-1 свиней (Р2А) или вируса Thea asigna (Т2А), или любой из пептидов 2А, описанных в работе Szymczak-Workman, A. et al. "Design and Construction of 2A Peptide-Linked Multicistronic Vectors".
Настоящее изобретение относится и к гену, кодирующему интерлейкин-12 (IL-12), и к гену, экспрессирующему олигонуклеотид, который комплементарен мРНК C-met (тирозинкиназы Met) и ингибирует экспрессию C-met, с обеспечением синергетического эффекта в отношении усиления противоракового и противоопухолевого иммунитета путем совместной экспрессии обоих генов. Кроме того, технология в соответствии с настоящим изобретением важна тем, что позволяет обеспечивать превосходный терапевтический эффект, несмотря на введение IL-12 в небольшом количестве, и решить проблему побочных эффектов, вызываемых традиционным введением цитокинов.
В соответствии с настоящим описанием термин «интерлейкин-12 (IL-12)» относится к гетеродимерному цитокину, образованному из субъединицы 40 кДа (субъединицы р40) и субъединицы 35 кДа (субъединицы р35), связанных дисульфидной связью. IL-12 продуцируется антигенпрезентирующими клетками, такими как макрофаги, и связывается с рецепторами на клеточных поверхностях активированных Т-клеток, В-клеток и NK-клеток. IL-12 обеспечивает пролиферацию Т-клеток и NK-клеток; усиливает цитотоксический эффект Т-клеток, NK-клеток и макрофагов; индуцирует продуцирование IFN-γ, TNF-α и GM-CSF, а также индуцирует активацию Th1-клеток. Кроме того, IL-12 известен как важный костимулятор пролиферации клона Th1, а также, как известно, усиливает продуцирование антител IgG2a в сыворотке. В соответствии с настоящим изобретением термины «субъединица р35» и «субъединица р40» включают в себя не только субъединицы, иллюстрируемые в примерах, но также и все аналоги субъединиц, способные выполнять уникальные функции каждой субъединицы.
Аденовирусная система в соответствии с настоящим изобретением включает в себя ген, кодирующий IL-12 в экспрессируемой форме, и секретирует IL-12 после инфицирования опухолевыми клетками с индуцированием сильного противоопухолевого иммунного ответа.
Аденовирусная система в соответствии с настоящим изобретением может включать в себя ген IL-12A (р35) и ген IL-12B (р40), экспрессирующие IL-12A (р35) и IL-12B (р40), в качестве субъединиц, чтобы эффективно экспрессировать IL-12. Кроме того, между последовательностью гена IL-12A (р35) и последовательностью гена IL-12B (р40) может быть дополнительно включена линкерная последовательность, служащая для связывания двух субъединиц, или может быть дополнительно включена последовательность внутреннего участка посадки рибосомы (IRES), используемая для повышения эффективности экспрессии белка.
Линкер означает любую последовательность, которая может быть включена между двумя генами, и в соответствии с настоящим изобретением линкер означает последовательность, которая может быть включена между геном IL-12A (р35) и геном IL-12В (р40). Линкер включает в себя все обычные линкерные последовательности или рандомно сконструированные последовательности, которые, как известно, вставляются между генами, и любые линкеры могут быть включены в соответствии с настоящим изобретением, если они не влияют отрицательно на экспрессию IL-12 или не нарушают функциональность IL-12. Например, линкер может представлять собой последовательность SEQ ID NO: 19, но настоящее изобретение не ограничивается перечисленными.
Аминокислотная последовательность «субъединицы IL-12A (субъединицы р35)», которая может быть использована в соответствии с настоящим изобретением, может быть последовательностью, описанной под номером доступа AAD56385 в GenBank (если желательна экспрессия аминокислотной последовательности мышиного р35, номер доступа ААА39292 в GenBank). Кроме того, ген IL-12A (р35) в качестве последовательности, кодирующей субъединицу IL-12A, может представлять собой нуклеотидную последовательность, соответствующую кодирующей последовательности (CDS) среди последовательностей, описанных под номером доступа AF180562 в GenBank (если желательно использование мышиной последовательности, относится к последовательности CDS среди последовательностей, описанных в М86672). Кроме того, ген IL-12A (р35) может иметь последовательность SEQ ID NO: 1 или SEQ ID NO: 4, используемую согласно варианту осуществления настоящего изобретения (в случае мыши - последовательность SEQ ID NO: 7).
Аминокислотная последовательность «субъединицы IL-12B (субъединицы р40)», которая может быть использована в соответствии с настоящим изобретением, может быть последовательностью, описанной под номером доступа AAD56386 в GenBank (если желательна экспрессия аминокислотной последовательности мышиного р40, номер доступа ААА39296 в GenBank). Кроме того, ген IL-12B (р40) в качестве последовательности, кодирующей субъединицу IL-12B, может представлять собой нуклеотидную последовательность, соответствующую кодирующей последовательности (CDS) среди последовательностей, описанных под номером доступа AF180563 в GenBank (если желательно использование мышиной последовательности, относится к последовательности CDS среди последовательностей, описанных в М86671). Кроме того, это может быть последовательность SEQ ID NO: 2 или SEQ ID NO: 5, используемая согласно варианту осуществления настоящего изобретения (в случае мыши - последовательность SEQ ID NO: 8).
Согласно варианту осуществления настоящего изобретения подтвердили, что IL-12 может экспрессироваться в опухолевых клетках с использованием гена IL-12 SEQ ID NO: 3 или SEQ ID NO: 6 (SEQ ID NO: 9 в случае мыши), в частности, при одновременной экспрессии с РНК для C-met, уровень экспрессии 12 был значительно повышен.
В соответствии с настоящим описанием термин «С-met» относится к семейству рецепторов тирозинкиназы. C-met действует как рецептор фактора роста гепатоцитов/рассеивающего фактора (HGF/SF) и надэкспрессируется при различных раковых заболеваниях. Большинство больных с надэкспрессией C-met имеют плохой прогноз лечения рака. Ген C-met в соответствии с настоящим изобретением может представлять собой нуклеотидную последовательность, соответствующую кодирующей последовательности (CDS) среди последовательностей мРНК, раскрытых под номером доступа gi: 4557746 в GenBank (если желательно использование последовательности мыши, относится к последовательности CDS среди последовательностей, описанных под номером доступа gi: 146198695).
Надэкспрессия C-met усиливает митогенез и подвижность клеток благодаря системе передачи сигнала HGF/SF-Met, а также индуцирует инвазию и миграцию во внеклеточный матрикс с усилением тем самым злокачественности рака. Таким образом, в лечении рака ингибирование экспрессии C-met представляет собой очень важную задачу. В соответствии с настоящим изобретением ингибируют экспрессию C-met с использованием олигонуклеотида, который комплементарен мРНК C-met и ингибирует экспрессию C-met, в частности, подтвердили, что ингибирование экспрессии C-met заметно усиливается по сравнению с группой, в которой ингибируется только экспрессия C-met, при совместной экспрессии олигонуклеотида с IL-12.
Согласно варианту осуществления мРНК C-met, которая является целью ингибирования, в соответствии с настоящим изобретением может быть последовательностью, показанной в SEQ ID NO: 10 (в случае мыши - SEQ ID NO: 11).
Олигонуклеотид, который связывается с геном C-met с ингибированием экспрессии C-met, может представлять собой один или несколько, выбранных из группы, состоящей из shRNA, miRNA, siRNA, антисмысловых олигонуклеотидов, рибозимов, ДНКзима, образующих триплекс олигонуклеотидов (TFO), пептидных нуклеиновых кислот (PNA) и направляющей РНК для CRISPR.
Олигонуклеотидная последовательность, ингибирующая экспрессию C-met, может включать в себя последовательность, идентичную или комплементарную части последовательности мРНК C-met SEQ ID NO: 10, предпочтительно включает в себя последовательность, идентичную или комплементарную последовательности из 4 или более последовательных нуклеотидов в последовательности SEQ ID NO: 10.
Согласно варианту осуществления настоящего изобретения подтвердили, что экспрессия C-met в опухолевых клетках может быть эффективно ингибирована с использованием shRNA, которая включает в себя последовательность, комплементарную мРНК C-met и способную ингибировать экспрессию C-met, в качестве олигонуклеотида.
В соответствии с настоящим изобретением «shRNA» (малую шпилечную РНК или короткую шпилечную РНК), которая представляет собой искусственную молекулу РНК, имеющую шпилечную структуру, используют для подавления экспрессии целевого гена посредством РНК-интерференции. shRNA главным образом транспортируется в клетки с помощью плазмидных, бактериальных или вирусных векторных систем. shRNA обладает преимуществом, заключающимся в относительно низкой скорости разложения и обновления.
Согласно варианту осуществления настоящего изобретения подтвердили, что экспрессия C-met эффективно ингибируется вирусной системой в соответствии с настоящим изобретением, которая использует shRNA, «Hshc-met (нацеленную на последовательность SEQ ID NO: 13)» или «shc-met (нацеленную на последовательность SEQ ID NO: 15)», кодируемую геном SEQ ID NO: 12 (человека) или SEQ ID NO: 14 (мыши), в качестве shRNA, для ингибирования экспрессии C-met.
Олигонуклеотид, который связывается с геном C-met с ингибированием экспрессии C-met, может представлять собой направляющую РНК для CRISPR. Когда система доставки генов в соответствии с настоящим изобретением экспрессирует систему CRISPR-CAS, то может быть дополнительно включена последовательность, экспрессирующая белок Cas.
В соответствии с настоящим изобретением термин «система CRISPR-CAS» относится к технологии распознавания конкретной нуклеотидной последовательности, присутствующей на целевой ДНК, и разрезания ДНК рестрикционным ферментом для коррекции гена. В соответствии с настоящим изобретением система CRISPR-CAS характеризуется тем, что, если последовательность, экспрессирующая направляющую РНК для целевого гена C-met, вставляется в аденовирусную систему, и экспрессированная направляющая РНК гибридизируется с целевым C-met, то целевой сайт расщепляется с использованием белка Cas для ингибирования экспрессии C-met.
Если не указано иное, способ построения системы CRISPR-CAS, тип белка рестрикционного фермента, который будет использоваться в системе CRISPR-CAS, и т.д. можно применять с использованием методик, обычно используемых в области техники настоящего изобретения.
Белок Cas, используемый в соответствии с настоящим изобретением, может представлять собой белок Cas9 или Cas 12. Белок Cas9 или Cas12 (также называемый Cas12a или Cpf1), используемый в соответствии с настоящим изобретением, можно применять без ограничений, если он является белком Cas, обычно используемым для реализации системы CRISPR/Cas в области техники настоящего изобретения. Кроме того, примеры конкретных типов белка Cas9 или Cas 12 показаны в приведенной ниже таблице 1, но не ограничиваются перечисленными. Ссылки, приведенные в таблице 1, целиком включены в описание настоящего изобретения.


Cpf1 представляет собой тип системы CRISPR/Cas и классифицируется как система CRISPR/Cas 2 класса 5 типа. Cpf1 работает как единичный эффекторный модуль субъединицы, подобный Cas9, но немного отличается от Cas9 с точки зрения функциональности, так что, в то время как для Cas9 требуется tracrRNA для разрезания гена, для Cpf1 не требуется tracrRNA. В случае Cas9 ген разрезается в области с прилегающим к протоспейсеру мотивом (РАМ), содержащим много гуанина, тогда как Cpf1 может эффективно разрезать область, содержащую много тимина. Кроме того, Cpf1 обладает способностью создавать выступающие части из 4-5 нуклеотидов при разрезании гена. Из-за этих различных признаков и структурных различий Cpf1 демонстрирует более высокую точность, хотя его эффективность функционирования немного ниже, чем у Cas9.
Промотор для экспрессии системы CRISPR-CAS в соответствии с настоящим изобретением может представлять собой любой промотор без ограничений, при условии, что он используется в системе CRISPR/Cas в технической области, к которой относится настоящее изобретение. Например, можно использовать промотор РНК-полимеразы III, который относится к классу III типа, или промотор U6. В этом случае, поскольку обычно используемый промотор U6 требует нуклеотидов гуанозина для инициации транскрипции, использование промотора U6 может дополнительно ограничить геномный сайт нацеливания до GN19NGG (Mali et al. (2013) Science 339: 823-826; Ding et al. (2013) Cell Stem Cell 12: 393-394). Промотор T7, Т3 или SP6 также можно использовать в векторной системе в соответствии с настоящим изобретением (Adhya et al. (1981) Proc. Natl. Acad. Sci. U.S.A. 78: 147-151; Melton et al. (1984) Nucleic Acids Res. 12: 7035-7056; Pleiss et al. (1998) RNA 4: 1313-1317).
Согласно варианту осуществления настоящего изобретения подтвердили, что экспрессия C-met может быть эффективно ингибирована с помощью системы CRISPR-CAS crRNA-LbCpf1 с использованием 55-77 нуклеотидов в мРНК C-met человека SEQ ID NO: 10 в качестве целевой последовательности (SEQ ID NO: 17) и с использованием аденовирусной системы, содержащей ген SEQ ID NO: 16, экспрессирующий направляющую РНК для CRISPR, которая может быть комплементарно гибридизирована с целевой последовательностью, и ген SEQ ID NO: 18, экспрессирующий Lbcpf1.
Согласно варианту осуществления настоящего изобретения систему CRISPR-CAS экспрессировали с использованием векторной системы рекомбинантного аденовируса, содержащей последовательность гена, экспрессирующую LbCpf1, как показано на фиг. 13.
В соответствии с настоящим изобретением термин «комплементарный» охватывает не только 100% комплементарность, но также неполную комплементарность, достаточную для подавления экспрессии гена C-met посредством механизма РНК-интерференции, и предпочтительно 90% комплементарность, более предпочтительно 98% комплементарность, наиболее предпочтительно 100% комплементарность. В настоящем описании выражение «100% комплементарность» означает «полностью комплементарный».
Согласно варианту осуществления настоящего изобретения последовательность shRNA, включенная в аденовирус в соответствии с настоящим изобретением, включает в себя последовательность, которая комплементарна некоторым из последовательностей SEQ ID NO: 10, предпочтительно последовательность, которая комплементарна последовательности от 1987-го нуклеотида до 2007-го нуклеотида из последовательности мРНК C-met SEQ ID NO: 10.
Согласно конкретному варианту осуществления настоящего изобретения shRNA, как олигонуклеотид, способный ингибировать экспрессию C-met, может быть кодирована геном SEQ ID NO: 12 или SEQ ID NO: 16 (в случае мыши - геном SEQ ID NO: 14).
Используемый в соответствии с настоящим изобретением термин «ген или последовательность гена» интерпретируется как включающий в себя последовательность гена, демонстрирующую существенную идентичность или существенное сходство с каждой последовательностью из номеров последовательностей, представленных в настоящем изобретении. Существенная идентичность при выравнивании последовательности в соответствии с настоящим изобретением и любой другой последовательности так, чтобы они соответствовали друг другу насколько это возможно, и при анализе выровненной последовательности с использованием алгоритма, обычно используемого в уровне техники, относится к последовательности, которая демонстрирует гомологию более чем 70%, предпочтительно 80% гомологию, более предпочтительно 90% гомологию и наиболее предпочтительно 95% гомологию. Существенное сходство, как правило, относится к случаю, когда изменения в последовательности генов IL-12, такие как делеция или вставка одного или нескольких оснований, не влияют на цель настоящего изобретения, заключающуюся в минимизации гомологичной рекомбинации с помощью рекомбинантной векторной системы. Соответственно, последовательность гена IL-12 в соответствии с настоящим изобретением не ограничивается приведенными в качестве примеров перечнями последовательностей, и ее следует рассматривать как включенную в объем настоящего изобретения при условии, что она существенно не влияет на активность желаемого конечного продукта в соответствии с настоящим изобретением.
Аденовирусная система в соответствии с настоящим изобретением может обеспечивать лечение рака с использованием геномного остова аденовируса. Аденовирус широко используют в качестве системы доставки генов благодаря среднему размеру его генома, простоте манипуляции, высокому титру, широкому диапазону целевых клеток и отличной инфекционности. Оба конца генома содержат от 100 до 200 п.н. инвертированного концевого рецептора (ITR), который является важным компонентом репликации и упаковки ДНК. Область Е1 генома (Е1А и Е1В) кодирует белки, которые регулируют транскрипцию и транскрипцию генов клетки-хозяина. Область Е2 (Е2А и Е2В) кодирует белок, участвующий в репликации вирусной ДНК. Поскольку известно, что в цис требуется лишь небольшая часть генома аденовируса (Tooza, J. Molecular biology of DNA Tumor viruses, 2nd ed. Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1981)), аденовирусы обладают способностью нести чужеродные молекулы ДНК.
В геноме аденовирусной системы в соответствии с настоящим изобретением области Е1 и Е3 могут быть удалены. В частности, аденовирусная система в соответствии с настоящим изобретением может включать в себя ген Е1А и инактивированный ген Е1В 19, инактивированный ген Е1В 55 или инактивированный ген Е1В 19 и ген Е1В 55.
Термин «инактивация», используемый в отношении гена в соответствии с настоящим описанием, означает, что транскрипция и/или трансляция гена не выполняется нормально, и функция нормального белка, кодируемого геном, не проявляется. Например, в случае инактивированного гена Е1В 19 активный белок Е1В 19 кДа не может быть продуцирован из-за мутации (замены, добавления, частичной или полной делеции) гена Е1В 19. Когда Е1В 19 удален, апоптоз клеток может усиливаться, а когда удален ген Е1В 55, проявляется специфичность опухолевых клеток (см. заявку на выдачу патента №2002-23760). В соответствии с настоящим описанием термин «делеция», используемый в отношении гена или последовательности, имеет значение, включающее в себя не только полную делецию соответствующей последовательности, но также ее частичную делецию.
Рекомбинантный аденовирус в соответствии с настоящим изобретением может иметь мутацию, в которой 45-ый остаток Glu в нуклеотидной последовательности, кодирующей сайт связывания Rb, расположенный в последовательности гена Е1А, заменен на Gly, и мутацию, в которой его последовательность 121-127-ой аминокислот полностью заменена на Gly.
Согласно варианту осуществления настоящего изобретения рекомбинантный аденовирус может включать в себя сайт Е1А, а сайт Е1В 19 кДа и сЕ3 (ΔЕ3) в нем могут быть удалены. Рекомбинантный аденовирус, содержащий ген Е1А, обладает свойством реплицируемости. Ген IL-12 и олигонуклеотид, ингибирующий экспрессию C-met, могут быть вставлены в удаленные сайты Е1 и Е3 аденовируса, соответственно.
Аденовирусная система в соответствии с настоящим изобретением может дополнительно включать в себя биосовместимый полимер для усиления способности внутриклеточной доставки аденовируса или его вирусной ДНК или для увеличения времени сохранения и т.д. путем доставки в клетки. В частности, биосовместимый полимер может быть включен в систему в соответствии с настоящим изобретением в форме объединения с аденовирусом или аденовирусной плазмидной ДНК.
Биосовместимый полимер может быть любым полимером, при условии, что он может быть использован в векторной системе для доставки генов в технической области настоящего изобретения.
Например, биосовместимый полимер в соответствии с настоящим изобретением может быть чувствительным к рН и биовосстанавливающим полимером, включающим в себя (а) часть, ускользающую от иммунной реакции, (b) заряжаемую часть и (с) биовосстанавливаемую часть, содержащую дисульфидную связь.
Часть (а), ускользающая от иммунной реакции, функционирует с обеспечением возможности для вируса, с которым связывается полимер, избегать иммунных ответов in vivo (включающих в себя реакции клеточного и системного иммунитета). Материал, который может быть использован в части, ускользающей от иммунной реакции, представляет собой, в частности, полимер, способный ускользать от иммунного ответа in vivo (включающего в себя реакции клеточного и системного иммунитета), более конкретно PEG (полиэтиленгликоль), полиалкиленоксид (например, полиоксиэтилен, полиоксипропилен или его сополимер (сополимер полиэтиленоксида, полипропиленоксида и полиэтиленоксида), полифениленоксид, сополимер PEG и полиалкиленоксида, поли(метоксиэтилметакрилат), поли(метакрилоилфосфатидилхолин), перфторированный полиэфир, декстран или поливинилролидон, более конкретно, PEG, полиалкиленоксид или сополимер PEG и полиалкиленоксида, еще более конкретно PEG.
Заряжаемая часть (b) может обеспечивать положительный заряд полимеру при значении рН in vivo, в частности, при значении рН, близком к нейтральному, чтобы связываться посредством взаимодействия с поверхностью или ДНК отрицательно заряженного вируса. В качестве альтернативы, заряжаемая часть (b) может обеспечивать отрицательный заряд полимеру, в отличие от указанного выше, в зависимости от поляризуемости вирусной поверхности или ДНК. Соответственно, заряжаемая часть (b) включает в себя материал, который сообщает полимеру положительный или отрицательный заряд. Например, если обеспечивается отрицательный заряд, то в заряжаемой части (b) может использоваться карбоксилатная группа, тогда как, если обеспечивается положительный заряд, то в заряжаемой части (b) может использоваться мономер, имеющий третичную аминогруппу или аминогруппу.
Биовосстановляемая часть (с), содержащая дисульфидную связь, может быть включена в настоящее изобретение без ограничения типом мономера при условии, что она включает в себя дисульфидную связь. Биовосстанавливаемая часть (с) восстанавливается в кислой среде in vivo, так что дисульфидная связь превращается в сульфгидрильную группу, таким образом, структура полимера разрывается, и, в конечном итоге, голый вирус или ДНК, связанные с комплексом полимер-вирус или комплексом полимер-ДНК, высвобождаются.
Согласно другому варианту осуществления биосовместимый полимер в соответствии с настоящим изобретением может включать в себя все из полимера, наноматериала, дендримера и гидрогеля. Биосовместимый полимер предпочтительно выбран из группы, состоящей из PEI-Arg-mPEG-S-S-mPEG-Arg-PEI (PAPS), mPEG-PEI-g-Arg-S-S-Arg-g-PEI-mPEG (PPSA), пегилированного и сшитого наночастицами оксида железа поли-L-лизина (PLL) с привитым катехолом (PICION), биоразлагаемого полимера с привитым аргинином (АВР), пегилированной и конъюгированной с РТХ полимерной мицеллы (АРР), mPEG-b-Pip-CBA (РРСВА), PPCBA-PEI-аргинина (РРА), дендромера поли(амидоамина) (РАМАМ), полиэтиленгликоля (PEG), полилактида (PLA), полигликолида (PGA), сополимера лактида с гликолидом (PLGA), поли-ε-капролактона (PCL), полиэтиленимина (PEI), гиалуроновой кислоты (НА), желатина, хитозана и сывороточного альбумина
Полимер PAPS представляет собой PEI-Arg-mPEG-S-S-mPEG-Arg-PEI и может характеризоваться структурой следующей структурной формулы 1:
Структурная формула 1

В структурной формуле 1, каждый х и у независимо может представлять собой целое число от 1 до 500.
Полимер PPSA представляет собой mPEG-PEI-g-Arg-S-S-Arg-g-PEI-mPEG и может характеризоваться структурой следующей структурной формулы 2:
Структурная формула 2

В структурной формуле 2, каждый пит независимо может представлять собой целое число от 1 до 500.
PICION представляет собой пегилированный и сшитый наночастицами оксида железа поли-L-лизин (PLL) с привитым катехолом и может характеризоваться структурой, в которой поли-L-лизин с привитым катехолом следующей структурная формулы 3 сшит частицами оксида железа, и mPEG модифицирован на своей поверхности:
Структурная формула 3

В структурной формуле 3, n может представлять собой целое число от 1 до 500.
Полимер АВР представляет собой биоразлагаемый полимер с привитым аргинином (биоредуцируемый полимер с привитым аргинином) и может характеризоваться структурой следующей структурной формулы 4:
Структурная формула 4

В структурной формуле 4, n может представлять собой целое число от 1 до 500.
АРР представляет собой пегилированные и конъюгированные с РТХ полимерные мицеллы (пегилированную и конъюгированную с РТХ полимерную мицеллу) и может характеризоваться структурой следующей структурной формулы 5:
Структурная формула 5

В структурной формуле 5 каждый n и m независимо может представлять собой целое число от 1 до 500.
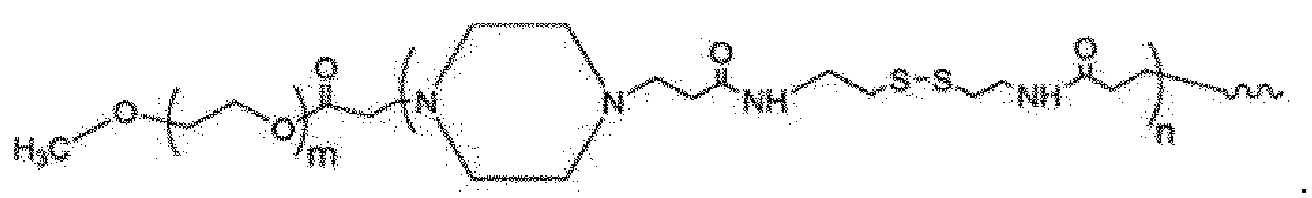
Полимер РРСВА представляет собой mPEG-b-Pip-CBA, принадлежит к чувствительному к рН и биоразлагаемому полимеру и может характеризоваться структурой следующей структурной формулы 6:
Структурная формула 6
В структурной формуле 6 каждый пит независимо может представлять собой целое число от 1 до 500.
РРА представляет собой PPCBA-PEI-аргинин, принадлежит к чувствительному к рН и биоразлагаемому полимеру и может представлять собой полимер, в котором PEI и аргинин далее связываются с РРСВА. РРА может характеризоваться структурой следующей структурной формулы 7:
Структурная формула 7

В структурной формуле 7 каждый a, b и с независимо может представлять собой целое число от 1 до 500. Например, может представлять собой от 100 до 200, b может представлять собой от 1 до 10, и с может представлять собой от 1 до 5, или а может представлять собой 113, b может представлять собой 6, и с может представлять собой 1, но настоящее изобретение не ограничивается перечисленными.
Полиэтиленимин (PEI) может включать в себя все линейные или разветвленные полиэтиленимины, с которыми связывается мономер структурной формулы 8:
Структурная формула 8

В структурной формуле 8 n может представлять собой целое число от 1 до 500.
Разветвленный полиэтилинамин может также включать в себя дендример, в котором цепи молекул равномерно распределены в трехмерном пространстве наружу от центра в соответствии с определенным правилом, в дополнение к обычным разветвленным полиэтилениминам.
Структурная формула 9

Структурная формула 9 является примером разветвленного полиэтиленимина. В данном случае n может представлять собой целое число от 1 до 500.
Биоразлагаемый полимер в соответствии с настоящим изобретением включает в себя дендримерный полимер, который является примером полимера структурной формулы 8, содержащего этиленамин в качестве мономера. Например, разветвленный полиэтиленимин дендримерного типа может представлять собой полимер структурной формулы 10 или 11, но настоящее описание не ограничивается перечисленными. Полимер структурной формулы 11 представляет собой полимер поли(амидоамин) и также может называться РАМАМ.
Структурная формула 10

Структурная формула 11
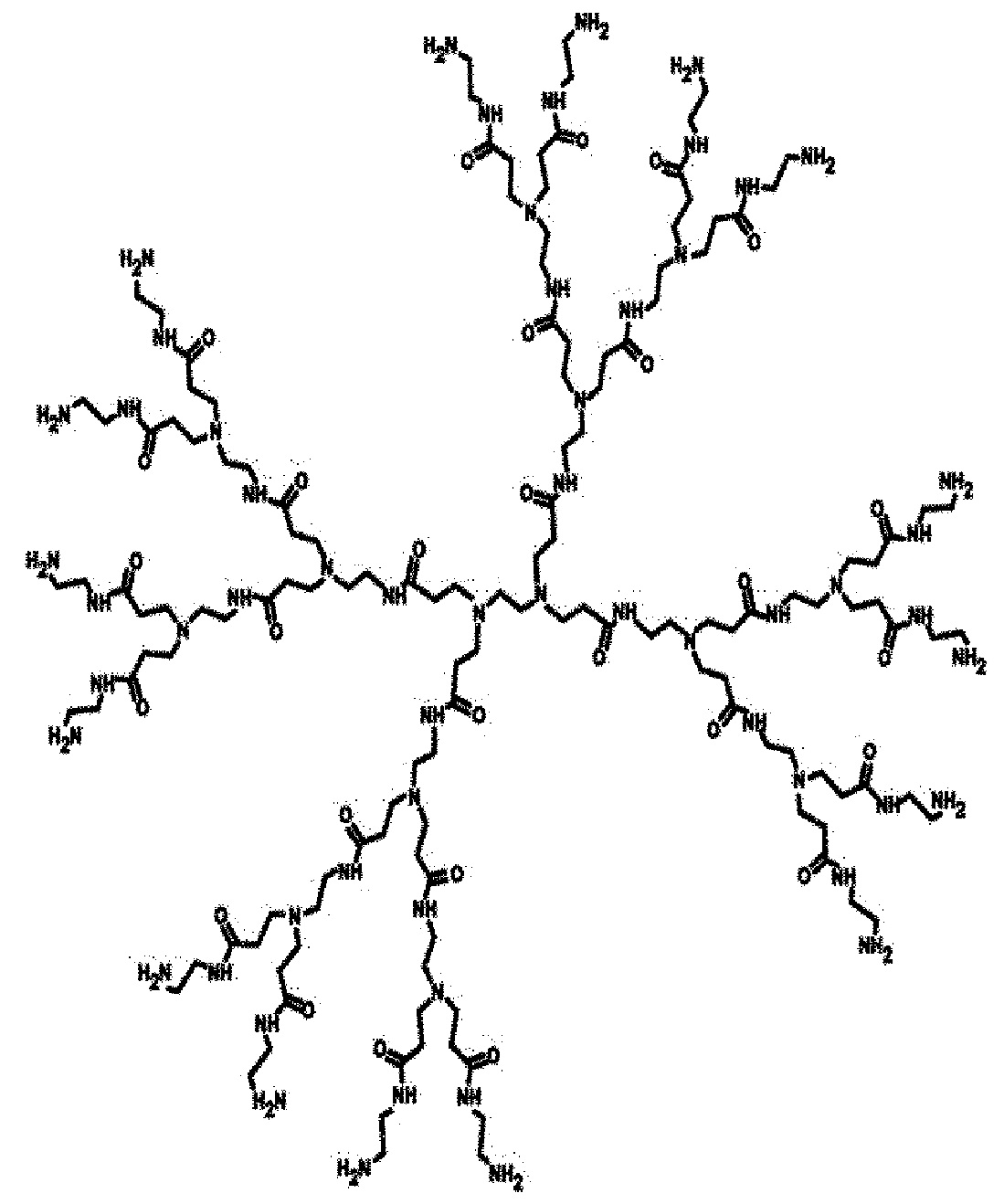
Биосовместимый полимер связывается с рекомбинантный аденовирусом или вирусной ДНК в соответствии с настоящим изобретением для повышения эффективности проникновения в клетки, повышает стабильность у индивидуума и повышает эффективность доставки вируса или вирусной ДНК к целевому участку за счет снижения иммуногенности, что тем самым значительно усиливает эффект лечения рака за счет аденовируса или вирусной ДНК в соответствии с настоящим изобретением.
Биосовместимый полимер и аденовирусная система могут быть связаны электростатическим взаимодействием, ионным взаимодействием или химической связью.
Согласно другому аспекту настоящего изобретения настоящее изобретение относится к фармацевтической композиции, которая включает в себя систему доставки генов, содержащую последовательность нуклеиновой кислоты, кодирующую интерлейкин-12 (IL-12), и последовательность нуклеиновой кислоты, экспрессирующую олигонуклеотид, который комплементарно связывается с геном C-met и ингибирует экспрессию C-met. Композиция может представлять собой противораковую композицию, противометастатическую композицию для раковых клеток или композицию для усиления противоопухолевого иммунитета.
Композиция может включать в себя аденовирусную систему в соответствии с настоящим изобретением в терапевтически эффективном количестве. Кроме того, композиция дополнительно может включать в себя фармацевтически приемлемый носитель.
Противораковая композиция служит для ингибирования выживания, пролиферации и/или миграции опухолевых клеток, для ингибирования пролиферации раковых клеток или для индуцирования или обеспечения гибели раковых клеток. Рекомбинантная аденовирусная система в соответствии с настоящим изобретением или содержащая ее композиция может эффективно индуцировать гибель раковых клеток и ингибировать их миграцию.
Противометастатическая композиция для раковых клеток обладает эффектом ингибирования миграции раковых клеток посредством перемещения. Например, может быть подтверждено, что противометастатическая композиция ингибирует ЕМТ в раковых клетках, тем самым подавляя их миграцию. Противометастатическая композиция в соответствии с настоящим изобретением может обладать как противораковым эффектом за счет уничтожения раковых клеток, так и эффектом ингибирования миграции раковых клеток.
Композиция для усиления противоопухолевого иммунитета способна лечить рак путем преодоления избегания опухолью иммунного надзора с использованием иммуносупрессивной молекулы, продуцируемой в опухолевой ткани, и может быть включена в противораковую композицию. В частности, композиция для усиления противоопухолевого иммунитета служит для нормализации дисбаланса иммунных клеток в опухолевых тканях и индукции дифференцировки хелперных Т-клеток с помощью IL-12, что тем самым активирует цитотоксичность цитотоксических Т-лимфоцитов и естественных клеток-киллеров, приводя к усилению противоопухолевого иммунитета.
Фармацевтическая композиция в соответствии с настоящим изобретением экспрессирует IL-12 для усиления противоопухолевого иммунитета у страдающего раком субъекта. Кроме того, экспрессия C-met ингибируется посредством shRNA против C-met, что тем самым дополнительно усиливает функцию IL-12. Согласно варианту осуществления настоящего изобретения подтвердили, что даже на мышиной модели, инъецированной раковыми клетками человеческого происхождения, заметные противораковые эффекты и эффекты в отношении миграции опухоли проявлялись, если вводили инъекцией аденовирус в соответствии с настоящим изобретением, совместно экспрессирующий IL-12 и shc-met.
Кроме того, композиция может представлять собой композицию для адъювантного лечения с целью усиления терапевтического эффекта стандартной терапии или композицию для адъювантного лечения с целью улучшения или усиления эффекта стандартных терапевтических средств, содержащую другие противораковые средства, ингибиторы иммунных контрольных точек, иммунотерапевтические средства и т.п.
В противораковой композиции в соответствии с настоящим изобретением используется рекомбинантный аденовирус, включенный в упомянутую выше композицию, для усиления противоопухолевого иммунитета. Соответственно, описания одного и того же содержания опущены, чтобы избежать чрезмерной сложности настоящего описания.
Согласно варианту осуществления настоящего изобретения рак может быть выбран из группы, состоящей из рака желудка, рака легкого, немелкоклеточного рака легкого, рака молочной железы, рака яичника, рака печени, рака бронхов, рака носоглотки, рака гортани, рака поджелудочной железы, рака мочевого пузыря, колоректального рака, рака толстой кишки, рака шейки матки, рака кости, немелкоклеточного рака кости, рака крови, рака кожи (меланомы и т.д.), рака головы или шеи, рака матки, рака прямой кишки, рака анального канала, рака толстой кишки, рака маточной трубы, рака эндометрия, рака влагалища, рака вульвы, болезни Ходжкина, рака пищевода, рака тонкой кишки, эндокринного рака, рака щитовидной железы, рака паращитовидной железы, рака надпочечника, саркомы мягких тканей, рака уретры, рака полового члена, рака предстательной железы, хронического или острого лейкоза, лимфоцитарной лимфомы, рака почки или мочеточника, почечно-клеточного карциномы, карциномы почечной лоханки, полиплоидной карциномы, рака слюнной железы, саркомы, псевдомиксомы, гепатобластомы, рака яичка, глиобластомы, рака расщелины губы, опухоли зародышевых клеток яичника, базальноклеточной карциномы, множественной миеломы, рака желчного пузыря, хориоидальной меланомы, рака фатерова соска, рака брюшины, рака надпочечника, рака языка, мелкоклеточного рака, лимфомы детского возраста, бластомы нерва, рака двенадцатиперстной кишки, рака мочеточника, астроцитомы, менингиомы, почечной карциномы, рака вульвы, рака тимуса, опухоли центральной нервной системы (CNS), первичной лимфомы центральной нервной системы, опухоли спинного мозга, глиомы ствола головного мозга или аденомы гипофиза, но настоящее изобретение не ограничивается перечисленными.
Все упомянутые выше композиции в соответствии с настоящим изобретением включают в себя фармацевтически приемлемый носитель. Фармацевтически приемлемый носитель, используемый в соответствии с настоящим изобретением, является носителем, обычно используемым в составе, и включает в себя лактозу, декстрозу, сахарозу, сорбит, маннит, крахмал, гуммиарабик, фосфат кальция, альгинат, желатин, силикат кальция, мелкокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп, метилцеллюлозу, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния, минеральное масло и т.д., но настоящее описание не ограничивается перечисленными. Фармацевтическая композиция в соответствии с настоящим изобретением может дополнительно включать в себя смазывающее средство, смачивающее средство, подсластитель, ароматизатор, эмульгирующее средство, суспендирующее средство, консервант и т.д. в дополнение к указанным выше компонентам. Подходящие фармацевтически приемлемые носители и составы подробно описаны в Remington's Pharmaceutical Sciences (19-е изд., 1995 г.).
Композиция в соответствии с настоящим изобретением может быть введена перорально или парентерально. Парентеральное введение может представлять собой внутриопухолевую инъекцию, внутривенную инъекцию, внутрикожную инъекцию, подкожную инъекцию, внутримышечную инъекцию, внутрибрюшинную инъекцию, интратекальную инъекцию, внутрисердечную инъекцию, внутригрудную инъекцию, внутриартериальную инъекцию, внутрикостную инъекцию, внутрисуставную инъекцию, трансдермальное введение и т.д., предпочтительно парентеральное введение.
Кроме того, композиция может быть предназначена для местного или системного введения.
Согласно варианту осуществления настоящего изобретения композицию для усиления противоопухолевого иммунитета в соответствии с настоящим изобретением предпочтительно вводят непосредственно внутритуморально, что тем самым обеспечивает эффект усиления противоопухолевого иммунитета.
Подходящая дозировка композиции в соответствии с настоящим изобретением может варьировать в зависимости от таких факторов, как способ составления, способ введения, возраст больного, вес, пол, патологическое состояние и рацион, время введения, путь введения, скорость выведения и чувствительность ответа. Суточная дозировка фармацевтической композиции в соответствии с настоящим изобретением составляет, например, от 0,2 до 1000 мг/кг. Однако фактическая дозировка активного ингредиента может быть определена с учетом различных связанных факторов, таких как количество целевых клеток ткани, подлежащих дифференцировке и пролиферации, путь введения, а также вес, возраст и пол больного. Соответственно, дозировка может быть обеспечена в любой форме без ограничения объема настоящего изобретения.
Согласно другому аспекту настоящего изобретения настоящее изобретение относится к применению системы доставки генов, которая включает в себя ген, кодирующий интерлейкин-12 (IL-12), и ген, экспрессирующий олигонуклеотид, который комплементарно связывается с геном C-met с ингибированием экспрессии C-met, в качестве противоракового средства. Система доставки генов в соответствии с настоящим изобретением совместно экспрессирует IL-12 и ингибирующую C-met РНК с ингибированием тем самым миграции опухоли и дополнительным улучшением противоопухолевого иммунного эффекта IL-12. Применение системы доставки генов в соответствии с настоящим изобретением в качестве противоракового средства осуществляют с соответствующими изменениями приведенного выше описания системы доставки генов или фармацевтической композиции, чтобы избежать дублирования описаний.
Согласно еще одному аспекту настоящего изобретения настоящее изобретение относится к способу лечения рака, при этом способ предусматривает введение субъекту системы доставки генов, которая включает в себя ген, кодирующий интерлейкин-12 (IL-12), и ген, экспрессирующий олигонуклеотид, который комплементарно связывается с геном С-met с ингибированием экспрессии C-met, или фармацевтической композиции, содержащей систему доставки генов.
Система доставки генов в соответствии с настоящим изобретением совместно экспрессирует IL-12 и ингибирующую C-met РНК, с ингибированием тем самым миграции опухоли и дополнительным улучшением противоопухолевого иммунного эффекта IL-12, что приводит к синергетическому эффекту при лечении рака. Способ лечения с системой доставки генов в соответствии с настоящим изобретением в качестве противоракового средства осуществляют с соответствующими изменениями приведенного выше описания системы доставки генов или фармацевтической композиции, чтобы избежать дублирования описаний.
Далее настоящее изобретение будет описано более подробно со ссылкой на следующие примеры. Специалистам в данной области техники будет очевидно, что примеры служат исключительно для конкретного объяснения настоящего изобретения и, следовательно, не предназначены для ограничения настоящего изобретения.
Примеры
Подготовка эксперимента и конструирование рекомбинантной векторной системы
Пример получения 1. Получение клеток и культивирование
В качестве среды для культивирования клеток использовали среду Игла, модифицированную Дульбекко (DMEM; Gibco BRL, Grand Island, NY), среду Roswell Park Memorial Institute (RPMI; Gibco BRL) или минимальную необходимую среду (MEM; Gibco BRL), которая содержала 10% эмбриональной бычьей сыворотки (FBS; Gibco BRL), L-глутамин (2 ммоль/л), пенициллин (100 МЕ/мл) и стрептомицин (50 мг/мл). HEK293 (экспрессирующую сайт аденовируса Е1 линию клеток эмбриональной почки человека), H1975 (линию клеток немелкоклеточного рака легкого человека) и HaK (линию клеток рака почки хомяка) приобретали в Американской коллекции типовых культур, Manassas (АТСС, VA). НаР-Т1 (линия клеток карциномы поджелудочной железы хомяка) была предоставлена доктором Масато Абей (Университет Цукуба, Ibaraki, Japan). Все клеточные линии культивировали во влажной среде при 37°С и 5% CO2 и подвергали тесту на наличие микоплазмы с использованием красителя Hoeschst, клеточной культуры и ПЦР. Е. coli (Escherichia coli) культивировали при 37°С в среде Лурия Бертани.
Пример изготовления 1. Конструирование онколитической аденовирусной системы, экспрессирующей IL-12 и/или shc-met
Пример изготовления 1-1. Конструирование пДНК, экспрессирующей IL-12 человеческого происхождения и shc-met
Для исследования противоопухолевых эффектов и противоопухолевого иммунного ответа с использованием Ad векторной системы конструировали две онколитических аденовирусных плазмидных ДНК (называемых Ad пДНК или oAd пДНК), рекомбинированных на основе mT-Rd19-RGD, чтобы экспрессировать противоопухолевый иммунный ген, человеческий интерлейкин-12 (hIL-12) и/или короткую шпилечную РНК (далее именуемую «shc-met»), комплементарно связывающуюся с C-met для ингибирования экспрессии C-met, играющего важную роль в росте и дифференцировке раковых клеток (фиг. 1): (mT-Rd19-RGD и mT-Rd19-RGD/hIL-12/shc-met).

Примеры изготовления 1-2. Конструирование комплекса полимер-вирусная ДНК, экспрессирующего IL-12 мышиного происхождения и shc-met
Кроме того, ген, экспрессирующий IL-12 р35 (SEQ ID NO: 7) и IL-12 р40 (SEQ ID NO: 8) мышиного происхождения, вставляли на основе HE5cT-Rd19-RGD. Кроме того, shRNA конструировали с использованием 4398-го - 4422-го нуклеотидов мышиного гена C-met SEQ ID NO: 11 в качестве целевых последовательностей (SEQ ID NO: 15). Конструировали плазмидную ДНК HE5cT-Rd19-RGD/scIL-12/shc-met, в которую вставляли нуклеотидную последовательность SEQ ID NO: 14, комплементарно связывающуюся с геном С-МЕТ и экспрессирующую shc-met, которая была способна ингибировать экспрессию гена С-МЕТ. Сконструированную плазмидную ДНК HE5cT-Rd19-RGD/scIL-12/shc-met смешивали с полимером PPCBA-PEI-аргинин (РРА) с конструированием тем самым комплекса пДНК/полимер РРА.
Пример изготовления 2. Конструирование рекомбинантного онколитического аденовируса, экспрессирующего IL-12 и/или shc-met
Для исследования противоопухолевых эффектов и противоопухолевого иммунного ответа, обусловленного противораковым аденовирусом, совместно экспрессирующим IL-12 и shc-met, конструировали противораковый аденовирус (фиг. 4, обозначенный как HscIL-12 и Hshc-met, если рекомбинантный аденовирус включал в себя последовательность человеческого происхождения):
HE5cT-Rd19-RGD: Ad векторная система, не содержащая ген экспрессии;
HE5cT-Rd19-RGD/scIL-12: Ad векторная система, экспрессирующая только IL-12;
HE5cT-Rd19-RGD/shc-met: Ad векторная система, экспрессирующий shRNA для гена C-Met;
HE5cT-Rd19-RGD/scIL-12/shc-met: Ad векторная система, экспрессирующая shRNA для IL-12 и ген C-Met.
Более конкретно, гены, соответственно экспрессирующие IL-12 р35 (SEQ ID NO: 1) и IL-12 р40 (SEQ ID NO: 2) человеческого происхождения вставляли, соответственно, в HE5cT-Rd19-RGD. Кроме того, shRNA последовательности SEQ ID NO: 12, которая нацеливалась на 1987-ой - 2007-ой нуклеотиды мРНК C-met человека SEQ ID NO: 10 в качестве целевой последовательности (SEQ ID NO: 13), вставляли в рекомбинантную аденовирусную векторную систему.
Кроме того, способом, аналогичным описанному выше, каждый ген, соответственно экспрессирующий IL-12 р35 (SEQ ID NO: 8) и IL-12 р40 (SEQ ID NO: 9) мышиного происхождения и экспрессирующую shc-met последовательность (SEQ ID NO: 14), нацеливающуюся на 4398-ой 4422-ой нуклеотиды гена С-МЕТ мышиного происхождения SEQ ID NO: 11 в качестве целевой последовательности (SEQ ID NO: 15) и комплементарно связывающуюся с нуклеотидами с ингибированием их экспрессии, вставляли для изготовления аденовирусной векторной системы, совместно экспрессирующей IL-12 и shc-met.
Пример изготовления 3. Создание животной модели
3-1. Модель ксенотрансплантата опухоли рака легкого человека
Голой мыши, приобретенной в компании Orient, возрастом 6-8 недель вводили подкожной инъекцией линию клеток рака легкого человека (Н1975) при 3×106 клеток/50 мкл. Затем при достижении размера опухоли среднего значения 100 мм3 ей вводили противораковый аденовирус примера получения 1 или 2 и подтверждали его эффект.
3-2. Мышиная модель опухоли
Для экспериментов мышей C57BL6 (модель опухоли B16-F10) приобретали в компании Daehan Biolink, а мышей BALB/C (модель опухоли СТ26) приобретали в компании Orient. Когда мышам было 6-8 недель, линию клеток рака кожи мыши (B16-F10) или линию клеток рака желудка мыши (СТ26) вводили подкожной инъекцией мыши при 5×105 клеток/50 мкл, а затем при достижении размера опухоли среднего значения 100 мм3вводили противораковый аденовирус примера изготовления 1 или 2 и подтверждали его эффекты.
Экспериментальный пример 1. Подтверждение экспрессии mIL-12 и hIL-12 в клетках с помощью Ad пДНК
Для исследования экспрессии гена IL-12 (hIL-12) человека с помощью Ad пДНК, сконструированной согласно примеру изготовления 1, осуществляли реагирование mT-Rd19-RGD и Ad пДНК mT-Rd19-RGD/hIL-12/shc-met с липофектамином при комнатной температуре, а затем осуществляли реагирование 293А с конфлюентностью 50%, которая представляет собой линия клеток эмбриональной почки человека с хорошей эффективностью внутриклеточной доставки, с продуктом реакции. Через 72 часа после обработки собирали среду культуры клеток для выполнения ELISA на предмет hIL-12.
Как показано на фиг. 2, подтвердили, что в случае примера (Ad пДНК mT-Rd19-RGD/hIL-12/shc-met; два Рас I) hIL-12 экспрессировался при 97,500±6,384 пг/мл. Следовательно, подтвердили, что Ad пДНК, сконструированная согласно примеру, эффективно индуцировала экспрессию терапевтического гена интерлейкина-12 в клетках.
Экспериментальный пример 2. Подтверждение совместной экспрессии межклеточного IL-12 и C-met с помощью аденовирусной (Ad) пДНК
Принимая во внимание эффективность внутриклеточной доставки аденовирусной пДНК, сконструированной согласно примеру изготовления 1, экспрессию hIL-12 с помощью Ad пДНК mT-Rd219-RGD/hIL-12/shc-met исследовали на линии клеток 293А. Однако ингибирование экспрессии C-met с помощью экспрессии специфической в отношении C-met shRNA не подтвердили на линии клеток 293А, поскольку C-met не надэкспрессировался в нормальных клетках 293А.
Следовательно, чтобы проверить способность ингибирования экспрессии C-met с помощью mT-Rd19-RGD/hIL-12/shc-met(два Pac I) примера, изготавливали аденовирус mT-Rd19-RGD/hIL-12/shc-met (Ad), линию клеток рака легкого человека А549 с конфлюентностью 50%, надэкспрессирующую C-met, в 6-луночном планшете обрабатывали с помощью 20 мкл изготовленного аденовируса mT-Rd19-RGD/hIL-12/shc-met (Ad). Через 48 часов после обработки собирали среду культуры клеток и выполняли ELISA на предмет hIL-12 и C-met. Уровни экспрессии hIL-12 и C-met в необработанной линии клеток А549 рака легкого человека использовали в качестве контролей.
Как показано на фиг. 3, подтвердили, что экспрессия (235,000±20,518 пг/мл) hIL-12 с помощью Ad mT-Rd19-RGD/hIL-12/shc-met усиливалась по сравнению с контролем, а экспрессия C-met в группе, обрабатываемой Ad mT-Rd19-RGD/hIL-12/shc-met, снижалась в 1,2 раза по сравнению с контролем. Следовательно, можно подтвердить, что экспрессия терапевтических генов IL-12 и shc-met эффективно индуцируется системой Ad, изготовленной в соответствии с настоящим изобретением.
Экспериментальный пример 3. Подтверждение in vivo противоопухолевых эффектов противоракового аденовируса, совместно экспрессирующего IL-12 и shc-met (мышиная модель сингенной опухоли)
Для проверки противоракового лечебного эффекта противоракового аденовируса, который совместно экспрессирует мышиный IL-12 и мышиный нацеливающийся на C-met shc-met и который сконструирован согласно примеру изготовления 2, создавали соответствующие модели опухоли с использованием линии клеток рака кожи мыши В16-F10 или линии клеток рака желудка мыши СТ26 и подтверждали противоопухолевые эффекты.
После подкожной инъекции линии мышам клеток рака кожи мыши B16-F10 или линии клеток рака желудка мыши СТ26 при 5×105 клеток/50 мкл мышам соответсвенно вводили инъекцией PBS или HE5cT-Rd19-RGD/scIL-12/shc-met при достижении размером опухоли среднего значения 100 мм3. После введения в опухоль три раза с интервалами два дня (1×1010 VP) измеряли размер опухоли для наблюдения противоопухолевого эффекта.
Как показано на фиг. 5а и 5b, с использованием двух типов мышиных моделей опухоли подтвердили, что опухоли быстро росли в обрабатываемой PBS группе, но у всех субъектов, которым вводили HE5cT-Rd19-RGD/scIL-12/shc-met, опухоли полностью исчезали.
Экспериментальный пример 4. Подтверждение in vivo противоопухолевых эффектов противоракового комплекса аденовирусная пДНК/РРА, совместно экспрессирующего IL-12 и shc-met (мышиная модель сингенной опухоли)
Конструировали комплекс (пДНК/РРА) ДНК вируса HE5cT-Rd19-RGD/scIL-12/shc-met и полимера РРА, конструируемый согласно примерам изготовления 1-2, для подтверждения противоракового эффекта лечения. Конкретнее создавали модели опухоли с использованием линии клеток рака кожи мыши B16-F10 и подтверждали их противоопухолевые эффекты. Линию клеток рака кожи мыши (B16-F10) вводили мышам подкожной инъекцией при 5×105 клеток/50 мкл, а затем, когда размер опухоли достигал среднего значения 100 мм3, мышиным моделям вводили инъекцией PBS и комплекс пДНК Ad HE5cT-Rd19-RGD/scIL-12/shc-met/PPA, соответственно. После введения в опухоль 7 раз в сутки измеряли размер опухоли для наблюдения противоопухолевого эффекта.
Как показано на фиг. 6, подтвердили, что размер опухоли уменьшался до 2514,7±202,1 мм3 в получавшей введение PBS группе, при этом значительные противоопухолевые эффекты наблюдали у всех субъектов в группе, получавшей введение противоракового вируса, комплекса пДНК/РРА. Средний размер опухоли в группе, получавшей введение комплекса пДНК Ad HE5cT-Rd19-RGD/scIL-12/shc-met/PPA, составлял 1387,6±171,8 мм3, что было на 44,8% ниже по сравнению с получавшей введение PBS группой. Этот результат указывает на то, что вирусная ДНК, совместно экспрессирующая IL-12 и shc-met, также индуцирует улучшенные противоопухолевые эффекты.
Экспериментальный пример 5. Подтверждение межклеточной экспрессии IL-12 и shc-met противораковым аденовирусом, совместно экспрессирующим IL-12 и shc-met (человека)
Для исследования экспрессии человеческого IL-12 или человеческого нацеливающегося на c-Met shc-Met противораковым аденовирусом, совместно экспрессирующим IL-12 и shc-met, в линию клеток рака легкого человека H1975 вводили каждый из рекомбинантных аденовирусов HE5cT-Rd19-RGD, HE5cT-Rd19-RGD/shc-met, HE5cT-Rd19-RGD/hscIL-12 и HE5cT-Rd19-RGD/hscIL-12/shc-met, сконструированных согласно примеру изготовления 2, при 2 ПУМ (фиг. 7b) или 5 ПУМ (фиг. 7а). Через 48 часов после обработки клетки и культуральную среду собирали для выполнения ELISA на предмет человеческого IL-12 и вестерн-блоттинга на предмет c-Met и подтверждали экспрессию каждого гена.
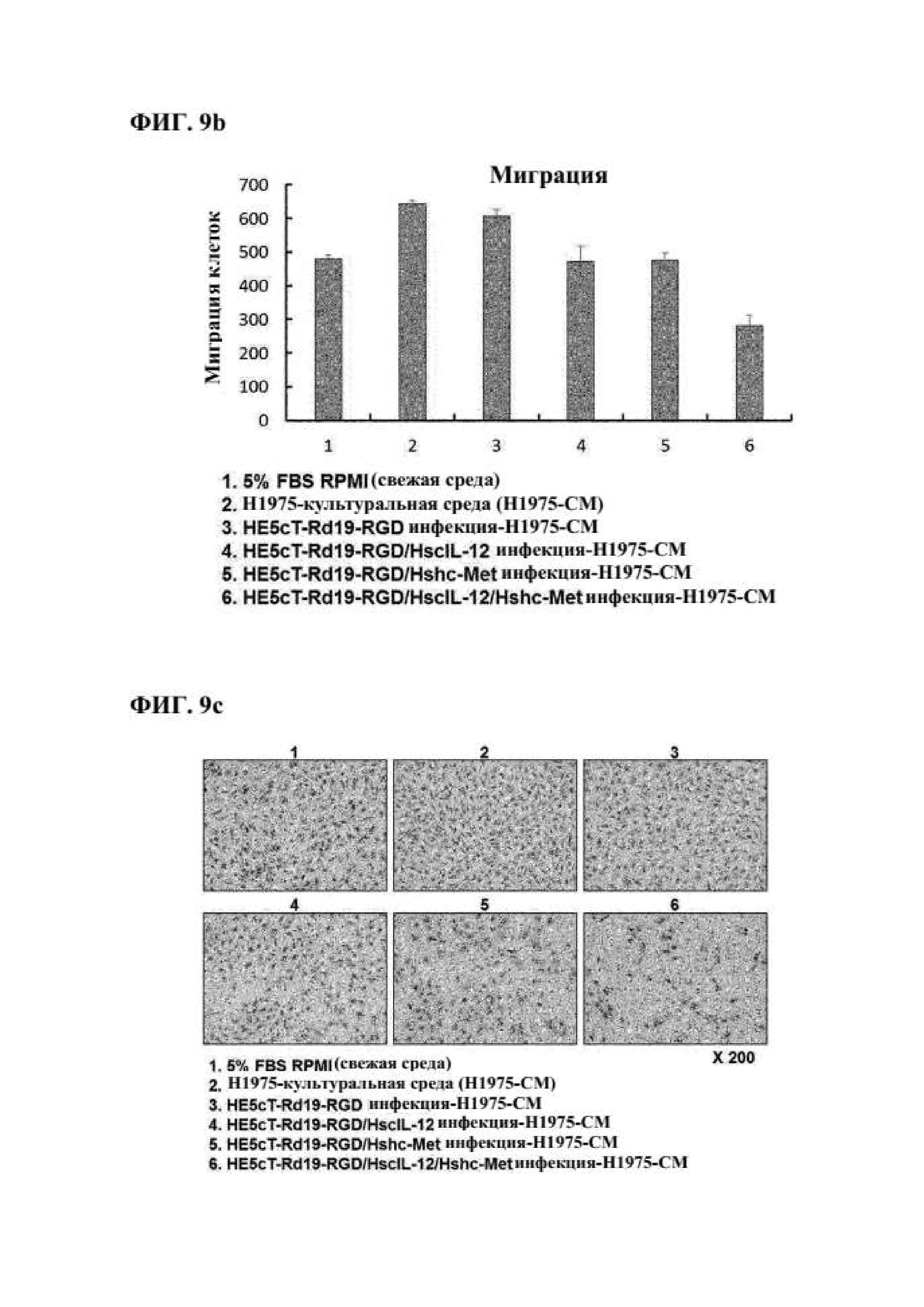
Как показано на фиг. 7а, подтвердили, что человеческий IL-12 экспрессировался как в HE5cT-Rd19-RGD/hscIL-12 (3066,3±165,7 пг/мг), так и в HE5cT-Rd19-RGD/hscIL-12/shc-met (94922,6±185,8 пг/мг) рекомбинантных векторных системах.
Кроме того, как показано на фиг. 7b, подтвердили, что, в клетках, обрабатываемых с помощью рекомбинантной векторной системы HE5cT-Rd19-RGD/shc-met или НЕ5сТ-Rd19-RGD/hscIL-12/shc-met, экспрессия C-met ингибировалась, по сравнению с контролем HE5cT-Rd19-RGD. Следовательно, подтвердили, что экспрессия терапевтических генов IL-12 и shc-met, вставленных в рекомбинантную противораковую аденовирусную векторную систему, изготовленную в соответствии с настоящим изобретением, эффективно индуцировалась.
Экспериментальный пример 6. Проверка способности противоракового аденовируса, совместно экспрессирующего IL-12 человеческого происхождения и shc-met, уничтожать раковые клетки
Для исследования способности противоракового аденовируса, совместно экспрессирующего IL-12 человеческого происхождения и shc-met, уничтожать раковые клетки линию клеток рака легкого человека Н1975 вводили инъекцией с противораковым аденовирусом HE5cT-Rd19-RGD; HE5cT-Rd19-RGD/hscIL-12; HE5cT-Rd19-RGD/shc-met; или HE5cT-Rd19-RGD/hscIL-12/shc-met, изготовленным согласно примеру изготовления 2, при 2, 5, 10, 20 или 50 ПУМ и наблюдали способность аденовируса уничтожать раковые клетки в условии нормального содержания кислорода (нормоксии) и в условии гипоксии (гипоксии).
Как показано на фиг. 8а и 8b, подтвердили, что способность HE5cT-Rd19-RGD, HE5cT-Rd19-RGD/hscIL-12, HE5cT-Rd19-RGD/shc-met или HE5cT-Rd19-RGD/hscIL-12/shc-met уничтожать раковые клетки усиливалась пропорционально вирусному титру как в условии нормального содержания кислорода, так и в условии гипоксии. Кроме того, при условии введении инъекцией 50 ПУМ способность уничтожать раковые клетки в группе, обрабатываемой одним терапевтическим геном, т.е. HE5cT-Rd19-RGD/hscIL-12 или HE5cT-Rd19-RGD/shc-met, повышалась по сравнению с HE5cT-Rd19-RGD, но в группе с совместной экспрессией, т.е. HE5cT-Rd19-RGD/hscIL-12/shc-met, индуцировалась заметно усиленная способность уничтожать раковые клетки по сравнению с обрабатываемой одним терапевтическим геном группой. Этот результат указывает на то, что совместная экспрессия IL-12 и shc-met демонстрирует синергетический эффект при химиотерапии.
Экспериментальный пример 7. Проверка способности противоракового аденовируса, совместно экспрессирующего IL-12 человеческого происхождения и shc-met, для ингибирования миграции и инвазии HTJVEC
Сообщали, что HGF, экспрессируемый в раковых клетках, усиливает миграцию и инвазию раковых клеток за счет активации системы передачи сигналов C-met в эндотелиальных клетках сосудов и в результате индуцирует аномальное образование кровеносных сосудов. Таким образом, следующий эксперимент проводили, чтобы подтвердить, может ли противораковый аденовирус, совместно экспрессирующий IL-12 и shc-met, уменьшать метастазирование и инвазивную способность HUVEC.
Линию клеток рака легкого человека Н1975 инъецировали с HE5cT-Rd19-RGD, HE5cT-Rd19-RGD/hscIL-12, HE5cT-Rd19-RGD/shc-met или HE5cT-Rd19-RGD/hscIL-12/shc-met, а затем собирали надосадочную жидкость для анализа миграции и инвазии. В качестве контролей использовали необработанную среду (свежую среду, 5% FBS RPMI) и среду раковых клеток (культуральную среду Н1975, Н1975-СМ), в которые не инъецировали противораковый вирус.
Как показано на фиг. 9а, 9b, 9 с и 9d, подтвердили, что миграционная и инвазивная способность HUVEC в Н1975-СМ (среде раковых клеток без инъецирования противоракового вируса) усиливалась по сравнению с группой, обрабатываемой необработанной средой (свежей средой). С другой стороны, подтвердили, что, в группе раковых клеток, которые обрабатывали средой с инъекцией HE5cT-Rd19-RGD/HscIL-12 или HE5cT-Rd19-RGD/Hshc-met, миграционная и инвазивная способность HUVEC снижалась по сравнению с группой с инъекцией HE5cT-Rd19-RGD, в частности, миграционная и инвазивная способность HUVEC заметно ингибировалась в среде раковых клеток с инъекцией HE5cT-Rd19-RGD/HscIL-12/Hshc-met. Этот результат указывает на то, что количество HGF, экспрессируемого в раковых клетках, эффективно ингибировалось противораковым аденовирусом, совместно экспрессирующим IL-12 и shc-met, что приводит к синергетическому эффекту в снижении миграционной и инвазивной способности HUVEC.
Экспериментальный пример 8. Подтверждение эффекта ингибирования эпителиальной-мезенхимальной мутации (эндо-МТ) противораковым аденовирусом, совместно экспрессирующим IL-12 человеческого происхождения и shc-met.
Чтобы проверить эффект нормализации кровеносных сосудов, индуцированный противоопухолевым аденовирусом, совместно экспрессирующим IL-12 и shc-met, в линию клеток рака легкого человека Н1975 инъецировали HE5cT-Rd19-RGD, HE5cT-Rd19-RGD/HscIL-12, HE5cT-Rd19-RGD/Hshc-met или HE5cT-Rd19-RGD/HscIL-12/Hshc-met, a затем собирали ее надосадочную жидкость. Клетки HUVEC культивировали в надосадочной жидкости, а затем с помощью вестерн-блоттинга исследовали изменения экспрессии эндотелиальных или мезенхимальных маркеров. В качестве контролей использовали необработанную среду (свежую среду, 5% FBS RPMI) и среду раковых клеток, не инфицированных противораковым вирусом.
Как показано на фиг. 10, подтвердили, что в случае групп, обработанных культуральной средой, собранной из раковых клеток, инфицированных HE5cT-Rd19-RGD/Hshc-met или HE5cT-Rd19-RGD/HscIL-12/Hshc-met, экспрессия мезенхимальных маркеров N-кадгерина и a-SMA была снижена по сравнению с контролем (группой, обработанной свежей средой). Среди них группа, обработанная аденовирусом, совместно экспрессирующим IL-12 и shc-met, показывала наиболее высокий эффект снижения экспрессии. Эти результаты показывают, что совместная экспрессия IL-12 и shc-met не только ингибирует миграционную и инвазивную способность клеток HUVEC, но также ингибирует переход эндо-МТ, тем самым демонстрируя превосходный эффект ренормализации кровеносных сосудов.
Экспериментальный пример 9. Подтверждение in vivo противоопухолевых эффектов противоракового аденовируса, совместно экспрессирующего IL-12 и shc-met, на ксенотрансплантатной модели опухоли человека.
Для проверки противоракового лечебного эффекта противоракового аденовируса в соответствии с настоящим изобретением, совместно экспрессирующего IL-12 и shc-met, на ксенотрансплантатной модели опухоли человека создавали модели опухоли с использованием линии клеток рака легкого человека H1975 и исследовали их противоопухолевые эффекты.
Для создания ксенотрансплантатных моделей опухоли человека, в частности, голым мышам вводили подкожной инъекцией линию клеток рака легкого человека (H1975) при 3×106 клеток/50 мкл, а затем, когда размер опухоли достигал среднего значения 100 мм3, соответсвенно вводили PBS, HE5cT-Rd19-RGD, HE5cT-Rd19-RGD/HscIL-12, HE5cT-Rd19-RGD/Hshc-met и HE5cT-Rd19-RGD/HscIL-12/Hshc-met. После введения (5×106 КОЕ) в опухоль два раза каждые двое суток измеряли размер опухоли.
Как показано на фиг. 11, подтвердили, что опухоли быстро пролиферировали в получавшей введение PBS группе, но значительные противоопухолевые эффекты наблюдали во всех группах, получавших введение противоракового аденовируса. В частности, может быть подтверждено, что по сравнению с получавшей введение PBS группой размер опухоли уменьшился на 81,7% с HE5cT-Rd19-RGD, на 85,5% с НЕ5 сТ-Rd19-RGD/HscIL-12, на 92,2% с HE5cT-Rd19. -RGD/Hshc-met и на 94,6% с HE5cT-Rd19-RGD/HscIL-12/Hshc-met. Эти результаты могут подтвердить, что при использовании противоракового аденовируса, совместно экспрессирующего IL-12 и shc-met, могут быть обеспечены синергетические эффекты по сравнению с группой, обрабатываемой одним геном.
Экспериментальный пример 10. Подтверждение снижения экспрессии IL-12 и экспрессии C-met в клетках с помощью противоракового аденовируса, совместно экспрессирующего IL-12 и Lbcpf1-crMET
Экспериментальный пример 10-1. Конструирование противоракового аденовируса, совместно экспрессирующего IL-12 и нацеливающуюся на C-met CRISPR РНК
Систему CRISPR РНК (систему LbCpf1-crRNA) конструировали с использованием генных ножниц 3,5 поколения (CRISPR/Cpf1), которые обеспечивают генную коррекцию и возникновение желаемой мутации в процессе разрезания целевой ДНК, а затем повторное соединение ее посредством внутриклеточной системы репарации, чтобы исследовать, проявляется ли такой же эффект, если система CRISPR используется в аденовирусной системе в соответствии с настоящим изобретением. Последовательность IL-12 локализовали в рекомбинантной векторной системе таким же образом, как в примере изготовления 2, но последовательность (SEQ ID NO: 6) (обозначенная как HIL-12 на фиг. 12), содержащая последовательность, кодирующую IRES, (SEQ ID NO: 20) была расположена между последовательностью, кодирующей р35 IL-12, (SEQ ID NO: 4) и последовательностью, кодирующей р40 IL-12, (SEQ ID NO: 5).
Нацеливающиеся на C-met последовательности направляющей РНК отбирали с использованием программы, а затем синтез олигомеров заказывали у компании Bionics. Клонирование осуществляли путем отжига. Ген, кодирующий белок Cpf1, (SEQ ID NO: 18) вставляли в сайт Е1 аденовируса RdB-RGD, а промотор U6 располагали в 3'-5' направлении сайта, экспрессирующего направляющую РНК (crC-met). Кроме того, последовательность, кодирующую IL-12, и последовательность, экспрессирующую нацеливающуюся на C-met направляющую РНК (SEQ ID NO: 16), вставляли в область Е3 аденовируса RdB-RGD, с конструированием тем самым рекомбинантного аденовируса, который совместно экспрессирует IL-12 и систему CRISPR-CAS. Направляющую РНК разрабатывали для нацеливания на 55-ый - 77-ой нуклеотиды последовательности C-met человека SEQ ID NO: 10 (фиг. 12).
Подтвердили, что при распознавании направляющей РНК (crcmet), экспрессируемой сконструированным рекомбинантный аденовирусом, целевого сайта в целевом гене и определении положения, подлежащего коррекции, генные ножницы Cpf1 могут разрезать целевой сайт и, таким образом, могут эффективно ингибировать C-met.
Экспериментальный пример 10-2. Исследование эффекта ингибирования C-met посредством противоракового аденовируса, совместно экспрессирующего IL-12 и нацеливающуюся на C-met CRISPR РНК
Для исследования экспрессии IL-12 человеческого происхождения или снижения экспрессии C-met с помощью системы Lbcpf1-crMET посредством противоракового аденовируса, совместно экспрессирующего IL-12 и Lbcpf1-crMET, линию клеток рака легкого человека H1975 инфицировали противораковым аденовирусом при 5 ПУМ или 100 ПУМ, а через 48 часов клетки и культуральные среды собирали и подвергали ELISA на предмет человеческого IL-12 или вестерн-блоттингу на предмет c-Met.
Как показано на фиг. 13а, 13b, и 13с, подтвердили экспрессию IL-12 9000,0±600,0 пг/мл и 17400,0±1200,0 пг/мл, соответственно, в группах, обрабатываемых RdB-RGD/Lbcpf1/HscIL-12 и RdB-RGD/Lbcpf1/HscIL-12-crMET, соответственно. Кроме того, подтвердили, что экспрессия C-met ингибировалась во всех группах, обрабатываемых противораковым вирусом. В частности, экспрессия C-met наиболее эффективно снижалась с помощью RdB-RGD/Lbcpf1/HscIL-12-crMET.
Экспериментальный пример 11. Подтверждение in vivo противоопухолевых эффектов противоракового аденовируса, совместно экспрессирующего IL-12 и Lbcpf1-crMET, на ксенотрансплантатных моделях опухоли человека
Проводили эксперименты, чтобы выяснить, может ли ингибирование экспрессии С-met с помощью CRISPR, а не shRNA, осуществляться вместе с экспрессией IL-12 на ксенотрансплантатных моделях опухоли человека.
Ингибирование экспрессии C-met с помощью CRISPR исследовали с использованием системы Lbcpf1-crMET, сконструированной согласно экспериментальному примеру 10-1.
Для проверки противоракового лечебного эффекта противоракового аденовируса, совместно экспрессирующего IL-12 и Lbcpf1-crMET, создавали модели опухоли с использованием линии клеток рака легкого человека Н1975 и исследовали в них противоопухолевые эффекты. Линию клеток рака легкого человека H1975 вводили подкожной инъекцией при 3×106 клеток/50 мкл голым мышам, а затем, когда размер опухоли достигал среднего значения 90 мм3, соответсвенно вводили PBS, RdB-RGD/Lbcpf1, RdB-RGD/Lbcpf1/HscIL-12 и RdB-RGD/Lbcpf1/HscIL-12-crMET. После введения (5×106VP) в опухоль три раза каждые двое суток измеряли размер опухоли для наблюдения противоопухолевых эффектов.
Как показано на фиг. 14, размер опухоли быстро снижался до 1486,5±221,1 мм3 на 25ые сутки в получавшей введение PBS группе, но существенный противоопухолевый эффект наблюдали во всех группах, обрабатываемых противораковым вирусом. В группах, обрабатываемых противораковым вирусом, среднее значение размера опухоли составляло 876,9±146,2 мм3 (RdB-RGD/Lbcpf1), 792,0±230,3 мм3 (RdB-RGD/Lbcpf1/scIL-12) и 535,6±172,6 мм3 (RdB-RGD/Lbcpf1/scIL-12-crMET), соответственно. То есть в группах, обрабатываемых противораковым вирусом, размер опухоли снижался на 41,0, 46,7 или 64% по сравнению с получавшей введение PBS группой. В частности, в случае использования способа CRISPR для совместной экспрессии с IL-12 размер опухоли заметно снижался. Таким образом, подтвердили, что синергетический эффект, обусловленный двумя терапевтическими генами, проявлялся также при использовании системы CRISPR.
--->
SEQUENCE LISTING
<110> Genemedicine Co.,Ltd.
<120> ANTI-CANCER COMPOSITION
<130> X19U10C0101
<150> 10-2018-0079752
<151> 2018-07-10
<160> 20
<170> PatentIn version 3.2
<210> 1
<211> 759
<212> DNA
<213> Homo sapiens
<400> 1
atgtggcccc ctgggtcagc ctcccagcca ccgccctcac ctgccgcggc cacaggtctg 60
catccagcgg ctcgccctgt gtccctgcag tgccggctca gcatgtgtcc agcgcgcagc 120
ctcctccttg tggctaccct ggtcctcctg gaccacctca gtttggccag aaacctcccc 180
gtggccactc cagacccagg aatgttccca tgccttcacc actcccaaaa cctgctgagg 240
gccgtcagca acatgctcca gaaggccaga caaactctag aattttaccc ttgcacttct 300
gaagagattg atcatgtaga tatcacaaaa gataaaacca gcacagtgga ggcctgttta 360
ccattggaat taaccaagaa tgagagttgc ctaaattcca gagagacctc tttcataact 420
aatgggagtt gcctggcctc cagaaagacc tcttttatga tggccctgtg ccttagtagt 480
atttatgaag acttgaagat gtaccaggtg gagttcaaga ccatgaatgc aaagcttctg 540
atggatccta agaggcagat ctttctagat caaaacatgc tggcagttat tgatgagctg 600
atgcaggccc tgaatttcaa cagtgagact gtgccacaaa aatcctccct tgaagaaccg 660
gatttttata aaactaaaat caagctctgc atacttcttc atgctttcag aattcgggca 720
gtgactattg atagagtgat gagctatctg aatgcttcc 759
<210> 2
<211> 921
<212> DNA
<213> Homo sapiens
<400> 2
atatgggaac tgaagaaaga tgtttatgtc gtagaattgg attggtatcc ggatgcccct 60
ggagaaatgg tggtcctcac ctgtgacacc cctgaagaag atggtatcac ctggaccttg 120
gaccagagca gtgaggtctt aggctctggc aaaaccctga ccatccgagt caaagagttt 180
ggagatgctg gccagtacac ctgtcacaaa ggaggcgagg ttctaagcca ttcgctcctg 240
ctgcttcaca aaaaggaaga tggaatttgg tccactgata ttttaaagga ccagaaagaa 300
cccaaaaata agacctttct aagatgcgag gccaagaatt attctggacg tttcacctgc 360
tggtggctga cgacaatcag tactgatttg acattcagtg tcaaaagcag cagaggctct 420
tctgaccccc aaggggtgac gtgcggagct gctacactct ctgcagagag agtcagaggg 480
gacaacaagg agtatgagta ctcagtggag tgccaggagg acagtgcctg cccagctgct 540
gaggagagtc tgcccattga ggtcatggtg gatgccgttc acaagctcaa gtatgaaaac 600
tacaccagca gcttcttcat cagggacatc atcaaacctg acccacccaa gaacttgcag 660
ctgaagccat taaagaattc tcggcaggtg gaggtcagct gggagtaccc tgacacctgg 720
agtactccac attcctactt ctccctgaca ttctgcgttc aggtccaggg caagagcaag 780
agagaaaaga aagatagagt cttcacggac aagacctcag ccacggtcat ctgccgcaaa 840
aatgccagca ttagcgtgcg ggcccaggac cgctactata gctcatcttg gagcgaatgg 900
gcatctgtgc cctgcagtta g 921
<210> 3
<211> 1725
<212> DNA
<213> Artificial
<220>
<223> Human IL-12 (p35-linker-p40)
<400> 3
atgtggcccc ctgggtcagc ctcccagcca ccgccctcac ctgccgcggc cacaggtctg 60
catccagcgg ctcgccctgt gtccctgcag tgccggctca gcatgtgtcc agcgcgcagc 120
ctcctccttg tggctaccct ggtcctcctg gaccacctca gtttggccag aaacctcccc 180
gtggccactc cagacccagg aatgttccca tgccttcacc actcccaaaa cctgctgagg 240
gccgtcagca acatgctcca gaaggccaga caaactctag aattttaccc ttgcacttct 300
gaagagattg atcatgtaga tatcacaaaa gataaaacca gcacagtgga ggcctgttta 360
ccattggaat taaccaagaa tgagagttgc ctaaattcca gagagacctc tttcataact 420
aatgggagtt gcctggcctc cagaaagacc tcttttatga tggccctgtg ccttagtagt 480
atttatgaag acttgaagat gtaccaggtg gagttcaaga ccatgaatgc aaagcttctg 540
atggatccta agaggcagat ctttctagat caaaacatgc tggcagttat tgatgagctg 600
atgcaggccc tgaatttcaa cagtgagact gtgccacaaa aatcctccct tgaagaaccg 660
gatttttata aaactaaaat caagctctgc atacttcttc atgctttcag aattcgggca 720
gtgactattg atagagtgat gagctatctg aatgcttccg gtggcggtgg ctcgggcggt 780
ggtgggtcgg gtggcggcgg atctatatgg gaactgaaga aagatgttta tgtcgtagaa 840
ttggattggt atccggatgc ccctggagaa atggtggtcc tcacctgtga cacccctgaa 900
gaagatggta tcacctggac cttggaccag agcagtgagg tcttaggctc tggcaaaacc 960
ctgaccatcc gagtcaaaga gtttggagat gctggccagt acacctgtca caaaggaggc 1020
gaggttctaa gccattcgct cctgctgctt cacaaaaagg aagatggaat ttggtccact 1080
gatattttaa aggaccagaa agaacccaaa aataagacct ttctaagatg cgaggccaag 1140
aattattctg gacgtttcac ctgctggtgg ctgacgacaa tcagtactga tttgacattc 1200
agtgtcaaaa gcagcagagg ctcttctgac ccccaagggg tgacgtgcgg agctgctaca 1260
ctctctgcag agagagtcag aggggacaac aaggagtatg agtactcagt ggagtgccag 1320
gaggacagtg cctgcccagc tgctgaggag agtctgccca ttgaggtcat ggtggatgcc 1380
gttcacaagc tcaagtatga aaactacacc agcagcttct tcatcaggga catcatcaaa 1440
cctgacccac ccaagaactt gcagctgaag ccattaaaga attctcggca ggtggaggtc 1500
agctgggagt accctgacac ctggagtact ccacattcct acttctccct gacattctgc 1560
gttcaggtcc agggcaagag caagagagaa aagaaagata gagtcttcac ggacaagacc 1620
tcagccacgg tcatctgccg caaaaatgcc agcattagcg tgcgggccca ggaccgctac 1680
tatagctcat cttggagcga atgggcatct gtgccctgca gttag 1725
<210> 4
<211> 762
<212> DNA
<213> Homo sapiens
<400> 4
atgtggcccc ctgggtcagc ctcccagcca ccgccctcac ctgccgcggc cacaggtctg 60
catccagcgg ctcgccctgt gtccctgcag tgccggctca gcatgtgtcc agcgcgcagc 120
ctcctccttg tggctaccct ggtcctcctg gaccacctca gtttggccag aaacctcccc 180
gtggccactc cagacccagg aatgttccca tgccttcacc actcccaaaa cctgctgagg 240
gccgtcagca acatgctcca gaaggccaga caaactctag aattttaccc ttgcacttct 300
gaagagattg atcatgaaga tatcacaaaa gataaaacca gcacagtgga ggcctgttta 360
ccattggaat taaccaagaa tgagagttgc ctaaattcca gagagacctc tttcataact 420
aatgggagtt gcctggcctc cagaaagacc tcttttatga tggccctgtg ccttagtagt 480
atttatgaag acttgaagat gtaccaggtg gagttcaaga ccatgaatgc aaagcttctg 540
atggatccta agaggcagat ctttctagat caaaacatgc tggcagttat tgatgagctg 600
atgcaggccc tgaatttcaa cagtgagact gtgccacaaa aatcctccct tgaagaaccg 660
gatttttata aaactaaaat caagctctgc atacttcttc atgctttcag aattcgggca 720
gtgactattg atagagtgat gagctatctg aatgcttcct aa 762
<210> 5
<211> 987
<212> DNA
<213> Homo sapiens
<400> 5
atgtgtcacc agcagttggt catctcttgg ttttccctgg tttttctggc atctcccctc 60
gtggccatat gggaactgaa gaaagatgtt tatgtcgtag aattggattg gtatccggat 120
gcccctggag aaatggtggt cctcacctgt gacacccctg aagaagatgg tatcacctgg 180
accttggacc agagcagtga ggtcttaggc tctggcaaaa ccctgaccat ccaagtcaaa 240
gagtttggag atgctggcca gtacacctgt cacaaaggag gcgaggttct aagccattcg 300
ctcctgctgc ttcacaaaaa ggaagatgga atttggtcca ctgatatttt aaaggaccag 360
aaagaaccca aaaataagac ctttctaaga tgcgaggcca agaattattc tggacgtttc 420
acctgctggt ggctgacgac aatcagtact gatttgacat tcagtgtcaa aagcagcaga 480
ggctcttctg acccccaagg ggtgacgtgc ggagctgcta cactctctgc agagagagtc 540
agaggggaca acaaggagta tgagtactca gtggagtgcc aggaggacag tgcctgccca 600
gctgctgagg agagtctgcc cattgaggtc atggtggatg ccgttcacaa gctcaagtat 660
gaaaactaca ccagcagctt cttcatcagg gacatcatca aacctgaccc acccaagaac 720
ttgcagctga agccattaaa gaattctcgg caggtggagg tcagctggga gtaccctgac 780
acctggagta ctccacattc ctacttctcc ctgacattct gcgttcaggt ccagggcaag 840
agcaagagag aaaagaaaga tagagtcttc acggacaaga cctcagccac ggtcatctgc 900
cgcaaaaatg ccagcattag cgtgcgggcc caggaccgct actatagctc atcttggagc 960
gaatgggcat ctgtgccctg cagttag 987
<210> 6
<211> 2331
<212> DNA
<213> Artificial
<220>
<223> Human IL-12 (p35-lRES-p40)
<400> 6
atgtggcccc ctgggtcagc ctcccagcca ccgccctcac ctgccgcggc cacaggtctg 60
catccagcgg ctcgccctgt gtccctgcag tgccggctca gcatgtgtcc agcgcgcagc 120
ctcctccttg tggctaccct ggtcctcctg gaccacctca gtttggccag aaacctcccc 180
gtggccactc cagacccagg aatgttccca tgccttcacc actcccaaaa cctgctgagg 240
gccgtcagca acatgctcca gaaggccaga caaactctag aattttaccc ttgcacttct 300
gaagagattg atcatgaaga tatcacaaaa gataaaacca gcacagtgga ggcctgttta 360
ccattggaat taaccaagaa tgagagttgc ctaaattcca gagagacctc tttcataact 420
aatgggagtt gcctggcctc cagaaagacc tcttttatga tggccctgtg ccttagtagt 480
atttatgaag acttgaagat gtaccaggtg gagttcaaga ccatgaatgc aaagcttctg 540
atggatccta agaggcagat ctttctagat caaaacatgc tggcagttat tgatgagctg 600
atgcaggccc tgaatttcaa cagtgagact gtgccacaaa aatcctccct tgaagaaccg 660
gatttttata aaactaaaat caagctctgc atacttcttc atgctttcag aattcgggca 720
gtgactattg atagagtgat gagctatctg aatgcttcct aagccccccc ccctaacgtt 780
actggccgaa gccgcttgga ataaggccgg tgtgcgtttg tctatatgtt attttccacc 840
atattgccgt cttttggcaa tgtgagggcc cggaaacctg gccctgtctt cttgacgagc 900
attcctagct aggggtcttt cccctctcgc caaaggaatg caaggtctgt tgaatgtcgt 960
gaaggaagca gttcctctgg aagcttcttg aagacaaaca acgtctgtag cgaccctttg 1020
caggcagcgg aaccccccac ctggcgacag gtgcctctgc ggccaaaagc cacgtgtata 1080
agatacacct gcaaaggcgg cacaacccca gtgccacgtt gtgagttgga tagttgtgga 1140
aagagtcaaa tggctctcct caagcgtatt caacaagggg ctgaaggatg cccagaaggt 1200
accccattgt atgggatctg atctggggcc tcggtgcaca tgctttacat gtgtttagtc 1260
gaggttaaaa aaacgtctag gccccccgaa ccacggggac gtggttttcc tttgaaaaac 1320
acgatgataa tatggccaca accaatgtgt caccagcagt tggtcatctc ttggttttcc 1380
ctggtttttc tggcatctcc cctcgtggcc atatgggaac tgaagaaaga tgtttatgtc 1440
gtagaattgg attggtatcc ggatgcccct ggagaaatgg tggtcctcac ctgtgacacc 1500
cctgaagaag atggtatcac ctggaccttg gaccagagca gtgaggtctt aggctctggc 1560
aaaaccctga ccatccaagt caaagagttt ggagatgctg gccagtacac ctgtcacaaa 1620
ggaggcgagg ttctaagcca ttcgctcctg ctgcttcaca aaaaggaaga tggaatttgg 1680
tccactgata ttttaaagga ccagaaagaa cccaaaaata agacctttct aagatgcgag 1740
gccaagaatt attctggacg tttcacctgc tggtggctga cgacaatcag tactgatttg 1800
acattcagtg tcaaaagcag cagaggctct tctgaccccc aaggggtgac gtgcggagct 1860
gctacactct ctgcagagag agtcagaggg gacaacaagg agtatgagta ctcagtggag 1920
tgccaggagg acagtgcctg cccagctgct gaggagagtc tgcccattga ggtcatggtg 1980
gatgccgttc acaagctcaa gtatgaaaac tacaccagca gcttcttcat cagggacatc 2040
atcaaacctg acccacccaa gaacttgcag ctgaagccat taaagaattc tcggcaggtg 2100
gaggtcagct gggagtaccc tgacacctgg agtactccac attcctactt ctccctgaca 2160
ttctgcgttc aggtccaggg caagagcaag agagaaaaga aagatagagt cttcacggac 2220
aagacctcag ccacggtcat ctgccgcaaa aatgccagca ttagcgtgcg ggcccaggac 2280
cgctactata gctcatcttg gagcgaatgg gcatctgtgc cctgcagtta g 2331
<210> 7
<211> 645
<212> DNA
<213> Mus musculus
<400> 7
atgtgtcaat cacgctacct cctctttttg gccacccttg ccctcctaaa ccacctcagt 60
ttggccaggg tcattccagt ctctggacct gccaggtgtc ttagccagtc ccgaaacctg 120
ctgaagacca cagatgacat ggtgaagacg gccagagaaa aactgaaaca ttattcctgc 180
actgctgaag acatcgatca tgaagacatc acacgggacc aaaccagcac attgaagacc 240
tgtttaccac tggaactaca caagaacgag agttgcctgg ctactagaga gacttcttcc 300
acaacaagag ggagctgcct gcccccacag aagacgtctt tgatgatgac cctgtgcctt 360
ggtagcatct atgaggactt gaagatgtac cagacagagt tccaggccat caacgcagca 420
cttcagaatc acaaccatca gcagatcatt ctagacaagg gcatgctggt ggccatcgat 480
gagctgatgc agtctctgaa tcataatggc gagactctgc gccagaaacc tcctgtggga 540
gaagcagacc cttacagagt gaaaatgaag ctctgcatcc tgcttcacgc cttcagcacc 600
cgcgtcgtga ccatcaacag ggtgatgggc tatctgagct ccgcc 645
<210> 8
<211> 1005
<212> DNA
<213> Mus musculus
<400> 8
tgtcctcaga agctaaccat ctcctggttt gccatcgttt tgctggtgtc tccactcatg 60
gccatgtggg agctggagaa agacgtttat gttgtagagg tggactggac tcccgatgcc 120
cctggagaaa cagtgaacct cacctgtgac acgcctgaag aagatgacat cacctggacc 180
tcagaccaga gacatggagt cataggctct ggaaagaccc tgaccatcac tgtcaaagag 240
tttctagatg ctggccagta cacctgccac aaaggaggcg agactctgag ccactcacat 300
ctgctgctcc acaagaagga aaatggaatt tggtccactg aaattttaaa aaatttcaaa 360
aacaagactt tcctgaagtg tgaagcacca aattactccg gacggttcac gtgctcatgg 420
ctggtgcaaa gaaacatgga cttgaagttc aacatcaaga gcagtagcag ttcccctgac 480
tctcgggcag tgacatgtgg aatggcgtct ctgtctgcag agaaggtcac actggaccaa 540
agggactatg agaagtattc agtgtcctgc caggaggatg tcacctgccc aactgccgag 600
gagaccctgc ccattgaact ggcgttggaa gcacggcagc agaataaata tgagaactac 660
agcaccagct tcttcatcag ggacatcatc aaaccagacc cgcccaagaa cttgcagatg 720
aagcctttga agaactcaca ggtggaggtc agctgggagt accctgactc ctggagcact 780
ccccattcct acttctccct caagttcttt gttcgaatcc agcgcaagaa agaaaagatg 840
aaggagacag aggaggggtg taaccagaaa ggtgcgttcc tcgtagagaa gacatctacc 900
gaagtccaat gcaaaggcgg gaatgtctgc gtgcaagctc aggatcgcta ttacaattcc 960
tcatgcagca agtgggcatg tgttccctgc agggtccgat cctag 1005
<210> 9
<211> 1695
<212> DNA
<213> Artificial
<220>
<223> Mouse IL-12 (p35-linker-p40)
<400> 9
atgtgtcaat cacgctacct cctctttttg gccacccttg ccctcctaaa ccacctcagt 60
ttggccaggg tcattccagt ctctggacct gccaggtgtc ttagccagtc ccgaaacctg 120
ctgaagacca cagatgacat ggtgaagacg gccagagaaa aactgaaaca ttattcctgc 180
actgctgaag acatcgatca tgaagacatc acacgggacc aaaccagcac attgaagacc 240
tgtttaccac tggaactaca caagaacgag agttgcctgg ctactagaga gacttcttcc 300
acaacaagag ggagctgcct gcccccacag aagacgtctt tgatgatgac cctgtgcctt 360
ggtagcatct atgaggactt gaagatgtac cagacagagt tccaggccat caacgcagca 420
cttcagaatc acaaccatca gcagatcatt ctagacaagg gcatgctggt ggccatcgat 480
gagctgatgc agtctctgaa tcataatggc gagactctgc gccagaaacc tcctgtggga 540
gaagcagacc cttacagagt gaaaatgaag ctctgcatcc tgcttcacgc cttcagcacc 600
cgcgtcgtga ccatcaacag ggtgatgggc tatctgagct ccgccggtgg cggtggctcg 660
ggcggtggtg ggtcgggtgg cggcggatct tgtcctcaga agctaaccat ctcctggttt 720
gccatcgttt tgctggtgtc tccactcatg gccatgtggg agctggagaa agacgtttat 780
gttgtagagg tggactggac tcccgatgcc cctggagaaa cagtgaacct cacctgtgac 840
acgcctgaag aagatgacat cacctggacc tcagaccaga gacatggagt cataggctct 900
ggaaagaccc tgaccatcac tgtcaaagag tttctagatg ctggccagta cacctgccac 960
aaaggaggcg agactctgag ccactcacat ctgctgctcc acaagaagga aaatggaatt 1020
tggtccactg aaattttaaa aaatttcaaa aacaagactt tcctgaagtg tgaagcacca 1080
aattactccg gacggttcac gtgctcatgg ctggtgcaaa gaaacatgga cttgaagttc 1140
aacatcaaga gcagtagcag ttcccctgac tctcgggcag tgacatgtgg aatggcgtct 1200
ctgtctgcag agaaggtcac actggaccaa agggactatg agaagtattc agtgtcctgc 1260
caggaggatg tcacctgccc aactgccgag gagaccctgc ccattgaact ggcgttggaa 1320
gcacggcagc agaataaata tgagaactac agcaccagct tcttcatcag ggacatcatc 1380
aaaccagacc cgcccaagaa cttgcagatg aagcctttga agaactcaca ggtggaggtc 1440
agctgggagt accctgactc ctggagcact ccccattcct acttctccct caagttcttt 1500
gttcgaatcc agcgcaagaa agaaaagatg aaggagacag aggaggggtg taaccagaaa 1560
ggtgcgttcc tcgtagagaa gacatctacc gaagtccaat gcaaaggcgg gaatgtctgc 1620
gtgcaagctc aggatcgcta ttacaattcc tcatgcagca agtgggcatg tgttccctgc 1680
agggtccgat cctag 1695
<210> 10
<211> 4227
<212> DNA
<213> Homo sapiens
<400> 10
atgaaggccc ccgctgtgct tgcacctggc atcctcgtgc tcctgtttac cttggtgcag 60
aggagcaatg gggagtgtaa agaggcacta gcaaagtccg agatgaatgt gaatatgaag 120
tatcagcttc ccaacttcac cgcggaaaca cccatccaga atgtcattct acatgagcat 180
cacattttcc ttggtgccac taactacatt tatgttttaa atgaggaaga ccttcagaag 240
gttgctgagt acaagactgg gcctgtgctg gaacacccag attgtttccc atgtcaggac 300
tgcagcagca aagccaattt atcaggaggt gtttggaaag ataacatcaa catggctcta 360
gttgtcgaca cctactatga tgatcaactc attagctgtg gcagcgtcaa cagagggacc 420
tgccagcgac atgtctttcc ccacaatcat actgctgaca tacagtcgga ggttcactgc 480
atattctccc cacagataga agagcccagc cagtgtcctg actgtgtggt gagcgccctg 540
ggagccaaag tcctttcatc tgtaaaggac cggttcatca acttctttgt aggcaatacc 600
ataaattctt cttatttccc agatcatcca ttgcattcga tatcagtgag aaggctaaag 660
gaaacgaaag atggttttat gtttttgacg gaccagtcct acattgatgt tttacctgag 720
ttcagagatt cttaccccat taagtatgtc catgcctttg aaagcaacaa ttttatttac 780
ttcttgacgg tccaaaggga aactctagat gctcagactt ttcacacaag aataatcagg 840
ttctgttcca taaactctgg attgcattcc tacatggaaa tgcctctgga gtgtattctc 900
acagaaaaga gaaaaaagag atccacaaag aaggaagtgt ttaatatact tcaggctgcg 960
tatgtcagca agcctggggc ccagcttgct agacaaatag gagccagcct gaatgatgac 1020
attcttttcg gggtgttcgc acaaagcaag ccagattctg ccgaaccaat ggatcgatct 1080
gccatgtgtg cattccctat caaatatgtc aacgacttct tcaacaagat cgtcaacaaa 1140
aacaatgtga gatgtctcca gcatttttac ggacccaatc atgagcactg ctttaatagg 1200
acacttctga gaaattcatc aggctgtgaa gcgcgccgtg atgaatatcg aacagagttt 1260
accacagctt tgcagcgcgt tgacttattc atgggtcaat tcagcgaagt cctcttaaca 1320
tctatatcca ccttcattaa aggagacctc accatagcta atcttgggac atcagagggt 1380
cgcttcatgc aggttgtggt ttctcgatca ggaccatcaa cccctcatgt gaattttctc 1440
ctggactccc atccagtgtc tccagaagtg attgtggagc atacattaaa ccaaaatggc 1500
tacacactgg ttatcactgg gaagaagatc acgaagatcc cattgaatgg cttgggctgc 1560
agacatttcc agtcctgcag tcaatgcctc tctgccccac cctttgttca gtgtggctgg 1620
tgccacgaca aatgtgtgcg atcggaggaa tgcctgagcg ggacatggac tcaacagatc 1680
tgtctgcctg caatctacaa ggttttccca aatagtgcac cccttgaagg agggacaagg 1740
ctgaccatat gtggctggga ctttggattt cggaggaata ataaatttga tttaaagaaa 1800
actagagttc tccttggaaa tgagagctgc accttgactt taagtgagag cacgatgaat 1860
acattgaaat gcacagttgg tcctgccatg aataagcatt tcaatatgtc cataattatt 1920
tcaaatggcc acgggacaac acaatacagt acattctcct atgtggatcc tgtaataaca 1980
agtatttcgc cgaaatacgg tcctatggct ggtggcactt tacttacttt aactggaaat 2040
tacctaaaca gtgggaattc tagacacatt tcaattggtg gaaaaacatg tactttaaaa 2100
agtgtgtcaa acagtattct tgaatgttat accccagccc aaaccatttc aactgagttt 2160
gctgttaaat tgaaaattga cttagccaac cgagagacaa gcatcttcag ttaccgtgaa 2220
gatcccattg tctatgaaat tcatccaacc aaatctttta ttagtacttg gtggaaagaa 2280
cctctcaaca ttgtcagttt tctattttgc tttgccagtg gtgggagcac aataacaggt 2340
gttgggaaaa acctgaattc agttagtgtc ccgagaatgg tcataaatgt gcatgaagca 2400
ggaaggaact ttacagtggc atgtcaacat cgctctaatt cagagataat ctgttgtacc 2460
actccttccc tgcaacagct gaatctgcaa ctccccctga aaaccaaagc ctttttcatg 2520
ttagatggga tcctttccaa atactttgat ctcatttatg tacataatcc tgtgtttaag 2580
ccttttgaaa agccagtgat gatctcaatg ggcaatgaaa atgtactgga aattaaggga 2640
aatgatattg accctgaagc agttaaaggt gaagtgttaa aagttggaaa taagagctgt 2700
gagaatatac acttacattc tgaagccgtt ttatgcacgg tccccaatga cctgctgaaa 2760
ttgaacagcg agctaaatat agagtggaag caagcaattt cttcaaccgt ccttggaaaa 2820
gtaatagttc aaccagatca gaatttcaca ggattgattg ctggtgttgt ctcaatatca 2880
acagcactgt tattactact tgggtttttc ctgtggctga aaaagagaaa gcaaattaaa 2940
gatctgggca gtgaattagt tcgctacgat gcaagagtac acactcctca tttggatagg 3000
cttgtaagtg cccgaagtgt aagcccaact acagaaatgg tttcaaatga atctgtagac 3060
taccgagcta cttttccaga agatcagttt cctaattcat ctcagaacgg ttcatgccga 3120
caagtgcagt atcctctgac agacatgtcc cccatcctaa ctagtgggga ctctgatata 3180
tccagtccat tactgcaaaa tactgtccac attgacctca gtgctctaaa tccagagctg 3240
gtccaggcag tgcagcatgt agtgattggg cccagtagcc tgattgtgca tttcaatgaa 3300
gtcataggaa gagggcattt tggttgtgta tatcatggga ctttgttgga caatgatggc 3360
aagaaaattc actgtgctgt gaaatccttg aacagaatca ctgacatagg agaagtttcc 3420
caatttctga ccgagggaat catcatgaaa gattttagtc atcccaatgt cctctcgctc 3480
ctgggaatct gcctgcgaag tgaagggtct ccgctggtgg tcctaccata catgaaacat 3540
ggagatcttc gaaatttcat tcgaaatgag actcataatc caactgtaaa agatcttatt 3600
ggctttggtc ttcaagtagc caaagcgatg aaatatcttg caagcaaaaa gtttgtccac 3660
agagacttgg ctgcaagaaa ctgtatgctg gatgaaaaat tcacagtcaa ggttgctgat 3720
tttggtcttg ccagagacat gtatgataaa gaatactata gtgtacacaa caaaacaggt 3780
gcaaagctgc cagtgaagtg gatggctttg gaaagtctgc aaactcaaaa gtttaccacc 3840
aagtcagatg tgtggtcctt tggcgtcgtc ctctgggagc tgatgacaag aggagcccca 3900
ccttatcctg acgtaaacac ctttgatata actgtttact tgttgcaagg gagaagactc 3960
ctacaacccg aatactgccc agacccctta tatgaagtaa tgctaaaatg ctggcaccct 4020
aaagccgaaa tgcgcccatc cttttctgaa ctggtgtccc ggatatcagc gatcttctct 4080
actttcattg gggagcacta tgtccatgtg aacgctactt atgtgaacgt aaaatgtgtc 4140
gctccgtatc cttctctgtt gtcatcagaa gataacgctg atgatgaggt ggacacacga 4200
ccagcctcct tctgggagac atcatag 4227
<210> 11
<211> 6652
<212> DNA
<213> Mus musculus
<400> 11
gctcggcggg gttcggcccg ggccgcaggt gacccggacg gcctcgccgc ccgcagcgtc 60
cgagcccggg tgaccctgtg cggagccaga tgctgggcga ccgctgactc gctggagaag 120
ggcggagcgc gcgggtggtc cccagccggc tgacttcggc gccgcgcgct ccgggcaccc 180
caaggtacaa actccagccg cgtcgatcag gcacccagcc tctcccagcc cctctgcttt 240
ctttgttcca ctaagggaac tggctactgc tctggaggac aagaccaccg aggatggctg 300
tggagagaaa gctgacggtg tagcagaacg cttggcatgt gatcaactcc tcacaatgaa 360
ggctcccacc gtgctggcac ctggcattct ggtgctgctg ttgtccttgg tgcagaggag 420
ccatggggag tgcaaggagg ccctagtgaa gtctgagatg aacgtgaaca tgaagtatca 480
gctccccaac ttcacggcag aaacccccat ccagaatgtc gtcctacacg gccatcatat 540
ttatctcgga gccacaaact acatttatgt tttaaatgac aaagaccttc agaaggtatc 600
cgaattcaag accgggcccg tgttggaaca cccagattgt ttaccttgtc gggactgcag 660
cagcaaagcc aattcatcag gaggggtttg gaaagacaac atcaacatgg ctctgcttgt 720
tgacacatac tatgatgatc aactcattag ctgtggcagt gtcaacagag ggacttgcca 780
gcggcatgtc cttcctcctg acaattctgc tgacatccag tctgaggtcc actgcatgtt 840
ctccccagaa gaggagtcag ggcagtgtcc tgactgtgta gtgagtgccc tcggagccaa 900
agtcctcctg tcggaaaagg accggttcat caatttcttt gtggggaata cgatcaattc 960
ctcctatcct cctggttatt cactgcattc gatatcggtg agacggctga aggaaaccca 1020
agatggtttt aagtttttga cagaccagtc ctatattgat gtcttaccag aattccaaga 1080
ttcctacccc ataaagtaca tacatgcctt cgaaagcaac cattttattt actttctgac 1140
tgtccaaaag gaaactctag atgctcagac ttttcataca agaataatca ggttctgttc 1200
cgtagactct gggttgcact cctacatgga aatgcccctg gaatgcatcc tgacagaaaa 1260
aagaaggaag agatccacaa gggaagaagt gtttaatatc ctccaagccg cgtatgtcag 1320
taaaccaggg gccaatcttg ctaagcaaat aggagctagc ccttctgatg acattctctt 1380
cggggtgttt gcacaaagca agccagattc tgctgaacct gtgaatcgat cagcagtctg 1440
tgcattcccc atcaaatatg tcaatgactt cttcaacaag attgtcaaca aaaacaacgt 1500
gagatgtctc cagcattttt acggacccaa ccatgagcac tgtttcaata ggaccctgct 1560
gagaaactct tccggctgtg aagcgcgcag tgacgagtat cggacagagt ttaccacggc 1620
tttgcagcgc gtcgacttat tcatgggccg gcttaaccaa gtgctcctga catccatctc 1680
caccttcatc aaaggtgacc tcaccattgc taatctaggg acgtcagaag gtcgcttcat 1740
gcaggtggtg ctctctcgaa cagcacacct cactcctcat gtgaacttcc tcctggactc 1800
ccatcctgta tctccagaag ttattgttga gcatccatca aatcaaaatg gctatacatt 1860
ggttgtcaca ggaaagaaga tcaccaagat tccattgaat ggcctgggct gtggacattt 1920
ccaatcctgc agtcagtgcc tctctgcccc ttactttata cagtgtggct ggtgccacaa 1980
tcaatgtgtg cgttttgatg aatgccccag cggtacatgg actcaagaga tctgtctgcc 2040
ggcggtttat aaggtgttcc ccaccagcgc gccccttgaa ggaggaacag tgttgaccat 2100
atgtggctgg gactttggat tcaggaagaa taataaattt gatttaagga aaaccaaagt 2160
tctgcttggc aacgagagct gtaccttgac cttaagcgag agcacgacaa atacgttgaa 2220
atgcacagtt ggtcccgcga tgagtgagca cttcaatgtg tctgtaatta tctcaaacag 2280
tcgagagacg acgcaataca gtgcattctc ctatgtagat cctgtaataa caagcatttc 2340
tccgaggtac ggccctcagg ctggaggcac cttactcact cttactggga aatacctcaa 2400
cagtggcaat tctagacaca tttcaattgg agggaaaaca tgtactttaa aaagtgtatc 2460
agatagtatt cttgaatgct acaccccagc ccaaactacc tctgatgagt ttcctgtgaa 2520
attgaagatt gacttggcta accgagagac cagcagcttc agttaccggg aagaccccgt 2580
tgtctatgaa atccacccga ccaaatcttt tattagtggt ggaagcacaa taacgggtat 2640
tgggaagacc ctgaactcgg ttagcctccc aaagctggta atagatgtgc atgaagtggg 2700
tgtgaactac acagtggcat gtcagcatcg ctcaaattca gagatcatct gctgcactac 2760
tccttcactg aaacagctgg gcctgcaact ccccctgaag accaaagcct tcttcctgtt 2820
agacgggatt ctttccaaac actttgatct cacttatgtg cataatcctg tgtttgagcc 2880
ttttgaaaag ccagtaatga tctcaatagg caatgaaaat gtagtggaaa ttaagggaaa 2940
caatattgac cctgaagcag ttaaaggtga agtgttaaaa gttggaaatc agagctgcga 3000
gagtctccac tggcactctg gagctgtgtt gtgtacagtc cccagtgacc tgctcaaact 3060
gaacagcgag ctaaatatag agtggaagca agcagtctct tcaactgttc ttggaaaagt 3120
gatcgttcaa ccggatcaga attttgcagg attgatcatt ggtgcggtct caatatcagt 3180
agtagttttg ttattatccg ggctcttcct gtggatgaga aagagaaagc ataaagatct 3240
gggcagtgaa ttagttcgct atgacgcaag agtacacact cctcatttgg ataggcttgt 3300
aagtgcccga agtgtaagtc caactacaga gatggtttca aatgagtctg tagactacag 3360
agctactttt ccagaagacc agtttcccaa ctcctctcag aatggagcat gcagacaagt 3420
gcaataccct ctgacagacc tgtcccctat cctgacaagt ggagactctg atatatccag 3480
cccattacta caaaatactg ttcacattga cctcagtgct ctaaatccag agctggtcca 3540
agcagttcag cacgtagtga ttggacccag cagcctgatt gtgcatttca atgaagtcat 3600
aggaagaggg cattttggct gtgtctatca tgggactttg ctggacaatg acggaaagaa 3660
aattcactgt gctgtgaaat ccttaaatag aatcacagat atagaagagg tctcccagtt 3720
tctgactgag ggaatcatca tgaaagactt cagccatccc aatgttctct cactcttggg 3780
aatctgcctg aggagtgaag ggtctcctct ggtggtcctg ccctatatga agcatggaga 3840
tctgcgaaat ttcattcgaa acgagactca taatccaact gtgaaagatc ttataggatt 3900
tggccttcaa gtagccaaag gcatgaaata tcttgccagc aaaaagtttg tccacagaga 3960
cttagctgca agaaactgca tgttggatga aaaattcact gtcaaggttg ctgatttcgg 4020
tcttgccaga gacatgtacg ataaagagta ctatagtgtc cacaacaaga cgggtgccaa 4080
gctaccagta aagtggatgg ctttagagag tctgcaaacg cagaagttca ccaccaagtc 4140
agatgtgtgg tcctttggtg tgctcctctg ggagctcatg acgagaggag cccctcctta 4200
tcccgacgtg aacacatttg atatcactat ctacctgttg caaggcagaa gactcttgca 4260
accagaatac tgtccagacg ccttgtacga agtgatgcta aaatgctggc accccaaagc 4320
ggaaatgcgc ccgtcctttt ccgaactggt ctccaggata tcctcaatct tctccacgtt 4380
cattggggaa cactacgtcc acgtgaacgc tacttatgtg aatgtaaaat gtgttgctcc 4440
atatccttct ctgttgccat cccaagacaa cattgatggc gaggggaaca catgatgaat 4500
gagaggtcca ccagcccact tccaagaaac agttctggcc caaaccagac tatcccttcc 4560
ccaacagttc tcactgcctg gcctttggaa ggtcacttaa catttgttgt tgttttgttt 4620
tgttttttgt tttgcttttg cggtaactgc accactatga aacattgact tgctatttca 4680
aattcctgga ttctaaggaa tttctcatct gacaatggaa cagaaataga agcatggccc 4740
ccacaggctg gggaccagtg gcaacctgca gctacaacac tcctatctca gcggaattct 4800
aaatctcagt tctggcttaa aagttttaaa aataagatat atatacatat atatatccaa 4860
tacaatgaac tttgaagatt tctcagaaaa ctcagaagaa acgccctctt tcaggataaa 4920
tgtggtgttc ctagcaggct gcttgttgaa attccagtgt tttaaaaata tttttgttgt 4980
gttgcagtcg tgaacatttt ccatttctga tgttgtctgc ccatcaggca aacattccct 5040
tttaaatgct tatatacaca ttccttaggt tggaagaata tccacggaca atgcacttat 5100
ttttaaacga gcatgacatg aggtgtgttt ataaattatc agggatttta tgtattgtac 5160
atagatgaca ataggaaatt gtttatttca agaaatagct ttgttacagt aaaatatttg 5220
tcatttaaaa cccagctgtt tagcaaggag tgttggctca cacctacaat cccagcattt 5280
gggaagctga ggcaagcaga ttaccacaag tttgaaacca accttggctg catacagatg 5340
atgtatatat aggccagcat gggttacact gtctgtctta gcaaacaaaa tttcaactgt 5400
ttgagaaaga ttttgttctg atctaatgaa tgtggacatt taaatttttt atctgttttt 5460
taatggcaac tttggaaata agtaacttgc ggtgataaat ctttttaaag gcaactcagt 5520
attttttaaa ggacaaaata aactgactga agggttcgct acttccagtc acaacctgtg 5580
tatagaagaa agaaagggtc agtgatcgag aatcagacac tctcgttcag gaggaggctt 5640
ctcgcctgaa acaattgcac ccaacacttt tggggaagtc tcatttttgc attaggacat 5700
attttaggtt aaacaaaagc atattttaga aacagacaaa agccaactga aaatcgtgga 5760
tgaatagtta ctctggacag gacttttgac atgtcttgct ctgtggaatt ttgtgcttac 5820
tactgtatag tgcatgtggc ttaggttacc ctagctggtt ttgtccgtgt aaacattgaa 5880
agtattatat ttttatagaa atgtttattt ttaatgatgt aagaaaaatt ttccttaggc 5940
cgcagaaatc ctgcactgtg agcatttcag aagaggtatg tgagacccag ttcaacgaca 6000
gcatgatttt ttaaatggct gtaagttatg ataaggaaat gtactgattg ccagtgcact 6060
ccaccctcat tacgtcacca ggacttgaag ccaagggtta agagggcaag ctatgacatg 6120
ggtgtgtggt ctgctgaaac ccaatcgttg aacttggctg ttgttacagg aaaatgatgg 6180
catcaacagg tctttgatgg tggtggagca tatcagaaca cataaggaac tgtagcccag 6240
atttatttca attcaaatat tactgcttcg taattatgaa gagtagtgca aatttacaga 6300
gcactgtcaa agactgacag aaaaaaaaaa gatctgctct gtagaaagaa ttgtctgcca 6360
ttacagggtc aagaaaatga atgcgccaat aacagtaaga gctgtggaag acacccatac 6420
ctgtatatac atgctcgaga aagctgtaat gtgaaaatca tgttctctat ttatgactct 6480
tcctagggca atgtgtctgg acagattgta agagtaagtc attttcctaa agaattagat 6540
atttgtcact gcctatacct gcagttgagc tgaatggtac tccatgtgtt aataattgtt 6600
ctgatgaatc atacagttga aataaagtga cgtaacatct tgtatactgt ga 6652
<210> 12
<211> 62
<212> DNA
<213> Artificial
<220>
<223> shRNA SEQ. for Human c-met
<400> 12
caaactagag ttctccttgg aattcaagag attccaagga gaactctagt ttttttttgg 60
aa 62
<210> 13
<211> 21
<212> DNA
<213> Artificial
<220>
<223> Target sequence in Human c-met
<400> 13
aaactagagt tctccttgga a 21
<210> 14
<211> 69
<212> DNA
<213> Artificial
<220>
<223> shRNA SEQ for Mouse c-met
<400> 14
ctccacgtga acgctactta tgtgaattca agagattcac ataagtagcg ttcacgtgga 60
tttttggaa 69
<210> 15
<211> 25
<212> DNA
<213> Artificial
<220>
<223> Target sequence in Mouse c-met
<400> 15
tccacgtgaa cgctacttat gtgaa 25
<210> 16
<211> 63
<212> DNA
<213> Artificial
<220>
<223> CRISPR gRNA SEQ for Human c-met
<400> 16
aatttctact aagtgtagat aatttctact aagtgtagat cactccccat tgctcctctg 60
cac 63
<210> 17
<211> 23
<212> DNA
<213> Artificial
<220>
<223> Target sequence in Human c-met
<400> 17
gtgcagagga gcaatgggga gtg 23
<210> 18
<211> 3684
<212> DNA
<213> Artificial
<220>
<223> Lbcpf1 SEQ
<400> 18
atgagcaagc tggagaagtt tacaaactgc tactccctgt ctaagaccct gaggttcaag 60
gccatccctg tgggcaagac ccaggagaac atcgacaata agcggctgct ggtggaggac 120
gagaagagag ccgaggatta taagggcgtg aagaagctgc tggatcgcta ctatctgtct 180
tttatcaacg acgtgctgca cagcatcaag ctgaagaatc tgaacaatta catcagcctg 240
ttccggaaga aaaccagaac cgagaaggag aataaggagc tggagaacct ggagatcaat 300
ctgcggaagg agatcgccaa ggccttcaag ggcaacgagg gctacaagtc cctgtttaag 360
aaggatatca tcgagacaat cctgccagag ttcctggacg ataaggacga gatcgccctg 420
gtgaacagct tcaatggctt taccacagcc ttcaccggct tctttgataa cagagagaat 480
atgttttccg aggaggccaa gagcacatcc atcgccttca ggtgtatcaa cgagaatctg 540
acccgctaca tctctaatat ggacatcttc gagaaggtgg acgccatctt tgataagcac 600
gaggtgcagg agatcaagga gaagatcctg aacagcgact atgatgtgga ggatttcttt 660
gagggcgagt tctttaactt tgtgctgaca caggagggca tcgacgtgta taacgccatc 720
atcggcggct tcgtgaccga gagcggcgag aagatcaagg gcctgaacga gtacatcaac 780
ctgtataatc agaaaaccaa gcagaagctg cctaagttta agccactgta taagcaggtg 840
ctgagcgatc gggagtctct gagcttctac ggcgagggct atacatccga tgaggaggtg 900
ctggaggtgt ttagaaacac cctgaacaag aacagcgaga tcttcagctc catcaagaag 960
ctggagaagc tgttcaagaa ttttgacgag tactctagcg ccggcatctt tgtgaagaac 1020
ggccccgcca tcagcacaat ctccaaggat atcttcggcg agtggaacgt gatccgggac 1080
aagtggaatg ccgagtatga cgatatccac ctgaagaaga aggccgtggt gaccgagaag 1140
tacgaggacg atcggagaaa gtccttcaag aagatcggct ccttttctct ggagcagctg 1200
caggagtacg ccgacgccga tctgtctgtg gtggagaagc tgaaggagat catcatccag 1260
aaggtggatg agatctacaa ggtgtatggc tcctctgaga agctgttcga cgccgatttt 1320
gtgctggaga agagcctgaa gaagaacgac gccgtggtgg ccatcatgaa ggacctgctg 1380
gattctgtga agagcttcga gaattacatc aaggccttct ttggcgaggg caaggagaca 1440
aacagggacg agtccttcta tggcgatttt gtgctggcct acgacatcct gctgaaggtg 1500
gaccacatct acgatgccat ccgcaattat gtgacccaga agccctactc taaggataag 1560
ttcaagctgt attttcagaa ccctcagttc atgggcggct gggacaagga taaggagaca 1620
gactatcggg ccaccatcct gagatacggc tccaagtact atctggccat catggataag 1680
aagtacgcca agtgcctgca gaagatcgac aaggacgatg tgaacggcaa ttacgagaag 1740
atcaactata agctgctgcc cggccctaat aagatgctgc caaaggtgtt cttttctaag 1800
aagtggatgg cctactataa ccccagcgag gacatccaga agatctacaa gaatggcaca 1860
ttcaagaagg gcgatatgtt taacctgaat gactgtcaca agctgatcga cttctttaag 1920
gatagcatct cccggtatcc aaagtggtcc aatgcctacg atttcaactt ttctgagaca 1980
gagaagtata aggacatcgc cggcttttac agagaggtgg aggagcaggg ctataaggtg 2040
agcttcgagt ctgccagcaa gaaggaggtg gataagctgg tggaggaggg caagctgtat 2100
atgttccaga tctataacaa ggacttttcc gataagtctc acggcacacc caatctgcac 2160
accatgtact tcaagctgct gtttgacgag aacaatcacg gacagatcag gctgagcgga 2220
ggagcagagc tgttcatgag gcgcgcctcc ctgaagaagg aggagctggt ggtgcaccca 2280
gccaactccc ctatcgccaa caagaatcca gataatccca agaaaaccac aaccctgtcc 2340
tacgacgtgt ataaggataa gaggttttct gaggaccagt acgagctgca catcccaatc 2400
gccatcaata agtgccccaa gaacatcttc aagatcaata cagaggtgcg cgtgctgctg 2460
aagcacgacg ataaccccta tgtgatcggc atcgataggg gcgagcgcaa tctgctgtat 2520
atcgtggtgg tggacggcaa gggcaacatc gtggagcagt attccctgaa cgagatcatc 2580
aacaacttca acggcatcag gatcaagaca gattaccact ctctgctgga caagaaggag 2640
aaggagaggt tcgaggcccg ccagaactgg acctccatcg agaatatcaa ggagctgaag 2700
gccggctata tctctcaggt ggtgcacaag atctgcgagc tggtggagaa gtacgatgcc 2760
gtgatcgccc tggaggacct gaactctggc tttaagaata gccgcgtgaa ggtggagaag 2820
caggtgtatc agaagttcga gaagatgctg atcgataagc tgaactacat ggtggacaag 2880
aagtctaatc cttgtgcaac aggcggcgcc ctgaagggct atcagatcac caataagttc 2940
gagagcttta agtccatgtc tacccagaac ggcttcatct tttacatccc tgcctggctg 3000
acatccaaga tcgatccatc taccggcttt gtgaacctgc tgaaaaccaa gtataccagc 3060
atcgccgatt ccaagaagtt catcagctcc tttgacagga tcatgtacgt gcccgaggag 3120
gatctgttcg agtttgccct ggactataag aacttctctc gcacagacgc cgattacatc 3180
aagaagtgga agctgtactc ctacggcaac cggatcagaa tcttccggaa tcctaagaag 3240
aacaacgtgt tcgactggga ggaggtgtgc ctgaccagcg cctataagga gctgttcaac 3300
aagtacggca tcaattatca gcagggcgat atcagagccc tgctgtgcga gcagtccgac 3360
aaggccttct actctagctt tatggccctg atgagcctga tgctgcagat gcggaacagc 3420
atcacaggcc gcaccgacgt ggattttctg atcagccctg tgaagaactc cgacggcatc 3480
ttctacgata gccggaacta tgaggcccag gagaatgcca tcctgccaaa gaacgccgac 3540
gccaatggcg cctataacat cgccagaaag gtgctgtggg ccatcggcca gttcaagaag 3600
gccgaggacg agaagctgga taaggtgaag atcgccatct ctaacaagga gtggctggag 3660
tacgcccaga ccagcgtgaa gcac 3684
<210> 19
<211> 45
<212> DNA
<213> Artificial
<220>
<223> linker sequence for IL-12
<400> 19
ggtggcggtg gctcgggcgg tggtgggtcg ggtggcggcg gatct 45
<210> 20
<211> 582
<212> DNA
<213> Artificial
<220>
<223> lRES sequence
<400> 20
gccccccccc ctaacgttac tggccgaagc cgcttggaat aaggccggtg tgcgtttgtc 60
tatatgttat tttccaccat attgccgtct tttggcaatg tgagggcccg gaaacctggc 120
cctgtcttct tgacgagcat tcctagctag gggtctttcc cctctcgcca aaggaatgca 180
aggtctgttg aatgtcgtga aggaagcagt tcctctggaa gcttcttgaa gacaaacaac 240
gtctgtagcg accctttgca ggcagcggaa ccccccacct ggcgacaggt gcctctgcgg 300
ccaaaagcca cgtgtataag atacacctgc aaaggcggca caaccccagt gccacgttgt 360
gagttggata gttgtggaaa gagtcaaatg gctctcctca agcgtattca acaaggggct 420
gaaggatgcc cagaaggtac cccattgtat gggatctgat ctggggcctc ggtgcacatg 480
ctttacatgt gtttagtcga ggttaaaaaa acgtctaggc cccccgaacc acggggacgt 540
ggttttcctt tgaaaaacac gatgataata tggccacaac ca 582
<---
Реферат
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая аденовирусную систему для лечения рака, противораковую композицию, включающую вышеуказанную аденовирусную систему, и композицию для усиления противоопухолевого иммунитета, включающую вышеуказанную аденовирусную систему. В одном из вариантов реализации аденовирусная система содержит ген, кодирующий интерлейкин-12 (IL-12); и ген, экспрессирующий олигонуклеотид, который комплементарен мРНК C-met (тирозинкиназы Met) и ингибирует экспрессию C-met. Изобретение расширяет арсенал противораковых средств. 3 н. и 12 з.п. ф-лы, 22 ил., 2 табл., 16 пр.

Комментарии