Противораковая композиция, содержащая рекомбинантный аденовирус, экспрессирующий разрушающий фактор для внеклеточного матрикса - RU2742726C2
Код документа: RU2742726C2
Чертежи
























Описание
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к противораковой композиции, содержащей рекомбинантный аденовирус, который экспрессирует разрушающие факторы для внеклеточного матрикса.
Настоящее изобретение было выполнено в соответствии с проектом №20160000002116 при поддержке Министерства науки, информационных технологий и планирования будущего республики Корея, и органом по руководству научно-исследовательскими работами в рамках вышеуказанного проекта является Национальный исследовательский фонд республики Корея, и название сферы исследований: фундаментальные исследования в области науки и техники/поддержка опытных исследователей/ускоряющее исследование (поддержка дополнительных стратегических исследований), название исследовательского проекта: Разработка наноматериала-носителя гибридных генов для селективного контроля опухолей. Настоящее изобретение было выполнено в соответствии с проектом №20160000002536 при поддержке Министерства науки, информационных технологий и планирования будущего республики Корея, и органом по руководству научно-исследовательскими работами в рамках вышеуказанного проекта является Национальный исследовательский фонд республики Корея, название сферы исследований: Разработка первичных технологий/разработка биомедицинских технологий/разработка технологий на основе новых лекарственных средств нового поколения, и название исследовательского проекта: Исследование по разработке и практическому применению лизирующего опухоли аденовирусного материала-кандидата для лечения рака поджелудочной кислоты.
Согласно настоящей патентной заявке испрашивается приоритет и преимущество по корейской патентной заявке №10-2016-0167265, поданной 9 декабря 2016 года, раскрытие которой включено в данный документ посредством ссылки во всей своей полноте.
Предшествующий уровень техники настоящего изобретения
Рак представляет собой заболевание, которое является ведущей причиной смерти в мировом масштабе, и является трудноизлечимым заболеванием, при котором 50% или больше пациентов умирают, невзирая на комплексное лечение, такое как хирургическое вмешательство, лучевая терапия и химиотерапия (WHO: World Health Report, 2001). Было разработано лечение рака в следующем порядке: хирургическое вмешательство, лучевая терапия и лечение противораковым средством. Хирургическое вмешательство является эффективным для рака на ранних стадиях, но для большинства разновидностей рака, которые дали метастазы, необходима комбинация лучевой терапии или противораковой терапии помимо хирургического вмешательства. В частности, поскольку эти методы лечения оказывают значительные побочные эффекты на нормальные клетки и характеризуются низким показателем излечения вследствие устойчивости раковых клеток ко многим лекарственным средствам, существует насущная потребность в разработке нового метода противораковой терапии. В частности, в срочном порядке необходима разработка терапевтического средства для рефрактерного (устойчивого) рака, ассоциированного с рецидивом или метастазированием рака. Вследствие такой практической необходимости, из общего числа 2356 клинических испытаний по генной терапии по результатам 2016 года приблизительно 64,4% клинических испытаний проводили с раком в качестве заболевания-мишени, и клинические испытания проводили с наиболее высокой частотой среди различных нарушений.
Как описано выше, примеры стандартных способов лечения, в настоящее применяемых для рака, включают в себя хирургическое вмешательство, лучевую терапию и лечение противораковым средством. На ранней стадии, то есть, когда рак дал метастазы только в локальный или периферический лимфатический узел, рак может быть полностью излечен с помощью только хирургического вмешательства, но, когда его метастазирование прогрессирует в дальнейшем, существует ограничение в лечении, вследствие чего только малое число пациентов с раком могут быть излечены посредством хирургического вмешательства. Соответственно, большинство разновидностей рака следует лечить в комбинации с облучением и лечением противораковым средством дополнительно к хирургическому вмешательству. Тем не менее, поскольку и облучение, и лечение противораковым средством не являются направленным методом лечения, они не могут отличать раковые клетки, подлежащие лечению, от нормальных клеток, вследствие чего некоторые нормальные клетки также повреждаются во время лечения. Среди нормальных клеток значительно повреждаются клетки, которые быстро делятся и пролиферируют, то есть клетки крови, образующиеся в костном мозге, эпителиальные клетки в желудочно-кишечном тракте, в том числе в ротовой полости, волосковые клетки, зародышевые клетки, продуцирующие сперматозоиды и яйцеклетки, и т.п. Поскольку побочные эффекты в отношении нормальных клеток являются большими, показатель излечения в случае реальных опухолей является крайне низким.
Идеальное противораковое средство должно быть способно удалять раковые клетки без повреждения нормальных клеток. К сожалению, ни одно разработанное на сегодняшний день лекарственное средство не удовлетворяет условиям, описанным выше, и характеризуется токсичностью, просто сравнимой с эффектами в случае предпочтительного лечения. Когда химиотерапевтические средства, которые недавно интенсивно разрабатывались, классифицируют, первая группа представляет собой воздействующее на дифференцировку производное, способное к блокированию созревания опухолевых клеток, устраняя способность неоцитов к пролиферации или позволяя неоцитам находиться в телофазе; вторая представляет собой противодействующее метастазированию лекарственное средство, способное нарушать способность к инвазии и метастазированию за счет изменения поверхностных характеристик клеток злокачественной опухоли; третья представляет собой лекарственное средство, специфическое к гипоксическим гепатоцитарным опухолям, которое индуцирует реакцию восстановления из состояния недостаточности кислорода в раковых клетках солидных опухолей; четвертая представляет собой специфическое к опухолевым клеткам лекарственное средство для радиотерапии и т.п.
Новые терапевтические материалы, которые описаны выше, характеризуются усиленными противораковыми эффектами по сравнению с существующими методами противораковой терапии. В частности, примеры лекарственного средства, проявляющие лучший потенциал, включают в себя производные таксана (например, доцетаксел), производные камптотецина, ингибиторы тимидилат-синтазы (например, ралтитрексед), производные нуклеозидов (гемцитабин), производные 5 -FU для перорального применения и т.п. Тем не менее, токсичность этих химиотерапевтических средств все еще остается проблемой, которую нужно решить.
В последнее время, по мере того как были освещены многие молекулярно-биологические характеристики рака, были разработаны целенаправленно воздействующие терапевтические средства, которые атакуют только конкретные раковые клетки. Направленное лечение рака относится к применению лекарственных средств, которые блокируют рост и пролиферацию раковых клеток, препятствуя активности специальных молекул, вовлеченных в рост и проявление рака. Когда оно фокусируется на изменении в молекулах и клетках, направленное лечение имеет преимущество, заключающееся в том, что побочные эффекты могут быть сведены к минимуму, поскольку направленное лечение селективно атакует только раковые клетки, при этом относительно сводя к минимуму повреждение нормальных клеток. Целенаправленно воздействующие терапевтические средства были созданы для того, чтобы целенаправленно воздействовать на молекулы, которые являются характерными для большинства раковых клеток и проявляют их эффекты. В качестве молекулярной мишени были применены молекулы, вовлеченные в путь передачи сигнала, ангиогенез, взаимодействие с матриксом, регуляцию клеточного цикла, апоптоз раковых клеток и т.п., но до их клинического применения необходимы дополнительные исследования.
Кроме того, в качестве нового подхода к лечению рака были проведены исследования по иммунотерапии с применением опухолеспецифической иммунной активности организма. Тем не менее, осуществление иммунной терапии представляется сложным, поскольку рак имеет способность не только ловко ускользать от различных иммунных реакций хозяина и нарушать их, и в результате устойчиво поддерживает выживание опухолей посредством индукции иммунодепрессивного опухолевого микроокружения, но также избегать активированной противоопухолевой иммунной реакции, даже если иммунная система активируется. Соответственно, для того чтобы усилить иммунную реакцию против раковых клеток посредством улучшения иммунодепрессивного опухолевого микроокружения, были проведены исследования в различных направлениях с применением генов цитокинов, таких как IL-12, IL-18, интерферон-гамма (IFN-γ), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) и фактор некроза опухолей альфа (TNF-α), костимулирующих факторов, таких как молекулы В7, дендритные клетки (DC), служащие непосредственно в качестве антигенпрезентирующих клеток (АРС), Т-клетки, активированные опухолевыми антигенами, клетки-натуральные киллеры (NKC) и т.п. В частности, IL-12 обычно секретируется из АРС, таких как моноциты, макрофаги и DC, и, как известно, непосредственно действует на цитотоксические Т-лимфоциты (CTL) и NK-клетки, способные к эффективному удалению раковых клеток, активируя эти клетки, индуцируя секрецию IFN-γ и усиливая способность к лизису раковых клеток. Кроме того, IL-12 играет важную роль в стимулировании дифференцировки в клетки-Т-хелперы 1 (ТН1), действуя на наивные CD4+ лимфоциты и в результате активируя противораковую иммунную реакцию посредством индукции и усиления клеточно-опосредованной иммунной реакции, которая играет ключевую роль в противораковой иммунной реакции.
Исходя из этих данных из уровня техники, авторы настоящего изобретения сообщали о противоопухолевом эффекте YKL-1 (Ad-E1B-55k) в виде селективного к опухоли цитолитического аденовируса с делецией гена Е1В-55k, а также сообщали о противоопухолевом эффекте GM-CSF при применении RdB аденовируса с более усиленной способностью к селективному к опухоли цитолизу, чем у YKL-1 вследствие делеции гена

Раскрытие настоящего изобретения
Техническая проблема
В результате интенсивного изучения по разработке нового способа лечения, способного к улучшению противоракового эффекта, авторы настоящего изобретения получали селективный к опухоли цитолитический рекомбинантный аденовирус, который экспрессирует разрушающие факторы для внеклеточного матрикса, и преодолевали ограничение методов лечения с помощью существующих противораковых средств, и одновременно демонстрировали очень значительный противоопухолевый эффект при комбинировании рекомбинантного аденовируса с существующими противораковыми средствами или ингибиторами иммунных контрольных точек, таким образом осуществляя настоящее изобретение, основываясь на этом.
Соответственно, целью настоящего изобретения является обеспечение фармацевтической композиции для содействия противораковому средству, содержащей рекомбинантный аденовирус, который экспрессирует разрушающие факторы для внеклеточного матрикса.
Другой целью настоящего изобретения является обеспечение фармацевтической композиции для лечения рака, вводимой в комбинации с ингибиторами иммунных контрольных точек и содержащей рекомбинантный аденовирус, который экспрессирует разрушающие факторы для внеклеточного матрикса.
Тем не менее, технические проблемы, решение которых должно быть достигнуто настоящим изобретением, не ограничиваются вышеупомянутыми проблемами, и другие проблемы, которые не упоминаются, могут быть четко поняты специалистам в данной области техники из следующего описания.
Техническое решение
Для того чтобы достичь цели настоящего изобретения, которые описаны выше, предусматривается фармацевтическая композиция для содействия противораковому средству, содержащая рекомбинантный аденовирус, содержащий ген, кодирующий интерлейкин 12 (IL-12); и ген, кодирующий декорин или релаксин.
В качестве варианта осуществления настоящего изобретения у рекомбинантного аденовируса может быть удален участок Е1 и/или Е3.
В качестве еще одного варианта осуществления настоящего изобретения ген, кодирующий IL-12, может быть вставлен в участок Е1 рекомбинантного аденовируса, и ген, кодирующий декорин или релаксин, может быть вставлен в участок Е1 или Е3 аденовируса.
В качестве еще одного варианта осуществления настоящего изобретения композицию можно вводить одновременно, отдельно или последовательно в комбинации с ингибиторами иммунных контрольных точек, и ингибиторы иммунных контрольных точек могут представлять собой любой, выбранный из группы, состоящей из антагонистов PD-1, антагонистов PD-L1, антагонистов CTLA-4, антагонистов PD-L2, антагонистов CD27, антагонистов CD28, антагонистов CD70, антагонистов CD80, антагонистов CD86, антагонистов CD 137, антагонистов CD276, антагонистов KIR, антагонистов LAG3, антагонистов TNFRSF4, антагонистов GITR, антагонистов GITRL, антагонистов 4-1BBL и их комбинации.
В качестве еще одного варианта осуществления настоящего изобретения рак может представлять собой любой, выбранный из группы, состоящей из рака желудка, рака легкого, немелкоклеточного рака легкого, рака молочной железы, рака яичника, рака печени, рака бронхов, рака носоглотки, рака гортани, рака поджелудочной железы, рака мочевого пузыря, рака ободочной кишки, рака шейки матки, рака кости, немелкоклеточного рака кости, гематологической злокачественной опухоли, рака кожи, рака головы или шеи, рака матки, рака ободочной и прямой кишки, рака перианальной области, рака ободочной кишки, рака фаллопиевой трубы, рака эндометрия, рака влагалища, рака вульвы, болезни Ходжкина, рака пищевода, рака тонкой кишки, рака из эндокринной ткани, рака щитовидной железы, рака паращитовидной железы, рака надпочечника, саркомы мягких тканей, рака уретры, рака полового члена, рака предстательной железы, хронического или острого лейкоза, лимфоцитарной лимфомы, рака почки или рака с гидроуретером, почечно-клеточной карциномы, карциномы почечной лоханки, рака слюнной железы, саркомы, псевдомиксомы брюшины, гепатобластомы, рака яичка, глиобластомы, хейлокарциномы, герминогенных опухолей яичника, базально-клеточной карциномы, множественной миеломы, рака желчного пузыря, хориоидальной меланомы, рака ампулы Фатерова соска, перитонеального рака, рака языка, мелкоклеточного рака, лимфомы педиатрического типа, нейробластомы, рака двенадцатиперстной кишки, рака мочеточника, астроцитомы, менингиомы, рака почечной лоханки, рака наружных половых органов, рака вилочковой железы, опухолей центральной нервной системы, первичной лимфомы центральной нервной системы, опухолей спинного мозга, нейроглиомы ствола головного мозга и аденомы гипофиза, и он может представлять собой рецидивирующий рак или рак, устойчивый к противораковым средствам.
В качестве еще одного варианта осуществления настоящего изобретения композиция может усиливать противоопухолевый иммунитет.
Кроме того, настоящее изобретение относится к способу усиления терапевтической эффективности противораковых средств, предусматривающему введение индивиду рекомбинантного аденовируса, содержащего ген, кодирующий IL-12; и ген, кодирующий декорин или релаксин.
Кроме того, настоящее изобретение относится к способу лечения рака, предусматривающему введение индивиду рекомбинантного аденовируса, содержащего ген, кодирующий IL-12; и ген, кодирующий декорин или релаксин.
Полезные эффекты
Рекомбинантный аденовирус согласно настоящему изобретению проявляет отличный противоопухолевый эффект посредством значительного снижения содержания основных структурных компонентов внеклеточного матрикса в опухолевой ткани, в том числе коллагена I, коллагена III, фибронектина, эластина или подобного, а также посредством экспрессии терапевтического гена на высоком уровне селективно только в опухолевых клетках вследствие пролиферации вируса. В особенности, при введении в комбинации с существующими противораковыми средствами или ингибиторами иммунных контрольных точек, рекомбинантный аденовирус значительно повышает диффузию и распространение совместно вводимых терапевтических материалов в опухолевых тканях, при этом обеспечивая возможность проявления уже существующих противораковых эффектов, тем самым дополнительно улучшая противоопухолевый эффект. Соответственно, настоящее изобретение можно использовать в качестве основной методики в области лечения рака.
Описание чертежей
Фиг. 1 представляет собой схематическое изображение, схематически иллюстрирующее механизм специфического в отношении опухолевых клеток действия селективного к опухоли цитолитического аденовируса согласно настоящему изобретению.
Фиг. 2 представляет собой схематическое изображение, схематически иллюстрирующее механизм разрушения внеклеточного матрикса (ЕСМ) под действием селективного к опухоли цитолитического аденовируса согласно настоящему изобретению.
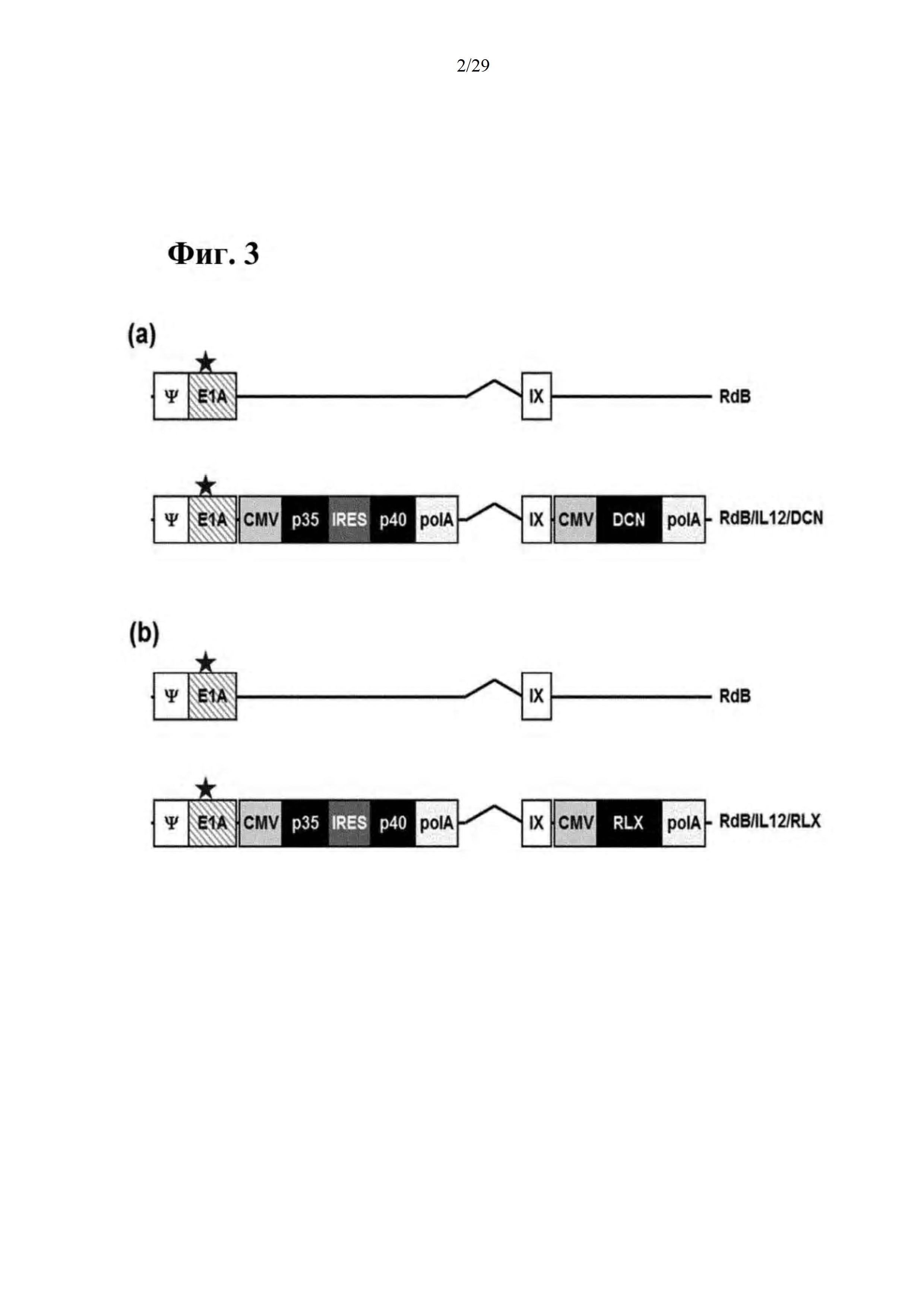
На фиг. 3 схематически иллюстрируется генетическая структура селективного к опухоли цитолитического аденовируса согласно настоящему изобретению, на фиг. 3А иллюстрируется генетическая структура селективного к опухоли цитолитического аденовируса (RdB/IL-12/DCN), который одновременно экспрессирует IL-12 и декорин (DCN), и на фиг. 3В иллюстрируется генетическая структура селективного к опухоли цитолитического аденовируса (RdB/IL-12/RLX), который одновременно экспрессирует IL-12 и релаксин (RLX). В частности, RdB включает в себя модифицированный участок E1А (открытая звездочка - мутация в сайте связывания белка Rb), и участки Е1В-19k и Е1В-55k (Е1В) и участок Е3 (Е3) удалены; a IL-12 и DCN/RLX вставлены в сайт(сайты) Е1 и/или Е3 аденовирусного генома, соответственно.
Фиг. 4 представляет собой результат подтверждения с помощью МТТ анализа способности к лизису клеток из линии клеток опухоли поджелудочной железы (PANC-1, MIA РаСа-2 или AsPC-1) при совместном введении RdB/IL-12/DCN и гемцитабина.
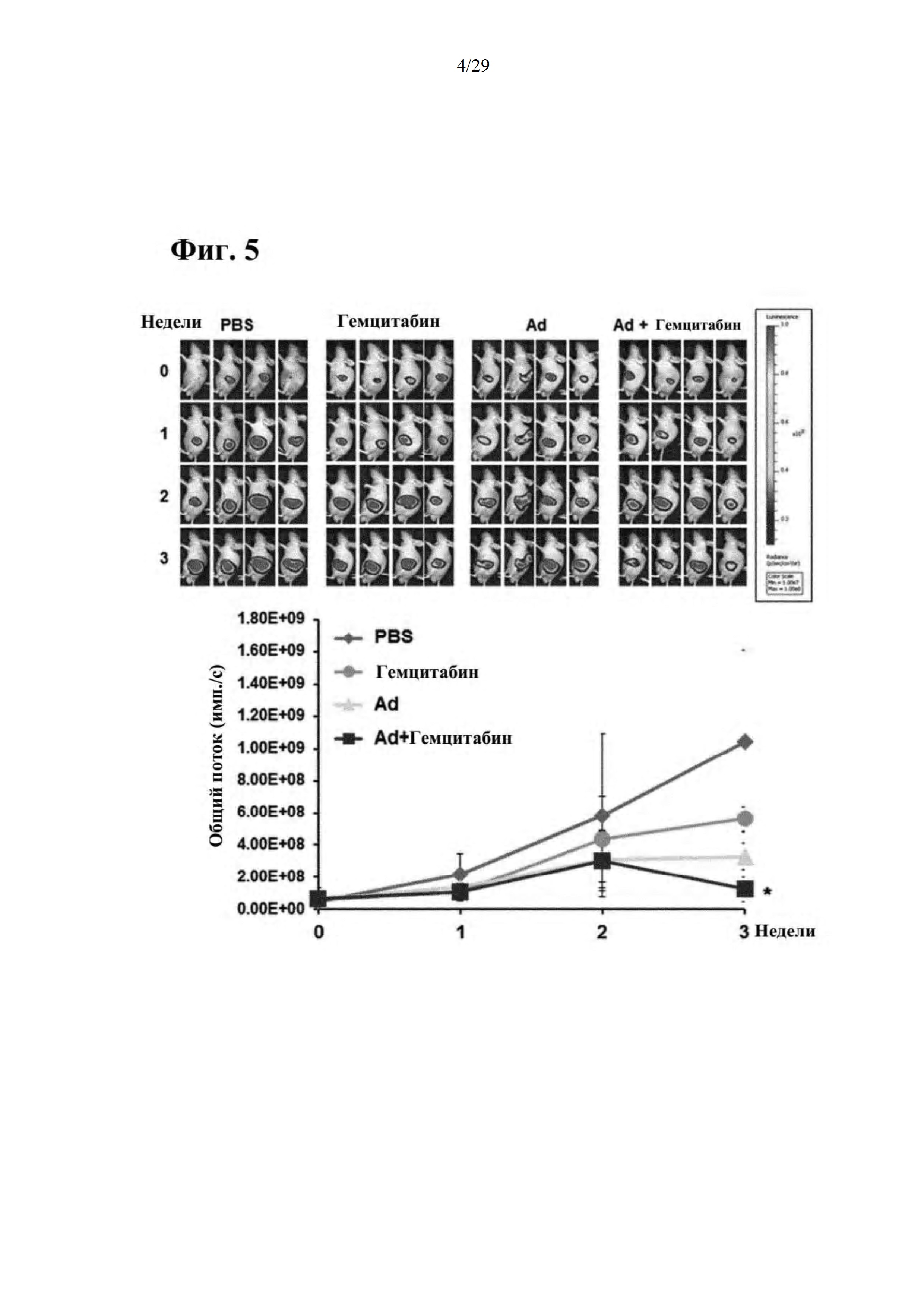
Фиг. 5 представляет собой результат подтверждения противоопухолевого эффекта при совместном введении RdB/IL-12/DCN и гемцитабина на основании изменения в размере опухолей, образовавшихся в ортотопической модели рака поджелудочной железы на животных.
Фиг. 6 представляет собой результат гистологической оценки противоопухолевых эффектов при совместном введении RdB/IL-12/DCN и гемцитабина, и она представляет собой результат осуществления окрашивания гематоксилином-эозином (Н & Е), иммуногистологического окрашивания PCNA, иммуногистологического окрашивания с применением антитела к белку Е1А и анализа TUNEL, соответственно.
Фиг. 7 представляет собой результат подтверждения противоопухолевого эффекта при совместном введении RdB/IL-12/DCN и ингибитора иммунных контрольных точек (антитела к PD-L1) на основании изменения в размере опухолей, образовавшихся в подкожной модели меланомы на животных.
Фиг. 8 представляет собой результат подтверждения противоопухолевого эффекта при совместном введении RdB/IL-12/DCN и ингибитора иммунных контрольных точек (антитела к PD-L1) на основании изменения показателя выживаемости в подкожной модели меланомы на животных.
Фиг. 9 представляет собой результат подтверждения противоопухолевого эффекта при совместном введении RdB/IL-12/DCN и ингибитора иммунных контрольных точек (антитела к PD-L1, антитела к PD-L1 или антитела к CTLA-4) на основании изменения в размере опухолей, образовавшихся в подкожной животной модели рака поджелудочной железы на хомяках.
Фиг. 10 представляет собой результат подтверждения реакции иммунологической памяти (эффект лечения рецидивирующего рака) при совместном введении RdB/IL-12/DCN и ингибитора иммунных контрольных точек (антитела к PD-L1, антитела к PD-L1 или антитела к CTLA-4) на основании изменения в размере опухолей, образовавшихся в подкожной животной модели рака поджелудочной железы на хомяках.
Фиг. 11 представляет собой результат подтверждения противоопухолевого эффекта при совместном введении RdB/IL-12/DCN и ингибитора иммунных контрольных точек (антитела к PD-L1) на основании изменения в размере опухолей, образовавшихся в животной модели с индуцированной устойчивостью к противораковому средству.
Фиг. 12 представляет собой результат подтверждения с помощью МТТ анализа способности к лизису клеток из линии клеток опухоли поджелудочной железы (MIA РаСа-2 или PANC-1) при совместном введении RDB/IL-12/RLX и гемцитабина.
Фиг. 13 представляет собой результат подтверждения с помощью TUNEL анализа противоопухолевого эффекта при совместном введении RdB/IL-12/RLX и гемцитабина.
Фиг. 14 представляет собой результат подтверждения эффекта разрушения внеклеточного матрикса при совместном введении RdB/IL-12/RLX и гемцитабина на основании изменения в уровне экспрессии коллагена I или коллагена III.
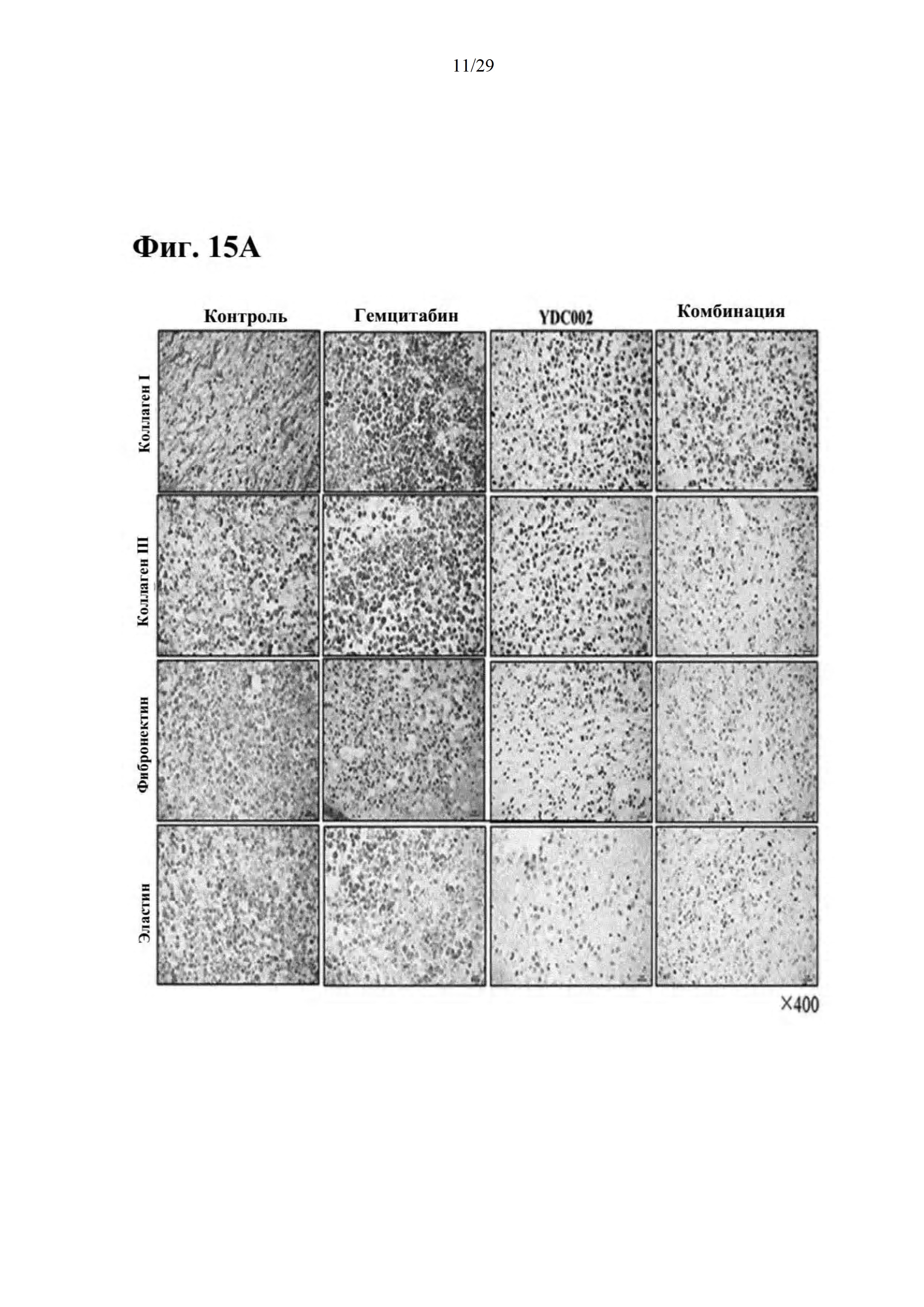
Фиг. 15А и 15В представляют собой результаты подтверждения эффекта разрушения внеклеточного матрикса при совместном введении RdB/IL-12/RLX и гемцитабина на основании изменения в уровне экспрессии коллагена I, коллагена III, фибронектина или эластина.
Фиг. 16А и 16В представляют собой результаты гистологической оценки противоопухолевого эффекта при совместном введении RdB/IL-12/RLX и гемцитабина, и они представляют собой результаты осуществления окрашивания МТ, окрашивания пикросириусом и TUNEL анализа, соответственно.
Фиг. 17А, 17В и 17С представляют собой результаты подтверждения противоопухолевого эффекта при совместном введении RdB/IL-12/RLX и гемцитабина на основании изменения в размере опухолей, образовавшихся в подкожной модели рака поджелудочной железы на животных.
Фиг. 18 представляет собой результат подтверждения эффекта разрушения внеклеточного матрикса при совместном введении RdB/IL-12/RLX и гемцитабина на основании изменения в уровне экспрессии коллагена I, коллагена IV, фибронектина или эластина в тканях опухолей, образовавшихся в животной модели с ксенотрансплантатом опухоли поджелудочной железы.
Фиг. 19 представляет собой результат гистологической оценки противоопухолевого эффекта при совместном введении RdB/IL-12/RLX и гемцитабина, и она представляет собой результат осуществления окрашивания гематоксилином-эозином (Н & Е), TUNEL анализа и иммуноанализа расщепленной каспазы 3, соответственно.
Фиг. 20 представляет собой результат подтверждения противоопухолевого эффекта при совместном введении RdB/IL-12/RLX и ингибитора иммунных контрольных точек (антитела к PD-L1) на основании изменения в размере опухолей, образовавшихся в подкожной модели меланомы на животных.
Фиг. 21 представляет собой результат подтверждения противоопухолевого эффекта при совместном введении RdB/IL-12/RLX и ингибитора иммунных контрольных точек (антитела к PD-L1) на основании изменения показателя выживаемости в подкожной модели меланомы на животных.
Фиг. 22 представляет собой результат подтверждения противоопухолевого эффекта при совместном введении RdB/IL-12/RLX и ингибитора иммунных контрольных точек (антитела к PD-L1) на основании изменения в размере опухолей, образовавшихся в подкожной модели меланомы на животных.
Фиг. 23 представляет собой результат подтверждения противоопухолевого эффекта при совместном введении RdB/IL-12/RLX и ингибитора иммунных контрольных точек (антитела к PD-L1) на основании изменения показателя выживаемости в подкожной модели меланомы на животных.
Фиг. 24 представляет собой результат подтверждения противоопухолевого эффекта при совместном введении RdB/IL-12/RLX (1×109 VP) и ингибитора иммунных контрольных точек (антитела к PD-L1) на основании изменения в размере опухолей, образовавшихся в подкожной модели меланомы на животных.
Фиг. 25 представляет собой результат подтверждения реакции иммунологической памяти (эффект лечения рецидивирующего рака) при совместном введении RdB/IL-12/RLX и ингибитора иммунных контрольных точек (антитела к PD-L1 или антитела к PD-L1) на основании изменения в размере опухолей, образовавшихся в подкожной модели меланомы на животных.
Фиг. 26 представляет собой результат подтверждения противоопухолевого эффекта при совместном введении RdB/IL-12/RLX и ингибитора иммунных контрольных точек (антитела к PD-L1) на основании изменения в размере опухолей, образовавшихся в животной модели с индуцированной устойчивостью к противораковому средству.
Фиг. 27 представляет собой результат подтверждения эффекта усиления проникновения противоракового средства в ткани опухоли желудка при совместном введении RdB/IL-12/RLX с трастузумабом в качестве противоракового средства и при иммунофлуоресцентном окрашивании.
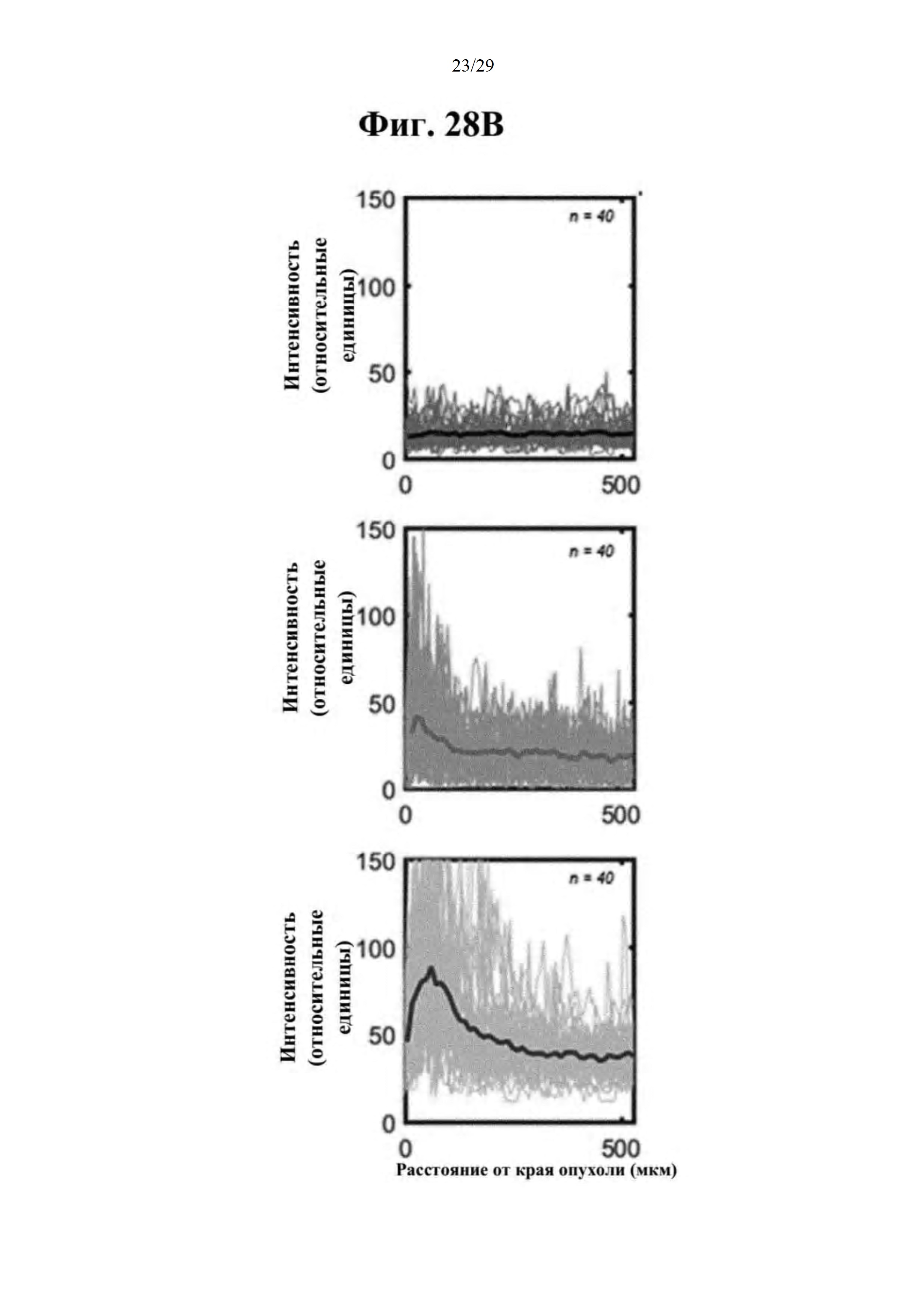
Фиг. 28А, 28В и 28С представляют собой результаты оценки распределения противоракового средства в ткани опухоли желудка при совместном введении RdB/IL-12/RLX, и они представляют собой результаты подтверждения распределения противоракового средства по краевому сайту в опухолевой ткани при увеличении участка, показанного на фиг.27.
Фиг. 29А, 29В и 29С представляют собой результаты оценки распределения противоракового средства в ткани опухоли желудка при совместном введении RdB/IL-12/RLX, и они представляют собой подтверждения распределения противоракового средства на основании кровеносных сосудов в опухолевой ткани.
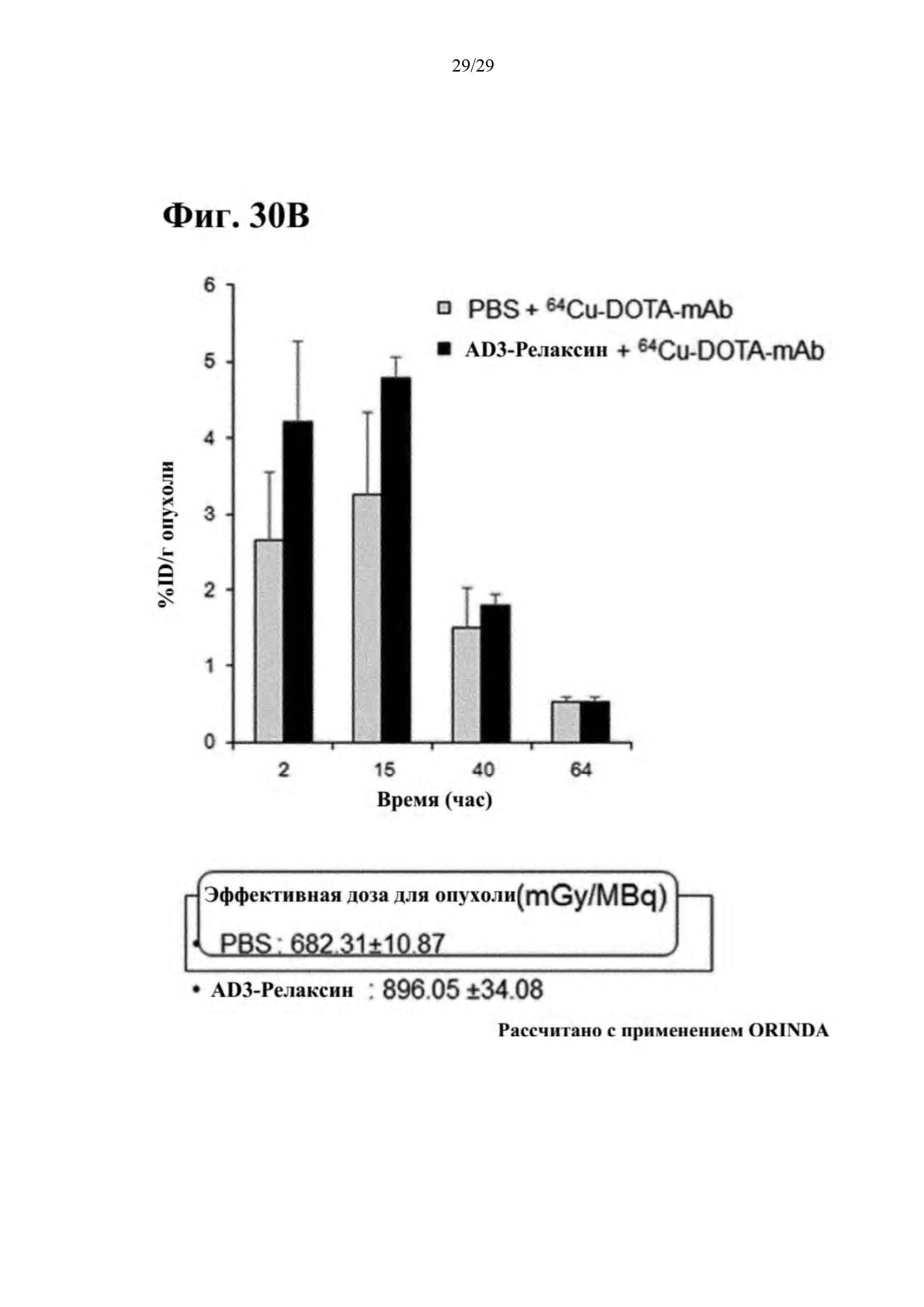
Фиг. 30А и 30В представляют собой результаты оценки времени пребывания противоракового средства в ткани опухоли желудка при совместном введении RdB/IL-12/RLX, и они представляют собой результаты осуществления визуализации методом PET.
Варианты осуществления настоящего изобретения
Далее в данном документе настоящее изобретение будет описано подробно.
Настоящее изобретение относится к фармацевтической композиции для содействия противораковому средству, при этом фармацевтическая композиция содержит рекомбинантный аденовирус, содержащий ген, кодирующий интерлейкин 12 (IL-12), и ген, кодирующий декорин или релаксин; к применению композиции для усиления терапевтической эффективности противоракового средства и к способу лечения рака, при этом способ предусматривает стадию введения терапевтически эффективного количества композиции в комбинации с противораковым средством.
В контексте данного документа термин «лечение» относится ко всем действиям, которые ослабляют или благоприятным образом изменяют симптомы (опухоли) при введении фармацевтической композиции согласно настоящему изобретению.
В соответствии с настоящим изобретением «индивид» относится к субъекту, нуждающемуся в лечении заболевания и, более конкретно, относится к млекопитающему, такому как человек или отличный от человека примат, грызун (крыса, мышь, морская свинка и т.п.), собака, кошка, лошадь, корова, овца, свинья, коза, верблюд и антилопа.
«Рак», который представляет собой заболевание, подлежащее лечению с помощью фармацевтической композиции согласно настоящему изобретению, собирательно относится к заболеваниям, вызванным клетками, имеющими агрессивные характеристики, при которых клетки игнорируют нормальные границы роста, а также делятся и растут, инвазивные характеристики для инфильтрации в окружающие ткани и метастатические характеристики распространения в другие места в организме. В настоящем изобретении рак используется в том же смысле, что и злокачественная опухоль или опухоль, и может включать в себя солидную опухоль и опухоль гемопоэтического происхождения. Например, при классификации на основании места патологического изменения рак может представлять собой любой, выбранный из группы, состоящей из рака желудка, рака легкого, немелкоклеточного рака легкого, рака молочной железы, рака яичника, рака печени, рака бронхов, рака носоглотки, рака гортани, рака поджелудочной железы, рака мочевого пузыря, рака ободочной кишки, рака шейки матки, рака кости, немелкоклеточного рака кости, гематологической злокачественной опухоли, рака кожи, рака головы или шеи, рака матки, рака ободочной и прямой кишки, рака перианальной области, рака ободочной кишки, рака фаллопиевой трубы, рака эндометрия, рака влагалища, рака вульвы, болезни Ходжкина, рака пищевода, рака тонкой кишки, рака из эндокринной ткани, рака щитовидной железы, рака паращитовидной железы, рака надпочечника, саркомы мягких тканей, рака уретры, рака полового члена, рака предстательной железы, хронического или острого лейкоза, лимфоцитарной лимфомы, рака почки или рака с гидроуретером, почечно-клеточной карциномы, карциномы почечной лоханки, рака слюнной железы, саркомы, псевдомиксомы брюшины, гепатобластомы, рака яичка, глиобластомы, хейлокарциномы, герминогенных опухолей яичника, базально-клеточной карциномы, множественной миеломы, рака желчного пузыря, хориоидальной меланомы, рака ампулы Фатерова соска, перитонеального рака, рака языка, мелкоклеточного рака, лимфомы педиатрического типа, нейробластомы, рака двенадцатиперстной кишки, рака мочеточника, астроцитомы, менингиомы, рака почечной лоханки, рака наружных половых органов, рака вилочковой железы, опухолей центральной нервной системы, первичной лимфомы центральной нервной системы, опухолей спинного мозга, нейроглиомы ствола головного мозга и аденомы гипофиза, и при классификации на основании патологических характеристик рак может представлять собой рецидивирующий рак или рак, устойчивый к противораковым средствам, но не ограничивается ими.
В контексте данного документа термин фармацевтическая композиция для содействия противораковому средству относится к улучшению эффективности лечения рака при ее применении в комбинации с существовавшими терапевтическими материалами для лечения рака. В качестве примера, фармацевтическая композиция для содействия противораковому средству указывает на сведение к минимуму побочных эффектов, вызванных противораковым средством, на основании снижения терапевтически эффективной дозы противоракового средства или значительного ингибирования роста опухолей. Фармацевтическую композицию для содействия противораковому средству можно применять взаимозаменяемо с противораковым адъювантом, противораковым терапевтическим адъювантом или подобным.
В конкретном примере согласно настоящему изобретению противораковое средство может представлять собой антиметаболит, алкилирующее средство, антагонист топоизомеразы, антагонист микротрубочек, противораковый антибиотик, полученный из растений алкалоид, противораковое средство на основе антител или противораковое средство, воздействующее на молекулярные мишени, и, более конкретно, оно может представлять собой таксол, азотистый иприт, иматиниб, оксалиплатин, ритуксимаб, эрлотиниб, трастузумаб, гефитиниб, бортезомиб, сунитиниб, карбоплатин, сорафениб, бевацизумаб, цисплатин, цетуксимаб, Viscum album, аспарагиназу, третиноин, гидроксикарбамид, дазатиниб, эстрамустин, гемтузумаб озогамицин, ибритумомаб тиуксетан, гептаплатин, метиламинолевулиновую кислоту, амсакрин, алемтузумаб, прокарбазин, алпростадил, хитозановый комплекс нитрата гольмия, гемцитабин, доксифлуридин, пеметрексед, тегафур, капецитабин, гимерацил, отерацил, азацитидин, метотрексат, урацил, цитарабин, фторурацил, флударабин, эноцитабин, децитабин, меркаптопурин, тиогуанин, кладрибин, кармофур, ралтитрексед, доцетаксел, паклитаксел, иринотекан, белотекан, топотекан, винорелбин, этопозид, винкристин, винбластин, тенипозид, доксорубицин, идарубицин, эпирубицин, митоксантрон, митомицин, блеомицин, даунорубицин, дактиномицин, пирарубицин, акларубицин, пепломицин, темозоломид, бусульфан, ифосфамид, циклофосфамид, мелфалан, алтретамин, дакарбазин, тиотепу, нимустин, хлорамбуцил, митолактол, ломустин и кармустин, иматиниб, гефитиниб, эрлотиниб, тристузумаб, роцилетиниб, неситумумаб, эверолимус, рамуцирумаб, дакомитиниб, форетиниб, пембролизумаб, ипилимумаб, ниволумаб, дабрафениб, велипариб, церитиниб, кармустин, циклофосфамид, ифосфамид, иксабепилон, мелфалан, меркаптопурин, митоксантрон или TS-1, но не ограничивается ими.
Селективный к опухоли цитолитический рекомбинантный аденовирус, включенный в фармацевтическую композицию согласно настоящему изобретению, характеризуется содержанием гена, кодирующего IL-12; и гена, кодирующего декорин или релаксин, который представляет собой разрушающий фактор для внеклеточного матрикса.
В качестве рекомбинантного аденовируса согласно настоящему изобретению можно применять онколитический аденовирус, широко известный в уровне техники. В качестве конкретного примера, рекомбинантный аденовирус содержит активированный ген Е1А и инактивированный ген Е1В-19k, ген Е1В-55k или ген Е1В-19k/Е1В-55k. В данном описании термин инактивация, используемый в сочетании с геном, означает, что транскрипция и/или трансляция гена не осуществляется нормально, и функция нормального белка, кодируемого геном, не проявляется. Например, инактивированный ген Е1В-19k представляет собой ген, неспособный продуцировать активированный белок Е1В-19k вследствие модификации (замены, добавления и частичной или полной делеции) в гене. Делеция EIB-19k может повышать способность к лизису клеток, и делеция гена Е1В-55k делает рекомбинантный аденовирус специфичным в отношении опухоли (см. корейскую патентную заявку №2002-23760 и фиг. 1). В частности, селективный к опухоли цитолитический аденовирус, который описан выше, проявляет терапевтические эффекты в отношении первичных инфицированных клеток, пролиферирующий вирус лизирует опухолевые клетки при последовательной вторичной и третичной инфекции окружающих опухолевых клеток, в результате чего терапевтический эффект от него может продолжаться, распространяясь по принципу домино, и в результате противоопухолевый эффект может быть значительно повышен. Термин «делеция», применяемый совместно с последовательностью вирусного генома в данном описании, имеет значение, включающее в себя полную делецию и частичную делецию соответствующей последовательности.
В соответствии с вариантом осуществления настоящего изобретения рекомбинантный аденовирус включает в себя участок Е1А, у него удален участок Е1В, то есть Е1В-19k и Е1В-55k (Е1В), и/или удален участок Е3 (Е3). Рекомбинантный аденовирус, включающий в себя ген Е1А, будет иметь воспроизводимые характеристики. Ген, кодирующий IL-12, вставлен в удаленный участок Е1 в рекомбинантном аденовирусе, ген, кодирующий декорин или релаксин, может быть вставлен в участок Е1 или Е3, но сайт вставки вышеупомянутого гена может быть соответствующим образом изменен. В то же время, сайт Е1А имеет модификацию, при которой остаток Glu 45 заменен на Gly, и модификацию, при которой последовательность из аминокислот 121-127 полностью заменена на Gly в нуклеотидной последовательности, кодирующей сайт связывания Rb, расположенный в последовательности гена Е1А.
В то же время, в настоящем изобретении также можно применять вирусы, отличные от аденовируса. Вирус, который можно применять в настоящем изобретении, предпочтительно может представлять собой аденоассоциированные вирусы (AAV) (Lashford LS., et al., Gene Therapy Technologies, Applications and Regulations Ed. A. Meager (1999)), ретровирусы (Gunzburg WH, et al., Gene Therapy Technologies, Applications and Regulations Ed. A. Meager, (1999)), лентивирусы (Wang G. et al., J. Clin. Invest. 104(11):R55-62(1999)), вирусы простого герпеса (Chamber R., et al., Proc. Natl. Acad. Sci USA 92:1411-1415(1995)), вирусы коровьей оспы (Puhlmann M. et al., Human Gene Therapy 10:649-657(1999)), реовирусы, поксвирусы (GCE, NJL, Krupa M, Esteban M., The poxvirus vectors MVA and NYVAC as gene delivery systems for vaccination against infectious diseases and cancer Curr Gene Ther 8(2):97-120(2008)), вирусы леса Семлики, и они могут быть нанесены на полимеры (Hwang et al., In vitro and In vivo Transfection Efficiency of Human Osteoprotegerin Gene using Non-Viral Polymer Carriers., Korean J. Bone Metab. 13(2): 119-128(2006)), в липосомы (Methods in Molecular Biology, Vol 199, S.C. Basu and M. Basu (Eds.), Human Press 2002), наноматериалы или ниосомы, но не ограничиваются ими.
Рекомбинантный аденовирус, применяемый в настоящем изобретении, включает в себя промотор, который является функциональным в клетках животных, предпочтительно, в клетках млекопитающих. Промотор, подходящий для настоящего изобретения, включает в себя промотор, полученный из вируса млекопитающих, и промотор, полученный из генома клеток млекопитающих, и включает в себя, например, промотор цитомегало вируса (CMV), промотор U6 и промотор H1, промотор длинного концевого повтора (LTR) вируса лейкоза мышей (MLV), промотор ранних генов аденовируса, промотор поздних генов аденовируса, промотор 7.5K вируса коровьей оспы, промотор SV40, tk промотор HSV, промотор RSV, промотор EF1 α, промотор металлотионеина, промотор β-актина, промотор гена IL-2 человека, промотор гена IFN человека, промотор гена IL-4 человека, промотор гена лимфотоксина человека, промотор гена GM-CSF человека, индуцируемый промотор, специфический для раковых клеток промотор (например, промотор TERT, модифицированный промотор TERT, промотор PSA, промотор PSMA, промотор СЕА, промотор сурвивина, промотор E2F, модифицированный промотор E2F, промотор AFP, модифицированный промотор AFP, гибридный промотор E2F-AFP и гибридный промотор E2F-TERT), тканеспецифический промотор (например, альбуминовый промотор), промотор фосфоглицераткиназы (PGK) человека и промотор фосфоглицераткиназы (PGK) мыши, но не ограничивается ими. Наиболее предпочтительно, промотор представляет собой промотор CMV. Предпочтительно, чтобы в экспрессионной конструкции для экспрессии трансгена, последовательность полиаденилирования связывалась ниже относительно трансгена. Последовательность полиаденилирования включает в себя терминатор бычьего гормона роста (Gimmi, Е.R., et al. Nucleic Acids Res. 17:6983-6998(1989)), происходящую из SV40 последовательность полиаденилирования (Schek, N, et al. Mol. Cell Biol. 12:5386-5393(1992)), полиА ВИЧ-1 (Klasens, В. I. F., et al. Nucleic Acids Res. 26:1870-1876(1998)), полиА β-глобина (Gil, A., et al., Cell 49:399-406(1987)), полиА TK HSV (Cole, C. N. and T. P. Stacy, Mol. Cell. Biol. 5:2104-2113(1985)) или полиА полиомавируса (Batt, D. В and G. G. Biol. 15:4783-4790(1995)), но не ограничивается ими.
В рекомбинантном аденовирусе, применяемом в настоящем изобретении, последовательность гена IL-12 и последовательность гена декорина или релаксина являются функционально связанными с промотором. В контексте данного документа термин «функционально связанный» относится к функциональной связи между регуляторной последовательностью для экспрессии нуклеиновой кислоты (например, набора из промотора, сигнальной последовательности и сайта связывания для фактора, регулирующего транскрипцию) и отличающейся последовательностью нуклеиновой кислоты, и, соответственно, регуляторная последовательность регулирует транскрипцию и/или трансляцию отличающейся последовательности нуклеиновой кислоты.
Рекомбинантный аденовирус согласно настоящему изобретению может дополнительно включать в себя ген устойчивости к антибиотику и репортерный ген (например, ген зеленого флуоресцентного белка (GFP), люциферазы и β-глюкуронидазы) в качестве селектируемых маркеров. Ген устойчивости к антибиотику включает в себя ген устойчивости к антибиотику, как правило, применяемый в уровне техники, например, ген, придающий устойчивость к ампициллину, гентамицину, карбенициллину, хлорамфениколу, стрептомицину, канамицину, генетицину, неомицину и тетрациклину, и, предпочтительно, он представляет собой ген устойчивости к неомицину. Вышеупомянутый селектируемый маркер можно экспрессировать даже в экспрессионной системе, соединенной с помощью отдельного промотора или сайта внутренней посадки рибосомы (IRES), и IRES, который можно применять в настоящем изобретении, представляет собой регуляторную последовательность, которая обнаруживается в РНК некоторых типов вирусов и клеток.
«Ген, кодирующий IL-12», применяемый в настоящем изобретении, включает в себя последовательность гена IL-12A (р35) и последовательность гена IL-12B (р40), и он может включать в себя последовательность IRES между последовательностью гена IL-12A (р35) и последовательностью гена IL-12B (р40) для эффективной трансляции вирусного белка. Предпочтительно, последовательность гена IL-12A (р35), последовательность гена IL-12B (р40) и последовательность IRES могут состоять из SEQ ID No. 1, SEQ ID No. 2 и SEQ ID No. 3, соответственно. IL-12 служит для повышения противоопухолевого иммунитета посредством индукции дифференцировки клеток-Т-хелперов 1 и активации цитотоксичности цитотоксических Т-лимфоцитов и клеток-натуральных киллеров.
Применительно к «гену, кодирующему декорин или релаксин», применяемому в настоящем изобретении, предпочтительно, последовательность гена декорина и последовательность гена релаксина могут состоять из SEQ ID No. 4 и SEQ ID No. 5, соответственно. В случае большинства опухолей, демонстрирующих относительно низкие терапевтические эффекты вследствие развития внеклеточного матрикса (ЕСМ), аденовирус не диффундирует равномерно в опухолевую ткань и часто остается в локализованном сайте введения. Декорин или релаксин служит для повышения диффузии и распределения терапевтического материала в опухолевой ткани посредством разрушения составляющих элементов внеклеточного матрикса, например, коллагена I, коллагена III, фибронектина, эластина или подобного (см. фиг. 2), и, кроме того, декорин проявляет свой собственный противоопухолевый эффект. В частности, вышеупомянутый эффект также может воздействовать на диффузию и распределение самого селективного к опухоли цитолитического рекомбинантного аденовируса и совместно вводимого материала, тем самым способствуя максимальному повышению противоопухолевого эффекта при совместном введении с существующим терапевтическим материалом для лечения рака.
То есть фармацевтическая композиция согласно настоящему изобретению имеет технический признак максимального повышения эффекта лечения рака посредством включения такой объединенной композиции для устойчивого улучшения эффективности селективного к опухоли цитолиза, являющегося результатом действия самого рекомбинантного аденовируса и проникновения противоракового средства, вводимого совместно с композицией, в опухолевые ткани. Иными словами, представляется возможным в конечном счете получить терапевтическую эффективность, близкую к идеальному методу лечения, за счет значительного повышения терапевтической эффективности противоракового средства из уровня техники при сохранении эффективности самой генной терапии.
Предполагается, что последовательности генов также включают в себя последовательность гена, проявляющую существенную идентичность или существенное сходство. Вышеупомянутая существенная идентичность относится к произвольной последовательности, отличающейся от последовательности согласно настоящему изобретению и характеризующейся по меньшей мере 80% гомологией, более предпочтительно, 90% гомологией и, более предпочтительно, 95% гомологией с последовательностью согласно настоящему изобретению при ее выравнивании для максимального соответствия последовательности согласно настоящему изобретению, и выравниваемые последовательности анализируют с применением алгоритма, как правило, применяемого в уровне техники. Вышеупомянутое существенное сходство собирательно относится ко всем из изменений в последовательности гена, таким как делеция или вставка одного или нескольких оснований, которые не воздействуют на объект настоящего изобретения в отношении сведения к минимуму гомологичной рекомбинации с рекомбинантным аденовирусным вектором. Таким образом, последовательность гена согласно настоящему изобретению не ограничена последовательностями, проиллюстрированными в SEQ ID NO. 1-5, и предполагается, что она включена в объем правовой охраны согласно настоящему изобретению при условии, что последовательность не воздействует значительно на активность конечного продукта, желаемого в настоящем изобретении.
Кроме того, фармацевтическую композицию согласно настоящему изобретению можно вводить одновременно, отдельно или последовательно в комбинации с ингибитором иммунных контрольных точек.
В контексте данного документа термин «иммунная контрольная точка» собирательно относится к белку, вовлеченному в выработку стимулирующих или подавляющих сигналов для иммунной реакции на поверхности иммунных клеток, и раковые клетки избегают сети надзора иммунной системы вследствие манипуляций, в результате которых стимуляция иммунной реакции и являющееся результатом ингибирование раковых клеток посредством иммунной контрольной точки не осуществляются надлежащим образом, то есть противоопухолевая иммунная реакция нейтрализуется. Предпочтительно, белок, выступающий в качестве иммунной контрольной точки может представлять собой белок программируемой гибели клеток 1 (PD-1), лиганд 1 белка программируемой гибели клеток (PD-L1), лиганд 2 белка программируемой гибели клеток (PD-L2), кластер дифференцировки 27 (CD27), кластер дифференцировки 28 (CD28), кластер дифференцировки 70 (CD70), кластер дифференцировки 80 (CD80, также известный как В7-1), кластер дифференцировки 86 (CD86, также известный как В7-2), кластер дифференцировки 137 (CD137), кластер дифференцировки 276 (CD276), иммуноглобулин-подобных рецепторов киллерных клеток (KIR), гена 3 активации лимфоцитов (LAG3), член 4 суперсемейства рецепторов фактора некроза опухолей (TNFRSF4, также известный как CD 134), индуцируемый глюкокортикоидами TNFR-родственный белок (GITR), лиганд индуцируемого глюкокортикоидами TNFR-родственного белка (GITRL), лиганд 4-1ВВ (4-1BBL) или цитолитический Т-лимфоцит-ассоциированный антиген 4 (CTLA-4), но не ограничивается ими.
Ингибитор иммунных контрольных точек представляет собой антагонист или антитело, целенаправленно воздействующие на белок, выступающий в роли иммунной контрольной точки, и он проявляет противоопухолевый эффект, вызванный иммунной реакцией за счет усиления активности белка, который стимулирует иммунную реакцию, или блокирования белка, который подавляет иммунную реакцию. Поскольку ингибитор иммунных контрольных точек использует систему иммунной реакции, которая является отличной в отношении эффекта памяти дополнительно к преимуществам меньшего количества побочных эффектов, таких как рвота или алопеция, чем неспецифические цитотоксические противораковые средства, и значительным терапевтическим эффектам, терапевтический эффект может продолжаться в течение длительного периода времени даже после того, как введение лекарственного средства прекращают. Тем не менее, сообщалось, что ингибитор иммунных контрольных точек характеризуется значительным снижением терапевтического эффекта в иммунодепрессивном микроокружении, и, в частности, опухоли рецидивируют у некоторых пациентов.
В то же время, генная иммунотерапия для опухолей была разработана в качестве перспективного подхода в течение последних нескольких десятилетий, но опухоли также создали многочисленные другие стратегии ускользания от системы иммунного надзора. Для того чтобы преодолеть эти препятствия и усилить эффект противоопухолевого иммунитета, согласно настоящему изобретению конструировали систему на основе селективного к опухоли цитолитического аденовируса, включающую в себя IL-12 и разрушающий фактор для внеклеточного матрикса, как описано выше (RdB/IL12/DCN, RdB/IL12/RLX), и обеспечивали окружение, в котором система согласно настоящему изобретению может действовать более эффективно, посредством применения системы на основе селективного к опухоли цитолитического аденовируса в комбинации с ингибитором иммунных контрольных точек. То есть, эффективность генной иммунотерапии максимально повышали посредством блокирования механизма уклонения опухолевых клеток, которые нейтрализуют противоопухолевый иммунный ответ. В соответствии со значительным эффектом, фармацевтическая композиция согласно настоящему изобретению проявляла эффективные эффекты в отношении лечения не только первичного рака, но также и рецидивирующего рака или рака, устойчивого к противораковым средствам, что было отмечено как ограничение для противоракового средства в уровне техники.
Фармацевтическая композиция согласно настоящему изобретению может содержать фармацевтически приемлемый носитель дополнительно к активному ингредиенту. В этом случае фармацевтически приемлемый носитель, как правило, применяют в ходе получения состава, и он включает в себя лактозу, декстрозу, сахарозу, сорбит, маннит, крахмал, гуммиарабик, фосфат кальция, альгинат, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидинон, целлюлозу, воду, сироп, метилцеллюлозу, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния, минеральное масло и т.п., но не ограничиваются ими. Более того, фармацевтически приемлемый носитель может дополнительно содержать смазывающее средство, смачивающее средство, подсластитель, ароматизирующее средство, эмульгатор, суспендирующее средство, консервант и т.п. дополнительно к вышеупомянутым ингредиентам. Подходящие фармацевтически приемлемые носители и составы подробно описаны в Remingtonʹs Pharmaceutical Sciences (19th ed., 1995).
Фармацевтическую композицию согласно настоящему изобретению можно вводить перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно, внутриальвеолярно или ее можно наносить местно), и в соответствии с вариантом осуществления настоящего изобретения фармацевтическую композицию согласно настоящему изобретению, предпочтительно, можно вводить прямо внутрь опухоли. Доза варьирует в зависимости от состояния пациента и массы тела, тяжести заболевания, формы лекарственного средства, пути и продолжительности введения, но может быть подходящим образом выбрана специалистами в данной области техники.
Фармацевтическую композицию согласно настоящему изобретению вводят в фармацевтически эффективном количестве. В настоящем изобретении «фармацевтически эффективное количество» означает количество, достаточное для лечения заболеваний при обоснованном соотношении польза/риск, применимое к медицинскому лечению, и эффективный уровень дозы можно определить в соответствии с факторами, включающими в себя тип заболевания у пациентов, тяжесть заболевания, активность лекарственных средств, чувствительность к лекарственным средствам, время введения, путь введения, скорость экскреции, период лечения и одновременно применяемые лекарственные средства, а также другие факторы, хорошо известные в области медицины. Другую фармацевтическую композицию согласно настоящему изобретению можно вводить в виде отдельного терапевтического средства или в комбинации с другими терапевтическими средствами, можно вводить последовательно или одновременно с терапевтическими средствами из уровня техники и можно вводить в виде однократной дозы или многократных доз. Важно вводить композицию в минимальном количестве, которое может обеспечить максимальный эффект без каких-либо побочных эффектов, принимая во внимание все вышеупомянутые факторы, и это количество может быть легко определено специалистами в данной области техники.
В то же время, в качестве еще одного аспекта настоящего изобретения настоящее изобретение относится к: фармацевтической композиции для лечения рака, фармацевтической композиции, содержащей рекомбинантный аденовирус, содержащий ген, кодирующий интерлейкин 12 (IL-12), и ген, кодирующий декорин или релаксин, и вводимой в комбинации с ингибитором иммунных контрольных точек; применению композиции для лечения рака и способу лечения рака, при этом способ предусматривает стадию совместного введения индивиду композиции и ингибитора иммунных контрольных точек.
Поскольку в фармацевтической композиции для лечения рака согласно настоящему изобретению и подобном применяют техническую конфигурацию, описанную в отношении вышеописанной фармацевтической композиции для содействия противораковому средству, описание информации, одинаковой для этих двух объектов, будет опущено во избежание избыточной сложности данного описания.
Ниже в данном документе будут предложены предпочтительные примеры для помощи в понимании настоящего изобретения. Тем не менее, следующие примеры представлены только для более простого понимания настоящего изобретения, и содержание настоящего изобретения не ограничивается следующими примерами.
ПРИМЕРЫ
Пример 1. Получение селективного к опухоли цитолитического аденовируса
1-1. Получение RdB/IL-12/DCN и RdB/IL-12/RLX
Для того чтобы сконструировать аденовирусный челночный вектор, который экспрессирует декорин или релаксин в сайте Е3 аденовируса, челночные векторы pSP72 E3/DCN и pSP72 E3/RLX Е3 получали посредством клонирования последовательности, кодирующей декорин или релаксин, в аденовирусный челночный вектор pSP72 E3/CMV-polA Е3 (Yun CO. et al., Cancer Gene Ther, 2005. 12(1): p. 61-71). Для гомологичной рекомбинации аденовирусные плазмиды pdE1/DCN и pdE1/RLX получали посредством одновременной трансформации Е. coli BJ5183 с использованием pSP72 E3/DCN и pSP72 E3/RLX и каждого аденовирусного полного вектора pdE1.
Для того чтобы сконструировать челночный вирус Ad E1, который экспрессирует IL-12, получали челночный вектор pXC1RdB/IL12 E1 посредством вырезания мышиного гена IL-12 из pCA14/IL12 (Lee YS. et al, Clin Cancer Res, 2006. 12(19): p. 5859-68) и субклонирования гена в челночный вектор pXC1RdB E1. Для гомологичной рекомбинации Е. coli BJ5183 трансформировали одновременно с использованием челночного вектора pXC1RdB/IL12 E1 и pdE1/DCN или pdE1/RLX, таким образом получая векторы pRdB/IL12/DCN и pRdB/IL12/RLX Ad. Очистку, титрование и анализ качества аденовируса осуществляли в соответствии с уровнем техники (Lee YS. et al., Clin Cancer Res, 2006. 12(19): p. 5859-68, Choi KJ. et al., Gene Ther, 2012. 19(7): p. 711-23).
Пример 2. Применение селективного к опухоли цитолитического аденовируса, экспрессирующего декорин, в комбинации с противораковым средством
2-1. Подтверждение способности к лизису клеток опухоли поджелудочной железы
Когда селективный к опухоли цитолитический аденовирус, экспрессирующий релаксин (в данном документе ниже называемый RdB/IL-12/DCN), и гемцитабин в качестве стандартного терапевтического средства для рака поджелудочной железы вводили совместно, предполагалось проверить, может ли значительно повышаться способность к лизису клеток опухоли поджелудочной железы. Для этой цели клетки из линий клеток опухоли поджелудочной железы человека PANC-1, MIA РаСа-2 и AsPC-1 инфицировали с использованием RdB/IL-12/DCN согласно настоящему изобретению с показателем MOI (множественность инфицирования), составляющим 0,5 или 2, и обрабатывали вместе с гемцитабином (0,05, 0,2, 1, 2, 5, 20 или 100 мкг/мл), а затем степень апоптоза наблюдали посредством МТТ анализа.
Как иллюстрируется на фиг.4, при обработке только гемцитабином всех из PANC-1, M1 А РаСа-2 и AsPC-1 демонстрировали способность к лизису не более 30% клеток из линий клеток опухоли поджелудочной железы даже при высокой концентрации, составляющей 100 мкг/мл, но, когда RdB/IL-12/DCN вводили в комбинации с гемцитабином, способность к лизису клеток из линий клеток опухоли поджелудочной железы значительно повышалась даже при низкой концентрации гемцитабина, составляющей 0,2 мкг/мл. В частности, этот эффект был отличным по сравнению со случаем, когда вводили только RdB/IL-12/DCN, и чем выше была концентрация рекомбинантного аденовируса (2 MOI), тем более значительным был эффект. Таким образом, результат эксперимента говорит о том, что совместное введение существующего противоракового средства и RdB/IL-12/DCN согласно настоящему изобретению может не только снижать вводимую дозу противоракового средства для противоопухолевой терапии, но также может проявлять более сильный противоопухолевый эффект.
2-2. Подтверждение противоопухолевого эффекта в ортотопической модели рака молочной железы на животных
(1) Подтверждение изменения в размере опухоли
Для того чтобы создать ортотопическую модель рака поджелудочной железы на животных, клетки из линии клеток опухоли поджелудочной железы человека MIA РаСа-2-Fluc выбирали и использовали в эксперименте. Опухолевые клетки вводили инъекцией в поджелудочные железы мышей и две недели спустя образование опухолей подтверждали с помощью визуализирующего прибора IVIS. После этого RdB/IL-12/DCN вводили внутрибрюшинно три раза в количестве 2×1010 VP(вирусные частицы)/500 мкл каждые двое суток и гемцитабин вводили два раза в неделю в дозе 100 мг/кг в течение в общей сложности 3 недель. В то же время группу с введением только PBS использовали в качестве отрицательного контроля. Перед введением RdB/IL-12/DCN размер и значения плотности фотонов для опухолей подтверждали с применением визуализирующего прибора IVIS и через 1, 2 и 3 недели после введения изменения в размере опухолей количественно сравнивали.
Как иллюстрируется на фиг. 5, можно подтвердить, что резкие увеличения размера опухолей наблюдали у отрицательного контроля (PBS) и в группе с введением только гемцитабина (гемцитабин), в то время как в группе с совместным введением (Ad + гемцитабин) рост опухолей замедлялся (1 и 2 неделя), и, более того, размер опухолей достаточно значительно уменьшался на 3 неделе. Результаты эксперимента указывают на то, что противоопухолевый эффект, вызванный совместным введением существующего противоракового средства и RdB/IL-12/DCN, является очень значительным по сравнению с соответствующими введениями отдельных составляющих.
(2) Гистологическая оценка противоопухолевого эффекта
Предполагалась гистологическая оценка противоопухолевого эффекта в вышеупомянутых экспериментах. Вначале образование опухолей индуцировали посредством инъекции клеток из линии клеток опухоли поджелудочной железы человека MIA PaCa-2-Fluc в поджелудочные железы мышей, а затем каждый из PBS, гемцитабин, RdB/IL-12/DCN или гемцитабин + RdB/IL-12/DCN вводили туда. После этого, окрашивание гематоксилином-эозином (Н & Е) и иммуногистологическое окрашивание PCNA осуществляли после сбора опухолевых тканей. Кроме того, TUNEL анализ осуществляли для того, чтобы подтвердить степень апоптоза опухолевых клеток, и иммуногистологическое окрашивание с использованием антитела к белку Е1А аденовируса осуществляли для того, чтобы подтвердить, был ли противоопухолевый эффект вызван репликацией аденовируса, присутствующего в опухолевых тканях.
Как иллюстрируется на фиг. 6, в группах с введением только PBS или гемцитабина некроз почти не наблюдали, в то время как при введении RdB/IL-12/DCN отдельно или при совместном введении гемцитабина + RdB/IL-12/DCN некроз клеток в опухолях был очень активным. В частности, подтвердили, что в группе, которой совместно вводили гемцитабин и RdB/IL-12/DCN, некроз встречался в большинстве опухолей. Кроме того, как и в случае вышеуказанных результатов, при иммуногистологическом окрашивании PCNA наблюдали, что в группе, которой вводили отдельно RdB/IL-12/DCN или вводили гемцитабин + RdB/IL-12/DCN, пролиферация опухолевых клеток значительно снижалась по сравнению с группой, которой вводили PBS или гемцитабин отдельно, и эффект был наиболее значительным в группе, которой совместно вводили гемцитабин и RdB/IL-12/DCN. Более того, что касается степени апоптоза, высокий уровень апоптоза также подтверждали в группе, которой вводили отдельно RdB/IL-12/DCN или вводили гемцитабин + RdBAL-12/DCN, в особенности, в группе, которой совместно вводили гемцитабин и RdBAL-12/DCN. Наконец, в результате осуществления иммуногистологического окрашивания с применением антитела к белку Е1А аденовируса можно подтвердить, что содержание белка E1A аденовируса было значительно повышено в опухолях у мышей, которым вводили отдельно RdB/IL-12/DCN или вводили гемцитабин + RdB/IL-12/DCN, по сравнению с опухолями у мышей, которым вводили только PBS или гемцитабин.
При рассмотрении этих результатов в совокупности распределение RdB/IL-12/DCN в опухолевых тканях повышается декорином, и, соответственно, индуцируется активная репликация селективного к опухоли цитолитического аденовируса и лизис опухолевых клеток. Кроме того, можно увидеть, что в случае, когда ген декорина экспрессируется на высоком уровне при активной пролиферации RdB/IL-12/DCN, распространившегося в опухолевых тканях, апоптоз опухолевых клеток опять стимулировался, и сильный противоопухолевый эффект был вызван повышением эффективности совместно вводимого противоракового средства.
Пример 3. Применение селективного к опухоли цитолитического аденовируса, экспрессирующего декорин, в комбинации с ингибитором иммунных контрольных точек
3-1. Подтверждение противоопухолевого эффекта в подкожной модели меланомы на животных
После того как клетки из линии клеток меланомы B16-F10 вводили инъекцией подкожно мышам в количестве 5×105 клеток/50 мкл на животное, приблизительно 10 суток спустя, когда размер опухолей достигал приблизительно 100 мм3, изменение в размере опухолей наблюдали при введении 5×109 VP RdB/IL-12/DCN отдельно или в комбинации с ингибитором иммунных контрольных точек (антитело к PD-L1) в дозе 200 мкг.В ходе совместного введения RdB/IL-12/DCN вводили внутрь опухоли в День 1, 3 и 5 (в общей сложности три раза) и ингибитор иммунных контрольных точек вводили внутрибрюшинно в День 3, 6 и 9 (в общей сложности три раза). В то же время группу с введением только PBS использовали в качестве отрицательного контроля.
Как иллюстрируется на фиг. 7 и 8, подтвердили, что в случае, когда селективный к опухоли цитолитический аденовирус (RdB/IL-12/DCN) вводили в комбинации с ингибитором иммунных контрольных точек, увеличение размера опухоли значительно снижалось, и выживаемость в подкожной модели меланомы на животных значительно улучшалась по сравнению с группой с введением только RdB/IL-12/DCN или ингибитора иммунных контрольных точек. Таким образом, результаты эксперимента указывают на то, что совместное введение RdB/IL-12/DCN согласно настоящему изобретению и ингибитора иммунных контрольных точек можно применять в качестве более сильного и более эффективного противоракового терапевтического средства.
3-2. Подтверждение противоопухолевого эффекта в подкожной животной модели рака поджелудочной железы на хомяках
Предполагалось подтвердить противоопухолевую иммунную реакцию при совместном введении RdB/IL-12/DCN и ингибитора иммунных контрольных точек с использованием модели на хомяках, в которой возможна in vivo репликация рекомбинантного вируса, которая в то же время обладает иммунной функцией in vivo. После того как клетки из линии клеток опухоли поджелудочной железы хомяка Нар-Т1 вводили инъекцией подкожно хомяку, когда размер опухолей достигал приблизительно 100 мм3, наблюдали изменение в размере опухолей, когда 2×109 VP RdB/IL-12/DCN вводили отдельно или в комбинации с ингибитором иммунных контрольных точек (антитело к PD-L1, антитело к PD-L1 или антитело к CTLA-4) в дозе 700 мкг. В ходе совместного введения RdB/IL-12/DCN вводили внутрь опухоли в общей сложности три раза с интервалом 2 суток и ингибитор иммунных контрольных точек вводили внутрибрюшинно в общей сложности три раза. В то же время группу с введением только PBS использовали в качестве отрицательного контроля.
Как иллюстрируется на фиг.9, в результате введения селективного к опухоли цитолитического аденовируса (RdB/IL-12/DCN) в комбинации с ингибитором иммунных контрольных точек увеличение размера опухолей значительно снижалось по сравнению с группой с введением только RdB/IL-12/DCN или ингибитора иммунных контрольных точек, и эта тенденция в равной степени проявлялась для всех из трех ингибиторов иммунных контрольных точек (антитела к PD-1, антитела к PD-L1 или антитела к CTLA-4). В частности, спустя 21 сутки введения ингибиторы иммунных контрольных точек (антитело к PD-1, антитело к PD-L1 или антитело к CTLA-4) ингибировали рост опухолей только приблизительно на 35,4%, 38,8% или 7,2%, соответственно, по сравнению с отрицательным контролем, но только в группе с введением RdB/IL-12/DCN рост опухолей мог ингибироваться не менее чем приблизительно на 89,8%, 57,7% или 48,2%, соответственно. В частности, совместное введение RdB/IL-12/DCN и ингибитора иммунных контрольных точек может ингибировать рост опухолей не менее чем на 95,7%, 82,1% или 78,1%, соответственно, по сравнению с отрицательным контролем, таким образом, вышеописанный противоопухолевый эффект можно проверить еще раз.
3-3. Подтверждение реакции иммунологической памяти в подкожной животной модели рака поджелудочной железы на хомяках
Предполагалось проверить противоопухолевую реакцию иммунологической памяти при совместном введении селективного к опухоли цитолитического аденовируса и ингибитора иммунных контрольных точек. Через 49 суток после того, как образовывалась первая опухоль, опухоль образовывалась вновь у мышей, у которых опухоль полностью исчезла (группа с введением только RdB/IL-12/DCN или группа с совместным введением RdB/IL-12/DCN и ингибитора иммунных контрольных точек), посредством введения инъекцией клеток Нар-Т1 мышам в тех же самых условиях, что и предшествующие условия. После этого, рост опухолей наблюдали таким же образом, что и в предыдущем случае при введении RdB/IL-12/DCN отдельно или RdB/IL-12/DCN в комбинации с ингибитором иммунных контрольных точек (антитело к PD-1, антитело к PD-L1 или антитело к CTLA-4).
Как иллюстрируется на фиг.10, подтверждали, что в группе, получавшей обработку RdB/IL-12/DCN отдельно, повторно индуцируемая опухоль быстро росла вновь, в то время как в случае, когда RdB/IL-12/DCN и ингибитор иммунных контрольных точек (антитело к PD-1, антитело к PD-L1 или антитело к CTLA-4) вводили совместно, рост опухолей все еще ингибировался. Таким образом, результаты эксперимента указывают на то, что совместное введение RdB/IL-12/DCN согласно настоящему изобретению и ингибитора иммунных контрольных точек также может быть эффективным для лечения рецидивирующего рака посредством индукции сильной противоопухолевой реакции иммунологической памяти.
3-4. Подтверждение противоопухолевого эффекта в животной модели с индуцированной устойчивостью к противораковому средству
В условиях, когда противоопухолевый эффект, вызванный противораковым средством, является незначительным вследствие устойчивости к противораковому средству и т.п., предполагалось проверить противоопухолевый эффект in vivo при совместном введении RdB/IL-12/DCN и ингибитора иммунных контрольных точек (антитело к PD-1; αPD-1). После того как клетки из линии клеток меланомы мыши B16-F10 вводили инъекцией (5×105 клеток) подкожно в бок C57BL/6 мышей, таксол (День 1, 2 и 3; 10 мг/кг) вводили инъекцией внутрибрюшинно в образовавшуюся опухоль (День 1, приблизительно 50 мм3) и после того, как RdB/IL-12/DCN вводили отдельно (День 3, 5, 7 и 9; 5×105 VP), αPD-1 вводили отдельно (День 4, 7, 8 и 10; 200 мкг) или RdB/IL-12/DCN и αPD-1 вводили совместно (в тех же условиях, соответственно), наблюдали рост опухолей. В то же время группу с введением только PBS использовали в качестве отрицательного контроля.
Как иллюстрируется на фиг. 11, через 15 суток после первого введения противоракового средства (т.е. в День 16), когда PBS, таксол или αPD-1 вводили отдельно, размер опухолей составлял 7649,0±798,5 мм3, 5394,5±288,2 мм3 или 5814,2±471,6 мм3, соответственно, подтверждая быстрый рост опухолей, в то время как в группе с введением только RdB/IL-12/DCN или в группе с совместным введением RdB/IL-12/DCN и αPD-1 размер опухолей составлял 2374,0±776,2 мм3 или 669,8±335,2 мм3, соответственно, демонстрируя значительный противоопухолевый эффект. В частности, в группе с совместным введением RdB/IL-12/DCN и αPD-1 размер опухолей уменьшался приблизительно на 71,8% по сравнению с группой с введением только RdB/IL-12/DCN, таким образом, эффект был очень значительным (Р<0,01). Эти результаты эксперимента демонстрируют значительный эффект, заключающийся в том, что совместное введение RdB/IL-12/DCN согласно настоящему изобретению и ингибитора иммунных контрольных точек не только сильнее улучшает противоопухолевый эффект, чем эффект существующих противораковых средств, но также обеспечивает значительный противоопухолевый эффект даже в случае, когда эффект противоракового средства является незначительным вследствие in vivo факторов, таких как устойчивость к противораковому средству.
Пример 4. Применение селективного к опухоли цитолитического аденовируса, экспрессирующего релаксин, в комбинации с противораковым средством
4-1. Подтверждение способности к лизису клеток опухоли поджелудочной железы
Когда селективный к опухоли цитолитический аденовирус, экспрессирующий релаксин, и стандартное терапевтическое средство для рака поджелудочной железы гемцитабин вводили совместно, предполагалось проверить, может ли значительно повышаться способность к цитолизу клеток поджелудочной железы. Для этой цели после того, как клетки из линий клеток опухоли поджелудочной железы MIA РаСа-2 и PANC-1 инфицировали RdB/IL-12/RLX с показателем MOI, составляющим 0,1, 0,5, 1 или 2, и одновременно обрабатывали гемцитабином в количестве 0,01 мкМ или 0,05 мкМ, степень апоптоза наблюдали посредством МТТ анализа. В то же время группу без обработки использовали в качестве отрицательного контроля.
Как иллюстрируется на фиг. 12, когда RdB/IL-12/RLX (YDC002) вводили в комбинации с гемцитабином, способность к лизису клеток из линий клеток опухоли поджелудочной железы была значительно повышена по сравнению со случаем обработки только гемцитабином. В частности, этот эффект был отличным по сравнению со случаем, когда вводили только RdB/IL-12/RLX, и чем выше была концентрация рекомбинантного аденовируса (2 MOI), тем более значительным был эффект. Таким образом, результат эксперимента говорит о том, что совместное введение существующего противоракового средства и RdB/IL-12/RLX согласно настоящему изобретению может не только снижать вводимую дозу противоракового средства для противоопухолевой терапии, но также может проявлять более сильный противоопухолевый эффект.
4-2. Гистологическая оценка противоопухолевого эффекта
Предполагалась гистологическая оценка противоопухолевого эффекта в вышеупомянутых экспериментах. Вначале, после того как RdB/IL-12/RLX вводили отдельно (MOI 0,5 или 1), гемцитабин вводили отдельно (0,02 или 0,05 мкМ) или RdB/IL-12/RLX и гемцитабин совместно вводили в клетки из линий клеток опухоли поджелудочной железы MIA РаСа-2 или PANC-1, TUNEL анализ осуществляли для того, чтобы подтвердить степень апоптоза опухолевых клеток. В то же время группу без обработки использовали в качестве отрицательного контроля. Кроме того, предполагалось подтвердить изменение во внеклеточном матриксе (ЕСМ) под действием RdB/IL-12/RLX в клетках из линии клеток опухоли поджелудочной железы. Для того чтобы подтвердить уровни экспрессии мРНК коллагена I и коллагена III в опухолевых клетках, осуществляли qPCR, и изменение во внеклеточном матриксе в тканях опухоли поджелудочной железы (сфероидах) и эффект апоптоза, вызванный изменением, подтверждали посредством иммуногистологического окрашивания, МТ окрашивания, окрашивания пикросириусом и т.п.
Как иллюстрируется на фиг. 13, как на MIA РаСа-2, так на PANC-1 клетках наблюдали, что апоптоз опухолевых клеток значительно повышался в группе с введением только RdB/IL-12/RLX или в группе с совместным введением RdB/IL-12/RLX и гемцитабина по сравнению с контролем или группой с введением только гемцитабина, и эффект был наиболее значительным в группе с совместным введением RdB/IL-12/RLX и гемцитабина. В результате сравнения уровней экспрессии мРНК коллагена I и коллагена III через 72 часа после того, как клетки из линии клеток опухоли поджелудочной железы человека MIA РаСа-2 и PANC-1 инфицировали RdB/IL-12/RLX с показателем MOI, составляющим 1, как иллюстрируется на фиг. 14, уровни экспрессии мРНК значительно снижались в группе с введением только RdB/IL-12/RLX или в группе с совместным введением RdB/IL-12/RLX и гемцитабина по сравнению с уровнями экспрессии в других группах. Аналогично, как иллюстрируется на фиг. 15А, 15В, 16А и 16В, подтверждали, что в группе с введением только RdB/IL-12/RLX или в группе с совместным введением RdB/IL-12/RLX и гемцитабина уровни экспрессии коллагена I, коллагена III, фибронектина и эластина сильно снижались, и, соответственно, подтверждали, что апоптоз опухолевых клеток сильно улучшался.
При рассмотрении этих результатов в совокупности можно увидеть, что экспрессия белков внеклеточного матрикса снижалась под действием релаксина, и, соответственно, противоопухолевый эффект максимально повышается за счет усиления эффективности селективного в отношении рака цитолитического аденовируса и совместно вводимого противоракового средства.
4-3. Подтверждение противоопухолевого эффекта в подкожной модели рака поджелудочной железы на животных
Предполагалось проверить противоопухолевый эффект при совместном введении RdB/IL-12/RLX и гемцитабина в подкожной модели рака поджелудочной железы на животных. Образование опухолей индуцировали посредством подкожной инъекции PANC-1, MIA РаСа-2 или ВхРС-3 клеток мышам, изменение в размере опухолей наблюдали при введении RdB/IL-12/RLX отдельно или при введении RdB/IL-12/RLX (вводимого внутрь опухоли) в комбинации с гемцитабином (10 мг/кг). В то же время группу с введением только PBS использовали в качестве отрицательного контроля.
Как иллюстрируется на фиг. 17А-17С, практически во всех подкожных моделях рака поджелудочной железы на животных (PANC-1, MIA РаСа-2 или ВхРС-3) наблюдали резкое увеличение в размере опухолей у отрицательного контроля (PBS) и в группе с введением только гемцитабина (гемцитабин), при этом подтверждали, что в группе с введением только RdB/IL-12/RLX или в группе с совместным введением RdB/IL-12/RLX и гемцитабина рост опухолей сильно замедлялся, и, в частности, эффект был очень значительным в случае совместного введения. Результаты эксперимента указывают на то, что противоопухолевый эффект, вызванный совместным введением существующего противоракового средства и RdB/IL-12/RLX, является очень значительным по сравнению с соответствующими введениями отдельных составляющих.
4-4. Подтверждение противоопухолевого эффекта в животной модели с ксенотрансплантатом опухоли поджелудочной железы
Для того чтобы создать животную модель с ксенотрансплантатом опухоли поджелудочной железы, 5×105 MIA РаСа-2 вводили инъекцией подкожно мышам, а затем, когда размер опухолей достигал 50-100 мм3, изменение во внеклеточном матриксе и эффект апоптоза наблюдали при введении 2×106 рпд(бляшкообразующая единица) RdB/IL-12/RLX отдельно или при введении в комбинации с 1,5 мг/кг гемцитабина. В ходе совместного введения RdB/IL-12/RLX вводили внутрь опухоли в общей сложности три раза с интервалом 2 суток и гемцитабин вводили внутрибрюшинно один раз. После этого осуществляли иммуногистологическое окрашивание и окрашивание гематоксилином-эозином (Н & Е), и для того чтобы подтвердить степень апоптоза, осуществляли TUNEL анализ и иммуноокрашивание расщепленной каспазы 3. В то же время группу с введением только PBS использовали в качестве отрицательного контроля.
Как иллюстрируется на фиг. 18, в группе с совместным введением RdB/IL-12/RLX и гемцитабина содержание всех из коллагена I, коллагена IV, фибронектина и эластина в тканях опухолей MIA РаСа-2 значительно снижалось по сравнению с другими группами, которым совместно вводили RdB/IL-12/RLX и гемцитабин. Кроме того, как иллюстрируется на фиг. 19, можно увидеть, что у отрицательного контроля и в группе с введением только гемцитабина или RdB/IL-12/RLX некроз или апоптоз клеток в опухолях почти не протекал или был незначительным, в то время как некроз или апоптоз был активным в группе с совместным введением RdB/IL-12/RLX и гемцитабина. То есть, результат эксперимента вновь подтверждает противоопухолевый эффект, вызванный совместным введением противоракового средства и RdB/IL-12/RLX согласно настоящему изобретению.
Пример 5. Применение селективного к опухоли цитолитического аденовируса, экспрессирующего релаксин, в комбинации с ингибитором иммунных контрольных точек
5-1. Подтверждение противоопухолевого эффекта в подкожной модели меланомы на животных
После того как клетки из линии клеток меланомы B16-F10 вводили инъекцией подкожно мышам в количестве 5×105 клеток/50 мкл на животное, приблизительно через 7-14 суток спустя, когда размер опухолей достигал приблизительно 100-150 мм3, изменение в размере опухолей и выживаемость в животной модели оценивали при введении 5×109 VP RdB/IL-12/RLX отдельно или в комбинации с ингибитором иммунных контрольных точек (антитело к PD-L1 или антитело к PD1) в дозе 200 мкг. В ходе совместного введения RdB/IL-12/RLX вводили внутрь опухоли в День 1, 3 и 5 (в общей сложности три раза) и ингибитор иммунных контрольных точек вводили внутрибрюшинно в День 3, 6 и 9 (в общей сложности три раза). В то же время группу с введением только PBS использовали в качестве отрицательного контроля.
Как иллюстрируется на фиг. 20-23, подтвердили, что в результате совместного введения селективного к опухоли цитолитического аденовируса (RdB/IL-12/RLX) и ингибитора иммунных контрольных точек (антитела к PD-L1 или антитела к PD1), увеличение размера опухолей значительно снижалось, и выживаемость в подкожной модели меланомы на животных значительно улучшалась по сравнению с группой с введением только RdB/IL-12/RLX или ингибитора иммунных контрольных точек. Кроме того, в вышеупомянутом эксперименте противоопухолевый эффект, вызванный отдельным введением селективного к опухоли цитолитического аденовируса RdB/IL-12/RLX, был столь сильным, что было сложно доказать отличный эффект совместного введения. Соответственно, в результате осуществления повторного эксперимента при снижении вводимой концентрации RdB/IL-12/RLX в 5 раз (1×109 VP), как иллюстрируется на фиг. 24, можно подтвердить, что противоопухолевый эффект в группе, которой совместно вводили RdB/IL-12/RLX и ингибитор иммунных контрольных точек (антитело к PD1), был значительным по сравнению с эффектом в группе с введением только RdB/IL-12/RLX. Таким образом, результаты эксперимента указывают на то, что совместное введение RdB/IL-12/IL согласно настоящему изобретению и ингибитора иммунных контрольных точек можно применять в качестве более сильного и более эффективного противоракового терапевтического средства.
5-2. Подтверждение реакции иммунологической памяти в подкожной модели меланомы на животных
Предполагалось проверить противоопухолевую реакцию иммунологической памяти при совместном введении селективного к опухоли цитолитического аденовируса и ингибитора иммунных контрольных точек. Через 50 суток после того, как образовывалась первая опухоль, опухоль вновь образовывалась у мышей, у которых опухоль полностью исчезла (группа с совместным введением RdB/IL-12/RLX и ингибитора иммунных контрольных точек), при введении инъекцией клеток B16-F10 мышам в тех же самых условиях, что и предшествующие условия. После этого, рост опухолей наблюдали таким же образом, что и в предыдущем случае при введении RdB/IL-12/RLX отдельно или RdB/IL-12/RLX в комбинации с ингибитором иммунных контрольных точек (антитело к PD-1 и антитело к PD-L1).
Как иллюстрируется на фиг. 25, подтверждалось, что в случае совместного введения RdB/IL-12/RLX и ингибитора иммунных контрольных точек (антитела к PD-1 и антитела к PD-L1) рост опухолей резко уменьшался. Таким образом, результаты эксперимента указывают на то, что совместное введение RdB/IL-12/RLX согласно настоящему изобретению и ингибитора иммунных контрольных точек также может быть эффективным для лечения рецидивирующего рака посредством индукции сильной противоопухолевой реакции иммунологической памяти.
5-3. Подтверждение противоопухолевого эффекта в животной модели с индуцированной устойчивостью к противораковому средству
В условиях, когда противоопухолевый эффект, вызванный противораковым средством, является несущественным вследствие устойчивости к противораковому средству и т.п., предполагалось проверить противоопухолевый эффект in vivo при совместном введении RdB/IL-12/RLX и ингибитора иммунных контрольных точек (антитело к PD-1; αPD-1). После того как клетки из линии клеток меланомы мыши B16-F10 вводили инъекцией (5×105 клеток) подкожно в бок C57BL/6 мышей, таксол (День 1, 2 и 3; 10 мг/кг) вводили инъекцией внутрибрюшинно в образовавшуюся опухоль (День 1, приблизительно 50 мм3) и после того, как RdB/IL-12/DCN вводили отдельно (День 3, 5, 7 и 9; 5×105 VP), αPD-1 вводили отдельно (День 4, 7, 8 и 10; 200 мкг) или RdB/IL-12/DCN и αPD-1 вводили совместно (в тех же условиях, соответственно), наблюдали рост опухолей. В то же время группу с введением только PBS использовали в качестве отрицательного контроля.
Как иллюстрируется на фиг. 26, через 15 суток после первого введения противоракового средства (т.е. в День 16), когда PBS, таксол или αPD-1 вводили отдельно, размер опухолей составлял 7649,0±798,5 мм3, 5394,5±288,2 мм3 или 5814,2±471,6 мм3, соответственно, подтверждая быстрый рост опухолей, в то время как в группе с введением только RdB/IL-12/RLX или в группе с совместным введением RdB/IL-12/RLX и αPD-1 размер опухолей составлял 2817,1±776,2 мм3 или 633,9±141,9 мм3, соответственно, демонстрируя значительный противоопухолевый эффект. В частности, в группе с совместным введением RdB/IL-12/RLX и αPD-1 размер опухолей уменьшался приблизительно на 77,5% по сравнению с группой с введением только RdB/IL-12/RLX, таким образом, эффект был очень значительным (Р<0,01). Эти результаты эксперимента демонстрируют значительный эффект, заключающийся в том, что совместное введение RdB/IL-12/RLX согласно настоящему изобретению и ингибитора иммунных контрольных точек не только сильнее улучшает противоопухолевый эффект, чем эффект существующих противораковых средств, но также обеспечивает значительный противоопухолевый эффект даже в случае, когда эффект противоракового средства является незначительным вследствие in vivo факторов, таких как устойчивость к противораковому средству.
Пример 6. Подтверждение эффекта селективного к опухоли цитолитического аденовируса, экспрессирующего релаксин, в отношении инфильтрации в опухолевую ткань
Предполагалось подтвердить степень инфильтрации и диффузии терапевтического материала в опухолевые ткани посредством осуществления иммунофлуоресцентного окрашивания. После того как вводили PBS отдельно и совместно вводили PBS и трастузумаб (150 мкг/мышь) или RdB/IL-12/RLX (2,5×1010 VP) и трастузумаб в ткани опухоли желудка NCIN87, сравнивали характеристики инфильтрации и распределения трастузумаба, меченого А1еха488, в опухолевых тканях.
Как иллюстрируется на фиг. 27, подтверждали, что в случае опухолевых тканей, в которые вводили PBS и трастузумаб, трастузумаб более интенсивно распределялся по периферии опухолевой ткани, а не в центре опухолевой ткани, при этом при совместном введении RdB/IL-12/RLX и трастузумаба трастузумаб равномерно распределялся по опухоли, и, в частности, можно увидеть, что трастузумаб диффундировал к центру опухолевой ткани. Кроме того, когда область, отмеченную на фиг. 27, увеличивали и изучали, как иллюстрируется на фиг. 28А-28С, в случае опухолевой ткани, в которую вводили PBS и трастузумаб, инфильтрация трастузумаба повышалась по сравнению с отрицательным контролем, но по мере того как область отдалялась от краевого участка опухолевой ткани, флуоресценция трастузумаба снижалась до уровня отрицательного контроля. Тем не менее, подтверждалось, что в случае опухолевой ткани, в которую совместно вводили RdB/IL-12/RLX и трастузумаб, инфильтрация трастузумаба сохранялась на высоких уровнях не только в краевом участке, но также в центре далеко от краевого участка. Более того, когда кровеносные сосуды опухолевой ткани сильно увеличивали и изучали, как иллюстрируется на фиг. 29А-29С, подтверждали, что в случае опухолевой ткани, в которую вводили PBS и трастузумаб, содержание трастузумаба повышалось только вокруг кровеносных сосудов, в то время как в случае опухолевой ткани, в которую совместно вводили RdB/IL-12/RLX и трастузумаб, трастузумаб инфильтрировал не только в область вокруг кровеносных сосудов, но также в область, отдаленную от кровеносных сосудов. Наконец, чтобы проверить время, в течение которого трастузумаб находится с мишенью в опухолевой ткани, трастузумаб метили64Cu-DOTA, а затем осуществляли визуализацию методом PET. В результате, как иллюстрируется на фиг. 30А и 30В, подтверждали, что при совместном введении RdB/IL-12/RLX (2,5×1010 VP) и трастузумаба трастузумаб, распределяющийся in vivo, концентрировался в опухолевой ткани, когда начинали истекать 15 часов после введения, и трастузумаб все еще оставался в опухолевой ткани до 60 часов после введения по сравнению со случаем, когда вводили PBS и трастузумаб (150 мкг/мышь).
При рассмотрении этих результатов в совокупности ингибирование экспрессии белков внеклеточного матрикса в опухолевых тканях RdB/IL-12/RLX может улучшать противоопухолевый эффект посредством большего усиления эффектов инфильтрации и диффузии трастузумаба в опухолях, благодаря чему RdB/IL-12/RLX применяют в форме введения в комбинации с существующими противораковыми средствами и т.п., тем самым обеспечивая более сильный противоопухолевый эффект.
Вышеизложенное описание настоящего изобретения представлено с целью иллюстрации, и специалист в области техники, к которой относится настоящее изобретение, поймет, что настоящее изобретение может быть легко модифицировано в другие конкретные формы без изменения технического замысла или основных признаков настоящего изобретения. Таким образом, следует понимать, что вышеописанные примеры являются только иллюстративными во всех аспектах, а не ограничивающими.
--->
SEQUENCE LISTING
<110> Genemedicine Co.,Ltd.
<120> ANTICANCER COMPOSITION COMPRISING RECOMBINANT ADENOVIRUS
EXPRESSING DEGRADATION FACTOR FOR EXTRACELLULAR MATRIX
<130> O20170245WO_X17U10C0241
<150> KR 10-2016-0167265
<151> 2016-12-09
<160> 5
<170> PatentIn version 3.2
<210> 1
<211> 648
<212> DNA
<213> Mus musculus
<400> 1
atgtgtcaat cacgctacct cctctttttg gccacccttg ccctcctaaa ccacctcagt 60
ttggccaggg tcattccagt ctctggacct gccaggtgtc ttagccagtc ccgaaacctg 120
ctgaagacca cagatgacat ggtgaagacg gccagagaaa aactgaaaca ttattcctgc 180
actgctgaag acatcgatca tgaagacatc acacgggacc aaaccagcac attgaagacc 240
tgtttaccac tggaactaca caagaacgag agttgcctgg ctactagaga gacttcttcc 300
acaacaagag ggagctgcct gcccccacag aagacgtctt tgatgatgac cctgtgcctt 360
ggtagcatct atgaggactt gaagatgtac cagacagagt tccaggccat caacgcagca 420
cttcagaatc acaaccatca gcagatcatt ctagacaagg gcatgctggt ggccatcgat 480
gagctgatgc agtctctgaa tcataatggc gagactctgc gccagaaacc tcctgtggga 540
gaagcagacc cttacagagt gaaaatgaag ctctgcatcc tgcttcacgc cttcagcacc 600
cgcgtcgtga ccatcaacag ggtgatgggc tatctgagct ccgcctga 648
<210> 2
<211> 1008
<212> DNA
<213> Mus musculus
<400> 2
atgtgtcctc agaagctaac catctcctgg tttgccatcg ttttgctggt gtctccactc 60
atggccatgt gggagctgga gaaagacgtt tatgttgtag aggtggactg gactcccgat 120
gcccctggag aaacagtgaa cctcacctgt gacacgcctg aagaagatga catcacctgg 180
acctcagacc agagacatgg agtcataggc tctggaaaga ccctgaccat cactgtcaaa 240
gagtttctag atgctggcca gtacacctgc cacaaaggag gcgagactct gagccactca 300
catctgctgc tccacaagaa ggaaaatgga atttggtcca ctgaaatttt aaaaaatttc 360
aaaaacaaga ctttcctgaa gtgtgaagca ccaaattact ccggacggtt cacgtgctca 420
tggctggtgc aaagaaacat ggacttgaag ttcaacatca agagcagtag cagttcccct 480
gactctcggg cagtgacatg tggaatggcg tctctgtctg cagagaaggt cacactggac 540
caaagggact atgagaagta ttcagtgtcc tgccaggagg atgtcacctg cccaactgcc 600
gaggagaccc tgcccattga actggcgttg gaagcacggc agcagaataa atatgagaac 660
tacagcacca gcttcttcat cagggacatc atcaaaccag acccgcccaa gaacttgcag 720
atgaagcctt tgaagaactc acaggtggag gtcagctggg agtaccctga ctcctggagc 780
actccccatt cctacttctc cctcaagttc tttgttcgaa tccagcgcaa gaaagaaaag 840
atgaaggaga cagaggaggg gtgtaaccag aaaggtgcgt tcctcgtaga gaagacatct 900
accgaagtcc aatgcaaagg cgggaatgtc tgcgtgcaag ctcaggatcg ctattacaat 960
tcctcatgca gcaagtgggc atgtgttccc tgcagggtcc gatcctag 1008
<210> 3
<211> 597
<212> DNA
<213> Artificial
<220>
<223> IRES sequence
<400> 3
tagcgatccg cccctctccc tccccccccc ctaacgttac tggccgaagc cgcttggaat 60
aaggccggtg tgcgtttgtc tatatgttat tttccaccat attgccgtct tttggcaatg 120
tgagggcccg gaaacctggc cctgtcttct tgacgagcat tcctaggggt ctttcccctc 180
tcgccaaagg aatgcaaggt ctgttgaatg tcgtgaagga agcagttcct ctggaagctt 240
cttgaagaca aacaacgtct gtagcgaccc tttgcaggca gcggaacccc ccacctggcg 300
acaggtgcct ctgcggccaa aagccacgtg tataagatac acctgcaaag gcggcacaac 360
cccagtgcca cgttgtgagt tggatagttg tggaaagagt caaatggctc tcctcaagcg 420
tattcaacaa ggggctgaag gatgcccaga aggtacccca ttgtatggga tctgatctgg 480
ggcctcggta cacatgcttt acatgtgttt agtcgaggtt aaaaaaacgt ctaggccccc 540
gaaccacggg gacgtggttt tccttttgaa aaacacgatg ataatatggc cacaacc 597
<210> 4
<211> 1080
<212> DNA
<213> Homo sapiens
<400> 4
atgaaggcca ctatcatcct ccttctgctt gcacaagttt cctgggctgg accgtttcaa 60
cagagaggct tatttgactt tatgctagaa gatgaggctt ctgggatagg cccagaagtt 120
cctgatgacc gcgacttcga gccctcccta ggcccagtgt gccccttccg ctgtcaatgc 180
catcttcgag tggtccagtg ttctgatttg ggtctggaca aagtgccaaa ggatcttccc 240
cctgacacaa ctctgctaga cctgcaaaac aacaaaataa ccgaaatcaa agatggagac 300
tttaagaacc tgaagaacct tcacgcattg attcttgtca acaataaaat tagcaaagtt 360
agtcctggag catttacacc tttggtgaag ttggaacgac tttatctgtc caagaatcag 420
ctgaaggaat tgccagaaaa aatgcccaaa actcttcagg agctgcgtgc ccatgagaat 480
gagatcacca aagtgcgaaa agttactttc aatggactga accagatgat tgtcatagaa 540
ctgggcacca atccgctgaa gagctcagga attgaaaatg gggctttcca gggaatgaag 600
aagctctcct acatccgcat tgctgatacc aatatcacca gcattcctca aggtcttcct 660
ccttccctta cggaattaca tcttgatggc aacaaaatca gcagagttga tgcagctagc 720
ctgaaaggac tgaataattt ggctaagttg ggattgagtt tcaacagcat ctctgctgtt 780
gacaatggct ctctggccaa cacgcctcat ctgagggagc ttcacttgga caacaacaag 840
cttaccagag tacctggtgg gctggcagag cataagtaca tccaggttgt ctaccttcat 900
aacaacaata tctctgtagt tggatcaagt gacttctgcc cacctggaca caacaccaaa 960
aaggcttctt attcgggtgt gagtcttttc agcaacccgg tccagtactg ggagatacag 1020
ccatccacct tcagatgtgt ctacgtgcgc tctgccattc aactcggaaa ctataagtaa 1080
<210> 5
<211> 558
<212> DNA
<213> Homo sapiens
<400> 5
atgcctcgcc tgttcttgtt ccacctgcta gaattctgtt tactactgaa ccaattttcc 60
agagcagtcg cggccaaatg gaaggacgat gttattaaat tatgcggccg cgaattagtt 120
cgcgcgcaga ttgccatttg cggcatgagc acctggagca aaaggtctct gagccaggaa 180
gatgctcctc agacacctag accagtggca gaaattgtac catccttcat caacaaagat 240
acagaaacta taattatcat gttggaattc attgctaatt tgccaccgga gctgaaggca 300
gccctatctg agaggcaacc atcattacca gagctacagc agtatgtacc tgcattaaag 360
gattccaatc ttagctttga agaatttaag aaacttattc gcaataggca aagtgaagcc 420
gcagacagca atccttcaga attaaaatac ttaggcttgg atactcattc tcaaaaaaag 480
agacgaccct acgtggcact gtttgagaaa tgttgcctaa ttggttgtac caaaaggtct 540
cttgctaaat attgctga 558
<---
Реферат
Изобретение относится к биотехнологии, в частности к противораковой композиции, содержащей рекомбинантный аденовирус, который экспрессирует разрушающие факторы для внеклеточного матрикса. Рекомбинантный аденовирус согласно настоящему изобретению проявляет отличный противоопухолевый эффект посредством значительного снижения содержания основных структурных компонентов внеклеточного матрикса в опухолевой ткани, в том числе коллагена I, коллагена III, фибронектина, эластин и т.п., а также посредством экспрессии терапевтического гена на высоком уровне избирательно только в опухолевых клетках вследствие пролиферации вируса. В особенности, при введении в комбинации с терапевтическими материалами, такими как противораковые средства или ингибиторы иммунных контрольных точек, рекомбинантный аденовирус значительно повышает диффузию и распространение совместно вводимых терапевтических материалов в опухолевых тканях, при этом обеспечивая возможность проявления существующих противораковых эффектов, тем самым дополнительно улучшая противораковый эффект. Соответственно, настоящее изобретение может быть доступно в качестве основной методики в области лечения рака. 8 з.п. ф-лы, 6 пр., 30 ил.

Комментарии