Покрытые онколитические аденовирусы для противораковых вакцин - RU2695375C2
Код документа: RU2695375C2
Чертежи















Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к аденовирусным векторам, где вирусный капсид покрывали полипептидами, которые способны стимулировать пептидоспецифичный иммунный ответ у субъекта, и к их применениям. Кроме того, настоящее изобретение относится к способам лечения заболеваний, например, рака, аденовирусными векторами, которые покрывали полипептидами, вызывающими пептидоспецифичный иммунный ответ. Также настоящее изобретение относится к способу покрытия аденовирусных векторов специфическими пептидами, а также к способу идентификации тех пептидов, которые подходят для покрытия капсида аденовирусного вектора.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Рак представляет собой смертельное заболевание, нуждающееся в более эффективных способах лечения. Онколитические вирусы представляют значительный интерес, поскольку они имеют потенциал к тому, чтобы быть более безопасными и эффективными, чем любая другая стандартная терапия. Однако у раковых пациентов общий терапевтический эффект был умеренным. Существует множество исследований по модифицированию аденовирусных векторов для того, чтобы найти оптимальные средства для терапий. Одним аспектом регулирования функции аденовирусов является модификация поверхности вируса. Хорошо известны как генетические, так и негенетические модификации поверхностей аденовирусов.
Например, Stevenson М et al. (Cancer Gene Therapy (2007) 14, 335-345) акцентирует внимание на усилении доставки аденовирусных векторов к сайтам-мишеням. Stevenson et al. описывают исследование, в котором аденовирусные векторы нацелены на инфицированные клетки посредством интегринов, которые селективно экспресируются на метастатических опухолевых клетках. С этой целью в поверхность вирусов, покрытых полимером, включали пептид (-SIKVAV-), происходящий из ламинина.
В WO 2013/116778 описан иммунологически усиленный аденовирус против рака. Аденовирус был модифицирован вставкой в его геном трансгена опухолевого антигена таким образом, что опухолевый антиген экспрессируется во время цикла репликации вируса и презентируется непосредственно МНС-I (главный комплекс гистосовместимости класса-I). Данный способ является очень медленным и слишком трудозатратым и дорогим для индивидуализированных терапий, поскольку требуется получение нового вируса для каждого другого опухолевого антигена (например, необходимо клонировать новый вирус для каждого пептида, который желательно экспрессировать).
В самом деле, существует потребность в простых и улучшенных аденовирусных средствах и способах для терапевтических средств, особенно для индивидуализированных терапий. Согласно настоящему изобретению предложены аденовирусные приложения для управления иммунным ответом у субъекта с использованием вируса в качестве системы доставки пептидов, но не включающие генетическую манипуляцию с вирусом.
Настоящее изобретение относится к применению онколитических аденовирусов в качестве платформы для доставки пептидов, специфичных в отношении пациента и заболевания, и, следовательно, для преобразования иммунитета против капсида в иммунный ответ, специфичный в отношении пептида (например, противоопухолевый иммунитет).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложена новая и мощная адаптируемая к индивидуальным потребностям платформа иммунотерапии (например, раковой иммунотерапии). Целью является предложение аденовирусного вектора с модифицированной поверхностью вируса, его применения и способ лечения заболевания посредством стимулирования пептидоспецифичного (т.е. противопептидного) иммунного ответа для решения проблем, например, неэффективных, медленных, дорогих и трудозатратных аденовирусных терапий, а также непригодности аденовирусных терапий для индивидуализированной медицины. Цели изобретения достигаются посредством схемы и способа, которые характеризуются тем, что утверждается в независимых пунктах формулы изобретения. Предпочтительные воплощения изобретения раскрыты в зависимых пунктах формулы изобретения.
Посредством настоящего изобретения могут быть преодолены проблемы предшествующего уровня техники, например, недостаток специфичности и иммунодоминирование онколитических аденовирусов.
Иммунные ответы, генерированные аденовирусной инфекцией, нацелены преимущественно на вирус, а не на опухоль. Кроме того, большая часть противовирусного иммунитета направлена против белков капсида. В настоящем изобретении данные проблемы будут преодолены. В самом деле, настоящее изобретение основано на идее о том, что покрытие вирусного капсида пептидами, происходящими из опухолевых белков, перенацеливает противовирусный иммунитет на опухоль (Фиг. 3). Пептиды, ограниченные главным комплексом гистосовместимости I (МСН-I), установленные на капсиде онколитического аденовируса, переводят противокапсидный иммунитет в противоопухолевый иммунитет.
Просто при введении пептида(дов) и вируса(сов) в виде одной физически связанной единицы и сигнал опасности (вирус), и опухолевый антиген (пептид) будут попадать в ту же самую антигенпрезентирующую клетку для максимального противоопухолевого эффекта. Клинический опыт уже показал то, что вакцинация только одним пептидом приводит к временному и субоптимальному иммунному ответу, не способному к контролю роста опухоли1. Соответственно, в то время как онколитические вирусы являются перспективными в качестве монотерапии, иммунный ответ, который они вызывают, нацелен, главным образом, против вируса, а не опухоли. Даже если пептид и вирус инъецируются в один и тот же анатомический участок, они не эффективно поступают в ту же самую клетку, поскольку они не связаны в одной терапевтической единице - данные аспекты являются критически важными для достижения правильной и максимальной иммунной активации2. Физическое связывание пептида и аденовируса в одной терапевтической единице является значительным улучшением по сравнению с существующими технологиями вакцин против рака на основе вируса и пептида. В отличие от рекомбинантных вирусов предшествующего уровня техники, генетически модифицированных для экспрессии одного антигена или пептида, ассоциированного с опухолью, настоящее изобретение делает возможным достижение индивидуализированной медицины значительно более быстрым и более дешевым способом, чем ранее. В самом деле, согласно настоящему изобретению пептиды, присоединенные к вирусному капсиду, не кодируются аденовирусным вектором.
Одним аспектом настоящего изобретения является технология, обеспечивающая постоянный и быстрый мониторинг презентации опухолевых антигенов в виде маленьких пептидов (ограниченных МНС-I). В настоящем изобретении используется преимущество пептидов, специфичных в отношении заболевания (например, опухоли) и пациента, которые одновременно презентируются на опухолевых клетках и до, и после аденовирусной терапии (т.е. которые не маскируются или не редактируются после терапии) и на дендритных клетках (DC) после аденовирусной терапии. После идентификации данных специфических пептидов их можно синтезировать и размещать на капсиде онколитического аденовируса для достижения сильного противоопухолевого иммунитета. Этим способом можно обеспечивать то, что опухоль эффективно служит в качестве мишени для цитотоксических Т-клеток (CTL) также и после виротерапии, за счет чего становится невозможным избежание иммунологического ответа, поскольку иммунная система нацелена на вирус. Наоборот, посредством сравнения пептидов, появляющихся на DC после вирусной терапии в присутствии или в отсутствие опухоли, можно устранять «только вирусные» пептиды и находить пептиды, происходящие из опухолевых клеток, которые индуцируют ответ CTL.
Индивидуализированный покрытый аденовирус может быть получен всего-лишь через две недели после биопсии; это становится возможным благодаря тому, что выделение и секвенирование пептидов из МНС, а также автоматизированный синтез являются быстрыми процессами, и вирус (например, тот же самый каркасный вирус для всех пептидов) может быть накоплен в больших количествах, ожидая покрытия. Само покрытие осуществляется за один час, после чего покрытый аденовирус готов для инъекции. Это является весьма уникальной характеристикой системы авторов изобретения, так как она предотвращает любую генетическую манипуляцию с вирусом, которая замедляет процесс, делая невозможным «метод с индивидуализированной вакциной».
Настоящее изобретение также делает возможным открытие новых иммуногенных опухолеспецифичных пептидов.
Помимо противораковой терапии, покрытый аденовирус по настоящему изобретению можно использовать для лечения любых других заболеваний в ситуации, когда необходим более сильный и пептидоспецифичный иммунный ответ.
Настоящее изобретение относится к способу стимулирования пептидоспецифичного иммунного ответа у субъекта, нуждающегося в этом, где данный способ включает введение субъекту аденовирусных векторов, содержащих полипептиды, присоединенные к вирусному капсиду. Настоящее изобретение также относится к способу стимулирования пептидоспецифичного иммунного ответа у субъекта, нуждающегося в этом, где данный способ включает введение субъекту аденовирусных векторов, содержащих полипептиды, присоединенные к вирусному капсиду, где данные полипептиды не были генетически закодированы указанным аденовирусным вектором.
Настоящее изобретение дополнительно относится к аденовирусному вектору, содержащему полипептиды, присоединенные к вирусному капсиду, для применения в стимулировании пептидоспецифичного иммунного ответа у субъекта. Настоящее изобретение также относится к аденовирусному вектору, содержащему полипептиды, присоединенные к вирусному капсиду, для применения в стимулировании пептидоспецифичного иммунного ответа у субъекта, где данные полипептиды не были генетически закодированы указанным аденовирусным вектором.
Настоящее изобретение дополнительно относится к способу лечения рака у субъекта, нуждающегося в этом, включающему введение субъекту аденовирусных векторов, содержащих полипептиды, которые способны стимулировать пептидоспецифичный иммунный ответ у субъекта, и которые были присоединены к вирусному капсиду. Настоящее изобретение также относится к способу лечения рака у субъекта, нуждающегося в этом, где данный способ включает введение субъекту аденовирусных векторов, содержащих полипептиды, которые способны стимулировать пептидоспецифичный иммунный ответ у субъекта, и которые были присоединены к вирусному капсиду, где данные полипептиды не были генетически закодированы указанным аденовирусным вектором.
Также настоящее изобретение относится к аденовирусному вектору, содержащему полипептиды, которые способны стимулировать пептидоспецифичный иммунный ответ у субъекта, и которые были присоединены к вирусному капсиду, для применения в лечении рака у субъекта. Настоящее изобретение также относится к аденовирусному вектору, содержащему полипептиды, которые способны стимулировать пептидоспецифичный иммунный ответ у субъекта, и которые были присоединены к вирусному капсиду, для применения в лечении рака у субъекта, где данные полипептиды не были генетически закодированы указанным аденовирусным вектором.
Кроме того, настоящее изобретение относится к аденовирусному вектору, где вирусный капсид был соединен с полипептидами, и где аденовирусный вектор, соединенный с полипептидами, способен стимулировать пептидоспецифичный иммунный ответ у субъекта.
Кроме того, настоящее изобретение относится к способу покрытия капсида аденовируса, включающему связывание полипептидов, которые способны стимулировать пептидоспецифичный иммунный ответ у субъекта, с аденовирусным капсидом ковалентно или нековалентно. Настоящее изобретение также относится к способу модифицирования капсида аденовируса, включающему связывание полипептидов, модифицированных полилизином, с аденовирусным капсидом ковалентно или нековалентно, где модифицированный аденовирусный вектор способен стимулировать пептидоспецифичный иммунный ответ у субъекта.
Кроме того, настоящее изобретение относится к применению полипептидов (например, полипептидов, модифицированных полилизином), которые способны стимулировать пептидоспецифичный иммунный ответ у субъекта, для покрытия капсида аденовируса посредством ковалентного или нековалентного присоединения или связывания полипептидов с капсидом.
Аденовирусный вектор и способы по изобретению используются для преобразования противовирусного иммунитета в антипептидный иммунитет. Модифицированный вирусный вектор по изобретению вызывает у субъекта антипептидный ответ.
Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей аденовирусный вектор по изобретению.
И, кроме того, настоящее изобретение относится к способу идентификации опухолеспецифичных и MHC-I-специфичных полипептидов от субъекта, причем указанный способ включает:
1) инфицирование опухолевых клеток субъекта аденовирусными векторами;
2) инфицирование дендритных клеток субъекта аденовирусными векторами;
3) выделение молекул МНС-I из опухолевых клеток стадии 1) и из дендритных клеток стадии 2) и идентификацию MHC-I-ассоциированных полипетидов из обеих групп;
4) выделение молекул MHC-I из неинфицированных опухолевых клеток и идентификацию MHC-I-ассоциированных полипептидов;
5) идентификацию тех полипептидов, которые были презентированы инфицированными и неинфицированными опухолями стадий 3) и 4) и дендритными клетками стадии 3).
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Далее изобретение будет описано с большими подробностями посредством предпочтительных воплощений со ссылкой на прикрепленные графические материалы, в которых:
На Фиг. 1 показана схема настоящего изобретения, где модифицированный аденовирус способен реплицироваться и умерщвлять раковые клетки при перенацеливании противовирусного иммунного ответа на опухоль.
На Фиг. 2 показано иммунодоминирование противоаденовирусного ответа (левый столбик) относительно противоопухолевого ответа (правый столбик). Мыши) Мышей C57BL/6, несущих опухоль B16-OVA, обрабатывали PBS (фосфатно-солевой буферный раствор) (имитация), Ad5D24 (немодифицированный онколитический вирус) и Ad5D24-CpG (более иммуногенный онколитический вирус). Отбирали Т-клетки из опухоли, и проводили ELISPOT (метод иммуноферментных пятен) IFN-гамма (интерферон-гамма) для оценки противоопухолевого ответа и противоаденовирусного ответа. Раковые пациенты) ELISPOT IFN-гамма проводили на РВМС (одноядерные клетки периферической крови) от пациентов, обработанных онколитическим аденовирусом, кодирующим GMCSF (гранулоцитарно-макрофагальный колониестимулирующий фактор (Ad5D24-GMCSF)15. Для стимуляции РВМС перед ELISPOT использовали пептиды, полученные из Ad5 (противовирусные) и пептиды, полученные из сурвивина (противоопухолевые).
На Фиг. 3 показано то, что покрытые аденовирусы по настоящему изобретению представляют собой преимущество относительно существующей технологии. А) Онколитический аденовирус имеет способность стимулировать АРС (антигенпрезентирующие клетки) презентировать не только вирусные антигены (что приводит к противовирусному ответу) (другой антиген, презентируемый на клетке на Фиг. А), но также и, в качестве побочного эффекта, опухолевые антигены (другой антиген, презентируемый на клетке на Фиг. А), что приводит к противоопухолевому иммунитету. Противоопухолевые Т-клетки отмечены как две самые нижние клетки группы Т-клеток. Б) Покрытые аденовирусы по настоящему изобретению будут способствовать презентированию опухолевого антигена (отмеченного в виде обоих антигенов, презентируемых на клетке на Фиг. Б), так как их капсид покрыт готовыми к использованию МНС-I опухолеспецифичными антигенами (пептидами). Этим способом противокапсидный иммунитет может быть перенаправлен на противоопухолевый иммунитет. Противоопухолевые Т-клетки отмечены в виде четырех самых нижних клеток группы Т-клеток. Сокращение АРС в том виде, в котором оно здесь используется, относится к антигенпрезентирующим клеткам, сокращение ТАА относится к антигену, ассоциированному с опухолью, и фраза «активация PRR» относится к активации паттерн-распознающего рецептора. PRR представляют собой белки, экспрессируемые клетками врожденной иммунной системы для идентификации ассоциированных с патогеном молекулярных паттернов, которые, например, ассоциированы с микробными патогенами.
На Фиг. 4 показаны претерпевающие наиболее сильную повышенную регуляцию биологические функции сети дендритных клеток, подвергнутых воздействию онколитического аденовируса. Человеческие первичные дендритные клетки отбирали и культивировали в течение двух недель с IL4 (интерлейкин-4) и GMCSF. На эти клетки оказывали импульсное воздействие онколитического аденовируса (Ad5D24) в количестве 10 VP (вирусные частицы)/клетку. Через 72 ч отбирали общую РНК и анализировали на Agilent SurePrint G3 human 8×60k (мРНК). Затем анализировали данные с использованием программы Ingenuity Pathway.
На Фиг. 5 показана схема, представляющая открытие новых иммуногенных ассоциированных с опухолью пептидов, ограниченных MHC-I. Разные условия позволяют авторам изобретения подбирать пептиды, которые экспрессирует опухоль, с пептидами той же самой опухоли, которые презентируют дендритные клетки. Это является ключевой характеристикой в данной системе, облегчающей идентификацию иммуногенных пептидов. А) Дендритные клетки подвергали импульсному воздействию онколизата опухоли для обеспечения презентирования опухолевых антигенов. Б) Не подвергавшиеся импульсному воздействию дендритные клетки созревали и были проанализированы. Это служит в качестве контроля для последующего устранения собственных пептидов, презентируемых DC. В) Инфицированную линию опухолевых клеток (те же самые, что и при условии А) инфицировали онколитическим аденовирусом и анализировали перед полным лизисом (меньше, чем 48 ч). Данное условие помогает авторам изобретения различать то, оказывает ли аденовирус значимое влияние на качество презентируемых опухолевых антигенов. Г) Здесь указана неинфицированная опухоль, которая презентирует опухолевые антигены и собственные пептиды (естественно, эти две группы могут быть одинаковыми) на МНС-I.
На Фиг. 6 показана схема OVA-специфичных покрытых вирусов. А) В данном случае, поскольку авторы изобретения знают весь подвергнутый процессингу пептид куриного овальбумина (OVA), авторы изобретения покрыли вирус OVA-специфичным иммуногенным пептидом (SIINFEKL) (SEQ ID NO: 1). Затем авторы изобретения получили другие покрытые вирусы для использования в качестве контролей, такие как SIINFDL (SEQ ID NO: 2) (антагонист) и FILKSINE (SEQ ID NO: 3) (скремблированный вариант), а также непокрытые вирусы. Б) Как только было получено подтверждение концепции, авторы изобретения начали исследование II поколения аденовирусов, которые покрыты различными пептидами. (Сокращение PeptiCRAd относится к онколитическому аденовирусу, покрытому пептидами).
На Фиг. 7 показана схема, представляющая три разные стратегии для получения онколитического аденовируса, покрытого пептидом.
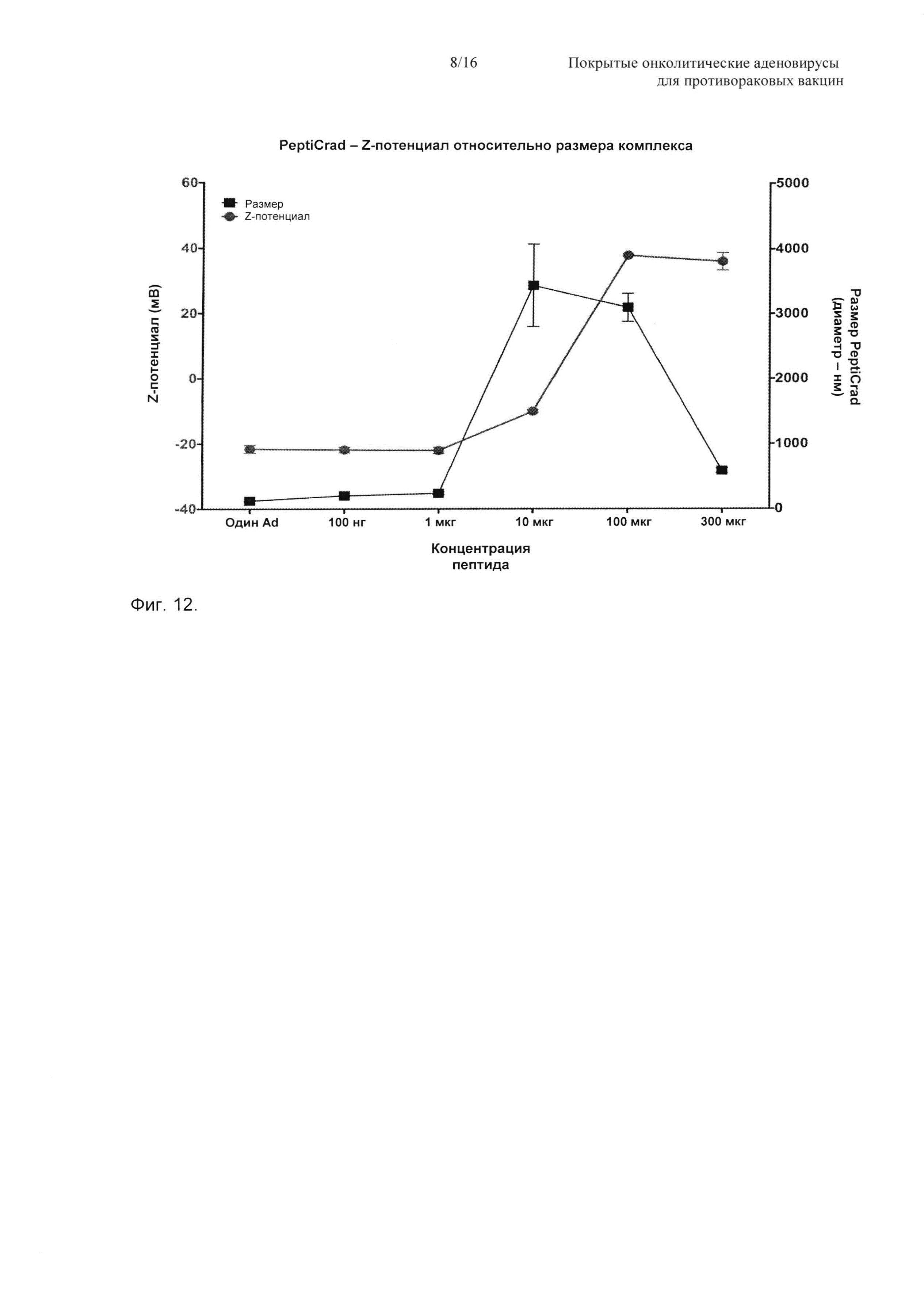
На Фиг. 8 показано образование комплекса между онколитическими аденовирусами и опухолеспецифичными пептидами и взаимодействие между модифицированными эпитопами и онколитическими аденовирусами. На Фиг. 8А показано образование комплекса между онколитическим аденовирусом Ad5D24 и опухолеспецифичными пептидами. Линия «Z-потенциала») 1×1010 вирусных частиц конъюгировали с разными концентрациями положительно заряженного опухолеспецифичного пептида. После реакции измеряли Z-потенциал одиночных частиц. Линия «размера») 1×1010 вирусных частиц конъюгировали с разными концентрациями положительно заряженного опухолеспецифичного пептида. Затем измеряли размер одиночных частиц и приводили в виде функции от концентрации пептида. Когда Z-потенциал составляет от -20 мВ до +20 мВ, имеется резкое изменение размера комплекса, показывающего высокую степень полидисперсности (вероятно, агрегация вируса), но данное сотояние возвращается к нормальному при более высокой концентрации пептидов, свидетельствуя о том, что комплекс (PeptiCRAd) полностью покрывается без возможности образования диполя, который стимулирует образование агрегатов (высокая полидисперсность). На Фиг. 8Б показано взаимодействие между модифицированным эпитопом SIINFEKL MHC-I и онколитическими аденовирусами. Взаимодействие вирус/пептид измеряли посредством SPR (поверхностный плазмонный резонанс). Сенсор на основе диоксида кремния SiO2 APTES покрывали Ad5D24, и возрастающие концентрации (0,15; 0,3; 0,6; 1,2; 2,4 и 7,2 мкМ) либо SIINFEKL (пунктирная линия), либо полиK-SIINFEKL (сплошная линия) инъецировали в проточную систему. Ответ сигнала SPR показан в течение эксперимента.
На Фиг. 9 показано то, что покрытый аденовирус Ad5D24 по настоящему изобретению (PeptiCRAd) демонстрирует усиленную активность умерщвления клеток по сравнению с непокрытым онколитическим вирусом. Репрезентативный анализ жизнеспособности клеток (анализ с MTS (внутренняя соль 5-3-карбоксиметоксифенил-2-4,5-диметилтиазолил-3-4-сульфофенилтетразолия)) проводили на линии раковых клеток аденокарциномы легкого (А549). Клетки высевали на сутки 0, инфицировали при указанной множественности заражения на сутки 1, тест останавливали и анализировали на сутки 3.
На Фиг. 10 показано то, что OVA-специфичный аденовирус усиливает OVA-специфичный иммунитет. Мышам, несущим подкожные опухоли B16-OVA, инъецировали в опухоль: PBS, онколитический вирус (Ad5D24), онколитический вирус + пептиды SIINFEKL (не образующие комплекс), онколитический вирус + SIINFEKL (образующий комплекс в виде одного соединения, PeptiCRAd). А) Рост опухоли измеряли и приводили в показанные моменты времени. Б) Специфичный иммунитет в отношении SIINFEKL оценивали проточной цитометрией (анализ пентамеров).
На Фиг. 11 показана постоянность методики покрытия пептидом. На данной Фиг. показан полный заряд двух разных онколитических аденовирусов, покрытых модифицированным пептидом (6K-SIINFEKL). Два вируса, использованных в данном примере, представляют собой Ad5D24-CpG (онколитический аденовирус, генетически модифицированный так, чтобы его геном был обогащен островками CpG) и Ad5D24-RFP, который представляет собой онколитический аденовирус, кодирующий красный флуоресцентный белок, для облегчения визуализации in vitro и in vivo; (RFP означает красный флуоресцентный белок).
На Фиг. 12 показана корреляция между полным зарядом PeptiCRAd и его размером. В данном примере авторы изобретении начали с непокрытого вируса (полный заряд примерно -25-30 мВ), добавляя затем возрастающую концентрацию пептидов, с образованием комплекса, который авторы изобретения называют PeptiCRAd. Она показывает, что чем больше пептидов добавляли авторы изобретения, тем больше изменялся полный заряд вируса от отрицательных до положительных значений, в конце, когда образовался комплекс PeptiCRAd, полный заряд вируса, покрытого пептидом, составлял примерно +30-35 мВ.
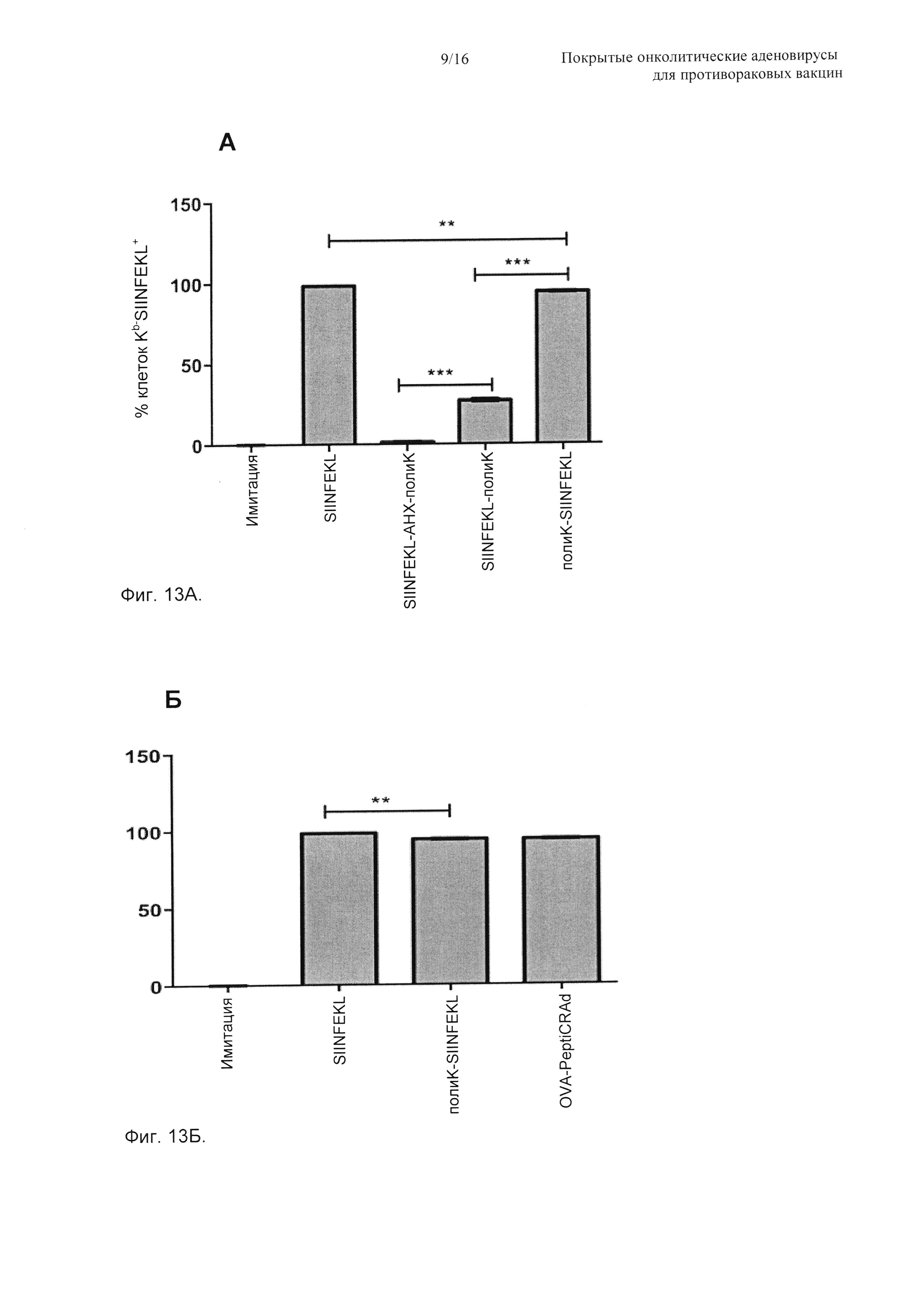
На Фиг. 13 показано перекрестное презентирование модифицированных аналогов SIINFEKL на MHC-I, адсорбированных или неадсорбированных на вирусном капсиде. Селезенки отбирали у мышей C57BL/6 (Н-2Kb), и суспензию одиночных клеток получали в ростовых средах RPMI-1640 с 10% FBS (фетальная телячья сыворотка). (А) Всего 2×106 спленоцитов инкубировали с 200 мкл сред, содержащих немодифицированный SIINFEKL (позитивный контроль), SIINFEKL-AHX-полиK, содержащий аминокапроновую кислоту (негативный контроль), SIINFEKL-полиK, удлиненный на С-конце, или полиK-SIINFEKL, удлиненный на N-конце (0,19 мкг/мкл). После 2 ч инкубации при 37°С клетки промывали и окрашивали АРС против Н-2Kb, связанными с SIINFEKL, или изотипическим контролем. (Б) аналогично (А) свежие мышиные спленоциты инфицировали OVA-PeptiCRAd (100 vp/клетку + 37,5 мкг пептида) и 37,5 мкг SIINFEKL (позитивный контроль) или полиK-SIINFEKL. После 2 ч инкубации образцы промывали и анализовали проточной цитометрией. Данные показаны как среднее ± SEM (стандартная ошибка среднего). Значимость оценивали с использованием однофакторного ANOVA (дисперсионный анализ) с критерием множественных сравнений Бонферрони; * Р<0,05; ** Р<0,01; *** Р<0,001.
На Фиг. 14 показано то, что PeptiCRAd сохраняет интактную онколитическую активность и демонстрирует повышенную инвазионную способность в линиях клеток с низкой экспрессией CAR (рецептор вируса коксаки и аденовируса). (А) Клетки высевали в плотности 1×104 клеток на лунку и инфицировали OVA-PeptiCRAd или непокрытым Ad5D24 с использованием разных отношений vp/клетку (0,1, 1, 10 и 100). Пептид полиK-SIINFEKL (пунктирная линия, кружки) включали в качестве контроля. Жизнеспособность клеток затем определяли посредством анализа с MTS. Данные показаны в виде среднего ± SEM (n равно 3). (Б) Исследование вирусной инвазионной способности посредством ICC (иммуноцитохимия). Всего 2×105 клеток на лунку высевали в 24-луночный планшет и инфицировали 100 мкл раствора вируса (10 vp/клетку), содержащего либо OVA-PeptiCRAd, либо Ad5D24 (контроль), на следующие сутки. После двух суток инкубирования проводили ICC против гексона, и получали пять неперекрывающихся изображений с использованием цифрового микроскопа. Представлено среднее число пятен на видимое поле. Данные из репрезентативного эксперимента показаны в виде среднего ± SEM (n равно 2-3). Значимость оценивали с использованием непарного t-критерия с поправкой Уэлча; * Р<0,05, ** Р<0,01, *** Р<0,001.
На Фиг. 15 показана противоопухолевая эффективность PeptiCRAd и иммунологический анализ антигенспецифичных Т-клеток CD8+ и DC. (А) Мыши C57BL/6 (n=6) получали 3×105 клеток B16-OVA в оба бока. Обработку начинали через 9 суток и включали физиологический раствор (имитация), пептид (SIINFEKL) сам по себе, вирус (Ad5D24-CpG) сам по себе, смесь вируса и пептида (Ad5D24-CpG + SIINFEKL) и комплекс вирус-пептид (OVA-PeptiCRAd). Мышей обрабатывали три раза (на сутки 0, 2 и 7). Затем измеряли размер опухоли и представляли в виде среднего ± SEM как функцию времени. Статистический анализ проводили с использованием двухфакторного ANOVA с критерием множественных сравнений Бонферрони. * Р<0,05, ** Р<0,01, *** Р<0,001. Опухоли, селезенки и паховые лимфатические узлы отбирали у мышей (n=3-4) в два момента времени: на 7-е сутки (рано) (Б) и 16-е сутки (поздно) (В). Затем определяли долю SIINFEKL-специфичных Т-клеток CD8+посредством выделения клеток CD19+. Процентная доля Т-клеток CD8+OVA+ представлена в виде среднего ± SEM. (Г) Средний размер опухоли в конце эксперимента (линейная у ось) откладывали на графике против средней процентной доли двойных позитивных Т-клеток CD8+OVA+ (log10 × ось). Также рассчитывали значения Пирсона r и r2 и откладывали их на графике для каждого набора образцов. (Д) Определяли кратность изменения DC, показывающих зрелый профиль и перекрестно презентирующих SIINFEKL на своих молекулах MHC-I. Зрелые DC определяли как клетки CD19-CD3- CD11c+CD86высокий. АРС, конъюгированные с антителами против мышиного H-2Kb, связанные с SIINFEKL, использовали для отслеживания перекрестной презентации SIINFEKL на MHC-I в выбранном пуле DC.
На Фиг. 16 показано то, что нацеливание на два опухолевых антигена с использованием PeptiCRAd уменьшает рост и обработанной, и удаленной, необработанной опухолей. Одну первичную опухоль пересаживали мышам C57BL/6 на правый бок с использованием 1×105 меланомных клеток B16-F10. Обработка начиналась на сутки 10. На сутки 16 мыши получали 3×105 клеток B16-F10 в их левый бок. (А) Приводится рост первичной (правой) опухоли, и данные представлены как среднее ± SEM (n=5). Значимость определяли с использованием двухфакторного ANOVA с критерием множественных сравнений Бонферрони. * Р<0,05, ** Р<0,01, *** Р<0,001. (Б) Размер вторичных (левых) опухолей в конце эксперимента приводится на log2 шкале. Значимость оценивали с использованием U-критерия Манна-Уитни; * Р<0,05, ** Р<0,01, *** Р<0,001. (В) Отбирали селезенки и паховые лимфатические узлы, и уровень TRP-2- и hgp100-специфичных Т-клеток CD8+ определяли в каждом органе посредством окрашивания пентамера MHC-I. Процентную долю эпитопспецифичных Т-клеток CD8+, обнаруженных в каждом органе, нормировали относительно имитации, и она представляется в виде совокупного относительного ответа для каждой экспериментальной группы.
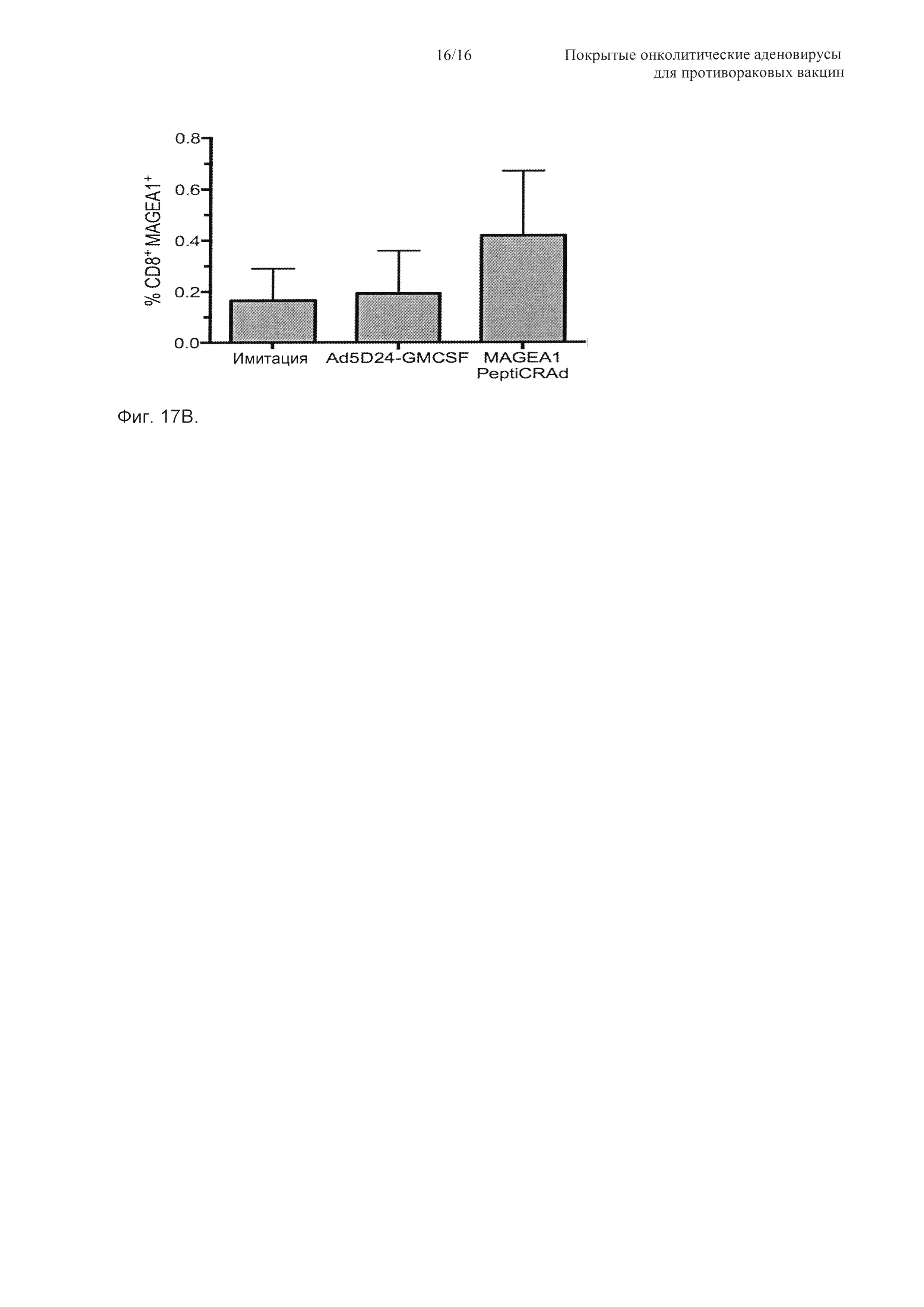
На Фиг. 17 показана эффективность PeptiCRAd у гуманизированных мышей, несущих человеческие меланомы. Тройные нокаутные мыши NGS получали 2×106 человеческих меланомных клеток (SK-MEL-2) в каждый бок. При достижении опухолями среднего диаметра 4-5 мм группа мышей (n равно 3) получала человеческие РВМС от здорового донора, соответствующего по HLA-A (антиген лейкоцитов человека А), тогда как другая группа мышей (n равно 2) не получала РВМС. Мышей затем обрабатывали (в сутки 0, 2 и 4) одним из следующего: 1) физиологический раствор (имитация), 2) Ad5D24-GM-CSF и 3) MAGE-A1 PeptiCRAd. Объем опухоли гуманизированных мышей (А) представлен в виде среднего ± SEM. Значимость оценивали с использованием двухфакторного ANOVA с критерием множественных сравнений Бонферрони; * Р<0,05, ** Р<0,01, *** Р<0,001, **** Р<0,0001. (Б) Для каждой группы гуманизированных мышей представлена площадь под кривой (AUC) относительно размера опухоли. (В) Объем опухоли негуманизированных мышей приводится в виде среднего ± SEM (**** Р<0,0001).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Иммунология опухоли и иммунопептидом
Дендритные клетки (DC) представляют собой профессиональные антигенпрезентирующие клетки, происходящие из костного мозга. DC представляют собой оптимальные антигенпрезентирующие клетки для презентирования эпитопов опухолевых антигенов Т-клеткам CD8+ и CD4+3. Экзогенные антигены можно загружать на МНС класса I для «перекрестного презентирования» Т-клетке CD8+4. Перекрестное презентирование представляет собой явление, результат которого определяется статусом активации DC5. В раковых клетках степень созревания DC, которое приводит к перекрестному презентированию опухолевого антигена, обычно является очень низкой из-за агрессивного микроокружения в опухоли и также возникающей из-за опухоли иммунодепрессии в местных лимфатических узлах. Данные препятствия могут быть преодолены посредством онколитической виротерапии, так как разрушающие опухоль вирусы обеспечивают необходимые «сигналы опасности» для управления активацией DC и препятствуют вызванной опухолью иммунодепрессии, экспонируя скрытые иммуногенные антигены6-8.
Онколитические аденовирусы, также известные как реплицирующие в зависимости от условий аденовирусы (CRAd), являются генетически модифицированными для репликации и умерщвления только раковых клеток9,10. Известно то, что индуцируемый вирусом апоптоз и/или некроз опухоли приводит к высвобождению больших количеств ассоциированных с опухолью белков, которые обычно являются недоступными для антигенпрезентирующих клеток, что управляет эффективным перекрестным презентированием DC, ассоциированными с опухолью, в лимфатических узлах, дренирующих эту опухоль11-13.
В общем, было обнаружено, что вирусная терапия рака хорошо переносится, однако, общая эффективность лечения оставалась умеренной; при тщательном изучении иммунологических эффектов виротерапии наблюдали явное преобладание вируса над опухолью как у мышей, так и у человека (Фиг. 2). Покрытие капсида аденовируса синтетическими специфичными для опухоли пептидами, ограниченными MHC-I, будет «обманывать» антигенпрезентирующие клетки (АРС), заставляя их презентировать данные опухолевых антигенов в виде части вируса. Другими словами, в настоящем изобретении использование капсида аденовируса в качестве каркаса для доставки пептидов, ограниченных MHC-I, сдвинуло бы иммунный ответ от вируса к опухоли.
Термин молекулы «главного комплекса гистосовместимости класса I» в том виде, как он здесь используется, относится к одному из двух первичных классов молекул главного комплекса гистосовместимости (МНС) (причем другим является МНС класса II), и они обнаруживаются почти на каждой содержащей ядро клетке организма. Их функцией является демонстрация фрагментов белков изнутри клетки для Т-клеток; здоровые клетки будут игнорироваться, тогда как клетки, содержащие чужеродные белки, будут атаковаться иммунной системой. Молекулы МНС класса I связывают пептиды, генерированные, главным образом, в результате деградации цитозольных белков протеасомой. Комплекс МНС I : пептид затем вставляется в плазматическую мембрану клетки. Пептид связывается внеклеточной частью молекулы МНС класса I. Таким образом, функцией МНС класса I является демонстрация внутриклеточных белков цитотоксическим Т-клеткам (CTL). Однако МНС класса I также презентируют пептиды, генерированные из экзогенных белков, в процессе, известном как перекрестная презентация. Термин «полипептиды, специфичные для МНС-I», в том виде, как он здесь используется, относится к тем пептидам, которые связываются с МНС-I, т.е. с внеклеточной частью молекулы МНС класса I, и демонстрируются для CTL.
Все пептиды MHC-I (MIP) в совокупности называются иммунопептидомом14. Только недавно, с применением передовых технологий, появилась возможность начать исследоваь иммунопептидом MHC-I. Решающим отличием в настоящем изобретении по сравнению с другими стратегиями, в которых предпринимается попытка подвергнуть широкому скринингу весь иммунопептидом, является то, что настоящее изобретение сосредоточено на специфических пептидах, которые присутствуют одновременно на опухолевых клетках как до, так и после терапии (т.е. которые не будут маскироваться или редактироваться после терапии), и на DC после терапии (Фиг. 3).
Значительным отличием между настоящим изобретением и традиционной иммунотерапией на основе пептидов является то, что в настоящем изобретении используется полное преимущество того факта, что вирусы и, в частности, аденовирусы, имеют привилегированные средства для взаимодействия с DC (следовательно, нет обязательной потребности в направленной доставке к DC). Аденовирусы стимулируют несколько рецепторов распознавания паттерна (PRR), Toll-подобных рецепторов16,17, семейство NOD-подобных рецепторов18 и инфламмасому19, предрасполагая DC к надежной презентации антигена и активации CTL20. С этой целью авторы изобретения показывают то, что человеческие первичные DC, подвергнутые импульсному воздействию онколитического аденовируса, активируют пути, участвующие в адгезии клеток, взаимодействиии клетка-клетка и сигнализации, созревании и презентации антигена, свидетельствуя о том, что аденовирус способен стимулировать созревание и миграцию незрелых первичных дедритных клеток (Фиг. 4).
Фраза «стимулирование пептидоспецифичного иммунного ответа» в том виде, как она здесь используется, относится к вызову иммунного ответа, в котором клетки, представляющие специфические пептиды, будут атакованы и разрушены. Термин «иммунный ответ» относится к системе, включающей лимфоциты (т.е. белые кровяные клетки): либо Т- или В-лимфоциты, либо и те, и другие. Т-лимфоциты непосредственно атакуют антигены и помогают контролировать иммунный ответ. Они также высвобождают химические соединения, известные как цитокины, которые контролируют весь иммунный ответ. В-лимфоциты становятся клетками, которые продуцируют антитела. Антитела атакуют специфический антиген и облегчают для иммунных клеток разрушение антигена.
В одном воплощении изобретения один или более чем один полипептид, присоединенный к вирусному капсиду, выбран из группы, состоящей из фрагментов белка 2, родственного тирозиназе (TRP-2), фрагментов антигена gp100 человеческой меланомы (hgp100), фрагментов антигена А1, ассоциированного с меланомой (MAGE-A1), SIINFEKL, полиK-SIINFEKL, SIINFEKL-полиK, SLFRAVITK (SEQ ID NO: 4), полиK-SLFRAVITK, SLFRAVITK-полиK, SVYDFFVWL (SEQ ID NO: 5), полиK-SVYDFFVWL, SVYDFFVWL-полиK, KVPRNQDWL (SEQ ID NO: 6), полиK-KVPRNQDWL и KVPRNQDWL-полиK. В одном воплощении изобретения один или более чем один тип полипептидов, присоединенных к вирусному капсиду, включает SIINFEKL, SLFRAVITK, SVYDFFVWL или KVPRNQDWL. В другом воплощении на аденовирусный капсид присоединяются фрагменты полипептидов TRP-2 и hgp100 (например, SVYDFFVWL или KVPRNQDWL). В одном воплощении изобретения полипептиды, используемые в настоящем изобретении, модифицируются полилизином (полиK). ПолиK в том виде, как он здесь используется, может быть выбран из группы, состоящей из 3K-15K, 3K-10K, 3K-8K, 5K-8K, 5K-7K и 6K. Фраза «полипептид, модифицированный полилизином» в том виде, как она здесь используется, относится к полипептиду, в который была вставлена полилизиновая последовательность. Добавление полилизиновой последовательности в полипептид вызывает изменение заряда пептида и последующую абсорбцию на поверхности вируса.
Аденовирусный вектор
Аденовирусы, покрытые пептидами, могут принадлежать к любому типу и виду Adenoviridae (например, не ограничиваясь человеческим аденовирусом). В одном воплощении изобретения аденовирусы способны реплицироваться и умерщвлять раковые клетки при перенаправлении противовирусного иммунного ответа на опухоль (Фиг. 1). Вирус по настоящему изобретению, разрушающий раковые клетки, покрытый полученными от пациента опухолеспецифичными иммуноактивирующими пептидами, усиливает и перенаправляет противовирусный иммунитет на противоопухолевый иммунитет.
Аденовирусные векторы, используемые в настоящем изобретении, могут представлять собой любые аденовирусные векторы, подходящие для лечения человека или животного. В качестве альтернативы, согласно настоящему изобретению можно использовать разные типы аденовирусных векторов. Также векторы могут быть модифицированы любым способом, известным в данной области, например, посредством делеции, вставки, мутирования или модификации любых областей вируса. Эти векторы могут быть сделаны опухолеспецифичными в отношении репликации. Например, аденовирусный вектор может содержать модификации в Е1, Е3 и/или Е4, такие как вставка опухолеспецифичных промоторов, делеции областей и вставка трансгенов.
В одном воплощении изобретения аденовирусный вектор представляет собой онколитический аденовирусный вектор. Фраза «онколитический аденовирусный вектор» в том виде, как она здесь используется, относится к аденовирусному вектору, способному инфицировать и умерщвлять раковые клетки посредством селективной репликации в опухоли по сравнению с нормальными клетками. В одном воплощении изобретения векторы являются компетентными в отношении репликации только в клетках, которые имеют дефекты в сигнальном пути Rb, в особенности в пути Rb-p16. Данные дефектные клетки включают все опухолевые клетки у животных и человека. Фраза «дефекты в сигнальном пути Rb» в том виде, как она здесь используется, относится к мутациям и/или эпигенетическим изменениям в любых генах или белках этого пути. Опухолеспецифичный онколитический аденовирус может быть генетически модифицирован, например, посредством делетирования 24 пар оснований (D24) константной области 2 (CR2) Е1. Термины «D24» или «делеция 24 п.о.» в том виде, как они здесь используются, относятся к делеции нуклеотидов, соответствующих аминокислотам 122-129 вектора согласно Heise C. et al. (2000, Nature Med 6, 1134-1139). В одном воплощении изобретения аденовирусный вектор содержит делецию 24 п.о. (онколитический вирус) или делецию гена Е1 (второе поколение вируса), или вектор представляет собой вектор, зависимый от хелпера. Делеция гена Е1 может быть частичной или полной делецией области Е1. Термин «вектор, зависимый от хелпера» в том виде, как он здесь используется, относится к вектору, который не включает гены, кодирующие ферменты и/или структурные белки, требующиеся для репликации, и, следовательно, зависимый от помощи хелперного вируса для того, чтобы реплицироваться.
Каркас аденовирусного вектора может быть любого серотипа. В одном воплощении изобретения серотип аденовирусного вектора выбран из серотипа 3 или 5. Термин «каркас нуклеиновой кислоты аденовируса серотипа 5 (Ad5)» в том виде, как он здесь используется, относится к геному Ad5, и «каркас нуклеиновой кислоты аденовируса серотипа 3 (Ad3)» относится к геному Ad3.
Кроме того, векторы могут быть химерными векторами, например, векторами Ad5/3, Ad3/5 или Ad5/35. В качестве примера термин «вектор Ad5/3» относится к химерному вектору, имеющему части обоих векторов - Ad5 и Ad3.
В одном воплощении изобретения аденовирусный вектор содержит модификацию капсида (т.е. модификацию в нуклеотидных последовательностях, кодирующих белки, образующие капсид вируса). Термин «капсид» аденовируса относится к белковой оболочке вируса. Капсид состоит из нескольких олигомерных структурных субединиц, составленных из белков, именуемых протомерами.
Кроме того, области волокнистых выступов вектора могут быть модифицированы. В одном воплощении изобретения аденовирусный вектор представляет собой Ad5/3 или Ad5/35, содержащий каркас нуклеиновой кислоты Ad5 и волокнистый выступ, выбранный из группы, состоящей из волокнистого выступа Ad3, волокнистого выступа Ad35, химерного волокнистого выступа Ad5/3 и химерного волокнистого выступа Ad5/35.
В конкретном воплощении изобретения онколитический аденовирусный вектор основан на каркасе нуклеиновой кислоты аденовируса серотипа 5 (Ad5) и содержит делецию D24, возможно трансген и возможно сайт CpG. В другом воплощении онколитический аденовирусный вектор основан на каркасе нуклеиновой кислоты аденовируса серотипа 5 (Ad5) и содержит модификацию капсида (например, волокнистого выступа Ad3), возможно делецию D24 и возможно трансген.
Вставка экзогенных элементов может усиливать эффекты векторов в клетках-мишенях. Применение экзогенных ткане- или опухолеспецифичных промоторов является обычным в рекомбинантных векторах, и они также могут использоваться в настоящем изобретении. Подходящие промоторы хорошо известны специалисту в данной области, и они включают hTERT, CMV, E2F, но не ограничиваются ими.
Аденовирусный вектор также может вызывать экспрессию любого(бых) трансгена(нов) (например, гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF)). В одном воплощении изобретения аденовирусный вектор содержит один или более чем один трансген. Одним примером подходящих трансгенов являются цитокины, которые манипулируют усиленным транспортом иммунных клеток в месте, пораженном заболеванием, например, в месте опухоли. Цитокины, используемые в настоящем изобретении, могут быть выбраны из любых цитокинов, известных в данной области. В одном воплощении изобретения трансген выбран из группы, состоящей из хемокинов и цитокинов, и сигнальных пептидов для рекрутинга или манипуляции с иммунологической стромой в месте опухоли, особенно в том, что касается Т-клеток, дендритных клеток, макрофагов, клеток-природных киллеров. Вирусные векторы по изобретению могут кодировать любые один или несколько трансгенов, например, цитокинов (например, два, три, четыре, пять или более чем пять). Аденовирусный вектор, например, может экспрессировать моноклональные антитела для специфичной блокировки иммунологических контрольных точек (например, CTLA4, PD1, PDL1).
Трансген(ны) может быть помещен в разные положения аденовирусного вектора. Трансген, например, может быть помещен в подвергаемую частичной или полной делеции область Е3, либо под контролем промотора Е3, либо экзогенного промотора, или в подвергаемую частичной или полной делеции область Е1, либо под контролем промотора Е1, либо экзогенного промотора.
В одном воплощении изобретения аденовирусный вектор для покрытия представляет собой Ad5D24, Ad5D24CpG или Ad5D24-GMCSF. В Ad5D24-GMCSF трансген GM-CSF находится в месте подвергнутой делеции области Е3 (т.е. подвергнутой делеции 6.7K/gp19K) под контролем промотора Е3 (Cerullo V et al. 2010, Cancer Research 70: 4297-4309). Термин «CpG» в том виде, как он здесь используется, относится к группировкам CpG, добавленным в геном аденовируса для того, чтобы сделать вирус более иммуностимулирующим. Вставка областей, обогащенных CpG, в каркас аденовируса увеличивает способность аденовируса к стимуляции TLR9 (Toll-подобный рецептор 9) в антигенпрезентирующих клетках, следовательно, увеличивая стимуляцию и созревание Т-клеток, а также активацию NK (клетка природный киллер) (Nayak S, Herzog RW. Gene Ther. 2010 Mar; 17(3):295-304.).
Вирусные векторы, используемые в настоящем изобретении, также могут содержать другие модификации, чем описанные выше. Любые дополнительные компоненты или модификации возможно могут использоваться, но не являются обязательными для настоящего изобретения.
Покрытие аденовирусного вектора
Согласно настоящему изобретению капсид аденовируса покрывают синтетическими пептидами или пептидами, которые способны симулировать пептидоспецифичный иммунный ответ у субъекта. Полипептиды, используемые для покрытия аденовирусных векторов, не кодировались генетически указанными аденовирусными векторами. Здесь термины «полипептид» и «пептид» используются взаимозаменяемо для обозначения полимеров из аминокислот любой длины.
Полипептиды могут быть присоединены к капсиду любым известным подходящим химическим или биохимическим способом. В одном воплощении изобретения пептиды были присоединены к вирусному капсиду ковалентно или нековалентно. В другом воплощении изобретения полипептиды были присоединены к капсиду связью на основе электростатической, дисульфидной или амидной связи, или были совместно доставлены и присоединены к капсиду в одной наночастице. Наночастица(цы) также может(гут) быть присоединена(ны) к капсиду ковалентно или нековалентно, например, связью на основе электростатической, дисульфидной или амидной связи. Термин «наночастицы» в том виде, как он здесь используется, относится к любым частицам, которые имеют размер от 1 до 100 нанометров. В стратегии на основе электростатической связи используется преимущество того факта, что аденовирусный капсид имеет отрицательный общий суммарный заряд, она подразумевает синтез положительно заряженных пептидов, состоящих из полилизина, присоединенного к маленькому линкеру, который присоединен к интересующему пептиду. Первая стратегия имеет два потенциальных преимущества: 1) она является быстрой (например, примерно 15-30 минут при комнатной температуре или примерно 20 мин при комнатной температуре), что может быть ключевой характеристикой персонализированных лекарственных средств, и 2) трансдукция аденовируса, образующего комплекс с катионными полимерами, значительно усиливается26,29.
Полипептиды, присоединенные к вирусному капсиду, могут быть одинаковыми пептидами или разными пептидами, выбранными из двух или более чем двух типов разных опухолевых антигенов. В одном воплощении изобретения аденовирусы покрыты более чем одним типом пептидов. Пептиды могут быть, например, разными полипептидами одного и того же антигена, специфичными в отношении МНС-I, полипептидами МНС-I из разных антигенов или комбинацией пептидов, ограниченных МНС-I и MHC-II. В одном воплощении изобретения полипептиды, присоединенные к вирусному капсиду, выбраны из группы, состоящей из полипептидов, специфичных в отношении главного комплекса гистосовместимости класса I (МНС-I) (полипептиды, связывающиеся с МНС-I), полипептидов, специфичных в отношении главного комплекса гистосовместимости класса II (МНС-II) (полипептиды, связывающиеся с МНС-II), полипептидов, специфичных для заболевания (полипептиды, ассоциированные с заболеванием), опухолеспецифичных полипептидов (полипептиды, ассоциированные с опухолями или со специфичной опухолью) и полипептидов, специфичных для DC (полипептиды, связывающиеся с DC). В конкретном воплощении изобретения полипептиды, присоединенные к вирусному капсиду, представляют собой опухолеспецифичные пептиды, ограниченные МНС-I. Данные пептиды могут быть выделены непосредственно из опухоли пациентов с использованием способа, показанного на Фиг. 5. Посредством использования способа, показанного на Фиг. 5, полипептиды, подлежащие присоединению к вирусному капсиду, могут быть одновременно презентированы на МНС-I опухоли и на DC, которых загружали онколизатом опухоли. Термин «опухолеспецифичные полипептиды» в том виде, как он здесь используется, относится к полипептидам, которые презентируются опухолевыми клетками. Термин «DC-специфичные полипептиды» в том виде, как он здесь используется, относится к полипептидам, которые презентируются DC. Термин «полипептиды, специфичные для заболевания» в том виде, как он здесь используется, относится к полипептидам, которые презентируются клетками, имеющими фенотип заболевания или инфицированными заболеванием.
Полипептиды, подлежащие присоединению к капсиду аденовирусного вектора, включают любые полипептиды, которые одновременно презентируются больными или опухолевыми клетками и дендритными клетками одного пациента (например, опухолевые антигены или полипептиды, полученные из них). Примеры подходящих пептидов включают gp100, но не ограничиваются им.
Концентрация полипептидов на капсиде может варьировать, и в одном воплощении изобретения полипептиды находятся в концентрации по меньшей мере 500 нМ.
Согласно настоящему изобретению при получении аденовирусов, покрытых адаптированным для пациента полипептидом, можно выделять и идентифицировать пептиды, загруженные на МНС-I, полученные из больной клетки или полученные из опухоли, синтезировать и смешивать на капсиде онколитического аденовируса, стимулирующего DC. Однако данный способ включает по меньшей мере два этапа. Во-первых, идентифицируют наиболее иммуногенные полипептиды, загруженные на МНС-I, и, во-вторых, эти полипептиды загружают на капсид онколитического аденовируса.
Фармацевтические композиции
Согласно настоящему изобретению предложены не только терапевтические способы и применения для лечения расстройств, но также и фармацевтические композиции для использования в указанных способах и терапевтических применениях. Такие фармацевтические композиции содержат покрытые аденовирусы, либо сами по себе, либо в комбинации с другими агентами, такими как терапевтически эффективный агент или агенты и/или фармацевтически приемлемый носитель или носители.
Фармацевтически приемлемый носитель, например, может быть выбран из группы, состоящей из фармацевтически приемлемого растворителя, разбавителя, адъюванта, эксципиента, буфера, носителя, антисептика, наполнителя, стабилизатора и загустителя. Необязательно, могут быть включены любые другие компоненты, обычно находящиеся в соответствующих продуктах. В одном воплощении изобретения фармацевтическая композиция содержит аденовирусы, покрытые полипептидом, и фармацевтически приемлемый носитель.
Фармацевтическая композиция может находиться в любой форме, такой как твердая, полутвердая или жидкая форма, подходящей для введения. Композиция может быть выбрана из группы, состоящей из, например, растворов, эмульсий или суспензий, но не ограничиваясь ими. Средства и способы приготовления в виде композиции настоящих фармацевтических препаратов известны специалистам в данной области, и они могут быть изготовлены способом, который сам по себе известен.
Терапевтические методы
В пределы объема настоящего изобретения включено любое заболевание или расстройство, которое можно лечить, развитие которого может быть замедлено, или в котором симптомы могут быть ослаблены посредством стимулирования пептидоспецифичного иммунного ответа против ненормальных клеток, обусловленных заболеванием. В одном воплощении изобретения пептидоспецифичный иммунный ответ выбран из группы, состоящей из противоопухолевого (против первичных и/или вторичных опухолей), противоракового (против первичных и/или вторичных злокачественных новообразований), противоинфекционного и противовирусного иммунного ответа. В этих случаях иммунный ответ направлен против опухоли (включая и злокачественные и доброкачественные опухоли, а также первичные и вторичные опухоли), рака (т.е. либо первичного, либо вторичного злокачественного новообразования), инфекционного заболевания (например, малярии), вирусов (в случае вирусной инфекции, например, гриппа, SARS-CoV (коронавирус, ассоциированный с атипичной пневмонией) или ВИЧ (вирус иммунодефицита человека)) и т.д., соответственно. Например, мишенью покрытого аденовируса по настоящему изобретению может быть любой рак. В одном воплощении изобретения рак выбран из группы, состоящей из носоглоточного рака, синовиального рака, печеночно-клеточного рака, рака почки, рака соединительных тканей, меланомы, рака легкого, рака кишечника, рака толстой кишки, рака прямой кишки, колоректального рака, рака мозга, рака глотки, рака полости рта, рака печени, рака кости, рака поджелудочной железы, хориокарциномы, гастриномы, феохромоцитомы, пролактиномы, Т-клеточного лейкоза/лимфомы, нейромы, болезни фон Гиппеля-Линдау, синдрома Золлингера-Эллисона, рака надпочечника, рак ануса, рак желчного протока, рак мочевого пузыря, рака мочеточника, рака мозга, олигодендроглиомы, нейробластомы, менингиомы, опухоли спинного мозга, рака кости, остеохондромы, хондросаркомы, саркомы Юинга, рака с неизвестной первичной локализацией, карциноида, карциноида желудочно-кишечного тракта, фибросаркомы, рака молочной железы, болезни Пэджета, рака шейки матки, колоректального рака, рака прямой кишки, рака пищевода, рака желчного пузыря, рака головы, рака глаза, рака шеи, рака почки, опухоли Вильмса, рака печени, саркомы Капоши, рака предстательной железы, рака легкого, рака яичка, ходжкинекой лимфомы, неходжкинской лимфомы, рака полости рта, рака кожи, мезотелиомы, множественной миеломы, рака яичника, рака эндокринных клеток поджелудочной железы, глюкагономы, рака поджелудочной железы, рака паращитовидной железы, рака пениса, рака гипофиза, саркомы мягких тканей, ретинобластомы, рака тонкого кишечника, рака желудка, рака вилочковой железы, рака щитовидной железы, трофобластического рака, пузырного заноса, рака матки, рака эндометрия, рака вагины, рака вульвы, нейромы слухового нерва, фунгоидного микоза, инсулиномы, карциноидного синдрома, соматостатиномы, рака десны, рака сердца, рака губы, рака оболочки головного мозга, рака ротовой полости, рака нерва, рака неба, рака околоушной железы, рака брюшины, рака зева, рака плевры, рака слюнной железы, рака языка и рака миндалины.
Термин «лечение» или «осуществление лечения» в том виде, как он здесь используется, относится к введению субъекту по меньшей мере покрытых аденовирусных векторов или фармацевтической композиции, содержащей покрытые аденовирусные векторы. Термин «осуществление лечения», а также слова, происходящие от него, в том виде, как они здесь используются, не обязательно подразумевают 100% или полное лечение или улучшение. Скорее имеют место варьирующие степени того, что обычный специалист в данной области распознает как имеющее потенциальную пользу или терапевтический эффект. В данном отношении настоящие способы и применения по изобретению могут обеспечивать любую степень лечения или предупреждения заболевания. Следовательно, термин «осуществление лечения» включает не только полное излечение, но также, например, профилактику, уменьшение интенсивности или ослабление расстройств или симптомов, относящихся к рассматриваемому заболеванию, такому как рак, опухоль, инфекционное заболевание или вирусная инфекция. Терапевтический эффект может быть оценен любым способом, известным специалисту в данной области, например, посредством отслеживания симптомов пациента или маркеров заболевания в крови.
Термин «субъект» в том виде, как он здесь используется, относится к субъекту, который выбран из группы, состоящей из животного, млекопитающего или человека. В одном воплощении изобретения субъект представляет собой человека или животное.
Аденовирус, покрытый полипептидами, вводят субъекту в терапевтически эффективном количестве, что вызывает пептидоспецифичный иммунный ответ. Термин «терапевтически эффективное количество» в том виде, как он здесь используется, относится к количеству покрытого аденовируса, с которым вредные эффекты заболевания или расстройства (например, рака), как минимум, ослабевают. Вредные эффекты включают любые выявляемые или заметные эффекты у субъекта, такие как боль, головокружение или опухание.
Терапевтическими эффектами может обладать только одно введение покрытых аденовирусных векторов или фармацевтической композиции по изобретению. С другой стороны, лечение может включать несколько введений. Аденовирусные векторы или фармацевтическая композиция могут вводиться, например, от 1 до 10 раз на протяжении 2, 3, 4 или 8 недель, или на протяжении периода лечения. Продолжительность периода лечения может варьировать и, например, может длиться от двух до 12 месяцев или более. В некоторых случаях также возможно использовать несколько периодов лечения для одного пациента.
Эффективная доза векторов зависит по меньшей мере от субъекта, нуждающегося в лечении, типа заболевания и стадии заболевания. Доза может варьировать, например, от примерно 1×108 вирусных частиц (VP) до примерно 1×1014 VP, конкретно от примерно 1×109 VP до примерно 1×1013 VP и, более конкретно, от примерно 5×109 VP до примерно 1×1012 VP.
Введение покрытого аденовируса может проводиться посредством любого подходящего способа, известного специалисту в данной области. В одном воплощении изобретения введение аденовирусных векторов проводят посредством внутриопухолевой, внутриартериальной, внутривенной, внутриплевральной, внутрипузырной, внутриполостной или брюшинной инъекции, или перорального введения. Также возможно объединять разные пути введения.
Покрытые аденовирусы также можно использовать совместно (одновременно или последовательно) с другими терапевтическими агентами или терапевтическими способами, или с комбинацией способов лечения. Например, способ или применение по изобретению может дополнительно включать лучевую терапию, химиотерапию, введение других лекарственных средств или любые клинические операции.
Перед классификацией человеческого или животного пациента как подходящего для терапии по настоящему изобретению практикующий врач может осмотреть пациента. На основе результатов, отклоняющихся от нормальных и выявляющих заболевание, такое как рак, лечащий врач может предложить для пациента способы или лечение по настоящему изобретению.
Идентификация специфических пептидов для покрытия
В настоящем изобретении выявлен способ идентифицирования по меньшей мере опухолеспецифичных и MHC-I-специфичных полипептидов от субъекта. В данном способе используется качественное и количественное исследование по иммунопептидому МНС-I опухолей и DC, подвергающихся воздействию лизата опухоли, в особенности in vitro. Вкратце методология, обобщенная на Фиг. 5, включает выделение молекул МНС-I как из опухолевых клеток, так и из DC, подвергнутых импульсному воздействию онколизата in vitro (опухолевые клетки, инфицированные вирусом), и секвенирование полипептидов, ассоциированных с МНС, посредством технологии на основе масс-спектрометрии. Иммунологически релевантные пептиды будут презентироваться и опухолями, и дендритными клетками, подвергнутыми импульсному воздействию лизата опухоли. Например, применение мышиной модели, экспрессирующей OVA, может облегчать подтверждение этой системы, фактически, хорошо известные иммуногенные пептиды, происходящих из OVA (например, SIINFEKL) получаются из экспериментов на мышах и могут служить в качестве позитивного контроля.
Опухолевые клетки субъекта до и после аденовирусного инфецирования in vitro используются в данном способе для того, чтобы блокировать те полипептиды, которые подвергаются клеточному дисплею вследствие вирусного инфецирования. DC, подвергнутые импульсному воздействию онколизата опухоли in vitro, также используются в данном способе для того, чтобы обеспечить презентирование опухолевого антигена. Преимуществом использования не только опухоли, но также и DC, подвергавшихся импульсному воздействию онколизата опухоли, для выделения опухолеспецифичных пептидов является лучшая идентификация иммунологически активных пептидов (эффективный иммунный ответ будет иметь место, только если пептид презентируется и на опухоли, и на DC). Выделение молекул МНС-I из опухолевых клеток и дендритных клеток может проводиться любым подходящим способом выделения, известным в данной области. Затем может осуществляться секвенирование данных полипептидов посредством любой подходящей технологии на основе масс-спектрометрии (например, ЖХ-МС/МС) для идентификации пептидов, ассоциированных с МНС. Полипептиды, презентируемые и опухолями, и дендритными клетками, могут быть идентифицированы посредством сравнения полипептидов, презентируемых данными клетками. Общие полипептиды в двух группах, т.е. полипептиды, презентируемые DC, подвергавшимися импульсному воздействию лизата, за вычетом полипептидов DC, не подвергавшихся импульсному воздействию (для устранения собственных пептидов DC), и полипептиды, презентируемые опухолями, инфицированными вирусом, и неинфицированными опухолями (для устранения вирусоспецифичных пептидов) являются подходящими для покрытия аденовирусов. Сравнение полипептидов может проводиться вручную или посредством любого биоинформационного метода, известного специалисту в данной области. Необязательно, для любого конкретного полипептида или их комбинации может осуществляться подтверждение in vitro, ex vivo и/или in vivo. В одном воплощении изобретения, помимо выделения молекул МНС-I из инфицированных и неинфицированных опухолевых клеток, а также инфицированных дендритных клеток, этот способ дополнительно включает выделение молекул МНС-I из неинфицированных дендритных клеток и идентификацию полипептидов, ассоциированных с МНС-I; и идентификацию тех полипептидов, которые были презентированы инфицированными и неинфицированными опухолями со стадий 3) и 4), и инфицированными дендритными клетками со стадии 3), но не неинфицированными дендритными клетками. В конкретном воплощении изобретения инфецирование опухолевых клеток и DC аденовирусными векторами производят in vitro. Аденовирусные векторы, используемые для способа по настоящему изобретению, могут представлять собой любой аденовирусный вектор, например, любой из тех векторов, которые описаны в предыдущих разделах.
В одном воплощении изобретения способ идентификации опухолеспецифичных и MHC-I-специфичных полипептидов от субъекта используется для отбора одного или более чем одного опухолеспецифичного и MHC-I-специфичного полипептида для покрытия аденовирусного капсида. Любой из данных опухолеспецифичных и MHC-I-специфичных полипептидов или их комбинацию можно использовать для покрытия.
Для специалиста в данной области будет очевидно то, что, по мере развития технологии, идею изобретения можно осуществлять разными способами. Изобретение и его воплощения не ограничиваются примерами, описанными выше, но могут варьировать в пределах объема формулы изобретения.
ПРИМЕРЫ
Следующие примеры демонстрируют по меньшей мере анализ опухолевого иммунопептидома МНС-I для выделения и отбора опухолеспецифичных полипептидов, получения и физической характеризации онколитических аденовирусов, покрытых опухолеспецифичным полипептидом, и характеризации покрытых аденовирусов в животных моделях (например 1) терапевтической эффективности, 2) способности перенацеливать противовирусный иммунитет на противоопухолевый иммунитет и 3) способности рекрутировать клетки иммунной системы и стимулировать ответы Т-клеток).
Получение онколитического аденовируса
Все онколитические аденовирусы (OAd) получали и размножали с использованием стандартных протоколов, как описано ранее (8). Вкратце, вирусы амплифицировали посредством инфицирования 10 колб Т175 с клетками А549 с конфлюентностью 70-80% при множественности заражения (MOI) 30. Через трое суток после инфецирования клетки собирали и лизировали посредством четырех циклов замораживания (-80°С) и оттаивания (37°С). Аденовирусные частицы затем отделяли от обломков клеток и примесей посредством двух ультрацентрифугирований (22000 и 27000 об./мин) на градиентах CsCI. Выделенные полосы очищали посредством диализа в течение ночи при 4°С против буфера А195 с непрерывным перемешиванием. Конкретно, использовали кассеты для диализа с порогом отсечения молекулярной массы 10000 кДа (Pierce, Life Technologies). Очищенные вирусы выделяли из кассет, разделяли на аликвоты и хранили при -80°С.
Целостность аденовирусного генома оценивали посредством ПЦР (полимеразная цепная реакция) с использованием праймеров, специфичных в отношении гена Е3 и делеции D24 в гене Е1А.
Титр вирусных частиц определяли с использованием спектрофотометрического метода, тогда как инфекционный титр определяли иммуноцитохимическим окрашиванием, как описано в данном разделе в других местах. Концентрацию белка вирусного препарата определяли посредством анализа по Бредфорд с использованием концентрата цветных реактивов для анализа белка от Bio-Rad (Bio-Rad Laboratories, Hercules, CA, США). Все спектрофотометрические показания получали с использованием спектрофотометра SPECTROstar Nano (BMG Labtech, Ортенбер, Германия).
Все вирусы, использованные в данном исследовании, были описаны ранее: Ad5D24 представляет собой аденовирус, который характеризуется делецией 24 пар оснований (D24) в гене Е1А (9), Ad5D24-CpG представляет собой OAd, несущий геном, обогащенный CpG, в гене Е3 (30), и Ad5D24-GM-CSF представляет собой OAd, экспрессирующий GM-CSF под контролем вирусного промотора Е3 (8).
Анализ иммунопептидома МНС-I опухоли для выделения и отбора опухолеспецифичных пептидов
Способ 1а:
Мышиные дендритные клетки красного костного мозга, сортированные по CD11c+, отбирали у мышей C57BL/6 и культивировали в течение 1 недели23. Клетки затем подвергали воздействию:
A) PBS в качестве контроля,
Б) онколизата из клеток B16-OVA (этот онколизат получают из клеток B16-OVA, инфицируемых онколитическим аденовирусом Ad5D24 до их полного лизиса),
B) клеточного лизата B16-OVA, полученного посредством замораживания и оттаивания клеток.
В разные моменты времени из жизнеспособных DC выделяли MHC-I, загруженный пептидами, с помощью мягкого кислотного элюирования25. Во время анализа пептиды растворяли в водном растворе и анализировали нано ЖХ-МС/МС (жидкостная хроматография-тандемная масс-спектрометрия) на масс-спектрометре LTQ-Orbitrap Elite (Thermo Fisher Scientific). Поиски в базах данных проводили относительно версии 3.23 мышиной базы данных Международного белкового индекса, содержащей 51536 последовательностей и 24497860 остатков, http://www.ebi.ac.uk/IPI/IPIhelp.html). Релевантные пептиды находились в группе, образованной пептидами, которые обычно присутствуют в обеих группах: DC, подвергавшихся импульсному воздействию лизата, за вычетом DC, не подвергавшихся импульсному воздействию (для устранения собственных пептидов DC), и инфицированных вирусом B16-OVA за вычетом не инфицированные вирусом B16-OVA (для устранения вирусоспецифичных пептидов).
Способ 1б:
Авторы изобретения сначала уменьшили сложность иммунопептидома по Способу 1а in silico. Прогнозирование пептидов класса MHC-I (http://www.syfpeithi.de/home.htm). Использовали функциональную аннотацию белков (http://david.abcc.ncifcrf.gov) и (http://www.ingenuity.com).
Для предположения об уровне экспрессии данного белка при разных раковых заболеваниях человека и в разных линиях клеток использовали анализ Oncomine (https://www.oncomine.org). Наиболее важно то, что авторы изобретения подтвердили пептиды с использованием инструмента для прогнозирования эпитопов ([17]).
Экспериментально для отбора наиболее иммуногенных пептидов авторы изобретения использовали ELISPOT (метод иммуноферментных пятен) мышиного IFN-гамма (Mabtech АВ, Швеция) на спленоцитах, опухолях и лимфатических узлах, отобранных у мышей C57BL/6 и подвергнутых импульсному воздействию всех разных пептидов, выделенных с использованием способа 1а.
Вкратце, мышей C57BL/6, несущих опухоли B16-OVA, обрабатывали онколитическим аденовирусом (Ad5D24). Через одну-две недели после обработки мышей умерщвляли, органы и опухоли отбирали и доводили до простой суспензии клеток для анализа ELISPOT на IFN-гамма (Mabtech, Palo Alto СА). Затем, сразу после идентификации пула из нескольких наиболее иммуногенных пептидов, авторы изобретения получали сделанный на заказ тетрамер или пентамер (Proimmune, Великобритания) для основанного на проточном цитометре детектирования специфичных Т-клеток CD8, распознающих данные пептиды на молекулах MHC-I.
Получение и физическая характеризации опухолеспецифичных покрытых пептидом онколитических аденовирусов
Поскольку происходящие из OVA пептиды являются очень хорошо известными, в качестве подтверждения концепции авторы изобретения сначала генерировали OVA-специфичный покрытый вирус (Фиг. 6). Более конкретно, авторы изобретения генерировали покрытый SIINFEKL аденовирус (SIINFEKL (SEQ ID NO: 1) представляет собой наиболее иммуногенный пептид, происходящий из OVA); покрытый SIINFEDL вирус (SIINFEDL (SEQ ID NO: 7) представляет собой антагонист пептида SIINFEKL); покрытый FILKSINE вирус (FILKSINE (SEQ ID NO: 3) представляет собой скремблированный пептид SIINFEKL).
Способ 2а:
Для того чтобы получить онколитический аденовирус, покрытый пептидом, принимали во внимание разные стратегии (Фиг. 7).
В одной из них используется электростатическое связывание между вирусом и пептидами, и две другие включают ковалентные связи между вирусом и пептидами.
I. Электростатическое взаимодействие. Положительно заряженные пептиды, образующие комплекс с отрицательно заряженным капсидом вируса26.
II. Ковалентная связь. Дисульфидная связь с цистеином белка капсида27,28.
III. Ковалентная связь. Амидная связь. Реакция сукцинимидилового сложного эфира с аминогруппами лизина капсида28.
Способы связывания описаны в соответствующих документах в списке ссылок.
В одном воплощении изобретения покрытые пептидом онколитические аденовирусы получали следующим образом:
Образование комплекса PeptiCRAd
Все комплексы PeptiCRAd, описанные в данной работе, получали путем смешивания онколитических вирусов (описанных в разделе «Получение онколитического аденовируса») и полиK-эпитопов в соотношении 1:500 (см. Фиг. 8А и 12) согласно следующему протоколу: 1) для каждого микролитра использованного вирусного препарата рассчитывали соответствующее число микрограммов присутствующего белка; 2) затем на каждый микрограмм вирусного белка добавляли 500 мкг пептида; 3) после встряхивания смесь инкубировали при комнатной температуре (RT) в течение 15 мин; и 4) раствор встряхивали и использовали для анализов или инъекций животным. Новые PeptiCRAd готовили перед каждым экспериментом с использованием свежих реактивов. Все разведения вируса и пептидов, требующиеся перед инкубацией, проводили в стерильной воде Milli-Q, доведенной до pH 7,4. PeptiCRAd затем разводили буфером, требующимся для анализа.
Способ 2б:
Инвазионная способность этого вируса, покрытого пептидом из способа 2а, оценивали in vitro в разных линиях клеток (человеческих и мышиных) посредством анализа люциферазы и посредством кПЦР (количественная полимеразная цепная реакция)30. Для оценки инвазионной способности группу различных линий опухолевых клеток с разными уровнями экспрессии CAR инфицировали различными концентрациями покрытого вируса, экпрессирующего люциферазу (Ad5D24-Luc) (1, 10, 100, 1000 VP/клетку); непокрытый вирус всегда использовали в качестве контроля. В разные моменты времени количественно измеряли экспрессию люциферазы. Одновременно отбирали общую ДНК, и репликацию вирусной ДНК количественно измеряли посредством кПЦР. Онколитическую активность in vitro тестировали посредством TCID50 (доза заражения 50% культуры ткани) и анализов MTS31.
В одном воплощении изобретения инвазионную способность исследовали посредством ICC (иммуноцитохимия) следующим образом:
Анализ инфекционной способности посредством ICC
Опухолевые клетки высевали в количестве 2,0×105 клеток на лунку на 24-луночные планшеты в 3 или 5 повторностях. На следующие сутки клетки инфицировали 100 мкл раствора вируса. Планшеты затем центрифугировали в течение 90 мин при центрифужной силе 1000 при 37°С, с последующей инкубацией в течение 48 ч. После периода инкубации культуральные среды удаляли, и клетки фиксировали посредством инкубации с 250 мкл ледяного метанола в течение 15 мин. Сразу после удаления метанола клетки 3 раза промывали 300 мкл PBS, дополненного 1% бычьего сывороточного альбумина (BSA). Клетки затем окрашивали 250 мкл мышиного моноклонального антитела против гексона (Novus Biologicals, Littleton, СО, США), разведенного 1:2000, в течение 1 ч при RT (комнатная температура) в темноте. Клетки затем промывали и окрашивали 250 мкл антитела козы против мышиного антитела, конъюгированного с биотином-стрептавидином, разведенного 1:500 PBS/1% BSA в течение 1 ч при RT в темноте. Клетки затем инкубировали с 250 мкл экстравидин-пероксидазы (Sigma-Aldrich, St. Louis, МО, США), разведенной 1:200, в течение 30 мин при RT. Клетки обильно промывали, и готовили окрашивающий раствор DAB (диаминобензидин) (Sigma-Aldrich, St. Louis, МО, США) согласно инструкциям изготовителя. Затем в кажую лунку наносили всего 250 мкл окрашивающего раствора DAB, и клетки наблюдали под микроскопом на появление темных пятен. При достижении оптимального соотношения сигнала к шуму реакцию гасили добавлением PBS/1% BSA (500 мкл на лунку). Для каждой повторности (т.е. лунки) получали 5 изображений неперекрывающихся полей с использованием микроскопа AMG EVOS XL (AMG group, Life Technologies). Для определения инфекционного титра использовали следующую формулу:

Для сравнений инвазионной способности данные представлены как среднее число пятен в каждом поле.
В поддержку способов 2:
Отрицательно заряженный капсид аденовируса электростатически покрывали опухолеспецифичным пептидом. Данный комплекс имел изменение Z-потенциала, которое пропорционально количеству пептидов. Данное изменение Z-потенциала демонстрировало то, что положительно заряженные пептиды связывались с вирусным капсидом, определяя инверсию заряда (Фиг. 8А, линия с точками). Как только все отрицательные заряды капсида были насыщены, Z-потенциал, по-видимому, достигал плато (Фиг. 12, линия с кружками). Может образоваться однородный монодисперсный комплекс с концентрацией полипептидов более чем 500 нМ для перехода к оценке эффективности in vitro и in vivo.
Для дальнейшей характеризации комплекса аденовируса, покрытого пептидом, авторы изобретения провели несколько анализов жизнеспособности (анализ MTS), сравнивая эффективность умерщвления клеток PeptiCRAd с непокрытым онколитическим вирусом (Фиг. 9). Результаты показывают то, что покрытие вируса постоянно приводит к неизменной или лучшей активности умерщвления клеток по сравнению с непокрытыми онколитическими вирусами.
В одном воплощении изобретения анализ жизнеспособности проводили следующим образом:
Анализ жизнеспособности
Опухолевые клетки высевали в количестве 1,0×104 клеток на лунку на 96-луночных планшетах в ростовые среды с 5% FBS (фетальная телячья сыворотка). На следующие сутки среды удаляли, и 50 мкл вируса, разведенного в ростовых средах с 2% FBS, использовали для инфицирования клеток в течение 2 ч при 37°С. Затем добавляли 100 мкл ростовых сред с 5% FBS, и клетки вновь инкубировали при 37°С. Ростовые среды заменяли через сутки. Когда самые инфекционные условия (100 vp/клетку) демонстрировали обширный цитопатический эффект (больше 90%), жизнеспособность клеток определяли анализом MTS согласно протоколу изготовителя (CellTiter 96 AQueous One Solution Cell Proliferation Assay; Promega, Nacka, Швеция). Спектрофотометрические данные получали с использованием многорежимного ридера Varioskan Flash (Thermo Scientific, Carlsbad, CA, США).
Схема исследования
Размер выборки определяли с использованием следующего уравнения:

где С представляет собой константу на основе значений α и β, s представляет собой оцениваемую изменчивость, и d представляет собой эффект, подлежащий наблюдению (34). Для всех экспериментов на животных рассматривали степень (1-β), составляющую по меньшей мере 80%, и значимость (α) 0,05. Правилами для прекращения сбора данных были 1) смерть более чем 60% мышей в одной или более чем одной группе и 2) полное устранение опухолей. Всех мышей, которые умирали до окончания эксперимента, исключали из ростовых кривых для сохранения статистической целостности анализа.
Целью исследования было использование моделей меланомы для тестирования того, могли ли OAd преставлять собой подходящий адъювант для метода с пептидной противораковой вакциной. Дополнительно было поставлено два конкретных вопроса: 1) Может ли PeptiCRAd ограничивать рост удаленных, необработанных опухолей? 2) Может ли эффективность PeptiCRAd усиливаться нацеливанием на многие опухолевые антигены, вместо одного антигена? Для ответа на данные вопросы авторы изобретения использовали иммунокомпетентных или гуманизированных мышей, несущих меланомные опухоли. Данных мышей случайным образом приписывали к каждой экспериментальной группе, и не применяли слепого подхода.
Линии клеток, реагенты и человеческие образцы
Линию клеток человеческой карциномы легкого А549, линию клеток человеческой колоректальной аденокарциномы САСО-2, линию клеток человеческой злокачественной меланомы SK-MEL-2, линию клеток человеческой меланомы HS294T и линию клеток мышиной меланомы B16-F10 приобретали в Американской коллекции типовых культур (АТСС; Manassas, VA, США). Линия клеток B16-OVA (35), линия клеток мышиной меланомы, экспрессирующая OVA курицы, была любезно предоставлена Проф. Ричардом Вайлом (Mayo Clinic, Rochester, MN, США).
Линии клеток А549, САСО-2 и B16-OVA культивировали в DMEM (среда Игла, модифицированная по Дульбекко) с низким содержанием глюкозы (Lonza, Базель, Швейцария), линию клеток HS294T культивировали в DMEM с высоким содержанием глюкозы (Gibco, Life Technologies, Carlsbad, CA, США), линию клеток SK-MEL-2 культивировали в ЕМЕМ (минимальная питательная среда Игла) (АТСС), и линию клеток B16-F10 культивировали в RPMI-1640 (Gibco, Life Technologies). Все среды дополняли 10% фетальной телячьей сыворотки (FBS; Gibco, Life Technologies), 2 мМ GlutaMAX (Gibco, Life Technologies), 100 U/мл пенициллина и 0,1 мг/мл стрептомицина (Gibco, Life Technologies). Линию клеток B16-OVA также культивировали в присутствии 5 мг/мл генетицина (Gibco, Life Technologies) для обеспечения отбора клеток, экспрессирующих OVA. На протяжении периода культивирования или когда это было необходимо для анализов клетки промывали 1× фосфатно-солевым буферным раствором (PBS) и отделяли посредством инкубации с 1× TrypLE Express (Gibco, Life Technologies) в течение 3 мин при 37°С.
Пептиды SIINFEKL (OVA257-264), полиK-SIINFEKL, SIINFEKL-полиK, полиK-AHX-SIINFEKL, полиK-SVYDFFVWL (TRP-2180-188), полиK-KVPRNQDWL (hgp10025-33) и полиK-SLFRAVITK (MAGE-A196-104) приобретали у Zhejiang Ontores Biotechnologies Co. (Zhejiang, Китай). Чистота всех пептидов была оценена как составляющая больше 80%, и их анализировали посредством масс-спектрометрического анализа.
В разделе примеров термин «полиK» относится к 6K.
Общий заряд пептидов рассчитывали посредством онлайн утилиты Peptide Property Calculator Версия 3.1 online tool (http://www.biosyn.com/PeptidePropertyCalculator/PeptidePropertyCalculator.aspx).
Генотип линии клеток SK-MEL-2 представлял собой HLA-A*03-*26; В*35-*38; С*04-*12. Лейкоцитарные пленки от здорового донора также были получены от Финского красного креста, и генотип был определен как представляющий собой HLA-A*03-*03; В*07-*27; С*01-*07.
Характеризация покрытых аденовирусов в животных моделях
Способ 3а:
Авторы изобретения протестировали in vivo эффективность, иммуногенность, токсичность, биораспределение покрытых вирусов по сравнению с непокрытыми типичными онколитическими вирусами. Эффективность и иммуногенность тестировали на мышах C57BL/6, несущих опухоли B16-OVA. Вирус, покрытый SIINFEKL, демонстрировал более сильный ответ против OVA, который воплощался в более явном контроле опухоли (эффективность) по сравнению с другими покрытыми вирусами (антагонистическим, скремблированным и непокрытым). Одновременно посредством адаптивного переноса радиоактивно меченых клеток (DC и Т-клеток) также оценивали направленную миграцию данных клеток в микроокружение опухоли. Наконец, также исследовали токсичность и биораспределение модифицированного аденовирусного вектора.
Для исследования эффективности покрытых вирусов разные группы мышей C57BL/6 (N=15 для каждой группу), несущих изогенные опухоли B16-OVA (две опухоли на мышь), обрабатывали следующим образом: а) вирусом, покрытым SIINFEKL, б) вирусом, покрытым SIINFEDL, в) вирусом, покрытым FILKSINE, и г) непокрытым вирусом в качестве контроля. В различные моменты времени, начинающиеся с 3 суток после введения вируса, двух мышей из каждой группы умерщвляли, и селезенку, лимфатические узлы и опухоль отбирали в суспензию одиночных клеток для ELISPOT, совместного культивирования и анализа проточной цитометрией. Одновременно рост опухоли измеряли с течением времени с использованием стандартного штангенциркуля. Анализ проточной цитометрией непосредственно выявил количество SIINFEKL-специфичных Т-клеток в опухоли, в селезенке и в лимфатических узлах (опухоль дренирует или нет). Для данного анализа авторы изобретения использовали SIINFEKL-специфичные пентамеры (например 31). ELISPOT мышиного IFN-гамма также дал авторам изобретения количественное показание активации Т-клеток против OVA (против SIINFEKL). В эксперименте по совместному культивированию авторы изобретения тестировали in vitro способность Т-клеток (отобранных у экспериментальных мышей) умерщвлять В16 и B16-OVA. Клетки совместно культивировали при разных соотношениях клетка : мишень, и жизнеспособность В16 и B16-OVA оценивали посредством анализа с MTS или МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид). Во всем данном эксперименте Т-клетки, отобранные от мышей OT-I, использовали в качестве контроля. Также использовали модель CMT64-OVA, которая представляет собой мышиную опухоль, экспрессирующую OVA, где человеческий аденовирус является полупермиссивным33.
Способ 3б:
Сравнивали противоопухолевую активность и иммуногенность вируса, покрытого: 1) пептидом OVA (SIINFEKL (SEQ ID NO: 1)), 2) пептидом B16 TRP2 (SVYDFFVWL (SEQ ID NO: 5)), 3) пептидом hgp100 (KVPRNQDWL (SEQ ID NO: 6)) или 4) новыми пептидами, идентифицированными в способе 1.
Данные вирусы тестировали на их эффективность и способность индуцировать противоопухолевый иммунный ответ. Противовирусный ответ сравнивали с противоопухолевым ответом (ELISPOT и анализ пентамеров). Также оценивали способность индуцировать иммунный ответ к другому эпитопу (например, OVA-вирус запускает ответ на TRP2, распространение эпитопа). Способы, использованные в данном способе, уже были описаны в способе 3а.
Исследования, основанные на способах 2 и 3:
Авторы изобретения получили OVA-специфичный PeptiCRAd (онколитический аденовирус, покрытый SIINFEKL), как описано на Фиг. 7, стратегия I. Вкратце, синтетические пептиды SIINFEKL синтезировали и присоединяли к полилизиновому линкеру (полиK-SIINFEKL) для придания этим пептидам положительного суммарного заряда и образовывали комплекс с непокрытым вирусом, который имеет отрицательный суммарный заряд, за 30 минут до инъекции. Этот комплекс затем вводили в опухоль мышам, несущим подкожные опухоли B16-OVA. Рост опухоли отслеживали, и в конце эксперимента мышей умерщвляли, опухоли отбирали, и OVA-специфичные Т-клетки количественно измеряли посредством проточной цитометрии (Фиг. 10).
Данный эксперимент демонстрирует преимущество модифицированного аденовирусного вектора по настоящему изобретению по сравнению с вирусом самим по себе, а также с вирусом и пептидами, введенными по отдельности. Он также показывает важность правильного приготовления покрытого вируса, так как с более высокими концентрациями пептидов он, по-видимому, индуцирует меньше опухолеспецифичных Т-клеток (данные не показаны).
Второе поколение покрытых аденовирусов
Способ 4:
Второе поколение PeptiCRAd было получено покрытием онколитических вирусов более чем одним пептидом для вызывания более сильного и поливалентного иммунного ответа. Данные новые вирусы были охарактеризованы так же, как и в Способе 2, и эффективность оценивали, как описано в способе 3. Далее авторы изобретения покрыли онколитический аденовирус, экспрессирующий цитикины, несколькими типами полипептидов. Данные полипептиды могут представлять собой либо различные MHC-I-специфичные пептиды одного и того же антигена, либо пептиды MHC-I из различных антигенов, либо комбинацию пептидов, ограниченных MHC-I и МНС-II.
Способы, используемые для проведения анализа покрытых онколитических вирусов
Анализ дзета-потенциала и динамического рассеяния света (DLS)
Образцы покрытого онколитического вируса получали, как описано в разделе «образование комплекса PeptiCRAd». Каждый образец затем встряхивали и разводили до конечного объема 700 мкл стерильной водой Milli-Q, доведенной до pH 7,4, после чего образец переносили в полистирольную одноразовую кювету для определения размера комплексов. Образец затем выделяли из кюветы и переносили в одноразовую капиллярную ячейку DTS1070 (Malvern, Worcestershire, Великобритания) для измерений дзета-потенциала. Все измерения проводили при 25°C с использованием Zetasizer Nano ZS (Malvern).
SPR (поверхностный плазмонный резонанс)
Взаимодействие полиK-SIINFEKL или SIINFEKL с OAd оценивали с использованием SPR. Измерения проводили с использованием мультипараметрического прибора SPR Navi™ 220А (Bionavis Ltd, Тампере, Финляндия). Данный прибор содержит канал с двойным потоком с контролем температуры с интегрированной жидкостной системой и автоматическим пробоотборником для обращения с буфером и образцом. В качестве подвижного буфера использовали воду Milli-Q с pH, доведенным до 7,4. Кроме того, на протяжении всех экспериментов использовали постоянную скорость потока 30 мкл/мин, и была установлена температура +20°С. Для возбуждения поверхностного плазмона использовали лазерное излучение с длиной волны 670 нм.
Перед началом эксперимента SPR сенсорный слайд с поверхностью из диоксида кремния активировали 3-минутной обработкой плазмой с последующим покрытием APTES ((3-аминопропил)триэтоксисилан) посредством инкубирования сенсора в 50 мМ APTES в растворе толуола в течение 1 ч. Затем сенсор помещали в устройство SPR, и OAd иммобилизировали in situ на сенсорной поверхности опытного канала посредством инъецирования 50 мкг/мл OAd в воде Milli-Q (pH 7,4) в течение приблизительно 12 мин, с последующей 3 мин промывкой 20 мМ CHAPS (3-[(3-холамидопропил)диметиламмонио]-1-пропансульфонат). Второй проточный канал использовали в качестве контроля и осуществляли в него инъекцию воды Milli-Q (pH 7,4), с последующей промывкой CHAPS. Исходный уровень наблюдали в течение по меньшей мере 10 мин перед инъекциями образца. Затем в оба проточных канала проточной ячейки параллельно инъецировали полиK-SIINFEKL или SIINFEKL с возрастающими концентрациями.
Эксперимент по перекрестной презентации
У наивных мышей C57BL/6 отбирали свежие селезенки и проталкивали через 70 мкм сетки для клеток (Fisher Scientific, Waltham, MA, США). Эритроциты лизировали посредством инкубирования образцов с 5 мл лизисного буфера ACK (Life Technologies) в течение 5 мин при RT. Затем спленоциты промывали и готовили для анализа (2×106 клеток в 800 мкл 10% культуральной среды RPMI-1640 для каждого тестируемого условия). К спленоцитам добавляли всего 200 мкл пептидного раствора SIINFEKL, полиK-SIINFEKL, SIINFEKL-полиK или SIINFEKL-AHX-полиK (0,19 мкг/мл). Для тестирования OVA-PeptiCRAd использовали следующие условия инфецирования: 100 vp/клетку (всего 7,9×109 vp, смешанных с 37,5 мкг полиK-SIINFEKL в 200 мкл 10% RPMI-1640). Комплекс PeptiCRAd приготовляли, как описано в Способе 2. Спленоциты затем инкубировали в течение 2 ч при 37°С. Затем клетки обильно промывали и окрашивали либо АРС (антиген презентирующая клетка), конъюгированная с антителом против мышиного H-2Kb, связанным с SIINFEKL, либо АРС, конъюгированной с мышиным IgG1, изотип к Ctrl (BioLegend, Сан-Диего, СА, США). После 30-минутной инкубации на льду образцы промывали и анализировали проточной цитометрией.
Анализ проточной цитометрией
Опухоли, селезенки и лимфатические узлы обработанных мышей отбирали, проталкивали через 70 мкм сетку для клеток и культивировали в течение ночи в 10% средах RPMI-1640. При необходимости образцы замораживали в RPMI-1640 (с 10% FBS и 10% DMSO (диметилсульфоксид)) и хранили при -80°С. Суспензии одиночных клеток окрашивали моноклональными антителами, конъюгированными с флуорохромом, и анализировали с использованием проточного цитометра BD LSR II (BD Biosciences) или Gallios (Beckman Coulter) и программы FlowJo (Tree Star, Ashland, OR, США). Стерильный PBS использовали в качестве буфера для окрашивания. Эпитопспецифичные Т-клетки исследовали с использованием пентамеров МНС класса I (ProImmune, Оксфорд, Великобритания). Другие использованные антитела включали следующие: мышиные и человеческие Fc, блокирующие CD16/32 (BD Pharmingen); антитело против мышиного CD8, конъюгированное с FITC (флуоресцеинизотиоцианат) и антитело против человеческого CD8, конъюгированное с FITC (ProImmune); антитело против мышиного CD3ε, конъюгированное с РЕ (фикоэритрин)/Cy7, антитело против мышиного CD19, конъюгированное с РЕ/Cy7, антитело против мышиного CD11c, конъюгированное с FITC, антитело против мышиного CD86, конъюгированное с PerCp/Cy5.5, АРС, конъюгированная с антителом против мышиного H-2Kb, связанным с SIINFEKL, и АРС, конъюгированная с мышиным антителом IgG1, изотип к Ctrl (BioLegend). Все процедуры окрашивания проводили согласно рекомендациям изготовителей.
Статистические анализы
Статистическую значимость определяли с использованием GraphPad Prism 6 (GraphPad Software, Inc., Ла Хойя, СА, США). Подробное описание статистических методов, используемых для анализа данных из каждого эксперимента, можно найти в каждом кратком описании графического материала.
Эксперименты на животных и этические вопросы
Эксперименты на животных выполняли согласно финскому и европейскому праву и законодательству. Разрешение для экспериментов на животных (ESAVI/5924/04.10.03/2012) было проверено и принято финскими властями (Комитет по экспериментам на животных Университета Хельсинки и Правительство провинции Южная Финляндия). Полностью иммунокомпетентных мышей C57BL/6 приобретали у Scanbur (Карлслунде, Дания), а иммунодефицитных тройных нокаутных мышей NOD.Cg-Prkdcscid-IL2rgtm1Wjl/SzJ приобретали у Jackson Laboratories (Bar Harbor, ME, США). Всех мышей приобретали в возрасте 4-6 недель и содержали к карантине в течение 2 недель до исследования. Мышей содержали в клетках с изолированным и контролируемым током воздуха, и они имели неограниченный доступ к пище на протяжении всего периода исследования. Состояние здоровья мышей часто отслеживали, и животных умерщвляли при первых признаках боли или недомогания. Все процедуры осуществляли в камере с уровнем биобезопасности 2 в стерильных условиях.
Для экспериментов по эффективности опухолевые клетки собирали при конфлюентности 60-70% (логарифмическая фаза роста) и инъецировали подкожно (п.к.) в бока мышей. Число опухолевых клеток, инъецированных в каждый бок, варьировало согласно типу линии клеток: 3×105 B16-OVA, 1×105B16-F10 и 2×106 SK-MEL-2. Во всех экспериментах обрабатывали тремя инъекциями. Затем отслеживали рост опухоли, и объем опухоли определяли с использованием формулы.
Согласно лицензии авторов изобретения ожидаемые критические точки для человека были следующими: 1) потеря массы 25%, 2) диаметр опухоли больше 15 мм и 3) очевидные признаки боли (сниженная подвижность или изъязвление опухоли). Эвтаназию осуществляли посредством ингаляции диоксида углерода, с последующим смещением шейных позвонков.
Результаты
Отрицательный заряд капсида аденовируса можно использовать для образования комплекса с положительно заряженными иммуногенными пептидами, образуя PeptiCRAd
Капсиды аденовирусов несут сильно отрицательный суммарный заряд (36); следовательно, авторы изобретения предположили, что положительно заряженный пептид, ограниченный МНС-I, связывался бы с капсидом посредством электростатического взаимодействия, покрывая вирус иммунологически релевантными пептидами (т.е. опухолеспецифичными пептидами, ограниченными МНС-I). Для проверки гипотезы авторов изобретения авторы изобретения использовали модель опухоли B16-OVA (37). Эта линия клеток экспрессирует куриный овальбумин (OVA) и презентирует на MHC-I пептид SIINFEKL, происходящий из OVA, который авторы изобретения использовали в качестве модельного эпитопа.
Для обеспечения электростатического взаимодействия между нейтральным, гидрофобным пептидом SIINFEKL и отрицательно заряженной поверхностью вируса авторы изобретения добавили к последовательности пептида полилизиновую (полиK) цепь. Эиа химическая модификация увеличивала суммарный заряд пептида при физиологических условиях от 0 до +6 мВ. Затем авторы изобретения исследовали взаимодействие между капсидом вируса и модифицированными пептидами посредством поверхностного плазмонного резонанса (SPR). В частности, авторы изобретения покрывали OAd сенсор на основе диоксида кремния SiO2 APTES и инъецировали возрастающие концентрации SIINFEKL или полиK-SIIN в проточную систему (Фиг. 8Б). С немодифицированным пептидом не наблюдали увеличения сигнала (Фиг. 8Б, пунктирная линия), тогда как с модифицированным пептидом наблюдали зависимое от концентрации увеличение сигнала (Фиг. 8Б, сплошная линия), что демонстрирует то, что модификация пептида значительно увеличивала взаимодействие с капсидом аденовируса.
Затем авторы изобретения исследовали оптимальную концентрацию пептида, требующуюся для эффективного покрытия поверхности вируса. С этой целью авторы изобретения оценили суммарный заряд и гидродинамический диаметр комплексов вирус-пептид, образующихся в результате разных соотношений OAd : пептид (1:5, 1:50, 1:100 и 1:500). Авторы изобретения наблюдали явную связь между количеством положительно заряженного пептида в реакционной смеси и суммарным зарядом комплексов (Фиг. 8А). Наименьшее осотношение (1:5) было способно увеличивать заряд вирусных частиц от -29,7±0,5 до +6,3±0,06 мВ, хотя при данных условиях наблюдалась сильная агрегация, на что указывает увеличение размера комплексов (800±13,5 нм). При соотношении больше 1:5 суммарный заряд возрастал, достигая плато-подобной кинетики; фактически, авторы изобретения измерили зета потенциалы, представляющие собой +17,5±0,2, +18,4±0,1 и +18±0,8 мВ для соотношений 1:50, 1:100 и 1:500, соответственно. Однако только при соотношении 1:500 диаметр комплекса уменьшался до значения меньше 120 нм, что представляет собой нормальный диаметр аденовирусных частиц. (Фиг. 8А) Тот же самый эксперимент повторяли для облегчения воспроизводимости с концентрацией пептидов, а не с соотношением (Фиг. 12).
Модифицированные эпитопы МНС-I, адсорбированные на PeptiCRAd, эффективно перекрестно презентируются
Для индукции эффективного цитотоксического иммунного ответа, опосредованного Т-лимфоцитами, пептиды должны перекрестно презентироваться для наивных Т-лимфоцитов CD8+ посредством МНС-I на АРС. Следовательно, авторы изобретения исследовали то, могло ли присутствие и положение цепи полиK влиять на эффективность перекрестного презентирования. С этой целью авторы изобретения подвергали спленоциты, культивируемые ex vivo (из мышей C57BL/6), импульсному воздействию либо природного SIINFEKL, либо двух разных версий с лизиновыми удлинениями: полиK-SIINFEKL (удлиненный на N-конце) и SIINFEKL-полиK (удлиненный на С-конце). В качестве негативного контроля авторы изобретения включали удлиненный SIINFEKL, содержащий остаток аминокапроновой кислоты (АНХ), который представляет собой хорошо известный аналог лизина, который может ингибировать протеолитическую активность протеасомы. Затем авторы изобретения оценивали перекрестное презентирование SIINFEKL с применением антитела, которое специфично распознает МНС-I, загруженный SIINFEKL (38).
Как и ожидалось, 98,5% спленоцитов, подвергнутых импульсному воздействию SIINFEKL, были позитивными в отношении присутствия SIINFEKL на молекуле МНС-I на мембранах спленоцитов (Фиг. 13А). Интересно то, что положение цепи полиK в последовательности пептида значительно изменяло долю окрашенных клеток. Фактически, 94,5% спленоцитов, подвергнутых импульсному воздействию пептида, удлиненного на N-конце, осуществляли перекрестное презентирование SIINFEKL. В отличие от этого, при импульсном воздействии на спленоциты SIINFEKL-полиK, удлиненного на С-конце, окрашенная популяция снижалась до 27,1%. При импульсном воздействии негативного контроля - SIINFEKL-AHX-полиK только 1,36% спленоцитов осуществляли перекрестное презентирование пептида SIINFEKL. На основании этих данных авторы изобретения выбрали для дальнейших исследований версию, удлиненную на N-конце (полиK-SIINFEKL).
Затем авторы изобретения исследовали, могла ли адсорбция модифицированного SIINFEKL на вирусном капсиде воздействовать на его перекрестное презентирование. Как и в предыдущем эксперименте, авторы изобретения инкубировали мышиные спленоциты с пептидом SIINFEKL или полиK-SIINFEKL, или с OVA-PeptiCRAd. Авторы изобретения обнаружили то, что полиK-SIINFEKL, удлиненный на N-конце, образующий комплекс с OAd, формируя PeptiCRAd, обеспечивал эффективную ограниченное MHC-I презентирование пептида SIINFEKL (Фиг. 13Б).
PeptiCRAd демонстрирует неизменную инвазионную способность и интактную онколитическую активность по сравнению с немодифицированными вирусами
OAd могут избирательно инфицировать опухолевые клетки и лизировать их через цикл репликации OAd. Таким образом, авторы изобретения исследовали то, влияло бы покрытие вирусов модифицированными пептидами на их биологические свойства. Авторы изобретения выбрали исследование линии клеток человеческой колоректальной аденокарциномы (САСО-2), экспрессирующей низкие уровни рецептора вируса коксаки и аденовируса (CAR), и двух линий клеток человеческой меланомы (SK-MEL-2 и А2058), экспрессирующих более высокие уровни CAR. Сначала провели анализ жизнеспособности in vitro, сравнивая OVA-PeptiCRAd с немодифицированным вирусом Ad5D24 (Фиг. 14А), и результаты не продемонстрировали значимых различий в отношении онколитической активности. Как и ожидалось, самые инфекционные условия (100 vp/клетку) коррелировали с наименьшей жизнеспособностью во всех линиях клеток. Кроме того, авторы изобретения продемонстрировали то, что пептид полиK-SIINFEKL не имел токсического эффекта на клетки.
Затем авторы изобретения оценивали инвазионную способность PeptiCRAd посредством иммуногистохимических анализов (ICC) с использованием тех же самых линий клеток in vitro (Фиг. 14Б). В то время как авторы изобретения не наблюдали какого-либо отличия в линии клеток SK-MEL-2, в линиях клеток САСО-2 и А2058 PeptiCRAd демонстрировал значимое увеличение инвазионной способности (Р<0,01) по сравнению с непокрытым аденовирусом. Это увеличение вероятно было обусловлено разными зарядами PeptiCRAd и непокрытого аденовируса (36).
Исследования противоопухолевой эффективности и иммунологии противораковой вакцины PeptiCRAd в мышиной модели меланомы
Для тщательного исследования противоопухолевой эффективности PeptiCRAd и противоопухолевого иммунитета, который она стимулирует, авторы изобретения сначала использовали мышиную модель меланомы, сверхэкспрессирующей куриный OVA (B16-OVA) (35). Конкретно, B16-OVA имплантировали в бока мышей, после чего обрабатывали появившиеся опухоли. Данный эксперимент проводили с использованием OAd, несущего делецию D24 в Е1А (Ad5D24) (37), и затем повторяли с обогащенным CpG аденовирусом (Ad5D24-CpG) (39) для дальнейшего стимулирования иммунитета (Фиг. 15). Исследуемые группы включали мышей, которых обрабатывали OVA-PeptiCRAd, с не образующими комплекс Ad5D24-CpG и SIINFEKL (Ad5D24-CpG + SIINFEKL), одним OAd (Ad5D24-CpG) или пептидом (SIINFEKL), или физиологическим раствором (имитация).
Обработка PeptiCRAd значимо уменьшала рост опухоли по сравнению с имититующей обработкой или обработкой смесью OAd и SIINFEKL (Р<0,01). В конце эксперимента средние объемы опухолей у мышей, которых обрабатывали OVA-PeptiCRAd, были меньше, чем во всех других группах (120,4±31,6 мм3 по сравнению с 697,7±350 мм3 при имитации, 255±61,5 мм3 при обработке SIINFEKL, и 713,7±292,6 мм3 при обработке Ad5D24-CpG, 489,7±73,2 мм3 при обработке Ad5D24-CpG + SIINFEKL; Фиг. 15А).
В два разных момента времени (сутки 7 и 16 для ранних и поздних моментов времени, соответственно) мышей умерщвляли, и селезенки, опухоли и дренирующие лимфатические узлы отбирали для иммунологического анализа. Данный анализ выявил присутствие большой популяции SIINFEKL-специфичных Т-клеток CD8+ (Т-клетки CD8+OVA+) в паховых дренирующих лимфатических узлах в группе мышей, обработанных PeptiCRAd (7,4% на сутки 7 и 3,2% на сутки 16). Такой же анализ не показал резких отличий в опухолях в ранний момент времени, тогда как в поздний момент времени наблюдали значительное увеличение (0,23% при обработке OVA-PeptiCRAd по сравнению с 0,02% при имитации, 0,03% при обработке SIINFEKL, 0,1% при обработке Ad5D24-CpG и 0,02% при обработке Ad5D24-CpG + SIINFEKL на сутки 16; Фиг. 15Б и В).
Затем авторы изобретения изучали корреляцию между размерами опухолей и популяцией OVA-специфичных Т-клеток (Т-клетки CD8+OVA+) в селезенке, лимфатических узлах и опухолях. Авторы изобретения рассчитывали значение r Пирсона для оценки природы корреляции (отрицательное значение - отрицательная корреляция; положительное значение - положительная корреляция) и наблюдали отрицательную корреляцию между объемом опухоли и степенью ответа против OVA (Фиг. 15Г), указывающую на то, что группы животных с меньшими опухолями соответствовали группам животных с более надежной популяцией Т-клеток CD8+OVA+. Затем рассчитывали значение r2 для каждого набора образцов для оценки силы данной корреляции (селезенка, r2=0,5719; лимфатические узлы, r2=0,6385; опухоли, r2=0,7445). Интересно то, что в анализах корреляции группа PeptiCRAd (красные точки на Фиг. 15Г) последовательно демонстрировала наименьший объем опухоли и наибольший иммунологический ответ.
Наконец, для углубления понимания авторами изобретения механизмов действия PeptiCRAd авторы изобретения оценили долю зрелых DC (клетки CD19-CD3-CD11c+CD86высокий), презентирующих пептид SIINFEKL на MHC-I в селезенках мышей. В поздний момент времени доля зрелых DC, презентирующих SIINFEKL, была значимо выше (Р<0,05) у мышей, обработанных OVA-PeptiCRAd, чем у мышей, которых обрабатывали не образующими комплекс Ad5D24-CpG + SIINFEKL. При рассмотрении обоих моментов времени PeptiCRAd был единственной обработкой, которая индуцировала увеличение зрелых DC, презентирующих SIINFEKL, что демонстрируется 9,67-кратным увеличением популяции DC CD86высокийOVA+ (Фиг. 15Д).
Данные результаты свидетельствуют о том, что увеличение пула зрелых и эпитопспецифичных DC могло быть основой большей противоопухолевой эффективности PeptiCRAd.
Многовалентный PeptiCRAd демонстрирует увеличенную противоопухолевую активность против удаленных, необработанных меленом
Одним из главных преимуществ применения онколитических вакцин является то, что вызванный иммунный ответ облегчает направленное воздействие не только на первичные опухоли, но и также на диссеминированные метастазы. По этой причине авторы изобретения исследовали противоопухолевую эффективность PeptiCRAd в отношении необработанных расположенных на противоположной стороне опухолей в мышиной модели меланомы. В том же самом наборе экспериментов авторы изобретения также исследовали то, увеличивало бы общую эффективность направленное воздействие на два опухолевых антигена (посредством многовалентных PeptiCRAd), а не на один антиген. Следовательно, авторы изобретения выбрали два опухолеспецифичных эпитопа, ограниченных MHC-I, для покрытия онколитического вируса Ad5D24-CpG: SVYDFFVWL (TRP-2180-188; ограниченный мышиной молекулой MHC-I Н-2Kb) и KVPRNQDWL (человеческий gp10025-33, или hgp100; ограниченный мышиной молекулой MHC-I H-2Db (40)). Для данных экспериментов авторы изобретения использовали высокоагрессивную меланому B16-F10, которая экспрессирует оба опухолевых антигена (41). Пептиды модифицирвали цепью полиK на из N-конце для того, чтобы благоприятствовать их адсорбции на вирусном капсиде, как ранее делали в отношении SIINFEKL.
Сначала авторы изобретения имплантировали 1×105 клеток B16-F10 в правый бок мышей C57BL/6. Через 10 суток начинали обработки следующим образом: 1) физиологический раствор (имитация), 2) непокрытый онколитический вирус (Ad5D24-CpG) и 3) TRP-2-hgp100-PeptiCRAd с двойным покрытием. Производили внутриопухолевые обработки через сутки, как показано на схеме на Фиг. 6А. Через двое суток после последнего цикла инъекций 3×105 клеток B16-F10 инъецировали в левый бок мышей, и отслеживали рост меланом. Мыши, которых обрабатывали PeptiCRAd с двойным покрытием, демонстрировали значимо сниженный рост опухолей (Р<0,001) по сравнению с контролем (на сутки 11; Фиг. 16А). Анализ вторичных и необработанных опухолей выявил преимущество PeptiCRAd с двойным покрытием по сравнению со всеми другими группами. В частности, в конце эксперимента вторичные опухоли в данной группе были значительно меньше по сравнению с опухолями в контролях, получающих физиологический раствор или только Ad5D24-CpG (Р<0,01; Фиг. 16Б).
Для лучшего выяснения механизмов, лежащих в основе данных результатов, авторы изобретения провели анализ проточной цитометрией для исследования ответов специфичных Т-клеток в отношении обоих эпитопов. У мышей, которых обрабатывали TRP-2-hgp100-PeptiCRAd, авторы изобретения наблюдали большую совокупную популяцию эпитопспецифичных Т-клеток CD8+ (Фиг. 16В), чем во всех других группах.
В совокупности данные результаты демонстрируют то, что подход с PeptiCRAd является эффективным в моделе менее иммуногенной и более агрессивной меланомы. Кроме того, нацеливание на многие антигены приводит к сильному эффекту как на обработанные, так и на необработанные опухоли. Следовательно, можно генерировать многовалентные PeptiCRAd, и они могут дать нам возможность нацеливания на разные опухолевые антигены, за счет чего преодолевается некоторое иммунологическое избегание опухоли.
PeptiCRAd демонстрирует повышенную эффективность и противоопухолевый имунитет у гуманизированных мышей, несущих человеческие опухоли
Наконец, авторы изобретения хотели оценить эффективность PeptiCRAd в моделе, которая могла бы дать информацию по возможности ее перевода в клинические условия. Следовательно, авторы изобретения выбрали более сложную модель гуманизированных мышей. С этой целью тройным нокаутным мышам (NOD.Cg-Prkdcscid-IL2rgtm1Wjl/SzJ или NSG) сначала пересаживали линию клеток человеческой меланомы SK-MEL-2. При достижении опухолью пальпируемого размера тем же самым мышам пересаживали частично соответствующие человеческие одноядерные клетки периферической крови (РВМС) от здорового донора. Через одни сутки мышей обрабатывали PeptiCRAd, непокрытым вирусом или физиологическим раствором. Для данного эксперимента авторы изобретения выбрали пептид, происходящий из антигена А1, ассоциированного с меланомой (MAGE-A196-104; SLFRAVITK), и модифицировали его для обеспечения взаимодействия с вирусным капсидом (полиK-SLFRAVITK). В этом эксперименте, поскольку авторы изобретения исследовали полностью человеческую иммунную систему, авторы изобретения выбрали OAd, экспрессирующий человеческий GM-CSF, который, как было ранее показано авторами изобретения, имеет повышенную активность в иммунокомпетентной системе, включая раковых пациентов (8).
Авторы изобретения обнаружили то, что MAGE-A1 PeptiCRAd демонстрировал повышенную эффективность по сравнению с контрольными обработками, что демонстрируется быстрым уменьшением объема опухоли (Фиг. 17А и Б). Наконец, авторы изобретения исследовали то, мог ли более сильный иммунологический ответ объяснять повышенную противоопухолевую эффективность PeptiCRAd в данной модели. С этой целью авторы изобретения исследовали присутствие Т-клеток CD8+, специфичных в отношении MAGE-А196-104. посредством окрашивания пентамеров (Фиг. 17В), и авторы изобретения обнаружили наибольшую популяцию человеческих MAGE-специфичных Т-клеток (CD8+MAGE-A1+) в селезенках мышей, которых обрабатывали PeptiCRAd.
Эти данные подтверждают предыдущие открытия авторов изобретения о том, что PeptiCRAd стимулирует опухолеспецифичный иммунный ответ, используя преимущество природной иммуногенности онколитических вирусов, следовательно, улучшая эффективность противораковой иммунотерапии.
Анализ MHC-I-специфичных полипептидов при любом заболевании и покрытии аденовирусного капсида и их применения
Любой(бые) МНС-I-специфичный(ные) полипептид(ды) идентифицируется(ются) сравнением ограниченных МНС-I полипетидов, презентируемых DC и инфицированными больными клетками субъекта. Один или более чем один полипептид, презентируемый обеими группами клеток, выбирается для покрытия аденовирусного вектора.
Любой аденовирусный вектор отбирается и покрывается согласно любому способу, описанному в Способе 2.
Покрытые векторы используются для лечения заболевания пациента.
ССЫЛКИ
1. Mocellin, S (2012). Peptides in melanoma therapy. Curr Pharm Des 18: 820-831.
2. Lipscomb, MF and Masten, BJ. Dendritic Cells: Immune Regulators in Health and Disease, physrev.physiology.org.
3. Degli-Esposti, MA and Smyth, MJ (2005). Close encounters of different kinds: dendritic cells and NK cells take centre stage. Nat Rev Immunol 5: 112-124.
4. Trinchieri, G, Aden, DP and Knowles, BB (1976). Cell-mediated cytotoxicity to SV40-specific tumour-associated antigens. Nature 261: 312-314.
5. Steinman, RM, Hawiger, D and Nussenzweig, MC (2003). Tolerogenic dendritic cells. Annu. Rev. Immunol. 21: 685-711.
6. Wongthida, P, Diaz, RM, Galivo, F, Kottke, T, Thompson, J, Melcher, A, et al. (2011). VSV oncolytic virotherapy in the B16 model depends upon intact MyD88 signaling. Mol Ther 19: 150-158.
7. Prestwich, RJ, Errington, F, Diaz, RM, Pandha, HS, Harrington, KJ, Melcher, AA, et al. (2009). The case of oncolytic viruses versus the immune system: waiting on the judgment of Solomon. Hum Gene Ther 20: 1119-1132.
8. Cerullo, V, Pesonen, S, Diaconu, I, Escutenaire, S, Arstila, PT, Ugolini, M, et al. (2010). Oncolytic adenovirus coding for granulocyte macrophage colony-stimulating factor induces antitumoral immunity in cancer patients. Cancer Res 70: 4297-4309.
9. Heise, C, Hermiston, T, Johnson, L, Brooks, G, Sampson-Johannes, A, Williams, A, et al. (2000). An adenovirus E1A mutant that demonstrates potent and selective systemic anti-tumoral efficacy. Nat Med 6: 1134-1139.
10. Heise, C, Sampson-Johannes, A, Williams, A, McCormick, F, Hoff, von, DD and Kirn, DH (1997). ONYX-015, an E1B gene-attenuated adenovirus, causes tumor-specific cytolysis and antitumoral efficacy that can be augmented by standard chemotherapeutic agents. Nat Med 3: 639-645.
11. Nowak, AK, Lake, RA, Marzo, AL, Scott, B, Heath, WR, Collins, EJ, et al. (2003). Induction of tumor cell apoptosis in vivo increases tumor antigen cross-presentation, cross-priming rather than cross-tolerizing host tumor-specific CD8 T cells. J Immunol 170: 4905-4913.
12. Zitvogel, L, Apetoh, L, Ghiringhelli, F and Kroemer, G (2008). Immunological aspects of cancer chemotherapy. Nat Rev Immunol 8: 59-73.
13. van der Most, RG, Currie, AJ, Robinson, BWS and Lake, RA (2008). Decoding dangerous death: how cytotoxic chemotherapy invokes inflammation, immunity or nothing at all. Cell Death Differ 15: 13-20.
14. Istrail, S, Florea, L,

15. Cerullo, V, Pesonen, S, Diaconu, I, Escutenaire, S, Arstila, PT, Ugolini, M, et al. (2010). Oncolytic adenovirus coding for granulocyte macrophage colony-stimulating factor induces antitumoral immunity in cancer patients. Cancer Res 70: 4297-4309.
16. Cerullo, V, Seiler, MP, Mane, V, Brunetti-Pierri, N, Clarke, C, Bertin, TK, et al. (2007). Toll-like receptor 9 triggers an innate immune response to helper-dependent adenoviral vectors. Mol Ther 15: 378-385.
17. Suzuki, M, Cerullo, Bertin, T, Cela, Clarke, Guenther, M, et al. (2009). MyD88-dependent silencing of transgene expression during the innate and adaptive immune response to Helper-dependent adenovirus. Hum Gene Therdoi:10.1089/hum.2009.155.
18. Suzuki, M, Cela, R, Bertin, TK, Sule, G, Cerullo, V, Rodgers, JR, et al. (2011). NOD2 signaling contributes to the innate immune response against helper-dependent adenovirus vectors independently of MyD88 in vivo. Hum Gene Ther 22: 10 1082.
19. Muruve, DA,

20. Tewalt, EF, Grant, JM, Granger, EL, Palmer, DC, Heuss, ND, Gregerson, DS, et al. (2009). Viral Sequestration of Antigen Subverts Cross Presentation to CD8+ T Cells. PLoS Pathog 5: e1000457.
21. Cerullo, V, Seiler, MP, Mane, VP, Brunetti-Pierri, N, Clarke, C, Bertin, TK, et al. (2007). Toll-like receptor 9 triggers an innate immune response to helper-dependent adenoviral vectors. Mol Ther 15: 378-385.
22. Suzuki, M, Cerullo, V, Bertin, TK, Cela, R, Clarke, C, Guenther, M, et al. (2010). MyD88-dependent silencing of transgene expression during the innate and adaptive immune response to helper-dependent adenovirus. Hum Gene Ther 21: 325-336.
23. Seiler, MP, Gottschalk, S, Cerullo, V, Ratnayake, M, Mane, VP, Clarke, C, et al. (2007). Dendritic cell function after gene transfer with adenovirus-calcium phosphate co-precipitates. Mol Ther 15: 386-392.
24. Suzuki, M, Cela, R, Bertin, TK, Sule, G, Cerullo, V, Rodgers, JR, et al. (2011). NOD2 Signaling Contributes to the Innate Immune Response Against Helper-Dependent Adenovirus Vectors Independently of MyD88 In Vivo. Hum Gene Therdoi:10.1089/hum.2011.002.
25. Fortier, M-H, Caron, E, Hardy, M-P, Voisin, G, Lemieux, S, Perreault, C, et al. (2008). The MHC class I peptide repertoire is molded by the transcriptome. Journal of Experimental Medicine 205: 595-610.
26. Fasbender, A, Zabner, J, Chillon, M, Moninger, TO, Puga, AP, Davidson, BL, et al. (1997). Complexes of adenovirus with polycationic polymers and cationic lipids increase the efficiency of gene transfer in vitro and in vivo. J Biol Chem 272: 6479-6489.
27. Croyle, MA, Yu, QC and Wilson, JM (2000). Development of a rapid method for the PEGylation of adenoviruses with enhanced transduction and improved stability under harsh storage conditions. Hum Gene Ther 11: 1713-1722.
28. Wonganan, P and Croyle, MA (2010). PEGylated Adenoviruses: From Mice to Monkeys. Viruses 2: 468-502.
29. Toyoda, K, Ooboshi, H, Chu, Y, Fasbender, Al, Davidson, BL, Welsh, MJ, et al. Cationic Polymer and Lipids Enhance Adenovirus-Mediated Gene Transfer to Rabbit Carotid Artery, stroke.ahajournals.org.
30. Cerullo, V, Diaconu, I, Romano, V, Hirvinen, M, Ugolini, M, Escutenaire, S, et al. (2012). An Oncolytic Adenovirus Enhanced for Toll-like Receptor 9 Stimulation Increases Antitumor Immune Responses and Tumor Clearance. Mol Ther 20, 2076.
31. Cerullo, V, Diaconu, I, Romano, V, Hirvinen, M, Ugolini, M, Escutenaire, S, et al. (2012). An Oncolytic Adenovirus Enhanced for Toll-like Receptor 9 Stimulation Increases Antitumor Immune Responses and Tumor Clearance. Mol Ther 20, 2076.
32. Dias, JD, Liikanen, I, Guse, K, Foloppe, J, Sloniecka, M, Diaconu, I, et al. (2010). Targeted chemotherapy for head and neck cancer with a chimeric oncolytic adenovirus coding for bifunctional suicide protein FCU1. Clin Cancer Res 16: 2540-2549.
33. Edukulla, R, Woller, N, Mundt, B, Knocke, S, Gurlevik, E, Saborowski, M, et al. (2009). Antitumoral immune response by recruitment and expansion of dendritic cells in tumors infected with telomerase-dependent oncolytic viruses. Cancer Res 69: 1448-1458.
34. R.B. Dell, S. Holleran, R. Ramakrishnan, Sample size determination. ILAR journal / National Research Council, Institute of Laboratory Animal Resources 43, 207 (2002).
35. M.W. Moore, F.R. Carbone, M.J. Bevan, Introduction of soluble protein into the class I pathway of antigen processing and presentation. Cell 54, 777 (Sep 9, 1988).
36. A. Fasbender et al., Complexes of adenovirus with polycationic polymers and cationic lipids increase the efficiency of gene transfer in vitro and in vivo. The Journal of biological chemistry 272, 6479 (Mar 7, 1997).
37. C. Heise et al., An adenovirus E1A mutant that demonstrates potent and selective systemic anti-tumoral efficacy. Nature medicine 6, 1134 (Oct, 2000).
38. Y. Deng et al., Assembly of MHC class I molecules with biosynthesized endoplasmic reticulum-targeted peptides is inefficient in insect cells and can be enhanced by protease inhibitors. J Immunol 161, 1677 (Aug 15, 1998).
39. V. Cerullo et al., An oncolytic adenovirus enhanced for toll-like receptor 9 stimulation increases antitumor immune responses and tumor clearance. Molecular therapy: the journal of the American Society of Gene Therapy 20, 2076 (Nov, 2012).
40. W.W. Overwijk et al., gp100/pmel 17 is a murine tumor rejection antigen: induction of "self-reactive, tumoricidal T cells using high-affinity, altered peptide ligand. The Journal of experimental medicine 188, 277 (Jul 20, 1998).
41. W.W. Overwijk, N.P. Restifo, B16 as a mouse model for human melanoma. Current protocols in immunology / edited by John E. Coligan … [et al.] Chapter 20, Unit 20 1 (May, 2001).
Реферат
Предложенная группа изобретений относится к области медицины. Предложен аденовирусный вектор для стимулирования пептидоспецифичного иммунного ответа у субъекта, содержащий полипептиды, присоединенные к вирусному капсиду, выбранные из группы, состоящей из полипептидов, специфичных в отношении главного комплекса гистосовместимости класса I (MHC-I), или полипептидов, специфичных в отношении главного комплекса гистосовместимости класса II (MHC-II), которые являются опухолеспецифичными. Предложена композиция для стимулирования пептидоспецифичного иммунного ответа, содержащая аденовирусный вектор. Предложен способ стимулирования пептидоспецифичного иммунного ответа, включающий введение субъекту аденовирусного вектора. Предложенная группа изобретений обеспечивает введение полипептидов и вирусов в виде одной физически связанной единицы для максимального противоопухолевого эффекта. 3 н. и 16 з.п. ф-лы, 17 ил., 4 пр.

Комментарии