Продуцирующие гистамин бактериальные штаммы и их применение при злокачественных опухолях - RU2747390C2
Код документа: RU2747390C2
Чертежи













Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в основном относится к штаммам молочнокислых бактерий, и в частности, к продуцирующим гистамин штаммам молочнокислых бактерий и к их применению, например, при злокачественных опухолях.
УРОВЕНЬ ТЕХНИКИ ДЛЯ ИЗОБРЕТЕНИЯ
Ранее получено доказательство, указывающее на то, что гистамин может модулировать пролиферацию различных нормальных и злокачественных клеток. Опубликован высокий уровень и высокое содержание гистамина вместе с рецепторами гистамина при различных злокачественных опухолях человека, включая меланому, рак толстой кишки и молочной железы.
Колоректальный рак (CRC), обозначаемый также как рак толстой кишки, рак прямой кишки или рак кишечника, является третьей из наиболее распространенных злокачественных опухолей и третьей из ведущих причин смертности, связанной со злокачественными опухолями. Колоректальный канцерогенез ассоциирован как с генетическими факторами, так и с факторами внешней среды. Колоректальный рак представляет собой рак толстой и/или прямой кишки.
Lactobacillus reuteri представляет собой комменсальную кишечную фирмикуту и пробиотик, широко преобладающий в желудочно-кишечном тракте различных видов птиц и млекопитающих. Этот организм является признанным полностью безвредным (GRAS) и обеспечивающим преимущества микроорганизмом, и его используют по всему миру в качестве пробиотика в течение приблизительно двух десятилетий. Опубликовано, что L. reuteri супрессирует провоспалительные цитокины в клетках эпителия кишечника, моноцитах и воспаление кишечника в различных моделях на грызунах.
В WO 2013/011137 описан отбор специфических пробиотических штаммов молочнокислых бактерий, продуцирующих гистамин, и применение таких штаммов для получения благоприятных эффектов для млекопитающих. Выбранные штаммы бактерий можно использовать для местной продукции гистамина у млекопитающих, в частности, для применения для лечения или профилактики воспалительных состояний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение, описанное в настоящем документе, относится к продуцирующим гистамин штаммам бактерий для применения в лечении злокачественных опухолей, включая колоректальный рак.
Авторы изобретения обнаружили, что продуцирующие гистамин пробиотические бактерии являются способными уменьшать частоту и тяжесть ассоциированного с воспалением CRC при колоректальном раке Hdc-/-. L. reuteri ATCC PTA-6475 значительно уменьшал количество и размер колоректальных опухолей или опухолей толстой кишки. В то же время, изогенный мутант dcAL. reuteri ATCC PTA-6475, лишенный активности продукции гистамина, не оказывал таких эффектов, что указывает на значительную роль бактериального гена hdcA в желудочно-кишечном микробиоме и продукции гистамина для супрессии образования колоректальных опухолей.
Соответственно, один аспект вариантов осуществления относится к продуцирующему гистамин штамму молочнокислых бактерий для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива колоректального рака.
Другой аспект вариантов осуществления относится к продуцирующему гистамин штамму молочнокислых бактерий для применения в качестве вспомогательного средства при лечении злокачественных опухолей, выбранном из группы, состоящей из радиотерапии и химиотерапии.
Следующий аспект вариантов осуществления относится к продуцирующему гистамин штамму молочнокислых бактерий для применения для профилактики, ингибирования или лечения расстройств желудочно-кишечного тракта, ассоциированных с лечением злокачественных опухолей, выбранным из группы, состоящей из радиотерапии и химиотерапии.
Другой аспект вариантов осуществления относится к способу выбора штамма молочнокислых бактерий для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива колоректального рака. Способ включает в себя скрининг молочнокислых бактерий по присутствию активного гистидинового оперона. Способ включает в себя также отбор, для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива колоректального рака, штамма молочнокислых бактерий, идентифицированного в качестве штамма молочнокислых бактерий, обладающего активным гистидиновым опероном и способным продуцировать гистамин.
Следующий аспект вариантов осуществления относится к способу отбора штамма молочнокислых бактерий для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива злокачественных опухолей. Способ включает в себя скрининг молочнокислых бактерий по присутствию активного гистидинового оперона, а также по способности продуцировать диацилглицеринкиназу (DagK). Способ включает в себя также отбор, для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива злокачественных опухолей, штамма молочнокислых бактерий, идентифицированного в качестве штамма молочнокислых бактерий, обладающего активным гистидиновым опероном и способного продуцировать гистамин и DagK.
Следующий аспект вариантов осуществления относится к способу выбора штамма молочнокислых бактерий для применения для профилактики, ингибирования или лечения воспалительного состояния. Способ включает в себя скрининг молочнокислых бактерий по присутствию активного гистидинового оперона и способности продуцировать DagK. Способ включает в себя также отбор, для применения для профилактики, ингибирования или лечения воспалительного состояния, штамма молочнокислых бактерий, идентифицированного в качестве штамма молочнокислых бактерий, обладающего активным гистидиновым опероном и способного продуцировать гистамин и DagK.
Следующие аспекты вариантов осуществления относятся к новому штамму L. reuteri - Lactobacillus reuteri DSM 32273, к такому штамму L. reuteri DSM 32273 для применения в качестве лекарственного средства и в частности, для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива злокачественной опухоли или для применения для профилактики, ингибирования или лечения воспалительного состояния.
Следующий объект изобретения относится к применению продуцирующего гистамин штамма бактерий для изготовления лекарственного средства для лечения колоректального рака у мужчин.
Следующий объект изобретения относится к композиции для лечения колоректального рака у мужчин, содержащей эффективное количество указанного штамма бактерий и фармацевтически приемлемый носитель.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
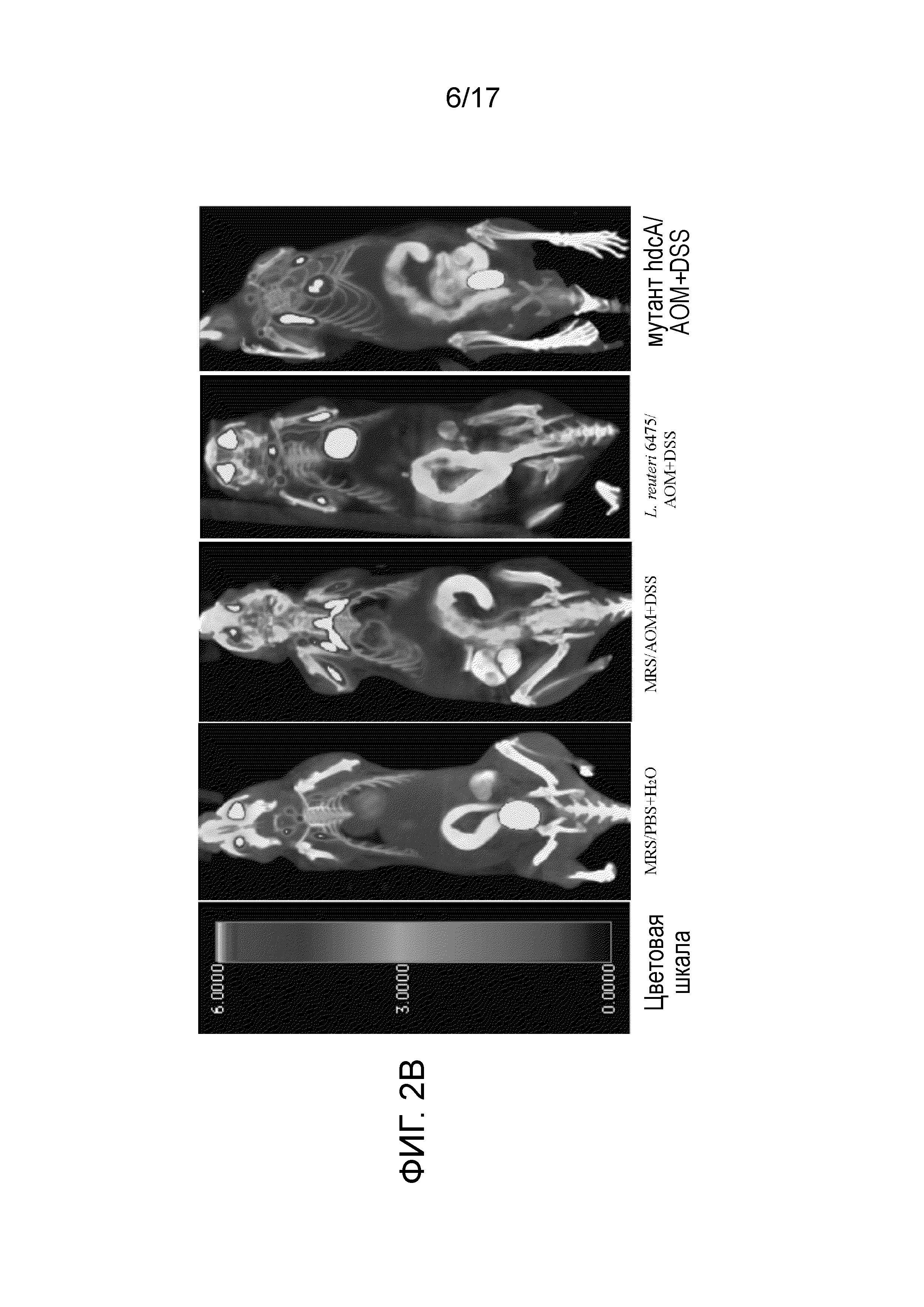
Фигура 1. L. reuteri ATCC PTA-6475 дикого типа, но не его мутант hdcA Mutant, облегчает индуцированный AOM/DSS рак толстой кишки in vivo. (A) Расписание экспериментов на мышах. Мышей Hdc-/- BALB/c в возрасте одиннадцать недель случайным образом разделяли на четыре группы, включая группу отрицательного контроля, группу положительного контроля, группу лечения L. reuteri ATCC PTA-6475 и группу лечения мутантом hdcAL. reuteri. Мышам в группе лечения L. reuteri ATCC PTA-6475 или в группе лечения мутантом hdcA вводили 5×109КОЕ L. reuteri ATCC PTA-6475 дикого типа или изогенного штамма L. reuteri с мутацией hdcA,соответственно, в 0,2 мл MRS посредством введения через орогастральный зонд один раз в сутки в течение семи суток и затем один раз в трое суток. Мышам в группе отрицательного и положительного контроля вводили только богатые микробиологические среды (MRS). В возрасте двенадцати недель, этих мышей подвергали воздействию одной дозы AOM (12,5 мг/кг) посредством внутрибрюшинной инъекции с последующими двумя циклами обработки 2% DSS в питьевой воде в течение 6 суток с двухнедельными периодами восстановления с использованием только питьевой воды между датами введения DSS. Мышам в группе отрицательного контроля вводили одну дозу PBS и только питьевую воду, вместо AOM и DSS. Мышей умерщвляли в возрасте 27 недель и оценивали канцерогенез в толстой кишке в каждой группе. (B) Репрезентативные изображения толстой кишки в группе отрицательного контроля (MRS/PBS-H2O), в группе положительного контроля (MRS/AOM-DSS), в группе лечения L. reuteri ATCC PTA-6475 (L. reuteri 6475/AOM-DSS) и в группе лечения изогенным мутантом hdcAL. reuteri (мутант hdcA/AOM-DSS). (C) Количества как больших (>3 мм), так и небольших (<3 мм) опухолей толстой кишки у мышей в каждой группе, упомянутой выше. Данные представлены в форме графиков вида «ящик с усами», показывающих медиану и 10-й и 90-й процентили (**P<0,01, ***p<0,001, n=8~10 для каждой группы). (D) Репрезентативные изображения при микроскопии толстой кишки (окрашенные H&E) от мышей из группы отрицательного контроля (MRS/PBS-H2O), из группы положительного контроля (MRS/AOM-DSS), из группы лечения L. reuteri ATCC PTA-6475 дикого типа (L. reuteri 6475/AOM-DSS) и из группы лечения изогенным мутантом hdcAL. reuteri (мутант hdcA/AOM-DSS).
Фигура 2. Детекция уменьшения образования опухолей толстой кишки посредством получения изображений PET. (A) Процедуры для получения изображений PET. (B) Репрезентативные изображения мышей, полученные посредством сканирования PET/CT в каждой группе. Шкала обозначений представляет интенсивность сигнала FDG. (C) Количественная оценка сигналов FDG в целой толстой кишке мыши с использованием SUV в каждой группе показала, что введение L. reuteri ATCC PTA-6475 значимо уменьшало интенсивность FDG в толстой кишке мыши, по сравнению с контролем со средой MRS, однако у изогенного мутанта hdcAL. reuteri отсутствовали такие эффекты (анализировано вслепую). Данные представлены в форме диаграмм рассеяния (*P <0,05, n=6 для каждой группы).
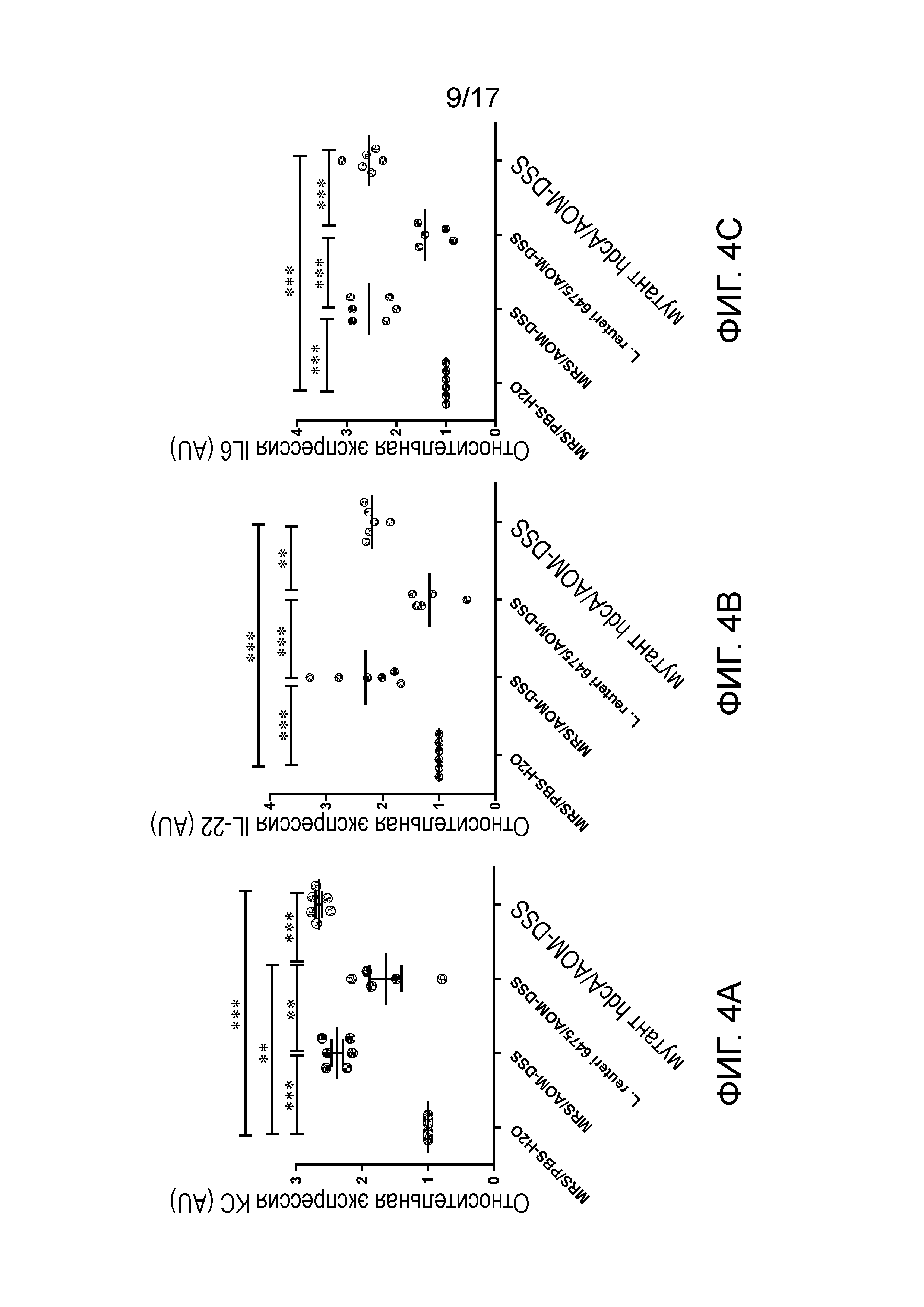
Фигура 3. Введение L. reuteri ATCC PTA-6475 влияет на продукцию цитокинов в плазме мыши. Введение L. reuteri ATCC PTA-6475 значимо уменьшало продукцию провоспалительных цитокинов KC (A), IL-22 (B) и IL-6 (C) в плазме крови самцов мышей Hdc-/- на уровне белка, определенном посредством анализа Luminex, в то время как изогенный мутант hdcAL. reuteri, лишенный способности продуцировать гистамин, не оказывал таких эффектов. Данные представлены в форме диаграмм рассеяния (*P <0,05, **P<0,01, ***p<0,001, n=8~10 для каждой группы).
Фигура 4. Введение L. reuteri ATCC PTA-6475 влияет на экспрессию генов цитокинов в толстой кишке. Введение L. reuteri ATCC PTA-6475 значимо уменьшало экспрессию генов провоспалительных цитокинов KC (A), IL-22 (B), IL-6 (C), TNF (D), и IL-1α (E) в слизистой оболочке толстой кишки самцов мышей Hdc-/- на уровне мРНК, определенном посредством ОТ-qПЦР, в то время как изогенный мутант hdcAL. reuteri, лишенный способности продуцировать гистамин, не оказывал таких эффектов. Данные представлены в форме диаграмм рассеяния (*P <0,05, **P<0,01, ***p<0,001, n=5~6 для каждой группы).
Фигура 5. Экспрессию H2R уменьшали посредством воздействия AOM/DSS и индуцировали посредством L. reuteri. (A) Иммуногистохимические исследования с использованием специфического для H2R антитела показали, что H2R экспрессировался в толстой кишке мышей Hdc-/-. Воздействие AOM и DSS уменьшало интенсивность H2R по сравнению с здоровым контролем, и введение L. reuteri индуцировало экспрессию H2R. (B) экспрессия гена H2R в слизистой оболочке толстой кишки значимо не изменялась посредством воздействия AOM/DSS или введения L. reuteri у самцов мышей Hdc-/- (n=5~6 для каждой группы).
Фигура 6. Количество CD11b+Gr-1+ IMC в селезенке уменьшали посредством введения L. reuteri ATCC PTA-6475. Анализ проточной цитометрии, проведенный для образцов костного мозга (A) и селезенки (B) самцов мышей Hdc-/- показал, что воздействие AOM/DSS значимо увеличивало процент CD11b+Gr-1+ IMC в селезенке по сравнению с здоровым контролем. Введение L. reuteri ATCC PTA-6475 у мышей, подвергнутых воздействию AOM/DSS, значимо уменьшало процент CD11b+Gr-1+ IMC в селезенке по сравнению с мышами, которым не вводили бактерий (***p<0,001, средние±s.d.; n=3~4 для каждой группы).
Фигура 7. L. reuteri ATCC PTA-6475 уменьшал количество больших опухолей толстой кишки у самок мышей Hdc-/-. (A) Репрезентативные изображения толстой кишки мышей в группе отрицательного контроля (MRS/PBS-H2O), в группе положительного контроля (MRS/AOM-DSS), в группе лечения L. reuteri ATCC PTA-6475 (L. reuteri 6475/AOM-DSS) и в группе лечения мутантом hdcA (hdcA мутант/AOM-DSS). (B) Количество больших (>3 мм) опухолей толстой кишки у самок мышей Hdc-/- значимо уменьшали посредством введения L. reuteri ATCC PTA-6475, однако, количество небольших (<3 мм) опухолей толстой кишки у самок мышей Hdc-/- значимо не изменялось. Данные представлены в форме графиков вида «ящик с усами», показывающих медиану и 10 и 90 процентили (*P<0,05, ***p<0,001, n=8~10 для каждой группы).
Фигура 8. Механизм действия L. reuteri в модели ассоциированного с воспалением канцерогенеза. Фигура схематически иллюстрирует потенциальный механизм пробиоза L. reuteri ATCC PTA-6475 в модели ассоциированного с воспалением канцерогенеза на мышах.
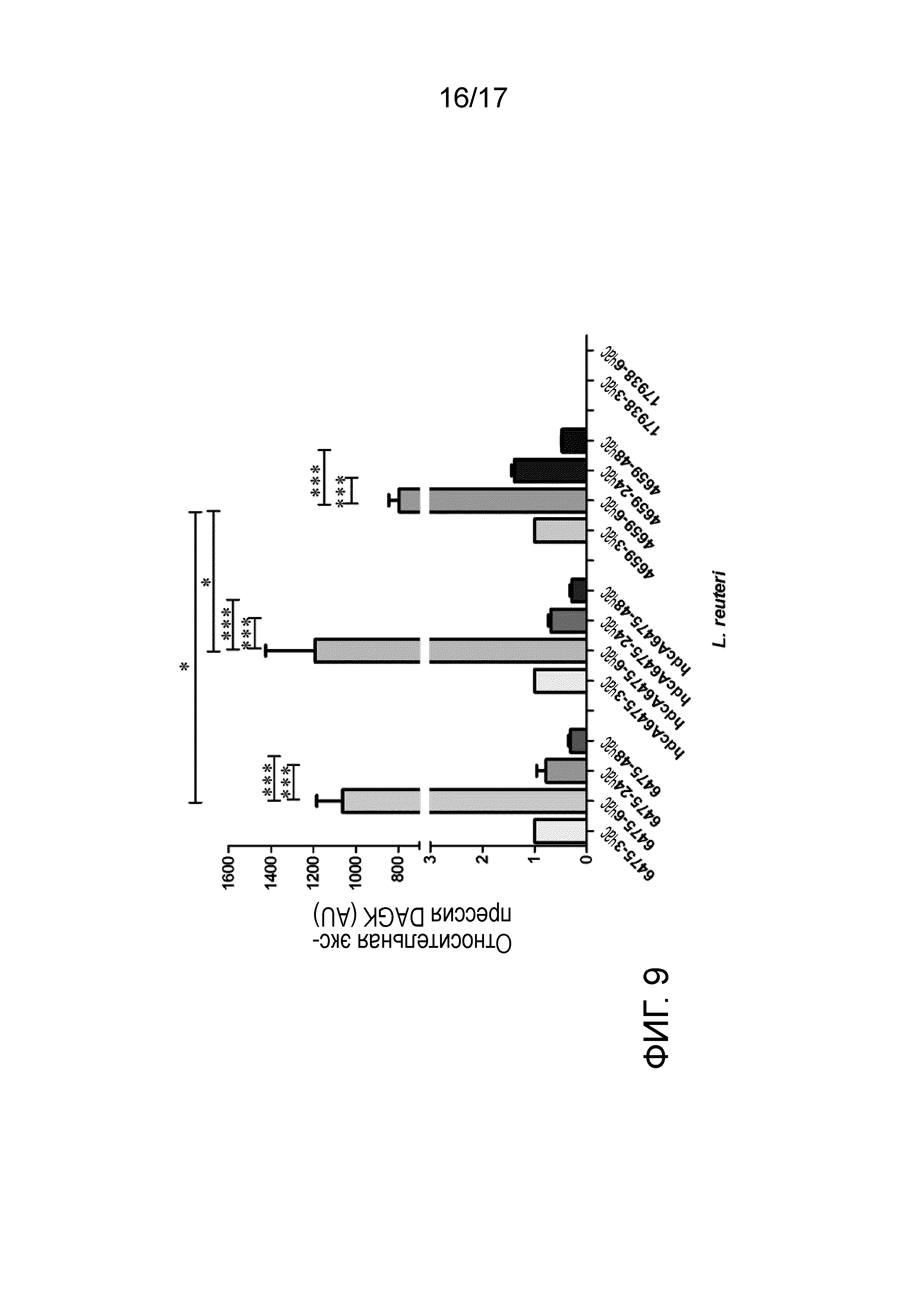
Фигура 9. L. reuteri WT и мутант hdcA ATCC PTA-6475 и ATCC PTA-4659 продуцируют диацилглицеринкиназу (DagK). Относительные уровни экспрессии мРНК генов-мишеней, нормализованные по гену домашнего хозяйства rpoB, представлены через 3, 6, 24 и 48 часов культивирования каждой бактерии. мРНК, полученные через 3 часа культивирования каждой бактерии, устанавливали на 1,0 и использовали в качестве калибратора для идентификации кратности относительных отличий количества мРНК.
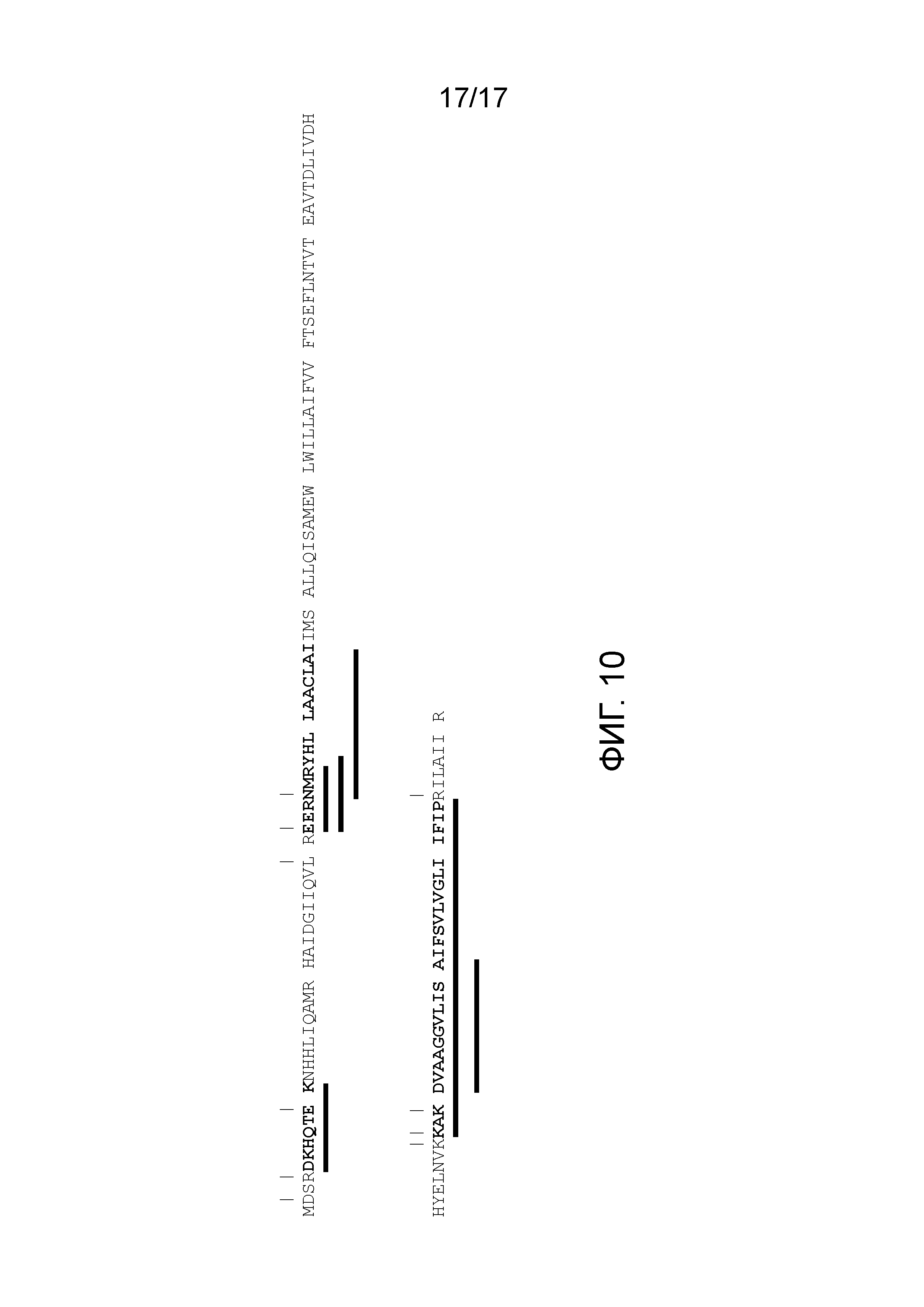
Фигура 10. Аминокислотная последовательность DagK L. reuteri. Аминокислотная последовательность DagK L. reuteri (SEQ ID NO: 25) показана вместе с участками расщепления трипсином (вертикальные линии). Обозначенные жирным шрифтом аминокислоты указывают последовательности пептидов, полученных после такой обработки трипсином. Черными прямоугольниками обозначены последовательности пептидов, обнаруженных в экспериментах LC-MS/MS.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ И ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ЕГО ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение относится к пробиотическим продуцирующим гистамин штаммам бактерий для применения при злокачественных опухолях, особенно зависимых от гистамина злокачественных опухолях, включая, но без ограничения, колоректальный рак. Настоящее изобретение относится к отбору пробиотических продуцирующих гистамин штаммов бактерий для применения при злокачественных опухолях. Выбранные продуцирующие гистамин штаммы бактерий можно использовать для местной доставки гистамина, в качестве агонистов рецепторов гистамина.
Один вариант осуществления изобретения относится к отбору конкретных пробиотических бактерий, способных продуцировать гистамин. Эти выбранные бактерии можно использовать для лечения злокачественной опухоли, особенно зависимой от гистамина злокачественной опухоли, например, такой как колоректальный рак.
Другой вариант осуществления настоящего изобретения относится к отбору конкретных пробиотических бактерий, способных продуцировать гистамин, а также способных продуцировать диацилглицеринкиназу (DagK), например, продуцировать и секретировать DagK, или по меньшей мере высвобождать DagK, чтобы оказывать внеклеточный эффект. Эти выбранные бактерии можно использовать для профилактики, ингибирования, лечения или уменьшения риска рецидива злокачественных опухолей, особенно зависимой от гистамина злокачественной опухоли, например, такой как колоректальный рак.
Другой вариант осуществления настоящего изобретения относится к отбору конкретных пробиотических бактерий, способных продуцировать гистамин и способных продуцировать DagK. Эти избранные бактерии можно использовать для профилактики, ингибирования или лечения воспалительного состояния, например, такого как колит, воспалительное заболевание кишечника (IBD), синдром раздраженной кишки (IBS), дивертикулез, гингивит, мастит или вагинит.
В другом варианте осуществления изобретения избранные штаммы бактерий предпочтительно используют для пациентов мужского пола с злокачественными опухолями, и в другом варианте осуществления изобретения штаммы бактерий используют для пациентов мужского пола с большими опухолями толстой или прямой кишки.
Избранные штаммы бактерий можно использовать в качестве вспомогательного средства для классической радиотерапии или химиотерапии.
Избранные штаммы бактерий могут быть также использованы в качестве продукта для минимизации диареи и других расстройств желудочно-кишечного тракта, ассоциированных с радиотерапией или химиотерапией злокачественных опухолей, и в то же самое время действуют в качестве вспомогательного средства для улучшения такого лечения для уменьшения злокачественных опухолей.
Происходящий из микроорганизмов гистамин может оказывать различные эффекты на хозяина, в зависимости от активации специфических рецепторов гистамина, которая отличается от паттернов их экспрессии в тканях. В частности, в отношении CRC, значительно увеличенная активность гистидиндекарбоксилазы (HDC) обнаружена в образцах удаленных опухолей человека в серии из десяти подвергнутых хирургической операции пациентов с колоректальной карциномой, что указывает на значительную роль активности фермента HDC в развитии клеток колоректальных опухолей (Garcia-Caballero et al., 1988). С другой стороны, показано, что недостаточность HDC стимулирует ассоциированный с воспалением CRC посредством накопления CD11b+Gr-1+ IMC (Yang et al., 2011). В отношении H2R, ингибирование H2R посредством его антагониста увеличивала выживаемость пациентов с CRC (Adams and Morris, 1994; Kelly et al., 1999).
Авторы настоящего изобретения обнаружили, что продуцирующие гистамин бактерии, такие как L. reuteri ATCC PTA-6475, защищали самцов мышей Hdc-/- в модели колоректального рака, ассоциированного с воспалением, индуцированным азоксиметаном/декстрансульфатом натрия (AOM/DSS), как показано по уменьшению количеств и размеров опухолей толстой кишки, оцененному посредством макроскопической и микроскопической оценки толстой кишки, так же как посредством получения изображений PET с18F-FDG для живого животного. В то же время, авторы настоящего изобретения обнаружили, что ферментативный аппарат, гистидиндекарбоксилаза, должен присутствовать в микробиоме кишечника, чтобы получать гистамин в форме биологически активного соединения, как показано по утрате эффекта против образования опухолей у мутанта hdcA. Исследования цитокинов (количеств белка в плазме и количеств мРНК в слизистой оболочке толстой кишки) показали уменьшение уровня ассоциированных с воспалением/опухолями цитокинов посредством введения продуцирующего гистамин штамма, но не штамма, не продуцирующего гистамин, что согласуется с фенотипическими наблюдениями.
Авторы настоящего изобретения наблюдали также потенциальное изменение экспрессии H2R в толстой кишке мышей Hdc-/-. Воздействие AOM и DSS уменьшало интенсивность H2R по сравнению с здоровым контролем, и введение L. reuteri индуцировало экспрессию H2R. Это наблюдение позволяет предполагать ассоциацию между экспрессией H2R и воспалением или CRC. Когда мышей подвергали воздействию AOM/DSS для индукции рака толстого кишечника, экспрессия H2R уменьшалась. Когда вводили L. reuteri, экспрессия H2R была индуцирована. Принимая во внимание то, что для введения мутанта hdcA также показана увеличенная экспрессия H2R (не настолько высокая, как в группе L. reuteri ATCC PTA-6475) по сравнению с мышами в группе положительного контроля, которым вводили AOM/DSS, но без бактерий, L. reuteri может продуцировать некоторые вещества в дополнение к гистамину, которые могут индуцировать H2R.
Объектом настоящего изобретения являются продуцирующие гистамин бактерии для лечения и предотвращения зависимых от гистамина злокачественных опухолей, включая колоректальный рак (рак толстой кишки), меланому, рак молочной железы, рак поджелудочной железы и т.п.
Другим объектом является применение конкретных бактерий для местной доставки гистамина в качестве агониста рецепторов гистамина, возможно, доставляемых вместе с специфическим источником гистидина.
В другом предпочтительном варианте осуществления избранные штаммы бактерий используют главным образом для пациентов мужского пола, страдающих злокачественными опухолями, в частности, колоректальным раком.
В другом варианте осуществления избранные штаммы бактерий используют главным образом для пациентов мужского пола с большими опухолями толстой или прямой кишки.
В другом варианте осуществления продуцирующие гистамин штаммы используют в качестве вспомогательного средства для классической радиотерапии или химиотерапии
Другой вариант осуществления относится к продукту, который содержит продуцирующие гистамин штаммы, для минимизации диареи и других расстройств желудочно-кишечного тракта, ассоциированных с радиотерапией или химиотерапией злокачественных опухолей, и в то же самое время действует в качестве вспомогательного средства для улучшения такого лечения для уменьшения зависимой от гистамина злокачественной опухоли.
Другим признаком индуцированного AOM/DSS колоректального рака у мышей Hdc-/- является накопление CD11b+Gr-1+ IMC в селезенке. Наблюдали большое накопление CD11b+Gr-1+ IMC в селезенке несущих злокачественные опухоли мышей (Watanabe et al., 2008) с недостаточной экспрессией гена Hdc (Yang et al., 2011). Авторы изобретения обнаружили, что введение продуцирующих гистамин бактерий уменьшало количество CD11b+Gr-1+ IMC, что подтверждало, что этот экзогенный гистамин регулировал дифференцировку CD11b+Gr-1+ IMC.
На основании этих исследований, авторы настоящего изобретения обобщили потенциальный механизм пробиоза L. reuteri ATCC PTA-6475 в модели ассоциированного с воспалением канцерогенеза на мышах (Фигура 8). Внутрибрюшинная инъекция AOM с последующим воздействием DSS в питьевой воде индуцировала в модели ассоциированный с воспалением рак толстой кишки, как показано по макроскопически видимым опухолям толстой кишки, увеличенным количествам KC, IL-22, IL-6, TNF и IL-1α в толстой кишке по данным экспрессии генов, и увеличенным количествам IL-6, IL-22 и KC в плазме. Когда мышей кормили содержащим гистидин кормом, hdc+L. Reuteri, введенный мышам посредством введения через орогастральный зонд, превращал L-гистидин в гистамин посредством гистидиндекарбоксилазы (HdcA) и экспортировал гистамин в просвет посредством антипортера гистидина/гистамина (HdcP) (Thomas et al., 2012). Происходящий из L. reuteri гистамин активировал рецептор гистамина H2 (H2R) на эпителиальных клетках и запускал пути против образования опухолей, как показано по супрессии экспрессии генов KC, IL-22, IL-6, TNF и IL-1α в толстой кишке, и продукции IL-6, IL-22 и KC в плазме. С другой стороны, введение L. reuteri ATCC PTA-6475 уменьшало относительную распространенность CD11b+Gr-1+ IMC в селезенке, и уменьшение количества CD11b+Gr-1+ IMC также вносило вклад в потенциальный эффект против образования опухолей.
L. reuteri ATCC PTA-6475, но не мутант hdcA, ослабляет канцерогенез в толстой кишке in vivo
Чтобы проверить, играет ли колонизация L. reuteri ATCC PTA-6475 роль против образования опухолей, авторы настоящего изобретения использовали воздействие AOM плюс DSS для индукции ассоциированного с колитом рака толстой кишки у мышей Hdc-/- BALB/c в возрасте двенадцати недель (фигура 1A). Тяжесть образования опухолей оценивали через 15 недель после инъекции AOM по количеству и размеру опухолей толстой кишки. Для самцов, у мышей из отрицательного контроля, которым вводили забуференный солевой раствор (PBS) и питьевую воду, вместо AOM и 2% DSS, не развивались опухоли. У мышей из положительного контроля, которых подвергали воздействию AOM/DSS и которым вводили через зонд среду MRS, но не вводили экзогенных бактерий, развивались опухоли толстой кишки. Введение L. reuteri ATCC PTA-6475 в ее экспоненциальной фазе значимо уменьшало количество и размер опухолей толстой кишки, по сравнению с группой положительного контроля. Однако, введение мутанта hdcA не оказывало таких эффектов (фигура 1B~1C). Для самок наблюдали сходную картину. У мышей из отрицательного контроля не развивались опухоли толстой кишки, и у мышей из положительного контроля развивались опухоли толстой кишки. Введение L. reuteri ATCC PTA-6475 значимо уменьшало количество больших (>3 мм) опухолей толстой кишки по сравнению с группой положительного контроля, но количество небольших (<3 мм) опухолей не уменьшалось. Введение мутанта hdcAL. reuteri не уменьшало количеств больших или небольших колоректальных опухолей (фигура 7).
Гистологический анализ толстой кишки самцов посредством окрашивания H&E подтвердил эффект уменьшения образования опухолей для продуцирующего гистамин L. reuteri ATCC PTA-6475 дикого типа. Для мышей из отрицательного контроля показаны ожидаемые результаты гистологии толстой кишки, в то время как для мышей из положительного контроля показаны доказательства существования обширных опухолей толстой кишки. Для мышей, подвергнутых лечению L. reuteri ATCC PTA-6475, получено уменьшение размеров и количеств опухолей толстой кишки, по сравнению с группой положительного контроля, и для изогенного штамма L. Reuteri, мутантного по hdcA, не получено сходных эффектов (фигура 1D).
Подтвержденные получением изображений PET эффекты уменьшения образования опухолей для L. reuteri ATCC PTA-6475
Для дальнейшего анализа возможных эффектов уменьшения образования опухолей для L. reuteri в модели индуцированного AOM/DSS рака толстой кишки на мышах, получение изображений PET, один из наиболее мощных неинвазивных диагностических инструментов для отслеживания функционирования органов, применяли для мышей до их умерщвления (фигура 2A). [18F]FDG использовали в качестве метки, и его концентрация в организме отражает распределение поглощения и фосфорилирования глюкозы (Brewer et al., 2008). В ходе образования опухолей толстой кишки, поглощение FDG активированными лимфоцитами в толстой кишке можно детектировать по высокой интенсивности сигнала метки. У мышей из группы отрицательного контроля, сигнал FDG в основном детектировали в мочевом пузыре и верхней части грудной клетки мышей, в областях, как предполагают, являющихся «нормальными» участками организма, в которых происходит сильное поглощение и метаболизм глюкозы (Galitovskiy et al., 2013). Следовые количества сигнала FDG обнаружены в области толстой кишки, что указывает на низкое поглощение глюкозы в толстой кишке здоровых мышей (фигура 2B~2C). У мышей из группы положительного контроля, наблюдали несколько очагов сильного сигнала в толстой кишке, и интенсивность FDG во всей толстой кишке мышей являлась значимо увеличенной по сравнению с группой отрицательного контроля (фигура 2B~2C), что указывает на детекцию опухолей толстой кишки и увеличенное поглощение глюкозы в толстой кишке мышей, подвергнутых воздействию AOM плюс DSS и введению через зонд среды MRS. Для мышей, подвергнутых лечению L. reuteri ATCC PTA-6475, показано уменьшенное количество очагов сильного сигнала в толстой кишке и значимо уменьшенная интенсивность FDG по сравнению с положительным контролем, демонстрирующие эффект уменьшения образования опухолей для L. reuteri ATCC PTA-6475. В то же время, изогенный мутант hdcAL. reuteri не оказывал сходных эффектов, и для него показано увеличенное количество очагов сильного сигнала в толстой кишке в дополнение к значимому увеличению интенсивности FDG, по сравнению с мышами, подвергнутыми лечению L. reuteri ATCC PTA-6475. Эти результаты показывают, что утрата интактного бактериального гена гистидиндекарбоксилазы в микробиоме кишечника приводит к потере эффектов уменьшения образования опухолей, в соответствии с наблюдаемыми количествами и размерами опухолей толстой кишки.
Системные концентрации цитокинов в плазме мышей были ассоциированы с эффектами уменьшения образования опухолей для L. reuteri
Опубликовано, что специфические провоспалительные цитокины вносят вклад в образование опухолей в толстой кишке, способствуя формированию поддерживающего опухоли микроокружения (Landskron et al., 2014). Воспользовавшись преимуществами системы Luminex (Millipore, Billerica, MA, USA), авторы настоящего изобретения были способны проводить мультиплексный анализ (одновременное измерение) аналитов в одном микропланшете с использованием небольших объемов образцов (25 мкл). Уровни белка для шестнадцати цитокинов (таблица 1) в плазме измеряли с использованием четырех мультиплексных наборов для цитокинов. Интересно, что авторы настоящего изобретения обнаружили, что для трех цитокинов, включая KC, IL-22 и IL-6, показана сходная картина (фигура 3): воздействие AOM/DSS на самцов мышей Hdc-/- значимо увеличивало продукцию этих цитокинов в плазме по сравнению с контрольными мышами, которым вводили PBS/H2O; введение L. reuteri ATCC PTA-6475 значимо уменьшало продукцию этих цитокинов, в то время как изогенный мутант hdcAL. reuteri, утративший способность продуцировать гистамин, не уменьшал уровень этих цитокинов у подвергнутых воздействию AOM/DSS самцов мышей Hdc-/-.
KC разделяет множество функциональных свойств с IL-8 (Oquendo et al., 1989), который, как опубликовано, стимулирует рост, прогрессирование и метастазирование рака толстой кишки (Lee et al., 2012). Показано, что IL-22 также способствует инвазии клеток рака желудка (Fukui et al., 2014; Ji et al., 2014) и стволовости рака толстой кишки (Kryczek et al., 2014). IL-6 рассматривают как ключевой регулятор развития колоректального рака (Waldner et al., 2012), и высокие уровни IL-6 в плазме коррелируют с плохим прогнозом для множества злокачественных опухолей, включая рак толстой кишки (Nagasaki et al., 2014). На основании этих опубликованных доказательств, изменения уровня этих цитокинов в плазме различных групп мышей в исследовании авторов настоящего изобретения являются ассоциированными и согласованными с фенотипом заболевания: увеличение уровня цитокинов ассоциировано с индукцией CRC посредством воздействия AOM/DSS по сравнению с здоровым контролем, уменьшение уровня цитокинов ассоциировано с ослаблением CRC посредством введения продуцирующего гистамин L. reuteri ATCC PTA-6475, и увеличение уровня цитокинов ассоциировано с утратой эффектов уменьшения образования опухолей посредством не продуцирующего гистамин мутанта hdcA.
Экспрессию генов цитокинов в слизистой оболочке толстой кишки регулировали посредством введения L. reuteri
Для дальнейшего исследования ассоциаций между цитокинами и тяжестью CRC, авторы настоящего изобретения анализировали экспрессию генов избранных цитокинов (таблица 2) в образцах слизистой оболочки толстой кишки посредством ОТ-qПЦР с использованием GAPDH в качестве внутреннего стандарта, в дополнение к измерению системных количеств цитокинов в плазме. Воздействие AOM/DSS значимо индуцировало экспрессию генов провоспалительных цитокинов KC, IL-22, IL-6, TNF и IL-1α по сравнению со здоровыми самцами мышей Hdc-/- (фигура 4). Лечение с использованием L. reuteri ATCC PTA-6475 мышей, подвергнутых воздействию AOM/DSS, значимо уменьшало относительную экспрессию генов этих цитокинов, в то время как изогенный мутант hdcAL. reuteri, лишенный продукции гистамина, приводил к увеличенной относительной экспрессии генов этих провоспалительных цитокинов по сравнению с мышами, которым вводили через зонд бактерии дикого типа. Детекция мРНК других цитокинов посредством qПЦР приводила либо к не поддающимся детекции результатам (IL-17), либо к отсутствию значимых различий между группами (IL-12, IL-23 и IFN-γ).
Экспрессию H2R индуцировали посредством введения L. reuteri
Введение продуцирующих гистамин L. reuteri ATCC PTA-6475 ослабляло индуцированный AOM/DSS CRC у самцов мышей Hdc-/-, в то время как у не продуцирующего гистамин мутанта hdcA такие эффекты отсутствовали, что указывает на важную роль гистамина в просвете кишечника в ослаблении CRC. Однако, путь передачи сигнала, посредством которого гистамин может оказывать свои противовоспалительные и антиканцерогенные эффекты, неясен. Гистамин представляет собой биогенный амин, осуществляющий различные патофизиологические функции посредством четырех рецепторов гистамина (H1R, H2R, H3R и H4R) (O'Mahony et al., 2011), и активация H2R ассоциирована с противовоспалительными эффектами (Frei et al., 2013; Jutel et al., 2001; O'Mahony et al., 2011). Более того, предшествующие исследования авторов настоящего изобретения показали, что L. reuteri ATCC PTA-6475 ослабляет индуцированный TNBS колит посредством активации H2R. Так, в настоящем исследовании авторов настоящего изобретения, они исследовали относительную экспрессию H2R в различных группах самцов мышей Hdc-/- посредством иммуногистохимии с использованием специфических для H2R антител. Экспрессию H2R детектировали в толстой кишке здоровых самцов мышей Hdc-/-, с относительно высокой интенсивностью в криптах (фигура 5A). Интересно, что воздействие AOM/DSS уменьшало относительную интенсивность H2R в кишечнике, по сравнению с здоровым контролем. Когда мышам, подвергнутым воздействию AOM/DSS, вводили либо L. reuteri ATCC PTA-6475, либо изогенный мутант hdcAL. reuteri, наблюдали увеличенную экспрессию H2R по сравнению с контрольной группой, в которой не вводили бактерий. Введение L. reuteri ATCC PTA-6475 приводило к наивысшей интенсивности H2R, что позволяет предполагать, что активацию H2R можно индуцировать посредством специфических микроорганизмов кишечника, и то, что гистамин может играть важную роль в ослаблении CRC. Уменьшение уровня H2R ассоциировано с развитием CRC у мышей, подвергнутых воздействию AOM/DSS, и индукция H2R посредством введения L. reuteri ATCC PTA-6475 ассоциирована с ослаблением CRC. Поскольку введение мутанта hdcA также увеличивает интенсивность H2R (хотя и не так сильно, как штамм дикого типа), по-видимому, L. reuteri, введенные мышам, могут подавать сигнал, в дополнение к гистамину, который может индуцировать экспрессию H2R в толстой кишке мыши.
Однако, когда экспрессию H2R на уровне мРНК исследовали посредством ОТ-qПЦР в слизистой оболочке толстой кишки, не наблюдали значимых различий между группами (фигура 5B). Это наблюдение указывает на то, что различные количества H2R на поверхности клеток обусловлены посттранскрипционными различиями в продукции и локализации белка.
L. reuteri ATCC PTA-6475 осуществлял понижающую регуляцию CD11b+Gr-1+ IMC в селезенке
Отсутствие эндогенного гистамина приводит к увеличению количества CD11b+Gr-1+ IMC, и это ассоциировано с прогрессированием злокачественных опухолей у млекопитающих (Yang et al., 2011). Чтобы оценить, влияет ли введение продуцирующих гистамин L. reuteri ATCC PTA-6475 на дифференцировку IMC, проводили анализ проточной цитометрии на клетках, полученных из образцов костного мозга и селезенки, собранных немедленно после умерщвления самцов мышей Hdc-/-. Процент CD11b+Gr-1+ IMC в селезенке являлся значимо увеличенным у мышей, подвергнутых воздействию AOM/DSS, по сравнению с здоровым контролем (фигура 6). Введение L. reuteri ATCC PTA-6475 мышам, подвергнутым воздействию AOM/DSS, значимо уменьшало процент CD11b+Gr-1+ IMC по сравнению с контрольными мышами, которым вводили только среду (MRS). Эти наблюдения были согласованы с фенотипическими результатами относительно того, что L. reuteri ATCC PTA-6475 ослаблял индуцированный AOM/DSS CRC. Показано, что введение продуцирующих гистамин L. reuteri ATCC PTA-6475 влияет на дифференцировку IMC.
L. reuteri ATCC PTA-6475, ATCC PTA-4659 и DSM 32273 экспрессируют ген dagK
L. reuteri ATCC PTA-6475 дикого типа и мутант hdcA вместе с L. reuteri DSM 32273 и L. reuteri ATCC PTA-4659 являлись способными экспрессировать ген dagK. Ген dagK экспрессировался на очень высоком уровне в ходе фазы элонгации у бактерий. Другие штаммы бактерий, включая другие штаммы L. reuteri, которые экспрессируют ген dagK, можно детектировать с использованием способов, какие описаны в настоящем документе. Этот ген dagK отсутствует в штамме DSM 17938 L. reuteri, который также не способен продуцировать гистамин.
L. reuteri ATCC PTA-6475 секретируют/высвобождают DagK
Белок DagK, экспрессируемый посредством гена dagK в L. reuteri ATCC PTA-6475, обнаружен в супернатанте культуральной среды после удаления интактных клеток бактерий. Соответственно, L. reuteri ATCC PTA-6475 является способным продуцировать и секретировать, или другими способами высвобождать DagK, чтобы таким образом осуществлять эффект внеклеточного DagK.
DagK представляет собой фермент, катализирующий превращение диацилглицерина (DAG) в фосфатидную кислоту (PA) с использованием аденозинтрифосфата (ATP) в качестве источника фосфата. В нестимулированных клетках, активность DagK является низкой, позволяя использовать DAG для биоссинтеза глицерофосфолипида. Однако, при активации посредством рецептора пути фосфоинозитида, активность DagK увеличивается, управляя превращением DAG в PA. Превращение DAG в PA истощает DAG, который в ином случае может активировать протеинкиназу C (PKC).
Передача сигнала ниже H1R прерывается посредством синтеза DagK в L. reuteri посредством ингибирования липида DAG, вовлеченного в передачу сигнала. Соответственно, штаммы молочнокислых бактерий, продуцирующие гистамин и DagK, как описано в настоящем документе, супрессируют провоспалительные эффекты гистамина. Это, в свою очередь, позволяет активацию только H2R посредством гистамина, продуцируемого штаммами бактерий. Такая активация H2R стимулирует противовоспалительные симптомы.
Таким образом, штамм молочнокислых бактерий, способный продуцировать как гистамин, так и DagK, вызывает супрессию передачи сигнала ниже H1R, но индуцирует активацию H2R. Это, в свою очередь, супрессирует провоспалительные эффекты гистамина и стимулирует противовоспалительные симптомы. Штаммы бактерий с активной экспрессией гена dagK могут продуцировать и необязательно, секретировать, или другими путями высвобождать DagK.
Один из аспектов вариантов осуществления относится к продуцирующему гистамин штамму молочнокислых бактерий для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива колоректального рака.
Продуцирующие гистамин штаммы молочнокислых бактерий из вариантов осуществления, какие описаны в настоящем документе, обладают теми благоприятными характеристиками, что их можно использовать в отношении пациентов с злокачественными опухолями, или пациентов, подверженных риску развития злокачественных опухолей. Это означает, что продуцирующие гистамин штаммы молочнокислых бактерий в вариантах осуществления можно использовать для лечения злокачественной опухоли у пациента, и в частности, для лечения колоректального рака у пациента.
Лечение с использованием продуцирующих гистамин штаммов молочнокислых бактерий можно комбинировать с другими способами лечения злокачественных опухолей, включая, но без ограничения, радиотерапию, химиотерапию и хирургию. Продуцирующие гистамин штаммы молочнокислых бактерий можно в таком случае использовать в качестве вспомогательного средства в лечении злокачественных опухолей. Соответственно, другой аспект вариантов осуществления относится к продуцирующему гистамин штамму молочнокислых бактерий для применения в качестве вспомогательного средства для применения в качестве вспомогательного средства в лечении злокачественных опухолей, выбранного из группы, состоящей из радиотерапии и химиотерапии.
Продуцирующие гистамин штаммы молочнокислых бактерий из вариантов осуществления обладают также, в дополнение к собственно свойствам лечения злокачественных опухолей, свойствами, благоприятными для пациентов, подвергаемых или подлежащих лечению злокачественных опухолей, в частности, пациентов, подлежащих радиотерапии и/или химиотерапии. В частности, продуцирующие гистамин штамм молочнокислых бактерий можно использовать для борьбы с расстройствами желудочно-кишечного тракта или для лечения расстройств желудочно-кишечного тракта, ассоциированных с лечением злокачественных опухолей, например, вызванных лечением злокачественных опухолей. Таким образом, дополнительный аспект вариантов осуществления относится к продуцирующему гистамин штамму молочнокислых бактерий для применения для профилактики, ингибирования или лечения расстройств желудочно-кишечного тракта, ассоциированных с лечением злокачественных опухолей, выбранным из группы, состоящей из радиотерапии и химиотерапии.
В одном из вариантов осуществления, продуцирующий гистамин штамм молочнокислых бактерий предназначен для применения для профилактики, ингибирования или лечения диареи, ассоциированной с лечением злокачественных опухолей. В конкретном варианте осуществления, лечение злокачественных опухолей представляет собой лечение злокачественных опухолей для лечения колоректального рака, т.е. пациент, подлежащий лечению злокачественных опухолей, представляет собой пациента, страдающего колоректальным раком.
Введение продуцирующих гистамин штаммов молочнокислых бактерий пациенту, однако, не обязательно должно приводить к 100% излечению колоректального рака у пациента, т.е. приводить к состоянию пациента вообще без каких-либо поддающихся детекции опухолей. Таким образом, продуцирующие гистамин штаммы молочнокислых бактерий можно использовать для ингибирования или уменьшения колоректального рака у пациента. Например, экспериментальные данные, как представлено в настоящем документе, показывают, что продуцирующие гистамин штаммы молочнокислых бактерий являются способными уменьшать количество опухолей и уменьшать размеры опухолей. Соответственно, ингибирование или уменьшение колоректального рака включает в себя, в вариантах осуществления, уменьшение количества опухолей у пациента, уменьшение размеров опухолей у пациента или уменьшение количества и размеров опухолей у пациента. Таким образом, в одном варианте осуществления, продуцирующий гистамин штамм молочнокислых бактерий предназначен для применения для уменьшения количества и/или размеров опухолей у пациента, страдающего от колоректального рака.
Продуцирующие гистамин штаммы молочнокислых бактерий из вариантов осуществления можно дополнительно или альтернативно использовать для профилактики, т.е. для уменьшения риска развития колоректального рака у пациента. Пациент может, например, представлять собой пациента, обладающего предрасположенностью к колоректальному раку, такой как генетическая или наследственная предрасположенность к колоректальному раку. Продуцирующие гистамин штаммы молочнокислых бактерий можно затем вводить такому пациенту для предотвращения или по меньшей мере уменьшения риска для пациента заболеть колоректальным раком.
Продуцирующие гистамин штаммы молочнокислых бактерий из вариантов осуществления также обладают характеристиками, благоприятными для пациентов, страдавших колоректальным раком и подвергавшихся лечению от колоректального рака. Продуцирующие гистамин штаммы молочнокислых бактерий можно, таким образом, использовать для уменьшения риска рецидива колоректального рака.
В одном варианте осуществления, продуцирующий гистамин штамм молочнокислых бактерий предназначен для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива ассоциированного с воспалением колоректального рака.
Пациент предпочтительно представляет собой пациента-млекорпитающего и более предпочтительно, пациента-человека. В конкретном варианте осуществления, пациент представляет собой пациента-человека мужского пола. Таким образом, в этом варианте осуществления, продуцирующий гистамин штамм молочнокислых бактерий предназначен для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива колоректального рака у пациента мужского пола.
В одном варианте осуществления, продуцирующий гистамин штамм молочнокислых бактерий содержит активный гистидиновый оперон. В конкретном варианте осуществления этот гистидиновый оперон содержит ген антипортера гистидина/гистамина (hdcP), ген гистидиндекарбоксилазы пирувильного типа A (hdcA) и ген гистидиндекарбоксилазы пирувильного типа B (hdcB), например, состоит из них. Таким образом, в одном варианте осуществления продуцирующий гистамин штамм молочнокислых бактерий содержит ген hdcP, ген hdcA и ген hdcB.
В одном варианте осуществления, продуцирующий гистамин штамм молочнокислых бактерий является способным продуцировать диацилглицеринкиназу (DagK). Экспериментальные данные, как представлено в настоящем документе, показывают, что может обеспечивать преимущества применение продуцирующего гистамин и продуцирующего DagK штамма молочнокислых бактерий для профилактики, ингибирования или лечения колоректального рака или уменьшения риска рецидива колоректального рака.
Продукция DagK оказывает благоприятные эффекты в отношении супрессии передачи сигналов ниже H1R, чтобы таким образом супрессировать воспалительные эффекты, которые гистамин может оказывать в ином случае. Соответственно, продукция гистамина и DagK перенаправляет действие от активации H1R к H2R, который, в свою очередь, стимулирует противовоспалительные эффекты гистамина.
В одном варианте осуществления, продуцирующие гистамин штамм молочнокислых бактерий представляет собой продуцирующий гистамин штамм Lactobacillus reuteri. В конкретном варианте осуществления, продуцирующий гистамин штамм L. reuteri представляет собой L. reuteri ATCC PTA-6475. В другом конкретном варианте осуществления, продуцирующий гистамин штамм L. reuteri представляет собой L. reuteri ATCC PTA-4659. В дополнительном конкретном варианте осуществления, продуцирующий гистамин штамм L. reuteri представляет собой L. reuteri DSM 32273. В другом варианте осуществления, продуцирующий гистамин штамм L. reuteri представляет собой смесь из по меньшей мере двух штаммов L. Reuteri, способных продуцировать гистамин и необязательно, кроме того, способных продуцировать DagK. Например, можно использовать смесь L. reuteri ATCC PTA-6475 и ATCC PTA-4659, смесь L. reuteri ATCC PTA-6475 и DSM 32273, смесь L. reuteri ATCC PTA-4659 и DSM 32273 или смесь L. reuteri ATCC PTA-6475, ATCC PTA-4659 и DSM 32273.
В одном варианте осуществления, продуцирующий гистамин штамм молочнокислых бактерий является способным супрессировать продукцию по меньшей мере одного ассоциированного с злокачественной опухолью цитокина, выбранного из группы, состоящей из лиганда 1 хемокинов (с мотивом C-X-C) (CXCL1), интерлейкина 22 (IL-22) и интерлейкина 6 (IL-6). CXCL1 обозначают в данной области также как онкоген GRO1, GROα, KC, активирующий нейтрофилы белок 3 (NAP-3) и белок альфа с активностью стимуляции роста меланомы (MSGA-α). Известно, что все эти три цитокина вовлечены в колоректальный рак. Соответственно, супрессия продукции этих цитокинов может оказывать благоприятные эффекты в отношении супрессии роста, прогрессирования и метастазирования рака толстой кишки (благодаря супрессии CXCL1), супрессии инвазии клеток рака желудка и стволовости рака толстой кишки (благодаря супрессии IL-22) и улучшения прогноза рака толстой кишки (благодаря супрессии IL-6). Супрессию хемокинов можно индуцировать различными способами. Например, транскрипцию генов цитокинов можно супрессировать или уменьшать посредством продуцирующих гистамин штаммов молочнокислых бактерий. Альтернативно или дополнительно, трансляцию молекул мРНК цитокинов можно супрессировать или уменьшать посредством продуцирующих гистамин штаммов молочнокислых бактерий. Также, или кроме того, можно привлекать посттрансляционные эффекты для супрессии продукции этих цитокинов. Экспериментальные данные, как представлено в настоящем документе, показывают, что продуцирующие гистамин штаммы молочнокислых бактерий из вариантов осуществления уменьшают уровни белков этих цитокинов в плазме и уменьшают относительную экспрессию генов этих цитокинов.
В одном варианте осуществления, продуцирующий гистамин штамм молочнокислых бактерий является способным уменьшать количество CD11b+Gr-1+ незрелых миелоидных клеток (IMC) в селезенке. CD11b+Gr-1+ IMC ассоциированы с прогрессированием злокачественных опухолей у млекопитающих. Соответственно, уменьшение количества этих CD11b+Gr-1+ IMC, как показано в экспериментальных данных, может оказывать благоприятные эффекты по отношению к супрессии прогрессирования злокачественных опухолей.
Дополнительный аспект вариантов осуществления относится к способу отбора штамма молочнокислых бактерий для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива колоректального рака. Способ включает в себя скрининг молочнокислых бактерий по присутствию активного гистидинового оперона. Способ включает в себя также отбор, для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива колоректального рака, штамма молочнокислых бактерий, идентифицированного в качестве штамма молочнокислых бактерий, обладающего активным гистидиновым опероном и способного продуцировать гистамин.
Таким образом, этот аспект вариантов осуществления относится к способу, который можно использовать для отбора и идентификации штаммов молочнокислых бактерий, пригодных для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива колоректального рака. Такие выбранные штаммы молочнокислых бактерий идентифицируют как имеющие активный гистидиновый оперон и способные продуцировать гистамин, как описано в настоящем документе.
Присутствие активного гистидинового оперона можно детектировать на основании детекции присутствия гена антипортера гистидина/гистамина, гена гистидиндекарбоксилазы пирувильного типа A и гена гистидиндекарбоксилазы пирувильного типа B, например, присутствия гена hdcP, гена hdcA и гена hdcB. Альтернативно, о присутствии активного гистидинового оперона можно заключить на основании детекции продукции или присутствия белка антипортера гистидина/гистамина, белка гистидиндекарбоксилазы пирувильного типа A и белка гистидиндекарбоксилазы пирувильного типа B, например, продукции или присутствия белков HdcP, HdcA и HdcB.
В одном варианте осуществления, скрининг молочнокислый бактерий включает в себя скрининг молочнокислых бактерий по присутствию активного гистидинового оперона и по дополниительной способности продуцировать диацилглицеринкиназу (DagK). В этом варианте осуществления, отбор штамма молочнокислых бактерий включает в себя отбор для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива колоректального рака штамма молочнокислых бактерий, идентифицированного в качестве штамма молочнокислых бактерий, обладающего активным гистидиновым опероном и способного продуцировать гистамин и продуцировать DagK.
Таким образом, в одном варианте осуществления штамм молочнокислых бактерий не только содержит активный гистидиновый оперон для продукции гистамина, но также обладает способностью продуцировать DagK. Способность продуцировать DagK можно оценивать либо по детекции присутствия гена, кодирующего диацилглицеринкиназу, такого как ген dagK, в штамме молочнокислых бактерий, либо в его геноме, либо в экспрессирующей кассете, например, в плазмиде. Альтернативно, способность продуцировать DagK можно определять посредством детекции присутствия белка диацилглицеринкиназы, например, в цитозоле бактерий, или, если штамм бактерий, кроме того, является способным секретировать DagK, в культуральной среде, в которой культивируют штамм бактерий.
В одном варианте осуществления, способ отбора штамма молочнокислых бактерий для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива колоректального рака включает в себя идентификацию и отбор штамма молочнокислых бактерий, отличного от L. reuteri ATCC PTA-4659 и ATCC PTA-6475.
Дополнительный аспект вариантов осуществления относится к способу отбора штамма молочнокислых бактерий для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива злокачественной опухоли. Способ включает в себя скрининг молочнокислых бактерий по присутствию активного гистидинового оперона и способности продуцировать диацилглицеринкиназу (DagK). Способ включает в себя также отбор для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива злокачественных опухолей штамма молочнокислых бактерий, идентифицированного в качестве штамма молочнокислых бактерий, обладающего активным гистидиновым опероном и способного продуцировать гистамин и продуцировать DagK.
В этом аспекте, выбранный штамм молочнокислых бактерий не обязательно следует использовать для предотвращения, ингибирования, лечения или уменьшения риска рецидива колоректального рака. В явном отличии от этого, способность продуцировать не только гистамин, но также диацилглицеринкиназу, может обеспечивать преимущества также при других типах злокачественных опухолей в дополнение к колоректальному раку, включая меланому, рак молочной железы, рак поджелудочной железы и т.п.
В одном варианте осуществления, отбор штамма молочнокислых бактерий включает в себя отбор, для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива ассоциированной с гистамином злокачественной опухоли, выбранной из группы, состоящей из колоректального рака, меланомы, рака молочной железы и рака поджелудочной железы, штамма молочнокислых бактерий, идентифицированного в качестве штамма молочнокислых бактерий, обладающего активным гистидиновым опероном и способного продуцировать гистамин и продуцировать DagK.
В одном варианте осуществления, способ отбора штамма молочнокислых бактерий для применения для профилактики, ингибирования, лечения или уменьшения риска рецидива злокачественных опухолей включает в себя идентификацию и отбор штамма молочнокислых бактерий, отличного от L. reuteri ATCC PTA-4659 и ATCC PTA-6475.
Другой аспект вариантов осуществления относится к способу отбора штамма молочнокислых бактерий для применения для профилактики, ингибирования или лечения воспалительного состояния. Способ включает в себя скрининг молочнокислых бактерий по присутствию активного гистидинового оперона и способности продуцировать диацилглицеринкиназу (DagK). Способ включает в себя также отбор, для применения для профилактики, ингибирования или лечения воспалительного состояния, штамма молочнокислых бактерий, идентифицированного в качестве штамма молочнокислых бактерий, обладающего активным гистидиновым опероном и способного продуцировать гистамин и продуцировать DagK.
Штамм молочнокислых бактерий, способный продуцировать как гистамин, так и диацилглицеринкиназу, может, при введении пациенту, оказывать благоприятные эффекты в отношении предотвращения, уменьшения или лечения различных воспалительных состояний. Продуцированная DagK может супрессировать воспалительные свойства гистамина посредством супрессии передачи сигналов или пути ниже H1R. Соответственно, гистамин может проявлять противовоспалительные свойства благодаря активации H2R.
Для пациентов, страдающих колоректальным раком, показано отсутствие созревания IMC из-за недостаточности гистамина. Соответственно, может обеспечивать преимущества обеспечение этих пациентов гистамином на биологическом уровне. Однако, для этих пациентов показан также увеличенный провоспалительный ответ, и введение им молекулы гистамина может приводить к неблагоприятным эффектам. Таким образом, наилучшим терапевтическим способом может являться предоставление обеспечивающего преимущества штамма бактерий, который обладает способностью поставлять экзогенный гистамин, а также супрессирует воспалительные ответы посредством ингибирования передачи провоспалительных сигналов. Таким образом, штамм молочнокислых бактерий из вариантов осуществления, способный продуцировать как гистамин, так и DagK, представляет огромный интерес для лечения провоспалительных нарушений с миелоидной дисфункцией.
В одном варианте осуществления, отбор штамма молочнокислых бактерий включает в себя отбор, для применения для профилактики, ингибирования или лечения воспалительного состояния, выбранного из группы, состоящей из колита, воспалительного заболевания кишечника, синдрома раздраженной кишки, дивертикулеза, гингивита, мастита и вагинита, штамма молочнокислых бактерий, идентифицированного в качестве штамма молочнокислых бактерий, обладающего активным гистидиновым опероном и способного продуцировать гистамин и продуцировать DagK.
Таким образом, вышеописанные воспалительные состояния являются иллюстративными, но предпочтительными примерами воспалительных состояний, которые можно предотвращать, ингибировать или лечить посредством штаммов молочнокислых бактерий, идентифицированных и отобранных, как описано в настоящем документе.
В одном варианте осуществления, способ отбора штамма молочнокислых бактерий для применения для профилактики, ингибирования или лечения воспалительного состояния включает в себя идентификацию и отбор штамма молочнокислых бактерий, отличного от L. reuteri ATCC PTA-4659 и ATCC PTA-6475.
Следующие аспекты вариантов осуществления относятся к Lactobacillus reuteri DSM 32273, который представляет собой продуцирующий гистамин и DagK штамм L. reuteri. Штамм DSM 32273 Lactobacillus reuteri депонирован согласно Будапештскому соглашению в DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (Inhoffenstrasse 7B, D - 38124 Braunschweig) 8 марта 2016 г. Этот новый L. reuteri DSM 32273 можно использовать в качестве лекарственного средства. Например, L. reuteri DSM 32273 можно использовать для профилактики, ингибирования, лечения или уменьшения риска рецидива злокачественной опухоли. В конкретном варианте осуществления, злокачественная опухоль представляет собой ассоциированную с гистамином злокачественную опухоль, выбранную из группы, состоящей из колоректального рака, меланомы, рака молочной железы и рака поджелудочной железы, предпочтительно, колоректального рака. L. reuteri DSM 32273 можно также использовать для профилактики, ингибирования или лечения воспалительного состояния. В конкретном варианте осуществления, воспалительное состояние выбрано из группы, состоящей из колита, воспалительного заболевания кишечника, синдрома раздраженной кишки, дивертикулеза, гингивита, мастита и вагинита. Дополнительные применения L. reuteri DSM 32273 включают в себя облегчение колик грудных детей, облегчение экземы, уменьшение приступов профессиональных заболеваний, супрессию инфекции Heliobacter pylori.
Варианты осуществления включают в себя также использование продуцирующего гистамин штамма молочнокислых бактерий для изготовления лекарственного средства для профилактики, ингибирования, лечения или уменьшения риска рецидива колоректального рака, использование продуцирующего гистамин штамма молочнокислых бактерий для изготовления вспомогательного средства для лечения злокачественных опухолей, выбранного из группы, состоящей из радиотерапии и химиотерапии, и использование продуцирующего гистамин штамма молочнокислых бактерий для изготовления лекарственного средства для профилактики, ингибирования или лечения расстройства желудочно-кишечного тракта вместе с лечением злокачественной опухоли, выбранным из группы, состоящей из радиотерапии и химиотерапии. В этих вариантах осуществления, продуцирующий гистамин штамм молочнокислых бактерий предпочтительно, способен также продуцировать и, необязательно, секретировать диацилглицеринкиназу.
Дополнительный вариант осуществления относится к способу профилактики, ингибирования, лечения или уменьшения риска рецидива колоректального рака у субъекта. Способ включает в себя введение эффективного количества продуцирующего гистамин штамма молочнокислых бактерий пациенту. Другой вариант осуществления относится к способу профилактики, ингибирования или лечения расстройства желудочно-кишечного тракта, ассоциированного с лечением злокачественной опухоли, выбранным из группы, состоящей из радиотерапии и химиотерапии. Способ включает в себя введение эффективного количества продуцирующего гистамин штамма молочнокислых бактерий пациенту, подвергаемого или подлежащего подверганию лечению злокачественных опухолей. Продуцирующий гистамин штамм молочнокислых бактерий предпочтительно является также способным продуцировать и необязательно, секретировать диацилглицеринкиназу. Пациент предпочтительно представляет собой пациента-млекопитающего и более предпочтительно, пациента-человека, такого как пациент-человек мужского пола.
Подходящий способ введения и составления штаммов выбирают в зависимости от участка, где желательна местная продукция гистамина и необязательно, DagK. Предпочтительным способом введения является пероральный, однако, эквивалентно, для некоторых видов лечения местное введение или некоторая другая форма местного введения на кожу, в прямую кишку, влагалище или на десны являются подходящими, или внутривенная или внутримышечная инъекция является подходящей.
Питательные смеси, содержащие гистидин, можно использовать для обеспечения присутствия гистидина и таким образом, увеличения эффективности бактерий. Гистидин можно вводить отдельно или вместе с бактериями.
Одной из возможностей обеспечения бактерий дополнительным гистидином является употребление пищи, богатой гистидином, включая, но без ограничения, соевый белок, сыр, яйца, курицу и свинину.
ПРИМЕРЫ
ПРИМЕР 1
Штаммы бактерий и условия культивирования
L. reuteri ATCC PTA 6475 (депонированный согласно Будапештскому соглашению в ATCC - Американской коллекции типовых культур (10801 University Boulevard, Manassas, VA 20110 USA) 21 декабря 2004 г.) и его мутант hdcA, как описано ранее (Thomas et al., 2012), использовали для колонизации мышей. Оба штамма культивировали при 37°C в среде Де Мана, Рогоза и Шарпа (Difco, Franklin Lakes, NJ) в анаэробной рабочей станции (MACS MG-500, Microbiology International, Frederick, MD), дополненной смесью 10% CO2, 10% H2 и 80% N2.
Животные
Мышей Hdc-/- BALB/c первоначально получали от Timothy C. Wang(Columbia University) и заново разводили в Baylor College of Medicine. Заново разведенных мышей Hdc-/- поддерживали в условиях отсутствия специфических патогенов (SPF) в Texas Children' Hospital. Мышей содержали в клетках с фильтром на крышке (5 мышей на клетку) и обеспечивали свободный доступ к дистиллированной воде и корму PicoLab Rodent 50IF/6F. Все эксперименты на мышах проводили в виварии SPF, в соответствии с одобренным Институциональным комитетом по содержанию и использованию животных (IACUC) протоколом для мышей в Baylor College of Medicine, Houston, TX.
Получение бактерий и введение мышам
Штаммы L. reuteri и условия культивирования описаны выше. Бактерии собирали в экспоненциальной фазе (5,5 часов в среде MRS с исходной OD600нм=0,03), центрифугировали при 2500 × g в течение 4 мин, и осадок бактерий ресуспендировали в стерильной среде MRS для кормления животных. Все штаммы L. reuteri получали свежими перед введением мышам. Каждой мыши вводили 5×109 КОЕ бактерий в 0,2 мл MRS или только среду MRS в качестве контроля посредством введения через орогастральный зонд. Частота введения бактерий составляла один раз в сутки в течение семи суток до инъекции AOM и один раз в трое суток после в течение 15 недель с паузой, когда мышей подвергали воздействию DSS.
Индукция рака толстой кишки у мышей Balb/c
В возрасте 12 недель, мышам в группе положительного контроля и в группе лечения бактериями вводили однократную дозу генотоксического карциногена для толстой кишки AOM (12,5 мг на кг массы тела) посредством внутрибрюшинной инъекции. Этих мышей подвергали воздействию двух циклов 2% (масс./об.) DSS в питьевой воде в течение 6 суток, с одним циклом немедленно после инъекции AOM, с последующим периодом восстановления с питьевой водой в течение двух недель перед вторым циклом. Мышам в группе отрицательного контроля вводили однократную дозу забуференного солевого раствора (PBS) вместо AOM и питьевую воду.
Оценка опухолей и препараты тканей
Через пятнадцать недель после инъекции AOM, мышей умерщвляли и образцы собирали следующим образом. Кровь отбирали у усыпленных мышей посредством пункции сердца в пробирки для сбора образцов крови с K2ЭДТА (Becton, Dickinson and Company, Franklin Lakes, NJ), центрифугировали при 17000 × gв течение10 мин при 4°C для выделения плазмы. Желудочно-кишечный тракт осторожно удаляли и содержимое просветов подвздошной кишки, слепой кишки и толстой кишки собирали и быстро замораживали в жидком азоте. Толстую кишку мыши вырезали и открывали продольно, и количество и размер опухолей подсчитывали и измеряли вслепую. Слизистую оболочку кишечника соскабливали с помощью лезвия скальпеля и сохраняли в RNALater (Ambion, Austin, TX) для анализа уровней экспрессии мРНК в будущем. Все образцы сохраняли при -80°C до анализа.
Кишечники мышей фиксировали в 10% формалине, погружали в парафин, и с помощью микротома получали срезы по 5 мкм. Нарезанные ткани использовали для гистологических и иммуногистохимических исследований, нацеленных на экспрессию H2R, с использованием специфического антитела (Alomone Labs, Jerusalem, Israel и Abcam plc, MA, US). Образцы селезенки мышей собирали немедленно после умерщвления мышей. Эти образцы использовали для исследований проточной цитометрии.
Статистический анализ
Биостатистический анализ проводили с использованием программного обеспечения GraphPad Prism (версии 5) (GraphPad Inc., La Jolla, CA). Для числовых переменных, соответствующих нормальному распределению (определенному с использованием теста Колмогорова-Смирнова), данные представлены как средние арифметические со стандартными отклонениями, и различные группы сравнивали с использованием t-критерия (две группы) или однофакторного ANOVA (более двух групп). В ином случае, данные представлены в форме графиков вида «ящик с усами», показывающих медианные значения, 10-й и 90-й процентили, или в форме диаграмм рассеяния, показывающих медианные значения. Различные группы сравнивали посредством непараметрического U-критерия Манна-Уитни (две группы) или посредством критерия Крускала-Уоллиса. Различия между группами считали значимыми при *P < 0,05, **P<0,01, ***p<0,001.
ПРИМЕР 2
Препараты, как описано в Примере 1.
Анализ проточной цитометрии
Клетки костного мозга из бедренной кости и большой берцовой кости мышей из каждой группы немедленно смывали ледяной DMEM (ATCC, кат. 30-2002), содержащей 10% FBS. За этой процедурой следовало добавление буфера для лизиса эритроцитов для истощения RBC (BD Biosciences). Селезенки удаляли и сохраняли в ледяной DMEM (ATCC, кат. 30-2002) с 10% FBS. За этой стадией следовало выделение клеток селезенки с использованием стерильных стекол, и буфер для лизиса RBC добавляли к выделенным клеткам. Суспензии отдельных клеток получали посредством фильтрации клеток через 40-мкм сетчатые фильтры. Для анализа проточной цитометрии, суспензии отдельных клеток окрашивали с использованием антител [1 мкл конъюгированного с APC-Cy7 антитела против Gr-1 (BD Pharmingen, кат. 557661) и 5 мкл конъюгированного с FITC антитела против CD11b (BD Pharmingen, кат. 557396)] в течение 30 мин на льду, в темноте, и оценивали посредством многоцветной проточной цитометрии с использованием анализатора клеток BD FACSCanto, и данные собирали с помощью программного обеспечения FACSDiva (BD Biosciences). Собранные данные анализировали с использованием программного обеспечения FlowJo V10 (FlowJo, LLC).
ПРИМЕР 3
Препараты, как в примере 1.
Измерение количества цитокинов посредством мультиплексного иммуноанализа в плазме мышей
Концентрации мышиных IFN-γ, IL-1α, IL-1β, IL-4, IL-6, IL-10, IL-12, IL-13, IL-17A, KC, TNF, IL-21, IL-22 и IL-23 в плазме измеряли с использованием мультиплексных наборов для цитокинов (Millipore, Billerica, MA, USA), см. таблицу 1. Количественную оценку цитокинов проводили с использованием системы Luminex (Austin, TX, USA) в соответствии с инструкциями производителя. Кратко, образцы плазмы по 25 мкл, собранные выше от каждой мыши, полностью размораживали и разводили таким же количеством буфера для анализа, представленного в наборах. Анализы проводили вслепую в двух повторах. Отчеты, автоматически полученные посредством программного обеспечения MILLIPLEX® Analyst 5.1, проверяли, и учитывали только цитокины, значения для которых находились выше предела детекции и ниже значения при насыщении.
Таблица 1. Цитокины, измеряемые в четырех мультиплексных наборах для анализа Luminex.
ПРИМЕР 4
Препараты, как в примере 1.
Уровни мРНК цитокинов и рецепторов гистамина в слизистой оболочке толстой кишки
Для количественной оценки относительных уровней экспрессии мРНК интерферона (IFN)-γ, фактора некроза опухоли (TNF), интерлейкина (IL)-6, IL-12, IL-23, IL-17, IL-18, Il-22, IL-4, KC и рецептора гистамина H2 (H2R), РНК выделяли из образцов слизистой оболочки толстой кишки с использованием набора miRNeasy® mini (Qiagen, Hilden). Один мкг РНК подвергали обратной транскрипции до одноцепочечной кДНК с использованием набора для синтеза первой цепи кДНК RevertAid H minus (ThermoFisher Scientific, USA). ПЦР с обратной транскриптазой (ОТ) с детекцией в реальном времени проводили с использованием системы для ПЦР с детекцией в реальном времени (Stratagene). Реакционная смесь для ОТ-ПЦР (доведенная H2O до суммарного объема 25 мкл) содержала 1 мкл ДНК-матрицы, 12,5 мкл готовой реакционной смеси для ПЦР Power SYBR Green (ABI, Life Tech) и 0,5 мкл соответствующих праймеров (10 мкМ каждый). Прямые и обратные праймеры, использованные для количественной оценки IFN-γ, IL-12, IL-17, TNF-α, IL-6, IL-23, IL-18 и IL-4, описаны ранее (Ganesh et al., 2012), и праймеры для других генов показаны в таблице 2. Относительные уровни экспрессии мРНК генов-мишеней (Отношение=[(Eмишень)dCPмишень (Контроль-Образец)]/[(Eэтал.)dCPэтал. (Контроль-Образец)]) нормализовали по гену домашнего хозяйства, глицеральдегид-3-фосфатдегидрогеназе (GAPDH), и использовали в качестве эталона. Затем значения экспрессии генов цитокинов и H2R в слизистой оболочке кишечника в контрольной группе устанавливали на 1,0 и использовали в качестве калибратора для идентификации кратности относительных различий количества мРНК между группой отрицательного контроля (MRS/PBS-H2O), группой положительного контроля (MRS/AOM-DSS), группой, подвергнутой лечению L. reuteri ATCC PTA-6475 (L. reuteri 6475/AOM-DSS), и группой, подвергнутой лечению изогенным мутантом hdcAL. reuteri (мутант hdcA/AOM-DSS).
Таблица 2. Праймеры и зонды, использованные для исследований экспрессии генов.
ПРИМЕР 5
Препараты, как в примере 1.
Получение изображений PET для живых мышей
Сканирование PET/CT проводили через 15 недель после инъекции AOM, непосредственно перед умерщвлением мышей, как описано (Brewer et al., 2008) с незначительными модификациями. Кратко, мышей подвергали анестезии с использованием изофлурана и вводили им 200 мкКи18F-FDG посредством внутрибрюшинной (IP) инъекции. Через один час, этим мышам вводили 200 мкл MD-Gastroview ректально через катетер 3,5F непосредственно перед началом сканирования. Проводили сканирование посредством компьютерной томографии (CT) в течение 10 мин с последующим сканированием PET в течение 20 мин с использованием системы для работы в нескольких режимах Inveon PET/CT (Siemens, Germany). Мышей поддерживали усыпленными в течение процесса сканирования посредством постоянной ингаляции изофлурана. Изображения записывали, и стандартизованные значения накопления FDG (SUV) анализировали вслепую с использованием программного обеспечения Inveon Research Workplace (Siemens, Germany). 2D изображения мышей получали посредством программного обеспечения OsiriX (Pixmeo, Swiss).
ПРИМЕР 6
Количественная оценка экспрессии мРНК гена dagK посредством qОТ-ПЦР
Lactobacillus reuteri ATCC PTA-6475 дикого типа, мутант hdcAL. reuteri 6475, L. reuteri ATCC PTA-4659 дикого типа (депонированные согласно Будапештскому соглашению в ATCC - Американской коллекции типовых культур (10801 University Boulevard, Manassas, VA 20110 USA) 11 сентября 2002 г.) и L. reuteri DSM 17938 дикого типа (депонированный согласно Будапештскому соглашению в DSMZ - Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (Mascheroeder Weg 1b, D-38124 Braunschweig) 30 января 2006 г.) выращивали в среде MRS в течение ночи при 37°C и культивировали в строгих условиях кислородного голодания с N2/CO2 (80/20; об./об.) в качестве газообразной фазы. 100 мкл свежей культуры инкубировали в 10 мл среды определенного состава для лактобактерий 4 (LDM4). Культуры поддерживали в минибиореакторах при 37°C в строгих условиях кислородного голодания. Образцы собирали через 3 часа, 6 часов, 24 часа и 48 часа. Осадок бактерий получали посредством обработки культуры при 6000 × g в течение 10 мин при 4°C. Осадок обрабатывали РНКазой. мРНК из клеток бактерий выделяли посредством набора для выделения с тризолом. 500 нг мРНК из каждой группы использовали для перевода мРНК в кДНК. Обработанную кДНК разводили 1:2 и использовали для проведения qОТ-ПЦР. Stratagene Mx3000p (Agilent Technologies GmbH, USA) для qОТ-ПЦР использовали для амплификации и сбора данных флуоресценции. Готовая реакционная смесь состояла из 12,5 мкл Power SYBR Green 2000 (ABI systems, USA), 0,5 мкл каждого праймера (10 мкМ), 1 мкл образца, и ее доводили с использованием воды до конечного объема 25 мкл на лунку. После амплификации ПЦР, специфичность праймеров проверяли посредством проверки кривой плавления и определения размера ампликона посредством электрофореза в агарозном геле (1%). Относительные уровни экспрессии мРНК генов-мишеней (Отношение =[(Eмишень)dCPмишень (контроль-образец)]/[(Eэтал.)dCPэтал. (контроль-образец)]) нормализовали по гену домашнего хозяйства rpoB и использовали в качестве эталона. Затем количество мРНК, полученной через 3 часа культивирования каждой бактерии, устанавливали на 1,0 и использовали в качестве калибратора для идентификации кратности относительных различий количества мРНК для одного и того же штамма бактерий в различных временных точках, подобных 6 час, 24 час и 48 час, для L. reuteri ATCC PTA-6475, ATCC PTA-4659 и DSM 17938.
На фигуре 9 проиллюстрированы результаты экспериментов по экспрессии гена dagK. На фигуре показана увеличенная экспрессия dagK как в штамме дикого типа, так и в мутанте hdcAL. reuteri ATCC PTA-6475 вместе с L. reuteri ATCC PTA-4659. Однако, в L. reuteri DSM 17938, который не способен продуцировать гистамин, отсутствовала также экспрессия dagK. Интересно, что экспрессия мРНК dagK проходила на очень высоком уровне в ходе фазы элонгации бактерий. Из повторных экспериментов выбрана временная точка инкубации 12 час, поскольку для нее показана сходная экспрессия, как и для 6 час.
ПРИМЕР 7
LC-MS/MS для детекции белка DagK в супернатантах культуры бактерий
В соответствии с литературными данными, считают, что DagK имеет растворимые изоформы в грамположительных бактериях. Авторы настоящего изобретения выдвинули гипотезу, что DagK высвобождается из L. reuteri ATCC PTA-6475 и взаимодействует с передачей сигналов липидами эпителия кишечника хозяина, и стимулирует противовоспалительное действие в условиях воспаления вместе с высвобождением гистамина. Когда авторы настоящего изобретения вводили мутацию в ген dagK в L. reuteri ATCC PTA-6475 и колонизировали выведенных авторами настоящего изобретения асептических (GF) мышей мутантом DAGK L. reuteri ATCC PTA-6475, они не наблюдали супрессии IL-6 и IL-1α, подобной той, которую они наблюдали у асептических мышей, колонизированных L. reuteri ATCC PTA-6475 дикого типа. Исходные уровни провоспалительных цитокинов являлись значимо супрессированными. Это привело авторов настоящего изобретения к заключению, что L. reuteri ATCC PTA-6475 нуждается в гистамине для активации H1R и H2R. Однако, передача сигнала ниже H1R прерывается посредством синтеза DagK в L. reuteri посредством ингибирования липида DAG, вовлеченного в передачу сигнала, и таким образом, супрессии провоспалительного эффекта гистамина. Это обеспечивает активацию только H2R посредством происходящего из L. reuteri гистамина, и известно, что активация H2R способствует противовоспалительным симптомам.
Чтобы dagK оказывала какой-либо положительный эффект на иммунный ответ хозяина, липид DAG хозяина должен экспрессироваться. Чтобы DAG активировался, должна быть активирована передача сигнала H1R. Это является причиной того, почему, когда авторы настоящего изобретения вводили мутацию в dagK в L. reuteri и колонизировали мышей, они не наблюдали супрессии провоспалительных цитокинов. Это, кроме того, подтверждали с использованием активации PKC и PKA. Кроме того, авторы настоящего изобретения не наблюдали каких-либо различий экспрессии H1R и H2R на ткани (f-IHC) между группами, колонизированными штаммами L. reuteri дикого типа или мутантным по hdcA или мутантным по dagK, поскольку эти асептические мыши также экспрессировали эндогенный гистамин.
Когда мышам с нокаутом HDC вводили мутант hdcAL. reuteri, они не могли защищаться от воспаления и злокачественных опухолей, поскольку у них отсутствовал как эндогенный, так и экзогенный гистамин. Но у мышей GF, колонизированных мутантом hdcAL. reuteri, присутствовал эндогенный гистамин, который активировал рецептор. Однако, DagK, продуцируемый мутантом hdcAL. reuteri помогал супрессировать проявление активации H1R. Это являлось причиной того, почему авторы настоящего изобретения наблюдали супрессию провоспалительных биомаркеров в группах, колонизированных мутантом hdcA. Но при нокауте dagK в L. reuteri (мутант dagK) присутствовал эндогенный и экзогенный гистамин, активирующий как H1R, так и H2R, но отсутствовал DagK для супрессии H1R. Соответственно, авторы настоящего изобретения наблюдали увеличение передачи провоспалительных сигналов, подобно мышам GF без каких-либо бактерий. У мышей GF эндогенный гистамин активирует как H1R, так и H2R.
Таким образом, экспериментальные данные показали, что исходный уровень иммунитета сильно уменьшался после колонизации мышей L. reuteri ATCC PTA-6475 дикого типа, который, таким образом, является полным иммуносупрессором, и для пациентов с агрессивным иммунным ответом этот штамм бактерий может являться очень важным лекарственным средством.
Чтобы дополнительно показать, секретируются изоформы DagK из L. reuteri или нет, авторы настоящего изобретения проводили эксперимент по культивированию клеток бактерий. 100 мкл L. reuteri ATCC PTA-6475, выращенного в течение ночи в MRS при 37°C в условиях кислородного голодания, добавляли в 10 мл среды LDM4 и оставляли при 37°C на 12 часов в условиях кислородного голодания. Клетки бактерий удаляли посредством центрифугирования при 6000 × g, 10 мин при 4°C. К супернатанту добавляли ингибитор протеазы и протеинкиназы в соотношении 1:1. Супернатанты фильтровали через 0,22 мкм фильтр для удаления следов бактерий. Поскольку DagK представляет собой белок 10-13 кДа, необходимо уменьшить фон. Поэтому супернатант пропускали через фильтр 50 кДа. Проскок наносили на фильтр 3 кДа и центрифугировали при 5000 × g в течение 30 мин. Концентрат верхней фазы использовали для проведения LC-MS/MS после расщепления трипсином. На фигуре 10 проиллюстрирована аминокислотная последовательность белка DagK из L. reuteri ATCC PTA-6475 вместе с участками расщепления или разрезания трипсином (Tryps).
Результаты эксперимента LC-MS/MS представлены в таблице 3 и на фигуре 10. Последовательности, совпадающие с белком DagK L. reuteri, обнаружены в супернатанте. Соответсвенно, L. reuteri ATCC PTA-6475 является способным продуцировать и секретировать белок DagK.
Таблица 3. Результаты LC-MS/MS после обработки трипсином супернатанта L. reuteri ATCC PTA-6475
Пептиды A-F в таблице 3:
ПРИМЕР 8
Идентификация штаммов, способных продуцировать DagK
Бактерии культивируют на планшетах с MRS в течение 16 час при 37°C в анаэробной атмосфере. Колонии бактерий собирают с помощью стерильной пластиковой петли и суспендируют в 100 мкл стерильной воды (пригодного для ПЦР качества). Альтернативно, ДНК можно получать из культуры бактерий с использованием любого пригодного способа, см., например, пример 6.
Присутствие гена dagK проверяют посредством ПЦР, например, с использованием бусин для ПЦР PuReTaq Ready To Go (GE HealthCare) и пары праймеров dagK_LrF (TGGACTCACGCGATAAACATCA, SEQ ID NO: 21) и dagK_LrR (ACAATCAAATCTGTAACAGCTTCG, SEQ ID NO: 22), 0,4 мМ каждый. Суспензию бактерий или препарат ДНК (0,5 мкл) добавляют в смесь для ПЦР и проводят реакцию ПЦР посредством выполнения программы 95°C, 5 мин; 30× (95°C, 30 с; 58°C, 30 с; 72°C, 30 с); 72°, 10 мин. Продукты ПЦР разделяют и визуализируют с использованием стандартного электрофореза в агарозном геле и последовательность определяют посредством стандартного секвенирования по Сэнгеру с использованием прямого праймера (dagK_LrF), использованного для ПЦР.
ПРИМЕР 9
Анализ Lactobacillus reuteri DSM 32273, способного продуцировать гистамин и DagK
Бактерии Lactobacillus reuteri DSM 32273 (депонированные согласно Будапештскому соглашению в DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (Inhoffenstrasse 7B, D - 38124 Braunschweig) 8 марта 2016 г.) выращивали в течение ночи в среде MRS при 37°C. Суспензии бактерий центрифугировали при 3500 об/мин в течение 5 мин, и 1 мкл осадка суспендировали в 100 мкл PBS.
Анализ ПЦР (гистидиндекарбоксилазы (hdc)) проводили со следующими праймерами: hdcA425fde (CGTCAYTATCCWGCTCCWGG, SEQ ID NO: 23) и hdcA867rde (TCCATRTCAGTATCWGGKGT, SEQ ID NO: 24). Полученный продукт ПЦР обладал размером 442 п.о. Праймеры для ПЦР разрабатывали, исходя из выравнивания hdc из L. reuteri, L. hilgardii, L. buchneri и L. sakei. Готовую смесь для ПЦР DreamTaq Green (2X Thermo Scientific, номер изделия K1081) использовали для реакций ПЦР. Реакционные смеси для ПЦР соответствовали следующему:
24,5 мкл готовой реакционной смеси смешивали с 0,5 мкл суспензии бактерий и выполняли следующую программу ПЦР: 95°C, 10 мин; 30× (95°C, 30 с; 48°C, 30 с; 72°C, 30 с); 72°C, 5 мин.
Анализ ПЦР гена dagK в L. reuteri DSM 32273 выполняли, как описано в примере 8.
Результаты показывают, что L. reuteri DSM 32273 являлся положительным по гену, кодирующему гистидиндекарбоксилазу, и гену dagK, см. таблицу 4. Штаммы бактерий L. reuteri ATCC PTA-6475 и DSM 17938 включали в качестве контроля.
Таблица 4. Результаты анализа ПЦР, показывающие вид, штамм и исходного хозяина тестированных бактерий.
Варианты осуществления, описанные выше, следует понимать как немногие иллюстративные примеры настоящего изобретения. Специалисту в данной области понятно, что различные модификации, комбинации и изменения можно осуществлять для вариантов осуществления без отклонения от объема настоящего изобретения. В частности, различные части решений в различных вариантах осуществления можно комбинировать в других конфигурациях, когда это технически возможно. Объем настоящего изобретения, однако, определен посредством прилагаемой формулы изобретения.
СПИСОК ЛИТЕРАТУРЫ
Adams, W.J., and Morris, D.L. (1994). Short-course cimetidine and survival with colorectal cancer. Lancet 344, 1768-1769.
Brewer, S., McPherson, M., Fujiwara, D., Turovskaya, O., Ziring, D., Chen, L., Takedatsu, H., Targan, S.R., Wei, B., and Braun, J. (2008). Molecular imaging of murine intestinal inflammation with 2-deoxy-2-[18F]fluoro-D-glucose and positron emission tomography. Gastroenterology 135, 744-755.
Frei, R., Ferstl, R., Konieczna, P., Ziegler, M., Simon, T., Rugeles, T.M., Mailand, S., Watanabe, T., Lauener, R., Akdis, C.A., et al. (2013). Histamine receptor 2 modifies dendritic cell responses to microbial ligands. The Journal of allergy and clinical immunology 132, 194-204.
Fukui, H., Zhang, X., Sun, C., Hara, K., Kikuchi, S., Yamasaki, T., Kondo, T., Tomita, T., Oshima, T., Watari, J., et al. (2014). IL-22 produced by cancer-associated fibroblasts promotes gastric cancer cell invasion via STAT3 and ERK signaling. British journal of cancer 111, 763-771.
Galitovskiy, V., Kuruvilla, S., Sevriokov, E., Corches, A., Pan, M., Kalantari-Dehaghi, M., Chernyavsky, A., Mukherjee, J., and Grando, S. (2013). Development of novel approach to diagnostic imaging of lung cancer with 18F-Nifene PET/CT using A/J Mice treated with NNK. J Cancer Res Ther 1, 128-137.
Ganesh, B.P., Richter, J.F., Blaut, M., and Loh, G. (2012). Enterococcus faecium NCIMB 10415 does not protect interleukin-10 knock-out mice from chronic gut inflammation. Beneficial microbes 3, 43-50.
Garcia-Caballero, M., Neugebauer, E., Campos, R., Nunez de Castro, I., and Vara-Thorbeck, C. (1988). Increased histidine decarboxylase (HDC) activity in human colorectal cancer: results of a study on ten patients. Agents Actions 23, 357-360.
Ji, Y., Yang, X., Li, J., Lu, Z., Li, X., Yu, J., and Li, N. (2014). IL-22 promotes the migration and invasion of gastric cancer cells via IL-22R1/AKT/MMP-9 signaling. International journal of clinical and experimental pathology 7, 3694-3703.
Jutel, M., Watanabe, T., Klunker, S., Akdis, M., Thomet, O.A., Malolepszy, J., Zak-Nejmark, T., Koga, R., Kobayashi, T., Blaser, K., et al. (2001). Histamine regulates T-cell and antibody responses by differential expression of H1 and H2 receptors. Nature 413, 420-425.
Kelly, M.D., King, J., Cherian, M., Dwerryhouse, S.J., Finlay, I.G., Adams, W.J., King, D.W., Lubowski, D.Z., and Morris, D.L. (1999). Randomized trial of preoperative cimetidine in patients with colorectal carcinoma with quantitative assessment of tumor-associated lymphocytes. Cancer 85, 1658-1663.
Kryczek, I., Lin, Y., Nagarsheth, N., Peng, D., Zhao, L., Zhao, E., Vatan, L., Szeliga, W., Dou, Y., Owens, S., et al. (2014). IL-22(+)CD4(+) T cells promote colorectal cancer stemness via STAT3 transcription factor activation and induction of the methyltransferase DOT1L. Immunity 40, 772-784.
Landskron, G., De la Fuente, M., Thuwajit, P., Thuwajit, C., and Hermoso, M.A. (2014). Chronic inflammation and cytokines in the tumor microenvironment. Journal of immunology research 2014, 149185.
Lee, Y.S., Choi, I., Ning, Y., Kim, N.Y., Khatchadourian, V., Yang, D., Chung, H.K., Choi, D., LaBonte, M.J., Ladner, R.D., et al. (2012). Interleukin-8 and its receptor CXCR2 in the tumour microenvironment promote colon cancer growth, progression and metastasis. British journal of cancer 106, 1833-1841.
Nagasaki, T., Hara, M., Nakanishi, H., Takahashi, H., Sato, M., and Takeyama, H. (2014). Interleukin-6 released by colon cancer-associated fibroblasts is critical for tumour angiogenesis: anti-interleukin-6 receptor antibody suppressed angiogenesis and inhibited tumour-stroma interaction. British journal of cancer 110, 469-478.
O'Mahony, L., Akdis, M., and Akdis, C.A. (2011). Regulation of the immune response and inflammation by histamine and histamine receptors. The Journal of allergy and clinical immunology 128, 1153-1162.
Oquendo, P., Alberta, J., Wen, D.Z., Graycar, J.L., Derynck, R., and Stiles, C.D. (1989). The platelet-derived growth factor-inducible KC gene encodes a secretory protein related to platelet alpha-granule proteins. The Journal of biological chemistry 264, 4133-4137.
Thomas, C.M., Hong, T., van Pijkeren, J.P., Hemarajata, P., Trinh, D.V., Hu, W., Britton, R.A., Kalkum, M., and Versalovic, J. (2012). Histamine derived from probiotic Lactobacillus reuteri suppresses TNF via modulation of PKA and ERK signaling. PLoS One 7, e31951.
Tjalsma, H., Boleij, A., Marchesi, J.R., and Dutilh, B.E. (2012). A bacterial driver-passenger model for colorectal cancer: beyond the usual suspects. Nature reviews Microbiology 10, 575-582.
Waldner, M.J., Foersch, S., and Neurath, M.F. (2012). Interleukin-6--a key regulator of colorectal cancer development. International journal of biological sciences 8, 1248-1253.
Watanabe, S., Deguchi, K., Zheng, R., Tamai, H., Wang, L.X., Cohen, P.A., and Shu, S. (2008). Tumor-induced CD11b+Gr-1+ myeloid cells suppress T cell sensitization in tumor-draining lymph nodes. Journal of immunology 181, 3291-3300.
Yang, X.D., Ai, W., Asfaha, S., Bhagat, G., Friedman, R.A., Jin, G., Park, H., Shykind, B., Diacovo, T.G., Falus, A., et al. (2011). Histamine deficiency promotes inflammation-associated carcinogenesis through reduced myeloid maturation and accumulation of CD11b+Ly6G+ immature myeloid cells. Nature medicine 17, 87-95.
Реферат
Изобретение относится к применению продуцирующего гистамин штамма молочнокислых бактерий для профилактики, ингибирования, лечения или уменьшения риска рецидива колоректального рака, ассоциированного с воспалением. Предложено применение продуцирующего гистамин штамма молочнокислых бактерий, содержащего активный гистидиновый оперон и продуцирующего диацилглицеринкиназу (DagK) для профилактики, ингибирования, лечения или уменьшения риска рецидива ассоциированного с воспалением колоректального рака. Предложен также штамм Lactobacillus reuteri, депонированный в DSMZ под номером доступа DSM 32273, где указанный штамм содержит активный гистидиновый оперон и продуцирует DagK. Указанный штамм может быть применен в качестве лекарственного средства для профилактики, ингибирования, лечения или уменьшения риска рецидива колоректального рака, ассоциированного с воспалением. Изобретение может быть использовано в лечении злокачественных опухолей, в частности ассоциированного с воспалением колоректального рака. 3 н. и 3 з.п. ф-лы, 4 табл., 9 пр., 10 ил.

Комментарии