Терапия для стимуляции роста клеток - RU2586302C2
Код документа: RU2586302C2
Чертежи


Описание
Область изобретения
Настоящее изобретение в целом относится к способам и композициям для стимуляции разрастания и пролиферации нервных клеток. Настоящее изобретение также относится к способу стимуляции роста клеток in vitro.
Уровень техники
Поражения нервной системы возникают у множества людей каждый год. В результате такой высокой частоты возникновения неврологических повреждений, область исследования регенерации и восстановления нервной ткани становится быстрорастущей областью, посвященной разработке новых способов восстановления функционирования нервов после повреждения. Тем не менее, до настоящего времени клиническое исправление повреждений центральной нервной системы (ЦНС) и восстановление неврологических функций у пациентов, страдающих от поражения нервной системы, было проблематичным. Таким образом, лечащие врачи пациентов с различными формами заболеваний нервной системы, такими как боковой амиотрофический склероз (ALS) и старческое слабоумие, всегда сообщают пациентам, что будет сложно восстановить их неврологические функции.
Способность нейронов удлинять нейриты (такие как аксоны и дендриты) имеет первостепенное значение для образования нервных соединений в процессе развития. Указанная способность также необходима в процессе нейрорегенерации для восстановления связей, разрушенных is результате повреждения. Тем не менее, аксоны is центральной нервной системе обладают очень ограниченной способностью регенерировать после повреждения.
Таким образом, для таких заболеваний, как старческое слабоумие, при которых происходит прогрессирующая дегенерация нервных клеток, поиски терапевтических агентов или молекул, которые способны стимулировать разрастание и пролиферацию нервных клеток, откроют новую терапевтическую стратегию, которая будет направлена на регенерацию нервной ткани и восстановление неврологической функции.
Существует потребность в усовершенствовании способов лечения поражений нервной системы и неврологических заболеваний. В частности, существует потребность в разработке регенеративных методов лечения, которые будут способствовать разрастанию нервных клеток и пролиферации нейронов, что обеспечит возобновление функционирования поврежденных или больных нервов.
Краткое описание изобретения
Согласно первому аспекту настоящего изобретения, предложено применение композиции, которая содержит но меньшей мере два компонента, выбранные из группы, состоящей из следующих компонентов: Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen (корень шалфея многокорневого)), Prunus Porsica (семя персика или Taoren), Radix Polygalae (корень тонколистного истода, Polyqala tenuifolia Willd., Polygala sibirica L. или Yuanzhi) и Rhizoma acori Tabarinowii (корневище вира травянистого или Shichangpu), и комбинаций перечисленных компонентов, и возможно компонента, выбранного из группы, состоящей из: Radix Astragali (корня астрагала сладколистного перепончатого или Huang Qi), Radix Paeoniae Rubra (корня красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Lynch или Chi Shao), корневища лигустикума чуаньсионского (Chuan Xiong), цветка сафлора красильного (сафлора или HongHua) и radix angelicae sinensis (корня аралии китайской или DanGui) и комбинаций перечисленных компонентов, для получения лекарственного средства для стимуляции разрастания нейронов и пролиферации нервных клеток в тканях центральной или периферической нервной системы.
В одном варианте реализации, указанная в норном аспекте композиция может дополнительно содержать компонент, выбранный из группы, состоящей из: Buthus martensii (высушенного тела скорпиона или Quanxie), Eupolyphaqa Seu Seteleophaqa (высушенного тела жужелицы, Eupolyphaqa sinensis Walker, Steleophaqa plancyi или Tubiechonq), Calculus Bovis Artifactus (природного или искусственного безоара коровы или Renqonq Niuhuanq), Cornu Saiqae Tataricae (рога антилопы или Linqyanqjiao) и высушенных тел пиявок (Hurudo, Whitmania piqra Whitman, Hirudo nipponica Whitman, Whitmania acranulata Whitman или Shuizhi).
Предпочтительно, указанное лекарственное средство может вызывать разрастание нейронов и пролиферацию нейронов в больной или поврежденной ткани, когда произошло существенное сокращение ткани, ее потеря, атрофия или гибель клеток ткани. Стимуляция разрастания нейронов и пролиферации нервных клеток позволяет поврежденным или больным нервам осуществлять направленное разрастание, что может способствовать образованию полезного синаптического соединения, или приводит к их замещению на новые функционирующие клетки. Указанная композиция также может стимулировать дифференцировку стволовых клеток и их привлечение в больные или поврежденные ткани.
В одном варианте реализации, предложено применение композиции, которая содержит первый компонент, выбранный из группы, состоящей из следующих компонентов: Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Prunus Persica (семя персика или Taoren), Radix Polyqalae (корень тонколистного истода, Polygala tenuifolia Willd., Polygala sibirica L. или Yuanzhi), Buthus martensii (высушенное тело скорпиона или Quanxie), Rhizoma acori Tatarinowii (корневище вира травянистого или Shichanqpu), Eupolyphaqa Seu Seteleophaqa (высушенное тело жужелицы, Eupolyphaqa sinensis Walker, Steleophaga plancyi, или Tubiechonq), Calculus Bovis Artifactus (природный или искусственный безоар коровы или Rengong Niuhuang) и Cornu Saigae Tataricae (рог антилопы или Lingyangjiao), и комбинаций перечисленных компонентов, и возможно второго компонента, выбранного из группы, состоящей из: Radix Astragali (корня астрагала сладколистного перепончатого или Huang Qi), Radix Paeoniae Rubra (корня красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Hynch или Chi Shao), корневища лигустикума чуаньсионского (Chuan Xionq), цветка сафлора красильного (сафлора или HonqHua), radix angelicae sinensis (корня аралии китайской или DanGui) и высушенных тел пиявок (Hirudo, Whitmania piqra Whitman, Hirudo nipponica Whitman Whitmania acranulata Whitman или Shuizhi), и комбинаций перечисленных компонентов, для получения лекарственного средства для лечения пациентов, страдающих от патологического состояния, выбранного ид группы, состоящей из депрессии, психических симптомов, естественного старения и травматической гибели клеток головного мозга, для уменьшения последствий инсульта или нейродегенерации у предрасположенных к этому субъектов или у субъектов, для которых существует риск инсульта или нейродегеперации, для лечения пациента, страдающего от наличия пораженных болезнью или поврежденных тканей центральной и периферической нервной системы, и для стимуляции роста клеток.
Согласно второму аспекту, предложено применение композиции, которая содержит по меньшей море два из следующих компонентов: Radix Astragali (корень астрагала сладколистного перепончатого или Huang Qi), Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Radix Paeoniae Rubra (корень красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Lynch или Chi Shao), корневище лигустикума чуаньсионского (Chuan Xiong), radix angelicae sinensis (корень аралии китайской или DanGui), цветок сафлора красильного (сафлор или HongHua), Prunus Persica (семя персика или Taoren), Radix Polyqalae (корень тонколистного истода, Polyqala tenuiflora Willd., Polygala sibirica L. или Yuanzhi) и Rhizoma acori Tatarinowii (корневище аира травянистого или Shichanqpu), для получения лекарственного средства для лечения пациентов, страдающих от патологического состояния, выбранного из группы, состоящей из депрессии, психических симптомов, естественного старения и травматической гибели клеток головного мозга.
Без привязки к какой-либо конкретной теории, мы полагаем, что лекарственное средство, описанное в данной заявке, может оказаться полезным для лечения пациентов, страдающих от депрессии или других психических симптомов, таких как шизофрения и тревожные расстройства, благодаря стимуляции регуляции гормонального баланса, который может быть нарушен в результате потери функции клеток.
Согласно третьему аспекту настоящего изобретения, предложено применение композиции, которая содержит по меньшей мере три из следующих компонентов: Radix Astraqali (корень астрагала сладколистного перепончатого или Huanq Qi), Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Radix Paeoniae Rubra (корень красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Lynch или Chi Shao), корневище лигустикума чуаньсионского (Chuan Xionq), radix anqelicae sinensis (корень аралии китайской или DanGui), цветок сафлора красильного (сафлор или HonqHua), Prunus Persica, (семя персика или Taoren), Radix Polyqalae (корень тонколистного истода, Polyqala tenuifolia Willd., Polyqala sibirica L. или Yuanzhi) и Rhizoma acori Tatarinowii (корневище аира травянистого или Shichanqpu), для получения лекарственного средства для уменьшения последствий инсульта или нейродегенерации у предрасположенных к этому субъектов или субъектов, для которых существует риск инсульта или нейродегенерации.
Согласно четвертому аспекту, предложено применение композиции, которая содержит по меньшей мере три из следующих компонентов: Radix Astraqali (корень астрагала сладколистного перепончатого или Huanq Qi), Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Radix Paeoniao Rubra (корень красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Lynch или Chi Shao), корневище лигустикума чуаньсионского (Chuan Xiong), radix angelicae sinensis (корень аралии китайской или DanGui), цветок сафлора красильного (сафлор или HonqHua), Prunus Persica (семя персика или Taoren), Radix Polygalac (корень тонколистного истода, Polyqala tenuifolia Willd., Polygala sibirica L. или Yuanzhi) и Rhizoma acori Tatarinowii (корневище вира травянистого или Shichangpu), для получения лекарственного средства для стимуляции роста клеток.
В одном варианте реализации, указанное лекарственное средство может способствовать контролируемому росту хондроцитов, клеток скелетных мышц, клеток сердечной мышцы, клеток гладких мышц, гепатоцитов, клеток ночек и эпителиальных клеток кожи. Лекарственное средство, которое способствует" росту клеток, можно применять для лечения таких состояний, как ревматоидный артрит, дегенеративные мышечные расстройства, инсульт, болезни почек и печени. Лекарственное средство также можно применять для замедления процессов старения посредством улучшения пролиферации или функционирования эпителиальных или эпидермальных клеток.
Согласно пятому аспекту, предложено применение но меньшей мере одного из следующих компонентов: Radix Astragali (корень астрагала сладколистного перепончатого или Huang Qi), Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Radix Paeoniae Rubra (корень красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Lynch или Chi Shao), корневище лигустикума чуаньсионского (Chuan Xionq), radix angelicae sinensis (корень аралии китайской или DanGui), цветок сафлора красильного (сафлор или HongHua), Prunus Persica (семя персика или Taoren), Radix Polygalae (корень тонколистного истода, Polygala tenuifolia Willd., Polygala sibirica L. или Yuanzhi) и Rhizoma acori Tatarinowii (корневище вира травянистого или Shichangpu), для изготовления лекарственного средства, и дополнительного агента для лечения пациента, страдающего от наличия пораженных болезнью или поврежденных тканей центральной или периферической нервной системы.
В одном варианте реализации, предложено применение описанной выше композиции, при этом указанная композиция содержит по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 из указанных компонентов. Указанный дополнительный агент может представлять собой минеральные добавки, витамины, травяные добавки, лекарственные сродства западной медицины или рыбий жир.
Согласно шестому аспекту настоящего изобретения, предложен реагент для ведения культуры клеток для стимуляции выживаемости и роста клеток, содержащий культуральную среду и по меньшей мере один из следующих компонентов: Radix Astraqali (корень астрагала сладколистного перепончатого или Huanq Qi), Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Radix Paeoniae Rubra (корень красного пиона, Paeonia lactiflora Pall, Paeoma veitchii Lynch или Chi Shao), корневище лигустикума чуаньсионского (Chuan Xionq), radix angelicae sinensis (корень аралии китайской или DanGui), цветок сафлора красильного (сафлор или HongHua), Prunus Persica (семя персика или Taoren), Radix Polygalae (корень тонколистного истода, Polygala tenuifolia Willd., Polyqala sibirica L. или Yuanzhi) и Rhizoma acori Tatarinowii (корневище, вира травянистого или Shichangpu).
В одном варианте реализации, предложен реагент для ведения культуры клеток, содержащий композицию, описанную в шестом аспекте, при этом указанная композиция содержит но меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 из указанных компонентов.
В другом варианте реализации, указанный реагент для ведения культуры клеток может способствовать выживаемости и росту нейронов, стволовых клеток, хондроцитов, клеток скелетных мышц, клеток сердечной мышцы, клеток гладких мышц, гепатоцитов, клеток почек, клеток островков Лангерганса и эпителиальных клеток кожи.
Согласно седьмому аспекту, предложен способ стимуляции выживаемости клеток, индукции пролиферации или дифференцировки клеток, включающий осуществление контакта указанных клеток с эффективным количеством но меньшой мере трех из следующих компонентов: Radix Astraqali (корень астрагала сладколистного перепончатого или Huanq Qi), Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Radix Paeoniae Rubra (корень красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Lynch или Chi Shao), корневище лигустикума чуаньсионского (Chuan Xiong), radix anqeticae sinensis (корень аралии китайской или DanGui), цветок сафлора красильного (сафлор или HongHua), Prunus Persica (семя персика или Taoren), Radix Polyqalae (корень тонколистного истода, Polyqala tenuifolia Willd., Polygala sibirica L. или Yuanxhi) и Rhizoma acori Tatarinowii (корневище аира травянистого или Shichanqpu).
Указанный этап приведения в контакт из седьмого аспекта можно осуществлять in vitro. Этан приведения в контакт in vitro может способствовать росту, дифференцировке или выживаемости клеток, облегчит культивирование in vitro различных клеток, которые можно использовать для тканевой инженерии или терапевтических применений ex vivo. В одном варианте реализации, эффективное количество составляет от 1 г до 8 г.В другом варианте реализации, указанные нервные клетки представляют собой нервные клетки позвоночного, предпочтительно нервные клетки человека. В одном варианте реализации, указанные нервные клетки получают из кортикальных нервных клеток.
Согласно восьмому аспекту настоящего изобретения, предложен способ стимуляции разрастания нейронов и пролиферации нервных клеток в тканях центральной или периферической нервной системы пациента, включающий этан введения указанному пациенту композиции, которая содержит по меньшей мере два компонента, выбранных из группы, состоящей из перечисленных далее компонентов: Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Prunus Persica (семя персика или Taoren), Radix Polyqalae (корень тонколистного истода, Polyqala tenuifolia Willd., Polyqala sibirica L. или Yuanzhi) и Rhizoma acori Tatarinowii (корневище вира травянистого или Shichanqpu), и комбинаций перечисленных компонентов.
Согласно донятому аспекту, предложен способ лечения пациентов, страдающих от патологического состояния, выбранного из группы, состоящей из депрессии, психических симптомов, естественного старения и травматической гибели клеток головного мозга, включающий этан введения указанным пациентам по меньшей мере двух из следующих компонентов: Radix Astraqali (корень астрагала сладколистного перепончатого или Huanq Qi), Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Radix Paeoniae Rubra (корень красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Lynch или Chi Shao), корневище лигустикума чуаньсионского (Chuan Xionq), radix anqelicae sinensis (корень аралии китайской или DanGui), цветок сафлора красильного (сафлор или HonqHua), Prunus Persica (семя персика или Taoren), Radix Polyqalae (корень тонколистного истода, Polyqala tenuifolia Willd., Polygala sibirica L,. или Yuanzhi) и Rhizoma acori Tatarinowii (корневище, вира травянистого или Shichanqpu).
Согласно десятому аспекту, предложен способ уменьшения последствий инсульта или нейродегенерации у предрасположенных к этому субъектов или субъектов, для которых существует риск инсульта или нейродегенерации, включающий этап введения указанным субъектам по меньшей мере трех из следующих компонентов: Radix Astraqali (корень астрагала сладколистного перепончатого или Huanq Qi), Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Radix Paeoniac Rubra (корень красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Lynch или Chi Shao), корневище лигустикума чуаньсионского (Chuan Xionq), radix anqelicae sinensis (корень аралии китайской или DanGui), цветок сафлора красильного (сафлор или HongHua), Prunus Persica (семя персика или Taoren), Radix Polyqalae (корень тонколистного истода, Polyqala tenuifolia Willd., Polyqala sibirica L. или Yuanzhi) и Rizoma acori Tatarinowii (корневище вира травянистого или Shichanqpu).
ГЛОССАРИЙ ТЕРМИНОВ
В этом разделе предусмотрено руководство по толкованию терминов и выражений, описанных ниже (и, когда это уместно, их грамматических вариантов).
Термин "разрастание нейронов" в настоящем описании относится к общему направленному разрастанию аксонов и дендритов. Разрастание нейронов важно для образования или увеличения синаптических контактов.
Если не указано иное, предполагается, что термины "включающий" и "содержать" и их грамматические варианты представляют собой "открытую" или "включительную" терминологию, то есть они включают перечисленные элементы, но также позволяют включение дополнительных элементов, которые не указаны.
В данной заявке термин "приблизительно" в отношении численного значения означает, например,+50% или+30% от указанного численного значения, предпочтительно+20%, более предпочтительно+10%, хотя более предпочтительно+5% и наиболее предпочтительно+1%. При необходимости, термин "приблизительно" может быть опущен в определениях настоящего изобретения.
Термин "лечение" включает любое и каждое применение, которое позволяет вылечить от болезненного состояния или симптомов, предотвращает возникновение заболевания, или каким-либо другим образом предотвращает, препятствует, замедляет или обращает прогрессирование заболевания или другие нежелательные симптомы любым возможным способом. Следовательно, термин "лечение" включает профилактическое и терапевтическое лечение.
Повсюду в настоящем описании, некоторые варианты реализации могут быть описаны в формате диапазона значений. Должно быть очевидно, что описание в формате диапазона значений приведено исключительно для удобства и краткости, и оно не должно толковаться как жесткое ограничение границ указанных диапазонов. Соответственно, описание диапазона следует рассматривать как конкретное описание всех возможных частичных диапазонов, а также отдельных численных значений внутри указанного диапазона. Например, описание такого диапазона, как от 1 до 6, следует рассматривать как конкретное описание, таких поддиапазонов, как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., а также отдельных чисел внутри данного диапазона, например, 1, 2, 3, 4, 5 и 6. Это применимо независимо от широты диапазона.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложено применение композиции, которая содержит по меньшей морс 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 13, 12, 13 или 14 из следующих компонентов: Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Prunus Persica (семя персика или Taoren), Radix Polygalae (корень тонколистного истода, Polyqala tenuifolia Willd., Polyqata sibirica L. или Yuanzhi), Buthus martensii (высушенное тело скорпиона или Quanxie), Rhizoma acori Tatarinowii (корневище вира травянистого или Shichangpu), Eupolyphaqa Seu Seteleophaga (высушенное тело жужелицы, Eupolyphaga sinensis Walker, Steleophaga plancyi или Tubiechong), Calculus Bovis Artifactus (природный или искусственный безоар коровы или Rengonq Niuhuang) и Cornu Saigae Tataricae (рог антилопы или Lingyangjiao), и комбинаций перечисленных компонентов, для получения лекарственного средства для стимуляции разрастания нейронов и пролиферации нервных клеток или стволовых клеток в тканях центральной или периферической нервной системы.
В одном варианте реализации, указанная композиция дополнительно содержит второй компонент, выбранный из группы, состоящей из: Radix Astragali (корня астрагала сладколистного перепончатого или Huang Qi), Radix Paeoniae Rubra (корня красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Lynch или Chi Shao), корневища лигустикума чуаньсионского (Chuan Xionq), цветка сафлора красильного (сафлора или HonqHua), radix angelicae sinensis (корня аралии китайской или DanGui) и высушенных тел пиявок (Hirudo, Whitmania pigra Whitman, Hirudo nipponica Whitman Whitmania acranulata Whitman или Shuizhi), и комбинаций перечисленных компонентов.
Указанное лекарственное сродство стимулирует разрастание нейронов и пролиферацию нервных клеток или стволовых клеток в поврежденных или пораженных болезнью тканях, которые могут встречаться у пациентов, которые имеют любое из следующих заболеваний: боковой амиотрофический склероз (ALS), абсцесс мозга, ишемия мозга, связанная с диабетом атрофия мозга, церебральная аутосомно-доминантная артериопатия с подкорковыми инфарктами и лейкоэнцефалопатией (CADASTL), цереброваскулярные расстройства, кортикобазальная ганглиозная дегенерация (CBGD), хроническая ишемия, синдром Крейцфельда-Якоба, синдром Денди-Уокера, миодистрофия Дюшенна, старческое слабоумие, деменция, связанная с синдромом приобретенного иммунодефицита (AIDS), энцефаломиелит, эссенциальный тремор, атаксия Фридрейха, болезнь Герстманна-Штройслера-Шейнкера, болезнь Хантингтона, гидроцефалия, гипоксия, семейная фатальная инсомния, преходящее нарушение мозгового кровообращения, куру, синдром Ландау-Клеффнера, болезнь с тельцами Леви, болезнь Мачадо-Джозефа, бактериальный и вирусный менингит, сопутствующие мигрени расстройства, миелит, оливомостомозжечковые атрофии, ассоциированная с пантотенаткиназой нейродегенерация, полиомиелит, постполиомиелитный синдром, прионные болезни, ложная опухоль головного мозга, синдром Шая-Дрейджера, инфантильные спазмы, прогрессирующий надъядерный паралич, болезнь Штейнерта, сирингомислия, таламические синдромы, тикозные расстройств, синдром Туретта и синдром увеоменингоэнцефалита.
Указанную композицию также можно применять для лечения пациентов, страдающих от патологического состояния, выбранного из группы, состоящей из психических симптомов, таких как тревожные расстройства, шизофрения, депрессия и послеродовая депрессия; естественного старения, травматической гибели клеток головного мозга и других неврологических проявлений, таких как амнезия, боль в пояснице, головокружение, потеря сознания, ложное ощущение ампутированной конечности, расстройства обоняния, боль в тес, головная боль, мигрени, судорога и расстройства речи.
В другом варианте реализации, указанная композиция может уменьшать последствия инсульта или нейродегенерации у предрасположенных к этому субъектов или субъектов, для которых существует риск возникновения инсульта или нейродегенерации. Нейродегенерация может вызываться заболеваниями у предрасположенных к этому субъектов, выбранными из группы, состоящей из: болезни Альцгеймера, бокового амиотрофического склероза (ALS), абсцесса мозга, ишемии мозга, связанной с диабетом атрофии мозга, церебральной аутосомно-доминантной артериопатии с подкорковыми инфарктами и лейкоонцефалопатией (CADASIL), цереброваскулярных расстройств, кортикобазальный ганглиозной дегенерации (CBGD), хронической ишемии, синдрома Кройцфельда-Якоба, синдрома Денди-Уокера, миодистрофии Дюшенна, старческого слабоумия, деменции, связанной с синдромом приобретенного иммунодефицита (AIDS), энцефаломиелита, эссенциального тремора, атаксии Фридрейха, болезни Герстманна-Штройслера-Шейнкера, болезни Хантингтона, гидроцефалии, гипоксии, семейной фатальной инсомнии, преходящего нарушения мозгового кровообращения, куру, синдрома Ландау-Клеффнера, болезни с тельцами Леви, болезни Мачадо-Джозефа, бактериального и вирусного менингита, сопутствующих мигрени расстройств, миелита, оливомостомозжечковых атрофии, ассоциированной с пантотенаткиназой нейродегенерации, болезни Паркинсона, полиомиелита, постполиомиелитного синдрома, прионных болезней, ложной опухоли головного мозга, синдрома Шая-Дрейджера, болезни Штейнерта, инфантильных спазмов, прогрессирующего надъядерного паралича, сирингомиелии, таламических синдромов, тикозных расстройств, синдрома Туретта, синдрома увеоменингоэнцефалита, генерализованной и очаговой ишемии, и других сердечно-сосудистых заболеваний.
Предполагается, что NeuroAid(или подобную NouroAid(композицию (например, композицию, описанную ниже) можно применять в комбинации с доступными дополнительными агентами, которые могут оказаться полезными для общего состояния нейронов или для лечения различных заболеваний нервной системы и других дегенеративных заболеваний. Указанные дополнительные агенты могут представлять собой витамины, минеральные добавки, травяные добавки, рыбий жир и лекарственные средства западной медицины. Как правило, указанный дополнительный агент, используемый в комбинации с NeuroAid(или подобной NeuroAid(композицией, представляет собой такой агент, который нацелен на механизм, отличный от механизма на который направлено действие NeuroAid(или подобной NeuroAid(композиции. Например, лекарственные средства западной медицины могут представлять собой факторы роста, обычно используемые для улучшения способности к выздоровлению у пациентов, страдающих от дегенеративных заболеваний. Примеры подходящих агентов, применяемых в лекарственных средствах западной медицины, включают блокаторы кальциевых каналов (D-600, дилтиазем, нитрендипин, нимодипин, нифедипин, флунаризин, флуспирилен, исрадипин, никардипин, PY 108-068, верапамил и трианамил), хелаторы кальция (DP-b99), акцепторы свободных радикалов (эбселен, тирилазад, NXY-059), агонисты ГАМК-рецепторов (диазепам, баклофен), агонисты АМПК (ZK 200775/ MPQX), конкурентные антагонисты НМДА (аптиганель/церестат, СР 101,606, декстрофан, МК 801 / дизоцилпин, ремацемид), антагонисты глицинового сайта (GV 150526, ACEA 1021), антагонисты полиаминового сайта (элипродил), факторы роста (bFGF), блокаторы натриевых каналов (фосфснитоин, 639С89), открыватель калиевых каналов (BMS 204352, кромакалим, левкромакалим, априкалим, пинацидил, диазоксид, никораидил, миноксидил), пирацетам, ингибитор транспорта адснозипа (пропентофиллин), ганглиозиды GM (антагонист рецепторов, не относящихся к НМДА), ингибиторы пресинантического высвобождения глутамата, клазосонтан, десмотеплазу, випринекс (анкрод), тенектеплазу (ТНКазу; метализу), алтеплазу, циклические нитроны, рецептор TWEAK (TNF-подобного слабого индуктора апоптоза), тромболитические лекарства (урокиназу, стрептокиназу, t-PA / тканевой активатор плазминогена или рекомбинантную урокиназу), анистреплазу, рилузол и дисуфентон натрия (NXY 059), кандесартан, AX-200 (G-CSF, филграстим), кофеинол (кофеин+этанол), энекадин, микроплазмин, сонолизис + tPA, V-10153, HTUPA, солюлин, пиклозотан, S-0139, S-18986, AEOL-10150, AL-208, KN-38-7271, пиридоксаль-5'-фосфат, Neu-2000KL, ONO-2231, PCX-100, RVX-208, SUN-N4057, SUN-N8075, TAT-NR2 В9 с, терапию экспрессирующими GLP-1 стволовыми клетками, Msc-1 (SA-4503, AGY-94806)), NH-02D, S-0139 259, -тканепротективные цитокины (Lu-AA24493), V10153 270 (ВВ-10153, TAPqen), комбинированное применение статинов и других снижающих уровень холестерина лекарственных средств, эритропоэтин, церебролизин и CDP-холин (цитидин-5'-дифосфохолин).
Предложен способ индукции пролиферации или дифференцировки клеток, включающий приведение во взаимодействие указанных клеток с эффективным количеством по меньшей мере одного из следующих компонентов: Radix Astragali (корень астрагала сладколистного перепончатого или Huang Qi), Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Radix Paeoniae Rubra (корень красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Lynch или Chi Shao), корневище лигустикума чуаньсионского (Chuan Xiong), radix angelicae sinensis (корень аралии китайской или DanGui), цветок сафлора красильного (сафлор или HongHua), Prunus Persica (семя персика или Taoren), Radix Polygalac (корень тонколистного истода, Polygala tenuifolia Willd., Polyqala sibirica L. или Yuanzhi), Buthus martensii (высушенное тело скорпиона или Quanxie), Rhizoma acori Tatarinowii (корневище вира травянистого или Shichangpu), высушенные тела пиявок (Hirudo, Whitmania piqra Whitman, Hirudo nipponica Whitman, Whitmania acranulata Whitman или Shuizhi), Eupolyphaga Seu Seteleophaga (высушенное тело жужелицы, Eupolyphaqa sinensis Walker, Steleophaqa plancyi или Tubiechong), Calculus Bovis Artifactus (природный или искусственный безоар коровы или Rengong Niuhuang) и Cornu Saigae Tataricae (рог антилопы или Lingyangjiao).
Указанная композиция может способствовать росту клеток или выживаемости клеток, может облегчать культивирование in vitro различных клеток, которые можно использовать для тканевой инженерии или терапевтических применений ex vivo. В одном варианте реализации, пациенту, получающему культивированные клетки, также следует вводить NeuroAid™.
NeuroAid(и аналогичные композиции
Описанные выше ингредиенты могут присутствовать в указанной композиции в относительно неочищенной форме (например, в виде необработанных или измельченных трав) или в более переработанной форме (например, в виде очищенных экстрактов).
В одном варианте реализации, используют NeuroAid(от Moleac Pte Ltd. NeuroAid(представляет собой продукт традиционной китайской медицины (ТКМ) в форме капсулы, содержащий 9 травяных компонентов и 5 компонентов животного происхождения. NeuroAid(содержит Radix Astragali (корень астрагала сладколистного перепончатого или Huang Qi), Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Radix Paeoniae Rubra (корень красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Lynch или Chi Shao), корневище лигустикума чуаньсионского (Chuan Xionq), radix angelicae sinensis (корень аралии китайской или DanGui), цветок сафлора красильного (сафлор или HonqHua), Prunus Persica (семя персика или Taoren), Radix Polyqalae (корень тонколистного истода, Polygala tenuifolia Willd., Polygala sibirica L. или Yuanzhi), Rhizoma acori Tatarinowii (корневище вира травянистого или Shichanqpu), Buthus martensii (высушенное тело скорпиона или Quanxie), высушенные тела пиявок (Hirudo, Whitmania pigra Whitman, Hirudo nipponica Whitman, Whitmania acranulata Whitman или Shuizhi), Eupolyphaqa Seu Seteleophaqa (высушенное тело жужелицы, Eupolyphaga sinensis Walker, Steleophaga plancyi или Tubiechong), Calculus Bovis Artifactus (природный или искусственный безоар коровы или Renqonq Niuhuanq) и Cornu Saiqae Tataricae (рог антилоны или Lingyangjio).
В другом варианте реализации, NeuroAid II содержит Radix Astraqali (корень астрагала сладколистного перепончатого или Huanq Qi), Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Radix Paeoniae Rubra (корень красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Lynch или Chi Shao), корневище лигустикума чуаньсионского (Chuan Xionq), radix anqelicae sinensis (корень аралии китайской или DanGui), цветок сафлора красильного (сафлор или HonqHua), Prunus Persica (семя персика или Taoren), Radix Polyqalae (корень тонколистноро истода, Polygala tenuifolia Willd., Polygala sibirica L. или Yuanzhi) и Rhizoma acori Tatarinowii (корневище вира травянистого или Shichanqpu). NeuroAid™, который может быть зарегистрирован под различными названиями в различных странах (например, в Южной Африке он реализуется под названием Strocaid™ или Danqi Piantan Jiaonanq™), производится и доступен для приобретения в Китайской Народной Республике у фармацевтической группы Tianjin Shitian Pharmaceutical Group Co., Ltd (расположенной в промышленной зоне Jianxin, административный центр Wangwenzhuang, округ Xiqing, город Тяньцзинь, Китай; почтовый индекс 300381;). Он также доступен для приобретения у Moleac Pte Ltd (бывшей Molecular Acupuncture Pte Ltd), основного лицензиата за пределами Китайской Народной Республики (трасса Biopolis, 11, Helios #09-08, Сингапур 138667).
Во избежание сомнений, NeuroAid™ включает не только NeuroAid™ в той форме, в которой он реализуется на сегодняшний день, но также включает будущие лекарственные формы NeuroAid™, которые, например, могут реализовываться Tianjin Shitian Pharmaceutical Group Co., Ltd, или Moleac Pte Ltd. Такие будущие лекарственные формы, например, могут отличаться дозировками или концентрацией активных ингредиентов и т.д. NeuroAid™ также известен под названием MLC 601, и термины "NeuroAld™" и "MLC 601" можно использовать взаимозаменяемо. Аналогично, NeuroAid II также известен под названием MLC 901, и термины "NeuroAid II" и "MLC 901" можно использовать взаимозаменяемо.
Нейропротекторы
Нейропротекторы представляют собой соединения, которые, с использованием различных механизмов, защищают нервную ткань, которая может погибнуть в течение болезни, что может привести к нежелательной нейродегенерации. Некоторые нейропротекторные агенты включают антиоксиданты (например, селен, витамин F, витамин С, глутатион, цистеин, флавоноиды, хинолины, ферменты с восстановительной активностью и т.д.), антагонисты рецептора N-мстил-D-аспартата (декстрорфан, селфотел, магний), антагонист наркотических рецепторов (налмефен (цервен), блокаторы кальциевых каналов, модуляторы натриевых каналов (лубелузол), агонист альфа-аминомасляной кислоты (клометиазол), модуляторы глутаматных рецепторов, агонисты серотонинового рецептора (репинотан), фосфолипиды, акцептор свободных радикалов (тирилазад и NXY-059), ингибитор активации астроцитои (ONO 2506), моноклональные антитела, такие как антитело против ICAM-1 (Энлимомаб), противолейкоцитарное антитело человека, Hu23F2G, стабилизирующий мембрану агент CDP-холин (цитихолин), фактор роста фибробластов (фибласт), ненасыщенные и полиненасыщенные жирные кислоты, острогоны и избирательные модуляторы эстрогенных рецепторов (SEAMS), прогестины, тиреоидный гормон и имитирующие тиреоидный гормон соединения, циклоспорин A и его производные, талидомид и его производные, метилксантины, ингибиторы моноаминоксидазы (IMAO), блокаторы захвата серотонина, норадреналина и дофамина, агонисты дофамина I, L-DOPA, никотин и его производные и модуляторы NO-синтазы.
Факторы роста
Факторы роста представляют собой соединения, которые, с использованием различных механизмов, вызывают дифференцировку или пролиферацию определенных клеток. Некоторые факторы роста включают белки морфогенеза костной ткани (BMP), эпидермальный фактор роста (EGF), эритропоэтин (EPO), фактор роста фибробластов (FGF), колониестимулирующий фактор гранулоцитов (G-CSF), колоний стимулирующий фактор гранулоцитов-макрофагов (GM-CSF), факторы роста гепатоцитов (HGF), инсулиноподобный фактор роста (IGF), миостатин (GDF-8), фактор роста нервов (NGF), нейротропины, тромбоцитарный фактор роста (PDGF), тромбопоэтин (ТРО), трансформирующий фактор роста альфа (TGF-α), трансформирующий фактор роста бета (TGF-β), фактор роста эндотелия сосудов (VEGF), интерлейкин-1β (IL-1β), IL-2, IL-3, IL-4, IL-6, IL-7, IL-8, IL-21, IL-33, M-CSF, ноггин (Noqqin), инторфероны (IFN)-α, IFN-β и IFN-γ.
Соединения, активирующие калиевые каналы TREK-1
Другие подходящие агенты, применяемые в лекарственных средствах западной медицины, включают соединения, способные активировать калиевые каналы TREK-1. Было обнаружено, что активация TREK-1 уменьшает последствия инсульта или нейродегенерации у предрасположенных к этому субъектов или субъектов, для которых существует риск инсульта или нейродегенерации. Кроме того, было показано, что TREK-1 играет важную роль при лечении пациентов с больными или поврежденными тканями центральной или периферической нервной системы, а также пациентов, страдающих от депрессии, психических симптомов, естественного старения и травматической гибели клеток головного мозга. Так как NeuroAid® не активирует калиевые каналы TREK 1, в комбинации с NeuroAld™ (MLC 601) можно применять соединения, которые способны активировать калиевые каналы TREK-1, чтобы уменьшить последствия инсульта или нейродегенерации и лечить пациентов с больными или поврежденными тканями центральной или периферической нервной системы, а также пациентов, страдающих от депрессии, психических симптомов, естественного старения и травматической гибели клеток головного мозга.
Один пример соединения, которое способно активировать калиевые каналы TREK-1, представляет собой полиненасыщенные жирные кислоты (ПНЖК). Полиненасыщенные жирные кислоты представляют собой жирные кислоты, которые содержат более чем одну двойную связь. ПНЖК можно классифицировать как метиленразделенные полиены или конъюгированные жирные кислоты.
Метиленразделенные полиены представляют собой жирные кислоты, которые содержат две или более цис-двойных связей, которые отделены друг от друга одной метиленовой группой. Незаменимые жирные кислоты представляют собой все омога-3 и -6 метиленразделенные жирные кислоты. Примеры омега-3 жирных кислот включают, без ограничения: альфа-линоленовую кислоту (ALA), стеаридоновую кислоту (STD), эйкозатриеновую кислоту (ЕТЕ), эйкозатетраеновую кислоту (ЕТА), эйкозапентаеновую кислоту (ЕРА), докозапентаеновую кислоту (DPA), докозагексаеновую кислоту (DHA), клупанодоновую кислоту, тетракозапентаеновую кислоту, тетракозагексаеновую кислоту или низиновую кислоту. Примеры омога-6 жирных кислот включают, без ограничения: линолевую кислоту (LIN), гамма-линоленовую кислоту (СТЛ), эйкозадиеновую кислоту, дигомо-гамма-линоленовую кислоту (DGLA), арахидоновую кислоту (AA), докозадиеновую кислоту, адреновую кислоту, докозапентаеновую кислоту или кислоту Осбонда. Омега-9 жирные кислоты также представляют собой метиленразделенные полиены, и могут быть мононасыщенными или полинасыщенными. Примеры омега-9 жирных кислот включают, без ограничения: олеиновую кислоту, эйкозеновую кислоту, кислоту Мида, эруковую кислоту или нервоновую кислоту.
Конъюгированные жирные кислоты представляют собой жирные кислоты, которые содержат две или более конъюгированных двойных связей. Примеры конъюгированных жирных кислот включают, без ограничения: руменовую кислоту, α-календовую кислоту, β-календовую кислоту, якаровую кислоту, α-элеостеариновую кислоту, β-элеостеариновую кислоту, катальповую кислоту, пунициновую кислоту, румеленовую кислоту, α-паринаровую кислоту, β-паринаровую кислоту, боссеопентановую кислоту.
Некоторые другие ПНЖК, которые не принадлежат к категории метиленразделенных полиенов или конъюгированных жирных кислот, включают, без ограничения: пиноленовую кислоту и подокарновую кислоту.
Другие соединения, которые могут оказаться способными активировать калиевые каналы TREK-1, включают лекарственное средство Рилузол (Рилутек®), лизофосфолипиды (LPL), эфиры кофеиновой кислоты и ксенон. Данные соединения также можно применять в комбинации с NeuroAid™ (MLC 601) для уменьшения последствий инсульта или нейродегенерации и лечения пациентов с больными или поврежденными тканями центральной или периферической нервной системы и пациентов, страдающих от депрессии, психических симптомов, естественного старения и травматической гибели клеток головного мозга.
Способы введения
NeuroAid™ (MLC 601) можно вводить перорально, парентерально, внутривенно, подкожно, внутрикожно, интраперитонеально или топически, в жидкой, полужидкой или твердой форме, и они входят в состав лекарственной формы, подходящей для каждого пути введения. Если NeuroAid™ (MLC 601) вводят перорально, его можно вводить в виде четырех капсул по 0,4 г три раза в день. Для пациентов с нарушениями глотания, капсулы можно вскрыть и разбавить порошок водой, а затем выпить как есть или инъецировать через желудочный зонд. Следовательно, предусмотрена ежедневная доза в количестве приблизительно 4,8 г. В одном варианте реализации, ежедневная доза NeuroAid™ (MLC 601) для пациента составляет приблизительно от 1 г до 8 г; от 2 г до 8 г; от 3 г до 7 г; от 4 г до 6 г; от 4,25 г до 5,75 г; от 4,5 г до 5,25 г; от 4,5 г до 5 г; от 4,6 г до 4,10 г; или от 4,7 г до 4,9 г. "Ежедневную дозу" можно вводить в определенный день в виде одной таблетки или капсулы и т.д., или в виде множества таблеток или капсул и т.д.
В одном варианте реализации, каждый курс лечения NeuroAid™ (MLC 601) длится приблизительно 4 недели. Обычно проводят 3 курса лечения, чаще всего непосредственно следующее друг за другом. В терапевтическом окне необходимости нет, но можно добавить дополнительные курсы даже по прошествии нескольких дней после остановки лечения. Таким образом, в одном варианте реализации, каждый курс лечения NeuroAid™ (MLC 601) длится приблизительно 12 недель. В другом варианте реализации, курс лечения NeuroAid™ (MLC 601) длится приблизительно от 4 до 24 недель; от 7 до 16 недель; от 9 до 15 недоль; от 10 до 14 недель; или от 11 до13 недель.
В другом варианте реализации, NeuroAid™ (MLC 601) также можно применять в качестве постоянного лекарства для лечения хронического заболевания или в качестве профилактической меры.
В одном варианте реализации, NeuroAid™ (MLC 601) можно применять как часть комбинированной терапии вместе с лекарственными средствами западной медицины, которые способствуют росту клеток. Партнеры NcuroAid™ (MLC 601) но комбинированной терапии и фактор роста клеток могут находиться в единой лекарственной форме или могут находиться в отдельных лекарственных формах. В одном варианте реализации, может наблюдаться синергичное действие.
Средства, используемые совместно с NeuroAid™ (MLC 601) в комбинированной терапии и факторы роста клеток можно вводить пациенту в то же время (например, одновременно) или в различные моменты времени (например, последовательно) и на протяжении различных периодов времени, которые могут быть отделены друг от друга или могут перекрываться. Партнеры NeuroAid™ (MLC 601) по комбинированной терапии и фактор роста клеток можно вводить в любом порядке.
Случаи, когда используют фактор роста клеток, и подходящий путь введения и уровень дозы должны быть известны специалистам в данной области, или специалист в данной области сможет легко определить их. Обычно, что хорошо известно в области медицины, схема приема лекарственного средства может зависеть от различных факторов, включая размер пациента, площадь поверхности тела, возраст, конкретное соединение, которое нужно вводить, пол, время и путь введения, общее состояние здоровья и наличие других вводимых одновременно лекарственных средств. Несмотря на то, что индивидуальные нужды варьируются, определение оптимальных диапазонов эффективных количеств каждого компонента находится в рамках компетенции в данной области. Дозировка будет аналогичной таковой, которую вводят, когда указанный агент применяют без NeuroAid™ (MLC 601).
Краткое описание фигур
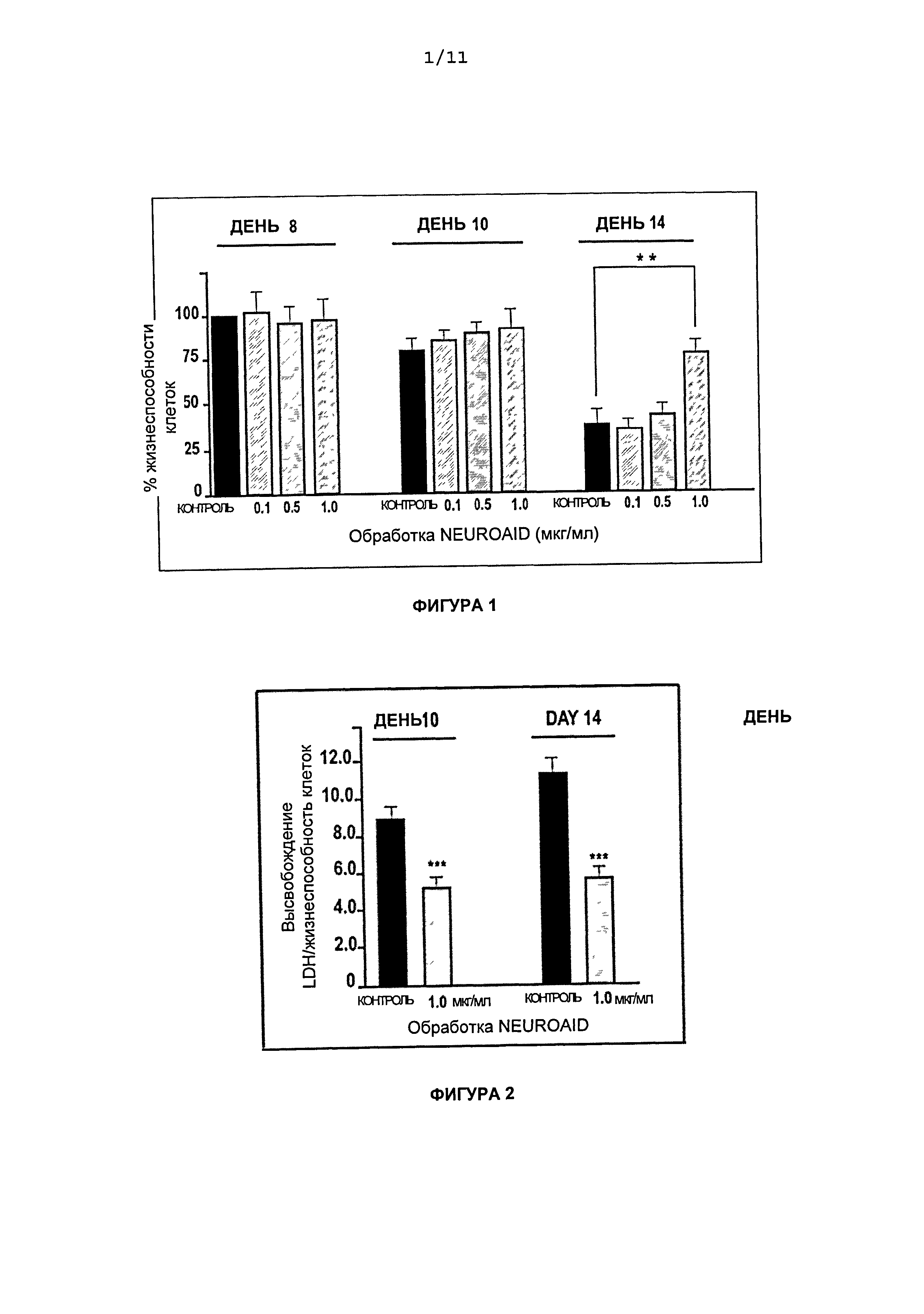
На Фиг.1 приведены графики влияния доз NeuroAid™ (MLC 601) на жизнеспособность клеток в день 8, день 10 и день 14. Три концентрации NeuroAid™ (MLC 601) (0,1, 0,5, 1,0 мкг/мл) сравнивали с контролем.
На Фиг.2 приведены графики влияния доз NeuroAid™ (MLC 601) на высвобождение лактатдегидрогеназы (LDH) в день 10 и день 14. Концентрацию NeuroAid™ (MLC 601) 1,0 мкг/мл сравнивали с контролем.
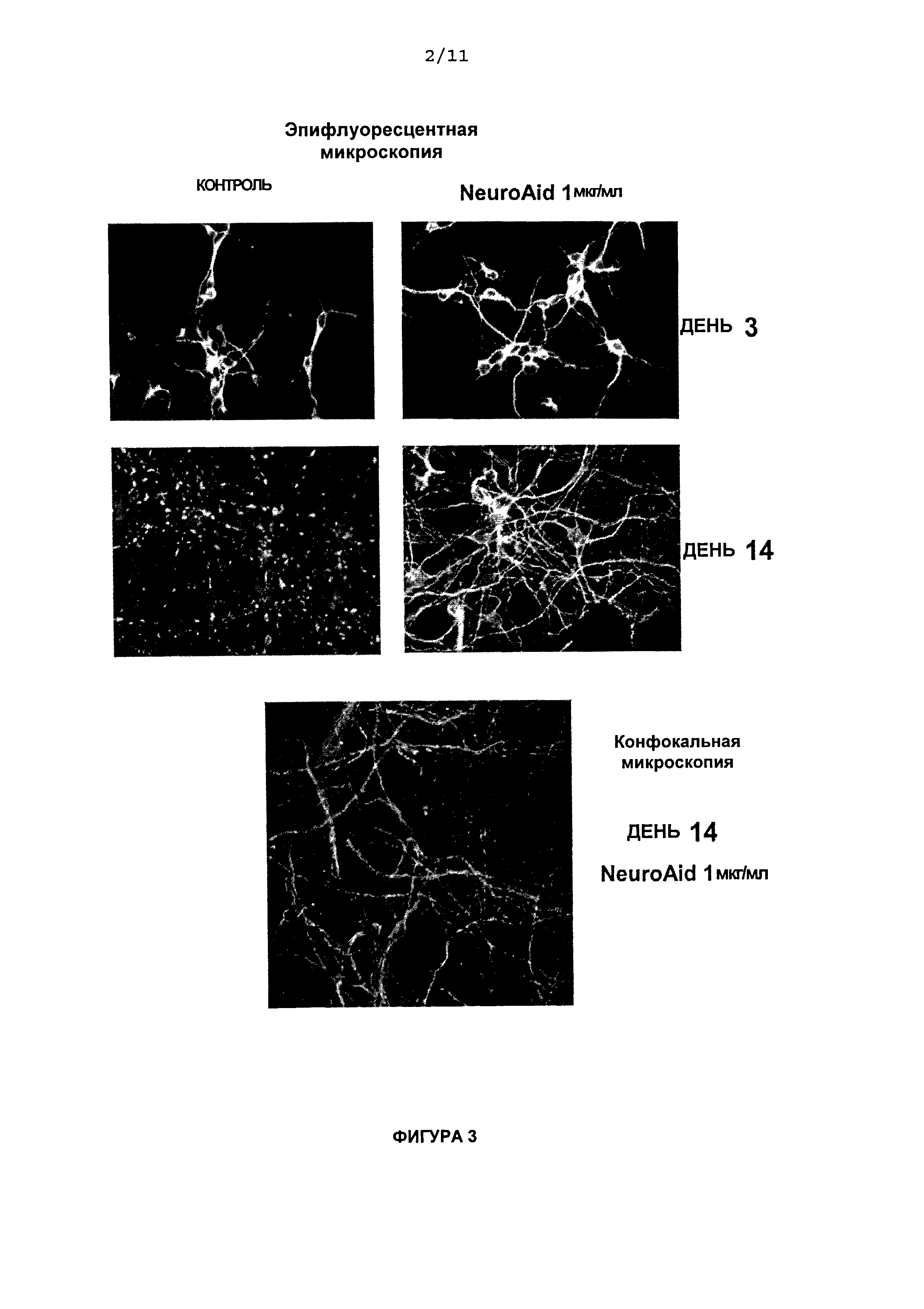
На Фиг.3 приведены конфокальные изображения влияния обработки NeuroAid™ (MLC 601) на экспрессию нейронального даблкортина (DCX) в день 3 и день 14. Концентрацию NeuroAid™ (MLC 601) 1,0 мкг/мл сравнивали с контролем.
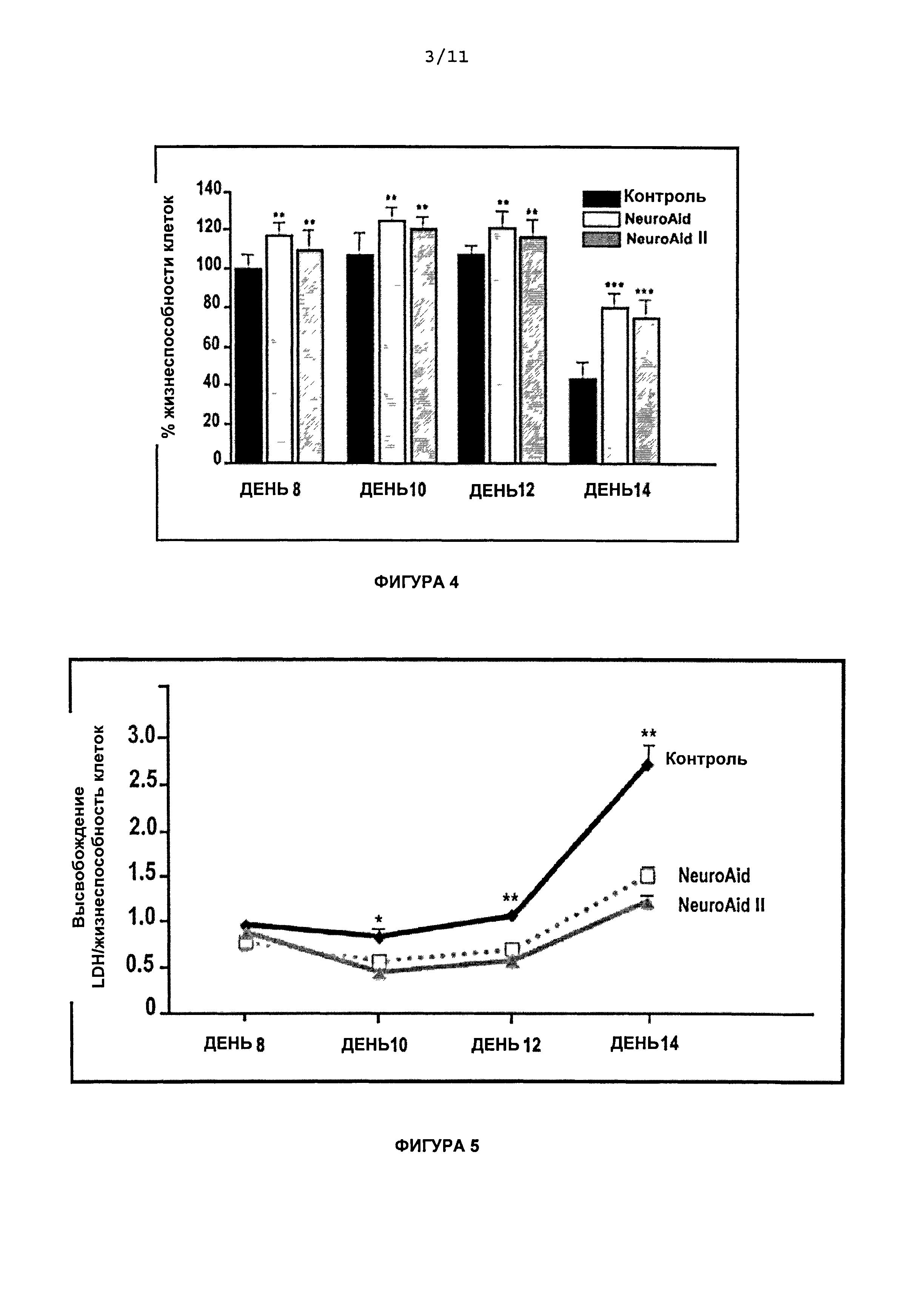
На Фиг.4 приведены графики влияния обработки NeuroAid™ (MLC 601) и NeuroAid II (MLC 901) на жизнеспособность клеток в день 8, день 10, день 12 и день 14. Концентрацию NeuroAid™ (MLC 601) 1,0 мкг/мл и концентрацию NeuroAid II (MLC 901) 1,0 мкг/мл сравнивали с контролем.
На Фиг.5 приведен линейный график влияния обработки NeuroAid™ (MLC 601) и NeuroAid II (MLC 901) на высвобождение LDH в день 8, день 10, день 12 и день 14. Концентрацию NeuroAid™ (MLC 601) 1,0 мкг/мл и концентрацию NeuroAid II (MLC 901) 1,0 мкг/мл сравнивали с контролем.
На Фиг.6 приведены конфокальные изображения влияния обработки NeuroAid™ (MLC 601) и NeuroAid II (MLC 901) на экспрессию DCX в день 3 и день 14. Концентрацию NeuroAid™ (MLC 601) 1,0 мкг/мл и концентрацию NeuroAid II (MLC 901) 1,0 мкг/мл сравнивали с контролем.
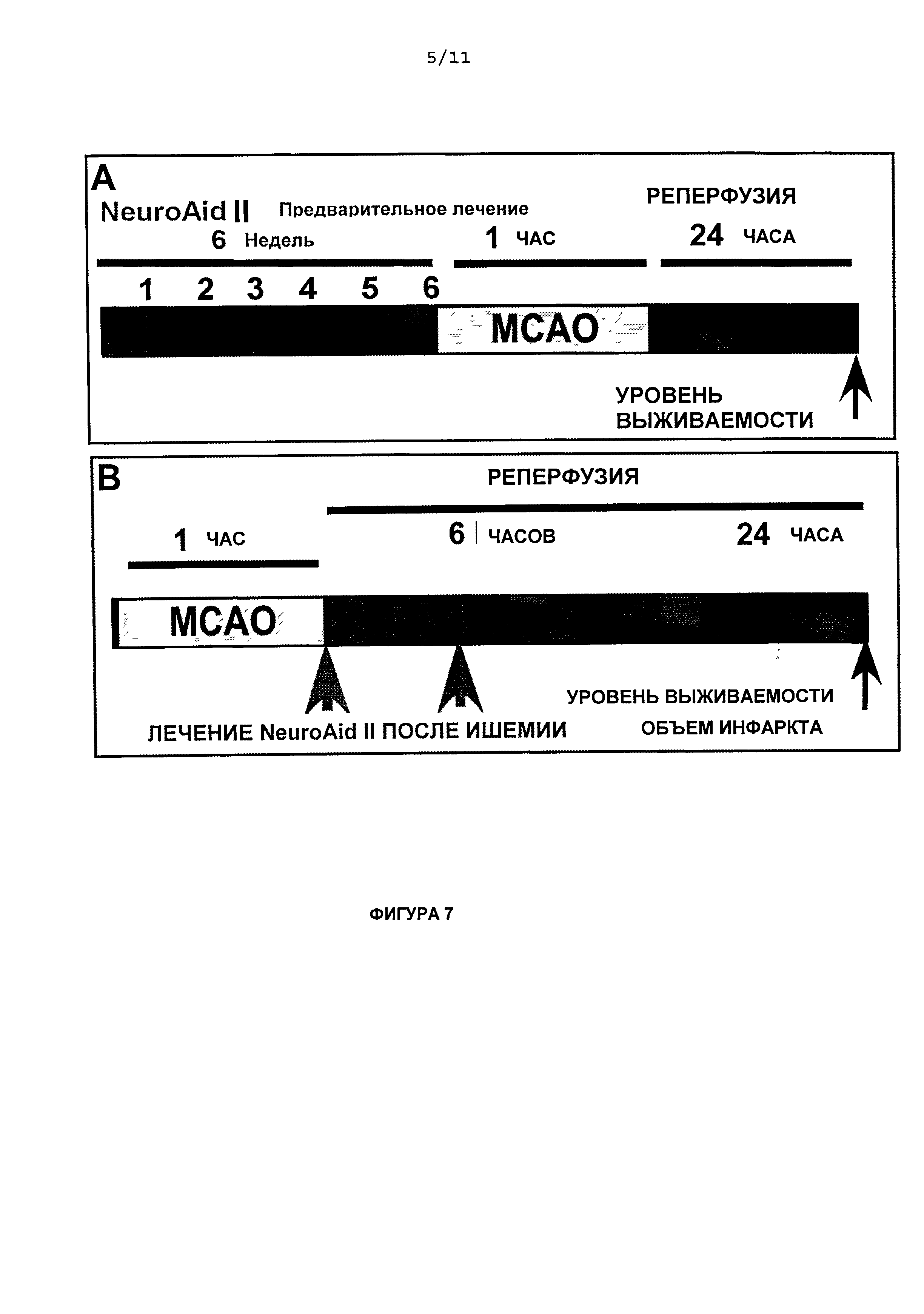
На Фиг.7 приведены схематические диаграммы протоколов экспериментов по лечению инсульта с помощью NeuroAid II (MLC 901). На Фиг.7А показан протокол эксперимента из Примера 4, в котором исследуется эффект лечения NeuroAid II (MLC 901); на Фиг.7В показан протокол эксперимента из Примера 5, в котором исследуется эффект неотложного лечения NeuroAid II (MLC 901). В обоих исследованиях оценивают процент выживаемости, а также измеряют объем инфаркта через 24 ч после ишемии.
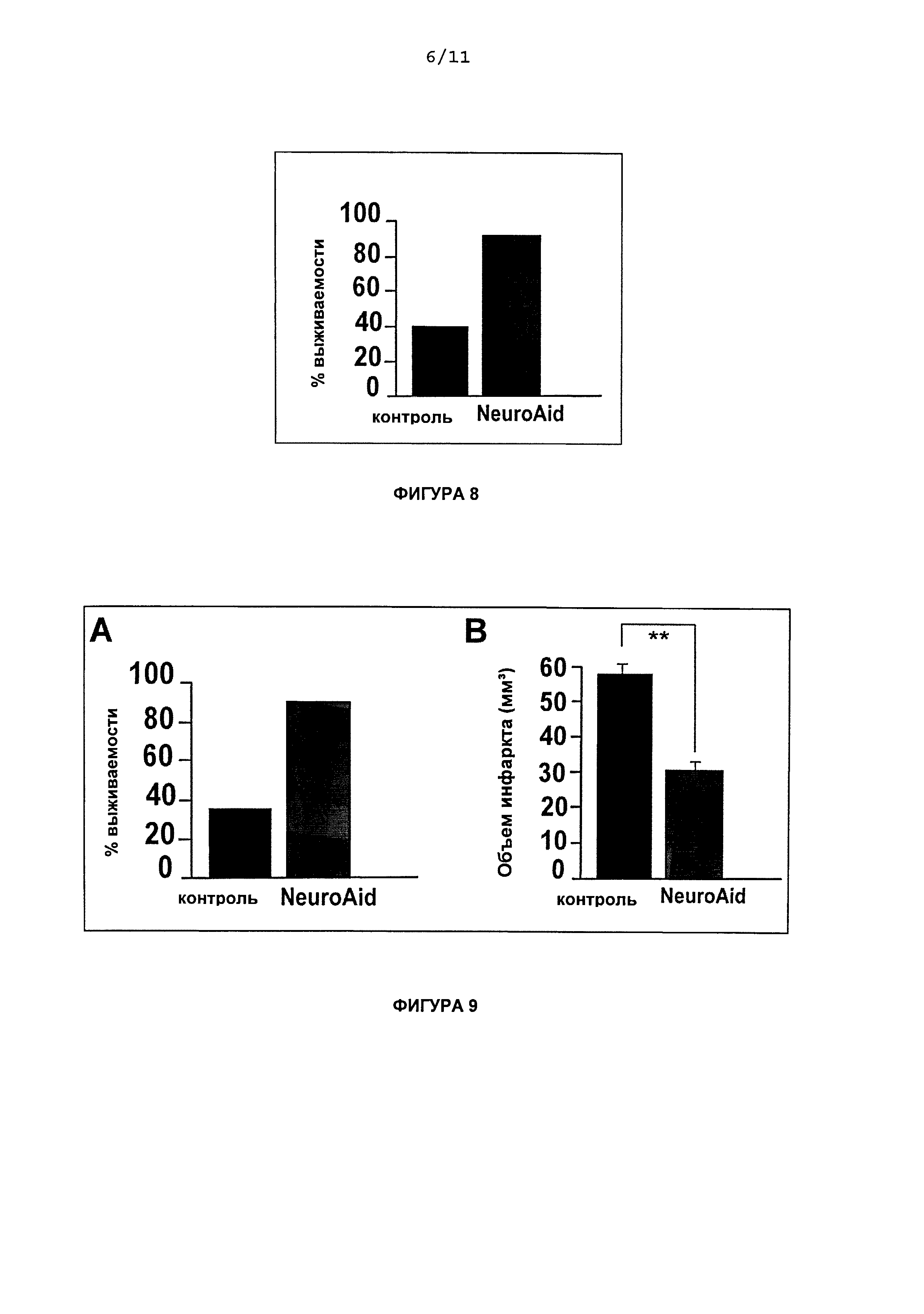
На Фиг.8 приведена график процента выживаемости после предварительного лечения NeuroAid II (MLC 901) через 24 ч после ишемии.
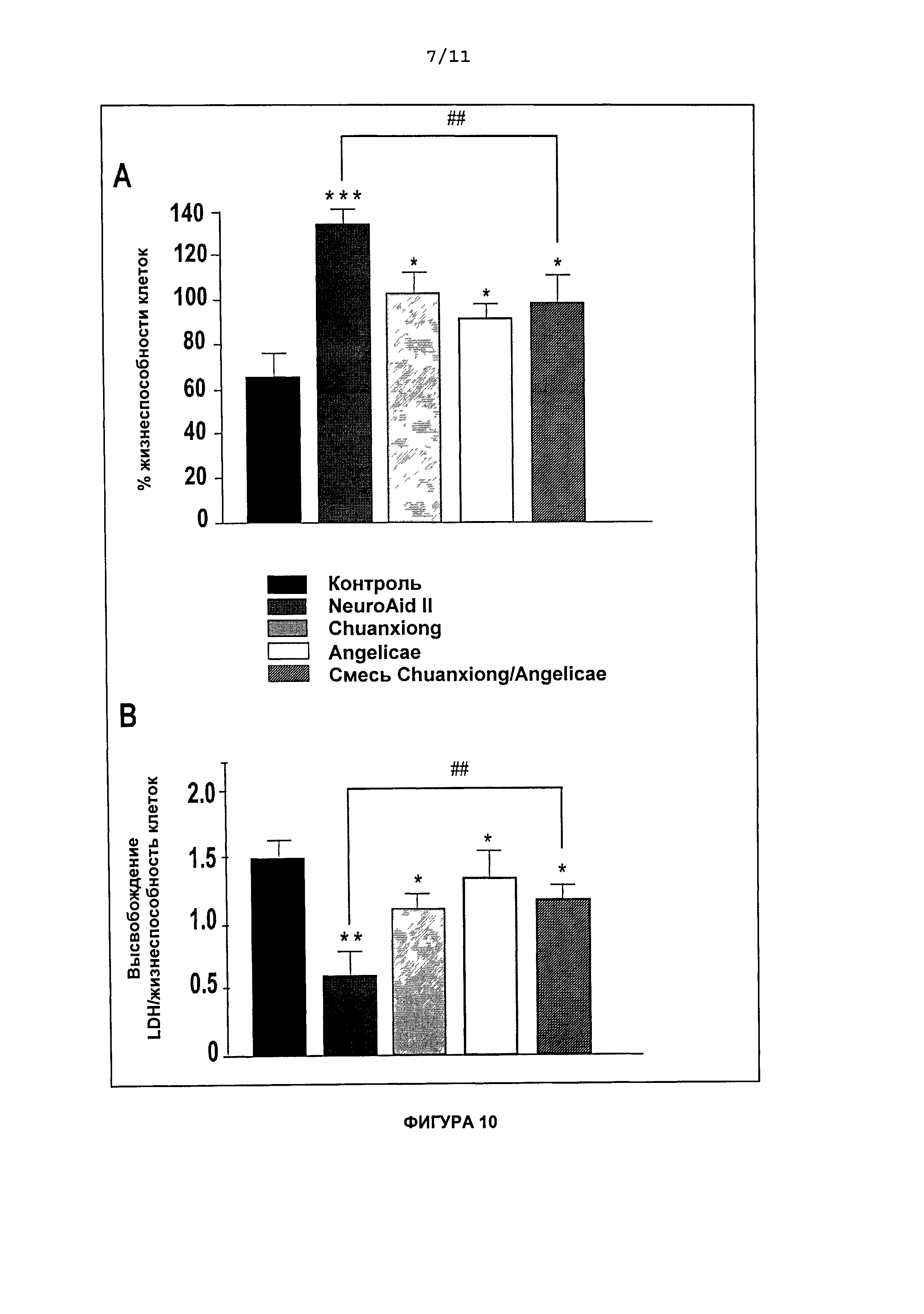
На Фиг.9 приведен график процента выживаемости (A) и объема инфаркта (В) через 24 ч после лечения NeuroAid II (MLC 901) после ишемии.
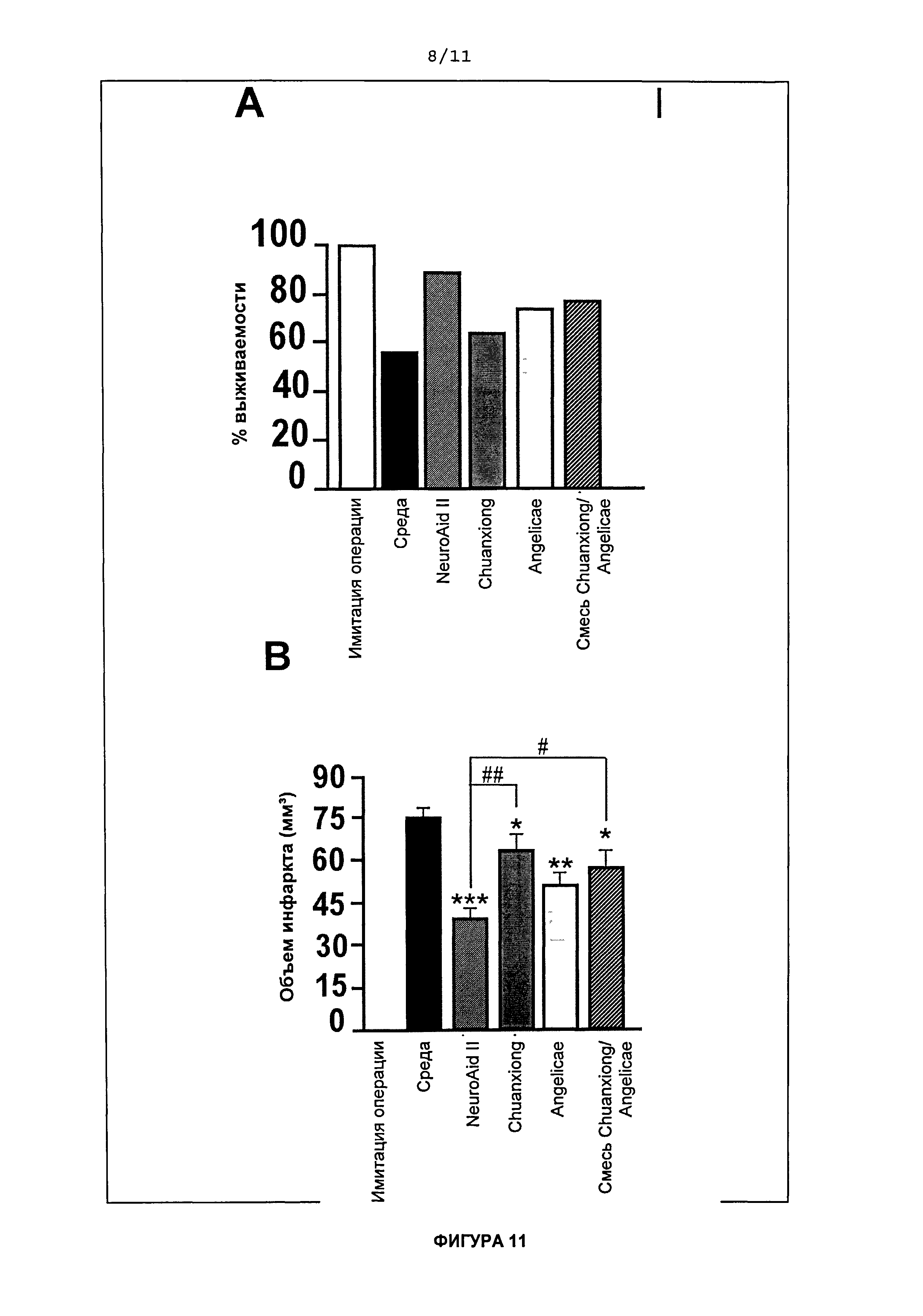
На Фиг.10 приведены графики сравнительной эффективности действия NeuroAid II (MLC 901), Rhizoma chuanxionq Radix anqelicae sinensis и комбинированного действия Rhizoma chuanxionq/Radix anqelicae sinensis (1 мкг/мл) на кортикальные нейроны в культуре, которое оценивали на 12 день обработки. На Фиг.10A показано влияние соответствующих типов обработки на жизнеспособность клеток и на Фиг.10B показано влияние соответствующих типов обработки на высвобождение LDH.
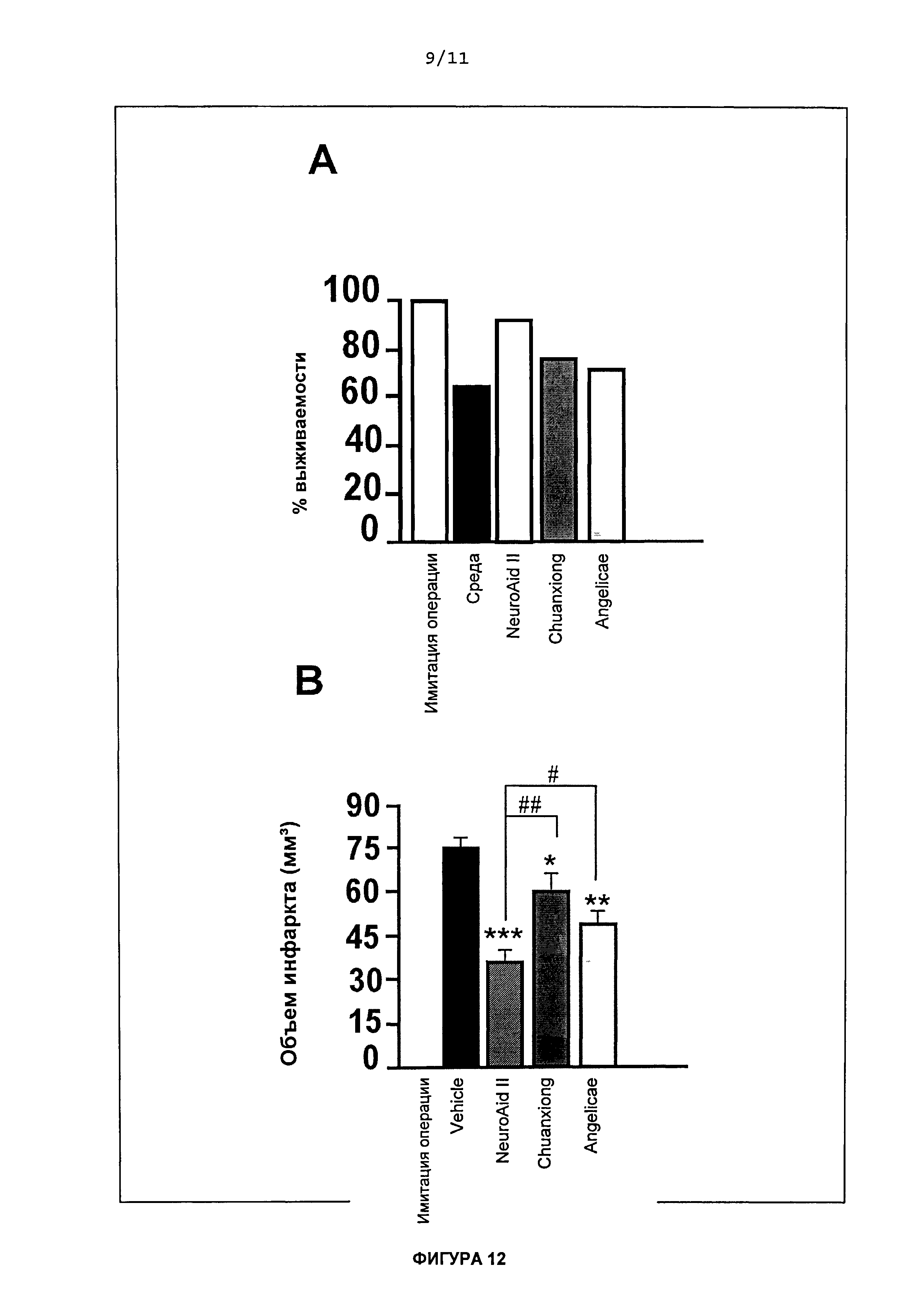
На Фиг.11 приведены графики сравнительной эффективности лечения NeuroAid 11 (MLC 901), Rhizoma chuanxionq, Radix angelicae sinensis и комбинированного лечения Rhizoma chuanxionq/Radix anqelicae sinensis после ишемического повреждения головного мозга in vivo. На Фиг.11A и Фиг.11B показан процент выживаемости (A) и объем инфаркта (B), соответственно.
На Фиг.12 приведены графики сравнительной эффективности предварительного лечения NeuroAid II (MLC 901), Rhizoma chuanxionq и Radix angelicae sinensis ишемического повреждения головного мозга in vivo. На Фиг.12A и Фиг.12В показан процент выживаемости (А) и объем инфаркта (В), соответственно.
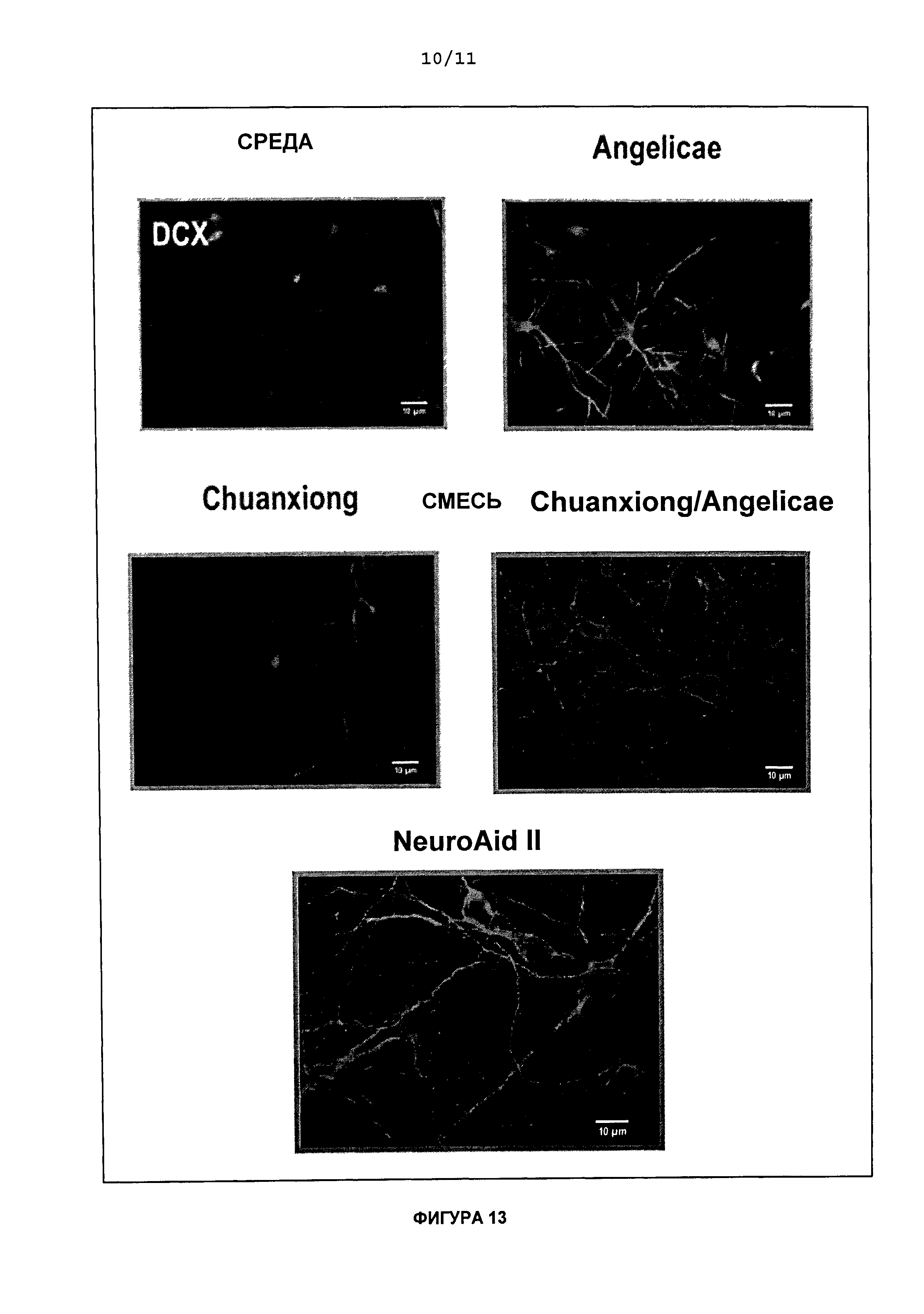
На Фиг.13 приведены типичные фотоснимки эпифлуоресцентной микроскопии сравнительной эффективности действия NeuroAid II (MLC 901), Rhizoma chuanxiong, Radix anqelicae sinensis и комбинированного действия Rhizoma chuanxionq/Radix anqelicae sinensis (1 мкг/мл) на иммуноэкспрессию DCX in vitro в культивируемых кортикальных клетках па 12 день обработки.
На Фиг.14 приведены графики интенсивности сигнала DCX в иммуноокрашенных нейронах, наблюдаемого при эпифлуоресцентной микроскопии.
На Фиг.15 приведены графики разрастания нейритов, полученные путем измерения методом эпифлуоресцентной микроскопии общей длины нейритов (в мкм), в зависимости от видов обработки.
Примеры
Далее более подробно описаны неограничивающие примеры настоящего изобретения на основе конкретных примеров, которые не должны толковаться как каким-либо образом ограничивающие объем настоящего изобретения.
Материалы
Среда, для отбора, кортикальных проб:
- HBSS/1
NaCl 8 г/л
KCl 0,26 г/л
MgSO4 0,2 г/л
CaCl2 0,264 г/л
NaH2CO3 2,24 г/л
NaH2PO4 0,15 г/л в H2O
- HBSS +: добавить 6 г глюкозы
Культуральная среда
Neurobasal (21103-049; Invitrogen, Сан-Диего, Калифорния)
В27 (nº17504; Invitroqen, Сан-Диего, Калифорния)
Уридин (U3003; Siqma, Сент-Луис, Миссури, США)
Фтордезоксиуридин (46875; Fluka-Chemika-Biochemika, Букс, Швейцария)
Glutamax (35050; Gibco-BRL Life Technoloqies. GmbH, Карлсруэ, Германия)
Антибиотики (пенициллин-стрептомицин) (Gibco-BRL Life Technologies. GmbH, Карлсруэ, Германия)
Животные
Вес эксперименты были выполнены и соответствии с правилами законодательства Европейского союза по уходу и использованию лабораторных животных. Внутренний Комитет но этике одобрил описанные эксперименты (номера протоколов NCA/2006/10-1 и NCA/2006/30-2). В настоящем исследовании использовали взрослых самцов мыши С57/Bl6, весящих от 22 до 26 г. Животных поселяли в контролируемых лабораторных условиях с 12-часовым циклом света-темноты, при температуре 21±2ºС и влажности от 60 до 70% на по меньшей мере одну неделю перед введением лекарственного средства или хирургическим вмешательством. Мышам был обеспечен свободный доступ к стандартной пище для грызунов и водопроводной воде.
Питьевой раствор NeuroAid II (MLC 901)
Одну капсулу NeuroAid II (MLC 901) растворяли в 66 мл воды при перемешивании с помощью мешалки в течение одного часа при 37ºС. Полученный раствор затем фильтровали с помощью 0,45 мкм фильтра.
NeuroAid II (MLC 901) для интраперитонеальних инъекций
30 мг из капсулы NeuroAid II (MLC 901) разбавляли is 3 мл солевого раствора, что соответствовало концентрации 10 мг/мл (исходный раствор), при 37ºС в течение 60 мин. Используемая в эксперименте концентрация составляла 1 мкг/мл (инъецируемый объем: 500 мкл). Для получения дозы 1 мкг/мл, исходный раствор разбавляли в 100 раз. После разбавления, смесь встряхивали на вортексе до достижения хорошей гомогенизации и фильтровали через 0,45 мкм фильтр.
Методы
A. КУЛЬТУРА КОРТИКАЛЬНЫХ КЛЕТОК
Мышей C57Bl6/J во время беременности (Е14) анестезировали с помощью изопентана, а затем смещали им шейные позвонки. Эмбрионы удаляли и помещали в холодный раствор HBSS+ (сбалансированный солевой раствор Хенкса). Кору головного мозга разрезали в холодном растворе HBSS+ и удаляли мягкие мозговые оболочки. Кортикальные образцы разрезали на малые кусочки и аккуратно растирали с помощью оплавленной стеклянной пастеровской пипетки в 8 мл раствора HBSS+. Смесь фильтровали (40 мкм фильтр) и центрифугировали при 800 об/мин в течение 8 мин. Супернатант удаляли и осадок растворяли в 2 мл культуральной среды. Клетки высевали на покрытые полилизином 12-луночные планшеты (24 мм в диаметре; Sigma-Aldrich Chimie, Сен-Кантен-Фаллавье, Франция)) со стеклянными покровными стеклами внутри (12 мм в диаметре; CML, Немур, Франция) при плотности 1×106 клеток/лунку. Культуры вели при 37ºС в увлажненном инкубаторе в атмосфере 5% CO2 в среде Neurobasal, дополненной В27, Glutamax, антибиотиками, и использовали для экспериментов через 16 дней. Рост глиальных клеток подавляли путем добавления 5-фтор-2-дезоксиуридина (2 мкМ) и уридина (2 мкМ) во время второго дня культивирования.
В. ОБРАБОТКА NEUROAID™ (MLC 601)
30 мг из капсулы NeuroAid™ (MLC 601) разбавляли в 3 мл среды Neurobasal, что соответствовало концентрации 10 мг/мл (исходный раствор) при 37ºС на протяжении 60 минут. Концентрации, которые тестировали в экспериментах, составляли: 1 мкг/мл или 10 мкг/мл культуральной среды. 1 мл раствора NcuroAid™ (MLC 601) помещали в каждую 24 мм лунку планшета.
Для получения дозы, раиной 1 мкг/мл, исходный раствор разбавляли в 100 раз; 0,1 мг/мл (10 мкл на 24 мм лунку /мл, что соответствовало 1 мкг/лунку).
Для получения лозы, равной 10 мкг/мл, исходный раствор разбавляли в 10 раз: 1 мг/мл (10 мкл на 24 мм лунку /мл, что соответствовало 10 мкг/лунку).
После разбавления, смесь встряхивали на вортексе до достижения хорошей гомогенизации и фильтровали через 0,45 мкм фильтр.
Клетки обрабатывали NeuroAid™ (MLC 601), NeuroAid II (MLC 901) или средой Neurobasal каждый день начиная с 1 дня культивирования.
С. ИЗМЕРЕНИЕ ЛАКТАТДЕГИДРОГЕНАЗЫ (LDH)
Повреждение нервных клеток оценивали количественно путем измерения высвобождения лактатдегидротеназы (LDH) из культивируемых нейронов, которые инкубировали в культуральной среде. В 1 день, 5, 8, 10, 12, 14 и 16, 100 мкл культуральной среды переносили из культуральных лунок в 96-луночные планшеты и смешивали со 100 мкл реакционного раствора из набора для анализа LDH (Roche Diagnostic: набор для определения цитотоксичности: номер в каталоге 3644793, Индиананолис, США). Оптическую плотность (OD) измеряли спустя 30 минут на 492 нм, применяя планшет-ридер Labsystem Multiscan (Labsystem Multiscan RC, Финляндия). Вычитали фоновое поглощение на 620 нм. Активность LDH выражали как активность, присутствующую в 25 мкл объема среды. Результаты выражали как OD×10-3.
D. ЖИЗНЕСПОСОБНОСТЬ КЛЕТОК
В дни 1, 5, 8, 10, 12, 14 и 16 всю культуральную среду удаляли и заменяли на 500 мкл среды Neurobasal + CellTiter 96 AQueous One Solution, набор: CellTiter 96® AQueous One Solution Cell Proliferation Assay Kit. Жизнеспособность нервных клеток определяли, применяя CellTiter 96® AQueous One Solution Cell Proliferation Assay (Promega, Медисон, США). Согласно протоколу данного набора для анализа пролиферации, клетки инкубировали в течение 4 часов при 37ºС в увлажненном инкубаторе в атмосфере 5% CO2. Реакцию останавливали добавлением 2% додецилсульфата натрия (SDS). Оптическую плотность измеряли на 490 нм спустя 4 часа, применяя планшет-ридер Labsystem Multiscan. Вычитали фоновое поглощение на 620 нм. Результаты выражали как OD×103, что представляло количество жизнеспособных клеток.
Статистический анализ жизнеспособности клеток и результаты LDH оценивали, применяя однофакторный дисперсионный анализ (ANOVA), а затем апостериорный тест (Р<0,05).
Е. ИММУНОГИСТОХИМИЯ ДАБЛКОРТИНА (DCX) В КОРТИКАЛЬНЫХ КЛЕТКАХ НА ПОКРОВНЫХ СТЕКЛАХ
Кортикальные клетки фиксировали на покровных стеклах с помощью 4% параформальдегида в фосфатно-солевом буферном растворе (ФБР), пермеабилизировали в 0,3% полиоксиэтиленсорбитанмонолаурате (Twecn 20, Siqma) в течение 10 минут и блокировали с помощью 2,5% сыворотки осла на ФБР в течение 2 часов при комнатной температуре. Покровные стекла инкубировали с антителом козы против даблкортина (DCX) (1:200, SC-8066, Santa Cruz Biotechnology Inc., Санта-Круз, Калифорния) в 2% сыворотке осла на ФБР в течение ночи. После 3 промывок в ФБР, покровные стекла инкубировали с меченными Alexa 488 антителами против антитела козы (FluoProbes, Interchim, Монлюсон, Франция) в 2% сыворотке осла в течение 2 часов, и промывали три раза в ФБР, каждый раз в течение 5 мин. Покровные стекла затем инкубировали в растворе Хехста (3 мкл в 10 мл; Siqma-Aldricht Chimie, Сен-Кантен-Фаллавье, Франция) в течение 10 минут, чтобы пометить ядра клеток. После 2 промывок в ФБР и 1 промывки в воде, покровные стекла сушили и приклеивали на предметные стекла с помощью Fluoroprep (75521; BioMerieux, Марси-л'Этуаль, Франция). Клетки изучали, применяя эпифлуоресцентную и конфокальную микроскопию. Наблюдения методом конфокальной микроскопии осуществляли, применяя лазерный сканирующий конфокальный микроскоп (TCS SP, Leica Microsystems Heidelberq GmbH, расположенное в Мангейм, Германия), оборудованный инвертированным микроскопом DMIRBE и аргон-криптоновым лазером (возбуждение лазера 488 нм, сбор данных от 500 до 600 нм каждые 10 им). Специфичность сигнала оценивали с помощью покровных стекол, служащих отрицательным контролем, которые не инкубировали с первичным антителом, направленным против белка DCX. Изображения получали в виде отдельных оптических срезов клеток и усредняли по меньшей мере по четырем отсканированным изображениям на кадр. Затем получали конфокальные изображения мечения антителом DCX-Alexa-488, после спектральной коррекции фоновой аутофлуоресценции.
F. Физиологические параметры, используемые при исследовании действия NeuroAid II (MLC 901) на мышей C57Bl/6
Общую анестезию проводили 3% изофлураном, и поддерживали ее 1% изофлураном, подаваемым через открытую лицевую маску каждой мыши. Мышам позволяли дышать самопроизвольно. Исследовали физиологические параметры подгруппы животных (n=5 на группу), включая среднее артериальное давление (СрАД), ректальную температуру, газы артериальной крови и pH, перед, во время и после ишемии. В правую бедренную артерию вводили катетер с полиэтиленовой трубкой РЕ-10 и соединяли с датчиком кровяного давления (Harvard Apparatus, Массачусетс, США) для непрерывного наблюдения за СрАД (мм рт ст). Образец гепаринизированной крови (75 мкл) затем отбирали из введенного в бедренную артерию катетера и измеряли pO2, pCO2 и pH крови, применяя радиометр ABL 555 (Acid-Base Laboratory System). Внутреннюю температуру тела отслеживали непрерывно с помощью термометра (диаметр зонда 3 мм; Harvard Apparatus, Массачусетс, США), вставленного в прямую кишку, и поддерживали на физиологическом уровне с помощью термостатически контролируемого одеяла с электрообогревом (Harvard Apparatus, Массачусетс, США). Внутреннюю температуру тела поддерживали на физиологическом уровне с помощью комбинированного регулятора гомойотермного одеяла.
G. Индукция временной фокальной ишемии головного мозга у мышей C57Bl/6
Фокальную ишемию вызывали путем закупорки левой средней мозговой артерии (МСА), применяя методику с внутрипросветной нитью (Heurteaux и др., 2006). После осуществления разреза шеи посередине, общую и наружную левые сонные артерии отделяли и перевязывали с помощью шелковой хирургической нити 4-0 (Ethicon). Временную клипсу для аневризмы yasarqil (BMH31, Aescuiap, Туттлинген, Германия) временно помещали на внутреннюю сонную артерию. Нить с покрытием 6-0 (Doccol, Редлендс, Калифорния, США), с оплавленным на открытом пламени кончиком, вводили через небольшой надрез в общую сонную артерию, на расстоянии 13 мм от раздвоения сонной артерии, чтобы закупорить начало МСА. Животных держали на 37ºС в течение одного часа, после чего нить аккуратно извлекали, чтобы позволить реперфузию участка МСА. Для контроля тяжести МСАО, определяли региональный мозговой кровоток CBF (rCBF) путем лазерной доплер-флоуметрии (Perimed), применяя гибкое 0,5-мм оптоволоконное удлинение основного зонда, фиксированного на нетронутом черепе над ишемической корой головного мозга (2 мм постериорально и 6 мм латерально от брегмы). Имитацию операции осуществляли путем вставки нити в общую сонную артерию без сопродвижения для закупорки МСА. Животным позволили полностью прийти в сознание на электрической грелке перед возвращением в клетку.
H. Определение объема инфаркта
Чтобы оценить объем инфаркта в исследовании неотложного лечения NeuroAid II (MLC 901) после ишемии (Пример 5), мышей умерщвляли через 24 часа после реперфузии. Их головной мозг удаляли и осуществляли шесть коронарных срезов толщиной 1 мм, применяя приспособление для приготовления срезов ткани (Phymep, Франция). Коронарные срезы головного мозга немедленно погружали в 2% хлористый 2,3,5-трифенилтетразол (ТТС, Siqma, Франция) на 20 мин при комнатной температуре в темноте, а затем фиксировали 4% раствором параформальдегида в течение ночи перед анализом, описанным ранее (Dinq-Zhou и др., 2002). Стриарные и кортикальные области инфаркта, представленные высветленными, измеряли на каждом срезе, применяя компьютерную систему анализа изображений, и корректировали с учетом отека головного мозга, согласно Golanov и Reis (Golanov и Reis, 1995). Объем инфаркта, выраженный в мм3, рассчитывали путем линейного интегрирования уточненных участков повреждения.
Кроме того, использовали крезил-виолет, краситель, который окрашивает тельца Ниссля в звездчатых телах жизнеспособных нейронов, чтобы подтвердить процесс увеличения объема инфаркта у мышей с ишемией. Коронарные срезы замороженного головного мозга (толщиной 10 мкм) помещали в 1% раствор крезил-виолета в 0,25% уксусной кислоте на 3 мин, промывали, обезвоживали и заливали средой Entellan. Срезы анализировали с помощью световой микроскопии.
Пример 1
Зависимость жизнеспособности клеток и высвобождения LDH от дозы NeuroAid™ (MLC 601)
Кортикальные клетки, полученные с помощью описанных выше способов, обрабатывали четырьмя концентрациями NeuroAid™ (MLC 601): 0,1, 0,5, 1,0, 10 мкг/мл, в дни культивирования с 1 по 14. Жизнеспособность клеток изучали в дни 8, 10 и 14 с помощью описанных выше способов, результаты показаны на Фиг.1.
Действие NeuroAid™ (MLC 601) против нейродегенерации кортикальных клеток с течением времени в культуре также анализировали по высвобождению LDH. Повышение страдания клеток, которое приводит к гибели клеток, связано с повышенным высвобождением LDH. Высвобождение LDH измеряли в день 10 и день 14 с помощью описанных выше способов, результаты показаны на Фиг.2.
Результаты
На Фиг.1 показано, что обработка NeuroAid™ (MLC 601) в концентрации, равной 1 мкг/мл, вызывала существенное повышение (35%) выживаемости нейронов в день 14 по сравнению с контролем (**Р<0,01). До 10 дня не наблюдалось существенных различий в проценте жизнеспособности клеток, обработанных NeuroAid™ (MLC 601) в концентрациях от 0,1-0,5-1,0 мкг/мл, по сравнению с контролем (P>0,05) (n=10 лунок на экспериментальную группу).
На Фиг.2 показано отношение высвобождения LDH к жизнеспособности клеток в дни 10 и 14 при концентрациях NeuroAid™ (MLC 601), равных 1 мкг/мл. По сравнению с контролем, обработка NeuroAid™ (MLC 601) значительно уменьшала высвобождение LDH после 10 и 14 дней культивирования (P<0,01) (n=10 лунок на экспериментальную группу).
На основании экспериментальных данных из Примера 1 можно продемонстрировать, что обработка NeuroAid™ (MLC 601) кортикальных клеток в культуре способствует повышению жизнеспособности клеток и уменьшению высвобождения LDH, который представляет собой маркер страдания клеток. Пример 1 также демонстрирует, что NeuroAid™ (MLC 601) можно применять для снижения поражающего воздействия инсульта или нейродегенерации у предрасположенных к этому субъектов или субъектов, для которых существует риск инсульта или нейродегенерации, для лечения пациентов с пораженными болезнью или поврежденными тканями центральной или периферической нервной системы, или для применения в качестве реагента для ведения культуры клеток.
Пример 2
Влияние NeuroAid™ (MLC 601) на пролиферацию нервных клеток/нейрогенез
DCX представляет собой высокогидрофильный ассоциированный с микротрубочками белок, который специфично экспрессируется во всех мигрирующих предшественниках развивающейся ЦНС и в областях непрерывного нейрогенеза во взрослом головном мозге. Пролиферацию нервных клеток анализировали по экспрессии DCX в культуре кортикальных клеток с помощью описанных выше способов. Кортикальные клетки, полученные с помощью описанных выше способов, обрабатывали 1 мкг/мл NeuroAid™ (MLC 601) в дни культивирования с 1 по 14. Клетки затем обрабатывали и изучали с помощью эпифлуоресцентной и конфокальной микроскопии, как описано в способах выше, чтобы определить экспрессию DCX. Результаты показаны на Фиг.3.
Результаты
На Фиг.3 с помощью окрашивания антителом против DCX показано, что в день 3 не было различий в экспрессии DCX контрольными клетками и кортикальными клетками, обработанными 1 мкг/мл NeuroAid™ (MLC 601). Тем не менее, в день 14 иммунореактивность по отношению к DCX исчезла в контроле, тогда как наблюдалось повышение экспрессии DCX, вызванное обработкой NeuroAid™ (MLC 601), что указывает на формирование существенной аксональной и дендритной сети.
Благодаря его связи с нейрогенными процессами, белок DCX в настоящее время используют в качестве маркера нейрогенеза. DCX представляет собой ассоциированный с микротрубочками белок, экспрессия которого происходит во всех мигрирующих предшественниках нервных клеток в головном мозге эмбриона и взрослого человека. DCX, похоже, важен для нормальной, происходящей при развитии, миграции кортикальных нейронов, так как мутации в DCX у человека приводят к синдромам, дли которых свойственна остановка миграции данных нейронов, и которые проявляются клинически субкортикальными ламинарными гетеротопиями, умственной отсталостью и пароксизмом. DCX также экспрессируется в некоторых зрелых нейронах в головном мозге взрослого человека, где он участвует в разрастании аксонов и синаптогенезе.
Таким образом, на основании экспериментальных данных из Примера 2, можно продемонстрировать, что обработка NeuroAid™ (MLC 601) приводит к повышению экспрессии DCX в кортикальных клетках, что убедительно указывает на то, что обработка NeuroAid™ (MLC 601) повышает нейропролиферацию, нейрогенез и восстановление нервных клеток, что необходимо для восстановления неврологической функции (например, двигательной и когнитивной). В Примере 2 также продемонстрировано, что NeuroAid™ (MLC 601) можно применять для стимуляции разрастания нейронов и пролиферации нервных клеток в тканях центральной или периферической нервных систем, для стимуляции роста клеток и для способа стимуляции выживаемости клеток, роста, пролиферации или дифференцировки клеток путем применения NeuroAid™ (MLC 601).
Пример 3
Влияние обработки NeuroAid™ (MLC 601) и NeuroAid II (MLC 901) на жизнеспособность клеток, высвобождение LDH и пролиферацию нервных клеток
Кортикальные клетки подвергали обработке концентрацией NeuroAid™ (MLC 601) или NeuroAid II (MLC 901), равной 1 мкг/мл, в дни культивирования с 1 по 14. Данная концентрация, равная 1 мкг/мл, соответствует наилучшим результатам, полученным в описанных выше исследованиях жизнеспособности клеток и высвобождения LDH. Жизнеспособность клеток изучали в дни 8, 10, 12 и 14. Пролиферацию нервных клеток с течением времени анализировали по экспрессии DCX в кортикальных клетках в культуре, обработанной 1 мкг/мл NeuroAid™ (MLC 601) или NeuroAid II (MLC 901).
Результаты
На Фигуре 4 показано, что в день 8 наблюдалось существенное повышение жизнеспособности кортикальных клеток, обработанных 1 мкг/мл NeuroAid™ (MLC 601) или NeuroAid II (MLC 901), но сравнению с соответствующим контролем (**P<0,01; ***P<0,001). Тем не менее, максимальная эффективность после обработки обоими средствами наблюдалась в день 14 в виде ~45% увеличения выживаемости клеток (***P<0,001). Не наблюдалось существенного различия в эффективности NeuroAid™ (MLC 601) и NeuroAid II (MLC 901) на различных стадиях культивирования (n=10 лунок на экспериментальную группу).
На Фигуре 5 показано сравнение результатов обработки NeuroAid™ (MLC 601) и NeuroAid II (MLC 901) при концентрациях, равных 1 мкг/мл, на отношение высвобождения LDH к жизнеспособности клеток в дни 8, 10, 12 и 14. По сравнению с контролем, оба варианта обработки вызывали значительное снижение высвобождения LDH через 12 и 14 дней культивирования (*Р<0,05 и ***P<0,001) (n=10 лунок на экспериментальную группу). Не наблюдалось существенного различия в эффективности высвобождения LDH при обработке NeuroAid™ (MLC 601) и NeuroAid II (MLC 901).
На Фигуре 6 показано, что, по сравнению с контролем, кортикальные клетки, обработанные 1 мкг/мл NeuroAid™ (MLC 601) или NeuroAid II (MLC 901), образовывали гораздо более густую аксональную и дендритную сеть, начиная с 3 дня в культуре. В день 14, иммунореактивность по отношению к DCX исчезала в контроле и мочение белка DCX стало отличаться между кортикальными клеткам, обработанными NeuroAid™ (MLC 601), и кортикальными клетками, обработанными NeuroAid II (MLC 901). Белок DCX всегда экспрессировался при развитии кортикальных клеток, обработанных NeuroAid™ (MLC 603) или NeuroAid II (MLC 901). Тем не менее, представляется, что в цитоплазме кортикальных клеток, обработанных NeuroAid II (MLC 901), также сильно возрастала иммунореактивность по отношению к DCX.
Результаты, полученные для обоих вариантов обработки NeuroAid™ (MLC 601) (NeuroAid™ (MLC 601) и NeuroAid II (MLC 901)), показали повышение выживаемости клеток, повышение высвобождения LDH и повышение экспрессии DCX в кортикальных клетках. Не наблюдалось существенного различия между результатами для NeuroAid™ (MLC 601) и NeuroAid II (MLC 901). Таким образом, на основании экспериментальных данных можно продемонстрировать, что оба варианта лечения NeuroAid™ (MLC 601) (NeuroAid™ (MLC 601) и NeuroAid II (MLC 901)) повышают нейропролиферацию, нейрогенез и восстановление нервных клеток, и могут представлять собой улучшенный способ лечения неврологических заболеваний и поражений нервной системы.
Результаты описанных выше экспериментов также подтверждают возможность применения экстрактов NeuroAid™ (MLC 601) и NeuroAid II (MLC 903) для улучшения способности соединяться и выживаемости культур всех типов нервных клеток. Данные экстракты можно систематически добавлять в классические культуральные среды для культур нервных клеток, чтобы значительно улучшить их жизнеспособность, рост дендритов и синаптогенез. В Примере 3 также продемонстрировано, что (NeuroAid™ (MLC 601) и NeuroAid II (MLC 901) можно применять для стимуляции разрастания нейронов и пролиферации нервных клеток в тканях центральной или периферической нервной системы, для стимуляции роста клеток, для лечения пациентов, страдающих от патологического состояния, выбранного из группы, состоящей из депрессии, психических симптомов, естественного старения и травматической гибели клеток головного мозга, снижая тем самым поражающее действие инсульта или нейродегенерации у предрасположенных к этому субъектов или субъектов, для которых существует риск инсульта или нейродегенерации, вызывая рост клеток; для лечения пациентов с пораженными болезнью или поврежденными тканями центральной или периферической нервных систем, для применения в качестве реагента для ведения культуры клеток, и для способа стимуляции выживаемости, роста, пролиферации или дифференцировки клеток.
Пример 4
Влияние предварительного лечения NeuroAid II (MLC 901) мышей через 24 ч после ишемии
В данном исследовании, мышам (n=11) предварительно вводили питьевой раствор NeuroAid II (MLC 901) в течение шести недель, и процент выживаемости анализировали через 24 ч после ишемии (Фиг.7A). Контрольные мыши (n=10) получали в качестве питьевого раствора водопроводную воду.
Чтобы определить, повышает ли предварительное лечение NeuroAid II (MLC 901) процент выживаемости мышей, подвергнутых ишемии, животным вводили NeuroAid II (MLC 901) в течение шести недель перед индукцией ишемии. На Фиг.8 показано, что предварительное лечение NeuroAid II (MLC 901), которое давали с питьем в течение шести недель, вызывало существенное снижение смертности животных, которым давали NeuroAid II (MLC 901), по сравнению с контрольными мышами. Предварительное лечение NeuroAid II (MLC 901) в течение шести недель приводило к 90,9% выживаемости по сравнению с 40,0% в контрольной группе.
В Примере 4 продемонстрировано, что NeuroAid полезно принимать перед ишемическим инсультом. Данные исследования иллюстрируют, что NeuroAid успешно снижал размер инфаркта и уровень смертности мышей с ишемией в клинически значимой модели инсульта.
Пример 5
Влияние неотложного после ишемии лечения NeuroAid II (MLC 901) мышей через 24 ч после ишемии
В данном исследовании, мыши (n=10) получали неотложное лечение интраперитонеальной инъекцией NeuroAid II (MLC 901), которую осуществляли при наступлении ишемии и через 6 ч. после реперфузии. Контрольным мышам (n=10) инъецировали солевой раствор. Процент выживаемости и объем инфаркта измерили через 24 ч реперфузии.
Чтобы определить, защищает ли неотложное введение NeuroAid II (MLC 901) от ишемического инсульта, мышей (n=10) подвергали ишемии и инъецировали им интраперитонеально разовую дозу раствора 1 мг NeuroAid II (MLC 901)/мл, при наступлении ишемии и через 6 ч после реперфузии. Неотложное введение NeuroAid II (MLC 901) приводило к 90,0% выживаемости по сравнению с 38,8% выживаемости, наблюдаемыми у контрольных мышей (Фиг.9А). На Фиг.9В показано, что такое лечение NeuroAid II (MLC 901) после ишемии радикально уменьшало церебральный инфаркт. Лечение NeuroAid после ишемии уменьшало объем инсульта на 47,4% (P<0,001) по сравнению с контрольными мышами.
Данные исследования демонстрируют, что NeuroAid полезно применять как перед, так и после ишемического инсульта. Данные исследования демонстрируют, что NeuroAid успешно уменьшал размер инфаркта и уровень смертности мышей с ишемией в клинически значимой модели инсульта.
Способы для примеров с 6 по 8
А. КУЛЬТУРА КОРТИКАЛЬНЫХ КЛЕТОК
Мытой C57Bl6/J во время беременности (E14) анестезировали с помощью изопентана, а затем смещали им шейные позвонки. Эмбрионы удаляли и помещали в холодный раствор HBSS+ (сбалансированный солевой раствор Хенкса). Кору головного мозга разрезали в холодном растворе HBSS+ и удаляли мягкие мозговые оболочки. Кортикальные образцы разрезали на малые кусочки и аккуратно растирали с помощью оплавленной стеклянной пастеровской пипетки в 8 мл раствора HBSS+. Смесь фильтровали (40 мкм фильтр) и центрифугировали при 800 об/мин в течение 8 мин. Супернатант удаляли и осадок растворяли в 7 мл культуральной среды. Клетки высевали на покрытые полилизином 12-луночные планшеты (24 мм в диаметре; Siqma-Aldrich Chimie, Сен-Кантен-Фаллавье, Франция)) со стеклянными покровными стеклами внутри (12 мм в диаметре; CML, Немур, Франция) при плотности 1×106 клеток/лунку. Культуры вели при 37ºС в увлажненном инкубаторе в атмосфере 5% CO2 в среде Neurobasal, дополненной B27, Glutamax, антибиотиками, и использовали для экспериментов через 16 дней. Рост глиальных клеток подавляли путем добавления 5-фтор-2-дезоксиуридина (2 мкМ) и уридина (2 мкМ) во время второго дня культивирования.
Эксперименты контролировал один исследователь, который не знал статус лечения (n=3 культуры, 36 лунок на экспериментальную группу).
В. АНАЛИЗ ПОВРЕЖДЕНИЯ КЛЕТОК: ИЗМЕРЕНИЕ ВЫЖИВАЕМОСТИ КЛЕТОК И ЛАКТАТДЕГИДРОГЕНАЗЫ (LDH)
Жизнеспособность клеток оценивали в день 12 культивирования с помощью CellTiter 96® AQueous One Solution Cell Proliferation Assay (Promega, Шарбоньер-Ле-Бене, Франция) (n=3 культуры, 36 лунок на экспериментальную группу). Анализ представлял собой колориметрический способ, который был основан на применении внутренней соли 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолия (MTS), маркера митохондриальной активности, и электрофильного реагента (феназинэтосульфата, PES). MTS тетразолия подвергался биологическому восстановлению в клетках с образованием окрашенного формазанового продукта, который растворим и культуральной среде.
В день 12, всю культуральную среду удаляли и замещали на 500 мкл среды Neurobasal + CellTiter 96 AQueous One Solution, набор: CellTiter 96® AQueous One Solution Cell Proliferation Assay Kit. Согласно протоколу набора для анализа пролиферации, клетки инкубировали в течение 4 часов при 37ºС в увлажненном инкубаторе в атмосфере 5% CO2. Реакцию останавливали добавлением 2% додецилсульфата натрия (SDS). Оптическую плотность измеряли на 490 нм спустя 4 часа, применяя планшет-ридер Labsystem Multiscan (Labsystem Multiscan RC, VWR Internatinal, Фонтено-су-Буа, Франция). Вычитали фоновое поглощение на 620 нм. Результаты выражали в виде оптической плотности (OD×10-3), которая представляла количество жизнеспособных клеток. Результаты выражали как процент жизнеспособности клеток, который рассчитывали путем деления значения поглощения для обработанных образцов на таковое для необработанных контрольных образцов в каждой группе.
Повреждение нервных клеток оценивали количественно путем измерения высвобождения лактатдегидрогеназы (LDH) из культивируемых нейронов, которые инкубировали с культуральной средой, на 12 день культивирования (Koh и Choi, 1987). Анализ высвобождения LDH отражал меру целостности цитплазматической мембраны. В день 12, 100 мкл культуральной среды переносили из культуральных лунок в 96-луночные планшеты и смешивали со 100 мкл реакционного раствора из набора для анализа LDH (Roche Diagnostic: набор для определения цитотоксичности: номер в каталоге 1644793, Индианаполис, США). Оптическую плотность (OD) измеряли спустя 30 минут на 492 нм, применяя планшет-ридер Labsystcm Multiscan (Labsystem Multiscan RC, VWR International, Фонтене-су-Буа, Франция). Вычитали фоновое поглощение на 620 им. Нейроны, которые подвергли воздействию лизирующего раствора (ФБР, содержащего 0,1% Triton X-100), использовали в качестве положительного контроля и принимали за 300% высвобождение LDH. Результаты выражали как отношение выхода LDH к жизнеспособности клеток.
Результаты представляли собой среднее по трем независимым экспериментам с трехкратным определением. Статистические анализы результатов по жизнеспособности клеток и высвобождению LDH оценивали, применяя однофакторный дисперсионный анализ (ANOVA), а затем апостериорный тест (Р<0,05).
С. ФОКАЛЬНАЯ ИШЕМИЯ
Исследователи, которые осуществляли ишемическое хирургическое вмешательство и измеряли объемы инфарктов, не знали код лечения (двойной слепой метод).
Модель фокальной ишемии
Фокальную ишемию вызывали у взрослых самцов мышей C57/B16, весящих от 22 до 26 г (в возрасте 7-9 недель), путем закупорки левой средней мозговой артерии (МСА), применяя методику с внутрипросветной нитью (Huang и др., 1994). Общую и наружную левые сонные артерии отделяли и перевязывали шелковой хирургической нитью 4-0 (Ethicon). Временную клипсу для аневризмы yasargil (BMH31, Aesculap, Туттлинген, Германия) временно помещали на внутреннюю сонную артерию. Нить с покрытием 6-0 (Doccol, Редлендс, Калифорния, США) вводили через небольшой надрез в общую сонную артерию, на расстоянии 13 мм от раздвоения сонной артерии, чтобы закупорить начало МСА. Животных держали на 37ºС в течение одного часа, после чего нить аккуратно извлекали, чтобы позволить реперфузию участка МСА. Для контроля тяжести МСАО, определяли региональный мозговой кровоток CBF (rCBF) путем лазерной доплер-флоуметрии (Perimed), применяя гибкое 0,5-мм оптоволоконное удлинение основного зонда, фиксированного на нетронутом черепе над ишемической корой головного мозга (2 мм постериорально и 6 мм латерально от брегмы). Имитацию операции осуществляли путем вставки нити в общую сонную артерию без ее продвижения для закупорки МСА.Животным позволили полностью прийти в сознание на электрической грелке перед возвращением в клетку.
Определение объема инфаркта
Через 30 часов после реперфузии, осуществляли окрашивание крезил-виолетом коронарных срезов замороженного головного мозга (толщиной 10 мкм), применяя 1% раствор крезил-виолета в 0,25% уксусной кислоте, и заливали средой Entellan. Стриарные и кортикальные области инфаркта, представленные высветленными, измеряли на каждом срезе, применяя компьютерную систему анализа изображений, и корректировали с учетом отека головного мозга, согласно Golanov и Reis (Golanov и Reis, 1995). Объем инфаркта, выраженный в мм3, рассчитывали путем линейного интегрирования уточненных участков повреждения, как описано ранее (Heurteaux и др., 2006а). D. ЛЕКАРСТВЕННАЯ ТЕРАПИЯ Используемая композиция NeuroAid IE (MLC 903) (0,4 г на капсулу) описана далее:
D. ЛЕКАРСТВЕННАЯ ТЕРАПИЯ
0,57 г Radix astragali,
0,114 г Radix salvia miltiorrhizae,
0,114 г Radix paeoniae rubra,
0,114 г Rhizoma chuanxiong,
0,114 г Radix angelicae sinensis,
0,114 г Carthamus tinctorius,
0,114 г Prunus persica,
0,114 г Radix polygalae,
0,114 г Rhizoma acori tatarinowii,
0,0665 Hirudo.
Для экспериментов in vitro, осуществляли обработку клеток NeuroAid II (MLC 901), Rhizoma chuanxiong, Radix angelicae sinensis и комбинированную обработку Rhizoma chuanxiong/Radix angelicae sinensis при концентрации 1 мкг/мл, начиная с 3 дня культивирования, в течение 12 дней (что соответствовало 15 дням культивирования).Для лечения in vivo после ишемии, мышам инъецировали интраперитонеально разовую дозу раствора 2 мкг/мл NeuroAid II (MLC 901) в солевом растворе (в качестве среды) в суммарном объеме, равном 500 мкл/мышь, весящую 25 г, через 3 и 24 часа после окончания ишемии. Для предварительного лечения in vivo, NeuroAid II (MLC 901), Rhizoma chuanxionq, Radix angelicae sinensis и комбинацию Rhizoma chuanxiong/Radix anqelicae sinensis давали мышам в питьевой воде при концентрации 6 мг/мл в течение 6 недель предварительно перед индукцией ишемии.
Е. ИММУНОГИСТОХИМИЯ КОРТИКАЛЬНЫХ НЕЙРОНОВ В КУЛЬТУРЕ
Кортикальные клетки фиксировали на покровных стеклах с помощью 4% параформальдегида/ФБР, пермеабилизировали в 0,3% полиоксиэтиленсорбитанмонолаурате (Tween 20, Siqma) в течение 10 минут и блокировали с помощью 2,5% сыворотки осла на ФБР в течение 2 часов при комнатной температуре. Клетки инкубировали с антителом козы против даблкортина (DCX) (1:200, SC-8066, Santa Cruz Biotechnology Inc., Санта-Круз, Калифорния) в 2% сыворотке осла на фосфатно-солевом буферном растворе в течение ночи (Heurteaux и др., 2006b). После 3 промывок в фосфатно-солевом буферном растворе (ФБР), клетки инкубировали с мечеными Alexa 488 антителами против антитела козы (FluoProbes, Interchim, Монлюсон, Франция) в 2% сыворотке осла в течение 2 часов, и промывали три раза в ФБР, каждый раз в течение 5 мин. Нейроны затем инкубировали в растворе Хехста (3 мкл в 10 мл; Sigma-Aldricht Chimie, Сен-Кантен-Фаллавье, Франция) в течение 10 минут, чтобы пометить ядра клеток. После 2 промывок в ФБР и 1 промывки в воде, покровные стекла сушили и приклеивали на предметные стекла с помощью Fluoroprep (75521; BioMerieux, Марси-л'Этуаль, Франция). Клетки изучали, применяя эпифлуоресцентную микроскопию.
Специфичность сигнала оценивали с помощью покровных стекол, служащих отрицательным контролем, которые не инкубировали с первичным антителом. Изображения эпифлуоресцентной микроскопии мечения белка захватывали с идентичным временем экспонирования после спектральной коррекции фоновой аутофлуоресценции. Дифференцируемые нейриты кортикальных нейронов в культуре наблюдали с помощью иммуноокрашивания DCX на 12 день лечения. Разрастание нейритов определяли с помощью эпифлуоресцентной микроскопии путем измерения общей длины нейритов в культуральных чашках в различные моменты времени, используя фотоизображение клетки и программное обеспечение Neurite Tracer image J (Pool и др., 2008).
F. СТАТИСТИЧЕСКИЙ АНАЛИЗ
Результаты выражали как среднее ± стандартная ошибка среднего. Статистический анализ различий между группами осуществляли, применяя непарный критерий Стьюдента или дисперсионный анализ. Если F-отношения оказывались значимыми, статистические анализы продолжали, и осуществляли апостериорные сравнения с помощью критерия множественного сравнения Тьюки. Во всех анализах уровень значимости составлял Р<0,05.
Пример 6
Сравнение эффективности влияния на жизнеспособность клеток и высвобождение LDH обработки NeuroAid II (MLC 901), Rhizoma chuanxiong, Radix angelicae sinensis и комбинацией Rhizoma chuanxiong/Radix angelicae sinensis
Кортикальные клетки, полученные с помощью описанных выше способов, подвергали обработке NeuroAid II (MLC 901), Rhizoma chuanxiong, Radix anqclicae sinensis или комбинацией Rhizoma chuanxiong/Radix angelicae sinensis при концентрации, равной 1 мкг/мл, в течение 12 дней.
Сравнивали действие NeuroAid II (MLC 901) с таковым для Rhizoma chuanxiong, Radix angelicae sinensis или комбинации Rhizoma chuanxiong/Radix angelicae sinensis против нейродегенерации кортикальных клеток в 15 день культивирования (12 день обработки), используя измерения жизнеспособности клеток и LDH, описанные в способах выше. Результаты показаны на Фиг.10.
Результаты
На Фиг.10А показано, что при концентрации, равной 1 мкг/мл, три указанных обработки вызывали существенное повышение жизнеспособности нервных клеток но сравнению с контролем (*Р<0,05, **Р<0,01, ***Р<0,001). Тем не менее, NeuroAid II (MLC 901) продемонстрировал наибольшую эффективность повышения выживаемости клеток по сравнению с обработкой Rhixoma chuanxionq или Radix anqclicae sinensis. На Фиг.10A показано, что обработка NeuroAid II (MLC 90]) вызывала повышение жизнеспособности клеток на приблизительно 51% по сравнению с контролем (***P<0,001), тогда как повышение выживаемости клеток, вызванное Rhizoma chuanxiong, Radix anqelicae sinensis и комбинированной обработкой Rhizoma chuanxionq/Radix anqelicae sinensis, составляло 37%, 29,5% и 35%, соответственно. Наблюдали значимое различие между эффективностью NeuroAid II (MLC 901) и эффективностью Rhizoma chuanxionq, Radix anqelicae sinensis и комбинации Rhizoma chuanxionq/Radix anqelicae sinensis (##P<0,1) (n=36 лунок на группу).
Хорошо известно, что неблагоприятное воздействие на клетки, которое приводит к гибели клеток, связано с повышенным высвобождением лактатдегидрогеназы (LDH). На Фиг.10В показано, что, по сравнению с контролем, три указанные обработки значительно уменьшали отношение высвобождения LDH к жизнеспособности клеток через 12 дней обработки (*Р<0,05 и **Р<0,01). На Фиг.10В также показано, что NeuroAid II (MLC 901) значительно уменьшал высвобождение LDH, по сравнению с обработкой Rhizoma chuanxionq, Radix anqelicae sinensis или комбинацией Rhizoma chuanxionq/Radix anqelicae sinensis (##P<0,01) (n=36 лунок на группу).
На основании экспериментальных данных из Примера 6 можно продемонстрировать, что NeuroAid II (MLC 901) более эффективен для повышения жизнеспособности клеток и уменьшения высвобождения LDH в культуре, чем любой из Rhizoma chuainxionq, Radix anqelicae sinensis или комбинации Rhizoma chuanxionq/Radix anqelicae sinensis.
Пример 7
Сравнение действия in vivo NeuroAid II (MLC 901), Rhizoma chuanxiong, Radix angelicae sinensis и комбинированного лечения Rhizoma chuanxiong/Radix angelicae sinensis против ишемического повреждения головного мозга in vivo
Лечение после ишемии: Чтобы сравнить эффект NeuroAid II (MLC 903), Rhizoma chuanxiong, Radix anqelicae sinensis и комбинированного лечения Rhizoma chuanxionq/Radix anqelicae sinensis in vivo, каждое лечение тестировали в модели фокальной ишемии у мышей.
Ишемию вызывали с помощью временной закупорки средней мозговой артерии (MCAO) на 60 мин (Huanq и др., 1994). Мышей (n=12) подвергали фокальной ишемии и осуществляли интраперитонеальную инъекцию (через 3 часа, а затем снова через 24 часа после MCAO) разовой дозы раствора 1 мкг NeuroAid II (MLC 901), Rhizoma chuanxjonq, Radix anqelicae sinensis или комбинации Rhizoma chuanxionq/Radix anqeliae sinensis.
Неотложное введение каждого лекарственного средства приводило к существенному уровню выживаемости, при этом лучшей эффективности добивались с применением NeuroAid II (MLC 901). На Фиг.11A показано, что с NeuroAid II (MLC 901) достигали уровня выживаемости 89%, по сравнению с уровнем выживаемости 58,5%, 64%, 73% и 75%, достигнутым при введении ишемическим мышам среды, Rhizoma chuanxionq, Radix anqelicae и комбинации Rhizoma chuanxiong/Radix angolicae sinensis, соответственно.
Существенное уменьшение церебрального инфаркта, как показано на Фиг.11В, подтверждает, что наилучший результат наблюдался для NeuroAid II (MLC 901). На Фиг.11В показано, что NeuroAid II (MLC 901) уменьшал объем инсульта на 48,4% (***Р<0,001), по сравнению с контрольными мышами с ишемией, через 30 ч после ишемии. Размер инфаркта у мышей, которым вводили Rhizoma chuanxionq, Radix anqelicae и комбинацию Rhizoma chuanxionq/Radix angelicae sinensis, был значительно больше, чем у животных, которым вводили NeuroAid II (MLC 901) через 30 часов реперфузии (Фиг.11В, #Р<0,05, ##Р<0,001 против группы NeuroAid II (MLC 901)).
Предварительное лечение: Чтобы сравнить потенциальное влияние in vivo MLC 901, Rhizoma chuanxionq и Radix anqelicae sinensis на предотвращение инсульта, каждое лекарственное средство тестировали с помощью предварительного лечения.
Животных (n=12) лечили NeuroAid II (MLC 901), Rhixoma chuanxionq или Radix anqelicae sinensis, которые вводили в питьевой воде (6 мг/мл) в течение 6 недель перед индукцией ишемии. Не наблюдалось существенного различия в потреблении пищи и питьевого раствора между группами, которым вводили среду и NeuroAid II (MLC 901). На Фиг.12A показано, что 6-недельное предварительное лечение NeuroAid II (MLC 901), Rhizoma chuanxionq и Radix anqelicae sinensis вызывало уменьшение смертности животных из группы лечения по сравнению с контрольными мышами с ишемией.
Предварительное лечение приводило к уровню выживаемости 92%, 78% и 70% в группах NeuroAid II (MLC 901), Rhizoma chuanxionq и Radix anqelicae sinensis, соответственно, по сравнению с 62,5% в контрольной группе. Наилучший результат уменьшения последствий инсульта или нейродегенерации у предрасположенных к этому субъектов или субъектов, для которых существует ппе риск инсульта или нейродегенерации, полученный для NeuroAid II (MLC 901), подтверждали существенным уменьшением объема инфаркта, который был на 39% и 24,5% менее значительным по сравнению с Rhizoma chuanxionq и Radix anqelicae sinensis (Фиг.3В, Р<0,01).
Данные исследования в Примере 7 демонстрируют, что NeuroAid II (MLC 901) более эффективен, чем любой из Rhizoma chuanxionq или Radix anqelicae sinensis, при предварительном лечении фокальной ишемии, а также NeuroAid II (MLC 901) более эффективен, чем любой из Rhizoma chuanxiong, Radix anqelicae sinensis или комбинации Rhizoma chuanxionq/Radix anqelicae sinensis, при лечении после фокальной ишемии.
Пример 8
Сравнительное действие NeuroAid II (MLC 901), Rhizoma chuanxiong, Radix angelicae sinensis и комбинированной обработки Rhizoma chuanxiong/Radix angelicae sinensis на нейропролиферацию и разрастание нейритов
Для анализа действия NeuroAid II (MLC 901), Rhizoma chuanxionq, Radix anqelicae sinensis и комбинированной обработки Rhizoma chuanxionq/Radix anqelicae sinensis на пролиферацию нервных клеток и разрастание нейритов, сравнивали экспрессию DCX в культивируемых кортикальных клетках из эмбрионов мышей через 14 дней обработки.
Типичные изображения эпифлуоресцентной микроскопии окрашивания DCX показаны на Фиг.13. На Фиг.13 показано, что наблюдалось повышение экспрессии DCX, вызванное обработкой NeuroAid II (MLC 901), Radix anqelicae sinensis или комбинацией Rhizoma chuanxionq/Radix anqelicae sinensis, что указывает на формирование существенной аксональной и дендритной сети при данных трех обработках по сравнению с клетками, обработанными средой или Rhizoma chuanxionq отдельно.
Количественный анализ интенсивности флуоресценции на каждом изображении эпифлуоресцентной микроскопии показан на Фиг.14. На Фиг.14 показано, что наилучшее нейропролиферативное действие оказывала на кортикальные культуры обработка NeuroAid II (MLC 901).
Для изучения того, вызывает ли обработка NeuroAid II (MLC 901), Rhizoma chuanxionq, Radix angelicae sinensis или комбинацией Rhizoma chuanxionq/Radix anqelicae sinensis разрастание нейритов, измеряли общую длину нейритов в культивируемых кортикальных нейронах на 14 день обработки.
На Фиг.15 показано, что NeuroAid II (MLC 901), Radix anqelicae sinensis и комбинированная обработка Rhizoma chuanxionq/Radix anqelicae sinensis вызывала существенное разрастание нейритов по сравнению с группой, обработанной средой (*Р<0,05, ***Р<0,001). Наилучшую активность стимуляции разрастания нейритов наблюдали для NeuroAid II (MLC 901), по сравнению с таковой для Radix angelicae sinensis отдельно или для комбинации Rhizoma chuanxionq/Radix anqelicae sinensis (#P<0,05).
Данные исследования из Примера 8 демонстрируют, что NeuroAid II (MLC 903) более эффективен, чем любой из Rhizoma chuanxionq, Radix anqelicae sinensis или комбинации Rhixoma chuanxionq/Radix anqelicae sinensis, для стимуляции нейропролиферации и разрастания нейритов.
Применения
Предпочтительно, согласно описанным композициям и способам предложена новая терапевтическая стратегия, в центре внимания которой стоит регенерация нервов и восстановление неврологических функций.
Согласно описанным способам предложены регенеративные методы лечения для лечения поражений нервной системы и неврологических заболеваний путем стимуляции роста нервных клеток, что позволяет поврежденным или пораженным болезнью нервам снова функционировать.
Описанные способы также можно применять для стимуляции роста клеток in vitro. Предпочтительно, культивирование различных клеток in vitro можно применять для тканевой инженерии или терапевтических применений ex vivo.
Должно быть очевидно, что различные другие модификации и доработки настоящего изобретения должны быть очевидны для специалиста в данной области после прочтения предшествующего описания, без отклонения от сущности и объема настоящего изобретения, и предполагается, что все такие модификации и доработки входят в объем прилагаемой формулы изобретения.
Реферат
Изобретение относится к композиции для уменьшения последствий инсульта или нейродегенерации у предрасположенного к этому субъекта, которая содержит по меньшей мере три из следующих компонентов: Radix Astragali (корень астрагала сладколистного перепончатого или Huang Qi), Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Radix Paeoniae Rubra (корень красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Lynch или Chi Shao), корневище лигустикума чуаньсионского (Chuan Xiong), radix angelicae sinensis (корень аралии китайской или DanGui), цветок сафлора красильного (сафлор или HongHua), Prunus Persica (семя персика или Taoren), Radix Polygalae (корень тонколистного истода, Polygala tenuifolia Willd., Polygala sibirica L. или Yuanzhi) и Rhizoma acori Tatarinowii (корневище аира травянистого или Shichangpu), при этом указанные три компонента включают radix angelicae sinensis (корень аралии китайской или DanGui). Также заявлен способ уменьшения последствий инсульта или нейродегенерации путем введения по меньшей мере трех из вышеперечисленных компонентов. 2 н. и 11 з.п. ф-лы, 15 ил., 8 пр.
Формула
указанная композиция содержит по меньшей мере три из следующих компонентов: Radix Astragali (корень астрагала сладколистного перепончатого или Huang Qi), Radix et Rhizoma Salviae Miltiorrhizae (корень красного шалфея или Dan Shen), Radix Paeoniae Rubra (корень красного пиона, Paeonia lactiflora Pall, Paeonia veitchii Lynch или Chi Shao), корневище лигустикума чуаньсионского (Chuan Xiong), radix angelicae sinensis (корень аралии китайской или DanGui), цветок сафлора красильного (сафлор или HongHua), Prunus Persica (семя персика или Taoren), Radix Polygalae (корень тонколистного истода, Polygala tenuifolia Willd., Polygala sibirica L. или Yuanzhi) и Rhizoma acori Tatarinowii (корневище аира травянистого или Shichangpu), при этом указанные три компонента включают radix angelicae sinensis (корень аралии китайской или DanGui).
цереброваскулярные расстройства, кортикобазальная ганглиозная дегенерация (CBGD), хроническая ишемия, синдром Крейцфельда-Якоба, синдром Денди-Уокера, миодистрофия Дюшенна, старческое слабоумие, деменция, связанная с синдромом приобретенного иммунодефицита (AIDS), энцефаломиелит, эссенциальный тремор, атаксия Фридрейха, болезнь Герстманна-Штройслера-Шейнкера, болезнь Хантингтона, гидроцефалия, гипоксия, семейная фатальная инсомния, преходящее нарушение мозгового кровообращения, куру, синдром Ландау-Клеффнера, болезнь с тельцами Леви, болезнь Мачадо-Джозефа, бактериальный и вирусный менингит, сопутствующие мигрени расстройства, миелит, оливомостомозжечковые атрофии, ассоциированная с пантотенаткиназой нейродегенерация, полиомиелит, постполиомиелитный синдром, прионные болезни, ложная опухоль головного мозга, синдром Шая-Дрейджера, болезнь Штейнерта, инфантильные спазмы, болезнь Паркинсона, прогрессирующий надъядерный паралич, сирингомиелия, таламические синдромы, тикозные расстройства, синдром Туретта, синдром увеоменингоэнцефалита, генерализованная и очаговая ишемия и другие сердечно-сосудистые заболевания.

Комментарии