Экстракты акульего хряща, обладающие антиангиогенной активностью и оказывающие влияние на регрессию опухоли, способы их получения - RU2156132C2
Код документа: RU2156132C2
Чертежи


















Описание
Хрящ представляет собой аваскуляризованную ткань и его изучают как потенциального кандидата, содержащего антиангиогенные факторы. Кроме этого, хрящ представляет собой ткань, которая относительно устойчива в отношении развития опухолей. Опухоль, связанная с хрящом, хондросаркома, является примером наименьшей васкуляризации твердых опухолей. Ангиогенез является одним из важнейших факторов развития опухоли. Дискретные твердые опухолевые массы появляются в том случае, если опухолевые клетки способны вызывать расширение соседней сосудистой системы для обеспечения их питательных потребностей. Поэтому исследование факторов, участвующих в стимуляции ангиогенеза, было направлено на выяснение их роли в развитии опухоли, и антиангиогенные факторы, как и лекарства, обладающие ангиогенной ингибиторной активностью, так же исследовались, как средства, регулирующие рост опухолей или оказывающие влияние на их развитие.
Было обнаружено, что плечевой хрящ телят содержит вещество, ингибирующее васкуляризацию твердых опухолей (Langer et.al, 1976).
Продолжаются поиски источников, обеспечивающих большую поставку хрящевого материала в связи с его обнадеживающими потенциальными свойствами противоопухолевого агента.
Акулы относятся к животным, являющимся потенциальным источником ингибитора ангиогенеза такого типа, поскольку их эндоскелет полностью состоит из хрящей (6% от веса их тела, против 0,6% у телят). Кроме этого, акулы обладают интересными характеристиками в отношении пониженной склонности к развитию опухолей. Для объяснения такой низкой вероятности развития опухолей у акул было выдвинуто большое число гипотез. Marchalonis et al. (1990) продемонстрировали IgM антитела, способные легко атаковать любой агрессивный агент. McKinney et al. (1990) показали, что акулы содержат макрофаги, способные дифференцировать нормальные клетки из новообразовавшихся клеток и разрушать последние.
Rosen и Woodhead (1980) постулировали, что редкость возникновения опухолей у эласмобранхов (elasmobranch) (группа животных, к которой относятся акулы и скаты) может быть связана с высокой ионной прочностью их тканей, которая эквивалентна высокой температуре тела. Указанные авторы полагают, что в этих условиях иммунная система осуществляет близкий к 100% иммунологический надзор. Moore et al. (1993) обнаружили, что акулы выделяют аминостерол, обладающий антибактериальными и антипротозоальными свойствами. Наконец, Lee и Langer (1983), а также Folkman и Klagsbrun (1987) показали, что акулы выделяют вещество, которое ингибирует неоваскуляризацию. Lee и Langer (ор. cit) выделили это вещество путем экстракции из акульего хряща в денатурирующих условиях (экстракция гуанидином). Однако такой процесс экстракции очень длителен (41 день), и в результате могут получаться экстракты, содержащие денатурированные факторы. Хотя активное вещество, выделенное из телят, имеет молекулярный вес около 16 кДа, та же группа исследователей не приводит точного значения молекулярного веса соединения, выделенного из акул. Это вещество, охарактеризованное лишь, как имеющее молекулярный вес выше 3500 Да. Oikawa et.al (1990) применили тот же метод экстракции, что описан Lee и Langer, но значительно менее длительный (2 дня вместо 41 дня). Вещество, выделенное из акульих хрящей Oikawa et al., имело молекулярный вес в интервале 1000-10000 Да. Schinitsky (патент США 4 473 551) описывает водный экстракт сырого порошкообразного акульего хряща, фракция которого с молекулярным весом более 100 000 Да обладает противовоспалительной активностью, как таковая или в комбинации с глюкозамином. В этом патенте не содержится никаких предположений о компоненте такого экстракта, обладающем антиангиогенной или антиопухолевой активностью. Kuetner et al. (патент США 4746729) выделили полиморфонуклеарный нейтрофильный (PMN) эластазный ингибитор из бычьих хрящей. Такой ингибитор был получен из водного экстракта хрящей, в котором были сохранены молекулы вещества с молекулярным весом более 50 000 Да. В результате фракционирования на Сефакрил S-200 было получено большое число фракций, из которых отбирали фракции с молекулярным весом 10-40 кДа после того, как они показали антиэластазную активность. Активный компонент имел изоэлектрическую точку 9,5 и должен был иметь молекулярный вес около 15 000 Да. Kuetner et al. (патент США 4042457) также показали, что бычий хрящ содержит компонент с молекулярным весом менее 50 000 Да, обладающий ингибирующей активностью в отношении пролиферации клеток и отсутствием активности в отношении роста эндотелиальных клеток. Spilburg et al. (патент США 4243582) выделили два гликопротеина с молекулярным весом 65 кДа и pl 3,8 из бычьих хрящей (экстракция гуанидином), которые обладали антитрипсиновой активностью и ингибиторной активностью в отношении роста эндотелиальных клеток.
Телячьи и акульи хрящи обладают различными биологическими активностями, например, лизозимной активностью, промотирующей активностью в отношении роста клеток, ингибирующей активностью в отношении коллагенез типа I и IV, эластазы и таких протеаз, как трипсин, химотрипсин и плазмин.
Известны методы получения экстрактов и фракций акульих хрящей. В некоторых из таких способов получают порошкообразный сырой хрящ без какой-либо экстракции (патент США 5075112), в других методах используют такие денатурирующие агенты, как гуанидин (патент США 4243582) или проводят энзимные реакции для освобождения от любых мышечных, нервных или сосудистых структур, окружающих хрящ, и используют органические растворители для удаления жиров (патенты США 3478146, 4350682 и 4656137) и получения хрящевого экстракта, тогда, как в других способах просто получают водные экстракты (в воде патент США 4473551) или в солевых растворах хрящей (патент США 4746729)) путем удаления нерастворимого материала. В последних способах сохраняют конкретные фракции с конкретным молекулярным весом с целью их дополнительного исследования и очистки (см. приведенное выше обсуждение).
Таким образом, акулий хрящ известен, как материал, содержащий антиангиогенный компонент (ы), который обычно тестируют с использованием анализа на сумке роговой оболочки кроликов или анализа на куриной хориоаллантойной мембране (CAM). До настоящего времени, весь порошкообразный хрящ испытывали непосредственно на опухолях in vivo, на ксенотрансплантате человеческой меланомы, имплантированной на мышах, лишенных волосяного покрова (патент США 5075112), а также тестировали в анализе САМ с целью установления антиангиогенного эффекта. Однако не имеется доказательств прямого воздействия хрящевого экстракта на опухолевые клетки.
Ангиогенез затрагивает не только развитие рака. Многие заболевания или состояния, влияющие на различные физиологические системы (указанные в скобках), являются ангиогенеззависимыми, среди которых можно привести следующие примеры: артрит и атеросклеротические бляшки (кости и связки), диабетическая ретинопатия, неоваскулярная глаукома, трахома и неоваскуляризация ткани роговой оболочки (глаза), псориаз, склеродерма, гемангиома и гипертрофированное рубцевание (кожа), сосудистые адгезии и ангиофиброма (кровяная система). В связи с этим любой новый антиангиогенный фактор может найти применение в лечении таких заболеваний, а также в терапии рака.
Настоящее изобретение относится к способу получения экстрактов, обладающих антиангиогенными свойствами (уменьшение площади кровеносных сосудов, наблюдаемое in vivo на экспериментально индуцированных опухолях), опухолево-регрессивной активностью in vivo, а также проявляющих прямое ингибирующее действие на линии опухолевых клеток. Такие экстракты получают из хрящей акул, обычно называемых Обычная колючая рыба-собака (Common Spiny dog Fish) и Черная колючая рыба-собака (Black Spiny dog fish) (Squalus acanthias). Такой способ не включает использование какого-либо денатурирующего растворителя или продукта и не предусматривает использование каких-либо энзимов. Такой способ заключается в получении смеси целого хряща в водном растворе с нейтральным значением pH, предпочтительно в чистой воде, причем такую смесь центрифугируют и осадок и надосадочную жидкость сохраняют для дальнейшей обработки. Осадок после центрифугирования лиофилизируют и тестируют на противоопухолевую и антиангиогенную активности in vivo in vitro в отсутствие или в присутствии надосадочной жидкости. Было показано, что надосадочная жидкость обладает антиангиогенной и опухолево-регрессирующей активностями in vivo. Затем состав надосадочной жидкости исследовали различными методами. Фракционирование такой надосадочной жидкости позволяло охарактеризовать некоторые из ее активных компонентов. Фракции испытывали на их прямую in vitro активность на раковых клеточных линиях. Было предположено, что не фракционированная надосадочная жидкость обладает такой in vitro активностью. Лиофилизация существенно разрушает активность таких фракций, и следует отметить, что имеется большое различие между твердыми и жидкими экстрактами и их фракциями.
Настоящее изобретение также относится к хрящевому лиофилизату или твердому экстракту, жидкому хрящевому экстракту и его жидким фракциям, а также к способу получения всех перечисленных материалов.
Наконец, настоящее изобретение относится к использованию хрящевых экстрактов в лечении ангиогенеззависимых заболеваний. Предварительные клинические испытания показали эффективность фармацевтических композиций, содержащих концентрированный нефракционированный жидкий экстракт, в улучшении состояния пациентов, страдающих ангиогенеззависимыми заболеваниями. Среди таких заболеваний с успехом были тестированы такие дерматологические нарушения, как псориаз и один случай рака простаты. Воспаление сальных желез (акне), которое представляет собой другое дерматологическое расстройство, не задокументированное как ангиогенеззависимое заболевание, также неожиданно с успехом подвергалось лечению. Избыточная неоваскуляризация является отличительным признаком гипертрофического зарубцовывания у пациентов с ожогами. Композиции, содержащие хрящевой экстракт настоящего изобретения, испытываются на предмет предотвращения такого явления. Фармацевтические композиции, содержащие в качестве активного ингредиента жидкий хрящевой экстракт, также являются объектом изобретения.
Настоящее изобретение станет более понятным на примере следующих конкретных воплощений, которые дополнены следующими фигурами, приведенными в целях иллюстрации, а не
ограничения сферы
изобретения;
Фиг. 1 демонстрирует ингибиторную активность повышающихся дозировок акульего хряща (твердый экстракт) на клетках ZR75-1 и MCF-7.
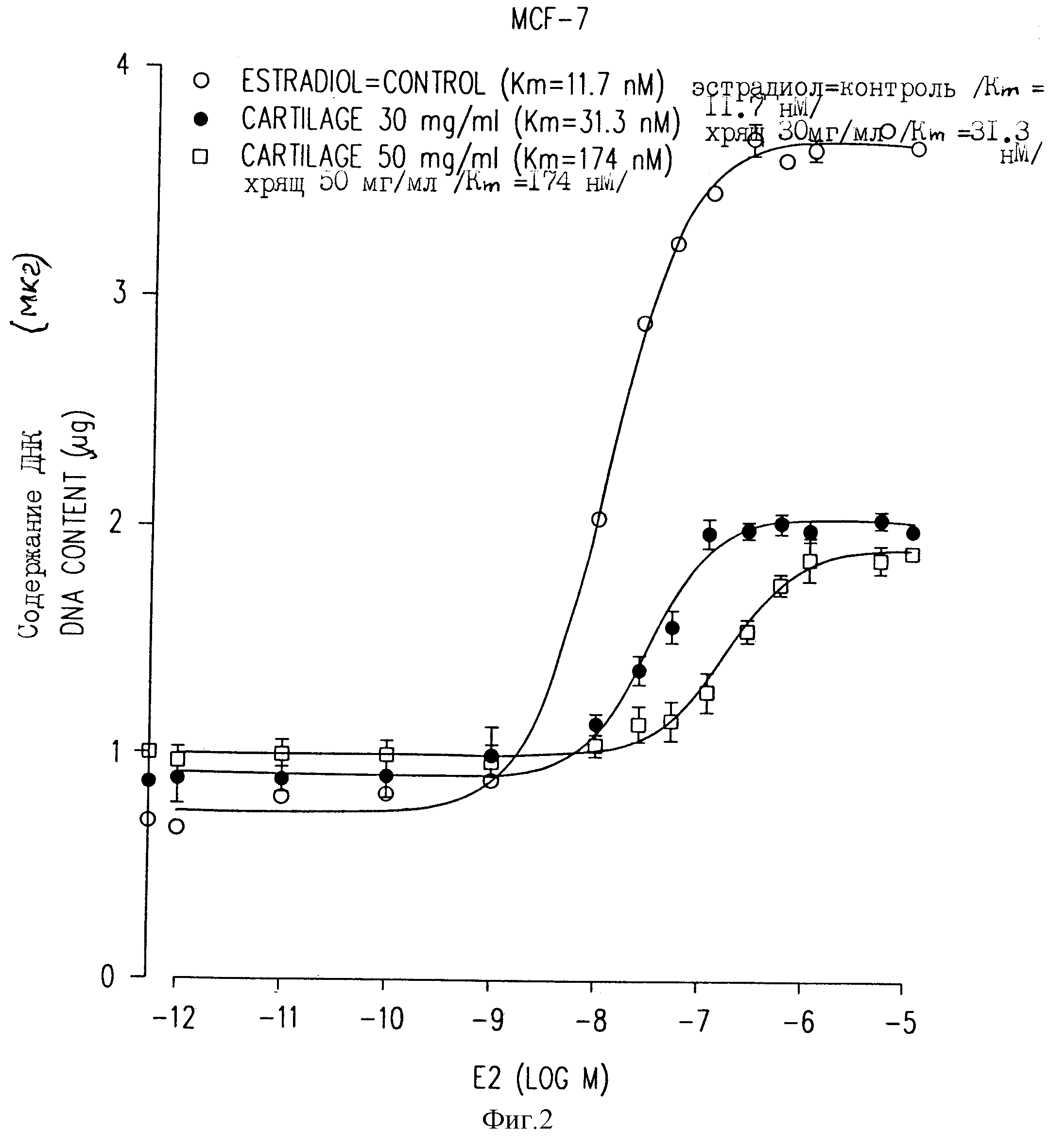
Фиг. 2 иллюстрирует кривые дозовой зависимости количества клеток MCF-7, измеренного по содержанию в них ДНК в присутствии повышающихся концентраций эстрадиола, в присутствии или отсутствие двух концентраций хрящевого лиофилизата.
На фиг. 3 a, b приведено сравнение разрезов печени крыс с развившимся раком молочной железы, на которых принудительным кормлением применяли комбинацию хрящевого лиофилизата и надосадочной жидкости и тех, на которых применяли только воду.
На фиг. 4a, b показано сравнение разрезов почки крыс с развившимся раком молочной железы, на которых применяли принудительным кормлением комбинацию хрящевого лиофилизата и надосадочной жидкости тех крыс, на которых применяли только воду.
На фиг. 5a, b показано сравнение разрезов легких у крыс с развившимся раком грудной железы, на которых принудительным кормлением применяли комбинацию хрящевого лиофилизата и надосадочной жидкости, и крыс, на которых применяли только воду.
На фиг. 6a, b показано сравнение разрезов опухоли грудной железы крыс с развившейся опухолью, на которых принудительно применяли комбинацию хрящевого лиофилизата и надосадочной жидкости, и крыс, которым давали только воду.
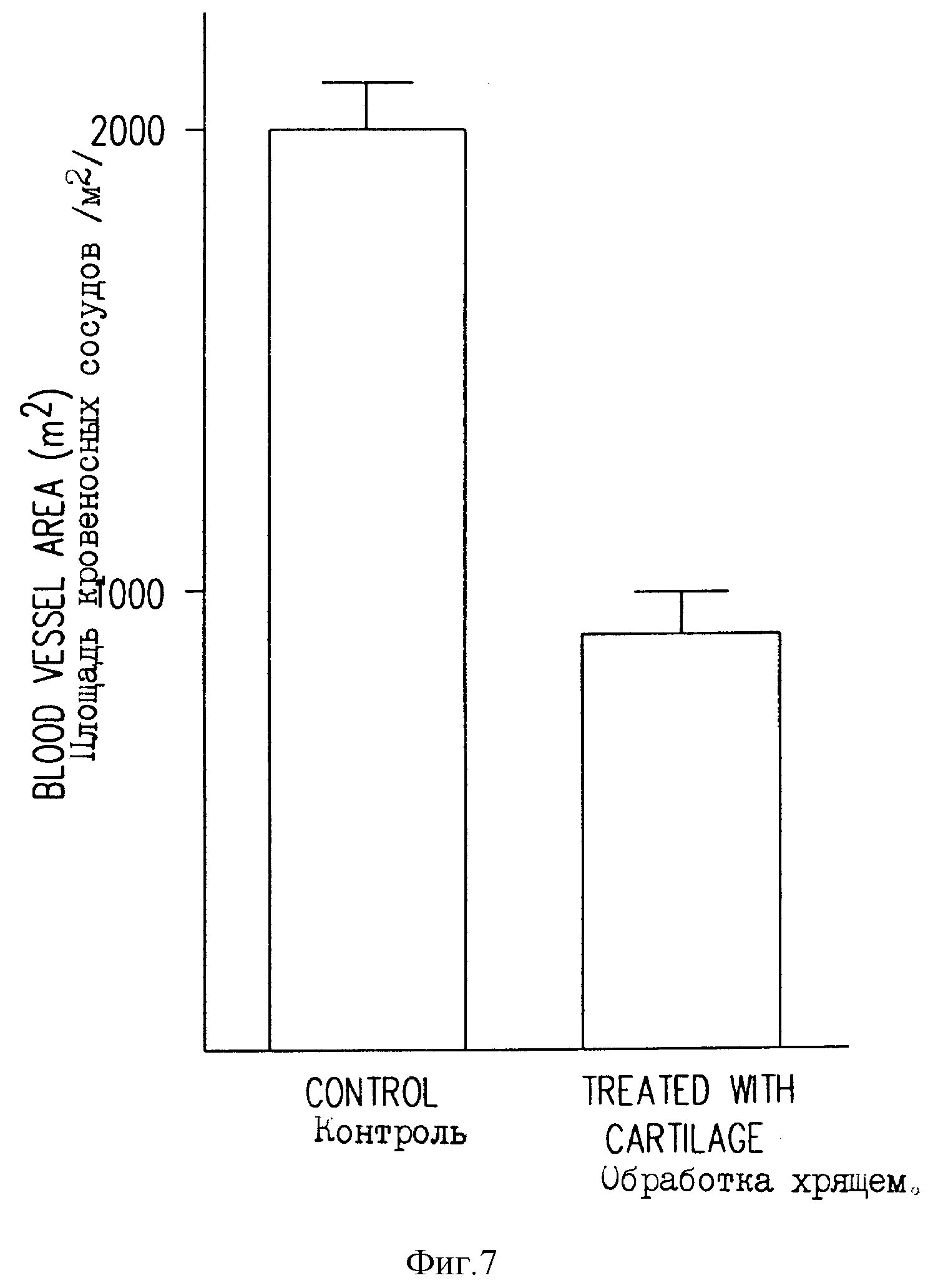
На фиг. 7 приведена гистограмма, полученная из фиг. 6a, b, иллюстрирующая влияние хрящевого экстракта на площадь кровеносных сосудов в опухоли.
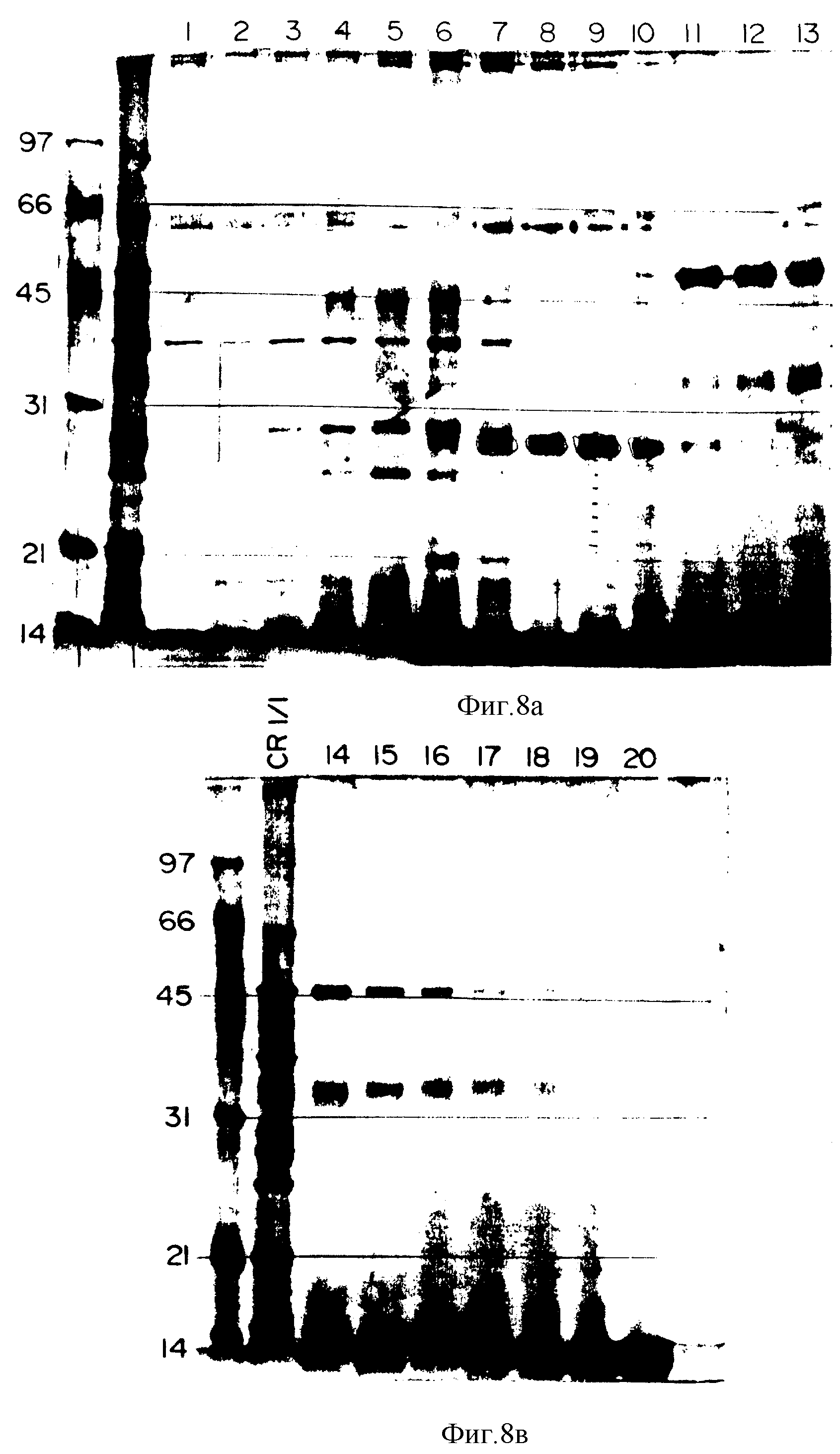
На фиг. 8 представлен электрофоретический профиль в неденатурированных условиях жидких фракций, разделенных на Ротофоре; маркеры молекулярного веса приведены слева и за ними указан образец сырого пермеата до фракционирования, для сравнения с выделенными фракциями.
На фиг. 9a, b проиллюстрировано значительное улучшение состояния двух пациентов, страдающих псориазом, у одного из которых наблюдается гиперкератоз 9a, а у другого отсутствует гиперкератоз 9b, при местном лечении композицией, содержащей эффективное количество концентрированного жидкого хрящевого экстракта (нижняя фотография) в сравнении с начальным состоянием этих пациентов (верхняя фотография).
После добычи акул хрящи получали от здоровых животных, относящихся к разновидностям Черная колючая рыба-собака и Обычная колючая рыба-собака. Мышечную и соединительную ткани удаляли соскребыванием с помощью обработанных этанолом скальпелей и ножниц. Затем хрящи упаковывали в вакууме в пластмассовые мешки и замораживали до -20oC для последующего применения.
Приготовление лиофилизированного хряща
Хрящи оттаивали до
температуры 4oC. Затем хрящи трижды пропускали через отверстия обработанной этанолом мясорубки совместно с равным количеством (вес/объем) воды, которую очищали обратимым осмосом и
фильтрацией на 0,1 мкм фильтре с получением первой смеси. Многие водные растворы могут использоваться вместо воды, при условии сохранения нейтрального значения pH в целях избежания лизиса или
денатурации хрящевых компонентов.
Затем такую смесь гомогенизировали путем перемешивания с максимальной скоростью в промышленном смесителе при 4oC в течение 10 мин. Разжижение такого гомогената проводилось с помощью дезинтегратора Политрон в течение 10 мин при 4oC. На этой стадии размер оставшихся частиц составлял величину менее 500 мкм. Такую смесь центрифугировали при 13600 х г в течение 15 мин при 4oC. Полученный в результате осадок после центрифугирования лиофилизировали в течение 24-48 ч. Такая первая фракция далее в тексте определяется, как лиофилизат или твердый экстракт.
Надосадочную жидкость фильтровали через 24 мкм ватмановский фильтр с целью удаления частиц, способных оказывать влияние на эксплуатационные характеристики ультрафильтрационной колонки. Затем отфильтрованный материал подвергали ультрафильтрации при 4oC на тангенциальной проточной фильтрационной колонне с пористостью порядка 500 000 Да. Такой надосадочный раствор подвергали стерильной фильтрации на 0,22 мкм фильтре, и аликвоты жидкости помещали в стерильные бутылки для дальнейшего использования. На такую фракцию далее ссылаются, как на надосадочную жидкость или жидкий экстракт.
Была разработана альтернативная высокопроизводительная методика получения лиофилизата и надосадочной жидкости. Стадию центрифугирования при 13600 х г в течение 15 мин с последующей грубой фильтрацией на ватмановских фильтрах заменяли центрифугированием в центрифуге СЕРА, снабженной нейлоновым карманом с пористостью 30 мкм, при 3000-4000 х г. 20 кг/20 л препарата может быть подвергнуто центрифугированию с использованием такого способа за 30 мин с получением 21 л надосадочной жидкости. Полученный водный объем даже выше исходного объема воды, что означает тот факт, что была собрана даже часть водного содержимого хрящей. Лиофилизат и надосадочная жидкость могут иметь следующие ниже составы.
Лиофилизат
Липиды - 7,35% (1)
Протеины - 46,2% (2)
Влажность - 20,4%
Натрий - 4,16 мг/г (3)
Калий - 2,64 мг/г
Кальций
- 114 мг/г
Магний - 1,49 мг/г
Цинк и железо - В следовых количествах
Надосадочная жидкость
Липиды - 0,10% (1)
Протеины - 8 мг/мл (2)
Влажность
- 98,8%
Натрий - 33,6 мг/100 г(3)
Калий - 39,2 мг/100 г
Кальций - 2,0 мг/100 г
Магний - 1,1 мг/100 г
Цинк и железо - В следовых количествах
(1),(2) Измерения проведены в соответствии с указаниями, опубликованными в АОАС Официальных разделах (1984) 16.219- 220 и 2.055 соответственно;
(3)
Измерено в соответствии с методикой SAA.
Содержание протеина оценивали согласно методу Къельдаля, в котором предусматривается измерение содержания органического азота (N).
Органический азот превращается в эквивалентный протеин в соответствии со следующим уравнением
Содержание протеина (мг/мл) =

Карбогидраты не были обнаружены, однако можно предположить, что они содержатся в том или ином экстракте, но в виде протеогликанов и/или мукополисахаридов. Возможно, что такие соединения включены в измеренное содержание влаги. Лиофилизат имеет неожиданный уровень содержания влаги, который измеряли по содержанию OH-групп. Поскольку 20% содержание воды близко к процентному содержанию карбогидратов, обычно присутствующих в хрящах, тогда как влажность лиофилизата должна быть близка к 0%, такая гипотеза нуждается в проверке.
Стерильность контролировали с использованием USP XXII спецификаций от:
1) Laboratoire de genie sanitaire du Quebec Inc. 1090, l'Escarbot, Centre Industriel St-Malo, Quebec. GIN 4J4; and
2) Northview Laboratories Inc. 1880, Holste Road, Northbrook, IL, 60062 U.S.A. FDA registration no. 12-18028
Анализы на активность
Лиофилизат:
Анализы in vitro
Эти анализы проводили на гормонозависимых раковых клеточных линиях MCF-7 и ZR75-1 (АТСС (R) номера 22-НТВ и 1500-CRL, соответственно).
Клетки ZR75-1
Базальная RPM1 среда
52 г RPM1 1640 без фенола красного (Sigma R8755), 17875 г Hepes (свободная кислота; Sigma H0763), 0,55 г пирувата натрия (Sigma P5280) и 10 г NaHCO3 смешивали в 5 л чистой воды и
устанавливали pH 7,40 с помощью NaOH.
Если такой раствор не используют сразу после приготовления, то он должен быть защищен от действия света с целью сохранения фотолабильных соединений. Такой раствор фильтровали, распределяли по 500 мл стерильным бутылкам и хранили при 4oC при максимальном сроке хранения в три месяца.
Стабилизирующая среда
клеточной культуры:
Базальную RPM1 среду дополняли 10% (об./об.) FBS (фетальная бычья сыворотка), 100 ед. пенициллина G/50 мкг сульфата стрептомицина (Sigma-P0906)/мл среды, 2 мМ L-глютамина
(Sigma G-1517) и 1 нМ E2 (β-экстрадиол Sigma E8875).
Экспериментальная среда:
Базальную RPM1 среду дополняли 5% FBSA (фетальная бычья сыворотка,
адсорбированная на системе декстран-древесный уголь), 2 мМ L-глютамина, 100 ед. пенициллина G/50 мкг сульфата стрептомицина/мл среды и 50 нг/мл инсулина (Sigma). К такой среде добавляли повышающиеся
концентрации описанного выше лиофилизата, а также различные концентрации эстрадиола (10-12-10-5 М).
Клетки MCF-7
Базальная DME-F12 среда
DME-F12
среду (не содержащую бикарбоната и фенола красного; Sigma) реконструировали в соответствии с указаниями производителя в чистой воде. На 1 л добавляли 1,2 г бикарбоната натрия и устанавливали
pH 7,40 с
помощью системы NaOH/HCl. Такой раствор фильтровали, распределяли по 500 мл стерильным бутылкам и хранили при 4oC максимум в течение трех месяцев.
Стабилизирующая
среда для
клеточной культуры
Базальную DME-F12 среду дополняли 10% (об./об.) FBS (фетальная бычья сыворотка), 100 ед. пенициллина G/50 мкг сульфата стрептомицина/мл среды, 2мМ L-глютамина
(Sigma) и 1
нМ E2 (эстрадиол).
Экспериментальная среда
Базальную DME-F12 среду дополняли 5% FBSA (фетальная бычья сыворотка, адсорбированная на системе
декстран-древесный
уголь), 2мМ L-глютамина, 100 ед. пенициллина G/50 мкг сульфата стрептомицина/мл среды и 50 нг/мл инсулина (Sigma). В соответствии с описанным для ZR75-1 клеток, в тех же
концентрациях добавляли
эстрадиол и лиофилизат.
Приготовление FBSA
Фетальную бычью сыворотку смешивали с 1% (вес./об.) древесного угля (обесцвеченный щелочной углерод).
Раствор декстрана Т70
добавляли к раствору древесный уголь - сыворотка до достижения концентрации 0,1% (вес./об.). Полученную смесь взбалтывали в течение ночи при 4oC. После
центрифугировали при 4oC в
течение 30 мин при 10000 х г, сыворотку декантировали, снова смешивали с теми же количествами древесного угля и декстрана, взбалтывали при комнатной температуре
в течение 3 ч и повторно
центрифугировали. Затем сыворотку подвергали тепловой инактивации при 56oC в течение 20 мин, фильтровали в стерильных условиях, и аликвоты помещали в стерильные
конические пробирки
Фалкон.
Клетки ZR75-1 и MCF-7 выращивали до достижения плотности популяции 20 000 клеток/лунку на диске с 24 лунками или 150 000 клеток/лунку на диске с 6 лунками и обрабатывали в присутствии или отсутствие различных концентраций лиофилизата, приготовленного, как описано выше. Все эксперименты повторяли три раза. Каждые два дня культурную среду удаляли и заменяли на свежую. Клетки выращивали в инкубаторе в постоянно увлажненной атмосфере, содержащей 5% CO2, при 37oC в течение 17, 7, 3 или 3 дней, что соответствовало первому, второму, третьему и четвертому экспериментам соответственно. Ингибирование роста клеток измеряли прямым подсчетом или измерением общего содержания ДНК в лунке (табл. 1).
Приведенные выше процентные значения ингибирования клеточного роста демонстрируют способность лиофилизата ингибировать доза-зависимым образом рост клеток двух таких клеточных линий.
Как показано на фиг.1, дозы в 50 и 100 мг/мл лиофилизата вызывают явную гипоплазию таких клеточных линий через три дня лечения.
На фиг.2 показано, что в присутствии 10-12-10-9 М эстрадиола, обработанные клетки реагируют аналогично контрольным клеткам, не стимулированным такими дозами гормонов. Однако при концентрации выше 1 нМ контрольные клетки сильно стимулируются, и концентрация ДНК достигает 3,75 мкг в присутствии 10-7 М эстрадиола (против 0,69 мкг в контрольном эксперименте без эстрадиола). В случае клеток, обработанных 30 и 50 мг/мл лиофилизата, измеренные концентрации ДНК при максимальной стимуляции составляют 1,9 и 1,8 мкг соответственно. На фиг. 2 показано, что аффинная константа (Km) клеток, обработанных экстрадиолом, в 3 и 16 раз выше, чем значение Km контрольных клеток в присутствии 30 и 50 мг/мл соответственно. Это означает, что необходимы более высокие концентрации эстрадиола для достижения того же роста клеток в присутствии хрящевого лиофилизированного твердого экстракта. Поэтому такой экстракт уменьшает максимальную реакцию (90% ингибирование) и повышает значение аффинной константы клеток в отношении эстрадиола.
Анализы in vivo.
Четыреста самок крыс разновидности Sprague-Dawley в возрасте 40 дней (полученных от Charles River Со, St.- Constant Quebec) адаптировали к окружающей среде в течение 12 дней. В это время принудительно применяли 20 мг DMBA/1 мл кукурузного масла (9,10-диметил-1,2-бензантрацен; полученный от Sigma Chemical Co.). Через три месяца после такой обработки 240 крыс с развившимся раком молочной железы подвергали селекции и распределяли по двум группам. Первая группа крыс состояла из пяти подгрупп. На крысах из групп, подвергаемых обработке, применяли ежедневные дозировки с повышающимися концентрациями лиофилизатного экстракта в 3 мл воды, и такое применение продолжали в течение 8 недель, тогда как контрольная группа животных получала такой объем воды. Вторая группа крыс состояла из пяти подгрупп. На крысах из групп, подвергаемых обработке, также применяли в течение десяти недель ежедневные дозировки лиофилизата в 3 мл воды (около 25 мг протеина) совместно с надосадочной жидкостью или без нее, тогда как контрольная группа животных получала такой же объем воды. Только одной подгруппе из второй группы крыс, обработанной лиофилизатом с концентрацией 3000 мг/кг/день и 3 мл надосадочной жидкости, также делали внутрибрюшинную инъекцию небольшой дозы надосадочной жидкости (около 8 мг протеина на 1 мл воды).
Крысы в начале двух указанных экспериментов имели вес 151-175 г и им давали пищу и питьевую воду ad libitum. У первой группы крыс появились опухоли со средним диаметром 0, 9 см, тогда как во второй группе крыс средний диаметр опухоли составил 0,6 см.
Полученные результаты суммированы в табл. 2.
Представленные результаты показывают, что лиофилизат содержит активный компонент, который абсорбируется в желудочно-кишечном тракте и оказывает влияние на размер опухоли. Такой эффект может быть следствием прямого влияния на клетки опухоли или может быть связан с антиангиогенезом.
Представленные результаты также показывают, что надосадочная жидкость обладает активностью, что сказывается на дополнительном уменьшении размера опухоли примерно на 5% даже несмотря на то, что такая добавка была сильно разбавленной (количество протеинов в 3 мл надосадочной жидкости составило примерно 25 мг).
Гистопатология
С целью оценки нетоксичности активных молекул хрящевого экстракта животных, используемых в описанных выше экспериментах in vivo, умертвляли обезглавливанием и ткани следующих
ниже органов отбирали на анализ: ткани печени, почек, легких, сердца, мозгов, мышц и молочной железы. Полученные ткани обезжиривались и в течение двух дней фиксировались в жидкости Bouin. После
дегидратации в этаноле фиксированные ткани заливали парафином. Получали срезы таких тканей и помещали их на предметные стекла, окрашенные гематоксилином, после чего препараты исследовали под
микроскопом.
Гистологическое исследование позволило обнаружить, что не наблюдается вредных побочных эффектов при использовании наибольших дозировок одного лиофилизата (данные не представлены), или при использовании лиофилизата в комбинации с надосадочной жидкостью (см. фиг. 3a,b; 4a, b; 5a,b).
Полученные результаты позволяют предположить, что лиофилизат и надосадочная жидкость обладают активностью в отношении селективной регрессии размера опухоли.
В пораженной раком молочной железе (см. фиг. 6a, b) наблюдалось важное уменьшение площади кровеносных сосудов. Антиангиогенный эффект таких активных молекул был далее подтвержден результатами, проиллюстрированными и суммированными на указанном чертеже и гистограмме.
Данные, представленные на фиг. 7, показывают, что при использовании комбинации лиофилизата (перорально) и надосадочной жидкости (перорально + внутрибрюшинно) (см. фиг. 6a, b) наблюдается уменьшение площади кровеносных сосудов на 55%.
Уменьшение размера опухоли может быть связано с важным понижением ее васкуляризации с непосредственным влиянием на опухолевые клетки или с комбинацией двух таких явлений. Антиангиогенный эффект таких экстрактов хорошо описан выше. Прямое гипоплазиантное действие наблюдалось in vitro на гормонозависимых клетках и оно было подтверждено в экспериментах in vivo.
Представленные выше результаты показали, что надосадочная жидкость дает большой эффект, чем лиофилизат при применении на клетках ZR75-1, в связи с чем ее компоненты были подвергнуты дальнейшему исследованию.
Получение жидких фракций, содержащих активные молекулы.
Хрящи акул добывали и обрабатывали в соответствии с описанным выше за исключением того, что не проводили стадию концентрирования.
Полученный после центрифугирования осадок отбрасывали и надосадочную жидкость обрабатывали так же, как описано выше вплоть до стадии стерильной фильтрации на 0,22 мкм фильтре.
На такую надосадочную жидкость далее в тексте ссылаются, как на сырой пермеат, т.е. продукт, полученный после ультрафильтрации.
Полученный таким образом сырой пермеат анализировали методом FPL C (Быстрая жидкостная хроматография на протеин).
Условия FPLC.
Колонка Hiloand 26 мм х 60 см, SephacrylS-300 FPLC система: получена из фирмы Pharmacia.
Перед загрузкой в колонку все образцы фильтровали на 0,22 мкм фильтре. В качестве элюирующего буфера использовали отфильтрованный и дегазированный в течение 15 мин фосфатный буферный физиологический раствор (PBS). Объем загруженного образца обычно составляет 3,2 мл (может составлять до 13 мл). Объемная скорость 1 мл/мин. Собирали фракции объемом 10 мл. Элюированные соединения детектировали по их УФ-поглощению (280 нм). Калибровочную карту получали с использованием калибровочного набора MW-GF-1000 фирмы Sigma, причем калибровочный образец имел тот же объем, что и анализируемый образец (3,2 мл).
Объем элюируемого образца определяли из графика зависимости молекулярного веса соединений калибровочного набора от их элюируемого объема, из которого вычитали объем пустот колонки. Объем пустот определяли путем пропускания декстрана голубого (М.В. = 2 000 000). Активность фракций тестировали на клетках ZR75-1. Идентифицировали фракции, представляющие интерес, и их характеристики подтверждали дополнительным исследованием (см. ниже).
Дополнительное охарактеризование активных компонентов пермеата проводили на Ротофоре (Biorad 170-2950; см. приведенный ниже раздел Изоэлектрофокусировка) и на фильтрах Амикон с различными значениями отсечки, в результате чего получали фракции с молекулярным весом 10-30 кДа, 30-100 кДа и более 100 кДа.
Изоэлектрофокусировка.
Препарат акульего хряща (46 мл пермеата 1 кг/л) подвергали в течение ночи диализу противотоком к 4 л чистой воды, содержащей 5% глицерина при 4oC с использованием мембранного устройства Spectra pore # 7 MWCO 3500 кДа (Spectrum 132110). Диализированный раствор смешивали с 2,75 мл амфолитов (Pharmacia # 80-1125-87), pH 3,5-10,0 и 0,5 г стружек (Sigma C3023; 3-[(3-холамидопропил)-диметиламмоний] -1-пропан-сульфонат). Объем системы доводили до 55 мл с помощью чистой воды. Полученный раствор загружали в устройство Porofor. Изоэлектрофокусировку осуществляли при 4oC при постоянной мощности 12 Вт (источник мощности 3000 xi Biorad 165-0554) при постоянной циркуляции воды для обеспечения поддержания температуры. В начале разделения напряжение составляло 380 В при силе тока 31 мА. При стабилизации силы тока (на значении 14 мА) напряжение составляло 870 В. Изоэлектрофокусировку прекращали и собирали 20 фракций (табл. 3).
Идентификацию таких протеинов осуществляли путем установления их молекулярного веса на геле для элекрофореза (Laemmli, U.K. (1970) Nature (Lond.) 227: 680).
Такие фракции разбавляли вчетверо загрузочным буфером (см. работу Laemmli), и 8 мкл аликвоты подвергали электрофорезу в невосстанавливающих условиях.
На фиг. 8 показан электрофоретический профиль каждой фракции и материала до изоэлектрофокусировки.
Все фракции помещали в бутылки в стерильных условиях под колпаком с ламинарным потоком путем их пропускания через стерильный фильтр Millipack-60 с пористостью 0,22 мкм.
Содержание
протеина во фракциях
оценивали дозировочным методом Lowry. Растворы с концентрацией 1 кг/2 мл (выраженной отношением веса сырого хряща на литр пермеата) тестировали на клетках ZR75-1 при различных
концентрациях культурной
среды. Полученные результаты суммированы ниже:
1-ое испытание
Пермеат лиофилизировали и пропускали на FPLC. Гипоплазийная активность не детектировалась
(данные не приведены).
2-ое испытание
Испытания, проведенные на ротофорных фракциях: идентификация протеина (табл. 4).
3-е испытание, проведенное на FPLC
фракциях:
Фракция 6 и 7
- молекулярный вес 1-2,5 кДа.
4-ое испытание, проведенное на 100 мкл фракциях, полученных на молекулярных фильтрах Амикон (табл. 5).
FPLC фракции 6 и 7 содержат активные компоненты очень малого молекулярного веса: 1-2,5 кДа.
Гипоплазиантный эффект таких фракций может в 33 000 раз превосходить эффект, наблюдаемый при использовании лиофилизата. Приведенные выше результаты показывают, что лиофилизация существенно разрушает и/или ингибирует активность протеинов, содержащихся в элюате, тогда как этого не наблюдается при лиофилизации твердого экстракта.
Дополнительная идентификация активных компонентов элюата.
Активные фракции (испытанные на клетках ZLR75-1) располагались в указанном ниже интервале молекулярных весов, определенных с помощью очистки другого типа, в которой использовали тот же пермеат (1 кг/л) на колонке длиной 30 см и диаметром 10 мм с Суперозой-12 и описанные выше методики с применением FPLC и ротофора. Использовали объемную скорость 1 мл/мин. Отбирали 45 фракций объемом в 1 мл.
Фракции 20-21 - активность в фракциях соответствует молекулярному весу 70-120 кДа.
Фракция 22 - активность фракции соответствует молекулярному весу 60-70 кДа.
Фракции 29-32 - активность в перекрывающихся фракциях, соответствующая молекулярному весу 35-46 кДа.
Фракции 34-35 - активность в фракциях, соответствующая молекулярному весу 29 кДа.
Фракции 38-39 - активность, соответствующая молекулярному весу 1-2,5 кДа.
Специфичность
Для оценки специфичности активности на опухолевых клетках пермеат, полученный после ультрафильтрации,
испытывали на других клетках мезенхимового
происхождения, человеческих TENON фибробластах (HTF), которые являются обычными фибробластами.
B. In vitro
а) пациенты
Использовали только НТF от двух пациентов
(одного - с неоваскулярной глаукомой, NVG, и другого - с первичной открыто-угловой глаукомой, POAG).
б) субкультивирование и сохранение
HTF
Каждую слитную культуру пассировали
промыванием и разъединением с помощью 0,5 мл, 0,05% системы трипсин/0,5 мМ EDTA (Gibco 610-5300 AG) в течение 5-10 мин при 37oC. Затем
добавляли 1,5 мл DME/F12 среды, содержащей 15% FBS с
целью нейтрализации системы трипсин/EDTA.
Ассоциацию клеток осуществляли растиранием в порошок и переносом в T-матрасы площадью 25 см2, в которые добавляли дополнительное количество среды, содержащей 10% FBS. После достижения сливания HTF переносили в T-матрасы площадью 75 см2 и, в конечном счете, на T-матрасы площадью 180 см2. После получения достаточного числа клеток некоторые из них использовали в описанных ниже экспериментах, а другие одновременно замораживали с целью сохранения идентичных пассажей для будущих экспериментов.
с) экспериментальные методики
После достижения слияния клетки от одного из пациентов, растущие на двух или трех идентичных
T-матрасах для культивирования площадью 180 см2,
подвергали диссоциации в соответствии с описанной выше методикой. После кратковременного и центрифугирования с низкой скоростью производили
подсчет клеток с помощью счетчика ZMI Coulter 216013,
снабженного 256-канальным анализатором.
Во всех описанных ниже экспериментах in vitro примерно пятьдесят тысяч клеток инокулировали в 1 мл среды DME/F-12, содержащей 1% FBS на каждую 16 мм чашку и 12-луночную пластинку. Через 17 час после посева добавляли 1 мл свежей идентичной среды, дополненной 1% FBS ("абсолютный" контроль). В зависимости от плана эксперимента (см. выше и ниже) 1% FBS среду дополняли или не дополняли GF (факторами роста), или растворы пермеата с концентрацией 1 кг/2 л (вес хрящей/объем воды), и проводили фильтрацию в стерильных условиях. К этому дню (день 0) в некоторых образцах также производили подсчет клеток с целью определения эффективности нанесения (которая должна быть равной или выше 95%).
Через 48 ч после начала экспериментов клетки промывали и подвергали диссоциации по описанной выше методике и снова подсчитывали их количество. Число клеток выражали в процентах от числа полученного в "абсолютных" контрольных экспериментах. Каждую "абсолютную" или положительную контрольную группу, содержащую 1 или 5% FBS соответственно и каждую экспериментальную группу дополняли 1% FBS и индивидуальным фактором роста GF, либо хрящевым пермеатом, состоящим из тройных образцов.
Каждый эксперимент проводили во времени на клетках одного или двух пациентов и повторяли по крайней мере дважды.
Стимуляцию пролиферации фибробласта факторами роста (GF) или хрящевым пермеатом сравнивали со стимуляцией под действием 5% FBS.
В этих экспериментах GF, PDGF свиней (pPDGF) и человеческий рекомбинантный bFGF, hr bFGF (подаренный д-ру P. Brazeau из Farmitalia Carlo Erba, Милан, Италия) добавляли с концентрациями 10-100 нг/мл в 1% FBS соответственно. Через 48 ч после начала эксперимента клетки диспергировали с помощью системы Трипсин-EDTA и подсчитывали на счетчике Coulter. Все значения трех повторных экспериментов (колонки 1, 2 и 3), представленные ниже, равны двенадцатой части подсчетов в расчете на одну лунку (табл. 6).
Хотя факторы роста, подобные PDCF (тромбоцит-производный фактор роста) и bFGF (фактор роста основного фибробласта), демонстрируют стимулирующую активность на HTF, никакого эффекта, положительного или отрицательного, не наблюдалось при выращивании этих клеток в присутствии хрящевого пермеата (1 кг/2 л). Гипоплазиантный эффект также не наблюдался. Полученный результат подтверждает тот факт, что пермеат оказывает гипоплазиантный эффект, который является специфичным в отношении опухолевых клеток и не оказывает детектируемого влияния на нормальные клетки. Такой же хрящевой экстракт не оказывает влияния на другой тип фибробластовых клеток, HSF (фибробласты человеческой кожи; данные не представлены). Даже не проводя испытаний, можно предположить, что лиофилизат также не оказывает влияния на нормальные клетки.
Клинические испытания
Перед проведением предварительных
клинических испытаний сырой пермеат, полученный после ультрафильтрации, концентрировали в 2 и 20 раз, получая обогащенный
активный пермеат. Такие уровни концентраций получали на тангенциальной
проточной фильтрационной колонке с пористостью 1000 Да, которая понижала объем элюата в 2 и 20 раз. Концентрированный пермеат
фильтровали на миллипористом фильтре с пористостью 0,22 мкм. При обработке
хрящей альтернативным способом центрифугирования (с использованием центрифуги СЕРА с мембраной, имеющей пористость порядка
30 мкм) при десятикратном концентрировании достигалось получение
концентрированного экстракта почти с таким же уровнем содержания протеина, что и в случае указанного выше 20-кратно
сконцентрированного экстракта, например, 12 мг/мл (усовершенствованный способ)
вместо 14 мг/мл (способ, осуществленный в лабораторном масштабе). Стерильный 10-кратно сконцентрированный пермеат
распределяли аликвотами в 7 мл (около 85 мг протеинов) по стерильным колбам,
замораживали до -80oC в течение ночи и далее хранили при -20oC для последующего использования.
Основное различие между сырым и концентрированным пермеатом заключается в
концентрации содержащихся в них протеинов. Следует отметить, что в способе, используемом для определения содержания протеинов,
измеряют содержание азотистых соединений, а не только протеинов (метод
Kjeldahl) Кьельдаля. Этим можно объяснить, почему концентрация белков не повышается пропорционально уровню объемного
концентрирования, как это обычно имеет место при определении содержания протеина
методом Лоури (Lowry). Таким образом, предполагается, что стадия концентрирования позволяет осуществить проницаемость
водой, а также азотсодержащими соединениями с низким молекулярным весом.
Концентрированный пермеат использовали для лечения ангиогенеззависимых заболеваний. Два различных вида ангиогенеззависимых заболеваний подвергались тестированию на практике при лечении людей; первый тип представлял собой дерматологические нарушение (псориаз), а второй тип представлял собой заболевание раком (рак простаты).
Среди дерматологических заболеваний были выбраны случаи псориаза. Среди тестированных случаев псориаза интересно отметить различие между случаями псориаза, осложенного гиперкератозом и не осложненного этим явлением. Кератозный компонент такого заболевания не подвергается существенному воздействию per se концентрированного хрящевого пермеата, тогда как, в отличие от этого, ангиогенный компонент является мишенью для такой смеси активных ингредиентов. Приведенные ниже примеры иллюстрируют и подтверждают такое положение.
На пациенте, страдающем раком простаты, при его добровольном согласии, испытывали 10-кратно концентрированный хрящевой пермеат. На этом пациенте была применена серия последовательных традиционных терапий, которые давали временный успех. Этот пациент недавно начал принимать хрящевой экстракт после рецидива его ракового заболевания.
Представленные ниже результаты являются весьма обнадеживающими и на их основании можно предсказать пригодность сырого пермеата и его фракций для лечения всех ангиогенеззависимых заболеваний, а не только тех, что были подвергнуты специальному тестированию. Если заболевание характеризуется наличием ангиогенного компонента, то можно предполагать, что хрящевой экстракт настоящего изобретения окажется эффективным в этом отношении при условии его наличия в применяемой композиции в эффективном количестве и обеспечения приемлемой формы такой композиции для надлежащего применения. Поэтому следует принимать во внимание, что настоящее изобретение не ограничивается следующими конкретными композициями, поскольку специалист в данной области сможет получить большое число композиций, выбор которых будет определяться типом применения и природой больной ткани. Композиции можно применять различными способами, например, местно, орально, сублингвально, ректально, внутривенно, внутримышечно, путем диффузии и т.п.
ПСОРИАЗ
Следующую ниже композицию дерматологического назначения готовили и испытывали для
проверки ее эффективности на пациентах, страдающих псориазом:
- Эмульгэйд (Emulgade)TM CLB 29%
(вес/вес),
- 20X сырой пермеат 69,5% (вес/вес),
- Гермабен
(Germaben)TM 11, 1% (вес/вес), и
- Lavandula Angustifolia 0,5% (вес/вес)
ЭмульгэйдTM CLB, представляющий собой смесь стеаратных сложных эфиров, жирных спиртов и
неионных эмульгаторов (приобретенный у Henkel Canada Ltd.), нагревали при 65-70oC при перемешивании.
Нагревание прекращали, продолжая перемешивать смесь. При достижении температуры смеси
45oC добавляли эфирное масло Lavandula Augustifolia и предохраняющие агенты ГермабенTM 11
(диазонидил мочевина 30%, метилпарабен 11%, пропилпарабен 3% и пропилен гликоль 56%;
приобретенный у Suttor Laboratories, Нью Джерси, США). При достижении смесью температуры 30oC добавляли
хрящевой экстракт. Полученная таким образом композиция представляла собой однородный
нежирный крем; в результате изменения процентного количества ЭмульгэйдаTM могут быть получены другие
формы дерматологических композиций с различной вязкостью в соответствии с указаниями
производителя (молоко, лосьон, мазь). Другие связующие или эксципиенты могут использоваться для получения паст,
гелей и любых других форм трансдермальных препаратов.
Указанную выше рецептуру применяли дважды в день в течение двенадцати недель на группе из десяти пациентов (местное применение), страдающих псориазом, которые реагировали на применяемые традиционные терапии, но с течением времени эффект лечения исчезал. Для такого исследования отбирали пациентов с аналогичной и симметричной степенью псориаза на обеих сторонах. Такие испытания проводили дупликатно-слепым методом, причем ни дерматолог, ни пациенты не знали, какую из больных сторон обрабатывали композицией, содержащей хрящевой экстракт, и какую из сторон обрабатывали контрольной композицией. Значительное улучшение наблюдалось у пяти пациентов с псориазом, осложненным гиперкератозом; фотографии частей тел двух пациентов показаны на фиг. 9a, 9b. На фиг. 9a продемонстрировано, что у пациента, больного псориазом с явлениями гиперкератоза, несмотря на это, наблюдается значительное уменьшение покраснения, связанное с отсутствием зуда, всего лишь через месяц после начала лечения. Однако гиперкератоз остается важным компонентом заболевания. Фотографии второго пациента, страдающего псориазом, не осложненным гиперкератозом (фиг. 9b), демонстрируют более значительное улучшение состояния после лечения в течение трех месяцев. Поскольку псориаз, по-видимому, является многофакторным заболеванием, предполагается, что реакция пациентов зависит от значимости вовлечения ангиогенного фактора в развитие и укоренение такого болезненного состояния. Вероятно, что улучшенные результаты могут быть получены в том случае, если рецептору такого типа дополнить другими терапевтическими агентами, адресованными другим факторам болезни (кератолитические агенты, противовоспалительные агенты, антигистамины, иммуносупрессоры и т.п.).
Такое дополнение может производиться путем изменения рецептуры таким образом, чтобы она включала эффективное количество, например, кератолитического агента. Такое дополнение также может достигаться путем отдельного применения такого дополнительного терапевтического агента, одновременно или после применения настоящей рецептуры для местного применения. Кроме этого, дополнительное лечение не требует того, чтобы применение указанных лекарственных средств производилось одинаковыми способами.
Описанная выше рецептура не проявляет системного эффекта (такой эффект ограничивается воздействием лишь на пораженный участок) и не оказывает вторичного действия несмотря на ее высокое содержание в хрящевом экстракте.
АКНЕ (угри)
Хотя, насколько известно авторам изобретения, акне не
классифицировали, как заболевание или расстройство, связанное с наличием ангиогенного компонента,
представлялось заманчивым провести тестирование жидкого хрящевого экстракта на пациентах, страдающих
таким заболеванием. С целью экспериментального применения хрящевого экстракта на пациентах,
страдающих акне, была приготовлена следующая рецептура,%:
Карбопол (Carbopol)TM - 1,2
Очищенная вода - 77,2
NaOH - 0,3
Феноксетол (Phenoxetol)TM - 0,3
Твин (Tween) 80TM - 0,3
2 X хрящевой экстракт - 20,0
40 X
экстракт алое - 0,5
2 X хрящевой экстракт содержал 9-12 мг/мл протеинов.
Такая рецептура демонстрировала значительное улучшение состояния кожи пациентов, пораженной более или менее серьезными формами акне (воспалительная акне и кистойная акне, данные не приведены).
Такие удивительные результаты могут быть связаны с антиангиогенным эффектом (обнаруживая тем самым ангиогенный компонент в заболевании акне), либо они могут быть связаны с наличием активных ингредиентов, обеспечивающих воздействие, отличное от антиангиогенного эффекта. Здесь следует еще раз отметить, что такой же экстракт проявляет по крайней мере еще один эффект, отличный от антиангиогенного; прямой гипоплазиантный эффект был продемонстрирован на линиях раковых клеток.
РАК
На одном пациенте с раком предстательной железы испытывали
10-кратно концентрированный пермеат. Диагноз аденокарциномы был поставлен в 1986 г. Тогда же была предпринята радиотерапия. В
1991 г. уровень содержания PSA (антиген сыворотки предстательной железы)
составил 138 мкг/л, тогда как обычный приемлемый верхний предел этой величины составляет 4 мкг/л. Затем этот пациент был
подвергнут совершенно другому лечению путем кастрации совместно с
антиандрогенной терапией (Эуфлекс (Euflex)TM). Такое лечение было эффективным в течение трех лет, после чего уровень
содержания PSA снова начал увеличиваться. Начиная с июня 1994 г., этот
пациент принимает 10X пермеат (ежедневная сублингвальная доза около 75 мг протеина/7 мл дистиллированной воды, что эквивалентно
дозе 1-1,5 мг/кг веса тела/день).
Хотя значительная часть указанной дозы проглатывается, вероятно, она абсорбируется в желудочно-кишечном тракте, если полагаться на результаты, полученные при лечении животных с помощью DMBA (см. выше). Уровень содержания PSA понизился с 12 до 0,9 мкг/мл (последние результаты, полученные в декабре 1994 г.). Дозовый режим может быть также изменен по желанию в соответствии с видом применения, биодоступностью активных ингредиентов и желаемой агрессивностью контролирования такой патологии. В то же время отсутствие токсичности было проверено на крысах (см. приведенные выше примеры) и на людях (данные не представлены).
В другом эксперименте in vivo, осуществленном на крысах, обработанных DMBA, дозировка жидкого экстракта составляла 190-220 мг протеинов/кг веса тела, и такая дозировка, как было показано ранее, оказывает значительное влияние на уменьшение площади опухолевых кровеносных сосудов (55% при одновременном применении значительно более высокой дозы лиофилизата). Поэтому предполагается, что дозировка в интервале 1-200 мг/кг веса тела в день охватывает приемлемые средние дозы (ED50 ) для лечения рака в результате уменьшения или уничтожения ангиогенеза.
Полученные результаты демонстрируют большой потенциал жидкого хрящевого экстракта в лечении ангиогенеззависимых заболеваний. Количество хрящевого экстракта, а также его рецептуры могут, по желанию, изменяться с целью удовлетворения конкретных потребностей. Предполагается, что столь же эффективными окажутся фракции сырого пермеата, которые содержат активный ингредиент. Такие фракции ожидают дальнейшего охарактеризования.
Основываясь на содержании протеина, можно отметить, что рецептуры для местного применения на коже могут содержать широкий интервал дозировок хрящевого экстракта. Так, например, в двух конкретных категориях тестированных случаев заболевания соотношение конечных концентраций протеина в рецептурах для лечения псориаза к соответствующей концентрации в рецептурах для лечения акне составляет величину 4-5, в то время как отношение разбавлений пермеата составляет 35. Для всех предсказанных применений, направленных на подавление ангиогенеззависимых заболеваний (от глазных капель до дерматологических и противораковых лекарственных рецептур), предполагается, что минимальная конечная концентрация протеина в сыром пермеате должна иметь очень низкое значение (менее 0,1 мг/мл). Такой пониженный интервал дозировок зависит от доступности и проницаемости активных ингредиентов в отношении места их действия, а также от эффективности захвата таких ингредиентов и чувствительности или реакции ткани на ангиогенные ингибиторы. Верхний предел конечной концентрации протеина в рецептурах для таких же применений в настоящее время неизвестен. Испытанные наивысшие конечные концентрации составляли около 9 мг/мл протеинов в рецептуре, предназначенной для лечения псориаза, и около 12 мг/мл в единичной дозе объемом 7 мл, применяемой в случаях лечения рака предстательной железы.
Поскольку сырой пермеат не может быть лиофилизирован без потери активности, предполагается, что наивысшие дозировки зависят от ограничения по концентрации при практическом применении сырого пермеата, например, до получения концентрированного сиропа.
Требуемые материалы:
- холодильники,
- хирургические инструменты,
- мясорубка,
- пластиковые мешки,
- промышленный смеситель (3-скоростной
смеситель Варинга (Waring), приобретенный у фирмы Fisher Scientific),
- система для очистки воды (обратный осмос и 0,1 мкм фильтрация, Continental Water System, модель PRE 2202, серийный
номер 91089, Modulab Bioscience RQ/Polishing System, приобретенный у
фирмы Fisher Scientific, Монреаль, Квебек). Такая система обеспечивает получение апирогенной воды высокого качества,
- прецизионные весы Меттлер (Mettler) серии AE, приобретенные у Fisher
Scientific,
- центрифуга Сорвалл (Sorvall) RC-285, приобретенная у DuPont, Канада,
- центрифуга CEPA,
- нейлоновый карман пористостью 30 мкм,
- автоклав
(автоматический паровой стерилизатор Sanyo, модель MAC 350P/,
- 500 мл резервуары Nalgene, стерилизованные при 132oC в
течение 10 мин и высушенные в течение 35 мин,
- система из конических фильтров Whatman Reeve Angel пористостью 24 мкм,
- ультрафильтрационная колонка (молекулярно-весовое отсечение
500 кДа и (1 кДа в случае необходимости такого
применения); поверхность: 25 фут2 (2,3 м2); скорость потока: 130 л/мин; давление на входе: 30 фунт/дюйм2 (2,1 кг/см2); давление на выходе: 5 фунт/д2 (0,35 кг/см2); приобретено у фирмы Koch Membrane Systems Inc., Вилмингтон, MA, США),
- насос для санитарной центрифуги (Monarch
Industries, модель ACE-S100, типа A) для
обеспечения потока скоростью 130 л/мин,
- стерильная ячейка (ячейка с ламинарным протоком NuAire, приобретенная у Ingram & Bell),
- 0,
22 мкм стерильные фильтры Миллипак
(Millipack-60),
- стерильные прозрачные или желтые стеклянные бутыли,
- концентратор DC-10 Амикон (Amicon),
- Ротофор Биорад (Biorad)
170-2950,
- фильтры Амикон
S10y10, S10Y30 и S10Y100 со значениями отсечения 10, 30 и 100 кДа соответственно
- FPLC Pharmacia 216007 (компьютер Pharmacia 216 014),
- Хилстэнд-300 26 мм/60 см (Pharmacia),
- колонка Супероза (Syperose S-12) 10 мм/30 см (Pharmacia),
- лиофилизатор Лабконко (Labconco) 10273 A.
Выше было описано настоящее изобретение и следует иметь в виду, что специалист в данной области техники, в рамках своих возможностей и знаний, не нарушая сущности приведенного описания, сможет осуществить модификации путем замены некоторых элементов изобретения на практике их эквивалентами, которые позволят достичь тех же целей, что и настоящее изобретение. Предполагается, что такие изменения охватываются настоящей заявкой.
Реферат
Изобретение относится к акульим хрящевым экстрактам и способу их получения. Способ состоит в получении смеси целого хряща с водным раствором, имеющим нейтральное значение рН, предпочтительно с чистой водой, причем такую смесь подвергают центрифугированию, и осадок после центрифугирования и надосадочную жидкость сохраняют для дальнейшей обработки. Осадок после центрифугирования лиофилизируют и тестируют на противоопухолевую и антиангиогенную активности in vivo и in vitro в присутствии или в отсутствие недосадочной жидкости. Показано, что надосадочная жидкость обладает антиангиогенной и опухолево-регрессирующей активностями in vivo. В результате фракционирования надосадочной жидкости охарактеризовывали некоторые из ее активных компонентов, которые демонстрируют прямой ингибирующий эффект на линиях опухолевых клеток. Способы обеспечивают получение хрящевых экстрактов, повышающих эффективность лечения ангиогенеззависимых заболеваний. 7 с. и 17 з.п. ф-лы, 6 табл., 9 ил.

Формула
Липиды, % - 0,10
Протеины, % - 1,77
Влажность, % - 98, 8
Натрий, мг/100г - 33,6
Калий, мг/100г - 39,2
Кальций, мг/100г - 2,0
Магний, мг/100г - 1,1
Цинк и железо - Следы
4. Жидкий экстракт по п.1, включающий: (I) жидкую фракцию, имеющую молекулярный вес от около 1 до около 2,5 кДа, измеренный методом быстрой жидкостной хроматографии на протеин (FPILC); (II) жидкую фракцию, имеющую молекулярный вес от около 29 кДа и изоэлектрическую точку от около 5,3 до около 6,26, измеренную методом электрофореза после разделения на устройстве ротофор; (III) жидкую фракцию, имеющую молекулярный вес около 35 кДа и изоэлектрическую точку от около 7,64 до около 7,94, измеренную методом электрофореза после разделения на устройстве Ротофор; (IV) жидкую фракцию, имеющую молекулярный вес около 48 кДа и изоэлектрическую точку от около 7,29 до около 7,94, измеренную методом электрофореза после разделения на устройстве Ротофор; (V) жидкую фракцию, имеющую молекулярный вес около 60 кДа и изоэлектрическую точку от около 5,30 до около 6,26, измеренную методом электрофореза после разделения на устройстве Ротофор.
28.04.94 - по пп.1 - 23;
03.02.95 - по п.24.

Комментарии