Фармацевтическая композиция иммуностимулирующих веществ мурамилпептидной природы - RU2768484C1
Код документа: RU2768484C1
Чертежи
Описание
Изобретение относится к области фармакологии и может быть использовано для блокирования рецидивов инфекционных заболеваний и усиления действия вакцин.
Мурамилдипептид (MDP, N-ацетилмурамил-L-аланил-D-изоглутамин)-синтетический иммунореактивный пептид, состоящий из N-ацетилмураминовой кислоты, присоединенной к короткой аминокислотной цепи L-Ala-D-isoGln. Впервые он был идентифицирован в пептидогликане бактериальной клеточной стенки в качестве активного компонента полного адъюванта Фрейнда (FCA). В 1974 году было обнаружено, что MDP является минимальной структурой, необходимой для эффективности FCA, одного из самых мощных и широко используемых адъювантов в экспериментальных моделях на животных. Мурамилдипептиды известны своими иммуномодулирующими свойствами. Мурамилдипептиды - это мельчайшие биологически активные компоненты клеточных стенок бактерий. Производные мурамилдипептида проявляют значительные иммуномодулирующие свойства через один из рецепторов PRRs (Pattern Recognition Receptors), нуклеотидсвязывающий олигомеризационный домен 2 (NOD2) рецептора (Girardin S. et al., 2003. J Biol Chem. 278(11): 8869-72; F. Coulombe et al., 2012 PloS ONE, 7 (5): Article ID e36734). Мурамилдипептиды активируют макрофаги и другие клетки иммунной системы для уничтожения раковых клеток (I Jakopin, 2013. Современная медицинская химия, 20 (16): 2068-2079; Ogawa et al., 2011. CurrBioact Compd. 7(3): 180-197). Однако Мурамилдипептиды являются пирогенным по своей природе. С целью снижения его пирогенного эффекта до настоящего времени разработан, синтезирован и испытан ряд производных МДП для повышения специфических функций при одновременном подавлении пирогенности.
Известна фармацевтическая композиция, обладающая иммуностимулирующим действием, на основе лигандов паттерн-распознающих рецепторов (RU № 2497541, кл. A61K 38/05, A61K 31/739, A61P 31/00, A61P 37/04, 10.11.2013), содержащая фрагменты пептидогликана. Композиция также содержит липополисахарид или липид А, а в качестве фрагмента пептидогликана используют фрагмент пептидогликана, содержащий в своей структуре мурамилдипептид структурной формулы N-ацетилмурамил-L-аланил-D-изоглютамин при следующем соотношении компонентов, мас.%:
- мурамилпептид, структурной формулы N-ацетилмурамил-L-аланил-D- изоглютамин от 0,00001 до 0,01;
- липополисахарид или липид А от 0,00001 до 0,01;
- растворитель остальное.
Используют мурамилпептид, полученный путем химического синтеза из клеточной стенки бактерий, а липополисахарид или липид А, полученные путем химического синтеза из клеточной стенки бактерий.
Однако данный препарат, содержащий очищенные бактериальные или их синтетические аналоги мурамилдипептидов, направлен на модулирование только инфекционного воспаления.
Проблемой изобретение является создание фармацевтической композиции, обладающей способностью запечатлевать вирусные антигены при лечении хронических вирусных заболеваний.
Техническим результатом изобретения является повышение адъювантной активности для терапевтического или профилактического использования вакцин.
Поставленная проблема и технический результат достигаются тем, что фармацевтическая композиция иммуностимулирующих веществ мурамилпептидной природы согласно изобретению содержит лиганды NOD2-рецептора, включающая в качестве веществ мурамилпептидной природы смесь веществ, выделенных из экстракта мышц и кожи ужа обыкновенного Natrix natrix путем препаративного разделения с помощью тонкослойной хроматографии, с получением пятен на хроматограмме со значениями Rf = 0,06 и Rf = 0,57, при этом брутто формулы выделенных веществ, соответствующих пятну на хроматограмме со значением Rf = 0,06 соответствуют C22H33O2N6 или C19H35O5N5 с M=413.26448 Да, а также C20H37O2 N6 или C17H39O5 N5с M=393.2960 Да, а брутто формулы выделенных веществ, соответствующих пятну на хроматограмме со значениям Rf = 0,57 - соответствуют C22H43O8 или C20H41O7N3, или C18H39O6N6 с M=435.29441 Да.
Изобретение иллюстрируется чертежами, где на фиг. 1 представлена
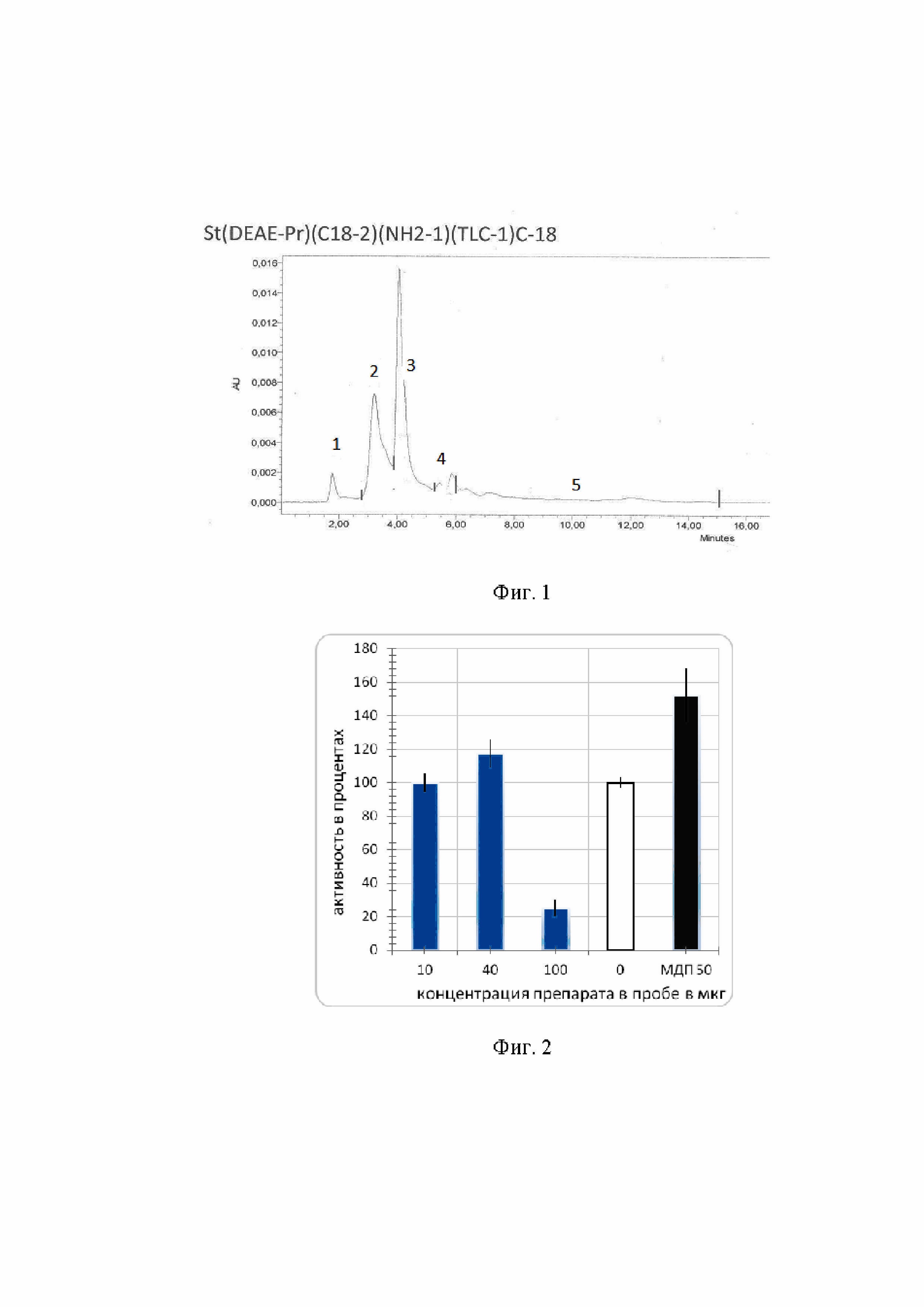
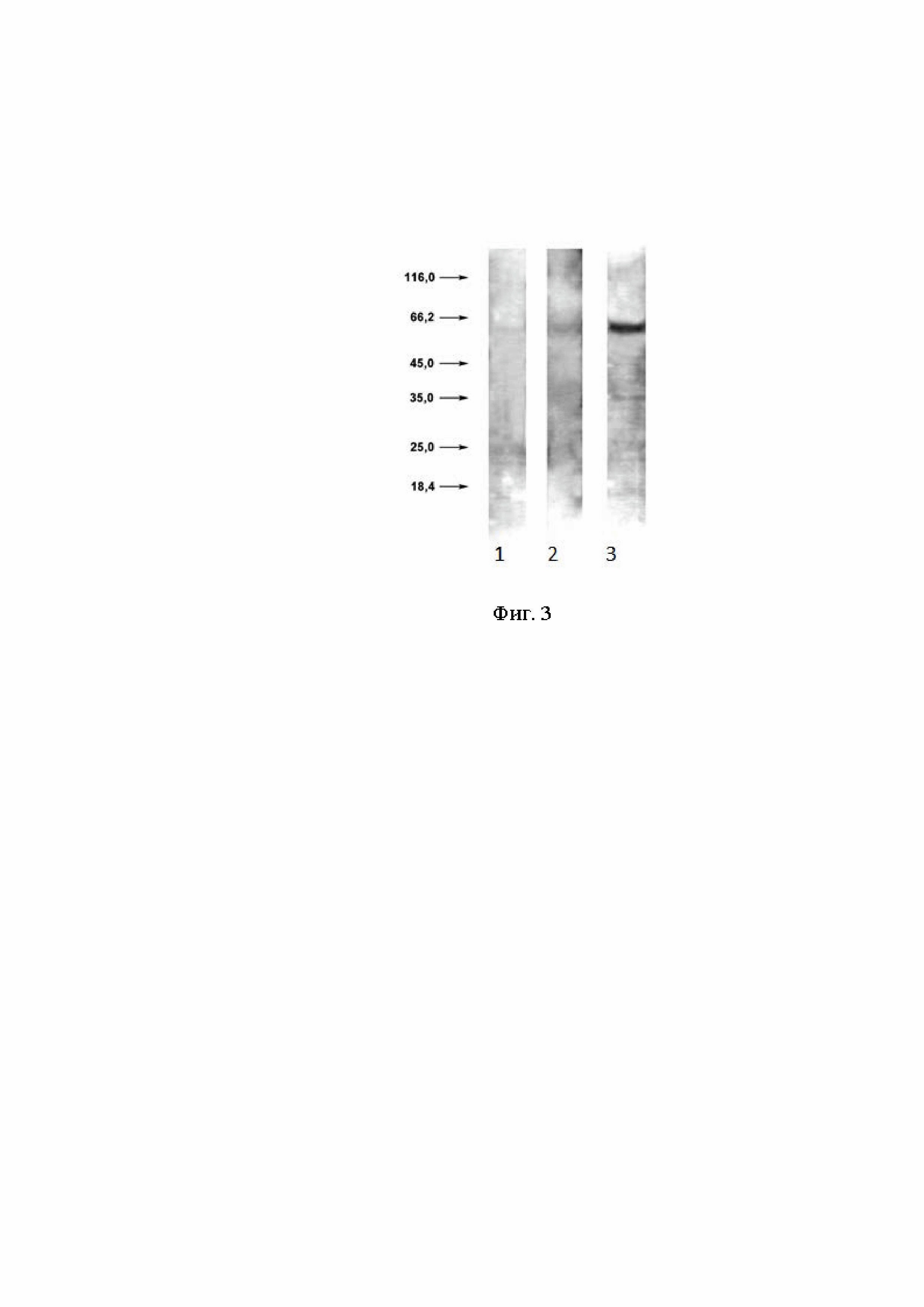
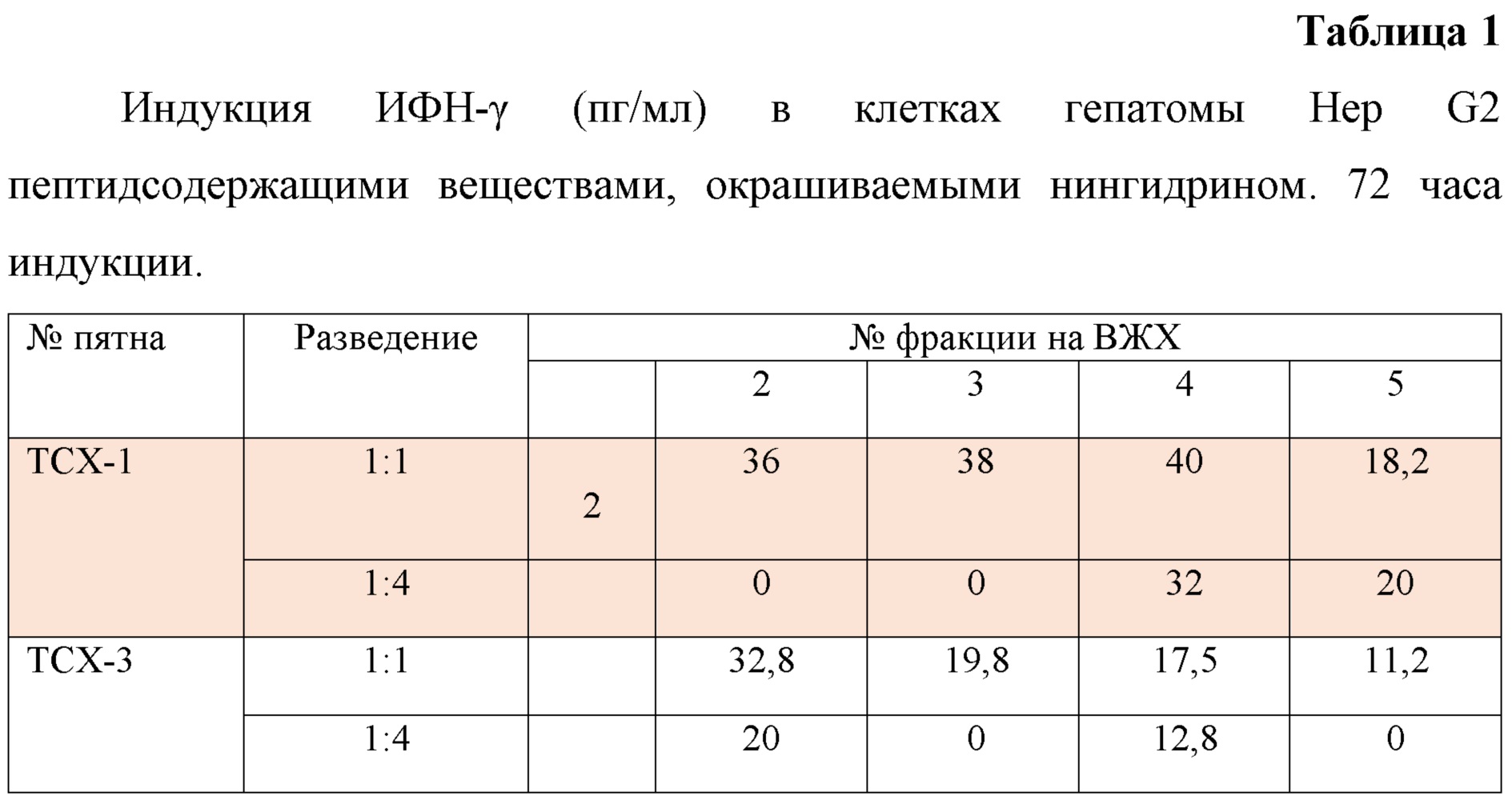
хроматограмма разделения пятна 1, полученного на тонкослойной хроматографии (ТСХ), произведенное аффинной хроматографией высокого давления на колонках с носителем C18 Discovery в градиенте растворителей вода: 10% ацетонитрил; на фиг. 2 – зависимость влияния концентрации пептидсодержащих веществ на активность HEK-BlueTM-hNOD2 клеток; на фиг. 3 - Вестерн-блот вирионов ВГС, выявляемых с помощью антител из сывороток мышей, зараженных штаммом 1b, которые получали пептидсодержащие вещества на 7 сутки после однократного введения препарата.
Вещества выделяют с помощью ряда хроматографических очисток водного экстракта из мышц и кожи ужа обыкновенного (Natrix natrix).
Приготовленную тушку ужа помещают в емкость с 0,1N HEPES-буфером pH 7,0 – 7,2 и нагревают содержимое емкости до кипения воды, и кипятят в течение 40 – 120 минут. В результате кипячения получают водную вытяжку, содержащую водорастворимые вещества. Полученную водную вытяжку очищают хлороформом. Затем осуществляют лиофильную сушку целевого продукта, которую ведут под вакуумом при температуре 0 – (-2)°С.
В результате получают порошкообразный препарат желтого цвета, представляющий собой лиофилизированную смесь низкомолекулярных гидрофильных веществ.
Полученный продукт разводят и подвергают очистке на DEAE-Сефарозе в том же буфере. Отбирают фракцию, не сорбирующуюся на этом носителе в данном растворе.
Затем проводят гель-фильтрацию на Сефадексе G-15 или G-25, отбирают содержимое 2-х первых пиков при λ= 220 нм из разделяющихся на данном носителе. Отобранный материал смешивают и наносят на колонку С18 Discovery. Собирают материал 1-го выраженного пика при λ = 220 нм. Содержимое концентрируют под вакуумом. Наносят на колонку с NH2- Сефарозой. Собирают 1-й пик, виден как при λ = 220 нм, так и при λ = 280 нм.
Выделенные вещества окрашивают нингидрином после разделения тонкослойной хроматографии (ТСХ) с силикагелем в качестве носителя при разделении в смеси изопропанол : вода = 1: 1. Их количество можно определить микробиуретовым методом. Следовательно, данные выделенные вещества содержат аминогруппу и пептидную связь.
Эти вещества были очищены из экстракта примерно в 700 – 800 раз и разделены на ТСХ препаративно. Из пяти наиболее выраженных по окраске веществ наибольшей стимулирующей интерфероны активностью обладали два с наименьшей величиной Rf (фиг. 1). Пятно 1 (Rf = 0,06) содержало вещества c брутто формулами C22H33O2N6 или C19H35O5N5 (M=413.26448 Да); C20H37O2 N6 или C17H39O5 N5(M=393.2960 Да). Пятно 2 (Rf = 0,57), C22H43O8 или C20H41O7N3, или C18H39O6N6 (M=435.29441 Да).
Полученные вещества имеют определенное химическое сходство с мурамилдипептидом (MDP) грамположительных бактерий. Вещества из пятен, также как MDP, расщепляются протеиназой К и не лизируются трипсином, что указывает на наличие сходных или идентичных аминокислот, образующих пептидную связь. Вещества имеют также сходную подвижность в системе изопропанол : вода = 1 : 1. Вещества окрашиваются нингидрином и количественно определяются микробиуретовым методом.
На фиг. 1 видно, что пептидсодержащие вещества из экстракта ужей значительно отличаются от классических молекул MDP. Судя по небольшому количеству атомов кислорода в брутто формулах, они не имеют углеводных остатков, и, исходя из этих же брутто формул, эти вещества больше похожи на ромуртид, чем на природные MDP.
Разделение пятна 1, полученного на ТСХ, производили аффинной хроматографией высокого давления на колонках с носителем C18 Discovery в градиенте растворителей вода : 10% ацетонитрил (Фиг. 1).
Вещества, содержащиеся в обоих пятнах, активно стимулируют продукцию интерферонов (ИФН), при этом их активность характеризуется разными концентрационными кривыми, что указывает на их различающиеся взаимодействия с рецептором. Вещества из 2-х остальных пятен - малоактивны.
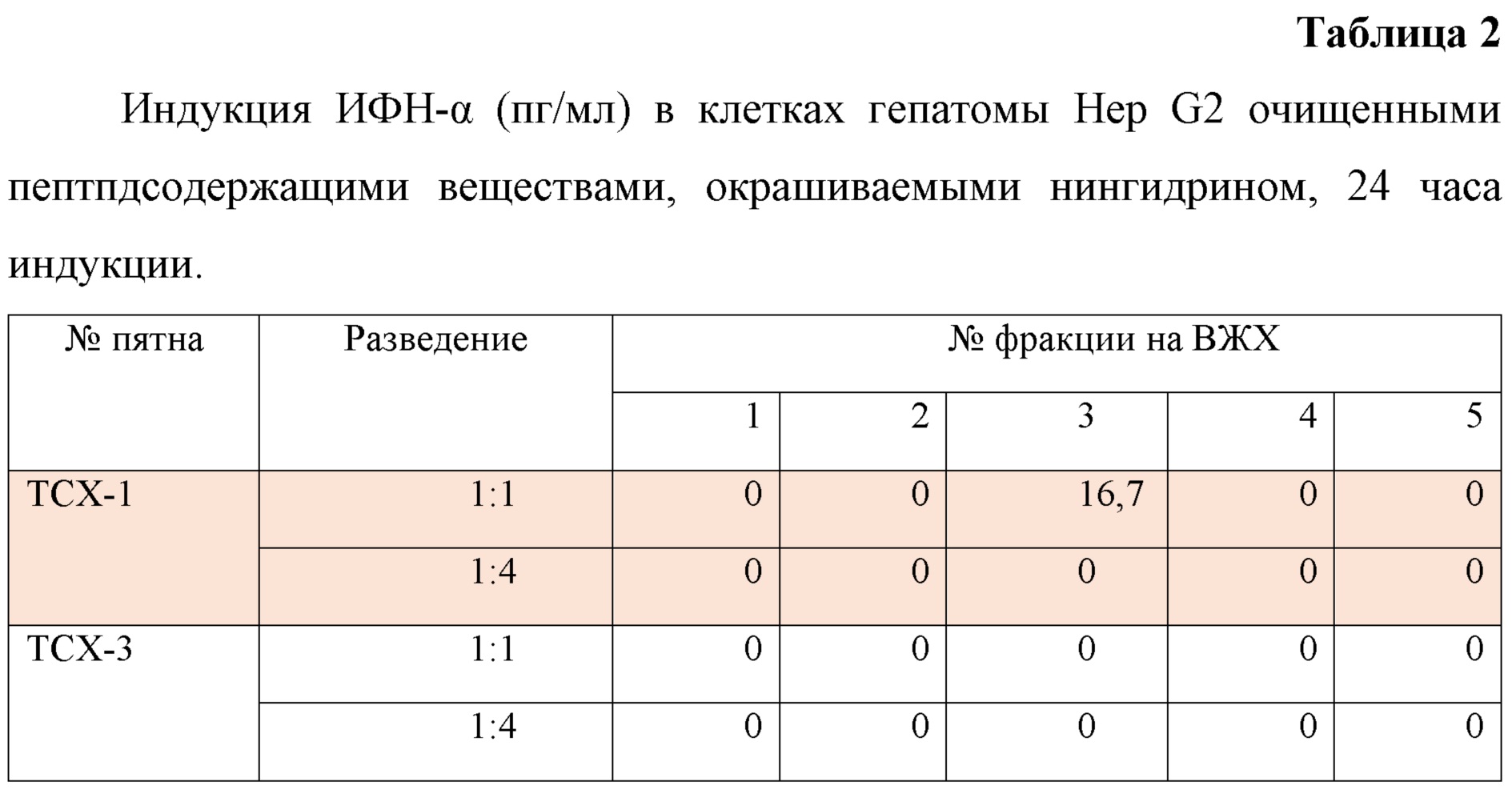
Как видно из табл.1 и 2, пептидсодержащие вещества обладают ИФН-индуцирующей активностью. Практически все они стимулируют увеличение продукции ИФН-γ и не стимулируют продукцию ИФН-α, следовательно, не взаимодействуют с толлподобным рецептором 4 (TLR-4), активация которого характерна для Стимфорте (Мальдов и др. 2011).
Судя по сходству с MDP и тому, что основная масса веществ этих фракций стимулирует продукцию только ИФН-γ, они являются лигандами NOD2-рецептора. Это выявлено на основании способности стимулировать активность клеток HEK-BlueTM-hNOD2 (клеточная система на основе клеток HEK, позволяющая определять лиганды NOD2-рецептора), и доказывает, что стимулируется активность именно NOD2-рецептора. В клетках HEK-Blue™-hNOD2 эти вещества в концентрации 10 мкг/мл неактивны, в концентрации 40 мкг/мл стимулируют ответ NOD2-рецептора на 33% по отношению к MDP (Фиг. 2). Данный феномен позволяет установить, что биологический эффект обнаруженных веществ производится через тот же NOD2-рецептор, что и MDP.
Условные обозначения к фиг. 2:
10 - Вещества, содержащие пептиды и окрашивающиеся нингидрином 10 мкг/мл (по микробиурету)
40 - Вещества, содержащие пептиды и окрашивающиеся нингидрином 40 мкг/мл.
100 - Вещества, содержащие пептиды и окрашивающиеся нингидрином 100 мкг/мл.
0 - Без воздействий. Негативный контроль - MDP 50 – позитивный контроль MDP 50 нг/мл.
Таким образом, доказано, что именно данные вещества являются MDP-подобными не только химически, но и по биологическому действию.
Для MDP и других лигандов NOD2 характерно усиление иммунной памяти (адьювантный эффект). В настоящее время активно разрабатывается технология вакцин в сочетании с адъювантами. Наиболее перспективными считаются адъюванты, действующие через патоген-ассоциированные молекулярные паттерны (PAMP). Адъюванты типа PAMP являются лигандами для толл-подобных рецепторов и могут непосредственно влиять на дендритные клетки, изменяя силу, потенцию, скорость, продолжительность, смещение, ширину и объем адаптивного иммунитета (Powell et al., 2015). Из всех адъювантов типа PAMP наиболее эффективными являются лиганды NOD2- рецептора (Gutjahr et al., 2020; Khan et al., 2020).
Данные свойства описанных веществ были проверены.
Пример 1
У мышей вызывали хроническую инфекцию вируса гепатита С (ВГС) на одиннадцатый день инфекции им ввели смесь пептидсодержащих веществ в дозе 50 мкг/мышь (6 мышей). 6 мышей получили физраствор вместо препарата и 6 мышей были взяты в качестве контроля незараженными. На 18 день инфекции у мышей была взята кровь, и из проб крови получены сыворотки. Сыворотки в каждой группе были смешаны и проверены на способность связываться с белками ВГС в Вестернблоте (фиг. 3).
Примечание: Материал, анализируемый в Вестернблоте: штамм ВГС - 106 БОЕ на дорожку; Сыворотки 18-й сутки инфекции гепатитом С: 1 – контроль №1. Источником сыворотки служили здоровые мыши 2 - контроль, без препарата 18-й сутки инфекции мышей ВГС, 3 - 18-й сутки инфекции 7-е сутки после однократного введения пептидсодержащих веществ (50 мкг/мышь);
Как видно из фиг. 3, антитела мышей, получавших пептидсодержащие вещества, значительно лучше связываются с вирусным белком Е2 (наиболее представленным в ВГС), что безусловно свидетельствует о адьювантном эффекте, вызванном этими веществами.
Пример 2
Выделенные поверхностные белки вируса гриппа (А/Калифорния/7/09 (Н1N1) и А/Москва/1/09 (Н1N1), содержащие 50 нг гемагглютинина (доза для каждой мыши) вводили подкожно трём группам мышей по 10 мышей в каждой. Были использованы белые беспородные мыши женского пола массой 14-16 г. Одна из этих групп была также обработана смесью пептидсодержащих веществ по 50 мкг на каждую мышь однократно в момент введения вирусных белков. Затем через 7 дней вводили разрешающую дозу вируса гриппа - А/Калифорния /7/09 (Н1N1) с множественностью 10 ЛД50, которая вызывала гриппозную пневмонию мышей. В группе без предварительного введения вакцины (вирусных белков) гибель мышей от гриппозной пневмонии началась на третий день после заражения, и к седьмому дню все мыши погибли.
Средняя продолжительность жизни в группе контроля составила 4,2 ± 1,1 дня. В группе, которая получала только вакцину, выжило 5 мышей. Средняя продолжительность жизни мышей была 14,2 ± 2,1 дня. В группе мышей, которым вводили вакцину и пептидсодержащие вещества, выжили все животные.
Так как препарат вводили за 7 дней до введения патогенного вируса, то можно исключить действие этих веществ непосредственно на вирус гриппа или на стимуляцию продукции интерферонов, а эффект может быть связан только с усилением действия вакцины.
Препарат прошел стадию доклинических испытаний.
Реферат
Изобретение относится к области фармакологии и может быть использовано для блокирования рецидивов инфекционных заболеваний и усиления действия вакцин. Предлагаемая композиция иммуностимулирующих веществ мурамилпептидной природы, содержащая лиганды NOD2-рецептора, включает в качестве веществ мурамилпептидной природы смесь веществ, выделенных из водного экстракта мышц и кожи ужа обыкновенного Natrix natrix путем препаративного разделения с помощью тонкослойной хроматографии, с использованием силикагеля в качестве носителя при разделении в смеси изопропанол:вода = 1:1, с получением пятен на хроматограмме со значениями Rf = 0,06 и Rf = 0,57, при этом брутто формулы выделенных веществ, соответствующих пятну на хроматограмме со значением Rf = 0,06 соответствуют C22H33O2N6 или C19H35O5N5 с M=413.26448 Да, а также C20H37O2 N6 или C17H39O5 N5с M=393.2960 Да, а брутто формулы выделенных веществ, соответствующих пятну на хроматограмме со значениям Rf = 0,57 – соответствуют C22H43O8 или C20H41O7N3, или C18H39O6N6 с M=435.29441 Да. При этом указанный водный экстракт мышц и кожи ужа обыкновенного получен путем кипячения приготовленной тушки ужа в 0,1 N HEPES-буфере pH 7,0-7,2, предварительно очищен хлороформом, затем лиофильно высушен под вакуумом при температуре от 0 до - 2°С до получения порошкообразного препарата, разведен в воде и очищен с помощью ряда хроматографических очисток: на DEAE-Сефарозе в том же буфере с отбором фракции, не сорбирующейся на этом носителе в данном растворе, с помощью гель-фильтрации на Сефадексе G-15 или G-25 с отбором содержимого двух первых пиков при λ= 220 нм из разделяющихся на данном носителе и смешением отобранного материала, на колонке С18 Discovery с отбором материала первого выраженного пика при λ = 220 нм с концентрированием содержимого под вакуумом, на колонке с NH2-Сефарозой со сбором первого пика, видимого как при λ = 220 нм, так и при λ = 280 нм. Техническим результатом изобретения является повышение адъювантной активности для терапевтического или профилактического использования вакцин. 2 табл., 2 пр., 3 ил.

Комментарии