Стимуляция пути wnt при перепрограммировании соматических клеток - RU2492232C2
Код документа: RU2492232C2
Чертежи



Описание
ГОСУДАРСТВЕННОЕ ФИНАНСИРОВАНИЕ
Описанное в данном документе изобретение было поддержано, полностью или частично, грантами 5-RO1-HDO45022, 5-R37-CA084198 и 5-RO1-CA087869 для RJ и грантом NIH HG002668 от Национальных институтов здравоохранения. Правительство Соединенных Штатов имеет определенные права на изобретение.
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Данной заявкой испрашивается приоритет по отношению к предварительной патентной заявке США 60/967028, зарегистрированной 31 августа 2007 г., и предварительной патентной заявке США 61/188190, зарегистрированной 6 августа 2008 г., обе из которых включены в данный документ посредством ссылок.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Стволовые клетки представляют собой клетки, которые способны самообновляться и давать начало более дифференцированным клеткам. Эмбриональные стволовые (ЭС) (ES) клетки могут дифференцироваться во многие типы специализированных клеток, которые в совокупности составляют тело. Свойство плюрипотентности, помимо того, что оно представляет колоссальный научный интерес, придает ЭС клеткам человека большой клинический потенциал для применений в регенеративной медицине, такой как клеточная/тканевая заместительная терапия заболеваний.
В настоящее время используют несколько различных способов получения ЭС клеток. В одном способе линию ЭС клеток получают из внутренней клеточной массы нормального эмбриона на стадии бластоцисты (смотри патенты США №№ 5843780 и 6200806, Thompson, J. A. et al. Science, 282: 1145-7, 1998). Во втором способе для создания плюрипотентных ЭС клеток используют перенос ядра соматической клетки (SCNT). По данной методике ядро удаляют из нормальной яйцеклетки, тем самым удаляя генетический материал. Ядро донорской диплоидной соматической клетки вводят непосредственно в безъядерный ооцит, например, при помощи микроманипуляции, либо донорскую диплоидную соматическую клетку помещают рядом с безъядерной яйцеклеткой и проводят слияние двух клеток. Полученная клетка обладает потенциалом развития в ранний эмбрион, из которого можно получать часть, содержащую продуцирующую стволовые клетки внутреннюю клеточную массу. Согласно третьему способу, ядро человеческой клетки трансплантируют в безъядерный ооцит животного, относящегося к виду, отличному от вида донорской клетки. Смотри, например, патентную публикацию США № 20010012513. Полученные клетки-химеры используют для продукции плюрипотентных ЭС клеток, особенно плюрипотентных ЭС клеток, подобных человеческим. К недостаткам данного способа относится то, что данные клетки-химеры могут содержать неизвестные вирусы и сохранять митохондрии животных.
Традиционные способы выделения ЭС клеток имеют ряд ограничений при использовании для получения человеческих ЭС клеток. К ним относятся этические спорные вопросы, относящиеся к источнику данных клеток, а также технические сложности. Существенным ограничением для продуктивного использования ЭС клеток для клинического применения является сложность, связанная с получением ЭС клеток, которые генетически соответствуют отдельным пациентам. Существует насущная потребность в альтернативных способах получения плюрипотентных клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям и способам для перепрограммирования соматических клеток в менее дифференцированное состояние. В некоторых вариантах осуществления композиции и способы позволяют перепрограммировать соматические клетки в клетки, подобные плюрипотентным эмбриональным стволовым клеткам («ЭС»-подобные клетки).
В одном аспекте данное изобретение относится к способу перепрограммирования соматической клетки млекопитающего, включающему культивирование клетки в присутствии внеклеточной сигнальной молекулы таким образом, что клетка становится перепрограммированной.
В одном аспекте изобретение относится к способу перепрограммирования соматической клетки млекопитающего, включающему культивирование клетки в Wnt-кондиционированной среде для культивирования клеток таким образом, что клетка становится перепрограммированной. В некоторых вариантах осуществления способ включает культивирование соматической клетки таким образом, что клетка индуцируется к превращению в плюрипотентную. В некоторых вариантах осуществления Wnt-кондиционированная среда для культивирования клеток представляет собой Wnt3a-кондиционированную среду для культивирования клеток (Wnt3a-CM).
В другом аспекте изобретение относится к способу перепрограммирования соматической клетки млекопитающего, включающему создание контакта клетки со средством, которое повышает активность пути Wnt, таким образом, что клетка индуцируется к превращению в плюрипотентную. В некоторых вариантах осуществления средство представляет собой растворимый биологически активный белок Wnt, например, белок Wnt3a. В некоторых вариантах осуществления средство выбирают из группы, состоящей из: (i) малых молекул, которые имитируют эффект Wnt3a-кондиционированной среды или растворимых биологически активных белков Wnt, например, путем взаимодействия с клеточным рецептором(ами) для Wnt; (ii) средств, которые модулируют взаимодействие между β-катенином и членом семейства TCF/LEF и/или модулируют экспрессию или активность члена семейства TCF/LEF; (iii) средств, которые ингибируют экспрессию или активность эндогенного ингибитора пути Wnt.
Изобретение относится к соматическим клеткам, перепрограммированным при помощи патентоспособных способов.
Среды для культивирования клеток, содержащие активатор Wnt3a и дополнительное перепрограммирующее средство, способное заменять рекомбинантную экспрессию Oct4, Klf4 и/или Sox2 (или любого их сочетания), являются дополнительными аспектами данного изобретения. Следующими аспектами изобретения являются (1) композиция, содержащая: (i) клетку, которая была модифицирована для повышения в ней экспрессии Oct4, Klf4 и/или Sox2, или любого их набора; и (ii) модулятор пути Wnt, например, активатор пути Wnt; (2) композиция, содержащая: (i) клетку, которая была модифицирована для повышения в ней экспрессии или внутриклеточного уровня одного или более перепрограммирующих факторов, где перепрограммирующий фактор(ы) по желанию выбирают из Oct4, Klf4 и/или Sox2, или любого их набора; и (ii) Wnt-кондиционированную среду; (3) композиция, содержащая: (i) клетку, которая была модифицирована для повышения в ней экспрессии или внутриклеточного уровня одного или более перепрограммирующих факторов, где перепрограммирующий фактор(ы) по желанию выбирают из Oct4, Nanog, Lin28 и/или Sox2, или любого их набора; и (ii) активатор пути Wnt; а также (4) композиция, содержащая: (i) клетку, которая была модифицирована для повышения в ней экспрессии или внутриклеточного уровня одного или более перепрограммирующих факторов, где перепрограммирующий фактор(ы) по желанию выбирают из Oct4, Nanog, Lin28 и/или Sox2, или любого их набора; и (ii) Wnt-кондиционированную среду.
Изобретение также относится к способам выявления средства, которое перепрограммирует соматические клетки в менее дифференцированное состояние и/или вносит свой вклад в такое перепрограммирование в сочетании с одним или большим количеством других средств. В некоторых способах соматические клетки приводят в контакт со средством, которое повышает активность пути Wnt, и со средством-кандидатом. Клетки оценивают по признакам плюрипотентности.
Наличие как минимум некоторого набора признаков плюрипотентности свидетельствует о том, что средство способно перепрограммировать соматические клетки в менее дифференцированное состояние. Средства, выявленные при помощи настоящего изобретения, затем можно использовать для перепрограммирования соматических клеток путем создания контакта между соматическими клетками и данными средствами.
Настоящее изобретение дополнительно относится к способам лечения патологического состояния у индивидуума, нуждающегося в лечении патологического состояния. В некоторых вариантах осуществления соматические клетки получают от индивидуума и перепрограммируют при помощи способов по изобретению. Перепрограммированные клетки можно наращивать в культуре. Плюрипотентные перепрограммированные клетки (что означает исходные перепрограммированные клетки и/или их потомков, которые сохраняют свойство плюрипотентности) поддерживают в условиях, подходящих для того, чтобы клетки развивались в клетки желаемого клеточного типа или клеточной линии дифференцировки. В некоторых вариантах осуществления клетки дифференцируют in vitro, используя протоколы, известные в данной области. Перепрограммированные клетки желаемого клеточного типа вводят индивидууму для лечения патологического состояния. В некоторых вариантах осуществления соматические клетки, полученные от индивидуума, содержат мутацию в одном или большем количестве генов. В таких случаях, в некоторых вариантах осуществления соматические клетки, полученные от индивидуума, сначала подвергают воздействию для устранения или компенсации дефекта, например, путем введения одной или более копий гена(ов) дикого типа в клетки так, что полученные клетки экспрессируют вариант гена дикого типа. Затем клетки вводят индивидууму.
В некоторых вариантах осуществления соматические клетки, полученные от индивидуума, подвергают изменениям, чтобы они экспрессировали один или более генов после их извлечения из индивидуума. Клетки можно изменять путем введения в клетки гена или полигенного экспрессирующего кластера, содержащего ген. Введенный ген может представлять собой ген, являющийся полезным для целей выявления, отбора и/или создания перепрограммированной клетки. В некоторых вариантах осуществления введенный ген(ы) вносит вклад в инициирование и/или поддержание перепрограммированного состояния. В некоторых вариантах осуществления продукт(ы) экспрессии введенного гена(ов) вносит вклад в создание перепрограммированного состояния, но не является необходимым для поддержания перепрограммированного состояния.
В некоторых других вариантах осуществления способы по изобретению можно использовать для лечения индивидуумов, нуждающихся в функциональном органе. В данных способах соматические клетки получают от индивидуума, нуждающегося в функциональном органе, и перепрограммируют при помощи способов по изобретению для получения перепрограммированных соматических клеток. Затем такие перепрограммированные соматические клетки культивируют в условиях, подходящих для развития перепрограммированных соматических клеток в нужный орган, который затем помещают в индивидуума.
Далее в кратком изложении, изобретение относится к способу перепрограммирования соматической клетки млекопитающего, включающему создание контакта соматической клетки млекопитающего со средством, которое модулирует путь Wnt таким образом, что соматическая клетка млекопитающего становится перепрограммированной. В некоторых вариантах осуществления изобретения способ включает перепрограммирование соматической клетки млекопитающего в плюрипотентное состояние. В некоторых аспектах изобретение относится к усовершенствованию способов получения индуцированных плюрипотентных стволовых (иПС) (iPS) клеток. Например, в некоторых аспектах изобретение способствует перепрограммированию в плюрипотентность соматических клеток, которые не были подвергнуты генетическим изменениям для экспрессии c-Myc. В некоторых аспектах патентоспособные способы облегчают получение гомогенных ЭС-подобных колоний. В некоторых вариантах осуществления патентоспособные способы увеличивают образование гомогенных ЭС-подобных колоний без вынужденного введения этапа селекции, для которого необходима генетическая модификация исходных соматических клеток.
В некоторых вариантах осуществления изобретения способ включает культивирование клетки в Wnt-кондиционированной среде. В некоторых вариантах осуществления способ включает культивирование клетки в Wnt3a-кондиционированной среде. В некоторых вариантах осуществления клетка представляет собой клетку человека. В некоторых вариантах осуществления клетка представляет собой клетку мыши. В некоторых вариантах осуществления клетка представляет собой клетку примата, отличного от человека. В некоторых вариантах осуществления соматическая клетка млекопитающего представляет собой окончательно дифференцированную клетку. В некоторых вариантах осуществления клетка представляет собой фибробласт или клетку иммунной системы (например, B- или T-клетку). В некоторых вариантах осуществления соматическая клетка млекопитающего не является окончательно дифференцированной клеткой. Например, соматическая клетка млекопитающего может представлять собой клетку-предшественника, например, нейронного предшественника или гемопоэтическую клетку-предшественника. В некоторых вариантах осуществления способ практикуют in vitro. В некоторых вариантах осуществления приведение клетки в контакт включает культивирование клетки в культуральной среде, содержащей определенное средство. В некоторых вариантах осуществления приведение в контакт включает культивирование клетки в культуральной среде, содержащей определенное средство, в течение как минимум 10 дней. В некоторых вариантах осуществления приведение в контакт включает культивирование клетки в культуральной среде, содержащей определенное средство, в течение как минимум 12, или как минимум 15 дней, или как минимум 20 дней. В некоторых вариантах осуществления соматическая клетка является генетически модифицированной для содержания в ней последовательности нуклеиновой кислоты, кодирующей селектируемый маркер, функционально связанный с промотором для эндогенного гена плюрипотентности, что позволяет проводить селекцию клеток, которые были перепрограммированы в плюрипотентность, тогда как в других вариантах осуществления соматическая клетка не является генетически модифицированной для содержания в ней последовательности нуклеиновой кислоты, кодирующей селектируемый маркер, функционально связанный с промотором для эндогенного гена плюрипотентности, что позволяет проводить отбор клеток, которые были перепрограммированы в плюрипотентность. В некоторых вариантах осуществления соматическая клетка модифицирована для экспрессии или содержания в ней как минимум одного перепрограммирующего фактора в количествах больших, чем обычно встречаются в соматических клетках данного типа. В некоторых вариантах осуществления перепрограммирующий фактор представляет собой Oct4. В некоторых вариантах осуществления перепрограммирующий фактор представляет собой Sox2. В некоторых вариантах осуществления перепрограммирующий фактор представляет собой Klf4. В некоторых вариантах осуществления перепрограммирующий фактор представляет собой Nanog. В некоторых вариантах осуществления перепрограммирующий фактор представляет собой Lin28. В некоторых вариантах осуществления перепрограммирующий фактор(ы) представляют собой Oct4 и Sox2. В некоторых вариантах осуществления перепрограммирующий фактор(ы) представляют собой Oct4, Sox2 и Klf4. В некоторых вариантах осуществления соматическая клетка не является генетически модифицированной для экспрессии в ней c-Myc в количествах больших, чем обычно встречаются в соматических клетках данного клеточного типа. В некоторых вариантах осуществления клетку приводят в контакт также со вторым средством, которое модулирует путь Wnt. В некоторых вариантах осуществления соматическую клетку культивируют в среде, содержащей экзогенный растворимый биологически активный белок Wnt. В некоторых вариантах осуществления белок Wnt представляет собой белок Wnt3a. В некоторых вариантах осуществления способ дополнительно включает подтверждение того, что перепрограммированная клетка является плюрипотентной. В некоторых вариантах осуществления способ практикуют на популяции клеток, и способ дополнительно включает отделение клеток, которые являются перепрограммированными в плюрипотентное состояние, от клеток, которые не являются перепрограммированными в плюрипотентное состояние. В некоторых вариантах осуществления способ дополнительно включает введение перепрограммированных клеток субъекту. В некоторых вариантах осуществления способ дополнительно включает дифференцирование клетки в желаемый клеточный тип in vitro после перепрограммирования клетки. В некоторых вариантах осуществления способ дополнительно включает введение дифференцированной клетки субъекту.
Изобретение также относится к способу лечения индивидуума, нуждающегося в этом, включающему: (a) получение соматических клеток от индивидуума; (b) перепрограммирование как минимум некоторых соматических клеток при помощи способа, включающего создание контакта соматических клеток млекопитающего со средством, которое модулирует путь Wnt (например, активатором пути Wnt), и (c) введение как минимум некоторых перепрограммированных клеток индивидууму, возможно, после дифференцирования клеток в один или большее количество желаемых клеточных типов. В некоторых вариантах осуществления индивидуум является человеком. В некоторых вариантах осуществления способ практикуют на популяции клеток, и он дополнительно включает отделение клеток, которые являются перепрограммированными в плюрипотентное состояние, от клеток, которые не являются перепрограммированными в плюрипотентное состояние. В некоторых вариантах осуществления способ дополнительно включает дифференцирование клетки в желаемый клеточный тип in vitro и, возможно, введение дифференцированной клетки индивидууму, нуждающемуся в лечении патологического состояния, для которого применима клеточная терапия. Например, клетки могут быть дифференцированы в направлении желаемой клеточной линии дифференцировки, например, нейронной линии дифференцировки, мышечной линии дифференцировки, и так далее.
Изобретение дополнительно относится к композиции, содержащей (i) соматическую клетку млекопитающего, которая была модифицирована или подвергнута воздействию так, что она экспрессирует или содержит как минимум один перепрограммирующий фактор в количествах больших, чем было бы без подобной модификации или воздействия; и (ii) средство, которое повышает активность пути Wnt и вносит вклад в перепрограммирование соматической клетки в плюрипотентное состояние. В некоторых вариантах осуществления средство представляет собой белок Wnt3a. В некоторых вариантах осуществления средство представляет собой малую молекулу.
Изобретение дополнительно относится к способу выявления средства, пригодного для модулирования перепрограммирования соматических клеток млекопитающих в плюрипотентное состояние, включающему: (a) культивирование популяции соматических клеток млекопитающих в среде, содержащей средство, которое модулирует активность пути Wnt, и средство-кандидата; и (b) определение, после соответствующего периода времени, присутствуют ли клетки, обладающие одним или большим количеством признаков ЭС клеток, после культивирования клеток и их потомков в течение соответствующего периода времени, где средство-кандидата идентифицируют как пригодное для модулирования перепрограммирования соматических клеток млекопитающих в плюрипотентное состояние, если клетки, обладающие одним или большим количеством признаков ЭС клеток, присутствуют в количествах, отличающихся от тех, которые можно было ожидать в случае, если бы среда не содержала средство-кандидата.
В некоторых вариантах осуществления признаки выбирают из: морфологии колоний, экспрессии эндогенного гена, экспрессируемого избирательно ЭС клетками, экспрессии детектируемого маркера, функционально связанного с последовательностями контроля экспрессии гена, экспрессируемого избирательно ЭС клетками, способности дифференцироваться в клетки, обладающие признаками эндодермы, мезодермы и эктодермы, когда их инъецируют мышам с иммунной недостаточностью, а также способности участвовать в образовании химер, которые выживают до срока. В некоторых вариантах осуществления клетки были модифицированы для экспрессии как минимум одного перепрограммирующего фактора. В некоторых вариантах осуществления среда представляет собой Wnt-кондиционированную среду.
В некоторых вариантах осуществления среда представляет собой Wnt3a-кондиционированную среду. В некоторых вариантах осуществления средство, которое модулирует активность пути Wnt, представляет собой белок Wnt3a. В некоторых вариантах осуществления средство, которое модулирует активность пути Wnt, представляет собой малую молекулу. В некоторых вариантах осуществления средство-кандидат представляет собой малую молекулу. В некоторых вариантах осуществления способ включает выявление средства, пригодного для усиления перепрограммирования соматических клеток млекопитающих, где средство-кандидата идентифицируют как пригодное для усиления перепрограммирования соматических клеток млекопитающих в плюрипотентное состояние, если клетки, обладающие одним или большим количеством признаков ЭС клеток, присутствуют в количествах, больших, чем можно было ожидать в случае, если бы среда не содержала средство-кандидата. В некоторых вариантах осуществления этап (b) включает определение того, присутствуют ли клеточные колонии, обладающие одним или большим количеством признаков ЭС клеточных колоний, после культивирования клеток и их потомков в течение соответствующего периода времени, где средство-кандидата идентифицируют как пригодное для модулирования перепрограммирования соматических клеток млекопитающих в плюрипотентное состояние, если клеточные колонии, обладающие одним или большим количеством признаков ЭС клеточных колоний, присутствуют в количествах, отличающихся от тех, которые можно было ожидать в случае, если бы среда не содержала средство-кандидата. В некоторых вариантах осуществления клетки экспрессируют как минимум один перепрограммирующий фактор.
Изобретение также относится к способу выявления средства, пригодного для перепрограммирования соматических клеток млекопитающих в плюрипотентное состояние, включающему: (a) создание контакта популяции соматических клеток млекопитающих со средством, которое повышает активность пути Wnt, и средством-кандидатом; (b) поддержание клеток в течение соответствующего периода времени в системе культивирования клеток; и (c) определение того, присутствуют ли клетки, обладающие одним или большим количеством признаков ЭС клеток, в указанной системе культивирования, где средство идентифицируют как пригодное для перепрограммирования соматических клеток млекопитающих в ЭС-подобное состояние, если клетки, обладающие одним или большим количеством признаков ЭС клеток, присутствуют в количествах, больших, чем можно было ожидать в случае, если бы клетки не контактировали со средством-кандидатом.
В некоторых вариантах осуществления изобретения признаки выбирают из: морфологии колоний, экспрессии эндогенного гена, экспрессируемого избирательно ЭС клетками, экспрессии детектируемого маркера, функционально связанного с последовательностями контроля экспрессии гена, экспрессируемого избирательно ЭС клетками, способности дифференцироваться в клетки, обладающие признаками эндодермы, мезодермы и эктодермы, когда их инъецируют мышам с иммунной недостаточностью, а также способности участвовать в образовании химер, которые выживают до срока.
В некоторых вариантах осуществления средство, которое повышает активность пути Wnt, представляет собой белок Wnt3a. В некоторых вариантах осуществления средство-кандидат представляет собой малую молекулу. В некоторых вариантах осуществления клетки экспрессируют как минимум один перепрограммирующий фактор. В некоторых вариантах осуществления этап (b) включает определение того, присутствуют ли клеточные колонии, обладающие одним или большим количеством признаков ЭС клеточных колоний, после культивирования клеток и их потомков в течение соответствующего периода времени, где средство-кандидата идентифицируют как пригодное для модулирования перепрограммирования соматических клеток млекопитающих в плюрипотентное состояние, если клеточные колонии, обладающие одним или большим количеством признаков ЭС клеточных колоний, присутствуют в количествах, отличающихся от тех, которые можно было ожидать в случае, если бы среда не содержала средство-кандидата.
Изобретение также относится к способу перепрограммирования соматической клетки млекопитающего, включающему культивирование клетки в присутствии внеклеточной сигнальной молекулы таким образом, что клетка становится перепрограммированной. В некоторых вариантах осуществления указанная внеклеточная сигнальная молекула представляет собой молекулу, связывание которой с внеклеточным доменом клеточного рецептора запускает или изменяет путь передачи сигнала внутри клетки. В некоторых вариантах осуществления путь передачи сигнала представляет собой путь Wnt.
Изобретение также относится к способу выявления модулятора пути Wnt, пригодного для модулирования перепрограммирования соматических клеток млекопитающих в плюрипотентное состояние, включающему: (a) культивирование популяции соматических клеток млекопитающих в среде, содержащей модулятор пути Wnt; (b) определение, после соответствующего периода времени, присутствуют ли клетки, обладающие одним или большим количеством признаков ЭС клеток, после культивирования клеток и их потомков в течение соответствующего периода времени, где модулятор пути Wnt идентифицируют как пригодный для модулирования перепрограммирования соматических клеток млекопитающих в плюрипотентное состояние, если клетки, обладающие одним или большим количеством признаков ЭС клеток, присутствуют в количествах, отличающихся от тех, которые можно было ожидать в случае, если бы среда не содержала модулятора пути Wnt.
В некоторых вариантах осуществления способ включает (i) тестирование как минимум 10 модуляторов пути Wnt; и (ii) выявление одного или более модуляторов пути Wnt, обладающих значительно большим эффектом на скорость или эффективность перепрограммирования, чем как минимум 50% других тестируемых модуляторов пути Wnt. В некоторых вариантах осуществления способ включает тестирование как минимум 20, как минимум 50 или как минимум 100 модуляторов пути Wnt. В некоторых вариантах осуществления способ включает выявление одного или более модуляторов пути Wnt, обладающих значительно большим эффектом на скорость или эффективность перепрограммирования, чем как минимум 75%, или как минимум 90% других тестируемых модуляторов пути Wnt. В некоторых вариантах осуществления тестируемые модуляторы пути Wnt представляют собой малые молекулы. В некоторых вариантах осуществления тестируемые модуляторы пути Wnt обладают структурным родством. Например, они могут являться членами группы соединений, например, комбинаторной библиотеки соединений, синтезированных на основе общей центральной структуры, либо они могут являться производными, полученными путем модифицирования центральной структуры, либо соединениями-прототипами, в которых осуществляют замены или добавления на одной или большем количестве позиций. В некоторых вариантах осуществления модулятор пути Wnt идентифицируют как пригодный для повышения скорости или эффективности перепрограммирования клеток в ЭС-подобное состояние, если, после соответствующего периода времени, клетки, обладающие одним или большим количеством признаков ЭС клеток, присутствуют в количествах, больших, чем можно было ожидать в случае, если бы среда не содержала модулятора пути Wnt. В некоторых вариантах осуществления модулятор пути Wnt идентифицируют как пригодный для повышения скорости или эффективности перепрограммирования клеток в плюрипотентное состояние, если, после соответствующего периода времени, клеточные колонии, обладающие одним или большим количеством признаков ЭС клеточных колоний, присутствуют в количествах больших, чем можно было ожидать в случае, если бы среда не содержала модулятора пути Wnt. Например, способ может приводить к увеличению процентного содержания колоний, обладающих признаками колоний ЭС клеток и/или колонии могут быть более гомогенными, чем были бы в случае отсутствия модулятора пути Wnt.
Изобретение дополнительно относится к композиции клеточной культуры, включающей: (a) среду для культивирования клеток, содержащую модулятор пути Wnt; и (b) множество соматических клеток млекопитающих, где (i) клетки являются генетически модифицированными или временно трансфицированными для экспрессии одного или более перепрограммирующих факторов; (ii) клетки генетически модифицированы для содержания последовательности нуклеиновой кислоты, кодирующей селектируемый маркер, функционально связанный с промотором для эндогенного гена плюрипотентности, что позволяет проводить отбор клеток, которые были перепрограммированы в плюрипотентность, или (iii) среда для культивирования клеток содержит одну или большее количество малых молекул, нуклеиновых кислот или полипептидов, которые заменяют перепрограммирующий фактор, отличный от c-Myc.
В некоторых вариантах осуществления среда для культивирования клеток представляет собой Wnt-3a CM. В некоторых вариантах осуществления среда содержит малую молекулу, которая модулирует путь Wnt.
В некоторых вариантах осуществления один или более перепрограммирующих факторов выбирают из: Oct4, Nanog, Sox2, Lin28 и Klf4. Изобретение дополнительно относится к композиции, содержащей: иПС клетку и средство, которое модулирует, например, активирует путь Wnt. В некоторых вариантах осуществления средство, которое активирует путь Wnt, представляет собой белок Wnt3a. В некоторых вариантах осуществления средство, которое активирует путь Wnt, представляет собой малую молекулу.
В некоторых вариантах осуществления изобретение относится к применению средства, которое модулирует путь Wnt, в производстве лекарственного средства для перепрограммирования соматической клетки млекопитающего.
Предполагается, что все варианты осуществления, описанные в данном документе, применимы к различным аспектам изобретения. Также предполагается, что различные варианты осуществления изобретения и их элементы можно по возможности комбинировать с одним или большим количеством других таких вариантов осуществления и/или элементов.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1. Wnt3a стимулирует эпигенетическое перепрограммирование. a. Схематическое изображение экспериментальной временной шкалы. Клетки MEF инфицировали DOX-индуцируемым лентивирусом, разделяли на культуры, подвергающиеся и не подвергающиеся воздействию Wnt3-CM, а затем индуцировали при помощи DOX (день 0). В фиксированные моменты времени после индукции начинали селекцию с помощью G418, и воздействие Wnt3a-CM проводили в течение 7 дней селекции. Присутствие DOX и G418 поддерживали до тех пор, пока не определяли устойчивые колонии. b. Количество устойчивых к G418 колоний из клеток MEF, избыточно экспрессирующих Oct4/Sox2/Klf4/c-Myc, в стандартной ЭС клеточной среде или с воздействием Wnt3a-CM. c. Фазовые изображения устойчивых к G418 колоний, образованных при воздействии Wnt3a-CM или без него. d. Количество устойчивых к G418 колоний из клеток MEF, инфицированных перепрограммирующими факторами в различных сочетаниях, в присутствии или в отсутствие Wnt3a-CM. Устойчивые к G418 колонии, возникшие без трансдукции c-Myc, в присутствии Wnt3a-CM. e. Фазовые изображения устойчивых к G418 Myc[-] колоний, образованных при воздействии Wnt3a-CM. В данном эксперименте не наблюдали никаких колоний для клеток Myc[-] в отсутствие Wnt3a-CM. f. Количество устойчивых к G418 колоний из клеток MEF, избыточно экспрессирующих Oct4/Sox2/Klf4 (Myc[-]) или Oct4/Sox2/Klf4/c-Myc (Myc[+]), в присутствии (красные столбики) и в отсутствие (серые столбики) Wnt3a-CM. Селекцию с помощью G418 начинали на день 5 или на день 10 после индукции, как указано, и колонии (на площади 32 см2) оценивали на день 20. g. Диаграммы разброса данных, сравнивающие интенсивность флуоресценции GFP с аутофлуоресценцией, полученные методом проточной цитометрии в клетках Oct4-GFP на день 20 после индукции Oct4/Sox2/Klf4, выявили популяцию клеток, экспрессирующих GFP (указано стрелкой), только при воздействии Wnt3a-CM. h. Фазовые изображения экспрессирующих GFP клеток Myc[-], полученных при воздействии Wnt3a-CM и без какой-либо генетической селекции.
Фигура 2. Индукция плюрипотентности в стимулированных Wnt клетках. a-d. Иммунное окрашивание выявило индукцию маркеров плюрипотентности, Nanog (a-b) и SSEA-1 (c-d) в обработанных Wnt3a-CM клетках Myc[-], например, обработанные Wnt3a-CM линии Myc[-] образовывали тератомы при подкожном инъецировании мышам SCID. Тератомы от Oct4/Sox2/Klf4/Wnt3aCM иПС линий проявляли признаки дифференцированных клеток трех зародышевых слоев, аналогично тератомам, образованным в результате инъекций V6.5 mES. Стрелками отмечены нервная ткань в (e), хрящ в (f) и эндодермальные клетки в (g), h. Oct4/Sox2/Klf4/Wnt3aCM иПС линии, полученные без селекции, привели к развитию мышей-химер (как показано слева) масти агути с пигментированными глазами (в отличие от мышей Balb/c дикого типа, справа), что является подтверждением вклада в соматические клетки. Масть потомства является подтверждением того, что Oct4/Sox2/Klf4/Wnt3aCM иПС линия, полученная в данном эксперименте, является компетентной зародышевой (данные не представлены).
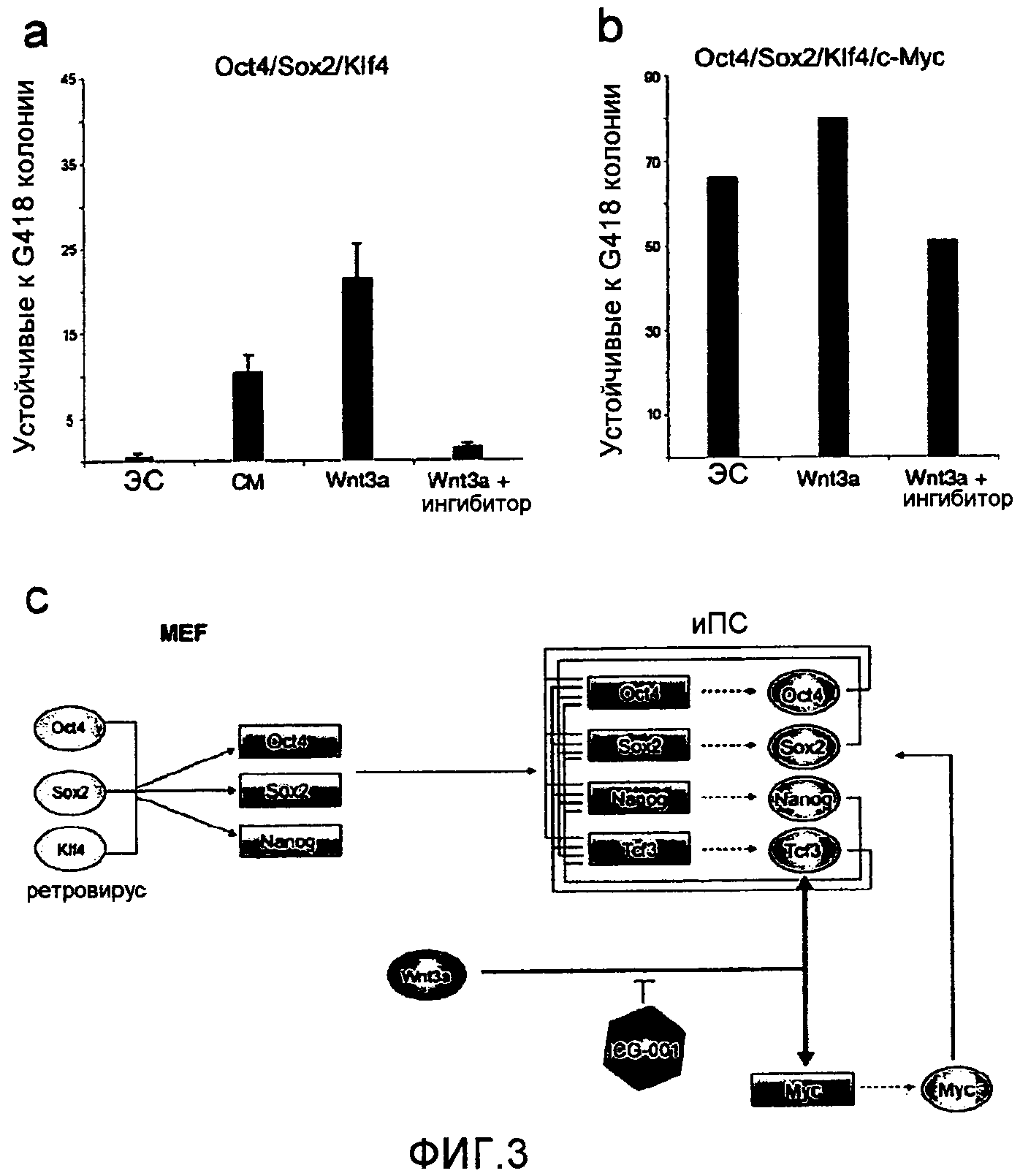
Фигура 3. Стимуляция Wnt/β-катенином повышает образование иПС колоний в отсутствие ретровируса c-Myc. a. Приведено количество устойчивых к G418 колоний в избыточно экспрессирующих Oct4/Sox2/Klf4 клетках MEF, культивированных в ЭС клеточной среде, кондиционированной MEF среде, кондиционированной избыточно экспрессированным Wnt3a среде, а также кондиционированной избыточно экспрессированным Wnt3a среде с ICG001 (4 мкМ). Селекцию начинали на день 15 после индукции, и колонии оценивали на день 28. Воздействие Wnt3a-CM проводили вплоть до дня 22. Приведено среднее количество из трижды повторенных экспериментов с планками погрешностей, отмечающими стандартное отклонение. b. Приведены количества устойчивых к G418 колоний (на площади 32 см2) в избыточно экспрессирующих Oct4/Sox2/Klf4/c-Myc клетках MEF, культивированных в ЭС клеточной среде, кондиционированной избыточно экспрессированным Wnt3a среде, а также кондиционированной избыточно экспрессированным Wnt3a среде с ICG-001 (4 мкМ). Селекцию начинали на день 10 после индукции, Wnt3a-CM сохраняли вплоть до дня 17, и колонии оценивали на день 20. c. Стимуляция Wnt способствует образованию иПС клеток в отсутствие трансдукции c-Myc. Это может происходить в результате: i) прямой регуляции путем Wnt ключевых эндогенных факторов плюрипотентности, таких как Oct4, Sox2 и Nanog, что следует из геномных исследований на ЭС клетках (Cole et al., 2008), ii) индуцированной путем Wnt активации эндогенного Myc (He et al., 1998; Cole et al., 2008) или других генов клеточной пролиферации, что ускоряет последующий процесс образования иПС колоний.
Фигура 4. (a) Временная шкала начальных экспериментов, демонстрирующих способность Wnt3a-кондиционированной среды стимулировать образование иПС клеток. Экспрессию индуцирующих плюрипотентность факторов индуцировали в день 2. Экспрессию GFP и образование колоний оценивали, как указано. (b). Wnt3a стимулирует образование иПС клеток в клетках, избыточно экспрессирующих Oct4, Sox2, Klf4 и c-Myc; Фигура 4C. Wnt3a стимулирует образование иПС клеток в клетках, избыточно экспрессирующих Oct4, Sox2, Klf4 без рекомбинантной экспрессии c-Myc; (c) Wnt3a стимулирует образование иПС клеток в клетках, избыточно экспрессирующих Oct4, Sox2, Klf4 без рекомбинантной экспрессии c-Myc.
Фигура 5. Структура ICG-001.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Введение и определения
Настоящее изобретение относится к композициям и способам для перепрограммирования соматических клеток, например, для перепрограммирования соматических клеток в плюрипотентность in vitro. Изобретение относится к способам для перепрограммирования соматических клеток в менее дифференцированное состояние. Полученные клетки называют в данном документе «перепрограммированные соматические клетки» («RSC»), или, в некоторых вариантах осуществления - индуцированные плюрипотентные стволовые (иПС) клетки, если они перепрограммированы в плюрипотентное состояние. Термин «соматическая клетка» означает любую клетку, отличную от половой клетки, клетку, присутствующую или полученную от эмбриона до стадии имплантации, либо клетку, полученную в результате пролиферации такой клетки in vitro. В некоторых вариантах осуществления соматическая клетка представляет собой «не эмбриональную соматическую клетку», под которой подразумевают соматическую клетку, которая не присутствует или не получена от эмбриона и не возникает в результате пролиферации такой клетки in vitro. В некоторых вариантах осуществления соматическая клетка представляет собой «взрослую соматическую клетку», под которой подразумевают клетку, присутствующую или полученную от организма, отличного от эмбриона или плода, или возникшую в результате пролиферации такой клетки in vitro. Если не указано особо, способы перепрограммирования клеток в менее дифференцированное состояние осуществляют in vitro, то есть, их практикуют с использованием выделенных соматических клеток, поддерживаемых в культуре.
Изобретение заключает в себе признание того факта, что существующие в природе сигнальные молекулы, которые модулируют экспрессию эндогенных факторов транскрипции ЭС клеток, являются перспективными кандидатами в растворимые средства, способствующие перепрограммированию. Изобретение также заключает в себе признание того факта, что модулирование биологических путей, с которыми взаимодействуют такие существующие в природе сигнальные молекулы, полезно для усиления (например, увеличения скорости и/или эффективности) перепрограммирования. Изобретение также заключает в себе признание того факта, что средства (либо природные, либо синтетические, например, малые молекулы), которые модулируют биологические пути, с которыми взаимодействуют такие природные сигнальные молекулы, являются перспективными кандидатами в растворимые средства, способствующие перепрограммированию.
Как описано более подробно ниже, некоторые варианты осуществления изобретения основаны, как минимум частично, на признании того факта, что модулирование, например, активация, пути Wnt является полезным для перепрограммирования соматических клеток. Некоторые из способов включают повышение активности пути Wnt в соматических клетках таким образом, что как минимум некоторые клетки становятся перепрограммированными, например, в плюрипотентное состояние. Некоторые из способов включают культивирование соматических клеток в Wnt-кондиционированной среде таким образом, что как минимум некоторые клетки становятся перепрограммированными, например, в плюрипотентное состояние.
Перепрограммирование, как используют в данном документе, означает процесс, который изменяет или обращает вспять дифференцированное состояние соматической клетки. Клетка может являться либо частично, либо полностью дифференцированной до перепрограммирования. Перепрограммирование включает в себя полное обращение вспять дифференцированного состояния соматической клетки до плюрипотентного состояния. Как известно в данной области, «плюрипотентная» клетка обладает способностью дифференцироваться в, или давать начало клеткам, происходящим из всех трех зародышевых слоев эмбриона (эндодермы, мезодермы и эктодермы), и, как правило, обладает потенциалом делиться in vitro в течение длительного периода времени, например, более одного года, или более 30 пассажей. ЭС клетки представляют собой пример плюрипотентных клеток. Перепрограммирование также заключает в себе частичное обращение вспять дифференцированного состояния соматической клетки до мультипотентного состояния. «Мультипотентная» клетка представляет собой клетку, которая способна дифференцироваться в некоторые, но не во все, клетки, происходящие из всех трех зародышевых слоев. Таким образом, мультипотентная клетка является частично дифференцированной клеткой. Взрослые стволовые клетки являются мультипотентными клетками. Взрослые стволовые клетки включают, например, гемопоэтические стволовые клетки и нейронные стволовые клетки. Перепрограммирование также заключает в себе частичное обращение вспять дифференцированного состояния соматической клетки до состояния, которое делает клетки более восприимчивыми к полному перепрограммированию в плюрипотентное состояние при выполнении дополнительных процедур, таких как те, что описаны в данном документе. Такое создание контакта может приводить к экспрессии конкретных генов клетками, и эта экспрессия вносит вклад в перепрограммирование. В некоторых вариантах осуществления изобретения перепрограммирование соматической клетки вынуждает соматическую клетку входить в плюрипотентное ЭС-подобное состояние. Полученные клетки называют в данном документе перепрограммированными плюрипотентными соматическими клетками или индуцированными плюрипотентными стволовыми (иПС) клетками.
Перепрограммирование включает в себя изменение, например, обращение вспять, как минимум некоторых из наследственных характерных особенностей модификации нуклеиновых кислот (например, метилирования), конденсации хроматина, эпигенетических изменений, геномного импринтинга, и так далее, которые имеют место в процессе клеточной дифференциации, когда зигота развивается во взрослое состояние. Перепрограммирование отличается от простого поддержания существующего недифференцированного состояния клетки, которая уже является плюрипотентной, или от поддержания существующего недостаточно полного дифференцированного состояния клетки, которая уже является мультипотентной клеткой (например, гемопоэтической стволовой клеткой). Перепрограммирование также отличается от стимулирования самообновления или пролиферации клеток, которые уже являются плюрипотентными или мультипотентными, хотя композиции и способы по изобретению можно также использовать для данных целей. Некоторые композиции и способы по настоящему изобретению вносят вклад в создание плюрипотентного состояния. Способы можно применять скорее к клеткам, которые являются полностью дифференцированными и/или имеющими ограничения для развития только в клетки определенного типа, чем к клеткам, которые уже являются мультипотентными или плюрипотентными.
На соматические клетки воздействуют любым из множества вариантов, чтобы вызвать перепрограммирование способами по настоящему изобретению. Воздействие может включать создание контакта клеток с одним или большим количеством средств, которые вносят вклад в перепрограммирование («перепрограммирующее средство»). Такое создание контакта можно осуществлять путем культивирования клеток в среде, содержащей средство(а). В некоторых вариантах осуществления соматические клетки являются генетически измененными. Соматические клетки могут быть генетически изменены для экспрессии одного или более перепрограммирующих средств, как дополнительно описано ниже.
В способах по настоящему изобретению соматические клетки, как правило, можно культивировать в стандартных условиях температуры, pH и других внешних условиях, например, как прикрепляющиеся клетки в планшетах для культивирования при 37°C в атмосфере, содержащей 5-10% CO2. Клетки и/или среду для культивирования соответствующим образом модифицируют для достижения перепрограммирования, как описано в данном документе. В некоторых вариантах осуществления соматические клетки культивируют на, или в присутствии материала, который имитирует одну или более черт внеклеточного матрикса, либо содержит один или более компонентов внеклеточного матрикса или базальной мембраны. В некоторых вариантах осуществления используют Matrigel™. Другие материалы включают белки или их смеси, такие как желатин, коллаген, фибронектин, и так далее. В некоторых вариантах осуществления изобретения соматические клетки культивируют в присутствии питающего подслоя клеток. Такие клетки могут быть, например, мышиными или человеческими. Их можно облучать, химически инактивировать обработкой химическим инактивирующим агентом, таким как митомицин c, или иным образом обрабатывать для ингибирования их пролиферации, если это необходимо. В других вариантах осуществления соматические клетки культивируют без питающего подслоя клеток.
Получение плюрипотентных или мультипотентных клеток путем перепрограммирования соматических клеток с использованием способов по настоящему изобретению имеет ряд преимуществ. Первое, способы по настоящему изобретению дают возможность получать аутологичные плюрипотентные клетки, которые представляют собой клетки, специфические для индивидуума и генетически подходящие ему. Клетки происходят из соматических клеток, полученных от индивидуума. Как правило, аутологичные клетки с меньшей вероятностью, чем не аутологичные клетки, подвергаются иммунному отторжению. Второе, способы по настоящему изобретению дают возможность квалифицированному специалисту получать плюрипотентные клетки без использования эмбрионов, ооцитов и/или технологии ядерного переноса. Результаты, полученные соискателями патента, свидетельствуют о том, что (i) соматические клетки можно перепрограммировать в ЭС-подобное состояние без необходимости генетически изменять клетки для экспрессии ими онкогенов, таких как c-Myc; и (ii) перепрограммирование соматических клеток может, как минимум частично, быть выполнено средствами иными, чем генетическое изменение клеток для экспрессии перепрограммирующих факторов, то есть, путем создания контакта клеток с перепрограммирующим средством, отличным от нуклеиновой кислоты или вирусного вектора, которое может поглощаться и вызывать стабильную генетическую модификацию клеток. В частности, изобретение заключает в себе признание того факта, что внеклеточные сигнальные молекулы, например, молекулы, которые, если присутствуют во внеклеточном пространстве, связываются с рецепторами клеточной поверхности и активируют внутриклеточные каскады передачи сигнала, являются полезными для перепрограммирования соматических клеток. Кроме того, изобретение заключает в себе признание того факта, что активация таких сигнальных путей иными способами, чем применение внеклеточных сигнальных молекул, также полезна для перепрограммирования соматических клеток. Кроме того, способы по настоящему изобретению увеличивают образование колоний ЭС-подобных клеток, которые можно определять на основании морфологических критериев, без необходимости использовать селектируемый маркер. Таким образом, в настоящем раскрытии отражены различные принципиально важные преимущества в области технологии перепрограммирования соматических клеток in vitro. В то время как некоторые аспекты изобретения описаны в данном документе на примере использования сигнального пути Wnt, способы по изобретению охватывают активацию других сигнальных путей с целью перепрограммирования соматических клеток.
Определения некоторых терминов, полезных для понимания аспектов данного изобретения, приведены ниже:
«Средство», как используют в данном документе, означает любое соединение или вещество, такое как, но не ограничиваясь ими, малая молекула, нуклеиновая кислота, полипептид, пептид, лекарственное средство, ион и так далее.
«Среда для культивирования клеток» (также называемая в данном документе «культуральная среда» или «среда») представляет собой среду для культивирования клеток, содержащую питательные вещества, которые обеспечивают жизнеспособность клеток и поддерживают пролиферацию. Среда для культивирования клеток может содержать любое из перечисленного далее в подходящем сочетании: соль(и), буфер(ы), аминокислоты, глюкозу или другой сахар(а), антибиотики, сыворотку или заменитель сыворотки, а также другие компоненты, такие как пептидные ростовые факторы, и так далее. Среды для культивирования клеток, обычно используемые для конкретных типов клеток, известны специалистам в данной области. Некоторые не ограничивающие примеры приведены в данном документе.
«Клеточная линия» означает популяцию во многом или в основном идентичных клеток, которая, как правило, происходит из одной клетки-родоначальника или из определенной и/или в основном идентичной популяции клеток-родоначальников. Клеточная линия может поддерживаться, или обладать способностью поддерживаться, в культуре в течение длительного периода времени (например, месяцы, годы, в течение неограниченного периода времени). Она может претерпевать спонтанный или индуцированный процесс трансформации, дающий клеткам возможность выживать неограниченное количество времени в культуре. Клеточные линии включают все клеточные линии, признанные таковыми в данной области. Следует принимать во внимание, что клетки приобретают мутации и, возможно, эпигенетические изменения с течением времени, так что, как минимум, некоторые свойства отдельных клеток в клеточной линии могут различаться между собой.
Термин «экзогенный» означает вещество, присутствующее в клетке или организме, отличных от его естественного источника. Например, термины «экзогенная нуклеиновая кислота» или «экзогенный белок» означают нуклеиновую кислоту или белок, которые были введены путем действия с участием человека в биологическую систему, такую как клетка или организм, в которых они обычно отсутствуют, или в которых находятся в меньших количествах. Вещество будет считаться экзогенным, если его вводят в клетку или в клетку-родоначальника, которая наследует данное вещество. Напротив, термин «эндогенный» означает вещество, которое является естественным для биологической системы.
«Экспрессия» означает клеточные процессы, вовлеченные в производство РНК и белков, и, где применимо, секрецию белков, включая, в соответствующих случаях, но не ограничиваясь ими, например, транскрипцию, трансляцию, укладку, модификацию и процессинг. «Продукты экспрессии» включают РНК, транскрибированную с гена, и полипептиды, полученные в результате трансляции мРНК, транскрибированной с гена.
«Генетически модифицированная» или «рекомбинантная» клетка, как используют в данном документе, означает клетку, в которую введена экзогенная нуклеиновая кислота путем действия с участием человека (или потомка такой клетки, который унаследовал как минимум часть нуклеиновой кислоты). Нуклеиновая кислота может, например, содержать последовательность, которая является экзогенной для клетки, она может содержать собственные последовательности (то есть, последовательности, существующие в клетках естественным образом), но не в естественном окружении (например, кодирующая область, связанная с промотором от другого гена), либо измененные варианты собственных последовательностей, и так далее. Процесс переноса нуклеиновой кислоты в клетку можно осуществлять любым подходящим методом. Подходящие методы включают кальциево-фосфатную или опосредованную липидом трансфекцию, электропорацию и трансдукцию или инфицирование при помощи вирусного вектора. В некоторых вариантах осуществления полинуклеотид, или его часть, интегрирован в геном клетки. Впоследствии нуклеиновую кислоту можно удалять или вырезать из генома, при условии, что такое удаление или вырезание приводит к поддающимся измерению изменениям в клетке по сравнению с не модифицированной, но в остальном такой же клеткой.
«Идентичность» означает степень схожести последовательностей двух или более нуклеиновых кислот или полипептидов. Процент идентичности между интересующей последовательностью и второй последовательностью в окне сравнения, например, на протяжении длины интересующей последовательности, можно рассчитывать путем выравнивания последовательностей, определения числа остатков (нуклеотидов или аминокислот) внутри окна сравнения, которые расположены напротив идентичных остатков, с возможностью внесения разрывов для максимальной идентичности, деления на общее число остатков интересующей последовательности или второй последовательности (которая из двух является длиннее), которые находятся внутри окна, и умножения на 100. При расчете числа идентичных остатков, необходимых для достижения конкретного процента идентичности, дробные части нужно округлять до ближайшего целого числа. Процент идентичности можно рассчитывать при помощи различных компьютерных программ, известных в данной области. Например, с помощью компьютерных программ, таких как BLAST2, BLASTN, BLASTP, Gapped BLAST и так далее, можно проводить выравнивания и получать процентную идентичность между интересующими последовательностями. Алгоритм Karlin и Altschul (Karlin and Altschul, Proc. Natl. Acad. Sci. USA 87: 22264-2268, 1990), модифицированный как в Karlin and Altschul, Proc. Natl. Acad. Sci. USA 90: 5873-5877, 1993, включен в программы NBLAST и XBLAST Altschul et al. (Altschul, et al., J. Mol. Biol. 215: 403-410, 1990). Для получения выравниваний с разрывами для целей сравнения используют Gapped BLAST, как описано в Altschul et al. (Altschul, et al. Nucleic Acids Res. 25: 3389-3402, 1997). При использовании программ BLAST и Gapped BLAST можно использовать параметры по умолчанию соответствующих программ. Можно использовать матрицу PAM250 или BLOSUM62. Программное обеспечение для выполнения анализов BLAST является общедоступным через Национальный центр биотехнологической информации (National Center for Biotechnology Information) (NCBI). Смотри Web-сайт с URL www.ncbi.nlm.nih.gov для таких программ. В конкретном варианте осуществления процент идентичности рассчитывали при помощи BLAST2 с параметрами по умолчанию, предоставленными NCBI.
«Выделенный» или «частично очищенный», как используют в данном документе, в случае нуклеиновой кислоты или полипептида означает нуклеиновую кислоту или полипептид, отделенные как минимум от одного из других компонентов (например, нуклеиновой кислоты или полипептида), который присутствует вместе с нуклеиновой кислотой или полипептидом в их естественном источнике, и/или который присутствовал бы вместе с нуклеиновой кислотой или полипептидом, будучи экспрессированным клеткой, или секретированным, в случае секретируемых полипептидов. Химически синтезированные нуклеиновую кислоту или полипептид, либо синтезированные при помощи in vitro транскрипции/трансляции, считают «выделенными». «Выделенная клетка» представляет собой клетку, которая была изъята из организма, в котором она изначально существовала, либо потомка такой клетки. Данная клетка, возможно, была культивирована in vitro, например, в присутствии других клеток. Данную клетку, возможно, впоследствии вводят во второй организм или вновь вводят в организм, из которого ее (или клетку, из которой она происходит) выделяли.
Термин «ген, функция которого связана с плюрипотентностью», как используют в данном документе, означает ген, экспрессия которого в нормальных условиях (например, в отсутствие генно-инженерного вмешательства или другой процедуры, предназначенной для изменения экспрессии гена) происходит в плюрипотентных стволовых клетках, и только в них, и является принципиально важной для их функционирования в качестве таковых. Следует принимать во внимание, что полипептид, кодируемый геном, функционально связанным с плюрипотентностью, может присутствовать в качестве материнского фактора в ооците. Ген может экспрессироваться, как минимум, некоторыми клетками эмбриона, например, как минимум, на протяжении части предымплантационного периода и/или в предшественниках половых клеток взрослой особи.
Термин «модулировать» используют в соответствии с его применением в данной области, то есть, имея в виду вызывать или способствовать качественному или количественному изменению, преобразованию или модификации интересующего процесса, пути или феномена. Без ограничений, такое изменение может представлять собой возрастание, снижение или изменение относительной концентрации или активности различных компонентов или участков процесса, пути или феномена. «Модулятор» представляет собой средство, которое вызывает или способствует качественному или количественному изменению, преобразованию или модификации интересующего процесса, пути или феномена.
Термин «фактор плюрипотентности» используют для обозначения продукта экспрессии гена, функция которого связана с плюрипотентностью, например, полипептида, кодируемого геном. В некоторых вариантах осуществления фактор плюрипотентности представляет собой фактор, который, как правило, в основном не экспрессируется в соматических клетках, которые составляют тело взрослого животного (за исключением половых клеток или их предшественников). Например, фактор плюрипотентности может представлять собой фактор, среднее содержание которого в ЭС клетках как минимум в 50 или 100 раз превышает его среднее содержание в полностью дифференцированных типах клеток, имеющихся в организме взрослого млекопитающего. В некоторых вариантах осуществления фактор плюрипотентности представляет собой фактор, являющийся необходимым для поддержания жизнеспособности или плюрипотентного состояния ЭС клеток in vivo и/или ЭС клеток, полученных при помощи общепринятых способов. Таким образом, если ген, кодирующий фактор, подвергнут нокауту или ингибирован (то есть, его экспрессия элиминирована или существенно снижена), ЭС клетки не образуются, погибают или, в некоторых вариантах осуществления, дифференцируются. В некоторых вариантах осуществления ингибирование экспрессии гена, функция которого связана с плюрипотентностью, в ЭС клетках (что приводит, например, к снижению среднего стационарного уровня транскрипта РНК и/или белка, кодируемого геном, как минимум на 50%, 60%, 70%, 80%, 90%, 95% или более) приводит к тому, что клетка является жизнеспособной, но больше не плюрипотентной. В некоторых вариантах осуществления ген отличается тем, что его экспрессия в ЭС клетках снижается (что приводит, например, к снижению среднего стационарного уровня транскрипта РНК и/или белка, кодируемого геном, как минимум на 50%, 60%, 70%, 80%, 90%, 95% или более), если клетка дифференцируется в окончательно дифференцированную клетку.
«Ген, индуцирующий плюрипотентность», как используют в данном документе, означает ген, экспрессия которого вносит вклад в перепрограммирование соматических клеток в плюрипотентное состояние. «Фактор, индуцирующий плюрипотентность» означает продукт экспрессии гена, индуцирующего плюрипотентность. Фактор, индуцирующий плюрипотентность, может являться, но не обязательно должен быть, фактором плюрипотентности. Экспрессия экзогенно привнесенного фактора, индуцирующего плюрипотентность, может быть временной, то есть, она может быть необходима на протяжении как минимум части процесса перепрограммирования для индукции плюрипотентности и/или установления стабильного плюрипотентного состояния, но после этого перестает быть необходимой для поддержания плюрипотентности. Например, фактор может индуцировать экспрессию эндогенных генов, функция которых связана с плюрипотентностью. Затем данные гены могут поддерживать перепрограммированные клетки в плюрипотентном состоянии.
Термин «полинуклеотид» используют в данном документе взаимозаменяемо с термином «нуклеиновая кислота» для обозначения полимера нуклеозидов. Как правило, полинуклеотид по данному изобретению состоит из нуклеозидов, которые естественным образом встречаются в ДНК или РНК (например, аденозин, тимидин, гуанозин, цитидин, уридин, дезоксиаденозин, дезокситимидин, дезоксигуанозин и дезоксицитидин), соединенных фосфодиэфирными связями. Однако термин охватывает молекулы, содержащие нуклеозиды или аналоги нуклеозидов, имеющие химически или биологически модифицированные основания, модифицированные остовы молекулы, и так далее, независимо от их наличия в природных нуклеиновых кислотах, и такие молекулы могут являться предпочтительными для некоторых применений. В случае, когда данное применение относится к полинуклеотиду, очевидно, что предусмотрены как ДНК, так и РНК, и в каждом случае как одно-, так и двуспиральная формы (а также комплементарные молекулы для каждой односпиральной молекулы). «Полинуклеотидная последовательность», как используют в данном документе, может означать собственно полинуклеотидный материал и/или информацию о последовательности (то есть, последовательность букв, используемых как сокращения для оснований), которая биохимически характеризует конкретную нуклеиновую кислоту. Полинуклеотидная последовательность, приведенная в данном документе, представлена в направлении от 5' к 3' концу, если не указано иное.
«Полипептид» означает полимер аминокислот. Термины «белок» и «полипептид» в данном документе используют взаимозаменяемо. Пептид представляет собой относительно короткий полипептид, как правило, примерно от 2 до 60 аминокислот в длину. Полипептиды, используемые в данном документе, как правило, содержат аминокислоты, например, 20 L-аминокислот, которые наиболее часто встречаются в белках. Однако можно использовать другие аминокислоты и/или аналоги аминокислот, известные в данной области. Одна или более аминокислот в полипептиде могут быть модифицированы, например, путем добавления химического фрагмента, такого как углеводная группа, фосфатная группа, группа жирной кислоты, линкер для конъюгации, функционализации, и так далее. Полипептид, который обладает не полипептидным фрагментом, ковалентно или нековалентно связанным с ним, по-прежнему считается «полипептидом». Примеры модификаций включают гликозилирование и пальмитоилирование. Полипептиды можно очищать из природных источников, получать при помощи технологии рекомбинантной ДНК, синтезировать химическими методами, такими как общепринятый твердофазный пептидный синтез, и так далее. Термин «полипептидная последовательность» или «аминокислотная последовательность», как используют в данном документе, может означать собственно полипептидный материал и/или информацию о последовательности (то есть, последовательность букв или трехбуквенные коды, используемые в качестве аббревиатур названий аминокислот), которая биохимически характеризует полипептид. Полипептидная последовательность, приведенная в данном документе, представлена в направлении от N-конца к C-концу, если не указано иное.
«Полипептидный вариант» означает любой полипептид, отличающийся от природного полипептида аминокислотной вставкой(ами), делецией(ями) и/или заменой(ами). Варианты могут быть природными или созданными при помощи, например, методов рекомбинантной ДНК или химического синтеза. В некоторых вариантах осуществления аминокислотные «замены» являются результатом замены одной аминокислоты другой аминокислотой, имеющей сходные структурные и/или химические свойства, то есть, консервативными аминокислотными заменами. «Консервативные» аминокислотные замены можно производить на основе сходства любого из множества свойств, таких как размер боковой цепи, полярность, заряд, растворимость, гидрофобность, гидрофильность и/или амфипатичность затронутых остатков. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, глицин, пролин, фенилаланин, триптофан и метионин. Полярные (гидрофильные), нейтральные аминокислоты включают серин, треонин, цистеин, тирозин, аспарагин и глютамин. Положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин. Отрицательно заряженные (кислые) аминокислоты включают аспарагиновую кислоту и глютаминовую кислоту. Размер вставок или делеций может находиться в пределах примерно от 1 до 20 аминокислот, например, 1-10 аминокислот. В некоторых случаях домены большего размера можно удалять без существенного влияния на функцию. В некоторых вариантах осуществления изобретения последовательность варианта можно получать, производя в общей сложности не более чем 5, 10, 15 или 20 аминокислотных добавлений, делеций или замен в последовательности природного фермента. В некоторых вариантах осуществления не более чем 1%, 5%, 10% или 20% аминокислот в полипептиде являются вставками, делециями или заменами относительно исходного полипептида. Указания на то, какие аминокислотные остатки можно заменять, добавлять или делетировать без элиминации или существенного снижения интересующей активности, можно получить, сравнивая последовательность конкретного полипептида с таковой для гомологичных полипептидов (например, из других организмов) и сводя к минимуму число изменений аминокислотной последовательности, совершаемых в областях высокой гомологии (консервативные области), либо заменяя аминокислоты теми аминокислотами, которые встречаются в гомологичных последовательностях, поскольку аминокислотные остатки, которые сохраняются у различных видов, наиболее вероятно, являются более важными для активности, чем аминокислоты, которые не сохраняются.
«Очищенный» или «в основном очищенный», как используют в данном документе, означает, что указанная нуклеиновая кислота или полипептид являются в значительной степени свободными от других биологических макромолекул, например, полинуклеотидов, белков и тому подобного. В одном варианте осуществления полинуклеотид или полипептид является очищенным так, что он составляет как минимум 90% по весу, например, как минимум 95% по весу, например, как минимум 99% по весу от присутствующих полинуклеотида(ов) или полипептида(ов) (однако вода, буферные растворы, ионы и другие малые молекулы, особенно молекулы, обладающие молекулярной массой менее чем 1000 дальтон, могут присутствовать).
Термин «РНК-интерференция» используют в данном документе в соответствии с его значением в данной области для обозначения феномена, заключающегося в том, что двуспиральная РНК (дсРНК) (dsRNA) запускает специфичную для последовательности деградацию или подавление трансляции соответствующей мРНК, обладающей комплементарностью со спиралью дсРНК. Следует принимать во внимание, что комплементарность между спиралью дсРНК и мРНК не обязательно должна быть 100%, а только должна быть достаточной для того, чтобы опосредовать ингибирование экспрессии гена (также называемый «сайленсинг» или «нокдаун»). Например, степень комплементарности является таковой, что спираль может либо (i) направлять расщепление мРНК в индуцированном РНК комплексе сайленсинга (RISC); или (ii) вызывать трансляционное подавление мРНК. В некоторых вариантах осуществления двуспиральная часть РНК составляет менее чем примерно 30 нуклеотидов в длину, например, от 17 до 29 нуклеотидов в длину. В клетках млекопитающих РНКи можно достичь, вводя в клетки соответствующую двуспиральную нуклеиновую кислоту или осуществляя экспрессию в клетках нуклеиновой кислоты, которая затем подвергается процессингу внутри клетки с образованием дсРНК. Нуклеиновые кислоты, способные опосредовать РНКи, называют в данном документе «средства для РНКи». Примерами нуклеиновых кислот, способных опосредовать РНКи, являются короткие шпилечные РНК (кшРНК) (shRNA), короткие интерферирующие РНК (киРНК) (siRNA) и предшественник микроРНК. Эти термины хорошо известны и используются в данном документе в соответствии с их значением в данной области. Молекулы киРНК, как правило, представляют собой две раздельные спирали нуклеиновой кислоты, которые гибридизуются друг с другом с образованием дуплекса. Их можно синтезировать in vitro, например, используя стандартные методы синтеза нуклеиновых кислот. Они могут содержать множество модифицированных нуклеозидов, аналогов нуклеозидов и могут содержать химически или биологически модифицированные основания, модифицированные остовы молекулы и так далее. Можно использовать любую модификацию, признанную в данной области применимой для РНКи. Некоторые модификации приводят к повышению стабильности, поглощения клеткой, активности и так далее. В некоторых вариантах осуществления киРНК содержит дуплекс длиной примерно 19 нуклеотидов и один или два выступающих фрагмента длиной 1-5 нуклеотидов с 3'-конца, которые могут состоять из дезоксирибонуклеотидов. Молекулы кшРНК представляют собой одну спираль нуклеиновой кислоты, которая содержит две комплементарные области, разделенные преимущественно не самокомплементарной областью. Комплементарные области гибридизуются с образованием дуплексной структуры, а не самокомплементарная область образует петлю, соединяющую 3'-конец одной спирали дуплекса и 5'-конец другой спирали. Молекулы кшРНК претерпевают внутриклеточный процессинг с образованием киРНК.
МикроРНК (миРНК) (miRNA) представляют собой небольшие некодирующие односпиральные молекулы РНК длиной примерно 21-25 нуклеотидов (в системах млекопитающих), которые ингибируют экспрессию генов специфическим для последовательности образом. Они образуются внутри клетки из предшественников, обладающих характерной вторичной структурой, состоящей из короткой шпильки (примерно 70 нуклеотидов в длину), содержащей дуплекс, который часто включает одну или более областей дефектной комплементарности. Природные миРНК только частично комплементарны своей целевой мРНК и, как правило, действуют через подавление трансляции. Средства для РНКи, имитирующие эндогенные предшественники микроРНК, применимы в данном изобретении. В некоторых вариантах осуществления последовательность, кодирующая стеблевую область структуры типа «стебель-петля», или кодирующая полную структуру «стебель-петля», можно встраивать в нуклеиновую кислоту, содержащую как минимум часть эндогенного первичного транскрипта микроРНК, например, на место последовательности, которая кодирует эндогенную микроРНК или минимальную (~70 нуклеотидов) шпильку микроРНК.
«Перепрограммирующий фактор» означает ген, РНК или белок, которые способствуют или вносят вклад в перепрограммирование клетки, например, in vitro. В аспектах данного изобретения, относящихся к перепрограммирующему фактору(ам), по изобретению предложены варианты осуществления, в которых перепрограммирующий фактор(ы) представляет интерес для перепрограммирования соматических клеток в плюрипотентность in vitro. Примерами перепрограммирующих факторов, представляющих интерес для перепрограммирования соматических клеток в плюрипотентность in vitro, являются Oct4, Nanog, Sox2, Lin28, Klf4, c-Myc, а также любой ген/белок, который способен заменять один или большее количество из перечисленного в способе перепрограммирования соматических клеток in vitro. Словосочетания «перепрограммирование в плюрипотентное состояние in vitro» или «перепрограммирование в плюрипотентность in vitro» используют в данном документе для обозначения способов перепрограммирования in vitro, которые не требуют и, как правило, не включают ядерный или цитоплазматический перенос, либо слияние клеток, например, в случае ооцитов, эмбрионов, половых клеток или плюрипотентных клеток. Любой вариант осуществления или пункт формулы изобретения может определенно исключать композиции или способы, относящиеся к, или затрагивающие ядерный или цитоплазматический перенос, либо слияние клеток, например, в случае ооцитов, эмбрионов, половых клеток или плюрипотентных клеток.
«Селектируемый маркер» означает ген, РНК или белок, которые, будучи экспрессированными, придают клеткам селектируемый фенотип, такой как устойчивость к цитотоксическому или цитостатическому средству (например, устойчивость к антибиотику), питательную прототрофность или экспрессию конкретного белка, который можно использовать как основу для того, чтобы различать клетки, которые экспрессируют белок, от клеток, которые не экспрессируют его. Белки, экспрессию которых можно легко детектировать, например, флуоресцентный или люминесцентный белок, либо фермент, который выступает в роли субстрата с образованием окрашенного, флуоресцентного или люминесцентного вещества («детектируемых маркеров»), составляют группу селектируемых маркеров. Наличие селектируемого маркера, связанного с элементами контроля экспрессии, свойственными гену, который, как правило, экспрессируется избирательно или исключительно в плюрипотентных клетках, дает возможность выявлять и отбирать соматические клетки, которые были перепрограммированы в плюрипотентное состояние. Можно использовать множество генов селектируемых маркеров, таких как ген устойчивости к неомицину (neo), ген устойчивости к пуромицину (puro), гуанинфосфорибозилтрансферазы (gpt), дигидрофолатредуктазы (DHFR), аденозиндезаминазы (ada), пуромицин-N-ацетилтрансферазы (PAC), ген устойчивости к гигромицину (hyg), ген множественной лекарственной устойчивости (mdr), тимидинкиназы (TK), гипоксантингуанин-фосфорибозилтрансферазы (HPRT) и ген hisD. Детектируемые маркеры включают зеленый флуоресцентный белок (GFP) синий, сапфировый, желтый, красный, оранжевый и голубой флуоресцентные белки, а также варианты любого из перечисленных. Также можно использовать люминесцентные белки, такие как люцифераза (например, люциферазу светлячков или Renilla). Как будет очевидно любому специалисту в данной области, термин «селектируемый маркер», как используют в данном документе, может означать ген или продукт экспрессии гена, например, кодируемый белок.
В некоторых вариантах осуществления селектируемый маркер придает преимущество для пролиферации и/или выживания клеткам, которые его экспрессируют, относительно клеток, которые его не экспрессируют, либо которые экспрессируют его в значительно меньших количествах. Такое преимущество для пролиферации и/или выживания, как правило, проявляется, если клетки находятся в определенных условиях, то есть, «селективных условиях». Чтобы гарантировать эффективную селекцию, популяцию клеток можно поддерживать в нужных условиях в течение достаточного периода времени так, чтобы клетки, которые не экспрессируют маркер, не пролиферировали и/или не выживали и элиминировались из популяции, или чтобы их количество снижалось до крайне небольшой доли в популяции. Процесс отбора клеток, экспрессирующих маркер, который придает преимущество для пролиферации и/или выживания, посредством выдерживания популяции клеток в селективных условиях так, чтобы в значительной степени или полностью элиминировать клетки, которые не экспрессируют маркер, называют в данном документе «положительной селекцией», и маркер называют «пригодным для положительной селекции». Отрицательная селекция и маркеры, пригодные для отрицательной селекции, также представляют интерес для некоторых способов, описанных в данном документе. Экспрессия таких маркеров создает неблагоприятные условия для пролиферации и/или выживания клеток, которые экспрессируют маркер, относительно клеток, которые не экспрессируют маркер, либо экспрессируют его в значительно меньших количествах (или, иными словами, клетки, которые не экспрессируют маркер, обладают преимуществом для пролиферации и/или выживания относительно клеток, которые экспрессируют маркер). Вследствие этого, клетки, которые экспрессируют маркер, могут в значительной степени или полностью элиминироваться из популяции клеток, поддерживаемых в селективных условиях в течение достаточного периода времени.
Термины «воздействовать», «обработка», «лечение» и так далее, применительно к выделенной клетке, включают подвергание клетки процессу или условиям любого типа, либо выполнение с клеткой манипуляций или процедур любого типа. Применительно к субъекту, термины означают обеспечение медицинской или хирургической помощи, лечения или терапии для индивидуума. Индивидуум, как правило, является больным или травмированным, либо имеет повышенную степень риска заболеть, по сравнению со средним членом популяции, и нуждается в такой помощи, лечении или терапии.
Термин «Wnt» или «белок Wnt», как используют в данном документе, означает полипептид, обладающий природной аминокислотной последовательностью белка Wnt или его фрагмента, варианта, либо производного от него, который, как минимум частично, сохраняет способность природного белка связываться с рецептором(ами) Wnt и активировать передачу сигнала Wnt. Следует принимать во внимание, что, как в случае практически всех белков, в дополнение к существующим в природе аллельным вариантам последовательностей Wnt, которые могут существовать в популяции, можно вносить множество изменений в последовательности, приведенные под регистрационными номерами в таблице 1 (называемые последовательностями «дикого типа»), без существенного изменения функциональной (биологической) активности полипептидов. Такие варианты находятся в рамках терминов «Wnt», «белок Wnt» и так далее.
Вариант может представлять собой, например, полипептид, как минимум на 80%, 85%, 90%, 95%, 98% или 99% идентичный полноразмерному Wnt. Вариант может представлять собой фрагмент полноразмерного Wnt. Вариант может представлять собой существующий в природе сплайсированный вариант. Вариант может представлять собой полипептид, как минимум на 80%, 85%, 90%, 95%, 98% или 99% идентичный фрагменту Wnt, где фрагмент имеет длину, как минимум на 50%, 60%, 70%, 80%, 85%, 90%, 95%, 98% или 99% соответствующую длине полноразмерного полипептида дикого типа или его домена, обладающего интересующей активностью, такой как способность связываться с рецептором Wnt. В некоторых вариантах осуществления домен составляет как минимум 100, 200, 300 или 400 аминокислот в длину, начиная с любой аминокислотной позиции в последовательности, и продолжается до C-конца. Желательно избегать вариантов, которые, как известно в данной области, элиминируют или существенно снижают активность белка Wnt. В некоторых вариантах осуществления у варианта отсутствует N- и/или C-концевая область полноразмерного полипептида, например, отсутствуют вплоть до 10, 20 или 50 аминокислот с любого конца. В некоторых вариантах осуществления полипептид обладает последовательностью зрелого полипептида Wnt, под которым подразумевают полипептид Wnt, у которого одна или более областей, таких как сигнальный пептид, удаляются в процессе обычного внутриклеточного протеолитического процессинга (например, в процессе котрансляционного или посттрансляционного процессинга). В некоторых вариантах осуществления, где белок Wnt получают иным путем, нежели его очистка из клеток, которые обычно его экспрессируют, белок представляет собой химерный полипептид, под которым подразумевают, что он содержит области, происходящие из двух или более различных видов. В некоторых вариантах осуществления, где белок Wnt получают иным путем, нежели его очистка из клеток, которые обычно его экспрессируют, белок представляет собой производное Wnt, под которым подразумевают, что белок содержит дополнительные последовательности, не относящиеся к Wnt, при условии, что эти последовательности существенно не снижают биологическую активность белка.
Специалисту в данной области будет известно, либо он сможет легко проверить, используя анализы, известные в данной области, является ли функциональным конкретный вариант, фрагмент или производное Wnt. Например, способность варианта полипептида Wnt связываться с рецептором Wnt можно оценивать при помощи стандартных анализов на связывание белков. Подходящие анализы включают измерение способности активировать транскрипцию репортерного конструкта, содержащего центр связывания TCF, функционально связанный с последовательностью нуклеиновой кислоты, кодирующей детектируемый маркер, такой как люцифераза. Один из анализов включает определение того, индуцирует ли вариант Wnt фосфорилирование β-катенина. Состояние фосфорилирования можно определять при помощи соответствующего метода, например, иммуноблоттинга. Другие анализы включают тестирование варианта или фрагмента на известные биологические активности Wnt. Смотри, например, Barker, N. and Clevers, H., Nat Rev Drug Discov. 5(12): 997-1014, 2006, где описаны анализы, подходящие для выявления средств, которые модулируют активность пути Wnt. Такие анализы легко можно приспособить для выявления или для подтверждения активности средств, которые инициируют активность пути Wnt. В некоторых вариантах осуществления изобретения функциональный вариант или фрагмент обладает как минимум 50%, 60%, 70%, 80%, 90%, 95% или более активности полноразмерного полипептида дикого типа.
«Активность пути Wnt» или «передача сигнала Wnt» означает серию биохимических событий, которые происходят вследствие связывания стимулирующего лиганда (например, белка Wnt) с рецептором для члена семейства Wnt, в конечном итоге приводя к изменениям транскрипции гена и, в случае in vivo, часто приводя к характерному биологическому эффекту в организме.
Перепрограммирование соматических клеток при помощи активации пути Wnt
Настоящее изобретение заключает в себе признание того факта, что активацию пути Wnt можно использовать для перепрограммирования соматических клеток. Изобретение также заключает в себе признание того факта, что активация пути Wnt повышает эффективность перепрограммирования соматических клеток, например, если такие клетки подвергать воздействию, которое приведет к перепрограммированию как минимум некоторых клеток. «Повышать эффективность перепрограммирования» означает вызывать увеличение процентного содержания клеток, которые претерпевают перепрограммирование, если популяцию клеток подвергают перепрограммирующему воздействию, что, как правило, приводит к появлению большего числа отдельных колоний перепрограммированных клеток после заданного периода времени. В некоторых вариантах осуществления изобретения активация пути Wnt по изобретению повышает число перепрограммированных клеток и/или числа колоний перепрограммированных клеток, и/или процентного содержания клеток, которые претерпевают перепрограммирование. Изобретение также заключает в себе признание того факта, что активация пути Wnt позволяет перепрограммировать соматические клетки, которые не были генетически модифицированы для повышения экспрессии в них онкогена, такого как c-Myc. Таким образом, по изобретению предлагают пути замены для рекомбинантной экспрессии c-Myc в любом способе перепрограммирования соматических клеток, который иначе включал бы генетическое изменение клеток для экспрессии ими c-Myc. В некоторых вариантах осуществления изобретения активации пути Wnt достаточно, чтобы имело место перепрограммирование в условиях, в которых иначе перепрограммирования не произошло бы.
Изобретение относится к способам получения перепрограммированных соматических клеток, включающим модулирование, например, повышение, активности пути Wnt. Кроме того, изобретение относится к композициям, применяемым в данных методах. В одном аспекте, изобретение относится к способу перепрограммирования соматических клеток, включающему модулирование, например, повышение, активности пути Wnt в клетке. Кроме того, изобретение относится к усовершенствованным способам перепрограммирования соматических клеток, где способ включает подвергание соматических клеток воздействию, которое способно перепрограммировать как минимум некоторые клетки, где усовершенствование представляет собой повышение активности пути Wnt в указанных клетках. Воздействие может представлять собой любое воздействие, известное в данной области, которое применяют для перепрограммирования соматических клеток, либо считают потенциально применимым для данной цели. В некоторых вариантах осуществления изобретения активность пути Wnt повышают при помощи активаторов пути Wnt, таких как малые молекулы, растворимые белки Wnt или средства, которые опосредуют РНК-интерференцию и тем самым ингибируют эндогенные ингибиторы пути Wnt. В некоторых вариантах осуществления соматические клетки, предназначенные для перепрограммирования, культивируют в Wnt-кондиционированной среде. В любом из вариантов осуществления изобретения, если не указано особо или не следует из контекста, «перепрограммирование» может означать перепрограммирование в плюрипотентное состояние.
Молекулы Wnt представляют собой семейство секретируемых белков, играющих важную роль во множестве связанных с развитием и физиологических процессов (Mikels, A.J. and Nusse, R., Oncogene, 25: 7461-7468, 2006). Молекулы Wnt обладают сходством последовательностей между собой и являются в высокой степени консервативными по структуре и функции у многих видов. Таким образом, белок Wnt, проявляющий активность у одного вида, можно использовать у других видов для активации пути Wnt у таких видов, и можно ожидать, что он будет проявлять аналогичную активность. Члены семейства Wnt включают Wnt1, Wnt2, Wnt2b (также называемый Wnt13), Wnt3, Wnt3a, Wnt4, Wnt5a, Wnt5b, Wnt6, Wnt7a, Wnt7b, Wnt7c, Wnt8, Wnt8a, Wnt8b, Wnt8c, Wnt10a, Wnt10b, Wnt11, Wnt14, Wnt15 или Wnt16. Последовательности генов и белков Wnt известны в данной области. Специалист в данной области может легко найти идентифицирующие коды генов (ID генов), регистрационные номера, а также информацию о последовательностях членов семейства Wnt и других генов и белков, представляющих интерес в данном документе, в общедоступных базах данных (для примеров смотри таблицу 1).
Инициация передачи сигнала Wnt происходит в результате взаимодействия белков Wnt с различными рецепторами, включая членов семейства Frizzled (Fz) трансмембранных рецепторов и членов семейства белков, родственных рецепторам липопротеинов низкой плотности (LRP) (например, LRP5/LRP6). Внеклеточный сигнал Wnt стимулирует внутриклеточные каскады передачи сигнала, включая канонический путь, который регулирует экспрессию генов в ядре (обзор Logan C.Y. and Nusse, R. Annu. Rev. Cell Dev. Biol., 20: 781-810, 2004), и некоторые неканонические пути (обзор Kohn, A.D. and Moon, R.T., Cell Calcium, 38: 439-446, 2005). Вкратце, передача сигнала Wnt через канонический путь приводит к стабилизации и ядерной локализации β-катенина, который соединяется с членами семейства T-клеточных факторов/лимфоидных энхансерных факторов (TCF/LEF) из транскрипционных факторов, с образованием комплексов, которые, как правило, активируют транскрипцию. В отсутствие передачи сигнала Wnt β-катенин, наоборот, подлежит деградации с помощью комплекса разрушения β-катенина, и факторы TCF/LEF образуют комплексы, которые, как правило, подавляют транскрипцию. В отсутствие передачи сигнала Wnt киназы, такие как гликогенсинтазакиназа-3 (GSK3) и казеинкиназа 1 (CK1) фосфорилируют β-катенин, который, вследствие этого, является убиквитированным и подлежит разрушению протеасомой. Таким образом, активация пути приводит к пониженному фосфорилированию β-катенина, тем самым приводя к его стабилизации. Некоторые эндогенные белки были идентифицированы в качестве ингибиторов передачи сигнала Wnt, включая Dickkopf (Dkk), белок области локализации сайта инициации реаранжировки (Bcr), белки, содержащие домен WIF (ингибиторный фактор Wnt) и так далее.
В некоторых вариантах осуществления изобретения способы перепрограммирования включают создание контакта клетки со средством, которое модулирует, например, повышает, активность пути Wnt. В некоторых вариантах осуществления повышение активности пути Wnt индуцирует превращение клетки в плюрипотентную и обладающую характерными особенностями ЭС клеток. Таким образом, способы можно применять для получения плюрипотентных, ЭС-подобных клеток (иПС клеток). В некоторых вариантах осуществления изобретения воздействие, которое вызывает повышение активности пути Wnt, является воздействием, которое приводит к повышению внутриклеточных уровней β-катенина. В некоторых вариантах осуществления изобретения воздействие, которое вызывает повышение активности пути Wnt, является воздействием, которое приводит к усилению ядерной транслокации β-катенина. В некоторых вариантах осуществления изобретения воздействие, которое вызывает повышение активности пути Wnt, является воздействием, способным вызывать изменения в генной экспрессии, характерной для клеток, подвергнутых воздействию источника биологически активного белка Wnt. В некоторых вариантах осуществления изобретения перепрограммирование модулируют при помощи ингибитора пути Wnt.
Значительный успех в достижении цели перепрограммирования соматических клеток в плюрипотентное состояние in vitro был достигнут, когда было показано, что клеточные линии, обладающие некоторыми свойствами ЭС клеток, можно получать, вводя гены, кодирующие четыре фактора транскрипции, связанные с плюрипотентностью, то есть, Oct3/4, Sox2, c-Myc и Klf4, в кожные фибробласты мышей посредством ретровирусной инфекции, а затем отбирая клетки, которые экспрессируют маркер плюрипотентности, Fbx15, в ответ на такие факторы (Takahashi, K. & Yamanaka, S. Cell 126, 663-676, 2006). Однако полученные клетки отличались от ЭС клеток по генной экспрессии и характерным особенностям метилирования ДНК, а будучи инъецированы в нормальные бластоцисты мыши, не приводили к появлению живых химер (животных, несущих во всем организме клетки как из исходной бластоцисты, так и из привнесенных клеток). Дальнейшая работа позволила улучшить данные результаты путем проведения более строгого отбора, приводящего к получению стабильных перепрограммированных клеточных линий, которые, исходя из приведенных профилей транскрипции, импринтинга (экспрессии аллелей, предопределенных родительской формой, от которой они происходят) и модификации хроматина, выглядели в основном идентичными ЭС клеткам (Okita, K., et al., 448, 313-317, 2007; Wernig, M. et al. Nature 448, 318-324, 2007; Maherali, N. et al. Cell Stem Cell 1, 55-70, 2007). Соматические клетки, которые были перепрограммированы в плюрипотентное состояние in vitro с помощью данных способов или других способов (например, с применением малых молекул), называют в данном документе, как принято называть в данной области, «индуцированными плюрипотентными стволовыми» (иПС) клетками. В дальнейшем было показано, что соматические клетки человека также можно перепрограммировать в плюрипотентность при помощи данных факторов. Более того, показано, что сочетание Oct4, Nanog, Sox2, и Lin28 также способно перепрограммировать соматические клетки в плюрипотентное состояние in vitro (Yu J, Science, 318(5858): 1917-20, 2007). Однако для получения таких клеток также необходимо использовать генетическое изменение клеток для экспрессии ими множественных факторов транскрипции и применять ретровирусную трансдукцию.
В настоящее время заявители показали, что увеличенное количество колоний, состоящих из ЭС-подобных клеток, появляется, если соматические клетки, генетически измененные для экспрессии ими Oct4, Sox2, Klf4 и c-Myc, культивируют с Wnt3a-кондиционированной средой, по сравнению с тем, когда клетки культивируют в среде, кондиционированной контрольными клетками, или в стандартной среде для культивирования клеток, обычно используемой для наращивания ЭС клеток. Заявители также показали, что колонии, состоящие из ЭС-подобных клеток, появляются, если соматические клетки, генетически измененные для экспрессии ими Oct4, Sox2 и Klf4, но не модифицированные для экспрессии ими c-Myc, культивируют в Wnt3a-кондиционированной среде, в то время как колонии ЭС-подобных клеток не образуются в течение 20-дневного периода времени, представленного на фигуре 1, если такие клетки культивировать в некондиционированной среде или среде, кондиционированной контрольными клетками. В обоих случаях колонии демонстрировали морфологические признаки, характерные для колоний ЭС клеток, и экспрессию детектируемого маркера, являющегося индикатором экспрессии Oct4. По всем проверенным критериям клетки, очевидно, являлись плюрипотентными, ЭС-подобными клетками (иПС клетками). Более того, культивирование соматических клеток в Wnt3a-кондиционированной среде, судя по всему, способствовало селекции перепрограммированных клеток. Колонии, образованные в присутствии Wnt3a-кондиционированной среды, выглядели более гомогенными, чем те, что образовались в отсутствие Wnt3a-кондиционированной среды. Таким образом, данные способы можно использовать для облегчения идентификации перепрограммированных клеток, и, возможно, для облегчения отделения таких клеток от клеток, которые не были перепрограммированы, без необходимости использования химической селекции, основанной на встроенном генетическом элементе, таком как ген, продукт экспрессии которого придает устойчивость к лекарственному средству или вызывает флуоресценцию. Таким образом, данные способы можно использовать для получения перепрограммированных клеток, которые не имеют генетических модификаций с целью отбора или выявления перепрограммированных клеток. Более того, данные способы можно использовать для увеличения среднего процентного содержания перепрограммированных клеток в колонии, содержащей перепрограммированные клетки, по сравнению со средним процентным содержанием клеток, которые были бы перепрограммированы в отсутствие средства, которое повышает активность пути Wnt.
Заявители и другие заметили, что некоторые иПС-подобные клетки можно получать без инфицирования клеток вирусом c-Myc. Однако это малоэффективное событие, и оно может являться, как минимум частично, следствием инсерционного мутагенеза, при котором процесс интеграции вируса напрямую активирует c-Myc или целевой ген(ы) c-Myc. В экспериментах заявителей на очень поздних временных точках на чашках были видны некоторые колонии, которые избыточно экспрессировали Klf4, Sox2 и Oct4 (без введения вируса c-Myc), даже без Wnt-кондиционированной среды. Wnt-кондиционированная среда значительно сокращала необходимое время и повышала эффективность процесса перепрограммирования. Один из аспектов изобретения заключается в том, что более короткий срок для перепрограммирования, достигнутый при помощи способов по изобретению, облегчит использование временных средств избыточной экспрессии индуцирующих плюрипотентность факторов для образования иПС клеток (например, временной трансфекции) и/или перепрограммирование путем воздействия на соматические клетки перепрограммирующими средствами, такими как белки, малые молекулы и так далее, вместо вирусной инфекции. Кроме того, заявители предполагают, что повышенная эффективность образования иПС клеток при помощи способов по изобретению может являться чрезвычайно полезной для перепрограммирования человеческих клеток, как при избыточной экспрессии Myc, так и без нее.
Без ограничения, данные способы являются способами, применимыми для повышения скорости перепрограммирования соматических клеток в иПС клетки. Таким образом, изобретение относится к способу повышения скорости перепрограммирования соматических клеток, включающему культивирование популяции соматических клеток млекопитающих в Wnt-кондиционированной культуральной клеточной среде таким образом, что как минимум некоторые из клеток индуцируются к превращению в ЭС-подобные клетки за более короткий период времени, чем в случае отсутствия Wnt-кондиционированной среды. Изобретение также относится к способу повышения скорости перепрограммирования соматических клеток, включающему активирование пути Wnt в культивируемой популяции соматических клеток таким образом, что как минимум некоторые из клеток индуцируются к превращению в ЭС-подобные клетки за более короткий период времени, чем в случае, если бы путь Wnt не был активирован. Изобретение также относится к способу повышения скорости перепрограммирования соматических клеток, включающему культивирование популяции соматических клеток млекопитающих в присутствии средства, которое повышает активность пути Wnt таким образом, что как минимум некоторые из клеток индуцируются к превращению в ЭС-подобные клетки за более короткий период времени, чем в случае отсутствия указанного средства. В некоторых вариантах осуществления изобретения период времени составляет 7 дней, тогда как в других вариантах осуществления изобретения период времени составляет 10, 15 или 20 дней. В некоторых вариантах осуществления изобретения клетки обрабатывают (например, генетически изменяют) таким образом, что они экспрессируют Sox2, Klf4, Oct4 и c-Myc в количествах больших, чем было в случае отсутствия подобной обработки. В некоторых вариантах осуществления изобретения клетки являются обработанными таким образом, что они избыточно экспрессируют Sox2, Klf4 и Oct4 в количествах больших, чем было бы в случае отсутствия подобной обработки, но не являются генетически измененными для избыточной экспрессии ими c-Myc. Один из способов обработки представляет собой инфицирование клеток вирусами (например, ретровирусом, лентивирусом) или трансфицирование клеток вирусными векторами (например, ретровирусными, лентивирусными), которые содержат последовательности факторов, функционально связанные с подходящими элементами контроля экспрессии, чтобы направлять экспрессию в клетках после инфекции или трансфекции и, возможно, интеграции в геном, как известно в данной области. Дополнительные подробности относительно композиций и способов по изобретению приведены ниже.
Изобретение относится к способу перепрограммирования соматической клетки, включающему культивирование клетки в Wnt-кондиционированной культуральной клеточной среде таким образом, что клетки становятся перепрограммированными. В некоторых вариантах осуществления культивирование клетки в Wnt-кондиционированной культуральной клеточной среде индуцирует превращение клетки в плюрипотентную и обладающую характерными особенностями ЭС клеток. Таким образом, данные способы применимы для получения плюрипотентных ЭС-подобных клеток (иПС клеток). В некоторых вариантах осуществления Wnt-кондиционированная культуральная клеточная среда представляет собой Wnt3a-кондиционированную среду.
Термин «кондиционированная среда» означает культуральную клеточную среду, которую прежде использовали для культивирования клеток. Кондиционированная среда отличается тем, что она содержит растворимые вещества, например, сигнальные молекулы, ростовые факторы, гормоны и так далее, которые продуцируются клетками в процессе их культивирования и высвобождаются в среду. Как используют в данном документе, «Wnt-кондиционированная среда» означает кондиционированную среду, которую прежде использовали для культивирования клеток, которые продуцируют и секретируют Wnt. Среду можно дополнительно описывать, исходя из конкретного белка Wnt, продуцируемого клетками. Например, «Wnt3a-кондиционированная среда» означает кондиционированную среду, которую прежде использовали для культивирования клеток, которые продуцируют Wnt3a. Данные клетки могут также продуцировать другие типы Wnt в дополнение к конкретному специально указанному типу Wnt. В любом варианте осуществления изобретения, где используют Wnt-кондиционированную среду, можно использовать Wnt3a-кондиционированную среду, если не указано иное.
Следует принимать во внимание, что некоторые типы Wnt обладают сходными биологическими активностями с Wnt3a и/или являются близкородственными для Wnt3a с точки зрения последовательности. Кондиционированную среду, полученную при помощи клеток, которые продуцируют такие типы Wnt, используют в некоторых вариантах осуществления изобретения.
Кондиционированную среду можно получать способами, известными в данной области. Такие способы, как правило, включают культивирование первой популяции клеток в культуральной клеточной среде, а затем сбор среды (обычно без сбора клеток). Собранную среду можно фильтровать для удаления клеточного детрита и так далее. Кондиционированную среду (содержащую компоненты, секретируемые в среду клетками) затем можно использовать для поддержания роста второй популяции клеток. Клетки культивируют в среде в течение достаточного периода времени, чтобы достичь соответствующей концентрации высвобождаемых факторов, таких как Wnt (и/или истощения компонентов среды), для получения среды, которая поддерживает перепрограммирование соматических клеток. В некоторых вариантах осуществления среду кондиционируют путем культивирования в течение 24 ч при 37°C. Однако можно использовать более длинный или короткий периоды времени, например, от 24 до 72 часов. Клетки можно использовать для кондиционирования множественных партий среды в течение дополнительных периодов времени, до тех пор, пока клетки сохраняют свою способность кондиционировать среду соответствующим образом для заданной цели.
Среда, в которой клетки культивируют для получения кондиционированной среды, может представлять собой обычную среду для культивирования клеток, способную поддерживать жизнеспособность клеток. В некоторых вариантах осуществления устанавливают химические характеристики среды. В некоторых вариантах осуществления среда является сходной или идентичной по составу со средой, обычно используемой для культивирования эмбриональных стволовых клеток из тех же видов, что и соматические клетки, подлежащие перепрограммированию при помощи кондиционированной среды. Базовая среда, используемая для кондиционирования, может содержать любое количество различных компонентов, отчасти зависящих от типов используемых клеток. Среда должна быть способна поддерживать культуру клеточной линии, используемой для кондиционирования среды. В некоторых вариантах осуществления среда также поддерживает культуру соматических клеток до их перепрограммирования и, возможно, соматических клеток, которые были перепрограммированы. Однако кондиционированную среду можно дополнять другими компонентами, комбинировать с другой средой, и так далее, после кондиционирования так, чтобы сделать ее подходящей для культивирования соматических клеток и перепрограммированных соматических клеток.
Подходящую базовую среду можно получать из следующих компонентов: модифицированная по способу Дульбекко среда Игла (DMEM), Invitrogen кат. № 11965-092; нокаутная модифицированная по способу Дульбекко среда Игла (KO DMEM), Invitrogen кат. № 10829-018; среда Хэма F12/50% минимальная среда DMEM; 200 мМ L-глютамин, Invitrogen кат. № 15039-027; раствор заменимых аминокислот, Invitrogen кат. № 11140-050; бета-меркаптоэтанол; человеческий рекомбинантный основной фактор роста фибробластов (bFGF). Типичная содержащая сыворотку ЭС среда состоит из 80% DMEM (как правило, KO DMEM), 20% типированной фетальной сыворотки крупного рогатого скота (FBS), не инактивированной нагреванием, 1% заменимых аминокислот, 1 мМ L-глютамина и 0,1 мМ β-маркаптоэтанола. Среду фильтруют и хранят при 4°C в течение не более 2 недель. Бессывороточную ЭС среду можно готовить из 80% KO DMEM, 20% заменителя сыворотки, 1% заменимых аминокислот, 1 мМ L-глютамина и 0,1 мМ β-маркаптоэтанола с заменителем сыворотки, таким как Invitrogen кат. № 10828-028. Среду фильтруют и хранят при 4°C. Прежде чем смешивать с клетками, используемыми для кондиционирования, можно добавлять человеческий bFGF до конечной концентрации 4 нг/мл. Используют StemPro® hESC SFM (Invitrogen кат. № A 1000701), полностью типированную, свободную от сыворотки и от фидера среду (SFM), специально разработанную для роста и размножения человеческих эмбриональных клеток.
Клетки, используемые для получения кондиционированной среды, могут естественным образом продуцировать Wnt. В некоторых вариантах осуществления клетки, используемые для получения среды, являются генетически измененными для повышения в них экспрессии Wnt, например, путем трансфицирования их кДНК, кодирующей Wnt, где последовательность, кодирующая Wnt, функционально связана с последовательностями контроля экспрессии, активными в клетках. Смотри, например, Cai, L., et al., Cell Res. 17: 62-72, 2007. В некоторых вариантах осуществления клетки продуцируют и секретируют Wnt в свою среду, в результате чего среда содержит белок Wnt в концентрации от 100 нг/мл до 1000 нг/мл. В некоторых вариантах осуществления клетки продуцируют и секретируют Wnt в свою среду, в результате чего среда содержит белок Wnt в концентрации от 200 нг/мл до 500 нг/мл. Клетки, избыточно экспрессирующие Wnt, также можно использовать в качестве фидерных клеток для целей перепрограммирования соматических клеток.
Прежде чем использовать, кондиционированную среду можно объединять с некондиционированной средой. Для краткости полученную среду по-прежнему называют кондиционированной средой, если она содержит как минимум 5% по объему кондиционированной среды. В некоторых вариантах осуществления количество (по объему) кондиционированной среды составляет как минимум 10%, например, как минимум 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, или более, кондиционированной среды. В некоторых вариантах осуществления количество кондиционированной среды по объему составляет примерно от 50% до 75%. Некондиционированная среда может представлять собой стандартную среду для культивирования клеток. В некоторых вариантах осуществления некондиционированная среда представляет собой среду, обычно используемую для наращивания ЭС клеток из того же вида, что и соматические клетки, предназначенные для перепрограммирования.
Кондиционированную среду можно использовать сразу после отделения от клеток, используемых для ее получения, либо можно хранить (например, примерно при 4°C или замороженной) до использования. Среду можно хранить в условиях и в течение периода времени, не препятствующих сохранению способности кондиционированной среды поддерживать перепрограммирование в способах по данному изобретению. Без ограничения, такие условия и период времени могут не препятствовать сохранению как минимум 20% исходной биологической активности секретируемого Wnt, присутствующего в среде, что можно определять с помощью методов, упомянутых выше. Кондиционированную среду можно концентрировать или иным образом обрабатывать, например, при помощи стандартных методов, при условии, что такая концентрация или обработка не препятствует сохранению способности концентрата поддерживать перепрограммирование при добавлении к некондиционированной среде. Без ограничения, такая концентрация или обработка может не препятствовать сохранению как минимум 20% исходной биологической активности секретируемого Wnt, присутствующего в среде. Как отмечено в разделе «Примеры», результаты, полученные заявителями, свидетельствуют о том, что нормальные фибробласты (генетически не измененные для избыточной экспрессии ими Wnt) могут секретировать факторы, возможно, включая Wnt3a, которые способствуют перепрограммированию, из чего следует вероятность того, что соматические клетки, подвергающиеся перепрограммированию in vitro, например, клетки в культуре, которые были подвергнуты воздействию ретровируса или иным образом генетически изменены для экспрессии ими Oct4, Sox2, Klf4 и, возможно, c-Myc, могут секретировать такие факторы и, тем самым, вносить вклад в свое собственное перепрограммирование. В некоторых вариантах осуществления настоящего изобретения Wnt-кондиционированная среда содержит белок Wnt в большей концентрации и/или обладает большей способностью активировать путь Wnt, чем было бы в случае, если немодифицированные соматические клетки, например, фибробласты, подвергающиеся перепрограммированию, культивируют в среде, известной в данной области как применимая для культивирования соматических клеток, подвергающихся перепрограммированию. В некоторых вариантах осуществления такая концентрация и/или способность к активации пути Wnt может быть как минимум в 1,5, 2, 5, 10, 20 или более раз больше, чем присутствующие в среде, в которой культивируют контрольные фибробласты, как описано в примере 5.
Некоторые способы по изобретению включают создание контакта in vitro соматической клетки с одним или большим количеством определенных средств, которые модулируют, например, повышают, активность пути Wnt. Клетки можно культивировать в стандартной среде для культивирования клеток, известной в данной области. Средство(а) можно добавлять в среду до того, как использовать ее для культивирования клеток, или в процессе культивирования. Термин «определенное средство» в данном контексте означает, что структура, последовательность или отличительные особенности средства, которое модулирует, например, повышает, активность пути Wnt, известны и/или средство химически синтезировано и/или средство (до добавления в среду) выделено, или как минимум частично очищено. Например, средство не может являться не охарактеризованным или не идентифицированным компонентом кондиционированной среды, клеточного или тканевого лизата, либо экстракта, клеточной цитоплазмы или ядерного материала, и так далее.
Для повышения активности пути Wnt можно использовать множество средств. Такие средства в данном документе называют «активаторы пути Wnt» или «агонисты Wnt». Активатор пути Wnt может действовать прямо, взаимодействуя с рецептором Wnt, или косвенно, взаимодействуя с одним или большим количеством внутриклеточных компонентов сигнального пути Wnt, таких как β-катенин, киназа или фосфатаза, которые действуют на β-катенин, фактор транскрипции, который объединяется с β-катенином, и так далее. Активатор может повышать экспрессию Wnt или компонента пути Wnt, такого как β-катенин. В некоторых вариантах осуществления активатор пути Wnt повышает активность пути Wnt до уровней, достаточных для стимуляции перепрограммирования соматических клеток. В некоторых вариантах осуществления изобретения активатор пути Wnt ингибирует разрушение β-катенина, тем самым стимулируя перепрограммирование соматических клеток. В некоторых вариантах осуществления изобретения представляет интерес ингибирование пути Wnt в соматических клетках или в перепрограммированных соматических клетках. Например, ингибиторы пути Wnt можно использовать, чтобы характеризовать или исследовать механизм, за счет которого происходит перепрограммирование и/или чтобы выявлять перепрограммирующие средства (например, средства, которые не действуют через путь Wnt). Кроме того, в некоторых вариантах осуществления изобретения ингибиторы пути Wnt (например, малые молекулы, киРНК, белки и так далее) можно использовать для содействия дифференциации перепрограммированных плюрипотентных клеток в желаемый тип клеток, например, в протоколах дифференциации in vitro.
В некоторых вариантах осуществления изобретения активатор или ингибитор пути Wnt представляет собой белок или малую молекулу, которые связываются с рецептором Wnt. Например, активатор пути Wnt может представлять собой растворимый биологически активный белок Wnt.
В некоторых вариантах осуществления концентрация белка Wnt, добавленного к среде, составляет от 10 до 10000 нг/мл, например, от 100 до 5000 нг/мл, например, от 1000 до 2500 нг/мл или от 2500 до 5000 нг/мл, или от 5000 до 10000 нг/мл.
Как отмечено выше, некоторые типы Wnt обладают сходными биологическими активностями с Wnt3a и/или являются близкородственными для Wnt3a с точки зрения последовательности. Такие типы Wnt и/или средства, которые имитируют активность таких типов Wnt, используют в некоторых вариантах осуществления изобретения.
Белок Wnt можно выделять из природных источников (например, клеток млекопитающих, которые естественным образом продуцируют белок), продуцировать в эукариотических или прокариотических клетках при помощи методов рекомбинантной экспрессии, либо синтезировать химическими методами. Растворимые биологически активные белки Wnt можно получать в очищенной форме при помощи способов, известных в данной области. Смотри, например, публикацию патента США № 20040248803 и Willert, K., et al., Nature, 423: 448-52, 2003. В некоторых вариантах осуществления растворимый биологически активный белок Wnt представляет собой Wnt3a. В некоторых вариантах осуществления белок Wnt является ко- или посттрансляционно модифицированным, что имеет место, когда белок Wnt продуцируется в клетке-хозяине, которая естественным образом экспрессирует белок Wnt. В других вариантах осуществления белок Wnt не является ко- или посттрансляционно модифицированным, как в природе. В некоторых вариантах осуществления растворимый биологически активный белок Wnt модифицирован липидным фрагментом, таким как пальмитат. Липидный фрагмент может быть присоединен к консервативному остатку цистеина. Например, в некоторых вариантах осуществления белок Wnt является пальмитоилированным по консервативному остатку цистеина, как известно в данной области. В некоторых вариантах осуществления белок Wnt является гликозилированным, что имеет место, когда белок Wnt продуцируется в клетке-хозяине млекопитающего, которая естественным образом экспрессирует белок Wnt. В других вариантах осуществления белок Wnt не является гликозилированным, как происходит в природе. Рекомбинантный мышиный Wnt3a является коммерчески доступным (например, от компаний Millipore кат. № GF 145 или R& D Systems кат. № 1324-WN-002).
В некоторых вариантах осуществления изобретения активатор пути Wnt представляет собой средство, которое повышает уровень β-катенина, способствует его ядерной локализации, либо иным образом активирует передачу сигнала β-катенином.
В некоторых вариантах осуществления изобретения активатор пути Wnt представляет собой малую молекулу, под которой подразумевают органическое соединение, имеющее множественные углерод-углеродные связи и молекулярную массу менее чем 1500 дальтон. Как правило, такие соединения содержат одну или более функциональных групп, которые опосредуют структурные взаимодействия с белками, например, образование водородной связи, и обычно содержат как минимум одну амино-, карбонильную, гидроксильную или карбоксильную группу, и в некоторых вариантах осуществления - как минимум две из функциональных химических групп. Низкомолекулярные средства могут содержать циклические углеродные или гетероциклические структуры и/или ароматические или полиароматические структуры, замещенные одной или большим количеством химических функциональных групп и/или гетероатомов.
В некоторых вариантах осуществления изобретения активатор пути Wnt представляет собой средство, которое ингибирует гликогенсинтазакиназу-3 (GSK3). Такие средства эффективно «включают» путь Wnt без необходимости во внеклеточном Wnt. GSK3 представляет собой сериновую/треониновую киназу, исходно идентифицированную как регулятор метаболизма глюкозы (обзор в Frame and Cohen, Biochem J 359: 1-16, 2001; смотри также Cohen, Biochem Soc Trans 7: 459-80, 1979; Embi et al., Eur J Biochem 107: 519-27, 1980). «GSK3», как используют в данном документе, означает либо одну из, либо обе изоформы GSK3 (GSK3α и GSK3β). Используют ингибиторы, которые ингибируют либо одну из, либо обе изоформы. В некоторых вариантах осуществления ингибитор GSK3 специфически ингибирует GSK3 и не ингибирует существенно большинство других киназ млекопитающих. В некоторых вариантах осуществления ингибитор GSK3 не ингибирует существенно как минимум 10 различных киназ млекопитающих. В некоторых вариантах осуществления ингибитор GSK3 специфически ингибирует как GSK3β, так и GSK3α. В некоторых вариантах осуществления ингибитор GSK3 специфически ингибирует GSK3β, но не GSK3α. Например, IC50 для GSK3α может быть как минимум в 10 раз выше, чем для GSK3β. В некоторых вариантах осуществления ингибитор GSK3 специфически ингибирует GSK3α, но не GSK3β. Например, IC50 для GSK3β может быть как минимум в 10 раз выше, чем для GSK3α. В некоторых вариантах осуществления IC50 ингибитора GSK3 для GSK3 является как минимум в 10 раз ниже, чем его IC50 для большинства других киназ млекопитающих. В некоторых вариантах осуществления IC50 ингибитора GSK3 для GSK3 составляет менее чем 10 мкМ. В некоторых вариантах осуществления IC50 ингибитора GSK3 для GSK3 составляет менее чем 1 мкМ. Следует понимать, что ингибитор GSK3 должен обладать способностью проникать в клетки в достаточных количествах в условиях, применяемых для того, чтобы ингибировать там GSK3. В некоторых вариантах осуществления используемая концентрация ингибитора GSK3 как минимум равна IC50 соединения при измерении in vitro. В некоторых вариантах осуществления используемая концентрация ингибитора GSK3 не более чем в 100 раз превышает IC50 соединения при измерении in vitro. В некоторых вариантах осуществления диапазон используемых концентраций составляет от 0,5 до 50-кратного избытка над IC50 при измерении in vitro.
В настоящее время идентифицировано множество сильных и избирательных низкомолекулярных ингибиторов GSK3 (Wagman A.S., Johnson K.W., Bussiere D.E., Curr Pharm Des., 10(10): 1105-37, 2004). Типичные используемые ингибиторы GSK3 включают следующие: (1) BIO: (2'Z,3'E)-6-броминдирубин-3'-оксим. 6-броминдирубин-3'-оксим (BIO) представляет собой сильный, обратимый и конкурирующий с АТФ ингибитор GSK-3 (Polychronopoulos, P. et al. J. Med. Chem. 47, 935-946, 2004). (2) AR-A014418: N-(4-метоксибензил)-N'-(5-нитро-1,3-тиазол-2-ил)мочевина. AR-A014418 ингибирует GSK3 (IC50=104 нМ), конкурентным с АТФ способом (Ki=38 нМ). AR-A014418 существенно не ингибирует cdk2 или cdk5 (IC50>100 мкМ) или 26 других киназ, демонстрируя высокую специфичность для GSK3 (Bhat, R., et al., J. Biol. Chem. 278, 45937-45945, 2003). (3) SB 216763: 3-(2,4-дихлорфенил)-4-(1-метил-1H-индол-3-ил)-1H-пиррол-2,5-дион. Смотри, например, Smith, D.G., et al., Bioorg. Med. Chem. Lett. 11, 635-639, (2001) и Cross, D. A., et al., J. Neurochem. 77, 94-102, (2001), (4) SB 415286: 3-[(3-хлор-4-гидроксифенил)амино]-4-(2-нитрофенил)-1H-пиррол-2,5-дион. SB 415286 описан в Smith, D.G., et al, Bioorg. Med. Chem. Lett. 11, 635-639, 2001 и Coughlan, M.P., et al., Chem. Biol. 10, 793-803, 2000, (5) TDZD-8: 4-бензил-2-метил-1,2,4-тиадиазолидин-3,5-дион. Данное соединение является избирательным ингибитором GSK-3, производным тиадиазолидинона, не конкурирующим с АТФ ингибитором GSK3β (IC50=2 мкМ). Оно не ингибирует Cdk-1/циклин B, CK-II, PKA или PKC при концентрации >100 мкМ. Было предположено, что оно связывает киназный центр GSK-3β. (Martinez et al., J. Med. Chem. 45, 1292-1299, 2002); Используют CHIR-911 и CHIR-837 (также называемые CT-99021 и CT-98023, соответственно) от корпорации Chiron Corporation (Emeryville, Calif.), а также родственные соединения. Хлорид лития, вальпроат натрия и ингибитор II GSK3 (Calbiochem) являются другими используемыми ингибиторами. Дополнительные ингибиторы GSK3 описаны в патентах США №№ 6057117 и 6608063; публикациях патентных заявок США 20040092535, 20040209878, 20050054663. Другие используемые ингибиторы GSK3 описаны в WO/2003/049739, в котором описывают СОЕДИНЕНИЯ ПИРИМИДИНА, ПРИМЕНИМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ GSK-3; WO/2002/085909, в котором описывают ПРОИЗВОДНЫЕ 9-ДЕАЗАГУАНИНА КАК ИНГИБИТОРЫ GSK-3, WO/2003/011287, в котором описывают ПРОИЗВОДНЫЕ ПИРАЗОЛОНА КАК ИНГИБИТОРЫ GSK-3, WO/2005/039485 и/или WO/2006/091737.
В некоторых вариантах осуществления изобретения активатор пути Wnt представляет собой ингибитор казеинкиназы 1 (CK1). Примеры включают D4476, IC261 и CKI-7 (смотри, например, Rena, G., et al. EMBO reports 5(1), 60-65, 2004). Соединения, которые ингибируют CK1 и GSK3, раскрыты в патенте США № 7098204.
В некоторых вариантах осуществления изобретения активатор пути Wnt представляет собой активатор фосфатазы, который естественным образом дефосфорилирует β-катенин по одному или большему количеству сайтов, фосфорилированных GSK3 или CK1.
CREB-связывающий белок (CBP) и близкородственный белок p300 могут объединяться с β-катенином и действовать как связывающие β-катенин коактиваторы транскрипции. Например, для получения транскрипционно активного комплекса, β-катенин вступает во взаимодействие с коактиваторами транскрипции, CREB-связывающим белком (CBP) или его близкородственным гомологом p300 (Hecht et al., EMBO J. 19: 1839-50 (2000); Takemaru et al., J. Cell Biol. 149:249-54 (2000)), а также с другими компонентами основного транскрипционного комплекса. Другие коактиваторы β-катенина включают TBP, BRG1, BCL9/PYG и так далее. Изобретение охватывает прямое или косвенное модулирование взаимодействий между β-катенином и любым одним или более из данных коактиваторов с целью стимулирования перепрограммирования соматических клеток. Например, изобретение охватывает изменение относительного участия β-катенина в любом одном или большем количестве таких комплексов по сравнению с его участием в одном или большем количестве других комплексов. Такие средства, как малые молекулы, можно использовать для избирательного нарушения взаимодействия β-катенина с конкретным коактиватором, тем самым потенциально подавляя транскрипцию, что будет ингибировать перепрограммирование или способствовать дифференциации. Избирательное нарушение может смещать равновесие в сторону взаимодействия с другим коактиватором с образованием комплекса, который усиливает перепрограммирование. Средство может действовать непосредственно на комплекс, либо косвенно, например, вызывая посттрансляционную модификацию, такую как фосфорилирование β-катенина или коактиватора. В одном варианте осуществления средство представляет собой соединение, описанное в патентной публикации США № 20070128669, либо его аналог или производное, или средство, имеющее тот же механизм действия. Белок, взаимодействующий с β-катенином (также известный как ICAT или CTNNBIP1), связывает β-катенин и ингибирует взаимодействие между β-катенином и членами семейства TCF (Gottardi, et al., Am J Physiol Cell Physiol. 286(4): C747-56, 2004). Кодируемый белок представляет собой отрицательный регулятор сигнального пути Wnt. Изобретение охватывает ингибирование ICAT (данный термин включает любые транскрипционные варианты или члены семейства, которые ингибируют взаимодействие β-катенина и TCF) для того, чтобы активировать путь Wnt. В некоторых вариантах осуществления изобретения средство, которое активирует путь Wnt, делает это посредством ингибирования экспрессии или активности эндогенного ингибитора или отрицательного регулятора пути Wnt. В некоторых вариантах осуществления средство ингибирует экспрессию посредством РНК-интерференции (RNAi). В некоторых вариантах осуществления средство ингибирует экспрессию или активность GSK3, ICAT, CK1 или CTNNBIP1.
В некоторых вариантах осуществления используемый по настоящему изобретению ингибитор представляет собой средство РНКи. Специалист в данной области сможет идентифицировать подходящее средство РНКи для ингибирования экспрессии интересующего гена. Смотри, например, Yu, J-Y., et al., Molecular Therapy, 7(2): 228-236, 2003. Средство РНКи может ингибировать экспрессию в достаточной степени, чтобы снизить средний равновесный уровень РНК, транскрибируемой с гена (например, мРНК), или кодируемого ею белка, например, как минимум на 50%, 60%, 70%, 80%, 90%, 95% или более). Средство РНКи может содержать последовательность длиной 17-29 нуклеотидов, например, длиной 19-23 нуклеотидов, которая на 100% комплементарна с мРНК, либо содержит вплоть до 1, 2, 3, 4 или 5 нуклеотидов, или примерно вплоть до 10-30% нуклеотидов, которые не принимают участие в образовании пар оснований по принципу Уотсона-Крика при выравнивании с мРНК для достижения максимального числа пар комплементарных оснований. Средство РНКи может содержать дуплекс длиной 17-29 нуклеотидов, в котором все нуклеотиды принимают участие в образовании пар оснований по принципу Уотсона-Крика, или в котором примерно вплоть до 10-30% нуклеотидов не принимают участие в образовании пар оснований по принципу Уотсона-Крика. Специалист в данной области знает, какие характеристики последовательности часто связаны с лучшими функциональными свойствами киРНК, и знаком с алгоритмами и правилами, при помощи которых можно проектировать такие киРНК (смотри, например, Jagla, B., et al., RNA, 11(6): 864-72, 2005). В способах по изобретению можно, но не обязательно, использовать киРНК, обладающие такими характеристиками. В некоторых вариантах осуществления последовательность любой из, или обеих, спиралей средства РНКи выбирают так, чтобы избежать сайленсинга нецелевых генов, например, спираль(ли) может иметь менее чем 70%, 80% или 90% комплементарности с любой мРНК, отличной от целевой мРНК. В некоторых вариантах осуществления используют множество различных последовательностей. В таблице 1 приведены ID человеческих и мышиных генов, кодирующих GSK3, а также регистрационные номера последовательностей нуклеиновых кислот (мРНК) и белков. Средства РНКи, способные вызывать сайленсинг генов млекопитающих, коммерчески доступны (например, от таких поставщиков, как Qiagen, Dharmacon, Invitrogen, и так далее). Если существуют множественные изоформы, можно разработать молекулы киРНК или кшРНК, направленные против области, присутствующей во всех изоформах, экспрессируемых в данной интересующей клетке.
Способы сайленсинга генов путем трансфицирования клеток киРНК или конструктами, кодирующими кшРНК, известны в данной области. Для экспрессии средства РНКи в соматических клетках, конструкт нуклеиновой кислоты, включающий последовательность, которая кодирует средство РНКи, функционально связанную с подходящими элементами контроля экспрессии, например, промотором, можно вводить в клетки, как принято в данной области. Для целей настоящего изобретения, конструкт нуклеиновой кислоты, который включает последовательность, кодирующую интересующую РНК или полипептид, где последовательность является функционально связанной с элементами контроля экспрессии, например, промотором, которые направляют транскрипцию в интересующей клетке, называют «полигенным экспрессирующим кластером». Промотор может представлять собой промотор РНК-полимеразы I, II или III, функционирующий в соматических клетках млекопитающих. В некоторых вариантах осуществления экспрессия средства РНКи является условной. В некоторых вариантах осуществления экспрессия регулируется размещением последовательности, кодирующей средство РНКи, под контролем регулируемого (например, индуцируемого или репрессируемого) промотора.
Конститутивно активные варианты белков, таких как β-катенин, или других компонентов сигнального пути Wnt, также находят применение. N-концевое укорочение или делеция потенциального сайта фосфорилирования GSK-3 в N-концевой области, либо миссенс-мутация в ней остатков серина или треонина приводит к накоплению укороченного или полноразмерного β-катенина, а затем к активации опосредованного β-катенином сигнала (de La Coste PNAS, 95(15): 8847-8851, 1998). Также используют доминантно-негативные варианты эндогенных белков, которые ингибируют передачу сигнала Wnt. В некоторых вариантах осуществления соматические клетки генетически изменяют для экспрессии ими данных белков. В некоторых вариантах осуществления белок добавляют к культуральной среде.
В некоторых вариантах осуществления клетки обрабатывают для усиления поглощения активатора пути Wnt, который действует внутри клетки. Например, проницаемость клеточной мембраны может быть частично нарушена. В некоторых вариантах осуществления активатор пути Wnt модифицируют так, чтобы он содержал аминокислотную последовательность, которая повышает поглощение клетками молекул (также называемую «домен белковой трансдукции»). Такие повышающие поглощение аминокислотные последовательности обнаружены, например, в белке HIV-1 TAT, ДНК-связывающем белке VP22 вируса простого герпеса 1 (HSV-1), транскрипционном факторе Drosophila Antennapedia (Antp), и так далее. Также используют искусственные последовательности. Смотри, например, Fischer et al, Bioconjugate Chem., Vol. 12, No. 6, 2001 и патент США № 6835810.
Без ограничения, по изобретению предусмотрено использование в способах по настоящему изобретению любых композиций и подходов, раскрытых в патентной публикации США № 20060147435 как применимые для стимуляции передачи сигнала Wnt/β-катенином.
В некоторых вариантах осуществления изобретения соматические клетки обрабатывают таким образом, что они экспрессируют белок Wnt в количествах больших, чем было бы в случае отсутствия такой обработки. В некоторых вариантах осуществления соматические клетки подвергают генетическим изменениям, чтобы они постоянно или временно экспрессировали белок Wnt в количествах больших, чем было бы в случае отсутствия такой обработки. В некоторых вариантах осуществления изобретения соматические клетки обрабатывают таким образом, что они экспрессируют компонент пути Wnt, такой как β-катенин или TCF/LEF, в количествах больших, чем было бы в случае отсутствия такой обработки. В некоторых вариантах осуществления изобретения соматические клетки подвергают генетическим изменениям, чтобы они постоянно или временно экспрессировали компонент пути Wnt, такой как β-катенин или TCF/LEF, в количествах больших, чем было бы в случае отсутствия такой обработки.
Способы по изобретению могут включать воздействие на клетки многими перепрограммирующими средствами, либо одновременно (то есть, на протяжении периодов времени, которые перекрываются как минимум частично), либо последовательно и/или повторяя этапы воздействия на клетки средством. Средство, используемое при повторном воздействии, может представлять собой то же средство, которое использовали при первом воздействии, или другое. Клетки могут контактировать с перепрограммирующим средством в течение различных периодов времени. В некоторых вариантах осуществления клетки контактируют со средством в течение периода времени от 1 часа до 60 дней, например, от 10 до 30 дней, например, в течение примерно 15-20 дней. Перепрограммирующие средства можно добавлять каждый раз при замене среды для культивирования клеток. Перепрограммирующее средство(а) можно удалять до того, как проводить отбор с целью обогащения плюрипотентных клеток или оценивать клетки по признакам плюрипотентности.
Интересующие перепрограммирующие средства или кандидаты в перепрограммирующие средства включают множество соединений. Типичные соединения включают средства, которые ингибируют деацетилирование гистонов, например, ингибиторы гистондеацетилазы (HDAC), а также средства, которые ингибируют метилирование ДНК, например, ингибиторы ДНК-метилтрансферазы. Не стремясь углубляться в теорию, деметилирование ДНК может регулировать экспрессию генов, «открывая» структуру хроматина, что можно определять по повышенной чувствительности к нуклеазе. Такое изменение структуры хроматина позволяет факторам транскрипции связываться с промоторными областями, делает возможной сборку транскрипционного комплекса и экспрессию генов.
Основные классы ингибиторов HDAC включают (a) короткоцепочечные жирные кислоты (например, вальпроевую кислоту); (b) гидроксаматные низкомолекулярные ингибиторы (например, SAHA и PXD101); (c) не гидроксаматные низкомолекулярные ингибиторы, например, MS-275; и (d) циклические пептиды: например, депсипептид (смотри, например, Carey N. and La Thangue N.B., Curr Opin Pharmacol.; 6(4): 369-75, 2006). Примеры ингибиторов гистондеацетилазы включают трихостатин A: [R-(E,E)]-7-[4-(диметиламино)фенил]-N-гидрокси-4,6-диметил-7-оксо-2,4-гептадиенамид, который ингибирует гистондеацетилазу в наномолярных концентрациях; происходящее в результате гиперацетилирование гистона приводит к релаксации хроматина и модулированию экспрессии генов. (Yoshida, M., et al., Bioessays 17, 423-430, 1995; Minucci, S., et al., Proc. Natl. Acad. Sci. USA 94, 11295-11300, 1997; Brehm, A., et al., 1998; Medina, V., et al., Induction of caspase-3 protease activity and apoptosis by butyrate and trichostatin A (inhibitors of histone deacetylase): dependence on protein synthesis and synergy with a mitochondrial/cytochrome c-dependent pathway. Cancer Res. 57, 3697-3707, 1997; Kim, M.S., et al., Inhibition of histone deacetylase increases cytotoxicity to anticancer drugs targeting DNA. Cancer Res. 63, 7291-7300, 2003); апицидин: цикло[(2S)-2-амино-8-оксодеканоил-1-метокси-L-триптофил-L-изолейцил-(2R)-2-пиперидинэкскарбонил] (Kwon, S.H., et al. J. Biol. Chem. 18, 2073, 2002; Han, J.W., et al. Cancer Res. 60, 6068, 2000; Colletti, S.L., et al. Bioorg. Med. Chem. 11, 107, 2001 ; Kim, J.S., et al. Biochem. Biophys. Res. Commun. 281, 866, 2001).
Многие ингибиторы метилирования ДНК известны в данной области и применяются в данном изобретении. Смотри, например, Lyko, F. and Brown, R., JNCI Journal of the National Cancer Institute, 97(20): 1498-1506, 2005. Ингибиторы метилирования ДНК включают нуклеозидные ингибиторы ДНК-метилтрансферазы, такие как децитабин (2'-дезокси-5-азацитидин), 5-азадезоксицитидин и зебуларин, не нуклеозидные ингибиторы, такие как полифенол(-)-эпигаллокатехин-3-галлат (EGCG) и низкомолекулярный RG108 (2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)-3-(1H-индол-3-ил)пропановая кислота), соединения, описанные в WO2005085196 и фталамиды, сукцинимиды и родственные соединения, описанные в WO2007007054. Три дополнительных класса соединений представляют собой: (1) производные 4-аминобензойной кислоты, такие как лекарственное средство против аритмии прокаинамид и анестетик местного действия прокаин; (2) псаммаплины, которые также ингибируют гистондеацетилазу (Pina, I.C., J Org Chem., 68(10): 3866-73, 2003); и (3) олигонуклеотиды, включая киРНК, кшРНК, а также специфические антисмысловые олигонуклеотиды, такие как MG98. Ингибиторы метилирования ДНК могут действовать при помощи множества различных механизмов. Нуклеозидные ингибиторы метаболизируются в путях клеточного метаболизма, прежде чем встраиваться в ДНК. После встраивания они действуют как суицидальные субстраты для ферментов DNMT. Не нуклеозидные ингибиторы прокаин, эпигаллокатехин-3-галлат (EGCG) и RG108, как предполагают, ингибируют ДНК-метилтрансферазы, маскируя целевые последовательности DNMT (то есть, прокаин), либо блокируя активный центр фермента (то есть, EGCG и RG108). В некоторых вариантах осуществления изобретения используют сочетания ингибиторов метилирования ДНК. В некоторых вариантах осуществления концентрации выбирают так, чтобы свести к минимуму токсическое воздействие на клетки. В некоторых вариантах осуществления не используют средства, которые встраиваются в ДНК (или продукты метаболизма которых встраиваются в ДНК).
ДНК-мтилтрансферазу (DNMT1, 3a и/или 3b) и/или один или более членов семейства HDAC можно альтернативно или дополнительно ингибировать при помощи средств РНКи.
Изобретение охватывает использование Wnt-кондиционированной среды, растворимого Wnt или малых молекул, которые модулируют сигнальный путь Wnt, в сочетании с другими временными сигналами, например, малыми молекулами, которые могут заменять Oct4, Sox2, Klf4, Nanog и/или Lin28 ретровирусы при перепрограммировании соматических клеток в плюрипотентность. Изобретение относится к композиции, содержащей модулятор пути Wnt и как минимум одно соединение, выбранное из группы, состоящей из: ингибиторов HDAC и ингибиторов метилирования ДНК. Изобретение относится к композиции, содержащей модулятор пути Wnt, как минимум один ингибитор HDAC и как минимум один ингибитор метилирования ДНК. Изобретение относится к среде для культивирования клеток, содержащей любое из вышеперечисленных сочетаний средств. В некоторых вариантах осуществления ингибитор HDAC представляет собой любой ингибитор HDAC, упомянутый выше. В некоторых вариантах осуществления ингибитор метилирования ДНК представляет собой любой ингибитор HDAC, упомянутый выше. В некоторых вариантах осуществления модулятор пути Wnt активирует путь Wnt. В некоторых вариантах осуществления среда для культивирования клеток включает Wnt-кондиционированную среду, например, Wnt3a-CM, в качестве источника модулятора пути Wnt. В некоторых вариантах осуществления модулятор пути Wnt представляет собой малую молекулу. В некоторых вариантах осуществления композиция включает соматические клетки. В некоторых вариантах осуществления соматические клетки являются генетически измененными для экспрессии ими как минимум одного из факторов транскрипции Oct4, Nanog, Sox2, Klf4 и Lin28.
Соматические клетки и перепрограммирование соматических клеток
Соматические клетки, используемые по изобретению, могут представлять собой первичные клетки (не иммортализованные клетки), например, клетки, свежевыделенные из животного, либо могут происходить от линии клеток, способных пролиферировать в культуре длительное время (например, в течение более 3 месяцев), либо неограниченное время (иммортализованные клетки). Взрослые соматические клетки можно получать от индивидуумов, например, субъектов-людей, и культивировать в соответствии со стандартными протоколами культивирования клеток, известными рядовым специалистам в данной области. Клетки можно поддерживать в клеточной культуре после их выделения из субъекта. В некоторых вариантах осуществления клетки пересеивают один или более раз после их выделения из индивидуума (например, 2-5, 5-10, 10-20, 20-50, 50-100 раз, или более) до того как использовать их в способе по изобретению. Их можно замораживать, а затем оттаивать перед использованием. В некоторых вариантах осуществления клетки пересеивают не более чем 1, 2, 5, 10, 20 или 50 раз после их выделения из индивидуума до того как использовать их в способе по изобретению.
Соматические клетки, используемые по настоящему изобретению, включают клетки млекопитающих, такие как, например, клетки человека, клетки приматов, отличных от человека, или клетки мыши. Их можно получать хорошо известными способами из различных органов, например, кожи, легкого, поджелудочной железы, печени, желудка, кишечника, сердца, репродуктивных органов, мочевого пузыря, почки, мочеиспускательного канала и других органов мочевой системы, и так далее, как правило, из любого органа или ткани, которые содержат живые соматические клетки. Соматические клетки млекопитающих, применимые в различных вариантах осуществления настоящего изобретения, включают, например, фибробласты, взрослые стволовые клетки, клетки Сертоли, гранулезные клетки, нейроны, клетки островков Лангерганса, эпидермальные клетки, эпителиальные клетки, эндотелиальные клетки, гепатоциты, клетки волосяных фолликулов, кератиноциты, гемопоэтические клетки, меланоциты, хондроциты, лимфоциты (B- и T-лимфоциты), эритроциты, макрофаги, моноциты, мононуклеарные клетки, клетки сердечной мышцы, клетки скелетной мышцы, и так далее, как правило, любые живые соматические клетки.
Соматические клетки можно обрабатывать таким образом, чтобы заставить их экспрессировать или содержать один или более перепрограммирующих факторов, факторов плюрипотентности и/или факторов, индуцирующих плюрипотентность, в количествах больших, чем было бы в случае отсутствия такой обработки. Например, соматические клетки можно генетически изменять для экспрессии ими одного или более генов, кодирующих один или большее количество таких факторов, и/или можно обрабатывать средством(ами), которые повышают экспрессию одного или более эндогенных генов, кодирующих такие факторы и/или стабилизирующих такой фактор(ы). Средство может представлять собой, например, малую молекулу, нуклеиновую кислоту, полипептид и так далее. В некоторых вариантах осуществления факторы, такие как факторы плюрипотентности, вводят в соматические клетки, например, микроинъекцией или путем создания контакта клеток с факторами в условиях, при которых факторы поглощаются клетками. В некоторых вариантах осуществления факторы модифицируют, чтобы они содержали домен белковой трансдукции. В некоторых вариантах осуществления у клеток нарушают проницаемость мембраны или иным образом обрабатывают для усиления поглощения ими факторов. Примеры факторов обсуждаются ниже.
Фактор транскрипции Oct4 (также называемый Pou5fl, Oct-3, Oct3/4) является примером фактора плюрипотентности. Показано, что Oct4 необходим для создания и поддержания недифференцированного фенотипа ЭС клеток и играет основную роль в определении ранних событий эмбриогенеза и клеточной дифференциации (Nichols et al., 1998, Cell 95: 379-391; Niwa et al., 2000, Nature Genet. 24: 372-376). Экспрессия Oct4 понижается при дифференциации стволовых клеток в более специализированные клетки. Nanog является другим примером фактора плюрипотентности. Nanog представляет собой содержащий гомеобокс фактор транскрипции с основной функцией поддержания плюрипотентных клеток внутренней клеточной массы и производства из нее ЭС клеток. Кроме того, избыточная экспрессия Nanog способна поддерживать признаки плюрипотентности и самообновления ЭС клеток в условиях, которые обычно были бы условиями культивирования, индуцирующими дифференциацию (смотри Chambers et al., 2003, Cell 113: 643-655; Mitsui et al., Cell. 2003, 113(5): 631-42). Sox2, другой фактор плюрипотентности, представляет собой содержащий домен HMG фактор транскрипции, который, как известно, является необходимым для нормального развития и поддержания плюрипотентной клетки (Avilion, A., et al., Genes Dev. 17, 126-140, 2003). Klf4 является фактором транскрипции, представляющим собой цинковый палец типа Круппеля (Kruppel-type zinc finger), исходно идентифицированный как член семейства Klf, экспрессируемый в пищеварительном канале (Shields, J. M, et al., J. Biol. Chem. 271: 20009-20017, 1996). Обнаружено, что избыточная экспрессия Klf4 в ЭС клетках мыши предотвращает дифференциацию в эмбриоидных тельцах, образованных в суспензионной культуре, из чего следует, что Klf4 вносит вклад в самообновление ЭС клеток (Li, Y., et al., Blood 105: 635-637, 2005). Sox2 представляет собой члена семейства факторов транскрипции SOX (Y-бокс определяющей пол области) и является важным для поддержания самообновления ЭС клеток. c-Myc является фактором транскрипции, который играет огромное множество ролей в нормальном развитии и физиологии, а также представляет собой онкоген, неуправляемая экспрессия или мутация которого связана с различными типами рака (обзор в Pelengaris S., Khan M., Arch Biochem Biophys. 416(2): 129-36, 2003; Cole M.D., Nikiforov M.A., Curr Top Microbiol Immunol., 302: 33-50, 2006). В некоторых вариантах осуществления такие факторы выбирают из: Oct4, Sox2, Klf4 и их сочетаний. В некоторых вариантах осуществления другой, функционально дублирующий член семейства Klf, такой как Klf2, используют вместо Klf4. В некоторых вариантах осуществления факторы включают как минимум Oct4. В некоторых вариантах осуществления факторы включают как минимум Oct4 и члена семейства Klf, например, Klf2. Lin28 представляет собой регулируемый в процессе развития РНК-связывающий белок. В некоторых вариантах осуществления соматические клетки обрабатывают так, чтобы они экспрессировали или содержали один или более перепрограммирующих факторов, выбираемых из: Oct4, Sox2, Klf4, Nanog, Lin28 и их сочетаний. CCAAT/энхансер-связывающий белок альфа (C/EBPalpha) представляет собой другой белок, который способствует перепрограммированию как минимум в некоторых типах клеток, например, лимфоидных клетках, например, B-клеточной линии дифференцировки, его считают перепрограммирующим фактором для такого типа клеток и используют в некоторых вариантах осуществления изобретения, например, в сочетании с одним или большим количеством генов плюрипотентности и/или модуляторами пути Wnt, описанными в данном документе.
Другие интересующие гены принимают участие в модификации хроматина и/или, как показано, являются важными для поддержания плюрипотентности ЭС клеток. Ген, необязательно, является геном, который понижающе регулируется при дифференциации клеток и/или не экспрессируется во взрослых соматических клетках. Другие интересующие гены кодируют предшественники микроРНК, которые связаны с мультипотентностью или плюрипотентностью и/или которые естественным образом экспрессируются в мультипотентных или плюрипотентных клетках. Другие интересующие гены кодируют средства РНКи, которые ингибируют гены, являющиеся мишенью эндогенных микроРНК, которые естественным образом экспрессируются в мультипотентных или плюрипотентных клетках.
В одном из вариантов осуществления экзогенно введенный ген может экспрессироваться с хромосомного локуса, отличного от хромосомного локуса эндогенного гена, функция которого связана с плюрипотентностью. Такой хромосомный локус может представлять собой локус с открытой структурой хроматина и содержать ген(ы), экспрессия которого не нужна в соматических клетках, например, хромосомный локус содержит ген(ы), разрушение которых не вызовет гибель клетки. Типичные хромосомные локусы включают, например, локус ROSA 26 и локус коллагена типа II (Col2al) мыши (смотри Zambrowicz et al., 1997).
Способы для экспрессирования генов в клетках известны в данной области. Как правило, последовательность, кодирующую полипептид или функциональную РНК, такую как средство РНКи, функционально связывают с соответствующими регуляторными последовательностями. Термин «регуляторная последовательность» включает промоторы, энхансеры и другие элементы контроля экспрессии. Типичные регуляторные последовательности описаны в Goeddel; Gene Expression Technology: Methods in Enzymology, Academic Press, San Diego, CA (1990). Например, любую из широкого разнообразия последовательностей контроля экспрессии, которые контролируют экспрессию последовательности ДНК, будучи функционально связанными с ней, можно использовать в данных векторах для экспрессии молекул кДНК.
Экзогенно введенный ген может экспрессироваться с индуцируемой или репрессируемой регуляторной последовательности таким образом, что его экспрессия может регулироваться. Термин «индуцируемая регуляторная последовательность», как используют в данном документе, означает регуляторную последовательность, которая в отсутствие индуктора (такого как химическое или биологическое вещество), или сочетания индукторов, не направляет экспрессию, либо направляет экспрессию в малых количествах функционально связанной последовательности нуклеиновой кислоты, такой как кДНК, и, в ответ на индуктор, ее способность направлять экспрессию возрастает. Типичные индуцируемые промоторы включают, например, промоторы, которые отвечают на тяжелые металлы (CRC Boca Raton, Fla. (1991), 167-220; Brinster et al. Nature (1982), 296, 39-42), на температурный шок, на гормоны (Lee et al. P.N.A.S. USA (1988), 85, 1204-1208; (1981), 294, 228-232; Klock et al. Nature (1987), 329, 734-736; Israel and Kaufman, Nucleic Acids Res. (1989), 17, 2589-2604), промоторы, которые отвечают на химические вещества, такие как глюкоза, лактоза, галактоза или антибиотик. «Репрессируемая регуляторная последовательность» представляет собой последовательность, которая направляет экспрессию функционально связанной последовательности нуклеиновой кислоты в отсутствие специфического средства или сочетания средств, которые ингибируют экспрессию.
Индуцируемый тетрациклином промотор является примером индуцируемого промотора, который отвечает на антибиотик. Смотри Gossen, M. and Bujard, H., Annu Rev Genet. Vol. 36: 153-173, 2002 и приведенные там ссылки. Индуцируемый тетрациклином промотор представляет собой минимальный промотор, функционально связанный с одним или большим количеством тетрациклиновых операторов. Присутствие тетрациклина или одного из его аналогов приводит к связыванию активатора транскрипции с последовательностями тетрациклинового оператора, что активирует минимальный промотор и, как следствие, транскрипцию связанной кДНК. Аналог тетрациклина включает любое соединение, которое обладает структурным сходством с тетрациклином и способно активировать индуцируемый тетрациклином промотор. Типичные аналоги тетрациклина включают, например, доксициклин, хлортетрациклин и ангидротетрациклин.
В некоторых вариантах осуществления изобретения экспрессия введенного гена, например, гена, кодирующего перепрограммирующий фактор или средство РНКи, является временной. Временную экспрессию можно получать путем временной трансфекции или путем экспрессии с регулируемого промотора. В некоторых вариантах осуществления экспрессия может регулироваться при помощи, или зависит от экспрессии сайт-специфической рекомбиназы. Рекомбиназные системы включают системы Cre-Lox и Flp-Frt, среди прочих (Gossen, M. and Bujard, H., 2002). В некоторых вариантах осуществления рекомбиназу используют, чтобы запустить экспрессию путем удаления блокаторной последовательности, которая, в противном случае, будет отделять кодирующую последовательность от последовательностей контроля экспрессии. В некоторых вариантах осуществления рекомбиназу используют, чтобы вырезать как минимум часть гена после того, как была индуцирована плюрипотентность. В некоторых вариантах осуществления рекомбиназа экспрессируется временно, например, ее невозможно детектировать спустя примерно 1-2 дня, 2-7 дней, 1-2 недели и так далее. В некоторых вариантах осуществления рекомбиназу вводят из внешних источников. В данных вариантах осуществления изобретения рекомбиназа, необязательно, содержит домен белковой трансдукции.
Перепрограммирование соматических клеток можно оценивать по одному или большему количеству признаков плюрипотентности. Наличие признака(ов) плюрипотентности указывает на то, что соматические клетки были перепрограммированы в плюрипотентное состояние. Термин «признак плюрипотентности», как используют в данном документе, означает признак, связанный с, или указывающий на плюрипотентность, включая, например, способность дифференцироваться в клетки, происходящие из всех трех зародышевых слоев эмбриона всех типов, а также отличительные особенности экспрессии генов, характерные для плюрипотентной клетки, включая экспрессию факторов плюрипотентности и экспрессию других маркеров ЭС клеток.
Для оценки потенциально перепрограммированных соматических клеток на наличие признаков плюрипотентности, можно анализировать такие клетки по конкретным ростовым характеристикам и ЭС-подобной клеточной морфологии. Клетки можно вводить подкожно мышам линии SCID с иммунной недостаточностью для определения того, способны ли они вызывать тератомы (стандартный тест для ЭС клеток). ЭС-подобные клетки могут дифференцироваться в эмбриоидные тельца (другая характерная особенность ЭС клеток). Кроме того, можно вызывать дифференциацию ЭС-подобных клеток in vitro, добавляя определенные ростовые факторы, которые, как известно, вызывают дифференциацию в конкретные типы клеток. Способность к самообновлению, характеризующаяся индукцией активности теломеразы, является другим признаком плюрипотентности, который можно контролировать. Можно проводить функциональные тесты с перепрограммированными соматическими клетками, вводя их в бластоцисты и определяя, способны ли клетки давать начало всем типам клеток. Смотри Hogan et al., 2003. Если перепрограммированные клетки способны образовывать несколько типов клеток организма, они являются мультипотентными; если перепрограммированные клетки способны образовывать все типы клеток организма, включая половые клетки, они являются плюрипотентными.
Можно также изучать экспрессию отдельного фактора плюрипотентности в перепрограммированных соматических клетках для оценки их признаков плюрипотентности. Дополнительно или альтернативно можно оценивать экспрессию других маркеров ЭС клеток. Стадиеспецифические эмбриональные 1 5 антигены-1, -3 и -4 (SSEA-1, SSEA-3, SSEA-4) представляют собой гликопротеины, специфически экспрессирующиеся при раннем эмбриональном развитии, и являются маркерами для ЭС клеток (Solter and Knowles, 1978, Proc. Natl. Acad. Sci. USA 75: 5565-5569; Kannagi et al., 1983, EMBO J 2: 2355-2361). Повышенная экспрессия фермента щелочной фосфатазы (AP) является другим маркером, связанным с недифференцированными эмбриональными стволовыми клетками (Wobus et al., 1984, Exp. Cell 152: 212-219; Pease et al., 1990, Dev. Biol. 141: 322-352). Дополнительные маркеры ЭС клеток описаны в Ginis, I., et al., Dev. Biol., 269: 369-380, 2004, а также в The International Stem Cell Initiative, Adewumi O, et al., Nat Biotechnol., 25(7): 803-16, 2007 и приведенных там ссылках. Например, используют TRA-1-60, TRA-1-81, GCTM2 и GCT343, а также протеиновые антигены CD9, Thy1 (также известный как CD90), HLA класса 1, NANOG, TDGF1, DNMT3B, GABRB3 и GDF3, REX-1, TERT, UTF-1, TRF-1, TRF-2, коннексин 43, коннексин 45, Foxd3, FGFR-4, ABCG-2 и Glut-1.
Можно проводить определение профиля экспрессии перепрограммированных соматических клеток для оценки их признаков плюрипотентности. Известно, что плюрипотентные клетки, такие как эмбриональные стволовые клетки, и мультипотентные клетки, такие как взрослые стволовые клетки, имеют разные характерные особенности общей экспрессии генов. Смотри, например, Ramalho-Santos et al., Science 298: 597-600, 2002; Ivanova et al., Science 298: 601-604, 2002; Boyer, L.A., et al. Nature 441, 349, 2006, и Bernstein, B.E., et al., Cell 125 (2), 315, 2006. Можно оценивать метилирование ДНК, экспрессию генов и/или эпигенетическое состояние клеточной ДНК, и/или дифференцировочный потенциал клеток, например, как описано в Wernig, M., et al., Nature, 448: 318-24, 2007. Клетки, которые способны образовывать тератомы, содержащие клетки, обладающие характеристиками эндодермы, мезодермы и эктодермы при введении инъекцией мышам линии SCID, и/или обладают способностью принимать участие (после инъекции в мышиные бластоцисты) в образовании химер, которые выживают до срока, считают плюрипотентными. Другой применяемый способ для оценки плюрипотентности заключается в определении того, реактивировали ли клетки молчащую Х-хромосому.
Соматические клетки можно перепрограммировать для приобретения полного набора признаков плюрипотентности. Альтернативно, соматические клетки можно перепрограммировать для приобретения только части признаков плюрипотентности.
Некоторые способы по изобретению включают этап отбора клеток, которые экспрессируют маркер, экспрессируемый мультипотентными или плюрипотентными клетками. Маркер может специфически экспрессироваться в таких клетках. Можно использовать стандартные методы разделения клеток, например, проточную цитометрию, аффинное разделение и так далее. Альтернативно или дополнительно можно отбирать клетки, которые не экспрессируют маркеры, характерные для соматических клеток, от которых происходят потенциально перепрограммированные клетки, и не экспрессируемые в ЭС клетках, полученных общепринятыми способами. В других способах разделения клеток можно использовать различия в средних размерах или плотности клеток, которые могут существовать между плюрипотентными клетками и соматическими клетками. Например, клетки можно фильтровать через материалы, которые имеют поры, позволяющие проходить через них только определенным клеткам.
В некоторых вариантах осуществления соматические клетки содержат нуклеиновую кислоту, содержащую регуляторные последовательности гена, кодирующего фактор плюрипотентности, функционально связанные с селектируемым или детектируемым маркером (например, GFP или neo). Последовательность нуклеиновой кислоты, кодирующую маркер, можно интегрировать по локусу эндогенного гена, кодирующего фактор плюрипотентности (например, Oct4), или конструкт может содержать регуляторные последовательности, функционально связанные с маркером. Экспрессию маркера можно использовать, чтобы отбирать, идентифицировать и/или подсчитывать перепрограммированные клетки.
Любой из способов по изобретению, который относится к получению перепрограммированной соматической клетки, может включать этап получения соматической клетки или получения популяции соматических клеток от индивидуума, нуждающегося в клеточной терапии. Перепрограммированные соматические клетки создают, отбирают или выявляют из числа полученных клеток или клеток, происходящих от полученных клеток. По желанию, клетку(ки) наращивают в культуре прежде чем создавать, отбирать или выявлять перепрограммированную соматическую клетку(ки), генетически подходящую для донора.
В некоторых вариантах осуществления колонии субклонируют и/или пересевают один или более раз для получения популяции клеток, обогащенных ЭС-подобными клетками. Обогащенная популяция может содержать как минимум 95%, 96%, 97%, 98%, 99% или более, например, 100% ЭС-подобных клеток. Данное изобретение относится к клеточным линиям соматических клеток, которые были устойчиво и наследуемо перепрограммированы в ЭС-подобное состояние.
В некоторых вариантах осуществления практикуют способы с использованием соматических клеток, которые не изменены генетически для целей идентификации или отбора перепрограммированных клеток. Полученные перепрограммированные соматические клетки не содержат экзогенного генетического материала, который был введен в указанные клетки (или в предшественники указанных клеток) рукой человека, например, для целей идентификации или отбора перепрограммированных клеток. В некоторых вариантах осуществления соматические клетки и происходящие от них перепрограммированные соматические клетки действительно содержат экзогенный генетический материал в своем геноме, однако такой генетический материал вводят с целью коррекции генетического дефекта в таких клетках или придания таким клеткам способности синтезировать нужный белок для терапевтических целей, и не используют для выявления или отбора перепрограммированных клеток.
В некоторых вариантах осуществления в способах используют морфологические критерии для выявления перепрограммированных соматических клеток среди популяции соматических клеток, которые не являются перепрограммированными. В некоторых вариантах осуществления в способах используют морфологические критерии для выявления соматических клеток, которые были перепрограммированы в ЭС-подобное состояние, среди популяции клеток, которые не перепрограммированы или только частично перепрограммированы в ЭС-подобное состояние. Термин «морфологические критерии» используют в широком смысле для обозначения любого визуально определяемого признака или характеристики клеток или колоний. Морфологические критерии включают, например, форму колоний, четкость границ колоний, плотность, малый размер и круглую форму клеток, по сравнению с не перепрограммированными клетками, и так далее. На фигуре 1 представлены колонии клеток, соответствующих морфологическим критериям, характерным для клеток, которые были перепрограммированы в ЭС-подобное состояние. Обратите внимание на плотные колонии, состоящие из небольших круглых клеток, и на четкие границы колоний. Изобретение охватывает выявление и, при желании, выделение колоний (или клеток из колоний), где колонии обладают одним или большим количеством таких признаков. Перепрограммированные соматические клетки можно идентифицировать как колонии, растущие в первой чашке для культивирования клеток (данный термин означает любой сосуд, планшет, чашку, емкость, контейнер и так далее, в котором живые клетки можно поддерживать in vitro), и колонии, или их части, переносить во вторую чашку для культивирования клеток, тем самым выделяя перепрограммированные соматические клетки. Затем клетки можно дополнительно наращивать.
Способы скрининга средства, которое перепрограммирует или участвует в перепрограммировании соматических клеток
Настоящее изобретение также относится к способам выявления средства, которое, одно или в сочетании с одним или большим количеством других средств, перепрограммирует соматические клетки в менее дифференцированное состояние. Кроме того, изобретение относится к средствам, выявленным согласно данным способам. В одном варианте осуществления способы включают создание контакта соматических клеток с активатором пути Wnt и средством-кандидатом и определение того, приводит ли присутствие средства-кандидата к усиленному перепрограммированию (например, повышенной скорости и/или эффективности перепрограммирования) по сравнению с тем, что происходило бы в случае отсутствия контакта со средством-кандидатом. В некоторых вариантах осуществления активатор Wnt и средство-кандидат присутствуют совместно в среде для культивирования клеток, тогда как в других вариантах осуществления активатор Wnt и средство-кандидат не присутствуют совместно (например, клетки последовательно подвергают воздействию данных средств). Клетки можно поддерживать в культуре в течение, например, как минимум 3 дней, как минимум 5 дней, вплоть до 10 дней, вплоть до 15 дней, вплоть до 30 дней, и так далее, на протяжении данного времени они находятся в контакте с активатором Wnt и средством-кандидатом в течение всего или части времени. В некоторых вариантах осуществления средство идентифицируют как средство, которое перепрограммирует клетки, если появляется как минимум в 2, 5 или 10 раз больше перепрограммированных клеток или колоний, содержащих преимущественно перепрограммированные клетки, после указанного периода времени, чем в случае, если бы клетки не контактировали со средством.
Средство-кандидат может представлять собой любую молекулу или супрамолекулярный комплекс, например, полипептид, пептид (термин, используемый в данном документе для обозначения полипептида, содержащего 60 аминокислот или менее), малую органическую или неорганическую молекулу (то есть, молекулы, обладающие молекулярной массой менее чем 1500 Да, 1000 Да или 500 Да), полисахарид, полинуклеотид и так далее, которые предстоит тестировать на способность перепрограммировать клетки. В некоторых вариантах осуществления средства-кандидаты представляют собой органические молекулы, в частности, низкомолекулярные органические молекулы, содержащие функциональные группы, которые опосредуют структурные взаимодействия с белками, например, образование водородных связей, и, как правило, содержат как минимум амино-, карбонильную, гидроксильную или карбоксильную группу, а в некоторых вариантах осуществления - как минимум две из функциональных химических групп. Средства-кандидаты могут содержать циклические углеродные или гетероциклические структуры и/или ароматические или полиароматические структуры, замещенные одной или большим количеством химических функциональных групп и/или гетероатомов.
Средства-кандидаты получают из множества различных источников, как известно специалистам в данной области, включая библиотеки синтетических или природных соединений. В некоторых вариантах осуществления средства-кандидаты представляют собой синтетические соединения. Известно множество методов для произвольного и направленного синтеза широкого разнообразия органических соединений и биологических молекул. В некоторых вариантах осуществления модуляторы-кандидаты предлагают в виде смесей природных соединений в форме бактериальных, грибковых, растительных и животных экстрактов, ферментационных бульонов, кондиционированных сред, и так далее, которые являются доступными или легко получаемыми.
В некоторых вариантах осуществления проводят скрининг библиотеки соединений. Как правило, библиотека представляет собой коллекцию соединений, которые могут быть представлены или экспонированы таким образом, что соединения можно обнаруживать при скрининге. В некоторых вариантах осуществления соединения в библиотеке размещены в отдельных лунках (например, планшетах для микротитрования), емкостях, пробирках и так далее, чтобы создать условия для удобного переноса в отдельные лунки или емкости для контакта с клетками, выполнения бесклеточных анализов, и так далее. Библиотека может быть составлена из молекул, имеющих общие структурные особенности, которые различаются по числу или типу групп, присоединенных к основной структуре, либо может быть полностью бессистемной. Библиотеки, например, включают, но не ограничиваются ими, фагово-дисплейные библиотеки, пептидные библиотеки, полисомные библиотеки, аптамерные библиотеки, библиотеки синтетических малых молекул, библиотеки природных соединений и химические библиотеки. Способы получения библиотек из молекул хорошо известны в данной области, и многие библиотеки доступны из коммерческих или некоммерческих источников. Интересующие библиотеки включают синтетические органические комбинаторные библиотеки. Библиотеки, такие как библиотеки синтетических малых молекул и химические библиотеки, могут содержать структурно разноплановую коллекцию химических молекул. Малые молекулы включают органические молекулы, часто имеющие множественные углерод-углеродные связи. Библиотеки могут содержать циклические углеродные, или гетероциклические структуры и/или ароматические или полиароматические структуры, замещенные одной или большим количеством химических функциональных групп. В некоторых вариантах осуществления малая молекула имеет от 5 до 50 атомов углерода, например, от 7 до 30 атомов углерода. В некоторых вариантах осуществления соединения являются макроциклическими. Интересующие библиотеки также включают пептидные библиотеки, рандомизированные олигонуклеотидные библиотеки, и тому подобное. Библиотеки можно синтезировать из пептоидов и непептидных синтетических фрагментов. Кроме того, можно синтезировать такие библиотеки, которые содержат непептидные синтетические фрагменты, менее подверженные ферментативному расщеплению, по сравнению с их природными аналогами. Можно также создавать комбинаторные библиотеки малых молекул. Комбинаторная библиотека низкомолекулярных органических соединений может содержать коллекцию близкородственных аналогов, которые отличаются друг от друга по одной или большему количеству точек множества и синтезируются органическими методами с использованием многоэтапных процессов. Комбинаторные библиотеки могут включать огромное множество низкомолекулярных органических соединений. Термин «совокупность соединений», как используют в данном документе, означает коллекцию соединений, идентифицируемых по их пространственным адресам в прямоугольной системе координат и организованных таким образом, что каждое соединение имеет общее молекулярное ядро и один или более вариабельных элементов структурного разнообразия. Соединения в такой совокупности соединений получают параллельно в отдельных реакционных емкостях, при этом каждое соединение является идентифицированным и прослеженным по своему пространственному адресу. Примеры смесей параллельного синтеза и способов параллельного синтеза приведены в патенте США № 5712171. В некоторых вариантах осуществления проводят скрининг смесей, содержащих два или более соединений, экстрактов или других препаратов, полученных из природных источников (которые могут содержать десятки соединений или более), и/или неорганические соединения, и так далее.
В одном из вариантов осуществления способы по изобретению используют для скрининга «одобренных лекарственных средств». «Одобренное лекарственное средство» представляет собой любое соединение (данный термин включает биологические молекулы, такие как белки и нуклеиновые кислоты), которое было одобрено для применения людьми с любой целью FDA или аналогичным государственным агентством в другой стране. Данный тип соединений может являться особенно полезным для скрининга, поскольку он представляет собой набор соединений, считающихся безопасными, и, как минимум, в случае с одобренными FDA лекарственными средствами, терапевтическими как минимум для одной цели. Таким образом, существует высокая вероятность того, что данные лекарственные средства будут, как минимум, безопасными для других целей.
Репрезентативные примеры библиотек, для которых можно проводить скрининг, включают DIVERSet™, поставляемую корпорацией ChemBridge Corporation, 16981 Via Tazon, San Diego, Calif. 92127. DIVERSet содержит от 10000 до 50000 синтезированных вручную малых молекул, подобных лекарственным средствам. Соединения прошли предварительный отбор для образования «универсальной» библиотеки, которая покрывает максимальное разнообразие фармакофоров с минимальным числом соединений, и подходит как для масштабного, так и для ограниченного скрининга. Для описания дополнительных библиотек смотри, например, Tan, et al., Am. Chem Soc. 120, 8565-8566, 1998; Floyd C. D., Leblanc C., Whittaker M., Prog Med Chem 36: 91-168, 1999. Многочисленные библиотеки являются коммерчески доступными, например, от компаний AnalytiCon USA Inc., P.O. Box 5926, Kingwood, Tex. 77325; 3-Dimensional Pharmaceuticals, Inc., 665 Stockton Drive, Suite 104, Exton, Pa. 19341-1 151; Tripos, Inc., 1699 Hanley Rd., St. Louis, Mo., 63144-2913, и так далее. Например, библиотеки на базе хинной кислоты и шикимовой кислоты, гидроксипролина, сантонина, диангидро-D-глюциола, гидроксипипеколиновой кислоты, андрографолида, библиотека на базе пиперазин-2-карбоновой кислоты, цитозина и так далее, являются коммерчески доступными.
В некоторых вариантах осуществления средства-кандидаты представляют собой кДНК из экспрессионной библиотеки кДНК, полученной из клеток, например, плюрипотентных клеток. Такие клетки могут представлять собой эмбриональные стволовые клетки, ооциты, бластомеры, тератокарциномы, эмбриональные половые клетки, клетки внутренней клеточной массы, и так далее.
Следует принимать во внимание, что перепрограммирующее средство-кандидат, предназначенное для тестирования, как правило, является средством, которое не присутствует в стандартной среде для культивирования клеток, либо, если присутствует, то присутствует в меньших количествах, чем при использовании по настоящему изобретению.
Следует также принимать во внимание, что применимое перепрограммирующее средство или иная форма перепрограммирующего воздействия не обязательно должны быть способны перепрограммировать все типы соматических клеток и не обязательно должны быть способны перепрограммировать все соматические клетки данного клеточного типа. Без ограничения, применяют средство-кандидат, которое приводит к образованию популяции, обогащенной перепрограммированными клетками в 2, 5, 10, 50, 100 или более раз (то есть, фракция перепрограммированных клеток в популяции составляет в 2, 5, 10, 50 или 100 раз больше, чем присутствовало в исходной популяции клеток, обработанных аналогичным образом, но без осуществления контакта со средством-кандидатом).
В некоторых вариантах осуществления изобретения используют патентоспособный способ скрининга для выявления средства или сочетания средств, которые заменяют Klf4 при перепрограммировании клеток в ЭС-подобное состояние. Способ можно практиковать, используя соматические клетки, генетически измененные для экспрессии ими Sox2 и Oct4 и приведенные в контакт с активатором пути Wnt. В некоторых вариантах осуществления используют способ для выявления средства, которое заменяет Sox2 при перепрограммировании клеток в ЭС-подобное состояние. Способ можно практиковать, используя соматические клетки, генетически измененные для экспрессии ими Klf4 и Oct4 и приведенные в контакт с активатором пути Wnt. В некоторых вариантах осуществления используют способ для выявления средства, которое заменяет Oct4 при перепрограммировании клеток в ЭС-подобное состояние. Способ можно практиковать, используя соматические клетки, генетически измененные для экспрессии ими Sox2 и Klf4 и приведенные в контакт с активатором пути Wnt. Предполагается, что генно-инженерную экспрессию Klf4, Sox2, Oct4 и c-Myc заменяют воздействием на соматические клетки сочетанием малых молекул и/или полипептидов или других средств, которые не приводят к модификации генома. В некоторых вариантах осуществления практикуют способы с использованием человеческих клеток. В некоторых вариантах осуществления практикуют способы с использованием мышиных клеток. В некоторых вариантах осуществления практикуют способы с использованием клеток приматов, отличных от человека.
Изобретение охватывает тестирование модуляторов пути Wnt, например, библиотек малых молекул, которые точно или предположительно модулируют путь Wnt, для выявления тех из них, которые являются эффективными для усиления перепрограммирования и/или обладают превосходной способностью усиливать перепрограммирование соматических клеток в плюрипотентность, например, по сравнению с другими тестируемыми соединениями. В некоторых вариантах осуществления тестируют как минимум 10, как минимум 20, как минимум 50, как минимум 100 или как минимум 1000 малых молекул, например, структурно родственных молекул, как минимум некоторые из которых, как известно или считается, модулируют активность пути Wnt. В некоторых вариантах осуществления используют ингибитор Wnt для подтверждения того, что соединение, которое усиливает перепрограммирование, или предположительно делает это путем модулирования активности пути Wnt, действительно действует через путь Wnt. Например, если ингибитор пути Wnt блокирует эффект тестируемого соединения на перепрограммирование, можно заключить, что тестируемое соединение действует через путь Wnt.
Способы и композиции по настоящему изобретению, относящиеся к модулированию пути Wnt, можно применять или использовать в сочетании с различными другими способами и композициями, применимыми для перепрограммирования соматических клеток и/или для выявления перепрограммирующих средств для использования при перепрограммировании соматических клеток. Такие комбинированные способы и композиции являются аспектами данного изобретения. Например, в некоторых вариантах осуществления изобретения используют типы клеток (например, нейронные стволовые клетки или клетки-предшественники), которые естественным образом экспрессируют один или более перепрограммирующих факторов в количествах больших, чем такой фактор(ы) экспрессируется во многих других типах клеток (смотри, например, Eminli, et al., Reprogramming of Neural Progenitor Cells into iPS Cells in the Absence of Exogenous Sox2 Expression, Stem Cells. 2008 Jul 17, электронная публикация до выхода печатного варианта).
Способы и композиции можно использовать совместно со способами и композициями, раскрытыми в PCT/US2008/004516, которая включена в данный документ посредством ссылки.
Генетически гомогенные «вторичные» соматические клетки, которые несут перепрограммирующие факторы как определенные индуцируемые доксициклином (dox) трансгены, были получены Wernig, et al., A novel drug-inducible transgenic system for direct reprogramming of multiple somatic cell types. Nature Biotechnology; опубликовано online 1 июля 2008; doi: 10.1038/nbtl483). Данные клетки получены путем инфицирования фибробластов dox-индуцируемыми лентивирусами, перепрограммирования путем добавления dox, отбора индуцированных плюрипотентных стволовых клеток и получения мышей-химер. Клетки, полученные из таких химер, перепрограммируются при воздействии dox без необходимости вирусной инфекции с эффективностью в 25-50 раз большей, чем эффективность, наблюдаемая при прямом инфицировании и отборе с использованием лекарственного средства на реактивацию маркера плюрипотентности. В некоторых вариантах осуществления изобретения такие вторичные соматические клетки используют в вариантах осуществления настоящего изобретения и/или вторичные соматические клетки получают без использования вируса c-Myc при помощи стимуляции пути Wnt, как описано в данном документе. В данном изобретении предусмотрено использование модуляции пути Wnt в композициях и способах, относящихся к вторичным соматическим клеткам.
В некоторых вариантах осуществления изобретения соматические клетки содержат последовательность нуклеиновой кислоты, кодирующую селектируемый маркер, функционально связанную с промотором эндогенного гена плюрипотентности, например, Oct4 или Nanog. Последовательность, кодирующая маркер, может быть встроена в геном по эндогенному локусу. Селектируемый маркер может представлять собой, например, легко определяемый белок, такой как флуоресцентный белок, например, GFP или его производное. Экспрессия маркера является свидетельством перепрограммирования и, таким образом, может использоваться для выявления или отбора перепрограммированных клеток, подсчета эффективности перепрограммирования и/или для идентификации, характеристики или использования средств, которые усиливают перепрограммирование, и/или тестируются на их способность усиливать перепрограммирование.
Перепрограммированные соматические клетки и их применения
Настоящее изобретение относится к перепрограммированным соматическим клеткам (ПСК) (RSC), включая индуцированные плюрипотентные стволовые клетки (иПС клетки), полученным способами по настоящему изобретению. Данные клетки имеют множество применений в медицине, сельском хозяйстве и других областях, некоторые из которых описаны в данном документе.
Изобретение относится к способам лечения или предотвращения патологического состояния у млекопитающего. В одном варианте осуществления способы включают получение соматических клеток от индивидуума, перепрограммирование полученных таким образом соматических клеток с помощью способов по настоящему изобретению для получения ПСК, например, иПС клеток. Затем ПСК культивируют в условиях, подходящих для их развития в клетки нужного клеточного типа. Развившиеся клетки нужного клеточного типа вводят индивидууму для лечения патологического состояния. В альтернативном варианте осуществления способы начинаются с получения соматических клеток от индивидуума, перепрограммирования полученных таким образом соматических клеток с помощью способов по настоящему изобретению. Затем ПСК культивируют в условиях, подходящих для развития ПСК в нужный орган, который собирают и вводят индивидууму для лечения патологического состояния. Патологическое состояние может быть любым состоянием, при котором функция клетки или органа является аномальной и/или сниженной по сравнению с нормальными уровнями. Таким образом, изобретение охватывает получение соматических клеток от индивидуума, нуждающегося в клеточной терапии, перепрограммирование клеток при помощи способа, который включает активацию пути Wnt и/или культивирование клеток в Wnt-кондиционированной среде, при желании, дифференцирование перепрограммированных соматических клеток для получения клеток одного или большего количества желаемых клеточных типов и введение клеток индивидууму. Индивидуум, нуждающийся в клеточной терапии, может страдать от любого патологического состояния, где состояние или один или более симптомов состояния могут быть облегчены путем введения клеток донору и/или при котором прогрессирование патологического состояния можно замедлять путем введения клеток индивидууму. Способ может включать этап выявления или отбора перепрограммированных соматических клеток и отделение их от клеток, которые не являются перепрограммированными.
В некоторых вариантах осуществления настоящего изобретения ПСК представляют собой ЭС-подобные клетки, также называемые иПС клетками, и, таким образом, могут быть индуцированы для дифференциации с целью получения нужных клеточных типов известными способами дифференциации ЭС клеток. Например, иПС клетки можно индуцировать для дифференциации в гемопоэтические стволовые клетки, мышечные клетки, клетки сердечной мышцы, клетки печени, клетки поджелудочной железы, хрящевые клетки, эпителиальные клетки, клетки мочевыводящих путей, клетки нервной системы (например, нейроны), и так далее, путем культивирования таких клеток в среде для дифференциации и в таких условиях, которые обеспечивают дифференциацию клеток. Среда и способы, которые приводят к дифференциации эмбриональных стволовых клеток, полученных при помощи традиционных способов, известны в данной области, также как и подходящие условия культивирования. Подобные способы и условия культивирования можно применять к иПС клеткам, полученным согласно настоящему изобретению. В качестве примеров смотри, например, Trounson, A., The production and directed differentiation of human embryonic stem cells, Endocr Rev. 27(2): 208-19, 2006 и приведенные в данном документе ссылки, все из которых включены посредством ссылок. Смотри также Yao, S., et al., Long-term self-renewal and directed differentiation of human embryonic stem cells in chemically defined conditions, Proc Natl Acad Sci USA, 103(18): 6907-6912, 2006 и приведенные в данном документе ссылки, все из которых включены посредством ссылок.
Таким образом, используя известные способы и культуральную среду специалист в данной области может культивировать перепрограммированные плюрипотентные клетки для получения нужных типов дифференцированных клеток, например, нервных клеток, мышечных клеток, гемопоэтических клеток, и так далее. Клетки субъекта можно использовать для получения любого нужного типа дифференцированных клеток. Такие дифференцированные человеческие клетки предоставляют множество терапевтических возможностей. Например, человеческие гемопоэтические стволовые клетки, полученные из клеток, перепрограммированных согласно настоящему изобретению, можно использовать в медицинском лечении, при котором требуется трансплантация костного мозга. Такие способы используют для лечения многих заболеваний, например, рака на поздней стадии и злокачественных новообразований, таких как лейкоз. Такие клетки также используют для лечения анемии, заболеваний, нарушающих функционирование иммунной системы, таких как СПИД, и так далее. Способы по настоящему изобретению можно также использовать для лечения, предотвращения или стабилизации неврологического заболевания, такого как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона или ALS, лизосомная болезнь накопления, рассеянный склероз или повреждение спинного мозга. Например, соматические клетки можно получать от индивидуума, нуждающегося в лечении, и перепрограммировать для приобретения ими плюрипотентности, и культивировать для развития клеток нейроэктодермы, которые можно использовать для замены или для оказания помощи нормальному функционированию больной или поврежденной ткани.
Перепрограммированные клетки, которые продуцируют ростовой фактор или гормон, например, инсулин, и так далее, можно вводить млекопитающему для лечения или предотвращения эндокринных заболеваний. Перепрограммированные эпителиальные клетки можно вводить для устранения повреждений выстилки полости тела или органа, например, легкого, кишечника, железы внешней секреции или мочеполовых путей. Также предусмотрено, что перепрограммированные клетки можно вводить млекопитающему для лечения повреждения или дефектов клеток в органе, таком как мочевой пузырь, головной мозг, пищевод, фаллопиева труба, сердце, кишечник, желчный пузырь, почка, печень, легкое, яичники, поджелудочная железа, предстательная железа, спинной мозг, селезенка, желудок, семенники, тимус, щитовидная железа, трахея, мочеточник, мочеиспускательный канал или матка.
Настоящее изобретение обладает потенциалом для обеспечения практически неограниченного источника генетически подобранных клеток, подходящих для трансплантации. Такой источник позволит решать существенную проблему, связанную с современными методами трансплантации, то есть, отторжение трансплантированной ткани, которое может иметь место вследствие реакции «хозяин против трансплантата» или «трансплантат против хозяина». ПСК можно также комбинировать с матрицей для образования ткани или органа in vitro или in vivo, которые можно использовать для восстановления или замены ткани или органа у млекопитающего-реципиента. Например, ПСК можно культивировать in vitro в присутствии матрицы для получения ткани или органа мочеполовой, сердечно-сосудистой или скелетно-мышечной системы. Альтернативно, смесь клеток и матрицу можно вводить млекопитающему для образования нужной ткани in vivo. ПСК, полученные по данному изобретению, можно использовать для получения генетически измененных или трансгенных дифференцированных клеток, например, путем введения нужного гена или генов, либо удаления всего, либо части, эндогенного гена или генов ПСК, полученных согласно данному изобретению, и давая возможность таким клеткам дифференцироваться в нужный клеточный тип. Одним из способов достижения такой модификации является гомологичная рекомбинация, данный метод можно использовать для вставки, делеции или модификации гена или генов в конкретном участке или участках генома.
Данную методологию можно использовать для замены дефектных генов или для введения генов, которые обеспечат экспрессию терапевтически полезных белков, таких как ростовые факторы, гормоны, лимфокины, цитокины, ферменты и так далее. Например, ген, кодирующий ростовой фактор головного мозга, можно вводить в человеческие эмбриональные или подобные стволовым клетки, проводить дифференциацию данных клеток в нервные клетки и клетки трансплантировать пациенту с болезнью Паркинсона, чтобы замедлить потерю нервных клеток в процессе такого заболевания. Используя известные способы введения нужных генов/мутаций в ЭС клетки, можно генетически изменять ПСК, и полученные генетически измененные клетки дифференцировать в нужные типы клеток, например, гемопоэтические клетки, нервные клетки, клетки поджелудочной железы, хрящевые клетки и так далее. Гены, которые можно вводить в ПСК, включают, например, гены эпидермального фактора роста, основного фактора роста фибробластов, глиального нейротрофического фактора роста, инсулиноподобного фактора роста (I и II), нейротрофина-3, нейротрофина-4/5, цилиарного нейротрофического фактора, AFT-1, гены цитокинов (интерлейкинов, интерферонов, колониестимулирующих факторов, факторов некроза опухолей (альфа и бета), и так далее), гены, кодирующие терапевтические ферменты, коллаген, человеческий сывороточный альбумин и так далее.
Системы отрицательной селекции, известные в данной области, можно использовать для элиминации терапевтических клеток у пациента, если необходимо. Например, клетки, трансфицированные геном тимидинкиназы (TK), дадут начало образованию эмбриональных (например, ЭС-подобных) клеток, содержащих ген TK. Дифференциация данных клеток приведет к выделению интересующих терапевтических клеток, которые также экспрессируют ген TK. Такие клетки можно избирательно элиминировать у пациента в любое время путем введения ганцикловира. Такая система отрицательной селекции описана в патенте США № 5698446. В других вариантах осуществления клетки генетически изменяют для содержания в них гена, который кодирует токсичный продукт, экспрессия которого находится под контролем индуцируемого промотора. Введение индуктора вызывает продукцию токсичного продукта, что приводит к гибели клеток. Таким образом, любые соматические клетки по изобретению могут содержать суицидальный ген, необязательно содержащийся в полигенном экспрессирующем кластере, который можно встраивать в геном. Суицидальный ген представляет собой ген, экспрессия которого является летальной для клеток. Примеры включают гены, кодирующие дифтерийный токсин, холерный токсин, рицин и так далее. Суицидальный ген может находиться под контролем элементов контроля экспрессии, которые не направляют экспрессию в нормальных условиях в отсутствие специфического индуцирующего средства или стимула. Однако экспрессию можно индуцировать в соответствующих условиях, например, (i) путем введения соответствующего индуцирующего средства в клетку или организм или (ii) если конкретный ген (например, онкоген, ген, вовлеченный в цикл клеточного деления, или ген, указывающий на дедифференциацию или потерю способности к дифференциации) экспрессируется в клетках, или (iii) если экспрессия гена, такого как ген, контролирующий клеточный цикл, или ген, указывающий на дифференциацию, утрачена. Смотри, например, патент США № 6761884. В некоторых вариантах осуществления ген экспрессируется только после акта рекомбинации, опосредованной сайт-специфической рекомбиназой. Такой акт может приводить к образованию функциональной связи кодирующей последовательности с элементами контроля экспрессии, такими как промотор. Экспрессию суицидального гена можно индуцировать, если необходимо элиминировать клетки (или их потомки) из организма субъекта, после того, как клетки (или их родоначальники) были введены субъекту. Например, если перепрограммированная соматическая клетка дает начало опухоли, опухоль можно элиминировать, индуцируя экспрессию суицидального гена. В некоторых вариантах осуществления образование опухоли ингибируется, поскольку клетки автоматически элиминируются при дифференциации или утрате надлежащего контроля клеточного цикла.
Примеры заболеваний, расстройств или патологических состояний, которые можно лечить или предотвращать, включают неврологические, эндокринные, структурные, скелетные, сосудистые, мочевыводящей системы, пищеварительные, покровные, системы крови, иммунные, аутоиммунные, воспалительные, эндокринные, почечные, мочевого пузыря, сердечно-сосудистые, раковые, системы кровообращения, пищеварительные, гемопоэтические и мышечные заболевания, расстройства или патологические состояния. Кроме того, перепрограммированные клетки можно использовать для восстановительных целей, например, для восстановления или замены тканей или органов. В некоторых вариантах осуществления может оказаться полезным включать ростовые факторы и белки, либо другие средства, которые стимулируют ангиогенез. Альтернативно, на образование тканей можно оказывать влияние полностью in vitro, используя соответствующие среды для культивирования и условия, ростовые факторы и биодеградируемые полимерные матрицы.
Что касается терапевтических способов по изобретению, введение ПСК млекопитающему не ограничено конкретным способом введения, дозировкой или частотой введения доз; по настоящему изобретению предусмотрены все способы введения, включая внутримышечное, внутривенное, внутрисуставное, внутрь пораженной ткани, подкожное или любой другой способ, подходящий для обеспечения дозы, адекватной для лечения или предотвращения заболевания. ПСК можно вводить млекопитающему одной или множественными дозами. Если вводят множественные дозы, дозы можно разделять промежутком, например, в одну неделю, один месяц, один год или десять лет. Один или более ростовых факторов, гормонов, интерлейкинов, цитокинов или других клеток можно также вводить до, во время, или после введения клеток, для того, чтобы дополнительно направить их в сторону конкретного клеточного типа.
ПСК по настоящему изобретению можно использовать в качестве in vitro модели дифференциации, в частности, для изучения генов, которые вовлечены в регуляцию раннего развития. Дифференцированные клеточные ткани и органы, полученные с использованием перепрограммированных клеток, можно использовать для изучения эффектов лекарственных средств и/или выявления потенциально полезных фармацевтических средств.
Дополнительные применения способов перепрограммирования соматических клеток и перепрограммированных клеток
Способы перепрограммирования, раскрытые в данном документе, можно использовать для получения ПСК, например, иПС клеток, множества видов животных. Полученные ПСК можно использовать для создания нужных животных. Животные включают, например, птиц и млекопитающих, а также любого животного, которое относится к исчезающим видам. Типичные примеры птиц включают одомашненных птиц (например, перепела, куры, утки, гуси, индейки и цесарки). Типичные примеры млекопитающих включают мышей, коз, овец, крупный рогатый скот, свиней, собак, кошек и приматов, отличных от человека. Из вышеперечисленных, предпочтительные представители включают одомашненных животных, включая, например, крупный рогатый скот, свиней, лошадей, коров, кроликов, морских свинок, овец и коз.
Способы идентификации генов
Изобретение относится к способам идентификации гена, экспрессия которого ингибирует возникновение перепрограммированных клеток. Один из способов включает: (i) активацию пути Wnt в соматических клетках; (ii) снижение экспрессии гена-кандидата при помощи РНКи; (iii) определение того, приводит ли снижение экспрессии гена-кандидата к повышению эффективности перепрограммирования, и, если так, то идентификацию гена-кандидата как гена, экспрессия которого ингибирует перепрограммирование соматических клеток. Один из способов включает: (i) культивирование соматических клеток в Wnt-кондиционированной среде; (ii) снижение экспрессии гена-кандидата при помощи РНКи; (iii) определение того, приводит ли снижение экспрессии гена-кандидата к повышению эффективности перепрограммирования, и, если так, то идентификацию гена-кандидата как гена, экспрессия которого ингибирует перепрограммирование соматических клеток. Как вариант, соматические клетки генетически изменяют для экспрессии ими как минимум одного гена, выбранного из: Oct4, Sox2, Nanog, Lin28 и Klf4. Как вариант, клетки приводят в контакт с модулятором пути Wnt. Используемые в данном способе библиотеки кшРНК или киРНК коммерчески доступны. Идентифицированный ген является мишенью для ингибирования с целью усиления перепрограммирования клеток. Средства, которые ингибируют ген (либо средства РНКи, либо другие средства, такие как малые молекулы), используют для перепрограммирования соматических клеток, например, в сочетании с активатором Wnt.
ИЛЛЮСТРАТИВНЫЕ ПРИМЕРЫ
После общего описания изобретения его можно легче разъяснить со ссылкой на следующие примеры, которые включены только лишь с целью иллюстрирования некоторых аспектов и вариантов осуществления настоящего изобретения, и не призваны ограничивать рамки изобретения.
Материалы и методы для примера 1
Клеточные культуры, вирусное инфицирование, индукция экспрессии генов. Клетки культивируют в 15% FBS, DMEM-KO, пенн/стреп, глютамин, заменимые аминокислоты, β-МЭ и LIF. Эмбриональные фибробласты мыши (MEF) с конструктом Oct4-IRES-eGFP (Meissner, A., et al., Nature Biotechnology, Direct reprogramming of genetically unmodified fibroblasts into pluripotent stem cells. Опубликовано online: 27 августа 2007 г. |doi:10.1038/nbt1335), встроенным в локус эндогенного Oct4, инфицировали лентивирусными векторами, направляющими индуцируемую доксициклином экспрессию Oct4, Sox2, Klf4 и c-Myc, либо только Oct4, Sox2 и Klf4. Векторы были основаны на остове лентивирусного вектора FUGW (Lois C, et al., Science 2002; 295: 868-872), модифицированного для содержания tet-индуцируемого промотора. Через два дня после инфицирования клетки разделяли и индуцировали доксициклином в присутствии или в отсутствие Wnt3a-кондиционированной среды (использованной в разведении 1:1 с нормальной ЭС средой с 2x LIF). Данные клетки контролировали на экспрессию GFP методом проточной цитометрии на день 13 и, повторно, на день 20. Параллельно, клетки MEF с индуцируемым доксициклином Oct4, экспрессируемым с коллагенового локуса, и Oct4-IRES-(neo устойчивость), встроенным в локус эндогенного Oct4, инфицировали лентивирусами, направляющими избыточную экспрессию либо Sox2, Klf4 и c-Myc, либо Sox2 и Klf4. Вновь, через два дня после инфицирования клетки разделяли и индуцировали доксициклином в присутствии или в отсутствие Wnt3a-кондиционированной среды. На отдельных планшетах с данными клетками проводили селекцию при помощи G418 на день 7 и день 13, соответственно. Спустя как минимум одну неделю после селекции с G418, устойчивые колонии проверяли и подсчитывали.
Кондиционированная среда. Wnt3a-кондиционированную среду (CM) собирали с мышиных L-клеток, которые были трансфицированы кДНК Wnt3a (Shibamoto et al. 1998). Данные клетки доступны от ATCC (CRL-2647), как и нетрансфицированная исходная клеточная линия (CRL-2648), используемая для контрольной кондиционированной среды. Трансфицированные Wnt3a клетки секретируют Wnt, достигая уровней вплоть до 400 нг/мл белка Wnt3a в своей ростовой среде. Минимальная среда состояла из DMEM, 15% FBS, пенн/стреп, глютамина и заменимых аминокислот, и готовилась согласно протоколу Singla et al. (Singla, et al., Biochem Biophys Res Commun., 345(2): 789-95, 2006). Среду, собранную с секретирующих фибробластов, фильтровали и разбавляли в соотношении 1:1 обычной средой для ЭС клеток (15% FBS, DMEM-KO, пенн/стреп, глютамин, заменимые аминокислоты, β-МЭ и LIF). Данную среду затем использовали для воздействия на ЭС клетки. Как показано заявителями и другими, Wnt3a-кондиционированная среда активирует сигнальный путь Wnt в ЭС клетках, о чем свидетельствуют иммуноблоты для проверки фосфорилирования бета-катенина.
Пример 1: Получение ЭС-подобных клеток с помощью Wnt3a-кондиционированной среды
Авторы изобретения создали гипотезу, согласно которой стимуляция пути Wnt при помощи растворимых факторов может модулировать эффективность индукции плюрипотентности в соматических клетках. В данном примере описаны начальные эксперименты, предпринятые для определения эффекта стимуляции пути Wnt на перепрограммирование. Клетки, содержащие конструкт Oct4-IRES-eGFP или Oct4-IRES-neo, инфицировали лентивирусными векторами, кодирующими либо три, либо четыре фактора, как описано выше. Экспрессию факторов плюрипотентности индуцировали на день 2. В некоторых экспериментах клетки культивировали в Wnt3a-кондиционированной среде или некондиционированной среде, как показано на фигуре 4A (вверху) в дни 2-13. Экспрессию GFP анализировали с помощью FACS на день 13 и 20. В других экспериментах клетки культивировали в Wnt3a-кондиционированной среде или некондиционированной среде, как показано на фигуре 4A (внизу) в дни 2-13 или 2-20. Селекцию с G418 проводили в день 7 или 13. Выжившие колонии подсчитывали на день 20.
Результаты свидетельствовали, что Wnt3a-кондиционированная среда увеличивает скорость образования иПС в фибробластах, трансдуцированных четырьмя перепрограммирующими факторами транскрипции. Как показано на фигуре 4B, Wnt3a стимулирует образование иПС клеток в клетках, избыточно экспрессирующих Oct4, Sox2, Klf4 и c-Myc. Селектируемые клетки, избыточно экспрессирующие Oct4, Sox2, Klf4 и c-Myc, образовывали сильные G418-устойчивые колонии в присутствии Wnt3a-кондиционированной среды раньше, чем в отсутствие данной среды. При селекции на день 7, только небольшие колонии образовывались в отсутствие Wnt, ни одну из которых не удавалось размножать в культуре. Колонии, образованные в присутствии Wnt-кондиционированной среды, на данный момент были крупнее и поддавались пересеву как клоны. Когда селекцию начинали на день 13, в отсутствие Wnt3a-кондиционированной среды наблюдали колонии, которые можно было размножать. Несмотря на то, что на данный момент времени в присутствии Wnt-кондиционированной среды было меньше колоний, чем в отсутствие Wnt-кондиционированной среды, колонии, которые образовывались, были крупными, относительно гомогенными по внешнему виду и, опять же, их можно было поддерживать в культуре. Данный результат свидетельствует о том, что Wnt3a-кондиционированная среда не только увеличивает скорость перепрограммирования, но также способствует отбору колоний перепрограммированных клеток.
Wnt3a-кондиционированная среда также дает возможность образовываться иПС клеткам без добавления онкогенного фактора транскрипции c-Myc. В то время как иПС клетки не образовывались в начальных экспериментах авторов изобретения, когда фибробласты трансдуцировали Oct4, Sox2 и Klf4, авторы наблюдали иПС колонии с данными тремя факторами, если клетки выращивали в Wnt3a-кондиционированной среде. Данные колонии, похоже, являлись истинными иПС клетками, судя по морфологии и активации локуса эндогенного Oct4, событии, обычно свойственном только плюрипотентным клеткам. Как показано на фигуре 4C, в присутствии Wnt3a-кондиционированной среды сильные neo-устойчивые колонии наблюдались в избыточно экспрессирующих Oct4, Sox2, Klf4 клетках, отобранных как на день 7, так и на день 13. В отсутствие Wnt-кондиционированной среды не было обнаружено клеток, неинфицированных вирусом c-Myc, которые были бы neo-устойчивы, в любой момент времени. Без селекции, Oct4-IRES-eGFP клетки, инфицированные Sox2 и Klf4 лентивирусом, как установлено, экспрессируют GFP (индикатор активации локуса эндогенного Oct4) на день 20 только в присутствии Wnt-кондиционированной среды.
Обсуждение
Данные, описанные выше, являются важными как минимум по двум основным причинам. Во-первых, существует огромный интерес к созданию иПС клеток, которые не имеют вирусной интеграции онкогенного фактора транскрипции c-Myc. Мыши-химеры с иПС клетками, полученными с Myc, отличаются высокой степенью заболеваемости раком, связанной с соматической реактивацией вируса c-Myc. Даже in vitro авторы изобретения замечали, что иПС клеточные линии, полученные с вирусом c-Myc, содержат смешанную популяцию с некоторыми клетками, которые морфологически выглядят очень похоже на ЭС клетки, и другими, растущими скорее как трансформированные, раковые клетки. Результаты авторов, полученные к настоящему времени, свидетельствуют о том, что иПС линии, полученные без c-Myc в Wnt3a-кондиционированной среде, выглядят морфологически более гомогенными по ЭС-подобным клеткам. Во-вторых, Wnt3a-кондиционированная среда, очевидно, оказывает избирательный эффект, способствуя образованию крупных гомогенных колоний. Таким образом, использование Wnt3a-кондиционированной среды или активаторов пути Wnt3a может служить альтернативным методом селекции взамен введения этапа селекции, для которой требуется генетическая модификация исходных соматических клеток. Использование Wnt3a-кондиционированной среды или активаторов пути Wnt3a в процессе перепрограммирования, таким образом, является ценным усовершенствованием для любого способа перепрограммирования соматических клеток, известного в настоящее время в данной области или разработанного в будущем.
Материалы и методы для примеров 2-8
Культивирование клеток
ЭС клетки V6.5 (C57BL/6-129) мыши и иПС клетки выращивали в типичных для ЭС клеток условиях на облученных эмбриональных фибробластах мыши (MEF). Трансгенные клетки MEF, использованные при инфицировании DOX-индуцируемыми лентивирусами (T. Brambrink, R. Foreman, Cell Stem Cell 2, 151-159 (2008)), собирали при 13,5 dpc и проводили селекцию на 2 мкг/мл пуромицине из эмбрионов после инъекции в бластоцисту Oct4-IRES-GFPneo/Oct4-индуцируемых ЭС клеток (M. Wernig, A. Meissner, Nature 448, 318-324 (2007).), или отбирали у F1 потомства от скрещивания между R26-M2rtTA мышами (C. Beard, K. Hochedlinger, Genesis 44, 23-28 (2006)) и Oct4-GFP мышами (A. Meissner, M. Wernig, Nat Biotechnol 25, 1177-1181 (2007). Wnt3a-кондиционированную среду и контрольную кондиционированную среду получали согласно стандартным протоколам (ATCC) (K. Willert, J. D. Brown, Nature 423, 448-452 (2003), также описанным выше) и использовали в соотношении 1:1 со стандартной средой для ЭС клеток. Ингибитор Wnt ICG-001 растворяли в DMSO до концентрации маточного раствора 0,1 М. Конечная рабочая концентрация ингибитора Wnt составляла 4 мкМ.
Вирусная трансдукция
Индуцируемые тетрациклином лентивирусные конструкты, экспрессирующие кДНК для Oct4, Klf-4, Sox2 и c-Myc, использовали, как описано ранее (Brambrink, выше). Вирус получали, трансфицируя клетки HEK293T смесью вирусной плазмиды и упаковывающих конструктов, экспрессирующих функции вирусной упаковки и белок VSV-G (Fugene, Roche). Среду заменяли спустя 24 часа после трансфекции и вирусные супернатанты собирали через 48 часов и 72 часа. После фильтрации супернатанты объединяли и 2,5×105 клеток MEF инкубировали с вирусными супернатантами и свежей средой в соотношении 1:1 в течение 24 часов. Затем инфицированные клетки распределяли в соотношениях от 1:5 до 1:12 на покрытые желатином 10-см чашки. Через один день после распределения в ЭС среду добавляли 2 мкг/мл DOX и, в соответствующих чашках, кондиционированную среду и/или химический ингибитор.
Иммуноокрашивание и антитела. Клетки окрашивали, как описано ранее (Wernig, выше). Антитела против Nanog (Bethyl) и SSEA1 (R&D systems, Minneapolis, MN) использовали в соответствии с рекомендациями производителя.
Образование тератом
Образование тератом анализировали, как описано ранее. Вкратце, клетки обрабатывали трипсином и 5×105 клеток вводили подкожной инъекцией мышам линии SCID. Через 14-21 дней, тератомы вырезали, фиксировали в 10% забуференном фосфатом формалине в течение ночи, а затем помещали в парафиновый воск при помощи заливочного устройства Tissue-Tek VIP (Miles Scientific, Naperville, IL) и Thermo Shandon Histocenter 2 (Thermo Fisher Scientific, Waltham, MA). Нарезали срезы толщиной 2 мкм с помощью Leica RM2065 (Leica, Wetzlar, Germany) и окрашивали их гематоксилином и эозином (K. Hochedlinger, Y. Yamada, Cell 121, 465-477 (2005).
Инъекция в бластоцисты. Инъекции иПС клеток в бластоцисты мыши-хозяина Balb/c проводили, как описано ранее (Beard, выше).
Пример 2: Дополнительные эксперименты, относящиеся к получению ЭС-подобных клеток при помощи Wnt3a-кондиционированной среды
Чтобы дополнительно выяснить эффект Wnt3a на перепрограммирование, авторы изобретения инфицировали клетки MEF, которые содержат кДНК индуцируемого доксициклином (DOX) Oct4 (Hochedlinger, 2005), DOX-индуцируемыми лентивирусными векторами, кодирующими Sox2, Klf4 и c-Myc (Brambrink, et al., 2008). Данные клетки также содержали кассету устойчивости к G418 в локусе эндогенного Oct4, дающую возможность селекции иПС клеток при помощи лекарственного средства (Meissner et al., 2007).
Экспрессию четырех факторов индуцировали добавлением DOX в клетки, культивируемые в присутствии или в отсутствие Wnt3a-кондиционированной среды (Wnt3a-CM), селекцию с G418 начинали спустя 5 дней, и количество устойчивых к лекарственному средству колоний определяли через 24 дня после индукции (фигура 1a). На фигуре 1b показано, что общее количество устойчивых к лекарственному средству колоний возросло более чем в 7 раз, когда клетки культивировали в Wnt3a-CM. Авторы изобретения также отметили, что устойчивые к лекарственному средству колонии были крупнее и морфологически были больше похожи на ЭС клетки при культивировании в Wnt3a-CM, чем в среде для ЭС клеток (фигура 1c). Кроме того, колонии, которые появлялись в Wnt3a-CM при селекции с G418, начатой на день 5, можно было далее размножать, в отличие от небольших колоний, возникших в стандартной среде для ЭС клеток.
Принимая во внимание, что Wnt3a-CM обладает положительным эффектом на перепрограммирование во взаимодействии с четырьмя факторами транскрипции, авторы изобретения далее исследовали, может ли Wnt3a-CM заменять любой из ядерных факторов. В параллельных экспериментах фибробласты трансдуцировали подгруппами факторов транскрипции и изучали в присутствии и в отсутствие Wnt3a-CM (фигуры 1d и 1e). В отсутствие инфекции Oct4 или Klf4 устойчивые колонии не образовывались. Одну колонию наблюдали в отсутствие ретровируса Sox2, однако данную колонию невозможно было далее размножать в условиях культивирования ЭС клеток. Напротив, в присутствии Wnt3a-CM, множество сильных устойчивых к G418 колоний образовывалось в отсутствие c-Myc в клетках, избыточно экспрессирующих Oct4, Sox2 и Klf4 (фигуры 1d и 1e). Аналогично колониям из клеток MEF, трансдуцированных всеми четырьмя факторами, данные иПС линии можно было размножать в стандартной среде для ЭС клеток без дополнительной селекции, и они сохраняли морфологию ЭС клеток. В параллельных экспериментах без трансдукции c-Myc в отсутствие Wnt3a-CM устойчивые к G418 колонии образовывались эпизодически. Однако в соответствии с опубликованными отчетами (8,9), такие колонии были редкими. В дальнейшем иПС клетки, полученные при помощи только трех факторов и без c-Myc, будут называться Myc[-] иПС клетками.
Для более подробного изучения эффектов воздействия Wnt3a-CM на процесс перепрограммирования, избыточно экспрессирующие Oct4/Sox2/Klf4 и Oct4/Sox2/Klf4/c-Myc клетки MEF культивировали с Wnt3a-CM и без нее, а селекцию с G418 начинали в разное время после добавления DOX. На фигуре 1f показано, что, когда избыточно экспессирующие три фактора клетки культивировали в среде Wnt3a-CM, примерно в 3 раза больше Myc[-] иПС колоний возникало, если G418 добавляли на день 5, и примерно в 20 раз больше колоний возникало, если G418 добавляли на день 10 после индукции, по сравнению с культивированием в среде для ЭС клеток (фигура 1f, левая панель). Среда Wnt3a-CM также увеличивала число устойчивых к лекарственному средству колоний после индукции всех четырех факторов, хотя кратность увеличения была менее выражена, чем в случае клеток с тремя индуцированными факторами (фигура 1f, правая панель). Данные результаты свидетельствуют о том, что Wnt3a-CM увеличивала число устойчивых к лекарственному средству колоний как в клетках с тремя, так и четырьмя индуцированными факторами, с более выраженным эффектом на клетки, избыточно экспрессирующие три фактора, при селекции, проведенной в более поздний момент времени.
Пример 3: Получение Myc[-] иПС клонов без генетической селекции.
Недавно были получены иПС клетки без ретровируса c-Myc (Myc[-]), однако в отсутствие экзогенного c-Myc эффективность и кинетика перепрограммирования значительно снижены (Nakagawa et al., 2008; Wernig et al., 2008). Авторы изобретения проверяли, сможет ли Wnt3a-CM также способствовать получению иПС клеток в отсутствие селекции на реактивацию Oct4. Для этого использовали клетки с GFP, направляемым промотором эндогенного Oct4 (Meissner, et al., 2008). Клетки, инфицированные Oct4/Sox2/Klf4, с воздействием Wnt3a-CM или без него, анализировали на экспрессию GFP методом проточной цитометрии в дни 10, 15 и 20 после индукции DOX. Положительные по GFP клетки отсутствовали при воздействии Wnt3a-CM или без него на день 10 или день 15. На день 20 небольшую популяцию экспрессирующих GFP клеток обнаруживали в клетках, культивируемых в Wnt3a-CM, но не в стандартной среде для ЭС клеток (фигура 1g). В культурах, подвергнутых воздействию Wnt3a-CM, образовывались экспрессирующие GFP колонии с морфологией, типичной для ЭС или иПС клеток (фигура 1h). Однако, в отличие от трансдуцированных четырьмя факторами клеток, которые, как правило, образуют сильно гетерогенную популяцию клеток при размножении без селекции, Oct4/Sox2/Klf4/Wnt3a-CM колонии выглядели гомогенными ЭС-подобными, аналогично описанным ранее Myc[-] иПС клонам (Nakagawa, et al., 2008).
Пример 4: Потенциал развития Myc[-] иПС клеток, полученных при помощи Wnt3a-CM
Были проведены некоторые анализы для характеристики потенциала развития Myc[-] иПС клеток, полученных при воздействии Wnt3a-CM. Иммуногистохимическими методами была подтверждена экспрессия маркеров плюрипотентности, включая ядерный фактор Nanog (фигуры 2a и 2b), а также поверхностного гликопротеина SSEA1 (фигуры 2c и 2d). Функциональный анализ подтвердил, что, подобно ЭС клеткам, данные иПС клетки являлись плюрипотентными. При введении подкожной инъекцией мышам SCID Myc[-] иПС клетки давали начало тератомам с гистологическим подтверждением наличия клеток, дифференцирующихся во все три зародышевых слоя (фигуры 2e, 2f и 2g). Более важно, что Myc[-] иПС клетки, полученные при воздействии Wnt3a-CM, участвовали в образовании дифференцированных тканей в мышах-химерах (фигура 2h). Данные результаты указывают на то, что обработанные Wnt3a-CM Myc[-] клоны являются плюрипотентными клетками, которые морфологически и функционально не отличаются от ЭС клеток.
Пример 5: Эффект низкомолекулярного ингибитора пути Wnt на получение иПС Myc[-] и иПС клеток в присутствии Wnt3a-CM
Для количественного определения эффектов Wnt3a-CM, проводили троекратно повторенные эксперименты на Oct4/Sox2/Klf4-индуцируемых, селектируемых на G418 клетках MEF (фигура 3a). G418 добавляли к культурам через 15 дней после инфицирования, чтобы отбирать клетки, у которых реактивирован локус Oct4. При подсчете на день 28 после инфицирования только несколько Myc[-]колоний, устойчивых к G418 (от 0 до 3 колоний, образующихся на каждой десятисантиметровой чашке), обнаруживали в стандартных условиях культивирования ЭС клеток. Напротив, ~ в 20 раз больше устойчивых к лекарственному средству колоний образовывалось, если начинали селекцию с G418 обработанных Wnt3a-CM клеток, что совпадало с выводами о том, что активация пути Wnt усиливает перепрограммирование. Следует отметить, что кондиционированная среда от контрольных фибробластов, лишенных избыточной экспрессии Wnt3a, также вызывала умеренное увеличение количества устойчивых к G418 колоний, по сравнению со стандартной ЭС средой, из чего следует, что нормальные фибробласты способны секретировать факторы, возможно, включая Wnt3a, которые способствуют перепрограммированию.
Чтобы независимо оценить эффект Wnt3a на перепрограммирование, авторы изобретения культивировали клетки в присутствии ICG-001 (Teo et al., 2005; McMillan and Kahn, 2005; смотри фигуру 5), ингибитора пути Wnt/β-катенин. На фигуре 3a (правые колонки) показано, что 4 мкМ ICG-001 сильно ингибировал эффект Wnt3a-CM на образование Myc[-] иПС. Эффекты Wnt3a-CM и ICG-001 также исследовали в клетках MEF, избыточно экспрессирующих все четыре перепрограммирующих фактора, включая c-Myc (фигура 3b). Большое число устойчивых к G418 колоний наблюдали как в стандартной среде для ЭС клеток, так и в Wnt3a-CM среди перепрограммированных клеток с четырьмя факторами, лишь с незначительным превышением числа колоний в случае Wnt3a-CM. В отличие от сильного эффекта ICG-001 на Myc[-] клетки, при той же дозе соединение оказывало лишь незначительный эффект на число колоний с G418 среди трансдуцированных c-Myc клеток, и относительно большое число устойчивых колоний наблюдали при данных условиях. При более высоких дозах ICG-001 число иПС колоний было еще меньше, однако даже при 25 мкМ наблюдали множество Oct4/Sox2/Klf4/c-Myc иПС колоний (данные не приведены). Эти результаты согласуются с идеей о том, что Wnt3a способен, как минимум частично, выполнять функцию c-Myc в перепрограммировании.
Показано, что сигнальный путь Wnt напрямую связан с центральной схемой регуляции транскрипции ЭС клеток, предполагая механизм, при помощи которого данный путь может напрямую стимулировать индукцию плюрипотентности в отсутствие трансдукции c-Myc (фигура 3c). Показано, что сигнальный путь Wnt напрямую связан с центральной схемой регуляции транскрипции ЭС клеток, предполагая механизм, при помощи которого данный путь может напрямую стимулировать индукцию плюрипотентности в отсутствие трансдукции c-Myc (фигура 2c). В ЭС клетках Tcf3 занимает и регулирует промоторы Oct4, Sox2 и Nanog (Cole et al., 2008; Tarn et al., 2008; Yi et al., 2008). В клетках MEF эти эндогенные транскрипционные факторы плюрипотентности являются молчащими. В процессе перепрограммирования экзогенные Oct4, Sox2 и Klf4 участвуют в реактивации эндогенных факторов плюрипотентности (Jaenisch and Young, 2008), передача сигнала Wnt может непосредственно усиливать эффект данных транскрипционных факторов, как это происходит в ЭС клетках (Cole et al., 2008). Дополнительно или альтернативно, Wnt может активировать эндогенный c-Myc напрямую, тем самым предоставляя замену экзогенному c-Myc. Действительно, c-Myc представляет собой традиционную цель пути Wnt в клетках рака ободочной и прямой кишки (He et al., 1998). В ЭС клетках Tcf3 занимает промотор c-Myc, и Wnt3a положительно влияет на экспрессию гена (Cole et al., 2008). Тот факт, что вызванная искусственно избыточная экспрессия c-Myc нейтрализует отрицательный эффект ингибитора Wnt ICG-001 на процесс перепрограммирования, указывает на то, что стимуляция Wnt может действовать в 3'-5' направлении от эндогенного Myc. Индуцируемые Wnt эффекты на клеточную пролиферацию, опосредованные c-Myc или другими эндогенными факторами пролиферации, могут способствовать ускорению цепи событий, которые приводят к образованию Myc[-] иПС колоний.
Главной целью настоящего исследования является определение временных стимулов, которые могут перепрограммировать соматические клетки, устраняя необходимость в ретровирусах. Описанные в данном документе исследования свидетельствуют, что стимуляцию Wnt можно использовать для повышения эффективности перепрограммирования в сочетании с ядерными факторами Oct4, Sox2 и Klf4. Благодаря повышению эффективности перепрограммирования в отсутствие ретровируса c-Myc, растворимый Wnt или малые молекулы, которые модулируют сигнальный путь Wnt, по всей вероятности, окажутся полезными в сочетании с другими временными стимулами, которые могут заменять оставшиеся ретровирусы.
Пример 6: Идентификация дополнительных перепрограммирующих средств
Пример 3 модифицирован в том отношении, что среда дополнительно содержит, вдобавок к Wnt3a-CM, перепрограммирующее средство-кандидат, которое подлежит тестированию его способности стимулировать или ингибировать перепрограммирование. В некоторых вариантах осуществления клетки инфицируют так, чтобы они экспрессировали только 2 из следующих 3 перепрограммирующих факторов: Oct4, Klf4 и Sox2. Идентифицируют средства, которые стимулируют получение перепрограммированных клеток (например, повышают скорость или эффективность перепрограммирования). Процесс повторяют для идентификации средств, способных заменять генно-инженерную экспрессию Oct4, Klf4 и/или Sox2 при перепрограммировании соматических клеток.
Пример 7: Идентификация дополнительных перепрограммирующих средств
Пример 3 модифицирован в том отношении, что среда Wnt3a-CM дополнительно содержит перепрограммирующее средство-кандидат. В некоторых вариантах осуществления клетки инфицируют так, чтобы они экспрессировали только 1 или 2 из следующих перепрограммирующих факторов: Oct4, Lin28, Sox2 и Nanog (например, один Oct4, Oct-4 и Sox2). Идентифицируют средства, которые стимулируют получение перепрограммированных клеток. Процесс повторяют для идентификации средств, способных заменять генно-инженерную экспрессию Oct4, Lin28, Sox2 и/или Nanog при перепрограммировании соматических клеток.
Пример 8: Использование низкомолекулярного модулятора пути Wnt при перепрограммировании
Пример 3 повторяют, за исключение того, что вместо использования Wnt3a-CM используют среду для ЭС клеток, содержащую низкомолекулярный активатор пути Wnt.
Литература
Brambrink, T., Foreman, R., Welstead, G. G., Lengner, C. J., Wernig, M., Suh, H., and Jaenisch, R. (2008). Sequential expression of pluripotency markers during directreprogramming of mouse somatic cells. Cell Stem Cell 2, 151-159.
Cai, L., Ye, Z., Zhou, B. Y., Mali, P., Zhou, C, and Cheng, L. (2007). Promoting humanembryonic stem cell renewal or differentiation by modulating Wnt signal and cultureconditions. Cell Res 17, 62-72.
Cole, M. F., Johnstone, S. E., Newman, J. J., Kagey, M. H., and Young, R. A. (2008). Tcf3 is an integral component of the core regulatory circuitry of embryonic stem cells. Genes and Development 15; 22(6):746-55 (2008).
Hanna, J., Wernig, M., Markoulaki, S., Sun, C. W., Meissner, A., Cassady, J. P., Beard,C, Brambrink, T., Wu, L. C., Townes, T. M., and Jaenisch, R. (2007). Treatment ofsickle cell anemia mouse model with iPS cells generated from autologous skin. Science318, 1920-1923.
He, T. C, Sparks, A. B., Rago, C, Hermeking, H., Zawel, L., da Costa, L. T., Morin, P.J., Vogelstein, B., and Kinzler, K. W. (1998). Identification of c-MYC as a target of theAPC pathway. Science 281, 1509-1512.
Hochedlinger, K., Yamada, Y., (2005) Cell. 121, 465-477.
Jaenisch, R., and Young, R. A. (2008). Stem cells, the molecular circuitry of pluripotencyand nuclear reprogramming. Cell 132, 567-582.
Kim, J., Chu, J., Shen, X., Wang, J., and Orkin, S. H. (2008). An extended transcriptionalnetwork for pluripotency of embryonic stem cells. Cell 132, 1049-1061.
Knoepfler, P. S. (2008). Why Myc? An unexpected ingredient in the stem cell cocktail. Cell Stem Cell 2, 18-21.
McMillan, M., and Kahn, M. (2005). Investigating Wnt signaling: a chemogenomicsafari. Drug Discov Today 10, 1467-1474.
Meissner, A., Wernig, M., and Jaenisch, R. (2007). Direct reprogramming of geneticallyunmodified fibroblasts into pluripotent stem cells. Nat Biotechnol 25, 1177-1181.
Nakagawa, M., Koyanagi, M., Tanabe, K., Takahashi, K., Ichisaka, T., Aoi, T., Okita, K., Mochiduki, Y., Takizawa, N., and Yamanaka, S. (2008). Generation of inducedpluripotent stem cells without Myc from mouse and human fibroblasts. Nat Biotechnol26, 101-106.
Ogawa, K., Nishinakamura, R., Iwamatsu, Y., Shimosato, D., and Niwa, H. (2006). Synergistic action of Wnt and LIF in maintaining pluripotency of mouse ES cells. Biochem Biophys Res Commun 343, 159-166.
Okita, K., Ichisaka, T., and Yamanaka, S. (2007). Generation of germline-competentinduced pluripotent stem cells. Nature 448, 313-317.
Reya, T., and Clevers, H. (2005). Wnt signalling in stem cells and cancer. Nature 434,843-850.
Sato, N., Meijer, L., Skaltsounis, L., Greengard, P., and Brivanlou, A. H. (2004). Maintenance of pluripotency in human and mouse embryonic stem cells throughactivation of Wnt signaling by a pharmacological GSK-3-specific inhibitor. Nat Med 10, 55-63.
Singla, D. K., Schneider, D. J., LeWinter, M. M., and Sobel, B. E. (2006). wnt3a but notwnt1 1 supports self-renewal of embryonic stem cells. Biochem Biophys Res Commun345, 789-795.
Stadtfeld, M., Maherali, N., Breault, D. T., and Hochedlinger, K. (2008). Definingmolecular cornerstones during fibroblast to iPS cell reprogramming in mouse. Cell StemCell in press.
Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., and Yamanaka, S. (2007). Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 131, 861-872.
Takahashi, K., and Yamanaka, S. (2006). Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 126, 663-676.
Tarn, W. L., Lim, C. Y., Han, J., Zhang, J., Ang, Y. S., Ng, H. H., Yang, H., and Lim, B. (2008). Tcf3 Regulates Embryonic Stem Cell Pluripotency and Self-Renewal by the Transcriptional Control of Multiple Lineage Pathways. Stem Cells.
Teo, J. L., Ma, H., Nguyen, C, Lam, C, and Kahn, M. (2005). Specific inhibition of CBP/beta-catenin interaction rescues defects in neuronal differentiation caused by apresenilin-1 mutation. Proc Natl Acad Sci U S A 102, 12171-12176.
Wernig, M., Meissner, A., Cassady, J. P., and Jaenisch, R. (2008). c-Myc is dispensablefor direct reprogramming of mouse fibroblasts. Cell Stem Cell 2, 10-12.
Willert, K., Brown, J. D., Danenberg, E., Duncan, A. W., Weissman, I. L., Reya, T., Yates, J. R., 3rd, and Nusse, R. (2003). Wnt proteins are lipid-modified and can act asstem cell growth factors. Nature 423, 448-452.
Yi, F., Pereira, L., and Merrill, B. J. (2008). Tcf3 Functions as a Steady State Limiter of Transcriptional Programs of Mouse Embryonic Stem Cell Self Renewal. Stem Cells.
Yu, J., Vodyanik, M. A., Smuga-Otto, K., Antosiewicz-Bourget, J., Frane, J. L., Tian, S.,Nie, J., Jonsdottir, G. A., Ruotti, V., Stewart, R., et al. (2007). Induced pluripotent stem cell lines derived from human somatic cells. Science 318, 1917- 1920.
При осуществлении на практике настоящего изобретения используют, если не указано особо, общепринятые методы генетики мышей, биологии развития, клеточной биологии, культивирования клеток, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинантной ДНК и иммунологии, которые находятся в пределах уровня техники в данной области. Такие методы описаны в литературе. Смотри, например, Current Protocols in Cell Biology, ed. by Bonifacino, Dasso, Lippincott-Schwartz, Harford, and Yamada, John Wiley and Sons, Inc., New York, 1999; Manipulating the Mouse Embryos, A Laboratory Manual, 3rd Ed., by Hogan et al., Cold Spring Contain Laboratory Press, Cold Spring Contain, New York, 2003; Gene Targeting: A Practical Approach, IRL Press at Oxford University Press, Oxford, 1993; и Gene Targeting Protocols, Human Press, Totowa, New Jersey, 2000. Полное содержание всех патентов, патентных заявок и ссылок, цитированных в данном документе, включено в него посредством ссылок.
Специалист в данной области с легкостью признает, что настоящее изобретение хорошо приспособлено для осуществления поставленных задач, а также достижения указанных, и связанных с ними, конечных результатов и преимуществ. Способы, системы и наборы являются репрезентативными для некоторых вариантов осуществления, они представляют собой примеры и не предназначены служить ограничениями для объема изобретения. Их модификации и другие применения будут очевидны для специалистов в данной области. Данные модификации охвачены сущностью изобретения и определены объемом формулы изобретения. Специалисту в данной области будет очевидно, что в раскрытое в данном документе изобретение можно вносить различные изменения и модификации без отклонения от объема и сущности изобретения.
Как используют в данном документе в описании и формуле изобретения, единственное число существительного, если прямо не указано обратное, следует понимать как включающее соответствующее множественное число. Пункты формулы изобретения или описания, где встречается союз «или» между одним или большим количеством членов группы, считаются удовлетворяющими требованиям, если один, более чем один или все члены группы присутствуют в, используются в, или иным образом имеют отношение к данному продукту или процессу, если не указано иное, или иное не следует из контекста. Изобретение включает варианты осуществления, в которых в точности один член группы присутствует в, используется в, или иным образом имеет отношение к данному продукту или процессу. Изобретение также включает варианты осуществления, в которых более чем один, или все члены группы присутствуют в, используются в, или иным образом имеют отношение к данному продукту или процессу. Кроме того, следует понимать, что изобретение охватывает все вариации, комбинации и изменения, в которых одно или более ограничений, элементов, условий, описательных терминов, и так далее, из одного или большего количества перечисленных пунктов формулы изобретения введены в другой пункт формулы изобретения, зависимый от того же основного пункта (или, если применимо, любого другого пункта), если не указано иное, или если любому рядовому специалисту в данной области не будет очевидно, что может возникнуть противоречие или несоответствие. Там, где элементы представлены в виде списка, например, в группе Markush или общем формате, следует понимать, что каждая подгруппа элементов также раскрыта, и любой элемент(ы) можно удалять из группы. Следует понимать, что, как правило, если изобретение или аспекты изобретения называют содержащим(ими) конкретные элементы, характерные особенности и так далее, некоторые варианты осуществления изобретения или аспекты изобретения состоят, или в основном состоят, из таких элементов, характерных особенностей и так далее. Для упрощения, такие варианты осуществления в каждом случае конкретно не изложены в данном документе. Следует также понимать, что любой вариант осуществления изобретения может быть в явной форме исключен из формулы изобретения, независимо от того, изложено ли конкретное исключение в описании. Например, любой модулятор Wnt, например, любое активирующее путь Wnt средство, любой тип соматических клеток, любое перепрограммирующее средство и так далее, могут быть исключены.
Там, где в данном документе указан диапазон значений, изобретение включает варианты осуществления, в которых конечные значения включены, варианты осуществления, в которых оба конечных значения исключены, и варианты осуществления, в которых одно конечное значение включено, а другое исключено. Следует считать, что оба конечные значения включены, если не указано иное. Кроме того, следует понимать, что, если не указано особо или иным образом не очевидно из контекста и не понятно любому рядовому специалисту в данной области, значения, которые выражены в виде диапазона, могут предполагать любое конкретное значение или подгруппу в пределах заявленного диапазона в различных вариантах осуществления изобретения, до десятой доли целого нижнего предела диапазона, если из контекста с очевидностью не следует иное. Также очевидно, что там, где в данном документе приведена серия численных значений, изобретение включает варианты осуществления, которые относятся аналогично к любому промежуточному значению или диапазону, определяемому любыми двумя значениями в серии, и что наименьшее значение можно принимать в качестве минимума, а наибольшее значение можно принимать в качестве максимума. Как используют в данном документе, численные значения включают значения, выраженные в виде процентов. Для любого варианта осуществления изобретения, в котором перед численным значением стоит слово «примерно» или «приблизительно», изобретение включает вариант осуществления, в котором приведено точное значение. Для любого варианта осуществления изобретения, в котором перед численным значением не стоит слово «примерно» или «приблизительно», изобретение включает вариант осуществления, в котором перед значением стоит слово «примерно» или «приблизительно». Термины «приблизительно» или «примерно» должны охватывать числа, которые попадают в диапазон ±10% от числа, в некоторых вариантах осуществления - в пределах ±5% от числа, в некоторых вариантах осуществления - в пределах ±1%, в некоторых вариантах осуществления - в пределах ±0,5% от числа, в некоторых вариантах осуществления - в пределах ±0,1% от числа, если не указано иное, или иное не является очевидным из контекста (за исключением того, когда такое число будет недопустимо превышать 100% от возможного значения).
Некоторые пункты формулы изобретения приведены в подчиненной форме для удобства, однако заявители оставляют за собой право переписать любой подчиненный пункт формулы изобретения в независимой форме, чтобы включить ограничения независимого пункта формулы и любого другого пункта(ов) формулы, которому такой пункт формулы подчиняется, и такой переписанный пункт формулы изобретения следует считать эквивалентным во всех отношениях подчиненному пункту формулы, в какой бы форме он ни находился (либо измененной, либо неизмененной) до того, как быть переписанным в независимом формате. Следует также понимать, что, если четко не указано иное, в любых способах, заявленных в данном документе, которые включают более чем одно действие, порядок действий способа не обязательно ограничен порядком, в котором перечислены действия данного способа, однако изобретение включает варианты осуществления, в которых порядок ограничен таким образом.
Реферат
Изобретение относится к области молекулярной биологии. Предложен способ перепрограммирования соматических клеток млекопитающего, включающий приведение соматической клетки млекопитающего в контакт с перепрограммирующими факторами, выбранными из группы, состоящей из: (i) Oct4; (ii) Oct4 и Klf4; (iii) Oct4, Klf4 и Sox2, и с Wnt-кондиционированной средой или с активатором пути Wnt. Изобретение может быть использовано для получения индуцированных плюрипотентных стволовых клеток в целях лечения или предотвращения медицинского патологического состояния у индивидуума. 9 з.п. ф-лы, 1 табл., 5 ил, 8 пр.
Формула
(I) с перепрограммирующими факторами, выбранными из группы, состоящей из: (i) Oct4; (ii) Oct4 и Klf4; (iii) Oct4, Klf4 и Sox2, таким образом перепрограммируя клетку до менее дифференцированного состояния; и
II) с Wnt-кондиционированной средой; или с активатором пути Wnt, выбранным из группы, состоящей из: экзогенного растворимого биологически активного белка Wnt, который связывается с рецептором Wnt и активирует путь Wnt, и малой молекулы антагониста GSK-3, которая активирует путь Wnt.
a) представляет собой клетку человека;
b) представляет собой окончательно дифференцированную клетку;
c) представляет собой фибробласт;
d) модифицирована таким образом, что экспрессирует или содержит по меньшей мере один перепрограммирующий фактор, уровень которого выше, чем обычный уровень в клетках данного типа;
e) не является генетически модифицированной; или
f) не является генетически модифицированной таким образом, что экспрессирует с-Мус, уровень которого выше, чем обычный уровень в клетках данного типа.
a) подтверждение того, что перепрограммированная клетка является плюрипотентной; или
b) дифференциацию перепрограммированной клетки млекопитающего до нужного типа клетки in vitro после перепрограммирования клетки.
a) дополнительно включает идентификацию перепрограммированных соматических клеток млекопитающего по морфологическому критерию; или
b) не включает проведение химической селекции для отбора перепрограммированных клеток млекопитающих; или
c) включает отделение перепрограммированных клеток млекопитающих, которые перепрограммированы до плюрипотентного состояния, от клеток, которые не перепрограммированы до плюрипотентного состояния.

Комментарии