Специфичные для пациента линии стволовых клеток, полученные из человеческих партеногенетических бластоцистов - RU2511418C2
Код документа: RU2511418C2
Чертежи











Описание
УРОВЕНЬ ТЕХНИКИ
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится, главным образом, к эмбриональным стволовым клеткам и, более конкретно, к способу получения линий HLA-гомозиготных партеногенетических линий стволовых клеток человека для клеточной терапии.
УРОВЕНЬ ТЕХНИКИ
Первые эмбриональные стволовые клетки человека (ESC) были получены из внутренней клеточной массы (ICM) бластоцисты, полученной из оплодотворенного ооцита, способной к бесконечному делению и дифференцировке в клетки всех клеточных типов. Эмбриональная стволовая клетка представляет собой потенциально безграничный источник плюрипотентных клеток для трансплантационно-клеточных терапий.
Эмбриональные стволовые клетки человека (ES) представляют собой плюрипотентные клетки, которые могут дифференцироваться в широкое множество клеточных типов. После инъекции мышам с иммунодефицитом эмбриональные стволовые клетки образуют дифференцированные опухоли (тератомы). Однако эмбриональные стволовые клетки, которые индуцированы in vitro для образования эмбриоидных телец (ЕВ), обеспечивают источник линий эмбриональных стволовых клеток, которые подвержены дифференцировке в многочисленные клеточные типы, характерные для нескольких тканей, при определенных условиях роста. Например, клетки ES дифференцируются в нейроны в присутствии фактора роста нервов и ретиноевой кислоты.
Эмбриональные стволовые клетки человека обладают потенциалом оказывать значительное благоприятное действие на пациентов при условии, что проблема иммунного отторжения может быть решена. Эмбриональные стволовые клетки, которые генетически родственны реципиенту, могут преодолеть указанные проблемы отторжения. В настоящее время эмбриональные стволовые клетки человека (hES) получают из трех источников: бластоцист, остающихся после лечения бесплодия и предоставленных для исследований, бластоцист, полученных из донорских гамет (ооцитов и спермы), и продуктов ядерного переноса (NT). Трупная фетальная ткань является единственным источником эмбриональных зародышевых клеток человека (hEG). Клетки hES и hEG предоставляют замечательные научные и терапевтические возможности, включая возможность генерации более специализированных клеток или тканей. Однако этические соображения, касающиеся источников клеток hES и hEG, и опасения, что использование NT для исследований могут привести к использованию NT для создания человека, стимулировали большие споры и дебаты в обществе.
Партеногенетическую активацию ооцитов млекопитающих можно использовать в качестве альтернативы оплодотворению спермой/NT для получения ооцитов для генерации эмбриональных стволовых клеток. Партеногенетическая активация представляет собой продукцию эмбриональных клеток, с конечным развитием во взрослую особь или без него, из женской гаметы в отсутствие какого бы то ни было вклада со стороны мужской гаметы.
Партеногенетическая активация ооцитов представляет собой относительно простой способ создания гистосовместимых стволовых клеток по сравнению с SCNT, поскольку она не требует использования сложного оборудования, необходимого для микроскопических манипуляций с ооцитом. Партеногенетические стволовые клетки образуются из неоплодотворенных ооцитов и содержат генетический материал исключительно донора ооцитов (потенциального пациента). Кроме того, после направленной клеточной дифференцировки аутологичные клетки можно трансплантировать, не опасаясь угрозы иммунного отторжения. Партеногенетические мышиные МНС-гомозиготные линии стволовых клеток и одна партеногенетическая гетерозиготная эмбриональная линия стволовых клеток примата (Cyno-1) уже получены, и в указанных линиях продемонстрирована плюрипотентность клеток.
Как уже сказано выше, самым большим риском после трансплантации аллогенной ткани и органа является иммунное отторжение. Степень риска пропорциональна степени несовместимости между антиген-презентирующими белками клеточной поверхности донора и реципиента. В идеальном трансплантате донорская ткань является гистосовместимой с реципиентом по главному комплексу гистосовместимости (МНС). Система лейкоцитарных антигенов человека (HLA) представляет собой номенклатуру, характеризующую человеческий МНС, и представляет антигены, важные для трансплантации. Совпадающая по антигенам HLA ткань донора и реципиента уменьшает вероятность цитотоксического Т-клеточного ответа в организме реципиента и, таким образом, значительно увеличивает вероятность выживания трансплантата.
HLA гаплотипы МНС класса I и II представляют собой специфические совокупности аллелей локусов HLA-A, -B, -DR, наследуемые вместе от родителя. Несмотря на высокую степень полиморфизма HLA, существуют лишь 200 распространенных гаплотипов HLA в популяции белого населения США. Указанное разнообразие HLA в сочетании с коэффициентом гетерозиготной селекции, означает, что вероятность обнаружения совпадения донор-реципиент находится в пределах от одного на 1000 до одного на несколько миллионов, в силу уникальности тканевого типа, обусловленного комбинацией указанных аллельных вариантов у гетерозиготного индивидуума.
Лечение с использованием стволовых клеток на основе трансплантации сталкивается с теми же проблемами совместимости HLA, которые ограничивают использование солидных аллогенных трансплантатов органов из-за иммунного отторжения. Совместимые по HLA линии стволовых клеток могут преодолеть риск иммунного отторжения. Чтобы получить партеногенетические клетки, HLA-гетерозиготные линии клеток получают от HLA-гетерозиготных доноров путем активации ооцитов с использованием комбинации А23187 и 6-DMAP. Поскольку указанные клетки являются HLA-совместимыми с донором ооцитов, их способность обеспечивать тканевосовместимые дериваты ограничена.
МНС-совместимость между донором и реципиентом значительно увеличивается, если донорские клетки являются HLA-гомозиготными, т.е. содержат идентичные аллели для каждого антиген-презентирующего белка. Кроме того, если гомозиготные донорские клетки имеют гаплотип, который часто встречается в популяции, указанные клетки можно использовать для лечения с использованием стволовых клеток на основе трансплантации для большого количества индивидуумов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам получения линий HLA-гомозиготных партеногенетических стволовых клеток человека (hpSC-Hhom) как от HLA-гомозиготных, так и от HLA-гетерозиготных доноров. Указанные линии hpSC-Hhom демонстрируют морфологию эмбриональных стволовых клеток человека, экспрессируя типичные маркеры стволовых клеток (т.е. SSEA-3, SSEA-4, TRA-1-60, TRA-1-81 и ОСТ-4) и имея высокие уровни активности щелочной фосфатазы и теломеразы. Помимо этого инъекция указанных линий клеток животным с иммунодефицитом приводит к образованию тератомы. Анализ данных SNP показывает, что линии hpSC-Hhom, полученные от HLA-гетерозиготных доноров ооцитов, являются гомозиготными по всему геному. Описанный протокол сводит к минимуму использование компонентов, полученных от животных, что делает указанные стволовые клетки идеально подходящими для клинического применения.
В одном варианте осуществления настоящего изобретения описана изолированная линия стволовых клеток человека, полученная из партеногенетических бластоцист, в которой по меньшей мере одна клетка, составляющая линию клеток, является гетерозиготной по одному или более однонуклеотидным полиморфизмам (SNP), гомозиготной по одному или более аллелям HLA или включает комбинацию гомозиготных и гетерозиготных SNP.
В одном аспекте по меньшей мере одна клетка является гомозиготной по аллелям HLA. В другом аспекте по меньшей мере одна клетка образует тератому после трансплантации мыши с ослабленным иммунитетом. В еще одном аспекте по меньшей мере одна клетка является МНС-совместимой с донором бластоцисты.
В родственном аспекте по меньшей мере одна клетка является МНС-совместимой с прямым родственником донора бластоцисты, включая то, что по меньшей мере одна клетка в значительной степени подверглась генетическому импринтингу в соответствии с происхождением донора.
В одном аспекте по меньшей мере одна клетка (i) будет пролиферировать в культуре in vitro в течение более одного года, (ii) сохраняет потенциал дифференцировки в производные тканей эндодермы, мезодермы и эктодермы во всей культуре и (iii) поддается ингибированию дифференцировки, когда ее культивируют в питающем подслое фибробластов.
В другом аспекте по меньшей мере одна клетка дифференцируется в клетку, включая нейрональную клетку, сердечную клетку, гладкомышечную клетку, клетки поперечно-полосатой мышцы, эндотелиальную клетку, остеобласт, олигодендроцит, гемопоэтическую клетку, жировую клетку, стромальную клетку, хондроцит, астроцит, кератиноцит, клетку панкреатического островка, лимфоидную клетку-предшественник, тучную клетку, мезодермальную клетку и эндодермальную клетку. В родственном аспекте по меньшей мере одна клетка не обладает способностью формировать жизнеспособный организм.
В другом варианте осуществления настоящего изобретения описан способ лечения субъекта, нуждающегося в этом, включающий введение клеточной композиции, содержающей дифференцированные клетки, в котором дифференцированные клетки получены из линии стволовых клеток, полученной из партеногенетических бластоцист, где по меньшей мере одна клетка, составляющая линию клеток, является гетерозиготной по одному или более однонуклеотидным полиморфизмам (SNP), гомозиготной по одному или более аллелям HLA или включает комбинацию гомозиготных и гетерозиготных SNP.
В одном аспекте субъект имеет заболевание, включая болезнь Паркинсона, болезнь Хантингтона, болезнь Альцгеймера, ALS, дефекты или повреждения спинного мозга, рассеянный склероз, мышечную дистрофию, муковисцидоз, болезнь печени, диабет, болезнь сердца, дегенерацию желтого пятна, дефекты или повреждения хряща, ожоги, язвы стопы, болезнь сосудов, болезнь мочевыводящих путей, СПИД и рак.
В одном варианте осуществления настоящего изобретения описана библиотека стволовых клеток, включающая аутологичные или аллогенные стволовые клетки, в которой стволовые клетки получены из партеногенетически активированных ооцитов от одного или более доноров-людей и где стволовые клетки представляют собой HLA-гомозиготные стволовые клетки. В одном аспекте каждый член библиотеки идентифицирован как полный сибс, полусибс или неродственный согласно маркерам однонуклеотидного полиморфизма (SNP). В другом аспекте каждый член библиотеки характеризуется по типу HLA, и член библиотеки является HLA-совместимым с потенциальными реципиентами для терапевтического применения.
В другом аспекте донор ооцитов является гистосовместимым с членом библиотеки. В родственном аспекте член библиотеки подвергся геномному импринтингу в соответствии с происхождением донора ооцитов, включая то, что стволовые клетки библиотеки могут быть получены от HLA-гетерозиготного донора ооцитов. В еще одном аспекте каждый член библиотеки является гомозиготным по комбинации аллелей МНС/HLA, отличной от других членов библиотеки.
В одном аспекте каждый член библиотеки является по меньшей мере гомозиготным по одному или более генам HLA класса I и генам HLA класса II. В родственном аспекте гены HLA класса I включают комбинации гаплотипов HLA A*, HLA B*, HLA и Cw*. В другом родственном аспекте гены HLA класса II включают комбинации гаплотипов HLA DRB1*, DRB3*, DRB4*, DRB5*, DQA1* и DQB1*.
В другом варианте осуществления настоящего изобретения описан способ генерации HLA-гомозиготных стволовых клеток, включающий скрининг доноров ооцитов на HLA-гаплотипы, широко распространенные в данной популяционной группе, инкубирование ооцитов человека, находящихся в метафазе II, в средах для экстракорпорального оплодотворения (IVF), инкубирование клеток в средах IVF, включающих ионофор, инкубирование клеток в средах IVF, включающих пуромицин, и инкубирование клеток в свежей среде IVF, где одну или более инкубаций осуществляют при различающихся значениях парциального давления О2 и где внутренние клеточные массы (ICM), полученные из клеток, продуцируют пригодные для культивирования стволовые клетки.
Примеры способов и композиций по настоящему изобретению более подробно описаны ниже.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фигура 1 показывает специфические маркеры, характерные для линий phESC. Недифференцированные колонии phESC на питающем подслое клеток человека (A-F), отрицательное окрашивание на SSEA-1 (G-L), экспрессия маркеров клеточной поверхности SSEA-3 (M-R), SSEA-4 (S-X). Увеличение (А) по (Е) × 100; (F) × 200; (G) по (Х) × 400. Положительное окрашивание на щелочную фосфатазу колоний phESC на питающих клетках (A-F), OCT-4 (G-L), TRA-1-60 (K-R) и TRA-1-81 (S-X). Увеличение (A, B, O, R) × 100; (C-F, M, S, X) × 200; (G-L, N, P, Q, T-W) × 400.
Фигура 2 показывает, что phESC демонстрируют высокий уровень активности теломеразы по сравнению с положительными контрольными клетками: «+» - экстракт из 500 клеток; «-» - клеточный экстракт после термической обработки с инактивированной теломеразой; «контроль +» - положительный по теломеразе клеточный экстракт (использовался набор TRAPEZE); «В» - лизирующий буфер CHAPS, контроль контаминации праймер-димер/ПЦР; TSR8 - матрица количественного контроля теломеразы (0,1 и 0,2 амоль/мкл); «М» - маркер, ДНК-лэддер.
Фигура 3 показывает кариотипирование линий phESC по Гимза-диску. phESC-1 (А), phESC-3 (В), phESC-4 (С), phESC-5 (D) и phESC-6 (Е) линии имеют нормальный 46,ХХ кариотип. phESC-7 линия имеет кариотип 47,ХХХ (F).
Фигура 4 показывает in vitro дифференцировку phESC в производные всех трех зародышевых слоев. Дифференцировка эктодермы представлена положительным иммуноцитохимическим окрашиванием на нейрон-специфичные маркеры нейрофиламент 68 (А), NCAM (B), тубулин бета III (C) и маркер глиальных клеток GFAP (D, M). Дифференцированные клетки были положительными на маркеры мезодермы: специфичные для мышц альфа-актинин (G) и десмин (J), эндотелиальные маркеры PECAM-1 (E) и VE-кадхерин (F). Дифференцировка эндодермы представлена положительным окрашиванием на альфа-фетопротеин (H, L). phESC продуцируют пигментированные эпителий-подобные клетки (I, K). Увеличение (I) × 100; (A-H, J-M) × 400.
Фигура 5 показывает in vivo дифференцировку phESC и образование тератомы у мышей SCID. Иммунофлюоресцентное окрашивание на маркеры всех трех зародышевых слоев. Мышечный актин, маркер мезодермальных клеток, располагается вокруг других компонентов и четко идентифицируется (А). Присутствие фибронектина в более высоких количествах является специфичным для соединительной ткани мезодермального происхождения (В). Области невральных дифференцированных клеток (эктодермального происхождения) являются обширными и интенсивно метятся антителами против бета-тубулина (С). Альфа-фетопротеин, маркер незрелых эндодермальных клеток, может извлекаться из областей железистого внешнего вида (D). Ядра окрашивали DAPI - (A), (D). Увеличение (A), (C), (D) × 100; (B) × 200.
Фигура 6 показывает анализ ОТ-ПЦР экпрессии подвергшихся импринтингу генов. Две линии hESC, hESC1 и hESC2 от неиспользованных эмбрионов IVF использовали в качестве положительных контролей для анализа экспрессии отцовских экспрессированных генов SNRPN и PEG1_2 и материнских экспрессированных генов TSSC5 и Н19 в линиях phESC: phESC-1; phESC-3; phESC-4; phESC-5; phESC-6 и phESC-7 (1, 3, 4, 5, 6 и 7 соответственно). Ген PEG1_1 экспрессируется биаллельно и был использован в качестве дополнительного контроля. GAPDH был включен в качестве количественного контроля мРНК. ОТ данные показывают отсутствие геномной контаминации в образцах ОТ.
Фигура 7 показывает специфические маркеры, характерные для линий hpSC-Hhom. Клетки из всех четырех линий hpSC-Hhom показывают положительное окрашивание на SSEA-3, SSEA-4, TRA-1-60, TRA-1-81, OCT-4 (ядра окрашивали с использованием DAPI), щелочную фосфатазу и отрицательное окрашивание на SSEA-1. Мышиные эмбриональные стволовые клетки (ESC) использовали в качестве положительного контроля для окрашивание на SSEA-1.
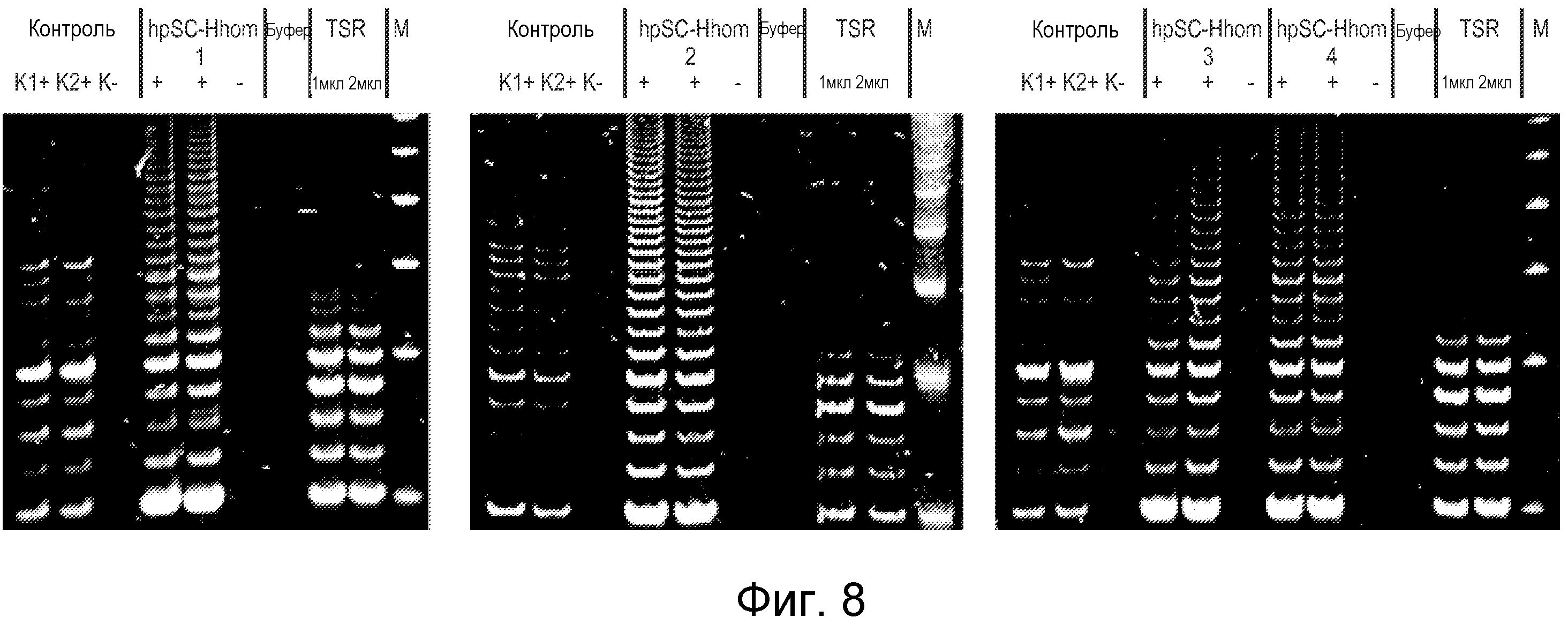
Фигура 8 показывает, что линии hpSC-Hhom демонстрируют высокие уровни активности теломеразы по сравнению с положительными контрольными клетками: «К1+» - экстракт положительных по теломеразе клеток (использовали набор TRAPEZE); «К2+» - экстракт из 500 клеток; «К-» или «-» - клеточный экстракт после термической обработки с инактивированной теломеразой; Buf - лизирующий буфер CHAPS, контроль контаминации праймер-димер/ПЦР; TSR - матрица количественного контроля теломеразы (0,1 и 0,2 амоль/мкл); «М» - маркер, ДНК-лэддер.
Фигура 9 показывает кариотипирование по Гимза-диску линий HLA-гомозиготных партеногенетических стволовых клеток человека: hpSC-Hhom-1 (А) и hpSC-Hhom-4 (В) линии имеют нормальный 46, ХХ кариотип; hpSC-Hhom-2 (C) линия имеет 15% клеток с кариотипом 47, ХХ, +8 кариотипом - анеуплоидией хромосомы 8; hpSC-Hhom-3 (D) линия имеет 4,2% клеток с 47, ХХ, +1 кариотипом - анеуплоидию хромосомы 1.
Фигура 10 показывает in vitro дифференцировку hpSC-Hhom-4 в производные всех трех зародышевых слоев: дифференцировка эктодермы представлена положительным иммуноцитохимическим окрашиванием на нейрон-специфичные маркеры нейрофиламент 68 (А) и NCAM (B); дифференцировка эндодермы представлена положительным окрашиванием на альфа-фетопротеин (С); дифференцированные клетки были положительны на маркеры мезодермы, специфичные для мышц десмин (D) и альфа-актинин (Е); увеличение × 200 (А-Е).
Фигура 11 показывает in vivo дифференцировку hpSC-Hhom-4. Образование тератомы у мышей SCID. Производные из всех трех эмбриональных зародышевых слоев (эктодермы, эндодермы и мезодермы): хорошо сформированные железы респираторного типа, окруженные мезенхимальными клетками, окрашивание гематоксилин-эозином (h/e), увеличение × 140 (А); возможно, невральная трубка с одиночным слоем клеток; справа эндодермальная железа и внизу хрящевая дифференцировка, окрашивание h/e, увеличение × 70 (В); кость, окруженная мезенхимальными клетками, в центре тубулярная железа с кубическим эпителием, окрашивание пикрофусцином, увеличение × 140 (С); хорошо сформированная кость, окруженная мезенхимальными клетками и жировой тканью, окрашивание h/e, увеличение × 140 (D); слева эндодермальные железы, мезодермальная и жировая ткань, коллаген; кость видна справа и внизу, окрашивание по Kraberg, увеличение × 70 (Е); эндодермальная железистая структура, окруженная мезенхимальными клетками, высокая продукция коллагеновых волокон, окрашивание по Van Gieson, увеличение × 280 (F); многослойный эпителий, в центре ядро гиперкератоза, слева другая железа, окрашивание h/e, увеличение × 140 (G); колония желез, окрашивание h/e, увеличение × 70 (Н); железы, содержащие клетки, продуцирующие коричневый пигмент, возможно, желчный пигмент, окруженные жировой тканью и мезенхимальными клетками, окрашивание h/e, увеличение × 140 (I).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
До того как будут описаны настоящая композиция, способы и методики культивирования, следует понимать, что настоящее изобретение не ограничивается описанными конкретными композициями, способами и экспериментальными условиями, поскольку указанные композиции, способы и условия могут варьировать. Следует понимать также, что терминология, которая используется в настоящем документе, служит лишь целям объяснения конкретных вариантов осуществления настоящего изобретения и не предназначена для ограничения, поскольку объем настоящего изобретения ограничивается только прилагаемой формулой изобретения.
Используемые в настоящем документе и прилагаемой формуле изобретения формулы единственного числа “a”, “an” и “the” включают формы множественного числа, если в контексте ясно не указано иное. Так, например, ссылки на «способ» включают один или более способов и/или этапов типа, описанного в настоящем документе, что будет очевидным для специалистов после прочтения настоящего описания и прочего.
Настоящее изобретение описывает по меньшей мере два различных подхода для получения линий HLA-гомозиготных партеногенетических стволовых клеток человека, пригодных для терапии с использованием стволовых клеток на основе трансплантации.
В одном варианте осуществления настоящего изобретения одну линию клеток получают от HLA-гомозиготного донора, включая использование А23187 и 6-DMAP во время активации ооцитов, блокирующее вытеснение 2-го полярного тельца и, таким образом, сохранение всего генетического материала ооцита MII. HLA-генотип стволовых клеток, полученных из указанных ооцитов, соответствовал генотипу донора (Revazova et al., Cloning Stem Cells (2007) 9 (3): 432-449). В родственном аспекте также может быть получена диплоидная линия hpSC-Hhom-1 от HLA-гомозиготного донора.
В другом варианте осуществления настоящего изобретения HLA-гомозиготные эмбриональные стволовые клетки могут быть получены от HLA-гетерозиготных доноров ооцитов, включая использование партеногенетической активации ооцитов в сочетании с А23187 и пуромицином, что позволяет осуществить вытеснение 2-го полярного тельца. Активированный ооцит, таким образом, содержал только половину набора хромосом в метафазе II, что позволяло формирование гомозиготного генотипа. Например, 80 процентов ооцитов человека, активированных комбинацией кальциевого ионофора и пуромицина, демонстрируют пронуклеус с вытеснением второго полярного тельца. Кроме того, цитогенетический анализ показывает, что 78 процентов содержат нормальный гаплоидный набор хромосом (Yamano S., et al., J. Med. Investigation (2000) 47 (1-2): 1-8). Помимо этого ооциты человека, активированные А23187 и пуромицином, демонстрировали один пронуклеус и два полярных тельца с гаплоидным набором хромосом (Nakagawa K., et al., Zygote (2001) 9:83-88). Указанный пронуклеарный партенот с нормальным гаплоидным набором хромосом был разработан на мышиных моделях. (Nakagawa K., et al., Zygote (2000) 8:203-208).
Результатом использования указанного протокола являются многочисленные диплоидные линии клеток из ооцитов, выделенных от HLA-гетерозиготных доноров (например, без ограничения, hpSC-Hhom-2, hpSC-Hhom-3, hpSC-Hhom-4).
Не будучи связанными теорией, данные по генотипированию HLA предполагают, что HLA-гаплотип наследуется исключительно от одного из родителей донора. Анализ данных SNP предполагает, что указанные три линии клеток являются гомозиготными по всему геному по оценке анализа SNP. Например, примеры линий клеток, описанные в настоящем изобретении (см. пример 1), имеют диплоидный кариотип, что соответствует более ранней работе, в которой линии диплоидных стволовых клеток были получены из гаплоидных мышиных эмбрионов (Kaufman et al., J. Embryol. Exp. Morphol. (1983) 73:249-261).
Точный механизм и время удвоения гаплоидного генетического материала после активации ооцита неясны, однако не ограничиваясь теорией, представляется, что репликация ДНК наблюдается в отсутствие дробления или деления клеток. Более ранние исследования предполагают, что 80% партеногенетически активированных мышиных ооцитов сохраняют свое гаплоидное состояние до стадии морулы, после чего линии стволовых клеток, полученные из указанных эмбрионов, становятся диплоидными (Kaufman M.H. et al., выше).
Помимо заместительной терапии, репозиторий клеток и тканей, полученных из линий hpSC-Hhom, может быть неоценимым для лечения генетических нарушений. Согласно Online Mendelian Inheritance в штате Мэн (OMIM), университету Джона Хопкинса и Национальному центру биотехнологической информации (NCBI), существует более 100 генетических нарушений, и их перечень продолжает увеличиваться. Примеры включают болезнь Альцгеймера, диабет, базедову болезнь, гемофилию, болезнь Хантингтона, мышечную дистрофию, болезнь Паркинсона, серповидно-клеточную анемию, фенилкетонурию (PKU) и тяжелый комбинированный иммунодефицит (SCID). В указанных ситуациях будет важно использовать линии клеток, полученные от доноров, не несущих один и тот же генетический дефект.
«Дифференцировка» относится к изменению, которое наблюдается в клетках и приводит к приобретению клетками определенных специализированных функций и к потере способности меняться на некоторые другие специализированные функциональные единицы. Клетки, способные к дифференцировке, могут представлять собой тотипотентные, плюрипотентные или мультипотентные клетки. Дифференцировка может быть частичной или полной по отношению к зрелым взрослым клеткам.
«Гиногенез» относится к продукции эмбриона, содержащего различимый трофобласт и внутреннюю клеточную массу, которые являются результатом активации клетки, такой как ооцит, или другого эмбрионального клеточного типа, содержащего ДНК млекопитающего полностью женской природы, предпочтительно человеческой женской природы, например ДНК ооцита примата, являющегося или не являющегося человеком. Указанная женская ДНК млекопитающего может быть генетически модифицированной, например, посредством инсерции, делеции или замещения по меньшей мере одной последовательности ДНК или может быть немодифицированной. Например, ДНК может быть модифицирована посредством инсерции или делеции желательных кодирующих последовательностей или последовательностей, которые стимулируют или ингибируют эмбриогенез. Обычно указанный эмбрион получают путем in vitro активации ооцита, который содержит ДНК полностью женской природы. Гиногенез входит в понятие партеногенеза, который определен ниже. Он также включает способы активации, при которых ДНК сперматозоида не вносит свой вклад в ДНК активированного ооцита.
В родственном аспекте ооциты получают от субъектов с суперовуляцией, подготовленных для IVF. Методики «суперовуляции», такие как введение субъекту женского пола гормонов, используемые в IVF, разработаны для того, чтобы стимулировать яичники к производству нескольких яйцеклеток (ооцитов), а не к одной яйцеклетке, как это обычно происходит при естественном цикле.
Лекарственные средства, которые требуются для увеличения продукции яйцеклеток, могут включать, без ограничения, следующие лекарственные средства: Lupron (агонист релизинг-гормона гонадотропина), Orgalutran, Antagon или Cetrotide (антагонист релизинг-гормона гонадотропина), Follistim, Bravelle или Gonal-F (FSH, фолликулостимулирующий гормон), Repronex (комбинация FSH и LH, лютеинизирующего гормона) и Pregnyl или Novarel (hCG, человеческий хорионический гонадотропин).
В родственном аспекте отбор яйцеклеток можно осуществлять под трансвагинальным ультразвуковым контролем. Для осуществления указанной процедуры иглу вводят (например, под в/в седацией) через стенку влагалища в яичники с использованием ультразвука для обнаружения месторасположения каждого фолликула. Фолликулярную жидкость извлекают и помещают в пробирку для получения яйцеклеток.
«Партеногенез» («партеногенически активированный» и «партеногенетически активированный» используются взаимозаменяемым образом) представляет собой процесс, посредством которого осуществляется активация ооцита в отсутствие проникновения спермы и относится к развитию эмбриона на ранней стадии, включающего трофобласт и массу внутренних клеток, который получен активацией ооцита или эмбриональной клетки, например бластомера, включающий ДНК полностью женской природы. В родственном аспекте «партенот» относится к клетке, полученной с помощью указанной активации. В другом родственном аспекте «бластоциста» относится к стадии дробления оплодотворенного или активированного ооцита, включающей полый шар из клеток, состоящий из внешних клеток трофобласта и массы внутренних клеток (ICM). В еще одном родственном аспекте «формирование бластоцисты» относится к процессу, происходящему после оплодотворения или активации ооцита, во время которого ооцит впоследствии культивирует в средах в течение периода времени, требующегося для его развития, в полый шар из клеток, состоящий из внешних клеток трофобласта и ICM (например, от 5 до 6 дней).
В одном варианте осуществления настоящего изобретения описан способ создания линии клонированных эмбриональных стволовых клеток человека партеногенетически активированными ооцитами. В то время как партеногенез не является редкой формой размножения в природе, млекопитающие не способны размножаться указанным путем. Однако 10% спонтанного партеногенеза можно обнаружить в ооцитах штамма инбредных мышей LT/Sv (Hoppe и Illmensee, Proc. Natl. Acad. Sci. USA (1982) 79:1912-1916), и спонтанный партеногенез является причиной возникновения пузырных заносов у человека (Berkowitz и Goldstein, New Eng. J. Med. (1996) 335(23):1740-1748). В ооцитах от плацентарных млекопитающих можно индуцировать партеногенез in vitro; однако эмбрион успешно не развивается.
После партеногенетической активации ооцитов млекопитающего и переноса активированного ооцита в организм суррогатной матери наблюдается ограниченное выживание эмбрионов: десять дней у мышей, 21 день у овец, 29 дней у свиней и 11,5 дней у кроликов (Kure-bayashi et al., Theriogenology (2000) 53:1105-1119; Hagemann et al., Mol. Reprod. Dev. (1998) 50:154-162; Ozil и Huneau, Development (2001) 128:917-928; Surani и Barton, Science (1983) 222:1034-1036). Причиной указанной остановки развития, вероятно, является генетический импринтинг. Было показано, что материнский и отцовский геномы являются эпигенетически различными и что оба набора требуются для успешного развития эмбриона (Surani, Cell (1998) 93:309-312; Sasaki et al., (1992) 6:1843-1856). Если не ограничиваться теорией, у партенотов весь генетический материал должен иметь материнское происхождение и, таким образом, не будет иметь отцовского импринтинга. Отцовский импринтинг, как полагают, отвечает за развитие экстраэмбриональных тканей, как, например, за развитие ткани трофобласта после оплодотворения энуклеированного ооцита (Surani и Barton (1983), выше). У животных, таким образом, энуклеированные зиготы могут быть пригодными для переноса ядра с последующей партеногенетической активацией.
Партеноты млекопитающих претерпевают лишь ограниченное развитие и в конечном итоге гибель эмбриона. У Macao fascicular только 14 процентов ооцитов в стадии II метафазы после in vitro партеногенетической активации развивались до стадии бластоцисты после 8 дней культивирования (Vrana et al., Proc. Natl. Acad. Sci. USA (2003) 100(suppl. 1):11911-11916).
Эмбрионы, сформированные в спонтанно активированных партенотов у девственных самок штамма инбредных мышей LT/Sv, умирают в течение нескольких дней. В случае когда осуществляют перенос ядра из клеток, включающих внутреннюю клеточную массу (ICM) указанных эмбрионов, в оплодотворенные энуклеированные ооциты мышей C57BL/6j, получают клонированных мышей с геномом LT/Sv (Hoppe и Illmensee, Proc. Natl. Acad. Sci. USA (1982) 79:1912-1916). Таким образом, использование оплодотворенных ооцитов предусматривает донашивание партенота. В одном аспекте оплодотворенный энуклеированный ооцит человека можно использовать для поддержания развития партеногенетического эмбриона, содержащего ядро донора, до стадии бластоцисты.
«Плюрипотентная клетка» относится к клетке, полученной из эмбриона, полученного активацией клетки, содержащей ДНК полностью женской или мужской природы, которую можно культивировать in vitro в течение продолжительного, теоретически неопределенного периода времени в недифференцированном состоянии, которая может давать начало различным дифференцированным тканевым типам, т.е. эктодерме, мезодерме и эндодерме. Плюрипотентное состояние клеток предпочтительно поддерживается культивированием внутренней клеточной массы или клеток, полученных из внутренней клеточной массы, эмбриона, полученного андрогенетическим или гиногенетическим способом при подходящих условиях, например культивированием на питающем подслое фибробластов или другом питающем подслое или культуре, которые включает лейкозный ингибирующий фактор (LIF). Плюрипотентное состояние указанных культивируемых клеток может быть подтверждено различными способами, например (i) подтверждением экспрессии маркеров, характерных для плюрипотентных клеток; (ii) продукцией гибридных животных, которые содержат клетки, экспрессирующие генотип плюрипотентных клеток; (iii) инъекцией клеток животным, например мышам SCID, с выработкой различных дифференцированных клеточных типов in vivo; и (iv) наблюдением дифференцировки клеток (например, при культивировании в отсутствие питающего подслоя или LIF) в эмбриоидные тельца и другие дифференцированные клеточные типы in vitro.
«Диплоидная клетка» относится к клетке, например ооциту или бластомеру, имеющей диплоидный набор ДНК полностью мужской или женской природы.
«Гаплоидная клетка» относится к клетке, например ооциту или бластомеру, имеющей гаплоидный набор ДНК полностью мужской или женской природы.
«Активация» относится к процессу, в ходе которого оплодотворенный или неоплодотворенный ооцит, например, без ограничения, находящийся в метафазе II мейоза, претерпевает процесс, обычно включающий разделение пар хроматид, выталкивание второго полярного тельца, в результате чего возникает ооцит, имеющий гаплоидное число хромосом, каждая с одной хроматидой. Активация включает способы, посредством которых клетку, содержащую ДНК полностью мужской или женской природы, индуцируют для развития в эмбрион, который имеет различимую внутреннюю клеточную массу и трофобласт, который является пригодным для продукции плюрипотентных клеток, но который сам по себе, вероятно, не способен развиваться в жизнеспособного потомка. Активацию можно осуществлять, например, при одном из следующих условий: (i) при условиях, которые не вызывают выталкивания второго полярного тельца; (ii) при условиях, которые вызывают выталкивание второго полярного тельца, но выталкивание второго полярного тельца ингибируют; или (iii) при условиях, которые ингибируют первое клеточное деление гаплоидного ооцита.
«Метафаза II» относится к стадии клеточного развития, во время которой ДНК клеток состоит из гаплоидного набора хромосом, каждая из которых представлена двумя хроматидами. Для настоящего изобретения подавление второго мейотического деления после партеногенетической активации ооцитов человека в метафазе II и генерации диплоидного эмбриона приводит к происхождению МНС-гетерозиготных phESC.
Обычно напряжение кислорода в фаллопиевой трубе и матке млекопитающих намного ниже половины напряжения кислорода в нормальной атмосфере (Fisher и Bavister, J. Reprod. Fertil. (1993) 99:673-679; Kaufman et al., Comp. Biochem. Physiol. Comp. Physiol. (1994) 107:673-678). Для успешного культивирования человеческих эмбрионов после IVF использовали концентрации кислорода 20%, а также 5%. Однако повышение кислорода может генерировать реакционноспособные виды кислорода, который могут индуцировать апоптоз (Van Soom et al., Theriogeology (2002) 57:1453-1465). Сообщается, что низкая концентрация кислорода повышает жизнеспособность эмбрионов до имплантации, способствует их нормальному развитию и чаще обеспечивает формирование здоровых бластоцист, о чем свидетельствует большее количество клеток и хорошо сформированная внутренняя клеточная масса (ICM) (Dumoulin et al., Hum. Reprod. (1999) 14:465-469). В более ранних исследованиях партеногенетические эмбрионы человека развивались in vitro с использованием газовых смесей с высоким (20%) содержанием кислорода (Lin et al., Stem Cells (2003) 21:152-161; Cibelli et al., J. Reg. Med. (2001) 2:25-31).
В одном варианте осуществления настоящего изобретения способы выделения ICM и культивирования phESC включали использование фибробластов кожи человека, и клетки размножали с использованием сыворотки крови человеческого пупочного канатика (HUCBS) вместо сыворотки крови животных и использовали их в качестве питающих клеток. Получение производных и культивирование линий phESC можно осуществлять в среде VitroHES (Vitrolife), разработанной для культивирования hESC, с добавлением HUCBS. Например, использование HUCBS для получения hESC оказывает положительное влияние на разрастание ICM и размножение phESC (например, рост phESC в среде VitroHES был лучше при добавлении HUCBS, чем в ее отсутствие). Кроме того, выделение ICM из цельных бластоцист механическими срезами из выроста трофобласта представляется более щадящим и предпочтительным способом по сравнению с иммунохирургией и обработкой трипсином. Помимо этого указанный способ позволял исключить взаимодействие с реагентами животного происхождения.
Несмотря на то что линии phESC по настоящему изобретению обладают типичными характеристиками линий hESC, они демонстрируют и уникальные свойства, включая генотипы, которые являются практически идентичными генотипам доноров ооцитов, что можно видеть по полученной партеногенетически линии обезьяньих ES клеток Cyno-1 (Vrana et al., 2003, Proc. Natl. Acad. Sci. USA (2003) 100:11911-11916). В качестве такового создание линий hESC из партеногенетических эмбрионов может быть превосходным способом для генерации МНС-совместимых и, возможно, гистосовместимых эмбриональных стволовых клеток по сравнению с SCNT.
Как показали предыдущие исследования, касающиеся мышиных и обезьяньих партеногенетических стволовых клеток, указанные клетки могут образовывать тератомы с производными из всех трех эмбриональных зародышевых слоев (Lin et al., 2003, выше; Vrana et al., выше). Обезьяньи партеногенетические эмбриональные стволовые клетки при определенных условиях культивирования дифференцировались в нервные клетки и функциональные дофаминергические и серотонинергические нейроны (Vrana et al., выше). phESC по настоящему изобретению также могут дифференцироваться в производные всех трех зародышевых слоев in vitro и in vivo и являются плюрипотентными. Помимо этого эмбриоидные тельца из phESC были способны давать начало сокращающимся клеткам, подобным кардиомиоцитам.
Настоящее изобретение демонстрирует способ создания партеногенетических эмбриональных стволовых клеток человека, экспериментальные данные, касающиеся этих клеток, показывают, что phESC могут дифференцироваться в функциональные клетки, которые могут иметь огромное значение для лечения дегенеративных заболеваний человека.
В одном варианте осуществления настоящего изобретения ооциты в метафазе II активируют путем инкубации ооцитов при различном давлении О2 в окружающей среде. В родственном аспекте низкое напряжение газа О2создается газовой смесью, включающей О2в концентрации приблизительно 2%, 3%, 4% или 5%. В еще одном родственном аспекте газовая смесь включает приблизительно 5% CO2. Кроме того, газовая смесь включает приблизительно 90% N2, 91% N2 или 93% N2. Указанную газовую смесь следует отличать от воздуха с 5% СО2, который содержит приблизительно 5% СО2, 20% О2 и 75% N2.
«Парциальное давление О2» относится к парциальному давлению (давлению, которое создает один компонент газовой смеси) кислорода в жидкости (т.е. в жидкости или газе). Низкое давление существует, когда парциальное давление кислорода (pO2) является низким, а высокое давление существует, когда pO2 является высоким.
«Определенные условия среды» относятся к среде, окружающей культивируемые клетки, в которой концентрации компонентов, требующиеся для оптимального роста, подробно описаны. Например, в зависимости от использования клеток (например, в терапевтических целях) изъятие клеток из условий, которые содержат чужеродные белки, является важным; т.е. условия культивирования представляют собой условия, не содержащие компонентов животного происхождения или не содержащие белков животных, не являющихся человеком. В родственном аспекте «среды для экстракорпорального оплодотворения (IVF)» относятся к питательной системе, которая содержит химически определенные вещества или в которой можно выращивать оплодотворенные ооциты.
«Внеклеточные матриксные (ЕСМ) субстраты» относятся к поверхности под клетками, которая поддерживает оптимальный рост. Например, указанные ЕСМ субстраты включают, без ограничения, субстраты Matrigel, ламинин, желатин и фибронектин. В родственном аспекте указанные субстраты могут включать коллаген IV, энтактин, протеогликан гепарин-сульфат, различные факторы роста (например, bFGF, фактор роста эпидермиса, инсулиноподобный фактор роста-1, тромбоцитарный фактор роста, фактор роста нервов и TGF-β-1).
«Эмбрион» относится к эмбриону, который образуется в результате активации клетки, например ооцита или другой эмбриональной клетки, содержащей ДНК полностью мужской или женской природы, которая, необязательно, может быть модифицирована, который включает различимый трофобласт и внутреннюю клеточную массу, который не может давать жизнеспособного потомства и в котором ДНК имеет полностью мужскую или женскую природу. Внутренняя клеточная масса или клетки, которые в ней содержатся, являются пригодными для продукции плюрипотентных клеток, как было определено ранее.
«Внутренняя клеточная масса (ICM)» относится к внутренней части эмбриона, которая дает начало тканям плода. В настоящем изобретении указанные клетки используют для создания постоянного источника плюрипотентных клеток in vitro. Помимо этого ICM включает внутреннюю часть эмбриона, который возникает в результате андрогенеза или гиногенеза, т.е. эмбрионов, которые возникают в результате активации клеток, содержащих ДНК полностью мужской или женской природы. Указанная ДНК может быть, например, человеческой ДНК, например ДНК ооцита или сперматозоида человека, которая может быть или не быть генетически модифицированной.
«Трофобласт» относится к другой части эмбриона, находящегося на ранней стадии развития, которая дает начало тканям плаценты, включая ткань эмбриона, которая возникает в результате андрогенеза или гиногенеза, т.е. эмбрионов, которые возникают в результате активации клеток, содержащих ДНК полностью мужской или женской природы, например ооцита или сперматозоида человека.
«Дифференцированная клетка» относится к неэмбриональной клетке, которая находится в определенном дифференцированном, т.е. неэмбриональном, состоянии. Три наиболее ранних дифференцированных типа клеток представляют собой эндодерм, мезодерм и экдодерм.
«Практически идентичный» относится к качеству сходства, касающемуся конкретной характеристики, которая настолько близка, что является в значительной степени той же самой в пределах способности измерения разницы (например, посредством HLA-типирования, анализа SNP и т.п.).
«Гистосовместимый» относится к той степени, до которой организм будет переносить трансплантат чужеродной ткани.
«Геномный импринтинг» относится к механизму, посредством которого ряд генов в геноме экспрессируется моноаллельно, согласно своему происхождению от родителя.
«Гомоплазмия», включая грамматические варианты, относится к наличию одного и того же типа митохондриальной ДНК (мтДНК) в клетке или индивидууме.
«Гетероплазмия», включая грамматические варианты, относится к наличию смеси более одного типа митохондриальной ДНК (мтДНК) в клетке или индивидууме.
«Партеногенетический» относится к одной или более клеток или индивидуумов, от которой происходит другая клетка или индивидуум и по отношению к которой она остается второстепенной.
«Механическое выделение» относится к процессу разделения клеточных агрегатов с помощью физических сил. Например, указанный процесс исключает использование ферментов (или других расщепляющих клеточных продуктов), которые могут содержать материалы, полученные не от человека.
В естественной среде незрелые ооциты (яйцеклетки) из яичника претерпевают процесс созревания, в результате которого происходит развитие посредством мейоза до метафазы II мейоза. Ооциты затем останавливаются в метафазе II. В метафазе II ДНК в клетке содержит гаплоидное число хромосом, каждая из которых представлена двумя хроматидами.
Указанные ооциты можно сохранять с использованием неопределенно долго с помощью криоконсервирования, например, без ограничения, с использованием микроинъекции сахара.
В одном варианте осуществления настоящего изобретения описан способ получения стволовых клеток человека из криоконсервированного ооцита или партенота, включающий микроинъекцию в цитоплазму ооцита или партенота криоконсервирующего агента, замораживание ооцита или партенота до криогенной температуры для введения его в дремлющее состояние, хранение ооцита или партенота в дремлющем состоянии, оттаивание ооцита или партенота, партеногенетическую активацию ооцита при высоком парциальном давлении О2 в присутствии ионофора с последующим контактированием ооцита с ингибитором сериновой треонин-киназы при низком парциальном давлении О2, культивирование активированного ооцита или партенота до формирования бластоцисты, выделение внутренней клеточной массы (ICM) из бластоцисты и культивирование клеток ICM на слое человеческих питающих клеток, где культивирование клеток ICM осуществляют при высоком парциальном давлении О2.
В одном аспекте полученные описанным способом ооциты переносят в модифицированную изотоническую среду IVF, покрытую протестированным на эмбрионах минеральным маслом (Sigma), или в любую другую подходящую среду. Если это желательно, ооциты можно инкубировать с внеклеточным сахаром в той же концентрации, которая планируется для микроинъекции. Например, чтобы инъецировать 0,1 М сахар, ооциты можно уравновешивать в DMEM/F-12 с 0,1 М сахаром. В одном аспекте агент для криоконсервации включает более низкую концентрацию Na+, чем стандартная DMEM (т.е. среды с низким содержанием Na+). В родственном аспекте агент для криоконсервации включает более высокую концентрацию К+, чем стандартная DMEM (т.е. с высоким содержанием К+). В еще одном родственном аспекте агент для криоконсервации включает более низкую концентрацию Na+ и более высокую концентрацию К+, чем стандартная DMEM (т.е. среды с низким содержанием Na+ и с высоким содержанием К+). В одном аспекте агент для криоконсервации включает органический буфер, включая, без ограничения, HEPES. В другом аспекте агент для криоконсервации включает компоненты, которые ингибируют апоптотический белок (например, капазы).
Альтернативно, ооциты, необязательно, можно уравновешивать с использованием любого другого практически непроникающего растворяющегося агента, такого как NaCl, для уменьшения их клеточного объема до микроинъекции. Указанное уменьшение объема клетки может привести к более маленькому конечному объему ооцитов, получивших микроинъекцию, по сравнению с ооцитами, которые не инкубировали в гипертонических средах до микроинъекции. Указанный более маленький объем может минимизировать любой потенциальный неблагоприятный эффект набухания ооцитов. Указанную общую процедуру подготовки клеток для микроинъекции также можно использовать для других типов клеток (например, активированных ооцитов, hES клеток и т.п.).
Затем производят микроинъекцию в ооциты криоконсервирующего агента. Оборудование и процедуры для микроинъекций хорошо описаны, и оборудование для микроинъекций, известное для применения для инъекции малых молекул в клетки, можно использовать в настоящем изобретении. В качестве примера этапа микроинъекции можно осуществлять микроинъекцию в ооциты при давлении 10 дюймов на кв. дюйм в течение 30 миллисекунд. Другим примером стандартной методики микроинъекции является способ, описанный Nakayama и Yanagimachi (Nature Biotech. 16:639-642, 1998).
Криоконсервирующий агент, подходящий для указанного способа, включает любой химический агент, который обладает криопротективными свойствами и обычно является непроникающим. В частности, криоконсервирующий агент может включать сахара как в отдельности, так и в смеси с другими традиционными криоконсервирующими агентами. Углеводные сахара, такие как трегалоза, сахароза, фруктоза и рафиноза, можно микроинъецировать до концентраций, меньших или равных приблизительно 1,0 M, более предпочтительно меньших или равных приблизительно 0,4 М. В одном аспекте концентрация составляет от 0,05 до 0,20 М включительно. Помимо этого внеклеточный сахар или традиционный криоконсервирующий агент можно добавлять перед хранением. Если клетки инкубировали в гипертоническом растворе до микроинъекции, можно позволить практически непроникающему агенту оставаться в средах после микроинъекции, или его можно удалять из сред путем отмывания клеток средами, содержащими более низкую концентрацию указанного растворенного вещества или не содержащими его вовсе.
Некоторые сахара или полисахариды, которые обычно не проникают через клеточные мембраны, поскольку они слишком большие, чтобы проходить через мембрану, обладают превосходными физико-химическими и биологическими свойствами для целей криоконсервации. В то время как указанные сахара обычно сами по себе не проникают через клеточные мембраны, при использовании способа, описанного в настоящем документе, указанные обычно не проникающие сахара можно микроинъецировать внутриклеточно для получения благоприятного эффекта.
Непроникающие сахара, обладающие стабилизирующим или консервирующим действием на клетки, которые являются особенно пригодными в качестве криоконсервирующего агента в настоящем способе, включают сахарозу, трегалозу, фруктозу, декстран и рафинозу. Среди указанных сахаров трегалоза, невосстанавливающий дисахарид глюкозы, как было показано, является исключительно эффективным для стабилизации клеточных структур в низких концентрациях. Добавление внеклеточных гликолипидов или гликопротеинов также может стабилизировать клеточную мембрану.
После микроинъекции криоконсервирующего агента клетки подготовлены для хранения. Ряд способов замораживания и/или сушки можно использовать для подготовки клеток к хранению. В частности, в настоящем документе описано три подхода: сушка в вакууме или воздухом, лиофилизация и протоколы замораживание/оттаивание. Процессы сушки обладают тем преимуществом, что стабилизированный биологический материал можно транспортировать и хранить при комнатных температурах.
Обычно ооциты, нагруженные с использованием DMSO от 1 до 2 М, охлаждают с очень малой скоростью охлаждения (от 0,3 до 0,5°С в мин) до промежуточной температуры (от -60°С до -80°С) перед погружением в жидкий азот для хранения. Образец затем можно хранить при указанной температуре.
Суспендированный материал можно хранить при температурах криоконсервации, например оставляя флаконы в жидком азоте (LN2) на желательный период времени.
Протоколы для сушки в вакууме или воздухом и для лиофилизации белков хорошо описаны (Franks et al., “Materials Science and the Production of Shelf-Stable Biologicals”, BioPharm, октябрь 1991 г., стр. 39; Shalaev et al., “Changes in the Physical State of Model Mixtures during Freezing and Drying: Impact on Product Quality,” Cryobiol. 33, 14-26 (1996)), и указанные протоколы можно использовать для подготовки клеточных суспензий для хранения способом, описанным в настоящем документе. Помимо сушки воздухом другие конвективные способы сушки, которые можно использовать для удаления воды из клеточных суспензий, включают конвективный поток азота или других газов.
Пример протокола испарительной вакуумной сушки, пригодного для способа по настоящему изобретению, может включать помещение 20 мкл материала в каждую из ячеек 12-ячеечных планшетов и вакуумную сушку в течение 2 часов при комнатной температуре. Разумеется, можно использовать и другие способы сушки, включая сушку клеток во флаконах. Клетки, подготовленные указанным способом, можно хранить в сухом виде и регидратировать разведением в DMEM или в любых других подходящих средах.
Способ по настоящему изобретению с использованием лиофильной сушки для подготовки клеток к хранению начинается с замораживания клеточной суспензии. В то время как можно использовать способы замораживания, известные в уровне техники, простой способ замораживания погружением, описанный в настоящем документе, для способа замораживания-оттаивания можно также использовать для этапа замораживания в протоколе лиофилизации.
После замораживания можно использовать двухэтапный процесс сушки. На первом этапе добавляют энергию сублимации для выпаривания замороженной воды. Вторичную сушку осуществляют после сублимирования из образца чистого кристаллического льда. Клетки, высушенные замораживанием, можно хранить и гидратировать так же, как описано выше для вакуумной сушки. Жизнеспособные клетки затем можно восстанавливать.
После восстановления клеток из замороженного или высушенного состояния любой внешний криоконсервирующий агент можно, необязательно, удалить из культуральных сред. Например, среды можно разводить добавлением соответствующих сред с более низкой концентрацией криоконсервирующего агента. Например, восстановленные клетки можно инкубировать приблизительно в течение пяти минут в средах, содержащих более низкую концентрацию сахара, чем в тех средах, которые использовались для хранения клеток. Для указанной инкубации среды могут содержать тот же сахар, который использовался в качестве криоконсервирующего агента; другой криоконсервирующий агент, такой как галактоза, или любой другой практически непроникающий растворяющийся агент. Для минимизации любого осмотического шока, вызванного уменьшением осмолярности сред, концентрацию внеклеточного криоконсервирующего агента можно медленно уменьшать путем выполнения указанного этапа разведения множество раз, каждый раз с более низкой концентрацией криоконсервирующего агента. Указанные этапы разведения можно повторять до тех пор, пока не останется внеклеточного криоконсервирующего агента, или до тех пор, пока концентрация криоконсервирующего агента или осмолярность сред не уменьшится до желательного уровня.
Партеногенетически активированные ооциты, бластоцисты, ICM, аутологичные стволовые клетки и полученные из них дифференцированные клетки можно хранить или «создавать банк клеток» таким способом, который позволяет оживлять клетки, когда это будет необходимо в будущем. Аликвоту партеногенетически активированных ооцитов и аутологичных или аллогенных стволовых клеток можно извлечь в любое время для выращивания в культуры многих недифференцированных клеток, а затем дифференцировки в конкретный клеточный тип или тип ткани, а затем их можно использовать для лечения заболевания или для замещения плохо функционирующих тканей у субъекта. В одном аспекте клетки получены партеногенетическим путем от донора, клетки можно хранить таким образом, что индивидуум или его близкий родственник может иметь доступ к клеткам в течение продолжительного периода времени. В другом аспекте клетки получены партеногенетическим путем от донора, который является гомозиготным по HLA-гаплотипу, который является распространенным в человеческой популяции; клетки можно хранить таким образом, что индивидуум с таким же или близким HLA-гаплотипом может иметь доступ к клеткам в течение продолжительного периода времени. В одном аспекте клетки получены партеногенетическим путем от донора, который имеет HLA-гаплотип, который является распространенным в человеческой популяции; клетки можно хранить таким образом, что индивидуум с таким же или близким HLA-гаплотипом может иметь доступ к клеткам в течение продолжительного периода времени.
В одном варианте осуществления настоящего изобретения создается банк клеток для хранения полученных партеногенетическим путем ооцитов, бластоцистов, ICM и/или образцов аутологичных или аллогенных стволовых клеток и их дифференцированных производных. В другом варианте осуществления настоящего изобретения описаны способы использования указанного банка клеток. Опубликованная патентная заявка США № 20030215942, которая в полном объеме включена в настоящий документ в качестве ссылки, описывает пример системы банка стволовых клеток.
Использование способов, таких как способы, описанные выше, выделение и in vitro размножение партеногенетически активированных ооцитов, бластоцистов, ICM и образцов аутологичных или аллогенных стволовых клеток и их дифференцированных производных, а также их криоконсервация облегчают создание «банка» пригодных для трансплантации стволовых клеток человека. Поскольку возможно хранение более маленьких аликвот клеток, процедура хранения банка может занимать относительно малое пространство. Таким образом, клетки от многих индивидуумов можно хранить или «банкировать» на краткосрочной или долгосрочной основе при относительно малой стоимости.
В одном варианте осуществления настоящего изобретения часть образца делают доступной для тестирования как до, так и после обработки и хранения.
Настоящее изобретение относится также к способам маркировки или индексирования партеногенетически активированных ооцитов, бластоцист, ICM и/или образцов аутологичных или аллогенных стволовых клеток и их дифференцированных производных таким образом, что, когда необходимо определить месторасположение образца, его легко можно изъять. Любое индексирование и систему изъятия можно использовать для осуществления указанной цели. Любой подходящий тип системы хранения можно использовать таким образом, что можно хранить партеногенетически активированные ооциты, бластоцисты, ICM и/или образцы аутологичных или аллогенных стволовых клеток и их дифференцированные производные. Системы могут быть разработаны таким образом, чтобы хранить отдельные образцы, или могут быть разработаны таким образом, чтобы хранить сотни, тысячи и даже миллионы образцов различных клеток.
Хранящиеся партеногенетически активированные ооциты, бластоцисты, ICM и/или образцы аутологичных или аллогенных стволовых клеток и их дифференцированные производные можно индексировать для надежного и точного изъятия. Например, каждый образец может быть промаркирован алфавитно-цифровым кодом, штрихкодом, или любым другим способом, или их комбинацией. Может также иметь место доступный и читаемый перечень информации, которая делает возможной идентификацию каждого партеногенетически активированного ооцита, бластоцисты, ICM и/или образца аутологичных или аллогенных стволовых клеток и их дифференцированных производных и определение их месторасположения в банке и делает возможной идентификацию источника и/или типа образца клеток, который находится вне банка. Указанную систему индексирования можно устроить любым известным способом, например ручным или неручным, например можно использовать обычные компьютерные программы.
В одном варианте осуществления настоящего изобретения образцы клеток организуют с использованием системы индексации таким образом, чтобы образцы клеток были доступны для использования донором, когда бы они ни потребовались. В других вариантах осуществления настоящего изобретения образцы клеток могут использоваться лицами, которые являются родственниками оригинального донора. В альтернативных вариантах осуществления настоящего изобретения образцы клеток могут использоваться лицами, имеющими HLA-гаплотипы, которые совпадают с HLA-гаплотипами образцов клеток. Будучи занесен в систему индексирования, образец клеток может быть сделан доступным для целей поиска совместимости, например для программы совместимости будет идентифицировать индивидуума с совпадающим типом информации и индивидуум будет иметь выбор совместимого образца.
Система банковского хранения может включать систему для хранения множества записей, связанных со множеством индивидуумов и множеством образцов клеток. Каждая запись может содержать информацию о типе, генетическую информацию или фенотипическую информацию, связанную с образцами клеток или конкретными индивидуумами. В одном варианте осуществления настоящего изобретения система будет включать таблицу перекрестной совместимости, которая совмещает типы образцов с типами индивидуумов, которые желают получить образец.
В одном варианте осуществления настоящего изобретения в системе базы данных хранится информация для каждого партеногенетически активированного ооцита, бластоцисты, ICM и/или образца аутологичных или аллогенных стволовых клеток или их дифференцированных производных в банке. Определенная информация хранится в ассоциации с каждым образцом. Информация может быть связана с конкретным донором, например с идентификацией донора и историей болезни донора. Например, каждый образец может быть типирован по HLA, и информация о типе HLA может храниться в ассоциации с каждым образцом. Хранящаяся информация может также быть доступной информацией. Хранящаяся с каждым образцом информация доступна для поиска и идентифицирует образец таким образом, что можно определить его месторасположение и немедленно предоставить клиенту.
Соответственно, варианты осуществления настоящего изобретения используют системы компьютерных баз данных, которые содержат информацию, такую как донор, дату регистрации, тип предоставленных клеток, типы представленных маркеров клеточной поверхности, HLA-типы клеток, генетическую информацию, касающуюся донора, или другую относящуюся к делу информацию, а также подробности хранения, такие как записи о хранении и месторасположение хранящихся образцов и прочая полезная информация.
Термин «система на компьютерной основе» относится к аппаратному обеспечению компьютера, программному обеспечению и любой базе данных, которые используются для хранения, поиска и получении информации о хранящихся клетках. Система на компьютерной основе предпочтительно включает средства хранения, описанные выше, и процессор для доступа к данным и манипулирования ими. Аппаратное обеспечение систем на компьютерной основе указанного варианта осуществления настоящего изобретения включает центральный процессорный блок (CPU) и базу данных. Опытный специалист может легко оценить, что подходящей является любая из доступных в настоящее время систем на компьютерной основе.
В одном варианте осуществления настоящего изобретения компьютерная система включает процессор, соединенный с шиной, которая соединена с основной памятью (предпочтительно осуществляемой RAM), и ряд различных второстепенных устройств для хранения, таких как жесткий диск и запоминающее устройство сменного носителя. Запоминающее устройство сменного носителя может представлять, например, флоппи-дисковод, накопитель на DVD-дисках, накопитель на оптических дисках, накопитель на компактных дисках, накопитель на магнитных лентах и т.п. Запоминающий сменный носитель, такой как флоппи-диск, компактный диск, магнитная лента и т.п., содержащий логические схемы управления и/или данные, записанные на нем, можно вставлять в запоминающее сменное устройство. Компьютерная система включает подходящую программу для чтения логических схем управления и/или данных из запоминающего сменного носителя, однажды вставленного в запоминающее сменное устройство. Информация, касающаяся партеногенетически активированного ооцита, бластоцисты, ICM и/или образца аутологичных или аллогенных стволовых клеток, может храниться хорошо известным образом в основной памяти, любом из второстепенных запоминающих устройств и/или запоминающих сменных носителей. Программа для доступа и обработки указанных данных (такая, как инструмент поиска, инструмент сравнения и т.п.) постоянно находится в основной памяти во время исполнения.
Используемая в настоящем документе «база данных» относится к памяти, которая может хранить любую полезную информацию, относящуюся к коллекциям партеногенетически активированных ооцитов и/или коллекциям аутологичных или аллогенных стволовых клеток, включая их дифференцированные производные, и донорам.
Данные, относящиеся к хранящимся партеногенетически активированному ооциту, бластоцисте, ICM и/или аутологичным или аллогенным стволовым клеткам и их дифференцированным производным, можно хранить и использовать в ряде программ процессора данных в ряде форматов. Например, данные могут храниться в виде текста в текстовой программе, такой как Microsoft WORD или WORDPERFECT, ASCII file, html file или pdf file, в ряде программ баз данных, известных специалистам, таких как DB2, SYBASE или ORACLE.
«Программа поиска» относится к одной или более программ, которые выполняются в системе на компьютерной основе для поиска деталей или сравнения информации, относящейся к криоконсервированным образцам внутри базы данных. «Программа выдачи» относится к одной или более программам, которые могут выполняться в системе на компьютерной основе для идентификации параметров, представляющих интерес, в базе данных. Например, программу выдачи можно использовать, чтобы находить образцы, которые соответствуют определенному профилю, образцы, имеющие специфические маркеры или последовательности ДНК, или чтобы находить месторасположение образцов, соответствующих конкретным индивидуумам.
Не существует верхней границы для количества образцов клеток, которые можно хранить в одном банке клеток. В одном варианте осуществления настоящего изобретения сотни продуктов от различных индивидуумов будут храниться в одном банке или складском сооружении. В другом варианте осуществления настоящего изобретения до миллионов продуктов могут храниться в одном складском сооружении. Одно складское сооружение можно использовать для хранения образцов партеногенетически активированных ооцитов и/или аутологичных или аллогенных стволовых клеток, или можно использовать множество складских сооружений.
В некоторых вариантах осуществления настоящего изобретения складское сооружение может иметь средства для осуществления любого способа организации и индексирования хранящихся образцов клеток, такие как, например, автоматические роботизированные механизмы доставки и механизмы для манипуляций с клеточными образцами. Сооружение может включать микроманипуляционные устройства для обработки образцов клеток. Известные общепринятые технологии можно использовать для эффективного хранения и доставки образцов клеток. Примеры технологий включают, без ограничения, Machine Vision, Robotics, Automated Guided Vehicle System, Automated Storage и Retrieval Systems, Computer Integrated Manufacturing, Computer Aided Process Planning, Statistical Process Control и т.п.
Тип информации или другую информацию, связанную в индивидуумом, который нуждается в образце, можно заносить в систему, которую можно использовать для идентификации соответствующего подходящего продукта, такую как, например, система базы данных, индексирующая система и т.п. После занесения в систему можно определять соответствие между типом индивидуума и донорским клеточным образцом. В предпочтительных вариантах осуществления настоящего изобретения донорский образец происходит от того же самого индивидуума, который нуждается в образце. Однако можно использовать также совпадения донор/реципиент, сходные, но не идентичные. Совместимый образец является доступным для индивидуума, обладающего идентификатором совместимого типа. В одном варианте осуществления настоящего изобретения идентифицирующую информацию индивидуума хранят в соединении с образцом клеток. В некоторых вариантах осуществления настоящего изобретения процесс совпадения наблюдается во время, примерно соответствующее времени отбора образца, или может наблюдаться в любое время во время обработки, хранения или возникновения потребности в образце. Соответственно, в некоторых вариантах осуществления настоящего изобретения процесс определения соответствия наблюдается до того, как индивидууму действительно потребуется образец клеток.
Когда партеногенетически активированный ооцит, бластоциста, ICM и/или образцы аутологичных или аллогенных стволовых клеток, включая их дифференцированные производные, требуются индивидууму, их можно доставлять и делать доступными для исследований, трансплантации или других целей в течение минут, если это необходимо. Образец также можно впоследствии обрабатывать для его подготовки к трансплантации или для иных нужд.
Обычно ооцит, остановившийся в метафазе II, овулирует и оплодотворяется спермой. Сперма инициирует завершение мейоза в ходе процесса, называемого активацией. Во время активации пары хроматид разделяются, вторичное полярное тельце выталкивается, а ооцит сохраняет гаплоидное число хромосом, каждая - с одной хроматидой. Сперма вносит другой гаплоидный набор хромосом с образованием полностью диплоидной клетки с единственными хроматидами. Хромосомы затем прогрессируют посредством синтеза ДНК во время первого клеточного цикла. Указанные клетки затем развиваются в эмбрионы.
Напротив, эмбрионы, описанные в настоящем документе, развиваются в результате искусственной активации клеток, обычно ооцитов или бластомеров млекопитающих, содержащих ДНК полностью мужского или женского происхождения. Как обсуждалось ранее, в разделе «уровень техники», в литературе имеются сообщения о многочисленных способах искусственной активации неоплодотворенных ооцитов. Указанные способы включают физические способы, например механические способы, такие как укол, манипуляция или ооциты в культуре, термические способы, такие как охлаждение и нагревание, повторные электрические импульсы, ферментативные воздействия, такие как обработка трипсином, проназой, гиалуронидазой, осмотические воздействия, ионные воздействия, такие как воздействия двухвалентными катионами и кальциевыми ионофорами, такими как иономицин и А23187, использование анестетиков, таких как эфир, этанол, тетракаин, лигнокаин, прокаин, фенотиазин, транквилизаторов, таких как тиоридазин, трифторперазин, флуфеназин, хлорпромазин, использование ингибиторов синтеза белка, таких как циклогексимид, пуромицин, использование ингибиторов фосфорилирования, например ингибиторов протеинкиназы, таких как стауроспорин, 2-аминопурин, сфингозин и DMAP, их комбинации, а также другие способы.
Указанные способы активации хорошо известны специалистам и обсуждаются, например, в патенте США № 5945577.
В одном варианте осуществления настоящего изобретения клетку человека в метафазе II, обычно ооцит или бластомер, включающий ДНК полностью мужского или женского происхождения, искусственно активируют для осуществления искусственной активации ооцитов.
В родственном аспекте, активированной клетке, например ооциту, который является диплоидным, позволяют развиваться в эмбрион, который включает трофобласт и внутреннюю клеточную массу. Это можно осуществлять с использованием известных способов и культуральных сред, которые облегчают развитие бластоцисты.
После того как гиногенетические эмбрионы культивировались до образования различимого трофобласта и внутренней клеточной массы, клетки внутренней клеточной массы затем используют для получения желаемых плюрипотентных линий клеток. Это можно осуществлять переносом клеток, полученных из внутренней клеточной массы, или внутренней клеточной массы целиком в культуру, которая ингибирует дифференцировку. Это можно осуществлять переносом внутренней клеточной массы на питающий слой, который ингибирует дифференцировку, например, фибробласты или эпителиальные клетки, такие как фибробласты, полученные из постнатальных человеческих тканей и т.п., или другие клетки, которые продуцируют LIF. Другие факторы/компоненты можно использовать для создания подходящих условий культивирования, чтобы поддерживать клетки в недифференцированном состоянии, включая, без ограничения, добавление кондиционированных сред (Amit et al., Developmental Biol. (2003) 227:271-278), bFGF и TGF-β1 (с LIF или без него) (Amit et al., Biol. Reprod. (2004) 70:837-845), факторов, которые активируют путь gp130/STAT3 (Hoffman и Carpenter, Nature Biotech. (2005) 23(6):699-708), факторов, которые активируют путь PI3K/Akt, PKB (Kim et al., FEBS Lett. (2005) 579:534-540), факторов, которые являются членами суперсемейства костного морфогенетического белка (ВМР) (Hoffman и Carpenter (2005), выше), и факторов, которые активируют сигнальный путь канонический/β-катенин Wnt (например, GSK-специфичный ингибитор; Sato et al., Nat. Med. (2004) 10:55-63). В родственном аспекте указанные факторы могут включать условия культивирования, которые включают питающие клетки и/или субстраты ЕСМ (Hoffman и Carpenter (2005), выше).
В одном аспекте клетки внутренней клеточной массы культивируют на клетках человеческой постнатальной крайней плоти или фибробластах кожи или на других клетках, которые продуцируют лейкозный ингибирующий фактор, или в присутствии лейкозного ингибирующего фактора. В родственном аспекте питающие клетки инактивируют перед посевом ICM. Например, питающие клетки можно митотически инактивировать с использованием антибиотика. В родственном аспекте антибиотик может представлять собой, без ограничения, митомицин С. В родственном аспекте питающие клетки можно инактивировать с использованием радиации.
Культивирование будет осуществляться при условиях, которые поддерживают клетки в недифференцированном, плюрипотентном состоянии, в течение продолжительных периодов времени, теоретически бесконечно. В одном варианте осуществления настоящего изобретения ооциты партеногенетически активируют с использованием кальциевых ионофоров при высоком парциальном давлении О2 с последующим контактированием ооцитов с ингибитором сериновой треонин-киназы при низком парциальном давлении О2. Полученную из партеногенетически активированных ооцитов ICM культивируют при высоком парциальном давлении О2, когда клетки, например, поддерживают с использованием газовой смеси с содержанием 20% О2. В одном аспекте «культивируемый» относится к способному или подходящему для культивирования. В родственном аспекте выделение ICM осуществляют механическим путем, после четырех дней культивирования бластоцисты, при осуществлении культивирования на питающих клетках. Указанное культивирование, например, устраняет необходимость использования материалов, полученных из источников животного происхождения, как это имеет место в случае иммунохирургии.
В родственном аспекте в культуральные среды для ICM добавляют сыворотки неживотного происхождения, включая, без ограничения, сыворотку человеческого пупочного канатика, когда сыворотка присутствует в определенных средах (например, IVF от MediCult A/S, Дания; Vitrolife, Швеция, или Zander IVF, Inc., Vero Beach, Fl). В другом аспекте среды и процессы в том виде, в котором они предоставляются, не содержат продуктов животного происхождения. В родственном аспекте продукты животного происхождения представляют собой продукты, включая сыворотку, интерфероны, хемокины, цитокины, гормоны и факторы роста, которые получены из источников, не относящихся к человеку.
Плюрипотентное состояние клеток, полученных с использованием настоящего изобретения, можно подтверждать различными способами. Например, клетки можно тестировать на присутствие или отсутствие характерных маркеров ES клеток. В случае человеческих ES клеток примеры указанных маркеров идентифицированы выше и включают SSEA-4, SSEA-3, TRA-1-60, TRA-1-81 и ОСТ4 и известны в уровне техники.
Также плюрипотентность можно подтвердить инъецированием клеток подходящему животному, например мыши SCID, и наблюдением за продукцией дифференцированных клеток и тканей. Еще одним способом подтверждения плюрипотентности является использование плюрипотентных клеток субъекта для генерации химерных животных и наблюдение вклада внедренных клеток в различные клеточные типы. Способы получения химерных животных хорошо известны в уровне техники и описаны в патенте США № 6642433.
Еще одним способом подтверждения плюрипотентности является наблюдение дифференцировки ES клеток в эмбриоидных тельцах и других дифференцированных клеточных типах при культивировании в условиях, которые способствуют дифференцировке (например, удаление питающих слоев фибробластов). Указанный способ использовался, и было подтверждено, что плюрипотентные клетки субъекта дали начало эмбриоидным тельцам и различным дифференцированным клеточным типам в культуре ткани.
Полученные плюрипотентные клетки и линии клеток, предпочтительно человеческие плюрипотентные клетки и линии клеток, которые получены из ДНК полностью женского происхождения, применяют для множества терапевтических и диагностических целей. Указанные плюрипотентные клетки можно использовать для лечения трансплантацией клеток или для генной терапии (при условии генетического модифицирования) для лечения многочисленных болезненных состояний.
В этом отношении известно, что мышиные эмбриональные стволовые (ES) клетки способны дифференцироваться почти в любой клеточный тип. Следовательно, человеческие плюрипотентные (ES) клетки, полученные в соответствии с настоящим изобретением, обладают аналогичной способностью к дифференцировке. Плюрипотентные клетки по настоящему изобретению будут индуцироваться для дифференцировки, чтобы получать желательные клеточные типы, в соответствии с известными способами. Например, человеческие ES клетки, полученные в соответствии с настоящим изобретением, можно индуцировать для дифференцировки, чтобы получить гемопоэтические стволовые клетки, мышечные клетки, клетки сердечной мышцы, клетки печени, клетки панкреатических островков, клетки сетчатки, хрящевые клетки, эпителиальные клетки, клетки мочевыводящих путей и т.п. путем культивирования указанных клеток в среде для дифференцировки и при условиях, которые обеспечивают дифференцировку клеток. Среды и способы, которые обеспечивают дифференцировку ES клеток, известны в уровне техники как подходящие условия культивирования.
Например, Palacios et al., Proc. Natl. Acad. Sci. USA, 92:7530-7537 (1995) описывают получение гемопоэтических стволовых клеток из эмбриональной линии клеток с использованием в отношении стволовых клеток процедуры индукции, включающей первоначальное культивирование агрегатов указанных клеток в суспензионной культуральной среде, не содержащей ретиноевой кислоты, с последующим культивированием в той же среде, содержащей ретиноевую кислоту, с последующим переносом клеточных агрегатов на субстрат, который предусматривает прикрепление клеток.
Кроме того, Pedersen, J. Reprod. Fertil. Dev., 6:543-552 (1994) представляют обзорную статью, которая ссылается на многочисленные статьи, описывающие способы in vitro дифференцировки эмбриональных стволовых клеток для получения различных дифференцированных клеточных типов, включая, среди прочих, гемопоэтические клетки, мышечные клетки, клетки сердечной мышцы, нервные клетки.
Кроме того, Bain et al., Dev. Biol., 168:342-357 (1995) описывают in vitro дифференцировку эмбриональных стволовых клеток для получения нервных клеток, которые обладают свойствами нейронов. Указанные ссылки являются примерами описанных в литературе способов получения дифференцированных клеток из эмбриональных или стволовых клеток. Так, используя известные способы и культуральную среду, специалист может культивировать ES клетки, являющиеся предметом настоящего обсуждения, включая полученные методами генной инженерии или трансгенные ES клетки, для получения желаемых дифференцированных клеточных типов, например, нервных клеток, мышечных клеток, гемопоэтических клеток и т.п. Плюрипотентные клетки, полученные способами, описанными в настоящем документе, можно использовать для получения любого желаемого дифференцированного клеточного типа.
Например, гомозиготность по главному комплексу гистосовместимости (МНС) линии hpSC-Hhom может являться уникально подходящей для терапевтического применения. При должном отборе доноров ооцитов по их HLA-гаплотипу и HLA-гаплотипу биологических родителей донора и при использовании одобренных FDA протоколов возможно создание банка линий клеток, чьи тканевые производные коллективно могли бы быть МНС-совместимыми со значительным числом индивидуумов. Было высказано предположение о том, что панель всего лишь из десяти HLA-гомозиготных человеческих эмбриональных линий стволовых клеток, отобранных по распространенным типам, может обеспечить полную совместимость по HLA-A, HLA-B и HLA-DR для 37,7% реципиентов в Соединенном Королевстве и благоприятную совместимость для 67,4% (Taylor C.J. et al., Lancet (2005) 366(9502):2019-2025). Использование расчетов на популяции США предполагает, что существует около 200 распространенных гаплотипов на расовую группу (Mori M. Et al., Transplantation (1997) 64:1017-1027). Линия hpSC-Hhom-4 несет наиболее распространенный гаплотип, потенциально обеспечивающий МНС-совместимость почти для 5% индивидуумов в популяции. Так, линии hpSC-Hhom идеально подходят для создания репозитория дифференцированных клеток и тканей, HLA-совместимых для популяции, который мог бы быть доступным для немедленного клинического применения. Возможна озабоченность, касающаяся гемопоэтических производных, которые потенциально могут способствовать болезни «трансплантат против хозяина» (Billingham, R.E., Harv. Led. (1966) 62:21-78) у гетерозиготного реципиента; в данном случае специфичные для пациента партеногенетические стволовые клетки могут решить проблему.
Виды терапевтического применения дифференцированных человеческих клеток являются беспримерными. Например, человеческие гемопоэтические стволовые клетки можно использовать для медицинского лечения, требующего трансплантации костного мозга. Указанные процедуры используются для лечения многих заболеваний, например злокачественных опухолей на поздних стадиях, таких как рак яичника и лейкоз, а также заболеваний, которые компрометируют иммунную систему, таких как СПИД. Гемопоэтические стволовые клетки можно получить, например, внедрением мужской или женской ДНК, полученной от пациента мужского или женского пола, имеющего злокачественную опухоль или СПИД, в энуклеированный ооцит, получением плюрипотентных клеток, как описано выше, и культивированием указанных клеток при условиях, которые благоприятствуют дифференцировке, вплоть до получения гемопоэтических стволовых клеток. Указанные гемопоэтические клетки можно использовать для лечения заболеваний, включая злокачественную опухоль и СПИД.
Альтернативно, плюрипотентные клетки субъекта можно использовать для лечения пациента, страдающего неврологическим нарушением, путем культивирования указанных клеток при условиях дифференцировки, которые обеспечивают возникновение линий нервных клеток. Конкретные заболевания, которые можно лечить трансплантацией указанных человеческих нервных клеток, включают, среди прочих, например, болезнь Паркинсона, болезнь Альцгеймера, ALS и церебральный паралич. В конкретном случае болезни Паркинсона было показано, что трансплантированные фетальные нервные клетки головного мозга образуют должные соединения с окружающими клетками и вырабатывают дофамин. Результатом этого может являться долгосрочное обратное развитие симптомов болезни Паркинсона. В родственном аспекте предшественников нервных клеток можно использовать для реанимации серьезно поврежденных нервных волокон, чтобы восстановить движения после повреждения рук, ног и спинного мозга.
Одной целью настоящего изобретения является создание практически неограниченного источника плюрипотентных человеческих клеток, которые можно использовать для получения дифференцированных клеток, пригодных для аутологичной трансплантации донору ооцитов или аллогеннной трансплантации HLA-совместимым реципиентам. Эмбриональные стволовые клетки человека и их дифференцированные потомки, полученные из бластоцистов, остающихся после лечения бесплодия, или созданные с использованием NT, будут, вероятно, отторгаться иммунной системой реципиента, если их использовали для терапии аллогенной трансплантацией клеток. Полученные партеногенетическим путем стволовые клетки будут давать дифференцированные клетки, которые могут облегчить значительную проблему, связанную с существующими в настоящее время способами трансплантации, т.е. отторжение трансплантированной ткани, которое может наблюдаться в результате реакции «хозяин против трансплантата» или реакции «трансплантат против хозяина» относительно донора ооцитов. Обычно отторжение предотвращают или уменьшают введением лекарственных средств против отторжения, таких как циклоспорин. Однако указанные лекарственные средства имеют значительные неблагоприятные побочные эффекты, например иммуносупрессию, канцерогенные свойства, а также очень высокую стоимость. Клетки, полученные описанными в настоящем документе способами, должны будут устранять в некоторых случаях и, по меньшей мере, уменьшать в других случаях потребность в лекарственных средствах против отторжения относительно донора ооцитов.
Другой целью настоящего изобретения является создание практически неограниченного источника плюрипотентных человеческих клеток, которые можно использовать для получения дифференцированных клеток, пригодных для аллогенной трансплантации членам семьи донора ооцитов (например, братьям или сестрам). Клетки будут иммунологически и генетически сходными с клетками прямых членов семьи донора ооцитов и, таким образом, с меньшей вероятностью будут отторгаться членами семьи донора.
Другой целью указанного способа является то, что партеногенетическая активация ооцитов млекопитающих представляет собой относительно простую процедуру по сравнению с SCNT и приводит к созданию стволовых клеток при меньшем количестве манипуляций с клетками.
Партеногенетическая активация ооцитов млекопитающих, как было показано, является более эффективной для создания стволовых клеток, чем способы, требующие механических манипуляций с ооцитами (например, SCNT).
Недостатком SCNT является то, что субъекты с дефицитом активности митохондриальной дыхательной цепи представляют фенотипы с разительным сходством с видами патологии, с которыми обычно встречаются у плодов и потомков после SCNT (Hiendleder et al., Repro. Fertil. Dev. (2005) 17(1-2):69-83). Обычно клетки содержат только один тип митохондриальной ДНК (мтДНК), что называется гомоплазмией, однако гетероплазмия все же существует, обычно в виде комбинации молекул мутантной мтДНК и мтДНК дикого типа, или образует комбинацию вариантов дикого типа (Spikings et al., Hum. Repro. Update (2006) 12(4):401-415). Гетероплазмия может приводить к митохондриальному заболеванию; существуют различные механизмы, гарантирующие только материнскую передачу. Однако с возрастанием использования протоколов, которые обходят нормальные механизмы поддержания гомоплазмии (например, цитоплазматический перенос (СТ) и SCNT), нарушенная митохондриальная функция может иметь место в стволовых клетках, полученных из указанных источников.
В одном аспекте, поскольку партеноты имеют одного родителя, вероятность гетероплазмии сведена к минимуму.
Другие заболевания и состояния, которые можно лечить с использованием клеточной терапии, включают, например, повреждения спинного мозга, рассеянный склероз, мышечную дистрофию, диабет, заболевания печени, включая острые заболевания (вирусный гепатит, передозировки лекарственных средств (ацетаминофена) и другие), хронические заболевания (хронический гепатит и другие (обычно приводящие к циррозу), наследственные дефекты печени (гемофилия В, дефицит IX фактора, дефекты метаболизма билирубина, дефекты цикла мочевины, болезнь лизосомального накопления, дефицит а1-антитрипсина и другие), заболевания сердца, замещение хряща, ожоги, язвы стопы, желудочно-кишечные заболевания, сосудистые заболевания, заболевание почек, заболевание сетчатки, заболевание мочевыводящих путей и заболевания и состояния, связанные со старением.
Указанную методологию можно использовать для замещения дефектных генов, например дефектных генов иммунной системы, генов муковисцидоза, или для внедрения генов, которое приводит к экспрессии терапевтически благоприятных белков, таких как факторы роста, лимфокины, цитокины, ферменты и т.п.
Например, ген, кодирующий полученный из головного мозга фактор роста, можно внедрять в человеческие плюрипотентные клетки, полученные в соответствии с настоящим изобретением, клетки, дифференцировавшиеся в нервные клетки, и клетки, трансплантированные пациенту с болезнью Паркинсона, для замедления утраты нервных клеток в ходе указанного заболевания.
Также плюрипотентные человеческие ES клетки субъекта можно использовать в качестве in vitro модели дифференцировки, в частности, для изучения генов, которые вовлечены в клинические и биологические исследования. Указанные исследования включают, без ограничения, регуляцию раннего развития, регенеративную медицину или разработку лекарственных средств. Например, инсерцию генов-репортеров (например, зеленого флюоресцентного белка (gfp), люциферазы и т.п.), которые транскрибируются вместе с генами, представляющими интерес, можно использовать для изучения заболевания, биологии развития, регенеративной медицины или разработки лекарственных средств. Также дифференцированные клетки, ткани и органы, полученные с использованием ES клеток субъекта, можно использовать для изучения лекарственных средств.
Помимо этого ES клетки субъекта или полученные из них дифференцированные клетки можно использовать в качестве доноров ядер для получения других ES клеток и клеточных колоний.
Помимо этого плюрипотентные клетки, полученные в соответствии с настоящим описанием, можно использовать для идентификации белков и генов, которые участвуют в эмбриогенезе. Это можно осуществить, например, посредством дифференциальной экспрессии, т.е. сравнением мРНК, которые экспрессируются в плюрипотентных клетках, полученных в соответствии с настоящим изобретением, с мРНК, которые экспрессируются по мере дифференцировки указанных клеток в различные клеточные типы, например нервные клетки, кардиомиоциты, другие мышечные клетки, клетки кожи и т.п. Таким образом, возможно определить, какие гены вовлечены в дифференцировку конкретных клеточных типов.
Помимо этого ES клетки и/или их дифференцировавшиеся потомки, которые имеют конкретные генетические дефекты, такие как генетический дефект, приводящий к мышечной атрофии Дюшена, можно использовать в качестве моделей для изучения конкретного заболевания, связанного с генетическим дефектом.
Также еще одной целью настоящего описания является воздействие на плюрипотентные линии клеток, полученные в соответствии с описанными способами, смесей из различных факторов роста, при различных концентрациях и при различных условиях культивирования клеток, таких как культивирование на различных клеточных матриксах или при различных величинах парциального давления газов, чтобы идентифицировать условия, которые индуцируют продукцию и пролиферацию желаемых дифференцированных клеточных типов.
Следующие примеры предназначены для иллюстрации, но не для ограничения изобретения.
ПРИМЕРЫ
Получение партеногенетических эмбриональных стволовых клеток человека
Материалы и методы
Отбор доноров и процесс получения согласия доноров, основанного на полученной информации
Доноров набирали из группы женщин, которые впервые обращались в центр IVF и были признаны подходящими для процедуры IVF в соответствии с клиническими требованиями.
К каждому потенциальному донору обращался ее лечащий врач и информировал и консультировал по вопросам, касающимся исследования. Если донор принимала решение об участии, ей представляли корректный документ осогласии, основанном на полученной информации (изученный и одобренный независимым комитетом US-based ESCRO Committee), написанный на русском языке, в котором обрисовывались цели и процедуры исследования. Если у потенциального донора имелись вопросы, врач был в его распоряжении. Только потенциальные доноры, которые подписалисогласие, основанное на полученной информации, участвовали в исследовании.
Доноры предоставляли донорские ооциты добровольно и безвозмездно. В подписанном согласии, основанном на полученной информации, говорилось, что весь донорский материал предназначался для исследований, а не для репродуктивных целей, а именно для разработки способов получения человеческих ES клеток и их дифференцированных потомков.
Пригодность для исследований определяли в соответствии с правилами FDA по определению пригодности доноров человеческих клеток, тканей и продуктов на основе клеток и тканей (FDA HCT/Ps, 2004), а также в соответствии с приказом № 67 (02.26.2003) Министерства Здравоохранения Российской Федерации. Это включало тщательное медицинское обследование с рентгенографией грудной клетки, анализами крови (включая анализ функции печени) и мочи. Скрининг осуществляли также на Chlamydia trachomatis, Neisseria gonorrhoeae, сифилис, ВИЧ, HBV и HCV.
Потенциальных доноров и их родителей далее отбирали для участия в исследовании согласно типу HLA.
В указанном протоколе приоритетом для сбора ооцитов являлась успешная процедура IVF. Самые лучшие, полностью развившиеся клеточно-ооцитарные комплексы отбирали для IVF. Если общее количество собранных ооцитов составляло менее 11, женщину автоматически исключали из доноров для целей исследования.
Суперовуляция у доноров
Каждому донору проводили стимуляцию яичников с использованием FSH (Gonal-F, Lab. Serono, Швейцария) в промежуток от 3-го до 13-го дня менструального цикла. Всего вводили 1500 МЕ. С 10-го по 14-й день менструального цикла донора инъецировали антагонист гонадолиберина Orgalutran (Organon, Голландия) в дозе 0,25 мг в день. С 12-го по 14-й день менструального цикла донора ежедневно инъецировали 75 МЕ FSH + 75 МЕ LH (Menopur, Ferring GmbH, Германия). Если ультразвуковое исследование выявляло фолликулы диаметром от 18 до 20 мм, вводили однократную дозу 8000 МЕ hCG (Choragon, Ferring GmbH, Германия) на 14-й день менструального цикла донора. Трансвагинальную пункцию осуществляли через 35 часов после инъекции hCG, приблизительно на 16-й день. Под общим наркозом у доноров в стерильные пробирки собирали фолликулярную жидкость из антральных фолликулов аспирацией с использованием иглы под контролем ультразвука.
Активация ооцитов и культивирование партеногенетических эмбрионов
Клеточно-ооцитарные комплексы (СОС) извлекали из фолликулярной жидкости, промывали в среде для промывания (MediCult), а затем инкубировали в универсальной среде для IVF (MediCult) с покрывающим слоем из вазелинового масла (MediCult) в течение двух часов в увлажненной атмосфере с содержанием 20% О2, 5% СО2 при 37°С. Перед активацией СОС обрабатывали гиадазой Syn Vitro (MediCult) для удаления кумулятивных клеток с последующей инкубацией в универсальной среде для IVF с покрывающим слоем из вазелинового масла в течение 30 минут. Дальнейшее культивирование ооцитов и эмбрионов осуществляли в увлажненной атмосфере при 37°С в газовой смеси с пониженным содержанием О2 (90% N2 + 5% O2 + 5% СО2), за исключением обработки А23187, которую осуществляли при условиях, описанных для культуры СОС. Активацию осуществляли в универсальной среде для IVF с покрывающим слоем из вазелинового масла путем последовательного воздействия на ооциты 5 мкМ А23187 (Sigma) в течение пяти минут и 10 мкг/мл пуромицина (Sigma) или 1 мМ 6-DMAP (Sigma) в течение четырех часов с последующим тщательным промыванием ооцитов в универсальной среде для IVF. Ооциты затем помещали в свежую среду для IVF с покрывающим слоем из вазелинового масла для последующего культивирования. На следующий день (день 1) партеногенетически активированные ооциты культивировали до стадии бластоцисты с использованием последовательных сред BlastAssist System (MediCult) согласно рекомендациям производителя. Из полученных бластоцистов выделяли внутреннюю клеточную массу (ICM) на пятый-шестой день культивирования.
Выделение внутренней клеточной массы бластоцисты и культивирование hpSC-Hhom
Zona pellucida удаляли обработкой 0,5% проназой (Sigma). Цельные бластоцисты помещали на питающий слой человеческих неонатальных фибробластов (NSF), митотически инактивированных митомицином С (Revazova et al., 2007, выше), в среду, разработанную для культивирования hpSC-Hhom. Когда клетки трофобласта распределяли по поверхности после прикрепления бластоцисты, ICM становится видимой. После трех-четырех дней дополнительного культивирования ICM выделяли механическими срезами ICM из выроста трофобласта с использованием тонко вытянутой стеклянной пипетки. Выделенную ICM помещали на свежий питательный слой и культивировали в течение дополнительных трех-четырех дней. Первую колонию механически срезали и повторно помещали на среду после пяти дней культивирования. Все последующие пассажи осуществляли после пяти-шести дней культивирования. Колонии ранних пассажей механически разделяли на отдельные скопления клеток и повторно помещали на среды. Затем осуществляли пассажи hpSC-Hhom с использованием обработки коллагеназой IV и механической диссоциации. Размножение hpSC-Hhom осуществляли при 37°С, 5% СО2 в увлажненной атмосфере.
Для культивирования ICM и hpSC-Hhom заявители использовали VitroHES (Vitrolife) с добавлением 4 нг/мл hrbFGF (Chemicon), 5 нг/мл hrLIF (Chemicon) и 10% сыворотки крови человеческого пупочного канатика. Среда для культивирования NSF состояла из 90% DMEM (высокое содержание глюкозы, с L-глутамином) (Invitrogen), 10% сыворотки крови человеческого пупочного канатика и пенициллина-стрептомицина (100 ЕД/100 мкг) (Invitrogen). Перед изготовлением среды сыворотки крови человеческого пупочного канатика подвергали скринингу на предмет сифилиса, ВИЧ, HBV и HCV.
Определение характеристик hpSC-Hhom
Для окрашивания на маркеры эмбриональных стволовых клеток с использованием иммунной метки колонии hpSC-Hhom фиксировали при комнатной температуре в течение 20 минут с использованием 4% параформальдегида для идентификации SSEA-1, SSEA-3 и SSEA-4; 100% метанол использовали в течение пяти минут при минус 20°С для идентификации остающихся маркеров. Использованные моноклональные антитела включали: SSEA-1 (МАВ4301), SSEA-3 (МАВ4303), SSEA-4 (МАВ4304), TRA-1-60 (МАВ4360) и TRA-1-81 (МАВ4381) от Chemicon, а также OCT-4 (sc-9081) от Santa Cruz Biotechnology; вторичные антитела включали Alexa Fluor 546 (оранжевый флюоресцентный) и 488 (зеленый флюоресцентный) от Molecular Probes (Invitrogen). Ядра окрашивали DAPI (Sigma). Активность щелочной фосфатазы и теломеразы определяли с использованием набора АР и набора TRAPEZE (Chemicon). Срезы хромосом изготавливали обычным способом. Кариотипирование по Гимза-диску осуществляли согласно методике трипсин-Гимза и 30-100 метафаз кариотипировали в каждом случае.
Образование эмбриоидных телец и нейральная дифференцировка
Колонии hpSC-Hhom механически разделяли на отдельные скопления клеток и повторно помещали на 24-ячеечные кластерные чашки, предварительно покрытые 2% агарозой (Sigma), в среду, содержащую 85% нокаутной DMEM, 15% сыворотки крови человеческого пупочного канатика, 1xMEM NEAA, 1 мМ Glutamax, 0,055 мМ Р-меркаптоэтанола, пенициллин-стрептомицин (50 ЕД/59 мкг) (все от Invitrogen, за исключением сыворотки). Эмбриоидные тельца культивировали в суспензии в течение 14 дней с последующим засевом на чашки для развития выроста или дополнительным культивированием в суспензии в течение одной недели.
Нейральную дифференцировку индуцировали культивированием двухнедельных эмбриоидных телец, прикрепленных к поверхности культуральной чашки, в течение одной недели в среде для дифференцировки DMEM/F2, B27, 2 мМ Glutamax, пенициллин-стрептомицин (100 ЕД/100 мкг) и 20 нг/мл hrbFGF (все от Invitrogen). Все эмбриоидные тельца дали начало дифференцированным клеткам с нейральной морфологией, другие рассекали и дополнительно культивировали для получения нейросфер.
Пульсирующие эмбриоидные тельца появлялись спонтанно через пять дней культивирования после помещения на адгезивную поверхность в ту же среду, которая использовалась для генерации эмбриоидных телец.
Иммуногистохимия дифференцированных производных hpSC-Hhom
Эмбриоидные тельца, нейросферы или сокращающиеся эмбриоидные тельца помещали на микропокровные стекла (VWR Scientific Inc.) с покрытием из поли-D-лизина (Sigma) и культивировали в течение приблизительно одной недели в подходящей для дифференцировки среде. Для иммунного окрашивания дифференцированные клетки фиксировали 100% метанолом в течение пяти минут при минус 20°С.
Для выявления эктодермальных маркеров заявители использовали моноклональное мышиное антитело против нейрофиламента 68 (Sigma), античеловеческое CD56 (NCAM) антитело (Chemicon) и антитело против тубулина бета III (Chemicon) для выявления нейрональных маркеров. Антитело (Chemicon) против глиального фибриллярного кислотного белка (GFAP) использовали для выявления маркера глиальных клеток.
Для выявления мезодермальных маркеров в трехнедельных эмбриоидных тельцах или сокращающихся эмбриоидных тельцах использовали моноклональное мышиное антитело против десмина (Chemicon), антитело против человеческого альфа-актинина (Chemicon) в качестве специфичных в отношении мышц маркеров, а антитело против человеческого CD31/PECAM-1 (R&D Systems) и антитело против человеческого VE-кадаверина (CD 144) (R&D Systems) использовали в качестве эндотелиальных маркеров.
Для выявления эндодермальных маркеров в эмбриоидных тельцах использовали моноклональное мышиное антитело против человеческого альфа-фетопротеина (R&D Systems). Вторичные антитела Alexa Fluor 546 (оранжевый флюоресцентный) и 488 (зеленый флюоресцентный) получали от Molecular Probes (Invitrogen). Ядра окрашивали DAPI (Sigma). NLA генотипировано.
Изучение HLA-гаплотипов и HLA-генотипирование осуществляли у доноров и их родителей. Геномную ДНК экстрагировали из крови, кумулятивных клеток, hpSC-Hhom и NSF с использованием Dynabeads DNA Direct Blood от Dynal (Invitrogen). HLA-генотипирование осуществляли с использованием ПЦР с аллель-специфичным секвенирующим праймером (PCR-SSP, Protrans). Все тесты выполняли в соответствии с инструкциями производителя.
Асимметричный анализ микроряда SNP
Геномную ДНК выделяли из крови, кумулятивных клеток, hpSC-Hhom и NSF с использованием метода экстракции фенол/хлороформом. Образцы ДНК, полученные от трех доноров, четыре линии hpSC-Hhom и NSF генотипировали с использованием Affymetrix Mapping 250K Nsp Arrays. Поскольку исходный ряд данных, содержащий 252973 маркеров бинарных SNP, превышал количество, необходимое для определения эквивалентности геномных образцов, его уменьшали для упрощения расчетов.
Следующие критерии использовали для отбора маркеров на основе генетических рассуждений: 1) чем выше степень гетерозиготности в маркерах, тем больше информации они предоставляют для идентификации происхождения образцов SNP. Гетерозиготность маркеров бинарных SNP кэппируется при максимуме 0,5. Выбирали только маркеры SNP с гетерозиготностью, превышающей 0,375 (т.е. не аллели, имеющие частоту менее 0,25 или более 0,75 в популяции белой расы); 2) использовали все 22 аутосомные хромосомы; 3) маркеры с низкой надежностью удаляли, поскольку идентификация образцов на общее происхождение является очень чувствительной к ошибкам генотипирования. В наборе данных Affymetrix высокие балльные оценки доверительности соответствуют низкой надежности, поэтому маркеры с высокими балльными оценками доверительности удаляли. При стандартной настройке не устанавливали запрос маркера, если его балльная оценка доверительности превышала 0,25. Еще более строгие требования предъявляли к надежности путем использования только тех маркеров, которые имели балльные оценки доверительности менее или равные 0,02 для всех 12 образцов.
С использованием указанных критериев количество маркеров SNP было сокращено с 252973 до 4444. Один финальный этап был предпринят для уменьшения количества маркеров (случайный отбор образцов не проводили) путем отбора только тех из них, у которых дистанции между маркерами составляли по меньшей мере 0,1 сМ (1 Mbp = 1 cM), поскольку маркеры, располагающиеся очень близко друг к другу, предоставляют меньше информации благодаря наличию тесной связи между ними. Указанные этапы привели к конечному отбору 3993 маркеров.
3993 маркеров, отобранные таким образом, анализировали с использованием Relcheck (версия 0,67, копирайт (С) 2000 Karl W. Broman, Johns Hopkins University, лицензировано как General Public License version 2 (июнь 1991 г.)). Relcheck обеспечивает способ определения взаимоотношений между парой образцов SNP. Это основано на вычислении отношения правдоподобия при наблюдении данной конфигурации маркеров в соответствии с генетическими взаимоотношениями образцов. Использование Relcheck основано на знании того факта, что, поскольку монозиготные близнецы имеют одну и ту же ДНК, тест на эквивалентность между двумя образцами можно осуществлять с помощью проверки, могут ли указанные образцы происходить от монозиготных близнецов. Relcheck осуществляли при допущении, что коэффициенты ошибок генотипирования составляют приблизительно 0,4%. Программа Relcheck идентифицирует пять типов взаимоотношений: монозиготные близнецы, пара родитель/потомок, родные братья или сестры (полные сибсы), единокровные или единоутробные братья или сестры (полусибсы) и неродственники (Boehnke M. еt al., Am. J. Hum. Genet. (1997) 61:423-429; Broman K.W. et al., Am. J. Hum. Genet. (1998) 63:1563-1563).
Для того чтобы определить долю гетерозиготных SNP в 15 хромосомах для донора и образцов стволовых клеток, использовали 1495 случайно отобранных маркеров SNP, использовавшиеся для более раннего анализа, анализировали по 6 стволовым клеточным линиям, 4 донорам и 1 контрольному образцу.
Расположение центромеры для каждой хромосомы определяли взятием средней точки между последним доступным р-маркером (короткое плечо) и первым доступным q-маркером (длинное плечо) для каждой из хромосом 1-12. Для акроцентрических хромосом 13-15 не существовало маркеров SNP на р-плече, поэтому центромеру считали располагающейся на позиции 0 (начало q-плеча).
Следующие величины использовали в качестве позиции центромер для chr 1-15 (в Mbp от конца р-плеча):
Для каждого маркера SNP рассчитывали абсолютную дистанцию от центромеры на конкретной хромосоме (т.е. оба направления от центромеры обрабатывали эквивалентно при переводе всех «отрицательных» дистанций в положительные дистанции). Для целей вычисления доли гетерозигот дистанции хромосом (от центромер) разделяли на 15 интервалов (называемые «отсеками» на выходе). Каждый интервал состоял из 10 Mbp в длину. Номер, присваиваемый каждому «отсеку», соответствовал верхней границе на дистанции хромосомы для данного интервала. Все единицы выражали в мега пар оснований (Mbp):
Например:
Отсеки=10 соответствуют интервалу [0,10] Mbp от центромер.
Отсеки=70 соответствуют интервалу [60,70] Mbp от центромер.
Отсеки=150 соответствуют интервалу [140,150] Mbp от центромер.
Дистанции в парах оснований, предоставленные в наборе данных по SNP Affymetrix, использовали для поддержания соответствия с предыдущим анализом данных. Для каждого интервала долю гетерозиготности оценивали с использованием средней величины индикаторных переменных для гетерозиготности для всех SNP в пределах интервала.
Для донора и стволовых клеток переменная гетерозиготности хранит в себе среднюю величину индикаторных переменных для гетерозиготности на каждом расположении маркера SNP для донора (2, 12, 10, 11) и образцов стволовых клеток (3, 4, 5, 9, 6, 7, 8). Соответствующие величины для долей гетерозиготности можно легко получить вычитанием величин гетерозиготности из 1.
Внутренние контроли корректно идентифицировали парное генотипическое взаимоотношение между расщепленными культурами, полученными из одной и той же линии hpSC-Hhom, как «монозиготные близнецы».
Анализ импринтинговых генов
Общую РНК экстрагировали, как описано (Chomcznski и Sacchi, Anal. Biochem. (1987) 162:156-159), и осаждали изопропанолом. Оставшуюся геномную ДНК удаляли с использованием обработки РНКазой без ДНКазы (Promega). кДНК синтезировали из 1 мкг общей РНК с использованием обратной транскриптазы RevertAid M-Mul V (Fermentas) в 20 мкл объема реакции. Реакции ПЦР осуществляли с 1 мкл кДНК с использованием Taq ДНК-полимеразы (Fermentas). Все реакции проводили в соответствии с инструкциями производителя.
Последовательность праймеров и условия ПЦР были следующие: TSSC5 (Lee et al., Cancer Res. (1998) 58:4155-4159) форвард-праймер 5'-GCTCTTCATGGTCATGTTCTCCA-3' (SEQ ID NO:1) и реверсивный праймер 5'-GGAGCAGTGGTTGTACAGAGG-3' (SEQ ID NO:2), при условиях 94°С в течение 4 мин в количестве 1 цикла; 94°С в течение 1 мин, 55°С в течение 1 мин и 72°С в течение 1 мин в количестве 33 циклов. Размер продукта составлял 364 bp. H19 (Hashimoto et al., Nat. Genet. (1995) 9:109-110) форвард-праймер 5'-TACAACACTGCACTACCTG-3' (SEQ ID NO:3) и реверсивный праймер 5'-TGGCCATGAAGATGGAGTCG-3' (SEQ ID NO:4), при условиях 94°С в течение 4 мин в количестве 1 цикла; 94°С в течение 1 мин, 52°С в течение 1 мин и 72°С в течение 1 мин в количестве 38 циклов. Размер продукта составлял 148 bp. PEG_1 (Li et al., J. Biol. Chem. (2002) 277:13518-13527) форвард-праймер 5'-GAG TCC TGT AGG CAA GGT CTT ACC T-3' (SEQ ID NO:5) и реверсивный праймер 5'-CTT GCC TGA AGA CTT CCA TGA GTG A-3' (SEQ ID NO:6), при условиях 94°С в течение 4 мин в количестве 1 цикла; 94°С в течение 1 мин, 55°С в течение 1 мин и 72°С в течение 1 мин в количестве 35 циклов. Размер продукта составлял 155 bp. PEG_2 (Li et al., выше) форвард-праймер 5'-GCT GCT GGC CAG CTC TGC ACG GCT G-3' (SEQ ID NO:7) и реверсивный праймер 5'-CTT GCC TGA AGA CTT CCA TGA GTG A-3' (SEQ ID NO:8), при условиях 94°С в течение 4 мин в количестве 1 цикла; 94°С в течение 1 мин, 65°С в течение 1 мин и 72°С в течение 1 мин в количестве 39 циклов. Размер продукта составлял 230 bp. SNRPN (Glenn et al., Hum. Mol. Genet.(1993) 2:2001-2005) форвард-праймер 5'-CTTAGCTGAGACACCAAGAGG (SEQ ID NO:9) и реверсивный праймер 5'-GCAGCATCTTGCTACTCTTGC-3' (SEQ ID NO:10), при условиях 94°С в течение 4 мин в количестве 1 цикла; 94°С в течение 1 мин, 55°С в течение 1 мин и 72°С в течение 1 мин в количестве 33 циклов. Размер продукта составлял 246 bp. GAPDH (Adjaye et al., Gene (1999) 237:373-383) форвард-праймер 5'-ACCACAGTCCATGCCATCAC (SEQ ID NO:11) и реверсивный праймер 5'-TCCACCACCCTGTTGCTGTA-3' (SEQ ID NO:12) при условиях 94°С в течение 4 мин в количестве 1 цикла; 94°С в течение 1 мин, 55°С в течение 1 мин и 72°С в течение 1 мин в количестве 21 цикла. Размер продукта составлял 450 bp.
Продукты ПЦР анализировали с использованием электрофореза в 5% полиакриламидном геле (5 мкл на линию), окрашивали бромидом этидия и документировали с использованием системы Biolmaging (UVP). Эксперименты ОТ-ПЦР осуществляли повторно с воспроизводимыми результатами. GAPDH служил повсюду экспрессируемым контролем. Геномную контаминацию исключали путем включения ОТ-отрицательного образца (без обратной транскриптазы на этапе обратной транскриптазы) в каждую серию ПЦР в качестве контроля.
Образование и оценка тератомы
Все процедуры на животных осуществлялись следующими учреждениям: Biological Testing Laboratory-Branch of Shemyakin и институтом биоорганической химии Российской Академии Наук Овчинникова (Пущино, Московская область, Россия), аккредитованными Association for the Assessment and Accreditation of Laboratory Animal Care International (AAALAC).
Мышей с иммунодефицитом SCID, которые были выведены от мышей CB17/ICR-PRKDC-SCID CRL, полученных от Charles River Laboratories Research Model and Services (Германия), использовали для наблюдения образования тератом. Для инъекции мышам hpSC-Hhom ферментативно отделяли от культуральных чашек с использованием коллагеназы типа IV, а затем ресуспендировали до образования скоплений клеток. Приблизительно от двух до пяти миллионов hpSC-Hhom клеток инъецировали подкожно в заднюю конечность. Приблизительно спустя два месяца образовавшиеся тератомы удаляли и фиксировали 4% параформальдегидом. Половину ткани подвергали криопротекции сахарозой, а другую половину заливали 5% агар-агаром, а затем производили 60 мкм срезы с использованием микротома. Срезы помещали на покровные стекла и окрашивали хематоксилин-эозином, по Kraberg, Van Gieson и пикрофусцином.
Приблизительно от двух до пяти миллионов человеческих фибробластов, обработанных митомицином С, использованных в качестве питающих слоев для phEC клеток, инъецировали в качестве контролей. У контрольных животных рост тератом не наблюдался.
Пример 1. Генерация партенотов
В данном исследовании участвовали пять доноров ооцитов - все старше 31 года. Ооциты получали с использованием гормональной стимуляции с главным намерением экстракорпорального оплодотворения (IVF). Всего 46 клеточно-ооцитарных комплексов (СОС) были отобраны от пяти доноров и использованы в данном исследовании (таблица 1).
Перед активацией ооцитов СОС содержали при атмосферном напряжении кислорода. После удаления кумулятивных клеток только нормальные ооциты в метафазе II с различимым первым полярным тельцем брали для процедуры активации. Ооциты активировали 5 мМ иономицином в течение пяти минут с последующей инкубацией с 6-DMAP в течение четырех часов для предотвращения выталкивания второго полярного тельца и продукции диплоидных эмбрионов. Манипуляции и культивирование ооцитов и эмбрионов осуществляли в среде Medical в соответствии с инструкциями производителя с использованием стандартных процедур IVF и при пониженном напряжении кислорода (90% N2 + 5% O2 +5% CO2). Только 40 ооцитов были способны расщепляться после партеногенетической активации. Указанные процедуры позволяли осуществить продукцию 23 бластоцист на пятый-шестой день культивирования эмбриона. Одиннадцать бластоцист имели видимые ICM (таблица 1).
Дифференцировка партеногенетических линий hESC
Очень важно минимизировать, если не устранить, компоненты животного происхождения при дифференцировке и культивировании hESC, предназначенных для клинического применения. Для данной цели некоторые исследователи используют для выделения ICM не иммунохирургию, а механические средства для выделения из цельных бластоцист (Kim et al., Stem Cells (2005) 23:1228-1233). Культуральные среды и питающие клетки также могут содержать животные патогены. Для устранения возможной контаминации исследователи использовали человеческие клетки в качестве питающего слоя вместо мышиных фибробластов (Cheng et al., Stem Cells (2003) 21:131-142; Hovatta et al., Hum. Repro. (2003) 18:1404-1429; Stojkovic et al., Stem Cells (2005) 23:306-314) или культивировали hESC в условиях отсутствия питающего слоя и сыворотки (Amit et al., 2004; Klimanskaya et al., Lancet (2005) 365:1636-1641). Принимая во внимание указанные предыдущие исследования, условия культивирования для выделения ICM и phESC были модифицированы.
Для дифференцировки и культивирования phESC в качестве питающих клеток использовали митотически инактивированные митомицином С человеческие неонатальные кожные фибробласты (NSF). Указанные клетки первоначально были получены и размножены с использованием среды, содержащей сыворотку крови человеческого пупочного канатика вместо сыворотки животного происхождения. Культуральная среда для phESC состояла из среды VitroHES (Vitrolife) с добавлением человеческой сыворотки, полученной из крови пупочного канатика, hrbFGF и hrLIF. phESC размножали при 37°С, 5%СО2, увлажненная атмосфера.
Все полученные партеногенетические бластоцисты сначала обрабатывали 0,5% проназой для удаления zona pellucida. Хорошо сформированные ICM из двух бластоцист получали от первого донора ооцитов с использованием обработки трипсином (Li et al., Mol. Reprod. Dev. (2003) 65:429-434) и традиционной иммунохирургии (Solter и Knowles, Proc. Natl. Acad. Sci. USA (1975) 72:5099-5102). ICM затем помещали на человеческие питающие клетки при описанных для получения phESC условиях. ICM из обработанной трипсином бластоцисты не давала живых клеток. ICM, полученная после иммунохирургии, демонстрировала разрастание клеток, в результате чего была создана линия клеток phESC-1. Остальные 21 бластоцисту сначала помещали на питающий слой при описанных условиях. ICM выделяли механическими срезами из разрастания клеток трофобласта и повторно помещали на свежие питающие клетки. Пять линий phESC (от phESC-3 до phESC-7) генерировали указанным способом (таблица 1).
Определение характеристик линий phESC
Линии phESC демонстрируют морфологию, которую ожидали от hESC и формируют колонии из плотно упакованных клеток, с заметными ядрышками и малым соотношением цитоплазмы и ядра (фигура 1). Указанные клетки экспрессируют традиционные маркеры hES клеток SSEA-3, SSEA-4 (фигура 1), TRA-1-60, TRA-1-81 и ОСТ-4 (фигура 1, продолжение) и не экспрессируют SSEA-1, положительный маркер для недифференцированных мышиных эмбриональных стволовых клеток (фигура 1). Клетки, полученные из всех линий, демонстрируют высокие уровни активности щелочной фосфатазы (фигура 1, продолжение) и теломеразы (фигура 2).
Кариотипирование по Гимза-диску показало, что линии phESC имеют нормальный человеческий 46,ХХ кариотип, за исключением линии phESC-7 (фигура 3). Приблизительно 91% клеток из линии phESC-7 имеют кариотип 47,ХХХ, а 9% клеток имеют кариотип 48,ХХХ,+6. Различная степень гетероморфизма Х-хромосомы наблюдалась при анализе 100 метафаз в клеточных линиях: приблизительно 12% клеток в линиях phESC-1 и phESC-6 показали гетероморфизм Х-хромосомы; 42% клеток в линии phESC-5 и 70%, 80% и 86% в линиях phESC-7, phESC-3 и phESC-4, соответственно, показали гетероморфизм Х-хромосомы (фигура 3).
Способность phESC к дифференцировке
Линия phESC-1 оставалась недифференцированной в течение 10 месяцев культивирования с 35 пассажами. Другие линии клеток успешно культивировали в течение по меньшей мере 21 пассажа. Клетки из всех линий phESC формировали цистные эмбриоидные тельца в суспензионной культуре и давали начало производным всех трех зародышевых слоев, эктодермы, мезодермы и эндодермы после дифференцировки in vitro (фигура 4). Приблизительно 5% эмбриоидных телец из линии phESC-1 давали начало пульсирующим клеткам через пять дней после посева. Линия phESC-6 продуцировала пигментированные эпителий-подобные клетки (фигура 4 L, K). Эктодермальная дифференцировка представлена положительным иммуноцитохимическим окрашиванием на нейрон-специфичные маркеры нейрофиламент 68 (фигура 4А), NCAM (фигура 4B), тубулин бета-III (фигура 4C) и маркер глиальных клеток GFAP (фигура 4D, M). Дифференцированные клетки были положительными по мезодермальным маркерам, включая альфа-актинин (фигура 4G) и десмин (фигура 4J), которые представляют собой маркеры, специфичные для мышц, и эндотелиальные маркеры РЕС АМ-1 (фигура 4Е) и VE-кадхерин (фигура 4F). Эндодермальная дифференцировка представлена положительным окрашиванием дифференцированных производных на альфа-фетопротеин (фигура 4H, L). Способность линий phESC образовывать производные всех трех зародышевых слоев изучали in vivo путем подкожной инъекции phESC мышам и крысам с иммунодефицитом (фигура 5). Клетки из всех линий phESC были способны образовывать тератомы приблизительно через два месяца после инъекции. Гистологическое исследование показало наличие организованных структур, включая: эпителии, капсулу, гладкую мускулатуру, жировую ткань, гематогенную ткань, невральную трубку и железистые эпителии. Иммуногистохимический анализ выявил положительное окрашивание на бета-тубулин (фигура 5С) - эктодермальный маркер; фибронектин (фигура 5В) и мышечный актин (фигура 5А) - мезодермальные маркеры; и альфа-фетопротеин (фигура 5D) - эндодермальный маркер. Указанные данные демонстрируют, что phESC могут дифференцироваться in vivo во все три зародышевые слои, которые приводят к образованию всех клеточных типов в теле человека.
Анализ профиля ДНК в линиях phESC
Осуществляли сравнительный анализ профиля ДНК во всех линиях phESC, соматических клетках донора и питающих клетках. В указанных исследованиях использовали анализмикрорядов полиморфизмов единственного нуклеотида (SNP) Affymetrix (Mapping 50K Hind 240 Arrays) для подтверждения генетического сходства phESC с соматическими клетками донора. Всего 1459 маркеров SNP вдоль 15 аутосом (хромосом 1-15) были выбраны со средней дистанцией между маркерами 1,12 Mbp. Все парные генотипические взаимоотношения между линиями phESC и соответствующими им соматическими клетками донора идентифицировали как «полные сибсы» (генетически совпавшие), а все остальные комбинации пар идентифицировали как «неродственники». Внутренние контроли идентифицировали парные генотипические взаимоотношения между разделенными культурами, полученными из одной и той же линии phESC, как «монозиготные близнецы (таблица 2).

Анализировавшиеся образцы ДНК были пронумерованы следующим образом: 1 - человеческие неонатальные кожные фибробласты, 2 - донор линии phESC-7, 3 - линия phESC-7, 4 - линия phESC-1, 5 - линия phESC-1, 6 - линия phESC-3, 7 - линия phESC-4, 8 - линия phESC-5, 9 - линия phESC-6, 10 - донор линии phESC-6, 11 - донор линий с phESC-3 по phESC-5, 12 - донор линии phESC-1.
Колонки IBS на выходе показывают количество маркеров, по которым типировали пары, и имеют общие 0, 1 или 2 аллеля, идентичные по состоянию. (Для МЗ близнецов при идеальных условиях отсутствия ошибок генотипирования все маркеры должны помещаться под IBS=2.) Выход не демонстрирует Р (наблюдающиеся маркеры I данные взаимоотношения) напрямую, но он показывает сумму баллов LOD = log10 {P(наблюдающиеся маркеры I предполагаемые взаимоотношения) / P(наблюдающиеся маркеры I взаимоотношения, для которых была получена максимальная вероятность и, таким образом, был сделан запрос)} в качестве меры сходства. Чем меньше сумма баллов LOD, тем менее вероятными являются предполагаемые взаимоотношения между двумя образцами.
Сравнительный анализ маркеров SNP показал, что в целом донорские клетки, как представляется, не демонстрируют четкий паттерн тенденции к гетерозиготности вдоль дистанций от центромер, в то время как стволовые клетки демонстрируют несколько более маленькие доли гетерозиготности вблизи центромер и теломер по сравнению с долями гетерозиготности в середине как результат возможной рекомбинации хромосом (таблицы A-I).
Хромосома = номер рассматриваемой хромосомы; Отсеки = конкретный интервал с номером, данным для верхней границы интервала в 10 Mbp от центромеры; Частота = количество маркеров SNP для каждой комбинации хромосомы и рассматриваемого интервала; Остальные колонки предназначены для доли гетерозиготности для каждой комбинации хромосомы и рассматриваемого интервала; хромосома=., отсеки=.
Строка: Общее резюме для всех 1459 маркеров в образце; хромосома=., отсеки=** Строки: резюме от интервала до интервала, суммировано вдоль всех хромосом; хромосома=**, отсеки=.
Строки: резюме от хромосомы до хромосомы, суммировано вдоль всех интервалов; хромосома=**, отсеки=**. Строки: резюме для каждой комбинации хромосомы и интервала.
Во всех 7 парах стволовые клетки демонстрировали более маленькие доли гетерозиготности, чем клетки соответствующих им доноров. В целом, донорские клетки, как представляется, не демонстрируют четкий паттерн тенденции к гетерозиготности вдоль дистанций от центромер, в то время как стволовые клетки демонстрируют несколько более маленькие доли гетерозиготности вблизи центромер и теломер по сравнению с долями гетерозиготности в середине.
На основе результатов HLA-типирования стволовые клетки, полученные из всех линий phESC, оказались МНС-совместимыми с донорами ооцитов, что делает это возможным способом для создания клеток для терапевтического применения (таблица 3). HLA-анализ генетического материала из человеческих фибробластов, которые использовались как питающие клетки, не выявил контаминации линий phESC материалом из человеческих фибробластов (таблица 3).
Анализ подвергшихся импринтингу генов
Изменения геномного импринтинга в человеческих эмбрионах могут вносить свой вклад в развитие расстройств, сцепленных с генами, экспрессируемыми в материнском или отцовском организме (Gabriel et al., Proc. Natl. Acad. Sci. USA (1998) 95:14857-14862). Исследования импринтинга в phESC требуют детального изучения в силу возможного влияния на дифференцировку phESC и функциональность их производных. В качестве предварительного исследования был осуществлен анализ экспрессии подвергшихся импринтингу генов человека (Morison et al., Trends Genet. (2005) 21:457-465) TSSC5, H19, PEG1 и SNRPN в недифференцированных phESC (фигура 6). Две линии hESC, полученные из ненужных эмбрионов для IVF, использовали в качестве контролей. Транскрипты экспрессированных материнским организмом генов TSSC5 (Morison et al., 2005, выше) и Н19 (Morison et al., 2005, выше) наблюдались во всех линиях phESC, а также в контрольных линиях. Человеческий ген PEG1 транскрибируется от двух альтернативных промоторов (Li et al., 2002, выше). Участок гена от первого промотора экспрессируется биаллельно, а участок гена от второго промотора (изоформа 1) экспрессируется патернально (Li et al., 2002, выше). Экспрессия гена PEG1 от первого промотора не подвергалась воздействию в линиях phESC. Анализ патернально экспрессируемого участка гена PEG1 и патернально экспрессируемого гена SNRPN (Morison et al., 2005, выше) показал, что экспрессия указанных генов достоверно регулировалась в сторону понижения в линиях phESC по сравнению с контрольными линиями hESC (фиг. 6 FP). Указанные результаты предоставляют дополнительное свидетельство партеногенетического происхождения описанных линий phESC.
Пример 2. Происхождение линии hpSC-Hhom от HLA-гомозиготного донора
С исходной целью выделения HLA-гомозиготной партеногенетической линии стволовых клеток человека использовали ооциты от HLA-гомозиготного донора. HLA-генотипирование донора (донор 1) и ее родителей показало, что оба родителя были гетерозиготными. Один и тот же гаплотип A *25, B* 18, DRB1*15 был унаследован от каждого родителя, и донор имел HLA-гомозиготный генотип A *25, A *25, B* 18, B* 18, DRB1*15, DRB1*15 (таблица 5, случай 1).
Девятнадцать клеточно-ооцитарных комплексов (СОС) были взяты от донора 1, из которых семь использовали для исследования (таблица 4).
Партеногенетическую активацию осуществляли с использованием ранее описанного протокола с обработкой А23187 и 6-DMAP (Revazova et al., 2007, выше). Четыре партеногенетических эмбриона достигли стадии бластоцисты, из которых из одного была выделена линия hpSC-Hhom-1.
Генотипические взаимоотношения между клетками линии hpSC-Hhom-1 и соматическими клетками донора 1 были идентифицированы как «полные сибсы» (генетическое совпадение) с помощью анализа SNP. Сравнение маркеров SNP показало, что клетки донора 1 имели паттерн гетерозиготности, в то время как клетки hpSC-Hhom-1 демонстрировали более маленькую долю гетерозиготности.
HLA-генотипирование показало, что линия hpSC-Hhom-1 является HLA-гомозиготной: A *25, A *25, B* 18, B* 18, DRB1*15, DRB1*15 и является полностью HLA-совместимой с донором (таблица 5, случай 1).
Жирным выделен HLA-гаплотип матери донора; подчеркиванием - HLA-гаплотип отца донора, каждый из которых был унаследован донором, а впоследствии - линией hpSC-Hhom.
Происхождение линий hpSC-Hhom от HLA-гетерозиготного донора
Поскольку HLA-гомозиготные доноры ооцитов встречаются редко, прибегали к выделению HLA-гомозиготных линий клеток из ооцитов, полученных от HLA-гетерозиготных доноров. Всего от донора 2 было получено восемнадцать СОС, из которых семь было пожертвовано для исследования (таблица 4). Указанные ооциты партеногенетически активировали с использованием другого протокола с обработкой А23187 и пуромицином. Через 18 часов наблюдалось выталкивание 2-го полярного тельца и образование одного пронуклеуса в активированных ооцитах. Три бластоцисты развились из указанных зигот, что позволило выделить две линии hpSC-Hhom: hpSC-Hhom-2 и hpSC-Hhom-3.
Анализ SNP, проведенный между соматическими клетками донора ооцитов 2 и линиями hpSC-Hhom-2 и hpSC-Hhom-3, показал взаимоотношения «пара родитель/потомок». Более того, обе указанные линии клеток оказались гомозиготными по всему геному (оценка по маркерам SNP), в противоположность гетерозиготным соматическим клеткам донора.
На основании результатов HLA-генотипирования клетки из обоих указанных линий оказались HLA-гомозиготными: линия hpSC-Hhom-2 показала HLA-генотип A *68, A *68, B* 18, B* 18, DRB1*13, DRB1*13, а линия hpSC-Hhom-3 показала HLA-генотип A *02, A *02, B* 13, B* 13, DRB1*07, DRB1*07 (в исследованных локусах). Также каждая линия hpSC-Hhom унаследовала отличающийся HLA-гаплотип, один - от отца донора, а другой - от матери донора. HLA-гаплотип отца донора (A *68, B* 18, DRB1*13) был обнаружен в гомозиготном состоянии в линии hpSC-Hhom-2, а HLA-гаплотип матери донора (A *02, B* 13, DRB1*07) был обнаружен в гомозиготном состоянии в линии hpSC-Hhom-3 (таблица 5, случай 2).
Выделение линий hpSC-Hhom из ооцитов HLA-гетерозиготных доноров, выбранных по HLA-гаплотипу
В качестве финального этапа осуществляли выделение линий hpSC-Hhom с HLA-гаплотипом, о котором известно, что он встречается с высокой частотой в популяции. Скрининг кандидатов на IVF по HLA-гаплотипу дал двух HLA-гетерозиготных доноров ооцитов, несущих распространенный гаплотип.
Согласно опубликованному перечню частот HLA-гаплотипа (Mori et al., Transplantation (1997) 64:1017-1027), донор 3 (HLA-гаплотип A *02, B* 08, DRB1*03) и донор 4 (HLA-гаплотип A *01, B* 08, DRB1*03) (таблица 5, случай 3 и случай 4) несли распространенные в популяции США гаплотипы. Однако при гетерозиготном HLA-генотипе каждый донор нес не только часто встречающийся гаплотип, но также и менее распространенный. Таким образом, было невозможно предсказать с абсолютной точностью, какой гаплотип будет присутствовать в выделенной линии hpSC-Hhom.
А23187 и пуромицин использовали для партеногенетической активации ооцитов доноров. Не увенчалось успехом выделение линии hpSC-Hhom из ооцитов донора 3, от которого было получено двадцать СОС и 10 ооцитов были пожертвованы для исследования. Ни один из них не достиг стадии бластоцисты. Более того, процедура IVF у данного донора не привела к беременности. Вместе эти факты могут отражать плохое качество ооцитов от данного конкретного донора (таблица 4).
От донора 4 было получено 27 СОС, и четырнадцать ооцитов были пожертвованы для исследования. После партеногенетической активации ооцитов получили две бластоцисты, из которых была выделена линия hpSC-Hhom-4 (таблица 4).
Генотипические взаимоотношения между hpSC-Hhom-4 и соматическими клетками донора 4 были идентифицированы как «пара родитель/потомок» посредством анализа SNP, сходного со случаем 2. Линия hpSC-Hhom-4 оказалась гомозиготной по всему геному (оценка по маркерам SNP), по сравнению с гетерозиготными соматическими клетками донора (1,174 гетерозиготных маркера SNP).
Согласно HLA-генотипированию, линия hpSC-Hhom-4 была HLA-гомозиготной (в исследованных локусах) и имела наиболее распространенный в США гаплотип, общий для ряда расовых групп (таблица 6): A *01, B* 08, DRB1*03 (таблица 5, случай 4).
Процедура IVF привела в беременности трех из четырех доноров (доноры 1, 2 и 4). Большая доля успешных IVF в большой степени была обязана отбору доноров с хорошим прогнозом на беременность после IVF. Интересно, что от донора 2 было выделено две линии hpSC-Hhom, а после процедуры IVF у донора наступила беременность двойней.
Определение характеристик линий hpSC-Hhom
Клетки из всех линий hpSC-Hhom демонстрировали морфологию, которую ожидали от эмбриональных стволовых клеток человека, формировали колонии из плотно упакованных клеток и демонстрировали заметные ядрышки при малом соотношении цитоплазмы и ядра. Все клетки экспрессировали распространенные маркеры эмбриональных стволовых клеток человека SSEA-3, SSEA-4, TRA-1-60, TRA-1-81 и ОСТ-4 и не экспрессировали SSEA-1, положительный маркер для недифференцированных мышиных эмбриональных стволовых клеток (фигура 7). Все линии демонстрировали высокие уровни активности щелочной фосфатазы (фигура 7) и теломеразы (фигура 8).
Кариотипирование по Гимза-диску показало, что линии hpSC-Hhom-1 и hpSC-Hhom-4 имеют нормальный человеческий 46,ХХ кариотип (фигура 9, А и В). Линии hpSC-Hhom-2 и hpSC-Hhom-3, полученные от одного и того же донора, имели отклонения в кариотипе. Приблизительно 15% клеток из линии hpSC-Hhom-2 имеет анеуплоидию хромосомы 8: кариотип 47,ХХ, +8 (фигура 9, С), а 4,2% клеток из линии hpSC-Hhom-3 имеют анеуплоидию хромосомы 1: кариотип 47,ХХ, +1 (фигура 9, D). Гетероморфизма Х-хромосомы не наблюдалось ни в одной линии клеток при анализе 100 метафаз (фигура 9).
Линия hpSC-Hhom-4 оставалась недифференцированной в течение 27 пассажей. Другие линии клеток успешно культивировали в течение по меньшей мере 21 пассажа. Клетки из линии hpSC-Hhom-4 формировали цистные эмбриоидные тельца в суспензионной культуре и давали начало производным всех трех зародышевых слоев- эктодермы, мезодермы и эндодермы - после дифференцировки in vitro (фигура 10). Эктодермальная дифференцировка подтверждалась положительным иммуноцитохимическим окрашиванием на нейрон-специфичные маркеры нейрофиламент 68 (фигура 10А) и NCAM (фигура 10B). Дифференцированные клетки были также положительными по мезодермальным маркерам, включая специфичные для мышц маркеры десмин (фигура 10С) и альфа-актинин (фигура 10D). Эндодермальная дифференцировка подтверждалась положительным окрашиванием на альфа-фетопротеин (фигура 10Е).
Способность всех линий hpSC-Hhom образовывать производные всех трех зародышевых слоев далее изучали in vivo путем подкожной инъекции клеток hpSC-Hhom мышам с иммунодефицитом (фигура 11). Все линии hpSC-Hhom были способны образовывать тератомы приблизительно через два месяца после инъекции. Образование тератокарцином не наблюдалось. Приблизительно четыре миллиона обработанных митомицином-С человеческих фибробластов, использовавшихся в качестве питающих слоев для клеток hpSC-Hhom, также инъецировали в качестве контролей, и роста тератом не наблюдалось.
Гистологическое исследование клеточных трансплантатов показало наличие организованных структур, включая различные типы желез (некоторые продуцировали коричневый пигмент, возможно, желчный пигмент), хрящевую дифференцировку, хорошо сформированные кости, мезенхимальные клетки, высокую выработку коллагеновых волокон, жировую ткань, невральные трубки и многослойный выстилающий эпителий с жемчужинами паракератоза (фигура 11). Указанные данные предполагают, что hpSC-Hhom будут дифференцироваться in vivo в ткани, происходящие из всех трех зародышевых слоев.
Несмотря на то, что изобретение описано со ссылкой на приведенные выше примеры, следует понимать, что его модификации и вариации входят в объем и охватываются идеей изобретения. Соответственно, изобретение ограничивается только следующей формулой изобретения.
Реферат
Изобретение относится к области биотехнологии. Описаны способы генерации HLA-гомозиготных партеногенетических линий стволовых клеток человека (hpSC-Hhom) как от HLA-гомозиготных, так и от HLA-гетерозиготных доноров. Указанные линии hpSC-Hhom демонстрируют типичную морфологию эмбриональных стволовых клеток человека, экспрессируя соответствующие маркеры стволовых клеток и обладая высокими уровнями активности щелочной фосфатазы и теломеразы. Помимо этого инъекция указанных линий клеток животным с иммунодефицитом приводит к образованию тератом. Кроме того, в случае HLA-гетерозиготных доноров линии hpSC-Hhom наследуют гаплотип только от одного из родителей донора. Анализ данных SNP предполагает, что линии hpSC-Hhom, полученные от HLA-гетерозиготных доноров ооцитов, являются гомозиготными по всему геному, по оценке анализа однонуклеотидного полиморфизма (SNP). Описанный протокол сводит к минимуму использование полученных от животных компонентов, что делает стволовые клетки более подходящими для клинического применения. 2 н. и 11 з.п. ф-лы, 11 ил., 15 табл., 2 пр.
Формула
a) инкубирование неоплодотворенных ооцитов человека, находящихся в метафазе II, в средах для экстракорпорального оплодотворения (IVF), где ооциты не имеют отцовского импринтинга и не имеют чужеродной ДНК;
b) инкубирование клеток стадии (а) в средах IVF, включающих ионофор;
c) инкубирование клеток стадии (b) в средах IVF, включающих пуромицин; и
d) инкубирование клеток стадии (с) в свежей среде IVF при низком парциальном давлении O2,
в котором стадии инкубации (а)-(с) осуществляют при высоком парциальном давлении O2, где высокое парциальное давление O2 составляет около 20% O2 и низкое парциальное давление O2 составляет около 5% O2, где внутренние клеточные массы (ICM), полученные из клеток на стадии (с), продуцируют пригодные для культивирования стволовые клетки и где
по меньшей мере одна клетка, составляющая линию клеток, является гомозиготной по всему геному согласно маркерам SNP относительно донорских гетерозиготных соматических клеток.
a) скрининг доноров ооцитов на HLA-гаплотипы, широко распространенные в данной популяционной группе;
b) инкубирование неоплодотворенных ооцитов человека, находящихся в метафазе II, в средах для экстракорпорального оплодотворения (IVF), где ооциты не имеют отцовского импринтинга и не имеют чужеродной ДНК;
c) инкубирование клеток стадии (b) в средах IVF, включающих ионофор;
d) инкубирование клеток стадии (с) в средах IVF, включающих пуромицин; и
e) инкубирование клеток стадии (d) в свежей среде IVF при низком парциальном давлении O2,
в котором стадии инкубации (b)-(d) осуществляют при высоком парциальном давлении O2, где высокое парциальное давление O2 составляет около 20% O2 и низкое парциальное давление O2 составляет около 5% O2, и в котором внутренние клеточные массы (ICM), полученные из клеток на стадии (d), продуцируют пригодные для культивирования стволовые клетки.

Комментарии