Способ получения клеток, продуцирующих панкреатические гормоны - RU2576000C2
Код документа: RU2576000C2
Чертежи






Описание
Область техники
[0001]
Настоящее изобретение относится к способу получения клеток, продуцирующих панкреатические гормоны, и к лекарственному средству, содержащему клетки, продуцирующие панкреатические гормоны, полученные указанным способом, и к тому подобному.
Предпосылки изобретения
[0002]
Поджелудочная железа имеет эндокринные железы (эндокринные клетки) и экзокринные железы (экзокринные клетки) и представляет собой орган, играющий важную роль, благодаря обоим видам клеток. Экзокринные клетки главным образом играют роль секреции пищеварительных ферментов, таких как панкреатическая липаза, трипсин, эластаза, панкреатическая амилаза и тому подобные.
Эндокринные клетки играют роль секреции панкреатических гормонов, и известно, что глюкагон секретируется из панкреатических α-клеток, инсулин секретируется из панкреатических β-клеток, соматостатин секретируется из панкреатических δ-клеток, и панкреатический полипептид (иногда сокращенно именуемый в настоящем описании PP) секретируется из PP клеток. В последние годы, сообщалось, что грелин, который представляет собой гормон, секретируемый желудком, также секретируется из поджелудочной железы.
[0003]
Инсулин играет важную роль содействия утилизации глюкозы, синтезу белка и образованию и накоплению нейтральных жиров, снижению уровня глюкозы в крови и поддержанию нормальной концентрации глюкозы крови. Панкреатический глюкагон играет важную роль, наряду с инсулином, в регуляторном механизме метаболизма сахаров, в качестве гипергликемического гормона посредством печеночного гликогенолиза, действия в виде глюконеогенеза и тому подобного. Соматостатин проявляет действие связывания с рецептором соматостатина, и подавляет секрецию различных гормонов, таких как глюкагон, инсулин и тому подобное, в поджелудочной железе. PP представляет собой гормон, известный как фактор чувства насыщения, секретируемый из клеток островков Лангреганса в ответ на рацион, и снижающий потребление пищи и прибавку массы тела. Известно, что грелин стимулирует потребление пищи, и увеличивает прибавку массы тела путем снижения окисления жиров.
[0004]
Сахарный диабет представляет собой заболевание, развивающееся вследствие недостаточной секреции инсулина и утраты его функции, и после развития сахарного диабета, он трудно поддается лечению. Сахарный диабет может преимущественно классифицироваться на два типа: сахарный диабет I типа (инсулинозависимый сахарный диабет) и сахарный диабет II типа (инсулиннезависимый сахарный диабет).
Сахарный диабет II типа представляет собой хроническое заболевание, развивающееся вследствие устойчивости к инсулину, которое создает проблемы в отношении привычного образа жизни, такие как ожирение ввиду переедания и гиподинамии, стресса и т.д. Сахарный диабет II типа часто развивается у взрослых людей среднего возраста, и многие пациенты с сахарным диабетом страдают этим типом сахарного диабета.
Сахарный диабет I типа представляет собой хроническое заболевание, вызываемое деструкцией продуцирующих инсулин клеток аутоиммунными заболеваниями, вирусной инфекцией и тому подобными факторами, приводящими к прекращению секреции инсулина в организме. В качестве способа лечения, который может автоматически регулировать постоянно изменяющийся уровень глюкозы в крови в организме и снизить бремя, воздействующее на пациентов, у пациентов с сахарным диабетом I типа выполняют трансплантацию поджелудочной железы или трансплантацию панкреатических островков. Хотя этими способами можно достичь нормального уровня глюкозы в крови, техника трансплантации еще недостаточно отработана, ткани поджелудочной железы и панкреатических островков, которые могут быть трансплантированы, недостаточно. Кроме того, во избежание отторжения трансплантата, пациенты должны в течение всей жизни принимать иммунодепрессант, и еще остаются проблемы риска инфекции, побочных эффектов, вызванных иммунодепрессантом, и тому подобные.
[0005]
Одним из способов лечения, испытывавшихся по поводу сахарного диабета I типа, является способ, включающий репродукцию самих продуцирующих инсулин клеток из клеток, полученных у пациента, и трансплантацию клеток в тело пациента. В соответствии с этим способом, инсулин может вырабатываться в организме пациента. Кроме того, поскольку клетки представляют собой собственные клетки пациента, этот способ также имеет преимущества с точки зрения безопасности, поскольку может быть решена проблема отторжения и тому подобные.
[0006]
Известные способы получения продуцирующих инсулин клеток включают способ дифференцировки ES (эмбриональных стволовых) клеток, способ дифференцировки эмбриональных стволовых клеток поджелудочной железы пациента, способ выделения клеток, полученных из эпителия панкреатического протока пациента из организма и их дифференцировки и тому подобные. В частности, способ индукции дифференциации панкреатических β-клеток из человеческих ES клеток путем использования активина и ретиноевой кислоты (RA) (патентный документ 1, не патентные документы 1-4), способ индукции дифференциации продуцирующих глюкагон клеток (α-клеток) из человеческих ES клеток (не патентный документ 8), способ индукции дифференциации панкреатических β-клеток из человеческих iPS (индуцированных плюрипотентных стволовых) клеток (не патентные документы 5-7), способ эффективной индукции дифференциации продуцирующих инсулин клеток, включая введение PDX1, который, как известно, является важным фактором транскрипции, участвующим в развитии поджелудочной железы, а также ответственным за развитие и функциональную поддержку продуцирующих инсулин клеток в ES клетки, и культивирования клеток (патентный документ 2), и тому подобные.
[0007]
Однако поскольку продуцирующие инсулин клетки, полученные этими способами, проявляют значительно сниженную эффективность продукции инсулина, по сравнению с нормальными панкреатическими β-клетками, то еще требуется разработка способа эффективного получения продуцирующих инсулин клеток, которые могут быть приняты для применения клеточной терапии. Кроме того, для лечения сахарного диабета и тому подобных заболеваний желательно увеличение числа получаемых клеток до практического уровня.
Перечень документов, приведенных в качестве ссылок
Патентные документы
Патентный документ 1 - патент Японии JP-A-2009-225661
Патентный документ 2 - патент США № B-7534608
Не патентные документы
Не патентный документ 1 - E. Kroon et al., «Pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-secreting cells in vivo.», Nature Biotechnology (2008) Vol. 26, No.4: 443-452
Не патентный документ 2 - K. A D'Amour et al., «Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells.», Nature Biotechnology (2006) Vol. 24, No. 11: 1392-1401
Не патентный документ 3 - W. Jiang, «In vitro derivation of functional insulin-producing cells from human embryonic stem cells.», Cell Research (2007) 17: 333-344
Не патентный документ 4 - J. H. Shim et al., «Directed differentiation of human embryonic stem cells towards a pancreatic cell fate.», Diabetologia (2007) 50:1228-1238
Не патентный документ 5 - R. Maehra et al., «Generation of pluripotent stem cells from patients with type 1 diabetes.», PNAS (2009), vol. 106, No. 37: 15768-15773
Не патентный документ 6 - MC. Nostro et al., «Stage-specific signaling through TGFbeta family members и WNT regulates patterning и pancreatic specification of human pluripotent stem cells.», Development (2011), 138: 861-871
Не патентный документ 7 - A. Rezania et al., «Production of functional glucagon-secreting alpha-cells from human embryonic stem cells.», Diabetes (2011), 60: 239-247
Не патентный документ 8 - T. Thatava et al., «Indolactam V/GLP-1-mediated differentiation of human iPS cells into glucose-responsive insulin-secreting progeny.», Gene Ther (2011), 18: 283-293
Краткое изложение сущности изобретения
Проблемы, подлежащие решению изобретением
[0008]Целью настоящего изобретения является разработка способа получения панкреатических гормонпродуцирующих клеток, более подходящих для применения при клеточной терапии, лекарственного средства, содержащего гормонпродуцирующие клетки, полученные указанным способом получения, и способа скрининга терапевтического лекарственного препарата для лечения сахарного диабета с использованием указанных клеток.
Средства решения проблем
[0009]Заявители провели интенсивные исследования в связи с указанной выше проблемой и обнаружили, что панкреатические гормонпродуцирующие клетки в форме, более имитирующей панкреатогенез (форме, поддерживающей трехмерную структуру), могут быть получены из стволовой клетки путем серийного изменения вида и комбинации индукторов дифференциации и путем культивирования в суспензионном состоянии после образования клеточной массы из эндодермальных клеток и тому подобных, что привело к созданию настоящего изобретения.
[0010]Соответственно, настоящее изобретение относится к следующему.
[1] Способ получения панкреатических гормонпродуцирующих клеток, включающий подвергание стволовых клеток следующим стадиям (1)-(6):
(1) стадии культивирования стволовых клеток в среде, содержащей ингибитор Rho-киназы
(2) стадии культивирования клеток, полученных на указанной выше стадии (1) в среде, содержащей ингибитор GSK3 (гликоген-синтазы киназы)
(3) стадии культивирования клеток, полученных на указанной выше стадии (2) в среде, содержащей ингибитор GSK3, и активатор подобной рецептору активина киназы-4,7
(4) стадии образования клеточной массы из клеток, полученных на указанной выше стадии (3), и культивирования клеточной массы в суспензионном состоянии в среде
(5) стадии культивирования клеток, полученных на указанной выше стадии (4) в среде, содержащей агонист рецептора ретиноевой кислоты, ингибитор АМФ-активируемой протеинкиназы и/или подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы-4,5,7 и фактор роста клеток
(6) стадии культивирования клеток, полученных на указанной выше стадии (5);
[2] Способ получения по указанному выше пункту [1], где активатор подобной рецептору активина киназы-4,7 на стадии (3) представляет собой активин;
[3] Способ получения по указанному выше пункту [1] или [2], где ингибитор Rho киназы на стадии (1) представляет собой (+)-(R)-транс-4-(1-аминоэтил)-N-(4-пиридил)циклогексанкарбоксамид дигидрохлорид;
[4] Способ по любому из указанных выше пунктов [1]-[3], где ингибитор GSK3 на стадиях (2) и (3) представляет собой (i) 6-[[2-[[4-(2,4-дихлорфенил)-5-(4-метил-1H-имидазол-2-ил)-2-пиримидинил]амино]этил]амино]никотинонитрил и/или (ii)(2'Z,3'E)-6-броминдирубин-3'-оксим;
[5] Способ по любому из указанных выше пунктов [1]-[4], где агонист рецептора ретиноевой кислоты на стадии (5) представляет собой ретиноевую кислоту;
[6] Способ по любому из указанных выше пунктов [1]-[5], где ингибитор АМФ-активируемой протеинкиназы и/или подобной рецептору активина киназы-2,3,6 на стадии (5) представляет собой дорсоморфин;
[7] Способ по любому из указанных выше пунктов [1]-[6], где ингибитор подобной рецептору активина киназы-4,5,7 на стадии (5) представляет собой 4-[4-(1,3-бензодиоксол-5-ил)-5-(2-пиридинил)-1H-имидазол-2-ил]-бензамид;
[8] Способ по любому из указанных выше пунктов [1]-[7], где фактор роста клеток на стадии (5) представляет собой основной фактор роста фибробластов;
[9] Способ по любому из указанных выше пунктов [1]-[8], где на стадиях (1)-(6) по существу не используется питающая клетка;
[10] Способ по любому из указанных выше пунктов [1]-[7], где среда на стадиях (1)-(6) по существу не содержит сыворотку;
[11] Способ по любому из указанных выше пунктов [1]-[10], где стволовые клетки представляют собой индуцированные плюрипотентные стволовые клетки (iPS летки), эмбриональные стволовые клетки (ES клетки) или человеческие соматические стволовые клетки;
[12] Способ по любому из указанных выше пунктов [1]-[11], где панкреатические гормонпродуцирующие клетки представляют собой любые гормонпродуцирующие клетки, выбранные из группы, состоящей из клеток, продуцирующих инсулин, клеток, продуцирующих глюкагон, клеток, продуцирующих соматостатин, клеток, продуцирующих панкреатический полипептид (PP), и клеток, продуцирующих грелин;
[13] Способ получения панкреатических гормонпродуцирующих клеток, включающий подвергание эндодермальных клеток следующим стадиям (4') и (5'):
(4') стадии образования клеточной массы из эндодермальных клеток и культивирования клеточной массы в суспензионном состоянии в среде
(5') стадии культивирования клеток, полученных на указанной выше стадии (4') в среде, содержащей агонист рецептора ретиноевой кислоты, ингибитор АМФ-активируемой протеинкиназы и/или подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы-4,5,7 и фактор роста клеток;
[14] Лекарственное средство, содержащее панкреатические гормонпродуцирующие клетки, полученные способом получения по любому из указанных выше пунктов [1]-[13];
[15] Способ скрининга лекарственного препарата для лечения сахарного диабета, включающий использование клеток, полученных одной или более стадий, выбранных из группы, состоящей из следующих стадий (1)-(6):
(1) стадии культивирования стволовых клеток в среде, содержащей ингибитор Rho-киназы
(2) стадии культивирования клеток, полученных на указанной выше стадии (1) в среде, содержащей ингибитор GSK3
(3) стадии культивирования клеток, полученных на указанной выше стадии (2) в среде, содержащей ингибитор GSK3, и активатор подобной рецептору активина киназы-4,7
(4) стадии образования клеточной массы из клеток, полученных на указанной выше стадии (3), и культивирования клеточной массы в суспензионном состоянии в среде
(5) стадии культивирования клеток, полученных на указанной выше стадии (4) в среде, содержащей агонист рецептора ретиноевой кислоты, ингибитор АМФ-активируемой протеинкиназы и/или подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы-4,5,7 и фактор роста клеток
(6) стадии культивирования клеток, полученных на указанной выше стадии (5).
Эффект изобретения
[0011]В соответствии со способом получения по настоящему изобретению, панкреатические гормонпродуцирующие клетки в форме, более имитирующей панкреатогенез, могут быть получены из стволовых клеток. Кроме того, клетки, полученные на одном или более видов указанных выше стадий (1)-(6), могут использоваться для скрининга соединения, полезного для профилактики и/или лечения заболеваний, вызванных патологической продукцией и/или секрецией панкреатических гормонов, таких как сахарный диабет и тому подобные. Кроме того, поскольку клетки по настоящему изобретению могут использоваться для клеточной терапии для лечения таких заболеваний, и они сохраняют трехмерную структуру, это больше подходит для применения к клеточной терапии, даже по сравнению с панкреатическими гормонпродуцирующими клетками, полученными в соответствии с обычным способом получения.
Краткое описание чертежей
[0012]
На фиг. 1 показаны результаты, полученные инициацией индукции дифференциации из человеческих iPS клеток путем использования различных факторов и ежедневного измерения экспрессии примитивного штрихового маркера (гена Brachyury) и эндодермального маркера (SOX17) в течение первых 4 дней количественной RT-PCR (полимеразной цепной реакции в реальном масштабе времени). Уровни экспрессии соответствующих генов показаны в виде относительных величин к уровню экспрессии конститутивного гена GAPDH. На 3-й день культивирования, уровень экспрессии гена Brachyury транзиторно увеличивался, а уровень экспрессии SOX17 заметно увеличивался на 4-й день.
На фиг. 2 показаны результаты иммунофлуоресцентного окрашивания с использованием антитела к человеческому SOX17 клеток, полученных индукцией дифференциации человеческих iPS клеток в течение 4 дней с использованием активина A и CHIR99021, пересева клеток на 96-луночный планшет, покрытый фибронектином, и культивирования клеток в течение суток. Ядра SOX17-положительных клеток окрашивались в зеленый цвет Alexa 488 (SOX17 на фиг.), а ядра клеток окрашивались в синий цвет Hoechst 33342 (Hoechst на фиг.). Кроме того, оба окрашенных изображения комбинировали, и они показаны в виде наложения изображений. Наблюдалось, что большинство клеток экспрессируют белок SOX17.
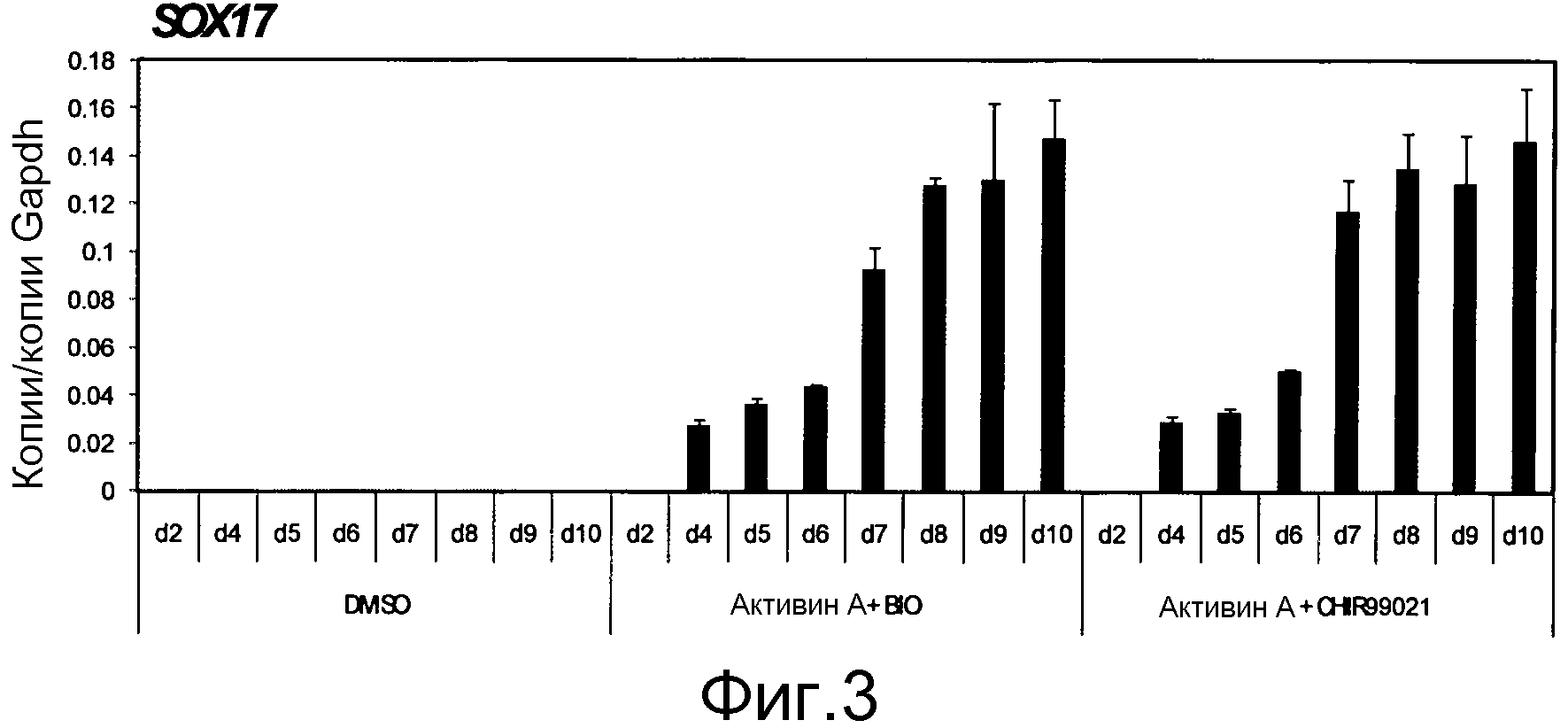
На фиг. 3 показаны результаты экспрессии SOX17 человеческими iPS клетками, которые культивировали в среде, содержащей CHIR99021, в течение 2 дней и затем культивировали с использованием активина A и CHIR99021, а также активина A и BIO, по данным ежедневного измерения количественной RT-PCR. Уровни экспрессии гена показаны в виде относительных величин к уровню экспрессии конститутивного гена GAPDH. При использовании или CHIR99021, или BIO, экспрессия SOX17 со временем увеличивалась с 4-го дня культивирования, и проявляла одинаковый тип экспрессии. В контроле с добавлением только DMSO (диметилсульфоксида), экспрессия SOX17 не увеличивалась.
На фиг. 4 показаны результаты анализа экспрессии инсулина клетками, полученными индукцией дифференциации человеческих iPS клеток с использованием активина A и CHIR99021 в течение 4 дней, высеванием клеток на 96-луночный сфероидный планшет, культивированием клеток в течение суток, культивированием клеток в течение 8 дней в усовершенствованной среде MEM Zinc Option, содержащей 1% B27, и с добавлением дорсоморфина, ретиноевой кислоты, SB431542 и bFGF, затем заменой среды на усовершенствованную среду MEM Zinc Option, содержащую 1% B27, и далее непрерывным культивированием клеток (Инсулин на фиг.). Уровни экспрессии гена показаны в виде относительных величин к уровню экспрессии конститутивного гена GAPDH. Экспрессия инсулина увеличивалась с 13-го дня культивирования в усовершенствованной среде MEM Zinc Option, содержащей 1% B27, и увеличивалась со временем до 23-го дня культивирования.
На фиг. 5 показаны результаты анализа экспрессии инсулина клетками на 19-й день культивирования, причем клетки были получены индукцией дифференциации человеческих iPS клеток с использованием активина A и CHIR99021 в течение 4 дней, высеванием клеток на 96-луночный сфероидный планшет, культивированием клеток в течение 1 дня, культивированием клеток в течение 8 дней с использованием комбинации дорсоморфина, ретиноевой кислоты, SB431542 и bFGF или комбинации дорсоморфина, ретиноевой кислоты и SB431542, и затем культивированием в усовершенствованной среде Improved MEM Zinc Option, содержащей 1% B27 (Инсулин на фиг.). Уровни экспрессии гена показаны в виде относительных величин к уровню экспрессии конститутивного гена GAPDH. Уровень экспрессии инсулина был выше на 19-й день культивирования при использовании комбинации дорсоморфина, ретиноевой кислоты, SB431542 и bFGF, чем комбинации дорсоморфина, ретиноевой кислоты и SB431542.
На фиг. 6 показаны результаты иммунофлуоресцентного окрашивания с использованием антитела к инсулину и антитела к глюкагону замороженного среза, полученного из клеточной массы (сферы), на 21-й день культивирования клеток, полученных индукцией дифференциации таким же образом, как в способе, показанном на фиг. 4. Инсулин-положительные клетки окрашивались в красный цвет Alexa 568 (Инсулин на фиг.), глюкагон-положительные клетки окрашивались в зеленый цвет Alexa 488 (Глюкагон на фиг.), а ядра клеток окрашивались в синий цвет Hoechst 33342 (Hoechst на фиг.). Кроме того, все окрашенные изображения комбинировали, и они показаны в виде наложения изображений. Много клеток, экспрессирующих инсулин, обнаруживали внутри клеточной массы (сферы), а часть клеток экспрессировала глюкагон.
На фиг. 7 показаны результаты анализа экспрессии различных маркеров дифференциации в клетках, полученных индукцией человеческих iPS клеток с использованием матригеля BD или фибронектина в качестве подложки и введения активина A и CHIR99021 в эндодерму для образования клеточной массы (сферы), и затем дополнительной индукцией дифференциации в клетки-предшественники панкреатических гормонпродуцирующих клеток и затем панкреатические гормонпродуцирующие клетки. Уровни экспрессии соответствующих генов были показаны в виде относительных величин к уровню экспрессии конститутивного гена GAPDH. Экспрессия SOX17 заметно уменьшалась при дифференциации, а уровни экспрессии PDX1 и NGN3 постепенно увеличивались до 17-го дня культивирования. Экспрессия инсулина резко увеличивалась с 17-го дня культивирования. Изменение экспрессии этих различных маркеров дифференциации с течением времени было почти одинаковым, пока эндодермальные клетки индуцировали с использованием матригеля BD или фибронектина в качестве подложки.
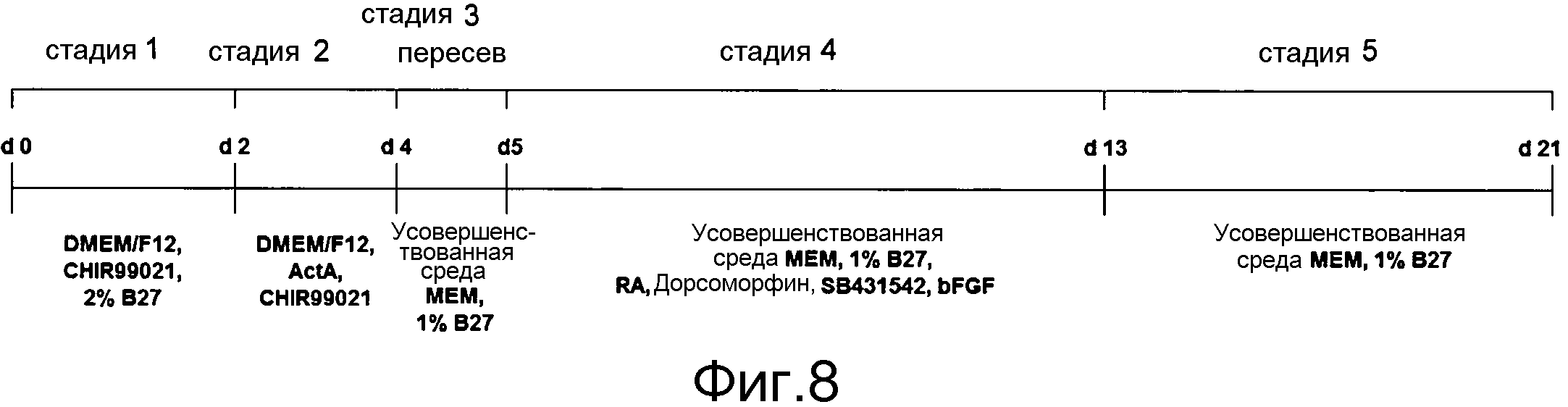
На фиг. 8 показана общая схема способа получения панкреатической гормонпродуцирующей клетки, который включает стадию индукции дифференциации путем образования клеточной массы (сферы) из эндодермы [стадия (4)], и в котором не используется питающая клетка или сыворотка.
Подробное описание изобретения
[0013]
Настоящее изобретение объясняется в следующем описании. Пока нет конкретных определений, термины, используемые в настоящем описании, означают те, которые в целом используются в данной области.
[0014]
В настоящем изобретении, термин «панкреатические гормонпродуцирующие клетки» означает клетки, обладающие способностью продуцировать панкреатический гормон. Панкреатические гормонпродуцирующие клетки не должны постоянно продуцировать панкреатический гормон, но должны только быть способны продуцировать панкреатический гормон. Поэтому, подлежащее выработке количество панкреатического гормона конкретно не ограничивается. Примеры панкреатического гормона включают инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин. Примеры панкреатических гормонпродуцирующих клеток включают клетки, продуцирующие инсулин (синонимичные панкреатическим β-клеткам), клетки, продуцирующие глюкагон (синонимичные панкреатическим α-клеткам), клетки, продуцирующие соматостатин (синонимичные панкреатическим δ-клеткам), клетки, продуцирующие панкреатический полипептид (PP), и клетки, продуцирующие грелин. Конечно, предпочтительны клетки, продуцирующие инсулин.
[0015]
В настоящем изобретении термин «стволовые клетки» означает клетки, которые могут культивироваться in vitro, и могут дифференцироваться во множественные линии дифференцировки, составляющие организм. В частности, можно указать эмбриональные стволовые клетки (ES клетки), плюрипотентные стволовые клетки, происходящие из примордиальных зародышевых клеток эмбриона (EG клетки: Proc Natl Acad Sci USA. 1998, 95:13726-31), происходящие из семенников плюрипотентные стволовые клетки (GS клетки: Nature. 2008, 456: 344-9), происходящие из соматических клеток индуцированные плюрипотентные стволовые клетки (индуцированные плюрипотентные стволовые клетки; iPS клетки) и человеческие соматические стволовые клетки (тканевые стволовые клетки). Предпочтительными являются iPS клетки, ES клетки и человеческие соматические стволовые клетки, а более предпочтительными являются iPS клетки.
[0016]
В качестве ES клеток, могут использоваться ES клетки, происходящие из любого теплокровного животного, предпочтительно, млекопитающего. Примеры млекопитающего включают мышь, крысу, морскую свинку, хомячка, кролика, кошку, собаку, овцу, свинью, корову, лошадь, козу, обезьяну и человека. Предпочтительны примеры клеток, происходящих от человека.
Конкретные примеры ES клеток включают ES клетки млекопитающего и тому подобного, которые основываются культивированием раннего эмбриона перед имплантацией, ES клетки, которые основываются культивированием раннего эмбриона, полученного ядерной трансплантацией ядер соматических клеток, и ES клетки, полученные изменением гена на хромосоме таких ES клеток генетической инженерией. Каждая ES клетка может быть получена способом, в целом выполняемым в данной области, в соответствии с известным документом.
ES клетки мыши были основаны в 1981 г. Evans et al. (Evans et al., 1981, Nature 292: 154-6) и Martin et al. (Martin GR. et al., 1981, Proc Natl Acad Sci 78: 7634-8) и могут быть закуплены, например, у компании Dainippon Sumitomo Pharma Co., Ltd. (Osaka, Japan).
ES клетки человека были основаны в 1998 г. Thomson et al. (Thomson et al., Science, 1998, 282:1145-7), и могут быть получены в институте WiCell Research Institute (сайт интернета: http://www.wicell.org/, Madison, Wisconsin, USA), в институте National Institute of Health, Kyoto University и тому подобных и, например, могут быть закуплены у компании Cellartis AB (сайт интернета: http://www.cellartis.com/, Sweden).
[0017]
В качестве клеток iPS, могут использоваться iPS клетки, полученные у любого теплокровного животного, предпочтительно, млекопитающего. Примеры млекопитающего включают мышь, крысу, морскую свинку, хомячка, кролика, кошку, собаку, овцу, свинью, корову, лошадь, козу, обезьяну и человека. Предпочтительные примеры включают клетки, полученные у человека.
Конкретные примеры iPS клеток включают клетки, которые приобрели мультипотентность, подобную мультипотентности ES клеток, и были получены введением множественных генов в соматические клетки, такие как клетки кожи и тому подобные (например, iPS клетки, полученные введением гена Oct3/4, гена Klf4, гена c-Myc и гена Sox2 (Nat Biotechnol 2008; 26: 101-106)). Кроме этого, можно указать способ, при котором дополнительно редуцируются трансгены (Nature. 2008 Jul 31; 454(7204):646-50), способ с использованием соединений с низкой молекулярной массой (Cell Stem Cell. 2009 Jan 9; 4(1):16-9, Cell Stem Cell. 2009 Nov 6; 5(5):491-503), способ с использованием белков как транскрипционных факторов вместо гена (Cell Stem Cell. 2009 May 8; 4(5):381-4) и тому подобное. Хотя в способы получения iPS клеток интенсивно вносились технические усовершенствования, основное свойство полученных iPS клеток, то есть, то, что они обладают мультипотентностью, является эквивалентным, независимо от способов получения, и поэтому, все такие способы могут использоваться для способа получения по настоящему изобретению.
[0018]
В качестве соматических стволовых клеток могут использоваться клетки, полученные у человека. В настоящем описании, термин «соматические стволовые клетки» относится к клеткам, способным к дифференциации в панкреатические гормонпродуцирующие клетки, например, стволовые клетки, присутствующие в мезенхимальных стволовых клетках, происходящих из костного мозга, и жировые и стволовые клетки, присутствующие в поджелудочной железе.
[0019]С использованием способа по настоящему изобретению, панкреатические гормонпродуцирующие клетки могут быть получены из различных линий стволовых клеток, таких как линия человеческих iPS клеток, которые варьируются по способам получения.
[0020]
1. Способ получения панкреатических гормонпродуцирующих клеток
Способ получения по настоящему изобретению включает способ получения панкреатических гормонпродуцирующих клеток из стволовых клеток. Способ получения по настоящему изобретению также включает способ индукции дифференциации клеток в менее дифференцированном состоянии (стволовые клетки) в более дифференцированное состояние (панкреатические гормонпродуцирующие клетки).
[0021]
Способ получения по настоящему изобретению включает следующие стадии (1)-(6).
(1) стадию культивирования стволовых клеток в среде, содержащей ингибитор Rho киназы
(2) стадию культивирования стволовых клеток, полученных на указанной выше стадии (1) в среде, содержащей ингибитор GSK3
(3) стадию культивирования стволовых клеток, полученных на указанной выше стадии (2) в среде, содержащей ингибитор GSK3, и активатор подобной рецептору активина киназы-4,7
(4) стадию образования клеточной массы из клеток, полученных на указанной выше стадии (3), и культивирования клеточной массы в суспензионном состоянии в среде
(5) стадию культивирования клеток, полученных на указанной выше стадии (4), в среде, содержащей агонист рецептора ретиноевой кислоты, ингибитор активируемой АМФ протеинкиназы и/или подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы-4,5,7 и фактор роста клеток
(6) стадию культивирования клеток, полученных на указанной выше стадии (5)
[0022]
Стадия (1): стадия культивирования стволовых клеток в среде, содержащей ингибитор Rho киназы
Эта стадия соответствует предварительной стадии перед указанной ниже стадией (2), инициирующей индукцию дифференциации стволовых клеток в панкреатические гормонпродуцирующие клетки, то есть, стадии прекультивирования (посева) стволовых клеток.
[0023]
Стволовые клетки на этой стадии могут быть получены совместным культивированием с питающими клетками или экстрактом питающих клеток. В настоящем описании, питающая клетка означает клетку, которая обеспечивает путем совместного культивирования среду, в которой могут расти другие виды клеток.
Хотя стволовые клетки на этой стадии могут представлять собой любые из диспергированных клеток и не диспергированных клеток, желательны диспергированные клетки.
Примеры диспергированных клеток включают отделившиеся клетки и клетки, образующие массу, состоящую из нескольких клеток (обычно примерно 2-500, 20-200 или 50-100 клеток [как объясняется в указанной ниже стадии (4), клеточная масса означает состояние образования массы сцеплением множества клеток друг с другом и тому подобное]), которая желательно представляет собой клеточную массу на этой стадии.
Диспергированная клетка может быть получена по существу известным способом. Примеры такого способа включают обработку хелатирующим агентом (например, EDTA (этилендиаминтетрауксусной кислотой)), ферментом (например, трипсином, коллагеназой) и тому подобными, и такими операциями как механическая дисперсия (например, пипетирование) и тому подобные.
Диспергированные клетки могут представлять собой не прикрепленные клетки [не прикрепленные клетки означают клетки в состоянии, свободном от прикрепления к культуральному сосуду или подложке], или прикрепленные клетки [прикрепленные клетки означают клетки в состоянии прикрепления к культуральному сосуду или подложке].
На этой стадии желательно после удаления питающих клеток или экстракта питающих клеток (например, удаления помещением в центрифужную пробирку, отстоя в течение 2-10 мин и затем удаления супернатанта), культивировать клетки в указанной ниже среде, содержащей ингибитор Rho киназы (то есть, инициировать индукцию дифференциации без использования питающих клеток при посеве и в последующем).
[0024]
Ингибитор Rho киназы означает вещество, которое ингибирует активность Rho киназы.
Rho киназа представляет собой один вид малого ГТФ-связывающего белка (малого G белка), содержащегося в категории ГТФазы, которая представляет собой фермент, разрушающий ГТФ (гуанозинтрифосфат), и имеет домен серин/треонинкиназы на амино конце, свернутую спиралью область в центральной части и взаимодействующий с Rho домен на карбокси конце (Amano et al., Exp. Cell. Res., 261, 44-51 (2000)).
Примеры ингибитора Rho киназы, подлежащего использованию на этой стадии, включают 1-(5-изохинолинсульфонил)-2-метилпиперазин (H-7), 1-(5-изохинолинсульфонил)-3-метилпиперазин (изоH-7), N-2-(метиламино)этил-5-изохинолинсульфонамид дигидрохлорид (H-8), N-(2-аминоэтил)-5-изохинолинсульфонамид дигидрохлорид (H-9), N-[2-п-бромциннамиламино)этил]-5-изохинолинсульфонамид дигидрохлорид (H-89), N-(2-гуанидинэтил)-5-изохинолинсульфонамид гидрохлорид (HA-1004), 1-(5-изохинолинсульфонил)гомопиперазин дигидрохлорид (фазудил/HA-1077), (S)-(+)-2-метил-4-глицил-1-(4-метилизохинолинил-5-сульфонил)гомопиперидин дигидрохлорид (H-1152), и (+)-(R)-транс-4-(1-аминоэтил)-N-(4-пиридил)циклогексанамид дигидрохлорид (Y-27632).
Все эти соединения имеются в продаже и выпускаются компаниями SIGMA и Wako Pure Chemical Industries, Ltd.). Из них особенно предпочтителен Y-27632.
На этой стадии может использоваться один и любая комбинация ингибиторов Rho киназы.
[0025]
На этой стадии стволовая клетка культивируется в среде, содержащей ингибитор Rho киназы.
Хотя концентрация ингибитора Rho киназы в среде конкретно не ограничивается, пока может быть достигнут желательный эффект, такой как повышение частоты выживания стволовых клеток и тому подобный, она в целом составляет от 0,01 до 1000 мкМ, предпочтительно, от 0,1 до 100 мкМ, особенно предпочтительно, от 1,0 до 50 мкМ. Когда Y-27632 используется в качестве ингибитора Rho киназы, то предпочтительно используемая концентрация составляет от примерно 1,0 до примерно 30 мкМ, предпочтительнее, от примерно 2,0 до примерно 20 мкМ. Когда фазудил/HA1077 используется в качестве ингибитора Rho киназы, то концентрация может быть примерно в 2 раза выше, по сравнению с указанной выше концентрацией Y-27632.
Когда множественные виды ингибитора Rho киназы используются в комбинации, то каждый ингибитор используется в концентрации, соответствующим образом увеличенной или уменьшенной на основании указанного выше диапазона концентрации.
[0026]
Время культивирования в среде, содержащей ингибитор Rho киназы, конкретно не ограничивается, пока может быть достигнут желательный эффект, такой как повышение частоты выживания стволовых клеток и тому подобный. Например, когда стволовая клетка представляет собой человеческую iPS клетку, то человеческие iPS клетки диспергируются и культивируются в среде, содержащей ингибитор Rho киназы в течение примерно 12 ч или дольше (например, 12-72 ч), посредством чего может быть в достаточной степени получен желательный эффект.
Плотность стволовых клеток в среде, содержащей ингибитор Rho киназы, конкретно не ограничивается, пока может быть достигнут желательный эффект, такой как повышение частоты выживания стволовых клеток и тому подобный. Она предпочтительно составляет примерно от 1,0×101 до 1,0×107 клеток/мл, предпочтительнее, примерно от 1,0×102 до 1,0×107 клеток/мл, еще предпочтительнее, примерно от 1,0×103 до 1,0×107 клеток/мл, наиболее предпочтительно, примерно от 3,0×104 до 1,0×106 клеток/мл.
[0027]
Среда, подлежащая использованию на этой стадии, конкретно не ограничивается, пока она содержит ингибитор Rho киназы, и в целом представляет собой среду, используемую для культивирования стволовых клеток с добавлением ингибитора Rho киназы (далее в настоящем описании также для удобства именуемую основной средой).
В качестве основной среды, подлежащей использованию на этой стадии, может использоваться среда для клеток ES/iPS приматов (среда ReproCELL), среда BME, среда BGJb, среда CMRL 1066, среда Glasgow MEM, среда Improved MEM Zinc Option, среда IMDM, среда Medium 199, среда Eagle MEM, среда αMEM, среда DMEM, среда Хэма, среда RPMI 1640, среда Фишера, смесь двух или более видов сред, необязательно, выбранных из этих сред, и тому подобных. Среда конкретно не ограничивается, пока она может использоваться для культивирования клеток животных. На этой стадии особенно желательно использование среды для ES клеток приматов (среды ReproCELL).
Эти среды могут быть закуплены у компаний ReproCELL Inc., Invitrogen, SIGMA, COSMO BIO Co., Ltd. и тому подобных.
[0028]
В качестве среды, подлежащей использованию на этой стадии, предпочтительна среда, по существу не содержащая сыворотку и/или сывороточный экстракт, а предпочтительнее бессывороточная среда.
В настоящем описании, по существу не содержащая сыворотку означает, что содержание сыворотки составляет менее чем примерно 1 об.%, предпочтительно, менее чем примерно 0,1 об.%, предпочтительнее, менее чем примерно 0,01 об.%. Бессывороточная среда означает основную среду, не содержащую неприспособленную или неочищенную сыворотку, и считается, что среда, смешанная с очищенным, полученным из крови компонентом, или компонентом, полученным из ткани животного (например, фактор роста), подпадает под определение бессывороточной среды.
[0029]
Среда, подлежащая использованию на этой стадии, может также содержать заменители сыворотки. Примеры заменителя сыворотки включают альбумин (например, альбумин, обогащенный липидами), трансферрин, жирную кислоту, предшественник коллагена, микроэлемент (например, цинк, селен), добавку B-27, добавку N2, заменитель сыворотки от нокаутных животных, 2-меркаптоэтанол, 3'-тиоглицерин или их эквиваленты. Заменитель сыворотки от нокаутных животных может быть закуплен у компании Invitrogen. Другие заменители сыворотки могут быть закуплены у компаний Invitrogen, SIGMA, Wako Pure Chemical Industries, Ltd., Dainippon Sumitomo Pharma Co., Ltd. и тому подобных.
Концентрация в среде добавки B-27 при ее использовании составляет от 0,01 до 10 масс.%, предпочтительно, от 0,1 до 2 масс.%.
[0030]
На этой стадии предпочтительно по существу не использовать питающие клетки и/или экстракт питающих клеток. То есть, среда, подлежащая использованию на этой стадии, предпочтительно представляет собой среду, по существу не содержащую питающие клетки и/или экстракт питающих клеток, предпочтительнее, среду, полностью свободную от питающих клеток и/или экстракта питающих клеток.
В настоящем описании, по существу не содержащая питающие клетки и/или экстракт питающих клеток означает, что содержание питающих клеток и/или экстракта питающих клеток в среде составляет менее чем примерно 5 об.%, предпочтительно, менее чем примерно 1 об.%, предпочтительнее, менее чем примерно 0,01 об.%.
Когда питающие клетки и/или экстракт питающих клеток по существу не используется на этой стадии, то панкреатические гормонпродуцирующие клетки, получаемые этим способом получения по настоящему изобретению, меньше загрязнены веществом, вызывающим отторжение (например, клетками животного происхождения).
[0031]
Культивирование на этой стадии в целом выполняется с использованием культуральных сосудов. Хотя такой культуральный сосуд конкретно не ограничивается, пока могут культивироваться стволовые клетки, для получения адгезионной культуры желательно использование сосуда для адгезионной культуры клеток, а сосуд для не адгезионной клеточной культуры желательно используется для получения «плавающей» культуры. Примеры культурального сосуда включают колбу, колбу для культуры ткани, чашку, чашку Петри, чашку для культуры ткани, чашку для множественных культур, микропланшет, микролуночный планшет, мультилуночный планшет, микропредметное стекло, камерное предметное стекло, шале, пробирку, лоток, культуральный мешок и вращающийся флакон. Сосуд для адгезионной культуры клеток представляет собой культуральный сосуд, покрытый любой поддерживающей клетки подложкой, такой как внеклеточная матрица (ECM) и тому подобная, с тем, чтобы улучшить адгезионную способность клеток к поверхности культурального сосуда.
Примеры культурального сосуда для адгезиионной культуры включают чашку, колбу, микропланшет, пластину для клеточной культуры и топу подобные. Этим культуральным сосудам может придаваться гидрофильность для улучшения адгезионной способности с клеткой или они могут покрываться поддерживающими клетки подложками, такими как коллаген, желатин, поли-L-лизин, поли-D-лизин, ламинин, фибронектин и тому подобные. Пластина для клеточной культуры относится к подкладке, предназначенной для культивирования клеток в подобной листу форме, и имеется в продаже, например, от компании OptiCell (Nunc).
В качестве поддерживающей клетки подложки на этой стадии предпочтительными являются коллаген I типа, матригель BD (Nippon Becton Dickinson Company, Ltd.), фибронектин (Invitrogen) и тому подобные, более предпочтительными являются матригель BD и фибронектин, и еще более предпочтительным является фибронектин.
Примеры культурального сосуда для «плавающей» культуры включают чашку, колбу, микропланшет, пробирку, вращающийся флакон и тому подобные. Эти культуральные сосуды могут быть выполнены из гидрофобного материала или покрыты материалом, предотвращающим адсорбцию клетки и белка, таким как гидрогель, липид и тому подобные. Для эффективного образования клеточных агрегатов желательно используется культуральный сосуд, имеющий U- или V-образное дно.
[0032]
Другие условия культивирования могут быть определены соответствующим образом. Например, температура культивирования конкретно не ограничивается, пока она подходит для культуры подлежащих использованию стволовых клеток, и может составлять примерно 30-40°C, предпочтительно, примерно 37°C. Концентрация CO2 может составлять примерно 1-10%, предпочтительно, примерно 2-5%. Парциальное давление кислорода может составлять 1-10%.
[0033]
Стадия (2): стадия культивирования клеток, полученных на указанной выше стадии (1) в среде, содержащей ингибитор GSK3
Эта стадия выполняется после указанной выше стадии (1) и соответствует стадии индукции дифференциации стволовых клеток в эндодермальные клетки вместе с указанной ниже стадией (3).
[0034]
GSK3 (гликогенсинтазакиназа 3), которая представляет собой серин-треонин-протеинкиназу, вовлечена во многие пути передачи сигналов, связанные с продукцией гликогена и апоптозом, поддержанием стволовых клеток и тому подобным. GSK3 включает изоформы GSK3α и GSK3β, которые кодируются различными генами, и имеют высокую гомологию на уровне аминокислотной последовательности. Известно, что GSK3 также вовлечена в передачу сигнала Wnt, и ингибирование GSK3 активирует сигнал Wnt.
Примеры ингибитора GSK3 включают ингибитор GSK3α и ингибитор GSK3β. На этой стадии желателен ингибитор GSK3β.
Определенные примеры ингибитора GSK3 включают CHIR98014 (2-[[2-[(5-нитро-6-аминопиридин-2-ил)амино]этил]амино]-4-(2,4-дихлорфенил)-5-(1H-имидазол-1-ил)пиримидин), CHIR99021, кенпауллон, AR-AO144-18, TDZD-8 (4-бензил-2-метил-1,2,4-тиадиазолидин-3,5-дион), SB216763 (3-(2,4-дихлорфенил)-4-(1-метил-1H-индол-3-ил)-1H-пиррол-2,5-дион), BIO, TWS-119 (3-[6-(3-аминофенил)-7H-пиррол[2,3-d]пиримидин-4-илокси]фенол), SB415286 (2-(3-хлор-4-гидроксифениламино)-3-(2-нитрофенил) малеимид [2-[2,5-дигидро-4-[(3-хлор-4-гидроксифенил)амино]-2,5-диоксо-1H-пиррол-3-ил]фенил]оксилат иминия) и тому подобные. Эти соединения могут быть закуплены у компаний Axon Medchem BV, Wako Pure Chemical Industries, Ltd., Enzo Life Sciences, Inc., Merck Biosciences, Tocris bioscience, Stemgent, Sigma и тому подобных.
Кроме того, в качестве ингибитора GSK3 могут использоваться антисмысловой олигонуклеотид, siRNA (малая интерферирующая РНК) и тому подобные для мРНК GSK3. Все из них имеются в продаже или могут быть синтезированы в соответствии с опубликованными документами.
Известен способ применения пептида Wnt-3A для индукции дифференциации стволовых клеток в эндодермальные клетки (не патентные документы 1, 2 и 5). На этой стадии лучшая производительность, воспроизводимость и селективность могут быть обеспечены использованием ингибитора GSK3, который представляет собой соединение с низкой молекулярной массой.
Ингибитор GSK3 представляет собой предпочтительно CHIR99021 (6-[[2-[[4-(2,4-дихлорфенил)-5-(4-метил-1H-имидазол-2-ил)-2-пиримидинил]амино]этил]амино]никотинонитрил) или BIO ((2'Z,3'E)-6-броминдирубин-3'-оксим).
На этой стадии могут использоваться один и любые комбинации двух или более видов ингибиторов GSK3.
Хотя концентрация ингибитора GSK3 в среде должным образом определяется в соответствии с видом подлежащего применению ингибитора, она в целом составляет от 0,01 до 100 мкМ, предпочтительно, от 0,1 до 10 мкМ. Когда используется CHIR99021, то концентрация в целом составляет от 0,1 до 20 мкМ, предпочтительно, от 1 до 5 мкМ, а когда используется BIO, то концентрация в целом составляет от 0,01 до 5 мкМ, предпочтительно от 0,1 до 2 мкМ.
Когда множественные виды ингибиторов GSK3 используются в комбинации, то количества каждого ингибитора должным образом увеличиваются или уменьшаются на основании указанного выше диапазона концентрации.
[0035]
Среда, подлежащая использованию на этой стадии, конкретно не ограничивается, пока она содержит ингибитор GSK3, и в целом представляет собой среду, используемую для культивирования стволовых клеток (основную среду), в которую добавляется ингибитор GSK3.
Указанная выше основная среда включает среду BME, среду BGJb, среду CMRL 1066, среду Glasgow MEM, усовершенствованную среду MEM Zinc Option, среду IMDM, среду Medium 199, среду Eagle MEM, среду αMEM, среду DMEM, бессывороточную среду DMEM/F12, среду Хэма, среду RPMI 1640, среду Фишера и среду из их смеси и тому подобные. Основная среда, подлежащая использованию на этой стадии, конкретно не ограничивается, пока ее можно использовать для культивирования клеток животных. Эти основные среды могут быть закуплены у компаний Invitrogen, SIGMA, Wako Pure Chemical Industries, Ltd., Dainippon Sumitomo Pharma Co., Ltd. и тому подобных.
Основная среда, подлежащая использованию на этой стадии, предпочтительно представляет собой бессывороточную среду DMEM/F12, среду RPMI 1640 и усовершенствованную среду MEM Zinc Option, особенно предпочтительно, бессывороточную среду DMEM/F12.
[0036]
В качестве среды, подлежащей использованию на этой стадии, предпочтительна среда, по существу не содержащая сыворотку и/или сывороточный экстракт, и предпочтительнее среда, не содержащая сыворотку.
На этой стадии предпочтительно по существу не использовать питающие клетки и/или экстракт питающих клеток, и предпочтительнее, вообще не использовать питающие клетки и/или экстракт питающих клеток.
Когда по существу не используются питающие клетки и экстракт питающих клеток, то панкреатический гормон-продуцирующая клетка, полученная способом получения по настоящему изобретению, содержит меньшее количество вещества (например, клетки животного происхождения), вызывающего отторжение.
[0037]
Среда, подлежащая использованию на этой стадии, может также содержать заменитель сыворотки.
Примеры заменителя сыворотки включают альбумин, трансферрин, жирную кислоту, предшественник коллагена, микроэлемент (например, цинк, селен), добавку B-27, добавку N2, заменитель сыворотки от нокаутных животных, 2-меркаптоэтанол, 3'-тиоглицерин или их эквиваленты. Заменитель сыворотки, подлежащий использованию на этой стадии, представляет собой предпочтительно заменитель B-27.
Концентрация в среде заменителя B-27 при его использовании составляет от 0,01 до 10 масс.%, предпочтительно, от 0,1 до 2 масс.%. Эти заменители сыворотки могут быть закуплены у компаний Invitrogen, SIGMA, Wako Pure Chemical Industries, Ltd., Dainippon Sumitomo Pharma Co., Ltd. и тому подобных.
[0038]
Хотя температура культивирования на этой стадии конкретно не ограничивается, пока она подходит для культивирования подлежащих использованию стволовых клеток, она составляет примерно 30-40°C, предпочтительно примерно 37°C.
Время культивирования составляет от 6 до 144 ч, предпочтительно, от 12 до 72 ч, при температуре культуры примерно 37°C. Культивирование на этой стадии в целом выполняется в инкубаторе, аэрируемом примерно 1-10%, предпочтительно, 5% CO2.
[0039]
Стадия (3): стадия культивирования клеток, полученных на указанной выше стадии (2), в среде, содержащей ингибитор GSK3 и активатор подобной рецептору активина киназы-4,7
Эта стадия выполняется после указанной выше стадии (2) и соответствует стадии завершения индукции дифференциации стволовых клеток в эндодермальные клетки.
[0040]
Активатор подобной рецептору активина киназы (ALK)-4,7, используемый на этой стадии, выбирается из веществ, оказывающих активирующее действие на ALK-4 и/или ALK-7.
Примеры активатора подобной рецептору активина киназы-4,7, используемого на этой стадии, включают активин, Nodal и Myostatin. Все эти активаторы имеются в продаже. Из них, активин предпочтителен в качестве активатора подобной рецептору активина киназы-4,7, используемого на этой стадии.
Указанный выше активин представляет собой пептидный фактор клеточной пролиферации и дифференциации, относящийся к семейству TGFβ (трансформирующего фактора роста β), где две β субъединицы составляют димер посредством связи SS (Ling, N., et al., (1986) Nature 321, 779-782; Vale, W., et al., (1986) Nature 321, 776-779). В настоящем изобретении может использоваться любой из активинов A, B, C, D и AB, и активина, полученного из любого животного, такого как человек, мышь и тому подобные, и они имеются в продаже. Из них, предпочтительно используется активин A. Предпочтительно используется активин, полученный из того же вида животного, что и стволовые клетки, подлежащие использованию для дифференциации. Например, в качестве исходного материала используются стволовые клетки, полученные у человека, предпочтительно используется человеческий активин A.
Хотя концентрация активатора подобной рецептору активина киназы-4,7 в среде на этой стадии должным образом определяется в соответствии с видом активатора подобной рецептору активина киназы-4,7, концентрация человеческого активина A, используемого в качестве активатора подобной рецептору активина киназы-4,7, составляет в целом от 0,1 до 200 нг/мл, предпочтительно, от 5 до 150 нг/мл, особенно предпочтительно, от 10 до 100 нг/мл.
На этой стадии могут использоваться один и любая комбинация двух или более видов активаторов подобной рецептору активина киназы-4,7. Когда множество видов активаторов используются в комбинации, количества каждого активатора должным образом увеличиваются или уменьшаются на основании указанного выше диапазона концентрации. На этой стадии активатор подобной рецептору активина киназы-4,7 добавляют к среде вместе с ингибитором GSK3. Когда стволовые клетки культивируются в присутствии активина и ингибитора GSK3, то клетки могут предпочтительнее дифференцироваться в эндодермальные клетки.
[0041]
Примеры ингибитора GSK3, подлежащего использованию на этой стадии, включают ингибитор GSK3α и ингибитор GSK3β. В качестве ингибитора GSK3, подлежащего использованию на этой стадии, предпочтителен ингибитор GSK3β.
Конкретные примеры ингибитора, подлежащего использованию на этой стадии, включают те, которые аналогичны ингибиторам GSK3, приведенным в качестве примера на указанной выше стадии (2). Также на этой стадии предпочтительно используется CHIR99021 или BIO, который представляет собой ингибитор GSK3. Хотя концентрация ингибитора GSK3 в среде должным образом определяется в соответствии с видом подлежащего использованию ингибитора, концентрация CHIR99021 при использовании составляет в целом от 0,1 до 20 мкМ, предпочтительно, от 1 до 5 мкМ, а концентрация BIO при его использовании составляет в целом от 0,01 до 5 мкМ, предпочтительно, от 0,1 до 2 мкМ.
На этой стадии можно использовать один и любую комбинацию двух или более видов ингибитора GSK3. Когда множественные виды ингибиторов используются в комбинации, то количества каждого ингибитора должным образом увеличиваются или уменьшаются на основании указанного выше диапазона концентрации.
[0042]
На этой стадии активатор подобной рецептору активина киназы-4,7 и ингибитор GSK3 можно одновременно добавлять в среду или можно отдельно добавлять к среде в «шахматном» порядке, пока может быть индуцирована дифференциация стволовых клеток в эндодермальные клетки. Удобно и предпочтительно, чтобы активатор подобный рецептору активина киназы-4,7 и ингибитор GSK3 одновременно добавлялись к среде.
[0043]
Среду, подлежащую использованию на этой стадии, получают добавлением активатора подобной рецептору активина киназы-4,7 и ингибитора GSK3 к основной среде, примеры которой приведены на указанной выше стадии (2).
Среда, подлежащая использованию на этой стадии, может быть получена с использованием некоторого вида основной среды, как та, которая используется на указанной выше стадии (2), или с использованием другого вида основной среды. Предпочтительна среда, полученная с использованием такого же вида основной среды (например, бессывороточной среды DMEM/F12).
Основная среда, подлежащая использованию на этой стадии, представляет собой предпочтительно бессывороточную среду DMEM/F12, среду RPMI 1640 и усовершенствованную среду MEM Zinc Option, особенно предпочтительно, бессывороточную среду DMEM/F12.
[0044]
На этой стадии предпочтительно по существу не использовать питающие клетки и/или экстракт питающих клеток. А предпочтительнее вообще не использовать питающие клетки и/или экстракт питающих клеток.
В качестве среды, подлежащей использованию на этой стадии, предпочтительна среда, по существу не содержащая сыворотку и/или экстракт сыворотки, и более предпочтительной является бессывороточная среда.
Когда питающие клетки и экстракт питающих клеток по существу не используются, то панкреатический гормонпродуцирующая клетка, продуцируемая способом получения по настоящему изобретению, содержит меньшее количество веществ (например, полученные у животных клетки), вызывающих отторжение.
Среда, подлежащая использованию на этой стадии, может также содержать заменитель сыворотки.
Примеры заменителя сыворотки включают альбумин, трансферрин, жирную кислоту, предшественник коллагена, микроэлемент (например, цинк, селен), добавку B-27, добавку N2, заменитель сыворотки от нокаутных животных, 2-меркаптоэтанол, 3'-тиоглицерин или их эквиваленты, причем предпочтение отдается заменителю B-27. Концентрация в среде заменителя B-27 при его использовании составляет от 0,01 до 10 масс.%, предпочтительно, от 0,1 до 2 масс.%.
Хотя температура культивирования на этой стадии конкретно не ограничивается, пока она подходит для культивирования подлежащих использованию клеток, она составляет примерно 30-40°C, предпочтительно примерно 37°C.
Время культивирования составляет от 6 до 288 ч, предпочтительно, от 12 до 124 ч, при температуре культивирования примерно 37°C. Культивирование на этой стадии в целом выполняется в инкубаторе, аэрируемом примерно 1-10%, предпочтительно, 5% CO2.
[0045]
На этой стадии, индукция дифференциации стволовых клеток в эндодермальные клетки подтверждается с использованием эндодермальных маркеров. В частности, подтверждение может выполняться оценкой присутствия или отсутствия экспрессии белка или гена, который специфически экспрессирован в эндодермальных клетках (эндодермальный маркер). Экспрессию белка можно оценить способом с использованием реакции между антигеном и антителом и тому подобных, а экспрессию гена можно оценить способом с использованием RT-PCR и тому подобными. Примеры маркера включают SOX17 (определяющую пол область Y), ген Goosecoid (goosecoid homeobox), рецептор CXCR4 (рецептор 4 хемокина (мотив C-X-C)) и FOXA2 (белок forkhead box A2).
[0046]
Стадия (4): стадия образования клеточной массы (сферы) из клеток, полученных на указанной выше стадии (3), и культивирования клеточной массы в суспензионном состоянии в среде
На этой стадии клетки, полученные на указанной выше стадии (3), которые дифференцировались в эндодермальные клетки, а именно, эндодермальные клетки, образуют клеточную массу, и клеточную массу культивируют в суспензионном состоянии в среде (стадия пересева).
[0047]
В настоящем описании, клеточная масса относится к состоянию, при котором множественные клетки сцепляются и, подобным образом, прикрепляются друг к другу для образования одной массы (например, состоянию, при котором 10 или более клеток сцепляются друг с другом), и представляет собой концепцию, противоположную изолированной клетке и почти изолированной клетке. Изолированная клетка относится к одной клетке в независимом состоянии без сцепления с другой клеткой. Почти изолированная клетка относится к группе из нескольких клеток, сцепленных с 1 или 2 другими клетками, или собранных слабой силой сцепления, которая обеспечивает возможность легкого отделения друг от друга.
На этой стадии клеточная масса относится к состоянию, при котором множество (например, 10 или более) клеток (эндодермальных клеток), полученных на указанной выше стадии (3), сцепляются друг с другом для образования массы.
Клеточная масса, изолированные клетки и почти изолированные клетки могут различаться числом собранных клеток (например, клеточная масса, когда собираются 3 или более клеток), или могут различаться площадью одной собранной группы клеток в увеличенном плоскостном изображении клеточной суспензии под оптическим микроскопом и тому подобными параметрами.
Например, когда размер (радиус) клетки составляет примерно 10 мкм, то ее площадь в разрезе составляет примерно 300 мкм2. Поэтому, например, когда площадь области образования одной собранной группы клеток составляет менее чем 300 мкм2, то их можно определить как изолированные клетки или почти изолированные клетки, а когда она больше чем 900 мкм2 (то есть, соответствует 3 клеткам), то она может быть определена как клеточная масса. Когда 10 или более клеток сцепляются друг с другом для образования клеточной массы, то предполагается, что ее площадь в разрезе составляет 3000 мкм2 или более.
[0048]
В настоящем описании, «культивировать в суспензионном состоянии» означает культивирование в среде в не адгезионных условиях. Культивирование в не адгезионных условиях означает культивирование в состоянии без адгезии к культуральному сосуду или подложке (например, с использованием не адгезионного многолуночного планшета).
Культивирование в не адгезионных условиях может выполняться по существу известным способом. Примеры такого способа включают способ, включающий нанесение гидрофильного вещества протеогликана, такого как поли(гидроксиэтилметакрилат) и тому подобного на поверхность культурального сосуда для ингибирования клеточной адгезии к подложке (Cell Struct Funct, 13, 179(1988)), и способ, включающий нанесение синтетического полимерного соединения, которое растворяется в культуральной среде охлаждением, на поверхность культурального сосуда, давая возможность клеткам прикрепиться к ней, и растворения синтетического полимерного соединения охлаждением культурального сосуда для образования клеточного пласта (Bio Technology, 8, 854(1990)). Эти способы могут быть при необходимости усовершенствованы. Например, для предотвращения потери клеток во время обмена культуральных сред, возможно однократное подвергание культурального сосуда операции центрифугирования для принудительного прикрепления клеточной массы к поверхности культурального сосуда и смены культуральной среды или перенести культуральную среду, включающую клетки, в центрифужную пробирку, осадить клетки операцией центрифугирования и заменить среду в супернатанте.
[0049]
На этой стадии, перед образованием клеточной массы к клеткам, полученным на указанной выше стадии (3) (эндодермальным клеткам) можно добавить переваривающий белок фермент для отделения каждой клетки для получения отделившихся клеток.
Примеры подходящего переваривающего белок фермента включают без ограничения трипсин, коллагеназу, папаин, диспазу, аккутазу (Invitrogen, торговое название) и тому подобные. Эти переваривающие белок ферменты обычно используются в форме раствора трипсина-ЭДТА (например, 0,25% трипсин-1 мМ ЭДТА) добавлением ЭДТА для хелатирования Ca2+ и Mg2+, которые являются ингибиторами переваривающих ферментов.
[0050]
На этой стадии, например, клеточная масса, может быть получена следующим образом из клеток, полученных на указанной выше стадии (3).
То есть, клетки, полученные на указанной выше стадии (3), подвергают культивированию в «плавающей» культуре в подходящей среде на культуральном сосуде. Например, когда 96-луночный планшет с круглым дном используется в качестве низкоадгезионного культурального сосуда, то высевают 20000-400000 клеток на лунку в подходящей среде при 37°C в течение от примерно 6 ч до примерно 10 дней, предпочтительно, от примерно 6 ч до примерно 2 дней, предпочтительнее, 1 день, с переносом или без переноса образованных агрегатов в низкоадгезионную чашку диаметром 6 см и тому подобные сосуды. Примеры низкоадгезионного культурального сосуда включают те, которые в целом используются в этой технической области, и обрабатываются для обеспечения низкой адгезии. Примеры культурального сосуда включают культуральную чашку, культуральную колбу, аппарат для культивирования во вращающемся сосуде (вращающейся колбе и т.д.) и тому подобные, в частности, сфероидный планшет. В качестве обработки для обеспечения низкой адгезивности, используют обработку для подавления адгезии белка и клеток образованием ковалентной связи (покрытия) из гидрогеля.
[0051]
Конкретнее, на этой стадии клетки, полученные на указанной выше стадии (3), высевают на 96-луночный сфероидный планшет, например, при плотности 2×104 клеток на лунку и культивируют в условиях 37°C и 5% CO2 в течение 1 дня в усовершенствованной среде MEM Zinc Option с добавлением добавки 1% B-27.
[0052]
На этой стадии, клеточную массу, полученную, как указано выше, культивируют в суспензионном состоянии в среде. Культура в суспензионном состоянии означает, как указано выше, культуру в состоянии без адгезии к культуральному сосуду или подложке (например, с использованием не адгезионного многолуночного планшета).
Примеры среды, подлежащей использованию на этой стадии (то есть, среды для пересева), включают основные среды, приведенные в качестве примера на указанной выше стадии (2). Среда, подлежащая использованию на этой стадии, может быть получена использованием того же вида основной среды, как на указанных выше стадиях (2)-(3), или с использованием другой основной среды. Поскольку индукцию дифференциации в панкреатические гормонпродуцирующие клетки можно выполнять более эффективно, для этой стадии предпочтительно в качестве основной среды используют усовершенствованную среду MEM Zinc Option (Invitrogen). Среда может быть также получена в соответствии с известным документом (Richter A. et al., National Cancer (1972) 49, 1705).
[0053]
Среда, подлежащая использованию на этой стадии, может также содержать заменитель сыворотки. Примеры заменителя сыворотки включают альбумин, трансферрин, жирную кислоту, предшественник коллагена, микроэлемент (например, цинк, селен), добавку B-27 добавку N2, заменитель сыворотки от нокаутных животных, 2-меркаптоэтанол, 3'-тиоглицерин или их эквиваленты. В качестве заменителя сыворотки, подлежащего использованию на этой стадии, предпочтительна добавка B-27.
[0054]
На этой стадии особенно предпочтительно используют усовершенствованную среду MEM Zinc Option (Invitrogen) с добавлением добавки B-27. Концентрация добавки B-27 в среде составляет 0,01-10 масс.%, предпочтительно 0,1-2 масс.%.
[0055]
На этой стадии предпочтительно по существу не использовать питающие клетки и/или экстракт питающих клеток, и предпочтительнее, вообще не использовать питающие клетки и/или экстракт питающих клеток.
Когда по существу не используются питающие клетки и/или экстракт питающих клеток, то вещество (например, полученные у животных клетки), вызывающее отторжение, содержится в меньшем количестве.
В качестве среды, подлежащей использованию на этой стадии, предпочтительна среда, по существу не содержащая сыворотку и/или сывороточный экстракт, и более предпочтительна бессывороточная среда.
[0056]
Хотя температура культивирования конкретно не ограничивается, пока она подходит для культивирования подлежащих использованию клеток, она составляет примерно 30-40°C, предпочтительно примерно 37°C.
Время культивирования составляет от 6 до 360 ч, предпочтительно, от примерно 1 дня до примерно 12 дней, предпочтительнее, примерно 8 дней.
Когда клеточная масса образуется в суспензионном состоянии, то после образования клеточной массы, клеточная масса может также подвергаться стадии (5) без подвергания культивированию в «плавающей» культуре. В этом случае образованная клеточная масса может культивироваться в суспензионном состоянии в течение 0-48 ч, предпочтительно, 0-24 ч, перед выполнением стадии (5).
Культивирование на этой стадии в целом выполняют в инкубаторе, аэрируемом примерно 1-10%, предпочтительно 5% CO2.
[0057]
Конкретнее, на этой стадии клетки, полученные на указанной выше стадии (3), высевают на 96-луночный сфероидный планшет, например, при плотности 2×104 клеток на лунку, и культивируют в условиях 37°C и 5% CO2 в течение 1 дня в усовершенствованной среде MEM Zinc Option с добавлением добавки 1% B-27.
[0058]
На этой стадии (4) панкреатические гормонпродуцирующие клетки могут быть также получены с использованием в качестве исходного материала эндодермальных клеток, отличных от клеток, полученных указанными выше стадиями (1)-(3). Поэтому, настоящее изобретение также относится, посредством данной стадии (4) к способу получения панкреатических гормонпродуцирующих клеток с использованием эндодермальных клеток в качестве исходного материала, то есть, к способу получения панкреатических гормонпродуцирующих клеток, включающему образование клеточной массы из эндодермальных клеток, и культивирование клеточной массы в суспензионном состоянии в среде (иногда сокращенно называемому в настоящем описании способом получения 2 по настоящему изобретению).
Способ получения панкреатических гормонпродуцирующих клеток с использованием в качестве исходного материала эндодермальных клеток, отличных от клеток, полученных указанными выше стадиями (1)-(3), может также выполняться таким же образом как на стадии (4) способа получения панкреатических гормонпродуцирующих клеток с использованием клеток, полученных на указанной выше стадии (3), в качестве исходного материала.
Конкретнее, способ получения 2 по настоящему изобретению характеризуется подверганием эндодермальных клеток следующим стадиям (4') и (5').
(4') стадия образования клеточной массы из эндодермальных клеток, и культивирования клеточной массы в суспензионном состоянии в среде
(5') стадия культивирования клеток, полученных на указанной выше стадии (4') в среде, содержащей агонист рецептора ретиноевой кислоты, ингибитор АМФ-активируемой протеинкиназы и/или ингибитор подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы-4,5,7 и фактор клеточного роста
Стадия (4') может выполняться таким же образом как указанная выше стадия (4), а стадия (5') может выполняться таким же образом как указанная выше стадия (5).
[0059]
Панкреатические гормонпродуцирующие клетки в форме, больше имитирующей панкреатогенез, могут быть получены этой стадией, предпочтительнее, указанной выше стадией (1)-(3) с последующей этой стадией (4). Поскольку эти клетки образуют трехмерную структуру клеточной массы, они считаются более близкими к состоянию в организме и более функциональными, чем клетки, культивированные в одном слое. Кроме того, вследствие трехмерной структуры, эти клетки считаются более подходящими для применения в клеточной терапии, по сравнению с панкреатическими гормонпродуцирующими клетками, полученными обычными способами получения.
[0060]
Стадия (5): стадия культивирования клеток, полученных на указанной выше стадии (4) в среде, содержащей агонист рецептора ретиноевой кислоты, ингибитор АМФ-активируемой протеинкиназы и/или ингибитор подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы-4,5,7 и фактор клеточного роста
Эта стадия соответствует стадии индукции дифференциации клеток, полученных на указанной выше стадии (4), а именно, эндодермальных клеток, культивированных в суспензионном состоянии в клетки-предшественники панкреатических гормонпродуцирующих клеток.
[0061]
Агонист рецептора ретиноевой кислоты (RAR), подлежащий использованию на этой стадии, может представлять собой естественно встречающийся ретиноид или синтезированный ретиноид, соединение агониста рецептора ретиноевой кислоты без ретиноидного скелета или естественно встречающееся вещество, обладающее эквивалентной активностью. Примеры естественно встречающихся ретиноидов включают ретиноевую кислоту (стереоизомеры полностью транс-ретиноевой кислоты (известны полностью транс-RA) и 9-цис-ретиноевая кислота (9-цис-RA)). Синтезированный ретиноид известен в данной области (патент США № 5234926, патент США № 4326055 и т.д.). Примеры соединения агониста ретиноевой кислоты без ретиноидного скелета включают Am80, TTNPB и AC55649. Примеры естественно встречающегося вещества включают гонокиол и магнолол (Annual Report of Research Institute for Biological Function 9:55-61, 2009). Агонист RAR, подлежащий использованию на этой стадии, представляет собой предпочтительно ретиноевую кислоту. Хотя концентрация агониста RAR в среде должным образом определяется в соответствии с видом подлежащего использованию типа RAR, концентрация ретиноевой кислоты при ее использовании составляет в целом от 0,1 до 100 мкМ, предпочтительно, от 0,5 до 10 мкМ.
[0062]
Ингибитор АМФ-активируемой протеинкиназы и/или подобной рецептору активина киназы-2,3,6, подлежащий использованию на этой стадии, выбирают из группы, состоящей из соединений, обладающих ингибиторной активностью в отношении АМФ-активируемой протеинкиназы (AMPK), соединений, обладающих ингибиторной активностью в отношении подобной рецептору активина киназы (ALK)-2,3,6, и соединений, обладающих ингибиторной активностью в отношении АМФ-активируемой протеинкиназы, и ингибиторной активностью в отношении подобной рецептору активина киназы-2,3,6 в комбинации.
[0063]
Примеры соединения, обладающего ингибиторной активностью в отношении AMPK, включают дорсоморфин (6-[4-(2-пиперидин-1-илэтокси)фенил]-3-пиридин-4-илпиразоло[1,5-a]пиримидин), araA (аденин-9-β-D-арабинофуранозид), C75 и тому подобные. Подобную рецептору активина киназу (ALK) классифицировали на несколько типов, и ALK-2,3,6 известен как рецептор киназы BMP I типа, и указанный ниже ALK-4,5,7 известен как рецептор киназы I типа суперсемейства TGF-β. В качестве соединений, обладающих ингибиторной активностью в отношении ALK-2,3,6, можно указать дорсоморфин, LDN-193189 (6-(4-пиперазинофенил)-3-(хинолин-4-ил)пиразоло[1,5-a]пиримидин) и тому подобные. Дорсоморфин обладает и ингибиторной активностью в отношении AMPK, и ингибиторной активностью в отношении ALK-2,3,6. В качестве ингибитора АМФ-активируемой протеинкиназы и/или подобной рецептору активина киназы-2,3,6, предпочтителен дорсоморфин.
Эти соединения могут быть закуплены у компаний SIGMA, Tocris bioscience, Stemgent, Merck Biosciences и тому подобных.
[0064]
Кроме того, антисмысловой олигонуклеотид, siРНК (малая интерферирующая РНК) мРНК GSK3 для АМФ-активируемой протеинкиназы или ALK-2,3,6 и тому подобные могут также использоваться в качестве ингибитора АМФ-активируемой протеинкиназы и/или подобной рецептору активина киназы-2,3,6. На этой стадии, кроме того, когда подтверждается увеличение содержания факторов дифференциации, относящихся к семейству BMP, или секреции этих факторов дифференциации из клеток в условиях культивирования в среду, то антитело, которое нейтрализует активность этих факторов дифференциации или Noggin, Chordin, Cerberus, Gremlin и тому подобные, которые, как известно, связываются с BMP для ингибирования его действия, также могут использоваться в качестве ингибитора АМФ-активируемой протеинкиназы и/или ALK-2,3,6.
[0065]
Когда подтверждается увеличение или секреция активина клетками в условиях культивирования в среду, приведенные в качестве примера на указанной выше стадии (3) в качестве активатора подобной рецептору активина киназы-4,7, то в качестве ингибитора АМФ-активируемой протеинкиназы и/или ALK-2,3,6 также может использоваться антитело, которое, как известно, нейтрализует активность активина, или фоллистатин, который, как известно, связывается с активином для ингибирования его действия.
[0066]
Хотя концентрация ингибитора АМФ-активируемой протеинкиназы и/или подобной рецептору активина киназы-2,3,6 в среде должным образом определяется в соответствии с подлежащим использованию ингибитором, концентрация дорсоморфина при его использовании составляет в целом от 0,1 до 20 мкМ, предпочтительно, от 0,2 до 5 мкМ.
[0067]
В качестве ингибитора подобной рецептору активина киназы (ALK)-4,5,7, подлежащего использованию на этой стадии, можно указать SB-431542, SB-505124 (2-(5-бензо[1,3]диоксол-5-ил-2-трет-бутил-3H-имидазол-4-ил)-6-метилпиридина гидрохлорид), SB-525334 (6-[2-трет-бутил-5-(6-метил-пиридин-2-ил)-1H-имидазол-4-ил]-хиноксалин), A-83-01 (3-(6-метил-2-пиридил)-N-фенил-4-(4-хинолинил)-1H-пиразол-1-тиокарбоксамид), GW6604, LY-580276 (2-(6-метил-2-пиридинил)-3-(4-фторфенил)-5,6-дигидро-4H-пиррол[1,2-b]пиразол) и SD-208 (2-(5-хлор-2-фторфенил)-N-(пиридин-4-ил)пиридо[2,3-d]пиримидин-4-амин) и тому подобные.
Они могут быть закуплены у компаний SIGMA, Tocris bioscience, Wako Pure Chemical Industries, Ltd. и тому подобных. Кроме того, антисмысловой олигонуклеотид и siРНК мРНК для ALK-4,5,7 могут также использоваться в качестве ингибитора ALK-4,5,7.
[0068]
В качестве ингибитора ALK-4,5,7, подлежащего использованию на этой стадии, предпочтителен SB-431542 (4-[4-(1,3-бензодиоксол-5-ил)-5-(2-пиридинил)-1H-имидазол-2-ил]-бензамид или его гидрат). Хотя концентрация ингибитора подобной рецептору активина киназы-4,5,7 в среде должным образом определяется в соответствии с видом подлежащего использованию ингибитора, концентрация SB-431542 при его использовании составляет в целом от 0,1 до 50 мкМ, предпочтительно, от 1 до 20 мкМ.
[0069]
Примеры фактора клеточного роста, подлежащего использованию на этой стадии, включают сосудистый эндотелиальный фактор роста (VEGF), фактор роста гепатоцитов (HGF), фактор роста стволовых клеток (SCF), эпителиальный фактор роста (EGF), различные факторы роста фибробластов (a/bFGF) и тому подобные. Особенно предпочтителен основной фактор роста фибробластов (bFGF).
Хотя концентрация фактора клеточного роста в среде должным образом определяется в соответствии с видом подлежащего использованию фактора, концентрация bFGF при его использовании составляет в целом от 1 до 200 нг/мл, предпочтительно, от 20 до 100 нг/мл.
[0070]
Эта стадия выполняется в среде, содержащей все 4 вида компонентов указанного выше агониста рецептора ретиноевой кислоты, ингибитор активируемой АМФ протеинкиназы и/или подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы-4,5,7 и фактор клеточного роста.
На этой стадии агонист рецептора ретиноевой кислоты, ингибитор активируемой АМФ протеинкиназы и/или подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы-4,5,7 и фактор клеточного роста могут одновременно добавляться к среде или добавляться к среде с определенным интервалом времени, пока может быть индуцирована дифференциация в клетки-предшественники панкреатических гормонпродуцирующих клеток. Агонист рецептора ретиноевой кислоты, ингибитор активируемой АМФ протеинкиназы и/или подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы-4,5,7 и фактор клеточного роста удобно и предпочтительно добавляются к среде одновременно.
[0071]
Среду, подлежащую использованию на этой стадии, получают добавлением агониста рецептора ретиноевой кислоты, ингибитора активируемой АМФ протеинкиназы и/или подобной рецептору активина киназы-2,3,6, ингибитора подобной рецептору активина киназы-4,5,7 и фактора клеточного роста к основной среде, приведенной в качестве примера на указанной выше стадии (2).
Среда, подлежащая использованию на этой стадии, может быть получена использованием такого же вида основной среды как на указанной выше стадии (4) или использованием другой основной среды. Поскольку индукция дифференциации в клетки-предшественники панкреатических гормонпродуцирующих клеток может выполняться более эффективно, в качестве основной среды для этой стадии предпочтительно используется усовершенствованная среда MEM Zinc Option (Invitrogen).
[0072]
На этой стадии, предпочтительно по существу не использовать питающие клетки и/или экстракт питающих клеток, а предпочтительнее, вообще не использовать питающие клетки и/или экстракт питающих клеток.
Когда питающие клетки и экстракт питающих клеток по существу не используются, то вещество (например, клетки животного происхождения), вызывающее отторжение, содержится в меньшем количестве.
В качестве среды, подлежащей использованию на этой стадии, предпочтительна среда, по существу не содержащая питающие клетки и/или экстракт питающих клеток, а предпочтительнее, бессывороточная среда.
[0073]
Среда, подлежащая использованию на этой стадии, может также содержать заменитель сыворотки.
Примеры заменителя сыворотки включают альбумин, трансферрин, жирную кислоту, предшественник коллагена, микроэлемент (например, цинк, селен), добавку B-27, добавку N2, заменитель сыворотки от нокаутных животных, 2-меркаптоэтанол, 3'-тиоглицерин, или их эквиваленты. Заменителем сыворотки, подлежащим использованию на этой стадии, предпочтительно является заменитель B-27.
Концентрация заменителя сыворотки в среде при использовании B27 составляет от 0,01 до 10 масс.%, предпочтительно, 0,1-2 масс.%.
[0074]
Эта стадия выполняется культивированием при температуре культивирования, подходящей для культуры эндодермальной клетки, подлежащей использованию, которая в целом составляет 30-40°C, предпочтительно, примерно 37°C, в течение 72-288 ч, предпочтительно 120-216 ч, в CO2 инкубаторе, аэрируемом 1-10%, предпочтительно 5% диоксида углерода.
[0075]
На этой стадии индукция дифференциации эндодермальных клеток в клетки-предшественники панкреатических гормонпродуцирующих клеток может быть подтверждена оценкой присутствия или отсутствия экспрессии белка и гена, которые проявляют экспрессию, специфическую для клеток-предшественников панкреатических гормонпродуцирующих клеток (маркер для клеток-предшественников панкреатических гормонпродуцирующих клеток). Экспрессию белка можно оценить способом с использованием реакции антигена-антитела и тому подобной, а экспрессию гена можно оценить способом с использованием RT-PCR и тому подобного. Примеры маркера включают NGN3, HNF6 (ядерный фактор 6 гепатоцитов, aka: гомеобокс 1 с одним надрезом), PDX1 (панкреатический и дуоденальный гомеобокс 1) и тому подобные.
[0076]
Стадия (6): стадия культивирования клеток, полученных на указанной выше стадии (5)
Эта стадия соответствует стадии индукции дифференциации клеток-предшественников панкреатических гормонпродуцирующих клеток в панкреатические гормонпродуцирующие клетки.
[0077]
Основная среда, подлежащая использованию на этой стадии, может представлять собой среду, приведенную в качестве примера на указанной выше стадии (2). Основная среда, подлежащая использованию на этой стадии, может быть получена использованием такого же вида основной среды как на указанной выше стадии (5), или с использованием другой среды. Поскольку индукция дифференциации в панкреатические гормонпродуцирующие клетки может выполняться эффективнее, то в качестве основной среды для этой стадии предпочтительно используется усовершенствованная среда MEM Zinc Option (Invitrogen).
[0078]
На этой стадии, предпочтительно по существу не использовать питающие клетки и/или экстракт питающих клеток, а предпочтительнее, вообще не использовать питающие клетки и/или экстракт питающих клеток.
Когда питающие клетки и экстракт питающих клеток по существу не используются, то вещество (например, клетки животного происхождения), вызывающее отторжение, содержится в меньшем количестве.
В качестве среды, подлежащей использованию на этой стадии, предпочтительна среда, по существу не содержащая питающие клетки и/или экстракт питающих клеток, а предпочтительнее, бессывороточная среда.
[0079]
Среда, подлежащая использованию на этой стадии, может также содержать заменитель сыворотки. Примеры заменителя сыворотки включают альбумин (например, альбумин, обогащенный липидами), трансферрин, жирную кислоту, предшественник коллагена, микроэлемент (например, цинк, селен), добавку B-27, добавку N2, заменитель сыворотки от нокаутных животных, 2-меркаптоэтанол, 3'-тиоглицерин, или их эквиваленты. Из них, предпочтителен заменитель B-27. В частности, предпочтительно используется усовершенствованная среда MEM Zinc Option (Invitrogen) с добавлением добавки B27. Концентрация добавки B27 в среде составляет от 0,01 до 10 масс.%, предпочтительно, 0,1-2 масс.%. Кроме того, для повышения частоты выживания клеток к усовершенствованной среде MEM Zinc Option может добавляться добавка. Примеры такой добавки включают заменители сыворотки, такие как заменитель сыворотки от нокаутных животных, заменитель N2 и тому подобные, и тому подобные. Концентрация указанной выше добавки в среде составляет от 0,01 до 10 масс.%, предпочтительно, 0,1-2 масс.%.
[0080]
Предпочтительно, среда, подлежащая использованию на этой стадии, не содержит агонист рецептора ретиноевой кислоты, ингибитор АМФ-активируемой протеинкиназы и/или ингибитор подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы-4,5,7 и фактор клеточного роста. Поэтому, предпочтительно обменивать среду между стадией (5) и стадией (6).
[0081]
Эта стадия выполняется культивированием при температуре культивирования, подходящей для подлежащей использованию культуры клеток-предшественников панкреатических гормонпродуцирующих клеток, которая в целом составляет 30-40°C, предпочтительно, примерно 37°C, в течение 24-240 ч, предпочтительно 72-192 ч, в CO2 инкубаторе, аэрируемом 1-10%, предпочтительно 5% диоксида углерода.
На этой стадии индукция дифференциации клеток-предшественников панкреатических гормонпродуцирующих клеток в панкреатические гормонпродуцирующие клетки может быть подтверждена оценкой экспрессии белка и гена (маркер панкреатических гормонпродуцирующих клеток), которые проявляют специфическую для панкреатических гормонпродуцирующих клеток экспрессию, или измерением количества в среде секретируемого панкреатического гормона. Примеры маркера включают инсулин, глюкагон, панкреатический полипептид, соматостатин, PCSK1 (пропротеин конвертаза субтилизин/кексин типа 1), SUR1 (рецептор 1 сульфонилмочевины, aka: АТФ-связывающая кассета, член 8 подсемейства C (CFTR/MRP), NKX6.1 (NK6 гомеобокс 1), PAX6 (парный гомеобокс 6), NEUROD (нейрогенная дифференциация 1), ARX (гомеобокс, родственный Aristaless) и тому подобные.
[0082]
Как указано выше, настоящее изобретение относится к способу получения панкреатических гормонпродуцирующих клеток из стволовых клеток. Аналогичным способом, т.е., способом индукции дифференциации клеток в менее дифференцированном состоянии в более дифференцированное состояние, можно вызвать дифференциацию стволовых клеток в клетки в различных дифференцированных состояниях (эндодермальную клетку, клетку панкреатических протоков, панкреатическую эндокринную клетку, панкреатическую экзокринную клетку, общую для них клетку-предшественник и т.д.). Уровень индуцированной дифференциации можно узнать подтверждением присутствия или отсутствия экспрессии белка или гена, который экспрессируется специфически для каждой клетки.
[0083]
Используя способ получения по настоящему изобретению, можно эффективно индуцировать дифференциацию стволовых клеток в панкреатические гормонпродуцирующие клетки, посредством чего, можно в больших количествах поставлять панкреатические гормонпродуцирующие клетки, обладающие высокой способностью секреции панкреатических гормонов. Панкреатические гормонпродуцирующие клетки можно использовать в качестве инструмента для разработки лекарственного средства (в частности, лекарственного средства для клеточной терапии) или терапевтического лекарственного препарата для лечения сахарного диабета.
[0084]
2. Лекарственное средство, содержащее клетки по настоящему изобретению
Настоящее изобретение относится к лекарственному средству, содержащему панкреатические гормонпродуцирующие клетки (клетки по настоящему изобретению), полученные указанным выше способом получения по настоящему изобретению или способом получения 2 по настоящему изобретению.
Кроме того, настоящее изобретение относится к лекарственному средству (иногда сокращенно именуемому в настоящем описании лекарственным средством по настоящему изобретению), содержащему клетки-предшественники панкреатических гормонпродуцирующих клеток, получаемых указанным выше способом получения по настоящему изобретению (предпочтительно, стадиями (1)-(5)) или способом получения 2 по настоящему изобретению.
[0085]
В лекарственном средстве по настоящему изобретению панкреатические гормонпродуцирующие клетки или клетки-предшественники панкреатических гормонпродуцирующих клеток используются, как они есть или в виде клеточной массы, такой как концентрированные гранулы и тому подобные, фильтрацией через фильтр и тому подобными способами. Кроме того, лекарственное средство с добавлением защитного вещества, такого как DMSO (диметилсульфоксид) и тому подобные, также может криоконсервироваться. Для более безопасного использования в качестве лекарственного средства, лекарственное средство может быть подвергнуто такой обработке как термообработка, лучевая обработка и тому подобные, в условиях, которые денатурируют патогенный белок, в то же время, сохраняя его функцию в качестве панкреатических гормонпродуцирующих клеток или функцию в качестве клеток-предшественников панкреатических гормонпродуцирующих клеток. Для предотвращения роста панкреатических гормонпродуцирующих клеток или клеток-предшественников панкреатических гормонпродуцирующих клеток в более чем требуемом количестве, клетки могут быть подвержены обработке в комбинации с указанными выше способами обработки, такими как подавление роста предварительной обработкой митомицином C и тому подобной, способ, включающий введение гена метаболического фермента, обычно отсутствующего в клетках млекопитающих, при необходимости, введение неактивного лекарственного препарата для обеспечения возможности лекарственному препарату изменяться в токсин только в клетках, в которые введен ген метаболического фермента, обычно отсутствующий в клетках млекопитающих, для вызова гибели клеток (суицидальная генная терапия), и тому подобные.
[0086]
Лекарственное средство по настоящему изобретению безопасно и низкотоксично и может вводиться (трансплантироваться) млекопитающему (например, человеку, мыши, крысе, морской свинке, свинье, обезьяне и т.д., предпочтительно, человеку).
Доза (подлежащее трансплантации количество) лекарственного средства по настоящему изобретению составляет, например, 1×105-1×1010 клеток/индивида, предпочтительно, 5×107-1×1010 клеток/индивида, предпочтительнее, 1×109-1×1010 клеток/индивида. Для лекарственного средства по настоящему изобретению предпочтительно используются панкреатические гормонпродуцирующие клетки, полученные с использованием собственных клеток пациента или клеток донора, проявляющих тип цитосовместимости или гистосовместимости, допустимый для пациента. Когда получение достаточного количества клеток не может быть достигнуто вследствие возраста, конституции и тому подобного, трансплантация также возможна заливкой клеток в капсулу, такую как полиэтиленгликоль и силикон, пористый контейнер и тому подобные во избежание отторжения. В этом случае также возможна внутрибрюшинная или подкожная трансплантация. Доза (подлежащее трансплантации количество) лекарственного средства по настоящему изобретению может соответствующим образом изменяться в зависимости от возраста, массы тела, симптома и тому подобного пациентов, которым вводится лекарственное средство.
[0087]
Из лекарственных средств по настоящему изобретению, лекарственное средство, содержащее панкреатические гормонпродуцирующие клетки, обеспечивает возможность продукции (секреции) панкреатического гормона в организме пациента его введением (трансплантацией) и может применяться для лечения заболевания, вызванного уменьшенной продукцией (секрецией) панкреатического гормона. Например, лекарственное средство, содержащее инсулин-продуцирующие клетки, можно применять для лечения сахарного диабета (I типа и II типа, предпочтительно, I типа и II типа с уменьшенным уровнем инсулина, предпочтительно, I типа). С другой стороны, из лекарственных средств по настоящему изобретению, после введения (трансплантации) лекарственного средства, содержащего клетки-предшественники панкреатических гормонпродуцирующих клеток пациенту, происходит индукция дифференциации в панкреатические гормонпродуцирующие клетки в подходящих условиях, при которых продуцируется (секретируется) панкреатический гормон.
[0088]
3. Способ скрининга
Настоящее изобретение относится к способу скрининга лекарственного средства (предпочтительно, терапевтического лекарственного препарата для лечения сахарного диабета), включающему применение клеток, полученных любой одной или более стадиями, выбранными из группы, состоящей из следующих стадий (1)-(6):
(1) стадии культивирования стволовых клеток в среде, содержащей ингибитор Rho киназы
(2) стадии культивирования клеток, полученных на указанной выше стадии (1), в среде, содержащей ингибитор GSK3
(3) стадии культивирования клеток, полученных на указанной выше стадии (2), в среде, содержащей ингибитор GSK3 и активатор подобной рецептору активина киназы-4,7
(4) стадии образования клеточной массы из клеток, полученных на указанной выше стадии (3), и культивирования клеточной массы в суспензионном состоянии в среде
(5) стадии культивирования клеток, полученных на указанной выше стадии (4), в среде, содержащей агонист рецептора ретиноевой кислоты, ингибитор АМФ-активируемой протеинкиназы и/или подобной рецептору активина киназы-2,3,6, ингибитор подобной рецептору активина киназы -4,5,7 и фактор клеточного роста
(6) стадии культивирования клеток, полученных на указанной выше стадии (5).
[0089]
Указанные выше стадии (1)-(6) могут выполняться таким же образом как в указанных выше стадиях (1)-(6) способа получения панкреатических гормонпродуцирующих клеток по настоящему изобретению.
В качестве клеток, подлежащих использованию для скрининга, можно указать панкреатические гормонпродуцирующие клетки, полученные посредством указанных выше стадий (1)-(6); клетки-предшественники панкреатических гормонпродуцирующих клеток, полученные посредством указанных выше стадий (1)-(5); эндодермальные клетки, полученные посредством указанных выше стадий (1)-(4), или указанных выше стадий (1)-(3); клетки, полученные посредством указанных выше стадий (1)-(2); клетки, полученные посредством указанной выше стадии (1).
[0090]
Способ скрининга по настоящему изобретению в частности выполняется следующим образом (вариант осуществления 1).
Способ, где (a) панкреатические гормонпродуцирующие клетки культивируют в присутствии тестируемого соединения, и (b) панкреатические гормонпродуцирующие клетки культивируют в отсутствие тестируемого соединения, измеряют и сравнивают каждый из показателей уровня экспрессии внутриклеточного панкреатического гормона и уровня экспрессии внеклеточного панкреатического гормона.
В качестве уровня экспрессии панкреатического гормона, можно указать уровень экспрессии белка панкреатического гормона, уровень экспрессии полинуклеотида (например, мРНК и тому подобного), кодирующего белок панкреатического гормона, и тому подобный. Уровень экспрессии и уровень секреции панкреатического гормона можно измерять известным способом, например, указанный выше панкреатический гормон, присутствующий в клеточном экстракте, среде и тому подобном, можно измерить, используя антитело, распознающее панкреатический гормон, и в соответствии с таким способом как вестерн-блоттинг анализ, способ ELISA (иммуноферментный анализ) и тому подобные или аналогичный им способ.
Уровень мРНК можно измерить известным способом, например, Нозерн-гибридизацией, способом картирования S1, способом ПЦР, способом с использованием ДНК-чипа или микрочипа или аналогичным ему способом и тому подобным.
Культура клеток, продуцирующих панкреатический гормон, конкретно не ограничивается, пока она выполняется в условиях, при которых может экспрессироваться и/или секретироваться панкреатический гормон, и может выполняться в соответствии с известным способом. Примеры возможно используемой среды включают среду MEM, содержащую примерно 1-20% фетальной телячьей сыворотки [Science, vol. 122, 501(1952) и т.д.], среду DMEM [Virology, vol. 8, 396(1959)], среду RPMI 1640 [The Journal of the American Medical Association vol. 199, 519(1967)] и среду 199 [Proceeding of the Society for the Biological Medicine, vol. 73, 1(1950)]. pH среды составляет предпочтительно примерно 6-8. Культивирование выполняют в целом примерно при 30°C-40°C в течение примерно от 15 ч до 5 дней при необходимости с аэрацией и перемешиванием.
Примеры тестируемого соединения включают пептид, белок, антитело, непептидное соединение, синтетическое соединение, продукт ферментации, клеточный экстракт, растительный экстракт, экстракт животной ткани, плазму. В данном случае тестируемое соединение может образовывать соль. В качестве соли используется соль с физиологически приемлемой кислотой, основанием (например, соль щелочного металла, соль щелочноземельного металла, соль алюминия) и тому подобная. Примеры такой соли включают соли с неорганическими кислотами (например, хлористоводородной кислотой, фосфорной кислотой, бромистоводородной кислотой, серной кислотой), соли с органическими кислотами (например, уксусной кислотой, муравьиной кислотой, пропионовой кислотой, фумаровой кислотой, малеиновой кислотой, янтарной кислотой, винной кислотой, лимонной кислотой, яблочной кислотой, щавелевой кислотой, бензойной кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой), соль натрия, соль калия, соль кальция, соль магния, соль бария и соль алюминия.
Например, тестируемое соединение, которое подавляет (ингибирует) уровень экспрессии или уровень секреции панкреатического гормона в указанных выше клетках (a) не менее чем примерно на 20%, предпочтительно, не менее чем примерно на 30%, предпочтительнее, не менее чем примерно на 50%, по сравнению с уровнем экспрессии или уровнем секреции в указанных выше клетках (b), может быть выбрано в качестве соединения, которое подавляет (ингибирует) экспрессию панкреатического гормона в панкреатических гормонпродуцирующих клетках.
Тестируемое соединение, которое повышает уровень экспрессии или секреции панкреатического гормона в указанных выше клетках (a) менее чем примерно на 20%, предпочтительно, не менее чем примерно на 30%, предпочтительнее, не менее чем примерно на 50%, по сравнению с уровнем экспрессии или уровнем секреции в указанных выше клетках (b), может быть выбрано в качестве соединения, которое усиливает экспрессию или секрецию панкреатического гормона в панкреатических гормонпродуцирующих клетках.
Когда панкреатические гормонпродуцирующие клетки представляют собой инсулин-продуцирующие клетки, то соединение, которое усиливает экспрессию инсулина, может применяться в качестве терапевтического лекарственного препарата для лечения сахарного диабета. Когда панкреатические гормонпродуцирующие клетки представляют собой глюкагон-продуцирующие клетки, то соединение, которое подавляет (ингибирует) экспрессию глюкагона, может применяться в качестве терапевтического лекарственного препарата для лечения сахарного диабета.
[0091]
Другой вариант осуществления способа скрининга по настоящему изобретению представляет собой способ, где (a) панкреатические гормонпродуцирующие клетки культивируются в присутствии тестируемого соединения и (b) панкреатические гормонпродуцирующие клетки культивируются в отсутствие тестируемого соединения, измеряют, и сравнивают пролиферативную способность клеток (вариант осуществления 2). В качестве подлежащего использованию тестируемого соединения, можно указать те соединения, которые аналогичны тестируемым соединениям, используемым в указанном выше варианте осуществления 1. Культивирование клеток в данном варианте осуществления можно выполнять таким же образом как в указанном выше варианте осуществления 1. В качестве способа измерения пролиферативной способности клеток, можно использовать способ, в целом используемый в данной области, и он включает, например, способ подсчета числа клеток, способ оценки захвата3H, 5-бром-2'-дезоксиуридина (BrdU) и тому подобный, уровень АТФ, уровень превращения соединения тетразолия в продукт формазан и тому подобные.
Например, когда панкреатические гормонпродуцирующие клетки представляют собой инсулин-продуцирующие клетки, то соединение, которое значимо усиливает рост инсулин-продуцирующих клеток, можно применять в качестве терапевтического лекарственного препарата для лечения сахарного диабета. Когда панкреатические гормонпродуцирующие клетки представляют собой глюкагон-продуцирующие клетки, то соединение, которое значимо подавляет (ингибирует) рост глюкагон-продуцирующих клеток, можно применять в качестве терапевтического лекарственного препарата для лечения сахарного диабета.
[0092]
Другой вариант осуществления способа скрининга по настоящему изобретению представляет собой способ, где (a) клетки-предшественники панкреатических гормонпродуцирующих клеток культивируют в присутствии тестируемого соединения и (b) клетки-предшественники панкреатических гормонпродуцирующих клеток культивируют в отсутствие тестируемого соединения, измеряют и сравнивают уровень дифференциации клеток (вариант осуществления 3). В качестве подлежащего тестированию соединения, можно указать соединения, аналогичные тестируемым соединениям, используемым в указанном выше варианте осуществления 1. Культивирование клеток в данном варианте осуществления можно выполнять таким же образом как в указанном выше варианте осуществления 1. Уровень дифференциации клеток-предшественников панкреатических гормонпродуцирующих клеток можно исследовать, например, присутствием или отсутствием экспрессии маркера, специфического для клеток-предшественников панкреатических гормонпродуцирующих клеток и/или панкреатических гормонпродуцирующих клеток. Примеры маркера, специфического для клеток-предшественников панкреатических гормонпродуцирующих клеток, включают NGN3 (нейрогенин 3), PAX4 (парный гомеобокс 4), а примеры маркера, специфичного для панкреатических гормонпродуцирующих клеток, включают инсулин, глюкагон, панкреатический полипептид, соматостатин, грелин, PCSK1 (пропротеин конвертаза субтилизин/кексин типа 1), SUR1 (рецептор 1 сульфонилмочевины, aka: АТФ-связывающая кассета, член 8 подсемейства C (CFTR/MRP), глюкокиназу, MAFA (v-maf: гомолог A онкогена мышечноапоневротической фибросаркомы), IAPP (островковый амилоидный полипептид) и тому подобные.
Например, когда клетки-предшественники панкреатических гормонпродуцирующих клеток представляют собой клетки-предшественники инсулин-продуцирующих клеток, то соединение, которое значимо повышает дифференциацию клеток-предшественников инсулин-продуцирующих клеток, можно применять в качестве терапевтического лекарственного препарата для лечения сахарного диабета. Когда клетки-предшественники панкреатических гормонпродуцирующих клеток представляют собой клетки-предшественники глюкагон-продуцирующих клеток, то соединение, которое значимо подавляет (ингибирует) дифференциацию клеток-предшественников глюкагон-продуцирующих клеток, можно применять в качестве терапевтического лекарственного препарата для лечения сахарного диабета.
[0093]
Другой вариант осуществления способа скрининга по настоящему изобретению представляет собой способ, где (a) эндодермальные клетки культивируют в присутствии тестируемого соединения и (b) эндодермальные клетки культивируют в отсутствие тестируемого соединения, измеряют, и сравнивают способность пролиферации или дифференциации клеток (вариант осуществления 4). В качестве подлежащего использованию тестируемого соединения, можно указать соединения, аналогичные тестируемым соединениям, в указанном выше варианте осуществления 1. Культивирование клеток в данном варианте осуществления можно выполнять таким же образом как в указанном выше варианте осуществления 1. В качестве способа измерения пролиферативной способности клеток, можно использовать способ, в целом используемый в данной области, и он включает, например, способ подсчета числа клеток, способ оценки захвата3H, 5-бром-2'-дезоксиуридина (BrdU) и тому подобные, уровень АТФ, уровень превращения соединения тетразолия в продукт формазан и тому подобные. Способность дифференциации эндодермальных клеток можно исследовать, например, присутствием или отсутствием экспрессии маркера, специфичного для эндодермальных клеток. Примеры маркера, специфичного для эндодермальных клеток, включают α-фетопротеин, альбумин, пепсин, легочный поверхностно-активный белок и тому подобные. В целом, индукция дифференциации и культивирование эндодермальных клеток являются технически трудными, по сравнению с индукцией дифференциации и культивированием мезодермальных или эктодермальных клеток, и/или систему индукции эндодермальной дифференциации, полученную использованием соединения, полученного способом скрининга, можно использовать для новой системы скрининга для лекарственных средств.
[0094]
Лекарственное средство и т.д., которое защищает (сохраняет) функцию панкреатических гормонпродуцирующих клеток, можно получить способом в соответствии со способом скрининга по настоящему изобретению. Другой вариант осуществления способа скрининга по настоящему изобретению представляет собой способ, где (a) панкреатические гормонпродуцирующие клетки культивируют в присутствии тестируемого соединения и (b) панкреатические гормонпродуцирующие клетки культивируют в отсутствие тестируемого соединения, соответственно измеряют, и сравнивают число или функцию жизнеспособных клеток (вариант осуществления 5). В качестве подлежащего использованию тестируемого соединения, можно указать соединения, аналогичные тестируемым соединениям, используемым в указанном выше варианте осуществления 1. Культивирование клеток в данном варианте осуществления можно выполнять таким же образом как в указанном выше варианте осуществления 1. В качестве способа подсчета жизнеспособных клеток, можно использовать способ, в целом используемый в данной области, и он включает, например, способ подсчета числа клеток, способ оценки захвата3H, 5-бром-2'-дезоксиуридина (BrdU) и тому подобные, уровень АТФ, уровень превращения соединения тетразолия в продукт формазана и тому подобные. Кроме того, число клеток после индукции апоптоза можно количественно определить, в дополнение к подсчету клеток, показывающему морфологические характеристики (агрегацию хроматина, фрагментацию ядер, сокращение клеток и тому подобные), выявлением фрагментированной ДНК способом TUNNEL (методом TdT- опосредованной метки dUTP-конца разрыва цепи ДНК) и выявлением присутствия или отсутствия активной каспазы и измерением ядерного окрашивания непроницаемым в живые клетки красителем, таким как 7-AAD (7-амино-актиномицин D) и тому подобные, воздействием фосфатидилсерина на клеточную поверхность, деполяризацией мембраны митохондрий, расщеплением и разрушением конкретного внутриклеточного белка и тому подобными способами. В качестве способа определения клеточной функции, можно указать способ измерения уровня секреции инсулина или C-пептида и изменения потенциала клеточных мембран, которые соответствуют концентрации глюкозы, и тому подобные. В данном варианте осуществления фактор, который, как известно, вызывает нарушение в панкреатических гормонпродуцирующих клетках, например, воспалительный цитокин, активный кислород и вызывающее его продукцию вещество, высокую концентрацию жирной кислоты, глюкозы и тому подобных веществ, добавляют во время культивирования клеток, и измеряют и сравнивают, число жизнеспособных клеток или функцию клеток.
Когда панкреатические гормонпродуцирующие клетки представляют собой инсулин-продуцирующие клетки, то соединение, которое значимо увеличивает выживание или функциональную поддержку инсулин-продуцирующих клеток против фактора, известного как вызывающего нарушения панкреатических гормонпродуцирующих клеток, можно применять в качестве терапевтического лекарственного препарата для лечения сахарного диабета.
[0095]
Лекарственное средство, полученное способом скрининга по настоящему изобретению, можно составить обычными средствами и используя физиологически приемлемую добавку (например, носитель, отдушку, эксципиент, консервант, стабилизатор, связывающее вещество).
Примеры лекарственной формы полученного таким образом препарата включают пероральные препараты, такие как таблетка с нанесенным при необходимости сахарным покрытием, капсула, эликсир, микрокапсула и тому подобные; и парентеральные средства, такие как раствор для инъекций и тому подобные. Содержание активного ингредиента в этих препаратах составляет, например, от 0,1 до 90 масс.%.
[0096]
Примеры указанных выше добавок включают связывающие вещества, такие как желатин, кукурузный крахмал, трагакант, аравийская камедь и тому подобные; эксципиенты, такие как кристаллическая целлюлоза и тому подобные; набухающие агенты, такие как кукурузный крахмал, желатин, альгиновая кислота и тому подобные; смазывающие вещества, такие как стеарат магния и тому подобные; подсластители, такие как сахароза, лактоза, сахарин и тому подобные; отдушки, такие как мята перечная, масло Gaultheria adenothrix, вишня и тому подобные; жидкие носители, такие как жиры и масла, вода для инъекций, растительное масло (например, кунжутное масло, пальмовое масло, соевое масло), забуферивающие агенты (например, фосфатный буфер, натрий-ацетатный буфер) и тому подобные; солюбилизирующие агенты (например, этанол, пропиленгликоль, полиэтиленгликоль); неионное поверхностно-активное вещество (например, полисорбат 80TM, HCO-50); солюбилизирующие агенты (например, бензилбензоат, бензиловый спирт); смягчающие агенты (например, бензалконий хлорид, прокаин гидрохлорид); стабилизаторы (например, человеческий сывороточный альбумин, полиэтиленгликоль); консерванты (например, бензиловый спирт, фенол); и антиоксиданты.
Примеры указанной выше воды для инъекций включают солевой раствор; и изотонический раствор, содержащий глюкозу, D-сорбит, D-маннит, хлорид натрия или тому подобные.
Поскольку лекарственное средство (предпочтительно, терапевтический лекарственный препарат для лечения сахарного диабета), полученное способом скрининга по настоящему изобретению, является безопасным и низко токсичным, то его можно вводить перорально или парентерально, например, млекопитающему (например, человеку, мыши, крысе, кролику, овце, свинье, корове, лошади, кошке, собаке, обезьяне, шимпанзе).
Дозу лекарственного средства должным образом определяют в соответствии с его действием, подвергаемым лечению заболеванием, индивидом, которому предполагается его введение, путем введения и тому подобными факторами.
ПРИМЕРЫ
[0097]
Настоящее изобретение подробно объясняется ниже со ссылкой на примеры, которые не следует рассматривать как ограничивающие.
[0098]
Пример 1 (1):
Индукция дифференциации человеческих iPS клеток в эндодермальные клетки [стадии (1)-(3)]
Индукцию дифференциации человеческих iPS клеток в эндодермальные клетки выполняли следующим способом.
Сначала, человеческие iPS клетки (iPS клетки, полученные внесением гена Oct3/4, гена Klf4 и гена Sox2: см. Nat Biotechnol 2008; 26: 101-106), культивированные и поддерживаемые в состоянии клеточной массы вместе с питающими клетками, отделяли в состоянии клеточной массы использованием раствора для диссоциации клеток для ES клеток приматов (ReproCELL Inc.), эти клетки переносили в центрифужную пробирку емкостью 15 мл и отстаивали в течение 5 мин. Питающие клетки удаляли удалением супернатанта.
К человеческим iPS клеткам, осажденным в центрифужной пробирке, добавляли 0,25% раствор трипсина-1 мМ ЭДТА (GIBCO) и давали возможность диссоциировать до образования ими отделившихся клеток. Затем человеческие iPS клетки, диспергированные в среде, высевали при плотности 15×104 клеток на одну чашку диаметром 100 мм, покрытую матригелем BD (Nippon Becton Dickinson Company, Ltd.), и культивировали при 37°C, 5% CO2 в течение 1 дня. Используемая чашка диаметром 100 мм представляла собой чашку, покрытую матригелем BD, разбавленным в 40 раз бессывороточной средой DMEM/F12 (Invitrogen), при комнатной температуре в течение 3 ч или дольше. В качестве среды для дисперсии и посева использовали среду для ES клеток приматов (ReproCELL Inc.) с добавлением 10 мкМ Y-27632 (Wako Pure Chemical Industries, Ltd.). Через сутки после посева, среду заменяли средой DMEM/F12, содержащей ингибитор GSK3β CHIR99021 (3 мкМ) и добавку 2% B-27 (GIBCO), и культивировали в течение 2 дней. Затем среду заменяли средой DMEM/F12, содержащей активин A (50 нг/мл) и CHIR99021 (1 мкМ), и культивировали в течение 2 дней.
[0099]
Для исследования изменения экспрессии маркеров эндодермальной дифференциации при культивировании человеческих iPS клеток, клетки после индукции дифференциации извлекали с течением времени, и общую фракцию РНК очищали с использованием RNeasy96 (Qiagen). кДНК синтезировали с использованием набора реагентов PrimeScriptRT (Takara Bio Inc.), выполняли количественную RT-PCR и измеряли уровень экспрессии генов примитивного штрихового маркера Brachyury и маркера эндодермы SOX17. Результаты анализа экспрессии показаны на фиг. 1. На 3-й день культивирования, уровень экспрессии Brachyury временно увеличивался, а уровень экспрессии SOX17 заметно увеличивался на 4-й день.
На основании этих исследований выяснили, что экспрессия маркера эндодермы эффективно индуцировалась посредством дифференциации в примитивный штрих.
[0100]
Для исследования экспрессии белка SOX17 выполняли иммунофлуоресцентное окрашивание с использованием антитела к SOX17. Эндодермальные клетки, полученные индукцией дифференциации в чашке диаметром 100 мм, диссоциировали в отделившиеся клетки с использованием Accutase (Invitrogen) (торговое название), высевали в покрытый фибронектином 96-луночный планшет при плотности 4×104 клеток, и культивировали при 37°C, 5% CO2 в течение суток. Покрытие фибронектином выполняли разведением фибронектина (BD) в 20 раз средой DMEM/F12 и его окрашиванием при комнатной температуре в течение 3 ч. В качестве культуральной среды для посева использовали усовершенствованную среду MEM Zinc Option (Invitrogen), содержащую добавку 1% B-27. После культивирования добавляли 4% параформальдегид и клетки фиксировали инкубацией при комнатной температуре в течение 30 мин. Клетки после культивирования последовательно вступали во взаимодействие с антителом к человеческому SOX17 (AF1924, R&D) в качестве первичного антитела и затем с меченым Alexa488 вторичным антителом (Invitrogen) в качестве вторичного антитела, клеточное ядро окрашивали Hoechst 33342 и осматривали под флуоресцентным микроскопом. Результаты показаны на фиг. 2. В результате, большинство клеток экспрессировали белок SOX17. В результате описанного выше исследования было выяснено, что дифференциацию в эндодермальные клетки можно эффективно индуцировать культивированием в течение 2 дней в среде DMEM/F12 с добавлением CHIR99021 и добавки B-27, и еще в течение 2 дней в среде DMEM/F12 с добавлением активина A и CHIR99021 без использования питающих клеток и сыворотки.
[0101]
Пример 1 (2):
Исследовали индукцию эндодермы ингибитором GSK3 (BIO), отличным от CHIR99021 на стадии (2).
Через сутки после посева человеческих iPS клеток, среду заменяли средой DMEM/F12, содержащей CHIR99021 (3 мкМ) и 2% добавку B-27 (GIBCO), и культивировали в течение 2 дней.
Затем одну среду заменяли средой DMEM/F12, содержащей CHIR99021 (3 мкМ) в качестве ингибитора GSK3 и активин A (100 нг/мл) и добавку 2% B-27 (GIBCO), и культивирование продолжали (указано как «Активин A+CHIR99021» на фиг. 3).
Другую среду заменяли средой DMEM/F12, содержащей BIO (0,5 мкМ) в качестве ингибитора GSK3 и активин A (100 нг/мл), и 2% добавку B-27 (GIBCO), и культивирование продолжали (указано как «Активин A+BIO» на фиг. 3).
С течением времени при культивировании человеческих iPS клеток измеряли уровень экспрессии гена SOX17. Результаты анализа экспрессии показаны на фиг. 3. При использовании и CHIR99021, или BIO уровень экспрессии SOX17 заметно увеличился с 4-го дня культивирования, и наблюдали аналогичный тип экспрессии. Полученные результаты прояснили, что эндодерму можно индуцировать даже использованием ингибитора GSK3, отличного от CHIR99021.
[0102]
Пример 2:
Индукция дифференциации эндодермальных клеток в панкреатические гормонпродуцирующие клетки [стадии (4)-(6)]
Клеточную массу образовывали из клеток, дифференцированных в эндодермальные клетки, после чего дополнительно индуцированных для дифференциации в клетки-предшественники панкреатических гормонпродуцирующих клеток, а затем - в панкреатические гормонпродуцирующие клетки.
Используя эндодермальные клетки, индуцированные для дифференциации в чашке диаметром 100 мм, их диссоциировали до тех пор, пока они образовывали отделившиеся клетки, с использованием аккутазы (Invitrogen) (торговое название). Затем эндодермальные клетки, диспергированные в среде, высевали при плотности 2×104 клетки на лунку в 96-луночный сфероидный планшет (SUMITOMO BAKELITE), и культивировали при 37°C, 5% CO2 в течение суток для образования клеточной массы. В качестве среды для дисперсии и посева использовали усовершенствованную среду MEM Zinc Option, содержащую добавку 1% B-27. Через сутки после посева эндодермальных клеток, среду заменяли усовершенствованной средой MEM Zinc Option, содержащей добавку B-27, и добавляли дорсоморфин (1 мкМ), ретиноевую кислоту (2 мкМ), SB431542 (10 мкМ) и bFGF (50 нг/мл) и культивировали в условиях 37°C, 5% CO2 в течение 8 дней. Замену среды выполняли на 4-й день. После культивирования в течение 8 дней среду заменяли усовершенствованной средой MEM Zinc Option, содержащей добавку 1% B-27, и клетки дополнительно культивировали. Затем замену среды выполняли через каждые 3-4 дня.
Через сутки после посева эндодермы, клетки культивировали с комбинацией дорсоморфина, ретиноевой кислоты, SB431542 и bFGF в течение 8 дней, среду заменяли усовершенствованной средой MEM Zinc Option, содержащей добавку 1% B-27, и культивирование продолжали. Результаты анализа экспрессии инсулина в это время показаны на фиг. 4. Экспрессию инсулина почти не наблюдали в точку времени 13-го дня культивирования после замены среды усовершенствованной средой MEM Zinc Option, содержащей добавку 1% B-27, но она резко увеличивалась с 15-го дня культивирования.
В качестве сравнительного примера, через сутки высевали эндодермальные клетки, клетки культивировали, используя комбинацию дорсоморфина, ретиноевой кислоты и SB431542, в течение 8 дней, среду заменяли усовершенствованной средой MEM Zinc Option, содержащей добавку 1% B-27, и клетки дополнительно культивировали. Результаты анализа экспрессии на 19-й день культивирования показаны на фиг. 5. Экспрессия инсулина проявила более высокую величину на 19-й день культивирования при культивировании с использованием комбинации дорсоморфина, ретиноевой кислоты, SB431542 и bFGF, чем при культивировании с использованием комбинации дорсоморфина, ретиноевой кислоты и SB431542.
[0103]
Затем для исследования экспрессии белка инсулина и глюкагона выполняли иммунофлуоресцентное окрашивание с использованием антитела к инсулину. Через сутки после посева эндодермальных клеток добавляли дорсоморфин, ретиноевую кислоту, SB431542 и bFGF, и клетки культивировали в течение 8 дней. Затем среду заменяли усовершенствованной средой MEM Zinc Option, содержащей добавку 1% B-27, и культивировали в течение 8 дней. После культивирования клетки фиксировали при 4°C в течение 3 ч, используя 4% параформальдегид, культивированные клетки заливали в соединение OCT (Tissue-tek) для получения замороженного среза толщиной 10 мкМ. Клетки последовательно вступали во взаимодействие с антителом к инсулину (A0564, DAKO) или с антителом к глюкагону (G2654, SIGMA) в качестве первичного антитела, затем с меченым Alexa568 вторичным антителом (Invitrogen) или меченым Alexa488 вторичным антителом (Invitrogen) в качестве вторичного антитела, и клеточное ядро окрашивали Hoechst 33342, и осматривали под флуоресцентным микроскопом. Результаты иммунофлуоресцентного окрашивания показаны на фиг. 6. Ряд клеток, экспрессирующих инсулин, были обнаружены внутри сферы, а также были частично обнаружены клетки, экспрессирующие глюкагон.
[0104]
Пример 3: Индукция дифференциации человеческой iPS клетки в клетку, продуцирующую панкреатический гормон
[стадии (1)-(6); Индукция дифференциации в эндодермальные клетки с использованием матригеля BD Matrigel или фибронектина, и индукция дифференциации в панкреатические гормонпродуцирующие клетки]
Индукцию дифференциации человеческих iPS клеток в эндодермальные клетки выполняли следующим способом.
Сначала человеческие iPS клетки, поддерживаемые в состоянии клеточной массы, диссоциировали до тех пор, пока они образовывали отделившиеся клетки, таким же образом как в примере 1.
Затем человеческие iPS клетки, диспергированные в среде, высевали при плотности 60×104 клеток на одну чашку диаметром 100 мм, покрытую фибронектином (Invitrogen), и культивировали при 37°C, 5% CO2 в течение суток. Чашка диаметром 100 мм представляла собой чашку, покрытую фибронектином, разбавленным в 40 раз бессывороточной средой DMEM/F12 (Invitrogen), при комнатной температуре в течение 3 ч или дольше (указано как «фибронектин» на фиг. 7)
Человеческие iPS клетки, диспрегированные в среде, высевали при плотности 15×104 клеток на чашку диаметром 100 мм, покрытую матригелем BD (Nippon Becton Dickinson Company, Ltd.), и культивировали при 37°C, 5% CO2 в течение суток. Чашка диаметром 100 мм представляла собой чашку, покрытую матригелем BD, разбавленным в 40 раз бессвывороточной средой DMEM/F12 (Invitrogen), при комнатной температуре в течение 3 ч или дольше (указано как «Матригель» на фиг. 7)
В качестве среды для дисперсии и высевания использовали среду для ES клеток приматов (ReproCELL Inc.) с добавлением 10 мкМ Y-27632 (Wako Pure Chemical Industries, Ltd.). Через сутки после посева среду заменяли средой DMEM/F12, содержащей ингибитор GSK3β CHIR99021 (3 мкМ) и добавку 2% B-27 (GIBCO) и культивировали в течение 2 дней. Затем среду заменяли средой DMEM/F12, содержащей активин A (50 нг/мл) и CHIR99021 (1 мкМ), и культивировали в течение 2 дней.
[0105]
Клеточную массу образовывали таким же образом как в примере 2 из клеток, дифференцированных в эндодермальные клетки, после чего дополнительно индуцировали дифференциацию в клетки-предшественники панкреатических гормонпродуцирующих клеток, затем в панкреатические гормонпродуцирующие клетки.
Таким же образом как в примере 2, через сутки после посева эндодермальных клеток клетки культивировали с комбинацией дорсоморфина, ретиноевой кислоты, SB431542 и bFGF в течение 8 дней, среду заменяли усовершенствованной средой MEM Zinc Option, содержащей 1% B-27, для индукции дифференциации, и выполняли анализ динамики экспрессии различных маркеров дифференциации. Результаты анализа экспрессии показаны на фиг. 7.
Экспрессия SOX17, который представляет собой маркер эндодермы, заметно уменьшалась наряду с дифференциацией, а экспрессия маркера панкреатических клеток-предшественников (PDX1) и маркера клеток-предшественников панкреатических гормонпродуцирующих клеток (NGN3) постепенно увеличивалась до 17-го дня культивирования. Экспрессия инсулина резко увеличивалась с 17-го дня культивирования. Такое динамическое изменение экспрессии различных маркеров дифференциации было почти одинаковым у эндодермальных клеток, индуцированных с использованием матригеля BD в качестве подложки, и у эндодермальных клеток, индуцированных с использованием фибронектина в качестве подложки. Матригель BD представляет собой продукт основной пластинки, экстрагированный из клеток мышиной саркомы Engelbreth-Holm-Swarm (EHS). С другой стороны, фибронектин, использованный в данном примере, экстрагировали из человеческой плазмы аффинной хроматографией. Из этого примера было выяснено, что дифференциацию в панкреатические гормонпродуцирующие клетки можно индуцировать даже при использовании фибронектина, как в случае матригеля BD Matrigel (примеры 1 и 2).
[0106]
Изучением описанных выше примеров 1-3 было выяснено, что дифференциацию в панкреатические гормонпродуцирующие клетки можно индуцировать использованием системы индукции дифференциации поджелудочной железы, показанную на фиг. 8, где сфера образована из эндодермальных клеток, клетки культивируют в течение 8 дней в усовершенствованной среде MEM Zinc Option, содержащей добавку 1% B-27 с добавлением дорсоморфина, ретиноевой кислоты, SB431542 и bFGF, затем среду заменяют усовершенствованной средой MEM Zinc Option, содержащей добавку 1% B-27, и клетки культивируют.
Панкреатические гормонпродуцирующие клетки, получаемые способом по настоящему изобретению, превосходят по уровню продукции инсулина панкреатические гормонпродуцирующие клетки, полученные другими способами.
Промышленная применимость
[0107]
В соответствии со способом получения по настоящему изобретению, панкреатические гормонпродуцирующие клетки в форме, более имитирующей панкреатогенез, могут быть получены из стволовой клетки. Кроме того, клетка по настоящему изобретению может использоваться для скрининга соединения, полезного для профилактики и/или лечения заболеваний, вызванных отклоняющейся от нормы продукцией и/или секрецией панкреатических гормонов, таких как сахарный диабет и тому подобные. Кроме того, поскольку клетку по настоящему изобретению можно использовать для клеточной терапии с целью лечения таких заболеваний, и она поддерживает трехмерную структуру, она больше подходит для применения в клеточной терапии, даже по сравнению с панкреатическими гормонпродуцирующими клетками, полученными в соответствии с обычным способом получения.
Настоящая заявка основана на патентной заявке № 2010-178523, поданной в Японии, полное содержание которой включено в настоящее описание.
Реферат
Настоящее изобретение относится к способу получения панкреатических гормонпродуцирующих клеток (варианты). Представленный способ включает культивирование человеческих индуцированных плюрипотентных стволовых (iPS) клеток в среде, содержащей (+)-(R)-транс-4-(1-аминоэтил)-N-(4-пиридил)циклогексанкарбоксамид дигидрохлорид; далее культивирование полученных клеток в среде, содержащей (i) 6-[[2-[[4-(2,4-дихлорфенил)-5-(4-метил-1Н-имидазол-2-ил)-2-пиримидинил]амино]этил]амино]никотинонитрил и/или (ii) (2′Z,3′Е)-6-броминдирубин-3′-оксим; далее культивирование полученных клеток в среде, содержащей (i) 6-[[2-[[4-(2,4-дихлорфенил)-5-(4-метил-1Н-имидазол-2-ил)-2-пиримидинил]амино]этил]амино]никотинонитрил и/или (ii) (2′Z,3′E)-6-броминдирубин-3′-оксим и активин; далее образование клеточной массы из полученных клеток и культивирование клеточной массы в суспензионном состоянии в среде; далее культивирование полученных клеток в среде, содержащей ретиноевую кислоту, дорсоморфин, 4-[4-(1,3-бензодиоксол-5-ил)-5-(2-придинил)-1Н-имидазол-2-ил]-бензамид и основной фактор роста фибробластов; далее культивирование полученных клеток. При осуществлении заявленного изобретения не используется питающая клетка, а среда не содержит сыворотку. Изобретение может быть использовано в клеточной терапии при лечении сахарного диабета. 2 н. и 1 з.п. ф-лы, 8 ил., 3 пр.
Формула
(1) стадии культивирования человеческих iPS клеток в среде, содержащей (+)-(R)-транс-4-(1-аминоэтил)-N-(4-пиридил)циклогексанкарбоксамид дигидрохлорид;
(2) стадии культивирования клеток, полученных на указанной выше стадии (1), в среде, содержащей (i) 6-[[2-[[4-(2,4-дихлорфенил)-5-(4-метил-1Н-имидазол-2-ил)-2-пиримидинил]амино]этил]амино]никотинонитрил и/или (ii) (2′Z,3′Е)-6-броминдирубин-3′-оксим;
(3) стадии культивирования клеток, полученных на указанной выше стадии (2), в среде, содержащей (i) 6-[[2-[[4-(2,4-дихлорфенил)-5-(4-метил-1Н-имидазол-2-ил)-2- пиримидинил]амино]этил]амино]никотинонитрил и/или (ii) (2′Z,3′E)-6-броминдирубин-3′-оксим и активин;
(4) стадии образования клеточной массы из клеток, полученных на указанной выше стадии (3), и культивирования клеточной массы в суспензионном состоянии в среде;
(5) стадии культивирования клеток, полученных на указанной выше стадии (4), в среде, содержащей ретиноевую кислоту, дорсоморфин, 4-[4-(1,3-бензодиоксол-5-ил)-5-(2-придинил)-1Н-имидазол-2-ил]-бензамид и основной фактор роста фибробластов;
(6) стадии культивирования клеток, полученных на указанной выше стадии (5);
где на стадиях (1)-(6), по существу, не используется питающая клетка, и среда на стадиях (1)-(6), по существу, не содержит сыворотку.
(4′) стадии образования клеточной массы из эндодермальных клеток и культивирования клеточной массы в суспензионном состоянии в среде;
(5′) стадии культивирования клеток, полученных на указанной выше стадии (4′), в среде, содержащей ретиноевую кислоту, дорсоморфин, 4-[4-(1,3-бензодиоксол-5-ил)-5-(2-придинил)-1Н-имидазол-2-ил]-бензамид и основной фактор роста фибробластов;
где на стадиях (4′) и (5′), по существу, не используется питающая клетка, и среда на стадиях (4′) и (5′), по существу, не содержит сыворотку.

Комментарии