Выращенные в прикрепленной к субстрату культуре клетки из ткани плаценты и их использование при лечении - RU2539786C2
Код документа: RU2539786C2
Чертежи
















Описание
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет предварительной заявки на патент 61/202050, поданной 23 января 2009 года, и предварительной заявки на патент 61/136375, поданной 2 сентября 2008 года.
Содержание указанных выше документов полностью включено в настоящее описание путем ссылки.
Область, к которой относится изобретение, и его предпосылки
Настоящее изобретение, в некоторых его вариантах осуществления, относится к выращенным в прикрепленной к субстрату культуре клеткам ткани плаценты, а конкретнее, но не исключительно, к способам их культивирования и их использования для лечения.
В последние годы значительная активность была сосредоточена на терапевтическом потенциале мезенхимальных стромальных клеток (MSC) для различных видов медицинского применения, включая восстановление тканей поврежденных органов, таких как мозг, сердце, кости и печень, и при поддержании трансплантации костного мозга (BMT). MSC, гетерогенная популяция клеток, полученных, например, из костного мозга, жировой ткани, плаценты и крови, способна дифференцироваться в различные типы клеток (например, ретикулярные эндотелиальные клетки, фибробласты, адипоциты, остеогенные клетки-предшственники) в зависимости от влияний различных биологически активных факторов. Соответственно, MSC широко исследовались в регенеративной медицине как фундамент для строительства новых тканей, таких как кость, хрящ и жир, для восстановления травмированных тканей или замещения патологических тканей и в качестве лечения по поводу генетических и приобретенных заболеваний [Fibbe and Noort, Ann N Y Acad Sci (2003) 996: 235-44; Horwitz et al., Cytotherapy (2005) 7(5): 393-5; Zimmet and Hare, Basic Res Cardiol (2005) 100(6): 471-81]. Кроме того, мультипотентная способность MSC, легкость их выделения и культивирования, а также их высокий потенциал размножения ex vivo делают их привлекательным лечебным инструментом [Fibbe and Noort, смотрите выше; Minguell et al. Exp Biol Med (Maywood) (2001) 226(6): 507-20].
Появляющийся массив данных указывает на то, что MSC избегают распознавания аллореактивных клеток и считаются иммунологически привилегированными [Le Blanc et al., Exp Hematol (2003) 31(10): 890-6]. Обладая низкой иммуногенностью, MSC не отторгаются иммунной системой пациента и поэтому считаются не требующими подбора по HLA.
MSC, полученные из плаценты, проявляют много маркеров, общих для MSC, выделенных из других тканей, например CD105, CD73, CD90 и CD29, и отсутствие экспрессии гематопоэтических, эндотелиальных и специфических для трофобластических клеточных маркеров. Адипогенная, остеогенная и нейрогенная дифференциация была достигнута после культивирования полученных из плаценты MSC в соответствующих условиях [Yen et al., Stem Cells (2005) 23(1): 3-9]. Кроме того, было продемонстрировано, что MSC, выделенные из плаценты и культивированные in vitro, являются иммунологически привилегированными таким же образом, как MSC [Li et al., Cell Res (2005) 15(7): 539-47]. Таким образом, плацента этически не противоречивый и легкодоступный источник MSC для экспериментального и клинического применения [Zhang et al., Exp Hematol (2004) 32(7): 657-64]. Кроме того, заявители ранее разработали трехмерные (3D) условия культивирования, подходящие для размножения MSC, полученных из плаценты (WO/2007/108003).
Краткое описание сущности изобретения
В соответствии с одним аспектом некоторых вариантов осуществления изобретения настоящее изобретение относится к способу культивирования выращенных в прикрепленной к субстрату культуре клеток из плаценты или жировой ткани, причем способ включает культивирование выращенных в прикрепленной к субстрату культуре клеток из плаценты или жировой ткани в трехмерных (3D) условиях культивирования, которые обеспечивают возможность размножения клеток, причем указанные условия включали перфузию.
В соответствии с одним аспектом некоторых вариантов осуществления изобретения настоящее изобретение относится к популяции клеток, генерированных в соответствии с указанным выше способом.
В соответствии с одним аспектом некоторых вариантов осуществления изобретения настоящее изобретение относится к популяции клеток, содержащих профиль экспрессии генов, по существу, как описано в настоящей заявке.
В соответствии с одним аспектом некоторых вариантов осуществления изобретения настоящее изобретение относится к применению популяции клеток для получения лекарственного средства, идентифицированного для лечения состояния, на которое может благоприятное воздействие оказывать трансплантация клеток или органов.
В соответствии с одним аспектом некоторых вариантов осуществления изобретения настоящее изобретение относится к способу индукции переносимости и/или иммуносуппрессии у нуждающегося в нем индивида, причем способ включает введение индивиду терапевтически эффективного количества прикрепленных к субстрат клеток, посредством этого индуцируя у индивида устойчивость и/или иммуносуппрессию.
В соответствии с некоторыми вариантами осуществления изобретения перфузия регулируется в соответствии с концентрацией глюкозы в культуральной среде.
В соответствии с некоторыми вариантами осуществления изобретения концентрация глюкозы в культуральной среде поддерживается на уровне примерно 550 мг/л.
В соответствии с некоторыми вариантами осуществления изобретения условия 3D-культивирования включают 3D-биореактор.
В соответствии с некоторыми вариантами осуществления изобретения условия 3D-культивирования включают материал субстрата для прикрепления, выбранный из группы, состоящей из стекла и пластика, полиэфира, полипропилена, полистирола, декстрана и коллагена.
В соответствии с некоторыми вариантами осуществления изобретения 3D-условия культивирования используются в течение по меньшей мере 3 дней.
В соответствии с некоторыми вариантами осуществления изобретения, культивирование клеток проводится до тех пор, пока не будет достигнута пролиферация по меньшей мере 10% клеток.
В соответствии с некоторыми вариантами осуществления изобретения по меньшей мере 10% клеток, прикрепленных к субстрату, находятся на пролиферативной фазе.
В соответствии с некоторыми вариантами осуществления изобретения клетки, прикрепленные к субстрату, способны подавлять иммунную реакцию.
В соответствии с некоторыми вариантами осуществления изобретения клетки, прикрепленные к субстрату, содержат положительный маркер экспрессии, выбранный из группы, состоящей из CD73, CD90, CD29, CD105 и D7-fib.
В соответствии с некоторыми вариантами осуществления изобретения клетки, прикрепленные к субстрату, содержат отрицательный маркер экспрессии, выбранный из группы, состоящей из CD11b, CD34, HLA-DR, CD14, CD19, CD45, CD31, CD200 и KDR.
В соответствии с некоторыми вариантами осуществления изобретения клетки, прикрепленные к субстрату, содержат профиль экспрессии генов, по существу, как описано в настоящей заявке.
В соответствии с некоторыми вариантами осуществления изобретения клетки, прикрепленные к субстрату, меньше склонны к остеогенной линии дифференциации по сравнению с выращенными клетками из костного мозга, прикрепленными к субстрату, которым предоставлена возможность дифференциации в таких же условиях.
В соответствии с некоторыми вариантами осуществления изобретения клетки, прикрепленные к субстрату, меньше склонны к адипогенной линии дифференциации по сравнению с выращенными клетками из костного мозга, прикрепленными к субстрату, которым предоставлена возможность дифференциации в таких же условиях.
В соответствии с некоторыми вариантами осуществления изобретения состояние выбрано из группы, состоящей из ишемии, заболеваний периферических артерий (PAD), критической ишемии конечностей (CLI), ишемии нижних конечностей, ишемических сосудистых заболеваний, сосудистых заболеваний почек, ишемической болезни сердца, ишемии миокарда, коронарной болезни сердца (CAD), атеросклеротических сердечно-сосудистых заболеваний, поражения основного ствола левой коронарной артерии, артериального окклюзионного поражения, периферической ишемии, заболеваний периферических сосудов, артериосклероза, ишемических заболеваний мозга, инсульта, церебральной ишемии, церебральных сосудистых заболеваний, ретинопатии, восстановления сетчатки, расстройства тканевой перестройки, синдрома фон Гиппеля-Линдау, наследственной геморрагической телеангиэктазии, ишемических сосудистых заболеваний, болезни Бюргера, ишемического почечного заболевания, ишемии плаценты, расстройств, связанных с репродукцией, болезни трансплантат против хозяина, трансплантации солидных органов, трансплантации гематопоэтических стволовых клеток, сахарного диабета, повреждения соединительной ткани, злокачественных новообразований, предраковых заболеваний, злокачественного поражения костей, остеосаркомы, костных метастазов, переломов костей, ожоговых ран, дефекта суставной хрящевой ткани, заживления ран, глубоких ран, задержки заживления ран, задержки заживления язв, подхрящевой костной кисты, остеопороза, остеоартрита, дегенерации кости, повреждения хрящевой ткани, дефекта суставной хрящевой ткани, травм сухожилий, аутоиммунных заболеваний, метаболических расстройств, псориаза, нейропатической боли, повреждения периферических нервов, предотвращения отторжения почечного трансплантата и воспалительных заболеваний.
В соответствии с некоторыми вариантами осуществления изобретения состояние выбрано из группы, состоящей из воспалительного кишечного заболевания (IBD) и болезни Крона.
Пока нет других определений все технические и/или научные термины, используемые в настоящем описании, имеют значение, которое обычно понятно среднему специалисту в данной области, для которого предназначено изобретение. Хотя способы и материалы, аналогичные или эквивалентные тем, которые описаны в настоящей заявке, могут использоваться при реализации или тестировании вариантов осуществления изобретения ниже описаны иллюстративные способы и/или материалы. В случае противоречия преимущество должно иметь описание патентной заявки, включая определения. Кроме того, материалы, способы и примеры являются лишь иллюстративными и не обязательно предназначены для ограничения.
Краткое описание фигур
Некоторые варианты осуществления описаны в настоящей заявке только в качестве примера со ссылкой на сопутствующие фигуры. Теперь, с детальной конкретной ссылкой на фигуры, подчеркивается, что конкретные признаки показаны в качестве примера и в целях иллюстративного обсуждения вариантов осуществления изобретения. В этом отношении описание, взятое с фигурами, делает очевидным для специалистов в данной области, как могут реализовываться варианты осуществления изобретения.
На фигурах:
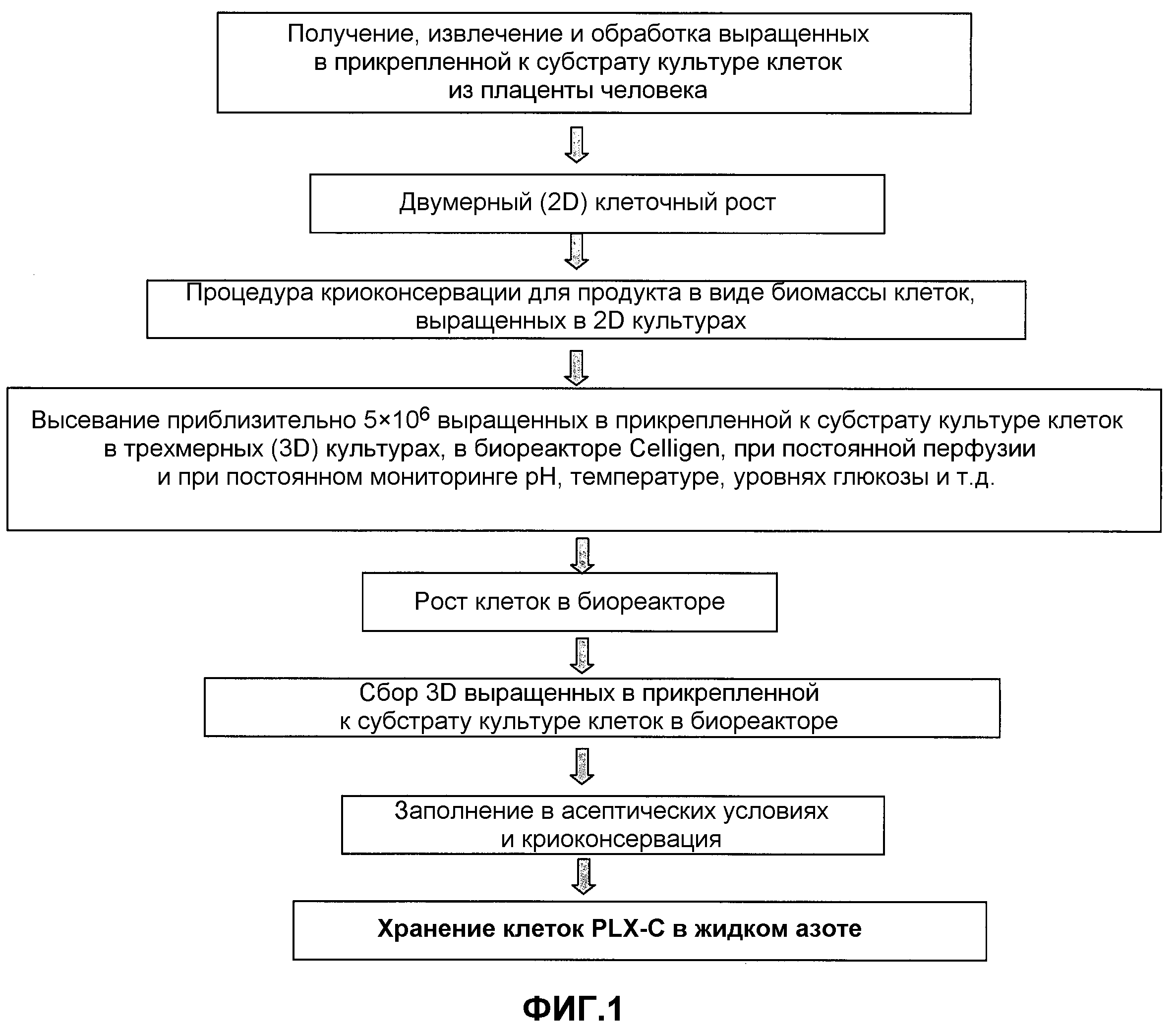
Фиг.1 представляет собой схему последовательности операций, изображающую получение прикрепленных к субстрату 3D-клеток из плацент в соответствии с положениями настоящего изобретения (обозначенных как клетки PLX-C).
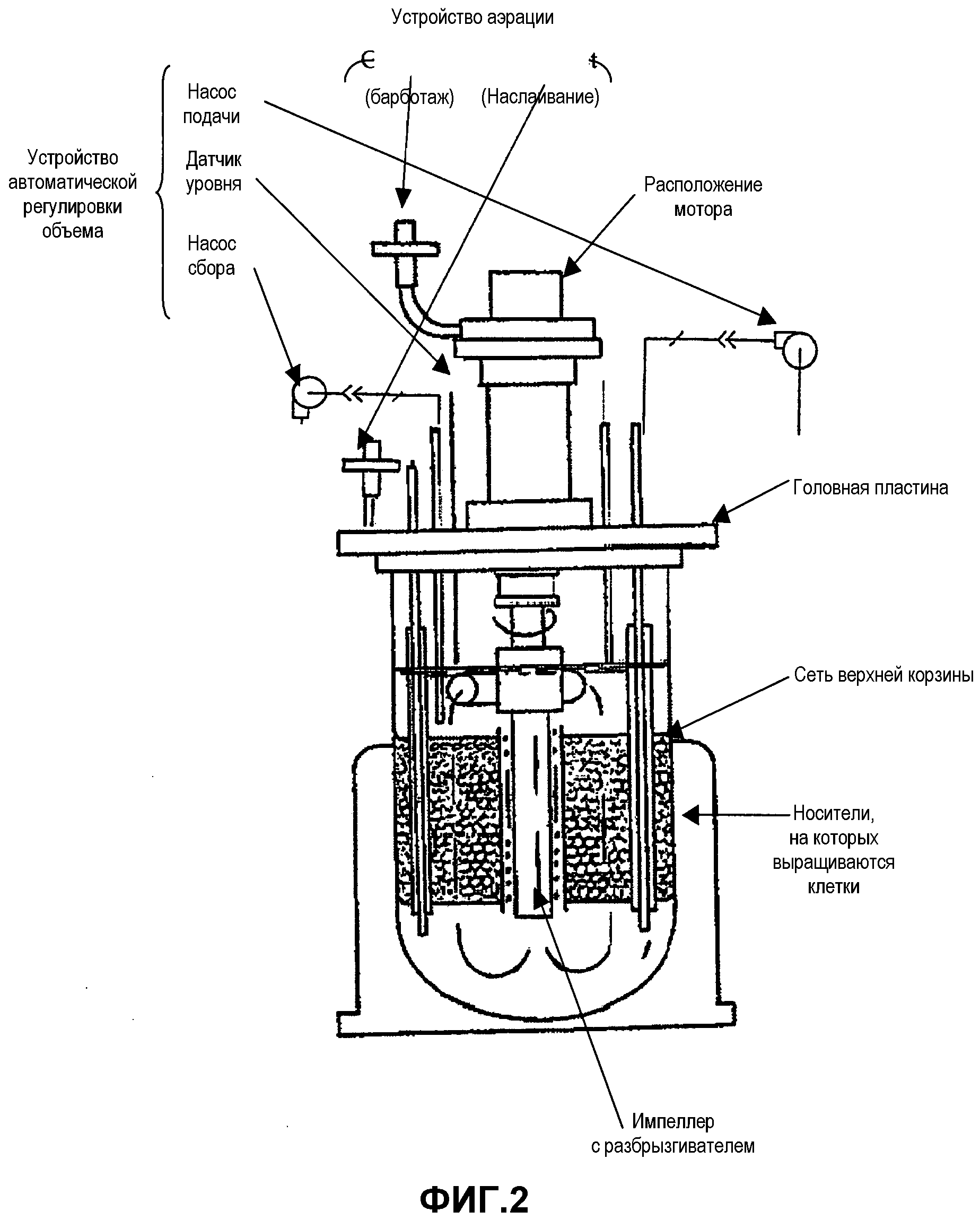
Фиг.2 представляет собой схему иллюстративного сосуда биореактора и его частей, адаптированную из сайта интернета The New Brunswick Scientific.
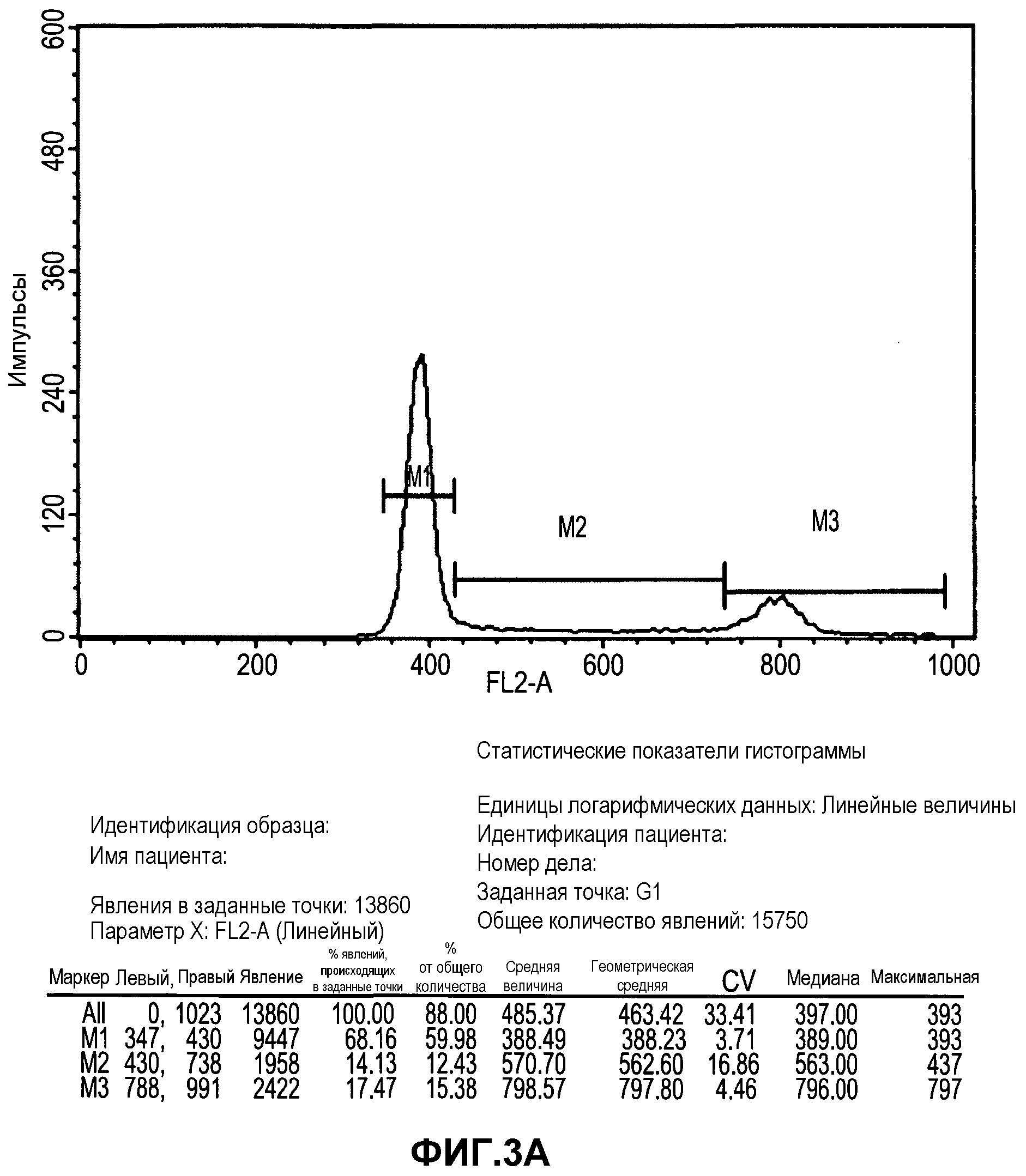
Фиг.3A-B изображают анализ клеточного цикла получения прикрепленных к субстрату 3D клеток Plurix (обозначенных PLX, фиг.3B) и в соответствии с положениями настоящего изобретения (PLX-C, фиг.3A). Клетки фиксировали в 70% EtOH O.N, центрифугировали и ресуспендировали в растворе йодида пропидия (PI) и затем анализировали FACS (сортировщиком клеток с активацией флюоресценции).
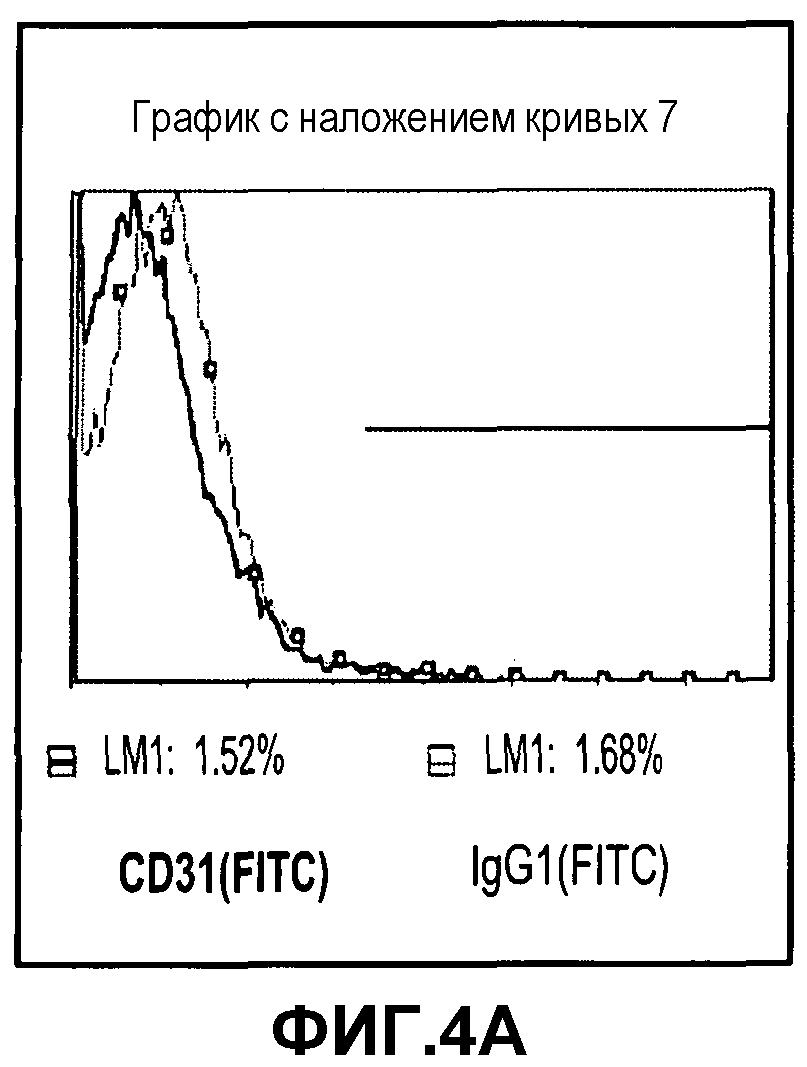
Фиг.4A-D изображают экспрессию типичных маркеров фибробластов, но не экспрессию типичных эндотелиальных маркеров на PLX-C. На фиг.4A изображена отрицательная экспрессия эндотелиального маркера CD31; на фиг.4B изображена отрицательная экспрессия эндотелиального маркера KDR; на фиг.4C изображена положительная экспрессия маркера фибробластов человека (D7-FIB), где красные гистограммы для изотипа IgG1 (FITC) представляют отрицательный контроль, тогда как синие гистограммы представляют положительно окрашенные клетки); и на фиг.4D изображена отрицательная экспрессия маркера человеческого CD200 (розовые гистограммы для изотипа IgG1 (PE) представляют отрицательный контроль, тогда как зеленые гистограммы представляют положительно окрашенные клетки).
На фиг.5A-D изображена экспрессия стимулирующих и совместно стимулирующих молекул на клетках PLX-C. На фиг.5A изображена экспрессия CD80 на PLX-C; на фиг.5B изображена экспрессия CD86 на PLX-C; на фиг.5C изображена экспрессия CD40 на PLX-C; и на фиг.5D изображена экспрессия HLA-A/B/C на PLX-C. Отрицательные контроли получали молекулами с релевантным изотипом флюоресценции. Следует отметить, что красные гистограммы указывают на популяцию клеток, экспрессирующих маркер PLX-C, синие гистограммы указывают на популяцию клеток, экспрессирующих маркер клеток костного мозга (BM), и зеленые гистограммы указывают на популяцию клеток, экспрессирующих маркер мононуклеарных клеток (MNC).
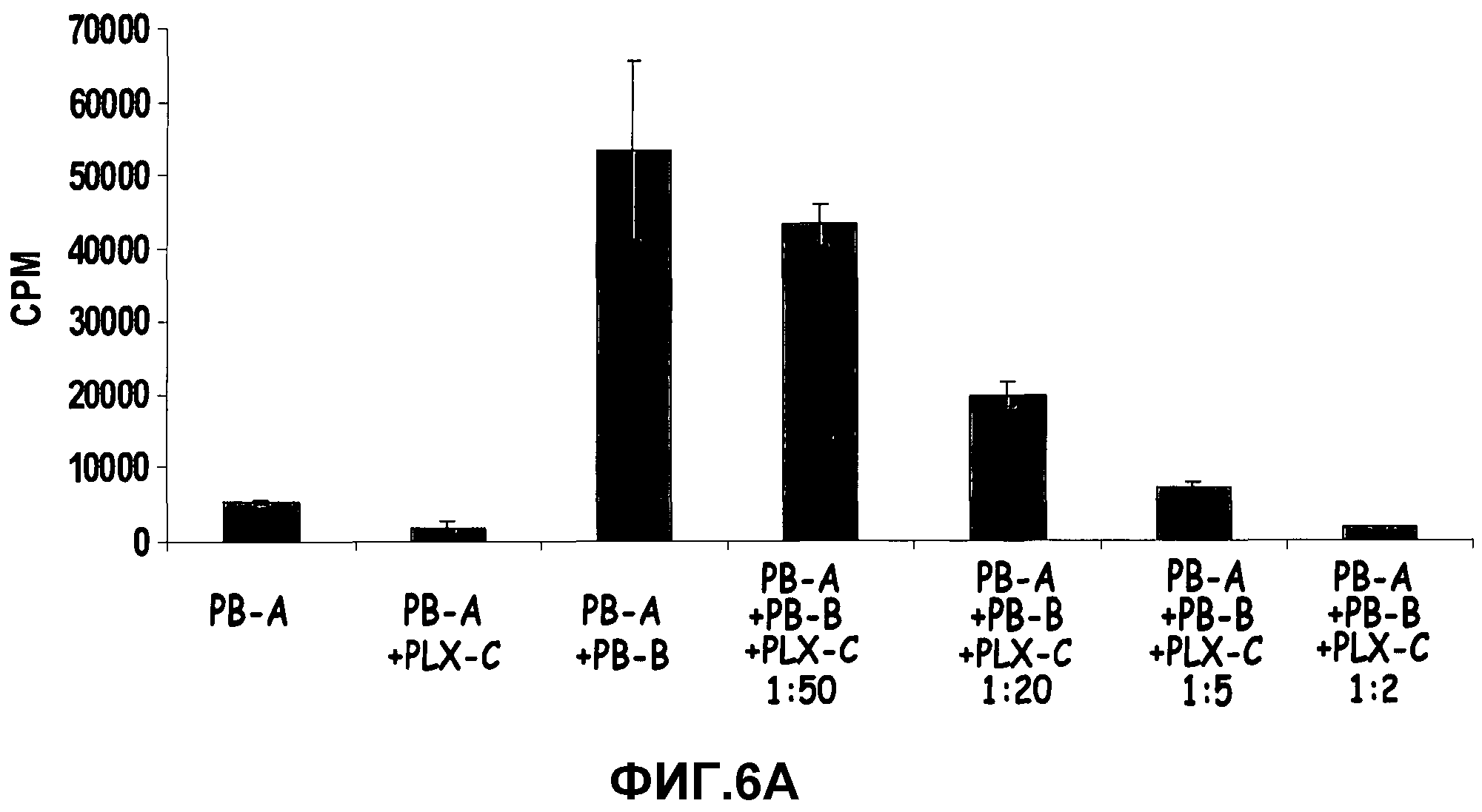
На фиг.6A-B изображено ингибирование пролиферации лимфоцитов PLX-C. На фиг.6A изображены тесты реакции смешанных лимфоцитов (MLR), выполненные с 2×105 мононуклеарных клеток, полученных из периферической крови (PB) (MNC, донор A), стимулированных равным количеством облученных (3000 рад) MNC, полученных из PB (донор B) с последующим добавлением к культурам увеличивающихся количеств клеток PLX-C. Каждую группу в трех повторениях высевали в 96-луночные планшеты. Скорость пролиферации измеряли включением [3H]-тимидина; на фиг.6B изображены MNC, полученные из периферической крови (PB), стимулированные ConA (конкавалином А) (1,5 мг/мл). Увеличивающиеся количества клеток PLX-C добавляли к культурам. Каждую группу в трех повторениях высевали в 96-луночные планшеты. Скорость пролиферации измеряли включением [3H]-тимидина.
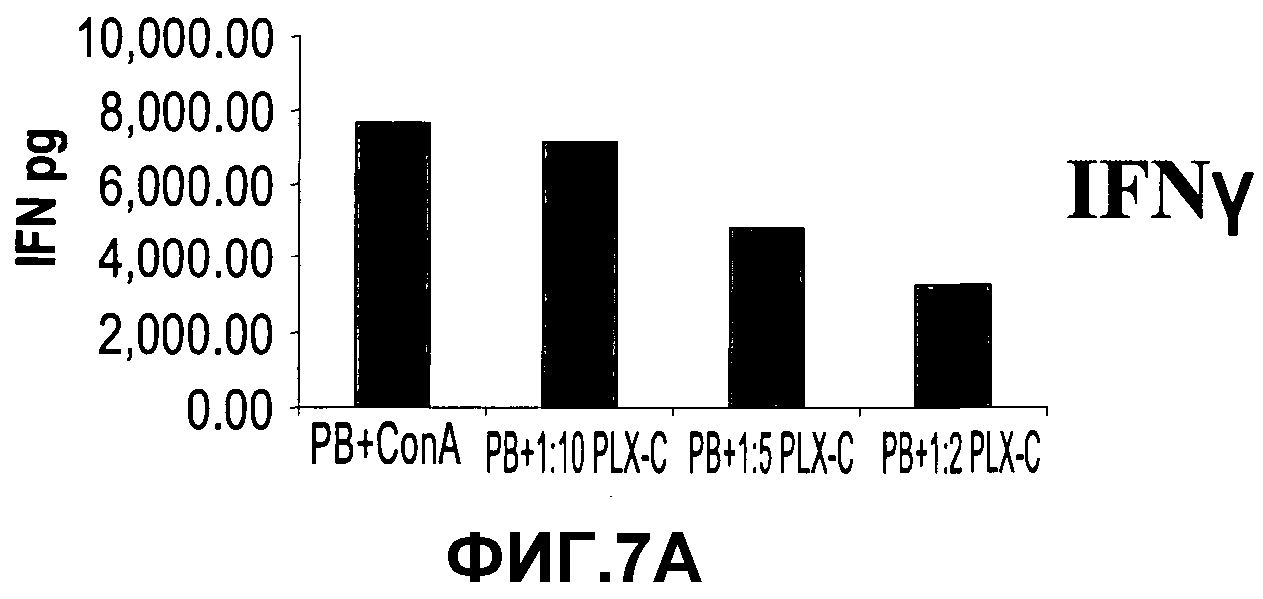
На фиг.7A-C изображена регуляция PLX-C воспалительных и противовоспалительных цитокинов после кокультивирования с клетками периферической крови. На фиг.7A-B изображена секреция IFNγ (фиг.7A) и TNFα (фиг.7B) после кокультивирования полученных человеческих MNC (изолированных из периферической крови), стимулированных ConA, с PLX-C; на фиг.7C изображена секреция IFNγ, TNFα и IL-10 после кокультивирования полученных человеческих MNC (изолированных из периферической крови), стимулированных LPS, с PLX-C. Супернатанты собирали и подвергали анализу цитокинов с использованием ELISA (иммуноферментного анализа).
Фиг.8A-F представляют собой фотографии, изображающие рост клеток костного мозга и плаценты, в условиях дифференциации в форме остеогенеза или адипогенеза. Клетки, полученные из костного мозга (фиг.8A-C), или клетки, полученные из плаценты (фиг.8D-F), высевали в ростовую среду (фиг.8A и 8D), среду для дифференциации в остоегенез (фиг.8B и 8E) или в среду дифференциации в адипозогенез (фиг.8C и 8F) в 24-луночные планшеты, покрытые витронектином и коллагеном. Среду замещали через каждые 3-4 дня. В конце периода роста клетки фиксировали, окрашивали и фотографировали, как детально описано в следующем разделе «Примеры».
Фиг.9A-F представляют собой фотографии, изображающие рост клеток костного мозга и плаценты в модифицированных условиях дифференциации в остеогенез или адипозогенез. Клетки, полученные из костного мозга (фиг.9A-C), или клетки, полученные из плаценты (фиг.9D-F), высевали в ростовую среду (фиг.9A и 9D), среду дифференциации в остеогенез (фиг.9B и 9E) или в среду дифференциации в адипозогенез (фиг.9C и 9F) в 24-луночный планшет, покрытый витронектином и коллагеном. Среду замещали через каждые 3-4 дня. В конце периода роста клетки фиксировали, окрашивали и фотографировали, как детально описано в следующем разделе «Примеры».
На фиг.10 изображен вектор экспрессии люциферазы, используемый для инфекции клеток PLX-C. В данном случае использовали вектор экспрессии Lv33 от OmicsLink. Ген люциферазы клонировали в ORF.
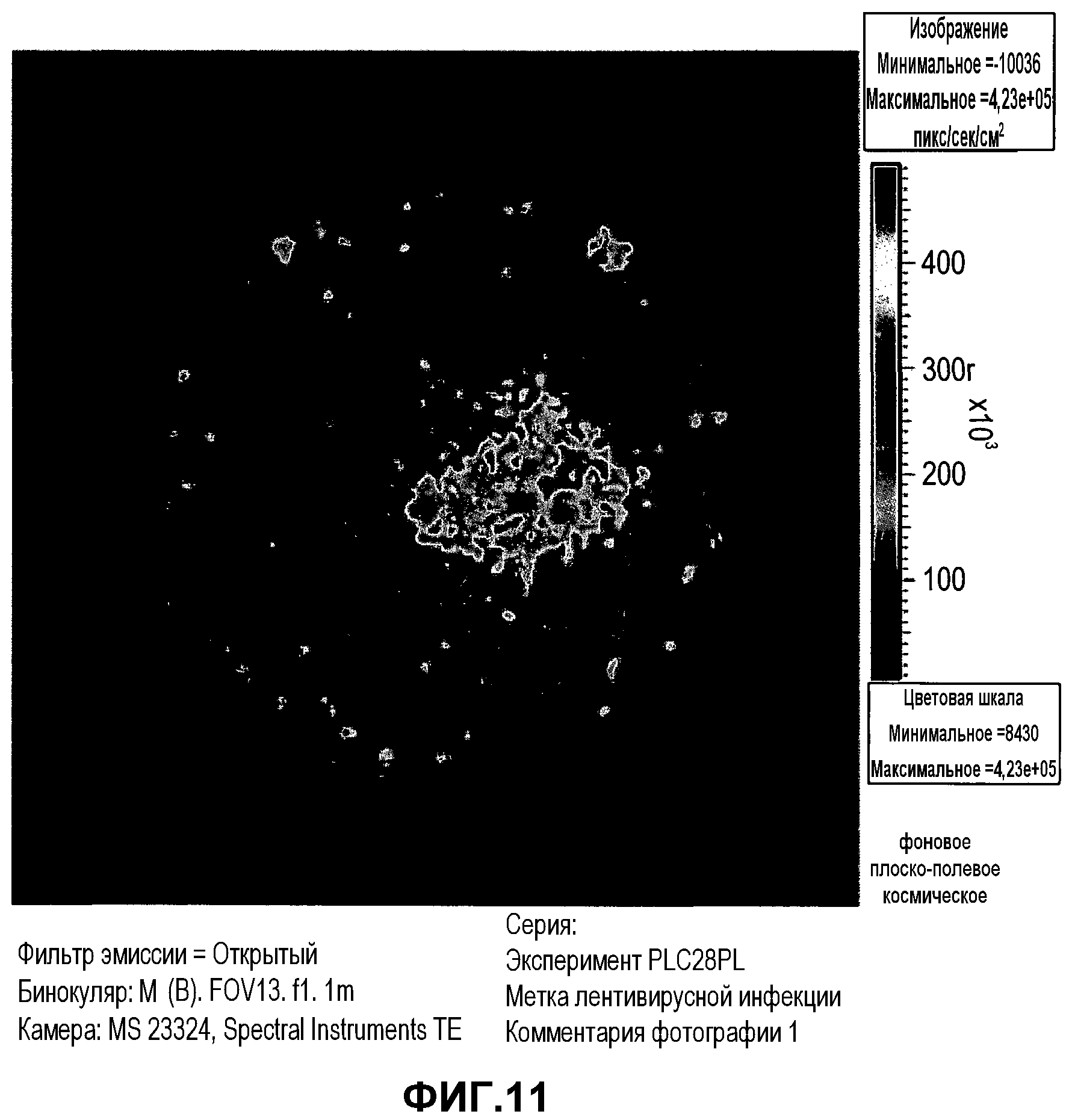
На фиг.11 изображена высокая экспрессия люциферазы инфицированными клетками PLX-C. Клетки инфицировали вектором экспрессии люциферазы и визуализировали устройством трехмерной визуализации IVIS через 48 часов после инфекции. Следует отметить, что клетки проявляли высокие уровни экспрессии люциферазы.
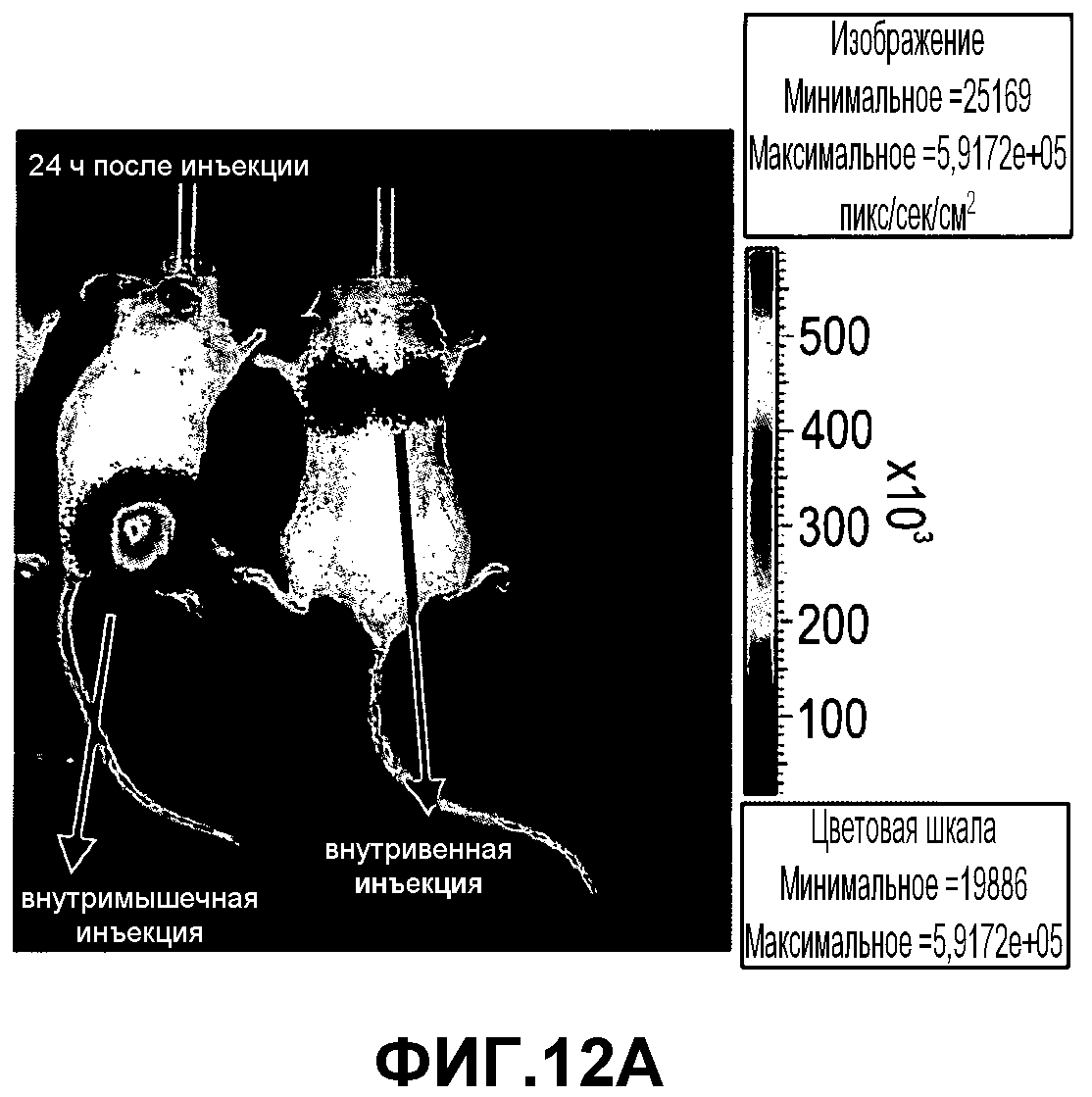
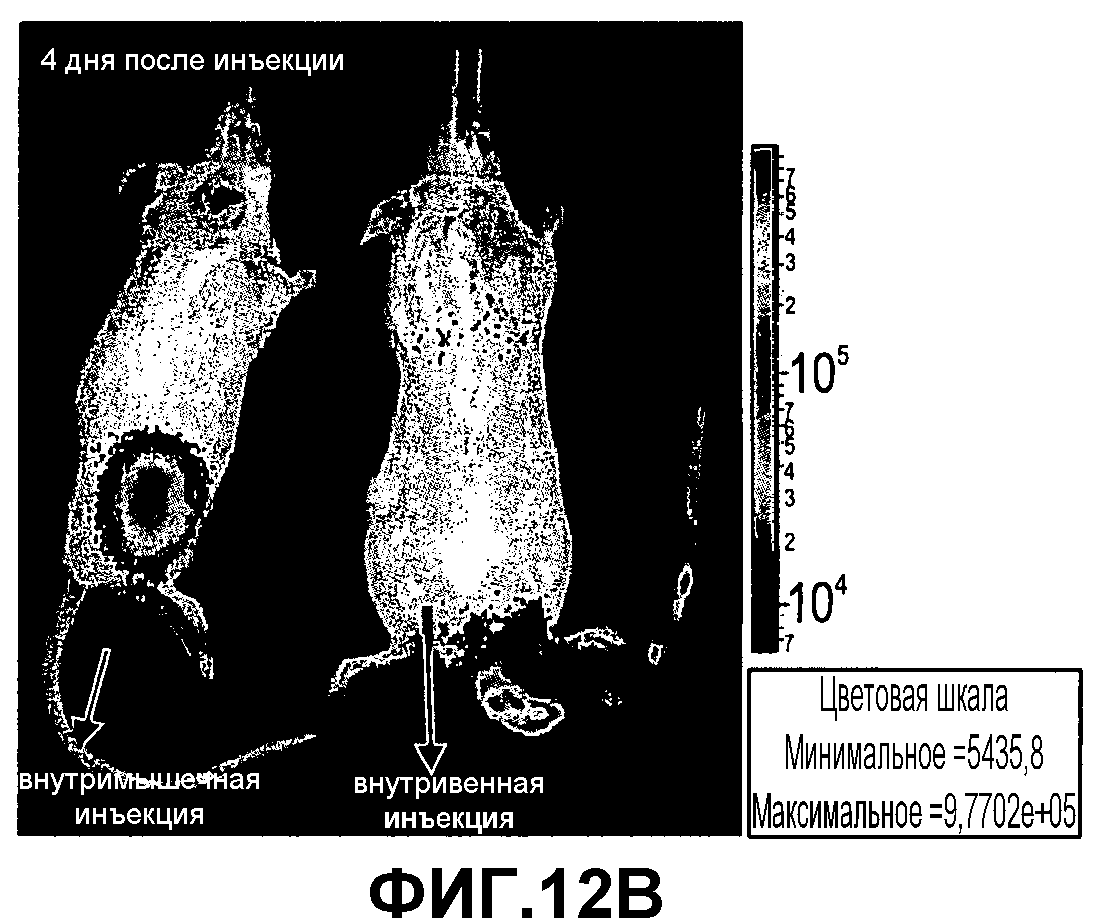
На фиг.12A-D изображена инъекция 2×106 экспрессирующих люциферазу клеток PLX-C мышам SCID/Beige. Одной мыши проводили внутримышечную инъекцию и одной внутривенную инъекцию. Мониторинг мышей после инъекции проводили с использованием устройства IVIS для оценки биологического распределения PLX-C in vivo. Представлены результаты, полученные IVIS, в 1-й (фиг.12A), 4-й (фиг.12B), 6-й (фиг.12C) и 22-й дни (фиг.12D).
Описание конкретных вариантов осуществления изобретения
Настоящее изобретение в определенных вариантах его осуществления относится к выращенным в прикрепленной к субстрату культуре клетам плаценты, а конкретнее, но не исключительно, к способам их культивирования и их применению для лечения.
Принципы и операции настоящего изобретения можно лучше понять со ссылкой на фигуры и сопровождающие описания.
Перед детальным объяснением по меньшей мере одного варианта осуществления изобретения следует понимать, что изобретение необязательно ограничивается в его заявке деталями, изложенными в следующем описании или иллюстрируемых примерами. Возможны другие варианты осуществления или реализации или проведения его различными путями. Следует также понимать, что фразеология и терминология, используемые в настоящем описании, служат цели описания и не должны рассматриваться как ограничивающие.
При осуществлении на практике настоящего изобретения заявители обнаружили, что культивирование выращенных в прикрепленной к субстрату культуре клеток, полученных из плаценты, в трехмерных (3D) условиях культивирования, включающих перфузию, общие большие количества выращенных в прикрепленной к субстрату культуре клеток, которые характеризуются отличительным профилем генной экспрессии, способны подавить иммунный ответ и являются высокопролиферативными. Таким образом, выращенные в прикрепленной к субстрату культуре клетки плаценты могут использоваться для лечебных видов применения.
Как иллюстрируется в настоящем описании ниже в примерах 1-8 раздела «Примеры», заявители смогли расселить полученные из плаценты выращенные в прикрепленной к субстрату культуре клетки в 3D-условиях. 3D-условия по настоящему изобретению включают перфузию клеточной среды внутри биореактора (смотрите пример 2). Как показано в примере 3, полученные из плаценты выращенные в прикрепленной к субстрату культуре клетки по настоящему изобретению имеют свойства стромальных стволовых клеток, например они экспрессируют клеточные маркеры, типичные для стромальных стволовых клеток, и имеют иммуносуппрессивные свойства. Кроме того, эти клетки являются высокопролиферативными (28% клеток находились в фазах S и G2/M) и сохраняются в организме в течение нескольких недель после введения (смотрите примеры 3 и 8), свидетельствуя о том, что эти клетки могут использоваться для лечения.
Кроме того, полученные из плаценты выращенные в прикрепленной к субстрату культуре клетки по настоящему изобретению не дифференцировались в остеоциты (примеры 4-5) или адипоциты (примеры 6-7), что резко отличается от выращенных в прикрепленной к субстрату культуре клеток костного мозга, высокая процентная доля которых (более 50%) подвергалась дифференциации при выращивании в таких же условиях.
Таким образом, в соответствии с одним аспектом настоящего изобретения предоставляется способ культивирования выращенных в прикрепленной к субстрату культуре клеток из плаценты или жировой ткани, причем способ включает культивирование выращенных в прикрепленной к субстрату культуре клеток из плаценты или жировой ткани в трехмерных (3D) условиях культивирования, которые обеспечивают возможность размножения клеток, причем условия включают перфузию.
Используемая в настоящем описании фраза «выращенные в прикрепленной к субстрату культуре клетки» относится к однородной или гетерогенной популяции клеток, которые зависят от якорной подложки, т.е. требуют прикрепления к поверхности для роста in vitro.
Используемая в настоящем описании фраза «жировая ткань» относится к соединительной ткани, которая содержит жировые клетки (адипоциты).
Используемая в настоящем описании фраза «ткань плаценты» относится к любой части органа млекопитающего, которая выстилает стенку матки, и во время беременности окутывает плод, к которому она прикреплена пупочным кантиком. После рождения плацента изгоняется (и именуется послеродовой плацентой). В иллюстративном варианте осуществления плацента относится к цельной плаценте.
В соответствии с положениями настоящего изобретения, полученные из плаценты или жировой ткани клетки, прикрепленные к субстрату, расселяются с использованием трехмерных (3D) условий культивирования.
Используемая в настоящем описании фраза «трехмерная культура» относится к культуре, в которой клетки расположены в условиях, которые совместимы с ростом клеток, включая каркас, который обеспечивает возможность межклеточных контактов в трех измерениях. Хорошо понятно, что окружение in situ клетки в живом организме (или ткани) находится в трехмерной архитектуре. Клетки окружены другими клетками. Они удерживаются в сложной сети наномасштабных волокон внеклеточной матрицы, которая обеспечивает возможность установления различных локальных микросред. Их внеклеточные лиганды опосредуют не только прикрепление к базальной мембране, но также доступ к разнообразным кровеносным и лимфатическим сосудам. Кислород, гормоны и питательные вещества доставляются к клеткам, а отходы клеточной жизнедеятельности уносятся от них. Условия в трехмерной культуре по изобретению предназначены для имитации такой среды, как далее объясняется ниже.
Следует понимать, что условия трехмерной культуры таковы, чтобы обеспечить возможность размножения клеток, прикрепленных к субстрату.
Используемый в настоящем описании термин «размножение» относится по существу к лишенному дифференциации поддержанию клеток и, в конечном счете, клеточного роста, т.е. к увеличению клеточной популяции (например, по меньшей мере в 2 раза) без дифференциации, сопровождающей такое увеличение.
Используемый в настоящем описании термин «поддержание» относится по существу к лишенному дифференциации клеточному обновлению, т.е. по существу стационарной клеточной популяции без дифференциации, сопровождающей такую стационарность.
Как указано, прикрепленные к субстрату клетки данного аспекта изобретения получены из плацентарной или жировой ткани.
Плацентарные клетки могут быть получены из плаценты при доношенной и недоношенной беременности. Плацента по существу перфузируется в течение периода времени, достаточного для удаления остаточных клеток (например, крови).
Термины «перфузировать» или «перфузия», используемые в настоящем описании, относятся к действию вливания и пропускания жидкости через плаценту или на более поздних стадиях способа через культивируемые клетки. Плацентарная ткань может быть получена у млекопитающего; например, плацентарная ткань является человеческой. Удобным источником плацентарной ткани является послеродовая плацента (например, через 1-6 часов после родов), однако источник плацентарной ткани или клеток или способ выделения плацентарной ткани не имеет решающего значения для изобретения.
Происходящие из плаценты клетки, прикрепленные к субстрату, могут быть получены и из фетальной (т.е. амниона, хориона, хориональных ворсинок или внутренних частей плаценты, смотрите пример 1) и из материнской (т.е. отслаивающейся базальной и отслаивающейся париетальной) частей плаценты. Образцы ткани промываются в физиологическом буфере [например, забуференном фосфатом солевом растворе (PBS) или буфере Хенкса]. Одноклеточные суспензии готовятся обработкой ткани переваривающим ферментом (смотрите ниже) и/или перемалыванием и пропусканием частей ткани через нейлоновый фильтр или осторожным пипетированием (Falcon, Becton, Dickinson, San Jose, CA) промывающей средой.
Следует понимать, что выращенные в прикрепленной к субстрату культуре клетки могут быть получены из жировой ткани. Происходящие из жировой ткани выращенные в прикрепленной к субстрату культуре клетки могут быть выделены различными способами, известными специалистам в данной области. Например, такие способы описаны в патенте США № 6153432. Жировая ткань может быть получена из участков ткани сальников/висцеральных органов, молочной железы, половых органов или других участков жировой ткани. Один источник жировой ткани представляет собой жировую ткань сальника. У людей жировая ткань обычно выделяется липосакцией.
Изолированные выращенные в прикрепленной к субстрату культуре клетки из плаценты или жировой ткани могут быть получены обработкой ткани переваривающим ферментом, таким как коллагеназа, трипсин и/или диспаза; и/или эффективные концентрации гиалуронидазы или ДНКазы; и этилендиаминтетрауксусной кислотой (ЭДТА); при температуре от 25 до 50°С, в течение периодов от 10 минут до 3 часов. Затем клетки могут пропускаться через нейлоновый или марлевый сетчатый фильтр с размером отверстий от 20 мкм до 1 мм. Клетки центрифугируются при величинах скорости от 100 до 3000×g в течение периодов от 1 минуты до 1 часа при температурах от 4 до 50°С (смотрите патент США № 7078230).
Извлечение клеток из плаценты или жировой ткани предпочтительно осуществляется в асептических условиях. После получения изолированных клеток им предоставляется возможность прикрепления к липкому материалу (например, сконфигурированному в виде поверхности) для выделения, посредством этого, выращенных в прикрепленной к субстрату культуре клеток.
Используемый в настоящем описании термин «липкий материал» относится к синтетическому, естественно встречающемуся или имеющему комбинацию указанных свойств нецитотоксическому (т.е. биологически совместимому) материалу, имеющему химическую структуру (например, заряженные группы, открытые на поверхность), который может удерживать клетки на поверхности.
Примеры липких материалов, которые могут использоваться в соответствии с данным аспектом изобретения, включают без ограничения полиэфир, полипропилен, полиалкилен, полифторхлорэтилен, поливинилхлорид, полистирол, полисульфон, ацетат целлюлозы, стекловолокно, керамическую частицу, матригель, компонент внеклеточной матрицы (например, фибронектин, витронектин, хондронектин, ламинин), коллаген, поли L молочную кислоту, декстрин и волокно инертного металла.
Дальнейшие стадии очистки или обогащения для стромальных стволовых клеток могут осуществляться с использованием способов, которые хорошо известны в данной области (таких как FACS, с использованием маркера экспрессии стромальных стволовых клеток, как далее описано ниже в настоящей заявке).
Неограничивающие примеры основных сред, используемых при культивировании в соответствии с изобретением, включают минимальную эссенциальную среду Игла, ADC-1, LPM (бычья сыворотка, лишенная альбумина), F10 (HAM), F12 (HAM), DCCM1, DCCM2, RPMI 1640, среда BGJ (в модификации Fitton-Jackson и без нее), основная среда Игла (BME с добавлением основной соли Игла), модифицированная по Дульбекко среда Игла (DMEM без сыворотки), Yamane, IMEM-20, модифицированная по Глазгов среда Игла (GMEM), среда Leibovitz L-15, среда McCoy's 5A, среда M199 (M199E- с основной солью Ирла), среда M199 (M199H- с основной солью Хенка), минимальная эссенциальная среда Игла (MEM-E- с основной солью Ирла), минимальная эссенциальная среда Игла (MEM-H- с основной солью Хенка) и минимальная эссенциальная среда Игла (MEM-NAA с незаменимыми аминокислотами), среди многочисленных других, включая среду 199, CMRL 1415, CMRL 1969, CMRL 1066, NCTC 135, MB 75261, MAB 8713, DM 145, Williams' G, Neuman & Tytell, Higuchi, MCDB 301, MCDB 202, MCDB 501, MCDB 401, MCDB 411, MDBC 153. Предпочтительной средой для использования в изобретении является DMEM. Эти и другие полезные среды выпускаются, среди других, компаниями GIBCO, Grand Island, N.Y., USA и Biological Industries, Bet Haemek, Israel. Ряд указанных сред обобщен в публикациях Methods in Enzymology, Volume LVIII, "Cell Culture", pp. 62 72, edited by William B. Jakoby, и Ira H. Pastan, published by Academic Press, Inc.
В среду может добавляться сыворотка, такая как фетальная сыворотка коров, или людей, или других видов, и, возможно, или альтернативно, факторы роста, витамины (например, аскорбиновой кислоты), цитокины, соли (например, B-глицерофосфат), стероиды (например, дексаметазон) и гормоны, например гормон роста, эритропоэтин, тромбропоэтин, интерлейкин 3, интерлейкин 6, интерлейкин 7, фактор, стимулирующий колонии макрофагов, c-набор лиганда/фактора стволовых клеток, лиганд остеопротегерина, инсулин, подобный инсулину фактор роста, эпидермальный фактор роста, фактор роста фибробластов, фактор роста нервов, цилиарный нейротропный фактор, фактор роста, полученный из тромбоцитов, и костный морфогенетический белок в концентрациях на уровнях от пикрограммов/мл до миллиграммов/мл.
Кроме того, допускается добавление дополнительных компонентов к культуральной среде. Такие компоненты могут представлять собой антибиотики, противогрибковые средства, альбумин, аминокислоты и другие компоненты, известные в области культивирования клеток. Кроме того, при необходимости, могут добавляться компоненты для усиления процесса дифференциации (смотрите ниже).
Как указано, выращенные в прикрепленной к субстрату культуре клетки получены, они могут пассироваться в двумерные или трехмерные системы (смотрите примеры 1 и 2 ниже в разделе «Примеры»). Хотя следует понимать, что клетки могут переноситься в матрицу 3D-конфигурации непосредственно после выделения или, альтернативно, могут пассироваться в трехмерные системы после двумерных (2D) условий (как указано ниже).
Следует понимать, что во время культивирования в 2D-условиях культивирования выращенные в прикрепленной к субстрату культуре клетки могут непрерывно пересеваться. В соответствии с одним вариантом осуществления настоящего изобретения клетки могут пересеваться по меньшей мере в 4 пассажа, по меньшей мере в 5 пассажей, по меньшей мере в 6 пассажей, по меньшей мере в 7 пассажей или по меньшей мере в 8 пассажей. Следует понимать, что клетки обычно пересеваются, когда культура достигает слияния примерно 70-90%, обычно через 3-7 дней (например, 3-5 дней, 1-3 удвоения). Кроме того, в условиях 2D культивирования, клетки могут выращиваться в культуральной среде, лишенной добавок антибиотиков по меньшей мере после 2-го пересева, по меньшей мере после 3-го пересева, или по меньшей мере после 4-го пересева.
Таким образом, прикрепленный материал данного аспекта изобретения сконфигурирован для 3D-культивирования, посредством этого предоставляя ростовую матрицу, которая существенно увеличивает доступную поверхность прикрепления для прилипания клеток с тем, чтобы имитировать инфраструктуру ткани (например, плаценты).
Для крупномасштабной продукции культивирование может осуществляться в 3D-биореакторе.
Примеры таких биореакторов включают без ограничения поршневой проточный биореактор, биореактор с непрерывно перемешиваемым резервуаром, биореактор со стационарным слоем (биореактор с упакованным слоем) и биореактор с пседосжиженным слоем.
Как показано в примере 2 раздела «Примеры», биореактор Celligen способен обеспечить 3D-размножение прикрепленных к субстрату клеток в регулируемых условиях (например, pH, температуры и уровней кислорода) и при постоянной перфузии средой для роста клеток. Кроме того, мониторинг клеточных культур может производиться по уровням концентрации глюкозы, лактата, глутамина, глутамата и аммония. Скорость потребления глюкозы и скорость образования лактата в выращенных в прикрепленной к субстрату культуре клетках обеспечивает возможность измерения скорости роста клеток и для определения времени сбора.
Другие 3D-биореакторы, которые могут использоваться в изобретении, включают без ограничения биореактор с непрерывно перемешиваемым резервуаром, где культуральная среда непрерывно подается в биореактор, а используемая среда непрерывно отсасывается для поддержания постоянного во времени стационарного состояния внутри биореактора. Биореактор с перемешиваемым резервуаром может использоваться с псевдосжиженным слоем (взвешенными носителями) или с корзиной с волокнистым слоем (которая выпускается, например, компанией New Brunswick Scientific Co., Edison, NJ), биореактор со стационарным слоем, биореактор с воздушным подъемом, где воздух обычно подается в дно трубы центрального дутья, проходя вверх с образованием пузырьков и выпуская выходной газ на верхушке колонны, биореактор с полиактивными пенами [как описано в публикации Wendt, D. et al., Biotechnol Bioeng 84: 205-214, (2003)], пористыми каркасами в биореакторе с перфузией в радиальном потоке [как описано в публикации Kitagawa et al., Biotechnology and Bioengineering 93(5): 947-954 (2006)], биореактор радиального потока с каркасом или носителями, половолоконный биореактор и микроносители. Другие биореакторы, которые могут использоваться в соответствии с изобретением, описаны в патентах США №№ 6277151, 6197575, 6139578, 6132463, 5902741 и 5629186.
В иллюстративном варианте осуществления всего высеваются 150±50×106 клеток, 3-7×106 клеток/г носителя или 0,06-0,13×106 клеток/мл. В соответствии с иллюстративным вариантом осуществления посев клеток осуществляется в концентрации 1400-7000 клеток/см2 дисков FibraCel.
Клетки могут быть собраны, когда по меньшей мере примерно 10% клеток пролиферируют, в то же время избегая неконтролируемой дифференциации и старения.
Культивирование осуществляется в течение по меньшей мере 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 7 дней, 10 дней, 14 дней, 20 дней, месяца или даже более. Следует понимать, что культивирование в биореакторе может удлинить этот период. Культивирование выращенных в прикрепленной к субстрату культуре клеток в 3D-культуре может осуществляться при непрерывном потоке культуральной среды. Пересев может также осуществляться для увеличения числа клеток. Следует понимать, что культуральная среда может меняться для продления и улучшения условий культивирования.
В соответствии с одним вариантом осуществления настоящего изобретения культивирование клеток осуществляется в условиях перфузии культуральной среды. Обычно скорость перфузии определяется концентрацией глюкозы в культуральной среде выращенных в прикрепленной к субстрату культуре клеток. Таким образом, в соответствии с положениями настоящего изобретения культуральная среда может меняться, когда концентрация глюкозы составляет примерно 500 мг/л, примерно 550 мг/л или примерно 600 мг/л.
Выращенные в прикрепленной к субстрату культуре клетки некоторых вариантов осуществления настоящего изобретения содержат по меньшей мере примерно 10%, 28%, 30%, 50%, 80% или более пролиферативных клеток (как может анализироваться с помощью мониторинга FACS фаз S и G2/M).
Выращенные в прикрепленной к субстрату культуре клетки некоторых вариантов осуществления изобретения могут содержать по меньшей мере один «фенотип стромальных стволовых клеток».
Используемая в настоящем описании фраза «фенотип стромальных стволовых клеток» относится к структурному или функциональному фенотипу, типичному для полученной из костного мозга стромальной (т.е. мезенхимальной) стволовой клетки.
Используемая в настоящем описании фраза «стволовая клетка» относится к клетке, которая терминально не дифференцирована.
Так, например, клетки могут иметь форму веретена. Альтернативно или дополнительно клетки могут экспрессировать маркер или коллекцию маркеров (например, поверхностный маркер), типичных для стромальных стволовых клеток. Примеры маркеров поверхности стромальных стволовых клеток (положительных и отрицательных) включают без ограничения CD105+, CD29+, CD44+, CD73+, CD90+, D7-fib+, CD3-, CD4-, CD34-, CD45-, CD80-, CD5-, CD20-, CD11B-, CD14-, CD19-, CD79-, HLA-DR-, CD31-, KDR- и FMC7-. Другие маркеры стромальных клеток включают без ограничения тирозин-гидроксилазу, нестин и H-NF.
Прикрепленные к субстратам клетки ткани плаценты, генерированные в соответствии с положениями настоящего изобретения, имеют профиль генной экспрессии, по существу, как описано в примере 3 ниже в разделе «Примеры».
Примеры функциональных фенотипов, типичных для стромальных стволовых клеток, включают без ограничения активность подавления Т-клеток (они не стимулируют Т-клетки, а наоборот, подавляют их) и активность поддержки гематопоэтических стволовых клеток.
В соответствии с иллюстративным вариантом осуществления выращенные в прикрепленной к субстрату культуре клетки по настоящему изобретению менее склонны к дифференциации в остеогенную или адипогенную линии дифференциации по сравнению с выращенным в прикрепленной к субстрату культуре клеткам из костного мозга, выросших и дифференцированных в таких же условиях (смотрите соответственно примеры 4-5 и примеры 6-7).
Как показано ниже в примере 3 раздела «Примеры», было обнаружено, что выращенные в прикрепленной к субстрату культуре клетки по настоящему изобретению подавляют иммунную реакцию мононуклеарных клеток человека в анализе реакции смешанных лимфоцитов (MLR) и, таким образом, проявляют биологическую активность, которая может предпочтительно использоваться в клинике (например, активность подавления Т-клеток, активность поддержания гематопэтических стволовых клеток).
В соответствии с одним вариантом осуществления изобретения выращенные в прикрепленной к субстрату культуре клетки по изобретению способны подавлять иммунную реакцию у индивида.
Используемая в настоящем описании фраза «подавлять иммунную реакцию у индивида» относится к уменьшению или ингибированию иммунной реакции, происходящей у индивида в ответ на антиген (например, инородная клетка или ее часть). Иммунный ответ, который может подавляться выращенными в прикрепленной к субстрату культуре клетками, включает гуморальные иммунные реакции и клеточные иммунные реакции, которые включают соответственно специфическое распознавание антигенов патогенов посредством антител и Т-лимфоцитов (пролиферацию Т-клеток).
Популяции клеток, генерированных в соответствии с положениями настоящего изобретения, могут использоваться для лечения состояния, на которое может благоприятное воздействие оказывать трансплантация клеток или органов.
Используемый в настоящем описании термин «состояние» относится к любой патологии (заболеванию, состоянию, синдрому или расстройству), на которое может оказывать благоприятное воздействие трансплантация клеток (например, стволовых клеток) или органов. Примеры включают ишемические состояния, сердечно-сосудистые состояния, состояния нервной системы, состояния желудочно-кишечного тракта, ортопедические состояния, гематопэтические состояния, почечные состояния и печеночные состояния, такие как без ограничения заболевания периферических артерий (PAD), такие как ишемия конечностей и критическая ишемия конечностей (CLI), ишемия нижних конечностей, ишемические сосудистые заболевания, ишемическая болезнь сердца, ишемия миокарда, острый инфаркт миокарда (MI), коронарная болезнь сердца (CAD), атеросклеротические сердечно-сосудистые заболевания, поражение основного ствола левой коронарной артерии, артериальные окклюзионные заболевания, периферическая ишемия, заболевания периферических сосудов, артериосклероз, ишемическая болезнь мозга, инсульт, церебральная ишемия, цереброваскулярные заболевания, ретинопатия, восстановление сетчатки, расстройство перестройки, синдром фон Гиппеля-Линдау, наследственная геморрагическая телеангиэктазия, ишемическое сосудистое заболевание, болезнь Бюргера, сахарный диабет, сосудистое заболевание почек, ишемическое почечное заболевание, заболевания печени, ишемия плаценты, расстройства, связанные с репродукцией, болезнь трансплантат против хозяина (GVHD), трансплантация солидных органов, трансплантация гематопоэтических стволовых клеток (HSCT), метаболические расстройства, воспалительные состояния желудочно-кишечного тракта (GI) [например, воспалительное заболевание кишечника (IBD)], язвенный колит, задержка заживления ран, задержка заживления язв, злокачественные новообразования (например, рак молочной железы), предраковые заболевания, состояния, характеризуемые повреждением соединительной ткани, таким как злокачественное поражение костей, остеосаркома, костные метастазы, перелом костей, дегенеративное заболевание межпозвонковых дисков, несовершенный остеогенез (OI), ожоги, ожоговые раны, дефект суставного хряща, заживление ран, глубокие раны, задержка заживления ран, задержка заживления язв, подхрящевая киста кости, остеопороз, остеоартрит (OA), дегенеративное изменение костей, повреждение хряща, дефект суставного хряща, повреждения сухожилий (например, травмы, вызванные перерастяжением сухожилий) и повреждения связок.
Следует понимать, что выращенные в прикрепленной к субстрату культуре клетки по настоящему изобретению способны вызвать иммуносуппрессию и/или толерантность у индивида. Таким образом, выращенные в прикрепленной к субстрату культуре клетки могут использоваться для лечения любого состояния, при котором требуется иммуносуппрессия и/или толерантность. Такие состояния включают без ограничения аутоиммунные заболевания и воспалительные заболевания (включая острые и хронические воспалительные заболевания), включая без ограничения сердечно-сосудистые заболевания, ревматоидные заболевания, заболевания железистых органов, желудочно-кишечные заболевания, кожные заболевания, печеночные заболевания, неврологические заболевания (например, нейропатическую боль, повреждение периферических нервов), мышечные заболевания, почечные заболевания, поддержка для трансплантации почек, заболевания, связанные с репродукцией, заболевания соединительной ткани и системные заболевания.
Примеры аутоиммунных заболеваний включают без ограничения атеросклероз (Matsuura E. et al., Lupus. 1998, 7 Suppl 2:S135), инфаркт миокарда (Vaarala O. Lupus. 1998, 7 Suppl 2:S132), тромбоз (Tincani A. et al., Lupus 1998, 7 Suppl 2:S107-9), грануломатоз Вегенера, артериит Такаясу, синдром Кавасаки (Praprotnik S. et al., Wien Klin Wochenschr, 25 августа 2000 года, 112 (15-16): 660), аутоиммунное заболевание с выработкой антител против фактора VIII (Lacroix-Desmazes S. et al., Semin Thromb Hemost. 2000; 26 (2): 157), некротизирующий васкулит мелких сосудов, микроскопический полиангиит, синдром Churg м Strauss, малоиммунный очаговый некротизирующий и полулунный гломерулонефрит (Noel LH. Ann Med Interne (Paris), май 2000; 151 (3): 178), антифосфолипидный синдром (Flamholz R. et al., J Clin Apheresis 1999; 14 (4): 171), вызванная антителами сердечная недостаточность (Wallukat G. et al., Am J Cardiol., 17 июня 1999 года; 83 (12A): 75H), тромбоцитопеническая пурпура (Moccia F. Ann Ital Med Int., апрель-июнь 1999; 14 (2): 114; Semple JW. et al., Blood, 15 мая 1996 года; 87 (10): 4245), аутоиммунная гемолитическая анемия (Efremov DG. et al., Leuk Lymphoma, июнь 1998; 28 (3-4): 285; Sallah S. et al., Ann Hematol, март 1997; 74 (3): 139), аутоиммунное поражение сердца при болезни Шагакса (Cunha-Neto E. et al., J Clin Invest, 15 октября 1996 года; 98 (8): 1709) и аутоиммунитет против Т хелперных лимфоцитов (Caporossi AP. et al., Viral Immunol 1998; 11 (1): 9).
Примеры аутоиммунных ревматоидных заболеваний включают без ограничения ревматоидный артрит (Krenn V. et al., Histol Histopathol, июль 2000; 15 (3): 791; Tisch R, McDevitt HO. Proc Natl Acad Sci units S A, 18 января 1994 года; 91 (2): 437) и анкилозирующий спондилит (Jan Voswinkel et al., Arthritis Res 2001; 3 (3): 189).
Примеры аутоиммунных железистых заболеваний включают без ограничения заболевания поджелудочной железы, сахарный диабет I типа, заболевания щитовидной железы, болезнь Грэйвса, тироидит, спонтанный аутоиммунный тироидит, тироидит Хашимото, идиопатическую микседему, аутоиммунные заболевания яичников, аутоиммунное бесплодие вследствие продукции антител против спермы, аутоиммунный простатит и аутоиммунный полигландулярный синдром I типа. Эти заболевания включают без ограничения аутоиммунные заболевания поджелудочной железы, сахарный диабет I типа (Castano L. and Eisenbarth GS. Ann. Rev. Immunol. 8:647; Zimmet P. Diabetes Res Clin Pract, октябрь 1996; 34 Suppl: S125), аутоиммунные заболевания щитовидной железы, болезнь Грэйвса (Orgiazzi J. Endocrinol Metab Clin North Am, июнь 2000; 29 (2): 339; Sakata S. et al., Mol Cell Endocrinol, март 1993; 92 (1): 77), спонтанный аутоиммунный тироидит (Braley-Mullen H. and Yu S, J Immunol, 15 декабря 2000 года; 165 (12): 7262), тироидит Хашимото (Toyoda N. et al., Nippon Rinsho, август 1999; 57 (8): 1810), идиопатическую микседему (Mitsuma T. Nippon Rinsho., август 1999; 57 (8): 1759), аутоиммунные заболевания яичников (Garza KM. et al., J Reprod Immunol, февраль 1998; 37 (2): 87), аутоиммунное бесплодие вследствие продукции антител против спермы (Diekman AB. et al., Am J Reprod Immunol., март 2000; 43 (3): 134), аутоиммунное воспаление предстательной железы (Alexander RB. et al., Urology, декабрь 1997; 50 (6): 893) и аутоиммунный полигландулярный синдром I типа (Hara T. et al., Blood, 1 марта 1991 года; 77 (5): 1127).
Примеры аутоиммунных желудочно-кишечных заболеваний включают, без ограничения, хронические воспалительные кишечные заболевания (Garcia Herola A. et al., Gastroenterol Hepatol., январь 2000; 23 (1): 16), брюшную болезнь (Landau YE. and Shoenfeld Y. Harefuah, 16 января 2000 года; 138 (2): 122), колит, илеит и болезнь Крона.
Примеры аутоиммунных кожных заболеваний включают, без ограничения, аутоиммунные буллезные заболевания кожи, такие как, без ограничения, обыкновенная пузырчатка, буллезная псевдопузырчатка, псориаз и листовидная пузырчатка.
Примеры аутоиммунных печеночных заболеваний включают, без ограничения, гепатит, аутоиммунный хронический активный гепатит (Franco A. et al., Clin Immunol Immunopathol, март 1990; 54 (3): 382), первичный билиарный цирроз (Jones DE. Clin Sci (Colch), ноябрь 1996; 91 (5): 551; Strassburg CP. et al., Eur J Gastroenterol Hepatol., июнь 1999; 11 (6): 595) и аутоиммунный гепатит (Manns MP. J Hepatol, август 2000; 33 (2): 326).
Примеры аутоиммунных неврологических заболеваний включают, без ограничения, рассеянный склероз (Cross AH. et al., J Neuroimmunol, 1 января 2001 года; 112 (1-2): 1), Alzheimer's disease (Oron L. et al., J Neural Transm Suppl. 1997; 49: 77), тяжелую миастению (Infante AJ. and Kraig E, Int Rev Immunol 1999; 18 (1-2): 83; Oshima M. et al., Eur J Immunol, декабрь 1990; 20 (12): 2563), нейропатии, двигательные нейропатии (Romberg AJ. J Clin Neurosci., май 2000; 7 (3): 191); синдром Гиллена-Барре и аутоиммунные нейропатии (Kusunoki S. Am J Med Sci., апрель 2000; 319 (4): 234), миастению, миастенический синдром Ламбера-Итона (Takamori M. Am J Med Sci., апрель 2000; 319 (4): 204); паранеопластические неврологические заболевания, мозжечковую атрофию, паранеопластическую мозжечковую атрофию и синдром мышечной скованности (Hiemstra HS. et al., Proc Natl Acad Sci units S A, 27 марта 2001 года; 98 (7): 3988); непаранеопластический синдром мышечной скованности, прогрессирующие мозжечковые атрофии, энцефалит, энцефалит Расмуссена, боковой амиотрофический склероз, хорею Сидхэма, синдром Гиля де ля Туретта и аутоиммунные полиэндокринопатии (Antoine JC. and Honnorat J. Rev Neurol (Paris), январь 2000; 156 (1): 23); дисиммунные нейропатии (Nobile-Orazio E. et al., Electroencephalogr Clin Neurophysiol Suppl 1999; 50: 419); приобретенную нейромиотонию, множественный врожденный артрогрипоз (Vincent A. et al., Ann N Y Acad Sci. 1998 May 13; 841:482), неврит, оптический неврит (Soderstrom M. et al., J Neurol Neurosurg Psychiatry, май 1994; 57 (5): 544) и нейродегенеративные заболевания.
Примеры аутоиммунных мышечных заболеваний включают, без ограничения, миозит, аутоиммунный миозит и первичный синдром Шегрена (Feist E. et al., Int Arch Allergy Immunol, сентябрь 2000; 123 (1): 92) и гладкомышечные аутоиммунные заболевания (Zauli D. et al., Biomed Pharmacother, июнь 1999; 53 (5-6): 234).
Примеры аутоиммунных почечных заболеваний включают, без ограничения, нефрит и аутоиммунный интерстициальный нефрит (Kelly CJ. J Am Soc Nephrol, август 1990; 1 (2): 140).
Примеры аутоиммунных заболеваний, связанных с репродукцией, включают, без ограничения, повторные выкидыши (Tincani A. et al., Lupus 1998; 7 Suppl 2: S107-9).
Примеры аутоиммунных заболеваний соединительной ткани включают, без ограничения, ушные заболевания, аутоиммунные ушные заболевания (Yoo TJ. et al., Cell Immunol, август 1994; 157 (1): 249) и аутоиммунные заболевания внутреннего уха (Gloddek B. et al., Ann N Y Acad Sci, 29 декабря 1997 года; 830: 266).
Примеры аутоиммунных системных заболеваний включают, без ограничения, системную красную волчанку (Erikson J. et al., Immunol Res 1998; 17 (1-2): 49) и склеродермию (Renaudineau Y. et al., Clin Diagn Lab Immunol., март 1999; 6 (2): 156); Chan OT. et al., Immunol Rev, июнь 1999; 169: 107).
Кроме того, выращенные в прикрепленной к субстрату культуре клетки по настоящему изобретению могут использоваться для лечения заболеваний, связанных с трансплантацией трансплантата, включая, без ограничения, отторжение трансплантата, хроническое отторжение трансплантата, подострое отторжение трансплантата, сверх острое отторжение трансплантата, острое отторжение трансплантата и болезнь трансплантат против хозяина.
Используемый в настоящем описании термин «лечение» относится к ингибированию или остановке развития патологии и/или вызову снижения, ремиссии или обратного развития патологии. Специалистам в данной области понятно, что различные методологии и анализы могут использоваться для оценки развития патологии, и, аналогичным образом, различные методологии и анализы могут использоваться для оценки снижения, ремиссии или обратного развития патологии. Термин «лечение» может также относиться к облегчению или уменьшению симптома, связанного с патологией.
Индивид, получающий лечение клетками, выращенными в прикрепленной к субстрату культуре, может представлять собой любого индивида (например, млекопитающее), такого как человек или одомашненное животное, включая без ограничения лошадей (т.е. лошадиных), крупный рогатый скот, коз, овец, свиней, собак, кошек, верблюдов, альпак, лам и яков, у которых диагностирована или имеется указанная выше патология и на которых может оказать благоприятное воздействие трансплантация стромальных стволовых клеток.
Способы получения клеток со специфическими линиями дифференцировки из клеток, выращенных в прикрепленной к субстрату культуре (например, стромальных стволовых клеток) по изобретению, хорошо известны в данной области. Смотрите, например, патенты США №№ 5486359, 5942225, 5736396, 5908784 и 5902741.
Клетки, выращенные в прикрепленной к субстрату культуре, могут быть интактными или могут быть генетически модифицированными с тем, чтобы получить представляющую интерес линию дифференциации (смотрите заявку на патент США № 20030219423).
Клетки могут быть из аутологичного или неаутологичного источника. Неаутологичный источник может быть аллогенным или ксеногенным. Клетки могут использоваться в виде свежих или замороженных (например, криоконсервированных) препаратов.
В зависимости от медицинского состояния, индивиду могут вводиться дополнительные химические лекарственные средства (например, иммуномодулирующие средства, химиотерапевтические средства и т.д.) или клетки.
Даже, хотя клетки характеризуются иммуносуппрессивной активностью, они все еще могут спровоцировать происходящие у хозяина или у донора нежелательные иммунные реакции. Были разработаны подходы для снижения вероятности отторжения неаутологичных клеток или GvHD (болезни трансплантат против хозяина). Они включают или подавление иммунной системы реципиента, или инкапсуляцию неаутологичных клеток в иммуноизолирующие, полупроницаемые мембраны перед трансплантацией.
Методики инкапсуляции в целом классифицируют как микроинкапсуляцию, включающую маленькие сферические везикулы, и микроинкапсуляцию, включающую более крупные плосколистные или половолоконные мембраны (Uludag, H. et al. Technology of mammalian cell encapsulation. Adv Drug Deliv Rev. 2000; 42: 29-64).
Способы получения микрокапсул известны в данной области и включают, например, способы, описанные Lu MZ, et al., Cell encapsulation with alginate and alpha-phenoxycinnamylidene-acetylated poly(allylamine). Biotechnol Bioeng. 2000, 70: 479- 83, Chang TM and Prakash S. Procedures for microencapsulation of enzymes, cells and genetically engineered microorganisms. Mol Biotechnol. 2001, 17: 249-60, and Lu MZ, et al., A novel cell encapsulation method using photosensitive poly(allylamine alpha- cyanocinnamylideneacetate). J Microencapsul. 2000, 17: 245-51.
Например, микрокапсулы получают образованием комплексов модифицированного коллагена с тер-полимерной капсулой из 2-гидроксиэтилметакрилата (HEMA), метакриловой кислоты (MAA) и метилметакрилата (MMA), приводя к получению капсулы толщиной 2-5 мкм. Такие микрокапсулы могут быть, кроме того, инкапсулированы в дополнительные оболочки из тер-полимера толщиной 2-5 мкм для получения отрицательно заряженной гладкой поверхности и для минимизации абсорбции белка плазмы (Chia, S.M. et al., Multi-layered microcapsules for cell encapsulation Biomaterials. 200223: 849-56).
Другие микрокапсулы основаны на альгинате, морском полисахариде (Sambanis, A. Encapsulated islets in diabetes treatment. Diabetes Technol. Ther. 2003, 5: 665-8) или его производных. Например, микрокапсулы могут быть получены образованием полиэлектролитных комплексов между полианионами альгината натрия и сульфатцеллюлозы натрия с поликатионом поли(метилен-ко-гуанидин) гидрохлоридом в присутствии хлорида кальция.
Следует понимать, что инкапсуляция клеток улучшается, когда используются более мелкие капсулы. Такими образом, контроль качества, механическая устойчивость, диффузионные свойства и активность in vitro инкапсулированных клеток улучшались, когда размер капсулы уменьшался от 1 мм до 400 мкм (Canaple L. et al., Improving cell encapsulation through size control. J Biomater Sci Polym Ed. 2002; 13:783-96). Кроме того, было обнаружено, что нанопористые биокапсулы с хорошо регулируемым размером пор до столь маленького размера, как 7 нм, создавали требуемые химические свойства и точную микроархитектуру, которые успешно создавали иммунно изолированные микросреды для клеток (Williams D. Small is beautiful: microparticle and nanoparticle technology in medical devices. Med Device Technol. 1999, 10: 6-9; Desai, T.A. Microfabrication technology for pancreatic cell encapsulation. Expert Opin Biol Ther. 2002, 2: 633-46).
Примеры иммуносуппрессивных средств включают без ограничения метотрексат, циклофосфамид, циклоспорин, циклоспорин A, хлорохин, гидроксихлорохин, сульфасалазин (сульфасалазопирин), соли золота, D-пеницилламин, лефлуномид, азатиоприн, анакинра, инфликсимаб (REMICADE), этанерцепт, блокаторы TNFальфа, биологическое средство, которое нацелено на воспалительный цитокин, и нестероидное противовоспалительное лекарственное средство (NSAID). Примеры NSAID включают без ограничения ацетилсалициловую кислоту, холин-магнийсалицилат, дифлунизал, салицилат магния, салсалат, салицилат натрия, диклофенак, этодолак, фенопрофен, флурбипрофен, индометацин, кетопрофен, кеторолак, меклофенамат, напроксен, набуметон, фенилбутазон, пироксикам, сулиндак, толметин, ацетаминофен, ибупрофен, ингибиторы Cox-2 и трамадол.
Кроме того, следует понимать, что клетки могут вводиться или сами по себе, или, предпочтительно, в виде части фармацевтической композиции, которая, кроме того, содержит фармацевтически приемлемый носитель.
Используемый в настоящем описании термин «фармацевтическая композиция» относится к препарату клеток, выращенных в культуре, прикрепленной к субстрату, по изобретению (т.е. клетки, выращенные в культуре, прикрепленной к субстрату) с другими химическими компонентами, такими как фармацевтически приемлемые носители и эксципиенты. Назначением фармацевтичекой композиции является содействие введению клеток индивиду.
Далее, термин «фармацевтически приемлемый носитель» относится к носителю или разбавителю, который не вызывает значительного раздражения у субъекта и не устраняет биологическую активность и свойства вводимого соединения. Примерами носителей являются без ограничений пропиленгликоль, солевой раствор, эмульсии и смеси органических растворителей с водой.
В настоящем описании термин «эксципиент» относится к инертному веществу, добавляемому к фармацевтической композиции для дополнительного содействия введению соединения. Примеры эксципиентов без ограничений включают карбонат кальция, фосфат кальция, различные сахара и типы крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли.
Методики составления и введения лекарственных средств можно найти в самом последнем издании руководства "Remington's Pharmaceutical Sciences", Mack Publishing Co., Easton, PA, которое включено в настоящее описание путем ссылки.
Фармацевтические композиции для применения в соответствии с изобретением, таким образом, могут составляться обычным образом с использованием одного или более физиологически приемлемых носителей, содержащих эксципиенты и вспомогательные вещества, которые облегчают переработку активных ингредиентов в препараты, которые могут применяться фармацевтически. Соответствующая препаративная форма зависит от выбранного пути введения.
Для инъекции активные ингредиенты фармацевтической композиции могут составляться в виде водных растворов, предпочтительно в физиологически совместимых буферах, таких как раствор Хенкса, раствор Рингера, физиологический солевой буфер или замораживающая среда, содержащая криоконсерванты.
Специалисты в данной области вполне способны определить терапевтически эффективное количество, особенно в свете представленного здесь описания.
Токсичность и терапевтическую эффективность активных ингредиентов, описанных в настоящей заявке, можно определить стандартными фармацевтическими процедурами in vitro, в клеточных культурах или у экспериментальных животных.
В зависимости от тяжести и реактивности на лечение подлежащего терапии состояния введение может быть однократным или множественным. Однако подлежащее введению количество будет, конечно, зависеть от подвергаемого лечению индивида, тяжести поражения, способа введения, суждения назначающего лечения врача и т.д.
Композиции, включающие фармацевтическое средство по изобретению, составленное в препаративную форму с совместимым фармацевтическим носителем, могут быть также получены, помещены в соответствующий контейнер и мечены для лечения указанного состояния.
При желании композиции по изобретению могут быть представлены в упаковке или в раздаточном устройстве, таком как утвержденный FDA (Администрацией по контролю за пищевыми продуктами и лекарственными средствами США) набор, который может содержать одну или более единичных дозированных форм, содержащих активный ингредиент. Упаковка может, например, содержать металлическую или пластиковую фольгу, такую как блистерная упаковка. Упаковка или раздаточное устройство может сопровождаться инструкциями по введению. Упаковка или раздаточное устройство может также снабжаться аннотацией, приложенной к контейнеру, в форме, предписанной правительственным агентством, контролирующим изготовление, применение или продажу фармацевтических средств, причем в аннотации отражается утверждение агентством формы композиций или для введения людям, или в ветеринарной практике. Такая аннотация может, например, быть представлена в форме этикетки, одобренной Администрацией по контролю за пищевыми продуктами и лекарственными средствами США, для прописываемых лекарственных средств или вкладыша продукта, использование которого одобрено уполномоченными органами.
Ожидается, что во время вступления в полную силу патента по настоящей заявке будет разработано много релевантных трехмерных культур, и предполагается, что объем термина «трехмерные культуры» a priori включает все такие новые технологии.
Используемый здесь термин «примерно» относится к ±10%.
Термины «содержит», «содержащий», «включает», «включающий», «имеющий» и связанные с ними означают «включая без ограничения».
Термин «состоящий из» означает «включающий и ограничивающийся».
Термин «состоящий по существу из» означает, что композиция, способ или структура может включать дополнительные ингредиенты, стадии и/или части, но только если дополнительные ингредиенты, стадии и/или части материально не изменяют основные и новые характеристики заявленной композиции, способа или структуры.
Пока контекст ясно не требует иного, используемая в настоящем описании форма единственного числа включает соответствующую форму множественного числа. Например, термин «соединение» или «по меньшей мере, одно соединение» может включать множество соединений, включая их смеси.
По всей заявке различные варианты осуществления настоящего изобретения могут быть представлены в формате диапазона. Следует понимать, что описание в формате диапазона представлено просто для удобства и краткости и не должно рассматриваться как жесткое ограничение объема изобретения. Соответственно, описание диапазона должно рассматриваться как определенное описание всех возможных поддиапазонов, а также отдельных числовых величин в пределах данного диапазона. Например, описание такого диапазона, как от 1 до 6, должно рассматриваться как определенное описание поддиапазонов, таких как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6, а также как отдельные числа в пределах указанного диапазона, например, 1, 2, 3, 4, 5 и 6. Это относится ко всем случаям, независимо от ширины диапазона.
Когда в настоящем описании указан числовой диапазон, то это означает включение любого приведенного числа (фракционного или интегрального) в пределах указанного диапазона. Фразы «в диапазоне от... до», первое указанное число, и второе указанное число, и во фразе «в диапазоне от» первое указанное число и второе указанное число используются в настоящем описании взаимозаменяемо и предназначены для включения первого и второго указанных чисел и всех фракционных и интегральных чисел между ними.
Используемый в настоящем описании термин «способ» относится к путям, средствам, методикам и процедурам для решения данной задачи, включая без ограничения те пути, средства, методики и процедуры, которые или известны, или легко разрабатываются на основании известных путей, средств, методик и процедур специалистами в области химии, фармакологии, биологии, биохимии и медицины.
Понятно, что определенные признаки изобретения, которые для ясности описаны в контексте отдельных вариантов осуществления, могут быть также представлены в комбинации в одном варианте осуществления. Напротив, различные признаки изобретения, которые для краткости описаны в контексте одного варианта осуществления, могут быть также представлены отдельно или в любой подходящей субкомбинации или в как подходящие при любом другом описанном варианте осуществления изобретения. Пока данный вариант осуществления невыполним без указанных элементов, то определенные признаки, описанные в контексте различных вариантов осуществления, не следует рассматривать как существенные признаки указанных вариантов осуществления.
Различные варианты осуществления и аспекты настоящего изобретения, как указано выше в настоящем описании и как заявлено ниже в формуле изобретения, экспериментально подтверждены в следующих примерах.
ПРИМЕРЫ
Далее будут представлены следующие примеры, которые вместе с приведенным выше описанием, не ограничивающим образом иллюстрируют изобретение.
В целом, номенклатура, используемая в настоящем описании и лабораторные процедуры, используемые в настоящем изобретении, включают молекулярные, биохимические, микробиологические методики и методики рекомбинантной ДНК. Такие методики подробно объяснены в литературе. Смотрите, например, документы "Molecular Cloning: A laboratory Manual" Sambrook et al., (1989); "Current Protocols in Molecular Biology" Volumes I-III Ausubel, R. M., ed. (1994); Ausubel et al., "Current Protocols in Molecular Biology", John Wiley and Sons, Baltimore, Maryland (1989); Perbal, "A Practical Guide to Molecular Cloning", John Wiley & Sons, New York (1988); Watson et al., "Recombinant DNA", Scientific American Books, New York; Birren et al. (eds) "Genome Analysis: A Laboratory Manual Series", Vols. 1-4, Cold Spring Harbor Laboratory Press, New York (1998); методики, проиллюстрированные в патентах США №№ 4666828, 4683202, 4801531, 5192659 и 5272057; "Cell Biology: A Laboratory Handbook", Volumes I-III Cellis, J. E., ed. (1994); "Current Protocols in Immunology" Volumes HII Coligan J. E., ed. (1994); Stites et al. (eds), "Basic and Clinical Immunology" (8th Edition), Appleton & Lange, Norwalk, CT (1994); Mishell and Shiigi (eds), "Selected Methods in Cellular Immunology", W. H. Freeman and Co., New York (1980); доступные иммуноанализы, в большом количестве описанные в патентной и научной литературе, смотрите, например, патенты США №№ 3791932, 3839153, 3850752, 3850578, 3853987, 3867517, 3879262, 3901654, 3935074, 3984533, 3996345, 4034074, 4098876, 4879219, 5011771 и 5281521; "Oligonucleotide Synthesis" Gait, M. J., ed. (1984); "Nucleic Acid Hybridization" Hames, B. D., and Higgins S. J., eds. (1985); "Transcription and Translation" Hames, B. D., and Higgins S. J., Eds. (1984); "Animal Cell Culture" Freshney, R. L, ed. (1986); "Immobilized Cells and Enzymes" IRL Press, (1986); "A Practical Guide to Molecular Cloning" Perbal, B., (1984) and "Methods in Enzymology" Vol. 1-317, Academic Press; "PCR Protocols: A Guide To Methods And Applications", Academic Press, San Diego, CA (1990); Marshak et al., "Strategies for Protein Purification and Characterization - A Laboratory Course Manual" CSHL Press (1996); все указанные публикации полностью включены в настоящее описание путем ссылки. Другие общие ссылки представлены по всему настоящему документу. Считается, что используемые в настоящих примерах процедуры хорошо известны в данной области и представлены для удобства читателя. Вся информация, содержащаяся в настоящем описании, включена в него путем ссылки.
Пример 1
Получение происходящих из плаценты клеток, выращенных в прикрепленной к субстрату культуре, способами в соответствии с документом WO/2007/108003
Клетки, выращенные в прикрепленной к субстрату культуре, получали, как было описано ранее (смотрите WO/2007/108003), в устройстве биореактора, содержащем 3D носители для получения клеток, выращенных в прикрепленной к субстрату культуре (обозначенных в настоящем описании как PLX).
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ ПРОЦЕДУРЫ
Происходящие из плаценты клетки, выращенные в прикрепленной к субстрату культуре
Внутренние части плаценты после срочных родов в результате доношенной беременности (медицинский центр Bnei Zion, Haifa, Israel) разрезали в асептических условиях, промывали 3 раза буфером Хенкса, инкубировали в течение 3 часов при 37°С с 0,1% коллагеназой (1 мг/мл ткани; Sigma-Aldrich, St. Lewis, MO). Используя острожное пипетирование, суспендированные клетки затем промывали средой DMEM с добавлением 10% FCS, смеси пенициллина-стрептомицина-нистатина (100 ЕД/мл:100 мкг/мл:1,25 ед/мл) и 2 мМ L-глутамина. Высевали в колбы объемом 75 см2и инкубировали при 37°С в инкубаторе для культуры ткани в увлажненных условиях 5% CO2.
Двумерный (2D) рост клеток
Клеткам предоставляли возможность прикрепиться к пластиковой поверхности в течение 48-72 часов, после чего среду меняли через каждые 3-4 дня. После 2-3 пересевов, клетки криоконсервировали, оттаивали и высевали для вторичного роста в колбы. При достижении слияния 60-80% клетки открепляли от ростовой колбы с использованием 0,25% трипсин-ЭДТА и высевали в новые колбы (обычно через каждые 3-5 дней) в течение еще 2-5 пересевов. Затем культивированные клетки собирали для анализа или для культивирования в биореакторах.
Поршневой проточный биореактор PluriX™
Поршневой проточный биореактор PluriX™ (Pluristem, Haifa, Israel; как ранее описано в патенте США № 6911201 и в документе WO/2007/108003), загружали 1-100 мл уплотненных 3D пористых носителей (диаметром 4 мм), выполненных из неплетеной тканевой матрицы из полиэфира. Эти носители обеспечивают возможность размножения больших количеств клеток в относительно небольшом объеме. Стеклянная лабораторная посуда была спроектирована и изготовлена компанией Pluristem (Pluristem, Haifa, Israel). Биореактор поддерживали в инкубаторе при 37°С, при скорости потока, регулируемой и контролируемой клапаном и перистальтическим насосом. Биореактор содержит точку взятия проб и инжекции, обеспечивающую возможность последовательного посева клеток. Культуральную среду подавали при pH 6,7-7,4 из резервуара. В резервуар подавалась фильтрованная газовая смесь, содержащая воздух/CO2/O2 в различающихся пропорциях, в зависимости от плотности клеток в биореакторе. Пропорцию O2 подбирали к уровню растворенного O2 на выходе биореактора, определяемого монитором. Газовая смесь подавалась в резервуар через силиконовые трубки или диффузор (Degania Bet, Emek Hayarden, Israel). Культуральную среду пропускали через сепарационный контейнер, который обеспечивает возможность сбора циркулирующих, неприкрепленных клеток. Циркуляцию среды получали перистальтическим насосом. Биореактор был, кроме того, оборудован дополнительной точкой взятия проб и контейнерами для непрерывного обмена среды.
Получение клеток PLX, выращенных в прикрепленной к субстрату культуре
Неслившиеся первичные 2D-культуры человеческих клеток, выращенных, как описано выше, в прикрепленной к субстрату культуре, трипсинизировали, промывали, ресуспендировали в среде DMEM с добавлением 10% FBS, смеси пенициллина-стрептомицина-нистатина (100 ЕД/мл:100 мкг/мл:1,25 ед/мл) и 2 мМ L-глутамина и высевали (103-105 клеток/мл) через точку инжекции на 3D носители в стерильном поршневом проточном биореакторе. Перед инокуляцией биореактор заполняли PBS-Ca-Mg (Biological Industries, Beit Ha'emek, Israel), автоклавировали (120ºС, 30 мин) и промывали ростовой средой Дульбекко, содержащей 10% инактивированной нагреванием фетальной телячьей сыворотки и смеси пенициллина-стрептомицина-нистатина (100 ЕД/мл:100 мкг/мл:1,25 ед/мл). Скорость потока удерживали на уровне 0,1-5 мл/мин. Процесс высевания включал прекращение циркуляции на 2-48 часов, посредством этого обеспечивая возможность клеткам осесть на носителях. Биореактор удерживали в условиях регулируемой температуры (37ºС) и условиях pH (pH 6,7-7,4), используя инкубатор с подачей стерильного воздуха и, при необходимости, CO2. Ростовую среду замещали 2-3 раза в неделю. Циркулирующую среду замещали свежей средой DMEM через каждые интервалы от 4 ч до 7 дней. При плотности 1×106-1×107 клеток/мл (после 12-40 дней роста) общий объем среды удаляли из биореактора, и биореактор и носители промывали 3-5 раз PBS. PLX клетки, выращенные в среде, прикрепленной к субстрату, затем открепляли от носителей трипсином-ЭДТА; (Biological Industries, Beit Ha'emek, Israel; 3-15 минут при осторожном перемешивании, 1-5 раз), и затем ресуспендировали в среде DMEM и криоконсервировали.
Пример 2
Получение выращенных в прикрепленной к субстрату культуре клеток, происходящих из плаценты, по настоящему изобретению
Выращенные в прикрепленной к субстрату культуре клетки PLX-C, полученные в соответствии с настоящим изобретением, проявляют характеристики, отличные от описанных выше выращенных в прикрепленной к субстрату культуре клеток PLX.
МАТЕРИАЛ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
Поршневой проточный биореактор Celligen™
Получение выращенных в прикрепленной к субстрату культуре клеток по настоящему изобретению с помощью биореактора Celligen™ (клеток PLX-C) состоит из нескольких основных стадий, как иллюстрируется на фиг.1. Процесс начинается взятием плаценты при планируемом кесаревом сечении по окончании доношенной беременности.
Затем выращенные в прикрепленной к субстрату культуре клетки выделяли из цельных плацент, выращенных в колбах для культуры ткани (2D культуры), собирали и хранили в жидком азоте в виде 2D-клеточной биомассы (2DCS), соответствующее количество 2DCS оттаивали, промывали и высевали на носители в биореакторах для дальнейшего размножения в виде 3D-культуры. После 4-12 дней роста в биореакторах клетки собирали и криоконсервировали в газовой фазе жидкого азота в виде клеток PLX-C.
Получение ткани человека
Все плаценты получали в родильном отделении в соответствии с утвержденными нормами Хельсинкского комитета по контролю за медицинским учреждением. Соответственно, все доноры плаценты подписали информированное согласие, и выполнялся скрининг доноров и тестирование доноров. Сразу после забора плаценты у донора (во время процедуры кесарева сечения), ее помещали в стерильный пластиковый мешок и затем в поддерживающую низкую температуру коробку с пакетами со льдом.
Извлечение и обработка выращенных в прикрепленной к субстрату культуре клеток
Для начала процесса, ткань плаценты разрезали на кусочки в асептических условиях под вытяжным колпаком с ламинарным потоком, промывали буферным раствором Хенкса и инкубировали в течение 2-5 часов при 37°С с 0,1% коллагеназой (1 мг коллагеназы/мл ткани). Добавляли 2D-клеточную среду (2D-среда, содержащая среду DMEM с добавками 10% FBS, фунгизона 0,25 мкг/мл и гентамицина 50 мкг/мл) и переваренную ткань подвергали грубой очистке через стерильный металлический сетчатый фильтр, собирали в стерильный химический стакан и центрифугировали (10 минут, 1200 об/мин, 4°С). Затем, используя острожное пипетирование, суспендированные клетки разбавляли 2D-средой с добавлением антибиотиков, высевали в колбы на 175 см2 и инкубировали при 37°С в инкубаторе для культуры ткани в условиях увлажнения с добавлением 5% CO2. После 2-3 дней, в течение которых клеткам предоставлялась возможность прикрепиться к поверхности колбы, их промывали PBS и добавляли 2D-среду.
Двумерный (2D) клеточный рост
Перед первым пересевом, образцы ростовой среды из 10% общего числа колб в карантине объединяли и брали для тестирования на наличие микоплазмы (IPC2). Если обнаруживалось, что анализ на микоплазму был отрицательным (набор для выявления микоплазмы EZ-PCR, Biological Industries, Israel), то клетки выпускали из карантина. После 1-2 дополнительных пересевов с использованием 2D-среды с добавлением антибиотиков, клетки переносили в чистую комнату для получения 2D-среды (2DP). При попадании в комнату 2DP, культивирование продолжали еще в течение 3-6 пересевов с использованием 2D-среды без антибиотиков. В течение всего процесса, культуры выращивали в инкубаторе для культуры ткани в условиях увлажнения 5% CO2 при 37°C. После общего числа пересевов от 6 до 9 (9-17 клеточных удвоений), клетки собирали и криоконсервировали в качестве биомассы 2D-клеток (2DCS).
Первый пересев обычно проводили через 7-15 дней. Начиная со 2-го пересева и продолжая до пересева 6-9, клетки пересевали, когда культура достигала слияния 70-90%, обычно после 4-5 дней (1,5-2 удвоения). Клетки открепляли от колбы, используя 0,25% трипсин-ЭДТА (4 минуты при 37°С) и высевали в культуру при плотности 4±0,5×103 клеток/см2. Размер колб для культуры ткани увеличивался по мере проведения пересевов. Процесс культивирования начинали в колбе для культуры ткани на 175 см2, продолжали в колбе на 500 см2 (тройной колбе) и, наконец, клетки высевали в лоток Cell Factory 10 (6320 см2).
Перед криоконсервацией, в конце периода роста 2DCS, ростовую среду собирали и образец готовили для отсылки в утвержденную лабораторию GLP (должной лабораторной практики) для тестирования на наличие микоплазмы (IPC 4).
Процедура криоконсервации для продукта биомассы 2D-клеток
Для криоконсервации 2DCS, 2D-культивированные клетки собирали в асептических условиях, используя 0,25% трипсин-ЭДТА. Клетки центрифугировали (1200 об/мин, 10 мин, 4°С), подсчитывали и ресуспендировали в 2D-среде.
Для замораживания клеточные суспензии разбавляли 1:1 2D-замораживающей смесью (конечные концентрации составляли: 10% ДМСО, 40% FBS и 50% 2D-среды). Из плаценты получали приблизительно 1,5-2,5×109 клеток из одной плаценты. 4 мл клеток хранили при конечной концентрации 10×106/мл в полиэтиленовых флаконах емкостью 5 мл. Флаконы метили и переносили в регулируемую морозильную камеру для процесса градуированного снижения температуры (1°C/мин), после чего их переносили для хранения в газовой фазе морозильной камеры с жидким азотом. Этот материал называли партией биомассы 2D-клеток (2DCS).
Начало процедур трехмерной (3D) культуры
Для начала 3D культуры, соответствующее количество (150±50×106) клеток из 2DCS оттаивали в комнате 2DP и промывали 3D-средой (DMEM с 10% FBS и 20 мМ Hepes) для удаления ДМСО перед высеванием в заранее подготовленные системы биореакторов. Содержание каждого флакона 2DCS пипетировали и разбавляли 1:9 предварительно нагретой (37°С) 3D-средой. Клетки центрифугировали (1200 об/мин, 10 мин, 4°C) и ресуспендировали снова в 50-100 мл предварительно согретой (37°С) 3D-среды в стерильном флаконе емкостью 250 мл. Брали образец, и клетки подсчитывали с использованием окрашивания трипановым синим для определения числа и жизнеспособности клеток. Суспензию клеток переносили под вытяжным колпаком с ламинарным потоком во флакон для посева емкостью 0,5 л. Из флакона для посева клеточную суспензию переносили через стерильную трубку в биореактор под действием гравитации.
Получение выращенных в прикрепленной к субстрату культуре клеток (PLX-C)
Описание биореактора
3D-фазу роста выполняли с использованием автоматического устройства биореактора CelliGen Plus® или BIOFLO 310 [(New Brunswick Scientific (NBS)], изображена на фиг.2. Устройство биореактора использовали для культивирования клеточной культуры, в которой условия были подходящими для высоких концентраций клеток. Процесс культивирования проводили с использованием биореактора в режиме перфузии. Биореактор лабораторного масштаба был сконструирован из двух основных устройств - устройства регулятора и самого биореактора (сосуда и вспомогательных приспособлений). Параметры процесса контролировались и регулировались консолью регулировки, которая включала переходники для датчиков, двигателя и насосов, петель регулировки для растворенного кислорода (DO), pH, перфузии и перемешивания (моторчиком), системы регулировки газов, системы циркуляции воды и нагревания для регулировки температуры и интерфейса оператора. Регулируемые параметры процесса (такие как температура, pH, DO и т.д.) могли представляться на дисплее на интерфейсе оператора и контролироваться предназначенным регулятором.
Процедура выращивания клеточной культуры в биореакторе
Как отмечено в разделе выше, 150±50×106 клеток из криоконсервированных 2DCS оттаивали, промывали и высевали в стерильный биореактор. Биореактор содержал 30-50 г носителей (диски FibraCel®, NBS), выполненных из полиэфира и полипропилена, и 1,5±0,1 л 3D-среды. Ростовую среду в биореакторе поддерживали при следующих условиях: 37°С, 70% растворенного кислорода (DO) и pH 7,3. Фильтрованные газы (воздух, CO2, N2 и O2) подавали, по данным определения устройством регулировки для поддержания величины DO, на уровне 70%, а величину pH - на уровне 7,3. В течение первых 24 часов среду перемешивали при 50 оборотах в минуту (об/мин), и скорость вращения увеличивали до 200 об/мин ко 2-му дню. В течение первых 2-3 дней, клетки выращивали в серийном режиме. Перфузию начинали, когда концентрация глюкозы в среде снижалась ниже 550 мг/литр. Среду перекачивали из контейнера подачи в биореактор с использованием стерильной силиконовой трубки. Все соединения трубок выполняли под ламинарным потоком с использованием стерильных переходников. Перфузию регулировали на ежедневной основе для поддержания концентрации глюкозы на постоянном уровне приблизительно 550±50 мг/литр. Образец ростовой среды брали через каждые 1-2 дня для определения концентрации глюкозы, лактата, глутамина, глутамата и аммония (анализатор BioProfile 400, Nova Biomedical). Скорость потребления глюкозы и скорость образования лактата обеспечивали возможность измерения скорости роста клеток. Эти параметры использовали для определения времени сбора на основании накопленных экспериментальных данных.
Сбор 3D выращенных клеток PLX-C из биореактора
Процесс сбора клеток начинали в конце фазы роста (4-12 дней). Собирали два образца ростовой среды. Один образец готовили для направления в сертифицированную лабораторию GLP для тестирования на наличие микоплазмы в соответствии с USP Фармакопеей США и европейских стандартов. Этот образец среды считали частью тестирования на микоплазму конечного продукта, и результаты считали частью критерия для выпуска продукта.
3D-выращенную культуру собирали в зоне ламинарного потока Class-100 в помещении 3DP следующим образом:
Сосуд биореактора опорожняли с использованием гравитации через трубку в контейнер для отходов. Затем сосуд биореактора вновь заполняли 1,5 л предварительно нагретого PBS (37°C). Скорость перемешивания увеличивали до 150 об/мин в течение 2 минут. PBS дренировали через трубку под давлением или под действием гравитации во флакон для отходов. Процедуру промывания повторяли дважды.
Для освобождения клеток из носителей 1,5 л предварительно согретого до 37°C трипсина-ЭДТА (трипсин 0,25%, ЭДТА 1 мМ) добавляли в сосуд биореактора, и носители перемешивали в течение 1-4 минут при 150 об/мин, 37°С. 250 мл FBS добавляли в сосуд биореактора, и клеточную суспензию собирали в стерильный контейнер емкостью 5 л. Клеточную суспензию делили в 500-мл стерильные центрифужные пробирки, которые центрифугировали (1200 об/мин, 10 мин, 4°С) и ресуспендировали в растворе для криоконсервации в концентрации 5-30×106 клеток/мл. Клетки заполняли в асептических условиях и криоконсервировали в виде PLX-C.
Пример 3
Сравнение выращенных в прикрепленной к субстрату культуре клеток WO/2007/108003 (PLX) с выращенными в прикрепленной к субстрату культуре клетками по настоящему изобретению
Выращенные в прикрепленной к субстрату культуре клетки, полученные в соответствии с WO/2007/108003 (обозначенные в настоящем описании как PLX), описанные выше в примере 1, сравнивали с новыми выращенными в прикрепленной к субстрату культуре клетками по настоящему изобретению (обозначенными в настоящем описании как PLX-C).
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
Анализ клеточного цикла
Клетки PLX-C, полученные Celligen, и клетки PLX, полученные Plurix, фиксировали 70% EtOH O.N, центрифугировали и ресуспендировали в растворе проподия йодида (PI), содержащем 2 мкг/мл PI (Sigma), 0,2 мг/мл РНКазы A (Sigma) и 0,1% (об./об.) Triton (Sigma) в течение 30 минут. Клеточный цикл анализировали FACS.
Чип генной экспрессии (микрочип)
Выращенные в прикрепленной к субстрату культуре клетки получали из человеческих плацент при доношенной беременности и размножали Plurix или Celligen. Три различные партии клеток получали при использовании каждого из способов размножения для дальнейшего исследования
РНК экстрагировали из клеток (микронабор Qiagen-Rneasy) и наносили на чип экспрессии цельного генома Affymetrix. В чипе использовали GeneChip® Human Exon 1.0 ST Array (Affymetrix, Santa Clara, California, USA).
Анализ FACS мембранных маркеров
Клетки окрашивали моноклональными антителами, как описано ранее. Вкратце, 400000-600000 клеток суспендировали в 0,1 мл буфера проточного цитометра в пробирке для тестирования объемом 5 мл и инкубировали в течение 15 минут при комнатной температуре (RT), в темноте, с каждым из следующих моноклональных антител (MAb): FITC-конъюгированные античеловеческие CD29 MAb (eBioscience), PE-конъюгированные античеловеческие CD73 MAb (Becton Dickinson), PE-конъюгированные античеловеческие CD105 MAb (eBioscience), PE-конъюгированные античеловеческие CD90 MAb (Becton Dickinson), FITC-конъюгированные античеловеческие CD45 MAb (IQProducts), PE-конъюгированные античеловеческие CD19 MAb (IQProducts), PE-конъюгированные античеловеческие CD14 MAb (IQProducts), FTTC-конъюгированные античеловеческие HLA-DR MAb (IQProduct), PE-конъюгированные античеловеческие CD34 MAb (IQProducts), FITC-конъюгированные античеловеческие CD31 MAb (eBioscience), FITC-конъюгированные античеловеческие KDR MAb (R&D systems), маркер античеловеческих фибробластов (D7-FIB) MAb (ACRIS), FITC-конъюгированные античеловеческие CD80 MAb (BD), FITC-конъюгированные античеловеческие CD86 MAb (BD), PE-конъюгированные античеловеческие CD200 MAb (BD), FTTC-конъюгированные античеловеческие CD40 MAb (BD), FITC-конъюгированные античеловеческие HLA-ABC MAb (BD), изотип IgG1 FITC-конъюгированный (IQ Products), изотип IgG1 PE-конъюгированный (IQ Products).
Клетки промывали дважды буфером проточного цитометра, ресуспендировали в 500 мкл буфера проточного цитометра и анализировали проточной цитометрией с использованием проточного цитометра FC-500 Flow Cytometer (Beckman Coulter). Отрицательные контроли получали молекулами с релевантным изотипом флюоресценции.
Реакция смешанных лимфоцитов (MLR)
2×105 MNC (мононуклеарных клеток), полученных из периферической крови (PB) (от донора A), стимулировали равным количеством облученных (3000 рад) MNC, полученных из PB (от донора B). К культурам добавляли увеличивающиеся количества клеток PLX-C. Три повторения из каждой группы высевали в 96-луночные планшеты. Клетки культивировали в среде RPMI 1640, содержащей 20% FBS. Планшеты подвергали пульсирующему воздействию 1 мкКи3H-тимидина в течение последних 18 ч 5-дневного культивирования. Клетки собирали через стекловолоконный фильтр, и захват тимидина количественно определяли сцинтилляционным счетчиком.
Для окрашивания CFSE (сложным сукцинимидиловым эфиром карбоксифлуоресцеина), клетки PB-MNC окрашивали на CFSE (Molecular Probes) для измерения пролиферации перед культивированием. Клетки собирали через 5 дней, и интенсивность окрашивания CFSE выявляли проточной цитометрией.
ELISA
ELISA проводили, как описано ранее. Вкратце, MNC (выделенные из периферической крови) стимулировали 5 мкг/мл ConA (Sigma), 0,5 мкг/мл LPS (SIGMA), или 10 мкг/мл PHA (SIGMA) в присутствии клеток PLX-C в увлажненной 5% CO2 атмосфере при 37ºС. Супернатанты собирали и подвергали анализу цитокина с использованием наборов ELISA для выявления IFNγ (DIACLONE), TNFα (DIACLONE) и IL-10 (DIACLONE).
Экспериментальные результаты
Изменения при получении Celligen, по сравнению с Plurix привели к нескольким основным различиям (обобщенным ниже в таблице 1).
Изменение способа получения привело к изменениям характеристик полученных клеток, выращенных в прикрепленной к субстрату культуре. Указанные различия суммированы ниже.
Анализ клеточного цикла PLX, полученных Plurix, в сравнении с PLX-C, полученных Celligen
Клетки PLX-C, полученные Celligen, сравнивали с клетками PLX, полученными Plurix, для исследования распределения клеток между различными фазами клеточного цикла. Как ясно из фиг.3A-B, клетки PLX-C, размноженные Celligen, проявляли типичный профиль пролиферации (распределения клеток между различными фазами клеточного цикла). В частности, 28% клеток находились в фазах S и G2/M (фиг.3A). Эти результаты указывают на то, что клетки собирали во время пролиферации и что условия биореактора Celligen поддерживали клеточный рост.
Сравнение клеток, полученных Plurix и Celligen, с помощью микрочипа
Микрочипы генной экспрессии обеспечили возможность одновременного мониторинга профилей экспрессии всего генома клеток, выращенных в прикрепленной к субстрату культуре, которые получены из человеческой плаценты при доношенной беременности, размноженных Plurix (PLX), или Celligen (PLX-C). Эти результаты обеспечили возможность оценки молекулярного механизма, лежащего в основе фенотипического изменения между клетками, полученными указанными различными способами роста (см. табл. 2).
Экспрессия клеточных маркеров на клетках PLX-C
Поверхностные акнтигены, экспрессированные PLX-C, исследовали с использованием моноклональных антител. Результаты показали, что клетки PLX-C характеризовались положительными маркерами: CD73, CD29 и CD105 и отрицательными маркерами: CD34, CD45, CD19, CD14, CD200 и HLA-DR. В некоторых экспериментах спецификации тестирования иммунного фенотипа были установлены как: ≥90% для всех положительных маркеров и ≤3% для всех отрицательных маркеров.
Кроме того, как показано на фиг.4A-B, культуры PLX-C не экспрессировали эндотелиальные маркеры, как показано отрицательным окрашиванием по двум эндотелиальным маркерам CD31 и KDR. Однако экспрессия клетками PLX-C типичного для фибробластов маркера была очевидна (экспрессия D7-fib, фиг.4C). В дополнение, как показано на фиг.4D, клетки PLX-C отрицательно экспрессируют CD200.
Иммуногенность и иммуномодулирующие свойства клеток PLX-C
Поскольку PLX-C состоит из выращенных в прикрепленной к субстрату культуре клеток, полученных из плаценты, то ожидается, что тип I HLA будет экспрессирован всеми клетками организма и, как известно, вызовет аллореактивный иммунный ответ. HLA типа II и другие костимулирующие молекулы обычно экспрессированы только на поверхности антиген-представляющих клеток (APC).
Для исследования иммуногенности полученных клеток PLX-C выполняли исследование экспрессии костимулирующих молекул на поверхности этих клеточных мембран. Анализ FACS продемонстрировал отсутствие CD80, CD86 и CD40 на мембранах клеток PLX-C (фиг.5A-C). Кроме того, PLX-C экспрессировали низкие уровни HLA класса I по данным выявления окрашивания на HLA A/B/C (фиг.5D). Экспрессия стимулирующих и костимулирующих молекул были аналогичным полученным из костного мозга (BM) MSC (как показано на фиг.5A-D).
Для дальнейшего исследования иммуногенности, а также свойств иммуномодуляции клеток PLX-C, выполняли тесты реакции смешанных лимфоцитов (MLR). Как показано на фиг.6A-B, клетки PLX-C и избегают аллораспознавания и снижают реакцию Т-клеток по данным измерения включением тимидина. Кроме того, снижение пролиферации лимфоцитов (по данным оценки измерения CPM) было выше по мере увеличения числа PLX-C (дозозависимым образом). PLX-C также снижали пролиферацию лимфоцитов после митогенных стимулов, таких как конкавалин A (ConA, фиг.6B) и фитогемагглютинин (PHA), и после неспецифической стимуляции антиCD3, антиCD28 (данные не показаны).
Для исследования механизма действия, посредством которого PLX-C иммуностимулируют пролиферацию лимфоцитов и для определения того, опосредуется это действие посредством межклеточного взаимодействия или секреции цитокина, полученные из PB мононуклеарные клетки (MNC) стимулировали PHA с использованием способа трансмембранного межкамерного хемотаксиса (который предотвращает межклеточный контакт, но обеспечивает возможность диффузии цитокинов между двумя компартментами). Результаты показали, что ингибирование пролиферации сохранялось, даже когда межклеточный контакт ингибировался (данные не показаны).
Секреция цитокина
Как изображено выше в настоящем описании, PLX-C снижают скорость пролиферации лимфоцитов, предпочтительно посредством растворимых факторов. Дальнейшее исследование цитокинов, секретируемых лимфоцитами, в ответ на PLX-C выполняли для выяснения механизма действия PLX-C. Как изображено на фиг.7A-B, культивирование мононуклеарных клеток с PLX-C слегка снижает секрецию провоспалительного цитокина INFγ и резко снижает секрецию TNFα (даже в присутствии небольших количеств PLX-C). Кроме того, после стимуляции секреции IL-10 липополисахаридом (LPS) MNC, полученными из PB, увеличивалась в присутствии PLX-C, тогда как уровень секреции TNFα уменьшался, дозозависимым образом (фиг.7C).
Пример 4
Сравнение дифференциации остеоцитов 2D, выращенных в прикрепленной к субстрату культуре клеток по настоящему изобретению и клеток костного мозга
Новые выращенные в прикрепленной к субстрату культуре клетки по настоящему изобретению (плацентарного происхождения) выращивали в условиях, стимулирующих дифференциацию остеоцитов на их стадии 2D, выращенных в прикрепленной к субстрату культуре клеток, по сравнению с клетками, полученными из костного мозга.
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
Остеогенез
Остеогенез проводили в соответствии с набором остеогенеза Chemicon (каталожный № scr028, Millipore, MA, USA).
Среда для индукции остеогенеза
Среду для индукции остеогенеза готовили перед каждой заменой среды с использованием компонентов набора (см. табл. 3).
Для получения 1 мМ раствора дексаметазона, 900 мкл этанола добавляли к 100 мкл раствора дексаметазона 10 мМ. Основной раствор хранили с остальными компонентами набора при -20ºС. 50 мл сыворотки во флаконе инактивировали нагреванием, делили на аликвотные количества по 5 мл и держали при -20ºС до использования.
Покрытие 24-луночных планшетов для культуры ткани
Смесь для покрытия, содержащую 12 мкг/мл витронектина и 12 мкг/мл коллагена (оба включенные в набор), получали разведением каждого 1×PBS.
Смесь покрытия затем добавляли в лунки для покрытия поверхностей лунок (получали 5 лунок × 2 планшета). Планшеты инкубировали в течение ночи при комнатной температуре. Смесь покрытия затем удаляли и лунки промывали однократно PBS. Содержимое планшетов аспирировали непосредственно перед использованием.
Рост клеток
Клетки, происходящие из плаценты (plc11-3-1), или клетки, происходящие из костного мозга (BM108), помещали (200000 клеток на лунку) в 1 мл ростовой среды, содержащей DMEM (Invitrogen, Gibco), 10% FCS (Invitrogen, Gibco), 2 мМ L-глутамина (Sigma-Aldrich), 45 мкг/мл гентамицина-IKA (Teva Medical) и 0,25 мкг/мл фунгизона (Invitrogen, Gibco). Клетки, происходящие из плаценты (4 лунки × 2 планшета), или клетки, происходящие из костного мозга (1 лунка × 2 планшета), выращивали до слияния 100% (обычно, в течение ночи) перед инициацией остеогенной дифференциации.
Когда клетки достигали 100% слияния, ростовую среду аспирировали и замещали 1 мл среды для индукции остеогенеза (1-й день дифференциации). Среду индукции остеогенеза замещали свежей средой через каждые 2-3 дня всего в течение 14-17 дней.
В качестве контроля один из двух планшетов (для каждого типа клеток) не инкубировали со средой для остеогенной дифференциации, но скорее с ростовой средой (описанной выше).
На 17-й день остеоциты фиксировали и окрашивали раствором ализарина красного, как детально описано ниже.
Протокол окрашивания
Окрашивание остеоцитов выполняли сначала осторожной аспирацией среды из каждой лунки (с предосторожностью во избежание аспирации клеток). Затем клетки фиксировали инкубацией в ледяном 70% этаноле в течение 1 часа при комнатной температуре. Затем осторожно аспирировали спирт и клетки промывали дважды водой (каждое промывание по 5-10 минут). Затем воду аспирировали и к клеткам добавляли раствор ализарина красного (500-1000 мкл). Клетки инкубировали с раствором ализарина красного при комнатной температуре в течение 30 минут. Ализарин красный удаляли и клетки промывали 4 раза 1 мл воды и аспирировали после каждого промывания. Наконец, в каждую лунку добавляли 1-1,5 мл воды для предотвращения высыхания клеток. Планшеты рассматривали под инвертированным микроскопом Nikon.
Экспериментальные результаты
Дифференциация в остеоциты выращенных в прикрепленной к субстрату культуре клеток, полученных из плаценты или костного мозга, привела к дифференциации более 50% клеток костного мозга, как продемонстрировано положительным окрашиванием ализарином красным (фиг.8B). Напротив, ни одна из происходящих из плаценты клеток не проявила никакого признака остеогенной дифференциации (см. фиг.8E и табл. 4).
Пример 5
Сравнение дифференциации остеоцитов 2D выращенных в прикрепленной к субстрату культуре клеток по настоящему изобретению и клеток костного мозга в модифицированной ростовой среде
Выращенные в прикрепленной к субстрату культуре клетки по настоящему изобретению (плацентарного происхождения в их 2D стадии выращенных в прикрепленной к субстрату культуре клеток) или клетки, происходящие из костного мозга, выращивали в условиях стимуляции дифференциации в остеоциты в модифицированной остеогенной среде, содержащей витамин D и более высокие концентрации дексаметазона.
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
Среда для индукции остеогенеза
Среду для индукции остеогенеза вновь готовили перед каждым обменом среды с использованием компонентов, перечисленных ниже в таблице 5, наряду с витамином D.
50 мл сыворотки во флаконе инактивировали нагреванием, делили на аликвотные количества по 5 мл и держали при -20°С до использования.
Покрытие 48-луночных планшетов для культуры ткани
Смесь для покрытия, содержащую 12 мкг/мл витронектина и 12 мкг/мл коллагена (оба от компании Chemico), получали разведением каждого 1×PBS.
Смесь покрытия затем добавляли в лунки для покрытия поверхностей лунок (получали 5 лунок × 2 планшета). Планшеты инкубировали в течение ночи при комнатной температуре. Смесь покрытия затем удаляли и лунки промывали однократно PBS. Содержимое планшетов аспирировали непосредственно перед использованием.
Рост клеток
Клетки, происходящие из плаценты (фетальные клетки PLC 8-2-1, PLC 15 3-4-2 или PLC 19-4-3-1), высевали (100000 клеток на лунку) в 0,5 мл ростовой среды, содержащей DMEM (Invitrogen, Gibco), 10% FCS (Invitrogen, Gibco), 2 мМ L-глутамина (Sigma-Aldrich), 45 мкг/мл гентамицина-IKA (Teva Medical) и 0,25 мкг/мл фунгизона (Invitrogen, Gibco) (4 лунки × 2 планшета). Происходящие из костного мозга клетки (BM109) высевали (150000 клеток на лунку) в 0,5 мл ростовой среды (как описано выше) (1 лунка × 2 планшета). Клетки выращивали до слияния 100% (обычно в течение ночи) перед инициацией остеогенной дифференциации.
Когда клетки достигали 100% слияния, ростовую среду аспирировали и замещали 0,5 мл среды для индукции остеогенеза (1-й день дифференциации). Среду индукции остеогенеза замещали свежей средой через каждые 2-3 дня всего в течение 26 дней.
В качестве контроля один из двух планшетов (для каждого типа клеток) не инкубировали со средой для остеогенной дифференциации, но скорее с ростовой средой (описанной выше).
На 26-й день остеоциты фиксировали и окрашивали раствором ализарина красного, как детально описано ниже.
Протокол окрашивания
Окрашивание остеоцитов выполняли сначала осторожной аспирацией среды из каждой лунки (с предосторожностью во избежание аспирации клеток). Затем клетки фиксировали инкубацией в ледяном 70% этаноле в течение 1 часа при комнатной температуре. Затем осторожно аспирировали спирт и клетки промывали дважды водой (каждое промывание по 5-10 минут). Затем воду аспирировали и к клеткам добавляли раствор ализарина красного (500-1000 мкл). Клетки инкубировали с раствором ализарина красного при комнатной температуре в течение 30 минут. Ализарин красный удаляли и клетки промывали 4 раза 1 мл воды и аспирировали после каждого промывания. Наконец, в каждую лунку добавляли 1-1,5 мл воды для предотвращения высыхания клеток. Планшеты рассматривали под инвертированным микроскопом Nikon.
Экспериментальные результаты
Остеогенную дифференциацию происходящих из плаценты и из костного мозга выращенных в прикрепленной к субстрату культуре клеток выполняли модификацией протокола, описанного выше в примере 4 в соответствии с ранее описанными положениями [Parloni et al. (2008) Stem Cells 26(2): 300-11]. Основное различие между условиями роста, представленными в примере 4, и результатами, представленными в настоящем примере, состояло в добавлении витамина D к среде дифференциации и высокой концентрации дексаметазона. Как очевидно из результатов, более 50% клеток костного мозга подвергались дифференциации в остеоциты, как демонстрируется положительным окрашиванием ализарином красным (смотрите фиг.9В). Однако ни одна из клеток плацентарного происхождения не проявила никаких признаков остеогенной дифференциации (см. фиг.9E и табл. 4).
Пример 6
Сравнение дифференциации в адипоциты 2D выращенных в прикрепленной к субстрату культуре клеток по настоящему изобретению и клеток костного мозга
Новые выращенные в прикрепленной к субстрату культуре клетки по настоящему изобретению (плацентарного происхождения) выращивали в условиях стимуляции дифференциации адипоцитов в их стадии 2D прикрепленной к субстрату культуры клеток по сравнению с клетками, происходящими из костного мозга.
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
Адипозогинез
Адипозогенез проводили в соответствии с набором для адипозогенеза Chemicon (набор для адипозогенеза Chemicon, каталожный № scr020, Millipore, MA, USA)
Среда для индукции адипозогенеза
Среду для индукции или поддержания адипозогенеза готовили вновь перед каждым обменом среды с использованием компонентов, перечисленных в табл. 6 и 7.
Рост клеток
Клетки, происходящие из плаценты (plc11-3-1), или клетки, происходящие из костного мозга (BM108), помещали (200000 клеток на лунку) в 1 мл ростовой среды, содержащей DMEM (Invitrogen, Gibco), 10% FCS (Invitrogen, Gibco), 2 мМ L-глутамина (Sigma-Aldrich), 45 мкг/мл гентамицина-IKA (Teva Medical) и 0,25 мкг/мл фунгизона (Invitrogen, Gibco). Клетки, происходящие из плаценты (4 лунки × 2 планшета), или клетки, происходящие из костного мозга (1 лунка × 2 планшета), выращивали до слияния 100% (обычно в течение ночи) перед инициацией адипогенной дифференциации.
Когда клетки достигали 100% слияния, ростовую среду аспирировали и замещали 1 мл среды для индукции адипозогенеза (1-ый день дифференциации). Среду индукции адипозогенеза замещали свежей средой через каждые 2-3 дня всего в течение 25 дней (как детально указано ниже в таблице 8). Следует отметить, что монослои адипозогенных клеток были крайне хрупкими и могли легко отслаиваться от планшетов, и поэтому замены среды выполняли с осторожностью во избежание разрушения липидных капелек.
В качестве контроля, один из двух планшетов (для каждого типа клеток) не инкубировали со средой для адипозогенной дифференциации, но скорее с ростовой средой (описанной выше).
На 25-й день, адипоциты фиксировали и окрашивали раствором масляного красного, как в деталях описано ниже.
Протокол окрашивания
Окрашивание адипоцитов выполняли сначала осторожной аспирацией среды из каждой лунки (с предосторожностью во избежание аспирации клеток). Затем клетки фиксировали инкубацией в 4% параформальдегиде в течение 30-40 минут при комнатной температуре. Фиксатор затем осторожно аспирировали, и клетки промывали три раза PBS (каждое промывание по 5-10 минут). Затем PBS аспирировали и клетки дважды промывали в воде. Затем воду аспирировали и к клеткам добавляли раствор масляного красного (500-1000 мкл). Клетки инкубировали с раствором масляного красного при комнатной температуре в течение 50 минут. Раствор масляного красного удаляли и клетки промывали 4 раза 1 мл воды и аспирировали после каждого промывания. Наконец, в каждую лунку добавляли 1-1,5 мл воды для предотвращения высыхания клеток. Планшеты рассматривали под инвертированным микроскопом Nikon.
Получение раствора масляного красного
Использовали базовый компонент 0,25 г масляного красного (Sigma), который растворяли в 50 мл изопропанола инкубацией в течение 10-15 мин в бане при 37°С.
Для использования 30 мл базового красителя смешивали с 20 мл DDW (который оставляли отстаиваться в течение 10 минут и затем фильтровали через кофейную фильтровальную бумагу). Для каждого использования готовили свежий раствор масляного красного.
Экспериментальные результаты
Дифференциация в адипоциты происходящих из плаценты или костного мозга выращенных в прикрепленной к субстрату культуре клеток в среде для индукции адипозогенеза, привела к дифференциации более 50% происходящих из костного мозга клеток (см. фиг.8С), что демонстрируется положительным окрашиванием масляным красным и типичными морфологическими изменениями (т.е. накоплением капелек масла в цитоплазме). Напротив, ни одна из происходящих из плаценты клеток по настоящему изобретения не дифференцировалась в адипоциты (см. фиг.8F и табл. 4).
Пример 7
Сравнение дифференциации адипоцитов 2D выращенных в прикрепленной к субстрате культуре клеток по настоящему изобретению и клеток костного мозга в модифицированной ростовой среде
Выращенные в прикрепленной к субстрате культуре клетки по настоящему изобретению (плацентарного происхождения в их 2D стадии выращенных в прикрепленной к субстрате культуре клеток) или клетки, происходящие из костного мозга, стимулировали к дифференциации в адипоциты в модифицированной адипоцитогенной среде, содержащей более высокий уровень индометацина.
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
Среда для индукции адипозогенеза
Среду для индукции адипозогенеза вновь готовили перед каждым обменом среды с использованием компонентов, перечисленных в табл. 9.
Рост клеток
Клетки, происходящие из плаценты (фетальные клетки PLC 8-2-1, PLC 15 3-4-2 или PLC 19-4-3-1), высевали (100000 клеток на лунку) в 0,5 мл ростовой среды, содержащей DMEM (Invitrogen, Gibco), 10% FCS (Invitrogen, Gibco), 2 мМ L-глутамина (Sigma- Aldrich), 45 мкг/мл гентамицина-IKA (Teva Medical) и 0,25 мкг/мл фунгизона (Invitrogen, Gibco) (5 лунок × 2 планшета).
Происходящие из костного мозга клетки (BM109) высевали (100000 клеток на лунку) в 0,5 мл ростовой среды, содержащей DMEM (Invitrogen, Gibco), 10% FCS (Invitrogen, Gibco), 2 мМ L-глутамин (Sigma-Aldrich), 45 мкг/мл гентамицина-IKA (Teva Medical) и 0,25 мкг/мл фундизона (Invitrogen, Gibco) (4 лунки × 2 планшета). Клетки выращивали до слияния 100% (обычно в течение ночи) перед инициацией адипозогенной дифференциации.
Когда клетки достигали 100% слияния, ростовую среду аспирировали и замещали 0,5 мл среды для индукции адипозогенеза (1-й день дифференциации). Среду для индукции адипозогенеза замещали свежей средой через каждые 2-3 дня всего в течение 3-4 недель.
В качестве контроля один из двух планшетов (для каждого типа клеток) не инкубировали со средой для адипозогенной дифференциации, но скорее с ростовой средой (описанной выше).
На 26-й день адипоциты фиксировали и окрашивали раствором масляного красного, как детально описано ниже.
Протокол окрашивания
Окрашивание адипозоцитов выполняли сначала осторожной аспирацией среды из каждой лунки (с предосторожностью во избежание аспирации клеток). Затем клетки фиксировали инкубацией в 4% параформальдегиде в течение 30-40 минут при комнатной температуре. Затем фиксатор осторожно аспирировали и клетки промывали три раза PBS (каждое промывание по 5-10 минут). Затем PBS аспирировали и клетки дважды промывали в воде. Затем воду аспирировали и к клеткам добавляли раствор масляного красного (500-1000 мкл). Клетки инкубировали с раствором масляного красного при комнатной температуре в течение 50 минут. Раствор масляного красного удаляли и клетки промывали 3 раза 1 мл дважды дистиллированной воды и аспирировали после каждого промывания. Наконец, в каждую лунку добавляли 1-1,5 мл воды для предотвращения высыхания клеток. Планшеты рассматривали под инвертированным микроскопом Nikon.
Получение раствора масляного красного
Использовали базовый компонент 0,25 г масляного красного (Sigma), который растворяли в 50 мл изопропанола инкубацией в течение 10-15 мин в бане при 37°С.
Для использования 30 мл базового красителя смешивали с 20 мл DDW (который оставляли отстаиваться в течение 10 минут и затем фильтровали через кофейную фильтровальную бумагу). Для каждого использования готовили свежий раствор масляного красного.
Экспериментальные результаты
Дифференциация в адипоциты происходящих из плаценты или костного мозга выращенных в прикрепленной к субстрату культуре клеток выполняли модификацией описанного выше протокола примера 6 в соответствии с положениями публикации [Parloni et al. (2007), смотрите выше]. Основное различие между условиями роста, представленными в примере 6, и результатами, представленными в настоящем примере, состояло в высокой концентрации индометацина. Как очевидно из представленных результатов, более 50% происходящих из костного мозга клеток были подвергнуты дифференциации в адипоциты (см. фиг.9С), что демонстрируется положительным окрашиванием масляным красным и типичными морфологическими изменениями (т.е. накоплением капелек масла в цитоплазме). Напротив, ни одна из происходящих из плаценты клеток по настоящему изобретения не проявила морфологических изменений, типичных для адипоцитов (см. фиг.9F и табл. 4).
Пример 8
Биораспределение PLX-C
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
Трансфекция клеток PLX-C вектором экспрессии люциферазы
Клетки PLX-C устойчиво инфицировали лентивирусным конструктом, экспрессирующим ген люциферазы под действием промотора CMV (цитомегаловируса) (фиг.10).
Получение инфицирующего вируса
Продуцирующие клетки 293TN выращивали в среде DMEM (Gibco) с добавлением сыворотки и антибиотиков в течение 2-3 дней (слияние 50-70%) перед трансфекцией. Смесь из 10 мкг упаковочной плазмиды и 2 мкг конструкта экспрессии и 20 мкл реагента Plus™ (Invitrogen) добавляли к 400 мкл среды DMEM без добавок. Смесь инкубировали в течение 15 мин при комнатной температуре (RT) и добавляли Lipofectamine™ (30 мкл разведений в 400 мкл среды DMEM). Смесь инкубировали при RT в течение 15 мин. Клетки 293TN промывали и переносили в 2% сывороточную среду и добавляли трансфекционную смесь. Клетки инкубировали в CO2-инкубаторе при 37°С в течение ночи, и среду собирали через 24-60 ч после инфекции. Максимальная продукция вируса достигалась после 48 ч. Среду собирали и центрифугировали при 3000 об/мин при комнатной температуре в течение 5 минут для осаждения клеточных осколков. После центрифугирования супернатант фильтровали через фильтры из PVDF (поливиниленфторида) Millex-HV с размером пор 0,45 мкм (Millipore, каталожный № SLHVR25LS).
Инфекция PLX-C
Клетки PLX-C высевали в 24-луночный планшет при плотности 0,6-1×105 клеток на лунку в полной среде за 24 часа до вирусной инфекции. Через 24 ч добавляли 0,5 мл суспензии вируса (разведенной в полной среде с полибреном в конечной концентрации 5-8 мкг/мл). Клетки инкубировали в течение 24 ч, затем среду заменяли полной средой DMEM и клетки инкубировали при 37°С в атмосфере 5% CO2 в течение ночи. На 4-й день культура достигала слияния и расщеплялась от 1:3 до 1:5, клеткам давали возможность расти в течение 48 часов в полной среде DMEM, затем клетки анализировали для определения экспрессии люциферазы.
Частота эффективности инфекции приближалась к 100%. Оценку люминесценции в живых клетках и у живых мышей выполняли с использованием системы визуализации IVIS Lumina Imaging, которая включала высокочувствительную камеру с CCD (дисплеем, управляемым от компьютера), которая принимала сигнал люминесценции люциферазы.
Через две недели после инфекции 2×106 клеток инъецировали внутримышечно или внутривенно мышам SCID/Beige, NOD/SCID, SCID и Balb/C. Мониторинг инъецированных клеток проводили с использованием описанной системы IVIS.
Экспериментальные результаты
Как очевидно из полученных результатов, клетки PLX-C продолжали делиться после инфекции, и уровни экспрессии люциферазы в растущих клетках оставались сильными и стабильными (фиг.11).
После инъекции клеток PLX-C мышам Balb/C исследовали тип биораспределения. Как очевидно из полученных результатов, клетки исчезали через 72 ч после внутримышечной инъекции (данные не показаны). Однако клетки PLX-C сохраняли постоянный высокий уровень экспрессии люциферазы in vitro в течение более трех недель (данные не показаны).
Как показано на фиг.12A-D, клетки, внутримышечно инъецированные мышам SCID/Beige с иммунной недостаточностью, удерживались до 5 дней в участке инъекции и не наблюдались после этого. Клетки PLX-C, внутривенно инъецированные мышам SCID/Beige, мигрировали через 24 ч в легкие, затем в участок инъекции (предположительно, стремясь к участку повреждения). Затем клетки постепенно исчезали и не наблюдались через 3-4 недели.
Хотя изобретение было описано в сочетании с определенными вариантами его осуществления, очевидно, что для специалистов в данной области будут очевидны многие альтернативы, модификации и изменения. Соответственно, предусматривается, что все такие альтернативы, модификации и изменения охватываются сущностью и широким объемом прилагаемой формулы изобретения.
Все публикации, патенты и патентные заявки, указанные в настоящем описании, полностью включены в него путем ссылки в такой же степени, как если бы отдельная публикация, патент или патентная заявка была определенно и отдельно указана как включенная в настоящее описание путем ссылки. Кроме того, цитирование или идентификацию любой ссылки в настоящей заявке не следует рассматривать как допущение того, что такая ссылка доступна в качестве предшествующего уровня техники относительно настоящего изобретения. В той степени, в которой используются заголовки разделов, их не следует рассматривать как обязательно ограничивающие.
Реферат
Изобретение относится к биотехнологии и представляет собой выращенную прикрепленной к субстрату клетку из плаценты. Данная клетка культивирована в трехмерных (3D) условиях культивирования, которые обеспечивают возможность размножения клетки. Вышеуказанные условия содержат культивирование в течение по меньшей мере 3 дней при продолжительной перфузии с культуральной средой. Указанная клетка не проявляет остеогенную дифференциацию в условиях и в культуральной среде, в которых выращенная прикрепленной к субстрату клетка из костного мозга проявляет остеогенную дифференциацию. Указанная клетка экспрессирует CD73, CD90, CD29, CD105 и D7-fib. Предложенное изобретение позволяет снижать пролиферацию лимфоцитов. 7 з.п. ф-лы, 35 ил., 9 табл., 8 пр.
Формула
где указанные 3D условия культивирования:
(a) содержат 3D биореактор и/или
(b) содержат материал прикрепления, выбранный из группы, состоящей из стекла, пластика, полиэфира и полипропилена, полистирола, декстрана и коллагена; и/или
(c) осуществляются в течение по меньшей мере 3 дней,
и
где указанные 3D условия культивирования содержат одно из:
(i) культивирование популяции указанной выращенной прикрепленной к субстрату клетки в биореакторе с цилиндрическим уплотненным слоем и культуральной средой, текущей через уплотненный слой;
(ii) культивирование популяции указанной выращенной прикрепленной к субстрату клетки в фазе роста, поддерживая рабочий объем, по меньшей мере, на уровне примерно 1500 мл;
(iii) высевание клеток в концентрации высевания по меньшей мере примерно 0,1×106 клеток/мл; или
(iv) культивирование популяции указанной выращенной прикрепленной к субстрату клетки в биореакторе с носителем с массой по меньшей мере 30 грамм;
и где указанная клетка экспрессирует CD73, CD90, CD29, CD105 и D7-fib.

Комментарии