Способ определения кардио-генеративного потенциала клеток млекопитающих - RU2624498C2
Код документа: RU2624498C2
Чертежи

Описание
Перекрестная ссылка на родственные заявки
Настоящая заявка испрашивает приоритет на основании международной заявки под номером PCT/US 2009/044751, поданной 20 мая 2009 г. Раскрытие этой первоначальной заявки считается частью (и включено посредством ссылки) настоящей заявки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к лечению сердечно-сосудистых заболеваний путем введения клеток млекопитающих. В частности, оно относится к способу количественной оценки кардио-генеративного потенциала клеток млекопитающих, который обеспечивает хорошую прогнозируемость успеха восстановления сердца, нуждающегося в этом. Также оно относится к способу количественной оценки изменения этого кардио-генеративного потенциала и кардиогенного потенциала обработки, направленной на дифференцировку клеток, а также к компьютерному устройству, включающему процессор и связанную с процессором память, в которой содержатся в кодированном виде одна или более программ, не являющихся нейросетевыми, причем указанные программы обеспечивают осуществление процессором способа, включающего расчет CARPI.
Существующий уровень техники
Сердечно-сосудистые заболевания являются основной причиной заболеваемости и смертности во всем мире, несмотря на достижения в области лечения пациентов. В отличие от тканей с высокой восстановительной способностью, сердечная ткань чувствительна и подвержена необратимым повреждениям. В настоящее время в клинической практике для решения проблем, связанных с нарушением работы сердечно-сосудистой системы, применяют методы клеточной регенеративной сердечно-сосудистой медицины.
Недавнее появление биологии стволовых клеток расширило спектр существующих способов лечения от традиционного временного облегчения до восстановительного лечения. Обычно клинический опыт основан на стволовых клетках взрослого организма, вводимых в неизмененном состоянии. Первое поколение биопрепаратов представляют собой «наивные» стволовые клетки человека, идентифицированные как легкодоступные типы клеток. У нескольких человек наблюдали улучшения после введения наивных стволовых клеток.
Современный уровень области трансплантации наивных клеток в сердце человека описан, в частности, в обзоре Abdel-Latif A. et al. ‘Adult bone marrow-derived cells for cardiac repair: a systematic review and meta-analysis’ Arch Intern Med. (2007) 167: 989-997 и источниках, цитируемых в этом обзоре.
Для улучшения клинических результатов были разработаны терапевтические средства второго поколения на основе стволовых клеток, обеспечивающие дифференцировку наивных стволовых клеток человека в клетки сердца перед введением в организм пациента. В обзоре Behfar et al. ‘Guided stem cell cardiopoietic: Discovery and translation’ J. Mol. and Cell. Cardiology (2008) 45: 523-529 рассмотрена идея применения кардиальных клеток-предшественников, таких как кардиопоэтические клетки, для регенерации сердца.
Кардиопоэтические клетки обладают уникальным фенотипом: они характеризуются транслокацией в ядро полипептидов Nkx2.5 и MEF2C в сочетании с отсутствием детектируемых саркомерных белков. Такое кардиопоэтическое состояние соответствует промежуточному фенотипу клетки, т.е. клетки находятся на пути дифференцировки в клетки сердца, но еще не полностью дифференцированы. Уникальной особенностью кардиопоэтических клеток является отсутствие детектируемого уровня экспрессии саркомерных белков, что отличает их от сократительных и содержащих саркомеры кардиомиоцитоподобных клеток, образующихся из стволовых клеток, как описано в других заявках, таких как заявки Chunhui Xu (заявка США №2005/0164382) и Lough et al. (заявка США №2002/0061837).
Повышенное содержание белков - факторов транскрипции может и не означать его внутриклеточную локализацию, которая может быть также цитоплазматической или ядерной. Транслокация полипептидов Nkx2.5 и MEF2C в ядро необходима для однозначной дифференцировки в клетки сердца. Дополнительные объяснения можно найти у Behfar A. et al. (Derivation of a cardiopoietic population from human mesenchymal stem cells yields cardiac progeny, Nature Clinical Practice, 2006, 3: S78-S82). Хотя ядерная транслокация может быть количественно определена методами иммуноцитохимии и иммуногистохимии, такие методики, как Вестерн-блоттинг и флуоресцентная сортировка клеток (FACS), которые позволяют оценить общее содержание белка, не подходят для количественной оценки распределения полипептида внутри клетки. Изучение распределения полипептида внутри клетки, описанное в заявке США №2008/0019944, не только является качественным, но и будет промышленной перспективе трудоемким, зависимым от оператора исследованием. Клинические результаты, а именно кардио-генеративный потенциал этих наивных стволовых клеток ‘первого поколения’ и ориентированных стволовых клеток ‘второго поколения’, нелегко спрогнозировать до введения клеток.
Существует потребность в способе количественной оценки кардио-генеративного потенциала клеток млекопитающих.
Настоящее изобретение обеспечивает прогностический способ оценки кардио-генеративного потенциала клеток млекопитающих, который включает оценку коэффициента кардиального генеративного потенциала (CARPI) как функции количественных показателей экспрессии генов указанных клеток. Также оно решает проблемы, связанные с количественной оценкой изменения кардио-генеративного потенциала клеток млекопитающих и кардиогенного потенциала лечения, направленного на дифференцировку клеток.
Определения
В рамках настоящего документа, если не указано обратное, перечисленные ниже в кавычках термины имеют следующие определения.
‘Кардио-генеративный потенциал’ клетки обозначает способность этой клетки образовывать клетки сердца, например кардиомиоциты.
‘Кардиопоэтические клетки’ представляют собой клетки промежуточного фенотипа, т.е. клетки, направленные по пути дифференцировки в клетки сердца, но не полностью дифференцированные. Кардиопоэтические клетки характеризуются транслокацией в ядро полипептидов Nkx2.5 и MEF2C в сочетании с отсутствием детектируемых саркомерных белков (Behfar et al. ‘Derivation of a cardiopoietic population from human mesenchymal stem yields progeny’, Nature din. Pract., Cardiovasc. Med. (2006) 3: S78-S82). Кардиопоэтические клетки сохраняют способность к пролиферации. Кардиопоэтические клетки могут быть получены из стволовых клеток, включая, например, мезенхимальные стволовые клетки взрослого человека (Terzic et al. заявка США №2008/0019944), эмбриональные стволовые клетки мыши (Behfar et al, ‘Cardiopoietic programming of embryonic stem cells for tumour-free heart repair’ J Exp Med 2007 204: 405-420), стволовые клетки, подобные эмбриональным, индуцированные плюрипотентные стволовые клетки, клетки пуповинной крови, резидентные стволовые клетки сердца и т.п. или любые другие пригодные источники (при условии, что их получение не подразумевает разрушение эмбриона человека).
‘Коктейль’ или ‘кардиогенный коктейль’ представляет собой композицию, включающую по меньшей мере два кардиогенных вещества.
‘Кардиогенная обработка’ представляет собой обработку, которая увеличивает кардио-генеративный потенциал клетки. Пример такой обработки заключается в приведении указанных клеток в контакт с коктейлем. Примеры таких коктейлей включают по меньшей мере два вещества, выбранных из группы, состоящей из факторов роста, цитокинов, гормонов и их комбинаций. Указанные по меньшей мере два вещества могут быть выбраны из группы, в которую входят костные морфогенетические белки (BMP), такие как ВМР-1, BMP-2, BMP-5, BMP-6; эпидермальный фактор роста (EGF); эритропоэтин (ЕРО); фактор роста фибробластов (FGF), такой как FGF-1, FGF-4, FGF-5, FGF-12, FGF-13, FGF-15, FGF-20; колониестимулирующий фактор гранулоцитов (G-CSF); гранулоцито-макрофаго-колониестимулирующий фактор (GM-CSF); фактор роста и дифференцировки 9 (GDF-9); фактор роста гепатоцитов (HGF); инсулиноподобный фактор роста (IGF), такой как IGF-2; миостатин (GDF-8); нейротрофины, такие как NT-3, NT-4, NT-1 и фактор роста нервов (NGF); тромбоцитарный фактор роста (PDGF), такой как PDGF-beta, PDGF-AA, PDGF-BB; тромбопоэтин (ТРО); трансформирующий фактор роста альфа (TGF-α); трансформирующий фактор роста β (TGF-β), такой как TGF-β1, TGF-β2, TGF-β3; фактор роста эндотелия сосудов (VEGF), такой как VEGF-A, VEGF-C; TNF-α; фактор, ингибирующий лейкемию (LIF); интерлейкин 6 (IL-6); ретиноевая кислота; фактор роста стромальных клеток 1 (С SDF-1); нейротрофический фактор головного мозга (BDNF); периостин; ангиотонин II; Flt3 лиганд; глиальный нейротрофический фактор; гепарин; белок-3, связывающий инсулиноподобный фактор роста; белок-5 связывающий инсулиноподобный фактор роста; интерлейкин-3; интерлейкин-8; мидкин; прогестерон; путресцин; фактор стволовых клеток; Wnt1; Wnt3a; Wnt5a; каспаза-4; хемокиновый лиганд 1; хемокиновый лиганд 2; хемокиновый лиганд 5; хемокиновый лиганд 7; хемокиновый лиганд 11; хемокиновый лиганд 20; гаптоглобин; лектин; холестерин-25-гидроксилаза; синтаксин 8; синтаксин 11; церулоплазмин; компонент комплемента 1; компонент комплемента 3; альфа 6 интегрин; лизосомальная кислая липаза 1; β-2 микроглобулин; убиквитин; фактор ингибирования миграции макрофагов; кофилин; циклофилин A; FKBP12; NDPK; профилин 1; цистатин С; кальциклин; станниокалцин-1; PGE-2; mpCCL2; IDO; iNOS; HLA-G5; M-CSF; ангиопоэтин; PIGF; МСР-1; молекулы внеклеточного матрикса; CCL2 (МСР-1); CCL3 (MIP-1α); CCL4 (MIP-1β); CCL5 (RANTES); CCL7 (МСР-3); CCL20 (MIP-3α); CCL26 (эотаксин 3); CX3CL1 (фракталкин); CXCL5 (ENA-78); CXCL11 (i-TAC); CXCL1 (GROa); CXCL2 (GROp); CXCL8 (IL-8); CCL10 (IP-10) и их комбинации.
‘Коктейль-ориентированные клетки’ или ‘клетки, ориентированные на дифференцировку в клетки сердца’ представляют собой клетки, обработанные коктейлем.
‘Дифференцировка’ представляет собой процесс, посредством которого менее специализированные клетки становятся более специализированными.
‘Фракция выброса’ представляет собой фракцию крови, выбрасываемую при сокращении сердца. Без ограничения, в настоящем описании термин фракция выброса обозначает фракцию выброса левого желудочка (фракция выброса левого желудочка или LVEF).
В описании настоящего изобретения формы единственного числа (англ. ‘а’, ‘an’ и ‘the’) включают формы множественного числа, если из контекста ясно следует обратное. Так, например, термин ‘стволовые клетки’ обозначает клетку, или две, или более клеток; ‘агент’ или ‘вещество’ обозначает агент или реагент или два или более агента или реагента; ‘настоящее изобретение’ или ‘изобретение’ обозначает один или несколько аспектов изобретения и так далее.
Все технические и научные термины, используемые в настоящей заявке, имеют значение, обычно подразумеваемое специалистами в области техники, к которой принадлежит это изобретение, за исключением тех случаев, когда не определено обратное. Несмотря на то, что для осуществления изобретения могут быть использованы материалы и методы, аналогичные или эквивалентные тем, которые описаны в настоящей заявке, ниже описаны пригодные методы и материалы. Все публикации, заявки на патент, патенты и другие ссылки, упомянутые в настоящем тексте, полностью включены в него путем ссылки. В случае конфликтных ситуаций определяющим является настоящее описание, включая определения. Дополнительно, материалы, методы и примеры являются исключительно иллюстративными и не являются ограничивающими.
Краткое изложение сущности изобретения
В настоящем изобретении предложен способ оценки кардио-генеративного потенциала клеток млекопитающих или кардиогенного потенциала обработки, который включает оценку коэффициента кардиального генеративного потенциала (CARPI) в зависимости от количественных показателей экспрессии генов указанных клеток.
Предпочтительно CARPI зависит от количественных показателей уровней матричной РНК (мРНК) определенных генов в указанных клетках.
Предпочтительно по меньшей мере один ген выбран из группы, в которую входят гены Nkx2.5, Tbx5, MEF2C, GATA4, GATA6, Mespl, FOG1, FOG2, Fik1, их гомологи у млекопитающих и комбинации этих генов. Клетки могут представлять собой кардиальные клетки-предшественники. Они также могут быть соматическими, половыми клетками, клетками пуповинной крови, кардиальными предшественниками, эмбриональными и/или генетически модифицированными клетками.
В некоторых случаях клетки могут принадлежать одному индивидууму и CARPI может быть измерен для этих клеток до или после кардиогенной обработки клеток.
В другом варианте реализации оценивают CARPI для клеток индивидуума или группы индивидуумов в сравнении с другим индивидуумом или группой индивидуумов.
В особенно предпочтительном варианте CARPI представляет собой уравнение с несколькими переменными, в котором значения экспрессии генов на уровне мРНК являются переменными.
Уравнение предпочтительно выбрано из группы, состоящей из полиномиальных функций, трансцендентных функций и их комбинаций.
В частном варианте реализации способа согласно настоящему изобретению осуществляемое измерение CAPPI обеспечивает количественную оценку кардиогенного потенциала обработки.
Согласно одному из вариантов реализации способа согласно настоящему изобретению определяют корреляцию CARPI с каким-либо показателем функции сердца.
Настоящее изобретение также относится к компьютерному устройству, содержащему процессор и связанную с процессором память, в которой содержатся в кодированном виде одна или более программ, причем указанные одна или более программ обеспечивают осуществление процессором способа, включающего расчет CARPI.
Краткое описание графических материалов
На Фиг.1 по оси ординат Y в условных единицах (УЕ) показан CARPI, рассчитанный как для наивных МСК человека (hMSC), так и для коктейль-ориентированных МСК человека (CP-hMSC) на основе количественных показателей экспрессии генов на уровне мРНК, а по оси X показано процентное изменение LVEF (ΔEF) до и после инъекции в сердце мышам с инфарктом миокарда. Черными символами представлены индивидуальные данные, не закрашенными символами представлены усредненные данные (Avg).
Подробное описание изобретения
Пример 1
Образцы костного мозга были получены от пациентов с ишемической болезнью сердца, перенесших аортокоронарное шунтирование. Пациенты подписали информированное согласие, утвержденное ведомственным этическим комитетом.
Мезенхимальные стволовые клетки были получены в результате посева необработанного костного мозга на пластиковые чашки, с последующей отмывкой через 12 часов, отбора адгезионных клеток, идентичность которых была подтверждена методом флуоресцентной сортировки клеток (FACS) с использованием панели маркеров CD34-/CD45-/CD133+. В дальнейшем клетки культивировали и размножали при температуре 37°С в среде DMEM с добавлением 5% лизата тромбоцитов человека (Мауо Clinic Blood Bank, Rochester, MN).
Для получения кардиопоэтической популяции клеток осуществляли культивирование наивных мезенхимальных стволовых клеток, полученных из костного мозга, либо в лизате тромбоцитов, либо сыворотке с добавлением кардиогенного коктейля, содержащего TGFβ-1 (2.5 нг/мл), ВМР4 (5 нг/мл), FGF2 (5 нг/мл), IGF-1 (50 нг/мл), активин А (10 нг/мл), кардиотрофин (1 нг/мл), α-тромбин (1 ед./мл) и кардиогенол С (100 нмоль).
Настоящее изобретение обеспечивает количественную оценку кардио-генеративного потенциала указанной кардиопоэтической популяции клеток путем измерения уровня экспрессии одного или более генов на уровне РНК. Нестоящее изобретение позволяет обойти трудности, связанные с качественными наблюдениями, затратами времени, зависимостью от оператора, которые свойственны измерениям внутриклеточной локализации полипептидов фактора транскрипции. Одним из предпочтительных методов является количественная полимеразная цепная реакция с обратной транскрипцией в режиме реального времени (ОТПЦР). Этот метод обеспечивает быстрые результаты (в течение 1 дня), которые не зависят от оператора и определены с использованием стандартного образца. Кроме того, хотя образцы, окрашенные с использованием иммунной метки, требуют поочередного анализа методом флуоресцентной микроскопии, метод кОТПЦР с использованием 96-луночного планшета позволяет исследовать до 48 различных образцов (или условий) в двух повторностях.
С целью идентификации пригодных маркеров для кОТПЦР выделяли мРНК из кардиопоэтических клеток, которые идентифицировали методом иммунофлуоресцентного окрашивания.
Стандартный образец состоял из клеток той же партии, которые культивировали в отсутствие кардиогенного коктейля.
Были определены перечисленные в табл.1 гены кардиальной транскрипционной активности.
кОТПЦР выполняли с использованием набора TaqMan PCR на автоматическом секвенаторе Applied Biosystems 7,900HT (Applied Biosystems, Foster City, шт. Калифорния, США). Реагенты TaqMan Gene Expression инкубировали в 96-луночном планшете, реакции осуществляли в трипликатах. Пороговый цикл (CT) был задан как дробный номер цикла, при котором флуоресценция проходит фиксированный порог. Значения TaqMan CT преобразовывали в относительные кратные изменения, определенные с использованием метода, нормированные по экспрессии гена ‘домашнего хозяйства’, например GAPDH (P/N 435,2662-0506003).
Результаты обработанных клеток были нормированы по соответствующему стандартному образцу.
CARPI, представляющий собой функцию измеренных значений экспрессии двух или более генов указанных клеток, рассчитывали с помощью электронных таблиц (Microsoft Excel 2007®, Microsoft Corporation) как среднее значение экспрессии генов Nkx2.5, Tbx-5, MEF2C, GATA-4, GATA-6, MESP-1 и FOG-1 на уровне РНК. Использовали следующую формулу:
,
где ‘i’ обозначает выбранный ген, а ‘n’ - общее количество выбранных генов, с минимальным значением, равным 2. В данном конкретном случае n=7.
Вычисляли кардио-генеративный потенциал кардиопоэтических клеток, полученных из мезенхимальных стволовых клеток человека, у ‘голой’ (бестимусной) мыши с ослабленным иммунитетом (Harlan, Indianapolis, IN, США). Протокол был утвержден надлежащим ведомственным комитетом по уходу за животными и их использованию.
Вызвали инфаркт миокарда. В соответствии моделью слепого исследования, через месяц после инфаркта под контролем микроскопа вводили 600000 (в сумме) жизнеспособных наивных МСК человека или 600000 (в сумме) жизнеспособных кардиопоэтических клеток, полученных из МСК человека, суспендированных в 12,5 мкл среды для размножения, не содержащей лизата тромбоцитов, в пять эпикардиальных участков передней стенки левого желудочка (по 2,5 мкл на каждый участок введения).
Осуществляли периодическое наблюдение за функцией и структурой левого желудочка с помощью трансторакальной эхокардиографии (Sequoia 512; Siemens, Malvem, PA and VisualSonics Inc, Toronto, Canada). Фракцию выброса левого желудочка (LVEF, %) рассчитывали как [(LVVd - LVVs)/LVVd]×100, где LVVd - конечно-диастолический объем левого желудочка (мкл), a LVVs - конечно-систолический объем левого желудочка (мкл).
Изменение LVEF (ΔEF) вычисляли как разницу между LVEF, измеренной спустя месяц после введения клеток, и LVEF, измеренной до введения клеток.
На Фиг.1 показан график CARPI для каждой конкретной культуры клеток в зависимости от соответствующей ΔEF у мышей, которым вводили соответствующие описанные выше отдельные культуры клеток. Наивные МСК человека (небольшие черные ромбы) обычно демонстрировали низкий CARPI, что связано с отсутствием существенного улучшения функции миокарда через месяц после введения клеток (отрицательное ΔEF). Стоит отметить редкие партии наивных МСК человека, врожденно обладающих высоким значением CARPI, наряду с врожденным регенеративным потенциалом. Среднее значение для всех групп наивных МСК человека представлено большим белым треугольником. Кардиопоэтические клетки, полученные из МСК человека (небольшие черные квадраты), обычно демонстрировали повышенный CARPI, связанный с устойчивым улучшением функции миокарда (положительное ΔEF). Среднее значение для всех групп наивных МСК человека изображено в виде большого белого квадрата. Средние значения представлены с 95%-м доверительным интервалом.
Таким образом, авторы изобретения продемонстрировали, что существует положительная корреляция между повышенным CARPI введенных клеток и изменением во фракции выброса после введения в сердце после инфаркта. Таким образом, CARPI является прогностическим показателем кардио-генеративного потенциала.

Пример 2
Аналогичные результаты были получены при обработке стволовых клеток коктейлем, содержащим смесь рекомбинантных белков: TGFβ-1 (2.5 нг/мл), ВМР4 (5 нг/мл), Активин-А (5 нг/мл), FGF-2 (10 нг/мл), α-тромбин (1 ед./мл), IGF-1 (50 нг/мл), кардиотрофин (1 нг/мл) и кардиогенол С (100 нмоль).
Пример 3
Аналогичные результаты были получены при обработке стволовых клеток коктейлем, содержащим смесь рекомбинантных белков: TGFβ-1 (2.5 нг/мл), ВМР4 (5 нг/мл), Активин-А (5 нг/мл), FGF-2 (10 нг/мл), α-тромбин (1 ед./мл), IGF-1 (50 нг/мл), интерлейкин 6 (100 нг/мл) и ретиноевая кислота (1 мкммоль).
Другие варианты реализации
Следует понимать, что несмотря на то, что настоящее изобретение раскрыто в прилагаемом подробном описании изобретения, предшествующее описание приведено с целью иллюстрации и не ограничивает объем настоящего изобретения, который определяется прилагающейся формулой изобретения. Существуют другие аспекты, преимущества и модификации изобретения, находящиеся в пределах объема формулы изобретения.
Реферат
Изобретение относится к области медицины. Предложен способ определения кардио-генеративного потенциала клеток млекопитающих, включающий сбор измеренных уровней экспрессии в клетках млекопитающих генов Nkx2.5, Tbx5, MEF2C, GATA4, GATA6, Mesp1, FOG1 и определение коэффициента кардиального генеративного потенциала (CARPI) как среднего значения измеренных уровней экспрессии указанных генов указанных клеток. Изобретение обеспечивает хорошую прогнозируемость успеха восстановления сердца. 12 з.п. ф-лы, 1 ил., 1 табл., 3 пр.
Формула
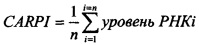

Комментарии