Способ получения суспензионной формы измельченного децеллюляризованного внеклеточного матрикса - RU2627844C1
Код документа: RU2627844C1
Чертежи

Описание
Область техники
Настоящее изобретение относится к области фармацевтики и медицины, а именно к способу получения не требующей предварительной регидратации суспензионной формы измельченного децеллюляризованного внеклеточного матрикса с регулируемым размером его структурных компонентов, а также к продукту, полученному указанным способом, который предназначен для стимуляции репаративной регенерации тканей.
Предпосылки изобретения
Медицинские изделия, структурной основой которых служит децеллюляризованный (бесклеточный) внеклеточный матрикс, в настоящее время широко используют в пластической и реконструктивной хирургии. Кроме того, растет число их применения и в области регенеративной медицины. Научный и практический интерес к биорезорбируемому материалу данного типа вызван его высокими репаративными свойствами, во многом обусловленными сохранностью трехмерной ультраструктуры, пространственной топологии и химического состава внеклеточного матрикса, присутствующего в тканях организма. Во многих исследования показана способность децеллюляризованного внеклеточного матрикса, полученного по различным технологиям из различных источников, способствовать хемотаксису, миграции и дифференцировки клеток, а также ремоделированию собственных тканей организма (Crapo P.M., Gilbert T.W., Badylak S.F. An overview of tissue and whole organ decellularization processes. Biomaterials. 2011, v. 32, № 12, pp. 3233-3243).
Большинство представленных на рынке изделий из децеллюляризованного внеклеточного матрикса представляют собой высушенные пластины или мембраны, предназначенные для возмещения дефектов в стенке полых органов (Burger G.W., Halm J.A., Wijsmuller A.R., ten Raa S., Jeekel J. Evaluation of new prosthetic meshes for ventral hernia repair. Surgical endoscopy. 2006, v. 20, № 8, pp.1320-1325), направленной регенерации костной ткани в стоматологи (Bunyaratavej P., Wang H.L. Collagen membranes: a review. Journal of periodontology. 2001, v. 72, № 2, pp. 215-229.), восстановления связок и сухожилий, а также, в меньшей степени, для терапии раневых дефектов кожи различной этиологии (Cornwell K.G., Landsman A., James K.S. Extracellular matrix biomaterials for soft tissue repair. Clinics in podiatric medicine and surgery. 2009, v. 26, № 4, pp. 507-523). Однако, при хирургическом лечении ряда патологий, в первую очередь в урологии и отоларингологии, а также при коррекции возрастных и эстетических изменений в косметологии, необходимо применение инъекционных форм биосовместимых пластических материалов с целью, как замещения утраченной механической функции тканей, так и активации репаративных процессов, приводящих к новообразованию аутологичных тканей. Также для терапии длительно незаживающих ран со слабой экссудацией предпочтительнее использовать покрытия, легко заполняющие раневой дефект и содержащие большое количество влаги. Проблема создания медицинских изделий, совмещающих обозначенные выше характеристики с наличием биологических свойств очищенного внеклеточного матрикса может быть во многом решена путем применения его измельченных частиц, суспендированных в каком-либо жидком компоненте. Так, в US 6933326 B1 и EP 1087756 A1 описана технология получения лиофилизированного измельченного децеллюляризованного внеклеточного матрикса аллогенного или ксеногенного происхождения, требующего проведения предварительной регидратации перед использованием. На основе технологии данного патента корпорацией LifeCell (США) выпускается медицинское изделие Cymetra®, представляющее собой лиофилизированный измельченный аллогенный внеклеточный матрикс дермы, упакованный в шприц. Согласно опубликованным данным, применение Cymetra®оказывает терапевтический эффект при проведении трахеопищеводного прокола (Seshamani M., Ruiz C., Kasper Schwartz S., Mirza N. Cymetra injections to treat leakage around a tracheoesophageal puncture. Journal of oto-rhino-laryngology and its related specialities. 2006, v. 68, № 3, pp. 146-148), ларингопластики у пациентов с односторонним параличом истинных голосовых связок (Milstein C.F., Akst L.M., Hicks M.D., Abelson T.I., Strome M. Long-term effects of micronized Alloderm injection for unilateral vocal fold paralysis. Laryngoscope. 2005, v. 115, № 9, pp. 1691-1696) и косметологической коррекции губ (Sclafani A.P., Romo T., Jacono A.A. Rejuvenation of the aging lip with an injectable acellular dermal graft (Cymetra). Archives of fascial plastic surgery. 2002, v. 4, № 4, pp. 252-257). Также в литературе описано успешное применение путем инъекционного введения смешанного непосредственно перед использованием с жидким компонентом измельченного очищенного внеклеточного матрикса мочевого пузыря свиней для терапии приобретенного недержания мочи (Wood J.D., Simmons-Byrd A., Spievack A.R., Badylak S.F. Use of a particulate extracellular matrix bioscaffold for treatment of acquired urinary incontinence in dogs. Journal of the American veterinary medical association. 2005, v. 226, № 7, pp. 1095-1097) и остеоартрита тазобедренного сустава (Rose W., Wood J.D., Simmons-Byrd A., Spievack A.R. Effect of a xenogeneic urinary bladder injectable bioscaffold on lameness in dogs with osteoarthritis of the coxofemoral joint (hip): a randomized, double blinded controlled trial. International journal of applied research in veterinary medicine. 2009, v. 7, № 1, pp. 13-22) у собак.
Существенным недостатком описанного выше подхода к применению измельченного децеллюляризированного матрикса, значительно ограничивающим его внедрение в методики терапевтического лечения, является сложность проведения гидратации материала с последующим изготовлением суспензионной формы для парентерального или наружного введения. Данная сложность вызвана главным образом слипанием частиц материала и их неравномерным намоканием, что мешает осуществлению их равномерного суспендирования.
Из литературы известно, что уменьшение размеров структурных элементов матрикса, на котором происходит рост клеток, способствует увеличению их жизнеспособности, а также ускорению миграции и дифференцировки (Stevens M.M., George J.H. Exploring and engineering the cell surface interface. Science. 2005. v. 310, № 5751, pp. 1135-1138.), что связывают с увеличением площади поверхности и, как следствие, количества доступных сайтов связывания с рецепторами клеточных мембран. В то же время простое суспендирование измельченного децеллюляризированного матрикса в жидкости не позволяет значительно влиять на размерные характеристики компонентов твердой дисперсной фазы суспензии, кроме как варьируя размер частиц матрикса. Это, в свою очередь, существенно затрудняет получение инъекционного биорезорбируемого материала с регулируемыми репаративными свойствами.
Таким образом, сохраняется необходимость в разработке способа получения не требующей предварительной регидратации суспензионной формы измельченного децеллюляризованного внеклеточного матрикса с регулируемым размером его структурных компонентов, применение которой позволит без нанесения разреза, производить ее инъекционное введение в необходимую область и легко заполнять открытый раневой дефект различных тканей.
Краткое изложение сущности изобретения
Поставленная задача решена в результате разработки способа получения не требующей предварительной регидратации суспензионной формы измельченного децеллюляризованного внеклеточного матрикса с регулируемым размером его структурных компонентов, где предложенный способ включает следующие стадии:
сепарирование пластов очищенного волокнистого внеклеточного матрикса,
измельчение пластов с получением мелкодисперсного порошка из частиц очищенного внеклеточного матрикса,
последующее фракционирование порошка с получением фракции частиц необходимого размера и
суспендирование отобранной фракции частиц очищенного внеклеточного матрикса в жидкой среде путем чередования циклов перемешивания и диспергирования частиц в жидкой среде с преобладанием по длительности процесса перемешивания при температуре, не вызывающей денатурацию коллагена,
дегазацию полученной суспензии частиц.
Размер структурных компонентов внеклеточного матрикса в составе суспензионной формы определяется степенью разволокнения пучков волокон коллагена в диапазоне от полностью неразволокненных пучков до пучков меньшего порядка и волокон и, в соответствии с предложенным способом, может регулироваться путем изменения продолжительности процессов перемешивания и диспергации, а также количества их повторяющихся циклов в зависимости от типа используемого очищенного матрикса.
В конкретных вариантах воплощения настоящего изобретения внеклеточный матрикс получен из соединительных тканей аллогенного или ксеногенного происхождения.
В конкретных вариантах воплощения настоящего изобретения в качестве гомогенизатора-диспергатора используют прибор погружного типа или прибор циркуляционного типа.
В другом конкретном варианте воплощения настоящего изобретения жидкая среда, в которой осуществляют перемешивание и диспергирование, представляет собой изотонический или гипертонической раствор, который может дополнительно содержать, по меньшей мере, один компонент, выбранный из группы, содержащей факторы роста, морфогенетические белки, гормоны, природные полисахариды терапевтического назначения, а также лекарственные субстанции и препараты, такие, как антибиотики, гемостатики, анальгетики и местные анестетики.
В другом конкретном варианте воплощения настоящего изобретения все стадии проводят в асептических условиях, что обеспечивает стерильность получаемой суспензионной формы.
В другом конкретном варианте воплощения настоящего изобретения дополнительно проводят радиационную стерилизацию полученной суспензии в конечной упаковке, что обеспечивает стерильность получаемой суспензионной формы.
В другом конкретном варианте воплощения настоящего изобретения измельчение пластов с получением мелкодисперсного порошка проводят при комнатной температуре.
В другом конкретном варианте воплощения настоящего изобретения децеллюляризованный внеклеточный матрикс перед измельчением дополнительно обрабатывают сшиваюшими агентами.
Еще одним объектом настоящего изобретения является продукт, полученный описанным выше способом, который предназначен для стимуляции репаративной регенерации тканей, в частности, заживления кожных ран.
Краткое описание фигур
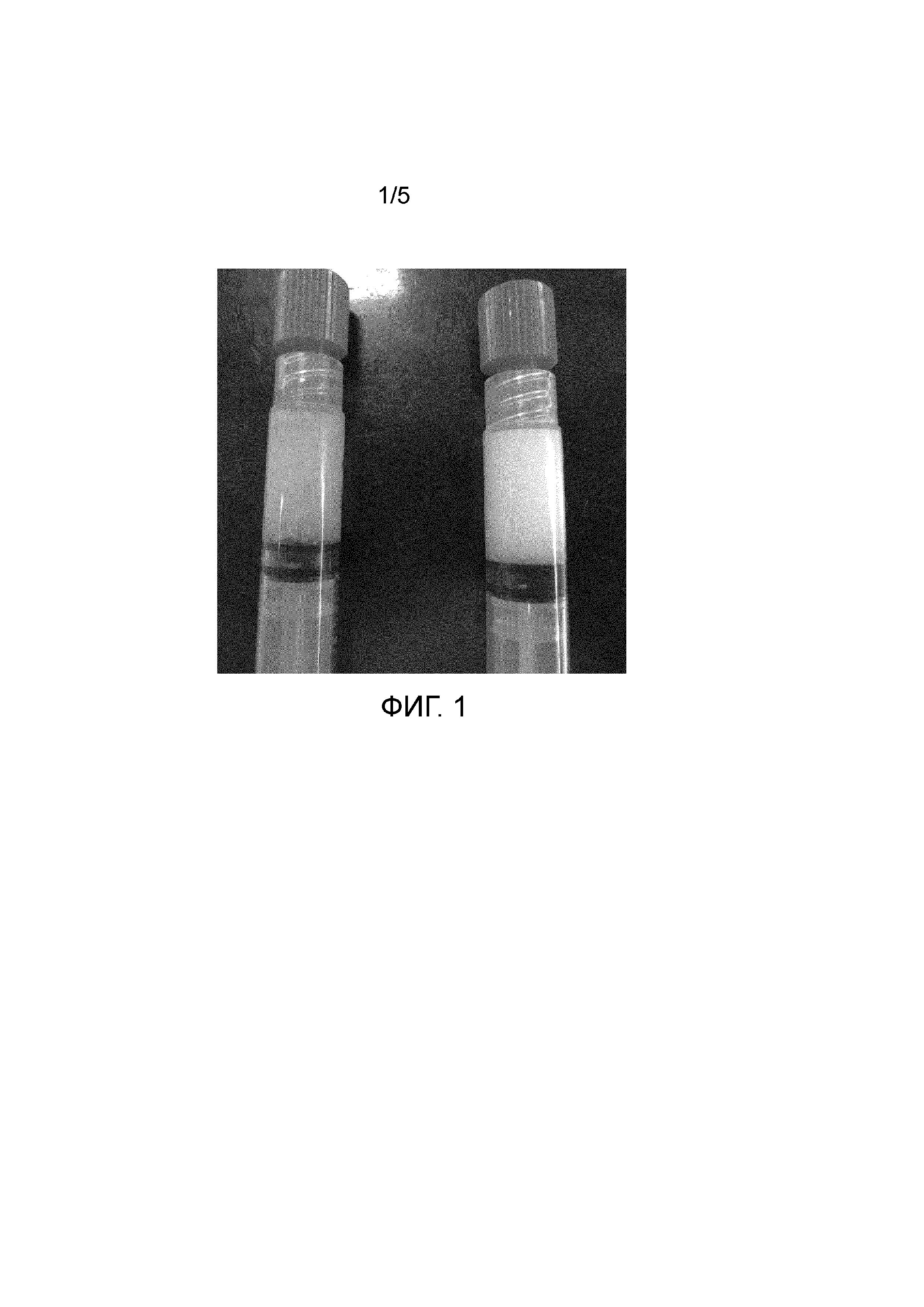
На Фиг.1 показан внешний вид шприцов с суспензионными формами гидратированного измельченного децеллюляризованного внеклеточного матрикса дермы кожи крупного рогатого скота, полученными с применением однократной диспергации в течение 60 с (слева) и 10 мин (справа).
На Фиг.2 показаны препараты суспензионных форм гидратированного измельченного децеллюляризованного внеклеточного матрикса дермы кожи крупного рогатого скота, полученных с применением однократной диспергации в течение 60 с (А) и 10 мин (Б). Световая микроскопия. Дифференциально-интерференционный контраст.
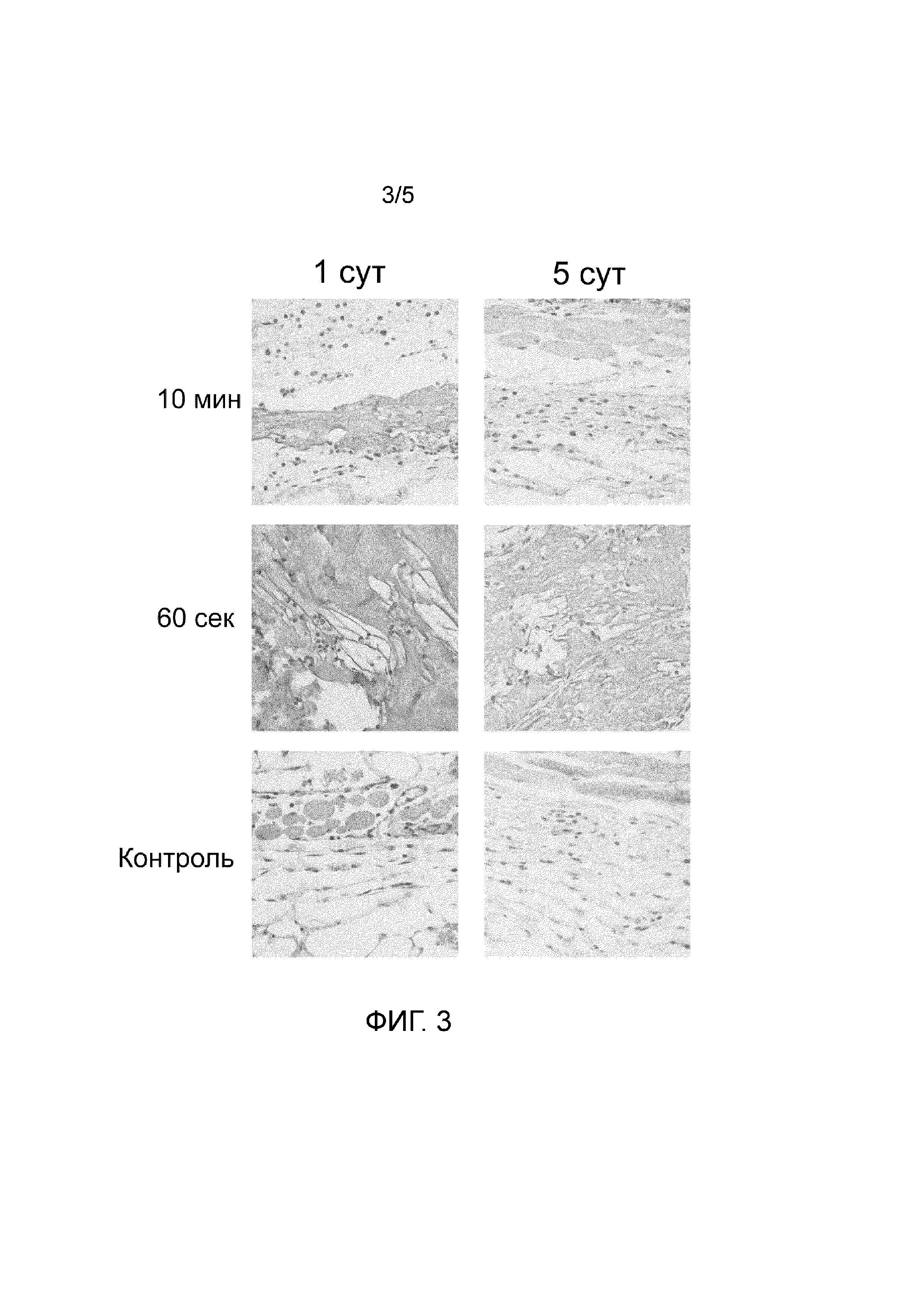
На Фиг.3 показан участок гистологического среза области инъекционного введения суспензионных форм гидратированного измельченного децеллюляризованного внеклеточного матрикса дермы кожи крупного рогатого скота, полученных с применением однократной диспергации в течение 60 с и 10 мин, а также 10% раствора глюкозы (контроль). Окраска гематоксилином и эозином. Представлены репрезентативные микрофотографии.
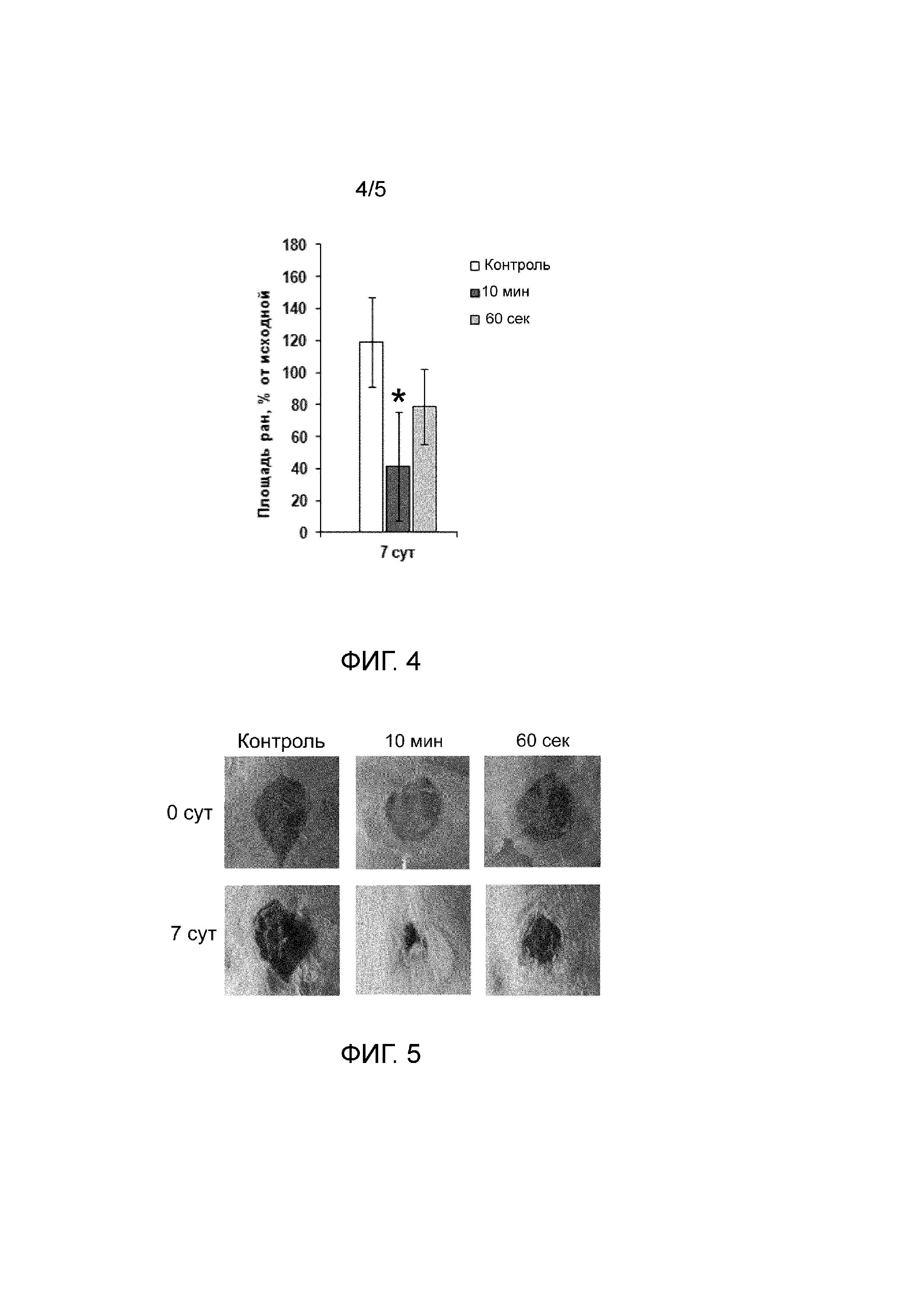
На Фиг.4 показана относительная площадь раневой поверхности у животных, раны которых заживали под повязками из суспензионных форм гидратированного измельченного децеллюляризованного внеклеточного матрикса дермы кожи крупного рогатого скота, полученных с применением однократной диспергации в течение 60 с и 10 мин, а также под фиксирующей повязкой без нанесения суспензии (контроль). Значение, отмеченное звездочкой, достоверно (p < 0,05) отличается от значения контрольной группы.
На Фиг.5 представлены репрезентативные макрофотоснимки раневой области животных, раны которых заживали под повязками из суспензионных форм гидратированного измельченного децеллюляризованного внеклеточного матрикса дермы кожи крупного рогатого скота, полученных с применением однократной диспергации в течение 60 с и 10 мин, а также под фиксирующей повязкой без нанесения суспензии (контроль).
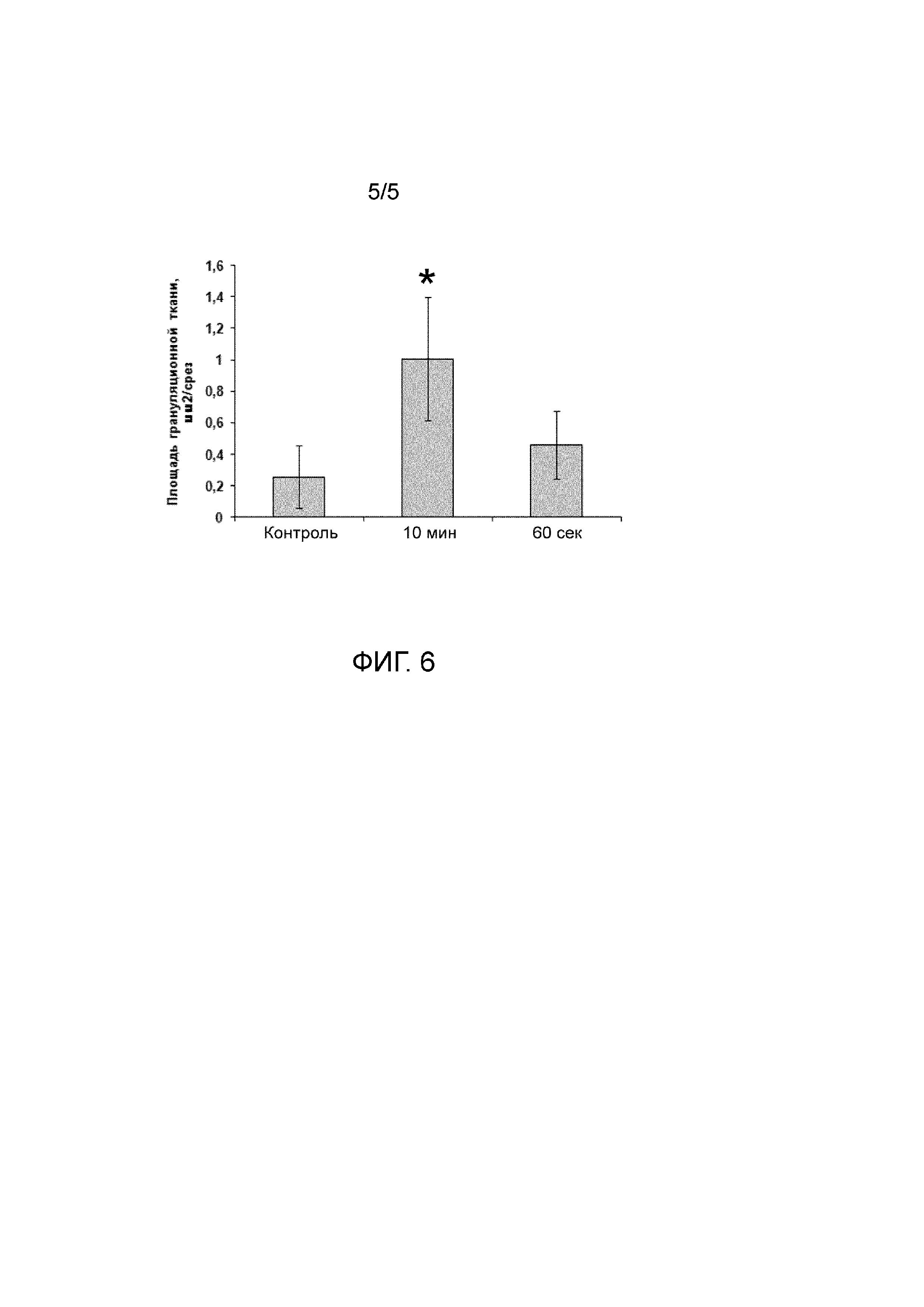
На Фиг.6 показана площадь грануляционной ткани на гистологических срезах центральной зоны раневого дефекта животных, раны которых заживали под повязками из суспензионных форм гидратированного измельченного децеллюляризованного внеклеточного матрикса дермы кожи крупного рогатого скота, полученных с применением однократной диспергации в течение 60 с и 10 мин, а также под фиксирующей повязкой без нанесения суспензии (контроль). Значение, отмеченное звездочкой, достоверно (p < 0,05) отличается от значения контрольной группы.
Подробное описание изобретения
Для изготовления суспензионной формы для медицинского применения используют децеллюляризованный внеклеточный матрикс с преобладанием волокнистого компонента (волокон коллагена и эластина). Матрикс может быть получен как запатентованным методом (например, согласно РФ № 2353397 или US 5336616 A), так и методом или комбинацией методов, описанных в научной литературе (Badylak S.F., Taylor D., Uygun K. Whole-organ tissue engineering: decellularization and recellularization of three-dimensional matrix scaffolds. Annual review of biomedical engineering. 2011, v. 15, № 13, pp.27-53). При этом использование методик очистки на основе обработки щелочными растворами является предпочтительным. Также предпочтительно, чтобы используемый метод очистки обеспечивал остаточное количество ДНК в полученном материале менее 50 нг/мг сухой массы. Источником очищенного внеклеточного матрикса должны являться соединительные ткани аллогенного или ксеногенного происхождения. Наилучшим образом для изготовления суспензионной формы подходит внеклеточный матрикс сетчатого слоя дермы кожи. Однако матрикс соединительной ткани перикарда, брюшины, оболочек крупных сосудов, кишечника и других органов также может быть использован для данной цели. Для увеличения устойчивости к биодеградации децеллюляризованный матрикс может быть предварительно обработан сшиваюшими агентами (например, растворимым карбодиимидом или глутаровым альдегидом).
Полученный децеллюляризованный внеклеточный матрикс разделяют на пласты. Ширину пластов выбирают исходя из удобства последующего внесения их в измельчающее устройство. Затем для уменьшения сопротивления материала и предотвращения образования его локальных деформаций при измельчении пласты подвергают сушке на воздухе или же лиофилизацией.
По завершении сушки, полученный материал измельчают, предпочтительно при комнатной температуре (в диапазоне от +15 до +25°C). Для измельчения используют модель мельницы, предназначенную для измельчения сухих волокнистых материалов низкой или средней твердости (например, PULVERISETTE 15 (FRITSCH, Германия). Предпочтительно, чтобы в конструкции прибора присутствовала решетная вставка с изменяемым размером отверстий. Ее наличие позволяет изменять распределение образующихся частиц матрикса по размерам путем варьирования диаметра отверстий. После измельчения матрикс представляет собой мелкодисперсный порошок с размером частиц в диапазоне 5-4000 мкм.
Размер частиц, составляющих твердую дисперсную фазу суспензии, во многом определяет ее реологические и биологические свойства. Как правило, для осуществления возможности интрадермального инъекционного введения через иглы малого диаметра (30G, 27G) при косметологических процедурах наиболее целесообразно для изготовления суспензии использовать частицы размером в диапазоне 5-400 мкм. В тоже время, для инъекционного введения суспензий через иглы большего диаметра в хирургии более предпочтительно использование фракций частиц диаметром 400-800 мкм. В свою очередь для наружных аппликаций, не требующих инъекционного введения, лучшим образом подходят суспензии из частиц, диаметром 700-1000 мкм. При этом суспензии из частиц большего размера, как правило, характеризуются более длительным сроком биодеградации. В связи с этим, для последующего изготовления суспензионных форм измельченного децеллюляризованного матрикса проводят фракционирование с получением частиц необходимого размера. Для этой цели проводят микроситование на вибрационном грохоте (например, ANALYSETTE 3 PRO (FRITSCH, Германия) с набором плетеных или микропрецизионных сит с ячейками необходимого размера, предназначенных для сухого рассева. Сита должны быть изготовлены в соответствие с ISO-3310-1, для возможности применения на чистом производстве. При микроситовании предпочтительным является проведение просева при амплитуде вибрации в диапазоне 0,2-2,5 мм. Это позволяет уменьшить потерю материала, вызванную его оседанием на стенках прибора при пылении. Также возможно применение особых режимов отделения частиц определенного размера, если таковые предусмотрены конструкцией и программным обеспечением прибора.
Полученный в результате измельчения и фракционирования внеклеточный матрикс используют для дальнейшего изготовления суспензий. Для этого отобранную фракцию частиц смешивают с жидким компонентом суспензии в гомогенизаторе-диспергаторе с последующим диспергированием. В качестве жидкого компонента предпочтительно используют изотонический (например, 0,9% раствор хлорида натрия или 5% раствор глюкозы) или гипертонический (например, 10% раствор глюкозы) растворы. Для улучшения терапевтических свойств суспензионной формы в состав жидкой дисперсионной среды могут быть дополнительно внесены различные компоненты, такие как факторы роста, морфогенетические белки, гормоны, лекарственные субстанции или препараты, в частности, антибиотики, гемостатики, анальгетики, местные анестетики, а также природные полисахаридытерапевтического назначения (например, гиалуроновая кислота) и комбинации таких компонентов.
В качестве гомогенизатора-диспергатора применяют прибор погружного (например, ULTRA-TURRAX (IKA, Германия) или циркуляционного типа (например, magic LAB (IKA, Германия). При использовании погружного диспергатора смешивание и диспергирование компонентов проводят в лабораторной емкости, например стакане, а при работе с циркуляционным - в резервуаре прибора. В обоих случаях на всем протяжении процесса изготовления суспензии необходимо контролировать ее температуру, повышающуюся за счет нагревания при трении материала о детали диспергирующего модуля. При этом желательно не допускать превышение температуры суспензии выше температуры необратимой денатурации основных белков используемого децеллюляризованного внеклеточного матрикса. Циркуляционные диспергаторы могут быть оснащены дополнительными термостатируемыми модулями, как охлаждающими, так и нагревающими. Можно комбинировать такие модули на разных деталях прибора, создавая оптимальный температурный режим. Например, на диспергирующем модуле можно установить охлаждающий модуль на 4°C, для сведения к минимуму локального нагрева, а на рубашке резервуара установить нагревающий модуль на 27°C, чтобы поддерживать реологические параметры смеси в пределах рабочих параметров вязкости системы.
На первом этапе приготовления суспензии в емкость или резервуар вводят часть объема жидкого компонента. Затем туда помещают перемешивающий модуль, например, мешалку якорного типа. После этого вручную постепенно вводят необходимое количество измельченного децеллюляризованного внеклеточного матрикса. Затем вносят оставшийся расчетный объем жидкого компонента и запускают вращение мешалки. Предпочтительная скорость при этом составляет 20-45 об/мин. На прибор циркуляционного типа также может быть установлен специальный модуль для автоматизированного постепенного введения твердой дисперсной фазы. В случае если мощности мешалки не хватает для равномерного перемешивания суспензии, то допускается дополнительное перемешивание вручную с помощью палочки или другого лабораторного инструмента. По окончании перемешивания в емкость или резервуар погружают диспергирующий модуль, предварительно установив максимальный зазор между ротором и статором. Наиболее предпочтительной является величина зазора в диапазоне от 0,6 до 2 мм. Следует предварительно установить величину вращающего момента (например, 3000-6000 об/мин), а затем включить диспергирующий модуль.
При изготовлении суспензионной формы необходимо чередовать циклы перемешивания и диспергации со значительным преобладанием первых по времени. При этом режим перемешивания должен предшествовать первому диспергированию, что обеспечивает необходимую гидратацию измельченного матрикса. Путем варьирования длительности циклов перемешивания и диспергации можно регулировать степень разволокнения пучков волокон коллагена, входящего в состав измельченного очищенного волокнистого внеклеточного матрикса. Это позволяет получать суспензии с различными реологическими и биологическими свойствами. Так, суспензии с большей степенью разволокнения будут способны проходить через иглы меньшего диаметра, а также характеризоваться более высокой скоростью биодеградации. Для получения суспензий, состоящих из частиц, образованных фрагментами неразволокненных пучков волокон коллагена, следует использовать циклы перемешивания длительностью 10 мин - 4 ч и диспергирования длительностью 30 с - 10 мин. Для изготовления форм, преобладающим компонентом которых являются пучки волокон коллагена меньшего порядка, при той же длительности перемешивания проводят диспергирование в течение 1-60 мин. Продолжительность диспергирования выбирают исходя из массовой доли твердой дисперсной фазы: приготовление суспензий с большей концентрацией децеллюляризированного матрикса, как правило, требует применения более продолжительного диспергирования. Количество циклов перемешивания-диспергирования должно быть подобрано эмпирически в зависимости от типа очищенного матрикса, используемого в работе. Для матриксов, полученных путем «жесткой» очистки (например, растворами щелочей), как правило, достаточно проведения одного цикла перемешивания-диспергации. В то же время для образцов, полученных более «мягким» способом (например, обработкой детергентами), требуется большее количество повторяющихся циклов.
Перед фасовкой, проводят дегазацию полученной суспензии при помощи вакуумной дегазационной системы при перемешивании (например, при помощи вакуумного насоса входящего в комплектацию установки Magic Plant (IKA, Германия)). Если суспензия получена погружным гомогенизатором-диспергатором, то ее следует перелить в резервуар дегазатора. Если суспензия получена в циркуляционном гомогенизаторе-диспергаторе, то можно либо также перенести ее в резервуар дегазатора, либо использовать специальный дегазирующий вакуумный модуль, обычно предусмотренный производителем в качестве дополнительной комплектации.
После дегазации суспензию расфасовывают в конечную упаковку (например, шприцы или тюбики) вручную или же применяя промышленные фасовочные установки.
Для обеспечения стерильности полученного продукта предпочтительно осуществление производства в асептических условиях, согласно ГОСТ Р 52249 и ГОСТ Р ИСО 13408. Также для стерилизации суспензии в конечной упаковке возможно применение радиационной стерилизации, в случае если деградация компонентов продукта под ее воздействием не оказывает существенный эффект на терапевтические свойства.
Область применения
Суспензионные формы гидратированного измельченного децеллюляризованного внеклеточного матрикса, полученные методом, описанным в настоящем изобретении, можно применять в области:
(1) дерматологии и косметологии с целью лечения острых и длительно незаживающих ран кожи, коррекции атрофических рубцов и морщин;
(2) урологии с целью лечения недержания мочи и везико-уретрального рефлюкса;
(3) отоларингологии с целью пластики голосовых связок;
(4) реконструктивной хирургии с целью механического замещения дефектов различных тканей.
Также суспензионная форма, полученная согласно настоящему изобретению, может быть использована в качестве гемостатического средства и субстрата для трасплантации клеток в тканевой инжененрии.
Суспензии матрикса, полученные согласно методике, описанной в настоящем изобретении, могут быть введены в желаемую область, как путем инъекций, так и путем поверхностного нанесения, или же комбинацией методов. Также возможно их нанесение на фиксирующие повязки или другие изделия медицинского назначения.
Пример
Пласты децеллюляризованного внеклеточного матрикса дермы кожи крупного рогатого скота площадью 400-700 см2 получали путем очистки по методике, описанной в RU 2353397. Остаточное содержание ДНК в материале составляло 6,5 нг/мг сухой массы, что, согласно данным литературы свидетельствует об эффективности удаления клеточных компонентов (Crapo P.M., Gilbert T.W., Badylak S.F. An overview of tissue and whole organ decellularization processes. Biomaterials. 2011, v. 32, № 12, pp. 3233-3243). Данные пласты разрезали и высушивали на воздухе до остаточной влажности 30%. Затем их измельчали при помощи режущей мельницы PULVERISETTE 15 (FRITSCH, Германия) при установленной решетной вставке с размером отверстий в 500 мкм. Полученный мелкодисперсный порошок очищенного матрикса подвергали микроситованию на вибрационном грохоте ANALYSETTE 3 PRO (FRITSCH, Германия) с набором микропрецизионных сит для сухого рассева размером 100, 250, 400, 500, 1000 мкм. Амплитуду вибрации при фракционировании изменяли в процессе ситования в пределах от 0,2 мм до 2,5 мм. Для последующего изготовления суспензии отбирали фракцию порошка с размером частиц 200-300 мкм. Приготовление суспензионной формы гидратированного измельченного матрикса проводили при помощи гомогенизатора-диспергатора циркуляционного типа magic LAB (IKA, Германия). В резервуар прибора наливали 200 мл жидкой дисперсионной среды, в качестве которой выступал 10% раствор глюкозы. Затем включали якорную мешалку, установив скорость вращения в 20 об/мин. После этого в резервуар вносили 70 г измельченного матрикса, добавляли 800 мл раствора глюкозы и перемешивали полученную суспензию в течение 40 мин. По истечении данного времени перемешивание останавливали и включали диспергирующй модуль с охлаждением на 4°C, установив величину зазора между ротором и статором в 1 мм. Для изготовления формы, содержащей частицы неразволокненных пучков волокон коллагена проводили перемешивание в течение 15 минут, а потом диспергацию при 3000 об/мин в течение 60 с. В свою очередь для получения формы, состоящей из пучков волокон коллагена, диаметром 10-20 мкм, другую партию частиц матрикса того же размера обрабатывали по аналогичной схеме, за исключением времени диспергирования. В данном случае диспергировали суспензию в течение 10 мин. На всем протяжении нахождения материала в резервуаре прибора проводили мониторинг температуры суспензии, при помощи встроенного термометра. Значение температуры образцов при этом находилось в диапазоне 20-40°C.
После этого проводили дегазирование суспензий в камере диспергатора при помощи вакуумного насоса входящего в комплектацию установки Magic Plant (IKA, Германия). Затем в асептических условиях в ручную проводили упаковку суспензионных форм в полипропиленовые шприцы с резьбой объемом 1,5 мл. Шприцы закрывали заглушкой «Комби-стоппер» (B. Braun, Германия) и упаковывали в рулон для стерилизации (steriCLIN, Германия). После этого их подвергали радиационной стерилизации при дозе в 11 кГр.
Произведенные изделия представляли собой непрозрачные вязкие суспензии белого цвета, упакованные в шприцы с заглушкой, как показано на Фиг.1. При этом в составе суспензий, полученных при диспергировании в течение 60 с визуально различимы отдельные частицы, в то время как суспензии, диспергированные 10 мин, гомогенны.
Для анализа структуры полученных образцов проводили их морфологическое исследование методом световой микроскопии. Для светомикроскопического исследования готовили препараты суспензий, заключая 50 мкл образца между предметным и покровным стеклом. Полученные препараты анализировали при помощи микроскопа NikonNi-U (Nikon, Япония) с использованием объектива Nikon Plan Fluor 10Х/0,3 (Nikon, Япония) методом дифференциально-интерференционного контраста (ДИК).
Светомикроскопическое исследование показало, что полученные образцы состоят из жидкой дисперсионной среды, в которую погружены фрагменты измельченного очищенного волокнистого матрикса (см. Фиг. 2). В образцах суспензий, диспергированных в течение 60 с, данные фрагменты представлены отдельными частицами размером 200-300 мкм, состоящими из плотно уложенных пучков волокон коллагена. В то же время твердая дисперсная фаза образцов суспензий, диспергированных в течение 10 мин, представляет собой переплетающуюся сеть из пучков волокон коллагена диаметром преимущественно 10-20 мкм.
Для оценки биологического действия полученных медицинских изделий проводили исследование их биодеградации и репаративных свойств у мышей в моделях подкожной имплантации и заживления полнослойных кожных ран соответственно. Для анализа процесса биодеградации мышам проводили подкожные инъекции суспензий в количестве 250 мкл в лопаточной области спины через иглу 24G. Мышам контрольной группы вводили тот же объем 10% раствора глюкозы, являющегося жидким компонентом медицинского изделия. На первые и пятые сутки после инъекций мышей выводили из эксперимента и иссекали кожные лоскуты из области введения образцов, а также регионарные лимфатические узлы, которые подвергали гистологическому исследованию. Качественно оценивали присутствие имплантатов в зоне инъекций, а также наличие патологических изменений в области введения суспензий и в регионарных лимфатических узлах.
Для исследования репаративных свойств мышам под Золетиловым наркозом (Virbac, Франция; 40 мг/кг массы тела) хирургически наносили полнослойные кожные раны в межлопаточной области спины диаметром 0,7 см. Непосредственно после нанесения, раны животных опытных групп полностью заполняли соответствующими суспензиями и накрывали сверху фиксирующей повязкой «Hydrofilm» (Paul Hartmann, Германия). В свою очередь на раны животных контрольной группы сразу наносили фиксирующую повязку. Сразу после нанесения ран и перед выведением мышей из эксперимента проводили цифровую макрофотосъемку раневой зоны для последующего фотопланиметрического анализа. Выведение животных и эксперимента и забор тканей для гистологического исследования проводили на 7-е сутки заживления. Полученные ткани подвергали гистологическому исследованию. На полученных препаратах морфометрически оценивали степень эпителизации раневой поверхности, а также площадь грануляционной ткани.
Результаты исследования в модели подкожной имплантации показали существенные различия в скорости биодеградации исследованных суспензий. Так образцы, полученные путем диспергации в течение 60 с, были выявлены в зонах инъекций у всех животных на обоих исследованных сроках. В то же время, фрагменты суспензии, полученной в результате 10-минутной диспергации, были обнаружены лишь у 50% животных в первые сутки после введения. На пятые сутки эксперимента данные образцы резорбировались полностью (см. Таблицу 1 и Фиг. 3).
Таблица 1
Динамика биодеградации суспензий по данным гистологического исследования
Качественное морфологическое исследование показало, что введение обеих типов суспензий вызывает развитие в окружающей соединительной ткани слабо выраженного отека, практически полностью спадающего к пятым суткам эксперимента, а также лейкоцитарной инфильтрации зоны введения. Как в первые, так и пятые сутки преобладающей клеточной формой в инфильтрате являлись моноциты/макрофаги. Было выявлено, что лейкоциты активно внедряются в толщу имплантированных образцов, что свидетельствует о способности изделий выступать в качестве эффективного субстрата для миграции клеток. Других значительных патологических изменений в области инъекций, в частности некрозов, кровоизлияний, фиброза, выявлено не было. Выраженность альтеративно-воспалительных изменений в тканях при инъекции суспензий обеих типов существенно не превышало величину неспецифической тканевой реакции, вызываемой введением раствора глюкозы (см. Фиг. 3) Также введение образцов не вызывало развития лимфаденита и других патологических изменений регионарных лимфатических узлов.
Исследование репаративных свойств полученных суспензий в модели заживления полнослойной кожной раны показало более чем двукратное статистически достоверное уменьшение площади раневой поверхности у животных, на раны которых наносили суспензию, диспергированую 10 мин, по сравнению с контролем (см. Фиг. 4 и 5). Среднее значение данного показателя в группе, получавшей суспензию, диспергированную 60 с, также было ниже, чем в контроле, однако величина полученного эффекта была не столь выражена (см. Фиг. 4). Заживление ран под раневым покрытием в виде суспензии, диспергированной 10 мин, приводило к значительному достоверному четырехкратному увеличению количества грануляционной ткани в зоне раневого дефекта (см. Фиг. 6). В то же время, нанесение на раны суспензии, диспергированной 60 с, увеличивало значение данного показателя в среднем менее чем в два раза (см. Фиг. 6). Результаты проведенных экспериментов свидетельствуют о влиянии длительности диспергирования на свойства полученных суспензий. Так, структура (см. Фиг. 2) суспензии, диспергированной в течение 60 с, обеспечивает более продолжительное время ее резорбции, по сравнению с суспензией, диспергированной 10 мин. С другой стороны, суспензия, диспергированная в течение 10 мин, гораздо более эффективно способствует процессу репаративной регенерации кожи.
Реферат
Изобретение относится к области фармацевтики и медицины, а именно к способу получения не требующей предварительной регидратации суспензионной формы измельченного децеллюляризованного внеклеточного матрикса с регулируемым размером его структурных компонентов, а также к продукту, полученному указанным способом, который предназначен для стимуляции репаративной регенерации тканей. Способ включает сепарирование пластов очищенного волонистого внеклеточного матрикса, измельчение пластов, фракционирование порошка и суспендирование отобранной фракции частиц очищенного внеклеточного матрикса в жидкой среде путем чередования циклов перемешивания и диспергирования частиц в жидкой среде с преобладанием по длительности процесса перемешивания при температуре, не вызывающей денатурацию коллагена, и дегазацию полученной суспензии частиц. Способ по изобретению обеспечивает получение суспензионной формы децеллюляризованного внеклеточного матрикса с регулируемым размером его структурных компонентов, применение которой позволяет без нанесения разрезов производить ее инъекционное введение в необходимую область и легко заполнять открытый раневой дефект различных тканей. 2 н. и 10 з.п. ф-лы, 6 ил., 1 табл.

Комментарии