Способ получения средства для стимулирования соединения между частями живой минерализованной ткани - RU2008915C1
Код документа: RU2008915C1
Чертежи


Описание
Изобретение относится к новому способу на биологической основе для стимулирования соединения между частями минерализованной ткани, например, зубов с костью. Несмотря на то, что настоящее изобретение может быть в общем применено для обеспечения такого соединения, в нижеследующем описании изобретение будет проиллюстрировано главным образом в связи с лечением расшатанных зубов, так называемого альвеолярного пориостита. При нормальном состоянии зубов последние крепко сидят в специальных полостях, так называемых альвеолах, в челюстной кости. Между корнями зубов и челюстной костью имеется так называемая околозубная перепонка. Корни зубов состоят главным образом из вещества, называемого дентином. Этот дентин покрыт снаружи слоем цемента толщиной 0,01 - 1,0 мм. Имеются также коллагеновые волокна, которые начинаются в цементе, проходят через околозубную перепонку и закрепляются в челюстной кости. Следовательно, этот цемент имеет исключительно важное значение для удерживания зубов в челюстной кости. Околозубная перепонка имеет толщину порядка 0,2 мм и состоит из вышеупомянутых коллагенных волокон и сосудов и нервов, расположенных между этими волокнами и клетками, принадлежащими к этим тканям.
Челюстная кость не доходит до коронки зубов и в части корня, которая не охватывается челюстной костью, волокна от корневого цемента простираются в окружающую зубы десну. Эти волокна способствуют креплению зуба на месте и, более того, делают устойчивой десну. Зубная десна, как и вся ротовая полость, покрыта тонким слоем эпителия, который образует плотное кольцо или гильзу вокруг зубов. В непосредственной близости к зубам имеется неглубокая бороздка между зубами и эпителием.
Воспалительные процессы в тканях, соединяющих зубы с челюстной костью, являются нередким явлением и ими страдает подавляющее большинство населения во всем мире. Известные до сих пор способы лечения направлены главным образом на приостановление прогрессирующего заболевания и по возможности предотвращение выпадения зубов. В настоящее время нет никакого клинически применимого способа лечения, который позволял бы восстановить первоначальное надежное соединение зубов с челюстной костью.
Другая проблема в этой области воспалительных процессов заключается в наличии врожденных дефектов в прочной посадке зубов в раннем возрасте, в так называемом ювенальном альвеолярном периостате. Его лечение часто заканчивается удалением зуба и установкой какого-нибудь моста за значительную плату.
Бактерин на поверхности зубов могут приводить к хроническим воспалительным процессам в десне вокруг зуба. Воспаленые клетки выделяют содержащиеся в них ферменты (энзимы), предназначенные для уничтожения этих бактерий, но в этом случае одновременно неблагоприятно воздействующие на коллагенные волокна, скрепляющие зубы с челюстной костью. Клетки на поверхности корня зуба или цемент становятся, таким образом, объектом разрушения, и эпителий от ротовой слизистой перепонки разрастается к низу вдоль зубов, образуя так называемые щели между десной и поверхностью зубов. В этих щелях создаются благоприятные условия роста для новых бактерий и новые воспалительные клетки вторгаются в эту область, приводя к прогрессированию разложения тканей околозубной перепонки. Клетки цемента отмирают и кость в альвеолярной области разрушается. Как правило, этот процесс прогрессирует довольно медленно, но через некоторые интервалы времени может протекать очень быстро, спустя некоторое время зубы, подвергнутые такому воздействию воспалительного процесса, полностью теряют свою способность удерживаться в челюстной кости.
В настоящее время лечение в таких случаях направлено главным образом на устранение бактериальных очагов на поверхности зубов. После удаления бактерий воспаление десны и околозубной перепонки прекращается, останавливается и процесс разложения. Такое лечение также имеет целью устранение возможности образования новых бактериальных очагов на зубной поверхности. Эти меры, таким образом, приводят к прекращению нарушения сцепления зубов с челюстной костью, но при таком лечении не формируется никакой новый околозубной перепонки или цемента.
В ходе исследований, результатом которого и является настоящее изобретение, было использовано знание того, что формирование цемента начинается тонким слоем предшественника эмали, который при росте корня формируется вдоль всей поверхности корня. Следует подчеркнуть, что сведения о том, что предшественник эмали может стимулировать формирование цемента, не являются общеизвестным. Последующие эксперименты и научные исследования механизма формирования цемента неожиданно показали, что предшественник зубной эмали, так называемая эмаль-матка, содержит в качестве активной составляющей протеиновую фракцию, которую можно получить из органической части эмали-матки. Это открытие является еще больше неожиданным, поскольку, как полагают, что биологическая функция протеинов, составляющих упомянутую протеиновую фракцию, заключается в формировании, в частности, минерализации зубной эмали (см. Fisher, L. , Fermine D, Clinice Orfhopacdics, 200, 1985, 362-85). Протеины эмаль-матки включают в себя высокомолекулярную часть и низкомолекулярную часть. Установлено, что их активной составляющей является низкомолекулярная часть, но может также являться и их активной детерминантой. Поскольку низкомолекулярная часть протеинов представляет собой экстрагируемые из уксусной кислоты протеины, известные под названием амелогининов, имеющих мол. м. до 40000, но, как правило от ≈ 5000 до ≈25000.
Дается толкование терминов "предшественник эмали" и "эмаль-матка" (A. G. Ten Cafe, orlil Hisfology, Dvelopment stweture fnd Frenction, The C. V. Mosby Co. , St. , Lonis USA (1980), пр. 182-83.
I. A. Mjor, o Tejersnov, Human oral Gucbryology, g, Histology, Munusgaarol, Coreubageu (1986) р. 44-45).
Установлено, что, если дентин открыт для клеток оклозубной перепонки, например, из-за полости на поверхности корня, лечение проводится с помощью костеобразной ткани, нуждающейся в волокнах, которые скрепляют здоровый зуб с окружающими тканями. Если однако поверхность искусственно выполненной полости покрывается активной фракцией протеина, берущего начало от предшественника эмали, который в последующем будет называться эмаль-маткой, установлено, что происходит образование нормальной цементной соединительной ткани.
Протеины для эмаль-матки целесообразно брать из млекопитающихся животных, например, из крупного рогатого скота и свиней. В ходе проведения экспериментов установлено, что стимулирование формирование цемента у обезьян и людей можно достигнуть путем нанесения на основание полости на поверхности корня протеиновой фракции, полученной из эмаль-матки других видов животных, например, свиней.
Таким образом, настоящее изобретение обеспечивает создание новой технологии стимулирования соединения частей живой минерализованной ткани путем формирования новой минерализованной ткани по меньшей мере на одной их этих частей. Эта технология отличается нанесением эмаль-маточных протеинов, берущих начало от предшественника зубной эмали, так называемой эмаль-матки, для стимулирования соединения. Далее настоящее изобретение направлено на создание для вышеупомянутого применения, содержащего в качестве активной составляющей такие эмаль-маточные протеины или какую-либо активную детерминанту.
Как указывалось выше, преимущества настоящего изобретения особенно очевидны при применении в зубоврачебной практике, например, при лечении альвеолярного периостита, т. е. для лечения шатающихся зубов, при пересадке зубов или восстановлении случайно выпавших зубов. Однако, настоящее изобретение может быть распространено также и на стимуляцию формирования минерализованной ткани на искусственных зубах или тазобедренных суставах, а при желании и для скрепления новых сухожилий.
Протеиновая фракция, применяемая для нанесения по технологии в соответствии с настоящим изобретением, целесообразно брать из эмаль-матки некоторых млекопитающихся животных, зубы которых находятся в стадии роста, предпочтительно у крупного рогатого скота и свиней, можно и от овец или грызунов, у которых зубы растут постоянно. В качестве альтернативного источника протеиновой фракции можно также использовать культивированные клетки или бактерии, модифицированные по рекомбинационной ДНК-технологии.
Состав для использования в терапии в соответствии с настоящим изобретением может содержать только такую протеиновую фракцию или ее активную составляющую, соответственно смешанную с водой, но может также содержать протеиновую фракцию в сочетании с носителем, разбавителем или клеем, например, с модифицированным целлюлозами, алгинатом, агаром или желатином, приемлемыми для этой цели. В случае зубоврачебной практики необходимо, чтобы носитель или разбавитель был совместим с зубами и т. п. Целесообразно применять носитель из растворимых в воде полимеров. Примерами таких полимеров, но без ограничения ими области настоящего изобретения, могут служить: натрийкарбоксицеллюлоза, микрокристаллическая целлюлоза, гидрооксиэтилцеллюлоза, гидроксипропилцеллюлоза, метилцеллюлоза, высокомолекулярная акриловая кислота, альгинат, натрия, альгинат пропиленгликоля, ксантановые смолы, гуаровая смола, смола из зерен белой акации, модифицированный крахмал, желатин, пектин или вышеперечисленные вещества в сочетании друг с другом. После введения активной протеиновой фракции эти растворимые в воде полимеры могут преобразованы в гели или в пленки, которые легко можно накладывать благодаря им преимущественными физическим свойствам. С целью увеличения срока хранения в состав могут быть включены стабилизаторы или предохранительные вещества.
Настоящее изобретение касается также способа лечения альвеолярного периостата, связанного с восстановлением зубов путем стимулирования формирования корневого цемента и размещения физиологической коллагеновой ткани между ней и челюстной костью. Этот способ отличается тем, что эпителий, если таковой присутствует, удаляется с корня зуба, после чего на него накладывается протеиновая фракция, полученная из эмаль-матки.
В предпочтительном варианте применения настоящего изобретения для лечения альвеолярного периостата коллагеновая ткань (десна), примыкающая к участку зуба, подвергнутого атаке, надрезается с тем, чтобы оголить корень. Эпителий, если таковой имеется, удаляется, и чистая поверхность зуба затем покрывается слоем упомянутой протеиновой фракции или составом, содержащим такую протеиновую фракцию в качестве активной составляющей, после чего надрезанная коллагеновая ткань (десна) возвращается на место и при необходимости сшивается с тем, чтобы лечение проходило более эффективно.
Как указывалось выше, настоящее изобретение, помимо лечения альвеолярного периостита, может быть применено для восстановления или трансплантации зубов. Довольно часто встречаются случаи, когда молодежь в возрасте после десяти попадает в аварию, в результате чего произошло выпадение одного или нескольких зубов, как правило, передних зубов. При быстром возврате смешанных зубов на место можно достигнуть хороших результатов лечения путем обычной посадки в челюстной кости. Но во многих случаях такое восстановление смещенных зубов не может быть выполнено немедленно и зубы в течение какого-то периода времени находятся в неподходящей среде и вне полости рта, например, на открытом воздухе. Это приводит к разрушению клеток оклозубной перепонки на поверхности корня. Когда после этого зуб возвращается на место в полость рта, достигнуть физиологического состояния уже невозможно и зуб будет шататься. До сих пор не было предложено никаких способов, которые обеспечивали бы надежное крепление зубов через генерацию ткани.
По технологии в соответствии с настоящим изобретением мертвую околозубную перепонку на выпавшем зубе можно удалить механическим или химическим путем, после чего на голенную поверхность корня наносится состав, содержащий или представляющий собой упомянутую протеиновую фракцию. Зуб затем возвращается обратно в свою альвеолу и слегка фиксируется на несколько недель. Благодаря наличию протеиновой фракции или содержащего ее состава на поверхности корня будет генерироваться новый слой цемента и достигаться надежное крепление зубов.
Что касается трансплантации зубов, т. е. переноса зубов от одного человека к другому, то было установлено, что ткани пересаженных зубов не выдерживают иммунной защиты (отторжения) организма человека и через очень короткий промежуток времени разлагаются. Провели ряд экспериментов по трансплантации между совместимыми по иммунитету индивидуумами, которые тоже не привели к положительным результатам. Поскольку длительное лечение с применением препаратов для борьбы с этим явлением не стоит риска с связи с предполагаемыми последствиями, до сих пор не разработано клинически приемлемого способа трансплантации зубов с длительным благоприятным прогнозом.
Однако, используя технологию в соответствии с настоящим изобретением, такой способ может быть разработан, и проблема может быть разрешена путем удаления намеченных в трансплантации зубов у донора, удаления пульпы зуба, зачистки этой области пульпы и заполнения ее применяемым в таких случаях материалом. Околозубная перепонка удаляется механическим или химическим путем и корень зуба покрывается составом, содержащим активную протеиновую фракцию. Затем этот зуб вставляется в полость рта его преемника и выдерживается в фиксированном положении какой-то период времени. Благодаря наличию протеиновой фракции будет иметь место преобразование эндогенной минерализованной ткани, которая покрывает трансплантированный зуб и обеспечивает его фиксацию на месте.
В соответствии с другим отличительным аспектом настоящего изобретения состав, содержащий активную протеиновую фракцию, может быть дополнен тканевым адгезивом на основе фибриногена, фактором ХIII, представляющим собой полученный из плазмы коагуляционный фактор, и тромбином. Такой состав может представлять собой предварительную смесь эмаль-матки, фибриногена и фактора XIII, а тромбин добавляться непосредственно перед нанесением состава на место хирургической операции. Для снижения скорости разложения в предварительную смесь может быть добавлен апротинин. Приемлемым промышленным материалом для применения в таком расширенном составе является фибриновый уплотнитель, выпускаемый и продаваемый под названием "Тi geeI фирмой "IMMVNO AG", Вена, Австрия. При применении такого клея для тканей предварительная смесь протеиновой фракции, фибриногена, фактора ХIII и, возможно, апритина смешивается с раствором тромбина, и полученный состава быстро наносится на место хирургической операции. При лечении альвеолярного периостита эта технология значительно ускоряет процесс операции. Благодаря этому повышается прочность сцепления состава с корнем зуба, останавливается кровотечение и значительно упрощается размещение наклейки, что исключает необходимость наложения швов.
Предпочтительными веществами для применения в расширенном составе в соответствии с настоящим изобретением являются производные целлюлозы и алгинаты такие, так карбоксиметилцеллюлоза и алгинат натрия или пропиленгликоля.
Способ поясняется чертежом.
Ниже настоящее изобретение будет проиллюстрировано на конкретных примерах, в основу которых были положены эксперименты, проведенные на обезьянах и человеке. Примеры рассматриваются со ссылкой на чертеж, на котором проиллюстрировано выделение протеиновой фракции методом SDS-Page (электрофореза с применением полиакриламидгеля). Две основные части протеиновой фракции, получаемой из эмаль-матки, в основу которых положен молекулярный вес, называются амелогенином (низкий молекулярный вес) и энамелином (высокий молекулярный вес).
П р и м е р 1. Приготовление экстрактов для экспериментов на животных.
Для установления какие компоненты в эмаль-матке являются действующими в экспериментах на животных, были приготовлены нижеследующие экспериментальные составы. В основу всех составов была положена эмаль-матка, взятая у свиней.
Эксперимент Е 1. 0,3 г маточного вещества (эмаль-матки), содержащего 27,4% протеина, было слито в 3 мл 0,9% -ного раствора NaCl и гомогенизировано с охлаждением льдом с помощью политрона в течение 1 мин с интервалами по 10 с. Полученный таким образом гомогенизированный состав был высушен при температуре ниже 0оС. Выход: 199 мг, содержание протеина по Лаури 47 +2% .
Эксперимент Е 2. 0,3 г эмаль-матки были слито и гомогенизировано так же, как и выше, а затем этот состав был прогрет над водяной ванной в течение 4 мин. Послу сушки ниже 0оС выход составил 199 мг, а содержание растворимого протеина - 13 +3% .
Эксперимент Е 3. 0,3 вещества было слито в 3 мл 0,5 м уксусной кислоты (р. а. ), гомогенизировано, как и выше, и затем подвергнуто помешиванию при 4оС в течение 24 ч с целью экстрагирования протеина с последующим центрифугированием в холоде в течение 10 , мин при скорости до 10000 оборотов в 1 мин. Выход лиофилизаты ≈68 мг, содержание протеина - 29 +3% .
Эксперимент Е 4. 0,3 г эмаль-матки было слито в 0,3 мл 10% -ной этилендиаминтетрауксусной кислоты в 0,03 М трис-буфере с показателем рН 7,4 и гомогенизировано с охлаждением как и выше. Затем проводилось экстрагирование путем помешивания в холоде в течение 24 ч, полученный состав центрифугировали в центрифуге с охлаждением. Всплывающий слой был подвергнут диализу с применением дистиллированной воды и сушке при температуре ниже 0оС. Выход: 11 мг, содержание протеина 33 + 2 % .
Эксперимент Е 5. Осадок после центрифугирования (Е 4) был экстрагирован порядка 10 объемами 0,5 М уксусной кислоты при медленном помешивании с охлаждением в течение 24 ч. Затем снова повторили центрифугирование и всплывающее вещество подвергли сушке при температуре ниже 0оС. Выход: 109 мг, содержание протеина 15 +3% .
Эксперимент Е 6. Осадок после центрифугирования (Е , 5) был подвергнут сушке при температуре ниже 0оС. Выход: 37 мг, содержание протеина 18 + 4% .
Эксперимент Е 7. 0,03 г эмаль-матки было вылито в 3 мл 10% -ной этилендиаминтетрауксусной кислоты в 0,03 М трис-буфере с показателем рН 7,4 с применением протеиназового ингибитора РМSF (фенилметилсульфонилфторида) и гомогенизировано и экстрагировано так же, как и в Е 4. После центрифугирования и диализа всплывающего вещества была проведена сушка при температуре ниже 0оС. Выход: 11 мг, содержание протеина 41+2% .
Эксперимент Е 8. Осадок после центрифугирования (Е 8) был экстрагирован с применением 0,5 М уксусной кислоты в течение 48 ч при низкой температуре, снова центрифугирован и высушен при температуре ниже 0оС. Выход: 11 мг, содержание протеина 17+1% .
Эксперимент Е 9. Осадок после центрифугирования (Е 8) был подвергнут сушке при температуре ниже 0оС. Выход: 40 мг, содержание протеина 30 +3% .
Вещества, полученные в Е1 - 9, оценивались с точки зрения содержания протеина, распределения молекулярного веса протеина (SDS -Page c Ptast), изоэлектрических точек протеина и содержания углеводов. Составы с кажущимся молекулярным весом экстрактов эмаль-маток, взятых от свиней, представлены на чертеже. После SDS-электрофореза полиакриламидного геля (SDS 8-25% , Phast, Phar macia) диапазоны протеинов были преобразованы в пики с помощью лазерного развертывающего устройства (LKB Ultroscam XL). Молекулярные веса рассчитывались из калибровки с протеином (14 - 90 кDа) и полипептидом (2 - 14 кDа), Pharmaciа. Диаграммы представлены для экстрактоз Е4 и Е 5, и эти и другие извлечения суммированы ниже (табл. 1).
Цель этого примера заключается в том, чтобы показать влияние веществ согласно Е 1 - Е9, полученных путем поэтапного экстрагирования из ткани предшественника зубной эмали (эмаль-матки) на лечение экспериментально образованных маргинальных околозубных ранок. Дефекты в маргинальном альвеолярном вериостите зубов обезьяны выполнялись путем удаления цемента зуба, оклозубной перепонки и маргинальной альвеолярной кости на отрезке приблизительно 5 мм с помощью бормашины. Затем эти вещества накладывались на экспериментально созданные дефекты и ранее давали возможность заживления. Были также приготовлены контрольные дефекты, которые оставлялись без нанесения какого-либо вещества. Спустя 8 недель с начала лечения результаты были оценены гистоморфометрическим путем.
Результаты процесса вылечивания выражаются в процентах к выходному уровню цемента и костного покрытия (см. табл. 2).
Таким образом, заживление имело место после наложения вещества согласно Е1 , Е 3, Е 5 и Е 8. Этого не наблюдалось в случае контрольных зубов и зубов, обработанных веществами согласно Е 2, Е 4, Е 6, Е 7 и Е 9; дефекты продолжали оставаться в тех случаях, когда зубы закрывались только эпителием ротовой полости. Вышеприведенные результаты указывают на то, что наложение низкомолекулярной фракции протеиновой части эмали-матки стимулирует закрепление тканей при лечении альвеолярного периостата.
П р и м е р 2. Приготовление обессоленного кислотного экстракта из эмаль-матки.
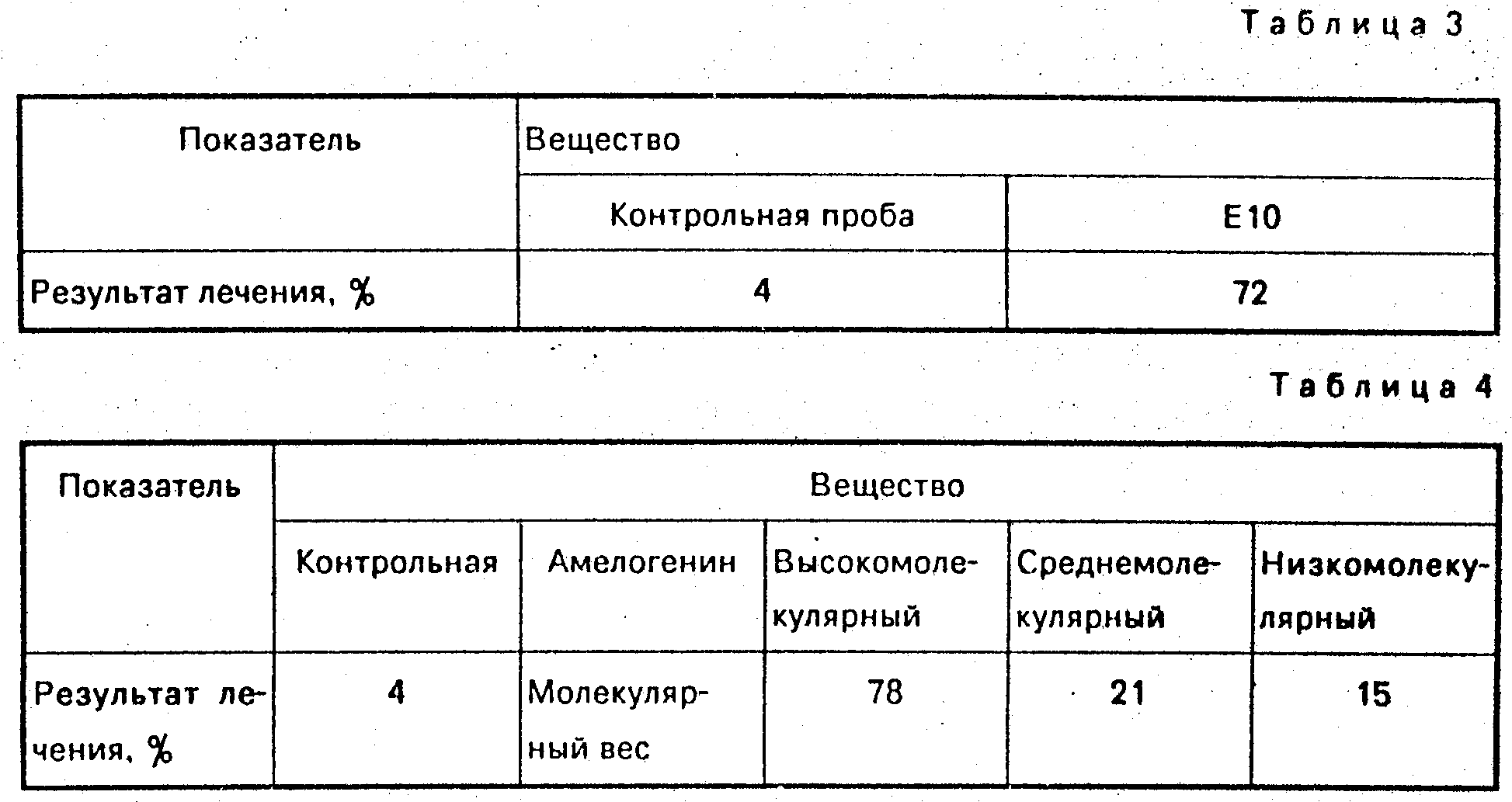
Осушенный при температуре ниже 0оС препарат, аналогичный таковому согласно примеру (Е 3), растворили в 0,1 М уксусной кислоты и перенесли (144 мг/12 мл) на колонну 15 х 540 мм с помощью Sephadex G-25. Получили первую богатую протеином фракцию (Е 10), которую подвергали сушке при температуре ниже 0оС. Выход составил 34 мг вещества, содержащего порядка 72% протеина, что соответствует 85% протеинов в исходном материале. Остальные протеины обнаружены в солевой фракции (63 мг осушенного при температуре ниже 0оС материала, содержащего порядка 7% протеина).
Осушенную протеиновую фракцию затем разлили в 10 мл пузырьки (по 20 мг в каждый) и подвергли стеpилизации (35 кCy) методом облучения перед применением ее в экспериментах на животных.
Препараты были проанализированы как и в предыдущем примере. Результаты приведены в табл. 3.
П р и м е р 8. Приготовление очищенных протеиновых фракций
200 мг
осушенного препарата Е 3 - 6, аналогично таковому в примере 2, растворили в 20 мл 0,1 М уксусной кислоты и нанесли на колонку 25 х 780 мм с Sephadex G-75, причем уксусную кислоту
поддерживали при
4оС. Колонку вымывали со скоростью 55 мл/ч; брали 4 мл пробы. Элюат контролировали при 280 нм (Uvicoro) и пробы, содержащие основную часть вымытого материала, были
объединены, чтобы
получить пять фракций, которые были подвергнуты методом электрофореза (SDS -Page - электрофореза) на предмет распределения молекулярных весов. Получены пять пиков их хроматограммы
(0 - IA)
вымывания.
Проба фракции.
(1) 50 - 60: высокомолекулярные протеины - энамелины (мол. м. > 40000); (2) 62 - 80: высокомолекулярный амелогенин (мол. м. ≈25 килодальтонов); (3) 90 - 100: амелогенин со средним молекулярным весом (мол. м. ≈14 килодальтонов); (4) 110 - 125: низкомолекулярный амелогенин (мол. м. ≈5 - 10 кДа); (5) 130 - 160: соли.
После сушки при температуре ниже 0оС пики (2), (3) и (4) показали выход 10,7 и 12 мг высокомолекулярного, среднемолекулярного и низкомолекулярного амелогенина соответственно (содержание протеина ≈90% ).
Цель этого эксперимента заключалась в том, чтобы показать влияние амелогениновых веществ с высоким, средним и низким молекулярным весом, экстрагированных из предварительной ткани эмали (эмаль-матки) на лечение экспериментальных маргинальных околозубных ран. Экспериментальные дефекты в маргинальном периденте зубов обезьяны образовывали путем удаления цемента зуба, оклозубной перепонки и маргинальной альвеолярной кости с помощью бормашины на отрезке ≈5 мм. Эти вещества затем наносили на экспериментально образованные дефекты, и ранам давалась возможность заживления.
Спустя 8 недель лечения было проведено гистоморфометрическое обследование, результаты которого приведены в табл. 4.
Таким образом, высокие результаты были получены в случае высокомолекулярного амелогенина и более низкие в случае средне- и низкомолекулярного амелогенина. Эти результаты указывают на то, что нанесение высокомолекулярной фракции амелогенина, полученного из эмаль-матки, приводит к наиболее эффективному стимулированию присоединения ткани при лечении альвеолярного периостита.
П р и м е р 4. Приготовление кислотного экстракта эмаль-матки.
Нижние челюсти забитых поросят в возврасте приблизительно 6 мес и массой порядка 80 кг освобождались от мягкой ткани и замораживали на бойке. Затем вырезали соответствующие зубные зародыши из половинок замороженных челюстей после частичного оттаивания и отделяли эмаль-матку.
38 г эмаль-матки вливали в 780 мл 0,5 М уксусной кислоты с показателем рН 41 и гомогенизировали при охлаждении льдом с помощью гомогенизатора-политрона РТ 10-30. Гомогенат помешивали в холоде в течение 24 ч для экстрагирования протеина, растворимого при рН ≈ 4. Нерастворимый материал удаляли путем центрифугирования и раствор уксусной кислоты подвергали сушке при температуре ниже 0oС. Было получено 8,5 г лиофилизата, содержащего приблизительно 20% протеина, что соответствует выходу протеина, равному порядка 50% .
Высушенный экстракт подвергали анализу на предмет определения содержания воды, ацетата, протеина (по Лаури) и углеводов и распределения молекулярных весов протеина (SDS-Page) и изоэлектрических точек протеина.
Перед применением в клинических экспериментах содержащий протеины раствор уксусной кислоты пропускали через стерильный фильтр, заливали в стерильные пузырьки емкостью 10 мл и сушили при температуре ниже 0оС в стерильных условиях.
Цель этого примера заключалась в том, чтобы показать эффективность вещества Е 3 при лечении альвеолярного периостита у людей. После одобрения Шведским медицинским управлением и Региональным комитетом по вопросам этики этот состав применяли в качестве вспомогательного средства к известному хирургическому лечению пациентов, страдающих мергинальным альвеолярным периоститом. Пациенты были оперированы с целью удаления камней с зубов и грануляционной ткани. Вещество Е 3 наносили тонким слоем на оголенные поверхности корня, а поверх него накладывали соответствующий лоскут. Ход лечения периодически проверяли в клинических условиях, фиксируя при этом глубину кармана, уровень сцепления и состояние десен, а также делали внутриротовые рентгеновские снимки. Результаты сопоставляли с таковыми, полученными при ранее приведенных количественных исследованиях с применением известной околозубной хирургии и аналогичных контрольных областей у тех же пациентов.
Результаты экспериментов показали, что вещество Е 3 способствовало значительному увеличению маргинальной высоты альвеолярной кости (4 - 8 мм) и уровня скрепления (5 - 9 мм). Это был такой результат лечения, которого никогда не получали при применении известной околозубной хирургии. Такое лечение является очевидным прогрессом с точки зрения клинического аспекта, так и уменьшение глубины маргинальных карманов. Эти результаты показывают, что низкомолекулярная протеиновая фракция из эмаль-матки обладает возможностью стимулировать образование новой околозубной ткани у людей, чего никогда не наблюдалось при известных методах лечения.
Усовершенствование лечения костей.
Положительное влияние низкомолекулярной части протеиновой фракции эмаль-матки на лечение костей было экспериментально исследовано на бедренных костях и нижних челюстях взрослых крыс. Угловатые части челюстей вскрывались путем хирургического надреза кожи и жевательного мускула. Точно так же были проделаны отверстия того же размера, что и в нижней челюсти, на периферии бедренных костей. Для правых челюстных и правых тазовых костей использовали "низкомолекулярную часть протеиновой фракции эмаль-матки", а левые оставляли в качестве контрольных костей.
Низкомолдекулярную часть протеиновой фракции эмаль-матки закладывали в проделанные отверстия в виду высушенного губкообразного материала или в виде небольших желатиновых цилиндриков контрольные отверстия в челюстях и бедренных костях на левой стороне заполняли желатиновыми цилиндриками без низкомолекулярной части протеиновой фракции эмаль-матка". Ничего не закладывали в контрольные отверстия в челюстных и бедренных костей крыс, к которым была применена сухая "низкомолекулярная часть протеиновой фракции эмаль-матки".
Крыс убивали спустя 1 - 5 недель после начала эксперимента, экспериментальные и контрольные части удалялись и готовились для микроскопического исследования.
Спустя неделю после наложения низкомолекулярной части протеиновой фракции эмаль-матки в просверленные отверстия было обнаружено, что эти отверстия были полностью заполнены костью и, кроме того, имело место значительное надкостничное противодействие кости. В контрольных образцах, не обработанных материалом в соответствии с настоящим изобретением, новая кость также образовывалась, но в значительно меньшей степени, и высверленные отверстия не заличивались. (56) Clinica ocfhopaedis, 200, 1985, p. 362 - 385.
Реферат
Использование : медицина. Цель - расширение спектра средств, обладающих способностью стимулировать соединение между частями живой минерализованной ткани. Сущность изобретения : получают состав для применения с целью стимулирования соединения между двумя частями минерализованной ткани путем регенерирования минерализованной ткани, по меньшей мере на одной из частей, содержащий в качестве активной составляющей протеиновую фракцию из предшественника зубной эмали, так называемой эмаль-матки. 1 ил. , 4 табл.

Комментарии