Способ получения индуцированных нервных стволовых клеток, перепрограммированных из клеток, не являющихся нервными, с использованием hmga2 - RU2646099C2
Код документа: RU2646099C2
Чертежи












































Описание
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
1. Область изобретения
Настоящее изобретение относится к способу получения индуцированных стволовых клеток, перепрограммированных из клеток, не являющихся нервными, с использованием HMGA2.
2. Описание уровня техники
Стволовые клетки в целом классифицируют на тотипотентные стволовые клетки и плюрипотентные стволовые клетки. Тотипотентные стволовые клетки обладают потенциалом дифференцировки, дающим начало всем клеткам. Тотипотентные клетки образуют все различные типы клеток в организме, например оплодотворенные яйцеклетки. Плюрипотентные стволовые клетки образуют произвольные типы клеток в организме, которые имеют происхождение из трех основных зародышевых листков или самих зародышей.
Плюрипотентные стволовые клетки, такие как эмбриональные стволовые клетки (ESC), быстро пролиферируют, при этом сохраняя способность к дифференцировке в различные типы клеток, то есть плюрипотентность. Эмбриональные стволовые клетки являются перспективным источником доставки для трансплантационной клеточной терапии.
До недавнего времени плюрипотентные стволовые клетки получали, в основном, путем трансплантации ядер и слияния клеток (Shinya Yamanaka, Pluripotency and Nuclear Reprogramming, Philos Trans R Soc Lond В Biol Sci. 363(1500): 2079-2087 (June 27, 2008)). Тем не менее, в обоих способах используют эмбриональные стволовые клетки, и, следовательно, существует этическая дилемма.
Однако вследствие недавнего открытия индуцированных плюрипотентных стволовых клеток (iPSC) стало возможным преодоление проблем, связанных с использованием эмбриональных стволовых клеток. "Индуцированные плюрипотентные стволовые клетки (iPSC)" представляют собой клетки, проявляющие свойства, подобные свойствам эмбриональных стволовых клеток (ESC). Индуцированные плюрипотентные стволовые клетки были впервые получены путем увеличения экспрессии определенных факторов в фибробластах мыши в 2006 году (Takahashi, Y. and S. Yamanaka, Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors, Cell 126: 663-676 (2006)) и в фибробластах человека в 2007 году (Yu Junying et al., Induced Pluripotent Stem Cell Lines Derived from Human Somatic cells, Science 318: 1917-1920 (2007), Takahashi, K. et al., Induction of Pluripotent Stem Cell From Adult Human Fibroblasts by Defined Factors, Cell 131: 861-872 (2007)).
Эти исследования по инициации перепрограммирования зрелых соматических клеток в iPSC включали Oct-3/4, Sox2, Klf4 и с-Мус (Takahashi, Cell 126: 663-676; Takahashi, Cell 131: 861-872), и в них использовали Oct4, Sox2, Nanog и Lin28 (Junying, Cell 318: 1917-1920). Тем не менее, iPSC обладают ограничениями, состоящими в том, что они не могут быть преобразованы в желаемые клетки in vivo, поскольку могут вызвать появление тератомы, как и в эмбриональных стволовых клетках, и, в то же время, невозможно адекватно контролировать дифференцировку во время трансплантации in vivo.
Соответственно, в целях преодоления этих ограничений недавно выявлена технология дифференцировки в клетки определенной линии посредством прямой конверсии/перепрограммирования. Она представляет собой технологию, с помощью которой можно осуществлять прямую индукцию конкретных клеток без прохождения через плюрипотентное состояние путем введения конкретного линиеспецифического гена в клетку, не завершившую дифференцировку, то есть в фибробласт, и может исключить риск образования тератомы плюрипотентными клетками. В частности, для нервных клеток, которые после повреждения могут оставаться поврежденными постоянно, проведены различные серии исследований, в которых предпринята попытка прямой индукции. В результате группой исследователей США под руководством профессора Marius Wernig успешно проведена прямая индукция нервных клеток [Vierbuchen Τ, Ostermeier A, Pang ZP, Kokubu Y, Sudhof ТС, Wernig M (2010) Direct conversion of fibroblasts to functional neurons by defined factors. Nature 463(7284): 1035-1041. doi:10.1038/nature08797]. Тем не менее, индуцированные нервные клетки трудно культивировать без способности к самообновлению in vitro в течение более чем определенного периода времени и, таким образом, сохранять достаточное количество клеток, и, следовательно, практически невозможно получить достаточное количество клеток, необходимое для клеточной терапии, включающих молекулярный цитологический механизм, вовлеченный в прямое перепрограммирование.
Позже двумя группами немецких исследователей были успешно получены индуцированные нервные стволовые клетки (iNSC) путем введения гена в фибробласты мыши (Thier M. Worsdorfer Ρ, Lakes ΥΒ, Gorris R, Herms S, Opitz Τ, Seiferling D, Quandel T, Hoffmann P, Nothen MM, Brustle O, Edenhofer F (2012) Direct conversion of fibroblasts into stably expandable neural stem cells. Cell Stem Cell 10(4): 473-479. doi:10.1016/j.stem.2012.03.003). Что касается людей, имеется сообщение о том, что была успешно проведена индукция iNSC путем введения единственного гена SOX2 в фибробласт (Thier M, Worsdorfer Ρ, Lakes ΥΒ, Gorris R, Herms S, Opitz T, Seiferling D, Quandel T, Hoffmann P, Nothen MM, Brustle O, Edenhofer F (2012) Direct conversion of fibroblasts into stably expandable neural stem cells. Cell Stem Cell 10(4): 473-479. doi:10.1016/j.stem.2012.03.003).
Тем не менее, традиционные способы получения индуцированных нервных клеток с использованием этих факторов имеют ограничения, состоящие в том, что они обладают низкой эффективностью индукции и неспособны пролиферировать нервные клетки, и, следовательно, эти способы не обладали пользой для терапевтических целей.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
С целью решения проблем, показанных для традиционных способов, настоящее изобретение нацелено на обеспечение нового способа получения индуцированных нервных стволовых клеток или нервных клеток из дифференцированных клеток и на индуцированные нервные стволовые клетки или нервные клетки, полученные этим способом.
Целью настоящего изобретения является обеспечение набора для индукции перепрограммирования клетки, не являющейся нервной, в нервную стволовую клетку (NSC), включающего (а) белок SRY (определяющий пол участок Y-хромосомы)-box 2 (SOX2) или молекулу нуклеиновой кислоты, кодирующую белок SOX2; и (б) белок группы белков с высокой подвижностью с мотивом АТ-крюка 2 (HMGA2) или молекулу нуклеиновой кислоты, кодирующую белок HMGA2.
Другой целью настоящего изобретения является обеспечение способа получения индуцированной нервной стволовой клетки, которая была перепрограммирована из клетки, не являющейся нервной, или дифференцированной из нее нервной клетки, включающего (а) доставку в клетку, не являющуюся нервной, белка SOX2 или молекулы нуклеиновой кислоты, кодирующей белок SOX2, и белка HMGA2 или молекулы нуклеиновой кислоты, кодирующей белок HMGA2, или увеличение экспрессии белка SOX2 и белка HMGA2 в клетке, не являющейся нервной; и (б) культивирование клеток из стадии (а).
Еще одной другой целью настоящего изобретения является обеспечение индуцированной нервной стволовой клетки, полученной описанным выше способом; или нервной клетки, дифференцированной из индуцированной нервной стволовой клетки.
Еще одной другой целью настоящего изобретения является обеспечение продукта для клеточной терапии для регенерации нервной клетки, включающего индуцированную нервную стволовую клетку или нервную клетку, дифференцированную из индуцированной нервной стволовой клетки, в качестве активного ингредиента.
Еще одной другой целью настоящего изобретения является обеспечение фармацевтической композиции для предотвращения или лечения заболеваний, обусловленных повреждением нервных клеток, включающей белок SOX2 или молекулу нуклеиновой кислоты, кодирующей белок SOX2; и белок HMGA2 или молекулу нуклеиновой кислоты, кодирующей белок HMGA2, в качестве активных ингредиентов.
Еще одной другой целью настоящего изобретения является обеспечение способа скрининга стимулятора регенерации или ингибитора регенерации для нервной стволовой клетки или нервной клетки, включающего 1) получение изолированной клетки, не являющейся нервной; 2) индуцирование образования индуцированной нервной стволовой клетки путем доставки в клетку, не являющуюся нервной, белка SOX2 или молекулы нуклеиновой кислоты, кодирующей белок SOX2; и белка HMGA2 или молекулы нуклеиновой кислоты, кодирующей белок HMGA2, либо увеличение экспрессии белка SOX2 и белка HMGA2 в клетке, не являющейся нервной; 3) возможно дифференцировку индуцированной нервной стволовой клетки, образованной на стадии 2), в нервную клетку; и 4) подтверждение образования индуцированной нервной стволовой клетки или нервной клетки в соответствии с наличием обработки веществом-кандидатом путем обработки веществом-кандидатом после стадии 1 или стадии 2.
Еще одной другой целью настоящего изобретения является обеспечение способа скрининга продукта индивидуально подобранной нейронной терапии, включающего 1) получение изолированной клетки, не являющейся нервной; 2) индуцирование образования индуцированной нервной стволовой клетки путем доставки в клетку, не являющуюся нервной, белка SOX2 или молекулы нуклеиновой кислоты, кодирующей белок SOX2; и белка HMGA2 или молекулы нуклеиновой кислоты, кодирующей белок HMGA2, либо увеличение экспрессии белка SOX2 и белка HMGA2 в клетке, не являющейся нервной; 3) дифференцировку индуцированной нервной стволовой клетки, образованной на стадии 2), в нервную клетку; и 4) подтверждение продукта для нейронной терапии, индивидуально подобранной для субъекта, у которого выделена клетка, не являющаяся нервной, путем обработки клетки, не являющейся нервной, образованной на стадии 3, веществом-кандидатом.
Еще одной другой целью настоящего изобретения является обеспечение композиции для стимуляции перепрограммирования клеток, не являющихся нервными, в нервные стволовые клетки (NSC), включающей белок HMGA2 или нуклеиновую кислоту, кодирующую белок HMGA2, в качестве активного ингредиента.
Еще одной другой целью настоящего изобретения является обеспечение композиции для пролиферации клеток, включающей белок HMGA2 или нуклеиновую кислоту, кодирующую белок HMGA2, в качестве активного ингредиента.
Еще одной другой целью настоящего изобретения является обеспечение композиции для ингибирования клеточного старения, включающей белок HMGA2 или нуклеиновую кислоту, кодирующую белок HMGA2, в качестве активного ингредиента.
Полезный эффект изобретения
Способ образования индуцированных нервных стволовых клеток согласно настоящему изобретению обеспечивает получение индуцированных нервных стволовых клеток из клеток, не являющихся нервными, при использовании только двух индуцирующих факторов SOX2 и HMGA2. Таким образом, способом по настоящему изобретению можно получить индуцированные нервные стволовые клетки более эффективно, чем традиционными способами с использованием четырех или пяти индуцирующих факторов. Кроме того, способ по настоящему изобретению проявляет значительно более высокую индуцирующую эффективность, включающую эффективность и способность к пролиферации, чем при использовании только SOX2, что, таким образом, повышает эффективность его применения в терапевтических целях.
В настоящем изобретении Oct4 не использовали в комбинации с перепрограммирующими факторами в процессе перепрограммирования в нервные стволовые клетки, и, следовательно, дифференцированные клетки прямо перепрограммировали в нервные стволовые клетки без прохождения через процесс дедифференцировки. Полученные таким путем индуцированные нервные стволовые клетки могут не только сохранять способность к самообновлению и способность к пролиферации при трансплантации с тканями головного мозга мыши, но могут также претерпевать достаточную дифференцировку в клетки, связанные с нервами, такие как нейроны, астроциты, олигодендроциты и т.д., и, следовательно, ожидается их применение в терапевтических целях.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фиг. 1А показана морфология фибробластов кожи новорожденного человека (hDF), наблюдаемых под светлопольным микроскопом.
На фиг. 1В показаны iNSC, индуцированные из SOX2-трансдуцированных hDF, наблюдаемые под светлопольным микроскопом.
На фиг. 1С показано изображение колоний, подобных ранним нейросферам, образованных в результате SOX2-трансдукции, наблюдаемых под светлопольным микроскопом.
На фиг. 1D показан результат иммуноцитохимического анализа NSC-специфических маркерных белков hDF-iNSC с использованием антител против РАХ6 и нестина.
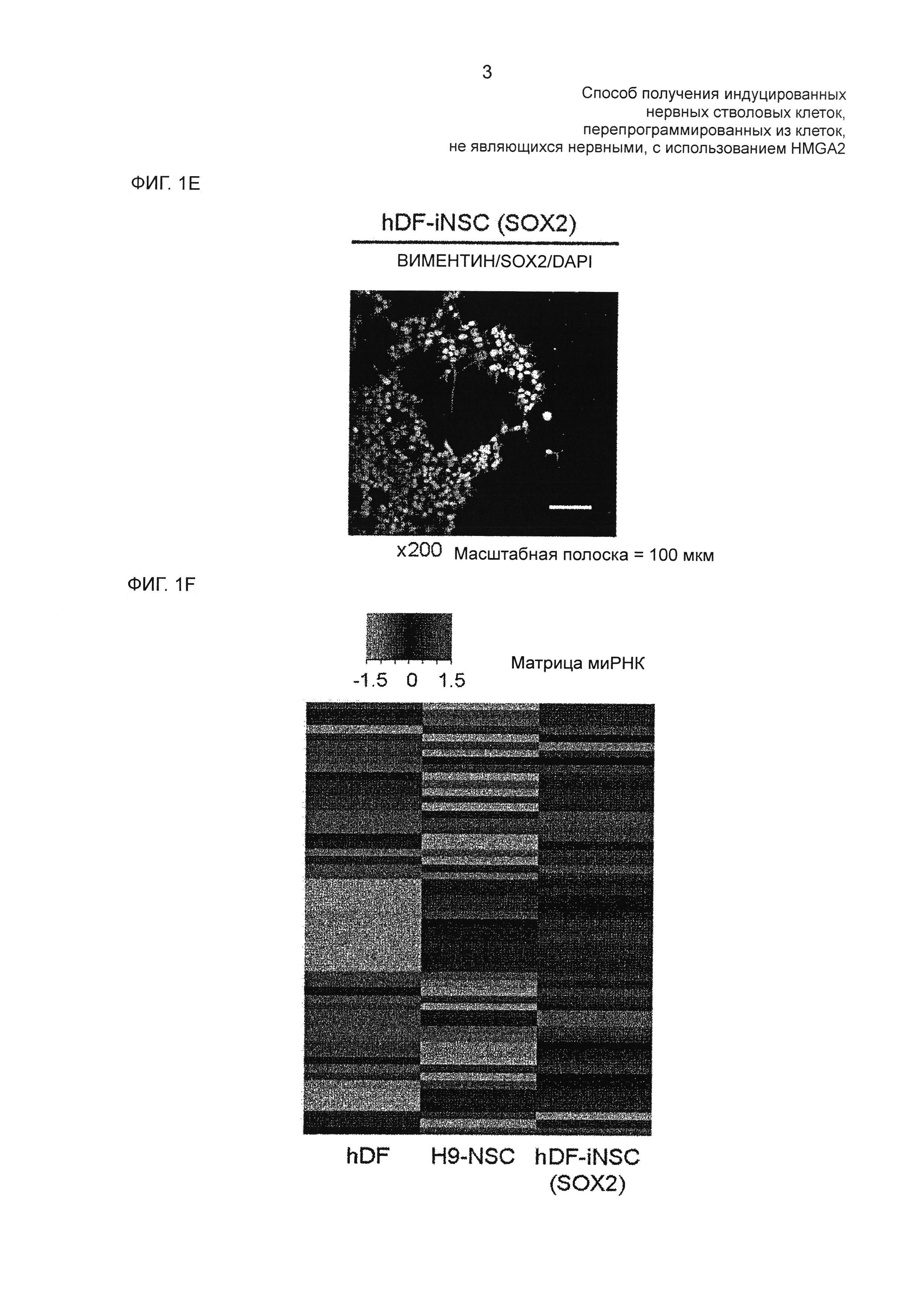
На фиг. 1Е показан результат иммуноцитохимического анализа NSC-специфических маркерных белков hDF-iNSC с использованием антител против виментина и SOX2.
На фиг. 1F показана тепловая карта общих профилей экспрессии микроРНК в hDF, H9-NSC и hDF-iNSC (SOX2).
На фиг. 1G показаны тепловые карты специфичных для нервной системы микроРНК в hDF, H9-NSC и hDF-iNSC (SOX2).
На фиг. 1Н показаны результаты количественной полимеразной цепной реакции (ПЦР) в реальном времени miR-124-3р в hDF, H9-NSC и hDF-iNSC (SOX2).
На фиг. 11 показаны результаты количественной ПЦР в реальном времени miR-9-5p/-3p в hDF, H9-NSC и hDF-iNSC (SOX2).
На фиг. 1J показаны относительные уровни экспрессии специфического для эмбриональных стволовых клеток семейства miR-302/367 в hDF, H9-NSC, hDF-iNSC (SOX2) и hESC, измеренные с помощью количественной ПЦР в реальном времени.
На фиг. 1K показаны относительные уровни экспрессии семейства let-7/miR-98 в hDF, H9-NSC и hDF-iNSC (SOX2), измеренные с помощью количественной ПЦР в реальном времени.
На фиг. 1L показаны эффективности образования РАХ6 и нестин-положительных колоний miR-124-3р, miR-9-5p, miR-9-3р, анти-let-7b и let-7b, измеренные после их трансфекции в SOX2-трансдуцированные hDF.
На фиг. 2А показаны результаты МТТ-анализа пролиферации клеток, проведенного в контрольной группе hDF и в группах hDF, трансдуцированных SOX2, SOX2/CMYC, SOX2/LIN28 и SOX2/HMGA2.
На фиг. 2В показано время образования колоний, измеренное в группах hDF, трансдуцированных SOX2, SOX2/CMYC, SOX2/LIN28 и SOX2/HMGA2.
На фиг. 2С показана эффективность образования РАХ6- и нестин-положительных колоний, измеренная в группах hDF, трансдуцированных SOX2, SOX2/CMYC, SOX2/LIN28 и SOX2/HMGA2.
На фиг. 2D показаны результаты анализа методом проточной цитометрии контрольной группы hDF и групп hDF, трансдуцированных SOX2, SOX2/CMYC, SOX2/LIN28 и SOX2/HMGA2, проведенного через 7 суток после вирусной трансдукции с использованием маркера клеточной поверхности NSC (CD44) и их положительного маркера (CD184).
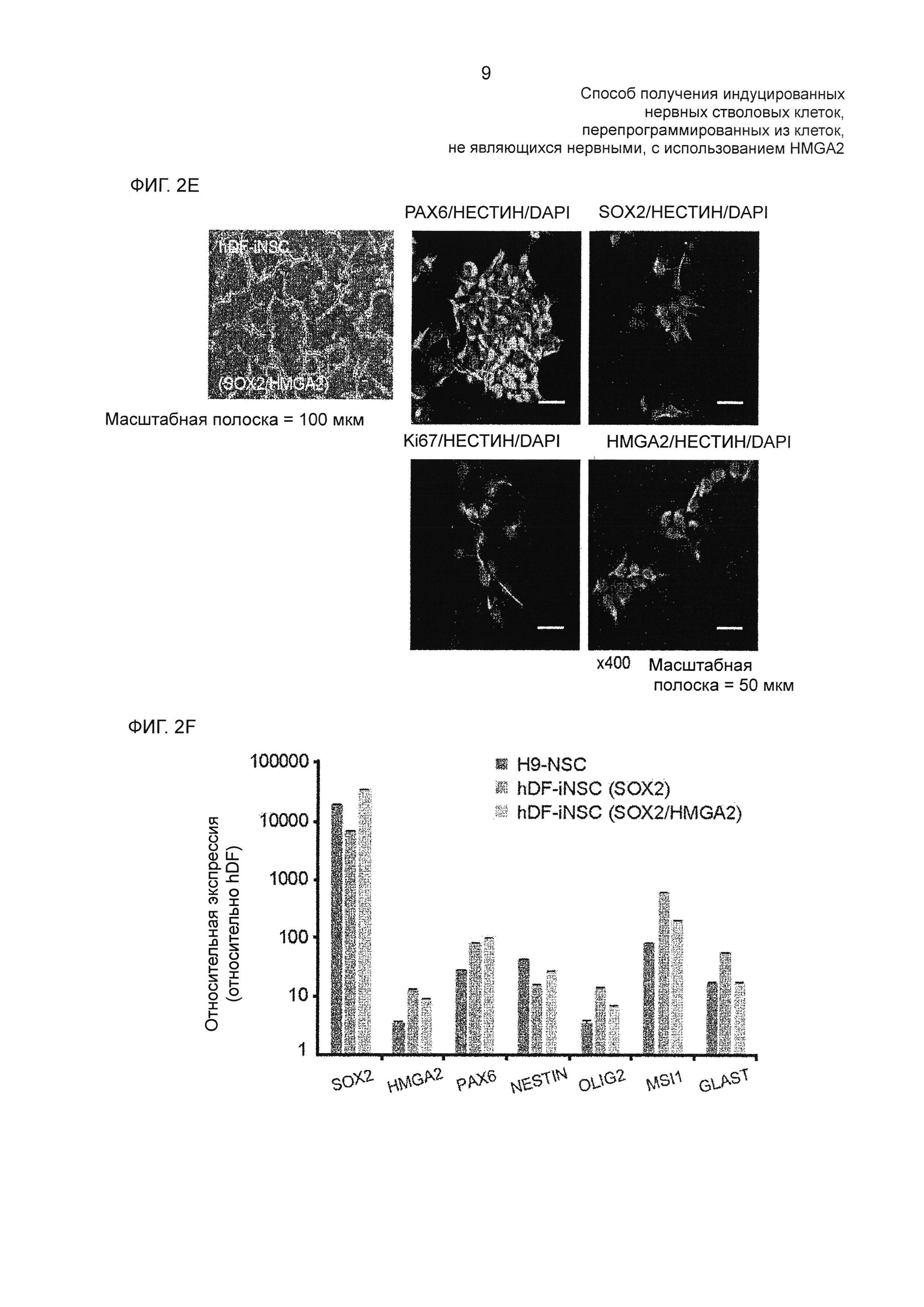
На фиг. 2Е показана морфология hDF-iNSC (SOX2/HMGA2) и результаты иммуноцитохимического анализа экспрессии РАХ6, нестина, Ki67 и HMGA2, наблюдаемые под светлопольным микроскопом.
На фиг. 2F показаны результаты количественной ПЦР в реальном времени экспрессии NSC-специфических микроРНК в H9-NSC, hDF-iNSC (SOX2) и hDF-iNSC (SOX2/HMGA2) по сравнению с уровнем экспрессии hDF.
На фиг. 2G показаны результаты анализа паттернов метилирования промоторов гена SOX2 путем бисульфидной обработки ДНК, имеющей происхождение от hDF, H9-NSC, hDF-iNSC (SOX2) и hDF-iNSC (SOX2/HMGA2).
На фиг. 3А показан иммуноцитохимический анализ hDF-iNSC (SOX2/HMGA2) после их дифференцировки в трех основных типах клеток, то есть в нервных клетках (α-интернексин, ТН, DCX, ChAT, NF, МАР2 и TUJ1), астроцитах (GFAP) и олигодендроцитах (OLIG2 и O4).
На фиг. 3В показан ток натрия и потенциал действия нервных клеток, имеющих происхождение от индуцированных нервных стволовых клеток человека (hiNSC), записанный путем измерения фиксации потенциала.
На фиг. 3С показан ток натрия и потенциал действия нервных клеток hiNSC-происхождения после блокирования тока натрия лидокаином, записанный путем измерения фиксации потенциала.
На фиг. 3D показан ток натрия и потенциал действия нервных клеток hiNSC-происхождения после восстановления тока натрия в результате отмывания, записанный путем измерения фиксации потенциала.
На фиг. 3Е показано, что после трансплантации меченых CM-Dil hiNSC в область парагиппокампальной извилины мыши 4-недельного возраста hiNSC дифференцировали в нервные клетки (TUJ1), астроциты (GFAP) и олигодендроциты (МВР) и локализовались вместе с CM-Dil.
На фиг. 4А показана методика получения iNSC из мезенхимных стволовых клеток, выделенных из крови пуповины человека с использованием SOX2/HMGA2. Фиг. 4А подтверждает, что колонии, подобные нейросферам, образовывались через 7 суток после вирусной трансдукции, и что hiNSC hUCB-MSC-происхождения иммунологически окрашивались РАХ6 (красный), нестином (зеленый) и 4,6-диамидино-2-фенилиндола дигидрохлоридом (DAPI) (синий).
На фиг. 4В показана морфология стареющих клеток hUCB-MSC, которые были трансдуцированы SOX2, SOX2/CMYC, SOX2/LIN28 и SOX2/HMGA2 (21-суточный пассаж). Стареющие клетки hUCB-MSC оценивали на основании активности β-галактозидазы, и исходный кластер iNSC был образован путем трансдукции только SOX2/HMGA2.
На фиг. 4С показаны количественные результаты РАХ6- и нестин-положительных колоний в контрольной группе, стареющих клетках hUCB-MSC, трансдуцированных SOX2, SOX2/CMYC, SOX2/LIN28 и SOX2/HMGA2.
На фиг. 4D показана схематическая диаграмма эксперимента, иллюстрирующая стратегию перепрограммирования hiNSC из клеток CD34+ hUCB-происхождения.
На фиг. 4Е показана чистота клеток CD34+ на основании анализа проточной цитометрии с помощью точечной диаграммы. Было показано, что клетки CD34+, выделенные из мононуклеарных клеток, имеют чистоту 84,15%.
На фиг. 4F показаны изображения, иллюстрирующие характеристики hUCB-CD34+ iNSC на основании иммунохимического анализа, где клетки окрашивали NSC-специфическими маркерами (РАХ6, нестином и SOX2), маркером нервных клеток (NF) и маркером астроцитов (GFAP).
На фиг. 5 показаны изображения H9-NSC, иммунологически окрашенных РАХ6, нестином, SOX2, Ki67 и HMGA2, наблюдаемые под микроскопом.
На фиг. 6А показаны hDF-iNSC (SOX2), трансфицированные miR-CTL либо 50 нМ или 100 нМ let-7b, которые были иммунологически окрашены BrdU-специфическими антителами (зеленый) и DAPI (синий) после обработки BrdU в течение 2,5 часов.
На фиг. 6В показаны количественные результаты BrdU-положительных клеток в hDF-iNSC (SOX2), которые были трансфицированы miR-CTL, либо 50 нМ или 100 нМ let-7b.
На фиг. 6С показан диаметр нейросфер клеток, трансфицированных miR-CTL, либо 50 нМ или 100 нМ let-7b.
На фиг. 6D показано абсолютное число клеток, трансфицированных miR-CTL, либо 50 нМ или 100 нМ let-7b.
На фиг. 6Е показана доля первичных нейросфер клеток, трансфицированных miR-CTL, либо 50 нМ или 100 нМ let-7b.
На фиг. 7А показаны результаты анализа проточной цитометрии отрицательного маркера клеточной поверхности (CD44) и положительного маркера клеточной поверхности (CD184) в hDF-iNSC (SOX2), hDF-iNSC (SOX2/HMGA2) и H9-NSC.
На фиг. 7В показаны тепловые карты общих геномов hDF, H9-NSC, hDF-iNSC (SOX2) и hDF-iNSC (SOX2/HMGA2).
На фиг. 7С показаны точечные диаграммы для сравнения между hDF-iNSC (SOX2/HMGA2) и hDF и между hDF-iNSC (SOX2/HMGA2) и H9-NSC.
На фиг. 8А показаны результаты hDF-iNSC (SOX2), трансфицированных siCTL или 50 нМ siHMGA2, которые были иммунологически окрашены BrdU-специфическими антителами (зеленый) и DAPI (синий) после обработки BrdU в течение 2,5 часов.
На фиг. 8В показаны количественные результаты BrdU-положительных клеток в hDF-iNSC (SOX2), которые были трансфицированы siCTL или 50 нМ siHMGA2.
На фиг. 8С показан диаметр нейросфер клеток, трансфицированных siCTL или 50 нМ siHMGA2.
На фиг. 8D показано абсолютное число клеток, трансфицированных siCTL или 50 нМ siHMGA2.
На фиг. 8Е показана доля первичных нейросфер клеток, трансфицированных siCTL или 50 нМ siHMGA2.
На фиг. 9А показан иммуноцитохимический анализ H9-NSC после их дифференцировки в три основных типа клеток, то есть нейроны (ChAT, NF и МАР2), астроциты (GFAP) и олигодендроциты (O4).
На фиг. 9В показан ток натрия и потенциал действия нервных клеток, имеющих происхождение от hiNSC, записанный с помощью измерения фиксации потенциала.
На фиг. 9С показан ток натрия и потенциал действия нервных клеток, имеющих происхождение от hiNSC, после блокирования тока натрия лидокаином (0,1%), записанный с помощью измерения фиксации потенциала.
На фиг. 9D показан ток натрия и потенциал действия нервных клеток, имеющих происхождение от hiNSC, после восстановления тока натрия в результате отмывания, записанный с помощью измерения фиксации потенциала.
На фиг. 9Е показаны иммуногистохимические результаты трансплантированных CM-Dil-меченых hiNSC.
На фиг. 10А показаны результаты анализа проточной цитометрии маркеров поверхности мезенхимных стволовых клеток человека (hMSC) (отрицательные маркеры: CD34, CD45 и HLA-DR; положительные маркеры: CD73 и CD105) и положительного маркера клеточной поверхности (CD184) в iNSC, имеющих происхождение от hMSC и hMSC.
На фиг. 10В показаны результаты анализа с помощью Вестерн-блоттинга, относящиеся к уровням экспрессии в трех различных линиях HMGA2 и hUCB-MSC соответственно.
На фиг. 10С показаны эффективности образования РАХ6- и нестин-положительных колоний, измеренные после трансдукции SOX2 или SOX2/HMGA2 в hUCB-MSC.
На фиг. 10D показаны скорости пролиферации H9-NSC, hDF-iNSC и hMSC-iNSC, определенные с помощью анализа уровня кумулятивных удвоений популяции (CPDL; cumulative population doubling level).
На фиг. 10Е показаны эффективности образования РАХ6- и нестин-положительных колоний, измеренные в клетках hUCB-CD34+, трансфицированных SOX2 или SOX2/HMGA2.
На фиг. 11 показаны результаты подтверждения потенциала дифференцировки стромальных клеток, выделенных из крови пуповины человека (hUCBSC).
На фиг. 12 показаны результаты измерения эффективности трансдукции hUCBSC HMGA2.
На фиг. 13 показаны результаты уровня экспрессии HMGA2 на ранних стадиях HMGA2-трансдуцированных hUCBSC в ходе 8 или менее генераций, измеренного с помощью иммуноцитохимического анализа.
На фиг. 14 показаны результаты уровня экспрессии HMGA2 на ранних стадиях HMGA2-трансдуцированных hUCBSC в ходе 8 или менее генераций, измеренного с помощью микроматричного анализа.
На фиг. 15 показаны результаты уровня экспрессии HMGA2 на ранних стадиях HMGA2-трансдуцированных hUCBSC в ходе 8 или менее генераций, измеренного с помощью ПЦР.
На фиг. 16 показаны результаты измерения морфологии клеток в ходе генераций HMGA2-трансдуцированных hUCBSC, измеренной с помощью фазово-контрастного изображения.
На фиг. 17 показаны результаты уровня экспрессии ассоциированной со старением бета-галактозидазы (SA-β-gal) в ходе генераций HMGA2-трансдуцированных hUCBSC, измеренного с помощью окрашивания β-gal.
На фиг. 18 показаны результаты пролиферации клеток в ходе генераций HMGA2-трансдуцированных hUCBSC, измеренной с помощью МТТ анализа.
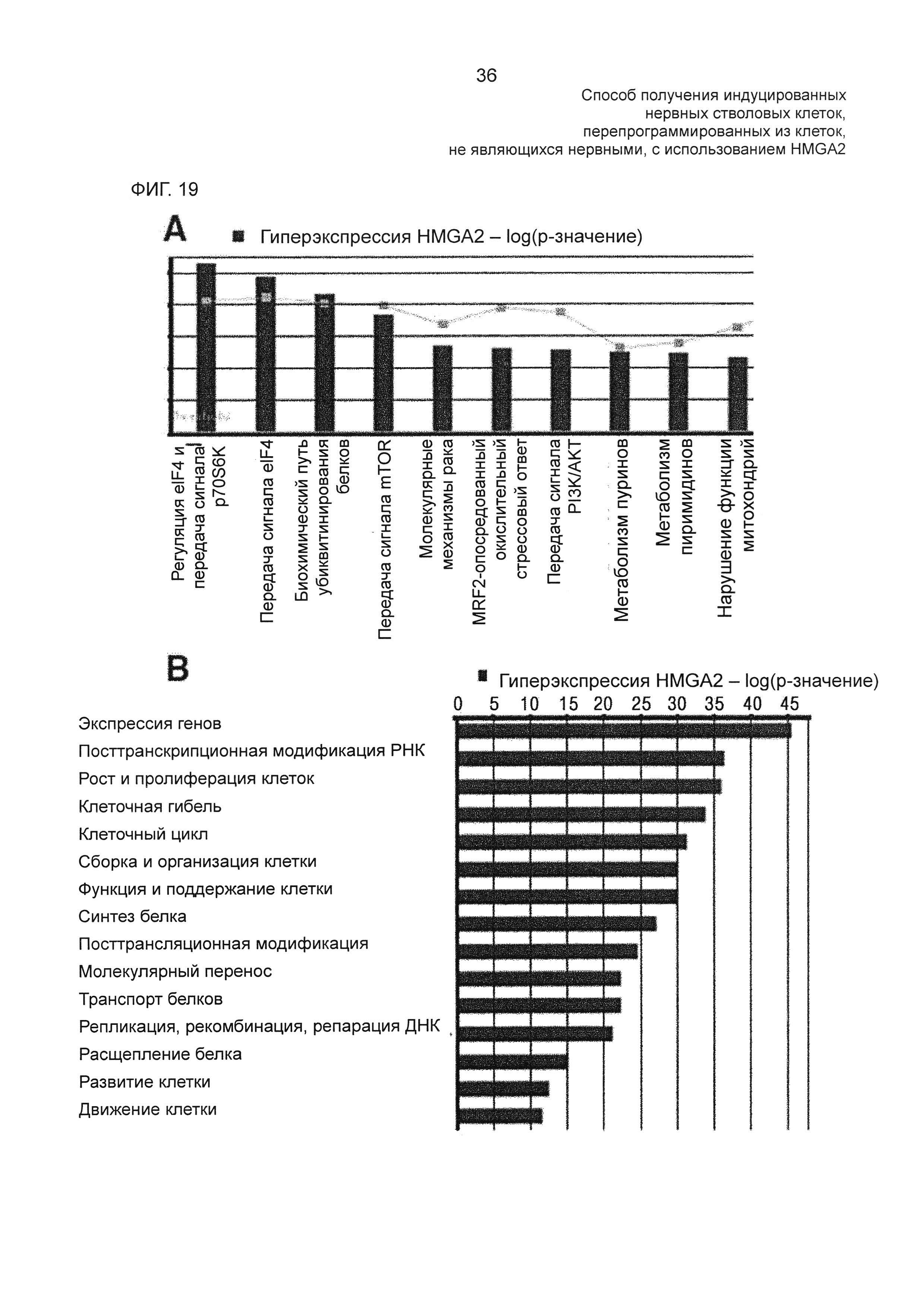
На фиг. 19 показаны результаты уровней экспрессии генов, ассоциированных с биохимическим путем передачи сигнала, связанного с гиперэкспрессией HMGA2, и генов, ассоциированных с молекулярными клеточными функциями, в HMGA2-трансдуцированных hUCBSC, измеренных с помощью программы Ingenuity Pathway Analysis (ΙΡΑ).
На фиг. 20 показаны результаты анализа с помощью Вестерн-блоттинга для оценки воздействия гиперэкспрессии HMGA2 на биохимический путь PI3K/AKT и mTOR/p70s6K в HMGA2-трансдуцированных hUCBSC.
На фиг. 21 показаны результаты морфологии клеток в ходе генераций HMGA2-трансдуцированных hUCBSC, измеренной с помощью фазово-контрастного изображения, и результаты уровня экспрессии ассоциированной со старением бета-галактозидазы (SA-β-gal) в ходе генераций HMGA2-трансдуцированных hUCBSC, измеренного с помощью окрашивания β-gal, для оценки уровня старения HMGA2-ингибированных hUCBSC, измеренного с помощью окрашивания β-gal.
На фиг. 22 показаны результаты пролиферации клеток в HMGA2-ингибированных hUCBSC, измеренной с помощью МТТ анализа.
На фиг. 23 показаны результаты анализа с помощью Вестерн-блоттинга для оценки воздействия ингибирования HMGA2 на биохимический путь PI3K/AKT и mTOR/p70s6K в HMGA2-трансдуцированных hUCBSC.
На фиг. 24 показаны результаты потенциала дифференцировки HMGA2-ингибированных hUCBSC в жировых тканях.
На фиг. 25 показаны результаты сравнения между экспрессией генов hUCBSC с гиперэкспрессией HMGA2 и экспрессией генов HMGA2-ингибированных hUCBSC.
На фиг. 26 показаны результаты ПЦР, проведенной на 8 генах, которые были отобраны путем сравнения экспрессии генов hUCBSC с гиперэкспрессией HMGA2 и экспрессией генов HMGA2-ингибированных hUCBSC.
На фиг. 27 показаны результаты ПЦР, проведенной на отобранных генах, экспрессии которых увеличиваются при гиперэкспрессии HMGA2 и уменьшаются при ингибировании HMGA2 в hUCBSC, и на тех генах, экспрессии которых уменьшаются при гиперэкспрессии HMGA2 и увеличиваются при ингибировании HMGA2 в hUCBSC.
На фиг. 28 показаны результаты анализа с помощью проточной цитометрии клеток CD34+, выделенных из мононуклеарных клеток крови пуповины.
На фиг. 29 показана флуктуация числа клеток CD34+ в соответствии с сутками культивирования в CD34+-специфичной среде.
На фиг. 30 показан ход морфологического изменения клеток CD34+ до индуцированных нервных стволовых клеток.
На фиг. 31 показаны признаки экспрессии CD34+ iNSC, иммунологически окрашенных DAPI, нестином, HMGA2 и SOX2.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВОПЛОЩЕНИЙ ИЗОБРЕТЕНИЯ
В одном аспекте в настоящем изобретении предложен набор для индукции перепрограммирования клетки, не являющейся нервной, в нервную стволовую клетку (NSC), включающий (а) белок SRY (участок Y-хромосомы, определяющий пол)-box 2 (SOX2) или молекулу нуклеиновой кислоты, кодирующую белок SOX2; и (б) белок группы белков с высокой подвижностью с мотивом АТ-крюка 2 (HMGA2) или молекулу нуклеиновой кислоты, кодирующую белок HMGA2.
Настоящее изобретение относится к получению индуцированных нервных стволовых клеток из клеток-мишеней путем увеличения экспрессии двух факторов SOX2 и HMGA2, являющихся традиционными хорошо известными транскрипционными факторами дифференцировки нервных клеток, внутри клеток-мишеней, таких как клетки, не являющиеся нервными, и т.д. Способом получения индуцированных нервных стволовых клеток по настоящему изобретению можно получить индуцированные нервные стволовые клетки из клеток, не являющихся нервными, просто путем использования двух индуцирующих факторов SOX2 и HMGA2, и, таким образом, можно получить индуцированные нервные стволовые клетки более эффективно, чем традиционными способами, в которых используют четыре или пять индуцирующих факторов. Кроме того, способ по настоящему изобретению может значительно уменьшить время, требующееся для перепрограммирования, и обеспечить значительно более высокую эффективность перепрограммирования-индукции и способность к пролиферации, чем при использовании только одного гена SOX2, что, таким образом, повышает эффективность его применения в терапевтических целях.
Белки SOX2 представляют собой белки, экспрессируемые генами определяющего пол участка Y-хромосомы-box 2 (Sox2), и известно, что они экспрессируются в центральной нервной системе на пренатальной стадии и вовлечены в саморепликацию нервных стволовых клеток, а также известно, что они часто экспрессируются в злокачественной глиоме.
Известно, что белки группы белков с высокой подвижностью с мотивом АТ-крюка 2 (HMGA2) служат в качестве фактора модификации структур хроматина за счет связывания с ДНК и в результате могут индуцировать изменение транскрипции генов.
В настоящем изобретении белки SOX2 и белки HMGA2 или молекулы нуклеиновых кислот, кодирующие эти белки, могут включать все белки SOX2 и HMGA2, имеющие происхождение из животных, включающих людей, мышей и т.д., и предпочтительно SOX2 и HMGA2 имеют происхождение из людей. Кроме того, белки SOX2 и HMGA2 по настоящему изобретению могут включать не только белки, имеющие аминокислотную последовательность дикого типа этих белков, но также их варианты. В данном документе все варианты белков SOX2 и HMGA2 включают белки, имеющие последовательности, отличающиеся от природных аминокислотных последовательностей SOX2 и HMGA2 по меньшей мере одним аминокислотным остатком вследствие делеции, инсерции, консервативной или неконсервативной замены или их комбинации. Варианты могут представлять собой функциональные эквиваленты, проявляющие такие же биологические активности, что и природные белки, или те варианты, где физико-химические свойства белков модифицированы вследствие необходимости в повышенной структурной стабильности или физиологических активностей по отношению к физико-химическим окружающим условиям.
При использовании в настоящем документе термин "молекула нуклеиновой кислоты, кодирующая белок SOX2 или HMGA2" относится к нуклеотидной последовательности, кодирующей белок SOX2 или HMGA2 дикого типа или вариантный тип белка SOX2 или HMGA2, как описано выше, где по меньшей мере один нуклеотид может быть модифицирован за счет замены, делеции, инсерции или их комбинации, и которая может быть получена путем выделения из природных источников или путем химического синтеза.
Молекула нуклеиновой кислоты, кодирующая белок SOX2, или молекула нуклеиновой кислоты, кодирующая белки HMGA2, может находиться в форме, где каждая из молекул нуклеиновой кислоты независимо включена в экспрессионный вектор.
Конкретно белок SOX2 или белок HMGA2 может представлять собой белок в форме, экспрессируемой in vitro в клеточной линии с использованием экспрессионного вектора, включающего молекулы нуклеиновой кислоты, кодирующие эти белки. Что касается экспрессионного вектора, можно использовать бакуловирусный экспрессионный вектор, экспрессионный вектор млекопитающих или бактериальный экспрессионный вектор, и в качестве клеточной линии можно использовать линию клеток насекомых, линию клеток млекопитающих или линию клеток бактерий, но экспрессионный вектор и линия клеток, используемые в настоящем изобретении, не ограничены ими.
При использовании в настоящем документе термин "экспрессионный вектор" может относиться к генной конструкции, включающей существенные регуляторные элементы, в которых экспрессируют функционально связанный с ними ген вставки, способный к экспрессии целевого белка. Экспрессионный вектор по настоящему изобретению можно использовать с целью доставки перепрограммирующих-индуцирующих факторов в клетки, не являющиеся нервными. Экспрессионный вектор по настоящему изобретению может включать не только экспрессионные регуляторные элементы, такие как промотор, оператор, кодон инициации, кодон терминации, сигнал полиаденилирования и энхансер, но может также избирательно включать сигнальную последовательность для нацеливания на мембрану или секреции или лидерную последовательность, и может быть получен различными путями в соответствии с предназначенными применениями. Промотор вектора может быть конститутивным или индуцибельным. Кроме того, экспрессионный вектор включает селективный маркер для отбора клетки-хозяина, включающей вектор, и в случае, когда экспрессионный вектор представляет собой реплицирующийся экспрессионный вектор, он включает точку начала репликации. Экспрессионный вектор может самореплицироваться или может быть интегрирован в ДНК хозяина. Вектор может включать плазмидный вектор, космидный вектор, эписомный вектор, вирусный вектор и т.д., и предпочтительно вирусный вектор. Вирусный вектор может включать векторы, имеющие происхождение от ретровирусов, таких как вирус иммунодефицита человека (HIV), вирус лейкоза мышей (MLV), вирус саркомы/лейкоза птиц (ASLV), вирус некроза селезенки (SNV), вирус саркомы Payca (RSV), вирус опухоли молочной железы млекопитающих (MMTV), аденовирус, аденоассоциированный вирус, вирус простого герпеса, вирус Сендай и т.д., но не ограничен ими.
Молекулы нуклеиновой кислоты, кодирующие белок SOX2 или белок HMGA2, могут представлять собой матричную РНК (мРНК).
При использовании в настоящем документе термин "перепрограммирование" относится к процессу, который восстанавливает или преобразует дифференцированные клетки, находящиеся в состоянии различных признаков, например, клетки без потенциала дифференцировки или клетки с частичным потенциалом дифференцировки и т.д. в клетки с новым типом потенциала дифференцировки. Механизм перепрограммирования клеток относится к установлению другой серии эпигенетических маркеров после делеции эпигенетического маркера внутри ядра (состояния ДНК, относящегося к индукции генетического изменения функции без изменения данной нуклеотидной последовательности), и другие клетки и ткани получают другие программы экспрессии генов в процессе дифференцировки и роста многоклеточного организма. Эти другие паттерны экспрессии генов, по-видимому, по существу контролируются эпигенетическими модификациями, например, метилированием ДНК, модификацией гистонов и других хроматин-связывающих белков. Соответственно, типы клеток в многоклеточном организме являются постоянными и не изменяются, как только клетки дифференцировались или вышли из клеточного цикла, но в течение конкретного периода в процессе нормального развития или в ходе конкретного заболевания может происходить значительное эпигенетическое перепрограммирование. В настоящем изобретении предложен способ получения клеток, обладающих эффективностью недифференцированных клеток, путем обработки уже дифференцированных целевых клеток конкретным белком.
При использовании в настоящем документе термин "перепрограммирующий-индуцирующий фактор" относится к веществу, которое может индуцировать перепрограммирование окончательно дифференцированной клетки или частично дифференцированной клетки в индуцированную нервную стволовую клетку, обладающую потенциалом дифференцировки в новые типы клеток, и может включать белки SOX2, белки HMGA2 или молекулы нуклеиновых кислот, кодирующие эти белки. Перепрограммирующий-индуцирующий фактор может без ограничения включать любое вещество, способное к индукции перепрограммирования дифференцированных клеток.
При использовании в настоящем документе белки HMGA2 или молекулы нуклеиновых кислот, кодирующие эти белки, могут представлять собой модуляторы хроматина. В частности, хроматин представляет собой нуклеосому, имеющую основную структуру комплекса между ДНК и гистоновым белком. Модулирование хроматина выполняют таким образом, что экспрессионный признак соответствующих генных изменений, например, пути, посредством которого ДНК окружает гистон, изменяется за счет, например, ацетилирования гистона, метилирования ДНК и т.д. Соответственно, хроматин можно модулировать посредством метилирования/деметилирования ДНК, и HMGA2 может действовать в качестве модулятора хроматина за счет стимуляции низкого метилирования на промоторном участке гена SOX2 (пример 4-5).
При использовании в настоящем документе "клетка, не являющаяся нервной" относится ко всем дифференцированным или недифференцированным клеткам, не являющимся нервными, которые служат в качестве клетки-мишени в настоящем изобретении. Клетки, не являющиеся нервными, могут представлять собой клетки, имеющие происхождение от различных животных, включая людей, обезьян, свиней, лошадей, крупный рогатый скот, овец, собак, кошек, мышей, кроликов и т.д., и предпочтительно клетки, имеющие происхождение от людей, но клетки, перепрограммируемые путем индукции нервных стволовых клеток, не ограничены ими.
Клетка, не являющаяся нервной, может представлять собой соматическую клетку, взрослую стволовую клетку или плюрипотентную стволовую клетку.
При использовании в настоящем документе термин "соматическая клетка" относится к клеткам, составляющим взрослый организм, имеющим ограниченный потенциал дифференцировки и ограниченную способность к самообновлению, где конкретно соматические клетки составляют кожу, волосы, жировую ткань, кровь и т.д. людей, и предпочтительно относятся к фибробластам человека или клеткам крови пуповины человека, но не ограничен ими.
При использовании в настоящем документе термин "взрослая стволовая клетка" относится к стволовым клеткам, присутствующим в костях, жировой ткани, строме костного мозга, мышцах, нервах и т.д., и предпочтительно к мезенхимным стволовым клеткам, но не ограничена ими.
При использовании в настоящем документе термин "индуцированная нервная стволовая клетка" относится к клеткам, полученным таким путем, как при основании недифференцированных стволовых клеток, обладающих плюрипотентностью, которые подобны или аналогичны нервным стволовым клеткам, путем применения технологии перепрограммирования к дифференцированным клеткам. Индуцированная нервная стволовая клетка обладает характеристиками, аналогичными или подобными характеристикам нервной стволовой клетки, в частности, имеет подобную морфологию клетки, подобные паттерны генной и белковой экспрессии, и может обладать плюрипотентностью и in vivo, и in vitro. Соответственно, индуцированная нервная стволовая клетка по настоящему изобретению может представлять собой клетку, которая может дифференцироваться в нервную клетку (нейрон), астроцит, олигодендроцит, ГАМК-эргический нейрон, дофаминергический нейрон и т.д.
Набор по настоящему изобретению может быть конкретно не ограничен, но можно использовать любой тип набора, который можно традиционно применять в данной области техники.
Набор по настоящему изобретению может быть упакован в такой форме, в которой первая композиция, включающая белки SOX2 и молекулы нуклеиновой кислоты, кодирующие белки SOX2, и вторая композиция, включающая белки HMGA2 и молекулы нуклеиновой кислоты, кодирующие белки HMGA2, содержатся в отдельных контейнерах соответственно или в одном контейнере, разделенном на более чем одну секцию.
В иллюстративном воплощении настоящего изобретения с целью подтверждения действий белков SOX2 и HMGA2 в процессе перепрограммирования-индукции из фибробластов человека в индуцированные нервные стволовые клетки эти белки подвергали гиперэкспрессии и непрерывно исследовали морфологические изменения клеток и перепрограммирующую-индуцирующую эффективность с помощью анализа РАХ6/нестин-положительных колоний. В результате было подтверждено, что при одновременном увеличении экспрессии обоих белков SOX2 и HMGA2 способность к самообновлению, способность к пролиферации и потенциал дифференцировки в нервные клетки, а также перепрограммирующая-индуцирующая эффективность увеличивались по сравнению с увеличением экспрессии только одного белка SOX2. В частности, когда перепрограммирование индуцировали в сочетании с HMGA2, колонии индуцированных нервных стволовых клеток образовывались приблизительно на 10 суток раньше.
Кроме того, было подтверждено, что SOX2 и HMGA2 могут участвовать в эффективном перепрограммировании мезенхимных стволовых клеток, имеющих происхождение из крови пуповины человека (hUCB-MSC), и клеток крови, имеющих происхождение из крови пуповины человека, в индуцированные нервные стволовые клетки, и, в частности, было подтверждено, что HMGA2 может вносить вклад в усиление перепрограммирования и уменьшение времени, требующегося на перепрограммирование.
В качестве клетки, не являющейся нервной, используемой в настоящем изобретении, мезенхимные стволовые клетки, имеющие происхождение из крови пуповины человека, являются репрезентативным примером взрослых стволовых клеток, а клетки крови, имеющие происхождение из крови пуповины человека, являются репрезентативным примером соматических клеток, и эти результаты позволяют предположить, что с помощью SOX2 и HMGA2 в качестве перепрограммирующих-индуцирующих факторов не только соматические клетки, но также взрослые стволовые клетки можно эффективно перепрограммировать путем индукции нервных стволовых клеток.
В другом аспекте в настоящем изобретении предложен способ получения индуцированных нервных стволовых клеток, перепрограммированных из клеток, не являющихся нервными клетками, или нервных клеток, дифференцированных из них. Конкретно способ по настоящему изобретению может включать (а) доставку в клетку, не являющуюся нервной, белка SOX2 или молекулы нуклеиновой кислоты, кодирующей белок SOX2, и белка HMGA2 или молекулы нуклеиновой кислоты, кодирующей белок HMGA2, либо увеличение экспрессии белка SOX2 и белка HMGA2 в клетке, не являющейся нервной; и (б) культивирование клеток стадии (а).
Предпочтительно способ по настоящему изобретению может дополнительно включать стадию (в) отделения колоний клеток, подобных нервным стволовым клеткам, от культуры клеток, полученной на стадии (б).
В способе получения индуцированных нервных стволовых клеток согласно настоящему изобретению экспрессия SOX2 и HMGA2 в клетках-мишенях может быть увеличена путем введения в клетки-мишени экспрессионных регуляторных элементов SOX2 и/или HMGA2.
Конкретно способ доставки в клетки перепрограммирующих-индуцирующих факторов, таких как белок SOX2 или молекула нуклеиновой кислоты, кодирующая белок SOX2, и белок HMGA2 или молекула нуклеиновой кислоты, кодирующая белок HMGA2, можно выполнять традиционными способами доставки молекул нуклеиновых кислот или белков, используемыми в данной области техники, без ограничений, и предпочтительно способом добавления перепрограммирующих-индуцирующих факторов в культуральную среду для клеток, не являющихся нервными, или прямой инъекции перепрограммирующих-индуцирующих факторов в клетки, не являющиеся нервными, где перепрограммирующие-индуцирующие факторы, используемые в данном изобретении, можно использовать в форме вирусов, которые были получены из пакующей клетки, трансфицированной вирусным вектором, в который были встроены соответствующие гены, то есть молекулы нуклеиновой кислоты, кодирующие белки SOX2, и молекулы нуклеиновой кислоты, кодирующие белки HMGA2, соответственно; в форме мРНК, полученных путем транскрипции in vitro; или в форме белков, продуцированных в различных линиях клеток.
Способ прямой инъекции перепрограммирующих-индуцирующих факторов в дифференцированные клетки может быть выполнен любым способом, известным в данной области техники, но без ограничений, и может быть выполнен путем целесообразного выбора способа из микроинъекции, электропорации, бомбардировки частицами, прямой инъекции в мышцы и способов с использованием инсуляторов и транспозонов.
Вирусный вектор, который следует использовать, может представлять собой вектор, имеющий происхождение от ретровируса, лентивируса, аденовируса, аденоассоциированного вируса, вируса простого герпеса, вируса Сендай и т.д., но не ограничен ими, и предпочтительно можно использовать ретровирусный вектор. Дополнительно в качестве пакующей клеточной линии можно использовать различные клетки, известные в данной области техники, после отбора в соответствии с используемыми вирусными векторами.
Дополнительно экспрессия SOX2 и HMGA2 внутри клеток-мишеней может быть увеличена путем введения экспрессионных регуляторных факторов SOX2 и/или HMGA2.
Конкретно экспрессионный регуляторный фактор HMGA2 может представлять собой ингибитор кластера микроРНК let-7 или ингибитор PDE4D. Известно, что кластер микроРНК let-7 представляет собой микроРНК, нацеленную на HMGA2, за счет чего уменьшается его экспрессия. В настоящем изобретении уровень экспрессии HMGA2 возможно увеличить внутри клеток-мишеней путем введения ингибитора кластера микроРНК let-7.
Кроме того, экспрессионный регуляторный фактор SOX2 может представлять собой ингибитор PDE4D. Известно, что основным клеточным механизмом активации циклического АМФ (цАМФ) является расщепление цАМФ серией изоферментов, называемых фосфодиэстеразой циклических нуклеотидов (PDE). Ферменты PDE включают 12 известных ферментов. Признано, что ингибирование PDE типа IV (PDE4) особенно эффективно и при ингибировании опосредованного воспалением расслабления, и при релаксации гладкой мускулатуры дыхательных путей. Активация цАМФ была предложена в качестве перспективной стратегии индукции преодоления нервной клеткой ингибиторных сигналов после повреждения спинного мозга (SCI; spinal cord injury). Известно, что ингибирование гидролиза цАМФ ролипрамом, который является ингибитором PDE4, предотвращает снижение уровня цАМФ после контузии спинного мозга. Соответственно, при связывании ингибитора PDE4 с трансплантатом шванновской клетки он стимулирует значительное сохранение спинного мозга и аксона проприорецепции и образование миелинового волокна. В качестве ингибитора активности PDE IV можно использовать SelCID™.
Соответственно, использование ингибитора PDE4D, который является общим экспрессионным регуляторным фактором для обоих белков SOX2 и HMGA2, может количественно увеличить уровень экспрессии обоих белков SOX2 и HMGA2, что, таким образом, значительно увеличивает перепрограммирующую-индуцирующую эффективность и т.д.
Перепрограммирующие-индуцирующие факторы могут включать по меньшей мере один белок, выбранный из группы, состоящей из ОСТ4, KIF4, CMYC, LIN28 и Nanog, или по меньшей мере одну молекулу нуклеиновой кислоты, кодирующую эти белки, в дополнение к перепрограммирующим-индуцирующим факторам SOX2 и HMGA2 по настоящему изобретению. Эти белки являются известными перепрограммирующими-индуцирующими факторами, и среди них CMYC и LIN28 принадлежат к кластеру микроРНК let-7. Таким образом, перепрограммирующая-индуцирующая эффективность может быть увеличена путем дополнительной экспрессии этих индуцирующих факторов.
Кроме того, в настоящем изобретении можно использовать другие наночастицы и соединения для введения белков SOX2 или молекул нуклеиновых кислот, кодирующих белки SOX2, и белков HMGA2 или молекул нуклеиновых кислот, кодирующих белки HMGA2.
Культивирование клеток на стадии (б) настоящего изобретения можно выполнять в соответствующей культуральной среде и в условиях культивирования, известных специалистам в данной области техники. Эти способы культивирования могут быть легко отрегулированы специалистом в данной области техники в соответствии с выбранными клетками.
Стадия (б) включает культивирование в среде для дифференцировки нервных клеток, и нервные клетки могут образовываться из индуцированных нервных стволовых клеток.
В другом аспекте в настоящем изобретении предложены индуцированные нервные стволовые клетки, полученные описанным выше способом, и дифференцированные из них нервные клетки.
Индуцированные нервные стволовые клетки являются такими, как описано выше.
Как подтверждено в разделе Примеров, индуцированные нервные стволовые клетки могут дифференцироваться в нейроны, астроциты и олигодендроциты, и также могут быть получены нервные клетки, дифференцированные из индуцированных нервных стволовых клеток.
В другом аспекте в настоящем изобретении предложен продукт для клеточной терапии для регенерации нервных клеток, включающий индуцированные нервные стволовые клетки или нервные клетки, дифференцированные из индуцированных нервных стволовых клеток, в качестве активного ингредиента.
Индуцированные нервные стволовые клетки по настоящему изобретению представляют собой клетки, которые могут быть дифференцированы в клетки, ассоциированные с нервными клетками, и, следовательно, полезны для регенерации нервных клеток. Соответственно, их можно применять в качестве продукта для клеточной терапии.
Продукт для клеточной терапии по настоящему изобретению может включать от 1,0×105 клеток до 1,0×109 клеток на 1 мл, предпочтительно от 1,0×106 клеток до 1,0×108 клеток на 1 мл и более предпочтительно 1,0×107 клеток на 1 мл, но без ограничений.
Продукт для клеточной терапии по настоящему изобретению можно применять без сублимационной сушки или в сублимированном виде для дальнейшего использования. Когда сублимационная сушка необходима, перед сублимационной сушкой к популяции клеток можно добавлять криоконсервант (например, ДМСО, глицерин и среду для сублимационной сушки клеток Epilife™ (Cascade Biologiсs)).
Кроме того, продукт для клеточной терапии можно вводить после включения в единичную форму введения, подходящую для введения в организм пациента согласно традиционному способу в области фармацевтики, и продукт может включать дозу введения, которая эффективна после одного или нескольких введений. Примеры продуктов, подходящих для этой цели в качестве продукта для парентерального введения, могут предпочтительно представлять собой инъекционные продукты, такие как ампулы для инъекций, средства инфузии, такие как инфузионные пакеты, а также средства распыления, такие как аэрозольные композиции, и т.д. Ампулы для инъекций могут быть получены путем смешивания инъекций непосредственно перед применением. Для инъекционных растворов можно использовать физиологический раствор, глюкозу, маннит, раствор Рингера и т.д. Кроме того, для инфузионных пакетов можно использовать материалы из поливинилхлорида и полиэтилена и инфузионные пакеты, изготавливаемые компаниями Baxter, Becton Dickinson, Medcep, National Hospital Products и Terumo.
Продукт для клеточной терапии может дополнительно включать по меньшей мере один фармацевтически приемлемый носитель, например, консервирующее средство, анальгетик, солюбилизатор, стабилизатор и т.д., для инъекционных продуктов; и основу, эксципиент, смазывающее средство, консервирующее средство и т.д. для местных продуктов.
Полученный таким путем продукт для клеточной терапии по настоящему изобретению можно вводить без ограничений с помощью традиционного способа введения, используемого в данной области техники, в сочетании с другими стволовыми клетками, используемыми для трансплантации и других применений, или в смешанной форме с этими стволовыми клетками, и могут быть предпочтительно привиты или трансплантированы непосредственно в область заболевания, либо непосредственно трансплантированы или инфузированы в брюшную полость пациента, нуждающегося в лечении. Кроме того, введение может быть выполнено либо нехирургическим способом введения с использованием катетера, либо хирургическим способом введения путем инъекции в область заболевания после ее эксцизии или трансплантации в область заболевания, но более предпочтительно введение нехирургическим способом введения с использованием катетера. Кроме того, возможно парентеральное введение в соответствии с традиционным способом, например, прямое введение в повреждения, а также трансплантация путем инфузии в кровеносный сосуд, которая представляет собой общий способ трансплантации гемопоэтических стволовых клеток.
Суточную дозу описанных выше клеток можно вводить один раз или в виде нескольких разделенных доз ежесуточно в количестве от 1,0×104 клеток/кг до 1,0×1010 клеток/кг массы тела и предпочтительно от 1,0×105 клеток/кг до 1,0×109 клеток/кг массы тела. Тем не менее, должно быть понятно, что действительную дозу активных ингредиентов определяют с учетом различных сопутствующих факторов, таких как заболевание, подлежащее лечению, тяжесть заболевания, путь введения, масса тела, возраст и пол пациента и т.д., и, таким образом, дозу никоим образом не следует рассматривать как ограничивающую объем настоящего изобретения.
В другом аспекте в настоящем изобретении предложен способ ингибирования или восстановления повреждения нервных клеток субъекта, включающий введение перепрограммирования индуцированных нервных стволовых клеток или нервных клеток, дифференцированных из них. Конкретно повреждение нервных клеток субъекта можно ингибировать или восстанавливать путем введения индуцированных нервных стволовых клеток, которые были перепрограммированы путем доставки в клетки, не являющиеся нервными, белка SOX2 или молекулы нуклеиновой кислоты, кодирующей белок SOX2, и белка HMGA2 или молекулы нуклеиновой кислоты, кодирующей белок HMGA2; и культивирование клеток или нервных клеток, дифференцированных из них.
При использовании в настоящем документе термин "субъект" относится без ограничений к крупному рогатому скоту, собакам, свиньям, курам, овцам, лошадям, и к млекопитающим, включающим людей. Предпочтительно введение перепрограммированных индуцированных нервных стволовых клеток или продукта их культивирования может представлять собой интраперитонеальное или внутрисосудистое введение, прямое введение в повреждения или введение в синовиальную полость сустава и т.д.
Ингибирование или восстановление повреждения нервных клеток может включать профилактику или лечение заболеваний, обусловленных повреждением нервных клеток.
В другом аспекте в настоящем изобретении предложена фармацевтическая композиция для профилактики или лечения заболеваний, обусловленных повреждением нервных клеток, включающая в качестве активных ингредиентов белок SRY (определяющий пол участок Y-хромосомы)-box 2 (SOX2) или молекулу нуклеиновой кислоты, кодирующую белок SOX2, и белок группы белков с высокой подвижностью с мотивом АТ-крюка 2 (HMGA2) или молекулу нуклеиновой кислоты, кодирующую белок HMGA2.
Как объяснено выше, композицию, включающую белок SOX2 или молекулу нуклеиновой кислоты, кодирующую белок SOX2, и белок HMGA2 или молекулу нуклеиновой кислоты, кодирующую белок HMGA2, можно вводить в клетку, не являющуюся нервной, чтобы индуцировать ее перепрограммирование в нервную стволовую клетку, и посредством этого применять для профилактики или лечения заболеваний, обусловленных повреждением нервных клеток.
Кроме того, ген(ы) SOX2 и/или HMGA2 могут быть представлены без ограничений в форме системы внутриклеточной доставки генов или транспортера генов, известных в данной области техники, например, липоплекса, полиплекса, проникающего пептида (СРР; cell permeable peptide), домена белковой продукции (PTD; protein transduction domain) и т.д.
PTD можно использовать без ограничений, если он может повысить эффективность внутриклеточного введения SOX2 и/или HMGA2.
Кроме того, SOX2 и/или HMGA2 могут находиться в форме слитого белка, кодируемого конъюгатом между плазмидой SOX2 и/или HMGA2 и транспортером для доставки плазмиды в клетку. Например, они могут находиться в форме слитого белка между SOX2 и/или HMGA2 и СРР или PTD, либо между SOX2 и/или HMGA2 и низкомолекулярным протаминовым конъюгатом.
При использовании в настоящем документе термин "заболевания, обусловленные повреждением нервных клеток", относится к заболеваниям, которые могут возникать вследствие модификации, утраты и т.д. нервных клеток, включающим без ограничения болезнь Паркинсона, болезнь Альцгеймера, болезнь Пика, болезнь Гентингтона, боковой амиотрофический склероз, ишемическую энцефалопатию, такую как удар, демиелинизирующее заболевание, рассеянный склероз, эпилепсию, дегенеративные заболевания нервных клеток, повреждение спинного мозга и т.д.
При использовании в настоящем документе термин "профилактика" относится ко всем видам действий, связанных с ингибированием или задержкой развития заболеваний, обусловленных повреждением нервных клеток, в результате введения описанной выше композиции, а термин "лечение" относится ко всем видам действий, связанных с улучшением или полезными изменениями в симптомах заболеваний, обусловленных повреждением нервных клеток, в результате введения описанной выше композиции.
В другом аспекте в настоящем изобретении предложен способ скрининга стимулятора регенерации или ингибитора регенерации для нервной стволовой клетки или нервной клетки, включающий 1) получение изолированной клетки, не являющейся нервной; 2) индукцию получения индуцированной нервной стволовой клетки путем доставки в клетку, не являющуюся нервной, белка SOX2 или молекулы нуклеиновой кислоты, кодирующей белок SOX2; и белка HMGA2 или молекулы нуклеиновой кислоты, кодирующей белок HMGA2, либо увеличение экспрессии белка SOX2 и белка HMGA2 в клетке, не являющейся нервной; 3) возможно дифференцировку индуцированной нервной стволовой клетки, полученной на стадии 2), в нервную клетку; и 4) обработку веществом-кандидатом после стадии 1 или стадии 2 и определение, образуется ли индуцированная нервная стволовая клетка или нервная клетка, или зависит ли уровень их образования от обработки веществом-кандидатом.
В настоящем изобретении наличие образования или уровень образования нервных стволовых клеток или нервных клеток путем перепрограммирования клеток, не являющихся нервными, можно оценивать путем наблюдения изменений, таких как морфологические изменения в клетках, не являющихся нервными, наличие экспрессии нейрон-специфических маркеров, способность к самообновлению, способность к пролиферации, потенциал дифференцировки в нервные клетки и т.д., до и после обработки веществом-кандидатом.
Кроме того, настоящее изобретение может дополнительно включать стадию определения вещества-кандидата в качестве стимулятора регенерации для нервных стволовых клеток или нервных клеток, если уровень образования индуцированных нервных стволовых клеток или нервных клеток увеличивается на стадии 4.
Предпочтительно способ скрининга может состоять в скрининге индивидуально подобранного для пациента стимулятора регенерации или индивидуально подобранного для пациента ингибитора регенерации для нервной стволовой клетки или нервной клетки с использованием клетки, не являющейся нервной, выделенной у пациента.
Конкретно предложен способ лечения путем определения стимулятора регенерации или ингибитора регенерации для нервных клеток, подходящего для состояния или окружения индивидуального пациента, на основании индивидуального исследования. Соответственно, индивидуально подобранное терапевтическое средство может быть выбрано путем отбора лекарственного средства-кандидата в качестве стимулятора регенерации или ингибитора регенерации для нервных клеток в соответствии со способом скрининга, испытание лекарственного средства на пациентах с заболеваниями, обусловленными повреждением нервных клеток, и подтверждение терапевтических воздействий с последующим картированием и хранением. То есть путем комбинирования способа скрининга in vitro и способа подтверждения in vivo, индивидуально подобранные терапевтические средства для пациентов с заболеваниями, обусловленными повреждением нервных клеток, могут быть более эффективно подобраны и подтверждены.
В иллюстративном воплощении настоящего изобретения с помощью вышеописанного способа скрининга было подтверждено, что эффективность индукции в индуцированные нервные стволовые клетки увеличивалась приблизительно в два раза или выше при дополнительном введении гена HMGA2 по сравнению с индукцией при введении гена SOX2 или тому подобного, и, таким образом, было подтверждено, что белки HMGA2 можно использовать в качестве стимулятора регенерации нервных клеток.
В другом аспекте в настоящем изобретении предложен способ скрининга индивидуально подобранного терапевтического средства для нервных клеток, включающий: 1) получение изолированной клетки, не являющейся нервной; 2) индукцию образования индуцированной нервной стволовой клетки путем доставки в клетку, не являющуюся нервной, белка SOX2 или молекулы нуклеиновой кислоты, кодирующей белок SOX2; и белка HMGA2 или молекулы нуклеиновой кислоты, кодирующей белок HMGA2, либо увеличение экспрессии белка SOX2 и белка HMGA2 в клетке, не являющейся нервной; 3) дифференцировку индуцированной нервной стволовой клетки, полученной на стадии 2), в нервную клетку; и 4) обработку клетки, не являющейся нервной, образованной на стадии 3, веществом-кандидатом и определение, является ли вещество-кандидат терапевтическим средством для нервных клеток, подобранным для субъекта, от которого выделена клетка, не являющаяся нервной.
Конкретно для выбора индивидуального подобранного продукта нейронной терапии в соответствии с состоянием или окружением индивидуального пациента можно подтвердить и проверить, можно ли использовать клетки, не являющиеся нервными, для получения индуцированных нервных стволовых клеток в качестве индивидуально подобранного продукта нейронной терапии для субъекта, от которого имели происхождение клетки, не являющиеся нервной, путем подтверждения изменений в механизме, относящемся к регенерации нервных клеток, и в экспрессии белков, связанных с ней, путем обработки нервных стволовых клеток, индуцированных на стадии 2, или нервных клеток, образованных на стадии 3, веществом-кандидатом.
В другом аспекте в настоящем изобретении предложена композиция для стимуляции перепрограммирования клетки, не являющейся нервной, в индуцированную нервную стволовую клетку (iNSC), включающая белок HMGA2 или нуклеиновую кислоту, кодирующую белок HMGA2, в качестве активного ингредиента.
В качестве иллюстративного технического признака настоящего изобретения было подтверждено, что эффективность индукции из клеток, не являющихся нервными, в индуцированные нервные стволовые клетки и способность к пролиферации были значительно выше при увеличении экспрессии белка HMGA2 в сочетании с фактором SOX2, который общеизвестен в качестве транскрипционного фактора для дифференцировки нервных клеток, чем при перепрограммировании с использованием традиционного SOX2. Соответственно, белки HMGA2 и кодирующие их молекулы нуклеиновых кислот можно применять для стимуляции перепрограммирования клеток, не являющихся нервными, в нервные стволовые клетки.
В другом аспекте в настоящем изобретении предложена композиция для пролиферации клеток или композиция для ингибирования клеточного старения, содержащая белок HMGA2 или нуклеиновую кислоту, кодирующую белок HMGA2, в качестве активного ингредиента.
При использовании в настоящем документе термин "пролиферация клеток" включает увеличение числа клеток, и, соответственно, пролиферация клеток может сопровождать репликацию ДНК, деление клеток и увеличение различных клеточных компонентов, и скорость пролиферации клеток можно контролировать in vivo.
Кроме того, термин "клеточное старение" относится к процессу, включающему дегенерацию характеристик и функций клеток до момента гибели клетки или остановки пролиферации клетки. Известные причины старения включают ингибирование метаболизма метаболитами, изменение в клеточной поверхности, увеличение сшивания между молекулами цитоскелета, такими как коллаген, накопление в клетках молекул, разрушенных свободными радикалами, накопление ошибок в транскрипции и трансляции генетической информации, продолжительность жизни клетки, генетически программируемая летальными генами, ухудшение повреждений внутриклеточной ДНК и репарационной активности и т.д. При использовании в настоящем документе термин "старение" включает не только клеточное старение, но также старение тканей и живых организмов. В частности, старение стволовых клеток может сопровождать увеличение экспрессии ассоциированной со старением β-галактозидазы в стволовых клетках, увеличение размера стволовых клеток, уменьшение скорости пролиферации стволовых клеток, уменьшение периода пролиферации, снижение теломеразной активности или снижение потенциала дифференцировки стволовых клеток в соответствии с увеличением числа субкультур.
В примерах 11-20 настоящего изобретения было подтверждено, что HMGA2-трансдуцированные клетки, имеющие происхождение из крови пуповины человека (hUCBSC), не только показали сниженное изменение морфологии, но также показали уменьшение экспрессии SA-β-gal и поддержание пролиферации клеток. Напротив, когда HMGA2 ингибировал увеличение изменений в морфологии, клеточная пролиферация была также значительно снижена в сочетании с увеличением экспрессии SA-β-gal. Соответственно, было подтверждено, что гиперэкспрессия белка HMGA2 может стимулировать пролиферацию стромальных клеток, при этом ингибируя старение клеток. Кроме того, регулирование пролиферации, поддержания и старения стромальных клеток согласно настоящему изобретению может быть выполнено путем регулирования пролиферации стромальных клеток индукцией экспрессии белка HMGA2 посредством трансфекции стромальных клеток и поддержания потенциала дифференцировки и способности стволовых клеток, в результате чего предотвращается старение стромальных клеток. Таким образом, по мере увеличения числа субкультур в процессе культивирования старение стромальных клеток протекает быстрее, и, следовательно, может быть решена проблема снижения клеточного деления. Этот способ можно также применять к стволовым клеткам.
Далее настоящее изобретение описано более подробно со ссылкой на приведенные ниже примеры. Тем не менее, эти примеры предназначены только для иллюстративной цели, и изобретение не подразумевают как ограниченное этими примерами.
Пример получения 1: Культура клеток
(1) Мезенхимные стволовые клетки, имеющие происхождение из крови пуповины человека (hUCB-MSC), были получены от матерей в возрасте от 20 до 30 лет сразу после рождения доношенного ребенка, и использовали только образцы крови, собранной в пределах 24 часов с момента рождения. Образцы крови пуповины смешивали с раствором HetaSep (Stem Cell Technology, Ванкувер, Канада) в соотношении 5:1 (об./об.), а затем инкубировали при комнатной температуре до истощения эритроцитов. При инкубации супернатант собирали и мононуклеарные клетки собирали с помощью центрифугирования в градиенте плотности фиколла (GE Healthcare Life Sciences, Питтсбург, Пенсильвания) при 2500 об/мин в течение 20 минут. Клетки дважды промывали фосфатно-солевым буфером (ФСБ) и высевали на культуральные чашки со средой для выращивания субстрат-2 для выращивания эндотелиальных клеток (Gibco BRL, Гранд-Айленд, Небраска), содержащей 10% фетальную бычью сыворотку (ФБС; Gibco BRL). Протоколы выделения и исследования выполняли при одобрении Экспертного совета организации (ЭСО) больницы Бораме и ЭСО Национального университета Сеула (1109/001-006).
(2) В то же время, фибробласты кожи человека (hDF, С-013-5С) приобретали у компании Life Technologies и культивировали в среде-2 для выращивания фибробластов (Gibco BRL), содержащей 10% ФБС.
(3) Нервные стволовые клетки человека Н9-происхождения (H9-hNSC, NA800-100) приобретали у компании Gibco и культивировали в базовой среде KnockOut DMEM/F12, содержащей добавку для нервных клеток StemPro, базовый фактор роста фибробластов (FGF; fibroblast growth factor) и рекомбинантные белки эпидермального фактора роста (EGF; epidermal growth factor).
(4) Стромальные клетки, имеющие происхождение из крови пуповины человека, выделяли и культивировали, как описано ниже. Конкретно с целью удаления эритроцитов из крови пуповины (больница Сеульского Государственного Университета) кровь пуповины смешивали с раствором HetaSep (Stem Cell Technology, Ванкувер, Канада) в соотношении 5:1 (об./об.), а затем инкубировали при комнатной температуре в течение 30 минут. Супернатант осторожно собирали, и мононуклеарные клетки собирали путем добавления раствора фиколла и центрифугировали при 2500 об/мин в течение 20 минут. Были получены только изолированные клетки, дважды промывали ФСБ и культивировали в среде ЕМЕМ (Gibco), содержащей гепарин, аскорбиновую кислоту, рекомбинантный эпидермальный фактор роста человека (rhEGF), гидрокортизон, фактор роста эндотелия сосудов (VEGF), рекомбинантный фактор роста фибробластов человека (rhFGF-B), рекомбинантный длинный R инсулиноподобный фактор роста 1 (R3-IGF-1), сульфат гентамицина, амфотерицин-В (GA-1000)) и 10% ФБС (Gibco), при концентрации 2×105 клеток/см2. Через 4 суток после инкубации клетки, не прикрепившиеся ко дну, удаляли и субкультуры проводили, когда 80% клеток были конфлюэнтны.
Пример получения 2: Получение индуцированных нервных стволовых клеток (hiNSC) из фибробластов кожи человека путем трансдукции
Плазмиды SOX2, HMGA2, CMYC и LIN28 трансфицировали в клетки 293Т с плазмидами VSV-G и gag/pol и реагентом трансфекции Fugene 6 (Roche, Индианаполис, Индиана). Вирусы собирали через 48 часов и через 72 часа после трансфекции и нагружали 5 мкг/мл полибрена (Sigma, Ronkonkoma, NY) для трансдукции генов, либо отдельно, либо в комбинации по меньшей мере двух генов, в клетки hDF, hUCB-MSC и hUCB-CD34+MNC. После трансдукции клетки дважды промывали ФСБ для удаления вирусов и культивировали в ростовой среде для пролиферации.
Для индукции нервной стволовой клетки среду заменяли средой для поддержания ReNcell NSC (Millipore, Биллерика, Массачусетс), представляющей собой среду для индукции нервных стволовых клеток, содержащую bFGF (Sigma) и EGF (Sigma). Клетки hiNSC субкультивировали с помощью аккутазы (Gibco BRL).
Пример 1: Выделение iNSC и подтверждение их характеристик
hDF трансфицировали в hiNSC на покровном стекле, покрытом поли-L-орнитином (PLO) и фибронектином (FN) с фидерными клетками STO, используя ретровирусный SOX2. SOX2- и NSC-подобные колонии образовывались из SOX2-трансдуцированных hDF в пределах от 2 недель до 3 недель трансфекции.
Колонии индуцированных нервных стволовых клеток выделяли и стабилизировали с помощью повторных субкультур и культуры нейросферы. Для прикрепления индуцированных нервных стволовых клеток покровное стекло покрывали PLO/FN и распределяли на нем 5×104 индуцированных нервных стволовых клеток. В течение 24 часов клетки фиксировали 4% параформальдегидом (PFA) в течение 20 минут, а затем пермеабилизировали 0,3% Тритоном Х-100 в ФСБ в течение 10 минут. Клетки блокировали 5% нормальной сывороткой козы (NGS) в течение 1 часа и обрабатывали первичными антителами при концентрации 1:100 в течение ночи. На следующие сутки клетки инкубировали со вторичными антителами при концентрации 1:1000 в течение 1 часа. Ядра окрашивали DAPI и высушивали после закрепления.
В результате SOX2-трансдуцированные iNSC имели сходную морфологию с NSC Н9-происхождения (H9-NSC) и проявляли экспрессию NSC-специфических маркеров, таких как РАХ6, нестин, виментин и SOX2 (фиг. 1A-1D и S1A).
Пример 2: Анализ профиля экспрессии микроРНК в SOX2-трансдуцированных hiNSC
Пример 2-1: Микроматричный анализ микроРНК
Суммарную РНК экстрагировали из клеток с использованием реагента Тризола, и с целью получения флуоресцентно меченных микроРНК 100 нг образца суммарной РНК метили и гибридизовали с использованием набора для полного мечения и гибридизации микроРНК Agilent. Сигналы меченых микроРНК сканировали с помощью микроматричного сканера Agilent. Необработанные данные вычитали с использованием программы (Agilent Feature Extraction Software (v11.0.1.1)) и анализировали и визуализировали с использованием статистического языка R версия 2.15.0.
Пример 2-2: Результаты анализа профиля экспрессии микроРНК
Профили микроРНК hDF, H9-NSC и SOX2-трансдуцированных hiNSC определяли посредством микроматричного анализа, как в примере 2-1.
В результате было подтверждено, что паттерн экспрессии микроРНК SOX2-трансдуцированных hiNSC имел большее сходство с паттерном экспрессии H9-NSC, чем с паттерном экспрессии hDF (на фиг. 1Е).
Конкретно было подтверждено, что уровни экспрессии микроРНК, специфичных нервным клеткам, таких как miR-9-5p, miR-9-3р и miR-124, играющих ключевые роли в преобразовании фибробластов в функциональные нервные клетки, претерпевали большую повышающую регуляцию в клетках Н9-NSC и SOX2-трансдуцированных hiNSC, чем в hDF.
Кроме того, что касается let-7, который, как известно, играет роль в контроле поддержания и самообновления NSC, было подтверждено, что уровни экспрессии всего семейства let-7/miR-98 претерпевали большую понижающую регуляцию в клетках H9-NSC и SOX2-трансдуцированных hiNSC, чем в hDF (фиг. 1F и 1J).
Тем не менее, значительное изменение экспрессии микроРНК, специфичных для эмбриональных стволовых клеток, семейства miR-302/367 не было обнаружено между hDF, H9-NSC и SOX2-трансдуцированными hiNSC, тогда как значительная экспрессия была обнаружена в эмбриональных стволовых клетках человека (hESC).
Пример 3: Анализ эффективности перепрограммирования, пролиферации и самообновления iNSC с помощью Let-7b
Пример 3-1: Анализ эффективности перепрограммирования iNSC за счет активности микроРНК
С целью подтверждения, стимулирует ли активность микроРНК перепрограммирование hDF в iNSC, miR-9-5p, miR-9-3p, miR-124, анти-let-7b, let-7b, miR-CTL и анти-miR-CTL трансфицировали во время перепрограммирования с SOX2.
Конкретно микроРНК подвергали гиперэкспрессии с использованием имеющихся в продаже hsa-let-7b (Invitrogen, РМ11050), miR-124-3p (Invitrogen, PM10691), miR-9-5p (Invitrogen, PM10022), miR-9-3р (Invitrogen, PM13072) и анти-let-7b (Invitrogen, AM11050) и использовали соответствующий отрицательный контроль предшественника пре-микроРНК (Invitrogen, АМ17110) и отрицательный контроль ингибитора пре-микроРНК (Invitrogen, АМ17010).
Для анализа эффективности образования колоний 2×104 клеток SOX-2-трансдуцированных hDF высевали в 24-луночный планшет перед трансфекцией. Трансфекцию выполняли с использованием 50 нМ hsa-let-7b, miR-124-3р, miR-9-5p, miR-9-3р и анти-let-7b (сутки 0) и снова трансфицировали через 3 суток (сутки 3).
В результате было подтверждено, что SOX2-трансдуцированные клетки hDF вероятнее преобразовывались в нейроноподобные клетки, чем в NSC-подобные колонии. Эффективность образования РАХ6/нестин-положительных колоний незначительно снижалась или совсем не изменялась в клетках, трансфицированных miR-124, miR-9-5p или miR-9-3р, по сравнению с клетками, трансфицированными miR-CTL.
Тем не менее, гиперэкспрессия let-7b снижала эффективность перепрограммирования, тогда как ингибирование let-7b повышало эффективность перепрограммирования по меньшей мере в 3,5 раза по сравнению с анти-miR-CTL (фиг. 11).
Пример 3-2: Способность hiNSC к пролиферации под действием let-7b
С целью подтверждения того, контролирует ли микроРНК let-7b пролиферацию hiNSC, let-7b трансфицировали в SOX2-трансдуцированные hiNSC, и пролиферацию клеток измеряли с помощью мечения делящихся клеток 5-бром-2-деоксиуридином (BrdU).
Конкретно с целью измерения скорости пролиферации клетки iNSC окрашивали 5-бром-2-деоксиуридином (BrdU; Sigma), как описано ниже. Кратко, 10 мкМ BrdU добавляли в клеточную культуральную среду и инкубировали в течение 5 часов при 37°С. Затем клетки отмывали ФСБ и фиксировали 4% PFA в течение 10 минут при комнатной температуре. Для пермеабилизации использовали натрийцитратный буфер в течение 15 минут при 85°С и клетки инкубировали с блокирующим раствором (5% NGS). Затем клетки инкубировали в течение ночи при 4°С с первичными антителами к BrdU, разведенными в блокирующем растворе (Abcam, Кембридж, Массачусетс). Клетки обрабатывали вторичными антителами Alexa-488 в течение 1 часа. Для окрашивания ядер DAPI разводили до 1:1000 в ФСБ и инкубировали с клетками в течение 10 минут. Изображения снимали на конфокальном микроскопе (Eclipse ТЕ200, Nikon, Токио, Япония).
В результате было подтверждено, что процент BrdU-положительных клеток был снижен, и, в частности, трансфекция let-7b дозозависимо снижала скорость пролиферации hiNSC (фиг. 6А и 6В).
Пример 3-3: Способность к самообновлению hiNSC под действием let-7b
С целью подтверждения, регулирует ли let-7b самообновление SOX2-трансдуцированных hiNSC, проводили анализ образования нейросфер.
Конкретно после обработки микроРНК 2000 клеток культивировали в чашках для неприкрепленных культур с целью образования первичных нейросфер. Клетки первичных нейросфер диссоциировали на отдельные клетки с использованием аккутазы, затем пересевали при клональной плотности в неприкрепленных культурах с образованием вторичных нейросфер. Число и размер вторичных нейросфер считали и измеряли после 7 суток культуры.
В результате было подтверждено, что размер let-7b-трансфицированных hiNSC был меньше, чем размер miR-CTL-трансфицированных hiNSC, а также, что в результате увеличения let-7b во время субклонирования вторичные нейросферы почти не образовывались (фиг. 6С-7Е).
Пример 4: Активация перепрограммирования hiNSC путем одновременной трансдукции SOX/HMGA2
Поскольку в примере 3 было подтверждено, что гиперэкспрессия let-7b снижала эффективность перепрограммирования hiNSC, исследовали, может ли гиперэкспрессия MYC и LIN28 (которые, как известно, ингибируют экспрессию let-7b) и HMGA2 (экспрессию которого, как известно, ингибирует let-7b) повышать эффективность перепрограммирования hiNSC.
Пример 4-1: Подтверждение пролиферации клеток HMGA2
Чтобы исследовать, увеличивает ли CMYC, LIN28 и HMGA2 в комбинации с SOX2 пролиферацию клеток по сравнению с гиперэкспрессией одного SOX2, был проведен МТТ анализ (анализ по оценке жизнеспособности клеток с 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромидом (МТТ), основанный на определении активности дегидрогеназы митохондрий). Конкретно 1×104 клеток высевали в 24-луночный планшет. После 48 часов инкубации в среду добавляли 50 мкл исходного раствора МТТ (5 мг/мл). После 4 часов инкубации при 37°С среду, содержащую раствор МТТ, удаляли. В целях солюбилизации кристаллов формазана добавляли ДМСО, а затем раствор переносили в 96-луночный планшет. Поглощение при длине волны 540 нм измеряли с помощью считывающего устройства для микропланшетов EL800 (BIO-ТЕК Instruments, Винуски, Вермонт).
В результате было подтверждено, что среди них HMGA2 обладает по меньшей мере способностью к пролиферации, и эта способность была меньше CMYC на 32% и меньше LIN28 на 17% (фиг. 2А).
Пример 4-2: Подтверждение повышения эффективности перепрограммирования iNCS под действием HMGA2
С целью подтверждения, стимулируют ли гиперэкспрессии CMYC, LIN28, и HMGA2 в комбинации с SOX2 перепрограммирование hiNSC по сравнению с гиперэкспрессией одного SOX2, измеряли эффективность образования РАХ6/нестин-положительных колоний для каждого случая соответственно.
В результате было подтверждено, что гиперэкспрессия HMGA2 в сочетании с SOX2 значительно повышает эффективность перепрограммирования по сравнению с hiNSC (фиг. 2С), и одновременная гиперэкспрессия SOX2/HMGA2 уменьшает время, требующееся на образование РАХ6/нестин-положительных колоний, с 17 суток до 7,4 суток (фиг. 2В).
Пример 4-3: Подтверждение изменения иммунофенотипа под действием HMGA2
С целью подтверждения индукции изменения иммунофенотипа на ранней стадии перепрограммирования ее подтверждали с помощью сортировки флуоресцентно-активированных клеток (FACS; fluorescence activated cell sorting).
В результате наблюдали, что только клетки с гиперэкспрессией SOX2/HMGA2 показали изменения в клеточной популяции с CD44-положительных на CD44-отрицательные приблизительно в 10% суммарного числа клеток через 7 суток после трансфекции, и одновременно приблизительно 7% клеточной популяции показало сдвиг с CD184-отрицательного на CD184-положительный (фиг. 2D).
Большинство клеток hiNSC и H9-NSC показало CD44-отрицательные и CD184-положительные популяции клеток (фиг. 7А), и SOX2/HMGA2-трансдуцированные hiNSC также показали морфологические характеристики, подобные характеристикам SOX2-трансдуцированных hiNSC и H9-NSC, и экспрессию NSC-специфических маркеров, таких как РАХ6, нестин, SOX2, Ki67 и HMGA2 (фиг. 2Е).
Пример 4-4: Оценка уровня перепрограммирования транскриптома под действием HMGA2
С целью оценки уровня перепрограммирования транскриптома под действием HMGA2 сравнительные данные общей экспрессии генов анализировали с помощью микроматричного анализа, и для оценки микроматричных данных проводили количественную ПЦР в реальном времени (qRT-PCR).
В результате было подтверждено, что общая тепловая карта генома и попарные диаграммы разброса показали, что hiNSC имеют близкое подобие H9-NSC, но отличаются от родительских hDF (фиг. 7В и 7С). SOX2, HMGA2, РАХ6, нестин, OLIG2, MSI1 и GLAST индуцировали и в SOX2-, и в SOX2/HMGA2-трансдуцированных iNSC, и уровни их экспрессии были сравнимыми с уровнями H9-NSC (фиг. 2F).
Пример 4-5: Анализ состояния метилирования промотора SOX2
С целью анализа состояния метилирования ДНК SOX2 в hDF, H9-NSC и SOX2- и SOX2/HMGA2-трансдуцированных hiNSC неметилированные тимины преобразовывали в цитозины с использованием набора EZ DNA Methylation-Gold (Zymo Research, Ирвин, Калифорния).
Конкретно неметилированные цитозины в CpG-островках преобразовывали в урацил посредством интеграции тепловой денатурации и обработки бисульфатом натрия с реагентом СТ-конверсии. Поскольку ДНК выделяли после бисульфитной конверсии ДНК, конвертированную ДНК десульфонировали, а затем очищали и элюировали. Затем ДНК, модифицированную бисульфитом, сразу амплифицировали с помощью ПЦР и хранили при температуре ниже -20°С. Для амплификации ДНК, конвертированной бисульфитом, праймеры конструировали на MethPrimer (http://www.urogene.org/methprimer) и проводили ПЦР. Последовательности праймеров приведены ниже:
Sox2 смысловой

Sox2 антисмысловой

Полученные продукты ПЦР лигировали с векторной системой I pGEM Т-Easy (Promega, Madison, WI). Затем плазмидные ДНК клонировали в бактериях (DH5α). Плазмидные ДНК, экстрагированные из бактериальных клонов, анализировали посредством секвенирования с обратным праймером М13

В результате было подтверждено, что промотор SOX2 был гипометилирован в hiNSC подобно H9-NSC, что позволяет предположить, что SOX2 был транскрипционно активирован (фиг. 2G). Таким образом, было подтверждено, что HMGA2 играл роль модулятора хроматина путем стимуляции гипометилирования промотора SOX2.
В заключение пример позволяет предположить, что HMGA2 в качестве мишени let-7b значительно повышает эффективность и время SOX2-индуцированного перепрограммирования в hiNSC, и SOX2/HMGA2-трансдуцированные hiNSC проявляют сходные характеристики с H9-NSC по сигнатуре маркеров клеточной поверхности, транскрипционному уровню, паттерну метилирования и т.д.
Пример 5: Подтверждение ингибирования пролиферации и самообновления hiNSC посредством понижающей регуляции HMGA2
С целью подтверждения, контролирует ли HMGA2 пролиферацию hiNSC, hiNSC трансфицировали HMGA2-нацеленной малой интерферирующей РНК (миРНК) (siHMGA2), и пролиферацию клеток измеряли путем мечения деления клеток BrdU, конкретно с использованием имеющихся в продаже миРНК (Dharmacon, ON Target plus SMART pool, Cat #L-013495-00-0005, Lafayette, CO) в качестве ингибитора HMGA2 и ненацеленной миРНК (Dharmacon, ON Target plus SMART pool, Cat # D-001810-01) в качестве контроля. Клетки высевали в 24-луночный планшет при концентрации 1×104, и 50 нМ миРНК трансфицировали с реагентом трансфекции Dharmafect (Dharmacon), добавленном в культуральную среду без антибиотиков.
В результате понижающая регуляция HMGA2 резко снижала процентное содержание BrdU-положительных клеток (фиг. 8А и 8В). Кроме того, было подтверждено, что siHMGA2-трансфицированные hiNSC значительно уменьшали размер нейросфер, а также уменьшали самообновление, что подтверждено числом и процентным содержанием клеток, которые могут вызывать образование вторичных нейросфер среди первичных нейросфер (фиг. S4C-S4E). Взятые вместе, эти данные позволяют предположить, что понижающая регуляция HMGA2 посредством миРНК против HMGA2 ингибирует пролиферацию и самообновление hiNSC.
Пример 6: Подтверждение мультипотентности hiNSC
Для дифференциации нервных клеток hiNSC высевали при плотности 1000 на каждое из покровных стекол, покрытых поли-L-орнитином/фибронектином, в 24-луночный планшет, содержащий среду для поддержания iNSC (среда для поддержания ReNcell NSC (Millipore)). Через 24 часа среду заменяли на Neurocult (Stem Cell Technology) для случайной дифференцировки. После 1 недели Neurocult среду заменяли тремя средами для индукции специфичных линий (нейронов, астроцитов и олигодендроцитов).
В то же время, после индукции дифференцировки iNSC подтверждали маркерами клеточных линий с помощью иммуноцитохимии.
Пример 6-1: Подтверждение потенциала дифференцировки в нервные клетки
В качестве среды индукции нервных клеток использовали смесь 1:1 среды DMEM/F12 (Gibco BRL) и Neurobasal (Gibco BRL), содержащую B27 (Gibco BRL), Gmax (Gibco BRL), ретиноевую кислоту (Sigma), аскорбиновую кислоту (Sigma), нейротрофический фактор головного мозга (BDNF; brain-derived neurotrophic factor) (Peprotech, Rocky Hill, NJ), глиальный нейротрофический фактор (GDNF; Glial Cells Derived Neurotrophic Factor) (Peprotech) и форсколин (Sigma).
В результате дифференцировки от 10 суток до 15 суток после нейронной индукции SOX2/HMGA2-трансдуцированных hiNSC была подтверждена экспрессия маркеров незрелых нервных клеток: нейрон-специфического бета-тубулина класса III (TUJ1), даблкортина (DCX), и нервноклеточнных промежуточных микрофиламентов: α-интернексина и нейрофиламента (NF) (фиг. 3А).
Кроме того, в результате клонального анализа для оценки потенциала самообновления hiNSC было подтверждено, что дифференцировка нервных клеток была индуцирована NF, и α-интернексин окрашивался в клонах при множественных пересевах. После периода от 10 суток до 25 суток нейронной индукции МАР2 (маркер зрелых нервных клеток), тирозингидролаза (ТН) (маркер дофаминергических и норадренергических нейронов) и холинацетилтрансфераза (ChAT) экспрессировались на подобном уровне по сравнению с уровнем H9-NSC (фиг. 3А и 9А).
Пример 6-2: Подтверждение потенциала дифференцировки в астроциты
В качестве среды индукции астроцитов использовали среду DMEM (с высоким содержанием глюкозы), содержащую N2 (Gibco BRL), Gmax и 1% ФБС.
В результате было подтверждено, что SOX2/HMGA2-трансдуцированные hiNSC образовывали клетки, положительные по глиальному фибриллярному кислому белку (GFAP), что, таким образом, подтверждает дифференцировку hiNSC в астроциты (фиг. 3А).
Пример 6-3: Подтверждение потенциала дифференцировки в олигодендроциты
Существует два различных типа сред индукции олигодендроцитов. Во-первых, клетки культивировали в среде DMEM/F12 с добавлением N2, MEM раствора неэссенциальных аминокислот (MEM NEAA; Gibco BRL), гепарина (Sigma), RA, SHH (Peprotech) и B27 в течение 2 недель, а затем среду заменяли средой DMEM/F12 с добавлением N2, В27, MEM NEAA, Т3, цАМФ (Sigma), PDGF (Peprotech), IGF (R&D) и NT3 (Sigma) в течение 2 недель.
В результате было подтверждено, что двойные положительные клетки по O4- и OLIG2 (маркеры олигодендроцитов) обнаруживали после периода времени от 20 суток до 35 суток индукции в направлении олигодендроглиальной судьбы (фиг. 3А).
Пример 7: Анализ электрофизиологических характеристик hiNSC
С целью оценки функциональности SOX2/HMGA2-трансдуцированных hiNSC электрофизиологические свойства тестировали посредством считывания методом пэтч-кламп (фиксации потенциалов). Конкретно регистрации пэтч-клампа в целых клетках в нервной клетке, имеющих происхождение от iNSC, проводили с использованием усилителя ЕРС 10 USB (НЕКА Electronik, Лампрехт, Германия) при комнатной температуре (22±1°С). Камеру для регистрации заполняли непрерывно текущим раствором Тироде (скорость тока 10 мл/мин), и контактные электроды изготавливали из боросиликатных стеклянных капилляров с помощью пуллера РС-10 (Narishige Company). Сопротивление электродов составляло от 4 МОм до 7 МОм при заполнении его раствором для пипетки. Данные собирали и анализировали с использованием программы Pulse версия 8.67 (НЕКА Electronik) и программы Origin 6.1 (MircoCal). Ток фильтровали при 3 кГц с использованием четырехпольного фильтра Bessels и оцифровывали при 10 кГц. Раствор Тироде содержал 143 мМ NaCl, 5,4 мМ KCl, 0,5 мМ MgCl2, 1,8 мМ CaCl2, 0,5 мМ NaHPO4, 10 мМ глюкозу и 5 мМ 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту (ГЭПЭС); и рН доводили до 7,5 NaOH. Раствор в пипетке содержал 150 мМ KCl, 1,0 мМ MgCl2, 10 мМ ГЭПЭС, 5 мМ ЭГТА, 2 мМ Mg-АТФ, и рН доводили до 7,2 NaOH. Лидокаин (0,1%) использовали для блокирования тока Na.
В результате было подтверждено, что SOX2/НМОА2-трансдуцированные hiNSC могут генерировать различные потенциалы действия, когда дают начало нервной клетким, экспрессирующим ток натрия. Ток натрия (или внутренний ток) и потенциалы действия были ингибированы блокатором натриевых каналов лидокаином и восстанавливались до нормального состояния после отмывки (фиг. 3B-3D и 9B-9D). Эти данные позволяют предположить, что нервные клетки, дифференцированные из hiNSC, обладают функциональными мембранными свойствами и активностями нормальных нервных клеток.
Пример 8: Тест на дифференцировку и выживаемость hiNSC в модели на животных
Пример 8-1: Трансплантация CMDil-меченых hiNSC
SOX2/HMGA2-трансдуцированные hiNSC открепляли с использованием аккутазы и суспендировали в ФСБ. hiNSC метили CM-Dil (молекулярные зонды) для прослеживания после инъекции. hiNSC инкубировали с CM-Dil в водяной бане на 37°С в течение 15 минут, а затем при 4°С в течение 10 минут. CM-Dil-меченые hiNSC суспендировали в ФСБ при плотности 1×105 клеток/мкл. CM-Dil-меченые hiNSC трансплантировали в субвентрикулярную зону (SVZ; subventricular zone) с использованием стереотаксического прибора и ультра-микронасоса (World Precision Instruments, Сарасота, Флорида). После трансплантации волосистую часть кожи головы закрывали швом, и животным давали возможность восстановиться от анестезии с получением, таким образом, модели на 4-недельных мышах.
Пример 8-2: Криосрезы для иммуногистохимии (ИГХ)
Через три недели после трансплантации головной мозг изолировали из мышиных моделей и погружали в 4% PFA на ночь, а затем переносили в 30% сахарозу на 48 часов. Затем изолированные головные мозги заливали смесью для пропитывания (реактив OCT; Sakura Finetek, Токио, Япония), держали при - 70°С в течение ночи и выполняли криосекцию на криостате (СМ 3050, Leica, Вецлар, Германия). Конкретно ткани инкубировали с 0,05% Тритоном Х-100 в течение 20 минут. Ткани инкубировали с 5% NGS для блокирования неспецифического связывания антитела. Затем ткани инкубировали с первыми антителами при коэффициенте разведения 5% NGS в течение ночи при 4°С. Ткани инкубировали со вторыми антителами, меченными Alexa 488 или Alexa 594 (1:1000), в течение 1 часа при комнатной температуре. Ядра окрашивали DAPI в течение 10 минут. Изображения фотографировали с использованием конфокального микроскопа (Nikon).
В результате трансплантированные клетки определяли с помощью иммунологического окрашивания и определенные клетки подвергали одновременному окрашиванию маркерами трех различных линий происхождения. Иммунологическое окрашивание выявило, что трансплантированные hiNSC оказались положительными по TUJ1 (нейроны), GFAP (астроциты) и МВР (олигодендроциты), которые совместно локализовались с флуоресценцией CMDN1 (фиг. 3Е и 9Е). Взятые вместе, эти данные позволяют предположить, что SOX2/HMGA2-трансдуцированные hiNSC способны выживать и дифференцироваться в нейроны, астроциты и олигодендроциты in vivo.
Пример 9: Эффективное перепрограммирование различных соматических клеток в hiNSC посредством HMGA2
Пример 9-1: перепрограммирование iNSC hUCB-MSC посредством HMGA2
Поскольку клетки крови пуповины человека (hUCB) обладают преимуществами в том, что они могут быть получены неинвазивным путем и сохранять минимальные генетические мутации, оценивали, можно ли использовать клетки hUCB в качестве источника для перепрограммирования iNSC.
Популяции мезенхимных стволовых клеток (MSC) были изолированы из hUCB, как описано в Примере 1. После трансдукции SOX2/HMGA2 в hUCB-MSC колонии hiNSC hUCB-MSC-происхождения появлялись в период времени от 7 суток до 12 суток после трансфекции, и иммуноцитохимическим методом было доказано, что они представляют собой iNSC, положительно окрашиваемые РАХ6 и нестином (фиг. 4А). Описано, что MSC являются положительными по CD73 и CD105, но отрицательными по гемопоэтическим маркерам CD34, CD45 и HLA-DR. Клетки hiNSC hUCB-MSC-происхождения были отрицательными по CD73 и CD105, что позволяет предположить, что сигнатура маркеров клеточной поверхности изменилась (фиг. 10А).
Кроме того, было подтверждено, что экспрессия HMGA2 была значительно выше в клетках hUCB-MSC по сравнению с hDF (фиг. 10В). SOX2/HMGA2-трансдуцированные клетки hUCB-MSC вызывали 3-4-кратное увеличение числа образующихся РАХ6/нестин-положительных колоний по сравнению с SOX2-трансдуцированными hUCB-MSC (фиг. 10С).
Пример 9-2: Различие в способности к пролиферации клеток H9-NSC и hiNSC
С целью подтверждения различия в способности к пролиферации между клетками H9-NSC и hiNSC из различных источников клеток и различной комбинацией трансгенов скорости пролиферации H9-NSC и hiNSC измеряли с помощью анализа уровня кумулятивных удвоений популяции (CPDL). Конкретно скорости пролиферации определяли на основании уровня кумулятивных удвоений всей популяции с использованием уравнения CPDL=ln(Nf/Ni)ln2, где Ni представляет собой исходное число высеянных клеток, Nf представляет собой конечное число собранных клеток, и ln представляет собой натуральный логарифм.
5×104 клеток инокулировали в трех повторах в 6-луночные планшеты и субкультивировали каждые 4 суток. С целью определения только живых клеток конечное число клеток считали с использованием трипанового синего, и 5×104 клеток снова инокулировали. Для вычисления уровня кумулятивных удвоений популяции вычисляли удвоение популяции для каждого пересева и прибавляли к уровню удвоений популяции предыдущего пересева.
В результате было подтверждено, что нет значительной разницы в способности к пролиферации между линиями клеток H9-NSC и hiNSC, и это позволяет предположить, что линии клеток H9-NSC и hiNSC обладают сходной способностью к пролиферации (фиг. 10D).
Пример 9-3: Подтверждение способности к индукции стареющих клеток hUCB-MSC в нервные стволовые клетки
С целью исследования роли let-7b/HMGA2 в эффективности перепрограммирования было изучено, могут ли стареющие клетки hUCU-MSC быть индуцированы в нервные стволовые клетки путем трансдукции одного SOX2 или в комбинации с факторами нацеливания let-7. С этой целью стареющие клетки hUCB-MSC, старение которых было подтверждено с помощью анализа ассоциированной со старением (SA)-β-галактозидазы, трансдуцировали SOX2, SOX2/CMYC, SOX2/LIN28 и SOX2/HMGA2 (фиг. 4В).
Для анализа галактозидазы в 6-луночный планшет высевали hUCB-MSC и инкубировали до тех пор, пока популяция не достигла от 40% до 50%, дважды промывали ФСБ и фиксировали 0,5% глутаральдегидом в ФСБ в течение 5 минут при комнатной температуре. Клетки промывали ФСБ, содержащим 1 мМ MgCl2 (рН 7,2), и инкубировали с раствором X-gal (1 мг/мл X-gal, 0,12 мМ K3Fe[CN]6 (феррицианид калия), 0,12 мМ K4Fe[CN]6 (ферроцианид калия) и 1 мМ MgCl2 в ФСБ, рН 6,0) в течение ночи при 37°С. На следующие сутки фотографировали изображения под микроскопом (IX70, Olympus, Japan).
Комбинация между SOX2/CMYC и SOX2/LIN28 приводила в результате к морфологическим изменениям, но не обладала способностью к образованию колоний hiNSC, и было явно показано, что только гиперэкспрессия SOX2/HMGA2 стимулирует образование колоний hiNSC (фиг. 4В). Гиперэкспрессия SOX2/HMGA2 приводила к образованию от 2 до 4 колоний из 1×105 стареющих hUCB-MSC (эффективность конверсии от 0,004% до 0,008%) через три недели после конверсии (фиг. 4С).
Пример 10: Перепрограммирование hiNSC посредством CD34+ клеток крови пуповины
Пример 10-1: Выделение и очистка CD34+ клеток крови пуповины
Выделение клеток CD34+ проводили с помощью системы магнито-активированного клеточного сортинга на микрогранулах CD34 (MACS; microbead sorting system). Конкретно 50 мкл микрогранул CD34 (#130-046-703, Miltenyi Biotech) инкубировали с мононуклеарными клетками (приблизительно 1×108), собранными из крови пуповины с помощью центрифугирования в градиенте плотности Lymphoprep (ProteoGenix, Portland, OR) при температуре от 2 до 8°С в течение 30 минут, и посредством этого магнитно метили клетки CD34+. Суспензию мононуклеарных клеток пропускали через сортер MACS с магнитным полем после присоединения колонки MACS таким образом, что только магнитно-меченые клетки CD34+ могут удерживаться внутри колонки. После удаления колонки из сортера MACS буферный раствор выталкивали под действием давления, выделяя, таким образом, удерживаемые клетки CD34+. Клетки CD34+ культивировали в среде Дульбекко, модифицированной по способу Исков (IMDM), содержащей 10% ФБС, 50 нг/мл SCF, 20 нг/мл IL-6, 50 нг/мл ТРО и 100 нг/мл Flt3.
Эффективность очистки клеток CD34+ измеряли с помощью проточной цитометрии, используя антитела анти-CD34-ФИТЦ (флуоресцеинизотиоцианат) (Miltenyi Biotech), и в результате было подтверждено, что клетки CD34+ чистоты 84,15% выделены и очищены (фиг. 4Е и 27).
Пример 10-2: Подтверждение перепрограммирования hiNSC с помощью клеток CD34+ пуповины человека
Для стимуляции цитокинеза клетки hUCB-CD34+ культивировали с цитокинами (SCF, Flt3L, ТРО и IL-6) в течение 3 суток и трансдуцировали SOX2/HMGA2 с помощью ретровируса (фиг. 4D). Затем клетки высевали на фидер вплоть до 10 суток - 14 суток после трансдукции и колонии iNSC наблюдали в состоянии NSC. Результаты иммуноцитохимического окрашивания выявили, что hUCB-CD34+ iNSC имели положительные экспрессии РАХ6, SOX2 и нестина. Дополнительно эти клетки hUCB-CD34+ iNSC обладали способностью к развитию в нейроны или в астроциты (фиг. 4F). Одного SOX2 было достаточно для образования hUCB-CD34+ iNSC, но показана его очень низкая эффективность. Клетки hUCB-CD34+, совместно экспрессирующие SOX2 и HMGA2, показали увеличение от 10- до 20-кратной частоты образования РАХ6/нестин-положительных колоний (фиг. 10Е).
В заключение, эффективное прямое перепрограммирование посредством синергического взаимодействия между SOX2 и HMGA2 обеспечивает перепрограммирование не только стволовых клеток, но также различных соматических клеток, таких как клетки крови, в hiNSC.
Пример 11: Подтверждение увеличения экспрессии белка HMGA2 в трансфицированных клетках hUCBSC
Пример 11-1: Трансфекция для гиперэкспрессии HMGA2
С целью проверки роли белка HMGA2 в дифференцировке и старении стромальных клеток, имеющих происхождение из крови пуповины человека (hUCBSC), клетки hUCBSC на ранней стадии в ходе 8 или менее генераций трансфицировали HMGA2.
Сначала последовательность HMGA2 клонировали в плазмидном ретровирусном векторе рМХ. Плазмиду HMGA2 трансфицировали в клетки 293Т в сочетании с плазмидами VSV-G и gag/pol. Вирусные последовательности собирали через 48 часов и 72 часа после трансфекции и использовали для трансфекции hUCBSC в присутствии 5 мкг/мл полибрена. Измеряли эффективность трансдукции, и показали, что она составляет 80% или выше, как показано на фиг. 12.
Пример 11-2: Иммуноцитохимический анализ
В стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), на ранней стадии в ходе 8 или менее генераций трансфицировали HMGA2, полученный в Примере 11-1, увеличение экспрессии белка HMGA2 подтверждали с помощью иммуноцитохимического анализа, и результаты приведены на фиг. 13.
Пример 11-3: Микроматрица
В стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC) на ранней стадии, в ходе 8 или менее генераций, трансфицированных HMGA2, полученных в Примере 11-1, увеличение экспрессии белка HMGA2 было подтверждено с помощью микроматричного анализа, и результаты представлены на фиг. 14.
Пример 11-4: Измерение уровня экспрессии HMGA2 в соответствии с ходом пассажей субкультивирования
В стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), трансдуцированных HMGA2, полученных в примере 11-1, уровень экспрессии HMGA2 в соответствии с ходом субкультур подтверждали с помощью ПЦР.
В соответствии с протоколом, рекомендованном изготовителем, суммарную РНК экстрагировали, используя реагент тризол™ (Invitrogen, США), а затем к экстракту добавляли праймер олиго-dT и премикс Accupower RT (Bioneer, Корея) для синтеза кДНК. ПЦР проводили в соответствии с протоколом, рекомендованным изготовителем, используя кДНК в качестве матрицы, и результаты представлены на фиг. 15. На основании результатов эксперимента ПЦР подтвердили, что уровень экспрессии HMGA2 снижался в ходе субкультивирования от 6го пассажа до 20го пассажа.
Пример 12: Подтверждение морфологических изменений в ходе субкультивирования
В стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), трансдуцированных HMGA2, полученных в примере 11-1, морфологию клеток в соответствии с ходом пассажей субкультивирования измеряли по фазово-контрастному изображению, и результаты представлены на фиг. 16.
На основании фиг. 16 подтвердили, что стромальные клетки, имеющие происхождение из крови пуповины человека (hUCBSC), трансдуцированные HMGA2, становятся более плоскими и растянутыми в ходе пассажей, при этом в стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), морфологические изменения ослаблялись.
Пример 13: Окрашивание SA-b-gal (ассоциированной со старением бета-галактозидазой)
С целью подтверждения уровня старения в стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), трансдуцированных HMGA2, полученных в примере 11-1, измеряли уровень экспрессии ассоциированной со старением бета-галактозидазы (SA-β-gal) в соответствии с ходом пассажей субкультивирования способом окрашивания β-gal, и результаты представлены на фиг. 17.
На основании фиг. 17 было подтверждено, что в стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), снижался уровень экспрессии ассоциированной со старением бета-галактозидазы (SA-β-gal).
Пример 14: Пролиферация клеток в ходе пассажей субкультивирования
В стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), трансдуцированных HMGA2, полученных в примере 11-1, измеряли уровень пролиферации клеток в соответствии с ходом пассажей субкультивирования с помощью МТТ анализа, и результаты представлены на фиг. 18.
На основании фиг. 18 было подтверждено, что в стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), уровень пролиферации клеток в соответствии с ходом пассажей субкультивирования был снижен меньше по сравнению с уровнем в контролях.
Пример 15: Оценка воздействия HMGA2 на биохимический путь PI3K/AKT
Пример 15-1: Подтверждение релевантных генов
В стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), трансдуцированных HMGA2, полученных в примере 11-1, были установлены гены, ассоциированные с биохимическим путем передачи сигнала, связанные с гиперэкспрессией, и ген, связанный с молекулярной клеточной функцией HMGA2, с помощью программы анализа Ingenuity Pathway Analysis (ΙΡΑ), и результаты представлены на фиг. 19.
На основании фиг. 19 было подтверждено, что сигналы elF4 и p70S6K, связанные с транскрипционным контролем, экспрессировались в большом количестве, и что биохимические пути передачи сигнала mTOR и PI3K/AKT, связанные с elF4 и p70S6K, экспрессировались в большом количестве.
Пример 15-2: Вестерн-блоттинг
В стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), трансдуцированных HMGA2, полученных в примере 11-1, проводили Вестерн-блоттинг для оценки воздействия гиперэкспрессии HMGA2 на биохимический путь PI3K/AKT и mTOR/p70s6K.
Вестерн-блот-анализ проводили на следующих клетках: (i) hUCBSC, в которых происходила гиперэкспрессия HMGA2, (ii) hUCBSC, в которых происходила гиперэкспрессия HMGA2, обработанного LY294002, и (iii) GFP в качестве сравнительного примера.
Конкретно клетки пульверизировали в буфере 50 мМ Трис-HCl, содержащем 1 мМ фенилметилсульфонилфторид, 1 мМ апротинин, 1 мМ лейпептин, 1 мМ антипаин и 0,1 мМ ортованадат натрия. Содержание белка подтверждали с помощью аналитического набора DC (Bio-Rad, USA) и проводили электрофорез в полиакриламидном геле с додецилсульфатом натрия (ДСН-ПААГ) путем нанесения определенного количества белков на полиакриламидный гель концентрации от 10 до 15%, и белки переносили на нитроцеллюлозную мембрану при 50 В и 350 мА в течение 5 часов. Все антитела использовали в соответствии с инструкцией изготовителя, и полосы белка подтверждали с помощью набора для идентификации по усилению хемилюминесценции (Amersham Pharmacia Biotech, Бакингемшир, Великобритания), и результаты представлены на фиг. 20.
На основании фиг. 20 было подтверждено, что фосфорилирование АКТ, mTOR и p70S6K индуцировалось HMGA2, и при обработке LY294002 отсутствовало изменение количества экспрессии суммарного белка, но фосфорилирование АКТ, mTOR и p70S6K было ингибировано.
Хотя уровни экспрессии p16INK4A и p21CIP1/WAF1 были ингибированы под действием HMGA2, уровни экспрессии восстанавливались в результате обработки LY294002, и, следовательно, биохимические пути PI3K/AKT/mTOR/p70S6K подходят для снижения уровней экспрессии p16INK4A и p21CIP1/WAF1.
Кроме того, было подтверждено, что гиперэкспрессия HMGA2 активирует биохимические пути PI3K/AKT/mTOR/p70S6K и ингибирует экспрессию p16INK4A и p21CIP1/WAF1.
Пример 16: Подтверждение морфологического изменения в соответствии с ходом пассажей субкультивирования в результате ингибирования HMGA2
С целью проверки роли белка HMGA2 в дифференцировке и старении стромальных клеток, имеющих происхождение из крови пуповины человека (hUCBSC), ингибировали экспрессию HMGA2 в hUCBSC на ранней стадии в ходе 8 или менее генераций с использованием миРНК.
В стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), где экспрессия HMGA2 была ингибирована, измеряли морфологию клеток в соответствии с ходом пассажей субкультивирования по фазово-контрастному изображению, и результаты представлены на фиг. 21. Таким образом, было подтверждено, что стромальные клетки, имеющие происхождение из крови пуповины человека (hUCBSC), где экспрессия HMGA2 была ингибирована, становились более плоскими и растянутыми.
Пример 17: Измерение уровня экспрессии ассоциированной со старением бета-галактозидазы (SA-β-gal) посредством ингибирования HMGA2
С целью подтверждения уровня старения стромальных клеток, имеющих происхождение из крови пуповины человека (hUCBSC), где экспрессия HMGA2 была ингибирована, измеряли уровень экспрессии ассоциированной со старением бета-галактозидазы (SA-β-gal) путем окрашивания β-gal, и результаты представлены на фиг. 21.
Было подтверждено, что в клетках hUCBSC, трансдуцированных HMGA2, повышался уровень экспрессии ассоциированной со старением бета-галактозидазы (SA-β-gal).
Пример 18: Подтверждение воздействия пассажей субкультивирования на пролиферацию клеток
В стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), где экспрессия HMGA2 была ингибирована, измеряли уровень пролиферации клеток в соответствии с ходом пассажей субкультивирования с помощью МТТ анализа, и результаты представлены на фиг. 22. На основании фиг. 22 было подтверждено, что в HMGA2-ингибированных клетках hUCBSC пролиферация клеток в соответствии с ходом пассажей субкультивирования значительно снижалась.
Пример 19: Вестерн-блот
В стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), проводили анализы Вестерн-блот с целью оценки воздействия ингибирования HMGA2 на биохимические пути PI3K/AKT и mTOR/p70s6K, и результаты представлены на фиг. 23.
На основании фиг. 23 было подтверждено, что фосфорилирование АКТ, mTOR и p70S6K было резко снижено, при этом уровни экспрессии p16INK4A и p21CIP1/WAF1 увеличились. На основании этих результатов было подтверждено, что ингибирование HMGA2 ингибирует биохимические пути PI3K/AKT/mTOR/p70S6K при увеличении экспрессии p16INK4A и p21CIP1/WAF1.
На основании результатов примера 15-2 и приведенного выше примера биохимический путь передачи сигнала в стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), под действием экспрессии белка HMGA2 представлен на фиг. 24.
Пример 20: Измерение потенциала дифференцировки в жировые ткани
Измеряли потенциал дифференцировки HMGA2-ингибированных стромальных клеток, имеющих происхождение из крови пуповины человека (hUCBSC).
С целью подсчета уровня дифференцировки на основании аккумулированных жиров, присутствующих в клетках, культивируемые клетки окрашивали масляным красным О, и масляный красный О, проникший в клетки, снова экстрагировали с использованием 100% изопропилового спирта и количественно определяли при OD 500 с помощью считывающего устройства для планшетов ELISA (EL800, Bio-Tek Instruments, США). Результаты представлены на фиг. 25.
На основании фиг. 25 было подтверждено, что процент окрашивания масляным красным О HNGA2-ингибированных стромальных клеток, имеющих происхождение из крови пуповины человека (hUCBSC), был ниже, чем в контрольной группе, и коэффициенты экспрессии генов, ассоциированных с дифференцировкой жировых клеток, таких как PPARr, аР2 и С/ЕВР-b, быстро снижались.
Пример 21: Скрининг и ПЦР генов, связанных с HMGA2-контролем
Экспрессию генов в стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), с гиперэкспрессией HMGA2, полученных в примере 11-1, и экспрессию генов в HMGA2-ингибированных стромальных клетках, имеющих происхождение из крови пуповины человека (hUCBSC), полученных в примере 7, сравнивали, как показано на фиг. 26.
На основании результатов фиг. 26 было отобрано три гена: циклина F, циклина Е1 и CDC25A, уровни экспрессии которых увеличиваются при гиперэкспрессии HMGA2, и при этом уровни их экспрессии уменьшаются при ингибировании HMGA2, а также было отобрано пять генов: C14orf153, EID2B, ZNF394, CDKN2AIPNL и C9orf80, уровни экспрессии которых уменьшаются при гиперэкспрессии HMGA2, при этом уровни их экспрессии увеличиваются при ингибировании HMGA2. Восемь генов, отобранных таким образом, подвергали ПЦР, и результаты представлены на фиг. 27.
На основании приведенного выше описания специалистам в данной области техники понятно, что настоящее изобретение может быть приведено в другой конкретной форме без изменения его технической сущности или существенных характеристик. Следовательно, должно быть понятно, что описанное выше воплощение изобретения не является ограничивающим, но является иллюстративным во всех аспектах. Объем изобретения вероятнее определяется прилагаемой формулой изобретения, чем предшествующим ей описанием, и, следовательно, все изменения и модификации, попадающие в границы и пределы формулы изобретения или эквиваленты таких границ и пределов, подразумевают как охваченные формулой изобретения.
Реферат
Изобретение относится к области клеточной биологии, конкретно к получению индуцированной нервной стволовой клетки из дифференцированной клетки. Способ включает доставку в клетку, не являющуюся нервной, набора для индукции перепрограммирования, состоящего из белка SOX2 или молекулы нуклеиновой кислоты, кодирующей белок SOX2, и белка HMGA2 или молекулы нуклеиновой кислоты, кодирующей белок HMGA2, либо увеличение экспрессии указанных белков в клетке с последующим культивированием. Изобретение позволяет производить скрининг стимулятора или ингибитора регенерации, индивидуально подобранного для пациента терапевтического средства, а также способ лечения и профилактики заболеваний, обусловленных повреждением нервных стволовых клеток. 7 н. и 12 з.п. ф-лы, 31 ил., 21 пр.

Комментарии