Мембрана в качестве подложки для выращивания клеток ретинального пигментного эпителия (варианты), ее применение и способ засевания таких клеток - RU2530169C2
Код документа: RU2530169C2
Чертежи








Описание
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к мембране для использования в качестве подложки для выращивания клеток. Кроме того, изобретение относится к способам выращивания клеток, способам изготовления мембраны и использованию клеток. В частности, клетки могут быть использованы при лечении возрастной макулярной дегенерации.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Возрастная макулярная дегенерация (AMD) представляет собой заболевание, обнаруживаемое у людей пожилого возраста, при котором происходит истончение, атрофия и кровоизлияния в макулярной зоне сетчатки. Это приводит к потере зрения в зоне центрального (макулярного) зрения, в частности к неспособности видеть мелкие детали, читать или распознавать лица.
AMD подразделяется на сухую (не неоваскулярную) и влажную (неоваскулярную). Влажная AMD включает в себя рост новых кровеносных сосудов в области, где их, предположительно, не должно быть. Сухая форма является более распространенной, чем влажная, при этом приблизительно у 85-90% больных AMD диагностирована сухая форма AMD. Влажная форма заболевания обычно приводит к более серьезной потере зрения.
Сухая AMD является ранней стадией заболевания и может проистекать из старения и истончения макулярных тканей, отложения пигмента в макуле либо из комбинации этих двух поцессов. Сухую макулодистрофию диагностируют в случаях, когда из отложений или продуктов распада разрушающейся ткани первоначально в области макулы начинают накапливаться желтоватые пятна, так называемые друзы. При сухой макулодистрофии может происходить постепенная потеря центрального зрения.
Сухая AMD может прогрессировать во влажную AMD, при которой под сетчаткой происходит рост новых кровеносных сосудов и пропотевание крови и жидкости. Такое пропотевание приводит к необратимому повреждению светочувствительных клеток сетчатки, которые отмирают и создают слепые пятна в центральном зрении.
Лечение AMD в настоящее время является ограниченным, однако некоторые процедуры могут приостановить прогрессирование заболевания или улучшить зрение. Способы лечения макулярной дегенерации зависят от того, находится ли заболевание в его ранней стадии или имеет сухую форму либо соответствует более прогрессирующей стадии, влажной форме, которая может привести к серьезной потере зрения. Один из способов лечения заключается в трансплантации клеток из здоровой периферийной области глаза больного влажной AMD в пораженную область. Хотя это и эффективно, однако существует ограничение в виде размера пораженной зоны, которая может быть обработана, и, кроме того, операция является длительной и не подходит для большинства пациентов пожилого возраста. Было бы целесообразным разработать улучшенные способы лечения обеих форм AMD.
Авторы настоящего изобретения исследовали способы замещения и трансплантации эпителиальных клеток сетчатки, в частности, используя для получения требуемых клеток стволовые клетки. Авторы изобретения разработали мембрану, на которой могут быть выращены такие клетки и которая может быть трансплантирована в глаз вместе с клетками. Мембрана особенно хорошо подходит для выращивания клеток пигментного эпителия сетчатки (RPE) и их производных, однако также могут быть выращены и клетки другого типа.
Клетки выращивали на мембранах и прежде. Williams et al. (Journal of Materials Science: Materials in Medicine 16 (2005) 1087-1092) использовали полиуретановые мембраны для культуры клеток RPE, однако было установлено, что для того, чтобы сделать возможным присоединение клеток, поверхность мембраны, как правило, нуждается в обработке. Другие группы использовали полиэфирные мембраны.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В соответствии с изобретением предложена мембрана для использования в качестве подложки для выращивания клеток, при этом мембрана является по существу небиоразлагаемой и пористой и имеет поры диаметром приблизительно от 0,2 мкм до 0,5 мкм. Предпочтительно, чтобы диаметр пор составлял от 0,3 мкм до 0,45 мкм.
Мембрана является небиоразлагаемой, чтобы гарантировать, что она будет продолжать поддерживать клетки после трансплантации в глаз. Под термином по существу небиоразлагаемая подразумевается, что мембрана не будет разрушаться в течение по меньшей мере 5 лет после введения в организм, более предпочтительно, по меньшей мере в течение 10 лет, еще более предпочтительно, по меньшей мере в течение 15 лет.
Поры такого диаметра делают возможной диффузию всех питательных веществ и белков, в то же время не допуская миграции клеток через полимер.
Плотность пор предпочтительно лежит в диапазоне приблизительно от 1×107 до 3×108 пор на 1 см, более предпочтительно в диапазоне от 5×107 до 1×108 пор на 1 см. Такая плотность позволяет обеспечивать требуемые уровни проницаемости, а также делает возможной васкуляризацию. В частности, размер и плотность пор имеют большое значение для обеспечения движения питательных веществ от одной стороны мембраны к другой, а также для возможности новообразования кровеносных сосудов через мембрану. Это особенно важно после имплантации. Полимерное тело может воспринимать васкуляризацию из обильного хориоидального русла. Это показано на примере обильного сосудистого русла вне глаза (Cassell et al., 2002; Patrick et al., 1999; Saxena et al. 1999, Peter et al. 1998), однако может протекать только при достаточной пористости (Menger et al., 1990).
Предпочтительно, чтобы гидравлическая проводимость мембраны превышала 50×10-10 м сек-1 Па-1. В частности, гидравлическая проводимость мембраны предпочтительно составляет приблизительно 33 мл/мин/см2. Это соответствует 801,21×10-10 м сек-1 Па-1, что в восемь раз превышает гидравлическую проводимость молодой макулярной трупной мембраны Бруха. Такая избыточная проводимость полезна, поскольку искусственная мембрана полностью опирается на пассивные процессы. Будучи в состоянии обеспечивать потребности лежащих выше клеток в плане диффузии питательных веществ, мембрана в то же время не должна служить помехой для переноса жидкости от базальной стороны слоя RPE, в противном случае RPE будет отрываться от поверхности полимера. Это является целесообразным, поскольку пониженная гидравлическая проводимость мембраны Бруха у пожилых людей предположительно вызывает отделение эпителиального пигмента при AMD (Bird & Marshall, 1986).
Предпочтительно, чтобы мембрану можно было стерилизовать без ухудшения ее свойств с помощью гамма-облучения, окиси этилена, путем автоклавной обработки или под действием ультрафиолетового излучения.
Предпочтительно, чтобы мембрана могла быть герметизирована с помощью ультразвуковой сварки, сварки токами высокой частоты или формованием вставки. Это позволяет присоединять к мембране другие слои, например присоединять к мембране фармацевтические либо покровные слои. Например, можно присоединить более жесткий биоразлагаемый слой, такой как слой PLGA (сополимера молочной и гликолевой кислот), для придания мембране жесткости для облегчения введения. Или же могут быть присоединены слои, включающие в себя фармакологические или биологические агенты, либо слои, поддерживающие другие клетки.
Мембрана предпочтительно имеет максимальную толщину приблизительно 11 мкм. Более предпочтительно толщина мембраны составляет от 9 мкм до 11 мкм. Толщину мембраны выбирают с учетом протекания диффузии питательных веществ, васкуляризации, а также возможности осуществления легкого введения мембраны в глаз.
Таким образом, предложена мембрана для использования в качестве подложки для выращивания клеток, при этом мембрана является по существу небиоразлагаемой и пористой и имеет максимальную толщину приблизительно 11 мкм. Мембрана предпочтительно является по существу плоской, при этом ее наименьший размер предпочтительно составляет менее приблизительно 11 мкм. Она может варьироваться по толщине в этом измерении, но предпочтительно имеет толщину в диапазоне от 9 мкм до 11 мкм.
Мембрана предпочтительно имеет максимальную массу приблизительно 1,5 мг/см2. Более предпочтительно, чтобы масса мембраны составляла от 1,0 мг/см2 до 1,4 мг/см2. Минимальный предел прочности при растяжении мембраны составляет предпочтительно 100 бар для обеспечения достаточной прочности во время хирургической операции. Максимальный предел прочности при растяжении предпочтительно составляет 300 бар, опять-таки чтобы сделать возможным легкое манипулирование во время хирургической операции. Прочность на разрыв мембраны предпочтительно составляет по меньшей мере 10 пси.
Предпочтительно, чтобы мембрана была гидрофильной. Это наделяет мембрану хорошей смачивающей способностью и позволяет легко присоединять клетки и другие требуемые покрытия.
Мембрана предпочтительно имеет величину pH от 4 до 8, это физиологически приемлемая величина pH.
Мембрана предпочтительно содержит покрытие на по меньшей мере одной из сторон. Покрытие предпочтительно представляет собой белок или гликопротеин, такой как ламинин, матригель, коллаген, фибронектин и PLGA (сополимер молочной и полигликолевой кислот). Покрытие также может включать в себя фармакологический или биологический агент, присоединенный к компоненту покрытия. Например, покрытие может включать в себя нейротрофический агент, противовоспалительный агент или антиангиогенный агент.
В частности, покрытие предпочтительно содержит ламинин, в особенности, ламинин-1 или его фрагмент, такой как IgVAV. В частности, покрытие предпочтительно содержит больше ламинина-1, чем другого белка или гликопротеина. Предпочтительно, чтобы покрытие включало в себя по меньшей мере 30%, более предпочтительно, по меньшей мере 40% ламинина, в особенности ламинина-1. Покрытие предпочтительно наносят с получением на мембране концентрации ламинина-1 приблизительно 40-45 м кг/см2.
Соответственно, предложена мембрана для использования в качестве подложки для выращивания клеток, при этом мембрана включает в себя по существу небиоразлагаемый и пористый поддерживающий слой, покрытый по меньшей мере с одной стороны покрытием, содержащим ламинин-1.
Мембрана предпочтительно изготовлена из гидрофильного полимера. Могут также использоваться и гидрофобные полимеры, сделанные гидрофильными путем облучения такого полимера ультрафиолетовым светом. Особенно предпочтительные полимеры включают в себя полиэфиры, такие как полиэтилентерефталат, полибутилентерефталат; полиуретаны и полимочевиноуретаны, в частности те из них, которые содержат поликарбонат и полисилоксан, а также те, которые имеют в своей основе сложные эфиры и простые эфиры; полиамиды, такие как найлон; полиэфирэфиры, такие как Sympatex; поликарбонаты, такие как Makrolon; полиакрилаты, такие как Perspex; поли(тетрафторэтен) (PTFE); полисилоксаны; подлиолефины, такие как полиэтилен и полипропилен; и полиоксиметилен (РОМ), широко известный под торговой маркой DeIrin компании DuPont. Особенно предпочтительно, чтобы мембрана была изготовлена из полиэтилентерефталата или полибутилентерефталата. Согласно другому предпочтительному варианту осуществления мембрану изготавливают из полиэфира.
Мембрану используют для выращивания слоя клеток. Мембрана предпочтительно включает в себя слой клеток на мембране. Клетки могут быть любыми клетками, выбранными в соответствии с предполагаемым использованием мембраны и клеток. Типы клеток представляют собой любые клетки, которые могут быть выращены в виде монослоя, и включают в себя клетки сетчатки глаза, кожные клетки и клетки эндотелия, а также индуцированные плюрипотентные стволовые клетки. Клетки могут происходить из разнообразных источников, например клетки могут быть аутологичными клетками, взятыми от данного организма для трансплантации обратно данному организму, или же могут быть клетками, выращенными специально для определенной цели. Клетки могут происходить из стволовых клеток, в особенности стволовых клеток человеческого эмбриона. Если клетки происходят из эмбриональных стволовых клеток, предпочтительно, чтобы клетки были доступны из неэмбрионального источника, такого как банк клеток. Согласно предпочтительному варианту осуществления стволовые клетки человеческого эмбриона являются эмбриональными плюрипотентными стволовыми клетками. Более предпочтительно, чтобы стволовые клетки человеческого эмбриона согласно изобретению были получены с помощью средств, отличных от умерщвления человеческого эмбриона, таких как метод изоляции hESC (стволовых клеток человеческого эмбриона), раскрытый в работе Lonza et al., Nature, 444:481-485, Nov. 2006. Клетки могут быть иммортализованными («бессмертными») клетками, такими как клетки ARP-19. В частности, данное изобретение используют для лечения дегенеративных заболеваний, в особенности, сетчатки глаза. Соответственно, клетки могут быть клетками ретинального пигментного эпителия (RPE клетками) или родственными клетками, такими как клетки, дифференцирующиеся с образованием RPE клеток или образующиеся в результате дифференцировки RPE клеток (ретинальных производных) или их предшественников. Такие клетки могут включать в себя фоторецепторные клетки, горизонтальные клетки, амакринные клетки или ганглиозные клетки сетчатки. Также могут быть использованы и другие высокодифференцированные клетки.
Мембрана и слой клеток предпочтительно имеют длину и ширину по меньшей мере 3 мм × 5 мм. Предпочтительно, чтобы мембрана и слой клеток составляли по меньшей мере 4 мм × 6 мм.
При нанесении клеток на мембрану полезно засевать клетки плотно, чтобы снизить вероятность дедифференцировки клеток. В идеальном случае клетки должны быть засеяны с плотностью по меньшей мере 200000 клеток на см2, более предпочтительно около 250000 клеток на см2, или же с более высокой плотностью, такой как 300000 или 350000 клеток на см2.
Таким образом, предложена пористая небиоразлагаемая мембрана для использования в качестве подложки для колонии клеток, при этом мембрана имеет слой клеток на по меньшей мере одной из сторон, причем клетки засеяны с плотностью по меньшей мере 200000 клеток на см2.
Также представлен способ засевания клеток на мембрану, включающий в себя стадию высевания клеток на мембрану с плотностью 200000 клеток на см2 или выше.
Мембрана предпочтительно представляет собой мембрану в соответствии с изобретением. При этом клетки предпочтительно являются высокодифференцированными клетками, такими как RPE клетки.
Также посредством изобретения представлено применение мембраны в соответствии с изобретением в качестве подложки для колонии клеток.
Также предложена мембрана в соответствии с изобретением для применения в терапии. В частности, предложено применение мембраны для лечения возрастной макулярной дегенерации, разрывов сетчатки, макулодистрофии, хориоидеремии, атрофии зрительного нерва Лебера и болезни Штаргардта.
Кроме того, предложен способ культивирования клеток, включающий в себя стадии:
a) засевания стволовых клеток человеческого эмбриона фидерами из мышиных эмбриональных фибробластов (MEF), инактивированных митомицином C, с плотностью засевания по меньшей мере 1,2×104/см2, или фидерами из человеческих фибробластов с плотностью засевания по меньшей мере 6×103/см2; и
b) выдерживания клеток в среде, включающей в себя следующие компонентты или их эквиваленты: модифицированную Дульбекко среду Игла с высоким содержанием глюкозы (4,8 г/л) (Knockout DMEM, Invitrogen) с заменителем сыворотки 20% Knockout serum replacement (Invitrogen), 1% раствор незаменимых аминокислот, 1 ммоль L-глутамина (Invitrogen), 4 нг/мл человеческого bFGF (Invitrogen) и 0,1 ммоль β-меркаптоэтанола (Sigma).
Выращиваемые клетки предпочтительно подпитывают через каждые два дня. Через десять дней после пассажа режим подпитки предпочтительно изменяют на ежедневную подпитку, используя среду без основного фактора роста человеческих фибробластов.
Растущие клетки предпочтительно выращивают в питательной среде в течение по меньшей мере 30 дней, более предпочтительно по меньшей мере 35 дней.
Среда для культивирования предпочтительно содержит по меньшей мере 15%, более предпочтительно по меньшей мере 18% или по меньшей мере 20% KSR (заменителя сыворотки Knockout serum replacement). Кроме того, среда предпочтительно не содержит плазманат, LIF (фактор ингибирования лейкемии) человека и/или bFGF.
Клетки образуют пигментированные очаги. Очаги предпочтительно извлекают и помещают на внеклеточный матрикс для обеспечения присоединения и растяжения монслоя.
Далее изобретение будет описано подробно исключительно в качестве примера со ссылкой на прилагаемые графические материалы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг.1 показан фрагмент биополимера с HESC-RPE in situ в глазу свиньи через 1 месяц после трансплантации (А). В: Световая микрофотография А, показывающая фоторецепторы с внутренними/внешними сегментами рядом с HESC-RPE на биополимере. С: Один полимер, трансплантированный в глаз свиньи, фоторецепторы дегенерированы. Краситель: крезиловый фиолетовый. Цена деления шкалы: А, 1 мм; В, 100 мкм. Этот рисунок демонстрирует биосовместимость биополимера в опытах in vivo, а также тот факт, что монослой RPE клеток является необходимым для поддержания жизнеспособности фоторецепторов.
Фиг.2 представляет собой конфокальный снимок HESC-RPE на биополимере в глазу свиньи, 1 месяц приживления. HESC-RPE образует однородную пигментированную поверхность рядом с фоторецепторами свиньи (родопсин, FITC (флуоресцеин изотиоцианат)) и покрывает RPE свиньи. Некоторое количество фоторецепторов присутствует внутри HESC-RPE клеток (А). Рисунок В показывает, что донорные RPE клетки выражают RPE65 (TRITC). Этот рисунок демонстрирует, что трансплантированная HESC-RPE функционирует в обычном порядке в опытах in-vivo.
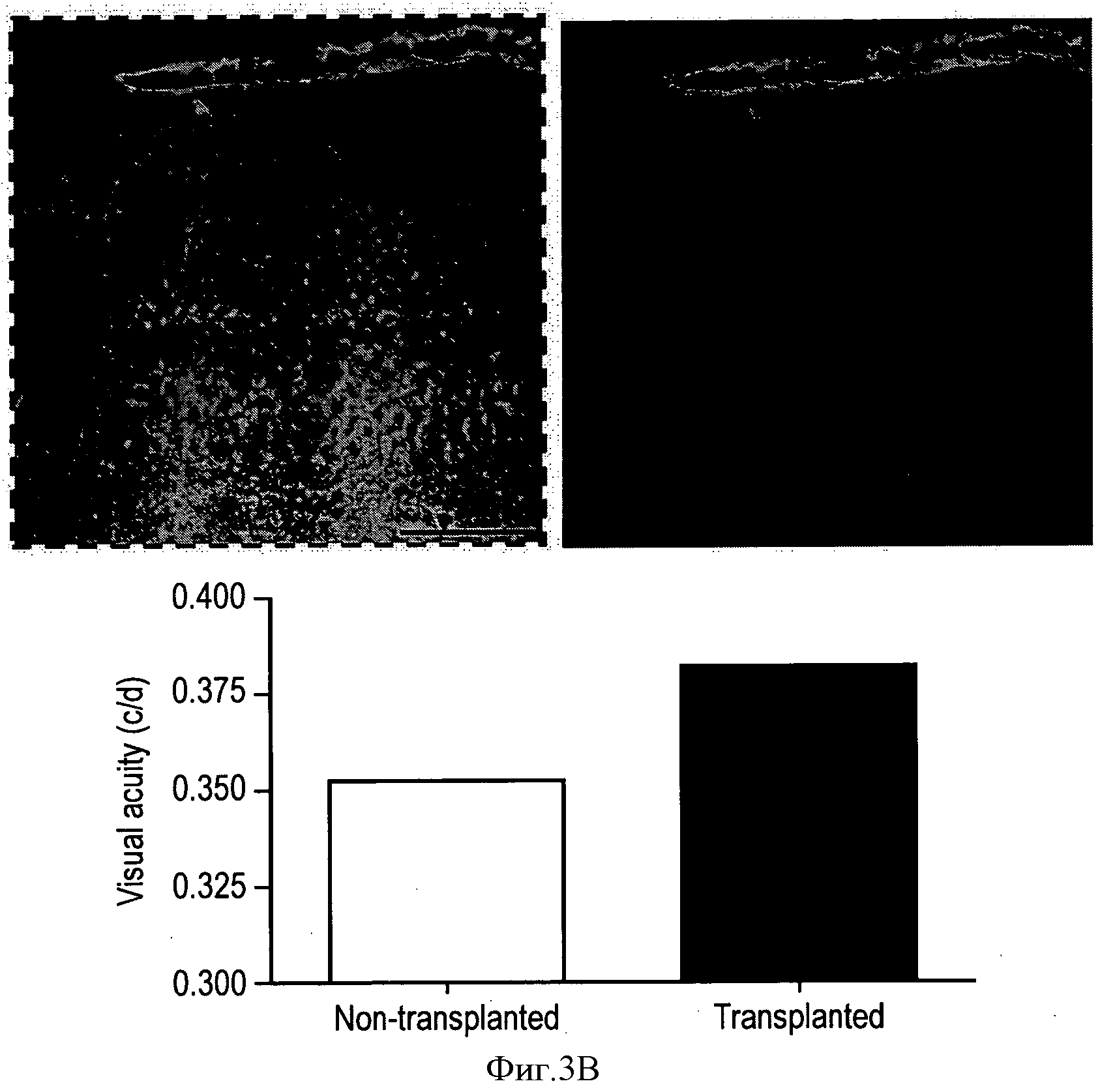
Фиг.3 показывает диссоциированные HESC-RPE, трансплантированные трехнедельным дистрофичным RCS крысам, через 5 недель на циклоспорине. Привитые человеческие клетки маркировали красным с помощью собственного уникального антитела поверхностного маркера человеческих клеток (HSM). Меченые отростки HESC-RPE-производных клеток обходят наружную ограничивающую мембрану и вставляются в синаптические слои хозяина. Выделенная квадратом область на Фиг.А увеличена на Фиг.В. Это показывает, что трансплантированные клетки были способны поддерживать хороший уровень зрительной функции в трансплантированном глазу (по сравнению с нетрансплантированным глазом того же животного). Остроту зрения оценивали с помощью собственного оптикокинетического оборудования и выражали в циклах на градус (с/d).
На Фиг.4 показан клеточный рост на различных мембранах.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Пример 1
Приготовление мембраны
Тонкую полиэфирную пленку подвергали воздействию коллимированных заряженных частиц из ядерного реактора. При прохождении таких частиц через полиэфирный материал они оставляют следы с повышенной фотопроводимостью. Далее полимерные следы растворяют травильным раствором с получением цилиндрических пор. Изменяя температуру и концентрацию травильного раствора, а также время выдержки в нем, получают поры точно заданного размера.
Полученная в результате мембрана представляет собой тонкую, полупрозрачную, микропористую полиэфирную пленку с гладкой плоской поверхностью, содержащей поры, заданного диаметра и количества.
Получение клеток человеческого ретинального пигментного эпителия (hRPE) из стволовых клеток человеческого эмбриона (hESC)
Клеточная культура
hESC выдерживали в культуральных флаконах, покрытых 0,1% желатином, и засевали фидерами из мышиных эмбриональных фибробластов (MEF), инактивированных митомицином С (с плотностью засевания 1,2×104/см2), или эквивалентными фидерами из человеческих фибробластов. Клетки выдерживали в базальной HESC-среде, состоящей из следующих компонентов: модифицированной Дульбекко среды Игла с высоким содержанием глюкозы (4,8 г/л) (Knockout DMEM, Invitrogen) с заменителем сыворотки 20% Knockout serum replacement (Invitrogen), 1% раствора незаменимых аминокислот, 1 ммоль L-глутамина (Invitrogen), 4 нг/мл человеческого bFGF (Invitrogen) и 0,1 ммоль β-меркаптоэтанола (Sigma). Сразу после извлечения из криоконсервации линии HESC выдерживали в течение 74 пассажей с заменой среды через каждые 2 дня. Клетки регулярно разделяли (1:5) для поддержания колоний из недифференцированного HESC. (Оценку проводили путем контрастирования для маркеров SSEA3, SSEA4, TRA-1-60 и TRA-181. Стандартное тестирование, выполненное в университете Шеффилда, подтвердило, что используемые HESC имели нормальный кариотип (Shef1 (46XY) и Shef7 (46XX)).
Дифференцировка и экспансия HESC-RPE
Было установлено, что hESC-hRPE достоверно образуются, когда колонии hESC становятся суперконфлюентными на MEF (мышиных эмбриональных фибробластах). Когда границы отдельных колоний hESC сливаются вместе (10 дней после пассажа), режим замены среды изменяют от одного раза в два дня до одного раза в день, используя базальную среду hESC, подробно обсуждавшуюся выше (без bFGF). Этот компонент был изъят из среды из-за зарегистрированной связи между bFGF и репрессией спецификации RPE. Пигментированные очаги появляются в суперконфлюентных культурах hESC между 1-2 неделями после введения режима ежедневной подпитки.
Образовавшиеся пигментированные очаги вырезали механически с помощью наконечника стеклянной пипетки и микрохирургических ножей. Такой подход применим на практике только в случаях, когда образующиеся очаги имеют диаметр по меньшей мере 1 мм. Во время этой процедуры старались отсечь окружающий непигментированный материал до помещения пигментированного очага на 35 мм чашки Петри, покрытые Матригелем™ с пониженным фактором роста (BD Biosciences, разбавленный 1:30) или ламинином. На каждую чашку помещали в общей сложности 10 пигментированных очагов, после чего RPE клетки оставляли расти на матригеле в течение последующих 35 дней (то есть 5 недель в базальной HESC-среде без bFGF). Во время этой фазы замену среды проводили каждые 2-3 дня. Этого срока достаточно для получения монослойных пластов пигментированных клеток размером от 2-3 мм. С помощью этого способа пласты RPE (приблизительно 1 см) поддерживали в лаборатории in vitro в течение 4 месяцев.
Для получения целевых клеток могут быть использованы и другие способы и методики дифференцировки, известные в данной области техники, включая способы получения RPE клеток из khES-1 и khES-3 клеточных линий (Osakada et al., (2008) Nat Biotechnol, 26, 215-24), а также способы получения RPE из Н1, Н7 и Н9 клеток (Klimanskaya et. al., (2004) Cloning and stem cells, 6, 217-245).
Засевание человеческих ES клеток на мембраны и метод последовательного культивирования
Сбор клеточной среды:
Вокруг пигментированных клеточных кластеров делали рассечения с помощью стерильного хирургического ножа, чтобы отделить их от непигментированных клеточных популяций внутри склянок с тканевой культурой. Затем кластеры извлекали с помощью микродозатора или стерильной стеклянной пипетки. В отдельных случаях это делали с одновременным аспирированием для облегчения препарирования.
Затем пигментированные кластеры объединяли вместе с их культуральной средой в пробирке Эппендорфа. После чего осуществляли центрифугирование со скоростью 12000-13500 об/мин в течение 3-5 минут, обеспечивая плотное осаждение кластеров, обмен среды с диссоциирующим раствором. Диссоциирующий раствор готовят следующим образом: 90% неферментный клеточный диссоциирующий раствор PBS без кальция или магния (Sigma-Aldrich) и 0,25% трипсин. Остальную часть составляет забуференный фосфатом Дульбекко физиологический раствор без кальция или магния. Клеточные кластеры инкубировали в этом диссоциирующем растворе в течение 5-15 минут при температуре 37°C.
С помощью пипетки тщательно гомогенизировали клеточные скопления до растворения пигментных кластеров. Проводили повторное центрифугирование со скоростью 12000-13500 об/мин в течение 5 минут. Диссоциирующий раствор аспирировали, не нарушая осадка. После этого добавляли культуральную среду и имеющийся сгусток клеток повторно суспендировали путем гомогенизации. На этой стадии определяли плотность клеток с помощью счетной камеры и на основании этого рассчитывали плотность посева.
Приготовление мембраны:
Мембраны стерилизовали, используя ламинарный шкаф с ультрафиолетовой лампой, в течение 30 минут с обеих сторон. Затем их помещали внутрь чашки для культивирования и использовали подходящую вставку для их отягощения. С помощью этой установки мембраны затем покрывали матригелем 1:30 (BD Biosciences) при температуре 37°C в течение 30 минут (метод густого геля), либо при температуре 4°C в течение ночи (метод жидкого геля). Кроме того, с успехом использовали ламинин при поверхностной концентрацией 1-10 мкг/см2. Преимущество ламинина заключается в том, что человеческий ламинин коммерчески доступен, позволяя использовать метод xeno-free (без чужеродных компонентов), имеющий существенное значение для достижения клинических стандартов чистоты (Lei et al., 2007).
Фрагменты мембраны трансплантировали в глаза свиней и глаза крыс. Результаты трансплантации представлены на фигурах с 1 по 3. На Фиг.1 показан биополимерный фрагмент с HESC-RPE in situ в глазу свиньи через один месяц после трансплантации. Это свидетельствует о биосовместимости полимера, а также о том, что монослой RPE клеток является существенным для поддержания жизнеспособности фоторецепторов.
На Фиг.2 показан снимок HESC-RPE на биополимере в глазу свиньи через месяц после приживления. Этот рисунок показывает, что трансплантированный HESC-RPE функционирует в обычном порядке in vivo.
На Фиг.3 показан диссоциированный HESC-RPE, трансплантированный трехнедельным дистрофичным RCS крысам, через 5 недель на циклоспорине. Этот рисунок демонстрирует, что трансплантированные клетки были способны поддерживать хороший уровень зрительной функции в трансплантированном глазу (по сравнению с нетрансплантированным глазом того же животного). Остроту зрения оценивали с помощью собственного оптикокинетического оборудования и выражали в циклах на градус (c/d).
Пример 2
Засевание мембран
Для нахождения оптимальной плотности засевания высокодифференцированных клеток RPE клетки высевали на мембраны при различных плотностях. За клетками наблюдали для изучения таких характеристик RPE клеток, как пигментация и морфология по типу «булыжной мостовой». Результаты представлены в следующей таблице:
Пример 3
Выращивание клеток на различных мембранах
Ряд различных мембран испытывали на предмет их способности поддерживать клеточный рост. Результаты представлены в следующей таблице:
Пример 4
Выращивание RPE клеток
Морфология: оценивали для светопроницаемых полимеров, используя фиксацию прямого изображения на инвертированном микроскопе с фазовым контрастом. Морфологию светонепроницаемых полимеров оценивали с помощью иммунного окрашивания для синаптических маркеров (обычно ZO-1).
Для тестирования клеточного роста:
Для оценки клеточного роста использовали комбинацию светолучевой микроскопии, иммунохимии с конфокальной микроскопией, электронной микроскопии и анализа жизнеспособности клетки.
Анализ жизнеспособности клетки (анализ на основе Alamar Blue):
Различные полиуретановые полимеры связывали с коммерческими вставками из тканевых культур, как в случае с PLGA. Вкратце, первичный фильтр подрезали и остаточный материал отшкуривали с помощью наждачной бумаги. После тщательного прополаскивания с помощью PBS исследуемый полимер устанавливали на вставку с помощью домашнего цианоакрилового клея (Loctite, Henkel Corporation, Avon, Ohio). Для определения пригодности полимеров на основе полиуретана выполняли анализ жизнеспособности клетки с использованием Alamar blue, измеряя плотность жизнеспособных клеток следующим образом: анализ выполняли следующим образом: клетки засевали на различные поверхности с низкой плотностью, используя для достижения оптимального скрепления среду, содержащую сыворотку. Для обеспечения достаточного скрепления клетки инкубировали в течение 24 часов при температуре 37°С. Затем их дважды прополаскивали в бессывороточной среде, чтобы отмыть неприсоединившиеся клетки, после чего снова инкубировали в течение по меньшей мере 12-24 часов в бессывороточной среде для синхронизации клеток. Далее в течение необходимого времени выращивали культуры. Для проведения измерений перед добавлением определенного объема 10% раствора Alamar Blue в PRF-HBSS культуры однократно прополаскивали в сбалансированном солевом растворе Хенкса, не содержащем фенолового красного (PRF-HBSS). Культуры инкубировали при температуре 37°C в течение 45 минут. Надосадочная жидкость синего цвета будет изменять цвет на флуоресцирующий красный пропорционально количеству живых клеток. Надосадочную жидкость собирали в 96-луночный планшет и анализировали в планшет-ридере на предмет флуоресценции (возбуждение 530-560 нм, эмиссия 590 нм).
Результаты анализа жизнеспособности на основе Alamar Blue для различных материалов приведены в таблице ниже. Кроме того, сравнивали рост клеток на полиуретанах и полиэфире, результаты представлены на Фиг.4. Все полимеры на основе полиуретана показали пониженный клеточный рост по сравнению с заявляемым полиэфирным фильтром.
Эти результаты были подтверждены методами иммуноцитохимии и конфокальной микроскопии, которые показали присутствие рассеянных клеток в большинстве полимеров на основе полиуретана. Для одного из полимеров на основе полиуретана (твердый полимер) был получен хороший клеточный рост и соединительное окрашивание, однако клеточные пласты легко отслаивались от поверхности полимера.
Из результатов анализа видно, как показано в приведенной выше таблице, что полиэфир обладает значительными преимуществами по сравнению с другими возможными мембранными материалами.
Способы с использованием PLGA (сополимера молочной и гликолевой кислот):
Мембраны из PLGA были получены в дар от Е.В.Lavik и R.Langer (Department of Chemical Engineering, MIT, Cambridge, Massachusetts). Изначально PLGA материал приобретали как Resomer® 5031-1 (Boehringer-lngelheim, Ingelheim, Germany) и синтезировали асимметричные мембраны из PLGA как описано этими авторами (Lu et al., 2000a and 2000b; Lavik et al., 2001 и 2002). Данные асимметричные профили позволяют осуществлять присоединение клеток к гладкой верхней поверхности, в то же время давая возможность клеткам связываться с базальной окружающей средой через посредство нижней пористой стороны полимера.
Асимметричную PLGA мембрану устанавливали в 6,5 мм вставки Corning Transwell® после удаления исходной мембраны. Установку осуществляли с помощью собственного цианоакрилатного клея (Loctite, Henkel Corporation, Avon, Ohio). Полученные вставки стерилизовали, облучая каждую сторону под УФ-лампой в вытяжном шкафу с ламинарным потоком в течение 30-60 минут. Клетки 28 ARPE-19 засевали на мембраны с плотностью 90000 клеток/см2.
В другой серии асимметричную PLGA мембрану устанавливали на пустые вставки (как указано выше). Вставки, а также полистирольные планшеты с тканевыми культурами (для контроля) покрывали ламинином при стандартной рабочей концентрации (Sigma-Aldrich, приготовленный из мышиной опухоли Engelbreth-Holm-Swarm). Планшеты и вставки засевали с помощью р30 ARPE19 с более высокой плотностью 180000 клеток/см2 для уменьшения времени на слияние монослоя. Культуры поддерживали с помощью RPE среды на основе DMEM с высоким содержанием глюкозы дважды в неделю.
Пример 5
Покрытия
Способы культивирования HESC:
HESC линий Shef1 и Shef7 выдерживали в склянках, покрытых 0,1% желатином, и засевали фидерами из инактивированных мышиных эмбриональных фибробластов (MEF) (Draper et al., 2002). Клетки выдерживали в базальной HESC-среде, состоящей из модифицированной Дульбекко среды Игла с высоким содержанием глюкозы (DMEM, Invitrogen) с заменителем сыворотки 20% Knockout serum replacement (Invitrogen), 1% раствора незаменимых аминокислот, 1 ммоль L-глутамина (Invitrogen), 4 нг/мл человеческого bFGF (Invitrogen) и 0,1 ммоль (3-меркаптоэтанола (Sigma). После извлечения с криоконсервации HESC линии поддерживали в течение 74 пассажей с помощью изменения среды каждые 2 дня. Клетки регулярно расщепляли (1:4), чтобы сохранить колонии недифференцированных HESC.
Следующие покрытия наносили в соответствии со стандартным протоколом изготовителя, если не указано иное: матригель (1:30), ламинин, коллаген IV, человеческий коллаген I, Puramatrix®, плазманат, поли-L-лизин и без покрытия в качестве контроля. Вкратце, каждое покрытие размораживали при температуре 4°C и разбавляли PBS или бессывороточной средой. Планшеты/вставки покрывали при температуре 4°C, при комнатной температуре или при температуре 37°C для каждого случая в соответствии с указаниями производителя. Затем матричный раствор удаляли и планшеты промывали либо сушили на воздухе согласно стандартной методике. HESC-RPE колонии (первичные колонии) вырезали из склянок с культурой и помещали в среду, после чего их высевали на планшеты/вставки.
Для оценки прикрепления колоний HESC и их распространения использовали визуальное наблюдение. Наблюдение за недавно засеянными HESC в интервале от 24 до 72 часов после высевания показало, что только матригель и ламинин приводили к колониальной адгезии HESC-RPE, то есть колонии были хорошо иммобилизованы и не подвергались отрыву даже при тщательном прополаскивании средой. В одной серии опытов с человеческими пепсинизированными плацентарными ламининами была достигнута иммобилизация HESC-RPE колоний, тогда как в другой потерпели неудачу. Все прочие покрытия (коллаген IV, человеческий коллаген I, поли-L-лизин, Puramatrix®, плазманат) оказались неудачными в этом отношении.
Пример 6
Культура RPE из Shef 1 HESC
Клеточная культура
Shef 1 HESC выдерживали в склянках Т25, покрытых 0,1% желатином, и засевали фидерами из человеческих фибробластов (оптимальная плотность посева 2,25×105клеток на Т25 (9×103/см2)). Клетки выдерживали в базальной HESC-среде, состоящей из следующих компонентов: модифицированной Дульбекко среды Игла с высоким содержанием глюкозы (4,8 г/л) (Knockout DMEM, Invitrogen) с заменителем сыворотки 20% Knockout serum replacement (Invitrogen), 1% раствора незаменимых аминокислот, 1 ммоль L-глутамина (Invitrogen), 4 нг/мл человеческого bFGF (Invitrogen) и 0,1 ммоль β- меркаптоэтанола (Sigma). После извлечения с криоконсервации Shef 1 HESC подвергали заменам среды каждые 2 дня и регулярно разделяли (1:4), чтобы сохранить колонии недифференцированных HESC (оценивали путем окрашивания для маркеров SSEA3, SSEA4, TRA-1-60 и TRA-181).
Дифференцировка и экспансия HESC-RPE
Было установлено, что HESC-RPE достоверно образуются, когда колонии SHEF1 HESC становятся суперконфлюентными на фидерах. Когда границы отдельных колоний HESC сливаются вместе (приблизительно 10 дней после пассажа), режим замены среды изменяют от одного раза в два дня до одного раза в день, используя базальную среду HESC, подробно обсуждавшуюся выше (без bFGF). Этот компонент был изъят из среды из-за зарегистрированной связи между bFGF и репрессией спецификации RPE. Пигментированные очаги появляются в суперконфлюентных культурах HESC между 1-2 неделями после введения режима ежедневной подпитки.
Клетки культивировали в течение еще 5 недель, после чего пигментированные очаги вырезали механически, используя наконечник стеклянной пипетки и микрохирургические ножи. Такой подход применим на практике только в случаях, когда получаются очаги диаметром по меньшей мере 1 мм, вследствие чего это может быть полезным для культивирования клеток в течение более чем 5 недель. Во время этой процедуры старались отсечь окружающий непигментированный материал до помещения пигментированного очага на 35 мм чашки Петри, покрытые ламинином-1. В каждую чашку могут быть помещены в общей сложности 10-20 пигментированных очагов, после чего RPE клетки оставляют расти в 2 мл среды в течение последующих 35 дней (то есть 5 недель в базальной HESC-среде без bFGF). Во время этой фазы замену среды проводили каждые 2-3 дня. Этого срока достаточно для получения монослойных пластов пигментированных клеток размером от 2-3 мм.
Этот способ отличается от других опубликованных методик по следующим параметрам: 1. Используется более высокая стандартизированная концентрация KSR (20% в противоположность 8-15%, измененной группой Lanza) 2. Во время продуцирования клеток RPE из суперконфлюентных HESC культур не используется плазманат, человеческий LIF или bFGF.
Диссоциация и суспензия HESC-RPE
Пигментированные HESC-RPE собирали из склянок Т25, содержащих колонии HESC-RPE на фидерах (пассаж 0) либо из разрастающихся пластов HESC-RPE на фидерах (пассаж 1). Клетки извлекали путем вырезания их с помощью стерильного микроножа и перемещения их с помощью стерильного микродозатора. Колонии/пласты HESC затем аспирировали и суспендировали в смеси HES-cpeдa-bFGF (без bFGF) до дальнейшего использования.
Требуемое количество кластеров помещали вместе с их средой для выращивания в пробирку и центрифугировали со скоростью от 2400 до 3600 об/мин в течение 5 минут для облегчения удаления надосадочной среды. Центрифугирование повторяли по мере необходимости, чтобы дать возможность замены растворов следующим образом: клетки дважды промывали PBS и затем инкубировали при температуре 37°C в течение 20 минут в 90% неферментном растворе для разъединения клеток в PBS (сополимере бутадиена и стирола) (Sigma #C5914) и 10% растворе Трипсина 10х в PBS (трипсин из поджелудочной железы свиньи, Sigma; конечная концентрация трипсина 0,25%). После такого инкубационного периода клетки тщательно измельчали до полного суспендирования, то есть до отсутствия видимых клеточных скоплений. Затем их снова центрифугировали для удаления буферного раствора для разъединения клеток, после чего клетки ресуспендировали в HES-cpeдe-bFGF и помещали в инкубатор при температуре 37°C до дальнейшего использования.
Установка полимерных пластов на культуральные вставки
13 мм полиэфирные фильтровальные диски с размером пор 0,4 мкм и плотностью пор приблизительно 1×108 пор/см2 присоединяли к вставкам Transwell вместо первоначальных фильтров, используя силиконовый эластомер на виниловой основе биологической степени чистоты (Kwik-Sil, World Precision Instruments Inc. Sarasota, Florida). Вставки имели толщину от 5 до 12 мкм. Полиэфир имел массу 1,2 мг/см2. Вставки однократно прополаскивали в PBS, сушили на воздухе и облучали с каждой стороны под УФ-лампой в вытяжном шкафу с ламинарным потоком в течение 30 минут для стерилизации. Затем стерилизованные вставки хранили в стерильном вытяжном шкафу с ламинарным потоком.
Покрытие и засевание подготовленных культуральных вставок
Стерилизованные вставки покрывали разбавленным 1:30 ламинином-1 в течение 30 минут при температуре 37°C. (Ламинин имел концентрацию 43 мкг/см2 и был инкубирован при температуре 37°C в течение 30 минут.) Ламинин аспирировали непосредственно перед засеванием клеток. Плотность клеток в суспензии HESC-RPE измеряли с помощью счетной камеры Neubauer® с разбавлением трипановым синим. Окрашивание трипановым синим использовали для подтверждения жизнеспособности клеток, которая в каждом случае превышала 93%. Клетки засевали с оптимальной плотностью 200000-400000 клеток/см2. Засеянные клетки оставляли присоединяться в течение по меньшей мере 24 часов и, как правило, 48 часов перед первой заменой среды. Впоследствии среду меняли трижды в неделю.
Реферат
Изобретения касаются мембраны, используемой в качестве подложки для выращивания клеток ретинального пигментного эпителия, ее применения для поддержания клеток и способа засевания клеток на такую мембрану. Охарактеризованная мембрана является небиоразлагаемой и пористой, покрытой по меньшей мере с одной стороны покрытием, содержащим гликопротеин, с порами диаметром приблизительно от 0,2 мкм до 0,5 мкм, причем плотность пор мембраны составляет приблизительно от 1×10до 3×10пор на 1 см, а гидравлическая проводимость мембраны превышает 50×10м секПа,и имеющей максимальную толщину 11 мкм. Представленные изобретения позволяют получать трансплантаты для лечения возрастной макулярной дегенерации. 4 н. и 15 з.п. ф-лы, 4 ил., 6 пр., 3 табл.

Комментарии