Нейротрансплантация с использованием плюрипотентных нейроэпителиальных клеток - RU2185833C2
Код документа: RU2185833C2
Чертежи



















Описание
Настоящее изобретение относится к коррекции поведенческих и/или психологических нарушений с помощью внутрицеребральной трансплантации нервных клеток, а также к клеткам и лекарствам, применяемым для этой цели. Настоящее изобретение относится также к способам получения и поддержания таких клеточных линий.
Поведенческие и/или физиологические нарушения вызываются многими заболеваниями, и могут также быть вызваны травмами мозга. Так, например, дисфункция моторики является одним из симптомов болезни Паркинсона. До сих пор в большинстве случаев не существовало удовлетворительных способов лечения.
В настоящем изобретении предложен способ лечения поведенческих и/или психологических нарушений, который включает внутрицеребральную трансплантацию терапевтически эффективного количества плюрипотентных нейроэпителиальных клеток.
Настоящее изобретение частично основано на наблюдении, что будучи трасплантированы в поврежденный или больной мозг плюрипотентные нейроэпителиальные клетки, по-видимому, реагируют на сигналы поврежденного или больного мозга, принимая такой фенотип, который способен заменить или компенсировать функциональные нарушения, к которым, в противном случае, приводит повреждение или болезнь мозга.
Термин "плюрипотентный" используют здесь для обозначения недифференцированных нейроэпителиальных клеток, которые обладают способностью дифференцироваться в различные типы или различные фенотипы клеток, в частности в клетки подходящего фенотипа для конкретного использования. Тип или фенотип клеток, в которые такие плюрипотентные клетки в итоге дифференцируются, по крайней мере, частично зависит от условий, в которых клетки существуют, или сами находятся.
Для использования в настоящем изобретении нейроэпителиальные клетки должны быть способны дифференцироваться в клетки, подходящие для восстановления или компенсации повреждения или заболевания в мишеневом участке мозга. Следует учесть, что клетки для трансплантации не должны быть способны дифференцироваться во все типы или фенотипы нервных клеток. Эти клетки могут, например, быть бипотентными. Однако высокая степень эффективности обычно предпочтительна, и это обеспечивает большую гибкость и эффективность для трансплантации в различные участки мозга.
Подходящие плюрипотентные клетки включают клетки, называемые или известные как "стволовые клетки" и называемые или известные как "клетки-предшественники".
Плюрипотентные нейроэпителиальные клетки удобны и обычно бывают кондиционно иммортализованными.
Такой способ лечения может осуществляться для любых млекопитающих, но настоящее изобретение конкретно относится к лечению людей, особенно к лечению человеческими клетками, и человеческими клетками и человеческими линиями. В настоящем изобретении предложены млекопитающие, которые подверглись лечению по способу настоящего изобретения.
В настоящем изобретении предложены выделенные плюрипотентные нейроэпителиальные клетки.
В настоящем изобретении особенно предложены человеческие, кондиционно иммортализованные плюрипотентные, нейроэпителиальные клетки.
Кроме того, в настоящем изобретении предложена кондиционно иммортализованная плюрипотентная нейроэпителиальная клеточная линия, особенно для терапевтического использования, более конкретно для лечения поведенческого и/или психологического дефицита.
Клетки настоящего изобретения способны корректировать поведенческий или психологический дефицит, будучи имплантированы в поврежденный участок человеческого мозга. Термин "повреждение" в том смысле, как здесь использован, включает снижение или потерю функций. Повреждение может быть вызвано любой из множества причин, включая физическую травму, гипоксию (недостаток кислорода), химические агенты, например, повреждение может быть вызвано злоупотреблением лекарствами и заболеваниями. Нижеследующие заболевания и патологические состояния являются примерами заболеваний или состояний, которые приводят к поведенческому и/или психологическому дефициту, которые можно лечить по способу настоящего изобретения: травматические повреждения мозга, удар, перинатальная ишемия, включая церебральный паралич, нейродегенеративные заболевания, деменции Альцгеймера, Пика и родственные, мультиинфарктная деменция, болезнь Паркинсона и болезни типа болезни Паркинсона, болезнь Хантингтона, болезнь Корсакова и болезнь Крейцфельд-Якоба. В соответствии со способом настоящего изобретения можно также лечить амнезию, особенно после преходящей глобальной ишемии, такой как после остановки сердца или хирургических операций шунтирования.
Далее, в настоящем изобретении предложен способ получения
человеческих кондиционно иммортализованных плюрипотентных нейроэпителиальных клеток, который включает стадии:
(а) получение нейроэпителиальных клеток человеческого зародыша, клеток, которые
находятся на достаточно ранней стадии развития, чтобы они были способны дифференцироваться в различные типы клеток мозга,
(b) введение в эти клетки ДНК, которая содержит последовательность,
способную вызывать кондиционную иммортализованность клеток под контролем соответствующих контрольных элементов, и
(c) поддержание клеток in vitro в разрешающих условиях.
Способ может включать далее стадию клонирования клеток для получения одной или более из клеточных линий.
В дальнейшем аспекте в настоящем изобретении предложены плюрипотентные нейроэпителиальные клетки, необязательно в выделенной форме, для терапевтического использования, особенно в отношении человека. Терапевтическим лечением может быть лечение поведенческого и/или психологического дефицита.
В еще одном аспекте в настоящем изобретении предложены кондиционно иммортализованные плюрипотентные нейроэпителиальные клетки для терапевтического использования, особенно в отношении людей. Терапевтическим использованием может быть лечение поведенческого и/или психологического дефицита.
В настоящем изобретении предложены для использования плюрипотентные нейроэпителиальные клетки, необязательно в изолированной форме, для изготовления лекарств для лечения поведенческого и/или психологического дефицита. Предлагаемое для введения лекарство включает плюрипотентные нейроэпителиальные клетки.
В настоящем изобретении предложены для использования кондиционно иммортализованные плюрипотентные нейроэпителиальные клетки для изготовления лекарств для лечения поведенческого и/или психологического дефицита. Предполагаемое для введения лекарство включает кондиционно иммортализованные нейроэпителиальные клетки.
Кондиционно иммортализованные клетки в соответствии с изобретением могут быть как из клонированных клеточных линий, так и из смешанной популяции. Предпочтительны клетки из клонированных клеточных линий. Можно использовать клетки из одной клеточной линии или смесь клеток из двух или более клеточных линий.
Далее в настоящем изобретении предложен фармацевтический препарат, включающий клетки настоящего изобретения и фармацевтически приемлемый носитель.
Трансплантация конспецифической (принадлежащей к одному виду) фетальной нервной ткани в поврежденный мозг изучалась в экспериментах на животных и последующее восстановление наблюдалось на нейроанатомическом, физиологическом и поведенческом уровнях (Dunnett & Bjorklund, 1994). Существует несколько приложений этой работы при лечении моторной дисфункции болезни Паркинсона (Lindvall, 1994), но широкое применение этой методики тормозилось необходимостью иметь ткань, полученную от конспецифической фетальной ткани мозга.
Необходимая фетальная ткань должна быть специфичной типу повреждения, которое хотят исправить, и ее необходимо получить на конкретной, временем ограниченной стадии развития мозга, которая отличается как по участку мозга, так и по клеточному типу. Это приводит сразу как к практическим, так и к этическим проблемам.
Работа с трансплантатом фетальной ткани (Sinden, 1995) при некоторых типах повреждений показала, что для достижения улучшения когнитивных функций необходимо очень специфическое совпадение клеточных типов.
Авторами было обнаружено, что, если кондиционно иммортализованные плюрипотентные нейроэпителиальные клетки имплантируют в поврежденный мозг, клетки дифференцируются в правильную форму клеток, необходимых для восстановления повреждения, и эти дифференцированные клетки способны образовывать соответствующие связи, необходимые для улучшения функций. Фенотип дифференцированных клеток может быть тем же, что и фенотип поврежденных или утраченных клеток, однако дифференцированные клетки могут быть другого фенотипа или несколькими фенотипами. В любом случае, клетки принимают такой фенотип, который способен функционально интегрироваться и компенсировать повреждение или утрату клеток. Это сопровождается предрасположенностью (которую авторы обнаружили) клеток мигрировать в направлении к поврежденной ткани, обнаруживать ее.
Использование плюрипотентных клеток означает, что, имея одну клональную клеточную линию, можно восстанавливать повреждение в нескольких различных участках мозга. Это означает также, что, если для восстановления повреждений в конкретной области необходимы клетки более чем одного типа, тогда единственная плюрипотентная клеточная линия будет способна к дифференцированию в различные требуемые типы клеток.
Кондиционно иммортализованные клетки представляют собой клетки, которые бессмертны в определенных разрешающих (пермиссивных) условиях, но уже не являются иммортализованными в запрещающих (непермиссивных) условиях. В данном конкретном случае это означает, что с помощью кондиционной иммортализации плюрипотентных клеток-предшественников, экстрагированных из фетальной ткани и поддерживаемых в разрешающих условиях, развитие клеток-предшественников можно остановить на выбранной стадии и их можно размножать в течение длительных промежутков времени. Использование кондиционной иимортализации обеспечивает развитие клональных линий, которые можно легко размножить in vitro. Если условия, в которых клетки поддерживают, меняют на запрещающие условия, развитие клеток может снова возобновиться. Если обеспечить нужные условия, клетки будут продолжать развиваться и будут дифференцироваться.
Иммортализованные клетки обычно получают в результате трансдукции онкогена в клетки. Поэтому существует риск образования опухоли при длительном промежутке времени и поэтому такие клетки предпочтительно не использовать в рамках настоящего изобретения.
Кондиционно иммортализованные клетки обладают тем преимуществом бессмертных клеток, что они "заморожены" на наружной стадии развития, их легко поддерживать и легко размножать в разрешающих условиях, но их можно использовать в трансплантатах до тех пор, пока окружение, в которое они трансплантированы, имеет запрещающие условия. В том случае, когда используют клетки настоящего изобретения, ген, который используют для придания кондиционной иммортализации следует выбирать таким образом, чтобы условия, существующие в мозге, соответствовали запрещающим условиям.
Обычным путем иммортализации клеток является трансдукция онкогена. Использование кондиционно иммортализованных клеток означает, что в запрещающих условиях клетки не будут обладать онкогенными свойствами, что исключит любую возможность имплантации клеток, приводящих к росту опухоли.
Если используют неиммортализованные клетки, тогда их можно сохранять in vitro в культуральной среде с добавлением фактора роста.
Ген, который используют для придания кондиционной иммортализации, можно вводить в клетки после экстракции из зародыша животного. В другом варианте можно вывести и вырастить трансгенных животных, отличных от человека, у которых нервные эпителиальные клетки включают ген, придающий кондиционную иммортализованность. Если выводят трансгенных животных, тогда клетки, полученные от фетальной ткани животного, уже кондиционно иммортализованы, и не требуют дальнейшей обработки.
Клетки, которые используют для лечения людей, должны быть, предпочтительно, получены из человеческих клеток, для уменьшения проблем, связанных с иммунным отторжением. Это требует использования фетальной ткани. Использование кондиционно иммортализованных клеток означает, что раз популяция клеток была установлена, уже нет необходимости снова использовать фетальную ткань. Так, например, клетки берут от человеческого зародыша на соответствующей стадии развития и в эти клетки вводят ДНК, необходимую для того, чтобы вызвать кондиционную иммортализацию. Затем эти клетки можно размножить или их можно клонировать и отобрать индивидуальные клеточные линии. Сохранение смешанных популяций и/или выбранных клеточных линий обеспечивает постоянный источник материала для имплантации.
Для лечения пациента обычно желательно знать, в каком участке мозга произошло повреждение. После того, как установлено наличие повреждения, независимо от того, произошло это в одном месте или в нескольких местах, можно осуществить лечение с помощью имплантации клеток в поврежденный участок. Во многих случаях, однако, положение и/или тип поврежденной ткани может быть неизвестен или только слабо охарактеризован. Так, например, нейродегенеративные заболевания могут привести к обширному повреждению различных типов клеток. Лечение такого повреждения все еще возможно и обеспечивается способностью плюрипотентных нейроэпителиальных клеток интенсивно мигрировать после трансплантации и отыскивать поврежденную ткань. Плюрипотентные клетки можно трансплантировать в один участок или, предпочтительно, во множество участков, и они способны мигрировать в участок (участки) повреждения, и, попав туда, дифференцироваться в ответной реакции на окружение в необходимый фенотип или фенотипы для улучшения или сохранения функций. Анализы постмортем мозга крыс, которым вводили клеточные трансплантаты из кондиционно иммортализованных плюрипотентных нейроэпителиальных клеток клеточной линии, показывают, что клетки собираются в участке поврежденной ткани (см. пример 9, далее), что иллюстрирует предрасположенность клеток устанавливаться и интегрироваться в участках поражения, а не в участках неповрежденной ткани. Плюрипотентный характер клеток и их предрасположенность к поврежденной ткани означают, что лечение клетками из отдельной клеточной линии с высоким потенциалом способно привести к компенсации обширного повреждения нескольких различных типов клеток.
После лечения за развитием состояния пациента можно следить, используя поведенческие и/или психологические тесты, и/или, при желании, тесты, с помощью которых контролируют активность мозга в выбранных участках мозга. Так, например, тесты для когнитивной функции можно осуществить до и после трансплантации.
Предпочтительно, чтобы лечение практически исправило поведенческий и/или психологический дефицит. Однако это не всегда возможно. Лечение в соответствии со способом настоящего изобретения и с клетками лекарствами и фармацевтическими препаратами настоящего изобретения может привести к улучшению функции без полной коррекции. Тем не менее, такое улучшение будет желательным и представит ценный результат.
Количество используемых клеток будет меняться в зависимости от характера и степени повреждения ткани. Обычно число клеток, которое используют при трансплантации, составляет величину от сотни тысяч до нескольких миллионов. Лечение нет необходимости ограничивать одним трасплантатом. Можно добавлять дополнительные трансплантаты для того, чтобы еще более улучшить функцию.
Настоящее изобретение иллюстрируется работой, которая была выполнена на крысах, у которых были повреждения мозга. В описанных далее экспериментах кондиционно иммортализованные клетки, которые использовали для трансплантации, получены из H-2Кb-tsA58 трансгенной мыши, созданной М. Noble и его ассистентами в институте Ludwig institute for Cancer Research (Jat et al., 1991). Все клетки из этой мыши содержат температурочувствительный онкоген (tsA58, температурочувствительный мутант SV40 крупного Т антигена под контролем интерферон-индуцируемого промотора), так что клетки делятся при допустимой температуре (ниже чем температура тела, 33o С), но дифференцируются только, если остаются при температуре тела мыши (38-39oC). Именно эта особенность обеспечивает им кондиционную иммортализованность. Это позволило авторам клонировать и размножать клеточные линии in vitro, которые затем дифференцировались после трансплантации в мозг хозяина. Был клонирован ряд клеточных линий из популяции клеток, исходно полученных из трансгенной мыши, более конкретно, из гиппокампа четырнадцатидневного эмбриона (Е 14). За крысами, которым приживили трансплантаты этих клеток, наблюдали, по крайней мере, в течение 8 месяцев, и ни в одном из случаев клетки после трансплантации не образовали опухолей. Кроме того, в гистологических препаратах постмортем, трансплантированные клетки (помеченные предварительной трансфекцией lac-z репортерным геном) имели вид дифференцированных клеток, соответствующих нервной системе грызунов.
Клонированные клеточные линии демонстрируют потенциал, in vitro, дифференцирования более чем в один фенотип, например, как в астроглиальный, так и в нейронный фенотипы (см. пример 4).
Модель поражения и поведения, в которой демонстрируют то, что клонированные клеточные линии способны сохранять функции в поврежденном мозге, и была моделью, которую ранее изучали интенсивно, используя фетальные конспецифические трансплантаты (см. Sinden et al., 1995). В ней используют крыс, у которых методика для окклюзии четырех сосудов (4 VO), симулирующая сердечный приступ у человека, вызывает относительно ограниченное и специфическое повреждение СА 1 пирамидальных клеток дорсального гиппокампа, наряду с когнитивным дефицитом, который проявляется в затруднении обнаружения погруженной и невидимой площадки в плавательном бассейне. Это повреждение и поведенческая модель представляют модель когнитивной дисфункции, которая является следствием обычной формы повреждения мозга, т.е. преходящей потери кровоснабжения мозга, например такой, которая наблюдается при остановке сердца.
Ранее было продемонстрировано, что для фетальных клеточно-суспензионных трансплантатов для восстановления функций в этой задаче, они должны быть высоко специфичны к повреждению, вызванному 4 VO: трансплантаты, содержащие СА 1 пирамидальные клетки, эффективны; трансплантаты, содержащие холинергичные клетки из базальной лобной передней части мозга, гранулоподобные клетки из зубчатой извилины или даже другого класса пирамидальные клетки (САЗ) из гиппокампа, оказываются неэффективными. Приводимые далее примеры 5-8 описывают эксперименты, в которых как клональные клеточные линии, так и смешанная популяция Е 14 гиппокаппальных нейроэпителиальных клеток, полученных из H-2Kb-tsA58 трансгенной мыши, обеспечивает эффективные трансплантаты для сохранения когнитивной функции в этой модели.
Было обнаружено, что две из трех тестированных клональных клеточных линий, МНР36 клеточная линия (ранее известная, как клеточная линия С36) и клеточная линия МНРЗ, столь же эффективны в отношении восстановления когнитивной функции, что и фетальные крысиные трансплантаты, содержащие СА 1 пирамидальные клетки. Третья тестированная клеточная линия, МНР15 клеточная линия (известная ранее, как С15 клеточная линия) приводит к улучшению функции, но не демонстрирует столь же сильного улучшения, что МНР36 и МНРЗ. Шансы обнаружить клеточные линии, которые дифференцировались бы в СА 1 пирамидальные клетки, независимо от характера мозгового окружения хозяина, малы. То есть, по-видимому, клеточные линии способны реагировать на связанные с повреждениями сигналы таким образом, чтобы дифференцироваться в клетки одного или более типов, то есть способны восстанавливать необходимые связи и восстанавливать функцию (функции), нарушенные в результате повреждения тканей. Именно эта способность обеспечивает как стратегию, так и материальную базу для тансплантатной терапии, связанной с широким кругом поведенческих и психологических дефицитов, которые являются следствиями также широкого круга возможных форм повреждений человеческого мозга, ограниченной этическими и практическими проблемами, связанных с использованием фетальных тканей человека.
Две клеточные линии, которые продемонстрировали наибольшую способность восстанавливать функцию, обе оказались FGF2-зависимыми, т.е. происходит существенное усиление их пролиферации как в разрешающей, так и в запрещающей культуре в присутствии фактора роста, тогда как третья клеточная линия реагирует лишь слабо. Клетки и клеточные линии, которые демонстрируют существенное усиление пролиферации в ответ на добавление в их культуральную среду фактора роста, поэтому и обычно предпочтительны. Клетки можно тестировать как в разрешающих условиях, так и/или в запрещающих условиях. Клетки, демонстрирующие наибольшее усиление пролиферации, обычно наиболее предпочтительны. Фактор роста, который используют для тестирования клеток, должен, предпочтительно, соответствовать тому участку мозга, в котором эти клетки предполагается использовать, т. е. фактору роста, секретируемому на этом участке. Так, например, клетки, которые предполагается использовать для восстановления ткани в гиппокампе, можно тестировать с помощью FGF2 (известного также как bFGF). Обычно предпочтительны клетки, реагирующие на FGF2. При тестировании можно использовать и другие митогенные факторы роста, включая EGF и NGF.
В настоящем изобретении предложен способ тестирования, который включает поддержание популяции клеток кондиционно иммортализованной плюрипотентной нейроэпителиальной клеточной линии in vitro и культивирование части клеток в разрешающих условиях в присутствии фактора роста или без него, например FGF2, и определение пролиферации клеток. Предпочтительно также тестировать эти клетки в запрещающих условиях. Те клетки, которые оказываются реагирующими, т.е. демонтрируют значительное усиление пролиферации в присутствии фактора роста как в разрешающих, так и в запрещающих условиях, по-видимому, и являются клетками, наиболее приспособленными для использования для лечения по способу настоящего изобретения. Фактор роста можно, например, использовать в концентрации 10 нг/мл.
Температурочувствительный онкоген, который придает кондиционную иммортализованность клеткам, полученным из Н-2Kb-tsA58 трансгенной мыши, можно вводить в человеческие клетки in vitro. Существуют и могут быть использованы известные методики для введения экзогенных ДНК, например ген можно ввести за счет трансфекции клеток. Обычные методики скринирования для проверки того, что ген был встроен, можно использовать. Например, для скринирования по ДНК инсерционным сайтам можно использовать Саузернблоттинг. В некоторых случаях можно использовать маркеры или, если используют ген ts SV40 крупного Т антигена, клетки можно скринировать при разрешающей температуре для экспрессии SV40, как раскрыто в примере 4.
Следует учитывать, что хотя приведенные далее эксперименты осуществлены с использованием гена ts SV40 крупного Т антигена для придания клеткам кондиционной иммортализованности, можно использовать и любой другой ген, который способен вызвать кондиционную иммортализованность. Можно сконструировать такие гены из известных онкогенов. Так, например, был сконструирован ген кондиционной имморта-лизованности из с-mус онкогена, он описан Hoshimaiuaru et al., 1996.
В экспериментах на крысах, описанных в примерах 6, 7 и 8, кондиционно иммортализованные плюрипотентные клетки используют для восстановления весьма специфического типа повреждений. Использование клеток настоящего изобретения не ограничивается восстановлением этого конкретного типа повреждений. Трансплантация в любой участок мозга осуществляется с последующим улучшением функций.
Часть фетального мозга, из которого берут нейроэпителиальные клетки, и точное время (стадия развития) могут меняться. Для плюрипотентных клеток желательно, однако, чтобы эти клетки отбирались на достаточно ранней стадии развития, чтобы они оказались способны дифференцироваться в нужное разнообразие различных типов и/или фенотипов клеток мозга. Так, например, в том случае, когда клетки берут из гиппокампа мышиного эмбриона, эти клетки можно отбирать на 14-15 день жизни эмбриона. Человеческие клетки можно отбирать на эквивалентной стадии развития. Так, например, клетки человеческого зародыша можно брать примерно в возрасте 8 недель.
Извлеченные клетки можно скринировать in vitro, для того чтобы убедиться, что они все еще способны к дифференциации в соответствующий тип или фенотип клеток. Различные участки мозга при повреждениях могут продуцировать различные сигналы, так, например, факторы роста и/или различные типы поражения могут вызвать различные сигналы. Способность к дифференцированию можно определить in vitro в присутствии соответствующего сигнала, например, соответствующего фактора роста. В примере 4 далее описана процедура, в которой можно продемонстрировать способность клеток дифференцироваться в нейрональный и глиальный фенотипы.
Некоторые поведенческие и/или психологические дефициты вызваны отсутствием одного или более из химических соединений в мозге, который в остальных планах является здоровым. Ранее было предположено, что трансплантаты трансгенных клеток можно использовать для доставки утраченных химических соединений. Настоящее изобретение конкретно к этой проблеме не относится. Хотя клетки настоящего изобретения можно генетически модифицировать так, чтобы они включали дополнительные гены, которые экспрессируют нужные продукты, обычно в этом нет необходимости, так как клетки, используемые в соответствии со способом настоящего изобретения, будучи трансплантированы, дифференцируются, а затем функционируют полностью как замена клеток, которые были утрачены при повреждении. Эти клетки достигают функциональной интеграции и заменяют или компенсируют утраченные или поврежденные клетки. Они скорее становятся функциональной частью мозга, нежели являются просто усложненным методом введения лекарства. Поэтому обычно генетическая модификация клеток ограничена встраиванием генов, необходимых для кондиционной иммортализации и клонирования. Генами, необходимыми для клонирования, могут быть, например, ген, обеспечивающий устойчивость к выбранному антибиотику, для обеспечения отбора. Генетическая модификация для обеспечения секреции фармакологических агентов не является предпочтительной.
Способы трансплантации клеток человеку и животным известны специалистам и описаны в специальной литературе. Термин "трансплантация" в том смысле, как здесь использован, включает трансплантацию клеток, которые были выращены in vitro, и могут быть генетически модифицированы, а также трансплантацию материала из другого организма. Клетки можно трансплантировать за счет имплантации с помощью инфузии через микрошприц известного количества клеток в нужный участок, где они будут нормально распределены вокруг места инъекции. Их можно также имплантировать в вентрикулярное пространство в мозге. При имплантации новорожденному они тогда могут распространяться по всему мозгу.
Фраза "внутримозговая трансплантация" в том смысле, как здесь использована, включает трансплантацию в любую часть мозга. Трансплантация не ограничивается лобной и большей частью мозга.
Нижеследующие нелимитирующие примеры иллюстрируют изобретение.
Фиг.1-20 представляют результаты экспериментов, описанных в примерах 3 и 5-8, на них изображено следующее:
Фиг.1 представляет пролиферацию МНР15 клеток при 33oС и 39oС в SFM.
Фиг. 2 представляет пролиферацию МНР15 клеток при 33oС и 39oС в SFM с гамма-интерфероном (12 ед/мл).
Фиг. 3 представляет пролиферацию МНР15 клеток при 33oС и 39oС в SFM с FGF2 (10 нг/мл).
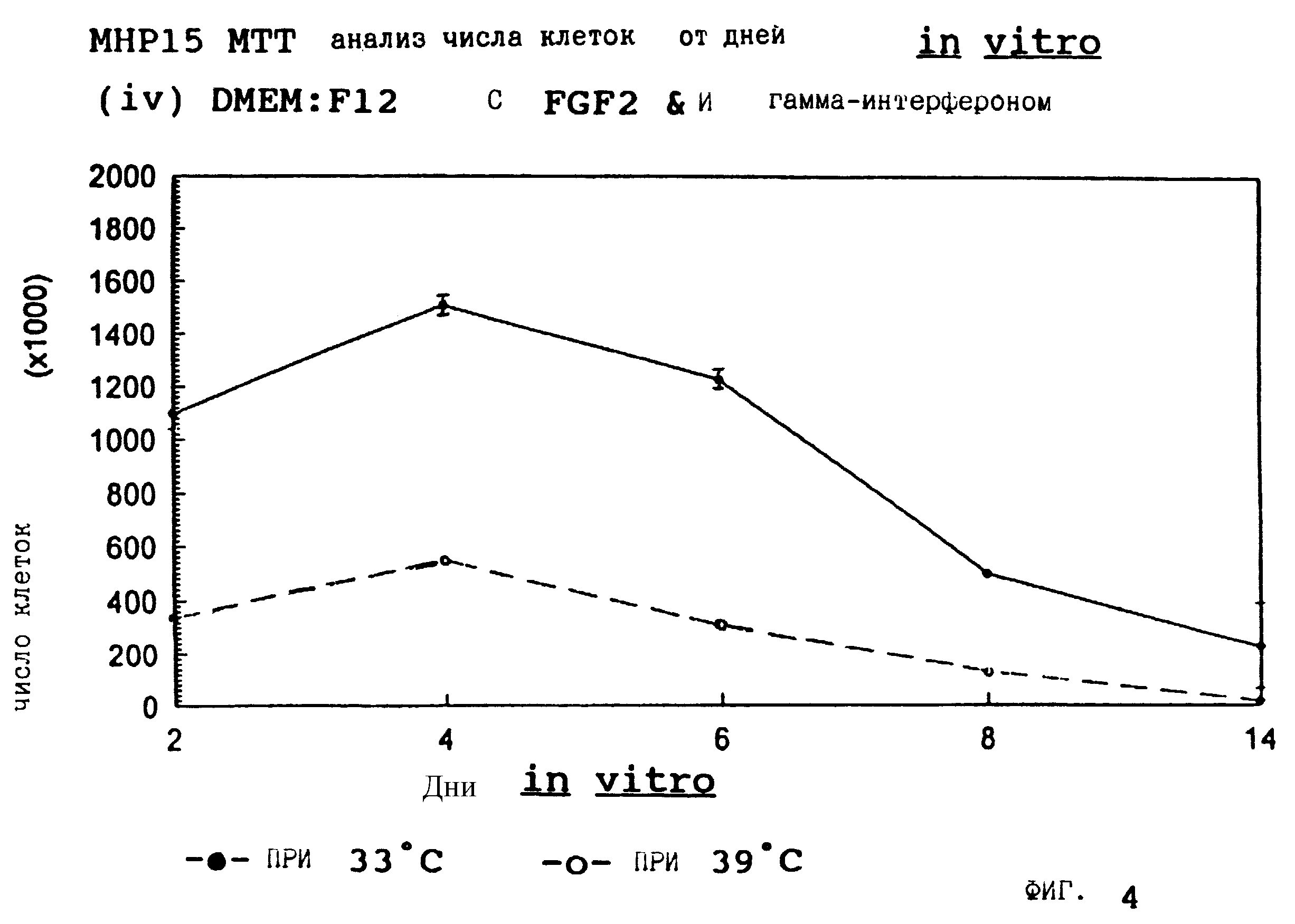
Фиг. 4 представляет пролиферацию МНР15 клеток при 33oС и 39o С в SFM с гамма-интерфероном (12 ед/мл) и FGF2 (10 нг/мл).
Фиг.5 представляет пролиферацию МНР36 клеток при 33oС и 39oС в SFM.
Фиг. 6 представляет пролиферацию МНР36 клеток при 33oС и 39oС в SFM с гамма-интерфероном (12 ед/мл).
Фиг. 7 представляет пролиферацию МНР36 клеток при 33oС и 39o С в SFM с FGF2 (10 нг/мл).
Фиг. 8 представляет пролиферацию МНР36 клеток при 33oС и 39oС в SFM с гамма-интерфероном (12 ед/мл) и FGF2 (10 нг/мл).
Фиг. 9 представляет латентность крыс в водном лабиринте Морриса с течением времени для контрольных крыс с мнимым поражением, которым трансплантировали имитацию трансплантатов (CON), ишемических крыс с мнимыми трансплантатами (ISC), ишемических крыс с имплантатами СА1 клеток (СА1), САЗ клеток (САЗ) или смешанной популяции, клеток кондиционно иммортализованной популяции клеток-предшественников гиппокампа, полученных из H-2Kb-tsA58 трансгенной мыши (tsA58).
Фиг. 10 представляет латентность крыс в водном лабиринте Морриса с течением времени для контрольных крыс с мнимым поражением, которым имплантировали мнимый трансплантат (CON), ишемических крыс с мнимыми трансплантатами (ISC), ишемических крыс с имплантатами СА1 клеток (СА1), клетками МНР36 клеточной линии (МНР36) или смешанной популяции кондиционно иммортализованных клеток-предшественников гиппокампа, взятых из H-2Kb-tsA58 трансгенной мыши (tsA58).
Фиг. 11 представляет латентность крыс в водном лабиринте Морриса с течением времени для контрольных крыс с имитацией поражения, которым имплантировали мнимый трансплантат (CON), ишемических крыс с мнимыми трансплантатами (ISC) и ишемических крыс с имплантатами клеток МНР36 клеточной линии (пассажи 24-32) (МНР36).
Фиг. 12 представляет латентность крыс в водном лабиринте Морриса с течением времени для контрольных крыс с мнимыми поражениями, которым имплантировали мнимые трансплантаты (CON), ишемических крыс с мнимыми трансплантатами (ISC), ишемических крыс с имплантатами клеток МНР36 клеточной линии (МНР36), клеток МНР15 клеточной линии (МНР15) или клеток МНРЗ клеточной линии (МНРЗ).
Фиг.13 представляет пролиферацию МНР15 клеток при 33oС и 39oС в SFM, как на фиг.1, но для дней 0-6.
Фиг. 14 представляет пролиферацию МНР15 клеток при 33oС и 39oС в SFM с гамма-интерфероном (12 ед/мл), как на фиг.2, но для дней 0-6.
Фиг. 15 представляет пролиферацию МНР15 клеток при 33oС и 39oС в SFM с FGF2 (10 нг/мл), как на фиг.З, но в течение дней 0-6.
Фиг. 16 представляет пролиферацию МНР15 клеток при 33oС и 39oС в SFM с гамма-интерфероном (12 ед/мл) и FGF2 (10 нг/мл), как на фиг.4, но в течение дней 0-6.
Фиг.17 представляет пролиферацию МНР36 клеток при 33oС и 39oС в SFM, как на фиг.5, но в течение дней 0-6.
Фиг. 18 представляет пролиферацию МНР36 клеток при 33oС и 39oС в SFM с гамма-интерфероном (12 ед/мл), как на фиг.6, но для дней 0-6.
Фиг. 19 представляет пролиферацию МНР36 клеток при 33oС и 39oС в SFM с FGF2 (10 нг/мл), как на фиг.7, но для дней 0-6.
Фиг. 20 представляет пролиферацию МНР36 клеток при 33oС и 39oС в SFM с гамма-интерфероном (12 ед/мл) и FGF2 (10 нг/мл), как на фиг.8, но в течение дней 0-6.
Пример 1
Получение культур смешанных популяций
Гиппокамп иссекают у Е14 H-2Kb-tsA58 мыши. Суспензию клеток,
полученных после трипсинизации и механического измельчения клеток, высевают при концентрации 45 х 103 до 50 х 103 клеток/мл в культуральные чашки площадью 10 см2.
Клетки культивируют в DMEM: F12 не содержащей сыворотки среде (SFM) со следующими дополнениями: альбумин бычьей сыворотки (0,0286%); трансферрин (0,1 мг/мл); путресцин (16,2 мкг/мл); инсулин (5
мкг/мл); прогестерон (0,062 мкг/мл); селен (0,0383 мкг/мл); L-глутамин (2 мМ); L-тироксин (0,4 мкг/мл); трииодотиронин (0,337 мкг/мл); гепарин (10 USP ед/мл); пенициллин/стрептомицин (10000: 1000
ед/мл) (все получены от Sigma). Кроме того, к клеткам добавляют основной фактор роста фибробластов, ранее известный как bFGF, а теперь называемый FGF2 (FGF2 , 10 нг/мл) и гамма-интерферон (g-IFN, 12
ед/мл), и все это инкубируют при 33oС в 5% CO2. Каждые 2-3 дня половину среды заменяют, но все содержат FGF2 и g-IFN.
Пример 2
Получение клональных
линий
pPGKB-geo плазмиду (полученную от Р. Soriano), которая состоит из гибрида lacZ и устойчивости к неомицину под управлением pGK промотора, выращивают в течение ночи при 37oС в
бульоне Luria Bertani, а затем очищают, используя коммерческий набор (Quiagen, Germany). Очищенную плазмидную ДНК линеаризуют, используя рестрикционный фермент Sal 1 (Promega, U.K.), затем стерилизуют
и снова суспендируют в ТЕ буфере при конечной концентрации 1 мг/мл. Смешанную популяцию нейроэпителиальных клеток гиппокампа, полученную в примере 1, подвергают электропорации для того, чтобы ввести в
клетки гибридный lacZ ген.
Клетки высевают при концентрации 105-106 клеток/пластину в SFM (с добавлениями, перечисленными в примере 1) с соответствующим добавлением FGF2 и g-IFN, и спустя 24 часа среду заменяют SFM, содержащей G418 (подобный неомицину антибиотик) (200 мкг/мл), который допускает экспрессию устойчивых к G418 клеток, в которых плазмида встроена правильным образом. Среду заменяют 2-3 раза в неделю, и клетки оставляют на 4-6 недель, чтобы обеспечить образование клонов.
Клоны, которые были выбраны, были отделены друг от друга и собраны с использованием стеклянных колец для клонирования, которые были погружены в силиконовую смазку. Клональные клетки переносят на пластины с 24 ячейками после кратковременного инкубирования в течение 5 минут с EDTA/EGTA (1:100) раствором при 37oС. Спустя несколько дней эти клетки стали конфлюэнтными и были перенесены в пластины с 6 ячейками, а затем в 10 см2 культуральные чашки, после чего их обрабатывают точно так же, как и нетрансфектированные линии смешанных популяций, как это было указано ранее, за исключением добавления G418. Из 32 отобранных клонов 9 клонов преобразовали в постоянные клеточные линии.
Все эти клональные гиппокамповые линии, как было показано, являются кондиционно иммортализованными. Клетки подсчитывают с помощью хромогенного МТТ анализа, который демонстрирует 1-2 х 10-3-кратную пролиферацию по сравнению с исходными плотностями в разрешающих условиях в не содержащей сыворотки среде без добавления FGF2 на 2-6 дни in vitro (здесь и далее называемые "DIV") с быстрым уменьшением количества клеток на пластине при запрещающих условиях (39oС, гамма-IFN). Однако гиппокампальная нейроэпителиальная популяция, из которой были получены эти линии, требует дополнения FGF2 для пролиферации. Оказалось, что две из этих девяти линий, кроме того, были FСFГ2-реактивны, существенно повышая скорость своей пролиферации как в разрешающих, так и в запрещающих условиях культуры в присутствии этого фактора роста.
Линии поддерживались в течение многих пассажей, а замороженные партии оттаивали и культивировали без изменения фенотипа.
Пример 3
Пролиферация клональных линий МНР15 и МНР36 in vitro (Клеточные линии МНР36 и МНР15 были ранее
известны как С36 и С15 соответственно. Обозначения С36 и С15 использованы в заявке, на основании которой заявлен приоритет рассматриваемой заявки. Сами по себе клеточные линии те же самые, изменены
лишь их названия).
Клетки из двух постоянных клеточных линий помещают на пластины с 96 ячейками при плотности 8-12 х 103 клеток/ячейку в не содержащую сыворотки среду
DMEM:F12 (SFM) с добавлением основного фактора роста (FGF2, 10 нг/мл) и гамма-интерферона (12 ед/мл) в течение 24 часов при 33oС с 5% CO2. После этого всю среду, FGF2 и
гамма-интерферон удаляют и каждую из колонок, состоящую из 8 ячеек, обрабатывают одним из:
(i) SFM без дополнений;
(ii) SFM с g-интерфероном (12 ед/мл);
(iii) SFM с FGF2 (10
нг/мл) или
(iv) SFM как с g-интерфероном (12 ед/мл), так и FGF2 (10 нг/мл);
для 2, 4, 6, 8 и 14 дней in vitro, либо при 33oС, либо при 39oС. Клетки подсчитывают
в каждой временной точке для каждой температуры и дополнительных условий, используя хромогенный МТТ анализ. Обе клеточные линии демонстрируют четкую температурную зависимость в SFM как с
g-интерфероном, так и без него; клетки быстро пролиферируют вплоть до 200-кратной плотности на пластине при разрешающей температуре (33oС), но демонстрируют минимальную пролиферацию при
запрещающей температуре (39oС). Добавление FGF2 усиливает пролиферацию при обеих температурах для МНР36 линии, но наблюдается лишь незначительный эффект для МНР15 линии, что указывает на то,
что эти клеточные линии отличаются по их реакции на этот фактор роста.
Фиг. 1-4 представляют результаты для МНР15 клеточной линии вплоть до 14 дней, а фиг.13-16 представляют результаты более подробно для дней 0-6. Фиг. 5-8 представляют результаты для МНР36 клеточной линии вплоть до 14 дней, а фиг.17-20 представляют результаты более подробно для дней 0-6.
Пример 4
МНР15 и МНР36 клональные клеточные линии имеют нейрональный и глиальный потенциалы при дифференцировании in vitro
Клетки для иммуноцитохимических исследований приготавливают,
используя различные маркеры как в разрешающих условиях (33oС плюс g-интерферон с добавленным FGF2), так и в запрещающих условиях (39oС) в SFM с добавлением дифференцирующего
агента дибутирил сАМР (1 мМ). По 50-100 х 103 клеток из каждой линии высевают на фиброниктином обработанные камерные слайды в SFM с FGF2 и g-интерфероном при 33oС в течение 48
часов. Половину слайдов фиксируют на этой стадии, а для другой половины среду удаляют и заменяют на SFM, содержащую 1 мМ дибутирил сАМР и поддерживают при 39oС. Эти слайды фиксируют после
2-8 дней in vitro 4% параформальдегидом. В таблице представлены пропорции всех клеток в 5 произвольно выбранных полях, экспрессирующие маркер для клеток потомства, Nestin; нейронный маркер,
нейронспецифическая энолаза (NSE); глиальный маркер, глиальный фибриллярный кислотный протеин (GFAP) и маркер, для иммортализующего генного антигена, SV40. Обе клеточные линии демонстрируют нейронный
и глиальный фенотипы, но не до дифференциации.
Дальнейшая характеризация МНР36 клональной линии
МНР36 клеточную линию характеризуют далее при 2 DIV как в культуре с
разрешающими, так и неразрешающими условиями. Обнаружено, что клетки более чем на 95% X-gal мечены (что подтверждает гистохимическую реакцию с β-gal трансдуктным маркером) в разрешающих
условиях. Клетки тестируют также с двумя другими антителами, одним для нейронального маркера PGP 9,5 (Wilson et al. , 1988) и одним для бромдеоксиуридина (BrdU) после одного часа инкубирования с BrdU
метящей средой в качестве маркера для разделения клеток. В культуре с разрешающими условиями BrdU окрашенные клетки обнаруживаются по всей культуре. В культуре с разрешающими условиями не наблюдается
PGP 9,5 клеток.
После переключения на запрещающие условия в не содержащей сыворотки среде (SFM) без дополнений эта клеточная линия прекращает деление, и большая часть клеток погибает без дифференцирования на зрелые нейрональные или глиальные фенотипы. Однако в присутствии форсколина или ретиновой кислоты (оба представляют дифференцирующие агенты) культуры можно поддерживать в течение длительного времени (5-14 DIV), и соотношение клеток демонстрирует нейрональные: глиальные фенотипы для 2 DIV. MHP36 клетки демонстрируют морфологию плоских клеток в присутствии ретиновой кислоты (10-9M с некоторым количеством GFAP-позитивных фибриллярных клеток, SV40 экспрессия снижается до 30%, а BrdU окрашивание до 5% клеток; не обнаружено PGP 9,5 окрашенных клеток. В присутствии форсколина, однако, (10-8М) часто обнаруживаются биполярные PGP 9,5 позитивные клетки, причем многие клетки обладают длительными нейритными процессами. GFAP-окрашенные фибриллы не обнаружены в культурах, SV40 экспрессия снижается (до 42% от полного количества клеток) и BrdU окрашивание найдено в 4% культуры. Эти факты представляют дополнительное подтверждение того, что MHP36 является плюрипотентной клеточной линией предшественников нейронов, происхождение которых, по крайней мере, частично определяется индуктивными сигналами.
Пример 5
Трансплантированные H-2Кb-tsA58 гиппокомпальные клетки-предшественники, подобно клеточным суспензиям СА1 клеток, восстанавливают пространственное обучение и память у крыс с ишемическими
поражениями СА1.
Изучают влияние трансплантатов клеточных суспензий Е19 СА1 (СА1), Е19 СА3 (СА3) и размноженных культур Е14 трансгенных H-2Кb-tsA58 гиппокампальных нейроэпителиальных клеток (tsA58) (собранных на 5 пассаже) на обнаружение положения спрятанной платформы в водном лабиринте Морриса после 15 минут 4VO ишемии (ISC), приводящей к селективным поражениям СА1. Способы, описанные в статье Sinden с сотр., 1995, особенно те, которые описаны в 9 разделе статьи, были использованы, за исключением тех случаев, когда указаны отклонения. В статье приведены детали способа, использованного для того, чтобы вызвать ишемию, способа трансплантации и использования теста с водным лабиринтом Морриса. Далее приводится краткое описание процедуры.
Преходящую глобальную ишемию вызывают у самцов крыс штамма Вистар по способу 4VO, в котором вертебральные артерии электрокоагулируют через крыловидный formanae на первом шейном позвонке под анестезией (2% галотана в 70% закиси азота и 30% кислорода) и силастиковую петлю вводят вокруг сонной артерии и выводят на поверхность. Спустя 24 часа перевязь подтягивают и артерии перекрывают на 15 минут. Тех крыс, которым не удается восстановить нужный рефлекс за две минуты, не включают в эксперимент. Раны быстро закрывают клипсами и наносят лигнокаин.
H-2Kb-tsA58 клетки извлекают из разрешающей культуры и снова суспендируют в сбалансированном солевом растворе Хэнка с 1 мМ н-ацетил-L-цистеина, готового для трансплантации. Перед извлечением клетки обрабатывают импульсами 0,5 мкКюри/мл H3-тимидина в течение 48 часов.
Трансплантаты билатерально направляют к дорсальному СА1 клеточному полю (2 сайта на полушарие, 2 мкл/сайт, 25К клеток/мкл для каждого трансплантата клеточного типа) и крысам проводят трансплантацию через 2-3 недели после ишемической хирургии. Крыс, которым трансплантированы tsA58 клетки, обрабатывают через день в течение 14 дней после трансплантации иммуносупрессором, циклоспорином A (Sandoz 2,5 мг/крысу в Cremophore EL, внутримышечно). Тренировку (2 испытания/день) начинают спустя 12 недель после трансплантации (число подопытных (Ns)=7-11 на группу).
Контрольные крысы с имитацией поражений подвергаются каутеризации вертебральных артерий, но им не перевязывают сонную артерию, а затем вводят имитации трансплантатов. Имитацию трансплантаций осуществляют, вводя иглу для инъекции трансплантата в соответствующий участок, но не производя инъекции.
Водный лабиринт состоит из черного полипропиленового круглого бассейна (2 м диаметр, 0,5 м высота, 0,25 м глубина воды при 26oС; воду делают непрозрачной, добавляя 200 мл молока). Спасательная платформа представляет собой 9 см прозрачный закрытый плексигласовый цилиндр, расположенный на 0,02 м под поверхностью воды в середине северо-западного квадранта бассейна. В начале испытаний крыс помещают в бассейн лицом к стене и дают возможность плыть до тех пор, пока они не достигают платформы, где они остаются на 10 секунд перед тем, как их удаляют. Крыс, которые сами не смогли обнаружить платформу за 60 секунд, направляют к ней, и подсчитывают максимальный промежуток времени. Стартовое положение обозначают как север, юг, запад и восток и в псевдохаотическом порядке каждый день в качестве стартовой точки используют точку, близкую к платформе, и точку на расстоянии от нее. Направление плывущей крысы регистрируют с помощью системы анализа изображения (HVS Image, VP112), и в цифровом виде превращают в интервал навигационных измерений.
Величина ошибки указывает на 2 стандартные ошибки между группами из групп х дни взаимодействия анализа дисперсии. Промежуток времени, необходимый для обнаружения платформы для ишемических крыс как с СА1, так и с tsA58 трансплантатами существенно не отличается от этих величин для контрольных, неповрежденных крыс (контрольные животные с имитацией поражений, которым трансплантировали имитацию трансплантатов) (CON), тогда как другая ишемическая группа с САЗ или имитацией трансплантатов была значительно хуже, по сравнению с контролем, СА1 и tsA58 группами по латентности и другим измерениям пространственного обучения. Анализ постмортем показал аналогичную селективную СА1 нейрональную потерю (70-75%) от СА1 хозяина во всех ишемических группах, включая каждую из групп с трансплантатами. Приживаемость трансплантатов была прекрасной во всех группах с трансплантатами.
Латентность в тесте с водным лабиринтом Морриса представлена временем, которое оно занимает у испытуемого для того, чтобы доплыть до спрятанной платформы.
Полученные результаты представлены на фиг.9.
Пример
6
Клональная клеточная линия (МНР36), полученная из Н-2Kb-tsA58 гиппокампальных клеток-предшественников, восстанавливает пространственное обучение и память у крыс с ишемическими
поражениями СА1.
Исследуют влияние трансплантатов из клеточных суспензий Е19 СА1 (СА1), размноженных культур Е14 трансгенных из H-2Kb-tsA58 гиппокампальных нейроэпителиальных клеток (tsA58) (собранных на 5 пассаже) и размноженной клональной клеточной линии (МНР36), полученной из Е14 иммортальной гиппокампальной популяции предшественников, на достижение положения спрятанной платформы в водном лабиринте Морриса после 15 минут 4VO ишемии (ISC), приводящей к поражениям СА1. Способ аналогичен способу примера 5. МНР36 клетки извлекают из разрешающей культуры и снова суспендируют в сбалансированном солевом растворе Хэнка с 1 мМ н-ацетил-L-цистеином, готовым для трансплантации.
Как и в примере 5, трансплантаты билатерально помещают к дорсальному СА1 клеточному полю (2 сайта/полушарие, 2 мкл/сайт, 25К клеток/мкл для трансплантата каждого клеточного типа) и хирургическую трансплантацию проводят на 7-14 день после ишемии. Всех крыс в этом эксперименте, включая без трансплантатов (мнимая трансплантация) и без поражений (мнимые поражения) контроли, обрабатывают через день в течение 14 дней после трансплантации иммуносупрессором, циклоспорином A (Sandoz, 2,5 мг/крысу в Cremophore EL, внутримышечно). Тренировку (два испытания в день) начинают через 12 недель после трансплантации (Ns=7-11 на группу). Величина ошибок указывает 2 стандартные ошибки между группами из группы х дни взаимодействия анализа дисперсии. При повторении первого эксперимента период до обнаружения платформы для ишемических крыс как с СА1, так и с tsA58 трансплантатами существенно не отличается от контролей с имитацией поражений, которым трансплантированы имитаторы-трансплантаты (CON). Более того, группа с МНР36 клональной клеточной линией трансплантатов также существенно не хуже по сравнению с контролем, СА1 и tsA58 группами. Результаты этих экспериментов представлены на фиг.10.
Эти эксперименты демонстрируют, что трансплантированные клетки-предшественники, по-видимому, реагируют на сигналы из поврежденного мозга, принимая фенотип, способный заменить или компенсировать функциональный дефицит, к которому в противном случае приведет повреждение.
Далее анализ дисперсии (ANOVA) с повторными измерениями показывает значительные главные эффекты групп (F4,38=2,92, Р<0,05), Blocks (F5,896=36,50, Р<0,001) и значительные группы х Blocks линейный коэффициент взаимодействия (F4,896=3,23, Р<0,02). Сравнение t-тестов между линейными коэффициентами показывает, что ишемическая группа с имитацией трансплантатов имеет значительно худшие характеристики латентности по сравнению с контролем и тремя группами с трансплантатами (минимум t38=2,29, Р<0,05); контроль и три трансплантированные группы заметно не отличаются между собой (все t38<1). ANOVAs проплытых дистанций показывает сходные результаты для латентности.
Пример 7
Повторяют тесты с водным лабиринтом примеров 5 и 6 в дальнейшем цикле экспериментов. В этих экспериментах все крысы были иммуносупрессированы за
счет внутримышечной инъекции циклоспорина А (2,5 мг/крысу в Cremophore EL) через день в течение 15 дней после трансплантации. Полученные результаты представлены на фиг. 11, на которой среднее время,
потребовавшееся для обнаружения платформы, выражено как функция двухдневного (4 опыта) блока тренировок. Прямоугольники демонстрируют 2Х s.e.m. из группы х блоки взаимодействий анализа дисперсий.
Эти результаты дополнительно подтверждают, что трансплантировнные МНР36 клетки способны восстановить вызванный ишемией дефицит обучения. Как контрольная (крысы с имитацией поражений, которым трансплантированы имитации трансплантатов), так и МНР36 группы демонстрируют значительно более быстрые спасительные латентности и более короткие дистанции плавания к спасательной платформе, нежели для группы с ишемией, в которой были трансплантированы имитирующие трансплантаты.
Ишемическая группа с трансплантатами МНР36 клеток (Р24-32) (N=12) (темные квадраты) сравнивают с ишемической группой с трансплантатами-имитаторами (N= 10) (темные круги) и контролями с имитацией поражений, которым трансплантированы имитации трансплантатов (N=10) (открытые круги) на идентичных процедурах водного лабиринта. ANOVA спасительных латентностей демонстрирует значительно меньшие эффекты групп (F2,29=27,80, Р<0,001), блоков (F5,674= 54,72, Р<0, 001) и значительные группы х блоки взаимодействия (F10,674= 5,81, Р<0,001) со значительным линейным коэффициентом взаимодействия (F2,674=23,31, Р<0,001). Сравнения t-тестов между линейными коэффициентами показывают, что ишемическая группа с имитацией трансплантаций имеет значительно худшие характеристики спасительной латентности по сравнению как с контрольной, так и МНР36 группой (минимум t29=5,54, Р<0,001), контрольная и МНР36 группа заметно не отличаются (t29=1,01). ANOVA проплытых расстояний и другие измерения пространственного обучения в водном лабиринте полностью соответствуют результатам спасительной латентности.
Пример 8
Повторяют эксперимент примера 7, используя трансплантацию
клеток из МНР3 и МНР15 клеточных линий. МНР3 является одной из девяти клональных клеточных линий, упомянутых ранее в примере 2, и является одной из клеточных линий, которые демонстрируют реакционную
способность в отношении FGF2. Результаты представлены на фиг. 12. Показано также, что фиг. 12 является результатами для контрольных крыс (снова крысы с имитацией поражений, которым трансплантировали
имитирующие трансплантаты), ишемических крыс, которым трансплантировали имитирующие трансплантаты, и ишемических крыс, которым трансплантировали имплантаты клеток из МНРЗ6 клеточной линии, как в
примере 7 ранее. Для МНР3 и МНР15 N=9. Как можно видеть, трансплантаты из МНР3 клеток обеспечивают эффективные характеристики обучения, как и МНР36, т.е. значительно быстрее, нежели для ишемической
группы, но значительно медленнее, чем для контрольной группы. Трансплантаты из МНР15 клеток демонстрируют промежуточные эффекты, т. е. значительно быстрее, чем для ишемической группы, но также
значительно медленнее, чем для контрольной группы.
Пример 9
Постмортем ишемические повреждения мозга в эксперименте 7А оценивают из срезов, окрашенных крезил фиолетовым в
двух независимых наблюдениях в коре и стратуме на двух уровнях и участках СА1-4 гиппокампа на двух дополнительных уровнях. Используя пятибальную шкалу можно сказать, что ни в одном из участков, кроме
СА1, не было обнаружено повреждений, за исключением двух крыс, у которых наблюдалась умеренная утрата СА3 клеток. Независимо от участков трансплантированных клеток, средняя утрата СА1 клеток на уровне
максимального ишемического повреждения (внутриауральное пространство 5,7 мм) меняется от 80% для ишемической плюс имитирующий трансплантат группы до 90% для ишемической полюс СА1 трансплантированной
группы, при отсутствии значительных различий между только ишемическими (имитирующий трансплантат) и ишемической плюс трансплантат группами. Трансплантаты Е19 фетальных СА1 клеток формируют
ограниченную трансплантированную массу, расположенную выше СА1-поврежденного участка, аналогично ранее сообщавшемуся.3H-тимидинмеченые размноженные популяции клеток были обнаружены
диспергированными по всему гиппокампальному образованию corpus callosum и расположенному поверх neocortex; некоторые кластеры меченых клеток были обнаружены внутри поврежденного слоя СА1 клеток.
Трансплантаты Х-да1-позитивных МНР36 клеток отличаются гораздо более ограниченным распределением: другие, нежели соседние с траекторией иглы, меченые клетки, как было обнаружено, ограничены
гиппокампом. Это, вероятно, отражает как более высокую чувствительность радиоактивной метки, так и даун-регуляцию β-gal экспрессии по сравнению с длительным временем жизни в этих экспериментах.
Пилотные эксперименты показали, что если трансплантаты МНР36 клеток вводят в непораженный гиппокамп, Х-gal-позитивные клетки, по-видимому, интегрируются во все СА (но не дентатный гирус - зубчатую
извилину) нейрональных слоев. (Дискретные меченые клетки обнаружены в ткани гиппокампа, и особенно в участках СА3 и 4). Однако, в отличие от трансплантатов в непораженный гиппокамп, плотные агрегации
X-gal-окрашенных клеток были дополнительно обнаружены в ишемическом СА1 клеточном слое. Степень трансплантации менялась между крысами, так что агрегации были в небольшом количестве в СА1 поле или
почти полностью занимали пораженное поле внутри конкретного участка, появлялись как X-gal-, так и nissl-окрашенных участках. Так, например, некоторые агрегации были обнаружены в одном и том же
полушарии в различных точках вдоль рострокаудальной (rostro-caudal) оси поврежденного СА1 слоя. Из этого, очевидно, следует, что клетки МНР36 клеточной линии обладают предпрасположенностью к агрегации
в пораженном СА1 нейрональном слое.
Исследование во времени миграции меченых трансплантированных МНР36 клеток у ишемических крыс с использованием анти-В-gal иммунохимии для идентификации трансплантированных клеток показало, что миграция в направлении к и агрегация у СА1 завершается к 4 неделям после трансплантации.
Ссылки
Dunnett 6 Bjorklund,
1994, Functional Neural Transplantation, Raven Press, New York
Jat P.S. et al., 1991, P.N.A.S. (USA) 88, p. 5096
Lindvall, 0, 1994, in Dunnett & Bjorklund, op. cit.
Sinden J.D. et al. (1995) Beh. Brain Sci. 18, plO
Wilson, P. O. G., Barber, P.C., Hamid Q., A. Power, B.F., Dhillon A.P., Rode, J. , Day, I.N.M., Thompson, R.J., and Polak J.M.,
Br. J. Exp. Pathol 69), p.1-104 (1988)
Hoshimaiuaru, M., Ray, J., Sah, D.W.Y., Gage, F.H., PNAS USA, Vol.93, p. l518-1523 (1996)
Настоящее изобретение не должно быть ограничено
объемом приведенных примеров, которые предназначены лишь для иллюстрации изобретения. На самом деле, различные модификации настоящего изобретения в дополнение к представленным и описанным здесь будут
очевидны специалистам и должны попасть в объем прилагаемой формулы изобретения.
Содержание вышеуказанных литературных ссылок включено сюда для ссылки.
Реферат
Изобретение относится к области медицины и может быть использовано в неврологии и психиатрии для восстановления функций головного мозга, которые были нарушены в результате гибели клеток или повреждения ткани мозга. Осуществляют внутрицеребральную трансплантацию эффективного количества условно иммортализованных плюрипотентных нейтроэпителиальных клеток или фармацевтической композиции на основе этих клеток. Способ позволяет повысить эффективность лечения, что достигается за счет дифференцировки трансплантированных клеток в нейроны с фенотипом поврежденного отдела головного мозга. 3 н. и 19 з.п.ф-лы, 20 ил.


Комментарии